JP5205798B2 - マイクロインジェクション装置、捕捉プレート、およびマイクロインジェクション方法 - Google Patents
マイクロインジェクション装置、捕捉プレート、およびマイクロインジェクション方法 Download PDFInfo
- Publication number
- JP5205798B2 JP5205798B2 JP2007119924A JP2007119924A JP5205798B2 JP 5205798 B2 JP5205798 B2 JP 5205798B2 JP 2007119924 A JP2007119924 A JP 2007119924A JP 2007119924 A JP2007119924 A JP 2007119924A JP 5205798 B2 JP5205798 B2 JP 5205798B2
- Authority
- JP
- Japan
- Prior art keywords
- capture
- capillary needle
- hole
- cell
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M35/00—Means for application of stress for stimulating the growth of microorganisms or the generation of fermentation or metabolic products; Means for electroporation or cell fusion
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M25/00—Means for supporting, enclosing or fixing the microorganisms, e.g. immunocoatings
- C12M25/06—Plates; Walls; Drawers; Multilayer plates
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical & Material Sciences (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Sustainable Development (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
Description
細胞を捕捉して位置を固定する捕捉プレートと、
前記捕捉プレートによって捕捉された細胞に物質を注入するキャピラリ針と、
前記キャピラリ針を長手方向先端側へ突き出した後、長手方向根元側へ引き上げる移動機構部と、
前記移動機構部によって前記キャピラリ針が所定位置まで引き上げられた際に、前記キャピラリ針の先端から物質を吐出させる吐出制御部と
を有することを特徴とするマイクロインジェクション装置。
細胞を捕捉する複数の捕捉孔があらかじめ定められた座標に形成されることを特徴とする付記1記載のマイクロインジェクション装置。
平面視形状が円形であり、直径が細胞の直径の70〜80%に相当することを特徴とする付記2記載のマイクロインジェクション装置。
いずれか一方の面に細胞を捕捉する平面部と、
前記平面部のいずれか他方の面の周囲に密閉された空間が形成されるように前記平面部を支持する脚部とを有し、
前記平面部は、
細胞を捕捉する一方の面が円柱形状に陥没する複数の捕捉孔を備えることを特徴とする付記1記載のマイクロインジェクション装置。
底面に前記平面部を貫通する貫通孔が形成されることを特徴とする付記4記載のマイクロインジェクション装置。
直径が1〜2μmまたは細胞の直径の10〜20%に相当することを特徴とする付記5記載のマイクロインジェクション装置。
底面の前記キャピラリ針が前記移動機構部によって突き出された際の先端到達位置付近にさらに円柱形状に陥没するリセス部が形成されることを特徴とする付記4記載のマイクロインジェクション装置。
底面の直径が3〜4μmかつ深さが2〜3μmの円柱形状に前記捕捉孔の底面が陥没して形成されることを特徴とする付記7記載のマイクロインジェクション装置。
当該捕捉プレートを貫通し、直径が細胞の直径と比較して十分小さい貫通孔と、
前記貫通孔付近に捕捉された細胞に物質を注入するキャピラリ針の先端到達位置付近が円柱形状に陥没するリセス部と
を有することを特徴とする捕捉プレート。
前記キャピラリ針を長手方向先端側へ突き出す突出ステップと、
前記突出ステップ後、前記キャピラリ針を長手方向根元側へ引き上げる引上ステップと、
前記引上ステップにおいて前記キャピラリ針が所定位置まで引き上げられた際に、前記キャピラリ針の先端から物質を吐出する吐出ステップと
を有することを特徴とするマイクロインジェクション方法。
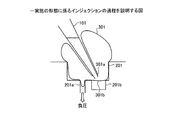
102 シャーレ
103 捕捉プレート
104 ステージ
105 照明
106 吸引部
107 ステージ移動機構部
108 キャピラリ針移動機構部
109 捕捉座標記憶部
110 制御部
111 吐出機構部
112 CCDカメラ
113 倒立顕微鏡
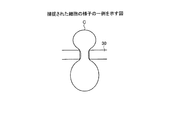
201 捕捉孔
201a 貫通孔
201b リセス部
202 平面部
203 脚部
Claims (9)
- 細胞に物質を注入するマイクロインジェクション装置であって、
細胞を捕捉して位置を固定する複数の捕捉孔があらかじめ定められた座標に形成された捕捉プレートと、
前記捕捉プレートによって捕捉された細胞に物質を注入するキャピラリ針と、
前記捕捉孔の底面から第1の距離まで前記キャピラリ針を長手方向先端側へ突き出した後、前記第1の距離よりも大きい第2の距離であって前記捕捉孔の底面および細胞の中心の距離を基準に設定された第2の距離まで前記キャピラリ針を長手方向根元側へ引き上げる移動機構部と、
前記移動機構部によって前記キャピラリ針が前記捕捉孔の底面から前記第2の距離の位置まで引き上げられた際に、前記キャピラリ針の先端から物質を吐出させる吐出制御部と
を有することを特徴とするマイクロインジェクション装置。 - 前記捕捉孔は、
平面視形状が円形であり、直径が細胞の直径の70〜80%に相当することを特徴とする請求項1記載のマイクロインジェクション装置。 - 前記捕捉プレートは、
いずれか一方の面に細胞を捕捉する平面部と、
前記平面部のいずれか他方の面の周囲に密閉された空間が形成されるように前記平面部を支持する脚部とを有し、
前記平面部は、
細胞を捕捉する一方の面が円柱形状に陥没する複数の捕捉孔を備えることを特徴とする請求項1記載のマイクロインジェクション装置。 - 前記捕捉孔は、
底面に前記平面部を貫通する貫通孔が形成されることを特徴とする請求項3記載のマイクロインジェクション装置。 - 前記貫通孔は、
直径が1〜2μmまたは細胞の直径の10〜20%に相当することを特徴とする請求項4記載のマイクロインジェクション装置。 - 前記捕捉孔は、
底面の前記キャピラリ針が前記移動機構部によって突き出された際の先端到達位置付近にさらに円柱形状に陥没するリセス部が形成されることを特徴とする請求項3記載のマイクロインジェクション装置。 - 前記リセス部は、
底面の直径が3〜4μmかつ深さが2〜3μmの円柱形状に前記捕捉孔の底面が陥没して形成されることを特徴とする請求項6記載のマイクロインジェクション装置。 - 物質を注入するために緩衝液中の細胞を捕捉して位置を固定する捕捉プレートであって、
当該捕捉プレートを貫通し、直径が細胞の直径と比較して十分小さい貫通孔と、
前記貫通孔付近に捕捉された細胞に物質を注入するキャピラリ針の先端到達位置付近が円柱形状に陥没するリセス部と
を有することを特徴とする捕捉プレート。 - 細胞を捕捉して位置を固定する複数の捕捉孔があらかじめ定められた座標に形成された捕捉プレートと、前記捕捉プレートによって捕捉された細胞に物質を注入するキャピラリ針とを備えたマイクロインジェクション装置におけるマイクロインジェクション方法であって、
前記捕捉孔の底面から第1の距離まで前記キャピラリ針を長手方向先端側へ突き出す突出ステップと、
前記突出ステップ後、前記第1の距離よりも大きい第2の距離であって前記捕捉孔の底面および細胞の中心の距離を基準に設定された第2の距離まで前記キャピラリ針を長手方向根元側へ引き上げる引上ステップと、
前記引上ステップにおいて前記キャピラリ針が前記捕捉孔の底面から前記第2の距離の位置まで引き上げられた際に、前記キャピラリ針の先端から物質を吐出する吐出ステップと
を有することを特徴とするマイクロインジェクション方法。
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007119924A JP5205798B2 (ja) | 2007-04-27 | 2007-04-27 | マイクロインジェクション装置、捕捉プレート、およびマイクロインジェクション方法 |
| US12/081,994 US7897395B2 (en) | 2007-04-27 | 2008-04-24 | Microinjection apparatus, trap plate and microinjection method |
| EP08103729A EP1985694B1 (en) | 2007-04-27 | 2008-04-25 | Microinjection apparatus, trap plate and microinjection method |
| DE602008004798T DE602008004798D1 (de) | 2007-04-27 | 2008-04-25 | Mikroeinspritzvorrichtung, Fangplatte und Mikroeinspritzverfahren |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007119924A JP5205798B2 (ja) | 2007-04-27 | 2007-04-27 | マイクロインジェクション装置、捕捉プレート、およびマイクロインジェクション方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008271866A JP2008271866A (ja) | 2008-11-13 |
| JP5205798B2 true JP5205798B2 (ja) | 2013-06-05 |
Family
ID=39615781
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007119924A Expired - Fee Related JP5205798B2 (ja) | 2007-04-27 | 2007-04-27 | マイクロインジェクション装置、捕捉プレート、およびマイクロインジェクション方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US7897395B2 (ja) |
| EP (1) | EP1985694B1 (ja) |
| JP (1) | JP5205798B2 (ja) |
| DE (1) | DE602008004798D1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011004674A (ja) * | 2009-06-26 | 2011-01-13 | Fujitsu Ltd | 誘導多能性幹細胞(iPS細胞)の製造方法 |
| EP2707474B1 (en) * | 2011-05-13 | 2019-07-10 | The Regents of The University of California | Photothermal substrates for selective transfection of cells |
| GB2508906A (en) * | 2012-12-14 | 2014-06-18 | Life Science Methods Bv | Frame element for sample injection with optical control means |
| KR102202742B1 (ko) | 2013-03-15 | 2021-01-12 | 더 리전트 오브 더 유니버시티 오브 캘리포니아 | 광열 플랫폼을 이용한 살아있는 세포 내로의 고속대량 주입물 전달 |
| US20150050735A1 (en) * | 2013-08-14 | 2015-02-19 | 3-D Matrix, Ltd. | Well plates |
| AU2015235932B2 (en) | 2014-03-28 | 2021-08-05 | The Regents Of The University Of California | Efficient delivery of large cargos into cells on a porous substrate |
| WO2016046938A1 (ja) * | 2014-09-25 | 2016-03-31 | 株式会社サイフューズ | 細胞トレイ、並びに細胞構造体製造装置、方法、及びシステム |
| CN110520738A (zh) * | 2017-04-12 | 2019-11-29 | 通用自动化实验技术公司 | 用于采拾生物样品的装置和方法 |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL68507A (en) * | 1982-05-10 | 1986-01-31 | Univ Bar Ilan | System and methods for cell selection |
| DE3718066A1 (de) * | 1987-05-29 | 1988-12-08 | Zeiss Carl Fa | Verfahren zur mikroinjektion in zellen bzw. zum absaugen aus einzelnen zellen oder ganzer zellen aus zellkulturen |
| JP2559760B2 (ja) | 1987-08-31 | 1996-12-04 | 株式会社日立製作所 | 細胞搬送方法 |
| JP2564322B2 (ja) | 1987-10-07 | 1996-12-18 | 株式会社日立製作所 | 細胞融合装置 |
| JP2624719B2 (ja) | 1987-10-28 | 1997-06-25 | 株式会社日立製作所 | マイクロインジエクション装置 |
| US5262128A (en) | 1989-10-23 | 1993-11-16 | The United States Of America As Represented By The Department Of Health And Human Services | Array-type multiple cell injector |
| JPH0779676B2 (ja) * | 1991-03-29 | 1995-08-30 | 株式会社島津製作所 | インジェクション装置 |
| JPH0690770A (ja) * | 1991-03-29 | 1994-04-05 | Shimadzu Corp | マイクロマニピュレータ用微小器具 |
| JPH05192171A (ja) * | 1991-08-08 | 1993-08-03 | Hitachi Ltd | マイクロインジェクション法及びその装置 |
| JPH10127267A (ja) | 1996-10-31 | 1998-05-19 | Shimadzu Corp | マイクロマニピュレータシステム |
| JP3035608B2 (ja) | 1998-07-09 | 2000-04-24 | 農林水産省食品総合研究所長 | マイクロキャピラリーアレイ、その製造方法、及び物質注入装置 |
| FR2784189B3 (fr) * | 1998-10-05 | 2000-11-03 | Commissariat Energie Atomique | Biopuce et dispositif de lecture d'une biopuce comportant une pluralite de zones de reconnaissance moleculaire |
| JP3442357B2 (ja) | 2000-08-25 | 2003-09-02 | 株式会社日立製作所 | 両生類卵母細胞試料導入装置、両生類卵母細胞試料導入システム、両生類卵母細胞試料導入方法、両生類卵母細胞の製造方法、両生類卵母細胞及びそれを販売又は譲渡する方法、スクリーニング用のセンサーとして用いる方法、容器、及び解析方法 |
| US20030152255A1 (en) * | 2002-02-14 | 2003-08-14 | Ngk Insulators, Ltd. | Probe reactive chip, apparatus for analyzing sample and method thereof |
| JP3670260B2 (ja) | 2002-02-14 | 2005-07-13 | 日本碍子株式会社 | プローブ反応性チップ |
| JP2004344036A (ja) | 2003-05-21 | 2004-12-09 | Fujitsu Ltd | 物質導入装置及び物質導入システム |
| JP2005278480A (ja) * | 2004-03-29 | 2005-10-13 | Fujitsu Ltd | 物質導入装置及び物質導入用チップ |
| JP4504089B2 (ja) * | 2004-05-10 | 2010-07-14 | 富士通株式会社 | マイクロインジェクション装置およびマイクロインジェクション方法 |
| JP4456429B2 (ja) * | 2004-07-27 | 2010-04-28 | 富士通株式会社 | インジェクション装置 |
| JP4621942B2 (ja) * | 2004-12-14 | 2011-02-02 | 国立大学法人 東京大学 | レーザ加熱による液体膨張圧を用いたマイクロインジェクション法 |
| JP2006197880A (ja) | 2005-01-21 | 2006-08-03 | Fujitsu Ltd | 細胞捕捉装置および細胞捕捉方法 |
| WO2006098430A1 (ja) | 2005-03-17 | 2006-09-21 | Kyoto University | 細胞内物質導入装置、細胞クランプ装置及び流路の形成方法 |
| JP4659553B2 (ja) * | 2005-08-05 | 2011-03-30 | 富士通株式会社 | 自動マイクロインジェクション装置および細胞捕捉プレート |
-
2007
- 2007-04-27 JP JP2007119924A patent/JP5205798B2/ja not_active Expired - Fee Related
-
2008
- 2008-04-24 US US12/081,994 patent/US7897395B2/en not_active Expired - Fee Related
- 2008-04-25 DE DE602008004798T patent/DE602008004798D1/de active Active
- 2008-04-25 EP EP08103729A patent/EP1985694B1/en not_active Not-in-force
Also Published As
| Publication number | Publication date |
|---|---|
| EP1985694B1 (en) | 2011-02-02 |
| US7897395B2 (en) | 2011-03-01 |
| EP1985694A1 (en) | 2008-10-29 |
| US20080268540A1 (en) | 2008-10-30 |
| JP2008271866A (ja) | 2008-11-13 |
| DE602008004798D1 (de) | 2011-03-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5205798B2 (ja) | マイクロインジェクション装置、捕捉プレート、およびマイクロインジェクション方法 | |
| US8394085B2 (en) | Laser perforation device and laser perforation method | |
| JP2008295376A (ja) | 細胞捕捉プレート、マイクロインジェクション装置、および細胞捕捉プレートの製造方法 | |
| US8414504B2 (en) | Blood test device | |
| US8204568B2 (en) | Blood inspection device | |
| US7976478B2 (en) | Blood test apparatus and method of controlling the same | |
| JP5488966B2 (ja) | ダイエジェクタ | |
| EP1875560A2 (en) | Diffusion delivery systems and methods of fabrication | |
| KR101500568B1 (ko) | 마이크로젯 약물 전달 장치의 약물 공급 제어 방법 및 이를 이용한 마이크로젯 약물 전달 시스템 | |
| EP1752221A1 (en) | Automatic microinjection apparatus and cell trapping plate | |
| RU2013141508A (ru) | Трансдермальный пластырь с микроиглами | |
| EP2172538A2 (en) | Holding petri dish, microinjection apparatus, and microinjection method | |
| JP2005318851A (ja) | マイクロインジェクション装置およびマイクロインジェクション方法 | |
| EP1607474A1 (en) | Apparatus and method for injecting a substance into a cell | |
| EP1649885B1 (en) | Method of cell injection into biotissue and apparatus therefor | |
| JP4816598B2 (ja) | チップ剥離装置およびチップ剥離方法ならびにチップピックアップ装置 | |
| US7479388B2 (en) | Apparatus for injecting solution into cell | |
| JP4816622B2 (ja) | チップ剥離装置およびチップ剥離方法ならびにチップピックアップ装置 | |
| KR100967850B1 (ko) | 자동 멀티 셀 주입장치 및 주입방법 | |
| Paik et al. | A highly dense nanoneedle array for intracellular gene delivery | |
| US20220126287A1 (en) | Micro-fluidic chip, liquid loading method thereof and micro-fluidic system | |
| JP2014048301A (ja) | 液晶注入装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100119 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20110901 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120313 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120514 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130122 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130204 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20160301 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |