JP4836613B2 - Novel phenolic compounds - Google Patents
Novel phenolic compounds Download PDFInfo
- Publication number
- JP4836613B2 JP4836613B2 JP2006061855A JP2006061855A JP4836613B2 JP 4836613 B2 JP4836613 B2 JP 4836613B2 JP 2006061855 A JP2006061855 A JP 2006061855A JP 2006061855 A JP2006061855 A JP 2006061855A JP 4836613 B2 JP4836613 B2 JP 4836613B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- developer
- acrylate
- meth
- color
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B41—PRINTING; LINING MACHINES; TYPEWRITERS; STAMPS
- B41M—PRINTING, DUPLICATING, MARKING, OR COPYING PROCESSES; COLOUR PRINTING
- B41M5/00—Duplicating or marking methods; Sheet materials for use therein
- B41M5/26—Thermography ; Marking by high energetic means, e.g. laser otherwise than by burning, and characterised by the material used
- B41M5/30—Thermography ; Marking by high energetic means, e.g. laser otherwise than by burning, and characterised by the material used using chemical colour formers
- B41M5/333—Colour developing components therefor, e.g. acidic compounds
- B41M5/3333—Non-macromolecular compounds
- B41M5/3335—Compounds containing phenolic or carboxylic acid groups or metal salts thereof
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B41—PRINTING; LINING MACHINES; TYPEWRITERS; STAMPS
- B41M—PRINTING, DUPLICATING, MARKING, OR COPYING PROCESSES; COLOUR PRINTING
- B41M5/00—Duplicating or marking methods; Sheet materials for use therein
- B41M5/26—Thermography ; Marking by high energetic means, e.g. laser otherwise than by burning, and characterised by the material used
- B41M5/30—Thermography ; Marking by high energetic means, e.g. laser otherwise than by burning, and characterised by the material used using chemical colour formers
- B41M5/305—Thermography ; Marking by high energetic means, e.g. laser otherwise than by burning, and characterised by the material used using chemical colour formers with reversible electron-donor electron-acceptor compositions
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Heat Sensitive Colour Forming Recording (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
本発明は、新規なフェノール化合物に関し、さらに詳しくは、熱エネルギーを制御することにより発色画像の形成と消去が可能な可逆性感熱記録媒体の顕色剤として有用な電子受容性化合物である新規フェノール化合物に関する。 The present invention relates to a novel phenol compound, and more specifically, a novel phenol which is an electron-accepting compound useful as a developer for a reversible thermosensitive recording medium capable of forming and erasing a color image by controlling thermal energy. Relates to compounds.
従来、電子供与性呈色性化合物(以下、発色剤またはロイコ染料ともいう)と電子受容性化合物(以下、顕色剤ともいう)との間の発色反応を利用した感熱記録媒体は広く知られており、OA化の進展と共にファクシミリ、ワードプロセッサ、科学計測機などの出力用紙として、また最近ではプリペイドカードやポイントカードなどの磁気感熱カードとしても広く使用されている。しかし、これら実用化されている従来の記録媒体は環境問題上、リサイクルや使用量の減量化などの見直しが迫られているが、不可逆的な発色であるため、一度記録した画像を消去して繰り返し使用することはできないし、新しい情報は画像が記録されていない部分に追記されるぐらいで記録可能な部分の面積は限られている。そのため、記録する情報量を減らしたり、記録エリアがなくなった時点でカードを作り直しているのが実状である。そこで、近年盛んに論じられているゴミ問題や森林破壊問題を背景に、何度でも書き換え可能な可逆性感熱記録媒体の開発が望まれていた。 2. Description of the Related Art Conventionally, heat-sensitive recording media using a color developing reaction between an electron donating color developing compound (hereinafter also referred to as a color former or a leuco dye) and an electron accepting compound (hereinafter also referred to as a developer) are widely known. With the progress of OA, it is widely used as an output sheet for facsimiles, word processors, scientific measuring instruments, etc., and recently as a magnetic thermal card such as prepaid cards and point cards. However, these conventional recording media that have been put to practical use are being reviewed for recycling and reduced usage due to environmental problems. However, since they are irreversible colors, once recorded images are erased. It cannot be used repeatedly, and the area of the recordable part is limited because new information is added to the part where no image is recorded. Therefore, the actual situation is that the amount of information to be recorded is reduced or the card is remade when the recording area runs out. Therefore, it has been desired to develop a reversible thermosensitive recording medium that can be rewritten any number of times, against the background of the dust problem and forest destruction problem that have been actively discussed in recent years.
ところで、これらの要求から様々な可逆性感熱記録媒体が提案されてきた。例えば、透明・白濁という物理的変化を利用した高分子タイプの可逆性感熱記録媒体が開示されている(特許文献1、2参照)。また、新たに化学的変化を利用した染料タイプの可逆性感熱記録媒体も提案されている。具体的には、顕色剤として没食子酸とフロログルシノールの組み合わせを用いるもの(例えば、特許文献3参照)、顕色剤にフェノールフタレインやチモールフタレインなどの化合物を用いるもの(例えば、特許文献4参照)、発色剤と顕色剤とカルボン酸エステルの均質相溶体を記録層に含有するもの(例えば、特許文献5、6、7参照)、顕色剤にアスコルビン酸誘導体を用いたもの(例えば、特許文献8参照)、顕色剤にビス(ヒドロキシフェニル)酢酸または没食子酸と高級脂肪族アミンとの塩を用いるもの(例えば、特許文献9、10参照)などが開示されている。
By the way, various reversible thermosensitive recording media have been proposed from these requirements. For example, polymer-type reversible thermosensitive recording media using physical changes such as transparency and cloudiness are disclosed (see
さらに本発明者らは、先に特許文献11において顕色剤として長鎖脂肪族炭化水素基をもつ有機リン酸化合物、脂肪族カルボン酸化合物またはフェノール化合物を用い、これと発色剤であるロイコ染料とを組み合わせることによって、発色と消色を加熱冷却条件により容易に行なわせることができ、その発色状態と消色状態を常温において安定に保持させることが可能であり、しかも発色と消色を繰り返すことが可能な可逆性感熱発色組成物およびこれを記録層に用いた可逆性感熱記録媒体を提案した。またその後、長鎖脂肪族炭化水素基をもつフェノール化合物について特定の構造のものを使用することが提案されている(例えば、特許文献12、13参照)。
Furthermore, the present inventors previously used an organic phosphate compound, aliphatic carboxylic acid compound or phenol compound having a long-chain aliphatic hydrocarbon group as a developer in Patent Document 11, and this and a leuco dye which is a color former. In combination, the color development and decoloring can be easily performed under heating and cooling conditions, and the color development state and the color erasure state can be stably maintained at room temperature, and the color development and color erasure are repeated. A reversible thermosensitive coloring composition and a reversible thermosensitive recording medium using the same for a recording layer have been proposed. Thereafter, it has been proposed to use a phenolic compound having a long chain aliphatic hydrocarbon group having a specific structure (see, for example,
しかし、このような材料を用いた記録媒体では、消色速度が遅く書き替えに時間がかかる、消色が不充分、あるいは発色画像の熱安定性が低いなどの問題を有していた。
そこで、さらに本発明者らは特許文献14に記載のフェノール化合物を用いることで、発色と消色のコントラストが高く、高速消去が可能であり、画像部の発色安定性に優れる記録媒体を提案した。このフェノール性化合物を用いた記録媒体は、ホットスタンプやヒートローラ、セラミックヒータなどの加熱部材による消去が可能であり実用性に優れるものであった。
However, the recording medium using such a material has problems such as a slow erasing speed and a long time for rewriting, insufficient erasing, or low thermal stability of a color image.
Therefore, the present inventors further proposed a recording medium having a high contrast between color development and decoloration, capable of high-speed erasing, and excellent in color stability of the image area by using the phenol compound described in Patent Document 14. . The recording medium using this phenolic compound can be erased by a heating member such as a hot stamp, a heat roller, or a ceramic heater, and has excellent practicality.
しかしながら特許文献14に記載の化合物は高融点なものが多く、発色および消色の際に高温に加熱する必要があり、高エネルギーの印加が必要であった。
高エネルギーの印加をするために、記録時に長時間のパルスの印加が必要であるため書き込み速度が遅い、また、高温になるため記録媒体へのダメージが大きく打痕が発生しやすい、さらには記録装置の電源が大きくなってしまい書き変え装置が大きくなってしまうなどの問題があった。
However, many of the compounds described in Patent Document 14 have a high melting point, and it is necessary to heat to a high temperature during color development and decoloration, and application of high energy is necessary.
To apply high energy, it is necessary to apply a pulse for a long time during recording, so the writing speed is slow, and since the temperature is high, damage to the recording medium is large and dents are easily generated. There has been a problem that the power source of the apparatus becomes large and the rewriting apparatus becomes large.
一方、特許文献12に記載のフェノール化合物には比較的低融点のものも提案されているが、これらの化合物を用いた記録媒体は、発色感度は良好なものの画像の保存性が悪く、実用性の低いものであった。
On the other hand, phenol compounds having a relatively low melting point have been proposed as the phenol compounds described in
本発明の課題は、可逆性感熱記録媒体の顕色剤として用いられたとき、高い発色感度を有し、安定な発色性と消去性を保持し、優れた保存性を有する新規なフェノール化合物を提供することである。 An object of the present invention is to provide a novel phenol compound having high color development sensitivity, stable color development and erasability, and excellent storage stability when used as a developer for a reversible thermosensitive recording medium. Is to provide.
本発明者らは、このような発色剤と顕色剤の組成物の可逆的な発色消色現象では、長鎖脂肪族基をもつ顕色剤の発色剤を発色させる能力と分子間の凝集力のバランスが重要であると考え、種々の構造の化合物を設計、合成、検討した。その結果、特定の構造をもつフェノール化合物を顕色剤として用いることにより上記の課題が解決できることを見出した。 In the reversible coloring and decoloring phenomenon of such a color former and developer composition, the present inventors have shown that the ability of the developer having a long-chain aliphatic group to develop color and intermolecular aggregation. We thought that balance of force was important, and designed, synthesized, and studied compounds with various structures. As a result, it has been found that the above problem can be solved by using a phenol compound having a specific structure as a developer.
すなわち、上記課題は、本発明の、下記式(1)で表わされるフェノール化合物によって解決される。 That is, the said subject is solved by the phenolic compound represented by following formula (1) of this invention.
本発明のフェノール化合物は新規な化合物である。さらに、本発明の化合物を、顕色剤として用いた可逆性感熱記録媒体は発色感度、発色濃度が良好であって、かつ画像保存性に優れた実用性の高い書き替え記録を得ることができ、実用性の高い書き換え型記録媒体が得られる。 The phenolic compound of the present invention is a novel compound. Furthermore, a reversible thermosensitive recording medium using the compound of the present invention as a developer can provide reproducible recording with excellent color development sensitivity and color density and excellent image storage stability and high practicality. Thus, a highly practical rewritable recording medium can be obtained.
本発明は、下記式(1)で表わされる新規なフェノール化合物に関する。 The present invention relates to a novel phenol compound represented by the following formula (1).
このような新規なフェノール化合物は、例えば、長鎖脂肪族アミンから誘導される長鎖脂肪族イソシアネートを経由し、p−アミノフェノールとのカップリング反応により得られるし、長鎖脂肪酸または脂肪酸エステルから酸クロリド、次いでアジド化、イソシアネートを経由し、p−アミノフェノールとのカップリング反応により得られる。通常、p−アミノフェノールとのカップリング反応終了後、室温に戻し又はさらに冷却し、酸、例えば塩酸の親水性有機溶媒液を加え、析出物をろ別し、洗浄、乾燥後、適当な溶媒を用いて再結晶する。ヒドロキシル基とアミノ基を共に有している場合、ウレタン結合生成反応とカップリング反応が競争的になるが、p−アミノフェノールの場合、ベンゼン環の共鳴構造によってヒドロキシル基の電子供与性が減少するため縮合反応が優勢に進行し、高選択的に当該フェノール化合物を得ることができる。なお、本発明で用いる当該フェノール化合物は、この合成法に何ら限定されるものではない。 Such a novel phenol compound is obtained, for example, by a coupling reaction with p-aminophenol via a long-chain aliphatic isocyanate derived from a long-chain aliphatic amine, or from a long-chain fatty acid or a fatty acid ester. It is obtained by coupling reaction with p-aminophenol via acid chloride, then azidation and isocyanate. Usually, after completion of the coupling reaction with p-aminophenol, the solution is returned to room temperature or further cooled, a hydrophilic organic solvent solution of acid such as hydrochloric acid is added, the precipitate is filtered, washed and dried, and then an appropriate solvent. Recrystallize using When both the hydroxyl group and the amino group are present, the urethane bond formation reaction and the coupling reaction become competitive, but in the case of p-aminophenol, the electron donating property of the hydroxyl group is reduced due to the resonance structure of the benzene ring. Therefore, the condensation reaction proceeds predominantly, and the phenol compound can be obtained with high selectivity. The phenol compound used in the present invention is not limited to this synthesis method.
本発明のフェノール化合物である顕色剤を用いる可逆的感熱記録媒体は、加熱温度および/または加熱後の冷却速度により相対的に発色した状態と消色した状態を形成しうるものである。この基本的な発色・消色現象を説明する。 The reversible thermosensitive recording medium using the developer, which is the phenol compound of the present invention, can form a relatively colored state and a decolored state depending on the heating temperature and / or the cooling rate after heating. This basic coloring / decoloring phenomenon will be described.
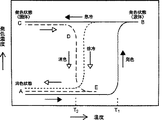
図1はこの記録媒体の発色濃度と温度との関係を示したものである。はじめ消色状態(A)にある記録媒体を昇温していくと、溶融し始める温度T1でロイコ染料と顕色剤が溶融混合し、発色が起こり溶融発色状態(B)となる。溶融発色状態(B)から急冷すると発色状態のまま室温に下げることができ、固定された発色状態(C)となる。この発色状態が得られるかどうかは、溶融状態からの降温の速度に依存しており、徐冷では降温の過程で消色が起き、はじめと同じ消色状態(A)あるいは急冷発色状態(C)より相対的に濃度の低い状態が形成される。一方、急冷発色状態(C)をふたたび昇温していくと発色温度より低い温度T2で消色が起き(DからE)、ここから降温するとはじめと同じ消色状態(A)に戻る。実際の発色温度、消色温度は、用いる顕色剤と発色剤の組合せにより変化するので目的に合わせて選択できる。また溶融発色状態の濃度と急冷したときの発色濃度は、必ずしも一致するものではなく、異なる場合もある。 FIG. 1 shows the relationship between the color density of this recording medium and the temperature. Introduction gradually heated the recording medium in the decolored state (A), leuco dye and the developer are mixed melt at temperatures T 1 begins to melt, coloring occurs a molten color developed state (B). When rapidly cooled from the melt color state (B), the color state can be lowered to room temperature and a fixed color state (C) is obtained. Whether or not this color development state is obtained depends on the rate of temperature decrease from the molten state, and in slow cooling, the color disappears during the temperature decrease, and the same color disappearance state (A) or rapid color development state (C ) A relatively low concentration state is formed. On the other hand, rapidly cooled colored state (C) is again raised gradually and discoloring occurs at a lower temperature T 2 than the coloring temperature (E from D), returns the beginning when the temperature decreases from here to the same decolored state (A). The actual color developing temperature and color erasing temperature vary depending on the combination of the developer and color former used, and can be selected according to the purpose. Further, the density of the melt coloring state and the coloring density when rapidly cooled are not necessarily the same and may be different.
本発明の顕色剤を用いた記録媒体では、溶融状態から急冷して得た発色状態(C)は顕色剤と発色剤が分子どうしで接触反応しうる状態で混合された状態であり、これは固体状態を形成していることが多い。この状態は顕色剤と発色剤が凝集して発色を保持した状態であり、この凝集構造の形成により発色が安定化していると考えられる。一方、消色状態は両者が相分離した状態である。この状態は少なくとも一方の化合物の分子が集合してドメインを形成したり結晶化した状態であり、凝集あるいは結晶化することにより発色剤と顕色剤が分離して安定化した状態であると考えられる。本発明の化合物では、両者が相分離し顕色剤が結晶化することによってより完全な消色が起きる。図1に示した溶融状態から徐冷による消色および発色状態からの昇温による消色は、いずれもこの温度で凝集構造が変化し、相分離や顕色剤の結晶化が起きている。 In the recording medium using the developer of the present invention, the colored state (C) obtained by quenching from the melted state is a state in which the developer and the color former are mixed in a state where they can contact each other between molecules, This often forms a solid state. This state is a state where the developer and the color former are aggregated to maintain the color development, and it is considered that the color development is stabilized by the formation of this aggregated structure. On the other hand, the decolored state is a state in which both phases are separated. This state is a state in which molecules of at least one compound aggregate to form a domain or crystallize, and the color former and developer are separated and stabilized by aggregation or crystallization. It is done. In the compound of the present invention, complete decolorization occurs when both of them are phase-separated and the developer is crystallized. In both the decoloring by slow cooling from the molten state and the decoloring by raising the temperature from the colored state shown in FIG. 1, the aggregation structure changes at this temperature, and phase separation and crystallization of the developer occur.
顕色剤は発色性と消色性を与える重要な基本骨格として、発色部位であるフェノール基と、構造を支配している水素結合性会合基及び長鎖脂肪族炭化水素基から成り立っている。これまで、発色部位であるフェノール基と構造に支配的な水素結合性会合基とのバランスに注力が注がれていた。その理由は発色状態の安定性は、顕色剤と発色剤の凝集構造が安定であるほど、より安定となると考えられてきたためである。そのために顕色剤分子構造中に水素結合性の会合基を1種乃至2種類以上導入することがこれまで検討されてきた。しかしながら、顕色剤分子の水素結合が強くなることや、水素結合の数が増えることで顕色剤が高融点なものとなり、発色開始温度が高くなり記録媒体の感度特性が低下してしまう問題が生じた。そのため本発明者らはもう一つの構造を支配していると考えられてきた長鎖脂肪族炭化水素基について着目し、発色性、消去性に優れている尿素基の両端にそれぞれフェノール基と脂肪族炭化水素基が修飾されている顕色剤について、その脂肪族炭化水素の長さのバランスについて検討することに注力した。しかし、顕色剤末端の脂肪族炭化水素基の炭素数を増加させる研究は、これまで検討されていなかった。これは、合成上の問題に他ならなかった。脂肪族炭化水素基の炭素数が18以下のものは、イソシアネート誘導体として市販されており、そのイソシアネートとアミン誘導体の縮合反応から容易に顕色剤が得られる。また、炭素数22までのものは脂肪酸アミンを用いることにより、ホスゲンを使ったイソシアネート化によって脂肪族アミンから誘導体を合成することができる。 The developer is composed of a phenol group that is a color development site, a hydrogen bonding associative group that controls the structure, and a long-chain aliphatic hydrocarbon group as an important basic skeleton that imparts color developability and color erasability. So far, efforts have been focused on the balance between the phenolic group that is the coloring site and the hydrogen-bonding associative group that is dominant in the structure. The reason is that it has been considered that the stability of the color development state becomes more stable as the aggregation structure of the developer and color former is more stable. Therefore, it has been studied so far to introduce one or more hydrogen bonding associative groups into the developer molecular structure. However, the problem is that the developer molecules have a high melting point due to the strong hydrogen bonds of the developer molecules and the increase in the number of hydrogen bonds, and the color development start temperature increases and the sensitivity characteristics of the recording medium deteriorate. Occurred. For this reason, the present inventors focused on a long-chain aliphatic hydrocarbon group that has been considered to dominate another structure, and a phenol group and an aliphatic group at both ends of the urea group, which are excellent in color developability and erasability, respectively. We focused on investigating the balance of the length of the aliphatic hydrocarbons of the developers with modified aromatic hydrocarbon groups. However, no research has been conducted so far to increase the number of carbon atoms of the aliphatic hydrocarbon group at the end of the developer. This was nothing but a synthesis problem. An aliphatic hydrocarbon group having 18 or less carbon atoms is commercially available as an isocyanate derivative, and a developer can be easily obtained from a condensation reaction of the isocyanate and an amine derivative. For those having up to 22 carbon atoms, a fatty acid amine can be used to synthesize a derivative from an aliphatic amine by isocyanate conversion using phosgene.
しかし、この方法では炭素数が23以上の顕色剤を合成することはできなかった。そこで、本発明者らは、鋭意研究の結果、新たな合成方法を見つけ出し、23以上の脂肪酸から本発明の化学式(1)で示す新規な顕色剤を作ることに成功した。その結果、長鎖脂肪族炭化水素基としてアルキル基の炭素数を長鎖化することで、発色状態の安定性が著しく向上することがわかった。特に、この種の記録媒体に求められる60℃の画像保存性に対して、アルキル基の炭素数が22以下の場合には発色状態の安定性が悪く、画像部の保存性に致命的な問題があったが、23以上にすることによって60℃での発色状態は著しく向上し、高い画像保持率を得ることができるようになった。
これは、発色状態からの消色開始温度がアルキル基の鎖長に依存し、炭素数22の場合には消色開始温度が60℃以下であるが、23以上にすることで消色開始温度が60℃以上となり、60℃の画像保存性に対して劇的な変化が現れている。
また、アルキル鎖長を長鎖化していっても、化合物の融点はほぼ一定であって上昇せず、発色感度の低下を引き起こす高融点化を伴わないことが明らかとなった。
さらに、炭素数23以上のアルキル基をもったこれらの顕色剤化合物は、発色状態が安定であるにもかかわらず、消色温度での短時間な加熱で十分に消色し、高速消去性にも優れたものである。
However, this method could not synthesize a developer having 23 or more carbon atoms. As a result of intensive studies, the present inventors have found a new synthesis method and succeeded in producing a novel developer represented by the chemical formula (1) of the present invention from 23 or more fatty acids. As a result, it was found that the stability of the colored state is remarkably improved by increasing the number of carbon atoms of the alkyl group as the long-chain aliphatic hydrocarbon group. In particular, in contrast to image storability at 60 ° C. required for this type of recording medium, when the carbon number of the alkyl group is 22 or less, the stability of the colored state is poor and the storability of the image area is fatal. However, the color development state at 60 ° C. was remarkably improved by setting it to 23 or more, and a high image retention rate could be obtained.
This is because the decolorization start temperature from the colored state depends on the chain length of the alkyl group, and in the case of 22 carbon atoms, the decolorization start temperature is 60 ° C. or less, but by setting it to 23 or more, the decoloration start temperature Is 60 ° C. or higher, and a dramatic change appears in the image storage stability at 60 ° C.
Further, it was revealed that even when the alkyl chain length is increased, the melting point of the compound is almost constant and does not increase, and the melting point is not increased to cause a decrease in color development sensitivity.
Furthermore, these developer compounds having an alkyl group having 23 or more carbon atoms are sufficiently decolored by heating in a short time at the decoloring temperature in spite of the stable color development state, and high-speed erasability. It is also excellent.
本発明と共に用いられる発色剤は電子供与性を示すものであり、単独又は混合して用いることができる。発色剤はそれ自体無色または淡色の染料前駆体であり、特に限定されず、たとえば、フタリド化合物、アザフタリド化合物、フルオラン化合物など公知の染料前駆体である。 The color former used together with the present invention exhibits an electron donating property and can be used alone or in combination. The color former itself is a colorless or light-colored dye precursor, and is not particularly limited. For example, the color former is a known dye precursor such as a phthalide compound, an azaphthalide compound, or a fluorane compound.
また、本発明と共に用いられるロイコ染料の具体例としては、以下のものが挙げられるが、何等これに限定されるものではない。
2−アニリノ−3−メチル−6−ジエチルアミノフルオラン、
2−アニリノ−3−メチル−6−ジ(n−ブチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−n−プロピル−N−メチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−イソプロピル−N−メチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−イソブチル−N−メチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−n−アミル−N−メチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−sec−ブチル−N−メチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−n−アミル−N−エチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−iso−アミル−N−エチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−n−プロピル−N−イソプロピルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−シクロヘキシル−N−メチルアミノ)フルオラン、
2−アニリノ−3−メチル−6−(N−エチル−p−トルイジノ)フルオラン、
2−アニリノ−3−メチル−6−(N−メチル−p−トルイジノ)フルオラン、
2−(m−トリクロロメチルアニリノ)−3−メチル−6−ジエチルアミノフルオラン、
2−(m−トリフロロメチルアニリノ)−3−メチル−6−ジエチルアミノフルオラン、
2−(m−トリクロロメチルアニリノ)−3−メチル−6−(N−シクロヘキシル−N−メチルアミノ)フルオラン、
2−(2,4−ジメチルアニリノ)−3−メチル−6−ジエチルアミノフルオラン、
2−(N−エチル−p−トルイジノ)−3−メチル−6−(N−エチルアニリノ)フルオラン、
2−(N−エチル−p−トルイジノ)−3−メチル−6−(N−プロピル−p−トルイジノ)フルオラン、
2−アニリノ−6−(N−n−ヘキシル−N−エチルアミノ)フルオラン、
2−(o−クロロアニリノ)−6−ジエチルアミノフルオラン、
2−(o−クロロアニリノ)−6−ジブチルアミノフルオラン、
2−(m−トリフロロメチルアニリノ)−6−ジエチルアミノフルオラン、
2,3−ジメチル−6−ジメチルアミノフルオラン、
3−メチル−6−(N−エチル−p−トルイジノ)フルオラン、
2−クロロ−6−ジエチルアミノフルオラン、
2−ブロモ−6−ジエチルアミノフルオラン、
2−クロロ−6−ジプロピルアミノフルオラン、
3−クロロ−6−シクロヘキシルアミノフルオラン、
3−ブロモ−6−シクロヘキシルアミノフルオラン、
2−クロロ−6−(N−エチル−N−イソアミルアミノ)フルオラン、
2−クロロ−3−メチル−6−ジエチルアミノフルオラン、
2−アニリノ−3−クロロ−6−ジエチルアミノフルオラン、
2−(o−クロロアニリノ)−3−クロロ−6−シクロヘキシルアミノフルオラン、
2−(m−トリフロロメチルアニリノ)−3−クロロ−6−ジエチルアミノフルオラン、
2−(2,3−ジクロロアニリノ)−3−クロロ−6−ジエチルアミノフルオラン、
1,2−ベンゾ−6−ジエチルアミノフルオラン、
3−ジエチルアミノ−6−(m−トリフロロメチルアニリノ)フルオラン、
3−(1−エチル−2−メチルインドール−3−イル)−3−(2−エトキシ−4−ジエチルアミノフェニル)−4−アザフタリド、
3−(1−エチル−2−メチルインドール−3−イル)−3−(2−エトキシ−4−ジエチルアミノフェニル)−7−アザフタリド、
3−(1−オクチル−2−メチルインドール−3−イル)−3−(2−エトキシ−4−ジエチルアミノフェニル)−4−アザフタリド、
3−(1−エチル−2−メチルインドール−3−イル)−3−(2−メチル−4−ジエチルアミノフェニル)−4−アザフタリド、
3−(1−エチル−2−メチルインドール−3−イル)−3−(2−メチル−4−ジエチルアミノフェニル)−7−アザフタリド、
3−(1−エチル−2−メチルインドール−3−イル)−3−(4−ジエチルアミノフェニル)−4−アザフタリド、
3−(1−エチル−2−メチルインドール−3−イル)−3−(4−N−n−アミル−N−メチルアミノフェニル)−4−アザフタリド、
3−(1−メチル−2−メチルインドール−3−イル)−3−(2−ヘキシルオキシ−4−ジエチルアミノフェニル)−4−アザフタリド、
3,3−ビス(2−エトキシ−4−ジエチルアミノフェニル)−4−アザフタリド、
3,3−ビス(2−エトキシ−4−ジエチルアミノフェニル)−7−アザフタリド等が挙げられる。
Specific examples of the leuco dye used together with the present invention include the following, but the leuco dye is not limited thereto.
2-anilino-3-methyl-6-diethylaminofluorane,
2-anilino-3-methyl-6-di (n-butylamino) fluorane,
2-anilino-3-methyl-6- (Nn-propyl-N-methylamino) fluorane,
2-anilino-3-methyl-6- (N-isopropyl-N-methylamino) fluorane,
2-anilino-3-methyl-6- (N-isobutyl-N-methylamino) fluorane,
2-anilino-3-methyl-6- (Nn-amyl-N-methylamino) fluorane,
2-anilino-3-methyl-6- (N-sec-butyl-N-methylamino) fluorane,
2-anilino-3-methyl-6- (Nn-amyl-N-ethylamino) fluorane,
2-anilino-3-methyl-6- (N-iso-amyl-N-ethylamino) fluorane,
2-anilino-3-methyl-6- (Nn-propyl-N-isopropylamino) fluorane,
2-anilino-3-methyl-6- (N-cyclohexyl-N-methylamino) fluorane,
2-anilino-3-methyl-6- (N-ethyl-p-toluidino) fluorane,
2-anilino-3-methyl-6- (N-methyl-p-toluidino) fluorane,
2- (m-trichloromethylanilino) -3-methyl-6-diethylaminofluorane,
2- (m-trifluoromethylanilino) -3-methyl-6-diethylaminofluorane,
2- (m-trichloromethylanilino) -3-methyl-6- (N-cyclohexyl-N-methylamino) fluorane,
2- (2,4-dimethylanilino) -3-methyl-6-diethylaminofluorane,
2- (N-ethyl-p-toluidino) -3-methyl-6- (N-ethylanilino) fluorane,
2- (N-ethyl-p-toluidino) -3-methyl-6- (N-propyl-p-toluidino) fluorane,
2-anilino-6- (Nn-hexyl-N-ethylamino) fluorane,
2- (o-chloroanilino) -6-diethylaminofluorane,
2- (o-chloroanilino) -6-dibutylaminofluorane,
2- (m-trifluoromethylanilino) -6-diethylaminofluorane,
2,3-dimethyl-6-dimethylaminofluorane,
3-methyl-6- (N-ethyl-p-toluidino) fluorane,
2-chloro-6-diethylaminofluorane,
2-bromo-6-diethylaminofluorane,
2-chloro-6-dipropylaminofluorane,
3-chloro-6-cyclohexylaminofluorane,
3-bromo-6-cyclohexylaminofluorane,
2-chloro-6- (N-ethyl-N-isoamylamino) fluorane,
2-chloro-3-methyl-6-diethylaminofluorane,
2-anilino-3-chloro-6-diethylaminofluorane,
2- (o-chloroanilino) -3-chloro-6-cyclohexylaminofluorane,
2- (m-trifluoromethylanilino) -3-chloro-6-diethylaminofluorane,
2- (2,3-dichloroanilino) -3-chloro-6-diethylaminofluorane,
1,2-benzo-6-diethylaminofluorane,
3-diethylamino-6- (m-trifluoromethylanilino) fluorane,
3- (1-ethyl-2-methylindol-3-yl) -3- (2-ethoxy-4-diethylaminophenyl) -4-azaphthalide,
3- (1-ethyl-2-methylindol-3-yl) -3- (2-ethoxy-4-diethylaminophenyl) -7-azaphthalide,
3- (1-octyl-2-methylindol-3-yl) -3- (2-ethoxy-4-diethylaminophenyl) -4-azaphthalide,
3- (1-ethyl-2-methylindol-3-yl) -3- (2-methyl-4-diethylaminophenyl) -4-azaphthalide,
3- (1-ethyl-2-methylindol-3-yl) -3- (2-methyl-4-diethylaminophenyl) -7-azaphthalide,
3- (1-ethyl-2-methylindol-3-yl) -3- (4-diethylaminophenyl) -4-azaphthalide,
3- (1-ethyl-2-methylindol-3-yl) -3- (4-Nn-amyl-N-methylaminophenyl) -4-azaphthalide,
3- (1-methyl-2-methylindol-3-yl) -3- (2-hexyloxy-4-diethylaminophenyl) -4-azaphthalide,
3,3-bis (2-ethoxy-4-diethylaminophenyl) -4-azaphthalide,
3,3-bis (2-ethoxy-4-diethylaminophenyl) -7-azaphthalide and the like.
本発明の化合物である顕色剤と発色剤の割合は、使用する化合物の組み合わせにより適切な範囲が変化するが、おおむねモル比で発色剤1に対し本発明の化合物が0.1から20の範囲であり、好ましくは0.2から10の範囲である。この範囲より顕色剤が少なくても多くても発色状態の濃度が低下し問題となる。また、発色剤と顕色剤はマイクロカプセル中に内包して用いることもできる。 The ratio of the developer and the color former, which is the compound of the present invention, varies in an appropriate range depending on the combination of the compounds used, but the molar ratio of the compound of the present invention is 0.1 to 20 with respect to the color former 1. Range, preferably in the range of 0.2 to 10. If the amount of the developer is less or more than this range, the density of the colored state is lowered, which causes a problem. In addition, the color former and the developer can be used in a microcapsule.
本発明の化合物である顕色剤を用いた記録媒体において、ロイコ染料、顕色剤とともに可逆性感熱記録層の形成に用いられるバインダー樹脂としては、たとえばポリ塩化ビニル、ポリ酢酸ビニル、塩化ビニル酢酸ビニル共重合体、エチルセルロース、ポリスチレン、スチレン系共重合体、フェノキシ樹脂、ポリエステル、芳香族ポリエステル、ポリウレタン、ポリカーボネート、ポリアクリル酸エステル、ポリメタクリル酸エステル、アクリル酸系共重合体、マレイン酸系共重合体、ポリビニルアルコール、変性ポリビニルアルコール、ヒドロキシエチルセルロース、カルボキシメチルセルロース、デンプン類などがある。これらのバインダー樹脂の役割は、組成物の各材料が記録消去の熱印加によって片寄ることなく均一に分散した状態を保つことにある。したがって、バインダー樹脂には耐熱性の高い樹脂を用いることが好ましい。たとえば、熱、紫外線、電子線などで、バインダー樹脂を架橋させてもよい。 In the recording medium using the developer which is the compound of the present invention, the binder resin used for forming the reversible thermosensitive recording layer together with the leuco dye and the developer is, for example, polyvinyl chloride, polyvinyl acetate, vinyl chloride acetic acid. Vinyl copolymer, ethyl cellulose, polystyrene, styrene copolymer, phenoxy resin, polyester, aromatic polyester, polyurethane, polycarbonate, polyacrylate ester, polymethacrylate ester, acrylic acid copolymer, maleic acid copolymer There are coalesced, polyvinyl alcohol, modified polyvinyl alcohol, hydroxyethyl cellulose, carboxymethyl cellulose, starches and the like. The role of these binder resins is to keep the materials of the composition uniformly dispersed without being displaced by the application of heat for recording and erasing. Therefore, it is preferable to use a resin having high heat resistance as the binder resin. For example, the binder resin may be crosslinked with heat, ultraviolet light, electron beam, or the like.
本発明の化合物である顕色剤を用いた記録媒体で用いられる架橋状態にある樹脂としては、具体的にはアクリルポリオール樹脂、ポリエステルポリオール樹脂、ポリウレタンポリオール樹脂、フェノキシ樹脂、ポリビニルブチラール樹脂、セルロースアセテートプロピオネート、セルロースアセテートブチレートなど架橋剤と反応する基を持つ樹脂、または架橋剤と反応する基を持つモノマーとそれ以外のモノマーを共重合した樹脂などが挙げられるが、これらの材料に限定されるものではない。 Specific examples of the crosslinked resin used in the recording medium using the developer which is the compound of the present invention include acrylic polyol resin, polyester polyol resin, polyurethane polyol resin, phenoxy resin, polyvinyl butyral resin, and cellulose acetate. Resin having a group that reacts with a crosslinking agent such as propionate and cellulose acetate butyrate, or a resin copolymerized with a monomer having a group that reacts with a crosslinking agent and other monomers, but is limited to these materials Is not to be done.
更に、好ましくは、水酸基価70(KOHmg/g)以上の樹脂が含有される(当初用いられる)が、水酸基価70(KOHmg/g)以上の樹脂としては、アクリルポリオール樹脂、ポリエステルポリオール樹脂、ポリウレタンポリオール樹脂などが用いられるが、本発明の化合物を用いる場合、発色の安定性が良好で、消色性が良好であることから、アクリルポリオール樹脂が好ましく用いられる。水酸基価としては70(KOHmg/g)以上であり、特に好ましくは90(KOHmg/g)以上である。水酸基価の大小は架橋密度に影響するため塗膜の耐化学薬品性、物性などを左右する。本発明者らは、水酸基価が70(KOHmg/g)以上で耐久性、塗膜表面硬度、ワレ抵抗性が向上することを見い出した。水酸基価70(KOHmg/g)以上の樹脂が用いられた可逆性感熱記録媒体であるか否かは、残存水酸基の量やエーテル結合の量を分析すること等により確認することができる。 Further, preferably, a resin having a hydroxyl value of 70 (KOHmg / g) or more is contained (initially used). As the resin having a hydroxyl value of 70 (KOHmg / g) or more, acrylic polyol resin, polyester polyol resin, polyurethane A polyol resin or the like is used. When the compound of the present invention is used, an acrylic polyol resin is preferably used because of good color development stability and good decoloring properties. The hydroxyl value is 70 (KOHmg / g) or more, particularly preferably 90 (KOHmg / g) or more. The magnitude of the hydroxyl value affects the crosslink density and thus affects the chemical resistance and physical properties of the coating film. The present inventors have found that durability, coating film surface hardness, and crack resistance are improved when the hydroxyl value is 70 (KOHmg / g) or more. Whether or not it is a reversible thermosensitive recording medium using a resin having a hydroxyl value of 70 (KOHmg / g) or more can be confirmed by analyzing the amount of residual hydroxyl groups and the amount of ether bonds.
また、アクリルポリオール樹脂においては構成の違いによってその特性に違いがあり、水酸基モノマーとしてヒドロキシエチルアクリレート(HEA)、ヒドロキシプロピルアクリレート(HPA)、2−ヒドロキシエチルメタクリレート(HEMA)、2−ヒドロキシプロピルメタクリレート(HPMA)、2−ヒドロキシブチルモノアクリレート(2−HBA)、1,4―ヒドロキシブチルモノアクリレート(1−HBA)などが用いられるが、特に第1級水酸基をもつモノマーを使用した方が塗膜のワレ抵抗性や耐久性が良いことから、2−ヒドロキシエチルメタクリレートが好ましく用いられる。 In addition, acrylic polyol resins have different characteristics depending on the structure. Hydroxyethyl acrylate (HEA), hydroxypropyl acrylate (HPA), 2-hydroxyethyl methacrylate (HEMA), 2-hydroxypropyl methacrylate ( HPMA), 2-hydroxybutyl monoacrylate (2-HBA), 1,4-hydroxybutyl monoacrylate (1-HBA), etc. are used, but it is particularly preferable to use a monomer having a primary hydroxyl group. Since the crack resistance and durability are good, 2-hydroxyethyl methacrylate is preferably used.
硬化剤としては、従来公知のイソシアネート類、アミン類、フェノール類、エポキシ化合物等が挙げられる。その中でもイソシアネート系硬化剤が好ましく用いられる。ここで用いられるイソシアネート系化合物は、公知のイソシアネート単量体のウレタン変性体、アロファネート変性体、イソシアヌレート変性体、ビュレット変性体、カルボジイミド変性体、ブロックドイソシアネートなどの変性体から選択される。また、変性体を形成するイソシアネート単量体としては、トリレンジイソシアネート(TDI)、4,4’−ジフェニルメタンジイソシアネート(MDI)、キシリレンジイソシアネート(XDI)、ナフチレンジイソシアネート(NDI)、パラフェニレンジイソシアネート(PPDI)、テトラメチルキシリレンジイソシアネート(TMXDI)、ヘキサメチレンジイソシアネート(HDI)、ジシクロヘキシルメタンジイソシアネート(HMDI)、イソフォロンジイソシアネート(IPDI)、リジンジイソシアネート(LDI)、イソプロピリデンビス(4−シクロヘキシルイソシアネート)(IPC)、シクロヘキシルジイソシアネート(CHDI)、トリジンジイソシアネート(TODI)、等が挙げられるが、これらの化合物に限定されるものではない。 Examples of the curing agent include conventionally known isocyanates, amines, phenols, epoxy compounds and the like. Of these, isocyanate curing agents are preferably used. The isocyanate compound used here is selected from known modified urethane monomers, allophanate-modified, isocyanurate-modified, burette-modified, carbodiimide-modified, blocked isocyanate and the like. The isocyanate monomer that forms the modified product includes tolylene diisocyanate (TDI), 4,4′-diphenylmethane diisocyanate (MDI), xylylene diisocyanate (XDI), naphthylene diisocyanate (NDI), paraphenylene diisocyanate ( PPDI), tetramethylxylylene diisocyanate (TMXDI), hexamethylene diisocyanate (HDI), dicyclohexylmethane diisocyanate (HMDI), isophorone diisocyanate (IPDI), lysine diisocyanate (LDI), isopropylidenebis (4-cyclohexylisocyanate) (IPC) ), Cyclohexyl diisocyanate (CHDI), tolidine diisocyanate (TODI), and the like. The present invention is not limited to.
更に、架橋促進剤としてこの種の反応に用いられる触媒を用いてもよい。架橋促進剤としては、例えば1,4−ジアザ−ビシクロ[2,2,2]オクタンなどの3級アミン類、有機すず化合物などの金属化合物などが挙げられる。また、硬化剤は添加した全量が架橋反応をしていても、していなくても良い。すなわち、未反応硬化剤が存在していても良い。この種の架橋反応は経時的に進行するため、未反応の硬化剤が存在していることは架橋反応が全く進行していないことを示すのではなく、未反応の硬化剤が検出されたとしても、架橋状態にある樹脂が存在しないということにはならない。また、本発明におけるポリマーが架橋状態にあるのか非架橋状態にあるのかを区別する方法として、塗膜を溶解性の高い溶媒中に浸すことによって区別することができる。すなわち、非架橋状態にあるポリマーは、溶媒中に該ポリマーが溶け出し溶質中には残らなくなるため、溶質のポリマー構造の有無を分析すればよい。 Furthermore, you may use the catalyst used for this kind of reaction as a crosslinking accelerator. Examples of the crosslinking accelerator include tertiary amines such as 1,4-diaza-bicyclo [2,2,2] octane, and metal compounds such as organic tin compounds. Further, the total amount of the curing agent may or may not undergo a crosslinking reaction. That is, an unreacted curing agent may be present. Since this type of crosslinking reaction proceeds over time, the presence of an unreacted curing agent does not indicate that the crosslinking reaction has progressed at all, but an unreacted curing agent is detected. However, this does not mean that there is no resin in a crosslinked state. Further, as a method for distinguishing whether the polymer in the present invention is in a crosslinked state or in a non-crosslinked state, it can be distinguished by immersing the coating film in a highly soluble solvent. That is, since the polymer in the non-crosslinked state dissolves in the solvent and does not remain in the solute, the presence or absence of the polymer structure of the solute may be analyzed.
さらに、本発明によれば、上記の顕色剤、ロイコ染料とともに、直鎖の炭化水素基やアミド基や尿素基などの水素結合基などをもった発色消色制御剤を記録層中に含有させることにより、発色画像の保存安定性が良好であるとともに、消色時の消色性も向上して良好な消去性を得ることができる。 Furthermore, according to the present invention, the recording layer contains a color development / decoloration control agent having a linear hydrocarbon group, a hydrogen bond group such as an amide group or a urea group, and the like together with the developer and the leuco dye. As a result, the storage stability of the color image is good, and the erasability at the time of erasing is also improved to obtain good erasability.
また、可逆性感熱記録層上に架橋状態にある樹脂を含有する保護層を設けることができる。該保護層に用いられる樹脂としては、前述の記録層と同様の熱硬化樹脂、紫外線硬化樹脂、電子線硬化樹脂が用いられる。 Further, a protective layer containing a resin in a crosslinked state can be provided on the reversible thermosensitive recording layer. As the resin used for the protective layer, the same thermosetting resin, ultraviolet curable resin, and electron beam curable resin as those used for the recording layer are used.
該保護層中に用いる樹脂として、特に好ましくは、紫外線吸収基を分子構造中に有した紫外線吸収性ポリマーが用いられる。 As the resin used in the protective layer, an ultraviolet absorbing polymer having an ultraviolet absorbing group in the molecular structure is particularly preferably used.
紫外線吸収性ポリマーとしては紫外線吸収基を有した単量体と、架橋可能な官能基を有した単量体をもつポリマーが好ましく用いられ、紫外線吸収基を有した単量体としては、(2’−ヒドロキシ−5’−メタクリロキシエチルフェニル)−2H−ベンゾトリアゾール、2−(2’−ヒドロキシ−5’−メチルフェニル)ベンゾトリアゾール、2−(2’−ヒドロキシ−3’−ω−ブチル−5’−メチルフェニル)−5−クロロベンゾトリアゾールなどのベンゾトリアゾール骨格を有した単量体が特に好ましく用いられる。 As the ultraviolet absorbing polymer, a monomer having an ultraviolet absorbing group and a polymer having a monomer having a crosslinkable functional group are preferably used. As the monomer having an ultraviolet absorbing group, (2 '-Hydroxy-5'-methacryloxyethylphenyl) -2H-benzotriazole, 2- (2'-hydroxy-5'-methylphenyl) benzotriazole, 2- (2'-hydroxy-3'-ω-butyl- A monomer having a benzotriazole skeleton such as 5′-methylphenyl) -5-chlorobenzotriazole is particularly preferably used.
また、官能基を含む単量体としては、例えば2−イソプロペニル−2−オキサゾリン、2−アジリジニルエチル(メタ)アクリレート、メタクリル酸、グリシジル(メタ)アクリレート、ヒドロキシルエチル(メタ)アクリレート、ヒドロキシルプロピル(メタ)アクリレート、ジメチルアミノエチル(メタ)アクリレート、ジエチルアミノエチル(メタ)アクリレート、t−ブチルアミノエチル(メタ)アクリレート、テトラヒドロフルフリル(メタ)アクリレートなどが挙げられるが、なかでもヒドロキシルエチル(メタ)アクリレート、ヒドロキシルプロピル(メタ)アクリレートなどが特に好ましく用いられる。 Examples of the monomer containing a functional group include 2-isopropenyl-2-oxazoline, 2-aziridinylethyl (meth) acrylate, methacrylic acid, glycidyl (meth) acrylate, hydroxylethyl (meth) acrylate, hydroxyl Examples include propyl (meth) acrylate, dimethylaminoethyl (meth) acrylate, diethylaminoethyl (meth) acrylate, t-butylaminoethyl (meth) acrylate, and tetrahydrofurfuryl (meth) acrylate, among which hydroxylethyl (meth) ) Acrylate, hydroxylpropyl (meth) acrylate and the like are particularly preferably used.
更に塗膜強度アップや耐熱性向上のために、紫外線吸収性基を含む単量体と官能基を含む単量体の共重合体に下記に示す単量体を共重合させてもよい。例えば、スチレン、スチレン−ブタジエン、スチレン−イソブチレン、エチレン酢酸ビニル、酢酸ビニル、メタクリロニトリル、ビニルアルコール、ビニルピロリドン、アクリロニトリル、メタアクリロニトリルなどのモノマー群;アクリル酸、メチル(メタ)アクリレート、エチル(メタ)アクリレート、プロピル(メタ)アクリレート、ブチル(メタ)アクリレート、イソブチル(メタ)アクリレート、t−ブチル(メタ)アクリレート、エチルヘキシル(メタ)アクリレート、オクチル(メタ)アクリレート、イソデシル(メタ)アクリレート、ラウリル(メタ)アクリレート、ラウリルトリデシル(メタ)アクリレート、トリデシル(メタ)アクリレート、セチルステアリル(メタ)アクリレート、ステアリル(メタ)アクリレート、シクロヘキシル(メタ)アクリレート、ベンジル(メタ)アクリレートなどの官能基を含まない(メタ)アクリル酸エステル群;エチレンジ(メタ)アクリレート、ジエチレングリコールジ(メタ)アクリレート、トリエチレングリコールジ(メタ)アクリレート、テトラエチレングリコールジ(メタ)アクリレート、デカエチレングリコールジ(メタ)アクリレート、ペンタコンタヘクタエチレングリコール(メタ)アクリレート、ブチレンジ(メタ)アクリレート、ペンタエリスリトールテトラ(メタ)アクリレート、トリメチロールプロパントリ(メタ)アクリレート、ペンタデカエチレングリコールジ(メタ)アクリレート、フタル酸ジエチレングリコールジ(メタ)アクリレートなど1分子中に2個以上の重合性2重結合を有するモノマー群などから挙げられ、特に限定されるものではないが、なかでもスチレン、メチル(メタ)アクリレート、エチル(メタ)アクリレート、プロピル(メタ)アクリレート、ブチル(メタ)アクリレート、イソブチル(メタ)アクリレート、t−ブチル(メタ)アクリレートなどが特に好ましく用いられる。また、必要に応じて2種以上を併用することもできる。 Furthermore, in order to increase the strength of the coating film and improve heat resistance, the following monomers may be copolymerized with a copolymer of a monomer containing an ultraviolet absorbing group and a monomer containing a functional group. For example, monomer groups such as styrene, styrene-butadiene, styrene-isobutylene, ethylene vinyl acetate, vinyl acetate, methacrylonitrile, vinyl alcohol, vinyl pyrrolidone, acrylonitrile, methacrylonitrile; acrylic acid, methyl (meth) acrylate, ethyl (meth ) Acrylate, propyl (meth) acrylate, butyl (meth) acrylate, isobutyl (meth) acrylate, t-butyl (meth) acrylate, ethylhexyl (meth) acrylate, octyl (meth) acrylate, isodecyl (meth) acrylate, lauryl (meth) ) Acrylate, lauryl tridecyl (meth) acrylate, tridecyl (meth) acrylate, cetyl stearyl (meth) acrylate, stearyl (meth) acrylate (Meth) acrylic acid ester groups not containing functional groups such as cyclohexyl (meth) acrylate and benzyl (meth) acrylate; ethylene di (meth) acrylate, diethylene glycol di (meth) acrylate, triethylene glycol di (meth) acrylate, tetraethylene Glycol di (meth) acrylate, decaethylene glycol di (meth) acrylate, pentacontahector ethylene glycol (meth) acrylate, butylene di (meth) acrylate, pentaerythritol tetra (meth) acrylate, trimethylolpropane tri (meth) acrylate, penta Decaethylene glycol di (meth) acrylate, phthalic acid diethylene glycol di (meth) acrylate, etc. have two or more polymerizable double bonds in one molecule Although it is mentioned from a monomer group etc., it is not particularly limited, among them, styrene, methyl (meth) acrylate, ethyl (meth) acrylate, propyl (meth) acrylate, butyl (meth) acrylate, isobutyl (meth) acrylate, Particularly preferred is t-butyl (meth) acrylate. Moreover, 2 or more types can also be used together as needed.
以上より、本発明の化合物を用いた可逆性感熱記録媒体中の紫外線吸収構造を有するポリマーの具体的な好ましい例としては、2−(2’−ヒドロキシ−5’−メタクリロキシエチルフェニル)−2H−ベンゾトリアゾールとメタクリル酸2−ヒドロキシエチルとスチレンからなる共重合体、2−(2’−ヒドロキシ−5’−メチルフェニル)ベンゾトリアゾールとメタクリル酸−2−ヒドロキシプロピルとメタクリル酸メチルからなる共重合体などが挙げられるが、特に限定されるものではない。 From the above, specific preferred examples of the polymer having an ultraviolet absorption structure in the reversible thermosensitive recording medium using the compound of the present invention include 2- (2′-hydroxy-5′-methacryloxyethylphenyl) -2H. -Copolymer consisting of benzotriazole, 2-hydroxyethyl methacrylate and styrene, Copolymer consisting of 2- (2'-hydroxy-5'-methylphenyl) benzotriazole, 2-hydroxypropyl methacrylate and methyl methacrylate Examples include coalescence, but are not particularly limited.
さらに、該保護層中に紫外線吸収能を有する無機微粒子を含有することができる。
本発明の化合物である顕色剤を用いた記録媒体で用いられる無機顔料は0.1μm以下の平均粒径を有する顔料ならば任意である。このような無機顔料としては酸化亜鉛、酸化インジウム、アルミナ、シリカ、酸化ジルコニウム、酸化スズ、酸化セリウム、酸化鉄、酸化アンチモン、酸化バリウム、酸化カルシウム、酸化ビスマス、酸化ニッケル、酸化マグネシウム、酸化クロム、酸化マンガン、酸化タンタル、酸化ニオブ、酸化トリウム、酸化ハフニウム、酸化モリブデン、鉄フェライト、ニッケルフェライト、コバルトフェライト、チタン酸バリウム、チタン酸カリウムのような金属酸化物及びこれらの複合酸化物、硫化亜鉛、硫酸バリウムのような金属硫化物あるいは硫酸化合物、チタンカーバイド、シリコンカーバイド、モリブデンカーバイド、タングステンカーバイド、タンタルカーバイドのような金属炭化物、窒化アルミニウム、窒化珪素、窒化ホウ素、窒化ジルコニウム、窒化バナジウム、窒化チタニウム、窒化ニオブ、窒化ガリウムのような金属窒化物等が挙げられる。
Furthermore, the protective layer can contain inorganic fine particles having ultraviolet absorbing ability.
The inorganic pigment used in the recording medium using the developer which is the compound of the present invention is optional as long as it has a mean particle diameter of 0.1 μm or less. Examples of such inorganic pigments include zinc oxide, indium oxide, alumina, silica, zirconium oxide, tin oxide, cerium oxide, iron oxide, antimony oxide, barium oxide, calcium oxide, bismuth oxide, nickel oxide, magnesium oxide, chromium oxide, Manganese oxide, tantalum oxide, niobium oxide, thorium oxide, hafnium oxide, molybdenum oxide, iron ferrite, nickel ferrite, cobalt ferrite, barium titanate, metal oxides such as potassium titanate and complex oxides thereof, zinc sulfide, Metal sulfides such as barium sulfate or sulfate compounds, titanium carbide, silicon carbide, molybdenum carbide, tungsten carbide, metal carbides such as tantalum carbide, aluminum nitride, silicon nitride, boron nitride, nitride Rukoniumu, vanadium nitride, titanium nitride, niobium nitride, and metal nitrides such as gallium nitride.
この中でも特に好ましいのは400nm以下の波長領域に吸収端を有する顔料である。
このような顔料は、紫外線UV−A領域、即ち波長320〜400nmの紫外線UV−A領域に吸収端を有する顔料(A)および紫外線UV−A領域より短波長側に吸収端を有する無機顔料(B)の2群に分類できる。無機顔料(A)あるいは無機顔料(B)を単独で用いることもできるが、無機顔料(A)と無機顔料(B)を併用する事により効果がより顕著になる。無機顔料(A)あるいは無機顔料(B)を単独で用いる場合にはこれらの顔料を中間層あるいは保護層のいずれかに含有させることができる。また無機顔料(A)と無機顔料(B)を併用する場合にはこれらの顔料を同時に中間層あるいは保護層に含有させることができるが、無機顔料(A)と無機顔料(B)を中間層と保護層に別々に含有させることもできる。この場合無機顔料(A)を中間層に含有させ、無機顔料(B)を保護層に含有させることにより、紫外吸収能の効果が一層顕著に発揮される。
Among these, a pigment having an absorption edge in a wavelength region of 400 nm or less is particularly preferable.
Such a pigment includes a pigment (A) having an absorption edge in the ultraviolet UV-A region, that is, an ultraviolet UV-A region having a wavelength of 320 to 400 nm, and an inorganic pigment having an absorption edge on the shorter wavelength side than the ultraviolet UV-A region ( B) can be classified into two groups. The inorganic pigment (A) or the inorganic pigment (B) can be used alone, but the effect becomes more remarkable by using the inorganic pigment (A) and the inorganic pigment (B) in combination. When the inorganic pigment (A) or the inorganic pigment (B) is used alone, these pigments can be contained in either the intermediate layer or the protective layer. In the case where the inorganic pigment (A) and the inorganic pigment (B) are used in combination, these pigments can be simultaneously contained in the intermediate layer or the protective layer, but the inorganic pigment (A) and the inorganic pigment (B) are included in the intermediate layer. And can be contained separately in the protective layer. In this case, by incorporating the inorganic pigment (A) in the intermediate layer and the inorganic pigment (B) in the protective layer, the effect of ultraviolet absorbing ability is more remarkably exhibited.
無機顔料(A)の具体例としては硫化亜鉛、酸化チタン、酸化インジウム、酸化セリウム、酸化スズ、酸化モリブデン、酸化亜鉛、窒化ガリウム等が挙げられる。
また無機顔料(B)の具体例としてはシリカ、アルミナ、シリカ−アルミナ、酸化アンチモン、酸化マグネシウム、酸化ジルコニウム、酸化バリウム、酸化カルシウム、酸化ストロンチウム、窒化珪素、窒化アルミニウム、窒化ホウ素、硫酸バリウム等が挙げられる。
Specific examples of the inorganic pigment (A) include zinc sulfide, titanium oxide, indium oxide, cerium oxide, tin oxide, molybdenum oxide, zinc oxide, and gallium nitride.
Specific examples of the inorganic pigment (B) include silica, alumina, silica-alumina, antimony oxide, magnesium oxide, zirconium oxide, barium oxide, calcium oxide, strontium oxide, silicon nitride, aluminum nitride, boron nitride, and barium sulfate. Can be mentioned.
さらに、本発明の化合物である顕色剤を用いた記録媒体の保護層中にこの種の記録媒体に使用される無機/有機のフィラー、滑剤などを用いても良い。 Furthermore, inorganic / organic fillers, lubricants and the like used for this type of recording medium may be used in the protective layer of the recording medium using the developer which is the compound of the present invention.
本発明の化合物である顕色剤を用いた記録媒体の支持体としては、紙、樹脂フィルム、PETフィルム、合成紙、金属箔、ガラスまたはこれらの複合体などであり、感熱記録層を保持できるものであればよい。また、必要に応じた厚みのものが単独あるいは貼り合わす等して用いることができる。すなわち、好ましくは60〜150μmで、数μm程度から数mm程度まで任意の厚みの支持体が用いられる。
また、これら支持体上に前記アンダー層を設ける場合、接着層を介して設けることにより、クラック発生防止やバリの発生が改善される。
該接着層は、上記の各層と同様の塗工方式等で形成することができる。
The support of the recording medium using the developer that is the compound of the present invention is paper, resin film, PET film, synthetic paper, metal foil, glass, or a composite thereof, and the like, and can hold a heat-sensitive recording layer. Anything is acceptable. Moreover, the thing of the thickness as needed can be used individually or by bonding. That is, it is preferably 60 to 150 μm, and a support having an arbitrary thickness from about several μm to about several mm is used.
Moreover, when providing the said under layer on these support bodies, crack generation | occurrence | production prevention and generation | occurrence | production of a burr | flash are improved by providing through an contact bonding layer.
The adhesive layer can be formed by the same coating method as that for each of the above layers.
本発明を下記実施例によって具体的に説明する。
実施例1(本発明のフェノール化合物の合成1)
The present invention will be specifically described by the following examples.
Example 1 (
実施例2(本発明のフェノール化合物の合成2)
Example 2 (
実施例3(本発明のフェノール化合物の合成3)
Example 3 (
実施例4(本発明のフェノール化合物の合成4)
Example 4 (
実施例5(本発明のフェノール化合物の合成5) Example 5 (Synthesis 5 of the phenolic compound of the present invention)
応用例1(可逆性感熱記録媒体の作成例)
[感熱記録層の作成]
実施例1のフェノール化合物 4部
Application Example 1 (Example of making a reversible thermosensitive recording medium)
[Creation of thermal recording layer]
4 parts of the phenolic compound of Example 1
(三菱レイヨン社製LR503 固形分濃度50%溶液) 9部
メチルエチルケトン 70部
上記組成物をボールミルを用いて平均粒径約1μmまで粉砕分散した。得られた分散液に2−アニリノ−3−メチル−6−ジブチルアミノフルオラン1.5部、日本ポリウレタン社製コロネートHL(アダクト型ヘキサメチレンジイソシアネート75%酢酸エチル溶液)2部を加え、良く攪拌し感熱記録層塗布液を調製した。
上記組成の感熱記録層塗布液を、厚さ188μmの白PETにワイヤーバーを用い塗布し、100℃2分で乾燥した後、60℃24時間加熱して、膜厚約11.0μmの記録層を設けた。
The thermal recording layer coating solution having the above composition was applied to white PET having a thickness of 188 μm using a wire bar, dried at 100 ° C. for 2 minutes, and then heated at 60 ° C. for 24 hours to form a recording layer having a thickness of about 11.0 μm. Was provided.
[保護層の作成]
紫外線吸収性ポリマーの40%溶液(日本触媒社製UV−G300) 10部
イソシアネート系架橋剤(日本ポリウレタン社製、コロネートHX) 1.4部
シリコーン系アクリル樹脂(東亞合成社製GS−1015) 0.5部
メチルエチルケトン 10部
以上の組成物を良く撹拌し、保護層塗布液を調整した。
上記組成の保護層塗布液を上記記録層上にワイヤーバーを用いて塗布し、100℃2分で乾燥した後、60℃24時間加熱して、厚さ約3.5μmの保護層を設け本発明の可逆性感熱記録媒体を作製した。
[Create protection layer]
40% solution of UV-absorbing polymer (UV-G300 manufactured by Nippon Shokubai Co., Ltd.) 10 parts Isocyanate-based crosslinking agent (manufactured by Nippon Polyurethane Co., Ltd., Coronate HX) 1.4 parts Silicone-based acrylic resin (GS-1015 manufactured by Toagosei Co., Ltd.) 0 .5 parts Methyl ethyl ketone 10 parts The above composition was well stirred to prepare a protective layer coating solution.
A protective layer coating solution having the above composition is applied onto the recording layer using a wire bar, dried at 100 ° C. for 2 minutes, and then heated at 60 ° C. for 24 hours to provide a protective layer having a thickness of about 3.5 μm. The reversible thermosensitive recording medium of the invention was produced.
応用例2
応用例1で用いた顕色剤の代わりに、実施例2の化合物を用いた他は応用例1と同様にして可逆性感熱記録媒体を作製した。
Application example 2
A reversible thermosensitive recording medium was produced in the same manner as in Application Example 1 except that the compound of Example 2 was used instead of the developer used in Application Example 1.
応用例3
応用例1で用いた顕色剤の代わりに、実施例3の化合物を用いた他は応用例1と同様にして可逆性感熱記録媒体を作製した。
Application example 3
A reversible thermosensitive recording medium was prepared in the same manner as in Application Example 1 except that the compound of Example 3 was used instead of the developer used in Application Example 1.
応用例4
応用例1で用いた顕色剤の代わりに、実施例4の化合物を用いた他は応用例1と同様にして可逆性感熱記録媒体を作製した。
Application example 4
A reversible thermosensitive recording medium was prepared in the same manner as in Application Example 1 except that the compound of Example 4 was used instead of the developer used in Application Example 1.
応用例5
応用例1で用いた顕色剤の代わりに、実施例5の化合物を用いた他は応用例1と同様にして可逆性感熱記録媒体を作製した。
Application example 5
A reversible thermosensitive recording medium was prepared in the same manner as in Application Example 1 except that the compound of Example 5 was used instead of the developer used in Application Example 1.
比較例1
応用例1で用いた顕色剤の代わりに、下記の化合物(融点145℃)を用いた他は応用例1と同様にして可逆性感熱記録媒体を作製した。
Comparative Example 1
A reversible thermosensitive recording medium was produced in the same manner as in Application Example 1 except that the following compound (melting point: 145 ° C.) was used instead of the developer used in Application Example 1.
比較例2
応用例1で用いた顕色剤の代わりに、下記の化合物(融点145℃)を用いた他は応用例1と同様にして可逆性感熱記録媒体を作製した。
Comparative Example 2
A reversible thermosensitive recording medium was produced in the same manner as in Application Example 1 except that the following compound (melting point: 145 ° C.) was used instead of the developer used in Application Example 1.
比較例3
応用例1で用いた顕色剤の代わりに、下記の化合物(融点171℃)を用いた他は応用例1と同様にして可逆性感熱記録媒体を作製した。
Comparative Example 3
A reversible thermosensitive recording medium was prepared in the same manner as in Application Example 1 except that the following compound (melting point: 171 ° C.) was used instead of the developer used in Application Example 1.
以上のように作製した可逆性感熱記録媒体について、以下のように試験を実施した。
試験1:発色特性
ビーコム社製感熱印字シミュレーターを用いてパルス幅2msecの条件で表1に記載の電圧で印字を行なった。発色濃度および地肌濃度をマクベス濃度計RD914を用いて測定した。結果を表2に示す。
The reversible thermosensitive recording medium produced as described above was tested as follows.
Test 1: Color development characteristics Printing was performed at the voltage shown in Table 1 under the condition of a pulse width of 2 msec using a thermal printing simulator manufactured by BCOM. The color density and background density were measured using a Macbeth densitometer RD914. The results are shown in Table 2.
試験2:消色特性
試験1と同様にビーコム社製感熱印字装置にて表中記載の電圧で印字した後、印字された部位に対して、同様の印字シミュレーターを用いてパルス幅2msecの条件で電圧を変えながらの階調印字により消去を行った。そのとき最も消去された部位を消去濃度とし、消去率を下記式により算出した。その結果を表3に示す。
消去率(%)=(1−(消去濃度−地肌濃度)/(発色濃度−地肌濃度))×100
なお、印字の電圧および消去に用いた電圧は記録媒体の発色感度、消色特性に応じて適切な条件を選択した。
Test 2: Decoloring characteristics After printing at the voltage shown in the table using a thermal printing apparatus manufactured by B.COM as in
Erase rate (%) = (1− (erase density−background density) / (color density−background density)) × 100
Appropriate conditions were selected for the printing voltage and the voltage used for erasing depending on the color development sensitivity and decoloring characteristics of the recording medium.
試験3:画像保存性
試験2で得た印字画像を60℃乾燥条件で24時間保存した。保存前後の濃度を試験1と同様にして測定した後、下記式にて画像保持率を算出した。その結果を表4に示す。
画像保持率(%)=(保存後画像濃度−保存後地肌濃度)/(保存前画像濃度−保存前地肌濃度)×100
Test 3: Image storability The printed image obtained in
Image retention (%) = (image density after storage−background density after storage) / (image density before storage−background density before storage) × 100
Claims (1)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006061855A JP4836613B2 (en) | 2005-03-17 | 2006-03-07 | Novel phenolic compounds |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005076409 | 2005-03-17 | ||
| JP2005076409 | 2005-03-17 | ||
| JP2006061855A JP4836613B2 (en) | 2005-03-17 | 2006-03-07 | Novel phenolic compounds |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006290874A JP2006290874A (en) | 2006-10-26 |
| JP4836613B2 true JP4836613B2 (en) | 2011-12-14 |
Family
ID=37411821
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006061855A Expired - Fee Related JP4836613B2 (en) | 2005-03-17 | 2006-03-07 | Novel phenolic compounds |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4836613B2 (en) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4943133B2 (en) * | 2006-12-19 | 2012-05-30 | 株式会社リコー | Reversible thermosensitive coloring composition and reversible thermosensitive recording medium using the same |
| JP2009061777A (en) | 2007-08-13 | 2009-03-26 | Ricoh Co Ltd | Reversible thermosensitive recording medium, reversible thermosensitive recording label, member, and image processing method |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3403757B2 (en) * | 1993-06-15 | 2003-05-06 | 三菱製紙株式会社 | Reversible thermosensitive recording material |
| JPH08169181A (en) * | 1994-12-19 | 1996-07-02 | Mitsubishi Paper Mills Ltd | Reversibly thermosensible recording material |
| JPH08244346A (en) * | 1995-03-08 | 1996-09-24 | Mitsubishi Paper Mills Ltd | Reversible thermal recording material |
| JP2003253175A (en) * | 2002-03-05 | 2003-09-10 | Ricoh Co Ltd | Inkjet thermal recording ink composition |
-
2006
- 2006-03-07 JP JP2006061855A patent/JP4836613B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006290874A (en) | 2006-10-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7553796B2 (en) | Phenol compound, reversible thermosensitive recording medium, reversible thermosensitive recording label, reversible thermosensitive recording member, image-processing apparatus and image-processing method | |
| US7456132B2 (en) | Phenol compound, reversible thermosensitive recording medium, reversible thermosensitive recording label, reversible thermosensitive recording member, image-processing apparatus and imaging-processing method | |
| JP4849947B2 (en) | Reversible thermosensitive coloring composition and reversible thermosensitive recording medium using the same | |
| JP4836613B2 (en) | Novel phenolic compounds | |
| JP2006289958A (en) | Reversible thermal recording medium | |
| JP4410704B2 (en) | Reversible thermosensitive recording medium | |
| JP2006273846A (en) | New phenol compound and reversible heat-sensitive recording medium using the same compound | |
| JP4464848B2 (en) | Reversible thermosensitive recording medium | |
| JP4546891B2 (en) | Reversible thermosensitive recording medium | |
| JP4628907B2 (en) | Reversible thermosensitive recording medium | |
| JP3752623B2 (en) | Reversible thermosensitive coloring composition and reversible thermosensitive recording medium using the same | |
| JP4397312B2 (en) | Reversible thermosensitive recording medium | |
| JP4567559B2 (en) | Reversible thermosensitive coloring composition and reversible thermosensitive recording medium using the same | |
| JP4414359B2 (en) | Reversible thermosensitive recording medium, reversible thermosensitive recording label, and image processing method therefor | |
| JP4944666B2 (en) | Reversible thermosensitive coloring composition and reversible thermosensitive recording medium using the same | |
| JP2007182004A (en) | Reversible thermal recording medium | |
| JP2006240188A (en) | Reversible thermal recording medium | |
| JP4943133B2 (en) | Reversible thermosensitive coloring composition and reversible thermosensitive recording medium using the same | |
| JP4761795B2 (en) | Phenolic compounds | |
| JP4879853B2 (en) | Reversible thermosensitive recording medium | |
| JP4467008B2 (en) | Reversible thermosensitive recording medium, image processing method and image processing apparatus using the same | |
| JP2008168494A (en) | Reversible thermal recording medium | |
| JP2004276410A (en) | Reversible heat sensitive recording medium | |
| JP2001105733A (en) | Method for manufacturing reversibly thermally recording medium | |
| JP2008036934A (en) | Reversible thermal color developing composition and reversible thermal recording medium using it |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20081120 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110922 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110927 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20141007 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4836613 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |