JP3819540B2 - Mammalian polypeptide having L-asparaginase activity - Google Patents
Mammalian polypeptide having L-asparaginase activity Download PDFInfo
- Publication number
- JP3819540B2 JP3819540B2 JP16062597A JP16062597A JP3819540B2 JP 3819540 B2 JP3819540 B2 JP 3819540B2 JP 16062597 A JP16062597 A JP 16062597A JP 16062597 A JP16062597 A JP 16062597A JP 3819540 B2 JP3819540 B2 JP 3819540B2
- Authority
- JP
- Japan
- Prior art keywords
- dna
- polypeptide
- asparaginase
- sequence
- derived
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Peptides Or Proteins (AREA)
- Enzymes And Modification Thereof (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Saccharide Compounds (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
【0001】
【発明の属する技術分野】
この発明はL−アスパラギナーゼ活性を有する新規なポリペプチド、詳細には、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドに関する。
【0002】
【従来の技術】
L−アスパラギナーゼ(EC3.5.1.1)は、L−アスパラギンを加水分解してL−アスパラギン酸とアンモニアを生ずる反応を触媒する酵素である。L−アスパラギナーゼの抗腫瘍剤としての研究は、ジェー・ジー・キッズが『ジャーナル・オブ・エキスペリメンタル・メディスン』、第98巻、565乃至582頁(1953年)において、モルモットの血清にリンパ腫に対する抗腫瘍作用が認められることを報告したことに端を発する。その後、ジェー・ディー・ブルームは『ネイチャー』、第191巻、1114乃至1115頁(1961年)において、この抗腫瘍作用の実体がL−アスパラギナーゼであることを明らかにした。現在、その作用機作は次のように説明されている。即ち、急性リンパ性白血病細胞等の腫瘍細胞は、L−アスパラギンシンテターゼを欠損しているため、生体内のL−アスパラギンが必須栄養素となることから、生体内にL−アスパラギンが不足するか存在しない条件下では増殖できないので、生き続けることができない。ところがL−アスパラギンは正常細胞にとっては必須栄養素ではないので、悪性腫瘍患者においては、L−アスパラギナーゼにより生体内のL−アスパラギンを加水分解すれば、腫瘍細胞のみを選択的に死滅させ、悪性腫瘍を治療することができるというものである。以来、L−アスパラギナーゼの抗腫瘍剤としての実用化を目指して精力的な研究が続けられ、その結果、現在では、大腸菌由来のL−アスパラギナーゼは白血病及びリンパ腫の治療剤として用いられるようになった。
【0003】
しかしながら、大腸菌由来のL−アスパラギナーゼは、人体からみれば、所詮、異種蛋白質であり、これを配合使用する従来の治療剤は、患者に投与すると、アナフィラキシーショック、蕁麻疹、浮腫、喘鳴、呼吸困難などの過敏反応を始めとする深刻な副作用を頻発させることとなった。斯くして、従来の治療剤は用量及び投与頻度を大幅に制限せざるを得ない状況にあり、そのため、斯かる副作用を軽減乃至解消するための提案が幾つかなされてきた。
【0004】
その第一は、特開昭54−119082号公報に見られるように、2−O−置換ポリエチレングリコール−4,6−ジクロロ−S−トリアジンにより大腸菌由来のL−アスパラギナーゼにおけるアミノ基の65%以上を封鎖し、L−アスパラギナーゼそのものを化学的に修飾しようというものである。第二は、特開平4−320684号公報又は特開昭55−19018号公報に見られるように、ある種のヒト細胞株の培養物又は人尿から、ヒトのL−アスパラギナーゼを採取しようというものである。第一の提案には、大量に入手の容易な大腸菌のL−アスパラギナーゼを利用できる利点はあるものの、修飾反応の制御が困難なうえに、副作用を完全に解消するまでには到らないという問題がある。第二の提案によるヒトのL−アスパラギナーゼは、大腸菌が産生するものと違って、患者に投与しても抗体を産生し難い利点はあるものの、特開平4−320684号公報に開示されたヒト細胞はL−アスパラギナーゼ産生能が充分高いとは言えず、L−アスパラギナーゼを量産しようとすると、細胞を大量に培養しなければならない問題があり、また特開昭55−19018号公報で開示された方法においても、工業的規模で継続して新鮮な人尿を得ることが困難であるという問題がある。
【0005】
ところで、昨今の組換えDNA技術の進歩には目覚しいものがある。今日では、目的とするポリペプチドをコードするDNAを単離することができれば、そのDNAと自律複製可能なベクターから組換えDNAを作製し、これを微生物や動植物の細胞に導入して得られる形質転換体を培養することにより、所望量のポリペプチドが容易に取得できるようになった。しかしながら今日に至るまで、L−アスパラギナーゼをコードする哺乳類由来のDNAは未だ単離されておらず、
当然のことながら、組換えDNA技術により、哺乳類由来のL−アスパラギナーゼが製造されてもいない。
【0006】
斯かる状況に鑑み、斯界においては、一刻も早く活性なL−アスパラギナーゼをコードする哺乳類由来のDNAが単離され、その単離されたDNAに組換えDNA技術を適用することにより、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドを大量生産する技術の確立が待ち望まれている。
【0007】
【発明が解決しようとする課題】
この発明の第一の課題は、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドを提供することにある。
【0008】
この発明の第二の課題は、斯かるポリペプチドをコードするDNAを提供することにある。
【0009】
この発明の第三の課題は、斯かるポリペプチドをコードするDNAと自律複製可能なベクターを含んでなる組換えDNAを提供することにある。
【0010】
この発明の第四の課題は、斯かる組換えDNAを適宜宿主に導入してなる形質転換体を提供することにある。
【0011】
この発明の第五の課題は、斯かる形質転換体を用いる上記ポリペプチドの製造法を提供することにある。
【0012】
この発明の第六の課題は、斯かるポリペプチドを有効成分として含んでなる感受性疾患剤を提供することにある。
【0013】
【課題を解決するための手段】
この発明は、上記第一の課題をL−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドにより解決するもである。
【0014】
またこの発明は、上記第二の課題をL−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドをコードするDNAにより解決するものである。
【0015】
またこの発明は、上記第三の課題をL−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドをコードするDNAと自律複製可能なベクターを含んでなる組換えDNAにより解決するものである。
【0016】
またこの発明は、上記第四の課題を、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドをコードするDNAを適宜宿主に導入してなる形質転換体により解決するものである。
【0017】
またこの発明は、上記第五の課題を、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドをコードするDNAを適宜宿主に導入してなる形質転換体を培養し、産生したポリペプチドを培養物から採取してなるポリペプチドの製造方法により解決するものである。
【0018】
またこの発明は、上記第六の課題を、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドを有効成分として含んでなる感受性疾患剤により解決するものである。
【0019】
【作用】
哺乳類由来のこの発明のポリペプチドは、L−アスパラギンに作用し、L−アスパラギン酸とアンモニアを生成する。
【0020】
この発明のDNAは、自律複製可能な適宜ベクターに挿入して組換えDNAとし、この組換えDNAを、通常当該ポリペプチドを産生しないけれども、容易に増殖させることのできる適宜宿主に導入して形質転換体とすることにより、当該ポリペプチドの産生を発現する。
【0021】
この発明の複製可能な組換えDNAは、通常、当該ポリペプチドを産生しないけれども、容易に増殖させることのできる適宜宿主に導入して形質転換体とすることにより、当該ポリペプチドの産生を発現する。
【0022】
この発明の形質転換体は、培養すると、当該ポリペプチドの産生を発現する。
【0023】
この発明の製造方法に従ってこの形質転換体を培養すれば、所望量のポリペプチドが容易に得られる。
【0024】
この発明の感受性疾患剤は、ヒトに投与すると重篤な副作用なく、顕著な治療・予防効果を発揮する。
【0025】
本発明者は、L−アスパラギナーゼをコードするモルモット及びヒト由来のDNAを世界で初めて単離し、その塩基配列を解明するのに成功した。すなわち、モルモット由来のDNAは、配列表における配列番号15に示す塩基配列を、また、ヒト由来のDNAは、配列表における配列番号16に示す塩基配列を有していることを明らかにした。この知見は、同じ出願人による特開平8−214885号公報に開示されている。本発明はこれら知見に基づくものであって、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドを世界で初めて提供するものである。
【0026】
【発明の実施の形態】
この発明のポリペプチドは、それが哺乳類に由来するものであって、かつ、L−アスパラギナーゼ活性を有する限りその出所・由来は問わない。この発明のポリペプチドは哺乳類由来の遺伝子を発現させることにより得ることができ、通常、配列表における配列番号1、2及び3に示すアミノ酸配列を含んでいる。ただし、その配列番号3に示すアミノ酸配列において、符号「Xaa」を付して示したアミノ酸はグルタミン又はアルギニンを表すものとする。個々のポリペプチドとしては、例えば、配列表における配列番号4乃至9に示すいずれかのアミノ酸配列のポリペプチドが挙げられる。ただし、斯界の技術水準に鑑み、その配列番号4乃至9に示すアミノ酸配列に対して、L−アスパラギナーゼ活性を実質的に喪失させることなく、そのアミノ酸の1個又は2個以上を他のアミノ酸で置換することは比較的容易である。一方、同じDNAに由来するポリペプチドであっても、それを導入する際に用いるベクターの種類や、それを導入する宿主の種類又はそのDNAを含む形質転換体の培養に使用する培地の成分・組成や培養温度・pHなどによっては、宿主内酵素によるDNA発現後の修飾や精製の過程で、所期の活性は保持しているものの、N末端及び/又はC末端におけるアミノ酸が1個又は2個以上欠失するか、N末端及び/又はC末端に1個又は2個以上のアミノ酸が付加したり、産生したポリペプチドに糖鎖の付加が生じることがある。斯かる状況に鑑み、配列表における配列番号4乃至9に示すいずれかのアミノ酸配列をそっくりそのまま有するポリペプチドは言うに及ばず、L−アスパラギナーゼ活性を有する限り、それらの相同体も、当然この発明に包含される。なお、この発明のポリペプチドは、通常多量体の形態、望ましくは、4量体の形態をとるときにL−アスパラギナーゼ活性を有する。
【0027】
この発明のポリペプチドは、通常、組換えDNA技術により製造される。すなわち、この発明のポリペプチドは、通常、それをコードするDNAを含む形質転換体を培養し、産生したポリペプチドを培養物から採取することにより製造することができる。斯かる形質転換体は、例えば、配列表における配列番号10乃至15に示すいずれかの塩基配列を含んでいる組換えDNAを適宜宿主に導入することにより得ることができる。なお上記の塩基配列は、遺伝子コードの縮重を利用して、コードするアミノ酸配列を変えることなく、塩基の1個又は2個以上を他の塩基で置き換えても良い。また、DNAの宿主中での当該ポリペプチドの産生を促すために、当該ポリペプチド又はその相同体をコードする塩基配列における、塩基の1個又は2個以上を他の塩基で適宜置換し得ることは云うまでもない。さらには、当該ポリペプチド又はその相同体をコードする塩基配列における塩基の5′末端及び/又は3′末端に1個又は2個以上のアミノ酸をコードする配列及び/又はアミノ酸をコードしない配列を付加し得ることも云うまでもない。
【0028】
この発明のポリペプチドをコードするDNAは、その発現産物たるポリペプチドがL−アスパラギナーゼ活性を有している限り、それが天然から得られたものであっても、人為的に合成されたものであってもかまわないし、また天然から得られたものと配列の一致する野生型DNAであっても、野生型DNAに対するDNA相同体であっても構わない。この発明のポリペプチドをコードするDNAの天然の給源としては、例えば、モルモットの肝臓が挙げられ、そこからは常法により、例えば、配列番号15に示す塩基配列を含んでいる野生型DNAが得られる。すなわち、同じ出願人による特開平8−214885号公報に開示されているように、先ず、モルモット肝臓より精製したポリ(A)付加RNAを材料として、常法によりcDNAライブラリーを作製する。ここに、モルモット血清より精製したL−アスパラギナーゼの部分アミノ酸配列に基づき化学合成したオリゴヌクレオチドをプローブとして用いて、プラークハイブリダイゼーション法を適用し、この発明のポリペプチドをコードするDNAを含むファージクローンを採取する。斯くして得られたファージクローンを通常一般の方法により処理すれば、当該DNAが得られる。また、配列表における配列番号15に基づいてDNAを化学合成することも可能である。野生型DNAに対する相同体の例としては、例えば、配列表における配列番号10乃至14に示す塩基配列を含む個々のDNAが挙げられる。配列表における配列番号10に示す塩基配列を含むDNAは、配列表における配列番号15に示す、上述のようにして得られる野生型DNAに、斯界において慣用の方法、例えば、PCR法や点突然変異導入法を、配列表における配列番号10の塩基配列に基づいて適用することにより得ることができる。配列表における配列番号11乃至14に示す塩基配列を含むDNAは、いずれも以下のようにして得ることができる。すなわち、先ず、同じ出願人による特開平8−214885号公報に開示されたような、ヒト肝臓cDNAライブラリーのスクリーニング等により、配列表における配列番号16に示す塩基配列を含む野生型DNAを得る。そして次に、この野生型DNAに、斯界において慣用のPCR法や点突然変異導入法などを、配列表における配列番号11乃至14の塩基配列に基づき適用すればよい。また、配列表における配列番号10乃至14に示す塩基配列に基づいてDNAを化学合成することも可能である。
【0029】
斯かるDNAは、通常、組換えDNAの形態で宿主に導入される。組換えDNAは、通常DNAと自律複製可能なベクターを含んでなり、DNAが入手できれば、通常一般の組換えDNA技術により比較的容易に調製することができる。斯かるベクターの例としては、例えば、pKK223−3、pGEX−2T、pRL−λ、pBTrp2 DNA、pUB110、YEp13、Tiプラスミド、Riプラスミド、pBI121、pCDM8、pBPV、BCMGSneo等のプラスミドベクターが挙げられ、このうち、この発明のDNAを大腸菌、枯草菌等の原核細胞で発現させるにはpKK223−3、pGEX−2T、pRL−λ、pBTrp2 DNAおよびpUB110が、また酵母或いは動植物由来の細胞すなわち、真核細胞で発現させるにはYEp13、Tiプラスミド、Riプラスミド、pBI121、pCDM8、pBPV及びBCMGSneoが好適である。
【0030】
斯かるベクターにこの発明のDNAを挿入するには、斯界において通常一般の方法が採用される。具体的には、例えば、先ず、自律複製可能なベクターを制限酵素により切断する。次にPCR法を応用して、この発明のDNAの5′末端及び3′末端に、先にベクターの切断に用いたのと同一の制限酵素切断部位を導入し二本鎖とした後、同制限酵素で切断する。次に、該ベクターと該DNA断片の混合液に、DNAリガーゼを作用させて連結する。斯くして得られた組換えDNAは、適宜宿主に導入して形質転換体とし、これを培養することにより無限に複製可能である。
【0031】
この発明による組換えDNAは、大腸菌、枯草菌、放線菌、酵母、植物細胞、動物細胞を始めとする適宜の宿主に導入することができる。宿主が大腸菌の場合には、例えば、宿主を組換えDNAとカルシウムイオンの存在下で培養すればよく、一方宿主が枯草菌の場合には、例えば、コンピテントセル法やプロトプラスト法を適用すればよい。また宿主が動物細胞の場合には、例えば、DEAE−デキストラン法やエレクトロポレーション法によればよい。形質転換体をクローニングするには、ハイブリダイゼーション法を適用するか、培地で培養し、L−アスパラギナーゼを産生するものを選択すればよい。
【0032】
斯くして得られる形質転換体は、培地で培養すると、菌体内外又は細胞内外に当該ポリペプチドを産生する。培地には、通常、炭素源、窒素源、ミネラルさらには必要に応じてアミノ酸やビタミンなどの微量栄養素を補足した通常一般の液体培地が使用され、ここの炭素源としては、澱粉、澱粉加水分解物、グルコース、果糖、蔗糖などの糖質が、また窒素源としては、例えばアンモニア乃至アンモニウム塩、尿素、硝酸塩、ペプトン、酵母エキス、脱脂大豆、コーンスティープリカー、肉エキスなどの含窒素無機乃至有機物が挙げられる。形質転換体を斯かる培地に接種し、栄養培地を温度25乃至65℃、pH5乃至8に保ちつつ、通気攪拌などによる好気的条件下で約1乃至10日間培養すれば、当該ポリペプチドを含む培養物が得られる。この培養物は、感受性疾患剤としてそのまま使用可能なこともあるが、通常は、例えば、使用に先立ち必要に応じて、超音波や細胞壁溶解酵素により菌体又は細胞を破砕した後、濾過、遠心分離などにより当該ポリペプチドを菌体破砕物又は細胞破砕物から分離し、精製する。又例えば、培養物から菌体又は細胞を濾過、遠心分離などにより除去した培養上清を回収し、精製する。精製には、菌体又は細胞破砕物由来の不溶性成分を除去した上澄液や、培養上清に、例えば、塩析、透析、濾過、濃縮、ゲル濾過クロマトグラフィー、イオン交換クロマトグラフィー、親和性クロマトグラフィー、疎水クロマトグラフィー、等電点電気泳動及びゲル電気泳動などの、蛋白質を精製するための斯界における通常一般の方法が採用でき、必要に応じて、これら方法を適宜組み合わせればよい。そして、最終使用形態に応じて、精製したポリペプチドを濃縮・凍結乾燥して液状又は固状にすればよい。
【0033】
以下、実験例に基づき説明するが、ここで用いられる方法は斯界において慣用のものであり、例えば、ジェイ・サムブルックら、『モレキュラー・クローニング・ア・ラボラトリー・マニュアル』(1989年)、コールド・スプリング・ハーバー発行や、松村正実、『ラボマニュアル遺伝子工学』(1988年)、丸善発行などにも詳述されている。
【0034】
【実験例1】
〈モルモット及びヒト由来の野生型DNAの発現〉
【0035】
【実験例1−1】
〈モルモット由来の野生型DNAの発現〉
【0036】
【実験例1−1(a)】
〈モルモット由来の野生型DNAの調製〉
モルモット由来のL−アスパラギナーゼをコードする野生型DNAは、同じ出願人による特開平8−214885号公報に開示された方法に準じて調製した。このDNAは、配列表における配列番号15に示す塩基配列を有していた。以後、その配列番号15に示す塩基配列において、ポリペプチドをコードする領域すなわち、当該塩基配列における第20乃至第1714の塩基よりなる配列を有するDNAを『GPA/WT DNA』と呼ぶ。また、GPA/WT DNAの発現産物たる、配列表における配列番号15に並記したアミノ酸配列を有するポリペプチドを、以後『モルモット野生型L−アスパラギナーゼ』と呼ぶ。なお、配列表における配列番号17には、GPA/WT DNAの塩基配列とともに、そのコードするアミノ酸配列が併記されている。
【0037】
【実験例1−1(b)】
〈組換えDNAの調製〉
0.5ml容反応管に10×PCR緩衝液を10μl、25mM dNTPミックスを1μl、鋳型として、実験例1−1(a)で得たモルモット由来のL−アスパラギナーゼをコードする野生型DNAを1ngとり、配列表の配列番号15に並記したアミノ酸配列におけるN末端及びC末端付近の配列に基づき化学合成したオリゴヌクレオチドをセンスプライマー及びアンチセンスプライマーとして適量加え、滅菌蒸留水で99.5μlとした後、2.5単位/μlアンプリタックDNAポリメラーゼを0.5μl加えた。センスプライマーは、配列が5′−AATCTCGAGCCACCATGGCGCGCGCATCA−3′であり、配列表における配列番号15に併記したアミノ酸配列のN末端をコードする部分の上流に、エム・コザックが『ニュークレイック・アシッド・リサーチ』、第15巻、8125乃至8148頁(1987年)に示した動物細胞における共通配列を付加し、さらにその上流に制限酵素Xho I切断部位を付加したものである。アンチセンスプライマーは、配列が5′−CTGCGGCCGCTTATCAGATGGCAGGCGGCAC−3′であり、配列表における配列番号15に併記したアミノ酸配列のC末端をコードする部分の下流に2個の終始コドンを付加し、さらにその下流に制限酵素Not I切断部位を付加した配列に相補的な配列のものである。常法により、上記混合物を94℃で1分間、55℃で1分間、72℃で3分間の順序でインキュベートするサイクルを40回繰り返すことによりPCRを行いDNAを増幅させ、GPA/WT DNAを含むDNAを得た。このDNAを制限酵素Xho I及びNot Iで切断することにより得られる約1.7kbpのDNA断片を25ngとり、これに予め制限酵素XhoI及びNot Iで切断しておいたインビトロジェン社製プラスミドベクター『pCDM8』を10ngを加え、さらに宝酒造製ライゲーション・キット・バージョン2の溶液Iを先のDNA混合溶液と同容量加えた後、16℃で2時間インキュベートして、複製可能な組換えDNA『pCGPA/WT』を得た。
【0038】
組換えDNA pCGPA/WTをコンピテントセル法によりインビトロジェン社製大腸菌MC1061/P3株に導入し、得られた形質転換体を20μg/mlのアンピシリン及び10μg/mlのテトラサイクリンを含むLブロス培地(pH7.2)に接種し、37℃で18時間振とう培養した。培養物を遠心分離して形質転換体を採取し、通常のアルカリ−SDS法を適用して組換えDNA pCGPA/WTを抽出した。蛍光光度計を使用する自動シーケンサにより分析したところpCGPA/WTは、その3′末端に終止コドンが連結されたGPA/WT DNAを含んでおり、またGPA/WT DNAは、CMVプロモーター下流に5′末端から3′末端方向に連結されていることが確認された。
【0039】
実験例1乃び後述する実験例2でのDNAの発現には、いずれもサル腎臓由来の細胞株であるCOS−1細胞(ATCC CRL−1650)を宿主とした系を用いた。この系は一過性発現系であるため、形質転換体内では導入されたDNAが安定して、すなわち数日を超えて保持されず、形質転換体を用いて繰り返し目的とするペプチドを産生できないという欠点がある。しかし、該細胞に先述のプラスミドベクター『pCDM8』のようなSV40ウイルス複製起点を有するベクターを導入した場合には、その細胞あたりのコピー数が一次的に 105個程度に上昇することが知られており、このために目的とするDNAの発現産物の解析が極めて容易であるという利点がある。
【0040】
【実験例1−1(c)】
〈組換えDNAのCOS−1細胞への導入と発現〉
実施例1−1(b)で調製した組換えDNA pCGPA/WTを、フレデリック・エム・オースベルらが『カレント・プロトコール・イン・モレキュラー・バイオロジー』(1987年)、ジョン・ワイリー・アンド・サンズ・インク発行、チャプター9.2.1乃至9.2.3及び、チャプター9.2.5乃至9.2.6で紹介しているDEAE−デキストラン法に準じてCOS−1細胞に導入し、発現させた。詳細には、先ず口径3.5cmのベクトン・ディッキンソン・ラブウェア製6穴マルチウエルプレート『3046』の1穴に2.5mlの10%(v/v)牛胎児血清を含むDME培地を入れ、1.8×105 個のCOS−1細胞を接種し、5%(v/v)CO2 インキュベーター内で37℃で培養した。翌日、培養上清をアスピレーターで除去し、50mMトリス−塩酸(pH7.4)を含むDME培地で細胞を洗浄後、2.8μg/mlのpCGPA/WT、50mMのトリス−塩酸(pH7.4)、0.4mg/mlのDEAE−デキストラン、0.1mMのクロロキンを含むDME培地を、1穴あたり2.5mlずつ加え、5%(v/v)CO2 インキュベーター内で37℃で4時間静置した。その後上清を除去し10(v/v)%DMSOを含む10mMリン酸食塩緩衝液(以後PBSという)を1穴当たり2.5ml添加して室温で2分間静置し、上清を除去して50mMトリス−塩酸(pH7.4)を含むDME培地で細胞を洗浄し、2.5mlのコスモバイオ社製COS培地を加え、5%(v/v)CO2 インキュベーター内で37℃で3日間培養し、目的DNAを発現させた。なお、対照区としてプラスミドベクターpCDM8を用いてこれと同一の実験をも行った。
【0041】
3日間培養した後の、先述の培養器を−80℃で静置して凍結させた後、室温で融解させる操作を3回繰り返して細胞を破砕させた。その後全培養物を遠沈管に移し取り、遠心分離により不溶性成分を沈澱として除去し、全可溶性画分を得た。そしてこれを膜濃縮し、1穴由来の全可溶性画分を0.5mlに調整して、以降の分析に用いた。
【0042】
【実験例1−1(d)】
〈L−アスパラギナーゼ活性の測定〉
L−アスパラギナーゼ活性は、次のようにして測定した活性値(単位)で表示した。すなわち、1.5ml反応管に被検試料を50μlずつ分注する一方、L−アスパラギンを1.4mg/mlになるように50mMリン酸緩衝液(pH7.0)に溶解し、溶液を1反応管あたり200μlずつ加え反応混合液とした。同反応管を37℃で0、1、2、4、6及び16時間静置した後、反応混合液中のL−アスパラギン酸をアミノ酸分析機により測定した。これと並行して、1.0、0.5又は0.25単位/mlに希釈した大腸菌由来のL−アスパラギナーゼ標品を用いる系を設け、37℃で0及び1時間静置した後、L−アスパラギン酸測定結果から求めたL−アスパラギン酸の増加量に基づき検量線を作成した。被検試料の系で測定されたL−アスパラギン酸の増加量をこの検量線に内挿し、被検試料の活性値を推定した。活性の低い被検試料は反応時間を2時間以上にのばした系での測定結果から活性値を推定した。なお、L−アスパラギナーゼ1単位は、上記条件下で反応させたとき、1分間にL−アスパラギンからアンモニアを1μmol遊離する量と定義した。
【0043】
実験例1−1(c)で得た全可溶性画分それぞれにこの処理を施し、3.6×105 個のCOS−1細胞由来の全可溶性画分中に検出されたL−アスパラギナーゼ活性の総量として表示した。その結果、モルモット野生型L−アスパラギナーゼの活性は0.083単位であった。対照区では、検出されなかった。
【0044】
【実験例1−1(e)】
〈ウエスタン・ブロッティング〉
先ず以下の方法により、抗L−アスパラギナーゼ抗体を調製した。すなわち、常法に従って化学合成した、Gly−Ser−Gly−Asn−Gly−Pro−Thr−Lys−Pro−Asp−Leu−Leu−Gln−Glu−Leu−Arg−Cysにより表される配列のオリゴペプチドのC末端にキーホール・リンペット・ヘモシアニンを結合させ、精製した後、常法に従いウサギに免疫した。2週間間隔で6回免疫した後、全採血し50%(w/v)硫安塩析にて精製し、抗L−アスパラギナーゼ・ウサギ抗血清を得た。次に、ユー・ケー・レムリが『ネイチャー』、第227巻、680乃至685頁(1970年)に報告した方法に準じて、実験例1−1(c)で得た、全可溶性画分のうち0.2mlを、還元剤存在下で12.5%(w/v)SDS−ポリアクリルアミドゲル電気泳動(以後SDS−PAGEという)に供し、泳動された全ポリペプチドをSDS−ポリアクリルアミドゲルからニトロセルロース膜に転写した後、先の抗L−アスパラギナーゼ・ウサギ抗血清を用いて、エイチ・トービンが『プロシーディング・オブ・ザ・ナショナル・アカデミー・オブ・サイエンシズ・オブ・ザ・ユー・エス・エー』、第76巻、4350乃至4354頁(1979年)に報告した方法に準じてウエスタン・ブロッティングを行った。発色はアルカリフォスファターゼ発色系によった。対照と比較して、試料で特異的に染色されたバンドを確認するとともに、染色されたバンドを分子量マーカーと比較してL−アスパラギナーゼのサブユニットあたりの分子量を求めた。用いた分子量マーカーは、ウシ血清アルブミン(67kDa)、オボアルブミン(45kDa)、大豆トリプシンインヒビター(20.1kDa)及びα−ラクトアルブミン(14.4kDa)であり、これらはアミドブラックにて染色した。実験例1−1(c)で得た全可溶性画分は明瞭なバンドは示さなかった。
【0045】
【実験例1−1(f)】
〈ゲル濾過による分子量の測定〉
次に実験例1−1(c)で得た、COS−1細胞由来の全可溶性画分のうち2mlを、PBSで平衡化したファルマシア製『ハイロード・スーパーデックス・200・カラム』(内径16mm×60cm)を用いてゲル濾過カラムクロマトグラフィーに供し、溶出フラクションのL−アスパラギナーゼ活性を調べることにより、モルモット野生型L−アスパラギナーゼのネイティブな分子量を調べた。分子量マーカーとして、チログロブリン(669kDa)、フェリチン(440kDa)、カタラーゼ(232kDa)、アルドラーゼ(158kDa)、ウシ血清アルブミン(67kDa)及びオボアルブミン(43kDa)を用た。その結果、溶出画分のL−アスパラギナーゼ活性のピークは分子量約300kDaに相当する位置に認められた。
【0046】
ウエスタン・ブロッティングでは明瞭なバンドを示さなかったため、モルモット野生型L−アスパラギナーゼの解離した状態での分子量は測定できなかった。そのネイティブな状態での分子量は、ゲル濾過の結果から、約300kDaと見積もられた。これに対して、モルモット血清L−アスパラギナーゼを精製し、ネイティブな状態での分子量をゲル濾過により分子量を求めると、約190kDaと見積もられる。因みに、SDS−PAGEにより解離した状態での分子量を求めると約43kDaと見積もられる。一方、同じ出願人による特開平8−214885号公報に開示されたモルモット血清L−アスパラギナーゼの3個の部分アミノ酸配列は、モルモット野生型L−アスパラギナーゼのアミノ酸配列における、第10乃至第236のアミノ酸残基よりなる領域内に認められる。また、イー・ハームズらが『フェブス・レター』、第285巻、55乃至58頁(1991年)で大腸菌由来のL−アスパラギナーゼ等を用いた実験結果から提唱した、L−アスパラギナーゼ活性に必須な2つの共通配列すなわち、配列表における配列番号1及び2に示すアミノ酸配列は、モルモット野生型L−アスパラギナーゼのアミノ酸配列上ではそれぞれ、第16乃至第19のアミノ酸残基及び第114乃至第118のアミノ酸残基よりなる配列と一致する。これらのことと実験例1−1に示した結果から本発明者は、モルモット野生型L−アスパラギナーゼにとって、当該アミノ酸配列における第1乃至第400のアミノ酸残基又はその前後のアミノ酸残基よりなる部分が、その活性発現に必須であろうと推測した。そこで、実験例2−1ではモルモット由来のL−アスパラギナーゼ相同体であるC末端欠失変異体の活性を調べるべく、モルモット由来のDNA相同体の発現産物の性質・性状について試験する。
【0047】
【実験例1−2】
〈ヒト由来の野生型DNAの発現〉
ヒト由来のL−アスパラギナーゼをコードする野生型DNAは、同じ出願人による特開平8−214885号公報に開示された方法に準じて調製した。このDNAは配列表における配列番号16に示す塩基配列を有していた。以後、その配列番号16に示す塩基配列においてポリペプチドをコードする領域すなわち、当該塩基配列における第93乃至第1811の塩基よりなる配列を有するDNAを『HA/WT DNA』と呼ぶ。また、HA/WT DNAの発現産物たる配列番号16に並記したアミノ酸配列を有するポリペプチドを、以後『ヒト野生型L−アスパラギナーゼ』と呼ぶこともある。なお、配列表における配列番号18には、HA/WT DNAの塩基配列とともに、そのコードするアミノ酸配列が併記されている。
【0048】
鋳型、センスプライマー及びアンチセンスプライマー以外は実験例1−1(b)と同一の条件でPCRを行った。鋳型は、この実験例1−2で得たヒト由来のL−アスパラギナーゼをコードする野生型DNA、センスプライマーは配列が5′−AATCTCGAGCCACCATGGCGCGCGCGGTG−3′であるオリゴヌクレオチド、アンチセンスプライマーは配列が5′−CTGCGGCCGCTTATCAGACACCAGGCAGCAC−3′であるオリゴヌクレオチドであった。この結果増幅されたDNAを引き続き実験例1−1(b)と同じ方法で処理し、組換えDNA『pCHA/WT』を調製した。同様に配列を確認した後、COS−1細胞に導入し、発現させて、実験例1−1と同様に分析した。
【0049】
モルモット野生型L−アスパラギナーゼとは対照的に、ヒト野生型L−アスパラギナーゼは、本実験系においては活性が検出できなかった。この原因のひとつとして、例えば、ヒト野生型L−アスパラギナーゼはモルモット野生型L−アスパラギナーゼに比べ、比活性が低いことが考えられた。そこで、次の実験例2−2においては、ヒト由来のDNA相同体の発現産物の性質・性状について試験する。
【0050】
【実験例2】
〈モルモット及びヒト由来のDNA相同体の発現〉
【0051】
【実験例2−1】
〈モルモット由来のDNA相同体の発現〉
モルモット由来の野生型DNAの、特定の位置の塩基配列が終止コドンに置換されたDNA相同体を次のように調製した。すなわち、配列表の配列番号17に示す塩基配列における、第1090乃至第1092の塩基よりなる配列を終止コドンに置換したDNA、及び第1012乃至第1014の塩基よりなる配列を終止コドンに置換したDNAを、PCR法を適用して調製した。アンチセンスプライマーの配列以外は、全て実験例1−1(b)と同一の条件でPCRを行った。それぞれのDNA調製のために使用したアンチセンスプライマーの配列は、5′−CTGCGGCCGCTTATCATGCCGTGGGCAGTGT−3′及び5′−CTGCGGCCGCTTATCAGCCCAACACGTAGGA−3′であった。この結果増幅されたDNAを引き続き実験例1−1(b)と同様に処理し、組換えDNA『pCGPA/D364stp』及び『pCGPA/L338stp』を調製した。同様に配列を確認したところ、pCGPA/D364stp及びpCGPA/L338stpは、それぞれモルモット野生型L−アスパラギナーゼにおける、第1乃至第363のアミノ酸残基及び第1乃至第337のアミノ酸残基よりなる配列をコードするDNAと、それぞれの3′末端側に介在配列なく存在する終止コドンを含むものでった。以後これらのポリペプチドをコードする部分のDNAを、それぞれ『GPA/D364stp DNA』及び『GPA/L338stp DNA』と呼ぶ。GPA/D364stp DNA及びGPA/L338stp DNAはCMVプロモーター下流に、5′末端から3′末端方向に連結されていた。以後これらのDNAの発現産物を『モルモットL−アスパラギナーゼ相同体』と呼ぶこともある。
【0052】
これら組換えDNAを、実験例1−1に従ってCOS−1細胞に導入した後、同様に試験した。対照区として、実験例1−1(b)で調製した組換えDNA pCGPA/WT及びpCDM8を同様に処理し試験した。結果を表1に示す。
【0053】
【表1】
【0054】
表1に示したように、上記のモルモットに由来する野生型DNA及びその相同体のうち、GPA/WT DNA及びGPA/D364stp DNAの発現産物では活性が認められたが、GPA/L338stp DNA発現産物では活性は検出されなかった。このことは、モルモット由来のL−アスパラギナーゼが十分な活性を示すためには、野生型L−アスパラギナーゼのアミノ酸配列上、第1乃至第363のアミノ酸残基よりなる領域があれば十分であることを示唆している。この第1乃至第363のアミノ酸残基よりなる配列は、配列表における配列番号4に示したものである。これをコードするDNAの塩基配列は、配列表における配列番号10に示したものである。またモルモット野生型L−アスパラギナーゼのアミノ酸配列は、配列表における配列番号5に示されている。
【0055】
【実験例2−2】
〈ヒト由来のDNA相同体の発現〉
ヒト由来の野生型DNAの特定の位置の塩基配列を終止コドン又は他のアミノ酸に対するコドンに置換したDNA相同体を調製した。先ず、配列表の配列番号18に示す塩基配列における第1096乃至第1098の塩基よりなる配列を終止コドンに置換したDNA相同体を、PCR法を適用して調製した。すなわち、鋳型、センスプライマー及びアンチセンスプライマー以外は、全て実験例1−1(b)と同一の条件でPCRを行った。鋳型は、実験例1−2で得たヒト由来のL−アスパラギナーゼをコードする野生型DNA、センスプライマーは配列が5′−AATCTCGAGCCACCATGGCGCGCGCGGTG−3′であるオリゴヌクレオチド、アンチセンスプライマーは配列が、5′−CTGCGGCCGCTCATTACACCGAGGGTGGCGT−3′であるオリゴヌクレオチドであった。この結果増幅されたDNAを実験例1−1に従って処理し、組換えDNA『pCHA/E366stp』を調製し、配列を確認した。pCHA/E366stpは、配列表の配列番号16に併記したアミノ酸配列における第1乃至第365のアミノ酸残基よりなる配列をコードするDNAと、その3′末端に介在配列なく存在する終止コドンを含むものであった。以後このコード部分のDNAを『HA/E366stp DNA』と呼ぶ。HA/E366stpDNAは、CMVプロモーターの下流に5′末端から3′末端方向に連結されていた。
【0056】
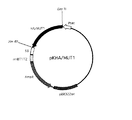
DNAの特定の位置のコドンを他のアミノ酸に対するコドンへ置換するには、ロバート・エム・ホートンらが『メソッズ・イン・エンザイモロジー』、アカデミック・プレス発行、第217巻、270乃至279頁(1993年)で紹介しているオーバーラップ・エクステンション法に従って行った。その概要を図1に示すと共に以下に説明する。第1、変異を導入すべき位置の塩基を、目的とする別の塩基に置換した互いに相補な変異プライマーA及び変異プライマーSを調製する。ここで、変異プライマーAはアンチセンス鎖であり、変異プライマーSはセンス鎖である。他方、目的とするDNAの全域を増幅し得るプライマーのセット、すなわち、5′末端プライマー及び3′末端プライマーを調製する。ここで5′末端プライマーはセンス鎖であり、3′末端プライマーはアンチセンス鎖である。第2、基の塩基配列のDNAを鋳型として、先の5′末端プライマーと変異プライマーAを用いて通常のPCRを行う。これと並行して、同じDNAを鋳型として、先の3′末端プライマーと変異プライマーSを用いて通常のPCRを行う(第1段PCR)。第3、第1段PCRにより増幅した2つのDNA、第1段PCRで使用した5′末端プライマー及び3′末端プライマーを、同一の反応管で混合し、PCRを行う(第2段PCR)。第1段PCRで増幅された2つのDNA断片は、鋳型兼プライマーとして変異が導入されたDNAの生成に用いられ、5′末端プライマー及び3′末端プライマーは変異が導入されたDNA増幅のためのプライマーとして用いられる。この方法により、7とおりの塩基置換を導入したDNAすなわち、7種のDNA相同体を調製した。7とおりの塩基置換の内容と、それに伴うアミノ酸配列の変化の内容を表2にまとめて示した。この7種のDNA相同体の調製に用いた、鋳型DNAと変異プライマーA及び変異プライマーSの配列を表3にまとめて示した。一方、7個のDNA相同体の調製に用いた、5′末端プライマー及び3′末端プライマーはそれぞれ、この実験例2−2で先に示したpCHA/E366stpの調製時に用いたセンスプライマー及びアンチセンスプライマーと同一である。
【0057】
【表2】
【0058】
【表3】
【0059】
ここで得たヒト由来のDNA相同体を実験例1−1に従って処理し、組換えDNA『pCHA/MUT1』、『pCHA/MUT2』、『pCHA/MUT3』、『pCHA/MUT4』、『pCHA/MUT5』、『pCHA/MUT6』及び『pCHA/MUT7』を得た。以後、この実験例2−2で得た、以上のDNA相同体の発現産物を、『ヒトL−アスパラギナーゼ相同体』と呼ぶこともある。同様に配列を確認した後、COS−1細胞へ導入し発現させ、試験した。対照区として、実験例1−2で得たpCHA/WT及びpCDM8を同様に処理・試験した。また、この実験例2−2では各発現産物の量的な比較のための参考としてウエスタン・ブロッティングで検出されたバンドのシグナル強度を、デンシトメトリーにより数値化した。以上の結果を表4に示した。
【0060】
【表4】
【0061】
表4の結果は、ヒト由来のL−アスパラギナーゼは野生型でも、その相同体の一つであるC末端欠失変異体(HA/E366stp DNA発現産物)でもモルモット由来のそれらに比べ、比活性が低いことを示唆している。また、これに対し、ヒト由来の野生型L−アスパラギナーゼ本来のアミノ酸配列の内のいくつかを他のアミノ酸に置換した点突然変異体の中には、検出され得る程度に比活性が上昇するものがあることをも示している。発現産物が少なくとも検出され得る程度の活性を示すことが確認された、ヒト由来のDNA相同体 HA/MUT1DNA、HA/MUT2 DNA、HA/MUT3 DNA及びHA/MUT5 DNAは、それぞれ配列表における配列番号11、12、13及び14に示す塩基配列を有すものであり、そのコードするポリペプチドは、それぞれ配列表における配列番号6、7、8及び9に示すアミノ酸配列を有すものである。
【0062】
以上の実験結果から、哺乳類に由来するポリペプチドが、少なくとも実験例1及び2で用いた発現系・活性測定系で検出され得る程度のL−アスパラギナーゼ活性を示すためには、従来公知の、配列表における配列番号1及び2に示すアミノ酸配列の他に、例えば、同じく配列番号3に示すアミノ酸配列を有する必要があることを見出した(ただし、符号「Xaa」を付して示したアミノ酸はグルタミン又はアルギニンを表すものとする)。因みに、モルモット野生型L−アスパラギナーゼは、そのアミノ酸配列上第298乃至第302の残基よりなる部分にこの配列を有している。配列表における配列番号1乃至3に示すアミノ酸配列を全て有するポリペプチドとしては、例えば、モルモットに由来する、配列表における配列番号4乃び5に示すアミノ酸配列を有するポリペプチドと、ヒトに由来する配列表における配列番号6乃至9に示すアミノ酸配列を有するポリペプチドが挙げられる。
【0063】
以上の知見に基づき、本発明者はL−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドを発明するに至った。以下実施例に基づきこの発明を説明するが、ここで選択した方法はいずれも斯界において慣用のものである。当然ながら、この発明を実施するための方法は、これらに限定されるわけではない。
【0064】
【実施例A−1】
〈L−アスパラギナーゼ活性を有するモルモット由来の野生型ポリペプチド〉
【0065】
【実施例A−1(a)】
〈形質転換体の調製〉
0.5ml容反応管に10×PCR緩衝液を10μl、25mM dNTPミックスを1μl、鋳型として、実験例1−1で得た組換えDNA pCGPA/WTを1ngとり、GPA/WT DNAの5′末端及び3′末端の配列に基づき化学合成したオリゴヌクレオチドをセンスプライマー又はアンチセンスプライマーとして適量加え、滅菌蒸留水で99.5μlとした後、2.5単位/μlアンプリタックDNAポリメラーゼを0.5μl加えた。センスプライマーは、配列が5′−GCGAATTCATGGCGCGCGCATCA−3′であり、GPA/WT DNAの5′末端の上流に制限酵素Eco RI切断部位を付加したものである。アンチセンスプライマーは、配列が5′−GCAAGCTTTCAGATGGCAGGCGGCAC−3′であり、GPA/WT DNAの3′末端の下流に終始コドンを付加し、さらにその下流に制限酵素Hin dIII切断部位を付加した配列に相補的な配列のものである。常法により、上記混合物を94℃で1分間、55℃で1分間、72℃で3分間の順序でインキュベートするサイクルを40回繰り返すことによりPCRを行い、DNAを増幅させた。このDNAを制限酵素Eco RI及びHin dIIIで切断することにより約1.7kbpのEco RI−Hin dIII断片を得た。このDNA断片を25ngとり、これに予め制限酵素Eco RI及びHin dIIIで切断しておいたファルマシア製プラスミドベクター『pKK223−3』を10ngを加え、さらに宝酒造製ライゲーションキット・バージョン2の溶液Iを先のDNA混合溶液と同体積加えた後、16℃で2時間インキュベートすることにより、複製可能な組換えDNA『pKGPA/WT』を得た。
【0066】
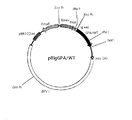
組換えDNA pKGPA/WTをコンピテントセル法によりファルマシア製大腸菌JM105株に導入し、ここで得られる形質転換体『J−GPA/WT』を50μg/mlのアンピシリンを含むLブロス培地(pH7.2)に接種し、37℃で18時間振とう培養した。培養物を遠心分離して形質転換体を採取し、通常のアルカリ−SDS法を適用して組換えDNA pKGPA/WTを抽出した。蛍光光度計を使用する自動シーケンサで分析することにより、このpKGPA/WTにおいては、図2に示すごとく配列表における配列番号17に示す塩基配列のGPA/WT DNAがタックプロモーターの下流に5′末端から3′末端方向に連結されているのが確認された。また、GPA/WT DNAの3′末端側には、介在配列なく終止コドンが存在していることも確認された。
【0067】
【実施例A−1(b)】
〈ポリペプチドの製造〉
形質転換体J−GPA/WTを50μg/mlのアンピシリンを含むLブロス培地(pH7.2)に接種し、37℃で18時間振とう培養した。次に30l容ジャーファーメンタに新鮮なLブロス培地を18lとり、先に培養しておいた種培養物を1%(v/v)の割合で接種し、37℃で通気攪拌培養した。培養物の一部を厚さ1cmのキュベットにとり、波長650nmにおける吸光度を測定しつつ培養し、吸光度が約1.5に達した時点でIPTGを終濃度0.1mMとなるように添加し、さらに5時間培養した。その後、遠心分離により培養物から回収される菌体を、139mM塩化ナトリウム、7mMリン酸水素二ナトリウム及び3mMリン酸二水素ナトリウムを含む混液(pH7.2)に懸濁し常法により超音波処理して菌体を破砕し、菌体破砕物を遠心分離して上清を回収した。
【0068】
この上清に氷冷下で硫酸アンモニウムを50%(w/v)まで加え、均一に溶解し、暫時静置し遠心分離後、沈澱を採取した。この沈澱を20mMトリス塩酸緩衝液(pH8.0)に溶解させ、同緩衝液に透析後、同緩衝液で平衡化したファルマシア製『キュー・セファロース・エフ・エフ・カラム』に負荷し、同緩衝液で充分に洗浄後、0から0.5Mの塩化ナトリウムの濃度勾配下、20mMトリス塩酸緩衝液(pH8.0)を通液した。塩化ナトリウム濃度が0.1乃至0.3M付近で溶出した画分を採取し、膜濃縮しながら10mMリン酸ナトリウム緩衝液(pH7.5)に溶媒交換した。同緩衝液で平衡化したシグマ製『L−アスパラギン・アガロース』に負荷し、同緩衝液で洗浄後0.5M塩化ナトリウムを含む10mMリン酸ナトリウム緩衝液(pH7.5)で溶出させた。溶出画分を膜濃縮し、10%(v/v)グリセリンを含むトリス塩酸−塩緩衝液(pH8.0)で平衡化したファルマシア製『ハイロード・スーパーデックス・200・カラム』に負荷し、約300kDa付近の溶出画分を採取したところ、純度90%以上の精製ポリペプチドが、培養液あたり約0.1mg/mlの収量で得られた。
【0069】
【実施例A−1(c)】
〈理化学的性質〉
精製ポリペプチドを次のように分析し、その理化学的性質を明らかにした。精製ポリペプチドのネイティブな分子量は、実験例1−1(e)に準じてゲル濾過により求めた。その結果、溶出画分のL−アスパラギナーゼ活性のピークは分子量約300kDaに相当する位置に認められた。精製ポリペプチドの、解離した状態での分子量は、実験例1−1(e)中に示したSDS−PAGEにより求めた。その結果、分子量50±10kDaの位置に、主たるバンドが認められた。この結果は、精製ポリペプチドは、ネイティブな状態では多量体を形成していることを示している。2種類の方法の測定誤差及び、大腸菌を始めとする哺乳類以外の従来公知のL−アスパラギナーゼのネイティブな状態での形態が全て4量体であることを考慮に入れると、この結果は精製ポリペプチドが4量体を形成していることを示していると考えられる。またこの精製ポリペプチドを、実験例1−1(d)に示した方法に供した結果、L−アスパラギナーゼ活性を有していることが確認された。
【0070】
【実施例A−2】
〈L−アスパラギナーゼ活性を有するモルモット由来の野生型ポリペプチド〉
【0071】
【実施例A−2(a)】
〈形質転換体の調製〉
概要を図3に示す。先ず始めに、センスプライマー及びアンチセンスプライマーの配列以外は、全て実施例A−1(a)と同一の条件でPCRを行った。センスプライマーの配列は、5′−GTGAATTCGGAGGTTCAGATGGCGCGCGCATCA−3′であり、アンチセンスプライマーの配列は、5′−CTGCGGCCGCTCAGATGGCAGGCGGCAC−3′であった。ここで増幅されたDNAを制限酵素Eco RI及びNot Iで切断し、約1.7kbpのEco RI−Not I断片を得た。このDNA断片70ngと、予め制限酵素Xho I及びNot Iで切断しておいたファルマシア製プラスミドベクター『pBPV』50ng及び、リンカーとして次の塩基配列よりなる4種のオリゴヌクレオチドを、それぞれ25ngずつ混合した。第1のオリゴヌクレオチドの配列は、5′−TCGAGCCACCATGAAGTGTTCGTGGGTTATT−3′、第2のそれは、5′−TTCTTCCTGATGGCCGTAGTGACAGGAGTG−3′、第3のそれは、5′−AATTCACTCCTGTCACTACGGCCATCAGGA−3′であり、第4のそれは、5′−AGAAAATAACCCACGAACACTTCATGGTGGC−3′である。なおリンカーとして用いたオリゴヌクレオチドは、いずれも常法に従い合成後、ファルマシア製T4ポリヌクレオチド・キナーゼを作用させた後、エタノール沈澱により精製したものを用いた。このDNA混合溶液に、等容の宝酒造製ライゲーション・キット・バージョン2の溶液Iを加え、16℃で2時間保持することにより複製可能な組換えDNA『pBIgGPA/WT』を得た。
【0072】
組換えDNA pBIgGPA/WTをコンピテントセル法により大腸菌HB101株に導入し、得られる形質転換体を50μg/mlのアンピシリンを含むLブロス培地(pH7.2)に接種し、37℃で18時間振とう培養した。培養物を遠心分離して菌体を回収し、通常のアルカリ−SDS法を適用して組換DNA pBIgGPA/WTを抽出した。自動シーケンサで配列を分析すると、このpBIgGPA/WTは図4に示すような構造をしていることが確認された。すなわち、モロニー・マウス肉腫ウイルスのロング・ターミナル・リピート由来のエンハンサー(Emsv)とマウス・メタロチオネインI遺伝子由来のプロモーター(Pmti)からなる転写調節域の下流に、ディー・エフ・スターンが『サイエンス』、第235巻、321乃至324頁(1987年)で紹介しているイムノグロブリンの分泌シグナル配列を含むペプチド部分をコードするDNA、Ig sec DNA が連結されており、さらにその下流に同じ読み枠で、GPA/WT DNAが5′末端から3′末端方向に連結されていた。また、GPA/WT DNAの3′末端には介在配列なく終止コドンが存在していることも確認した。
【0073】
この組換えDNA pBIgGPA/WTを、ライフ・テクノロジーズ製リポフェクチン試薬を用い、添付のプロトコールに従って、マウス由来細胞株C127(ATCC CRL−1616)に導入した。該組換えDNAが導入された形質転換体は、第一段階として、増殖の制御能力の喪失すなわちフォーカス形成能によって選択した。第二段階として、フォーカスを含む近傍の細胞を滅菌濾紙にて回収し、目的とする形質転換体を通常の限界希釈法により、L−アスパラギナーゼ活性の産生能に基づき単細胞化した。斯くして形質転換体『C−GPA/WT』を得た。
【0074】
【実施例A−2(b)】
〈ポリペプチドの製造〉
形質転換体C−GPA/WTを、先ず種培養として2.5mlの10%(v/v)ウシ胎児血清を含むDME培地を添加した口径3.5cmのベクトン・ディッキンソン・ラブウェア製6穴マルチウエルプレート『3046』の1穴に接種し、コンフルエントにまで培養した。ここから細胞をトリプシン処理することにより剥離させ、その一部を種細胞として、同培地を添加した別の新たな6穴プラスチックプレートの6穴に接種し培養した。同様の操作を順次培養器を拡張させながら繰り返し、細胞数を増加させて、150cm2 培養フラスコ50本を用いて、該形質転換体を通常の連続培養に供した。最終的に培養上清100lを回収し、実施例A−1(b)の菌体破砕物の上清の処理方法と同様に、硫酸アンモニウム沈澱、沈澱溶解液のキュー・セファロース・エフエフ・カラムを用いたクロマトグラフィー、その溶出画分のL−アスパラギン・アガロース・を用いたクロマトグラフィー及びその溶出画分のハイロード・スーパーデックス・200・カラムを用いたクロマトグラフィーの順で処理した。その結果、純度90%以上の精製ポリペプチドが、培養液あたり約1μg/mlの収量で得られた。
【0075】
【実施例A−2(c)】
〈理化学的性質〉
得られた精製ポリペプチドの理化学的性質を、実施例A−1(c)と同様に調べると、実施例A−1(b)で得た精製ポリペプチドと同等の性質を示すものであることが確認された。
【0076】
【実施例A−3】
〈L−アスパラギナーゼ活性を有するヒト及びモルモット由来のポリペプチド相同体〉
【0077】
【実施例A−3(a)】
〈形質転換体の調製〉
鋳型、センスプライマー及びアンチセンスプライマー以外は実施例A−1(a)に示した方法と同一条件でPCRを行い、得られたDNAを実施例A−1(a)と同様に処理することにより組換えDNA『pKGPA/D364stp』、『pKHA/MUT1』、『pKHA/MUT2』、『pKHA/MUT3』及び『pKHA/MUT5』を得た。それぞれの組換えDNAの調製のために用いた鋳型DNAの名称、センスプライマー及びアンチセンスプライマーの塩基配列を表5にまとめて示す。実施例A−1(a)と同様に塩基配列を分析し、これらの組換えDNAの構造を確認した。これらの組換えDNAの構造は、図5乃至9に示している。
【0078】
【表5】
【0079】
ここで得た、組換えDNAを同様に実施例A−1(a)に従って処理し、形質転換体『J−GPA/D364stp』、『J−HA/MUT1』、『J−HA/MUT2』、『J−HA/MUT3』及び『J−HA/MUT5』を得た。
【0080】
【実施例A−3(b)】
〈ポリペプチドの製造〉
これら5種類の形質転換体を実施例A−1(b)と同様に培養、菌体の破砕、菌体破砕物の硫酸アンモニウム沈澱、沈澱溶解液のキュー・セファロース・エフエフ・カラムを用いたクロマトグラフィー、及びその溶出画分のL−アスパラギン・アガロースを用いたクロマトグラフィーの順で処理した。この結果得られた溶出画分は実施例A−1(b)と同様に膜濃縮した後、ハイロード・スーパーデックス・200・カラムを用いたクロマトグラフィーに供し、約140kDa付近の溶出画分を採取したところ、いずれも純度90%以上の精製ポリペプチドが培養液あたり約0.1mg/mlの収量で得られた。これらの精製ポリペプチドを実施例A−1(c)の方法により分析し、理化学的性質を明らかにした。実施例A−1で得た結果とあわせて表6に示した。
【0081】
【表6】
【0082】
表6に示す結果は、大腸菌を宿主として発現させ精製された、それぞれの野生型ポリペプチド或いはポリペプチド相同体は、いずれもL−アスパラギナーゼ活性を示すことが分かる。またこれらのポリペプチドは4量体を形成していることが示されている。
【0083】
【実施例A−4】
〈L−アスパラギナーゼ活性を有するヒト及びモルモット由来のポリペプチド相同体〉
【0084】
【実施例A−4(a)】
〈形質転換体の調製〉
鋳型、センスプライマー又はアンチセンスプライマー以外は実施例A−1(a)に示した方法と同一条件でPCRを行った。得られたDNAを実施例A−2(a)で用いたのと同一のリンカーを用い、同一の条件で連結することにより、組換えDNA『pBIgGPA/D364stp』、『pBIgHA/MUT1』、『pBIgHA/MUT2』、『pBIgHA/MUT3』及び『pBIgHA/MUT5』を得た。それぞれの組換えDNAの調製のためのPCRに用いた鋳型DNAの名称、センスプライマー及びアンチセンスプライマーの塩基配列を表7にまとめて示す。実施例A−1(a)と同様に塩基配列を分析し、これらの組換えDNAの構造を確認した。これらの組換えDNAの構造は、図10乃至14に示している。
【0085】
【表7】
【0086】
ここで得た、組換えDNAを同様に実施例A−2(a)と同様に処理することにより、それぞれ形質転換体『C−GPA/D364stp』、『C−HA/MUT1』、『C−HA/MUT2』、『C−HA/MUT3』及び『C−HA/MUT5』を得た。
【0087】
【実施例A−4(b)】
〈ポリペプチドの製造〉
【0088】
これら5種類の形質転換体を実施例A−2(b)と同様に培養し、培養上清を実施例A−1(b)の菌体破砕の処理方法と同様に硫酸アンモニウム沈澱、沈澱溶解液のキュー・セファロース・エフ・エフ・カラムを用いたクロマトグラフィー及びその溶出画分のL−アスパラギン・アガロース・ゲルを用いたクロマトグラフィーの順で処理した。この結果得られた溶出画分は実施例A−1(b)と同様に膜濃縮した後、ハイロード・スーパーデックス・200・カラムを用いたクロマトグラフィーに供し、約140kDa付近の溶出画分を採取したところ、純度90%以上の精製ポリペプチドが培養液あたり約1μg/mlの収量で得られた。これらの精製ポリペプチドを実施例A−1(c)の方法により分析し、理化学的性質を明らかにした。実施例A−3で得た結果とあわせて表8に示した。
【0089】
【表8】
【0090】
表8に示す結果は、動物細胞を宿主として発現させ精製された、それぞれの野生型ポリペプチド或いは、ポリペプチド相同体は、いずれもL−アスパラギナーゼ活性を示すことが分かる。またこれらのポリペプチドは4量体を形成していることが示される。
【0091】
以上実施例Aに示すごとく、この発明のポリペプチドは、いずれもL−アスパラギナーゼ活性を示す。したがって、この発明の感受性疾患剤は、ヒトに投与すると、体内のL−アスパラギンを加水分解し、L−アスパラギナーゼ感受性疾患の治療・予防に効果を発揮する。この発明でいう感受性疾患とは、L−アスパラギン依存性腫瘍細胞の存在に起因する疾患全般を意味するものとし、具体的には、例えば、急性白血病・急性転化した慢性白血病・T細胞白血病等の白血病、非ホジキン病・ホジキン病等の悪性リンパ腫を挙げることができる。斯くしてこの発明の感受性疾患剤は、上記のごとき感受性疾患を治療・予防するための抗腫瘍剤としての用途を有することとなる。剤型並びに感受性疾患の種類及び性状にもよるが、この発明の感受性疾患剤は、通常、液状、ペースト状又は固状に調製され、当該ポリペプチドを0.000001乃至100%(w/w)、望ましくは、0.0001乃至100%(w/w)含んでいる。
【0092】
この発明の感受性疾患剤は当該ポリペプチド単独の形態はもとより、当該ポリペプチドとそれ以外の生理的に許容される、例えば、基剤、賦形剤、可溶剤、緩衝剤、安定剤、さらには必要に応じて、他の生理活性物質乃至は他の薬剤のうちから選ばれる1種又は2種以上との組成物としての形態をも包含する。基剤、賦形剤、可溶剤、緩衝剤及び安定剤としては具体的には、例えば、日本医薬品添加剤協会編集、『医薬品添加物辞典』(1994年)、薬事日報社発行や、日本医薬品添加剤協会編集、『医薬品添加物辞典追補 1995』(1995年)、薬事日報社発行などに記載のものが挙げられる。他の生理活性物質乃至他の薬剤としては具体的には、例えば、インターフェロン−α、インターフェロン−β、インターフェロン−γ、インターロイキン1、インターロイキン2、インターロイキン3、TNF−α、TNF−β、GM−CSF、カルボコン、シクロフォスファミド、アクラルビシン、チオテパ、ブスルファン、アンシタビン、シタラビン、フルオロウラシル、テトラヒドロフリルフルオロウラシル、メトトレキサート、アクチノマイシンD、クロモマイシンA3、ダウノルビシン、ドキソルビシン、ブレオマイシン、メルカプトプリン、プレドニゾロン、マイトマイシンC、ビンクリスチン、ビンブラスチン、金コロイド、クレスチン、ピシバニール、レンチナン及び丸山ワクチンなどが挙げられる。
【0093】
さらに、この発明の感受性疾患剤は、投薬単位形態の薬剤をも包含し、その投薬単位形態の薬剤とは、当該ポリペプチドを、例えば、1回当たりの用量又はその正数倍(4倍まで)若しくはその約数(1/40まで)に相当する量を含んでおり、投薬に適する物理的に分離した一体の剤型にある薬剤を意味する。この様な投薬形態の薬剤としては、注射剤、液剤、散剤、顆粒剤、錠剤、カプセル剤、舌下剤、点眼剤、点鼻剤、座剤などが挙げられる。
【0094】
この発明の感受性疾患剤は経口的に投与しても非経口的に投与しても、いずれの場合にも、感受性疾患の治療・予防に効果を発揮する。感受性疾患の種類や症状にもよるが、具体的には、患者の症状や投与後の経過を観察しながら、成人当たり約0.1μg乃至500mg/回、望ましくは約0.1乃至100mg/回のポリペプチドを1乃至4回/日又は1乃至7回/週の用量で1日乃至1年間にわたって経口投与するか、皮内、皮下、筋肉内又は静脈内に非経口投与すればよい。また、この発明の感受性疾患剤のその他の一形態としては、例えば、遺伝子治療を応用した形態が挙げられる。つまり、この発明のポリペプチドをコードするDNAを適宜宿主に導入してなる形質転換体を投与し、この発明のポリペプチドを感受性疾患患者の生体内で産生させることにより、上記の投与形態と同等の効果を発揮する。なお、遺伝子治療を実施するための一般的手順は、例えば、島田隆、斎藤泉、小澤敬也編集、『実験医学別冊バイオマニュアルUPシリーズ 遺伝子治療の基礎技術』(1996年)、羊土社発行に詳述されている。
【0095】
次に、実験例3に基づき、この発明のポリペプチドの生物活性について、実験例4に基づき、この発明のポリペプチドの安全性について説明する。
【0096】
【実験例3】
〈生物活性〉
【0097】
【実験例3−1】
〈イン・ビトロにおける抗腫瘍細胞効果〉
【0098】
ヒト組織球リンパ腫細胞株U937(ATCC No.CRL−1593)及びヒトリンパ芽球由来細胞株Molt4(ATCC No.CRL−1582)を、10%(v/v)ウシ胎児血清を含むRPMI1640培地で予め継代培養しておいた。対数増殖期にあるそれぞれの細胞培養系から、細胞を遠心分離により回収し、同培地で2×105個/mlの細胞濃度に調整し、該細胞懸濁液をベクトン・ディッキンソン・ラブウェア製24穴マルチウエルプレート『3047』プレートに、1穴あたり1mlで合計13穴に接種した。ここに実施例A−1乃至A−4で調製した12種類の精製ポリペプチドのPBSによる希釈液をそれぞれ添加し、5%(v/v)CO2インキュベーター内で、37℃で72時間培養した。各精製ポリペプチドの終濃度は、L−アスパラギナーゼ活性として1単位/mlであった。対照区として、PBSを等容添加して同じく培養する系を設けた。培養後細胞を回収し、トリパン・ブルーにより死細胞を染色して、精製ポリペプチド添加系の細胞生存率を対照区と比較した。その結果、いずれの精製ポリペプチドを添加した系も、細胞生存率は対照区と比較して有意に低い値を示した。このことは、実施例A−1乃至A−4で得られた精製ポリペプチドは、いずれもU937及びMolt4に対する細胞障害性を有することを示している。
【0099】
【実験例3−2】
〈イン・ビボにおける抗腫瘍細胞効果〉
【0100】
東北大学加齢医学研究所医用細胞資源センターに登録されているマウスリンパ腫細胞株6C3HEDを、常法により1×107個/匹で8日ごとにその脇腹に皮下注射することによって継代移植されているC3Hマウスをモデルマウスとして用いた。該細胞の移植後4日目から7日目までの毎日、該モデルマウスに実施例A−1乃至A−4で得られた精製ポリペプチドを、400単位/匹で、静脈注射にて投与した。移植後4及び8日目の腫瘍の大きさを肉眼で観察した。なお精製ポリペプチドは、0.15Mの塩化ナトリウム溶液で希釈した後、ミリポア製の孔径0.45μmのメンブランフィルターで濾過した後に投与した。対照区として、0.15M塩化ナトリウム溶液を同様に処理した系を設けた。その結果、対照区では腫瘍の明らかな肥大が認められたのに対し、精製ポリペプチドを投与した系では腫瘍の明らかな退縮又は消失が認められた。このことは、実施例A−1乃至A−4で調製される精製ポリペプチドが、いずれもモデルマウスの腫瘍を治癒する能力があることを示している。
【0101】
【実験例4】
〈急性毒性試験〉
実施例A−1乃至A−4で調製された精製ポリペプチドをそれぞれ別個に、常法にしたがって8週齢のマウスに経皮、経口あるいは腹腔内に注射投与した。その結果、これらの精製ポリペプチドのLD50は、いずれの投与経路による場合も約100mg/kg以上であった。このことは、この発明のポリペプチドがヒトへの投与を前提とする医薬品として安全であることを裏付けている。
【0102】
以下、この発明の感受性疾患剤につき実施例を挙げて説明する。
【0103】
【実施例B】
〈感受性疾患剤〉
【0104】
【実施例B−1】
〈液剤〉
安定剤として1%(w/v)のヒト血清アルブミンを含む生理食塩水に実施例A−1乃至A−4で得た精製ポリペプチドをそれぞれ別個に0.1mg/mlとなるように溶解させ、常法に従った精密濾過により滅菌して液剤を得た。
【0105】
いずれの製品も安定性に優れ、悪性腫瘍、急性白血病、悪性リンパ腫、慢性白血病の急性転化、T細胞白血病を含む感受性疾患を治療・予防するための注射剤、点眼剤、及び点鼻剤として有用である。
【0106】
【実施例B−2】
〈液剤〉
安定剤として1%(w/v)のグリセリンを含む生理食塩水に実施例A−1乃至A−4で得た精製ポリペプチドをそれぞれ別個に0.1mg/mlとなるように溶解させ、常法に従った精密濾過により滅菌して液剤を得た。
【0107】
いずれの製品も安定性に優れた、悪性腫瘍、急性白血病、悪性リンパ腫、慢性白血病の急性転化、T細胞白血病を含む感受性疾患を治療・予防するための注射剤、点眼剤、及び点鼻剤として有用である。
【0108】
【実施例B−3】
〈乾燥注射剤〉
安定剤として、1%(w/v)の精製ゼラチンを含む生理食塩水に実施例A−1乃至A−4で得た精製ポリペプチドをそれぞれ別個に50mg/mlとなるように溶解させ、常法に従った精密濾過により滅菌して、バイアル瓶に1mlずつ分注し、凍結乾燥後密栓した。
【0109】
いずれの製品も安定性に優れ、悪性腫瘍、急性白血病、悪性リンパ腫、慢性白血病の急性転化、T細胞白血病を含む感受性疾患を治療・予防するための乾燥注射剤として有用である。
【0110】
【実施例B−4】
〈軟膏剤〉
滅菌蒸留水に和光純薬工業製カルボキシビニルポリマー『ハイビスワコー104』と高純度トレハロースをそれぞれ濃度1.4%(w/w)及び2.0%(w/w)になるように溶解させ、実施例A−1乃至A−4で得た精製ポリペプチドをそれぞれ別個に均一に混合後、pH7.2に調整して1g当たり該ポリペプチドを約10mg含むペースト状物を得た。
【0111】
いずれの製品も延展性と安定性に優れ、悪性腫瘍、急性白血病、悪性リンパ腫、慢性白血病の急性転化、T細胞白血病を含む感受性疾患を治療・予防するための軟膏として有用である。
【0112】
【実施例B−5】
〈錠剤〉
林原製無水結晶α−マルトース粉末『ファイントース』に実施例A−1乃至A−4で得た精製ポリペプチドと細胞賦活剤としてのルミンを均一に混合し、得られる混合物を打錠機により打錠して製品1錠(約200mg)当たり該ポリペプチド及びルミンをそれぞれ約5mg含む錠剤を得た。
【0113】
いずれの製品も摂取性と安定性に優れ、さらに細胞賦活作用も有し、悪性腫瘍、急性白血病、悪性リンパ腫、慢性白血病の急性転化、T細胞白血病を含む感受性疾患を治療・予防するための錠剤として有用である。
【0114】
【発明の効果】
この発明は、L−アスパラギナーゼ活性を有する哺乳類由来のポリペプチドの発見に基づくものである。この発明のポリペプチドは、いずれもアミノ酸配列まで解明されている物質であり、安定したL−アスパラギンを加水分解する活性を有する。これにより、この発明のポリペプチドは、L−アスパラギン依存性腫瘍細胞に起因する各種の疾患に対する治療剤・予防剤として威力を発揮する。
【0115】
この発明のポリペプチドは哺乳類由来であることから、ヒトに対する抗原性が低く、多量投与或いは継続投与しても重篤な副作用を惹起することがない。したがって、この発明のポリペプチドは、使用に際して患者の感受性に関して厳密な管理をしなくとも、所望の効果を発揮できる利点がある。
【0116】
かくも有用なるこの発明のポリペプチドは、これをコードするこの発明のDNAを利用することにより、所望量を容易に製造することができる。
【0117】
この発明は、斯くも顕著な作用効果を発揮するものであり、斯界に貢献すること誠に多大な意義のある発明であるといえる。
【0118】
【配列表】
【0119】
【0120】
【0121】
【0122】
【0123】
【0124】
【0125】
【0126】
【0127】
【0128】
【0129】
【0130】
【0131】
【0132】
【0133】
【0134】
【0135】
【図面の簡単な説明】
【図1】オーバー・ラップ・エクステンション法の概要を示す図である。
【図2】組換えDNA pKGPA/WTの制限酵素地図を示す図である。
【図3】組換えDNA pBIgGPA/WTの調製法の概要を示す図である。
【図4】組換えDNA pBIgGPA/WTの制限酵素地図を示す図である。
【図5】組換えDNA pKGPA/D364stpの制限酵素地図を示す図である。
【図6】組換えDNA pKHA/MUT1の制限酵素地図を示す図である。
【図7】組換えDNA pKHA/MUT2の制限酵素地図を示す図である。
【図8】組換えDNA pKHA/MUT3の制限酵素地図を示す図である。
【図9】組換えDNA pKHA/MUT5の制限酵素地図を示す図である。
【図10】組換えDNA pBIgGPA/D364stpの制限酵素地図を示す図である。
【図11】組換えDNA pBIgHA/MUT1の制限酵素地図を示す図である。
【図12】組換えDNA pBIgHA/MUT2の制限酵素地図を示す図である。
【図13】組換えDNA pBIgHA/MUT3の制限酵素地図を示す図である。
【図14】組換えDNA pBIgHA/MUT5の制限酵素地図を示す図である。
【符号の説明】
Eco RI Eco RI切断部位
Hin dIII Hin dIII切断部位
Not I Not I切断部位
Xho I Xho I切断部位
GPA/WT モルモット野生型L−アスパラギナーゼをコードするDNA(GPA/WT DNA)
D364stp モルモットL−アスパラギナーゼ相同体をコードするDNA(GPA/D364stpDNA)
HA/MUT1 ヒトL−アスパラギナーゼ相同体をコードするDNA(HA/MUT1 DNA)
HA/MUT2 ヒトL−アスパラギナーゼ相同体をコードするDNA(HA/MUT2 DNA)
HA/MUT3 ヒトL−アスパラギナーゼ相同体をコードするDNA(HA/MUT3 DNA)
HA/MUT5 ヒトL−アスパラギナーゼ相同体をコードするDNA(HA/MUT5 DNA)
Ptac tacプロモーター
rrnBT1T2 リボゾームRNAオペロンの転写終領域
5S 5SリボゾームRNA遺伝子
AmpR アンピシリン耐性遺伝子
pBR322ori 大腸菌における複製開始点
Ig sec イムノグロブリンの分泌シグナル配列を含むペプチド部分をコードするDNA(Ig sec DNA)
Emsv モロニー・マウス肉腫ウイルスのロング・ターミナル・リピート由来のエンハンサー
Pmti マウス・メタロチオネインI遺伝子由来のプロモーター
Poly(A) SV40由来のポリ(A)付加シグナル
BPVI ウシパピローマ・ウイルスのゲノム[0001]
BACKGROUND OF THE INVENTION
The present invention relates to a novel polypeptide having L-asparaginase activity, and particularly to a polypeptide derived from a mammal having L-asparaginase activity.
[0002]
[Prior art]
L-asparaginase (EC 3.5.1.1) is an enzyme that catalyzes a reaction that hydrolyzes L-asparagine to produce L-aspartic acid and ammonia. The study of L-asparaginase as an anti-tumor agent was carried out by J. G. Kids in the Journal of Experimental Medicine, Vol. 98, pages 565-582 (1953) against guinea pig serum against lymphoma. It originates in reporting that anti-tumor action is recognized. Later, JD Bloom revealed in Nature, Vol. 191, pp. 1114 to 1115 (1961) that the substance of this antitumor activity was L-asparaginase. Currently, the mechanism of action is explained as follows. That is, since tumor cells such as acute lymphocytic leukemia cells lack L-asparagine synthetase, L-asparagine in the living body becomes an essential nutrient, and therefore L-asparagine is deficient or does not exist in the living body. You can't grow under the conditions, so you can't stay alive. However, since L-asparagine is not an essential nutrient for normal cells, in a malignant tumor patient, when L-asparagine is hydrolyzed in vivo by L-asparaginase, only the tumor cells are selectively killed, and the malignant tumor is removed. It can be treated. Since then, energetic research has continued with the aim of putting L-asparaginase into practical use as an antitumor agent. As a result, L-asparaginase derived from Escherichia coli has now been used as a therapeutic agent for leukemia and lymphoma. .
[0003]
However, L-asparaginase derived from Escherichia coli is a heterogeneous protein, as seen from the human body, and conventional therapeutic agents that use this protein are anaphylactic shock, urticaria, edema, wheezing, dyspnea when administered to patients. Serious side effects such as hypersensitivity reactions such as Thus, conventional therapeutic agents are in a situation in which the dose and administration frequency must be greatly limited, and therefore several proposals have been made to reduce or eliminate such side effects.
[0004]
First, as seen in JP-A No. 54-119082, 65% or more of amino groups in L-asparaginase derived from Escherichia coli by 2-O-substituted polyethylene glycol-4,6-dichloro-S-triazine. In order to chemically modify the L-asparaginase itself. The second is to collect human L-asparaginase from the culture or human urine of certain human cell lines, as seen in Japanese Patent Application Laid-Open No. 4-320684 or Japanese Patent Application Laid-Open No. 55-19018. It is. The first proposal has the advantage that L-asparaginase of Escherichia coli, which is easily available in large quantities, can be used, but the problem is that the modification reaction is difficult to control and the side effects are not completely eliminated. There is. The human L-asparaginase according to the second proposal, unlike that produced by Escherichia coli, has the advantage that it is difficult to produce antibodies even when administered to a patient. However, human cells disclosed in JP-A-4-320684 are disclosed. Has a problem that L-asparaginase production ability is not sufficiently high, and there is a problem that a large amount of cells must be cultured when trying to mass-produce L-asparaginase, and the method disclosed in JP-A-55-19018 However, there is a problem that it is difficult to obtain fresh human urine continuously on an industrial scale.
[0005]
By the way, recent advances in recombinant DNA technology are remarkable. Today, if DNA encoding the polypeptide of interest can be isolated, a recombinant DNA is produced from the DNA and a vector capable of autonomous replication, and this is introduced into cells of microorganisms or animals and plants. By culturing the transformant, a desired amount of the polypeptide can be easily obtained. To date, however, mammalian DNA encoding L-asparaginase has not yet been isolated,
Of course, mammalian L-asparaginase has not been produced by recombinant DNA technology.
[0006]
In view of such a situation, in this field, DNA derived from a mammal encoding an active L-asparaginase is isolated as soon as possible, and by applying recombinant DNA technology to the isolated DNA, L-asparaginase Establishment of a technique for mass-producing a polypeptide derived from a mammal having activity is desired.
[0007]
[Problems to be solved by the invention]
A first object of the present invention is to provide a polypeptide derived from a mammal having L-asparaginase activity.
[0008]
A second object of the present invention is to provide a DNA encoding such a polypeptide.
[0009]
A third object of the present invention is to provide a recombinant DNA comprising a DNA encoding such a polypeptide and a vector capable of autonomous replication.
[0010]
A fourth object of the present invention is to provide a transformant obtained by appropriately introducing such a recombinant DNA into a host.
[0011]
A fifth object of the present invention is to provide a method for producing the above polypeptide using such a transformant.
[0012]
The sixth object of the present invention is to provide a sensitive disease agent comprising such a polypeptide as an active ingredient.
[0013]
[Means for Solving the Problems]
This invention solves said 1st subject with polypeptide derived from the mammal which has L-asparaginase activity.
[0014]
In addition, the present invention solves the second problem by using a DNA encoding a mammal-derived polypeptide having L-asparaginase activity.
[0015]
In addition, the present invention solves the third problem by a recombinant DNA comprising a DNA encoding a mammalian polypeptide having L-asparaginase activity and a vector capable of autonomous replication.
[0016]
In addition, the present invention solves the fourth problem by a transformant obtained by appropriately introducing a DNA encoding a mammalian polypeptide having L-asparaginase activity into a host.
[0017]
The present invention also provides the fifth problem by cultivating a transformant obtained by appropriately introducing a DNA encoding a mammal-derived polypeptide having L-asparaginase activity into a host, and removing the produced polypeptide from the culture. The problem is solved by the method for producing the collected polypeptide.
[0018]
The present invention also solves the sixth problem by a sensitive disease agent comprising, as an active ingredient, a mammal-derived polypeptide having L-asparaginase activity.
[0019]
[Action]
The polypeptide of the present invention derived from a mammal acts on L-asparagine to produce L-aspartic acid and ammonia.
[0020]
The DNA of this invention is inserted into an appropriate vector capable of autonomous replication to form a recombinant DNA, and this recombinant DNA is usually introduced into a suitable host that does not produce the polypeptide but can be easily propagated. By producing a transformant, the production of the polypeptide is expressed.
[0021]
The replicable recombinant DNA of this invention does not usually produce the polypeptide, but expresses the production of the polypeptide by introducing it into a suitable host that can be easily propagated to form a transformant. .
[0022]
The transformant of this invention expresses production of the polypeptide when cultured.
[0023]
If this transformant is cultured according to the production method of the present invention, a desired amount of polypeptide can be easily obtained.
[0024]
The sensitive disease agent of the present invention exhibits a remarkable therapeutic / preventive effect without serious side effects when administered to humans.
[0025]
The inventor of the present invention has isolated the guinea pig and human-derived DNA encoding L-asparaginase for the first time in the world and succeeded in elucidating the base sequence. That is, it was clarified that the guinea pig-derived DNA has the base sequence shown in SEQ ID NO: 15 in the sequence listing, and the human-derived DNA has the base sequence shown in SEQ ID NO: 16 in the sequence listing. This finding is attributed to the same applicant. Special Kaihei 8-214885 public In the news It is disclosed. The present invention is based on these findings and provides for the first time in the world a polypeptide derived from a mammal having L-asparaginase activity.
[0026]
DETAILED DESCRIPTION OF THE INVENTION
The polypeptide of this invention does not ask | require the origin and origin as long as it is derived from mammals and has L-asparaginase activity. The polypeptide of the present invention can be obtained by expressing a gene derived from a mammal, and usually contains the amino acid sequences shown in SEQ ID NOs: 1, 2 and 3 in the sequence listing. However, in the amino acid sequence shown in SEQ ID NO: 3, the amino acid indicated by the symbol “Xaa” represents glutamine or arginine. Examples of the individual polypeptides include polypeptides having any one of the amino acid sequences shown in SEQ ID NOs: 4 to 9 in the sequence listing. However, in view of the state of the art, with respect to the amino acid sequences shown in SEQ ID NOs: 4 to 9, one or more of the amino acids are replaced with other amino acids without substantially losing L-asparaginase activity. It is relatively easy to replace. On the other hand, even if the polypeptides are derived from the same DNA, the type of vector used for the introduction thereof, the type of host to which the polypeptide is introduced, or the components of the medium used for culturing the transformant containing the DNA Depending on the composition, culture temperature, pH, etc., one or two amino acids at the N-terminus and / or C-terminus are retained in the process of modification and purification after DNA expression by the host enzyme, although the desired activity is retained. One or more amino acids may be deleted, or one or more amino acids may be added to the N-terminal and / or C-terminal, or a sugar chain may be added to the produced polypeptide. In view of such a situation, it goes without saying that the polypeptide has any amino acid sequence shown in SEQ ID NO: 4 to 9 in the sequence listing as it is, and as long as it has L-asparaginase activity, its homologues are naturally also present in the present invention. Is included. The polypeptide of the present invention usually has L-asparaginase activity when in the form of a multimer, preferably in the form of a tetramer.
[0027]
The polypeptides of this invention are usually produced by recombinant DNA technology. That is, the polypeptide of the present invention can be usually produced by culturing a transformant containing DNA encoding it and collecting the produced polypeptide from the culture. For example, such a transformant appropriately converts a recombinant DNA containing any one of the nucleotide sequences shown in SEQ ID NOs: 10 to 15 in the sequence listing. Introduce to host Can be obtained. In the above base sequence, one or two or more bases may be replaced with another base without changing the encoded amino acid sequence by utilizing the degeneracy of the gene code. In addition, in order to promote production of the polypeptide in a DNA host, one or more bases in the base sequence encoding the polypeptide or a homologue thereof can be appropriately substituted with other bases. Needless to say. Furthermore, a sequence encoding one or more amino acids and / or a sequence not encoding an amino acid is added to the 5 ′ end and / or 3 ′ end of the base sequence encoding the polypeptide or a homologue thereof. Needless to say, it can be done.
[0028]
The DNA encoding the polypeptide of the present invention is artificially synthesized even if it is obtained from nature as long as the polypeptide as its expression product has L-asparaginase activity. It may be a wild-type DNA whose sequence matches that obtained from nature, or a DNA homologue to the wild-type DNA. Examples of the natural source of DNA encoding the polypeptide of the present invention include guinea pig liver, from which wild-type DNA containing the nucleotide sequence shown in SEQ ID NO: 15 is obtained by a conventional method. It is done. That is, by the same applicant Special Kaihei 8-214885 public In the news As disclosed, first, a cDNA library is prepared by a conventional method using poly (A) -added RNA purified from guinea pig liver as a material. Here, a plaque hybridization method was applied using an oligonucleotide chemically synthesized based on a partial amino acid sequence of L-asparaginase purified from guinea pig serum as a probe, and a phage clone containing a DNA encoding the polypeptide of the present invention was obtained. Collect. If the phage clones thus obtained are usually treated by a general method, the DNA can be obtained. It is also possible to chemically synthesize DNA based on SEQ ID NO: 15 in the sequence listing. Examples of homologues to wild-type DNA include, for example, individual DNAs containing the base sequences shown in SEQ ID NOs: 10 to 14 in the sequence listing. DNA containing the nucleotide sequence shown in SEQ ID NO: 10 in the sequence listing is converted to wild-type DNA obtained as described above shown in SEQ ID NO: 15 in the sequence listing by methods commonly used in the art such as PCR and point mutation. The introduction method can be obtained by applying based on the base sequence of SEQ ID NO: 10 in the sequence listing. Any of the DNAs containing the base sequences shown in SEQ ID NOs: 11 to 14 in the sequence listing can be obtained as follows. That is, first, by the same applicant Special Kaihei 8-214885 public In the news By screening a human liver cDNA library or the like as disclosed, wild-type DNA containing the base sequence shown in SEQ ID NO: 16 in the sequence listing is obtained. Then, a PCR method or a point mutation introduction method commonly used in this field may be applied to the wild-type DNA based on the nucleotide sequences of SEQ ID NOs: 11 to 14 in the sequence listing. It is also possible to chemically synthesize DNA based on the base sequences shown in SEQ ID NOs: 10 to 14 in the sequence listing.
[0029]
Such DNA is usually introduced into the host in the form of recombinant DNA. Recombinant DNA usually comprises a vector that can autonomously replicate with DNA, and if DNA is available, it can usually be prepared relatively easily by general recombinant DNA techniques. Examples of such vectors include plasmid vectors such as pKK223-3, pGEX-2T, pRL-λ, pBTrp2 DNA, pUB110, YEp13, Ti plasmid, Ri plasmid, pBI121, pCDM8, pBPV, BCMGSneo, Of these, pKK223-3, pGEX-2T, pRL-λ, pBTrp2 DNA and pUB110 are used for expression of the DNA of the present invention in prokaryotic cells such as Escherichia coli and Bacillus subtilis. YEp13, Ti plasmid, Ri plasmid, pBI121, pCDM8, pBPV and BCMGSneo are preferred for expression in cells.
[0030]
In order to insert the DNA of the present invention into such a vector, a general method is usually employed in this field. Specifically, for example, an autonomously replicable vector is first cleaved with a restriction enzyme. Next, the PCR method is applied to introduce the same restriction enzyme cleavage sites as those previously used to cleave the vector into the 5 ′ and 3 ′ ends of the DNA of the present invention to form double strands. Cleave with restriction enzymes. Next, the mixture of the vector and the DNA fragment is ligated by allowing DNA ligase to act. The recombinant DNA thus obtained can be replicated indefinitely by appropriately introducing it into a host to form a transformant and culturing it.
[0031]
The recombinant DNA according to the present invention can be introduced into an appropriate host including E. coli, Bacillus subtilis, actinomycetes, yeast, plant cells, and animal cells. When the host is Escherichia coli, for example, the host may be cultured in the presence of recombinant DNA and calcium ions, while when the host is Bacillus subtilis, for example, the competent cell method or the protoplast method may be applied. Good. When the host is an animal cell, for example, the DEAE-dextran method or the electroporation method may be used. In order to clone the transformant, a hybridization method may be applied, or one that is cultured in a medium and produces L-asparaginase may be selected.
[0032]
When the transformant thus obtained is cultured in a medium, the polypeptide is produced outside or inside the cell or inside and outside the cell. The medium is usually a normal liquid medium supplemented with carbon sources, nitrogen sources, minerals, and micronutrients such as amino acids and vitamins as needed. As the carbon source, starch, starch hydrolysis can be used. Sugars such as food, glucose, fructose, sucrose, etc., and nitrogen sources include, for example, ammonia or ammonium salts, urea, nitrates, peptones, yeast extracts, defatted soybeans, corn steep liquor, meat extracts and other nitrogen-containing inorganic or organic substances Is mentioned. When the transformant is inoculated into such a medium and cultured for about 1 to 10 days under aerobic conditions such as aeration stirring while maintaining the nutrient medium at a temperature of 25 to 65 ° C. and
[0033]
The method used here is described below based on experimental examples. For example, Jay Sambrook et al., “Molecular Cloning a Laboratory Manual” (1989), Cold. Also published in detail by Spring Harbor, Masami Matsumura, “Lab Manual Genetic Engineering” (1988), published by Maruzen.
[0034]
[Experiment 1]
<Expression of wild-type DNA derived from guinea pig and human>
[0035]
[Experimental Example 1-1]
<Expression of wild-type DNA derived from guinea pig>
[0036]
[Experimental Example 1-1 (a)]
<Preparation of guinea pig-derived wild-type DNA>
Wild-type DNA encoding L-asparaginase from guinea pig has been obtained by the same applicant. Special Kaihei 8-214885 public In the news Prepared according to the disclosed method. This DNA had the base sequence shown in SEQ ID NO: 15 in the sequence listing. Hereinafter, in the base sequence shown in SEQ ID NO: 15, a DNA encoding a polypeptide, that is, a DNA having a sequence consisting of the 20th to 1714th bases in the base sequence is referred to as “GPA / WT DNA”. A polypeptide having the amino acid sequence shown in SEQ ID NO: 15 in the sequence listing, which is an expression product of GPA / WT DNA, is hereinafter referred to as “guinea pig wild-type L-asparaginase”. In addition, in SEQ ID NO: 17 in the sequence listing, the amino acid sequence encoded by it is shown together with the base sequence of GPA / WT DNA.
[0037]
[Experimental Example 1-1 (b)]
<Preparation of recombinant DNA>
In a 0.5 ml reaction tube, 10 μl of 10 × PCR buffer, 1 μl of 25 mM dNTP mix, and 1 ng of wild-type DNA encoding L-asparaginase derived from guinea pig obtained in Experimental Example 1-1 (a) were used as a template. After adding appropriate amounts of oligonucleotides chemically synthesized based on sequences near the N-terminal and C-terminal in the amino acid sequence shown in SEQ ID NO: 15 in the Sequence Listing as sense primers and antisense primers to make 99.5 μl with sterile distilled water Then, 0.5 μl of 2.5 units / μl of Amplac DNA polymerase was added. The sense primer has a sequence of 5'-AATCTCGAGCCCACCCATGGCGCGCGCATCA-3 ', and M Kozak's "New Craik Acid Research" is located upstream of the portion encoding the N-terminus of the amino acid sequence shown in SEQ ID NO: 15 in the Sequence Listing. 15: 8125-8148 (1987), a common sequence in animal cells was added, and a restriction enzyme Xho I cleavage site was further added upstream. The antisense primer has a sequence of 5′-CTGCGGCCCCTTATCAGATGGCAGGCGGCAC-3 ′, and adds two start codons downstream of the portion encoding the C-terminal of the amino acid sequence shown in SEQ ID NO: 15 in the sequence listing, and further downstream And a sequence complementary to the sequence added with a restriction enzyme Not I cleavage site. In a conventional manner, PCR is performed by repeating 40 cycles of incubating the above mixture in the order of 94 ° C. for 1 minute, 55 ° C. for 1 minute, and 72 ° C. for 3 minutes, and contains GPA / WT DNA. DNA was obtained. 25 ng of a DNA fragment of about 1.7 kbp obtained by cleaving this DNA with restriction enzymes Xho I and Not I was taken, and this was preliminarily cleaved with restriction enzymes XhoI and Not I. 10 ng, and then add the same volume of Takara Shuzo Ligation Kit Version 2 solution I to the previous DNA mixed solution, and then incubate at 16 ° C. for 2 hours to produce a replicable recombinant DNA “pCGPA / WT I got.
[0038]
Recombinant DNA pCGPA / WT was introduced into E. coli strain MC1061 / P3 manufactured by Invitrogen by the competent cell method, and the obtained transformant was L broth medium (pH 7.) containing 20 μg / ml ampicillin and 10 μg / ml tetracycline. 2) was inoculated and cultured with shaking at 37 ° C. for 18 hours. The transformant was collected by centrifuging the culture, and recombinant DNA pCGPA / WT was extracted by applying the usual alkali-SDS method. When analyzed by an automated sequencer using a fluorometer, pCGPA / WT contains GPA / WT DNA linked to a stop codon at its 3 'end, and GPA / WT DNA is 5' downstream of the CMV promoter. It was confirmed that they were linked from the end toward the 3 ′ end.
[0039]
For the expression of DNA in Experimental Example 1 and Experimental Example 2 described later, a system using COS-1 cells (ATCC CRL-1650), which is a monkey kidney-derived cell line, as hosts was used. Since this system is a transient expression system, the introduced DNA is stably maintained in the transformant, that is, not retained for several days, and the target peptide cannot be repeatedly produced using the transformant. There are drawbacks. However, when a vector having the SV40 viral origin of replication such as the aforementioned plasmid vector “pCDM8” is introduced into the cell, the number of copies per cell is temporarily 10 Five It is known that the level of the DNA increases, and this has the advantage that the analysis of the target DNA expression product is extremely easy.
[0040]
[Experimental Example 1-1 (c)]
<Introduction and expression of recombinant DNA into COS-1 cells>
The recombinant DNA pCGPA / WT prepared in Example 1-1 (b) was obtained from Frederick M. Osberg et al., “Current Protocol in Molecular Biology” (1987), John Wiley and Sons. -Introduced into COS-1 cells according to the DEAE-dextran method introduced in Ink Issuance, Chapters 9.2.1 to 9.2.3 and Chapters 9.2.5 to 9.2.6, Expressed. Specifically, first, put 2.5 ml of DME medium containing 10% (v / v) fetal calf serum into one hole of a 6-well multi-well plate “3046” made by Becton Dickinson Labware with a diameter of 3.5 cm, 1.8 × 10 Five Inoculated COS-1 cells and 5% (v / v) CO 2 The cells were cultured at 37 ° C. in an incubator. On the next day, the culture supernatant was removed with an aspirator, and the cells were washed with DME medium containing 50 mM Tris-HCl (pH 7.4), and then 2.8 μg / ml pCGPA / WT, 50 mM Tris-HCl (pH 7.4). 2.5 ml of DME medium containing 0.4 mg / ml DEAE-dextran and 0.1 mM chloroquine was added to each well, and 5% (v / v) CO 2 was added. 2 It left still at 37 degreeC in the incubator for 4 hours. Thereafter, the supernatant was removed, 2.5 ml of 10 mM phosphate buffer solution (hereinafter referred to as PBS) containing 10 (v / v)% DMSO was added per well and allowed to stand at room temperature for 2 minutes, and the supernatant was removed. The cells were washed with a DME medium containing 50 mM Tris-hydrochloric acid (pH 7.4), 2.5 ml of COS medium manufactured by Cosmo Bio was added, and 5% (v / v) CO 2 was added. 2 The target DNA was expressed by culturing at 37 ° C. for 3 days in an incubator. In addition, the same experiment was also performed using plasmid vector pCDM8 as a control group.
[0041]
After culturing for 3 days, the above-mentioned incubator was allowed to stand at −80 ° C. and frozen, and then the operation of thawing at room temperature was repeated 3 times to disrupt the cells. Thereafter, the entire culture was transferred to a centrifuge tube, and insoluble components were removed as a precipitate by centrifugation to obtain a total soluble fraction. This was concentrated in a membrane, and the total soluble fraction derived from one well was adjusted to 0.5 ml and used for the subsequent analysis.
[0042]
[Experimental Example 1-1 (d)]
<Measurement of L-asparaginase activity>
L-asparaginase activity was expressed as an activity value (unit) measured as follows. Specifically, 50 μl of the test sample was dispensed into a 1.5 ml reaction tube, while L-asparagine was dissolved in 50 mM phosphate buffer (pH 7.0) so as to be 1.4 mg / ml. 200 μl was added per tube to make a reaction mixture. The reaction tube was allowed to stand at 37 ° C. for 0, 1, 2, 4, 6 and 16 hours, and then L-aspartic acid in the reaction mixture was measured with an amino acid analyzer. In parallel with this, a system using an E. coli-derived L-asparaginase preparation diluted to 1.0, 0.5, or 0.25 units / ml was provided and allowed to stand at 37 ° C. for 0 and 1 hour. -A calibration curve was prepared based on the increase amount of L-aspartic acid obtained from the aspartic acid measurement result. The increased amount of L-aspartic acid measured in the test sample system was interpolated into this calibration curve, and the activity value of the test sample was estimated. The activity value of the test sample with low activity was estimated from the measurement result in a system in which the reaction time was extended to 2 hours or more. One unit of L-asparaginase was defined as the amount that liberates 1 μmol of ammonia from L-asparagine per minute when reacted under the above conditions.
[0043]
This treatment was applied to each of all the soluble fractions obtained in Experimental Example 1-1 (c) to obtain 3.6 × 10 6. Five Expressed as the total amount of L-asparaginase activity detected in the total soluble fraction from COS-1 cells. As a result, the activity of guinea pig wild-type L-asparaginase was 0.083 units. It was not detected in the control group.
[0044]
[Experimental Example 1-1 (e)]
<Western blotting>
First, an anti-L-asparaginase antibody was prepared by the following method. That is, an oligopeptide having a sequence represented by Gly-Ser-Gly-Asn-Gly-Pro-Thr-Lys-Pro-Asp-Leu-Leu-Gln-Glu-Leu-Arg-Cys chemically synthesized according to a conventional method Keyhole, limpet, and hemocyanin were bound to the C-terminal of, and purified, and then rabbits were immunized according to a conventional method. After 6 immunizations at 2 week intervals, whole blood was collected and purified by 50% (w / v) ammonium sulfate salting out to obtain anti-L-asparaginase / rabbit antiserum. Next, the total soluble fraction obtained in Experimental Example 1-1 (c) according to the method reported by Yu K. Remli in “Nature”, Vol. 227, pages 680 to 685 (1970). 0.2 ml of the solution was subjected to 12.5% (w / v) SDS-polyacrylamide gel electrophoresis (hereinafter referred to as SDS-PAGE) in the presence of a reducing agent, and all the migrated polypeptides were removed from the SDS-polyacrylamide gel. After being transferred to the nitrocellulose membrane, H Tobin uses the previous anti-L-asparaginase rabbit antiserum, "Proceeding of the National Academy of Sciences of the U.S. Western blotting was performed according to the method reported in A, Vol. 76, pages 4350-4354 (1979). Color development was based on an alkaline phosphatase color development system. Compared with the control, the band specifically stained with the sample was confirmed, and the stained band was compared with the molecular weight marker to determine the molecular weight per subunit of L-asparaginase. The molecular weight markers used were bovine serum albumin (67 kDa), ovalbumin (45 kDa), soybean trypsin inhibitor (20.1 kDa) and α-lactalbumin (14.4 kDa), which were stained with amide black. The total soluble fraction obtained in Experimental Example 1-1 (c) did not show a clear band.
[0045]
[Experimental Example 1-1 (f)]
<Measurement of molecular weight by gel filtration>
Next, 2 ml of the total soluble fraction derived from COS-1 cells obtained in Experimental Example 1-1 (c) was equilibrated with PBS, “High Road Superdex 200 Column” (inner diameter 16 mm). The native molecular weight of guinea pig wild-type L-asparaginase was examined by subjecting it to gel filtration column chromatography using × 60 cm) and examining the L-asparaginase activity of the eluted fraction. As molecular weight markers, thyroglobulin (669 kDa), ferritin (440 kDa), catalase (232 kDa), aldolase (158 kDa), bovine serum albumin (67 kDa) and ovalbumin (43 kDa) were used. As a result, the peak of L-asparaginase activity in the eluted fraction was observed at a position corresponding to a molecular weight of about 300 kDa.
[0046]
Since Western blotting did not show a clear band, the molecular weight of guinea pig wild-type L-asparaginase in a dissociated state could not be measured. The molecular weight in its native state was estimated to be about 300 kDa from the results of gel filtration. On the other hand, when guinea pig serum L-asparaginase is purified and the molecular weight in the native state is determined by gel filtration, it is estimated to be about 190 kDa. Incidentally, the molecular weight in the dissociated state by SDS-PAGE is estimated to be about 43 kDa. Meanwhile, by the same applicant Special Kaihei 8-214885 public In the news The three partial amino acid sequences of the disclosed guinea pig serum L-asparaginase are found in a region consisting of amino acid residues 10 to 236 in the amino acid sequence of guinea pig wild-type L-asparaginase. In addition, E-Harms et al., “Febs Letter”, Vol. 285, pp. 55 to 58 (1991), proposed from the experimental results using L-asparaginase derived from Escherichia coli, etc., are essential for L-asparaginase activity. The amino acid sequences shown in SEQ ID NOs: 1 and 2 in the sequence listing are the 16th to 19th amino acid residues and the 114th to 118th amino acid residues on the amino acid sequence of guinea pig wild-type L-asparaginase, respectively. Matches the base sequence. From these results and the results shown in Experimental Example 1-1, the present inventor, for guinea pig wild-type L-asparaginase, comprises the first to 400th amino acid residues in the amino acid sequence or the amino acid residues before and after that. However, it was speculated that it would be essential for its activity expression. Therefore, in Experimental Example 2-1, in order to examine the activity of the C-terminal deletion mutant which is a guinea pig-derived L-asparaginase homologue, the properties and properties of the expression product of the guinea pig-derived DNA homologue are tested.
[0047]
[Experimental Example 1-2]
<Expression of human-derived wild-type DNA>
Wild-type DNA encoding human L-asparaginase has been obtained by the same applicant. Special Kaihei 8-214885 public In the news Prepared according to the disclosed method. This DNA had the base sequence shown in SEQ ID NO: 16 in the sequence listing. Hereinafter, a region encoding a polypeptide in the base sequence shown in SEQ ID NO: 16, that is, a DNA having a sequence consisting of the 93rd to 1811th bases in the base sequence is referred to as “HA / WT DNA”. In addition, a polypeptide having the amino acid sequence listed in SEQ ID NO: 16, which is an expression product of HA / WT DNA, may hereinafter be referred to as “human wild type L-asparaginase”. In addition, in SEQ ID NO: 18 in the sequence listing, the amino acid sequence encoded by the base sequence of HA / WT DNA is also shown.
[0048]
PCR was performed under the same conditions as in Experimental Example 1-1 (b) except for the template, sense primer, and antisense primer. The template is a wild-type DNA encoding human-derived L-asparaginase obtained in Experimental Example 1-2, the sense primer is an oligonucleotide having a sequence of 5'-AATCTCGAGCCCCATGGCGCGCGCGTG-3 ', and the antisense primer is a sequence of 5' -An oligonucleotide that is CTGCGGCCCCTTATCAGACACCAGGCAGCAC-3 '. The resulting amplified DNA was subsequently treated in the same manner as in Experimental Example 1-1 (b) to prepare a recombinant DNA “pCHA / WT”. After confirming the sequence in the same manner, it was introduced into COS-1 cells, expressed, and analyzed in the same manner as in Experimental Example 1-1.
[0049]
In contrast to guinea pig wild-type L-asparaginase, human wild-type L-asparaginase could not detect activity in this experimental system. As one of the causes, for example, human wild-type L-asparaginase was considered to have a lower specific activity than guinea pig wild-type L-asparaginase. Therefore, in the following Experimental Example 2-2, the properties and properties of the expression products of human-derived DNA homologues are tested.
[0050]
[Experimental example 2]
<Expression of DNA homologues derived from guinea pig and human>
[0051]
[Experimental Example 2-1]
<Expression of DNA homologue from guinea pig>
A DNA homologue of a guinea pig-derived wild type DNA in which the base sequence at a specific position was replaced with a stop codon was prepared as follows. That is, in the base sequence shown in SEQ ID NO: 17 in the sequence listing, a DNA in which the sequence consisting of the 1090th to 1092th bases is replaced with a stop codon, and a DNA in which the sequence consisting of the 1012th to 1014th bases is replaced with a stop codon Was prepared by applying the PCR method. Except for the sequence of the antisense primer, PCR was carried out under the same conditions as in Experimental Example 1-1 (b). The sequences of the antisense primers used for each DNA preparation were 5′-CTGCGGCCCCTTATCATGCCGGTGGGCAGGTGT-3 ′ and 5′-CTGCGGCCGCTTATCAGCCCAACACGGTAGGA-3 ′. The resulting amplified DNA was subsequently treated in the same manner as in Experimental Example 1-1 (b) to prepare recombinant DNAs “pCGPA / D364stp” and “pCGPA / L338stp”. As a result of confirming the sequence in the same manner, pCGPA / D364stp and pCGPA / L338stp each encode a sequence comprising the first to 363th amino acid residues and the first to 337th amino acid residues in guinea pig wild-type L-asparaginase, respectively. And a stop codon present without intervening sequence at each 3 ′ end. Hereinafter, the DNAs encoding these polypeptides are referred to as “GPA / D364stp DNA” and “GPA / L338stp DNA”, respectively. GPA / D364stp DNA and GPA / L338stp DNA were ligated downstream from the CMV promoter in the direction from the 5 'end to the 3' end. Hereinafter, the expression products of these DNAs are sometimes referred to as “guinea pig L-asparaginase homologues”.
[0052]
These recombinant DNAs were similarly tested after being introduced into COS-1 cells according to Experimental Example 1-1. As a control, the recombinant DNAs pCGPA / WT and pCDM8 prepared in Experimental Example 1-1 (b) were similarly treated and tested. The results are shown in Table 1.
[0053]
[Table 1]
[0054]
As shown in Table 1, among the wild-type DNA derived from the above guinea pigs and homologues thereof, GPA / WT DNA and GPA / D364stp DNA expression products showed activity, but GPA / L338stp DNA expression product No activity was detected. This means that it is sufficient for the guinea pig-derived L-asparaginase to have sufficient activity in the amino acid sequence of the wild-type L-asparaginase. Suggests. The sequence consisting of the first to 363th amino acid residues is shown in SEQ ID NO: 4 in the sequence listing. The base sequence of the DNA encoding this is shown in SEQ ID NO: 10 in the sequence listing. The amino acid sequence of guinea pig wild-type L-asparaginase is shown in SEQ ID NO: 5 in the sequence listing.
[0055]
[Experimental example 2-2]
<Expression of DNA homologues derived from human>
A DNA homologue was prepared by substituting the base sequence at a specific position of human-derived wild-type DNA with a stop codon or a codon for another amino acid. First, a DNA homologue in which the sequence consisting of the 1096th to 1098th bases in the base sequence shown in SEQ ID NO: 18 in the sequence listing was replaced with a stop codon was prepared by applying the PCR method. That is, except for the template, sense primer, and antisense primer, PCR was performed under the same conditions as in Experimental Example 1-1 (b). The template is a wild-type DNA encoding human-derived L-asparaginase obtained in Experimental Example 1-2, the sense primer is an oligonucleotide whose sequence is 5'-AATCTCGAGCCCCATGGCGCGCGCGTG-3 ', and the antisense primer is 5' -An oligonucleotide which is CTGCGGCCGCTCATTACACCGAGGGTGGCGT-3 '. As a result, the amplified DNA was treated according to Experimental Example 1-1 to prepare a recombinant DNA “pCHA / E366stp”, and the sequence was confirmed. pCHA / E366stp includes DNA encoding a sequence consisting of
[0056]
To replace a codon at a specific position of DNA with a codon for another amino acid, Robert M. Horton et al., “Methods in Enzymology”, Academic Press, Vol. 217, pp. 270-279 ( (1993) and the overlap extension method introduced. The outline is shown in FIG. 1 and described below. First, a mutation primer A and a mutation primer S that are complementary to each other are prepared by replacing the base at the position where the mutation is to be introduced with another target base. Here, the mutation primer A is an antisense strand, and the mutation primer S is a sense strand. On the other hand, a primer set capable of amplifying the entire region of the target DNA, that is, a 5 ′ end primer and a 3 ′ end primer is prepared. Here, the 5 ′ end primer is a sense strand, and the 3 ′ end primer is an antisense strand. Second, normal PCR is performed using the DNA of the base sequence of the group as a template and the 5 ′ end primer and the mutation primer A. In parallel with this, normal PCR is performed using the same DNA as a template and the previous 3'-end primer and mutation primer S (first-stage PCR). The two DNAs amplified by the third and first stage PCR, the 5 ′ end primer and the 3 ′ end primer used in the first stage PCR are mixed in the same reaction tube, and PCR is performed (second stage PCR). The two DNA fragments amplified in the first stage PCR are used to generate DNA with mutations introduced as templates and primers, and the 5 ′ end primer and the 3 ′ end primer are used to amplify the DNA with mutations introduced. Used as a primer. By this method, DNA into which seven kinds of base substitutions were introduced, that is, seven kinds of DNA homologues were prepared. Table 2 summarizes the contents of the seven types of base substitutions and the changes in the amino acid sequence that accompanies them. Table 3 summarizes the sequences of template DNA, mutation primer A, and mutation primer S used for the preparation of these seven DNA homologues. On the other hand, the 5′-end primer and the 3′-end primer used for the preparation of the seven DNA homologues were respectively the sense primer and the antisense used in the preparation of pCHA / E366stp previously shown in this Experimental Example 2-2. Identical to the primer.
[0057]
[Table 2]
[0058]
[Table 3]
[0059]
The human-derived DNA homologue obtained here was treated according to Experimental Example 1-1, and recombinant DNAs “pCHA / MUT1”, “pCHA / MUT2”, “pCHA / MUT3”, “pCHA / MUT4”, “pCHA / “MUT5”, “pCHA / MUT6” and “pCHA / MUT7” were obtained. Hereinafter, the expression product of the above DNA homolog obtained in Experimental Example 2-2 may be referred to as “human L-asparaginase homolog”. Similarly, after confirming the sequence, it was introduced into COS-1 cells for expression and tested. As a control group, pCHA / WT and pCDM8 obtained in Experimental Example 1-2 were similarly treated and tested. In Experimental Example 2-2, the signal intensity of the band detected by Western blotting was quantified by densitometry as a reference for quantitative comparison of each expression product. The above results are shown in Table 4.
[0060]
[Table 4]
[0061]
The results in Table 4 show that the specific activity of human-derived L-asparaginase is higher than that of guinea pig-derived L-asparaginase, even if it is wild-type or C-terminal deletion mutant (HA / E366stp DNA expression product) which is one of its homologues. Suggests low. On the other hand, among the point mutants in which some of the original amino acid sequence of wild-type L-asparaginase derived from human is substituted with other amino acids, the specific activity increases to such a degree that it can be detected. It also shows that there is. The human-derived DNA homologs HA / MUT1 DNA, HA / MUT2 DNA, HA / MUT3 DNA, and HA / MUT5 DNA, in which the expression product has been confirmed to exhibit at least detectable activity, are shown in SEQ ID NOs: The polypeptides having the nucleotide sequences shown in 11, 12, 13, and 14 have the amino acid sequences shown in SEQ ID NOs: 6, 7, 8, and 9 in the sequence listing, respectively.
[0062]
From the above experimental results, in order to exhibit a L-asparaginase activity at a level at which a polypeptide derived from a mammal can be detected at least in the expression system / activity measurement system used in Experimental Examples 1 and 2, a conventionally known arrangement may be used. In addition to the amino acid sequences shown in SEQ ID NOS: 1 and 2 in the table, for example, it was found that it is necessary to have the amino acid sequence shown in SEQ ID NO: 3 (however, the amino acid shown with the symbol “Xaa” is glutamine Or arginine). Incidentally, guinea pig wild-type L-asparaginase is a portion consisting of residues 298 to 302 in the amino acid sequence. In It has this arrangement. Examples of the polypeptide having all the amino acid sequences shown in SEQ ID NOS: 1 to 3 in the sequence listing are derived from guinea pigs, polypeptides having the amino acid sequences shown in SEQ ID NO: 4 to 5 in the sequence listing, and humans. Examples include polypeptides having the amino acid sequences shown in SEQ ID NOs: 6 to 9 in the sequence listing.
[0063]
Based on the above findings, the present inventors have invented a mammal-derived polypeptide having L-asparaginase activity. The invention will now be described on the basis of examples which are all conventional in the field. Of course, the method for carrying out the invention is not limited to these.
[0064]
Example A-1
<Wild-type polypeptide derived from guinea pig having L-asparaginase activity>
[0065]
Example A-1 (a)
<Preparation of transformant>
In a 0.5 ml reaction tube, 10 μl of 10 × PCR buffer, 1 μl of 25 mM dNTP mix, 1 ng of the recombinant DNA pCGPA / WT obtained in Experimental Example 1-1 as a template, and 5 ′ end of GPA / WT DNA Add an appropriate amount of the oligonucleotide chemically synthesized based on the sequence of the 3 ′ end as a sense primer or an antisense primer, make 99.5 μl with sterilized distilled water, and then add 0.5 μl of 2.5 units / μl ampli-tack DNA polymerase. It was. The sense primer has a sequence of 5'-GCGAATTCATGGCGCGCGCATCA-3 'and has a restriction enzyme Eco RI cleavage site added upstream of the 5' end of GPA / WT DNA. The antisense primer has a sequence of 5'-GCAAGCTTTTGAGATGGCAGGCGGCAC-3 'and is complementary to a sequence in which a stop codon is added downstream of the 3' end of GPA / WT DNA and a restriction enzyme HindIII cleavage site is further added downstream thereof. Of a typical array. In a conventional manner, PCR was performed by amplifying DNA by repeating 40 cycles of incubating the mixture in the order of 94 ° C. for 1 minute, 55 ° C. for 1 minute, and 72 ° C. for 3 minutes. This DNA was cleaved with restriction enzymes Eco RI and Hin d III to obtain an Eco RI-Hind dIII fragment of about 1.7 kbp. Take 25 ng of this DNA fragment, add 10 ng of Pharmacia plasmid vector “pKK223-3” previously cut with restriction enzymes Eco RI and HindIII, and then add Solution I of Takara Shuzo Ligation Kit Version 2 first. After adding the same volume as that of the DNA mixture solution, the recombinant DNA “pKGPA / WT” capable of replication was obtained by incubating at 16 ° C. for 2 hours.
[0066]
Recombinant DNA pKGPA / WT was introduced into E. coli strain JM105 produced by Pharmacia by the competent cell method, and the transformant “J-GPA / WT” obtained here was added to L broth medium (pH 7.2) containing 50 μg / ml ampicillin. ) And cultured with shaking at 37 ° C. for 18 hours. The transformant was collected by centrifuging the culture, and the recombinant DNA pKGPA / WT was extracted by applying the usual alkali-SDS method. By analyzing with an automatic sequencer using a fluorometer, in this pKGPA / WT, as shown in FIG. 2, the GPA / WT DNA having the base sequence shown in SEQ ID NO: 17 in the sequence listing is located at the 5 ′ end downstream of the tack promoter. It was confirmed that they were linked in the 3 ′ end direction. It was also confirmed that there was a stop codon without an intervening sequence on the 3 ′ end side of GPA / WT DNA.
[0067]
Example A-1 (b)
<Manufacture of polypeptides>
The transformant J-GPA / WT was inoculated into L broth medium (pH 7.2) containing 50 μg / ml ampicillin and cultured with shaking at 37 ° C. for 18 hours. Next, 18 l of fresh L broth medium was placed in a 30 l jar fermenter, the seed culture previously cultured was inoculated at a rate of 1% (v / v), and cultured at 37 ° C. with aeration and stirring. A portion of the culture is placed in a 1 cm thick cuvette, cultured while measuring the absorbance at a wavelength of 650 nm, and when the absorbance reaches about 1.5, IPTG is added to a final concentration of 0.1 mM. Cultured for 5 hours. Thereafter, the cells recovered from the culture by centrifugation are suspended in a mixed solution (pH 7.2) containing 139 mM sodium chloride, 7 mM disodium hydrogen phosphate and 3 mM sodium dihydrogen phosphate, and sonicated by a conventional method. The cells were crushed, and the crushed cells were centrifuged to collect the supernatant.
[0068]
To this supernatant was added ammonium sulfate to 50% (w / v) under ice-cooling, and the mixture was uniformly dissolved, allowed to stand for a while and centrifuged, and the precipitate was collected. This precipitate is dissolved in 20 mM Tris-HCl buffer (pH 8.0), dialyzed into the same buffer, loaded onto a Pharmacia “Q Sepharose F. F. column” equilibrated with the same buffer, and the same buffer. After thoroughly washing with the solution, a 20 mM Tris-HCl buffer (pH 8.0) was passed through a concentration gradient of 0 to 0.5 M sodium chloride. The fraction eluted at a sodium chloride concentration of about 0.1 to 0.3 M was collected, and the solvent was exchanged into 10 mM sodium phosphate buffer (pH 7.5) while concentrating the membrane. Sigma “L-asparagine agarose” equilibrated with the same buffer was loaded, washed with the same buffer, and eluted with 10 mM sodium phosphate buffer (pH 7.5) containing 0.5 M sodium chloride. The elution fraction was concentrated in a membrane and loaded onto a Pharmacia “Hiload Superdex 200 column” equilibrated with Tris-HCl buffer solution (pH 8.0) containing 10% (v / v) glycerol. When an elution fraction of about 300 kDa was collected, a purified polypeptide having a purity of 90% or more was obtained at a yield of about 0.1 mg / ml per culture.
[0069]
Example A-1 (c)
<Physical and chemical properties>
The purified polypeptide was analyzed as follows to clarify its physicochemical properties. The native molecular weight of the purified polypeptide was determined by gel filtration according to Experimental Example 1-1 (e). As a result, the peak of L-asparaginase activity in the eluted fraction was observed at a position corresponding to a molecular weight of about 300 kDa. The molecular weight of the purified polypeptide in the dissociated state was determined by SDS-PAGE shown in Experimental Example 1-1 (e). As a result, a main band was observed at a molecular weight of 50 ± 10 kDa. This result indicates that the purified polypeptide forms a multimer in its native state. Taking into account the measurement errors of the two methods and the native form of the known L-asparaginase other than mammals including E. coli, all in the native state, this result is a purified polypeptide. Is considered to indicate that a tetramer is formed. In addition, as a result of subjecting this purified polypeptide to the method shown in Experimental Example 1-1 (d), it was confirmed that it had L-asparaginase activity.
[0070]
Example A-2
<Wild-type polypeptide derived from guinea pig having L-asparaginase activity>
[0071]
Example A-2 (a)
<Preparation of transformant>
An outline is shown in FIG. First, PCR was performed under the same conditions as in Example A-1 (a) except for the sequences of the sense primer and the antisense primer. The sequence of the sense primer was 5'-GTGAATTCGGAGGTTCAGATGCGCGCGCATCA-3 ', and the sequence of the antisense primer was 5'-CTGCGGCCGCTCAGATGGCAGGCGGCAC-3'. The amplified DNA was cleaved with restriction enzymes Eco RI and Not I to obtain an Eco RI-Not I fragment of about 1.7 kbp. 70 ng of this DNA fragment, 50 ng of Pharmacia plasmid vector “pBPV” previously cut with restriction enzymes Xho I and Not I, and 4 ng of the following 4 nucleotide oligonucleotides were mixed as linkers. . The sequence of the first oligonucleotide is 5'-TCGAGCCCACCCATGAAGTGTTCGGTGGGTTTATT-3 ', the second is 5'-TTCTTCCTGATGGCCGTAGTGACAGGAGGTG-3', the third is 5'-AATTCACTCCTGTCACTAG-3 '5'-AGAAATAACCCACGAACACTTTCATGGTGGC-3'. The oligonucleotides used as linkers were all synthesized according to a conventional method and then purified by ethanol precipitation after acting on Pharmacia T4 polynucleotide kinase. To this DNA mixed solution, an equal volume of Takara Shuzo Ligation Kit Version 2 Solution I was added and kept at 16 ° C. for 2 hours to obtain a replicable recombinant DNA “pBIgGPA / WT”.
[0072]
Recombinant DNA pBIgGPA / WT was introduced into E. coli strain HB101 by the competent cell method, and the resulting transformant was inoculated into L broth medium (pH 7.2) containing 50 μg / ml ampicillin and shaken at 37 ° C. for 18 hours. Cultured at last. The culture was centrifuged to collect the cells, and the recombinant DNA pBIgGPA / WT was extracted by applying a normal alkali-SDS method. When the sequence was analyzed by an automatic sequencer, it was confirmed that this pBIgGPA / WT had a structure as shown in FIG. That is, D.F. Stern is “Science” downstream of the transcriptional regulatory region consisting of the Moloney murine sarcoma virus long terminal repeat-derived enhancer (Emsv) and the mouse metallothionein I gene-derived promoter (Pmti). Volume 235, pp. 321 to 324 (1987). DNA encoding the peptide part containing the immunoglobulin secretion signal sequence, Ig sec DNA, is linked, and further downstream in the same reading frame, GPA / WT DNA was ligated from the 5 'end to the 3' end. It was also confirmed that there was a stop codon at the 3 'end of GPA / WT DNA without an intervening sequence.
[0073]
This recombinant DNA pBIgGPA / WT was introduced into a mouse-derived cell line C127 (ATCC CRL-1616) using Lipofectin reagent manufactured by Life Technologies according to the attached protocol. The transformant introduced with the recombinant DNA was selected as a first step based on loss of growth control ability, that is, focus-forming ability. As a second step, cells in the vicinity including the focus were collected with sterile filter paper, and the target transformant was made into a single cell based on the ability to produce L-asparaginase activity by an ordinary limiting dilution method. Thus, a transformant “C-GPA / WT” was obtained.
[0074]
Example A-2 (b)
<Manufacture of polypeptides>
Transformant C-GPA / WT was first seeded with a 6-well multi-centrifuge manufactured by Becton Dickinson Labware with a diameter of 3.5 cm to which 2.5 ml of DME medium containing 10% (v / v) fetal calf serum was added. One well of the well plate “3046” was inoculated and cultured to confluence. Cells were detached from the cells by trypsin treatment, and a portion thereof was used as seed cells to inoculate into 6 holes of another new 6-hole plastic plate to which the same medium had been added. Repeat the same procedure while expanding the incubator in order to increase the number of cells to 150 cm. 2 The transformant was subjected to normal continuous culture using 50 culture flasks. Finally, 100 l of the culture supernatant was collected, and the ammonium sulfate precipitation and precipitation solution Kew Sepharose FF column was used in the same manner as in the method for treating the supernatant of the disrupted bacterial cells of Example A-1 (b). Chromatography, chromatography using L-asparagine agarose of the eluted fraction, and chromatography using Hiload Superdex 200 column of the eluted fraction. As a result, a purified polypeptide having a purity of 90% or more was obtained at a yield of about 1 μg / ml per culture.
[0075]
Example A-2 (c)
<Physical and chemical properties>
When the physicochemical properties of the obtained purified polypeptide are examined in the same manner as in Example A-1 (c), it should exhibit the same properties as the purified polypeptide obtained in Example A-1 (b). Was confirmed.
[0076]
Example A-3
<Polypeptide homologue derived from human and guinea pig having L-asparaginase activity>
[0077]
Example A-3 (a)
<Preparation of transformant>
By performing PCR under the same conditions as in Example A-1 (a) except for the template, sense primer and antisense primer, and treating the resulting DNA in the same manner as in Example A-1 (a) Recombinant DNAs “pKGPA / D364stp”, “pKHA / MUT1”, “pKHA / MUT2”, “pKHA / MUT3” and “pKHA / MUT5” were obtained. Table 5 summarizes the name of the template DNA used for the preparation of each recombinant DNA, and the base sequences of the sense primer and the antisense primer. The base sequences were analyzed in the same manner as in Example A-1 (a), and the structures of these recombinant DNAs The confirmed. The structures of these recombinant DNAs are shown in FIGS.
[0078]
[Table 5]
[0079]
The recombinant DNA obtained here was similarly treated according to Example A-1 (a), and transformants “J-GPA / D364stp”, “J-HA / MUT1”, “J-HA / MUT2”, “J-HA / MUT3” and “J-HA / MUT5” were obtained.
[0080]
Example A-3 (b)
<Manufacture of polypeptides>
These five types of transformants were cultured, as in Example A-1 (b), microbial disruption, ammonium sulfate precipitation of the microbial disruption, and chromatography using a Kew Sepharose FF column of the precipitate solution. And chromatography of the eluted fractions using L-asparagine agarose. The resulting elution fraction was subjected to membrane concentration in the same manner as in Example A-1 (b), and then subjected to chromatography using a high-load superdex 200 column, and an elution fraction of about 140 kDa was obtained. When collected, a purified polypeptide with a purity of 90% or more was obtained at a yield of about 0.1 mg / ml per culture. These purified polypeptides were analyzed by the method of Example A-1 (c) to clarify physicochemical properties. The results are shown in Table 6 together with the results obtained in Example A-1.
[0081]
[Table 6]
[0082]
The results shown in Table 6 indicate that each wild-type polypeptide or polypeptide homologue purified by expressing Escherichia coli as a host exhibits L-asparaginase activity. These polypeptides are also shown to form a tetramer.
[0083]
Example A-4
<Polypeptide homologue derived from human and guinea pig having L-asparaginase activity>
[0084]
Example A-4 (a)
<Preparation of transformant>
PCR was performed under the same conditions as in Example A-1 (a) except for the template, sense primer or antisense primer. The obtained DNA was ligated under the same conditions using the same linker as used in Example A-2 (a), so that recombinant DNA “pBIgGPA / D364stp”, “pBIgHA / MUT1”, “pBIgHA” were used. / MUT2 ”,“ pBIgHA / MUT3 ”and“ pBIgHA / MUT5 ”. Table 7 summarizes the names of template DNAs used in PCR for the preparation of each recombinant DNA and the base sequences of the sense primer and antisense primer. Base sequences were analyzed in the same manner as in Example A-1 (a), and the structures of these recombinant DNAs were confirmed. The structures of these recombinant DNAs are shown in FIGS.
[0085]
[Table 7]
[0086]
The recombinant DNA obtained here was similarly treated in the same manner as in Example A-2 (a), whereby transformants “C-GPA / D364stp”, “C-HA / MUT1”, “C- “HA / MUT2”, “C-HA / MUT3” and “C-HA / MUT5” were obtained.
[0087]
Example A-4 (b)
<Manufacture of polypeptides>
[0088]
These five types of transformants were cultured in the same manner as in Example A-2 (b), and the culture supernatant was precipitated with ammonium sulfate and precipitated solution in the same manner as in the cell disruption method in Example A-1 (b). The chromatography was performed in the order of chromatography using a Kew Sepharose F. F column and chromatography using L-asparagine agarose gel of the eluted fraction. The resulting elution fraction was subjected to membrane concentration in the same manner as in Example A-1 (b), and then subjected to chromatography using a high-load superdex 200 column, and an elution fraction of about 140 kDa was obtained. When collected, a purified polypeptide having a purity of 90% or more was obtained at a yield of about 1 μg / ml per culture. These purified polypeptides were analyzed by the method of Example A-1 (c) to clarify physicochemical properties. Table 8 shows the results together with the results obtained in Example A-3.
[0089]
[Table 8]
[0090]
The results shown in Table 8 indicate that each wild-type polypeptide or polypeptide homologue purified by expressing animal cells as a host exhibits L-asparaginase activity. It is also shown that these polypeptides form a tetramer.
[0091]
As described above in Example A, all of the polypeptides of the present invention exhibit L-asparaginase activity. Therefore, when administered to humans, the sensitive disease agent of the present invention hydrolyzes L-asparagine in the body and exerts an effect on the treatment and prevention of L-asparaginase sensitive diseases. Sensitive diseases as used in the present invention mean all diseases caused by the presence of L-asparagine-dependent tumor cells. Specifically, for example, acute leukemia, acutely transformed chronic leukemia, T cell leukemia, etc. And malignant lymphomas such as leukemia, non-Hodgkin's disease and Hodgkin's disease. Thus, the sensitive disease agent of the present invention has a use as an antitumor agent for treating / preventing a sensitive disease as described above. Depending on the dosage form and the type and nature of the sensitive disease, the sensitive disease agent of the present invention is usually prepared in a liquid, paste or solid form, and the polypeptide is 0.000001 to 100% (w / w). Desirably, it contains 0.0001 to 100% (w / w).
[0092]
The sensitive disease agent of the present invention is not only in the form of the polypeptide alone, but also in the polypeptide and other physiologically acceptable, for example, base, excipient, solubilizer, buffer, stabilizer, As needed, the form as a composition with 1 type, or 2 or more types chosen from other physiologically active substance thru | or another chemical | medical agent is also included. Specific examples of bases, excipients, solubilizers, buffers, and stabilizers include, for example, edited by Japan Pharmaceutical Additives Association, “Pharmaceutical Additives Dictionary” (1994), published by Yakuji Nippo. Examples include those described in the “Additives Supplement Supplement 1995” (1995), published by Yakuji Nippo. Specific examples of other physiologically active substances or other drugs include, for example, interferon-α, interferon-β, interferon-γ,
[0093]
Furthermore, the susceptible disease agent of the present invention also includes a dosage unit form of the drug, which means that the polypeptide is administered at a dose per dose or a positive multiple thereof (up to 4 times). ) Or a fraction thereof (up to 1/40) means a drug in a physically separate unitary dosage form suitable for dosing. Examples of the drug in such a dosage form include injections, liquids, powders, granules, tablets, capsules, sublinguals, eye drops, nasal drops, suppositories and the like.
[0094]
The sensitive disease agent of this invention is effective for the treatment and prevention of sensitive diseases in both cases, whether orally or parenterally. Although it depends on the type and symptoms of the sensitive disease, specifically, about 0.1 μg to 500 mg / dose, preferably about 0.1 to 100 mg / dose per adult, while observing the patient's symptoms and the course after administration. The polypeptide may be orally administered at a dose of 1 to 4 times / day or 1 to 7 times / week for 1 day to 1 year, or parenterally intradermally, subcutaneously, intramuscularly or intravenously. Moreover, as another form of the sensitive disease agent of this invention, the form which applied gene therapy is mentioned, for example. That is, by administering a transformant in which a DNA encoding the polypeptide of the present invention is appropriately introduced into a host and producing the polypeptide of the present invention in a living body of a patient with a sensitive disease, it is equivalent to the above dosage form. Demonstrate the effect. General procedures for carrying out gene therapy are, for example, edited by Takashi Shimada, Izumi Saito, Takaya Ozawa, "Experimental Medicine Separate Bio Manual UP Series Basic Technology of Gene Therapy" (1996), published by Yodosha. Is described in detail.
[0095]
Next, the biological activity of the polypeptide of the present invention will be described based on Experimental Example 3, and the safety of the polypeptide of the present invention will be described based on Experimental Example 4.
[0096]
[Experiment 3]
<Bioactivity>
[0097]
[Experimental Example 3-1]
<Anti-tumor cell effect in vitro>
[0098]
Human histiocytic lymphoma cell line U937 (ATCC No. CRL-1593) and human lymphoblast-derived cell line Molt4 (ATCC No. CRL-1582) were previously prepared in RPMI 1640 medium containing 10% (v / v) fetal bovine serum. Successor Subcultured. Cells are collected from each cell culture system in the logarithmic growth phase by centrifugation and 2 × 10 2 in the same medium. 5 The cell concentration was adjusted to cell number / ml, and the cell suspension was inoculated into a 24-well multi-well plate “3047” plate manufactured by Becton Dickinson Labware in a total of 13 wells at 1 ml per well. To this, dilutions of 12 kinds of purified polypeptides prepared in Examples A-1 to A-4 with PBS were respectively added, and 5% (v / v) CO 2 was added. 2 The cells were cultured at 37 ° C. for 72 hours in an incubator. The final concentration of each purified polypeptide was 1 unit / ml as L-asparaginase activity. As a control group, a system in which an equal volume of PBS was added and cultured in the same manner was provided. After the culture, the cells were collected, dead cells were stained with trypan blue, and the cell viability of the purified polypeptide addition system was compared with the control group. As a result, the system to which any of the purified polypeptides was added showed a significantly lower cell viability than the control group. This indicates that the purified polypeptides obtained in Examples A-1 to A-4 all have cytotoxicity against U937 and Molt4.
[0099]
[Experimental Example 3-2]
<Anti-tumor cell effect in vivo>
[0100]
A mouse lymphoma cell line 6C3HED registered at the Center for Medical Cell Resources, Institute of Aging Medicine, Tohoku University is used for 1 × 10 7 By subcutaneous injection in the flank every 8 days per animal / animal Successor C3H mice that had been transplanted were used as model mice. The purified polypeptide obtained in Examples A-1 to A-4 was intravenously administered at 400 units / animal to the model mice every day from day 4 to day 7 after transplantation of the cells. . The size of the tumor on the 4th and 8th day after transplantation was observed with the naked eye. The purified polypeptide was administered after being diluted with a 0.15 M sodium chloride solution and then filtered through a membrane filter manufactured by Millipore having a pore diameter of 0.45 μm. As a control group, a system similarly treated with a 0.15 M sodium chloride solution was provided. As a result, clear enlargement of the tumor was observed in the control group, whereas clear regression or disappearance of the tumor was observed in the system administered with the purified polypeptide. This indicates that all of the purified polypeptides prepared in Examples A-1 to A-4 are capable of healing tumors in model mice.
[0101]
[Experimental Example 4]
<Acute toxicity test>
The purified polypeptides prepared in Examples A-1 to A-4 were separately administered to 8-week-old mice by transdermal, oral or intraperitoneal injection according to a conventional method. As a result, LD50 of these purified polypeptides was about 100 mg / kg or more by any route of administration. This confirms that the polypeptide of the present invention is safe as a pharmaceutical premised on administration to humans.
[0102]
Hereinafter, the sensitive disease agent of the present invention will be described with reference to examples.
[0103]
Example B
<Sensitive disease agent>
[0104]
Example B-1
<Liquid>
The purified polypeptides obtained in Examples A-1 to A-4 were dissolved separately in physiological saline containing 1% (w / v) human serum albumin as a stabilizer so as to be 0.1 mg / ml. The solution was sterilized by microfiltration according to a conventional method.
[0105]
All products have excellent stability and are useful as injections, eye drops, and nasal drops for the treatment and prevention of malignant tumors, acute leukemias, malignant lymphomas, chronic leukemia transformation, and sensitive diseases including T-cell leukemia It is.
[0106]
Example B-2
<Liquid>
Each of the purified polypeptides obtained in Examples A-1 to A-4 was dissolved separately in physiological saline containing 1% (w / v) glycerin as a stabilizer so as to be 0.1 mg / ml. Sterilized by microfiltration according to the method to obtain a solution.
[0107]
All products are excellent in stability as malignant tumors, acute leukemias, malignant lymphomas, chronic leukemia blast crisis, injections, eye drops, and nasal drops for treating and preventing sensitive diseases including T cell leukemia Useful.
[0108]
Example B-3
<Dry injection>
As a stabilizer, the purified polypeptides obtained in Examples A-1 to A-4 were separately dissolved in physiological saline containing 1% (w / v) of purified gelatin so as to be 50 mg / ml. The mixture was sterilized by microfiltration according to the method, dispensed in 1 ml portions into vials, freeze-dried and sealed.
[0109]
Each product has excellent stability and is useful as a dry injection for treating and preventing malignant tumors, acute leukemias, malignant lymphomas, chronic leukemias, and sensitive diseases including T cell leukemia.
[0110]
Example B-4
<Ointment>
In sterilized distilled water, carboxyvinyl polymer “Hibiswako 104” and high-purity trehalose manufactured by Wako Pure Chemical Industries, Ltd. are dissolved to a concentration of 1.4% (w / w) and 2.0% (w / w), respectively. The purified polypeptides obtained in Examples A-1 to A-4 were separately and uniformly mixed, and then adjusted to pH 7.2 to obtain a pasty product containing about 10 mg of the polypeptide per gram.
[0111]
Each product has excellent spreadability and stability, and is useful as an ointment for treating and preventing malignant tumors, acute leukemias, malignant lymphomas, chronic leukemias, and sensitive diseases including T-cell leukemia.
[0112]
Example B-5
<tablet>
The purified polypeptide obtained in Examples A-1 to A-4 and lumine as a cell activator were uniformly mixed in anhydrous crystal α-maltose powder “Finetose” manufactured by Hayashibara, and the resulting mixture was compressed with a tablet press. Tablets containing about 5 mg each of the polypeptide and lumine per tablet (about 200 mg) were obtained.
[0113]
Each product has excellent ingestion and stability, and also has cell activation. Tablets for treating and preventing malignant tumors, acute leukemias, malignant lymphomas, chronic leukemias, and sensitive diseases including T-cell leukemia Useful as.
[0114]
【The invention's effect】
This invention is based on the discovery of a polypeptide derived from a mammal having L-asparaginase activity. All of the polypeptides of the present invention are substances whose amino acid sequences have been elucidated, and have the activity of hydrolyzing stable L-asparagine. Thereby, the polypeptide of this invention exhibits power as a therapeutic agent / preventive agent for various diseases caused by L-asparagine-dependent tumor cells.
[0115]
Since the polypeptide of the present invention is derived from mammals, it has low antigenicity to humans and does not cause serious side effects even when administered in large doses or continuously. Therefore, the polypeptide of the present invention has an advantage that a desired effect can be exerted without strictly controlling the sensitivity of the patient at the time of use.
[0116]
Thus useful polypeptide of the present invention can be easily produced in a desired amount by utilizing the DNA of the present invention encoding the polypeptide.
[0117]
The present invention exhibits such remarkable operational effects, and it can be said that it is a very significant invention to contribute to the world.
[0118]
[Sequence Listing]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
[0131]
[0132]
[0133]
[0134]
[0135]
[Brief description of the drawings]
FIG. 1 is a diagram showing an overview of an overlap wrap extension method.
FIG. 2 is a diagram showing a restriction enzyme map of recombinant DNA pKGPA / WT.
FIG. 3 is a diagram showing an outline of a method for preparing recombinant DNA pBIgGPA / WT.
FIG. 4 is a diagram showing a restriction enzyme map of recombinant DNA pBIgGPA / WT.
FIG. 5 is a view showing a restriction enzyme map of recombinant DNA pKGPA / D364stp.
FIG. 6 is a diagram showing a restriction enzyme map of recombinant DNA pKHA / MUT1.
FIG. 7 is a diagram showing a restriction enzyme map of recombinant DNA pKHA / MUT2.
FIG. 8 is a diagram showing a restriction enzyme map of recombinant DNA pKHA / MUT3.
FIG. 9 is a diagram showing a restriction enzyme map of recombinant DNA pKHA / MUT5.
FIG. 10 shows a restriction enzyme map of recombinant DNA pBIgGPA / D364stp.
FIG. 11 is a diagram showing a restriction enzyme map of recombinant DNA pBIgHA / MUT1.
FIG. 12 is a diagram showing a restriction enzyme map of recombinant DNA pBIgHA / MUT2.
FIG. 13 is a diagram showing a restriction enzyme map of recombinant DNA pBIgHA / MUT3.
FIG. 14 is a diagram showing a restriction enzyme map of recombinant DNA pBIgHA / MUT5.
[Explanation of symbols]
Eco RI Eco RI cleavage site
Hin dIII Hin dIII cleavage site
Not I Not I cleavage site
Xho I Xho I cleavage site
GPA / WT DNA encoding guinea pig wild-type L-asparaginase (GPA / WT DNA)
D364stp DNA encoding guinea pig L-asparaginase homolog (GPA / D364stpDNA)
HA / MUT1 DNA encoding human L-asparaginase homologue (HA / MUT1 DNA)
HA / MUT2 DNA encoding human L-asparaginase homologue (HA / MUT2 DNA)
HA / MUT3 DNA encoding human L-asparaginase homologue (HA / MUT3 DNA)
HA / MUT5 DNA encoding human L-asparaginase homolog (HA / MUT5 DNA)
Ptac tac promoter
rrnBT1T2 Ribosomal RNA operon transcription termination region
AmpR ampicillin resistance gene
pBR322ori Origin of replication in E. coli
DNA encoding a peptide portion containing a secretory signal sequence of Ig sec immunoglobulin (Ig sec DNA)
Emsv Moloney Mouse Sarcoma Virus Long Terminal Repeat Enhancer
Promoter derived from Pmti mouse metallothionein I gene
Poly (A) SV40-derived poly (A) addition signal
BPVI Bovine papilloma virus genome
Claims (3)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP16062597A JP3819540B2 (en) | 1996-06-07 | 1997-06-04 | Mammalian polypeptide having L-asparaginase activity |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP16817296 | 1996-06-07 | ||
| JP8-168172 | 1996-06-07 | ||
| JP16062597A JP3819540B2 (en) | 1996-06-07 | 1997-06-04 | Mammalian polypeptide having L-asparaginase activity |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH1057080A JPH1057080A (en) | 1998-03-03 |
| JP3819540B2 true JP3819540B2 (en) | 2006-09-13 |
Family
ID=26487069
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP16062597A Expired - Fee Related JP3819540B2 (en) | 1996-06-07 | 1997-06-04 | Mammalian polypeptide having L-asparaginase activity |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3819540B2 (en) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2009011256A (en) * | 2007-04-20 | 2009-11-05 | Dsm Ip Assets Bv | Novel asparaginases and uses thereof. |
| EP2662444A1 (en) * | 2007-04-20 | 2013-11-13 | DSM IP Assets B.V. | Asparaginase enzyme variants and uses thereof |
| CA2802126A1 (en) | 2010-07-14 | 2012-01-19 | Nestec S.A. | Asparaginase from basidiomycetes |
| US11578315B2 (en) | 2017-08-11 | 2023-02-14 | The Board Of Trustees Of The University Of Illinois | Truncated guinea pig L-asparaginase variants and methods of use |
-
1997
- 1997-06-04 JP JP16062597A patent/JP3819540B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JPH1057080A (en) | 1998-03-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US5891704A (en) | Method to produce high levels of methioninase | |
| JPS6140221A (en) | Tumor nectrotic factor | |
| JPH01501283A (en) | Novel type of colony stimulating factor-1 | |
| JPS6156197A (en) | Recombined lymphotoxin | |
| JP2004043502A (en) | New protein and method for producing medicine using the same | |
| JPH10502360A (en) | Novel hIL-4 muteins used as antagonists or partial agonists of human interleukin 4 | |
| JPS62174026A (en) | Remedy for leukpenia | |
| JPH05503512A (en) | [ALA IL-8] as a leukocyte adhesion inhibitor ↓7↓7 | |
| KR20000016159A (en) | Lactoferrin variants and uses thereof | |
| US6368845B1 (en) | Polypeptides having L-asparaginase activity | |
| JP3011274B2 (en) | Recombinantly produced 3-des-hydroxy-cystatin C polypeptide or modified product thereof | |
| RU2354702C2 (en) | RECOMBINANT PLASMID DNA pHINS11 CODING HYBRID PROTEIN-HUMAN INSULIN PRECURSOR, Escherichia coli CELL, TRANSFORMED WITH RECOMBINANT PLASMID DNA pHINS11, Escherichia coli BACTERIA STRAIN JM109/pHINS11 - PRODUCER OF HYBRID PROTEIN-HUMAN INSULIN PRECURSOR, AND METHOD OF OBTAINING HUMAN INSULIN | |
| JP3819540B2 (en) | Mammalian polypeptide having L-asparaginase activity | |
| JPH10505502A (en) | Preparation of modified collagen-induced platelet aggregation inhibitor paridipine | |
| CN113980880B (en) | Genetically engineered bacterium and application thereof, and method for producing psicose by taking glucose as raw material | |
| CN110305221B (en) | Enhanced anti-tumor fusion protein, preparation method and application | |
| WO1990002183A1 (en) | Production of a novel lymphokine exhibiting differentiation inhibitory activity | |
| JPH04502260A (en) | N-acetylmuramidase M1 | |
| EP0956864A1 (en) | Tissue fibrosis inhibitor | |
| JPH02273193A (en) | Recombinant interleukin-2 fused proteins | |
| EP1111054B1 (en) | A new gene of human lysoenzyme, the encoding polypeptide and methods for preparing them | |
| WO2008046256A1 (en) | Haemocoagulase | |
| CN106674353A (en) | Novel radix trichosanthis fusion protein and application thereof | |
| WO1999033873A1 (en) | NOVEL POLYPEPTIDES, cDNAS ENCODING THE SAME AND UTILIZATION THEREOF | |
| CA2472280C (en) | Cytotoxic cyplasin of the sea hare, aplysia punctata, cdna cloning and expression of bioreactive recombinants |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060221 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060424 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20060606 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20060615 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090623 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100623 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110623 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120623 Year of fee payment: 6 |
|
| LAPS | Cancellation because of no payment of annual fees |