JP3784084B2 - Pharmaceutical tablets - Google Patents
Pharmaceutical tablets Download PDFInfo
- Publication number
- JP3784084B2 JP3784084B2 JP25170594A JP25170594A JP3784084B2 JP 3784084 B2 JP3784084 B2 JP 3784084B2 JP 25170594 A JP25170594 A JP 25170594A JP 25170594 A JP25170594 A JP 25170594A JP 3784084 B2 JP3784084 B2 JP 3784084B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- methyl
- dihydro
- oxo
- acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 0 C*(c1cccc(*)c1[n]1C)c1Br Chemical compound C*(c1cccc(*)c1[n]1C)c1Br 0.000 description 5
Images
Landscapes
- Plural Heterocyclic Compounds (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
【0001】
【産業上の利用分野】
本発明は、医薬用錠剤に関する。
【0002】
【従来の技術】
錠剤は薬物の投与形態として一般的であるが、錠剤化の過程において重要なことは薬物の安定性をいかに保持するかである。しかし、固体状態では温度、湿度などに対して安定である結晶性薬物であっても、他成分を配合した製剤処方で錠剤化した場合、製造過程における造粒あるいは加圧成形の際に加えられる圧力、摩擦、熱等により結晶の歪みが生じることがある。例えば、高血圧症などの治療薬として有望視されている抗AII作用を有するベンズイミダゾール−7−カルボン酸またはその誘導体(例えば、EP公開第520423号公報など)は、単独で固体状態では、温度、湿度に対して安定であるが、他成分を配合した製剤処方で錠剤化した場合、製造過程における造粒あるいは加圧成形の際に加えられる圧力、摩擦、熱等により結晶の歪みが生じることがあり、経日的な含量低下が加速されることが見いだされている。従来、有効成分を製剤中で安定化させる方法としては、増仕込みや極端な低水分化等が採用されてきたが、とかくコストアップにつながっており、コスト面でも十分実用性のある安定化方法が待望されていた。製剤の安定化により製品の品質保証期間をより長くすることができ、製品価値を高めることが要望されていた。
【0003】
【発明が解決しようとする課題】
本発明は、式(I):
【化2】
(式中、R1は水素またはヘテロ原子を介して結合していてもよい炭化水素残基を示し、R2は水素または置換基を有していてもよい炭化水素残基を示し、R3は陰イオンを形成しうる基またはそれに変じ得る基を示し、Xはフェニレン基とフェニル基が直接または原子鎖2以下のスペーサーを介して結合していることを示し、nは1または2を示し、環AはCOOR2で表される基以外にさらに置換基を有していてもよいベンゼン環を示す)で表される化合物またはその塩を含有し、素錠の密度を1.2ないし1.4mg/mm3に調整してなる、安定性を高く維持しかつ保存性に優れた医薬用錠剤を提供することである。
【0004】
【課題を解決するための手段】
本発明者らは、このような事情を考慮し、式(I)で表される化合物またはその塩を含有する錠剤の安定化を図るべく汎用的な安定化手段を種々試みたが、十分実用性のある安定化効果は見いだせなかった。さらに種々検討を加えたところ、意外にも錠剤の密度あるいは破断面積に対する硬度を特定すると式(I)で表される化合物またはその塩の安定性がよくなること、さらに金属セッケンを配合すると顕著に有効成分の分解が抑えられ安定な錠剤が製造面の問題もなく得られることを見いだし、さらに検討を重ねて、本発明を完成するに至った。
すなわち本発明は、
(1)式(I):
【化3】
(式中、R1は水素またはヘテロ原子を介して結合していてもよい炭化水素残基を示し、R2は水素または置換基を有していてもよい炭化水素残基を示し、R3は陰イオンを形成しうる基またはそれに変じ得る基を示し、Xはフェニレン基とフェニル基が直接または原子鎖2以下のスペーサーを介して結合していることを示し、nは1または2を示し、環AはCOOR2で表される基以外にさらに置換基を有していてもよいベンゼン環を示す)で表される化合物またはその塩(以下、有効成分Aと称することがある)を含有し、素錠の密度を1.2ないし1.4mg/mm3に調整してなる医薬用錠剤、
(2)素錠の直径方向における破断面積あたりの硬度が0.1ないし0.4kg/mm2である上記(1)記載の医薬用錠剤、および
(3)炭素数12ないし22の金属セッケンを含有してなる上記(1)記載の医薬用錠剤に関するものである。
【0005】
前記式(I)において、R3としての陰イオンを形成しうる基(プロトン として遊離しうる水素原子を有する基)またはそれに変じ得る基としては、N,S,Oのうちの1個または2個以上を含む5〜7員(好ましくは5〜6員)の単環状の置換されていてもよい複素環残基(好ましくは、脱プロトン化しうる水素原子を有する含窒素複素環残基)または生体内でそれに変じ得る基が挙げられる。例えば、
【化4】
【0006】
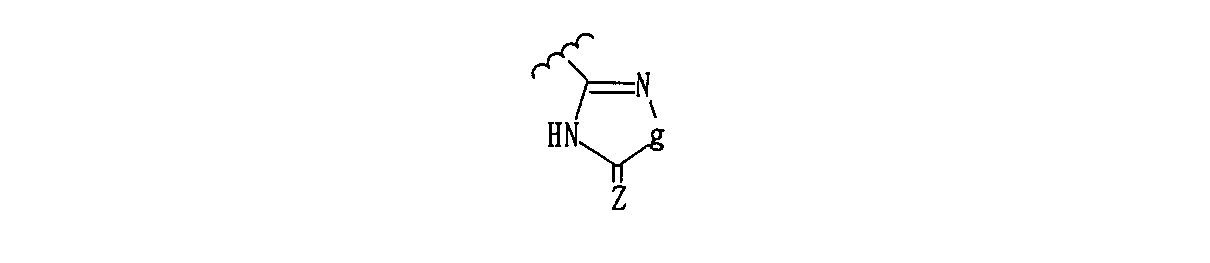
などが挙げられ、また、式R3で表される基と該基が結合するフェニル基との結合は、上記に示すような炭素−炭素結合だけでなく、上記式中g=−NH−を示す時などは複数個存在する窒素原子の1つを介して結合していてもよい。例えば、
【化5】
【化6】
>=Z,>=Z' および>=Z'' はそれぞれカルボニル基,チオカルボニル基または酸化されていてもよい硫黄原子(例、S,S(O),S(O)2など)(好ましくはカルボニルまたはチオカルボニル基、さらに好ましくはカルボニル基)を示し、mは0,1または2の整数を示し、R5は水素原子または置換されていてもよい低級アルキル基(例、メチル,エチル,プロピル,イソプロピル,ブチル,sec-ブチル,t-ブチルなどの低級(C1-4)アルキルなど)を示す。〕
【0007】
上記複素環残基としては、例えば、2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール環残基、2,5−ジヒドロ−5−チオキソ−1,2,4−オキサジアゾール環残基または2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール環残基のようなプロトンドナーとしての−NHや−OH基とプロトンアクセプターとしてのカルボニル基、チオカルボニル基またはスルフィニル基などを同時に有する基などが好ましい。また、R3で示される複素環残基は、環状の置換基が結合して縮合環を形成していてもよいが、R3としては、5−6員環さらに5員環残基が好ましい。また、これらの基が置換されていてもよい低級アルキル基またはアシル基などで保護されていてもよく、生物学的すなわち生理的条件下(例えば、生体内酵素などによる酸化、還元あるいは加水分解などの生体内反応など)で、または化学的に陰イオンを形成しうる基またはそれに変じ得る基であればいずれでもよい。
【0008】
R3としては、式
【化7】
〔式中、iは−O−または−S−を示し、jは>C=O,>C=Sまたは>S(O)mを示し、mは0,1または2を示す〕で示される基(なかでも、2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル、2,5−ジヒドロ−5−チオキソ−1,2,4−オキサジアゾール−3−イル、2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)が好ましい。R3の置換位置としては、オルト、メタ、パラのいずれの位置でもよいが、なかでもオルト位が好ましい。
【0009】
また、上記複素環残基(R3)は下記に示すように互変異性体が存在する。例えば、
【化8】
のようなa,bおよびcの3つの互変異性体が存在するが式
【化9】
で示される複素環残基は上記のa,bおよびcのすべてを含むものである。
【0010】
Xは隣接するフェニレン基とフェニル基が直接または原子鎖2以下のスペーサーを介して結合していること(好ましくは直接結合)を示し、原子鎖2以下のスペーサーとしては、直鎖部分を構成する原子数が1または2である2価の鎖であればいずれでもよく、側鎖を有していてもよい。具体的には低級(C1-4)アル キレン、−CO−,−O−,−S−,−NH−,−CO−NH−,−O−CH2 −,−S−CH2−,−CH=CH−などが挙げられる。
nは1または2の整数(好ましくは1)を示す。
上記したR3,Xおよびnで示される式
【化10】
としては
【化11】
で表されるものが好ましい。
【0011】
式(I)に関して、R1としての炭化水素残基としては、例えばアルキル基,アルケニル基,アルキニル基,シクロアルキル基,アリール基,アラルキル基などが挙げられるが、なかでもアルキル基,アルケニル基およびシクロアルキル基が好ましい。該炭化水素残基は、ヘテロ原子を介してベンズイミダゾール環に結合していてもよい。
R1としてのアルキル基は、炭素数1〜8程度の低級アルキル基で直鎖状、分枝状のいずれでもよく、例えばメチル,エチル,プロピル,イソプロピル,ブチル,イソブチル,sec−ブチル,t−ブチル,ペンチル,i−ペンチル,ヘキシル,ヘプチル,オクチルなどが挙げられる。
R1としてのアルケニル基は、炭素数2〜8程度の低級アルケニル基で直鎖状、分枝状のいずれでもよく、例えばビニル,プロペニル,2−ブテニル,3−ブテニル,イソブテニル,2−オクテニルなどが挙げられる。
R1としてのアルキニル基は、炭素数2〜8程度の低級アルキニル基で直鎖状、分枝状のいずれでもよく、例えばエチニル,2−プロピニル,2−ブチニル,2−ペンチニル,2−オクチニルなどが挙げられる。
R1としてのシクロアルキル基は、炭素数3〜6程度の低級シクロアルキル基が挙げられ、例えばシクロプロピル,シクロブチル,シクロペンチル,シクロヘキシルなどが挙げられる。
【0012】
上記したアルキル基,アルケニル基,アルキニル基またはシクロアルキル基は、水酸基,置換されていてもよいアミノ基(例、アミノ,N−低級(C1-4)アルキルアミノ,N,N−ジ低級(C1-4)アルキルアミノなど),ハロゲン,低級(C1-4)アルコキシ基,低級(C1-4)アルキルチオなどで置換されていてもよい。
R1としてのアラルキル基は、例えばベンジル,フェネチルなどのフェニル−低級(C1-4)アルキルが挙げられ、R1としてのアリール基としては、例えばフェニルが挙げられる。
上記したアラルキル基またはアリール基はそのベンゼン環上の任意の位置に、例えばハロゲン(例、F,Cl,Brなど)、ニトロ、置換されていてもよいアミノ基(例、アミノ,N−低級(C1-4)アルキルアミノ,N,N−ジ低級(C1-4)アルキルアミノなど)、低級(C1-4)アルコキシ(例、メトキシ,エトキシなど)、低級(C1-4)アルキルチオ(例、メチルチオ,エチルチオなど)、低級(C1-4)アルキル(例、メチル,エチルなど)などを有していてもよい。
上記した中でもR1としては、置換されていてもよいアルキル,アルケニルまたはシクロアルキル基(例、水酸基,アミノ基,ハロゲンあるいは低級(C1-4)アルコキシ基で置換されていてもよい低級(C1-5)アルキル、低級(C2-5)アルケニルまたは低級(C3-6)シクロアルキル基など)が好ましい。
また、上記したR1はヘテロ原子{例えば、酸素、硫黄(−S(O)m−(mは0,1または2を示す))または窒素(−N(R4)−(式中、R4は水素または低級(C1-4)アルキルを示す)など}を介して結合していてもよく、その中でも、ヘテロ原子を介して結合するアルキル,アルケニルまたはシクロアルキル基(例、メチルアミノ、エチルアミノ、プロピルアミノ、プロペニルアミノ、イソプロピルアミノ、アリルアミノ、ブチルアミノ、イソブチルアミノ、ジメチルアミノ、メチルエチルアミノ、メトキシ、エトキシ、プロポキシ、イソプロポキシ、プロペニルオキシ、アリルオキシ、ブトキシ、イソブトキシ、sec−ブトキシ、t−ブトキシ、2−ブテニルオキシ、3−ブテニルオキシ、イソブテニルオキシ、ペントキシ、イソペントキシ、ヘキシルオキシ、メチルチオ、エチルチオ、プロピルチオ、イソプロピルチオ、アリルチオ、ブチルチオ、イソブチルチオ、sec−ブチルチオ、t−ブチルチオ、2−ブテニルチオ、3−ブテニルチオ、イソブテニルチオ、ペンチルチオ、イソペンチルチオ、ヘキシルチオなど)が好ましく、さらに好ましくは、低級(C1-4)アルコキシ(例、メトキシ,エトキシ,プロポキシ,イソプロポキシ,ブトキシ,イソブトキシ,sec-ブトキシ,tert-ブトキシなど)が挙げられる。
【0013】
一般式(I)中、R2としての炭化水素残基としては、例えばアルキル基,アルケニル基,アルキニル基,シクロアルキル基などが挙げられるが、なかでもアルキル基およびアルケニル基が好ましい。
R2としてのアルキル基は、炭素数1〜8程度の低級アルキル基で直鎖状、分枝状のいずれでもよく、例えばメチル,エチル,プロピル,イソプロピル,ブチル,イソブチル,sec−ブチル,t−ブチル,ペンチル,i−ペンチル,ヘキシル,ヘプチル,オクチルなどが挙げられる。
R2としてのアルケニル基は、炭素数2〜8程度の低級アルケニル基で直鎖状、分枝状のいずれでもよく、例えばビニル,プロペニル,2−ブテニル,3−ブテニル,イソブテニル,2−オクテニルなどが挙げられる。
R2としてのアルキニル基は、炭素数2〜8程度の低級アルキニル基で直鎖状、分枝状のいずれでもよく、例えばエチニル,2−プロピニル,2−ブチニル,2−ペンチニル,2−オクチニルなどが挙げられる。
R2としてのシクロアルキル基は、炭素数3〜6程度の低級シクロアルキル基が挙げられ、例えばシクロプロピル,シクロブチル,シクロペンチル,シクロヘキシルなどが挙げられる。
上記したアルキル基,アルケニル基,アルキニル基またはシクロアルキル基は、置換されていてもよい水酸基,置換されていてもよいアミノ基(例、アミノ,ジメチルアミノ,ジエチルアミノ,ピペリジノ,モルホリノなど),ハロゲン,低級(C1-6)アルコキシ基,低級(C3-6)シクロアルキル,低級(C1-6)アルキルチオあるいはジオキソレニル(例、5−メチル−2−オキソ−1,3−ジオキソレン−4−イルなど)などで置換されていてもよい。
【0014】
上記した中でも、R2としての置換基を有していてもよい炭化水素残基としては、例えば、水酸基,置換されていてもよいアミノ(例、アミノ、ジメチルアミノ、ジエチルアミノ、ピペリジノ、モルホリノなど),ハロゲン,低級(C1-6)アルコキシ,低級(C3-6)シクロアルコキシ,低級(C1-6)アルキルチオあるいは置換されていてもよいジオキソレニル(例、5−メチル−2−オキソ−1,3−ジオキソレン−4−イルなど)で置換されていてもよい低級(C1-6)アルキル基、または式−CH(R6)−OCOR5〔式中、R6は水素、炭素数1−6の直鎖もしくは分枝状の低級アルキル基(例、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、t−ブチル、n−ペンチル、イソペンチル、ネオペンチルなど)、炭素数2−6の直鎖もしくは分枝状の低級アルケニル基または炭素数3−8のシクロアルキル基(例、シクロペンチル、シクロヘキシル、シクロヘプチルなど)を示し、R5 は炭素数1−6の直鎖もしくは分枝状の低級アルキル基(例、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、sec−ブチル、t−ブチル、n−ペンチル、イソペンチル、ネオペンチルなど)、炭素数2−6の直鎖もし くは分枝状の低級アルケニル基、炭素数3−8のシクロアルキル基(例、シクロペンチル、シクロヘキシル、シクロヘプチルなど)もしくは置換されていてもよいフェニルなどのアリール基で置換された炭素数1−3の低級アルキル基(例、ベンジル、p−クロロベンジル、フェネチル、シクロペンチル メチル、シクロヘキシルメチルなど)、炭素数3−8のシクロアルキルもしくは置換されていてもよいフェニルなどのアリール基で置換されていてもよい炭素数2−3の低級アルケニル基(例、シンナミル等のビニル、プロペニル、アリル、イソプロペニルなどのアルケニル部を持つものなど)、置換されていてもよいフェニルなどのアリール基(例、フェニル、p−トリル、ナフチルなど)、炭素数 1−6の直鎖もしくは分枝状の低級アルコキシ基(例、メトキシ、エトキシ、n −プロポキシ、イソプロポキシ、n−ブトキシ、イソブトキシ、sec−ブトキシ、t−ブトキシ、n−ペンチルオキシ、イソペンチルオキシ、ネオペンチルオキシなど)、炭素数2−8の直鎖もしくは分枝状の低級アルケニロキシ基(例、アリロキシ、イソブテニロキシなど)、炭素数3−8のシクロアルキルオキシ基(例、シクロペンチルオキシ、シクロヘキシルオキシ、シクロヘプチルオキシなど)、炭素数3−8のシクロアルキル(例、シクロペンチル、シクロヘキシル、シクロヘプチルなど)もしくは置換されていてもよいフェニルなどのアリール基で置換された炭素数1−3の低級アルコキシ基(例、ベンジロキシ、フェネチロキシ、シクロペンチルメトキシ、シクロヘキシルメトキシなどのメトキシ、エトキシ、n−プロポキシ、イソプロポキシなどのアルコキシ部を持つものなど)、炭素数3−8のシクロアルキル(例、シクロペンチル、シクロヘキシル、シクロヘプチルなど)もしくは置換されていてもよいフェニルなどのアリール基で置換された炭素数2−3の低級アルケニロキシ基(例、シンナミロキシ等のビニロキシ、プロペニロキシ、アリロキシ、イソプロペニロキシなどのアルケニロキシ部を持つものなど)、置換されていてもよいフェノキシなどのアリールオキシ基(例、フェノキシ、p−ニトロフェノキシ、ナフトキシなど)を示す〕で表される基などが挙げられる。
【0015】
置換基R2の例としては、水素、メチル、エチル、t−ブチル、プロピル、ピバロイルオキシメチル、1−(シクロヘキシルオキシカルボニルオキシ)エチル、5−メチル−2−オキソ−1,3−ジオキソレン−4−イルメチル、アセトキシメチル、プロピオニロキシメチル、n−ブチリロキシメチル、イソブチリロキシメチル、1−(エトキシカルボニロキシ)エチル、1−(アセトキシ)エチル、1−(イソブチリロキシ)エチル、シクロヘキシルカルボニルオキシメチル、ベンゾイルオキシメチル、シンナミル、シクロペンチルカルボニロキシメチルなどが挙げられる。
一般式(I)中のR2としては、水素、または水酸基,アミノ,ハロゲン,低級(C2-6)アルカノイルオキシ(例、アセチルオキシ,ピバロイルオキシなど),低級(C4-7)シクロアルカノイルオキシ,(低級(C1-6)アルコキシ)カルボニルオキシ(例、メトキシカルボニルオキシ,エトキシカルボニルオキシなど),(低級(C3-6)シクロアルコキシ)カルボニルオキシ(例、シクロヘキシルオキシカルボニルオキシなど),低級(C1-6)アルコキシあるいは低級(C3-6)シクロアルコキシで置換されていてもよい低級(C1-4)アルキルが好ましく、さらに好ましくは、水素またはシクロヘキシルオキシカルボニルオキシで置換された低級(C1-4)アルキルが挙げられる。
【0016】
一般式(I)中、環AはCOOR2で表される基以外にさらに置換基を有していてもよく、例えば、ハロゲン(例、F,Cl,Br など),シアノ, ニトロ,低級(C1-4)アルキル,低級(C1-4)アルコキシ,置換されていてもよいアミノ基(例、アミノ,N−低級(C1-4)アルキルアミノ(例,メチルアミノなど),N,N−ジ低級(C1-4)アルキルアミノ(例, ジメチルアミノなど),N−アリールアミノ(例、フェニルアミノなど)、脂環式アミノ(例、モルホリノ、ピベリジノ、ピペラジノ、N−フェニルピペラジノなど)など)、式 −CO−D′〔式中、D′は水酸基またはアルキル部分が水酸基,低級(C1-4)アルコキシ,低級(C2-6)アルカノイルオキシ(例、アセトキシ,ピバロイルオキシなど)あるいは低級(C1-6)アルコキシカルボニルオキシ(例、メトキシカルボニルオキシ,エトキシカルボニルオキシなど),低級(C3-6)シクロアルコキシカルボニルオキシ(例、シクロヘキシルオキシカルボニルオキシなど)で置換されていてもよい低級(C1-4)アルコキシを示す〕で表わされる基,または低級(C1-4)アルキルもしくはアシル(例、低級(C2-5)アルカノイル、置換されていてもよいベンゾイル など)で保護されていてもよいテトラゾリル基、トリフルオロメタンスルホン酸アミド基、リン酸基あるいはスルホン酸基などが挙げられ、好ましくは、低級(C1-4) アルキル,ハロゲンなどである。これらの置換基が環状の任意の位置に1〜2個同時に置換されていてもよい。
【0017】
上記(I)式で表される化合物の中でも、
【化12】
〔式中、環AはCOOR2で表わされる基以外にさらに1または2個の置換基を有していてもよいベンゼン環を示し、R1は水素または低級(C1-6)アルコキシ(好ましくは、低級(C1-4)アルコキシ)を示し、R2は水素または水酸基,アミノ,ハロゲン,低級(C2-6)アルカノイルオキシ(例、アセチルオキシ、ピバロイルオキシなど),低級(C4-7)シクロアルカノイルオキシ, (低級(C1-6)アルコキシ)カルボニルオキシ(例、メトキシカルボニルオキシ、エトキシカルボニルオキシなど),(低級(C3-7)シクロアルコキシ)カルボニルオキシ(例、シクロヘキシルオキシカルボニルオキシなど)あるいは低級(C1-4)アルコキシで置換されていてもよい低級(C1-4)アルキルを示し、R3は、置換されていてもよい低級(C1-4)アルキル(例、メチル,トリフェニルメチル,メトキシメチル,アセチルオキシメチル,メトキシカルボニルオキシメチル,エトキシカルボニルオキシメチル,1−(シクロヘキシルオキシカルボニルオキシ)エチル,ピバロイルオキシメチルなど)あるいはアシル基(例、低級(C2-5)アルカノイル,ベンゾイルなど)で保護されていてもよい、式
【化13】
〔式中、iは−O−または−S−を示し、jは>C=O,>C=Sまたは>S(O)mを示し、mは0,1または2を示す〕で表される基を示し、nは1または2(好ましくは1)を示す〕で表わされる化合物(I')またはその塩が好ましい。
【0018】
式(I')において、環AのCOOR2で表わされる基以外の置換基としては、ハロゲン(例、F,Cl,Br など),低級(C1-4)アルキル,低級(C1-4)アルコキシ,ニトロ,式 −CO−D′[式中、D′は水酸基またはアルキル部分が水酸基,低級(C1-4)アルコキシ,低級(C2-6)アルカノイルオキシ(例、アセチルオキシ,ピバロイルオキシなど)あるいは低級(C1-6)アルコキシカルボニルオキシ(例、メトキシカルボニルオキシ,エトキシカルボニルオキシ,シクロヘキシルオキシカルボニルオキシなど)で置換されていてもよい低級(C1-4)アルコキシを示す]で表わされる基,または低級(C1-4)アルキルで置換されていてもよいアミノなど(好ましくは、低級(C1-4)アルキル,ハロゲンなど)が挙げられるが、環Aとしては、式COOR2で表わされる基以外に置換基を有していないベンゼン環がより好ましい。
とりわけ上記式(I)中、R1はエトキシを示し、R2は水素を示し、環Aは式COOR2で表される基以外は置換基を有していないベンゼン環を示し、R3は2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イルを示し、nは1を示し、Xは結合手を示す化合物、すなわち2−エトキシ−1−〔〔2'−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル〕メチル〕−1H−ベンズイミダゾール−7−カルボン酸(以下、化合物Tと称することがある)が好ましく用いられる。
【0019】
式(I)で表される化合物としては、EP520423の実施例に挙げられたものが挙げられる。
式(I)で表される化合物またはその塩は、例えばEP520423などで開示されているか、またはこれら公報の開示にしたがって製造することができる。
また、式(I)で表される化合物またはその塩としては、好ましくは融点が120〜250℃、さらに好ましくは150〜250℃、特に好ましくは180〜220℃であるものが挙げられる。
【0020】
例えば、一般式(I)で表される化合物としては、下記のようなものが挙げられる。
2−エトキシ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
メチル 2−エトキシ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
メチル 2−ブチル−1−[[2’−(2−オキソ−3H−1,2,3,5−オキサチアジアゾール−4−イル)ビフェニル]メチル]ベンズイミダゾール−7−カルボキシラート、
メチル 2−エトキシ−1−[[2’−(2−オキソ−3H−1,2,3,5−オキサチアジアゾール−4−イル)ビフェニル]メチル]ベンズイミダゾール−7−カルボキシラート、
1−(シクロヘキシルオキシカルボニルオキシ)エチル 2−エトキシ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
2−ブチル−1−[[2’−(2,3−ジヒドロ−2−オキソ−1,3,4−オキサジアゾール−5−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
メチル 2−ブチル−1−[[2’−(2,3−ジヒドロ−2−オキソ−1,3,4−オキサジアゾール−5−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
アセトキシメチル 1−[[2’−(4−アセトキシメチル−4,5−ジヒドロ−5−オキソ−4H−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−エトキシベンズイミダゾール−7−カルボキシラート、
アセトキシメチル 2−エトキシ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
1−[[2’−(4−アセトキシメチル−4,5−ジヒドロ−5−オキソ−4H−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−エトキシベンズイミダゾール−7−カルボン酸、
【0021】
1−[[2’−(2,5−ジヒドロ−2−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロピルベンズイミダゾール−7−カルボン酸、
メチル 1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロピルベンズイミダゾール−7−カルボキシラート、
2−エチル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
2−シクロプロピル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
メチル 2−シクロプロピル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
2−ブチル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロピルチオベンズイミダゾール−7−カルボン酸、
メチル 1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロピルチオベンズイミダゾール−7−カルボキシラート、
1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−メトキシベンズイミダゾール−7−カルボン酸、
メチル 1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−メトキシベンズイミダゾール−7−カルボキシラート、
【0022】
1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロポキシベンズイミダゾール−7−カルボン酸、
メチル 1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロポキシベンズイミダゾール−7−カルボキシラート、
2−エチルチオ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
メチル 2−エチルチオ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−メチルチオベンズイミダゾール−7−カルボン酸、
メチル 1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−メチルチオベンズイミダゾール−7−カルボキシラート、
2−エトキシ−1−[[2’−(5−オキシド−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸 ジカリウム塩、
2−エトキシ−1−[[2’−(5−オキシド−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸 ジナトリウム塩、
メチル 2−エトキシ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
2−エトキシ−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
【0023】
メチル 2−エトキシ−1−[[2’−(2,5−ジヒドロ−5−チオキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
メチル 2−ブチル−1−[[2’−(2,5−ジヒドロ−5−チオキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
2−ブチル−1−[[2’−(2,5−ジヒドロ−5−チオキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
メチル 2−ブチル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
2−ブチル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
メチル 2−エチル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
2−エチル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸、
メチル 2−エチル−1−[[2’−(2,5−ジヒドロ−5−チオキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボキシラート、
メチル 1−[[2’−(2,5−ジヒドロ−5−チオキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロピルベンズイミダゾール−7−カルボキシラート、
メチル 1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロピルベンズイミダゾール−7−カルボキシラート、
【0024】
1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−メトキシベンズイミダゾール−7−カルボン酸、
1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−プロポキシベンズイミダゾール−7−カルボン酸、
1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−メチルベンズイミダゾール−7−カルボン酸、
2−シクロプロピル−1−[[2’−(2,5−ジヒドロ−5−オキソ−1,2,4−チアジアゾール−3−イル)ビフェニル−4−イル]メチル]ベンズイミダゾール−7−カルボン酸。
【0025】
上記塩としては、薬学的に許容される塩が挙げられ、例えば、無機塩基との塩、有機塩基との塩、無機酸との塩、有機酸との塩、塩基性または酸性アミノ酸との塩などが挙げられる。無機塩基との塩の好適な例としては、例えばナトリウム塩、カリウム塩などのアルカリ金属塩;カルシウム塩、マグネシウム塩などのアルカリ土類金属塩;ならびにアルミニウム塩、アンモニウム塩などが挙げられる。有機塩基との塩の好適な例としては、例えば、トリメチルアミン、トリエチルアミン、ピリジン、ピコリン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、ジシクロヘキシルアミン、N,N’−ジベンジルエチレンジアミンなどとの塩が挙げられる。無機酸との塩の好適な例としては、例えば塩酸、臭化水素酸、硝酸、硫酸、リン酸などとの塩が挙げられる。有機酸との塩の好適な例としては、例えばギ酸、酢酸、トリフルオロ酢酸、フマール酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸などとの塩が挙げられる。塩基性アミノ酸との塩の好適な例としては、例えばアルギニン、リジン、オルニチンなどとの塩が挙げられ、酸性アミノ酸との塩の好適な例としては、例えばアスパラギン酸、グルタミン酸などとの塩が挙げられる。
【0026】
また本発明における医薬用錠剤としては、上記式(I)で表される化合物またはその塩以外の薬物(以下、有効成分Bと称することがある)が添加されていてもよく、該薬物としては、特に限定されないが、例えば中枢神経系薬物として、ジアゼパム、イデベノン、アスピリン、イブプロフェン、パラセタモール、ナプロキセン、ピロキシカム、ジクロフェナック、インドメタシン、スリンダック、ロラゼパム、ニトラゼパム、フェニトイン、アセトアミノフェン、エテンザミド、ケトプロフェン等が、循環器系薬物としては、モルシドミン、ビンポセチン、プロプラノーロル、メチルドパ、ジピリダモール、フロセミド、トリアムテレン、ニフェジピン、アテノロール、スピロノラクトン、メトプロロール、ピンドロール、カプトプリル、硝酸イソソルビド等が、呼吸器系薬物としては、アムレキサノクス、デキストロメトルファン、テオフィリン、プソイドエフェドリン、サルブタモール、グアイフェニシン等が、消化器系薬物としては、ランソプラゾール、オメプラゾール等のベンツイミダゾール系薬物、シメチジン、ラニチジン、パンクレアチン、ビサコジル、5−アミノサリチル酸等が、抗生物質及び化学療法剤としては、セファレキシン、セファクロール、セフラジン、アモキシシリン、ピバンピシリン、バカンピシリン、ジクロキサシリン、エリスロマイシン、エリスロマイシンステアレート、リンコマイシン、ドキシサイクリン、トリメトプリム/スルファメトキサゾール等が、代謝系薬物としては、セラペプターゼ、塩化リゾチーム、アデノシントリフォスフェート、グリペンクラミド、塩化カリウム等が、ビタミン系薬物としては、ビタミンB1、ビタミンB2、ビタミンB6、ビタミンC、フルスルチアミン等が、また制酸剤等が挙げられる。
【0027】
本発明における素錠とは、i)医薬品をそのまま又は賦形剤,結合剤,崩壊剤もしくはその他の適当な添加剤を加えて均等に混和したものを、適当な方法で顆粒状とした後、滑沢剤などを加え圧縮成型する、ii)医薬品をそのまま又は賦形剤,結合剤,崩壊剤もしくはその他の適当な添加剤を加えて均等に混和したものを、直接圧縮成型して製造するか、またはあらかじめ製造した顆粒に医薬品をそのままもしくは適当な添加剤を加えて均等に混合した後、圧縮成型して製造した状態のものをいう。
本発明でいう素錠の密度とは、素錠の重量を体積で除したものであり、本発明における素錠の密度は、1.2〜1.4mg/mm3、好ましくは1.20〜1.40mg/mm3である。この密度は有効成分の含有率や処方化する際の添加剤の種類と量によっても異なるが打錠時の圧力により規制され、本発明においては、1.0〜6.5トン/cm2、好ましくは1.0〜4.0トン/cm2で打錠することが好ましい。密度が1.14mg/mm3以下の場合、素錠の空隙が大きくなり素錠としての姿を成さないか成形されても次工程等で素錠が破損する。一方、1.45mg/mm3以上の場合、素錠が硬くなりすぎ崩壊時間が遅くなり、また有効成分の溶出性が劣る。
本発明の医薬用錠剤は上記のようにその密度で特定することを特徴とするが、さらに特定の範囲の硬度を有するように調製することが望ましい。ここでいう硬度とは、素錠の直径方向における破断面積あたりの硬度をいい、〔図1〕のように素錠の直径方向に圧を加えたときに得られた硬度を破断する面の面積で除したものであり、本発明における素錠の直径方向における破断面積あたりの硬度は、0.1〜0.4kg/mm2で、好ましくは0.10〜0.40kg/mm2である。このような硬度範囲に調製することによって素錠の破損性が少なく、服用後の崩壊時間が適度であって有効成分の溶出性に優れた錠剤が得られる。一般的に破断面積に対する硬度は素錠密度と連動するが、絶対値は錠剤組成により異なる。
【0028】
次に本発明における金属セッケンは、炭素数12〜22の脂肪族モノカルボン酸(例、ラウリン酸,ミリスチン酸,パルミチン酸,ステアリン酸など)の金属塩が好ましく、例えばアルミニウムセッケン、カルシウムセッケン、マグネシウムセッッケン、亜鉛セッケンなどが挙げられ、単体あるいは混合物として使用できる。
本発明の医薬用錠剤において、金属セッケンは素錠あたり0.01〜10重量%、好ましくは0.05〜5重量%、さらに好ましくは0.1〜2重量%含有される。また、金属セッケンの添加率が10重量%以上の場合、打錠時にキャッピング等の打錠障害が発生するので好ましくないことが多い。
一方、有効成分の添加率は有効成分の薬効、打錠性および要求される錠剤の大きさによるが、本発明の医薬用錠剤において、有効成分は、有効成分Aのみからなる場合、素錠あたり0.01〜99.99重量%、好ましくは0.05〜50重量%、さらに好ましくは0.1〜30重量%含有され、有効成分AおよびBからなる場合、素錠あたり0.01〜99.98重量%、好ましくは0.5〜50重量%含有される。
【0029】
また、有効成分以外の添加物としては、組成物を製造する際に一般に配合される添加剤が挙げられ、例として賦形剤(例、乳糖、コーンスターチ、ショ糖、タルク、結晶セルロース、マンニトール、軽質無水ケイ酸、炭酸マグネシウム、炭酸カルシウム、L−システィン、多孔性物質等)、結合剤[例、アルファー化デンプン、部分アルファー化デンプン、メチルセルロース、カルボキシメチルセルロース、ポリビニルピロリドン、プルラン、デキストリン、アラビアゴム、ヒドロキシプロピルセルロース(以後HPCと記載することもある)、ヒドロキシプロピルメチルセルロース(以後HPMCと記載することもある)等]、崩壊剤[カルボキシメチルセルロースカルシウム、デンプン類、クロスカルメロース、クロスポビドン、低置換度ヒドロキシプロピルセルロース(以後L−HPCと記載することもある)等]、さらには、コーティング剤(例、HPC、HPMC、エチルセルロース、ヒドロキシメチルセルロース、ポリオキシエチレングリコール、ツイーン80、プルロニックF68、ヒマシ油、セルロースアセテートフタレート、ヒドロキシプロピルメチルセルロースフタレート、ヒドロキシメチルセルロースアセテートサクシネート、アクリル酸コーポリマー、カルボキシメチルエチルセルロース、ポリビニルアセタルジエチルアミノアセテート、セラック、ワックス類等)、着色剤(酸化チタン、ベンガラ、タール色素等)、マクロゴール類などが挙げられ、これらの2種以上を用いてもよい。
【0030】
本発明の医薬用錠剤の製造において、金属セッケンを素錠に添加する方法は、特に定まった方法はなく通常の方法でよく、例えば有効成分とともに金属セッケンを直接混合後打錠する乾式法、有効成分等を水等の溶媒で造粒後に他の成分と金属セッケンを混合後打錠する湿式法、さらには造粒時に金属セッケンを添加してもよい。造粒に用いる機械は一般的な転動造粒機、撹拌造粒機、流動造粒機、遠心転動造粒機及び転動流動造粒機、さらにはローラーコンパクターのような加圧造粒機や機械的な衝撃によるオーダードミクスチャーのようなボールミル、ハンマーミル及び転動圧密タイプの機械が用いられる。混合に用いる機械には前述の造粒機を用いてもよく、特にタンブル型またはダブルコーン型の転動タイプが望ましい。打錠に用いる機械は静圧タイプ及び動圧タイプのいずれでもよく動圧タイプにはストローク式及びロータリィ式の打錠機がある。さらに、本発明の医薬用錠剤は、その素錠において、水溶性、pH依存性及びpH非依存性の被覆剤で被覆することが可能で、一般的な糖衣機、通気型のコーティング機及び流動造粒機等が使用される。
本発明の医薬用錠剤は、哺乳動物(例えば、ヒト,イヌ,ウサギ,ラット,マウスなど)の医薬として安全に利用することができる。
ある特定の患者の投与量は、年齢,体重,一般的健康状態,性別,食事,投与時間,排泄速度,薬物の組み合わせなどを考慮し、また患者のその時に治療を行っている病状の程度に応じて決められるが、有効成分Aとして、一日投与量約0.05〜500mg、好ましくは0.1〜100mgである。また、有効成分Bについては、薬物の種類に応じた公知の使用法に準じて決めればよい。
【0031】
【発明の効果】
本発明の医薬用錠剤は安価に製造することができ、有効成分の分解などが抑えられ、日を経てもなお有効成分の高い含量を維持できる。したがって、製剤を安定化して製品の価値を高めることができる。
【0032】
【実施例】
次に実施例、参考例及び実験例を挙げて本発明をさらに具体的に説明するが、本発明はこれらに限定されるものではない。
実施例1
化合物T〔2−エトキシ−1−((2'−(2,5−ジヒドロ−5−オキソ−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル)メチル)−1H−ベンズイミダゾール−7−カルボン酸〕を10g、ステアリン酸マグネシウムを0.1gとり軽く混合後、混合末の250mgを杵径9.0mmφ平面でオートグラフ(島津製作所製:AG−5000B)により3トン/cm2の打錠圧で錠剤を製造した。錠剤は、厚み3.2mm、硬度8kgで、密度は1.23mg/mm3、断面積当りの硬度は0.28kg/mm2あった。
【0033】
実施例2
高速撹拌造粒機(パウレック社製:バーチカルグラニュレータ、FM−G25)に化合物Tを100g、乳糖を540g、コーンスターチを230g、HPCを30g入れ、精製水を200g添加して5分間練合し、その練合物を40℃真空にて10時間乾燥して取り出した後、整粒機(昭和化学機械製:パワーミル、P−3S、1.5mmφパンチングスクリーン)にて粉砕し整粒末(化合物T末1)845gを得た。化合物T末1を810g、L−HPCを85.5g、ステアリン酸マグネシウムを4.5gとりタンブル型混合機(昭和化学機械製:タンブラーミキサー、TM−15)にて1分間混合した。混合末をロータリィ打錠機(菊水製作所製:コレクト19K、杵6.5mmφ・9.0R、打錠圧2.9トン/cm2)を用いて打錠し、7800錠の重量100mg、厚み2.8mm、硬度5kg、崩壊時間4分のレンズ型の素錠を得た(崩壊時間の測定は日本薬局方(XII)一般試験法(43)崩壊試験法に基づいて行った。以下の場合も同様である)。錠剤の密度は1.37mg/mm3、断面積当りの硬度は0.32kg/mm2であった。さらに、素錠4000錠をとり、あらかじめ調製しておいた下記の組成の水性フィルム液を用い、通気型コーティング機(フロイント社製:ミニハイコータ)を用いてドラム回転数を約20rpm、給気温度約70℃、注液速度1.7g/分で錠剤が4mg被覆されるまでコーティングした。得られたフィルム錠は、重量104mg、直径6.7mmφ、厚み2.9mm、崩壊時間4分のピンクのレンズ型の錠剤であった。
[水性フィルム液]
HPMC 29.94g
マクロゴール6000 6.0 g
酸化チタン 4.0 g
ベンガラM 0.06g
精製水 380ml
【0034】
実施例3
化合物Tを5g及び乳糖100gをポリ袋に入れ振り混ぜて混合後48メッシュ丸篩で篩過、さらに篩過品をポリ袋に入れ乳糖200g追加し振り混ぜて混合後48メッシュで再篩過した。再篩過品305g、乳糖2745g、コーンスターチ1300g、HPCを150gとり、実施例2に準じて整粒末4380gを得た。得られた整粒末3600g、L−HPCを380g、ステアリン酸マグネシウム20gとり、実施例2に準じて混合した混合末を打錠して36000錠の錠剤を得た。得られた錠剤の重量は100mg、厚み2.8mm、硬度4kg、崩壊は2分であった。錠剤の密度は1.37mg/mm3、断面積に対する硬度は0.26kg/mm2であった。さらに錠剤を35000錠とり、あらかじめ調製しておいた下記の組成の水性フィルム液を用い、通気型コーティング機(パウレック社製:ドリアコータ−500)にてドラム回転数を約8rpm、給気温度約75℃、注液速度15g/分で錠剤が4mg被覆されるまでコーティングした。得られたフィルム錠は、重量104mg、直径6.7mmφ、厚み2.9mm、崩壊時間3分のピンクのレンズ型の錠剤であった。
[水性フィルム液]
HPMC 149.7 g
マクロゴール6000 30.0 g
酸化チタン 20.0 g
ベンガラM 0.3 g
精製水 1900 ml
【0035】
実施例4
流動造粒機(パウレック社製:ニュウスピードドライヤー、FD−3S)に化合物Tを10g、乳糖を590g、コーンスターチを260g、ステアリン酸マグネシウムを10g入れ、給気温度約70℃、品温約40℃にコントロールしながら、予め調製しておいたHPCを30g溶解した水溶液を600g噴霧し造粒した、規定量の噴霧が終了した時点で噴霧をやめそのまま乾燥を3分間行なった。その後、整粒機(昭和化学機械製:パワーミル、P−3S、1.5mmφパンチングスクリーン)を用いて粉砕し整粒末(化合物T末1)860gを得た。化合物T末1を810g、L−HPCを80g、ステアリン酸マグネシウムを10gとりタンブル型混合機(昭和化学機械製:タンブラーミキサー、TM−15)にて1分間混合した。混合末をロータリィ打錠機(菊水製作所製:コレクト19K、杵6.5mmφ・平面、打錠圧2.4トン/cm2)を用いて打錠し、7500錠の重量100mg、厚み2.5mm、硬度3kg、崩壊時間2分の錠剤を得た。錠剤の密度は1.21mg/mm3、断面積当りの硬度は0.18kg/mm2であった。
【0036】
参考例1
実施例1の錠剤を打錠圧7トン/cm2で成形し錠剤を製造した。錠剤は厚み2.7mm、硬度は12kgであった。錠剤の密度は1.46mg/mm3、断面積に対する硬度は0.49kg/mm2であった。
参考例2
実施例3で得た混合末を打錠圧1トン/cm2で実施例3と同じ装置で成形したが錠剤の形にはならなかった。
参考例3
実施例3で得た混合末を打錠圧8トン/cm2で実施例3と同じ装置で成形し、得られた錠剤の重量は100mg、厚み2.6mm、硬度7kg、崩壊は10分であった。錠剤の密度は1.51mg/mm3、断面積に対する硬度は0.49kg/mm2であった。
参考例4
実施例2の方法において、ステアリン酸マグネシウムのかわりにタルク4.5gを用いて錠剤を製した。錠剤は、厚み2.8mm、硬度5kgであった。錠剤の密度は1.37mg/mm3、断面積に対する硬度は0.32kg/mm2であった。
【0037】
実験例1
金属セッケンとしてステアリン酸マグネシウムを使用した、実施例1、実施例3、参考例1、参考例3、及びこれらの打錠前の検体をそれぞれガラス瓶にいれ、60℃の条件で2週間保存後、化合物Tの含量を高速クロマトグラフで定量した。保存前の含量に対する残存率を下式で求め、結果を〔表1〕に示す。
残存率(%)=60℃保存後の含量×100/保存前の含量
【表1】
この〔表1〕により、本発明の医薬用錠剤は、化合物Tが安定であるのに比べ、錠剤密度の高い参考例1及び参考例3は含量が著しく低下していることが分かる。さらに打錠前の検体がいずれも安定であることから化合物Tは打錠により安定性が劣化することも分かる。このことから本発明の製剤は打錠による結晶の歪みを生じ経日的な安定性の劣化の加速を防止するというすぐれた性質を有していることが分かる。
【0038】
実験例2
錠剤密度1.36mg/mm3、単位面積当りの硬度0.38kg/mm2の同じ特性である実施例2及び参考例4の検体をそれぞれガラス瓶にいれ、60℃の条件で2及び4週間保存後、実験例1と同じ評価を行い、結果を〔表2〕に示す。
【表2】
この〔表2〕により本発明の医薬用錠剤は化合物Tが安定であるのに比べ、金属セッケンの代わりにタルクを添加した参考例4の検体は含量が著しく低下している。これから金属セッケンの添加による効果が分かる。
【図面の簡単な説明】
【図1】は硬度を求めるための概略図を示す。[0001]
[Industrial application fields]
The present invention relates to a pharmaceutical tablet.
[0002]
[Prior art]
Tablets are a common drug dosage form, but what is important during the tableting process is how to maintain drug stability. However, even if it is a crystalline drug that is stable to temperature, humidity, etc. in the solid state, it is added during granulation or pressure molding in the manufacturing process when it is tableted with a pharmaceutical formulation containing other ingredients. Crystal distortion may occur due to pressure, friction, heat, or the like. For example, benzimidazole-7-carboxylic acid having an anti-AII action or a derivative thereof (for example, EP Publication No. 520423, etc.), which is considered promising as a therapeutic agent for hypertension or the like, alone is in a solid state at a temperature, Although stable against humidity, when tableted with a formulation containing other ingredients, crystal distortion may occur due to pressure, friction, heat, etc. applied during granulation or pressure molding in the manufacturing process. It has been found that the decrease in content over time is accelerated. Conventionally, as a method for stabilizing active ingredients in preparations, increased preparation and extremely low moisture content have been adopted, but this has led to an increase in cost, and a stabilization method that is sufficiently practical in terms of cost. Was long-awaited. It has been demanded that the quality assurance period of the product can be extended by stabilizing the preparation, and the product value can be increased.
[0003]
[Problems to be solved by the invention]
The present invention relates to a compound of formula (I):
[Chemical formula 2]
(Wherein R 1 Represents a hydrocarbon residue which may be bonded through hydrogen or a heteroatom, and R 2 Represents hydrogen or an optionally substituted hydrocarbon residue, R Three Represents a group capable of forming an anion or a group capable of changing to that, X represents that a phenylene group and a phenyl group are bonded directly or via a spacer having an atomic chain of 2 or less, and n represents 1 or 2. , Ring A is COOR 2 A benzene ring optionally having a substituent other than the group represented by formula (1) or a salt thereof, and the density of the uncoated tablet is 1.2 to 1.4 mg / mm Three It is an object of the present invention to provide a pharmaceutical tablet which is adjusted to have a high stability and is excellent in storage stability.
[0004]
[Means for Solving the Problems]
In consideration of such circumstances, the present inventors have tried various general-purpose stabilizing means to stabilize tablets containing the compound represented by the formula (I) or a salt thereof. We could not find any effective stabilizing effect. As a result of various studies, it was surprising that the stability of the compound represented by formula (I) or a salt thereof was improved when the hardness of the tablet or the fracture area was specified. The inventors have found that a stable tablet can be obtained without any problems in production, with the decomposition of the components suppressed, and further studies have been made to complete the present invention.
That is, the present invention
(1) Formula (I):
[Chemical 3]
(Wherein R 1 Represents a hydrocarbon residue which may be bonded through hydrogen or a heteroatom, and R 2 Represents hydrogen or an optionally substituted hydrocarbon residue, R Three Represents a group capable of forming an anion or a group capable of changing to that, X represents that a phenylene group and a phenyl group are bonded directly or via a spacer having an atomic chain of 2 or less, and n represents 1 or 2. , Ring A is COOR 2 The density of the uncoated tablet contains a compound represented by the following formula or a salt thereof (hereinafter sometimes referred to as active ingredient A): 1.2 to 1.4 mg / mm Three A pharmaceutical tablet prepared by adjusting to
(2) The hardness per broken area in the diameter direction of the uncoated tablet is 0.1 to 0.4 kg / mm 2 And the pharmaceutical tablet according to (1) above, and
(3) The present invention relates to the pharmaceutical tablet according to the above (1), comprising a metal soap having 12 to 22 carbon atoms.
[0005]
In the formula (I), R Three As a group capable of forming an anion (a group having a hydrogen atom that can be liberated as a proton) or a group capable of changing to it, it is a 5- to 7-membered group containing one or more of N, S, O ( Preferably a 5- to 6-membered monocyclic optionally substituted heterocyclic residue (preferably a nitrogen-containing heterocyclic residue having a hydrogen atom which can be deprotonated) or a group which can be changed to that in vivo. It is done. For example,
[Formula 4]
[0006]
And the formula R Three The bond between the group represented by the above and the phenyl group to which the group is bonded is not only a carbon-carbon bond as shown above but also a plurality of nitrogen atoms when g = -NH- is shown in the above formula. May be linked via one of For example,
[Chemical formula 5]
[Chemical 6]
> = Z,> = Z ′ and> = Z ″ are each a carbonyl group, a thiocarbonyl group or an optionally oxidized sulfur atom (eg, S, S (O), S (O)). 2 Etc.) (preferably a carbonyl or thiocarbonyl group, more preferably a carbonyl group), m represents an integer of 0, 1 or 2, and R Five Is a hydrogen atom or an optionally substituted lower alkyl group (eg, lower (C, methyl, ethyl, propyl, isopropyl, butyl, sec-butyl, t-butyl, etc. 1-4 ) Alkyl etc.). ]
[0007]
Examples of the heterocyclic residue include 2,5-dihydro-5-oxo-1,2,4-oxadiazole ring residue, 2,5-dihydro-5-thioxo-1,2,4-oxa -NH or -OH group as proton donor such as diazole ring residue or 2,5-dihydro-5-oxo-1,2,4-thiadiazole ring residue and carbonyl group as proton acceptor, thiocarbonyl A group having a group or a sulfinyl group at the same time is preferred. R Three The heterocyclic residue represented by may be bonded to a cyclic substituent to form a condensed ring. Three Is preferably a 5- or 6-membered ring or a 5-membered ring residue. Further, these groups may be protected by an optionally substituted lower alkyl group or acyl group, and biological or physiological conditions (for example, oxidation, reduction or hydrolysis by in vivo enzymes, etc.) Or any other group capable of chemically forming an anion or a group capable of changing to it.
[0008]
R Three As an expression
[Chemical 7]
[Wherein i represents -O- or -S-, j represents> C = O,> C = S or> S (O) m, and m represents 0, 1 or 2]. Groups (among others, 2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl, 2,5-dihydro-5-thioxo-1,2,4-oxadiazole-3 -Yl, 2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) are preferred. R Three The substitution position of may be any of ortho, meta, and para, but the ortho position is preferred.
[0009]
In addition, the heterocyclic residue (R Three ) Has tautomers as shown below. For example,
[Chemical 8]
There are three tautomers of a, b and c such as
[Chemical 9]
The heterocyclic residues represented by include all of a, b and c.
[0010]
X represents that an adjacent phenylene group and a phenyl group are bonded directly or via a spacer having an atomic chain of 2 or less (preferably a direct bond), and the spacer having an atomic chain of 2 or less constitutes a linear portion. Any divalent chain having 1 or 2 atoms may be used, and it may have a side chain. Specifically, lower (C 1-4 ) Alkylene, -CO-, -O-, -S-, -NH-, -CO-NH-, -O-CH 2 -, -S-CH 2 -, -CH = CH- and the like.
n represents an integer of 1 or 2 (preferably 1).
R mentioned above Three , X and n
Embedded image
as
Embedded image
The thing represented by these is preferable.
[0011]
For formula (I), R 1 Examples of the hydrocarbon residue include an alkyl group, an alkenyl group, an alkynyl group, a cycloalkyl group, an aryl group, an aralkyl group, and the like, among which an alkyl group, an alkenyl group, and a cycloalkyl group are preferable. The hydrocarbon residue may be bonded to the benzimidazole ring via a hetero atom.
R 1 The alkyl group as is a lower alkyl group having about 1 to 8 carbon atoms and may be linear or branched. For example, methyl, ethyl, propyl, isopropyl, butyl, isobutyl, sec-butyl, t-butyl, Examples include pentyl, i-pentyl, hexyl, heptyl, octyl and the like.
R 1 As the alkenyl group, a lower alkenyl group having about 2 to 8 carbon atoms may be linear or branched, and examples thereof include vinyl, propenyl, 2-butenyl, 3-butenyl, isobutenyl, 2-octenyl and the like. It is done.
R 1 The alkynyl group as a lower alkynyl group having about 2 to 8 carbon atoms may be either linear or branched, and examples thereof include ethynyl, 2-propynyl, 2-butynyl, 2-pentynyl, 2-octynyl and the like. It is done.
R 1 Examples of the cycloalkyl group include lower cycloalkyl groups having about 3 to 6 carbon atoms, such as cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl and the like.
[0012]
The alkyl group, alkenyl group, alkynyl group or cycloalkyl group described above is a hydroxyl group or an optionally substituted amino group (eg, amino, N-lower (C 1-4 ) Alkylamino, N, N-di-lower (C 1-4 ) Alkylamino), halogen, lower (C 1-4 ) Alkoxy group, lower (C 1-4 ) It may be substituted with alkylthio or the like.
R 1 As the aralkyl group, for example, phenyl-lower (C 1-4 ) Alkyl and R 1 Examples of the aryl group as include phenyl.
The above-mentioned aralkyl group or aryl group is, for example, halogen (eg, F, Cl, Br etc.), nitro, an optionally substituted amino group (eg, amino, N-lower ( C 1-4 ) Alkylamino, N, N-di-lower (C 1-4 ) Alkylamino), lower (C 1-4 ) Alkoxy (eg, methoxy, ethoxy, etc.), lower (C 1-4 ) Alkylthio (eg, methylthio, ethylthio, etc.), lower (C 1-4 ) Alkyl (eg, methyl, ethyl, etc.) may be included.
Among the above, R 1 As an optionally substituted alkyl, alkenyl or cycloalkyl group (eg, hydroxyl, amino, halogen or lower (C 1-4 ) Lower (C) optionally substituted with an alkoxy group 1-5 ) Alkyl, lower (C 2-5 ) Alkenyl or lower (C 3-6 ) A cycloalkyl group and the like.
In addition, the above R 1 Is a heteroatom {eg, oxygen, sulfur (-S (O) m- (m represents 0, 1 or 2)) or nitrogen (-N (R Four )-(Wherein R Four Is hydrogen or lower (C 1-4 ) Represents an alkyl group), etc., among them, an alkyl, alkenyl or cycloalkyl group bonded through a hetero atom (eg, methylamino, ethylamino, propylamino, propenylamino, isopropyl) Amino, allylamino, butylamino, isobutylamino, dimethylamino, methylethylamino, methoxy, ethoxy, propoxy, isopropoxy, propenyloxy, allyloxy, butoxy, isobutoxy, sec-butoxy, t-butoxy, 2-butenyloxy, 3-butenyloxy , Isobutenyloxy, pentoxy, isopentoxy, hexyloxy, methylthio, ethylthio, propylthio, isopropylthio, allylthio, butylthio, isobutylthio, sec-butylthio, t-butylthio, - -butenylthio, 3-butenylthio, Isobuteniruchio, pentylthio, isopentylthio, hexylthio) are preferred, more preferably, lower (C 1-4 ) Alkoxy (eg, methoxy, ethoxy, propoxy, isopropoxy, butoxy, isobutoxy, sec-butoxy, tert-butoxy, etc.).
[0013]
In general formula (I), R 2 Examples of the hydrocarbon residue include an alkyl group, an alkenyl group, an alkynyl group, a cycloalkyl group, and the like, among which an alkyl group and an alkenyl group are preferable.
R 2 The alkyl group as is a lower alkyl group having about 1 to 8 carbon atoms and may be linear or branched. For example, methyl, ethyl, propyl, isopropyl, butyl, isobutyl, sec-butyl, t-butyl, Examples include pentyl, i-pentyl, hexyl, heptyl, octyl and the like.
R 2 As the alkenyl group, a lower alkenyl group having about 2 to 8 carbon atoms may be linear or branched, and examples thereof include vinyl, propenyl, 2-butenyl, 3-butenyl, isobutenyl, 2-octenyl and the like. It is done.
R 2 The alkynyl group as a lower alkynyl group having about 2 to 8 carbon atoms may be either linear or branched, and examples thereof include ethynyl, 2-propynyl, 2-butynyl, 2-pentynyl, 2-octynyl and the like. It is done.
R 2 Examples of the cycloalkyl group include lower cycloalkyl groups having about 3 to 6 carbon atoms, such as cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl and the like.
The above alkyl group, alkenyl group, alkynyl group or cycloalkyl group is an optionally substituted hydroxyl group, an optionally substituted amino group (eg, amino, dimethylamino, diethylamino, piperidino, morpholino, etc.), halogen, Lower (C 1-6 ) Alkoxy group, lower (C 3-6 ) Cycloalkyl, lower (C 1-6 ) It may be substituted with alkylthio or dioxolenyl (eg, 5-methyl-2-oxo-1,3-dioxolen-4-yl).
[0014]
Among the above, R 2 Examples of the hydrocarbon residue optionally having a substituent include, for example, a hydroxyl group, an optionally substituted amino (eg, amino, dimethylamino, diethylamino, piperidino, morpholino, etc.), halogen, lower (C 1-6 ) Alkoxy, lower (C 3-6 ) Cycloalkoxy, lower (C 1-6 ) Alkylthio or optionally substituted dioxolenyl (eg, 5-methyl-2-oxo-1,3-dioxolen-4-yl etc.) 1-6 ) An alkyl group or the formula -CH (R 6 ) -OCOR Five [In the formula, R 6 Is hydrogen, a linear or branched lower alkyl group having 1 to 6 carbon atoms (eg, methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, t-butyl, n-pentyl, isopentyl, neopentyl, etc. ), A straight or branched lower alkenyl group having 2-6 carbon atoms or a cycloalkyl group having 3-8 carbon atoms (eg, cyclopentyl, cyclohexyl, cycloheptyl, etc.), and R Five Is a straight or branched lower alkyl group having 1 to 6 carbon atoms (eg, methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, sec-butyl, t-butyl, n-pentyl, isopentyl, Neopentyl, etc.), a straight chain or branched lower alkenyl group having 2-6 carbon atoms, a cycloalkyl group having 3-8 carbon atoms (eg, cyclopentyl, cyclohexyl, cycloheptyl, etc.) or optionally substituted. A lower alkyl group having 1 to 3 carbon atoms (eg, benzyl, p-chlorobenzyl, phenethyl, cyclopentylmethyl, cyclohexylmethyl, etc.) substituted with an aryl group such as phenyl, cycloalkyl having 3 to 8 carbon atoms or substituted A lower alkenyl group having 2 to 3 carbon atoms which may be substituted with an aryl group such as phenyl (eg, Vinyl having a alkenyl moiety such as propenyl, allyl and isopropenyl), an aryl group such as phenyl which may be substituted (eg, phenyl, p-tolyl, naphthyl, etc.), carbon number 1-6 Linear or branched lower alkoxy groups (eg, methoxy, ethoxy, n-propoxy, isopropoxy, n-butoxy, isobutoxy, sec-butoxy, t-butoxy, n-pentyloxy, isopentyloxy, neopentyl) Oxy), straight chain or branched lower alkenyloxy groups having 2 to 8 carbon atoms (eg, allyloxy, isobutenyloxy, etc.), cycloalkyloxy groups having 3 to 8 carbon atoms (eg, cyclopentyloxy, cyclohexyloxy, cycloheptyl) Oxy), cycloalkyl having 3 to 8 carbon atoms (eg, cyclopentyl, cyclohexyl). A lower alkoxy group having 1 to 3 carbon atoms substituted with an aryl group such as phenyl, which may be substituted (eg, benzyloxy, phenethyloxy, cyclopentylmethoxy, cyclohexylmethoxy and the like, ethoxy, n Substituted with an aryl group such as phenyl having 3 to 8 carbon atoms (eg, cyclopentyl, cyclohexyl, cycloheptyl, etc.) or optionally substituted phenyl. A lower alkenyloxy group having 2-3 carbon atoms (eg, those having an alkenyloxy moiety such as vinyloxy such as cinnamyloxy, propenyloxy, allyloxy, isopropenyloxy, etc.), and optionally substituted aryloxy groups such as phenoxy (eg, phenoxy) , P-nitrophenoxy, naphthoxy, etc.)].
[0015]
Substituent R 2 Examples of are hydrogen, methyl, ethyl, t-butyl, propyl, pivaloyloxymethyl, 1- (cyclohexyloxycarbonyloxy) ethyl, 5-methyl-2-oxo-1,3-dioxolen-4-ylmethyl , Acetoxymethyl, propionyloxymethyl, n-butyryloxymethyl, isobutyryloxymethyl, 1- (ethoxycarbonyloxy) ethyl, 1- (acetoxy) ethyl, 1- (isobutyryloxy) ethyl, cyclohexylcarbonyloxymethyl, benzoyl Examples include oxymethyl, cinnamyl, cyclopentylcarbonyloxymethyl and the like.
R in general formula (I) 2 As hydrogen, hydroxyl, amino, halogen, lower (C 2-6 ) Alkanoyloxy (eg, acetyloxy, pivaloyloxy, etc.), lower (C 4-7 ) Cycloalkanoyloxy, (lower (C 1-6 ) Alkoxy) carbonyloxy (eg, methoxycarbonyloxy, ethoxycarbonyloxy, etc.), (lower (C 3-6 ) Cycloalkoxy) carbonyloxy (eg, cyclohexyloxycarbonyloxy), lower (C 1-6 ) Alkoxy or lower (C 3-6 ) Lower (C) optionally substituted with cycloalkoxy 1-4 ) Alkyl is preferred, more preferably lower (C) substituted with hydrogen or cyclohexyloxycarbonyloxy 1-4 ) Alkyl.
[0016]
In general formula (I), ring A is COOR. 2 In addition to the group represented by the above, it may further have a substituent, for example, halogen (eg, F, Cl, Br etc.), cyano, nitro, lower (C 1-4 ) Alkyl, lower (C 1-4 ) Alkoxy, an optionally substituted amino group (eg, amino, N-lower (C 1-4 ) Alkylamino (eg, methylamino), N, N-di-lower (C 1-4 ) Alkylamino (eg, dimethylamino, etc.), N-arylamino (eg, phenylamino, etc.), alicyclic amino (eg, morpholino, piperidino, piperazino, N-phenylpiperazino, etc.), formula —CO -D '[wherein D' is a hydroxyl group or an alkyl moiety is a hydroxyl group, lower (C 1-4 ) Alkoxy, lower (C 2-6 ) Alkanoyloxy (eg acetoxy, pivaloyloxy, etc.) or lower (C 1-6 ) Alkoxycarbonyloxy (eg, methoxycarbonyloxy, ethoxycarbonyloxy, etc.), lower (C 3-6 ) Lower (C) optionally substituted with cycloalkoxycarbonyloxy (eg, cyclohexyloxycarbonyloxy, etc.) 1-4 ) Represents alkoxy, or a lower group (C 1-4 ) Alkyl or acyl (eg, lower (C 2-5 ) Alkanoyl, optionally substituted benzoyl, etc.) which may be protected by tetrazolyl group, trifluoromethanesulfonic acid amide group, phosphoric acid group or sulfonic acid group, etc., preferably lower (C 1-4 ) Alkyl, halogen, etc. One or two of these substituents may be simultaneously substituted at any cyclic position.
[0017]
Among the compounds represented by the above formula (I),
Embedded image
[Wherein ring A is COOR 2 In addition to the group represented by the formula, a benzene ring optionally having 1 or 2 substituents is shown, and R 1 Is hydrogen or lower (C 1-6 ) Alkoxy (preferably lower (C 1-4 ) Alkoxy) and R 2 Is hydrogen or hydroxyl, amino, halogen, lower (C 2-6 ) Alkanoyloxy (eg, acetyloxy, pivaloyloxy, etc.), lower (C 4-7 ) Cycloalkanoyloxy, (lower (C 1-6 ) Alkoxy) carbonyloxy (eg, methoxycarbonyloxy, ethoxycarbonyloxy, etc.), (lower (C 3-7 ) Cycloalkoxy) carbonyloxy (eg, cyclohexyloxycarbonyloxy) or lower (C 1-4 ) Lower (C) optionally substituted with alkoxy 1-4 ) Represents alkyl and R Three Is optionally substituted lower (C 1-4 ) Alkyl (eg, methyl, triphenylmethyl, methoxymethyl, acetyloxymethyl, methoxycarbonyloxymethyl, ethoxycarbonyloxymethyl, 1- (cyclohexyloxycarbonyloxy) ethyl, pivaloyloxymethyl, etc.) or acyl groups (eg , Lower (C 2-5 ) An alkanoyl, benzoyl, etc.) formula, which may be protected
Embedded image
[Wherein i represents -O- or -S-, j represents> C = O,> C = S or> S (O) m, and m represents 0, 1 or 2]. And n represents 1 or 2 (preferably 1)], and the compound (I ′) or a salt thereof is preferred.
[0018]
In formula (I ′), COOR of ring A 2 Substituents other than those represented by formula (1) include halogen (eg, F, Cl, Br etc.), lower (C 1-4 ) Alkyl, lower (C 1-4 ) Alkoxy, nitro, formula —CO—D ′ wherein D ′ is a hydroxyl group or an alkyl moiety is a hydroxyl group, lower (C 1-4 ) Alkoxy, lower (C 2-6 ) Alkanoyloxy (eg, acetyloxy, pivaloyloxy, etc.) or lower (C 1-6 ) Lower (C) optionally substituted by alkoxycarbonyloxy (eg, methoxycarbonyloxy, ethoxycarbonyloxy, cyclohexyloxycarbonyloxy, etc.) 1-4 ) Represents alkoxy, or lower (C 1-4 ) Amino optionally substituted with alkyl, etc. (preferably lower (C 1-4 And ring A includes the formula COOR 2 A benzene ring having no substituent other than the group represented by is more preferable.
In particular, in the above formula (I), R 1 Represents ethoxy and R 2 Represents hydrogen and ring A represents the formula COOR 2 A benzene ring having no substituent other than the group represented by Three Represents 2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl, n represents 1, and X represents a bond, that is, 2-ethoxy-1-[[[ 2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -1H-benzimidazole-7-carboxylic acid (hereinafter referred to as compound (Sometimes referred to as T) is preferably used.
[0019]
Examples of the compound represented by the formula (I) include those listed in Examples of EP520423.
The compound represented by the formula (I) or a salt thereof is disclosed in, for example, EP520423, or can be produced according to the disclosure of these publications.
In addition, the compound represented by the formula (I) or a salt thereof preferably has a melting point of 120 to 250 ° C, more preferably 150 to 250 ° C, and particularly preferably 180 to 220 ° C.
[0020]
For example, examples of the compound represented by the general formula (I) include the following.
2-Ethoxy-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carvone acid,
Methyl 2-ethoxy-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7- Carboxylate,
Methyl 2-butyl-1-[[2 ′-(2-oxo-3H-1,2,3,5-oxathiadiazol-4-yl) biphenyl] methyl] benzimidazole-7-carboxylate,
Methyl 2-ethoxy-1-[[2 ′-(2-oxo-3H-1,2,3,5-oxathiadiazol-4-yl) biphenyl] methyl] benzimidazole-7-carboxylate,
1- (cyclohexyloxycarbonyloxy) ethyl 2-ethoxy-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl ] Methyl] benzimidazole-7-carboxylate,
2-Butyl-1-[[2 ′-(2,3-dihydro-2-oxo-1,3,4-oxadiazol-5-yl) biphenyl-4-yl] methyl] benzimidazole-7-carvone acid,
Methyl 2-butyl-1-[[2 ′-(2,3-dihydro-2-oxo-1,3,4-oxadiazol-5-yl) biphenyl-4-yl] methyl] benzimidazole-7- Carboxylate,
Acetoxymethyl 1-[[2 '-(4-acetoxymethyl-4,5-dihydro-5-oxo-4H-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl]- 2-ethoxybenzimidazole-7-carboxylate,
Acetoxymethyl 2-ethoxy-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7 -Carboxylates,
1-[[2 ′-(4-Acetoxymethyl-4,5-dihydro-5-oxo-4H-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2- Ethoxybenzimidazole-7-carboxylic acid,
[0021]
1-[[2 ′-(2,5-dihydro-2-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-propylbenzimidazole-7-carvone acid,
Methyl 1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-propylbenzimidazole-7- Carboxylate,
2-Ethyl-1-[[2 '-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carvone acid,
2-Cyclopropyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7- carboxylic acid,
Methyl 2-cyclopropyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7 -Carboxylates,
2-Butyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carvone acid,
1-[[2 ′-(2,5-Dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-propylthiobenzimidazole-7- carboxylic acid,
Methyl 1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-propylthiobenzimidazole-7 -Carboxylates,
1-[[2 ′-(2,5-Dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-methoxybenzimidazole-7-carvone acid,
Methyl 1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-methoxybenzimidazole-7- Carboxylate,
[0022]
1-[[2 ′-(2,5-Dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-propoxybenzimidazole-7-carvone acid,
Methyl 1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-propoxybenzimidazole-7- Carboxylate,
2-ethylthio-1-[[2 '-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carvone acid,
Methyl 2-ethylthio-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7- Carboxylate,
1-[[2 ′-(2,5-Dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-methylthiobenzimidazole-7-carvone acid,
Methyl 1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-methylthiobenzimidazole-7- Carboxylate,
2-Ethoxy-1-[[2 ′-(5-oxide-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylic acid dipotassium salt,
2-ethoxy-1-[[2 ′-(5-oxide-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylic acid disodium salt,
Methyl 2-ethoxy-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylate ,
2-ethoxy-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylic acid,
[0023]
Methyl 2-ethoxy-1-[[2 ′-(2,5-dihydro-5-thioxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7- Carboxylate,
Methyl 2-butyl-1-[[2 ′-(2,5-dihydro-5-thioxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7- Carboxylate,
2-Butyl-1-[[2 ′-(2,5-dihydro-5-thioxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carvone acid,
Methyl 2-butyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylate ,
2-butyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylic acid,
Methyl 2-ethyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylate ,
2-ethyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylic acid,
Methyl 2-ethyl-1-[[2 ′-(2,5-dihydro-5-thioxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7- Carboxylate,
Methyl 1-[[2 ′-(2,5-dihydro-5-thioxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl] methyl] -2-propylbenzimidazole-7- Carboxylate,
Methyl 1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] -2-propylbenzimidazole-7-carboxylate ,
[0024]
1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] -2-methoxybenzimidazole-7-carboxylic acid,
1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] -2-propoxybenzimidazole-7-carboxylic acid,
1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] -2-methylbenzimidazole-7-carboxylic acid,
2-cyclopropyl-1-[[2 ′-(2,5-dihydro-5-oxo-1,2,4-thiadiazol-3-yl) biphenyl-4-yl] methyl] benzimidazole-7-carboxylic acid .
[0025]
Examples of the salt include pharmaceutically acceptable salts. For example, a salt with an inorganic base, a salt with an organic base, a salt with an inorganic acid, a salt with an organic acid, a salt with a basic or acidic amino acid. Etc. Preferable examples of the salt with inorganic base include alkali metal salts such as sodium salt and potassium salt; alkaline earth metal salts such as calcium salt and magnesium salt; and aluminum salt and ammonium salt. Preferable examples of the salt with an organic base include salts with trimethylamine, triethylamine, pyridine, picoline, ethanolamine, diethanolamine, triethanolamine, dicyclohexylamine, N, N′-dibenzylethylenediamine and the like. Preferable examples of the salt with inorganic acid include salts with hydrochloric acid, hydrobromic acid, nitric acid, sulfuric acid, phosphoric acid and the like. Preferable examples of the salt with organic acid include formic acid, acetic acid, trifluoroacetic acid, fumaric acid, oxalic acid, tartaric acid, maleic acid, citric acid, succinic acid, malic acid, methanesulfonic acid, benzenesulfonic acid, p -Salts with toluenesulfonic acid and the like. Preferable examples of salts with basic amino acids include salts with arginine, lysine, ornithine and the like, and preferable examples of salts with acidic amino acids include salts with aspartic acid and glutamic acid, for example. It is done.
[0026]
In addition, as the pharmaceutical tablet in the present invention, a drug other than the compound represented by the above formula (I) or a salt thereof (hereinafter sometimes referred to as active ingredient B) may be added. Although not particularly limited, for example, as central nervous system drugs, diazepam, idebenone, aspirin, ibuprofen, paracetamol, naproxen, piroxicam, diclofenac, indomethacin, sulindac, lorazepam, nitrazepam, phenytoin, acetaminophen, ethenamide, ketoprofen, etc. Systemic drugs include molsidomine, vinpocetine, propranolol, methyldopa, dipyridamole, furosemide, triamterene, nifedipine, atenolol, spironolactone, metoprolol, pindolol, captopril, Isosorbide acid, etc. are respiratory drugs such as amlexanox, dextromethorphan, theophylline, pseudoephedrine, salbutamol, guaifenicin, etc., and gastrointestinal drugs are benzimidazole drugs such as lansoprazole and omeprazole, cimetidine, ranitidine , Pancreatin, bisacodyl, 5-aminosalicylic acid, and the like, and antibiotics and chemotherapeutic agents include cephalexin, cefaclor, cefradine, amoxicillin, pivampicillin, bacampicillin, dicloxacillin, erythromycin, erythromycin stearate, lincomycin, doxycycline, trimethoprim / trimethoprim Sulfamethoxazole and the like are metabolites such as serrapeptase, lysozyme chloride, and adenosine triphosphate. DOO, Gripen Kura bromide, potassium chloride and the like, as a vitamin-based drugs, vitamin B 1 , Vitamin B 2 , Vitamin B 6 Vitamin C, fursultiamine and the like, and antacids and the like.
[0027]
The uncoated tablet in the present invention is i) a pharmaceutical product as it is or after adding an excipient, a binder, a disintegrant or other suitable additive and mixing it uniformly, and granulating it by an appropriate method. Compressed and molded with a lubricant, etc. ii) Is it manufactured by directly compressing a pharmaceutical product as it is or with an excipient, binder, disintegrant, or other suitable additive and mixed evenly? Alternatively, it refers to a state in which a pharmaceutical product is produced as it is by compressing and molding the pre-produced granule as it is or after adding an appropriate additive and mixing it evenly.
The density of the uncoated tablet referred to in the present invention is obtained by dividing the weight of the uncoated tablet by the volume, and the density of the uncoated tablet in the present invention is 1.2 to 1.4 mg / mm. Three , Preferably 1.20 to 1.40 mg / mm Three It is. This density varies depending on the content of the active ingredient and the type and amount of the additive at the time of formulation, but is regulated by the pressure at the time of tableting. In the present invention, 1.0 to 6.5 ton / cm 2 , Preferably 1.0-4.0 tons / cm 2 Tableting is preferred. Density is 1.14mg / mm Three In the following cases, the gap of the uncoated tablet becomes large, and even if it is not formed or formed, the uncoated tablet is damaged in the next step or the like. Meanwhile, 1.45 mg / mm Three In the above case, the uncoated tablet becomes too hard, the disintegration time is delayed, and the dissolution of the active ingredient is inferior.
The pharmaceutical tablet of the present invention is characterized by its density as described above, but it is desirable to prepare it to have a specific range of hardness. The hardness here refers to the hardness per fractured area in the diameter direction of the uncoated tablet, and the area of the surface that breaks the hardness obtained when pressure is applied in the diameter direction of the uncoated tablet as shown in FIG. The hardness per fracture area in the diameter direction of the uncoated tablet in the present invention is 0.1 to 0.4 kg / mm 2 And preferably 0.10-0.40 kg / mm 2 It is. By adjusting to such a hardness range, a tablet with little breakage of the uncoated tablet, a proper disintegration time after taking, and excellent dissolution of the active ingredient can be obtained. Generally, the hardness with respect to the breaking area is linked to the density of the uncoated tablet, but the absolute value varies depending on the tablet composition.
[0028]
Next, the metal soap in the present invention is preferably a metal salt of an aliphatic monocarboxylic acid having 12 to 22 carbon atoms (eg, lauric acid, myristic acid, palmitic acid, stearic acid, etc.), for example, aluminum soap, calcium soap, magnesium. A soap, a zinc soap, etc. are mentioned, It can use as a single-piece | unit or a mixture.
In the pharmaceutical tablet of the present invention, the metal soap is contained in an amount of 0.01 to 10% by weight, preferably 0.05 to 5% by weight, more preferably 0.1 to 2% by weight, per uncoated tablet. Further, when the addition ratio of the metal soap is 10% by weight or more, it is often not preferable because tableting troubles such as capping occur at the time of tableting.
On the other hand, the addition rate of the active ingredient depends on the drug efficacy, tabletability and required tablet size of the active ingredient. In the pharmaceutical tablet of the present invention, when the active ingredient consists of only the active ingredient A, 0.01 to 99.99% by weight, preferably 0.05 to 50% by weight, more preferably 0.1 to 30% by weight, and when active ingredients A and B are contained, 0.01 to 99 per uncoated tablet .98% by weight, preferably 0.5 to 50% by weight.
[0029]
Examples of additives other than the active ingredient include additives generally blended when the composition is produced. Examples include excipients (eg, lactose, corn starch, sucrose, talc, crystalline cellulose, mannitol, Light anhydrous silicic acid, magnesium carbonate, calcium carbonate, L-cysteine, porous substance, etc.), binder (eg, pregelatinized starch, partially pregelatinized starch, methylcellulose, carboxymethylcellulose, polyvinylpyrrolidone, pullulan, dextrin, gum arabic, Hydroxypropyl cellulose (hereinafter sometimes referred to as HPC), hydroxypropylmethylcellulose (hereinafter sometimes referred to as HPMC), etc.], disintegrant [carboxymethylcellulose calcium, starches, croscarmellose, crospovidone, low substitution Hydroxypropylcellulose (hereinafter also referred to as L-HPC), etc.], and further coating agents (eg, HPC, HPMC, ethylcellulose, hydroxymethylcellulose, polyoxyethylene glycol, Tween 80, Pluronic F68, castor oil, cellulose) Acetate phthalate, hydroxypropylmethylcellulose phthalate, hydroxymethylcellulose acetate succinate, acrylic acid copolymer, carboxymethylethylcellulose, polyvinyl acetal diethylaminoacetate, shellac, waxes, etc.), colorant (titanium oxide, bengara, tar dye, etc.), macro Examples include goals, and two or more of these may be used.
[0030]
In the production of the pharmaceutical tablet of the present invention, the method of adding the metal soap to the uncoated tablet may be a normal method without any specific method. For example, a dry method in which the metal soap is directly mixed with the active ingredient and then tableted is effective. The components may be granulated with a solvent such as water and then mixed with other components and a metal soap and then tableted, and the metal soap may be added during granulation. The machines used for granulation are general rolling granulators, stirred granulators, fluidized granulators, centrifugal rolling granulators and rolling fluidized granulators, and pressure granulations such as roller compactors. Ball mills, hammer mills, and rolling compaction type machines such as machines and ordered impacts due to mechanical impact are used. The above-mentioned granulator may be used as the machine used for mixing, and a tumble type or double cone type rolling type is particularly desirable. The machine used for tableting may be either a static pressure type or a dynamic pressure type, and there are stroke type and rotary type tableting machines. Furthermore, the pharmaceutical tablet of the present invention can be coated with a water-soluble, pH-dependent and pH-independent coating agent in the uncoated tablet, and is used for a general sugar coating machine, a breathable coating machine, and a flow. A granulator or the like is used.
The pharmaceutical tablet of the present invention can be safely used as a pharmaceutical for mammals (eg, human, dog, rabbit, rat, mouse, etc.).
The dose for a particular patient should be considered in terms of age, weight, general health, sex, diet, time of administration, excretion rate, drug combination, etc. The active ingredient A has a daily dose of about 0.05 to 500 mg, preferably 0.1 to 100 mg. In addition, the active ingredient B may be determined according to a known usage according to the type of drug.
[0031]
【The invention's effect】
The pharmaceutical tablet of the present invention can be produced at a low cost, the decomposition of the active ingredient is suppressed, and the high content of the active ingredient can be maintained even after the day. Therefore, the formulation can be stabilized and the value of the product can be increased.
[0032]
【Example】
EXAMPLES Next, although an Example, a reference example, and an experiment example are given and this invention is demonstrated further more concretely, this invention is not limited to these.
Example 1
Compound T [2-ethoxy-1-((2 ′-(2,5-dihydro-5-oxo-1,2,4-oxadiazol-3-yl) biphenyl-4-yl) methyl) -1H— 10 g of benzimidazole-7-carboxylic acid] and 0.1 g of magnesium stearate were mixed lightly, and then 250 mg of the mixed powder was 3 tons / automatically (Shimadzu Corporation: AG-5000B) on a plane with a diameter of 9.0 mmφ. cm 2 Tablets were produced with a tableting pressure of The tablet has a thickness of 3.2 mm, a hardness of 8 kg, and a density of 1.23 mg / mm. Three The hardness per cross-sectional area is 0.28kg / mm 2 there were.
[0033]
Example 2
100 g of compound T, 540 g of lactose, 230 g of corn starch, 30 g of HPC, and 200 g of purified water are added to a high-speed stirring granulator (manufactured by POWREC: Vertical Granulator, FM-G25), and 200 g of purified water is added and kneaded for 5 minutes. The kneaded product was dried at 40 ° C. for 10 hours and taken out, and then pulverized with a particle sizer (manufactured by Showa Chemical Machinery Co., Ltd .: Power Mill, P-3S, 1.5 mmφ punching screen). Powder 1) 845 g was obtained. 810 g of Compound T powder 1, 85.5 g of L-HPC and 4.5 g of magnesium stearate were taken and mixed for 1 minute with a tumble type mixer (manufactured by Showa Chemical Machinery Co., Ltd .: tumbler mixer, TM-15). The mixed powder is turned into a rotary tableting machine (manufactured by Kikusui Seisakusho: collect 19K, 杵 6.5 mmφ • 9.0R, tableting pressure 2.9 ton / cm 2 ) To obtain a lens-type uncoated tablet with a weight of 7800 tablets of 100 mg, a thickness of 2.8 mm, a hardness of 5 kg and a disintegration time of 4 minutes (disintegration time was measured by the Japanese Pharmacopoeia (XII) General Test Method) (43) Based on the disintegration test method, the same applies to the following cases). Tablet density is 1.37mg / mm Three The hardness per cross-sectional area is 0.32kg / mm 2 Met. Furthermore, 4000 uncoated tablets are used, an aqueous film solution having the following composition prepared in advance is used, and the drum rotation speed is about 20 rpm and the supply air temperature is about 20 rpm using a breathable coating machine (Freund Corporation: Mini High Coater). Coating was carried out at 70 ° C. and an injection rate of 1.7 g / min until 4 mg of the tablets were coated. The obtained film tablet was a pink lens-type tablet having a weight of 104 mg, a diameter of 6.7 mmφ, a thickness of 2.9 mm, and a disintegration time of 4 minutes.
[Aqueous film solution]
HPMC 29.94g
Macrogol 6000 6.0 g
Titanium oxide 4.0 g
Bengala M 0.06g
380 ml of purified water
[0034]
Example 3
Compound T (5 g) and lactose (100 g) were placed in a plastic bag and mixed by shaking. After mixing, the mixture was sieved with a 48 mesh round sieve. Further, the sieved product was placed in a plastic bag and added with 200 g of lactose. . Re-sieving product 305 g, lactose 2745 g, corn starch 1300 g, and HPC 150 g were obtained, and according to Example 2, 4380 g of sized powder was obtained. 3600 g of the obtained sized powder, 380 g of L-HPC, and 20 g of magnesium stearate were taken, and the mixed powder mixed according to Example 2 was tableted to obtain 36000 tablets. The weight of the obtained tablet was 100 mg, the thickness was 2.8 mm, the hardness was 4 kg, and the disintegration was 2 minutes. Tablet density is 1.37mg / mm Three The hardness against the cross-sectional area is 0.26kg / mm 2 Met. Further, 35,000 tablets were taken, and an aqueous film solution having the following composition prepared in advance was used. The drum rotation speed was about 8 rpm and the air supply temperature was about 75 with a ventilation type coating machine (Powrec Co., Ltd .: Doria Coater-500). The tablets were coated at 4 ° C. at an injection rate of 15 g / min until 4 mg of the tablets were coated. The obtained film tablet was a pink lens-type tablet having a weight of 104 mg, a diameter of 6.7 mmφ, a thickness of 2.9 mm, and a disintegration time of 3 minutes.
[Aqueous film solution]
HPMC 149.7 g
Macrogol 6000 30.0 g
Titanium oxide 20.0 g
Bengala M 0.3 g
Purified water 1900 ml
[0035]
Example 4
10 g of compound T, 590 g of lactose, 260 g of corn starch, and 10 g of magnesium stearate are placed in a fluid granulator (manufactured by POWREC: New Speed Dryer, FD-3S), supply temperature is about 70 ° C., product temperature is about 40 ° C. Then, 600 g of an aqueous solution in which 30 g of HPC previously prepared was dissolved was sprayed and granulated. When the specified amount of spraying was finished, the spraying was stopped and drying was performed for 3 minutes. Thereafter, the mixture was pulverized using a particle sizer (manufactured by Showa Kagaku Kikai Co., Ltd .: Power Mill, P-3S, 1.5 mmφ punching screen) to obtain 860 g of particle size adjusted powder (compound T powder 1). 810 g of compound T powder 1, 80 g of L-HPC and 10 g of magnesium stearate were mixed for 1 minute with a tumble type mixer (manufactured by Showa Chemical Machinery Co., Ltd .: tumbler mixer, TM-15). A rotary tableting machine (mixed by Kikusui Seisakusho: collect 19K, 杵 6.5 mmφ, flat, tableting pressure 2.4 ton / cm 2 ) To obtain 7500 tablets having a weight of 100 mg, a thickness of 2.5 mm, a hardness of 3 kg, and a disintegration time of 2 minutes. Tablet density is 1.21mg / mm Three The hardness per cross-sectional area is 0.18kg / mm 2 Met.
[0036]
Reference example 1
The tablet of Example 1 was compressed into a tableting pressure of 7 tons / cm. 2 To produce tablets. The tablet had a thickness of 2.7 mm and a hardness of 12 kg. Tablet density is 1.46mg / mm Three The hardness against the cross-sectional area is 0.49kg / mm 2 Met.
Reference example 2
The mixed powder obtained in Example 3 was compressed into a tableting pressure of 1 ton / cm. 2 However, it was molded with the same apparatus as in Example 3, but it did not form a tablet.
Reference example 3
The mixed powder obtained in Example 3 was compressed into a tableting pressure of 8 tons / cm. 2 Thus, the obtained tablet was weighed 100 mg, thickness 2.6 mm, hardness 7 kg, and disintegration was 10 minutes. Tablet density is 1.51mg / mm Three The hardness against the cross-sectional area is 0.49kg / mm 2 Met.
Reference example 4
In the method of Example 2, tablets were made using 4.5 g of talc instead of magnesium stearate. The tablet had a thickness of 2.8 mm and a hardness of 5 kg. Tablet density is 1.37mg / mm Three The hardness against the cross-sectional area is 0.32kg / mm 2 Met.
[0037]
Experimental example 1
Using Example 1, Example 3, Reference Example 1, Reference Example 3, and these pre-tablet specimens using magnesium stearate as the metal soap, each was placed in a glass bottle and stored at 60 ° C. for 2 weeks. The content of T was quantified by high speed chromatography. The residual rate with respect to the content before storage is calculated | required by the following Formula, and a result is shown in [Table 1].
Residual rate (%) = content after storage at 60 ° C. × 100 / content before storage
[Table 1]
From this [Table 1], it can be seen that the contents of Reference Example 1 and Reference Example 3 having a high tablet density are significantly reduced in the pharmaceutical tablet of the present invention compared to the case where Compound T is stable. Furthermore, since all the specimens before tableting are stable, it can be seen that the stability of Compound T is deteriorated by tableting. From this, it can be seen that the preparation of the present invention has excellent properties of preventing distortion of crystals due to tableting and accelerating deterioration of stability over time.
[0038]
Experimental example 2
Tablet density 1.36mg / mm Three , Hardness per unit area 0.38kg / mm 2 Samples of Example 2 and Reference Example 4 having the same characteristics were placed in glass bottles, stored at 60 ° C. for 2 and 4 weeks, evaluated in the same manner as in Experimental Example 1, and the results are shown in [Table 2].
[Table 2]
According to this [Table 2], the content of the sample of Reference Example 4 in which talc was added instead of the metal soap was significantly reduced in the pharmaceutical tablet of the present invention, compared to the compound T being stable. The effect by addition of metal soap is understood from this.
[Brief description of the drawings]
FIG. 1 shows a schematic diagram for determining hardness.
Claims (1)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP25170594A JP3784084B2 (en) | 1993-10-21 | 1994-10-18 | Pharmaceutical tablets |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP26383993 | 1993-10-21 | ||
| JP5-263839 | 1993-10-21 | ||
| JP25170594A JP3784084B2 (en) | 1993-10-21 | 1994-10-18 | Pharmaceutical tablets |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006009085A Division JP2006111639A (en) | 1993-10-21 | 2006-01-17 | Medicinal tablet |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH07165580A JPH07165580A (en) | 1995-06-27 |
| JP3784084B2 true JP3784084B2 (en) | 2006-06-07 |
Family
ID=26540322
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP25170594A Expired - Lifetime JP3784084B2 (en) | 1993-10-21 | 1994-10-18 | Pharmaceutical tablets |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3784084B2 (en) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5656290A (en) * | 1993-02-26 | 1997-08-12 | The Procter & Gamble Company | Bisacodyl dosage form with multiple enteric polymer coatings for colonic delivery |
| PT3738585T (en) * | 2004-01-20 | 2023-01-30 | Novartis Ag | Direct compression formulation and process |
| JP6808515B2 (en) * | 2016-02-12 | 2021-01-06 | エルメッド株式会社 | Wet tablets containing azilsartan and their manufacturing methods |
-
1994
- 1994-10-18 JP JP25170594A patent/JP3784084B2/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JPH07165580A (en) | 1995-06-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2701731C2 (en) | Pharmaceutical preparations containing nitro catechine derivatives, and methods for preparing thereof | |
| EP1027037B1 (en) | Pharmaceutical preparation comprising clodronate as active ingredient and silicified microcrystalline cellulose as excipient | |
| US20210315824A1 (en) | Pharmaceutical formulations comprising nitrocatechol derivatives and methods of making the same | |
| JP2022190168A (en) | Pharmaceutical combination comprising glucokinase activator and ppar receptor activator, composition, combination preparation, and preparation methods and uses thereof | |
| AU2007282400B2 (en) | Pharmaceutical composition | |
| TWI415634B (en) | Solid pharmaceutical composition | |
| KR101840182B1 (en) | Pharmaceutical compositions comprising 4-amino-5-fluoro-3-[6-(4-methylpiperazin-1-yl)-1h-benzimidazol-2-yl]-1h-quinolin-2-one lactate monohydrate | |
| KR20010040484A (en) | Celecoxib composition | |
| EP1711168A2 (en) | Oral pharmaceutical compositions of candesartan cilexetil | |
| US20080069879A1 (en) | Stable solid dosage form containing amorphous cefditoren pivoxil and process for preparation thereof | |
| SG189078A1 (en) | Pharmaceutical compositions containing a dgat1 inhibitor | |
| CN110869008B (en) | Pharmaceutical preparation and process for its preparation | |
| WO2002032403A1 (en) | Medicinal compositions quickly disintegrating in the oral cavity and process for producing the same | |
| TW201545745A (en) | Allisartan isoproxil solid dispersion and pharmaceutical composition | |
| JP5635491B2 (en) | Solid pharmaceutical composition | |
| JP3784084B2 (en) | Pharmaceutical tablets | |
| WO2010026597A1 (en) | Oral dosage forms of linezolid and processes for their preparation | |
| EP4025192A1 (en) | Process for producing a tablet comprising glp-1 peptides | |
| RU2483718C2 (en) | Galenic formulations of aliskiren | |
| JP2006111639A (en) | Medicinal tablet | |
| KR100700472B1 (en) | A Pharmaceutical Mixture Comprising a Profen | |
| CN111939135A (en) | Sustained-release tablet of metformin hydrochloride medicament and preparation method thereof | |
| JP2004250443A (en) | Solid preparation | |
| EP3731823A1 (en) | A pharmaceutical formulation for oral administration comprising dabigatran etexilate | |
| WO2024126772A1 (en) | Pharmaceutical composition comprising rupatadine and montelukast |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20050705 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20051122 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060117 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20060117 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20060126 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20060228 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20060314 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090324 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090324 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100324 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100324 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100324 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110324 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110324 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120324 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120324 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130324 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130324 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130324 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130324 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140324 Year of fee payment: 8 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140324 Year of fee payment: 8 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |