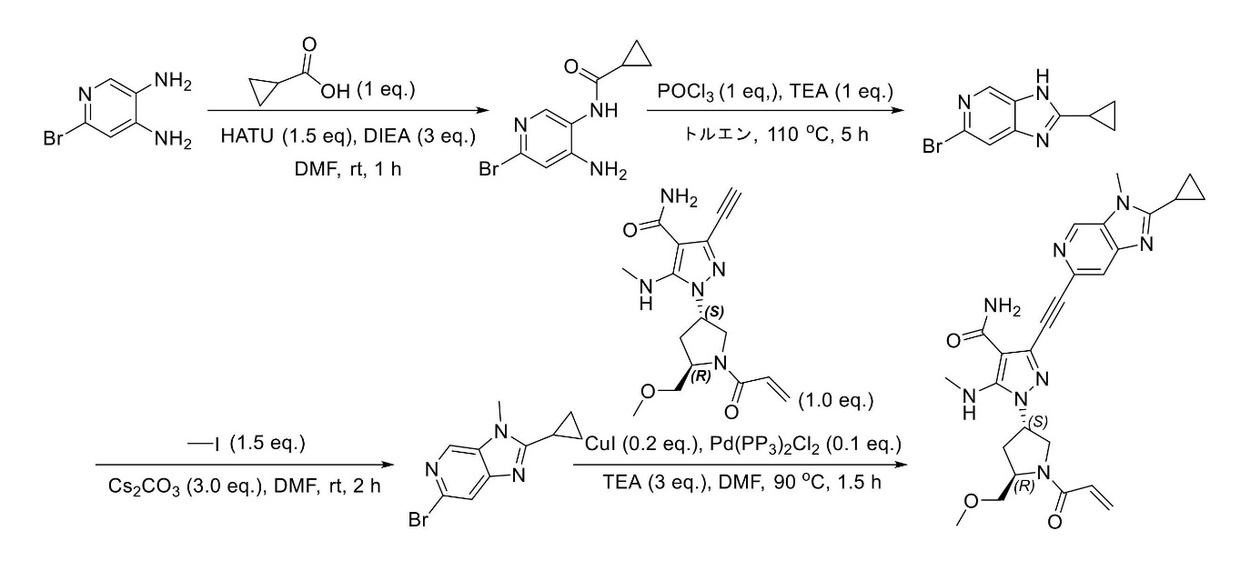
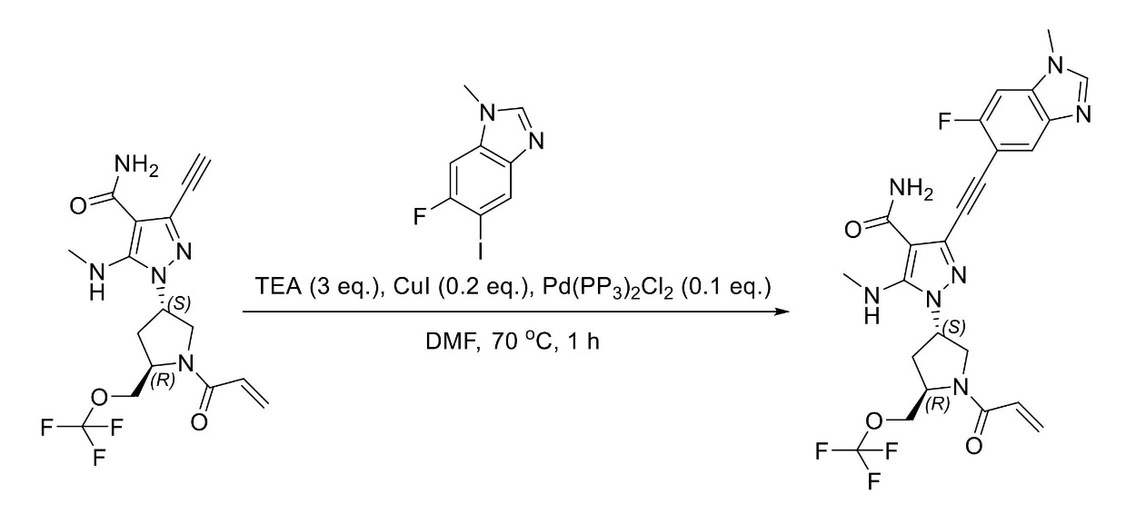
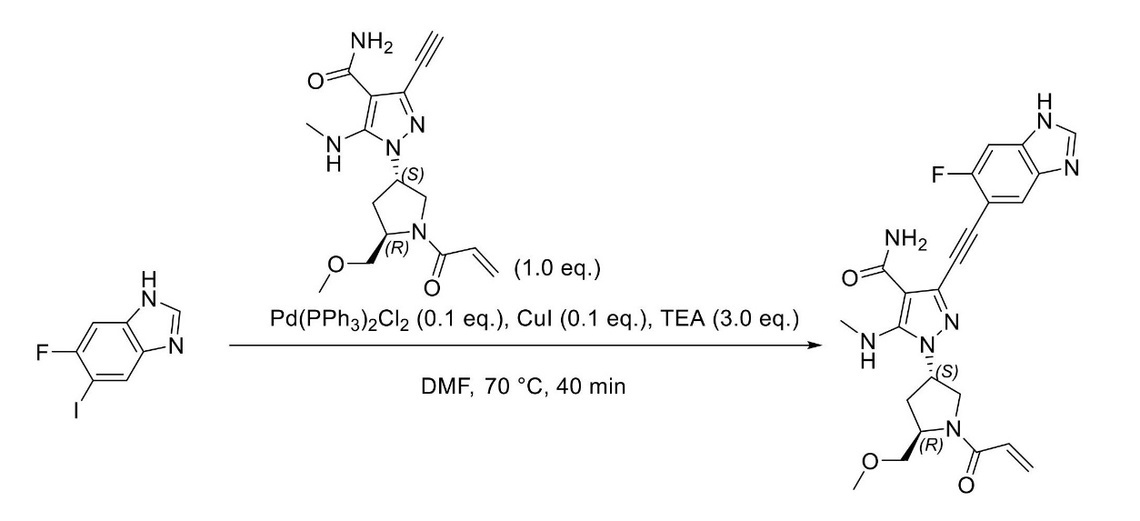
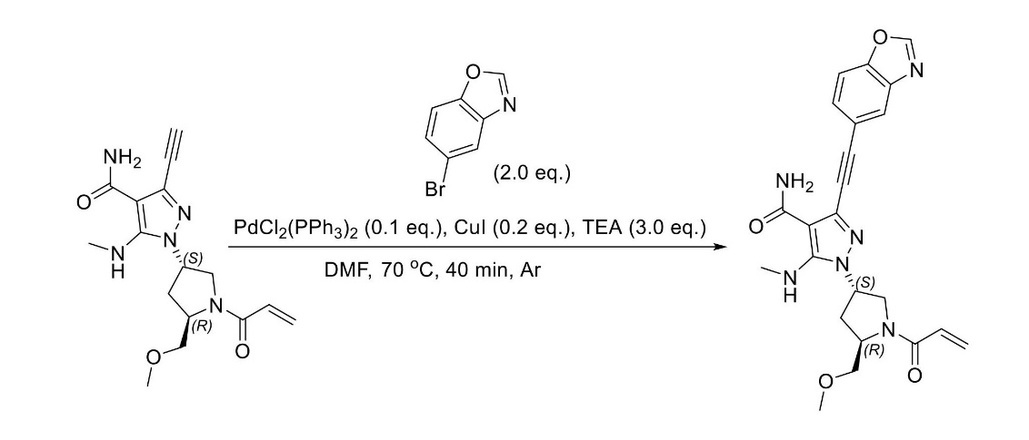
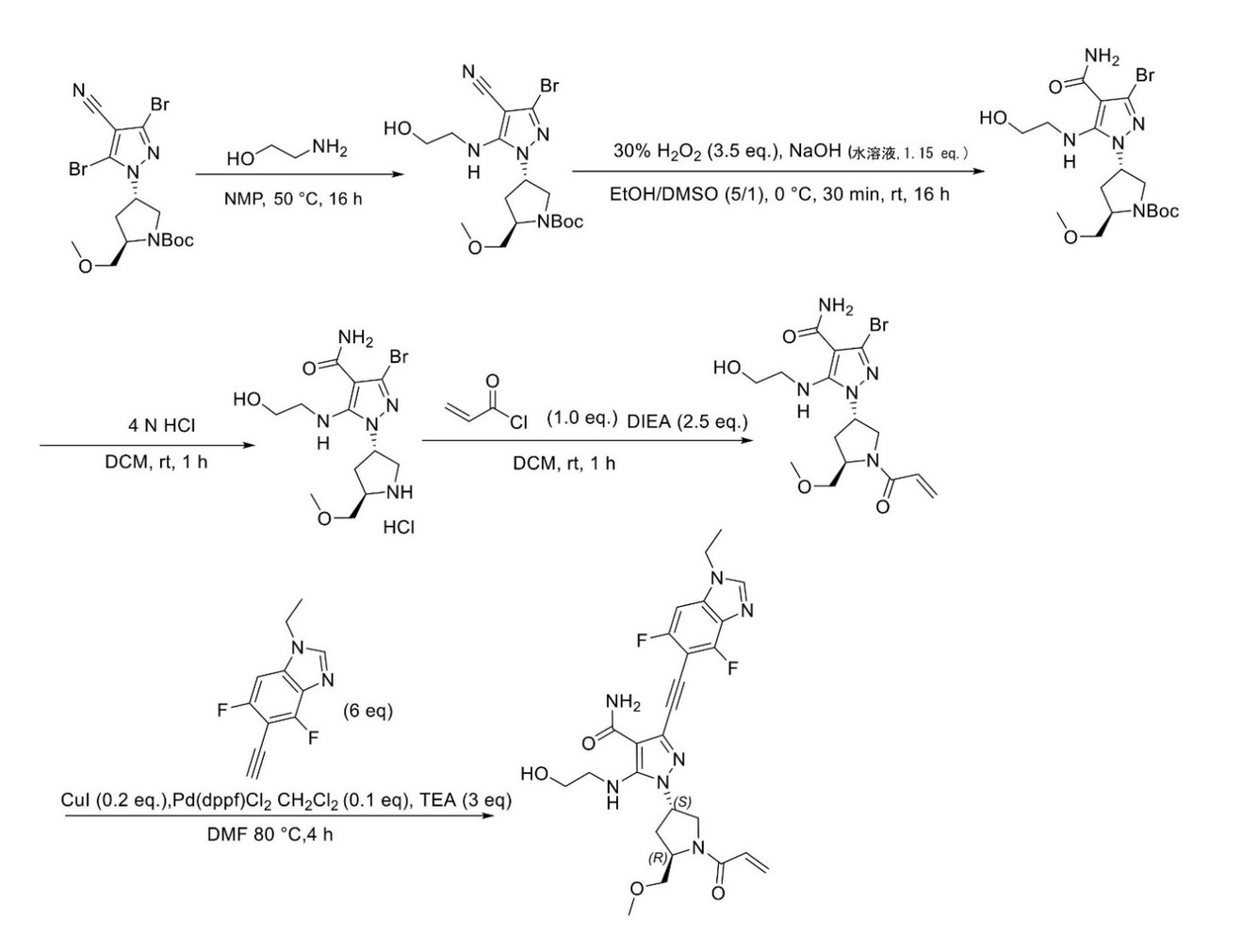
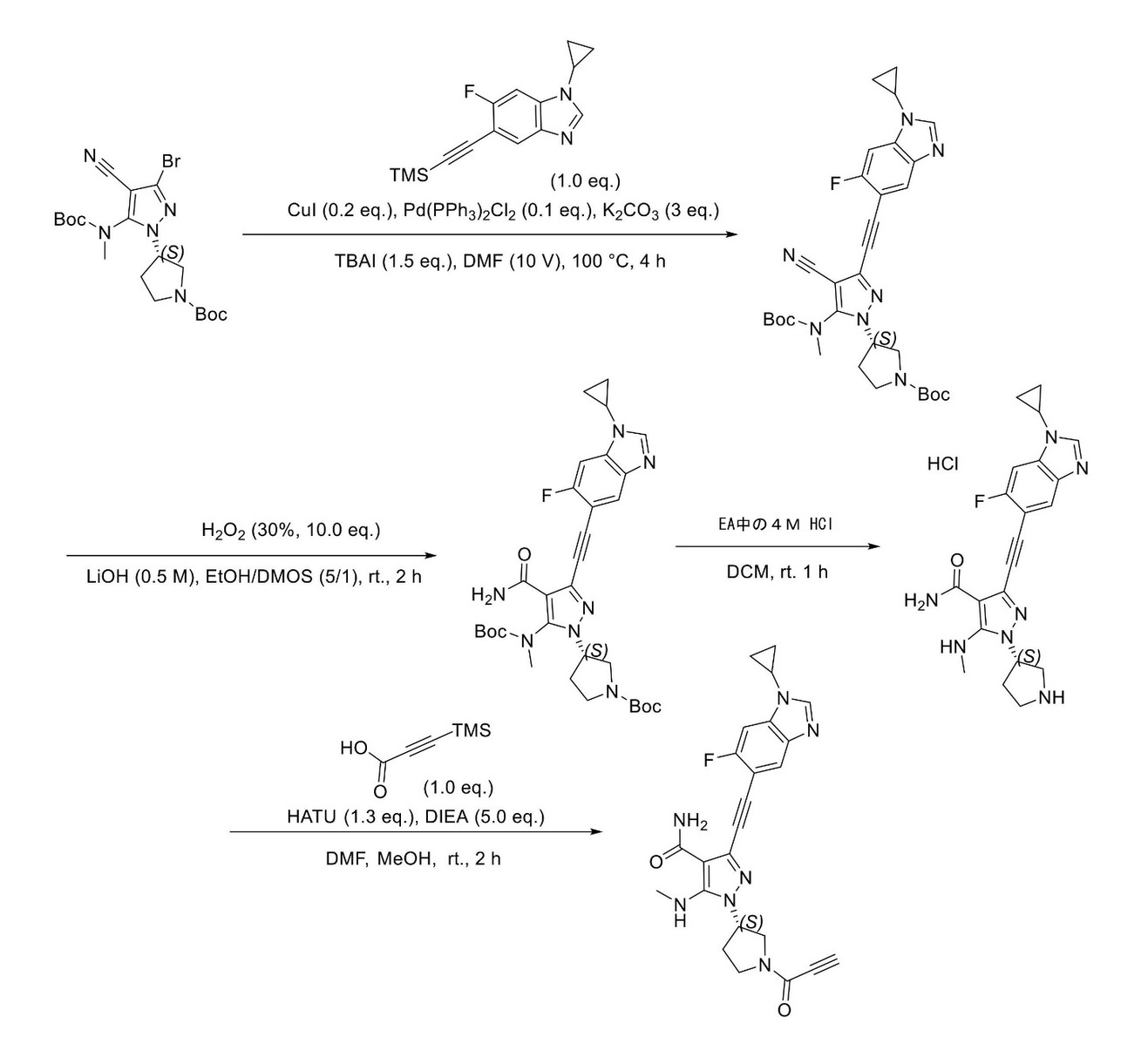
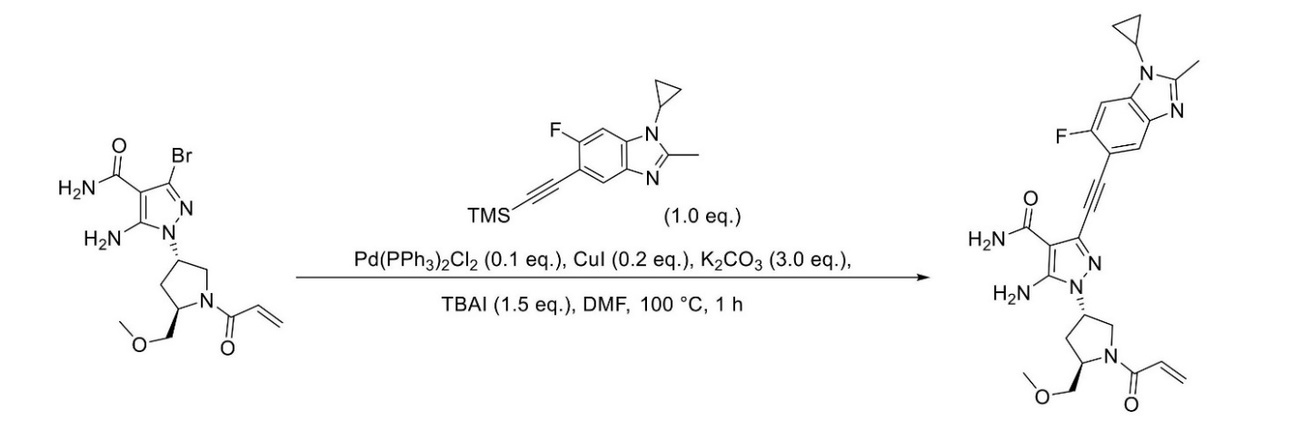
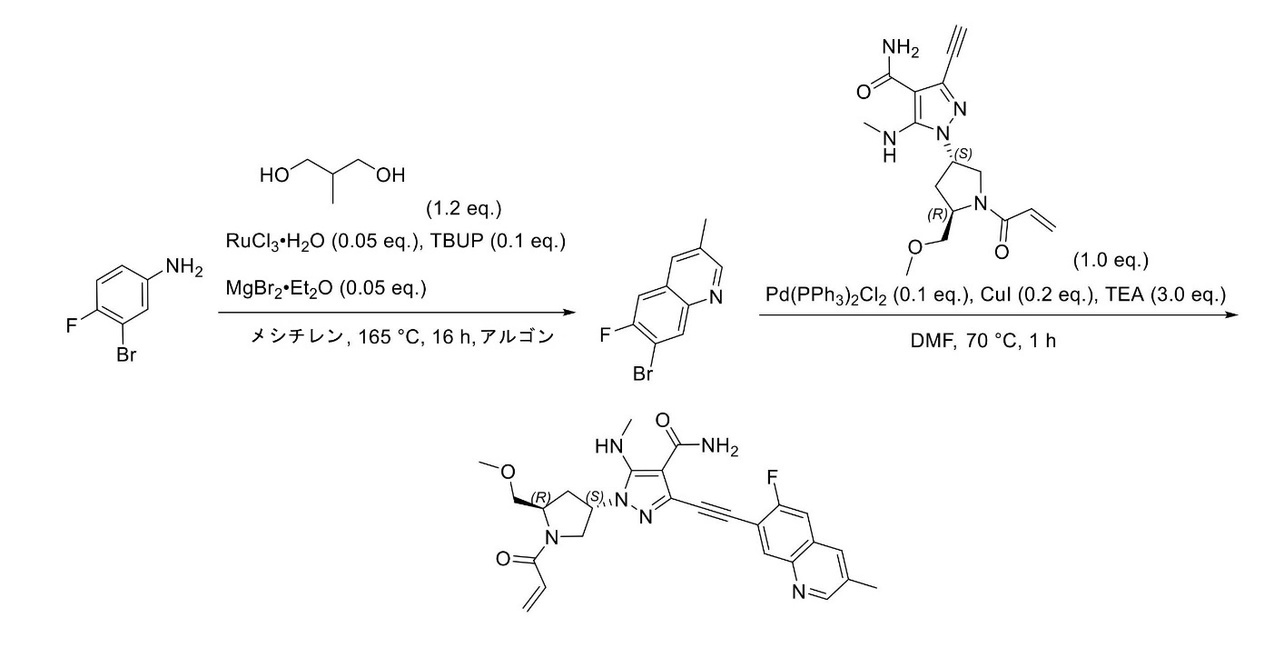
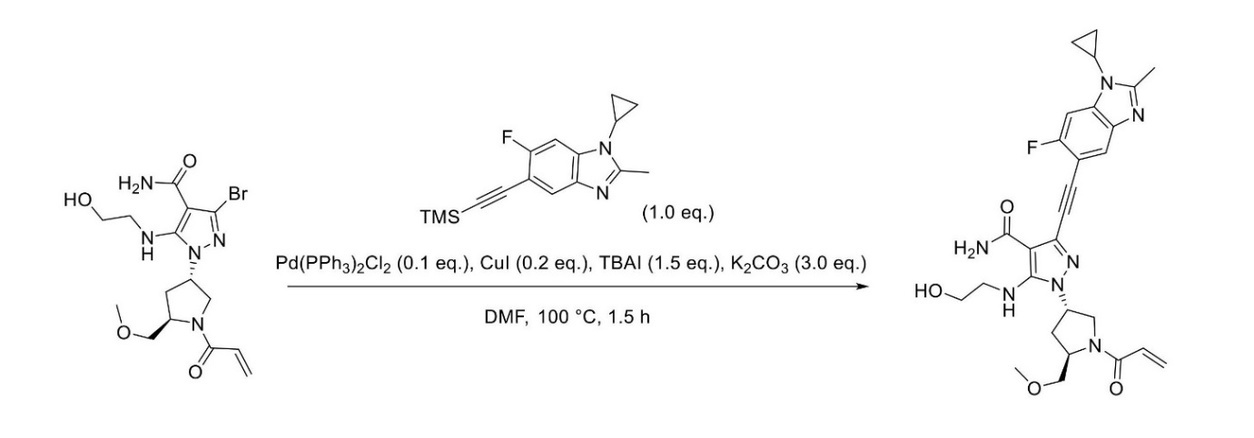
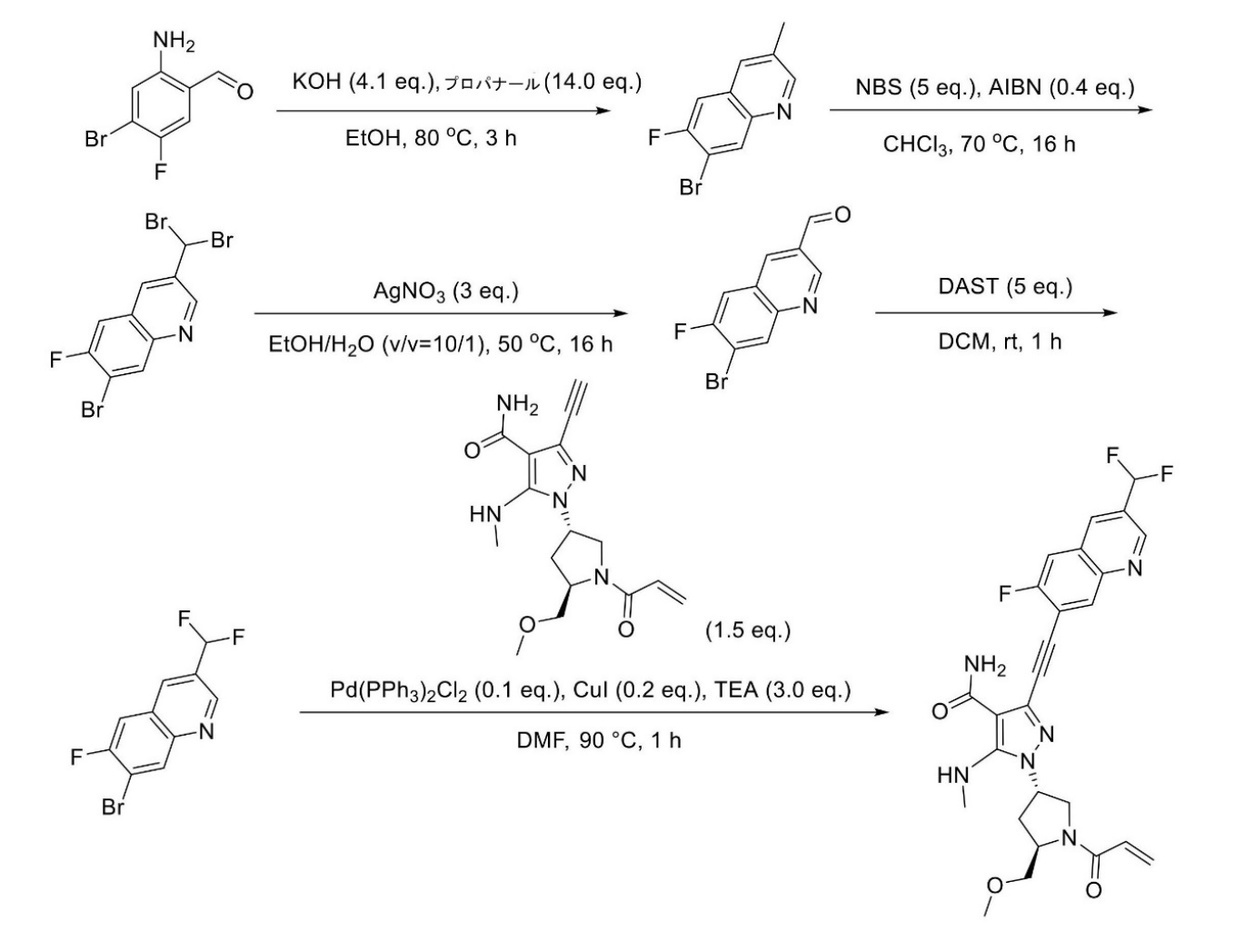
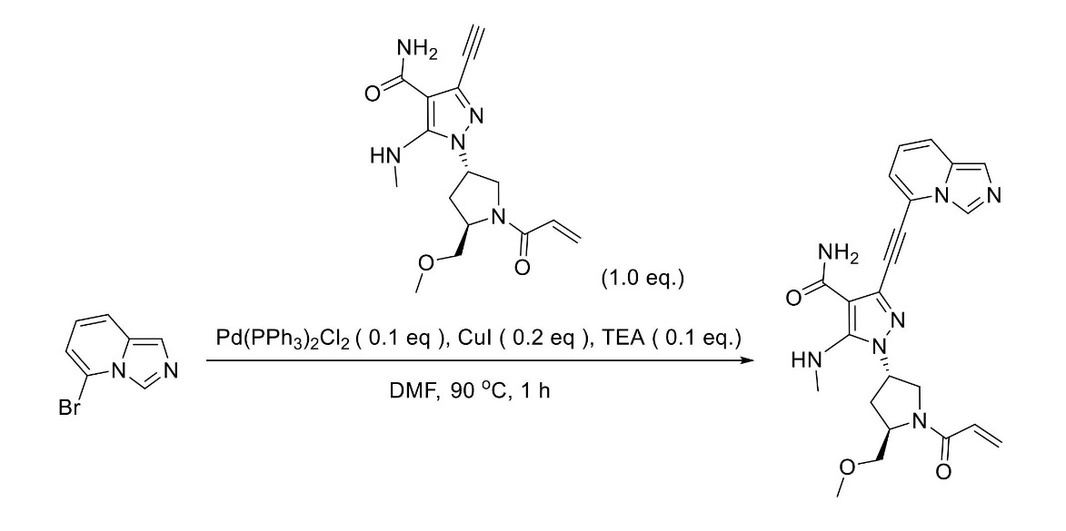
JP2023529867A - 線維芽細胞増殖因子受容体キナーゼの阻害剤 - Google Patents
線維芽細胞増殖因子受容体キナーゼの阻害剤 Download PDFInfo
- Publication number
- JP2023529867A JP2023529867A JP2022574753A JP2022574753A JP2023529867A JP 2023529867 A JP2023529867 A JP 2023529867A JP 2022574753 A JP2022574753 A JP 2022574753A JP 2022574753 A JP2022574753 A JP 2022574753A JP 2023529867 A JP2023529867 A JP 2023529867A
- Authority
- JP
- Japan
- Prior art keywords
- optionally substituted
- mmol
- pharmaceutically acceptable
- solvate
- acceptable salt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 108091008794 FGF receptors Proteins 0.000 title abstract description 49
- 102000044168 Fibroblast Growth Factor Receptor Human genes 0.000 title abstract description 49
- 239000003112 inhibitor Substances 0.000 title abstract description 5
- 150000001875 compounds Chemical class 0.000 claims abstract description 206
- 238000000034 method Methods 0.000 claims abstract description 38
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 22
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 17
- 201000010099 disease Diseases 0.000 claims abstract description 16
- 150000003839 salts Chemical class 0.000 claims description 187
- 239000012453 solvate Substances 0.000 claims description 165
- 229910052736 halogen Chemical group 0.000 claims description 103
- 150000002367 halogens Chemical group 0.000 claims description 102
- 125000000217 alkyl group Chemical group 0.000 claims description 63
- 125000000623 heterocyclic group Chemical group 0.000 claims description 54
- 229910052739 hydrogen Inorganic materials 0.000 claims description 42
- 239000001257 hydrogen Substances 0.000 claims description 42
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 41
- 125000004415 heterocyclylalkyl group Chemical group 0.000 claims description 38
- 125000004452 carbocyclyl group Chemical group 0.000 claims description 37
- 206010028980 Neoplasm Diseases 0.000 claims description 28
- 125000005884 carbocyclylalkyl group Chemical group 0.000 claims description 28
- 201000011510 cancer Diseases 0.000 claims description 22
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 22
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical class C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 claims description 18
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 14
- 125000003342 alkenyl group Chemical group 0.000 claims description 13
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 12
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 12
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 9
- 125000001153 fluoro group Chemical group F* 0.000 claims description 9
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 9
- 125000000547 substituted alkyl group Chemical group 0.000 claims description 9
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 7
- 125000003785 benzimidazolyl group Chemical class N1=C(NC2=C1C=CC=C2)* 0.000 claims description 7
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical class C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 claims description 6
- UBOOKRVGOBKDMM-UHFFFAOYSA-N 3h-imidazo[4,5-c]pyridine Chemical class C1=NC=C2NC=NC2=C1 UBOOKRVGOBKDMM-UHFFFAOYSA-N 0.000 claims description 6
- 241001465754 Metazoa Species 0.000 claims description 6
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 claims description 6
- 125000003277 amino group Chemical group 0.000 claims description 6
- 230000001613 neoplastic effect Effects 0.000 claims description 6
- DVUBDHRTVYLIPA-UHFFFAOYSA-N pyrazolo[1,5-a]pyridine Chemical compound C1=CC=CN2N=CC=C21 DVUBDHRTVYLIPA-UHFFFAOYSA-N 0.000 claims description 6
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 claims description 6
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims description 5
- GAMYYCRTACQSBR-UHFFFAOYSA-N 4-azabenzimidazole Chemical class C1=CC=C2NC=NC2=N1 GAMYYCRTACQSBR-UHFFFAOYSA-N 0.000 claims description 4
- 239000003814 drug Substances 0.000 claims description 4
- 125000006274 (C1-C3)alkoxy group Chemical group 0.000 claims description 3
- 239000012964 benzotriazole Substances 0.000 claims description 3
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- UTCSSFWDNNEEBH-UHFFFAOYSA-N imidazo[1,2-a]pyridine Chemical compound C1=CC=CC2=NC=CN21 UTCSSFWDNNEEBH-UHFFFAOYSA-N 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 238000002156 mixing Methods 0.000 claims description 3
- LDIJKUBTLZTFRG-UHFFFAOYSA-N pyrazolo[1,5-a]pyrimidine Chemical compound N1=CC=CN2N=CC=C21 LDIJKUBTLZTFRG-UHFFFAOYSA-N 0.000 claims description 3
- 125000003354 benzotriazolyl group Chemical class N1N=NC2=C1C=CC=C2* 0.000 claims description 2
- 150000002431 hydrogen Chemical class 0.000 claims 2
- INSWZAQOISIYDT-UHFFFAOYSA-N imidazo[1,2-a]pyrimidine Chemical compound C1=CC=NC2=NC=CN21 INSWZAQOISIYDT-UHFFFAOYSA-N 0.000 claims 1
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 claims 1
- 125000001072 heteroaryl group Chemical group 0.000 abstract description 50
- 238000011282 treatment Methods 0.000 abstract description 8
- 238000010586 diagram Methods 0.000 abstract 1
- 239000000203 mixture Substances 0.000 description 302
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 270
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 255
- 230000002829 reductive effect Effects 0.000 description 242
- 239000000047 product Substances 0.000 description 221
- 239000007787 solid Substances 0.000 description 203
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 200
- 239000011541 reaction mixture Substances 0.000 description 191
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 189
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 187
- -1 1-propyl (n-propyl) Chemical group 0.000 description 158
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 158
- 238000010898 silica gel chromatography Methods 0.000 description 129
- 235000019439 ethyl acetate Nutrition 0.000 description 126
- 239000000706 filtrate Substances 0.000 description 120
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 113
- 239000012044 organic layer Substances 0.000 description 113
- 239000007832 Na2SO4 Substances 0.000 description 108
- 229910052938 sodium sulfate Inorganic materials 0.000 description 108
- 235000011152 sodium sulphate Nutrition 0.000 description 108
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 92
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 88
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 85
- 239000012267 brine Substances 0.000 description 84
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 84
- 229910052786 argon Inorganic materials 0.000 description 79
- 125000004575 3-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 75
- 239000000243 solution Substances 0.000 description 70
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 66
- ZVXKYWHJBYIYNI-UHFFFAOYSA-N 1h-pyrazole-4-carboxamide Chemical compound NC(=O)C=1C=NNC=1 ZVXKYWHJBYIYNI-UHFFFAOYSA-N 0.000 description 65
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 63
- 238000002953 preparative HPLC Methods 0.000 description 57
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 56
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 56
- 239000012258 stirred mixture Substances 0.000 description 52
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 51
- 239000012299 nitrogen atmosphere Substances 0.000 description 51
- 238000005160 1H NMR spectroscopy Methods 0.000 description 50
- 125000004432 carbon atom Chemical group C* 0.000 description 50
- 125000002947 alkylene group Chemical group 0.000 description 49
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 46
- 239000012043 crude product Substances 0.000 description 44
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 42
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 38
- 101100030361 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pph-3 gene Proteins 0.000 description 32
- 230000002441 reversible effect Effects 0.000 description 31
- 238000003818 flash chromatography Methods 0.000 description 30
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 30
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 26
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 25
- 125000004450 alkenylene group Chemical group 0.000 description 25
- 239000000741 silica gel Substances 0.000 description 25
- 229910002027 silica gel Inorganic materials 0.000 description 25
- 125000003118 aryl group Chemical group 0.000 description 24
- 238000005481 NMR spectroscopy Methods 0.000 description 23
- 239000000126 substance Substances 0.000 description 23
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 22
- 229910052757 nitrogen Inorganic materials 0.000 description 22
- UQPUONNXJVWHRM-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 UQPUONNXJVWHRM-UHFFFAOYSA-N 0.000 description 22
- 229920006395 saturated elastomer Polymers 0.000 description 22
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 22
- CWMFRHBXRUITQE-UHFFFAOYSA-N trimethylsilylacetylene Chemical group C[Si](C)(C)C#C CWMFRHBXRUITQE-UHFFFAOYSA-N 0.000 description 22
- 125000003710 aryl alkyl group Chemical group 0.000 description 20
- 125000004419 alkynylene group Chemical group 0.000 description 19
- 239000012065 filter cake Substances 0.000 description 19
- 238000000746 purification Methods 0.000 description 19
- 238000006243 chemical reaction Methods 0.000 description 17
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 17
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 16
- 125000003709 fluoroalkyl group Chemical group 0.000 description 16
- PYOKUURKVVELLB-UHFFFAOYSA-N trimethyl orthoformate Chemical compound COC(OC)OC PYOKUURKVVELLB-UHFFFAOYSA-N 0.000 description 16
- 229910052799 carbon Inorganic materials 0.000 description 15
- 239000012298 atmosphere Substances 0.000 description 13
- 125000001424 substituent group Chemical group 0.000 description 13
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 12
- 241000209094 Oryza Species 0.000 description 12
- 235000007164 Oryza sativa Nutrition 0.000 description 12
- 230000002401 inhibitory effect Effects 0.000 description 12
- 235000009566 rice Nutrition 0.000 description 12
- HDPNBNXLBDFELL-UHFFFAOYSA-N 1,1,1-trimethoxyethane Chemical compound COC(C)(OC)OC HDPNBNXLBDFELL-UHFFFAOYSA-N 0.000 description 11
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 11
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 11
- 239000002253 acid Substances 0.000 description 11
- 239000012300 argon atmosphere Substances 0.000 description 11
- 229910052805 deuterium Inorganic materials 0.000 description 11
- 125000005843 halogen group Chemical group 0.000 description 11
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical compound CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 11
- 150000003254 radicals Chemical group 0.000 description 11
- 238000003786 synthesis reaction Methods 0.000 description 11
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 11
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 10
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 10
- 125000000304 alkynyl group Chemical group 0.000 description 10
- 150000001556 benzimidazoles Chemical class 0.000 description 10
- 125000004122 cyclic group Chemical group 0.000 description 10
- 229940126864 fibroblast growth factor Drugs 0.000 description 10
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 125000001183 hydrocarbyl group Chemical group 0.000 description 9
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 9
- 239000007788 liquid Substances 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 8
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 8
- 125000001841 imino group Chemical group [H]N=* 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 125000004433 nitrogen atom Chemical group N* 0.000 description 8
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 8
- 125000004429 atom Chemical group 0.000 description 7
- 125000004431 deuterium atom Chemical group 0.000 description 7
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 7
- 230000011664 signaling Effects 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 6
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 6
- BKBYCASCRVWMGE-UHFFFAOYSA-N [O-][N+](=O)C1=CC(I)=CC=C1NC1CC1 Chemical compound [O-][N+](=O)C1=CC(I)=CC=C1NC1CC1 BKBYCASCRVWMGE-UHFFFAOYSA-N 0.000 description 6
- 125000004093 cyano group Chemical group *C#N 0.000 description 6
- YMGUBTXCNDTFJI-UHFFFAOYSA-N cyclopropanecarboxylic acid Chemical compound OC(=O)C1CC1 YMGUBTXCNDTFJI-UHFFFAOYSA-N 0.000 description 6
- 238000001914 filtration Methods 0.000 description 6
- 230000004927 fusion Effects 0.000 description 6
- 239000000543 intermediate Substances 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- 235000019198 oils Nutrition 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- FQTICDRQJPLRAV-UHFFFAOYSA-N 2-cyclopropyl-4,6-difluoro-5-iodo-1H-benzimidazole Chemical compound FC(C(I)=C1F)=CC2=C1N=C(C1CC1)N2 FQTICDRQJPLRAV-UHFFFAOYSA-N 0.000 description 5
- ZCVMOJPPOGMQMR-UHFFFAOYSA-N 3-fluoro-4-iodobenzene-1,2-diamine Chemical compound NC1=CC=C(I)C(F)=C1N ZCVMOJPPOGMQMR-UHFFFAOYSA-N 0.000 description 5
- YFTSOOXKFXMERQ-UHFFFAOYSA-N 4,6-difluoro-5-iodo-1h-benzimidazole Chemical compound FC1=C(I)C(F)=CC2=C1N=CN2 YFTSOOXKFXMERQ-UHFFFAOYSA-N 0.000 description 5
- NFBSTZPBRMHTJL-UHFFFAOYSA-N 4-fluoro-5-iodobenzene-1,2-diamine Chemical compound NC1=CC(F)=C(I)C=C1N NFBSTZPBRMHTJL-UHFFFAOYSA-N 0.000 description 5
- 239000007821 HATU Substances 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 150000001721 carbon Chemical group 0.000 description 5
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 5
- 210000004027 cell Anatomy 0.000 description 5
- 125000000524 functional group Chemical group 0.000 description 5
- 125000005842 heteroatom Chemical group 0.000 description 5
- 238000004128 high performance liquid chromatography Methods 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 5
- 125000004430 oxygen atom Chemical group O* 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 238000010189 synthetic method Methods 0.000 description 5
- PTBOCVYHISHBFK-UHFFFAOYSA-N 1-N-cyclopropyl-4-iodobenzene-1,2-diamine Chemical compound NC1=CC(I)=CC=C1NC1CC1 PTBOCVYHISHBFK-UHFFFAOYSA-N 0.000 description 4
- GJCDSJWYTCQGKW-UONOGXRCSA-N 3-[2-[1-(difluoromethyl)-4,6-difluoro-2-methylbenzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1C(F)F GJCDSJWYTCQGKW-UONOGXRCSA-N 0.000 description 4
- FFHKCPLNYWPKDN-WDEREUQCSA-N 3-ethynyl-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#C)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O FFHKCPLNYWPKDN-WDEREUQCSA-N 0.000 description 4
- VWIBZDBZOOWXBC-UHFFFAOYSA-N 4,6-difluoro-5-iodo-2-methyl-1H-benzimidazole Chemical compound CC1=NC(C(F)=C(C(F)=C2)I)=C2N1 VWIBZDBZOOWXBC-UHFFFAOYSA-N 0.000 description 4
- FIHMWZLZKMUGJO-UHFFFAOYSA-N 4-bromo-1-n-ethylbenzene-1,2-diamine Chemical compound CCNC1=CC=C(Br)C=C1N FIHMWZLZKMUGJO-UHFFFAOYSA-N 0.000 description 4
- QSIRWCYJIFPGQD-UHFFFAOYSA-N 4-fluoro-5-iodo-1H-benzimidazole Chemical compound Fc1c(I)ccc2[nH]cnc12 QSIRWCYJIFPGQD-UHFFFAOYSA-N 0.000 description 4
- ISZHUJQSECCADF-UHFFFAOYSA-N 4-fluoro-5-iodo-2-methyl-1H-benzimidazole Chemical compound CC1=NC(C(F)=C(C=C2)I)=C2N1 ISZHUJQSECCADF-UHFFFAOYSA-N 0.000 description 4
- KMJMDIYGNFGEEO-UHFFFAOYSA-N 5-bromo-1-methylbenzimidazole Chemical compound BrC1=CC=C2N(C)C=NC2=C1 KMJMDIYGNFGEEO-UHFFFAOYSA-N 0.000 description 4
- AFTZWPUWLMJHSP-UHFFFAOYSA-N 5-ethynyl-1,2-dimethylbenzimidazole Chemical compound CC1=NC(C=C(C=C2)C#C)=C2N1C AFTZWPUWLMJHSP-UHFFFAOYSA-N 0.000 description 4
- CQQFXPFYQDHXKZ-UHFFFAOYSA-N 5-iodo-1-methylbenzimidazol-2-amine Chemical compound IC1=CC=C2N(C)C(N)=NC2=C1 CQQFXPFYQDHXKZ-UHFFFAOYSA-N 0.000 description 4
- XDKIMNCTRYUCQG-UHFFFAOYSA-N 6-fluoro-5-iodo-2-methyl-1H-benzimidazole Chemical compound IC1=C(F)C=C2NC(C)=NC2=C1 XDKIMNCTRYUCQG-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 150000001412 amines Chemical class 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 4
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 4
- 125000004043 oxo group Chemical group O=* 0.000 description 4
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 4
- 125000003367 polycyclic group Chemical group 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 4
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 4
- 238000001228 spectrum Methods 0.000 description 4
- 125000003107 substituted aryl group Chemical group 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 125000000464 thioxo group Chemical group S=* 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- LHQOBHVJKDJFGZ-UHFFFAOYSA-N 1-(difluoromethyl)-4,6-difluoro-5-iodo-2-methylbenzimidazole Chemical compound CC1=NC(C(F)=C(C(F)=C2)I)=C2N1C(F)F LHQOBHVJKDJFGZ-UHFFFAOYSA-N 0.000 description 3
- WHYIVYBSYCGXOF-UHFFFAOYSA-N 1-(difluoromethyl)-4,6-difluoro-5-iodobenzimidazole Chemical compound FC(N1C(C=C(C(I)=C2F)F)=C2N=C1)F WHYIVYBSYCGXOF-UHFFFAOYSA-N 0.000 description 3
- BJGQZKMRJUFYIP-UHFFFAOYSA-N 1-(difluoromethyl)-5-ethynyl-4,6-difluoro-2-methylbenzimidazole Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#C)=C2N1C(F)F BJGQZKMRJUFYIP-UHFFFAOYSA-N 0.000 description 3
- OUOZAOYTHFIENW-UHFFFAOYSA-N 1-N-tert-butyl-4-iodobenzene-1,2-diamine Chemical compound CC(C)(C)NC1=CC=C(I)C=C1N OUOZAOYTHFIENW-UHFFFAOYSA-N 0.000 description 3
- AJQGJOSWZUAVFV-DLBZAZTESA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-(1-methylbenzimidazol-5-yl)ethynyl]pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2N(C)C=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O AJQGJOSWZUAVFV-DLBZAZTESA-N 0.000 description 3
- UDHDFPLTBQYURI-JKSUJKDBSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-(3-methylimidazo[4,5-b]pyridin-6-yl)ethynyl]pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CN=C3N(C)C=NC3=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O UDHDFPLTBQYURI-JKSUJKDBSA-N 0.000 description 3
- PYHWCFBULRKVNT-UHFFFAOYSA-N 1-cyclopropyl-5-ethynyl-2-methylbenzimidazole Chemical compound CC1=NC(C=C(C=C2)C#C)=C2N1C1CC1 PYHWCFBULRKVNT-UHFFFAOYSA-N 0.000 description 3
- BNSAOMQZMVGUGT-UHFFFAOYSA-N 1-cyclopropyl-5-ethynylbenzimidazole Chemical compound C#CC(C=C1)=CC2=C1N(C1CC1)C=N2 BNSAOMQZMVGUGT-UHFFFAOYSA-N 0.000 description 3
- JUKYERZFANBZFZ-UHFFFAOYSA-N 1-cyclopropyl-5-iodo-2-(trifluoromethyl)benzimidazole Chemical compound FC(C1=NC(C=C(C=C2)I)=C2N1C1CC1)(F)F JUKYERZFANBZFZ-UHFFFAOYSA-N 0.000 description 3
- XRXRDBCLTORYPS-UHFFFAOYSA-N 1-cyclopropyl-5-iodo-2-methylbenzimidazole Chemical compound CC1=NC(C=C(C=C2)I)=C2N1C1CC1 XRXRDBCLTORYPS-UHFFFAOYSA-N 0.000 description 3
- XSSYYKRUTYUWSM-UHFFFAOYSA-N 1-cyclopropyl-5-iodobenzimidazole Chemical compound IC(C=C1)=CC2=C1N(C1CC1)C=N2 XSSYYKRUTYUWSM-UHFFFAOYSA-N 0.000 description 3
- CZBSLUZOPUGTRC-UHFFFAOYSA-N 1-ethyl-4,6-difluoro-5-iodo-2-methylbenzimidazole Chemical compound CCN1C(C=C(C(I)=C2F)F)=C2N=C1C CZBSLUZOPUGTRC-UHFFFAOYSA-N 0.000 description 3
- KHFNKINXOJNPQG-UHFFFAOYSA-N 1-ethyl-4,6-difluoro-5-iodobenzimidazole Chemical compound CCN1C(C=C(C(I)=C2F)F)=C2N=C1 KHFNKINXOJNPQG-UHFFFAOYSA-N 0.000 description 3
- FIQOVNBRHOCUNW-UHFFFAOYSA-N 1-ethyl-5-ethynyl-2-(trifluoromethyl)benzimidazole Chemical compound CCN1C(C=CC(C#C)=C2)=C2N=C1C(F)(F)F FIQOVNBRHOCUNW-UHFFFAOYSA-N 0.000 description 3
- MFVYQOBFPDOBOK-UHFFFAOYSA-N 1-ethyl-5-ethynyl-2-methylbenzimidazole Chemical compound CCN1C(C=CC(C#C)=C2)=C2N=C1C MFVYQOBFPDOBOK-UHFFFAOYSA-N 0.000 description 3
- QEFQBHYXMRSNBO-UHFFFAOYSA-N 1-ethyl-5-ethynyl-2-methylimidazo[4,5-b]pyridine Chemical compound CCN1C2=CC=C(C#C)N=C2N=C1C QEFQBHYXMRSNBO-UHFFFAOYSA-N 0.000 description 3
- JHWBFNDPZOETSI-UHFFFAOYSA-N 1-ethyl-5-ethynyl-4,6-difluoro-2-methylbenzimidazole Chemical compound CCN1C(C=C(C(C#C)=C2F)F)=C2N=C1C JHWBFNDPZOETSI-UHFFFAOYSA-N 0.000 description 3
- FAVGPICDROUJDM-UHFFFAOYSA-N 1-ethyl-5-ethynyl-4,6-difluorobenzimidazole Chemical compound CCN1C(C=C(C(C#C)=C2F)F)=C2N=C1 FAVGPICDROUJDM-UHFFFAOYSA-N 0.000 description 3
- UHAQRWDBQQRJDV-UHFFFAOYSA-N 1-ethyl-5-ethynyl-4-fluoro-2-methylbenzimidazole Chemical compound CCN1C(C=CC(C#C)=C2F)=C2N=C1C UHAQRWDBQQRJDV-UHFFFAOYSA-N 0.000 description 3
- IRCDIMCSTKBWTO-UHFFFAOYSA-N 1-ethyl-5-ethynylbenzimidazole Chemical compound CCN1C=NC2=C1C=CC(=C2)C#C IRCDIMCSTKBWTO-UHFFFAOYSA-N 0.000 description 3
- GKSWAVZCJHXSDC-UHFFFAOYSA-N 1-ethyl-5-iodo-2-(trifluoromethyl)benzimidazole Chemical compound CCN1C(C=CC(I)=C2)=C2N=C1C(F)(F)F GKSWAVZCJHXSDC-UHFFFAOYSA-N 0.000 description 3
- CVHUGJHBODWCNL-UHFFFAOYSA-N 1-ethyl-6-fluoro-5-iodo-2-methylbenzimidazole Chemical compound CCN1C(C=C(C(I)=C2)F)=C2N=C1C CVHUGJHBODWCNL-UHFFFAOYSA-N 0.000 description 3
- YRUSOSBPLDLXGB-UHFFFAOYSA-N 1-ethyl-6-fluoro-5-iodobenzimidazole Chemical compound CCN1C(C=C(C(I)=C2)F)=C2N=C1 YRUSOSBPLDLXGB-UHFFFAOYSA-N 0.000 description 3
- AGUFDDPONLRRKI-UHFFFAOYSA-N 1-ethyl-7-fluoro-6-iodobenzimidazole Chemical compound CCN1C(C(F)=C(C=C2)I)=C2N=C1 AGUFDDPONLRRKI-UHFFFAOYSA-N 0.000 description 3
- KUJTZQXHTBKAMO-UHFFFAOYSA-N 1-fluoro-4-iodo-2-nitrobenzene Chemical compound [O-][N+](=O)C1=CC(I)=CC=C1F KUJTZQXHTBKAMO-UHFFFAOYSA-N 0.000 description 3
- RKWDASSYVKEXAV-UHFFFAOYSA-N 1-tert-butyl-5-iodobenzimidazole Chemical compound CC(C)(C)N1C(C=CC(I)=C2)=C2N=C1 RKWDASSYVKEXAV-UHFFFAOYSA-N 0.000 description 3
- HEEHBSXUMPRCPN-UHFFFAOYSA-N 2-(1,2-benzoxazol-6-yl)ethynyl-trimethylsilane Chemical compound C[Si](C)(C)C#CC1=CC(ON=C2)=C2C=C1 HEEHBSXUMPRCPN-UHFFFAOYSA-N 0.000 description 3
- NYXFPFZYDJEWKW-UHFFFAOYSA-N 2-(1,2-dimethylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CC1=NC(C=C(C=C2)C#C[Si](C)(C)C)=C2N1C NYXFPFZYDJEWKW-UHFFFAOYSA-N 0.000 description 3
- HLJGQNOOTMJCLZ-UHFFFAOYSA-N 2-(1-cyclopropyl-2-methylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CC1=NC(C=C(C=C2)C#C[Si](C)(C)C)=C2N1C1CC1 HLJGQNOOTMJCLZ-UHFFFAOYSA-N 0.000 description 3
- JVODJEFNKSZMMB-UHFFFAOYSA-N 2-(1-cyclopropylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound C[Si](C)(C)C#CC(C=C1)=CC2=C1N(C1CC1)C=N2 JVODJEFNKSZMMB-UHFFFAOYSA-N 0.000 description 3
- YVDJOLZDYKUYRP-UHFFFAOYSA-N 2-(1-ethyl-2-methylimidazo[4,5-b]pyridin-5-yl)ethynyl-trimethylsilane Chemical compound CCN1C2=CC=C(C#C[Si](C)(C)C)N=C2N=C1C YVDJOLZDYKUYRP-UHFFFAOYSA-N 0.000 description 3
- WVWIIUDPFTUVAV-UHFFFAOYSA-N 2-(1-ethyl-4,6-difluoro-2-methylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CCN1C(C=C(C(C#C[Si](C)(C)C)=C2F)F)=C2N=C1C WVWIIUDPFTUVAV-UHFFFAOYSA-N 0.000 description 3
- FXPHGTAEXAZSAO-UHFFFAOYSA-N 2-(1-ethyl-4,6-difluorobenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CCN1C(C=C(C(C#C[Si](C)(C)C)=C2F)F)=C2N=C1 FXPHGTAEXAZSAO-UHFFFAOYSA-N 0.000 description 3
- OSTIQPSPCCJDEL-UHFFFAOYSA-N 2-(1-ethyl-4-fluoro-2-methylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CCN1C(C=CC(C#C[Si](C)(C)C)=C2F)=C2N=C1C OSTIQPSPCCJDEL-UHFFFAOYSA-N 0.000 description 3
- GDPZMUXYLGKYHI-UHFFFAOYSA-N 2-(2-cyclopropyl-1-ethylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CCN1C(C=CC(C#C[Si](C)(C)C)=C2)=C2N=C1C1CC1 GDPZMUXYLGKYHI-UHFFFAOYSA-N 0.000 description 3
- RTUBXGAQRDOBGG-UHFFFAOYSA-N 2-(2-cyclopropyl-3H-benzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound C[Si](C)(C)C#CC(C=C1)=CC2=C1NC(C1CC1)=N2 RTUBXGAQRDOBGG-UHFFFAOYSA-N 0.000 description 3
- FGLFXFKDXSDEGS-UHFFFAOYSA-N 2-(3-ethyl-2-methylimidazo[4,5-b]pyridin-6-yl)ethynyl-trimethylsilane Chemical compound CCN(C(C)=NC1=C2)C1=NC=C2C#C[Si](C)(C)C FGLFXFKDXSDEGS-UHFFFAOYSA-N 0.000 description 3
- UNOCGRZQQZSTQC-UHFFFAOYSA-N 2-(4,6-difluoro-2-methyl-1H-benzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#C[Si](C)(C)C)=C2N1 UNOCGRZQQZSTQC-UHFFFAOYSA-N 0.000 description 3
- AXZSEEVBOKNPQQ-UHFFFAOYSA-N 2-[1-(difluoromethyl)-4,6-difluoro-2-methylbenzimidazol-5-yl]ethynyl-trimethylsilane Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#C[Si](C)(C)C)=C2N1C(F)F AXZSEEVBOKNPQQ-UHFFFAOYSA-N 0.000 description 3
- UBHOWUBSPHXTEB-UHFFFAOYSA-N 2-[3-ethyl-2-(trifluoromethyl)-3H-indol-6-yl]ethynyl-trimethylsilane Chemical compound CCC(C(C(F)(F)F)=NC1=C2)C1=CC=C2C#C[Si](C)(C)C UBHOWUBSPHXTEB-UHFFFAOYSA-N 0.000 description 3
- KADZKDCFYWMZEL-UHFFFAOYSA-N 2-[4,6-difluoro-2-(trifluoromethyl)-1H-benzimidazol-5-yl]ethynyl-trimethylsilane Chemical compound C[Si](C)(C)C#CC(C(F)=CC1=C2N=C(C(F)(F)F)N1)=C2F KADZKDCFYWMZEL-UHFFFAOYSA-N 0.000 description 3
- BYPAYWYHMSWDKT-UHFFFAOYSA-N 2-cyclopropyl-1-ethyl-4,6-difluoro-5-iodobenzimidazole Chemical compound CCN1C(C=C(C(I)=C2F)F)=C2N=C1C1CC1 BYPAYWYHMSWDKT-UHFFFAOYSA-N 0.000 description 3
- XCXOSUJVFWMAHU-UHFFFAOYSA-N 2-cyclopropyl-1-ethyl-5-ethynylbenzimidazole Chemical compound CCN1C(C=CC(C#C)=C2)=C2N=C1C1CC1 XCXOSUJVFWMAHU-UHFFFAOYSA-N 0.000 description 3
- DBPVOEKJNBWQLP-UHFFFAOYSA-N 2-cyclopropyl-1-ethyl-5-iodobenzimidazole Chemical compound CCN1C(C=CC(I)=C2)=C2N=C1C1CC1 DBPVOEKJNBWQLP-UHFFFAOYSA-N 0.000 description 3
- VLPAICBYWHBMJR-UHFFFAOYSA-N 2-cyclopropyl-4,6-difluoro-5-iodo-1-methylbenzimidazole Chemical compound CN1C(C=C(C(I)=C2F)F)=C2N=C1C1CC1 VLPAICBYWHBMJR-UHFFFAOYSA-N 0.000 description 3
- OOCUDGYJYUXURO-UHFFFAOYSA-N 2-cyclopropyl-4-fluoro-5-iodo-1-methylbenzimidazole Chemical compound CN1C(C=CC(I)=C2F)=C2N=C1C1CC1 OOCUDGYJYUXURO-UHFFFAOYSA-N 0.000 description 3
- DLADLZNCYVVGBR-UHFFFAOYSA-N 2-cyclopropyl-4-fluoro-5-iodo-1H-benzimidazole Chemical compound FC(C1=C(C=C2)NC(C3CC3)=N1)=C2I DLADLZNCYVVGBR-UHFFFAOYSA-N 0.000 description 3
- NOHJRUQLTNDURF-UHFFFAOYSA-N 2-cyclopropyl-6-fluoro-5-iodo-1-methylbenzimidazole Chemical compound CN1C(C=C(C(I)=C2)F)=C2N=C1C1CC1 NOHJRUQLTNDURF-UHFFFAOYSA-N 0.000 description 3
- XDRFDUOFTVLETQ-UHFFFAOYSA-N 2-cyclopropyl-6-fluoro-5-iodo-1H-benzimidazole Chemical compound FC(C(I)=C1)=CC2=C1N=C(C1CC1)N2 XDRFDUOFTVLETQ-UHFFFAOYSA-N 0.000 description 3
- WOJFRTYJCYZFJL-UHFFFAOYSA-N 3,5-difluoro-4-iodobenzene-1,2-diamine Chemical compound Nc1cc(F)c(I)c(F)c1N WOJFRTYJCYZFJL-UHFFFAOYSA-N 0.000 description 3
- RZNAXYUGUXXPAV-JKSUJKDBSA-N 3-(2-imidazo[1,2-b]pyridazin-7-ylethynyl)-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC3=NC=CN3N=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O RZNAXYUGUXXPAV-JKSUJKDBSA-N 0.000 description 3
- HMYDGZFDJAIONB-UHFFFAOYSA-N 3-(ethylamino)-4-nitrobenzonitrile Chemical compound CCNC1=CC(C#N)=CC=C1[N+]([O-])=O HMYDGZFDJAIONB-UHFFFAOYSA-N 0.000 description 3
- WIQBEPAALNQBFG-VQTJNVASSA-N 3-[2-(1-cyclopropyl-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C=C(C=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1C1CC1 WIQBEPAALNQBFG-VQTJNVASSA-N 0.000 description 3
- LUVDROWXOHAZLX-ZWKOTPCHSA-N 3-[2-(1-ethyl-2-methylimidazo[4,5-b]pyridin-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C2=CC=C(C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)N=C2N=C1C LUVDROWXOHAZLX-ZWKOTPCHSA-N 0.000 description 3
- BXINGPJVMSNYIJ-JKSUJKDBSA-N 3-[2-(1-ethyl-4,6-difluoro-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=C(C(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2F)F)=C2N=C1C BXINGPJVMSNYIJ-JKSUJKDBSA-N 0.000 description 3
- CKIQALRXIOELNJ-LSDHHAIUSA-N 3-[2-(1-ethyl-4,6-difluorobenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=C(C(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2F)F)=C2N=C1 CKIQALRXIOELNJ-LSDHHAIUSA-N 0.000 description 3
- YWAHMZYHQKXLOX-ZWKOTPCHSA-N 3-[2-(1-ethyl-4-fluoro-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2F)=C2N=C1C YWAHMZYHQKXLOX-ZWKOTPCHSA-N 0.000 description 3
- XCHKSHSGVTUCHR-ZWKOTPCHSA-N 3-[2-(1-ethyl-6-fluoro-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=C(C(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)F)=C2N=C1C XCHKSHSGVTUCHR-ZWKOTPCHSA-N 0.000 description 3
- VZPYEWZNAAPDCK-DLBZAZTESA-N 3-[2-(2-cyclopropyl-1-ethyl-4,6-difluorobenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=C(C(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2F)F)=C2N=C1C1CC1 VZPYEWZNAAPDCK-DLBZAZTESA-N 0.000 description 3
- KJYHRFIDMUBTCW-VQTJNVASSA-N 3-[2-(2-cyclopropyl-1-ethylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N=C1C1CC1 KJYHRFIDMUBTCW-VQTJNVASSA-N 0.000 description 3
- RJWLUOVESRHIFY-RBUKOAKNSA-N 3-[2-(2-cyclopropyl-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2N(C)C(C2CC2)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O RJWLUOVESRHIFY-RBUKOAKNSA-N 0.000 description 3
- FVXWVQWCWBXGMR-ZWKOTPCHSA-N 3-[2-(2-cyclopropyl-3-methylimidazo[4,5-c]pyridin-6-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(N=C2)=CC3=C2N(C)C(C2CC2)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O FVXWVQWCWBXGMR-ZWKOTPCHSA-N 0.000 description 3
- XWNFMMHLQIYIHQ-ZWKOTPCHSA-N 3-[2-(2-cyclopropyl-3H-benzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2NC(C2CC2)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O XWNFMMHLQIYIHQ-ZWKOTPCHSA-N 0.000 description 3
- NMLYPQDTSRAZMD-JKSUJKDBSA-N 3-[2-(2-cyclopropyl-4,6-difluoro-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=CC2=C3N=C(C4CC4)N2C)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O NMLYPQDTSRAZMD-JKSUJKDBSA-N 0.000 description 3
- HLOXUGHXEUVRLH-LSDHHAIUSA-N 3-[2-(2-cyclopropyl-4,6-difluoro-1H-benzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=CC2=C3N=C(C4CC4)N2)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O HLOXUGHXEUVRLH-LSDHHAIUSA-N 0.000 description 3
- QIXJLIJORJJKBS-ZWKOTPCHSA-N 3-[2-(2-cyclopropyl-6-fluoro-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=C2)=CC3=C2N(C)C(C2CC2)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O QIXJLIJORJJKBS-ZWKOTPCHSA-N 0.000 description 3
- NBJZKMHQHBTAKY-ZWKOTPCHSA-N 3-[2-(3-ethyl-2-methylimidazo[4,5-b]pyridin-6-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN(C(C)=NC1=C2)C1=NC=C2C#CC1=NN([C@@H](C[C@@H]2COC)CN2C(C=C)=O)C(NC)=C1C(N)=O NBJZKMHQHBTAKY-ZWKOTPCHSA-N 0.000 description 3
- OAYONHGPMKJTRO-ZWKOTPCHSA-N 3-[2-(3-ethyl-2-methylimidazo[4,5-c]pyridin-6-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=NC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N=C1C OAYONHGPMKJTRO-ZWKOTPCHSA-N 0.000 description 3
- VBMBWPBRGSVCAQ-UONOGXRCSA-N 3-[2-(4,6-difluoro-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=CC2=C3N=CN2C)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O VBMBWPBRGSVCAQ-UONOGXRCSA-N 0.000 description 3
- SHBVMUDTJVEXDV-UONOGXRCSA-N 3-[2-(4,6-difluoro-2-methyl-1H-benzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1 SHBVMUDTJVEXDV-UONOGXRCSA-N 0.000 description 3
- WZFYCQCWJSYSKI-ZWKOTPCHSA-N 3-[2-(4-chloro-1-ethyl-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2Cl)=C2N=C1C WZFYCQCWJSYSKI-ZWKOTPCHSA-N 0.000 description 3
- IBRYCRYBSOGTPU-DLBZAZTESA-N 3-[2-(4-fluoro-1,2-dimethylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C(F)=C(C=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1C IBRYCRYBSOGTPU-DLBZAZTESA-N 0.000 description 3
- YMWXMAYEECPQKT-ZWKOTPCHSA-N 3-[2-(6-chloro-1-ethyl-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=C(C(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)Cl)=C2N=C1C YMWXMAYEECPQKT-ZWKOTPCHSA-N 0.000 description 3
- MZMPUBWHLKICIE-VQTJNVASSA-N 3-[2-(6-cyano-1-ethyl-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=C(C(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)C#N)=C2N=C1C MZMPUBWHLKICIE-VQTJNVASSA-N 0.000 description 3
- UVZPZSOCKGEMLR-DLBZAZTESA-N 3-[2-(6-fluoro-1,2-dimethylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C=C(C(F)=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1C UVZPZSOCKGEMLR-DLBZAZTESA-N 0.000 description 3
- MLTUNIXDSBUBHZ-DLBZAZTESA-N 3-[2-[1-ethyl-2-(trifluoromethyl)benzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N=C1C(F)(F)F MLTUNIXDSBUBHZ-DLBZAZTESA-N 0.000 description 3
- WXEZWNQNQASMOD-ZWKOTPCHSA-N 3-[2-[2-(dimethylamino)-1-methylbenzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2N(C)C(N(C)C)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O WXEZWNQNQASMOD-ZWKOTPCHSA-N 0.000 description 3
- SDGZXWJNWZRYQT-UONOGXRCSA-N 3-[2-[4,6-difluoro-1-(2,2,2-trifluoroethyl)benzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=CC2=C3N=CN2CC(F)(F)F)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O SDGZXWJNWZRYQT-UONOGXRCSA-N 0.000 description 3
- DPVQVMJNSROJOW-NWDGAFQWSA-N 3-[2-[4,6-difluoro-2-(trifluoromethyl)-1H-benzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=CC2=C3N=C(C(F)(F)F)N2)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O DPVQVMJNSROJOW-NWDGAFQWSA-N 0.000 description 3
- AEVRNKXPKHGHIF-LSDHHAIUSA-N 3-[2-[4,6-difluoro-2-methyl-1-(2,2,2-trifluoroethyl)benzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1CC(F)(F)F AEVRNKXPKHGHIF-LSDHHAIUSA-N 0.000 description 3
- PFBJRRJTISSRAT-DTWKUNHWSA-N 3-bromo-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(Br)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O PFBJRRJTISSRAT-DTWKUNHWSA-N 0.000 description 3
- XBTWWFSILUDCQN-VJBFUYBPSA-N 3-bromo-1-[(3S,5R)-5-(methoxymethyl)pyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide dihydrochloride Chemical compound CNC1=C(C(N)=O)C(Br)=NN1[C@@H]1CN[C@@H](COC)C1.Cl.Cl XBTWWFSILUDCQN-VJBFUYBPSA-N 0.000 description 3
- LVNOHIPCLQZTPZ-ZETCQYMHSA-N 3-bromo-5-(methylamino)-1-[(3S)-1-prop-2-enoylpyrrolidin-3-yl]pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(Br)=NN1[C@@H](CC1)CN1C(C=C)=O LVNOHIPCLQZTPZ-ZETCQYMHSA-N 0.000 description 3
- UGUDLNIPRDJVFL-XRIGFGBMSA-N 3-bromo-5-(methylamino)-1-[(3S)-pyrrolidin-3-yl]pyrazole-4-carboxamide dihydrochloride Chemical compound CNC1=C(C(N)=O)C(Br)=NN1[C@@H]1CNCC1.Cl.Cl UGUDLNIPRDJVFL-XRIGFGBMSA-N 0.000 description 3
- LNHUJXXAJNXABC-UHFFFAOYSA-N 3-chloro-4-iodobenzene-1,2-diamine Chemical compound C1=CC(=C(C(=C1N)N)Cl)I LNHUJXXAJNXABC-UHFFFAOYSA-N 0.000 description 3
- KDMZFGRLOJHFMW-UHFFFAOYSA-N 3-ethyl-2-methyl-6-(2-trimethylsilylethynyl)benzimidazole-5-carbonitrile Chemical compound CCN1C(C=C(C(C#C[Si](C)(C)C)=C2)C#N)=C2N=C1C KDMZFGRLOJHFMW-UHFFFAOYSA-N 0.000 description 3
- JKYQKCVRZVQDQZ-UHFFFAOYSA-N 3-ethyl-6-ethynyl-2-methylbenzimidazole-5-carbonitrile Chemical compound CCN1C(C=C(C(C#C)=C2)C#N)=C2N=C1C JKYQKCVRZVQDQZ-UHFFFAOYSA-N 0.000 description 3
- JOOIKXGMKRHFQV-UHFFFAOYSA-N 3-ethyl-6-ethynyl-2-methylimidazo[4,5-b]pyridine Chemical compound CCN(C(C)=NC1=C2)C1=NC=C2C#C JOOIKXGMKRHFQV-UHFFFAOYSA-N 0.000 description 3
- OYAFSXVLRBZEON-UHFFFAOYSA-N 3-ethyl-6-iodo-2-methylbenzimidazole-5-carbonitrile Chemical compound CCN1C(C=C(C(I)=C2)C#N)=C2N=C1C OYAFSXVLRBZEON-UHFFFAOYSA-N 0.000 description 3
- GHSZEOYKAPCHJP-UHFFFAOYSA-N 3-ethyl-6-iodo-2-methylimidazo[4,5-b]pyridine Chemical compound CCN(C(C)=NC1=C2)C1=NC=C2I GHSZEOYKAPCHJP-UHFFFAOYSA-N 0.000 description 3
- JJYHZRJLMANJMQ-UHFFFAOYSA-N 3-fluoro-4-iodo-2-nitroaniline Chemical compound Nc1ccc(I)c(F)c1[N+]([O-])=O JJYHZRJLMANJMQ-UHFFFAOYSA-N 0.000 description 3
- JMUSMUFQVHNMHL-UHFFFAOYSA-N 4,6-difluoro-5-iodo-1-(2,2,2-trifluoroethyl)benzimidazole Chemical compound FC(CN1C(C=C(C(I)=C2F)F)=C2N=C1)(F)F JMUSMUFQVHNMHL-UHFFFAOYSA-N 0.000 description 3
- AQSHBHQDSCDAQX-UHFFFAOYSA-N 4,6-difluoro-5-iodo-1-methylbenzimidazole Chemical compound CN1C(C=C(C(I)=C2F)F)=C2N=C1 AQSHBHQDSCDAQX-UHFFFAOYSA-N 0.000 description 3
- UVXXJUZJUMIGOH-UHFFFAOYSA-N 4,6-difluoro-5-iodo-2-(trifluoromethyl)-1H-benzimidazole Chemical compound FC(C1=NC(C(F)=C(C(F)=C2)I)=C2N1)(F)F UVXXJUZJUMIGOH-UHFFFAOYSA-N 0.000 description 3
- PLICWJOVQPZYJB-UHFFFAOYSA-N 4-amino-5-(ethylamino)-2-iodobenzonitrile Chemical compound CCNC(C(N)=C1)=CC(C#N)=C1I PLICWJOVQPZYJB-UHFFFAOYSA-N 0.000 description 3
- VRIRIGHMWUIJSH-UHFFFAOYSA-N 4-bromo-n-ethyl-2-nitroaniline Chemical compound CCNC1=CC=C(Br)C=C1[N+]([O-])=O VRIRIGHMWUIJSH-UHFFFAOYSA-N 0.000 description 3
- VRIRLIQULFXZFB-UHFFFAOYSA-N 4-chloro-1-ethyl-5-iodo-2-methylbenzimidazole Chemical compound CCN1C(C=CC(I)=C2Cl)=C2N=C1C VRIRLIQULFXZFB-UHFFFAOYSA-N 0.000 description 3
- ITRURZJHRPWUPJ-UHFFFAOYSA-N 4-chloro-5-iodobenzene-1,2-diamine Chemical compound NC1=CC(Cl)=C(I)C=C1N ITRURZJHRPWUPJ-UHFFFAOYSA-N 0.000 description 3
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 3
- QMHRYACBRCDCSX-UHFFFAOYSA-N 4-fluoro-5-iodo-1-methylbenzimidazole Chemical compound CN1C(C=CC(I)=C2F)=C2N=C1 QMHRYACBRCDCSX-UHFFFAOYSA-N 0.000 description 3
- ZEKNKYPOAWABKC-UHFFFAOYSA-N 5-(ethylamino)-2-iodo-4-nitrobenzonitrile Chemical compound CCNC(C([N+]([O-])=O)=C1)=CC(C#N)=C1I ZEKNKYPOAWABKC-UHFFFAOYSA-N 0.000 description 3
- VVCMSNQZJQAFND-UHFFFAOYSA-N 5-(methylamino)-1h-pyrazole-4-carboxamide Chemical compound CNC=1NN=CC=1C(N)=O VVCMSNQZJQAFND-UHFFFAOYSA-N 0.000 description 3
- KXQPLXMYJLKDMW-UHFFFAOYSA-N 5-bromo-1,2-dimethylbenzimidazole Chemical compound BrC1=CC=C2N(C)C(C)=NC2=C1 KXQPLXMYJLKDMW-UHFFFAOYSA-N 0.000 description 3
- MEHCOITYQHITIZ-UHFFFAOYSA-N 5-bromo-1-ethyl-2-methylbenzimidazole Chemical compound BrC1=CC=C2N(CC)C(C)=NC2=C1 MEHCOITYQHITIZ-UHFFFAOYSA-N 0.000 description 3
- NATVFBCDSRXYMW-UHFFFAOYSA-N 5-bromo-1-ethyl-2-methylimidazo[4,5-b]pyridine Chemical compound CCN(C(C)=NC1=N2)C1=CC=C2Br NATVFBCDSRXYMW-UHFFFAOYSA-N 0.000 description 3
- AXMQBOUOVYZIMK-UHFFFAOYSA-N 5-bromo-2-methyl-1h-imidazo[4,5-b]pyridine Chemical compound BrC1=CC=C2NC(C)=NC2=N1 AXMQBOUOVYZIMK-UHFFFAOYSA-N 0.000 description 3
- KWHURWOGZQWLTK-UHFFFAOYSA-N 5-chloro-4-iodo-2-nitroaniline Chemical compound NC1=CC(Cl)=C(I)C=C1[N+]([O-])=O KWHURWOGZQWLTK-UHFFFAOYSA-N 0.000 description 3
- LZOXQHXKMZHVAJ-UHFFFAOYSA-N 5-ethynyl-1-methylindazole Chemical compound CN1N=CC2=CC(C#C)=CC=C12 LZOXQHXKMZHVAJ-UHFFFAOYSA-N 0.000 description 3
- XFPUNQUDJSMJGD-UHFFFAOYSA-N 5-ethynyl-4,6-difluoro-1-methylbenzimidazole Chemical compound CN1C(C=C(C(C#C)=C2F)F)=C2N=C1 XFPUNQUDJSMJGD-UHFFFAOYSA-N 0.000 description 3
- SBKSXGZFNRZJTM-UHFFFAOYSA-N 5-ethynyl-4,6-difluoro-2-(trifluoromethyl)-1H-benzimidazole Chemical compound C#CC(C(F)=CC1=C2N=C(C(F)(F)F)N1)=C2F SBKSXGZFNRZJTM-UHFFFAOYSA-N 0.000 description 3
- KXOVFDKESBNHEQ-UHFFFAOYSA-N 5-ethynyl-4,6-difluoro-2-methyl-1H-benzimidazole Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#C)=C2N1 KXOVFDKESBNHEQ-UHFFFAOYSA-N 0.000 description 3
- BRZKRFMSCJWQTF-UHFFFAOYSA-N 5-ethynyl-4-fluoro-1,2-dimethylbenzimidazole Chemical compound CC1=NC(C(F)=C(C=C2)C#C)=C2N1C BRZKRFMSCJWQTF-UHFFFAOYSA-N 0.000 description 3
- VYUKTTWGCYDBIV-UHFFFAOYSA-N 5-fluoro-4-iodo-2-nitroaniline Chemical compound NC1=CC(F)=C(I)C=C1[N+]([O-])=O VYUKTTWGCYDBIV-UHFFFAOYSA-N 0.000 description 3
- GFFJVOZNLDFFFG-UHFFFAOYSA-N 5-iodo-2-n-methylpyridine-2,3-diamine Chemical compound CNC1=NC=C(I)C=C1N GFFJVOZNLDFFFG-UHFFFAOYSA-N 0.000 description 3
- PCGUHQDSFNPHCM-UHFFFAOYSA-N 5-iodo-N,N,1-trimethylbenzimidazol-2-amine Chemical compound CN(C)C1=NC(C=C(C=C2)I)=C2N1C PCGUHQDSFNPHCM-UHFFFAOYSA-N 0.000 description 3
- PDZMVEFIFKMKLM-UHFFFAOYSA-N 5-iodo-n-methyl-3-nitropyridin-2-amine Chemical compound CNC1=NC=C(I)C=C1[N+]([O-])=O PDZMVEFIFKMKLM-UHFFFAOYSA-N 0.000 description 3
- RDVLEMPZZVOHAV-UHFFFAOYSA-N 6-bromo-2-cyclopropyl-1H-benzimidazole Chemical compound N1C2=CC(Br)=CC=C2N=C1C1CC1 RDVLEMPZZVOHAV-UHFFFAOYSA-N 0.000 description 3
- PFBRFCMSMZVPKJ-UHFFFAOYSA-N 6-bromo-2-cyclopropyl-3-methylimidazo[4,5-c]pyridine Chemical compound CN1C(C=NC(Br)=C2)=C2N=C1C1CC1 PFBRFCMSMZVPKJ-UHFFFAOYSA-N 0.000 description 3
- CXFDOIDXUHAEHR-UHFFFAOYSA-N 6-bromo-2-cyclopropyl-3H-imidazo[4,5-c]pyridine Chemical compound BrC(N=C1)=CC2=C1NC(C1CC1)=N2 CXFDOIDXUHAEHR-UHFFFAOYSA-N 0.000 description 3
- SNASZDISVDMYNG-UHFFFAOYSA-N 6-bromo-2-methyl-3H-imidazo[4,5-c]pyridine Chemical compound BrC1=NC=C2NC(C)=NC2=C1 SNASZDISVDMYNG-UHFFFAOYSA-N 0.000 description 3
- RNYYYGKFEKPUDG-UHFFFAOYSA-N 6-bromo-3-ethyl-2-methylimidazo[4,5-c]pyridine Chemical compound CCN1C(C=NC(Br)=C2)=C2N=C1C RNYYYGKFEKPUDG-UHFFFAOYSA-N 0.000 description 3
- WFSGQJZCHLBVFF-UHFFFAOYSA-N 6-chloro-1-ethyl-5-iodo-2-methylbenzimidazole Chemical compound CCN1C(C=C(C(I)=C2)Cl)=C2N=C1C WFSGQJZCHLBVFF-UHFFFAOYSA-N 0.000 description 3
- UJZFASBECFXEMN-UHFFFAOYSA-N 6-chloro-5-iodo-2-methyl-1H-benzimidazole Chemical compound CC1=NC2=CC(=C(C=C2N1)Cl)I UJZFASBECFXEMN-UHFFFAOYSA-N 0.000 description 3
- TYBIOUMHAOBPNN-UHFFFAOYSA-N 6-ethynyl-1,2-benzoxazole Chemical compound C#CC1=CC=C2C=NOC2=C1 TYBIOUMHAOBPNN-UHFFFAOYSA-N 0.000 description 3
- JAUMLQCSESEAGT-UHFFFAOYSA-N 6-ethynyl-3-methylimidazo[4,5-b]pyridine Chemical compound C#CC1=CN=C2N(C)C=NC2=C1 JAUMLQCSESEAGT-UHFFFAOYSA-N 0.000 description 3
- GKDMFLLMJOIEHS-UHFFFAOYSA-N 6-fluoro-5-iodo-1,2-dimethylbenzimidazole Chemical compound CC1=NC(C=C(C(F)=C2)I)=C2N1C GKDMFLLMJOIEHS-UHFFFAOYSA-N 0.000 description 3
- NYXHCNDBWBOXMC-UHFFFAOYSA-N 6-fluoro-5-iodo-1-methylbenzimidazole Chemical compound CN1C(C=C(C(I)=C2)F)=C2N=C1 NYXHCNDBWBOXMC-UHFFFAOYSA-N 0.000 description 3
- QEPFJOYXBUFGDU-UHFFFAOYSA-N 6-fluoro-5-iodo-1H-benzimidazole Chemical compound C1=C(I)C(F)=CC2=C1N=CN2 QEPFJOYXBUFGDU-UHFFFAOYSA-N 0.000 description 3
- ZPYNEWBMMLGARD-UHFFFAOYSA-N 6-iodo-3-methylimidazo[4,5-b]pyridine Chemical compound IC1=CN=C2N(C)C=NC2=C1 ZPYNEWBMMLGARD-UHFFFAOYSA-N 0.000 description 3
- IGKJVJDJMQCZGI-UHFFFAOYSA-N 7-bromoimidazo[1,2-b]pyridazine Chemical compound BrC1=CC2=NC=CN2N=C1 IGKJVJDJMQCZGI-UHFFFAOYSA-N 0.000 description 3
- 102100026149 Fibroblast growth factor receptor-like 1 Human genes 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- YURADPOBMOJHTI-UHFFFAOYSA-N N-(2-amino-4-fluoro-5-iodophenyl)cyclopropanecarboxamide Chemical compound NC(C=C(C(I)=C1)F)=C1NC(C1CC1)=O YURADPOBMOJHTI-UHFFFAOYSA-N 0.000 description 3
- BFKYNCIMXUDDEL-UHFFFAOYSA-N N-(5-amino-2-bromopyridin-4-yl)cyclopropanecarboxamide Chemical compound NC(C(NC(C1CC1)=O)=C1)=CN=C1Br BFKYNCIMXUDDEL-UHFFFAOYSA-N 0.000 description 3
- OOMWPNRNCGFMQS-UHFFFAOYSA-N N-(6-amino-2,4-difluoro-3-iodophenyl)cyclopropanecarboxamide Chemical compound NC(C(NC(C1CC1)=O)=C1F)=CC(F)=C1I OOMWPNRNCGFMQS-UHFFFAOYSA-N 0.000 description 3
- DDFSLSBDHUIJTH-UHFFFAOYSA-N N-(6-amino-2-fluoro-3-iodophenyl)cyclopropanecarboxamide Chemical compound NC(C(NC(C1CC1)=O)=C1F)=CC=C1I DDFSLSBDHUIJTH-UHFFFAOYSA-N 0.000 description 3
- BYHNBIBCYZYLHS-UHFFFAOYSA-N N-[2-(ethylamino)-5-iodophenyl]cyclopropanecarboxamide Chemical compound CCNC(C=CC(I)=C1)=C1NC(C1CC1)=O BYHNBIBCYZYLHS-UHFFFAOYSA-N 0.000 description 3
- CLISRLQUZFHXAC-UHFFFAOYSA-N N-ethyl-5-iodo-3-nitropyridin-2-amine Chemical compound CCNC(C([N+]([O-])=O)=C1)=NC=C1I CLISRLQUZFHXAC-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 3
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 230000001594 aberrant effect Effects 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 230000027455 binding Effects 0.000 description 3
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 230000003831 deregulation Effects 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 125000005114 heteroarylalkoxy group Chemical group 0.000 description 3
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 3
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 3
- 125000000336 imidazol-5-yl group Chemical group [H]N1C([H])=NC([H])=C1[*] 0.000 description 3
- PQNFLJBBNBOBRQ-UHFFFAOYSA-N indane Chemical group C1=CC=C2CCCC2=C1 PQNFLJBBNBOBRQ-UHFFFAOYSA-N 0.000 description 3
- 239000007972 injectable composition Substances 0.000 description 3
- 230000000155 isotopic effect Effects 0.000 description 3
- 239000010410 layer Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 125000002757 morpholinyl group Chemical group 0.000 description 3
- 125000004193 piperazinyl group Chemical group 0.000 description 3
- 125000003386 piperidinyl group Chemical group 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 3
- 239000000376 reactant Substances 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- ZFHAQLARBYXDMO-HUUCEWRRSA-N tert-butyl (2R,4R)-2-(methoxymethyl)-4-(4-methylphenyl)sulfonyloxypyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(N(C1)[C@@H](COC)C[C@H]1OS(C1=CC=C(C)C=C1)(=O)=O)=O ZFHAQLARBYXDMO-HUUCEWRRSA-N 0.000 description 3
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical group C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 3
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 3
- WODWSYMIKUIJID-UHFFFAOYSA-M 1,2-dimethylpyrrolo[1,2-a]pyrazin-5-ium;iodide Chemical compound [I-].CN1C=C[N+]2=CC=CC2=C1C WODWSYMIKUIJID-UHFFFAOYSA-M 0.000 description 2
- XACWXXLICZWPLV-ZWKOTPCHSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-(2-pyrazolo[1,5-a]pyridin-5-ylethynyl)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC3=CC=NN3C=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O XACWXXLICZWPLV-ZWKOTPCHSA-N 0.000 description 2
- UZFIYJNSXFHDSZ-JKSUJKDBSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-(2-pyrazolo[1,5-a]pyrimidin-5-ylethynyl)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=NC3=CC=NN3C=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O UZFIYJNSXFHDSZ-JKSUJKDBSA-N 0.000 description 2
- UYQZZFJMQSNGJL-RBUKOAKNSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-(2-quinolin-7-ylethynyl)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC=C(C=CC=N3)C3=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O UYQZZFJMQSNGJL-RBUKOAKNSA-N 0.000 description 2
- XVHPYFFEDHYKME-DLBZAZTESA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-(2-quinoxalin-6-ylethynyl)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC=C3N=CC=NC3=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O XVHPYFFEDHYKME-DLBZAZTESA-N 0.000 description 2
- KHZYZEALOLWYDE-ZWKOTPCHSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-(1-methylindazol-5-yl)ethynyl]pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC=C3N(C)N=CC3=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O KHZYZEALOLWYDE-ZWKOTPCHSA-N 0.000 description 2
- DXVWDCOHXAEMCI-DLBZAZTESA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-(2-methyl-3H-benzimidazol-5-yl)ethynyl]pyrazole-4-carboxamide Chemical compound CC1=NC(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N1 DXVWDCOHXAEMCI-DLBZAZTESA-N 0.000 description 2
- ABHDQFMHHLWDMK-DLBZAZTESA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-(3-methyl-1,2-benzoxazol-6-yl)ethynyl]pyrazole-4-carboxamide Chemical compound CC1=NOC2=C1C=CC(C#CC1=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C1C(N)=O)=C2 ABHDQFMHHLWDMK-DLBZAZTESA-N 0.000 description 2
- AGHUQJMUUGJNLP-VQTJNVASSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-(3-methylquinolin-7-yl)ethynyl]pyrazole-4-carboxamide Chemical compound CC(C=NC1=C2)=CC1=CC=C2C#CC1=NN([C@@H](C[C@@H]2COC)CN2C(C=C)=O)C(NC)=C1C(N)=O AGHUQJMUUGJNLP-VQTJNVASSA-N 0.000 description 2
- ARBIKHNPNSSBQX-UHFFFAOYSA-N 1-ethyl-4-fluoro-5-iodo-2-methylbenzimidazole Chemical compound CCN1C(C=CC(I)=C2F)=C2N=C1C ARBIKHNPNSSBQX-UHFFFAOYSA-N 0.000 description 2
- VSDWRDHSFDXIKH-UHFFFAOYSA-N 1-ethyl-4-fluoro-5-iodobenzimidazole Chemical compound CCN1C(C=CC(I)=C2F)=C2N=C1 VSDWRDHSFDXIKH-UHFFFAOYSA-N 0.000 description 2
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical group C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 2
- YIBFJCKIOIVKIU-UHFFFAOYSA-N 2,2-difluoro-2-sulfoacetic acid Chemical compound OC(=O)C(F)(F)S(O)(=O)=O YIBFJCKIOIVKIU-UHFFFAOYSA-N 0.000 description 2
- FCHBEHHIFSYELW-UHFFFAOYSA-N 2-(1-ethyl-2-methylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CCN1C(C=CC(C#C[Si](C)(C)C)=C2)=C2N=C1C FCHBEHHIFSYELW-UHFFFAOYSA-N 0.000 description 2
- SHXUCJWKVGOFSB-UHFFFAOYSA-N 2-(1-ethylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CCN1C(C=CC(C#C[Si](C)(C)C)=C2)=C2N=C1 SHXUCJWKVGOFSB-UHFFFAOYSA-N 0.000 description 2
- OLYJFFQWJCFCHP-UHFFFAOYSA-N 2-(4,6-difluoro-1-methylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CN1C(C=C(C(C#C[Si](C)(C)C)=C2F)F)=C2N=C1 OLYJFFQWJCFCHP-UHFFFAOYSA-N 0.000 description 2
- VMSITGOPPGEQRD-UHFFFAOYSA-N 2-(4-fluoro-1,2-dimethylbenzimidazol-5-yl)ethynyl-trimethylsilane Chemical compound CC1=NC(C(F)=C(C=C2)C#C[Si](C)(C)C)=C2N1C VMSITGOPPGEQRD-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- GRYZMPWDECHEQG-UHFFFAOYSA-N 2-N-ethyl-5-iodopyridine-2,3-diamine Chemical compound CCNc1ncc(I)cc1N GRYZMPWDECHEQG-UHFFFAOYSA-N 0.000 description 2
- RNVCWFGGIKYWHC-UHFFFAOYSA-N 2-[8-[(4-benzhydrylpiperazin-1-yl)methyl]-1,3-dimethyl-2,6-dioxopurin-7-yl]acetamide Chemical compound NC(=O)CN1C=2C(=O)N(C)C(=O)N(C)C=2N=C1CN(CC1)CCN1C(C=1C=CC=CC=1)C1=CC=CC=C1 RNVCWFGGIKYWHC-UHFFFAOYSA-N 0.000 description 2
- PIJMRJPJERUFNI-UHFFFAOYSA-N 2-chloro-5-iodo-3-nitropyridine Chemical compound [O-][N+](=O)C1=CC(I)=CN=C1Cl PIJMRJPJERUFNI-UHFFFAOYSA-N 0.000 description 2
- VWCVBUBAEVNRRA-UHFFFAOYSA-N 2-cyclopropyl-1-ethyl-5,7-difluoro-6-iodobenzimidazole Chemical compound CCN1C(C(F)=C(C(F)=C2)I)=C2N=C1C1CC1 VWCVBUBAEVNRRA-UHFFFAOYSA-N 0.000 description 2
- OIUGLAQCKLLLAJ-UHFFFAOYSA-N 2-cyclopropyl-5-iodo-1-methylbenzimidazole Chemical compound CN1C(C=CC(I)=C2)=C2N=C1C1CC1 OIUGLAQCKLLLAJ-UHFFFAOYSA-N 0.000 description 2
- HRPIHKPQPGNCIW-UHFFFAOYSA-N 2-cyclopropyl-6-ethynyl-1H-benzimidazole Chemical compound C#CC(C=C1)=CC2=C1NC(C1CC1)=N2 HRPIHKPQPGNCIW-UHFFFAOYSA-N 0.000 description 2
- DIJSKWHWBYWONW-JKSUJKDBSA-N 3-(2-imidazo[1,2-a]pyrimidin-6-ylethynyl)-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=N2)=CN3C2=NC=C3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O DIJSKWHWBYWONW-JKSUJKDBSA-N 0.000 description 2
- DEGILBYUYQINRT-JKSUJKDBSA-N 3-(2-imidazo[1,2-a]pyrimidin-7-ylethynyl)-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=NC3=NC=CN3C=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O DEGILBYUYQINRT-JKSUJKDBSA-N 0.000 description 2
- XIJAKPJNPDLMBX-DLBZAZTESA-N 3-[2-(1,2-benzoxazol-6-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC(ON=C3)=C3C=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O XIJAKPJNPDLMBX-DLBZAZTESA-N 0.000 description 2
- KNPLSRBVKFTLQU-ZWKOTPCHSA-N 3-[2-(1,2-dimethylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C=C(C=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1C KNPLSRBVKFTLQU-ZWKOTPCHSA-N 0.000 description 2
- CHCRNUSFDLTSCW-INIZCTEOSA-N 3-[2-(1,2-dimethylbenzimidazol-5-yl)ethynyl]-5-(methylamino)-1-[(3S)-1-prop-2-enoylpyrrolidin-3-yl]pyrazole-4-carboxamide Chemical compound CC1=NC(C=C(C=C2)C#CC3=NN([C@@H](CC4)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1C CHCRNUSFDLTSCW-INIZCTEOSA-N 0.000 description 2
- CJVVXRNKGDZSSX-RBUKOAKNSA-N 3-[2-(1-cyclopropylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2N(C2CC2)C=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O CJVVXRNKGDZSSX-RBUKOAKNSA-N 0.000 description 2
- KNMUWOPKASWTJD-RBUKOAKNSA-N 3-[2-(1-ethyl-2-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N=C1C KNMUWOPKASWTJD-RBUKOAKNSA-N 0.000 description 2
- FPIKMDUNZISFAK-DLBZAZTESA-N 3-[2-(1-ethyl-6-fluorobenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=C(C(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)F)=C2N=C1 FPIKMDUNZISFAK-DLBZAZTESA-N 0.000 description 2
- SMUWQHVFXRNAMW-RBUKOAKNSA-N 3-[2-(1-tert-butylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC(C)(C)N1C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N=C1 SMUWQHVFXRNAMW-RBUKOAKNSA-N 0.000 description 2
- MCNHBMQHMRRNEW-JKSUJKDBSA-N 3-[2-(2-amino-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2N(C)C(N)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O MCNHBMQHMRRNEW-JKSUJKDBSA-N 0.000 description 2
- GJVNFVSGLDXXQM-DLBZAZTESA-N 3-[2-(3-ethyl-4-fluorobenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C(F)=C(C=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N=C1 GJVNFVSGLDXXQM-DLBZAZTESA-N 0.000 description 2
- LMWBWNAEGINARC-LSDHHAIUSA-N 3-[2-(4,6-difluoro-1,2-dimethylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=C2N1C LMWBWNAEGINARC-LSDHHAIUSA-N 0.000 description 2
- GQRDHHCMHZQBFZ-UONOGXRCSA-N 3-[2-(4,6-difluoro-1-methylindazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=C(C=NN2C)C2=C2)=C2F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O GQRDHHCMHZQBFZ-UONOGXRCSA-N 0.000 description 2
- GNPYYYOKDKYGEC-JKSUJKDBSA-N 3-[2-(4-fluoro-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=CC2=C3N=CN2C)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O GNPYYYOKDKYGEC-JKSUJKDBSA-N 0.000 description 2
- WOPRZPUKVRDSQU-JKSUJKDBSA-N 3-[2-(6-fluoro-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=C2)=CC3=C2N(C)C=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O WOPRZPUKVRDSQU-JKSUJKDBSA-N 0.000 description 2
- HSPFGESLRWLIFS-UHFFFAOYSA-N 3-chloro-4-iodo-2-nitroaniline Chemical compound Nc1ccc(I)c(Cl)c1[N+]([O-])=O HSPFGESLRWLIFS-UHFFFAOYSA-N 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- ZHLZDOLGBZSQGA-UHFFFAOYSA-N 4-chloro-5-iodo-2-methyl-1H-benzimidazole Chemical compound IC1=CC=C2NC(=NC2=C1Cl)C ZHLZDOLGBZSQGA-UHFFFAOYSA-N 0.000 description 2
- IFJKYONPTPWXIM-UHFFFAOYSA-N 4-fluoro-5-iodo-1,2-dimethylbenzimidazole Chemical compound CC1=NC(C(F)=C(C=C2)I)=C2N1C IFJKYONPTPWXIM-UHFFFAOYSA-N 0.000 description 2
- AOLOFBKQDULYTM-UHFFFAOYSA-N 4-iodo-1-n-methylbenzene-1,2-diamine Chemical compound CNC1=CC=C(I)C=C1N AOLOFBKQDULYTM-UHFFFAOYSA-N 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- RBHOMWUEEOYCFT-HNNXBMFYSA-N 5-(methylamino)-3-[2-(2-methyl-3H-benzimidazol-5-yl)ethynyl]-1-[(3S)-1-prop-2-enoylpyrrolidin-3-yl]pyrazole-4-carboxamide Chemical compound CC1=NC(C=CC(C#CC2=NN([C@@H](CC3)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N1 RBHOMWUEEOYCFT-HNNXBMFYSA-N 0.000 description 2
- BLOFTARVSUNVQP-UHFFFAOYSA-N 5-bromo-1-ethylbenzimidazole Chemical compound BrC1=CC=C2N(CC)C=NC2=C1 BLOFTARVSUNVQP-UHFFFAOYSA-N 0.000 description 2
- ARDYEAORIWTXJD-UHFFFAOYSA-N 7-fluoro-6-iodo-1-methylbenzimidazole Chemical compound CN1C(C(F)=C(C=C2)I)=C2N=C1 ARDYEAORIWTXJD-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- ULWBMOSYEDQKNZ-UHFFFAOYSA-N C1=C(C#C)C=C2NC(C)=NC2=C1 Chemical compound C1=C(C#C)C=C2NC(C)=NC2=C1 ULWBMOSYEDQKNZ-UHFFFAOYSA-N 0.000 description 2
- 208000005623 Carcinogenesis Diseases 0.000 description 2
- HTJDQJBWANPRPF-UHFFFAOYSA-N Cyclopropylamine Chemical compound NC1CC1 HTJDQJBWANPRPF-UHFFFAOYSA-N 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 101000912518 Homo sapiens Fibroblast growth factor receptor-like 1 Proteins 0.000 description 2
- 101000610640 Homo sapiens U4/U6 small nuclear ribonucleoprotein Prp3 Proteins 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- BXDZOYLPNAIDOC-UHFFFAOYSA-N N-[5-[(5-tert-butyl-1,3-oxazol-2-yl)methylsulfanyl]-1,3-thiazol-2-yl]-1-[2-[2-[2-[2-[2-[[2-(2,6-dioxopiperidin-3-yl)-1,3-dioxoisoindol-4-yl]amino]ethoxy]ethoxy]ethoxy]ethylamino]-2-oxoethyl]piperidine-4-carboxamide Chemical compound CC(C)(C)c1cnc(CSc2cnc(NC(=O)C3CCN(CC(=O)NCCOCCOCCOCCNc4cccc5C(=O)N(C6CCC(=O)NC6=O)C(=O)c45)CC3)s2)o1 BXDZOYLPNAIDOC-UHFFFAOYSA-N 0.000 description 2
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical class CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 2
- WCZJVSSWTYKXHO-UHFFFAOYSA-N N-tert-butyl-4-iodo-2-nitroaniline Chemical compound CC(C)(C)NC(C=CC(I)=C1)=C1[N+]([O-])=O WCZJVSSWTYKXHO-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical group C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- 229910002666 PdCl2 Inorganic materials 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical class C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical class C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical group C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- 101001110823 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-A Proteins 0.000 description 2
- 101000712176 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-B Proteins 0.000 description 2
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 102100040374 U4/U6 small nuclear ribonucleoprotein Prp3 Human genes 0.000 description 2
- HFBMWMNUJJDEQZ-UHFFFAOYSA-N acryloyl chloride Chemical compound ClC(=O)C=C HFBMWMNUJJDEQZ-UHFFFAOYSA-N 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- IYABWNGZIDDRAK-UHFFFAOYSA-N allene Chemical group C=C=C IYABWNGZIDDRAK-UHFFFAOYSA-N 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 239000013011 aqueous formulation Substances 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 150000001565 benzotriazoles Chemical class 0.000 description 2
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- 229910000024 caesium carbonate Inorganic materials 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 230000036952 cancer formation Effects 0.000 description 2
- 150000003857 carboxamides Chemical class 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 150000007942 carboxylates Chemical class 0.000 description 2
- 231100000504 carcinogenesis Toxicity 0.000 description 2
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 2
- 125000004186 cyclopropylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C1([H])[H] 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000006471 dimerization reaction Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 230000008029 eradication Effects 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 239000012458 free base Substances 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- VTVRXITWWZGKHV-UHFFFAOYSA-N imidazo[1,2-b]pyridazine Chemical compound N1=CC=CC2=NC=CN21 VTVRXITWWZGKHV-UHFFFAOYSA-N 0.000 description 2
- 125000002632 imidazolidinyl group Chemical group 0.000 description 2
- 125000002636 imidazolinyl group Chemical group 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 2
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Chemical group 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 235000015320 potassium carbonate Nutrition 0.000 description 2
- 125000004353 pyrazol-1-yl group Chemical group [H]C1=NN(*)C([H])=C1[H] 0.000 description 2
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- NYCVCXMSZNOGDH-UHFFFAOYSA-N pyrrolidine-1-carboxylic acid Chemical compound OC(=O)N1CCCC1 NYCVCXMSZNOGDH-UHFFFAOYSA-N 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 2
- 235000019345 sodium thiosulphate Nutrition 0.000 description 2
- 229910052717 sulfur Chemical group 0.000 description 2
- 239000011593 sulfur Chemical group 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 2
- HUFZBSAHGAZRNQ-WDEREUQCSA-N tert-butyl (2R,4S)-4-[3-bromo-4-cyano-5-(methylamino)pyrazol-1-yl]-2-(methoxymethyl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(N(C1)[C@@H](COC)C[C@@H]1N(C(NC)=C1C#N)N=C1Br)=O HUFZBSAHGAZRNQ-WDEREUQCSA-N 0.000 description 2
- QOIOYHOEWNMBCX-NSHDSACASA-N tert-butyl (3S)-3-[3-bromo-4-carbamoyl-5-[methyl-[(2-methylpropan-2-yl)oxycarbonyl]amino]pyrazol-1-yl]pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(N(C)C1=C(C(N)=O)C(Br)=NN1[C@@H](CC1)CN1C(OC(C)(C)C)=O)=O QOIOYHOEWNMBCX-NSHDSACASA-N 0.000 description 2
- JPWNHVLOFPOPOW-LBPRGKRZSA-N tert-butyl (3S)-3-[3-bromo-4-cyano-5-[methyl-[(2-methylpropan-2-yl)oxycarbonyl]amino]pyrazol-1-yl]pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(N(C)C(N([C@@H](CC1)CN1C(OC(C)(C)C)=O)N=C1Br)=C1C#N)=O JPWNHVLOFPOPOW-LBPRGKRZSA-N 0.000 description 2
- YAPQBXQYLJRXSA-UHFFFAOYSA-N theobromine Chemical class CN1C(=O)NC(=O)C2=C1N=CN2C YAPQBXQYLJRXSA-UHFFFAOYSA-N 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- HKYZPRAVKMZNCQ-UHFFFAOYSA-N trifluoro(trifluoromethylsulfonylmethoxy)methane Chemical compound O=S(COC(F)(F)F)(C(F)(F)F)=O HKYZPRAVKMZNCQ-UHFFFAOYSA-N 0.000 description 2
- FEXJYAZOYDLYKT-UHFFFAOYSA-N trimethyl-[2-(1-methylbenzimidazol-5-yl)ethynyl]silane Chemical compound CN1C=NC2=C1C=CC(=C2)C#C[Si](C)(C)C FEXJYAZOYDLYKT-UHFFFAOYSA-N 0.000 description 2
- XWXFNPDZHIPSIR-UHFFFAOYSA-N trimethyl-[2-(3-methylimidazo[4,5-b]pyridin-6-yl)ethynyl]silane Chemical compound C[Si](C)(C)C#CC1=CN=C2N(C)C=NC2=C1 XWXFNPDZHIPSIR-UHFFFAOYSA-N 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- 125000006833 (C1-C5) alkylene group Chemical group 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- 125000005988 1,1-dioxo-thiomorpholinyl group Chemical group 0.000 description 1
- NIIAVLFMTBTSNH-UHFFFAOYSA-N 1,2-dimethylquinolin-1-ium-4-amine;iodide Chemical compound [I-].C1=CC=CC2=[N+](C)C(C)=CC(N)=C21 NIIAVLFMTBTSNH-UHFFFAOYSA-N 0.000 description 1
- 125000005871 1,3-benzodioxolyl group Chemical group 0.000 description 1
- 125000005877 1,4-benzodioxanyl group Chemical group 0.000 description 1
- IZIOENOLCGUUNL-UHFFFAOYSA-N 1-(difluoromethyl)-5,7-difluoro-6-iodobenzimidazole Chemical compound FC(N1C(C(F)=C(C(F)=C2)I)=C2N=C1)F IZIOENOLCGUUNL-UHFFFAOYSA-N 0.000 description 1
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical group CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 1
- IWXNVCQEVLRIJR-UHFFFAOYSA-N 1-N-ethyl-4-iodobenzene-1,2-diamine Chemical compound CCNC1=CC=C(I)C=C1N IWXNVCQEVLRIJR-UHFFFAOYSA-N 0.000 description 1
- NKCYFERFXDDHAP-ZWKOTPCHSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-(2-pyrazolo[1,5-a]pyridin-6-ylethynyl)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CN3N=CC=C3C=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O NKCYFERFXDDHAP-ZWKOTPCHSA-N 0.000 description 1
- RJOHEJZPBSGJPH-ZWKOTPCHSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-(2-methylindazol-5-yl)ethynyl]pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC3=CN(C)N=C3C=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O RJOHEJZPBSGJPH-ZWKOTPCHSA-N 0.000 description 1
- QEXITIDOFPTTAE-JKSUJKDBSA-N 1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)-3-[2-[1-methyl-2-(trifluoromethyl)benzimidazol-5-yl]ethynyl]pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2N(C)C(C(F)(F)F)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O QEXITIDOFPTTAE-JKSUJKDBSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- CJMVTQGWNBNFQN-UHFFFAOYSA-N 1-ethyl-5,7-difluoro-6-iodo-2-methylbenzimidazole Chemical compound CCN1C(C(F)=C(C(F)=C2)I)=C2N=C1C CJMVTQGWNBNFQN-UHFFFAOYSA-N 0.000 description 1
- FLMFZKFJCIYHDV-UHFFFAOYSA-N 1-ethyl-5-ethynylindazole Chemical compound CCN1N=CC2=C1C=CC(=C2)C#C FLMFZKFJCIYHDV-UHFFFAOYSA-N 0.000 description 1
- 125000005987 1-oxo-thiomorpholinyl group Chemical group 0.000 description 1
- MITDXNUXOAYFGC-UHFFFAOYSA-N 1-prop-2-ynylbenzimidazole Chemical compound C1=CC=C2N(CC#C)C=NC2=C1 MITDXNUXOAYFGC-UHFFFAOYSA-N 0.000 description 1
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- HCSBTDBGTNZOAB-UHFFFAOYSA-N 2,3-dinitrobenzoic acid Chemical compound OC(=O)C1=CC=CC([N+]([O-])=O)=C1[N+]([O-])=O HCSBTDBGTNZOAB-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-IVMDWMLBSA-N 2-amino-2-deoxy-D-glucopyranose Chemical class N[C@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-IVMDWMLBSA-N 0.000 description 1
- QSKPIOLLBIHNAC-UHFFFAOYSA-N 2-chloro-acetaldehyde Chemical compound ClCC=O QSKPIOLLBIHNAC-UHFFFAOYSA-N 0.000 description 1
- ZUYJKVPNUJYYFI-UHFFFAOYSA-N 2-cyclopropyl-6-iodo-1H-benzimidazole Chemical compound IC(C=C1)=CC2=C1NC(C1CC1)=N2 ZUYJKVPNUJYYFI-UHFFFAOYSA-N 0.000 description 1
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 1
- 229940013085 2-diethylaminoethanol Drugs 0.000 description 1
- CDMVGNWYVKKGCF-UHFFFAOYSA-N 2-ethyl-5-ethynylindazole Chemical compound CCN1N=C(C=CC(C#C)=C2)C2=C1 CDMVGNWYVKKGCF-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M 2-methylbenzenesulfonate Chemical compound CC1=CC=CC=C1S([O-])(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 125000006088 2-oxoazepinyl group Chemical group 0.000 description 1
- 125000004638 2-oxopiperazinyl group Chemical group O=C1N(CCNC1)* 0.000 description 1
- 125000004637 2-oxopiperidinyl group Chemical group O=C1N(CCCC1)* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000004485 2-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])C1([H])* 0.000 description 1
- PQIBSIWXVPRNNY-DLBZAZTESA-N 3-(2-imidazo[1,2-a]pyridin-6-ylethynyl)-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CN3C2=NC=C3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O PQIBSIWXVPRNNY-DLBZAZTESA-N 0.000 description 1
- LADNBJIYDVWLGM-DLBZAZTESA-N 3-(2-imidazo[1,2-a]pyridin-7-ylethynyl)-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC2=CC3=NC=CN3C=C2)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O LADNBJIYDVWLGM-DLBZAZTESA-N 0.000 description 1
- TWOQGVJEOKQKQZ-UHFFFAOYSA-N 3-(4-fluorophenyl)-6,7-dihydro-5h-pyrrolo[1,2-a]imidazole Chemical compound C1=CC(F)=CC=C1C1=CN=C2N1CCC2 TWOQGVJEOKQKQZ-UHFFFAOYSA-N 0.000 description 1
- AQBZVFYCSSTAJO-VOTSOKGWSA-N 3-[(e)-2-phenylethenyl]-5-(trifluoromethyl)-1h-pyrazole Chemical compound N1C(C(F)(F)F)=CC(\C=C\C=2C=CC=CC=2)=N1 AQBZVFYCSSTAJO-VOTSOKGWSA-N 0.000 description 1
- RUUWTDVRBGAQCD-ZWKOTPCHSA-N 3-[2-(1-ethylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)=C2N=C1 RUUWTDVRBGAQCD-ZWKOTPCHSA-N 0.000 description 1
- STBUQWNSOLJYNJ-RBUKOAKNSA-N 3-[2-(1-ethylindazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1N=CC2=CC(C#CC3=NN([C@@H](C[C@@H]4COC)CN4C(C=C)=O)C(NC)=C3C(N)=O)=CC=C12 STBUQWNSOLJYNJ-RBUKOAKNSA-N 0.000 description 1
- OHFQRADRDMYNLI-ZWKOTPCHSA-N 3-[2-(2-cyclopropyl-4-fluoro-1-methylbenzimidazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=CC2=C3N=C(C4CC4)N2C)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O OHFQRADRDMYNLI-ZWKOTPCHSA-N 0.000 description 1
- PLMGHFDXMHKUAK-RBUKOAKNSA-N 3-[2-(2-ethylindazol-5-yl)ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CCN1N=C(C=CC(C#CC2=NN([C@@H](C[C@@H]3COC)CN3C(C=C)=O)C(NC)=C2C(N)=O)=C2)C2=C1 PLMGHFDXMHKUAK-RBUKOAKNSA-N 0.000 description 1
- IALNALWYDYUGJH-QWHCGFSZSA-N 3-[2-[1-(difluoromethyl)-4,6-difluorobenzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C(F)=CC2=C3N=CN2C(F)F)=C3F)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O IALNALWYDYUGJH-QWHCGFSZSA-N 0.000 description 1
- HXZKZGJKVZUSRL-ZWKOTPCHSA-N 3-[2-[1-cyclopropyl-2-(trifluoromethyl)benzimidazol-5-yl]ethynyl]-1-[(3S,5R)-5-(methoxymethyl)-1-prop-2-enoylpyrrolidin-3-yl]-5-(methylamino)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(C#CC(C=C2)=CC3=C2N(C2CC2)C(C(F)(F)F)=N3)=NN1[C@@H](C[C@@H]1COC)CN1C(C=C)=O HXZKZGJKVZUSRL-ZWKOTPCHSA-N 0.000 description 1
- UAOSALPICBLYCJ-UHFFFAOYSA-N 3-amino-5-bromo-1h-pyrazole-4-carbonitrile Chemical compound NC=1NN=C(Br)C=1C#N UAOSALPICBLYCJ-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- LVNOHIPCLQZTPZ-UHFFFAOYSA-N 3-bromo-5-(methylamino)-1-(1-prop-2-enoylpyrrolidin-3-yl)pyrazole-4-carboxamide Chemical compound CNC1=C(C(N)=O)C(Br)=NN1C(CC1)CN1C(C=C)=O LVNOHIPCLQZTPZ-UHFFFAOYSA-N 0.000 description 1
- YADOEPHJIBKBCN-UHFFFAOYSA-N 3-chloro-2-nitroaniline Chemical compound NC1=CC=CC(Cl)=C1[N+]([O-])=O YADOEPHJIBKBCN-UHFFFAOYSA-N 0.000 description 1
- NSFGNLQLWFZHKK-UHFFFAOYSA-N 3-fluoro-2-nitroaniline Chemical compound NC1=CC=CC(F)=C1[N+]([O-])=O NSFGNLQLWFZHKK-UHFFFAOYSA-N 0.000 description 1
- OZXCOGPRBUSXLE-UHFFFAOYSA-N 3-fluoro-4-nitrobenzonitrile Chemical compound [O-][N+](=O)C1=CC=C(C#N)C=C1F OZXCOGPRBUSXLE-UHFFFAOYSA-N 0.000 description 1
- ADUHCGZLROUKFY-UHFFFAOYSA-N 3-phenyl-1,2,4-triazine Chemical compound C1=CC=CC=C1C1=NC=CN=N1 ADUHCGZLROUKFY-UHFFFAOYSA-N 0.000 description 1
- VTDSGNMEZKRXKW-UHFFFAOYSA-N 4,6-difluoro-5-iodo-2-methyl-1-(2,2,2-trifluoroethyl)benzimidazole Chemical compound CC1=NC(C(F)=C(C(F)=C2)I)=C2N1CC(F)(F)F VTDSGNMEZKRXKW-UHFFFAOYSA-N 0.000 description 1
- DQRKTVIJNCVZAX-UHFFFAOYSA-N 4-(2-pyridin-4-ylethyl)pyridine Chemical compound C=1C=NC=CC=1CCC1=CC=NC=C1 DQRKTVIJNCVZAX-UHFFFAOYSA-N 0.000 description 1
- UQEANKGXXSENNF-UHFFFAOYSA-N 4-bromo-1-fluoro-2-nitrobenzene Chemical compound [O-][N+](=O)C1=CC(Br)=CC=C1F UQEANKGXXSENNF-UHFFFAOYSA-N 0.000 description 1
- JGXCXQPNYWBAGW-UHFFFAOYSA-N 4-bromo-1-n-methylbenzene-1,2-diamine Chemical compound CNC1=CC=C(Br)C=C1N JGXCXQPNYWBAGW-UHFFFAOYSA-N 0.000 description 1
- 125000005986 4-piperidonyl group Chemical group 0.000 description 1
- QNWKODADYPZGGJ-UHFFFAOYSA-N 5,7-difluoro-6-iodo-1-methylbenzimidazole Chemical compound CN1C(C(F)=C(C(F)=C2)I)=C2N=C1 QNWKODADYPZGGJ-UHFFFAOYSA-N 0.000 description 1
- WQOAKXFBWOXJNG-UHFFFAOYSA-N 5-bromopyrazolo[1,5-a]pyridine Chemical compound C1=C(Br)C=CN2N=CC=C21 WQOAKXFBWOXJNG-UHFFFAOYSA-N 0.000 description 1
- DIYTVASYDOBYQA-UHFFFAOYSA-N 5-bromopyrazolo[1,5-a]pyrimidine Chemical compound N1=C(Br)C=CN2N=CC=C21 DIYTVASYDOBYQA-UHFFFAOYSA-N 0.000 description 1
- VIZZTROFAJLFML-UHFFFAOYSA-N 5-bromopyridazin-3-amine Chemical compound NC1=CC(Br)=CN=N1 VIZZTROFAJLFML-UHFFFAOYSA-N 0.000 description 1
- ZCWXYZBQDNFULS-UHFFFAOYSA-N 5-chloro-2-nitroaniline Chemical compound NC1=CC(Cl)=CC=C1[N+]([O-])=O ZCWXYZBQDNFULS-UHFFFAOYSA-N 0.000 description 1
- FNXYLNNFCRADNQ-UHFFFAOYSA-N 5-ethynyl-1-methyl-2-(trifluoromethyl)benzimidazole Chemical compound CN1C(C=CC(C#C)=C2)=C2N=C1C(F)(F)F FNXYLNNFCRADNQ-UHFFFAOYSA-N 0.000 description 1
- LYLFWPJXAVZRJZ-UHFFFAOYSA-N 5-ethynyl-1-methylbenzimidazole Chemical compound C(#C)C1=CC2=C(N(C=N2)C)C=C1 LYLFWPJXAVZRJZ-UHFFFAOYSA-N 0.000 description 1
- LJFSDYZSKNONRF-UHFFFAOYSA-N 5-ethynyl-2-methylindazole Chemical compound CN1C=C2C=C(C=CC2=N1)C#C LJFSDYZSKNONRF-UHFFFAOYSA-N 0.000 description 1
- HLXSURPUQYVVHO-UHFFFAOYSA-N 5-ethynyl-4,6-difluoro-1,2-dimethylbenzimidazole Chemical compound CC1=NC(C(F)=C(C(F)=C2)C#C)=C2N1C HLXSURPUQYVVHO-UHFFFAOYSA-N 0.000 description 1
- DPIJVVSYDPODEP-UHFFFAOYSA-N 5-ethynyl-4,6-difluoro-1-methylindazole Chemical compound CN(C1=CC(F)=C2C#C)N=CC1=C2F DPIJVVSYDPODEP-UHFFFAOYSA-N 0.000 description 1
- PEDMFCHWOVJDNW-UHFFFAOYSA-N 5-fluoro-2-nitroaniline Chemical compound NC1=CC(F)=CC=C1[N+]([O-])=O PEDMFCHWOVJDNW-UHFFFAOYSA-N 0.000 description 1
- QHNORIBEFNHZMQ-UHFFFAOYSA-N 6-bromo-1,2-benzoxazole Chemical compound BrC1=CC=C2C=NOC2=C1 QHNORIBEFNHZMQ-UHFFFAOYSA-N 0.000 description 1
- LSPSVCJKVFCWHE-UHFFFAOYSA-N 6-bromo-3-methyl-1,2-benzoxazole Chemical compound BrC1=CC=C2C(C)=NOC2=C1 LSPSVCJKVFCWHE-UHFFFAOYSA-N 0.000 description 1
- BQMWMOQCMFLRQQ-UHFFFAOYSA-N 6-bromoimidazo[1,2-a]pyrimidine Chemical compound C1=C(Br)C=NC2=NC=CN21 BQMWMOQCMFLRQQ-UHFFFAOYSA-N 0.000 description 1
- MJGAKVFFADUFMG-UHFFFAOYSA-N 6-bromopyrazolo[1,5-a]pyridine Chemical compound C1=C(Br)C=CC2=CC=NN21 MJGAKVFFADUFMG-UHFFFAOYSA-N 0.000 description 1
- LWXOPWFJTFAZRO-UHFFFAOYSA-N 6-bromopyridine-2,3-diamine Chemical compound NC1=CC=C(Br)N=C1N LWXOPWFJTFAZRO-UHFFFAOYSA-N 0.000 description 1
- XCVAQMLOGLDTNX-UHFFFAOYSA-N 6-bromopyridine-3,4-diamine Chemical compound NC1=CN=C(Br)C=C1N XCVAQMLOGLDTNX-UHFFFAOYSA-N 0.000 description 1
- ZYXOOFUOEJPQKM-UHFFFAOYSA-N 6-iodoimidazo[1,2-a]pyridine Chemical compound C1=C(I)C=CC2=NC=CN21 ZYXOOFUOEJPQKM-UHFFFAOYSA-N 0.000 description 1
- NWQDPVJVUFEWLG-UHFFFAOYSA-N 6-iodoquinoxaline Chemical compound N1=CC=NC2=CC(I)=CC=C21 NWQDPVJVUFEWLG-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- CVFAZFPZYNGXHK-UHFFFAOYSA-N 7-bromo-3-methylquinoline Chemical compound C1=C(Br)C=CC2=CC(C)=CN=C21 CVFAZFPZYNGXHK-UHFFFAOYSA-N 0.000 description 1
- QNMPFHNDEOTXNR-UHFFFAOYSA-N 7-bromoimidazo[1,2-a]pyrimidine Chemical compound N1=C(Br)C=CN2C=CN=C21 QNMPFHNDEOTXNR-UHFFFAOYSA-N 0.000 description 1
- AUMHABVMQCQBPQ-UHFFFAOYSA-N 7-chloro-1-ethyl-6-iodo-2-methylbenzimidazole Chemical compound CCN1C(C(Cl)=C(C=C2)I)=C2N=C1C AUMHABVMQCQBPQ-UHFFFAOYSA-N 0.000 description 1
- LXPYXLTZQOLCIZ-UHFFFAOYSA-N 7-iodoimidazo[1,2-a]pyridine Chemical compound C1=C(I)C=CN2C=CN=C21 LXPYXLTZQOLCIZ-UHFFFAOYSA-N 0.000 description 1
- RIYITFZDKHVMRQ-UHFFFAOYSA-N 7-iodoquinoline Chemical compound C1=CC=NC2=CC(I)=CC=C21 RIYITFZDKHVMRQ-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 241001014432 Babina Species 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- KWIUHFFTVRNATP-UHFFFAOYSA-N Betaine Chemical class C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- CSLSZQAXTBKEEF-VIFPVBQESA-N BrC1=NN(C(=C1C#N)NC)[C@@H]1CN(CC1)C(=O)OC(C)(C)C Chemical compound BrC1=NN(C(=C1C#N)NC)[C@@H]1CN(CC1)C(=O)OC(C)(C)C CSLSZQAXTBKEEF-VIFPVBQESA-N 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- 230000004544 DNA amplification Effects 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical class NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 101150021185 FGF gene Proteins 0.000 description 1
- 101150081124 FGFR gene Proteins 0.000 description 1
- 101150017750 FGFRL1 gene Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 description 1
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 description 1
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 1
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 1
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 1
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 1
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 description 1
- 108700042658 GAP-43 Proteins 0.000 description 1
- 108700032487 GAP-43-3 Proteins 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- KWIUHFFTVRNATP-UHFFFAOYSA-O N,N,N-trimethylglycinium Chemical class C[N+](C)(C)CC(O)=O KWIUHFFTVRNATP-UHFFFAOYSA-O 0.000 description 1
- ROBWWXVYEZSKKE-UHFFFAOYSA-N N-(2-amino-3,5-difluoro-4-iodophenyl)cyclopropanecarboxamide Chemical compound NC(C(F)=C(C(F)=C1)I)=C1NC(C1CC1)=O ROBWWXVYEZSKKE-UHFFFAOYSA-N 0.000 description 1
- UEEJHVSXFDXPFK-UHFFFAOYSA-N N-dimethylaminoethanol Chemical compound CN(C)CCO UEEJHVSXFDXPFK-UHFFFAOYSA-N 0.000 description 1
- HTLZVHNRZJPSMI-UHFFFAOYSA-N N-ethylpiperidine Chemical class CCN1CCCCC1 HTLZVHNRZJPSMI-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- JCXJVPUVTGWSNB-UHFFFAOYSA-N Nitrogen dioxide Chemical compound O=[N]=O JCXJVPUVTGWSNB-UHFFFAOYSA-N 0.000 description 1
- 102100027069 Odontogenic ameloblast-associated protein Human genes 0.000 description 1
- 101710091533 Odontogenic ameloblast-associated protein Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- YNHIGQDRGKUECZ-UHFFFAOYSA-L PdCl2(PPh3)2 Substances [Cl-].[Cl-].[Pd+2].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-L 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 244000025272 Persea americana Species 0.000 description 1
- 235000008673 Persea americana Nutrition 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical class OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- IUHFWCGCSVTMPG-UHFFFAOYSA-N [C].[C] Chemical class [C].[C] IUHFWCGCSVTMPG-UHFFFAOYSA-N 0.000 description 1
- IPBVNPXQWQGGJP-UHFFFAOYSA-N acetic acid phenyl ester Natural products CC(=O)OC1=CC=CC=C1 IPBVNPXQWQGGJP-UHFFFAOYSA-N 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- AEMOLEFTQBMNLQ-BKBMJHBISA-N alpha-D-galacturonic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-BKBMJHBISA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960003121 arginine Drugs 0.000 description 1
- 159000000032 aromatic acids Chemical class 0.000 description 1
- 230000035578 autophosphorylation Effects 0.000 description 1
- 125000002785 azepinyl group Chemical group 0.000 description 1
- 150000007514 bases Chemical class 0.000 description 1
- 239000003637 basic solution Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000005870 benzindolyl group Chemical group 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 125000005875 benzo[b][1,4]dioxepinyl group Chemical group 0.000 description 1
- 125000005876 benzo[b][1,4]oxazinyl group Chemical group 0.000 description 1
- 125000005873 benzo[d]thiazolyl group Chemical group 0.000 description 1
- 125000000928 benzodioxinyl group Chemical group O1C(=COC2=C1C=CC=C2)* 0.000 description 1
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000005878 benzonaphthofuranyl group Chemical group 0.000 description 1
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- MSWZFWKMSRAUBD-UHFFFAOYSA-N beta-D-galactosamine Chemical class NC1C(O)OC(CO)C(O)C1O MSWZFWKMSRAUBD-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229960003237 betaine Drugs 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- BVCRERJDOOBZOH-UHFFFAOYSA-N bicyclo[2.2.1]heptanyl Chemical group C1C[C+]2CC[C-]1C2 BVCRERJDOOBZOH-UHFFFAOYSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M bisulphate group Chemical group S([O-])(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 150000001793 charged compounds Chemical class 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 150000005829 chemical entities Chemical class 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- KVSASDOGYIBWTA-UHFFFAOYSA-N chloro benzoate Chemical compound ClOC(=O)C1=CC=CC=C1 KVSASDOGYIBWTA-UHFFFAOYSA-N 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical class C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 230000008711 chromosomal rearrangement Effects 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 1
- GPWDPLKISXZVIE-UHFFFAOYSA-N cyclo[18]carbon Chemical compound C1#CC#CC#CC#CC#CC#CC#CC#CC#C1 GPWDPLKISXZVIE-UHFFFAOYSA-N 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- AIMMVWOEOZMVMS-UHFFFAOYSA-N cyclopropanecarboxamide Chemical compound NC(=O)C1CC1 AIMMVWOEOZMVMS-UHFFFAOYSA-N 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 210000000172 cytosol Anatomy 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 125000005507 decahydroisoquinolyl group Chemical group 0.000 description 1
- 125000004855 decalinyl group Chemical group C1(CCCC2CCCCC12)* 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 150000001975 deuterium Chemical group 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 125000005509 dibenzothiophenyl group Chemical group 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- CETRZFQIITUQQL-UHFFFAOYSA-N dmso dimethylsulfoxide Chemical compound CS(C)=O.CS(C)=O CETRZFQIITUQQL-UHFFFAOYSA-N 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- XWBDWHCCBGMXKG-UHFFFAOYSA-N ethanamine;hydron;chloride Chemical compound Cl.CCN XWBDWHCCBGMXKG-UHFFFAOYSA-N 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- RMBPEFMHABBEKP-UHFFFAOYSA-N fluorene Chemical group C1=CC=C2C3=C[CH]C=CC3=CC2=C1 RMBPEFMHABBEKP-UHFFFAOYSA-N 0.000 description 1
- 235000019256 formaldehyde Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 125000003844 furanonyl group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 229960002442 glucosamine Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- 125000000262 haloalkenyl group Chemical group 0.000 description 1
- 125000000232 haloalkynyl group Chemical group 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 229960002885 histidine Drugs 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- XGIHQYAWBCFNPY-AZOCGYLKSA-N hydrabamine Chemical class C([C@@H]12)CC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC[C@@]1(C)CNCCNC[C@@]1(C)[C@@H]2CCC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC1 XGIHQYAWBCFNPY-AZOCGYLKSA-N 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 125000000717 hydrazino group Chemical group [H]N([*])N([H])[H] 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- XMBWDFGMSWQBCA-YPZZEJLDSA-N iodane Chemical compound [125IH] XMBWDFGMSWQBCA-YPZZEJLDSA-N 0.000 description 1
- 229940044173 iodine-125 Drugs 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical compound CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 1
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000004628 isothiazolidinyl group Chemical group S1N(CCC1)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 229960003646 lysine Drugs 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 125000005341 metaphosphate group Chemical group 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000005322 morpholin-1-yl group Chemical group 0.000 description 1
- 125000004312 morpholin-2-yl group Chemical group [H]N1C([H])([H])C([H])([H])OC([H])(*)C1([H])[H] 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical compound C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- NOUUUQMKVOUUNR-UHFFFAOYSA-N n,n'-diphenylethane-1,2-diamine Chemical class C=1C=CC=CC=1NCCNC1=CC=CC=C1 NOUUUQMKVOUUNR-UHFFFAOYSA-N 0.000 description 1
- JGOAZQAXRONCCI-UHFFFAOYSA-N n-(benzylideneamino)aniline Chemical compound C=1C=CC=CC=1NN=CC1=CC=CC=C1 JGOAZQAXRONCCI-UHFFFAOYSA-N 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 125000003518 norbornenyl group Chemical group C12(C=CC(CC1)C2)* 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- VIKNJXKGJWUCNN-XGXHKTLJSA-N norethisterone Chemical compound O=C1CC[C@@H]2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 VIKNJXKGJWUCNN-XGXHKTLJSA-N 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Chemical group C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 1
- 125000005060 octahydroindolyl group Chemical group N1(CCC2CCCCC12)* 0.000 description 1
- 125000005061 octahydroisoindolyl group Chemical group C1(NCC2CCCCC12)* 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical compound CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- 231100000590 oncogenic Toxicity 0.000 description 1
- 230000002246 oncogenic effect Effects 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 238000006053 organic reaction Methods 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- 125000005476 oxopyrrolidinyl group Chemical group 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 229940049953 phenylacetate Drugs 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000000587 piperidin-1-yl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000004483 piperidin-3-yl group Chemical group N1CC(CCC1)* 0.000 description 1
- 125000004482 piperidin-4-yl group Chemical group N1CCC(CC1)* 0.000 description 1
- 229920003228 poly(4-vinyl pyridine) Polymers 0.000 description 1
- 229920000768 polyamine Chemical class 0.000 description 1
- 102000054765 polymorphisms of proteins Human genes 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 229940116351 sebacate Drugs 0.000 description 1
- CXMXRPHRNRROMY-UHFFFAOYSA-L sebacate(2-) Chemical compound [O-]C(=O)CCCCCCCCC([O-])=O CXMXRPHRNRROMY-UHFFFAOYSA-L 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- ILJOYZVVZZFIKA-UHFFFAOYSA-M sodium;1,1-dioxo-1,2-benzothiazol-3-olate;hydrate Chemical compound O.[Na+].C1=CC=C2C(=O)[N-]S(=O)(=O)C2=C1 ILJOYZVVZZFIKA-UHFFFAOYSA-M 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- TYFQFVWCELRYAO-UHFFFAOYSA-L suberate(2-) Chemical compound [O-]C(=O)CCCCCCC([O-])=O TYFQFVWCELRYAO-UHFFFAOYSA-L 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical class [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 238000003419 tautomerization reaction Methods 0.000 description 1
- PYUQSGRDHGTLQH-WDEREUQCSA-N tert-butyl (2R,4S)-4-(3-bromo-4-cyano-5-formamidopyrazol-1-yl)-2-(methoxymethyl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(N(C1)[C@@H](COC)C[C@@H]1N(C(NC=O)=C1C#N)N=C1Br)=O PYUQSGRDHGTLQH-WDEREUQCSA-N 0.000 description 1
- PAKXPWAFOPNUHI-VHSXEESVSA-N tert-butyl (2R,4S)-4-(5-amino-3-bromo-4-cyanopyrazol-1-yl)-2-(methoxymethyl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(N(C1)[C@@H](COC)C[C@@H]1N(C(N)=C1C#N)N=C1Br)=O PAKXPWAFOPNUHI-VHSXEESVSA-N 0.000 description 1
- XFWVNFSFKKYDDM-QWHCGFSZSA-N tert-butyl (2R,4S)-4-[3-bromo-4-carbamoyl-5-[methyl-[(2-methylpropan-2-yl)oxycarbonyl]amino]pyrazol-1-yl]-2-(methoxymethyl)pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(N(C)C1=C(C(N)=O)C(Br)=NN1[C@@H](C[C@@H]1COC)CN1C(OC(C)(C)C)=O)=O XFWVNFSFKKYDDM-QWHCGFSZSA-N 0.000 description 1
- FGGZZBDJYMUXDT-RKDXNWHRSA-N tert-butyl (2r,4r)-4-hydroxy-2-(methoxymethyl)pyrrolidine-1-carboxylate Chemical compound COC[C@H]1C[C@@H](O)CN1C(=O)OC(C)(C)C FGGZZBDJYMUXDT-RKDXNWHRSA-N 0.000 description 1
- ISIJQEHRDSCQIU-UHFFFAOYSA-N tert-butyl 2,7-diazaspiro[4.5]decane-7-carboxylate Chemical compound C1N(C(=O)OC(C)(C)C)CCCC11CNCC1 ISIJQEHRDSCQIU-UHFFFAOYSA-N 0.000 description 1
- VXHMHONZYPBQKK-UHFFFAOYSA-N tert-butyl 2-(1,1-difluoroethyl)morpholine-4-carboxylate Chemical compound CC(C)(C)OC(N1CC(C(C)(F)F)OCC1)=O VXHMHONZYPBQKK-UHFFFAOYSA-N 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 229960004559 theobromine Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000005985 thienyl[1,3]dithianyl group Chemical group 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- INQOMBQAUSQDDS-FIBGUPNXSA-N trideuterio(iodo)methane Chemical compound [2H]C([2H])([2H])I INQOMBQAUSQDDS-FIBGUPNXSA-N 0.000 description 1
- GKASDNZWUGIAMG-UHFFFAOYSA-N triethyl orthoformate Chemical compound CCOC(OCC)OCC GKASDNZWUGIAMG-UHFFFAOYSA-N 0.000 description 1
- DTHHVLLPUNOLHA-UHFFFAOYSA-N trimethyl-[2-(1-methylindazol-5-yl)ethynyl]silane Chemical compound CN1N=CC2=CC(C#C[Si](C)(C)C)=CC=C12 DTHHVLLPUNOLHA-UHFFFAOYSA-N 0.000 description 1
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 1
- 125000005455 trithianyl group Chemical group 0.000 description 1
- 238000001665 trituration Methods 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
【解決手段】線維芽細胞増殖因子受容体キナーゼのヘテロアリール阻害剤、前記化合物を含む医薬組成物、および疾患の処置のために前記化合物を使用する方法が本明細書で提供される。【選択図】なし
Description
関連出願の相互参照
本出願は、2020年10月28日に出願された米国特許出願第63/106,812号、および2020年6月5日に出願された米国特許出願第63/035,155号の利益を主張し、これらは両方とも、その全体が参照により本明細書に組み込まれる。
本出願は、2020年10月28日に出願された米国特許出願第63/106,812号、および2020年6月5日に出願された米国特許出願第63/035,155号の利益を主張し、これらは両方とも、その全体が参照により本明細書に組み込まれる。
線維芽細胞増殖因子受容体(FGFR)は、線維芽細胞増殖因子ファミリーのタンパク質のメンバーに結合する受容体型チロシンキナーゼ(RTK)のサブファミリーである。線維芽細胞増殖因子/FGF受容体ネットワークの調節解除は、腫瘍において頻繁に起こる。したがって、がんおよび他の障害の処置に使用するために、異常なFGFRキナーゼ活性を標的とする療法が望ましい。
線維芽細胞増殖因子受容体(FGFR)キナーゼの阻害剤、前記化合物を含む医薬組成物、および疾患の処置のために前記化合物を使用する方法が本明細書で提供される。
1つの実施形態は、式(I)
tは1または2であり、
R1、R2、およびR3は各々、水素、フルオロ、場合により置換されているC1-C4アルキル、または場合により置換されているヘテロシクリルアルキルから独立して選択され、
R4は、場合により置換されている窒素含有9または10個の原子のヘテロアリールであり、
Rは、水素、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、場合により置換されているC3-C7ヘテロシクリルアルキル、場合により置換されているC2-C7アルケニル、-CO2R5、-CONHR5、または-CON(R5)2から選択され、
各R5は、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、または場合により置換されているC3-C7ヘテロシクリルアルキルから独立して選択され、
R6は、場合により置換されているアルキル、場合により置換されているカルボシクリルアルキル、または場合により置換されているヘテロシクリルアルキルである、
化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
1つの実施形態は、式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物、および少なくとも1つの薬学的に許容され得る賦形剤を含む医薬組成物を提供する。
1つの実施形態は、疾患または障害の処置を必要とする患者において疾患または障害を処置する方法であって、式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を患者に投与することを含む、方法を提供する。別の実施形態は、疾患または障害ががんである方法を提供する。
参照による組込み
本明細書で言及されるすべての刊行物、特許、および特許出願は、本明細書で特定される特定の目的のために参照により本明細書に組み込まれる。
本明細書で言及されるすべての刊行物、特許、および特許出願は、本明細書で特定される特定の目的のために参照により本明細書に組み込まれる。
本明細書および添付の特許請求の範囲で使用される場合、単数形「a」、「and」、および「the」は、文脈上他に明確に指示されない限り、複数の指示対象を含む。したがって、例えば、「薬剤(an agent)」への言及は、複数のそのような薬剤を含み、「細胞(the cell)」への言及は、1つまたは複数の細胞(または複数の細胞)および当業者に公知なその等価物などへの言及を含む。分子量などの物理的特性、または化学式などの化学的特性について、範囲が本明細書で使用される場合、その中の範囲および特定の実施形態のすべての組合せおよび部分的組合せが含まれることが意図される。数または数値範囲に言及する場合の「約」という用語は、言及される数または数値範囲が実験的変動性内(または統計的実験誤差内)の近似であることを意味し、したがって数または数値範囲は、場合によっては、記載された数または数値範囲の1%~15%の間で変動し得る。「含む(comprising)」という用語(および「comprise(含む)」または「comprises(含む)」または「having(有する)」または「含む(including)」などの関連する用語)は、他のある特定の実施形態、例えば、本明細書に記載されている任意の物質の組成物、組成物、方法またはプロセスなどの実施形態において、記載された特徴「からなる(consist of)」または「本質的に~からなる(consist essentially of)」ことを排除することを意図しない。
定義
本明細書および添付の特許請求の範囲で使用される場合、反対に指定されない限り、以下の用語は以下に示される意味を有する。
本明細書および添付の特許請求の範囲で使用される場合、反対に指定されない限り、以下の用語は以下に示される意味を有する。
「アミノ」とは、-NH2基を指す。
「シアノ」とは、-CN基を指す。
「ニトロ」とは、-NO2基を指す。
「オキサ」とは、-O-基を指す。
「オキソ」とは、=O基を指す。
「チオキソ」とは、=S基を指す。
「イミノ」とは、=N-H基を指す。
「オキシモ」とは、=N-OH基を指す。
「ヒドラジノ」とは、=N-NH2基を指す。
「アルキル」とは、炭素および水素原子のみからなり、不飽和を含まず、1~15個の炭素原子を有する、直鎖または分岐の炭化水素鎖基(例えば、C1-C15アルキル)を指す。ある特定の実施形態では、アルキルは、1~13個の炭素原子を含む(例えば、C1-C13アルキル)。ある特定の実施形態では、アルキルは、1~8個の炭素原子を含む(例えば、C1-C8アルキル)。他の実施形態では、アルキルは、1~5個の炭素原子を含む(例えば、C1-C5アルキル)。他の実施形態では、アルキルは、1~4個の炭素原子を含む(例えば、C1-C4アルキル)。他の実施形態では、アルキルは、1~3個の炭素原子を含む(例えば、C1-C3アルキル)。他の実施形態では、アルキルは、1~2個の炭素原子を含む(例えば、C1-C2アルキル)。他の実施形態では、アルキルは、1個の炭素原子を含む(例えば、C1アルキル)。他の実施形態では、アルキルは、5~15個の炭素原子を含む(例えば、C5-C15アルキル)。他の実施形態では、アルキルは、5~8個の炭素原子を含む(例えば、C5-C8アルキル)。他の実施形態では、アルキルは、2~5個の炭素原子を含む(例えば、C2-C5アルキル)。他の実施形態では、アルキルは、3~5個の炭素原子を含む(例えば、C3-C5アルキル)。他の実施形態では、アルキル基は、メチル、エチル、1-プロピル(n-プロピル)、1-メチルエチル(イソ-プロピル)、1-ブチル(n-ブチル)、1-メチルプロピル(sec-ブチル)、2-メチルプロピル(イソ-ブチル)、1,1-ジメチルエチル(tert-ブチル)、1-ペンチル(n-ペンチル)から選択される。アルキルは、一重結合によって分子の残りの部分に結合している。本明細書で具体的に別途示されない限り、アルキル基は、以下の置換基の1つまたは複数によって場合により置換されている:ハロ、シアノ、ニトロ、オキソ、チオキソ、イミノ、オキシモ、トリメチルシラニル、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-OC(O)-N(Ra)2、-N(Ra)C(O)Ra、-N(Ra)S(O)tRa(式中、tは1または2である)、-S(O)tORa(式中、tは1または2である)、-S(O)tRa(式中、tは1または2である)および-S(O)tN(Ra)2(式中、tは1または2である)、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、カルボシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、カルボシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)である。
「アルコキシ」とは、式-O-アルキルの酸素原子を介して結合した基を指し、式中、アルキルは上記に定義されるアルキル鎖である。
「アルケニル」とは、炭素および水素原子のみからなり、少なくとも1つの炭素-炭素二重結合を含み、2~12個の炭素原子を有する、直鎖または分岐の炭化水素鎖基(radical group)を指す。ある特定の実施形態では、アルケニルは、2~8個の炭素原子を含む。他の実施形態では、アルケニルは、2~4個の炭素原子を含む。アルケニルは、一重結合によって分子の残りの部分に結合しており、例えば、エテニル(すなわち、ビニル)、プロパ-1-エニル(すなわち、アリル)、ブタ-1-エニル、ペンタ-1-エニル、ペンタ-1,4-ジエニルなどである。本明細書で具体的に別途示されない限り、アルケニル基は、以下の置換基の1つまたは複数によって場合により置換されている:ハロ、シアノ、ニトロ、オキソ、チオキソ、イミノ、オキシモ、トリメチルシラニル、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-OC(O)-N(Ra)2、-N(Ra)C(O)Ra、-N(Ra)S(O)tRa(式中、tは1または2である)、-S(O)tORa(式中、tは1または2である)、-S(O)tRa(式中、tは1または2である)および-S(O)tN(Ra)2(式中、tは1または2である)、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、カルボシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、カルボシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)である。
「アルキニル」とは、炭素および水素原子のみからなり、少なくとも1つの炭素-炭素三重結合を含み、2~12個の炭素原子を有する、直鎖または分岐の炭化水素鎖基(radical group)を指す。ある特定の実施形態では、アルキニルは、2~8個の炭素原子を含む。他の実施形態では、アルキニルは、2~6個の炭素原子を含む。他の実施形態では、アルキニルは、2~4個の炭素原子を含む。アルキニルは、一重結合によって分子の残りの部分に結合しており、例えば、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニルなどである。本明細書で具体的に別途示されない限り、アルキニル基は、以下の置換基の1つまたは複数によって場合により置換されている:ハロ、シアノ、ニトロ、オキソ、チオキソ、イミノ、オキシモ、トリメチルシラニル、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-OC(O)-N(Ra)2、-N(Ra)C(O)Ra、-N(Ra)S(O)tRa(式中、tは1または2である)、-S(O)tORa(式中、tは1または2である)、-S(O)tRa(式中、tは1または2である)および-S(O)tN(Ra)2(式中、tは1または2である)、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、カルボシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、カルボシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)である。
「アルキレン」または「アルキレン鎖」とは、分子の残りの部分を基(radical group)に連結し、炭素および水素のみからなり、不飽和を含まず、1~12個の炭素原子を有する、直鎖または分岐二価炭化水素鎖、例えば、メチレン、エチレン、プロピレン、n-ブチレンなどを指す。アルキレン鎖は、一重結合を介して分子の残りの部分に結合し、一重結合を介して基(radical group)に結合している。分子の残りの部分および基(radical group)に対するアルキレン鎖の結合点は、アルキレン鎖中の1個の炭素または鎖中の任意の2個の炭素を介している。ある特定の実施形態では、アルキレンは、1~8個の炭素原子を含む(例えば、C1-C8アルキレン)。他の実施形態では、アルキレンは、1~5個の炭素原子を含む(例えば、C1-C5アルキレン)。他の実施形態では、アルキレンは、1~4個の炭素原子を含む(例えば、C1-C4アルキレン)。他の実施形態では、アルキレンは、1~3個の炭素原子を含む(例えば、C1-C3アルキレン)。他の実施形態では、アルキレンは、1~2個の炭素原子を含む(例えば、C1-C2アルキレン)。他の実施形態では、アルキレンは、1個の炭素原子を含む(例えば、C1アルキレン)。他の実施形態では、アルキレンは、5~8個の炭素原子を含む(例えば、C5-C8アルキレン)。他の実施形態では、アルキレンは、2~5個の炭素原子を含む(例えば、C2-C5アルキレン)。他の実施形態では、アルキレンは、3~5個の炭素原子を含む(例えば、C3-C5アルキレン)。本明細書で具体的に別途示されない限り、アルキレン鎖は、以下の置換基の1つまたは複数によって場合により置換されている:ハロ、シアノ、ニトロ、オキソ、チオキソ、イミノ、オキシモ、トリメチルシラニル、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-OC(O)-N(Ra)2、-N(Ra)C(O)Ra、-N(Ra)S(O)tRa(式中、tは1または2である)、-S(O)tORa(式中、tは1または2である)、-S(O)tRa(式中、tは1または2である)および-S(O)tN(Ra)2(式中、tは1または2である)、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、カルボシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、カルボシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)である。
「アルケニレン」または「アルケニレン鎖」とは、分子の残りの部分を基(radical group)に連結し、炭素および水素のみからなり、少なくとも1つの炭素-炭素二重結合を含み、2~12個の炭素原子を有する、直鎖または分岐二価炭化水素鎖を指す。アルケニレン鎖は、一重結合を介して分子の残りの部分に結合し、一重結合を介して基(radical group)に結合している。ある特定の実施形態では、アルケニレンは、2~8個の炭素原子を含む(例えば、C2-C8アルケニレン)。他の実施形態では、アルケニレンは、2~5個の炭素原子を含む(例えば、C2-C5アルケニレン)。他の実施形態では、アルケニレンは、2~4個の炭素原子を含む(例えば、C2-C4アルケニレン)。他の実施形態では、アルケニレンは、2~3個の炭素原子を含む(例えば、C2-C3アルケニレン)。他の実施形態では、アルケニレンは、2個の炭素原子を含む(例えば、C2アルケニレン)。他の実施形態では、アルケニレンは、5~8個の炭素原子を含む(例えば、C5-C8アルケニレン)。他の実施形態では、アルケニレンは、3~5個の炭素原子を含む(例えば、C3-C5アルケニレン)。本明細書で具体的に別途示されない限り、アルケニレン鎖は、以下の置換基の1つまたは複数によって場合により置換されている:ハロ、シアノ、ニトロ、オキソ、チオキソ、イミノ、オキシモ、トリメチルシラニル、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-OC(O)-N(Ra)2、-N(Ra)C(O)Ra、-N(Ra)S(O)tRa(式中、tは1または2である)、-S(O)tORa(式中、tは1または2である)、-S(O)tRa(式中、tは1または2である)および-S(O)tN(Ra)2(式中、tは1または2である)、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、カルボシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、カルボシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)である。
「アルキニレン」または「アルキニレン鎖」とは、分子の残りの部分を基(radical group)に連結し、炭素および水素のみからなり、少なくとも1つの炭素-炭素三重結合を含み、2~12個の炭素原子を有する、直鎖または分岐二価炭化水素鎖を指す。アルキニレン鎖は、一重結合を介して分子の残りの部分に結合し、一重結合を介して基(radical group)に結合している。ある特定の実施形態では、アルキニレンは、2~8個の炭素原子を含む(例えば、C2-C8アルキニレン)。他の実施形態では、アルキニレンは、2~5個の炭素原子を含む(例えば、C2-C5アルキニレン)。他の実施形態では、アルキニレンは、2~4個の炭素原子を含む(例えば、C2-C4アルキニレン)。他の実施形態では、アルキニレンは、2~3個の炭素原子を含む(例えば、C2-C3アルキニレン)。他の実施形態では、アルキニレンは、2個の炭素原子を含む(例えば、C2アルキニレン)。他の実施形態では、アルキニレンは、5~8個の炭素原子を含む(例えば、C5-C8アルキニレン)。他の実施形態では、アルキニレンは、3~5個の炭素原子を含む(例えば、C3-C5アルキニレン)。本明細書で具体的に別途示されない限り、アルキニレン鎖は、以下の置換基の1つまたは複数によって場合により置換されている:ハロ、シアノ、ニトロ、オキソ、チオキソ、イミノ、オキシモ、トリメチルシラニル、-ORa、-SRa、-OC(O)-Ra、-N(Ra)2、-C(O)Ra、-C(O)ORa、-C(O)N(Ra)2、-N(Ra)C(O)ORa、-OC(O)-N(Ra)2、-N(Ra)C(O)Ra、-N(Ra)S(O)tRa(式中、tは1または2である)、-S(O)tORa(式中、tは1または2である)、-S(O)tRa(式中、tは1または2である)および-S(O)tN(Ra)2(式中、tは1または2である)、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、カルボシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、カルボシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)である。
「アリール」とは、環炭素原子から水素原子を除去することによって芳香族単環式または多環式炭化水素環系から誘導される基を指す。芳香族単環式または多環式炭化水素環系は、水素および5~18個の炭素原子のみを含み、環系中の環の少なくとも1つは完全に不飽和である、すなわち、Hueckel理論に従って環状の非局在化した(4n+2)π-電子系を含む。アリール基が由来する環系には、ベンゼン、フルオレン、インダン、インデン、テトラリンおよびナフタレンなどの基が含まれるが、これらに限定されない。本明細書で具体的に別途示されない限り、「アリール」という用語または接頭辞「ar-」(例えば、「アラルキル(aralkyl)」)は、アルキル、アルケニル、アルキニル、ハロ、フルオロアルキル、シアノ、ニトロ、場合により置換されているアリール、場合により置換されているアラルキル、場合により置換されているアラルケニル、場合により置換されているアラルキニル、場合により置換されているカルボシクリル、場合により置換されているカルボシクリルアルキル、場合により置換されているヘテロシクリル、場合により置換されているヘテロシクリルアルキル、場合により置換されているヘテロアリール、場合により置換されているヘテロアリールアルキル、-Rb-ORa、-Rb-OC(O)-Ra、-Rb-OC(O)-ORa、-Rb-OC(O)-N(Ra)2、-Rb-N(Ra)2、-Rb-C(O)Ra、-Rb-C(O)ORa、-Rb-C(O)N(Ra)2、-Rb-O-Rc-C(O)N(Ra)2、-Rb-N(Ra)C(O)ORa、-Rb-N(Ra)C(O)Ra、-Rb-N(Ra)S(O)tRa(式中、tは1または2である)、-Rb-S(O)tRa(式中、tは1または2である)、-Rb-S(O)tORa(式中、tは1または2である)および-Rb-S(O)tN(Ra)2(式中、tは1または2である)から独立して選択される1つまたは複数の置換基によって場合により置換されているアリール基を含むことを意味し、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、シクロアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、シクロアルキルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)であり、各Rbは、独立して、直接結合または直鎖もしくは分岐のアルキレンもしくはアルケニレン鎖であり、Rcは、直鎖または分岐のアルキレンまたはアルケニレン鎖であり、上記の置換基の各々は、特に指示しない限り、置換されていない。
「アラルキル」とは、式-Rc-アリールの基を指し、式中、Rcは上記に定義されるアルキレン鎖、例えば、メチレン、エチレンなどである。アラルキル基のアルキレン鎖部分は、アルキレン鎖について上述したように、場合により置換されている。アラルキル基のアリール部分は、アリール基について上述したように、場合により置換されている。
「アラルケニル」とは、式-Rd-アリールの基を指し、式中、Rdは上記に定義されるアルケニレン鎖である。アラルケニル基のアリール部分は、アリール基について上述したように、場合により置換されている。アラルケニル基のアルケニレン鎖部分は、アルケニレン基について上記に定義されるように、場合により置換されている。
「アラルキニル」とは、式-Re-アリールの基を指し、式中、Reは上記に定義されるアルキニレン鎖である。アラルキニル基のアリール部分は、アリール基について上述したように、場合により置換されている。アラルキニル基のアルキニレン鎖部分は、アルキニレン鎖について上記に定義されるように、場合により置換されている。
「アラルコキシ」とは、式-O-Rc-アリールの酸素原子を介して結合した基を指し、式中、Rcは上記に定義されるアルキレン鎖、例えば、メチレン、エチレンなどである。アラルキル基のアルキレン鎖部分は、アルキレン鎖について上述したように、場合により置換されている。アラルキル基のアリール部分は、アリール基について上述したように、場合により置換されている。
「カルボシクリル」とは、炭素および水素原子のみからなる、安定な非芳香族単環式または多環式炭化水素基を指し、3~15個の炭素原子を有する、融合または架橋環系を含む。ある特定の実施形態では、カルボシクリルは、3~10個の炭素原子を含む。他の実施形態では、カルボシクリルは、5~7個の炭素原子を含む。カルボシクリルは、一重結合によって分子の残りの部分に結合している。カルボシクリルは、飽和(すなわち、C-Cの一重結合のみを含む)または不飽和(すなわち、1つまたは複数の二重結合または三重結合を含む)である。完全飽和のカルボシクリル基はまた、「シクロアルキル」と称される。単環式シクロアルキルの例には、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、およびシクロオクチルが含まれる。不飽和のカルボシクリルはまた、「シクロアルケニル」と称される。単環式シクロアルケニルの例には、例えば、シクロペンテニル、シクロヘキセニル、シクロヘプテニル、およびシクロオクテニルが含まれる。多環式カルボシクリル基には、例えば、アダマンチル、ノルボルニル(すなわち、ビシクロ[2.2.1]ヘプタニル)、ノルボルネニル、デカリニル、7,7-ジメチル-ビシクロ[2.2.1]ヘプタニルなどが含まれる。本明細書で具体的に別途示されない限り、「カルボシクリル」という用語は、アルキル、アルケニル、アルキニル、ハロ、フルオロアルキル、オキソ、チオキソ、シアノ、ニトロ、場合により置換されているアリール、場合により置換されているアラルキル、場合により置換されているアラルケニル、場合により置換されているアラルキニル、場合により置換されているカルボシクリル、場合により置換されているカルボシクリルアルキル、場合により置換されているヘテロシクリル、場合により置換されているヘテロシクリルアルキル、場合により置換されているヘテロアリール、場合により置換されているヘテロアリールアルキル、-Rb-ORa、-Rb-OC(O)-Ra、-Rb-OC(O)-ORa、-Rb-OC(O)-N(Ra)2、-Rb-N(Ra)2、-Rb-C(O)Ra、-Rb-C(O)ORa、-Rb-C(O)N(Ra)2、-Rb-O-Rc-C(O)N(Ra)2、-Rb-N(Ra)C(O)ORa、-Rb-N(Ra)C(O)Ra、-Rb-N(Ra)S(O)tRa(式中、tは1または2である)、-Rb-S(O)tRa(式中、tは1または2である)、-Rb-S(O)tORa(式中、tは1または2である)および-Rb-S(O)tN(Ra)2(式中、tは1または2である)から独立して選択される1つまたは複数の置換基によって場合により置換されているカルボシクリル基を含むことを意味し、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、シクロアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、シクロアルキルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)であり、各Rbは、独立して、直接結合または直鎖もしくは分岐のアルキレンもしくはアルケニレン鎖であり、Rcは、直鎖または分岐のアルキレンまたはアルケニレン鎖であり、上記の置換基の各々は、特に指示しない限り、置換されていない。
「カルボシクリルアルキル」とは、式-Rc-カルボシクリルの基を指し、式中、Rcは上記に定義されるアルキレン鎖である。アルキレン鎖およびカルボシクリル基は、上記に定義されるように、場合により置換されている。
「カルボシクリルアルキ二ル」とは、式-Rc-カルボシクリルの基を指し、式中、Rcは上記に定義されるアルキニレン鎖である。アルキニレン鎖およびカルボシクリル基は、上記に定義されるように、場合により置換されている。
「カルボシクリルアルコキシ」とは、式-O-Rc-カルボシクリルの酸素原子を介して結合した基を指し、式中、Rcは上記に定義されるアルキレン鎖である。アルキレン鎖およびカルボシクリル基は、上記に定義されるように、場合により置換されている。
本明細書で使用される場合、「カルボン酸バイオアイソスター」とは、カルボン酸部分と同様の物理的、生物学的および/または化学的特性を示す、官能基または部分を指す。カルボン酸バイオアイソスターの例には、
「ハロ」または「ハロゲン」とは、ブロモ、クロロ、フルオロまたはヨード置換基を指す。
「フルオロアルキル」とは、上記に定義される1つまたは複数のフルオロ基によって置換されている、上記に定義されるアルキル基、例えば、トリフルオロメチル、ジフルオロメチル、フルオロメチル、2,2,2-トリフルオロエチル、1-フルオロメチル-2-フルオロエチルなどを指す。いくつかの実施形態では、フルオロアルキル基のアルキル部分は、アルキル基について上記に定義されるように、場合により置換されている。
「ヘテロシクリル」とは、2~12個の炭素原子と、窒素、酸素および硫黄から選択される1~6個のヘテロ原子とを含む、安定な3~18員の非芳香族環基を指す。本明細書で具体的に別途示されない限り、ヘテロシクリル基は、単環式、二環式、三環式または四環式の環系であり、場合により融合または架橋環系を含む。ヘテロシクリル基中のヘテロ原子は、場合により酸化されている。1個または複数の窒素原子は、存在する場合、場合により四級化されている。ヘテロシクリル基は、部分的または完全に飽和している。ヘテロシクリルは、環(複数可)の任意の原子を介して分子の残りの部分に結合している。そのようなヘテロシクリル基の例には、ジオキソラニル、チエニル[1,3]ジチアニル、デカヒドロイソキノリル、イミダゾリニル、イミダゾリジニル、イソチアゾリジニル、イソオキサゾリジニル、モルホリニル、オクタヒドロインドリル、オクタヒドロイソインドリル、2-オキソピペラジニル、2-オキソピペリジニル、2-オキソピロリジニル、オキサゾリジニル、ピペリジニル、ピペラジニル、4-ピペリドニル、ピロリジニル、ピラゾリジニル、キヌクリジニル、チアゾリジニル、テトラヒドロフリル、トリチアニル、テトラヒドロピラニル、チオモルホリニル、チアモルホリニル、1-オキソ-チオモルホリニル、および1,1-ジオキソ-チオモルホリニルが含まれるが、これらに限定されない。本明細書で具体的に別途示されない限り、「ヘテロシクリル」という用語は、アルキル、アルケニル、アルキニル、ハロ、フルオロアルキル、オキソ、チオキソ、シアノ、ニトロ、場合により置換されているアリール、場合により置換されているアラルキル、場合により置換されているアラルケニル、場合により置換されているアラルキニル、場合により置換されているカルボシクリル、場合により置換されているカルボシクリルアルキル、場合により置換されているヘテロシクリル、場合により置換されているヘテロシクリルアルキル、場合により置換されているヘテロアリール、場合により置換されているヘテロアリールアルキル、-Rb-ORa、-Rb-OC(O)-Ra、-Rb-OC(O)-ORa、-Rb-OC(O)-N(Ra)2、-Rb-N(Ra)2、-Rb-C(O)Ra、-Rb-C(O)ORa、-Rb-C(O)N(Ra)2、-Rb-O-Rc-C(O)N(Ra)2、-Rb-N(Ra)C(O)ORa、-Rb-N(Ra)C(O)Ra、-Rb-N(Ra)S(O)tRa(式中、tは1または2である)、-Rb-S(O)tRa(式中、tは1または2である)、-Rb-S(O)tORa(式中、tは1または2である)および-Rb-S(O)tN(Ra)2(式中、tは1または2である)から選択される1つまたは複数の置換基によって場合により置換されている、上記に定義されるヘテロシクリル基を含むことを意味し、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、シクロアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、シクロアルキルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)であり、各Rbは、独立して、直接結合または直鎖もしくは分岐のアルキレンもしくはアルケニレン鎖であり、Rcは、直鎖または分岐のアルキレンまたはアルケニレン鎖であり、上記の置換基の各々は、特に指示しない限り、置換されていない。
「N-ヘテロシクリル」または「N結合ヘテロシクリル」とは、少なくとも1つの窒素を含む、上記に定義されるヘテロシクリル基を指し、分子の残りの部分に対するヘテロシクリル基の結合点は、ヘテロシクリル基中の窒素原子を介している。N-ヘテロシクリル基は、ヘテロシクリル基について上述したように、場合により置換されている。そのようなN-ヘテロシクリル基の例には、1-モルホリニル、1-ピペリジニル、1-ピペラジニル、1-ピロリジニル、ピラゾリジニル、イミダゾリニル、およびイミダゾリジニルが含まれるが、これらに限定されない。
「C-ヘテロシクリル」または「C結合ヘテロシクリル」とは、少なくとも1個のヘテロ原子を含む、上記に定義されるヘテロシクリル基を指し、分子の残りの部分に対するヘテロシクリル基の結合点は、ヘテロシクリル基中の炭素原子を介している。C-ヘテロシクリル基は、ヘテロシクリル基について上述したように、場合により置換されている。そのようなC-ヘテロシクリル基の例には、2-モルホリニル、2-または3-または4-ピペリジニル、2-ピペラジニル、2-または3-ピロリジニルなどが含まれるが、これらに限定されない。
「ヘテロシクリルアルキル」とは、式-Rc-ヘテロシクリルの基を指し、式中、Rcは上記に定義されるアルキレン鎖である。ヘテロシクリルが窒素含有のヘテロシクリルである場合、ヘテロシクリルは、窒素原子においてアルキル基に場合により結合している。ヘテロシクリルアルキル基のアルキレン鎖は、アルキレン鎖について上記に定義されるように、場合により置換されている。ヘテロシクリルアルキル基のヘテロシクリル部分は、ヘテロシクリル基について上記に定義されるように、場合により置換されている。
「ヘテロシクリルアルコキシ」とは、式-O-Rc-ヘテロシクリルの酸素原子を介して結合した基を指し、式中、Rcは上記に定義されるアルキレン鎖である。ヘテロシクリルが窒素含有のヘテロシクリルである場合、ヘテロシクリルは、窒素原子においてアルキル基に場合により結合している。ヘテロシクリルアルコキシ基のアルキレン鎖は、アルキレン鎖について上記に定義されるように、場合により置換されている。ヘテロシクリルアルコキシ基のヘテロシクリル部分は、ヘテロシクリル基について上記に定義されるように、場合により置換されている。
「ヘテロアリール」とは、2~17個の炭素原子と、窒素、酸素および硫黄から選択される1~6個のヘテロ原子とを含む、3~18員の芳香環基に由来する基を指す。本明細書で使用される場合、ヘテロアリール基は、環系中の環の少なくとも1つは完全に不飽和である、単環式、二環式、三環式または四環式環系である、すなわち、Hueckel理論に従って環状の非局在化した(4n+2)π-電子系を含む。ヘテロアリールには、融合または架橋環系が含まれる。ヘテロアリール基中のヘテロ原子(複数可)は、場合により酸化されている。1個または複数の窒素原子は、存在する場合、場合により四級化されている。ヘテロアリールは、環(複数可)の任意の原子を介して分子の残りの部分に結合している。ヘテロアリールの例には、アゼピニル、アクリジニル、ベンゾイミダゾリル、ベンゾインドリル、1,3-ベンゾジオキソリル、ベンゾフラニル、ベンゾオキサゾリル、ベンゾ[d]チアゾリル、ベンゾチアジアゾリル、ベンゾ[b][1,4]ジオキセピニル、ベンゾ[b][1,4]オキサジニル、1,4-ベンゾジオキサニル、ベンゾナフトフラニル、ベンゾオキサゾリル、ベンゾジオキソリル、ベンゾジオキシニル、ベンゾピラニル、ベンゾピラノニル、ベンゾフラニル、ベンゾフラノニル、ベンゾチエニル(ベンゾチオフェニル)、ベンゾチエノ[3,2-d]ピリミジニル、ベンゾトリアゾリル、ベンゾ[4,6]イミダゾ[1,2-a]ピリジニル、カルバゾリル、シノリニル、シクロペンタ[d]ピリミジニル、6,7-ジヒドロ-5H-シクロペンタ[4,5]チエノ[2,3-d]ピリミジニル、5,6-ジヒドロベンゾ[h]キナゾリニル、5,6-ジヒドロベンゾ[h]シンノリニル、6,7-ジヒドロ-5H-ベンゾ[6,7]シクロヘプタ[1,2-c]ピリダジニル、ジベンゾフラニル、ジベンゾチオフェニル、フラニル、フラノニル、フロ[3,2-c]ピリジニル、5,6,7,8,9,10-ヘキサヒドロシクロオクタ[d]ピリミジニル、5,6,7,8,9,10-ヘキサヒドロシクロオクタ[d]ピリダジニル、5,6,7,8,9,10-ヘキサヒドロシクロオクタ[d]ピリジニル、イソチアゾリル、イミダゾリル、インダゾリル、インドリル、インダゾリル、イソインドリル、インドリニル、イソインドリニル、イソキノリル、インドリジニル、イソオキサゾリル、5,8-メタノ-5,6,7,8-テトラヒドロキナゾリニル、ナフチリジニル、1,6-ナフチリジノニル、オキサジアゾリル、2-オキソアゼピニル、オキサゾリル、オキシラニル、5,6,6a,7,8,9,10,10a-オクタヒドロベンゾ[h]キナゾリニル、1-フェニル-1H-ピロリル、フェナジニル、フェノチアジニル、フェノキサジニル、フタラジニル、プテリジニル、プリニル、ピロリル、ピラゾリル、ピラゾロ[3,4-d]ピリミジニル、ピリジニル、ピリド[3,2-d]ピリミジニル、ピリド[3,4-d]ピリミジニル、ピラジニル、ピリミジニル、ピリダジニル、ピロリル、キナゾリニル、キノキサリニル、キノリニル、イソキノリニル、テトラヒドロキノリニル、5,6,7,8-テトラヒドロキナゾリニル、5,6,7,8-テトラヒドロベンゾ[4,5]チエノ[2,3-d]ピリミジニル、6,7,8,9-テトラヒドロ-5H-シクロヘプタ[4,5]チエノ[2,3-d]ピリミジニル、5,6,7,8-テトラヒドロピリド[4,5-c]ピリダジニル、チアゾリル、チアジアゾリル、トリアゾリル、テトラゾリル、トリアジニル、チエノ[2,3-d]ピリミジニル、チエノ[3,2-d]ピリミジニル、チエノ[2,3-c]プリジニル、およびチオフェニル(すなわち、チエニル)が含まれるが、これらに限定されない。本明細書で具体的に別途示されない限り、「ヘテロアリール」という用語は、アルキル、アルケニル、アルキニル、ハロ、フルオロアルキル、ハロアルケニル、ハロアルキニル、オキソ、チオキソ、シアノ、ニトロ、場合により置換されているアリール、場合により置換されているアラルキル、場合により置換されているアラルケニル、場合により置換されているアラルキニル、場合により置換されているカルボシクリル、場合により置換されているカルボシクリルアルキル、場合により置換されているヘテロシクリル、場合により置換されているヘテロシクリルアルキル、場合により置換されているヘテロアリール、場合により置換されているヘテロアリールアルキル、-Rb-ORa、-Rb-OC(O)-Ra、-Rb-OC(O)-ORa、-Rb-OC(O)-N(Ra)2、-Rb-N(Ra)2、-Rb-C(O)Ra、-Rb-C(O)ORa、-Rb-C(O)N(Ra)2、-Rb-O-Rc-C(O)N(Ra)2、-Rb-N(Ra)C(O)ORa、-Rb-N(Ra)C(O)Ra、-Rb-N(Ra)S(O)tRa(式中、tは1または2である)、-Rb-S(O)tRa(式中、tは1または2である)、-Rb-S(O)tORa(式中、tは1または2である)および-Rb-S(O)tN(Ra)2(式中、tは1または2である)から選択される1つまたは複数の置換基によって場合により置換されている、上記に定義されるヘテロアリール基を含むことを意味し、ここで、各Raは、独立して、水素、アルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、フルオロアルキル、シクロアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、シクロアルキルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、アラルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロシクリルアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、ヘテロアリール(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)、またはヘテロアリールアルキル(ハロゲン、ヒドロキシ、メトキシ、またはトリフルオロメチルで場合により置換されている)であり、各Rbは、独立して、直接結合または直鎖もしくは分岐のアルキレンもしくはアルケニレン鎖であり、Rcは、直鎖または分岐のアルキレンまたはアルケニレン鎖であり、上記の置換基の各々は、特に指示しない限り、置換されていない。
「N-ヘテロアリール」とは、少なくとも1つの窒素を含む、上記に定義されるヘテロアリール基を指し、分子の残りの部分に対するヘテロアリール基の結合点は、ヘテロアリール基中の窒素原子を介している。N-ヘテロアリール基は、ヘテロアリール基について上述したように、場合により置換されている
「C-ヘテロアリール」とは、上記に定義されるヘテロアリール基を指し、分子の残りの部分に対するヘテロアリール基の結合点は、ヘテロアリール基中の炭素原子を介している。C-ヘテロアリール基は、ヘテロアリール基について上述したように、場合により置換されている
「ヘテロアリールアルキル」とは、式-Rc-ヘテロアリールの基を指し、式中、Rcは上記に定義されるアルキレン鎖である。ヘテロアリールが窒素含有のヘテロアリールである場合、ヘテロアリールは、窒素原子においてアルキル基に場合により結合している。ヘテロアリールアルキル基のアルキレン鎖は、アルキレン鎖について上記に定義されるように、場合により置換されている。ヘテロアリールアルキル基のヘテロアリール部分は、ヘテロアリール基について上記に定義されるように、場合により置換されている。
「ヘテロアリールアルコキシ」とは、式-O-Rc-ヘテロアリールの酸素原子を介して結合した基を指し、式中、Rcは上記に定義されるアルキレン鎖である。ヘテロアリールが窒素含有のヘテロアリールである場合、ヘテロアリールは、窒素原子においてアルキル基に場合により結合している。ヘテロアリールアルコキシ基のアルキレン鎖は、アルキレン鎖について上記に定義されるように、場合により置換されている。ヘテロアリールアルコキシ基のヘテロアリール部分は、ヘテロアリール基について上記に定義されるように、場合により置換されている。
本明細書に開示されている化合物は、いくつかの実施形態では、1つまたは複数の不斉中心を含み、したがって、絶対立体化学に関して(R)-または(S)-として定義されるエナンチオマー、ジアステレオマー、および他の立体異性体形態を生じる。別途示されない限り、本明細書に開示されている化合物のすべての立体異性体形態が本開示によって企図されることが意図される。本明細書に記載の化合物がアルケン二重結合を含む場合、特に明記しない限り、本開示はEおよびZ幾何異性体(例えば、シスまたはトランス)の両方を含むことが意図される。同様に、すべての可能な異性体、ならびにそれらのラセミおよび光学的に純粋な形態、ならびにすべての互変異性体形態が含まれることも意図される。「幾何異性体」という用語は、アルケン二重結合のEまたはZ幾何異性体(例えば、シスまたはトランス)を指す。「位置異性体」という用語は、ベンゼン環の周りのオルト-、メタ-、およびパラ-異性体などの中心環の周りの構造異性体を指す。
「互変異性体」とは、分子のある原子から同じ分子の別の原子へのプロトンシフトが可能な分子を指す。本明細書に提示されている化合物は、ある特定の実施形態では、互変異性体として存在する。互変異性化が可能な状況では、互変異性体の化学平衡が存在し得る。互変異性体の正確な比は、物理的状態、温度、溶媒、およびpHを含むいくつかの要因に依存する。互変異性平衡のいくつかの例には、
本明細書に開示されている化合物は、いくつかの実施形態では、例えば、2H、3H、11C、13Cおよび/または14Cの含有量が濃縮された様々な濃縮同位体形態で使用される。特定の一実施形態では、化合物は少なくとも1つの位置で重水素化されている。そのような重水素化形態は、米国特許第5,846,514号および同第6,334,997号に記載されている手順によって作製することができる。米国特許第5,846,514号および同第6,334,997号に記載されているように、重水素化は代謝安定性および または有効性を改善することができ、したがって薬物の作用の持続時間を増加させることができる。
別途示されない限り、本明細書に示されている構造は、1つまたは複数の同位体濃縮された原子の存在においてのみ異なる化合物を含むことが意図される。例えば、重水素もしくはトリチウムによる水素の置換え、または13Cもしくは14C濃縮された炭素による炭素の置換えを除いて、同構造を有する化合物は、本開示の範囲内である。
本開示の化合物は、場合により、そのような化合物を構成する1個または複数の原子に非天然割合の原子同位体を含む。例えば、化合物は、例えば、重水素(2H)、トリチウム(3H)、ヨウ素-125(125I)または炭素-14(14C)などの同位体で標識されてもよい。2H、11C、13C、14C、15C、12N、13N、15N、16N、16O、17O、14F、15F、16F、17F、18F、33S、34S、35S、36S、35Cl、37Cl、79Br、81Br、125Iによる同位体置換が、すべて企図される。いくつかの実施形態では、18Fによる同位体置換が企図される。本発明の化合物のすべての同位体変種は、放射性であるか否かにかかわらず、本発明の範囲内に包含される。
ある特定の実施形態では、本明細書に開示されている化合物は、1H原子の一部または全部が2H原子で置き換えられている。重水素含有化合物の合成方法は当技術分野で公知であり、単なる非限定的な例として、以下の合成方法が含まれる。
重水素置換された化合物は、Dean,Dennis C.;Editor.Recent Advances in the Synthesis and Applications of Radiolabeled Compounds for Drug Discovery and Development.[Curr.,Pharm.Des.,2000;6(10)]2000,110 pp;George W.;Varma,Rajender S.The Synthesis of Radiolabeled Compounds via Organometallic Intermediates,Tetrahedron,1989,45(21),6601-21、およびEvans,E.Anthony.Synthesis of radiolabeled compounds,J.Radioanal.Chem.,1981,64(1-2),9-32に記載されているような様々な方法を使用して合成される。
重水素化された出発物質は容易に入手可能であり、重水素含有化合物の合成を実現するために、本明細書に記載の合成方法に供される。多数の重水素含有試薬およびビルディングブロックが、Aldrich Chemical Co.などの化学供給業者から市販されている。
ヨードメタン-d3(CD3I)などの求核置換反応での使用に適した重水素移動試薬は容易に入手可能であり、求核置換反応条件下で重水素置換炭素原子を反応基質に移動させるために用いることができる。CD3Iの使用は、単なる例として、以下の反応スキームに示されている。
重水素移動試薬、例えば、リチウムアルミニウムジュウテリド(LiAlD4)を用いて、還元条件下で重水素を反応基質に移動させる。LiAlD4の使用は、単なる例として、以下の反応スキームに示されている。
重水素ガスおよびパラジウム触媒は、単なる例として、以下の反応スキームにおいて示されているように、不飽和炭素-炭素連結を還元し、アリール炭素-ハロゲン結合の還元的置換を行うために用いられる。
一実施形態では、本明細書に開示されている化合物は、1個の重水素原子を含む。別の実施形態では、本明細書に開示されている化合物は、2個の重水素原子を含む。別の実施形態では、本明細書に開示されている化合物は、3個の重水素原子を含む。別の実施形態では、本明細書に開示されている化合物は、4個の重水素原子を含む。別の実施形態では、本明細書に開示されている化合物は、5個の重水素原子を含む。別の実施形態では、本明細書に開示されている化合物は、6個の重水素原子を含む。別の実施形態では、本明細書に開示されている化合物は、6個を超える重水素原子を含む。別の実施形態では、本明細書に開示されている化合物は、重水素原子で完全に置換されており、交換不可能な1H水素原子を含まない。一実施形態では、重水素取込みのレベルは、重水素化合成ビルディングブロックが出発材料として使用される合成方法によって決定される。
「薬学的に許容され得る塩」は、酸付加塩および塩基付加塩の両方を含む。本明細書に記載されている線維芽細胞増殖因子受容体(FGFR)化合物の阻害剤のいずれか1つの薬学的に許容され得る塩は、任意のおよびすべての薬学的に適切な塩形態を包含することが意図される。本明細書に記載されている化合物の好ましい薬学的に許容され得る塩は、薬学的に許容され得る酸付加塩および薬学的に許容され得る塩基付加塩である。
「薬学的に許容され得る酸付加塩」とは、遊離塩基の生物学的有効性および特性を保持し、生物学的にまたは他の点で望ましくないことがなく、塩酸、臭化水素酸、硫酸、硝酸、リン酸、ヨウ化水素酸、フッ化水素酸、亜リン酸などの無機酸で形成される塩を指す。脂肪族モノ-およびジカルボン酸、フェニル置換されたアルカン酸、ヒドロキシアルカン酸、アルカン二酸、芳香族酸、脂肪族および芳香族スルホン酸など(例えば、酢酸、トリフルオロ酢酸、プロピオン酸、グリコール酸、ピルビン酸、シュウ酸、マレイン酸、マロン酸、コハク酸、フマル酸、酒石酸、クエン酸、安息香酸、桂皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、p-トルエンスルホン酸、サリチル酸などを含む)で形成される塩も含まれる。したがって、例示的な塩には、硫酸塩、ピロ硫酸塩、重硫酸塩、亜硫酸塩、重亜硫酸塩、硝酸塩、リン酸塩、リン酸一水素塩、リン酸二水素塩、メタリン酸塩、ピロリン酸塩、塩化物、臭化物、ヨウ化物、酢酸塩、トリフルオロ酢酸塩、プロピオン酸塩、カプリル酸塩、イソブチレート、シュウ酸塩、マロン酸塩、コハク酸塩 スベリン酸塩、セバシン酸塩、フマル酸塩、マレイン酸塩、マンデル酸塩、安息香酸塩、クロロ安息香酸塩、メチル安息香酸塩、ジニトロ安息香酸塩、フタル酸塩、ベンゼンスルホン酸塩、トルエンスルホン酸塩、フェニル酢酸塩、クエン酸塩、乳酸塩、リンゴ酸塩、酒石酸塩、メタンスルホン酸塩などが含まれる。アミノ酸の塩、例えば、アルギネート、グルコネート、およびガラクツロネートも企図される(例えば、Berge S.M.et al.「Pharmaceutical Salts」Journal of Pharmaceutical Science,66:1-19(1997)を参照)。塩基性化合物の酸付加塩は、いくつかの実施形態では、当業者によく知られている方法および技術に従って、遊離塩基形態を十分な量の所望の酸と接触させて塩を生成することによって調製される。
「薬学的に許容され得る塩基付加塩」はと、遊離酸の生物学的有効性および特性を保持し、生物学的にまたは他の点で望ましくないものではない塩を指す。これらの塩は、無機塩基または有機塩基を遊離酸に添加することによって調製される。薬学的に許容され得る塩基付加塩は、いくつかの実施形態では、アルカリおよびアルカリ土類金属または有機アミンなどの金属またはアミンで形成される。無機塩基から誘導される塩には、ナトリウム、カリウム、リチウム、アンモニウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、アルミニウム塩などが含まれるが、これらに限定されない。有機塩基から誘導される塩には、第一級、第二級、および第三級アミン、天然に存在する置換アミンを含む置換アミン、環状アミンおよび塩基性イオン交換樹脂、例えば、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、エタノールアミン、ジエタノールアミン、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、ジシクロヘキシルアミン、リジン、アルギニン、ヒスチジン、カフェイン、プロカイン、N,N-ジベンジルエチレンジアミン、クロロプロカイン、ヒドラバミン、コリン、ベタイン、エチレンジアミン、エチレンジアニリン、N-メチルグルカミン、グルコサミン、メチルグルカミン、テオブロミン、プリン、ピペラジン、ピペリジン、N-エチルピペリジン、ポリアミン樹脂などの塩が含まれるが、これらに限定されない。上記のBerge et al.を参照されたい。
「薬学的に許容され得る溶媒和物」とは、溶媒付加形態である物質の組成物を指す。いくつかの実施形態では、溶媒和物は、化学量論量または非化学量論量の溶媒を含み、水、エタノールなどの薬学的に許容され得る溶媒を用いて作製するプロセス中に形成される。溶媒が水である場合には水和物が形成され、溶媒がアルコールである場合にはアルコレートが形成される。本明細書に記載されている化合物の溶媒和物は、本明細書に記載されているプロセス中に都合よく調製または形成される。本明細書で提供される化合物は、場合により、非溶媒和形態および溶媒和形態のいずれかで存在する。
「対象」または「患者」という用語は哺乳動物を包含する。哺乳動物の例には、哺乳動物クラスの任意のメンバー:ヒト、非ヒト霊長類、例えば、チンパンジー、ならびに他の類人猿およびサル種、農場の動物、例えば、ウシ、ウマ、ヒツジ、ヤギ、ブタ、家畜、例えば、ウサギ、イヌ、およびネコ、げっ歯類を含む実験動物、例えば、ラット、マウスおよびモルモットなどが含まれるが、これらに限定されない。一態様では、哺乳動物はヒトである。
「対象」または「患者」という用語は哺乳動物を包含する。哺乳動物の例には、哺乳動物クラスの任意のメンバー:ヒト、非ヒト霊長類、例えば、チンパンジー、ならびに他の類人猿およびサル種、農場の動物、例えば、ウシ、ウマ、ヒツジ、ヤギ、ブタ、家畜、例えば、ウサギ、イヌ、およびネコ、げっ歯類を含む実験動物、例えば、ラット、マウスおよびモルモットなどが含まれるが、これらに限定されない。一態様では、哺乳動物はヒトである。
本明細書で使用される場合、「処置(treatment)」または「処置すること(treating)」または「緩和すること(palliating)」または「改善すること(ameliorating)」は互換的に使用される。これらの用語は、治療上の利益および/または予防(prophylactic)上の利益を含むがこれらに限定されない、有益なまたは所望の結果を得るためのアプローチを指す。「治療上の利益」とは、処置される原因障害の根絶または改善を意味する。また、患者が原因障害に依然として罹患している場合でも、患者において改善が観察されるように、原因障害に関連する生理学的症候の1つまたは複数の根絶または改善によって治療上の利益は達成される。予防(prophylactic)上の利益のために、組成物は、いくつかの実施形態では、特定の疾患を発症するリスクがある患者、または疾患の診断がなされていなくても、疾患の生理学的症候の1つまたは複数を報告する患者に投与される。
線維芽細胞増殖因子受容体(FGFR)
線維芽細胞増殖因子受容体(FGFR)は、線維芽細胞増殖因子ファミリーのタンパク質のメンバーに結合する受容体型チロシンキナーゼ(RTK)のサブファミリーである。FGFR遺伝子は、一般に、18個のエクソンを含み、同様のエクソン-イントロン構成を有し、FGF遺伝子位置への明らかな連結を伴わずにゲノム全体にランダムに分散している。FGFRは、発生を通して成体期まで組織特異的様式で差次的に発現され、細胞外リガンド結合ドメイン、単一膜貫通ドメイン、および分割された細胞内キナーゼドメインを含む。細胞外領域は、FGF結合に関与する2~3つの免疫グロブリン(Ig)様ドメインを含む。これらのIg様ドメインは、リガンド親和性およびリガンド特異性の両方を調節する。細胞内領域は、FGFRチロシンキナーゼ活性を担う機能的ドメイン、ならびに受容体分子のタンパク質結合およびリン酸化または自己リン酸化において役割を果たすさらなる部位を有する。線維芽細胞増殖因子受容体の薬理学は、Porta et al.(Critical Reviews in Oncology/Hematology 113(2017)256-67)ならびにBabina and Turner(Nature Review-Cancer 2017 doi:10.1038/nrc.2017.8)によって科学文献に概説されている。
線維芽細胞増殖因子受容体(FGFR)は、線維芽細胞増殖因子ファミリーのタンパク質のメンバーに結合する受容体型チロシンキナーゼ(RTK)のサブファミリーである。FGFR遺伝子は、一般に、18個のエクソンを含み、同様のエクソン-イントロン構成を有し、FGF遺伝子位置への明らかな連結を伴わずにゲノム全体にランダムに分散している。FGFRは、発生を通して成体期まで組織特異的様式で差次的に発現され、細胞外リガンド結合ドメイン、単一膜貫通ドメイン、および分割された細胞内キナーゼドメインを含む。細胞外領域は、FGF結合に関与する2~3つの免疫グロブリン(Ig)様ドメインを含む。これらのIg様ドメインは、リガンド親和性およびリガンド特異性の両方を調節する。細胞内領域は、FGFRチロシンキナーゼ活性を担う機能的ドメイン、ならびに受容体分子のタンパク質結合およびリン酸化または自己リン酸化において役割を果たすさらなる部位を有する。線維芽細胞増殖因子受容体の薬理学は、Porta et al.(Critical Reviews in Oncology/Hematology 113(2017)256-67)ならびにBabina and Turner(Nature Review-Cancer 2017 doi:10.1038/nrc.2017.8)によって科学文献に概説されている。
FGFRファミリーは、FGFR1、FGFR2、FGFR3、およびFGFR4の4つのファミリーメンバーを含むが、4つのメンバーは、一次転写物の選択的スプライシングを介して複数の受容体アイソフォームを産生することができる。FGFシグナル伝達チロシンキナーゼドメインを欠く密接に関連した受容体FGFR5(FGFRL1としても公知)が、最近、線維芽細胞増殖因子(FGF)として公知のFGFR結合リガンドとの相互作用に基づいて発見された(Trueb B.Biology of FGFRL1,the fifth fibroblast growth factor receptor.Cell Mol Life Sci.2011;68(6):951-964)。まとめると、FGFRシグナル伝達は、細胞増殖、増殖(proliferation)、分化および生存などの複数の細胞カスケードおよび応答の活性化に関連している(Thisse B et al.Functions and regulations of fibroblast growth factor signaling during embryonic development.Dev Biol.2005;287(2):390-402;Wesche J et al.Fibroblast growth factors and their receptors in cancer.Biochem J.2011;437(2):199-213;Haugsten EM et al.Roles of fibroblast growth factor receptors in carcinogenesis.Mol Cancer Res.2010;8(11):1439-1452)。
多数のヒト病理学的症状がFGFRシグナル伝達の調節解除に関連している。異常なFGFRシグナル伝達は、遺伝子増幅、機能獲得コード変異、遺伝子融合、一塩基多型(SNP)、リガンドの利用可能性およびFGF媒介シグナル伝達の終結プログラムの障害を含むいくつかの基礎となる機構に大きく起因する(Tiong KH et al.Functional roles of fibroblast growth factor receptors(FGFRs)signaling in human cancers.Apoptosis.2013;18(12):1447-68)。さらに、FGFRが選択的スプライシングを受け、異なる状況下で腫瘍形成を促進または抑制し得る複数のアイソフォームを生じるという事実によって、さらなる複雑さの層が追加されている。
FGFR融合物
ヒトがんにおけるFGFR融合物は、血液悪性腫瘍における染色体転座によって引き起こされる1型融合物と、固形腫瘍における染色体再編成によって引き起こされる2型融合物とに分類される(FGFR inhibitors:Effects on cancer cells,tumor microenvironment and whole-body homeostasis(Review).Int J Mol Med.2016;38(1):3-15))。両方のタイプのFGFR融合タンパク質は、リガンド非依存性二量体化および/または異常な基質の動員のための融合パートナーからのタンパク質-タンパク質相互作用モジュールの獲得を通じて、発癌可能性を付与される。ヒトFGFR融合タンパク質は、一般に、2つの主要なセグメントからなり、前部は、パートナー遺伝子由来の二量体化ドメインであり、後部にはチロシンキナーゼドメインである(Garcia-Closas M et al.Heterogeneity of breast cancer associations with five susceptibility loci by clinical and pathological characteristics.PLoS Genet.2008;4(4):e1000054)。野生型受容体とは異なり、変異型FGFRは細胞内に発現され、細胞質ゾルに保持されるため、典型的な受容体分解プロセスを回避し、活性化シグナルをさらに延長する。
ヒトがんにおけるFGFR融合物は、血液悪性腫瘍における染色体転座によって引き起こされる1型融合物と、固形腫瘍における染色体再編成によって引き起こされる2型融合物とに分類される(FGFR inhibitors:Effects on cancer cells,tumor microenvironment and whole-body homeostasis(Review).Int J Mol Med.2016;38(1):3-15))。両方のタイプのFGFR融合タンパク質は、リガンド非依存性二量体化および/または異常な基質の動員のための融合パートナーからのタンパク質-タンパク質相互作用モジュールの獲得を通じて、発癌可能性を付与される。ヒトFGFR融合タンパク質は、一般に、2つの主要なセグメントからなり、前部は、パートナー遺伝子由来の二量体化ドメインであり、後部にはチロシンキナーゼドメインである(Garcia-Closas M et al.Heterogeneity of breast cancer associations with five susceptibility loci by clinical and pathological characteristics.PLoS Genet.2008;4(4):e1000054)。野生型受容体とは異なり、変異型FGFRは細胞内に発現され、細胞質ゾルに保持されるため、典型的な受容体分解プロセスを回避し、活性化シグナルをさらに延長する。
線維芽細胞増殖因子(FGF)/FGF受容体(FGFR)ネットワークの調節解除は腫瘍において頻繁に起こり、その結果、いくつかの基礎研究、前臨床研究、および臨床研究の焦点として、FGF/FGFR標的化療法の開発をもたらしている。
ヘテロ芳香族FGFR阻害性化合物
一態様では、ヘテロ芳香族FGFR阻害性化合物が本明細書で提供される。
一態様では、ヘテロ芳香族FGFR阻害性化合物が本明細書で提供される。
1つの実施形態は、式(I)
tは1または2であり、
R1、R2、およびR3は各々、水素、フルオロ、場合により置換されているC1-C4アルキル、または場合により置換されているヘテロシクリルアルキルから独立して選択され、
R4は、場合により置換されている窒素含有9または10個の原子のヘテロアリールであり、
Rは、水素、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、場合により置換されているC3-C7ヘテロシクリルアルキル、場合により置換されているC2-C7アルケニル、-CO2R5、-CONHR5、または-CON(R5)2から選択され、
各R5は、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、または場合により置換されているC3-C7ヘテロシクリルアルキルから独立して選択され、
R6は、場合により置換されているアルキル、場合により置換されているカルボシクリルアルキル、または場合により置換されているヘテロシクリルアルキルである、
化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、Zが
別の実施形態は、R4が、場合により置換されているベンズイミダゾール、場合により置換されている1H-インダゾール、場合により置換されている2H-インダゾール、場合により置換されているベンゾトリアゾール、場合により置換されているベンゾオキサゾール、場合により置換されているイミダゾ[4,5-c]ピリジン、または場合により置換されているイミダゾ[4,5-b]ピリジンから選択される、場合により置換されている窒素含有9または10個の原子のヘテロアリールから選択される、式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が、キノリン、キノキサリン、ピラゾロ[1,5-a]ピリミジン、イミダゾ[1,2-a]ピリジン、ピラゾロ[1,5-a]ピリジン、イミダゾ[1,2-a]ピリミジン、イミダゾ[1,2-b]ピリダジン、またはピラゾロ[1,5-a]ピリジンから選択される、場合により置換されている窒素含有9または10個の原子のヘテロアリールから選択される、式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が場合により置換されているベンズイミダゾールである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が場合により置換されている1H-インダゾールである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が場合により置換されている2H-インダゾールである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が、場合により置換されているベンゾオキサゾール、場合により置換されているイミダゾ[4,5-c]ピリジン、または場合により置換されているイミダゾ[4,5-b]ピリジンである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されている窒素含有9または10個の原子のヘテロアリールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されているベンズイミダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されている1H-インダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されている2H-インダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、Rが水素である式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC1-C6アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7カルボシクリルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7カルボシクリルアルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7ヘテロシクリルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7ヘテロシクリルアルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが-CO2R5である化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが-CONHR5または-CON(R5)2である化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されているC1-C6アルキルが、C1-C3アルコキシで置換されているC1-C3アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R6が場合により置換されているアルキルである式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1-C4アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1-C3アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1-C2アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6がCH3である化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R6が場合により置換されているカルボシクリルアルキルである式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているカルボシクリルメチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されている(C3-C6カルボシクリル)メチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているシクロプロピルメチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているヘテロシクリルアルキルである式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているヘテロシクリルエチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているヘテロシクリルエチルであり、ヘテロシクリルが、ピペリジニル、ピロリジニル、モルホリニル、またはピペラジニルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールである式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールであり、Rが-CH2OCH3基であり、R6がメチルである式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールであり、Rが水素であり、R6がメチルである式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
1つの実施形態は、式(II)
tは1または2であり、
R1、R2、およびR3は各々、水素、フルオロ、場合により置換されているC1-C4アルキル、または場合により置換されているヘテロシクリルアルキルから独立して選択され、
R4は、場合により置換されている窒素含有9または10個の原子のヘテロアリールであり、
Rは、水素、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、場合により置換されているC3-C7ヘテロシクリルアルキル、場合により置換されているC2-C7アルケニル、-CO2R5、-CONHR5、または-CON(R5)2から選択され、
各R5は、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、または場合により置換されているC3-C7ヘテロシクリルアルキルから独立して選択され、
R6は、水素、場合により置換されているアルキル、場合により置換されているカルボシクリル、場合により置換されているカルボシクリルアルキル、または場合により置換されているヘテロシクリルアルキルである、
化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、nが0である式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、nが1である式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、nが1であり、ピロリジン環に対する立体化学がシスである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、nが1であり、ピロリジン環に対する立体化学がトランスである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、Zが
別の実施形態は、R4が、場合により置換されているベンズイミダゾール、場合により置換されている1H-インダゾール、場合により置換されている2H-インダゾール、場合により置換されているベンゾトリアゾール、場合により置換されているベンゾオキサゾール、場合により置換されているイミダゾ[4,5-c]ピリジン、または場合により置換されているイミダゾ[4,5-b]ピリジンから選択される、場合により置換されている窒素含有9または10個の原子のヘテロアリールから選択される式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が、キノリン、キノキサリン、ピラゾロ[1,5-a]ピリミジン、イミダゾ[1,2-a]ピリジン、ピラゾロ[1,5-a]ピリジン、イミダゾ[1,2-a]ピリミジン、イミダゾ[1,2-b]ピリダジン、またはピラゾロ[1,5-a]ピリジンから選択される、場合により置換されている窒素含有9または10個の原子のヘテロアリールから選択される式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が場合により置換されているベンズイミダゾールである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が場合により置換されている1H-インダゾールである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が場合により置換されている2H-インダゾールである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R4が、場合により置換されているベンゾオキサゾール、場合により置換されているイミダゾ[4,5-c]ピリジン、または場合により置換されているイミダゾ[4,5-b]ピリジンである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されている窒素含有9または10個の原子のヘテロアリールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されているベンズイミダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されている1H-インダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されている2H-インダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、Rが水素である式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC1-C6アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7カルボシクリルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7カルボシクリルアルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7ヘテロシクリルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが場合により置換されているC3-C7ヘテロシクリルアルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが-CO2R5である化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、Rが-CONHR5または-CON(R5)2である化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、場合により置換されているC1-C6アルキルが、C1-C3アルコキシで置換されているC1-C3アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R6が水素である式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R6が場合により置換されているアルキルである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1-C4アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1-C3アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1-C2アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているC1アルキルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6がCH3である化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R6が場合により置換されているカルボシクリルアルキルである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているカルボシクリルメチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されている(C3-C6カルボシクリル)メチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているシクロプロピルメチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているヘテロシクリルアルキルである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているヘテロシクリルエチルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。別の実施形態は、R6が場合により置換されているヘテロシクリルエチルであり、ヘテロシクリルが、ピペリジニル、ピロリジニル、モルホリニル、またはピペラジニルである化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールであり、Rが-CH2OCH3基であり、R6がメチルである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
別の実施形態は、R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールであり、Rが水素であり、R6がメチルである式(II)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
いくつかの実施形態では、本明細書に開示されているヘテロ芳香族FGFRキナーゼ阻害性化合物は、表1に提供される構造を有する。
いくつかの実施形態では、本明細書に開示されているヘテロ芳香族FGFRキナーゼ阻害性化合物は、表2に提供される構造を有する。
化合物の調製
本明細書に記載されている反応に使用される化合物は、市販の化学物質および/または化学文献に記載の化合物から出発して、当業者に公知の有機合成技術に従って作製される。「市販の化学物質」は、Acros Organics(Pittsburgh、PA)、Aldrich Chemical(Milwaukee、WI、Sigma ChemicalおよびFlukaを含む)、Apin Chemicals Ltd.(Milton Park、UK)、Avocado Research(Lancashire、U.K.)、BDH Inc.(Toronto、Canada)、Bionet(Cornwall、U.K.)、Chemservice Inc.(West Chester、PA)、Crescent Chemical Co.(Hauppauge、NY)、Eastman Organic Chemicals、Eastman Kodak Company(Rochester、NY)、Fisher Scientific Co.(Pittsburgh、PA)、Fisons Chemicals(Leicestershire、UK)、Frontier Scientific(Logan、UT)、ICN Biomedicals,Inc.(Costa Mesa、CA)、Key Organics(Cornwall、U.K.)、Lancaster Synthesis(Windham、NH)、Maybridge Chemical Co.Ltd.(Cornwall、U.K.)、Parish Chemical Co.(Orem、UT)、Pfaltz&Bauer,Inc.(Waterbury、CN)、Polyorganix(Houston、TX)、Pierce Chemical Co.(Rockford、IL)、Riedel de Haen AG(Hanover、Germany)、Spectrum Quality Product,Inc.(New Brunswick、NJ)、TCI America(Portland、OR)、Trans World Chemicals,Inc.(Rockville、MD)、およびWako Chemicals USA,Inc.(Richmond、VA)を含む標準的な商業的供給源から得られる。
本明細書に記載されている反応に使用される化合物は、市販の化学物質および/または化学文献に記載の化合物から出発して、当業者に公知の有機合成技術に従って作製される。「市販の化学物質」は、Acros Organics(Pittsburgh、PA)、Aldrich Chemical(Milwaukee、WI、Sigma ChemicalおよびFlukaを含む)、Apin Chemicals Ltd.(Milton Park、UK)、Avocado Research(Lancashire、U.K.)、BDH Inc.(Toronto、Canada)、Bionet(Cornwall、U.K.)、Chemservice Inc.(West Chester、PA)、Crescent Chemical Co.(Hauppauge、NY)、Eastman Organic Chemicals、Eastman Kodak Company(Rochester、NY)、Fisher Scientific Co.(Pittsburgh、PA)、Fisons Chemicals(Leicestershire、UK)、Frontier Scientific(Logan、UT)、ICN Biomedicals,Inc.(Costa Mesa、CA)、Key Organics(Cornwall、U.K.)、Lancaster Synthesis(Windham、NH)、Maybridge Chemical Co.Ltd.(Cornwall、U.K.)、Parish Chemical Co.(Orem、UT)、Pfaltz&Bauer,Inc.(Waterbury、CN)、Polyorganix(Houston、TX)、Pierce Chemical Co.(Rockford、IL)、Riedel de Haen AG(Hanover、Germany)、Spectrum Quality Product,Inc.(New Brunswick、NJ)、TCI America(Portland、OR)、Trans World Chemicals,Inc.(Rockville、MD)、およびWako Chemicals USA,Inc.(Richmond、VA)を含む標準的な商業的供給源から得られる。
本明細書に記載されている化合物の調製において有用な反応物の合成を詳述する、または調製を記載する論文への言及を提供する適切な参考書および論文には、例えば、「Synthetic Organic Chemistry」,John Wiley&Sons,Inc.,New York;S.R.Sandler et al.,「Organic Functional Group Preparations」,2nd Ed.,Academic Press,New York,1983;H.O.House,「Modern Synthetic Reactions」,2nd Ed.,W.A.Benjamin,Inc.Menlo Park,Calif.1972;T.L.Gilchrist,「Heterocyclic Chemistry」,2nd Ed.,John Wiley&Sons,New York,1992;J.March,「Advanced Organic Chemistry:Reactions,Mechanisms and Structure」,4th Ed.,Wiley-Interscience,New York,1992が含まれる。本明細書に記載されている化合物の調製において有用な反応物の合成を詳述する、または調製を記載する論文への言及を提供する、追加の適切な参考書および論文には、例えば、Fuhrhop,J.and Penzlin G.「Organic Synthesis:Concepts,Methods,Starting Materials」,Second,Revised and Enlarged Edition(1994)John Wiley&Sons ISBN:3-527-29074-5;Hoffman,R.V.「Organic Chemistry,An Intermediate Text」(1996)Oxford University Press,ISBN 0-19-509618-5;Larock,R.C.「Comprehensive Organic Transformations:A Guide to Functional Group Preparations」2nd Edition(1999)Wiley-VCH,ISBN:0-471-19031-4;March,J.「Advanced Organic Chemistry:Reactions,Mechanisms,and Structure」4th Edition(1992)John Wiley&Sons,ISBN:0-471-60180-2;Otera,J.(editor)「Modern Carbonyl Chemistry」(2000)Wiley-VCH,ISBN:3-527-29871-1;Patai,S.「Patai’s 1992 Guide to the Chemistry of Functional Groups」(1992)Interscience ISBN:0-471-93022-9;Solomons,T.W.G.「Organic Chemistry」7th Edition(2000)John Wiley&Sons,ISBN:0-471-19095-0;Stowell,J.C.,「Intermediate Organic Chemistry」2nd Edition(1993)Wiley-Interscience,ISBN:0-471-57456-2;「Industrial Organic Chemicals:Starting Materials and Intermediates:An Ullmann’s Encyclopedia」(1999)John Wiley&Sons,ISBN:3-527-29645-X,in 8 volumes;「Organic Reactions」(1942-2000)John Wiley&Sons,in over 55 volumes、および「Chemistry of Functional Groups」John Wiley&Sons,in 73 volumesが含まれる。
特定および類似の反応物は、ほとんどの公共および大学図書館ならびにオンラインデータベース(さらなる詳細については、アメリカ化学会(American Chemical Society)、Washington,D.C.に連絡されたい)で入手可能なアメリカ化学会のケミカルアブストラクツサービス(Chemical Abstract Service)によって用意された既知の化学物質のインデックスによって場合により同定される。既知であるがカタログでは市販されていない化学物質は、場合によりカスタム化学合成企業によって調製され、標準的な化学物質供給企業(例えば、上に列挙されたもの)の多くはカスタム合成サービスを提供している。本明細書に記載されている化合物の薬学的塩の調製および選択に有用な参考文献は、P.H.Stahl&C.G.Wermuth「Handbook of Pharmaceutical Salts」,Verlag Helvetica Chimica Acta,Zurich,2002である。
医薬組成物
ある特定の実施形態では、本明細書に記載のヘテロ芳香族FGFRキナーゼ阻害性化合物は、純粋な化学物質として投与される。他の実施形態では、本明細書に記載のヘテロ芳香族FGFRキナーゼ阻害性化合物は、例えば、Remington:The Science and Practice of Pharmacy(Gennaro,21st Ed.Mack Pub.Co.,Easton,PA(2005))に記載されるように、選択された投与の経路および標準的な製薬慣行に基づいて選択される薬学的に適切または許容され得る担体(本明細書では、薬学的に適切(または許容され得る)賦形剤、生理学的に適切(または許容され得る)賦形剤、または生理学的に適切(または許容され得る)担体とも称される)と組み合わされる。
ある特定の実施形態では、本明細書に記載のヘテロ芳香族FGFRキナーゼ阻害性化合物は、純粋な化学物質として投与される。他の実施形態では、本明細書に記載のヘテロ芳香族FGFRキナーゼ阻害性化合物は、例えば、Remington:The Science and Practice of Pharmacy(Gennaro,21st Ed.Mack Pub.Co.,Easton,PA(2005))に記載されるように、選択された投与の経路および標準的な製薬慣行に基づいて選択される薬学的に適切または許容され得る担体(本明細書では、薬学的に適切(または許容され得る)賦形剤、生理学的に適切(または許容され得る)賦形剤、または生理学的に適切(または許容され得る)担体とも称される)と組み合わされる。
本明細書に記載の少なくとも1つのヘテロ芳香族FGFRキナーゼ阻害性化合物、またはその立体異性体、薬学的に許容され得る塩、水和物もしくは溶媒和物を、1つまたは複数の薬学的に許容され得る担体と一緒に含む医薬組成物が本明細書で提供される。担体(複数可)(または賦形剤(複数可))は、担体が組成物の他の成分と適合性であり、組成物のレシピエント(すなわち、対象または患者)に有害でない場合、許容され得るかまたは適切である。
1つの実施形態は、薬学的に許容され得る賦形剤および式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を含む、医薬組成物を提供する。
1つの実施形態は、式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物、および薬学的に許容され得る担体を混合することを含む、医薬組成物を調製する方法を提供する。
ある特定の実施形態では、式(I)によって記載されるようなヘテロ芳香族FGFRキナーゼ阻害性化合物、またはその薬学的に許容され得る塩もしくは溶媒和物は、約5%未満、または約1%未満、または約0.1%未満の他の有機小分子、例えば、合成方法の1つまたは複数のステップにおいて生じる未反応の中間体または合成副産物を含むという点で、実質的に純粋である。
1つの実施形態は、薬学的に許容され得る賦形剤および式(II)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を含む、医薬組成物を提供する。
1つの実施形態は、式(II)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物、および薬学的に許容され得る担体を混合することを含む、医薬組成物を調製する方法を提供する。
ある特定の実施形態では、式(II)によって記載されるようなヘテロ芳香族FGFRキナーゼ阻害性化合物、またはその薬学的に許容され得る塩もしくは溶媒和物は、約5%未満、または約1%未満、または約0.1%未満の他の有機小分子、例えば、合成方法の1つまたは複数のステップにおいて生じる未反応の中間体または合成副産物を含むという点で、実質的に純粋である。
適切な経口剤形には、例えば、硬ゼラチンもしくは軟ゼラチン、メチルセルロースまたは消化管で容易に溶解される別の適切な材料の錠剤、丸剤、サシェ剤、またはカプセル剤が含まれる。いくつかの実施形態では、例えば、医薬グレードのマンニトール、ラクトース、スターチ、ステアリン酸マグネシウム、サッカリンナトリウム、タルカム、セルロース、グルコース、スクロース、炭酸マグネシウムなどを含む適切な非毒性固形担体が使用される。(例えば、Remington:The Science and Practice of Pharmacy(Gennaro,21st Ed.Mack Pub,Co.,Easton,PA(2005)を参照されたい)。
いくつかの実施形態では、式(I)もしくは(II)によって記載されるようなヘテロ芳香族FGFRキナーゼ阻害性化合物またはその薬学的に許容され得る塩もしくは溶媒和物は、注射による投与のために製剤化される。場合によっては、注射製剤は水性製剤である。場合によっては、注射製剤は非水性製剤である。場合によっては、注射製剤は、ゴマ油などの油性製剤である。
本明細書に記載の少なくとも1つのヘテロ芳香族FGFRキナーゼ阻害性化合物を含む組成物の用量は、対象または患者(例えば、ヒト)の症状に応じて異なる。いくつかの実施形態では、そのような要因は、一般的な健康状態、年齢、および他の要因を含む。
医薬組成物は、処置(または予防(prevented))される疾患に適切な様式で投与される。適切な用量ならびに適切な投与期間および投与頻度は、患者の症状、患者の疾患の種類および重症度、有効成分の特定の形態、ならびに投与の方法などの要因によって決定されよう。一般に、適切な用量および処置レジメンは、治療上および/または予防上(prophylactic)の利益(例えば、より頻繁な完全もしくは部分的寛解、またはより長い無病および/もしくは全生存、または症候重症度の低下などの改善された臨床転帰)をもたらすのに十分な量の組成物(複数可)を規定する。最適な用量は、一般に、実験モデルおよび/または臨床試験を使用して決定される。最適な用量は、患者のボディマス、体重、または血液量に依存する。
経口用量は、典型的には、1日当たり約1.0mg~約1000mg、1~4回またはそれを超える、範囲である。
処置の方法
1つの実施形態は、ヒトまたは動物の身体を処置する方法において使用するための、式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
1つの実施形態は、ヒトまたは動物の身体を処置する方法において使用するための、式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
1つの実施形態は、がんまたは新生物性疾患を処置する方法において使用するための、式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
1つの実施形態は、がんまたは新生物性疾患を処置するための医薬の製造における、式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物の使用を提供する。
いくつかの実施形態では、がんの処置を必要とする患者のがんを処置する方法であって、式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を患者に投与することを含む、方法が本明細書に記載されている。いくつかの実施形態では、がんの処置を必要とする患者のがんを処置する方法であって、式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物、および薬学的に許容され得る賦形剤を含む医薬組成物を患者に投与することを含む、方法が本明細書に記載されている。
1つの実施形態は、ヒトまたは動物の身体を処置する方法において使用するための、式(II)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
1つの実施形態は、がんまたは新生物性疾患を処置する方法において使用するための、式(II)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を提供する。
1つの実施形態は、がんまたは新生物性疾患を処置するための医薬の製造における、式(II)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物の使用を提供する。
いくつかの実施形態では、がんの処置を必要とする患者のがんを処置する方法であって、式(I)の化合物またはその薬学的に許容され得る塩もしくは溶媒和物を患者に投与することを含む、方法が本明細書に記載されている。いくつかの実施形態では、がんの処置を必要とする患者のがんを処置する方法であって、式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物、および薬学的に許容され得る賦形剤を含む医薬組成物を患者に投与することを含む、方法が本明細書に記載されている。
医薬組成物が経口投与される方法が本明細書で提供される。医薬組成物が注射によって投与される方法が本明細書で提供される。
他の実施形態および使用は、本開示に照らして当業者には明らかであろう。以下の例は、単に様々な実施形態の例示として提供され、決して本発明を限定すると解釈されるべきではない。
I.化学合成
いくつかの実施形態では、本明細書に開示されているヘテロ芳香族FGFRキナーゼ阻害性化合物は、以下の例に従って合成される。以下および本発明の説明を通して使用され場合、以下の略語は、別段の指示がない限り、以下の意味を有すると理解されるものとする。
℃ 摂氏
δH テトラメチルシランからのダウンフィールドでの百万分率の化学シフト
DCM ジクロロメタン(CH2Cl2)
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
EA 酢酸エチル
ESI エレクトロスプレーイオン化
Et エチル
g グラム
h 時間
HPLC 高速液体クロマトグラフィー
Hz ヘルツ
J カップリング定数(NMR分光法における)
LCMS 液体クロマトグラフィー質量分析
μ マイクロ
m 多重項(スペクトル)、メートル、ミリ
M モル濃度
M+親分子イオン
Me メチル
MHz メガヘルツ
min 分
mol モル、分子(mol wtの場合)
mL ミリリットル
MS 質量分析
nm ナノメートル
NMR 核磁気共鳴
pH 水素のポテンシャル、水溶液の酸性度または塩基性度の尺度
PE 石油エーテル
RT 室温
s 一重項(スペクトル)
t 三重項(スペクトル)
T 温度
TFA トリフルオロ酢酸
THF テトラヒドロフラン
いくつかの実施形態では、本明細書に開示されているヘテロ芳香族FGFRキナーゼ阻害性化合物は、以下の例に従って合成される。以下および本発明の説明を通して使用され場合、以下の略語は、別段の指示がない限り、以下の意味を有すると理解されるものとする。
℃ 摂氏
δH テトラメチルシランからのダウンフィールドでの百万分率の化学シフト
DCM ジクロロメタン(CH2Cl2)
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
EA 酢酸エチル
ESI エレクトロスプレーイオン化
Et エチル
g グラム
h 時間
HPLC 高速液体クロマトグラフィー
Hz ヘルツ
J カップリング定数(NMR分光法における)
LCMS 液体クロマトグラフィー質量分析
μ マイクロ
m 多重項(スペクトル)、メートル、ミリ
M モル濃度
M+親分子イオン
Me メチル
MHz メガヘルツ
min 分
mol モル、分子(mol wtの場合)
mL ミリリットル
MS 質量分析
nm ナノメートル
NMR 核磁気共鳴
pH 水素のポテンシャル、水溶液の酸性度または塩基性度の尺度
PE 石油エーテル
RT 室温
s 一重項(スペクトル)
t 三重項(スペクトル)
T 温度
TFA トリフルオロ酢酸
THF テトラヒドロフラン
中間体1:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-ブロモ-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
tert-ブチル(2R,4R)-2-(メトキシメチル)-4-(トシルオキシ)ピロリジン-1-カルボキシレート
DCM(150.00mL)中のtert-ブチル(2R,4R)-4-ヒドロキシ-2-(メトキシメチル)ピロリジン-1-カルボキシレート(15.20g、65.72mmol)、TEA(18.27mL、131.44mmol)およびDMAP(1.21g、9.86mmol)の撹拌溶液に、TsCl(18.79g、98.58mmol)を0℃で添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。得られた混合物を水(80mL)で希釈し、DCM(3×150mL)で抽出した。合わせた有機層をブライン(2×80mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の33%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4R)-2-(メトキシメチル)-4-(トシルオキシ)ピロリジン-1-カルボキシレート(18.5g、73%)を黄色油状物として得た。MS ESI C18H27NO6S[M+H]+についての計算値386.16、実測値386.10。
tert-ブチル(2R,4S)-4-(5-アミノ-3-ブロモ-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
ACN(190.00mL)中の3-アミノ-5-ブロモ-2H-ピラゾール-4-カルボニトリル(7.20g、38.50mmol)およびCs2CO3(25.09g、77.01mmol)の混合物に、tert-ブチル(2R,4R)-2-(メトキシメチル)-4-(トシルオキシ)ピロリジン-1-カルボキシレート(17.81g、46.20mmol)を添加した。反応混合物を90℃で4時間撹拌した。反応混合物を室温まで冷まし、濾過した。濾過ケーキをDCM(3×70mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、PE中の46%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製して、約6.2gの生成物を得、これを以下の条件を用いる逆相フラッシュクロマトグラフィーによってさらに精製した:カラム、C18シリカゲル、移動相、水中のACN、30分で5%から46%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(5-アミノ-3-ブロモ-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(5g、32%)をオフホワイトの固体として得た。MS ESI C15H22BrN5O3[M+H]+についての計算値400.09、402.09、実測値400.15、402.15。
tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-ホルムアミド-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
(ジエトキシメトキシ)エタン(70.00mL)中のtert-ブチル(2R,4S)-4-(5-アミノ-3-ブロモ-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.50g、8.74mmol)の混合物に、ベンゼンスルホン酸(0.23g、1.22mmol)を添加した。反応混合物を窒素雰囲気下、150℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(50mL)に分散させた。得られた混合物をEA(3×150mL)で抽出した。合わせた有機層をブライン(80mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-ホルムアミド-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.75g、粗製)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C16H22BrN5O4[M-H]-についての計算値426.09、428.09、実測値426.15、428.15。
tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-(メチルアミノ)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
EtOH(200.00mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-ホルムアミド-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.75g、8.76mmol)の撹拌溶液に、NaBH4(1.56g、41.23mmol)を窒素雰囲気下、0℃で添加した。反応混合物を室温で2時間撹拌した。得られた混合物を0℃にてブラインでクエンチした。得られた混合物をEA(3×150mL)で抽出した。合わせた有機層をブライン(70mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の62%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-(メチルアミノ)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.3g、91%)をオフホワイトの固体として得た。MS ESI C16H24BrN5O3[M-H]-についての計算値412.11、414.11、実測値412.20、414.20。
tert-ブチル(2R,4S)-4-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DCM(40.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.74g、4.20mmol)の撹拌溶液に、Et3N(1.75mL、12.61mmol)、DCM(2.00mL)中のBoc2O(2.22g、8.40mmol)およびDMAP(51.31mg、0.42mmol)を窒素雰囲気下、室温で添加した。反応混合物を室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中の39%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(2.12g、98%)をオフホワイトの固体として得た。MS ESI C21H32BrN5O5[M+H-56]+についての計算値458.16、実測値458.10。
tert-ブチル(2R,4S)-4-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
EtOH(23.50mL)およびDMSO(4.70mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.17g、6.16mmol)の撹拌溶液に、0.5M NaOH(8.14mL、7.08mmol)およびH2O2(30%)(1.69mL、14.77mmol)を0℃で添加した。反応混合物を0℃で30分間撹拌し、室温で1.5時間撹拌した。得られた混合物をEA(3×90mL)で抽出した。合わせた有機層をブライン(2×60mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の60%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.09g、94%)をオフホワイトの固体として得た。MS ESI C21H34BrN5O6[M+H-156]+についての計算値376.17、実測値376.00。
3-ブロモ-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド二塩酸塩
EA(8.5mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.68g、3.16mmol)の撹拌溶液に、EA(17mL)中の2M塩化水素溶液を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1時間撹拌した。沈殿した固体を濾過によって回収し、EA(3x30mL)で洗浄した。濾過ケーキを乾燥させて、3-ブロモ-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド二塩酸塩(1.3g、粗製)をオフホワイトの固体として得た。MS ESI C11H18BrN5O2[M+H]+についての計算値332.06、実測値332.15
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-ブロモ-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
THF(24.00mL)中の3-ブロモ-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド二塩酸塩(1.20g、2.96mmol)の撹拌混合物に、2.5M K2CO3水溶液(14.40mL、36mmol)およびTHF(6.00mL)中の塩化アクリロイル(0.23g、2.96mmol)を0℃で添加した。反応混合物を0℃で10分間撹拌した。得られた混合物をEA(3×100mL)で抽出した。合わせた有機層をブライン(2×60mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-ブロモ-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.89g、78%)をオフホワイトの固体として得た。MS ESI C14H20BrN5O3[M+H]+についての計算値386.07、実測値386.05。
実施例1:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(2-メチル-3H-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、0.26mmol)、5-エチニル-2-メチル-3H-1,3-ベンゾジアゾール(60.66mg、0.39mmol)、CuI(9.86mg、0.05mmol)の混合物に、Pd(PPh3)2Cl2(18.17mg、0.03mmol)およびTEA(0.11mL、1.07mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で16時間撹拌した。得られた混合物を水(20mL)で希釈し、EtOAc(3×20mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5um 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20ml/分、勾配:4.3分で20Bから50B。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(2-メチル-3H-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(35.8mg、29%)をオフホワイトの固体として得た。MS ESI C24H27N7O3[M+H]+についての計算値462.22、実測値462.15。H-NMR(400 MHz,DMSO-d6+D2O):δ 7.70(s,1H),7.52(d,J=8.0Hz,1H),7.34-7.32(m,1H),6.73-6.55(m,1H),6.19-6.14(m,1H),5.71-5.67(m,1H),5.23-5.10(m,1H),4.59-4.35(m,1H),3.90-3.85(m,1H),3.76-3.61(m,1H),3.59-3.31(m,2H),3.30(d,J=5.2Hz,3H),2.93(d,J=4.4Hz,3H),2.56(s,3H),2.51-2.33(m,1H),2.31-2.27(m,1H).
実施例2:(S)-1-(1-アクリロイルピロリジン-3-イル)-3-((2-メチル-1H-ベンゾ[d]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(S)-3-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-1H-ピラゾール-1-イル)ピロリジン-1-カルボキシレート
DCM(10.00mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.5g、1.35mmol)の撹拌溶液に、TEA(0.56mL、4.03mmol)、DCM(3.00mL)中のBoc2O(0.56g、2.70mmol)およびDMAP(16.50mg、0.14mmol)を窒素雰囲気下、室温で添加した。反応混合物を1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中の31%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を濃縮して、tert-ブチル(S)-3-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-1H-ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.6g、94%)をオフホワイトの固体として得た。MS ESI C19H28BrN5O4[M+H-112]+についての計算値470.13、実測値358.10。
ステップ2:tert-ブチル(S)-3-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-1H-ピラゾール-1-イル)ピロリジン-1-カルボキシレート
EtOH(4.00mL)およびDMSO(0.80mL)中のtert-ブチル(S)-3-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-1H-ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.5g、1.06mmol)の撹拌溶液に、0.5M NaOH(2.44mL、1.22mmol)およびH2O2(30%)(0.29mL、3.73mmol)を0℃で添加した。反応混合物を周囲温度で1時間撹拌した。得られた混合物を水(5mL)で希釈し、EtOAc(3×20mL)で抽出した。合わせた有機層をブライン(3×15mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の60%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(S)-3-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-1H-ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.56g、97%)をオフホワイトの固体として得た。MS ESI C19H30BrN5O5[M+H-156]+についての計算値488.13、実測値332.05。
ステップ3:(S)-3-ブロモ-5-(メチルアミノ)-1-(ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド二塩酸塩
DCM(1.50mL)中のtert-ブチル(S)-3-(3-ブロモ-5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-1H-ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.25g、0.51mmol)の撹拌溶液に、EA(3mL)中の4M塩化水素溶液を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。沈殿した固体を濾過によって回収し、DCM(3x10mL)で洗浄した。固体を減圧下で乾燥させて、(S)-3-ブロモ-5-(メチルアミノ)-1-(ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド二塩酸塩(0.20g、粗製)をオフホワイトの固体として得た。MS ESI C9H14BrN5O[M+H]+についての計算値288.04、実測値288.10。
ステップ4:(S)-1-(1-アクリロイルピロリジン-3-イル)-3-ブロモ-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DCM(5.00mL)中の(S)-3-ブロモ-5-(メチルアミノ)-1-(ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド二塩酸塩(0.16g、0.44mmol)の撹拌溶液に、塩化アクリロイル(36.10mg、0.40mmol)およびDIEA(0.32mL、1.84mmol)を0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(5mL)で希釈し、EtOAc(3×10mL)で抽出した。合わせた有機層をブライン(2×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、(S)-1-(1-アクリロイルピロリジン-3-イル)-3-ブロモ-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.12g、75%)をオフホワイトの固体として得た。MS ESI C12H18BrN5O2[M+H]+についての計算値342.05、実測値342.00。
ステップ5:(S)-1-(1-アクリロイルピロリジン-3-イル)-3-((2-メチル-1H-ベンゾ[d]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の(S)-1-(1-アクリロイルピロリジン-3-イル)-3-ブロモ-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(90.00mg、0.26mmol)、5-エチニル-2-メチル-3H-1,3-ベンゾジアゾール(61.62mg、0.40mmol)、CuI(10.02mg、0.05mmol)およびPd(PPh3)2Cl2(18.46mg、0.03mmol)の撹拌混合物に、TEA(0.09mL、0.89mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Shield RP18 OBD Column、30*150mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:10分で35Bから70B、210/254nm、RT1:9.75。所望の生成物を含有する分画を合わせ、濃縮して、(S)-1-(1-アクリロイルピロリジン-3-イル)-3-((2-メチル-1H-ベンゾ[d]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(22mg、20%)をオフホワイトの固体として得た。MS ESI C22H23N7O2[M+H]+についての計算値418.19、実測値418.10。H-NMR(300 MHz,CDCl3)δ 7.70(s,1H),7.51-7.48(m,1H),7.38-7.26(d,J=8.3Hz,1H),6.97(s,1H),6.66-6.31(m,3H),5.77-5.66(m,1H),5.48(s,1H),5.04-4.99(m,1H),4.16-3.94(m,3H),3.82-3.62(m,1H),2.99(t,J=6.1Hz,3H),2.65(s,4H),2.40(m,2H).
実施例3:3-[2-(1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:4-ブロモ-N-エチル-2-ニトロアニリン
Et3N(13.80g、136.38mmol)中の4-ブロモ-1-フルオロ-2-ニトロベンゼン(5.00g、22.73mmol)およびエチルアミン塩酸塩(9.27g、113.64mmol)の溶液を、80℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、室温にて飽和NH4HCO3(水溶液)でクエンチした。得られた混合物をEtOAc(3×50mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、4-ブロモ-N-エチル-2-ニトロアニリン(5g、89%)を赤色固体として得、これをさらに精製することなく次のステップに使用した。MS ESI C8H9BrN2O2[M+H]+についての計算値244.98、246.98、実測値245.05、247.05。
ステップ2:4-ブロモ-N1-エチルベンゼン-1,2-ジアミン
EtOH(66.00mL)中のFe(2.73g、48.96mmol)の混合物に、AcOH(3.30mL、54.90mmol)を添加した。得られた混合物を窒素雰囲気下、70℃で30分間撹拌した。上記混合物に、4-ブロモ-N-エチル-2-ニトロアニリン(3.00g、12.24mmol)を添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをTHFで洗浄した。濾液を減圧下で濃縮した。残渣を、室温にて飽和NH4HCO3(水溶液)(50mL)の添加によってクエンチした。得られた混合物をEtOAc(3×50mL)で抽出し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、4-ブロモ-N1-エチルベンゼン-1,2-ジアミン(2g、75%)を褐色固体として得、これをさらに精製することなく次のステップに使用した。MS ESI C8H11BrN2[M+H]+についての計算値215.01、217.01、実測値215.10、217.10。
ステップ3:5-ブロモ-1-エチル-2-メチル-1,3-ベンゾジアゾール
MeOH(13.00mL)中の4-ブロモ-N1-エチルベンゼン-1,2-ジアミン(1.30g、6.04mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(1.09g、0.01mmol)を添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(12:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-1-エチル-2-メチル-1,3-ベンゾジアゾール(1.00g、69%)を淡黄色固体として得た。MS ESI C10H11BrN2[M+H]+についての計算値239.01、241.01、実測値238.90、240.90。
ステップ4:1-エチル-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(15.00mL)中の5-ブロモ-1-エチル-2-メチル-1,3-ベンゾジアゾール(1.50g、6.27mmol)、トリメチルシリルアセチレン(1.85g、0.02mmol)、CuI(0.24g、1.26mmol)およびPd(PPh3)2Cl2(0.88g、1.25mmol)の撹拌混合物に、TEA(12.70g、0.13mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で16時間撹拌した。得られた混合物をEtOAc(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(12:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.5g、31%)を淡黄色固体として得た。MS ESI C15H20N2Si[M+H]+についての計算値257.14、実測値257.15。
ステップ5:1-エチル-5-エチニル-2-メチル-1,3-ベンゾジアゾール
THF(5.00mL)中の1-エチル-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.5g、1.95mmol)の溶液に、TBAF(0.76g、2.92mmol)を窒素雰囲気下、0℃で添加した。反応混合物を室温で4時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(12:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-エチニル-2-メチル-1,3-ベンゾジアゾール(0.30g、83%)を淡黄色固体として得た。MS ESI C12H12N2[M+H]+についての計算値185.10、実測値185.10。
ステップ6:3-[2-(1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(3mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.52mmol)、1-エチル-5-エチニル-2-メチル-1,3-ベンゾジアゾール(0.14g、0.78mmol)、CuI(19.72mg、0.10mmol)およびPd(PPh3)2Cl2(36.34mg、0.05mmol)の撹拌混合物に、TEA(0.16g、1.55mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で50Bから80B、210/254nm、RT1:4.02。所望の生成物を含有する分画を濃縮して、3-[2-(1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(50mg、19%)を白色固体として得た。MS ESI C26H31N7O3[M+H]+についての計算値490.25、実測値490.25。H-NMR(300 MHz,CDCl3)δ 7.90(s,1H),7.43(d,J=8.2Hz,1H),6.98(s,1H),6.98-6.77(m,2H),6.54-6.37(m,2H),5.70(dd,J=8.2,4.2Hz,1H),5.58-5.26(m,2H),4.56(d,J=9.0Hz,1H),4.26-3.85(m,5H),3.54-3.34(m,4H),3.05-3.01(m,3H),2.79-2.53(m,4H),2.33-2.29(m,1H),1.43(t,J=7.2Hz,3H).
実施例4:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-1-メチル-1,3-ベンゾジアゾール
MeOH(11.00mL)中の4-ブロモ-N1-メチルベンゼン-1,2-ジアミン(1.10g、5.47mmol)の撹拌溶液に、オルトギ酸トリメチル(0.87g、8.21mmol)を添加した。反応混合物を窒素雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の4%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-1-メチル-1,3-ベンゾジアゾール(1.02g、79%)を褐色固体として得た。MS ESI C8H7BrN2[M+H]+についての計算値210.98、実測値210.95。
ステップ2:1-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(20.00mL)中の5-ブロモ-1-メチル-1,3-ベンゾジアゾール(1.00g、4.74mmol)、トリメチルシリルアセチレン(2.01mL、20.45mmol)、CuI(0.18g、0.95mmolおよびPd(PPh3)2Cl2(0.33g、0.47mmol)の混合物に、TEA(13.17mL、130.16mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で16時間撹拌した。得られた混合物を水(60mL)で希釈し、EA(3×70mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。粗生成物を以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、30分で30%から70%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.51g、42%)を淡褐色固体として得た。MS ESI C13H16N2Si[M+H]+についての計算値229.11、実測値229.20。
ステップ3:5-エチニル-1-メチルインダゾール
THF(5.00mL)中の1-メチル-5-[2-(トリメチルシリル)エチニル]インダゾール(0.51g、2.25mmol)の撹拌溶液に、TBAF(THF中に1M)(3.38mL、3.37mmol)を窒素雰囲気下、0℃で滴下した。得られた混合物を室温で2時間撹拌した。得られた混合物を水(20mL)で希釈し、EtOAc(3×20mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-エチニル-1-メチルインダゾール(0.32g、81%)をオフホワイトの固体として得た。MS ESI C10H8N2[M+H]+についての計算値157.07、実測値157.10。
ステップ4:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.23g、0.59mmol)、5-エチニル-1-メチル-1,3-ベンゾジアゾール(0.14g、0.89mmol)、CuI(22.68mg、0.12mmol)およびPd(PPh3)2Cl2(41.80mg、0.06mmol)の撹拌混合物に、TEA(0.25mL、2.45mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、30分で20%から55%の勾配、検出器、UV 254nm。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5um 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:4.3分で35Bから70B、210/254nm、RT1:4.12分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.11g、37%)をオフホワイトの固体として得た。MS ESI C24H27N7O3[M+H]+についての計算値462.22、実測値462.10。H-NMR(400 MHz,DMSO-d6):δ 12.75(brs,1H),8.33-8.30(m,1H),8.15-8.13(m,1H),7.92-7.86(m,1H),7.66(d,J=8.4Hz,1H),7.47(d,J=8.4Hz,1H),7.38-7.34(m,1H),6.83-6.76(m,1H),6.73-6.54(m,1H),6.19-6.14(m,1H),5.71-5.67(m,1H),5.27-5.25(m,1H),4.59-4.35(m,1H),4.03-4.02(m,1H),3.93-3.91(m,4H),3.86-3.71(m,1H),3.45-3.30(m,3H),2.95(t,J=5.1Hz,3H),2.61-2.51(m,1H),2.33-2.24(m,1H).
実施例5:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1,2-ジメチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-1,2-ジメチル-1,3-ベンゾジアゾール
MeOH(40.00mL)中の4-ブロモ-N1-メチルベンゼン-1,2-ジアミン(4.00g、19.89mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(3.59g、29.84mmol)を添加した。反応混合物を窒素雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の6%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-1,2-ジメチル-1,3-ベンゾジアゾール(3.91g、78%)を淡黄色固体として得た。MS ESI C9H9BrN2[M+H]+についての計算値224.99、226.99、実測値225.00、227.00。
ステップ2:1,2-ジメチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(50.00mL)中の5-ブロモ-1,2-ジメチル-1,3-ベンゾジアゾール(2.53g、11.24mmol)、トリメチルシリルアセチレン(4.77mL、48.52mmol)、CuI(428.13mg、2.25mmol)およびPd(PPh3)2Cl2(788.94mg、1.12mmol)の撹拌混合物に、TEA(31.25mL、308.79mmol)を添加した。反応混合物を窒素で3回脱気し、80℃で16時間撹拌した。得られた混合物を水(200mL)で希釈し、EA(3×200mL)で抽出した。合わせた有機層をブライン(2×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、35分で30%から70%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1,2-ジメチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.52g、17%)を褐色固体として得た。MS ESI C14H18N2Si[M+H]+についての計算値243.12、実測値243.00。
ステップ3:5-エチニル-1,2-ジメチル-1,3-ベンゾジアゾール
THF(20.00mL)中の1,2-ジメチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.06g、4.37mmol)の撹拌溶液に、TBAF(6.56mL、6.56mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(100mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-エチニル-1,2-ジメチル-1,3-ベンゾジアゾール(0.68g、81%)をオフホワイトの固体として得た。MS ESI C11H10N2[M+H]+についての計算値171.08、実測値171.15。
ステップ4:3-[2-(1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.50mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.27g、0.70mmol)、5-エチニル-1,2-ジメチル-1,3-ベンゾジアゾール(0.18g、1.05mmol)、CuI(26.63mg、0.14mmol)およびPd(PPh3)2Cl2(49.06mg、0.07mmol)の撹拌混合物に、TEA(0.29mL、2.88mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で5時間撹拌した。得られた混合物を水(30mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、25分で25%から40%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で35Bから70B、210/254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.16g、46%)をオフホワイトの固体として得た。MS ESI C25H29N7O3[M+H]+についての計算値476.23、実測値476.25。H-NMR(400 MHz,DMSO-d6):δ 7.76(s,1H),7.58(d,J=8.3Hz,1H),7.43-7.38(m,2H),6.76-6.59(m,3H),6.19(d,J=16.5Hz,1H),5.71(d,J=10.2Hz,1H),5.27-5.21(m,1H),4.48-4.35(m,1H),4.11-3.82(m,1H),3.77-3.71(m,4H),3.67-3.38(m,2H),3.34(d,J=1.1Hz,3H),2.96(t,J=4.5Hz,3H),2.66-2.50(m,4H),2.29-2.21(m,1H).
実施例6:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-1-メチル-1,3-ベンゾジアゾール
MeOH(10.00mL)中の4-ブロモ-N1-エチルベンゼン-1,2-ジアミン(1.08g、5.02mmol)の撹拌溶液に、オルトギ酸トリメチル(0.80g、7.53mmol)を添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(12:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-1-エチル-1,3-ベンゾジアゾール(1g、88%)を淡黄色固体として得た。MS ESI C9H9BrN2[M+H]+についての計算値224.99、226.99、実測値225.00、227.00。
ステップ2:1-エチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(10.00mL)中の5-ブロモ-1-エチル-1,3-ベンゾジアゾール(1.00g、4.44mmol)、トリメチルシリルアセチレン(1.31g、13.33mmol)、CuI(0.17g、0.89mmol)およびPd(PPh3)2Cl2(0.62g、0.89mmol)の撹拌混合物に、TEA(8.99g、88.85mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で16時間撹拌した。得られた混合物を水(60mL)で希釈し、EtOAc(3×80mL)で抽出した。合わせた有機層をブライン(150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(15:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.80g、74%)を淡黄色固体として得た。MS ESI C14H18N2Si[M+H]+についての計算値243.12、実測値243.20。
ステップ3:1-エチル-5-エチニル-1,3-ベンゾジアゾール
THF(8.00mL)中の1-エチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.80g、3.30mmol)の溶液に、TBAF(THF中で1M、4.95mL、4.95mmol)を窒素雰囲気下、0℃で添加した。反応混合物を室温で4時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/PE(15:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-エチニル-1,3-ベンゾジアゾール(0.40g、71%)を黄色固体として得た。MS ESI C11H10N2[M+H]+についての計算値171.08、実測値171.15。
ステップ4:3-[2-(1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド ギ酸
DMF(3mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.52mmol)、1-エチル-5-エチニル-1,3-ベンゾジアゾール(0.13g、0.78mmol)、CuI(19.72mg、0.10mmol)およびPd(PPh3)2Cl2(36.34mg、0.05mmol)の撹拌混合物に、TEA(0.16g、1.55mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis Prep T3 OBD Column、19*250mm 10um、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから60B、210/254nm、RT1:5.88。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド ギ酸(50.6mg、18%)を淡黄色固体として得た。MS ESI C26H31N7O5[M+H-FA]+についての計算値476.23、実測値476.15。1H-NMR(400 MHz,d6-DMSO)δ 8.38(s,1H),7.90(s,1H),7.71(d,J=8.4Hz,1H),7.49-7.31(m,2H),6.85-6.54(m,3H),6.19-6.15(m,1H),5.71-5.67(m,1H),5.24(dd,J=16.9,7.5Hz,1H),4.57-4.37(m,1H),4.31(q,J=7.3Hz,2H),4.07-3.70(m,2H),3.64-3.43(m,2H),3.30(s,3H),2.95(t,J=5.2Hz,3H),2.67-2.53(m,1H),2.36-2.25(m,1H),1.42(t,J=7.2Hz,3H).
実施例7:(S)-1-(1-アクリロイルピロリジン-3-イル)-3-((1,2-ジメチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.2g、0.58mmol)、5-エチニル-1,2-ジメチル-1,3-ベンゾジアゾール(0.15g、0.88mmol)、CuI(22.26mg、0.12mmol)およびPd(PPh3)2Cl2(41.02mg、0.06mmol)の撹拌混合物に、TEA(0.24mL、2.41mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で20Bから50B、210/254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(89mg、35%)をオフホワイトの固体として得た。MS ESI C23H25N7O2[M+H]+についての計算値431.21、実測値431.20。H NMR(400 MHz,DMSO-d6)δ 7.60(s,2H),7.39-7.37(d,J=8.3Hz,2H),6.81(s,1H),6.68-6.56(m,2H),6.19-6.13(m,1H),5.72-5.66(m,1H),5.18-5.09(m,1H),3.89-3.79(m,2H),3.78-3.70(m,4H),3.73(m,1H),3.32(s,3H),2.97-2.90(m,2H),2.51-2.49(m,1H),2.41-2.36(m,1H),2.32-2.26(m,1H).
実施例8:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-メチル-1H-インダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.52mmol)、5-エチ二ル-1-メチルインダゾール(0.12g、0.78mmol)、CuI(19.72mg、0.10mmol)およびPd(PPh3)2Cl2(36.34mg、0.05mmol)の撹拌混合物に、TEA(0.16g、1.55mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で3時間撹拌した。反応混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で30Bから60B;254/210nm、RT1:4.350。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(1-メチルインダゾール-5-イル)エチニル]ピラゾール-4-カルボキサミド(80.0mg、33%)を白色固体として得た。MS ESI C24H27N7O3[M+H]+についての計算値462.22、実測値462.05。1H-NMR(300 MHz,d6-DMSO)δ 8.10(d,J=21.4Hz,2H),7.74(d,J=8.8Hz,1H),7.55(dd,J=8.7,1.7Hz,1H),7.36(s,1H),6.89-6.52(m,3H),6.18(d,J=16.6Hz,1H),5.71(d,J=10.3Hz,1H),5.27(dd,J=13.6,6.9Hz,1H),4.48(d,J=39.4Hz,1H),4.14-4.00(m,4H),3.96-3.84(m,1H),3.81-3.57(m,1H),3.50-3.48(m,1H),3.37-3.29(m,4H),2.96(t,J=4.5Hz,3H),2.33-2.30(m,1H).
実施例9:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((2-メチル-2H-インダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(5.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、0.78mmol)の撹拌溶液に、5-エチニル-2-メチルインダゾール(0.18g、1.17mmol)、塩化パラジウム;ビス(トリフェニルホスフィン)(54.52mg、0.08mmol)、ヨウ化銅(I)(29.58mg、0.16mmol)およびTEA(0.24g、2.33mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を、以下の条件を用いる逆相クロマトグラフィーによって直接精製した:カラム:Spherical C18、20-40um、80g、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配(B%):5分間0%保持、20分以内で0%-23%、5分間23%保持、15分以内で23%-31%、6分間31%保持、5分以内で31%-95%、3分間95%保持、検出器:UV 254&220nm;RT:45分。所望の生成物を含有する分画を合わせ、減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Prep C18 OBD Column、19×150mm、5um、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で20%Bから50%B、検出器:UV 210&254nm;RT:4.02分。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(2-メチルインダゾール-5-イル)エチニル]ピラゾール-4-カルボキサミド(74.0mg、20%)を白色固体として得た。MS ESI C24H27N7O3[M+H]+についての計算値462.22、実測値462.10。H-NMR(300 MHz,d6-DMSO)δ 8.44(s,1H),8.02(s,1H),7.64(d,J=8.9Hz,1H),7.33(brs,1H),7.31(dd,J=8.9,1.6Hz,1H),6.80(brs,1H),6.76-6.54(m,2H),6.20-6.13(m,1H),5.71-5.66(m,1H),5.31-5.17(m,1H),4.56-4.38(m,1H),4.19(s,3H),4.05-3.70(m,2H),3.63-3.43(m,2H),3.29(s,3H),2.94-2.92(m,3H),2.66-2.56(m,0.5H),2.47-2.42(m,0.5H),2.33-2.25(m,1H).
実施例10:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-メチル-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(9.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.86g、2.23mmol)、5-エチニル-1-メチル-2-(トリフルオロメチル)-1,3-ベンゾジアゾール(1.00g、4.45mmol)、Pd(PPh3)2Cl2(0.16g、0.22mmol)およびCuI(84.81mg、0.45mmol)の混合物に、TEA(0.93mL、9.17mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で4時間撹拌した。得られた混合物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、25分で10%から50%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから50B、210/254nm、RT1:5.58。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-[1-メチル-2-(トリフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.37g、30%)をオフホワイトの固体として得た。MS ESI C25H26F3N7O3[M+H]+についての計算値530.20、実測値530.15。H-NMR(400 MHz,DMSO-d6):δ 8.09(d,J=1.6Hz,1H),7.89(d,J=8.6Hz,1H),7.67(dd,J=8.5,1.5Hz,1H),7.35(s,1H),6.88-6.47(m,3H),6.23-6.18(m,1H),5.71-5.68(m,1H),5.27-5.24(m,1H),4.52-4.41(m,1H),4.02-4.00(m,4H),3.93-3.82(m,1H),3.63-3.42(m,2H),3.31(d,J=5.4Hz,3H),2.94(t,J=5.1Hz,3H),2.63-260(m,1H),2.34-2.24(m,1H).
実施例11:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール
MeOH(50.00mL)中の3,5-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン(5.00g、18.51mmol)の溶液に、オルトギ酸トリメチル(2.94g、27.70mmol)を室温で添加した。反応混合物を70℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。得られた混合物をEtOAc(50.00mL)で希釈した。残渣を水(3×40.00mL)で洗浄した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0~60%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(4.9g、94%)を褐色固体として得た。MS ESI C7H3F2IN2[M+H]+についての計算値280.93、実測値280.95。
ステップ2:4,6-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール
DMF(12.00mL)中の4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(0.30g、1.07mmol)の溶液に、NaH(0.13g、3.21mmol、60%)を窒素雰囲気下、0℃で添加した。反応混合物を周囲温度で30分間撹拌した。ヨウ化メチル(0.23g、1.60mmol)を窒素雰囲気下、0℃で滴下した。得られた混合物を室温で10分間撹拌した。得られた混合物を0℃にて水(1.00mL)でクエンチした。得られた混合物をEtOAc(20.00mL)で希釈した。残渣を水(3×10.00mL)で洗浄した。合わせた有機層をブライン(20mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40um、40g、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:50mL/分、勾配(B%):5分間5%保持、25分以内で5%-29%;8分間29%保持、5分以内で29%~95%、5分間95%保持、検出器:UV 254&220nm;RT:48分。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、4,6-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.18g、57%)を淡黄色固体として、および5,7-ジフルオロ-6-ヨード-1-メチル-1,3-ベンゾジアゾール(0.15g、47%)を黄色固体として得た。MS ESI C8H5F2IN2[M+H]+についての計算値294.95、実測値295.00。
ステップ3:4,6-ジフルオロ-1-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
50mLバイアルに、DMF(20.00mL)中の4,6-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(1.60g、5.44mmol)、トリメチルシリルアセチレン(1.60g、16.32mmol)、Pd(PPh3)2Cl2(0.38g、0.54mmol)、CuI(0.21g、1.09mmol)およびTEA(1.65g、16.32mmol)を室温で加えた。反応混合物をアルゴンで3回脱気し、80℃で2時間撹拌した。混合物を室温まで冷ました。得られた混合物を減圧下で濃縮した。得られた混合物をEtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:9)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4,6-ジフルオロ-1-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール4,6-ジフルオロ-1-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.2g、83%)を黄色固体として得た。MS ESI C13H14F2N2Si[M+H]+についての計算値264.08、実測値265.35。
ステップ4:5-エチニル-4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール
THF(10.00mL)中の4,6-ジフルオロ-1-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.30g、4.92mmol)の撹拌溶液に、TBAF(1.93g、7.38mmol)を室温で滴下した。得られた混合物を室温で2時間撹拌した。得られた混合物をEtOAc(3×200mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:9)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-エチニル-4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール(0.90g、95%)を黄色固体として得た。MS ESI C10H6F2N2[M+H]+についての計算値192.04、実測値193.16。
ステップ5:3-[2-(4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
50mLバイアルに、DMF(10.00mL)中の3-ヨード-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.70g、1.62mmol)、5-エチニル-4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール(0.37g、1.94mmol)、Pd(PPh3)2Cl2(0.11g、0.16mmol)、CuI(61.54mg、0.32mmol)およびTEA(0.49g、4.85mmol)を室温で加えた。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。混合物を室温まで冷ました。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(0-6%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆相フラッシュクロマトグラフィーによって精製した:カラム:Spherical C18、20-40um、330g、移動相A:水(+3.2g NH4HCO3)、移動相B:ACN、流量:90mL/分、勾配:5%から5%B、10分、20分で25%B-50%Bの勾配、検出器:254nm。所望の生成物を含有する分画を44%Bで回収し、減圧下で濃縮して、3-[2-(4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.51g、62%)を白色固体として得た。MS ESI C24H25F2N7O3[M+H]+についての計算値497.19、実測値498.50。1H-NMR(400 MHz,DMSO-d6)δ 8.37(s,1H),7.70-7.48(m,2H),6.87-6.53(m,3H),6.13-6.19(m,1H),5.71-5.68(m,1H),5.28-5.25(m,1H),4.46(dd,J=56.9,4.3Hz,1H),4.07-3.71(m,5H),3.65-3.42(m,2H),3.31(d,J=5.5Hz,3H),2.97(t,J=5.4Hz,3H),2.65-2.62(m,1H),2.32-2.29(m,1H).
実施例12:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:N-シクロプロピル-4-ヨード-2-ニトロアニリン
Et3N(29.15mL、288.10mmol)中の1-フルオロ-4-ヨード-2-ニトロベンゼン(10.00g、37.453mmol)の撹拌混合物に、アミノシクロプロパン(10.69g、187.27mmol)を室温で添加した。反応混合物を窒素雰囲気下、80℃で16時間撹拌した。混合物を室温まで冷ました。得られた混合物を飽和NaHCO3(水溶液)(300mL)の添加によってクエンチし、EtOAc(3×200mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、N-シクロプロピル-4-ヨード-2-ニトロアニリン(10g、87%)を褐色固体として得、これをさらに精製することなく次のステップに使用した。MS ESI C9H9IN2O2[M+H]+についての計算値304.00、実測値305.00。
ステップ2:N1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン
THF(1.00mL)中のN-シクロプロピル-4-ヨード-2-ニトロアニリン(5.20g、17.10mmol)の撹拌混合物に、Zn(11.19g、171.00mmol)およびHCl(2.60mL、71.25mmol)を室温で添加した。反応混合物を60℃で2時間、次いで室温で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOAc(3x300mL)で洗浄した。濾液を減圧下で濃縮し、乾燥させて、N1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン(5g、粗製)を褐色固体として得、これをさらに精製することなく次のステップに使用した。MS ESI C9H11IN2[M+H]+についての計算値274.95、実測値274.95。
ステップ3:1-シクロプロピル-5-ヨード-2-メチル-1,3-ベンゾジアゾール
メタノール(2.00mL)中のN1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン(0.20g、0.73mmol)の撹拌混合物に、1,1,1-トリメトキシエタン(0.13g、1.09mmol)を室温で添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を室温まで冷ました。得られた混合物を減圧下で濃縮した。残渣を、PE/(EtOAc/EtOH(3:1))(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-5-ヨード-2-メチル-1,3-ベンゾジアゾール(1.4g、51%)を黄色固体として得た。MS ESI C11H11IN2[M+H]+についての計算値298.95、実測値298.95。
ステップ4:1-シクロプロピル-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(7.00mL)中の1-シクロプロピル-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.70g、2.35mmol)およびCuI(89.44mg、0.47mmol)の撹拌混合物に、Pd(PPh3)2Cl2(0.16g、0.24mmol)、トリメチルシリルアセチレン(98.84mg、1.01mmol)およびTEA(6.53mL、64.51mmol)を添加した。反応混合物を窒素で3回脱気し、80℃で16時間撹拌した。混合物を室温まで冷ました。得られた混合物を、室温にて水(50mL)の添加によってクエンチし、EtOAc(3×50mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/(EtOAc/EtOH(3:1))(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.50g、79%)を褐色固体として得た。MS ESI C16H20N2Si[M+H]+についての計算値269.10、実測値269.10。
ステップ5:1-シクロプロピル-5-エチニル-2-メチル-1,3-ベンゾジアゾール
THF(5.00mL)中の1-シクロプロピル-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.50g、1.86mmol)の撹拌溶液に、TBAF(2.79mL、2.79mmol)を0℃で添加した。反応混合物を室温で16時間撹拌した。得られた混合物を、室温にて水(50mL)の添加によってクエンチした。得られた混合物をEtOAc(3×50mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:4)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-5-エチニル-2-メチル-1,3-ベンゾジアゾール(0.28g、76%)を黄色固体として得た。MS ESI C13H12N2[M+H]+についての計算値197.05、実測値197.05。
ステップ6:3-[2-(1-シクロプロピル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.17g、0.44mmol)および1-シクロプロピル-5-エチニル-2-メチル-1,3-ベンゾジアゾール(0.13g、0.66mmol)の撹拌混合物に、CuI(16.76mg、0.09mmol)、TEA(0.18mL、1.81mmol)およびPd(PPh3)2Cl2(30.89mg、0.04mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で16時間撹拌した。混合物を室温まで冷ました。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製して、粗生成物を得た:カラム、C18シリカゲル、移動相、水中のACN(0.1%NH4HCO3)、20分で10%から50%の勾配、検出器、UV 254nm。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で40Bから80B、210/254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(72.5mg、32%)をオフホワイトの固体として得た。MS ESI C27H31N7O3[M+H]+についての計算値501.15、実測値502.1;1H NMR(400 MHz,DMSO-d6)δ 7.76(s,1H),7.61(d,J=8.4Hz,1H),7.44-7.35(m,2H),6.91-6.58(m,2H),6.21-6.18(m,1H),5.69(dd,J=10.3,2.7Hz,1H),5.29-5.18(m,1H),4.56-4.36(m,1H),4.10-4.01(m,1H),3.91-3.83(m,1H),3.61-3.58(m,1H),3.51-3.43(m,2H),3.12-3.02(m,3H),2.94(s,3H),2.62(s,3H),2.48-2.43(m,1H),2.36-2.27(s,2H),1.25-1.14(m,2H),1.13-0.97(m,2H).
実施例13:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-シクロプロピル-5-ヨード-1,3-ベンゾジアゾール
メタノール(30.00mL)中のN1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン(2.50g、9.12mmol)の撹拌混合物に、オルトギ酸トリメチル(1.45g、13.68mmol)を室温で添加した。反応混合物を70℃で16時間撹拌した。混合物を室温まで冷ました。得られた混合物を減圧下で濃縮した。残渣を、PE/(EtOAc/EtOH)(3:1))(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-5-ヨード-1,3-ベンゾジアゾール(1.2g、46%)を黄色固体として得た。MS ESI C10H9IN2[M+H]+についての計算値284.95、実測値284.95。
ステップ2:1-シクロプロピル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(7.00mL)中の1-シクロプロピル-5-ヨード-1,3-ベンゾジアゾール(0.70g、2.46mmol)およびCuI(93.85mg、0.49mmol)の撹拌混合物に、Pd(PPh3)2Cl2(0.17g、0.25mmol)、トリメチルシリルアセチレン(0.10g、1.06mmol)およびTEA(6.85mL、67.69mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、80℃で16時間撹拌した。反応物を、室温にて水(50mL)の添加によってクエンチし、EtOAc(3×50mL)で抽出した。合わせた有機層をブライン(150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/(EtOAc/EtOH(3:1))(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.58g、92%)を褐色油状物として得た。MS ESI C15H18N2Si[M+H]+についての計算値255.15、実測値255.15。
ステップ3:1-シクロプロピル-5-エチニル-1,3-ベンゾジアゾール
THF(6.00mL)中の1-シクロプロピル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.60g、2.36mmol)の撹拌溶液に、TBAF(3.54mL、3.54mmol)を0℃で添加した。反応混合物を室温で16時間撹拌した。得られた混合物を、室温にて水(70mL)の添加によってクエンチし、EtOAc(3×70mL)で抽出した。合わせた有機層をブライン(150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:4)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-5-エチニル-1,3-ベンゾジアゾール(0.26g、60%)を黄色油状物として得た。MS ESI C10H12N2[M+H]+についての計算値183.05、実測値183.05。
ステップ4:3-[2-(1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.17g、0.44mmol)および1-シクロプロピル-5-エチニル-1,3-ベンゾジアゾール(0.12g、0.66mmol)の撹拌混合物に、CuI(16.76mg、0.09mmol)、TEA(0.18mL、1.81mmol)およびPd(PPh3)2Cl2(30.89mg、0.04mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で16時間撹拌した。得られた混合物を室温まで冷ました。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(0.1%NH4HCO3)、20分で10%から50%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量20mL/分、勾配:4.3分で40Bから80B、210/254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(74.2mg、34%)をオフホワイトの固体として得た。MS ESI C26H29N7O3[M+H]+についての計算値488.10、実測値488.10。H-NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.90(s,1H),7.70(d,J=8.3Hz,1H),7.49(d,J=8.7Hz,1H),7.37(s,1H),6.85-6.52(m,2H),6.17(dd,J=16.6,2.6Hz,1H),5.69(dd,J=10.2,2.6Hz,1H),5.33-5.18(m,1H),4.42-4.38(m,1H),4.07-3.98(m,1H),3.92-3.83(m,1H),3.65-3.51(m,2H),3.49-3.42-3.38(m,1H),3.31-3.30(m,3H),2.94(t,J=5.1Hz,3H),2.53-2.48(m,2H),2.35-2.31(m,1H),1.16-1.01(m,4H).
実施例14:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-1H-インダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(3.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.18g、0.47mmol)、1-エチル-5-エチニルインダゾール(0.12g、0.70mmol)、CuI(17.75mg、0.10mmol)およびPd(PPh3)2Cl2(32.71mg、0.05mmol)の撹拌混合物に、TEA(0.19mL、1.92mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で16時間撹拌した。得られた混合物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、25分で25%から40%の勾配、検出器、UV 254nm。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で40Bから60B、210/254nm、RT1:4.12。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチルインダゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(57.5mg、25%)をオフホワイトの固体として得た。MS ESI C25H29N7O3[M+H]+についての計算値476.23、実測値476.25。H-NMR(400 MHz,DMSO-d6):δ 8.15-8.10(m,2H),7.78(d,J=8.6Hz,1H),7.59-7.50(m,1H),7.36(s,1H),6.90-6.49(m,3H),6.18(d,J=16.6Hz,1H),5.71(d,J=10.4Hz,1H),5.26(s,1H),4.52-4.45(m,3H),4.09-3.68(m,2H),3.65-3.37(m,2H),3.33-3.31(m,3H),2.96(t,J=4.5Hz,3H),2.55-2.53(m,1H),2.34-2.32(m,1H),1.45-1.41(m,3H).
実施例15:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((2-エチル-2H-インダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.25g、0.65mmol)、2-エチル-5-エチニルインダゾール(0.16g、0.97mmol)、CuI(24.65mg、0.13mmol)およびPd(PPh3)2Cl2(45.43mg、0.06mmol)の撹拌混合物に、TEA(0.27mL、2.67mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で16時間撹拌した。得られた混合物を水(40mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、25分で25%から40%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Xselect CSH OBD Column 30*150mm 5um、n、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:30mL/分、勾配:8分で20Bから60B、210/254nm、RT1:7.78。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-エチルインダゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(71.4mg、23%)をオフホワイトの固体として得た。MS ESI C25H29N7O3[M+H]+についての計算値476.23、実測値476.20。H-NMR(400MHz、DMSO-d6):8.50(s,1H),8.03(s,1H),7.70-7.62(m,1H),7.32(dd,J=8.9,1.6Hz,2H),6.88-6.47(m,3H),6.19-6.17(m,1H),5.71-5.68(m,1H),5.27-5.23(m,1H),4.52-4.48(m,3H),4.06-3.41(m,4H),3.30(d,J=5.4Hz,3H),2.95(t,J=5.3Hz,3H),2.64-2.61(m,1H),2.35-2.31(m,1H),1.55-1.52(m,3H).
実施例16:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4,6-ジフルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-エチル-4,6-ジフルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール
THF(45.00mL)中の4,6-ジフルオロ-5-ヨード-2-メチル-1H-1,3-ベンゾジアゾール(3.00g、10.20mmol)およびKOH(2.86g、51.01mmol)の撹拌溶液に、ヨウ化エチル(2.39g、15.30mmol)を室温で滴下した。得られた混合物を室温で2時間撹拌した。得られた混合物をEtOAc(3×500mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/EtOAc(50-89%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4,6-ジフルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール(1.20g、36%)を黄色固体として、および1-エチル-5,7-ジフルオロ-6-ヨード-2-メチル-1,3-ベンゾジアゾール(1.00g、30%)を黄色固体として得た。MS ESI C10H9F2IN2[M+H]+についての計算値322.97、実測値323.09。
ステップ2:1-エチル-4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
50mLバイアルに、DMF(10.00mL)中の1-エチル-4,6-ジフルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール(1.23g、3.82mmol)、トリメチルシリルアセチレン(1.13g、11.46mmol)、Pd(PPh3)2Cl2(0.27g、0.38mmol)、CuI(0.15g、0.76mmol)およびTEA(1.16g、11.46mmol)を室温で加えた。反応混合物をアルゴンで3回脱気し、80℃で2時間撹拌した。得られた混合物を室温まで冷ました。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(0-75%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.1g、98%)を黄色固体として得た。MS ESI C15H18F2N2Si[M+H]+についての計算値293.12、実測値293.40。
ステップ3:1-エチル-5-エチニル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール
THF(10.00mL)中の1-エチル-4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.20g、4.10mmol)の撹拌溶液に、TBAF(1.61g、6.16mmol)を室温で小分けにして添加した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(150mL)で希釈し、EtOAc(3×150mL)で抽出した。合わせた有機層を水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(20-60%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-エチニル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール(0.67g、74%)を黄色固体として得た。MS ESI C15H18F2N2Si[M+H]+についての計算値221.08、実測値221.22。
ステップ4:3-[2-(1-エチル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
25mLバイアルに、DMF(4.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.52mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール(0.14g、0.62mmol)、Pd(PPh3)2Cl2(36.34mg、0.05mmol)およびCuI(19.72mg、0.10mmol)を加え、TEA(0.16g、1.55mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。混合物を室温まで冷ました。得られた混合物をEtOAc(3×100mL)で抽出した。合わせた有機層を水(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(0-6%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物(160mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で23Bから43B、210/254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(85.7mg、31%)を白色固体として得た。MS ESI C26H29F2N7O3[M+H]+についての計算値512.21、実測値526.56。1H-NMR(400 MHz,DMSO-d6)δ 7.60(t,J=11.4Hz,2H),6.83-6.50(m,3H),6.19-6.16(m,1H),5.71-5.68(m,1H),5.29-5.25(m,1H),4.46(d,J=54.4Hz,1H),4.24(q,J=7.2Hz,2H),4.07-3.71(m,2H),3.66-3.41(m,2H),3.30(d,J=5.6Hz,3H),2.96(t,J=5.5Hz,3H),2.70-2.60(m,1H),2.57(s,3H),2.37-2.25(m,1H),1.29(t,J=7.2Hz,3H).
実施例17:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール
DMF(10.00mL)中の4,6-ジフルオロ-5-ヨード-2-メチル-1H-1,3-ベンゾジアゾール(0.60g、2.04mmol)、トリメチルシリルアセチレン(0.60g、6.12mmol)、Pd(PPh3)2Cl2(0.14g、0.20mmol)およびCuI(77.72mg、0.41mmol)の撹拌混合物に、TEA(4.13g、40.81mmol)を添加した。反応混合物を窒素で3回脱気し、80℃で2時間撹拌した。得られた混合物を水(50mL)で希釈した。得られた混合物をEtOAc(3×50mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:4)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール(0.40g、74%)を褐色半固体として得た。MS ESI C13H14F2N2Si[M+H]+についての計算値265.09、実測値265.10。
ステップ2:5-エチニル-4,6-ジフルオロ-2-メチル-1H-1,3-ベンゾジアゾール
25mL丸底フラスコに、4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール(0.40g、1.51mmol)、TBAF(2.27mL、2.27mmol)およびTHF(4.00mL)を0℃で加えた。反応混合物を室温で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-エチニル-4,6-ジフルオロ-2-メチル-1H-1,3-ベンゾジアゾール(0.22g、75%)を淡黄色固体として得た。MS ESI C10H6F2N2[M+H]+についての計算値193.05、実測値193.15。
ステップ3:3-[2-(4,6-ジフルオロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.52mmol)および5-エチニル-4,6-ジフルオロ-2-メチル-1H-1,3-ベンゾジアゾール(0.15g、0.78mmol)の混合物に、CuI(19.72mg、0.10mmol)、Pd(PPh3)2Cl2(36.34mg、0.05mmol)およびTEA(1.05g、10.34mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を濾過し、濾過ケーキをMeOH(3x10mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mM NH4HCO3)、30分で5%から35%の勾配、検出器、UV 220nm。粗生成物(150mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5um 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:4.3分で40Bから80B、210/254nm、RT1:4.03。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(4,6-ジフルオロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(43.3mg、16%)を白色固体として得た。MS ESI C24H25F2N7O3[M+H]+についての計算値498.20、実測値498.20。H-NMR(400 MHz,DMSO-d6):δ 7.59(s,1H),7.37(d,J=9.1Hz,1H),6.81-6.67(m,2H),6.63-6.60(m,1H),6.18-6.16(m,1H),5.69-5.65(m,1H),5.35-5.21(m,1H),4.53-4.51(m,1H),4.41-4.39(m,1H),4.05-4.01(m,1H),3.90-3.87(m,1H),3.77-3.75(m,,1H),3.63-3.59(m,1H),3.49-3.45(m,3H),3.30(d,J=5.6Hz,3H),2.96(t,J=5.5Hz,3H),2.69-2.65(m,1H),2.36-2.23(m,1H).
実施例18:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(5.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、0.78mmol)の撹拌混合物に、5-エチニル-4,6-ジフルオロ-1,2-ジメチル-1,3-ベンゾジアゾール(0.19g、0.93mmol)、Pd(PPh3)2Cl2(54.52mg、0.08mmol)、CuI(29.58mg、0.16mmol)およびTEA(0.24g、2.33mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。混合物を室温まで冷ました。得られた混合物を濾過し、濾過ケーキをDMF(3x3mL)で洗浄した。残渣を、以下の条件を用いる逆相フラッシュクロマトグラフィーによって精製した:カラム:Spherical C18、20-40um、180g、移動相A:水(NH4HCO3 0.1mM)、移動相B:ACN、流量:90mL/分、勾配:5%から5%B、10分、20分で25%B-60%Bの勾配、検出器:254nm。所望の生成物を含有する分画を30%Bで回収し、減圧下で濃縮して、3-[2-(4,6-ジフルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミドを白色固体(83.7mg、21%)として白色固体として得た。MS ESI C25H27F2N7O3[M+H]+についての計算値512.21、実測値512.53。1H-NMR(300 MHz,DMSO-d6)δ 7.58(d,J=9.3Hz,2H),6.88-6.51(m,3H),6.23-6.11(m,1H),5.73-5.69(m,1H),5.29-5.26(m,1H),4.48(d,J=41.7Hz,1H),4.10-3.83(m,2H),3.76(s,3H),3.68-3.43(m,2H),3.35-3.32(m,3H),3.00-2.95(m,3H),2.69-2.63(m,1H),2.56(s,3H),2.39-2.24(m,1H).
実施例19:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-1-メチル-1H-インダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.39mmol)、5-エチ二ル-4,6-ジフルオロ-1-メチルインダゾール(0.11g、0.58mmol)、Pd(PPh3)2Cl2(27.26mg、0.04mmol)およびCuI(14.79mg、0.08mmol)の撹拌混合物に、TEA(0.12g、1.17mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、NH4HCO3 0.01mmol、20分で25%から40%の勾配、検出器、UV 254nm。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis Prep T3 OBD Column、19*250mm 10u、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm、RT1:5.56。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(4,6-ジフルオロ-1-メチルインダゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(27.5mg、14%)を白色固体として得た。ESI C24H25F2N7O3[M+H]+についての計算値498.2、実測値498.2。1H NMR(400 MHz,DMSO-d6)δ 8.33(s,1H),7.72(d,J=9.5Hz,1H),7.57(s,1H),6.91-6.53(m,3H),6.17-5.92(m,1H),5.69-5.45(m,1H),5.41-5.18(m,1H),4.54-4.34(m,1H),4.06(s,3H),3.88-3.65(m,1H),3.63-3.59(m,1H),3.55-3.39(m,2H),3.31(s,3H),2.98-2.94(m,3H),2.62-2.43(m,1H),2.30-1.96(m,1H).
実施例20:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:3-フルオロ-4-ヨード-2-ニトロアニリン
AcOH(250.00mL)中の3-フルオロ-2-ニトロアニリン(14.50g、92.88mmol)およびNaOAc(8.69g、105.93mmol)の撹拌溶液に、AcOH(50.00mL)中のICl(17.19g、105.88mmol)を窒素雰囲気下、室温で滴下した。反応混合物を90℃でさらに5時間撹拌し、次いで室温で1時間撹拌した。上記混合物に、水(300.00mL)を室温で添加し、16時間撹拌した。得られた混合物を濾過し、濾過ケーキを水3x80mL)で洗浄した。残渣を、PE/EtOAc(4:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、3-フルオロ-4-ヨード-2-ニトロアニリン(13.1g、50%)を橙色固体として得た。
ステップ2:3-フルオロ-4-ヨードベンゼン-1,2-ジアミン
EtOH(150.00mL)および水(50.00mL)中のFe(10.66g、190.92mmol)およびCH3COOH(13.84mL、241.53mmol)の混合物を70℃で0.5時間撹拌した。上記混合物に、3-フルオロ-4-ヨード-2-ニトロアニリン(13.10g、46.45mmol)を70℃で小分けにして添加した。得られた混合物を70℃でさらに2時間撹拌した。混合物を冷やした。得られた混合物を濾過し、濾過ケーキをEA(2x150mL)で洗浄した。濾液を減圧下で濃縮した。残渣に水(70mL)を添加し、EA(3×100mL)で抽出した。合わせた有機層を飽和NaCl(2×70mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。残渣を濃縮して、3-フルオロ-4-ヨードベンゼン-1,2-ジアミン(11.2g、95.7%)を褐色固体として得、これをさらに精製することなく次のステップに使用した。
ステップ3:4-フルオロ-5-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール
MeOH(50.00mL)中の3-フルオロ-4-ヨードベンゼン-1,2-ジアミン(5.00g、19.84mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(3.58g、29.79mmol)を窒素雰囲気下、室温で滴下した。反応混合物を窒素雰囲気下、70℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1:4)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、4-フルオロ-5-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール(5.15g、94%)を淡黄色固体として得た。MS ESI C8H6FIN2[M+H]+についての計算値276.96、実測値276.95。
ステップ4:4-フルオロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール
アセトン(25.00mL)中の4-フルオロ-5-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール(2.35g、8.51mmol)およびKOH(2.87g、51.15mmol)の撹拌溶液に、MeI(0.74mL、5.23mmol)を窒素雰囲気下、室温で滴下した。反応混合物を40分間撹拌した。得られた混合物をEtOAc(3×60mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、4-フルオロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(1.13g、45%)をオフホワイトの固体として得た。MS ESI C9H8FIN2[M+H]+についての計算値290.97、実測値290.95。
ステップ5:4-フルオロ-1,2-ジメチル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール
DMF(12.00mL)中の4-フルオロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(1.13g、3.89mmol)、トリメチルシリルアセチレン(1.15g、11.71mmol)、CuI(0.15g、0.78mmol)およびPd(PPh3)2Cl2(0.27g、0.39mmol)の混合物に、TEA(10.83mL、77.92mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で16時間撹拌した。得られた混合物をEtOAc(3×80mL)で抽出した。合わせた有機層を水(3×60mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:2)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、4-フルオロ-1,2-ジメチル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール(0.94g、92%)を淡黄色固体として得た。MS ESI C14H17FN2Si[M+H]+についての計算値261.11、実測値261.15。
ステップ6:5-エチニル-4-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール
THF(10.00mL)中の4-フルオロ-1,2-ジメチル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール(0.84g、3.23mmol)の撹拌溶液に、TBAF(4.84mL、4.84mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1:2)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、5-エチニル-4-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(0.67g、99%)をオフホワイトの固体として得た。MS ESI C11H9FN2[M+H]+についての計算値189.07、実測値189.20。
THF(10.00mL)中の4-フルオロ-1,2-ジメチル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール(0.84g、3.23mmol)の撹拌溶液に、TBAF(4.84mL、4.84mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1:2)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、5-エチニル-4-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(0.67g、99%)をオフホワイトの固体として得た。MS ESI C11H9FN2[M+H]+についての計算値189.07、実測値189.20。
ステップ7:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.2g、0.52mmol)、5-エチニル-4-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(0.19g、1.04mmol)、CuI(19.72mg、0.10mmol)およびPd(PPh3)2Cl2(36.34mg、0.05mmol)の混合物に、TEA(0.22mL、1.58mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから60B、210/254nm、RT1:5.55、所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.10g、39%)をオフホワイトの固体として得た。MS ESI C25H28FN7O3[M+H]+についての計算値494.22、実測値494.20。H NMR(400 MHz,DMSO-d6)δ 7.43-7.38(m,3H),6.76-6.56(m,3H),6.19-6.14(m,1H),5.70-5.67(m,1H),5.28-5.26(m,1H),4.53-4.39(m,1H),3.79-3.75(m,5H),3.62-3.44(m,2H),3.32(s,3H),2.97-2.94(t,J=5.2Hz,3H),2.58-2.52(m,4H),2.32-2.27(m,1H).
実施例21:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-エチル-4-フルオロ-5-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール
アセトン(25.00mL)中の4-フルオロ-5-ヨード-2-メチル-1H-1,3-ベンゾジアゾール(2.35g、8.51mmol)およびKOH(2.87g、51.08mmol)の撹拌溶液に、ヨウ化エチル(1.86g、11.93mmol)を窒素雰囲気下、室温で滴下した。得られた混合物を窒素雰囲気下、室温で2時間撹拌した。得られた混合物をEtOAc(3×60mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/EtOAc(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4-フルオロ-5-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール(1.46g、56.4%)をオフホワイトの固体として得た。MS ESI C10H10FIN2[M+H]+についての計算値304.99、実測値304.95。
ステップ2:1-エチル-4-フルオロ-2-メチル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール
DMF(15.00mL)中の1-エチル-4-フルオロ-5-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール(1.46g、4.80mmol)、トリメチルシリルアセチレン(1.41g、14.36mmol)、CuI(0.18g、0.96mmol)およびPd(PPh3)2Cl2(0.34g、0.48mmol)の混合物に、TEA(13.35mL、96.04mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で16時間撹拌した。得られた混合物をEtOAc(3×100mL)で抽出した。合わせた有機層を水(3×60mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:2)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4-フルオロ-2-メチル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール(1.0g、75%)を淡黄色固体として得た。MS ESI C15H19FN2Si[M+H]+についての計算値275.13、実測値275.15。
ステップ3:1-エチル-5-エチニル-4-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール
THF(10.00mL)中の1-エチル-4-フルオロ-2-メチル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール(0.91g、3.32mmol)の撹拌溶液に、TBAF(4.97mL、4.97mmol)を窒素雰囲気下、0℃で滴下した。得られた混合物を窒素雰囲気下、室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1:2)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-エチニル-4-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール(0.68g、96%)をオフホワイトの固体として得た。MS ESI C12H11FN2[M+H]+についての計算値203.09、実測値203.20。
ステップ4:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.2g、0.52mmol)、1-エチル-5-エチニル-4-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール(0.21g、1.04mmol)、CuI(19.72mg、0.10mmol)およびPd(PPh3)2Cl2(36.34mg、0.05mmol)の混合物に、TEA(0.22mL、2.13mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから60B、210/254nm、RT1:5.56、所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.11g、41%)をオフホワイトの固体として得た。MS ESI C26H30FN7O3[M+H]+についての計算値508.24、実測値508.25。H NMR(400 MHz,DMSO-d6)δ 7.48-7.38(m,3H),6.79-6.56(m,3H),6.19-6.14(m,1H),5.70-5.67(m,1H),5.30-5.24(m,1H),4.53-4.40(m,1H),4.28-4.23(m,2H),4.08-3.72(m,2H),3.66-3.41(m,2H),3.32-3.29(m,3H),2.96(t,J=5.2Hz,3H),2.60-2.56(m,4H),2.33-2.29(m,1H),1.30(t,J=7.1Hz,3H).
実施例22:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((3-エチル-2-メチル-3H-イミダゾ[4,5-b]ピリジン-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:N-エチル-5-ヨード-3-ニトロピリジン-2-アミン
EtOH(30.00mL)中の2-クロロ-5-ヨード-3-ニトロピリジン(3.10g、10.90mmol)およびエチルアミン(0.98g、21.8mmol)の撹拌混合物に、TEA(3.31g、32.69mmol)を空気雰囲気下、室温で添加した。反応混合物を80℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(300mL)で希釈し、EA(3×250mL)で抽出した。合わせた有機層を飽和NaCl(500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。残渣を濃縮して、N-エチル-5-ヨード-3-ニトロピリジン-2-アミン(3.5g、99%)を橙色固体として得、これをさらに精製することなく次のステップに使用した。ESI C7H8IN3O2[M+H]+についての計算値293.9、実測値294。
ステップ2:N2-エチル-5-ヨードピリジン-2,3-ジアミン
EtOH(52.00mL)および水(8mL)中のN-エチル-5-ヨード-3-ニトロピリジン-2-アミン(3.00g、10.24mmol)およびNH4Cl(2.74g、51.18mmol)の撹拌混合物に、Fe(2.29g、40.95mmol)を室温で添加した。反応混合物を空気雰囲気下、75℃で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをEA(2x150mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(200mL)で希釈し、EA(3×200mL)で抽出した。合わせた有機層を飽和NaCl(500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。得られた混合物を濃縮して、N2-エチル-5-ヨードピリジン-2,3-ジアミン(2.6g、96%)を黒色固体として得、これをさらに精製することなく次のステップに使用した。MS ESI C7H10IN3[M+H]+についての計算値263.9、実測値264.05。
ステップ3:3-エチル-6-ヨード-2-メチルイミダゾ[4,5-b]ピリジン
CH3COOH(22.00mL)中のN2-エチル-5-ヨードピリジン-2,3-ジアミン(2.20g、8.36mmol)の撹拌混合物に、1,1,1-トリメトキシエタン(2.01g、16.73mmol)を空気雰囲気下、室温で添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEtOAc(100mL)で希釈した。混合物を飽和NaHCO3(水溶液)でpH8に塩基性化した。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチル-6-ヨード-2-メチルイミダゾ[4,5-b]ピリジン(1.7g、70%)を褐色固体として得た。MS ESI C9H10IN3[M+H]+についての計算値287.99、実測値287.95。
ステップ4:3-エチル-2-メチル-6-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン
DMF(14.00mL)中の3-エチル-6-ヨード-2-メチルイミダゾ[4,5-b]ピリジン(1.50g、5.23mmol)、トリメチルシリルアセチレン(1.54g、15.67mmol)、Pd(PPh3)2Cl2(0.37g、0.52mmol)およびCuI(0.2g、1.05mmol)の撹拌混合物に、TEA(10.57g、104.49mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で2時間撹拌した。残渣を水(150mL)で希釈し、EtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチル-2-メチル-6-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン(1.1g、81%)を褐色固体として得た。MS ESI C14H19N3Si[M+H]+についての計算値258.13、実測値258.05。
ステップ5:3-エチル-6-エチニル-2-メチルイミダゾ[4,5-b]ピリジン
THF(10.00mL)中の3-エチル-2-メチル-6-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン(1.00g、3.89mmol)の撹拌混合物に、TBAF(1.52g、5.83mmol)を空気雰囲気下、室温で添加した。反応混合物を室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(100mL)で希釈し、EtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチル-6-エチニル-2-メチルイミダゾ[4,5-b]ピリジン(0.28g、38%)を褐色固体として得た。MS ESI C11H11N3[M+H]+についての計算値186.1、実測値186.15。
ステップ6:3-(2-[3-エチル-2-メチルイミダゾ[4,5-b]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.2g、0.52mmol)、3-エチル-6-エチニル-2-メチルイミダゾ[4,5-b]ピリジン(0.14g、0.78mmol)、Pd(PPh3)2Cl2(36.34mg、0.05mmol)およびCuI(19.72mg、0.1mmol)の撹拌混合物に、TEA(0.16g、1.55mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、NH4HCO3 0.01mmol、20分で20%から40%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから55B、210/254nm、RT1:5.53。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[3-エチル-2-メチルイミダゾ[4,5-b]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(59mg、23%)を淡黄色固体として得た。MS ESI C25H30N8O3[M+H]+についての計算値491.24、実測値491.15。1H NMR(400 MHz,DMSO-d6)δ 8.49(d,J=1.9Hz,1H),8.19-8.15(m,1H),7.31(s,1H),6.94-6.71(m,1H),6.69-6.47(m,2H),6.17-5.96(m,1H),5.69-5.43(m,1H),5.23-5.03(m,1H),4.49-4.45(m,1H),4.29(q,J=7.3Hz,2H),4.11-3.71(m,2H),3.68-3.41(m,2H),3.31(d,J=5.4Hz,3H),3.06-2.89(m,3H),2.65-2.60(m,4H),2.38-2.25(m,1H),1.34(t,J=7.2Hz,3H).
実施例23:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((3-メチル-3H-イミダゾ[4,5-b]ピリジン-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:5-ヨード-N-メチル-3-ニトロピリジン-2-アミン
EtOH(30.00mL)中の2-クロロ-5-ヨード-3-ニトロピリジン(3.00g、10.55mmol)およびメチルアミン(0.65g、21.09mmol)の撹拌混合物に、TEA(3.20g、31.64mmol)を空気雰囲気下、室温で添加した。反応混合物を80℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(300mL)で希釈し、EA(3×150mL)で抽出した。合わせた有機層を飽和NaCl(500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を濃縮し、乾燥させて、5-ヨード-N-メチル-3-ニトロピリジン-2-アミン(2.9g、98%)を橙色固体として得、これをさらに精製することなく次のステップに直接使用した。ESI C6H6IN3O2[M+H]+についての計算値279.95、実測値279.95。
ステップ2:5-ヨード-N2-メチルピリジン-2,3-ジアミン
EtOH(52.00mL)/H2O(7.00mL)中の5-ヨード-N-メチル-3-ニトロピリジン-2-アミン(3.00g、10.75mmol)およびNH4Cl(2.88g、53.75mmol)の撹拌混合物に、Fe(2.40g、43.00mmol)を空気雰囲気下、室温で添加した。反応混合物を75℃で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをEA(2x150mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(200mL)で希釈し、EA(3×200mL)で抽出した。合わせた有機層を飽和NaCl(500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を合わせ、濃縮して、5-ヨード-N2-メチルピリジン-2,3-ジアミン(1.7g、63%)を黒色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C6H8IN3[M+H]+についての計算値249.98、実測値250.0。
ステップ3:6-ヨード-3-メチルイミダゾ[4,5-b]ピリジン
CH3COOH(13.00mL)中の5-ヨード-N2-メチルピリジン-2,3-ジアミン(1.30g、5.22mmol)の撹拌混合物に、オルトギ酸トリメチル(1.11g、0.01mmol)を空気雰囲気下、室温で添加した。反応混合物を空気雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEtOAc(100mL)で希釈した。混合物を飽和NaHCO3(水溶液)でpH8に塩基性化した。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-ヨード-3-メチルイミダゾ[4,5-b]ピリジン(0.85g、62%)を褐色固体として得た。MS ESI C7H6IN3[M+H]+についての計算値258.96、実測値259.85。
ステップ4:3-メチル-6-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン
DMF(8.00mL)中の6-ヨード-3-メチルイミダゾ[4,5-b]ピリジン(0.8g、3.08mmol)、トリメチルシリルアセチレン(0.9g、9.26mmol)、Pd(PPh3)2Cl2(0.22g、0.31mmol)およびCuI(0.12g、0.62mmol)の撹拌混合物に、TEA(6.25g、61.76mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、80℃で2時間撹拌した。残渣を水(150mL)で希釈し、EtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-メチル-6-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン(0.70g、98%)を褐色固体として得た。MS ESI C12H15N3Si[M+H]+についての計算値230.1、実測値230.0。
ステップ5:6-エチニル-3-メチルイミダゾ[4,5-b]ピリジン
THF(6.00mL)中の3-メチル-6-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン(0.56g、2.44mmol)の撹拌混合物に、TBAF(0.96g、3.66mmol)を空気雰囲気下、室温で添加した。反応混合物を室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(100mL)で希釈し、EtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-エチニル-3-メチルイミダゾ[4,5-b]ピリジン(0.30g、78%)を褐色固体として得た。MS ESI C9H7N3[M+H]+についての計算値158.06、実測値158.10。
ステップ6:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[3-メチルイミダゾ[4,5-b]ピリジン-6-イル]エチニル)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.2g、0.52mmol)、6-エチニル-3-メチルイミダゾ[4,5-b]ピリジン(0.12g、0.78mmol)、Pd(PPh3)2Cl2(36.34mg、0.05mmol)およびCuI(19.72mg、0.11mmol)の撹拌混合物に、TEA(0.16g、1.55mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、NH4HCO3 0.01mmol、20分で20%から40%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5um 10nm、移動相A:水(0.1%FA)、移動相B:MeOH--HPLC、流量:20mL/分、勾配:6分で30Bから50B、210/254nm、RT1:5.68。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[3-メチルイミダゾ[4,5-b]ピリジン-6-イル]エチニル)ピラゾール-4-カルボキサミド(22.5mg、9%)を淡黄色固体として得た。MS ESI C23H26N8O3[M+H]+についての計算値463.21、実測値463.15。1H NMR(300 MHz,DMSO-d6)δ 8.64-8.57(m,2H),8.35(d,J=1.8Hz,1H),7.28(s,1H),6.65-6.43(m,2H),6.15-5.96(m,1H),5.68-5.43(m,1H),5.23-5.01(m,1H),4.60-4.47(m,1H),4.44-4.34(m,1H),4.05-4.00(m,1H),3.89-3.85(m,4H),3.65-3.42(m,2H),3.31-3.27(m,3H),2.95-2.90(m,3H),2.79-2.55(m,1H),2.39-2.19(m,1H).
実施例24:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-シアノ-1-エチル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:3-(エチルアミノ)-4-ニトロベンゾニトリル
EtOH(90.00mL)中の3-フルオロ-4-ニトロベンゾニトリル(10.00g、60.20mmol)およびエチルアミン(5.43g、120.40mmol)の撹拌混合物に、TEA(25.10mL、248.08mmol)を窒素雰囲気下、室温で添加した。反応混合物を50℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をNaHCO3(300mL)で希釈した。得られた混合物をEtOAc(3×200mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を乾燥させて、3-(エチルアミノ)-4-ニトロベンゾニトリル(11.5g、89%)を得、これをさらに精製することなく次のステップに直接使用した。H-NMR(400 MHz、クロロホルム-d):δ 8.27(d,J=8.7Hz,1H),7.98(s,1H),7.17(d,J=1.7Hz,1H),6.88(dd,J=8.7,1.7Hz,1H),3.41-3.38(m,2H),1.43(t,J=7.2Hz,3H).
ステップ2:5-(エチルアミノ)-2-ヨード-4-ニトロベンゾニトリル
AcOH(120.00mL)中の3-(エチルアミノ)-4-ニトロベンゾニトリル(12.50g、65.38mmol)の撹拌溶液に、NIS(16.18g、71.92mmol)を窒素雰囲気下、室温で小分けにして添加した。反応混合物を50℃で6時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEtOAc(100mL)で希釈した。得られた混合物を飽和NaHCO3(水溶液)でpH8に塩基性化し、EtOAc(3×500mL)で抽出した。合わせた有機層をブライン(3×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(50:1)(500mL)を用いた研和によって精製した。沈殿した固体を濾過によって回収し、乾燥させて、5-(エチルアミノ)-2-ヨード-4-ニトロベンゾニトリル(13.9g、60%)を赤褐色固体として得た。MS ESI C9H8IN3O2[M-H]-についての計算値315.97、実測値315.90。
ステップ3:4-アミノ-5-(エチルアミノ)-2-ヨードベンゾニトリル
EtOH(30.00mL)およびH2O(4.50mL)中の5-(エチルアミノ)-2-ヨード-4-ニトロベンゾニトリル(3.00g、9.46mmol)およびNH4Cl(2.53g、47.31mmol)の撹拌混合物に、Fe(2.11g、37.85mmol)を添加した。反応混合物を窒素雰囲気下、75℃で4時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOH(6x300mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(300mL)で希釈し、EtOAc(3×200mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。粗生成物4-アミノ-5-(エチルアミノ)-2-ヨードベンゾニトリル(2.4g、79%)を、さらに精製することなく次のステップに直接使用した。MS ESI C9H10IN3[M-H]-についての計算値285.99、実測値286.00。
ステップ4:3-エチル-6-ヨード-2-メチル-1,3-ベンゾジアゾール-5-カルボニトリル
AcOH(35.00mL)中の4-アミノ-5-(エチルアミノ)-2-ヨードベンゾニトリル(3.50g、12.19mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(2.93g、24.38mmol)を窒素雰囲気下、室温で添加した。反応混合物を70℃で5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEtOAc(100mL)で希釈した。混合物を飽和NaHCO3(水溶液)でpH8に塩基性化した。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチル-6-ヨード-2-メチル-1,3-ベンゾジアゾール-5-カルボニトリル(2.18g、54%)をオフホワイトの固体として得た。MS ESI C11H10IN3[M+H]+についての計算値311.99、実測値312.05。
ステップ5:3-エチル-2-メチル-6-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール-5-カルボニトリル
DMF(22.00mL)中の3-エチル-6-ヨード-2-メチル-1,3-ベンゾジアゾール-5-カルボニトリル(2.18g、7.01mmol)、トリメチルシリルアセチレン(2.97mL、30.25mmol)、CuI(0.27g、1.40mmol)およびPd(PPh3)2Cl2(0.49g、0.70mmol)の撹拌混合物に、TEA(19.48mL、192.50mmol)を添加した。反応混合物を窒素で3回脱気し、80℃で2時間撹拌した。得られた混合物を水(100mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(25:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチル-2-メチル-6-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール-5-カルボニトリル(2g、94%)を褐色固体として得た。MS ESI C16H19N3Si[M+H]+についての計算値282.13、実測値282.15。
ステップ6:3-エチル-6-エチニル-2-メチル-1,3-ベンゾジアゾール-5-カルボニトリル
THF(10.00mL)中の3-エチル-2-メチル-6-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール-5-カルボニトリル(1.00g、3.55mmol)の撹拌溶液に、TBAF(5.33mL、5.33mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で16時間撹拌した。得られた混合物を水(80mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(25:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチル-6-エチニル-2-メチル-1,3-ベンゾジアゾール-5-カルボニトリル(0.70g、84%)を黄色固体として得た。MS ESI C13H11N3[M+H]+についての計算値210.10、実測値210.20。
ステップ7:3-[2-(6-シアノ-1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.52mmol)、3-エチル-6-エチニル-2-メチル-1,3-ベンゾジアゾール-5-カルボニトリル(0.16g、0.78mmol)、CuI(19.72mg、0.10mmol)およびPd(PPh3)2Cl2(36.34mg、0.05mmol)の撹拌混合物に、TEA(0.22mL、2.13mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3(10mmol/L)、25分で10%から50%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19×250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから60B、210/254nm、RT1:5.52。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-シアノ-1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(49.9mg、18%)をオフホワイトの固体として得た。MS ESI C27H30N8O3[M+H]+についての計算値515.24、実測値515.30。H-NMR(400 MHz,DMSO-d6):δ 8.34(d,J=1.3Hz,1H),7.98(d,J=0.5Hz,1H),7.43(s,1H),6.78-6.53(m,3H),6.19-6.17(m,1H),5.73-5.61(m,1H),5.33-5.28(m,1H),4.50-4.45(m,1H),4.35-4.30(m,2H),4.07-3.70(m,2H),3.63-3.43(m,2H),3.30(s,3H),2.96-2.92(m,3H),2.63(s,3H),2.50-2.47(m,1H),2.36-2.27(m,1H),1.32(t,J=7.2Hz,3H).
実施例25:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((2-シクロプロピル-1-エチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:N-[2-(エチルアミノ)-5-ヨードフェニル]シクロプロパンカルボキサミド
DMF(5.00mL)中のシクロプロパンカルボン酸(0.16g、1.91mmol)およびHATU(1.09g、2.86mmol)の撹拌混合物に、N,N-ジイソプロピルエチルアミン(0.74g、5.72mmol)を室温で滴下した。反応混合物を室温で10分間撹拌した。上記混合物に、N1-エチル-4-ヨードベンゼン-1,2-ジアミン(0.50g、1.91mmol)を室温で添加した。得られた混合物をさらに1時間撹拌した。反応物を水(10mL)でクエンチし、EtOAc(3×20mL)で抽出した。合わせた有機層をブライン(3×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、N-[2-(エチルアミノ)-5-ヨードフェニル]シクロプロパンカルボキサミド(0.50g、79%)を暗灰色固体として得、これをさらに精製することなく次のステップに直接使用した。ESI C12H15IN2O[M+H]+についての計算値331.02、実測値331.05。
ステップ2:2-シクロプロピル-1-エチル-5-ヨード-1,3-ベンゾジアゾール
酢酸(9.00mL)中のN-[2-(エチルアミノ)-5-ヨードフェニル]シクロプロパンカルボキサミド(0.90g、2.73mmol)の混合物を80℃で1時間撹拌した。得られた混合物を室温まで冷まし、減圧下で濃縮した。残渣を飽和NaHCO3(水溶液)でpH=7に中和し、EtOAc(3×50mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(3:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-1-エチル-5-ヨード-1,3-ベンゾジアゾール(0.61g、71%)を褐色半固体として得た。MS ESI C12H13IN2[M+H]+についての計算値313.01、実測値312.95。
ステップ3:2-シクロプロピル-1-エチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(6.00mL)中の2-シクロプロピル-1-エチル-5-ヨード-1,3-ベンゾジアゾール(0.61g、1.95mmol)およびトリメチルシリルアセチレン(0.58g、5.86mmol)の混合物に、Pd(PPh3)2Cl2(0.14g、0.19mmol)、CuI(74.43mg、0.39mmol)およびTEA(3.95g、39.08mmol)を室温で添加した。反応混合物を窒素で3回脱気し、80℃で5時間撹拌した。混合物を室温まで冷ました。得られた混合物を水(30mL)で希釈し、EtOAc(3×50mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(3:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、2-シクロプロピル-1-エチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.54g、97%)を淡褐色半固体として得た。MS ESI C17H22N2Si[M+H]+についての計算値283.16、実測値283.25。
ステップ4:2-シクロプロピル-1-エチル-5-エチニル-1,3-ベンゾジアゾール
THF(6.00mL)中の2-シクロプロピル-1-エチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.54g、1.91mmol)の撹拌溶液に、TBAF(0.75g、2.88mmol)を添加した。反応混合物を室温で1.5時間撹拌した。反応物を、室温にて水(5mL)の添加によってクエンチした。得られた混合物をEtOAc(3×10mL)で抽出した。合わせた有機層をブライン(3×10mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、PE/EtOAc(3:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-1-エチル-5-エチニル-1,3-ベンゾジアゾール(0.35g、87%)を桃色半固体として得た。MS ESI C14H14N2[M+H]+についての計算値211.12、実測値211.05。
ステップ5:3-[2-(2-シクロプロピル-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の2-シクロプロピル-1-エチル-5-エチニル-1,3-ベンゾジアゾール(0.16g、0.76mmol)および3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.35g、0.91mmol)の混合物に、Pd(PPh3)2Cl2(53.41mg、0.07mmol)、CuI(28.98mg、0.15mmol)およびTEA(0.23g、2.28mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を室温まで冷ました。得られた混合物をEtOAc(3×10mL)で抽出した。合わせた有機層をブライン(3×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。粗生成物(150mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で15Bから60B;254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-シクロプロピル-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(75.8mg、19%)をオフホワイトの固体として得た。MS ESI C28H33N7O3[M+H]+についての計算値516.26、実測値516.15。1H NMR(300 MHz,DMSO-d6)δ 7.69(d,J=1.4Hz,1H),7.57(d,J=8.3Hz,1H),7.38-7.31(m,2H),6.85-6.48(m,3H),6.16(d,J=16.6Hz,1H),5.68(d,J=10.3Hz,1H),5.31-5.13(m,1H),4.41-4.34(m,3H),3.87-3.84(m,1H),3.79-3.66(m,1H),3.61-3.57(m,1H),3.50-3.37(m,2H),3.30-3.24(m,3H),2.95-2.90(m,3H),2.44-2.16(m,2H),1.34(t,J=7.1Hz,3H),1.10-1.05(m,4H).
実施例26:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-(ベンゾ[d]イソオキサゾール-6-イルエチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:6-[2-(トリメチルシリル)エチニル]-1,2-ベンゾオキサゾール
DMF(8.00mL)中の6-ブロモ-1,2-ベンゾオキサゾール(2.00g、10.10mmol)、トリメチルシリルアセチレン(1.49g、15.15mmol)、CuI(0.38g、2.02mmol)およびPd(PPh3)2Cl2(0.71g、1.01mmol)の混合物に、TEA(20.44g、202.00mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で16時間撹拌した。得られた混合物を水(100mL)で希釈した。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層を水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-[2-(トリメチルシリル)エチニル]-1,2-ベンゾオキサゾール(0.80g、36%)を黄色半固体として得た。MS ESI C12H13NOSi[M-H]-についての計算値214.09、実測値214.15。
ステップ2:6-エチニル-1,2-ベンゾオキサゾール
THF(8.00mL)中の6-[2-(トリメチルシリル)エチニル]-1,2-ベンゾオキサゾール(0.80g、3.72mmol)の撹拌溶液に、TBAF(5.57mL、5.57mmol)を空気雰囲気下、0℃で滴下した。反応混合物を室温で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-エチニル-1,2-ベンゾオキサゾール(0.29g、54%)を淡褐色固体として得た。MS ESI C9H5NO[M-H]-についての計算値142.04、実測値142.10。
ステップ3:3-[2-(1,2-ベンゾオキサゾール-6-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.52mmol)および6-エチニル-1,2-ベンゾオキサゾール(0.12g、0.78mmol)の撹拌混合物に、CuI(19.72mg、0.10mmol)、Pd(PPh3)2Cl2(36.34mg、0.05mmol)およびTEA(0.16g、1.55mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mM NH4HCO3)、30分で5%から35%の勾配、検出器、UV 220nm。粗生成物(150mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから60B、210/254nm、RT1:5.65。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1,2-ベンゾオキサゾール-6-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(37.00mg、16%)を白色固体として得た。MS ESI C23H24N6O4[M+H]+についての計算値449.19、実測値449.25。H-NMR(400 MHz,DMSO-d6):δ 7.67(d,J=7.9Hz,1H),7.34(m,1H),7.08(d,J=13.3Hz,2H),6.71(s,1H),6.58(m,J=16.8,10.3Hz,1H),6.52(d,J=5.7Hz,1H),6.17(d,J=16.6Hz,1H),5.69(d,J=10.0Hz,1H),5.30-5.14(m,1H),4.52(s,1H),4.39(s,1H),4.06-3.97(m,1H),3.89-3.79(m,1H),3.77-3.73(m,1H),3.61-3.58(m,1H),3.48-3.45(m,3H),2.94(s,3H),2.53-2.49(m,1H),2.36-2.32(m,1H).
実施例27:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-エチル-5-ヨード-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール
CF3COOH中のN1-エチル-4-ヨードベンゼン-1,2-ジアミン(2.00g、7.63mmol)の溶液を、窒素雰囲気下、70℃で0.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEA(50mL)で希釈し、室温にて飽和NH3HCO3(水溶液)(50mL)の添加によってクエンチした。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(5:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-ヨード-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール(2.5g、96%)をオフホワイトの固体として得た。ESI C10H8F3IN2[M+H]+についての計算値340.97、実測値340.80。
ステップ2:3-エチル-2-(トリフルオロメチル)-6-((トリメチルシリル)エチニル)-3H-インドール
DMF中の1-エチル-5-ヨード-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール(1.25g、3.68mmol)、Pd(PPh3)2Cl2(0.26g、0.37mmol)、CuI(0.14g、0.74mmol)およびトリメチルシリルアセチレン(1.08g、11.03mmol)の撹拌混合物に、TEA(7.44g、73.51mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で2時間撹拌した。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(5:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチル-2-(トリフルオロメチル)-6-((トリメチルシリル)エチニル)-3H-インドール(1.2g、96%)を白色固体として得た。MS ESI C16H18F3NSi[M+H]+についての計算値310.12、実測値310.25。
ステップ3:1-エチル-5-エチニル-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール
THF中の3-エチル-2-(トリフルオロメチル)-6-((トリメチルシリル)エチニル)-3H-インドール(1.10g、3.54mmol)の撹拌溶液に、TBAF(1.39g、5.32mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(5:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-エチニル-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール(0.83g、98%)を淡黄色固体として得た。MS ESI C12H9F3N2[M+H]+についての計算値239.07、実測値239.15。
ステップ4:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF中の1-エチル-5-エチニル-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール(0.17g、0.70mmol)、Pd(PPh3)2Cl2(32.71mg、0.05mmol)、CuI(17.75mg、0.09mmol)および1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-ブロモ-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.18g、0.47mmol)の撹拌混合物に、TEA(0.14g、1.40mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、10分で10%から50%の勾配、検出器、UV 254nm。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Xselect CSH OBD Column 30*150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:30mL/分、勾配:6分で20Bから60B、210/254nm;RT:5.59。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-2-(トリフルオロメチル)-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(97.3mg、38%)を白色固体として得た。MS ESI C26H28F3N7O3[M+H]+についての計算値544.22、実測値544.25。H-NMR(300 MHz,DMSO-d6)δ 8.11(s,1H),7.93(d,J=8.6Hz,1H),7.75-7.55(m,1H),7.35(s,1H),6.98-6.51(m,3H),6.18(d,J=16.6Hz,1H),5.70(d,J=10.4Hz,1H),5.26(s,1H),4.35-4.60(m,3H),4.14-3.66(m,2H),3.65-3.39(m,2H),3.31-3.27(m,3H),2.95(t,J=4.4Hz,3H),2.50-2.46(m,1H),2.25-2.58(m,1H),1.41(t,J=7.1Hz,3H).
実施例28:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-1,2-ジメチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:5-フルオロ-4-ヨード-2-ニトロアニリン
AcOH(120.00mL)中の5-フルオロ-2-ニトロアニリン(15.00g、96.08mmol)の混合物に、NIS(22.70g、100.88mmol)を添加した。反応混合物を70℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEtOAc(50mL)で希釈した。混合物を飽和NaHCO3(水溶液)でpH8に塩基性化した。得られた混合物をEtOAc(3×200mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(9:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-フルオロ-4-ヨード-2-ニトロアニリン(24g、79%)を黄色固体として得た。MS ESI C6H4FIN2O2[M-H]-についての計算値280.93、実測値281.00。
ステップ2:4-フルオロ-5-ヨードベンゼン-1,2-ジアミン
EtOH(100.00mL)およびH2O(15.00mL)中の5-フルオロ-4-ヨード-2-ニトロアニリン(10.00g、35.46mmol)およびNH4Cl(9.48g、177.29mmol)の撹拌混合物に、Fe(8.12g、145.38mmol)を添加した。反応混合物を窒素雰囲気下、75℃で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをエタノール(3x500mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(200mL)で希釈した。得られた混合物をEtOAc(3×200mL)で抽出した。合わせた有機層をブライン(500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮し、乾燥させて、4-フルオロ-5-ヨードベンゼン-1,2-ジアミン(10g、89%)を黒色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C6H6FIN2[M+H]+についての計算値252.96、実測値253.00。
ステップ3:5-フルオロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール
MeOH(30mL)中の4-フルオロ-5-ヨードベンゼン-1,2-ジアミン(3.17g、12.58mmol)の溶液に、1,1,1-トリメトキシエタン(2.27g、18.87mmol)を添加した。反応混合物を窒素雰囲気下、70℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-フルオロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(2.9g、83%)を淡黄色固体として得た。MS ESI C8H6FIN2[M+H]+についての計算値276.96、実測値277.00。
ステップ4:6-フルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール
アセトン中の5-フルオロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(1g、3.62mmol)およびKOH(1.01g、18.00mmol)の撹拌混合物に、ヨウ化メチル(0.36mL)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を濾過し、濾過ケーキを酢酸エチル(3x10mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-SFCによって精製した:カラム:CHIRALPAK IF、5*25cm、5um、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MEOH)、流量:180mL/分、勾配:40%B;220nm、RT1:5.22;RT2:6.2。所望の生成物を含有する分画を合わせ、濃縮して、6-フルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール(0.47g、44%)をオフホワイトの固体として得た。MS ESI C9H8FIN2[M+H]+についての計算値476.23、実測値476.25。
ステップ5:3-[2-(6-フルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL、20.52mmol)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、6-フルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール(0.16g、0.54mmol)、Pd(PPh3)2Cl2(31.77mg、0.05mmol)およびCuI(17.24mg、0.09mmol)の撹拌混合物に、TEA(0.19mL、1.86mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で50Bから80B、210/254nm、RT1:4.03。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物(70mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で25Bから50B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(58mg、25%)をオフホワイトの固体として得た。MS ESI C25H28FN7O3[M+H]+についての計算値494.22、実測値494.30。H-NMR(400 MHz,DMSO-d6):δ 7.78(dd,J=6.3,1.2Hz,1H),7.61(d,J=9.9Hz,1H),7.49(s,1H),6.79-6.52(m,3H),6.18-6.16(m,1H),5.72-5.67(m,1H),5.28-5.25(m,1H),4.55-4.42(m,1H),4.06-3.56(m,5H),3.52-3.42(m,2H),3.35-3.28(m,3H),2.99-2.93(m,3H),2.53(s,3H),2.49-2.43(m,1H),2.35-2.27(m,1H).
実施例29:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-エチル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール
DMF中の4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(1.00g、0.004mmol)の溶液に、水素化ナトリウム(油中で60%、0.26g)を0℃で添加した。混合物を15分間撹拌した。上記混合物に、ヨウ化エチル(1.67g、0.01mmol)を添加した。反応混合物を室温で1時間撹拌した。得られた混合物を水によってクエンチし、EA(3×50mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/EtOAc(5:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.4g、36%)をオフホワイトの固体として得た。MS ESI C9H7F2IN2[M+H]+についての計算値308.96、実測値308.90。
ステップ2:1-エチル-4,6-ジフルオロ-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(4.00mL)中の1-エチル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.40g、1.29mmol)、トリメチルシリルアセチレン(0.38g、3.90mmol)、CuI(49.46mg、0.26mmol)およびPd(PPh3)2Cl2(91.14mg、0.13mmol)の混合物に、TEA(2.63g、25.97mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を水(50mL)で希釈し、EtOAc(3×50mL)で抽出した。合わせた有機層を水(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4,6-ジフルオロ-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.30g、83%)を黄色油状物として得た。MS ESI C10H6F2N2[M+H]+についての計算値279.11、実測値279.25。
ステップ3:1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール
THF(3.00mL)中の1-エチル-4,6-ジフルオロ-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.30g、1.08mmol)の撹拌溶液に、TBAF(1.62mL、1.62mmol)を空気雰囲気下、0℃で滴下した。反応混合物を室温で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.18g、81%)を淡黄色固体として得た。MS ESI C11H8F2N2[M+H]+についての計算値207.07、実測値207.05。
ステップ4:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ヨード-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.35mmol)、1-エチル-5-エチ二ル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.14g、0.692mmol)、Pd(PPh3)2Cl2(24.30mg、0.04mmol)およびCuI(13.19mg、0.069mmol)の撹拌混合物に、TEA(0.11g、1.04mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mM NH4HCO3)、30分で5%から35%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物(130mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから60B、210/254nm、RT1:5.56。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(91mg、51%)を白色固体として得た。MS ESI C25H27F2N7O3[M+H]+についての計算値512.21、実測値512.20。H-NMR(400 MHz,DMSO-d6):δ 8.46(s,1H),7.73-7.70(m,1H),7.58(s,1H),6.78-6.55(m,3H),6.18-6.25(m,1H),5.71-5.68(m,1H),5.29-5.26(m,1H),4.60-4.36(m,1H),4.30(q,J=7.3Hz,2H),4.08-3.69(m,2H),3.65-3.41(m,2H),3.35-3.30(m,3H),2.97(t,J=5.3Hz,3H),2.71-2.58(m,1H),2.33-2.30(m,1H),1.41(t,J=7.2Hz,3H).
実施例30:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-ジフルオロメチル)-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-(ジフルオロメチル)-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール
EA(8.00mL)中の4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(1.00g、3.57mmol)の撹拌溶液に、ジフルオロ(スルホ)酢酸(0.76g、4.28mmol)およびK2CO3(1.48g、10.71mmol)を室温で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を、飽和重炭酸ナトリウム水溶液(30mL)によってクエンチした。有機層を分離し、水層をEA(3×45mL)で抽出した。合わせた有機層をブライン(2×45mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のEA(0-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-アキラル-SFCによってさらに分離した:カラム:BEH2-エチルピリジン、30*150mm、5μm、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:45mL/分、勾配:10%B、検出器:UV 254nm)。所望の生成物を含有するより速い分画(RT:2.93分)を合わせ、減圧下で濃縮して、1-(ジフルオロメチル)-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.45g、37%)を白色固体として得た。所望の生成物を含有するより遅い分画(RT:3.50分)を合わせ、減圧下で濃縮して、1-(ジフルオロメチル)-5,7-ジフルオロ-6-ヨード-1,3-ベンゾジアゾール(0.15g、12%)を白色固体として得た。MS ESI C8H3F4IN2[M+H]+についての計算値330.93、実測値330.95。
ステップ2:3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の1-(ジフルオロメチル)-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.18g、0.54mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)の撹拌混合物に、Pd(PPh3)2Cl2(44.29mg、0.05mmol)、CuI(20.66mg、0.11mmol)およびTEA(0.16g、1.63mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-4.8%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Prep C18 OBD Column、19×150mm、5μm、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で30%Bから60%B、検出器:UV 210&254nm;RT:4.02分。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(44.8mg、15%)を白色固体として得た。MS ESI C24H23F4N7O3[M+H]+についての計算値534.18、実測値534.25。H-NMR(400 MHz,d6-DMSO)δ 8.79(s,1H),8.11(t,J=58.4Hz,1H),7.75(d,J=8.4Hz,1H),7.56(brs,1H),6.71-6.55(m,3H),6.17(d,J=16.9Hz,1H),5.69(d,J=10.3Hz,1H),5.28(s,1H),4.53-4.39(m,1H),4.02-3.72(m,2H),3.60-3.45(m,2H),3.32(s,3H),2.96(s,3H),2.67-2.61(m,1H),2.33-2.30(m,1H).
実施例31:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-ジフルオロメチル)-4,6-ジフルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-(ジフルオロメチル)-4,6-ジフルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール
EA(3.00mL)中の4,6-ジフルオロ-5-ヨード-2-メチル-1H-1,3-ベンゾジアゾール(0.20g、0.68mmol)およびK2CO3(0.19g、1.36mmol)の撹拌溶液に、ジフルオロ(スルホ)酢酸(0.15g、0.82mmol)を0℃で滴下した。反応混合物を周囲温度で1時間撹拌した。得られた混合物を水(10mL)で希釈し、EA(3×10mL)で抽出した。合わせた有機層をブライン(2×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(10-35%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-(ジフルオロメチル)-4,6-ジフルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール(80mg、34%)を淡黄色固体として得た。MS ESI C9H5F4IN2[M+H]+についての計算値344.95、実測値345.00。
ステップ2:1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール
DMF(8.00mL)中の1-(ジフルオロメチル)-4,6-ジフルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.61g、1.77mmol)、トリメチルシリルアセチレン(0.52g、5.32mmol)、PdCl2(PPh3)2(0.12g、0.18mmol)およびCuI(67.53mg、0.36mmol)の撹拌混合物に、TEA(0.36g、3.55mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。周囲温度まで冷却した後、得られた混合物を水(20mL)で希釈し、EA(3×25mL)で抽出した。合わせた有機層をブライン(2×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(20-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.5g、89%)を黄色固体として得た。MS ESI C14H14F4N2Si[M+H]+についての計算値315.09、実測値315.15。
ステップ3:1-(ジフルオロメチル)-5-エチニル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール
THF(5.00mL)中の1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(0.50g、1.59mmol)の撹拌溶液に、TBAF(THF中で1.0M、2.40mL、2.40mmol)を0℃で滴下した。反応混合物をアルゴン雰囲気下、周囲温度で2時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(50-90%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、1-(ジフルオロメチル)-5-エチニル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール(0.33g、85%)を黄色固体として得た。MS ESI C11H6F4N2[M+H]+についての計算値243.05、実測値242.85。
ステップ4:3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ヨード-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.30mmol)、1-(ジフルオロメチル)-5-エチニル-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール(87.20mg、0.36mmol)、PdCl2(PPh3)2(21.06mg、0.03mmol)およびCuI(11.43mg、0.06mmol)の混合物に、TEA(60.73mg、0.60mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。周囲温度まで冷却した後、得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5.0%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で25%Bから50%B、検出器:UV 210&254nm;RT:4.02分。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(86mg、52%)を白色固体として得た。MS ESI C25H25F4N7O3[M+H]+についての計算値548.20、実測値548.05。H NMR(400 MHz,d6-DMSO)δ 8.11(t,J=57.2Hz,1H),7.67(d,J=8.8Hz,1H),7.56(brs,1H),6.75-6.56(m,3H),6.18-6.15(m,1H),5.71-5.68(m,1H),5.32-5.20(m,1H),4.55-4.36(m,1H),4.05-3.71(m,2H),3.62-3.44(m,2H),3.30(d,J=5.7Hz,3H),2.96(t,J=5.5Hz,3H),2.69(s,3H),2.67-2.46(m,1H),2.34-2.27(m,1H).
実施例32:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール
MeOH(30mL)中の4-フルオロ-5-ヨードベンゼン-1,2-ジアミン(3.17g、12.58mmol)の溶液に、オルトギ酸トリメチル(2.00g、18.85mmol)を添加した。反応混合物を窒素雰囲気下、70℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール(2.9g、88%)を淡褐色固体として得た。MS ESI C7H4FIN2[M+H]+についての計算値262.94、実測値262.95。
ステップ2:1-エチル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール
アセトン(16.50mL)中の5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール(1.10g、4.20mmol)およびKOH(1.18g、20.99mmol)の撹拌溶液に、ヨードエタン(0.50mL、3.23mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を水(100mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(15:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1.4gの粗生成物を得た。粗生成物を、以下の条件を用いるPrep-アキラル-SFCによって精製した:カラム:CHIRAL ART Cellulose-SB、3*25cm、5um、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:100mL/分、勾配:20%B;220nm、RT1:3.7;RT2:4.3;注入体積:2ml;ランの数:20;)。所望の生成物を含有する分画(最後のピークRT2:4.3)を合わせ、濃縮して、1-エチル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.44g、32%)を淡褐色固体として得た。
ステップ3:3-[2-(1-エチル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.18g、0.54mmol)、1-エチル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.19g、0.65mmol)、Pd(PPh3)2Cl2(38.13mg、0.05mmol)およびCuI(20.69mg、0.11mmol)の撹拌混合物に、TEA(0.23mL、2.24mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の6%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物(200mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で25Bから55B、210/254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(62.9mg、23%)をオフホワイトの固体として得た。MS ESI C25H28FN7O3[M+H]+についての計算値494.22、実測値494.25。H-NMR(400 MHz,DMSO-d6):δ 8.41(s,1H),7.95(d,J=6.2Hz,1H),7.76(d,J=9.7Hz,1H),7.49(s,1H),6.87-6.49(m,3H),6.19-6.17(m,1H),5.75-5.65(m,1H),5.29-5.25(m,1H),4.50-4.45(m,1H),4.28(q,J=7.3Hz,2H),4.07-3.44(m,3H),3.35-3.29(m,3H),2.96(t,J=5.2Hz,3H),2.47(t,J=7.1Hz,1H),2.45-2.44(m,1H),2.35-2.24(m,1H),1.41(t,J=7.3Hz,3H).
実施例33:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-1-エチル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:5-クロロ-4-ヨード-2-ニトロアニリン
AcOH(50.00mL)中の5-クロロ-2-ニトロアニリン(5.00g、28.97mmol)の混合物に、NIS(6.52g、28.98mmol)を添加した。反応混合物をアルゴン雰囲気下、50℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。残渣を、室温にて飽和NH4HCO3(水溶液)(100mL)の添加によってクエンチした。得られた混合物をEtOAc(2×300mL)で抽出した。合わせた有機層を水(2×150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(6:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-4-ヨード-2-ニトロアニリン(7.6g、87%)を淡黄色固体として得た。H-NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.60(s,2H),7.27(s,1H).
ステップ2:4-クロロ-5-ヨードベンゼン-1,2-ジアミン
EtOH(100.00mL)およびH2O(25.00mL)中のFe(5.61g、100.46mmol)および5-クロロ-4-ヨード-2-ニトロアニリン(7.50g、25.13mmol)の混合物に、NH4Cl(6.72g、125.63mmol、5.00当量)を添加した。反応混合物をアルゴン雰囲気下、75℃で1時間撹拌した。得られた混合物を濾過し、濾過ケーキをMeOH(3x100mL)で洗浄した。濾液を減圧下で濃縮した。得られた混合物をEA(2×200mL)で抽出した。合わせた有機層をEtOAc(2×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、4-クロロ-5-ヨードベンゼン-1,2-ジアミン(6.6g、97.83%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C6H6ClIN2[M+H]+についての計算値268.93、実測値268.85。
ステップ3:5-クロロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール
AcOH(40.00mL)中の4-クロロ-5-ヨードベンゼン-1,2-ジアミン(3.50g、13.04mmol)の溶液に、1,1,1-トリメトキシエタン(3.33mL、26.05mmol)を添加した。反応混合物をアルゴン雰囲気下、75℃で3時間撹拌した。残渣を、飽和NaHCO3(水溶液)でpH7に中和した。得られた混合物をEtOAc(2×200mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM/MeOH(20/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(3.2g、83%)をオフホワイトの固体として得た。MS ESI C8H6ClIN2[M+H]+についての計算値292.93、実測値292.95。
ステップ4:6-クロロ-1-エチル-5-ヨード-2-メチル-1,3-ベンゾジアゾール
アセトン(40.00mL)中の5-クロロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(3.20g、10.94mmol)およびKOH(3.68g、65.59mmol)の混合物に、ヨードエタン(1.28mL、8.19mmol)を添加した。反応混合物をアルゴン雰囲気下、室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEtOAc(2×300mL)で抽出した。合わせた有機層を水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3.8gの混合物を得た。粗生成物(2g)を、以下の条件を用いるPrep-SFCによって精製した:カラム:CHIRALPAK IG、5*25cm、10um、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MEOH)、流量:200mL/分、勾配:50%B;220nm、RT1:5.99;RT2:7.74;注入体積:3ml;ランの数:17。所望の生成物を含有する分画を合わせ、濃縮して、6-クロロ-1-エチル-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.80g、22%)を淡黄色固体として得た。MS ESI C10H10ClIN2[M+H]+についての計算値320.96、実測値320.95。
ステップ5:3-[2-(6-クロロ-1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、6-クロロ-1-エチル-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.17g、0.54mmol)、CuI(17.24mg、0.09mmol)およびPd(PPh3)2Cl2(31.77mg、0.05mmol)の混合物に、TEA(0.19mL、1.87mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で25Bから50B、210/254nm、RT1:4.23。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(44.4mg、18.72%)をオフホワイトの固体として得た。MS ESI C26H30ClN7O3[M+H]+についての計算値292.93、実測値292.95。H-NMR(400 MHz,DMSO-d6)δ 7.92-7.84(m,2H),7.51(s,1H),6.86(s,1H),6.77-6.55(m,2H),6.22-6.13(m,1H),5.73-5.65(m,1H),5.33-5.21(m,1H),4.58-4.36(m,1H),4.30-4.20(m,2H),4.08-3.70(m,2H),3.65-3.42(m,2H),3.33(s,1H),3.31(d,J=5.4Hz,3H),3.00-2.93(m,3H),2.56(s,3H),2.31(m,1H),1.29(t,J=7.2Hz,3H).
実施例34:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-1-(2,2,2-トリフルオロエチル)-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:4,6-ジフルオロ-5-ヨード-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール
DMSO(8.00mL)中の4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(0.80g、2.86mmol)およびトリフルオロ(トリフルオロメタンスルホニルメトキシ)メタン(0.99g、4.28mmol)の撹拌混合物に、Cs2CO3(2.79g、8.57mmol)を室温で添加した。反応混合物を24時間撹拌した。反応物を、室温にて水(10mL)の添加によってクエンチした。得られた混合物をEtOAc(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣をSFCによって精製して、4,6-ジフルオロ-5-ヨード-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール(0.32g、30%)を淡黄色固体として得た。MS ESI C9H4F5IN2[M+H]+についての計算値363.04、実測値363.00。
ステップ2:3-[2-[4,6-ジフルオロ-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、4,6-ジフルオロ-5-ヨード-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール(0.20g、0.54mmol)、Pd(PPh3)2Cl2(31.77mg、0.05mmol)およびCuI(17.24mg、0.09mmol)の撹拌混合物に、TEA(0.14g、1.36mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、Prep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で25Bから55B、210/254nm、RT1:4.12。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[4,6-ジフルオロ-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、39%)をオフホワイトの固体として得た。MS ESI C25H24F5N7O3[M+H]+についての計算値566.19、実測値566.20。1H NMR(400 MHz,d6-DMSO)δ 8.51(s,1H),7.81(d,J=9.1Hz,1H),7.56(s,1H),6.75-6.56(m,3H),6.17(d,J=16.6Hz,1H),5.69(d,J=9.5Hz,1H),5.43-5.27(m,3H),4.57-4.37(m,1H),4.08-3.83(m,2H),3.79-3.53(m,2H),3.52-3.34(m,3H),2.98-2.94(m,3H),2.51(m,1H),2.33-2.29(m,1H).
実施例35:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-2-メチル-1-(2,2,2-トリフルオロエチル)-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル2-(1,1-ジフルオロエチル)モルホリン-4-カルボキシレート
DMSO(10.00mL)中の4,6-ジフルオロ-5-ヨード-2-メチル-1H-1,3-ベンゾジアゾール(1.00g、3.40mmol)の撹拌溶液に、トリフルオロ(トリフルオロメタンスルホニルメトキシ)メタン(1.18g、5.10mmol)およびCs2CO3(3.32g、0.01mmol)を室温で小分けにして添加した。反応混合物を室温で24時間撹拌した。反応物を、室温にて水(10mL)の添加によってクエンチした。得られた混合物をEtOAc(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、SFCによって精製した:カラム:DAICEL DCpak P4VP(02)、30*250mm、5um、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:60mL/分、勾配:18%B;254nm;RT2:6.21;注入体積:0.8ml;ランの数:15。所望の生成物を含有する分画を合わせ、濃縮して、4,6-ジフルオロ-5-ヨード-2-メチル-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール(0.42g、32%)を淡黄色固体として得た。MS ESI C10H6F5IN2[M+H]+についての計算値376.95、実測値377.00。
ステップ2:3-[2-[4,6-ジフルオロ-2-メチル-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、4,6-ジフルオロ-5-ヨード-2-メチル-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール(0.20g、0.54mmol)、Pd(PPh3)2Cl2(31.77mg、0.05mmol)およびCuI(17.24mg、0.09mmol)の撹拌混合物に、TEA(0.14g、1.36mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、Prep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で25Bから60B、210/254nm、RT1:4.02。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[4,6-ジフルオロ-2-メチル-1-(2,2,2-トリフルオロエチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、37%)をオフホワイトの固体として得た。MS ESI C26H26F5N7O3[M+H]+についての計算値580.20、実測値580.25。1H NMR(400 MHz,DMSO-d6)δ 7.70(d,J=9.1Hz,1H),7.55(s,1H),6.86-6.49(m,3H),6.19-6.14(m,1H),5.71-5.67(m,1H),5.42-5.19(m,3H),4.62-4.35(m,1H),4.08-3.70(m,2H),3.65-3.42(m,2H),3.33-3.27(m,3H),2.96(t,J=5.5Hz,3H),2.60(s,3H),2.52-2.48(m,1H),2.37-2.25(m,1H).
実施例36:3-[2-(3-エチル-4-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾールおよび1-エチル-7-フルオロ-6-ヨード-1,3-ベンゾジアゾール
アセトン(20.00mL)中の4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(2.00g、7.63mmol)およびKOH(2.57g、45.80mmol)の撹拌混合物に、ヨードエタン(1.67g、10.69mmol)を空気雰囲気下、室温で添加した。反応混合物を室温で2時間撹拌した。得られた混合物を水(50mL)で希釈し、EA(3×70mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(1g/NH4HCO3)、30分で25%から55%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.80g、36%)を黄色固体として、および1-エチル-7-フルオロ-6-ヨード-1,3-ベンゾジアゾール(0.78g、35%)を黄色固体として得た。PH-FNT-KIN-03-1434-1:MS ESI C9H8FIN2[M+H]+についての計算値290.97、実測値290.99。PH-FNT-KIN-03-1300-1:MS ESI C9H8FIN2[M+H]+についての計算値290.97、実測値290.95。
ステップ2:3-[2-(3-エチル-4-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.18g、0.54mmol)、1-エチル-7-フルオロ-6-ヨード-1,3-ベンゾジアゾール(0.19g、0.65mmol)、CuI(20.69mg、0.11mmol)およびPd(pph3)Cl2(44.36mg、0.05mmol)の撹拌混合物に、TEA(0.23mL、2.24mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから60B、210/254nm、RT1:5.57。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(3-エチル-4-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(85mg、31%)をオフホワイトの固体として得た。MS ESI C25H28FN7O3[M+H]+についての計算値494.22、実測値494.25。H-NMR(400 MHz,DMSO-d6)δ 8.42(s,1H),7.64-7.29(m,3H),6.93-6.46(m,3H),6.17(d,J=16.4Hz,1H),5.74-5.65(m,1H),5.33-5.20(m,1H),4.62-4.30(m,3H),4.07-3.71(m,2H),3.65-3.41(m,2H),3.32-3.28(m,1H),3.03-2.92(m,3H),2.51(s,3H),2.35-2.30(m,1H),1.47-1.44(m,3H).
実施例37:3-[2-(1-エチル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:1-エチル-6-フルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール
アセトン(16.50mL)中の5-フルオロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(1.1g、3.98mmol)およびKOH(1.12g、19.92mmol)の撹拌溶液に、ヨードエタン(0.48mL、3.07mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を水(100mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(15:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1.29gの粗生成物を得た。粗生成物を、以下の条件を用いるPrep-アキラル-SFCによって精製した:カラム:CHIRAL ART Cellulose-SB、3*25cm、5um、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:100mL/分、勾配:20%B;220nm、RT1:3.7;RT2:4.3;注入体積:2ml;ランの数:20。所望の生成物を含有する分画(より遅いピークRT2:4.3)を合わせ、濃縮して、1-エチル-6-フルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.48g、35%)を淡褐色固体として得た。1H NMR(300 MHz、クロロホルム-d)δ 8.02(d,J=5.6Hz,1H),7.05(d,J=7.8Hz,1H),4.11(q,J=7.3Hz,2H),2.60(s,3H),1.40(t,J=7.3Hz,3H)
ステップ2:3-[2-(1-エチル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、0.31mmol)、1-エチル-6-フルオロ-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.14g、0.45mmol)、Pd(PPh3)2Cl2(21.18mg、0.03mmol)およびCuI(11.49mg、0.06mmol)の撹拌溶液に、TEA(91.61mg、0.91mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、NH4HCO3 0.01mmol、20分で25%から40%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis Prep T3 OBD Column、19*250mm 10u、移動相A:水(0.1%FA)、移動相B:MeOH--HPLC、流量:20mL/分、勾配:6分で15Bから50B、210/254nm、RT1:5.56。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(32.8mg、21%)を淡黄色固体として得た。ESI C26H30FN7O3[M+H]+についての計算値508.23、実測値508.25。1H NMR(300 MHz,DMSO-d6)δ 7.78(d,J=6.3Hz,1H),7.64(d,J=9.9Hz,1H),7.48(d,J=8.0Hz,1H),6.93-6.51(m,3H),6.16-5.88(m,1H),5.68-5.42(m,1H),5.25-5.01(m,1H),4.47-4.43(m,1H),4.21(q,J=7.2Hz,2H),4.10-3.73(m,2H),3.64-3.43(m,2H),3.37-3.26(m,3H),2.95(d,J=4.3Hz,3H),2.54(s,4H),2.33-2.28(m,1H),1.30-1.25(m,3H).
実施例38:3-[2-(4-クロロ-1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:3-クロロ-4-ヨード-2-ニトロアニリン
AcOH(50.00mL)中の3-クロロ-2-ニトロアニリン(5.00g、28.97mmol)の撹拌溶液に、NIS(6.84g、30.40mmol)を室温で添加した。得られた反応物を室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(50mL)に溶解した。混合物をEA(3×100mL)で抽出し、合わせた有機層を無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮して、3-クロロ-4-ヨード-2-ニトロアニリン(8.50g、98%)を橙色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C6H4ClIN2O2[M-H]-についての計算値296.89、297.90、実測値297.00、299.00。
ステップ2:3-クロロ-4-ヨードベンゼン-1,2-ジアミン
EtOH(12.00mL)およびH2O(3.00mL)中の3-クロロ-4-ヨード-2-ニトロアニリン(1.00g、3.35mmol)の撹拌混合物に、Fe(0.75g、13.43mmol)およびNH4Cl(0.90g、16.75mmol)を室温で添加した。反応混合物を75℃で2時間撹拌した。得られた混合物を室温まで冷ました。得られた混合物を濾過し、濾過ケーキをEtOH(3x10mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(20mL)に溶解し、EA(3×50mL)で抽出した。合わせた有機層をブライン(3×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、3-クロロ-4-ヨードベンゼン-1,2-ジアミン(0.79g、87%)を褐色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C6H6ClIN2[M+H]+についての計算値268.93、270.93、実測値268.85、270.85。
ステップ3:3-クロロ-4-ヨードベンゼン-1,2-ジアミン
MeOH(10.00mL)中の3-クロロ-4-ヨードベンゼン-1,2-ジアミン(0.79g、2.94mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(0.53g、4.41mmol)を室温で添加した。反応混合物を70℃で2時間撹拌した。得られた混合物を室温まで冷ました。残渣を、PE中のEA(0-70%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4-クロロ-5-ヨード-2-メチル-1H-1,3-ベンゾジアゾール(0.67g、77%)を褐色固体として得た。MS ESI C8H6ClIN2[M+H]+についての計算値292.93、294.93、実測値292.80、294.80。
ステップ4:4-クロロ-1-エチル-5-ヨード-2-メチル-1,3-ベンゾジアゾール
アセトン(6.00mL)中の4-クロロ-5-ヨード-2-メチル-1H-1,3-ベンゾジアゾール(0.52g、1.77mmol)の撹拌溶液に、ヨウ化エチル(0.42g、2.66mmol)およびKOH(0.50g、8.88mmol)を室温で添加した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の3%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4-クロロ-1-エチル-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.23g、40%)をオフホワイトの固体として得た。DCM中の4%MeOHも溶出した。所望の生成物を含有する分画を合わせ、濃縮して、7-クロロ-1-エチル-6-ヨード-2-メチル-1,3-ベンゾジアゾール(0.11mg、19%)を黄色固体として得た。MS ESI C10H10ClIN2[M+H]+についての計算値320.96、322.96、実測値320.85、322.85。
ステップ5:3-[2-(4-クロロ-1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(3.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)および4-クロロ-1-エチル-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.15g、0.47mmol)の撹拌混合物に、Pd(PPh3)2Cl2(27.54mg、0.03mmol)、CuI(14.94mg、0.07mmol)およびTEA(0.12g、1.17mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-6.0%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物(0.15g)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5um 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:4.3分で20Bから50B、210/254nm、RT1:4.02分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(4-クロロ-1-エチル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(49.30mg、23%)をオフホワイトの固体として得た。MS ESI C26H30ClN7O3[M+H]+についての計算値524.22、526.21、実測値524.15.526.15。H-NMR(300 MHz,DMSO-d6)δ 7.81-7.41(m,3H),6.88(s,1H),6.65(d,J=12.3Hz,1H),6.57(d,J=12.8Hz,1H),6.16(d,J=16.6Hz,1H),5.68(d,J=10.4Hz,1H),5.29-5.25(m,1H),4.61-4.21(m,3H),3.98-3.94(m,4H),3.29(d,J=3.8Hz,3H),2.95(d,J=3.1Hz,3H),2.63-2.59(m,4H),2.33-.2.30(m,1H),1.30(t,J=7.0Hz,3H).
実施例39:3-(2-[1-エチル-2-メチルイミダゾ[4,5-b]ピリジン-5-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-2-メチル-1H-イミダゾ[4,5-b]ピリジン
AcOH(30.00mL)中の6-ブロモピリジン-2,3-ジアミン(2.70g、14.36mmol)の溶液に、1,1,1-トリメトキシエタン(3.78mL、31.47mmol)を添加した。反応混合物をアルゴン雰囲気下、100℃で一晩撹拌した。得られた混合物を減圧下で濃縮した。残渣を、飽和NaHCO3(水溶液)でpH7に中和した。得られた混合物をEtOAc(2×200mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM/MeOH(20/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-2-メチル-1H-イミダゾ[4,5-b]ピリジン(2.4g、78%)を橙色固体として得た。MS ESI C7H6BrN3[M+H]+についての計算値211.97、実測値211.90。
ステップ2:5-ブロモ-1-エチル-2-メチルイミダゾ[4,5-b]ピリジン
アセトン(25.00mL)中の5-ブロモ-2-メチル-1H-イミダゾ[4,5-b]ピリジン(2.40g、11.32mmol)およびKOH(3.81g、67.91mmol)の撹拌混合物に、ヨードエタン(1.27mL、8.13mmol)を添加した。反応混合物をアルゴン雰囲気下、室温で2時間撹拌した。得られた混合物をEtOAc(2×100mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/EtOAc(1:2)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-1-エチル-2-メチルイミダゾ[4,5-b]ピリジン(0.77g、28%)を淡黄色固体として得た。MS ESI C9H10BrN3[M+H]+についての計算値240.01、実測値240.05。
ステップ3:1-エチル-2-メチル-5-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン
DMF(10.00mL)中の5-ブロモ-1-エチル-2-メチルイミダゾ[4,5-b]ピリジン(0.72g、3.00mmol)、トリメチルシリルアセチレン(0.86mL、8.78mmol)、CuI(0.11g、0.60mmol)およびPd(PPh3)2Cl2(0.21g、0.30mmol)の混合物に、TEA(1.30mL、12.81mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-2-メチル-5-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン(0.70g、90%)を褐色固体として得た。MS ESI C14H19N3Si[M+H]+についての計算値258.13、実測値258.20。
ステップ4:1-エチル-5-エチニル-2-メチルイミダゾ[4,5-b]ピリジン
THF(10.00mL)中の1-エチル-2-メチル-5-[2-(トリメチルシリル)エチニル]イミダゾ[4,5-b]ピリジン(0.70g、2.71mmol)の撹拌溶液に、TBAF(4.06mL、4.06mmol)をアルゴン雰囲気下、0℃で滴下した。得られた混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-5-エチニル-2-メチルイミダゾ[4,5-b]ピリジン(0.34g、67%)を淡黄色固体として得た。MS ESI C11H11N3[M+H]+についての計算値186.10、実測値186.25。
ステップ5:3-(2-[1-エチル-2-メチルイミダゾ[4,5-b]ピリジン-5-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-ヨード-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.35mmol)、1-エチル-5-エチニル-2-メチルイミダゾ[4,5-b]ピリジン(0.13g、0.69mmol)、CuI(13.19mg、0.07mmol)およびPd(PPh3)2Cl2(24.30mg、0.04mmol)の混合物に、TEA(0.14mL、1.01mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、19*250mm、5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で35Bから60B、210/254nm、RT1:5.56。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[1-エチル-2-メチルイミダゾ[4,5-b]ピリジン-5-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(43.7mg、25%)をオフホワイトの固体として得た。MS ESI C25H30N8O3[M+H]+についての計算値491.24、実測値491.25。H-NMR(400 MHz,DMSO-d6)δ 8.04(d,J=8.0Hz,1H),7.54-7.48(m,2H),6.90-6.52(m,3H),6.17(d,J=16.4Hz,1H),5.69(d,J=10.4Hz,1H),5.29-5.25(m,1H),4.60-4.32(m,1H),4.33-4.24(m,2H),4.09-3.70(m,2H),3.66-3.40(m,2H),3.32-3.27(m,1H),2.99-2.94(m,3H),2.63(s,3H),2.55-2.52(m,3H),2.34-2.30(m,1H),1.42-1.18(m,3H).
実施例40:3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:6-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール
アセトン中の5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール(0.1g、0.38mmol)およびKOH(0.11g、1.91mmol)の撹拌混合物に、ヨウ化メチル(0.04mL)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で20分間撹拌した。得られた混合物を濾過し、濾過ケーキを酢酸エチル(3x10mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-SFCによって精製した:カラム:CHIRALPAK IF、30*250mm、5um、移動相A:CO2、移動相B:MeOH(0.5% 2M NH3-MeOH)-HPLC、流量:80mL/分、勾配:40%B;220nm、RT1:3.8;RT2:4.59;注入体積:1ml;ランの数:40。所望の生成物を含有する分画を合わせ、濃縮して、6-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.44g、41%)を白色固体として得た。ESI C8H6FIN2[M+H]+についての計算値277、実測値277。
ステップ2:3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、6-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.15g、0.54mmol)、Pd(PPh3)2Cl2(31.77mg、0.04mmol)およびCuI(17.24mg、0.09mmolv)の撹拌混合物に、TEA(0.14g、1.36mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で20Bから50B、210/254nm、RT1:4.23。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(43.6mg、20%)を白色固体として得た。ESI C24H26FN7O3[M+H]+についての計算値480.21、実測値480.15。1H NMR(300 MHz,DMSO-d6)δ 8.30(s,1H),7.93(d,J=6.2Hz,1H),7.68(d,J=9.8Hz,1H),7.45(s,1H),6.84-6.50(m,3H),6.16(d,J=16.9Hz,1H),5.73-5.63(m,1H),5.27-5.23(m,1H),4.49-4.42(m,1H),4.16-3.92(m,1H),3.86-3.80(m,6H),3.65-3.36(m,3H),2.95-2.73(m,4H),2.41-2.15(m,1H).
実施例41:3-[2-(4-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール
MeOH(50.00mL)中の3-フルオロ-4-ヨードベンゼン-1,2-ジアミン(5.00g、19.84mmol)の撹拌溶液に、オルトギ酸トリメチル(3.16g、29.78mmol)を窒素雰囲気下、室温で滴下した。反応混合物を窒素雰囲気下、70℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(4.6g、88%)を淡黄色固体として得た。MS ESI C7H4FIN2[M+H]+についての計算値262.94、実測値263.00。
ステップ2:4-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾールおよび7-フルオロ-6-ヨード-1-メチル-1,3-ベンゾジアゾール
アセトン(35.00mL)中の4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(3.50g、13.36mmol)およびKOH(4.50g、80.21mmol)の撹拌混合物に、CH3I(1.16mL、8.20mmol)を室温で滴下した。反応混合物を室温で40分間撹拌した。得られた混合物を水(40mL)で希釈し、EA(3×70mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(NH4HCO3 1g/L)、30分で20%から50%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、4-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(1.6g、43%)をオフホワイトの固体として、および7-フルオロ-6-ヨード-1-メチル-1,3-ベンゾジアゾール(1.57g、42%)をオフホワイトの固体として得た。MS ESI C8H6FIN2[M+H]+についての計算値276.96、実測値277.00。
ステップ3:3-[2-(4-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)および4-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.16g、0.54mmol)、CuI(17.24mg、0.09mmol)、Pd(PPh3)2Cl2(31.77mg、0.045mmol)の撹拌混合物に、TEA(137.41mg、1.36mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。混合物を室温まで冷まし、減圧下で濃縮した。残渣を、DCM/MeOH(20:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、約110mgの生成物を得、これを以下の条件を用いるPrep-HPLCによってさらに精製し、精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから60B、210/254nm、RT1:5.56。所望の生成物を含有する分画を濃縮して、3-[2-(4-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(54.7mg、25%)をオフホワイトの固体として得た。MS ESI C24H26FN7O3についての計算値479.21、実測値480.10。H-NMR(400 MHz,DMSO-d6)δ 8.32(s,1H),7.53-7.36(m,3H),6.76-6.56(m,3H),6.20-6.14(m,1H),5.71-5.67(m,1H),5.31-5.20(m,1H),4.54-4.30(m,1H),4.04-3.59(m,5H),3.50-3.45(m,2H),3.27(d,J=2.8Hz,3H),2.96(t,J=5.2Hz,3H),2.52-2.47(m,1H),2.34-2.36(m,1H).
実施例42:3-[2-(2-シクロプロピル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-2-シクロプロピル-1H-ベンゾ[d]イミダゾール
HCl(H2O中で3.00M、10.00mL)中の4-ブロモベンゼン-1,2-ジアミン(1.00g、5.35mmol)の混合物に、シクロプロパンカルボン酸(3.22g、37.43mmol)を添加した。反応混合物を窒素雰囲気下、90℃で16時間撹拌した。得られた混合物を、NaOHでpH7に中和した。混合物をDCM(3×20mL)で抽出した。合わせた有機層を水(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(3:2)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、5-ブロモ-2-シクロプロピル-1H-1,3-ベンゾジアゾール(1.28g、100%)を黄色固体として得た。MS ESI C10H9BrN2[M+H]+についての計算値236.99、238.99、実測値236.90、238.90。
ステップ2:2-シクロプロピル-5-((トリメチルシリル)エチニル)-1H-ベンゾ[d]イミダゾール
DMF(10.00mL)中の5-ブロモ-2-シクロプロピル-1H-1,3-ベンゾジアゾール(1.32g、5.57mmol)の撹拌溶液に、トリメチルシリルアセチレン(1.64g、16.71mmol)、Pd(PPh3)2Cl2(0.39g、0.56mmol)、CuI(0.21g、1.11mmol)およびTEA(1.69g、16.70mmol)を室温で添加した。反応混合物を窒素で3回脱気し、85℃で2時間撹拌した。得られた混合物を水(100mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(3×80mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(5:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、2-シクロプロピル-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール(1.05g、74%)を黄色固体として得た。MS ESI C15H18N2Si[M+H]+についての計算値255.12、実測値255.15。
ステップ3:2-シクロプロピル-5-エチニル-1H-ベンゾ[d]イミダゾール
THF(10.00mL)中の2-シクロプロピル-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール(1.05g、4.13mmol)の混合物に、TBAF(1.62g、6.19mmol)を添加した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中のEA(5:1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、2-シクロプロピル-5-エチニル-1H-1,3-ベンゾジアゾール(0.60g、79%)を褐色固体として得た。MS ESI C12H10N2[M+H]+についての計算値183.08、実測値183.00。
ステップ4:3-[2-(2-シクロプロピル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ヨード-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.25g、0.58mmol)および2-シクロプロピル-5-エチニル-1H-1,3-ベンゾジアゾール(0.11g、0.58mmol)の撹拌混合物に、Pd(PPh3)2Cl2(40.50mg、0.06mmol)、CuI(21.98mg、0.12mmol)およびTEA(0.18g、1.73mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから65B、210/254nm、RT1:5.56分。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、3-[2-(2-シクロプロピル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(44.20mg、15%)を白色固体として得た。MS ESI C26H29N7O3[M+H]+についての計算値488.23、実測値488.15。1H NMR(400 MHz,DMSO-d6)δ 12.50(s,1H),7.85-7.14(m,4H),6.94-6.43(m,3H),6.17(d,J=16.6Hz,1H),5.69(d,J=10.2Hz,1H),5.27-5.24(m,1H),4.49-4.45(m,1H),4.03-4.00(m,1H),3.89-3.82(m,1H),3.69-5.65(m,1H),3.50-3.46(m,1H),3.32-3.28(m,3H),2.96-2.90(m,3H),2.63-2.57(m,1H),2.31-2.30(m,1H),2.13-2.09(m,1H),1.12-0.90(m,4H).
実施例43:3-[2-(2-シクロプロピル-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:2-シクロプロピル-5-ヨード-1-メチル-1,3-ベンゾジアゾール
DMF(10.00mL)中のHATU(4.60g、12.09mmol)およびDIEA(3.13g、24.18mmol)の撹拌混合物に、シクロプロパンカルボン酸(0.76g、8.86mmol)を添加した。反応混合物を室温で30分間撹拌した。上記混合物に、4-ヨード-N1-メチルベンゼン-1,2-ジアミン(2.00g、8.06mmol)を添加した。得られた混合物を室温で2時間撹拌した。最終反応混合物に50mlのH2Oを添加した。得られた混合物を5×30mLのEtOAcで洗浄した。有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣にAcOH(20.00mL)を添加した。得られた混合物を80℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を飽和NaHCO3でpH8に塩基性化し、EA(4×150mL)で抽出し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-5-ヨード-1H-1,3-ベンゾジアゾール(2.1g、87%)を得た。MS ESI C12H12IN[M+H]+についての計算値299.00、実測値298.90。
ステップ2:3-[2-(2-シクロプロピル-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の2-シクロプロピル-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.11g、0.36mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、0.30mmol)の撹拌混合物に、CuI(11.49mg、0.06mmol)およびPd(PPh3)2Cl2(21.18mg、0.03mmol)を添加した。反応混合物をアルゴンで3回脱気し、80℃で2時間撹拌した。得られた混合物を濃縮した。残渣を、DCM/MeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗製物を得た。粗製物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:SunFire Prep C18 OBD Column、19x150mm 5um 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で20Bから30B、210/254nm、RT1:5.58。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-シクロプロピル-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(47.4mg、31%)を得た。MS ESI C27H31N7O3[M+H]+についての計算値501.25、実測値502.15。H NMR(300 MHz,DMSO-d6)δ 7.74(d,J=1.4Hz,1H),7.63(d,J=8.4Hz,1H),7.49-7.26(m,2H),6.77(s,1H),6.71-6.46(m,2H),6.17(d,J=16.5Hz,1H),5.70(d,J=10.3Hz,1H),5.39-5.12(m,1H),4.47-4.39(m,1H),4.13-3.95(m,1H),3.93-3.85(m,4H),3.77-3.72(m,1H),3.57-3.52(m,2H),3.33-3.28(m,3H),2.97-2.92(m,3H),2.35-2.32(m,2H),1.21-1.02(m,4H).
実施例44:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(3-メチル-1,2-ベンゾオキサゾール-6-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.23g、0.69mmol)、6-ブロモ-3-メチル-1,2-ベンゾオキサゾール(0.22g、1.04mmol)、Pd(PPh3)2Cl2(48.72mg、0.07mmol)およびCuI(26.44mg、0.14mmol)の撹拌混合物に、TEA(0.29mL、2.86mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の6%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物(150mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから60B、210/254nm、RT1:5.56。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(3-メチル-1,2-ベンゾオキサゾール-6-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(44.9mg、13%)をオフホワイトの固体として得た。MS ESI C24H26N6O4[M+H]+についての計算値463.20、実測値463.20。H-NMR(400 MHz,DMSO-d6):δ 8.04-7.90(m,2H),7.56(dd,J=8.2,1.2Hz,1H),7.29-7.23(m,1H),6.94-6.42(m,3H),6.19-6.25(m,1H),5.71-5.67(m,1H),5.26-5.23(m,1H),4.56-4.33(m,1H),4.06-3.67(m,2H),3.64-3.39(m,2H),3.32(s,3H),2.97-2.90(m,3H),2.58(s,3H),2.45-2.41(m,1H),2.35-2.26(m,1H).
実施例45:3-[2-(2-シクロプロピル-1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:2-シクロプロピル-1-エチル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾールおよび2-シクロプロピル-1-エチル-5,7-ジフルオロ-6-ヨード-1,3-ベンゾジアゾール
DMF(15.00mL)中の2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(1.50g、4.69mmol)およびヨードエタン(1.46g、9.37mmol)の溶液に、Cs2CO3(4.58g、14.06mmol)を室温で滴下した。反応混合物を室温で45分間撹拌した。得られた混合物を濾過し、濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40um、300g、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量50mL/分、勾配(B%):40分以内で5%~45%、検出器:UV 254&220nm。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-1-エチル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.50g、31%)を淡黄色固体として、および2-シクロプロピル-1-エチル-5,7-ジフルオロ-6-ヨード-1,3-ベンゾジアゾール(0.37g、23%)を淡黄色固体として得た。MS ESI C9H9N3O2[M+H]+についての計算値348.99、実測値348.85。
ステップ2:3-[2-(2-シクロプロピル-1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の2-シクロプロピル-1-エチル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.21g、0.60mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.14g、0.45mmol)、CuI(22.98mg、0.12mmol)およびPd(PPh3)2Cl2(42.34mg、0.06mmol)の撹拌混合物に、TEA(0.18g、1.81mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40um、40g、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量40mL/分、勾配(B%):45分以内で5%-45%、検出器:UV 254&220nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-シクロプロピル-1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(84.1mg、25%)をオフホワイトの固体として得た。MS ESI C28H31F2N7O3[M+H]+についての計算値552.25、実測値552.25。1H NMR(300 MHz,d6-DMSO)δ 7.66-7.52(m,2H),6.83-6.52(m,3H),6.19-6.15(m,1H),5.71-5.68(m,1H),5.30-5.27(m,1H),4.58-4.32(m,3H),3.90(d,J=7.5Hz,2H),3.66-3.41(m,2H),3.34-3.26(m,4H),2.99-2.95(m,3H),2.30-2.25(m,2H),1.35(t,J=7.1Hz,3H),1.16-1.03(m,4H).
実施例46:3-[2-[4,6-ジフルオロ-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:4,6-ジフルオロ-5-ヨード-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール
トリフルオロ酢酸(55mL)中の3,5-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン(5.50g、20.37mmol)の溶液を50℃で30分間撹拌した。反応液を飽和NaHCO3と混合して、0℃での塩基性溶液とする。得られた混合物をチオ硫酸ナトリウム(550.0mL)に注ぎ、EA(3×500.0mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:Spherical C18、20-40um、40g、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配(B%):5分間0%保持,40分以内で5%-60%;5分間60%保持、20分以内で60%~95%、5分間95%保持、検出器:UV 254&210nm;RT:45分)。所望の生成物を含有する分画を合わせ、濃縮して、4,6-ジフルオロ-5-ヨード-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール(1.3g、18%)を淡黄色固体として得た。ESI C8H2F5IN2[M+H]+についての計算値348.92、実測値348.95。
ステップ2:4,6-ジフルオロ-2-(トリフルオロメチル)-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール
ジメチルホルムアミド(10mL)中の4,6-ジフルオロ-5-ヨード-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール(1.00g、2.87mmol)の撹拌溶液に、トリメチルシリルアセチレン(0.85g、8.62mmol)、塩化パラジウム;ビス(トリフェニルホスフィン)(0.20g、0.28mmol)、ヨウ化銅(I)(0.11g、0.57mmol)およびTEA(0.87g、8.62mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。周囲温度まで冷却した後、得られた混合物を水(100mL)に注ぎ、EA(3×100mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の18%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4,6-ジフルオロ-2-(トリフルオロメチル)-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール(0.40g、44%)を淡黄色固体として得た。MS ESI C13H11F5N2Si[M+H]+についての計算値319.06、実測値318.95。
ステップ3:5-エチニル-4,6-ジフルオロ-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール
テトラヒドロフラン(5mL)中の4,6-ジフルオロ-2-(トリフルオロメチル)-5-[2-(トリメチルシリル)エチニル]-1H-1,3-ベンゾジアゾール(0.38mg、1.19mmol)の撹拌溶液に、TBAF(THF中で1.0M、1.80mL、1.80mmol)を0℃で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物をチオ硫酸ナトリウム(10mL)に注ぎ、EA(3×20mL)で抽出した。合わせた有機層をブライン(2×10mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、H2O中のACN(0~34%)で溶出するCarbon18ゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-エチニル-4,6-ジフルオロ-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール(0.21g、71%)を褐色固体として得た。MS ESI C10H3F5N2[M+H]+についての計算値247.02、実測値247.14。
ステップ4:3-[2-[4,6-ジフルオロ-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.3mL)中の5-エチニル-4,6-ジフルオロ-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール(88.66mg)および3-ヨード-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g)の撹拌混合物に、Pd(PPh3)2Cl2(21.06mg)、CuI(11.4mg)およびTEA(91mg)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、30分で5%から30%の勾配、検出器、UV 210nm。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:4.3分で30Bから60B、210/254nm、RT1:4.23。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[4,6-ジフルオロ-2-(トリフルオロメチル)-1H-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(72mg、43%)を白色固体として得た。MS ESI C24H22F5N7O3[M+H]+についての計算値552.17、実測値552.48。1H NMR(400 MHz,DMSO-d6)δ 14.88(s,1H),7.58(brs,2H),6.76-6.59(m,3H),6.19-6.14(m,1H),5.71-5.66(m,1H),5.30-5.25(m,1H),4.48-4.44(m,1H),3.99-3.96(m,2H),3.59-3.44(m,2H),3.31(s,3H),2.96(s,3H),2.67-2.60(m,1H),2.32-2.28(m,1H).
実施例47:3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:N-シクロプロピル-4-ヨード-2-ニトロアニリン
Et3N(14.58mL、144.05mmol)中の1-フルオロ-4-ヨード-2-ニトロベンゼン(5.00g、18.72mmol)の撹拌混合物に、アミノシクロプロパン(5.35g、93.63mmol)を室温で添加した。反応混合物を窒素雰囲気下、80℃で4時間撹拌した。得られた混合物を冷やした。次いで、混合物を飽和NaHCO3(30mL)でクエンチし、EA(3×50mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、N-シクロプロピル-4-ヨード-2-ニトロアニリン(5.80g、粗製)を褐色固体として得た。MS ESI C9H9IN2O2[M+H]+についての計算値304.97、実測値304.90。
ステップ2:N1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン
EtOH(50.00mL)およびH2O(10.00mL)中の鉄(5.51g、98.65mmol)およびAcOH(5.65mL、94.14mmol)の撹拌混合物に、N-シクロプロピル-4-ヨード-2-ニトロアニリン(6.00g、19.73mmol)を70℃で添加した。得られた反応物を70℃で3時間撹拌した。得られた混合物を冷やした。得られた混合物を濾過し、濾過ケーキをEA(2x100mL)で洗浄した。濾液を減圧下で濃縮した。得られた混合物に水(50mL)を添加し、EA(3×50mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(20-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、N1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン(3.90g、72%)を褐色固体として得た。MS ESI C9H11IN2[M+H]+についての計算値275.11、実測値275.05。
ステップ3:1-シクロプロピル-5-ヨード-2-(トリフルオロメチル)-1,3-ベンゾジアゾール
TFA(15.00mL)中のN1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン(2.00g、7.29mmol)の溶液を、70℃で3時間撹拌した。得られた溶液を冷やし、減圧下で濃縮した。残渣をEA(30mL)でクエンチし、飽和NaHCO3でpH>7に塩基性化した。混合物をEA(3×30mL)で抽出した。合わせた有機層をブライン(20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-20%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-5-ヨード-2-(トリフルオロメチル)-1,3-ベンゾジアゾール(0.60g、23%)を白色固体として得た。MS ESI C11H8F3IN2[M+H]+についての計算値352.97、実測値352.95。
ステップ4:3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(3.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)の混合物に、1-シクロプロピル-5-ヨード-2-(トリフルオロメチル)-1,3-ベンゾジアゾール(0.16g、0.45mmol)、Pd(PPh3)2Cl2(31.77mg、0.04mmol)、CuI(17.24mg、0.09mmol)およびTEA(137.41mg、1.35mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5um、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で35%Bから70%B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[1-シクロプロピル-2-(トリフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(51mg、22%)を白色固体として得た。MS ESI C27H28F3N7O3[M+H]+についての計算値556.22、実測値556.20。1H NMR(400 MHz,d6-DMSO)δ 8.09(s,1H),7.84(d,J=8.6Hz,1H),7.66-7.64(m,1H),7.38(brs,1H),6.92-6.96(m,3H),6.17-6.14(m,1H),5.69-5.67(m,1H),5.30-5.19(m,1H),4.57-4.52(m,1H),3.91-3.83(m,1H),3.78-3.72(m,1H),3.67-3.58(m,2H),3.53-3.41(m,1H),3.32-3.28(m,3H),2.98-2.92(m,3H),2.49-2.45(m,1H),2.36-2.24(m,1H),1.31-1.12(m,4H).
実施例48:3-(2-[3-エチル-2-メチルイミダゾ[4,5-c]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:6-ブロモ-2-メチル-3H-イミダゾ[4,5-c]ピリジン
AcOH(10.00mL)中の6-ブロモピリジン-3,4-ジアミン(1.00g、5.32mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(1.36mL、10.64mmol)を添加した。反応混合物をアルゴン雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、飽和NaHCO3(水溶液)でpH7に中和した。得られた混合物をEtOAc(2×200mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM/MeOH(20/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-ブロモ-2-メチル-3H-イミダゾ[4,5-c]ピリジン(0.86g、75%)を淡黄色固体として得た。MS ESI C7H6BrN3[M+H]+についての計算値211.97、実測値212.00。
ステップ2:6-ブロモ-3-エチル-2-メチルイミダゾ[4,5-c]ピリジン
アセトン(20.00mL)中の6-ブロモ-2-メチル-3H-イミダゾ[4,5-c]ピリジン(0.85g、4.01mmol)およびKOH(1.35g、24.06mmol)の撹拌混合物に、ヨウ化エチル(0.45mL、5.63mmol)を0℃で滴下した。得られた混合物をアルゴン雰囲気下、室温で2時間撹拌した。得られた混合物をEtOAc(2×200mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-ブロモ-3-エチル-2-メチルイミダゾ[4,5-c]ピリジン(0.32g、33%)を淡黄色固体として得た。1H NMR(400 MHz,CDCl3)δ 8.50(d,J=0.8Hz,1H),7.78(d,J=0.8Hz,1H),4.25(q,J=7.2Hz,2H),2.68(s,3H),1.49(t,J=7.2Hz,3H).
ステップ3:3-(2-[3-エチル-2-メチルイミダゾ[4,5-c]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.18g、0.54mmol)、6-ブロモ-3-エチル-2-メチルイミダゾ[4,5-c]ピリジン(0.16g、0.65mmol)、CuI(20.69mg、0.11mmol)およびPd(PPh3)2Cl2(38.13mg、0.05mmol)の撹拌混合物に、TEA(0.24mL、1.73mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:MeOH、流量:20mL/分、勾配:6分で42Bから56B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[3-エチル-2-メチルイミダゾ[4,5-c]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(55.3mg、20%)をオフホワイトの固体として得た。MS ESI C25H30N8O3[M+H]+についての計算値491.24、実測値491.15;1H NMR(400 MHz,DMSO-d6)δ 9.00(s,1H),7.93(s,1H),7.47(s,1H),7.01-6.46(m,3H),6.17(d,J=16.8Hz,1H),5.69(d,J=10.4Hz,1H),5.34-5.20(m,1H),4.65-4.25(m,3H),4.09-3.47(m,5H),3.48-3.42(m,3H),2.96(d,J=4.8Hz,3H),2.64(s,3H),2.37-2.25(m,1H),1.36(t,J=7.2Hz,3H).
実施例49:3-[2-(2-アミノ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ヨード-1-メチル-1,3-ベンゾジアゾール-2-アミン
MeOH(6.00mL)およびH2O(6.00mL)中の4-ヨード-N1-メチルベンゼン-1,2-ジアミン(0.60g、2.42mmol)の撹拌溶液に、臭化シアン(0.60g、5.66mmol)を添加した。反応混合物を室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(10mL)で希釈し、NaHCO3固体でpH8に塩基性化した。水層をEA(3×15mL)で抽出し、合わせた有機層を無水硫酸ナトリウムで乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、5-ヨード-1-メチル-1,3-ベンゾジアゾール-2-アミン(0.25g、38%)を得た。MS ESI C8H8IN3[M+H]+についての計算値273.98、実測値274.00。
ステップ2:3-[2-(2-アミノ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド;ギ酸
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、5-ヨード-1-メチル-1,3-ベンゾジアゾール-2-アミン(0.13g、0.47mmol)、PdCl2(PPh3)2(27.54mg、0.04mmol)およびCuI(14.94mg、0.08mmol)の撹拌混合物に、TEA(0.12g、1.18mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5.0%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:MeOH、流量:20mL/分、勾配:6分で30%Bから50%B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-アミノ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド;ギ酸(30.7mg、15%)を白色固体として得た。MS ESI C24H28N8O3[M+H-FA]+についての計算値477.24、実測値477.25;1H NMR(400 MHz,DMSO-d6)δ 8.14(brs.1H),7.41-7.21(m,2H),7.18-7.09(m,1H),6.72(m,2H),6.66-6.56(m,2H),6.19-6.15(m,1H),5.70-5.68(m,1H),5.26-5.20(m,1H),4.56-4.36(m,1H),4.05-3.70(m,2H),3.63-3.42(m,5H),3.31-3.27(m,3H),2.96-2.93(m,3H),2.34-2.28(m,1H),2.50-2.45(m,1H).
実施例50:3-[2-(2-シクロプロピル-4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール
アセトン(60.00mL)中の2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(1.20g、3.75mmol)およびKOH(1.05g、18.75mmol)の撹拌混合物に、MeI(1.06g、7.50mmol)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を室温にて水(30mL)でクエンチし、EtOAc(3×60mL)で抽出した。合わせた有機層をブライン(2×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆相フラッシュによって精製した:カラム:Spherical C18、20-35μm、330g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:85mL/分、勾配:45分以内で0%-45%、検出器:UV 254&220nm;RT:45分。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.33g、26%)を淡黄色固体として得た。MS ESI C11H9F2IN2[M+H]+についての計算値334.98、実測値335.00。
ステップ2:3-[2-(2-シクロプロピル-4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.14g、0.40mmol)の撹拌混合物に、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、0.30mmol)、CuI(15.39mg、0.08mmol)、Pd(PPh3)2Cl2(28.36mg、0.04mmol)およびTEA(0.12g、1.21mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配:40分以内で20%~50%、検出器:254/220nm;RT:30分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-シクロプロピル-4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(61.3mg、28%)をオフホワイトの固体として得た。MS ESI C27H29F2N7O3[M+H]+についての計算値538.23、実測値538.30;1H NMR(300 MHz,DMSO-d6)δ 7.57(d,J=9.2Hz,2H),6.84-6.54(m,3H),6.18-6.17(m,1H),5.69-5.65(m,1H),5.28-5.26(m,1H),4.58-4.30(m,1H),4.04-4.02(m,1H),3.91-3.57(m,5H),3.49-3.45(m,1H),3.31(d,J=4.0Hz,3H),2.97-2.94(m,3H),2.68-2.58(m,1H),2.31-2.24(m,2H),1.23-1.02(m,4H).
実施例51:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((2-シクロプロピル-4-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:N-(6-アミノ-2-フルオロ-3-ヨードフェニル)シクロプロパンカルボキサミド
DMF(7.00mL)中の3-フルオロ-4-ヨードベンゼン-1,2-ジアミン(1.00g、3.97mmol)およびHATU(2.26g、5.95mmol)、DIEA(2.07mL、11.88mmol)の撹拌溶液に、DMF(3.00mL)中のシクロプロパンカルボン酸(0.17g、1.98mmol)を窒素雰囲気下、室温で滴下した。反応混合物を16時間撹拌した。得られた混合物を水(80mL)で希釈し、EtOAc(3×80mL)で抽出した。合わせた有機層をブライン(3×60mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-(6-アミノ-2-フルオロ-3-ヨードフェニル)シクロプロパンカルボキサミド(0.63g、50%)を褐色固体として得た。MS ESI C10H10FIN2O[M+H]+についての計算値320.98、実測値321.05。
ステップ2:2-シクロプロピル-4-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール
AcOH(6.00mL)中のN-(6-アミノ-2-フルオロ-3-ヨードフェニル)シクロプロパンカルボキサミド(0.63g、1.97mmol)の溶液を、窒素雰囲気下、70℃で5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、飽和NaHCO3(水溶液)でpH8に中和した。得られた混合物をEtOAc(3×40mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-4-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール(0.41g、69%)をオフホワイトの固体として得た。MS ESI C10H8FIN2[M+H]+についての計算値302.97、実測値302.95。
ステップ3:2-シクロプロピル-4-フルオロ-5-ヨード-1-メチル-1H-ベンゾ[d]イミダゾール
アセトン(5.00mL)中の2-シクロプロピル-4-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール(0.38g、1.26mmol)およびKOH(0.42g、7.55mmol)の撹拌混合物に、ヨウ化メチル(0.25g、1.76mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相A、水(10mmol/L NH4HCO3)、移動相B:ACN;20分で30Bから60Bの勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-4-フルオロ-5-ヨード-1-メチル-1H-ベンゾ[d]イミダゾール(0.14g、35%)をオフホワイトの固体として得た。MS ESI C11H10FIN2[M+H]+についての計算値316.99、実測値316.95。
ステップ4:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((2-シクロプロピル-4-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、2-シクロプロピル-4-フルオロ-5-ヨード-1-メチル-1H-ベンゾ[d]イミダゾール(0.12g、0.38mmol)、CuI(14.83mg、0.08mmol)およびPd(PPh3)2Cl2(27.32mg、0.04mmol)の撹拌混合物に、TEA(0.16mL、1.15mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19x150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから60B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((2-シクロプロピル-4-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(39.4mg、20%)をオフホワイトの固体として得た。MS ESI C27H30FN7O3[M+H]+についての計算値520.58、実測値520.25;1H NMR(400 MHz,DMSO-d6)δ 7.44-7.38(m,3H),6.84-6.71(m,3H),6.19-6.15(m,1H),5.70-5.68(m,1H),5.29-5.21(m,1H),4.53(d,J=54.3Hz,1H),4.07-3.98(m,1H),3.91-3.87(m,4H),3.66-3.40(m,2H),3.32-3.30(m,3H),2.97(t,J=5.2Hz,3H),2.33-2.28(m,3H),1.17-1.11(m,4H).
実施例52:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(キノリン-7-イル)エチニル]ピラゾール-4-カルボキサミド
DMF(2.00mL)中の7-ヨードキノリン(0.1g、0.39mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、CuI(14.93mg、0.07mmol)およびPd(PPh3)2Cl2(27.52mg、0.04mmol)の混合物に、TEA(0.12g、1.17mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mM NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配:30分以内で15%-40%、検出器:UV 254/220nm;RT:30分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(キノリン-7-イル)エチニル]ピラゾール-4-カルボキサミド(0.10g、47%)をオフホワイトの固体として得た。MS ESI C25H26N6O3[M+H]+についての計算値459.21、実測値459.20;1H NMR(300 MHz,DMSO-d6)δ 8.98(dd,J=4.2,1.7Hz,1H),8.46-8.37(m,1H),8.24(s,1H),8.06(d,J=8.5Hz,1H),7.73(dd,J=8.5,1.7Hz,1H),7.60(dd,J=8.3,4.2Hz,1H),7.37(s,1H),6.92(s,1H),6.80-6.48(m,2H),6.18-6.15(m,1H),5.73-5.68(m,1H),5.30-5.21(m,1H),4.49-4.45(m 1H),4.09-3.70(m,2H),3.66-3.41(m,2H),3.32(d,J=3.6Hz,3H),2.95-2.93(m,3H),2.67-2.53(m,1H),2.38-2.26(m,1H).
実施例53:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[ピラゾロ[1,5-a]ピリミジン-5-イル]エチニル)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の5-アミノ-3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.47mmol)および5-ブロモピラゾロ[1,5-a]ピリミジン(0.12g、0.61mmol)の撹拌混合物に、CuI(18.00mg、0.10mmol)、Pd(PPh3)2Cl2(33.18mg、0.05mmol)およびTEA(0.14g、1.42mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(0%-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で35Bから55B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[ピラゾロ[1,5-a]ピリミジン-5-イル]エチニル)ピラゾール-4-カルボキサミド(69.6mg、32%)を黄色固体として得た。MS ESI C22H24N8O3についての計算値448.20、実測値448.48;1H NMR(400 MHz,DMSO-d6)δ 9.19(dd,J=7.3,1.0Hz,1H),8.32(d,J=2.4Hz,1H),7.44(s,1H),7.22(dd,J=7.3,3.6Hz,1H),6.91-6.78(m,2H),6.64-6.46(m,2H),6.18-6.16(m,1H),5.71-5.68(m,1H),5.24-5.22(m,1H),4.23-4.21(m,1H),3.92-3.82(m,2H),3.74-3.72(m,1H),3.62-3.59(m,1H),3.53-3.42(m,3H),2.94(t,J=5.3Hz,3H),2.62-2.59(m,1H),2.46-2.43(m,1H).
実施例54:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-(イミダゾ[1,2-a]ピリジン-7-イルエチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、7-ヨードイミダゾ[1,2-a]ピリジン(0.12g、0.47mmol)、CuI(14.94mg、0.08mmol)およびPd(PPh3)2Cl2(27.54mg、0.04mmol)の撹拌混合物に、TEA(0.16mL、1.15mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19x150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で30Bから60B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-(イミダゾ[1,2-a]ピリジン-7-イルエチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(67.0mg、38%)を淡桃色固体として得た。MS ESI C23H25N7O3[M+H]+についての計算値448.20、実測値448.20;1H NMR(400 MHz,DMSO-d6)δ 8.68(s,1H),8.17-7.88(m,3H),7.32(s,1H),7.09-6.45(m,4H),6.19-6.14(m,1H),5.71-5.67(m,1H),5.27-5.19(m,1H),4.54-4.39(m,1H),4.07-3.68(m,2H),3.64-3.38(m,2H),3.32(s,3H),2.94(t,J=5.1Hz,3H),2.63-2.56(m,1H),2.34-2.24(m,1H).
実施例55:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-(イミダゾ[1,2-a]ピリジン-6-イルエチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、6-ヨードイミダゾ[1,2-a]ピリジン(0.11g、0.47mmol)、CuI(14.94mg、0.08mmol)およびPd(PPh3)2Cl2(27.54mg、0.04mmol)の撹拌混合物に、TEA(0.16mL、1.15mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19x150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから55B、210/254nm;RT:5.52分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-(イミダゾ[1,2-a]ピリジン-6-イルエチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(82.8mg、47%)をオフホワイトの固体として得た。MS ESI C23H25N7O3[M+H]+についての計算値448.20、実測値448.10;1H NMR(400 MHz,DMSO-d6)δ 9.16(s,1H),8.41-7.39(m,3H),7.35(s,2H),7.02-6.42(m,3H),6.19-6.13(m,1H),5.71-5.67(m,1H),5.29-5.17(m,1H),4.54-4.39(m,1H),4.13-3.65(m,2H),3.64-3.40(m,2H),3.30(s,3H),2.94(t,J=5.2Hz,3H),2.69-2.54(m,1H),2.36-2.23(m,1H).
実施例56:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[ピラゾロ[1,5-a]ピリジン-5-イル]エチニル)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.18g、0.54mmol)、5-ブロモピラゾロ[1,5-a]ピリジン(0.16g、0.82mmol)、Pd(PPh3)2Cl2(38.13mg、0.05mmol)およびCuI(20.69mg、0.11mmol)の撹拌混合物に、TEA(0.23mL、2.24mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから55B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[ピラゾロ[1,5-a]ピリジン-5-イル]エチニル)ピラゾール-4-カルボキサミド(66.6mg、27%)をオフホワイトの固体として得た。MS ESI C23H25N7O3[M+H]+についての計算値448.20、実測値448.15;1H NMR(400 MHz,DMSO-d6):δ 8.74(d,J=7.3Hz,1H),8.13-7.97(m,2H),7.34-7.32(m,1H),6.99-6.45(m,5H),6.17(d,J=16.5Hz,1H),5.76-5.62(m,1H),5.26-5.23(m,1H),4.49-4.39(m,1H),4.09-3.67(m,2H),3.63-3.38(m,2H),3.31(d,J=4.1Hz,3H),2.95(d,J=4.7Hz,3H),2.65-2.61(m,1H),2.39-2.24(m,1H).
実施例57:3-(2-[イミダゾ[1,2-a]ピリミジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、6-ブロモイミダゾ[1,2-a]ピリミジン(93.22mg、0.47mmol)、Pd(PPh3)2Cl2(27.54mg、0.04mmol)およびCuI(14.94mg、0.08mmol)の撹拌混合物に、TEA(0.12g、1.18mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を濾過し、濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから60B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[イミダゾ[1,2-a]ピリミジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(36.7mg、20%)を白色固体として得た。MS ESI C22H24N8O3[M+H]+についての計算値449.20、実測値449.15;1H NMR(400 MHz,DMSO-d6)δ 9.37-9.36(m,1H),8.66(d,J=2.4Hz,1H),7.94(d,J=1.4Hz,1H),7.91-7.76(m,1H),7.48-6.80(m,2H),6.77-6.47(m,2H),6.17-5.96(m,1H),5.69-5.43(m,1H),5.25-5.23(m,1H),4.63-4.34(m,1H),4.11-3.71(m,2H),3.67-3.38(m,2H),3.30(s,3H),2.96-2.93(m,3H),2.71-2.54(m,1H),2.44-2.24(m,1H).
実施例58:3-(2-[イミダゾ[1,2-a]ピリミジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)および7-ブロモイミダゾ[1,2-a]ピリミジン(77.69mg、0.39mmol)の撹拌混合物に、CuI(14.94mg、0.07mmol)、Pd(PPh3)2Cl2(27.54mg、0.03mmol)およびTEA(0.12g、1.17mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-7%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Shield RP18 OBD Column、30×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:30mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[イミダゾ[1,2-a]ピリミジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(62.1mg、34%)を淡黄色固体として得た。MS ESI C22H24N8O3[M+H]+についての計算値449.20、実測値449.10;1H NMR(300 MHz,DMSO-d6)δ 9.02(d,J=7.0Hz,1H),8.00(d,J=1.4Hz,1H),7.85(s,1H),7.60-7.11(m,2H),7.08-6.32(m,3H),6.28-6.07(m,1H),5.68(d,J=10.1Hz,1H),5.23-5.20(m,1H),4.54(s,1H),4.08-3.66(m,2H),3.25(s,3H),3.65-3.40(m,2H),2.93-2.91(m,3H),2.75-2.56(m,1H),2.38-2.22(m,1H).
実施例59:3-[2-(1-tert-ブチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:N-tert-ブチル-4-ヨード-2-ニトロアニリン
Et3N(4.55g、44.94mmol)中の1-フルオロ-4-ヨード-2-ニトロベンゼン(2.00g、7.49mmol)の撹拌溶液に、tert-ブチルアミン(2.74g、37.46mmol)を室温で添加した。反応混合物を80℃で16時間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を水(30mL)に溶解し、EtOAc(3×50mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、N-tert-ブチル-4-ヨード-2-ニトロアニリン(2.3g、95%)をオフホワイトの固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C10H13IN2O2[M+H]+についての計算値321.00、実測値321.10。
ステップ2:N1-tert-ブチル-4-ヨードベンゼン-1,2-ジアミン
EtOH(28.00mL)およびH2O(7.00mL)中のN-tert-ブチル-4-ヨード-2-ニトロアニリン(2.30g、7.18mmol)の撹拌混合物に、Fe(1.60g、28.65mmol)およびNH4Cl(1.92g、35.92mmol)を室温で添加した。反応混合物を70℃で2時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOH(3x70mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(50mL)に溶解した。得られた混合物をEtOAc(3×50mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、N1-tert-ブチル-4-ヨードベンゼン-1,2-ジアミン(2.1g、粗製)を暗緑色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C10H15IN2[M+H]+についての計算値291.03、実測値291.05。
ステップ3:1-tert-ブチル-5-ヨード-1,3-ベンゾジアゾール
オルトギ酸トリメチル(20.00mL)中のN1-tert-ブチル-4-ヨードベンゼン-1,2-ジアミン(1.90g、6.54mmol)の溶液を、100℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中のEA(0-53%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-tert-ブチル-5-ヨード-1,3-ベンゾジアゾール(1.5g、76%)を褐色固体として得た。MS ESI C11H13IN2[M+H]+についての計算値301.01、実測値300.90。
ステップ4:3-[2-(1-tert-ブチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)および1-tert-ブチル-5-ヨード-1,3-ベンゾジアゾール(0.14g、0.47mmol)の撹拌混合物に、Pd(PPh3)2Cl2(27.54mg、0.03mmol)、CuI(14.94mg、0.08mmol)およびTEA(0.12g、1.17mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-6%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、10分で10%から32%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-tert-ブチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(86.8mg、43%)をオフホワイトの固体として得た。MS ESI C27H33N7O3[M+H]+についての計算値504.26、実測値504.15;1H NMR(300 MHz,DMSO)δ 8.45(s,1H),δ 7.93-7.90(m,2H),7.39(d,J=8.6Hz,2H),7.01-6.47(m,3H),6.16(d,J=16.7Hz,1H),5.68(d,J=10.4Hz,1H),δ 5.25(s,1H),4.52-4.38(m,1H),4.13-3.68(m,2H),3.66-3.41(m,2H),3.25(s,3H),2.93-2.91(m,3H),2.60(m,1H),2.29-2.26(m,1H),1.71(s,J=3.4Hz,9H).
実施例60:3-[2-[2-(ジメチルアミノ)-1-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ヨード-N,N,1-トリメチル-1,3-ベンゾジアゾール-2-アミン
DMF(5.00mL、64.60mmol)中の5-ヨード-1-メチル-1,3-ベンゾジアゾール-2-アミン(0.50g、1.83mmol)の撹拌溶液に、NaH(0.18g、7.32mmol)を室温で小分けにして添加した。上記混合物に、ヨウ化メチル(1.30g、9.15mmol)を室温で滴下した。反応混合物を1時間撹拌した。得られた混合物に、H2O(100mL)を添加した。得られた混合物をEtOAc(5×50mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾過されたものを減圧下で濃縮した。残渣を、PE/EtOAc(0-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ヨード-N,N,1-トリメチル-1,3-ベンゾジアゾール-2-アミン(0.40g、72%)を淡黄色固体として得た。MS ESI C10H12IN3[M+H]+についての計算値302.01、実測値301.95。
ステップ2:3-[2-[2-(ジメチルアミノ)-1-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)および5-ヨード-N,N,1-トリメチル-1,3-ベンゾジアゾール-2-アミン(0.14g、0.47mmol)の撹拌混合物に、CuI(15.00mg、0.08mmol)、Pd(PPh3)2Cl2(27.50mg、0.04mmol)およびTEA(0.12g)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗製物を得た。粗製物を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:40mL/分;60分以内で5%-60%、検出器:UV 254&220nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[2-(ジメチルアミノ)-1-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(41.3mg、20%)を白色固体として得た。MS ESI C26H32N8O3[M+H]+についての計算値505.26、実測値505.15;1H NMR(300 MHz,DMSO-d6)δ 7.54(d,J=1.5Hz,1H),7.38(d,J=8.2Hz,2H),7.26(d,J=8.3Hz,1H),6.85-6.50(m,3H),6.18(d,J=16.7Hz,1H),5.70(d,J=10.5Hz,1H),5.26(d,J=7.9Hz,1H),4.53-4.38(m,1H),4.10-3.69(m,2H),3.66(s,3H),3.54-3.41(m,2H),3.33-3.30(m,3H),2.97(s,9H),2.60-2.58(m,1H),2.30-2.28(m,1H).
実施例61:3-[2-(2-シクロプロピル-4,6-ジフルオロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:N-(6-アミノ-2,4-ジフルオロ-3-ヨードフェニル)シクロプロパンカルボキサミドおよびN-(2-アミノ-3,5-ジフルオロ-4-ヨードフェニル)シクロプロパンカルボキサミド
DMF(30.00mL)中のシクロプロパンカルボン酸(1.91g、22.22mmol)の溶液に、HATU(10.56g、27.77mmol)およびDIEA(7.18g、55.55mmol)を室温で添加した。反応混合物を室温で30分間撹拌した。上記混合物に、DMF(20.00mL)中の3,5-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン(5.00g、18.51mmol)を添加した。得られた混合物を室温で16時間撹拌した。得られた混合物をEA(100mL)で希釈し、水(3×50mL)で洗浄した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-20%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-(6-アミノ-2,4-ジフルオロ-3-ヨードフェニル)シクロプロパンカルボキサミドおよびN-(2-アミノ-3,5-ジフルオロ-4-ヨードフェニル)シクロプロパンカルボキサミド(4.0g、63%)の混合物を黄色固体として得た。MS ESI C10H9F2IN2O[M+H]+についての計算値338.97、実測値339.00。
ステップ2:2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール
AcOH(60.00mL)中のN-(6-アミノ-2,4-ジフルオロ-3-ヨードフェニル)シクロプロパンカルボキサミドおよびN-(2-アミノ-3,5-ジフルオロ-4-ヨードフェニル)シクロプロパンカルボキサミド(5.00g、14.78mmol)の溶液を、70℃で24時間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を飽和NaHCO3(水溶液)でpH8に塩基性化した。得られた混合物を水(50mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-52%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(2.2g、46%)を黄色固体として得た。MS ESI C10H7F2IN2[M+H]+についての計算値320.96、実測値320.85。
ステップ3:3-[2-(2-シクロプロピル-4,6-ジフルオロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の2-シクロプロピル-4,6-ジフルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(0.12g、0.38mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.12g、0.38mmol)、Pd(PPh3)2Cl2(26.31mg、0.04mmol)およびCuI(14.28mg、0.08mmol)の撹拌混合物に、TEA(0.13g、1.13mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いる逆相フラッシュによって精製した:カラム:Spherical C18、20~40μm、330g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:65mL/分、勾配:30%~40%、20分、検出器:254nm;RT:20分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-シクロプロピル-4,6-ジフルオロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.11g、55%)をオフホワイトの固体として得た。MS ESI C26H27F2N7O3[M+H]+についての計算値524.22、実測値524.15;1H NMR(300 MHz,DMSO-d6)δ 7.57(s,1H),7.28(d,J=9.2Hz,1H),6.76-6.56(m,2H),6.19-6.12(m,1H),5.70-5.64(m,1H),5.27-5.25(m,1H),4.45-4.40(m,1H),4.05-4.02(m,1H),3.93-3.81(m,1H),3.76-3.73(m,1H),3.62-3.59(m,1H),3.48-3.45(m,3H),2.95(t,J=3.0Hz,4H),2.31-2.30(m,1H),2.29-2.27(m,1H),2.14-2.12(m,1H),1.08-1.04(m,4H).
実施例62:3-[2-(2-シクロプロピル-6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:N-(2-アミノ-4-フルオロ-5-ヨードフェニル)シクロプロパンカルボキサミド
DMF(20.00mL)中の4-フルオロ-5-ヨードベンゼン-1,2-ジアミン(2.00g、7.94mmol)、シクロプロパンカルボン酸(0.34g、3.97mmol)およびHATU(4.53g、11.90mmol)の撹拌混合物に、DIEA(3.30mL)を添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。得られた混合物を水(80mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-(2-アミノ-4-フルオロ-5-ヨードフェニル)シクロプロパンカルボキサミド(1.3g、51%)を白色固体として得た。MS ESI C10H10FIN2O[M+H]+についての計算値320.98、実測値321.00。
ステップ2:2-シクロプロピル-6-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール
AcOH(20mL)中のN-(2-アミノ-4-フルオロ-5-ヨードフェニル)シクロプロパンカルボキサミド(1.10g)の混合物を、窒素雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を飽和NaHCO3でpH8に塩基性化した。得られた混合物をEtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-6-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール)を白色固体として得た。MS ESI C10H8FIN2[M+H]+についての計算値302.97、実測値303.05。
ステップ3:2-シクロプロピル-6-フルオロ-5-ヨード-1-メチル-1H-ベンゾ[d]イミダゾール
アセトン(10.00mL)中の2-シクロプロピル-6-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール(0.67g、2.22mmol)およびKOH(0.62g、11.09mmol)の撹拌混合物に、CH3I(0.63g、4.44mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で2時間撹拌した。得られた混合物を水(150mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-アキラル-SFCによって精製した:カラム:EnantioPak A1-5、2.12×25cm、5μm、移動相A:CO2、移動相B:MeOH(0.5% 2M NH3-MeOH)、流量:40mL/分、勾配:35%B;254nm、RT1:4.45分;RT2:5.09分;注入体積:1mL;ランの数:28。所望の生成物を含有する分画を合わせ、濃縮して、2-シクロプロピル-6-フルオロ-5-ヨード-1-メチル-1H-ベンゾ[d]イミダゾール(0.54g、32%)をオフホワイトの固体として得た。MS ESI C11H10FIN2[M+H]+についての計算値316.99、実測値316.95。
ステップ4:3-[2-(2-シクロプロピル-6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の2-シクロプロピル-6-フルオロ-5-ヨード-1-メチル-1H-ベンゾ[d]イミダゾール(47.70mg、0.15mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(50mg、0.15mmol)、Pd(PPh3)2Cl2(27.54mg、0.039mmol)およびCuI(5.75mg、0.03mmol)の撹拌混合物に、TEA(0.06mL、0.62mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を水(50mL)で希釈し、EtOAc(5×50mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから70B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で30Bから70B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(2-シクロプロピル-6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(9.1mg、11%)を白色固体として得た。MS ESI C27H30FN7O3[M+H]+についての計算値520.24、実測値520.25;1H NMR(300 MHz,DMSO)δ 7.73(d,J=6.3Hz,1H),7.61(d,J=9.8Hz,1H),7.50(s,1H),6.88-6.48(m,2H),6.17(d,J=16.6Hz,1H),5.90-5.58(m,1H),5.27(s,1H),4.49-4.46(m,1H),4.03-4.01(m,1H),3.91-3.70(m,4H),3.63-3.59(m,1H),3.52-3.38(m,2H),3.31(s,3H),3.00-2.86(m,3H),2.69-2.67(m,1H),2.29-2.25(m,2H),1.26-0.95(m,5H).
実施例63:3-(2-[2-シクロプロピル-3-メチルイミダゾ[4,5-c]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:N-(5-アミノ-2-ブロモピリジン-4-イル)シクロプロパンカルボキサミド
DMF(10.00mL)中の6-ブロモピリジン-3,4-ジアミン(1.00g、5.31mmol)およびHATU(3.03g、7.98mmol)の撹拌混合物に、DIEA(2.06g、15.96mmol)を室温で滴下した。反応混合物を0.5時間撹拌した。上記混合物に、シクロプロパンカルボン酸(0.46g、5.32mmol)を3分間にわたって滴下した。反応混合物を室温でさらに1時間撹拌した。得られた混合物を室温にて水(10mL)の添加によってクエンチし、EtOAc(3×20mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-(5-アミノ-2-ブロモピリジン-4-イル)シクロプロパンカルボキサミド(0.96g、70%)を淡黄色固体として得た。MS ESI C9H10BrN3O[M+H]+についての計算値256.00、258.00、実測値256.05、258.05。
ステップ2:6-ブロモ-2-シクロプロピル-3H-イミダゾ[4,5-c]ピリジン
トルエン(12.00mL)中のN-(5-アミノ-2-ブロモピリジン-4-イル)シクロプロパンカルボキサミド(1.20g、4.69mmol)およびTEA(0.47g、4.69mmol)の撹拌溶液に、オキシ塩化リン(0.72g、4.69mmol)を室温で滴下した。反応混合物を110℃で5時間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を、PE/EtOAc(1/3)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-ブロモ-2-シクロプロピル-3H-イミダゾ[4,5-c]ピリジン(0.71g、63%)を淡黄色固体として得た。MS ESI C9H8BrN3[M+H]+についての計算値237.99、239.99、実測値238.05、240.05。
ステップ3:6-ブロモ-2-シクロプロピル-3-メチルイミダゾ[4,5-c]ピリジン
DMF(7.00mL)中6-ブロモ-2-シクロプロピル-3H-イミダゾ[4,5-c]ピリジン(0.71g、2.98mmol)およびCs2CO3(2.91g、8.94mmol)の撹拌混合物に、ヨウ化メチル(0.63g、4.47mmol)を室温で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を濾過し、濾過ケーキをDMF(2mL)で洗浄した。濾液を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、30分で5%から70%の勾配、検出器、UV254nm。所望の生成物を含有する分画を合わせ、濃縮して、6-ブロモ-2-シクロプロピル-3-メチルイミダゾ[4,5-c]ピリジン(0.13g、17%)をオフホワイトの固体として得た。MS ESI C10H10BrN3[M+H]+についての計算値252.01、254.00、実測値252.10、254.10。
ステップ4:3-(2-[2-シクロプロピル-3-メチルイミダゾ[4,5-c]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.43mmol)、6-ブロモ-2-シクロプロピル-3-メチルイミダゾ[4,5-c]ピリジン(0.11g、0.44mmol)、Pd(PPh3)2Cl2(30.71mg、0.04mmol)およびCuI(16.67mg、0.08mmol)の撹拌混合物に、TEA(0.13g、1.31mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を、PE/EtOAc(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮し、残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:MeOH、流量:20mL/分、勾配:6分で15Bから35B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[2-シクロプロピル-3-メチルイミダゾ[4,5-c]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5(メチルアミノ)ピラゾール-4-カルボキサミド(49.8mg、22%)をオフホワイトの固体として得た。MS ESI C26H30N8O3[M+H]+についての計算値503.24、実測値503.20;1H NMR(300 MHz,DMSO-d6)δ 8.88(d,J=1.0Hz,1H),7.81(s,1H),7.46(s,1H),6.86-6.52(m,3H),6.17(d,J=16.6Hz,1H),5.70(d,J=10.4Hz,1H),5.27(dd,J=13.6,6.8Hz,1H),4.40-4.05(m,1H),3.98-3.96(m,4H),3.92-3.82(m,1H),3.79-3.56(m,1H),3.53-3.41(m,2H),3.31(s,3H),2.98-2.95(m,3H),2.36-2.29(m,2H),1.27-1.01(m,4H).
実施例64:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(キノキサリン-6-イル)エチニル]ピラゾール-4-カルボキサミド
DMF(2.00mL)中の6-ヨードキノキサリン(0.12g、0.47mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、CuI(14.94mg、0.08mmol)およびPd(PPh3)2Cl2(27.54mg、0.04mmol)の混合物に、TEA(0.12g、1.18mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配:40分以内で20%-40%、検出器:UV 254/220nm;RT:30分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(キノキサリン-6-イル)エチニル]ピラゾール-4-カルボキサミド(91.4mg、51%)をオフホワイトの固体として得た。MS ESI C24H25N7O3[M+H]+についての計算値460.20、実測値460.15;1H NMR(300 MHz,DMSO-d6)δ 9.04-8.98(m,2H),8.34(d,J=1.7Hz,1H),8.16(d,J=8.7Hz,1H),7.98(dd,J=8.7,1.9Hz,1H),7.99-6.93(m,2H),6.79-6.47(m,2H),6.21-6.18(m,1H),5.73-5.68(m,1H),5.32-5.20(m,1H),4.51-4.48(m,1H),4.09-3.70(m,2H),3.64-3.44(m,2H),3.31(s,3H),2.95-2.92(m,3H),2.67-2.58(m,1H),2.39-2.23(m,1H).
実施例65:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-3-((3-メチルキノリン-7-イル)エチニル)-1H-ピラゾール-4-カルボキサミド
DMF(1.50mL)中の5-アミノ-3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.13g、0.41mmol)、7-ブロモ-3-メチルキノリン(0.11g、0.49mmol)、CuI(15.60mg、0.08mmol)およびPd(PPh3)2Cl2(28.75mg、0.04mmol)の撹拌混合物に、TEA(0.17mL、1.22mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:MeOH、流量:20mL/分、勾配:6分で50Bから60B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-3-((3-メチルキノリン-7-イル)エチニル)-1H-ピラゾール-4-カルボキサミド(30.3mg、16%)を黄色固体として得た。MS ESI C26H28N6O3[M+H]+についての計算値473.22、実測値473.35;1H NMR(400 MHz,DMSO-d6)δ 8.87(s,1H),8.23-8.19(m,2H),7.99(d,J=8.5Hz,1H),7.71(d,J=8.4Hz,1H),7.37(s,1H),6.90(s,1H),6.76-6.69(m,1H),6.63-6.56(m,1H),6.20-6.14(m,1H),5.72-5.68(m,1H),5.30-5.19(m,1H),4.66-4.30(m,1H),4.13-3.80(m,2H),3.76-3.68(m,1H),3.62-3.58(m,1H),3.52-3.47(m,3H),3.30(s,3H),2.94(s,3H),2.70-2.52(m,1H),2.34-2.25(m,1H).
実施例66:3-(2-[イミダゾ[1,2-b]ピリダジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:7-ブロモイミダゾ[1,2-b]ピリダジン
i-PrOH(5.50mL)中の5-ブロモピリダジン-3-アミン(0.5g、2.87mmol)の撹拌溶液に、クロロアセトアルデヒド(2.37mL、12.07mmol、40%)をアルゴン雰囲気下、室温で滴下した。反応混合物をアルゴン雰囲気下、90℃で16時間撹拌した。得られた混合物を水(100mL)で希釈し、EtOAc(3×150mL)で抽出した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、7-ブロモイミダゾ[1,2-b]ピリダジン(0.44g、78%)を白色固体として得た。MS ESI C6H4BrN3[M+H]+についての計算値197.96、実測値198.00。
ステップ2:3-(2-[イミダゾ[1,2-b]ピリダジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.17g、0.51mmol)、7-ブロモイミダゾ[1,2-b]ピリダジン(0.15g、0.77mmol)、Pd(PPh3)2Cl2(36.01mg、0.05mmol)およびCuI(19.54mg、0.10mmol)の撹拌混合物に、TEA(0.21mL、2.11mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を水(30mL)で希釈し、EtOAc(3×30mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis Prep T3 OBD Column、19×250mm 10μ、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから55B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[イミダゾ[1,2-b]ピリダジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(37.7mg、16%)を黄色固体として得た。MS ESI C22H24N8O3[M+H]+についての計算値449.20、実測値449.20;1H NMR(400 MHz,DMSO-d6)δ 8.67(d,J=2.0Hz,1H),8.52-8.33(m,2H),7.92(d,J=1.2Hz,1H),7.30(s,1H),6.90(s,1H),6.82-6.45(m,2H),6.17-5.96(m,1H),5.69-5.43(m,1H),5.25-5.23(m,1H),4.63-4.32(m,1H),4.17-3.70(m,2H),3.68-3.41(m,2H),3.30(d,J=5.5Hz,3H),2.94-2.76(m,3H),2.65-2.60(m,1H),2.41-2.20(m,1H).
実施例67:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[ピラゾロ[1,5-a]ピリジン-6-イル]エチニル)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の5-アミノ-3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.11g、0.35mmol)、6-ブロモピラゾロ[1,5-a]ピリジン(0.10g、0.52mmol)、Pd(PPh3)2Cl2(24.33mg、0.03mmol)およびCuI(13.20mg、0.07mmol)の撹拌混合物に、TEA(0.14mL、1.01mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の6%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから55B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[ピラゾロ[1,5-a]ピリジン-6-イル]エチニル)ピラゾール-4-カルボキサミド(31.9mg、20%)をオフホワイトの固体として得た。MS ESI C23H25N7O3[M+H]+についての計算値448.20、実測値448.20;1H NMR(400 MHz,DMSO-d6):δ 9.14(s,1H),8.12(d,J=2.2Hz,1H),7.78-7.70(m,1H),7.30(dd,J=9.2,1.5Hz,2H),6.88-6.48(m,4H),6.22-6.13(m,1H),5.73-5.68(m,1H),5.26-5.22(m,1H),4.55-4.38(m,1H),4.10-3.68(m,2H),3.64-3.39(m,2H),3.33-3.30(m,3H),2.95-2.94(m,3H),2.53-2.51(m,1H),2.39-2.35(m,1H).
実施例68:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾールおよび1-エチル-7-フルオロ-6-ヨード-1,3-ベンゾジアゾール
アセトン(20.00mL)中の4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(2.00g、7.63mmol)およびKOH(2.57g、45.80mmol)の撹拌混合物に、ヨードエタン(1.67g、10.69mmol)を室温で添加した。反応混合物を室温で2時間撹拌した。得られた混合物を水(50mL)で希釈し、EA(3×70mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、30分で25%から55%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.80g、36%)を黄色固体として得た。MS ESI C9H8FIN2[M+H]+についての計算値290.97、実測値290.99;また、1-エチル-7-フルオロ-6-ヨード-1,3-ベンゾジアゾール(0.78g、35%)も黄色固体として得た。MS ESI C9H8FIN2[M+H]+についての計算値290.97、実測値290.95。
ステップ2:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.2g、0.60mmol)、1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.21g、0.72mmol)、CuI(22.99mg、0.12mmol)およびPd(PPh3)2Cl2(42.36mg、0.06mmol)の撹拌混合物に、TEA(0.25mL、1.80mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis Prep T3 OBD Column、19×250mm 10u、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で30Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-エチル-4-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(60.0mg、20%)を淡桃色固体として得た。MS ESI C25H28FN7O3[M+H]+についての計算値494.22、実測値494.20;1H NMR(400 MHz,DMSO-d6)δ 8.56(s,1H),7.56-7.44(m,3H),6.99-6.43(m,2H),6.19-6.14(m,1H),5.70-5.67(m,2H),5.30-5.22(m,1H),4.57-4.38(m,3H),4.07-3.88(m,2H),3.81-3.65(m,2H),3.32(s,3H),2.98(s,3H),2.66-2.54(m,1H),2.34-2.27(m,1H),1.59-1.54(m,3H).
実施例69:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-3-((2-メチルキノキサリン-6-イル)エチニル)-1H-ピラゾール-4-カルボキサミド
DMF(1.60mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.16g、0.48mmol)、6-ブロモ-2-メチルキノキサリン(96.94mg、0.44mmol)、CuI(18.39mg、0.10mmol)およびPd(PPh3)2Cl2(33.89mg、0.05mmol)の撹拌混合物に、TEA(0.20mL、1.99mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis Prep T3 OBD Column、19×250mm 10u、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから45B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-3-((2-メチルキノキサリン-6-イル)エチニル)-1H-ピラゾール-4-カルボキサミド(39.1mg、17%)を黄色固体として得た。MS ESI C25H27N7O3[M+H]+についての計算値474.22、実測値474.15;1H NMR(400 MHz,DMSO-d6)δ 8.89(s,1H),8.21(s,1H),8.10(d,J=8.6Hz,1H),7.89(dd,J=8.6,1.8Hz,1H),7.34(s,1H),7.06-6.36(m,2H),6.20-6.14(m,1H),5.78-5.65(m,1H),5.28-5.18(m,1H),4.64-4.25(m,1H),4.12-3.67(m,2H),3.64-3.41(m,2H),3.30(s,4H),2.98-2.92(m,3H),2.72(s,2H),2.54(s,1H),2.31-2.28(m,1H).
実施例70:3-[2-[1-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ヨード-1H-1,3-ベンゾジアゾール
MeOH(50.00mL)中の4-ヨードベンゼン-1,2-ジアミン(5.00g、21.36mmol)の撹拌溶液に、オルトギ酸トリメチル(6.80g、0.06mmol)を窒素雰囲気下、室温で滴下した。反応混合物を70℃で2時間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を、PE/EtOAc(0~50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ヨード-1H-1,3-ベンゾジアゾール(5.5g、94%)を暗黄色固体として得た。MS ESI C7H5IN2[M+H]+についての計算値244.95、実測値245.00。
ステップ2:1-(ジフルオロメチル)-5-ヨード-1,3-ベンゾジアゾールおよび1-(ジフルオロメチル)-6-ヨード-1,3-ベンゾジアゾール
EtOAc(50.00mL)中の5-ヨード-1H-1,3-ベンゾジアゾール(5.00g、20.49mmol)およびK2CO3(5.66g、0.04mmol)の撹拌混合物に、1,1-ジフルオロ-2-オキソプロパン-1-スルホニルフルオリド(4.33g、0.03mmol)を窒素雰囲気下、室温で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を濾過した。濾過ケーキをMeOH(3×100mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(0~50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-SFCによって精製した:カラム:Chiralpak if、30×250mm、5μm、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:50mL/分、勾配:45%B;220nm、RT1:6.2分;RT2:7.8分;注入体積:0.5mL;ランの数:60。所望の生成物を含有する分画を合わせ、濃縮して、1-(ジフルオロメチル)-5-ヨード-1,3-ベンゾジアゾール(1.78g、29%、推定)を黄緑色固体として、および1-(ジフルオロメチル)-6-ヨード-1,3-ベンゾジアゾール(2.13g、35%、推定)を黄緑色固体として得た。MS ESI C8H5F2IN2[M+H]+についての計算値295.04、実測値295.00。
ステップ3:3-[2-[1-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の1-(ジフルオロメチル)-5-ヨード-1,3-ベンゾジアゾール(0.13g、0.45mmo)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、Pd(PPh3)2Cl2(31.80mg、0.05mmol)およびCuI(17.25mg、0.09mmol)の撹拌混合物に、TEA(0.14g、1.36mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、30分で5%から70%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[1-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(80.2mg、33%)をオフホワイトの固体として得た。MS ESI C24H25F2N7O3[M+H]+についての計算値498.51、実測値498.20;1H NMR(400 MHz,DMSO-d6)δ 8.71(s,1H),8.29-7.93(m,2H),7.80(d,J=8.4Hz,1H),7.61(dd,J=8.4,1.5Hz,1H),7.35(s,1H),6.85-6.57(m,3H),6.19-6.15(m,1H),5.69-5.66(m,1H),5.27-5.24(m,1H),4.58-4.36(m,1H),4.04-3.70(m,2H),3.63-3.42(m,2H),3.30(d,J=5.2Hz,3H),2.94(t,J=5.1Hz,3H),2.68-2.42(m,1H),2.32-2.28(m,1H).
実施例71:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール
MeOH(50.00mL)中の3-フルオロ-4-ヨードベンゼン-1,2-ジアミン(5.00g、19.84mmol)の撹拌溶液に、オルトギ酸トリメチル(3.16g、29.78mmol)を窒素雰囲気下、室温で滴下した。反応混合物を窒素雰囲気下、70℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(4.6g、88%)を淡黄色固体として得た。MS ESI C7H4FIN2[M+H]+についての計算値262.94、実測値263.00。
ステップ2:4-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾールおよび7-フルオロ-6-ヨード-1-メチル-1,3-ベンゾジアゾール
アセトン(35.00mL)中の4-フルオロ-5-ヨード-1H-1,3-ベンゾジアゾール(3.50g、13.36mmol)およびKOH(4.50g、80.21mmol)の撹拌混合物に、CH3I(1.16mL、8.20mmol)を滴下した。反応混合物を室温で40分間撹拌した。得られた混合物を水(40mL)で希釈し、EA(3×70mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、30分で20%から50%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、4-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(1.6g、43%)をオフホワイトの固体として得た。MS ESI C8H6FIN2[M+H]+についての計算値276.96、実測値277.00。また、7-フルオロ-6-ヨード-1-メチル-1,3-ベンゾジアゾール(1.57g、42%)もオフホワイトの固体として得た。MS ESI C8H6FIN2[M+H]+についての計算値276.96、実測値277.00。
ステップ3:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.2g、0.61mmol)、4-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.2g、0.72mmol)、CuI(22.99mg、0.12mmol)およびPd(PPh3)2Cl2(42.36mg、0.06mmol)の撹拌混合物に、TEA(0.25mL、2.49mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19x150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で35Bから60B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(45.3mg、15%)をオフホワイトの固体として得た。MS ESI C24H26FN7O3[M+H]+についての計算値480.53、実測値480.20;1H NMR(400 MHz,DMSO-d6)δ 8.35(s,1H),7.56-7.44(m,3H),6.99-6.43(m,3H),6.19-6.14(m,1H),5.70-5.67(m,1H),5.30-5.22(m,1H),4.53-4.40(m,1H),4.07-3.98(m,1H),3.91-3.85(m,4H),3.77-3.72(m,1H),3.63-3.59(m,1H),3.51-3.42(m,3H),2.97-2.94(m,3H),2.46-2.44(m,1H),2.34-2.27(m,1H).
実施例72:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-3-((3-メチルキノキサリン-6-イル)エチニル)-1H-ピラゾール-4-カルボキサミド
ステップ1:7-ブロモ-2-メチルキノキサリンおよび6-ブロモ-2-メチルキノキサリン
EtOH(10.00mL)中の4-ブロモベンゼン-1,2-ジアミン(1.00g、5.35mmol)の撹拌溶液に、2-オキソプロパナール(4mL、40%)をアルゴン雰囲気下、室温で添加した。反応混合物を10分間撹拌した。得られた混合物をEtOAc(3×300mL)で抽出した。合わせた有機層をブライン(2×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-SFCによって精製した:カラム:Chiralpak if、30×250mm、5μm、移動相A:CO2、移動相B:IPA(0.5% 2M NH3-MeOH)、流量:50mL/分、勾配:20%B;220nm、RT1:8.75分;RT2:10.62分;注入体積:0.8mL;ランの数:35。所望の生成物を含有する分画を合わせ、濃縮して、7-ブロモ-2-メチルキノキサリン(0.39g、33%)を淡褐色固体として得た。MS ESI C9H7BrN2[M+H]+についての計算値222.98、実測値222.95。また、6-ブロモ-2-メチルキノキサリン(0.32g、27%)も淡褐色固体として得た。MS ESI C9H7BrN2[M+H]+についての計算値222.98、実測値223.00。
ステップ2:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-3-((3-メチルキノキサリン-6-イル)エチニル)-1H-ピラゾール-4-カルボキサミド
DMF(1.60mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.16g、0.48mmol)、7-ブロモ-2-メチルキノキサリン(96.94mg、0.44mmol)、CuI(18.39mg、0.10mmol)およびPd(PPh3)2Cl2(33.89mg、0.05mmol)の撹拌混合物に、TEA(0.20mL、1.44mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis Prep T3 OBD Column、19x250mm 10u、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから55B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-3-((3-メチルキノキサリン-6-イル)エチニル)-1H-ピラゾール-4-カルボキサミド(52.2mg、23%)を黄色固体として得た。MS ESI C25H27N7O3[M+H]+についての計算値474.22、実測値474.20;1H NMR(400 MHz,DMSO-d6)δ 8.89(s,1H),8.21(s,1H),8.10(d,J=8.6Hz,1H),7.89-7.86(m,1H),7.34(s,1H),7.06-6.36(m,2H),6.20-6.14(m,1H),5.78-5.65(m,1H),5.28-5.18(m,1H),4.64-4.25(m,1H),4.12-3.67(m,2H),3.64-3.41(m,2H),3.30(s,4H),2.98-2.92(m,3H),2.72(s,2H),2.54(s,1H),2.31-2.28(m,1H).
実施例73:3-[2-[3-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の1-(ジフルオロメチル)-6-ヨード-1,3-ベンゾジアゾール(0.13g、0.45mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、Pd(PPh3)2Cl2(31.77mg、0.05mmol)およびCuI(17.24mg、0.09mmol)の撹拌混合物に、TEA(0.14g、1.36mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、30分で5%から70%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[3-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(88.3mg)をオフホワイトの固体として得た。MS ESI C24H25F2N7O3[M+H]+についての計算値498.51、実測値498.20;1H NMR(400 MHz,DMSO-d6)δ 8.73(s,1H),8.30-7.94(m,2H),7.84(d,J=8.4Hz,1H),7.56(dd,J=8.4,1.5Hz,1H),7.36(s,1H),6.85(s,1H),6.77-6.49(m,2H),6.19-6.15(m,1H),5.71-5.68(m,1H),5.25-5.23(m,1H),4.57-4.37(m,1H),4.08-3.67(m,2H),3.61-3.41(m,2H),3.30(d,J=5.3Hz,3H),2.94(t,J=5.2Hz,3H),2.66-2.41(m,1H),2.33-2.98(m,1H).
実施例74:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(4-メチルキノリン-7-イル)エチニル]ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.60mmol)、7-ブロモ-4-メチルキノリン(0.16g、0.72mmol)、Pd(PPh3)2Cl2(42.36mg、0.06mmol)およびCuI(22.99mg、0.12mmol)の撹拌混合物に、TEA(0.25mL、2.49mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中の6%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.05%TFA)、移動相B:ACN、流量:20mL/分、勾配:6分で35Bから60B、210/254nm;RT:5.57分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(4-メチルキノリン-7-イル)エチニル]ピラゾール-4-カルボキサミド(41.8mg、14%)をオフホワイトの固体として得た。MS ESI C26H28N6O3[M+H]+についての計算値473.22、実測値473.30;1H NMR(400 MHz,DMSO-d6):δ 8.82(d,J=4.4Hz,1H),8.26-8.07(m,2H),7.74(dd,J=8.6,1.7Hz,1H),7.44(d,J=4.4Hz,2H),6.91(s,1H),6.78-6.47(m,2H),6.19-6.15(m,1H),5.72-5.68(m,1H),5.26-5.24(m,1H),4.50-4.45(m,1H),4.08-3.68(m,2H),3.64-3.40(m,2H),3.31(d,J=5.3Hz,3H),2.95(t,J=5.2Hz,3H),2.75-2.54(m,4H),2.35-2.25(m,1H).
実施例75:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[3-メチルイミダゾ[1,2-a]ピリジン-7-イル]エチニル)ピラゾール-4-カルボキサミド
ステップ1:2-クロロプロパナール
CHCl3(25.00mL)中のプロピオンアルデヒド(2.50g、43.04mmol)の撹拌溶液に、NCS(6.32g、47.35mmol)およびDL-カンファースルホン酸(2.00g、8.61mmol)を0℃で添加した。反応混合物を室温で16時間撹拌した。沈殿した固体を濾過によって回収し、アセトン(50mL)で洗浄した。粗生成物2-クロロプロパナール(0.85g)を乾燥させ、さらに精製することなく次のステップに直接使用した。
ステップ2:7-ヨード-3-メチルイミダゾ[1,2-a]ピリジン
アセトン(50.00mL)およびCHCl3(25.00mL)中の2-クロロプロパナール(0.85g、粗製)の撹拌溶液に、4-ヨードピリジン-2-アミン(2.02g、9.19mmol)を添加した。反応混合物を空気雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、7-ヨード-3-メチルイミダゾ[1,2-a]ピリジン(80mg、1.43%)を淡黄色固体として得た。MS ESI C8H7IN2[M+H]+についての計算値258.97、実測値259.05;1H NMR(400 MHz,CDCl3)δ 8.04(s,1H),7.65(d,J=7.1Hz,1H),7.38(s,1H),7.10-7.07(m,1H),2.47(s,3H)
ステップ3:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[3-メチルイミダゾ[1,2-a]ピリジン-7-イル]エチニル)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の7-ヨード-3-メチルイミダゾ[1,2-a]ピリジン(0.10g、0.39mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.13g、0.39mmol)、CuI(14.76mg、0.08mmol)およびPd(PPh3)2Cl2(27.20mg、0.04mmol)の撹拌混合物に、TEA(23.53mg、0.23mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配:30分以内で5%-40%、検出器:UV 254/220nm;RT:30分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[3-メチルイミダゾ[1,2-a]ピリジン-7-イル]エチニル)ピラゾール-4-カルボキサミド(67.4mg、37%)をオフホワイトの固体として得た。MS ESI C24H27N7O3[M+H]+についての計算値462.22、実測値462.15;1H NMR(400 MHz,DMSO-d6)δ 8.38(s,1H),7.69-7.29(m,3H),7.03(d,J=7.0Hz,1H),6.90-6.48(m,3H),6.28-6.17(m,1H),5.79-5.61(m,1H),5.35-5.12(m,1H),4.52-4.35(m,1H),4.11-3.68(m,2H),3.62-3.42(m,2H),3.31(s,3H),2.94(t,J=5.2Hz,3H),2.68-2.55(m,1H),2.52-2.48(m,3H),2.36-2.21(m,1H).
実施例76:3-[2-[3-(ジフルオロメチル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の1-(ジフルオロメチル)-5-フルオロ-6-ヨード-1,3-ベンゾジアゾール(0.10g、0.32mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.11g、0.32mmol)、Pd(PPh3)2Cl2(22.49mg、0.03mmol)およびCuI(12.21mg、0.06mmol)の撹拌溶液に、TEA(0.97g、0.96mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Sun-Fire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で30Bから60B、210/254nm;RT:5.55分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[3-(ジフルオロメチル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド;ギ酸(0.79g、44%)を白色固体として得た。MS ESI C24H24F3N7O3[M+H]+についての計算値516.19、実測値516.15;1H NMR(400 MHz,CDCl3)δ 8.31(s,1H),7.91-7.88(m,1H),7.62(d,J=9.4Hz,1H),7.43(t,J=60.0Hz,1H),7.08(brs,1H),6.53-6.40(m,2H),5.75-5.72(m,1H),5.57-5.27(m,1H),4.62-4.41(m,1H),4.13-4.02(m,2H),3.92-3.90(m,1H),3.53-3.42(m,1H),3.39(s,3H),3.09-3.03(m,4H),2.75-2.68(m,1H),2.36-2.31(m,1H).
実施例77:3-[2-[1-(ジフルオロメチル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:1-(ジフルオロメチル)-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール
EA(300.00mL)中の5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール(30.00g、114.49mmol)およびK2CO3(47.47g、343.48mmol)の撹拌混合物に、2-(フルオロスルホニル)酢酸(30.58g、171.74mmol)を室温で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中のEA(20-80%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いるPrep-SFCによって精製した:カラム:Chiralpak ig、5×25cm、10μm、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:200mL/分、勾配:30%B;220nm、RT1:4.68分;RT2:6.32分;注入体積:6mL;ランの数:33。所望の生成物を含有する分画を合わせ、濃縮して、1-(ジフルオロメチル)-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(9.9g、26%)を淡黄色固体として得た。MS ESI C8H4F3IN2[M+H]+についての計算値312.94、実測値312.90;1H NMR(400 MHz,CDCl3)δ 8.24(d,J=5.5Hz,1H),8.10(s,1H),7.39(d,J=7.2Hz,1H),7.34(t,J=60.0Hz,1H).
ステップ2:3-[2-[1-(ジフルオロメチル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(60.00mL)中の1-(ジフルオロメチル)-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(2.82g、9.05mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(3.00g、9.05mmol)、Pd(PPh3)2Cl2(0.64g、0.90mmol)およびCuI(0.34g、1.81mmol)の撹拌混合物に、TEA(2.75g、27.16mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を水(200mL)で希釈し、EA(3×200mL)で抽出した。合わせた有機層をブライン(3×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Sun-Fire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(10mmoL/L NH4HCO3)、移動相B:ACN、流量:100mL/分、勾配:30分で25Bから40B;220/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[1-(ジフルオロメチル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(1.85g、39%)を白色固体として得た。MS ESI C24H24F3N7O3[M+H]+についての計算値516.19、実測値516.10;1H NMR(400 MHz,CDCl3)δ 8.28(brs,1H),8.10(brs,1H),7.47-7.40(m,1H),7.34(s,1H),7.05-6.69(m,1H),6.31-6.33(m,2H),5.73-5.69(m,1H),5.63-5.25(m,2H),4.51-4.42(m,1H),4.23-3.84(m,3H),3.63-3.41(m,1H),3.37(s,3H),3.07-2.98(m,4H),2.76-2.68(m,1H),2.42-2.30(m,1H).
実施例78:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:1-(tert-ブチル)2-メチル(2R,4R)-4-((tert-ブチルジフェニルシリル)オキシ)ピロリジン-1,2-ジカルボキシレート
DMF(80.00mL)中の1-(tert-ブチル)2-メチル(2R,4R)-4-ヒドロキシピロリジン-1,2-ジカルボキシレート(8.00g、32.62mmol)およびイミダゾール(4.44g、65.23mmol)の撹拌溶液に、tert-ブチル(クロロ)ジフェニルシラン(13.45g、48.93mmol)を0℃で30分間にわたって添加した。反応混合物を室温で16時間撹拌した。得られた混合物を水(400mL)で希釈し、EA(3×300mL)で抽出した。合わせた有機層をブライン(5×500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EA(6/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-(tert-ブチル)2-メチル(2R,4R)-4-((tert-ブチルジフェニルシリル)オキシ)ピロリジン-1,2-ジカルボキシレート(14.20g、90%)を無色油状物として得た。MS ESI C27H37NO5Si[M+H]+についての計算値484.24、実測値484.25。
ステップ2:tert-ブチル(2R,4R)-4-[(tert-ブチルジフェニルシリル)オキシ]-2-(ヒドロキシメチル)ピロリジン-1-カルボキシレート
THF(300.00mL)中の1-(tert-ブチル)2-メチル(2R,4R)-4-((tert-ブチルジフェニルシリル)オキシ)ピロリジン-1,2-ジカルボキシレート(30.00g、62.02mmol)の撹拌溶液に、LiBH4(6.08g、0.28mol)を窒素雰囲気下、0℃で小分けにして添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。得られた混合物を0℃にてHCl(1M)でpH5に酸性化し、次いで、飽和NaHCO3(水溶液)でpH8に塩基性化した。得られた混合物をEA(4×500mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EA(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4R)-4-[(tert-ブチルジフェニルシリル)オキシ]-2-(ヒドロキシメチル)ピロリジン-1-カルボキシレート(24.00g、85%)を淡黄色油状物として得た。MS ESI C26H37NO4Si[M+H]+についての計算値456.25、実測値456.30。
ステップ3:tert-ブチル(2R,4R)-4-[(tert-ブチルジフェニルシリル)オキシ]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
THF(18mL)中のNaH(0.20g、8.33mmol)の懸濁液に、THF(64.00mL)中のtert-ブチル(2R,4R)-4-[(tert-ブチルジフェニルシリル)オキシ]-2-(ヒドロキシメチル)ピロリジン-1-カルボキシレート(2.50g、5.49mmol)の溶液を、窒素雰囲気下、0℃でゆっくり添加した。0℃で1時間撹拌した後、上記混合物にCH3I(1.17g、8.23mmol)を0℃で滴下した。反応混合物を室温でさらに3時間撹拌した。得られた混合物を水(60mL)で希釈し、次いでEA(3×30mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(2R,4R)-4-[(tert-ブチルジフェニルシリル)オキシ]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(2.30g、89%)を淡黄色固体として得た。MS ESI C27H39NO4Si[M+H]+についての計算値470.26、実測値470.30。
ステップ4:tert-ブチル(2R,4R)-4-ヒドロキシ-2-(メトキシメチル)ピロリジン-1-カルボキシレート
THF(375.00mL)中のtert-ブチル(2R,4R)-4-[(tert-ブチルジフェニルシリル)オキシ]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(46.30g、98.57mmol)の撹拌溶液に、テトラ-n-ブチルアンモニウムフルオリド(THF中で1M)(146.70mL、0.14mol)を0℃で添加した。反応混合物を室温で3時間撹拌した。得られた混合物を水(1L)で希釈し、EA(3×500mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EA(3/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4R)-4-ヒドロキシ-2-(メトキシメチル)ピロリジン-1-カルボキシレート(16.60g、73%)を淡黄色油状物として得た。MS ESI C11H21NO4[M+H]+についての計算値232.15、実測値232.20。
ステップ5:tert-ブチル(2R)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
THF(40.00mL)中の3,5-ジブロモ-1H-ピラゾール-4-カルボニトリル(2.00g、7.97mmol)、tert-ブチル(2R,4R)-4-ヒドロキシ-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.84g、7.97mmol)およびトリフェニルホスフィン(3.14g、11.95mmol)の撹拌溶液に、ジイソプロピルアゾジカルボキシレート(2.42g、11.95mmol)をアルゴン雰囲気下、0℃で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を水(300mL)で希釈した。得られた混合物をEtOAc(3×200mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.50g、94%)を暗黄色固体として得た。MS ESI C15H20Br2N4O3[M+H-100]+についての計算値361.99、363.99、365.99、実測値362.10、364.10、366.10。
ステップ6:tert-ブチル(2S,4R)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.15mmol)の撹拌溶液に、CH3NH2(2.98mL、5.96mmol)を窒素雰囲気下、室温で添加した。反応混合物を窒素雰囲気下、50℃で16時間撹拌した。得られた混合物を水(30mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、PE/EA(3/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2S,4R)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.67g、35%)をオフホワイトの固体として得た。MS ESI C16H24BrN5O3[M+H-100]+についての計算値314.11、316.11、実測値314.10、316.10。
ステップ7:(2R,4S)-4-[3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DCM(300.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(20.30g、49.00mmol)の撹拌溶液に、Boc2O(20.97mL、98.01mmol)、DMAP(0.60g、4.90mmol)およびEt3N(20.43mL、0.14mol)を窒素雰囲気下、0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を水(3×200mL)で希釈し、DCM(3×200mL)で抽出した。合わせた有機層をブライン(3×100mL)で洗浄した。有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EA(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、(2R,4S)-4-[3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24.00g、95%)をオフホワイトの固体として得た。MS ESI C21H32BrN5O5[M+H]+についての計算値514.16、516.16、実測値514.15、516.15;1H NMR(400 MHz,CDCl3)δ 4.94-4.90(m,1H),4.23-4.19(m,1H),3.75-3.66(m,3H),3.44-3.40(m,1H),3.36(s,3H),3.25(s,3H),2.62-2.58(m,1H),2.41-2.19(m,1H),1.48(s,18H).
ステップ8:tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMF(240.00mL)中の(2R,4S)-4-[3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24.00g、46.65mmol)、CuI(1.78g、9.33mmol)、Pd(PPh3)2Cl2(3.27g、4.67mmol)およびトリメチルシリルアセチレン(19.78mL、0.20mol)の撹拌混合物に、TEA(19.45mL、0.19mol)を添加した。反応混合物を窒素で3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(500mL)で希釈し、EA(4×500mL)で抽出した。合わせた有機層をブライン(2×500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、濾液を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24.00g、96%)を褐色固体として得た。MS ESI C26H41N5O5Si[M+H]+についての計算値532.29、実測値532.40;1H NMR(400 MHz,CDCl3)δ 4.93-4.89(m,1H),4.23-4.17(m,1H),3.68-3.52(m,3H),3.42-3.37(m,1H),3.35-3.33(m,3H),3.25-3.20(m,3H),2.63-2.58(m,1H),2.33-2.13(m,1H),1.46(s,18H),0.27(s,9H).
ステップ9:tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
THF(200.00mL)中のtert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24.00g、45.14mmol)の撹拌溶液に、TBAF(67.70mL、67.70mmol、THF中で1M)を0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(500mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(2×500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.40g、83%)をオフホワイトの固体として得た。MS ESI C23H33N5O5[M+H]+についての計算値460.25、実測値460.40;1H NMR(400 MHz,CDCl3)δ 4.93-4.89(m,1H),4.22-4.18(m,1H),3.84-3.46(m,3H),3.42-3.37(m,1H),3.37-3.31(m,4H),3.24(s,3H),2.62-2.59(m,1H),2.28-2.24(m,1H),1.46(s,18H).
ステップ10:tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMSO(30.00mL)およびEtOH(150.00mL)中のtert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.40g、37.86mmol)の撹拌溶液に、0.5M NaOH(87.09mL、43.54mmol)およびH2O2(10.26mL、0.13mol)を0℃で添加した。反応混合物を0℃で0.5時間撹拌した。次いで、反応混合物を室温まで温め、室温でさらに0.5時間撹拌した。得られた混合物を水(500mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE/EA(1/2)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.20g、95%)をオフホワイトの固体として得た。MS ESI C23H35N5O6[M+H]+についての計算値478.26、実測値478.25;1H NMR(300 MHz,CDCl3)6.80-6.74(m,1H),5.69-5.62(m,1H),5.04-5.00(m,1H),4.23-4.19(m,1H),3.75-3.67(m,3H),3.49-3.42(m,1H),3.39-3.32(m,3H),3.14(s,3H),2.72-2.60(m,1H),2.32-2.21(m,1H),1.62-1.31(m,18H).
ステップ11:3-エチニル-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩
DCM(170.00mL)中のtert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.20g、36.02mmol)の撹拌混合物に、HCl(180.08mL、0.72mol、EA中で4M)を添加した。反応混合物をアルゴン雰囲気下、室温で1時間撹拌した。得られた混合物を濃縮し、乾燥させて、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(12.50g、粗製)をオフホワイトの固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C13H21Cl2N5O2[M+H-2HCl]+についての計算値278.15、実測値278.05。
ステップ12:3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
THF(250.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(12.50g、35.69mmol)およびK2CO3(172mL、0.43mol、2.5M)の撹拌混合物に、塩化アクリロイル(2.89g、32.15mmol)をアルゴン雰囲気下、0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を水(500mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(11.10g、84%)をオフホワイトの固体として得た。MS ESI C16H21N5O3[M+H]+についての計算値332.16、実測値332.20;1H NMR(400 MHz,CDCl3)δ 6.76(s,1H),6.60-6.36(m,2H),5.74-5.68(m,1H),5.50-5.20(m,2H),4.55-4.39(m,1H),4.06-3.83(m,3H),3.53-3.40(m,2H),3.36-3.35(m,3H),3.03-2.99(m,3H),2.68-2.60(m,1H),2.37-2.23(m,1H).
ステップ13:N-シクロプロピル-3,5-ジフルオロ-2-ニトロアニリン
EtOH(45.00mL)中の1,3,5-トリフルオロ-2-ニトロベンゼン(4.50g、25.41mmol)の撹拌溶液に、アミノシクロプロパン(2.90g、50.82mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を0℃で1時間撹拌した。得られた混合物を水(100mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-シクロプロピル-3,5-ジフルオロ-2-ニトロアニリン(4.11g、85%)を黄色固体として得た。1H NMR(400 MHz,CDCl3)δ 7.64(s,1H),6.80-6.74(m,1H),6.30-6.27(m,1H),2.59-2.54(m,1H),1.01-0.83(m,2H),0.76-0.61(m,2H).
ステップ14:N-シクロプロピル-3,5-ジフルオロ-4-ヨード-2-ニトロアニリン
メタンスルホン酸(45.00mL)中のN-シクロプロピル-3,5-ジフルオロ-2-ニトロアニリン(4.11g、19.19mmol)の撹拌混合物に、NIS(4.53g、20.15mmol)を0℃で小分けにして添加した。反応混合物を室温で2時間撹拌した。得られた混合物を0℃にて氷/水(100mL)でクエンチした。得られた混合物を飽和NaOHでpH8に塩基性化し、EA(3×100mL)で抽出した。合わせた有機層をブライン(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EA(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-シクロプロピル-3,5-ジフルオロ-4-ヨード-2-ニトロアニリン(4.50g、69%)黄色固体を得た。1H NMR(400 MHz,CDCl3)δ 7.53(s,1H),6.90-6.88(m,1H),2.57-2.54(m,1H),1.07-0.85(m,2H),0.83-0.58(m,2H).
ステップ15:N1-シクロプロピル-3,5-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン
EtOH(44.00mL)およびH2O(8.80mL)中のN-シクロプロピル-3,5-ジフルオロ-4-ヨード-2-ニトロアニリン(4.40g、12.94mmol)およびNH4Cl(2.77g、51.76mmol)の撹拌混合物に、Fe(2.89g、51.76mmol)を添加した。反応混合物を70℃で6時間撹拌した。得られた混合物を水(150mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、N1-シクロプロピル-3,5-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン(3.30g、粗製)を褐色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C9H9F2IN2[M+H]+についての計算値310.98、実測値311.00;1H NMR(300 MHz,CDCl3)δ 6.68-6.61(m,1H),2.50-2.41(m,1H),0.89-0.73(m,2H),0.78-0.51(m,2H).
ステップ16:1-シクロプロピル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール
MeOH(33.00mL)中のN1-シクロプロピル-3,5-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン(3.30g、10.64mmol)の撹拌溶液に、オルトギ酸トリメチル(3.39g、31.92mmol)を窒素雰囲気下、室温で添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を、PE/EA(1/2)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(1.70g、50%)を黄色固体として得た。MS ESI C10H7F2IN2[M+H]+についての計算値320.96、実測値321.00;1H NMR(300 MHz,CDCl3)δ 7.91(s,1H),7.22-7.18(m,1H),3.41-3.36(m,1H),1.31-1.02(m,4H).
ステップ17:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(15.00mL)中の1-シクロプロピル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.97g、3.02mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(1.00g、3.02mmol)、Pd(PPh3)2Cl2(0.21g、0.30mmol)およびCuI(0.11g、0.60mmol)の撹拌溶液に、TEA(0.92g、9.05mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で40分間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いる逆相フラッシュによってさらに精製した:カラム:C18シリカゲル、移動相:水中のACN(10mmol/L NH3HCO3)、30分で10%から50%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.51g、33%)を白色固体として得た。MS ESI C26H27F2N7O3[M+H]+についての計算値524.21、実測値524.35;1H NMR(300 MHz,CDCl3)δ 7.99(s,1H),7.30-7.12(m,2H),6.83(brs,1H),6.67-6.32(m,2H),5.84-5.73(m,1H),5.64-5.12(m,2H),4.71-4.38(m,1H),4.25-3.84(m,3H),3.60-3.33(m,5H),3.20-3.08(m,3H),2.86-2.70(m,1H),2.37-2.31(m,1H),1.40-0.89(m,4H).
実施例79:3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(25.00mL)中の3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(2.50g、6.49mmol)、6-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(1.79g、6.49mmol)、Pd(PPh3)2Cl2(0.46g、0.65mmol)およびCuI(0.25g、1.29mmol)の撹拌混合物に、TEA(2.71mL、19.46mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を水(200mL)で希釈し、EA(3×200mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中の5%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:100mL/分、勾配:30分で15Bから45B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(1.54g、44%)をオフホワイトの固体として得た。MS ESI C24H23F4N7O3[M+H]+についての計算値534.18、実測値534.15;1H NMR(400 MHz,DMSO-d6):δ 8.35(s,1H),7.96(s,1H),7.71(d,J=9.7Hz,1H),7.49(s,1H),6.81-6.55(m,3H),6.20(dd,J=16.7,2.3Hz,1H),5.78-5.68(m,1H),5.31-5.21(m,1H),4.83-4.37(m,2H),4.28-4.24(m,1H),4.03-3.98(m,2H),3.85(s,3H),3.02-2.94(m,3H),2.76-2.54(m,1H),2.38-2.31(m,1H).
実施例80:3-[2-(1-エチル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(48.00mL)中の3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(2.40g、6.22mmol)および1-エチル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(1.81g、6.24mmol)の撹拌混合物に、Pd(PPh3)2Cl2(0.44g、0.62mmol)、CuI(0.24g、1.24mmol)およびTEA(1.89g、18.68mmol)をアルゴン雰囲気下、10分間にわたって滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を水(300mL)で希釈し、EA(3×200mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、MeOH/DCM(0-3%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3(10mmol/L)、30分で5%から41%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(1.50g、43%)をオフホワイトの固体として得た。MS ESI C25H25F4N7O3[M+H]+についての計算値548.20、実測値548.10;1H NMR(300 MHz,DMSO-d6)δ 8.41(s,1H),7.96(d,J=6.3Hz,1H),7.76(d,J=9.8Hz,1H),7.50(s,1H),6.97-6.53(m,3H),6.33-6.10(m,1H),5.74(d,J=10.2Hz,1H),5.25(d,J=6.7Hz,1H),4.87-4.42(m,2H),4.29-4.25(m,3H),4.11-3.76(m,2H),3.14-2.89(m,3H),2.81-2.58(m,1H),2.44-2.27(m,1H),1.42(t,J=7.2Hz,3H).
実施例81:3-[2-[1-(ジフルオロメチル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(2.00mL)中の1-[(3S,5R)-5-[(1,1-ジフルオロエトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-エチニル-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、0.78mmol)、1-(ジフルオロメチル)-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.25g、0.78mmol)、Pd(PPh3)2Cl2(57.32mg、0.08mmol)およびCuI(31.11mg、0.16mmol)の撹拌混合物に、TEA(0.25g、2.45mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、MeOH/DCM(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮した。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Sun-Fire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(10mmoL/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:30分で25Bから40B;220/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[1-(ジフルオロメチル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.33g、75%)を白色固体として得た。MS ESI C24H21F6N7O3[M+H]+についての計算値570.16、実測値570.05;1H NMR(400 MHz,DMSO-d6)δ 8.73(s,1H),8.18-7.82(m,2H),7.81-7.80(m,1H),7.48(s,1H),6.76-6.38(m,3H),6.21-6.16(m,1H),5.83-5.61(m,1H),5.27-5.22(m,1H),4.78-4.50(m,1H),4.44-4.40(m,1H),4.30-4.20(m,1H),4.06-3.93(m,2H),2.97-2.96(m,3H),2.72-2.63(m,1H),2.38-2.33(m,1H).
実施例82:3-[2-(6-クロロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-クロロ-N-メチル-2-ニトロアニリン
EtOH(350.00mL)中の4-クロロ-2-フルオロ-1-ニトロベンゼン(35.00g、199.38mmol)の撹拌溶液に、メチルアミン(61.92g、598.15mmol、エタノール中で30%)をN2雰囲気下、0℃で滴下した。反応混合物を0℃で3時間撹拌した。得られた混合物を0℃にて水(300mL)でクエンチした。沈殿した固体を濾過によって回収し、水(3x300mL)で洗浄した。濾過ケーキを乾燥させて、5-クロロ-N-メチル-2-ニトロアニリン(36g、96%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C7H7ClN2O2[M-H]-についての計算値185.02、187.02、実測値185.00、187.00;1H NMR(400 MHz,CDCl3)δ 8.12-8.07(m,2H),6.83(d,J=2.2Hz,1H),6.61(dd,J=9.1,2.1Hz,1H),3.02(d,J=5.1Hz,3H).
ステップ2:5-クロロ-4-ヨード-N-メチル-2-ニトロアニリン
CH3COOH(420.00mL)中の5-クロロ-N-メチル-2-ニトロアニリン(42.00g、225.08mmol)の撹拌混合物に、NIS(50.64g、225.08mmol)を室温で添加した。反応混合物を50℃で3時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を水(400mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層を水(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-40%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-4-ヨード-N-メチル-2-ニトロアニリン(70g、99%)を橙色固体として得た。MS ESI C7H6ClIN2O2[M-H]-についての計算値310.92、312.92、実測値310.85、312.85;1H NMR(400 MHz,CDCl3)δ 8.74-8.52(m,1H),7.99(brs,1H),7.00(d,J=1.8Hz,1H),3.03(d,J=4.7Hz,3H).
ステップ3:5-クロロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン
EtOH(650.00mL)およびH2O(130.00mL)中の5-クロロ-4-ヨード-N-メチル-2-ニトロアニリン(65.00g、208.01mmol)およびNH4Cl(55.63g、1040.03mmol)の撹拌混合物に、Fe(46.46g、832.02mmol)を添加した。反応混合物を75℃で2時間撹拌した。得られた混合物を冷却し、濾過し、濾過ケーキをEA(2×100mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(500mL)で希釈し、EA(3×600mL)で抽出した。合わせた有機層をブライン(2×400mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を濃縮し、乾燥させて、5-クロロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(60g、粗製)を褐色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C7H8ClIN2[M-H]-についての計算値280.94、282.94、実測値281.00、283.00;1H NMR(400 MHz,CDCl3)δ 7.11(s,1H),6.70(s,1H),3.25(brs,3H),2.84(s,3H).
ステップ4:6-クロロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール
MeOH(280.00mL)中の5-クロロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(27.80g、98.40mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(18.87mL、147.61mmol)を添加した。反応混合物をアルゴン雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-クロロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(28.1g、93%)を褐色固体として得た。MS ESI C9H8ClIN2[M+H]+についての計算値306.94、実測値307.30;1H NMR(400 MHz,DMSO-d6)δ 8.06(s,1H),7.87(s,1H),3.71(s,3H),2.52(s,3H)
ステップ5:3-[2-(6-クロロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(20.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(2.00g、6.03mmol)、6-クロロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(1.85g、6.04mmol)、Pd(PPh3)2Cl2(0.42g、0.60mmol)およびCuI(0.23g、1.21mmol)の撹拌混合物に、TEA(2.52mL、24.87mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相A:ACN、B:水(10mmol/L NH4HCO3)、30分で10%から40%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(1.79g、58%)を白色固体として得た。ESI C25H28ClN7O3[M+H]+についての計算値510.19、実測値510.15;1H NMR(400 MHz,DMSO-d6)δ 7.85(d,J=1.5Hz,2H),7.51(s,1H),6.86(s,1H),6.78-6.54(m,2H),6.17-5.96(m,1H),5.69-5.45(m,1H),5.27-5.03(m,1H),4.52-4.41(m,1H),4.04-3.95(m,1H),3.89-3.65(m,1H),3.75(s,3H),3.61-3.56(m,1H),3.52-3.42(m,1H),3.33-3.30(m,3H),3.00-2.93(m,3H),2.64-2.58(m,1H),2.54(s,3H),2.29-2.12(m,1H).
実施例83:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(2-メチルキノリン-7-イル)エチニル]ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、0.9mmol)、7-ブロモ-2-メチルキノリン(0.20g、0.91mmol)、Pd(PPh3)2Cl2(63.54mg、0.09mmol)およびCuI(34.48mg、0.18mmol)の撹拌混合物に、TEA(0.27g、2.72mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相ACN、水(10mmol/L NH4HCO3)、30分で10%から40%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(2-メチルキノリン-7-イル)エチニル]ピラゾール-4-カルボキサミド(0.15g、35%)を白色固体として得た。MS ESI C26H28N6O3[M+H]+についての計算値473.20、実測値473.25;1H NMR(300 MHz,DMSO-d6)δ 8.28(d,J=8.5Hz,1H),8.10(s,1H),7.98(d,J=8.5Hz,1H),7.63(d,J=8.4Hz,1H),7.47(d,J=8.4Hz,1H),7.36(s,1H),6.86(s,1H),6.72-6.67(m,1H),6.64-6.52(m,1H),6.16(d,J=16.6Hz,1H),5.68(d,J=10.2Hz,1H),5.25(d,J=7.5Hz,1H),4.47(d,J=39.4Hz,1H),4.02-3.96(m,1H),3.86(d,J=6.7Hz,1H),3.64-3.55(m,1H),3.53-3.40(m,1H),3.30(d,J=5.2Hz,3H),2.94-2.75(m,3H),2.69-2.65(m,4H),2.33-2.30(m,1H).
実施例84:3-[2-(4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(3.00mL)中の4,6-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.23g、0.78mmol)、3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.30g、0.78mmol)、Pd(PPh3)2Cl2(54.90mg、0.08mmol)、CuI(29.79mg、0.16mmol)の撹拌混合物に、TEA(0.24g、2.34mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-4%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6.0分で30Bから60B、210/254nm;RT:5.58。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(4,6-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(53.0mg、12%)を白色固体として得た。MS ESI C24H22F5N7O3[M+H]+についての計算値552.17、実測値551.90;1H NMR(400 MHz,CDCl3)δ 7.90(s,1H),7.10-6.94(m,2H),6.84(s,1H),6.42(d,J=6.1Hz,2H),5.75(t,J=6.1Hz,1H),5.38-5.35(m,2H),4.74-4.58(m,2H),4.23-4.01(m,3H),3.85(s,3H),3.03(s,3H),2.89-2.87(m,1H),2.37-2.34(m,1H).
実施例85:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(3.00mL)中の1-エチル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(96.00mg、0.31mmol)および3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.12g、0.31mmol)の撹拌溶液に、Pd(PPh3)2Cl2(21.87mg、0.03mmol)、CuI(11.87mg、0.06mmol)およびTEA(94.60mg、0.94mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のNH4HCO3、30分で5%から70%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(64mg、36%)をオフホワイトの固体として得た。MS ESI C25H24F5N7O3[M+H]+についての計算値566.19、実測値566.15;1H NMR(400 MHz,CDCl3)δ 8.10(s,1H),7.05(d,J=8.3Hz,2H),6.52-6.42(m,2H),5.77(t,J=6.1Hz,1H),5.53-5.16(m,2H),4.71-4.58(m,2H),4.30-4.03(m,5H),3.05(s,3H),2.90-2.85(m,1H),2.39-2.35(m,1H),1.59(t,J=7.3Hz,3H).
実施例86:3-[2-(6-フルオロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(4.5mL)中の3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.39mmol)、5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール(0.10g、0.39mmol)、Pd(PPh3)2Cl2(27.32mg、0.04mmol)、CuI(14.83mg、0.08mmol)の撹拌混合物に、TEA(0.12g、1.17mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis HILIC OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で35Bから70B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(33.3mg、16%)をオフホワイトの固体として得た。MS ESI C23H21F4N7O3[M+H]+についての計算値520.16、実測値520.10;1H NMR(400 MHz,CDCl3)δ 8.15(s,1H),7.82(s,1H),7.42(s,1H),7.12(s,1H),6.86(d,J=6.1Hz,1H),6.53-6.33(m,2H),5.76(dd,J=7.3,4.9Hz,1H),5.40-5.32(m,2H),4.71-4.55(m,2H),4.19-3.92(m,3H),3.03(d,J=5.9Hz,3H),2.97-2.73(m,1H),2.39-2.35(m,1H).
実施例87:3-[2-(6-クロロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(1.50mL、19.38mmol)中の3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.39mmol)、5-クロロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(0.11g、0.39mmol)、Pd(PPh3)2Cl2(27.32mg、0.04mmol)およびCuI(14.83mg、0.08mmol)の撹拌混合物に、TEA(0.16mL、1.17mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の4%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で40Bから60B、210/254nm;RT:5.56分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S,5R)-1-(プロパ-2-エノイル)-5-[(トリフルオロメトキシ)メチル]ピロリジン-3-イル]ピラゾール-4-カルボキサミド(77.5mg、35%)をオフホワイトの固体として得た。MS ESI C24H23ClF3N7O3[M+H]+についての計算値550.15、実測値550.10;1H NMR(400 MHz,DMSO-d6)δ 7.72(d,J=37.9Hz,2H),6.88-6.84(m,1H),6.51-6.36(m,2H),5.78-5.76(m,1H),5.42-5.37(m,2H),4.80-4.51(m,2H),4.22-3.97(m,3H),3.05(d,J=5.9Hz,4H),2.94-2.76(m,1H),2.66(brs,3H),2.40-2.35(m,1H).
実施例88:3-[2-(6-クロロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-クロロ-N-メチル-2-ニトロアニリン
EtOH(350.00mL)中の4-クロロ-2-フルオロ-1-ニトロベンゼン(35.00g、199.38mmol)の撹拌溶液に、エタノール中のメチルアミン(61.92g、598.15mmol、エタノール中で30%)をN2雰囲気下、0℃で滴下した。反応混合物を3時間撹拌した。得られた混合物を0℃にて水(300mL)でクエンチした。沈殿した固体を濾過によって回収し、水(3x300mL)で洗浄した。濾過ケーキを乾燥させて、5-クロロ-N-メチル-2-ニトロアニリン(36.00g、96%)を黄色固体として得た。MS ESI C7H7ClN2O2[M-H]-についての計算値185.02、実測値185.00;1H NMR(400 MHz,CDCl3)δ 8.12-8.07(m,2H),6.83(d,J=2.2Hz,1H),6.61(dd,J=9.1,2.1Hz,1H),3.02(d,J=5.1Hz,3H).
ステップ2:5-クロロ-4-ヨード-N-メチル-2-ニトロアニリン
CH3COOH(420.00mL)中の5-クロロ-N-メチル-2-ニトロアニリン(42.00g、225.08mmol)の撹拌混合物に、NIS(50.64g、225.08mmol)を室温で添加した。反応混合物を50℃で3時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を水(400mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-40%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-4-ヨード-N-メチル-2-ニトロアニリン(70g、99%)を橙色固体として得た。MS ESI C7H6ClIN2O2[M-H]-についての計算値310.92、実測値310.85;1H NMR(400 MHz,CDCl3)δ 8.74-8.52(m,1H),7.99(brs,1H),7.00(d,J=1.8Hz,1H),3.03(d,J=4.7Hz,3H).
ステップ3:5-クロロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン
EtOH(650.00mL)およびH2O(130.00mL)中の5-クロロ-4-ヨード-N-メチル-2-ニトロアニリン(65.00g、208.01mmol)およびNH4Cl(55.63g、1040.03mmol)の撹拌混合物に、Fe(46.46g、832.02mmol)を添加した。反応混合物を75℃で2時間撹拌した。得られた混合物を冷却し、濾過し、濾過ケーキをEA(2×100mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(500mL)で希釈し、EA(3×600mL)で抽出した。合わせた有機層をブライン(2×400mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を濃縮し、乾燥させて、5-クロロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(60g、99%)を褐色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C7H8ClIN2[M-H]-についての計算値280.94、実測値281.00;1H NMR(400 MHz,CDCl3)δ 7.11(s,1H),6.70(s,1H),3.25(brs,3H),2.84(s,3H).
ステップ4:6-クロロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール
MeOH(600.00mL)中の5-クロロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(60.00g、212.38mmol)の撹拌溶液に、オルトギ酸トリメチル(33.81g、318.57mmol)を添加した。反応混合物を70℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中のEA(50-100%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-クロロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(65g、90%)を黄色固体として得た。MS ESI C8H6ClIN2[M+H]+についての計算値292.93、実測値292.95;1H NMR(400 MHz,CDCl3)δ 8.29(s,1H),7.83(s,1H),7.54(s,1H),3.81(s,3H).
ステップ5:3-[2-(6-クロロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(5.00mL)中の6-クロロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.33g、1.12mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.37g、1.12mmol)、Pd(PPh3)2Cl2(78.37mg、0.11mmol)およびCuI(42.53mg、0.22mmol)の撹拌混合物に、TEA(0.34g、3.35mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で35Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.21g、38%)を白色固体として得た。MS ESI C24H26ClN7O3[M+H]+についての計算値496.18、実測値496.05;1H NMR(400 MHz,CDCl3)δ 8.10(brs,1H),7.98(brs,1H),7.51(brs,1H),7.18(brs,1H),6.81(brs,1H),6.57-6.35(m,2H),5.79-5.21(m,3H),4.60-4.37(m,1H),4.18-3.77(m,6H),3.57-3.26(m,4H),3.08-3.01(m,3H),2.2.76-71(m,1H),2.34-2.27(m,1H).
実施例89:3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4R)-2-(メトキシメチル)-4-(トシルオキシ)ピロリジン-1-カルボキシレート
DCM(150.00mL)中のtert-ブチル(2R,4R)-4-ヒドロキシ-2-(メトキシメチル)ピロリジン-1-カルボキシレート(15.20g、65.72mmol)、TEA(18.27mL、131.44mmol)およびDMAP(1.21g、9.86mmol)の撹拌溶液に、TsCl(18.79g、98.58mmol)を0℃で添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。得られた混合物を水(80mL)で希釈し、DCM(3×150mL)で抽出した。合わせた有機層をブライン(2×80mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の33%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4R)-2-(メトキシメチル)-4-(トシルオキシ)ピロリジン-1-カルボキシレート(18.5g、73%)を黄色油状物として得た。MS ESI C18H27NO6S[M+H]+についての計算値386.16、実測値386.10;1H NMR(400 MHz,CDCl3)δ 7.88-7.72(m,2H),7.38-7.35(m,2H),5.04-5.48(m,1H),3.99-3.95(m,1H),3.65-3.61(m,2H),3.39-3.26(m,5H),2.46(s,3H),2.25-2.23(m,1H),2.18-2.15(m,1H),1.44(s,9H).
ステップ2:tert-ブチル(2R,4S)-4-(5-アミノ-3-ブロモ-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
ACN(190.00mL)中の3-アミノ-5-ブロモ-2H-ピラゾール-4-カルボニトリル(7.20g、38.50mmol)およびCs2CO3(25.09g、77.01mmol)の混合物に、tert-ブチル(2R,4R)-2-(メトキシメチル)-4-(トシルオキシ)ピロリジン-1-カルボキシレート(17.81g、46.20mmol)を添加した。反応混合物を90℃で4時間撹拌した。得られた混合物を室温まで冷却し、濾過した。濾過ケーキをDCM(3×70mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、PE中の46%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を濃縮した。残渣を、以下の条件を用いる逆相フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、30分で5%から46%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(5-アミノ-3-ブロモ-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(5g、32%)をオフホワイトの固体として得た。MS ESI C15H22BrN5O3[M+H]+についての計算値400.09、402.09、実測値400.15、402.15;1H NMR(400 MHz,CDCl3)δ 4.76-4.73(m,1H),4.53-4.49(m,2H),4.22-4.15(m,1H),3.74-3.69(m,3H),3.41-3.38(m,1H),3.37(s,3H),2.62-2.59(m,1H),2.25-2.21(m,1H),1.46(s,9H).
ステップ3:tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-ホルムアミド-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
(ジエトキシメトキシ)エタン(70.00mL)中のtert-ブチル(2R,4S)-4-(5-アミノ-3-ブロモ-4-シアノ-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.50g、8.74mmol)の混合物に、ベンゼンスルホン酸(0.23g、1.22mmol)を添加した。反応混合物を窒素雰囲気下、150℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を水(50mL)で希釈した。得られた混合物をEA(3×150mL)で抽出した。合わせた有機層をブライン(80mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を濃縮し、乾燥させて、tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-ホルムアミド-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.75g、粗製)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C16H22BrN5O4[M-H]-についての計算値426.09、428.09、実測値426.15、428.15。
ステップ4:tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-(メチルアミノ)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
EtOH(200.00mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-ホルムアミド-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.75g、8.76mmol)の撹拌溶液に、NaBH4(1.56g、41.23mmol)を窒素雰囲気下、0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を0℃にてブラインでクエンチし、EA(3×150mL)で抽出した。合わせた有機層をブライン(70mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の62%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-(メチルアミノ)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.3g、91%)をオフホワイトの固体として得た。MS ESI C16H24BrN5O3[M-H]-についての計算値412.11、414.11、実測値412.20、414.20;1H NMR(400 MHz,CDCl3):4.64-4.61(m,1H),4.43-4.20(m,2H),3.71-3.63(m,3H),3.40-3.37(m,1H),3.36(s,3H),3.21(s,3H),2.62-2.58(m,1H),2.22-2.17(m,1H),1.46(s,9H).
ステップ5:tert-ブチル(2R,4S)-4-[3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DCM(300.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(20.30g、49.00mmol)の撹拌溶液に、Boc2O(20.97mL、98.01mmol)、DMAP(0.60g、4.90mmol)およびEt3N(20.43mL、146.98mol)を窒素雰囲気下、0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を、水(3×200mL)およびブライン(200mL)で洗浄した。有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の39%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24.0g、95%)をオフホワイトの固体として得た。MS ESI C21H32BrN5O5[M+H]+についての計算値516.16、実測値516.15;1H NMR(400 MHz,CDCl3)δ 4.94-4.90(m,1H),4.23-4.19(m,1H),3.75-3.66(m,3H),3.44-3.40(m,1H),3.36(s,3H),3.25(s,3H),2.62-2.58(m,1H),2.41-2.19(m,1H),1.48(s,18 H).
ステップ6:tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMF(240mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24.00g、46.65mmol)、CuI(1.78g、9.33mmol)、Pd(PPh3)2Cl2(3.27g、4.67mmol)およびトリメチルシリルアセチレン(19.78mL、201.39mmol)の撹拌混合物に、TEA(19.45mL、192.26mmol)を室温で添加した。反応混合物を窒素で3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(500mL)で希釈し、EA(4×500mL)で抽出した。合わせた有機層をブライン(2×500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE中の25%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24g、96%)を褐色固体として得た。MS ESI C26H41N5O5Si[M+H]+についての計算値532.29、実測値532.40;1H NMR(400 MHz,CDCl3)δ 4.93-4.89(m,1H),4.23-4.17(m,1H),3.68-3.52(m,3H),3.42-3.37(m,1H),3.35-3.33(m,3H),3.25-3.20(m,3H),2.63-2.58(m,1H),2.33-2.13(m,1H),1.46(s,18H),0.27(s,9H).
ステップ7:tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
THF(200.00mL)中のtert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(24.00g、45.14mmol)の撹拌溶液に、TBAF(67.70mL、67.70mmol、THF中で1M)を0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(500mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(2×500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE中の30%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.4g、83%)をオフホワイトの固体として得た。MS ESI C23H33N5O5[M+H]+についての計算値460.25、実測値460.40;1H NMR(400 MHz,CDCl3)δ 4.93-4.89(m,1H),4.22-4.18(m,1H),3.84-3.46(m,3H),3.42-3.37(m,1H),3.37-3.31(m,4H),3.24(s,3H),2.62-2.59(m,1H),2.28-2.24(m,1H),1.46(s,18H).
ステップ8:tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMSO(30.00mL)およびEtOH(150.00mL)中のtert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.4g、37.86mmol)の撹拌溶液に、0.5M NaOH(87.09mL、43.54mmol)およびH2O2(10.26mL、132.14mmol)を0℃で添加した。反応混合物を0℃で0.5時間、室温で0.5時間撹拌した。得られた混合物を水(500mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE中の65%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.2g、95%)をオフホワイトの固体として得た。MS ESI C23H35N5O6[M+H]+についての計算値478.26、実測値478.25;1H NMR(300 MHz,CDCl3)6.80(brs,1H),5.67(brs,1H),5.04-5.00(m,1H),4.23-4.19(m,1H),3.75-3.67(m,3H),3.49-3.42(m,1H),3.39-3.32(m,3H),3.14(s,3H),2.72-2.60(m,1H),2.32-2.21(m,1H),1.62-1.31(m,18H).
ステップ9:3-エチニル-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩
DCM(170.00mL)中のtert-ブチル(2R,4S)-4-[5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(17.2g、36.02mmol)の撹拌混合物に、HCl(180.08mL、720.32mmol、EA中で4M)を添加した。反応混合物をアルゴン雰囲気下、室温で1時間撹拌した。得られた混合物を濃縮し、乾燥させて、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(12.5g、99%)をオフホワイトの固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C13H21Cl2N5O2[M+H-2HCl]+についての計算値278.15、実測値278.05。
ステップ10:3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
THF(250.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(12.50g、35.69mmol)およびK2CO3(172mL、430mmol、2.5M)の撹拌混合物に、THF(15.00mL)中の塩化アクリロイル((2.91mL、32.15mmol)をアルゴン雰囲気下、0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を水(500mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、MeOH中の5%DCMで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(11.1g、84%)をオフホワイトの固体として得た。MS ESI C16H21N5O3[M+H]+についての計算値332.16、実測値332.20;1H NMR(400 MHz,CDCl3)δ 6.76(s,1H),6.60-6.36(m,2H),5.74-5.68(m,1H),5.50-5.20(m,2H),4.55-4.39(m,1H),4.06-3.83(m,3H),3.53-3.40(m,2H),3.36-3.35(m,3H),3.03-2.99(m,3H),2.68-2.60(m,1H),2.37-2.23(m,1H).
ステップ11:3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(5.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.45g、1.36mmol)および6-クロロ-1-エチル-5-ヨード-1,3-ベンゾジアゾール(0.50g、1.63mmol)の撹拌混合物に、CuI(51.73mg、0.27mmol)、Pd(PPh3)2Cl2(95.32mg、0.14mmol)およびTEA(0.41g、4.07mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、80℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:XBridge Prep C18 OBD Column、5×25cm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配:60分で5Bから55B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.35g、50%)をオフホワイトの固体として得た。MS ESI C25H28ClN7O3[M+H]+についての計算値510.19、実測値510.10;1H NMR(300 MHz,CDCl3)δ 8.02-7.96(m,2H),7.21(s,1H),6.83(d,J=6.2Hz,1H),6.47-6.37(m,2H),5.72(dd,J=8.2,4.2Hz,1H),5.62-5.31(m,2H),4.60-4.56(m,1H),4.28-4.24(m,2H),4.19-4.02(m,2H),3.94-3.89(m,1H),3.42-3.36(m,4H),3.10-3.04(m,3H),2.76-2.73(m,1H),2.46-2.26(m,1H),1.59-1.55(m,3H).
実施例90::3-[2-(6-フルオロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.60mmol)、5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール(0.19g、0.72mmol)、Pd(PPh3)2Cl2(42.36mg、0.06mmol)、CuI(22.99mg、0.12mmol)の撹拌混合物に、TEA(0.18g、1.81mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で5Bから50B、210/254nm;RT:5.75分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(69.60mg、24%)をオフホワイトの固体として得た。MS ESI C23H24FN7O3[M+H]+についての計算値466.19、実測値466.05;1H NMR(400 MHz,CDCl3)δ 11.35(d,J=184.5Hz,1H),8.17(s,1H),7.69(d,J=73.3Hz,1H),7.17(s,1H),6.88-6.70(m,1H),6.57-6.25(m,2H),5.74(d,J=10.9Hz,1H),5.66-5.15(m,2H),4.70-4.38(m,1H),4.15-4.07(m,2H),3.90(d,J=9.2Hz,1H),3.60-3.17(m,5H),3.06-3.01(m,3H),2.76-2.68(m,1H),2.35-2.07(m,1H).
実施例91:3-[2-(6-フルオロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-フルオロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール
MeOH(50.00mL)中の4-フルオロ-5-ヨードベンゼン-1,2-ジアミン(5.00g、19.84mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(3.58g、29.76mmol)を室温で添加した。反応混合物をアルゴン雰囲気下、70℃で3時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、PE中のEA(0-80%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-フルオロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(4.96g、90%)を褐色半固体として得た。MS ESI C8H6FN2[M+H]+についての計算値276.96、実測値276.85;1H NMR(400 MHz,CDCl3)δ 7.89(d,J=5.3Hz,1H),7.30(s,1H),2.64(s,3H).
ステップ2:3-[2-(6-フルオロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(6.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.60mmol)、5-フルオロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(0.18g、0.66mmol)、Pd(PPh3)2Cl2(42.36mg、0.06mmol)およびCuI(22.99mg、0.12mmol)の撹拌溶液に、TEA(0.18g、1.81mmol)をアルゴン雰囲気下、室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で5Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.12g、40%)をオフホワイトの固体として得た。MS ESI C24H26FN7O3[M+H]+についての計算値480.22、実測値480.10;1H NMR(400 MHz,CDCl3)δ 7.67-7.58(m,1H),7.27(d,J=23.5Hz,1H),7.18(s,1H),6.83-6.81(m,1H),6.62-6.35(m,2H),5.78-5.72(m,1H),5.55-5.26(m,2H),4.58-4.45(m,1H),4.18-4.10(m,1H),4.08-3.95(m,1H),3.90-3.85(m,1H),3.45-3.42(m,1H),3.39-3.35(m,3H),3.04-3.01(m,3H),2.79-2.62(m,1H),2.65(s,3H),2.45-2.29(m,1H).
実施例92:3-[2-(6-クロロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:4-クロロ-5-ヨードベンゼン-1,2-ジアミン
EtOH(10.50mL)およびH2O(1.50mL)中の5-クロロ-4-ヨード-2-ニトロアニリン(3.00g、10.05mmol)およびFe(0.22g、4.01mmol)の撹拌混合物に、NH4Cl(0.27g、5.01mmol)を室温で添加した。反応混合物を75℃で2時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOH(3x200mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(300mL)で希釈し、EtOAc(3×200mL)で抽出した。合わせた有機層をブライン(2×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、EA中の50%PEで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4-クロロ-5-ヨードベンゼン-1,2-ジアミン(1.13g、41%)を淡黄色固体として得た。MS ESI C6H6ClIN2[M+H]+についての計算値268.93、実測値268.90;1H NMR(400 MHz,CDCl3)δ 7.11(s,1H),6.80(s,1H).
ステップ2:5-クロロ-6-ヨード-3H-1,3-ベンゾジアゾール
MeOH(15.00mL)中の4-クロロ-5-ヨードベンゼン-1,2-ジアミン(1.00g、3.73mmol)の撹拌混合物に、オルトギ酸トリメチル(0.59g、5.59mmol)を添加した。反応混合物を75℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の5%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-6-ヨード-3H-1,3-ベンゾジアゾール(0.66g、63%)を淡褐色固体として得た。MS ESI C7H4ClIN2[M+H]+についての計算値278.91、実測値278.95。
ステップ3:3-[2-(6-クロロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.24g、0.72mmol)、5-クロロ-6-ヨード-3H-1,3-ベンゾジアゾール(0.20g、0.72mmol)、CuI(27.20mg、0.14mmol)およびPd(PPh3)2Cl2(50.41mg、0.07mmol)の撹拌混合物に、TEA(0.40mL、2.88mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の6%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で35Bから70B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、57%)を褐色固体として得た。MS ESI C23H24ClN7O3[M+H]+についての計算値482.16、実測値482.05;1H NMR(300 MHz,DMSO-d6)δ 12.84(s,1H),8.41(s,1H),7.91(d,J=37.6Hz,2H),7.52(s,1H),7.04-6.49(m,3H),6.18(d,J=16.6Hz,1H),5.87-5.62(m,1H),5.39-5.19(m,1H),4.49-4.45(m,1H),4.07-3.56(m,4H),3.34-3.29(m,3H),2.97-2.94(m,3H),2.56-2.54(m,1H),2.33-2.29(m,1H).
実施例93:3-[2-[6-クロロ-3-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S.5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-クロロ-1-(ジフルオロメチル)-6-ヨード-1,3-ベンゾジアゾールおよび6-クロロ-1-(ジフルオロメチル)-5-ヨード-1,3-ベンゾジアゾール
EA(32.00mL)中の5-クロロ-6-ヨード-3H-1,3-ベンゾジアゾール(3.20g、11.49mmol)およびK2CO3(4.76g、34.47mmol)の撹拌混合物に、ジフルオロ(スルホ)酢酸(2.46g、13.79mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1.5時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中の39%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-SFCによって精製した:カラム:Chiralpak AD-H、5x25cm、5μm、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:200mL/分、勾配:50%B;220nm、RT1:4.98分;RT2:6.49分;注入体積:2.5mL;ランの数:20。所望の生成物を含有するより速いピークを合わせ、濃縮して、5-クロロ-1-(ジフルオロメチル)-6-ヨード-1,3-ベンゾジアゾール(0.97g、24%)をオフホワイトの固体として得た。MS ESI C8H4ClF2IN2[M+H]+についての計算値328.91、実測値328.95;1H NMR(400 MHz,CDCl3)δ 8.14(s,1H),8.09(s,1H),7.96(s,1H),7.28(t,J=60.1Hz,1H).
所望の生成物を含有するより遅いピークを合わせ、濃縮して、6-クロロ-1-(ジフルオロメチル)-5-ヨード-1,3-ベンゾジアゾール(0.99g、24%)をオフホワイトの固体として得た。MS ESI C8H4ClF2IN2[M+H]+についての計算値328.91、実測値328.95;1H NMR(400 MHz,CDCl3)δ 8.35(s,1H),8.08(s,1H),7.78(s,1H),7.29(t,J=60.1Hz,1H).
ステップ2:3-[2-[6-クロロ-3-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S.5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(6.00mL)中の5-クロロ-1-(ジフルオロメチル)-6-ヨード-1,3-ベンゾジアゾール(0.3g、0.91mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.33g、1.01mmol)、CuI(34.79mg、0.18mmol)およびPd(PPh3)2Cl2(64.10mg、0.09mmol)の撹拌混合物に、TEA(0.38mL、3.76mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で35Bから70B;210nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[6-クロロ-3-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、62%)をオフホワイトの固体として得た。MS ESI C24H24ClF2N7O3[M+H]+についての計算値532.16、実測値532.20;1H NMR(400 MHz,CDCl3)δ 8.22(s,1H),7.98(d,J=8.0Hz,1H),7.93(d,J=2.0Hz,1H),7.34(s,1H),7.16(s,1H),6.59-6.36(m,2H),5.78-5.70(m,1H),5.61-5.26(m,2H),4.65-4.35(m,1H),4.15-3.96(m,2H),3.94-3.83(m,1H),3.55-3.42(m,1H),3.39(d,J=5.6Hz,3H),3.05(d,J=14.2Hz,3H),2.78-2.66(m,1H),2.45-2.29(m,1H).
実施例94:3-[2-[6-クロロ-1-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(6.00mL)中の6-クロロ-1-(ジフルオロメチル)-5-ヨード-1,3-ベンゾジアゾール(0.3g、0.91mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.33g、1.01mmol)、CuI(34.79mg、0.18mmol)およびPd(PPh3)2Cl2(64.10mg、0.09mmol)の撹拌混合物に、TEA(0.38mL、3.76mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis HILIC OBD Column、19x150mmx5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で35Bから70B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[6-クロロ-1-(ジフルオロメチル)-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.23g、47%)をオフホワイトの固体として得た。MS ESI C24H24ClF2N7O3[M+H]+についての計算値532.16、実測値532.20;1H NMR(400 MHz,CDCl3)δ 8.33-8.09(m,2H),7.79(s,1H),7.50-7.31(m,1H),7.23-7.06(m,1H),6.57-6.38(m,2H),5.77-5.70(m,1H),5.61-5.25(m,2H),4.63-4.39(m,1H),4.17-4.00(m,2H),3.95-3.85(m,1H),3.55-3.43(m,1H),3.40-3.39(m,3H),3.07-3.04(m,3H),2.79-2.67(m,1H),2.45-2.28(m,1H).
実施例95:3-[2-[6-クロロ-3-(ジフルオロメチル)-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-クロロ-1-(ジフルオロメチル)-6-ヨード-2-メチル-1H-ベンゾ[d]イミダゾールおよび6-クロロ-1-(ジフルオロメチル)-5-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール
EtOAc(5.00mL)中の5-クロロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(0.30g、1.03mmol)およびK2CO3(0.28g、2.05mmol)の撹拌混合物に、ジフルオロ(スルホ)酢酸(0.22g、1.23mmol)を0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物(1.8g)を、以下の条件を用いるPrep-SFCによって精製した:カラム:Chiralpak IG、5x25cm、10μm、移動相A:CO2、移動相B:MeOH(0.1% 2M NH3-MeOH)、流量:200mL/分、勾配:50%B;220nm、RT1:4.1分;RT2:9.07分;注入体積:4.8mL;ランの数:10。所望の生成物を含有するより速いピークを合わせ、濃縮して、6-クロロ-1-(ジフルオロメチル)-5-ヨード-2-メチル1H-ベンゾ[d]イミダゾール(0.82g、35%)を白色固体として得た。1H NMR(300 MHz,CDCl3)δ 8.19(s,1H),7.72(s,1H),7.48-7.00(m,1H),2.71(s,3H).
所望の生成物を含有するより遅いピークを合わせ、濃縮して、5-クロロ-1-(ジフルオロメチル)-6-ヨード-2-メチル-1H-ベンゾ[d]イミダゾール(0.85g、36%)を白色固体として得た。1H NMR(300 MHz,CDCl3)δ 8.07(s,1H),7.82(s,1H),7.45-6.95(m,1H),2.71(s,3H).
ステップ2:3-[2-[6-クロロ-3-(ジフルオロメチル)-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(6.00mL)中の5-クロロ-1-(ジフルオロメチル)-6-ヨード-2-メチル-1,3-ベンゾジアゾール(0.3g、0.88mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.32g、0.96mmol)、CuI(33.36mg、0.18mmol)およびPd(PPh3)2Cl2(61.48mg、0.09mmol)の撹拌混合物に、TEA(0.37mL、3.61mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mmx5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから60B;210nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[6-クロロ-3-(ジフルオロメチル)-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.27g、56%)をオフホワイトの固体として得た。MS ESI C25H26ClF2N7O3[M+H]+についての計算値546.18、実測値546.25;1H NMR(400 MHz,CDCl3)δ 7.91(d,J=8.0Hz,1H),7.78(d,J=1.6Hz,1H),7.16(d,J=17.2Hz,1H),6.59-6.36(m,2H),5.78-5.70(m,1H),5.60-5.20(m,2H),4.62-4.38(m,1H),4.15-3.96(m,2H),3.94-3.86(m,1H),3.55-3.42(m,1H),3.39(d,J=5.2Hz,3H),3.05(d,J=14.4Hz,3H),2.75(s,3H),2.78-2.66(m,1H),2.45-2.28(m,1H).
実施例96:3-[2-[6-クロロ-1-(ジフルオロメチル)-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(6.00mL)中の6-クロロ-1-(ジフルオロメチル)-5-ヨード-2-メチル-1,3-ベンゾジアゾール(0.3g、0.88mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.32g、0.96mmol)、CuI(33.36mg、0.18mmol)およびPd(PPh3)2Cl2(61.48mg、0.09mmol)の撹拌混合物に、TEA(0.37mL、3.61mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mmx5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから60B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-[6-クロロ-1-(ジフルオロメチル)-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.25g、52%)をオフホワイトの固体として得た。MS ESI C25H26ClF2N7O3[M+H]+についての計算値546.18、実測値546.25;1H NMR(400 MHz,CDCl3)δ 7.99(d,J=5.2Hz,1H),7.69(s,1H),7.14(s,1H),6.59-6.36(m,2H),5.77-5.69(m,1H),5.59-5.26(m,2H),4.63-4.36(m,1H),4.17-3.99(m,2H),3.95-3.85(m,1H),3.55-3.42(m,1H),3.39(d,J=5.2Hz,3H),3.05(d,J=15.2Hz,3H),2.74(s,3H),2.74-2.66(m,1H),2.44-2.28(m,1H).
実施例97:3-[2-(4,6-ジフルオロ-1-メチル-1,2,3-ベンゾトリアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:4,6-ジフルオロ-5-ヨード-1-メチル-1H-ベンゾ[d][1,2,3]トリアゾール
濃HCl(1.58mL、19.01mmol)およびH2O(6.32mL)中の3,5-ジフルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(0.54g、1.90mmol)の撹拌溶液に、水(2mL)中のNaNO2(0.16g、2.39mmol)を0℃で滴下した。反応混合物を0℃で3時間撹拌した。得られた混合物を、飽和KOH(0.5M)でpH7に中和した。得られた混合物を水(3×5mL)で洗浄した。沈殿した固体を濾過によって回収し、水(3×10mL)で洗浄し、乾燥させて、4,6-ジフルオロ-5-ヨード-1-メチル-1H-ベンゾ[d][1,2,3]トリアゾール(0.36g、64%)を褐色固体として得た。MS ESI C7H4F2IN3[M+H]+についての計算値295.94、実測値296.00;1H NMR(400 MHz,CDCl3)δ 7.11(s,1H),4.31(s,3H).
ステップ2:3-[2-(4,6-ジフルオロ-1-メチル-1,2,3-ベンゾトリアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL、25.84mmol)中の4,6-ジフルオロ-5-ヨード-1-メチル-1H-ベンゾ[d][1,2,3]トリアゾール(0.2g、0.67mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.18g、0.56mmol)の撹拌溶液に、Pd(PPh3)2Cl2(47.58mg、0.07mmol)、CuI(25.82mg、0.13mmol)およびTEA(0.20g、2.03mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗製物を得た。粗生成物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:XBridge Prep C18 OBD Column、19x150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配:30分で5Bから35B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(4,6-ジフルオロ-1-メチル-1,2,3-ベンゾトリアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(55.5mg、16%)を白色固体として得た。MS ESI C23H24F2N8O3[M+H]+についての計算値499.19、実測値499.10;1H NMR(300 MHz,CDCl3)δ 7.13(d,J=7.4Hz,1H),6.45(d,J=8.8Hz,2H),5.73(m,1H),5.59-5.22(m,2H),4.58-4.45(m,1H),4.32(s,3H),4.11-4.09(m,2H),3.92-3.89(m,1H),3.50-3.48(m,1H),3.39(d,J=3.9Hz,3H),3.06(d,J=11.3Hz,3H),2.72-3.69(m,1H),2.33-2.30(m,1H).
実施例98:3-[2-(6-クロロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(0.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、5-クロロ-6-ヨード-2-メチル-3H-1,3-ベンゾジアゾール(0.13g、0.45mmol)、Pd(PPh3)2Cl2(31.77mg、0.05mmol)およびCuI(17.24mg、0.09mmol)の撹拌溶液に、TEA(0.14g、1.36mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で30Bから60B、210/254nm;RT:5.8分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-2-メチル-1H-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.11g、50%)を白色固体として得た。MS ESI C24H26ClN7O3[M+H]+についての計算値496.20、実測値496.10;1H NMR(400 MHz,DMSO-d6)δ 12.67(s,1H),7.82(s,1H),7.70(s,1H),7.53(s,1H),6.86(s,1H),6.76-6.46(m,2H),6.17-5.86(m,1H),5.70-5.46(m,1H),5.28-4.96(m,1H),4.59-4.34(m,1H),4.06-3.74(m,2H),3.65-3.40(m,2H),3.31(s,3H),2.96(t,J=5.1Hz,3H),2.66-2.57(m,1H),2.51(s,3H),2.36-2.27(m,1H).
実施例99:3-[2-(6-クロロ-1-エチル-4-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-クロロ-N-エチル-3-フルオロ-2-ニトロアニリン
EtOH(90.00mL)中の5-クロロ-1,3-ジフルオロ-2-ニトロベンゼン(4.50g、23.25mmol)の撹拌溶液に、EtOH中のエチルアミン(13.27mL、294.33mmol、30%)をアルゴン雰囲気下、0℃で滴下した。反応混合物を0℃でさらに1時間撹拌した。得られた混合物を水(100mL)で希釈し、濾過し、濾過ケーキを水(3×100mL)で洗浄した。濾過ケーキを乾燥させて、5-クロロ-N-エチル-3-フルオロ-2-ニトロアニリン(5.0g、98%)を赤色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C8H8ClFN2O2[M+H]+についての計算値219.03、実測値219.10。
ステップ2:5-クロロ-N-エチル-3-フルオロ-4-ヨード-2-ニトロアニリン
AcOH(100.00mL)中の5-クロロ-N-エチル-3-フルオロ-2-ニトロアニリン(5.00g、22.87mmol)の撹拌溶液に、NIS(5.40g、24.00mmol)を添加した。反応混合物をアルゴン雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、飽和NaHCO3(水溶液)でpH7に中和した。得られた混合物をEtOAc(3×500mL)で抽出した。合わせた有機層を水(3×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の15%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-N-エチル-3-フルオロ-4-ヨード-2-ニトロアニリン(7.5g、95%)を赤色固体として得た。MS ESI C8H7ClFIN2O2[M-H]-についての計算値342.92、実測値342.90;1H NMR(400 MHz,CDCl3)δ 7.12(s,1H),6.85(d,J=2.0Hz,1H),3.35-3.23(m,2H),1.37(t,J=7.2Hz,3H).
ステップ3:5-クロロ-N1-エチル-3-フルオロ-4-ヨードベンゼン-1,2-ジアミン
EtOH(80.00mL)およびH2O(20.00mL)中の5-クロロ-N-エチル-3-フルオロ-4-ヨード-2-ニトロアニリン(7.30g、21.19mmol)およびNH4Cl(5.67g、106.00mmol)の撹拌混合物に、Fe(4.73g、84.70mmol)を添加した。反応混合物をアルゴン雰囲気下、70℃で1時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOAc(3x400mL)で洗浄した。合わせた有機層を水(4×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、5-クロロ-N1-エチル-3-フルオロ-4-ヨードベンゼン-1,2-ジアミン(6.8g、96%)を赤色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C8H9ClFIN2[M+H]+についての計算値314.95、実測値314.90。
ステップ4:6-クロロ-1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾール
MeOH(60.00mL)中の5-クロロ-N1-エチル-3-フルオロ-4-ヨードベンゼン-1,2-ジアミン(3.00g、9.54mmol)の撹拌溶液に、オルトギ酸トリメチル(3.13mL、28.61mmol)を添加した。反応混合物をアルゴン雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1/2)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-クロロ-1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾール(2.3g、74%)を緑色固体として得た。MS ESI C9H7ClFIN2[M+H]+についての計算値324.93、実測値324.95;1H NMR(400 MHz,CDCl3)δ 7.91(s,1H),7.44(d,J=1.2Hz,1H),4.22(q,J=7.2Hz,2H),1.57(t,J=7.2Hz,3H).
ステップ5:3-[2-(6-クロロ-1-エチル-4-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(6.00mL)中の6-クロロ-1-エチル-4-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.3g、0.92mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.34g、1.02mmol)、CuI(35.21mg、0.19mmol)およびPd(PPh3)2Cl2(64.89mg、0.09mmol)の撹拌混合物に、TEA(0.39mL、3.81mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.75分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-エチル-4-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、42%)をオフホワイトの固体として得た。MS ESI C25H27ClFN7O3[M+H]+についての計算値528.18、実測値528.25;1H NMR(400 MHz,CDCl3)δ 7.98(s,1H),7.35(s,1H),7.14(s,1H),6.57-6.36(m,2H),5.82-5.67(m,1H),5.56-5.25(m,2H),4.63-4.39(m,1H),4.31-4.19(m,2H),4.19-4.07(m,1H),4.07-3.97(m,1H),4.00-3.87(m,1H),3.55-3.42(m,1H),3.39(d,J=5.2Hz,3H),3.04(d,J=15.6Hz,3H),2.79-2.67(m,1H),2.43-2.26(m,1H),1.58(t,J=7.2Hz,3H).
実施例100:3-[2-(6-クロロ-4-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(5.00mL)中の6-クロロ-4-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.5g、1.13mmol、70%)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.41g、1.24mmol)、CuI(42.94mg、0.23mmol)およびPd(PPh3)2Cl2(79.12mg、0.11mmol)の撹拌混合物に、TEA(0.50mL、4.94mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm×5μm 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:8分で25Bから45B;254/210nm;RT:6.5分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-4-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、34%)をオフホワイトの固体として得た。MS ESI C24H25ClFN7O3[M+H]+についての計算値514.17、実測値514.20;1H NMR(400 MHz,CDCl3)δ 8.07(s,1H),7.43(s,1H),7.11(s,1H),6.80(s,1H),6.46(d,J=11.2Hz,2H),5.73(d,J=9.2Hz,1H),5.61-5.19(m,2H),4.66-4.37(m,1H),4.20-3.99(m,2H),3.92(s,4H),3.55-3.43(m,1H),3.39(d,J=4.8Hz,3H),3.06(d,J-15.6Hz,3H),2.77-2.67(m,1H),2.39-2.30(m,1H).
実施例101:3-[2-(6,7-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:2,3-ジフルオロ-N-メチル-6-ニトロアニリン
ACN(30.00mL)中の1,2,3-トリフルオロ-4-ニトロベンゼン(3.00g、16.94mmol)の撹拌混合物に、CH3NH2HCl(1.20g、17.78mmol)およびDIEA(14.75mL)を室温で添加した。反応混合物を窒素雰囲気下、70℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(100mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(2×150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、2,3-ジフルオロ-N-メチル-6-ニトロアニリン(3g、94%)を淡黄色固体として得、これをさらに精製することなく次のステップに直接使用した。1H NMR(300 MHz,CDCl3)δ 7.99-7.95(m,1H),6.46-6.44(m,1H),3.29(d,J=7.5Hz,3H).
ステップ2:2,3-ジフルオロ-4-ヨード-N-メチル-6-ニトロアニリン
AcOH(30.00mL)中の2,3-ジフルオロ-N-メチル-6-ニトロアニリン(3.23g、17.16mmol)の撹拌混合物に、NIS(4.06g、18.04mmol)を添加した。反応混合物を窒素雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、飽和NaHCO3(水溶液)でpH7に中和した。得られた混合物を水(150mL)で希釈し、EA(3×150mL)で抽出した。合わせた有機層をブライン(2×150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の25%DCMで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2,3-ジフルオロ-4-ヨード-N-メチル-6-ニトロアニリン(3.66g、67%)を黄色固体として得た。MS ESI C7H5F2IN2O2[M+H]+についての計算値315.03、実測値315.00;1H NMR(300 MHz,CDCl3)δ 8.38(dd,J=6.3,2.4Hz,1H),7.98(s,1H),3.29(dd,J=7.5,5.5Hz,3H).
ステップ3:5,6-ジフルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン
EtOH(8.75ml)および水(1.25ml)中の2,3-ジフルオロ-4-ヨード-N-メチル-6-ニトロアニリン(0.50g、1.59mmol)およびNH4Cl(0.43g、7.96mmol)の撹拌混合物に、Fe(0.36g、6.36mmol)を添加した。反応混合物を75℃で16時間撹拌した。得られた混合物を冷却し、濾過し、濾過ケーキをEtOH(3×150mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(100mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、5,6-ジフルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(0.22g、48%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C7H7F2IN2[M+H]+についての計算値284.96、実測値285.00。
ステップ4:6,7-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール
MeOH(2.20mL)中の5,6-ジフルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(0.22g、0.77mmol)の撹拌溶液に、オルトギ酸トリメチル(0.12g、1.16mmol)を添加した。反応混合物をアルゴン雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6,7-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.20g、87%)を淡褐色固体として得た。MS ESI C8H5F2IN2[M+H]+についての計算値295.04、実測値294.95;1H NMR(300 MHz,CDCl3)δ 8.44(s,1H),8.11-8.04(m,1H),4.14(s,3H).
ステップ5:3-[2-(6,7-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、6,7-ジフルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.13g、0.45mmol)、CuI(17.24mg、0.09mmol)およびPd(PPh3)2Cl2(31.77mg、0.04mmol)の撹拌混合物に、TEA(0.19mL、1.86mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で10Bから50B、254nm;RT:5.85分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6,7-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(75.0mg、33%)を白色固体として得た。MS ESI C24H25F2N7O3[M+H]+についての計算値498.20、実測値498.15;1H NMR(300 MHz,DMSO-d6)δ 8.33(s,1H),7.80(d,J=5.2Hz,1H),7.45(s,1H),6.81-6.49(m,3H),6.16(d,J=16.5Hz,1H),5.82-5.53(m,1H),5.25-5.20(m,1H),4.46-4.32(m,1H),3.99-3.95(m,4H),3.92-3.75(m,1H),3.47-3.42(m,2H),3.31(s,3H),2.95-2.91(m,3H),2.46-2.43(m,1H),2.31-2.29(m,1H).
実施例102:3-[2-(1,3-ベンゾチアゾール-2-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(6.00mL)中の2-ヨード-1,3-ベンゾチアゾール(0.3g、1.15mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.42g、1.26mmol)、CuI(43.77mg、0.23mmol)およびPd(PPh3)2Cl2(80.65mg、0.12mmol)の撹拌混合物に、TEA(0.48mL、4.74mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN、40分で15%から45%の勾配、検出器、UV254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1,3-ベンゾチアゾール-2-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、56%)を淡黄色固体として得た。MS ESI C23H24N6O3S[M+H]+についての計算値465.16、実測値465.25;1H NMR(400 MHz,CDCl3)δ 8.15-8.08(m,1H),7.95-7.88(m,1H),7.62-7.46(m,2H),6.91-6.82(m,1H),6.76(s,1H),6.60-6.38(m,2H),5.82-5.73(m,1H),5.61-5.21(m,2H),4.64-4.40(m,1H),4.16-3.98(m,2H),3.95-3.89(m,1H),3.55-3.44(m,1H),3.39(d,J=4.8Hz,3H),3.06(m,3H),2.77-2.63(m,1H),2.46-2.30(m,1H).
実施例103:3-[2-(1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(3.00mL)中の5-ブロモ-1,3-ベンゾチアゾール(64.60mg、0.30mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、0.30mmol)、Pd(PPh3)2Cl2(21.18mg、0.03mmol)およびCuI(11.49mg、0.06mmol)の撹拌混合物に、TEA(91.61mg、0.91mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、アルゴン雰囲気下、70℃で1時間撹拌した。得られた混合物を室温まで冷却し、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3、移動相B:ACN、流量:20mL/分、勾配:5.8分で10Bから50B、210/254nm;RT:5.59分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.05g、32%)をオフホワイトの固体として得た。MS ESI C23H24N6O3S[M+H]+についての計算値465.16、実測値465.05;1H NMR(300 MHz,CDCl3)δ 9.09(s,1H),8.34(s,1H),7.99(d,J=8.3Hz,1H),7.63(d,J=8.4Hz,1H),6.82(s,2H),6.49-6.40(m,2H),5.73(dd,J=8.2,4.4Hz,1H),5.53(s,2H),4.58-4.45(m,1H),4.08-4.05(m,2H),3.92-3.89(m,1H),3.56-3.42(m,1H),3.39-3.36(m,3H),3.06-3.03(m,3H),2.73-2.70(m,1H),2.33-2.30(m,1H).
実施例104:3-(2-[イミダゾ[1,2-a]ピリジン-2-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、0.90mmol)、2-ブロモイミダゾ[1,2-a]ピリジン(0.18g、0.91mmol)、Pd(PPh3)2Cl2(63.54mg、0.09mmol)およびCuI(34.48mg、0.18mmol)の撹拌混合物に、TEA(0.27g、2.72mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:5.8分で5Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[イミダゾ[1,2-a]ピリジン-2-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(17.90mg、4%)を橙色固体として得た。MS ESI C23H25N7O3[M+H]+についての計算値448.20、実測値448.10;1H NMR(400 MHz,CDCl3)δ 8.12(d,J=6.8Hz,1H),7.87(s,1H),7.62(d,J=9.2Hz,1H),7.26(d,J=8.3Hz,1H),7.01(s,1H),6.89(d,J=6.8Hz,1H),6.82-6.64(m,1H),6.59-6.36(m,2H),5.73-5.70(m,1H),5.57-5.24(m,2H),4.65-4.38(m,1H),4.17-3.97(m,2H),3.92-3.88(m,1H),3.53-3.44(m,1H),3.39(d,J=4.1Hz,3H),3.06-3.01(m,3H),2.72-2.66(m,1H),2.34-2.29(m,1H).
実施例105:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((3-シアノイミダゾ[1,2-a]ピリジン-2-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:2-ブロモ-3-ヨードイミダゾ[1,2-a]ピリジン
ACN(16.00mL)中の2-ブロモイミダゾ[1,2-a]ピリジン(1.60g、8.12mmol)の撹拌溶液に、NIS(1.92g、8.53mmol)を窒素雰囲気下、室温で小分けにして添加した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、2-ブロモ-3-ヨードイミダゾ[1,2-a]ピリジン(2.3g、87%)を褐色固体として得た。MS ESI C7H4BrIN2[M+H]+についての計算値322.86、324.86、実測値322.85、324.85;1H NMR(400 MHz,CDCl3)δ 8.10-8.07(m,1H),7.61-7.52(m,1H),7.31-7.23(m,1H),6.98-6.96(m,1H).
ステップ2:2-ブロモイミダゾ[1,2-a]ピリジン-3-カルボニトリル
NMP(10mL)中の2-ブロモ-3-ヨードイミダゾ[1,2-a]ピリジン(1.00g、3.09mmol)の撹拌溶液に、シアン化第一銅(0.31g、3.46mmol)を窒素雰囲気下、室温で小分けにして添加した。反応混合物を70℃で24時間撹拌した。得られた混合物を、室温にてedta二ナトリウム塩二水和物(120.00mL、0.32mol)の添加によってクエンチし、EtOAc(150mL)で希釈した。得られた混合物を室温でさらに2時間撹拌した。得られた混合物をEtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×80mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-ブロモイミダゾ[1,2-a]ピリジン-3-カルボニトリル(0.14g、20%)をオフホワイトの固体として得た。MS ESI C8H4BrN3[M+H]+についての計算値221.96、223.96、実測値222.00、224.00;1H NMR(400 MHz,CDCl3)δ 8.33-8.30(m,1H),7.75-7.71(m,1H),7.53-7.48(m,1H),7.18-7.15(m,1H).
ステップ3:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((3-シアノイミダゾ[1,2-a]ピリジン-2-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.19g、0.57mmol)、2-ブロモイミダゾ[1,2-a]ピリジン-3-カルボニトリル(0.13g、0.57mmol)、CuI(0.02g、0.12mmol)およびPd(PPh3)2Cl2(0.04g、0.05mmol)の撹拌混合物に、TEA(0.24mL、1.72mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19x150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((3-シアノイミダゾ[1,2-a]ピリジン-2-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(87.8mg、32%)をオフホワイトの固体として得た。MS ESI C24H24N8O3[M+H]+についての計算値473.20、実測値473.15;1H NMR(400 MHz,DMSO-d6)δ 8.68-8.65(m,1H),7.86-7.82(m,1H),7.69-7.64(m,1H),7.49(s,1H),7.33-7.29(m,1H),6.97-6.40(m,3H),6.18-7.15(m,1H),5.69-5.66(m,1H),5.28-5.23(m,1H),4.48-4.44(m,1H),4.13-3.67(m,2H),3.66-3.41(m,2H),3.31(s,3H),2.94(t,J=5.6Hz,3H),2.64-2.61(m,1H),2.34-2.25(m,1H).
実施例106:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[[1,2,4]トリアゾロ[1,5-a]ピリジン-6-イル]エチニル)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の6-ヨード-[1,2,4]トリアゾロ[1,5-a]ピリジン(0.15g、0.61mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.22g、0.67mmol)、CuI(23.32mg、0.12mmol)およびPd(PPh3)2Cl2(42.97mg、0.06mmol)の撹拌混合物に、TEA(0.26mL、2.52mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.8分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[[1,2,4]トリアゾロ[1,5-a]ピリジン-6-イル]エチニル)ピラゾール-4-カルボキサミド(0.11g、40%)をオフホワイトの固体として得た。MS ESI C22H24N8O3[M+H]+についての計算値449.20、実測値449.30;1H NMR(400 MHz,CDCl3)δ 8.86(s,1H),8.44(s,1H),7.85-7.78(m,1H),7.65(dd,J=9.2,1.6Hz,1H),6.64(s,1H),6.59-6.37(m,2H),5.80-5.69(m,1H),5.61-5.23(m,2H),4.66-4.35(m,1H),4.14-3.95(m,2H),3.95-3.89(m,1H),3.55-3.42(m,1H),3.39(d,J=5.2Hz,3H),3.06(d,J=14.6Hz,3H),2.76-2.64(m,1H),2.46-2.29(m,1H).
実施例107:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[[1,2,4]トリアゾロ[1,5-a]ピリジン-7-イル]エチニル)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の7-ブロモ-[1,2,4]トリアゾロ[1,5-a]ピリジン(0.15g、0.76mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.27g、0.83mmol)、CuI(28.85mg、0.15mmol)およびPd(PPh3)2Cl2(53.17mg、0.08mmol)の撹拌混合物に、TEA(0.32mL、3.12mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物をEtOAc(300mL)で希釈し、水(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Atlantis HILIC OBD Column、19×150mmx5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.8分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-(2-[[1,2,4]トリアゾロ[1,5-a]ピリジン-7-イル]エチニル)ピラゾール-4-カルボキサミド(0.14g、40%)をオフホワイトの固体として得た。MS ESI C22H24N8O3[M+H]+についての計算値449.20、実測値449.10;1H NMR(400 MHz,CDCl3)δ 8.62(d,J=7.2Hz,1H),8.44(s,1H),7.98(s,1H),7.16(dd,J=7.2,1.2Hz,1H),6.88-6.57(m,1H),6.53-6.38(m,2H),5.78-5.69(m,1H),5.62-5.22(m,2H),4.68-4.36(m,1H),4.14-4.03(m,2H),4.02-3.88(m,1H),3.57-3.43(m,1H),3.39(d,J=5.2Hz,3H),3.06(d,J=14.4Hz,3H),2.76-2.64(m,1H),2.46-2.29(m,1H).
実施例108:3-[2-(1,3-ベンゾオキサゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(0.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.12g、0.36mmol)、5-ブロモ-1,3-ベンゾオキサゾール(0.14g、0.72mmol)、Pd(PPh3)2Cl2(25.42mg、0.04mmol)およびCuI(13.79mg、0.07mmol)の撹拌溶液に、TEA(0.11g、1.08mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で35Bから55B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1,3-ベンゾオキサゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(14.50mg、9%)を白色固体として得た。MS ESI C23H24N6O4[M+H]+についての計算値449.20、実測値449.15;1H NMR(300 MHz,CDCl3)δ 8.16(s,1H),7.99(s,1H),7.60(d,J=1.2Hz,2H),6.78(d,J=6.3Hz,2H),6.57-6.26(m,2H),5.70-5.51(m,1H),5.49-4.45(m,2H),4.56-4.45(m,1H),4.15-3.96(m,2H),3.90-3.67(m,1H),3.59-3.28(m,4H),3.04-2.87(m,3H),2.78-2.59(m,1H),2.34-2.12(m,1H).
実施例109:5-[(シクロプロピルメチル)アミノ]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.15mmol)の撹拌混合物に、1-シクロプロピルメタンアミン(0.46g、6.46mmol)を添加した。反応混合物を50℃で16時間撹拌した。得られた混合物を水(50mL)に注ぎ、EtOAc(3×50mL)で抽出した。合わせた有機層を水(4×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.0g、99%)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C19H28BrN5O3[M+H-56]+についての計算値398.14、400.14.実測値398.20、400.20;1H NMR(400 MHz,CDCl3)δ 6.40(s,1H),4.99-4.93(m,1H),4.72(s,1H),4.26-4.14(m,2H),3.78-3.56(m,4H),3.47-3.30(m,2H),2.59(s,1H),2.25(s,1H),2.06(s,1H),1.28(m,9H),1.20-1.09(m,1H),0.72-0.58(m,2H),0.32(m,2H).
ステップ2:tert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
EtOH(10.00mL)およびDMSO(2.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.20mmol)の撹拌溶液に、NaOH(水中で0.5M)(0.10mL、2.53mmol)およびH2O2(1.71mL、22.01mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層を水(2×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(20-70%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.80g、77%)を黄色固体として得た。MS ESI C19H30BrN5O4[M+H]+についての計算値472.15、474.15、実測値472.10、474.10;1H NMR(400 MHz,CDCl3)δ 6.69(d,J=100.4Hz,2H),6.06-5.29(m,1H),5.13(brs,1H),4.24-4.04(m,1H),3.79-3.62(m,3H),3.48-3.28(m,3H),3.05-3.02(m,2H),2.59-2.56(m,1H),2.32-1.98(m,1H),1.59-1.38(m,9H),1.37-1.01(m,2H),0.58-0.52(m,2H),0.29-0.25(m,2H).
ステップ3:3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩
DCM(8.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.80g、1.69mmol)の撹拌溶液に、HCl(EA中で4M)(4.00mL)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.70g、99%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C14H22BrN5O2[M+H]+についての計算値372.10、374.10、実測値372.15、374.15;1H NMR(400 MHz,CD3OD)δ 5.51-5.32(m,1H),4.36-4.25(m,2H),3.81-3.68(m,3H),3.67-3.55(m,1H),3.47(s,3H),3.18-3.05(m,2H),2.41-2.39(m,2H),2.04(s,2H),1.20-1.18(m,1H),1.16-1.02(m,1H),0.63-0.52(m,2H),0.32-0.24(m,2H).
ステップ4:1-[(2R,4S)-4-[4-(1-アミノエテニル)-3-ブロモ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-イル]プロパ-2-エン-1-オン
DCM(4.00mL)中の3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.35g、0.86mmol)およびDIEA(0.33g、2.57mmol)の撹拌溶液に、塩化アクリロイル(69.75mg、0.77mmol)をN2雰囲気下、0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を水(8mL)でクエンチし、EA(3×10mL)で抽出した。合わせた有機層を水(20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-[(2R,4S)-4-[4-(1-アミノエテニル)-3-ブロモ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-イル]プロパ-2-エン-1-オン(0.20g、55%)を白色固体として得た。MS ESI C17H24BrN5O3[M+H]+についての計算値426.11、428.11、実測値426.20、428.20;1H NMR(400 MHz,CDCl3)δ 6.57(s,1H),6.42-6.41(m,2H),5.73-5.71(m,1H),5.43-5.30(m,1H),4.54-4.50(m,1H),3.98(d,J=8.2Hz,2H),3.95-3.80(m,1H),3.52-3.40(m,1H),3.18-3.08(m,4H),3.12-2.98(m,2H),2.62-2.20(m,2H),1.27-1.12(m,2H),0.68-0.54(m,2H),0.36-0.24(m,2H).
ステップ5:5-[(シクロプロピルメチル)アミノ]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.35mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.15g、0.70mmol)、CuI(13.40mg、0.07mmol)およびPd(PPh3)2Cl2(24.70mg、0.04mmol)の撹拌溶液に、TEA(0.11g、1.06mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X-Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で10Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、5-[(シクロプロピルメチル)アミノ]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(43.4mg、22%)を白色固体として得た。MS ESI C28H31F2N7O3[M+H]+についての計算値552.25、実測値552.20;1H NMR(400 MHz,CDCl3)δ 8.05(s,1H),7.04(d,J=8.2Hz,2H),6.66-6.34(m,2H),5.72-5.69(m,1H),5.54-5.17(m,2H),4.64-4.36(m,1H),4.25-4.24(m,2H),4.09-4.06(m,2H),3.92-3.91(m,1H),3.58-3.44(m,1H),3.39(d,J=5.0Hz,3H),3.22-2.90(m,2H),2.84-2.63(m,1H),2.41-2.30(m,1H),1.71-1.59(m,4H),1.25-1.06(m,1H),0.65-0.61(m,2H),0.33-0.29(m,2H).
実施例110:3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.15mmol)の撹拌混合物に、N-アミノエチルモルホリン(0.84g、6.46mmol)を添加した。反応混合物を50℃で16時間撹拌した。得られた混合物を水(100mL)に注ぎ、EA(3×150mL)で抽出した。合わせた有機層をブライン(2×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.1g、99%)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C21H33BrN6O4[M+H]+についての計算値513.17、515.17、実測値513.25、515.25;1H NMR(400 MHz,CDCl3)δ 6.37(s,1H),5.32(s,1H),5.02-5.00(m,1H),4.73(s,1H),4.16(d,J=7.2Hz,1H),3.83-3.56(m,7H),3.52-3.40(m,2H),2.89-2.83(m,3H),2.79-2.50(m,2H),2.40-2.38(m,3H),2.33-2.19(m,1H),2.10-1.99(m,1H),1.32-1.29(m,9H).
ステップ2:tert-ブチル(2R,4S)-4-(3-ブロモ-4-ホルミル-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
EtOH(10.00mL)およびDMSO(2.00mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-4-メチル-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.95g、1.89mmol)の撹拌溶液に、NaOH(水中で0.5M)(86.97mg、2.17mmol)およびH2O2(1.47mL、43.17mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(200mL)で希釈し、EA(3×150mL)で抽出した。合わせた有機層を水(2×200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(50-100%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-ホルミル-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.65g、66%)を白色固体として得た。MS ESI C21H35BrN6O5[M+H]+についての計算値531.19、533.19、実測値531.20、533.20;1H NMR(400 MHz,CDCl3)δ 7.09-6.96(m,1H),6.59(s,1H),5.48(s,1H),5.25-5.03(m,1H),4.16(s,1H),3.78-2.75(m,5H),3.56(s,1H),3.50(s,2H),3.45-3.37(m,1H),3.38-3.34(m,3H),3.31(d,J=8.1Hz,2H),2.64-2.60(m,2H),2.70-2.50(m,3H),2.24-2.21(m,1H),1.79-1.75(m,1H),1.46-1.48(m,9H).
ステップ3:3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-4-カルボキサミド塩酸塩
DCM(6.00mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-4-カルバモイル-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.65g、1.22mmol)の撹拌混合物に、HCl(EA中で4M)(3.00mL)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-4-カルボキサミド塩酸塩(0.60g、99%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C16H27BrN6O3[M+H]+についての計算値431.13、433.13、実測値431.15、433.15;1H NMR(400 MHz,CD3OD)δ 5.51(s,1H),5.42(s,1H),4.35-4.32 m,1H),4.08(d,J=13.0Hz,2H),4.00-3.90(m,2H),3.84-3.81(m,1H),3.77-3.71(m,2H),3.69-3.58(m,4H),3.61-3.53(m,2H),3.47(s,3H),3.41-3.34(m,2H),3.26-3.22(m,2H),2.52-2.34(m,2H),2.04-2.02(m,1H),1.34-1.16(m,1H).
ステップ4:3-[2-[1-(ジフルオロメチル)-4,6-ジフルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル]エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DCM(6.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-4-カルボキサミド塩酸塩(0.60g、1.28mmol)およびDIEA(0.67mL、5.18mmol)の撹拌混合物に、塩化アクリロイル(0.11g、1.15mmol)をN2雰囲気下、0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を水(8mL)でクエンチし、EA(3×20mL)で抽出した。合わせた有機層をブライン(20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-4-カルボキサミド(0.37g、59%)を黄色固体として得た。MS ESI C19H29BrN6O4[M+H]+についての計算値485.14、487.14、実測値485.20、487.20;1H NMR(300 MHz,CDCl3)δ 7.10(s,1H),6.60-6.38(m,2H),5.75-5.72(m,1H),5.39-5.35(m,1H),4.55(d,J=9.2Hz,1H),3.99(d,J=8.3Hz,2H),3.95-3.81(m,1H),3.78-3.74(m,4H),3.49-3.45(m,1H),3.46-3.27(m,5H),2.66-2.64(m,2H),2.70-2.54(m,1H),2.54-2.51(m,4H),2.32-2.19(m,1H),1.30-1.28(m,1H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-4-カルボキサミド(0.19g、0.39mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.16g、0.78mmol)、CuI(14.91mg、0.08mmol)およびPd(PPh3)2Cl2(27.48mg、0.04mmol)の撹拌溶液に、TEA(0.12g、1.17mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X-Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-4-カルボキサミド(84.6mg、35%)を白色固体として得た。MS ESI C30H36F2N8O4[M+H]+についての計算値611.28、実測値611.25;1H NMR(300 MHz,CDCl3)δ 7.94(s,1H),7.15-6.96(m,2H),6.81(d,J=45.9Hz,1H),6.57-6.37(m,2H),5.71-5.68(m,1H),5.50-5.19(m,2H),4.64-4.38(m,1H),4.20-4.16(m,2H),4.15-3.84(m,3H),3.79-3.74(m,4H),3.50-3.47(m,1H),3.37-3.32(m,5H),2.79-2.58(m,3H),2.55-2.51(m,4H),2.43-2.21(m,1H),1.60-1.54(m,3H).
実施例111:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.15mmol)の撹拌混合物に、4-モルホリンプロパンアミン(0.93g、6.46mmol)を室温で滴下した。反応混合物を50℃で16時間撹拌した。得られた混合物を水(100mL)に注ぎ、EA(3×50mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.0g、88%)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C22H35BrN6O4[M+H]+についての計算値526.19、実測値527.25;1H NMR(400 MHz,CDCl3)δ 6.50(s,1H),3.75-3.70(m,5H),3.63-3.58(m,5H),3.38-3.34(m,5H),2.40-2.35(m,8H),2.00-1.75(m,2H),1.46(s,9H).
ステップ2:tert-ブチル(2R,4S)-4-(3-ブロモ-4-カルバモイル-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
EtOH(10.00mL)およびDMSO(2.00mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、1.90mmol)の撹拌溶液に、NaOH(水中で0.5M)(4.36mL、2.18mmol)およびH2O2(0.64g、18.96mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(100mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-カルバモイル-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1g、97%)を黄色固体として得た。MS ESI C22H37BrN6O5[M+H]+についての計算値545.20、547.20、実測値545.25、547.25;1H NMR(400 MHz,CDCl3)δ 6.74(s,1H),6.59(s,1H),6.44(s,1H),4.18(d,J=18.4Hz,1H),3.73-3.69(m,5H),3.49(s,1H),3.42-3.34(m,1H),3.37(s,3H),3.29-3.25(m,2H),2.86-2.82(m,2H),2.47-2.43(m,5H),2.39-2.31(m,1H),2.25-2.18(m,1H),2.08-1.96(m,1H),1.84-1.76(m,2H),1.47(s,9H).
ステップ3:3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド塩酸塩
DCM(10.00mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-4-カルバモイル-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、1.83mmol)の撹拌溶液に、HCl(EA中で4M)(5.00mL)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド塩酸塩(0.8g、91%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C17H29BrN6O3[M+H]+についての計算値445.15、447.15、実測値445.20、447.20;1H NMR(300 MHz,CDCl3)δ 6.37(s,1H),5.57(s,3H),5.30(s,1H),4.99-4.95(m,1H),4.12-4.09(m,1H),3.45-3.42(m,2H),2.90-2.85(m,2H),2.56-2.51(m,1H),2.08-2.05(m,1H),2.07-2.02(m,5H),1.27-1.21(m,10H).
ステップ4:3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド
DCM(10.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド塩酸塩(0.80g、1.66mmol)およびDIEA(0.64g、4.98mmol)の撹拌混合物に、塩化アクリロイル(5.97mL、1.45mmol、DCM中で0.25M)をN2雰囲気下、0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を水(50mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層を水(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド(0.25g、30%)をオフホワイトの固体として得た。MS ESI C20H31BrN6O4[M+H]+についての計算値499.16、実測値499.30;1H NMR(400 MHz,CDCl3)δ 6.83-6.81(m,2H),6.71(s,1H),5.39-5.26(m,2H),5.15-5.12(m,1H),4.53-4.50(m,2H),4.39(s,1H),3.97-3.92(m,4H),3.95-3.78(m,3H),3.66-3.62(m,1H),3.51-3.39(m,3H),3.10-3.08(m,1H),2.25-2.22(m,2H),1.85-1.82(m,4H),1.43-1.41(m,2H),1.25-1.22(m,2H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド
DMF(5.00mL)中の3-ブロモ-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド(0.15g、0.30mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.12g、0.60mmol)、Pd(PPh3)2Cl2(21.08mg、0.03mmol)およびCuI(11.44mg、0.06mmol)の撹拌溶液に、TEA(91.18mg、0.90mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X-Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmoL/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で20Bから50B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-4-カルボキサミド(68mg、36%)をオフホワイトの固体として得た。MS ESI C31H38F2N8O4[M+H]+についての計算値625.30、実測値625.25;1H NMR(300 MHz,CDCl3)δ 7.94(s,1H),7.13-6.93(m,2H),6.63-6.60(m,1H),6.50-6.30(m,2H),5.71-5.68(m,1H),5.50-5.12(m,2H),4.62-4.35(m,1H),4.20-4.18(m,2H),4.10-3.94(m,2H),3.89-3.85(m,1H),3.71-3.68(m,4H),3.53-3.40(m,1H),3.38-3.17(m,5H),3.01-2.63(m,1H),2.46(d,J=6.5Hz,6H),2.30-2.25(m,1H),1.84-1.80(m,2H),1.67(s,3H).
実施例112:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(3S)-3-(3-ブロモ-4-シアノ-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(1.00g、2.380mmol)の撹拌混合物に、N-アミノエチルモルホリン(0.93g、7.14mmol)を室温で滴下した。反応混合物をアルゴン雰囲気下、50℃で16時間撹拌した。得られた混合物を水(30mL)で希釈し、酢酸エチル(5×30mL)で抽出し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(3S)-3-(3-ブロモ-4-シアノ-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート(1g、78%)を淡黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C19H29BrN6O3[M+H]+についての計算値469.15、実測値469.15。
ステップ2:tert-ブチル(3S)-3-(3-ブロモ-4-カルバモイル-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート
EtOH(10.00mL)およびDMSO(2.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.20mmol)の撹拌溶液に、NaOH(水中で0.5M)(0.11mL、2.70mmol)およびH2O2(1.82mL、53.50mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層を水(2×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(20-70%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-(3-ブロモ-4-カルバモイル-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.37g、32%)を黄色固体として得た。MS ESI C21H35BrN6O5[M+H]+についての計算値487.16、489.16、実測値487.15,489.15;1H NMR(400 MHz,CDCl3)δ 6.92(s,1H),6.55(d,J=45.4Hz,1H),5.49(s,1H),5.09-4.81(m,1H),3.92-3.67(m,8H),3.56-3.41(m,1H),3.29-3.27(m,2H),3.00(s,1H),2.59-2.54(m,7H),2.28-2.25(m,1H),1.50-1.47(m,9H),1.29-1.25(m,2H).
ステップ3:3-ブロモ-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩
DCM(4.00mL)中のtert-ブチル(3S)-3-(3-ブロモ-4-カルバモイル-5-[[2-(モルホリン-4-イル)エチル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.36g、0.74mmol)の撹拌溶液に、HCl(EA中で4M)(2.00mL)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.32g、99%)を淡黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C14H23BrN6O2[M+H]+についての計算値387.16、389.16、実測値387.15、389.15;1H NMR(400 MHz,CD3OD)δ 5.51(s,2H),5.45-5.39(m,1H),4.17-3.89(m,3H),3.86-3.69(m,2H),3.73-3.65(m,1H),3.65(d,J=1.9Hz,1H),3.65-3.57(m,1H),3.61-3.54(m,1H),3.57-3.48(m,1H),3.41-3.36(m,2H),3.30-3.18(m,2H),2.70-2.65(m,1H),2.59-2.56(m,1H),2.37-2.31(m,1H),2.06-2.03(m,1H),1.64-1.61(m,1H),1.33-1.16(m,1H).
ステップ4:3-ブロモ-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(4.00mL)中の3-ブロモ-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.32g、0.75mmol)およびDIEA(0.39mL、3.05mmol)の撹拌溶液に、塩化アクリロイル(61.52mg、0.68mmol)をN2雰囲気下、0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を水(10mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層を水(20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.20g、60%)を黄色固体として得た。MS ESI C17H25BrN6O3[M+H]+についての計算値441.12、443.12、実測値441.25、443.25;1H NMR(300 MHz,CDCl3)δ 6.96(d,J=6.1Hz,1H),6.58-6.41(m,1H),6.45-6.36(m,1H),5.79-5.67(m,1H),5.46(s,1H),5.04-4.93(m,1H),4.11-3.83(m,3H),3.88-3.51(s,1H),3.31(d,J=6.0Hz,2H),2.68-2.65(m,2H),2.64-2.62(m,1H),2.55-2.52(m,4H),2.52-2.28(m,1H),1.60-1.57(m,1H),1.49-1.46(m,1H),1.28-1.27(m,1H),1.26-1.24(m,1H),0.93-0.82(m,1H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-ブロモ-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.10g、0.23mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(93.44mg、0.45mmol)、CuI(4.32mg、0.02mmol)、X-Phos Pd G3(19.18mg、0.02mmol)およびX-Phos(10.80mg、0.02mmol)の撹拌混合物に、TEA(68.79mg、0.68mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X-Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[[2-(モルホリン-4-イル)エチル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(30.4mg、23%)を白色固体として得た。MS ESI C28H32F2N8O3[M+H]+についての計算値567.26、実測値567.25;1H NMR(400 MHz,CDCl3)δ 7.96(s,1H),7.21-6.95(m,2H),6.76(d,J=7.0Hz,1H),6.62-6.33(m,2H),5.79-5.65(m,1H),5.44(s,1H),5.10-5.07(m,1H),4.25-4.20(m,2H),4.17-3.86(m,3H),3.78-3.76(m,5H),3.31-3.27(m,2H),2.83-2.27(m,8H),1.60-1.56(m,2H),1.33-1.27(m,1H).
実施例113:3-[2-(6-クロロ-7-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、6-クロロ-7-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.14g、0.45mmol)、CuI(17.24mg、0.09mmol)およびPd(PPh3)2Cl2(31.77mg、0.04mmol)の撹拌混合物に、TEA(0.14g、1.36mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X-Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で20Bから50B。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-7-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(70.1mg、30%)を白色固体として得た。MS ESI C24H25ClFN7O3[M+H]+についての計算値514.17、実測値514.15;1H NMR(300 MHz,CDCl3)δ 7.89(d,J=10.6Hz,2H),7.11(s,1H),6.83(d,J=6.1Hz,1H),6.56-6.35(m,2H),5.72(m,1H),5.61-5.46(m,2H),4.60-4.57(m,1H),4.18-3.88(m,6H),3.41-3.58(m,1H),3.56-3.45(m,3H),3.02-2.98(m,3H),2.81-2.64(m,1H),2.41-2.35(m,1H).
実施例114:3-[2-(1,3-ベンゾオキサゾール-2-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:2-ヨード-1,3-ベンゾオキサゾール
DMF(42.00mL)中のベンゾオキサゾール(1g、8.40mmol)の撹拌溶液に、1,1,1,2,2,3,3,4,4-ノナフルオロ-4-ヨードブタン(1.59mL、9.24mmol)およびナトリウム2-メチルプロパン-2-オレート(0.40g、4.16mmol)を室温で添加した。反応混合物を室温で20分間撹拌した。得られた混合物を水に注ぎ、EA(3×70mL)で抽出した。合わせた有機層をブライン(5×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE中の8%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-ヨード-1,3-ベンゾオキサゾール(1.88g、91%)を白色固体として得た。MS ESI C7H4INO[M+H]+についての計算値245.93、実測値245.95;1H NMR(400 MHz,CDCl3)δ 7.74-7.68(m,1H),7.57-7.52(m,1H),7.35-7.28(m,2H).
ステップ2:3-[2-(1,3-ベンゾオキサゾール-2-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1mL)中の2-ヨード-1,3-ベンゾオキサゾール(0.11g、0.45mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、Pd(PPh3)2Cl2(31.51mg、0.05mmol)およびCuI(17.10mg、0.09mmol)の撹拌混合物に、TEA(0.19mL、1.85mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を水(15mL)で希釈し、EA(3×30mL)で抽出した。合わせた有機層をブライン(5×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.75分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1,3-ベンゾオキサゾール-2-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.07g、36%)をオフホワイトの固体として得た。MS ESI C23H24N6O4[M+H]+についての計算値448.47、実測値448.19;1H NMR(400 MHz,CDCl3)δ 7.81-7.79(m,1H),7.58(d,J=7.6Hz,1H),7.50-7.41(m,2H),6.86(s,1H),6.68-6.44(m,2H),5.76-5.72(m,1H),5.56-5.52(m,2H),4.60-4.58(m,1H),4.41-3.91(m,3H),3.54-3.39(m,4H),3.07(d,J=15.2Hz,3H),2.98-2..65(m,1H),2.37-2.32(m,1H).
実施例115:3-[2-(6-フルオロ-1,3-ベンゾオキサゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-6-フルオロ-1,3-ベンゾオキサゾール
オルトギ酸トリメチル(17.00mL)中の2-アミノ-4-ブロモ-5-フルオロフェノール(1.70g、8.25mmol)の溶液を、150℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中の8%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-6-フルオロ-1,3-ベンゾオキサゾール(1.4g、78%)を淡桃色固体として得た。MS ESI C7H3BrFNO[M+H]+についての計算値215.94、実測値215.95;1H NMR(400 MHz,CDCl3)δ 8.10(s,1H),8.00(d,J=6.3Hz,1H),7.41(d,J=7.4Hz,1H).
ステップ2:3-[2-(6-フルオロ-1,3-ベンゾオキサゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(0.50mL)中の5-ブロモ-6-フルオロ-1,3-ベンゾオキサゾール(0.05g、0.23mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.08g、0.23mmol)、XPhos Pd G3(39.20mg、0.05mmol)、XPhos(22mg、0.05mmol)およびCuI(2.20mg、0.01mmol)の撹拌混合物に、TEA(0.10mL、0.95mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を水(15mL)で希釈し、EA(3×30mL)で抽出した。合わせた有機層を水(5×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.75分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-1,3-ベンゾオキサゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.07g、31%)をオフホワイトの固体として得た。MS ESI C23H23FN6O4[M+H]+についての計算値466.47、実測値466.18;1H NMR(400 MHz,CDCl3)δ 8.16(s,1H),8.01(t,J=16Hz,1H),7.42(d,J=8Hz,1H),7.00(s,1H),6.53-6.40(m,2H),5.75-5.71(m,1H),5.57-5.51(m,1H),5.40-5.31(m,1H),4.59-4.57(m,1H),4.13-4.01(m,2H),3.93-3.90(m,1H),3.53-3.44(m,1H),3.40(d,J=4Hz,3H),3.07-3.03(m,3H),2.76-2.68(m,1H),2.35-2.30(m,1H).
実施例116:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL、0.10mol)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.15mmol)の撹拌溶液に、エタノールアミン(0.39g、6.46mmol)を添加した。反応混合物を50℃で16時間撹拌した。得られた混合物を水(300mL)で希釈し、EtOAc(3×300mL)で抽出し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.95g、粗製)を得、これをさらに精製することなくに次のステップに直接使用した。MS ESI C17H28BrN5O5[M+H]+についての計算値444.12、実測値444.20。
ステップ2:tert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMSO(2.00mL、28.15mmol)およびEtOH(10.00mL、0.17mol)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.95g、2.15mmol)の撹拌溶液に、H2O2(1.67mL、71.68mmol、30%)およびNaOH(4.95mL、2.47mmol、0.5M)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(300mL)で希釈し、EtOAc(3×300mL)で抽出し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(0-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.65g、65%)をオフホワイトの油状物として得た。MS ESI C17H28BrN5O5[M+H]+についての計算値462.13、実測値462.15。
ステップ3:3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(7.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.65g、1.40mmol)の撹拌溶液に、HCl(EA中で4M)(7.73mL、30.93mmol)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.5g、粗製)を得、これをさらに精製することなく次のステップに直接使用した。MS ESI C12H20BrN5O3[M+H-HCl]+についての計算値362.07、実測値362.10。
ステップ4:3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(5.00mL)中の3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.5g、1.38mmol)およびDIEA(0.60mL、4.65mmol)の撹拌混合物に、塩化アクリロイル(5.02mL、1.25mmol)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物をH2O(1mL)でクエンチし、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.55g、95%)をオフホワイトの油状物として得た。MS ESI C15H22BrN5O4[M+H]+についての計算値416.09、実測値416.15;1H NMR(300 MHz,CDCl3)δ 6.73(s,1H),6.57-6.33(m,2H),5.71-5.68(m,1H),5.31(s,2H),4.03-3.81(m,2H),3.68-3.62(m,5H),3.42-3.31(m,4H),3.11-3.08(m,3H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(6.00mL)中の3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.19g、0.45mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.56g、2.73mmol)、CuI(17.39mg、0.09mmol)およびPd(dppf)Cl2CH2Cl2(37.18mg、0.05mmol)の撹拌混合物に、TEA(0.14g、1.36mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、80℃で4時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗製物を得た。粗製物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で5Bから40B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(62.2mg、25%)を白色固体として得た。MS ESI C26H29F2N7O4[M+H]+についての計算値542.22、実測値542.20;1H NMR(300 MHz,DMSO-d6)δ 8.46(s,1H),7.72(d,J=9.2Hz,1H),7.59(s,1H),6.81-6.51(m,3H),6.18(d,J=16.8Hz,1H),5.70-5.65(m,1H),5.34-5.23(m,1H),4.90-4.88(m,1H),4.48(d,J=41.8Hz,1H),4.31(q,J=7.2Hz,2H),4.04-4.01(m,1H),3.86(m,2H),3.61-3.43(m,4H),2.46-2.41(m,1H),2.33-2.30(m,1H),1.42(t,J=7.2Hz,3H).
実施例117:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.15mmol)の撹拌溶液に、エタンアミン2-メトキシ(0.57g、7.58mmol)を添加した。反応混合物を90℃で16時間撹拌した。得られた混合物を冷却し、水(30mL)で希釈し、EtOAc(3×30mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.98g、99%)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C18H28BrN5O4[M+H-56]+についての計算値402.13、404.13、実測値401.95、403.95;1H NMR(300 MHz,CDCl3)δ 6.37(s,1H),4.99-4.96(m,1H),4.14-4.12(m,1H),3.78-3.66(m,4H),3.62-3.59(m,2H),3.45-3.59(m,7H),2.66-2.63(m,1H),2.19-2.15(m,1H),1.29(s,9H).
ステップ2:tert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
EtOH(10.00mL)およびDMSO(2.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.98g、2.13mmol)およびNaOH(98.34mg、2.45mmol、0.5M)の撹拌溶液に、H2O2(0.72g、21.38mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(30mL)で希釈し、EtOAc(3×30mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-64%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.72g、70%)をオフホワイトの固体として得た。MS ESI C18H30BrN5O5[M+H]+についての計算値420.15、422.15、実測値419.95、421.95;1H NMR(300 MHz,CDCl3)δ 6.57(s,1H),5.17(s,1H),4.15(s,1H),3.87-3.45(m,5H),3.40-3.35(m,8H),2.62-2.59(m,1H),2.23-2.21(m,1H),1.66-1.10(m,9H).
ステップ3:3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩
DCM(8.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-カルバモイル-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.72g、1.51mmol)の撹拌溶液に、1,4-ジオキサン(8.00mL、140.14mmol、4M)中のHCl(ガス)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.61g、98%)をオフホワイトの固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C13H22BrN5O3[M+H]+についての計算値376.10、378.10、実測値376.10、378.10。
ステップ4:3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド-4-クロロ-1-エチル-5-ヨード-2-メチル-1,3-ベンゾジアゾール
DCM(6.00mL)中の3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.51g、1.23mmol)の撹拌溶液に、DIEA(0.63g、4.94mmol)および塩化アクリロイル(4.45mL、1.11mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を水(30mL)で希釈し、CH2Cl2(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-4%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.47g、88%)をオフホワイトの固体として得た。MS ESI C16H24BrN5O4[M+H]+についての計算値430.11、432.11、実測値430.20、432.20;1H NMR(300 MHz,CDCl3)δ 6.92(s,1H),6.56-6.33(m,2H),5.72-5.69(m,1H),5.55-5.11(m,2H),4.69-4.29(m,1H),4.06-3.77(m,3H),3.57(q,J=5.6Hz,2H),3.51-3.28(m,9H),2.72-2.50(m,1H),2.46-2.14(m,1H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.34mmol)および1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.14g、0.69mmol)の撹拌溶液に、XPhos Pd G3(29.51mg、0.04mmol)、X-Phos(16.62mg、0.03mmol)、CuI(3.32mg、0.01mmol)およびTEA(0.10g、1.04mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷やし、減圧下で濃縮した。残渣を、DCM中のMeOH(0-4%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep Phenyl OBD Column、19×150mm 5μm 13nm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-メトキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(99.4mg、50%)をオフホワイトの固体として得た。MS ESI C27H31F2N7O4[M+H]+についての計算値556.25、実測値556.20;1H NMR(300 MHz,CDCl3)δ 7.96(s,1H),7.06-7.02(m,2H),6.76(s,1H),6.62-6.33(m,2H),5.72(dd,J=7.9,4.5Hz,1H),5.62-5.24(m,2H),4.66-4.38(m,1H),4.22(q,J=7.3Hz,2H),4.08-4.42(m,2H),3.89-3.85(m,1H),3.61(q,J=5.8Hz,2H),3.54-3.29(m,9H),3.01-2.61(m,1H),2.33-2.30(m,1H),1.57(t,J=7.3Hz,3H).
実施例118:5-[(シクロプロピルメチル)アミノ]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート
THF(120.00mL)中の3,5-ジブロモ-1H-ピラゾール-4-カルボニトリル(6.90g、27.50mmol)およびtert-ブチル(3R)-3-ヒドロキシピロリジン-1-カルボキシレート(5.15g、27.50mmol)の撹拌溶液に、PPh3(8.66g、33.00mmol)およびDIAD(6.67g、33.00mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(100mL)で希釈し、EtOAc(3×150mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-21%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(11.4g、98%)をオフホワイトの固体として得た。MS ESI C13H16Br2N4O2[M+H-56]+についての計算値362.96、364.96、実測値362.90、364.90;1H NMR(400 MHz,CDCl3)δ 6.37-6.35(m,1H),50.5-4.92(m,1H),3.78-3.73(m,2H),3.52-3.49(m,1H),2.70-2.16(m,1H),1.69-1.68(m,1H),1.48-1.26(m,9H).
ステップ2:tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート
NMP(0.5mL)中のtert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(50.00mg、0.12mmol)の撹拌混合物に、1-シクロプロピルメタンアミン(16.93mg、0.24mmol)を室温で滴下した。反応混合物をアルゴン雰囲気下、50℃で16時間撹拌した。得られた混合物を水(100mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(8×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.90g、92%)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C17H24BrN5O2[M-H]-についての計算値408.11、実測値408.00。
ステップ3:tert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート
EtOH(7.00mL)およびDMSO(1.40mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.85g、2.07mmol)の撹拌混合物に、NaOH(0.10g、2.38mmol、0.5M)およびH2O2(2.35g、20.72mmol、30%)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、0℃で0.5時間、室温で100時間撹拌した。得られた混合物を0℃にて水(10mL)の添加によってクエンチし、EtOAc(3×20mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EtOAc(1/2)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のMeCN(10mmol/L NH4HCO3)、30分で10%から50%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.18g、20%)をオフホワイトの半固体として得た。MS ESI C17H26BrN5O3[M+H]+についての計算値428.13、実測値428.15;1H NMR(400 MHz,CDCl3)δ 6.76(s,1H),6.61(s,1H),4.83(d,J=7.8Hz,1H),3.69-3.65(m,1H),3.47-3.45(m,1H),3.05(t,J=6.6Hz,2H),2.52(s,1H),2.19-2.07(m,1H),1.64(s,2H),1.49(s,9H),1.28-1.26(m,1H),1.09(s,1H),0.64-0.57(m,2H),0.27-0.25(m,2H).
ステップ4:3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩
DCM(2.00mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(シクロプロピルメチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.18g、0.42mmol)の撹拌混合物に、HCl(EtOAc中で4M)(2.00mL)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.20g、99%)をオフホワイトの固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C12H18BrN5O[M+H]+についての計算値328.07、330.07、実測値328.00、330.00。
ステップ5:3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(4.50mL)中の3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.18g、0.49mmol)およびDIEA(28.35mg、0.22mmol)の撹拌混合物に、塩化アクリロイル(1.82mL、0.45mmol)を0℃で滴下した。反応混合物を窒素雰囲気下、0℃で10分間撹拌した。得られた混合物を0℃にて水(10mL)でクエンチし、CH2Cl2(3×10mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、79%)を淡黄色固体として得た。MS ESI C15H20BrN5O2[M+H]+についての計算値382.09、実測値382.00。
ステップ6:5-[(シクロプロピルメチル)アミノ]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-ブロモ-5-[(シクロプロピルメチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.39mmol)および1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.16mg、0.78mmol)の撹拌混合物に、X-Phos(18.71mg、0.04mmol)、XPhos Pd G3(33.21mg、0.04mmol)、CuI(7.47mg、0.04mmol)およびTEA(0.12g、1.18mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.05%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、5-[(シクロプロピルメチル)アミノ]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(80.6mg、39%)をオフホワイトの固体として得た。MS ESI C26H27F2N7O2[M+H]+についての計算値508.32、実測値508.30;1H NMR(300 MHz,CDCl3)δ 7.97(s,1H),7.23-6.98(m,2H),6.61-6.37(m,3H),5.80-5.68(m,1H),5.45(s,1H),5.01(dd,J=13.2,6.8Hz,1H),4.32-3.83(m,5H),3.75-3.68(m,1H),3.05(q,J=6.9Hz,2H),2.84-2.50(m,1H),2.37(s,1H),1.58(t,J=7.3Hz,3H),1.12(s,1H),0.67-0.57(m,2H),0.29-0.27(m,2H).
実施例119:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-メトキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(1.00g、2.38mmol)の撹拌溶液に、2-メトキシエタン-1-アミン(0.63g、8.38mmol)を添加した。反応混合物を90℃で16時間撹拌した。得られた混合物を冷却し、水(30mL)で希釈し、EtOAc(3×30mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.98g、99%)を黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C16H24BrN5O3[M+H-56]+についての計算値358.11、360.11、実測値357.95、359.95;1H NMR(300 MHz,CDCl3)δ 6.41(s,1H),4.99-4.95(m,1H),4.78-4.05(m,2H),3.86-3.57(m,5H),3.43(s,3H),2.62-1.98(m,2H),1.29(s,9H).
ステップ2:tert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート
EtOH(10.00mL)およびDMSO(2.00mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.98g、2.36mmol)およびNaOH(0.11g、2.72mmol、0.5M)の撹拌溶液に、H2O2(0.80g、23.65mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(30mL)で希釈し、EtOAc(3×30mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-82%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.55g、53%)をオフホワイトの固体として得た。MS ESI C16H26BrN5O4[M+H]+についての計算値432.12、434.12、実測値432.15、434.15。
ステップ3:3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩
DCM(6.00mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(2-メトキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.55g、1.27mmol)の撹拌溶液に、1,4-ジオキサン(6.00mL、105.10mmol)中のHCl(ガス)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.47g、99%)がオフホワイトの固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C11H18BrN5O2[M+H]+についての計算値332.07、334.07、実測値332.00、334.00。
ステップ4:3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(6.00mL)中の3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.41g、1.11mmol)の撹拌溶液に、DIEA(0.57g、4.44mmol)および塩化アクリロイル(4.00mL、1.00mmol)を窒素雰囲気下。0℃で滴下した。反応混合物を水(30mL)で希釈し、CH2Cl2(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-4%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.37g、86%)をオフホワイトの固体として得た。MS ESI C14H20BrN5O3[M+H]+についての計算値386.08、388.08、実測値386.10、388.10;1H NMR(300 MHz,CDCl3)δ 6.61(s,1H),6.54-6.32(m,2H),5.79-5.69(m,1H),5.51(s,1H),5.21-4.93(m,1H),4.13-3.84(m,3H),3.79-3.50(m,3H),3.48-3.15(m,5H),2.68-2.48(m,1H),2.45-2.25(m,1H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-メトキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(2.50mL)中の3-ブロモ-5-[(2-メトキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.38mmol)および1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.16g、0.77mmol)の撹拌溶液に、XPhos Pd G3(32.87mg、0.03mmol)、X-Phos(18.51mg、0.03mmol)、CuI(3.70mg、0.01mmol)およびTEA(0.11g、1.16mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep Phenyl OBD Column、19×150mm 5μm 13nm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-メトキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(86.3mg、43%)をオフホワイトの固体として得た。MS ESI C25H27F2N7O3[M+H]+についての計算値512.21、実測値512.15;1H NMR(300 MHz,CDCl3)δ 7.97(s,1H),7.23-6.97(m,2H),6.65-6.26(m,2H),5.86-5.66(m,1H),5.47(s,1H),5.27-4.98(m,1H),4.23(q,J=7.3Hz,2H),4.16-3.86(m,3H),3.84-3.65(m,1H),3.65-3.53(m,2H),3.48-3.24(m,5H),2.77-2.51(m,1H),2.40-2.35(m,1H),1.58(t,J=7.3Hz,3H).
実施例120:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(3S)-3-(3-ブロモ-4-シアノ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(1.00g、2.38mmol)の撹拌混合物に、4-モルホリンプロパンアミン(1.03g、7.14mmol)を室温で滴下した。反応混合物をアルゴン雰囲気下、50℃で16時間撹拌した。得られた混合物を水(100mL)に注ぎ、EA(3×50mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、tert-ブチル(3S)-3-(3-ブロモ-4-シアノ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート(1.0g、87%)を淡黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C20H31BrN6O3[M+H]+についての計算値483.16、実測値483.30。
ステップ2:tert-ブチル(3S)-3-(3-ブロモ-4-カルバモイル-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート
DMSO(1.60mL)およびEtOH(8.00mL)中のtert-ブチル(3S)-3-(3-ブロモ-4-シアノ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.75g、1.55mmol)およびNaOH(水中で0.5M)(3.57mL、1.78mmol)の撹拌溶液に、H2O2(1.20mL、51.51mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(100mL)で希釈し、EA(3×100mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-(3-ブロモ-4-カルバモイル-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.48g、62%)をオフホワイトの油状物として得た。MS ESI C20H33BrN6O4[M+H]+についての計算値501.17、実測値501.25。
ステップ3:3-ブロモ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩
DCM(5.00mL)中のtert-ブチル(3S)-3-(3-ブロモ-4-カルバモイル-5-[[3-(モルホリン-4-イル)プロピル]アミノ]ピラゾール-1-イル)ピロリジン-1-カルボキシレート(0.48mg、0.96mmol)の撹拌溶液に、HCl(EA中で4M)(5.00mL)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.4g、95%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C15H26BrClN6O2[M+H]+についての計算値401.12、実測値401.15;1H NMR(400 MHz,CD3OD)δ 5.49(s,1H),5.37(d,J=6.5Hz,2H),4.09-4.05(m,1H),3.88-3.72(m,4H),3.74-3.71(m,2H),3.68-3.63(m,1H),3.62-3.59(m,2H),3.49-3.45(m,1H),3.42-3.33(m,4H),3.17-3.15(m,2H),2.66-2.55(m,1H),2.34-2.26(m,1H),2.10-2.08(m,2H),2.02-2.19(m,1H).
ステップ4:3-ブロモ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(4.00mL)中の3-ブロモ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド塩酸塩(0.40g、0.91mmol)およびDIEA(0.35g、2.741mmol)の撹拌溶液に、塩化アクリロイル(3.29mL、0.82mmol、DCM中で0.25M)を0℃で滴下した。反応混合物をアルゴン雰囲気下、0℃で10分間撹拌した。得られた混合物を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.2g、48%)を白色固体として得た。MS ESI C18H27BrN6O3[M+H]+についての計算値457.13、実測値457.15;1H NMR(400 MHz,CDCl3)δ 6.64(s,2H),6.43-6.35(m,1H),5.76-5.66(m,1H),5.45(s,1H),4.99(m,1H),4.04(d,J=6.9Hz,1H),4.03-3.98(m,1H),3.98-3.95(m,1H),3.96-3.85(m,1H),3.85-3.81(m,4H),3.69-3.66(m,3H),1.93(s,3H),1.56-1.46(m,4H),1.26-1.23(m,2H),0.90-0.81(m,1H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(4.00mL)中の3-ブロモ-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.15g、0.33mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.14g、0.66mmol)、X-Phos(15.70mg、0.03mmol)、XPhos Pd G3(27.88mg、0.03mmol)およびCuI(6.27mg、0.03mmol)の撹拌混合物に、TEA(0.10g、0.99mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X-Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で15Bから50B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[[3-(モルホリン-4-イル)プロピル]アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(30.2mg、16%)をオフホワイトの固体として得た。MS ESI C29H34F2N8O3[M+H]+についての計算値581.27、実測値581.30;1H NMR(300 MHz,CDCl3)δ 7.94(s,1H),7.20-6.93(m,2H),6.58-6.31(m,3H),5.83-5.65(m,1H),5.41(s,1H),5.05-5.00(m,1H),4.26-4.21(m,2H),4.12-3.87(m,3H),3.72-3.69(m,5H),3.26-3.24(m,2H),2.78-2.57(m,1H),2.46-2.44(m,7H),1.85-1.75(m,2H),1.66(s,3H).
実施例121:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:2-フルオロ-N-メチル-6-ニトロアニリン
ACN(9.00mL)中の1,2-ジフルオロ-3-ニトロベンゼン(1.00g、6.28mmol)の撹拌混合物に、CH3NH2HCl(0.45g、6.66mmol)およびDIEA(5.47mL、42.35mmol)を添加した。反応混合物を70℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を水(20mL)で希釈し、EA(3×20mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、2-フルオロ-N-メチル-6-ニトロアニリン(0.98g、粗製)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。1H NMR(300 MHz,CDCl3)δ 7.94-7.83(m,2H),7.21-7.14(m,1H),6.59-6.52(m,1H),3.27-3.23(m,3H).
ステップ2:2-フルオロ-4-ヨード-N-メチル-6-ニトロアニリン
AcOH(9.60mL)中の2-フルオロ-N-メチル-6-ニトロアニリン(0.96g、5.6mmol)の撹拌溶液に、NIS(1.33g、5.92mmol)を70℃で添加した。反応混合物を窒素雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を水(100mL)で希釈し、NaHCO3でpH8に調整し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中の17%DCMで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2-フルオロ-4-ヨード-N-メチル-6-ニトロアニリン(1.48g、88%)を黄色固体として得た。1H NMR(300 MHz,CDCl3)δ 8.26(s,1H),7.87(s,1H),7.44-7.39(m,1H),3.25-3.23(m,3H)
ステップ3:6-フルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン
EtOH(14.00mL)および水(2.00mL)中の2-フルオロ-4-ヨード-N-メチル-6-ニトロアニリン(0.80g、2.70mmol)およびFe(0.60g、10.80mmol)の撹拌混合物に、NH4Cl(0.72g、13.51mmol)を添加した。反応混合物を75℃で16時間撹拌した。得られた混合物を冷やし、濾過し、濾過ケーキをEtOH(3×50mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(50mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、6-フルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(0.69g、粗製)を褐色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C7H8FIN2[M+H]+についての計算値266.98、実測値266.95。
ステップ4:7-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール
MeOH(7.00mL)中の6-フルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(0.69g、2.60mmol)の撹拌混合物に、オルトギ酸トリメチル(0.41g、3.90mmol)を添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、7-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.20g、87%)を淡褐色固体として得た。MS ESI C8H6FIN2[M+H]+についての計算値276.96、実測値277.00;1H NMR(300 MHz,CDCl3)δ 7.92(d,J=1.3Hz,1H),7.73(s,1H),7.34-7.21(m,1H),4.00(s,3H).
ステップ5:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(1.2mL)中の7-フルオロ-5-ヨード-1-メチル-1,3-ベンゾジアゾール(0.12g、0.45mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、CuI(17.24mg、0.09mmol)およびPd(PPh3)2Cl2(31.77mg、0.04mmol)の撹拌混合物に、TEA(0.19mL、1.86mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で20Bから50B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-フルオロ-1-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(79.6mg、36%)をオフホワイトの固体として得た。MS ESI C24H26FN7O3[M+H]+についての計算値480.21、実測値480.30;1H NMR(300 MHz,DMSO-d6
)δ 8.36(s,1H),7.75(d,J=1.2Hz,1H),7.39-7.18(m,2H),6.65-6.61(m,2H),6.21-6.11(m,1H),5.68-5.65(m,1H),5.32-5.15(m,1H),4.46-4.32(m,1H),4.00-3.97(m,3H),3.92-3.46(m,4H),3.29(m,3H),2.94(d,J=3.1Hz,3H),2.43-2.41(m,1H),2.31-2.27(m,1H).
実施例122:3-(2-[7-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:(E)-N’-(5-ブロモ-4-フルオロピリジン-2-イル)-N,N-ジメチルメタンイミドアミド
DMF(10.00mL)中の5-ブロモ-4-フルオロピリジン-2-アミン(3.00g、15.70mmol)の撹拌溶液に、DMF-DMA(9.36g、78.53mmol)を室温で添加した。反応混合物をアルゴン雰囲気下、130℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、(E)-N’-(5-ブロモ-4-フルオロピリジン-2-イル)-N,N-ジメチルメタンイミドアミド(3g、77%)を白色固体として得た。MS ESI C8H9BrFN3[M+H]+についての計算値246.00、実測値246.05;1H NMR(400 MHz,CDCl3)δ 8.44(s,1H),8.27(d,J=9.7Hz,1H),6.70(d,J=10.1Hz,1H),3.11-2.95(m,6H).
ステップ2:6-ブロモ-7-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン
MeOH(60.00mL)およびピリジン(4.82g、60.95mmol)中の(E)-N’-(5-ブロモ-4-フルオロピリジン-2-イル)-N,N-ジメチルメタンイミドアミド(3.00g、12.19mmol)の撹拌溶液に、アミノオキシスルホン酸(5.51g、48.76mmol)を0℃で添加した。反応混合物を窒素雰囲気下、30℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-ブロモ-7-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン(0.47g、17%)を白色固体として得た。MS ESI C6H3BrFN3[M+H]+についての計算値215.95、217.95、実測値216.00、218.00;1H NMR(400 MHz,DMSO-d6)δ 9.61-9.23(m,1H),8.55(s,1H),8.02(d,J=8.9Hz,1H).
ステップ3:3-(2-[7-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.2g、0.60mmol)、6-ブロモ-7-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン(0.13g、0.60mmol)、Pd(PPh3)2Cl2(42.36mg、0.06mmol)およびCuI(22.99mg、0.12mmol)の撹拌溶液に、TEA(0.18g、1.81mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で35Bから55B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[7-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン-6-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(89.4mg、31%)を白色固体として得た。MS ESI C22H23FN3O3[M+H]+についての計算値467.20、実測値467.20;1H NMR(400 MHz,CDCl3)δ 8.87(d,J=6.1Hz,1H),8.41(s,1H),7.51(d,J=8.8Hz,1H),7.12-6.52(m,1H),6.50-6.35(m,2H),5.85-5.65(m,1H),5.61-5.25(m,2H),4.65-4.34(m,1H),4.23-3.85(m,3H),3.55-3.42(m,1H),3.39(d,J=5.5Hz,3H),3.06(d,J=14.2Hz,3H),2.96-2.61(m,1H),2.38-2.13(m,1H).
実施例123:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート
NMP(30.00mL)中のtert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(3.00g、7.14mmol)の撹拌溶液に、エタノールアミン(1.32g、21.64mmol)を滴下した。反応混合物をアルゴン雰囲気下、50℃で16時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を水(200mL)で希釈し、EA(3×200mL)で抽出した。合わせた有機層をブライン(400mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(3.03g、粗製)を淡黄色油状物として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C15H22BrN5O3[M+H]+についての計算値400.09、実測値400.10;1H-NMR(300 MHz,CDCl3)δ 6.44(s,1H),5.03-4.99(m,2H),4.31-3.39(m,5H),2.66-2.20(m,2H),2.07(s,1H),1.48(s,2H)1.28(d,J=6.2Hz,9H).
ステップ2:tert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート
EtOH(15.00mL)およびDMSO(3.00mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(1.50g、3.75mmol)の撹拌溶液に、NaOH(8.61mL、4.31mmol、0.5M)およびH2O2(0.90mL、13.31mmol、30%)を0℃で添加した。反応混合物を0℃で30分間、室温で16時間撹拌した。得られた混合物を水(100mL)で希釈し、DCM(3×100mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/(EA:EtOH(3:1))で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.58g、37%)を淡黄色固体として得た。MS ESI C15H24BrN5O4[M+H]+についての計算値416.10、実測値416.15;1H-NMR(300 MHz,CDCl3)δ 6.77(s,1H),5.68(s,1H),4.90(t,J=7.4Hz,1H),4.18-3.59(m,5H),3.52-3.18(m,3H),2.55-2.16(m,2H),2.06(d,J=10.9Hz,1H),1.47(s,9H),1.26(t,J=7.2Hz,1H).
ステップ3:3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩
DCM(10mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-カルバモイル-5-[(2-ヒドロキシエチル)アミノ]ピラゾール-1-イル]ピロリジン-1-カルボキシレート(0.58g、1.38mmol)の撹拌溶液に、HCl(6mL、EA中で4M)を0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩(0.72g、粗製)を得、これをさらに精製することなく次のステップに直接使用した。MS ESI C10H16BrN5O2[M+H]+についての計算値318.18、実測値318.15。
ステップ4:3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(EB2000269-024)
THF(5.50mL)中の3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩(0.54g、1.38mmol)およびK2CO3(2.28g、16.54mmol)の撹拌混合物に、THF(10.00mL)中の塩化アクリロイル(6.66mL、16.66mmol、2.5M)をアルゴン雰囲気下、0℃で滴下した。反応混合物をアルゴン雰囲気下、0℃で10分間撹拌した。得られた混合物を水(80mL)で希釈し、DCM(3×80mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.32g、62%)を白色固体として得た。MS ESI C13H18BrN5O3[M+H]+についての計算値372.22、実測値372.10;1H-NMR(300 MHz,CDCl3)δ 6.78(s,1H),6.58-6.37(m,2H),5.81-5.58(m,2H),5.04(dd,J=14.7,7.3Hz,1H),4.13-3.56(m,7H),3.29(d,J=4.7Hz,2H),2.72-2.34(m,3H).
ステップ5:3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(1.75mL)中の3-ブロモ-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.18g、0.47mmol)、1-エチル-5-エチニル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.19g、0.94mmol)、CuI(4.48mg、0.02mmol)、X-Phos(22.41mg、0.05mmol)およびXPhos Pd G3(39.80mg、0.05mmol)の撹拌混合物に、TEA(0.20mL、1.94mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の8%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:X Bridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:5.8分で35Bから70B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(79.6mg、34%)を白色固体として得た。MS ESI C24H25F2N7O3[M+H]+についての計算値498.20、実測値498.25;1H-NMR(400 MHz,DMSO-d6)δ 8.45(s,1H),7.76-7.42(m,2H),6.87-6.52(m,3H),6.17-6.15(m,1H),5.70-5.68(m,1H),5.28-5.07(m,1H),4.87-4.82(m,1H),4.30(q,J=7.3Hz,2H),3.86-3.81(m,2H),3.79-3.63(m,2H),3.56-3.51(m,2H),3.33-3.27(m,2H),2.36-2.31(m,2H),1.41(t,J=7.2Hz,3H).
実施例124:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-クロロ-N-シクロプロピル-2-ニトロアニリン
EtOH(100.00mL)中の4-クロロ-2-フルオロ-1-ニトロベンゼン(10.00g、56.97mmol)の撹拌溶液に、アミノシクロプロパン(9.76g、170.90mmol)を0℃で滴下した。得られた混合物を0℃で1時間撹拌した。得られた混合物を濾過し、濾過ケーキを水(3×100mL)で洗浄し、乾燥させて、5-クロロ-N-シクロプロピル-2-ニトロアニリン(12g、99%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C9H9ClN2O2[M+H]+についての計算値213.04、215.04、実測値213.10、215.10;1H NMR(400 MHz,CDCl3)δ 8.13(s,1H),8.12(d,J=9.1Hz,1H),7.32(d,J=2.2Hz,1H),6.68(dd,J=9.1,2.2Hz,1H),2.62-2.56(m,1H),1.04-0.93(m,2H),0.74-0.66(m,2H).
ステップ2:5-クロロ-N-シクロプロピル-4-ヨード-2-ニトロアニリン
メタンスルホン酸(60mL)中の5-クロロ-N-シクロプロピル-2-ニトロアニリン(12.00g、56.44mmol)の撹拌混合物に、NIS(13.33g、59.26mmol)を0℃で小分けにして添加した。反応混合物を室温で2時間撹拌した。得られた混合物を0℃にて氷/水(100mL)でクエンチし、NaOHでpH8に調整し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-N-シクロプロピル-4-ヨード-2-ニトロアニリン(10g、52%)を橙色固体として得た。MS ESI C9H8ClN2O2[M-H]-についての計算値336.93、338.93、実測値336.90、338.85;1H NMR(300 MHz,CDCl3)δ 8.60(s,1H),8.03(s,1H),7.47(s,1H),2.62-2.51(m,1H),1.07-0.87(m,2H),0.81-0.64(m,2H).
ステップ3:5-クロロ-N1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン
THF(60.00mL)中の5-クロロ-N-シクロプロピル-4-ヨード-2-ニトロアニリン(9.00g、26.59mmol)およびIn(24.42g、212.68mmol)の撹拌混合物に、濃HCl(11.08mL、132.96mmol)を0℃で滴下した。反応混合物を窒素雰囲気下、室温で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-クロロ-N1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン(3g、36%)を淡褐色固体として得た。MS ESI C9H10ClIN2[M+H]+についての計算値308.96、310.96、実測値308.95、310.95。
ステップ4:6-クロロ-1-シクロプロピル-5-ヨード-1,3-ベンゾジアゾール
MeOH(30.00mL)中の5-クロロ-N1-シクロプロピル-4-ヨードベンゼン-1,2-ジアミン(3.00g、9.72mmol)の撹拌溶液に、オルトギ酸トリメチル(1.55g、14.58mmol)を添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、PE/EtOAc(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-クロロ-1-シクロプロピル-5-ヨード-1,3-ベンゾジアゾール(0.90g、29%)を淡褐色固体として得た。MS ESI C10H8ClN2[M+H]+についての計算値318.95、320.95、実測値318.95、320.95;1H NMR(300 MHz,CDCl3)δ 8.30(s,1H),7.92(s,1H),7.74(s,1H),3.39-3.33(m,1H),1.24-1.18(m,2H),1.10-1.01(m,2H).
ステップ5:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の6-クロロ-1-シクロプロピル-5-ヨード-1,3-ベンゾジアゾール(50.00mg、0.16mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(57.22mg、0.17mmol)の撹拌混合物に、XPhos Pd G3(13.29mg、0.02mmol)、XPhos Pd G3(13.29mg、0.02mmol)、CuI(2.99mg、0.02mmol)およびTEA(47.65mg、0.47mmol)を添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗製物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10m、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(41.5mg、50%)をオフホワイトの固体として得た。MS ESI C26H28ClN7O3[M+H]+についての計算値522.19、実測値522.25;1H NMR(400 MHz,CDCl3)δ 8.07(d,J=5.9Hz,2H),7.68(s,1H),7.20(s,1H),6.82(s,1H),6.59-6.36(m,2H),5.73-5.70(m,1H),5.57-5.40(m,2H),4.59-4.45(m,1H),4.17-3.95(m,2H),3.93-3.89(m,1H),3.50-3.36(m,5H),3.06(s,3H),2.79-2.67(m,1H),2.34-2.31(m,1H),1.28-1.17(m,2H),1.19-1.05(m,2H).
実施例125:3-[2-(1-エチル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:N-エチル-2,3-ジフルオロ-6-ニトロアニリン
EtOH(40mL)中の1,2,3-トリフルオロ-4-ニトロベンゼン(5g、28.23mmol)の溶液に、エチルアミン(3.82g、84.70mmol)を添加した。反応混合物を0℃で1時間撹拌した。沈殿した固体を濾過によって回収し、水(4×100mL)で洗浄し、乾燥させて、N-エチル-2,3-ジフルオロ-6-ニトロアニリン(5.3g、92%)を黄色固体として得、これをさらに精製することなく次のステップで直接使用した。MS ESI C25H24ClN7O2[M-H]-についての計算値201.06、実測値201.05;1H NMR(300 MHz,CDCl3)δ 8.00-7.92(m,J=9.8,5.6,2.3Hz,2H),6.53-6.39(m,1H),3.71-3.62(m,4.7Hz,2H),1.36-1.24(m,0.9Hz,3H).
ステップ2:N-エチル-2,3-ジフルオロ-4-ヨード-6-ニトロアニリン
AcOH(53mL)中のN-エチル-2,3-ジフルオロ-6-ニトロアニリン(5.30g、26.21mmol)の撹拌混合物に、NIS(6.20g、103.24mmol)を添加した。反応混合物を窒素雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、室温にて飽和NaHCO3(水溶液)(100mL)でpH8に塩基性化した。得られた混合物をEtOAc(2×300mL)で抽出した。合わせた有機層を水(2×150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/PE(6/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-エチル-2,3-ジフルオロ-4-ヨード-6-ニトロアニリン(7.3g、84%)を淡黄色固体として得た。MS ESI C8H7F2IN2O2[M-H]-についての計算値326.95、実測値326.70;1H NMR(300 MHz,CDCl3)δ 8.39(dd,J=6.3,2.4Hz,1H),7.92(s,1H),3.74-3.59(m,2H),1.39-1.22(m,3H).
ステップ3:N1-エチル-5,6-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン
EtOH(20.00mL)および水(4.00mL)中のN-エチル-2,3-ジフルオロ-4-ヨード-6-ニトロアニリン(2.00g、6.09mmol)およびNH4Cl(1.63g、30.47mmol)の撹拌混合物に、Fe(1.36g、24.35mmol)を添加した。反応混合物を75℃で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOAc(3x100mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(200mL)に溶解し、EA(3×100mL)で抽出した。合わせた有機層をブライン(3×100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮して、N1-エチル-5,6-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン(1.7g、93%)を暗灰色半固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C8H9F2IN2[M-H]-についての計算値296.98、実測値296.95。
ステップ4:1-エチル-6,7-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール
MeOH(17.00mL)中のN1-エチル-5,6-ジフルオロ-4-ヨードベンゼン-1,2-ジアミン(1.70g、5.70mmol)の撹拌溶液に、オルトギ酸トリメチル(0.91g、8.55mmol)を室温で添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EtOAc(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-エチル-6,7-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(1.3g、73%)を黄褐色固体として得た。MS ESI C9H7F2IN2[M+H]+についての計算値308.96、実測値309.00;1H NMR(400 MHz,CDCl3)δ 7.95(dd,J=4.5,1.7Hz,1H),7.88(s,1H),4.38(q,J=7.3Hz,2H),1.58(t,J=7.3Hz,3H).
ステップ5:3-[2-(1-エチル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(3mL)中の1-エチル-6,7-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.13g、0.45mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、Pd(PPh3)2Cl2(31.77mg、0.04mmol)およびCuI(17.24mg、0.09mmol)の撹拌混合物に、TEA(0.13g、1.35mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:XBridge Prep C18 OBD Column、19x150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で20Bから50B、210/254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-エチル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.12g、53%)を白色固体として得た。MS ESI C25H27F2N7O3[M+H]+についての計算値512.21、実測値512.20;1H NMR(400 MHz,CDCl3)δ 7.92(d,J=82.3Hz,2H),6.83-6.81(m,2H),6.54-6.36(m,2H),5.70-5.69(m,1H),5.52-5.49(m,1H),5.42-5.40(m,1H),4.56(d,J=9.0Hz,1H),4.39-4.33(m,2H),4.10(t,J=9.1Hz,1H),4.06-3.96(m,1H),3.90-3.88(m,1H),3.53-3.40(m,1H),3.37-3.35(m,3H),3.03-3.01(m,3H),2.76-2.64(m,1H),2.30-2.28(m,1H),1.5-1.55(m,3H).
実施例126:3-[2-(6-クロロ-1-エチル-7-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:3-クロロ-N-エチル-2-フルオロ-6-ニトロアニリン
EtOH(25.00mL)中の1-クロロ-2,3-ジフルオロ-4-ニトロベンゼン(3.30g、17.05mmol)の撹拌溶液に、EtOH中のエチルアミン(7.69g、51.15mmol、30%)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、0℃で1時間撹拌した。得られた混合物を濾過し、濾過ケーキを水(3x50mL)で洗浄した。濾過ケーキを乾燥させて、3-クロロ-N-エチル-2-フルオロ-6-ニトロアニリン(3.4g、91%)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C8H8ClFN2O2[M+H]+についての計算値219.03、実測値219.05;1H NMR(400 MHz,CDCl3)δ 7.93(dd,J=9.4,2.0Hz,1H),6.64(dd,J=9.4,6.5Hz,1H),3.72-3.61(m,2H),1.33(t,J=7.2Hz,3H).
ステップ2:3-クロロ-N-エチル-2-フルオロ-4-ヨード-6-ニトロアニリン
AcOH(34.00mL)中の3-クロロ-N-エチル-2-フルオロ-6-ニトロアニリン(3.40g、15.55mmol)の撹拌溶液に、NIS(4.02g、17.88mmol)を窒素雰囲気下、室温で小分けにして添加した。反応混合物を窒素雰囲気下、70℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEtOAc(100mL)で希釈した。得られた混合物を飽和NaHCO3(水溶液)でpH8に塩基性化し、EtOAc(2×150mL)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/DCM(4/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-クロロ-N-エチル-2-フルオロ-4-ヨード-6-ニトロアニリン(5g、93%)を黄色固体として得た。MS ESI C8H7ClFIN2O2[M+H]+についての計算値345.51、実測値345.00;1H NMR(300 MHz,CDCl3)δ 8.45(d,J=2.1Hz,1H),7.84(s,1H),3.65(s,2H),1.33(t,J=7.2Hz,3H).
ステップ3:5-クロロ-N1-エチル-6-フルオロ-4-ヨードベンゼン-1,2-ジアミン
EtOH(50.00mL)および水(10.00mL)中の5-クロロ-N-エチル-3-フルオロ-4-ヨード-2-ニトロアニリン(5.00g、14.51mmol)およびNH4Cl(3.88g、72.56mmol)の撹拌混合物に、Fe(3.24g、58.05mmol)を室温で小分けにして添加した。反応混合物を窒素雰囲気下、75℃で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOAc(3x150mL)で洗浄した。濾液を水(100mL)で希釈した。得られた混合物をEtOAc(3×200mL)で抽出した。合わせた有機層をブライン(3×80mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、5-クロロ-N1-エチル-6-フルオロ-4-ヨードベンゼン-1,2-ジアミン(4.5g、98%)を褐色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C8H9ClFIN2[M+H]+についての計算値314.95、実測値315.00。
ステップ4:6-クロロ-1-エチル-7-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール
MeOH(45.00mL)中の5-クロロ-N1-エチル-6-フルオロ-4-ヨードベンゼン-1,2-ジアミン(4.50g、14.31mmol)の撹拌溶液に、オルトギ酸トリメチル(2.28g、21.46mmol)を窒素雰囲気下、室温で滴下した。反応混合物を窒素雰囲気下、70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-クロロ-1-エチル-7-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール(4g、86%)を褐色固体として得た。MS ESI C9H7ClFIN2[M+H]+についての計算値324.93、実測値325.00;1H NMR(400 MHz,CDCl3)δ 8.11(d,J=1.2Hz,1H),7.84(s,1H),4.36(q,J=7.2Hz,2H),1.57-1.54(m,3H).
ステップ5:3-[2-(6-クロロ-1-エチル-7-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の6-クロロ-1-エチル-7-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.15g、0.45mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、Pd(PPh3)2Cl2(31.75mg、0.05mmol)およびCuI(17.23mg、0.09mmol)の撹拌溶液に、TEA(0.19mL、1.86mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を水(150mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層を水(5×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.75分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-エチル-7-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.1g、43%)を白色固体として得た。MS ESI C25H27ClFN7O3[M+H]+についての計算値528.18、実測値528.30;1H-NMR(400 MHz,CDCl3)δ 7.95(d,J=12Hz,2H),7.29-6.53(m,1H),6.51-6.43(m,2H),5.75-5.71(m,1H),5.56-5.41(m,2H),4.60-4.37(m,3H),4.16-3.90(m,3H),3.53-3.39(m,4H),3.05(d,J=16Hz,3H),2.78-2.29(m,2H),1.62-1.57(m,4H).
実施例127:3-[2-(6,7-ジフルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:6,7-ジフルオロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール
MeOH(18.00mL)中の5,6-ジフルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(1.64g、5.77mmol)の撹拌溶液に、1,1,1-トリメトキシエタン(1.04g、8.66mmol)を室温で添加した。反応混合物を70℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6,7-ジフルオロ-5-ヨード-1,2-ジメチル-1H-ベンゾ[d]イミダゾール(1.88g、82%)を褐色固体として得た。ESI C9H7F2IN2[M+H]+についての計算値308.96、実測値309.10。
ステップ2:3-[2-(6,7-ジフルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の6,7-ジフルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール(0.15g、0.49mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.16g、0.49mmol)、Pd(PPh3)2Cl2(34.18mg、0.05mmol)およびCuI(18.55mg、0.10mmol)の撹拌溶液に、TEA(0.20mL、2.01mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物をEA(100mL)で希釈し、水(3×30mL)およびブライン(50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮した。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で15Bから50B、210/254nm;RT:5.75分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6,7-ジフルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(58.5mg、23%)を白色固体として得た。MS ESI C25H27F2N7O3[M+H]+についての計算値511.53、実測値511.21;1H NMR(400 MHz,CDCl3)δ 7.66(d,J=4Hz,1H),7.02(s,1H),6.85(s,1H),6.53-6.43(m,2H),5.74-5.71(m,1H),5.55-5.50(m,1H),5.38-5.3(m,1H),4.57-4.45(m,1H),4.14-3.97(m,2H),3.93(s,3H),3.92-3.90(m,1H),3.53-3.44(m,1H),3.39-3.35(m,3H),3.07-3.03(m,3H),2.76-2.68(m,1H),2.64(s,3H),2.34-2.31(m,1H).
実施例128:3-[2-(6-クロロ-7-フルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:6-クロロ-7-フルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール
MeOH(60.00mL)中の5-クロロ-6-フルオロ-4-ヨード-N1-メチルベンゼン-1,2-ジアミン(1.50g、4.99mmol)の溶液に、1,1,1-トリメトキシエタン(1.80g、14.98mmol)を室温で添加した。反応混合物を70℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をEA(50mL)で希釈し、水(2×25mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(40-100%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-クロロ-7-フルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール(0.24g、15%)を黄色固体として得た。MS ESI C9H7ClFIN2[M+H]+についての計算値324.93、実測値324.95;1H NMR(400 MHz,CDCl3)δ 7.96(d,J=1.2Hz,1H),3.92-3.85(m,3H),2.59(s,3H).
ステップ2:3-[2-(6-クロロ-7-フルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.00mL)中の6-クロロ-7-フルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール(0.15g、0.45mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、Pd(PPh3)2Cl2(31.77mg、0.05mmol)およびCuI(17.24mg、0.09mmol)の撹拌溶液に、TEA(0.14g、1.36mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。次いで、粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:5.8分で25Bから50B。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-7-フルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(50.1mg、21%)を白色固体として得た。MS ESI C25H27ClFN7O3[M+H]+についての計算値528.18、実測値528.20;1H NMR(400 MHz,CDCl3)δ 7.78(s,1H),7.19-6.61(m,2H),6.63-6.29(m,2H),5.80-5.54(m,1H),4.57-4.51(m,1H),4.24-3.83(m,6H),3.57-3.32(m,4H),3.11-2.96(m,3H),2.81-2.58(m,4H),2.41-2.21(m,1H).
実施例129:3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(2-フルオロプロパ-2-エノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DCM(2.00mL)中の3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(90.00mg、0.20mmol)、2-フルオロプロパ-2-エン酸(20.62mg、0.23mmol)、HOBT(37.34mg、0.28mmol)およびEDCI(52.98mg、0.28mmol)の撹拌混合物に、DIEA(0.11g、0.83mmol)を0℃で滴下した。反応混合物をアルゴン雰囲気下、室温で1時間撹拌した。得られた混合物を水(40mL)で希釈し、CH2Cl2(3×30mL)で抽出した。合わせた有機層をブライン(2×20mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で14Bから55B、210/254nm;RT:5.8分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(2-フルオロプロパ-2-エノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(50.1mg、47%)をオフホワイトの白色固体として得た。MS ESI C25H27ClFN7O3[M+H]+についての計算値528.18、実測値528.20;1H NMR(400 MHz,DMSO-d6)δ 8.52(s,1H),8.02(d,J=5.3Hz,2H),7.49(s,1H),6.86(s,1H),5.54-5.15(m,3H),4.53-4.42(m,1H),4.32-4.29(m,2H),4.00-3.89(m,2H),3.54-3.49(m,2H),3.30(s,3H),2.95(s,3H),2.45-2.41(m,1H),2.34-2.31(m,1H),1.42(t,J=7.2Hz,3H).
実施例130:3-(2-[6-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:(E)-N-(5-フルオロ-4-ヨードピリジン-2-イル)-N,N-ジメチルメタンイミドアミド
DMF(24.40mL)中の5-フルオロ-4-ヨードピリジン-2-アミン(2.4g、10.25mmol)の撹拌溶液に、DMF-DMA(6.8mL、51.08mmol)を窒素雰囲気下、室温で添加した。反応混合物を130℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、(E)-N-(5-フルオロ-4-ヨードピリジン-2-イル)-N,N-ジメチルメタンイミドアミド(2.86g、95%)を淡黄色油状物として得た。MS ESI C8H9FIN3[M+H]+についての計算値293.99、実測値294.35;1H NMR(300 MHz,CDCl3)δ 8.36(s,1H),7.98(s,1H),7.45(d,J=4.5Hz,1H),3.12(d,J=3.8Hz,6H).
ステップ2:6-フルオロ-7-ヨード-[1,2,4]トリアゾロ[1,5-a]ピリジン
MeOH(28.60mL)中の(E)-N-(5-フルオロ-4-ヨードピリジン-2-イル)-N,N-ジメチルメタンイミドアミド(2.86g、9.76mmol)およびアミノオキシスルホン酸(4.41g、39.03mmol)の撹拌溶液に、ピリジン(3.93mL、49.65mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をPrep-TLC(CH2Cl2/MeOH 10/1)によって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-フルオロ-7-ヨード-[1,2,4]トリアゾロ[1,5-a]ピリジン(0.30g、11%)を淡黄色固体として得た。MS ESI C6H3FIN3[M+H]+についての計算値263.94、実測値264.00;1H NMR(300 MHz,CDCl3)δ 8.56(d,J=2.4Hz,1H),8.38(s,1H),8.30(d,J=5.7Hz,1H).
ステップ3:3-(2-[6-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-エチニル-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、6-フルオロ-7-ヨード-[1,2,4]トリアゾロ[1,5-a]ピリジン(0.12g、0.45mmol)、Pd(PPh3)2Cl2(31.59mg、0.05mmol)およびCuI(17.14mg、0.09mmol)の撹拌溶液に、TEA(0.14g、1.35mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、粗製物を得た。粗生成物を、以下の条件を用いる逆相フラッシュによって精製した:カラム:C18 spherical Column、20-35μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:40mL/分、勾配:20分で5Bから50B。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-[6-フルオロ-[1,2,4]トリアゾロ[1,5-a]ピリジン-7-イル]エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(39.6mg、44%)をオフホワイトの固体として得た。MS ESI C22H23FN8O3[M+H]+についての計算値467.19、実測値467.15;1H NMR(400 MHz,CDCl3)δ 8.66(s,1H),8.45(s,1H),8.02(s,1H),6.79-6.70(m,2H),6.55-6.38(m,2H),5.80-5.69(m,1H),5.60-5.44(m,2H),4.63-4.55(m,1H),4.18-3.87(m,3H),3.55-3.34(m,4H),3.12-3.03(m,3H),2.76-2.63(m,1H),2.39-2.29(m,1H).
実施例131:3-[2-(6-フルオロ-1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-6-フルオロ-3H-1,3-ベンゾチアゾール-2-チオン
NMP(5.00mL)中の5-ブロモ-2,4-ジフルオロアニリン(0.50g、2.404mmol)の溶液に、エトキシ(ポタッシオスルファニル)メタンチオン(0.46g、2.885mmol)を室温で添加した。反応混合物を100℃で18時間撹拌した。得られた混合物をEtOAc(10.00mL)で希釈した。残渣を水(3×10mL)で洗浄した。合わせた有機層をブライン(2×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、5-ブロモ-6-フルオロ-3H-1,3-ベンゾチアゾール-2-チオン(0.5g、78%)を桃色固体として得た。MS ESI C7H3BrFNS2[M-H]-についての計算値261.89、263.89、実測値262.00、264.00;1H-NMR(300 MHz,CDCl3)δ 11.41(s,1H),7.25(d,J=7.5Hz,2H).
ステップ2:5-ブロモ-6-フルオロ-1,3-ベンゾチアゾール
MeOH(26.00mL)中の5-ブロモ-6-フルオロ-3H-1,3-ベンゾチアゾール-2-チオン(2.60g、9.84mmol)、Zn(3.22g、49.22mmol)およびNiCl2・6H2O(2.46g、10.34mmol)の溶液に、濃HCl(20.00mL)をアルゴン雰囲気下、室温で滴下した。反応混合物をアルゴン雰囲気下、70℃で2時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOAc(200.00mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(200.00mL)で希釈し、飽和NaHCO3(水溶液)でpH9に塩基性化した。得られた混合物をEtOAc(3×200mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-6-フルオロ-1,3-ベンゾチアゾール(0.41g、17%)を黄色固体として得た。1H NMR(300 MHz,CDCl3)δ 8.90(s,1H),8.27(d,J=6.1Hz,1H),7.64(d,J=7.7Hz,1H).
ステップ3:3-[2-(6-フルオロ-1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.50mL)中の5-ブロモ-6-フルオロ-1,3-ベンゾチアゾール(0.15g、0.64mmol)、XPhos Pd G3(54.71mg、0.07mmol)、X-Phos(30.81mg、0.06mmol)、CuI(6.15mg、0.03mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.26g、0.77mmol)の溶液に、TEA(0.20g、1.94mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いる逆相フラッシュによって精製した:カラム:Spherical C18、20-40μm、40g移動相A:水(10mmol/mL NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:30分以内で5%-35%、検出器:UV 254/220nm;RT:48分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-フルオロ-1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(95.2mg、30%)を白色固体として得た。MS ESI C23H23FN6O3S[M+H]+についての計算値483.15、実測値483.10;1H-NMR(300 MHz,CDCl3)δ 9.05(s,1H),8.34(d,J=6.1Hz,1H),7.74(d,J=8.6Hz,1H),7.04(s,1H),6.59-6.36(m,2H),5.75-5.71(m,1H),5.63-5.24(m,2H),4.69-4.37(m,1H),4.19-3.91(m,3H),3.53-3.44(m,1H),3.39(d,J=3.6Hz,3H),3.06(d,J=11.2Hz,3H),2.77-2.62(m,1H),2.36-2.30(m,1H).
実施例132:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロイミダゾ[1,2-a]ピリジン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:6-フルオロ-7-ヨードイミダゾ[1,2-a]ピリジン
EtOH(0.50mL)中の5-フルオロ-4-ヨードピリジン-2-アミン(0.10g、0.42mmol)および2-ブロモ-1,1-ジエトキシエタン(0.17g、0.84mmol)の撹拌混合物に、HBr(0.05mL)を0℃で滴下した。得られた混合物を80℃で16時間撹拌した。得られた混合物を室温まで冷却した。得られた混合物をNaHCO3(水溶液)でクエンチし、EtOAc(3×60mL)で抽出した。合わせた有機層をブライン(40mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE/(EtOAc/EtOH(3:1))(1/3)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-フルオロ-7-ヨードイミダゾ[1,2-a]ピリジン(1.78g、81%)を褐色固体として得た。ESI C7H4FIN2[M+H]+についての計算値262.94、実測値262.90;1H NMR(400 MHz,CDCl3)δ 8.12(dd,J=10.0,4.4Hz,2H),7.69(s,1H),7.62(s,1H).
ステップ2:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロイミダゾ[1,2-a]ピリジン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(1.5mL)中の6-フルオロ-7-ヨードイミダゾ[1,2-a]ピリジン(0.12g、0.45mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)、CuI(17.24mg、0.09mmol)およびPd(PPh3)2Cl2(31.77mg、0.05mmol)の撹拌混合物に、TEA(0.14g、1.36mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:SunFire Prep C18 OBD Column、19×150mm 5μm 10nm、移動相A:水(0.1%FA)、移動相B:ACN、流量:20mL/分、勾配:6分で25Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロイミダゾ[1,2-a]ピリジン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.15g、73%)を淡黄色固体として得た。MS ESI C23H24FN7O3[M+H]+についての計算値466.19、実測値466.30;1H NMR(300 MHz,CDCl3)δ 8.29-8.15(m,1H),7.99(d,J=6.3Hz,1H),7.83(s,1H),7.73(d,J=6.6Hz,1H),6.89-6.70(m,2H),6.55-6.36(m,2H),5.73(dd,J=8.0,4.3Hz,1H),5.61-5.22(m,2H),4.65-4.35(m,1H),4.20-3.81(m,3H),3.60-3.30(m,4H),3.06(d,J=10.6Hz,3H),2.61-2.78(m,1H),2.35-2.30(m,1H).
実施例133:3-[2-(6-クロロ-4-フルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.60mmol)、CuI(22.99mg、0.12mmol)、Pd(PPh3)2Cl2(42.36mg、0.06mmol)および6-クロロ-4-フルオロ-5-ヨード-1,2-ジメチル-1,3-ベンゾジアゾール(0.22g、0.66mmol)の撹拌混合物に、TEA(0.25mL、1.81mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で1.5時間撹拌した。得られた混合物を水(150mL)で希釈し、EtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で20Bから50B、210/254nm;RT:5.58分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-4-フルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(60.0mg、18%)を白色固体として得た。MS ESI C25H27ClFN7O3[M+H]+についての計算値528.18、実測値528.30;1H NMR(300 MHz,DMSO-d6)δ 7.80(s,1H),7.58(s,1H),6.95-6.49(m,3H),6.18(d,J=16.6Hz,1H),5.70(d,J=10.2Hz,1H),5.50-5.00(m,1H),4.47-4.35(m,1H),4.13-3.98(m,1H),3.97-3.82(m,1H),3.77-3.74(m,3H),3.62(m,1H),3.47-3.42(m,1H),3.38-3.27(m,3H),2.98-2.95(m,3H),2.57(d,J=1.2Hz,3H),2.53-2.49(m,1H),2.33-2.29(m,1H).
実施例134:3-[2-(6-クロロ-1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-4-クロロ-2-フルオロアニリン
EtOH(10.00mL)およびH2O(2mL)中の1-ブロモ-2-クロロ-4-フルオロ-5-ニトロベンゼン(1.00g、3.93mmol)の溶液に、Fe(1.10g、19.65mmol)およびNH4Cl(1.05g、19.65mmol)を室温で添加した。反応混合物を70℃で2時間撹拌した。得られた混合物を濾過し、濾過ケーキをEA(3x150mL)で洗浄した。濾液を減圧下で濃縮した。残渣を水(200mL)で希釈した。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、5-ブロモ-4-クロロ-2-フルオロアニリン(0.7g、79%)を淡黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C6H4BrClFN[M+H]+についての計算値223.92、225.92、実測値223.95、225.95;1H-NMR(400 MHz,CDCl3)δ 7.12(d,J=10.5Hz,1H),7.04(d,J=8.7Hz,1H).
ステップ2:5-ブロモ-6-クロロ-3H-1,3-ベンゾチアゾール-2-チオン
NMP(10.00mL)中の5-ブロモ-4-クロロ-2-フルオロアニリン(0.7g、3.12mmol)の溶液に、エトキシ(ポタッシオスルファニル)メタンチオン(0.60g、3.74mmol)を室温で添加した。反応混合物を100℃で18時間撹拌した。得られた混合物をEtOAc(150mL)で希釈し、水(3×100mL)で洗浄した。合わせた有機層をブライン(200mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-100%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-6-クロロ-3H-1,3-ベンゾチアゾール-2-チオン(0.8g、91%)をオフホワイトの固体として得た。MS ESI C7H3BrClNS2[M-H]-についての計算値277.86、279.86、実測値277.95、279.95;1H NMR(400 MHz,CDCl3)δ 17.81(s,1H),8.05(s,1H),7.54(s,1H).
ステップ3:5-ブロモ-6-クロロ-1,3-ベンゾチアゾール
AcOH(20.00mL)中の5-ブロモ-6-クロロ-3H-1,3-ベンゾチアゾール-2-チオン(0.5g、1.78mmol)の溶液に、Fe(1.00g、17.82mmol)を室温で添加した。反応混合物を110℃で3時間撹拌した。得られた混合物を濾過し、濾過ケーキをEA(150.00mL)で洗浄した。濾液を減圧下で濃縮した。残渣を飽和NaHCO3(水溶液)でpH9に塩基性化した。得られた混合物をEtOAc(3×150mL)で抽出した。合わせた有機層をブライン(300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-80%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-6-クロロ-1,3-ベンゾチアゾール(0.28g、64%)を白色固体として得た。1H NMR(400 MHz,CDCl3)δ 9.02(s,1H),8.43(s,1H),8.09(s,1H).
ステップ4:3-[2-(6-クロロ-1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.5mL)中の5-ブロモ-6-クロロ-1,3-ベンゾチアゾール(0.15g、0.60mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.24g、0.73mmol)の溶液に、X-Phos(28.77mg、0.06mmol)、XPhos Pd G3(51.09mg、0.06mmol)、CuI(5.75mg、0.03mmol)およびTEA(0.18g、1.81mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:Spherical C18、20-40μm、40g 移動相A:水(10mmol/mL NH4HCO3)、移動相B:ACN、流量:50mL/分、勾配:30分以内で5%-34%、検出器:UV 254/220nm;RT:50分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1,3-ベンゾチアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(72.30mg、23%)を白色固体として得た。MS ESI C23H23ClN6O3S[M+H]+についての計算値499.12、501.12、実測値499.10、501.10;1H-NMR(400 MHz,CDCl3)δ 9.06(d,J=1.6Hz,1H),8.41(d,J=5.5Hz,1H),8.06(d,J=2.3Hz,1H),7.12(s,1H),6.88-6.70(m,1H),6.54-6.32(m,2H),5.74-5.50(m,1H),5.59-5.24(m,2H),4.59-4.57(m,1H),4.15-3.99(m,2H),3.93-3.90(m,1H),3.56-3.44(m,1H),3.39-3.36(m,3H),3.07-3.02(m,3H),2.74-2.68(m,1H),2.35-2.30(m,1H).
実施例135:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:N-シクロプロピル-5-フルオロ-2-ニトロアニリン
EtOH(200.00mL)中の2,4-ジフルオロ-1-ニトロベンゼン(20g、125.71mmol)の撹拌溶液に、アミノシクロプロパン(21.53g、377.14mmol)を0℃で滴下した。反応混合物を0℃で1時間撹拌した。得られた混合物をH2O(400mL)で希釈し、濾過した。濾過ケーキをH2O(3×200mL)で洗浄した。濾過ケーキを減圧下で乾燥させて、N-シクロプロピル-5-フルオロ-2-ニトロアニリン(25.5g、粗製)を黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C9H9FN2O2[M+H]+についての計算値197.06、実測値196.95。
ステップ2:N-シクロプロピル-5-フルオロ-4-ヨード-2-ニトロアニリン
メタンスルホン酸(100mL)中のN-シクロプロピル-5-フルオロ-2-ニトロアニリン(25.5g、129.98mmol)の撹拌溶液に、NIS(30.71g、136.48mmol)を0℃で添加した。反応混合物を室温で2時間撹拌した。得られた混合物を水(500mL)で希釈し、EtOAc(3×300mL)で抽出した。合わせた有機層をブライン(500mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PE中のEA(0-10%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、N-シクロプロピル-5-フルオロ-4-ヨード-2-ニトロアニリン(27g、64%)を黒色固体として得た。MS ESI C9H8FIN2O2[M+H]+についての計算値322.96、実測値322.95。
ステップ3:N1-シクロプロピル-5-フルオロ-4-ヨードベンゼン-1,2-ジアミン
EtOH(150mL)およびH2O(150mL)中のN-シクロプロピル-5-フルオロ-4-ヨード-2-ニトロアニリン(27.0g、83.83mmol)およびNH4Cl(22.42g、419.16mmol)の撹拌混合物に、Fe(23.41g、419.16mmol)を室温で添加した。反応混合物を室温で16時間撹拌した。得られた混合物を濾過した。濾過ケーキをMeOH(3×100mL)で洗浄した。濾液を減圧下で濃縮して、N1-シクロプロピル-5-フルオロ-4-ヨードベンゼン-1,2-ジアミン(23g、粗製)を淡褐色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C9H10FIN2[M+H]+についての計算値292.99、実測値292.95。
ステップ4:1-シクロプロピル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール
MeOH(230mL)中のN1-シクロプロピル-5-フルオロ-4-ヨードベンゼン-1,2-ジアミン(23g、78.74mmol)の撹拌溶液に、オルトギ酸トリメチル(25.07mL、236.22mmol)をアルゴン雰囲気下、室温で添加した。反応混合物を70℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中のEA(50-100%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-シクロプロピル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(8g、34%)を黄色固体として得た。MS ESI C10H8FIN2[M+H]+についての計算値302.97、実測値302.85.1H NMR(400 MHz,CDCl3)δ 8.15(d,J=5.6Hz,1H),7.92(s,1H),7.32(d,J=7.6Hz,1H),3.36-3.31(m,1H),1.26-1.13(m,2H),1.15-1.01(m,2H).
ステップ5:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(20mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.77g、2.32mmol)および1-シクロプロピル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.70g、2.32mmol)の撹拌溶液に、XPhos(0.11g、0.23mmol)、X-Phos Pd G3(0.20g、0.23mmol)、CuI(44.13mg、0.23mmol)を窒素雰囲気下、室温で添加した。上記混合物に、TEA(0.10g、0.99mmol)を室温で1分間にわたって滴下した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を室温まで冷却した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム、C18シリカゲル、移動相、水中のACN、30分で10%から50%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.63g、52%)をオフホワイトの固体として得た。MS ESI C26H28FN7O3[M+H]+についての計算値506.23、実測値506.20.1H NMR(300 MHz,DMSO-d6)δ 8.38(s,1H),7.97(d,J=6.3Hz,1H),7.66(d,J=9.5Hz,1H),7.50(s,1H),6.92-6.45(m,3H),6.24-6.13(m,1H),5.70(dd,J=10.2,2.7Hz,1H),5.30-5.26(m,1H),4.48-4.42(m,1H),4.05-4.01(m,1H),3.91-3.87(m,1H),3.66-3.43(m,3H),3.32(d,J=3.9Hz,3H),2.98-2.91(m,3H),2.68-2.62(m,1H),2.33-2.28(m,1H),1.13-1.03(m,4H).
実施例136:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート
THF(100mL)中の3,5-ジブロモ-1H-ピラゾール-4-カルボニトリル(5g、19.93mmol)およびtert-ブチル(R)-3-ヒドロキシピロリジン-1-カルボキシレート(4.48g、23.91mmol)の撹拌溶液に、PPh3(7.84g、29.89mmol)およびDIAD(6.04g、29.89mmol)をアルゴン雰囲気下、0℃で滴下した。反応混合物をアルゴンで3回脱気し、室温で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(8g、95%)を白色固体として得た。MS ESI C13H16Br2N4O2[M+H-56]+についての計算値362.96、364.96、366.96、実測値362.95、364.95、366.95;1H NMR(400 MHz,CDCl3)δ 3.90-3.31(m,4H),2.52-2.26(m,2H),2.09-2.00(m,1H),1.46(s,9H).
ステップ2:tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]ピロリジン-1-カルボキシレート
NMP(90mL)中のtert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(9g、21.42mmol)の撹拌溶液に、THF(2.46g、79.26mmol)中のCH3NH2を室温で添加した。反応混合物を50℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のMeCN(NH4HCO3)、30分で30%から60%の勾配、検出器、UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]ピロリジン-1-カルボキシレート(2.7g、34%)を白色固体として得た。MS ESI C14H20BrN5O2[M-H]-についての計算値、368.08、370.08、実測値368.10、370.10;1H NMR(400 MHz,CDCl3)δ 5.11(s,1H),4.53-4.33(m,1H),3.76-3.60(m,2H),3.58(d,J=9.9Hz,1H),3.51-3.36(m,1H),3.18(s,3H),2.49-2.45(m,1H),2.24-1.96(m,1H),1.46(s,9H).
ステップ3:tert-ブチル(3S)-3-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}ピロリジン-1-カルボキシレート
DCM(60mL)中のtert-ブチル(3S)-3-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]ピロリジン-1-カルボキシレート(6.3g、17.01mmol)およびTEA(2.58g、25.52mmol)の撹拌溶液に、DMAP(0.21g、1.70mmol)およびBoc2O(7.43g、34.03mmol)を室温で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}ピロリジン-1-カルボキシレート(7.60g、94%)を白色固体として得た。MS ESI C19H28BrN5O4[M+H]+についての計算値470.13、472.13、実測値470.25、472.25;1H NMR(400 MHz,CDCl3)δ 3.72-3.62(m,3H),3.52-3.26(m,2H),3.21(s,3H),2.47-2.16(m,2H),1.44(s,18H).
ステップ4:tert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}ピロリジン-1-カルボキシレート
DMF(70mL)中のtert-ブチル(3S)-3-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}ピロリジン-1-カルボキシレート(7g、14.88mmol)、Pd(PPh3)2Cl2(1.04g、1.48mmol)およびCuI(0.57g、2.97mmol)の撹拌溶液に、TEA(6.21mL、44.64mmol)およびトリメチルシリルアセチレン(4.39g、44.64mmol)を室温で滴下した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}ピロリジン-1-カルボキシレート(7g、96%)を褐色固体として得た。MS ESI C24H37N5O4Si[M+H]+についての計算値488.26、実測値488.35;1H NMR(300 MHz,CDCl3)δ 3.68-3.33(m,4H),3.22-2.96(m,3H),2.64-1.90(m,3H),1.44(s,18H),0.27(s,9H).
ステップ5:tert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}ピロリジン-1-カルボキシレート
THF(70mL)中のtert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}ピロリジン-1-カルボキシレート(7.00g、14.35mmol)の撹拌溶液に、TBAF(21.53mL、21.53mmol、THF中で1M)を室温で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(3/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}ピロリジン-1-カルボキシレート(4.30g、72%)を白色固体として得た。MS ESI C21H29N5O4[M+H]+についての計算値416.22、実測値416.30;1H NMR(400 MHz,CDCl3)δ 3.77-3.73(m,2H),3.60-3.50(m,1H),3.51-3.47(m,2H),3.38(s,1H),3.23(s,3H),2.43-2.39(m,1H),2.32-2.28(m,1H),1.46(s,18H).
ステップ6:tert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}ピロリジン-1-カルボキシレート
EtOH(30mL)およびDMSO(6mL)中のtert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}ピロリジン-1-カルボキシレート(3.70g、8.90mmol)およびNaOH(20.48mL、10.24mmol、0.5M)の撹拌溶液に、H2O2(0.73mL、31.16mmol、30%)を0℃で滴下した。反応混合物を0℃で30分間、次いで室温で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}ピロリジン-1-カルボキシレート(3.30g、85%)を白色固体として得た。MS ESI C21H31N5O5[M+H]+についての計算値434.24、実測値434.50;1H NMR(300 MHz,CDCl3)δ 6.81(brs,1H),6.16(brs,1H),4.86-4.82(m,1H),3.74-3.69(m,2H),3.51-3.45(m,1H),3.45-3.40(m,1H),3.12(s,3H),2.98-2.93(m,2H),2.27-2.22(m,1H),1.53-1.29(m,18H)
ステップ7:3-エチ二ル-5-(メチルアミノ)-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩
DCM(30mL)中のtert-ブチル(3S)-3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}ピロリジン-1-カルボキシレート(3.00g、6.92mmol)の撹拌混合物に、1,4-ジオキサン(15mL)中のHCl(ガス)を室温で滴下した。得られた混合物を室温で1時間撹拌した。得られた混合物を濾過した。濾過ケーキをDCM(3×20mL)で洗浄し、乾燥させて、3-エチニル-5-(メチルアミノ)-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩(2.30g、粗製)をオフホワイトの固体として得た。MS ESI C11H17Cl2N5O[M+H]+についての計算値306.08、実測値306.60。
ステップ8:3-エチニル-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
THF(22mL)中の3-エチニル-5-(メチルアミノ)-1-[(3S)-ピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩(2.20g、7.18mmol)およびK2CO3(34.49mL、86.22mmol、2.5M)の撹拌溶液に、塩化アクリロイル(0.59g、6.46mmol)を0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物を水(50mL)で希釈し、EtOAc(3×50mL)で抽出した。合わせた有機層をブライン(150mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチニル-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(1.20g、58%)を白色固体として得た。MS ESI C14H17N5O2[M+H]+についての計算値288.14、実測値288.05;1H NMR(400 MHz,DMSO-d6)δ 6.69-6.47(m,2H),6.15-5.96(m,1H),5.68-5.42(m,1H),5.24-5.01(m,1H),4.57-4.21(m,1H),3.88-3.65(m,3H),3.62-3.50(m,1H),2.52-2.48(m,4H),2.41-2.20(m,2H).
ステップ9:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DMF(1.5mL)中の3-エチニル-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.13g、0.45mmol)、1-シクロプロピル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.13g、0.45mmol)、Pd(PPh3)2Cl2(31.76mg、0.04mmol)およびCuI(17.23mg、0.09mmol)の撹拌混合物に、TEA(0.13g、1.35mmol)をアルゴン雰囲気下、室温で滴下した。反応混合物をアルゴンで3回脱気し、70℃で40分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep C18 OBD Column、19×150mm 5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:20mL/分、勾配:6分で20Bから50B、210/254nm;RT:5.58分;所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.10g、50%)を白色固体として得た。MS ESI C24H24FN7O2[M+H]+についての計算値462.20、実測値462.15;1H NMR(300 MHz,DMSO-d6)δ 8.37(s,1H),7.98-7.75(m,1H),7.65-7.51(m,1H),7.49(s,1H),6.92-6.51(m,3H),6.25-6.11(m,1H),5.70-5.42(m,1H),5.19-4.96(m,1H),4.14-3.44(m,5H),2.97-2.54(m,3H),2.36-1.96(m,2H),1.18-1.00(m,4H).
実施例137:1-[(3S,5R)-1-(ブタ-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
1-[(3S,5R)-1-(ブタ-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-3-[2-(1-エチル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミドMS ESI C26H27F2N7O3[M+H]+についての計算値524.21、実測値524.35;1H NMR(300 MHz,CD3OD)δ 8.33(s,1H),7.45(d,J=8.9Hz,1H),5.48-5.34(m,1H),4.64-4.49(m,1H),4.35-4.30(m,2H),4.12-3.68(m,3H),3.68-3.58(m,1H),3.43-3.40(m,1H),3.42-3.39(m,3H),3.04-3.01(m,3H),2.84-2.61(m,1H),2.47-2.43(m,1H),2.06-2.03(m,3H),1.53(t,J=7.3Hz,3H).
実施例138:1-((3S,5R)-1-アクリロイル-5-((メトキシ-d3)メチル)ピロリジン-3-イル)-3-((6-クロロ-1-エチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-((メトキシ-d3)メチル)ピロリジン-3-イル)-3-((6-クロロ-1-エチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミドMS ESI C25H25D3ClN7O3[M+H]+についての計算値531.21、実測値531.25;1H NMR(400 MHz,CDCl3)δ 8.10(d,J=5.1Hz,1H),8.00(s,1H),7.51(s,1H),6.82(s,1H),6.57-6.36(m,2H),5.72(dd,J=8.6,3.6Hz,1H),5.59-5.25(m,2H),4.57-4.45(m,1H),4.29-3.87(m,4H),3.55-3.42(m,1H),3.09-2.95(m,3H),2.73-2.69(m,1H),2.36-2.31(m,1H),1.58-1.50(m,3H).
実施例139:3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド MS ESI C22H22FN7O2[M+H]+についての計算値436.20、実測値436.20;1H NMR(400 MHz,DMSO-d6)δ 8.31(s,1H),7.96-7.73(m,1H),7.68(d,J=9.7Hz,1H),7.48(s,1H),6.80(s,1H),6.68(d,J=6.1,4.6Hz,1H),6.68-6.54(m,1H),6.17-5.89(m,1H),5.69-5.43(m,2.4Hz,1H),5.25-5.08(m,1H),4.10-3.99(m,1H),3.92-3.83(m,1H),3.84(s,3H),3.82-3.71(m,1H),3.73-3.50(m,1H),2.96-2.73(m,3H),2.40-2.35(m,1H),2.29-2.10(m,1H).
実施例140:3-[2-(1-エチル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-エチル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C23H23F2N7O2[M+H]+についての計算値468.20、実測値468.10;1H NMR(300 MHz,DMSO)δ 8.44(s,1H),7.85(d,J=5.3Hz,1H),7.47(s,1H),6.92-6.55(m,3H),6.25-6.12(m,1H),5.71-5.62(m,1H),5.18-5.12(m,1H),4.40(q,J=7.2Hz,2H),4.12-3.60(m,4H),2.97-2.92(m,3H),2.42-2.24(m,2H),1.47(t,J=7.2Hz,3H).
実施例141:3-[2-(6-クロロ-1-エチル-7-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-エチル-7-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C23H23ClFN7O2[M+H]+についての計算値484.20、実測値484.05;1H NMR(400 MHz,DMSO-d6)δ 8.46(d,J=1.2Hz,1H),7.93(d,J=1.6Hz,1H),7.49(s,1H),6.85(s,1H),6.71-6.55(m,2H),6.17-5.96(m,1H),5.70-5.46(m,1H),5.25-5.08(m,1H),4.39-4.12(m,2H),3.92-3.50(m,4H),2.96-2.64(m,3H),2.41-2.21(m,1H),2.34-2.26(m,1H),1.45(m,3H).
実施例142:3-[2-(6-クロロ-7-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-7-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C22H21ClFN7O2[M+H]+についての計算値470.14、実測値470.10;1H NMR(400 MHz,DMSO)δ 8.38(s,1H),7.92(s,1H),7.48(s,1H),6.85(s,1H),6.69-6.57(m,2H),6.20-6.14(m,1H),5.73-5.67(m,1H),5.22-5.10(m,1H),4.06-3.83(m,5H),3.76-3.33(m,2H),2.97(s,3H),2.43-2.38(m,1H),2.32-2.30(m,1H).
実施例143:3-[2-(1-エチル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-エチル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C23H24FN7O2[M+H]+についての計算値450.20、実測値450.15;1H NMR(300 MHz,DMSO-d6)δ 8.41(s,1H),7.97-7.77(m,1H),7.76-7.56(m,1H),7.49(s,1H),6.81(s,1H),6.70(s,1H),6.74-6.54(m,1H),6.25-6.11(m,1H),5.71-5.43(m,1H),5.18-4.96(m,1H),4.29(q,J=7.3Hz,2H),4.12-3.51(m,4H),2.97-2.69(m,3H),2.45-2.27(m,2H),1.42-1.23(m,3H).
実施例144:3-[2-(6-クロロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C22H22ClN7O2[M+H]+についての計算値452.16、実測値452.15;1H NMR(300 MHz,DMSO)δ 8.36(s,1H),8.04(s,1H),7.95(s,1H),7.51(s,1H),6.88(s,1H),6.78-6.54(m,2H),6.18-6.13(m,1H),5.70-5.65(m,1H),5.18-5.13(m,1H),3.87-3.81(m,4H),3.85-3.49(m,3H),2.97-2.93(m,3H),2.38-2.32(m,2H).
実施例145:3-[2-(6,7-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(6,7-ジフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C22H21F2N7O2[M+H]+についての計算値454.17、実測値454.15;1H NMR(300 MHz,DMSO-d6)δ 8.35(s,1H),7.83(d,J=5.2Hz,1H),7.47(s,1H),6.71-6.57(m,3H),6.21-6.14(m,1H),5.74-5.67(m,1H),5.22-5.13(m,1H),4.07(s,3H),3.91-3.58(m,4H),2.97-2.92(m,3H),2.52-2.28(m,2H).
実施例147:3-[2-(6-クロロ-1-シクロプロピル-7-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-7-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H27ClFN7O3[M+H]+についての計算値540.18、実測値540.30;1H NMR(300 MHz,CDCl3)δ 8.01(brs,1H),7.12(brs,1H),6.83(brs,1H),6.67-6.33(m,2H),5.77-5.71(m,1H),5.65-5.21(m,2H),4.66-4.38(m,1H),4.26-3.83(m,2H),3.73-3.28(m,6H),3.05-3.01(m,3H),2.89-2.57(m,1H),2.36-2.31(m,1H),1.44-0.97(m,4H).
実施例148:3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-フルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C23H23F2N7O2[M+H]+についての計算値468.19、実測値468.25;1H NMR(300 MHz,CDCl3)δ 7.98(d,J=6.3Hz,1H),7.91(s,1H),7.14(d,J=9.0Hz,2H),6.80-6.78(m,1H),6.43(d,J=2.1Hz,1H),6.41(s,1H),5.76-5.72(m,1H),5.43-5.40(m,1H),5.37-5.29(m,1H),5.05-4.85(m,1H),4.68-4.40(m,2H),4.17-4.04(m,2H),3.84(s,3H),3.03(d,J=6.0Hz,3H),2.89-2.78(m,1H),2.43-2.46(m,1H).
実施例149:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(4,6,7-トリフルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-4-カルボキサミド
1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(4,6,7-トリフルオロ-1,2-ジメチル-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-4-カルボキサミド.MS ESI C25H26F3N7O3[M+H]+についての計算値530.20、実測値530.20;1H NMR(400 MHz,CDCl3)δ 7.05-6.98(m,1H),6.89-6.82(m,1H),6.49-6.41(m,2H),5.78-5.72(m,1H),5.56-5.32(m,2H),4.58-4.32(m,1H),4.18-4.01(m,2H),3.98-3.91(m,4H),3.54-3.45(m,1H),3.38(s,3H),3.09-2.99(m,3H),2.79-2.71(m,1H),2.61(s,3H),2.39-2.31(m,1H).
実施例150:3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O3[M+H]+についての計算値520.25、実測値520.30;1H NMR(400 MHz,CDCl3)δ 7.87(s,1H),7.16(s,1H),6.83(d,J=6.0Hz,1H),6.58-6.35(m,2H),5.72-5.68(m,1H),5.58-5.22(m,2H),4.56(d,J=8.9Hz,1H),4.12-4.03(m,2H),3.91-3.85(m,1H),3.54-3.41(m,1H),3.38(d,J=4.4Hz,3H),3.20-3.15(m,1H),3.05-3.01(m,3H),2.80-2.48(m,3H),2.31-2.26(m,1H),1.29-1.27(m,2H),1.11-1.02(m,2H).
実施例151:3-[2-(1-シクロプロピル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H27F2N7O3[M+H]+についての計算値524.21、実測値524.30;1H NMR(400 MHz,CDCl3)δ 7.94(s,1H),7.75(d,J=5.0Hz,1H),7.05-6.95(m,1H),6.85-6.82(m,1H),6.55-6.39(m,2H),5.72-5.68(m,1H),5.53-5.45(m,1H),5.41-5.26(m,1H),4.58(d,J=9.1Hz,1H),4.16-3.87(m,3H),3.73-3.52(m,1H),3.55-3.42(m,1H),3.39(d,J=4.6Hz,3H),3.05(d,J=15.5Hz,3H),2.83-2.62(m,1H),2.45-2.26(m,1H),1.28-1.08(m,4H).
実施例152:1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(4,6,7-トリフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-4-カルボキサミド
1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(4,6,7-トリフルオロ-1-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-4-カルボキサミド.MS ESI C24H24F3N7O3[M+H]+についての計算値516.19、実測値516.10;1H NMR(400 MHz,CDCl3)δ 7.86(s,1H),6.99(s,1H),6.57-6.39(m,2H),5.74-5.71(m,1H),5.54-5.42(m,2H),4.59-4.56(m,1H),4.15-4.02(m,6H),3.53-3.44(m,1H),3.39(d,J=4Hz,3H),3.05(d,J=12Hz,3H),2.76-2.68(m,1H),2.42-2.30(m,1H).
実施例153:3-[2-(1-シクロプロピル-4,6,7-トリフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6,7-トリフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H26F3N7O3[M+H]+についての計算値542.20、実測値542.20;1H NMR(400 MHz,CDCl3)δ 7.92(s,1H),6.99(s,1H),6.50-6.41(m,2H),5.72-5.69(m,1H),5.55-5.48(m,1H),5.48-5.24(m,1H),4.61-4.39(m,1H),4.08-4.01(m,2H),3.99-3.39(m,1H),3.62-3.60(m,1H),3.54-3.42(m,1H),3.39(d,J=5.0Hz,3H),3.05(d,J=15.8Hz,3H),2.81-2.63(m,1H),2.39-2.26(m,1H),1.32-1.23(m,2H),1.22-1.12(m,2H).
実施例154:1-[(3S,5R)-5-(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(1-エチル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-3-[2-(1-エチル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H25F4N7O3[M+H]+についての計算値548.20、実測値548.15;1H NMR(400 MHz,CDCl3)δ 7.91(s,1H),7.76-7.45(m,1H),7.02(s,1H),6.82-6.43(m,1H),6.52-6.34(m,3H),5.80-5.70(m,1H),5.51-5.28(m,2H),4.68-4.61(m,1H),4.46-4.33(m,3H),4.09-3.98(m,2H),3.94-3.74(m,1H),3.04-2.96(m,3H),2.83-2.63(m,1H),2.41-2.32(m,1H),1.57-1.32(m,3H).
実施例155:3-[2-(1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H27F2N7O3[M+H]+についての計算値524.21、実測値524.20;1H NMR(400 MHz,CDCL3)δ 8.04(d,J=96.4Hz,2H),7.48(d,J=8.0Hz,1H),6.94-6.92(m,1H),6.77(d,J=6.2Hz,1H),6.56-5.97(m,3H),5.79-5.69(m,1H),5.40-5.38(m,1H),4.68-4.60(m,1H),4.41(dd,J=10.3,3.1Hz,1H),4.13-4.12(m,1H),4.04-4.01(m,1H),3.93-3.92(m,1H),3.40(s,1H),3.03-2.98(m,3H),2.83-2.37(m,1H),2.41-2.31(m,1H),1.20-1.18(m,2H),1.07-1.05(m,2H).
実施例156:1-((3S,5R)-1-アクリロイル-5-((ジフルオロメトキシ)メチル)ピロリジン-3-イル)-3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-((ジフルオロメトキシ)メチル)ピロリジン-3-イル)-3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C26H25F4N7O3[M+H]+についての計算値560.20、実測値560.15;1H NMR(400 MHz,CDCl3)δ 7.95(s,1H),7.27(s,1H),7.16(d,J=8.2Hz,1H),7.05(s,1H),6.88-6.00(m,3H),5.74-5.71(m,1H),5.56-5.01(m,2H),4.63(d,J=9.2Hz,1H),4.42(d,J=10.3,3.2Hz,1H),4.14(d,J=9.8,8.0Hz,1H),4.04(d,J=9.9,8.1Hz,1H),3.94(dd,J=10.4,2.3Hz,1H),3.38-3.35(m,1H),3.03(s,3H),2.84-2.81(m,1H),2.37-2.35(m,1H),1.28-1.14(m,2H),1.11-1.03(m,2H).
実施例157:3-[2-(1-エチル-4,6,7-トリフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-エチル-4,6,7-トリフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H26F3N7O3[M+H]+についての計算値530.20、実測値530.25;1H NMR(400 MHz,CDCl3)δ 7.92(s,1H),6.99(s,1H),6.63-6.32(m,2H),5.80-5.70(m,1H),5.57-5.25(m,2H),4.57(d,J=9.0Hz,1H),4.41(q,J=7.2Hz,2H),4.12(d,J=8.7Hz,1H),4.07-3.97(m,1H),3.93-3.90(m,1H),3.56-3.41(m,1H),3.39(d,J=5.1Hz,3H),3.05(d,J=15.7Hz,3H),2.77-2.66(m,1H),2.34-2.29(m,1H),1.60(t,J=7.3Hz,3H).
実施例158:3-[2-(1-シクロプロピル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H25F2N7O2[M+H]+についての計算値494.50、実測値494.20;1H NMR(400 MHz,CDCl3)δ 7.95(s,1H),7.74(s,1H),7.02(s,1H),6.59-6.40(m,1H),6.40-6.29(m,1H),5.80-5.59(m,1H),5.40(s,1H),5.13-4.96(m,1H),4.52-4.32(m,1H),4.16-3.93(m,2H),3.61-3.46(m,1H),3.01-2.96(m,3H),2.87-2.66(m,1H),2.07-1.85(m,1H),1.35-1.27(m,3H),1.26-1.21(m,2H),1.18-1.12(m,2H).
実施例159:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H25F2N7O2[M+H]+についての計算値494.20、実測値494.25;1H NMR(400 MHz,CDCl3)δ 7.97(s,1H),7.17(d,J=4Hz,1H),7.09(s,1H),6.58-6.40(m,2H),5.76-5.69(m,1H),5.43(s,1H),5.18-5.10(m,1H),4.58-4.49(m,1H),4.15-4.00(m,2H),3.43-3.35(m,1H),3.07-3.02(m,3H),2.87-2.79(m,1H),2.80-2.03(m,1H),1.37(d,J=4Hz,3H),1.28-1.21(m,2H),1.11-1.06(m,2H).
実施例161:1-((3S,5R)-1-アクリロイル-5-((ジフルオロメトキシ)メチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-((ジフルオロメトキシ)メチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C26H26F3N7O3[M+H]+についての計算値542.20、実測値542.20;1H NMR(400 MHz,CDCl3)δ 7.99(s,2H),7.33(d,J=9.1Hz,1H),7.13(s,1H),6.83(d,J=6.3Hz,1H),6.53-6.40(m,2H),6.23(s,1H),5.82-5.71(m,1H),5.57-5.33(m,2H),4.66(d,J=9.1Hz,1H),4.44(dd,J=10.4,3.1Hz,1H),4.24-3.81(m,3H),3.39-3.34(m,1H),3.05(d,J=5.8Hz,3H),2.85(dt,J=12.7,9.6Hz,1H),2.38(dd,J=13.1,7.2Hz,1H),1.22(q,J=6.5,5.9Hz,2H),1.09-1.01(m,2H).
実施例162:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ジフルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ジフルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H24ClF2N7O2[M+H]+についての計算値528.16、実測値528.20;1H NMR(400 MHz,CDCl3)δ 8.06(d,J=22.6Hz,2H),7.68(s,1H),7.20(s,1H),6.81(s,1H),6.53-6.37(m,2H),6.32-6.28(m,1H),5.80-5.75(m,1H),5.41-5.28(m,2H),4.70-4.65(m,1H),4.20-4.15(m,1H),4.06-4.02(m,1H),3.40-3.32(m,1H),3.05(s,3H),2.82-2.69(m,1H),2.64-2.58(m,1H),1.30-1.19(m,2H),1.15-1.05(m,2H).
実施例163:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ジフルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ジフルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H23F4N7O2[M+H]+についての計算値530.18、実測値530.25;1H NMR(400 MHz,CDCl3)δ 7.97(s,1H),7.18(d,J=8.2Hz,1H),7.07(s,1H),6.52-6.37(m,2H),6.34-6.13(m,1H),5.80(dd,J=8.6,3.6Hz,1H),5.45(s,1H),5.32-5.31(m,1H),4.70(dd,J=28.9,9.0Hz,1H),4.20-4.17(m,1H),4.06-4.03(m,1H),3.41-3.37(m,1H),3.05-3.02(m,3H),2.75-2.70(m,1H),2.63-2.60(m,1H),1.29-1.17(m,2H),1.17-1.05(m,2H).
実施例164:1-((3S,5R)-1-アクリロイル-5-メチルピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-メチルピロリジン-1-カルボキシレート
THF(170.00mL)中の3,5-ジブロモ-1H-ピラゾール-4-カルボニトリル(21.19g、84.47mmol)、tert-ブチル(2R,4R)-4-ヒドロキシ-2-メチルピロリジン-1-カルボキシレート(17g、84.47mmol)およびPPh3(33.23g、0.12mol)の撹拌溶液に、DIAD(22.20g、0.11mol)を0℃で滴下した。反応混合物を窒素で3回脱気し、室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(4/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-メチルピロリジン-1-カルボキシレート(42.70g、87%)をオフホワイトの固体として得た。MS ESI C14H18Br2N4O2[M+H-56]+についての計算値376.98、378.98、380.98、実測値376.80、378.80、380.80;1H NMR(400 MHz,CDCl3)δ 5.06-4.80(m,2H),4.07(d,J=51.2Hz,1H),3.88-3.47(m,1H),2.64-2.53(m,1H),2.28(s,1H),1.44-1.33(m,3H),1.29(s,9H).
ステップ2:tert-ブチル(2S,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-メチルピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-メチルピロリジン-1-カルボキシレート(44.65g、0.10mol)の撹拌溶液に、CH3NH2(0.19L、0.39mol、THF中で2M)を添加した。反応混合物を窒素雰囲気下、50℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、以下の条件を用いる逆相クロマトグラフィーによって精製した:カラム:Spherical C18、20-40um、330g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量80mL/分、勾配(B%):30分以内で30%~60%、検出器:UV 254/210nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2S,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-メチルピロリジン-1-カルボキシレート(24.30g、58%)をオフホワイトの固体として得た。MS ESI C15H22BrN5O2[M+H-56]+についての計算値328.10、330.09、実測値328.00、330.00;1H NMR(400 MHz,CDCl3)δ 4.89(s,1H),4.37-4.24(m,1H),3.98-3.88(m,1H),3.91-3.80(m,1H),3.40-3.35(m,1H),3.18(d,J=5.1Hz,3H),2.44-2.39(m,1H),2.37-2.24(m,1H),1.46(s,9H),1.35(d,J=6.2Hz,3H).
ステップ3:tert-ブチル(2R,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート
DCM(243.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-メチルピロリジン-1-カルボキシレート(24.30g、63.24mmol)およびDMAP(0.77g、6.32mmol)の撹拌溶液に、TEA(35.16mL、0.25mol)およびBoc2O(41.40g、0.19mol)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(4/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(26.80g、78%)をオフホワイトの固体として得た。MS ESI C20H30BrN5O4[M+H-56]+についての計算値428.15、430.15、実測値428.10、430.10;1H NMR(400 MHz,CDCl3)δ 4.53-4.45(m,1H),3.96(s,2H),3.56-3.48(m,1H),3.23(s,3H),2.51-2.44(m,1H),2.23(s,1H),1.47(s,18H),1.42-1.36(m,3H).
ステップ4:tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート
DMF(268.00mL)中のtert-ブチル(2R,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(26.80g、55.33mmol)、Pd(PPh3)2Cl2(3.88g、5.53mmol)およびCuI(2.11g、11.07mmol)の撹拌混合物に、TEA(23.07mL、0.16mol)およびトリメチルシリルアセチレン(23.46mL、0.16mol)を窒素雰囲気下、室温で添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中の23%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮したtert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(22.30g、72%)を褐色固体として。MS ESI C25H39N5O4Si[M+H]+についての計算値502.28、実測値502.35;1H NMR(400 MHz,CDCl3)δ 4.53-4.46(m,1H),3.98-3.92(m,2H),3.68-3.41(m,1H),3.24(d,J=4.4Hz,3H),2.49(s,1H),2.30-2.25(m,1H),1.48-1.45(m,18H),1.41(d,J=5.9Hz,3H),0.30(s,9H).
ステップ5:tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート
THF(223.00mL)中のtert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(22.30g、44.45mmol)の撹拌溶液に、THF中の1M TBAF(66.67mL、66.67mmol)を窒素雰囲気下、0℃で添加した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中の25%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(14.30g、67%)をオフホワイトの固体として得た。MS ESI C22H31N5O4[M+H-112]+についての計算値318.24、実測値318.05;1H NMR(400 MHz,CDCl3)δ 4.56-4.51(m,1H),3.99-3.95(m,2H),3.74-3.44(m,1H),3.39-3.32(m,1H),3.25(s,3H),2.63-2.39(m,1H),2.38-2.14(m,1H),1.54-1.49(m,18H),1.40(d,J=7.0Hz,3H).
ステップ6:tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート
EtOH(235.00mL)およびDMSO(47.00mL)中のtert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(14.30g、33.29mmol)の撹拌溶液に、0.5M LiOH(79.90mL、39.95mmol)およびH2O2(30%、9.05mL、0.11mol)を0℃で添加した。反応混合物を5~10℃で1.5時間撹拌した。得られた混合物を0℃にて飽和Na2SO3(水溶液)(2.5M)でクエンチした。得られた混合物を水(500mL)で希釈し、EA(3×500mL)で抽出した。合わせた有機層をブライン(5×300mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE中の63%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(16.50g、88%)を淡黄色固体として得た。MS ESI C22H33N5O5[M+H-156]+についての計算値292.25、実測値292.25;1H NMR(400 MHz,CDCl3)δ 6.84(s,1H),5.68(s,1H),4.77-4.68(m,1H),4.07-3.37(m,4H),3.08-3.02(m,6H),2.48-2.42(m,1H),1.87(s,1H),1.58-1.32(m,18H).
ステップ7:3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-5-メチルピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩
DCM(165.00mL)中のtert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}-2-メチルピロリジン-1-カルボキシレート(16.50g、36.87mmol)の撹拌混合物に、EA中の4M HCl(165.00mL、0.66mol)を添加した。反応混合物を室温で1時間撹拌した。沈殿した固体を濾過によって回収し、CH2Cl2(3x50mL)で洗浄した。濾過ケーキを乾燥させて、3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-5-メチルピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩(9.50g、68%)を淡黄色固体として得、これをさらに精製することなく次のステップに直接使用した。MS ESI C12H19Cl2N5O[M+H-2HCl]+についての計算値248.14、実測値248.05。
ステップ8:3-エチニル-1-[(3S,5R)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
THF(25.00mL)中の3-エチニル-5-(メチルアミノ)-1-[(3S,5R)-5-メチルピロリジン-3-イル]ピラゾール-4-カルボキサミド二塩酸塩(2.50g、7.81mmol)および塩化アクリロイル(0.71g、7.81mmol)の撹拌混合物に、2.5M K2CO3(37.47mL、93.68mmol)を窒素雰囲気下、0℃で滴下した。得られた混合物を窒素雰囲気下、0℃で10分間撹拌した。得られた混合物を3×50mLの水で洗浄した。得られた混合物をEA(3×100mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチニル-1-[(3S,5R)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(2.40g、96%)を白色固体として得た。MS ESI C15H19N5O2[M+H]+についての計算値302.15、実測値302.10;1H NMR(400 MHz,CDCl3)δ 6.81(s,1H),6.54-6.42(m,1H),6.41-6.30(m,1H),5.84-5.64(m,1H),5.42(s,1H),4.86-4.81(m,1H),4.50-3.76(m,3H),3.48(d,J=4.2Hz,1H),2.98(s,3H),2.74-2.54(m,1H),2.52-2.28(m,1H),1.45(d,J=6.2Hz,3H).
ステップ9:1-((3S,5R)-1-アクリロイル-5-メチルピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(5.00mL)中の3-エチニル-1-[(3S,5R)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.25g、0.83mmol)、Pd(PPh3)2Cl2(58.23mg、0.08mmol)、1-シクロプロピル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.25g、0.83mmol)およびCuI(31.60mg、0.17mmol)の撹拌混合物に、TEA(0.35mL、2.49mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を3×20mLの水で洗浄した。得られた混合物をEA(3×50mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム:C18シリカゲル、移動相:水中のACN(10mmol/L NH4HCO3)、20分で40%から60%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-メチルピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.14g、36%)を白色固体として得た。MS ESI C25H26FN7O2[M+H]+についての計算値476.21、実測値476.20;1H NMR(400 MHz,CDCl3)δ 8.08-7.86(m,2H),7.42-7.24(m,1H),7.15(s,1H),6.68(s,1H),6.59-6.27(m,2H),5.83-5.64(m,1H),5.50(s,1H),4.83(q,J=8.5Hz,1H),4.57-3.80(m,3H),3.39-3.32(m,1H),2.99(d,J=5.6Hz,3H),2.77-2.26(m,2H),1.48(d,J=6.2Hz,3H),1.29-1.16(m,2H),1.14-0.98(m,2H).
実施例165:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(5.00mL)中の3-エチニル-1-[(3S,5R)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、0.99mmol)、1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール(0.19g、0.99mmol)、Pd(PPh3)2Cl2(69.88mg、0.10mmol)およびCuI(37.92mg、0.20mmol)の撹拌溶液に、TEA(0.42mL、2.98mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で40分間撹拌した。得られた混合物を冷やし、真空下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆相フラッシュによってさらに精製した:カラム、C18シリカゲル、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、勾配:30分で20Bから50B、210/254nm。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-メチル-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、21%)を白色固体として得た。MS ESI C25H25F2N7O2[M+H]+についての計算値494.20、実測値494.10;1H NMR(400 MHz,CDCl3)δ 7.97(s,1H),7.26-6.99(m,2H),6.68(s,1H),6.58-6.29(m,2H),5.82-5.61(m,1H),5.43(s,1H),4.92-4.77(m,1H),4.56-4.09(m,2H),4.09-3.80(m,1H),3.48-3.36(m,1H),3.00(d,J=5.5Hz,3H),2.83-2.29(m,2H),1.49(d,J=6.2Hz,3H),1.32-1.25(m,2H),1.19-1.05(m,2H).
実施例166:1-((3S,5R)-1-アクリロイル-5-メチルピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-メチルピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C25H26ClN7O2[M+H]+についての計算値492.18、実測値492.25;1H NMR(400 MHz,CDCl3)δ 8.10(s,1H),8.02(s,1H),7.68(s,1H),7.22(s,1H),6.67(s,1H),6.54-6.36(m,2H),5.81-5.67(m,1H),5.45(s,1H),4.84(p,J=8.6,7.9Hz,1H),4.57-4.10(m,2H),4.09-3.79(m,1H),3.46-3.40(m,1H),3.00(s,3H),2.76-2.30(m,2H),1.49(d,J=6.2Hz,3H),1.31-1.19(m,2H),1.13-1.04(m,2H).
実施例167:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-((4-メトキシベンジル)アミノ)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、2.15mmol)および(4-メトキシフェニル)メタンアミン(1.48g、10.77mmol)の撹拌溶液に、窒素雰囲気下、室温で。得られた混合物を窒素雰囲気下、50℃で16時間撹拌した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のMeOH(10mmol/L NH4HCO3)、10分で10%から50%の勾配、検出器:UV 210nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-((4-メトキシベンジル)アミノ)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.70g、62%)をオフホワイトの固体として得た。MS ESI C23H30BrN5O4[M+H]+についての計算値520.15、522.15、実測値520.15、522.15;1H NMR(400 MHz,CDCl3)δ 7.28-7.10(d,J=1.8Hz,1H),6.90-6.86(m,1H),3.80-3.78(s,1H),3.39-3.34(m,6H),2.82-2.80(d,J=0.8Hz,9H),2.34-2.31(t,J=8.1Hz,6H),2.05-1.96(m,6H).
ステップ2:tert-ブチル(2R,4S)-4-{4-シアノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシラーテス
DMF(10.00mL)中のtert-ブチル(2R,4S)-4-(3-ブロモ-4-シアノ-5-((4-メトキシベンジル)アミノ)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.00g、1.92mmol)、Pd(PPh3)2Cl2(0.13g、0.19mmol)、K2CO3(0.80g、5.76mmol)、CuI(73.19mg、0.38mmol)およびTBAI(1.06g、2.88mmol)の撹拌混合物に、1-シクロプロピル-5-エチニル-6-フルオロ-1,3-ベンゾジアゾール(0.46g、2.30mmol)を添加した。反応混合物をアルゴンで3回脱気し、100℃で2時間撹拌した。得られた混合物を冷却し、真空下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、tert-ブチル(2R,4S)-4-{4-シアノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシラーテス(0.60g、48%)を黄色固体として得た。MS ESI C35H38FN7O4[M+H]+についての計算値640.30、実測値640.55。
ステップ3:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
H3PO4(2.00mL)中のtert-ブチル(2R,4S)-4-{4-シアノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシラーテス(0.60g、0.94mmol)の溶液を、130℃で2時間撹拌した。反応混合物を氷水(20mL)で希釈した。得られた混合物をEA(3×20mL)で抽出した。合わせた有機層を水(2×10mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、DCM/MeOH(15/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.26g、63%)を黄色固体として得た。MS ESI C22H24FN7O2[M+H]+についての計算値438.20、実測値438.25。
ステップ4:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ4:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(4.00mL)およびDIEA(0.31mL、1.78mmol)中の5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.26g、0.59mmol)の撹拌溶液に、塩化アクリロイル(48.41mg、0.53mmol)を0℃で滴下した。反応混合物を0℃で30分間撹拌した。得られた混合物を冷却し、真空下で濃縮した。残渣を、以下の条件を用いる逆相フラッシュによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、30分で10%から50%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.13g、44%)を白色固体として得た。MS ESI C25H26FN7O3[M+H]+についての計算値492.21、実測値492.15;1H NMR(400 MHz,CDCl3)δ 7.98(brs,2H),7.33(d,J=9.1Hz,1H),7.09(s,1H),6.61-6.29(m,2H),5.83-5.37(m,4H),5.23-4.83(m,1H),4.65-4.29(m,1H),4.13-3.81(m,3H),3.61-3.29(m,5H),3.09-2.61(m,1H),2.38-2.36(m,1H),1.32-1.00(m,4H).
実施例168:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル-(3S)-3-(3-ブロモ-4-シアノ-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル)ピロリジン-1-カルボキシレート
NMP(50.00mL)中のtert-ブチル(3S)-3-(3,5-ジブロモ-4-シアノピラゾール-1-イル)ピロリジン-1-カルボキシレート(5.00g、11.90mmol)の撹拌溶液に、(4-メトキシフェニル)メタンアミン(8.16g、59.51mmol)を室温で添加した。反応混合物を50℃で16時間撹拌した。得られた混合物をEA(50.00mL)で希釈した。残渣を水(3×30mL)で洗浄した。合わせた有機層をブライン(2×30mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、PE中の35%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(3S)-3-(3-ブロモ-4-シアノ-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル)ピロリジン-1-カルボキシレート(4.80g、84%)を淡黄色油状物として得た。MS ESI C13H16Br2N4O2[M+H-100]+についての計算値376.12、実測値376.15。
ステップ2:tert-ブチル(3S)-3-{4-シアノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル}ピロリジン-1-カルボキシレート
DMF(20.00mL)中のtert-ブチル(3S)-3-(3-ブロモ-4-シアノ-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル)ピロリジン-1-カルボキシレート(2.00g、4.19mmol)および1-シクロプロピル-6-フルオロ-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.37g、5.04mmol)の撹拌溶液に、2.5M K2CO3(1.74g、12.59mmol)、TBAI(2.33g、6.29mmol)、CuI(0.16g、0.84mmol)およびPd(PPh3)2Cl2(0.29g、0.42mmol)を添加した。反応混合物をアルゴンで3回脱気し、100℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM中の4%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆相フラッシュによってさらに精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配(B%):35分以内で0%から46%、検出器:UV 254/220nm。分画を合わせ、減圧下で濃縮して、tert-ブチル(3S)-3-{4-シアノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル}ピロリジン-1-カルボキシレート(1.36g、54%)を淡黄色固体として得た。MS ESI C33H34FN7O3[M+H]+についての計算値596.27、実測値596.35;1H NMR(400 MHz,CDCl3)δ 7.96-7.93(m,2H),7.38-7.30(m,3H),6.90(d,J=8.2Hz,2H),4.71(s,1H),3.82(s,3H),3.78-3.61(m,3H),3.49-3.32(m,2H),3.26(s,2H),2.49-2.19(m,1H),1.46(s,9H),1.22-1.19(m,2H),1.09-1.05(m,2H),1.03-0.98(m,2H).
ステップ3:(S)-5-アミノ-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド
H3PO4(5.50mL)中のtert-ブチル(3S)-3-{4-シアノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-{[(4-メトキシフェニル)メチル]アミノ}ピラゾール-1-イル}ピロリジン-1-カルボキシレート(0.55g、0.92mmol)の溶液を、130℃で1時間撹拌した。残渣をNaOH(水溶液)でpH8に塩基性化した。残渣を、以下の条件を用いる逆相フラッシュによって精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量60mL/分、勾配(B%):5分間0%保持、10分以内で5%から22%、5分間22%保持、20分以内で22%から45%、3分間45%保持、2分以内で45%から95%、5分間95%保持、検出器:UV 254/210nm。5分間0%保持、10分以内で5%から22%、5分間22%保持、20分以内で22%から45%、3分間45%保持、2分以内で45%から95%、5分間95%保持、検出器:UV 254/210nm。分画を合わせ、減圧下で濃縮して、(S)-5-アミノ-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド(0.27g、73%)を淡緑色固体として得た。MS ESI C20H20FN7O[M+H]+についての計算値394.17、実測値394.10;1H NMR(400 MHz,CDCl3)δ 8.11-8.01(m,1H),8.00-7.89(m,2H),7.31(d,J=8.9Hz,1H),6.83(d,J=9.4Hz,1H),5.30(s,1H),4.89(s,1H),3.39-3.36(m,1H),2.98(s,1H),2.90(s,1H),2.14(s,1H),1.69(s,2H),1.46(s,1H),1.32-1.13(m,2H),1.11-0.99(m,4H).
ステップ4:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(10.00mL)中の(S)-5-アミノ-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド(0.27g、0.68mmol)およびDIEA(0.35g、2.72mmol)の撹拌溶液に、塩化アクリロイル(2.50mL、0.62mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、0℃で10分間撹拌した。反応物を0℃にて水(10mL)でクエンチした。得られた混合物をEA(3×30mL)で抽出した。合わせた有機層をブライン(2×20mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、DCM中の6%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆相クロマトグラフィーによってさらに精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配(B%):30分以内で5%から35%、検出器:UV 254/210nm。回収した分画を合わせ、減圧下で濃縮して、5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(64.30mg、21%)を白色固体として得た。MS ESI C23H22FN7O2[M+H]+についての計算値448.18、実測値448.30;1H NMR(400 MHz,CDCl3)δ 7.98(d,J=6.6Hz,2H),7.32(d,J=9.0Hz,1H),7.10(s,1H),6.55-6.34(m,2H),5.81-5.58(m,3H),5.43(s,1H),4.76-4.72(m,1H),4.11-3.90(m,3H),3.84-3.60(m,1H),3.39-3.35(m,1H),2.85-2.53(m,1H),2.47-2.28(m,1H),1.24-1.19(m,2H),1.13-1.01(m,2H).
実施例169:1-((3S,5S)-1-アクリロイル-5-メチルピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5S)-1-アクリロイル-5-メチルピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C25H26FN7O2[M+H]+についての計算値476.21、実測値476.25;1H NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.95(d,J=6.2Hz,1H),7.63(d,J=9.4Hz,1H),7.47(s,1H),6.81(s,1H),6.72-6.50(m,2H),6.19-6.16(m,1H),5.70-5.67(m,1H),5.24-5.21(m,1H),4.53-4.27(m,1H),3.99-3.96(m,1H),3.82(d,J=6.8Hz,1H),3.57-3.47(m,1H),2.96(dd,J=5.7,1.2Hz,3H),2.76-2.54(m,1H),2.24-1.94(m,1H),1.26(dd,J=6.5,2.3Hz,3H),1.15-1.00(m,4H).
実施例170:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ジフルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ジフルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H24F3N7O2[M+H]+についての計算値512.19、実測値512.05;1H NMR(400 MHz,CDCl3)δ 8.01(s,1H),7.98(d,J=6.0Hz,1H),7.33(d,J=9.2Hz,1H),7.13(s,1H),6.82(s,1H),6.50-6.17(m,3H),5.82-5.79(m,1H),5.42-5.30(m,2H),4.75-4.65(m,1H),4.21-4.17(m,1H),4.09-4.04(m,1H),3.41-3.37(m,1H),3.05(s,3H),2.79-2.71(m,1H),2.66-2.63(m,1H),1.25-1.20(m,2H),1.10-1.06(m,2H).
実施例171:3-[2-(1-シクロプロピル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6,7-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C24H23F2N7O2[M+H]+についての計算値480.19、実測値480.25;1H NMR(400 MHz,CDCl3)δ 7.93(d,J=1.6Hz,1H),7.78-7.72(m,1H),7.04(s,1H),6.74-6.68(m,1H),6.58-6.35(m,2H),5.77-5.68(m,1H),5.50(s,1H),5.13-4.97(m,1H),4.14-4.04(m,3H),3.83-3.53(m,2H),3.02(t,J=5.6Hz,3H),2.80-2.55(m,1H),2.45-2.40(m,1H),1.26-1.23(m,2H),1.17-1.13(m,2H).
実施例172:3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(1-(2-フルオロアクリロイル)アゼチジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(1-(2-フルオロアクリロイル)アゼチジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C23H21F2N7O2[M+H]+についての計算値466.17、実測値466.05;1H NMR(400 MHz,CDCl3)δ 7.98(d,J=4.7Hz,2H),7.31(d,J=9.1Hz,1H),7.13(s,1H),6.71(q,J=6.0Hz,1H),5.76-5.50(m,2H),5.29-5.21(m,1H),5.16-5.00(m,2H),4.79(s,1H),4.65(dd,J=11.4,5.8Hz,1H),4.53(t,J=9.7Hz,1H),3.39-3.35(m,1H),2.95(d,J=5.8Hz,3H),1.20(d,J=7.2Hz,2H),1.06(s,2H).
実施例173:3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(1-(2-フルオロアクリロイル)アゼチジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-1-イル}アゼチジン-1-カルボキシレート
DMF(20.00mL)中のtert-ブチル3-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}アゼチジン-1-カルボキシレート(1.50g、3.29mmol)および1-シクロプロピル-4,6-ジフルオロ-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.15g、3.94mmol)の撹拌溶液に、K2CO3(1.36g、9.86mmol)、TBAI(1.82g、4.93mmol)、CuI(0.13g、0.65mmol)およびPd(PPh3)2Cl2(0.23g、0.32mmol)を窒素雰囲気下、室温で添加した。反応混合物を窒素で3回脱気し、100℃で3時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE中の58%EAで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-1-イル}アゼチジン-1-カルボキシレート(1.20g、61%)を淡黄色固体として得た。MS ESI C30H33F2N7O4[M+H]+についての計算値、594.26、実測値594.34;1H NMR(400 MHz,CDCl3)δ 8.02(s,1H),7.19(d,J=8.0Hz,1H),4.91(s,1H),4.54(s,1H),4.32(t,J=7.8Hz,3H),3.43-3.39(m,1H),3.29(s,3H),1.48(s,18H),1.29-1.23(m,2H),1.13-1.06(m,2H).
ステップ2:tert-ブチル3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-1-イル}アゼチジン-1-カルボキシレート
EtOH(10.00mL)およびDMSO(2.00mL)中のtert-ブチル3-{5-[(tert-ブトキシカルボニル(メチル)アミノ-4-シアノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-1-イル}アゼチジン-1-カルボキシレート(0.60g、1.01mmol)および30%H2O2(0.36mL、3.53mmol)の撹拌溶液に、LiOH(2.32mL、1.16mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、0℃で30分間、室温で40分間撹拌した。得られた混合物をEA(10.00mL)で希釈した。残渣を水(3×5mL)で洗浄した。合わせた有機層をブライン(2×5mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-3%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル3-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-1-イル}アゼチジン-1-カルボキシレート(0.49g、78%)を淡黄色固体として得た。MS ESI C30H35F2N7O5[M+H]+についての計算値612.27、実測値612.35。
ステップ3:1-(アゼチジン-3-イル)-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド塩酸塩
DCM(10.00mL)中のtert-ブチル3-{5-[(tert-ブトキシカルボニル(メチル)アミノ]-4-カルバモイル-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]ピラゾール-1-イル}アゼチジン-1-カルボキシレート(0.46g、0.79mmol)の撹拌溶液に、HCl(EA中で4M)(10.00mL)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、1-(アゼチジン-3-イル)-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド塩酸塩(0.32g、粗製)を淡黄色固体として得た。MS ESI C20H20ClF2N7O[M+H-HCl]+についての計算値412.16、実測値412.10。
ステップ4:3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(1-(2-フルオロアクリロイル)アゼチジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DCM(6.00mL)中の1-(アゼチジン-3-イル)-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド塩酸塩(0.33g、0.67mmol)および2-フルオロプロパ-2-エン酸(85.38mg、0.94mmol)の撹拌溶液に、HOBT(0.14g、1.02mmol)、EDCI(0.20g、1.02mmol)およびDIEA(0.43g、3.38mmol)を0℃で滴下した。反応混合物を室温で20分間撹拌した。残渣を、DCM中のMeOH(0-4%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆相フラッシュによってさらに精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:30分で5Bから35B、検出器:UV 254/210nm。所望の生成物を含有する分画を合わせ、濃縮して、3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(1-(2-フルオロアクリロイル)アゼチジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(84.80mg、25%)を白色固体として得た。MS ESI C23H20F3N7O2[M+H]+についての計算値484.16、実測値484.15;1H NMR(400 MHz,CDCl3)δ 7.97(s,1H),7.19(d,J=8.2Hz,1H),7.10(s,1H),6.72(s,1H),5.74(d,J=3.1Hz,1H),5.67-5.40(m,1H),5.33-5.26(m,1H),5.17-4.98(m,2H),4.81(s,1H),4.68-4.66(m,1H),4.55(t,J=9.6Hz,1H),3.40-3.36(m,1H),2.96(s,3H),1.30-1.20(m,2H),1.15-1.06(m,2H).
ステップ4:3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(1-(2-フルオロアクリロイル)アゼチジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DCM(6.00mL)中の1-(アゼチジン-3-イル)-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド塩酸塩(0.33g、0.67mmol)および2-フルオロプロパ-2-エン酸(85.38mg、0.94mmol)の撹拌溶液に、HOBT(0.14g、1.02mmol)、EDCI(0.20g、1.02mmol)およびDIEA(0.43g、3.38mmol)を0℃で滴下した。反応混合物を室温で20分間撹拌した。残渣を、DCM中のMeOH(0-4%)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆相フラッシュによってさらに精製した:カラム:Spherical C18、20-40μm、40g、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:30分で5Bから35B、検出器:UV 254/210nm。所望の生成物を含有する分画を合わせ、濃縮して、3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-(1-(2-フルオロアクリロイル)アゼチジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(84.80mg、25%)を白色固体として得た。MS ESI C23H20F3N7O2[M+H]+についての計算値484.16、実測値484.15;1H NMR(400 MHz,CDCl3)δ 7.97(s,1H),7.19(d,J=8.2Hz,1H),7.10(s,1H),6.72(s,1H),5.74(d,J=3.1Hz,1H),5.67-5.40(m,1H),5.33-5.26(m,1H),5.17-4.98(m,2H),4.81(s,1H),4.68-4.66(m,1H),4.55(t,J=9.6Hz,1H),3.40-3.36(m,1H),2.96(s,3H),1.30-1.20(m,2H),1.15-1.06(m,2H).
実施例174:1-((3S,5R)-1-アクリロイル-5-(ヒドロキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(ヒドロキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C25H26FN7O3[M+H]+についての計算値492.21、実測値492.10;1H NMR(400 MHz,DMSO-d6)δ 8.37(s,1H),7.96-7.76(m,1H),7.65(d,J=9.4Hz,1H),7.50(s,1H),6.77(d,J=18.5Hz,1H),6.73-6.53(m,2H),6.17-5.95(m,1H),5.69-5.36(m,1H),5.30-5.08(m,1H),5.04-4.83(m,1H),4.34-4.19(m,1H),4.09-3.74(m,2H),3.71-3.44(m,3H),2.96-2.72(m,3H),2.63-2.57(m,1H),2.40-2.26(m,1H),1.14-1.08(m,2H),1.08-1.02(m,2H).
実施例175:tert-ブチル3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
THF(1.80mL)中の1-(アゼチジン-3-イル)-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド塩酸塩(0.18g、0.42mmol)およびDIEA(0.13g、1.05mmol)の撹拌混合物に、塩化アクリロイル(34.30mg、0.37mmol)を0℃で滴下した。反応混合物を窒素雰囲気下、0℃で10分間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆相フラッシュによってさらに精製した:カラム:YMC-Actus Triart C18 ExRS、30mm×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:8分で25Bから45B、254nm、RT1:8分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド(19.90mg、10%)をオフホワイトの固体として得た。MS ESI C23H22FN7O2[M+H]+についての計算値448.18、実測値448.05;1H NMR(300 MHz,CDCl3)δ 8.01(d,J=5.3Hz,2H),7.34(d,J=8.9Hz,1H),6.44-6.35(m,1H),6.25-6.21(m,1H),5.76-5.71(m,1H),5.29(s,1H),4.98(s,1H),4.67-4.46(m,3H),3.44-3.36(m,1H),2.97(d,J=5.2Hz,3H),2.03(s,1H),1.33-1.15(m,3H),1.09(s,2H).
実施例176:1-((3S,5R)-1-アクリロイル-5-(フルオロメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(フルオロメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C25H25F2N7O2[M+H]+についての計算値494.20、実測値494.45;1H NMR(400 MHz,DMSO-d6)δ 8.56(s,1H),7.72(t,J=102.6Hz,3H),7.14-6.42(m,3H),6.23-6.14(m,1H),5.71-5.64(m,1H),5.26-5.18(m,1H),4.89-4.34(m,3H),4.17-3.67(m,2H),3.51(s,1H),2.96(d,J=5.2Hz,3H),2.79-2.64(m,1H),2.39-2.37(m,1H),1.20-0.95(m,4H).
実施例177:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C23H23F2N7O3[M+H]+についての計算値484.18、実測値484.30;1H NMR(400 MHz,DMSO-d6)δ 13.07(s,1H)8.41(s,1H),7.66-7.30(m,2H),6.86-6.41(m,3H),6.17-6.02(m,1H),5.69-.5.56(m,1H),5.28-5.16(m,1H),4.58-4.35(m,1H),4.09-3.71(m,2H),3.66-3.43(m,2H),3.38-3.25(m,3H),2.97-3.20(m,3H),2.63-2.51(m,1H),2.37-2.25(m,1H).
実施例178:1-((3S,5R)-1-アクリロイル-5-(フルオロメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(フルオロメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C25H26FN7O2[M+H]+についての計算値476.21、実測値476.15;1H NMR(400 MHz,CDCl3)δ 8.11(s,2H),7.52(d,J=4Hz,1H),6.96(s,1H),6.78(s,1H),6.47-6.44(m,2H),5.79-5.74(m,1H),5.39-5.34(m,2H),5.05-4.91(m,1H),4.69-4.44(m,2H),4.20-4.07(m,2H),3.44(s,1H),3.08-1.82(m,3H),1.44-1.39(m,1H),1.37-1.25(m,1H),1.24(d,J=4Hz,2H),1.10(s,2H).
実施例179:1-((3S,5R)-1-アクリロイル-5-(フルオロメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(フルオロメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C25H24F3N7O2[M+H]+についての計算値512.19、実測値512.35;1H NMR(400 MHz,CDCl3)δ 8.00(s,1H),7.19-7.08(m,2H),6.50-6.41(m,2H),5.86-5.74(m,1H),5.41-5.19(m,2H),5.06-4.90(dd,J=4,4Hz,1H),4.68-4.44(m,2H),4.19-4.14(m,1H),4.14-4.06(m,1H),3.43-3.73(m,1H),3.06(s,3H),2.90-2.82(m,1H),2.44-2.39(m,1H),1.27-1.23(m,2H),1.12-1.07(m,2H).
実施例180:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:1-(tert-ブチル)2-メチル(2S,4R)-4-(ベンジルオキシ)ピロリジン-1,2-ジカルボキシレート
DMF(300.00mL)中の1-(tert-ブチル)2-メチル(2S,4R)-4-ヒドロキシピロリジン-1,2-ジカルボキシレート(30.00g、0.12mol)およびBnBr(23.01g、0.13mol)の撹拌溶液に、NaH(鉱油中で60%)(6.36g、0.16mol)を窒素雰囲気下、0℃で小分けにして添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。得られた混合物を0℃にて水(100mL)で希釈し、EA(3×300mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮して、1-(tert-ブチル)2-メチル(2S,4R)-4-(ベンジルオキシ)ピロリジン-1,2-ジカルボキシレート(40.00g、97%)を黄色油状物として得た。MS ESI C18H25NO5[M+H]+についての計算値336.17、実測値336.20。
ステップ2:tert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-(ヒドロキシメチル)ピロリジン-1-カルボキシレート
THF(400.00mL)中の1-(tert-ブチル)2-メチル(2S,4R)-4-(ベンジルオキシ)ピロリジン-1,2-ジカルボキシレート(40.00g、0.12mol)の撹拌溶液に、LiBH4(11.69g、0.53mol)を窒素雰囲気下、0℃で小分けにして添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。得られた混合物に水(200mL)を添加し、0℃にてNH4Cl(400mL)でクエンチした。水層をEA(3×500mL)で抽出した。合わせた有機層を水(2×400mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、PE中のEA(50-100%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、tert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-(ヒドロキシメチル)ピロリジン-1-カルボキシレート(23.00g、62%)を黄色油状物として得た。MS ESI C17H25NO4[M+H-100]+についての計算値208.18、実測値208.05;1H NMR(400 MHz,DMSO-d6)δ 7.62-7.19(m,5H),4.72-4.56(m,1H),4.46(d,J=4.3Hz,2H),4.32-4.09(m,2H),3.39-3.10(m,4H),2.04(d,J=19.8Hz,2H),1.40(s,9H).
ステップ3:tert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-[(メタンスルホニルオキシ)メチル]ピロリジン-1-カルボキシレート
DCM(220.00mL)中のtert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-(ヒドロキシメチル)ピロリジン-1-カルボキシレート(22.00g、71.57mmol)およびTEA(29.84mL、0.21mol)の撹拌溶液に、MsCl(8.31mL、0.11mol)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で1.5時間撹拌した。得られた混合物を0℃にて水(100mL)で希釈した。水層をDCM(3×300mL)で抽出した。合わせた有機層を水(2×200mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮して、tert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-[(メタンスルホニルオキシ)メチル]ピロリジン-1-カルボキシレート(27.00g、97%)を黄色油状物として得た。MS ESI C18H27NO6S[M+H-100]+についての計算値286.16、実測値286.05。
ステップ4:tert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-(フルオロメチル)ピロリジン-1-カルボキシレート
THF(270.00mL)中のtert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-[(メタンスルホニルオキシ)メチル]ピロリジン-1-カルボキシレート(27.00g、70.04mmol)の撹拌溶液に、TBAF(54.94g、0.21mol)を室温で滴下した。反応混合物を70℃で16時間撹拌した。得られた混合物を冷却し、減圧下で濃縮した。残渣を、PE中のEA(0-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、tert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-(フルオロメチル)ピロリジン-1-カルボキシレート(18.00g、83%)を白色固体として得た。MS ESI C17H24FNO3[M+H-100]+についての計算値210.17、実測値210.20;1H NMR(400 MHz,CDCl3)δ 7.42-7.35(m,1H),7.35-7.28(m,4H),4.70-4.65(m,3H),4.48-4.33(m,1H),4.16(d,J=33.1Hz,2H),3.67-3.39(m,2H),2.28-2.12(m,2H),1.49(s,9H).
ステップ5:tert-ブチル(2S,4R)-2-(フルオロメチル)-4-ヒドロキシピロリジン-1-カルボキシレート
MeOH(180.00mL)中のtert-ブチル(2S,4R)-4-(ベンジルオキシ)-2-(フルオロメチル)ピロリジン-1-カルボキシレート(18.00g、58.18mmol)およびPd/C(水中で10%wt)(3.71g、3.49mmol)の撹拌溶液に、EA中の4M HCl(1.80mL、31.53mmol)を室温で滴下した。反応混合物を水素雰囲気下、室温で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをMeOH(2x100mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、PE中のEA(30-80%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、減圧下で濃縮して、tert-ブチル(2S,4R)-2-(フルオロメチル)-4-ヒドロキシピロリジン-1-カルボキシレート(12.00g、94%)をオフホワイトの油状物として得た。MS ESI C10H18FNO3[M+H-56]+についての計算値164.13、実測値164.05;1H NMR(400 MHz,CDCl3)δ 4.75-4.35(m,3H),4.13(d,J=17.8Hz,1H),3.48(d,J=10.9Hz,2H),2.25-2.00(m,3H),1.49(s,9H).
ステップ6:tert-ブチル(2S,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(フルオロメチル)ピロリジン-1-カルボキシレート
THF(100.00mL)中の3,5-ジブロモ-1H-ピラゾール-4-カルボニトリル(11.44g、45.61mmol)およびtert-ブチル(2S,4R)-2-(フルオロメチル)-4-ヒドロキシピロリジン-1-カルボキシレート(10.00g、45.60mmol)の撹拌溶液に、PPh3(14.36g、54.73mmol)を窒素雰囲気下、室温で添加した。反応混合物を窒素雰囲気下、室温で30分間撹拌した。上記混合物に、DIAD(11.99g、59.29mmol)を0℃で滴下した。反応混合物を室温でさらに2時間撹拌した。得られた混合物を0℃にて水(100mL)で希釈し、EA(3×300mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮して、tert-ブチル(2S,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(フルオロメチル)ピロリジン-1-カルボキシレート(20.00g、97%)をオフホワイトの油状物として得た。MS ESI C14H17Br2FN4O2[M+H-56]+についての計算値394.97、396.97、398.97、実測値394.90、396.90、398.90;1H NMR(400 MHz,CDCl3)δ 6.50-6.45(m,1H),5.15-4.87(m,2H),4.78-4.65(m,1H),4.27-3.94(m,1H),3.63(s,1H),2.72-2.65(m,1H),1.29(s,9H).
ステップ7:tert-ブチル(2S,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(フルオロメチル)ピロリジン-1-カルボキシレート
NMP(100.00mL)中のtert-ブチル(2S,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(フルオロメチル)ピロリジン-1-カルボキシレート(20.00g、44.23mmol)の撹拌混合物に、CH3NH2(THF中で1M)(84.05mL、0.17mol)を添加した。反応混合物を50℃で16時間撹拌した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相A、水中の10mmol/L NH4HCO3、移動相B:ACN;30分で20Bから80Bの勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2S,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(フルオロメチル)ピロリジン-1-カルボキシレート(15.00g、84%)を黄色固体として得た。MS ESI C15H21BrFN5O2[M+H]+についての計算値402.09、404.09、実測値402.15、404.15;1H NMR(400 MHz,CDCl3)δ 4.95-4.85(m,1H),4.78-4.65(m,1H),4.58-4.35(m,2H),4.15-3.96(m,2H),3.43(d,J=14.1Hz,1H),3.42-3.25(m,3H),2.89-2.51(m,1H),2.65-2.36(m,1H),1.47(s,9H).
ステップ8:tert-ブチル(2S,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート
DCM(150.00mL)中のtert-ブチル(2S,4S)-4-[3-ブロモ-4-シアノ-5-(メチルアミノ)ピラゾール-1-イル]-2-(フルオロメチル)ピロリジン-1-カルボキシレート(15.00g、37.29mmol)、Et3N(15.55mL、0.11mol)およびDMAP(0.46g、3.73mmol)の撹拌溶液に、Boc2O(16.28g、74.58mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物に水(100mL)を添加し、DCM(3×300mL)で抽出した。合わせた有機層を水(2×200mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮して、tert-ブチル(2S,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(16.00g、85%)を白色固体として得た。MS ESI C20H29BrFN5O4[M+H-112]+についての計算値390.14、392.14、実測値389.95、391.95;1H NMR(400 MHz,CDCl3)δ 4.87-4.45(m,3H),4.28-4.16(m,2H),3.62-3.56(m,1H),3.33-3.21(m,3H),2.67-2.56(m,2H),1.54(s,18H).
ステップ9:tert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート
DMF(80.00mL)中tert-ブチル(2S,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(8.00g、15.92mmol)、トリメチルシリルアセチレン(4.69g、47.77mmol)、Pd(PPh3)2Cl2(1.12g、1.59mmol)およびCuI(0.61g、3.18mmol)の撹拌溶液に、TEA(6.64mL、47.77mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で2時間撹拌した。得られた混合物を冷やし、真空下で濃縮した。残渣を、PE中のEA(10-50%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(7.40g、89%)を白色固体として得た。MS ESI C25H38FN5O4Si[M+H]+についての計算値520.27、実測値520.45;1H NMR(400 MHz,CDCl3)δ 4.74-4.51(m,3H),4.42-4.91(m,2H),3.61-3.49(m,1H),3.24(s,3H),2.53(d,J=36.9Hz,2H),1.47(s,18H),0.30(s,9H).
ステップ10:tert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート
THF(74.00mL)中のtert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-[2-(トリメチルシリル)エチニル]ピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(7.40g、14.24mmol)の撹拌溶液に、TBAF(5.58mL、21.36mmol)を0℃で滴下した。反応混合物を室温で1時間撹拌した。残渣を、PE中のEA(20-90%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(4.70g、73%)を黄色固体として得た。MS ESI C22H30FN5O[M+H]+についての計算値448.23、実測値448.20。
ステップ11:tert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート
DMSO(2.50mL)およびEtOH(25.00mL)中のtert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノ-3-エチニルピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(2.50g、5.58mmol)およびNaOH(水中で1M)(6.42mL、6.42mmol)の撹拌溶液に、H2O2(水中で30%)(0.46mL、19.55mmol)を0℃で滴下した。反応混合物を0℃で1時間撹拌した。得られた混合物を水(25mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層を水(2×25mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、PE中のEA(50-100%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(2.40g、92%)を白色固体として得た。MS ESI C22H32FN5O5[M+H]+についての計算値466.24、実測値466.20。
ステップ12:3-エチニル-1-[(3S,5S)-5-(フルオロメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩
DCM(10.00mL)中のtert-ブチル(2S,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}-2-(フルオロメチル)ピロリジン-1-カルボキシレート(2.30g、4.94mmol)の撹拌溶液に、HCl(EA中で4M)(10.00mL、0.17mol)を0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮して、3-エチニル-1-[(3S,5S)-5-(フルオロメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(1.48g、粗製)を黄色固体として得た。MS ESI C12H16FN5O[M+H-2HCl]+についての計算値266.13、実測値266.15。
ステップ13:3-エチニル-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DCM(23.00mL)中の3-エチニル-1-[(3S,5S)-5-(フルオロメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(1.48g、4.90mmol)およびDIEA(2.56mL、14.71mmol)の撹拌溶液に、塩化アクリロイル(0.40g、4.42mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物に水(20mL)を添加し、EA(3×50mL)で抽出した。合わせた有機層をブライン(1×20mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、DCM中のMeOH(0-5%)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチニル-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(1.30g、83%)を黄色固体として得た。MS ESI C15H18FN5O2[M+H]+についての計算値320.14、実測値320.10。
ステップ14:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(9.30mL)中の3-エチニル-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.30g、0.94mmol)、1-シクロプロピル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(0.29g、0.94mmol)、CuI(35.78mg、0.18mmol)およびPd(PPh3)2Cl2(65.94mg、0.09mmol)の撹拌混合物に、TEA(0.28g、2.77mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた溶液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム:C18シリカゲル、移動相:水中のACN(10mmol/L NH4HCO3)、30分で5%から70%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(95.90mg、20%)をオフホワイトの固体として得た。MS ESI C25H25F2N7O2[M+H]+についての計算値494.21、実測値494.35;1H NMR(400 MHz,CDCl3)δ 8.01(d,J=6.7Hz,2H),7.34(d,J=8.9Hz,1H),7.15(s,1H),6.68(s,1H),6.43(d,J=8.4Hz,2H),5.77(m,1H),5.39(s,1H),4.96-4.87(m,1H),4.82(d,J=23.0Hz,1H),4.77-4.60(m,1H),4.51(s,1H),4.21-4.07(m,1H),3.43-3.37(m,1H),3.01(s,3H),2.81(q,J=10.3Hz,1H),2.59(s,1H),1.30-1.16(m,2H),1.09(q,J=3.9,3.4Hz,2H).
実施例181:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.50mL、32.30mmol)中の3-エチニル-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.25g、0.78mmol)、1-シクロプロピル-4,6-ジフルオロ-5-ヨード-1,3-ベンゾジアゾール(0.25g、0.78mmol)、CuI(29.82mg、0.16mmol)およびPd(PPh3)2Cl2(54.95mg、0.08mmol)の撹拌溶液に、TEA(0.24g、2.35mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム:C18シリカゲル、移動相:水中のACN、40分で5%から35%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5S)-5-(フルオロメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(91.70mg、22%)を白色固体として得た。MS ESI C25H24F3N7O2[M+H]+についての計算値512.19、実測値512.10;1H NMR(400 MHz,CDCl3)δ 7.98(s,1H),7.19(d,J=8.3Hz,1H),7.10(s,1H),6.65-6.36(m,2H),5.79-5.73(m,1H),5.43(s,1H),5.00-4.59(m,3H),4.58-4.44(m,1H),4.12-4.07(m,1H),3.42-3.38(m,1H),3.01(s,3H),2.87-2.44(m,2H),1.30-1.21(m,2H),1.21-1.05(m,2H).
実施例182:3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-5-(メトキシメチル)-1-プロピオロイルピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMF(20.00mL)中のtert-ブチル(2R,4S)-4-{5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-カルバモイル-3-エチニルピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシレート(2.00g、4.18mmol)、CuI(0.16g、0.83mmol)、Pd(PPh3)2Cl2(0.29g、0.41mmol)および1-シクロプロピル-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(1.27g、4.18mmol)の撹拌混合物に、TEA(1.75mL、12.56mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を室温まで冷まし、減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(2.20g、80%)をオフホワイトの固体として得た。MS ESI C33H42FN7O6[M+H]+についての計算値652.32、実測値652.85;1H NMR(400 MHz,CDCl3)δ 10.42(s,1H),8.11-7.91(m,2H),7.33(d,J=8.9Hz,1H),5.52(s,1H),5.07(s,1H),4.23(s,1H),3.90-3.50(m,3H),3.38(s,1H),3.19-3.12(m,6H),2.66(s,1H),2.29(s,1H),1.82(s,1H),1.48(t,J=7.4Hz,18H),1.28-1.17(m,2H),1.11-0.79(m,2H).
ステップ2:3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド塩酸塩
DCM(11.00mL)中のtert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(2.20g、3.37mmol)の撹拌混合物に、EA(22.00mL)中の4M HClを窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。沈殿した固体を濾過によって回収し、DCM(3x20mL)で洗浄した。オフホワイトの粗生成物3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド塩酸塩(1.60g、粗製)をさらに精製することなく次のステップに直接使用した。MS ESI C23H27ClFN7O2[M+H-HCl]+についての計算値452.21、実測値452.30。
ステップ3:3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-5-(メトキシメチル)-1-プロピオロイルピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(3.00mL)中の3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド塩酸塩(0.30g、0.61mmol)およびHATU(0.35g、0.92mmol)の撹拌混合物に、DIEA(0.43mL、2.46mmol)およびプロピオール酸(50.85mg、0.73mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム:C18シリカゲル、移動相:水中のACN(10mmol/L NH4HCO3)、30分で10%から50%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-5-(メトキシメチル)-1-プロピオロイルピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(71.50mg、23%)をオフホワイトの固体として得た。MS ESI C26H26FN7O3[M+H]+についての計算値504.21、実測値504.20;1H NMR(400 MHz,CDCl3)δ 8.01(s,2H),7.36(s,1H),7.11(s,1H),6.80(s,1H),5.50-5.32(m,2H),4.51-4.47(m,1H),4.25-4.06(m,1H),4.05-3.84(m,1H),3.69-3.63(m,1H),3.44-3.35(m,5H),3.10-2.99(m,4H),2.97-2.69(m,1H),2.39-2.35(m,1H),1.21-1.19(m,2H),1.06(s,2H).
実施例183:1-((3S,5R)-1-(ブタ-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-(ブタ-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C27H28FN7O3[M+H]+についての計算値518.22、実測値518.30;1H NMR(400 MHz,CDCl3)δ 8.02-7.93(m,2H),7.31-7.26(m,1H),7.11(s,1H),6.80(s,1H),5.49-5.31(m,2H),4.49-4.43(m,1H),4.21-4.02(m,1H),4.02-3.81(m,1H),3.65-3.62(m,1H),3.43-3.32(m,5H),3.02(d,J=16.6Hz,3H),2.93-2.66(m,1H),2.36-2.33(m,1H),2.02(s,1H),1.98(s,2H),1.21-1.18(m,2H),1.15-1.02(m,2H).
実施例184:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-イノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-イノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H25F2N7O3[M+H]+についての計算値522.20、実測値522.35;1H NMR(400 MHz,CDCl3)δ 7.96(d,J=4Hz,1H),7.19-7.16(m,1H),7.08(s,1H),6.85-6.73(m,1H),5.49-5.35(m,2H),4.59-4.48(m,1H),4.26-4.21(m,1H),4.07-4.02(m,1H),3.80-3.78(m,1H),3.60-3.57(m,1H),3.44-3.36(m,4H),3.09-3.01(m,4H),2.98-2.76(m,1H),2.42-2.33(m,1H),1.28-1.22(m,2H),1.11-1.07(m,2H).
実施例185:1-[(3S,5R)-1-(ブタ-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(4.37mL)中の3-((1-シクロプロピル-4,6-ジフルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド塩酸塩(0.43g、0.93mmol)の撹拌溶液に、2-ブチン酸(78.25mg、0.93mmol)、HATU(0.53g、1.39mmol)およびDIEA(0.62mL、3.55mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Shield RP18 OBD Column、30×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:8分で28%Bから45%B;254/210nm、RT1:6.65分。所望の生成物を含有する分画を合わせ、濃縮して、1-[(3S,5R)-1-(ブタ-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.14g、28%)を白色固体として得た。MS ESI C27H27F2N7O3[M+H]+についての計算値536.21、実測値536.15;1H NMR(400 MHz,CDCl3)δ 7.97(s,1H),7.19-7.16(m,1H),7.08(s,1H),5.49-5.32(m,2H),4.55-4.45(m,1H),4.20-3.99(m,1H),3.93-3.86(m,1H),3.77-3.56(m,1H),3.43-3.40(m,2H),3.37(s,3H),3.06(s,3H),2.96-2.74(m,1H),2.39-2.30(m,1H).
実施例186:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C24H23F2N7O2[M+H]+についての計算値480.49、実測値480.35;1H NMR(400 MHz,DMSO-d6)δ 8.41-8.39(s,1H),7.58-7.50(d,J=8.8Hz,2H),6.80-6.54(m,3H),6.17-6.10(m,1H),5.77-5.65(m,1H),5.24-5.09(m,1H),4.09-3.80(m,2H),3.78-3.69(m,1H),3.68-3.49(m,2H),2.97-2.90(m,3H),2.42-2.40(m,1H),2.32-2.30(m,1H),1.17-1.04(m,4H).
実施例187:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H25F2N7O3[M+H]+についての計算値510.20、実測値510.15;1H NMR(400 MHz,DMSO-d6)δ 8.42(s,1H),7.59(d,J=8.8Hz,2H),6.80-6.54(m,3H),6.17-6.05(m,,1H),5.68(m,1H),5.31-5.24(m,1H),5.02-4.93(m,1H),4.34-4.22(m,1H),4.09-4.05(m,1H),3.94-3.73(m,1H),3.68-3.54(m,1H),3.59-3.47(m,2H),3.29-2.96(m,3H),2.68-2.53(m,1H),2.48-2.25(m,1H),1.22-1.01(m,4H).
実施例188:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-イノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-イノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C24H22FN7O2[M+H]+についての計算値460.18、実測値460.15;1H NMR(400 MHz,CDCl3)δ 8.28(d,J=12.8Hz,1H),8.05(s,1H),7.37(d,J=8.6Hz,1H),7.10(s,1H),5.43(s,1H),5.07(s,1H),4.21-4.01(m,2H),3.81(d,J=90.7Hz,2H),3.45(s,1H),3.10(d,J=15.7Hz,1H),3.02(d,J=11.0Hz,3H),2.68(s,1H),2.42(s,1H),1.29-1.24(m,2H),1.14(s,2H).
実施例189:5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H25F2N7O3[M+H]+についての計算値510.20、実測値510.10;1H NMR(400 MHz,DMSO-d6)δ 8.42(s,1H),7.59(d,J=8.8Hz,1H),7.45(s,1H),6.78-6.65(m,2H),6.57-6.48(m,1H),6.16-6.07(m,1H),5.69-5.61(m,1H),5.12(q,J=8.6,7.9Hz,1H),4.56-4.34(m,1H),4.00-3.65(m,2H),3.57-3.48(m,2H),3.42(d,J=5.7Hz,1H),3.37-3.32(m,3H),2.51-2.42(m,1H),2.31-2.22(m,1H),1.17-1.03(m,4H).
実施例190:5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C23H21F2N7O2[M+H]+についての計算値466.17、実測値466.35;1H NMR(400 MHz,DMSO-d6)δ 8.42(s,1H),7.59(d,J=8.9Hz,1H),7.45(s,1H),6.72-6.53(m,4H),6.19-6.14(m,1H),5.72-5.66(m,1H),4.05-4.93(m,1H),4.09-3.74(m,2H),3.71-3.48(m,3H),2.45-2.33(m,1H),2.28-2.25(m,1H),1.16-1.02(m,4H).
実施例191:3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C24H26ClN7O3[M+H]+についての計算値496.18、実測値496.35;1H NMR(400 MHz,CDCl3)δ 8.43(s,1H),8.01(d,J=4Hz,2H),7.49(s,1H),6.86(s,1H),6.75-6.57(m,2H),6.20-6.14(m,1H),5.71-5.67(m,1H),5.38-5.24(m,1H),5.10(t,J=12Hz,1H),4.95(t,J=12.6Hz,3H),4.38(d,J=4Hz,2H),4.33-4.28(m,2H),3.92-3.76(m,3H),3.71-3.66(m,1H),3.55-3.49(m,1H),1.41(t,J=12Hz,3H).
実施例192:3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-3-((トリメチルシリル)エチニル)-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート
DMF(28.00mL)中のtert-ブチル3-{3-ブロモ-5-[(tert-ブトキシカルボニル)(メチル)アミノ]-4-シアノピラゾール-1-イル}アゼチジン-1-カルボキシレート(2.80g、6.13mmol)、Pd(PPh3)2Cl2(0.43g、0.61mmol)およびCuI(0.23g、1.21mmol)の撹拌混合物に、TEA(2.56mL、18.42mmol)およびトリメチルシリルアセチレン(1.81g、18.41mmol)を室温で添加した。反応混合物を窒素で3回脱気し、80℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-3-((トリメチルシリル)エチニル)-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート(2.90g、94%)を淡黄色固体として得た。MS ESI C23H35N5O4Si[M+H-112]+についての計算値362.25、実測値362.00;1H NMR(400 MHz,CDCl3)δ 4.85(s,1H),4.47(s,1H),4.28(d,J=7.9Hz,3H),3.23(s,3H),1.46(d,J=3.0Hz,18H),0.29(s,9H).
ステップ2:tert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-3-エチニル-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート
THF(19.88mL)中のtert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-3-((トリメチルシリル)エチニル)-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート(2.84g、5.99mmol)の撹拌溶液に、TBAF(8.99mL、8.99mmol)を窒素雰囲気下、室温で滴下した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。残渣を、PE/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-3-エチニル-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート(2.00g、83%)をオフホワイトの固体として得た。MS ESI C20H27N5O4[M+H-56]+についての計算値346.21、実測値346.10。
ステップ3:tert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-3-エチニル-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート
EtOH(20.00mL)およびDMSO(4.0mL)中のtert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-シアノ-3-エチニル-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート(2g、4.98mmol)の撹拌溶液に、H2O2(30%)(1.35mL、17.43mmol)および0.5M NaOH(11.46mL、5.73mmol)を窒素雰囲気下、0℃で滴下した。次いで、反応混合物を0℃で1時間撹拌した。得られた混合物をEtOAc(3×100mL)で抽出した。合わせた有機層をブライン(3×50mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、DCM/EA(2/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製し、所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-3-エチニル-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート(2.00g、95%)をオフホワイトの固体として得た。MS ESI C20H29N5O5[M+H]+についての計算値420.22、実測値420.20。
ステップ4:1-(アゼチジン-3-イル)-3-エチニル-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩
DCM(10.00mL)中のtert-ブチル3-(5-((tert-ブトキシカルボニル)(メチル)アミノ)-4-カルバモイル-3-エチニル-1H-ピラゾール-1-イル)アゼチジン-1-カルボキシレート(2.10g、4.51mmol)の撹拌溶液に、EA中の4M HCl(20.00mL)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。沈殿した固体を濾過によって回収し、DCM(3x50mL)で洗浄した。粗生成物1-(アゼチジン-3-イル)-3-エチニル-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(0.77g、粗製)をさらに精製することなく次のステップに直接使用した。MS ESI C10H15Cl2N5O[M+H-2HCl]+についての計算値220.07、実測値220.25。
ステップ5:3-エチニル-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
DCM(10.00mL)中の1-(アゼチジン-3-イル)-3-エチニル-5-(メチルアミノ)ピラゾール-4-カルボキサミド二塩酸塩(0.77g、1.85mmol)の撹拌溶液に、塩化アクリロイル(5.90mL、1.48mmol)およびDIEA(1.29mL、7.38mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を窒素雰囲気下、0℃で10分間撹拌した。得られた混合物を水(30.00mL)で希釈し、EA(3×50mL)で抽出した。合わせた有機層をブライン(3×20mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、3-エチニル-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド(0.30g、60%)を白色固体として得た。MS ESI C13H15N5O2[M+H]+についての計算値274.12、実測値274.10;1H NMR(400 MHz,クロロホルム-d)δ 6.80(s,2H),6.45-6.29(m,1H),6.34-6.17(m,2H),6.14-6.02(m,1H),4.56(s,3H),4.03-3.88(m,1H),3.85-3.65(m,1H),3.50(d,J=2.7Hz,1H),2.95(s,3H).
ステップ6:3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
DMF(2.00mL)中の3-エチニル-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド(80.00mg、0.29mmol)、6-クロロ-1-エチル-5-ヨード-1,3-ベンゾジアゾール(89.73mg、0.29mmol)、CuI(11.15mg、0.06mmol)およびPd(PPh3)2Cl2(20.55mg、0.03mmol)の撹拌混合物に、TEA(0.12mL、0.88mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を水(20.00mL)で希釈した。得られた混合物をEA(3×50mL)で抽出した。合わせた有機層をブライン(3×30mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:Xselect CSH OBD Column 30×150mm 5μm、移動相A:水(0.1%FA)、移動相B:ACN、流量:60mL/分、勾配:8分で20%Bから30%B;波長:220nm、RT1:6.62分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド(28.10mg、21%)を白色固体として得た。MS ESI C22H22ClN7O2[M+H]+についての計算値452.15、実測値452.35;1H NMR(400 MHz,DMSO-d6)δ 8.43(s,1H),8.06(s,1H),8.01(s,1H),7.52(s,1H),6.87(s,1H),6.83-6.67(m,1H),6.45-6.29(m,1H),6.24-6.09(m,1H),5.80-5.68(m,1H),5.51-5.39(m,1H),4.73-4.52(m,2H),4.47-4.22(m,4H),2.91(d,J=5.7Hz,3H),1.41(t,J=7.2Hz,3H).
実施例193:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C23H21F2N7O2[M+H]+についての計算値466.17、実測値466.40;1H NMR(400 MHz,DMSO-d6)δ 8.43(s,1H),7.60(d,J=8.7Hz,2H),6.76(q,J=6.8,6.2Hz,2H),6.46-6.23(m,1H),6.24-6.07(m,1H),5.79-5.65(m,1H),5.51-5.34(m,1H),4.72-4.56(m,2H),4.39(t,J=9.2Hz,1H),4.37-4.23(m,1H),3.61-3.46(m,1H),2.91(d,J=5.7Hz,3H),1.17-1.03(m,4H).
実施例194:5-アミノ-3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
DCM(22.00mL)中の5-アミノ-3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド)(0.44g、0.89mmol)の溶液に、BBr3(1.11g、4.44mmol)を-20℃で滴下した。反応混合物を室温まで温め、2時間撹拌した。得られた混合物をNaHCO3(水溶液)でクエンチし、減圧下で濃縮した。残渣生成物を、以下の条件を用いる逆相フラッシュによって精製した:C18シリカゲル、移動相:水中のACN(10mmol/L NH4HCO3)、30分で5%から70%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、5-アミノ-3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(0.18g、42%)をオフホワイトの固体として得た。MS ESI C23H24ClN7O3[M+H]+についての計算値482.17、実測値482.30;1H NMR(400 MHz,DMSO-d6)δ 8.43(s,1H),8.01(d,J=6.2Hz,2H),7.35(s,1H),6.96-6.46(m,4H),6.22-6.12(m,1H),5.69-5.67(m,1H),5.14-5.05(m,1H),4.89-4.88(m,1H),4.33-4.27(m,3H),4.01-3.66(m,2H),3.58-3.55(m,1H),3.55-3.45(m,1H),2.48-2.11(m,2H),1.41(t,J=7.2Hz,3H).
実施例195:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H26ClN7O3[M+H]+についての計算値508.18、実測値508.10;1H NMR(400 MHz,CDCl3)δ 8.08(d,J=13.3Hz,2H),7.68(s,1H),7.20(s,1H),6.57-6.40(m,2H),5.78-5.66(m,1H),5.52-5.21(m,2H),4.55(d,J=73.4Hz,1H),4.23-4.12(m,1H),4.10-3.94(m,2H),3.73-3.62(m,1H),3.41-3.28(m,1H),3.03(s,3H),2.81-2.66(m,1H),2.21-2.13(m,1H),1.29-1.18(m,2H),1.18-1.06(m,2H).
実施例196:5-アミノ-3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C24H26ClN7O3[M+H]+についての計算値496.19、実測値496.15;1H NMR(400 MHz,CDCl3)δ 8.10(d,J=4.6Hz,1H),7.98(s,1H),7.51(s,1H),7.16(s,1H),6.46-6.42(m,2H),5.73-5.70(m,1H),5.64(s,2H),5.46(s,1H),5.08-5.03(m,1H),4.59(d,J=9.1Hz,1H),4.25-4.20(m,2H),4.09-3.83(m,3H),3.51-3.46(m,1H),3.39(s,3H),2.69(m,1H),2.36-2.31(m,1H),1.58(t,J=7.3Hz,3H).
実施例197:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C23H22ClN7O2[M+H]+についての計算値464.15、実測値464.35;1H NMR(400 MHz,CDCl3)δ 8.23(s,1H),7.88(s,1H),7.23-7.09(m,1H),6.72(s,1H),6.48-6.27(m,1H),6.30-6.13(m,1H),5.75-5.72(m,1H),5.42(s,1H),5.33-5.20(m,1H),4.99(d,J=8.1Hz,1H),4.63-4.52(m,3H),3.41(s,1H),2.97(s,3H),1.26(t,J=7.4Hz,2H),1.11(s,2H).
実施例198:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-イノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
オフホワイトの固体としての3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-イノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(19.30mg、19%)。MS ESI C25H24FN7O3[M+H]+についての計算値490.20、実測値490.20;1H NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.96(d,J=2.6Hz,1H),7.63(s,1H),7.47(s,1H),6.72-6.65(m,2H),5.16-5.13(m,1H),4.98-4.96(m,1H),4.39(s,1H),4.24(s,1H),3.89-3.82(m,1H),3.76-3.70(m,2H),3.52-3.49(m,2H),2.95(d,J=1.5Hz,3H),2.63-2.59(m,1H),2.42-2.33(m,1H),1.10-1.06(m,4H).
実施例199:5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C24H24ClN7O3[M+H]+についての計算値494.16、実測値494.15;1H NMR(400 MHz,DMSO-d6)δ 8.39(s,1H),8.02(s,1H),7.88(s,1H),7.35(s,1H),6.84-6.45(m,4H),6.18-6.14(m,1H),5.69-5.67(m,1H),5.20-4.85(m,2H),4.38-4.28(m,1H),4.03-3.66(m,2H),3.56-3.51(m,2H),3.48(d,J=5.2Hz,1H),2.44-2.27(m,2H),1.17-1.02(m,4H).
実施例200:5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H26ClN7O3[M+H]+についての計算値508.19、実測値508.35;1H NMR(400 MHz,CDCl3)δ 8.05(d,J=27.4Hz,2H),7.67(s,1H),7.16(s,1H),6.51-6.36(m,2H),5.75-5.72(m,1H),5.60(s,2H),5.44(s,1H),5.09-5.05(m,1H),4.60(d,J=8.9Hz,1H),4.06(d,J=8.2Hz,2H),3.99-3.86(m,1H),3.54-3.50(m,1H),3.39(s,4H),2.72-2.65(m,1H),2.47-2.29(m,1H),1.25-1.20(m,2H),1.10-1.06(m,2H).
実施例201:5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S.5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C24H23F2N7O3[M+H]+についての計算値496.19、実測値496.15;1H NMR(300 MHz,DMSO-d6)δ 8.43(s,1H),7.61(d,J=8.8Hz,1H),7.47(s,1H),6.70(s,3H),6.59-6.53(m,1H),6.17(d,J=16.6Hz,1H),5.69(d,J=10.4Hz,1H),5.13(s,2H),4.32(d,J=15.6Hz,1H),3.98-3.71(m,2H),3.59-3.40(m,3H),2.43(d,J=57.7Hz,2H),1.11(t,J=7.7Hz,4H).
実施例202:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C22H20FN7O2[M+H]+についての計算値434.17、実測値434.14;1H NMR(300 MHz,DMSO-d6)δ 8.38(s,1H),8.01(d,J=6.4Hz,1H),7.66(d,J=9.5Hz,1H),7.40(s,1H),6.66(s,3H),6.43-6.39(m,1H),6.23-6.11(m,1H),5.79-5.67(m,1H),5.29(s,1H),4.65(t,J=8.6Hz,1H),4.52(d,J=7.7Hz,1H),4.35(t,J=9.3Hz,1H),4.21(t,J=7.5Hz,1H),3.54(d,J=6.3Hz,1H),1.16-1.00(m,4H).
実施例203:3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
白色固体としての3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1-((3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(44.40mg、30%)。MS ESI C29H32FN7O4[M+H]+についての計算値562.25、実測値562.45;1H NMR(400 MHz,CDCl3)δ 8.02(d,J=50.8Hz,2H),7.33(s,1H),7.11(s,1H),6.79(s,1H),5.63-5.24(m,1H),4.62-4.39(m,2H),4.22-3.98(m,2H),3.88(d,J=9.6Hz,1H),3.70-3.50(m,1H),3.40(d,J=13.5Hz,5H),3.03(d,J=10.3Hz,3H),2.94-2.70(m,1H),2.40-2.25(m,1H),1.60(d,J=12.3Hz,6H),1.35-0.97(m,4H).
実施例204:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-{1-[(2E)-4-(ジメチルアミノ)ブタ-2-エノイル]アゼチジン-3-イル}-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-{1-[(2E)-4-(ジメチルアミノ)ブタ-2-エノイル]アゼチジン-3-イル}-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H29FN8O2[M+H]+についての計算値505.24、実測値505.40;1H NMR(400 MHz,CDCl3)δ 7.98(d,J=4.8Hz,2H),7.26(s,1H),7.12(s,1H),6.92-6.85(m,1H),6.75-6.67(m,1H),6.46(s,1H),5.36(s,1H),5.33-5.22(m,1H),4.95(t,J=7.4Hz,1H),4.72(t,J=8.5Hz,1H),4.61(t,J=8.3Hz,1H),4.51(t,J=9.4Hz,1H),3.50(s,2H),3.37-3.32(m,1H),2.95(d,J=5.9Hz,3H),2.61(s,6H),1.28-1.16(m,2H),1.10-1.02(m,2H).
実施例205:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(エチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-(エチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート
NMP(10.00mL)中のtert-ブチル(2R,4S)-4-(3,5-ジブロモ-4-シアノピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(5.00g、10.77mmol)の撹拌溶液に、THF中の2.0Mエチルアミン溶液(19.98mL、39.96mmol)を窒素雰囲気下、室温で滴下した。反応混合物を窒素雰囲気下、50℃で16時間撹拌した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム、C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、20分で25%から40%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-(エチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.80g、82%)を淡黄色油状物として得た。MS ESI C17H26BrN5O3[M+H]+についての計算値428.12、430.12、実測値428.20、430.20。
ステップ2:tert-ブチル(2R,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(エチル)アミノ]-4-シアノピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DCM(37.00mL)中のtert-ブチル(2R,4S)-4-[3-ブロモ-4-シアノ-5-(エチルアミノ)ピラゾール-1-イル]-2-(メトキシメチル)ピロリジン-1-カルボキシレート(3.69g、8.61mmol)およびTEA(2.62g、25.84mmol)の撹拌溶液に、Boc2O(3.76g、17.23mmol)およびDMAP(0.11g、0.86mmol)を窒素雰囲気下、0℃で小分けにして添加した。反応混合物を窒素雰囲気下、室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(1/2)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(エチル)アミノ]-4-シアノピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシレート(2.30g、50%)を黄色油状物として得た。MS ESI C22H34BrN5O5[M+H]+についての計算値528.17、530.17、実測値528.20、530.20。
ステップ3:tert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(エチル)アミノ)-4-シアノ-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMF(20.00mL)中のtert-ブチル(2R,4S)-4-{3-ブロモ-5-[(tert-ブトキシカルボニル)(エチル)アミノ]-4-シアノピラゾール-1-イル}-2-(メトキシメチル)ピロリジン-1-カルボキシレート(2.07g、3.91mmol)、1-シクロプロピル-6-フルオロ-5-[2-(トリメチルシリル)エチニル]-1,3-ベンゾジアゾール(1.28g、4.70mmol)、CuI(0.15g、0.78mmol)、Pd(PPh3)2Cl2(0.27g、0.39mmol)およびK2CO3(1.62g、11.75mmol)の撹拌混合物に、TBAI(2.17g、5.87mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で2時間撹拌した。得られた混合物を水(30mL)で希釈し、EA(3×30mL)で抽出した。合わせた有機層をブライン(3×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、DCM中の4%MeOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(エチル)アミノ)-4-シアノ-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.70g、67%)を暗黄色固体として得た。MS ESI C34H42FN7O5[M+H]+についての計算値648.32、実測値648.70;1H NMR(400 MHz,CDCl3)δ 8.02(s,1H),7.67-7.63(m,1H),7.55-7.52(m,1H),7.46-7.41(m,1H),5.00(s,1H),4.22(s,1H),3.70-3.69(m,1H),3.35(d,J=8.8Hz,4H),2.95(s,1H),2.88(s,1H),2.71(s,1H),2.62(s,1H),2.32(s,1H),2.21(s,1H),1.47(d,J=4.3Hz,21H),1.19(d,J=2.3Hz,2H),1.14-1.01(m,2H).
ステップ4:tert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(エチル)アミノ)-4-カルバモイル-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート
DMSO(2.60mL)およびEtOH(12.70mL)中のtert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(エチル)アミノ)-4-シアノ-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(1.53g、2.36mmol)の撹拌溶液に、NaOH(0.11g、2.71mmol)およびH2O2(30%)(0.32g、9.44mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。次いで、反応混合物を25℃まで温め、室温でさらに0.5時間撹拌した。得られた混合物を水(10mL)で希釈し、EA(3×10mL)で抽出した。合わせた有機層をブライン(5×10mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、EA中の65%EtOHで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、tert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(エチル)アミノ)-4-カルバモイル-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.96g、61%)を暗黄色固体として得た。MS ESI C34H44FN7O6[M+H-100]+についての計算値566.33、実測値566.35;1H NMR(400 MHz,CDCl3)δ8.04(s,1H),7.99(s,1H),7.35(d,J=8.7Hz,1H),7.19(s,1H),5.62(s,1H),5.20(s,2H),4.23(s,1H),4.04-4.01(m,1H),3.72(d,J=9.0Hz,2H),3.49(s,1H),2.85(s,1H),2.62(s,3H),2.58(s,1H),2.30(s,1H),2.22(s,1H),1.59-1.41(m,13H),1.37(d,J=3.3Hz,8H),1.15-1.03(m,2H),0.92-0.81(m,2H).
ステップ5:3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(エチルアミノ)-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド塩酸塩
EA中で4M HCl(g)(4.17mL、16.68mmol)中のtert-ブチル(2R,4S)-4-(5-((tert-ブトキシカルボニル)(エチル)アミノ)-4-カルバモイル-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-1-イル)-2-(メトキシメチル)ピロリジン-1-カルボキシレート(0.50g、0.75mmol)およびDCM(5.00mL)の撹拌溶液に、アルゴン雰囲気下、室温で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/PE(1/5、500mL)での研和によって精製して、3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(エチルアミノ)-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド塩酸塩(0.61g、粗製)を淡黄色固体として得た。MS ESI C24H28FN7O2[M+H]+についての計算値466.23、実測値466.35。
ステップ6:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(エチルアミノ)-1H-ピラゾール-4-カルボキサミド
3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(エチルアミノ)-1-((3S,5R)-5-(メトキシメチル)ピロリジン-3-イル)-1H-ピラゾール-4-カルボキサミド塩酸塩(0.20g、0.43mmol)および2.5M K2CO3(0.71mL、5.13mmol)の撹拌混合物に、THF(0.40mL)中の塩化アクリロイル(38.88mg、0.43mmol)を0℃で滴下した。反応混合物を0℃で10分間撹拌した。得られた混合物をEA(3×10mL)で抽出した。合わせた有機層をブライン(2×5mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(20/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(エチルアミノ)-1H-ピラゾール-4-カルボキサミド(74.50mg、33%)をオフホワイトの固体として得た。MS ESI C27H30FN7O3[M+H]+についての計算値520.24、実測値520.20;1H NMR(400 MHz,CDCl3)δ 8.10-7.84(m,2H),7.31(d,J=9.0Hz,1H),7.11(s,1H),6.85-6.07(m,3H),5.76-5.66(m,1H),5.87-4.90(m,2H),4.56(d,J=9.1Hz,1H),4.04(m,3H),3.52-3.40(m,1H),3.37(d,J=3.9Hz,4H),3.35-3.21(m,2H),2.70-2.30(m,2H),1.30(t,J=7.2Hz,3H),1.21-1.02(m,4H).
実施例206:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C26H28FN7[M+H]+についての計算値506.55、実測値506.40;1H NMR(400 MHz,CDCL3)δ 7.90-7.85(m,1H),7.40-7.32(m,1H),7.10-7.07(s,1H),6.61-6.35(m,2H),5.80-5.74(m,1H),5.50(m,3H),5.10-4.88(m,1H),4.65-4.42(m,1H),4.10-3.93(m,2H),3.90-3.89(m,1H),3.56-3.45(m,1H),3.40-3.35(m,3H),3.32-3.30(s,1H),3.02-2.75(m,3H),2.68-2.58(m,1H),2.40-2.39(m,1H),1.42-1.23(m,2H),1.20-1.13(s,2H).
実施例207:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
オフホワイトの固体としての5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(ヒドロキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(79.60mg、45%)。MS ESI C24H24FN7O3[M+H]+についての計算値478.20、実測値478.35;1H NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.96(d,J=6.5Hz,1H),7.65(d,J=9.4Hz,1H),7.34(s,1H),7.05-6.37(m,4H),6.18-6.14(m,1H),5.69-5.67(m,1H),5.13-5.11(m,1H),5.06-4.88(m,1H),4.32(d,J=19.2Hz,1H),4.05-3.84(m,2H),3.75-3.50(m,3H),2.39(s,2H),1.12-1.09(m,2H),1.06(t,J=4.4Hz,2H).
実施例208:5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
オフホワイトの固体としての5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド(64.20mg、55%)。MS ESI C22H20ClN7O2[M+H]+についての計算値450.14、実測値450.30;1H NMR(400 MHz,DMSO-d6)δ 8.40(s,1H),8.07(s,1H),7.89(s,1H),7.39(s,1H),6.74(s,1H),6.64(s,2H),6.43-6.39(m,1H),6.16-6.10(m,1H),5.72-5.68(m,1H),5.32-5.21(m,1H),4.65(t,J=8.6Hz,1H),4.51(t,J=7.2Hz,1H),4.35(t,J=9.3Hz,1H),4.23-4.12(m,1H),3.68-3.54(m,1H),1.13-0.99(m,4H).
実施例209:5-アミノ-3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(6-クロロ-1-エチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C21H20ClN7O2[M+H]+についての計算値438.14、実測値438.05;1H NMR(400 MHz,DMSO-d6)δ 8.43(s,1H),8.06(s,1H),8.01(s,1H),7.38(s,1H),6.75(s,1H),6.64(s,2H),6.42-6.33(m,1H),6.22-6.16(m,1H),5.65-5.72(m,1H),5.28(q,J=7.6,6.6Hz,1H),4.63(d,J=8.5Hz,1H),4.53-4.46(m,1H),4.31(q,J=7.3Hz,3H),4.22(d,J=5.6Hz,1H),1.42(t,J=7.2Hz,3H).
実施例210:5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[1-(プロパ-2-エノイル)アゼチジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C22H19F2N7O2[M+H]+についての計算値452.16、実測値452.35;1H NMR(400 MHz,DMSO-d6)δ 8.42(s,1H),7.60(d,J=8.8Hz,1H),7.48(s,1H),6.67(s,3H),6.43-6.38(m,1H),6.16-6.12(m,1H),5.74-5.71(m,1H),5.32-5.25(m,1H),4.64(m,1H),4.56-4.52(m,1H),4.35(t,J=9.2Hz,1H),4.27-4.21(m,1H),3.57-3.52(m,1H),1.19-1.02(m,4H).
実施例211:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H24F3N7O3[M+H]+についての計算値528.19、実測値528.40;1H NMR(400 MHz,CDCl3)δ 8.08(s,2H),7.48(s,1H),7.07(s,1H),6.60-5.98(m,3H),5.76(t,J=6.1Hz,1H),5.48(d,J=58.1Hz,3H),4.96(q,J=8.0Hz,1H),4.68(d,J=9.2Hz,1H),4.53-4.36(m,1H),4.09-4.06(m,2H),3.98(d,J=9.9Hz,1H),3.41(s,1H),2.84-2.72(m,1H),2.49-2.31(m,J=13.0,7.1Hz,1H),1.24(d,J=6.7Hz,2H),1.09(s,2H).
実施例212:5-アミノ-3-[2-(1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H25F2N7O3[M+H]+についての計算値510.20、実測値510.35;1H NMR(400 MHz,CDCl3)δ 8.11(s,1H),8.03(s,1H),7.63-7.51(m,2H),6.90(s,1H),6.54-6.40(m,2H),6.26(s,1H),5.75(t,J=6.1Hz,1H),5.48(d,J=51.1Hz,3H),5.02-4.93(m,1H),4.68(d,J=9.0Hz,1H),4.51-4.36(m,1H),4.14-3.84(m,3H),3.52-3.34(m,1H),2.84-2.72(m,1H),2.51-2.31(m,1H),1.29-1.17(m,2H),1.20-1.07(m,2H).
実施例213:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-{[1-(プロパ-2-エノイル)アゼチジン-3-イル]メチル}ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(メチルアミノ)-1-{[1-(プロパ-2-エノイル)アゼチジン-3-イル]メチル}ピラゾール-4-カルボキサミド.MS ESI C24H24FN7O2[M+H]+についての計算値462.20、実測値462.30;1H NMR(400 MHz,CDCl3)δ 8.01-7.96(m,2H),7.33(d,J=8Hz,1H),7.12(s,1H),6.76(s,1H),6.39-6.34(m,1H),6.24-6.16(m,1H),5.71-5.68(m,1H),5.36(s,1H),4.40-4.34(m,3H),4.28-4.23(m,1H),4.19-4.15(m,1H),3.93-3.89(m,1H),3.42-3.37(m,1H),3.33-3.29(m,1H),3.02(s,3H),1.25-1.18(m,2H),1.11-1.07(m,2H).
実施例214:5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C26H28ClN7O3[M+H]+についての計算値522.19、実測値522.15;1H NMR(400 MHz,CDCl3)δ 7.92(d,J=5.0Hz,1H),7.56(s,1H),7.20(s,1H),6.58-6.35(m,2H),5.76-5.62(m,3H),5.55(s,1H),5.17-4.88(m,1H),4.62-4.37(m,1H),4.11-3.94(m,2H),3.89-3.80(m,1H),3.47-3.39(m,1H),3.38(d,J=2.0Hz,3H),3.22-3.14(m,1H),2.68(s,4H),2.37-2.28(m,1H),1.29-1.20(m,2H),1.11-1.03(m,2H).
実施例215:5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(ジフルオロメトキシ)メチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H23F4N7O3[M+H]+についての計算値546.18、実測値546.15;1H NMR(400 MHz,CDCl3)δ 7.97-7.80(s,1H),7.19-7.18(m,1H),7.10-6.90(m,1H),6.44-6.40(m,2H),6.30-6.10(m,1H),5.83-5.70(m,1H),5.60-5.49(m,3H),4.95-4.90(m,1H),4.70-4.68(m,1H),4.42-4.40(m,1H),4.17-3.93(m,3H),3.39-3.30(m,1H),2.85-2.71(m,1H),2.39-2.35(m,1H),1.25-1.20(m,2H),1.10-1.05(m,2H).
実施例216:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(シクロプロピルアミノ)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-(シクロプロピルアミノ)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C29H30FN6O3[M+H]+についての計算値532.24、実測値532.45;1H NMR(400 MHz,CDCl3)δ 7.97(d,J=5.8Hz,2H),7.40(d,J=2.3Hz,1H),7.34(d,J=8.5Hz,1H),7.10(s,1H),6.56-6.39(m,2H),6.15-5.84(m,1H),5.76-5.69(m,1H),5.34(s,1H),4.59-4.57(m,1H),4.13-3.99(m,2H),3.91-3.87(m,1H),3.54-3.44(m,1H),3.36(d,J=10.4Hz,4H),3.01-2.74(m,2H),2.35-2.32(m,1H),1.24-1.16(m,2H),1.09-1.05(m,2H),0.94-0.83(m,2H),0.81-0.73(m,2H).
実施例217:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(2-ヒドロキシプロパン-2-イル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(2-ヒドロキシプロパン-2-イル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O3[M+H]+についての計算値520.24、実測値520.20;1H NMR(400 MHz,CDCl3)δ 8.36(s,1H),7.95(d,J=4.6Hz,1H),7.64(d,J=4.9Hz,1H),7.47(s,1H),6.72-6.59(m,3H),6.18-6.13(m,1H),5.71-5.68(m,1H),5.41-5.35(m,1H),4.96(s,1H),4.40-4.31(m,1H),4.19-4.15(m,3H),4.09-3.49(m,3H),2.48-2.35(m,2H),1.17-1.03(m,10H).
実施例218:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H28FN7O3[M+H]+についての計算値506.22、実測値506.45;1H NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.95-7.91(m,1H),7.64(d,J=9.4Hz,1H),7.49(s,1H),6.76(s,1H),6.74-6.64(m,1H),6.67-6.54(m,1H),6.22-6.10(m,1H),5.68-5.60(m,1H),5.33-5.30(m,1H),4.90(d,J=4.5Hz,1H),4.16(d,J=7.5Hz,1H),4.03-4.01(m,1H),3.92-3.73(m,2H),3.52-3.50(m,1H),2.95(t,J=5.7Hz,3H),2.47-2.20(m,2H),1.17-1.01(m,7H).
実施例219:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H28FN7O3[M+H]+についての計算値506.22、実測値506.40;1H NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.95-7.90(m,1H),7.64(d,J=9.4Hz,1H),7.48(s,1H),6.88-6.50(m,3H),6.14-6.10(m,1H),5.66-5.62(m,1H),5.33-5.18(m,1H),4.99(d,J=19.8Hz,1H),4.50-4.17(m,1H),3.99-3.96(m,2H),3.70-3.69(m,1H),3.52-3.50(m,1H),2.98-2.92(m,3H),2.44-2.24(m,2H),1.15-0.98(m,7H).
実施例220:1-((3S,5R)-1-アクリロイル-5-((R)-1-ヒドロキシエチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-((R)-1-ヒドロキシエチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C27H30ClN7O3[M+H]+についての計算値536.21、実測値536.35;1H NMR(400 MHz,DMSO-d6)δ 7.86(s,1H),7.71(s,1H),7.53(s,1H),6.94-6.78(m,1H),6.77-6.53(m,2H),6.20-6.08(m,1H),5.73-5.65(m,1H),5.44-5.28(m,1H),5.06-5.00(m,1H),4.36-3.66(m,3H),3.33(s,2H),2.95(m,3H),2.60(s,3H),2.54-2.18(m,2H),1.28-1.16(m,2H),1.09-1.04(m,5H).
実施例221:1-((3S,5R)-1-アクリロイル-5-((S)-1-ヒドロキシエチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ラセミ生成物(0.30g)を、以下の条件を用いるPrep-SFCによって精製した:カラム:CHIRAL ART Cellulose-SC、2×25cm、5μm、移動相A:Hex:DCM=1:1(0.5% 2M NH3-MeOH)、移動相B:EtOH、流量:20mL/分、勾配:12分で50%Bから50%B;波長:220/254nm;RT2:10.04分;試料溶媒:EtOH:DCM=1:1;注入体積:0.3mL;RT2:10.04分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-((S)-1-ヒドロキシエチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.12g、35%)を白色固体として得た。MS ESI C27H30ClN7O3[M+H]+についての計算値536.21、実測値536.45;1H NMR(400 MHz,DMSO-d6)δ 7.85(s,1H),7.71(s,1H),7.51(s,1H),6.99-6.50(m,3H),6.20-6.13(m,1H),5.70-5.62(m,1H),5.31-5.19(m,1H),5.03-4.95(m,1H),4.50-4.20(m,1H),4.06-3.95(m,2H),3.75-3.66(m,1H),3.40-3.34(m,1H),3.02-2.95(m,3H),2.60(s,3H),2.37-2.30(m,2H),1.25-1.18(m,2H),1.11-0.99(m,5H).
実施例222:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H28ClN7O3[M+H]+についての計算値522.19、実測値522.15;1H NMR(400 MHz,CDCl3)δ 8.39(s,1H),8.02(s,1H),7.88(s,1H),7.49(s,1H),6.84(s,1H),6.72-6.57(m,2H),6.21-6.13(m,1H),5.71-5.66(m,1H),5.39-5.32(m,1H),5.09-4.89(m,1H),4.27-4.16(m,1H),3.92-3.76(m,2H),3.57-3.52(m,1H),2.96(t,J=12Hz,3H),2.39-2.09(m,3H),1.15-1.04(m,7H).
実施例223:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H28ClN7O3[M+H]+についての計算値522.19、実測値522.20;1H NMR(400 MHz,CDCl3)δ 8.41(s,1H),8.03(s,1H),7.89(s,1H),7.52(s,1H),6.87-6.57(m,3H),6.15(d,J=10Hz,1H),5.71-5.64(m,1H),5.28(s,1H),5.04-4.97(m,1H),4.43-4.30(m,1H),4.05-3.97(m,2H),3.74-3.68(m,1H),3.55(s,1H),2.97-2.95(m,3H),2.51(s,1H),2.35(s,1H),1.13-1.01(m,7H).
実施例224:3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O3.[M+H]+についての計算値520.24、実測値520.25;1H NMR(400 MHz,DMSO-d6)δ 7.79(d,J=6.4Hz,1H),7.50(d,J=9.6Hz,2H),6.78-6.54(m,3H),6.23-6.11(m,1H),5.73-5.61(m,1H),5.41-5.29(m,1H),5.06-4.89(m,1H),4.33-3.70(m,4H),2.95(t,J=5.7Hz,3H),2.59(s,3H),2.46(s,3H),1.25-1.11(m,2H),1.11-1.02(m,5H).
実施例225:3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O3[M+H]+についての計算値520.24、実測値520.60;1H NMR(400 MHz,DMSO-d6)δ 7.78(d,J=6.3Hz,1H),7.49(d,J=9.7Hz,2H),6.83-6.54(m,3H),6.15(d,J=17.0Hz,1H),5.72-5.61(m,1H),5.31-5.20(m,1H),5.01-4.94(m,1H),4.48-4.24(m,1H),4.06-3.90(m,2H),3.79-3.68(m,1H),3.01-2.89(m,3H),2.59(s,3H),2.49(s,1H),2.40-2.29(m,1H),1.25-1.12(m,2H),1.12-1.05(m,2H),1.03(s,3H).
実施例226:3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C29H32ClN7O4[M+H]+についての計算値578.22、実測値578.30;1H NMR(400 MHz,クロロホルム-d)δ 8.17-8.06(m,2H),7.69(s,1H),7.19(s,1H),6.84(s,1H),5.56-5.29(m,2H),4.48(d,J=8.7Hz,1H),4.18(d,J=10.6,8.1Hz,1H),4.06(d,J=17.8,7.3Hz,1H),3.94-3.85(m,1H),3.79-3.53(m,1H),3.47-3.36(m,3H),3.04(d,J=14.9Hz,3H),2.86-2.74(m,1H),2.17(s,2H),1.60(d,J=13.1Hz,6H),1.30-1.21(m,2H),1.15-1.07(m,2H).
実施例227:3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C30H34FN7O4[M+H]+についての計算値576.27、実測値576.30;1H NMR(400 MHz,クロロホルム-d)δ 7.82(t,J=7.4Hz,1H),7.13(s,1H),6.82(d,J=5.9Hz,1H),5.50-5.30(m,2H),4.47(d,J=8.8Hz,1H),4.21-4.12(m,1H),4.12-4.01(m,1H),3.92-3.83(m,1H),3.73-3.59(m,1H),3.40(d,J=13.0Hz,3H),3.29(s,1H),3.09-2.96(m,3H),2.75(d,J=4.2Hz,3H),2.43-2.28(m,2H),1.60(d,J=14.8Hz,6H),1.35-1.25(m,2H),1.10(s,2H).
実施例228:3-[2-(6-クロロ-1-シクロプロピル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロプロピル-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-1-(4-ヒドロキシ-4-メチルペント-2-イノイル)-5-(メトキシメチル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C30H34ClN7O4[M+H]+についての計算値592.24、実測値592.30;1H NMR(400 MHz,CDCl3)δ 7.93(s,1H),7.57(s,1H),7.28(s,1H),6.83(s,1H),5.48-5.35(m,2H),4.52-4.43(m,1H),4.18-4.13(m,2H),3.77-3.74(m,1H),3.70-3.54(m,1H),3.42-3.38(m,1H),3.23(s,2H),3.06-3.01(m,1H),2.69(s,4H),2.46(s,3H),2.40-2.30(m,2H),1.61-1.58(m,6H),1.31-1.29(m,2H),1.08(s,2H).
実施例230:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロブチル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロブチル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O3[M+H]+についての計算値520.24、実測値520.25;1H NMR(400 MHz,CDCl3)δ 8.13(d,J=25.1Hz,1H),8.00(d,J=5.9Hz,1H),7.17(d,J=9.4Hz,2H),6.81(s,1H),6.61-6.32(m,2H),5.75-5.68(m,1H),5.61(s,1H),5.57-5.22(m,1H),4.85-6.78(m,1H),4.64-4.37(m,1H),4.15-4.09(m,1H),4.06-4.00(m,1H),3.94-3.87(m,1H),3.56-3.42(m,1H),3.38(d,J=4.4Hz,3H),3.04(d,J=15.5Hz,3H),2.79-2.62(m,3H),2.58-2.50(m,2H),2.38-2.30(m,1H),2.09-2.01(m,2H).
実施例231:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロブチル-6-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロブチル-6-フルオロ-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C28H32FN7O3[M+H]+についての計算値534.26、実測値534.40;1H NMR(400 MHz,CDCl3)δ 7.88(d,J=6.2Hz,1H),7.34(d,J=10.3Hz,1H),7.13(s,1H),6.84(d,J=6.3Hz,1H),6.44(d,J=7.9Hz,2H),5.78-5.67(m,1H),5.59-5.46(m,1H),5.33(d,J=26.1Hz,1H),4.89-4.82(m,1H),4.57(d,J=8.9Hz,1H),4.15-4.10(m,1H),4.06-4.00(m,1H),3.92(d,J=9.8Hz,1H),3.57-3.43(m,1H),3.39(d,J=3.9Hz,3H),3.13-2.98(m,3H),2.92-2.70(m,3H),2.65(s,5H),2.44-2.25(m,1H),2.09-2.01(m,2H).
実施例232:3-[2-(6-クロロ-1-シクロブチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-1-シクロブチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30ClN7O3[M+H]+についての計算値536.21、実測値536.15;1H NMR(400 MHz,CDCl3)δ 8.10(s,2H),7.72-7.67(m,1H),7.21(s,1H),6.83(s,1H),6.57-6.39(m,2H),5.73-5.70(m,1H),5.56-5.48(m,1H),5.36-5.28(m,1H),4.85-4.77(m,1H),4.57(d,J=12Hz,1H),4.15-3.96(m,2H),3.93-3.90(m,1H),3.52-3.38(m,4H),3.07-2.97(m,3H),2.77-2.66(m,3H),2.61-2.51(m,2H),2.41-2.29(m,1H),2.11-2.02(m,2H).
実施例233:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロブチル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロブチル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C28H32ClN7O3[M+H]+についての計算値550.23、実測値550.30;1H NMR(400 MHz,メタノール-d4)δ 7.93-7.90(s,1H),7.86-7.70(m,1H),6.71-6.70(m,1H),6.32-6.20(m,1H),5.78-5.70(m,1H),5.44-5.30(m,1H),5.07-5.01(m,1H),4.69-4.52(m,1H),4.16-4.04(m,2H),3.95-3.78(m,1H),3.56-3.50(m,1H),3.41-3.40(m.3H),3.04-3.01(m,3H),2.84-2.80(m,2H),2.75-2.57(m,6H),2.46-2.40(m,1H),2.15-1.98(m,2H).
実施例234:3-{2-[6-フルオロ-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-{2-[6-フルオロ-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H28FN7O4[M+H]+についての計算値522.22、実測値522.25;1H NMR(400 MHz,CDCl3)δ 8.13(s,1H),8.04(s,1H),7.57(d,J=8.40Hz,1H),7.10(s,1H),6.83(s,1H),6.55-6.35(m,2H),5.74-5.70(m,1H),5.54-5.50(m,2H),5.48-5.26(m,3H),5.10-5.07(m,2H),4.56(d,J=8.40Hz,1H),4.14-4.10(m,1H),4.09-4.02(m,1H),3.93-3.90(m,1H),3.53-3.40(m,1H),3.37(d,J=4.40Hz,3H),3.04(d,J=14.40Hz,3H),2.70-2.68(m,1H),2.42-2.25(m,1H).
実施例235:3-{2-[6-フルオロ-2-メチル-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-{2-[6-フルオロ-2-メチル-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O4[M+H]+についての計算値536.23、実測値536.65;1H NMR(400 MHz,CDCl3)δ 7.93-7.88(m,2H),7.09(s,1H),6.83(s,1H),6.58-6.33(m,2H),5.75-5.70(m,1H),5.54-5.50(m,2H),5.31-5.27(m,3H),5.19-5.11(m,2H),4.60-4.37(m,1H),4.15-4.10(m,1H),4.06-4.02(m,1H),3.94-3.90(m,1H),3.53-3.41(m,1H),3.40-3.38(m,3H),3.08-2.95(m,3H),2.78-2.57(m,4H),2.43-2.26(m,1H).
実施例236:3-[2-(6-フルオロ-3-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-フルオロ-3-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H27FN6O3[M+H]+についての計算値491.21、実測値491.30;1H NMR(400 MHz,クロロホルム-d)δ 8.78(s,1H),8.36(d,J=6.7Hz,1H),7.90(s,1H),7.43(d,J=9.5Hz,1H),7.16-6.98(m,1H),6.84(s,1H),6.56-6.36(m,2H),5.71-5.68(m,1H),5.58-5.45(m,1H),5.41(s,1H),4.56(d,J=9.0Hz,1H),4.11(t,J=9.1Hz,1H),4.09-3.96(m,1H),4.00-3.87(m,1H),3.58-3.42(m,1H),3.37(d,J=4.8Hz,3H),3.08-3.00(m,3H),2.77-2.65(m,1H),2.55(s,3H),2.44-2.27(m,1H).
実施例237:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-1-イソプロピル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-1-イソプロピル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C26H30FN7O3[M+H]+についての計算値508.60、実測値508.40;1H NMR(400 MHz,CDCl3)δ 8.09(d,J=42.0Hz,2H),7.18(d,J=40.0Hz,2H),6.78(d,J=46.0Hz,1H),6.54-6.39(m,2H),5.72(dd,J=8.5,3.8Hz,1H),5.53-5.24(m,2H),4.60(dd,J=16.4,8.4Hz,2H),4.18-4.09(m,2H),3.92(dd,J=9.7,2.9Hz,1H),3.53-3.37(m,4H),3.05(d,J=15.5Hz,3H),2.78-2.66(m,1H),2.38-2.34(m,1H),1.66(d,J=6.7Hz,6H).
実施例238:3-{2-[6-フルオロ-1-(1-メチルシクロプロピル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-{2-[6-フルオロ-1-(1-メチルシクロプロピル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O3[M+H]+についての計算値520.24、実測値520.35;1H NMR(400 MHz,DMSO-d6)δ 8.43-8.41(s,1H),7.96-7.95(m,1H),7.74-7.59(m,1H),7.52-7.50(m,1H),6.87-6.53(m,3H),6.17-6.16(m,1H),5.69-5.67(m,1H),5.28-5.20(m,1H),4.59-4.35(m,1H),4.06-3.74(m,2H),3.68-3.43(m,2H),3.31-3.30(m,3H),2.96-2.94(m,3H),2.63-2.62(m,1H),2.30-2.28(m,1H),1.55-1.52(s,3H),1.19-1.17(m,2H),1.11-1.00(m,2H).
実施例239:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-(1-シアノシクロプロピル)-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-(1-シアノシクロプロピル)-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C27H27FN8O3[M+H]+についての計算値531.22、実測値531.30;1H NMR(400 MHz,クロロホルム-d)δ 8.02(s,2H),7.37(d,J=8.6Hz,1H),7.02(d,J=16.9Hz,1H),6.76(dd,J=45.9,6.1Hz,1H),6.57-6.35(m,2H),5.70(dd,J=8.4,3.9Hz,1H),5.60-5.14(m,2H),4.48(d,J=54.9Hz,1H),4.12-3.99(m,2H),3.90(dd,J=9.6,2.9Hz,1H),3.52-3.31(m,4H),3.03(dd,J=15.3,5.9Hz,3H),2.76-2.64(m,1H),2.40-2.28(m,1H),2.05-1.92(m,2H),1.84-1.72(m,2H).
実施例240:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H26FN7O3[M+H]+についての計算値492.21、実測値492.35;1H NMR(400 MHz,DMSO-d6)δ 8.38(s,1H),8.00-7.93(m,1H),7.65(d,J=9.20Hz,1H),7.37(s,1H),6.77-6.49(m,4H),6.18-6.10(m,1H),5.69-5.84(m,1H),5.14-4.66(m,2H),4.32-4.11(m,1H),3.97-3.77(m,2H),3.67-3.62(m,1H),3.53-3.49(m,1H),2.41-2.36(m,1H),2.29-2.22(m,1H),1.10-1.03(m,7H).
実施例241:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
ラセミ生成物1-((3S,5R)-1-アクリロイル-5-(1-ヒドロキシエチル)ピロリジン-3-イル)-5-アミノ-3-((1-シクロプロピル-6-フルオロ-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-4-カルボキサミド(0.10g)を、以下の条件を用いるPrep-CHIRAL-HPLCによって精製した:カラム:CHIRAL ART Cellulose-SC、2×25cm、5μm、移動相A:Hex(0.5% 2M NH3-MeOH)-HPLC、移動相B:MeOH:EtOH=1:1-HPLC、流量:20mL/分、勾配:25分で50%Bから50%B;波長:220/254nm;RT2:22.72分;試料溶媒:MeOH:DCM=1:1;注入体積:0.4mL;所望の生成物を含有する分画を合わせ、濃縮して、5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド(47.60mg、18%)をオフホワイトの固体として得た。MS ESI C25H26FN7O3[M+H]+についての計算値492.21、実測値492.30;1H NMR(400 MHz,DMSO-d6)δ 8.36(s,1H),7.96(d,J=6.40Hz,1H),7.64(d,J=10.40Hz,1H),7.37(s,1H),6.85-6.51(m,4H),6.20-6.06(m,1H),5.72-5.59(m,1H),5.14-4.87(m,2H),4.46-4.18(m,1H),4.11-3.77(m,2H),3.72-3.58(m,1H),3.54-3.48(m,1H),2.48-2.38(m,1H),2.30(s,1H),1.15-0.99(m,7H).
実施例242:5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H26ClN7O3[M+H]+についての計算値508.18、実測値508.40;1H NMR(400 MHz,CDCl3)δ 8.40(s,1H),8.00(s,1H),7.90(s,1H),6.71-6.51(m,1H),6.19-6.11(m,1H),5.72-5.57(m,1H),5.03(s,1H),4.27-4.14(m,1H),3.90-3.64(m,3H),3.54-3.50(m,1H),2.41-2.26(m,2H),1.13-1.03(m,7H).
実施例243:5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(6-クロロ-1-シクロプロピル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C25H26ClN7O3[M+H]+についての計算値508.18、実測値508.40;1H NMR(400 MHz,CDCl3)δ 8.40(s,1H),8.01(s,1H),7.90(s,1H),6.80-6.51(m,1H),6.16-6.10(m,1H),5.71-5.63(m,1H),5.05(s,1H),4.41(s,1H),4.05-3.84(m,2H),3.55-3.50(m,1H),2.67-2.47(m,1H),2.45-2.25(m,2H),1.14-1.08(m,4H),1.06-1.01(m,3H).
実施例244:1-((3S,5R)-1-アクリロイル-5-((R)-1-ヒドロキシエチル)ピロリジン-3-イル)-5-アミノ-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-((R)-1-ヒドロキシエチル)ピロリジン-3-イル)-5-アミノ-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-4-カルボキサミド.MS ESI C26H28ClN7O3[M+H]+についての計算値522.19、実測値522.25;1H NMR(400 MHz,クロロホルム-d)δ 7.91(s,1H),7.55(s,1H),7.14(s,1H),6.56-6.27(m,2H),5.94-5.49(m,3H),5.11(s,1H),4.52-3.86(m,4H),3.36-3.06(m,1H),2.69-2.65(m,3H),2.56(d,J=11.6Hz,1H),2.38(t,J=9.7Hz,1H),1.31-1.18(m,6H),1.07(s,2H).
実施例245:1-((3S,5R)-1-アクリロイル-5-((S)-1-ヒドロキシエチル)ピロリジン-3-イル)-5-アミノ-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-((S)-1-ヒドロキシエチル)ピロリジン-3-イル)-5-アミノ-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-1H-ピラゾール-4-カルボキサミド.MS ESI C26H28ClN7O3[M+H]+についての計算値522.19、実測値522.20;1H NMR(400 MHz,DMSO-d6)δ 7.86(s,1H),7.72(s,1H),7.38(s,1H),6.87-6.48(m,4H),6.17-6.10(m,1H),5.69-5.62(m,1H),5.18-4.86(m,2H),4.52-4.17(m,1H),4.06-3.98(m,1H),3.91-3.85(m,1H),3.69-3.62(m,1H),3.35(dd,J=7.1,3.8Hz,1H),2.60(s,3H),2.48-2.27(m,2H),1.26-1.15(m,2H),1.14-0.96(m,5H).
実施例246:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1R)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C26H28FN7O3[M+H]+についての計算値506.22、実測値506.35;1H NMR(400 MHz,CDCl3)δ 7.83(d,J=4Hz,1H),7.25(s,1H),7.09(s,1H),6.50-6.38(m,2H),5.75-5.72(m,3H),5.68(s,1H),5.53(s,1H),4.47-4.38(m,2H),4.15-4.04(m,2H),2.39(s,1H),2.71(s,3H),2.63-2.55(m,1H),2.39(s,1H),2.30-2.26(m,2H),2.24-2.21(m,3H),1.08(s,2H).
実施例247:5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
5-アミノ-3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-[(1S)-1-ヒドロキシエチル]-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C26H28FN7O3[M+H]+についての計算値506.22、実測値506.35;1H NMR(400 MHz,CDCl3)δ 7.82(d,J=4Hz,1H),7.26-7.23(m,1H),7.11(s,1H),6.45-6.40(m,2H),5.79-5.73(m,1H),5.73(s,2H),5.68(s,1H),5.50(s,1H),4.86-4.68(m,1H),4.52-4.45(m,1H),4.15-4.12(m,1H),4.05-4.01(m,1H),3.91-3.84(m,1H),3.28-3.21(m,1H),2.76-2.69(m,4H),2.31-2.15(m,1H),1.32-1.21(m,4H),1.09-1.05(m,2H).
実施例248:3-{2-[6-クロロ-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-{2-[6-クロロ-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H28ClN7O4[M+H]+についての計算値538.19、実測値538.25;1H NMR(400 MHz,クロロホルム-d)δ 8.12(d,J=5.1Hz,2H),7.88(d,J=4.6Hz,1H),7.20-7.15(m,1H),6.83(s,1H),6.55-6.35(m,2H),5.76-5.67(m,1H),5.51-5.48(m,2H),5.45(s,1H),5.27(t,J=7.6Hz,2H),5.08-5.01(m,2H),4.56(d,J=9.0Hz,1H),4.11(t,J=9.1Hz,1H),4.06-3.94(m,1H),3.90-3.87(m,1H),3.57-3.41(m,1H),3.37(d,J=5.2Hz,3H),3.03(d,J=15.6Hz,3H),2.78-2.65(m,1H),2.34-2.31(m,1H).
実施例249:3-{2-[6-クロロ-2-メチル-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-{2-[6-クロロ-2-メチル-1-(オキセタン-3-イル)-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30ClN7O4[M+H]+についての計算値552.20、実測値552.25;1H NMR(400 MHz,クロロホルム-d)δ 8.13(d,J=3.0Hz,1H),7.99(d,J=5.8Hz,1H),7.22(s,1H),6.83(d,J=6.0Hz,1H),6.55-6.35(m,2H),5.71-5.65(m,1H),5.58-5.44(m,2H),5.26(t,J=7.7Hz,2H),5.17-5.10(m,2H),4.56(d,J=9.1Hz,1H),4.10-4.05(m,1H),4.03(t,J=9.3Hz,1H),3.90-3.84(m,1H),3.55-3.40(m,1H),3.37(d,J=5.0Hz,3H),3.03-2.94(m,3H),2.78-2.65(m,1H),2.60(s,3H),2.34-2.28(m,1H).
実施例250:3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C27H30FN7O4[M+H]+についての計算値536.24、実測値536.50;1H NMR(400 MHz,CDCl3)δ 8.02-7.94(m,2H),7.32(d,J=9.20Hz,2H),6.53-6.37(m,2H),5.88-5.21(m,4H),4.58(d,J=9.20Hz,1H),4.07-3.81(m,3H),3.71-3.41(m,4H),3.39-3.22(m,6H),2.73-2.61(m,1H),2.40-2.24(m,1H),1.21-1.07(m,2H),1.06(d,J=7.20Hz,2H).
実施例251:3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-4,6-ジフルオロ-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C27H29F2N7O4[M+H]+についての計算値554.22、実測値554.25;1H NMR(400 MHz,CDCl3)δ 7.99(s,1H),7.17(d,J=8.00Hz,1H),6.56-6.38(m,2H),5.76-5.67(m,2H),5.48-5.39(m,1H),4.62-4.39(m,1H),4.03(d,J=8.10Hz,2H),3.88-3.85(m,1H),3.67(s,2H),3.52-3.42(m,1H),3.38(d,J=3.20Hz,4H),3.32(s,2H),2.96-2.60(m,1H),2.39-2.25(m,1H),1.25-1.20(m,2H),1.08(s,2H).
実施例252:3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-フルオロ-2-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-5-[(2-ヒドロキシエチル)アミノ]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]ピラゾール-4-カルボキサミド.MS ESI C28H32FN7O4[M+H]+についての計算値550.25、実測値550.40;1H NMR(400 MHz,CDCl3)δ 7.79(d,J=4Hz,1H),7.50(s,2H),6.79-6.58(m,3H),6.23-6.15(m,1H),5.71-5.68(m,1H),5.67-5.25(m,1H),4.90-4.86(m,1H),4.50-4.45(m,1H),4.05-4.01(m,1H),3.90-3.73(m,1H),3.62-3.56(m,3H),3.49-3.44(m,2H),3.36-3.27(m,5H),2.75-2.59(m,3H),2.44(d,J=4Hz,1H),2.30-2.26(m,1H),1.22-1.17(m,2H),1.06-1.02(m,2H).
実施例253:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-((2-ヒドロキシエチル)アミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-1-シクロプロピル-2-メチル-1H-ベンゾ[d]イミダゾール-5-イル)エチニル)-5-((2-ヒドロキシエチル)アミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C28H32ClN7O4[M+H]+についての計算値566.22、実測値566.35;1H NMR(400 MHz,CDCl3)δ 7.93(d,J=5.6Hz,1H),7.58(s,1H),7.44(s,1H),6.44-6.42(m,2H),5.86-5.70(m,2H),5.60(s,1H),5.48-5.44(m,1H),4.61-4.58(m,1H),4.06-3.95(m,2H),3.87(dd,J=9.8,3.2Hz,1H),3.66(s,2H),3.47-3.42(m,1H),3.38(d,J=2.5Hz,3H),3.31(s,2H),3.21-3.16(m,1H),2.95-2.68(m,4H),2.32-2.30(m,1H),1.29-1.25(m,2H),1.10-1.02(m,2H).
実施例254:3-[2-(6-フルオロ-2H-1,3-ベンゾジオキソール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-フルオロ-2H-1,3-ベンゾジオキソール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C23H24FN5O5[M+H]+についての計算値470.18、実測値470.20;1H NMR(400 MHz,クロロホルム-d)δ 6.91(d,J=5.8Hz,1H),6.80(d,J=6.2Hz,1H),6.64(d,J=8.7Hz,1H),6.52-6.34(m,2H),6.03(s,2H),5.70-5.68(m,1H),5.48-5.46(m,1H),5.29(s,1H),4.55(d,J=9.0Hz,1H),4.07(t,J=8.9Hz,1H),4.00(t,J=9.1Hz,1H),3.89-3.85(m,1H),3.52-3.40(m,1H),3.36(d,J=4.6Hz,3H),3.01-2.98(m,3H),2.69-2.62(m,1H),2.29-2.21(m,1H),1.26(s,1H).
実施例256:3-[2-(3-クロロ-6-フルオロキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(3-クロロ-6-フルオロキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H24ClFN6O3[M+H]+についての計算値511.16、実測値511.15;1H NMR(400 MHz,クロロホルム-d)δ 8.82(d,J=2.3Hz,1H),8.32(t,J=5.5Hz,1H),8.08(d,J=2.4Hz,1H),7.44(d,J=9.4Hz,1H),6.96(s,1H),6.84(s,1H),6.58-6.36(m,2H),5.72-5.70(m,1H),5.58-5.45(m,1H),5.39(s,1H),4.57(d,J=9.0Hz,1H),4.10(t,J=8.9Hz,1H),4.09-3.97(m,1H),4.00-3.87(m,1H),3.54-3.41(m,1H),3.37(d,J=5.0Hz,3H),3.04(d,J=15.2Hz,3H),2.70-2.68(m,1H),2.35-2.31(m,1H).
実施例257:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-3-メチルイミダゾ[1,2-a]ピリジン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-3-メチルイミダゾ[1,2-a]ピリジン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C24H26FN7O3[M+H]+についての計算値480.21、実測値480.55;1H NMR(400 MHz,クロロホルム-d)δ 6.92-6.85(m,2H),6.42(d,J=8.2Hz,2H),5.71(s,1H),5.51(s,1H),5.30(s,1H),4.62-4.35(m,1H),4.16-3.96(m,2H),3.90(d,J=9.5Hz,1H),3.51(s,1H),3.45(s,1H),3.43(s,1H),3.37(d,J=4.6Hz,4H),3.09-3.00(m,3H),2.70(d,J=10.8Hz,1H),2.32(s,1H).
実施例258:3-[2-(6-クロロ-3-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-3-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H27ClN6O3[M+H]+についての計算値507.18、実測値507.50;1H NMR(400 MHz,DMSO-d6)δ 8.86(d,J=2.1Hz,1H),8.31(s,1H),8.20(s,1H),8.14(s,1H),7.54(s,1H),6.90(s,1H),6.78-6.55(m,2H),6.17-6.13(m,1H),5.70-5.60(m,1H),5.28-5.18(m,1H),4.64-4.31(m,1H),4.09-3.67(m,2H),3.63-3.42(m,2H),3.31(s,3H),2.96-2.86(m,3H),2.62-2.52(m,1H),2.50-2.40(m,3H),2.34-2.25(m,1H).
実施例259:3-[2-(1-シクロプロピル-6-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(1-シクロプロピル-6-メチル-1,3-ベンゾジアゾール-5-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H31N7O3[M+H]+についての計算値502.25、実測値502.30;1H NMR(400 MHz,CDCl3)δ 8.25(s,1H),7.83(s,1H),7.58(s,1H),7.38(s,1H),6.81-6.59(m,3H),6.20-6.15(m,1H),5.71-5.67(m,1H),5.29-5.21(m,1H),4.54-4.40(m,1H),4.05-3.72(m,2H),3.63-3.45(m,3H),3.20(s,3H),2.95(t,J=12Hz,3H),2.65-2.45(m,3H),2.32-2.26(m,1H),1.13-1.07(m,2H),1.05-1.01(m,2H).
実施例260:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-フルオロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-フルオロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C26H28FN7O3[M+H]+についての計算値506.22、実測値506.40;1H NMR(400 MHz,CDCl3)δ 7.81(s,1H),7.58-7.47(m,2H),6.78-6.56(m,3H),6.20-6.14(m,1H),5.71-5.67(m,1H),5.32-5.21(m,1H),4.55-4.40(m,1H),4.14-4.11(m,2H),4.06-3.72(m,2H),3.63-3.60(m,2H),3.50-3.45(m,3H),2.96(t,J=12Hz,5H),2.66-2.60(m,2H),2.46(d,J=8Hz,1H),2.33-2.29(m,1H).
実施例261:3-(2-{6-クロロ-3-シクロプロピルイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:7-ブロモ-6-クロロイミダゾ[1,2-a]ピリジン
EtOH(30.00mL)中の4-ブロモ-5-クロロピリジン-2-アミン(3.00g、14.46mmol)およびクロロアセトアルデヒド(4.26g、21.69mmol)の溶液を、窒素雰囲気下、80℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、7-ブロモ-6-クロロイミダゾ[1,2-a]ピリジン(2.50g、74%)を黄色固体として得た。MS ESI C7H4BrClN2[M+H]+についての計算値231.48、233.48、実測値231.00、233.00。
ステップ2:7-ブロモ-6-クロロ-3-ヨードイミダゾ[1,2-a]ピリジン
DCM(21.00mL)中の7-ブロモ-6-クロロイミダゾ[1,2-a]ピリジン(2.10g、9.07mmol)の撹拌溶液に、NIS(6.12g、27.21mmol)を窒素雰囲気下、室温で小分けにして添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。得られた混合物を水(70mL)で希釈し、EA(2×100mL)で抽出した。合わせた有機層を水(2×100mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、DCM/MeOH(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、7-ブロモ-6-クロロ-3-ヨードイミダゾ[1,2-a]ピリジン(1.80g、55%)をオフホワイトの固体として得た。MS ESI C7H3BrClIN2[M+H]+についての計算値356.82、358.82、実測値356.90、358.70。
ステップ3:7-ブロモ-6-クロロ-3-シクロプロピルイミダゾ[1,2-a]ピリジン
トルエン(7.00mL)および水(0.70mL)中の7-ブロモ-6-クロロ-3-ヨードイミダゾ[1,2-a]ピリジン(0.76g、2.12mmol)およびカリウム1-(トリフルオロ-ラムダ4-ボラニル)シクロプロパン-1-イド(0.37g、2.55mmol)の撹拌溶液に、Cs2CO3(2.08g、6.38mmol)およびPd(dppf)Cl2(0.15g、0.21mmol)を添加した。反応混合物に110℃で16時間マイクロ波を照射した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、7-ブロモ-6-クロロ-3-シクロプロピルイミダゾ[1,2-a]ピリジン(35.00mg、6%)を褐色固体として得た。MS ESI C10H8BrClN2[M+H]+についての計算値270.96、272.95、実測値270.90、272.90。
ステップ4:3-(2-{6-クロロ-3-シクロプロピルイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(0.50mL)中の7-ブロモ-6-クロロ-3-シクロプロピルイミダゾ[1,2-a]ピリジン(35.00mg、0.12mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(64.07mg、0.19mmol)およびPd(PPh3)2Cl2(9.05mg、0.01mmol)およびCuI(4.91mg、0.02mmol)の撹拌溶液に、TEA(39.13mg、0.38mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、粗生成物を得、これを以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム:C18シリカゲル、移動相:水中のACN(10mmol/L NH4HCO3)、10分で10%から50%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-{6-クロロ-3-シクロプロピルイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(32.40mg、48%)をオフホワイトの固体として得た。MS ESI C26H28ClN7O3[M+H]+についての計算値522.19、実測値522.25;1H NMR(400 MHz,クロロホルム-d)δ 8.90-8.12(s,1H),7.10-6.90(m,2H),6.60-6.44(m,2H),5.80-5.73(s,1H),5.63-5.53(s,1H),5.41-5.31(s,1H),4.67-4.42(m,1H),4.19-3.87(m,3H),3.60-3.44(m,1H),3.40-3.39(m,3H),3.17-3.06(m,4H),2.80-2.72(m,1H),2.49-2.24(m,1H),1.22-1.20(s,2H),0.85-0.78(s,2H).
実施例262:3-(2-{3-シアノ-6-フルオロイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{3-シアノ-6-フルオロイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C24H23FN8O3[M+H]+についての計算値491.19、実測値491.35;1H NMR(400 MHz,CDCl3)δ 9.15(s,1H),8.57(s,1H),8.31-8.29(m,1H),7.52(s,1H),6.65-6.55(m,3H),6.19(d,J=16.4Hz,1H),5.70(d,J=2.4Hz,1H),5.28-5.26(m,1H),4.41-4.03(m,1H),3.90-3.58(m,2H),3.60-3.58(m,2H),3.31(s,3H),2.96(s,3H),2.59(m,1H),2.20-2.39(m,1H).
実施例263:3-(2-{3-シアノピラゾロ[1,5-a]ピリジン-6-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{3-シアノピラゾロ[1,5-a]ピリジン-6-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C24H24N8O3[M+H]+についての計算値473.20、実測値473.25;1H NMR(400 MHz,DMSO-d6)δ 9.43(s,1H),8.76(s,1H),8.00(dd,J=9.1,1.0Hz,1H),7.73(dd,J=9.1,1.5Hz,1H),7.32(s,1H),6.87(s,1H),6.73(dd,J=16.7,10.3Hz,2H),6.20-6.14(m,1H),5.76-5.70(m,1H),5.29-5.23(m,1H),4.54(s,1H),4.03-3.60(m,2H),3.42-3.53(m,2H),3.32(s,3H),2.95-2.89(m,3H),2.52-2.45(m,1H),2.32(s,1H).
実施例264:3-[2-(3,6-ジフルオロキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(3,6-ジフルオロキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H24F2N6O3[M+H]+についての計算値495.19、実測値495.30。1H NMR(400 MHz,クロロホルム-d)δ 8.84(d,J=2.7Hz,1H),8.38(d,J=6.6Hz,1H),7.75(d,J=2.7Hz,1H),7.50(d,J=9.6Hz,1H),6.86(d,J=6.1Hz,2H),6.49-6.41(m,2H),5.73-5.64(m,1H),5.60-5.37(m,2H),4.59(d,J=9.0Hz,1H),4.14-4.02(m,2H),3.92-3.62(m,1H),3.50-3.44(m,1H),3.39(d,J=5.0Hz,3H),3.08(d,J=5.8Hz,3H),2.79-2.68(m,1H),2.45-2.31(m,1H).
実施例265:3-[2-(3,6-ジメチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(3,6-ジメチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H30N6O3[M+H]+についての計算値487.24、実測値487.30;1H NMR(400 MHz,クロロホルム-d)δ 8.76(d,J=2.2Hz,1H),8.28(d,J=3.7Hz,1H),7.86(s,1H),7.60(s,1H),7.03-6.72(m,2H),6.60-6.43(m,2H),5.78-5.70(m,1H),5.57-5.46(m,1H),5.35(d,J=27.2Hz,1H),4.67-4.42(m,1H),4.13-4.10(m,1H),4.08-3.98(m,1H),3.92-3.58(m,1H),3.50-3.42(m,1H),3.39(d,J=4.6Hz,3H),3.07(d,J=5.8Hz,3H),2.80-2.69(m,1H),2.67(d,J=3.7Hz,3H),2.54(s,3H),2.33-2.28(m,1H).
実施例266:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-4-メチルシンノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-4-メチルシンノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C25H26FN7O3[M+H]+についての計算値492.21、実測値492.35;1H NMR(400 MHz,DMSO-d6)δ 9.28(s,1H),8.82(dd,J=7.0,2.6Hz,1H),8.12(d,J=10.3Hz,1H),7.49(s,1H),6.90(s,1H),6.79-6.54(m,2H),6.20-6.15(m,1H),5.72-5.69(m,1H),5.32-5.23(m,1H),4.65-4.33(m,1H),4.11-3.70(m,2H),3.61(dd,J=9.4,5.2Hz,1H),3.55-3.41(m,2H),3.30(s,3H),2.96(t,J=5.1Hz,3H),2.66(s,3H),2.38-2.27(m,1H).
実施例267:3-[2-(6-クロロ-3-フルオロキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-3-フルオロキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C25H24ClFN6O3[M+H]+についての計算値511.16、実測値511.20;1H NMR(400 MHz,クロロホルム-d)δ 8.84(d,J=2.8Hz,1H),8.41(d,J=6.3Hz,1H),7.87(d,J=2.1Hz,1H),7.69-7.56(m,1H),7.06(s,1H),6.83(d,J=6.1Hz,1H),6.54-6.40(m,1H),6.44-6.35(m,1H),5.76-5.67(m,1H),5.57-5.51(m,1H),5.40(s,1H),4.57(d,J=9.0Hz,1H),4.16-3.97(m,2H),4.00-3.87(m,1H),3.54-3.41(m,1H),3.37(d,J=5.2Hz,3H),3.04-2.91(m,3H),2.71-2.65(m,1H),2.35-2.28(m,1H).
実施例268:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-4-メチルシンノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:5-ブロモ-4-クロロ-2-(プロパ-1-エン-2-イル)アニリン
THF(10.00mL)中のメチルトリフェニルホスファニウムブロミド(2.16g、6.04mmol)の撹拌混合物に、t-BuOK(0.68g、6.04mmol)を窒素雰囲気下、0℃で小分けにして添加した。室温で30分間撹拌した後、THF(5.00mL)中の1-(2-アミノ-4-ブロモ-5-クロロフェニル)エタノン(1.00g、4.02mmol)を窒素雰囲気下、0℃で滴下した。反応混合物を-40℃で45分間撹拌した。得られた混合物を-40℃にて水でクエンチし、EA(3×80mL)で抽出した。合わせた有機層をブライン(60mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE/DCM(4/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-4-クロロ-2-(プロパ-1-エン-2-イル)アニリン(0.10g、10%)を黄色油状物として得た。MS ESI C9H9BrClN[M+H]+についての計算値245.96、247.96、実測値246.05、248.05。
ステップ2:7-ブロモ-6-クロロ-4-メチルシンノリン
水(0.46mL)中の5-ブロモ-4-クロロ-2-(プロパ-1-エン-2-イル)アニリン(0.10g、0.43mmol)および濃HCl(0.46mL、5.54mmol)の撹拌混合物に、NaNO2(0.36mL、2M)を室温で滴下した。反応混合物を室温で16時間撹拌した。得られた混合物を水(10mL)で希釈し、EA(3×30mL)で抽出した。合わせた有機層をブライン(2×30mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE/EA(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、7-ブロモ-6-クロロ-4-メチルシンノリン(90.00mg、82%)を黄色固体として得た。MS ESI C9H6BrClN2[M+H]+についての計算値256.94、258.94、実測値257.00、259.00;1H NMR(400 MHz,CDCl3)δ 9.19(s,1H),8.86(s,1H),8.12(s,1H),2.68(s,3H).
ステップ3:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-4-メチルシンノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(1.00mL)中の7-ブロモ-6-クロロ-4-メチルシンノリン(80.00mg、0.31mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.10g、0.31mmol)、Pd(PPh3)2Cl2(21.80mg、0.03mmol)およびCuI(11.83mg、0.06mmol)の撹拌混合物に、TEA(94.31mg、0.93mmol)を室温で添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物(120mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Prep OBD C18 Column、30×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:8分で25%Bから35%B;波長:254nm;RT:8分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-クロロ-4-メチルシンノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(76.50mg、48%)を白色固体として得た。MS ESI C25H26ClN7O3[M+H]+についての計算値508.18、実測値508.20;1H NMR(400 MHz,DMSO-d6)δ 9.32(s,1H),8.81(s,1H),8.46(s,1H),7.50(s,1H),6.94(s,1H),6.78-6.50(m,2H),6.23-6.15(m,1H),5.74-5.67(m,1H),5.30-5.24(m,1H),4.63-4.33(m,1H),4.05(dd,J=10.6,7.4Hz,1H),3.97-3.83(m,1H),3.81-3.57(m,1H),3.47(dd,J=9.6,4.0Hz,1H),3.32(s,3H),2.96(t,J=5.1Hz,3H),2.69(s,3H),2.62(t,J=10.5Hz,1H),2.33(d,J=4.5Hz,1H).
実施例269:3-(2-{3-シアノイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{3-シアノイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C24H24N8O3[M+H]+についての計算値473.20、実測値473.05;1H NMR(400 MHz,CDCl3)δ 8.50(s,1H),8.01(s,1H),7.23(d,J=6.9Hz,1H),6.77(d,J=47.9Hz,1H),6.64-6.37(m,2H),5.75-5.71(m,1H),5.57-5.28(m,2H),4.62-4.40(m,1H),4.09-4.04(m,2H),3.93-3.90(m,1H),3.56-3.43(m,1H),3.39(d,J=5.3Hz,3H),3.12-3.03(m,3H),2.76-2.64(m,1H),2.44-2.32(m,1H).
実施例270:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((3-シアノ-4-メトキシピラゾロ[1,5-a]ピリジン-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((3-シアノ-4-メトキシピラゾロ[1,5-a]ピリジン-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド.MS ESI C22H29FN4O5[M+H]+についての計算値503.21、実測値503.35;1H NMR(400 MHz,クロロホルム-d)δ 8.43(d,J=1.1Hz,1H),8.24(s,1H),6.83(s,1H),6.75(d,J=1.1Hz,1H),6.56-6.37(m,2H),5.73(dd,J=7.5,4.8Hz,1H),5.52(m,2H),4.59(d,J=8.9Hz,1H),4.07(s,5H),4.02-3.87(m,1H),3.55-3.33(m,4H),3.09(d,J=5.7Hz,3H),2.69(m,1H),2.37(m,1H).
実施例271:3-(2-{1-[(1S)-2,2-ジフルオロシクロプロピル]-6-フルオロ-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(0.50mL)中の(S)-1-(2,2-ジフルオロシクロプロピル)-6-フルオロ-5-ヨード-1H-ベンゾ[d]イミダゾール(80mg、0.23mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(78.42mg、0.23mmol)の撹拌混合物に、Pd(PPh3)2Cl2(16.61mg、0.02mmol)、CuI(9.01mg、0.04mmol)およびTEA(71.84mg、0.71mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Prep OBD C18 Column、30×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:8分で28%Bから38%B、38%B;波長:254nm、RT1:7.17分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-{1-[(1S)-2,2-ジフルオロシクロプロピル]-6-フルオロ-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(立体化学は任意に割り当てられた)(71.20mg、55%)をオフホワイトの固体として得た。MS ESI C26H26F3N7O3[M+H]+についての計算値542.50、実測値542.55;1 H NMR(400 MHz,CDCl3)δ 8.04(s,2H),7.26(d,J=10.0Hz,2H),6.59-6.36(m,2H),5.77-5.68(m,1H),5.59-5.46(m,1H),5.41-5.28(m,1H),4.58(d,J=8.9Hz,1H),4.08-4.02(m,2H),3.97-3.92(m,2H),3.55-3.42(m,1H),3.39(d,J=4.5Hz,3H),3.05(d,J=15.2Hz,3H),2.79-2.66(m,1H),2.44-2.25(m,2H),2.09-2.04(m,1H).
実施例272:3-{2-[1-((R)-2,2-ジフルオロシクロプロピル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:ビニル4-メチルベンゼンスルホネート
THF(40.00mL)中のn-BuLi(13.00mL、32.77mmol)の溶液を、窒素雰囲気下、35℃で4時間撹拌した。次いで、上記混合物に、THF(13.00mL)中のP-トルエンスルホニルクロリド(5.00g、26.23mmol)の溶液を-78℃で30分間にわたって滴下した。反応混合物を-78℃で1時間、室温でさらに1時間撹拌した。得られた混合物を水(50mL)の添加によってクエンチし、MTBE(3×50mL)で抽出した。合わせた有機層をNa2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮した。残渣を、PEで溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、ビニル4-メチルベンゼンスルホネート(3.40g、65%)を無色油状物として得た。MS ESI C9H10O3S[M-H]-についての計算値197.04、実測値196.90;1H NMR(400 MHz,CDCl3)δ 7.89-7.74(m,2H),7.43-7.33(m,2H),6.62(dd,J=13.6,5.9Hz,1H),4.90(dd,J=13.5,2.5Hz,1H),4.70(dd,J=5.9,2.5Hz,1H).
ステップ2:2,2-ジフルオロシクロプロピル4-メチルベンゼンスルホネート
NaF(59.31mg、1.41mmol)およびビニル4-メチルベンゼンスルホネート(2.80g、14.12mmol)の撹拌混合物に、トリメチルシリル2,2-ジフルオロ-2-スルホアセテート(21.21g、84.74mmol)を窒素雰囲気下、室温で滴下した。反応混合物を窒素雰囲気下、105℃で10分間撹拌した。得られた混合物を、PE/EA(12/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、2,2-ジフルオロシクロプロピル4-メチルベンゼンスルホネート(1.70g、48%)を淡黄色固体として得た;1H NMR(400 MHz,CDCl3)δ 7.89-7.80(m,2H),7.45-7.37(m,2H),4.30-4.24(m,1H),2.50(s,3H),1.82-1.58(m,2H).
ステップ3:1-(2,2-ジフルオロシクロプロピル)-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール&1-(2,2-ジフルオロシクロプロピル)-5-フルオロ-6-ヨード-1,3-ベンゾジアゾール
DMF(5.00mL)中の2,2-ジフルオロシクロプロピル4-メチルベンゼンスルホネート(0.42g、1.68mmol)およびCs2CO3(1.49g、4.58mmol)の撹拌溶液に、5-フルオロ-6-ヨード-3H-1,3-ベンゾジアゾール(0.40g、1.53mmol)を室温で添加した。反応混合物を室温で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをDMF(2x20mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、以下の条件(カラム:C18シリカゲル、移動相、水中のACN(NH4HCO3、10mmol/L)、40分で10%から50%の勾配、検出器:UV 254nm)を用いる逆フラッシュクロマトグラフィーによって精製して、粗生成物(360mg)を得、これを以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:CHIRALPAK ID、2×25cm、5μm、移動相A:Hex(0.5% 2M NH3-MeOH)-HPLC、移動相B:MeOH:EtOH=1:1-HPLC、流量:20mL/分、勾配:15分で20%Bから20%B;波長:220/254nm、RT1:7.08分;RT2:11.51分;試料溶媒:MeOH:DCM=1:1。より速いピーク(RT1:7.08分)を合わせ、濃縮して、1-[(1R)-2,2-ジフルオロシクロプロピル]-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(80.00mg、15%)を淡黄色固体として得た。MS ESI C10H6F3IN2[M+H]+についての計算値338.85、実測値338.85;1H NMR(400 MHz,CDCl3)δ 8.20(d,J=5.5Hz,1H),7.95(d,J=1.7Hz,1H),7.23(d,J=7.3Hz,1H),3.95-3.88(m,1H),2.34-2.25(m,1H),2.09-1.96(m,1H).より遅いピーク(RT1:11.51分)を合わせ、濃縮して、1-[(1S)-2,2-ジフルオロシクロプロピル]-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(90.00mg、17%)を淡黄色固体として得た。MS ESI C10H6F3IN2[M+H]+についての計算値338.85、実測値338.85;1H NMR(400 MHz,CDCl3)δ 8.21(d,J=5.5Hz,1H),7.97(t,J=1.7Hz,1H),7.23(d,J=7.3Hz,1H),3.95-3.88(m,1H),2.34-3.25(m,1H),2.07-1.99(m,1H).
ステップ4:3-{2-[1-((R)-2,2-ジフルオロシクロプロピル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(2.00mL)中の1-[(1R)-2,2-ジフルオロシクロプロピル]-6-フルオロ-5-ヨード-1,3-ベンゾジアゾール(80.00mg、0.24mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(78.42mg、0.24mmol)、Pd(PPh3)2Cl2(16.61mg、0.02mmol)およびCuI(4.51mg、0.02mmol)の撹拌混合物に、TEA(71.84mg、0.71mmol)を室温で滴下した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物(100mg)を得、これを以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム、C18シリカゲル、移動相:水中のACN(10mmol/L NH4HCO3)、40分で5%から70%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-{2-[1-((R)-(2,2-ジフルオロシクロプロピル)-6-フルオロ-1,3-ベンゾジアゾール-5-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(立体化学は任意に割り当てられた)(45.30mg、35%)をオフホワイトの固体として得た。MS ESI C26H26F3N7O3[M+H]+についての計算値542.21、実測値542.30;1H NMR(400 MHz,CDCl3)δ 8.04(s,2H),7.29(s,1H),7.09(s,1H),6.86-6.67(m,1H),6.57-6.37(m,2H),5.72(dd,J=8.5,4.0Hz,1H),5.59-5.08(m,1H),4.61-4.36(m,1H),4.09-4.01(m,2H),3.96-3.90(m,2H),3.55-3.42(m,1H),3.39(d,J=4.4Hz,3H),3.05(dd,J=15.4,5.8Hz,3H),2.76-2.71(m,1H),2.32(dd,J=12.4,7.0Hz,2H),2.05(d,J=14.0Hz,1H).
実施例273:3-{2-[3-(ジフルオロメチル)-6-フルオロキノリン-7-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-{2-[3-(ジフルオロメチル)-6-フルオロキノリン-7-イル]エチニル}-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H25F3N6O3[M+H]+についての計算値527.19、実測値527.35;1H NMR(400 MHz,クロロホルム-d)δ 9.08-9.04(m,1H),8.43(d,J=6.4Hz,1H),8.27(s,1H),7.60(d,J=9.2Hz,1H),7.02(d,J=23.0Hz,1H),6.94-6.78(m,2H),6.52-6.34(m,2H),5.74-5.65(m,1H),5.54-5.51(m,1H),5.48-5.29(m,1H),4.65-4.41(m,1H),4.17-3.98(m,2H),3.93-3.54(m,1H),3.47-3.44(m,1H),3.40(d,J=5.1Hz,3H),3.07-2.84(m,3H),2.78-2.67(m,1H),2.34-2.29(m,1H).
実施例274:3-[2-(6-フルオロ-4-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-フルオロ-4-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H27FN6O3[M+H]+についての計算値491.21、実測値491.25;1H NMR(400 MHz,DMSO-d6)δ 8.81(d,J=4.4Hz,1H),8.33(d,J=6.3Hz,1H),8.01(d,J=10.9Hz,1H),7.47(d,J=4.4Hz,2H),6.86(s,1H),6.77-6.53(m,2H),6.17(dd,J=16.7,2.5Hz,1H),5.69(dd,J=10.4,2.8Hz,1H),5.29-5.24(m,1H),4.63-4.31(m,1H),4.10-3.68(m,2H),3.61(dd,J=9.3,5.2Hz,1H),3.53-3.41(m,1H),3.31(d,J=4.7Hz,3H),2.96(t,J=5.2Hz,3H),2.67(s,3H),2.32(s,1H).
実施例275:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-メチル-1H-インダゾール-4-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)-3-[2-(1-メチルインダゾール-4-イル)エチニル]ピラゾール-4-カルボキサミド.MS ESI C24H27N7O3[M+H]+についての計算値462.50、実測値462.20;1H NMR(400 MHz,CDCl3)δ 8.14(d,J=1.0Hz,1H),7.53-7.45(m,3H),7.41-7.38(m,2H),6.75(dd,J=47.1,6.1Hz,2H),6.60-6.37(m,1H),5.79-5.72(m,1H),5.58-5.52(m,1H),5.41-5.22(m,1H),4.62-4.03(m,5H),4.03-3.88(m,1H),3.55-3.43(m,1H),3.40(d,J=4.2Hz,3H),3.06(dd,J=15.5,5.9Hz,3H),2.80-2.67(m,1H),2.45-2.29(m,1H).
実施例276:3-[2-(1-シクロプロピルインダゾール-4-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:4-ブロモ-1-シクロプロピルインダゾール
DCE(100.00mL)中の4-ブロモ-1H-インダゾール(2.00g、10.15mmol)、シクロプロピルボロン酸(1.74g、20.30mmol)、2,2’-ビピリジン(1.59g、10.15mmol)の撹拌混合物に、Cu(OAc)2(3.69g、20.30mmol)を空気雰囲気下、室温で添加した。反応混合物を空気雰囲気下、70℃で16時間撹拌した。得られた混合物を水(50mL)で希釈し、DCM(3×100mL)で抽出した。合わせた有機層をブライン(2×50mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で濃縮した。残渣を、PE/EA(4/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4-ブロモ-1-シクロプロピルインダゾール(0.80g、33%)を無色油状物として得た。MS ESI C10H9BrN2[M+H]+についての計算値236.99、238.99、実測値237.00、239.00;1H NMR(400 MHz,クロロホルム-d)δ 7.94(d,J=0.9Hz,1H),7.54-7.50(m,1H),7.34-7.18(m,2H),3.64-3.55(m,1H),1.30-1.12(m,4H).
ステップ2:3-[2-(1-シクロプロピルインダゾール-4-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.00mL)中の4-ブロモ-1-シクロプロピルインダゾール(0.10g、0.42mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.16g、0.50mmol)の撹拌混合物に、Pd(PPh3)2Cl2(29.60mg、0.04mmol)、CuI(16.06mg、0.08mmol)およびTEA(0.12g、1.26mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で2時間撹拌した。得られた混合物を真空下で濃縮した。残渣を、DCM/MeOH(20/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XSelect CSH Prep C18 OBD Column、19×250mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:DCM:EtOH=9:1--HPLC、流量:25mL/分、勾配:20分で57%Bから57%B、57%B;波長:254nm、RT1:15.2分。所望の生成物を含有する分画を合わせ、濃縮して、3-[2-(1-シクロプロピルインダゾール-4-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(36.50mg、17%)を白色固体として得た。MS ESI C26H29N7O3[M+H]+についての計算値488.23、実測値488.25;1H NMR(400 MHz,クロロホルム-d)δ 8.07(d,J=1.0Hz,1H),7.71-7.63(m,1H),7.43-7.34(m,2H),6.79(d,J=6.1Hz,1H),6.57-6.34(m,2H),5.70-5.67(m,1H),5.51-5.46(m,1H),5.34(s,1H),4.56(d,J=9.1Hz,1H),4.11-4.09(m,1H),4.09-3.96(m,1H),4.00-3.86(m,1H),3.61-3.59(m,1H),3.53-3.40(m,1H),3.37(d,J=4.2Hz,3H),3.03-2.96(m,3H),2.77-2.65(m,1H),2.35-2.31(m,1H),1.29-1.14(m,5H).
実施例277:3-(2-{イミダゾ[1,5-a]ピリジン-8-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.50mL)中の3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.15g、0.45mmol)および8-ブロモイミダゾ[1,5-a]ピリジン(98.11mg、0.49mmol)の撹拌溶液に、Pd(PPh3)2Cl2(31.77mg、0.04mmol)およびCuI(17.24mg、0.09mmol)およびTEA(0.14g、1.35mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物(150mg)を、以下の条件を用いるPrep-HPLCによって精製した:カラム:XBridge Shield RP18 OBD Column、19×250mm、10μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:MeOH--HPLC、流量:25mL/分、勾配:8分で50%Bから55%B、55%B;波長:254nm、RT1:6.7分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-{イミダゾ[1,5-a]ピリジン-8-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(60.90mg、30%)を淡黄色固体として得た。MS ESI C23H25N7O3[M+H]+についての計算値448.49、実測値448.25;1H NMR(400 MHz,DMSO-d6)δ 8.61-8.37(m,2H),7.48-7.45(s,2H),7.14-7.40(m,1H),6.92-6.90(s,1H),6.78-6.55(m,2H),6.51-6.38(m,1H),6.17-6.16(m,1H),5.69-6.68(m,1H),5.23-5.22(m,1H),4.60-4.36(m,1H),4.08-3.70(m,2H),3.65-3.40(m,2H),3.35-3.33(m,3H),2.93-2.92(m,3H),2.69-2.54(m,1H),2.31-2.30(m,1H).
実施例278:3-(2-{イミダゾ[1,5-a]ピリジン-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{イミダゾ[1,5-a]ピリジン-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C23H25N7O3[M+H]+についての計算値448.20、実測値448.15;1H NMR(400 MHz,CDCl3)δ 8.75-8.63(s,1H),7.73(d,J=9.2Hz,1H),7.71(s,1H),7.15(s,2H),7.13-7.12(m,1H),6.87-6.84(m,1H),6.62-6.55(m,1H),6.19-6.13(m,2H),5.70(d,J=4.0Hz,1H),5.23-5.21(m,1H),4.01(m,1H),3.86-3.81(m,2H),3.57-3.55(m,1H),3.51-3.50(m,1H),3.44(s,3H),2.89(s,3H),2.55-2.53(m,1H),2.33-2.30(m,1H).
実施例279:3-(2-{6-クロロ-1-[(1R)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
ステップ1:(R)-5-クロロ-1-(2,2-ジフルオロシクロプロピル)-6-ヨード-1H-ベンゾ[d]イミダゾール&(S)-5-クロロ-1-(2,2-ジフルオロシクロプロピル)-6-ヨード-1H-ベンゾ[d]イミダゾール&(R)-6-クロロ-1-(2,2-ジフルオロシクロプロピル)-5-ヨード-1H-ベンゾ[d]イミダゾール&(S)-6-クロロ-1-(2,2-ジフルオロシクロプロピル)-5-ヨード-1H-ベンゾ[d]イミダゾール
DMF(2.00mL)中の5-クロロ-6-ヨード-3H-1,3-ベンゾジアゾール(0.45g、1.61mmol)および2,2-ジフルオロシクロプロピル4-メチルベンゼンスルホネート(0.44g、1.77mmol)の撹拌混合物に、Cs2CO3(1.58g、4.84mmol)を窒素雰囲気下、室温で小分けにして添加した。反応混合物を窒素雰囲気下、室温で3時間撹拌した。得られた混合物を濾過し、濾液を以下の条件(カラム、C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、30分で10%から50%の勾配、検出器:UV 254nm)を用いる逆フラッシュクロマトグラフィーによって精製して、6-クロロ-1-(2,2-ジフルオロシクロプロピル)-5-ヨード-1,3-ベンゾジアゾール(320mg)を得た。粗生成物を、以下の条件を用いるPrep-HPLCによって精製した:カラム:CHIRALPAK IG、2×25cm、5μm、移動相A:Hex(0.5% 2M NH3-MeOH)--HPLC、移動相B:MeOH:EtOH=1:1--HPLC、流量:20mL/分、勾配:17分で15%Bから15%B;波長:220/254nm、RT1:11.40分、RT2:13.65分;試料溶媒:MeOH:DCM=1:1;注入体積:0.3mL。所望の生成物を含有するより速いピークを合わせ、濃縮して、(R)-5-クロロ-1-(2,2-ジフルオロシクロプロピル)-6-ヨード-1H-ベンゾ[d]イミダゾール(30.20mg、6%)をオフホワイトの固体として得た。MS ESI C10H6ClF2IN2[M+H]+についての計算値355.50、実測値354.80;1H NMR(400 MHz,CDCl3)δ 7.96(s,1H),7.92(d,J=1.4Hz,2H),3.90-3.82(m,1H),2.29-2.24(m,1H),2.12-2.03(m,1H).また、(S)-5-クロロ-1-(2,2-ジフルオロシクロプロピル)-6-ヨード-1H-ベンゾ[d]イミダゾール(40.10mg、7%)をオフホワイトの固体として、MS ESI C10H6ClF2IN2[M+H]+についての計算値355.50、実測値354.80;1H NMR(400 MHz,CDCl3)δ 7.97(s,1H),7.93(s,2H),3.96-3.85(m,1H),2.29-2.23(m,1H),2.02-1.98(m,1H).
所望の生成物を含有するより遅いピークを合わせ、濃縮して、(R)-6-クロロ-1-(2,2-ジフルオロシクロプロピル)-5-ヨード-1H-ベンゾ[d]イミダゾール(39.89mg、7%)をオフホワイトの固体として得た。MS ESI C10H6ClF2IN2[M+H]+についての計算値355.50、実測値354.80;1H NMR(400 MHz,CDCl3)δ 8.35-8.29(m,1H),7.96-7.72(m,1H),7.65-7.60(m,1H),3.93-3.89(m,1H),2.36-2.22(m,1H),2.02(ddt,J=14.4,10.0,5.3Hz,1H).また、オフホワイトの固体としての(S)-6-クロロ-1-(2,2-ジフルオロシクロプロピル)-5-ヨード-1H-ベンゾ[d]イミダゾール(39.62mg、7%)。MS ESI C10H6ClF2IN2[M+H]+についての計算値355.50、実測値354.80;1H NMR(400 MHz,CDCl3)δ 8.29(s,1H),7.91(d,J=1.7Hz,1H),7.60(s,1H),3.94-3.90(m,1H),2.29-2.26(m,1H),2.08-1.95(m,1H).
ステップ2:3-(2-{6-クロロ-1-[(1R)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(0.40mL)中の(R)-6-クロロ-1-(2,2-ジフルオロシクロプロピル)-5-ヨード-1H-ベンゾ[d]イミダゾール(40mg、0.11mmol)および3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(37.39mg、0.11mmol)の撹拌溶液に、Pd(PPh3)2Cl2(7.92mg、0.01mmol)およびTEA(34.25mg、0.34mmol)を添加した。反応混合物をアルゴンで3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Prep OBD C18 Column、30×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:8分で28%Bから38%B、38%B;波長:254nm、RT1:7分。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-{6-クロロ-1-[(1R)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(立体化学は任意に割り当てられた)(20.40mg、32%)をオフホワイトの固体として得た。MS ESI C26H26ClF2N7O3[M+H]+についての計算値558.18、実測値558.20;1H NMR(400 MHz,CDCl3)δ 8.12(d,J=4.9Hz,2H),7.59(s,1H),6.60-6.36(m,2H),5.73(dd,J=8.7,3.6Hz,1H),5.59-5.46(m,1H),5.43-5.28(m,2H),4.58(d,J=8.9Hz,1H),4.17-3.88(m,4H),3.55-3.43(m,1H),3.39(d,J=4.8Hz,3H),3.05(d,J=15.2Hz,3H),2.79-2.67(m,1H),2.39-2.34(m,2H),2.08-2.03(m,1H).
実施例280:3-(2-{6-クロロ-1-[(1S)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
DMF(1.00mL)中の6-クロロ-1-[(1S)-2,2-ジフルオロシクロプロピル]-5-ヨード-1,3-ベンゾジアゾール(48.00mg、0.13mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(44.87mg、0.13mmol)、Pd(PPh3)2Cl2(9.50mg、0.01mmol)およびCuI(5.16mg、0.03mmol)の撹拌溶液に、TEA(41.10mg、0.41mmol)を添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆相フラッシュによってさらに精製した:カラム:XBridge Prep OBD C18 Column、30×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:8分で30%Bから35%B、波長:254nm。所望の生成物を含有する分画を合わせ、濃縮して、3-(2-{6-クロロ-1-[(1S)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(立体化学は任意に割り当てられた)(10.70mg、14%)を白色固体として得た。MS ESI C26H26ClF2N7O3[M+H]+についての計算値558.18、実測値558.25;1H NMR(400 MHz,CDCl3)δ 8.13(s,1H),8.03(s,1H),7.59(s,1H),7.17(s,1H),6.83(d,J=6.7Hz,1H),6.44(d,J=9.0Hz,2H),5.73-5.71(m,1H),5.57-5.48(m,1H),5.36(s,1H),4.58(d,J=9.0Hz,1H),4.15-4.04(m,2H),3.93(s,2H),3.60-3.31(m,4H),3.07-3.02(m,3H),2.77-2.72(m,1H),2.34(s,2H),2.04(t,J=6.8Hz,1H).
実施例281:3-[2-(6-クロロ-4-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-[2-(6-クロロ-4-メチルキノリン-7-イル)エチニル]-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H27ClN6O3[M+H]+についての計算値507.18、実測値507.25;1H NMR(400 MHz,CDCl3)δ 8.84(s,1H),8.44(s,1H),8.09(s,1H),7.32(s,1H),7.12(s,1H),6.85(s,1H),6.48-6.40(m,2H),5.85-5.73(m,1H),5.57-5.32(m,2H),4.59(d,J=9.0Hz,1H),4.22-4.10(m,2H),3.93(d,J=8.5Hz,1H),3.47(d,J=9.6Hz,1H),3.40(d,J=4.6Hz,3H),3.20-3.06(m,3H),2.71(s,4H),2.50-2.34(m,1H).
実施例282:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-3,4-ジメチルキノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-[4-ブロモ-5-フルオロ-2-(プロパ-2-エン-1-イルアミノ)フェニル]エタノン
HBr(5.00mL)中のN-(2-アセチル-5-ブロモ-4-フルオロフェニル)-N-アリル-4-メチルベンゼンスルホンアミド(0.50g、1.17mmol)の撹拌混合物に、フェノール(1.10g、11.73mmol)を窒素雰囲気下、室温で添加した。反応混合物を窒素雰囲気下、50℃で1時間撹拌した。得られた混合物を真空下で濃縮した。残渣を、PE/EA(5/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-[4-ブロモ-5-フルオロ-2-(プロパ-2-エン-1-イルアミノ)フェニル]エタノン(0.24g、75%)を黄色固体として得た。MS ESI C11H11BrFNO[M+H]+についての計算値272.00、274.00、実測値271.90、273.90;1H NMR(400 MHz,クロロホルム-d)δ 8.85(s,1H),7.49(d,J=9.6Hz,1H),6.88(d,J=5.7Hz,1H),5.93(m,1H),5.35-5.15(m,2H),3.86(m,2H),2.57(s,3H).
ステップ2:7-ブロモ-6-フルオロ-3,4-ジメチルキノリン
DMF(7.00mL)中の1-[4-ブロモ-5-フルオロ-2-(プロパ-2-エン-1-イルアミノ)フェニル]エタノン(0.20g、0.74mmol)の撹拌混合物に、t-BuOK(0.17g、1.47mmol)を窒素雰囲気下、室温で小分けにして添加した。反応混合物を窒素雰囲気下、室温で16時間撹拌した。残渣を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、25分で30%から70%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、7-ブロモ-6-フルオロ-3,4-ジメチルキノリン(63.00mg、34%)を黄色固体として得た。MS ESI C11H9BrFN[M+H]+についての計算値253.99、255.99、実測値253.65、255.65。
ステップ3.1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-3,4-ジメチルキノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(0.50mL)中の7-ブロモ-6-フルオロ-3,4-ジメチルキノリン(50.00mg、0.20mmol)および1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-エチニル-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(0.13g、0.40mmol)の撹拌混合物に、Pd(PPh3)2Cl2(13.81mg、0.02mmol)、CuI(7.50mg、0.04mmol)TEA(59.73mg、0.59mmol)を窒素雰囲気下、室温で添加した。反応混合物を窒素で3回脱気し、90℃で2時間撹拌した。得られた混合物を真空下で濃縮した。残渣を、DCM/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いるPrep-HPLCによってさらに精製した:カラム:XBridge Shield RP18 OBD Column、30×150mm、5μm、移動相A:水(10mmol/L NH4HCO3)、移動相B:ACN、流量:60mL/分、勾配:10分で34%Bから44%B、44%B;波長:220nm、RT1:9分。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((6-フルオロ-3,4-ジメチルキノリン-7-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(25.50mg、25%)をオフホワイトの固体として得た。MS ESI C27H29FN6O3[M+H]+についての計算値505.23、実測値505.35;1H NMR(400 MHz,クロロホルム-d)δ 8.71(s,1H),8.30(d,J=7.1Hz,1H),7.67(d,J=11.1Hz,1H),7.07(s,1H),6.86(d,J=6.0Hz,1H),6.60-6.37(m,2H),5.73(m,1H),5.62-5.20(m,2H),4.58(d,J=9.0Hz,1H),4.18-3.88(m,3H),3.56-3.43(m,1H),3.39(d,J=4.7Hz,3H),3.06(dd,J=15.7,5.9Hz,3H),2.80-2.67(m,1H),2.58(s,3H),2.50(s,3H),2.37(m,1H).
実施例283:3-(2-{3-シクロプロピル-6-フルオロイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{3-シクロプロピル-6-フルオロイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C26H28FN7O3[M+H]+についての計算値506.22、実測値506.25;1H NMR(400 MHz,CDCl3)δ 6.88-6.70(m,2H),6.44(d,J=8.6Hz,2H),5.85-5.73(m,1H),5.52(d,J=9.6Hz,1H),5.33(s,1H),4.60-4.43(m,1H),4.20-4.06(m,2H),3.93(d,J=9.7Hz,1H),3.50(d,J=22.2Hz,1H),3.39(s,3H),3.05(d,J=15.1Hz,3H),2.75-2.65(m,1H),2.45-2.33(m,1H),1.96(s,1H),1.14(d,J=7.5Hz,2H),0.77(s,2H).
実施例284:3-(2-{3-シクロプロピル-4-メトキシピラゾロ[1,5-a]ピリジン-6-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{3-シクロプロピル-4-メトキシピラゾロ[1,5-a]ピリジン-6-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C27H31N7O4[M+H]+についての計算値518.24、実測値518.40;1H NMR(400 MHz,クロロホルム-d)δ 8.30(s,1H),7.55(s,1H),6.75(s,1H),6.57-6.40(m,2H),6.35(s,1H),5.72-5.64(m,1H),5.55-5.28(m,2H),4.58(d,J=8.9Hz,1H),4.16-3.90(m,6H),3.50-3.41(m,1H),3.39(d,J=4.5Hz,3H),3.06(d,J=14.2Hz,3H),2.71-2.48(m,1H),2.44-2.30(m,2H),1.01-0.95(m,2H),0.73-0.63(m,2H).
実施例285:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-クロロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:1-(5-クロロ-2-ニトロフェニル)ピロリジン
EtOH(30mL)中の4-クロロ-2-フルオロ-1-ニトロベンゼン(3.30g、18.80mmol)の撹拌溶液に、ピロリジン(4.01g、56.40mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。得られた混合物を水(100mL)で希釈し、EtOAc(3×200mL)で抽出した。合わせた有機層をブライン(3×100mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮して、1-(5-クロロ-2-ニトロフェニル)ピロリジン(3.60g、粗製)を橙色固体として得た。MS ESI C10H11ClN2O2[M+H]+についての計算値227.05、実測値226.95;1H NMR(400 MHz,CDCl3)δ 7.70(d,J=8.8Hz,1H),6.91(d,J=2.1Hz,1H),6.69(dd,J=8.8,2.1Hz,1H),3.30-3.19(m,4H),2.09-1.95(m,4H).
ステップ2:1-(4-ブロモ-5-クロロ-2-ニトロフェニル)ピロリジン
AcOH(20.00mL)中の1-(5-クロロ-2-ニトロフェニル)ピロリジン(1.80g、7.94mmol)の撹拌溶液に、NBS(1.48g、8.34mmol)を0℃で小分けにして添加した。反応混合物を室温で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(12/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、1-(4-ブロモ-5-クロロ-2-ニトロフェニル)ピロリジン(2.50g、97%)を橙色固体として得た。MS ESI C10H10BrClN2O2[M+H]+についての計算値304.97、306.97、実測値305.05、307.05。
ステップ3:5-ブロモ-4-クロロ-2-(ピロリジン-1-イル)アニリン
EtOH(20.00mL)およびH2O(5.00mL)中の1-(4-ブロモ-5-クロロ-2-ニトロフェニル)ピロリジン(2.50g、8.18mmol)およびNH4Cl(4.38g、81.82mmol)の撹拌溶液に、Fe(4.57g、81.82mmol)を室温で小分けにして添加した。反応混合物を室温で16時間撹拌した。得られた混合物を濾過し、濾過ケーキをEtOAc(5x50mL)で洗浄した。濾液を減圧下で濃縮した。残渣を、PE/EA(12/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、5-ブロモ-4-クロロ-2-(ピロリジン-1-イル)アニリン(1.80g、79%)を暗赤色固体として得た。MS ESI C10H12BrClN2[M+H]+についての計算値274.99、276.99、実測値275.10、277.10。
ステップ4:6-ブロモ-7-クロロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール
EtOAc(20.00mL)中の5-ブロモ-4-クロロ-2-(ピロリジン-1-イル)アニリン(1.80g、6.53mmol)の撹拌溶液に、H2O2(14.81g、0.13mol、30%)を室温で滴下した。反応混合物を75℃で16時間撹拌した。得られた混合物を水(10mL)で希釈し、EtOAc(5×50mL)で抽出した。合わせた有機層をブライン(2×100mL)で洗浄し、無水Na2SO4で乾燥させた。濾過後、濾液を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(12/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、6-ブロモ-7-クロロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール(1.20g、60%)を褐色固体として得た。MS ESI C10H8BrClN2[M+H]+についての計算値270.96、272.96、実測値270.90、272.90;1H NMR(400 MHz,CDCl3)δ 7.95(s,1H),7.44(s,1H),4.18-4.07(m,2H),3.09(dd,J=8.3,7.1Hz,2H),2.83-2.71(m,2H).
ステップ5:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-クロロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の6-ブロモ-7-クロロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール(0.16g、0.60mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.20g、0.60mmol)、Pd(PPh3)2Cl2(42.36mg、0.06mmol)およびCuI(22.99mg、0.12mmol)の撹拌混合物に、TEA(0.18g、1.81mmol)を室温で滴下した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣をCH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得、これを以下の条件を用いる逆フラッシュクロマトグラフィーによってさらに精製した:カラム:C18シリカゲル、移動相:水中のACN(10mmol/L NH4HCO3)、40分で5%から70%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((7-クロロ-2,3-ジヒドロ-1H-ベンゾ[d]ピロロ[1,2-a]イミダゾール-6-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(26.20mg、8%)をオフホワイトの固体として得た。MS ESI C26H28ClN7O3[M+H]+についての計算値522.20、実測値522.35;1H NMR(400 MHz,CDCl3)δ 8.03(s,1H),7.48(s,1H),7.19(s,1H),6.83(s,1H),6.56-6.40(m,2H),5.76-5.69(m,1H),5.56-5.47(m,1H),5.37(s,1H),4.61-4.54(m,1H),4.21-4.10(m,3H),4.04(t,J=9.1Hz,1H),3.92(d,J=9.6Hz,1H),3.56-3.43(m,1H),3.39(d,J=4.4Hz,3H),3.15(s,2H),3.05(d,J=15.3Hz,3H),2.83-2.62(m,3H),2.33(s,1H).
実施例287:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-5-フルオロ-1H-インダゾール-4-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
ステップ1:4-ブロモ-1-シクロプロピル-5-フルオロ-1H-インダゾール
DCE(10.00mL)中の4-ブロモ-5-フルオロ-1H-インダゾール(0.50g、2.33mmol)、シクロプロピルボロン酸(0.40g、4.65mmol)および2-(ピリジン-2-イル)ピリジン(0.36g、2.33mmol)の撹拌混合物に、Cu(OAc)2(0.84g、4.65mmol)を添加した。反応混合物を酸素雰囲気下、50℃で16時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、PE/EA(1/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製した。所望の生成物を含有する分画を合わせ、濃縮して、4-ブロモ-1-シクロプロピル-5-フルオロ-1H-インダゾール(0.16g、27%)を淡橙色固体として得た。MS ESI C10H8BrFN2[M+H]+についての計算値254.99、256.99、実測値254.95、256.95;1H NMR(400 MHz,クロロホルム-d)δ 7.95(s,1H),7.51(dd,J=9.0,3.7Hz,1H),7.21(t,J=8.8Hz,1H),3.66-3.56(m,1H),1.25-1.19(m,4H).
ステップ2:1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-5-フルオロ-1H-インダゾール-4-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド
DMF(2.00mL)中の4-ブロモ-1-シクロプロピル-5-フルオロ-1H-インダゾール(0.16g、0.63mmol)、3-エチニル-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(0.21g、0.63mmol)、Pd(PPh3)2Cl2(44.03mg、0.06mmol)およびCuI(23.89mg、0.13mmol)の撹拌混合物に、TEA(0.19g、1.88mmol)を室温で添加した。反応混合物を窒素で3回脱気し、90℃で1時間撹拌した。得られた混合物を減圧下で濃縮した。残渣を、CH2Cl2/MeOH(10/1)で溶出するシリカゲルカラムクロマトグラフィーによって精製して、粗生成物を得た。粗生成物を、以下の条件を用いる逆フラッシュクロマトグラフィーによって精製した:カラム:C18シリカゲル、移動相、水中のACN(10mmol/L NH4HCO3)、30分で10%から50%の勾配、検出器:UV 254nm。所望の生成物を含有する分画を合わせ、濃縮して、1-((3S,5R)-1-アクリロイル-5-(メトキシメチル)ピロリジン-3-イル)-3-((1-シクロプロピル-5-フルオロ-1H-インダゾール-4-イル)エチニル)-5-(メチルアミノ)-1H-ピラゾール-4-カルボキサミド(47.40mg、15%)を白色固体として得た。MS ESI C26H28FN7O3[M+H]+についての計算値506.22、実測値506.30;1H NMR(400 MHz,DMSO-d6)δ 8.09(d,J=3.4Hz,1H),7.87(dd,J=9.3,4.0Hz,1H),7.68-7.39(m,2H),6.91(s,1H),6.80-6.43(m,2H),6.17(dd,J=16.7,2.4Hz,1H),5.69(dd,J=10.3,2.4Hz,1H),5.36-5.14(m,1H),4.47(d,J=57.4Hz,1H),4.09-3.98(m,1H),3.95-3.69(m,2H),3.68-3.42(m,2H),3.31(d,J=4.8Hz,3H),2.94(t,J=5.3Hz,3H),2.72-2.55(m,1H),2.38-2.23(m,1H),1.23-1.04(m,4H).
実施例288:3-(2-{6-クロロ-3-[(1R)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{6-クロロ-3-[(1R)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(立体化学は任意に割り当てられた).MS ESI C26H26ClF2N7O3[M+H]+についての計算値558.20、実測値558.25;1H NMR(400 MHz,CDCl3)δ 8.07(s,1H),7.91(s,1H),7.84(s,1H),7.29(s,2H),6.45(dd,J=12.4,7.3Hz,2H),5.73(dd,J=8.2,4.4Hz,1H),5.58-5.30(m,2H),4.60(d,J=9.0Hz,1H),4.08(dt,J=19.2,9.2Hz,2H),3.92(d,J=13.5Hz,1H),3.50(dd,J=22.8,6.7Hz,2H),3.40(d,J=5.0Hz,3H),3.06(d,J=13.2Hz,3H),2.76-2.71(m,1H),2.35(dd,J=12.7,7.2Hz,2H),2.04(s,1H).
実施例289:3-(2-{6-クロロ-3-[(1S)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{6-クロロ-3-[(1S)-2,2-ジフルオロシクロプロピル]-1,3-ベンゾジアゾール-5-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド(立体化学は任意に割り当てられた).MS ESI C26H26ClF2N7O3[M+H]+についての計算値558.18、実測値558.25;1H NMR(400 MHz,CDCl3)δ 8.14(s,1H),7.89(d,J=25.4Hz,2H),7.21(s,1H),6.57-6.35(m,2H),5.74-5.71(m,1H),5.55-5.51(m,1H),5.44-5.26(m,1H),4.62-4.35(m,1H),4.13-4.05(m,2H),4.01-3.85(m,2H),3.55-3.39(m,4H),3.06(d,J=13.0Hz,3H),2.76-2.71(m,1H),2.42-2.28(m,2H),2.09-2.02(m,1H).
実施例290:3-(2-{3-クロロ-6-フルオロイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド
3-(2-{3-クロロ-6-フルオロイミダゾ[1,2-a]ピリジン-7-イル}エチニル)-1-[(3S,5R)-5-(メトキシメチル)-1-(プロパ-2-エノイル)ピロリジン-3-イル]-5-(メチルアミノ)ピラゾール-4-カルボキサミド.MS ESI C23H23ClFN7O3[M+H]+についての計算値500.15、実測値500.10;1H NMR(400 MHz,CDCl3)δ 8.10(d,J=4.2Hz,1H),7.90(d,J=6.3Hz,1H),7.73(s,1H),6.85(s,1H),6.56-6.40(m,2H),5.84-5.73(m,1H),5.60-5.27(m,2H),4.59(d,J=9.0Hz,1H),4.15-3.99(m,2H),4.10-3.93(m,1H),3.54-3.37(m,4H),3.06(d,J=14.9Hz,3H),2.71-2.69(m,1H),2.50-2.37(m,1H).
II.生物学的評価
実施例1:FGFR2キナーゼアッセイ
実施例1:FGFR2キナーゼアッセイ
蛍光ベースのマイクロ流体移動度シフトアッセイを使用して、FGFR2キナーゼ活性の小分子阻害を評価した。FGFR2は、基質ペプチドであるFLPeptide30(5-FAM-KKKKEEIYFFF-CONH2)へのホスホリル転移中にATPからADPの産生を触媒する(Perkin Elmer、760430)。移動度シフトアッセイは、キナーゼ反応後に蛍光標識されたペプチド(基質およびリン酸化された生成物)を電気泳動的に分離する。基質および生成物の両方を測定し、これらの値の比を使用して、LabChip EZリーダー(Perkin Elmer)による基質から生成物への変換%を作成した。0.06nMの野生型FGFR2(Carna Bioscience、08-134)を、50nM HEPES、1mM EGTA、0.01%Brij-35、0.05%BSA、および2mM DTTを含有する緩衝液中1.5μM基質、10mM MgClおよび100μM ATPを用いて調製した後、DMSO中の化合物の添加、室温で80分間インキュベートした。反応を、0.5M EDTAの添加によって停止させた。IC50値を、Dotmatics Knowledge Solutions Studiesのカーブフィッティング(Dotmatics,Bishops Stortford,UK,CM23)を使用し、変換阻害の比を使用して計算し、表3に示す。
III.医薬剤形の調製
実施例1:経口カプセル
有効成分は、表1の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物である。経口投与用のカプセルは、1~1000mgの有効成分をスターチまたは他の適切な粉末ブレンドと混合することによって調製される。混合物は、経口投与に適した硬ゼラチンカプセルなどの経口投与ユニットに組み込まれる。
実施例1:経口カプセル
有効成分は、表1の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物である。経口投与用のカプセルは、1~1000mgの有効成分をスターチまたは他の適切な粉末ブレンドと混合することによって調製される。混合物は、経口投与に適した硬ゼラチンカプセルなどの経口投与ユニットに組み込まれる。
実施例2:注射用溶液
有効成分は、表1の化合物またはその薬学的に許容され得る塩であり、50mg-eq/mLの濃度でゴマ油中の溶液として製剤化される。
有効成分は、表1の化合物またはその薬学的に許容され得る塩であり、50mg-eq/mLの濃度でゴマ油中の溶液として製剤化される。
本明細書に記載の例および実施形態は、例示目的のみとしており、当業者に示唆される様々な修正または変更は、本出願の趣旨および範囲ならびに添付の特許請求の範囲内に含まれるべきである。
Claims (40)
- 式(I)
の構造を有する化合物、またはその薬学的に許容され得る塩もしくは溶媒和物であって、
式中、
Zは、構造
tは1または2であり、
R1、R2、およびR3は各々、水素、フルオロ、場合により置換されているC1-C4アルキル、または場合により置換されているヘテロシクリルアルキルから独立して選択され、
R4は、場合により置換されている窒素含有9または10個の原子のヘテロアリールであり、
Rは、水素、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、場合により置換されているC3-C7ヘテロシクリルアルキル、場合により置換されているC2-C7アルケニル、-CO2R5、-CONHR5、または-CON(R5)2から選択され、
各R5は、場合により置換されているC1-C6アルキル、場合により置換されているC3-C7カルボシクリル、場合により置換されているC3-C7カルボシクリルアルキル、場合により置換されているC3-C7ヘテロシクリル、または場合により置換されているC3-C7ヘテロシクリルアルキルから独立して選択され、
R6は、場合により置換されているアルキル、場合により置換されているカルボシクリルアルキル、または場合により置換されているヘテロシクリルアルキルである、
化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。 - R2が水素である、請求項1~2のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R3が水素またはフルオロである、請求項1~3のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R2およびR3が水素である、請求項1~4のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R1が水素である、請求項1~5のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R1が場合により置換されているC1-C4アルキルである、請求項1~5のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R1が場合により置換されているC1-C2アルキルである、請求項1~5のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R1が場合により置換されているC1アルキルである、請求項1~5のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 前記場合により置換されているアルキルが、場合により置換されているアミノ基で置換されている、請求項7、8、または9に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 前記場合により置換されているアミノ基が、ジメチルアミノである、請求項10に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が、場合により置換されているベンズイミダゾール、場合により置換されている1H-インダゾール、場合により置換されている2H-インダゾール、場合により置換されているベンゾトリアゾール、場合により置換されているベンゾオキサゾール、場合により置換されているイミダゾ[4,5-c]ピリジン、または場合により置換されているイミダゾ[4,5-b]ピリジンから選択される、請求項1~11のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が、キノリン、キノキサリン、ピラゾロ[1,5-a]ピリミジン、イミダゾ[1,2-a]ピリジン、ピラゾロ[1,5-a]ピリジン、イミダゾ[1,2-a]ピリミジン、イミダゾ[1,2-b]ピリダジン、またはピラゾロ[1,5-a]ピリジンから選択される、場合により置換されている窒素含有9または10個の原子のヘテロアリールから選択される、請求項1~11のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が場合により置換されているベンズイミダゾールである、請求項1~12のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が場合により置換されている1H-インダゾールである、請求項1~12のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が場合により置換されている2H-インダゾールである、請求項1~12のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が、場合により置換されているベンゾオキサゾール、場合により置換されているイミダゾ[4,5-c]ピリジン、または場合により置換されているイミダゾ[4,5-b]ピリジンである、請求項1~12のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 場合により置換されている窒素含有9または10個の原子のヘテロアリールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、請求項12または13に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 前記場合により置換されているベンズイミダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、請求項14に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 前記場合により置換されている1H-インダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、請求項15に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 前記場合により置換されている2H-インダゾールが、アルキル、シクロアルキル、またはハロゲンで場合により置換されている、請求項16に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが水素である、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが場合により置換されているC1-C6アルキルである、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが場合により置換されているC3-C7カルボシクリルである、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが場合により置換されているC3-C7カルボシクリルアルキルである、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが場合により置換されているC3-C7ヘテロシクリルである、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが場合により置換されているC3-C7ヘテロシクリルアルキルである、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが-CO2R5である、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- Rが-CONHR5または-CON(R5)2である、請求項1~21のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 前記場合により置換されているC1-C6アルキルが、C1-C3アルコキシで置換されているC1-C3アルキルである、請求項23に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールである、請求項30に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールであり、Rが-CH2OCH3基であり、R6がメチルである、請求項5または6に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- R4が、シクロアルキル基、および少なくとも1つのハロゲンでさらに置換された、場合により置換されているベンズイミダゾールであり、Rが水素であり、R6がメチルである、請求項5または6に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- 請求項1~33のいずれか一項に記載の式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を含む医薬組成物。
- 請求項1~33のいずれか一項に記載の化合物またはその薬学的に許容され得る塩もしくは溶媒和物、および薬学的に許容され得る担体を混合することを含む、医薬組成物を調製する方法。
- ヒトまたは動物の身体を処置する方法において使用するための、請求項1~33のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- がんまたは新生物性疾患を処置する方法において使用するための、請求項1~33のいずれか一項に記載の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物。
- がんまたは新生物性疾患を処置するための医薬品の製造における、請求項1~33のいずれか一項に記載の化合物またはその薬学的に許容され得る塩もしくは溶媒和物の使用。
- がんの処置を必要とする患者における前記がんを処置する方法であって、請求項1~33のいずれか一項に記載の式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物を前記患者に投与することを含む、方法。
- がんの処置を必要とする患者における前記がんを処置する方法であって、請求項1~33のいずれか一項に記載の式(I)の化合物、またはその薬学的に許容され得る塩もしくは溶媒和物、および薬学的に許容され得る賦形剤を含む医薬組成物を前記患者に投与することを含む、方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202063035155P | 2020-06-05 | 2020-06-05 | |
| US63/035,155 | 2020-06-05 | ||
| US202063106812P | 2020-10-28 | 2020-10-28 | |
| US63/106,812 | 2020-10-28 | ||
| PCT/US2021/035854 WO2021247969A1 (en) | 2020-06-05 | 2021-06-04 | Inhibitors of fibroblast growth factor receptor kinases |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023529867A true JP2023529867A (ja) | 2023-07-12 |
| JPWO2021247969A5 JPWO2021247969A5 (ja) | 2024-06-11 |
Family
ID=78829924
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022574753A Pending JP2023529867A (ja) | 2020-06-05 | 2021-06-04 | 線維芽細胞増殖因子受容体キナーゼの阻害剤 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US11345681B1 (ja) |
| EP (1) | EP4161656A4 (ja) |
| JP (1) | JP2023529867A (ja) |
| KR (1) | KR20230035031A (ja) |
| CN (1) | CN116057045A (ja) |
| AU (1) | AU2021282596A1 (ja) |
| BR (1) | BR112022024729A2 (ja) |
| CA (1) | CA3181162A1 (ja) |
| CL (1) | CL2022003427A1 (ja) |
| CO (1) | CO2022018806A2 (ja) |
| IL (1) | IL298760A (ja) |
| MX (1) | MX2022015410A (ja) |
| TW (1) | TW202210472A (ja) |
| WO (1) | WO2021247969A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2022015410A (es) | 2020-06-05 | 2023-03-13 | Kinnate Biopharma Inc | Inhibidores de las cinasas receptoras del factor de crecimiento de fibroblastos. |
| CN115867547A (zh) * | 2020-08-27 | 2023-03-28 | 上海和誉生物医药科技有限公司 | 一种1h-吡唑-4-酰胺衍生物,其制备方法和应用 |
| JP2024503661A (ja) * | 2021-01-12 | 2024-01-26 | ベイジン・イノケア・ファーマ・テク・カンパニー・リミテッド | (s)-1-(1-アクリロイルピロリジン-3-イル)-3-((3,5-ジメトキシフェニル)エチニル)-5-(メチルアミノ)-1h-ピラゾール-4-カルボキサミドの製造方法 |
| WO2023107870A1 (en) * | 2021-12-08 | 2023-06-15 | Kinnate Biopharma Inc. | Inhibitors of fibroblast growth factor receptor kinases |
| WO2023107979A1 (en) * | 2021-12-08 | 2023-06-15 | Kinnate Biopharma Inc. | Treatment of cancer with an fgfr kinase inhibitor |
| KR20240119095A (ko) * | 2021-12-08 | 2024-08-06 | 킨네이트 바이오파마 인크. | Fgfr 저해제의 고체 상태 형태 |
| CN115232074A (zh) * | 2022-08-22 | 2022-10-25 | 湖南复瑞生物医药技术有限责任公司 | 一种1-烷基取代-2-甲基-5-溴苯并咪唑的合成方法 |
| WO2024167423A1 (en) | 2023-02-07 | 2024-08-15 | Captor Therapeutics S.A. | Gspt1 degrader compounds |
Family Cites Families (115)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1087725C (zh) | 1994-03-25 | 2002-07-17 | 同位素技术有限公司 | 用氘代方法增强药物效果 |
| US6334997B1 (en) | 1994-03-25 | 2002-01-01 | Isotechnika, Inc. | Method of using deuterated calcium channel blockers |
| US5886022A (en) | 1995-06-05 | 1999-03-23 | Bayer Corporation | Substituted cycloalkanecarboxylic acid derivatives as matrix metalloprotease inhibitors |
| SI9600371B (sl) | 1996-12-18 | 2005-04-30 | LEK, tovarna farmacevtskih in kemi�nih izdelkov, d.d. | Etilidenski derivati tricikličnih karbapenemov |
| US6307049B1 (en) | 1998-09-30 | 2001-10-23 | The Procter & Gamble Co. | Heterocyclic 2-substituted ketoamides |
| US6300341B1 (en) | 1998-09-30 | 2001-10-09 | The Procter & Gamble Co. | 2-substituted heterocyclic sulfonamides |
| WO2003037894A1 (en) | 2001-11-02 | 2003-05-08 | Glaxo Group Limited | 4-(5-membered)-heteroaryl acyl pyrrolidine derivatives as hcv inhibitors |
| ES2289161T3 (es) | 2001-11-02 | 2008-02-01 | Glaxo Group Limited | Derivados de 4-(heteroaril de 6 miembros)-acil pirrolidina como inhibidores de hcv. |
| PL374434A1 (en) | 2002-07-05 | 2005-10-17 | Targacept, Inc. | N-aryl diazaspiracyclic compounds and methods of preparation and use thereof |
| US7754188B2 (en) | 2003-06-30 | 2010-07-13 | Merck Sharp & Dohme Corp. | Radiolabeled cannabinoid-1 receptor modulators |
| FR2860431A1 (fr) | 2003-10-02 | 2005-04-08 | Oreal | Composition capillaire ou de mascara contenant un compose azoique, son utilisation pour stimuler ou induire la pousse des cheveux ou des cils et/ou freiner leur chute |
| NZ547327A (en) | 2003-11-21 | 2009-08-28 | Array Biopharma Inc | AKT protein kinase inhibitors |
| US20080004263A1 (en) | 2004-03-04 | 2008-01-03 | Santora Vincent J | Ligands of Follicle Stimulating Hormone Receptor and Methods of Use Thereof |
| EP2168968B1 (en) | 2004-04-02 | 2017-08-23 | OSI Pharmaceuticals, LLC | 6,6-bicyclic ring substituted heterobicyclic protein kinase inhibitors |
| US7217702B2 (en) | 2004-04-02 | 2007-05-15 | Adenosine Therapeutics, Llc | Selective antagonists of A2A adenosine receptors |
| RU2387647C9 (ru) | 2004-08-20 | 2011-05-27 | Таргасепт, Инк. | Применение n-арилдиазаспироциклических соединений для лечения зависимостей |
| GB0428082D0 (en) | 2004-12-22 | 2005-01-26 | Welcome Trust The Ltd | Therapeutic compounds |
| WO2006071958A1 (en) | 2004-12-29 | 2006-07-06 | Millennium Pharmaceuticals, Inc. | Compounds useful as chemokine receptor antagonists |
| MX2008002467A (es) | 2005-08-22 | 2008-04-07 | Targacept Inc | Diazatricicloalcanos sustituidos con heteroarilo, metodos para su preparacion y uso de los mismos. |
| US7723336B2 (en) | 2005-09-22 | 2010-05-25 | Bristol-Myers Squibb Company | Fused heterocyclic compounds useful as kinase modulators |
| CN103214484B (zh) | 2005-12-13 | 2016-07-06 | 因塞特控股公司 | 作为两面神激酶抑制剂的杂芳基取代的吡咯并[2,3-b]吡啶和吡咯并[2,3-b]嘧啶 |
| CN101400678A (zh) | 2006-01-23 | 2009-04-01 | 沃泰克斯药物股份有限公司 | 可用作蛋白激酶抑制剂的噻吩酰胺 |
| EP2007757B1 (en) | 2006-04-13 | 2012-10-03 | Vertex Pharmceuticals Incorporated | Thiophene-carboxamides useful as inhibitors of protein kinases |
| EP1849781A1 (en) | 2006-04-28 | 2007-10-31 | Laboratorios del Dr. Esteve S.A. | Substituted 3-Amino-4-hydroxy pyrrolidines compounds, their preparation and use as medicaments |
| CA2653005A1 (en) | 2006-05-23 | 2007-12-06 | Vertex Pharmaceuticals Incorporated | Thiophene-carboxamides useful as inhibitors of protein kinases |
| WO2007139816A2 (en) | 2006-05-23 | 2007-12-06 | Vertex Pharmaceuticals Incorporated | Thiophene-carboxamides useful as inhibitors of protein kinases |
| CA2657227A1 (en) | 2006-07-14 | 2008-01-17 | Novartis Ag | Pyrimidine derivatives as alk-5 inhibitors |
| EP2049548A1 (en) | 2006-07-27 | 2009-04-22 | UCB Pharma, S.A. | Fused oxazoles & thiazoles as histamine h3- receptor ligands |
| US8466150B2 (en) | 2006-12-28 | 2013-06-18 | Abbott Laboratories | Inhibitors of poly(ADP-ribose)polymerase |
| RS53196B (en) | 2006-12-28 | 2014-06-30 | Abbvie Inc. | INHIBITORI POLI (ADP-RIBOZA) POLIMERAZE |
| EP2036906A1 (de) | 2007-09-05 | 2009-03-18 | Bayer Schering Pharma Aktiengesellschaft | Azaindole als Inhibitoren der löslichen Adenylatzyklase |
| AR070127A1 (es) | 2008-01-11 | 2010-03-17 | Novartis Ag | Pirrolo - pirimidinas y pirrolo -piridinas |
| MX2010007587A (es) | 2008-01-24 | 2010-08-04 | Ucb Pharma Sa | Compuestos que comprenden un grupo ciclobutoxi. |
| WO2009158719A2 (en) | 2008-06-27 | 2009-12-30 | Hydra Biosciences, Inc. | Methods and compositions for treating disorders |
| AU2010250055A1 (en) | 2009-02-27 | 2011-09-15 | Vertex Pharmaceuticals Incorporated | Tri-cyclic pyrazolopyridine kinase inhibitors |
| EP2485589A4 (en) | 2009-09-04 | 2013-02-06 | Biogen Idec Inc | HETEROARYARY INHIBITORS OF BTK |
| WO2011094890A1 (en) | 2010-02-02 | 2011-08-11 | Argusina Inc. | Phenylalanine derivatives and their use as non-peptide glp-1 receptor modulators |
| MX2012010919A (es) | 2010-03-24 | 2013-02-01 | Vertex Pharma | Analogos para el tratamiento o prevencion de infecciones por flavivirus. |
| TW201141857A (en) | 2010-03-24 | 2011-12-01 | Vertex Pharma | Analogues for the treatment or prevention of flavivirus infections |
| TW201139438A (en) | 2010-03-24 | 2011-11-16 | Vertex Pharma | Analogues for the treatment or prevention of flavivirus infections |
| WO2011117381A1 (en) | 2010-03-26 | 2011-09-29 | Boehringer Ingelheim International Gmbh | B-raf kinase inhibitors |
| WO2011117382A1 (en) | 2010-03-26 | 2011-09-29 | Boehringer Ingelheim International Gmbh | Pyridyltriazoles |
| US20110312996A1 (en) | 2010-05-17 | 2011-12-22 | Intermune, Inc. | Novel inhibitors of hepatitis c virus replication |
| MX342164B (es) | 2010-06-23 | 2016-09-19 | Hanmi Science Co Ltd | Derivados de pirimidina fusionados novedosos para la inhibicion de la actividad de tirosina cinasa. |
| US8735386B2 (en) | 2010-07-23 | 2014-05-27 | Boehringer Ingelheim International Gmbh | Aminopyrazoloquinazolines |
| JP5917545B2 (ja) | 2010-11-19 | 2016-05-18 | インサイト・ホールディングス・コーポレイションIncyte Holdings Corporation | Jak阻害剤としてのシクロブチル置換ピロロピリジンおよびピロロピリミジン誘導体 |
| CA2818545C (en) | 2010-11-19 | 2019-04-16 | Incyte Corporation | Heterocyclic-substituted pyrrolopyridines and pyrrolopyrimidines as jak inhibitors |
| US8710055B2 (en) | 2010-12-21 | 2014-04-29 | Boehringer Ingelheim International Gmbh | Triazolylphenyl sulfonamides as serine/threonine kinase inhibitors |
| US9295754B2 (en) | 2011-02-24 | 2016-03-29 | Emory University | Noggin inhibitory compositions for ossification and methods related thereto |
| US20120252721A1 (en) | 2011-03-31 | 2012-10-04 | Idenix Pharmaceuticals, Inc. | Methods for treating drug-resistant hepatitis c virus infection with a 5,5-fused arylene or heteroarylene hepatitis c virus inhibitor |
| WO2012154608A1 (en) | 2011-05-06 | 2012-11-15 | Intellikine, Llc | Reactive mtor and pi3 kinase inhibitors and uses thereof |
| WO2013025484A1 (en) | 2011-08-12 | 2013-02-21 | Lapchak Paul A | Polyphenol analogs to treat ischemia |
| CN103929959A (zh) | 2011-08-12 | 2014-07-16 | 萨克生物研究学院 | 神经保护性多酚类似物 |
| CN103889982A (zh) | 2011-10-18 | 2014-06-25 | 先正达参股股份有限公司 | 杀微生物的吡唑衍生物 |
| GB201119799D0 (en) | 2011-11-16 | 2011-12-28 | Sentinel Oncology Ltd | Pharmaceutical compounds |
| US9174994B2 (en) | 2011-11-23 | 2015-11-03 | Intellikine, Llc | Enhanced treatment regimens using mTor inhibitors |
| EP2615083A1 (en) | 2012-01-10 | 2013-07-17 | Studiengesellschaft Kohle mbH | Process for the asymmetric oxidation of organic compounds with peroxides in the presence of a chiral acid catalyst |
| US8940742B2 (en) | 2012-04-10 | 2015-01-27 | Infinity Pharmaceuticals, Inc. | Heterocyclic compounds and uses thereof |
| AU2013246485A1 (en) | 2012-04-12 | 2014-10-16 | Xenon Pharmaceuticals Inc. | Asymmetric syntheses for spiro-oxindole compounds useful as therapeutic agents |
| AR091023A1 (es) | 2012-05-11 | 2014-12-30 | Abbvie Inc | Inhibidores del nampt |
| CA2873075A1 (en) | 2012-05-11 | 2013-07-14 | Abbvie Inc. | Nampt inhibitors |
| EP2850081A1 (en) | 2012-05-11 | 2015-03-25 | AbbVie Inc. | Thiazolecarboxamide derivatives for use as nampt inhibitors |
| US9593115B2 (en) | 2012-09-21 | 2017-03-14 | Advinus Therapeutics Ltd. | Substituted fused tricyclic compounds, compositions, and medicinal applications thereof |
| US20150152122A1 (en) | 2013-03-13 | 2015-06-04 | Avon Products, Inc. | Tyrosinase inhibitors |
| CA2906542A1 (en) | 2013-03-15 | 2014-09-25 | Intellikine, Llc | Combination of kinase inhibitors and uses thereof |
| WO2014145493A1 (en) | 2013-03-15 | 2014-09-18 | The Johns Hopkins University | Radioactive substrates for aldehyde dehydrogenase |
| JP2016512239A (ja) | 2013-03-15 | 2016-04-25 | バーテックス ファーマシューティカルズ インコーポレイテッドVertex Pharmaceuticals Incorporated | Atrキナーゼの阻害剤として有用な化合物 |
| CN105407729B (zh) | 2013-05-22 | 2018-01-02 | 库扎环球有限责任公司 | 包含聚胺的组合物和方法 |
| CN105555785B (zh) | 2013-06-18 | 2019-03-01 | 4Sc股份公司 | 作为dyrk激酶抑制剂的2,3-二氢苯并呋喃-5-基化合物 |
| US20160368897A1 (en) | 2013-06-28 | 2016-12-22 | Emory University | Pyrazoline Dihydroquinolones, Pharmaceutical Compositions, and Uses |
| SG11201600147TA (en) | 2013-06-28 | 2016-02-26 | Beigene Ltd | Fused tricyclic urea compounds as raf kinase and/or raf kinase dimer inhibitors |
| AU2014291161B2 (en) | 2013-07-18 | 2018-04-26 | Taiho Pharmaceutical Co., Ltd. | Antitumor drug for intermittent administration of FGFR inhibitor |
| WO2015008844A1 (ja) * | 2013-07-18 | 2015-01-22 | 大鵬薬品工業株式会社 | Fgfr阻害剤耐性癌の治療薬 |
| CN105611924A (zh) | 2013-07-25 | 2016-05-25 | 泰莱托恩基金会 | Fapp2的抑制剂及其用途 |
| CN104341425B (zh) * | 2013-08-08 | 2018-11-02 | 上海医药集团股份有限公司 | 氘代乙炔衍生物、其药物组合物及应用 |
| US10005728B2 (en) | 2013-08-28 | 2018-06-26 | Vanderbilt University | Substituted indole Mcl-1 inhibitors |
| WO2015039612A1 (zh) | 2013-09-18 | 2015-03-26 | 北京韩美药品有限公司 | 抑制btk和/或jak3激酶活性的化合物 |
| CN104262328B (zh) | 2013-09-18 | 2016-09-07 | 北京韩美药品有限公司 | 抑制btk和/或jak3激酶活性的化合物 |
| CN105979948A (zh) | 2013-12-05 | 2016-09-28 | 安塞塔制药公司 | Pi3k抑制剂和btk抑制剂的治疗组合 |
| WO2015134357A1 (en) | 2014-03-03 | 2015-09-11 | Emory University | Modulators of insulin receptor |
| JP6328341B2 (ja) | 2014-08-15 | 2018-05-23 | チア タイ ティエンチン ファーマシューティカル グループ カンパニー リミテッド | Tlr7アゴニストとして使用されるピロロピリミジン化合物 |
| WO2016040449A1 (en) | 2014-09-10 | 2016-03-17 | Raze Therapeutics, Inc. | 3-phosphoglycerate dehydrogenase inhibitors and uses thereof |
| WO2016044445A2 (en) | 2014-09-17 | 2016-03-24 | Ironwood Pharmaceuticals, Inc. | sGC STIMULATORS |
| EP3204360B1 (en) | 2014-10-10 | 2020-08-26 | Genentech, Inc. | Therapeutic compounds and uses thereof |
| EP3242874B1 (en) | 2015-01-09 | 2018-10-31 | Genentech, Inc. | Pyridazinone derivatives and their use in the treatment of cancer |
| WO2016197027A1 (en) | 2015-06-04 | 2016-12-08 | Kura Oncology, Inc. | Methods and compositions for inhibiting the interaction of menin with mll proteins |
| AR104020A1 (es) | 2015-06-04 | 2017-06-21 | Kura Oncology Inc | Métodos y composiciones para inhibir la interacción de menina con proteínas mill |
| EP3356349A1 (en) | 2015-09-28 | 2018-08-08 | Araxes Pharma LLC | Inhibitors of kras g12c mutant proteins |
| US11476426B2 (en) | 2016-02-03 | 2022-10-18 | Sfc Co., Ltd. | Organic light emitting compounds and organic light emitting devices including the same |
| CN107840842A (zh) | 2016-09-19 | 2018-03-27 | 北京天诚医药科技有限公司 | 炔代杂环化合物、其制备方法及其在医药学上的应用 |
| US10882856B2 (en) | 2016-09-24 | 2021-01-05 | Beigene, Ltd. | 5 or 8-substituted imidazo [1,5-a] pyridines as selective inhibitors of indoleamine and/or tryptophane 2,3-dioxygenases |
| CN110312711A (zh) | 2016-10-07 | 2019-10-08 | 亚瑞克西斯制药公司 | 作为ras抑制剂的杂环化合物及其使用方法 |
| US11130761B2 (en) * | 2016-12-29 | 2021-09-28 | Cspc Zhongqi Pharmaceutical Technology (Shijiazhuang) Co., Ltd. | Substituted pyrrolo[2,1-f][1,2,4]triazines as FGFR inhibitors |
| CN110382482A (zh) | 2017-01-26 | 2019-10-25 | 亚瑞克西斯制药公司 | 稠合的杂-杂二环化合物及其使用方法 |
| US11279689B2 (en) | 2017-01-26 | 2022-03-22 | Araxes Pharma Llc | 1-(3-(6-(3-hydroxynaphthalen-1-yl)benzofuran-2-yl)azetidin-1 yl)prop-2-en-1-one derivatives and similar compounds as KRAS G12C modulators for treating cancer |
| US11274093B2 (en) | 2017-01-26 | 2022-03-15 | Araxes Pharma Llc | Fused bicyclic benzoheteroaromatic compounds and methods of use thereof |
| WO2018140598A1 (en) | 2017-01-26 | 2018-08-02 | Araxes Pharma Llc | Fused n-heterocyclic compounds and methods of use thereof |
| US10450303B2 (en) | 2017-03-15 | 2019-10-22 | Athenex, Inc. | Biaryl piperidine amide compounds and methods of use thereof |
| CN108623562A (zh) | 2017-03-24 | 2018-10-09 | 中国海洋大学 | 一种喹啉酮生物碱类化合物及其制备方法和应用 |
| CN108658974A (zh) | 2017-03-28 | 2018-10-16 | 中国海洋大学 | 一种内酰胺类化合物及其制备方法和用途 |
| CN108658972A (zh) | 2017-03-28 | 2018-10-16 | 中国海洋大学 | 一种取代内酰胺类化合物及其制备方法和用途 |
| CN108690016B (zh) | 2017-04-11 | 2022-08-12 | 广东东阳光药业有限公司 | 吡唑并吡啶类化合物及其用途 |
| WO2018226976A1 (en) | 2017-06-08 | 2018-12-13 | Kura Oncology, Inc. | Methods and compositions for inhibiting the interaction of menin with mll proteins |
| US11236053B2 (en) | 2017-07-26 | 2022-02-01 | Emory University | NADPH oxidase inhibitors and uses thereof |
| PE20200758A1 (es) | 2017-08-15 | 2020-07-27 | Inflazome Ltd | Sulfonilureas y sulfoniltioureas como inhibidores de nlrp3 |
| RU2020110366A (ru) | 2017-08-15 | 2021-09-16 | Инфлазоум Лимитед | Новые соединения сульфонамидкарбоксамидов |
| CN110117285B (zh) | 2018-02-07 | 2023-02-03 | 广东东阳光药业有限公司 | 流感病毒复制抑制剂及其用途 |
| EP3774798A1 (en) | 2018-04-02 | 2021-02-17 | Silverback Therapeutics, Inc. | Alk5 inhibitors, conjugates, and uses thereof |
| WO2019226991A1 (en) | 2018-05-25 | 2019-11-28 | Essa Pharma, Inc. | Androgen receptor modulators and methods for their use |
| TW202021969A (zh) | 2018-05-31 | 2020-06-16 | 南韓商C&C新藥研究所 | 雜環衍生物及其用途 |
| CN112243439A (zh) | 2018-06-13 | 2021-01-19 | 百济神州有限公司 | 作为hpk1抑制剂的吡咯并[2,3-b]吡啶或吡咯并[2,3-b]吡嗪及其用途 |
| AU2019312670A1 (en) | 2018-08-01 | 2021-02-04 | Araxes Pharma Llc | Heterocyclic spiro compounds and methods of use thereof for the treatment of cancer |
| AU2020278566A1 (en) | 2019-05-17 | 2021-12-23 | Kinnate Biopharma Inc. | Inhibitors of fibroblast growth factor receptor kinases |
| JP2023528880A (ja) | 2020-06-05 | 2023-07-06 | キネート バイオファーマ インク. | 線維芽細胞増殖因子受容体キナーゼの阻害剤 |
| MX2022015410A (es) | 2020-06-05 | 2023-03-13 | Kinnate Biopharma Inc | Inhibidores de las cinasas receptoras del factor de crecimiento de fibroblastos. |
-
2021
- 2021-06-04 MX MX2022015410A patent/MX2022015410A/es unknown
- 2021-06-04 CN CN202180057232.9A patent/CN116057045A/zh active Pending
- 2021-06-04 US US17/339,123 patent/US11345681B1/en active Active
- 2021-06-04 KR KR1020237000199A patent/KR20230035031A/ko active Search and Examination
- 2021-06-04 IL IL298760A patent/IL298760A/en unknown
- 2021-06-04 BR BR112022024729A patent/BR112022024729A2/pt unknown
- 2021-06-04 JP JP2022574753A patent/JP2023529867A/ja active Pending
- 2021-06-04 EP EP21817028.0A patent/EP4161656A4/en active Pending
- 2021-06-04 WO PCT/US2021/035854 patent/WO2021247969A1/en active Application Filing
- 2021-06-04 AU AU2021282596A patent/AU2021282596A1/en active Pending
- 2021-06-04 CA CA3181162A patent/CA3181162A1/en active Pending
- 2021-06-04 TW TW110120491A patent/TW202210472A/zh unknown
-
2022
- 2022-03-23 US US17/702,444 patent/US20230078839A1/en active Pending
- 2022-12-02 CL CL2022003427A patent/CL2022003427A1/es unknown
- 2022-12-23 CO CONC2022/0018806A patent/CO2022018806A2/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| MX2022015410A (es) | 2023-03-13 |
| EP4161656A1 (en) | 2023-04-12 |
| CL2022003427A1 (es) | 2023-06-30 |
| AU2021282596A1 (en) | 2023-01-19 |
| CN116057045A (zh) | 2023-05-02 |
| TW202210472A (zh) | 2022-03-16 |
| EP4161656A4 (en) | 2024-06-19 |
| CO2022018806A2 (es) | 2022-12-30 |
| US20230078839A1 (en) | 2023-03-16 |
| CA3181162A1 (en) | 2021-12-09 |
| BR112022024729A2 (pt) | 2023-02-28 |
| US11345681B1 (en) | 2022-05-31 |
| WO2021247969A1 (en) | 2021-12-09 |
| IL298760A (en) | 2023-02-01 |
| KR20230035031A (ko) | 2023-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2023529867A (ja) | 線維芽細胞増殖因子受容体キナーゼの阻害剤 | |
| JP7041198B2 (ja) | Jak阻害剤である5-クロロ-2-ジフルオロメトキシフェニルピラゾロピリミジン化合物 | |
| JP2024056707A (ja) | 抗癌剤として有用なピラゾリル誘導体 | |
| KR101862493B1 (ko) | Fgfr4 억제제로서의 고리-융합된 비시클릭 피리딜 유도체 | |
| TWI650319B (zh) | 用於調節表皮生長因子受體(egfr)活性之化合物及組合物 | |
| TW201020253A (en) | Substituted pyrazolo[1,5-a]pyrimidine compounds as Trk kinase inhibitors | |
| EP4257591A2 (en) | Inhibitors of lysine specific demethylase-1 | |
| BR112016011024B1 (pt) | Composto, composição farmacêutica, e, usos dos mesmos | |
| CA2767097A1 (en) | Pyrazolopyrimidine jak inhibitor compounds and methods | |
| WO2014078372A1 (en) | Pyrrolidinyl urea, thiourea, guanidine and cyanoguanidine compounds as trka kinase inhibitors | |
| EA029312B1 (ru) | Производные имидазопирролидинона и их применение при лечении заболеваний | |
| JP2023538060A (ja) | 二環化合物、それを含む組成物、及びそれらの使用 | |
| JP2018527412A (ja) | Perk阻害剤としての1−フェニルピロリジン−2−オン誘導体 | |
| WO2021247971A1 (en) | Inhibitors of fibroblast growth factor receptor kinases | |
| KR20210124961A (ko) | 티로신 키나제 억제제, 조성물 및 방법 | |
| TW201620913A (zh) | 作為PARP抑制劑的4H-吡唑並[1,5-α]苯並咪唑化合物的類似物 | |
| TW202140499A (zh) | 巨環rip2-激酶抑制劑 | |
| AU2014351413B2 (en) | Pyrrolopyrrolone derivatives and their use as BET inhibitors | |
| KR20240148322A (ko) | 이작용성 아릴설폰아미드 화합물 | |
| CN110272416A (zh) | 吡唑并[3,4-c]吡啶-7-胺衍生物及其制备方法和应用 | |
| TW202214634A (zh) | 雜環化合物及其衍生物 | |
| TW202024072A (zh) | 作為PI3Kβ抑制劑的1,5-二氮雜萘-4(1H)-酮衍生物 | |
| US20230303566A1 (en) | Inhibitors of raf kinases | |
| TW202245758A (zh) | 作為丙酮酸激酶活化劑之吡咯啶-吡唑 | |
| CN118974036A (zh) | Raf激酶的抑制剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230116 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240603 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20240603 |