JP2023528421A - キナーゼ阻害剤 - Google Patents
キナーゼ阻害剤 Download PDFInfo
- Publication number
- JP2023528421A JP2023528421A JP2022574229A JP2022574229A JP2023528421A JP 2023528421 A JP2023528421 A JP 2023528421A JP 2022574229 A JP2022574229 A JP 2022574229A JP 2022574229 A JP2022574229 A JP 2022574229A JP 2023528421 A JP2023528421 A JP 2023528421A
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- pharmaceutically acceptable
- acceptable salt
- solvate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 229940043355 kinase inhibitor Drugs 0.000 title 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 title 1
- 238000000034 method Methods 0.000 claims abstract description 59
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 29
- 150000001875 compounds Chemical class 0.000 claims description 287
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 182
- 150000003839 salts Chemical class 0.000 claims description 123
- 239000012453 solvate Substances 0.000 claims description 107
- 239000000203 mixture Substances 0.000 claims description 95
- 238000011282 treatment Methods 0.000 claims description 61
- 125000004432 carbon atom Chemical group C* 0.000 claims description 40
- 229910052731 fluorine Inorganic materials 0.000 claims description 31
- 102000001253 Protein Kinase Human genes 0.000 claims description 27
- 108060006633 protein kinase Proteins 0.000 claims description 27
- 125000004070 6 membered heterocyclic group Chemical group 0.000 claims description 23
- 230000001419 dependent effect Effects 0.000 claims description 23
- 239000003814 drug Substances 0.000 claims description 23
- 125000000623 heterocyclic group Chemical group 0.000 claims description 22
- 229910052739 hydrogen Inorganic materials 0.000 claims description 22
- 125000002373 5 membered heterocyclic group Chemical group 0.000 claims description 21
- 208000023275 Autoimmune disease Diseases 0.000 claims description 19
- 206010007953 Central nervous system lymphoma Diseases 0.000 claims description 17
- 208000016800 primary central nervous system lymphoma Diseases 0.000 claims description 17
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 16
- 201000006417 multiple sclerosis Diseases 0.000 claims description 16
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 15
- 206010028980 Neoplasm Diseases 0.000 claims description 14
- 208000027866 inflammatory disease Diseases 0.000 claims description 14
- 229910052801 chlorine Inorganic materials 0.000 claims description 12
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 12
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 11
- 201000004681 Psoriasis Diseases 0.000 claims description 10
- 208000021386 Sjogren Syndrome Diseases 0.000 claims description 10
- 201000011510 cancer Diseases 0.000 claims description 10
- 201000000596 systemic lupus erythematosus Diseases 0.000 claims description 10
- 208000001435 Thromboembolism Diseases 0.000 claims description 9
- 208000024780 Urticaria Diseases 0.000 claims description 9
- 150000004677 hydrates Chemical class 0.000 claims description 9
- 239000003937 drug carrier Substances 0.000 claims description 8
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 7
- 125000001963 4 membered heterocyclic group Chemical group 0.000 claims description 6
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 239000003981 vehicle Substances 0.000 claims description 5
- 230000002401 inhibitory effect Effects 0.000 claims description 4
- 239000002671 adjuvant Substances 0.000 claims description 3
- 208000037979 autoimmune inflammatory disease Diseases 0.000 claims 3
- 108010029445 Agammaglobulinaemia Tyrosine Kinase Proteins 0.000 abstract description 57
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 33
- 201000010099 disease Diseases 0.000 abstract description 27
- 238000002360 preparation method Methods 0.000 abstract description 19
- 108091000080 Phosphotransferase Proteins 0.000 abstract description 9
- 102000020233 phosphotransferase Human genes 0.000 abstract description 9
- 239000003112 inhibitor Substances 0.000 abstract description 7
- 229940124291 BTK inhibitor Drugs 0.000 abstract description 6
- 208000035475 disorder Diseases 0.000 abstract description 6
- 229940045988 antineoplastic drug protein kinase inhibitors Drugs 0.000 abstract description 3
- 230000008569 process Effects 0.000 abstract description 3
- 239000003909 protein kinase inhibitor Substances 0.000 abstract description 3
- 102000001714 Agammaglobulinaemia Tyrosine Kinase Human genes 0.000 abstract 2
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 504
- 239000011541 reaction mixture Substances 0.000 description 237
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 149
- -1 n-octyl groups Chemical group 0.000 description 138
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 132
- 238000005481 NMR spectroscopy Methods 0.000 description 112
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 109
- 239000012267 brine Substances 0.000 description 104
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 104
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 100
- 239000007787 solid Substances 0.000 description 89
- 239000000284 extract Substances 0.000 description 86
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 84
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 82
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 76
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 75
- 238000004440 column chromatography Methods 0.000 description 73
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 71
- 229910052938 sodium sulfate Inorganic materials 0.000 description 71
- 235000011152 sodium sulphate Nutrition 0.000 description 71
- 239000000741 silica gel Substances 0.000 description 67
- 229910002027 silica gel Inorganic materials 0.000 description 67
- 239000003208 petroleum Substances 0.000 description 66
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 64
- 239000000243 solution Substances 0.000 description 64
- 102100029823 Tyrosine-protein kinase BTK Human genes 0.000 description 55
- 229910052757 nitrogen Inorganic materials 0.000 description 50
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 48
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-chlorosuccinimide Chemical compound ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 46
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 42
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 36
- 230000015572 biosynthetic process Effects 0.000 description 34
- 238000006243 chemical reaction Methods 0.000 description 34
- 238000003786 synthesis reaction Methods 0.000 description 34
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 31
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 30
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 29
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 28
- 230000014759 maintenance of location Effects 0.000 description 27
- 238000002953 preparative HPLC Methods 0.000 description 24
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 23
- 239000012044 organic layer Substances 0.000 description 23
- HFBMWMNUJJDEQZ-UHFFFAOYSA-N acryloyl chloride Chemical compound ClC(=O)C=C HFBMWMNUJJDEQZ-UHFFFAOYSA-N 0.000 description 22
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 22
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 21
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 21
- 230000000694 effects Effects 0.000 description 20
- XBXCNNQPRYLIDE-UHFFFAOYSA-M n-tert-butylcarbamate Chemical compound CC(C)(C)NC([O-])=O XBXCNNQPRYLIDE-UHFFFAOYSA-M 0.000 description 20
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 20
- 125000000217 alkyl group Chemical group 0.000 description 19
- 239000003795 chemical substances by application Substances 0.000 description 19
- 239000000460 chlorine Substances 0.000 description 19
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 18
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 18
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 18
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 18
- 235000017557 sodium bicarbonate Nutrition 0.000 description 18
- 238000003756 stirring Methods 0.000 description 17
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 16
- 125000005842 heteroatom Chemical group 0.000 description 16
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 14
- LOTBYPQQWICYBB-UHFFFAOYSA-N methyl n-hexyl-n-[2-(hexylamino)ethyl]carbamate Chemical group CCCCCCNCCN(C(=O)OC)CCCCCC LOTBYPQQWICYBB-UHFFFAOYSA-N 0.000 description 14
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 14
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 13
- NGAHQLNRDSWDKY-UHFFFAOYSA-N 4-bromo-5-fluoro-2-methyl-1H-indole-7-carboxamide Chemical compound CC1=CC2=C(N1)C(=CC(=C2Br)F)C(=O)N NGAHQLNRDSWDKY-UHFFFAOYSA-N 0.000 description 12
- 239000002253 acid Substances 0.000 description 12
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 12
- 229910000024 caesium carbonate Inorganic materials 0.000 description 12
- 125000006239 protecting group Chemical group 0.000 description 12
- 230000002829 reductive effect Effects 0.000 description 12
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 12
- 210000004027 cell Anatomy 0.000 description 11
- 229920006395 saturated elastomer Polymers 0.000 description 11
- NYAZRCOMCDZMPW-UHFFFAOYSA-N 4-bromo-5-fluoro-2-methyl-1H-indole-7-carboxylic acid Chemical compound CC(NC1=C(C=C2F)C(O)=O)=CC1=C2Br NYAZRCOMCDZMPW-UHFFFAOYSA-N 0.000 description 10
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 10
- 235000019270 ammonium chloride Nutrition 0.000 description 10
- 125000003118 aryl group Chemical group 0.000 description 10
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 10
- 229910000027 potassium carbonate Inorganic materials 0.000 description 10
- 239000007858 starting material Substances 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 10
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 9
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 9
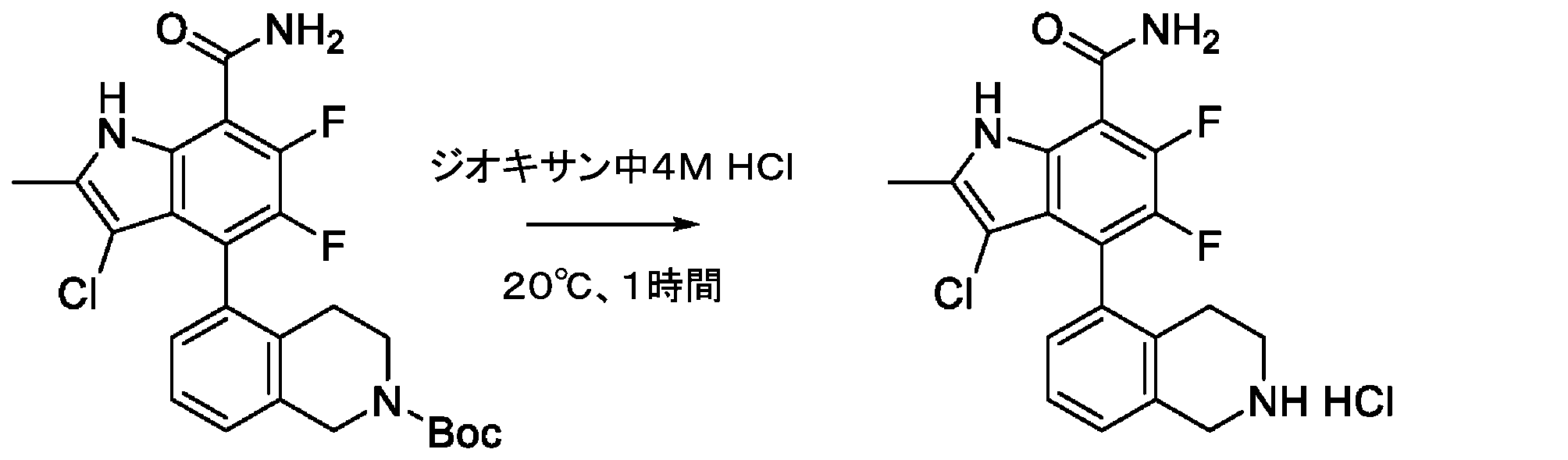
- QBAQNMAFLBIHIX-UHFFFAOYSA-N CC(NC(C1=C2C(C3)=CCCN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1Cl Chemical compound CC(NC(C1=C2C(C3)=CCCN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1Cl QBAQNMAFLBIHIX-UHFFFAOYSA-N 0.000 description 9
- 239000002177 L01XE27 - Ibrutinib Substances 0.000 description 9
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 9
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- 125000003277 amino group Chemical group 0.000 description 9
- 239000012131 assay buffer Substances 0.000 description 9
- 239000002585 base Substances 0.000 description 9
- 210000004556 brain Anatomy 0.000 description 9
- 150000003857 carboxamides Chemical group 0.000 description 9
- 229960001507 ibrutinib Drugs 0.000 description 9
- XYFPWWZEPKGCCK-GOSISDBHSA-N ibrutinib Chemical compound C1=2C(N)=NC=NC=2N([C@H]2CN(CCC2)C(=O)C=C)N=C1C(C=C1)=CC=C1OC1=CC=CC=C1 XYFPWWZEPKGCCK-GOSISDBHSA-N 0.000 description 9
- 239000000523 sample Substances 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- 239000007821 HATU Substances 0.000 description 8
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 8
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 8
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 238000004296 chiral HPLC Methods 0.000 description 8
- 208000024891 symptom Diseases 0.000 description 8
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 7
- QYBNVCZEANIUIW-UHFFFAOYSA-N 2,5-dibromo-3,4-difluoroaniline Chemical compound Nc1cc(Br)c(F)c(F)c1Br QYBNVCZEANIUIW-UHFFFAOYSA-N 0.000 description 7
- YJSXRUNGSRZEPS-UHFFFAOYSA-N 4-bromo-5,6-difluoro-2-methyl-1H-indole-7-carboxamide Chemical compound CC(NC1=C(C(N)=O)C(F)=C2F)=CC1=C2Br YJSXRUNGSRZEPS-UHFFFAOYSA-N 0.000 description 7
- DQAHRODTYYXRRM-UHFFFAOYSA-N 4-bromo-5-fluoro-2,3-dimethyl-1H-indole-7-carbonitrile Chemical compound BrC1=C2C(=C(NC2=C(C=C1F)C#N)C)C DQAHRODTYYXRRM-UHFFFAOYSA-N 0.000 description 7
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 7
- PJIIYUDBLCEDJM-UHFFFAOYSA-N CC(NC1=C(C=C2F)C#N)=CC1=C2Br Chemical compound CC(NC1=C(C=C2F)C#N)=CC1=C2Br PJIIYUDBLCEDJM-UHFFFAOYSA-N 0.000 description 7
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 7
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 7
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 7
- 210000003719 b-lymphocyte Anatomy 0.000 description 7
- 125000002837 carbocyclic group Chemical group 0.000 description 7
- KXDHJXZQYSOELW-UHFFFAOYSA-N carbonic acid monoamide Natural products NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 7
- 239000003054 catalyst Substances 0.000 description 7
- 125000000753 cycloalkyl group Chemical group 0.000 description 7
- 239000003085 diluting agent Substances 0.000 description 7
- 239000000543 intermediate Substances 0.000 description 7
- NNPPMTNAJDCUHE-UHFFFAOYSA-N isobutane Chemical compound CC(C)C NNPPMTNAJDCUHE-UHFFFAOYSA-N 0.000 description 7
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 7
- 108090000623 proteins and genes Proteins 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 238000010992 reflux Methods 0.000 description 7
- PZZZZLMGKKURSU-UHFFFAOYSA-N 1,4-dibromo-2,3-difluoro-5-nitrobenzene Chemical compound [O-][N+](=O)c1cc(Br)c(F)c(F)c1Br PZZZZLMGKKURSU-UHFFFAOYSA-N 0.000 description 6
- 238000005160 1H NMR spectroscopy Methods 0.000 description 6
- UNLAGKABHOTVKZ-UHFFFAOYSA-N 2,5-dibromo-3,4-difluoro-6-iodoaniline Chemical compound NC(C(I)=C(C(F)=C1F)Br)=C1Br UNLAGKABHOTVKZ-UHFFFAOYSA-N 0.000 description 6
- LNLBNWVWGVSZTH-UHFFFAOYSA-N 4-bromo-5,6-difluoro-2-methyl-1-(2-trimethylsilylethoxymethyl)indole-7-carboxylic acid Chemical compound CC(N(COCC[Si](C)(C)C)C1=C(C(O)=O)C(F)=C2F)=CC1=C2Br LNLBNWVWGVSZTH-UHFFFAOYSA-N 0.000 description 6
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 6
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 6
- 101000619542 Homo sapiens E3 ubiquitin-protein ligase parkin Proteins 0.000 description 6
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Chemical compound IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 6
- 235000011054 acetic acid Nutrition 0.000 description 6
- 125000003545 alkoxy group Chemical group 0.000 description 6
- 150000001412 amines Chemical class 0.000 description 6
- 125000004429 atom Chemical group 0.000 description 6
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000012141 concentrate Substances 0.000 description 6
- 235000008504 concentrate Nutrition 0.000 description 6
- 239000012065 filter cake Substances 0.000 description 6
- 125000001072 heteroaryl group Chemical group 0.000 description 6
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 6
- 239000005457 ice water Substances 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- 102000045222 parkin Human genes 0.000 description 6
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 238000000926 separation method Methods 0.000 description 6
- 230000004083 survival effect Effects 0.000 description 6
- FNXRYXMYNURKSK-UHFFFAOYSA-N 4-bromo-5,6-difluoro-2-methyl-1-(2-trimethylsilylethoxymethyl)indole-7-carboxamide Chemical compound CC(N(COCC[Si](C)(C)C)C1=C(C(N)=O)C(F)=C2F)=CC1=C2Br FNXRYXMYNURKSK-UHFFFAOYSA-N 0.000 description 5
- ZZOWZLZWUSOEMS-UHFFFAOYSA-N CC(NC1=C(C(F)=C2F)Br)=CC1=C2Br Chemical compound CC(NC1=C(C(F)=C2F)Br)=CC1=C2Br ZZOWZLZWUSOEMS-UHFFFAOYSA-N 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- CZQVQNRCRVWSSS-UHFFFAOYSA-N OC(=O)C1CC(=O)c2cccc(Br)c12 Chemical compound OC(=O)C1CC(=O)c2cccc(Br)c12 CZQVQNRCRVWSSS-UHFFFAOYSA-N 0.000 description 5
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 5
- 150000001408 amides Chemical class 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 239000003638 chemical reducing agent Substances 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 125000005843 halogen group Chemical group 0.000 description 5
- 238000004128 high performance liquid chromatography Methods 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 230000037361 pathway Effects 0.000 description 5
- 229910000160 potassium phosphate Inorganic materials 0.000 description 5
- 235000011009 potassium phosphates Nutrition 0.000 description 5
- 239000002244 precipitate Substances 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 239000012279 sodium borohydride Substances 0.000 description 5
- 229910000033 sodium borohydride Inorganic materials 0.000 description 5
- RUPAXCPQAAOIPB-UHFFFAOYSA-N tert-butyl formate Chemical compound CC(C)(C)OC=O RUPAXCPQAAOIPB-UHFFFAOYSA-N 0.000 description 5
- KJAMZCVTJDTESW-UHFFFAOYSA-N tiracizine Chemical compound C1CC2=CC=CC=C2N(C(=O)CN(C)C)C2=CC(NC(=O)OCC)=CC=C21 KJAMZCVTJDTESW-UHFFFAOYSA-N 0.000 description 5
- JZVCMOJSPCGLTC-UHFFFAOYSA-N 1020717-99-0 Chemical compound OC(=O)C1=CC(F)=C(Br)C=C1[N+]([O-])=O JZVCMOJSPCGLTC-UHFFFAOYSA-N 0.000 description 4
- VQGQGCGUMQSDOE-UHFFFAOYSA-N 2,5-dibromo-3,4-difluoro-6-prop-1-ynylaniline Chemical compound CC#CC(C(N)=C(C(F)=C1F)Br)=C1Br VQGQGCGUMQSDOE-UHFFFAOYSA-N 0.000 description 4
- XEYCODODJBSURR-UHFFFAOYSA-N 2-[(4,7-dibromo-5,6-difluoro-2-methylindol-1-yl)methoxy]ethyl-trimethylsilane Chemical compound CC(N(COCC[Si](C)(C)C)C1=C(C(F)=C2F)Br)=CC1=C2Br XEYCODODJBSURR-UHFFFAOYSA-N 0.000 description 4
- WIXBOGCCAWKOOJ-UHFFFAOYSA-N 3-chloro-5-fluoro-2-methyl-4-(1-prop-2-enoylpiperidin-3-yl)-1H-indole-7-carboxamide Chemical compound CC(NC(C1=C(C(CCC2)CN2C(C=C)=O)C(F)=C2)=C2C(N)=O)=C1Cl WIXBOGCCAWKOOJ-UHFFFAOYSA-N 0.000 description 4
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 4
- VPKHWEFDYAMWOS-UHFFFAOYSA-N 5-bromo-1-methyl-1,2,3,4-tetrahydroisoquinoline Chemical compound C1=CC=C2C(C)NCCC2=C1Br VPKHWEFDYAMWOS-UHFFFAOYSA-N 0.000 description 4
- WUTKJZGYMPMUSI-UHFFFAOYSA-N 5-bromo-1-methyl-3,4-dihydroisoquinoline Chemical compound C1=CC=C2C(C)=NCCC2=C1Br WUTKJZGYMPMUSI-UHFFFAOYSA-N 0.000 description 4
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- 108010012919 B-Cell Antigen Receptors Proteins 0.000 description 4
- 102000019260 B-Cell Antigen Receptors Human genes 0.000 description 4
- UNLMEBHPMHYXRR-UHFFFAOYSA-N CC(C1=CC=CC(C(C(F)=C2)=C(C(Cl)=C(C)N3)C3=C2C(N)=O)=C1CC1)N1C(C=C)=O Chemical compound CC(C1=CC=CC(C(C(F)=C2)=C(C(Cl)=C(C)N3)C3=C2C(N)=O)=C1CC1)N1C(C=C)=O UNLMEBHPMHYXRR-UHFFFAOYSA-N 0.000 description 4
- OBDKPRVBNULGEH-UHFFFAOYSA-N CC(NC(C1=C(C2=C(CCN(C3)C(C=C)=O)C3=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C2=C(CCN(C3)C(C=C)=O)C3=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl OBDKPRVBNULGEH-UHFFFAOYSA-N 0.000 description 4
- 102000001301 EGF receptor Human genes 0.000 description 4
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 4
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 4
- 206010025323 Lymphomas Diseases 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- KHYIBRUYMFXTCF-UHFFFAOYSA-N O=C(CC1C(C=CC=C2)=C2Br)OC1=O Chemical compound O=C(CC1C(C=CC=C2)=C2Br)OC1=O KHYIBRUYMFXTCF-UHFFFAOYSA-N 0.000 description 4
- 229920001213 Polysorbate 20 Polymers 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 230000005754 cellular signaling Effects 0.000 description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 4
- 238000010511 deprotection reaction Methods 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- 238000010790 dilution Methods 0.000 description 4
- 239000012895 dilution Substances 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 239000000975 dye Substances 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 125000001188 haloalkyl group Chemical group 0.000 description 4
- 229910052736 halogen Inorganic materials 0.000 description 4
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 4
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 4
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000012139 lysis buffer Substances 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- UZNGRHDUJIVHQT-UHFFFAOYSA-M magnesium;prop-1-ene;bromide Chemical compound [Mg+2].[Br-].C[C-]=C UZNGRHDUJIVHQT-UHFFFAOYSA-M 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 235000019198 oils Nutrition 0.000 description 4
- 230000003287 optical effect Effects 0.000 description 4
- 150000007524 organic acids Chemical class 0.000 description 4
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 4
- DNUTZBZXLPWRJG-UHFFFAOYSA-M piperidine-1-carboxylate Chemical compound [O-]C(=O)N1CCCCC1 DNUTZBZXLPWRJG-UHFFFAOYSA-M 0.000 description 4
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 4
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 4
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 4
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 4
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 4
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 4
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 4
- 125000001424 substituent group Chemical group 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- RGXGEFSBDPGCEU-UHFFFAOYSA-N 1,4-dibromo-2,3-difluorobenzene Chemical compound FC1=C(F)C(Br)=CC=C1Br RGXGEFSBDPGCEU-UHFFFAOYSA-N 0.000 description 3
- PMWZQYOFRAEMGP-UHFFFAOYSA-N 1h-indole-7-carboxamide;hydrochloride Chemical compound Cl.NC(=O)C1=CC=CC2=C1NC=C2 PMWZQYOFRAEMGP-UHFFFAOYSA-N 0.000 description 3
- ZYVUHPNGZXZEFZ-UHFFFAOYSA-N 2-(2-bromophenyl)butanedioic acid Chemical compound OC(=O)CC(C(O)=O)C1=CC=CC=C1Br ZYVUHPNGZXZEFZ-UHFFFAOYSA-N 0.000 description 3
- IEQAICDLOKRSRL-UHFFFAOYSA-N 2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-[2-(2-dodecoxyethoxy)ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethanol Chemical compound CCCCCCCCCCCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO IEQAICDLOKRSRL-UHFFFAOYSA-N 0.000 description 3
- VSWICNJIUPRZIK-UHFFFAOYSA-N 2-piperideine Chemical compound C1CNC=CC1 VSWICNJIUPRZIK-UHFFFAOYSA-N 0.000 description 3
- GRJZJFUBQYULKL-UHFFFAOYSA-N 4-bromo-1h-indole Chemical compound BrC1=CC=CC2=C1C=CN2 GRJZJFUBQYULKL-UHFFFAOYSA-N 0.000 description 3
- DUEDAXAIFPJZLS-UHFFFAOYSA-N 4-bromo-5-fluoro-2,3-dimethyl-1H-indole-7-carboxamide Chemical compound BrC1=C2C(=C(NC2=C(C=C1F)C(=O)N)C)C DUEDAXAIFPJZLS-UHFFFAOYSA-N 0.000 description 3
- SVOWPSQLEGLWMT-UHFFFAOYSA-N 6-bromo-2,3,4,5-tetrahydro-1H-2-benzazepine Chemical compound C1NCCCC2=C1C=CC=C2Br SVOWPSQLEGLWMT-UHFFFAOYSA-N 0.000 description 3
- PQALDHKLTCQGDF-UHFFFAOYSA-N 6-bromo-2,3,4,5-tetrahydro-2-benzazepin-1-one Chemical compound C1CCNC(=O)C2=C1C(Br)=CC=C2 PQALDHKLTCQGDF-UHFFFAOYSA-N 0.000 description 3
- 108091008875 B cell receptors Proteins 0.000 description 3
- QROFEYFGUUSXPB-UHFFFAOYSA-N C=CC(N1C(C2)C3=CC=CC(Br)=C3C2C1)=O Chemical compound C=CC(N1C(C2)C3=CC=CC(Br)=C3C2C1)=O QROFEYFGUUSXPB-UHFFFAOYSA-N 0.000 description 3
- UVXAIZUOWMNFSY-UHFFFAOYSA-N CC(C)(C)OC(N1CC(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)=CCC1)=O Chemical compound CC(C)(C)OC(N1CC(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)=CCC1)=O UVXAIZUOWMNFSY-UHFFFAOYSA-N 0.000 description 3
- PAAPIEQQEAJIHX-UHFFFAOYSA-N CC(C)(C)OC(N1CC(C2=C(C=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O Chemical compound CC(C)(C)OC(N1CC(C2=C(C=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O PAAPIEQQEAJIHX-UHFFFAOYSA-N 0.000 description 3
- SGMBPEILASVZNR-UHFFFAOYSA-N CC(C1=C(C(F)=C2)N(CCC3CC4)CC3N4C(C=C)=O)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(CCC3CC4)CC3N4C(C=C)=O)=C(C)NC1=C2C(N)=O SGMBPEILASVZNR-UHFFFAOYSA-N 0.000 description 3
- FUIVZRFXETXNLX-NEPJUHHUSA-N CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C=C)=O)C[C@@H]3F)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C=C)=O)C[C@@H]3F)=C(C)NC1=C2C(N)=O FUIVZRFXETXNLX-NEPJUHHUSA-N 0.000 description 3
- PVRRAZPFKWTLHU-UHFFFAOYSA-N CC(C1=CC=CC(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)=C1CC1)N1C(C=C)=O Chemical compound CC(C1=CC=CC(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)=C1CC1)N1C(C=C)=O PVRRAZPFKWTLHU-UHFFFAOYSA-N 0.000 description 3
- YCVDHKVYNJGMMZ-UHFFFAOYSA-N CC(NC(C1=C(C(C2)=CCCN2C(C=C)=O)C(F)=C2)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C(C2)=CCCN2C(C=C)=O)C(F)=C2)=C2C(N)=O)=C1Cl YCVDHKVYNJGMMZ-UHFFFAOYSA-N 0.000 description 3
- GXYBZWAKHUNWEU-UHFFFAOYSA-N CC(NC(C1=C(C(F)=C2)N(CCC3CC4)CC3N4C(C=C)=O)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C(F)=C2)N(CCC3CC4)CC3N4C(C=C)=O)=C2C(N)=O)=C1Cl GXYBZWAKHUNWEU-UHFFFAOYSA-N 0.000 description 3
- GWWKQOCUFQJQQH-VXGBXAGGSA-N CC(NC(C1=C(C(F)=C2)N3C[C@H](CN(C4)C(C=C)=O)[C@@H]4CC3)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C(F)=C2)N3C[C@H](CN(C4)C(C=C)=O)[C@@H]4CC3)=C2C(N)=O)=C1Cl GWWKQOCUFQJQQH-VXGBXAGGSA-N 0.000 description 3
- LLGNTQBQSZODLQ-UHFFFAOYSA-N CC(NC(C1=C(C2=C(C(CC34)CN3C(C=C)=O)C4=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C2=C(C(CC34)CN3C(C=C)=O)C4=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl LLGNTQBQSZODLQ-UHFFFAOYSA-N 0.000 description 3
- JKDOZFHCKISAPD-UHFFFAOYSA-N CC(NC(C1=C(C2=CCCNC2)C(F)=C2)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C2=CCCNC2)C(F)=C2)=C2C(N)=O)=C1Cl JKDOZFHCKISAPD-UHFFFAOYSA-N 0.000 description 3
- MMIWNKLQDSFXKZ-UHFFFAOYSA-N CC(NC(C1=C2C3=C(CCN(C4)C(C=C)=O)C4=CC=C3)=C(C(N)=O)C(F)=C2F)=C1Cl Chemical compound CC(NC(C1=C2C3=C(CCN(C4)C(C=C)=O)C4=CC=C3)=C(C(N)=O)C(F)=C2F)=C1Cl MMIWNKLQDSFXKZ-UHFFFAOYSA-N 0.000 description 3
- PYQZYWUNFVEAJX-SECBINFHSA-N CC(NC(C1=C2[C@H](CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1F Chemical compound CC(NC(C1=C2[C@H](CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1F PYQZYWUNFVEAJX-SECBINFHSA-N 0.000 description 3
- PPBXIILDCZGGJH-UHFFFAOYSA-N CC1(C)OB(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)OC1(C)C Chemical compound CC1(C)OB(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)OC1(C)C PPBXIILDCZGGJH-UHFFFAOYSA-N 0.000 description 3
- YFGPVVHGLJAQPG-UHFFFAOYSA-N CC1=CC2=C(C3=C(C(CC45)CN4C(C=C)=O)C5=CC=C3)C(F)=CC(C(N)=O)=C2N1 Chemical compound CC1=CC2=C(C3=C(C(CC45)CN4C(C=C)=O)C5=CC=C3)C(F)=CC(C(N)=O)=C2N1 YFGPVVHGLJAQPG-UHFFFAOYSA-N 0.000 description 3
- ORSBGPSUMGFFMC-UHFFFAOYSA-N CCOC(CC(C(OC)=O)C(C=CC=C1)=C1Br)=O Chemical compound CCOC(CC(C(OC)=O)C(C=CC=C1)=C1Br)=O ORSBGPSUMGFFMC-UHFFFAOYSA-N 0.000 description 3
- DRNWOJGWNYMPLW-UHFFFAOYSA-N COC(C(CC(C1=CC=C2)N)C1=C2Br)=O Chemical compound COC(C(CC(C1=CC=C2)N)C1=C2Br)=O DRNWOJGWNYMPLW-UHFFFAOYSA-N 0.000 description 3
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 3
- 108060006698 EGF receptor Proteins 0.000 description 3
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 3
- SAXJFRUXDKAGDM-UHFFFAOYSA-N N#CCCCOC(C(Br)=CC=C1)=C1C#N Chemical compound N#CCCCOC(C(Br)=CC=C1)=C1C#N SAXJFRUXDKAGDM-UHFFFAOYSA-N 0.000 description 3
- KPSLPEBBLDTJLW-UHFFFAOYSA-N NC(C1)C2=CC=CC(Br)=C2C1C(O)=O Chemical compound NC(C1)C2=CC=CC(Br)=C2C1C(O)=O KPSLPEBBLDTJLW-UHFFFAOYSA-N 0.000 description 3
- XHMVRAMVFPQULH-UHFFFAOYSA-N NC1=NC(OCC2)=C2C2=C1C=CC=C2Br Chemical compound NC1=NC(OCC2)=C2C2=C1C=CC=C2Br XHMVRAMVFPQULH-UHFFFAOYSA-N 0.000 description 3
- XIOIXEJWERURJJ-UHFFFAOYSA-N O=C(C1(CC1)C(C1=CC=C2)=C2Br)NC1=O Chemical compound O=C(C1(CC1)C(C1=CC=C2)=C2Br)NC1=O XIOIXEJWERURJJ-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- NFHFRUOZVGFOOS-UHFFFAOYSA-N Pd(PPh3)4 Substances [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 3
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 3
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 235000021355 Stearic acid Nutrition 0.000 description 3
- 108020000411 Toll-like receptor Proteins 0.000 description 3
- 102000002689 Toll-like receptor Human genes 0.000 description 3
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 3
- 239000007983 Tris buffer Substances 0.000 description 3
- 102100039079 Tyrosine-protein kinase TXK Human genes 0.000 description 3
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 3
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 3
- 239000012346 acetyl chloride Substances 0.000 description 3
- 125000002947 alkylene group Chemical group 0.000 description 3
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical group Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 3
- BHBXABDXNPPFRJ-UHFFFAOYSA-N benzyl-[1-[2-[benzyl(phenyl)phosphanyl]naphthalen-1-yl]naphthalen-2-yl]-phenylphosphane Chemical compound C=1C=CC=CC=1CP(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(CC=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 BHBXABDXNPPFRJ-UHFFFAOYSA-N 0.000 description 3
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 3
- 229960000106 biosimilars Drugs 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 239000001569 carbon dioxide Substances 0.000 description 3
- 229910002092 carbon dioxide Inorganic materials 0.000 description 3
- 230000003915 cell function Effects 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 208000017760 chronic graft versus host disease Diseases 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 3
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 3
- 238000003745 diagnosis Methods 0.000 description 3
- 239000013024 dilution buffer Substances 0.000 description 3
- UVIANNSNPZTLPQ-UHFFFAOYSA-N ethyl 2-[2-amino-3-[(2-fluorophenyl)methyl]benzimidazol-3-ium-1-yl]acetate;chloride Chemical compound Cl.N=C1N(CC(=O)OCC)C2=CC=CC=C2N1CC1=CC=CC=C1F UVIANNSNPZTLPQ-UHFFFAOYSA-N 0.000 description 3
- DEFVIWRASFVYLL-UHFFFAOYSA-N ethylene glycol bis(2-aminoethyl)tetraacetic acid Chemical compound OC(=O)CN(CC(O)=O)CCOCCOCCN(CC(O)=O)CC(O)=O DEFVIWRASFVYLL-UHFFFAOYSA-N 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 229940093915 gynecological organic acid Drugs 0.000 description 3
- 125000005343 heterocyclic alkyl group Chemical group 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- 229960003444 immunosuppressant agent Drugs 0.000 description 3
- 239000003018 immunosuppressive agent Substances 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 3
- 229910001629 magnesium chloride Inorganic materials 0.000 description 3
- 201000007924 marginal zone B-cell lymphoma Diseases 0.000 description 3
- 208000021937 marginal zone lymphoma Diseases 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- VVSUNRPCFIIDQL-UHFFFAOYSA-N n-[2-(2-bromophenyl)ethyl]acetamide Chemical compound CC(=O)NCCC1=CC=CC=C1Br VVSUNRPCFIIDQL-UHFFFAOYSA-N 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 238000010899 nucleation Methods 0.000 description 3
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 3
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 3
- 235000005985 organic acids Nutrition 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 125000003367 polycyclic group Chemical group 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 239000004323 potassium nitrate Substances 0.000 description 3
- 235000010333 potassium nitrate Nutrition 0.000 description 3
- 238000012746 preparative thin layer chromatography Methods 0.000 description 3
- MWWATHDPGQKSAR-UHFFFAOYSA-N propyne Chemical compound CC#C MWWATHDPGQKSAR-UHFFFAOYSA-N 0.000 description 3
- 125000006413 ring segment Chemical group 0.000 description 3
- 229960004641 rituximab Drugs 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 239000008117 stearic acid Substances 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 239000011534 wash buffer Substances 0.000 description 3
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 2
- VICOOSNNZUPVHM-IGPZRPDBSA-M (e,3r,5s)-7-[2-(4-fluorophenyl)-4-(3-phenylpentan-3-yl)phenyl]-3,5-dihydroxyhept-6-enoate Chemical compound C=1C=C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)C(C=2C=CC(F)=CC=2)=CC=1C(CC)(CC)C1=CC=CC=C1 VICOOSNNZUPVHM-IGPZRPDBSA-M 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- UWYZHKAOTLEWKK-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinoline Chemical compound C1=CC=C2CNCCC2=C1 UWYZHKAOTLEWKK-UHFFFAOYSA-N 0.000 description 2
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 2
- MXQJQZOSVMJABL-UHFFFAOYSA-N 1-bromoindole Chemical compound C1=CC=C2N(Br)C=CC2=C1 MXQJQZOSVMJABL-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- OXCXIABGNNQZOF-UHFFFAOYSA-N 1h-indole-7-carboxamide Chemical compound NC(=O)C1=CC=CC2=C1NC=C2 OXCXIABGNNQZOF-UHFFFAOYSA-N 0.000 description 2
- ILWGYWSBUWKROZ-UHFFFAOYSA-N 1h-indole;hydrobromide Chemical class Br.C1=CC=C2NC=CC2=C1 ILWGYWSBUWKROZ-UHFFFAOYSA-N 0.000 description 2
- BPXKZEMBEZGUAH-UHFFFAOYSA-N 2-(chloromethoxy)ethyl-trimethylsilane Chemical compound C[Si](C)(C)CCOCCl BPXKZEMBEZGUAH-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 2
- ZPRQXVPYQGBZON-UHFFFAOYSA-N 2-bromo-1h-indole Chemical compound C1=CC=C2NC(Br)=CC2=C1 ZPRQXVPYQGBZON-UHFFFAOYSA-N 0.000 description 2
- IZHVBANLECCAGF-UHFFFAOYSA-N 2-hydroxy-3-(octadecanoyloxy)propyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)COC(=O)CCCCCCCCCCCCCCCCC IZHVBANLECCAGF-UHFFFAOYSA-N 0.000 description 2
- BUWXNBPLRLEXOZ-UHFFFAOYSA-N 3-bromo-2-hydroxybenzonitrile Chemical compound OC1=C(Br)C=CC=C1C#N BUWXNBPLRLEXOZ-UHFFFAOYSA-N 0.000 description 2
- WHBMMWSBFZVSSR-UHFFFAOYSA-N 3-hydroxybutyric acid Chemical compound CC(O)CC(O)=O WHBMMWSBFZVSSR-UHFFFAOYSA-N 0.000 description 2
- VJPPLCNBDLZIFG-ZDUSSCGKSA-N 4-[(3S)-3-(but-2-ynoylamino)piperidin-1-yl]-5-fluoro-2,3-dimethyl-1H-indole-7-carboxamide Chemical compound C(C#CC)(=O)N[C@@H]1CN(CCC1)C1=C2C(=C(NC2=C(C=C1F)C(=O)N)C)C VJPPLCNBDLZIFG-ZDUSSCGKSA-N 0.000 description 2
- HVBSAKJJOYLTQU-UHFFFAOYSA-N 4-aminobenzenesulfonic acid Chemical compound NC1=CC=C(S(O)(=O)=O)C=C1 HVBSAKJJOYLTQU-UHFFFAOYSA-N 0.000 description 2
- OWRFJRVFHBJODM-UHFFFAOYSA-N 5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1,2,3,6-tetrahydropyridine Chemical compound O1C(C)(C)C(C)(C)OB1C1=CCCNC1 OWRFJRVFHBJODM-UHFFFAOYSA-N 0.000 description 2
- DMXOUYZZHVHEQR-UHFFFAOYSA-N 5-bromo-3,4-dihydro-2h-naphthalen-1-one Chemical compound O=C1CCCC2=C1C=CC=C2Br DMXOUYZZHVHEQR-UHFFFAOYSA-N 0.000 description 2
- SDZNOTOEMRHPPA-UHFFFAOYSA-N 5-bromospiro[2,3-dihydro-1h-isoquinoline-4,1'-cyclopropane] Chemical compound C1=2C(Br)=CC=CC=2CNCC21CC2 SDZNOTOEMRHPPA-UHFFFAOYSA-N 0.000 description 2
- IEDMTCUEHMCUJW-UHFFFAOYSA-N 7-bromo-10b-methyl-5,6-dihydro-[1,3]oxazolo[2,3-a]isoquinoline-2,3-dione Chemical compound BrC1=C2CCN3C(C2=CC=C1)(OC(C3=O)=O)C IEDMTCUEHMCUJW-UHFFFAOYSA-N 0.000 description 2
- HGINCPLSRVDWNT-UHFFFAOYSA-N Acrolein Chemical compound C=CC=O HGINCPLSRVDWNT-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 102100027203 B-cell antigen receptor complex-associated protein beta chain Human genes 0.000 description 2
- IAMXTTNRAYNUDL-UHFFFAOYSA-N BrC1=C(C2CNC3C2)C3=CC=C1 Chemical compound BrC1=C(C2CNC3C2)C3=CC=C1 IAMXTTNRAYNUDL-UHFFFAOYSA-N 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 2
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 2
- 238000011740 C57BL/6 mouse Methods 0.000 description 2
- SOKOIKOUBVAJCH-UHFFFAOYSA-N C=CC(N(CCC1)CC2=C1C(Br)=CC=C2)=O Chemical compound C=CC(N(CCC1)CC2=C1C(Br)=CC=C2)=O SOKOIKOUBVAJCH-UHFFFAOYSA-N 0.000 description 2
- GLGXKXUOXKGYDS-UHFFFAOYSA-N C=CC(N(CCC1)CC2=C1C(C(C(F)=C1)=C(C(Cl)=CN3)C3=C1C(N)=O)=CC=C2)=O Chemical compound C=CC(N(CCC1)CC2=C1C(C(C(F)=C1)=C(C(Cl)=CN3)C3=C1C(N)=O)=CC=C2)=O GLGXKXUOXKGYDS-UHFFFAOYSA-N 0.000 description 2
- IHKOPQHLSCVYFP-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O Chemical compound CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O IHKOPQHLSCVYFP-UHFFFAOYSA-N 0.000 description 2
- BVLFSDDNDBOTHH-UHFFFAOYSA-N CC(C)(C)OC(N(CCC1)CC1C(C(F)=C1)=C(C(Cl)=C(C)N2)C2=C1C(N)=O)=O Chemical compound CC(C)(C)OC(N(CCC1)CC1C(C(F)=C1)=C(C(Cl)=C(C)N2)C2=C1C(N)=O)=O BVLFSDDNDBOTHH-UHFFFAOYSA-N 0.000 description 2
- DJCNGCDUIHWJJG-UHFFFAOYSA-N CC(C)(C)OC(N1C(CN(C2)C(C(F)=C3)=C(C=C(C)N4)C4=C3C(N)=O)C2CCC1)=O Chemical compound CC(C)(C)OC(N1C(CN(C2)C(C(F)=C3)=C(C=C(C)N4)C4=C3C(N)=O)C2CCC1)=O DJCNGCDUIHWJJG-UHFFFAOYSA-N 0.000 description 2
- HMNQIHPKLKGHSP-UHFFFAOYSA-N CC(C)(C)OC(N1CC2=CC=CC(C3=C(C=C(C)N4)C4=C(C(N)=O)C(F)=C3F)=C2CC1)=O Chemical compound CC(C)(C)OC(N1CC2=CC=CC(C3=C(C=C(C)N4)C4=C(C(N)=O)C(F)=C3F)=C2CC1)=O HMNQIHPKLKGHSP-UHFFFAOYSA-N 0.000 description 2
- YMQJWNATRSVPDH-JSGCOSHPSA-N CC(C1=C(C(F)=C2)N(CC[C@@H]3F)C[C@@H]3NC(C=C)=O)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(CC[C@@H]3F)C[C@@H]3NC(C=C)=O)=C(C)NC1=C2C(N)=O YMQJWNATRSVPDH-JSGCOSHPSA-N 0.000 description 2
- YMQJWNATRSVPDH-OCCSQVGLSA-N CC(C1=C(C(F)=C2)N(CC[C@H]3F)C[C@@H]3NC(C=C)=O)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(CC[C@H]3F)C[C@@H]3NC(C=C)=O)=C(C)NC1=C2C(N)=O YMQJWNATRSVPDH-OCCSQVGLSA-N 0.000 description 2
- QYLUUQRQLGVNHZ-STQMWFEESA-N CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@H]3F)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@H]3F)=C(C)NC1=C2C(N)=O QYLUUQRQLGVNHZ-STQMWFEESA-N 0.000 description 2
- HRQRDGLBKSWVAN-NWDGAFQWSA-N CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C=C)=O)C[C@@H]3O)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C=C)=O)C[C@@H]3O)=C(C)NC1=C2C(N)=O HRQRDGLBKSWVAN-NWDGAFQWSA-N 0.000 description 2
- HRQRDGLBKSWVAN-RYUDHWBXSA-N CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C=C)=O)C[C@H]3O)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C=C)=O)C[C@H]3O)=C(C)NC1=C2C(N)=O HRQRDGLBKSWVAN-RYUDHWBXSA-N 0.000 description 2
- UNVGEIKSDPEYLW-UHFFFAOYSA-N CC(C1=CC=C2)NCCC1=C2C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O Chemical compound CC(C1=CC=C2)NCCC1=C2C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O UNVGEIKSDPEYLW-UHFFFAOYSA-N 0.000 description 2
- HFOMMTLUTXSOEA-MNOVXSKESA-N CC(NC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@@H]3F)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@@H]3F)=C2C(N)=O)=C1Cl HFOMMTLUTXSOEA-MNOVXSKESA-N 0.000 description 2
- HFOMMTLUTXSOEA-QWRGUYRKSA-N CC(NC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@H]3F)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@H]3F)=C2C(N)=O)=C1Cl HFOMMTLUTXSOEA-QWRGUYRKSA-N 0.000 description 2
- KSFPWLSXPVOPCM-UHFFFAOYSA-N CC(NC(C1=C(C2=C(C3(CC3)CN(C3)C(C=C)=O)C3=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C2=C(C3(CC3)CN(C3)C(C=C)=O)C3=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl KSFPWLSXPVOPCM-UHFFFAOYSA-N 0.000 description 2
- AFJHNNRRKNBFRR-UHFFFAOYSA-N CC(NC(C1=C(C2=CC=CC(C3)=C2CCCN3C(C=C)=O)C(F)=C2)=C2C(N)=O)=C1F Chemical compound CC(NC(C1=C(C2=CC=CC(C3)=C2CCCN3C(C=C)=O)C(F)=C2)=C2C(N)=O)=C1F AFJHNNRRKNBFRR-UHFFFAOYSA-N 0.000 description 2
- SLKLRZBRINJTSV-UHFFFAOYSA-N CC(NC(C1=C2C(C3)=CCCN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1C#N Chemical compound CC(NC(C1=C2C(C3)=CCCN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1C#N SLKLRZBRINJTSV-UHFFFAOYSA-N 0.000 description 2
- VFLMLAOPDPQFGJ-UHFFFAOYSA-N CC(NC(C1=C2C(CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1Cl Chemical compound CC(NC(C1=C2C(CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1Cl VFLMLAOPDPQFGJ-UHFFFAOYSA-N 0.000 description 2
- PYQZYWUNFVEAJX-UHFFFAOYSA-N CC(NC(C1=C2C(CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1F Chemical compound CC(NC(C1=C2C(CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1F PYQZYWUNFVEAJX-UHFFFAOYSA-N 0.000 description 2
- OHAJLLJLFFFMSW-UHFFFAOYSA-N CC(NC(C1=C2C3CNCCC3)=C(C(N)=O)C(F)=C2F)=C1F Chemical compound CC(NC(C1=C2C3CNCCC3)=C(C(N)=O)C(F)=C2F)=C1F OHAJLLJLFFFMSW-UHFFFAOYSA-N 0.000 description 2
- PYQZYWUNFVEAJX-VIFPVBQESA-N CC(NC(C1=C2[C@@H](CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1F Chemical compound CC(NC(C1=C2[C@@H](CCC3)CN3C(C=C)=O)=C(C(N)=O)C(F)=C2F)=C1F PYQZYWUNFVEAJX-VIFPVBQESA-N 0.000 description 2
- KWYAEHLBVONLQT-LCYFTJDESA-N COC(C(C/C(\C1=CC=C2)=N/O)C1=C2Br)=O Chemical compound COC(C(C/C(\C1=CC=C2)=N/O)C1=C2Br)=O KWYAEHLBVONLQT-LCYFTJDESA-N 0.000 description 2
- ZIONAMMDNDOHDK-UHFFFAOYSA-N COC(C(CC(C1=CC=C2)=O)C1=C2Br)=O Chemical compound COC(C(CC(C1=CC=C2)=O)C1=C2Br)=O ZIONAMMDNDOHDK-UHFFFAOYSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-IGMARMGPSA-N Carbon-12 Chemical compound [12C] OKTJSMMVPCPJKN-IGMARMGPSA-N 0.000 description 2
- OKTJSMMVPCPJKN-OUBTZVSYSA-N Carbon-13 Chemical compound [13C] OKTJSMMVPCPJKN-OUBTZVSYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 206010017533 Fungal infection Diseases 0.000 description 2
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 239000012981 Hank's balanced salt solution Substances 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000914491 Homo sapiens B-cell antigen receptor complex-associated protein beta chain Proteins 0.000 description 2
- 101000610640 Homo sapiens U4/U6 small nuclear ribonucleoprotein Prp3 Proteins 0.000 description 2
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 2
- 108010034143 Inflammasomes Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 208000031888 Mycoses Diseases 0.000 description 2
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 2
- QIAFMBKCNZACKA-UHFFFAOYSA-N N-benzoylglycine Chemical compound OC(=O)CNC(=O)C1=CC=CC=C1 QIAFMBKCNZACKA-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- 108010057466 NF-kappa B Proteins 0.000 description 2
- 102000003945 NF-kappa B Human genes 0.000 description 2
- QUHSZCILDBOVKM-UHFFFAOYSA-N O=C1NC2C3=CC=CC(Br)=C3C1C2 Chemical compound O=C1NC2C3=CC=CC(Br)=C3C1C2 QUHSZCILDBOVKM-UHFFFAOYSA-N 0.000 description 2
- 240000007594 Oryza sativa Species 0.000 description 2
- 235000007164 Oryza sativa Nutrition 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 229940122907 Phosphatase inhibitor Drugs 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- VYGQUTWHTHXGQB-FFHKNEKCSA-N Retinol Palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C VYGQUTWHTHXGQB-FFHKNEKCSA-N 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- 101001110823 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-A Proteins 0.000 description 2
- 101000712176 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-B Proteins 0.000 description 2
- 229940124639 Selective inhibitor Drugs 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- 238000006069 Suzuki reaction reaction Methods 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 2
- KZVWEOXAPZXAFB-BQFCYCMXSA-N Temocaprilat Chemical compound C([C@H](N[C@H]1CS[C@@H](CN(C1=O)CC(=O)O)C=1SC=CC=1)C(O)=O)CC1=CC=CC=C1 KZVWEOXAPZXAFB-BQFCYCMXSA-N 0.000 description 2
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 206010052779 Transplant rejections Diseases 0.000 description 2
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 2
- 102100040374 U4/U6 small nuclear ribonucleoprotein Prp3 Human genes 0.000 description 2
- 230000001594 aberrant effect Effects 0.000 description 2
- WDENQIQQYWYTPO-IBGZPJMESA-N acalabrutinib Chemical compound CC#CC(=O)N1CCC[C@H]1C1=NC(C=2C=CC(=CC=2)C(=O)NC=2N=CC=CC=2)=C2N1C=CN=C2N WDENQIQQYWYTPO-IBGZPJMESA-N 0.000 description 2
- 229950009821 acalabrutinib Drugs 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N acetone Substances CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000002313 adhesive film Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 150000001299 aldehydes Chemical class 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000000304 alkynyl group Chemical group 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical compound NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 208000006673 asthma Diseases 0.000 description 2
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- KGNDCEVUMONOKF-UGPLYTSKSA-N benzyl n-[(2r)-1-[(2s,4r)-2-[[(2s)-6-amino-1-(1,3-benzoxazol-2-yl)-1,1-dihydroxyhexan-2-yl]carbamoyl]-4-[(4-methylphenyl)methoxy]pyrrolidin-1-yl]-1-oxo-4-phenylbutan-2-yl]carbamate Chemical compound C1=CC(C)=CC=C1CO[C@H]1CN(C(=O)[C@@H](CCC=2C=CC=CC=2)NC(=O)OCC=2C=CC=CC=2)[C@H](C(=O)N[C@@H](CCCCN)C(O)(O)C=2OC3=CC=CC=C3N=2)C1 KGNDCEVUMONOKF-UGPLYTSKSA-N 0.000 description 2
- AJRQIXBBIDPNGK-BVSLBCMMSA-N benzyl n-[(2s)-1-[[(2s)-1-(1,3-benzothiazol-2-yl)-1-oxo-3-[(3s)-2-oxopyrrolidin-3-yl]propan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]carbamate Chemical compound N([C@@H](CC(C)C)C(=O)N[C@@H](C[C@H]1C(NCC1)=O)C(=O)C=1SC2=CC=CC=C2N=1)C(=O)OCC1=CC=CC=C1 AJRQIXBBIDPNGK-BVSLBCMMSA-N 0.000 description 2
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 2
- 229940010845 branebrutinib Drugs 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 2
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 2
- 235000015165 citric acid Nutrition 0.000 description 2
- 229940125833 compound 23 Drugs 0.000 description 2
- 239000003246 corticosteroid Substances 0.000 description 2
- 229960001334 corticosteroids Drugs 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 229910052805 deuterium Inorganic materials 0.000 description 2
- 125000004772 dichloromethyl group Chemical group [H]C(Cl)(Cl)* 0.000 description 2
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 108010075324 emt protein-tyrosine kinase Proteins 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 125000004438 haloalkoxy group Chemical group 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 230000036571 hydration Effects 0.000 description 2
- 238000006703 hydration reaction Methods 0.000 description 2
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 2
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 2
- 230000001861 immunosuppressant effect Effects 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 125000001041 indolyl group Chemical group 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- ODLHGICHYURWBS-FOSILIAISA-N molport-023-220-444 Chemical compound CC(O)COC[C@@H]([C@@H]([C@H]([C@@H]1O)O)O[C@@H]2O[C@H]([C@H](O[C@@H]3O[C@@H](COCC(C)O)[C@@H]([C@H]([C@@H]3O)O)O[C@@H]3O[C@@H](COCC(C)O)[C@@H]([C@H]([C@@H]3O)O)O[C@@H]3O[C@@H](COCC(C)O)[C@@H]([C@H]([C@@H]3O)O)O[C@@H]3O[C@@H](COCC(C)O)[C@@H]([C@H]([C@@H]3O)O)O3)[C@@H](O)[C@@H]2O)COCC(O)C)O[C@H]1O[C@@H]1[C@@H](O)[C@H](O)[C@H]3O[C@H]1COCC(C)O ODLHGICHYURWBS-FOSILIAISA-N 0.000 description 2
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 2
- NFPUARSXIMWASK-GOEBONIOSA-N n-[(5r,7s)-2-(3-chlorophenyl)-1-oxa-3-azaspiro[4.5]dec-2-en-7-yl]acetamide Chemical compound C1[C@@H](NC(=O)C)CCC[C@@]11OC(C=2C=C(Cl)C=CC=2)=NC1 NFPUARSXIMWASK-GOEBONIOSA-N 0.000 description 2
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000002560 nitrile group Chemical group 0.000 description 2
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 2
- 229960003347 obinutuzumab Drugs 0.000 description 2
- 229960002450 ofatumumab Drugs 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 235000011056 potassium acetate Nutrition 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 238000004393 prognosis Methods 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 2
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 235000009566 rice Nutrition 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 239000012363 selectfluor Substances 0.000 description 2
- 238000013207 serial dilution Methods 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000012312 sodium hydride Substances 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- 239000012258 stirred mixture Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 229960001967 tacrolimus Drugs 0.000 description 2
- QJJXYPPXXYFBGM-SHYZHZOCSA-N tacrolimus Natural products CO[C@H]1C[C@H](CC[C@@H]1O)C=C(C)[C@H]2OC(=O)[C@H]3CCCCN3C(=O)C(=O)[C@@]4(O)O[C@@H]([C@H](C[C@H]4C)OC)[C@@H](C[C@H](C)CC(=C[C@@H](CC=C)C(=O)C[C@H](O)[C@H]2C)C)OC QJJXYPPXXYFBGM-SHYZHZOCSA-N 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 229940033134 talc Drugs 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- CQJSNQCNXVJXDM-UHFFFAOYSA-N tert-butyl 1,3,3a,4,5,6,7,7a-octahydropyrrolo[3,4-c]pyridine-2-carboxylate Chemical compound C1CNCC2CN(C(=O)OC(C)(C)C)CC21 CQJSNQCNXVJXDM-UHFFFAOYSA-N 0.000 description 2
- KFOSBANHALBORK-UHFFFAOYSA-N tert-butyl 2,3,3a,4,5,6,7,7a-octahydropyrrolo[2,3-c]pyridine-1-carboxylate Chemical compound C1CNCC2N(C(=O)OC(C)(C)C)CCC21 KFOSBANHALBORK-UHFFFAOYSA-N 0.000 description 2
- XTDXZSGSIMLARD-UHFFFAOYSA-N tert-butyl 2h-pyridine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CC=CC=C1 XTDXZSGSIMLARD-UHFFFAOYSA-N 0.000 description 2
- KNLKRAUJQBLECR-UHFFFAOYSA-N tert-butyl pyridine-2-carboxylate Chemical compound CC(C)(C)OC(=O)C1=CC=CC=N1 KNLKRAUJQBLECR-UHFFFAOYSA-N 0.000 description 2
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 2
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 2
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 229910052722 tritium Inorganic materials 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 229950000815 veltuzumab Drugs 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical group C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 description 1
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 1
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 1
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 1
- LAJAFFLJAJMYLK-CVOKMOJFSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[[(7s)-4-methoxy-7-morpholin-4-yl-6,7,8,9-tetrahydro-5h-benzo[7]annulen-3-yl]amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound N1([C@H]2CCC3=CC=C(C(=C3CC2)OC)NC=2N=C(C(=CN=2)Cl)N[C@H]2[C@H]([C@@]3([H])C[C@@]2(C=C3)[H])C(N)=O)CCOCC1 LAJAFFLJAJMYLK-CVOKMOJFSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- SHAHPWSYJFYMRX-GDLCADMTSA-N (2S)-2-(4-{[(1R,2S)-2-hydroxycyclopentyl]methyl}phenyl)propanoic acid Chemical compound C1=CC([C@@H](C(O)=O)C)=CC=C1C[C@@H]1[C@@H](O)CCC1 SHAHPWSYJFYMRX-GDLCADMTSA-N 0.000 description 1
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- SLTBMTIRYMGWLX-XMMPIXPASA-N (2r)-2-[(4-chloroanilino)carbamoylamino]-3-(1h-indol-3-yl)-n-(2-phenylethyl)propanamide Chemical compound C1=CC(Cl)=CC=C1NNC(=O)N[C@@H](C(=O)NCCC=1C=CC=CC=1)CC1=CNC2=CC=CC=C12 SLTBMTIRYMGWLX-XMMPIXPASA-N 0.000 description 1
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 1
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 1
- BSGIKRCNMBTGEB-UHFFFAOYSA-N (5-bromo-1-methylpyrrolo[2,3-c]pyridin-2-yl)-[6-[(dimethylamino)methyl]-4-methyl-3,4-dihydro-1h-isoquinolin-2-yl]methanone Chemical compound BrC1=NC=C2N(C)C(C(=O)N3CC(C4=CC(CN(C)C)=CC=C4C3)C)=CC2=C1 BSGIKRCNMBTGEB-UHFFFAOYSA-N 0.000 description 1
- RXNPEQZHMGFNAY-GEALJGNFSA-N (5R)-4-[(1S,6R)-5-[(2S)-2-(4-chlorophenyl)-3-(propan-2-ylamino)propanoyl]-2,5-diazabicyclo[4.1.0]heptan-2-yl]-5-methyl-6,8-dihydro-5H-pyrido[2,3-d]pyrimidin-7-one Chemical compound C[C@@H]1CC(=O)NC2=C1C(=NC=N2)N3CCN([C@H]4[C@@H]3C4)C(=O)[C@H](CNC(C)C)C5=CC=C(C=C5)Cl RXNPEQZHMGFNAY-GEALJGNFSA-N 0.000 description 1
- HMLGSIZOMSVISS-ONJSNURVSA-N (7r)-7-[[(2z)-2-(2-amino-1,3-thiazol-4-yl)-2-(2,2-dimethylpropanoyloxymethoxyimino)acetyl]amino]-3-ethenyl-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound N([C@@H]1C(N2C(=C(C=C)CSC21)C(O)=O)=O)C(=O)\C(=N/OCOC(=O)C(C)(C)C)C1=CSC(N)=N1 HMLGSIZOMSVISS-ONJSNURVSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 1
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 1
- MXPCZHSTOIKVST-UHFFFAOYSA-N 1-[3-amino-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-4-[3-(2-hydroxyethoxy)phenyl]-2-oxo-1,8-naphthyridin-3-yl]urea;hydrochloride Chemical compound Cl.CC(C)C=1C=CC(N)=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C1=CC=CC(OCCO)=C1 MXPCZHSTOIKVST-UHFFFAOYSA-N 0.000 description 1
- OXTVBHDILDPYAS-UHFFFAOYSA-N 1-[4-(aminomethyl)-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-4-[3-(3-hydroxypropoxy)phenyl]-2-oxo-1,8-naphthyridin-3-yl]urea;hydrochloride Chemical compound Cl.CC(C)C=1C=C(CN)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C1=CC=CC(OCCCO)=C1 OXTVBHDILDPYAS-UHFFFAOYSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- KJLFFCRGGGXQKE-UHFFFAOYSA-N 1h-indole-6-carboxamide Chemical compound NC(=O)C1=CC=C2C=CNC2=C1 KJLFFCRGGGXQKE-UHFFFAOYSA-N 0.000 description 1
- ITRNQMJXZUWZQL-UHFFFAOYSA-N 2-(2-bromophenyl)ethanamine Chemical compound NCCC1=CC=CC=C1Br ITRNQMJXZUWZQL-UHFFFAOYSA-N 0.000 description 1
- ORHRHMLEFQBHND-UHFFFAOYSA-N 2-(3-bromophenyl)ethanamine Chemical compound NCCC1=CC=CC(Br)=C1 ORHRHMLEFQBHND-UHFFFAOYSA-N 0.000 description 1
- GVNVAWHJIKLAGL-UHFFFAOYSA-N 2-(cyclohexen-1-yl)cyclohexan-1-one Chemical compound O=C1CCCCC1C1=CCCCC1 GVNVAWHJIKLAGL-UHFFFAOYSA-N 0.000 description 1
- AXHVEQQLKVIZLO-UHFFFAOYSA-N 2-[4-[2-[5-(2,2-dimethylbutyl)-1h-imidazol-2-yl]ethyl]phenyl]benzoic acid Chemical compound CCC(C)(C)CC1=CNC(CCC=2C=CC(=CC=2)C=2C(=CC=CC=2)C(O)=O)=N1 AXHVEQQLKVIZLO-UHFFFAOYSA-N 0.000 description 1
- TVTJUIAKQFIXCE-HUKYDQBMSA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynyl-1H-purine-6,8-dione Chemical compound NC=1NC(C=2N(C(N(C=2N=1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C)=O TVTJUIAKQFIXCE-HUKYDQBMSA-N 0.000 description 1
- WLJVXDMOQOGPHL-PPJXEINESA-N 2-phenylacetic acid Chemical compound O[14C](=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-PPJXEINESA-N 0.000 description 1
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 1
- HNFMVVHMKGFCMB-UHFFFAOYSA-N 3-[3-[4-(1-aminocyclobutyl)phenyl]-5-phenylimidazo[4,5-b]pyridin-2-yl]pyridin-2-amine Chemical compound NC1=NC=CC=C1C1=NC2=CC=C(C=3C=CC=CC=3)N=C2N1C1=CC=C(C2(N)CCC2)C=C1 HNFMVVHMKGFCMB-UHFFFAOYSA-N 0.000 description 1
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- FTAHXMZRJCZXDL-UHFFFAOYSA-N 3-piperideine Chemical compound C1CC=CCN1 FTAHXMZRJCZXDL-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- JWEQLWMZHJSMEC-AFJTUFCWSA-N 4-[8-amino-3-[(2S)-1-but-2-ynoylpyrrolidin-2-yl]imidazo[1,5-a]pyrazin-1-yl]-N-pyridin-2-ylbenzamide (Z)-but-2-enedioic acid Chemical compound OC(=O)\C=C/C(O)=O.CC#CC(=O)N1CCC[C@H]1c1nc(-c2ccc(cc2)C(=O)Nc2ccccn2)c2c(N)nccn12 JWEQLWMZHJSMEC-AFJTUFCWSA-N 0.000 description 1
- GVFCESGZTADECV-UHFFFAOYSA-N 4-benzyl-n-(2-chloro-4,5-difluorophenyl)piperazine-1-carboxamide Chemical compound C1=C(F)C(F)=CC(Cl)=C1NC(=O)N1CCN(CC=2C=CC=CC=2)CC1 GVFCESGZTADECV-UHFFFAOYSA-N 0.000 description 1
- CQPGDDAKTTWVDD-UHFFFAOYSA-N 4-bromobutanenitrile Chemical compound BrCCCC#N CQPGDDAKTTWVDD-UHFFFAOYSA-N 0.000 description 1
- WNWVKZTYMQWFHE-UHFFFAOYSA-N 4-ethylmorpholine Chemical compound [CH2]CN1CCOCC1 WNWVKZTYMQWFHE-UHFFFAOYSA-N 0.000 description 1
- MVXAKOGJWVQPKC-UHFFFAOYSA-N 5-(3-ethynyl-5-fluorophenyl)-2-pyridin-2-yl-4,6,7,8-tetrahydro-[1,3]oxazolo[4,5-c]azepine Chemical compound FC1=CC(C#C)=CC(N2CC=3N=C(OC=3CCC2)C=2N=CC=CC=2)=C1 MVXAKOGJWVQPKC-UHFFFAOYSA-N 0.000 description 1
- DTVYNUOOZIKEEX-UHFFFAOYSA-N 5-aminoisoquinoline Chemical compound N1=CC=C2C(N)=CC=CC2=C1 DTVYNUOOZIKEEX-UHFFFAOYSA-N 0.000 description 1
- NWWWGAKVHCSAEU-UHFFFAOYSA-N 5-bromopentanenitrile Chemical compound BrCCCCC#N NWWWGAKVHCSAEU-UHFFFAOYSA-N 0.000 description 1
- FUIVZRFXETXNLX-RYUDHWBXSA-N 5-fluoro-4-[(3S,5S)-3-fluoro-5-(prop-2-enoylamino)piperidin-1-yl]-2,3-dimethyl-1H-indole-7-carboxamide Chemical compound CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C=C)=O)C[C@H]3F)=C(C)NC1=C2C(N)=O FUIVZRFXETXNLX-RYUDHWBXSA-N 0.000 description 1
- MJZJYWCQPMNPRM-UHFFFAOYSA-N 6,6-dimethyl-1-[3-(2,4,5-trichlorophenoxy)propoxy]-1,6-dihydro-1,3,5-triazine-2,4-diamine Chemical compound CC1(C)N=C(N)N=C(N)N1OCCCOC1=CC(Cl)=C(Cl)C=C1Cl MJZJYWCQPMNPRM-UHFFFAOYSA-N 0.000 description 1
- XVMSFILGAMDHEY-UHFFFAOYSA-N 6-(4-aminophenyl)sulfonylpyridin-3-amine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)C1=CC=C(N)C=N1 XVMSFILGAMDHEY-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 125000003627 8 membered carbocyclic group Chemical group 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 208000008190 Agammaglobulinemia Diseases 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 101710186708 Agglutinin Proteins 0.000 description 1
- 229920000856 Amylose Polymers 0.000 description 1
- 208000004736 B-Cell Leukemia Diseases 0.000 description 1
- 208000025324 B-cell acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 206010003908 B-cell small lymphocytic lymphoma Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- 208000020084 Bone disease Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- KCMXTGCQQGIGEX-UHFFFAOYSA-N C=CC(N1CC2=CC=CC(Br)=C2C2(CC2)C1)=O Chemical compound C=CC(N1CC2=CC=CC(Br)=C2C2(CC2)C1)=O KCMXTGCQQGIGEX-UHFFFAOYSA-N 0.000 description 1
- KASBWJSMCUIPRN-CHWSQXEVSA-N CC(C)(C)OC(N(C1)C[C@@H](C2)[C@@H]1CCN2C(C(F)=C1)=C(C(Cl)=C(C)N2)C2=C1C(N)=O)=O Chemical compound CC(C)(C)OC(N(C1)C[C@@H](C2)[C@@H]1CCN2C(C(F)=C1)=C(C(Cl)=C(C)N2)C2=C1C(N)=O)=O KASBWJSMCUIPRN-CHWSQXEVSA-N 0.000 description 1
- DZXBECZELDZADO-GDBMZVCRSA-N CC(C)(C)OC(N(C1)C[C@@H](C2)[C@@H]1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O Chemical compound CC(C)(C)OC(N(C1)C[C@@H](C2)[C@@H]1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O DZXBECZELDZADO-GDBMZVCRSA-N 0.000 description 1
- ZMEONCKCRQKWKX-ZIAGYGMSSA-N CC(C)(C)OC(N(C1)C[C@@H](C2)[C@@H]1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O Chemical compound CC(C)(C)OC(N(C1)C[C@@H](C2)[C@@H]1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O ZMEONCKCRQKWKX-ZIAGYGMSSA-N 0.000 description 1
- ZHFGFPVJTCAZCR-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C(C)=C(C)N2)C2=C1C#N)=O Chemical compound CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C(C)=C(C)N2)C2=C1C#N)=O ZHFGFPVJTCAZCR-UHFFFAOYSA-N 0.000 description 1
- NHWNYRWVCJMKPZ-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C(C)=C(C)N2)C2=C1C(N)=O)=O Chemical compound CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C(C)=C(C)N2)C2=C1C(N)=O)=O NHWNYRWVCJMKPZ-UHFFFAOYSA-N 0.000 description 1
- GEUCUXIUEMBMHT-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O Chemical compound CC(C)(C)OC(N(CC1)C(C2)C1CCN2C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O GEUCUXIUEMBMHT-UHFFFAOYSA-N 0.000 description 1
- BQEZXSRIGAPKNC-UHFFFAOYSA-N CC(C)(C)OC(N1C(CN(C2)C(C(F)=C3)=C(C=C(C)N4)C4=C3C#N)C2CCC1)=O Chemical compound CC(C)(C)OC(N1C(CN(C2)C(C(F)=C3)=C(C=C(C)N4)C4=C3C#N)C2CCC1)=O BQEZXSRIGAPKNC-UHFFFAOYSA-N 0.000 description 1
- SOQOICZNPFAHPR-UHFFFAOYSA-N CC(C)(C)OC(N1CC(C2=C(C(Br)=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O Chemical compound CC(C)(C)OC(N1CC(C2=C(C(Br)=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O SOQOICZNPFAHPR-UHFFFAOYSA-N 0.000 description 1
- RQXRVODQWDOYDW-UHFFFAOYSA-N CC(C)(C)OC(N1CC(C2=C(C(C#N)=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O Chemical compound CC(C)(C)OC(N1CC(C2=C(C(C#N)=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O RQXRVODQWDOYDW-UHFFFAOYSA-N 0.000 description 1
- ZSGUJOGDYDEQKV-UHFFFAOYSA-N CC(C)(C)OC(N1CC(C2=C(C(Cl)=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O Chemical compound CC(C)(C)OC(N1CC(C2=C(C(Cl)=C(C)N3)C3=C(C(N)=O)C(F)=C2F)=CCC1)=O ZSGUJOGDYDEQKV-UHFFFAOYSA-N 0.000 description 1
- JQQJVMFTVWTKPG-UHFFFAOYSA-N CC(C)(C)OC(N1CC2=CC=CC(C(C(F)=C3)=C(C(Cl)=C(C)N4)C4=C3C(N)=O)=C2CC1)=O Chemical compound CC(C)(C)OC(N1CC2=CC=CC(C(C(F)=C3)=C(C(Cl)=C(C)N4)C4=C3C(N)=O)=C2CC1)=O JQQJVMFTVWTKPG-UHFFFAOYSA-N 0.000 description 1
- YUTLALBFOWMZEV-UHFFFAOYSA-N CC(C)(C)OC(N1CC2=CC=CC(C(C(F)=C3)=C(C=C(C)N4)C4=C3C(N)=O)=C2CC1)=O Chemical compound CC(C)(C)OC(N1CC2=CC=CC(C(C(F)=C3)=C(C=C(C)N4)C4=C3C(N)=O)=C2CC1)=O YUTLALBFOWMZEV-UHFFFAOYSA-N 0.000 description 1
- UJGSHHGAXUGCBW-UHFFFAOYSA-N CC(C)(C)OC(N1CC2=CC=CC(C3=C(C(Cl)=C(C)N4)C4=C(C(N)=O)C(F)=C3F)=C2CC1)=O Chemical compound CC(C)(C)OC(N1CC2=CC=CC(C3=C(C(Cl)=C(C)N4)C4=C(C(N)=O)C(F)=C3F)=C2CC1)=O UJGSHHGAXUGCBW-UHFFFAOYSA-N 0.000 description 1
- HYRSWSXYZMHDSQ-ZBFHGGJFSA-N CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C#N)[C@@H]1F)=O Chemical compound CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C#N)[C@@H]1F)=O HYRSWSXYZMHDSQ-ZBFHGGJFSA-N 0.000 description 1
- HYRSWSXYZMHDSQ-HOCLYGCPSA-N CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C#N)[C@H]1F)=O Chemical compound CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C#N)[C@H]1F)=O HYRSWSXYZMHDSQ-HOCLYGCPSA-N 0.000 description 1
- SGQGVZYTBKLLOV-HIFRSBDPSA-N CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C(N)=O)[C@@H]1F)=O Chemical compound CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C(N)=O)[C@@H]1F)=O SGQGVZYTBKLLOV-HIFRSBDPSA-N 0.000 description 1
- SGQGVZYTBKLLOV-ZFWWWQNUSA-N CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C(N)=O)[C@H]1F)=O Chemical compound CC(C)(C)OC(N[C@@H](CN(CC1)C(C(F)=C2)=C(C(C)=C(C)N3)C3=C2C(N)=O)[C@H]1F)=O SGQGVZYTBKLLOV-ZFWWWQNUSA-N 0.000 description 1
- VYPVYLIZLKVWRE-KBPBESRZSA-N CC(C)(C)OC(N[C@@H](C[C@@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O Chemical compound CC(C)(C)OC(N[C@@H](C[C@@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O VYPVYLIZLKVWRE-KBPBESRZSA-N 0.000 description 1
- PKZOUMDRBBUDLN-RYUDHWBXSA-N CC(C)(C)OC(N[C@@H](C[C@@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O Chemical compound CC(C)(C)OC(N[C@@H](C[C@@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O PKZOUMDRBBUDLN-RYUDHWBXSA-N 0.000 description 1
- VYPVYLIZLKVWRE-KGLIPLIRSA-N CC(C)(C)OC(N[C@@H](C[C@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O Chemical compound CC(C)(C)OC(N[C@@H](C[C@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C#N)=O VYPVYLIZLKVWRE-KGLIPLIRSA-N 0.000 description 1
- PKZOUMDRBBUDLN-NEPJUHHUSA-N CC(C)(C)OC(N[C@@H](C[C@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O Chemical compound CC(C)(C)OC(N[C@@H](C[C@H](C1)F)CN1C(C(F)=C1)=C(C=C(C)N2)C2=C1C(N)=O)=O PKZOUMDRBBUDLN-NEPJUHHUSA-N 0.000 description 1
- QYLUUQRQLGVNHZ-OLZOCXBDSA-N CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@@H]3F)=C(C)NC1=C2C(N)=O Chemical compound CC(C1=C(C(F)=C2)N(C[C@H](C3)NC(C#CC)=O)C[C@@H]3F)=C(C)NC1=C2C(N)=O QYLUUQRQLGVNHZ-OLZOCXBDSA-N 0.000 description 1
- LECWWZVJSFYUAL-UHFFFAOYSA-N CC(C1=CC=CC(Br)=C1CC1)N1C(O)=O Chemical compound CC(C1=CC=CC(Br)=C1CC1)N1C(O)=O LECWWZVJSFYUAL-UHFFFAOYSA-N 0.000 description 1
- HAAMUKIAMMPOBF-UHFFFAOYSA-N CC(C1=CC=CC(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)=C1CC1)N1C(OC(C)(C)C)=O Chemical compound CC(C1=CC=CC(C(C(F)=C2)=C(C=C(C)N3)C3=C2C(N)=O)=C1CC1)N1C(OC(C)(C)C)=O HAAMUKIAMMPOBF-UHFFFAOYSA-N 0.000 description 1
- CBDJKKMGVZGZNT-UHFFFAOYSA-N CC(NC(C1=C(C(F)=C2)N(CC3CCC4)CC3N4C(C#CC)=O)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C(F)=C2)N(CC3CCC4)CC3N4C(C#CC)=O)=C2C(N)=O)=C1Cl CBDJKKMGVZGZNT-UHFFFAOYSA-N 0.000 description 1
- GWBXXMRTWMMQQM-UHFFFAOYSA-N CC(NC(C1=C(C2=C(CCNC3)C3=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C2=C(CCNC3)C3=CC=C2)C(F)=C2)=C2C(N)=O)=C1Cl GWBXXMRTWMMQQM-UHFFFAOYSA-N 0.000 description 1
- RFIQJBQKZMCGJE-UHFFFAOYSA-N CC(NC(C1=C(C2=CC=CC(C3)=C2CCCN3C(C=C)=O)C(F)=C2)=C2C(N)=O)=C1Cl Chemical compound CC(NC(C1=C(C2=CC=CC(C3)=C2CCCN3C(C=C)=O)C(F)=C2)=C2C(N)=O)=C1Cl RFIQJBQKZMCGJE-UHFFFAOYSA-N 0.000 description 1
- WKNBKDLNCZBSPE-UHFFFAOYSA-N CC(NC1=C(C(O)=O)C(F)=C2F)=CC1=C2Br Chemical compound CC(NC1=C(C(O)=O)C(F)=C2F)=CC1=C2Br WKNBKDLNCZBSPE-UHFFFAOYSA-N 0.000 description 1
- BWFZIALDOUNGHP-UHFFFAOYSA-N CC1=CC2=C(C3=C(C4(CC4)CN(C4)C(C=C)=O)C4=CC=C3)C(F)=CC(C(N)=O)=C2N1 Chemical compound CC1=CC2=C(C3=C(C4(CC4)CN(C4)C(C=C)=O)C4=CC=C3)C(F)=CC(C(N)=O)=C2N1 BWFZIALDOUNGHP-UHFFFAOYSA-N 0.000 description 1
- NPGXVTSDNQPQOM-UHFFFAOYSA-N CC1=CC2=C(C3=C(CCN(C4C5CC5)C(C=C)=O)C4=CC=C3)C(F)=CC(C(N)=O)=C2N1 Chemical compound CC1=CC2=C(C3=C(CCN(C4C5CC5)C(C=C)=O)C4=CC=C3)C(F)=CC(C(N)=O)=C2N1 NPGXVTSDNQPQOM-UHFFFAOYSA-N 0.000 description 1
- PNBARPCEEIDQIQ-UHFFFAOYSA-N CC1=CC2=C(C3=CC=CC(C4)=C3CCCN4C(C=C)=O)C(F)=CC(C(N)=O)=C2N1 Chemical compound CC1=CC2=C(C3=CC=CC(C4)=C3CCCN4C(C=C)=O)C(F)=CC(C(N)=O)=C2N1 PNBARPCEEIDQIQ-UHFFFAOYSA-N 0.000 description 1
- BQXUPNKLZNSUMC-YUQWMIPFSA-N CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 Chemical compound CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 BQXUPNKLZNSUMC-YUQWMIPFSA-N 0.000 description 1
- 102100024965 Caspase recruitment domain-containing protein 11 Human genes 0.000 description 1
- GHOKWGTUZJEAQD-UHFFFAOYSA-N Chick antidermatitis factor Natural products OCC(C)(C)C(O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 229940127007 Compound 39 Drugs 0.000 description 1
- 229940126062 Compound A Drugs 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- 244000304337 Cuminum cyminum Species 0.000 description 1
- 235000007129 Cuminum cyminum Nutrition 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- ZZZCUOFIHGPKAK-UHFFFAOYSA-N D-erythro-ascorbic acid Natural products OCC1OC(=O)C(O)=C1O ZZZCUOFIHGPKAK-UHFFFAOYSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-YMDCURPLSA-N D-galactopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-YMDCURPLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-AQKNRBDQSA-N D-glucopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-AQKNRBDQSA-N 0.000 description 1
- KDXKERNSBIXSRK-RXMQYKEDSA-N D-lysine Chemical compound NCCCC[C@@H](N)C(O)=O KDXKERNSBIXSRK-RXMQYKEDSA-N 0.000 description 1
- MQJKPEGWNLWLTK-UHFFFAOYSA-N Dapsone Chemical compound C1=CC(N)=CC=C1S(=O)(=O)C1=CC=C(N)C=C1 MQJKPEGWNLWLTK-UHFFFAOYSA-N 0.000 description 1
- 208000016192 Demyelinating disease Diseases 0.000 description 1
- 206010012305 Demyelination Diseases 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102100030322 Ephrin type-A receptor 1 Human genes 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 208000004332 Evans syndrome Diseases 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 108091008794 FGF receptors Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 201000005569 Gout Diseases 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 1
- 208000030836 Hashimoto thyroiditis Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 1
- 208000032759 Hemolytic-Uremic Syndrome Diseases 0.000 description 1
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 1
- 101000761179 Homo sapiens Caspase recruitment domain-containing protein 11 Proteins 0.000 description 1
- 101000938354 Homo sapiens Ephrin type-A receptor 1 Proteins 0.000 description 1
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 1
- 101001002508 Homo sapiens Immunoglobulin-binding protein 1 Proteins 0.000 description 1
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 101710146024 Horcolin Proteins 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010020983 Hypogammaglobulinaemia Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102100021042 Immunoglobulin-binding protein 1 Human genes 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000051628 Interleukin-1 receptor antagonist Human genes 0.000 description 1
- 108700021006 Interleukin-1 receptor antagonist Proteins 0.000 description 1
- UETNIIAIRMUTSM-UHFFFAOYSA-N Jacareubin Natural products CC1(C)OC2=CC3Oc4c(O)c(O)ccc4C(=O)C3C(=C2C=C1)O UETNIIAIRMUTSM-UHFFFAOYSA-N 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 101710189395 Lectin Proteins 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 101710179758 Mannose-specific lectin Proteins 0.000 description 1
- 101710150763 Mannose-specific lectin 1 Proteins 0.000 description 1
- 101710150745 Mannose-specific lectin 2 Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- 201000002795 Muckle-Wells syndrome Diseases 0.000 description 1
- 206010028372 Muscular weakness Diseases 0.000 description 1
- CZAFIFBJBFDMTP-UHFFFAOYSA-N N-[(4-bromophenyl)methyl]-2-[4-(2-phenylethylsulfamoyl)phenoxy]acetamide Chemical compound Brc1ccc(CNC(=O)COc2ccc(cc2)S(=O)(=O)NCCc2ccccc2)cc1 CZAFIFBJBFDMTP-UHFFFAOYSA-N 0.000 description 1
- TZYWCYJVHRLUCT-VABKMULXSA-N N-benzyloxycarbonyl-L-leucyl-L-leucyl-L-leucinal Chemical compound CC(C)C[C@@H](C=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)OCC1=CC=CC=C1 TZYWCYJVHRLUCT-VABKMULXSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 101100030361 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pph-3 gene Proteins 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 201000011152 Pemphigus Diseases 0.000 description 1
- 241000721454 Pemphigus Species 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 208000034943 Primary Sjögren syndrome Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102100038239 Protein Churchill Human genes 0.000 description 1
- 102000009516 Protein Serine-Threonine Kinases Human genes 0.000 description 1
- 108010009341 Protein Serine-Threonine Kinases Proteins 0.000 description 1
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 206010039085 Rhinitis allergic Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 229940100514 Syk tyrosine kinase inhibitor Drugs 0.000 description 1
- 201000009594 Systemic Scleroderma Diseases 0.000 description 1
- 206010042953 Systemic sclerosis Diseases 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 108010009978 Tec protein-tyrosine kinase Proteins 0.000 description 1
- 206010043561 Thrombocytopenic purpura Diseases 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 101710101516 Tyrosine-protein kinase TXK Proteins 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003268 Vitamin C Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 1
- NPUXORBZRBIOMQ-RUZDIDTESA-N [(2R)-1-[[4-[[3-(benzenesulfonylmethyl)-5-methylphenoxy]methyl]phenyl]methyl]-2-pyrrolidinyl]methanol Chemical compound C=1C(OCC=2C=CC(CN3[C@H](CCC3)CO)=CC=2)=CC(C)=CC=1CS(=O)(=O)C1=CC=CC=C1 NPUXORBZRBIOMQ-RUZDIDTESA-N 0.000 description 1
- NPKCKCVQUHCEEI-UHFFFAOYSA-N [N].N1CCCC=C1 Chemical compound [N].N1CCCC=C1 NPKCKCVQUHCEEI-UHFFFAOYSA-N 0.000 description 1
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 1
- 229960003697 abatacept Drugs 0.000 description 1
- YLEIFZAVNWDOBM-ZTNXSLBXSA-N ac1l9hc7 Chemical compound C([C@H]12)C[C@@H](C([C@@H](O)CC3)(C)C)[C@@]43C[C@@]14CC[C@@]1(C)[C@@]2(C)C[C@@H]2O[C@]3(O)[C@H](O)C(C)(C)O[C@@H]3[C@@H](C)[C@H]12 YLEIFZAVNWDOBM-ZTNXSLBXSA-N 0.000 description 1
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 238000010306 acid treatment Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 229960002964 adalimumab Drugs 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 239000000910 agglutinin Substances 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 229960002459 alefacept Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- SRVFFFJZQVENJC-IHRRRGAJSA-N aloxistatin Chemical compound CCOC(=O)[C@H]1O[C@@H]1C(=O)N[C@@H](CC(C)C)C(=O)NCCC(C)C SRVFFFJZQVENJC-IHRRRGAJSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 229960004238 anakinra Drugs 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000000181 anti-adherent effect Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 239000003911 antiadherent Substances 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 229960004676 antithrombotic agent Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000000010 aprotic solvent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 1
- 125000005602 azabenzimidazolyl group Chemical group 0.000 description 1
- 125000005334 azaindolyl group Chemical group N1N=C(C2=CC=CC=C12)* 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- ZSIQJIWKELUFRJ-UHFFFAOYSA-N azepane Chemical compound C1CCCNCC1 ZSIQJIWKELUFRJ-UHFFFAOYSA-N 0.000 description 1
- 125000003828 azulenyl group Chemical group 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 229960004669 basiliximab Drugs 0.000 description 1
- 229960005347 belatacept Drugs 0.000 description 1
- 229960003270 belimumab Drugs 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical compound C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 1
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- 229960003735 brodalumab Drugs 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- KDPAWGWELVVRCH-UHFFFAOYSA-N bromoacetic acid Chemical compound OC(=O)CBr KDPAWGWELVVRCH-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 1
- 229960001838 canakinumab Drugs 0.000 description 1
- 239000007894 caplet Substances 0.000 description 1
- 125000005392 carboxamide group Chemical group NC(=O)* 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 206010008129 cerebral palsy Diseases 0.000 description 1
- 229960003115 certolizumab pegol Drugs 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- VDANGULDQQJODZ-UHFFFAOYSA-N chloroprocaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1Cl VDANGULDQQJODZ-UHFFFAOYSA-N 0.000 description 1
- 229960002023 chloroprocaine Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 125000002676 chrysenyl group Chemical group C1(=CC=CC=2C3=CC=C4C=CC=CC4=C3C=CC12)* 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940125851 compound 27 Drugs 0.000 description 1
- 229940127204 compound 29 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940125877 compound 31 Drugs 0.000 description 1
- 229940125878 compound 36 Drugs 0.000 description 1
- 229940125807 compound 37 Drugs 0.000 description 1
- 229940127573 compound 38 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- GBRBMTNGQBKBQE-UHFFFAOYSA-L copper;diiodide Chemical compound I[Cu]I GBRBMTNGQBKBQE-UHFFFAOYSA-L 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229960005168 croscarmellose Drugs 0.000 description 1
- 229960000913 crospovidone Drugs 0.000 description 1
- 239000001767 crosslinked sodium carboxy methyl cellulose Substances 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- 208000022993 cryopyrin-associated periodic syndrome Diseases 0.000 description 1
- 125000006165 cyclic alkyl group Chemical group 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000000172 cytosol Anatomy 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 229960002806 daclizumab Drugs 0.000 description 1
- 229960000860 dapsone Drugs 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 125000004855 decalinyl group Chemical group C1(CCCC2CCCCC12)* 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 201000001981 dermatomyositis Diseases 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- WMKGGPCROCCUDY-PHEQNACWSA-N dibenzylideneacetone Chemical compound C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 WMKGGPCROCCUDY-PHEQNACWSA-N 0.000 description 1
- ZFTFAPZRGNKQPU-UHFFFAOYSA-N dicarbonic acid Chemical compound OC(=O)OC(O)=O ZFTFAPZRGNKQPU-UHFFFAOYSA-N 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229940043237 diethanolamine Drugs 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 208000037765 diseases and disorders Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 229960002224 eculizumab Drugs 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 230000010102 embolization Effects 0.000 description 1
- 239000003974 emollient agent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- MZQXAVZPEZUJIJ-UHFFFAOYSA-N ethyl 2-(2-bromophenyl)acetate Chemical compound CCOC(=O)CC1=CC=CC=C1Br MZQXAVZPEZUJIJ-UHFFFAOYSA-N 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 229940012017 ethylenediamine Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 102000052178 fibroblast growth factor receptor activity proteins Human genes 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000007888 film coating Substances 0.000 description 1
- 238000009501 film coating Methods 0.000 description 1
- 229960000556 fingolimod Drugs 0.000 description 1
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 238000007667 floating Methods 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000007897 gelcap Substances 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940074045 glyceryl distearate Drugs 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 208000024908 graft versus host disease Diseases 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 125000002192 heptalenyl group Chemical group 0.000 description 1
- 125000004474 heteroalkylene group Chemical group 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 208000009326 ileitis Diseases 0.000 description 1
- 125000004857 imidazopyridinyl group Chemical group N1C(=NC2=C1C=CC=N2)* 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000003427 indacenyl group Chemical group 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 229960000598 infliximab Drugs 0.000 description 1
- 239000000976 ink Substances 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 230000026045 iodination Effects 0.000 description 1
- 238000006192 iodination reaction Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- FBAFATDZDUQKNH-UHFFFAOYSA-M iron chloride Chemical compound [Cl-].[Fe] FBAFATDZDUQKNH-UHFFFAOYSA-M 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 229960000681 leflunomide Drugs 0.000 description 1
- VHOGYURTWQBHIL-UHFFFAOYSA-N leflunomide Chemical compound O1N=CC(C(=O)NC=2C=CC(=CC=2)C(F)(F)F)=C1C VHOGYURTWQBHIL-UHFFFAOYSA-N 0.000 description 1
- 238000001294 liquid chromatography-tandem mass spectrometry Methods 0.000 description 1
- 239000011344 liquid material Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- VQHSOMBJVWLPSR-WUJBLJFYSA-N maltitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-WUJBLJFYSA-N 0.000 description 1
- 239000000845 maltitol Substances 0.000 description 1
- 235000010449 maltitol Nutrition 0.000 description 1
- 229940035436 maltitol Drugs 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 229960003194 meglumine Drugs 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 235000006109 methionine Nutrition 0.000 description 1
- GRLJRQBQIZPKEO-UHFFFAOYSA-N methyl 1h-indene-1-carboxylate Chemical compound C1=CC=C2C(C(=O)OC)C=CC2=C1 GRLJRQBQIZPKEO-UHFFFAOYSA-N 0.000 description 1
- AMVCFIFDMKEIRE-UHFFFAOYSA-N methyl 2-(2-bromophenyl)acetate Chemical compound COC(=O)CC1=CC=CC=C1Br AMVCFIFDMKEIRE-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 229950007856 mofetil Drugs 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 125000006203 morpholinoethyl group Chemical group [H]C([H])(*)C([H])([H])N1C([H])([H])C([H])([H])OC([H])([H])C1([H])[H] 0.000 description 1
- 229960003816 muromonab-cd3 Drugs 0.000 description 1
- 230000036473 myasthenia Effects 0.000 description 1
- 230000023105 myelination Effects 0.000 description 1
- RLKHFSNWQCZBDC-UHFFFAOYSA-N n-(benzenesulfonyl)-n-fluorobenzenesulfonamide Chemical compound C=1C=CC=CC=1S(=O)(=O)N(F)S(=O)(=O)C1=CC=CC=C1 RLKHFSNWQCZBDC-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 229960005027 natalizumab Drugs 0.000 description 1
- 201000008383 nephritis Diseases 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 230000007658 neurological function Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 102000037979 non-receptor tyrosine kinases Human genes 0.000 description 1
- 108091008046 non-receptor tyrosine kinases Proteins 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 229940049964 oleate Drugs 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 1
- 238000003305 oral gavage Methods 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- WLJNZVDCPSBLRP-UHFFFAOYSA-N pamoic acid Chemical compound C1=CC=C2C(CC=3C4=CC=CC=C4C=C(C=3O)C(=O)O)=C(O)C(C(O)=O)=CC2=C1 WLJNZVDCPSBLRP-UHFFFAOYSA-N 0.000 description 1
- 229940055726 pantothenic acid Drugs 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 201000001976 pemphigus vulgaris Diseases 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- SIOXPEMLGUPBBT-UHFFFAOYSA-M picolinate Chemical compound [O-]C(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-M 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920000137 polyphosphoric acid Polymers 0.000 description 1
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 1
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 1
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 229940069328 povidone Drugs 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- DBABZHXKTCFAPX-UHFFFAOYSA-N probenecid Chemical compound CCCN(CCC)S(=O)(=O)C1=CC=C(C(O)=O)C=C1 DBABZHXKTCFAPX-UHFFFAOYSA-N 0.000 description 1
- 229960003081 probenecid Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- MKJZRZRIEWBTMN-UHFFFAOYSA-N prop-2-ynoyl chloride Chemical compound ClC(=O)C#C MKJZRZRIEWBTMN-UHFFFAOYSA-N 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000007974 regulation of B cell activation Effects 0.000 description 1
- 230000027174 regulation of B cell differentiation Effects 0.000 description 1
- 230000020129 regulation of cell death Effects 0.000 description 1
- 230000012121 regulation of immune response Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 235000019172 retinyl palmitate Nutrition 0.000 description 1
- 239000011769 retinyl palmitate Substances 0.000 description 1
- 229940108325 retinyl palmitate Drugs 0.000 description 1
- 229960001886 rilonacept Drugs 0.000 description 1
- 108010046141 rilonacept Proteins 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 201000000306 sarcoidosis Diseases 0.000 description 1
- 229950006348 sarilumab Drugs 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 150000003335 secondary amines Chemical group 0.000 description 1
- 229960004540 secukinumab Drugs 0.000 description 1
- 239000012056 semi-solid material Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 102000034285 signal transducing proteins Human genes 0.000 description 1
- 108091006024 signal transducing proteins Proteins 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 229960003323 siltuximab Drugs 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 229960001790 sodium citrate Drugs 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 108010087686 src-Family Kinases Proteins 0.000 description 1
- 102000009076 src-Family Kinases Human genes 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 229960004274 stearic acid Drugs 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 229950000244 sulfanilic acid Drugs 0.000 description 1
- NCEXYHBECQHGNR-QZQOTICOSA-N sulfasalazine Chemical compound C1=C(O)C(C(=O)O)=CC(\N=N\C=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-QZQOTICOSA-N 0.000 description 1
- 229960001940 sulfasalazine Drugs 0.000 description 1
- NCEXYHBECQHGNR-UHFFFAOYSA-N sulfasalazine Natural products C1=C(O)C(C(=O)O)=CC(N=NC=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-UHFFFAOYSA-N 0.000 description 1
- FWMUJAIKEJWSSY-UHFFFAOYSA-N sulfur dichloride Chemical compound ClSCl FWMUJAIKEJWSSY-UHFFFAOYSA-N 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 229960000331 teriflunomide Drugs 0.000 description 1
- UTNUDOFZCWSZMS-YFHOEESVSA-N teriflunomide Chemical compound C\C(O)=C(/C#N)C(=O)NC1=CC=C(C(F)(F)F)C=C1 UTNUDOFZCWSZMS-YFHOEESVSA-N 0.000 description 1
- LGEWGFOMLJQHLL-ZJUUUORDSA-N tert-butyl (4ar,7ar)-2,3,4,4a,5,6,7,7a-octahydropyrrolo[3,4-b]pyridine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC[C@@H]2CNC[C@H]12 LGEWGFOMLJQHLL-ZJUUUORDSA-N 0.000 description 1
- ZYKGQBWJSBEIAF-UHFFFAOYSA-N tert-butyl 1-methyl-3,4-dihydro-1h-isoquinoline-2-carboxylate Chemical compound C1=CC=C2C(C)N(C(=O)OC(C)(C)C)CCC2=C1 ZYKGQBWJSBEIAF-UHFFFAOYSA-N 0.000 description 1
- HTDOHIVUPFBSNR-UHFFFAOYSA-N tert-butyl 3,4-dihydro-1h-isoquinoline-2-carboxylate Chemical compound C1=CC=C2CN(C(=O)OC(C)(C)C)CCC2=C1 HTDOHIVUPFBSNR-UHFFFAOYSA-N 0.000 description 1
- SHHHRQFHCPINIB-UHFFFAOYSA-N tert-butyl 3,6-dihydro-2h-pyridine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCC=CC1 SHHHRQFHCPINIB-UHFFFAOYSA-N 0.000 description 1
- JYRWUSXRTGACLY-UHFFFAOYSA-N tert-butyl 4-[[3-(4-methylsulfonylphenyl)-[1,2]oxazolo[4,5-d]pyrimidin-7-yl]oxy]piperidine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)CCC1OC1=NC=NC2=C1ON=C2C1=CC=C(S(C)(=O)=O)C=C1 JYRWUSXRTGACLY-UHFFFAOYSA-N 0.000 description 1
- YHJIGQIWLFZKQN-UHFFFAOYSA-N tert-butyl 5-bromo-1-methyl-3,4-dihydro-1H-isoquinoline-2-carboxylate Chemical compound BrC1=C2CCN(C(C2=CC=C1)C)C(=O)OC(C)(C)C YHJIGQIWLFZKQN-UHFFFAOYSA-N 0.000 description 1
- 125000001935 tetracenyl group Chemical group C1(=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C12)* 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 125000004927 thianaphthalenyl group Chemical group S1C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 230000001732 thrombotic effect Effects 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 229960005196 titanium dioxide Drugs 0.000 description 1
- 235000010215 titanium dioxide Nutrition 0.000 description 1
- 229960003989 tocilizumab Drugs 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 238000011277 treatment modality Methods 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 125000003960 triphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C3=CC=CC=C3C12)* 0.000 description 1
- 229940046728 tumor necrosis factor alpha inhibitor Drugs 0.000 description 1
- 239000002452 tumor necrosis factor alpha inhibitor Substances 0.000 description 1
- 108010002164 tyrosine receptor Proteins 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 229960003824 ustekinumab Drugs 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 229960004914 vedolizumab Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 235000019154 vitamin C Nutrition 0.000 description 1
- 239000011718 vitamin C Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 230000036642 wellbeing Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/10—Spiro-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Public Health (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Immunology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
プロテインキナーゼ阻害剤としてのIH-インドール-7-カルボキサミド誘導体、特にブルトン型チロシンキナーゼ(BTK)阻害剤、それらを含む医薬組成物、それらを調製するためのプロセス、並びにキナーゼ機能に関連する疾患、障害、及び状態を治療又は予防するためのそのようなプロテインキナーゼ阻害剤の使用が本明細書に開示される。特に、本発明は、選択的BTK阻害剤に関する。
Description
本発明は、概して、プロテインキナーゼ阻害剤、特にブルトン型チロシンキナーゼ(Bruton tyrosine kinase、BTK)阻害剤、それらを含む医薬組成物、それらを調製するためのプロセス、並びにキナーゼ機能に関連する疾患、障害及び状態を治療又は予防するためのそのような阻害剤の使用に関する。
プロテインキナーゼは、真核細胞における細胞内及び膜貫通シグナル伝達タンパク質の大きな群である。これらの酵素は、ATPから標的タンパク質の特定のアミノ酸残基への末端(ガンマ)ホスフェートの移動を担う。標的タンパク質中の特定のアミノ酸残基のリン酸化は、それらの活性を調節することができ、細胞シグナル伝達及び代謝の大幅な変化をもたらす。プロテインキナーゼは、細胞膜、細胞質ゾル、及び核などのオルガネラにおいて見出すことができ、代謝、細胞の成長及び分化、細胞シグナル伝達、免疫応答の調節、並びに細胞死を含む複数の細胞機能を媒介することを担う。セリンキナーゼは、標的タンパク質中のセリン又はスレオニン残基を特異的にリン酸化する。同様に、チロシン受容体キナーゼを含むチロシンキナーゼは、標的タンパク質中のチロシン残基をリン酸化する。チロシンキナーゼファミリーには、TEC、SRC、ABL、JAK、CSK、FAK、SYK、FER、ACK、並びにERBB、FGFR、VEGFR、RET、及びEPHを含む受容体チロシンキナーゼサブファミリーが含まれる。受容体チロシンキナーゼスーパーファミリーのサブクラスIは、ERBB受容体を含み、4つのメンバー:ErbB1(上皮成長因子受容体(epidermal growth factor receptor、EGFR)とも呼ばれる)、ErbB2、ErbB3及びErbB4を含む。
キナーゼは、健康及び疾患に関連する主要な生物学的プロセスに対する制御を発揮する。更に、様々なプロテインキナーゼの異常な活性化又は過剰な発現は、良性及び悪性の増殖を特徴とする複数の疾患及び障害、並びに免疫系の不適切な活性化から生じる疾患のメカニズムに関与している。したがって、選択キナーゼ又はキナーゼファミリーの阻害剤は、固形腫瘍、血液悪性腫瘍、血栓、関節炎、移植片対宿主病、エリテマトーデス、乾癬、大腸炎、回腸炎、多発性硬化症、ブドウ膜炎、冠動脈血管障害、全身性強皮症、アテローム性動脈硬化症、喘息、移植拒絶、アレルギー、虚血、皮膚筋炎、天疱瘡などを含むがこれらに限定されない、がん、血管疾患、自己免疫疾患及び炎症状態の治療に有用であると考えられる。
Tecキナーゼは、排他的ではないが、主に造血起源の細胞において発現される、非受容体チロシンキナーゼのファミリーである。Tecファミリーとしては、TEC、ブルトン型チロシンキナーゼ(BTK)、誘発性T細胞キナーゼ(inducible T-cell kinase、ITK)、休止期リンパ球キナーゼ(resting lymphocyte kinase、RLK/チロシンプロテインキナーゼの場合、TXK)、及び骨髄発現キナーゼ(BMX/ETK)が挙げられる。
BTKは、B細胞受容体シグナル伝達、並びにB細胞の発生及び活性化の調節において重要である。ヒトにおけるBTKをコードする遺伝子の変異により、B細胞の成熟障害、免疫グロブリン及び末梢B細胞のレベルの低下、並びにT細胞非依存性免疫応答の低下を含む、免疫機能の低下を特徴とするX連鎖無ガンマグロブリン血症が引き起こされる。BTKは、Srcファミリーキナーゼによって活性化され、PLCガンマをリン酸化して、B細胞の機能及び生存に影響を与える。更に、BTKは、肥満細胞、マクロファージ及び好中球の細胞機能にとって重要であり、BTK阻害が、炎症、骨障害及びアレルギー性疾患を含む、これらの細胞及び関連細胞によって媒介される疾患の治療に有効であることを示している。BTK阻害は、リンパ腫細胞の生存においても重要であり、BTKの阻害がリンパ腫及び他のがんの治療に有用であることを示している。したがって、BTK及び関連キナーゼの阻害剤は、抗炎症剤及び抗がん剤として非常に興味深いものである。BTKは、血小板機能及び血栓形成にとっても重要であり、BTK選択的阻害剤も抗血栓剤として有用であることを示している。更に、BTKは、インフラマソームの活性化に必要であり、BTKの阻害は、脳卒中、痛風、2型糖尿病、肥満誘発インスリン抵抗性、アテローム性動脈硬化症及びマックル・ウェルズ(Muckle-Wells)症候群を含むインフラマソーム関連障害の治療に使用され得る。加えて、BTKは、HIV感染T細胞において発現され、BTK阻害剤による治療は、感染細胞をアポトーシス死に対して感作させ、ウイルス産生の低下をもたらす。したがって、BTK阻害剤は、HIV-AIDS及び他のウイルス感染症の治療において有用であると考えられる。
更に、BTKは、神経学的機能において重要である。脳及びCNS内のBTKを特異的に標的とすることは、進行性及び再発性のMS及び原発性CNSリンパ腫(primary CNS lymphoma、PCNSL)などの神経学的疾患の治療を著しく前進させる可能性を有する。
PCNSLは、米国で毎年約1900の新たな症例が発生する稀な脳腫瘍であり、新たに診断された脳腫瘍の約3%を構成する。
PCNSLは非常に侵攻性であり、CNS外の他のリンパ腫とは異なり、予後は、最先端の治療における改善にもかかわらず、依然として不良である。高用量メトトレキサートは、依然として治療の主要素であり、他の細胞毒性と組み合わせて使用され、より最近ではリツキシマブが添加されている。初期診断から、5年生存率は1990年から2000年までの間に19%から30%に改善されたが、高齢者集団(70歳超)では、これらの患者の20%以上が化学療法に適合しないと考えられているため、改善されていない。腫瘍退縮は、最先端の治療モダリティであるかどうかに関わらず、患者の約85%で観察されたが、これらの患者の約半数は、最初の治療後10~18ヶ月以内に再発性疾患を経験し、大半の再発は、診断から最初の2年以内に発生する。
したがって、再発/難治性PCNSL(relapsed/refractory PCNSL、R/R PCNSL)を有する患者の予後は、更なる治療を行わない場合、生存期間の中央値が約2ヶ月であり、依然として不良である。R/R PCNSLの治療のための均一な標準治療がないため、臨床試験への参加が奨励されている。新たな安全かつ効果的な治療が、緊急に必要とされている。
Btkは、B細胞抗原受容体(B cell antigen receptor、BCR)シグナル伝達経路におけるシグナル伝達に関与し、BCR及びToll様受容体(Toll-like receptor、TLR)シグナル伝達を統合する。これらの経路における遺伝子は、CD79B及び骨髄分化一次応答88(MyD88)を含む、びまん性大細胞型B細胞リンパ腫(diffuse large B-cell lymphoma、DLBCL)の変異を頻繁に保有する。Btkの第1世代不可逆的選択的阻害剤であるイブルチニブは、慢性リンパ性白血病/小細胞型リンパ球性リンパ腫(chronic lymphocytic leukemia、CLL/small cell lymphocytic lymphoma、SLL)、前治療歴のあるマントル細胞リンパ腫(Mantle Cell lymphoma、MCL)及び辺縁帯リンパ腫(Marginal Zone Lymphoma、MZL)、ワルデンストレーム高ガンマグロブリン血症(Waldenstrom’s macroglobulin)、並びに前治療歴のある慢性移植片対宿主病に対して承認されている。臨床研究では、イブルチニブの推奨用量(CLLにおいては480mg/日、MCLにおいては560mg/日)を840mgに漸増させて、原発性CNSリンパ腫における適切な脳曝露を達成した。
PCNSLにおけるNF-κB経路の異常な活性化は、より標的化された療法の可能性のあるメカニズムとして浮上している。特に、CARD11並びにMyD88(Toll様受容体経路)の活性化変異が関与している。患者の38%(11/29)~50%(7/14)において発生することが指摘されている、MyD88の265位でのロイシンからプロリンへの活性化交換は、PCNSLでこれまでに確認された最も頻繁な変異である。加えて、B細胞受容体シグナル伝達経路の成分であるCD79Bのコード領域は、症例の20%において変異を含むと見られ、これは、B細胞受容体及びNF-κB経路の調節不全がPCNSLの病因に寄与することを示唆している。これらのデータは、BCR経路変異及びBtk依存性がPCNSLと特に関連性があることを示唆している。
最近、いくつかの臨床研究では、PCNSLの治療における実質的な単剤臨床活性が70~77%の応答率で報告されている。しかしながら、患者の大多数は、9ヶ月目までに療法を中止した。イブルチニブ療法は、有害事象が管理しやすく、一般に耐容性が良好であると報告されているが、時には致命的な真菌感染症の報告がある。注目すべきことに、560mg~840mg/日を超える漸増用量が、より高い脳曝露を達成するために使用されており、これらのより高い用量は、イブルチニブのキナーゼ選択性プロファイルによって媒介されるオフターゲット効果に関連し得る。最後に、高用量ステロイドと併せた高用量イブルチニブの組み合わせは、増加した真菌感染症の悪化に寄与し得る。したがって、より大きな脳浸透、及びより大きなキナーゼ選択性を伴うBtk不活性化率のために、改善された有効性及び安全性プロファイルを有する第2世代のBtk阻害剤が、PCNSL患者に有益であり得る。
加えて、プロテインキナーゼ全般を調節する化合物、並びにBTKなどの特定のプロテインキナーゼを調節する化合物、並びに特定のプロテインキナーゼを調節し、関連する組成物について血液/脳関門を選択的に交差させる化合物、並びにそのような調節及び選択性から恩恵を受けるであろう疾患、障害、及び状態を治療するための方法が依然として必要とされている。
一態様では、式(I)の構造を有する化合物、
が、単結合又は二重結合を表し、
R1が、-H、-CH3、又は-Fであり、
R2が、-H、-CH3、又は-Fであるか、
あるいはR1及びR2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成し、
RI1が、-Cl、-F、-CN、-CH3、-CH2F、-CHF2、又は-CF3であり、
RI2が、-H又は-Fであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3であり、
RI1が-CH3であるとき、R1及びR2のうちの少なくとも一方が、-CH3又は-Fである、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
別の態様では、式(II)の構造を有する化合物、
であって、式中、
R3が、H、Me、又はシクロプロピルであり、
Xが、-CH2CH2-又は-CRx1Rx2-であり、
Rx1が、H、F、又はMeであり、
Rx2が、H、F、又はMeであるか、
あるいはRx1及びRx2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成するか、
あるいはRx1がHであり、Rx2及びR3が一緒になってアルキレン架橋を形成し、
RII1が、Cl、F、-CH2F、-CHF2、-CF3、又は-CNであり、
RII2が、H又はFであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3である、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
更に別の態様では、式(III)の構造を有する化合物、
であって、式中、
Zが、-CH2-、-CHMe-、又は結合であり、
Yが、-CHR4-又は結合であり、
R4が、H、F、又はOHであり、
R5が、H、F、又はMeであり、
R6が、H又はMeであり、
R7が、H又はMeであり、
R8がHであるか、
あるいはR5及びR7が、一緒になって、5員又は6員の複素環を形成するか、
あるいはR6及びR7が、一緒になって、4員、5員、又は6員の複素環を形成するか、
あるいはR8及びR7が、一緒になって、5員又は6員の複素環を形成し、
aが、0、1、又は2であり、
RIII1が、Cl、F、-CH2F、-CHF2、-CF3、又は-CNであるか、あるいは
R4がF若しくはOHであるとき、又はR5がFであるとき、又はR5及びR7若しくはR8及びR7が、一緒になって、5若しくは6員の複素環を形成するとき、又はR6及びR7が、一緒になって、4、5、若しくは6員の複素環を形成するとき、RIII1が-CH3であり、
RIII2が、H又はFであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3である、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
一実施形態では、式(I)、式(II)、若しくは式(III)の構造を有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体と、少なくとも1つの医薬的に許容される賦形剤と、を含む、医薬組成物が提供される。
一実施形態では、プロテインキナーゼを調節する方法であって、プロテインキナーゼを、有効量の式(I)、式(II)、若しくは(III)の構造を有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物と接触させることを含む、方法が提供される。一実施形態では、プロテインキナーゼはBTKである。
一実施形態では、BTK依存性状態を治療するための方法であって、それを必要とする対象に、有効量の式(I)、式(II)、若しくは式(III)の構造を有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物を投与することを含む、方法が提供される。
一実施形態では、医薬品の製造における、式(I)、式(II)、若しくは式(III)の構造を有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物の使用が提供される。
特に定義しない限り、本明細書で使用する全ての技術的及び科学的用語は、特許請求の範囲に記載される主題が属する分野の当業者によって一般的に理解されるものと同じ意味を有する。詳細な説明は、例示的かつ説明的なものにすぎず、特許請求の範囲に記載される任意の主題を制限するものではないことを理解されたい。本出願では、特に明記しない限り、単数形の使用は複数形を含む。本明細書において使用するときに、単数形「a」、「an」及び「the」は、文脈によって別段明確に指示されない限り、複数の指示対象を含むことに留意しなければならない。本出願では、「又は」の使用は、特に明記しない限り、「及び/又は」を意味する。更に、「含む(including)」という用語、並びに「含む(include)」、「含む(includes)」、及び「含まれる(included)」などの他の形態の使用は、限定的ではない。
本発明の様々な特質は、単一の実施形態の文脈で説明され得るが、それらの特質はまた、別々に又は任意の好適な組み合わせで提供され得る。逆に、本発明は、明確にするために別々の実施形態の文脈において本明細書で説明され得るが、本発明はまた、単一の実施形態で実施され得る。
本明細書における「いくつかの実施形態」、「実施形態」、「一実施形態」、又は「他の実施形態」への言及は、実施形態に関連して説明される特定の特質、構造、又は特徴が、少なくともいくつかの実施形態に含まれるが、必ずしも全ての実施形態に含まれるわけではないことを意味する。
本明細書で使用される場合、範囲及び量は、「約」特定の値又は範囲として表すことができる。約は、正確な量も含む。したがって、「約100μL」は、「約100μL」と、「100μL」も意味する。いくつかの実施形態では、約は、値の5%以内を意味する。したがって、「約100μL」は、95~105uLを意味する。一般に、「約」という用語は、実験誤差内にあると予想されるであろう量を含む。
本明細書で使用される場合、「アルキル」は、直鎖又は分岐鎖飽和炭化水素基を意味する。「低級アルキル」は、1~8個の炭素原子、いくつかの実施形態では1~6個の炭素原子、いくつかの実施形態では1~4個の炭素原子、いくつかの実施形態では1~2個の炭素原子を有する、直鎖又は分岐鎖アルキル基を意味する。直鎖低級アルキル基の例としては、メチル基、エチル基、n-プロピル基、n-ブチル基、n-ペンチル基、n-ヘキシル基、n-ヘプチル基、及びn-オクチル基が挙げられるが、これらに限定されない。分岐鎖低級アルキル基の例としては、イソプロピル基、イソ-ブチル基、sec-ブチル基、t-ブチル基、ネオペンチル基、イソペンチル基、及び2,2-ジメチルプロピル基が挙げられるが、これらに限定されない。
「アルケニル」基は、少なくとも1つの二重結合が2個の炭素原子間に存在することを除いて、上記で定義された直鎖及び分岐鎖並びに環状のアルキル基を含む。したがって、アルケニル基は、2~約20個の炭素原子、典型的には2~12個の炭素、又はいくつかの実施形態では2~8個の炭素原子を有する。例としては、とりわけ、-CH=CH2、-CH=CH(CH3)、-CH=C(CH3)2、-C(CH3)=CH2、-C(CH3)=CH(CH3)、-C(CH2CH3)=CH2、-CH=CHCH2CH3、-CH=CH(CH2)2CH3、-CH=CH(CH2)3CH3、-CH=CH(CH2)4CH3、ビニル、シクロヘキセニル、シクロペンテニル、シクロヘキサジエニル、ブタジエニル、ペンタジエニル、及びヘキサジエニルが挙げられるが、これらに限定されない。
「アルキニル」基は、少なくとも1つの三重結合が2個の炭素原子間に存在することを除いて、直鎖及び分岐鎖のアルキル基を含む。したがって、アルキニル基は、2~約20個の炭素原子、典型的には2~12個の炭素、又はいくつかの実施形態では2~8個の炭素原子を有する。例としては、とりわけ、-C≡CH、-C≡C(CH3)、-C≡C(CH2CH3)、-CH2C≡CH、-CH2C≡C(CH3)、及び-CH2C≡C(CH2CH3)が挙げられるが、これらに限定されない。
本明細書で使用される場合、「アルキレン」は、二価アルキル基を意味する。直鎖低級アルキレン基の例としては、メチレン(すなわち、-CH2-)、エチレン(すなわち、-CH2CH2-)、プロピレン(すなわち、-CH2CH2CH2-)、及びブチレン(すなわち、-CH2CH2CH2CH2-)が挙げられるが、これらに限定されない。本明細書で使用される場合、「ヘテロアルキレン」は、1個以上の炭素原子がN、O、S、又はPなど(ただしこれらに限定されない)のヘテロ原子で置き換えられる、アルキレン基である。
「アルコキシ」は、酸素原子(すなわち、-O-アルキル)によって結合された、上記で定義されたようなアルキルを指す。低級アルコキシ基の例としては、メトキシ、エトキシ、n-プロポキシ、n-ブトキシ、イソプロポキシ、sec-ブトキシ、tert-ブトキシなどが挙げられるが、これらに限定されない。
「炭素環式」及び「炭素環」という用語は、環の原子が炭素である環構造を示す。炭素環は、単環式又は多環式であり得る。炭素環は、飽和環及び不飽和環の両方を包含する。炭素環は、シクロアルキル基及びアリール基の両方を包含する。いくつかの実施形態では、炭素環は、3~8個の環員を有するが、他の実施形態では、環炭素原子の数は、4、5、6、又は7である。そうではないと具体的に示されない限り、炭素環式環は、最大でN個の置換基で置換され得るが、Nは、炭素環式環のサイズであり、例えば、アルキル基、アミノ基、ヒドロキシ基、シアノ基、カルボキシ基、ニトロ基、チオ基、アルコキシ基、及びハロゲン基で置換され得る。
「シクロアルキル」基は、環構造を形成するアルキル基であり、置換又は非置換であり得る。シクロアルキルの例としては、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基、シクロヘプチル基、及びシクロオクチル基が挙げられるが、これらに限定されない。いくつかの実施形態では、シクロアルキル基は、3~8個の環員を有するが、他の実施形態では、環炭素原子の数は、3~5、3~6、又は3~7の範囲である。シクロアルキル基としては、ノルボルニル基、アダマンチル基、ボルニル基、カンフェニル基、イソカンフェニル基、及びカレニル基など(ただしこれらに限定されない)の多環式シクロアルキル基、並びにデカリニルなど(ただしこれらに限定されない)の縮合環などが更に挙げられる。シクロアルキル基はまた、上記で定義されたような直鎖又は分岐鎖アルキル基で置換されている環を含む。代表的な置換シクロアルキル基は、一置換又は二置換以上の、例えば、2,2-二置換、2,3-二置換、2,4-二置換、2,5-二置換、又は2,6-二置換(ただしこれらに限定されない)のシクロヘキシル基、又は、例えば、アミノ基、ヒドロキシ基、シアノ基、カルボキシ基、ニトロ基、チオ基、アルコキシ基、及びハロゲン基で置換され得る、一置換、二置換、若しくは三置換ノルボルニル基又はシクロヘプチル基であり得る。
「アリール」基は、ヘテロ原子を含有しない環状芳香族炭化水素である。したがって、アリール基としては、フェニル基、アズレニル基、ヘプタレニル基、ビフェニル基、インダセニル基、フルオレニル基、フェナントレニル基、トリフェニレニル基、ピレニル基、ナフタセニル基、クリセニル基、ビフェニレニル基、アントラセニル基、及びナフチル基が挙げられるが、これらに限定されない。いくつかの実施形態では、アリール基は、基の環部分に6~14個の炭素を含有する。「アリール」及び「アリール基」という用語は、少なくとも1つの環が芳香族であるが、全ての環放棄族である必要はない融合環を含み、例えば、融合芳香族脂肪族環系(例えば、インダニル、テトラヒドロナフチルなど)である。
「炭素環アルキル」は、1個以上の水素原子が炭素環で置き換えられた、上記で定義されたアルキルを指す。炭素環アルキル基の例としては、ベンジルなどが挙げられるが、これらに限定されない。
本明細書で使用される場合、「複素環」又は「ヘテロシクリル」基としては、3個以上の環員を含有する芳香族及び非芳香族環化合物(複素環)であって、その環員うちの1個以上がN、O、S、又はPなど(ただしこれらに限定されない)のヘテロ原子である、芳香族及び非芳香族環化合物(複素環)が挙げられる。本明細書で定義されるような複素環基は、ヘテロアリール基、又は少なくとも1個の環ヘテロ原子を含む部分的又は完全飽和環状基であり得る。いくつかの実施形態では、複素環基は、3~20個の環員を含むが、他のそのような基は、3~15個の環員を有する。少なくとも1つの環は、ヘテロ原子を含むが、多環式系中の全ての環が、ヘテロ原子を含有する必要はない。例えば、ジオキソラニル環及びベンゾジオキソラニル環系(メチレンジオキシフェニル環系)は両方とも、本明細書の意味の範囲内の複素環基である。C2-複素環として示される複素環基は、2個の炭素原子及び3個のヘテロ原子を有する5員環、2個の炭素原子及び4個のヘテロ原子を有する6員環などであり得る。同様に、C4-複素環は、1個のヘテロ原子を有する5員環、2個のヘテロ原子を有する6員環などであり得る。炭素原子の数とヘテロ原子の数とを足すと、環原子の総数に等しくなる。飽和複素環式環は、不飽和炭素原子を含有しない複素環式環を指す。
「ヘテロアリール」基は、5個以上の環員を含有する芳香族環化合物であって、その環員のうちの1個以上がN、O、及びSなど(ただしこれらに限定されない)のヘテロ原子である、芳香族環化合物である。C2-ヘテロアリールとして指定されたヘテロアリール基は、2個の炭素原子と3個のヘテロ原子とを有する5員環、2個の炭素原子と4個のヘテロ原子とを有する6員環などであり得る。同様に、C4-ヘテロアリールは、1個のヘテロ原子を有する5員環、2個のヘテロ原子を有する6員環などであり得る。炭素原子の数とヘテロ原子の数とを足すと、環原子の総数に等しくなる。ヘテロアリール基としては、ピロリル基、ピラゾリル基、トリアゾリル基、テトラゾリル基、オキサゾリル基、イソオキサゾリル基、チアゾリル基、ピリジニル基、チオフェニル基、ベンゾチオフェニル基、ベンゾフラニル基、インドリル基、アザインドリル基、インダゾリル基、ベンズイミダゾリル基、アザベンズイミダゾリル基、ベンゾオキサゾリル基、ベンゾチアゾリル基、ベンゾチアジアゾリル基、イミダゾピリジニル基、イソオキサゾロピリジニル基、チアナフタレニル基、プリニル基、キサンチニル基、アデニニル基、グアニニル基、キノリニル基、イソキノリニル基、テトラヒドロキノリニル基、テトラヒドロイソキノリニル基、キノキサリニル基、及びキナゾリニル基などの基が挙げられるが、これらに限定されない。「ヘテロアリール」及び「ヘテロアリール基」という用語は、必ずしも全ての環ではないが、少なくとも1つの環が、芳香族である、例えば、テトラヒドロキノリニル、テトラヒドロイソキノリニル、インドリル、及び2,3-ジヒドロインドリルである、縮合環化合物を含む。
「複素環式アルキル」は、複素環で置換された1個以上の水素原子を有する、上記で定義されたアルキルを指す。複素環アルキル基の例としては、モルホリノエチルなどが挙げられるが、これらに限定されない。
「ハロ」又は「ハロゲン」は、フッ素、塩素、臭素、及びヨウ素を指す。
「ハロアルキル」は、1個以上の水素原子がハロゲンで置換されている、上記で定義されたアルキルを指す。低級ハロアルキル基の例としては、-CF3、-CH2CF3などが挙げられるが、これらに限定されない。
「ハロアルコキシ」は、1個以上の水素原子がハロゲンで置換されている、上記で定義されたアルコキシを指す。低級ハロアルコキシ基の例としては、-OCF3、-OCH2CF3などが挙げられるが、これらに限定されない。
「ヒドロキシアルキル」は、1個以上の水素原子が-OHで置換されている、上記で定義されたアルキルを指す。低級ヒドロキシアルキル基の例としては、-CH2OH、-CH2CH2OHなどが挙げられるが、これらに限定されない。
本明細書で使用される場合、「任意選択的に置換された」という用語は、0、1、又はそれ以上の置換基、例えば0~25個、0~20個、0~10個、又は0~5個の置換基を有する基(例えば、アルキル、炭素環、又は複素環)を指す。置換基としては、-ORa、-NRaRb、-S(O)2Ra、若しくは-S(O)2ORa、ハロゲン、シアノ、アルキル、ハロアルキル、アルコキシ、炭素環、複素環、炭素環アルキル、又は複素環アルキルが挙げられるが、これらに限定されず、式中、各Ra及びRbは、独立して、H、アルキル、ハロアルキル、炭素環、又は複素環であるか、あるいはRa及びRbは、それらが結合している原子と一緒になって、3~8員炭素環又は複素環を形成する。
「異性体」は、特定の立体化学又は異性体形態が具体的に示されていない限り、ある1つの構造体の全てのキラル形態、ジアステレオマー形態、又はラセミ形態を包含するように、本明細書で使用される。そのような化合物は、任意の濃縮度で、描写から明らかなように、任意の又は全ての不斉原子で濃縮又は分解された光学異性体であり得る。ラセミ混合物及びジアステレオマー混合物の両方、並びに個々の光学異性体は、それらのエナンチオマー又はジアステレオマーパートナーを実質的に含まないように合成することができ、これらは全て、本開示の特定の実施形態の範囲内である。キラル中心の存在から生じる異性体は、「エナンチオマー」と呼ばれる、一対の、重ね合わせられない異性体を含む。純粋な化合物の単一のエナンチオマーは、光学的に活性である(すなわち、それらは、平面偏光の平面を回転させることができ、R又はSと呼ばれる)。
「単離された光学異性体」は、同じ式の対応する光学異性体から実質的に精製された化合物を意味する。例えば、単離された異性体は、少なくとも約80%、少なくとも80%、又は少なくとも85%の純度であり得る。他の実施形態では、単離された異性体は、少なくとも90重量%の純度、少なくとも98重量%の純度、又は少なくとも99重量%の純度である。
「実質的にエナンチオマー的又はジアステレオマー的に」純粋であるとは、少なくとも約80%、より具体的には80%、85%、90%、95%、98%、99%、99.5%、又は99.9%を超える、他方のエナンチオマー又はジアステレオマーに対する、1つのエナンチオマーのエナンチオマー又はジアステレオマー濃縮のレベルを意味する。
「ラセミ体」及び「ラセミ混合物」という用語は、2つのエナンチオマーの等しい混合物を指す。ラセミ体は、光学的に活性ではない(すなわち、その構成エナンチオマーが互いに相殺するため、いずれの方向にも平面偏光を回転させない)ため、「(±)」とラベル付けされる。
「水和物」は、水分子と組み合わせて存在する化合物である。その組み合わせは、一水和物又は二水和物などの化学量論量の水を含むか、又はランダムな量で水を含み得る。本明細書で使用されるとき、「水和物」は、固体形態を指す。すなわち、水溶液中の化合物は、水和され得る一方で、その用語が本明細書で使用されるような水和物ではない。
「溶媒和物」は、水以外の溶媒が存在するという点を除き、水和物と同様である。例えば、メタノール又はエタノールは、「アルコール酸」を形成することができ、これは再び化学量論的又は非化学量論的であり得る。本明細書で使用されるとき、「溶媒和物」は、固体形態を指す。すなわち、溶媒溶液中の化合物は、溶媒和され得るが、その用語が本明細書で使用されるような溶媒和物ではない。
「同位体」は、プロトンの数は同じであるが中性子の数が異なる原子を指し、式(I)の化合物の同位体は、1個以上の原子がその原子の同位体で置き換えられている任意のそのような化合物を含む。例えば、炭素12(最も一般的な形態の炭素)は、6つの陽子及び6つの中性子を有するが、炭素13は6つの陽子及び7つの中性子を有し、炭素14は6つの陽子及び8つの中性子を有する。水素は、2つの安定した同位体、すなわち重水素(1つの陽子及び1つの中性子)及びトリチウム(1つの陽子及び2つの中性子)を有する。フッ素はいくつかの同位体を有するが、フッ素19が最も長寿命である。したがって、式(I)の構造を有する化合物の同位体としては、1個以上の炭素12原子が炭素-13及び/又は炭素-14原子で置き換えられている式(I)の化合物、1個以上の水素原子が重水素及び/又はトリチウムで置き換えられている式(I)の化合物、及び/又は1個以上のフッ素原子がフッ素-19で置き換えられている式(I)の化合物が挙げられるが、これらに限定されない。
「塩」は、一般に、イオン形態の、対イオンと組み合わせた、例えばカルボン酸又はアミンなどの有機化合物を指す。例えば、それらのアニオン形態の酸とカチオンとの間に形成される塩は、「酸付加塩」と称される。逆に、カチオン性形態の塩基とアニオンとの間に形成される塩は、「塩基付加塩」と称される。
「医薬的に許容される」という用語は、ヒトの消費について承認されており、概して非毒性である薬剤を指す。例えば、「医薬的に許容される塩」という用語は、非毒性の無機酸若しくは有機酸及び/又は塩基付加塩を指す(例えば、Lit et al.,Salt Selection for Basic Drugs,Int.J.Pharm.,33,201-217,1986を参照)(同文献は、参照により本明細書に組み込まれる)。
本開示の化合物の医薬的に許容される塩基付加塩は、例えば、アルカリ金属塩、アルカリ土類金属塩、及び遷移金属塩などを含む金属塩、例えば、カルシウム塩、マグネシウム塩、カリウム塩、ナトリウム塩、及び亜鉛塩などを含む。医薬的に許容される塩基付加塩としては、塩基性アミンから作製される有機塩が挙げられ、例えば、N,N’ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、メグルミン(N-メチルグルカミン)、及びプロカインなどが挙げられる。
医薬的に許容される酸付加塩は、無機酸又は有機酸から調製され得る。無機酸の例としては、塩酸、臭化水素酸、ヨウ化水素酸、硝酸、炭酸、硫酸、及びリン酸が挙げられる。適切な有機酸は、有機酸の脂肪族、脂環式、芳香族、芳香族脂肪族、複素環式、カルボン酸、及びスルホン酸クラスから選択することができ、その例としては、ギ酸、酢酸、プロピオン酸、コハク酸、グリコール酸、グルコン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、グルクロン酸、マレイン酸、フマル酸、ピルビン酸、アスパラギン酸、グルタミン酸、安息香酸、アントラニル酸、4-ヒドロキシ安息香酸、フェニル酢酸、マンデル酸、馬尿酸、マロン酸、シュウ酸、エンボニック(パモ酸)、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸、パントテン酸、トリフルオロメタンスルホン酸、2-ヒドロキシエタンスルホン酸、p-トルエンスルホン酸、スルファニル酸、シクロヘキシルアミノスルホン酸、ステアリン酸、アルギン酸、βヒドロキシ酪酸、サリチル酸、-ガラクタール酸、及びガラクツロン酸が挙げられる。
医薬的に許容されない塩は概して医薬品として有用ではないが、そのような塩は、例えば、本明細書に記載の化合物の合成における中間体として、例えば、再結晶によるそれらの精製において有用であり得る。
特定の実施形態では、本開示は、本明細書に記載の化合物、又はその医薬的に許容される異性体、ラセミ体、水和物、溶媒和物、同位体、若しくは塩を、少なくとも1つの医薬的に許容される担体、希釈剤、又は賦形剤とともに含む、医薬組成物を提供する。例えば、活性化合物は、通常、担体と混合されるか、又は担体によって希釈されるか、又はアンプル、カプセル、サシェ、紙、若しくは他の容器の形態であり得る担体内に封入される。活性化合物が担体と混合される場合、又は担体が希釈剤として機能する場合、それは、活性化合物のビヒクル、賦形剤、又は媒体として機能する固体、半固体、又は液体材料であり得る。活性化合物は、例えばサシェに含有される粒状固体担体に吸着され得る。好適な担体のいくつかの例としては、水、塩溶液、アルコール、ポリエチレングリコール、ポリヒドロキシエトキシル化ひまし油、ピーナツ油、オリーブ油、ゼラチン、ラクトース、白土、ショ糖、デキストリン、炭酸マグネシウム、砂糖、シクロデキストリン、アミロース、ステアリン酸マグネシウム、タルク、ゼラチン、寒天、ペクチン、アカシア、ステアリン酸、又は、セルロース、ケイ酸、脂肪酸、脂肪酸アミン、脂肪酸モノグリセリド及びジグリセリドの低級アルキルエーテル、ペンタエリスリトール脂肪酸エステル、ポリオキシエチレン、ヒドロキシメチルセルロース、並びにポリビニルピロリドンがある。同様に、担体又は希釈剤としては、モノステアリン酸グリセリル又はジステアリン酸グリセリルなどの、当該技術分野で既知の任意の持続的放出材料を挙げることができ、これらは単独で又はワックスと混合されて用いることができる。
本明細書で使用される場合、「医薬組成物」という用語は、本明細書に記載の化合物、又はその医薬的に許容される異性体、ラセミ体、水和物、溶媒和物、ホモログ、若しくは塩のうちの1つ以上を含有し、医薬的に許容される担体(他の添加剤を含み得る)とともに製剤化された組成物であって、哺乳動物における疾患の治療のための治療レジメンの一部として、政府規制機関の承認を受けて製造又は販売される組成物を指す。医薬組成物は、例えば、単位剤形での経口投与用(例えば、錠剤、カプセル、カプレット、ジェルキャップ、又はシロップとして)、局所投与用(例えば、クリーム、ジェル、ローション、又は軟膏として)、静脈内投与用(例えば、微粒子塞栓を含まない滅菌溶液及び静脈内使用に適した溶媒系中)、又は本明細書に記載の任意の他の製剤に製剤化され得る。好適な製剤の選択及び調製のための従来の手順及び成分は、例えば、Remington:The Science and Practice of Pharmacy,21st Ed.,Gennaro,Ed.,Lippencott Williams&Wilkins(2005)及び米国薬局方:The National Formulary(USP 36 NF31)(2013年発行)に記載されている。
他の実施形態では、本開示の化合物を医薬的に許容される担体又は希釈剤を用いて製剤化することを含む、本明細書に記載の化合物の組成物を作製する方法が提供される。いくつかの実施形態では、医薬的に許容される担体又は希釈剤は、経口投与に好適である。いくつかのそのような実施形態では、本方法は、組成物を錠剤又はカプセルに製剤化する工程を更に含み得る。他の実施形態では、医薬的に許容される担体又は希釈剤は、非経口投与に好適である。いくつかのそのような実施形態では、本方法は、組成物を凍結乾燥して、凍結乾燥調製物を形成する工程を更に含む。
本明細書で使用される場合、「医薬的に許容される担体」という用語は、開示された化合物、又はその医薬的に許容される異性体、ラセミ体、水和物、溶媒和物、ホモログ、若しくは塩以外の任意の成分(例えば、活性化合物を懸濁又は溶解させることができる担体)であって、患者において非毒性及び非炎症性の特性を有する成分を指す。賦形剤としては、例えば、粘着防止剤、酸化防止剤、結合剤、コーティング、圧縮助剤、崩壊剤、染料(色素)、皮膚軟化剤、乳化剤、充填剤(希釈剤)、皮膜形成剤若しくは皮膜コーティング、香味剤、香料、滑剤(流動性促進剤)、潤滑剤、防腐剤、印刷インク、吸着剤、懸濁剤若しくは分散剤、甘味料、又は水和水を挙げることができる。例示的な賦形剤としては、ブチル化ヒドロキシトルエン(butylated hydroxytoluene、BHT)、炭酸カルシウム、リン酸カルシウム(二塩基性)、ステアリン酸カルシウム、クロスカルメロース、架橋ポリビニルピロリドン、クエン酸、クロスポビドン、システイン、エチルセルロース、ゼラチン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ラクトース、ステアリン酸マグネシウム、マルチトール、マンニトール、メチオニン、メチルセルロース、メチルパラベン、微結晶セルロース、ポリエチレングリコール、ポリビニルピロリドン、ポビドン、α化でんぷん、プロピルパラベン、パルミチン酸レチニル、シェラック、二酸化ケイ素、カルボキシメチルセルロースナトリウム、クエン酸ナトリウム、でんぷんグリコール酸ナトリウム、ソルビトール、でんぷん(コーンスターチ)、ステアリン酸、ショ糖、タルク、二酸化チタン、ビタミンA、ビタミンE、ビタミンC、及びキシリトールが挙げられるが、これらに限定されない。
製剤は、活性化合物に悪影響を及ぼす形で反応しない補助剤と混合することができる。そのような添加剤としては、湿潤剤、乳化剤及び懸濁剤、浸透圧に影響を与えるための塩、緩衝液及び/若しくは着色物質、保存剤、甘味剤、又は香味剤を挙げることができる。必要に応じて、組成物を滅菌することもできる。
投与経路は、本開示の活性化合物を、経口、経鼻、肺、頬、皮下(subdermal)、皮内、経皮、又は非経口、例えば、直腸、デポ、皮下(subcutaneous)、静脈内、尿道内、筋肉内、鼻腔内、点眼液、若しくは軟膏などの適切な又は所望の作用部位に効果的に輸送する任意の経路であり得るが、経口経路が好ましい。
剤形は、1日1回、又は1日2回以上、例えば1日2回若しくは3回投与され得る。代替的に、剤形は、処方医師が推奨できると判断した場合、1日1回よりも少ない頻度で、例えば、2日に1回又は週1回投与され得る。投与レジメンには、例えば、治療される適応症に必要又は有用な程度の用量設定が含まれ、したがって患者の体が治療に適合することを可能にし、かつ/又は治療に関連する望ましくない副作用を最小限に抑えるか、若しくは回避することができる。他の剤形としては、遅延式又は制御式放出形態が挙げられる。好適な投与レジメン及び/又は形態には、例えば、参照により本明細書に組み込まれる、Physicians’Desk Referenceの最新版に記載されているものが含まれる。
本明細書で使用される場合、「投与すること」又は「投与」という用語は、(例えば)経口、非経口(例えば、静脈内)、若しくは局所投与を含む、任意の許容される手段又は経路によって、対象に、化合物、それを含む医薬組成物を提供することを指す。
本明細書で使用される場合、「治療」という用語は、疾患又は病的状態の兆候又は症状を改善する介入を指す。本明細書で使用される場合、疾患、病的状態又は症状に関する「治療」、「治療する」及び「治療すること」という用語はまた、その治療の任意の観察可能な有益な効果も指す。有益な効果は、例えば、影響を受けやすい対象における疾患の臨床症状の発症の遅延、疾患のいくつか又は全ての臨床症状の重篤性の低減、疾患のより遅い進行、疾患の再発の数の低減、対象の全体的な健康若しくはウェルビーイングの改善、あるいは特定の疾患に特異的な当該技術分野で周知の他のパラメータによって証明され得る。予防的治療は、症状が発症進行するリスクを減少させる目的で、疾患の兆候を示していないか、又は早期の兆候のみを示す対象に投与される治療である。治療的治療は、疾患の兆候及び症状が発症進行した後に対象に投与される治療である。
本明細書で使用される場合、「対象」という用語は、動物(例えば、ヒトなどの哺乳動物)を指す。本明細書に記載の方法に従って治療される対象は、脱髄、髄鞘形成不足、又は髄鞘の発達不全を伴う神経変性疾患と診断された対象、例えば、多発性硬化症若しくは脳性麻痺と診断された対象、又はその状態を発症するリスクのある対象であり得る。診断は、当該技術分野で既知の任意の方法又は技術によって実施され得る。当業者は、本開示に従って治療される対象が、疾患又は状態に関連する1つ以上のリスク因子の存在によって、リスクのあるものとして、標準試験に供されてもよく、又は検査なしで特定されてもよいということを理解するであろう。
本明細書で使用される場合、「有効量」という用語は、ある特定の薬剤の量であって、その薬剤で治療される対象において所望の効果を達成するのに十分な量を指す。理想的には、薬剤の有効量は、対象において実質的な毒性を引き起こすことなく、疾患を阻害又は治療するのに十分な量である。薬剤の有効量は、治療される対象、苦痛の深刻さ、及び医薬組成物の投与方法に応じて変化する。開示された化合物の、対象において所望の効果を達成するのに十分な有効量を決定する方法は、本開示に照らして当業者によって理解されるであろう。
本明細書で使用される場合、「調節する(modulate)」又は「調節すること(modulating)」という用語は、1つ以上のプロテインキナーゼの活性を増加又は減少させる能力を指す。したがって、本発明の化合物は、プロテインキナーゼを本明細書に記載の化合物又は組成物のうちのいずれか1つ以上と接触させることによって、プロテインキナーゼを調節する方法で使用することができる。いくつかの実施形態では、化合物は、1つ以上のプロテインキナーゼの阻害剤として作用することができる。いくつかの実施形態では、化合物は、1つ以上のプロテインキナーゼの活性を刺激するように作用することができる。更なる実施形態では、本発明の化合物は、調節量の本明細書に記載の化合物を投与することによって、受容体の調節を必要とする個体におけるプロテインキナーゼの活性を調節するために使用することができる。
本明細書で使用される場合、「BTK媒介性(BTK-mediated)」若しくは「BTK調節(BTK-modulated)」若しくは「BTK依存性(BTK-dependent)」疾患又は障害という用語は、BTK又はその変異体が役割を果たすことが知られている任意の疾患又は他の有害な状態を意味する。したがって、本出願の別の実施形態は、BTK若しくはその変異体が役割を果たすことが知られている1つ以上の疾患の治療すること又はその重症度を軽減することに関する。具体的には、本出願は、増殖性疾患又は自己免疫疾患から選択される疾患又は状態を治療するか、あるいはその重症度を軽減する方法であって、それを必要とする患者に、本出願による式(I)の化合物又は組成物を投与することを含む、方法に関する。
化合物
式(I)の構造を有する化合物、
式(I)の構造を有する化合物、
が、単結合又は二重結合を表し、
R1が、-H、-CH3、又は-Fであり、
R2が、-H、-CH3、又は-Fであるか、
あるいはR1及びR2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成し、
RI1が、-Cl、-F、-CN、-CH3、-CH2F、-CHF2、又は-CF3であり、
RI2が、-H又は-Fであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3であり、
RI1が-CH3であるとき、R1及びR2のうちの少なくとも一方が、-CH3又は-Fである、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が本明細書に開示される。
いくつかの実施形態では、---は単結合を表す。他の実施形態では、---は二重結合を表す。
いくつかの実施形態では、R1は-Hである。他の実施形態では、R1は-CH3である。他の実施形態では、R1は-Fである。いくつかの実施形態では、R1は-Hであり、R2は-Hである。他の実施形態では、R1は-Hであり、R2は-CH3である。他の実施形態では、R1は-Hであり、R2は-Fである。他の実施形態では、R1は-CH3であり、R2は-CH3である。他の実施形態では、R1は-CH3であり、R2は-Fである。他の実施形態では、R1は-Fであり、R2は-Fである。
いくつかの実施形態では、R1及びR2は、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成する。いくつかの実施形態では、R1及びR2は、それらが結合しているC原子と一緒になって、シクロプロピル環を形成する。いくつかの実施形態では、R1及びR2は、それらが結合しているC原子と一緒になって、シクロプロピル環を形成する。いくつかの実施形態では、R1及びR2は、それらが結合しているC原子と一緒になって、シクロブチル環を形成する。いくつかの実施形態では、R1及びR2は、それらが結合しているC原子と一緒になって、シクロペンチル環を形成する。いくつかの実施形態では、R1及びR2は、それらが結合しているC原子と一緒になって、シクロヘキシル環を形成する。
いくつかの実施形態では、RI1は、-Cl、-F、-CN、-CH2F、-CHF2、又は-CF3である。他の実施形態では、RI1は-Cl又は-Fである。他の実施形態では、RI1は-Clである。他の実施形態では、RI1は-Fである。他の実施形態では、RI1は-CNである。他の実施形態では、RI1は、F、-CH2F、-CHF2、又は-CF3である。
いくつかの実施形態では、RI2は-Hである。いくつかの実施形態では、RI2は-Fである。
いくつかの実施形態では、RBは-CH=CH2である。他の実施形態では、RBは-C≡CHである。他の実施形態では、RBは-C≡C-CH3である。
いくつかの実施形態では、---は単結合を表し、RI2は-Hであり、R1は-Hであり、R2は-Hである。他の実施形態では、---は単結合を表し、RI2は-Fであり、R1は-Hであり、R2は-Hである。他の実施形態では、---は単結合を表し、RI1は-Clであり、RI2は-Fであり、R1は-Hであり、R2は-Hである。
いくつかの実施形態では、式(I-S)又は(I-R)の構造を有する化合物である。
いくつかの実施形態では、以下に示す構造を有する化合物である。
一実施形態では、以下の表1の化合物の構造を有する、式(I)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
別の実施形態では、以下の表2の化合物の構造を有する、式(I)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
また、式(II)の構造を有する化合物、
であって、式中、
R3が、H、Me、又はシクロプロピルであり、
Xが、-CH2CH2-又は-CRx1Rx2-であり、
Rx1が、H、F、又はMeであり、
Rx2が、H、F、又はMeであるか、
あるいはRx1及びRx2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成するか、
あるいはRx1がHであり、Rx2及びR3が一緒になってアルキレン架橋を形成し、
RII1が、Cl、F、-CH2F、-CHF2、-CF3、又は-CNであり、
RII2が、H又はFであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3である、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体も本明細書に開示される。
一実施形態では、R3はHである。別の実施形態では、R3はMeである。更に別の実施形態では、R3はシクロプロピルである。他の実施形態では、R3はH又はMeである。
一実施形態では、Xは-CH2CH2-である。
一実施形態では、Xは-CRx1Rx2-である。
一実施形態では、Xは-CRx1Rx2-であり、Rx1はHであり、RX2はHである。
一実施形態では、Xは-CRx1Rx2-であり、Rx1はHであり、RX2はFである。
一実施形態では、Xは-CRx1Rx2-であり、Rx1はFであり、RX2はFである。
一実施形態では、Xは-CRx1Rx2-であり、Rx1はMeであり、RX2はFである。
一実施形態では、Xは-CRx1Rx2-であり、Rx1はMeであり、RX2はMeである。
一実施形態では、Xは-CRx1Rx2-であり、Rx1及びRx2は、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成する。いくつかの実施形態では、Rx1及びRx2は、それらが結合しているC原子と一緒になって、シクロプロピル、シクロブチル、シクロペンチル、又はシクロヘキシル環を形成する。
一実施形態では、Xは-CRx1Rx2-であり、Rx1はHであり、Rx2及びR3は、一緒になって、アルキレン架橋を形成する。一実施形態では、RX2及びR3は、一緒になって、メチレン架橋を形成する。
一実施形態では、RBは-CH=CH2である。
一実施形態では、RBは-C≡CHである。
一実施形態では、RBは-C≡C-CH3である。
一実施形態では、RII1は、Cl、F、又は-CNである。一実施形態では、RII1はClである。別の実施形態では、RII1はFである。別の実施形態では、RII1はCNである。
一実施形態では、RII1は、-CH2F、-CHF2、又は-CF3である。一実施形態では、RII1は-CH2Fである。別の実施形態では、RII1は-CHF2である。別の実施形態では、RII1は-CF3である。
一実施形態では、RII2はHである。別の実施形態では、RII2はFである。
一実施形態では、以下の化合物の構造を有する、式(II)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
一実施形態では、表3の化合物の構造を有する、式(II)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
いくつかの実施形態では、式(II)の化合物は、2つの異性体の混合物を含む。他の実施形態では、式(II)の化合物は、2つのアトロプ異性体の混合物を含む。他の実施形態では、式(II)の化合物は、2つのアトロプ異性体のラセミ混合物を含む。他の実施形態では、式(II)の化合物は、単一のアトロプ異性体を含む。他の実施形態では、式(II)の化合物は、単一の(R)-アトロプ異性体を含む。他の実施形態では、式(II)の化合物は、単一の(S)-アトロプ異性体を含む。いくつかの実施形態では、式(II-a)又は(II-b)の化合物が提供される。
また、式(III)の構造を有する化合物、
であって、式中、
Zが、-CH2-、-CHMe-、又は結合であり、
Yが、-CHR4-又は結合であり、
R4が、H、F、又はOHであり、
R5が、H、F、又はMeであり、
R6が、H又はMeであり、
R7が、H又はMeであり、
R8がHであるか、
あるいはR5及びR7が、一緒になって、5員又は6員の複素環を形成するか、
あるいはR6及びR7が、一緒になって、4員、5員、又は6員の複素環を形成するか、
あるいはR8及びR7が、一緒になって、5員又は6員の複素環を形成し、
aが、0、1、又は2であり、
RIII1が、Cl、F、-CH2F、-CHF2、-CF3、又は-CNであるか、あるいは
R4がF若しくはOHであるとき、又はR5がFであるとき、又はR5及びR7若しくはR8及びR7が、一緒になって、5若しくは6員の複素環を形成するとき、又はR6及びR7が、一緒になって、4、5、若しくは6員の複素環を形成するとき、RIII1が-CH3であり、
RIII2が、H又はFであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3である、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体も本明細書に開示される。
式(III)の一実施形態では、Zは結合であり、Yは結合であり、式(IV)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、a、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。
式(III)の一実施形態では、Zは-CH2-であり、Yは結合であり、式(V-a)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、a、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。
式(III)の一実施形態では、Zは結合であり、Yは-CHR4-であり、式(V-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、a、R4、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。式(III-b)の一実施形態では、R4はHである。式(III-b)の別の実施形態では、R4はFである。式(III-b)の別の実施形態では、R4は-OHである。
式(III)の一実施形態では、Zは-CH2-であり、Yは-CHR4-であり、式(VI-a)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、a、R4、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。式(VI-a)の一実施形態では、R4はFである。式(VI-a)の別の実施形態では、R4は-OHである。
式(VI-a)の一実施形態では、R4はHであり、式(VI-a-1)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、a、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。
式(III)の一実施形態では、Zは-CHMe-であり、Yは-CHR4-であり、式(VI-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、a、R4、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。式(VI-b)の一実施形態では、R4はHである。式(VI-b)の別の実施形態では、R4はFである。式(VI-b)の別の実施形態では、R4は-OHである。
式(III)の一実施形態では、R7及びR8は一緒になって5員複素環を形成し、aは0であり、R5はHであり、R6はHであり、式(VII-a)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(VII-a)のいくつかの実施形態では、ZはCH2である。式(VII-a)のいくつかの実施形態では、YはCH2である。式(VII-a)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(VII-a)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(VII-a)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R7及びR8は一緒になって5員複素環を形成し、aは1であり、R5はHであり、R6はHであり、式(VII-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(VII-b)のいくつかの実施形態では、ZはCH2である。式(VII-b)のいくつかの実施形態では、YはCH2である。式(VII-b)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(VII-b)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(VII-b)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R7及びR8は一緒になって5員複素環を形成し、aは2であり、R5はHであり、R6はHであり、式(VII-c)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(VII-c)のいくつかの実施形態では、ZはCH2である。式(VII-c)のいくつかの実施形態では、YはCH2である。式(VII-c)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(VII-c)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(VII-c)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R7及びR8は一緒になって6員複素環を形成し、aは0であり、R5はHであり、R6はHであり、式(VIII-a)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(VIII-a)のいくつかの実施形態では、ZはCH2である。式(VIII-a)のいくつかの実施形態では、YはCH2である。式(VIII-a)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(VIII-a)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(VIII-a)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R7及びR8は一緒になって6員複素環を形成し、aは1であり、R5はHであり、R6はHであり、式(VIII-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(VIII-b)のいくつかの実施形態では、ZはCH2である。式(VIII-b)のいくつかの実施形態では、YはCH2である。式(VIII-b)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(VIII-b)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(VIII-b)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R7及びR8は一緒になって6員複素環を形成し、aは2であり、R5はHであり、R6はHであり、式(VIII-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(VIII-c)のいくつかの実施形態では、ZはCH2である。式(VIII-c)のいくつかの実施形態では、YはCH2である。式(VIII-c)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(VIII-c)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(VIII-c)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R6及びR7は一緒になって4員複素環を形成し、aは0であり、R5はHであり、R8はHであり、式(IX-a)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(IX-a)のいくつかの実施形態では、ZはCH2である。式(IX-a)のいくつかの実施形態では、YはCH2である。式(IX-a)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(IX-a)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(IX-a)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R6及びR7は一緒になって4員複素環を形成し、aは1であり、R5はHであり、R8はHであり、式(IX-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(IX-b)のいくつかの実施形態では、ZはCH2である。式(IX-b)のいくつかの実施形態では、YはCH2である。式(IX-b)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(IX-b)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(IX-b)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R5及びR7は一緒になって5員複素環を形成し、aは2であり、R6はHであり、R8はHであり、式(X-a)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(X-a)のいくつかの実施形態では、ZはCH2である。式(X-a)のいくつかの実施形態では、YはCH2である。式(X-a)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(X-a)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(X-a)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R5及びR7は一緒になって5員複素環を形成し、aは1であり、R6はHであり、R8はHであり、式(X-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(X-b)のいくつかの実施形態では、ZはCH2である。式(X-b)のいくつかの実施形態では、YはCH2である。式(X-b)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(X-b)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(X-b)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R5及びR7は一緒になって5員複素環を形成し、aは0であり、R6はHであり、R8はHであり、式(X-c)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(X-c)のいくつかの実施形態では、ZはCH2である。式(X-c)のいくつかの実施形態では、YはCH2である。式(X-c)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(X-c)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(X-c)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R5及びR7は一緒になって6員複素環を形成し、aは2であり、R6はHであり、式(XI-a)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、R8、Z、及びYは、式(III)に照らして上に定義したとおりである。式(XI-a)のいくつかの実施形態では、ZはCH2である。式(XI-a)のいくつかの実施形態では、YはCH2である。式(XI-a)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(XI-a)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(XI-a)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R5及びR7は一緒になって6員複素環を形成し、aは1であり、R6はHであり、式(XI-b)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、R8、Z、及びYは、式(III)に照らして上に定義したとおりである。式(XI-b)のいくつかの実施形態では、ZはCH2である。式(XI-b)のいくつかの実施形態では、YはCH2である。式(XI-b)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(XI-b)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(XI-b)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)の一実施形態では、R5及びR7は一緒になって6員複素環を形成し、aは0であり、R5はHであり、R6はHであり、式(XI-c)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、R8、Z、及びYは、式(III)に照らして上に定義したとおりである。式(XI-c)のいくつかの実施形態では、ZはCH2である。式(XI-c)のいくつかの実施形態では、YはCH2である。式(XI-c)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(XI-c)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(XI-c)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。
式(III)のいくつかの実施形態では、R5及びR7は一緒になって6員複素環を形成し、R6はHであり、ZはCH2であり、式(XII-a)、(XII-b)、又は(XII-c)のうちの1つの構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、R8、及びYは、式(III)に照らして上に定義したとおりである。
式(III)のいくつかの実施形態では、R5及びR7は一緒になって6員複素環を形成し、R6はHであり、Zは結合であり、式(XIII-a)、(XIII-b)、又は(XIII-c)のうちの1つの構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、RB、R8、及びYは、式(III)に照らして上に定義したとおりである。
式(III)のいくつかの実施形態では、R5はHであり、R6はHであり、R7はHであり、R8はHであり、式(XIV)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、a、RB、Z、及びYは、式(III)に照らして上に定義したとおりである。式(XIV)のいくつかの実施形態では、ZはCH2である。式(XIV)のいくつかの実施形態では、YはCH2である。式(XIV)のいくつかの実施形態では、ZはCH2であり、YはCH2である。式(XIV)のいくつかの実施形態では、ZはCHMeであり、YはCH2である。式(XIV)のいくつかの実施形態では、ZはCH2であり、YはCHR4である。式(XIV)のいくつかの実施形態では、aは0である。式(XIV)の他の実施形態では、aは1である。式(XIV)の他の実施形態では、aは2である。
式(III)のいくつかの実施形態では、R5はH、R6はHであり、R7はHであり、R8はHであり、ZはCH2であり、YはCHR4であり、式(XV)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、a、R4、及びRBは、式(III)に照らして上に定義したとおりである。
式(XV)のいくつかの実施形態では、aは、0、1、又は2であり、式(XV-a)、(XV-b)、又は(XV-c)のうちの1つの構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、R4、及びRBは、式(III)に照らして上に定義したとおりである。
式(III)のいくつかの実施形態、並びに式(IV)、(V-a)、(V-b)、(VI-a)、(VI-a-1)、(VI-b)、(VII-a)、(VII-b)、(VII-c)、(VIII-a)、(VIII-b)、(VIII-c)、(IX-a)、(IX-b)、(X-a)、(X-b)、(X-c)、(XI-a)、(XI-b)、(XI-c)、(XII-a)、(XII-b)、(XII-c)、(XIII-a)、(XIII-b)、(XIII-c)、(XIV)、(XV-a)、(XV-b)、及び(XV-c)(以降「式(III)~(XV)」と称する)のうちのいずれか1つのより具体的な実施形態の各々では、RIII1は、Cl、F、-CN、-CH2F、-CHF2、又は-CF3である。式(III)~(XV)のうちのいずれか1つの他の実施形態では、RIII1はCl又はFである。式(III)~(XV)のうちのいずれか1つの他の実施形態では、RIII1はClである。式(III)~(XV)のうちのいずれか1つの他の実施形態では、RIII1はFである。式(III)~(XV)のうちのいずれか1つの他の実施形態では、RIII1-CNである。式(III)~(XV)のうちのいずれか1つの他の実施形態では、RIII1は、F、-CH2F、-CHF2、又は-CF3である。
式(III)~(XV)のうちの1つのいずれか1つのいくつかの実施形態では、R4がF又はOHであるとき、RIII1は-CH3である。式(III)~(XV)のうちの1つのいずれか1つの他の実施形態では、R5がFであるとき、RIII1は-CH3である。式(III)~(XV)のうちの1つのいずれか1つの他の実施形態では、R5及びR7が一緒になって5若しくは6員複素環を形成するか、又はR6及びR7が一緒になって4、5、若しくは6員複素環を形成するか、又はR8及びR7が一緒になって5若しくは6員複素環を形成するとき、RIII1は-CH3である。
式(III)~(XV)のうちのいずれか1つのいくつかの実施形態では、RIII2はHである。式(III)~(XV)のうちのいずれか1つのいくつかの実施形態では、RIII2はFである。
式(III)~(XV)のうちのいずれか1つの実施形態では、RBは-CH=CH2である。
式(III)の一実施形態では、RBは-CH=CH2であり、式(XVI)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、a、Z、Y、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。
式(III)~(XIII)のうちのいずれか1つの実施形態では、RBは-C≡CHであり、式(XVII)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、a、Z、Y、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。
式(III)~(XIII)のうちのいずれか1つの実施形態では、RBは-C≡C-CH3であり、式(XVIII)の構造を有する化合物、
又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供され、式中、RIII1、RIII2、a、Z、Y、R5、R6、R7、及びR8は、式(III)に照らして上に定義したとおりである。
一実施形態では、表4に列挙される化合物の構造を有する、式(III)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体が提供される。
更なる実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、又は式(XVIII)の化合物の医薬的に許容される塩である。
他の実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、又は式(XVIII)の化合物の溶媒和物である。
他の実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、又は式(XVIII)の化合物の水和物である。
他の実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、又は式(XVIII)の化合物の異性体である。
他の実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、又は式(XVIII)の化合物の互変異性体である。
他の実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、又は式(XVIII)の化合物のラセミ体である。
他の実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、又は式(XVIII)の化合物の同位体形態である。
更なる実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、若しくは式(XVIII)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体を含む、医薬組成物である。
更なる実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、若しくは式(XVIII)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体と、少なくとも1つの医薬的に許容される賦形剤と、を含む、医薬組成物である。
別の実施形態では、式(I)、式(II)、式(II-a)、式(II-b)、式(IV)、式(V-a)、式(V-b)、式(VI-a)、式(VI-a-1)、式(VI-b)、式(VII-a)、式(VII-b)、式(VII-c)、式(VIII-a)、式(VIII-b)、式(VIII-c)、式(IX-a)、式(IX-b)、式(X-a)、式(X-b)、式(X-c)、式(XI-a)、式(XI-b)、式(XI-c)、式(XII-a)、式(XII-b)、式(XII-c)、式(XIII-a)、式(XIII-b)、式(XIII-c)、式(XIII)、式(XIV)、式(XV-a)、式(XV-b)、式(XV-c)、式(XVI)、式(XVII、若しくは式(XVIII)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体と、医薬的に許容される担体、アジュバント、又はビヒクルと、を含む、医薬組成物である。
疾患
プロテインキナーゼを阻害する方法であって、プロテインキナーゼを、有効量の式(I)、式(II)、若しくは(III)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物と接触させることを含む、方法が本明細書に記載される。いくつかの実施形態では、プロテインキナーゼはBTKである。
プロテインキナーゼを阻害する方法であって、プロテインキナーゼを、有効量の式(I)、式(II)、若しくは(III)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物と接触させることを含む、方法が本明細書に記載される。いくつかの実施形態では、プロテインキナーゼはBTKである。
BTK依存性状態を治療するための方法であって、それを必要とする対象に、有効量の式(I)、式(II)、若しくは式(III)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物を投与することを含む、方法が本明細書に記載される。
いくつかの実施形態では、BTK依存性状態は、がん、自己免疫疾患、炎症性疾患、又は血栓塞栓性疾患である。いくつかの実施形態では、自己免疫疾患は、多発性硬化症、関節リウマチ、乾癬、シェーグレン症候群、又は全身性エリテマトーデスである。いくつかの実施形態では、炎症性疾患は、蕁麻疹である。いくつかの実施形態では、BTK依存性状態は、がんである。いくつかの実施形態では、BTK依存性状態は、自己免疫疾患である。いくつかの実施形態では、BTK依存性状態は、炎症性疾患である。いくつかの実施形態では、BTK依存性状態は、血栓塞栓性疾患である。いくつかの実施形態では、BTK依存性状態は、多発性硬化症である。いくつかの実施形態では、BTK依存性状態は、関節リウマチである。いくつかの実施形態では、BTK依存性状態は、乾癬である。いくつかの実施形態では、BTK依存性状態は、シェーグレン症候群である。いくつかの実施形態では、BTK依存性状態は、全身性エリテマトーデスである。いくつかの実施形態では、BTK依存性状態は、蕁麻疹である。
いくつかの実施形態では、医薬品の製造における、式(I)、式(II)、若しくは式(III)の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物の使用である。いくつかの実施形態では、医薬品は、がんの治療のためのものである。いくつかの実施形態では、医薬品は、自己免疫疾患の治療のためのものである。いくつかの実施形態では、医薬品は、炎症性疾患の治療のためのものである。いくつかの実施形態では、医薬品は、血栓塞栓性疾患の治療のためのものである。いくつかの実施形態では、医薬品は、多発性硬化症の治療のためのものである。いくつかの実施形態では、医薬品は、関節リウマチの治療のためのものである。いくつかの実施形態では、医薬品は、乾癬の治療のためのものである。いくつかの実施形態では、医薬品は、シェーグレン症候群の治療のためのものである。いくつかの実施形態では、医薬品は、全身性エリテマトーデスの治療のためのものである。いくつかの実施形態では、医薬品は、蕁麻疹の治療のためのものである。
したがって、BTK活性の阻害は、SLE、関節リウマチ、多発性血管炎、特発性血小板減少性紫斑病(idiopathic thrombocytopenic purpura、ITP)、筋無力症、アレルギー性鼻炎、多発性硬化症(multiple sclerosis、MS)、移植拒絶反応、I型糖尿病、膜性腎炎、炎症性腸疾患、自己免疫性溶血性貧血、自己免疫性甲状腺炎、寒冷及び温暖凝集素症、エヴァンス症候群、溶血性尿毒症症候群/血栓性血小板減少性紫斑病、サルコイドーシス、シェーグレン症候群、末梢神経障害(例えば、ギラン・バレー症候群)、尋常性天疱瘡、並びに喘息を含むがこれらに限定されない、アレルギー性障害及び/又は自己免疫疾患及び/又は炎症性疾患の治療に有用であり得る。
加えて、BTKは、特定のB細胞がんにおけるB細胞生存の制御において役割を果たすことが報告されている。例えば、BTKは、BCR-Abl陽性B細胞急性リンパ芽球性白血病細胞の生存にとって重要であることが示されている。したがって、BTK活性の阻害は、B細胞リンパ腫及び白血病の治療に有用であり得る。
本明細書に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、若しくは互変異性体は、任意選択でコルチコステロイド剤、非コルチコステロイド剤、免疫抑制剤、及び/又は抗炎症剤と組み合わせて、上に列挙した疾患の治療に有用であり得る。一実施形態では、免疫抑制剤は、インターフェロンアルファ、インターフェロンガンマ、シクロホスファミド、タクロリムス、マイコフェノールモフェチル、メトトレキサート、ダプソン、スルファサラジン、アザチオプリン、抗CD20剤(リツキシマブ、オファツムマブ、オビヌツズマブ、若しくはベルツズマブ、又はそのバイオシミラーバージョンなど)、抗TNFアルファ剤(エンタネルセプト(entanercept)、インフリキシマブ、ゴリルマブ、アダリムマブ、若しくはセルトリズマブペゴル、又はそのバイオシミラーバージョンなど)、配位子又はその受容体に対する抗IL6剤(トシリズマブ、サリルマブ、オロキズマブ、エルシルマブ、又はシルツキシマブなど)、配位子又はその受容体に対する抗IL17剤(セクキヌマブ、ウステキヌマブ、ブロダルマブ、又はイセキズマブなど)、配位子又はその受容体に対する抗IL1剤(リロナセプト、カナキヌマブ、又はアナキンラなど)、配位子又はその受容体に対する抗IL2剤(バシリキシマブ又はダクリズマブなど)、アレファセプトなどの抗CD2剤、ムロモナブ-cd3などの抗CD3剤、アバタセプト又はベラタセプトなどの抗CD80/86剤、フィンゴリモドなどの抗スフィンゴシン-1-リン酸受容体剤、エクリズマブなどの抗C5剤、ナタリズマブなどの抗インテグリンアルファ4剤、ベドリズマブなどの抗α4β7剤、シロリムス又はエベロリムスなどの抗mTOR剤、タクロリムスなどの抗カルシニューリン剤、並びに抗BAFF/BlyS剤(ベリムマブ、VAY736、又はブリシビモドなど)、レフルノミド、及びテリフルノミドから選択される。好ましくは、免疫抑制剤は、リツキシマブ、オファツムマブ、オビヌツズマブ、若しくはベルツズマブ、又はそのバイオシミラーバージョンである。
化合物の合成
本明細書に記載の反応、プロセス、及び合成方法は、以下の実験セクションに記載されている特定の条件に限定されず、むしろ、この分野における当業者へのガイドとして意図される。例えば、反応は、必要な変換を実施するため、任意の好適な溶媒又は他の試薬内で実施され得る。一般に、好適な溶媒は、プロトン性又は非プロトン性溶媒であり、反応が実行される温度(すなわち、凍結から沸騰温度までの範囲であり得る温度)で、反応物、中間体、又は生成物と、実質的に非反応性である。所与の反応は、1つの溶媒又は2つ以上の溶媒の混合物中で実施され得る。特定の反応に応じて、反応後の特定の作業に好適な溶媒を用いることができる。
本明細書に記載の反応、プロセス、及び合成方法は、以下の実験セクションに記載されている特定の条件に限定されず、むしろ、この分野における当業者へのガイドとして意図される。例えば、反応は、必要な変換を実施するため、任意の好適な溶媒又は他の試薬内で実施され得る。一般に、好適な溶媒は、プロトン性又は非プロトン性溶媒であり、反応が実行される温度(すなわち、凍結から沸騰温度までの範囲であり得る温度)で、反応物、中間体、又は生成物と、実質的に非反応性である。所与の反応は、1つの溶媒又は2つ以上の溶媒の混合物中で実施され得る。特定の反応に応じて、反応後の特定の作業に好適な溶媒を用いることができる。
特に指示がない限り、質量分析(mass spectroscopy、MS)、液体クロマトグラフィー質量分析(liquid chromatography-mass spectroscopy、LCMS)、NMR、HPLC、タンパク質化学、生化学、組換えDNA技術、及び薬理学の従来の方法が用いられる。化合物は、例えば、March’s Advanced Organic Chemistry,7th Edition,John Wiley and Sons,Inc(2013)に記載されているものなどの、標準的な有機化学技術を使用して調製される。本明細書に記載の合成変換の代替的な反応条件、例えば多様な溶媒、多様な反応温度、多様な反応時間、並びに異なる化学試薬及び異なる他の反応条件などが用いられ得る。必要に応じて、適切な保護基の使用が必要とされ得る。そのような基の組み込み及び切断は、Peter G.M.Wuts and Theodora W.Green,Protecting Groups in Organic Synthesis,4th Edition,Wiley-Interscience.(2006)に記載されている標準的な方法を使用して実行され得る。全ての出発材料及び試薬は市販されているか、又は容易に調製されるものである。
式(I)、式(II)、又は式(III)の構造を有する化合物は、当業者に既知の標準的な合成技術を使用して合成することができる。例えば、本開示の化合物は、スキーム1~21に記載の一般的な合成手順を使用して合成することができる。
4-ブロモ-1H-インドール出発材料の調製
4-ブロモ-5-フルオロ-2-ニトロ安息香酸をプロパ-1-エン-2-イルマグネシウムブロミドと反応させ、4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸を得て、これを、HATU及びDIEAの存在下、塩化アンモニウムで処理することによりアミド化して、4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(RI2、RII2、RIII2=H)を得る。
1,4-ジブロモ-2,3-ジフルオロベンゼンを硫酸中の硝酸カリウムで処理することによりニトロ化し、得られたニトロ基を還元して、2,5-ジブロモ-3,4-ジフルオロアニリンを形成する。ヨウ素化、続いてプロパ-1-インとの反応により、4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1H-インドールを得る。次いで、インドールを保護し(例えば、Boc)、n-ブチルリチウム及び二酸化炭素との反応により7位でカルボキシル化して、4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボン酸を得る。この酸を塩化アンモニウムで処理することによりアミド化し、インドールを脱保護して、4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(RI2、RII2、RIII2=F)を得る。
式(I)の構造を有する化合物の合成
3-R1-3-R2-1,2,3,6-テトラヒドロピリジンとのカップリング
4-ブロモ-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミドを、N保護(例えば、Boc)された5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1,2,3,6-テトラヒドロピリジンとカップリングさせる。テトラヒドロピリジンを3位でR1/R2で置換してもよい。
3-R1-3-R2-1,2,3,6-テトラヒドロピリジンとのカップリング
4-ブロモ-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミドを、N保護(例えば、Boc)された5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1,2,3,6-テトラヒドロピリジンとカップリングさせる。テトラヒドロピリジンを3位でR1/R2で置換してもよい。
4-ブロモ-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミドを、N保護(例えば、Boc)された5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1,2,3,6-テトラヒドロピリジンとカップリングさせる。テトラヒドロピリジンを3位でR1/R2で置換してもよい。
ピペリジンへの還元(任意選択)
N保護された5-フルオロ-6-RI2-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド
を、任意選択で、好適な還元剤(例えば、Pd/C、H2)で処理することにより還元して、N保護された5-フルオロ-6-RI2-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミドを得てもよく、ここで、ピペリジンを5位でR1/R2で置換してもよい。
N保護された5-フルオロ-6-RI2-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド、又はN保護された5-フルオロ-6-RI2-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド(ここで、テトラヒドロピリジン又はピペリジンをR1/R2で置換してもよい)を、スキーム5に示すように、すなわち、
N-クロロスクシンイミドと反応させてRI1をClとして得るか、又は
オキシ塩化リンと反応させて3-ホルミル化合物を得て、次いでこれをジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RI1をCHF2として得るか、又は
オキシ塩化リンと反応させて3-ホルミル化合物を得て、これを還元してヒドロキシメチルにし、次いでジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RI1をCH2Fとして得る。
N-クロロスクシンイミドと反応させてRI1をClとして得るか、又は
オキシ塩化リンと反応させて3-ホルミル化合物を得て、次いでこれをジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RI1をCHF2として得るか、又は
オキシ塩化リンと反応させて3-ホルミル化合物を得て、これを還元してヒドロキシメチルにし、次いでジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RI1をCH2Fとして得る。
3-RI1-4-(5-R1-5-R2-ピペリジン-3-イル)-5-フルオロ-6-R1-2-メチル-1H-インドール-7-カルボキサミド又は3-RI1-4-(5-R1-5-R2-1,2,5,6-テトラヒドロピリジン-3-イル)-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミドのピペリジン又はテトラヒドロピリジン窒素からの保護基の除去(例えば、HClでの処理によるBoc保護基の除去)により、遊離アミンを生じさせ、次いでこれをRB酸塩化物で処理して、式(I)の最終化合物、
3-RI1-4-(5-R1-5-R2-1-RBカルボニル-ピペリジン-3-イル)-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミド、又は
3-RI1-4-(5-R1-5-R2-1-RBカルボニル-1,2,5,6-テトラヒドロピリジン-3-イル)-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミドを得る。
3-RI1-4-(5-R1-5-R2-1-RBカルボニル-ピペリジン-3-イル)-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミド、又は
3-RI1-4-(5-R1-5-R2-1-RBカルボニル-1,2,5,6-テトラヒドロピリジン-3-イル)-5-フルオロ-6-RI2-2-メチル-1H-インドール-7-カルボキサミドを得る。
式(II)の構造を有する化合物の合成
II-INT-B中間体の調製
II-INT-B中間体の調製
XがCH2であり、R3がMeである中間体II-INT-Bを、塩化アセチルとの反応により2-(3-ブロモフェニル)エタン-1-アミンをアミドに変換することにより調製する。シュウ酸ジクロリド及び塩化鉄と反応させ、続いて酸処理することにより、5-ブロモ-1-メチル-3,4-ジヒドロイソキノリンを得る。好適な還元剤(例えば、水素化ホウ素ナトリウム)で還元することにより、5-ブロモ-1-メチル-1,2,3,4-テトラヒドロイソキノリンを得る。次いで、テトラヒドロイソキノリンを、好適な保護基(例えば、Boc)で保護してもよく、適切なRB酸塩化物との反応により所望の最終アミドに変換してもよい。
XがCH2CH2であり、R3がHである中間体II-INT-Bを、5-ブロモ-3,4-ジヒドロナフタレン-1(2H)-オンを6-ブロモ-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-1-オンに変換することにより調製する。好適な還元剤(例えば、BH3)で還元することにより、6-ブロモ-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピンを得る。次いで、アゼパンを、好適な保護基(例えば、Boc)で保護してもよく、適切なRB酸塩化物との反応により所望の最終アミドに変換してもよい。
R3がHであり、XがCRx1Rx2であり、Rx1及びRx2が、それらが結合しているC原子と一緒になって、シクロプロピル環を形成する中間体II-INT-Bを、3-ブロモ-2-ヒドロキシベンゾニトリルから出発して調製する。5-ブロモペンタンニトリルと反応させ、続いて強塩基(例えば、KOtBu)で処理することにより、9-ブロモ-1,2-ジヒドロフロ[2,3-c]イソキノリン-5-アミンを得る。酸(例えば、HCl)、塩基(例えば、炭酸カリウム)、次いで熱で処理し、続いて還元することにより、5’-ブロモ-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]を得る。次いで、イソキノリンを、好適な保護基(例えば、Boc)で保護してもよく、適切なRB酸塩化物との反応により所望の最終アミドに変換してもよい。
XがCRx1Rx2であり、Rx1がHであり、Rx2及びR3が一緒になってメチレン架橋を形成する中間体II-INT-Bを、2-(2-ブロモフェニル)酢酸エチルから出発して調製する。2-ブロモ酢酸エチルと反応させ、続いて塩基で処理し、次いで塩化アシル/塩化チオニルと反応させることにより、3-(2-ブロモフェニル)ジヒドロフラン-2,5-ジオンを得る。塩化アルミニウムで処理することにより、7-ブロモ-3-オキソ-2,3-ジヒドロ-1H-インデン-1-カルボン酸を形成する。酸基を保護し(例えば、メチルエステルなどのエステルとして)、次いでオキソ基を水酸化アンモニウムと反応させてヒドロキシイミンを形成し、次いでこれを還元してアミンにすることにより、アミンに変換してもよい。塩基で処理して架橋二環式化合物を形成し、これを好適な還元剤(例えば、BH3)で還元して、5-ブロモ-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリンを得る。次いで、メタノイソキノリンを、好適な保護基(例えば、Boc)で保護してもよく、適切なRB酸塩化物との反応により所望の最終アミドに変換してもよい。
II-INT-Bと4-ブロモ-5-フルオロ-2-メチル-3-RII1-1H-インドール-7-カルボキサミド(RII2=H)又は4-ブロモ-5,6-ジフルオロ-2-メチル-3-RII1-1H-インドール-7-カルボキサミド(RII2=F)とのカップリング
式(II)の化合物は、4-ブロモ-1H-インドールを対応するジオキサボロラニル誘導体に変換し、続いてII-INT-BとSuzukiカップリングすることにより調製してもよい(スキーム10、経路A参照)。
代替的に、式(II)の化合物は、(I-INT-B)を対応するジオキサボロラニル誘導体に変換し、続いて4-ブロモ-1H-インドールとSuzukiカップリングすることにより調製してもよい(スキーム10、経路B参照)。
RII1がHである式(II)の化合物を、RII1がHではない化合物に変換してもよい。N保護化合物をN-クロロスクシンイミド又はselectfluorで処理して、それぞれCl又はFを導入する。保護基を除去し、適切なRB酸塩化物で処理することにより、最終化合物を得る。これらの工程の順序は、スキーム11に示される順序から必要に応じて変更してもよい。
N保護された化合物をN-ヨードスクシンイミドで処理して、Iを導入する。保護基を除去し、適切なRB酸塩化物で処理することにより、最終化合物を得る。
N保護された化合物をPOCl3で処理して、アルデヒド基を導入する。このアルデヒドを、好適な還元剤(例えば、NaBH4)で処理することによりアルコールに還元してもよい。アルデヒドをDASTで処理することにより、CF2H基を得、アルコールを処理することにより、CH2F基を得る。保護基を除去し、続いてRB酸塩化物と反応させることにより、式(II)の最終化合物を得る。
式(III)の構造を有する化合物の合成
環状アミン出発材料
出発材料として使用してもよい環状アミンの非限定的な例を以下に示すが、これらは市販されているか、又は当業者には明らかな経路を介して調製される。必要に応じて、第2アミン基の差別的保護を行う。
環状アミン出発材料
出発材料として使用してもよい環状アミンの非限定的な例を以下に示すが、これらは市販されているか、又は当業者には明らかな経路を介して調製される。必要に応じて、第2アミン基の差別的保護を行う。
環状アミンと4-ブロモ-5-フルオロ-2-メチル-3-RII1-1H-インドール-7-カルボキサミド(RII2=H)又は4-ブロモ-5,6-ジフルオロ-2-メチル-3-RII1-1H-インドール-7-カルボキサミド(RII2=F)とのカップリング
一般的な手順として、式(III)の化合物をスキーム14に従って調製する。環状アミンをブロモインドールとカップリングさせる(例えば、Pd触媒を使用する)。次いで、アミン基を含む得られた化合物を、必要に応じて脱保護し、RB酸塩化物と反応させて、所望の最終化合物を得る。
RIII1がClであり、RIII2がHである式(III)の化合物をスキーム15に示すように調製する。カルボキサミド基を、まず、例えば塩化ホスホリルで処理してニトリル基に変換することにより、保護する。次いで、保護された化合物を環状アミンとカップリングさせ、カルボキサミド保護基を、例えばニトリル基の水和により除去する。次いで、N-クロロスクシンイミドで処理することによりRIII1クロロを導入する。最後に、第2のアミン基を脱保護し(例えば、Boc基の除去)、得られたアミンをRB酸塩化物と反応させて、所望の最終化合物を得る。
カルボキサミド保護されたブロモインドールを環状アミンとカップリングさせ(R6はHであり、R7はHである)、カルボキサミド保護基を除去する。N-クロロスクシンイミドで処理することによりRIII1クロロを導入する。最後に、第2のアミン基を脱保護し、RB酸塩化物と反応させて、所望の最終化合物を得る。
インドールブロミド(RIII1及びRIII2は両方ともHである)を、スキーム17に示すように、環状アミン(R5はHであり、R8はHであり、aは1であり、R5及びR7は一緒になって保護されたNを含む5員環を形成する)とカップリングさせ、続いて、必要に応じてカルボキサミドを脱保護する。N-クロロスクシンイミドで処理することによりRIII1クロロを導入する。最後に、第2のアミン基を脱保護し、RB酸塩化物と反応させて、所望の最終化合物を得る。
インドールブロミド(RIII1及びRIII2は両方ともHである)を、スキーム18に示すように、二環式アミン(R6はHであり、R8はHであり、aは0であり、R5及びR7は一緒になって保護されたNを含む5員環を形成する)とカップリングさせ、続いて、必要に応じてカルボキサミドを脱保護する。N-クロロスクシンイミドで処理することによりRIII1クロロを導入する。最後に、第2のアミン基を脱保護し、RB酸塩化物と反応させて、所望の最終化合物を得る。
インドールブロミド(RIII1はMeであり、RIII2はHである)を、スキーム19に示すように、二環式アミン(R6はHであり、R8はHであり、aは0であり、R5及びR7は一緒になって保護されたNを含む5員環を形成する)とカップリングさせ、続いて、必要に応じてカルボキサミドを脱保護する。N-クロロスクシンイミドで処理することによりRIII1クロロを導入する。最後に、第2のアミン基を脱保護し、RB酸塩化物と反応させて、所望の最終化合物を得る。
インドールブロミド(RIII1及びRIII2は両方ともHである)を、スキーム20に示すように、1-PG-オクタヒドロ-1H-ピロロ[3,4-b]ピリジン(PGは好適な保護基であり、Zは結合であり、YはCR4であり、R4はHであり、R6はHであり、R8はHであり、aは0であり、R5及びR7は一緒になって保護されたNを含む6員環を形成する)とカップリングさせ、続いて、必要に応じてカルボキサミドを脱保護する。N-クロロスクシンイミドで処理することによりRIII1クロロを導入する。最後に、第2のアミン基を脱保護し、RB酸塩化物と反応させて、所望の最終化合物を得る。
RIII1がHであり、スキーム21に示すとおりの式(III)の化合物を、
オキシ塩化リンと反応させて3-ホルミル化合物を得て、次いでこれをジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RIII1を-CHF2として得るか、又は
オキシ塩化リンと反応させて3-ホルミル化合物を得て、これを還元してヒドロキシメチルにし、次いでジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RIII1を-CH2Fとして得る。
オキシ塩化リンと反応させて3-ホルミル化合物を得て、次いでこれをジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RIII1を-CHF2として得るか、又は
オキシ塩化リンと反応させて3-ホルミル化合物を得て、これを還元してヒドロキシメチルにし、次いでジエチルアミノ硫黄トリフルオリド、(Et2NSF3;DAST)で処理して、RIII1を-CH2Fとして得る。
次いで、第2のアミン基を脱保護し、RB酸塩化物と反応させて、所望の最終化合物を得る。
以下の実施例は、例示目的のみのために提供され、本願で提供される特許請求の範囲を限定するものではない。本発明の好ましい実施形態が本明細書に示され説明されてきたが、そのような実施形態が例としてのみ提供されているということは、当業者には明らかであろう。当業者は、本発明から逸脱することなく、多数の変形、変更、及び置換を思いつくであろう。本明細書に記載の本発明の実施形態の様々な代替物が、本発明を実施する際に用いられ得るということを理解されたい。後述の請求項は、本発明の範囲を定義し、これらの請求項の範囲内の方法及び構造、並びにそれらの均等物をそれによってカバーすることが意図される。
式(I)の化合物の調製
実施例1
4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物1)の合成
4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物1)の合成
THF(200mL)中の4-ブロモ-5-フルオロ-2-ニトロ安息香酸(17g、64.4mmol)の撹拌溶液に、プロパ-1-エン-2-イルマグネシウムブロミド(451mL、225mmol、THF中0.5M)を窒素下-70℃で滴下した。添加後、反応混合物を-70℃で3時間撹拌した。反応混合物を飽和水性塩化アンモニウム(500mL)でクエンチし、酢酸エチル(2×500mL)で抽出した。合わせた抽出物をブライン(300mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、褐色固体の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸(17.5g)を得た。固体を精製せずに持ち越した。
ESI-MS[M-H]-(C10H7BrFNO2)に対する計算値269.96,271.96実測値:270.25,272.25.
工程2:4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
DMF(200mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸(17.5g、64.4mmol)、塩酸アンモニア(5.17g、96.6mmol)、及びHATU(29.4g、77.3mmol)の撹拌溶液に、N-エチル-N-イソプロピル-プロパン-2-アミン(25.0g、193mmol)を添加した。反応混合物を25℃で16時間撹拌し、水(300mL)でクエンチし、酢酸エチル(3×300mL)で抽出した。合わせた抽出物を、水(200mL)、ブライン(200mL)で洗浄し、次いで無水硫酸ナトリウムで乾燥させ、真空濃縮した。濃縮物をカラムクロマトグラフィー(石油エーテル中50%酢酸エチル)により精製して、黄色固体の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(3.8g、22%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.26(s,1H),8.11(s,1H),7.63-7.53(m,2H),6.19(s,1H),2.42(s,3H).
ESI-MS[M+H]+(C10H8BrFN2O)に対する計算値270.98,272.98;実測値:270.90,272.90.
工程3:5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル
1,4-ジオキサン(8mL)及び水(2mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(250mg、0.922mmol)、5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(314mg、1.01mmol)、Pd(dppf)Cl2(67mg、0.092mmol)、及び炭酸カリウム(382mg、2.77mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下90℃で2時間撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(20mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中50%酢酸エチル)により精製して、黄色固体の5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(330mg、96%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.46(d,J=11.7Hz,1H),6.17(s,1H),5.98(s,1H),4.12-4.06(m,2H),3.58-3.46(m,2H),2.38(s,3H),2.34-2.21(m,2H),1.40(s,9H).
ESI-MS[M+H]+(C20H24FN3O3)に対する計算値374.18,実測値:374.15.
工程4:tert-ブチル5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸
DMF(5mL)中の5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(150mg、0.40mmol)の溶液に、N-クロロスクシンイミド(54mg、0.40mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌し、水(20mL)でクエンチし、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、水中のアセトニトリル(10%から60%)で溶出させる逆相カラムクロマトグラフィーにより精製して、黄色固体の5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(100mg、61%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.55(d,J=10.8Hz,1H),5.78(s,1H),4.04-3.97(m,2H),3.63-3.43(m,2H),2.37(s,3H),2.33-2.18(m,2H),1.39(s,9H).
ESI-MS[M+H-tBu]+(C20H23ClFN3O3)に対する計算値352.14,352.14;実測値:352.10,352.10.
工程5:3-クロロ-5-フルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド
5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(100mg、0.245mmol)及びジオキサン(3mL)中4M塩化水素の混合物を20℃で2時間撹拌した。反応混合物を真空濃縮し、飽和水性重炭酸ナトリウム(30mL)で希釈し、酢酸エチル(3×20mL)で抽出した。合わせた抽出物を硫酸ナトリウムで乾燥させ、真空濃縮して、緑色固体の3-クロロ-5-フルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド(70mg)を得た。
ESI-MS[M+H]+(C15H15ClFN3O)に対する計算値308.09,310.09;実測値:308.05,310.05.
工程6:4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド:テトラヒドロフラン(4.0mL)及び水(1.0mL)中の3-クロロ-5-フルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド(70mg、0.23mmol)の混合物に、重炭酸ナトリウム(57mg、0.68mmol)及び塩化アクリロイル(20mg、0.23mmol)を0℃で添加した。反応混合物を0℃で2時間撹拌した。反応混合物を水(10mL)で希釈し、酢酸エチル(3×10mL)で抽出した。合わせた抽出物をブライン(10mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、水中のアセトニトリル(10%から35%)で溶出させる逆相カラムクロマトグラフィーにより精製して、緑色固体の4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(42.3mg、51%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.37(s,1H),8.12(s,1H),7.68-7.50(m,2H),6.93-6.69(m,1H),6.13(d,J=17.4Hz,1H),5.83-5.62(m,2H),4.35-4.05(m,2H),3.90-3.60(m,2H),2.41-2.27(m,5H).
ESI-MS[M+H]+(C18H17ClFN3O2)に対する計算値362.10,364.10;実測値:362.05,362.05.
実施例2
4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物2)の合成
4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物2)の合成
メタノール(20mL)中の5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(本明細書の実施例1に記載のとおりに調製;390mg、1.04mmol)及びPd/C(10%、500mg)の混合物を水素下(2atm)25℃で16時間撹拌した。反応混合物を濾過した。濾液を真空濃縮して、白色固体の3-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(340mg、87%)を得た。
ESI-MS[M-H]-(C20H26FN3O3)に対する計算値374.20,実測値:374.15.
工程2:3-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル
3-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル:DMF(10mL)中の3-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(340mg、0.91mmol)の溶液に、NCS(133mg、0.996mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(3×20mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から50%酢酸エチル)により精製して、白色固体の3-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(270mg、73%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.32(s,1H),8.10(s,1H),7.56-7.46(m,2H),4.14-3.96(m,3H),3.30-3.09(m,1H),2.91-2.62(m,1H),2.39(s,3H),1.94-1.87(m,2H),1.79-1.69(m,1H),1.47-1.38(m,1H),1.38(s,9H).
ESI-MS[M+H-tBu]+(C20H25ClFN3O3)に対する計算値354.16,356.16;実測値:354.15,356.15.
工程3:3-クロロ-5-フルオロ-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩
3-クロロ-5-フルオロ-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩:3-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(312mg、0.76mmol)及び塩化水素(ジオキサン中4M、6.0mL)の混合物を25℃で1時間撹拌した。反応混合物を真空濃縮して、白色固体の3-クロロ-5-フルオロ-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩(260mg)を得た。
ESI-MS[M-H]-(C15H17ClFN3O)に対する計算値308.10,310.10;実測値:308.00,310.00.
工程4:4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
水(2mL)及びTHF(8mL)中の4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド:3-クロロ-5-フルオロ-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩(260mg、0.76mmol)の混合物に、重炭酸ナトリウム(382mg、4.55mmol)及び塩化アクリロイル(65mg、0.76mmol)を0℃で添加した。反応混合物を0℃で0.5時間撹拌し、水(20mL)で希釈し、酢酸エチル(3×15mL)で抽出した。合わせた抽出物をブライン(20mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取HPLC(カラム:XSelect CSH Prep C18 OBD Column、5um、19×150mm;移動相A:水(10mmol/L NH4HCO3)、移動相B:アセトニトリル;流量:25mL/分;勾配:10% Bから35% B、7分;220nm;保持時間=6.4分)により精製して、白色固体の4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(165mg、60%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.40(s,1H),8.12(s,1H),7.62-7.48(m,2H),6.84-6.76(m,1H),6.16-6.07(m,1H),5.66-5.60(m,1H),4.57(d,J=12.6Hz,1H),4.23-3.94(m,2H),3.55-3.51(m,0.5H),3.12-3.08(m,1H),2.78-2.60(m,0.5H),2.40(s,3H),2.17-1.77(m,3H),1.60-1.38(m,1H).
ESI-MS[M+H]+(C18H19ClFN3O2)に対する計算値364.11,366.11;実測値:364.10,366.10.
工程5:キラル分離(化合物2a及び2b)
4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミドのエナンチオマーを、分取キラルHPLC(120mgの試料、カラム:CHIRALPAK IG、2×25cm、5um;移動相A:ヘキサン(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:17mL/分;勾配:14分で50% Bから50% B;220/254nm)により分離させて、化合物2a(RT=7.106分)及び2b(RT=11.312分)を得た。
化合物2a(保持時間=7.106分)48.6mgの白色固体を得た。
1H NMR(300MHz,DMSO-d6)δ 11.39(s,1H),8.11(s,1H),7.64-7.50(m,2H),6.84-6.80(m,1H),6.11-6.07(m,1H),5.66-5.61(m,1H),4.57(d,J=12.8Hz,1H),4.26-3.91(m,2H),3.57-3.54(m,0.5H),3.12-3.18(m,1H),2.68-2.64(m,0.5H),2.40(s,3H),1.95-1.83(m,3H),1.70-1.50(m,1H).
1H NMR(300MHz,DMSO-d6)δ 11.39(s,1H),8.11(s,1H),7.64-7.50(m,2H),6.84-6.80(m,1H),6.11-6.07(m,1H),5.66-5.61(m,1H),4.57(d,J=12.8Hz,1H),4.26-3.91(m,2H),3.57-3.54(m,0.5H),3.12-3.18(m,1H),2.68-2.64(m,0.5H),2.40(s,3H),1.95-1.83(m,3H),1.70-1.50(m,1H).
ESI-MS[M+H]+(C18H19ClFN3O2)に対する計算値364.11,366.11;実測値:364.05,366.05.
化合物2b(保持時間=11.312分)46.7mgの白色固体を得た。
1H NMR(300MHz,DMSO-d6)δ 11.40(s,1H),8.11(s,1H),7.63-7.46(m,2H),6.84-6.80(m,1H),6.11-5.95(m,1H),5.66-5.41(m,1H),4.57(d,J=12.7Hz,1H),4.23-3.95(m,2H),3.57-3.54(m,0.5H),3.12-3.01(m,1H),2.68-2.55(m,0.5H),2.40(s,3H),1.95-1.73(m,3H),1.70-1.50(m,1H).
1H NMR(300MHz,DMSO-d6)δ 11.40(s,1H),8.11(s,1H),7.63-7.46(m,2H),6.84-6.80(m,1H),6.11-5.95(m,1H),5.66-5.41(m,1H),4.57(d,J=12.7Hz,1H),4.23-3.95(m,2H),3.57-3.54(m,0.5H),3.12-3.01(m,1H),2.68-2.55(m,0.5H),2.40(s,3H),1.95-1.73(m,3H),1.70-1.50(m,1H).
ESI-MS[M+H]+(C18H19ClFN3O2)に対する計算値364.11,366.11;実測値:364.10,366.10.
実施例3
4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物3)の合成
4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物3)の合成
濃硫酸(200mL)中の1,4-ジブロモ-2,3-ジフルオロベンゼン(25.0g、91.95mmol)の溶液に、硝酸カリウム(11.0g、108.8mmol)を0℃で添加した。反応混合物を25℃で16時間撹拌した。反応混合物を氷水(1L)に注ぎ入れ、0℃で30分間撹拌した。得られた沈殿物を濾過し、濾過ケーキを水で洗浄し、減圧乾燥させて、黄色固体の1,4-ジブロモ-2,3-ジフルオロ-5-ニトロ-ベンゼン(27.0g、92%)を得た。
1H NMR(300MHz,DMSO-d6)δ 8.47(dd,J=6.0,2.4 Hz 1H).
工程2:2,5-ジブロモ-3,4-ジフルオロアニリン
酢酸(260mL)中の1,4-ジブロモ-2,3-ジフルオロ-5-ニトロベンゼン(27.0g、85.21mmol)の溶液に、鉄粉(47.6g、852.0mmol)を添加した。反応混合物を45℃で5時間撹拌した。冷却した反応混合物を濾過した。濾液を氷水(500mL)に注ぎ入れ、濾過した。濾過ケーキを水(300mL)で洗浄し、減圧乾燥させて、黄色固体の2,5-ジブロモ-3,4-ジフルオロアニリン(23.0g、収率94%)を得た。
1H NMR(300MHz,DMSO-d6)δ 6.88(dd,J=6.0,2.4 Hz 1H),5.74(brs,2H).
工程3:2,5-ジブロモ-3,4-ジフルオロ-6-ヨードアニリン
酢酸(250mL)中の2,5-ジブロモ-3,4-ジフルオロアニリン(23.0g、80.17mmol)の溶液に、N-ヨードスクシンイミド(19.84g、88.18mmol)を添加した。反応混合物を25℃で2時間撹拌した。反応混合物を氷水(500mL)に注ぎ入れ、濾過した。濾過ケーキを水(100mL)で洗浄し、減圧乾燥させた。粗生成物を、石油エーテル中の酢酸エチル(0から5%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、灰白色固体の2,5-ジブロモ-3,4-ジフルオロ-6-ヨードアニリン(30.0g、90%)を得た。
1H NMR(300MHz,DMSO-d6)δ 5.63(s,2H).
ESI-MS[M-H]-(C6H2Br2F2IN)に対する計算値409.76,411.75,413.75 実測値:409.75,411.75,413.70.
工程4:2,5-ジブロモ-3,4-ジフルオロ-6-(プロパ-1-イン-1-イル)アニリン
トリエチルアミン(365mL)中の2,5-ジブロモ-3,4-ジフルオロ-6-ヨードアニリン(30.0g、72.68mmol)、ヨウ化銅(II)(2.77g、14.54mmol)、及びPd(PPh3)2Cl2(5.12g、7.27mmol)の混合物に、プロパ-1-イン(THF中1M、364mL)を窒素下で添加した。反応混合物を密封フラスコ中50℃で4時間撹拌した。冷却した反応混合物を水(300ml)でクエンチし、酢酸エチル(300ml×3)で抽出した。合わせた有機層を無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から10%)で溶出させるシリカゲルへのカラムクロマトグラフィーにより精製して、黄色固体の2,5-ジブロモ-3,4-ジフルオロ-6-(プロパ-1-イン-1-イル)アニリン(20.0g、84%)を得た。
ESI-MS[M-H]-(C9H5Br2F2N)に対する計算値321.88,323.87,325.87 実測値:322.00,324.00,326.00.
1H NMR(300MHz,DMSO-d6)δ 5.79(s,2H),2.18(s,3H).
工程5:4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1H-インドール
アセトニトリル(400mL)中の2,5-ジブロモ-3,4-ジフルオロ-6-(プロパ-1-イン-1-イル)アニリン(20.0g、61.55mmol)及びPdCl2(1.09g、6.15mmol)の混合物を脱気し、窒素で3回詰め戻し、85℃で5時間撹拌した。冷却した反応混合物を真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から10%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1H-インドール(17.0g、85%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.75(s,1H),6.28(s,1H),2.41(s,3H).
ESI-MS[M-H]-(C9H5Br2F2N)に対する計算値321.88,323.87,325.87 実測値:321.80,323.80,325.80.
工程6:4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール
THF(200mL)中の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1H-インドール(10.0g、30.77mmol)中の撹拌溶液に、水素化ナトリウム(1.60g、40.01mmol、60%)を0℃で添加した。この温度で1時間撹拌した後、2-(トリメチルシリル)エトキシメチルクロリド(7.70g、46.16mmol)を0℃で添加した。反応混合物を25℃で16時間撹拌した。反応混合物を水(200mL)でクエンチし、酢酸エチル(150mL×3)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から10%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色油状の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール(12.3g、87%)を得た。
1H NMR(300MHz,DMSO-d6)δ 6.42(s,1H),5.78(s,2H),3.55(t,J=7.8Hz,2H),2.47(s,3H),0.83(t,J=8.1Hz,2H),-0.08(s,9H).
工程7:4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボン酸
THF(130mL)中の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール(12.3g、27.03mmol)の溶液に、n-ブチルリチウム(n-ヘキサン中2.5M、13mL、32.5mmol)を窒素下-70℃で添加した。この温度で0.5時間、0℃で0.5時間撹拌した後、反応混合物を-70℃に冷却し、二酸化炭素で30分間バブリングした。25℃で1.5時間撹拌した後、反応混合物を飽和水性塩化アンモニウム(100mL)でクエンチし、ジクロロメチル(100mL×3)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮して、黄色油状の4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボン酸(11.4g、粗)を得た。
ESI-MS[M-H]-(C16H20BrF2NO3Si)に対する計算値 418.04,420.03実測値:417.95,419.95.
工程8:4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボキサミド
DMF(100mL)中の4-ブロモ-5,6-ジフルオロ-2-メチル-1-(2-トリメチルシリルエトキシメチル)インドール-7-カルボン酸(11.4g、27.12mmol)及び塩化アンモニウム(2.18g、40.68mmol)の撹拌混合物に、HATU(12.38g、32.55mmol)及びDIPEA(17.53g、135.61mmol)を0℃で添加した。25℃で16時間撹拌した後、反応混合物を水(300ml)でクエンチし、酢酸エチル(300ml×3)で抽出した。合わせた有機層をブライン(200ml×3)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から50%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメヒルシリル)エトキシ)メチル)-1H-インドール-7-カルボキサミド(6.3g、55%)を得た。
1H NMR(300MHz,DMSO-d6)δ 8.34(s,1H),8.10(s,1H),6.40(s,1H),5.50(s,2H),3.42(t,J=8.1Hz,2H),2.46(s,3H),0.81(t,J=8.1Hz,2H),-0.06(s,9H).
ESI-MS[M+H]+(C16H21BrF2N2O2Si)に対する計算値419.05,421.05実測値:419.20,421.20.
工程9:4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド
混合物をTHF(60mL)中の4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボキサミド(6.3g、15.02mmol)、TBAF(THF中1M、150mL、150.2mmol)、及びエタン-1,2-ジアミン(30mL、450.6mmol)の混合物を75℃で40時間撹拌した。反応混合物を0℃に冷却し、2M塩酸でpH=4まで酸性化した。沈殿物を濾過により収集し、水(100mL)で洗浄し、減圧乾燥させて、黄色固体の4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(3.5g、80%)を得た。
ESI-MS[M+H]+(C10H7BrF2N2O)に対する計算値288.97,290.97 実測値:288.95,290.95.
1H NMR(300MHz,DMSO-d6)δ 11.38(s,1H),7.97(s,1H),7.90(s,1H),6.20(s,1H),2.40(s,3H).
工程10:5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル
ジオキサン(12mL)及び水(3mL)中の4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(600mg、2.1mmol)、5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-3,6-ジヒドロ-2H-ピリジン-1-カルボン酸tert-ブチル(706mg、2.3mmol)、Pd(dppf)Cl2.DCM(169mg、0.21mmol)、及び炭酸カリウム(860mg、6.23mmol)の混合物を脱気し、窒素で5回詰め戻し、90℃で2時間撹拌した。冷却した反応混合物を水(60mL)で希釈し、ジクロロメタン(3×50mL)で抽出した。合わせた有機層をブライン(60mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、ジクロロメタン中の酢酸エチル(0から7%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(700mg、86%)を得た。
ESI-MS[M-H]-(C20H23F2N3O3)に対する計算値390.17 実測値:390.05.
1H NMR(400MHz,DMSO-d6)δ 11.07(s,1H),7.86(s,1H),7.77(s,1H),6.18(s,1H),6.08-5.98(m,1H),4.17-4.07(m,2H),3.55(t,J=5.8Hz,2H),2.37(s,3H),2.35-2.27(m,2H),1.42(s,9H).
工程11:3-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル
メタノール(60mL)及びテトラヒドロフラン(30mL)中の5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(450mg、1.15mmol)の撹拌溶液に、Pd/C(300mg、10%)を添加した。反応混合物を水素(2atm)下25℃で48時間撹拌した。反応混合物を濾過し、濾液を真空濃縮した。残留物を、ジクロロメタン中の酢酸エチル(0から7%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の3-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(400mg、88%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.02(s,1H),7.82(s,1H),7.71(s,1H),6.38(s,1H),4.04-3.82(m,2H),3.31-3.04(m,2H),3.01-2.63(m,1H),2.38(s,3H),2.14-1.99(m,1H),1.90-1.68(m,2H),1.59-1.44(m,1H),1.40(s,9H).
ESI-MS[M+H-tBu]+(C20H25F2N3O3)に対する計算値338.19実測値:338.10.
工程12:3-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル
DMF(10mL)中の3-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(400mg、1.02mmol)の撹拌溶液に、NCS(136mg、1.02mmol)を0℃で添加した。反応混合物を25℃で3時間撹拌した。反応混合物を水(50mL)でクエンチし、酢酸エチル(3×40mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、ジクロロメタン中のメタノール(0から8%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の3-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(350mg、80%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.45(s,1H),7.92(s,1H),7.85(s,1H),4.13-4.04(m,2H),3.27-3.06(m,2H),2.90-2.65(m,1H),2.36(s,3H),1.98-1.88(m,2H),1.80-1.71(m,1H),1.57-1.42(m,1H),1.39(s,9H).
ESI-MS[M+H-tBu]+(C20H24ClF2N3O3)に対する計算値372.15,374.14実測値:372.10,374.10.
工程13:3-クロロ-5,6-ジフルオロ-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩
メタノール(1mL)中の3-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(350mg、0.82mmol)の撹拌溶液に、塩化水素(ジオキサン中4M、5mL)を添加した。反応混合物を25℃で1時間撹拌した。混合物を真空濃縮して、黄色固体の3-クロロ-5,6-ジフルオロ-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩(280mg、94%)を得た。
ESI-MS[M+H]+(C15H16ClF2N3O)に対する計算値328.09,330.09実測値:328.15,330.15.
工程14:4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド
THF(4mL)中の3-クロロ-5,6-ジフルオロ-2-メチル-4-(3-ピペリジル)-1H-インドール-7-カルボキサミド(280mg、0.76mmol)の撹拌溶液に、DIEA(294mg、2.28mmol)及び塩化アクリロイル((98mg、0.76mmol)を-70℃で添加した。反応混合物を1時間-70℃で撹拌した。反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、分取HPLCにより、次の条件:カラム:XBridge Prep OBD C18 Column、30×150mm 5um;移動相A:水(10MMOL/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で30% Bから52% B;220nm;Rt:6.32分で精製して、灰白色固体の4-(1-アクリロイルピペリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(123.7mg、42%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.46(s,1H),7.95(s,1H),7.88(s,1H),6.96-6.70(m,1H),6.20-6.03(m,1H),5.81-5.57(m,1H),4.74-4.45(m,1H),4.28-3.94(m,2H),3.60-3.45(m,0.5H),3.19-3.00(m,1H),2.77-2.63(m,0.5H),2.35(s,3H),2.13-1.91(m,2H),1.89-1.77(m,1H),1.64-1.40(m,1H).
ESI-MS[M+H]+(C18H18ClF2N3O2)に対する計算値382.11,384.11実測値:382.25,384.25.
実施例4
4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物4)の合成
4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物4)の合成
5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(150mg、0.38mmol)の撹拌溶液に、NCS(52mg、0.38mmol)を0℃で添加した。反応混合物を25℃で4時間撹拌した。反応混合物を水(20mL)でクエンチし、酢酸エチル(3×20mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、ジクロロメタン中のメタノール(0から10%)で溶出させる酸化アルミニウムでのカラムクロマトグラフィーにより精製して、黄色固体の5-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(140mg、85%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.46(s,1H),7.95(s,1H),7.89(s,1H),5.85(s,1H),4.16-3.91(m,2H),3.60-3.46(m,2H),2.35(s,3H),2.31-2.24(m,2H),1.40(s,9H).
ESI-MS[M+H]+(C20H22ClF2N3O3)に対する計算値426.13,426.13実測値:426.15,428.15.
工程2:3-クロロ-5,6-ジフルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩
メタノール(1mL)中の5-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(140mg、0.33mmol)の撹拌溶液に、塩化水素(ジオキサン中4M、2mL)を添加した。反応混合物を25℃で1時間撹拌した。混合物を真空濃縮して、黄色固体の3-クロロ-5,6-ジフルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩(125mg、粗)を得た。
ESI-MS[M+H]+(C15H14ClF2N3O)に対する計算値326.08,328.08,実測値:326.10,328.10.
工程3:4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド
THF(4mL)中の3-クロロ-5,6-ジフルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩(125mg、0.34mmol)の撹拌溶液に、DIEA(140mg、1.08mmol)及び塩化アクリロイル(33mg、0.36mmol)を-78℃で添加した。反応混合物を1時間-78℃で撹拌した。反応混合物を水(20mL)でクエンチし、酢酸エチル(3×20mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、分取HPLCにより、次の条件:カラム:Xselect CSH OBD Column 30×150mm 5um;移動相A:水(10MMOL/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で33% Bから53% B;220nm;Rt:5.53分で精製して、灰白色固体の4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(66.3mg、48%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.47(s,1H),7.99(s,1H),7.93(s,1H),6.95-6.68(m,1H),6.19-6.08(m,1H),5.95-5.84(m,1H),5.75-5.61(m,1H),4.40-4.09(m,2H),3.93-3.57(m,2H),2.44-2.16(m,5H).
ESI-MS[M+H]+(C18H16ClF2N3O2)に対する計算値380.09,382.09実測値:380.05,382.05.
実施例5
4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-シアノ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物5)の合成
4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-シアノ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物5)の合成
DMF(15mL)中の5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(600mg、1.53mmol)の撹拌溶液に、N-ブロモスクシンイミド(273mg、1.53mmol)を0℃で添加した。0℃で2時間撹拌した後、反応混合物を水(60mL)でクエンチし、酢酸エチル(3×50mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から33%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の5-(3-ブロモ-7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(530mg、73%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.57(s,1H),7.94(s,1H),7.89(s,1H),5.90-5.82(m,1H),4.15-3.86(m,2H),3.72-3.44(m,2H),2.36(s,3H),2.32-2.24(m,2H),1.41(s,9H).
ESI-MS[M+H-Boc]+(C20H22BrF2N3O3)に対する計算値370.08,372.08実測値:370.10,372.10.
工程2:5-(7-カルバモイル-3-シアノ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル
DMF(15mL)中の5-(3-ブロモ-7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(530mg、1.13mmol)、Pd(PPh3)4(130mg、0.112mmol)、及びZn(CN)2(132mg、1.13mmol)の混合物を脱気し、窒素で5回詰め戻した。反応混合物を120℃で2時間加熱した。冷却した反応混合物を水(60mL)でクエンチし、酢酸エチル(3×50mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から43%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の5-(7-カルバモイル-3-シアノ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(220mg、46%)を得た。
ESI-MS[M+H-Boc]+(C21H22F2N4O3)に対する計算値317.17 実測値:317.15.
工程3:3-シアノ-5,6-ジフルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩
MeOH(2mL)中の5-(7-カルバモイル-3-シアノ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,6-ジヒドロピリジン-1(2H)-カルボン酸tert-ブチル(220mg、0.528mmol)の撹拌溶液に、ジオキサン(5.00mL)中4M塩化水素を添加した。反応混合物を25℃で1時間撹拌した。得られた混合物を真空濃縮して、褐色固体の3-シアノ-5,6-ジフルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩(182mg、粗)を得た。
ESI-MS[M+H]+(C16H14F2N4O)に対する計算値317.11 実測値:317.15.
工程4:4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-シアノ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド
THF(6mL)中の3-シアノ-5,6-ジフルオロ-2-メチル-4-(1,2,5,6-テトラヒドロピリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩(160mg、0.453mmol)の溶液に、DIEA(293mg、2.27mmol)及び塩化アクリロイル(41mg、0.453mmol)を-70℃で添加した。反応混合物を-70℃で1時間撹拌した。反応混合物を水(40mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、分取HPLCにより、次の条件:カラム:XBridge Prep OBD C18 Column、30×150mm 5um;移動相A:水(50mmol/L NH4HCO3)、移動相B:アセトニトリル;流量:60mL/分;勾配:12分で5% Bから95% B;254nm;RT:4.33分で精製して、白色固体の4-(1-アクリロイル-1,2,5,6-テトラヒドロピリジン-3-イル)-3-シアノ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(88mg、52%)を得た。
1H NMR(400MHz,DMSO-d6)δ 12.19(s,1H),8.16-7.94(m,2H),6.98-6.70(m,1H),6.17-6.01(m,2H),5.80-5.63(m,1H),4.41-4.20(m,2H),3.88-3.67(m,2H),2.54(s,3H),2.44-2.28(m,2H).
ESI-MS[M+H]+(C19H16F2N4O2)に対する計算値371.12 実測値:371.05.
実施例6
(S)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド
及び
(R)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド
(化合物6a及び6b)の合成
(S)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド
及び
(R)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド
(化合物6a及び6b)の合成
アセトニトリル(8mL)及びDMSO(2mL)中の3-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)イペリジン-1-カルボン酸tert-ブチル(500mg、1.27mmol)の撹拌溶液に、selectfluor II(407mg、1.27mmol)を分割して15℃で添加した。反応混合物を15℃で1時間撹拌した。反応混合物を水(30mL)でクエンチし、ジクロロメタン(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から53%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の3-(7-カルバモイル-3,5,6-トリフルオロ-2-メチル-1H-インドール-4-イル)イペリジン-1-カルボン酸tert-ブチル(300mg、粗)を得た。
ESI-MS[M+H-tBu]+(C20H24F3N3O3)に対する計算値356.18 実測値:356.10.
工程2:3,5,6-トリフルオロ-2-メチル-4-(ピペリジン-3-イル)-1H-インドール-7-カルボキサミド塩酸塩
メタノール(1mL)中の3-(7-カルバモイル-3,5,6-トリフルオロ-2-メチル-1H-インドール-4-イル)ピペリジン-1-カルボン酸tert-ブチル(300mg、粗)の撹拌溶液に、塩化水素(ジオキサン中4M、4mL)を添加した。反応混合物を25℃で1時間撹拌した。反応混合物を真空濃縮して、黄色固体の3,5,6-トリフルオロ-2-メチル-4-(3-ピペリジル)-1H-インドール-7-カルボキサミド(220mg、粗)を得た。
ESI-MS[M+H]+(C15H16F3N3O)に対する計算値312.12 実測値:312.10.
工程3:4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド
THF(6mL)中の3,5,6-トリフルオロ-2-メチル-4-(3-ピペリジル)-1H-インドール-7-カルボキサミド(200mg、粗)撹拌溶液に、DIEA(223mg、1.73mmol)及び塩化アクリロイル(52mg、0.58mmol)を-70℃で添加した。反応混合物を-70℃で1時間撹拌した。反応混合物を水(20mL)でクエンチし、酢酸エチル(3×20mL)で抽出した。合わせた有機層をブライン(20mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、分取HPLCにより、次の条件:カラム:Xselect CSH OBD Column 30×150mm 5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で32% Bから53% B;220nm;RT:5.43分で精製して、灰白色固体の4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド(107mg、3工程で23%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.96(s,1H),7.92(s,1H),7.84(s,1H),6.96-6.71(m,1H),6.19-6.03(m,1H),5.78-5.52(m,1H),4.54(t,J=12.4Hz,1H),4.15(d,J=13.2Hz,1H),3.49(t,J=12.4Hz,0.5H),3.31-3.22(m,1H),3.16-2.97(m,1H),2.64(t,J=13.4Hz,0.5H),2.31(s,3H),2.12-1.97(m,1H),1.96-1.87(m,1H),1.86-1.76(m,1H),1.56-1.36(m,1H).
ESI-MS[M+H]+(C18H18F3N3O2)に対する計算値366.14 実測値:366.15.
工程4:(S)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド及び(R)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド
4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド(90mg)を、分取キラルHPLCにより、次の条件:カラム:CHIRALPAK IG、2×25cm、5μm;移動相A:ヘキサン(0.5% 2M NH3-MeOH)--HPLC、移動相B:EtOH--HPLC;流量:20mL/分;勾配:26分で50% Bから50% B;220/254nmで精製した。
保持時間:12.231分
1H NMR(300MHz,DMSO-d6)δ 10.96(s,1H),7.92(s,1H),7.84(s,1H),7.00-6.72(m,1H),6.22-6.05(m,1H),5.79-5.58(m,1H),4.67-4.47(m,1H),4.17(d,J=13.2Hz,1H),3.50(t,J=12.6Hz,0.5H),3.31-3.22(m,1H),3.18-2.98(m,1H),2.66(t,J=12.6Hz,0.5H),2.33(s,3H),2.17-1.79(m,3H),1.62-1.41(m,1H).
1H NMR(300MHz,DMSO-d6)δ 10.96(s,1H),7.92(s,1H),7.84(s,1H),7.00-6.72(m,1H),6.22-6.05(m,1H),5.79-5.58(m,1H),4.67-4.47(m,1H),4.17(d,J=13.2Hz,1H),3.50(t,J=12.6Hz,0.5H),3.31-3.22(m,1H),3.18-2.98(m,1H),2.66(t,J=12.6Hz,0.5H),2.33(s,3H),2.17-1.79(m,3H),1.62-1.41(m,1H).
ESI-MS[M+H]+(C18H18F3N3O2)に対する計算値366.14 実測値:366.15.
保持時間:20.421;分
1H NMR(300MHz,DMSO-d6)δ 10.96(s,1H),7.92(s,1H),7.84(s,1H),6.97-6.63(m,1H),6.24-6.01(m,1H),5.80-5.55(m,1H),4.66-4.45(m,1H),4.17(d,J=13.2Hz,1H),3.51(t,J=12.6Hz,0.5H),3.30-3.21(m,1H),3.19-2.97(m,1H),2.66(t,J=12.6Hz,0.5H),2.33(s,3H),2.16-1.77(m,3H),1.65-1.41(m,1H).
保持時間:20.421;分
1H NMR(300MHz,DMSO-d6)δ 10.96(s,1H),7.92(s,1H),7.84(s,1H),6.97-6.63(m,1H),6.24-6.01(m,1H),5.80-5.55(m,1H),4.66-4.45(m,1H),4.17(d,J=13.2Hz,1H),3.51(t,J=12.6Hz,0.5H),3.30-3.21(m,1H),3.19-2.97(m,1H),2.66(t,J=12.6Hz,0.5H),2.33(s,3H),2.16-1.77(m,3H),1.65-1.41(m,1H).
ESI-MS[M+H]+(C18H18F3N3O2)に対する計算値366.14 実測値:366.15.
白色固体の(S)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド(32.6mg 36%);白色固体の(R)-4-(1-アクリロイルピペリジン-3-イル)-3,5,6-トリフルオロ-2-メチル-1H-インドール-7-カルボキサミド(32.2mg、36%)
実施例7~19
化合物7~19の合成
以下の表5に示す化合物7~19を、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した。
化合物7~19の合成
以下の表5に示す化合物7~19を、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した。
式(II)の化合物の調製
実施例20
4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物20a)の合成
4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物20a)の合成
テトラヒドロフラン(16mL)及び水(4.0mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(2.0g、7.38mmol)、tert-ブチル-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸(2.70g、7.38mmol)、リン酸カリウム(4.70g、22.1mmol)、及びPd(dppf)Cl2(540mg、0.738mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下30℃で16時間撹拌し、次いで水(50mL)で希釈し、酢酸エチル(3×50mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中45%酢酸エチル)により精製して、黄色固体の5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(2.50g、80%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.03(s,1H),8.10(s,1H),7.60-7.47(m,2H),7.32-7.23(m,2H),7.16-7.13(m,1H),5.71(s,1H),4.64-4.49(m,2H),3.55-3.43(m,2H),2.39-2.30(m,5H),1.05(s,9H).
ESI-MS[M+H]+(C24H26FN3O3)に対する計算値424.20,実測値:424.15.
工程2:5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル
N,N-ジメチルホルムアミド(30.0mL)中の5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロ-イソキノリン-2(1H)-カルボン酸tert-ブチル(3.0g、7.08mmol)の溶液に、N-クロロスクシンイミド(1.00g、7.79mmol)を0℃で添加した。反応混合物を0℃で2時間撹拌した。反応混合物を水(80mL)でクエンチし、酢酸エチル(3×60mL)で抽出した。合わせた抽出物をブライン(60mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中45%酢酸エチル)により精製して、黄色固体の5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(2.30g、71%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.42(s,1H),8.16(s,1H),7.70-7.56(m,2H),7.28-7.20(m,2H),7.09-7.06(m,1H),4.56(s,2H),3.49-3.34(m,2H),2.40-2.22(m,5H),1.38(s,9H).
ESI-MS[M+H-Boc]+(C24H25ClFN3O3)に対する計算値358.16,360.16;実測値:358.05,360.05
工程3:3-クロロ-5-フルオロ-2-メチル-4-(1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド
5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(2.30g、5.02mmol)及びジオキサン(20mL)中4.0M塩化水素の混合物を20℃で2時間撹拌した。反応混合物を真空濃縮した。残留物を飽和水性重炭酸ナトリウム(150mL)で希釈し、酢酸エチル(3×100mL)で抽出した。合わせた抽出物を硫酸ナトリウムで乾燥させ、真空濃縮して、褐色固体の3-クロロ-5-フルオロ-2-メチル-4-(1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド(1.70g)を得た。
ESI-MS[M+H]+(C19H17ClFN3O)に対する計算値358.16,360.16;実測値:358.10,360.10.
工程4:4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物20a)
テトラヒドロフラン(16mL)及び水(4.0mL)中の3-クロロ-5-フルオロ-2-メチル-4-(1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド(1.70g、4.75mmol)の混合物に、重炭酸ナトリウム(1.20g、14.3mmol)及び塩化アクリロイル(430mg、4.75mmol)を0℃で添加した。反応混合物を0℃で2時間撹拌した。反応混合物を水(50mL)で希釈し、酢酸エチル(3×50mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中75%酢酸エチル)により精製して、白色固体の4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(1.20g、51%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.45(s,1H),8.19(s,1H),7.73-7.56(m,2H),7.38-7.22(m,2H),7.17-7.08(m,1H),6.98-6.75(m,1H),6.17-6.11(m,1H),5.78-5.62(m,1H),4.87(s,0.8H),4.76(s,1.2H),3.77-3.56(m,2H),2.43-2.35(m,5H).
ESI-MS[M+H]+(C22H19ClFN3O2)に対する計算値412.11,414.11;実測値:412.05,414.05.
工程5:
異性体(R)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物20b)及び
(S)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物20c)の分離:
異性体(R)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物20b)及び
(S)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物20c)の分離:
2つのアトロプ異性体を分取キラルHPLCにより分離させた(試料量=1.2g、カラム:CHIRALPAK IC(2×25cm、5um);移動相A:ヘキサン(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:20mL/分;勾配:30% B、アイソクラティック、16分;220/254nm)。
化合物20b:保持時間=9.807分(530mg)
1H NMR(400MHz,DMSO-d6)δ 11.45(s,1H),8.19(s,1H),7.67-7.63(m,2H),7.32-7.25(m,2H),7.13-7.11(m,1H),6.98-6.75(m,1H),6.17-6.11(m,1H),5.75-5.65(m,1H),4.87(s,0.8H),4.76(s,1.2H),3.78-3.59(m,2H),2.41-2.35(m,5H).
1H NMR(400MHz,DMSO-d6)δ 11.45(s,1H),8.19(s,1H),7.67-7.63(m,2H),7.32-7.25(m,2H),7.13-7.11(m,1H),6.98-6.75(m,1H),6.17-6.11(m,1H),5.75-5.65(m,1H),4.87(s,0.8H),4.76(s,1.2H),3.78-3.59(m,2H),2.41-2.35(m,5H).
ESI-MS[M+H]+(C22H19ClFN3O2)に対する計算値412.11,414.11;実測値:412.10,414.10.
化合物20c:保持時間=12.634分(515mg)
1H NMR(400MHz,DMSO-d6)δ 11.45(s,1H),8.19(s,1H),7.68-7.64(m,2H),7.30-7.25(m,2H),7.13-7.11(m,1H),6.94-6.75(m,1H),6.17-6.11(m,1H),5.75-5.65(m,1H),4.87(s,0.8H),4.76(s,1.2H),3.76-3.59(m,2H),2.41-2.35(m,5H).
1H NMR(400MHz,DMSO-d6)δ 11.45(s,1H),8.19(s,1H),7.68-7.64(m,2H),7.30-7.25(m,2H),7.13-7.11(m,1H),6.94-6.75(m,1H),6.17-6.11(m,1H),5.75-5.65(m,1H),4.87(s,0.8H),4.76(s,1.2H),3.76-3.59(m,2H),2.41-2.35(m,5H).
ESI-MS[M+H]+(C22H19ClFN3O2)に対する計算値412.11,414.11;実測値:412.10,414.10.
化合物20d~20i
以下の列挙する化合物20d~20iを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した(NA=該当なし)。
以下の列挙する化合物20d~20iを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した(NA=該当なし)。
化合物20j:5-フルオロ-2,3-ジメチル-4-(2-プロピオロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド
1H NMR(400MHz,DMSO-d6)δ 10.84(s,1H),8.08(s,1H),7.60-7.45(m,2H),7.38-7.28(m,2H),7.17-7.10(m,1H),4.97(s,1H),4.81-4.70(m,1H),4.68-4.50(m,1H),4.00-3.51(m,2H),2.47-2.32(m,2H),2.29(s,3H),1.46-1.35(m,3H).
ESI-MS[M+H]+m/z=390.15
×がCH2であり、R3がHであり、RII2がFである式(II)の化合物の調製
実施例21
4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物21a)の調製
4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物21a)の調製
濃硫酸(200mL)中の1,4-ジブロモ-2,3-ジフルオロベンゼン(25.0g、91.95mmol)の溶液に、硝酸カリウム(11.0g、108.8mmol)を0℃で添加した。反応混合物を25℃で16時間撹拌した。反応混合物を氷水(1L)に注ぎ入れ、0℃で30分間撹拌した。得られた沈殿物を濾過し、濾過ケーキを水で洗浄し、減圧乾燥させて、黄色固体の1,4-ジブロモ-2,3-ジフルオロ-5-ニトロ-ベンゼン(27.0g、92%)を得た。
1H NMR(300MHz,DMSO-d6)δ 8.47(dd,J=6.0,2.4Hz 1H).
工程2:2,5-ジブロモ-3,4-ジフルオロアニリン
酢酸(260mL)中の1,4-ジブロモ-2,3-ジフルオロ-5-ニトロベンゼン(27.0g、85.21mmol)の溶液に、鉄粉(47.6g、852.0mmol)を添加した。反応混合物を45℃で5時間撹拌した。冷却した反応混合物を濾過した。濾液を氷水(500mL)に注ぎ入れ、濾過した。濾過ケーキを水(300mL)で洗浄し、減圧乾燥させて、黄色固体の2,5-ジブロモ-3,4-ジフルオロアニリン(23.0g、収率94%)を得た。
1H NMR(300MHz,DMSO-d6)δ 6.88(dd,J=6.0,2.4Hz 1H),5.74(brs,2H).
工程3:2,5-ジブロモ-3,4-ジフルオロ-6-ヨードアニリン
酢酸(250mL)中の2,5-ジブロモ-3,4-ジフルオロアニリン(23.0g、80.17mmol)の溶液に、N-ヨードスクシンイミド(19.84g、88.18mmol)を添加した。反応混合物を25℃で2時間撹拌した。反応混合物を氷水(500mL)に注ぎ入れ、濾過した。濾過ケーキを水(100mL)で洗浄し、減圧乾燥させた。粗生成物を、石油エーテル中の酢酸エチル(0から5%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、灰白色固体の2,5-ジブロモ-3,4-ジフルオロ-6-ヨードアニリン(30.0g、90%)を得た。
1H NMR(300MHz,DMSO-d6)δ 5.63(s,2H).
ESI-MS[M-H]-(C6H2Br2F2IN)に対する計算値409.76,411.75,413.75 実測値:409.75,411.75,413.70.
工程4:2,5-ジブロモ-3,4-ジフルオロ-6-(プロパ-1-イン-1-イル)アニリン
トリエチルアミン(365mL)中の2,5-ジブロモ-3,4-ジフルオロ-6-ヨードアニリン(30.0g、72.68mmol)、ヨウ化銅(I)(2.77g、14.54mmol)、及びPd(PPh3)2Cl2(5.12g、7.27mmol)の混合物に、プロパ-1-イン(THF中1M、364mL)を窒素下で添加した。反応混合物を密封フラスコ中50℃で4時間撹拌した。冷却した反応混合物を水(300ml)でクエンチし、酢酸エチル(300ml×3)で抽出した。合わせた有機層を無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から10%)で溶出させるシリカゲルへのカラムクロマトグラフィーにより精製して、黄色固体の2,5-ジブロモ-3,4-ジフルオロ-6-(プロパ-1-イン-1-イル)アニリン(20.0g、84%)を得た。
1H NMR(300MHz,DMSO-d6)δ 5.79(s,2H),2.18(s,3H).
ESI-MS[M-H]-(C9H5Br2F2N)に対する計算値321.88,323.87,325.87実測値:322.00,324.00,326.00.
工程5:4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1H-インドール
アセトニトリル(400mL)中の2,5-ジブロモ-3,4-ジフルオロ-6-(プロパ-1-イン-1-イル)アニリン(20.0g、61.55mmol)及びPdCl2(1.09g、6.15mmol)の混合物を脱気し、窒素で3回詰め戻し、85℃で5時間撹拌した。冷却した反応混合物を真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から10%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1H-インドール(17.0g、85%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.75(s,1H),6.28(s,1H),2.41(s,3H).
ESI-MS[M-H]-(C9H5Br2F2N)に対する計算値321.88,323.87,325.87実測値:321.80,323.80,325.80.
工程6:4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール
THF(200mL)中の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1H-インドール(10.0g、30.77mmol)中の撹拌溶液に、水素化ナトリウム(1.60g、40.01mmol、60%)を0℃で添加した。この温度で1時間撹拌した後、2-(トリメチルシリル)エトキシメチルクロリド(7.70g、46.16mmol)を0℃で添加した。反応混合物を25℃で16時間撹拌した。反応混合物を水(200mL)でクエンチし、酢酸エチル(150mL×3)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から10%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色油状の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール(12.3g、87%)を得た。
1H NMR(300MHz,DMSO-d6)δ 6.42(s,1H),5.78(s,2H),3.55(t,J=7.8Hz,2H),2.47(s,3H),0.83(t,J=8.1Hz,2H),-0.08(s,9H).
工程7:4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボン酸
THF(130mL)中の4,7-ジブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール(12.3g、27.03mmol)の溶液に、n-ブチルリチウム(n-ヘキサン中2.5M、13mL、32.5mmol)を窒素下-70℃で添加した。この温度で0.5時間、0℃で0.5時間撹拌した後、反応混合物を-70℃に冷却し、二酸化炭素で30分間バブリングした。25℃で1.5時間撹拌した後、反応混合物を飽和水性塩化アンモニウム(100mL)でクエンチし、ジクロロメチル(100mL×3)で抽出した。合わせた有機層をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮して、黄色油状の4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボン酸(11.4g、粗)を得た。
ESI-MS[M-H]-(C16H20BrF2NO3Si)に対する計算値418.04,420.03実測値:417.95,419.95.
工程8:4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボキサミド
DMF(100mL)中の4-ブロモ-5,6-ジフルオロ-2-メチル-1-(2-トリメチルシリルエトキシメチル)インドール-7-カルボン酸(11.4g、27.12mmol)及び塩化アンモニウム(2.18g、40.68mmol)の撹拌混合物に、HATU(12.38g、32.55mmol)及びDIPEA(17.53g、135.61mmol)を0℃で添加した。25℃で16時間撹拌した後、反応混合物を水(300ml)でクエンチし、酢酸エチル(300ml×3)で抽出した。合わせた有機層をブライン(200ml×3)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から50%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボキサミド(6.3g、55%)を得た。
1H NMR(300MHz,DMSO-d6)δ 8.34(s,1H),8.10(s,1H),6.40(s,1H),5.50(s,2H),3.42(t,J=8.1Hz,2H),2.46(s,3H),0.81(t,J=8.1Hz,2H),-0.06(s,9H).
ESI-MS[M+H]+(C16H21BrF2N2O2Si)に対する計算値419.05,421.05実測値:419.20,421.20.
工程9:4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド
混合物をTHF(60mL)中の4-ブロモ-5,6-ジフルオロ-2-メチル-1-((2-(トリメチルシリル)エトキシ)メチル)-1H-インドール-7-カルボキサミド(6.3g、15.02mmol)、TBAF(THF中1M、150mL、150.2mmol)、及びエタン-1,2-ジアミン(30mL、450.6mmol)の混合物を75℃で40時間撹拌した。反応混合物を0℃に冷却し、2M塩酸でpH=4まで酸性化した。沈殿物を濾過により収集し、水(100mL)で洗浄し、減圧乾燥させて、黄色固体の4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(3.5g、80%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.38(s,1H),7.97(s,1H),7.90(s,1H),6.20(s,1H),2.40(s,3H).
ESI-MS[M+H]+(C10H7BrF2N2O)に対する計算値288.97,290.97実測値:288.95,290.95.
工程10:5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル
ジオキサン(8mL)及び水(2mL)中の4-ブロモ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(250mg、0.864mmol)、5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(373mg、1.04mmol)、炭酸カリウム(359mg、2.59mmol)、及びPd(dppf)Cl2.DCM(71mg、0.086mmol)の混合物を脱気し、窒素で5回詰め戻し、90℃で2時間撹拌した。冷却した反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、石油エーテル中の酢酸エチル(0から38%)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、白色固体の5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(340mg、89%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.11(s,1H),7.90(s,1H),7.82(s,1H),7.40-7.22(m,2H),7.17(dd,J=6.9,2.1Hz,1H),5.70(s,1H),4.70-4.44(m,2H),3.91(s,1H),3.56-3.44(m,1H),3.40-3.35(m,1H),2.43-2.38(m,1H),2.32(s,3H),1.41(s,9H).
ESI-MS[M+H-tBu]+(C24H25F2N3O3)に対する計算値386.19実測値:386.15.
工程11:5-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル
DMF(5mL)中の5-(7-カルバモイル-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(250mg、0.566mmol)の溶液に、NCS(91mg、0.679mmol)を0℃で添加した。10℃で2時間撹拌した後、反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取TLC(石油エーテル中30%酢酸エチル)により精製して、黄色固体の5-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(200mg、74%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.52(s,1H),8.01-7.95(m,2H),7.32-7.28(m,2H),7.17-7.11(m,1H),4.66-4.52(m,2H),3.52-3.43(m,2H),2.45-2.34(m,2H),2.31(s,3H),1.41(s,9H).
ESI-MS[M+H-tBu]+(C24H24ClF2N3O3)に対する計算値420.15,422.15実測値:420.05.,422.05.
工程12:3-クロロ-5,6-ジフルオロ-2-メチル-4-(1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド塩酸塩
5-(7-カルバモイル-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-4-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(240mg、0.504mmol)及び塩化水素(ジオキサン中4M、5mL)の混合物を2時間20℃で撹拌した。混合物を真空濃縮して、褐色固体の3-クロロ-5,6-ジフルオロ-2-メチル-4-(1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド塩酸塩(200mg、粗)を得た。
ESI-MS[M+H]+(C19H16ClF2N3O)に対する計算値376.09,378.09実測値:376.05,378.05.
工程13:4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド
テトラヒドロフラン(4mL)及び水(1mL)中の3-クロロ-5,6-ジフルオロ-2-メチル-4-(1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド塩酸塩(200mg、0.485mmol)の混合物に、重炭酸ナトリウム(204mg、2.43mmol)及び塩化アクリロイル(44mg、0.485mmol)を0℃で添加した。1時間0℃で撹拌した後、反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた有機層をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、分取HPLC、次の条件:カラム:XBridge Prep OBD C18 Column、30×150mm 5um;移動相A:水(10MMOL/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で30% Bから60% B;220nm;Rt:6.32分で精製して、白色固体の4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(80mg、38%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.54(s,1H),8.03(s,1H),7.99(s,1H),7.35-7.29(m,2H),7.17-7.14(m,1H),6.97-6.77(m,1H),6.15(dd,J=17.2,1.6Hz,1H),5.74-5.66(m,1H),4.89-4.75(m,2H),3.78-3.60(m,2H),2.46-2.34(m,2H),2.31(s,3H).
ESI-MS[M+H]+(C22H18ClF2N3O2)に対する計算値430.11,432.11実測値:430.05,432.05.
工程14:異性体の分離:
(R)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物21b)及び(S)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物21c):
(R)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物21b)及び(S)-4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物21c):
4-(2-アクリロイル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5,6-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミドの2つのアトロプ異性体を、分取キラルHPLCにより、本明細書に記載の手順に従って分離させた:
1H NMR(300MHz,DMSO-d6)δ 11.54(s,1H),8.05-7.96(m,2H),7.37-7.29(m,2H),7.18-7.13(m,1H),6.98-6.75(m,1H),6.20-6.10(m,1H),5.75-5.65(m,1H),4.95-4.67(m,2H),3.81-3.57(m,2H),2.46-2.36(m,2H),2.31(s,3H).LC-MS:m/z=430.05,432.05[M+H]+.
1H NMR(300MHz,DMSO-d6)δ 11.54(s,1H),8.02-7.97(m,2H),7.37-7.29(m,2H),7.18-7.13(m,1H),6.98-6.76(m,1H),6.15(dd,J=16.5,1.8Hz,1H),5.75-5.66(m,1H),4.88-4.77(m,2H),3.77-3.62(m,2H),2.46-2.36(m,2H),2.31(s,3H).LC-MS:m/z=430.05,432.05[M+H]+.
化合物21d~21e
化合物21d及び21eを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した。
化合物21d及び21eを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した。
×がCH2であり、R3がMEである式(II)の化合物の調製
実施例22
4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物22a)の合成
4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物22a)の合成
DCM(25mL)及びピリジン(50mL)中の2-(2-ブロモフェニル)エタン-1-アミン(5.0g、25.0mmol)の撹拌溶液に、塩化アセチル(1.96g、24.99mmol)を0℃で滴下した。添加後、反応混合物を1.5時間25Cで撹拌した。反応混合物を水(50mL)で希釈し、酢酸エチル(3×20mL)で抽出した。合わせた抽出物を水(30mL)及びブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。濃縮物を、シリカゲルでのカラムクロマトグラフィー(ジクロロメタン中5%メタノール)により精製して、黄色油状のN-(2-ブロモフェネチル)アセトアミド(4.8g、79%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.96(s,1H),7.59(d,J=6.0Hz,1H),7.35-7.28(m,2H),7.19-7.13(m,1H),3.31-3.20(m,2H),2.84-2.80(m,2H),1.78(s,3H).
ESI-MS[M+H]+(C10H12BrNO)に対する計算値242.01,244.01;実測値:242.10,244.10.
工程2:7-ブロモ-10b-メチル-6,10b-ジヒドロ-5H-オキサゾロ[2,3-a]イソキノリン-2,3-ジオン
DCM(70mL)中のN-(2-ブロモフェネチル)アセトアミド(5.0g、20.7mmol)の溶液に、塩化オキサリル(4.72g、37.2mmol)を0℃で滴下した。混合物を、0℃で2時間、その後25℃で3時間撹拌した。反応混合物を0℃に冷却し、FeCl3(4.02g、24.8mmol)を分割して添加した。反応混合物を25℃に温まらせ、16時間撹拌した。反応混合物を12M水性アンモニア(50mL)で希釈し、DCM(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、褐色固体の7-ブロモ-10b-メチル-6,10b-ジヒドロ-5H-オキサゾロ[2,3-a]イソキノリン-2,3-ジオン(6.0g)を得て、これを精製せずに使用した。
ESI-MS[M+H]+(C12H10BrNO3)に対する計算値295.98,297.98;実測値:296.05,298.05.
工程3:5-ブロモ-1-メチル-3,4-ジヒドロイソキノリン
メタノール(150mL)中の7-ブロモ-10b-メチル-6,10b-ジヒドロ-5H-オキサゾロ[2,3-a]イソキノリン-2,3-ジオン(6.0g、20.3mmol)の溶液に、濃硫酸(1.99g、20.3mmol)を添加した。反応混合物を65Cで20時間加熱した。反応混合物を、12M水性アンモニアを用いて0Cで希釈した。メタノールを減圧下で除去した。残留物を水(30mL)で希釈し、DCM(3×50mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、褐色油状の5-ブロモ-1-メチル-3,4-ジヒドロイソキノリン(3.9g、86%)を得た。
1H NMR(400MHz,DMSO-d6)δ 7.68(d,J=8.0Hz,1H),7.59(d,J=8.0Hz,1H),7.32-7.28(m,1H),3.58-3.54(m,2H),2.71-2.67(m,2H),2.31-2.30(m,3H).
ESI-MS[M+H]+(C12H10BrNO3)に対する計算値224.00,226.00;実測値:224.10,226.10.
工程4:5-ブロモ-1-メチル-1,2,3,4-テトラヒドロイソキノリン
エタノール(100mL)中の5-ブロモ-1-メチル-3,4-ジヒドロイソキノリン(3.9g、17.4mmol)の溶液に、水素化ホウ素ナトリウム(658mg、17.4mmol)を0℃で添加した。反応混合物を0℃で2時間撹拌し、水(100mL)で希釈し、DCM(3×100mL)で抽出した。合わせた抽出物をブライン(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、褐色固体の5-ブロモ-1-メチル-1,2,3,4-テトラヒドロイソキノリン(2.75g、70%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.40(d,J=7.8Hz,1H),7.18(d,J=7.5Hz,1H),7.12-7.01(mf,1H),3.93-3.87(m,1H),3.30(brs,1H),3.15-3.11(m,1H),2.88-2.76(m,1H),2.61-2.57(m,2H),1.33(d,J=6.6Hz,3H).
ESI-MS[M+H]+(C10H12BrN)に対する計算値226.02,228.02;実測値:226.15,228.11.
工程5:5-ブロモ-1-メチル-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル
DCM(75mL)中の5-ブロモ-1-メチル-1,2,3,4-テトラヒドロイソキノリン(2.75g、12.2mmol)及びトリエチルアミン(3.69g、36.5mmol)の溶液に、二炭酸ジ-tert-ブチル(2.65g、12.2mmol)を添加した。反応混合物を3時間25℃で撹拌し、水(50mL)でクエンチし、酢酸エチル(3×50mL)で抽出した。合わせた有機層をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中7%酢酸エチル)により精製して、白色固体の5-ブロモ-1-メチル-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(3.1g、78%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.48(d,J=7.8Hz,1H),7.28(d,J=7.5Hz,1H),7.21-7.10(m,1H),5.24-4.96(m,1H),4.13-3.97(m,1H),3.27-3.06(m,1H),2.86-2.73(m,1H),2.69-2.57(m,1H),1.46-1.37(m,12H).
ESI-MS[M+H-Boc]+(C15H20BrNO2)に対する計算値226.07,228.07;実測値:226.05,228.05.
工程6:1-メチル-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル
1,4-ジオキサン(100mL)中の5-ブロモ-1-メチル-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸(3.5g、10.7mmol)、4,4,4’,4’,5,5,5’,5’-オクタメチル-2,2’-ビ(1,3,2-ジオキサボロラン)(3.27g、12.9mmol)、Pd(dppf)Cl2.DCM(876mg、1.07mmol)、及び酢酸カリウム(3.16g、32.2mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下100℃で2時間加熱した。冷却した反応混合物を水(50mL)でクエンチし、酢酸エチル(3×50mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中60%酢酸エチル)により精製して、黄色油状の1-メチル-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-3,4-ジヒドロ-1H-イソキノリン-2-カルボン酸tert-ブチル(4.0g、89%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.52(d,J=7.5Hz,1H),7.30(d,J=7.2Hz,1H),7.21-7.14(m,1H),5.12-4.96(m,1H),3.97-3.81(m,1H),3.29-3.03(m,2H),2.93-2.88(m,1H),1.43(s,9H),1.36(d,J=6.0Hz,3H),1.29(s,12H).
ESI-MS[M+H-Boc]+(C21H32BNO4)に対する計算値274.24,実測値:274.25.
工程7:4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸
THF(200mL)中の4-ブロモ-5-フルオロ-2-ニトロ安息香酸(17g、64.4mmol)の撹拌溶液に、プロパ-1-エン-2-イルマグネシウムブロミド(451mL、225mmol、THF中0.5M)を窒素下-70℃で滴下した。添加後、反応混合物を-70℃で3時間撹拌した。反応混合物を飽和水性塩化アンモニウム(500mL)でクエンチし、酢酸エチル(2×500mL)で抽出した。合わせた抽出物をブライン(300mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、褐色固体の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸(17.5g)を得た。固体を精製せずに持ち越した。
ESI-MS[M-H]-(C10H7BrFNO2)に対する計算値269.96,271.96;実測値:270.25,272.25.
工程8:4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
DMF(200mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸(17.5g、64.4mmol)、塩酸アンモニア(5.17g、96.6mmol)、及びHATU(29.4g、77.3mmol)の撹拌溶液に、N-エチル-N-イソプロピル-プロパン-2-アミン(25.0g、193mmol)を添加した。反応混合物を25℃で16時間撹拌した。反応混合物を水(300mL)でクエンチし、酢酸エチル(3×300mL)で抽出した。合わせた抽出物を、水(200mL)、ブライン(200mL)で洗浄し、次いで無水硫酸ナトリウムで乾燥させ、真空濃縮した。濃縮物をカラムクロマトグラフィー(石油エーテル中50%酢酸エチル)により精製して、黄色固体の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(3.8g、22%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.26(s,1H),8.11(s,1H),7.63-7.53(m,2H),6.19(s,1H),2.42(s,3H).
ESI-MS[M+H]+(C10H8BrFN2O)に対する計算値270.98,272.98;実測値:270.90,272.90.
工程9:5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-1-メチル-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル
THF(12mL)及び水(3mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(400mg、1.47mmol)、1-メチル-5-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-3,4-ジヒドロ-1H-イソキノリン-2-カルボン酸tert-ブチル(550mg、1.47mmol)、リン酸カリウム(938mg、4.42mmol)、及びPd(dppf)Cl2(108mg、0.147mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下30℃で16時間撹拌し、水(60mL)でクエンチし、酢酸エチル(3×50mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。濃縮物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中55%酢酸エチル)により精製して、黄色固体の5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-1-メチル-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(500mg、78%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.05(s,1H),7.62-7.52(m,2H),7.36-7.26(m,3H),7.17-7.11(m,1H),5.78-5.76(m,1H),5.18-5.13(m,1H),3.92-3.61(m,1H),3.19-2.98(m,1H),2.43-2.40(m,1H),2.39-2.33(m,3H),2.30-2.24(m,1H),1.43(s,12H).
ESI-MS[M+H]+(C25H28FN3O3)に対する計算値438.21,実測値:438.30.
工程10:5-フルオロ-2-メチル-4-(1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド
5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-1-メチル-3,4-ジヒドロイソキノリン-2(1H)-カルボン酸tert-ブチル(500mg、1.14mmol)及び塩化水素(ジオキサン中4M、10mL)の混合物を25℃で1時間撹拌した。反応混合物を真空濃縮した。残留物を飽和水性重炭酸ナトリウム(50mL)で希釈し、酢酸エチル(3×50mL)で抽出した。合わせた抽出物を硫酸ナトリウムで乾燥させ、真空濃縮して、黄色固体の5-フルオロ-2-メチル-4-(1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド(370mg、89%)を得た。
ESI-MS[M+H]+(C20H20FN3O)に対する計算値338.16,実測値:338.15.
工程11:4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
THF(8mL)及び水(2mL)中の5-フルオロ-2-メチル-4-(1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-1H-インドール-7-カルボキサミド(370mg、1.10mmol)及び重炭酸ナトリウム(276mg、3.29mmol)の撹拌混合物に、塩化アクリロイル(99mg、1.10mmol)を0℃で添加した。反応混合物を0℃で0.5時間撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中75から100%酢酸エチル)により精製して、黄色固体の4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(290mg、67%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.09-11.00(m,1H),8.11(s,1H),7.63-7.49(m,2H),7.43-7.28(m,2H),7.19-7.14(m,1H),7.03-6.71(m,1H),6.25-6.08(m,1H),5.83-5.55(m,3H),4.36-3.85(m,1H),3.54-3.36(m,1H),2.76-2.53(m,1H),2.46-2.23(m,4H),1.56-1.47(m,3H).
ESI-MS[M+H]+(C23H22FN3O2)に対する計算値392.17,実測値:392.15.
工程12:4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
DMF(5.0mL)中の4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(230mg、0.59mmol)の撹拌溶液に、1-クロロピロリジン-2,5-ジオン(78mg、0.59mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。反応混合物を水(25mL)で希釈し、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。濃縮物を分取HPLC(カラム:XBridge Prep OBD C18 Column、19×250mm、5um;移動相A:水(10mmol/L NH4HCO3+0.1%NH3・H2O)、移動相B:アセトニトリル;流量:25mL/分;勾配:7分で40% Bから60% B;220nm;RT:6.00分)により精製して、白色固体の4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(110mg、44%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.55-11.40(m,1H),8.19(s,1H),7.72-7.59(m,2H),7.38-7.24(m,2H),7.15-7.07(m,1H),7.01-6.73(m,1H),6.18-6.11(m,1H),5.77-5.36(m,2H),4.31-3.93(m,1H),3.48-3.05(m,1H),2.44-2.18(m,5H),1.54-1.43(m,3H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,実測値:426.25.
工程13:異性体の分離
4-(2-アクリロイル-1-メチル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(100mg)を、分取キラルHPLCにより4つの異性体に分離させた。粗物質を、CHIRALPAK IG(2×25cm、5um);移動相A:ヘキサン(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:20mL/分;勾配:25% B、アイソクラティック、24分;220/254nmをとおして泳動させて、4つの化合物を得た。保持時間は次のとおりであった。
化合物22b:保持時間=11.342分(16.4mg)
1H NMR(400MHz,メタノール-d4)δ 7.55(d,J=10.4Hz,1H),7.38-7.28(m,2H),7.19-7.10(m,1H),6.96-6.73(m,1H),6.34-6.24(m,1H),5.83-5.68(m,1.6H),5.42-5.37(m,0.4H),4.42-3.96(m,1H),3.61-3.54(m,0.6H),3.28-3.21(m,0.4H),2.70-2.35(m,2H),2.38(s,3H),1.66(d,J=6.8Hz,1H),1.58(d,J=6.8Hz,2H).
1H NMR(400MHz,メタノール-d4)δ 7.55(d,J=10.4Hz,1H),7.38-7.28(m,2H),7.19-7.10(m,1H),6.96-6.73(m,1H),6.34-6.24(m,1H),5.83-5.68(m,1.6H),5.42-5.37(m,0.4H),4.42-3.96(m,1H),3.61-3.54(m,0.6H),3.28-3.21(m,0.4H),2.70-2.35(m,2H),2.38(s,3H),1.66(d,J=6.8Hz,1H),1.58(d,J=6.8Hz,2H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,実測値:426.05.
化合物22c:保持時間=18.98分(19.5mg)
1H NMR(400MHz,メタノール-d4)δ 7.51(d,J=10.4Hz,1H),7.30-7.28(m,2H),7.14-7.11(m,1H),6.96-6.73(m,1H),6.29-6.20(m,1H),5.82-5.35(m,2H),4.36-3.92(m,1H),3.59-3.52(m,0.6H),3.25-3.18(m,0.4H),2.65-2.47(m,2H),2.38(s,3H),1.62(d,J=6.8Hz,1H),1.54(d,J=6.8Hz,2H).
1H NMR(400MHz,メタノール-d4)δ 7.51(d,J=10.4Hz,1H),7.30-7.28(m,2H),7.14-7.11(m,1H),6.96-6.73(m,1H),6.29-6.20(m,1H),5.82-5.35(m,2H),4.36-3.92(m,1H),3.59-3.52(m,0.6H),3.25-3.18(m,0.4H),2.65-2.47(m,2H),2.38(s,3H),1.62(d,J=6.8Hz,1H),1.54(d,J=6.8Hz,2H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,実測値:426.05.
化合物22d
その後、14.331分で溶出した物質に、CHIRAL ART Cellulose-SC(2×25cm,5um);移動相A:ヘキサン(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:20mL/分;勾配:25% B、アイソクラティック、18分;220/254nmによるクロマトグラフィーを行った。保持時間=10.855分(14.9mg).
その後、14.331分で溶出した物質に、CHIRAL ART Cellulose-SC(2×25cm,5um);移動相A:ヘキサン(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:20mL/分;勾配:25% B、アイソクラティック、18分;220/254nmによるクロマトグラフィーを行った。保持時間=10.855分(14.9mg).
1H NMR(400MHz,メタノール-d4)δ 7.51(d,J=10.4Hz,1H),7.30-7.29(m,2H),7.14-7.11(m,1H),6.96-6.72(m,1H),6.29-6.19(m,1H),5.81-5.66(m,1.6H),5.39-5.34(m,0.4H),4.35-3.92(m,1H),3.59-3.52(m,0.6H),3.24-3.18(m,0.4H),2.55-2.47(m,2H),2.38(s,3H),1.62(d,J=6.8Hz,1H),1.54(d,J=6.8Hz,2H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,実測値:426.05.
化合物22e
その後、15.677分で溶出した物質に、CHIRAL ART Cellulose-SC(2×25cm,5um);移動相A:ヘキサン(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:20mL/分;勾配:25% B、アイソクラティック、18分;220/254nmによるクロマトグラフィーを行った。保持時間=14.665分(19.0mg).
その後、15.677分で溶出した物質に、CHIRAL ART Cellulose-SC(2×25cm,5um);移動相A:ヘキサン(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:20mL/分;勾配:25% B、アイソクラティック、18分;220/254nmによるクロマトグラフィーを行った。保持時間=14.665分(19.0mg).
1H NMR(400MHz,メタノール-d4)δ 7.51(d,J=10.4Hz,1H),7.31-7.28(m,2H),7.14-7.11(m,1H),6.96-6.72(m,1H),6.29-6.18(m,1H),5.82-5.65(m,1.6H),5.39-5.32(m,0.4H),4.36-3.90(m,1H),3.60-3.50(m,0.6H),3.24-3.18(m,0.4H),2.55-2.47(m,2H),2.37(s,3H),1.62(d,J=6.4Hz,1H),1.54(d,J=6.8Hz,2H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,実測値:426.05.
化合物22f~22i
表8に列挙する化合物を、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した。
表8に列挙する化合物を、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製した。
×がCH2であり、R3がシクロプロピルである式(II)の化合物の調製
実施例23
4-(2-アクリロイル-1-シクロプロピル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物23)の合成
4-(2-アクリロイル-1-シクロプロピル-1,2,3,4-テトラヒドロイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物23)の合成
1H NMR(400MHz,DMSO-d6)δ 11.18-10.92(m,1H),8.12(s,1H),7.63-7.49(m,2H),7.48-7.37(m,1H),7.36-7.27(m,1H),7.23-7.11(m,1H),7.04-6.68(m,1H),6.23-6.04(m,1H),5.85-5.58(m,2H),5.02-4.67(m,1H),4.41-3.85(m,1H),3.75-3.15(m,1H),2.70-2.28(m,5H),1.48-1.19(m,1H),0.99-0.32(m,4H).
LC-MS:m/z=418.15[M+H]+.
×が-CRx1Rx2-であり、Rx1及びRx2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成する、式(II)の化合物の調製
実施例24
4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物24a)の合成
4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物24a)の合成
DMF(100mL)中の3-ブロモ-2-ヒドロキシベンゾニトリル(10g、50.5mmol)、4-ブロモブタンニトリル(11.2g、75.8mmol)、及び炭酸カリウム(10.5g、75.8mmol)の混合物を、25℃で16時間撹拌した。反応混合物を水(200mL)で希釈し、酢酸エチル(3×100mL)で抽出した。合わせた抽出物をブライン(120mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から40%酢酸エチル)により精製して、無色油状の3-ブロモ-2-(3-シアノプロポキシ)ベンゾニトリル(12.0g、89%)を得た。
1H NMR(300MHz,DMSO-d6)δ 8.03(dd,J=8.1,1.5Hz,1H),7.88(dd,J=7.8,1.5Hz,1H),7.28-6.98(m,1H),4.22(t,J=6.0Hz,2H),2.77(t,J=7.2Hz,2H),2.20-2.06(m,2H).
工程2:9-ブロモ-1,2-ジヒドロフロ[2,3-c] イソキノリン-5-アミン
ジオキサン(30mL)中の3-ブロモ-2-(3-シアノプロポキシ)ベンゾニトリル(1.0g、3.77mmol)及び2-メチルプロパン-2-オレイン酸カリウム(847mg、7.54mmol)の混合物を95℃で1時間撹拌した。反応混合物を水(60mL)で希釈し、酢酸エチル(3×50mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から50%酢酸エチル)により精製して、黄色固体の9-ブロモ-1,2-ジヒドロフロ[2,3-c] イソキノリン-5-アミン(300mg、30%)を得た。
1H NMR(400MHz,DMSO-d6)δ 8.11(d,J=8.4Hz,1H),7.79(d,J=7.6Hz,1H),7.09(s,2H),7.06-6.95(m,1H),4.50(t,J=6.6Hz,2H),3.73(t,J=6.6Hz,2H).
ESI-MS[M+H]+(C11H9BrN2O)に対する計算値265.11,267.11;実測値:265.10,267.10.
工程3:5’-ブロモ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-1’,3’(2’H)-ジオン
濃塩酸(100mL)中の5’-ブロモ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-1’,3’(2’H)-ジオン及び9-ブロモ-1,2-ジヒドロフロ[2,3-c]イソキノリン-5-アミン(1.80g、6.78mmol)の混合物を100℃で3時間撹拌した。反応混合物を水(200mL)で希釈し、酢酸エチル(3×150mL)で抽出した。合わせた抽出物をブライン(150mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をDMF(25mL)に溶解させ、炭酸カリウム(1.90g、13.9mmol)を添加した。反応混合物を25℃で16時間撹拌した。反応混合物を水(50mL)でクエンチし、酢酸エチル(3×40mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から60%酢酸エチル)により精製して、白色固体の5’-ブロモ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-1’,3’(2’H)-ジオン(1.0g、55%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.43(d,J=8.1Hz,1H),7.20(d,J=8.4Hz,1H),7.11-7.01(m,1H),1.93-1.81(m,2H),0.86-0.77(m,2H).
ESI-MS[M-H]-(C11H8BrNO2)に対する計算値263.97,265.97;実測値:264.00,266.00.
工程4:5’-ブロモ-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン
THF(30mL)中の水素化ホウ素ナトリウム(600mg、15.8mmol)の混合物に、BF3.Et2O(3.00g、21.1mmol)を0℃で添加した。この温度で1時間撹拌した後、THF(50mL)中の5’-ブロモ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-1’,3’(2’H)-ジオン(1.40g、5.26mmol)の溶液を滴下した。反応混合物を70℃で16時間加熱した。反応混合物を水(60mL)でクエンチし、酢酸エチル(3×50mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中80%酢酸エチル)により精製して、白色固体の5’-ブロモ-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン(480mg、38%)を得た。
ESI-MS[M+H]+(C11H12BrN)に対する計算値238.02,240.02;実測値:238.10,240.10.
工程5:1-(5’-ブロモ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-2’(3’H)-イル)プロパ-2-エン-1-オン
水(2.0mL)及びTHF(8.0mL)中の5’-ブロモ-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン](480mg、2.02mmol)の撹拌混合物に、重炭酸ナトリウム(850mg、10.1mmol)及び塩化アクリロイル(180mg、2.02mmol)を0℃で添加した。反応混合物を0℃で1.5時間撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×25mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中40%酢酸エチル)により精製して、黄色固体の1-(5’-ブロモ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-2’(3’H)-イル)プロパ-2-エン-1-オン(350mg、59%)を得た。
1H NMR(400MHz,DMSO-d6)δ 7.47(d,J=8.4Hz,1H),7.39-7.31(m,1H),7.18-7.10(m,1H),7.00-6.59(m,1H),6.19-6.13(m,1H),5.76-5.67(m,1H),4.87(s,0.8H),4.78(s,1.2H),3.49(s,1.2H),3.33(s,0.8H),1.58-1.54(m,2H),1.08-1.02(m,2H).
ESI-MS[M+H]+(C14H14BrNO)に対する計算値292.03,294.03;実測値:292.00,294.00.
工程6:4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物5b)
水(2.5mL)及びジオキサン(10mL)中の5-フルオロ-2-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-インドール-7-カルボキサミド(350mg、1.10mmol)、1-(5’-ブロモ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-2’(3’H)-イル)プロパ-2-エン-1-オン(230mg、0.787mmol)、及びリン酸カリウム(500mg、2.36mmol)、及びPd(PPh3)4(90mg、0.078mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下80℃で16時間加熱した。冷却した反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中80%酢酸エチル)により精製して、緑色固体の4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(170mg、56%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.06(s,1H),8.13(s,1H),7.65-7.48(m,2H),7.46-7.36(m,1H),7.35-7.29(m,1H),7.19-7.10(m,1H),7.06-6.96(m,0.5H),6.67-6.58(m,0.5H),6.22-6.10(m,1H),5.82-5.60(m,2H),5.09-4.96(m,1H),4.85-4.55(m,1H),3.65-3.42(m,1H),3.37-3.13(m,1H),2.38(s,3H),0.72-0.59(m,2H),0.32-0.14(m,2H).
ESI-MS[M+H]+(C24H22FN3O2)に対する計算値404.17,実測値:404.30.
工程7:4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物5a)
DMF(6.0mL)中の4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(170mg、0.421mmol)の溶液に、NCS(56.0mg、0.421mmol)を0℃で添加した。反応混合物を0℃で2時間撹拌した。反応混合物を水(20mL)でクエンチし、酢酸エチル(3×15mL)で抽出した。合わせた抽出物をブライン(3×20mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取HPLC(カラム:Xselect CSH OBD Column 30×150mm 5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で38% Bから58% B;220nm;保持時間=5.32分)により精製して、白色固体の4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(32.6mg、17%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.43(s,1H),8.18(s,1H),7.68-7.56(m,2H),7.38-7.35(m,1H),7.24-7.21(m,1H),7.05-6.54(m,2H),6.14-6.08(m,1H),5.69-5.60(m,1H),4.98-4.65(m,2H),3.42-3.20(m,2H),2.34(s,3H),0.67-0.53(m,2H),0.36-0.22(m,2H).
ESI-MS[M+H]+(C24H21ClN3O2)に対する計算値438.13,実測値:438.15.
工程8:異性体の分離
(R)-4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物24c)及び(S)-4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物24d):
(R)-4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物24c)及び(S)-4-(2’-アクリロイル-2’,3’-ジヒドロ-1’H-スピロ[シクロプロパン-1,4’-イソキノリン]-5’-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物24d):
2つのアトロプ異性体を分取キラルHPLCにより分離させた(試料量=24mg、カラム:CHIRALPAK IE、2×25cm、5um;移動相A:MTBE(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:20mL/分;勾配:5% B、12分;220/254nm):
化合物24c:保持時間=8.078分(7.9mg)
1H NMR(400MHz,メタノール-d4)δ 7.50(d,J=10.0Hz,1H),7.36-7.34(m,1H),7.27-7.25(m,1H),7.09-7.07(m,1H),6.99-6.55(m,1H),6.26-6.23(m,1H),5.83-5.72(m,1H),5.03-4.78(m,2H),3.59-3.37(m,2H),2.38(s,3H),0.68-0.58(m,2H),0.48-0.40(m,2H).
1H NMR(400MHz,メタノール-d4)δ 7.50(d,J=10.0Hz,1H),7.36-7.34(m,1H),7.27-7.25(m,1H),7.09-7.07(m,1H),6.99-6.55(m,1H),6.26-6.23(m,1H),5.83-5.72(m,1H),5.03-4.78(m,2H),3.59-3.37(m,2H),2.38(s,3H),0.68-0.58(m,2H),0.48-0.40(m,2H).
ESI-MS[M+H]+(C24H21ClN3O2)に対する計算値438.13,実測値:438.10
化合物24d:保持時間=9.991分(7.6mg)
1H NMR(400MHz,メタノール-d4)δ 7.50(d,J=10.0Hz,1H),7.36-7.34(m,1H),7.30-7.25(m,1H),7.09-7.07(m,1H),6.98-6.56(m,1H),6.26-6.23(m,1H),5.77-5.72(m,1H),5.02-4.78(m,2H),3.56-3.41(m,2H),2.38(s,3H),0.66-0.58(m,2H),0.47-0.41(m,2H).
1H NMR(400MHz,メタノール-d4)δ 7.50(d,J=10.0Hz,1H),7.36-7.34(m,1H),7.30-7.25(m,1H),7.09-7.07(m,1H),6.98-6.56(m,1H),6.26-6.23(m,1H),5.77-5.72(m,1H),5.02-4.78(m,2H),3.56-3.41(m,2H),2.38(s,3H),0.66-0.58(m,2H),0.47-0.41(m,2H).
ESI-MS[M+H]+(C24H21ClN3O2)に対する計算値438.13,実測値:438.10.
×が-CH2CH2-である式(II)の化合物の調製
実施例25
4-(2-アクリロイル-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物25a)の合成
4-(2-アクリロイル-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物25a)の合成
ジオキサン(16mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(実施例1に記載のとおりに調製、1.30g、4.80mmol)、4,4,4’,4’,5,5,5’,5’-オクタメチル-2,2’-ビ(1,3,2-ジオキサボロラン)(1.34g、5.28mmol)、酢酸カリウム(941mg、9.59mmol)、及びPd(dppf)Cl2.DCM(196mg、0.24mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を、窒素下で2時間、100℃で加熱した。冷却した反応混合物を真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から30%酢酸エチル)により精製して、黄色固体の5-フルオロ-2-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-インドール-7-カルボキサミド(660mg)を得た。
ESI-MS[M+H]+(C16H20BFN2O3)に対する計算値319.16,実測値:319.25.
工程2:6-ブロモ-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-1-オン
エタノール(100mL)及び水(40mL)中の5-ブロモテトラリン-1-オン(5.2g、23.10mmol)、ヒドロキシルアミン塩酸塩(2.41g、34.7mmol)、及び酢酸ナトリウム(2.84g、34.7mmol)の混合物を窒素下90℃で2時間加熱した。冷却した反応混合物を水(150mL)で希釈し、酢酸エチル(3×100mL)で抽出した。合わせた抽出物をブライン(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をポリリン酸(100mL)に溶解させ、2時間100℃で撹拌した。冷却した反応混合物を水性水酸化ナトリウムで塩基性化し、酢酸エチル(4×150mL)で抽出した。合わせた抽出物をブライン(200mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から10%酢酸エチル)により精製して、褐色固体の6-ブロモ-2,3,4,5-テトラヒドロ-2-ベンズアゼピン-1-オン(2.7g、48%)を得た。
ESI-MS[M+H]+(C10H10BrNO)に対する計算値239.99,241.99;実測値:240.00,242.00.
工程3:6-ブロモ-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン
THF(54mL)中の6-ブロモ-2,3,4,5-テトラヒドロ-2-ベンズアゼピン-1-オン(2.7g、11.3mmol)の溶液に、ボラン(THF中1M、112mL、112mmol)を添加した。反応混合物を3時間70℃で加熱した。冷却した反応混合物をメタノール(100mL)で希釈し、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から12%酢酸エチル)により精製して、無色油状の6-ブロモ-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン(2.4g、94%)を得た。
1H NMR(400MHz,DMSO-d6)δ 6.96(dd,J=7.6,1.2Hz,1H),6.87-6.75(m,2H),5.44(s,1H),2.97-2.90(m,2H),2.89-2.82(m,2H),1.70-1.60(m,2H),1.59-1.49(m,2H).
ESI-MS[M+H]+(C10H12BrN)に対する計算値226.02,228.02;実測値:226.15,228.15.
工程4:1-(6-ブロモ-1,3,4,5-テトラヒドロ-2H-ベンゾ[c]アゼピン-2-イル)プロパ-2-エン-1-オン
THF(8mL)及び水(2mL)中の6-ブロモ-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン(1.6g、7.08mmol)の混合物に、重炭酸ナトリウム(1.78g、21.2mmol)及び塩化アクリロイル(769mg、8.49mmol)を0℃で添加した。反応混合物を0.5時間0℃で撹拌した。水(20mL)を添加した。混合物酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(40mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から15%酢酸エチル)により精製して、白色固体の1-(6-ブロモ-4,5-ジヒドロ-1H-ベンゾ[c]アゼピン-2(3H)-イル)プロパ-2-エン-1-オン(1.6g、80%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.63(dd,J=7.5,2.1Hz,1H),7.27-7.11(m,2H),6.25-6.13(m,1H),6.07-5.92(m,1H),5.58(dd,J=10.2,2.4Hz,1H),4.58-4.46(m,1H),3.27-3.14(m,1H),2.79-2.55(m,2H),1.99-1.85(m,1H),1.82-1.63(m,2H),1.45-1.14(m,1H).
ESI-MS[M+H]+(C13H14BrNO)に対する計算値280.03,282.03;実測値:280.10,282.10.
工程5:4-(2-アクリロイル-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-6-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物25b)
ジオキサン(8mL)及び水(2mL)中の1-(6-ブロモ-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-2-イル)プロパ-2-エン-1-オン(581mg、2.07mmol)、5-フルオロ-2-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-インドール-7-カルボキサミド(660mg、2.07mmol)、リン酸カリウム(1.32g、6.22mmol)、及びテトラキス(トリフェニルホスフィン)パラジウム(240mg、0.21mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を、窒素下80℃で16時間加熱した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(40mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から70%酢酸エチル)により精製して、白色固体の5-フルオロ-2-メチル-4-(2-プロパ-2-エノイル-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-6-イル)-1H-インドール-7-カルボキサミド(500mg、61%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.08(s,1H),8.12(s,1H),7.65-7.48(m,2H),7.42-7.36(m,1H),7.29-7.18(m,2H),6.25-6.15(m,1H),6.14-6.00(m,1H),5.88-5.68(m,1H),5.67-5.59(m,1H),4.69-4.52(m,1H),2.82-2.66(m,1H),2.45-2.25(m,5H),1.89-1.55(m,3H),1.48-1.08(m,1H).
ESI-MS[M+H]+(C23H22FN3O2)に対する計算値392.17,実測値:392.30.
工程6:4-(2-アクリロイル-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-6-イル)-3-クロロ-5-フルオロ-1H-インドール-7-カルボキサミド(化合物25a)
N,N-ジメチルホルムアミド(5.0mL)中の5-フルオロ-2-メチル-4-(2-プロパ-2-エノイル-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-6-イル)-1H-インドール-7-カルボキサミド(150mg、0.38mmol)の撹拌溶液に、N-クロロスクシンイミド(51mg、0.38mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×25mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、分取HPLCにより、次の条件:カラム:Xselect CSH OBD Column 30×150mm 5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で40% Bから60% B;220nm;RT:5.45分)で精製して、アトロプ異性体の混合物の3-クロロ-5-フルオロ-2-メチル-4-(2-プロパ-2-エノイル-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-6-イル)-1H-インドール-7-カルボキサミド(80mg、49%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.46(s,1H),8.19(s,1H),7.70-7.57(m,2H),7.43-7.29(m,1H),7.28-7.19(m,2H),6.28-5.96(m,2H),5.68-5.57(m,1H),4.66-4.52(m,1H),2.80-2.65(m,1H),2.45-2.25(m,5H),1.77-1.51(m,3H),1.33-1.10(m,1H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,428.13;実測値:426.25,428.25.
工程7:異性体の分離
(R)-3-クロロ-5-フルオロ-2-メチル-4-(2-プロパ-2-エノイル-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-6-イル)-1H-インドール-7-カルボキサミド(化合物25c)及び(S)-3-クロロ-5-フルオロ-2-メチル-4-(2-プロパ-2-エノイル-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-6-イル)-1H-インドール-7-カルボキサミド(化合物25d):
(R)-3-クロロ-5-フルオロ-2-メチル-4-(2-プロパ-2-エノイル-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-6-イル)-1H-インドール-7-カルボキサミド(化合物25c)及び(S)-3-クロロ-5-フルオロ-2-メチル-4-(2-プロパ-2-エノイル-1,3,4,5-テトラヒドロ-2-ベンズアゼピン-6-イル)-1H-インドール-7-カルボキサミド(化合物25d):
2つのアトロプ異性体を、キラルHPLC(試料量=45mg、CHIRAL ART Cellulose-SB、2×25cm、5um;移動相A:MTBE(0.5% 2M NH3-MeOH)、移動相B:IPA;流量:20mL/分;勾配:5% B、14分;220/254nm)により分離させた。
化合物25c:保持時間=8.502分(19.1mg)
1H NMR(400MHz,DMSO-d6)δ 11.44(s,1H),8.18(s,1H),7.70-7.54(m,2H),7.40-7.29(m,1H),7.29-7.16(m,2H),6.26-5.98(m,2H),5.67-5.55(m,1H),4.64-4.53(m,1H),2.80-2.65(m,1H),2.45-2.25(m,5H),1.81-1.62(m,3H),1.32-1.14(m,1H).
1H NMR(400MHz,DMSO-d6)δ 11.44(s,1H),8.18(s,1H),7.70-7.54(m,2H),7.40-7.29(m,1H),7.29-7.16(m,2H),6.26-5.98(m,2H),5.67-5.55(m,1H),4.64-4.53(m,1H),2.80-2.65(m,1H),2.45-2.25(m,5H),1.81-1.62(m,3H),1.32-1.14(m,1H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,428.13;実測値:426.10,428.10.
化合物25d:保持時間=11.588分(19.3mg)
1H NMR(400MHz,DMSO-d6)δ 11.44(s,1H),8.18(s,1H),7.70-7.60(m,2H),7.38-7.29(m,1H),7.27-7.17(m,2H),6.26-6.00(m,2H),5.67-5.56(m,1H),4.64-4.53(m,1H),2.80-2.65(m,1H),2.43-2.30(m,5H),1.77-1.65(m,3H),1.33-1.15(m,1H).
1H NMR(400MHz,DMSO-d6)δ 11.44(s,1H),8.18(s,1H),7.70-7.60(m,2H),7.38-7.29(m,1H),7.27-7.17(m,2H),6.26-6.00(m,2H),5.67-5.56(m,1H),4.64-4.53(m,1H),2.80-2.65(m,1H),2.43-2.30(m,5H),1.77-1.65(m,3H),1.33-1.15(m,1H).
ESI-MS[M+H]+(C23H21ClFN3O2)に対する計算値426.13,428.13;実測値:426.05,428.05.
4-(2-アクリロイル-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-6-イル)-3,5-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物25e)の合成
ジクロロメタン(10mL)中の4-(2-アクリロイル-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-6-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(80mg、0.20mmol)の撹拌溶液に、N-フルオロベンゼンスルホンイミド(126mg、0.51mmol)を添加した。反応混合物を36時間25℃で撹拌した。反応混合物を水(30mL)で希釈し、ジクロロメタン(3×30mL)で抽出した。合わせた抽出物をブライン(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取HPLC(カラム:YMC-Actus Triart C18、30×250mm、5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:40% Bから50% B、8分;254nm;保持時間=7.95)により精製して、白色固体の4-(2-アクリロイル-2,3,4,5-テトラヒドロ-1H-ベンゾ[c]アゼピン-6-イル)-3,5-ジフルオロ-2-メチル-1H-インドール-7-カルボキサミド(8.0mg、9%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.87(s,1H),8.09(s,1H),7.65-7.43(m,2H),7.37-7.12(m,3H),6.20-6.05(m,1H),6.03-5.80(m,1H),5.59-5.52(m,1H),4.60-4.45(m,1H),2.75-2.58(m,1H),2.42-2.28(m,2H),2.24(s,3H),1.75-1.52(m,3H),1.30-1.05(m,1H).
ESI-MS[M+H]+(C23H21F2N3O2)に対する計算値410.16,実測値:410.30.
×が-CRx1Rx2-であり、Rx1がHであり、Rx2及びR3が一緒になってアルキレン架橋を形成する、式(II)の化合物の調製
実施例26
4-(2-アクリロイル-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物26)の合成
4-(2-アクリロイル-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物26)の合成
THF(120mL)中の2-(2-ブロモフェニル)酢酸メチル(10.0g、43.7mmol)の撹拌溶液に、ビス(トリメチルシリル)アミドカリウム(1.0M、65.5mL、65.5mmol)を窒素下-78℃で滴下した。この温度で1時間撹拌した後、2-ブロモ酢酸(50.00g、299mmol)を滴下した。反応混合物を、1時間-78℃、次いで-40℃で3時間撹拌した。反応混合物を水(200mL)で希釈し、酢酸エチル(3×100mL)で抽出した。合わせた抽出物をブライン(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から30%酢酸エチル)により精製して、白色固体の2-(2-ブロモフェニル)コハク酸4-エチル 1-メチル(11.9g、86%)を得た。
1H NMR(400MHz,DMSO-d6)δ 7.63-7.59(m,1H),7.38-7.28(m,2H),7.24-7.19(m,1H),4.52-4.45(m,1H),4.03-4.00(m,2H),3.59(s,3H),3.03-2.99(m,1H),2.69-2.66(m,1H),1.12(t,J=6.8Hz,3H).
ESI-MS[M+H]+(C13H15BrO4)に対する計算値315.02,317.02;実測値:314.95,316.95.
工程2:2-(2-ブロモフェニル)コハク酸
水(150mL)中の2-(2-ブロモフェニル)コハク酸4-エチル 1-メチル(11.9g、37.8mmol)の撹拌混合物に、水酸化カリウム(21.2g、378mmol)を添加した。反応混合物を20時間加熱還流させた。冷却した反応混合物のpHを、1M水性HClで3~4に調整した。固体を濾過により収集し、減圧乾燥させて、白色固体の2-(2-ブロモフェニル)コハク酸(9.80g)を得た。
1H NMR(300MHz,DMSO-d6)δ 12.49(brs,2H),7.63(dd,J=8.1,1.5Hz,1H),7.40-7.13(m,3H),4.35-4.30(m,1H),2.89-2.85(m,1H),2.59-2.50(m,1H).
ESI-MS[M+H]+(C10H9BrO4)に対する計算値272.97,274.97;実測値:272.85,274.85.
工程3:3-(2-ブロモフェニル)ジヒドロフラン-2,5-ジオン
塩化アセチル(84.0g)中の2-(2-ブロモフェニル)コハク酸(9.80g、粗)及び二塩化硫黄(4.30g、35.9mmol)の混合物を還流下で3時間撹拌した。冷却した反応混合物を真空濃縮して、黄色固体の3-(2-ブロモフェニル)ジヒドロフラン-2,5-ジオン(9.0g)を得た。
1H NMR(400MHz,DMSO-d6)δ 7.67(dd,J=8.0,1.2Hz,1H),7.55(dd,J=7.6,1.6Hz,1H),7.48-7.36(m,1H),7.34-7.24(m,1H),5.00-4.87(m,1H),3.51-3.35(m,1H),3.21-3.09(m,1H).
ESI-MS[M-H]-(C10H7BrO3)に対する計算値252.96,254.96;実測値:252.85,254.85.
工程4:7-ブロモ-3-オキソ-2,3-ジヒドロ-1H-インデン-1-カルボン酸
1,2-ジクロロエタン(125mL)中の3-(2-ブロモフェニル)ジヒドロフラン-2,5-ジオン(9.0g)の溶液に、1,2-ジクロロエタン(32mL)中の塩化アルミニウム(11.0g、82.5mmol)の溶液を0℃で滴下した。反応混合物を25℃で1時間撹拌した。反応混合物を水(100mL)で希釈し、DCM(3×100mL)で抽出した。合わせた抽出物をブライン(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、黄色固体の7-ブロモ-3-オキソ-2,3-ジヒドロ-1H-インデン-1-カルボン酸(8.30g)を得た。
1H NMR(300MHz,DMSO-d6)δ 12.81(brs,1H),7.96(dd,J=7.8,1.2Hz,1H),7.70(dd,J=7.5,0.9Hz,1H),7.48-7.42(m,1H),4.18-4.09(m,1H),3.23-3.10(m,1H),2.72-2.67(m,1H).
工程5:7-ブロモ-3-オキソ-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル
メタノール(130mL)中の7-ブロモ-3-オキソ-2,3-ジヒドロ-1H-インデン-1-カルボン酸(8.00g、31.4mmol)の溶液に、濃硫酸(4.0mL)を添加した。反応混合物を5時間加熱還流させた。反応混合物を真空濃縮した。残留物を水(150mL)で希釈し、酢酸エチル(3×100mL)で抽出した。合わせた抽出物をブライン(100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から20%酢酸エチル)により精製して、黄色固体の7-ブロモ-3-オキソ-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル(7.30g、86%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.99(d,J=7.8,1.2Hz,1H),7.74(dd,J=7.5,1.2Hz,1H),7.64-7.49(m,1H),4.33(dd,J=8.7,2.9Hz,1H),3.67(s,3H),3.17(dd,J=19.1,8.7Hz,1H),2.79(dd,J=19.1,2.9Hz,1H).
ESI-MS[M+H+ACN]+(C11H9BrO3)に対する計算値309.97,311.97;実測値:309.95,311.95.
工程6:(Z)-7-ブロモ-3-(ヒドロキシイミノ)-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル
MeOH(50mL)中の7-ブロモ-3-オキソ-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル(7.30g、27.1mmol)の溶液に、ヒドロキシルアミン塩酸塩(2.60g、36.8mmol)を添加した。反応混合物を還流下で3時間撹拌した。冷却した反応混合物を水(150mL)で希釈し、酢酸エチル(3×100mL)で抽出した。合わせた抽出物をブライン(2×100mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮して、黄色固体の(Z)-7-ブロモ-3-(ヒドロキシイミノ)-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル(7.5g)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.32(s,1H),7.66-7.58(m,2H),7.39-7.31(m,1H),4.21(dd,J=9.6,3.3Hz,1H),3.65(s,3H),3.23(dd,J=18.9,9.6Hz,1H),2.88(dd,J=18.9,3.3Hz,1H).
ESI-MS[M+H]+(C11H10BrNO3)に対する計算値283.98,285.98;実測値:284.00,286.00.
工程7:3-アミノ-7-ブロモ-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル
酢酸(30mL)中の(Z)-7-ブロモ-3-(ヒドロキシイミノ)-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル(1.0g、3.52mmol)の溶液に、亜鉛粉(2.30g、35.2mmol)及び塩化アンモニウム(1.88g、35.2mmol)を添加した。反応混合物を16時間30℃で撹拌した。反応混合物を飽和水性NaHCO3で塩基性化し、酢酸エチル(3×60mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮させて、白色固体の3-アミノ-7-ブロモ-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル(700mg)を得た。
ESI-MS[M+H]+(C11H12BrNO2)に対する計算値270.01,272.01;実測値:270.00,272.00.
工程8:3-アミノ-7-ブロモ-2,3-ジヒドロ-1H-インデン-1-カルボン酸
2M塩酸(300mL)中の3-アミノ-7-ブロモ-2,3-ジヒドロ-1H-インデン-1-カルボン酸メチル(6.00g、22.2mmol)の混合物を5時間加熱還流させた。冷却した反応混合物のpHを飽和水性重炭酸ナトリウムで7に調整し、混合物を酢酸エチル(4×150mL)で抽出した。合わせた抽出物をブライン(150mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、白色固体の3-アミノ-7-ブロモ-2,3-ジヒドロ-1H-インデン-1-カルボン酸(5.50g)を得た。
1H NMR(300MHz,DMSO-d6)δ 12.94(s,1H),8.57(s,2H),7.69-7.62(m,2H),7.36-7.32(m,1H),4.92-4.74(m,1H),3.99-3.94(m,1H),2.95-2.85(m,1H),2.14-2.08(m,1H).
ESI-MS[M+H]+(C10H10BrNO2)に対する計算値255.99,257.99;実測値:255.95,257.95.
工程9:5-ブロモ-1,4-ジヒドロ-1,4-メタノイソキノリン-3(2H)-オン
アセトニトリル(150mL)中の3-アミノ-7-ブロモ-2,3-ジヒドロ-1H-インデン-1-カルボン酸(5.50g、粗)及びピリジン(9.30g、117mmol)の溶液に、ジシクロヘキシルカルボジイミド(5.3g、25.8mmol)を添加した。反応混合物を1時間加熱還流させた。冷却した反応混合物を水(200mL)でクエンチし、酢酸エチル(3×150mL)で抽出した。合わせた抽出物をブライン(100mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から50%酢酸エチル)により精製して、黄色固体の5-ブロモ-1,4-ジヒドロ-1,4-メタノイソキノリン-3(2H)-オン(2.40g、43%)を得た。
ESI-MS[M+H]+(C10H8BrNO)に対する計算値237.98,239.98;実測値:238.00,240.00.
工程10:5-ブロモ-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン
THF(10mL)中の水素化ホウ素ナトリウム(596mg、15.8mmol)の溶液に、BF3.Et2O(2.98g、21.0mmol)を0℃で添加した。この温度で1時間撹拌した後、THF(10mL)中の5-ブロモ-1,4-ジヒドロ-1,4-メタノイソキノリン-3(2H)-オン(1.25g、5.25mmol)の溶液を滴下した。反応混合物を還流下で16時間撹拌した。冷却した反応混合物を水(40mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(40mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、黄色固体の5-ブロモ-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン(1.00g)を得た。
ESI-MS[M+H]+(C10H10BrN)に対する計算値224.00,226.00;実測値:224.00,226.00.
工程11:1-(5-ブロモ-3,4-ジヒドロ-1,4-メタノイソキノリン-2(1H)-イル)プロパ-2-エン-1-オン
水(2mL)及びTHF(8mL)中の5-ブロモ-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン(800mg、3.57mmol)の混合物に、重炭酸ナトリウム(1.50g、17.9mmol)及び塩化アクリロイル(323mg、3.57mmol)を0℃で添加した。反応混合物を0℃で0.5時間撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から50%酢酸エチル)により精製して、白色固体の1-(5-ブロモ-3,4-ジヒドロ-1,4-メタノイソキノリン-2(1H)-イル)プロパ-2-エン-1-オン(400mg、40%)を得た。
ESI-MS[M+H]+(C13H12BrNO)に対する計算値278.01,280.01;実測値:277.95,279.95.
工程12:4-(2-アクリロイル-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
水(3.0mL)及びジオキサン(12mL)中の1-(5-ブロモ-3,4-ジヒドロ-1,4-メタノイソキノリン-2(1H)-イル)プロパ-2-エン-1-オン(755mg、2.37mmol)、5-フルオロ-2-メチル-4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-インドール-7-カルボキサミド(600mg、2.16mmol)、リン酸カリウム(1.37g、6.47mmol)、及びPd(PPh3)4(250mg、0.216mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下80℃で16時間加熱した。冷却した反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(ジクロロメタン中0から10%メタノール)により精製して、緑色固体の4-(2-アクリロイル-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(440mg、52%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.09(s,1H),8.14(s,1H),7.67-7.21(m,5H),7.08-6.24(m,1H),6.17-5.43(m,4H),3.94-3.45(m,2H),3.03-2.60(m,1H),2.46-2.34(m,3H),2.05-1.92(m,2H).
ESI-MS[M+H]+(C23H20FN3O2)に対する計算値390.15,実測値:390.30.
工程13:4-(2-アクリロイル-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物26)
DMF(6mL)中の4-(2-アクリロイル-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン-5-イル)-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(200mg、0.51mmol)の溶液に、NCS(83mg、0.62mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。反応混合物を水(15mL)でクエンチし、酢酸エチル(3×15mL)で抽出した。合わせた抽出物をブライン(3×20mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取HPLC(カラム:Xselect CSH OBD Column 30×150mm 5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:38% Bから58% B、7分;220nm;保持時間=5.32分)により精製して、白色固体の4-(2-アクリロイル-1,2,3,4-テトラヒドロ-1,4-メタノイソキノリン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(91mg、42%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.49(s,1H),8.21(s,1H),7.71-7.66(m,2H),7.40-7.32(m,1H),7.26-6.20(m,3H),6.18-6.01(m,1H),5.75-5.47(m,2H),3.79-3.40(m,1H),3.31-3.20(m,1H),2.81-2.76(m,1H),2.40-2.31(m,3H),1.96-1.88(m,2H).
ESI-MS[M+H]+(C23H19ClN3O2)に対する計算値424.11,実測値:424.10.
式(III)の化合物の調製
実施例27
4-((3S,5R)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物27)の合成
4-((3S,5R)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物27)の合成
THF(200mL)中の4-ブロモ-5-フルオロ-2-ニトロ安息香酸(17g、64.4mmol)の撹拌溶液に、プロパ-1-エン-2-イルマグネシウムブロミド(451mL、225mmol、THF中0.5M)を窒素下-70℃で滴下した。添加後、反応混合物を-70℃で3時間撹拌した。反応混合物を飽和水性塩化アンモニウム(500mL)でクエンチし、酢酸エチル(2×500mL)で抽出した。合わせた抽出物をブライン(300mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮して、褐色固体の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸(17.5g)を得た。固体を精製せずに持ち越した。
ESI-MS[M-H]-(C10H7BrFNO2)に対する計算値269.96,271.96 実測値:270.25,272.25.
工程2:4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
DMF(200mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボン酸(17.5g、64.4mmol)、塩酸アンモニア(5.17g、96.6mmol)、及びHATU(29.4g、77.3mmol)の撹拌溶液に、N-エチル-N-イソプロピル-プロパン-2-アミン(25.0g、193mmol)を添加した。反応混合物を25℃で16時間撹拌した。反応混合物を水(300mL)でクエンチし、酢酸エチル(3×300mL)で抽出した。合わせた抽出物を、水(200mL)、ブライン(200mL)で洗浄し、次いで無水硫酸ナトリウムで乾燥させ、真空濃縮した。濃縮物をカラムクロマトグラフィー(石油エーテル中50%酢酸エチル)により精製して、黄色固体の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(3.8g、22%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.26(s,1H),8.11(s,1H),7.63-7.53(m,2H),6.19(s,1H),2.42(s,3H).
ESI-MS[M+H]+(C10H8BrFN2O)に対する計算値270.98,272.98実測値:270.90,272.90.
工程3:4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボニトリル
DCM(40mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(2.00g、7.38mmol)の混合物に、ピリジン(1.46g、18.4mmol)及びオキシ塩化リン(1.70g、11.1mmol)を0℃で添加した。反応混合物を2時間25℃で撹拌した。反応混合物を真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から10%酢酸エチル)により精製して、白色固体の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボニトリル(1.50g、80%)を得た。
1H NMR(400MHz,DMSO-d6)δ 12.26(s,1H),7.63(d,J=9.2Hz,1H),6.34-6.31(m,1H),2.42(s,3H).
ESI-MS[M-H]-(C10H6BrFN2)に対する計算値250.97,252.97;実測値:250.95,252.95.
工程4:((3S,5R)-1-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
ジオキサン(10mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボニトリル(500mg、1.74mmol)、((3S,5R)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(418mg、1.91mmol)、ベンジル-[1-[2-[ベンジル(フェニル)ホスファニル]-1-ナフチル]-2-ナフチル]-フェニル-ホスファン(453mg、696μmol)、トリス(ジベンジリデンアセトン)ジパラジウム(360mg、348μmol)、及び炭酸セシウム(1.70g、5.22mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を、窒素下100℃で16時間加熱した。冷却した反応混合物を真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から16%酢酸エチル)により精製して、黄色固体の((3S,5R)-1-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(380mg)を得た。
ESI-MS[M+H]+(C20H24F2N4O2)に対する計算値391.19,実測値:391.15.
工程5:((3S,5R)-1-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
エタノール(16mL)及び水(4mL)中の((3S,5R)-1-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(350mg、0.89mmol)の混合物に、Parkin触媒(19mg、0.045mmol)を添加した。反応物を2時間90℃で撹拌した。冷却した反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から50%酢酸エチル)により精製して、黄色固体の((3S,5R)-1-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(320mg)を得た。
ESI-MS[M+H]+(C20H26F2N4O3)に対する計算値409.20,実測値:409.10.
工程6:((3S,5R)-1-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
((3S,5R)-1-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル:N,N-ジメチルホルムアミド(8mL)中の((3S,5R)-1-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(250mg、0.61mmol)の溶液に、N-クロロスクシンイミド(82mg、0.61mmol)を0℃で添加した。反応混合物を2時間0℃で撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、(石油エーテル中0から50%酢酸エチル)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、((3S,5R)-1-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(240mg)を得た。
ESI-MS[M+H]+(C15H17ClF2N4O)に対する計算値443.16,445.16;実測値:443.15,445.15
工程7:4-((3S,5R)-3-アミノ-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド塩酸塩
ジオキサン(10mL)中の((3S,5R)-1-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(200mg、0.45mmol)及び4M塩化水素の混合物を2時間20℃で撹拌した。反応混合物を真空濃縮して、44-((3S,5R)-3-アミノ-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド塩酸塩(170mg)を得た。
ESI-MS[M+H]+(C15H17ClF2N4O)に対する計算値343.11,345.11;実測値:343.05,345.05.
工程8:4-((3S,5R)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
N,N-ジメチルホルムアミド(8mL)中の4-((3S,5R)-3-アミノ-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド塩酸塩(170mg、0.49mmol)、ブテ-2-イノ酸(42mg、0.49mmol)、及びN,N,N’,N’-テトラメチル-O-(7-アザベンゾトリアゾール-1-イル)ウロニウムヘキサフルオロホスフェート(207mg、0.55mmol)の混合物に、N,N-ジイソプロピルエチルアミン(321mg、2.48mmol)を添加した。反応混合物を2時間20℃で撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(3×30mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取HPLC(カラム:YMC-Actus Triart C18、30×250mm、5um;移動相A:水(10 MMOL/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:8分で36% Bから47% B;254nm;RT1:7.5分により精製して、灰白色固体の4-((3S,5R)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(14.4mg)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.27(s,1H),8.43(s,1H),8.03(s,1H),7.61-7.42(m,2H),5.15-4.85(m,1H),4.49(s,1H),3.32-3.15(m,2H),2.90-2.70(m,1H),2.45-2.35(m,4H),2.20-2.08(m,1H),1.94(s,3H),1.75-1.50(m,1H).
ESI-MS[M+H]+(C19H19ClF2N4O2)に対する計算値409.12,411.12;実測値:409.05,411.05
実施例28
4-((3S,5S)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物28)の合成
4-((3S,5S)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物28)の合成
ジオキサン(10mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボニトリル(500mg、1.74mmol)、((3S,5S)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(418mg、1.91mmol)、ベンジル-[1-[2-[ベンジル(フェニル)ホスファニル]-1-ナフチル]-2-ナフチル]-フェニル-ホスファン(453mg、0.696mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(360mg、0.348mmol)、及び炭酸セシウム(1.70g、5.22mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下100℃で16時間加熱した。冷却した反応混合物を真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から16%酢酸エチル)により精製して、黄色固体の((3S,5S)-1-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(320mg)を得た。
ESI-MS[M+H]+(C20H24F2N4O2)に対する計算値391.19、実測値:391.10.
工程2:((3S,5S)-1-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
水(4mL)及びエタノール(16mL)中の((3S,5S)-1-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(320mg、0.82mmol)の混合物に、Parkin触媒(18mg、0.041mmol)を添加した。反応混合物を2時間90℃で加熱した。冷却した反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から50%酢酸エチル)により精製して、黄色固体の((3S,5S)-1-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(350mg)を得た。
ESI-MS[M+H]+(C20H26F2N4O3)に対する計算値409.20,実測値:409.10.
工程3:((3S,5S)-1-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
DMF(6mL)中の((3S,5S)-1-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(250mg、0.61mmol)の溶液に、N-クロロスクシンイミド(82mg、0.61mmol)を0℃で添加した。反応混合物を2時間0℃で撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(5mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、(石油エーテル中0から50%酢酸エチル)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、((3S,5S)-1-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(250mg)を得た。
ESI-MS[M+H]+(C20H25ClF2N4O3)に対する計算値443.16,445.16;実測値:443.15,445.15.
工程4:4-((3S,5S)-3-アミノ-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド塩酸塩
ジオキサン(10mL)中の(3S,5S)-1-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イルカルバミン酸tert-ブチル(250mg、粗)及び4M塩化水素の混合物を2時間20℃で撹拌した。反応混合物を真空濃縮して、4-((3S,5S)-3-アミノ-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド塩酸塩(200mg)を得た。
ESI-MS[M+H]+(C15H17ClF2N4O)に対する計算値343.11,345.11;実測値:343.10,345.10
工程5:4-((3S,5S)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
N,N-ジメチルホルムアミド(8mL)中の4-((3S,5S)-3-アミノ-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド塩酸塩(200mg、0.527mmol)、ブテ-2-イノ酸(44mg、0.527mmol)、及びN,N,N’,N’-テトラメチル-O-(7-アザベンゾトリアゾール-1-イル)ウロニウムヘキサフルオロホスフェート(221mg、0.58mmol)の溶液に、N,N-ジイソプロピルエチルアミン(341mg、2.64mmol)を添加した。混合物を2時間20℃で撹拌した。反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取HPLC(カラム:XBridge Prep OBD C18 Column、19×250mm、5um;移動相A:水(10MMOL/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:25mL/分;勾配:7分で38% Bから58% B;220nm;RT:5.12分により精製して、白色固体の4-((3S,5S)-3-ブテ-2-イナミド-5-フルオロピペリジン-1-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(34.9mg、16%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.28(s,1H),8.45(s,1H),8.03(s,1H),7.62-7.44(m,2H),5.12-4.88(m,1H),4.62-4.40(m,1H),3.51-3.35(m,1H),3.32-3.15(m,2H),2.90-2.70(m,1H),2.37(s,3H),2.21-2.03(m,1H),1.94(s,3H),1.78-1.44(m,1H).
実施例29
4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物29)の合成
4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物29)の合成
ジオキサン(15mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボニトリル(500mg、1.74mmol)、オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(シス-エナンチオマー混合物、433mg、1.91mmol)、ベンジル-[1-[2-[ベンジル(フェニル)ホスファニル]-1-ナフチル]-2-ナフチル]-フェニル-ホスファン(453mg、0.696mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(360mg、0.348mmol)、及び炭酸セシウム(1.70g、5.22mmol)の混合物を脱気し、窒素で詰め戻した。反応混合物を窒素下100℃で16時間加熱した。冷却した反応混合物を真空濃縮した。残留物を、(石油エーテル中0から16%酢酸エチル)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の6-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(400mg)を得た。
ESI-MS[M+H]+(C22H27FN4O2)に対する計算値399.21,実測値:399.20.
工程2:6-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル
水(4mL)及びエタノール(16mL)中の6-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(350mg、0.88mmol)の混合物に、Parkin触媒(19mg、0.044mmol)を添加した。反応混合物を2時間90℃で撹拌した。冷却した反応混合物を水(60mL)で希釈し、酢酸エチル(3×50mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を、(石油エーテル中0から50%酢酸エチル)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、黄色固体の6-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(350mg)を得た。
ESI-MS[M+H]+計算値(C22H29FN4O3)に対する417.22,実測値:417.20.
工程3:6-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル
DMF(6mL)中の6-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(330mg、0.792mmol)の溶液に、N-クロロスクシンイミド(106mg、0.792mmol)を0℃で添加した。反応混合物を2時間0℃で撹拌した。反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から50%酢酸エチル)により精製して、6-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(350mg)を得た。
ESI-MS[M+H]+(C22H28ClFN4O3)に対する計算値451.18,453.18;実測値:451.05,453.05.
工程4:3-クロロ-5-フルオロ-2-メチル-4-(オクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-1H-インドール-7-カルボキサミド 2,2,2-トリフルオロアセテート
ジクロロメタン(5mL)中の6-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(300mg、0.665mmol)の溶液に、トリフルオロ酢酸(5mL)を添加した。反応混合物を2時間25℃で撹拌した。反応混合物を真空濃縮して、3-クロロ-5-フルオロ-2-メチル-4-(オクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-1H-インドール-7-カルボキサミド2,2,2-トリフルオロアセテート(310mg)を得た。
ESI-MS[M+H]+(C17H20ClFN4O)に対する計算値351.13,353.13;実測値:351.05,353.05
工程5:4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
テトラヒドロフラン(3mL)中の3-クロロ-5-フルオロ-2-メチル-4-(オクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-1H-インドール-7-カルボキサミド 2,2,2-トリフルオロアセテート(310mg、0.667mmol)の混合物に、N,N-ジイソプロピルエチルアミン(517mg、4.00mmol)及び塩化アクリロイル(66mg、0.734mmol)を-78℃で添加した。反応混合物を0.5時間-78℃で撹拌した。反応混合物を水(30mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、硫酸ナトリウムで乾燥させ、真空濃縮した。残留物を分取HPLC(カラム:XBridge Prep OBD C18 Column、19×250mm、5um;移動相A:水(10MMOL/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:25mL/分;勾配:7分で40% Bから60% B;220nm;保持時間=5.78分)により精製して、白色ラセミ型混合物の4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(110mg、40%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.26(d,J=12.0Hz,1H),8.01(s,1H),7.60-7.35(m,2H),6.63-6.48(m,1H),6.15-6.05(m,1H),5.69-5.58(m,1H),4.38-4.27(m,1H),3.77-3.69(m,0.5H),3.58-3.49(m,1H),3.49-3.36(m,1H),3.32-3.10(m,2H),3.05-2.87(m,2H),2.58-2.52(m,0.5H),2.39(d,J=5.2Hz,3H),2.28-2.06(m,2H),1.95-1.63(m,2H).
ESI-MS[M+H]+(C20H22ClFN4O2)に対する計算値405.14,407.14;実測値:405.10,407.10
工程6:異性体の分離
ラセミ型4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミドを、分取キラルHPLC(試料量=90mg;カラム:Chiralpak IA、2×25cm、5um;移動相A:MTBE(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:18mL/分;勾配:50% B、アイソクラティック;220/254nm)により、そのそれぞれのエナンチオマーに分離させた。
ラセミ型4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミドを、分取キラルHPLC(試料量=90mg;カラム:Chiralpak IA、2×25cm、5um;移動相A:MTBE(0.5% 2M NH3-MeOH)、移動相B:EtOH;流量:18mL/分;勾配:50% B、アイソクラティック;220/254nm)により、そのそれぞれのエナンチオマーに分離させた。
化合物29a:保持時間=8.163分(29.1mg)。白色固体として単離
1H NMR(400MHz,DMSO-d6)δ 11.27(d,J=12.0Hz,1H),8.02(s,1H),7.58-7.39(m,2H),6.65-6.48(m,1H),6.16-6.06(m,1H),5.69-5.59(m,1H),4.39-4.23(m,1H),3.77-3.69(m,0.5H),3.58-3.49(m,1H),3.49-3.35(m,1H),3.32-3.10(m,2H),3.06-2.88(m,2H),2.58-2.54(m,0.5H),2.39(d,J=5.2Hz,3H),2.27-2.06(m,2H),1.95-1.76(m,1H),1.75-1.61(m,1H).ESI-MS[M+H]+(C20H22ClFN4O2)に対する計算値405.14,407.14;実測値:405.10,407.10.
1H NMR(400MHz,DMSO-d6)δ 11.27(d,J=12.0Hz,1H),8.02(s,1H),7.58-7.39(m,2H),6.65-6.48(m,1H),6.16-6.06(m,1H),5.69-5.59(m,1H),4.39-4.23(m,1H),3.77-3.69(m,0.5H),3.58-3.49(m,1H),3.49-3.35(m,1H),3.32-3.10(m,2H),3.06-2.88(m,2H),2.58-2.54(m,0.5H),2.39(d,J=5.2Hz,3H),2.27-2.06(m,2H),1.95-1.76(m,1H),1.75-1.61(m,1H).ESI-MS[M+H]+(C20H22ClFN4O2)に対する計算値405.14,407.14;実測値:405.10,407.10.
化合物29b:保持時間=11.102分(30.9mg)。白色固体として単離
1H NMR(400MHz,DMSO-d6)δ 11.27(d,J=12.0Hz,1H),8.02(s,1H),7.61-7.31(m,2H),6.64-6.48(m,1H),6.15-6.07(m,1H),5.69-5.57(m,1H),4.41-4.24(m,1H),3.77-3.69(m,0.5H),3.61-3.49(m,1H),3.48-3.37(m,1H),3.31-3.11(m,2H),3.06-2.85(m,2H),2.60-2.51(m,0.5H),2.39(d,J=5.2Hz,3H),2.28-2.06(m,2H),1.93-1.65(m,2H).
1H NMR(400MHz,DMSO-d6)δ 11.27(d,J=12.0Hz,1H),8.02(s,1H),7.61-7.31(m,2H),6.64-6.48(m,1H),6.15-6.07(m,1H),5.69-5.57(m,1H),4.41-4.24(m,1H),3.77-3.69(m,0.5H),3.61-3.49(m,1H),3.48-3.37(m,1H),3.31-3.11(m,2H),3.06-2.85(m,2H),2.60-2.51(m,0.5H),2.39(d,J=5.2Hz,3H),2.28-2.06(m,2H),1.93-1.65(m,2H).
ESI-MS[M+H]+(C20H22ClFN4O2)に対する計算値405.14,407.14;実測値:405.10,407.10.
実施例30
4-((3S,4S)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物30)の合成
4-((3S,4S)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物30)の合成
1,4-ジオキサン(10mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボニトリル(250mg、0.94mmol)及び((3S,4S)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(225mg、1.03mmol)の混合物に、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(61mg、0.09mmol)、トリス(ジベンジリデン-アセトン)ジパラジウム(86mg、0.09mmol)、及び炭酸セシウム(457mg、1.40mmol)を、窒素雰囲気下20℃で添加した。混合物を脱気し、窒素で3回詰め戻し、16時間100℃で撹拌した。冷却した混合物を水(50mL)で希釈し、酢酸エチル(50mL×3)で抽出した。合わせた抽出物を水(50ml×2)及びブライン(50mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をシリカでのカラムクロマトグラフィー(石油エーテル中0から25%酢酸エチル)により精製して、薄黄色固体の((3S,4S)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(290mg、77%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.59(s,1H),7.36(d,J=12.7Hz,1H),7.12(s,1H),4.64-4.35(m,1H),3.85-3.67(m,1H),3.18-3.04(m,3H),2.83(t,J=11.0Hz,1H),2.37(s,3H),2.30(s,3H),2.21-2.08(m,1H),1.91-1.74(m,1H),1.34(s,9H).
工程2:((3S,4S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
DMSO(5mL)中の((3S,4S)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(290mg、0.72mmol)及び炭酸カリウム(297mg、2.15mmol)の混合物に、過酸化水素(30%、813mg、7.17mmol)を添加した。反応混合物を30分間60℃で撹拌した。冷却した混合物を水(50mL)で希釈し、酢酸エチル(40mL×3)で抽出した。合わせた抽出物を水(50mL×3)及びブライン(50mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮して、黄色固体の((3S,4S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(300mg、99%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.64(s,1H),7.91(s,1H),7.39(d,J=14.0Hz,1H),7.34(s,1H),7.10(s,1H),4.63-4.36(m,1H),3.85-3.69(m,1H),3.19-3.01(m,3H),2.84(t,J=1.09Hz,1H),2.37(s,3H),2.31(s,3H),2.20-2.09(m,1H),1.91-1.76(m,1H),1.34(s,9H).
工程3:4-((3S,4S)-3-アミノ-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩
メタノール(5mL)中の((3S,4S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(300mg、0.71mmol)の溶液に、塩化水素(10mL、1,4-ジオキサン中4M)を添加した。反応混合物を2時間20℃で撹拌した。得られた混合物を真空濃縮して、黄色固体の4-((3S,4S)-3-アミノ-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(320mg、粗)を得た。
ESI-MS[M+H]+(C16H20F2N4O)に対する計算値323.16,実測値:323.25.
工程4:4-((3S,4S)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド
水(3.0mL)及びTHF(12mL)中の4-((3S,4S)-3-アミノ-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(320mg、0.89mmol)及び重炭酸ナトリウム(749mg、8.92mmol)の混合物に、塩化アクリロイル(81mg、0.89mmol)を0℃で添加した。反応混合物を1時間撹拌し、得られた混合物を水(30mL)で希釈し、酢酸エチル(2×30mL)で抽出した。合わせた抽出物を水及びブラインで洗浄し、次いで無水硫酸ナトリウムで乾燥させ、濾過し、減圧濃縮した。残留物を分取HPLC(カラム:YMC-Actus Triart C18、30×250mm、5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:45mL/分;勾配:7分で35% Bから45% B;254,220nm、保持時間=6.48分により精製して、灰白色固体の4-((3S,4S)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(50.2mg、15%)を得た。
1H NMR(300MHz,DMSO-d6)δ(ppm):10.65(s,1H),8.31(s,1H),7.92(s,1H),7.41(d,J=14.1Hz,1H),7.34(s,1H),6.32-6.00(m,2H),5.61(dd,J=9.8,2.5Hz,1H),4.79-4.45(m,1H),4.30-4.06(m,1H),3.26-3.05(m,3H),3.01-2.85(m,1H),2.42(s,3H),2.33(s,3H),2.28-2.15(m,1H),2.03-1.82(m,1H).
ESI-MS[M+H]+(C19H22F2N4O2)に対する計算値377.17,実測値:377.25.
実施例31
4-((3S,4R)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物31)の合成
4-((3S,4R)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物31)の合成
1,4-ジオキサン(10mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボニトリル(250mg、0.94mmol)及び((3S,4R)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(225mg、1.03mmol)の混合物に、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(61mg、0.09mmol)、トリス(ジベンジリデン-アセトン)ジパラジウム(86mg、0.09mmol)、及び炭酸セシウム(610mg、1.87mmol)を添加した。反応混合物を脱気し、窒素で詰め戻し、次いで100℃で16時間撹拌した。冷却した混合物を水(50mL)で希釈し、酢酸エチル(3×50mL)で抽出した。合わせた抽出物を水(2×50mL)及びブライン(50mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から25%酢酸エチル)により精製して、薄黄色固体の((3S,4R)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(238mg、63%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.58(s,1H),7.37(d,J=12.8Hz,1H),7.01(s,1H),4.97-4.78(m,1H),3.91-3.72(m,1H),3.25-3.14(m,2H),3.00-2.79(m,2H),2.34(s,3H),2.29(s,3H),2.09-1.87(m,2H),1.35(s,9H).
ESI-MS[M+H]+(C21H26F2N4O2)に対する計算値405.20,実測値:405.25.
工程2:((3S,4R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
DMSO(5mL)中の((3S,4R)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(238mg、0.59mmol)及び炭酸カリウム(244mg、1.77mmol)の混合物に、過酸化水素(30%、667mg、5.88mmol)を添加した。反応混合物を30分間60℃で撹拌した。冷却した混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物を水(3×30mL)及びブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮して、薄黄色固体の((3S,4R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(240mg、97%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.64(s,1H),7.91(s,1H),7.40(d,J=14.0Hz,1H),7.33(s,1H),6.99(s,1H),4.97-4.77(m,1H),3.91-3.74(m,1H),3.28-3.14(m,2H),2.94-2.79(m,2H),2.34(s,3H),2.30(s,3H),2.06-1.95(m,2H),1.36(s,9H).
ESI-MS[M+H]+(C21H28F2N4O3)に対する計算値423.21,実測値:423.15.
工程3:4-((3S,4R)-3-アミノ-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩
メタノール(5mL)中の((3S,4R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-4-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(240mg、0.57mmol)の溶液に、塩化水素(10mL、1,4-ジオキサン中4M)を添加した。反応混合物を2時間20℃で撹拌した。得られた混合物を真空濃縮して、薄黄色固体の4-((3S,4R)-3-アミノ-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(260mg、粗)を得た。
ESI-MS[M+H]+(C16H20F2N4O)に対する計算値323.16,実測値:323.25
工程4:4-((3S,4R)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド
水(3mL)及びTHF(12mL)の混合溶媒中の4-((3S,4R)-3-アミノ-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(260mg、0.72mmol)及び重炭酸ナトリウム(609mg、7.25mmol)の混合物に、塩化アクリロイル(66mg、0.72mmol)を0℃で添加した。反応混合物を1時間0℃で撹拌した。得られた混合物を水(30mL)で希釈し、酢酸エチル(2×30mL)で抽出した。合わせた抽出物を水(3×30mL)及びブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、減圧濃縮した。残留物を分取HPLC(カラム:YMC-Actus Triart C18、30×250mm、5um;移動相A:水(10mmol/L NH4HCO3)、移動相B:アセトニトリル;流量:50mL/分;勾配:7分で40% Bから70% B;220nm;保持時間=6.08分により精製して、灰白色固体の4-((3S,4R)-3-アクリルアミド-4-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(5.0mg、1.8%)を得た。
1H NMR(300MHz,DMSO-d6)δ(ppm):10.64(s,1H),8.29(s,1H),7.93(s,1H),7.42(d,J=14.1Hz,1H),7.34(s,1H),6.42-6.31(m,1H),6.14-6.07(m,1H),5.62-5.56(m,1H),5.03-4.84(m,1H),4.30-4.19(m,1H),3.05-2.86(m,2H),2.44-2.28(m,8H),2.20-1.96(m,2H).
ESI-MS[M+H]+(C19H22F2N4O2)に対する計算値377.17,実測値:377.25.
実施例32
4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物32)の合成
4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物32)の合成
1,4-ジオキサン(20mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボニトリル(650mg、2.43mmol)及びラセミ型シス-tert-ブチルオクタヒドロピロロ[2,3-c]ピリジン-1-カルボン酸(606mg、2.68mmol)の混合物に、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(152mg、0.24mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(223mg、0.24mmol)、及び炭酸セシウム(1.59g、4.86mmol)を添加した。反応混合物を脱気し、窒素で3回詰め戻し、窒素下100℃で16時間撹拌した。冷却した混合物を水(150mL)で希釈し、酢酸エチル(3×100mL)で抽出した。合わせた抽出物を水(2×100mL)及びブライン(150mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を、(石油エーテル中0から20%酢酸エチル)で溶出させるシリカゲルでのカラムクロマトグラフィーにより精製して、薄黄色固体の6-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(410mg、41%)を得た。
ESI-MS[M+H]+(C23H29FN4O2)に対する計算値413.23,実測値:413.20
工程2:6-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル
エタノール(16mL)及び水(4.0mL)中の6-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(410mg、0.99mmol)の混合物に、Parkin触媒(22mg、0.05mmol)を添加した。反応混合物を1時間90℃で撹拌した。冷却した混合物を水(50mL)に注ぎ入れた。沈殿物を濾過により収集し、水(20mL)で洗浄し、減圧乾燥させて、薄黄色固体の6-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(330mg、77%)を得た。
ESI-MS[M+H]+(C23H31FN4O3)に対する計算値431.24,実測値:431.15.
工程3:5-フルオロ-2,3-ジメチル-4-(オクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-1H-インドール-7-カルボキサミド 2,2,2-トリフルオロアセテート
ジクロロメタン(8mL)中の6-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[2,3-c]ピリジン-1-カルボン酸tert-ブチル(330mg、0.77mmol)の溶液に、トリフルオロ酢酸(2.0mL)を添加した。反応混合物を1時間20℃で撹拌した。反応混合物を真空濃縮して、褐色固体の5-フルオロ-2,3-ジメチル-4-(オクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-1H-インドール-7-カルボキサミド 2,2,2-トリフルオロアセテート(400mg)を得た。
ESI-MS[M+H]+(C18H23FN4O)に対する計算値331.19,実測値:331.15
工程4:4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド
テトラヒドロフラン(15mL)中の5-フルオロ-2,3-ジメチル-4-(オクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-1H-インドール-7-カルボキサミド 2,2,2-トリフルオロアセテート(400mg、粗)及びN,N-ジイソプロピルエチルアミン(995mg、7.70mmol)の溶液に、塩化アクリロイル(70mg、0.77mmol)を-78℃で添加した。反応混合物を1時間-78℃で撹拌した。反応混合物を水(50mL)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた抽出物を水(2×30mL)及びブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取TLC(シリカゲル、溶出剤:ジクロロメタン/メタノール=20:1)により精製して、灰白色固体の4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(130mg、2工程で44%)を得た。
1H NMR(300MHz,DMSO-d6)δ(ppm):10.67-10.59(m,1H),7.91(s,1H),7.47-7.32(m,2H),6.60-6.46(m,1H),6.14-6.04(m,1H),5.69-5.55(m,1H),4.42-4.13(m,1H),3.78-3.64(m,1H),3.61-3.48(m,1H),3.46-3.35(m,2H),3.25-3.12(m,1H),3.11-2.84(m,2H),2.41(s,3H),2.33(s,3H),2.22-2.02(m,2H),1.97-1.81(m,1H),1.78-1.66(m,1H).
ESI-MS[M+H]+(C21H25FN4O2)に対する計算値385.20,実測値:385.30.
工程5:
4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミドの異性体を分取キラルHPLC(試料=130mg、カラム:CHIRALPAK IA,2×25cm、5um;移動相A:MTBE(0.5% 2M NH3-MeOH)、移動相B:IPA--HPLC;流量:18mL/分;勾配:45% B、アイソクラティック;220/254nmにより精製した。
4-(1-アクリロイルオクタヒドロ-6H-ピロロ[2,3-c]ピリジン-6-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミドの異性体を分取キラルHPLC(試料=130mg、カラム:CHIRALPAK IA,2×25cm、5um;移動相A:MTBE(0.5% 2M NH3-MeOH)、移動相B:IPA--HPLC;流量:18mL/分;勾配:45% B、アイソクラティック;220/254nmにより精製した。
化合物32a:保持時間=4.826分(55mg).灰白色固体として単離.
1H NMR(300MHz,DMSO-d6)δ(ppm):10.65(d,J=6.1Hz,1H),7.93(s,1H),7.42(dd,J=14.2,4.0Hz,1H),7.35(s,1H),6.54(dd,J=16.9,10.5Hz,1H),6.10(dd,J=16.7,2.5Hz,1H),5.63(dd,J=10.3,2.5Hz,1H),4.42-4.16(m,1H),3.81-3.67(m,1H),3.61-3.47(m,1H),3.46-3.37(m,2H),3.27-3.14(m,1H),3.10-2.74(m,2H),2.42(s,3H),2.33(s,3H),2.25-2.01(m,2H),1.95-1.79(m,1H),1.78-1.68(m,1H).
1H NMR(300MHz,DMSO-d6)δ(ppm):10.65(d,J=6.1Hz,1H),7.93(s,1H),7.42(dd,J=14.2,4.0Hz,1H),7.35(s,1H),6.54(dd,J=16.9,10.5Hz,1H),6.10(dd,J=16.7,2.5Hz,1H),5.63(dd,J=10.3,2.5Hz,1H),4.42-4.16(m,1H),3.81-3.67(m,1H),3.61-3.47(m,1H),3.46-3.37(m,2H),3.27-3.14(m,1H),3.10-2.74(m,2H),2.42(s,3H),2.33(s,3H),2.25-2.01(m,2H),1.95-1.79(m,1H),1.78-1.68(m,1H).
ESI-MS[M+H]+(C21H25FN4O2)に対する計算値385.20,実測値:385.15.
化合物32b:保持時間=6.483分(52mg).灰白色固体として単離.
1H NMR(300MHz,DMSO-d6)δ(ppm):10.65(d,J=6.1Hz,1H),7.93(s,1H),7.42(dd,J=14.2,4.0Hz,1H),7.35(s,1H),6.54(dd,J=16.8,10.2Hz,1H),6.10(dd,J=16.7,2.5Hz,1H),5.63(dd,J=10.3,2.5Hz,1H),4.42-4.17(m,1H),3.79-3.67(m,1H),3.61-3.48(m,1H),3.46-3.37(m,2H),3.28-3.13(m,1H),3.10-2.72(m,2H),2.42(s,3H),2.33(s,3H),2.26-2.02(m,2H),1.96-1.79(m,1H),1.78-1.66(m,1H).
1H NMR(300MHz,DMSO-d6)δ(ppm):10.65(d,J=6.1Hz,1H),7.93(s,1H),7.42(dd,J=14.2,4.0Hz,1H),7.35(s,1H),6.54(dd,J=16.8,10.2Hz,1H),6.10(dd,J=16.7,2.5Hz,1H),5.63(dd,J=10.3,2.5Hz,1H),4.42-4.17(m,1H),3.79-3.67(m,1H),3.61-3.48(m,1H),3.46-3.37(m,2H),3.28-3.13(m,1H),3.10-2.72(m,2H),2.42(s,3H),2.33(s,3H),2.26-2.02(m,2H),1.96-1.79(m,1H),1.78-1.66(m,1H).
ESI-MS[M+H]+(C21H25FN4O2)に対する計算値385.20,実測値:385.15.
実施例33
4-((3S,5R)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物7)の合成
4-((3S,5R)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物7)の合成
ジクロロメタン(12mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(600mg、2.10mmol)の溶液に、ピリジン(416mg、5.26mmol)及びオキシ塩化リン(484mg、3.16mmol)を添加した。混合物を20℃で0.5時間撹拌した。完了後、反応混合物を真空濃縮した。残留物を水で洗浄し、濾過し、減圧乾燥させて、赤色固体の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボニトリル(520mg、92%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.96(s,1H),7.58(d,J=9.3Hz,1H),2.38(s,3H),2.33(s,3H).
工程2:((3S,5R)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
ジオキサン(8mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボニトリル(400mg、1.50mmol)及び((3S,5R)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(360mg、1.65mmol)の混合物に、トリス(ジベンジリデンアセトン)ジパラジウム(137mg、0.15mmol)、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(93mg、0.15mmol)、及び炭酸セシウム(732mg、2.25mmol)を添加した。反応混合物を排気し、窒素雰囲気で3回フラッシュし、窒素下100℃で16時間撹拌した。冷却した反応混合物を水(20ml)でクエンチし、酢酸エチル(3×20ml)で抽出した。合わせた抽出物をブライン(30ml)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から20%酢酸エチルにより精製して、白色固体の((3S,5R)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(350mg、58%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.60(s,1H),7.39(d,J=12.6Hz,1H),6.94(d,J=8.1Hz,1H),5.11-4.88(m,1H),4.05-3.96(m,1H),3.29-3.15(m,3H),2.76-2.66(m,1H),2.41(s,3H),2.32(s,3H),2.19-2.07(m,1H),1.77-1.52(m,1H),1.36(s,9H).
ESI-MS[M+H]+(C21H26F2N4O2)に対する計算値405.20 実測値:405.10.
工程3:((3S,5R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
ジメチルスルホキシド(6.0mL)中の((3S,5R)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(320mg、0.79mmol)の溶液に、炭酸カリウム(328mg、2.37mmol)及び過酸化水素(30%、1.34g、11.87mmol)を添加した。反応混合物を60℃で2時間撹拌し、次いで室温に冷却した。反応混合物を水(15mL)で希釈し、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(30ml)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から80%酢酸エチル)により精製して、黄色固体の((3S,5R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(250mg、75%)を得た。
1H NMR(300MHz,DMSO-d6)δ 10.62(s,1H),7.92(s,1H),7.40(d,J=14.1Hz,1H),7.3 4(s,1H),6.88(d,J=8.1Hz,1H),5.10-4.85(m,1H),4.00-3.93(m,1H),3.24-3.13(m,3H),2.74-2.65(m,1H),2.38(s,3H),2.30(s,3H),2.19-2.05(m,1H),1.72-1.48(m,1H),1.34(s,9H).
ESI-MS[M+H]+(C21H28F2N4O3)に対する計算値423.21,実測値:423.30.
工程4:4-((3S,5R)-3-アミノ-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩
((3S,5R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(250mg、0.59mmol)及び塩化水素(ジオキサン中4M、5.0mL)を20℃で2時間撹拌した。反応混合物を真空濃縮して、黄色固体の4-((3S,5R)-3-アミノ-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(240mg)を得た。
ESI-MS[M+H]+(C16H20F2N4O)に対する計算値323.16,実測値:323.15.
工程5:4-((3S,5R)-3-アミノ-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩
N,N-ジメチルホルムアミド(3mL)中のブテ-2-イノ酸(28mg、0.33mmol)の溶液に、HATU(148mg、0.39mmol)、4-((3S,5R)-3-アミノ-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(100mg、0.28mmol,)、及びN,N-ジイソプロピルエチルアミン(108mg、0.84mmol)を添加した。反応混合物を20℃で2時間撹拌した。反応混合物を水(15ml)でクエンチし、酢酸エチル(3×10mL)で抽出した。合わせた抽出物をブライン(30ml)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:X Bridge Shield RP18 OBD Column、19×250mm、10um;移動相A:水(10mmoL/L NH4HCO3)、移動相B:アセトニトリル;流量:25mL/分;勾配:35% Bから46% B、9分;254nm;保持時間=8.03分)により精製して、灰白色固体の4-((3S,5R)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(46mg、42%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.63(s,1H),8.51(d,J=8.4Hz,1H),7.93(s,1H),7.41(d,J=14.0Hz,1H),7.35(s,1H),5.05-4.93(m,1H),4.39-4.23(m,1H),3.27-3.13(m,3H),2.82-2.77(m,1H),2.38(s,3H),2.31(s,3H),2.25-2.14(m,1H),1.94(s,3H),1.76-1.56(m,1H).
ESI-MS[M+H]+(C20H22F2N4O2)に対する計算値389.17,実測値:389.05.
実施例34
4-((3S,5R)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物34)の合成
4-((3S,5R)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物34)の合成
4-((3S,5R)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド:テトラヒドロフラン(2.0mL)及び水(0.5mL)中の4-[(3S,5R)-3-アミノ-5-フルオロピペリジン-1-yl]-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(100mg、0.28mmol)の混合物に、重炭酸ナトリウム(70mg、0.84mmol)及び塩化アクリロイル(30mg、0.33mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。反応混合物を水(20ml)で希釈し、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(30ml)で洗浄し、硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:X Bridge Shield RP18 OBD Column、19×250mm、10um;移動相A:水(10mmoL/L NH4HCO3)、移動相B:アセトニトリル;流量:25mL/分;勾配:30% Bから50% B、8分;254nm;保持時間=7.77分)により精製して、白色固体の4-((3S,5R)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(42.7mg、41%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.63(s,1H),8.07(d,J=8.0Hz,1H),7.93(s,1H),7.42(d,J=14.0Hz,1H),7.35(s,1H),6.25-6.03(m,2H),5.58(dd,J=9.6,2.4Hz,1H),5.08-4.95(m,1H),4.45-4.32(m,1H),3.40-3.36(m,1H),3.27-3.20(m,2H),2.79(t,J=9.6Hz,1H),2.42(s,3H),2.32(s,3H),2.25-2.15(m,1H),1.75-1.56(m,1H).
ESI-MS[M+H]+(C19H22F2N4O2)に対する計算値377.17,実測値:377.10.
実施例35
4-((3S,5S)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物35)の合成
4-((3S,5S)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物35)の合成
1,4-ジオキサン(10mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボニトリル(600mg、2.25mmol)及び((3S,5S)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(539mg、2.47mmol)の混合物に、トリス(ジベンジリデンアセトン)ジパラジウム(206mg、0.22mmol)、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(140mg、0.22mmol)、及び炭酸セシウム(1.10g、3.37mmol)を添加した。反応混合物を排気し、窒素で3回フラッシュし、100℃で16時間撹拌した。冷却した反応混合物を水(30ml)でクエンチし、酢酸エチル(3×30mL)で抽出した。その後、合わせた抽出物をブライン(30ml)で洗浄し、硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から20%酢酸エチルにより精製して、白色固体の((3S,5S)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(450mg、50%)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.58(s,1H),7.39(d,J=12.4Hz,1H),6.92(d,J=8.0Hz,1H),5.08-4.91(m,1H),4.04-3.97(m,1H),3.27-3.16(m,3H),2.77-2.69(m,1H),2.41(s,3H),2.32(s,3H),2.18-2.08(m,1H),1.74-1.54(m,1H),1.36(s,9H).
ESI-MS[M+H]+(C21H26F2N4O2)に対する計算値405.20,実測値:405.25.
工程2:((3S,5S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル
ジメチルスルホキシド(6.0mL)中の((3S,5S)-1-(7-シアノ-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(450mg、1.11mmol)の溶液に、炭酸カリウム(461mg、3.34mmol)及び過酸化水素(30%、1.89g、16.69mmol)を添加した。反応混合物を60℃で2時間撹拌した。反応混合物水(25ml)で希釈し、酢酸エチル(3×20ml)で抽出した。合わせた有機層をブライン(30ml)で洗浄し、硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から80%酢酸エチル)により精製して、黄色固体の((3S,5S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(420mg、89%)を得た。
1H NMR(300MHz,DMSO-d6)δ 10.64(s,1H),7.94(s,1H),7.42(d,J=13.8Hz,1H),7.36(s,1H),6.90(d,J=7.8Hz,1H),5.12-4.86(m,1H),4.03-3.95(m,1H),3.26-3.15(m,3H),2.77-2.68(m,1H),2.40(s,3H),2.32(s,3H),2.21-2.07(m,1H),1.75-1.48(m,1H),1.36(s,9H).
ESI-MS[M+H]+(C21H28F2N4O3)に対する計算値423.21,実測値:423.25
工程3:4-((3S,5S)-3-アミノ-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩
((3S,5S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-フルオロピペリジン-3-イル)カルバミン酸tert-ブチル(420mg、0.99mmol)及び塩化水素(ジオキサン中4M、8mL)を20℃で2時間撹拌した。反応混合物を真空濃縮して、黄色固体の4-((3S,5S)-3-アミノ-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(350mg)を得た。
ESI-MS[M+H]+(C16H20F2N4O)に対する計算値323.16,実測値:323.15.
工程4:4-((3S,5S)-3-(ブテ-2-イナミド)-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド
N,N-ジメチルホルムアミド(5mL)中のブテ-2-イノ酸(47mg、0.56mmol)の溶液に、HATU(248mg、0.65mmol)、4-((3S,5S)-3-アミノ-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(165mg、0.46mmol,)、及びN,N-ジイソプロピルエチルアミン(180mg、1.40mmol)を添加した。反応混合物を20℃で2時間撹拌した。反応混合物を水(30ml)でクエンチし、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(30ml)で洗浄し、硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:Xselect CSH OBD Column 30×150mm、5um、移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で25% Bから52% B;220nm;保持時間=6.17分)により精製して、灰白色固体の4-[(3S,5S)-3-(ブテ-2-イノイルアミノ)-5-フルオロピペリジン-1-yl]-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(57.2mg、32%)を得た。
1H NMR(300MHz,DMSO-d6)δ 10.63(s,1H),8.51(d,J=8.1Hz,1H),7.93(s,1H),7.45-7.35(m,2H),5.07-4.91(m,1H),4.42-4.24(m,1H),3.28-3.13(m,3H),2.82-2.75(m,1H),2.38(s,3H),2.31(s,3H),2.20-2.09(m,1H),1.94(s,3H),1.78-1.53(m,1H).
ESI-MS[M+H]+(C20H22F2N4O2)に対する計算値389.17,実測値:389.25.
実施例36
4-((3S,5R)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物36)の合成
4-((3S,5R)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物36)の合成
4-((3S,5S)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド:テトラヒドロフラン(4.0mL)及び水(1.0mL)中の4-[(3S,5S)-3-アミノ-5-フルオロピペリジン-1-yl]-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(220mg、0.62mmol)の混合物に、重炭酸ナトリウム(156mg、1.86mmol)及び塩化アクリロイル(67mg、0.74mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。反応混合物を水(30mL)で希釈し、酢酸エチル(3×25mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:X select CSH OBD Column 30×150mm、5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で28% Bから48% B;220nm;保持時間=5.33分)により精製して、白色固体の4-((3S,5S)-3-アクリルアミド-5-フルオロピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(82.4mg、35%)を得た。
1H NMR(300MHz,DMSO-d6)δ 10.64(s,1H),8.09(d,J=7.8Hz,1H),7.94(s,1H),7.42(d,J=14.1Hz,1H),7.36(s,1H),6.28-6.02(m,2H),5.58(dd,J=9.6,2.7Hz,1H),5.10-4.93(m,1H),4.48-4.34(m,1H),3.43-3.38(m,1H),3.26-3.21(m,2H),2.82-2.75(m,1H),2.43(s,3H),2.32(s,3H),2.28-2.21(m,1H),1.78-1.53(m,1H).
ESI-MS[M+H]+(C19H22F2N4O2)に対する計算値377.17,実測値:377.30.
実施例37
4-((3S,5R)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物37)の合成
4-((3S,5R)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物37)の合成
1,4-ジオキサン(5.0mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(250mg、0.88mmol)及び((3S,5R)-5-ヒドロキシピペリジン-3-イル)カルバミン酸tert-ブチル(228mg、1.05mmol)の混合物に、トリス(ジベンジリデンアセトン)ジパラジウム(80mg、0.088mmol)、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(109mg、0.17mmol)、及び炭酸セシウム(429mg、1.32mmol)を添加した。反応混合物を排気し、窒素で3回フラッシュし、窒素下110℃で40時間撹拌した。冷却した反応混合物を水(30ml)でクエンチし、酢酸エチル(3×20ml)で抽出した。合わせた抽出物をブライン(30ml)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をシリカゲルでのカラムクロマトグラフィー(石油エーテル中0から60%酢酸エチル)により精製して、黄色固体の((3S,5R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-ヒドロキシピペリジン-3-イル)カルバミン酸tert-ブチル(150mg、41%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.65(s,1H),7.94(s,1H),7.41(d,J=14.0Hz,1H),7.36(s,1H),6.93(d,J=8.0Hz,1H),4.91(s,1H),3.72-3.63(m,2H),3.13-3.07(m,2H),2.77-2.58(m,2H),2.34(s,3H),2.32(s,3H),2.07-2.04(m,1H),1.35(s,9H),1.26-1.23(m,1H).
ESI-MS[M+H]+(C21H29F N4O4)に対する計算値421.22,実測値:421.25.
工程2:4-((3S,5R)-3-アミノ-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩
((3S,5R)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-ヒドロキシピペリジン-3-イル)カルバミン酸tert-ブチル(140mg、0.33mmol)及び塩化水素(ジオキサン中4M、5.0mL)の混合物を20℃で2時間撹拌した。完了後、反応混合物を真空濃縮して、黄色固体の4-((3S,5R)-3-アミノ-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(130mg)を得た。
ESI-MS[M+H]+(C16H21N4O2F)に対する計算値321.16,実測値:321.25.
工程3:4-((3S,5R)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド
テトラヒドロフラン(2.0mL)及び水(0.5mL)中の4-((3S,5R)-3-アミノ-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(130mg、0.37mmol)の混合物に、重炭酸ナトリウム(95mg、1.13mmol)及び塩化アクリロイル(41mg、451umol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。完了後、反応混合物を水(25mL)で希釈し、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(30ml)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:XBridge Prep OBD C18 Column、30×150mm、5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:7分で5% Bから35% B;220nm;保持時間=5.48分)により精製して、灰白色固体の4-((3S,5R)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(32.3mg、23%)を得た。
1H NMR(300MHz,DMSO-d6)δ 10.64(s,1H),8.10(d,J=7.8Hz,1H),7.92(s,1H),7.41(d,J=14.1Hz,1H),7.34(s,1H),6.28-6.01(m,2H),5.57(dd,J=9.6,2.7Hz,1H),4.97(d,J=4.8Hz,1H),4.12-4.03(m,1H),3.79-3.75(m,1H),3.19-3.15(m,2H),2.81-2.68(m,2H),2.36(s,3H),2.32(s,3H)2.16-2.11(m,1H),1.30-1.23(m,1H).
ESI-MS[M+H]+(C19H23F N4O3)に対する計算値375.18,実測値:375.25.
実施例38
4-((3S,5S)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物38)の合成
4-((3S,5S)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(化合物38)の合成
1,4-ジオキサン(7.0mL)中の4-ブロモ-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(380mg、1.33mmol)及び((3S,5S)-5-ヒドロキシピペリジン-3-イル)カルバミン酸tert-ブチル(240mg、1.11mmol)の混合物に、トリス(ジベンジリデンアセトン)ジパラジウム(102mg、0.11mmol)、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(138mg、0.22mmol)、及び炭酸セシウム(542mg、1.66mmol)を添加した。反応混合物を排気し、窒素で3回フラッシュし、窒素下110℃で60時間撹拌した。完了後、冷却した反応混合物を水(30mL)でクエンチし、ジクロロメタン(3×30mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取TLC(100%酢酸エチル、Rf=0.6)により精製して、黄色固体の((3S,5S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-ヒドロキシピペリジン-3-イル)カルバミン酸tert-ブチル(110mg)を得た。
ESI-MS[M+H]+(C21H29F N4O4)に対する計算値421.22,実測値:421.35.
工程2:4-((3S,5S)-3-アミノ-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩
((3S,5S)-1-(7-カルバモイル-5-フルオロ-2,3-ジメチル-1H-インドール-4-イル)-5-ヒドロキシピペリジン-3-イル)カルバミン酸tert-ブチル(110mg、0.33mmol)及び塩化水素(ジオキサン中4M、5.0mL)の混合物を20℃で2時間撹拌した。完了後、反応混合物を真空濃縮して、黄色固体の4-((3S,5S)-3-アミノ-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(80mg)を得た。
ESI-MS[M+H]+(C16H21F N4O2)に対する計算値321.16,実測値:321.15.
工程3:4-((3S,5S)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド
テトラヒドロフラン(2.0mL)及び水(0.5mL)中の4-((3S,5S)-3-アミノ-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド塩酸塩(68mg、0.19mmol)の溶液に、重炭酸ナトリウム(47mg、0.56mmol)及び塩化アクリロイル(20mg、0.22mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。完了後、反応混合物を水(20mL)で希釈し、酢酸エチル(3×15mL)で抽出した。合わせた抽出物をブライン(20mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:XBridge Prep OBD C18 Column、30×150mm、5um;移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル;流量:60mL/分;勾配:15% Bから30% B、7分;220nm;保持時間=6.02分)により精製して、白色固体の4-((3S,5S)-3-アクリルアミド-5-ヒドロキシピペリジン-1-イル)-5-フルオロ-2,3-ジメチル-1H-インドール-7-カルボキサミド(13.1mg、19%)を得た。
1H NMR(400MHz,DMSO-d6)δ 10.60(s,1H),7.98-7.92(m,2H),7.43-7.33(m,2H),6.40-6.14(m,1H),6.04(dd,J=17.2,2.0Hz,1H),5.55(dd,J=10.0,2.0Hz,1H),4.90-3.95(m,3H),3.21-2.95(m,3H),2.68-2.63(m,1H),2.49-2.30(m,6H),2.08-1.91(m,1H),1.60- 1.40(m,1H).
ESI-MS[M+H]+(C19H23F N4O3)に対する計算値375.18,実測値:375.15.
実施例39
4-(トランス-2-アクリロイルオクタヒドロ-5H-ピロロ[3,4-c]ピリジン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物39)の合成
4-(トランス-2-アクリロイルオクタヒドロ-5H-ピロロ[3,4-c]ピリジン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物39)の合成
1,4-ジオキサン(10mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボニトリル(600mg、2.37mmol)及びトランス-オクタヒドロ-2H-ピロロ[3,4-c]ピリジン-2-カルボン酸tert-ブチル(536mg、2.37mmol)の混合物に、トリス(ジベンジリデンアセトン)ジパラジウム(217mg、0.24mmol)、1.1’-ビナフチル-2.2’-ジフェミルホスフィン(295mg、0.47mmol)及び炭酸セシウム(2.32g、7.11mmol)を添加した。反応混合物を排気し、窒素で3回フラッシュし、窒素下100℃で16時間撹拌した。完了後、冷却した反応混合物を水(40ml)でクエンチし、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、石油エーテル中0から30%酢酸エチル)により精製して、黄色固体のトランス-5-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ[3,4-c]-ピリジン-2-カルボン酸tert-ブチル(500mg、53%)を得た。
1H NMR(300MHz,DMSO-d6)δ 7.36(d,J=12.9Hz,1H),6.35(s,1H),3.77-3.66(m,2H),3.57-3.43(m,2H),3.15-3.03(m,2H),2.91-2.79(m,2H),2.37(s,3H),1.92-1.85(m,2H),1.75-1.63(m,1H),1.58-1.49(m,1H),1.41(s,9H).
ESI-MS[M+H]+(C22H27FN4O2)に対する計算値399.21,実測値:399.15.
工程2:トランス-5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ[3,4-c]ピリジン-2-カルボン酸tert-ブチル
エタノール(12mL)及び水(3.0mL)中のトランス-5-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ[3,4-c]ピリジン-2-カルボン酸tert-ブチル(500mg、1.11mmol)の混合物に、Parkin触媒(47mg、0.11mmol)を添加した。反応混合物を90℃で2時間撹拌した。完了後、冷却した反応混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物をブライン(50mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、石油エーテル中0から60%酢酸エチル)により精製して、黄色固体のトランス-5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ[3,4-c]ピリジン-2-カルボン酸tert-ブチル(420mg、80%)を得た。
1H NMR(300MHz,DMSO-d6)δ 10.83(s,1H),7.89(s,1H),7.46(d,J=14.4Hz,1H),7.27(s,1H),6.22(s,1H),3.72-3.43(m,4H),3.18-3.00(m,2H),2.94-2.77(m,2H),2.39(s,3H),1.95-1.79(m,2H),1.75-1.50(m,2H),1.41(s,9H).
ESI-MS[M+H]+(C22H29FN4O3)に対する計算値417.22,実測値:417.15.
工程3:トランス-5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ[3,4-c]ピリジン-2-カルボン酸tert-ブチル
ジクロロメタン(10mL)中のトランス-5-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ[3,4-c]ピリジン-2-カルボン酸tert-ブチル(400mg、0.96mmol)の混合物に、N-クロロスクシンイミド(128mg、0.96mmol,)を0℃で添加した。反応混合物を0℃で1時間撹拌した。完了後、反応混合物を水(30mL)でクエンチし、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、石油エーテル中0から60%酢酸エチル)により精製して、黄色固体のトランス-5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ-[3,4-c]ピリジン-2-カルボン酸tert-ブチル(400mg、92%)を得た。
ESI-MS[M+H]+(C22H28ClFN4O3)に対する計算値451.18,453.18;実測値:451.10,453.10.
工程4:3-クロロ-5-フルオロ-2-メチル-4-(トランス-オクタヒドロ-5H-ピロロ[3,4-c]ピリジン-5-イル)-1H-インドール-7-カルボキサミド塩酸塩
トランス-5-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-2H-ピロロ[3,4-c]ピリジン-2-カルボン酸tert-ブチル(400mg、0.89mmol)及び塩化水素(ジオキサン中4M、8.0mL)の混合物を20℃で2時間撹拌した。完了後、反応混合物を真空濃縮して、黄色固体の3-クロロ-5-フルオロ-2-メチル-4-(トランス-オクタヒドロ-5H-ピロロ[3,4-c]ピリジン-5-イル)-1H-インドール-7-カルボキサミド塩酸塩(420mg)を得た。
ESI-MS[M+H]+(C17H20ClFN4O)に対する計算値351.13,353.13;実測値:351.05,353.05.
工程5:4-(トランス-2-アクリロイルオクタヒドロ-5H-ピロロ[3,4-c]ピリジン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
テトラヒドロフラン(5.0mL)中の3-クロロ-5-フルオロ-2-メチル-4-(トランス-オクタヒドロ-5H-ピロロ[3,4-c]ピリジン-5-イル)-1H-インドール-7-カルボキサミド塩酸塩(300mg、0.77mmol)の混合物に、N,N-ジイソプロピルエチルアミン(500mg、3.87mmol)を添加した。10分後、塩化アクリロイル(84mg、0.93mmol)を撹拌溶液に-70℃で添加した。反応混合物を-70℃で1時間撹拌した。完了後、反応混合物を水(20mL)でクエンチし、酢酸エチル(3×20mL)で抽出した。合わせた抽出物をブライン(40mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:Xselect CSH OBD Column 30×150mm 5um、移動相A:水(10mmol/L NH4HCO3+0.1% NH3.H2O)、移動相B:アセトニトリル、流量:60mL/分、勾配:7分で35% Bから55% B、220nm、保持時間=5.27分)により精製して、白色固体の4-(トランス-2-アクリロイルオクタヒドロ-5H-ピロロ[3,4-c]ピリジン-5-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(78.6mg、25%、トランスエナンチオマーの混合物)を得た。
1H NMR(400MHz,DMSO-d6)δ 11.24(s,1 H),8.00(s,1H),7.54(d,J=14.0Hz,1H),7.43(s,1H),6.62-6.51(m,1H),6.14(dd,J=16.8,2.4Hz,1H),5.69-5.64(m,1H),3.86-3.65(m,2H),3.41-3.38(m,1H),3.30-3.20(m,1H),3.19-3.08(m,3H),2.93-2.90(m,1H),2.38(s,3H),2.10-1.68(m,4H).
ESI-MS[M+H]+(C20H22ClFN4O2)に対する計算値405.14,407.14;実測値:405.10,407.10.
実施例40
4-(1-(ブテ-2-イノイル)オクタヒドロ-6H-ピロロ[3,4-b]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物40)の合成
4-(1-(ブテ-2-イノイル)オクタヒドロ-6H-ピロロ[3,4-b]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(化合物40)の合成
1,4-ジオキサン(10mL)中の4-ブロモ-5-フルオロ-2-メチル-1H-インドール-7-カルボニトリル(600mg、2.37mmol)及びオクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル(643mg、2.85mmol)の混合物に、1.1’-ビナフチル-2.2’-ビフェミルホスフィン(295mg、0.47mmol)、トリス(ジベンジリデンアセトン)ジパラジウム(217mg、0.23mmol)、及び炭酸セシウム(2.32g、7.11mmol)を添加した。反応混合物を脱気し、窒素で5回詰め戻し、100℃で16時間撹拌した。冷却した混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物を水(2×30mL)及びブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、石油エーテル中25%酢酸エチル)により精製して、黄色固体の6-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル(720mg、76%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.49(s,1H),7.26(d,J=14.7Hz,1H),6.62(s,1H),4.73-4.54(m,1H),4.17-4.07(m,1H),3.98-3.82(m,2H),3.67-3.56(m,1H),3.54-3.46(m,1H),2.95-2.81(m,1H),2.33(s,3H),2.26-2.10(m,1H),1.79-1.61(m,2H),1.42(s,9H),1.40-1.30(m,2H).
ESI-MS[M+H]+(C22H27FN4O2)に対する計算値399.21,実測値:399.30.
工程2:6-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル
エタノール(8mL)及び水(2.0mL)中の6-(7-シアノ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル(720mg、1.81mmol)の混合物に、Parkin触媒(38mg、0.09mmol)を添加した。反応混合物を90℃で2時間撹拌した。冷却した混合物を水(40mL)で希釈し、酢酸エチルで抽出した(3×40mL)。合わせた抽出物を水(2×30mL)及びブライン(50mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、石油エーテル中50%酢酸エチル)により精製して、黄色固体の6-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル(600mg、79%)を得た。
ESI-MS[M+H]+(C22H29FN4O3)に対する計算値417.22,実測値:417.20.
工程3:6-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル
DMF(10mL)中の6-(7-カルバモイル-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル(600mg、1.44mmol)の溶液に、1-クロロピロリジン-2,5-ジオン(192mg、1.44mmol)を0℃で添加した。反応混合物を0℃で1時間撹拌した。混合物を水(30mL)で希釈し、酢酸エチル(3×30mL)で抽出した。合わせた抽出物を水(2×30mL)及びブライン(40mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物をカラムクロマトグラフィー(シリカゲル、石油エーテル中40%酢酸エチル)により精製して、黄色固体の6-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル(600mg、92%)を得た。
ESI-MS[M+H]+(C22H28ClFN4O3)に対する計算値451.18,453.18;実測値:451.20,453.20.
工程4:3-クロロ-5-フルオロ-2-メチル-4-(オクタヒドロ-6H-ピロロ[3,4-b]ピリジン-6-イル)-1H-インドール-7-カルボキサミド 2,2,2-トリフルオロアセテート
ジクロロメタン(5.0mL)中の6-(7-カルバモイル-3-クロロ-5-フルオロ-2-メチル-1H-インドール-4-イル)オクタヒドロ-1H-ピロロ[3,4-b]ピリジン-1-カルボン酸tert-ブチル(600mg、1.33mmol)の溶液に、トリフルオロ酢酸(5.0mL)を添加した。反応混合物を2時間20℃で撹拌した。得られた混合物を真空濃縮して、黄色固体の3-クロロ-5-フルオロ-2-メチル-4-(オクタヒドロ-6H-ピロロ[3,4-b]ピリジン-6-イル)-1H-インドール-7-カルボキサミド 2,2,2-トリフルオロアセテート(600mg)を得た。
ESI-MS[M+H]+(C17H20ClFN4O)に対する計算値351.13,353.13;実測値:351.10,353.10.
工程5:4-(1-(ブテ-2-イノイル)オクタヒドロ-6H-ピロロ[3,4-b]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド
DMF(10mL)中の3-クロロ-5-フルオロ-2-メチル-4-(オクタヒドロ-6H-ピロロ[3,4-b]ピリジン-6-イル)-1H-インドール-7-カルボキサミド2,2,2-トリフルオロアセテート(600mg、1.33mmol)の混合物に、O-(7-アザベンゾトリアゾール-1-イル)-N,N,N’,N’-テトラメチルウロニウム ヘキサフルオロホスフェート(757mg、1.99mmol)、ブテ-2-イノ酸(134mg、1.60mmol)、及びN,N-ジイソプロピルエチルアミン(663mg、5.13mmol)を添加した。反応混合物を20℃で2時間撹拌した。得られた混合物を水(30mL)で希釈し、酢酸エチル(2×30mL)で抽出した。合わせた抽出物を水(2×30mL)及びブライン(30mL)で洗浄し、無水硫酸ナトリウムで乾燥させ、濾過し、真空濃縮した。残留物を分取HPLC(カラム:Xselect CSH OBD Column 30×150mm 5um、移動相A:水(10M NH4HCO3+0.1% NH3.H2O);移動相B:アセトニトリル;流量:60mL/分;勾配:40% Bから60% B、7分;220nm;保持時間=6.02分)により精製して、灰白色固体の4-(1-(ブテ-2-イノイル)オクタヒドロ-6H-ピロロ[3,4-b]ピリジン-6-イル)-3-クロロ-5-フルオロ-2-メチル-1H-インドール-7-カルボキサミド(28.6mg、5%)を得た。
1H NMR(300MHz,DMSO-d6)δ 11.26(d,J=4.8Hz,1H),8.03(s,1H),7.65-7.40(m,2H),5.19-5.03(m,1H),4.32-4.17(m,1H),3.65-3.40(m,2H),3.31-3.02(m,2.4H),2.78-2.65(m,0.6H),2.43-2.16(m,4H),2.05(d,J=5.7Hz,3H),1.91-1.70(m,3H),1.52-1.24(m,1H).
ESI-MS[M+H]+(C21H22ClFN4O2)に対する計算値417.14,419.14;実測値:417.10,419.10.
実施例41
以下の表7に示す化合物41a~41tを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製する。
以下の表7に示す化合物41a~41tを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製する。
実施例42
化合物42a~42x
以下の表8に示す化合物42a~42xを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製する。
化合物42a~42x
以下の表8に示す化合物42a~42xを、先行するスキーム及び実施例に記載したものと類似の方法に従い、相応して適切な出発材料を用いることにより調製する。
実施例43
BTKに対する活性を決定するためのアッセイ
DMSO中の化合物(試験又は対照)の溶液を所望の濃度で調製し、TECAN EVO200を使用して384ppプレートで3倍希釈して11濃度に段階希釈した。20nLのストックを、Echo550を使用して384プレートに移した。DMSOをビヒクル対照として使用した。
BTKに対する活性を決定するためのアッセイ
DMSO中の化合物(試験又は対照)の溶液を所望の濃度で調製し、TECAN EVO200を使用して384ppプレートで3倍希釈して11濃度に段階希釈した。20nLのストックを、Echo550を使用して384プレートに移した。DMSOをビヒクル対照として使用した。
2つの別個の溶液を調製した:MgCl2(10mM)、Brij-35(0.01%)、DTT(2mM)、BSA(0.05%)、EGTA(1mM)、HEPE(pH7.5)(50mM)、FLPeptide(6uM)、及びATP(4mM)を含むATP溶液;並びにMgCl2(10mM)、Brij-35(0.01%)、DTT(2mM)、BSA(0.05%)、EGTA(1mM)、HEPE(pH7.5)(50mM)、及びBTK(2.67nM)を含むBTK溶液。(BTKはCarnaから入手し、FLPeptide2はPerkinElmerから入手し、イブルチニブはSelleckから入手した。)5uLのATP溶液を各ウェルに添加し、続いて15uLのBTK溶液を添加して、反応を開始した。(各ウェルの最終体積は20uLであり、MgCl2(10mM)、Brij-35(0.01%)、DTT(2mM)、BSA(0.05%)、EGTA(1mM)、HEPE(pH7.5)(50mM)、FLPeptide(1.5uM)、ATP(1mM)、及びBTK(2nM)を含んだことに留意されたい。)
プレートを室温で90分間インキュベートし、次いで停止緩衝液(75uL、0.5M EDTAを含有)を添加して、反応を終結させた。各ウェルからの試料を、EZリーダーを使用して分析した。残存活性%は、以下の式に従って、読み取り転換率(CR)を使用して計算した。
XLFit(式201)を使用して、下部と上部との両方をフロート処理する(floating)ことによってIC50を計算した。
本発明の代表的な化合物についてのBTK IC50値を、以下の表9に提供する。BTK活性に関して、表4は、以下のように活性を列挙する。
「A」は、10nM未満のIC50を示し、
「B」は、10nM~100nM未満のIC50を示し、
「C」は、100nM以上のIC50を示す。
「A」は、10nM未満のIC50を示し、
「B」は、10nM~100nM未満のIC50を示し、
「C」は、100nM以上のIC50を示す。
実施例44
RAMOS B細胞におけるBTK活性を決定するためのアッセイ
アッセイ前日に、Ramos B細胞を播種培地(1%FBS及び1×ペニシリン-ストレプトマイシンを含有するRPMI1640培地)に播種した。アッセイの日に、2×染料溶液を、FLIRP Calcium 6 Assay Kitのマニュアルに従って調製した:染料をアッセイ緩衝液(1×HBSS、pH7.4中の20mM HEPES)で希釈し、プロベネシドを添加して、最終濃度を5mMとし、1~2分間激しくボルテックスする。遠心分離によって細胞を収集し、ペレットを播種培地に再懸濁させた。計数後、細胞を播種培地に3×106/mlの密度で再懸濁させた。等量の2×染料溶液を細胞懸濁液に添加した。次いで、細胞を20μl/ウェルで384ウェルのポリ-D-リジンコーティングプレートに播種した。プレートを1000rpmで3分間遠心分離し、次いで37℃で2時間インキュベートし、続いて25℃で更に15分間インキュベートした。化合物を希釈緩衝液(1×HBSS、pH7.4中の20mM HEPES及び0.1%BSA)中で3倍濃度で調製した。連続希釈化合物を、Echo550(Labcyte)を使用して、供給源プレートから384ウェルの化合物プレートに移した。20μl/ウェルの化合物希釈緩衝液を化合物プレートに添加し、プレートシェーカー上で2分間混合した。4×EC80の抗IgM(Jackson ImmunoResearch)を希釈緩衝液中で調製し、20μl/ウェルを新たな384ウェル化合物プレートに添加した。暗所にて25℃で60分間インキュベートした後、細胞プレート、4×EC80の抗IgM及びFLIPRチップを含む化合物プレートを、FLIPR(Molecular Devices)に入れた。10ul/ウェルの4×EC80の抗IgMを、FLIPRにより細胞プレートに移した。プレートを1秒間隔で160秒間読み取った。
RAMOS B細胞におけるBTK活性を決定するためのアッセイ
アッセイ前日に、Ramos B細胞を播種培地(1%FBS及び1×ペニシリン-ストレプトマイシンを含有するRPMI1640培地)に播種した。アッセイの日に、2×染料溶液を、FLIRP Calcium 6 Assay Kitのマニュアルに従って調製した:染料をアッセイ緩衝液(1×HBSS、pH7.4中の20mM HEPES)で希釈し、プロベネシドを添加して、最終濃度を5mMとし、1~2分間激しくボルテックスする。遠心分離によって細胞を収集し、ペレットを播種培地に再懸濁させた。計数後、細胞を播種培地に3×106/mlの密度で再懸濁させた。等量の2×染料溶液を細胞懸濁液に添加した。次いで、細胞を20μl/ウェルで384ウェルのポリ-D-リジンコーティングプレートに播種した。プレートを1000rpmで3分間遠心分離し、次いで37℃で2時間インキュベートし、続いて25℃で更に15分間インキュベートした。化合物を希釈緩衝液(1×HBSS、pH7.4中の20mM HEPES及び0.1%BSA)中で3倍濃度で調製した。連続希釈化合物を、Echo550(Labcyte)を使用して、供給源プレートから384ウェルの化合物プレートに移した。20μl/ウェルの化合物希釈緩衝液を化合物プレートに添加し、プレートシェーカー上で2分間混合した。4×EC80の抗IgM(Jackson ImmunoResearch)を希釈緩衝液中で調製し、20μl/ウェルを新たな384ウェル化合物プレートに添加した。暗所にて25℃で60分間インキュベートした後、細胞プレート、4×EC80の抗IgM及びFLIPRチップを含む化合物プレートを、FLIPR(Molecular Devices)に入れた。10ul/ウェルの4×EC80の抗IgMを、FLIPRにより細胞プレートに移した。プレートを1秒間隔で160秒間読み取った。
本発明の代表的な化合物についてのIC50値を、以下の表9に提供する。Ramos活性に関して、表9は、以下のように活性を列挙する。
「A」は、10nM未満のIC50を示し、
「B」は、10nM~100nM未満のIC50を示し、
「C」は、100nM以上のIC50を示す。
「A」は、10nM未満のIC50を示し、
「B」は、10nM~100nM未満のIC50を示し、
「C」は、100nM以上のIC50を示す。
実施例45
ヒト全血中のBTK不活性化率を決定するためのアッセイ
ヒト全血化合物処理及び溶解
ヒト全血をStemExpressから入手し、実験時まで周囲温度で維持する。10倍溶解緩衝液(Cell Signaling Technology、#9083S)、蒸留水、100倍プロテアーゼ及びホスファターゼ阻害剤カクテル(ThermoFisher、#78440)、及びGBD-1066プローブ(最終:0.4μM)を使用して、1倍溶解緩衝液を調製する。これは、各実験日に新しく調製する。溶解緩衝液を、時間点収集に備えて、v底プレート(GreinerBio、#651261)中の全ウェルに30μLの体積で添加する。化合物を10mMのストックに再構成し、2倍連続希釈で希釈して、DMSO中、最後の点をDMSOのみにして8点曲線を生成し、100倍希釈系列を創出する。DMSOを一定に維持するために、1.0μLの調製したDMSO滴定(100倍)を使用して、300μLの1倍PBSへの作業用10倍希釈系列を創出する。ヒト全血を、新しい96wのv底プレート中、ウェル当たり225μLの体積で添加し、このプレートでは、8ウェルの1つのカラムは、1つの化合物を試験するのに十分である。化合物処理のために、25μLのPBS中の10倍希釈系列を225μLの全血に添加し、続いて上下に2回手短にピペッティングする。プレートを蓋で覆い、37℃で、5、15、30、60分間インキュベートする。各時点で、30μLの処理した血液を各カラムから引き出し、30μLの補充した溶解緩衝液を含む予めロードした収集プレートに添加し、手短に混合する。収集し溶解させた試料を、60分間室温で、回転装置上で振盪する。これらの試料を、ELISAによる検出のために新鮮なまま使用し、反復が必要な場合、残りの試料を-80℃で凍結する。
ヒト全血中のBTK不活性化率を決定するためのアッセイ
ヒト全血化合物処理及び溶解
ヒト全血をStemExpressから入手し、実験時まで周囲温度で維持する。10倍溶解緩衝液(Cell Signaling Technology、#9083S)、蒸留水、100倍プロテアーゼ及びホスファターゼ阻害剤カクテル(ThermoFisher、#78440)、及びGBD-1066プローブ(最終:0.4μM)を使用して、1倍溶解緩衝液を調製する。これは、各実験日に新しく調製する。溶解緩衝液を、時間点収集に備えて、v底プレート(GreinerBio、#651261)中の全ウェルに30μLの体積で添加する。化合物を10mMのストックに再構成し、2倍連続希釈で希釈して、DMSO中、最後の点をDMSOのみにして8点曲線を生成し、100倍希釈系列を創出する。DMSOを一定に維持するために、1.0μLの調製したDMSO滴定(100倍)を使用して、300μLの1倍PBSへの作業用10倍希釈系列を創出する。ヒト全血を、新しい96wのv底プレート中、ウェル当たり225μLの体積で添加し、このプレートでは、8ウェルの1つのカラムは、1つの化合物を試験するのに十分である。化合物処理のために、25μLのPBS中の10倍希釈系列を225μLの全血に添加し、続いて上下に2回手短にピペッティングする。プレートを蓋で覆い、37℃で、5、15、30、60分間インキュベートする。各時点で、30μLの処理した血液を各カラムから引き出し、30μLの補充した溶解緩衝液を含む予めロードした収集プレートに添加し、手短に混合する。収集し溶解させた試料を、60分間室温で、回転装置上で振盪する。これらの試料を、ELISAによる検出のために新鮮なまま使用し、反復が必要な場合、残りの試料を-80℃で凍結する。
ELISA:占有されていないBTKの量を決定する
全てのストレプトアビジンで予めコーティングしたプレート(R&D Systems、#CP004)を、試料を溶解させている間に室温にする。アッセイ緩衝液1、1×PBS+0.05%Tween 20+1%BSAを調製し、使用しないときは4℃で保管する。このアッセイ緩衝液を使用して、アッセイ緩衝液+1倍プロテアーゼ/ホスファターゼ阻害剤カクテル(PIC)を、全ての試料に必要な量で調製する。90μL/ウェルの体積のアッセイ緩衝液+PICをELISAプレートに添加する。溶解させた血液試料(10μL)をELISAプレートに添加する。BTK組換えタンパク質希釈物を、μM)として使用するために、アッセイ緩衝液+PICS中で調製する。標準をELISAプレートに100μL/ウェルで、二連でロードする。これらの試料及び標準をプレート中に残し、4℃で一晩密封する。翌日、プレート洗浄機を使用して、プレートを1倍洗浄緩衝液(1倍PBS+0.05%Tween 20)で4回洗浄する。プレートを反転させて、毎回全ての流体を排出し、清潔なペーパータオルでふき取って、残った液体を除去する。アッセイ緩衝液2を調製し(1倍PBS+0.05%Tween 20+0.05%BSA)、使用しないときは4℃で維持する。抗体α-BTK(クローンD3H5、Cell Signaling Technology #8547S)をアッセイ緩衝液2中で1:500に希釈する。希釈したa-BTK抗体を100μl/ウェルで添加する。プレートを接着フィルムで覆い、90分間室温でインキュベートする。プレート洗浄機を使用して、プレートを1倍洗浄緩衝液(1倍PBS+0.05%Tween 20)で4回洗浄する。プレートを反転させて、毎回全ての流体を排出し、清潔なペーパータオルでふき取って、残った液体を除去する。三次抗体(Jackson Immuno Research、#711-005-152)をアッセイ緩衝液2で1:2,500に希釈する。希釈した抗体を100μl/ウェルで添加する。プレートを接着フィルムで覆い、1時間室温でインキュベートする。プレート洗浄機を使用して、プレートを1倍洗浄緩衝液で4回洗浄する。プレートを反転させて、毎回全ての流体を排出し、清潔なペーパータオルでふき取って、残った液体を除去する。予熱したTMB基質(ThermoFisher、#34029)を100μl/ウェルでプレートに添加する。プレートを暗所にて室温で約5~10分間インキュベートする。50μl/ウェルの2N硫酸(H2SO4)(R&D Systems、#DY994)を添加することにより、反応を停止させる。プレートを、波長460nm及び570nm(補正波長)にてプレートリーダーで読み取る。Graphpad Prismを使用して、XYテーブル+グラフを創出し、0~60分をX軸、濃度をY軸としてリスト化する。One Phase Decayモデル適合をデータに適用する。Resultsテーブルをチェックすることで、K値を得て、新しいXYテーブル+グラフを創出する。濃度をX軸に割り当て、最初の分析からのK値を入力する。ミカエリス・メンテン式をデータに適用する。結果テーブルから、Vmax(Kinact)及びKm(KI)値を使用して、Vmax、Km*10000を割ることによってKinact/Ki 10-4 nM-1分-1を計算する。
全てのストレプトアビジンで予めコーティングしたプレート(R&D Systems、#CP004)を、試料を溶解させている間に室温にする。アッセイ緩衝液1、1×PBS+0.05%Tween 20+1%BSAを調製し、使用しないときは4℃で保管する。このアッセイ緩衝液を使用して、アッセイ緩衝液+1倍プロテアーゼ/ホスファターゼ阻害剤カクテル(PIC)を、全ての試料に必要な量で調製する。90μL/ウェルの体積のアッセイ緩衝液+PICをELISAプレートに添加する。溶解させた血液試料(10μL)をELISAプレートに添加する。BTK組換えタンパク質希釈物を、μM)として使用するために、アッセイ緩衝液+PICS中で調製する。標準をELISAプレートに100μL/ウェルで、二連でロードする。これらの試料及び標準をプレート中に残し、4℃で一晩密封する。翌日、プレート洗浄機を使用して、プレートを1倍洗浄緩衝液(1倍PBS+0.05%Tween 20)で4回洗浄する。プレートを反転させて、毎回全ての流体を排出し、清潔なペーパータオルでふき取って、残った液体を除去する。アッセイ緩衝液2を調製し(1倍PBS+0.05%Tween 20+0.05%BSA)、使用しないときは4℃で維持する。抗体α-BTK(クローンD3H5、Cell Signaling Technology #8547S)をアッセイ緩衝液2中で1:500に希釈する。希釈したa-BTK抗体を100μl/ウェルで添加する。プレートを接着フィルムで覆い、90分間室温でインキュベートする。プレート洗浄機を使用して、プレートを1倍洗浄緩衝液(1倍PBS+0.05%Tween 20)で4回洗浄する。プレートを反転させて、毎回全ての流体を排出し、清潔なペーパータオルでふき取って、残った液体を除去する。三次抗体(Jackson Immuno Research、#711-005-152)をアッセイ緩衝液2で1:2,500に希釈する。希釈した抗体を100μl/ウェルで添加する。プレートを接着フィルムで覆い、1時間室温でインキュベートする。プレート洗浄機を使用して、プレートを1倍洗浄緩衝液で4回洗浄する。プレートを反転させて、毎回全ての流体を排出し、清潔なペーパータオルでふき取って、残った液体を除去する。予熱したTMB基質(ThermoFisher、#34029)を100μl/ウェルでプレートに添加する。プレートを暗所にて室温で約5~10分間インキュベートする。50μl/ウェルの2N硫酸(H2SO4)(R&D Systems、#DY994)を添加することにより、反応を停止させる。プレートを、波長460nm及び570nm(補正波長)にてプレートリーダーで読み取る。Graphpad Prismを使用して、XYテーブル+グラフを創出し、0~60分をX軸、濃度をY軸としてリスト化する。One Phase Decayモデル適合をデータに適用する。Resultsテーブルをチェックすることで、K値を得て、新しいXYテーブル+グラフを創出する。濃度をX軸に割り当て、最初の分析からのK値を入力する。ミカエリス・メンテン式をデータに適用する。結果テーブルから、Vmax(Kinact)及びKm(KI)値を使用して、Vmax、Km*10000を割ることによってKinact/Ki 10-4 nM-1分-1を計算する。
不活性化率に関して、本開示の代表的な化合物についてのKinact/Ki値を、以下の表10に提供する。同じくこれに関して、表10は、以下のように活性を列挙する。
「A」は、Kinact/Ki>10×10-4nM-1分-1を示し、
「B」は、10×10-4nM-1分-1~1×10-4nM-1分-1のKinact/Kiを示し、
「C」は、Kinact/Ki<1×10-4nM-1分-1を示す。
「A」は、Kinact/Ki>10×10-4nM-1分-1を示し、
「B」は、10×10-4nM-1分-1~1×10-4nM-1分-1のKinact/Kiを示し、
「C」は、Kinact/Ki<1×10-4nM-1分-1を示す。
実施例46
雌C57BL/6マウスへの試験化合物の単回経口投与後1時間での血漿及び総脳濃度の決定
試験物品
アカラブルチニブ、イブルチニブ、及びブラネブルチニブを比較対照化合物として使用した。
雌C57BL/6マウスへの試験化合物の単回経口投与後1時間での血漿及び総脳濃度の決定
試験物品
アカラブルチニブ、イブルチニブ、及びブラネブルチニブを比較対照化合物として使用した。
アカラブルチニブ(CALQUENCE(登録商標))は、マントル細胞リンパ腫(MCL)、慢性リンパ球性白血病(CLL)、又は小リンパ球性白血病(SLL)として知られる非ホジキンリンパ腫の治療のために承認されたBTK阻害剤である。
イブルチニブ(IMBRUVICA(登録商標))は、マントル細胞リンパ腫(MCL)、慢性リンパ球性白血病(CLL)/小リンパ球性リンパ腫(SLL)、ワルデンシュトレームマクログロブリン血症(WM)、辺縁帯リンパ腫(MZL)、及び慢性移植片対宿主病(chronic graft versus host disease、cGVHD)の治療のために承認されたBTK阻害剤である。
ブラネブルチニブは、マントル細胞リンパ腫(MCL)の治療のために承認されたBTK阻害剤であり、リウマチ性関節炎、全身性紅斑性狼瘡、及び原発性シェーグレン症候群の治療のために臨床試験中である。
試験物品の調製
適切な量の試験物品を、水中の10%ジメチルアセトアミド(DMA)/90%(20%ヒドロキシプロピル-b-シクロデキストリン(HP-B-CD)w/vに溶解させて、経口投薬のための最終濃度1mg/mLを得た。超音波処理、ボルテックス、及び均質化を必要に応じて使用した。7~9週間(20~30グラム)の3匹の雌C57BL/6マウスに、試験物品の10mg/kg溶液を強制経口投与によって投薬した。
適切な量の試験物品を、水中の10%ジメチルアセトアミド(DMA)/90%(20%ヒドロキシプロピル-b-シクロデキストリン(HP-B-CD)w/vに溶解させて、経口投薬のための最終濃度1mg/mLを得た。超音波処理、ボルテックス、及び均質化を必要に応じて使用した。7~9週間(20~30グラム)の3匹の雌C57BL/6マウスに、試験物品の10mg/kg溶液を強制経口投与によって投薬した。
試料分析
血漿及び脳試料中の代表的な試験化合物の濃度(全ての試料についての血漿及び脳ホモジネート標準曲線を適切に使用する)を、LC-MS/MSを使用して分析した。脳:血漿比に関して、結果を以下のように表11に列挙する。
「A」は、比>0.5を示し、
「B」は、0.1~0.5の間の比を示し
「C」は、比<0.1を示す。
血漿及び脳試料中の代表的な試験化合物の濃度(全ての試料についての血漿及び脳ホモジネート標準曲線を適切に使用する)を、LC-MS/MSを使用して分析した。脳:血漿比に関して、結果を以下のように表11に列挙する。
「A」は、比>0.5を示し、
「B」は、0.1~0.5の間の比を示し
「C」は、比<0.1を示す。
上に記載した様々な実施形態を組み合わせ、更なる実施形態を提供することができる。本明細書で言及された、及び/又は出願データシートに列挙された米国特許、米国特許出願公開、米国特許出願、外国特許、外国特許出願、及び非特許刊行物は全て、その全体が参照により本明細書に援用される。実施形態の態様は、様々な特許、出願、及び刊行物の概念を用いて、必要に応じて修正して、なお更なる実施形態を提供することができる。
上で詳述した説明を考慮して、これらの変更及び他の変更を実施形態に行うことができる。概して、以下の特許請求の範囲において、使用される用語は、特許請求の範囲を、明細書及び特許請求の範囲に開示される具体的な実施形態に限定するものと解釈すべきではなく、このような特許請求の範囲によって権利が与えられる均等物の全範囲に沿った全ての可能な実施形態を含むと解釈すべきである。したがって、特許請求の範囲は、本明細書の開示によって制限されるものではない。
本明細書で言及される全ての刊行物、特許、及び特許出願は、個々の刊行物、特許、又は特許出願各々が、参照により組み込まれることが具体的かつ個々に示されるのと同程度に、参照により本明細書中に組み込まれる。
Claims (98)
- 式(I)の構造を有する化合物、
であって、式中、
が、単結合又は二重結合を表し、
R1が、-H、-CH3、又は-Fであり、
R2が、-H、-CH3、又は-Fであるか、
あるいはR1及びR2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成し、
RI1が、-Cl、-F、-CN、-CH3、-CH2F、-CHF2、又は-CF3であり、
RI2が、-H又は-Fであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3であり、
RI1が-CH3であるとき、R1及びR2のうちの少なくとも一方が、-CH3又は-Fである、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。 - R1が-Hであり、R2が-Hである、請求項1に記載の化合物。
- R1が-Hであり、R2が-Fである、請求項1に記載の化合物。
- R1が-CH3であり、R2が-CH3である、請求項1に記載の化合物。
- R1及びR2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成する、請求項1に記載の化合物。
- R1及びR2が、それらが結合しているC原子と一緒になって、シクロプロピル環を形成する、請求項1に記載の化合物。
- RI2が-Hである、請求項1~8のいずれか一項に記載の化合物。
- RI2が-Fである、請求項1~8のいずれか一項に記載の化合物。
- RBが-CH=CH2である、請求項1~10のいずれか一項に記載の化合物。
- RBが-C≡CHである、請求項1~10のいずれか一項に記載の化合物。
- RBが-C≡C-CH3である、請求項1~10のいずれか一項に記載の化合物。
- RI1が-Clである、請求項14に記載の化合物。
- RI1が-Clである、請求項16に記載の化合物。
- 表1に列挙されている構造を有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 表2に列挙されている構造を有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 請求項1~20のいずれか一項に記載の化合物の医薬的に許容される塩。
- 請求項1~20のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体を含む、医薬組成物。
- 医薬的に許容される担体、アジュバント、又はビヒクルを更に含む、請求項22に記載の医薬組成物。
- プロテインキナーゼを阻害する方法であって、前記プロテインキナーゼを、有効量の請求項1~20のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物と接触させることを含む、方法。
- 前記プロテインキナーゼがBTKである、請求項24に記載の方法。
- BTK依存性状態を治療するための方法であって、それを必要とする対象に、有効量の請求項1~20のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物を投与することを含む、方法。
- 前記BTK依存性状態が原発性CNSリンパ腫である、請求項26に記載の方法。
- 前記BTK依存性状態が、がん、自己免疫疾患、炎症性疾患、又は血栓塞栓性疾患である、請求項26に記載の方法。
- 前記自己免疫疾患が、多発性硬化症、関節リウマチ、乾癬、シェーグレン症候群、又は全身性エリテマトーデスである、請求項28に記載の方法。
- 前記炎症性疾患が蕁麻疹である、請求項28に記載の方法。
- 医薬品の製造における、請求項1~20のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物の使用。
- 前記医薬品が、がん、自己免疫疾患、炎症性疾患、又は血栓塞栓性疾患の治療のためのものである、請求項30に記載の使用。
- 前記自己免疫疾患が、多発性硬化症、関節リウマチ、乾癬、シェーグレン症候群、又は全身性エリテマトーデスである、請求項32に記載の使用。
- 前記炎症性疾患が蕁麻疹である、請求項32に記載の使用。
- 式(II)の構造を有する化合物、
であって、式中、
RII1が、Cl、F、-CH2F、-CHF2、-CF3、又は-CNであり、
RII2が、H又はFであり、
R3が、H、Me、又はシクロプロピルであり、
Xが、-CH2CH2-又は-CRx1Rx2-であり、
Rx1が、H、F、又はMeであり、
Rx2が、H、F、又はMeであるか、
あるいはRx1及びRx2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成するか、
あるいはRx1がHであり、Rx2及びR3が一緒になってアルキレン架橋を形成し、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3である、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。 - R3がHである、請求項35に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- R3がMeである、請求項35に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Xが-CH2-である、請求項35~37のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Xが-CH2CH2-である、請求項35~37のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Xが-CRx1Rx2-であり、Rx1がHであり、Rx2がFである、請求項35~37のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Xが-CRx1Rx2-であり、Rx1及びRx2が、それらが結合しているC原子と一緒になって、C3-6員炭素環式環を形成する、請求項35~37のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Rx1及びRx2が、それらが結合しているC原子と一緒になって、シクロプロピル環を形成する、請求項41に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Xが-CRx1Rx2-であり、Rx1がHであり、Rx2及びR1が一緒になってアルキレン架橋を形成する、請求項35に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Rx2及びR3が一緒になってメチレン架橋を形成する、請求項43に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- RII1が、Cl、F、又は-CNである、請求項35~44のいずれか一項に記載の化合物、又はそれらの医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- RII1が、-CH2F、-CHF2、又は-CF3である、請求項35~44のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- RII2がHである、請求項35~46のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- RII2がFである、請求項35~46のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- RBが-CH=CH2である、請求項35~48のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- RBが-C≡CHである、請求項35~48のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- RBが-C≡C-CH3である、請求項35~48のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 2つの異性体を含む、請求項35~51のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 2つのアトロプ異性体を含む、請求項35~51のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 2つのアトロプ異性体のラセミ混合物を含む、請求項35~51のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 表3に列挙されている構造を有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 請求項35~57のいずれか一項に記載の化合物の医薬的に許容される塩。
- 請求項35~57のいずれか一項に記載の化合物の異性体又はラセミ体。
- 請求項35~57のいずれか一項に記載の化合物のアトロプ異性体。
- 請求項35~60のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体を含む、医薬組成物。
- 医薬的に許容される担体、アジュバント、又はビヒクルを更に含む、請求項61に記載の医薬組成物。
- プロテインキナーゼを阻害する方法であって、前記プロテインキナーゼを、有効量の請求項35~60のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物と接触させることを含む、方法。
- 前記プロテインキナーゼがBTKである、請求項63に記載の方法。
- BTK依存性状態を治療するための方法であって、それを必要とする対象に、有効量の請求項35~60のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物を投与することを含む、方法。
- 前記BTK依存性状態が原発性CNSリンパ腫である、請求項65に記載の方法。
- 前記BTK依存性状態が、がん、自己免疫疾患、炎症性疾患、又は血栓塞栓性疾患である、請求項65に記載の方法。
- 前記自己免疫疾患が、多発性硬化症、関節リウマチ、乾癬、シェーグレン症候群、又は全身性エリテマトーデスである、請求項67に記載の方法。
- 前記炎症性疾患が蕁麻疹である、請求項67に記載の方法。
- 医薬品の製造における、請求項35~60のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物の使用。
- 前記医薬品が、がん、自己免疫疾患、炎症性疾患、又は血栓塞栓性疾患の治療のためのものである、請求項70に記載の使用。
- 前記自己免疫疾患が、多発性硬化症、関節リウマチ、乾癬、シェーグレン症候群、又は全身性エリテマトーデスである、請求項71に記載の使用。
- 前記炎症性疾患が蕁麻疹である、請求項71に記載の使用。
- 式(III)の構造を有する化合物、
であって、式中、
Zが、-CH2-、-CHMe-、又は結合であり、
Yが、-CHR4-又は結合であり、
R4が、H、F、又はOHであり、
R5が、H、F、又はMeであり、
R6が、H又はMeであり、
R7が、H又はMeであり、
R8がHであるか、
あるいはR5及びR7が、一緒になって、5員又は6員の複素環を形成するか、
あるいはR6及びR7が、一緒になって、4員、5員、又は6員の複素環を形成するか、
あるいはR8及びR7が、一緒になって、5員又は6員の複素環を形成し、
aが、0、1、又は2であり、
RIII1が、Cl、F、-CH2F、-CHF2、-CF3、又は-CNであるか、あるいは
R4がF若しくはOHであるとき、又はR5がFであるとき、又はR5及びR7若しくはR8及びR7が、一緒になって、5若しくは6員の複素環を形成するとき、又はR6及びR7が、一緒になって、4、5、若しくは6員の複素環を形成するとき、RIII1が-CH3であり、
RIII2が、H又はFであり、
RBが、-CH=CH2、-C≡CH、又は-C≡C-CH3である、化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。 - Zが-CH2-である、請求項74及び78~82のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- Zが結合である、請求項74及び78~82のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 表4に列挙されている構造のうちの1つを有する化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体。
- 医薬的に許容される塩の形態である、請求項74~85のいずれか一項に記載の化合物。
- 請求項74~86のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、若しくは同位体と、少なくとも1つの医薬的に許容される賦形剤と、を含む、医薬組成物。
- プロテインキナーゼを阻害する方法であって、前記プロテインキナーゼを、有効量の請求項74~85のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物と接触させることを含む、方法。
- 前記プロテインキナーゼがBTKである、請求項88に記載の方法。
- BTK依存性状態を治療するための方法であって、それを必要とする対象に、有効量の請求項74~85のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物を投与することを含む、方法。
- 前記BTK依存性状態が原発性CNSリンパ腫である、請求項90に記載の方法。
- 前記BTK依存性状態が、がん、自己免疫疾患、炎症性疾患、又は血栓塞栓性疾患である、請求項90に記載の方法。
- 前記自己免疫疾患が、多発性硬化症、関節リウマチ、乾癬、シェーグレン症候群、又は全身性エリテマトーデスである、請求項92に記載の方法。
- 前記炎症性疾患が蕁麻疹である、請求項92に記載の方法。
- 医薬品の製造における、請求項74~85のいずれか一項に記載の化合物、又はその医薬的に許容される塩、溶媒和物、水和物、異性体、互変異性体、ラセミ体、同位体、若しくは医薬組成物の使用。
- 前記医薬品が、がん、自己免疫疾患、炎症性疾患、又は血栓塞栓性疾患の治療のためのものである、請求項95に記載の使用。
- 前記自己免疫疾患が、多発性硬化症、関節リウマチ、乾癬、シェーグレン症候群、又は全身性エリテマトーデスである、請求項96に記載の使用。
- 前記炎症性疾患が蕁麻疹である、請求項96に記載の使用。
Applications Claiming Priority (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202063033724P | 2020-06-02 | 2020-06-02 | |
| US202063033729P | 2020-06-02 | 2020-06-02 | |
| US202063033728P | 2020-06-02 | 2020-06-02 | |
| US63/033,729 | 2020-06-02 | ||
| US63/033,724 | 2020-06-02 | ||
| US63/033,728 | 2020-06-02 | ||
| US202163136577P | 2021-01-12 | 2021-01-12 | |
| US202163136593P | 2021-01-12 | 2021-01-12 | |
| US202163136587P | 2021-01-12 | 2021-01-12 | |
| US63/136,587 | 2021-01-12 | ||
| US63/136,577 | 2021-01-12 | ||
| US63/136,593 | 2021-01-12 | ||
| PCT/US2021/035509 WO2021247748A1 (en) | 2020-06-02 | 2021-06-02 | Kinase inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023528421A true JP2023528421A (ja) | 2023-07-04 |
| JPWO2021247748A5 JPWO2021247748A5 (ja) | 2024-06-10 |
Family
ID=76601840
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022574229A Pending JP2023528421A (ja) | 2020-06-02 | 2021-06-02 | キナーゼ阻害剤 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20230219923A1 (ja) |
| EP (1) | EP4157446A1 (ja) |
| JP (1) | JP2023528421A (ja) |
| CN (1) | CN115867346A (ja) |
| AU (1) | AU2021283916A1 (ja) |
| CA (1) | CA3179637A1 (ja) |
| WO (1) | WO2021247748A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2021398051A1 (en) | 2020-12-10 | 2023-07-27 | Principia Biopharma Inc. | Crystal form of tolebrutinib, preparation method therefor and use thereof |
| EP4395841A1 (en) * | 2021-08-30 | 2024-07-10 | Bristol-Myers Squibb Company | Compound useful for pet-imaging of bruton's tyrosine kinase |
| WO2023227080A1 (zh) * | 2022-05-25 | 2023-11-30 | 百极弘烨(南通)医药科技有限公司 | 一种protac化合物、含其的药物组合物及其制备方法和应用 |
| AR129672A1 (es) * | 2022-06-22 | 2024-09-18 | Genzyme Corp | Métodos de fabricación de inhibidores de btk modificados |
| CN116284025A (zh) * | 2023-02-20 | 2023-06-23 | 国科大杭州高等研究院 | 一种具有抗癌作用的螺杂环类化合物、药物组合物及其用途 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2708395C2 (ru) * | 2013-06-26 | 2019-12-06 | Эббви Инк. | Первичные карбоксамиды в качестве ингибиторов bтk |
| PE20171239A1 (es) * | 2014-10-24 | 2017-08-24 | Bristol Myers Squibb Co | Derivados de carbazol |
| CN110511209B (zh) * | 2014-10-24 | 2022-07-05 | 百时美施贵宝公司 | 可用作激酶抑制剂的吲哚甲酰胺化合物 |
-
2021
- 2021-06-02 JP JP2022574229A patent/JP2023528421A/ja active Pending
- 2021-06-02 AU AU2021283916A patent/AU2021283916A1/en active Pending
- 2021-06-02 CA CA3179637A patent/CA3179637A1/en active Pending
- 2021-06-02 US US18/007,705 patent/US20230219923A1/en active Pending
- 2021-06-02 CN CN202180048117.5A patent/CN115867346A/zh active Pending
- 2021-06-02 WO PCT/US2021/035509 patent/WO2021247748A1/en unknown
- 2021-06-02 EP EP21734730.1A patent/EP4157446A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CA3179637A1 (en) | 2021-12-09 |
| US20230219923A1 (en) | 2023-07-13 |
| WO2021247748A1 (en) | 2021-12-09 |
| AU2021283916A1 (en) | 2023-01-05 |
| EP4157446A1 (en) | 2023-04-05 |
| CN115867346A (zh) | 2023-03-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102317480B1 (ko) | Shp2 억제제로서 유용한 신규한 헤테로환형 유도체 | |
| TWI850648B (zh) | 作為jak1抑制劑之哌啶-4-基三亞甲亞胺衍生物 | |
| DK3126330T3 (en) | BICYCLE-FUSED HETEROARYL OR ARYL COMPOUNDS AND USE THEREOF AS IRAC4 INHIBITORS | |
| TWI789381B (zh) | 雜環化合物 | |
| JP6802263B2 (ja) | Tyk2阻害剤およびその使用 | |
| JP2023528421A (ja) | キナーゼ阻害剤 | |
| JP2023509366A (ja) | Irak分解剤およびそれらの使用 | |
| WO2023061294A1 (zh) | 含氮杂环类衍生物调节剂、其制备方法及应用 | |
| CN108721298A (zh) | 作为布鲁顿酪氨酸激酶抑制剂的嘧啶并杂环化合物及其应用 | |
| TW202122382A (zh) | 乙內醯脲衍生物 | |
| TW202200543A (zh) | Mdm2降解劑及其用途 | |
| TW202334151A (zh) | Tyk2降解劑及其用途 | |
| TW202334167A (zh) | 作為erbb2抑制劑之稠合四環喹唑啉衍生物 | |
| US20240246977A1 (en) | Degradation of bruton's tyrosine kinase (btk) by conjugation of btk inhibitors with e3 ligase ligand and method of use | |
| JP2023521172A (ja) | キナーゼ阻害剤 | |
| JP7535600B2 (ja) | 化合物および脾臓チロシンキナーゼ阻害剤としてのその使用 | |
| EP4277893A1 (en) | Indole derivatives as kinase inhibitors | |
| TR2022017135T2 (tr) | Kinaz inhibitörleri. | |
| WO2023230609A1 (en) | Heterocyclic pad4 inhibitors | |
| TW202417434A (zh) | 用於治療之parp14之靶向蛋白質降解 | |
| WO2023230612A1 (en) | Heterocyclic pad4 inhibitors | |
| EP4329766A1 (en) | Ripk1 inhibitors and methods of use | |
| KR20190007391A (ko) | 신규한 1h-피라졸로피리딘 유도체 및 이를 포함하는 약학 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240531 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20240531 |