JP2023015080A - 造血幹細胞を除去するための抗体薬物結合体 - Google Patents
造血幹細胞を除去するための抗体薬物結合体 Download PDFInfo
- Publication number
- JP2023015080A JP2023015080A JP2022167563A JP2022167563A JP2023015080A JP 2023015080 A JP2023015080 A JP 2023015080A JP 2022167563 A JP2022167563 A JP 2022167563A JP 2022167563 A JP2022167563 A JP 2022167563A JP 2023015080 A JP2023015080 A JP 2023015080A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- fab
- antibody
- heavy chain
- light chain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000003958 hematopoietic stem cell Anatomy 0.000 title claims abstract description 109
- 229940049595 antibody-drug conjugate Drugs 0.000 title abstract description 61
- 239000000611 antibody drug conjugate Substances 0.000 title abstract description 44
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims abstract description 398
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims abstract description 398
- 238000000034 method Methods 0.000 claims abstract description 74
- 231100000599 cytotoxic agent Toxicity 0.000 claims abstract description 34
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 33
- 229940127089 cytotoxic agent Drugs 0.000 claims abstract description 25
- 150000003839 salts Chemical class 0.000 claims abstract description 25
- 239000002254 cytotoxic agent Substances 0.000 claims abstract description 21
- 238000011134 hematopoietic stem cell transplantation Methods 0.000 claims abstract description 16
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 182
- 210000004027 cell Anatomy 0.000 claims description 140
- 210000003630 histaminocyte Anatomy 0.000 claims description 86
- 229910052799 carbon Inorganic materials 0.000 claims description 80
- 229910052739 hydrogen Inorganic materials 0.000 claims description 80
- 239000003814 drug Substances 0.000 claims description 72
- 125000000217 alkyl group Chemical group 0.000 claims description 57
- 235000018417 cysteine Nutrition 0.000 claims description 51
- 150000007523 nucleic acids Chemical class 0.000 claims description 48
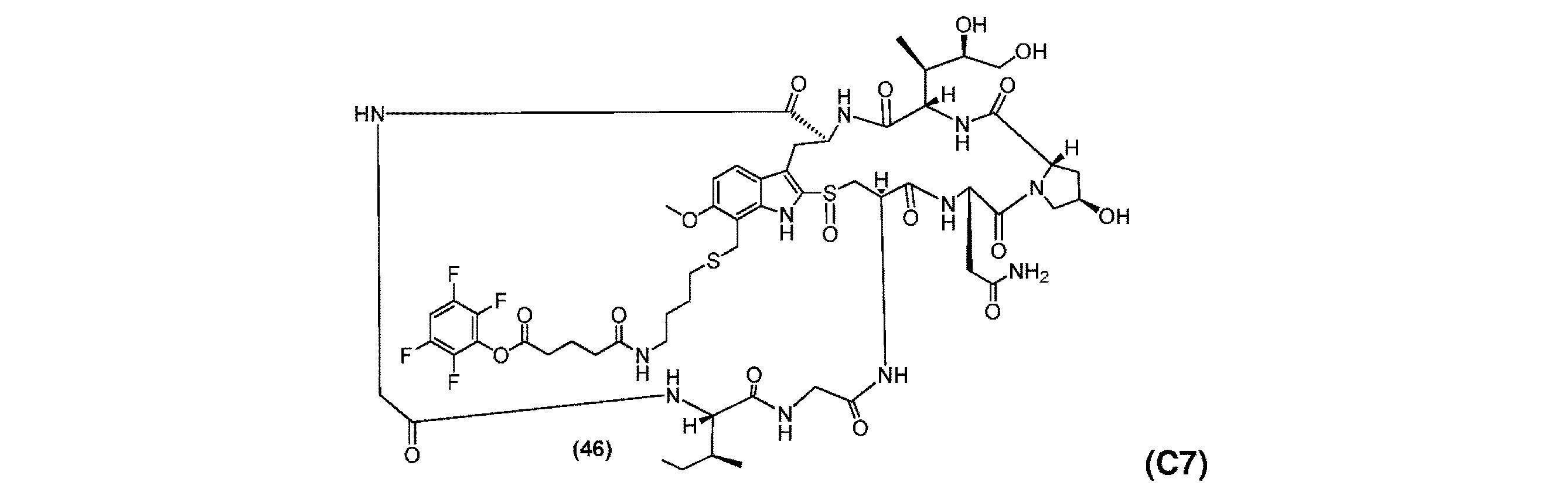
- CIORWBWIBBPXCG-JZTFPUPKSA-N amanitin Chemical compound O=C1N[C@@H](CC(N)=O)C(=O)N2CC(O)C[C@H]2C(=O)N[C@@H](C(C)[C@@H](O)CO)C(=O)N[C@@H](C2)C(=O)NCC(=O)N[C@@H](C(C)CC)C(=O)NCC(=O)N[C@H]1CS(=O)C1=C2C2=CC=C(O)C=C2N1 CIORWBWIBBPXCG-JZTFPUPKSA-N 0.000 claims description 45
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 43
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 claims description 42
- 239000000203 mixture Substances 0.000 claims description 39
- 239000013598 vector Substances 0.000 claims description 33
- 102000039446 nucleic acids Human genes 0.000 claims description 32
- 108020004707 nucleic acids Proteins 0.000 claims description 32
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 31
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 28
- 125000003545 alkoxy group Chemical group 0.000 claims description 20
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 20
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 claims description 20
- 125000001153 fluoro group Chemical group F* 0.000 claims description 20
- -1 maytansinoid Proteins 0.000 claims description 20
- 201000010099 disease Diseases 0.000 claims description 16
- 108010027164 Amanitins Proteins 0.000 claims description 15
- 229940124597 therapeutic agent Drugs 0.000 claims description 15
- 230000003750 conditioning effect Effects 0.000 claims description 14
- 206010000871 Acute monocytic leukaemia Diseases 0.000 claims description 13
- 208000035489 Monocytic Acute Leukemia Diseases 0.000 claims description 13
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 13
- 108010044540 auristatin Proteins 0.000 claims description 11
- 108010084592 Saporins Proteins 0.000 claims description 10
- 208000016245 inborn errors of metabolism Diseases 0.000 claims description 10
- 238000004519 manufacturing process Methods 0.000 claims description 10
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 9
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 9
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 9
- 208000017604 Hodgkin disease Diseases 0.000 claims description 8
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 8
- 230000000779 depleting effect Effects 0.000 claims description 8
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 7
- 208000023275 Autoimmune disease Diseases 0.000 claims description 7
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 7
- 208000032467 Aplastic anaemia Diseases 0.000 claims description 6
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims description 6
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 6
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 6
- 208000006110 Wiskott-Aldrich syndrome Diseases 0.000 claims description 6
- 201000009277 hairy cell leukemia Diseases 0.000 claims description 6
- 208000018706 hematopoietic system disease Diseases 0.000 claims description 6
- 208000028529 primary immunodeficiency disease Diseases 0.000 claims description 6
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 5
- 206010025323 Lymphomas Diseases 0.000 claims description 5
- 208000033759 Prolymphocytic T-Cell Leukemia Diseases 0.000 claims description 5
- 208000026651 T-cell prolymphocytic leukemia Diseases 0.000 claims description 5
- 230000003211 malignant effect Effects 0.000 claims description 5
- 239000002243 precursor Substances 0.000 claims description 5
- 230000008569 process Effects 0.000 claims description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 4
- 206010061598 Immunodeficiency Diseases 0.000 claims description 4
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 claims description 4
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 claims description 4
- 201000011452 Adrenoleukodystrophy Diseases 0.000 claims description 3
- 208000009746 Adult T-Cell Leukemia-Lymphoma Diseases 0.000 claims description 3
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 claims description 3
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 claims description 3
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 3
- 206010053138 Congenital aplastic anaemia Diseases 0.000 claims description 3
- 208000011231 Crohn disease Diseases 0.000 claims description 3
- 206010061850 Extranodal marginal zone B-cell lymphoma (MALT type) Diseases 0.000 claims description 3
- 201000004939 Fanconi anemia Diseases 0.000 claims description 3
- 208000015872 Gaucher disease Diseases 0.000 claims description 3
- 208000036066 Hemophagocytic Lymphohistiocytosis Diseases 0.000 claims description 3
- 208000032672 Histiocytosis haematophagic Diseases 0.000 claims description 3
- 208000029462 Immunodeficiency disease Diseases 0.000 claims description 3
- 206010062018 Inborn error of metabolism Diseases 0.000 claims description 3
- 206010052210 Infantile genetic agranulocytosis Diseases 0.000 claims description 3
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 3
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 claims description 3
- 208000006404 Large Granular Lymphocytic Leukemia Diseases 0.000 claims description 3
- 201000003791 MALT lymphoma Diseases 0.000 claims description 3
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 claims description 3
- 108010049137 Member 1 Subfamily D ATP Binding Cassette Transporter Proteins 0.000 claims description 3
- 201000011442 Metachromatic leukodystrophy Diseases 0.000 claims description 3
- 208000002678 Mucopolysaccharidoses Diseases 0.000 claims description 3
- 206010056886 Mucopolysaccharidosis I Diseases 0.000 claims description 3
- 208000034578 Multiple myelomas Diseases 0.000 claims description 3
- 208000014767 Myeloproliferative disease Diseases 0.000 claims description 3
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 3
- 208000000733 Paroxysmal Hemoglobinuria Diseases 0.000 claims description 3
- 208000027190 Peripheral T-cell lymphomas Diseases 0.000 claims description 3
- 102100036050 Phosphatidylinositol N-acetylglucosaminyltransferase subunit A Human genes 0.000 claims description 3
- 208000021386 Sjogren Syndrome Diseases 0.000 claims description 3
- 208000031672 T-Cell Peripheral Lymphoma Diseases 0.000 claims description 3
- 201000008717 T-cell large granular lymphocyte leukemia Diseases 0.000 claims description 3
- 208000000389 T-cell leukemia Diseases 0.000 claims description 3
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 claims description 3
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 3
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 3
- 206010043391 Thalassaemia beta Diseases 0.000 claims description 3
- 208000026911 Tuberous sclerosis complex Diseases 0.000 claims description 3
- 206010047115 Vasculitis Diseases 0.000 claims description 3
- 201000006966 adult T-cell leukemia Diseases 0.000 claims description 3
- 238000012258 culturing Methods 0.000 claims description 3
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 201000003444 follicular lymphoma Diseases 0.000 claims description 3
- 208000014752 hemophagocytic syndrome Diseases 0.000 claims description 3
- 230000007813 immunodeficiency Effects 0.000 claims description 3
- 208000033065 inborn errors of immunity Diseases 0.000 claims description 3
- 208000002551 irritable bowel syndrome Diseases 0.000 claims description 3
- 206010025135 lupus erythematosus Diseases 0.000 claims description 3
- 208000020968 mature T-cell and NK-cell non-Hodgkin lymphoma Diseases 0.000 claims description 3
- 206010028093 mucopolysaccharidosis Diseases 0.000 claims description 3
- 201000006417 multiple sclerosis Diseases 0.000 claims description 3
- 206010028417 myasthenia gravis Diseases 0.000 claims description 3
- 201000005962 mycosis fungoides Diseases 0.000 claims description 3
- 201000003045 paroxysmal nocturnal hemoglobinuria Diseases 0.000 claims description 3
- 208000009999 tuberous sclerosis Diseases 0.000 claims description 3
- 208000003670 Pure Red-Cell Aplasia Diseases 0.000 claims description 2
- 208000007502 anemia Diseases 0.000 claims description 2
- 208000002491 severe combined immunodeficiency Diseases 0.000 claims description 2
- 102000009030 Member 1 Subfamily D ATP Binding Cassette Transporter Human genes 0.000 claims 1
- 239000000562 conjugate Substances 0.000 abstract description 197
- 230000003247 decreasing effect Effects 0.000 abstract description 2
- 239000012634 fragment Substances 0.000 description 107
- 125000005647 linker group Chemical group 0.000 description 82
- 238000009739 binding Methods 0.000 description 74
- 230000027455 binding Effects 0.000 description 72
- 150000001875 compounds Chemical group 0.000 description 63
- 241000699670 Mus sp. Species 0.000 description 54
- 235000001014 amino acid Nutrition 0.000 description 54
- 229940024606 amino acid Drugs 0.000 description 52
- 238000006243 chemical reaction Methods 0.000 description 52
- 150000001413 amino acids Chemical class 0.000 description 51
- 229940079593 drug Drugs 0.000 description 51
- 108090000623 proteins and genes Proteins 0.000 description 51
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 47
- 239000002953 phosphate buffered saline Substances 0.000 description 47
- 102000004169 proteins and genes Human genes 0.000 description 42
- 239000000427 antigen Substances 0.000 description 40
- 108091007433 antigens Proteins 0.000 description 40
- 102000036639 antigens Human genes 0.000 description 40
- 235000018102 proteins Nutrition 0.000 description 39
- 229960002433 cysteine Drugs 0.000 description 37
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 36
- 108090000765 processed proteins & peptides Proteins 0.000 description 35
- 239000003795 chemical substances by application Substances 0.000 description 34
- 102000004196 processed proteins & peptides Human genes 0.000 description 33
- 238000011282 treatment Methods 0.000 description 33
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 32
- 239000011541 reaction mixture Substances 0.000 description 32
- 239000000872 buffer Substances 0.000 description 30
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 30
- 229920001184 polypeptide Polymers 0.000 description 30
- 150000003573 thiols Chemical class 0.000 description 29
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 28
- 210000001185 bone marrow Anatomy 0.000 description 28
- 238000002054 transplantation Methods 0.000 description 26
- 239000000047 product Substances 0.000 description 25
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 24
- 238000003556 assay Methods 0.000 description 24
- 230000015572 biosynthetic process Effects 0.000 description 24
- 150000002576 ketones Chemical group 0.000 description 24
- 238000012360 testing method Methods 0.000 description 24
- 239000008280 blood Substances 0.000 description 23
- 229940127121 immunoconjugate Drugs 0.000 description 23
- 210000004369 blood Anatomy 0.000 description 22
- 102000040430 polynucleotide Human genes 0.000 description 22
- 108091033319 polynucleotide Proteins 0.000 description 22
- 239000002157 polynucleotide Substances 0.000 description 22
- 239000000243 solution Substances 0.000 description 22
- 239000000523 sample Substances 0.000 description 21
- 238000002474 experimental method Methods 0.000 description 20
- 239000011347 resin Substances 0.000 description 20
- 229920005989 resin Polymers 0.000 description 20
- 230000002829 reductive effect Effects 0.000 description 19
- 238000006467 substitution reaction Methods 0.000 description 19
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 18
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 18
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 18
- 230000000694 effects Effects 0.000 description 18
- 230000014509 gene expression Effects 0.000 description 18
- 206010068051 Chimerism Diseases 0.000 description 17
- 241000699666 Mus <mouse, genus> Species 0.000 description 17
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 16
- 239000004007 alpha amanitin Substances 0.000 description 16
- 150000001412 amines Chemical class 0.000 description 16
- 125000000539 amino acid group Chemical group 0.000 description 16
- 229960005502 α-amanitin Drugs 0.000 description 16
- 239000010432 diamond Substances 0.000 description 15
- 238000004128 high performance liquid chromatography Methods 0.000 description 15
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 15
- 230000014759 maintenance of location Effects 0.000 description 15
- 238000004007 reversed phase HPLC Methods 0.000 description 15
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 14
- 239000003153 chemical reaction reagent Substances 0.000 description 14
- 239000002596 immunotoxin Substances 0.000 description 14
- 210000005259 peripheral blood Anatomy 0.000 description 14
- 239000011886 peripheral blood Substances 0.000 description 14
- 108020004705 Codon Proteins 0.000 description 13
- 206010028980 Neoplasm Diseases 0.000 description 13
- 108091028043 Nucleic acid sequence Proteins 0.000 description 13
- 239000002619 cytotoxin Substances 0.000 description 13
- 239000013604 expression vector Substances 0.000 description 13
- 238000000338 in vitro Methods 0.000 description 13
- 238000001727 in vivo Methods 0.000 description 13
- 230000004048 modification Effects 0.000 description 13
- 238000012986 modification Methods 0.000 description 13
- 210000000130 stem cell Anatomy 0.000 description 13
- 230000001960 triggered effect Effects 0.000 description 13
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 12
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 208000035475 disorder Diseases 0.000 description 12
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 12
- 210000004602 germ cell Anatomy 0.000 description 12
- 239000003112 inhibitor Substances 0.000 description 12
- 125000003729 nucleotide group Chemical group 0.000 description 12
- 150000002923 oximes Chemical class 0.000 description 12
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical group O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 12
- 210000001744 T-lymphocyte Anatomy 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 11
- 238000002648 combination therapy Methods 0.000 description 11
- 239000012149 elution buffer Substances 0.000 description 11
- 239000002773 nucleotide Substances 0.000 description 11
- 238000005481 NMR spectroscopy Methods 0.000 description 10
- 238000002360 preparation method Methods 0.000 description 10
- 241000894007 species Species 0.000 description 10
- 208000024891 symptom Diseases 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 9
- 101100330725 Arabidopsis thaliana DAR4 gene Proteins 0.000 description 9
- 101100112922 Candida albicans CDR3 gene Proteins 0.000 description 9
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 9
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- 238000002835 absorbance Methods 0.000 description 9
- 230000001588 bifunctional effect Effects 0.000 description 9
- 238000005516 engineering process Methods 0.000 description 9
- 125000000524 functional group Chemical group 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- 230000009467 reduction Effects 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 238000002560 therapeutic procedure Methods 0.000 description 9
- 108020004414 DNA Proteins 0.000 description 8
- 239000004480 active ingredient Substances 0.000 description 8
- 230000021615 conjugation Effects 0.000 description 8
- 238000010828 elution Methods 0.000 description 8
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 230000003993 interaction Effects 0.000 description 8
- 208000032839 leukemia Diseases 0.000 description 8
- 231100000654 protein toxin Toxicity 0.000 description 8
- 102000005962 receptors Human genes 0.000 description 8
- 108020003175 receptors Proteins 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 231100000331 toxic Toxicity 0.000 description 8
- 230000002588 toxic effect Effects 0.000 description 8
- 239000003053 toxin Substances 0.000 description 8
- 208000009329 Graft vs Host Disease Diseases 0.000 description 7
- 239000007821 HATU Substances 0.000 description 7
- 239000004698 Polyethylene Substances 0.000 description 7
- 239000002246 antineoplastic agent Substances 0.000 description 7
- 102000007478 beta-N-Acetylhexosaminidases Human genes 0.000 description 7
- 108010085377 beta-N-Acetylhexosaminidases Proteins 0.000 description 7
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 7
- 239000003623 enhancer Substances 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- 238000000684 flow cytometry Methods 0.000 description 7
- 238000009472 formulation Methods 0.000 description 7
- 208000024908 graft versus host disease Diseases 0.000 description 7
- 229940090044 injection Drugs 0.000 description 7
- 230000035772 mutation Effects 0.000 description 7
- 238000010405 reoxidation reaction Methods 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 6
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 210000003719 b-lymphocyte Anatomy 0.000 description 6
- 210000002798 bone marrow cell Anatomy 0.000 description 6
- 201000011510 cancer Diseases 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 230000000295 complement effect Effects 0.000 description 6
- 239000008187 granular material Substances 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 229940051026 immunotoxin Drugs 0.000 description 6
- 231100000608 immunotoxin Toxicity 0.000 description 6
- 230000001965 increasing effect Effects 0.000 description 6
- 238000011534 incubation Methods 0.000 description 6
- 238000001802 infusion Methods 0.000 description 6
- 210000000265 leukocyte Anatomy 0.000 description 6
- 238000011275 oncology therapy Methods 0.000 description 6
- 230000002195 synergetic effect Effects 0.000 description 6
- 239000011534 wash buffer Substances 0.000 description 6
- 238000005160 1H NMR spectroscopy Methods 0.000 description 5
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 5
- 238000011746 C57BL/6J (JAX™ mouse strain) Methods 0.000 description 5
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 5
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 5
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 5
- 239000007995 HEPES buffer Substances 0.000 description 5
- 102100027754 Mast/stem cell growth factor receptor Kit Human genes 0.000 description 5
- 239000004365 Protease Substances 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 239000013543 active substance Substances 0.000 description 5
- 239000011324 bead Substances 0.000 description 5
- 230000001143 conditioned effect Effects 0.000 description 5
- 230000001186 cumulative effect Effects 0.000 description 5
- 238000010494 dissociation reaction Methods 0.000 description 5
- 230000005593 dissociations Effects 0.000 description 5
- 150000002019 disulfides Chemical class 0.000 description 5
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 5
- 238000003018 immunoassay Methods 0.000 description 5
- 230000002637 immunotoxin Effects 0.000 description 5
- 230000001939 inductive effect Effects 0.000 description 5
- 210000004962 mammalian cell Anatomy 0.000 description 5
- 239000011159 matrix material Substances 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 238000002953 preparative HPLC Methods 0.000 description 5
- 230000001105 regulatory effect Effects 0.000 description 5
- 239000006228 supernatant Substances 0.000 description 5
- 238000004448 titration Methods 0.000 description 5
- 108700012359 toxins Proteins 0.000 description 5
- 230000014616 translation Effects 0.000 description 5
- 230000003612 virological effect Effects 0.000 description 5
- AIQKYLNXJKSLHP-NSHDSACASA-N (2S)-2-amino-N-(3-azidopropylsulfonyl)-3-phenylpropanamide Chemical compound N[C@H](C(=O)NS(=O)(=O)CCCN=[N+]=[N-])CC1=CC=CC=C1 AIQKYLNXJKSLHP-NSHDSACASA-N 0.000 description 4
- SUNMBRGCANLOEG-UHFFFAOYSA-N 1,3-dichloroacetone Chemical compound ClCC(=O)CCl SUNMBRGCANLOEG-UHFFFAOYSA-N 0.000 description 4
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 4
- RGICCULPCWNRAB-UHFFFAOYSA-N 2-[2-(2-hexoxyethoxy)ethoxy]ethanol Chemical compound CCCCCCOCCOCCOCCO RGICCULPCWNRAB-UHFFFAOYSA-N 0.000 description 4
- PBVAJRFEEOIAGW-UHFFFAOYSA-N 3-[bis(2-carboxyethyl)phosphanyl]propanoic acid;hydrochloride Chemical compound Cl.OC(=O)CCP(CCC(O)=O)CCC(O)=O PBVAJRFEEOIAGW-UHFFFAOYSA-N 0.000 description 4
- DBRIOBHILRGDPP-UHFFFAOYSA-N 3-azidopropane-1-sulfonic acid Chemical compound OS(=O)(=O)CCCN=[N+]=[N-] DBRIOBHILRGDPP-UHFFFAOYSA-N 0.000 description 4
- 101100330723 Arabidopsis thaliana DAR2 gene Proteins 0.000 description 4
- 108091026890 Coding region Proteins 0.000 description 4
- 108010036949 Cyclosporine Proteins 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 108010053187 Diphtheria Toxin Proteins 0.000 description 4
- 102000016607 Diphtheria Toxin Human genes 0.000 description 4
- 102100031334 Elongation factor 2 Human genes 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- 108090000526 Papain Proteins 0.000 description 4
- 108010077519 Peptide Elongation Factor 2 Proteins 0.000 description 4
- 229920001213 Polysorbate 20 Polymers 0.000 description 4
- 108010029485 Protein Isoforms Proteins 0.000 description 4
- 102000001708 Protein Isoforms Human genes 0.000 description 4
- 108010076504 Protein Sorting Signals Proteins 0.000 description 4
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 4
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 4
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 4
- PBCJIPOGFJYBJE-UHFFFAOYSA-N acetonitrile;hydrate Chemical compound O.CC#N PBCJIPOGFJYBJE-UHFFFAOYSA-N 0.000 description 4
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 4
- 125000003277 amino group Chemical group 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 239000011230 binding agent Substances 0.000 description 4
- 230000015556 catabolic process Effects 0.000 description 4
- 238000006731 degradation reaction Methods 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 210000005260 human cell Anatomy 0.000 description 4
- 210000004408 hybridoma Anatomy 0.000 description 4
- 150000003840 hydrochlorides Chemical class 0.000 description 4
- 230000005847 immunogenicity Effects 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 208000015978 inherited metabolic disease Diseases 0.000 description 4
- 230000002147 killing effect Effects 0.000 description 4
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 4
- OKKJLVBELUTLKV-VMNATFBRSA-N methanol-d1 Chemical compound [2H]OC OKKJLVBELUTLKV-VMNATFBRSA-N 0.000 description 4
- 229930182817 methionine Natural products 0.000 description 4
- 201000000050 myeloid neoplasm Diseases 0.000 description 4
- 229940055729 papain Drugs 0.000 description 4
- 235000019834 papain Nutrition 0.000 description 4
- 239000008188 pellet Substances 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 239000012071 phase Substances 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 4
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 4
- 229940068977 polysorbate 20 Drugs 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 238000001542 size-exclusion chromatography Methods 0.000 description 4
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- ONDSBJMLAHVLMI-UHFFFAOYSA-N trimethylsilyldiazomethane Chemical compound C[Si](C)(C)[CH-][N+]#N ONDSBJMLAHVLMI-UHFFFAOYSA-N 0.000 description 4
- OCXHPHOVIMNVPQ-UTHKHBGESA-N (2r,3r)-3-methoxy-3-[(2s)-1-[(3r,4s,5s)-3-methoxy-5-methyl-4-[methyl-[(2s)-3-methyl-2-[(2-methylpropan-2-yl)oxycarbonylamino]butanoyl]amino]heptanoyl]pyrrolidin-2-yl]-2-methylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(O)=O OCXHPHOVIMNVPQ-UTHKHBGESA-N 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- OBYJFWVFCFYKNY-UHFFFAOYSA-N 1-prop-2-ynylpyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1CC#C OBYJFWVFCFYKNY-UHFFFAOYSA-N 0.000 description 3
- FVRXLSOOPLSSNW-UHFFFAOYSA-N 3-azidopropane-1-sulfonyl chloride Chemical compound ClS(=O)(=O)CCCN=[N+]=[N-] FVRXLSOOPLSSNW-UHFFFAOYSA-N 0.000 description 3
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 3
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 3
- 108010092160 Dactinomycin Proteins 0.000 description 3
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 3
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 3
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 3
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 3
- 101100220044 Homo sapiens CD34 gene Proteins 0.000 description 3
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 3
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 3
- 102100032913 Leukocyte surface antigen CD47 Human genes 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 3
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 3
- 101000762949 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) Exotoxin A Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 239000012505 Superdex™ Substances 0.000 description 3
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 3
- 239000007983 Tris buffer Substances 0.000 description 3
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 210000000601 blood cell Anatomy 0.000 description 3
- 229960005243 carmustine Drugs 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- 238000002512 chemotherapy Methods 0.000 description 3
- 238000003776 cleavage reaction Methods 0.000 description 3
- 238000011260 co-administration Methods 0.000 description 3
- 229960003957 dexamethasone Drugs 0.000 description 3
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 3
- VSPMNQQOQWDCQX-UHFFFAOYSA-N diazonio(3-sulfamoylpropyl)azanide Chemical compound NS(=O)(=O)CCCN=[N+]=[N-] VSPMNQQOQWDCQX-UHFFFAOYSA-N 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 238000001647 drug administration Methods 0.000 description 3
- 230000006862 enzymatic digestion Effects 0.000 description 3
- 230000002255 enzymatic effect Effects 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 229960003180 glutathione Drugs 0.000 description 3
- 235000003969 glutathione Nutrition 0.000 description 3
- 125000000717 hydrazino group Chemical group [H]N([*])N([H])[H] 0.000 description 3
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 3
- 210000002865 immune cell Anatomy 0.000 description 3
- 210000000987 immune system Anatomy 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 239000007943 implant Substances 0.000 description 3
- 238000002513 implantation Methods 0.000 description 3
- 238000000099 in vitro assay Methods 0.000 description 3
- 238000011835 investigation Methods 0.000 description 3
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 3
- 230000036210 malignancy Effects 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 239000012562 protein A resin Substances 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 238000001959 radiotherapy Methods 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 230000007017 scission Effects 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 3
- 238000002741 site-directed mutagenesis Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 210000000603 stem cell niche Anatomy 0.000 description 3
- 239000003440 toxic substance Substances 0.000 description 3
- 230000002103 transcriptional effect Effects 0.000 description 3
- 238000003146 transient transfection Methods 0.000 description 3
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 3
- 239000013603 viral vector Substances 0.000 description 3
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 2
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 2
- ZYJPUMXJBDHSIF-NSHDSACASA-N (2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3-phenylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 ZYJPUMXJBDHSIF-NSHDSACASA-N 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- LQQKDSXCDXHLLF-UHFFFAOYSA-N 1,3-dibromopropan-2-one Chemical compound BrCC(=O)CBr LQQKDSXCDXHLLF-UHFFFAOYSA-N 0.000 description 2
- OKARNAREDZHGLR-UHFFFAOYSA-N 1,3-diiodopropan-2-one Chemical compound ICC(=O)CI OKARNAREDZHGLR-UHFFFAOYSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- 150000003923 2,5-pyrrolediones Chemical class 0.000 description 2
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- WUIABRMSWOKTOF-OYALTWQYSA-N 3-[[2-[2-[2-[[(2s,3r)-2-[[(2s,3s,4r)-4-[[(2s,3r)-2-[[6-amino-2-[(1s)-3-amino-1-[[(2s)-2,3-diamino-3-oxopropyl]amino]-3-oxopropyl]-5-methylpyrimidine-4-carbonyl]amino]-3-[(2r,3s,4s,5s,6s)-3-[(2r,3s,4s,5r,6r)-4-carbamoyloxy-3,5-dihydroxy-6-(hydroxymethyl)ox Chemical compound OS([O-])(=O)=O.N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1NC=NC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C WUIABRMSWOKTOF-OYALTWQYSA-N 0.000 description 2
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 2
- WOJKKJKETHYEAC-UHFFFAOYSA-N 6-Maleimidocaproic acid Chemical compound OC(=O)CCCCCN1C(=O)C=CC1=O WOJKKJKETHYEAC-UHFFFAOYSA-N 0.000 description 2
- 102100024643 ATP-binding cassette sub-family D member 1 Human genes 0.000 description 2
- 108010066676 Abrin Proteins 0.000 description 2
- 101800002638 Alpha-amanitin Proteins 0.000 description 2
- 108010024976 Asparaginase Proteins 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 208000011691 Burkitt lymphomas Diseases 0.000 description 2
- 102100032528 C-type lectin domain family 11 member A Human genes 0.000 description 2
- 101710167766 C-type lectin domain family 11 member A Proteins 0.000 description 2
- 101100289995 Caenorhabditis elegans mac-1 gene Proteins 0.000 description 2
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 2
- 101150034590 DAR1 gene Proteins 0.000 description 2
- 241000588921 Enterobacteriaceae Species 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 235000014066 European mistletoe Nutrition 0.000 description 2
- 108010029961 Filgrastim Proteins 0.000 description 2
- 102100020715 Fms-related tyrosine kinase 3 ligand protein Human genes 0.000 description 2
- 101710162577 Fms-related tyrosine kinase 3 ligand protein Proteins 0.000 description 2
- 108700004714 Gelonium multiflorum GEL Proteins 0.000 description 2
- 108010024636 Glutathione Proteins 0.000 description 2
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- BXNJHAXVSOCGBA-UHFFFAOYSA-N Harmine Chemical compound N1=CC=C2C3=CC=C(OC)C=C3NC2=C1C BXNJHAXVSOCGBA-UHFFFAOYSA-N 0.000 description 2
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- 101000868279 Homo sapiens Leukocyte surface antigen CD47 Proteins 0.000 description 2
- 101000863873 Homo sapiens Tyrosine-protein phosphatase non-receptor type substrate 1 Proteins 0.000 description 2
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 2
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 2
- 102000009438 IgE Receptors Human genes 0.000 description 2
- 108010073816 IgE Receptors Proteins 0.000 description 2
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 2
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 2
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 2
- 108090001090 Lectins Proteins 0.000 description 2
- 102000004856 Lectins Human genes 0.000 description 2
- 102100030874 Leptin Human genes 0.000 description 2
- 108010092277 Leptin Proteins 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 102000003792 Metallothionein Human genes 0.000 description 2
- 108090000157 Metallothionein Proteins 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 101710181812 Methionine aminopeptidase Proteins 0.000 description 2
- 102000029749 Microtubule Human genes 0.000 description 2
- 108091022875 Microtubule Proteins 0.000 description 2
- 101100174574 Mus musculus Pikfyve gene Proteins 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 208000008589 Obesity Diseases 0.000 description 2
- 229930040373 Paraformaldehyde Natural products 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- 241000589516 Pseudomonas Species 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 208000033501 Refractory anemia with excess blasts Diseases 0.000 description 2
- 244000152640 Rhipsalis cassutha Species 0.000 description 2
- 235000012300 Rhipsalis cassutha Nutrition 0.000 description 2
- 108010039491 Ricin Proteins 0.000 description 2
- RXGJTYFDKOHJHK-UHFFFAOYSA-N S-deoxo-amaninamide Natural products CCC(C)C1NC(=O)CNC(=O)C2Cc3c(SCC(NC(=O)CNC1=O)C(=O)NC(CC(=O)N)C(=O)N4CC(O)CC4C(=O)NC(C(C)C(O)CO)C(=O)N2)[nH]c5ccccc35 RXGJTYFDKOHJHK-UHFFFAOYSA-N 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 101100393304 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) GPD1 gene Proteins 0.000 description 2
- 241000710961 Semliki Forest virus Species 0.000 description 2
- 229920002684 Sepharose Polymers 0.000 description 2
- 108010079723 Shiga Toxin Proteins 0.000 description 2
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- PZBFGYYEXUXCOF-UHFFFAOYSA-N TCEP Chemical compound OC(=O)CCP(CCC(O)=O)CCC(O)=O PZBFGYYEXUXCOF-UHFFFAOYSA-N 0.000 description 2
- 101710120037 Toxin CcdB Proteins 0.000 description 2
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 2
- 102100029948 Tyrosine-protein phosphatase non-receptor type substrate 1 Human genes 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 2
- 230000000735 allogeneic effect Effects 0.000 description 2
- CIORWBWIBBPXCG-SXZCQOKQSA-N alpha-amanitin Chemical compound O=C1N[C@@H](CC(N)=O)C(=O)N2C[C@H](O)C[C@H]2C(=O)N[C@@H]([C@@H](C)[C@@H](O)CO)C(=O)N[C@@H](C2)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@H]1C[S@@](=O)C1=C2C2=CC=C(O)C=C2N1 CIORWBWIBBPXCG-SXZCQOKQSA-N 0.000 description 2
- CIORWBWIBBPXCG-UHFFFAOYSA-N alpha-amanitin Natural products O=C1NC(CC(N)=O)C(=O)N2CC(O)CC2C(=O)NC(C(C)C(O)CO)C(=O)NC(C2)C(=O)NCC(=O)NC(C(C)CC)C(=O)NCC(=O)NC1CS(=O)C1=C2C2=CC=C(O)C=C2N1 CIORWBWIBBPXCG-UHFFFAOYSA-N 0.000 description 2
- 238000012436 analytical size exclusion chromatography Methods 0.000 description 2
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 230000003474 anti-emetic effect Effects 0.000 description 2
- 239000002111 antiemetic agent Substances 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 238000010322 bone marrow transplantation Methods 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- 239000012267 brine Substances 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 239000001110 calcium chloride Substances 0.000 description 2
- 229910001628 calcium chloride Inorganic materials 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000022534 cell killing Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 229960001265 ciclosporin Drugs 0.000 description 2
- 229960002436 cladribine Drugs 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000013058 crude material Substances 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 229930182912 cyclosporin Natural products 0.000 description 2
- 229960000640 dactinomycin Drugs 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000011033 desalting Methods 0.000 description 2
- 238000003795 desorption Methods 0.000 description 2
- 239000000032 diagnostic agent Substances 0.000 description 2
- 229940039227 diagnostic agent Drugs 0.000 description 2
- 238000000502 dialysis Methods 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 229960005304 fludarabine phosphate Drugs 0.000 description 2
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 2
- 230000002538 fungal effect Effects 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 208000014951 hematologic disease Diseases 0.000 description 2
- 230000002489 hematologic effect Effects 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 229960002885 histidine Drugs 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N hydrazine group Chemical group NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- 230000000415 inactivating effect Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 239000002523 lectin Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000011068 loading method Methods 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 210000002752 melanocyte Anatomy 0.000 description 2
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 2
- 229960001428 mercaptopurine Drugs 0.000 description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- RUZLIIJDZBWWSA-INIZCTEOSA-N methyl 2-[[(1s)-1-(7-methyl-2-morpholin-4-yl-4-oxopyrido[1,2-a]pyrimidin-9-yl)ethyl]amino]benzoate Chemical group COC(=O)C1=CC=CC=C1N[C@@H](C)C1=CC(C)=CN2C(=O)C=C(N3CCOCC3)N=C12 RUZLIIJDZBWWSA-INIZCTEOSA-N 0.000 description 2
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical class CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 2
- 210000004688 microtubule Anatomy 0.000 description 2
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 238000000569 multi-angle light scattering Methods 0.000 description 2
- 208000016586 myelodysplastic syndrome with excess blasts Diseases 0.000 description 2
- 235000020824 obesity Nutrition 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 229920002866 paraformaldehyde Polymers 0.000 description 2
- 108010044644 pegfilgrastim Proteins 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- UHZYTMXLRWXGPK-UHFFFAOYSA-N phosphorus pentachloride Chemical compound ClP(Cl)(Cl)(Cl)Cl UHZYTMXLRWXGPK-UHFFFAOYSA-N 0.000 description 2
- 108700028325 pokeweed antiviral Proteins 0.000 description 2
- 229920000136 polysorbate Polymers 0.000 description 2
- 235000015320 potassium carbonate Nutrition 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 238000001243 protein synthesis Methods 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 239000012070 reactive reagent Substances 0.000 description 2
- 238000003259 recombinant expression Methods 0.000 description 2
- 206010067959 refractory cytopenia with multilineage dysplasia Diseases 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 210000003705 ribosome Anatomy 0.000 description 2
- 108010038379 sargramostim Proteins 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 239000006152 selective media Substances 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 208000007056 sickle cell anemia Diseases 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 2
- 239000001488 sodium phosphate Substances 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 235000011008 sodium phosphates Nutrition 0.000 description 2
- 229940074404 sodium succinate Drugs 0.000 description 2
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 2
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 238000011476 stem cell transplantation Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 229960004793 sucrose Drugs 0.000 description 2
- FQZYTYWMLGAPFJ-OQKDUQJOSA-N tamoxifen citrate Chemical compound [H+].[H+].[H+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 FQZYTYWMLGAPFJ-OQKDUQJOSA-N 0.000 description 2
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- GINSRDSEEGBTJO-UHFFFAOYSA-N thietane 1-oxide Chemical compound O=S1CCC1 GINSRDSEEGBTJO-UHFFFAOYSA-N 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- ORYDPOVDJJZGHQ-UHFFFAOYSA-N tirapazamine Chemical compound C1=CC=CC2=[N+]([O-])C(N)=N[N+]([O-])=C21 ORYDPOVDJJZGHQ-UHFFFAOYSA-N 0.000 description 2
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 2
- 231100000167 toxic agent Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- 241001529453 unidentified herpesvirus Species 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- JXLYSJRDGCGARV-CFWMRBGOSA-N vinblastine Chemical compound C([C@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-CFWMRBGOSA-N 0.000 description 2
- 238000011179 visual inspection Methods 0.000 description 2
- 108010043904 volkensin Proteins 0.000 description 2
- KQNNSYZQMSOOQH-GLDAUDTLSA-N volkensin Chemical compound C=1([C@@H]2C[C@@H]3O[C@@H](O)C[C@@H]4[C@]5(C)[C@H]6[C@H]([C@H]([C@@]4(C)C3=C2C)O)OC[C@]6(C)[C@H](OC(C)=O)C[C@@H]5OC(=O)C(/C)=C/C)C=COC=1 KQNNSYZQMSOOQH-GLDAUDTLSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 230000003442 weekly effect Effects 0.000 description 2
- IFAMSTPTNRJBRG-YIZRAAEISA-N (1s,2s,4r)-3-[(2-methylpropan-2-yl)oxycarbonyl]-3-azabicyclo[2.2.1]heptane-2-carboxylic acid Chemical compound C1C[C@@H]2[C@@H](C(O)=O)N(C(=O)OC(C)(C)C)[C@H]1C2 IFAMSTPTNRJBRG-YIZRAAEISA-N 0.000 description 1
- GCSZJMUFYOAHFY-SDQBBNPISA-N (1z)-1-(3-ethyl-5-hydroxy-1,3-benzothiazol-2-ylidene)propan-2-one Chemical compound C1=C(O)C=C2N(CC)\C(=C\C(C)=O)SC2=C1 GCSZJMUFYOAHFY-SDQBBNPISA-N 0.000 description 1
- BGVLELSCIHASRV-QPEQYQDCSA-N (1z)-1-(3-ethyl-5-methoxy-1,3-benzothiazol-2-ylidene)propan-2-one Chemical compound C1=C(OC)C=C2N(CC)\C(=C\C(C)=O)SC2=C1 BGVLELSCIHASRV-QPEQYQDCSA-N 0.000 description 1
- JKHVDAUOODACDU-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(2,5-dioxopyrrol-1-yl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCN1C(=O)C=CC1=O JKHVDAUOODACDU-UHFFFAOYSA-N 0.000 description 1
- NAALWFYYHHJEFQ-ZASNTINBSA-N (2s,5r,6r)-6-[[(2r)-2-[[6-[4-[bis(2-hydroxyethyl)sulfamoyl]phenyl]-2-oxo-1h-pyridine-3-carbonyl]amino]-2-(4-hydroxyphenyl)acetyl]amino]-3,3-dimethyl-7-oxo-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid Chemical compound N([C@@H](C(=O)N[C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C=1C=CC(O)=CC=1)C(=O)C(C(N1)=O)=CC=C1C1=CC=C(S(=O)(=O)N(CCO)CCO)C=C1 NAALWFYYHHJEFQ-ZASNTINBSA-N 0.000 description 1
- XSPUSVIQHBDITA-KXDGEKGBSA-N (6r,7r)-7-[[(2e)-2-(2-amino-1,3-thiazol-4-yl)-2-methoxyiminoacetyl]amino]-3-[(5-methyltetrazol-2-yl)methyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)/C(=N/OC)C=2N=C(N)SC=2)CC=1CN1N=NC(C)=N1 XSPUSVIQHBDITA-KXDGEKGBSA-N 0.000 description 1
- VNTHYLVDGVBPOU-QQYBVWGSSA-N (7s,9s)-9-acetyl-7-[(2r,4s,5s,6s)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-4-methoxy-8,10-dihydro-7h-tetracene-5,12-dione;2-hydroxypropane-1,2,3-tricarboxylic acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 VNTHYLVDGVBPOU-QQYBVWGSSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- UKAUYVFTDYCKQA-UHFFFAOYSA-N -2-Amino-4-hydroxybutanoic acid Natural products OC(=O)C(N)CCO UKAUYVFTDYCKQA-UHFFFAOYSA-N 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 description 1
- WGGFHAVVTPGHRD-UHFFFAOYSA-N 2-(pyridin-2-yldisulfanyl)ethanamine Chemical compound NCCSSC1=CC=CC=N1 WGGFHAVVTPGHRD-UHFFFAOYSA-N 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- JUIKUQOUMZUFQT-UHFFFAOYSA-N 2-bromoacetamide Chemical compound NC(=O)CBr JUIKUQOUMZUFQT-UHFFFAOYSA-N 0.000 description 1
- YTZFUAXOTCJZHP-UHFFFAOYSA-N 3-[2-(2,5-dioxopyrrol-1-yl)ethoxy]propanoic acid Chemical compound OC(=O)CCOCCN1C(=O)C=CC1=O YTZFUAXOTCJZHP-UHFFFAOYSA-N 0.000 description 1
- AUDYZXNUHIIGRB-UHFFFAOYSA-N 3-thiophen-2-ylpyrrole-2,5-dione Chemical compound O=C1NC(=O)C(C=2SC=CC=2)=C1 AUDYZXNUHIIGRB-UHFFFAOYSA-N 0.000 description 1
- MMBZCFJKAQZVNI-VPENINKCSA-N 4-amino-5,6-difluoro-1-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound FC1=C(F)C(N)=NC(=O)N1[C@@H]1O[C@H](CO)[C@@H](O)C1 MMBZCFJKAQZVNI-VPENINKCSA-N 0.000 description 1
- UZOVYGYOLBIAJR-UHFFFAOYSA-N 4-isocyanato-4'-methyldiphenylmethane Chemical compound C1=CC(C)=CC=C1CC1=CC=C(N=C=O)C=C1 UZOVYGYOLBIAJR-UHFFFAOYSA-N 0.000 description 1
- IJJWOSAXNHWBPR-HUBLWGQQSA-N 5-[(3as,4s,6ar)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]-n-(6-hydrazinyl-6-oxohexyl)pentanamide Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)NCCCCCC(=O)NN)SC[C@@H]21 IJJWOSAXNHWBPR-HUBLWGQQSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- 206010000830 Acute leukaemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- HJCMDXDYPOUFDY-WHFBIAKZSA-N Ala-Gln Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CCC(N)=O HJCMDXDYPOUFDY-WHFBIAKZSA-N 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 108010032595 Antibody Binding Sites Proteins 0.000 description 1
- 206010002961 Aplasia Diseases 0.000 description 1
- 101100004408 Arabidopsis thaliana BIG gene Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 102000002110 C2 domains Human genes 0.000 description 1
- 108050009459 C2 domains Proteins 0.000 description 1
- 101100069853 Caenorhabditis elegans hil-3 gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 102100033620 Calponin-1 Human genes 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 208000025212 Constitutional neutropenia Diseases 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 241000938605 Crocodylia Species 0.000 description 1
- 239000004971 Cross linker Substances 0.000 description 1
- 108010024986 Cyclin-Dependent Kinase 2 Proteins 0.000 description 1
- 102100036239 Cyclin-dependent kinase 2 Human genes 0.000 description 1
- 102100024457 Cyclin-dependent kinase 9 Human genes 0.000 description 1
- 101710112752 Cytotoxin Proteins 0.000 description 1
- 102100037579 D-3-phosphoglycerate dehydrogenase Human genes 0.000 description 1
- 239000012624 DNA alkylating agent Substances 0.000 description 1
- 230000004544 DNA amplification Effects 0.000 description 1
- 239000012623 DNA damaging agent Substances 0.000 description 1
- 239000012625 DNA intercalator Substances 0.000 description 1
- 239000012626 DNA minor groove binder Substances 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 101150086683 DYRK1A gene Proteins 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 208000027219 Deficiency disease Diseases 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- MWWSFMDVAYGXBV-RUELKSSGSA-N Doxorubicin hydrochloride Chemical compound Cl.O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 MWWSFMDVAYGXBV-RUELKSSGSA-N 0.000 description 1
- 101100485279 Drosophila melanogaster emb gene Proteins 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 241000701959 Escherichia virus Lambda Species 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 102100029095 Exportin-1 Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 241000282324 Felis Species 0.000 description 1
- 102100037362 Fibronectin Human genes 0.000 description 1
- 102000002090 Fibronectin type III Human genes 0.000 description 1
- 108050009401 Fibronectin type III Proteins 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 108700007698 Genetic Terminator Regions Proteins 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 108010031186 Glycoside Hydrolases Proteins 0.000 description 1
- 102000005744 Glycoside Hydrolases Human genes 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- RERZNCLIYCABFS-UHFFFAOYSA-N Harmaline hydrochloride Natural products C1CN=C(C)C2=C1C1=CC=C(OC)C=C1N2 RERZNCLIYCABFS-UHFFFAOYSA-N 0.000 description 1
- 206010019851 Hepatotoxicity Diseases 0.000 description 1
- 102100035108 High affinity nerve growth factor receptor Human genes 0.000 description 1
- 101000945318 Homo sapiens Calponin-1 Proteins 0.000 description 1
- 101000980930 Homo sapiens Cyclin-dependent kinase 9 Proteins 0.000 description 1
- 101000739890 Homo sapiens D-3-phosphoglycerate dehydrogenase Proteins 0.000 description 1
- 101001076408 Homo sapiens Interleukin-6 Proteins 0.000 description 1
- 101000716729 Homo sapiens Kit ligand Proteins 0.000 description 1
- 101000684208 Homo sapiens Prolyl endopeptidase FAP Proteins 0.000 description 1
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 101000800116 Homo sapiens Thy-1 membrane glycoprotein Proteins 0.000 description 1
- 101000652736 Homo sapiens Transgelin Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- 208000015178 Hurler syndrome Diseases 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 1
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 108010016648 Immunophilins Proteins 0.000 description 1
- 102000000521 Immunophilins Human genes 0.000 description 1
- 208000026350 Inborn Genetic disease Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000010638 Kinesin Human genes 0.000 description 1
- 108010063296 Kinesin Proteins 0.000 description 1
- 102100027629 Kinesin-like protein KIF11 Human genes 0.000 description 1
- 208000012565 Kostmann syndrome Diseases 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 125000000415 L-cysteinyl group Chemical group O=C([*])[C@@](N([H])[H])([H])C([H])([H])S[H] 0.000 description 1
- UKAUYVFTDYCKQA-VKHMYHEASA-N L-homoserine Chemical compound OC(=O)[C@@H](N)CCO UKAUYVFTDYCKQA-VKHMYHEASA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- QEFRNWWLZKMPFJ-ZXPFJRLXSA-N L-methionine (R)-S-oxide Chemical compound C[S@@](=O)CC[C@H]([NH3+])C([O-])=O QEFRNWWLZKMPFJ-ZXPFJRLXSA-N 0.000 description 1
- QEFRNWWLZKMPFJ-UHFFFAOYSA-N L-methionine sulphoxide Natural products CS(=O)CCC(N)C(O)=O QEFRNWWLZKMPFJ-UHFFFAOYSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 208000035809 Lymphohistiocytosis Diseases 0.000 description 1
- 208000015439 Lysosomal storage disease Diseases 0.000 description 1
- 102000043136 MAP kinase family Human genes 0.000 description 1
- 108091054455 MAP kinase family Proteins 0.000 description 1
- 108010058398 Macrophage Colony-Stimulating Factor Receptor Proteins 0.000 description 1
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 101710087603 Mast/stem cell growth factor receptor Kit Proteins 0.000 description 1
- 229920000134 Metallised film Polymers 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- BMEUPOROMBPSRB-AWEZNQCLSA-N N(=[N+]=[N-])CCCS(=O)(=O)NC([C@H](CC1=CC=CC=C1)NC(OC(C)(C)C)=O)=O Chemical compound N(=[N+]=[N-])CCCS(=O)(=O)NC([C@H](CC1=CC=CC=C1)NC(OC(C)(C)C)=O)=O BMEUPOROMBPSRB-AWEZNQCLSA-N 0.000 description 1
- LKJPYSCBVHEWIU-UHFFFAOYSA-N N-[4-cyano-3-(trifluoromethyl)phenyl]-3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-methylpropanamide Chemical compound C=1C=C(C#N)C(C(F)(F)F)=CC=1NC(=O)C(O)(C)CS(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-UHFFFAOYSA-N 0.000 description 1
- UGJBHEZMOKVTIM-UHFFFAOYSA-N N-formylglycine Chemical compound OC(=O)CNC=O UGJBHEZMOKVTIM-UHFFFAOYSA-N 0.000 description 1
- HFVPBQOSFYXKQZ-DTWKUNHWSA-N N6-[(2R)-3,4-Dihydro-2H-pyrrol-2-ylcarbonyl]-L-lysine Chemical compound [O-]C(=O)[C@@H]([NH3+])CCCCNC(=O)[C@H]1CCC=N1 HFVPBQOSFYXKQZ-DTWKUNHWSA-N 0.000 description 1
- 108091061960 Naked DNA Proteins 0.000 description 1
- 229920002274 Nalgene Polymers 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 208000001388 Opportunistic Infections Diseases 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 206010033661 Pancytopenia Diseases 0.000 description 1
- 241001631646 Papillomaviridae Species 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 241000233805 Phoenix Species 0.000 description 1
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 1
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 1
- 241000235648 Pichia Species 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 102100023832 Prolyl endopeptidase FAP Human genes 0.000 description 1
- 208000033766 Prolymphocytic Leukemia Diseases 0.000 description 1
- 229940079156 Proteasome inhibitor Drugs 0.000 description 1
- 102000012515 Protein kinase domains Human genes 0.000 description 1
- 108050002122 Protein kinase domains Proteins 0.000 description 1
- 229940123573 Protein synthesis inhibitor Drugs 0.000 description 1
- 108020005067 RNA Splice Sites Proteins 0.000 description 1
- 108090000873 Receptor Protein-Tyrosine Kinases Proteins 0.000 description 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 1
- 206010038272 Refractory anaemia with ringed sideroblasts Diseases 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 101100485284 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) CRM1 gene Proteins 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 241000607720 Serratia Species 0.000 description 1
- 101150115425 Slc27a2 gene Proteins 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 101710192266 Tegument protein VP22 Proteins 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 102100033523 Thy-1 membrane glycoprotein Human genes 0.000 description 1
- 102000004357 Transferases Human genes 0.000 description 1
- 108090000992 Transferases Proteins 0.000 description 1
- 108060008539 Transglutaminase Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- 241000223259 Trichoderma Species 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 102100040418 Tumor protein D52 Human genes 0.000 description 1
- 108091005906 Type I transmembrane proteins Proteins 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 101150094313 XPO1 gene Proteins 0.000 description 1
- VWQVUPCCIRVNHF-OUBTZVSYSA-N Yttrium-90 Chemical compound [90Y] VWQVUPCCIRVNHF-OUBTZVSYSA-N 0.000 description 1
- RLEOCVDWLAYGRX-AUWJEWJLSA-N [(2z)-3-ethyl-2-(2-oxopropylidene)-1,3-benzothiazol-5-yl] acetate Chemical compound C1=C(OC(C)=O)C=C2N(CC)\C(=C\C(C)=O)SC2=C1 RLEOCVDWLAYGRX-AUWJEWJLSA-N 0.000 description 1
- SWPYNTWPIAZGLT-UHFFFAOYSA-N [amino(ethoxy)phosphanyl]oxyethane Chemical compound CCOP(N)OCC SWPYNTWPIAZGLT-UHFFFAOYSA-N 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- RUDNHCHNENLLKM-UHFFFAOYSA-N ac1mj1v6 Chemical compound O=C1NC(CC(O)=O)C(=O)N2CC(O)CC2C(=O)NC(C(C)C(O)CO)C(=O)NC(C2)C(=O)NCC(=O)NC(C(C)CC)C(=O)NCC(=O)NC1CSC1=C2C2=CC=C(O)C=C2N1 RUDNHCHNENLLKM-UHFFFAOYSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 208000013685 acquired idiopathic sideroblastic anemia Diseases 0.000 description 1
- 229930183665 actinomycin Natural products 0.000 description 1
- 239000000362 adenosine triphosphatase inhibitor Substances 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 229940064305 adrucil Drugs 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229940098174 alkeran Drugs 0.000 description 1
- 125000005262 alkoxyamine group Chemical group 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000003444 anaesthetic effect Effects 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 230000002924 anti-infective effect Effects 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 230000001494 anti-thymocyte effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000009175 antibody therapy Methods 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 239000003096 antiparasitic agent Substances 0.000 description 1
- 229940125687 antiparasitic agent Drugs 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- PYMYPHUHKUWMLA-WDCZJNDASA-N arabinose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)C=O PYMYPHUHKUWMLA-WDCZJNDASA-N 0.000 description 1
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229940078010 arimidex Drugs 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 229940108502 bicnu Drugs 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- 238000001815 biotherapy Methods 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- SBDRQKOWDZWHOK-UHFFFAOYSA-N bis(2,3,5,6-tetrafluorophenyl) pentanedioate Chemical compound C(CCCC(=O)OC1=C(C(=CC(=C1F)F)F)F)(=O)OC1=C(C(=CC(=C1F)F)F)F SBDRQKOWDZWHOK-UHFFFAOYSA-N 0.000 description 1
- 210000003969 blast cell Anatomy 0.000 description 1
- 229960004395 bleomycin sulfate Drugs 0.000 description 1
- 239000002981 blocking agent Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 108010049223 bryodin Proteins 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 229940111214 busulfan injection Drugs 0.000 description 1
- 229940112133 busulfex Drugs 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 1
- 235000008207 calcium folinate Nutrition 0.000 description 1
- 239000011687 calcium folinate Substances 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- UHBYWPGGCSDKFX-UHFFFAOYSA-N carboxyglutamic acid Chemical compound OC(=O)C(N)CC(C(O)=O)C(O)=O UHBYWPGGCSDKFX-UHFFFAOYSA-N 0.000 description 1
- 229940097647 casodex Drugs 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 210000004671 cell-free system Anatomy 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000011278 co-treatment Methods 0.000 description 1
- 230000004154 complement system Effects 0.000 description 1
- 229920002055 compound 48/80 Polymers 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 1
- ARUVKPQLZAKDPS-UHFFFAOYSA-L copper(II) sulfate Chemical compound [Cu+2].[O-][S+2]([O-])([O-])[O-] ARUVKPQLZAKDPS-UHFFFAOYSA-L 0.000 description 1
- 229910000366 copper(II) sulfate Inorganic materials 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 229940077926 cytarabine liposome injection Drugs 0.000 description 1
- 208000024389 cytopenia Diseases 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 230000001085 cytostatic effect Effects 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 229940052372 daunorubicin citrate liposome Drugs 0.000 description 1
- 229960003109 daunorubicin hydrochloride Drugs 0.000 description 1
- 229940107841 daunoxome Drugs 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 229940070968 depocyt Drugs 0.000 description 1
- 230000001687 destabilization Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 229940061607 dibasic sodium phosphate Drugs 0.000 description 1
- 108020001096 dihydrofolate reductase Proteins 0.000 description 1
- RXKJFZQQPQGTFL-UHFFFAOYSA-N dihydroxyacetone Chemical compound OCC(=O)CO RXKJFZQQPQGTFL-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- SLPJGDQJLTYWCI-UHFFFAOYSA-N dimethyl-(4,5,6,7-tetrabromo-1h-benzoimidazol-2-yl)-amine Chemical compound BrC1=C(Br)C(Br)=C2NC(N(C)C)=NC2=C1Br SLPJGDQJLTYWCI-UHFFFAOYSA-N 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 229930188854 dolastatin Natural products 0.000 description 1
- 229960002918 doxorubicin hydrochloride Drugs 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 229940099302 efudex Drugs 0.000 description 1
- 229940073038 elspar Drugs 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 230000002449 erythroblastic effect Effects 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 231100000776 exotoxin Toxicity 0.000 description 1
- 239000002095 exotoxin Substances 0.000 description 1
- 108700002148 exportin 1 Proteins 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 229960000556 fingolimod Drugs 0.000 description 1
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960003297 gemtuzumab ozogamicin Drugs 0.000 description 1
- 208000016361 genetic disease Diseases 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 229940084910 gliadel Drugs 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- VJHLDRVYTQNASM-UHFFFAOYSA-N harmine Natural products CC1=CN=CC=2NC3=CC(=CC=C3C=21)OC VJHLDRVYTQNASM-UHFFFAOYSA-N 0.000 description 1
- 230000012447 hatching Effects 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 239000003481 heat shock protein 90 inhibitor Substances 0.000 description 1
- 230000001489 hematophagic effect Effects 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 230000007686 hepatotoxicity Effects 0.000 description 1
- 231100000304 hepatotoxicity Toxicity 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000013542 high molecular weight contaminant Substances 0.000 description 1
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 1
- 102000055151 human KITLG Human genes 0.000 description 1
- 210000000688 human artificial chromosome Anatomy 0.000 description 1
- 229940116886 human interleukin-6 Drugs 0.000 description 1
- 229940096120 hydrea Drugs 0.000 description 1
- 125000001183 hydrocarbyl group Chemical group 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229960001330 hydroxycarbamide Drugs 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 229940099279 idamycin Drugs 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229940090411 ifex Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 1
- 230000008004 immune attack Effects 0.000 description 1
- 230000007124 immune defense Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- 210000004495 interstitial cells of cajal Anatomy 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical group NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- DWKPPFQULDPWHX-VKHMYHEASA-N l-alanyl ester Chemical compound COC(=O)[C@H](C)N DWKPPFQULDPWHX-VKHMYHEASA-N 0.000 description 1
- 101150066555 lacZ gene Proteins 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960002293 leucovorin calcium Drugs 0.000 description 1
- 229940063725 leukeran Drugs 0.000 description 1
- 229940087875 leukine Drugs 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- WMFOQBRAJBCJND-UHFFFAOYSA-M lithium hydroxide Inorganic materials [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 1
- 239000003589 local anesthetic agent Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000013541 low molecular weight contaminant Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- SWVMLNPDTIFDDY-FVGYRXGTSA-N methyl (2s)-2-amino-3-phenylpropanoate;hydrochloride Chemical class Cl.COC(=O)[C@@H](N)CC1=CC=CC=C1 SWVMLNPDTIFDDY-FVGYRXGTSA-N 0.000 description 1
- HYLGKOGJOVGRNN-UHFFFAOYSA-N methyl 2-(bromomethyl)-3-methoxybenzoate Chemical compound COC(=O)C1=CC=CC(OC)=C1CBr HYLGKOGJOVGRNN-UHFFFAOYSA-N 0.000 description 1
- LSDPWZHWYPCBBB-UHFFFAOYSA-O methylsulfide anion Chemical compound [SH2+]C LSDPWZHWYPCBBB-UHFFFAOYSA-O 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 210000002500 microbody Anatomy 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 108010022050 mistletoe lectin I Proteins 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- 230000001483 mobilizing effect Effects 0.000 description 1
- 108010010621 modeccin Proteins 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 239000009562 momordin Substances 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 230000001459 mortal effect Effects 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 229940074923 mozobil Drugs 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 231100000219 mutagenic Toxicity 0.000 description 1
- 230000003505 mutagenic effect Effects 0.000 description 1
- 229940014456 mycophenolate Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 210000000066 myeloid cell Anatomy 0.000 description 1
- 229940090009 myleran Drugs 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 229940086322 navelbine Drugs 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229940063121 neoral Drugs 0.000 description 1
- 229940071846 neulasta Drugs 0.000 description 1
- 229940085033 nolvadex Drugs 0.000 description 1
- 208000037916 non-allergic rhinitis Diseases 0.000 description 1
- 230000030147 nuclear export Effects 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 229940005483 opioid analgesics Drugs 0.000 description 1
- 238000000424 optical density measurement Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- HQQSBEDKMRHYME-UHFFFAOYSA-N pefloxacin mesylate Chemical compound [H+].CS([O-])(=O)=O.C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCN(C)CC1 HQQSBEDKMRHYME-UHFFFAOYSA-N 0.000 description 1
- 229960001373 pegfilgrastim Drugs 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 230000000079 pharmacotherapeutic effect Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 229960005190 phenylalanine Drugs 0.000 description 1
- 150000008298 phosphoramidates Chemical class 0.000 description 1
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical group [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 description 1
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical compound OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 230000036470 plasma concentration Effects 0.000 description 1
- YIQPUIGJQJDJOS-UHFFFAOYSA-N plerixafor Chemical compound C=1C=C(CN2CCNCCCNCCNCCC2)C=CC=1CN1CCCNCCNCCCNCC1 YIQPUIGJQJDJOS-UHFFFAOYSA-N 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229940072288 prograf Drugs 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 239000003207 proteasome inhibitor Substances 0.000 description 1
- 239000000007 protein synthesis inhibitor Substances 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 229940024999 proteolytic enzymes for treatment of wounds and ulcers Drugs 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 229940117820 purinethol Drugs 0.000 description 1
- 239000002096 quantum dot Substances 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000002708 random mutagenesis Methods 0.000 description 1
- 229940099538 rapamune Drugs 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 229940053174 restasis Drugs 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 239000007320 rich medium Substances 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- 238000002390 rotary evaporation Methods 0.000 description 1
- 239000012146 running buffer Substances 0.000 description 1
- 229940063122 sandimmune Drugs 0.000 description 1
- 238000003118 sandwich ELISA Methods 0.000 description 1
- 229960002530 sargramostim Drugs 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 208000011571 secondary malignant neoplasm Diseases 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 208000027390 severe congenital neutropenia 3 Diseases 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 210000004927 skin cell Anatomy 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 235000019187 sodium-L-ascorbate Nutrition 0.000 description 1
- 239000011755 sodium-L-ascorbate Substances 0.000 description 1
- QPILZZVXGUNELN-UHFFFAOYSA-M sodium;4-amino-5-hydroxynaphthalene-2,7-disulfonate;hydron Chemical compound [Na+].OS(=O)(=O)C1=CC(O)=C2C(N)=CC(S([O-])(=O)=O)=CC2=C1 QPILZZVXGUNELN-UHFFFAOYSA-M 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 210000001324 spliceosome Anatomy 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000007801 sublethal irradiation Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000004114 suspension culture Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229940037128 systemic glucocorticoids Drugs 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229960001967 tacrolimus Drugs 0.000 description 1
- QJJXYPPXXYFBGM-SHYZHZOCSA-N tacrolimus Natural products CO[C@H]1C[C@H](CC[C@@H]1O)C=C(C)[C@H]2OC(=O)[C@H]3CCCCN3C(=O)C(=O)[C@@]4(O)O[C@@H]([C@H](C[C@H]4C)OC)[C@@H](C[C@H](C)CC(=C[C@@H](CC=C)C(=O)C[C@H](O)[C@H]2C)C)OC QJJXYPPXXYFBGM-SHYZHZOCSA-N 0.000 description 1
- 229960003454 tamoxifen citrate Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- RCINICONZNJXQF-XAZOAEDWSA-N taxol® Chemical compound O([C@@H]1[C@@]2(CC(C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3(C21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-XAZOAEDWSA-N 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 210000002303 tibia Anatomy 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- 229950002376 tirapazamine Drugs 0.000 description 1
- 238000012090 tissue culture technique Methods 0.000 description 1
- 230000008427 tissue turnover Effects 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 1
- 229960002190 topotecan hydrochloride Drugs 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000006276 transfer reaction Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 102000003601 transglutaminase Human genes 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 230000001296 transplacental effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- GRVDJDISBSALJP-FIBGUPNXSA-N trideuterio($l^{1}-oxidanyl)methane Chemical compound [2H]C([2H])([2H])[O] GRVDJDISBSALJP-FIBGUPNXSA-N 0.000 description 1
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 238000003817 vacuum liquid chromatography Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 231100000747 viability assay Toxicity 0.000 description 1
- 238000003026 viability measurement method Methods 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- GBABOYUKABKIAF-IELIFDKJSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-IELIFDKJSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- CILBMBUYJCWATM-PYGJLNRPSA-N vinorelbine ditartrate Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.OC(=O)[C@H](O)[C@@H](O)C(O)=O.C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC CILBMBUYJCWATM-PYGJLNRPSA-N 0.000 description 1
- 210000000605 viral structure Anatomy 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 239000000277 virosome Substances 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 229940007162 zarxio Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/07—Tetrapeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/12—Cyclic peptides, e.g. bacitracins; Polymyxins; Gramicidins S, C; Tyrocidins A, B or C
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68031—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being an auristatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68033—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a maytansine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6817—Toxins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6817—Toxins
- A61K47/6831—Fungal toxins, e.g. alpha sarcine, mitogillin, zinniol or restrictocin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6889—Conjugates wherein the antibody being the modifying agent and wherein the linker, binder or spacer confers particular properties to the conjugates, e.g. peptidic enzyme-labile linkers or acid-labile linkers, providing for an acid-labile immuno conjugate wherein the drug may be released from its antibody conjugated part in an acidic, e.g. tumoural or environment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/02—Linear peptides containing at least one abnormal peptide link
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Cell Biology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Obesity (AREA)
- Oncology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Enzymes And Modification Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Description
本出願は、2016年12月21日出願の米国仮特許出願第62/437,622号明
細書および2017年6月16日出願の米国仮特許出願第62/520,854号明細書
の利益を主張し、これらの出願の内容は、それらの全体が参照によって本明細書に組み込
まれる。
者、例えば造血幹細胞移植レシピエントにおいて造血幹細胞を除去するための使用に関す
る。
本出願は、ASCIIフォーマットで電子的に提出された配列表を含有し、これは、そ
の全体が参照によって本明細書に組み込まれる。前記ASCIIコピー(2017年12
月14日作成)は、PAT057400-WO-PCT_SL.txtと命名され、20
9,938バイトのサイズである。
幹細胞因子(SCF)に結合する。SCFは、cKITのホモ二量体化を誘導し、これは
、そのチロシンキナーゼ活性、ならびにPI3-AKT経路およびMAPK経路の双方を
介するシグナルを活性化する(Kindblom et al.,Am J.Path.
1998 152(5):1259)。cKITは最初に、ネコレトロウイルスによって
発現される切断型形態としてのオンコジーンとして発見された(Besmer et a
l.,Nature 1986 320:415-421)。対応するヒト遺伝子のクロ
ーニングにより、cKITは、受容体チロシンキナーゼのクラスIII型のメンバである
ことが実証され、これは、ファミリメンバ、FLT3、CSF-1受容体、およびPDG
F受容体の1つに数えられる。cKITは、造血細胞、胚細胞、肥満細胞、およびメラニ
ン細胞の発達に必要とされる。造血前駆細胞、例えば骨髄中の造血幹細胞(HSC)は、
細胞表面上で高レベルのcKITを発現する。加えて、肥満細胞、皮膚内のメラニン細胞
、および消化管内のカハールの間質細胞が、cKITを発現する。
再生させることができるので、治療潜在性は大きい。造血幹細胞移植が、白血病、リンパ
腫、および他の致命的な疾患の治療法として、広く用いられている。しかしながら、多く
のリスクが、そのような移植に付随し、不十分な移植、免疫拒絶、移植片対宿主疾患(G
VHD)、または感染症が挙げられる。同種造血幹細胞移植には、通常、移植片の免疫拒
絶を阻止するための、腫瘍縮小処理によるレシピエントのコンディション調整が必要とさ
れる。現行のコンディション調整レジメンは多くの場合、宿主に有毒であるので、移植患
者の大グループにとって禁忌であり、かつ/または移植片対宿主疾患を阻止するのに十分
な量で提供され得ない。ゆえに、コンディション調整方法および移植方法を向上させ、造
血幹細胞移植に付随するリスクを低下させ、かつ種々の障害についてのその有効性を増大
させることが必要とされている。
abまたはFab’)が、薬物部分(例えば細胞毒性剤)に、場合によってはリンカーを
介して結合されている抗体薬物結合体を提供する。当該抗体薬物結合体は、cKITを発
現する細胞、例えば造血幹細胞に細胞毒性剤を選択的に送達することによって、患者、例
えば造血幹細胞移植レシピエントにおいて当該細胞を選択的に除去することができる。好
ましくは、cKIT抗体薬物結合体は、患者の循環系において長い時間、存在しない、か
つ/または有効でないような薬物動態学的特性を有するので、造血幹細胞移植前の、造血
幹細胞移植レシピエントのコンディション調整に用いられ得る。一部の実施形態において
、本明細書中で提供されるのは、薬物部分(例えば細胞毒性剤)に、場合によってはリン
カーを介して結合されている、cKITに特異的に結合する抗体フラグメント(例えば、
FabまたはFab’)を含む結合体である。驚くべきことに、本発明者らは、完全長の
抗cKIT抗体(例えば完全長IgG)、F(ab’)2フラグメント、およびそれらの
毒物結合体が、肥満細胞脱顆粒を引き起こす一方、Fabフラグメントを認識する既存の
抗薬物抗体を患者が産生させ、またはこれを有する場合に観察され得るように、より大き
な複合体に架橋かつ/または多量体化された場合でさえ、抗cKIT Fab’またはF
ab-毒物結合体が、肥満細胞脱顆粒を引き起こさないことを見出した。本開示はさらに
、抗体薬物結合体を含む医薬組成物、ならびにそのような医薬組成物を製造する方法、お
よびそのような医薬組成物を、造血幹細胞の除去を必要とする患者、例えば造血幹細胞移
植レシピエントにおいて造血幹細胞を除去するのに用いる方法を提供する。
A-(LB-(D)n)y 式(I);
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
LBは、リンカーであり;
Dは、細胞毒性剤であり;
nは、1から10の整数であり、yは、1から10の整数である。
体および抗体フラグメント(例えば、FabまたはFab’)である。そのような抗cK
IT抗体および抗体フラグメント(例えば、FabまたはFab’)は、本明細書中に記
載されるあらゆる結合体に用いられ得る。
ト(例えば、FabまたはFab’)は、ヒトcKITの細胞外ドメイン(配列番号11
2)に特異的に結合する抗体または抗体フラグメント(例えば、FabまたはFab’)
である。
ト(例えば、FabまたはFab’)は、ヒトcKITのドメイン1~3(配列番号11
3)中のエピトープに特異的に結合する抗体または抗体フラグメント(例えば、Fabま
たはFab’)である。
ト(例えば、FabまたはFab’)は、表1に記載される抗体または抗体フラグメント
(例えば、FabまたはFab’)である。
ト(例えば、FabまたはFab’)は、配列番号1のHCDR1;配列番号2のHCD
R2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR2
;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号4のHCDR1;配列番号5のHCD
R2;配列番号3のHCDR3;配列番号19のLCDR1;配列番号20のLCDR2
;および配列番号21のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号6のHCDR1;配列番号2のHCD
R2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR2
;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号7のHCDR1;配列番号8のHCD
R2;配列番号9のHCDR3;配列番号22のLCDR1;配列番号20のLCDR2
;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号27のHCDR1;配列番号28のH
CDR2;配列番号29のHCDR3;配列番号42のLCDR1;配列番号17のLC
DR2;および配列番号43のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号30のHCDR1;配列番号31のH
CDR2;配列番号29のHCDR3;配列番号44のLCDR1;配列番号20のLC
DR2;および配列番号45のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号32のHCDR1;配列番号28のH
CDR2;配列番号29のHCDR3;配列番号42のLCDR1;配列番号17のLC
DR2;および配列番号43のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号33のHCDR1;配列番号34のH
CDR2;配列番号35のHCDR3;配列番号46のLCDR1;配列番号20のLC
DR2;および配列番号43のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号1のHCDR1;配列番号51のHC
DR2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR
2;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号4のHCDR1;配列番号52のHC
DR2;配列番号3のHCDR3;配列番号19のLCDR1;配列番号20のLCDR
2;および配列番号21のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号6のHCDR1;配列番号51のHC
DR2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR
2;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号7のHCDR1;配列番号53のHC
DR2;配列番号9のHCDR3;配列番号22のLCDR1;配列番号20のLCDR
2;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号60のHCDR1;配列番号61のH
CDR2;配列番号62のHCDR3;配列番号75のLCDR1;配列番号76のLC
DR2;および配列番号77のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号63のHCDR1;配列番号64のH
CDR2;配列番号62のHCDR3;配列番号78のLCDR1;配列番号79のLC
DR2;および配列番号80のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号65のHCDR1;配列番号61のH
CDR2;配列番号62のHCDR3;配列番号75のLCDR1;配列番号76のLC
DR2;および配列番号77のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号66のHCDR1;配列番号67のH
CDR2;配列番号68のHCDR3;配列番号81のLCDR1;配列番号79のLC
DR2;および配列番号77のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号86のHCDR1;配列番号87のH
CDR2;配列番号88のHCDR3;配列番号101のLCDR1;配列番号102の
LCDR2;および配列番号103のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号89のHCDR1;配列番号90のH
CDR2;配列番号88のHCDR3;配列番号104のLCDR1;配列番号105の
LCDR2;および配列番号106のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号91のHCDR1;配列番号87のH
CDR2;配列番号88のHCDR3;配列番号101のLCDR1;配列番号102の
LCDR2;および配列番号103のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号92のHCDR1;配列番号93のH
CDR2;配列番号94のHCDR3;配列番号107のLCDR1;配列番号105の
LCDR2;および配列番号103のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号10のアミノ酸配列を含む重鎖可変領
域(VH)、および配列番号23のアミノ酸配列を含む軽鎖可変領域(VL)を含む。
ト(例えば、FabまたはFab’)は、配列番号36のアミノ酸配列を含むVH、およ
び配列番号47のアミノ酸配列を含むVLを含む。
ト(例えば、FabまたはFab’)は、配列番号54のアミノ酸配列を含むVH、およ
び配列番号23のアミノ酸配列を含むVLを含む。
ト(例えば、FabまたはFab’)は、配列番号69のアミノ酸配列を含むVH、およ
び配列番号82のアミノ酸配列を含むVLを含む。
ト(例えば、FabまたはFab’)は、配列番号95のアミノ酸配列を含むVH、およ
び配列番号108のアミノ酸配列を含むVLを含む。
Fab’)は、配列番号14のアミノ酸配列を含む重鎖、および配列番号25のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号40のアミノ酸配列を含む重鎖、および配列番号49のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号58のアミノ酸配列を含む重鎖、および配列番号25のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号73のアミノ酸配列を含む重鎖、および配列番号84のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号99のアミノ酸配列を含む重鎖、および配列番号110のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号118のアミノ酸配列を含む重鎖、および配列番号122のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号118のアミノ酸配列を含む重鎖、および配列番号123のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号124のアミノ酸配列を含む重鎖、および配列番号128のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号124のアミノ酸配列を含む重鎖、および配列番号129のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号130のアミノ酸配列を含む重鎖、および配列番号134のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号130のアミノ酸配列を含む重鎖、および配列番号135のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号136のアミノ酸配列を含む重鎖、および配列番号140のアミノ
酸配列を含む軽鎖を含む。
Fab)は、配列番号141のアミノ酸配列を含む重鎖、および配列番号145のアミノ
酸配列を含む軽鎖を含む。
Fab’)は、配列番号119、120、または121から選択されるアミノ酸配列を含
む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号125、126、または127から選択されるアミノ酸配列を含
む重鎖、および配列番号49のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号131、132、または133から選択されるアミノ酸配列を含
む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号137、138、または139から選択されるアミノ酸配列を含
む重鎖、および配列番号84のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号142、143、または144から選択されるアミノ酸配列を含
む重鎖、および配列番号110のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号49のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号84のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号110のアミノ酸配列を含む軽鎖を含む。
)に、場合によってはリンカーを介して結合されている、cKITに特異的に結合する抗
体フラグメント(例えば、FabまたはFab’)(抗cKIT FabまたはFab’
)を含む結合体である。抗cKIT FabまたはFab’は、本明細書中に記載される
FabまたはFab’のいずれか、例えば、表1中のFabまたはFab’のいずれかで
あってよい。本明細書中に記載されるように、そのような抗cKIT Fab’またはF
ab-毒物結合体は、ヒトHSC細胞をインビトロかつインビボで除去することができる
一方、より大きな複合体に架橋かつ/または多量体化された場合でさえ、肥満細胞脱顆粒
を引き起こさない。
abまたはFab’)が、薬物部分(例えば細胞毒性剤)に、場合によってはリンカーを
介して結合されている抗体薬物結合体を提供する。当該抗体薬物結合体は、cKITを発
現する細胞、例えば造血幹細胞に細胞毒性剤を選択的に送達することによって、患者、例
えば造血幹細胞移植レシピエントにおいて当該細胞を選択的に除去することができる。好
ましくは、cKIT抗体薬物結合体は、患者の循環系において長い時間、存在しない、か
つ/または有効でないような薬物動態学的特性を有するので、造血幹細胞移植前の、造血
幹細胞移植レシピエントのコンディション調整に用いられ得る。一部の実施形態において
、本明細書中で提供されるのは、薬物部分(例えば細胞毒性剤)に、場合によってはリン
カーを介して結合されている、cKITに特異的に結合する抗体フラグメント(例えば、
FabまたはFab’)を含む結合体である。驚くべきことに、本発明者らは、完全長の
抗cKIT抗体(例えば完全長IgG)、F(ab’)2フラグメント、およびそれらの
毒物結合体が、肥満細胞脱顆粒を引き起こす一方、Fabフラグメントを認識する既存の
抗薬物抗体を患者が産生させ、またはこれを有する場合に観察され得るように、より大き
な複合体に架橋かつ/または多量体化された場合でさえ、抗cKIT Fab’またはF
ab-毒物結合体が、肥満細胞脱顆粒を引き起こさないことを見出した。本開示はさらに
、抗体薬物結合体を含む医薬組成物、ならびにそのような医薬組成物を製造する方法、お
よびそのような医薬組成物を、造血幹細胞の除去を必要とする患者、例えば造血幹細胞移
植レシピエントにおいて造血幹細胞を除去するのに用いる方法を提供する。
特に明記されない限り、本明細書中で用いられる以下の用語およびフレーズは、以下の
意味を有することが意図される:
、C1~6アルキルは、1から6個の炭素原子を有するアルキル基を指す。アルキル基は
、直鎖状であっても分枝状であってもよい。代表的な分枝状アルキル基は、1本、2本、
または3本の枝を有する。アルキル基の例として、以下に限定されないが、メチル、エチ
ル、プロピル(n-プロピルおよびイソプロピル)、ブチル(n-ブチル、イソブチル、
sec-ブチル、およびt-ブチル)、ペンチル(n-ペンチル、イソペンチル、および
ネオペンチル)、およびヘキシルが挙げられる。
に由来するタンパク質またはポリペプチド配列を指す。抗体は、ポリクローナルであって
もモノクローナルであっても、多重鎖であっても単鎖であっても、無傷の免疫グロブリン
であってもよく、そして天然の源に由来しても、組換え源に由来してもよい。天然に存在
する「抗体」は、ジスルフィド結合によって相互に連結される少なくとも2つの重(H)
鎖および2つの軽(L)鎖を含む糖タンパク質である。各重鎖は、重鎖可変領域(本明細
書中でVHと省略した)および重鎖定常領域で構成される。重鎖定常領域は、3つのドメ
イン、CH1、CH2、およびCH3で構成される。各軽鎖は、軽鎖可変領域(本明細書
中でVLと省略した)および軽鎖定常領域で構成される。軽鎖定常領域は、1つのドメイ
ン、CLで構成される。VH領域およびVL領域はさらに、相補性決定領域(CDR)と
呼ばれる超可変性の領域に再分割され得、より保存されている、フレームワーク領域(F
R)と呼ばれる領域が散在する。VHおよびVLはそれぞれ、アミノ末端からカルボキシ
ル末端まで以下の順序で配置される3つのCDRおよび4つのFRで構成される:FR1
、CDR1、FR2、CDR2、FR3、CDR3、FR4。重鎖および軽鎖の可変領域
は、抗原と相互作用する結合ドメインを含有する。抗体の定常領域は、免疫グロブリンの
、宿主の組織または因子への結合を媒介し得る(免疫系の種々の細胞(例えばエフェクタ
細胞)および古典的補体系の第1の成分(C1q)が挙げられる)。抗体は、モノクロー
ナル抗体、ヒト抗体、ヒト化抗体、ラクダ科動物の抗体、またはキメラ抗体であってよい
。抗体は、あらゆるアイソタイプ(例えば、IgG、IgE、IgM、IgD、IgA、
およびIgY)、クラス(例えば、IgG1、IgG2、IgG3、IgG4、IgA1
、およびIgA2)またはサブクラスのものであってよい。
およびVHの超可変領域を指す。CDRは、抗体鎖の標的タンパク質結合部位であり、こ
れは、そのような標的タンパク質に対する特異性を保有する。3つのCDR(N末端から
順に番号を付けられる、CDR1~3)が、ヒトの各VLまたはVH中に存在し、可変ド
メインの約15~20%を構成する。CDRは、その領域および順序によって呼ばれ得る
。例えば、「VHCDR1」または「HCDR1」は双方とも、重鎖可変領域の第1のC
DRを指す。CDRは、構造的に、標的タンパク質のエピトープと相補的であるので、結
合特異性を直接担う。VLまたはVHの残りの範囲、いわゆるフレームワーク領域は、ア
ミノ酸配列においてあまり変異を示さない(Kuby,Immunology,4th
ed.,Chapter 4.W.H.Freeman & Co.,New York
,2000)。
用いて判定され得、Kabat et al.(1991),”Sequences o
f Proteins of Immunological Interest”、第5
版 Public Health Service,National Institu
tes of Health,Bethesda,MD(「Kabat」ナンバリングス
キーム)、Al-Lazikani et al.,(1997)JMB 273,92
7-948(「Chothia」ナンバリングスキーム)、およびImMunoGenT
ics(IMGT)ナンバリング(Lefranc,M.-P.,The Immuno
logist,7,132-136(1999);Lefranc,M.-P.et a
l.,Dev.Comp.Immunol.,27,55-77(2003)(「IMG
T」ナンバリングスキーム)によって記載されるものが挙げられる。例えば、古典的フォ
ーマットについて、Kabat下では、重鎖可変ドメイン(VH)中のCDRアミノ酸残
基は、31~35(HCDR1)、50~65(HCDR2)、および95~102(H
CDR3)と番号を付けられ;そして軽鎖変数ドメイン(VL)中のCDRアミノ酸残基
は、24~34(LCDR1)、50~56(LCDR2)、および89~97(LCD
R3)と番号を付けられる。Chothia下では、VH中のCDRアミノ酸は、26~
32(HCDR1)、52~56(HCDR2)、および95~102(HCDR3)と
番号を付けられ;そしてVL中のアミノ酸残基は、26~32(LCDR1)、50~5
2(LCDR2)、および91~96(LCDR3)と番号を付けられる。Kabatお
よびChothiaの双方のCDR定義を組み合わせることによって、CDRは、ヒトV
Hにおいてアミノ酸残基26~35(HCDR1)、50~65(HCDR2)、および
95~102(HCDR3)、そしてヒトVLにおいてアミノ酸残基24~34(LCD
R1)、50~56(LCDR2)、および89~97(LCDR3)からなる。IMG
T下では、VH中のCDRアミノ酸残基は、おおよそ26~35(CDR1)、51~5
7(CDR2)、および93~102(CDR3)と番号を付けられ、そしてVL中のC
DRアミノ酸残基は、おおよそ27~32(CDR1)、50~52(CDR2)、およ
び89~97(CDR3)と番号を付けられる(「Kabat」に従うナンバリング)。
IMGT下では、抗体のCDR領域は、プログラムIMGT/DomainGap Al
ignを用いて判定され得る。
「定常」および「可変」は、機能的に用いられる。この点に関して、軽(VL)鎖部分お
よび重(VH)鎖部分の双方の可変ドメインが、抗原認識および特異性を決定することは
勿論である。逆に、軽鎖(CL)および重鎖(CH1、CH2、またはCH3、および、
場合によってはCH4)の定常ドメインは、重要な生物学的特性、例えば、分泌、経胎盤
運動能、Fc受容体結合、補体結合、FcRn受容体結合、半減期、および薬物動態を付
与する。表記規則によって、定常領域ドメインのナンバリングは、抗体の抗原結合部位ま
たはアミノ末端から遠位になるにつれ、増大する。N末端は可変領域であり、C末端では
定常領域である;CH3ドメインおよびCLドメインはそれぞれ、実際に、重鎖および軽
鎖のカルボキシ末端ドメインを含む。
、抗原(例えばcKIT)のエピトープと特異的に(例えば、結合、立体障害、安定化/
不安定化、空間分布によって)相互作用する能力を保持する抗体の1つ以上の部分を指す
。抗体フラグメントの例として、以下に限定されないが、VL、VH、CL、およびCH
1ドメインからなる一価のフラグメントであるFabフラグメント;VL、VH、CL、
CH1ドメイン、およびヒンジ領域からなる一価のフラグメントであるFab’フラグメ
ント;ヒンジ領域にてジスルフィド架橋によって結合される2つのFabフラグメントを
含む二価フラグメントであるF(ab’)2フラグメント;ジスルフィドブリッジによっ
て結合される単一の重鎖および単一の軽鎖を含むハーフ抗体;Fc領域に結合されるFa
bフラグメントを含むワンアーム抗体;CH3ドメインダイマーに結合された2つのFa
bフラグメントを含む、CH2ドメイン欠失抗体(Glaser,J Biol Che
m.2005;280(50):41494-503参照);単鎖Fv(scFv);ジ
スルフィド結合Fv(sdFv);VHドメインおよびCH1ドメインからなるFdフラ
グメント;抗体のシングルアームのVLドメインおよびVHドメインからなるFvフラグ
メント;VHドメインからなるdAbフラグメント(Ward et al.,Natu
re 341:544-546,1989);ならびに単離された相補性決定領域(CD
R)、または抗体の他のエピトープ結合フラグメント。例えば、Fabフラグメントは、
抗体の重鎖のアミノ酸残基1~222(EUナンバリング)を含み得る;一方、Fab’
フラグメントは、抗体の重鎖のアミノ酸残基1~236(EUナンバリング)を含み得る
。抗体のFabフラグメントまたはFab’フラグメントは、組換えにより、または親抗
体の酵素的消化によって、生成され得る。組換えにより生成されるFabまたはFab’
は、部位特異的結合のためにアミノ酸を導入するように操作され得、例えばシステイン(
Junutula,J.R.et al.,Nature biotechnology
2008,26,925)、ピロリン-カルボキシ-リジン(Ou,W.et al.
,Proc Natl Acad Sci USA 2011;108(26):104
37-42)、または非天然アミノ酸(例えば、Tian,F.et al.,Proc
Natl Acad Sci USA 2014,111,1766,Axup,J.
Y.et al.,Proc Natl Acad Sci USA.2012,109
,16101)がある。同様に、突然変異またはペプチドタグが、結合を促進するために
、ホスホパンテテイントランスフェラーゼ(Grunewald,J.et al.,B
ioconjugate chemistry 2015,26,2554)、ホルミル
グリシン形成酵素(Drake,P.M.et al.,Bioconjugate c
hemistry 2014,25,1331)、トランスグルタミナーゼ(Strop
,P.et al.,Chemistry & biology 2013,20,16
1)、ソルターゼ(Beerli,R.R.;Hell,T.;Merkel,A.S.
;Grawunder,U.PloS one 2015,10,e0131177)、
または他の酵素的結合戦略を介して加えられ得る。さらに、Fvフラグメントの2つのド
メイン、VLおよびVHは、別々の遺伝子によってコードされるが、組換え方法を用いて
、合成リンカーによって結合され得、これは、2つのドメインを、VL領域およびVH領
域が対形成して、一価の分子を形成する単一のタンパク質鎖として製造することを可能に
する(単一鎖Fv(「scFv」)として知られている;例えば、Bird et al
.,Science 242:423-426,1988;およびHuston et
al.,Proc.Natl.Acad.Sci.85:5879-5883,1988
参照)。そのような単鎖抗体もまた、用語「抗原結合フラグメント」内に包含されること
が意図される。これらの抗原結合フラグメントは、当業者に知られている従来の技術を用
いて得られ、そして当該フラグメントは、無傷の抗体であるのと同じ様式で、実用性の有
無に関してスクリーニングされる。
ディ、ミニボディ、ナノボディ、イントラボディ、ダイアボディ、トリアボディ、テトラ
ボディ、v-NAR、およびビス-scFv中に組み込まれてもよい(例えば、Holl
inger and Hudson,Nature Biotechnology 23
:1126-1136,2005参照)。抗原結合フラグメントは、ポリペプチドに基づ
くスカフォールド、例えばフィブロネクチンIII型(Fn3)中に融合(grafte
d)されてよい(米国特許第6,703,199号明細書(フィブロネクチンポリペプチ
ドモノボディを記載)参照)。
H-CH1-VH-CH1)を含む単鎖分子中に組み込まれてよく、これは、相補的軽鎖
ポリペプチドと一緒になって、一対の抗原結合領域を形成する(Zapata et a
l.,Protein Eng.8:1057-1062,1995;および米国特許第
5,641,870号明細書)。
物」は、ポリペプチドを指し、実質的に同じアミノ酸配列を有し、または同じ遺伝的源に
由来する抗体および抗原結合フラグメントが挙げられる。当該用語はまた、単一の分子組
成の抗体分子の調製物を含む。モノクローナル抗体組成物は、特定のエピトープに対して
単一の結合特異性および親和性を示す。
が、ヒト起源の配列に由来する可変領域を有する抗体を含む。さらに、抗体が定常領域を
含有するならば、定常領域もまた、例えば、ヒト生殖細胞系配列、もしくはヒト生殖細胞
系配列の突然変異バージョン、または、例えばKnappik et al.,J.Mo
l.Biol.296:57-86,2000に記載されている、ヒトフレームワーク配
列分析に由来する抗体含有コンセンサスフレームワーク配列のようなヒト配列に由来する
。
トロでのランダムもしくは部位特異的な突然変異誘発によって、またはインビボでの体細
胞突然変異によって導入される突然変異、あるいは安定性または製造を促進する保存的置
換)を含んでよい。
、そのエピトープを見つけ出してそれと相互作用する(例えば結合する)ことを指し、当
該エピトープは、直鎖状であるか立体配座的であるかは問わない。用語「エピトープ」は
、本開示の抗体または抗原結合フラグメントが特異的に結合する抗原上の部位を指す。エ
ピトープは、隣接アミノ酸、またはタンパク質の三次折畳みによって並べられる非隣接ア
ミノ酸の双方から形成され得る。隣接アミノ酸から形成されるエピトープは、典型的に、
変性溶媒への曝露直後に保持されるが、三次折畳みによって形成されるエピトープは、典
型的に、変性溶媒による処理直後に失われる。エピトープは典型的に、特有の空間的立体
配座において少なくとも3、4、5、6、7、8、9、10、11、12、13、14、
または15個のアミノ酸を含む。エピトープの空間的立体配座を判定する方法として、当
該技術における技術、例えば、X線結晶解析および二次元核磁気共鳴が挙げられる(例え
ば、Epitope Mapping Protocols in Methods i
n Molecular Biology,Vol.66,G.E.Morris,Ed
.(1996)参照)。「パラトープ」は、抗原のエピトープを認識する抗体の部分であ
る。
相互作用を説明する文脈において用いられる場合のフレーズ「特異的に結合する」または
「選択的に結合する」は、タンパク質および他の生物製剤の不均一集団における、例えば
、生体サンプル、例えば、血液、血清、血漿、または組織サンプルにおける、抗原の存在
で決定的となる結合反応を指す。ゆえに、指定された特定の免疫アッセイ条件下で、特定
の結合特異性を有する抗体または結合剤は、特定の抗原に、バックグラウンドの少なくと
も2倍結合し、実質的に、サンプル中に存在する他の抗原に多量に結合しない。一態様に
おいて、指定された免疫アッセイ条件下で、特定の結合特異性を有する抗体または結合剤
は、特定の抗原に、バックグラウンドの少なくとも10倍結合し、実質的に、サンプル中
に存在する他の抗原に多量に結合しない。そのような条件下での抗体または結合剤への特
異的な結合は、抗体または剤が、その、特定のタンパク質に対する特異性について、選択
されていることを必要とする場合がある。所望され、または適切であるならば、この選択
は、分子と交差反応する抗体を、他の種(例えば、マウスまたはラット)または他のサブ
タイプから取り去ることによって、達成され得る。これ以外にも、一部の態様において、
特定の所望の分子と交差反応する抗体または抗体フラグメントが選択される。
用の強度を指す。各抗原部位内で、抗体「アーム」の可変領域は、抗原と、多数の部位に
て、弱い非共有結合力を介して相互作用する;相互作用が多いほど、親和性は強い。
しかしながら、ある抗原に特異的に結合する単離された抗体は、他の抗原への交差反応性
を有する場合がある。さらに、単離された抗体は、他の細胞の物質および/または化学物
質が実質的にない場合もある。
配列によってコードされる他の全ての知られている可変領域のアミノ酸配列との比較にお
いて判定された、参照可変領域のアミノ酸配列またはサブ配列との最も高いアミノ酸配列
同一性を共有する、ヒト可変領域のアミノ酸配列またはサブ配列をコードする核酸配列を
指す。対応するヒト生殖細胞系の配列はまた、評価された他の全ての可変領域アミノ酸配
列との比較において、参照可変領域のアミノ酸配列またはサブ配列とのアミノ酸配列同一
性が最も高い、ヒト可変領域のアミノ酸配列またはサブ配列を指し得る。対応するヒト生
殖細胞系の配列は、フレームワーク領域のみ、相補性決定領域のみ、フレームワークおよ
び相補性決定領域、可変セグメント(先で定義される)、または可変領域を含む配列もし
くはサブ配列の他の組合せであってよい。配列同一性が、本明細書中に記載される方法を
用いて判定され得、例えば、当該技術において知られているBLAST、ALIGN、ま
たは別のアラインメントアルゴリズムを用いて2つの配列をアラインするものがある。対
応するヒト生殖細胞系の核酸配列またはアミノ酸配列は、参照可変領域の核酸配列または
アミノ酸配列との配列同一性が、少なくとも約90%、91%、92%、93%、94%
、95%、96%、97%、98%、99%、または100%であり得る。
体を選択するのに用いられてよい。例えば、固相ELISA免疫アッセイが、タンパク質
と特異的に免疫反応性である抗体を選択するのにルーチン的に用いられる(特異的な免疫
反応性を判定するのに用いられ得る免疫アッセイのフォーマットおよび条件の説明につい
て、例えば、Harlow & Lane,Using Antibodies,A L
aboratory Manual(1998)参照)。典型的には、特異的な、または
選択的な結合反応が、シグナルを、バックグラウンドシグナルの少なくとも2倍、より典
型的にはバックグラウンドの少なくとも10~100倍生じさせることとなる。
割った解離速度定数(kd[s-1])を指す。平衡解離定数は、当該技術において知ら
れているあらゆる方法を用いて測定され得る。本開示の抗体は通常、平衡解離定数が約1
0-7または10-8M未満、例えば約10-9Mまたは10-10M未満、一部の態様
では、約10-11M、10-12M、または10-13M未満となるであろう。
ラビリティ(すなわち血液/血漿レベル)を指す。バイオアベイラビリティは、投与され
た剤形から全身循環系に達する薬物の時間(速度)および総量(程度)の双方の測定値を
示す絶対値である。
れる活性薬剤の属または種、および当該方法または組成物の使用目的について不活性のあ
らゆる賦形剤を指す。一部の態様において、フレーズ「から本質的になる」は明示的に、
本開示の抗体薬物結合体以外の1つ以上の追加の活性剤の包含を除外する。一部の態様に
おいて、フレーズ「から本質的になる」は明示的に、本開示の抗体薬物結合体および同時
投与される第2の剤以外の1つ以上の追加の活性剤の包含を除外する。
酸、ならびにアミノ酸類似体、および天然に存在するアミノ酸と同様に機能するアミノ酸
模擬物を指す。天然に存在するアミノ酸は、遺伝的コードによってコードされるアミノ酸
、ならびに後に修飾されたアミノ酸、例えば、ヒドロキシプロリン、γ-カルボキシグル
タマート、およびO-ホスホセリンである。アミノ酸類似体は、天然に存在するアミノ酸
と同じ基本的な化学構造を有する化合物、すなわち、水素、カルボキシル基、アミノ基、
およびR基に結合したα-炭素、例えば、ホモセリン、ノルロイシン、メチオニンスルホ
キシド、メチオニンメチルスルホニウムを指す。そのような類似体は、修飾されたR基(
例えばノルロイシン)または修飾されたペプチド骨格を有するが、天然に存在するアミノ
酸と同じ基本的な化学構造を保持する。アミノ酸模擬物は、アミノ酸の一般的な化学構造
と異なる構造を有するが、天然に存在するアミノ酸と同様に機能する化合物を指す。
る。特定の核酸配列に関して、保存的に修飾された変異体は、同じ、もしくは本質的に同
じアミノ酸配列をコードする核酸を、または、核酸がアミノ酸配列をコードしない場合、
本質的に同じ配列を指す。遺伝的コードの縮重によって、多数の機能的に同じ核酸が、所
定のいずれかのタンパク質をコードする。例えば、コドンGCA、GCC、GCG、およ
びGCUは全て、アミノ酸アラニンをコードする。ゆえに、コドンによってアラニンが特
定される全ての位置にて、コドンは、記載される対応するコドンのいずれかに変更され得
、コードされるポリペプチドを変更することはない。そのような核酸変異は「サイレント
変異」であり、これは、保存的に修飾された変異の一種である。また、ポリペプチドをコ
ードする本明細書中の全ての核酸配列が、核酸の全ての可能なサイレント変異を記載する
。当業者であれば、核酸中の各コドン(通常メチオニンの唯一のコドンであるAUG、お
よび通常トリプトファンの唯一のコドンであるTGG以外)が、機能的に同じ分子を産す
るように修飾され得ることを認識するであろう。したがって、ポリペプチドをコードする
核酸の各サイレント変異が、記載される各配列内に潜在する。
ノ酸でアミノ酸を置換する、ポリペプチド配列に対する個々の置換、欠失、または付加を
含む。機能的に類似するアミノ酸を提供する保存的置換の表が、当該技術において周知で
ある。そのような保存的に修飾された変異体は、多型の変異体、異種間相同体、および対
立遺伝子にも加えられ、これらを排除しない。以下の8つの群が、互いに保存的置換であ
るアミノ酸を含有する:1)アラニン(A)、グリシン(G);2)アスパラギン酸(D
)、グルタミン酸(E);3)アスパラギン(N)、グルタミン(Q);4)アルギニン
(R)、リジン(K);5)イソロイシン(I)、ロイシン(L)、メチオニン(M)、
バリン(V);6)フェニルアラニン(F)、チロシン(Y)、トリプトファン(W);
7)セリン(S)、トレオニン(T);および8)システイン(C)、メチオニン(M)
(例えば、Creighton,Proteins(1984)参照)。一部の態様にお
いて、用語「保存的配列修飾」は、アミノ酸配列を含有する抗体の結合特性に大きく影響
を及ぼさない、またはこれを大きく変更しないアミノ酸修飾を指すのに用いられる。
細胞、例えば、酵母細胞、ピキア(Pichia)属細胞、真菌細胞、トリコデルマ(T
richoderma)属細胞、チャイニーズハムスター卵巣細胞(CHO)、またはヒ
ト細胞において好まれるコドンを用いてアミノ酸配列をコードするように変更されたヌク
レオチド配列を指す。最適化されたヌクレオチド配列は、「親」配列としても知られてい
る出発ヌクレオチド配列によって元々コードされるアミノ酸配列を完全に、または可能な
限り保持するように操作されている。
たは「パーセント同一性」は、2つ以上の配列またはサブ配列が同じである程度を指す。
2つの配列は、比較される領域にわたってアミノ酸またはヌクレオチドの配列が同じであ
るならば、「同じである」。2つの配列は、比較ウィンドウ、または指定された領域上で
、以下の配列比較アルゴリズムの1つを用いて、または手動のアラインメントおよび視覚
による検査によって測定されて、最大一致について比較かつアラインされた場合に、アミ
ノ酸残基またはヌクレオチドの特定のパーセンテージが同じである(すなわち、特定の領
域にわたって、または、特定されない場合には、配列全体にわたって、60%の同一性、
場合によっては65%、70%、75%、80%、85%、90%、95%、または99
%の同一性)ならば、「実質的に同じである」。場合によっては、同一性は、長さが少な
くとも約30ヌクレオチド(または10アミノ酸)である領域、より好ましくは長さが1
00~500ヌクレオチドまたは1000ヌクレオチド以上(または20、50、200
アミノ酸以上)である領域にわたって存在する。
機能する。配列比較アルゴリズムを用いて、試験配列および参照配列がコンピュータに入
力されて、必要に応じて、サブ配列座標(subsequence coordinat
e)が指定されて、配列アルゴリズムプログラムパラメータが指定される。デフォルトの
プログラムパラメータが用いられてもよいし、代替パラメータが指定されてもよい。次に
、配列比較アルゴリズムは、プログラムパラメータに基づいて、参照配列に対する試験配
列のパーセント配列同一性を算出する。
に、配列が、同じ数の隣接位置の参照配列と比較され得る、20~600、通常約50~
約200、さらに通常約100~約150からなる群から選択される隣接位置の数のいず
れか1つのセグメントへの言及を含む。比較のための配列アラインメント方法が、当該技
術において周知である。比較のための最適な配列アラインメントが、例えば、Smith
and Waterman,Adv.Appl.Math.2:482c(1970)
の局所的相同性アルゴリズムによって、Needleman and Wunsch,J
.Mol.Biol.48:443の相同性アラインメントアルゴリズムによって、Pe
arson and Lipman,Proc.Natl.Acad.Sci.USA
85:2444(1988)の類似性検索方法によって、これらのアルゴリズムのコンピ
ュータ化されたインプリメンテーション(Wisconsin Genetics So
ftware Package,Genetics Computer Group,5
75 Science Dr.,Madison,WIにおける、GAP、BESTFI
T、FASTA、およびTFASTA)によって、または手動アラインメントおよび視覚
による検査(例えば、Brent et al.,Current Protocols
in Molecular Biology,2003参照)によって行われ得る。
として、BLASTアルゴリズムおよびBLAST2.0アルゴリズムがあり、これらは
それぞれ、Altschul et al.,Nuc.Acids Res.25:33
89-3402,1977;およびAltschul et al.,J.Mol.Bi
ol.215:403-410,1990に記載されている。BLAST分析を実行する
ためのソフトウェアが、National Center for Biotechno
logy Informationから一般に入手可能である。このアルゴリズムは、最
初に、高いスコアリング配列対(HSP)を、クエリ配列中の長さWのショートワードを
特定することによって特定することを包含し、これは、データベース配列において同じ長
さのワードとアラインされた場合に、一部の正の値の閾値スコアTにマッチし、またはこ
れを満たすものである。Tは、近隣ワードスコア閾値と呼ばれる(Altschul e
t al.,前掲)。これらの最初の近隣ワードヒットは、これを含有するより長いHS
Pを見出すための検索を開始させるシードとして機能する。ワードヒットは、累積アライ
ンメントスコアが増大し得る限り、各配列に沿って両方向に延長される。累積スコアが、
ヌクレオチド配列について、パラメータM(一対のマッチング残基についての報酬スコア
;常に>0)およびN(ミスマッチング残基についてのペナルティスコア;常に<0)を
用いて算出される。アミノ酸配列について、スコアリングマトリックスが、累積スコアを
算出するのに用いられる。各方向におけるワードヒットの延長は、次の場合に停止する:
累積アラインメントスコアが、その最大達成値から量X落ちた場合;累積スコアが、1つ
以上の負の値のスコアリング残基アラインメントの蓄積に起因して、ゼロ以下になった場
合;またはいずれかの配列の端部に達した場合。BLASTアルゴリズムのパラメータW
、T、およびXは、アラインメントの感度および速度を判定する。BLASTNプログラ
ム(ヌクレオチド配列用)は、デフォルトとして、11のワード長(W)、10の予想(
E)、M=5、N=-4、および双方の鎖の比較を用いる。アミノ酸配列について、BL
ASTPプログラムは、デフォルトとして3のワード長、および10の予想(E)、なら
びにBLOSUM62スコアリングマトリックス(Henikoff and Heni
koff,(1989)Proc.Natl.Acad.Sci.USA 89:109
15参照)は、50のアラインメント(B)、10の予想(E)、M=5、N=-4、お
よび双方の鎖の比較を用いる。
えば、Karlin and Altschul,Proc.Natl.Acad.Sc
i.USA 90:5873-5787,1993参照)。BLASTアルゴリズムによ
って提供される類似性の一尺度が、最小和確率(P(N))であり、これは、2つのヌク
レオチド配列またはアミノ酸配列間のマッチが偶然によって起こるであろう確率の指標を
提供する。例えば、核酸は、参照核酸に対する試験核酸の比較において最小和確率が約0
.2未満、より好ましくは約0.01未満、最も好ましくは約0.001未満であれば、
参照配列に類似すると考える。
iller,Comput.Appl.Biosci.4:11-17(1988)のア
ルゴリズムを用いて(これは、ALIGNプログラム(バージョン2.0)に組み込まれ
ている)、PAM120加重残留表(weight residue table)、1
2のギャップ長ペナルティ、および4のギャップペナルティを用いて判定され得る。加え
て、2つのアミノ酸配列間のパーセント同一性は、Needleman and Wun
sch,J.Mol.Biol.48:444-453(1970)アルゴリズムを用い
て(これは、GCGソフトウェアパッケージ(www.gcg.comにて入手可能)に
おいて、GAPプログラムに組み込まれている)、Blossom62マトリックスまた
はPAM250マトリックス、ならびに16、14、12、10、8、6、または4のギ
ャップ加重および1、2、3、4、5、または6の長さ加重を用いて判定され得る。
ドが実質的に同じであることの別の指標として、第1の核酸によってコードされるポリペ
プチドが、下記のように、免疫学的に、第2の核酸によってコードされるポリペプチドに
対して高められた抗体と交差反応性であることがある。ゆえに、ポリペプチドは典型的に
、第2のポリペプチドと、例えば、2つのペプチドが保存的置換によってのみ異なる場合
、実質的に同じである。2つの核酸配列が実質的に同じであることの別の指標として、下
記のように、2つの分子またはそれらの相補体が、ストリンジェントな条件下で互いにハ
イブリダイズすることがある。2つの核酸配列が実質的に同じであることのさらに別の指
標として、配列を増幅させるのに同じプライマーが用いられ得ることがある。
鎖の形態または二本鎖の形態のデオキシリボヌクレオチドまたはリボヌクレオチド、およ
びそれらのポリマーを指す。当該用語は、知られているヌクレオチド類似体または修飾さ
れた骨格残基もしくは結合を含有する核酸を包含し、これらは、合成核酸、天然に存在す
る核酸、および天然に存在しない核酸であり、参照核酸と類似の結合特性を有し、そして
参照ヌクレオチドと類似の様式で代謝される。そのような類似体の例として、限定されな
いが、ホスホロチオアート、ホスホロアミダート、メチルホスホナート、キラルメチルホ
スホナート、2-O-メチルリボヌクレオチド、ペプチド核酸(PNA)が挙げられる。
(例えば縮重コドン置換)および相補配列、ならびに明示的に示される配列を包含する。
具体的には、以下で詳述されるように、縮重コドン置換は、1つ以上の選択された(また
は全ての)コドンの第3の位置が、混合塩基および/またはデオキシイノシン残基で置換
されている配列を生じさせることによって、達成され得る(Batzer et al.
,(1991)Nucleic Acid Res.19:5081;Ohtsuka
et al.,(1985)J.Biol.Chem.260:2605-2608;お
よびRossolini et al.,(1994)Mol.Cell.Probes
8:91-98)。
例えばDNA)セグメント間の機能的関係を指す。典型例として、転写調節配列の、転写
される配列との機能的関係を指す。例えば、プロモータまたはエンハンサ配列は、適切な
宿主細胞または他の発現系において、コード配列の転写を刺激または調節するならば、コ
ード配列に作動可能に結合されている。通常、転写される配列に作動可能に結合されるプ
ロモータ転写調節配列は、転写される配列に物理的に隣接している、すなわちシス作用性
である。しかしながら、一部の転写調節配列、例えばエンハンサは、転写を増強するコー
ド配列に物理的に隣接する必要もないし、それに近接して位置決めされる必要もない。
本明細書中で互換的に用いられる。当該用語は、1つ以上のアミノ酸残基が、対応する天
然に存在するアミノ酸の人工化学模擬物であるアミノ酸ポリマーに、そして天然に存在す
るアミノ酸ポリマーおよび天然に存在しないアミノ酸ポリマーに用いられる。特に明記さ
れない限り、特定のポリペプチド配列はまた、暗に、その保存的に修飾された変異体を包
含する。
抗原結合フラグメントの、別の剤、例えば、化学療法剤、毒物、免疫療法剤、およびイメ
ージングプローブとの結合を指す。結合は、共有結合、または非共有結合性の相互作用、
例えば静電力を介するものがあり得る。当該技術において知られている種々のリンカーが
、結合体を形成するのに使用され得る。加えて、結合体は、結合体をコードするポリヌク
レオチドから発現され得る融合タンパク質の形態で提供され得る。本明細書中で用いられ
る「融合タンパク質」は、別々のタンパク質(ペプチドおよびポリペプチドが挙げられる
)を元々コードする2つ以上の遺伝子または遺伝子フラグメントの結合を介して生じたタ
ンパク質を指す。融合遺伝子の翻訳は、機能特性が元の各タンパク質に由来する単一のタ
ンパク質をもたらす。
例えば哺乳類および非哺乳類、例えば非ヒト霊長類、ヒツジ、イヌ、ウシ、ニワトリ、両
生類、および爬虫類が挙げられる。示される場合以外は、用語「患者」または「対象」は
、本明細書中で互換的に用いられる。
の成長および増殖に有害であり、かつ細胞または悪性腫瘍を弱め、阻害し、または破壊す
るように作用し得るあらゆる剤を指す。
いられ得るあらゆる剤を指し、以下に限定されないが、細胞毒性剤、化学療法剤、放射線
療法および放射線療法剤、標的抗癌剤、ならびに免疫療法剤が挙げられる。
合フラグメントに結合される化学部分を指し、あらゆる治療薬または診断薬、例えば、抗
癌剤、抗炎症薬、抗感染薬(例えば、抗真菌剤、抗菌剤、抗寄生虫剤、抗ウイルス剤)、
または麻酔薬が挙げられ得る。特定の態様において、薬物部分は、Eg5インヒビタ、V
-ATPアーゼインヒビタ、HSP90インヒビタ、IAPインヒビタ、mTorインヒ
ビタ、微小管スタビライザ、微小管デスタビライザ、オーリスタチン、ドラスタチン、マ
イタンシノイド、MetAP(メチオニンアミノペプチダーゼ)、タンパク質CRM1の
核外移行のインヒビタ、DPPIVインヒビタ、ミトコンドリアにおけるホスホリル転移
反応のインヒビタ、タンパク質合成インヒビタ、キナーゼインヒビタ、CDK2インヒビ
タ、CDK9インヒビタ、プロテアソームインヒビタ、キネシンインヒビタ、HDACイ
ンヒビタ、DNA損傷剤、DNAアルキル化剤、DNAインターカレータ、DNAマイナ
ーグルーブバインダ、RNAポリメラーゼインヒビタ、アマニチン、スプライセオソーム
インヒビタ、トポイソメラーゼインヒビタ、およびDHFRインヒビタから選択される。
これらのそれぞれを、本開示の抗体および方法と適合するリンカーに取り付ける方法が、
当該技術において知られている。例えば、Singh et al.,(2009)Th
erapeutic Antibodies:Methods and Protoco
ls,vol.525,445-457参照。加えて、ペイロードは、生物物理学的プロ
ーブ、フルオロフォア、スピン標識、赤外線プローブ、アフィニティプローブ、キレータ
、分光学的プローブ、放射性プローブ、脂質分子、ポリエチレングリコール、ポリマー、
スピン標識、DNA、RNA、タンパク質、ペプチド、表面、抗体、抗体フラグメント、
ナノ粒子、量子ドット、リポソーム、PLGA粒子、糖、または多糖であってよい。
の部位に移行しなかったもの)および続発性悪性腫瘍(例えば、転移(元の腫瘍の部位と
異なる第2の部位への腫瘍細胞の移行)から生じたもの)を含む。
れている)は、受容体チロシンキナーゼIIIファミリのメンバであるチロシンキナーゼ
受容体を指す。ヒトcKITアイソフォームの核酸配列およびアミノ酸配列は知られてお
り、GenBankにおいて以下の登録番号で公開されている:
NM_000222.2→NP_000213.1 肥満/幹細胞成長因子受容体キッ
トアイソフォーム1前駆体;
NM_001093772.1→NP_001087241.1 肥満/幹細胞成長因
子受容体キットアイソフォーム2前駆体。
構造的に、cKIT受容体は、I型膜貫通タンパク質であり、細胞外ドメイン中にシグ
ナルペプチド、5 Ig様C2ドメインを含有し、かつその細胞内ドメイン中にプロテイ
ンキナーゼドメインを有する。本明細書中で用いられる用語「cKIT」は、cKITタ
ンパク質の天然に存在する全てのアイソフォームまたはその変異体をまとめて指すのに用
いられる。
的に同じヌクレオチド配列によってコードされ、かつ参照ポリペプチドの1つ以上の活性
を有することができるポリペプチドを指す。例えば、変異体は、参照ポリペプチドとの配
列同一性が約85%、90%、91%、92%、93%、94%、95%、96%、97
%、98%、99%、またはそれ以上であり得る一方、参照ポリペプチドの1つ以上の活
性を保持し得る。
こと」、またはその「処置」は、一態様において、疾患または障害を改善すること(すな
わち、疾患の進行、またはその臨床病徴の少なくとも1つを遅らせ、抑制し、または軽減
すること)を指す。別の態様において、「処置する」、「処置すること」、または「処置
」は、患者によって識別され得ないものを含む少なくとも1つの物理的パラメータを軽減
または改善することを指す。さらに別の態様において、「処置する」、「処置すること」
、または「処置」は、物理的に(例えば、識別できる病徴の安定化)、生理的に(例えば
、物理的パラメータの安定化)、または両方で、疾患または障害を調節することを指す。
さらに別の態様において、「処置する」、「処置すること」、または「処置」は、疾患ま
たは障害の発症または進行を予防し、または遅延させることを指す。
果(すなわち、腫瘍サイズの引下げ、腫瘍増殖の阻害、転移の予防、ウイルス、細菌、真
菌、または寄生虫感染の阻害または予防)をもたらすのに十分な量を指す。一部の態様に
おいて、治療的に許容可能な量は、不所望の副作用を誘導も引起しもしない。治療的に許
容可能な量は、最初に低い用量を投与してから、当該用量を、所望の効果が達成されるま
で段々に増大させることによって、決定され得る。本開示の分子の「治療的に有効な投薬
量」は、癌と関連する病徴が挙げられる病徴の発症を予防することができ、または病徴の
重症度を軽減することができる。
れる活性剤は、同時に送達されても、順次送達されてもよい。
反応によって形成される基を指し、以下の式を有する:
リンカー成分、抗体、またはペイロードを含み得る。チオールマレイミドは、以下の開環
構造体
よって2つの部分を連結するが、生理的に適切な条件下で分解して、部分間の共有結合を
切断することを指し、典型的には、切断可能な結合基は、細胞外よりも細胞内の環境にお
いてインビボでより迅速に切断されて、ペイロードの放出を標的細胞の内側で選択的に起
こす。切断は、酵素的であっても非酵素的であってもよいが、通常、抗体を分解させるこ
となくペイロードを抗体から放出する。切断は、結合基またはリンカー成分の一部分を、
ペイロードに取り付けたままにし得、または結合基のいかなる残基もなくペイロードを放
出し得る。
的条件下での分解に特に感受性でないことを指し、例えば結合基またはリンカー成分は、
少なくとも、結合体の抗体または抗原結合フラグメント部分と同じくらい安定している。
そのような結合基は時折、「安定している」と呼ばれ、これは、抗体または抗原結合フラ
グメントそれ自体が少なくとも部分的に分解される、すなわち、抗体または抗原結合フラ
グメントの分解が、インビボでの結合基の切断に先行するまで、ペイロードを抗体または
抗原結合フラグメントに連結されたままで維持するほど、分解に対して十分に耐性を示す
ことを意味する。安定した、または切断可能でない結合基を有するADCの抗体部分の分
解は、結合基の一部または全て、例えば、抗体由来の1つ以上のアミノ酸基を、インビボ
で送達されるペイロードまたは薬物部分に取り付けたままにし得る。
一態様において、本発明のリンカー-薬物部分は、リンカー(LB)に共有結合的に取
り付けられた1つ以上の細胞毒素を含み、1つ以上の細胞毒素は、オーリスタチン、アマ
ニチン、マイタンシノイド、およびサポリンから独立して選択される。
取り付けられた1つ以上の細胞毒素を含み、1つ以上の細胞毒素は、オーリスタチンおよ
びアマニチンから独立して選択される。
り付けられた1つ以上の細胞毒素を含み、リンカー(LB)は、切断可能なリンカーであ
り、1つ以上の細胞毒素は、オーリスタチン、アマニチン、マイタンシノイド、およびサ
ポリンから独立して選択される。
取り付けられた1つ以上の細胞毒素を含み、リンカー(LB)は、切断可能なリンカーで
あり、1つ以上の細胞毒素は、オーリスタチンおよびアマニチンから独立して選択される
。
り付けられた1つ以上の細胞毒素を含み、リンカー(LB)は、切断可能でないリンカー
であり、1つ以上の細胞毒素は、オーリスタチン、アマニチン、マイタンシノイド、およ
びサポリンから独立して選択される。
PAP)、ブリオジン1、ボウガニン、ゲロニン、リシン、アブリン、ヤドリギレクチン
、モデシン、ヴォルケンシン、アスパリン(asparin)、モモルジン、エブリン(
ebulin)、ビスキュミン、志賀毒素、ジフテリアトキシン(DT)、またはシュー
ドモナス(Pseudomonas)属外毒素(PE)から選択されるタンパク質毒素で
ある。そのようなタンパク質毒素は、リボソームを不活化することによって、または伸長
因子2(EF2)機能に干渉することによってタンパク質合成を阻害することによって、
細胞を死滅させることができる(Kreitman et al.,Immunotox
ins for targeted cancer therapy,The AAPS
Journal 2006;8(3)Article 63;Gadadhar an
d Karande,Targeted Cancer Therapy:Histor
y and Development of Immunotoxins,Chapte
r 1 of Resistance to Immunotoxins in Can
cer Therapy,pp 1-31参照)。一部の実施形態において、タンパク質
毒素は、サポリンである。そのようなタンパク質毒素は、切断可能なリンカー(LB)ま
たは切断可能でないリンカー(LB)に、共有結合的に取り付けられ得る。
取り付けられた1つ以上の細胞毒素を含み、リンカー(LB)は、切断可能でないリンカ
ーであり、1つ以上の細胞毒素は、オーリスタチンまたはアマニチンから独立して選択さ
れる。
たはその立体異性体もしくは薬学的に許容可能な塩であり、
R1は、
または
R1は、
R2は、C1~C6アルキルであり;
R4は、-L1R14、-L2R24、-L2R34、または-L3R44であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-、-(
CH2)mX1(CH2)m-、-(CH2)mNHC(=O)(CH2)m-、-(C
H2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-、-((CH2)m
O)p(CH2)mNHC(=O)(CH2)m、-((CH2)mO)pCH2)mC
(=O)NH(CH2)m-、-X3X4C(=O)((CH2)mO)p(CH2)m
-、-X3X4C(=O)(CH2)m-、-X3C(=O)(CH2)mNHC(=O
)(CH2)m-、-X3C(=O)(CH2)mNHC(=O)((CH2)mO)p
(CH2)m-、-(CH2)mC(R7)2-、-(CH2)mC(R7)2SS(C
H2)mNHC(=O)(CH2)m-、または-(CH2)mX3C(=O)(CH2
)mNHC(=O)((CH2)mO)p(CH2)m-であり;
L2は、-((CH2)mO)p(CH2)m-、-(CH2)mX1(CH2)m-、
-(CH2)mNHC(=O)(CH2)m-、-(CH2)mNHC(=O)(CH2
)mC(=O)NH(CH2)m-、-((CH2)mO)p(CH2)mNHC(=O
)(CH2)m、-((CH2)mO)pCH2)mC(=O)NH(CH2)m-、-
X3X4C(=O)((CH2)mO)p(CH2)m-、-X3X4C(=O)(CH
2)m-、-X3C(=O)(CH2)mNHC(=O)(CH2)m-、-X3C(=
O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-、-(CH2)m
C(R7)2-、-(CH2)mC(R7)2SS(CH2)mNHC(=O)(CH2
)m-、または-(CH2)mX3C(=O)(CH2)mNHC(=O)((CH2)
mO)p(CH2)m-であり;
L3は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-、-(
CH2)mX1(CH2)m-、-(CH2)mNHC(=O)(CH2)m-、-(C
H2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-、-((CH2)m
O)p(CH2)mNHC(=O)(CH2)m、-((CH2)mO)pCH2)mC
(=O)NH(CH2)m-、-X3X4C(=O)((CH2)mO)p(CH2)m
-、-X3X4C(=O)(CH2)m-、-X3C(=O)(CH2)mNHC(=O
)(CH2)m-、-X3C(=O)(CH2)mNHC(=O)((CH2)mO)p
(CH2)m-、-(CH2)mC(R7)2-、-(CH2)mC(R7)2SS(C
H2)mNHC(=O)(CH2)m-、または-(CH2)mX3C(=O)(CH2
)mNHC(=O)((CH2)mO)p(CH2)m-であり;
L4は、-(CH2)m-であり;
L5は、-NHS(=O)2(CH2)mX1L4、-NH((CH2)mO)p(CH
2)mX1L4-、-NH((CH2)mO)p(CH2)mX2L4-、-NH((C
H2)mO)p(CH2)m-、-NH(CH2)m-、-NH(CH2)mX1(CH
2)m-、-NH(CH2)mNHC(=O)(CH2)m-、-NH(CH2)mNH
C(=O)(CH2)mC(=O)NH(CH2)m-、-NH((CH2)mO)p(
CH2)mNHC(=O)(CH2)m、-NH((CH2)mO)pCH2)mC(=
O)NH(CH2)m-、-NH(CH2)nC(R7)2-、-NH(CH2)mC(
R7)2SS(CH2)mNHC(=O)(CH2)m-、または-NH(CH2)mX
3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-であり;
X1は、
X2は、
X3は、
X4は、
R14は、
O)2(CH=CH2)、-NR7S(=O)2(CH=CH2)、-NR7C(=O)
CH2Br、-NR7C(=O)CH2I、-NHC(=O)CH2Br、-NHC(=
O)CH2I、-C(=O)NHNH2、
R24は、
R34は、-N3、-ONH2、-NR7C(=O)CH=CH2、-C(=O)NHN
H2、-CO2H、-NH2、
R44は、
各R7は、HおよびC1~C6アルキルから独立して選択され;
R8は、-S(CH2)nCHR9NH2であり;
R9は、-C(=O)OR7であり;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
R13は、2-ピリジルまたは4-ピリジルであり;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
またはその立体異性体もしくは薬学的に許容可能な塩であり、
R54は、-L6R14、-L7R24、-L7R34、または-L8R44であり;
Xは、S(=O)、S(=O)2、またはSであり;
R5は、H、-CH3、または-CD3であり;
R6は、-NH2または-OHであり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1
L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、-(
(CH2)mO)p(CH2)m-、-(CH2)m-、-(CH2)mX1(CH2)
m-、-(CH2)mNHC(=O)(CH2)m-、-(CH2)mNHC(=O)(
CH2)mC(=O)NH(CH2)m-、-((CH2)mO)p(CH2)mNHC
(=O)(CH2)m、-((CH2)mO)pCH2)mC(=O)NH(CH2)m
-、-(CH2)mC(R7)2-、または-(CH2)mC(R7)2SS(CH2)
mNHC(=O)(CH2)m-であり;
L7は、-((CH2)mO)p(CH2)m-、-(CH2)mX1(CH2)m-、
-L4NHC(=O)NH((CH2)mO)p(CH2)m-、-L4NHC(=O)
NH((CH2)mO)p(CH2)m-、-(CH2)mNHC(=O)(CH2)m
-、-(CH2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-、-((
CH2)mO)p(CH2)mNHC(=O)(CH2)m、-((CH2)mO)pC
H2)mC(=O)NH(CH2)m-、-(CH2)mC(R7)2-、または-(C
H2)mC(R7)2SS(CH2)mNHC(=O)(CH2)m-であり;
L8は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1
L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、-(
(CH2)mO)p(CH2)m-、-(CH2)m-、-(CH2)mX1(CH2)
m-、-(CH2)mNHC(=O)(CH2)m-、-(CH2)mNHC(=O)(
CH2)mC(=O)NH(CH2)m-、-((CH2)mO)p(CH2)mNHC
(=O)(CH2)m、-((CH2)mO)pCH2)mC(=O)NH(CH2)m
-、-(CH2)mC(R7)2-、または-(CH2)mC(R7)2SS(CH2)
mNHC(=O)(CH2)m-であり;
L4は、-(CH2)m-であり;
X1は、
X2は、
R14は、
O)2(CH=CH2)、-NR7S(=O)2(CH=CH2)、-NR7C(=O)
CH2Br、-NR7C(=O)CH2I、-NHC(=O)CH2Br、-NHC(=
O)CH2I、-C(=O)NHNH2、
R24は、
R34は、-N3、-ONH2、-NR7C(=O)CH=CH2、-C(=O)NHN
H2、-CO2H、-NH2、
R44は、
各R7は、HおよびC1~C6アルキルから独立して選択され;
R8は、-S(CH2)nCHR9NH2であり;
R9は、-C(=O)OR7であり;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
R13は、2-ピリジルまたは4-ピリジルであり;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
以下のリストに記載される。各実施形態において特定された特徴が、他の特定された特徴
と組み合わされて、本発明の更なる実施形態が提供され得ることが認識されよう。
可能な塩を有する、式(A)の化合物、またはその薬学的に許容可能な塩:
の薬学的に許容可能な塩、
式中:
R4は、-L1R14、-L2R24、-L2R34、または-L3R44であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-、-X
3X4C(=O)((CH2)mO)p(CH2)m-、-X3X4C(=O)(CH2
)m-、-X3C(=O)(CH2)mNHC(=O)(CH2)m-、-X3C(=O
)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-であり;
L2は、-((CH2)mO)p(CH2)m-であり;
L3は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-、X3
X4C(=O)((CH2)mO)p(CH2)m-、-X3X4C(=O)(CH2)
m-、-X3C(=O)(CH2)mNHC(=O)(CH2)m-、-X3C(=O)
(CH2)mNHC(=O)((CH2)mO)p(CH2)m-であり;
L4は、-(CH2)m-であり;
X1は
X2は
X3は
X4は
R14は、
CH2)、-NR7S(=O)2(CH=CH2)、-NR7C(=O)CH2Br、-
NR7C(=O)CH2I、-NHC(=O)CH2Br、-NHC(=O)CH2I、
-C(O)NHNH2、
R24は、
R34は、-N3、-ONH2、-NR7C(=O)CH=CH2、-C(O)NHNH
2、-CO2H、-NH2、
R44は、
各R7は、HおよびC1~C6アルキルから独立して選択され;
R8は、-S(CH2)nCHR9NH2であり;
R9は、-C(=O)OR7であり;
各R10は、H、C1~C6アルキル、F、Clおよび-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
A-3a)の化合物、またはその薬学的に許容可能な塩、
式中:
L4は、-(CH2)m-であり;
L5は、-NHS(=O)2(CH2)mX1L4、-NH((CH2)mO)p(CH
2)mX1L4-、-NH((CH2)mO)p(CH2)mX2L4-、-NH((C
H2)mO)p(CH2)m-、または-NH(CH2)m-であり;
X1は、
X2は、
R14は、
CH2)、-NR7S(=O)2(CH=CH2)、-NR7C(=O)CH2Br、-
NR7C(=O)CH2I、-NHC(=O)CH2Br、-NHC(=O)CH2I、
-C(O)NHNH2、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
薬学的に許容可能な塩、式中:
R4は、-L1R14であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)m-、または-(CH2)m-であり;
L4は、-(CH2)m-であり;
L5は、-NHS(=O)2(CH2)mX1L4であり;
X1は、
R14は、
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
A-3a)の化合物、またはその薬学的に許容可能な塩、式中:
L4は、-(CH2)m-であり;
L5は、-NHS(=O)2(CH2)mX1L4であり;
X1は、
R14は、
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
の薬学的に許容可能な塩、
式中:R54は、-L6R14、-L7R24、-L7R34、または-L8R44であ
り;
R5は、H、-CH3、または-CD3であり;
R6は、-NH2または-OHであり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1
L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、-(
(CH2)mO)p(CH2)m-、または-(CH2)m-であり;
L7は、-((CH2)mO)p(CH2)m-であり;
L8は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-であり
;
L4は、-(CH2)m-であり;
X1は、
X2は、
R14は、
CH2)、-NR7S(=O)2(CH=CH2)、-NR7C(=O)CH2Br、-
NR7C(=O)CH2I、-NHC(=O)CH2Br、-NHC(=O)CH2I、
-C(O)NHNH2、
R24は、
R34は、-N3、-ONH2、-NR7C(=O)CH=CH2、-C(O)NHNH
2、-CO2H、-NH2、
R44は、
各R7は、HおよびC1~C6アルキルから独立して選択され;
R8は、-S(CH2)nCHR9NH2であり;
R9は、-C(=O)OR7であり;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
の薬学的に許容可能な塩、式中:
R54は、-L6R14であり;
R5は、-CH3であり;
R6は、-NH2であり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)m-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-、
-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、または-(C
H2)m-であり;
L4は、-(CH2)m-であり;
X1は、
R14は、
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
本開示は、cKITに特異的に結合する抗体または抗体フラグメント(例えば、Fab
またはFab’)が、薬物部分(例えば細胞毒性剤)に、場合によってはリンカーを介し
て結合されている抗体薬物結合体を提供する。一態様において、抗体または抗体フラグメ
ント(例えば、FabまたはFab’)は、リンカーによる共有結合的取付けを介して、
細胞毒性剤である薬物部分に結合される。
的に送達することによって、患者、例えば造血幹細胞移植レシピエントにおいて当該細胞
を選択的に除去することができる。好ましくは、cKIT抗体薬物結合体は、半減期が短
くて、患者の循環系から一掃されることとなるので、造血幹細胞移植前の、造血幹細胞移
植レシピエントのコンディション調整に用いられ得る。
きな複合体に架橋かつ/または多量体化された場合でさえ、肥満細胞脱顆粒を誘導する能
力が引き下げられるように修飾される。例えば、本明細書中で開示されるcKIT抗体薬
物結合体は、より大きな複合体に架橋かつ/または多量体化された場合でさえ、完全長c
KIT抗体、F(ab’)2もしくはF(ab)2フラグメント、またはそれらの結合体
と比較して、肥満細胞脱顆粒を誘導する能力が少なくとも約10%、20%、30%、4
0%、50%、60%、70%、80%、90%、95%、99%引き下げられるように
修飾される。一部の実施形態において、本明細書中で開示されるcKIT抗体薬物結合体
は、抗cKIT FabまたはFab’フラグメントを含んでよい。一部の実施形態にお
いて、本明細書中で開示される抗cKIT抗体薬物結合体は、より大きな複合体に架橋か
つ/または多量体化された場合でさえ、肥満細胞脱顆粒を誘導する活性が最小であり得、
例えば、ベータ-ヘキソサミニダーゼ放出アッセイにおいて、ベースライン補正されたO
.D.読出しが、0.25未満、例えば、0.2未満、0.15未満、または0.1未満
であり得る。
)に、場合によってはリンカーを介して結合されている、cKITに特異的に結合する抗
体フラグメント(例えば、FabまたはFab’)(抗cKIT FabまたはFab’
)を含む結合体である。本明細書中に記載されるように、そのような抗cKIT Fab
’またはFab-毒物結合体は、ヒトHSC細胞をインビトロかつインビボで除去するこ
とができる一方、より大きな複合体に架橋かつ/または多量体化された場合でさえ、肥満
細胞脱顆粒を引き起こさない。
A-(LB-(D)n)y 式(I);
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)であり;
LBは、リンカーであり;
Dは、細胞毒性剤であり;
nは、1から10の整数であり、
yは、1から10の整数であり、
リンカー-薬物部分(LB-(D)n)は、抗体フラグメント(A)に共有結合的に取り
付けられている。
b’)または鎖(例えば、HCまたはLC)であり;
A2は、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFa
b’)または鎖(例えば、HCまたはLC)であり;
LBは、リンカーであり;
Dは、細胞毒性剤であり、
nは、1から10の整数であり、
リンカー-薬物部分(LB-(D)n)は、抗体フラグメントA1およびA2を共有結合
的に連結する。
オーリスタチン、アマニチン、マイタンシノイド、およびサポリンから独立して選択され
る。
およびアマニチンから独立して選択される。
体フラグメントA(例えば、FabまたはFab’)に共有結合的に取り付けられること
によって、1つ以上の薬物部分Dが、抗体フラグメントA(例えば、FabまたはFab
’)に、リンカーLBを介して共有結合的に取り付けられ得る。LBは、抗体フラグメン
トA(例えば、FabまたはFab’)を、1つ以上の薬物部分Dに結合することができ
るあらゆる化学部分である。1つ以上の薬物部分Dが抗体フラグメントA(例えば、Fa
bまたはFab’)に共有結合されている式(I)の結合体は、同じ、または異なる1つ
以上の反応性官能基を有する二機能リンカー試薬または多機能リンカー試薬を用いて形成
され得る。二機能リンカー試薬または多機能リンカー試薬の反応性官能基の1つが用いら
れて、抗体フラグメントA上の基、一例として、チオールまたはアミン(例えば、システ
イン、N末端またはアミノ酸側鎖、例えばリジン)と反応して、リンカーLBの一端部と
の共有結合を形成する。二機能リンカー試薬または多機能リンカー試薬のそのような反応
性官能基として、以下に限定されないが、マレイミド、チオール、およびNHSエステル
が挙げられる。二機能リンカー試薬または多機能リンカー試薬の他の反応性官能基が用い
られて、1つ以上の薬物部分DがリンカーLBに共有結合的に取り付けられる。
ル、ならびに1,3-ジハロアセトン、例えば1,3-ジクロロアセトン、1,3-ジブ
ロモアセトン、1,3-ジヨードアセトン、および1,3-ジヒドロキシアセトンのビス
スルホン酸エステルの反応によってケトン架橋が形成されることによって、抗体フラグメ
ントA1およびA2が共有結合的に連結される。このケトン架橋部分は、1つ以上の薬物
部分Dを、リンカーLBを介して抗体フラグメントA1およびA2に共有結合的に取り付
けるのに用いられる。LBは、抗体フラグメントA1およびA2を、1つ以上の薬物部分
Dに結合することができるあらゆる化学部分である。1つ以上の薬物部分Dが抗体フラグ
メントA1およびA2に共有結合されている式(II)の結合体は、同じ、または異なる
1つ以上の反応性官能基を有する二機能リンカー試薬または多機能リンカー試薬を用いて
形成され得る。一実施形態において、二機能リンカー試薬または多機能リンカー試薬の反
応性官能基の1つが、アルコキシアミンであり、これは、ケトン架橋と反応してリンカー
LBの一端部とのオキシム結合を形成するのに用いられ、そして二機能リンカー試薬また
は多機能リンカー試薬の他の反応性官能基が用いられて、1つ以上の薬物部分Dがリンカ
ーLBに共有結合的に取り付けられる。別の実施形態において、二機能リンカー試薬また
は多機能リンカー試薬の反応性官能基の1つが、ヒドラジンであり、これが、ケトン架橋
と反応してリンカーLBの一端部とのヒドラゾン結合を形成するのに用いられ、そして二
機能リンカー試薬または多機能リンカー試薬の他の反応性官能基が用いられて、1つ以上
の薬物部分DがリンカーLBに共有結合的に取り付けられる。
断可能でないリンカーである。一部の態様において、LBは、酸に不安定なリンカー、感
光性リンカー、ペプチダーゼ切断可能リンカー、エステラーゼ切断可能リンカー、グリコ
シダーゼ切断可能リンカー、ホスホジエステラーゼ切断可能リンカー、ジスルフィド結合
還元可能リンカー、親水性リンカー、またはジカルボン酸ベースのリンカーである。
PAP)、ブリオジン1、ボウガニン、ゲロニン、リシン、アブリン、ヤドリギレクチン
、モデシン、ヴォルケンシン、アスパリン、モモルジン、エブリン、ビスキュミン、志賀
毒素、ジフテリアトキシン(DT)、またはシュードモナス(Pseudomonas)
属外毒素(PE)から選択されるタンパク質毒素である。そのようなタンパク質毒素は、
リボソームを不活化することによって、または伸長因子2(EF2)機能に干渉すること
によってタンパク質合成を阻害することによって、細胞を死滅させることができる(Kr
eitman et al.,Immunotoxins for targeted
cancer therapy,The AAPS Journal 2006;8(3
)Article 63;Gadadhar and Karande,Targete
d Cancer Therapy:History and Development
of Immunotoxins,Chapter 1 of Resistance
to Immunotoxins in Cancer Therapy,pp 1-
31参照)。一部の実施形態において、タンパク質毒素は、サポリンである。タンパク質
毒素は、切断可能なリンカー(LB)または切断可能でないリンカー(LB)を介して、
抗cKIT抗体フラグメント(A)に共有結合的に取り付けられ得る。一部の実施形態に
おいて、タンパク質毒素は、ジスルフィド結合またはチオエーテル結合を介して抗cKI
T抗体フラグメントに結合される。
およびyの積、ならびに式(II)中のn)を有する一方、値は多くの場合、典型的には
結合工程と関連する、幾らかの不均質性に起因して、多くの分子を含有するサンプルを説
明するのに用いられる場合の平均値になろうことが理解される。結合体のサンプルについ
ての平均ローディングは、本明細書中で、薬物対抗体(またはFab’)比、または「D
AR」と呼ばれる。一部の態様において、DARは、約1~約5、典型的には約1、2、
3、または4である。一部の態様において、サンプルの少なくとも50重量%が、平均D
ARプラスマイナス2を有する化合物であり、好ましくは、サンプルの少なくとも50%
が、平均DARプラスマイナス1を含有する結合体である。他の態様は、DARが約2で
ある結合体を含む。一部の態様において、「約y」のDARは、DARについて測定され
た値が、式(I)中のnおよびyの積の20%以内であることを意味する。一部の態様に
おいて、「約n」のDARは、DARについて測定された値が、式(II)中のnの20
%以内であることを意味する。
b’)に対する平均モル比(すなわち、薬物対抗体比(DAR)としても知られている、
nおよびyの積の平均値)は、約1~約10、約1~約6(例えば、0.9、1.0、1
.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2
.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3
.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4
.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5
.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0)、
約1~約5、約1.5~約4.5、または約2~約4である。
対する平均モル比(すなわち、薬物対抗体比(DAR)としても知られている、nの平均
値)は、約1~約10、約1~約6、(例えば、0.9、1.0、1.1、1.2、1.
3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.
3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.
3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.
3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.
3、5.4、5.5、5.6、5.7、5.8、5.9、6.0)、約1~約5、約1.
5~約4.5、または約2~約4である。
の特徴の1つ以上を有する:(a)結合体種の約90%超(例えば、約91%、92%、
93%、94%、95%、96%、97%、98%、99%、または100%以上)、好
ましくは約95%超が、単量体である、(b)結合体調製物中の非結合型リンカーレベル
が、約10%未満(例えば、約9%、8%、7%、6%、5%、4%、3%、2%、1%
、または0%以下)(総リンカーに対して)である、(c)結合体種の10%未満が架橋
されている(例えば、約9%、8%、7%、6%、5%、4%、3%、2%、1%、また
は0%以下)、(d)結合体調製物中の遊離型薬物(例えば、オーリスタチン、アマニチ
ン、マイタンシノイド、またはサポリン)レベルが、約2%未満(例えば、約1.5%、
1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%、0.7%、
0.6%、0.5%、0.4%、0.3%、0.2%、0.1%、または0%以下)(総
細胞毒性剤に対してmol/mol)である。
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
R2は、C1~C6アルキルであり;
L20は、-L1R40であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-、-(
CH2)mX1(CH2)m-、-(CH2)mNHC(=O)(CH2)m-、-(C
H2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-、-((CH2)m
O)p(CH2)mNHC(=O)(CH2)m、-((CH2)mO)pCH2)mC
(=O)NH(CH2)m-、X3X4C(=O)((CH2)mO)p(CH2)m-
、-X3X4C(=O)(CH2)m-、-X3C(=O)(CH2)nNHC(=O)
(CH2)m-、-X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(
CH2)m-、-(CH2)mC(R7)2-、-(CH2)mC(R7)2SS(CH
2)mNHC(=O)(CH2)m-、または-(CH2)mX3C(=O)(CH2)
mNHC(=O)((CH2)mO)p(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
X2は、
X3は、
X4は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各R15は、H、-CH3、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
R1は、
R2は、C1~C6アルキルであり;
L30は、-L5R40であり;
L4は、-((CH2)mであり;
L5は、-NHS(=O)2(CH2)mX1L4、-NH((CH2)mO)p(CH
2)mX1L4-、-NH((CH2)mO)p(CH2)mX2L4-、-NH((C
H2)mO)p(CH2)m-、-NH(CH2)m-、-NH(CH2)mX1(CH
2)m-、-NH(CH2)mNHC(=O)(CH2)m-、-NH(CH2)mNH
C(=O)(CH2)mC(=O)NH(CH2)m-、-NH((CH2)mO)p(
CH2)mNHC(=O)(CH2)m、-NH((CH2)mO)pCH2)mC(=
O)NH(CH2)m-、-NH(CH2)nC(R7)2-、-NH(CH2)mC(
R7)2SS(CH2)mNHC(=O)(CH2)m-、または-NH(CH2)mX
3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-であり;
X1は、
X2は、
X3は、
X4は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各R15は、H、-CH3、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
Xは、S(=O)、S(=O)2、またはSであり;
R5は、H、-CH3、または-CD3であり;
R6は、-NH2または-OHであり;
L40は、-L6R40であり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1
L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、-(
(CH2)mO)p(CH2)m-、-(CH2)m-、-(CH2)mX1(CH2)
m-、-(CH2)mNHC(=O)(CH2)m-、-(CH2)mNHC(=O)(
CH2)mC(=O)NH(CH2)m-、-((CH2)mO)p(CH2)mNHC
(=O)(CH2)m、-((CH2)mO)pCH2)mC(=O)NH(CH2)m
-、-(CH2)mC(R7)2-、または-(CH2)mC(R7)2SS(CH2)
mNHC(=O)(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
X2は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各R15は、H、-CH3、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
に記載される。各実施形態において特定された特徴が、他の特定された特徴と組み合わさ
れて、本発明の更なる実施形態が提供され得ることが認識されよう。
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
L20は、-L1R40であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-、-X
3X4C(=O)((CH2)mO)p(CH2)m-、-X3X4C(=O)(CH2
)m-、-X3C(=O)(CH2)mNHC(=O)(CH2)m-、-X3C(=O
)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
X2は、
X3は、
X4は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
L20は、-L1R40であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、または-(CH2)m-
であり;
L4は、-((CH2)mであり;
X1は、
X2は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
L20は、-L1R40であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)m-、または-(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
R40は、
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
D-2a)の構造を有する結合体、式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
L30は、-L5R40であり;
L4は、-((CH2)mであり;
L5は、-NHS(=O)2(CH2)mX1L4、-NH((CH2)mO)p(CH
2)mX1L4-、-NH((CH2)mO)p(CH2)mX2L4-、-NH((C
H2)mO)p(CH2)m-、または-NH(CH2)m-であり;
X1は、
X2は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
D-2a)の構造を有する結合体:
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
L30は、-L5R40であり;
L4は、-((CH2)mであり;
L5は、-NHS(=O)2(CH2)mX1L4、-NH((CH2)mO)p(CH
2)mX1L4-、-NH((CH2)mO)p(CH2)mX2L4-、-NH((C
H2)mO)p(CH2)m-、または-NH(CH2)m-であり;
X1は、
X2は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
D-2a)の構造を有する結合体、式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
L30は、-L5R40であり;
L4は、-((CH2)mであり;
L5は、-NHS(=O)2(CH2)mX1L4であり;
X1は、
R40は、
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
、式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
R5は、H、-CH3、または-CD3であり;
R6は、-NH2または-OHであり;
L40は、-L6R40であり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1
L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、-(
(CH2)mO)p(CH2)m-、または-(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
X2は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
、式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
R5は、H、-CH3、または-CD3であり;
R6は、-NH2または-OHであり;
L40は、-L6R40であり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1
L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、-(
(CH2)mO)p(CH2)m-、または-(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
X2は、
R40は、
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
、式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメント(例えば、FabまたはFab
’)を表し;
yは、1から10の整数であり;
R5は、-CH3であり;
R6は、-NH2であり;
L40は、-L6R40であり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)m、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1L4-、-
L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、または-(CH
2)m-であり;
L4は、-((CH2)mであり;
X1は、
R40は、
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される。
実施例1:(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)
-4-((S)-2-((1R,3S,4S)-2-(3-(2-(2,5-ジオキソ-
2,5-ジヒドロ-1H-ピロール-1-イル)エトキシ)プロパノイル)-2-アザビ
シクロ[2.2.1]ヘプタン-3-カルボキサミド)-N,3-ジメチルブタンアミド
)-3-メトキシ-5-メチルヘプタノイル)ピロリジン-2-イル)-3-メトキシ-
2-メチルプロパンアミド)-3-フェニルプロパン酸(C1)の合成
℃のN,N-ジメチルホルムアミド(DMF、20.0mL)溶液に、N,N-ジイソプ
ロピルエチルアミン(DIEA、0.677g、5.25mmol)および1-[ビス(
ジメチルアミノ)メチレン]-1H-1,2,3-トリアゾロ[4,5-b]ピリジニウ
ム3-オキシドヘキサフルオロホスファート(HATU)(0.731g、1.93mm
ol)を加えた。次に、生じた溶液を、5分間撹拌して、L-フェニルアラニンメチルエ
ステルHCl塩(0.377g、1.75mmol)およびDIEA(0.226g、1
.75mmol)の0℃のDMF(5.0mL)溶液に加えた。反応混合物を室温に温め
て、さらに30分間撹拌してから濃縮した。残留物を、ISCO系、C18カラムを用い
た逆相HPLCによって精製して、20~90%アセトニトリル水で溶出して、BocV
al-Dil-Dap-PheOMeを得た:MS m/z 733.4(M+1);保
持時間 1.47分間.
0.932mmol)のメタノール(20mL)溶液に、HCl(1,4-ジオキサン中
4N、16mL)を加えた。反応混合物を室温にて7時間撹拌して、濃縮した。残留物を
ジオキサン中に溶解させて、凍結乾燥させてVal-Dil-Dap-PheOMe H
Cl塩を得た:MS m/z 633.4(M+1);保持時間 0.96分間.
ン-3-カルボン酸(12.6mg、0.052mmol)を、15ml丸底フラスコ内
でDMF(1mL)中に溶解させた。DIEA(12.3mg、0.095mmol)お
よびHATU(19mg、0.050mmol)を加えた。反応混合物を10分間撹拌し
て、DMF(1.0mL)中Val-Dil-Dap-PheOMe HCl塩(30m
g、0.090mmol)を加えた。反応混合物を1時間撹拌した。LCMS分析により
、反応が完了したことが示され、生じた混合物を、C18カラムを用いた逆相HPLCに
よって精製して、0.05%トリフルオロ酢酸(TFA)を含有する20~90%アセト
ニトリル-H2Oで溶出した。所望の生成物を含有する画分をプールして濃縮して、(1
R,3S,4S)-tert-ブチル3-(((S)-1-(((3R,4S,5S)-
3-メトキシ-1-((S)-2-((1R,2R)-1-メトキシ-3-(((S)-
1-メトキシ-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-2-メチル-
3-オキソプロピル)ピロリジン-1-イル)-5-メチル-1-オキソへプタン-4-
イル)(メチル)アミノ)-3-メチル-1-オキソブタン-2-イル)カルバモイル)
-2-アザビシクロ[2.2.1]ヘプタン-2-カルボキシレートを得た:MS m/
z 856.6(M+1);保持時間 1.67分間.
せて、TFA(0.5mL)で処理した。反応混合物を、室温にて1時間撹拌した。LC
MS分析により、反応が完了したことが示された。反応混合物を、ロータリエバポレータ
によって濃縮して、(S)-メチル2-((2R,3R)-3-((S)-1-((3R
,4S,5S)-4-((S)-2-((1R,3S,4S)-2-アザビシクロ[2.
2.1]ヘプタン-3-カルボキサミド)-N,3-ジメチルブタンアミド)-3-メト
キシ-5-メチルヘプタノイル)ピロリジン-2-イル)-3-メトキシ-2-メチルプ
ロパンアミド)-3-フェニルプロパノアートがTFA塩として得られた:MS m/z
756.6(M+1);保持時間 1.22分間.
S)--1-((3R,4S,5S)-4-((S)-2-((1R,3S,4S)-2
-アザビシクロ[2.2.1]ヘプタン-3-カルボキサミド)-N,3-ジメチルブタ
ンアミド)-3-メトキシ-5-メチルヘプタノイル)ピロリジン-2-イル)-3-メ
トキシ-2-メチルプロパンアミド)-3-フェニルプロパノアートTFA塩(38.4
mg、0.044mmol)、LiOH一水和物(50.0mg、1.19mmol)、
およびMeOH-H2O(2:1、4.0mL)の溶媒混合物を加えた。混合物を、室温
にて60時間撹拌した。LC-MS分析により、反応が完了したことが示された。反応混
合物を濃縮して、逆相HPLC、C18カラムによって精製して、0.05%TFAを含
有するアセトニトリル-H2O(10~70%)で溶出した。所望の生成物を含有する画
分を組み合わせて濃縮して、(S)-2-((2R,3R)-3-((S)-1-((3
R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-アザビシクロ[2
.2.1]ヘプタン-3-カルボキサミド)-N,3-ジメチルブタンアミド)-3-メ
トキシ-5-メチルヘプタノイル)ピロリジン-2-イル)-3-メトキシ-2-メチル
プロパンアミド)-3-フェニルプロパン酸がTFA塩として得られた、MS m/z
742.5(M+1).保持時間 1.15分間.
mol)のDMF(1ml)溶液に、HATU(3.7mg、0.0098mmol)お
よびDIEA(3.6mg、0.028mmol)を加えた。反応物を5分間撹拌してか
ら、DMF(0.5ml)中(S)-2-((2R,3R)-3-((S)-1-((3
R,4S,5S)-4-((S)-2-((1R,3S,4S)-2-アザビシクロ[2
.2.1]ヘプタン-3-カルボキサミド)-N,3-ジメチルブタンアミド)-3-メ
トキシ-5-メチルヘプタノイル)ピロリジン-2-イル)-3-メトキシ-2-メチル
プロパンアミド)-3-フェニルプロパン酸(8mg、0.0093mmol)を加えた
。反応混合物を室温にて1時間撹拌してから濃縮して、分取用HPLC(0.05%TF
Aを含有する10~60%アセトニトリル-H2O)によって精製して、(S)-2-(
(2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((
1R,3S,4S)-2-(3-(2-(2,5-ジオキソ-2,5-ジヒドロ-1H-
ピロール-1-イル)エトキシ)プロパノイル)-2-アザビシクロ[2.2.1]ヘプ
タン-3-カルボキサミド)-N,3-ジメチルブタンアミド)-3-メトキシ-5-メ
チルヘプタノイル)ピロリジン-2-イル)-3-メトキシ-2-メチルプロパンアミド
)-3-フェニルプロパン酸(C1)を得た。MS m/z 937.5(M+H).保
持時間 1.138min.
-4-((S)-2-((1R,3S,4S)-2-(6-(2,5-ジオキソ-2,5
-ジヒドロ-1H-ピロール-1-イル)ヘキサノイル)-2-アザビシクロ[2.2.
1]ヘプタン-3-カルボキサミド)-N,3-ジメチルブタンアミド)-3-メトキシ
-5-メチルヘプタノイル)ピロリジン-2-イル)-3-メトキシ-2-メチルプロパ
ンアミド)-3-フェニルプロパン酸(C2)
(S)-2-((1R,3S,4S)-2-(6-(2,5-ジオキソ-2,5-ジヒド
ロ-1H-ピロール-1-イル)ヘキサノイル)-2-アザビシクロ[2.2.1]ヘプ
タン-3-カルボキサミド)-N,3-ジメチルブタンアミド)-3-メトキシ-5-メ
チルヘプタノイル)ピロリジン-2-イル)-3-メトキシ-2-メチルプロパンアミド
)-3-フェニルプロパン酸(2)を、実施例1の方法に従って製造したが、工程6にお
いて、DMF(1.0mL)中6-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピロ
ール-1-イル)ヘキサン酸(EMCA)(1.2mg、0.0058mmol)を、3
-(2-(マレイミド)エトキシ)プロパン酸の代わりに用いたことを除く。(S)-2
-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-
((1R,3S,4S)-2-(6-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピ
ロール-1-イル)ヘキサノイル)-2-アザビシクロ[2.2.1]ヘプタン-3-カ
ルボキサミド)-N,3-ジメチルブタンアミド)-3-メトキシ-5-メチルヘプタノ
イル)ピロリジン-2-イル)-3-メトキシ-2-メチルプロパンアミド)-3-フェ
ニルプロパン酸(2)MS m/z 935.6(M+1).保持時間 1.17分間.
((S)-2-((1R,2R)-3-(((S)-N-1-(3-(4-((2,5-
ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)メチル)-1H-1,2,3
-トリアゾル-1-イル)プロピルスルホンアミド)-1-オキソ-3-フェニルプロパ
ン-2-イル)アミノ)-1-メトキシ-2-メチル-3-オキソプロピル)ピロリジン
-1-イル)-3-メトキシ-5-メチル-1-オキソヘプタン-4-イル)(メチル)
アミノ)-3-メチル-1-オキソブタン-2-イル)-2-メチル-2-アザビシクロ
[2.2.1]ヘプタン-3-カルボキサミド(C3)
液に、1,3-プロパンスルホン(6.10g、50.0mmol)のアセトン(25m
L)溶液を加えた。反応混合物を室温にて24時間撹拌して、濃縮して乾燥させた。生じ
た固形物をジエチルエーテル(100mL)中に懸濁させて、1時間還流させながら撹拌
した。懸濁液を室温に冷却して、固形物を濾過によって収集して、アセトンおよびジエチ
ルエーテルで洗浄して、減圧下で乾燥させて、3-アジド-1-プロパンスルホン酸が得
られた。MS m/z 188.1(M+1).1H NMR(400MHz,CD3O
D):δ 3.47(t,J=6.8Hz,2H),2.87(t,J=7.6Hz,2
H),2.07-2.00(m,2H).
トルエン中に懸濁させた。PCl5(2.61g、13.0mmol)を加えた。混合物
を、3時間還流させながら加熱した。反応混合物を室温に冷却して、濾過して不溶物を取
り出した。濾過ケーキを、DCMで洗浄した。組み合わせた濾液を濃縮して、3-アジド
プロパン-1-スルホニルクロリドが暗黄色の油として得られ、これを、さらに精製する
ことなく次の工程に用いた。
ルクロリド(1.75g、9.53mmol)を加えた。10分後、反応混合物を室温に
温めて、同じ温度にて3時間撹拌した。油性の混合物が澄明になった。反応混合物をEt
OAcで3回抽出した。有機相をブラインで洗浄して、無水MgSO4上で乾燥させて、
濃縮した。残留溶媒をさらに、高減圧下で18時間除去して、3-アジドプロパン-1-
スルホンアミドが得られた。MS m/z 187.1(M+1).1H NMR(40
0MHz,CDCl3):δ 4.83(s,2H),3.51(t,J=6.4Hz,
2H),3.23(t,J=7.6Hz,2H),2.17-2.10(m,2H).
ロパン酸(100mg、0.38mmol)を、DMF(4mL)中に溶解させてから、
DIEA(0.395mL、2.26mmol)およびHATU(358mg、0.94
0mmol)を加えた。15分後、3-アジドプロパン-1-スルホンアミド(186m
g、1.13mmol)を加えた。反応混合物を2時間撹拌し、この時点にて、LCMS
分析により反応の完了が示された。次に、生じた混合物を、C18カラムを用いた逆相H
PLCによって精製して、0.05%TFAを含有する10~90%アセトニトリル-H
2Oで溶出した。所望の生成物を含有する画分をプールして凍結乾燥させて、(S)-t
ert-ブチル(1-(3-アジドプロピルスルホンアミド)-1-オキソ-3-フェニ
ルプロパン-2-イル)カルバマートを得た。MS m/z 312.1(M+1-Bo
c).保持時間 1.15分間.このように得た生成物(72.4mg、0.176mm
ol)を、3Mメタノール性HCl(5mL)中に溶解させた。溶媒を、減圧下で除去し
た。残留物を、アセトニトリルおよびH2O中に取って、凍結乾燥させて、(S)-2-
アミノ-N-((3-アジドプロピル)スルホニル)-3-フェニルプロパンアミドが、
ピンクがかった、黄色がかった固形物として得られた。MS m/z 312.1(M+
1).1H NMR(400MHz,CD3OD):δ 7.42-7.31(m,5H
),4.16-4.13(m,1H),3.51-3.47(m,4H),3.32-3
.26(m,1H),3.13-3.08(m,1H),2.00-1.94(m,2H
).
5mg、0.34mmol)に、DIEA(132mg、1.02mmol)およびHA
TU(108mg、0.28mmol)を加えた。反応混合物を室温にて15分間撹拌し
てから、(S)-2-アミノ-N-((3-アジドプロピル)スルホニル)-3-フェニ
ルプロパンアミド(59.2mg、0.17mmol)を加えた。反応混合物を、室温に
てさらに2時間撹拌した。次に、逆相HPLCによって精製して、所望の生成物が得られ
た(95mg、65%の収率、MS m/z 865.4(M+1),保持時間 1.4
3分間)。生成物を、MeOH(3mL)中3M HCl中に溶解させた。溶媒を、減圧
下で除去した。次に、アセトニトリルおよびH2Oを残留物に加えて、溶液を凍結乾燥さ
せて、所望の生成物(S)-1-(((3R,4S,5S)-1-((S)-2-((1
R,2R)-3-(((S)-N-1-(3-アジドプロピルスルホンアミド)-1-オ
キソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-メチル-3-オ
キソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1-オキソヘプタ
ン-4-イル)(メチル)アミノ)-2-アミノ-3-メチル-1-オキソブタンを得た
。MS m/z 765.4(M+1).保持時間 1.04分間.
ルボニル)-2-アザビシクロ[2.2.1]ヘプタン-3-カルボン酸(16.5mg
、0.068mmol)に、DIEA(17.6mg、0.137mmol)およびHA
TU(21.6mg、0.057mmol)を加えた。反応混合物を、室温にて10分間
撹拌してから、(S)-1-(((3R,4S,5S)-1-((S)-2-((1R,
2R)-3-(((S)-N-1-(3-アジドプロピルスルホンアミド)-1-オキソ
-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-メチル-3-オキソ
プロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1-オキソヘプタン-
4-イル)(メチル)アミノ)-2-アミノ-3-メチル-1-オキソブタン(20mg
、TFA塩、0.023mmol)を加えた。反応混合物を、室温にて2時間撹拌し、こ
の時点にて、LCMS分析により反応の完了が示された。次に、生じた混合物を、C18
カラムを用いた逆相HPLCによって精製して、0.05%TFAを含有する10~90
%ACN-H2Oで溶出した。所望の生成物を含有する画分をプールして、凍結乾燥させ
て、(1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-((S
)-2-((1R,2R)-3-(((S)-N-1-(3-アジドプロピルスルホンア
ミド)-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-
メチル-3-オキソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1
-オキソヘプタン-4-イル)(メチル)アミノ)-3-メチル-1-オキソブタン-2
-イル)-2-(tert-ブトキシカルボニル)-2-アザビシクロ[2.2.1]ヘ
プタン-3-カルボキサミドを得た。MS m/z 988.5(M+1).保持時間
1.51分間.このように得た生成物(9.4mg、0.0095mmol)を、メタノ
ール性HCl(3M、2.0mL)中に溶解させた。溶媒を、減圧下でゆっくり除去した
。残留物をアセトニトリルおよびH2O中に溶解させて、凍結乾燥させて、(1R,3S
,4S)-N-((S)-1-(((3R,4S,5S)-1-((S)-2-((1R
,2R)-3-(((S)-N-1-(3-アジドプロピルスルホンアミド)-1-オキ
ソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-メチル-3-オキ
ソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1-オキソヘプタン
-4-イル)(メチル)アミノ)-3-メチル-1-オキソブタン-2-イル)-2-ア
ザビシクロ[2.2.1]ヘプタン-3-カルボキサミドがHCl塩として得られた。M
S m/z 888.5(M+1).保持時間 1.10分間.
((S)-2-((1R,2R)-3-(((S)-N-1-(3-アジドプロピルスル
ホンアミド)-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ
-2-メチル-3-オキソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチ
ル-1-オキソヘプタン-4-イル)(メチル)アミノ)-3-メチル-1-オキソブタ
ン-2-イル)-2-アザビシクロ[2.2.1]ヘプタン-3-カルボキサミド(8.
8mg、0.0099mmol)を、MeOH(2.0mL)中に溶解させた。パラホル
ムアルデヒド(10.1mg、0.337mmol)および酢酸(0.0102mL)に
続いて、ナトリウムシアノボロハイドライド(21.2mg、0.337mmol)を加
えた。反応混合物を、撹拌しながら1時間、50℃にて加熱した。さらにパラホルムアル
デヒド(10.1mg、0.337mmol)、酢酸(0.0102mL)、およびナト
リウムシアノボロハイドライド(21.2mg、0.337mmol)を加えた。50℃
にて1時間後に、LCMS分析により、反応の完了が示された。次に、生じた混合物を、
C18カラムを用いた逆相HPLCによって精製して、0.05%TFAを含有する10
~90%ACN-H2Oで溶出した。所望の生成物を含有する画分をプールして、凍結乾
燥させて、(1R,3S,4S)-N-((S)-1-(((3R,4S,5S)-1-
((S)-2-((1R,2R)-3-(((S)-N-1-(3-アジドプロピルスル
ホンアミド)-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ
-2-メチル-3-オキソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチ
ル-1-オキソヘプタン-4-イル)(メチル)アミノ)-3-メチル-1-オキソブタ
ン-2-イル)-2-メチル-2-アザビシクロ[2.2.1]ヘプタン-3-カルボキ
サミドを得た。MS m/z 902.5(M+1).保持時間 1.12分間.
((S)-2-((1R,2R)-3-(((S)-N-1-(3-アジドプロピルスル
ホンアミド)-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ
-2-メチル-3-オキソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチ
ル-1-オキソヘプタン-4-イル)(メチル)アミノ)-3-メチル-1-オキソブタ
ン-2-イル)-2-メチル-2-アザビシクロ[2.2.1]ヘプタン-3-カルボキ
サミド(5.2mg、0.0058mmol)、1-(プロパ-2-イン-1-イル)-
1H-ピロール-2,5-ジオン(1.56mg、0.012mmol)、およびCuS
O4(0.7mg、0.004mmol)のDMF(2.0mL)およびH2O(0.5
mL)溶液を、L-アスコルビン酸ナトリウム塩(2.5mg、0.014mmol)で
処理して、室温にて2時間撹拌した。さらにCuSO4(0.7mg、0.004mmo
l)およびL-アスコルビン酸ナトリウム塩(2.5mg、0.014mmol)を加え
た。室温にてさらに2時間後、LCMS分析により、反応の完了が示された。次に、生じ
た混合物を、C18カラムを用いた逆相HPLCによって精製して、0.05%TFAを
含有する10~90%アセトニトリル-H2Oで溶出した。所望の生成物を含有する画分
をプールして、凍結乾燥させて、(1R,3S,4S)-N-((S)-1-(((3R
,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(3
-(4-((2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)メチル
)-1H-1,2,3-トリアゾル-1-イル)プロピルスルホンアミド)-1-オキソ
-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-メチル-3-オキソ
プロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1-オキソヘプタン-
4-イル)(メチル)アミノ)-3-メチル-1-オキソブタン-2-イル)-2-メチ
ル-2-アザビシクロ[2.2.1]ヘプタン-3-カルボキサミド(C3)を得た。M
S m/z 1037.4(M+1).保持時間 1.00分間.
R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(
3-(4-((2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)メチ
ル)-1H-1,2,3-トリアゾル-1-イル)プロピルスルホンアミド)-1-オキ
ソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-メチル-3-オキ
ソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1-オキソヘプタン
-4-イル)(メチル)アミノ)-3-メチル-1-オキソブタン(C4)の合成
1,3-プロパンスルホン(6.1g、50mmol)のアセトン(25ml)溶液を加
えた。反応混合物を、室温にて24時間撹拌して、濃縮した。生じた固形物を、ジエチル
エーテル(100ml)中に懸濁させて、1時間還流させながら撹拌した。懸濁液を、室
温に冷却した。固形物を、濾過によって収集して、アセトンおよびジエチルエーテルで洗
浄して、減圧下で乾燥させて、3-アジド-1-プロパンスルホン酸が得られた。MS
m/z 188.1(M+23).1H NMR(400MHz,CD3OD):δ 3
.47(t,J=6.8Hz,2H),2.87(t,J=7.6Hz,2H),2.0
7-2.00(m,2H).
エン中に懸濁させた。PCl5(2.61g、13mmol)を加えた。混合物を、3時
間還流させながら加熱した。反応物を、室温に冷却した。不溶性の物質を濾過によって取
り出して、DCMで洗浄した。組み合わせた濾液を濃縮して、3-アジドプロパン-1-
スルホニルクロリドが黄褐色の油として得られ、これを、さらに精製することなく次の工
程に用いた。
-スルホニルクロリド(1.75g、9.53mmol)を加えた。10分後、反応物を
室温に温めてから、室温にて3時間撹拌した。二相が均質になった。反応混合物を、Et
OAcで3回抽出した。組み合わせた有機相をブラインで洗浄して、MgSO4上で乾燥
させて、ロータリエバポレータに続いて高減圧下で18時間濃縮して、3-アジドプロパ
ン-1-スルホンアミドが得られた。MS m/z 187.1(M+23).1H N
MR(400MHz,CDCl3):δ 4.83(s,2H),3.51(t,J=6
.4Hz,2H),3.23(t,J=7.6Hz,2H),2.17-2.10(m,
2H).
ロパン酸(100mg、0.38mmol)を、DMF(4mL)中に溶解させた。DI
EA(0.395mL、2.26mmol)およびHATU(358mg、0.94mm
ol)を加えた。15分後、3-アジドプロパン-1-スルホンアミド(186mg、1
.13mmol)を加えた。反応物を、2時間撹拌した。LCMSにより反応の完了が示
された。反応混合物を、10~90%勾配を用いた分取用HPLCによって精製して、(
S)-tert-ブチル(1-(3-アジドプロピルスルホンアミド)-1-オキソ-3
-フェニルプロパン-2-イル)カルバマートを得た。MS m/z 312.1(M+
1-Boc).保持時間 1.15min.このように得た生成物(72.4mg、0.
176mmol)を、メタノール性HCl(3M、5mL)中に溶解した。溶媒を、蒸発
によって除去した。残留物を、アセトニトリルおよびH2Oから凍結乾燥させて、(S)
-2-アミノ-N-((3-アジドプロピル)スルホニル)-3-フェニルプロパンアミ
ドが、ピンクがかった、黄色がかった固形物として得られた。MS m/z 312.1
(M+1)1H NMR(400MHz,CD3OD):δ 7.42-7.31(m,
5H),4.16-4.13(m,1H),3.51-3.47(m,4H),3.32
-3.26(m,1H),3.13-3.08(m,1H),2.00-1.94(m,
2H).
0.34mmol)に、DIEA(132mg、1.02mmol)およびHATU(1
08mg、0.28mmol)を加えた。これを室温にて15分撹拌した。(S)-2-
アミノ-N-((3-アジドプロピル)スルホニル)-3-フェニルプロパンアミド(5
9.2mg、0.17mmol)を加えた。反応物を、室温にて2時間撹拌した。粗物質
を、分取用HPLCによって精製して、所望の生成物が得られた(95mg、65%の収
率、MS m/z 865.4(M+1),保持時間 1.43分間)。生成物を、Me
OH(3mL)中3M HCl中に溶解させた。溶媒を、蒸発によって除去した。残留物
を、アセトニトリル-水から凍結乾燥させて、(S)-1-(((3R,4S,5S)-
1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-アジドプロピル
スルホンアミド)-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-1-メト
キシ-2-メチル-3-オキソプロピル)ピロリジン-1-イル)-3-メトキシ-5-
メチル-1-オキソヘプタン-4-イル)(メチル)アミノ)-2-アミノ-3-メチル
-1-オキソブタン
in.
2-((1R,2R)-3-(((S)-N-1-(3-アジドプロピルスルホンアミド
)-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-メチ
ル-3-オキソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1-オ
キソヘプタン-4-イル)(メチル)アミノ)-2-アミノ-3-メチル-1-オキソブ
タンHCl塩(20mg、0.025mmol)に、DIEA(0.024mL、0.1
4mmol)およびHATU(21.6mg、0.057mmol)を加えた。反応物を
、室温にて2時間撹拌した。LCMSにより反応の完了が示された。次に、生じた混合物
を、10~90%勾配を用いた分取用HPLCによって精製して、(S)-2-((ビス
(ジメチルアミノ)メチレン)アミノ)-1-(((3R,4S,5S)-1-((S)
-2-((1R,2R)-3-(((S)-N-1-(3-アジドプロピルスルホンアミ
ド)-1-オキソ-3-フェニルプロパン-2-イル)アミノ)-1-メトキシ-2-メ
チル-3-オキソプロピル)ピロリジン-1-イル)-3-メトキシ-5-メチル-1-
オキソヘプタン-4-イル)(メチル)アミノ)-3-メチル-1-オキソブタンをTF
A塩として得た。MS m/z 863.5(M+1).保持時間 1.169min.
R,4S,5S)-1-((S)-2-((1R,2R)-3-(((S)-N-1-(
3-アジドプロピルスルホンアミド)-1-オキソ-3-フェニルプロパン-2-イル)
アミノ)-1-メトキシ-2-メチル-3-オキソプロピル)ピロリジン-1-イル)-
3-メトキシ-5-メチル-1-オキソヘプタン-4-イル)(メチル)アミノ)-3-
メチル-1-オキソブタンTFA塩(87.4mg、0.089mmol)および1-(
プロパ-2-イン-1-イル)-1H-ピロール-2,5-ジオン(24.2mg、0.
0179mmol)を、t-BuOHおよび水のそれぞれ3.0mL中に懸濁させた。反
応器を、N2よる5回の減圧-充填サイクルによってN2で充填した。L-アスコルビン
酸ナトリウム(17.7mg、0.089mmol)の脱ガスH2O(2.4ml)溶液
およびCuSO4(2.86mg、0.018mmol)の脱ガスH2O(0.6ml)
溶液を逐次加えて、反応物を室温にて5時間撹拌した。LCMSにより反応の完了が示さ
れた。粗物質を、20~45%勾配を用いた分取用HPLCによって精製して、(S)-
2-((ビス(ジメチルアミノ)メチレン)アミノ)-1-(((3R,4S,5S)-
1-((S)-2-((1R,2R)-3-(((S)-N-1-(3-(4-((2,
5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)メチル)-1H-1,2
,3-トリアゾル-1-イル)プロピルスルホンアミド)-1-オキソ-3-フェニルプ
ロパン-2-イル)アミノ)-1-メトキシ-2-メチル-3-オキソプロピル)ピロリ
ジン-1-イル)-3-メトキシ-5-メチル-1-オキソヘプタン-4-イル)(メチ
ル)アミノ)-3-メチル-1-オキソブタン(C4)をTFA塩として得た。MS m
/z 998.5(M+1).保持時間 1.014min.
ジヒドロ-1H-ピロール-1-イル)メチル)-1H-1,2,3-トリアゾル-1-
イル)-3,6,9,12,15,18,21-ヘプタオキサトリコサンチオ)メチル)
-α-アマニチン(C5)、7’C-((23-アジド-3,6,9,12,15,18
,21-ヘプタオキサトリコサンチオ)メチル)-α-アマニチン(A-3)、および6
’O-メチル-7’C-((23-アジド-3,6,9,12,15,18,21-ヘプ
タオキサトリコサンチオ)メチル)-α-アマニチン(A4)の合成
-3,6,9,12,15,18,21-ヘプタオキサトリコサン-1-チオール(35
mg、0.11mmol)を、α-アマニチン(20mg、0.022mmol)のMe
OH(2mL)溶液に加えた。トリエチルアミン(1.2mL、8.7mmol)および
酢酸(0.25mL、4.4mmol)を、反応混合物に加えて、N2ガスで3回フラッ
シュした。反応混合物を、40℃にて2日間撹拌した。次に、真空内での濃縮後、残留物
をHPLCによって精製して、凍結乾燥させて、7’C-((23-アジド-3,6,9
,12,15,18,21-ヘプタオキサトリコサンチオ)メチル)-α-アマニチンが
得られた。MS(m+1)=1342.4,HPLCピーク RT=0.834min,
1H-NMR(MeOD,500MHz)δ 10.65(s,1H),8.81(m,
1H),8.59(d,1H,J=2.0Hz),8.45(m,2H),8.33(s
,1H),8.14(d,1H,J=10.5Hz),8.00(d,1H,J=12.
0Hz),7.90(d,1H,J=11.0Hz),7.67(s,1H),7.48
(d,1H,J=11.0Hz),6.69(d,1H,J=10.5Hz),5.25
(m,1H),5.12(m,1H),4.74(bs,1H),4.61(dd,1H
,J=6.5および12.0Hz),4.51(m,2H),4.29(dd,1H,J
=10.5および23.0Hz),4.09(m,3H),3.92(m,1H),3.
38~3.73(m,43H),3.29(m,2H),3.21(m,1H),3.0
6(m,1H),3.12(m,1H),2.91(m,1H),2.56(m,2H)
,2.39(m,2H),2.00(m,1H),1.60(m,2H),1.15(m
,1H),0.94(d,3H,J=9.0Hz),0.85(m,6H).
キサトリコサンチオ)メチル)-α-アマニチン(14.0mg、0.011mmol)
およびDMSO(1mL)を、ヨウ化メチル(0.0007mL)およびK2CO3(1
.5mg)で室温にて処理して、室温にて1時間撹拌した。追加のヨウ化メチル(0.0
007mL)およびK2CO3(1.5mg)を室温にて加えて、室温にて2時間撹拌し
た。再度、追加のヨウ化メチル(0.0007mL)およびK2CO3(1.5mg)を
室温にて加えて、室温にて2時間撹拌した。次に、反応混合物を、RP-C18 ISC
Oによって精製して、凍結乾燥させて、6’O-メチル-7’C-((23-アジド-3
,6,9,12,15,18,21-ヘプタオキサトリコサンチオ)メチル)-α-アマ
ニチンが得られた。MS(m+2/2)=679.0,HPLCピーク RT=0.88
7min,1H-NMR(MeOD,500MHz)δ 10.75(s,1H),8.
83(m,1H),8.64(d,1H,J=2.0Hz),8.52(d,1H,J=
10.0Hz),8.47(d,1H,J=3.5Hz),8.36(s,1H),8.
18(d,1H,J=8.5Hz),8.05(d,1H,J=9.5Hz),7.96
(d,1H,J=9.0Hz),7.70(d,1H,J=9.0Hz),7.69(s
,1H),6.98(d,1H,J=9.0Hz),5.33(m,1H),5.18(
m,1H),4.80(bs,1H),4.68(dd,1H,J=5.5および9.5
Hz),4.56(m,2H),4.35(dd,1H,J=9.0および18.5Hz
),4.10~4.21(m,3H),3.97(m,1H),3.92(s,3H),
3.45~3.79(m,42H),3.35~3.44(m,3H),3.11(m,
1H),2.96(m,1H),2.61(m,2H),2.44(m,2H),2.0
6(m,1H),1.65(m,2H),1.21(m,1H),0.99(d,3H,
J=7.0Hz),0.90(m,6H).
,21-ヘプタオキサトリコサンチオ)メチル)-α-アマニチン(8mg、0.006
mmol)および1-(プロパ-2-イン-1-イル)-1H-ピロール-2,5-ジオ
ン(2mg、0.012mmol)を、t-ブタノール(0.5mL)に加えて、反応混
合物をN2ガスで5回フラッシュした。次に、L-アスコルビン酸ナトリウム塩(1mg
、0.006mmol)、CuSO4(0.2mg、0.0012mmol)、および0
.5mLのH2Oを加えた。反応混合物をN2ガスで5回フラッシュして、室温にて4時
間撹拌してから、RP-C18 ISCOによって精製して、6’O-メチル-7’C-
((23-(4-((2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル
)メチル)-1H-1,2,3-トリアゾル-1-イル)-3,6,9,12,15,1
8,21-ヘプタオキサトリコサンチオ)メチル)-α-アマニチン(C5)が得られた
。MS(m+2/2)=746.5,HPLCピーク RT=0.850min,1H-
NMR(MeOD,500MHz)δ 10.74(s,1H),8.83(m,1H)
,8.63(d,1H,J=2.0Hz),8.51(d,1H,J=10.0Hz),
8.47(d,1H,J=3.5Hz),8.36(s,1H),8.17(d,1H,
J=8.5Hz),8.04(d,1H,J=10.0Hz),7.96(d,1H,J
=9.5Hz),7.94(s,1H),7.69(d,1H,J=9.0Hz),6.
97(d,1H,J=9.0Hz),6.83(s,2H),5.34(m,1H),5
.17(m,1H),4.79(bs,1H),4.75(s,2H),4.68(dd
,1H,J=5.0および9.5Hz),4.56(m,2H),4.52(t,1H,
J=5.0Hz),4.34(dd,1H,J=9.0および18.5Hz),4.08
~4.20(m,3H),3.97(m,1H),3.91(s,3H),3.39~3
.78(m,38H),3.10(m,1H),2.94(dd,1H,J=14.0お
よび15.0Hz),2.61(m,2H),2.41(m,2H),2.05(m,1
H),1.57~1.68(m,2H),1.20(m ,1H),0.99(d,3H
,J=7.0Hz),0.91(m,6H).
ル-1H-1,2,3-トリアゾル-1-イル)-3,6,9,12,15,18,21
-ヘプタオキサトリコシル)ウレイド)ブチルチオ)メチル)-α-アマニチン(C6)
の合成
チル(4-メルカプトブチル)カルバマート(i-7)(34mg、0.16mmol)
を、40mLバイアル中のα-アマニチン(A)(15mg、0.016mmol)のM
eOH(5mL)およびトリエチルアミン(0.46mL、3.26mmol)溶液に加
えて、反応混合物を40℃にて3日間撹拌した。真空内での濃縮後、残留物を、2mLの
MeOH中に溶解させて、ジエチルエーテル中408μLの2Mトリメチルシリルジアゾ
メタンを加えて、混合物を室温にて2時間撹拌した。次に、別のジエチルエーテル中40
8μLの2Mトリメチルシリルジアゾメタンを加えて、室温にて2時間撹拌した。反応混
合物を、HPLCによって精製して、凍結乾燥させて、6’O-メチル-7’C-((4
-t-ブトキシカルボニルアミノブチルチオ)メチル)-α-アマニチン(A-4)が得
られた。
1H-NMR(MeOD-d4,400MHz)δ 10.78(s,1H),8.84
(m,1H),8.59(d,1H,J=2.4Hz),8.48(s,1H),8.4
6(d,1H,J=14.4Hz),8.35(s,1H),8.15(d,1H,J=
8.8Hz),8.01(d,1H,J=10.0Hz),7.92(d,1H,J=8
.8Hz),7.69(s,1H),7.63(d,1H,J=8.8Hz),6.92
(d,1H,J=8.8Hz),5.28(m,1H),5.13(m,1H),4.7
3(bs,1H),4.61(dd,1H,J=5.6および8.4Hz),4.51(
m,2H),4.30(dd,1H,J=8.8および18.4Hz),4.12(m,
1H),4.04(d,1H,J=13.2Hz),3.94(d,1H,J=13.2
Hz),3.92(m,1H),3.86(s,3H),3.35~3.75(m,14
H),3.05(m,1H),2.92(m,3H),2.49(m,4H),2.00
(m,1H),1.39~1.65(m,8H),1.37(s,9H),1.15(m
,1H),0.93(d,3H,J=7.2Hz),0.84(m,6H).
て、生じた溶液を室温にて2分間静置してから、減圧下で濃縮して、6’O-メチル-7
’C-((4-アミノブチルチオ)メチル)-α-アマニチン(A-5)が得られ、
ク RT=0.635min,1H-NMR(MeOD-d4,400MHz)δ 8.
87(m,1H),8.58(d,1H,J=2.4Hz),8.48(d,1H,J=
10.4Hz),8.44(d,1H,J=1.6Hz),8.16(d,1H,J=8
.4Hz),7.97(d,1H,J=9.6Hz),7.94(d,1H,J=9.2
Hz),7.62(d,1H,J=8.8Hz),6.92(d,1H,J=9.2Hz
),5.25(m,1H),5.13(m,1H),4.73(m,1H),4.60(
dd,1H,J=5.6および9.2Hz),4.49(m,2H),4.28(dd,
1H,J=8.8および18.4Hz),4.12(m,1H),4.04(d,1H,
J=13.2Hz),3.99(s,2H),3.92(m,1H),3.86(s,3
H),3.83(s,1H),3.60~3.72(m,4H),3.30~3.60(
m,10H),3.00~3.20(m,2H),2.90(m,1H),2.76(m
,2H),2.00(m,1H),1.50~1.75(m,7H),1.16(d,1
H,J=5.6Hz),1.24(d,2H,J=7.6Hz),1.15(m,1H)
,0.94(d,3H,J=6.8Hz),0.85(m,6H).
7mol)および4-ニトロフェニル(23-(4-((2,5-ジオキソ-2,5-ジ
ヒドロ-1H-ピロール-1-イル)メチル)-1H-1,2,3-トリアゾル-1-イ
ル)-3,6,9,12,15,18,21-ヘプタオキサトリコシル)カルバマート(
5.0mg、7mol)のDMF(1mL)溶液に加えて、反応混合物を室温にて2時間
撹拌して、HPLCによって精製して、凍結乾燥させて、6’O-メチル-7’C-((
4-(3-(23-((4-マレイミド)メチル-1H-1,2,3-トリアゾル-1-
イル)-3,6,9,12,15,18,21-ヘプタオキサトリコシル)ウレイド)ブ
チルチオ)メチル)-α-アマニチン(C6)が得られた。MS(m+2/2)=803
.5,HPLCピーク RT=0.834 min,1H-NMR(MeOD-d4,4
00MHz)δ 10.76(s,1H),8.84(m,1H),8.59(d,1H
,J=2.0Hz),8.49(s,1H),8.47(d,1H,J=8.0Hz),
8.15(d,1H,J=8.4Hz),8.01(d,1H,J=9.6Hz),7.
92(d,1H,J=8.8Hz),7.90(s,1H),7.63(d,1H,J=
8.8Hz),6.92(d,1H,J=9.2Hz),6.79(s,2H),5.2
8(m,1H),5.13(m,1H),4.74(m,1H),4.71(s,2H)
,4.62(dd,1H,J=5.2および9.6Hz),4.49(m,4H),4.
30(dd,1H,J=8.8および18.4Hz),4.14(m,1H),4.04
(d,1H,J=13.2Hz),3.94(d,1H,J=13.2Hz),3.92
(m,1H),3.85(s,3H),3.80(t,2H,J=4.8Hz),3.3
5~3.75(m,38H),2.90~3.10(m,4H),2.92(m,1H)
,2.40(m,4H),2.01(m,1H),1.38~1.65(m,6H),1
.15(m,1H),0.94(d,3H,J=6.8Hz),0.85(m,6H).
ミド)ブチルチオ)メチル)-α-アマニチンのテトラフルオロフェニルエステル(C7
)の合成
み合わせて、澄明な溶液が得られた。ビス(2,3,5,6-テトラフルオロフェニル)
グルタラート(2mg、5μmol)およびDIEA(4μL、20μmol)を加えた
。反応混合物を室温にて2時間撹拌した後、反応混合物を、HPLCによって精製して、
6’O-メチル-7’C-((4-(3-(カルボキシ)プロパンカルボキサミド)ブチ
ルチオ)メチル)-α-アマニチンのテトラフルオロフェニルエステル(C-7)が得ら
れた。MS(m+1)=1313.3,HPLCピーク RT=0.996min,1H
-NMR(MeOD,400MHz)δ 10.78(s,1H),8.85(m,1H
),8.59(s,1H),8.49(s,1H),8.47(d,1H,J=10.0
Hz),8.35(bs,1H),8.15(d,1H,J=8.0Hz),8.01(
d,1H,J=9.6Hz),7.93(d,1H,J=8.8Hz),7.69(bs
,1H),7.63(d,1H,J=8.8Hz),7.36(m,1H),6.92(
d,1H,J=8.8Hz),5.27(m,1H),5.14(m,1H),4.75
(bs,1H),4.61(dd,1H,J=5.2および9.6Hz),4.51(m
,2H),4.30(dd,1H,J=8.4および18.0Hz),4.12(m,1
H),4.00(d,1H,J=13.2Hz),3.95(d,1H,J=13.2H
z),3.91(m,1H),3.85(s,3H),3.34~3.70(m,9H)
,3.08(m,4H),2.91(m,1H),2.73(t,2H,J=14.4H
z),1.98(t,2H,J=7.6Hz),1.92~2.04(m,1H),1.
40~1.60(m,6H),1.16(m,1H),0.94(d,3H,J=6.8
Hz),0.87(m,6H)..
式(A)、式(B)、式(A-1)、式(A-2)、式(A-3)、式(B-1)、式(
A-1a)、式(A-2a)、式(A-3a)、または式(B-1a)の他の化合物を、
実施例1~実施例7の方法および適切な出発材料を用いて製造することができる。
特に明記しない限り、以下のHPLC法およびHPLC/MS法を、中間体および実施
例の調製に用いた。
LC/MS分析を、Agilent 1200sl/6140系で実行した。
カラム:Waters Acquity HSS T3 C18、50×2.0、1.
8μm
クロロ-14-ヒドロキシ-85,14-ジメトキシ-33,2,7,10-テトラメチ
ル-12,6-ジオキソ-7-アザ-1(6,4)-オキサジナナ(oxazinana
)-3(2,3)-オキシラナ(oxirana)-8(1,3)-ベンゼンアシクロテ
トラデカファン(benzenacyclotetradecaphane)-10,1
2-ジエン-4-イルN-(4-((2-(3-(2,5-ジオキソ-2,5-ジヒドロ
-1H-ピロール-1-イル)プロパンアミド)エチル)ジスルファニル)-4-メチル
ペンタノイル)-N-メチル-L-アラニナート
86-クロロ-14-ヒドロキシ-85,14-ジメトキシ-33,2,7,10-テト
ラメチル-12,6-ジオキソ-7-アザ-1(6,4)-オキサジナナ-3(2,3)
-オキシラナ-8(1,3)-ベンゼンアシクロテトラデカファン-10,12-ジエン
-4-イルN-(4-((2-アミノエチル)ジスルファニル)-4-メチルペンタノイ
ル)-N-メチル-L-アラニナートの調製
(480mg、0.62mmol)に、2-(ピリジン-2-イルジスルファニル)エタ
ン-1-アミン(151mg、0.68mmol)およびDIEA(0.27mL、1.
54mmol)を室温にて加えた。反応混合物を室温にて30分間撹拌して、真空内で濃
縮した。水性残留物を、CH3CN(1mL)およびH2O(2mL)で希釈して、逆相
ISCOによって精製して、0.05%TFAを含有する10~60%アセトニトリル-
H2Oで溶出した。所望の生成物を含有する画分を凍結乾燥させて、所望の生成物(55
5mg、93%の収率)を得た。1H NMR(400MHz,MeOD-d4)δ p
pm 0.83(s,3H)1.21(d,J=5.0Hz,3H)1.25(s,3H
)1.28(s,3H)1.30(d,J=5.0Hz,3H)1.45-1.55(m
,3H)1.67(s,3H)1.84-1.88(m,1H)1.95-2.01(m
,1H)2.14(dd,J=5.0および15.0Hz,1H)2.37-2.43(
m,1H)2.53-2.59(m,1H)2.64(dd,J=10.0および15.
0Hz,1H)2.82-2.89(m,5H)2.91(d,J=10.0Hz,1H
)3.16(dd,J=5.0および10.0Hz,2H)3.20(s,3H)3.2
3(d,J=10.0Hz,1H)3.35(s,3H)3.55(d,J=5.0Hz
,1H)3.58(d,J=10.0Hz,1H)4.15-4.20(m,1H)4.
64(dd,J=5.0および10.0Hz,1H)5.43(q,J=5.0Hz,2
H)5.66(dd,J=10.0および15.0Hz,1H))6.58(dd,J=
10.0および15.0Hz,1H)6.65(d,J=10.0Hz,1H)6.66
(s,1H)7.11(bs,1H)7.28(bs,1H);MS m/z 855.
3(M+H),保持時間 0.988分間.
86-クロロ-14-ヒドロキシ-85,14-ジメトキシ-33,2,7,10-テト
ラメチル-12,6-ジオキソ-7-アザ-1(6,4)-オキサジナナ-3(2,3)
-オキシラナ-8(1,3)-ベンゼンアシクロテトラデカファン-10,12-ジエン
-4-イルN-(4-((2-(3-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピ
ロール-1-イル)プロパンアミド)エチル)ジスルファニル)-4-メチルペンタノイ
ル)-N-メチル-L-アラニナートの調製。
無水DMSO(7mL)中に溶解させた(14S,16S,32S,33S,2R,4
S,10E,12E,14R)-86-クロロ-14-ヒドロキシ-85,14-ジメト
キシ-33,2,7,10-テトラメチル-12,6-ジオキソ-7-アザ-1(6,4
)-オキサジナナ-3(2,3)-オキシラナ-8(1,3)-ベンゼンアシクロテトラ
デカファン-10,12-ジエン-4-イルN-(4-((2-アミノエチル)ジスルフ
ァニル)-4-メチルペンタノイル)-N-メチル-L-アラニナート(555mg、0
.57mmol)に、2,5-ジオキソピロリジン-1-イル3-(2,5-ジオキソ-
2,5-ジヒドロ-1H-ピロール-1-イル)プロパノアート(171mg、0.63
mmol)およびDIEA(249mL、1.43mmol)を室温にて加えた。反応混
合物を室温にて15分間撹拌して、TFAを用いて中和した。混合物を氷浴で0℃に冷却
してから、CH3CN(2mL)およびH2O(7mL)を加えて、次に逆相ISCOに
よって精製して、0.05%TFAを含有する10~70%アセトニトリル-H2Oで溶
出した。所望の生成物を含有する画分を凍結乾燥させて、所望の生成物(430mg、6
6%の収率)を得た。1H NMR(400MHz,CDCl3)δ ppm 0.81
(s,3H)1.23(s,3H)1.24(s,3H)1.25(s,1H)1.28
(d,J=5.0Hz,3H)1.31(d,J=5.0Hz,3H)1.43-1.4
9(m,1H)1.61(d,J=15.0Hz,1H)1.64(s,3H)1.81
-1.87(m,1H)1.94-2.01(m,1H)2.19(dd,J=5.0お
よび15.0Hz,1H)2.30-2.36(m,1H)2.54(t,J=5.0H
z,2H)2.61(dd,J=10.0および15.0Hz,1H)2.70(t,J
=5.0Hz,2H)2.88(s,3H)3.00(d,J=10.0Hz,1H)3
.13(d,J=10.0Hz,1H)3.21(s,3H)3.55(s,3H)3.
45(q,J=5.0Hz,2H)3.49(d,J=5.0Hz,1H)3.62(d
,J=10.0Hz,1H)3.83(t,J=5.0Hz,1H)3.98(s,3H
)4.32(m,1H)4.80(dd,J=5.0および10.0Hz,1H)5.2
8(d,J=5.0Hz,1H)5.66(dd,J=10.0および15.0Hz,1
H))6.22(bs,1H)6.42(dd,J=10.0および15.0Hz,1H
)6.50(s,1H)6.63(s,1H)6.66(d,J=10.0Hz,1H)
6.70(s,2H)6.83(s,1H);MS m/z 988.3(M+H-H2
O),保持時間 1.145分間.
式(I)の抗体結合体を製造するプロセス
式(I)の結合体の形成のための一般的な反応スキームを、以下のスキーム1に示す:
これらは、リンカー-薬物部分に取り付けられた適合する反応基、RG2と反応すること
によって、抗体フラグメントAを1つ以上のリンカー-薬物部分に共有結合する。RG1
基およびRG2基のそのような反応の非限定的な例として、マレイミド(RG2)がチオ
ール(RG1)と反応してスクシンイミド環を与えるもの、またはヒドロキシルアミン(
RG2)がケトン(RG1)と反応してオキシムを与えるものがある。
:
-ジハロアセトンは、1,3-ジクロロアセトン、1,3-ジブロモアセトン、および1
,3-ジヨードアセトンから選択され、還元工程は、ジチオスレイトール(DTT)およ
びトリス(2-カルボキシエチル)ホスフィンヒドロクロリド(TCEP-HCl)から
選択される還元剤を用いて達成される。
L2R34であり、RG1は、反応基、ほんの一例として、チオール、アミン、またはケ
トンであり、これらは、式(A)の化合物の適合するR14、R24、またはR34基と
反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反応して
スクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシムを与え
る。A、R2、L1、L2、R14、R24、R34、およびR40は、本明細書中で定
義される通りである。
す:
L2R34であり、RG1は、式(A-1)の化合物の適合するR14、R24、または
R34基と反応して、対応するR40基を形成する反応基である。一例として、マレイミ
ドがチオールと反応してスクシンイミド環を与え、またはヒドロキシルアミンがケトンと
反応してオキシムを与える。A、L1、L2、R14、R24、R34、およびR40は
、本明細書中で定義される通りである。
示す:
L2R34であり、RG1は、反応基、ほんの一例として、チオール、アミン、またはケ
トンであり、これらは、式(A-1a)の化合物の適合するR14、R24、またはR3
4基と反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反
応してスクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシム
を与える。A、L1、L2、R14、R24、R34、およびR40は、本明細書中で定
義される通りである。
、ほんの一例として、チオール、アミン、またはケトンであり、これらは、式(A)の化
合物の適合するR14基と反応して、対応するR40基を形成する。一例として、マレイ
ミドがチオールと反応してスクシンイミド環を与え、またはヒドロキシルアミンがケトン
と反応してオキシムを与える。A、R2、L5、R14、およびR40は、本明細書中で
定義される通りである。
す:
、アミン、またはケトンであり、これらは、式(A-2)の化合物の適合するR14基と
反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反応して
スクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシムを与え
る。A、L5、R14、およびR40は、本明細書中で定義される通りである。
示す:
、アミン、またはケトンであり、これらは、式(A-2)の化合物の適合するR14基と
反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反応して
スクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシムを与え
る。A、L5、R14、およびR40は、本明細書中で定義される通りである。
す:
、アミン、またはケトンであり、これらは、式(A-3)の化合物の適合するR14基と
反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反応して
スクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシムを与え
る。A、L5、R14、およびR40は、本明細書中で定義される通りである。
に示す:
、アミン、またはケトンであり、これらは、式(A-3a)の化合物の適合するR14基
と反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反応し
てスクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシムを与
える。A、L5、R14、およびR40は、本明細書中で定義される通りである。
:
-L7R34であり、RG1は、反応基、ほんの一例として、チオール、アミン、または
ケトンであり、これらは、式(B)の化合物の適合するR14、R24、またはR34基
と反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反応し
てスクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシムを与
える。A、X、R5、R6、L6、L7、R14、R24、R34、およびR40は、本
明細書中で定義される通りである。
示す:
-L7R34であり、RG1は、反応基、ほんの一例として、チオール、アミン、または
ケトンであり、これらは、式(B-1)の化合物の適合するR14、R24、またはR3
4基と反応して、対応するR40基を形成する。一例として、マレイミドがチオールと反
応してスクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシム
を与える。A、y、R5、R6、L6、L7、R14、R24、R34、およびR40は
、本明細書中で定義される通りである。
に示す:
-L7R34であり、RG1は、反応基、ほんの一例として、チオール、アミン、または
ケトンであり、これらは、式(B-1a)の化合物の適合するR14、R24、またはR
34基と反応して、対応するR40基を形成する。一例として、マレイミドがチオールと
反応してスクシンイミド環を与え、またはヒドロキシルアミンがケトンと反応してオキシ
ムを与える。A、y、R5、R6、L6、L7、R14、R24、R34、およびR40
は、本明細書中で定義される通りである。
キーム14に示す:
(A’-(NH2)y)上の1つ以上の遊離アミンと反応することによって結合体を形成
する。Aは、本明細書中で定義される通りであり、A’は、遊離アミン部分を含まないA
の部分である。
キーム15に示す:
(A’-(NH2)y)上の1つ以上の遊離アミンと反応することによって結合体を形成
する。Aは、本明細書中で定義される通りであり、A’は、遊離アミン部分を含まないA
の部分である。
キーム16に示す:
(A’-(NH2)y)上の1つ以上の遊離アミンと反応することによって結合体を形成
する。Aは、本明細書中で定義される通りであり、A’は、遊離アミン部分を含まないA
の部分である。
キーム17に示す:
-(SH)y)上の1つ以上の遊離チオールと反応することによって結合体を形成する。
Aは、本明細書中で定義される通りであり、A’は、遊離チオール部分を含まないAの部
分である。
DARの判定およびADCの凝集
cKIT ADCのDAR値を、液体クロマトグラフィ-質量分析(LC-MS)によ
って評価した。化合物対抗体比を、還元かつ脱グリコシル化された(必要に応じて、すな
わち、Fcが含まれる場合)サンプルについてのLC-MSデータから推測した。LC-
MSにより、結合体サンプル中の抗体に取り付けられたリンカー-ペイロード(化合物)
の平均分子数の定量が可能となる。
結果は、結合体が有利な特性、例えば、製造するのをより容易にし、患者に投与するのを
より容易にし、より有効にし、かつ/または患者にとって潜在的により安全にするであろ
う特性を有することを実証することができる。一例が、サイズ排除クロマトグラフィ(S
EC)による分子サイズの判定であり、そこでは、サンプル中の所望の抗体種の量が、サ
ンプル中に存在する高分子量の混入物(例えば、ダイマー、マルチマー、または凝集抗体
)または低分子量の混入物(例えば、抗体フラグメント、分解生成物、または個々の抗体
鎖)の量と比較して判定される。一般に、例えば、抗体サンプルの他の特性、例えば、以
下に限定されないが、クリアランス速度、免疫原性、および毒性に及ぼす凝集体の影響に
起因して、より大量のモノマー、およびより少量の、例えば凝集抗体を有することが所望
される。更なる例が、疎水性相互作用クロマトグラフィ(HIC)による疎水性の判定で
あり、そこでは、サンプルの疎水性が、一組の標準的な抗体の知られている特性と比較し
て評価される。一般に、抗体サンプルの他の特性に及ぼす疎水性の影響、例えば、以下に
限定されないが、凝集、経時的な凝集、表面への付着、肝毒性、クリアランス速度、およ
び薬物動態学的曝露に起因して、低い疎水性を有することが所望される。Damle,N
.K.,Nat Biotechnol.2008;26(8):884-885;Si
ngh,S.K.,Pharm Res.2015;32(11):3541-71参照
。
本明細書中に記載される方法に用いるのに適した抗cKIT ADCを選択するために
、インビトロヒト造血幹細胞死滅アッセイを用いて、抗cKIT ADCを有効性および
効力についてスクリーニングすることができる。例えば、実施例5に記載される方法を用
いて、抗cKIT ADCをスクリーニングすることができる。適切な抗cKIT AD
Cを、EC50に基づいて選択することができ、例えば、EC50が500μg/ml未
満、例えば、100μg/ml未満、50μg/ml未満、10μg/ml未満、または
5μg/ml未満の抗cKIT ADCである。
ンド)が、ラット腹膜肥満細胞の直接的脱顆粒をインビトロで、そしてインビボで誘導す
ると報告されている(Taylor et al.,Immunology.1995
Nov;86(3):427-33)。SCFはまた、ヒト肥満細胞脱顆粒をインビボで
誘導する(Costa et al.,J Exp Med.1996;183(6):
2681-6)。移植レシピエントにおいて肥満細胞脱顆粒によって引き起こされる潜在
的に有害な作用を回避するために、選択したcKIT ADCを、肥満細胞脱顆粒をイン
ビトロで誘導する能力について試験することができる。例えば、実施例6に記載する実験
を用いて、cKIT ADCをスクリーニングすることができ、そして適切な抗cKIT
ADCを、最小の肥満細胞脱顆粒に基づいて選択することができ、例えば、ベータ-ヘ
キソサミニダーゼ放出アッセイにおいて、ベースライン補正されたO.D.読出しが、0
.25未満、例えば、0.2未満、0.15未満、または0.1未満のものである。
本開示は、ヒトcKITに特異的に結合する抗体または抗体フラグメント(例えば抗原
結合フラグメント)を提供する。本開示の抗体または抗体フラグメント(例えば抗原結合
フラグメント)として、以下に限定されないが、以下に記載するヒトモノクローナル抗体
またはそのフラグメントが挙げられる。
原結合フラグメント)は、より大きな複合体に架橋かつ/または多量体化された場合でさ
え、完全長抗cKIT抗体と比較して、肥満細胞脱顆粒を引き起こす能力が引き下げられ
ている。一部の実施形態において、本明細書中で開示される抗cKIT抗体または抗体フ
ラグメント(例えば抗原結合フラグメント)は、より大きな複合体に架橋かつ/または多
量体化された場合でさえ、肥満細胞脱顆粒を誘導する能力が引き下げられるように修飾さ
れる。例えば、本明細書中で開示される抗cKIT抗体または抗体フラグメント(例えば
抗原結合フラグメント)は、より大きな複合体に架橋かつ/または多量体化された場合で
さえ、完全長抗cKIT抗体、またはそのF(ab’)2もしくはF(ab’)2フラグ
メントと比較して、肥満細胞脱顆粒を誘導する能力が、少なくとも約10%、20%、3
0%、40%、50%、60%、70%、80%、90%引き下げられるように修飾され
る。一部の実施形態において、本明細書中で開示される抗cKIT抗体または抗体フラグ
メント(例えば抗原結合フラグメント)は、抗cKIT FabまたはFab’フラグメ
ントを含んでよい。一部の実施形態において、本明細書中で開示される抗cKIT抗体ま
たは抗体フラグメント(例えば抗原結合フラグメント)は、より大きな複合体に架橋かつ
/または多量体化された場合でさえ、肥満細胞脱顆粒を誘導する能力が最小であり得、例
えば、ベータ-ヘキソサミニダーゼ放出アッセイにおいて、ベースライン補正されたO.
D.読出しが、0.25未満、例えば、0.2未満、0.15未満、または0.1未満で
あり得る。
えば、FabまたはFab’)を含む。一部の実施形態において、本明細書中で提供され
る抗体薬物結合体は、ヒトcKITに特異的に結合するヒト抗体フラグメントまたはヒト
化抗体フラグメント(例えば、FabまたはFab’)を含む。一部の実施形態において
、本明細書中で提供される抗体薬物結合体は、ヒトcKITに特異的に結合するヒトFa
b’またはヒト化Fab’を含む。一部の実施形態において、本明細書中で提供される抗
体薬物結合体は、ヒトcKITに特異的に結合するヒトFabまたはヒト化Fabを含む
。
ト(例えば、FabまたはFab’)は、表1に記載されるあらゆるVHドメインのアミ
ノ酸配列を有するVHドメインを含む(例えば、配列番号10、36、54、69、95
)。他の適切な抗体または抗体フラグメント(例えば、FabまたはFab’)は、表1
に記載されるVHドメインのいずれかと少なくとも80、85、90、95、96、97
、98、または99パーセントの配列同一性を有するVHドメインを含み得る。
ト(例えば、FabまたはFab’)は、表1中で一覧にされるVH CDR(またはH
CDR)のいずれか1つのアミノ酸配列を有するVH CDR(またはHCDR)を含む
。特定の態様において、本開示は、表1中で一覧にされるVH CDR(またはHCDR
)のいずれかのアミノ酸配列を有する、1、2、3、4、5つ、またはそれ以上のVH
CDR(またはHCDR)を含む(または代わりに、これらからなる)抗体または抗体フ
ラグメント(例えば、FabまたはFab’)を提供する。
ト(例えば、FabまたはFab’)は、表1に記載されるいずれかのVLドメインのア
ミノ酸配列を有するVLドメインを含む(例えば、配列番号23、47、82、108)
。他の適切な抗体または抗体フラグメント(例えば、FabまたはFab’)は、表1に
記載されるVLドメインのいずれかと少なくとも80、85、90、95、96、97、
98、または99パーセントの配列同一性を有するVLドメインを含み得る。
ト(例えば、FabまたはFab’)は、表1中で一覧にされるVL CDR(またはL
CDR)のいずれか1つのアミノ酸配列を有するVL CDR(またはLCDR)を含む
。特定の態様において、本開示は、表1中で一覧にされるVL CDR(またはLCDR
)のいずれかのアミノ酸配列を有する1、2、3、4、5つ、またはそれ以上のVL C
DR(またはLCDR)を含む(または代わりに、これらからなる)抗体または抗体フラ
グメント(例えば、FabまたはFab’)を提供する。
またはFab’)は、突然変異しているが、表1に記載される配列中に示されるCDR領
域と、少なくとも60、70、80、90、または95パーセントの配列同一性をCDR
領域内に有するアミノ酸を含む。一部の態様において、これは、表1に記載される配列中
に示されるCDR領域と比較した場合に、1、2、3、4、または5つ以下のアミノ酸が
CDR領域内で突然変異している突然変異アミノ酸配列を含む。
、FabまたはFab’)のVH、VL、重鎖、および軽鎖をコードする核酸配列を提供
する。そのような核酸配列は、哺乳類細胞中での発現のために最適化され得る。
またはFab’)として、アミノ酸、またはアミノ酸をコードする核酸が突然変異してい
るが、表1に記載される配列と少なくとも60、70、80、90、または95パーセン
トの同一性を有するものが挙げられる。一部の態様において、これは、表1に記載される
配列中に示される可変領域と比較した場合に、1、2、3、4、または5つ以下のアミノ
酸が可変領域内で突然変異している突然変異アミノ酸配列を含む一方、実質的に同じ治療
活性を保持する。
cKITに結合することができるので、VH、VL、重鎖、および軽鎖の配列(アミノ酸
配列、およびアミノ酸配列をコードするヌクレオチド配列)は、他のcKIT-結合抗体
または抗体フラグメント(例えば、FabまたはFab’)を生じさせるように「混合か
つマッチ」され得る。そのような「混合かつマッチ」されたcKIT-結合抗体または抗
体フラグメント(例えば、FabまたはFab’)は、当該技術において知られている結
合アッセイ(例えば、ELISAおよび実施例の項において記載される他のアッセイ)を
用いて試験され得る。これらの鎖が混合かつマッチされる場合、特定のVH/VL対由来
のVH配列が、構造的に類似するVH配列で置換されるべきである。同様に、特定の重鎖
/軽鎖対由来の重鎖配列が、構造的に類似する重鎖配列で置換されるべきである。同様に
、特定のVH/VL対由来のVL配列が、構造的に類似するVL配列で置換されるべきで
ある。同様に、特定の重鎖/軽鎖対由来の軽鎖配列が、構造的に類似する軽鎖配列で置換
されるべきである。
5(表1)からなる群から選択されるアミノ酸配列を含む重鎖可変領域;ならびに配列番
号23、47、82、および108(表1)からなる群から選択されるアミノ酸配列を含
む軽鎖可変領域を有する単離された抗体または抗体フラグメント(例えば、Fabまたは
Fab’)を提供し;当該抗体または抗体フラグメント(例えば、FabまたはFab’
)は、ヒトcKITに特異的に結合する。
群から選択されるアミノ酸配列を含む重鎖;ならびに配列番号25、49、84、および
110からなる群から選択されるアミノ酸配列を含む軽鎖を有する単離された抗体を提供
する。
群から選択されるアミノ酸配列を含む重鎖;ならびに配列番号25、49、84、および
110からなる群から選択されるアミノ酸配列を含む軽鎖を有する単離された抗体フラグ
メント(例えばFab’)を提供する。
、およびCDR3、またはそれらの組合せを含むcKIT-結合抗体または抗体フラグメ
ント(例えば、FabまたはFab’)を提供する。抗体または抗体フラグメント(例え
ば、FabまたはFab’)のVH CDR1(またはHCDR1)のアミノ酸配列は、
配列番号1、4、6、7、27、30、32、33、60、63、65、66、86、8
9、91、および92に示される。抗体または抗体フラグメント(例えば、Fabまたは
Fab’)のVH CDR2(またはHCDR2)のアミノ酸配列は、配列番号2、5、
8、28、31、34、51、52、53、61、64、67、87、90、および93
に示される。抗体または抗体フラグメント(例えば、FabまたはFab’)のVH C
DR3(またはHCDR3)のアミノ酸配列は、配列番号3、9、29、35、62、6
8、88、および94に示される。抗体または抗体フラグメント(例えば、Fabまたは
Fab’)のVL CDR1(またはLCDR1)のアミノ酸配列は、配列番号16、1
9、22、42、44、46、75、78、81、101、104、および107に示さ
れる。抗体または抗体フラグメント(例えば、FabまたはFab’)のVL CDR2
(またはLCDR2)のアミノ酸配列は、配列番号17、20、76、79、102、お
よび105に示される。抗体または抗体フラグメント(例えば、FabまたはFab’)
のVL CDR3(またはLCDR3)のアミノ酸配列は、配列番号18、21、43、
45、77、80、103、および106に示される。
ヒトcKITに結合することができ、そしてその抗原-結合特異性が主に、CDR1、2
、および3の領域によって提供されるならば、VH CDR1、2、および3の配列(ま
たはHCDR1、2、3)、ならびにVL CDR1、2、および3の配列(またはLC
DR1、2、3)は、「混合かつマッチ」され得る(すなわち、各抗体が、VH CDR
1、2、および3、ならびにVL CDR1、2および3を含有して、cKIT-結合抗
体または抗体フラグメント(例えば、FabまたはFab’)を生じさせなければならな
いが、様々な抗体由来のCDRが混合かつマッチされ得る)。そのような「混合かつマッ
チ」されたcKIT-結合抗体または抗体フラグメント(例えば、FabまたはFab’
)は、当該技術において知られている結合アッセイを用いて試験され得る。VH CDR
配列が混合かつマッチされる場合、特定のVH配列由来のCDR1、CDR2、および/
またはCDR3の配列は、構造的に類似するCDR配列で置換されるべきである。同様に
、VL CDR配列が混合かつマッチされる場合、特定のVL配列由来のCDR1、CD
R2、および/またはCDR3の配列は、構造的に類似するCDR配列で置換されるべき
である。1つ以上のVHおよび/またはVLのCDR領域の配列を、本明細書中で示され
るCDR配列由来の構造的に類似する配列で置換することによって、新規のVH配列およ
びVL配列が生じ得ることは、当業者に容易に明らとなろう。
3、65、66、86、89、91、および92からなる群から選択されるアミノ酸配列
を含む重鎖CDR1(HCDR1);配列番号2、5、8、28、31、34、51、5
2、53、61、64、67、87、90、および93からなる群から選択されるアミノ
酸配列を含む重鎖CDR2(HCDR2);配列番号3、9、29、35、62、68、
88および94からなる群から選択されるアミノ酸配列を含む重鎖CDR3(HCDR3
);配列番号16、19、22、42、44、46、75、78、81、101、104
、および107からなる群から選択されるアミノ酸配列を含む軽鎖CDR1(LCDR1
);配列番号17、20、76、79、102、および105からなる群から選択される
アミノ酸配列を含む軽鎖CDR2(LCDR2);ならびに配列番号18、21、43、
45、77、80、103、および106からなる群から選択されるアミノ酸配列を含む
軽鎖CDR3(LCDR3)を含む単離された抗体または抗体フラグメント(例えば、F
abまたはFab’)を提供し;当該抗体は、cKITに特異的に結合する。
ト(例えば、FabまたはFab’)は、配列番号1のHCDR1;配列番号2のHCD
R2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR2
;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号4のHCDR1;配列番号5のHCD
R2;配列番号3のHCDR3;配列番号19のLCDR1;配列番号20のLCDR2
;および配列番号21のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号6のHCDR1;配列番号2のHCD
R2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR2
;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号7のHCDR1;配列番号8のHCD
R2;配列番号9のHCDR3;配列番号22のLCDR1;配列番号20のLCDR2
;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号27のHCDR1;配列番号28のH
CDR2;配列番号29のHCDR3;配列番号42のLCDR1;配列番号17のLC
DR2;および配列番号43のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号30のHCDR1;配列番号31のH
CDR2;配列番号29のHCDR3;配列番号44のLCDR1;配列番号20のLC
DR2;および配列番号45のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号32のHCDR1;配列番号28のH
CDR2;配列番号29のHCDR3;配列番号42のLCDR1;配列番号17のLC
DR2;および配列番号43のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号33のHCDR1;配列番号34のH
CDR2;配列番号35のHCDR3;配列番号46のLCDR1;配列番号20のLC
DR2;および配列番号43のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号1のHCDR1;配列番号51のHC
DR2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR
2;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号4のHCDR1;配列番号52のHC
DR2;配列番号3のHCDR3;配列番号19のLCDR1;配列番号20のLCDR
2;および配列番号21のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号6のHCDR1;配列番号51のHC
DR2;配列番号3のHCDR3;配列番号16のLCDR1;配列番号17のLCDR
2;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号7のHCDR1;配列番号53のHC
DR2;配列番号9のHCDR3;配列番号22のLCDR1;配列番号20のLCDR
2;および配列番号18のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号60のHCDR1;配列番号61のH
CDR2;配列番号62のHCDR3;配列番号75のLCDR1;配列番号76のLC
DR2;および配列番号77のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号63のHCDR1;配列番号64のH
CDR2;配列番号62のHCDR3;配列番号78のLCDR1;配列番号79のLC
DR2;および配列番号80のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号65のHCDR1;配列番号61のH
CDR2;配列番号62のHCDR3;配列番号75のLCDR1;配列番号76のLC
DR2;および配列番号77のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号66のHCDR1;配列番号67のH
CDR2;配列番号68のHCDR3;配列番号81のLCDR1;配列番号79のLC
DR2;および配列番号77のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号86のHCDR1;配列番号87のH
CDR2;配列番号88のHCDR3;配列番号101のLCDR1;配列番号102の
LCDR2;および配列番号103のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号89のHCDR1;配列番号90のH
CDR2;配列番号88のHCDR3;配列番号104のLCDR1;配列番号105の
LCDR2;および配列番号106のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号91のHCDR1;配列番号87のH
CDR2;配列番号88のHCDR3;配列番号101のLCDR1;配列番号102の
LCDR2;および配列番号103のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号92のHCDR1;配列番号93のH
CDR2;配列番号94のHCDR3;配列番号107のLCDR1;配列番号105の
LCDR2;および配列番号103のLCDR3を含む。
ト(例えば、FabまたはFab’)は、配列番号10のアミノ酸配列を含む重鎖可変領
域(VH)、および配列番号23のアミノ酸配列を含む軽鎖可変領域(VL)を含む。
ト(例えば、FabまたはFab’)は、配列番号36のアミノ酸配列を含むVH、およ
び配列番号47のアミノ酸配列を含むVLを含む。
ト(例えば、FabまたはFab’)は、配列番号54のアミノ酸配列を含むVH、およ
び配列番号23のアミノ酸配列を含むVLを含む。
ト(例えば、FabまたはFab’)は、配列番号69のアミノ酸配列を含むVH、およ
び配列番号82のアミノ酸配列を含むVLを含む。
ト(例えば、FabまたはFab’)は、配列番号95のアミノ酸配列を含むVH、およ
び配列番号108のアミノ酸配列を含むVLを含む。
Fab’)は、配列番号14のアミノ酸配列を含む重鎖、および配列番号25のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号40のアミノ酸配列を含む重鎖、および配列番号49のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号58のアミノ酸配列を含む重鎖、および配列番号25のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号73のアミノ酸配列を含む重鎖、および配列番号84のアミノ酸
配列を含む軽鎖を含む。
Fab’)は、配列番号99のアミノ酸配列を含む重鎖、および配列番号110のアミノ
酸配列を含む軽鎖を含む。
Fab’)は、配列番号119、120、または121から選択されるアミノ酸配列を含
む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号125、126、または127から選択されるアミノ酸配列を含
む重鎖、および配列番号49のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号131、132、または133から選択されるアミノ酸配列を含
む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号137、138、または139から選択されるアミノ酸配列を含
む重鎖、および配列番号84のアミノ酸配列を含む軽鎖を含む。
Fab’)は、配列番号142、143、または144から選択されるアミノ酸配列を含
む重鎖、および配列番号110のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号49のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号84のアミノ酸配列を含む軽鎖を含む。
ミノ酸配列を含む重鎖、および配列番号110のアミノ酸配列を含む軽鎖を含む。
例えば、FabまたはFab’)は、表1に記載される抗体または抗体フラグメント(例
えば、FabまたはFab’)である。
本開示は、ヒトcKIT受容体の細胞外ドメイン内のエピトープに特異的に結合する抗
体または抗体フラグメント(例えば、FabまたはFab’)を提供する。特定の態様に
おいて、抗体または抗体フラグメント(例えば、FabまたはFab’)は、ヒトcKI
T細胞外ドメインのドメイン1~3内のエピトープに結合し得る。
abまたはFab’)と同じエピトープに結合する抗体または抗体フラグメント(例えば
、FabまたはFab’)を提供する。したがって、cKIT結合アッセイにおいて他の
抗体または抗体フラグメント(例えば、FabまたはFab’)と交差競合する(例えば
、その結合を、統計学的に有意に、競合的に阻害する)能力に基づいて、追加の抗体また
は抗体フラグメント(例えば、FabまたはFab’)が同定され得る。交差競合に基づ
いて抗体を「ビニング(binning)」する高スループットプロセスが、国際公開第
2003/48731号パンフレットに記載されている。本明細書中で開示される抗体ま
たは抗体フラグメント(例えば、FabまたはFab’)の、cKITタンパク質(例え
ばヒトcKIT)への結合を阻害する試験抗体または抗体フラグメント(例えば、Fab
またはFab’)の能力は、試験抗体または抗体フラグメント(例えば、FabまたはF
ab’)が、cKITへの結合について、抗体または抗体フラグメント(例えば、Fab
またはFab’)と競合することができること;そのような抗体または抗体フラグメント
(例えば、FabまたはFab’)が、非限定的な理論に従って、競合する抗体または抗
体フラグメント(例えば、FabまたはFab’)と同じ、または関連する(例えば、構
造的に類似する、または空間的に近位の)、cKITタンパク質上のエピトープに結合し
得ることを実証する。特定の態様において、本明細書中で開示される抗体または抗体フラ
グメント(例えば、FabまたはFab’)と同じ、cKIT上のエピトープに結合する
抗体または抗体フラグメント(例えば、FabまたはFab’)は、ヒト抗体もしくはヒ
ト抗体フラグメント(例えば、FabまたはFab’)またはヒト化抗体もしくはヒト化
抗体フラグメント(例えば、FabまたはFab’)である。そのようなヒト抗体もしく
はヒト抗体フラグメント(例えば、FabまたはFab’)またはヒト化抗体もしくはヒ
ト化抗体フラグメント(例えば、FabまたはFab’)は、本明細書中で記載されるよ
うに調製かつ単離され得る。
本明細書中で開示される抗体薬物結合体は、例えば抗体薬物結合体の特性を向上させる
ような、VHおよび/またはVL内のフレームワーク残基に対する修飾を含む、修飾され
たcKIT-結合抗体または抗体フラグメント(例えば、FabまたはFab’)を含ん
でよい。
性を低下させるようになされる。例えば、一アプローチとして、1つ以上のフレームワー
ク残基を、対応する生殖細胞系配列に「復帰突然変異」させるものがある。そのような残
基は、抗体フレームワーク配列を、抗体が由来する生殖細胞系配列と比較することによっ
て、特定され得る。フレームワーク領域配列を、所望の生殖細胞系の構成に「マッチ」さ
せるために、残基を、例えば部位特異的突然変異誘発によって、対応する生殖細胞系配列
に「復帰突然変異」させることができる。そのような「復帰突然変異」した抗体または抗
体薬物結合体もまた、本発明によって包含されることが意図される。
R領域内の、1つ以上の残基を突然変異させて、T細胞エピトープを除去することによっ
て、抗体または抗体薬物結合体の潜在的免疫原性を引き下げることを包含する。このアプ
ローチは、「脱免疫化」とも呼ばれ、Carrらによる米国特許出願公開第2003/0
153043号明細書にさらに詳細に記載されている。
、抗体は、抗体の1つ以上の機能的特性、例えば血清半減期、補体結合を変更するように
操作され得る。さらに、抗体は、ここでも抗体の1つ以上の機能的特性を変更するように
、化学的に修飾されてもよい(例えば、1つ以上の化学部分が、抗体に取り付けられてよ
い)し、そのグリコシル化を変更するように修飾されてもよい。これらの態様のそれぞれ
が、以下でさらに詳細に説明される。
、例えば増減されるように修飾される。このアプローチは、Bodmer et al.
による米国特許第5,677,425号明細書においてさらに記載されている。CH1の
ヒンジ領域中のシステイン残基の数は、例えば、軽鎖および重鎖のアセンブリを促進して
、抗体の安定性を増大させ、もしくは低下させ、または別の分子への結合を可能にするよ
うに、変更される。
ば、FabまたはFab’)は、薬物部分への結合のための部位として、修飾または操作
されたアミノ酸残基、例えば、1つ以上のシステイン残基を含む(Junutula J
R, et al.:Nat Biotechnol 2008,26:925-932
)。一実施形態において、本発明は、本明細書中に記載される位置でのシステインによる
1つ以上のアミノ酸の置換を含む、修飾された抗体または抗体フラグメント(例えば、F
abまたはFab’)を提供する。システイン置換のための部位が、抗体または抗体フラ
グメント(例えば、FabまたはFab’)の定常領域中にあるので、種々の抗体または
抗体フラグメント(例えば、FabまたはFab’)に適用可能であり、そして当該部位
は、安定した、かつ均質な結合体を提供するように選択される。修飾された抗体またはフ
ラグメントは、1つ、2つ、またはそれ以上のシステイン置換を有してよく、これらの置
換は、本明細書中に記載される他の修飾方法および結合方法と組み合わせて用いられ得る
。抗体の特定の位置にシステインを挿入する方法が、当該技術において知られている。例
えば、Lyons et al,(1990)Protein Eng.,3:703-
708、国際公開第2011/005481号パンフレット、国際公開第2014/12
4316号パンフレット、国際公開第2015/138615号パンフレット参照。特定
の実施形態において、修飾された抗体は、抗体の重鎖の位置117、119、121、1
24、139、152、153、155、157、164、169、171、174、1
89、191、195、197、205、207、246、258、269、274、2
86、288、290、292、293、320、322、326、333、334、3
35、337、344、355、360、375、382、390、392、398、4
00、および422から選択される、その定常領域上でのシステインによる1つ以上のア
ミノ酸の置換を含み、当該位置は、EU系に従って番号を付けられている。特定の実施形
態において、修飾された抗体フラグメント(例えば、FabまたはFab’)は、抗体フ
ラグメント(例えば、FabまたはFab’)の重鎖の位置121、124、152、1
53、155、157、164、169、171、174、189、および207から選
択される、その定常領域上でのシステインによる1つ以上のアミノ酸の置換を含み、当該
位置は、EU系に従って番号を付けられている。特定の実施形態において、修飾された抗
体フラグメント(例えば、FabまたはFab’)は、抗体フラグメント(例えば、Fa
bまたはFab’)の重鎖の位置124、152、153、155、157、164、1
74、189、および207から選択される、その定常領域上でのシステインによる1つ
以上のアミノ酸の置換を含み、当該位置は、EU系に従って番号を付けられている。
たはFab’)は、抗体または抗体フラグメント(例えば、FabまたはFab’)の軽
鎖の位置107、108、109、114、126、127、129、142、143、
145、152、154、156、157、159、161、165、168、169、
170、182、183、188、197、199、および203から選択される、その
定常領域上でのシステインによる1つ以上のアミノ酸の置換を含み、当該位置は、EU系
に従って番号を付けられており、当該軽鎖は、ヒトカッパ軽鎖である。一部の実施形態に
おいて、修飾された抗体または抗体フラグメント(例えば、FabまたはFab’)は、
抗体または抗体フラグメント(例えば、FabまたはFab’)の軽鎖の位置107、1
08、114、126、127、129、142、159、161、165、183、お
よび203から選択される、その定常領域上でのシステインによる1つ以上のアミノ酸の
置換を含み、当該位置は、EU系に従って番号を付けられており、当該軽鎖は、ヒトカッ
パ軽鎖である。一部の実施形態において、修飾された抗体または抗体フラグメント(例え
ば、FabまたはFab’)は、抗体または抗体フラグメント(例えば、FabまたはF
ab’)の軽鎖の位置114、129、142、145、152、159、161、16
5、および197から選択される、その定常領域上でのシステインによる1つ以上のアミ
ノ酸の置換を含み、当該位置は、EU系に従って番号を付けられており、当該軽鎖は、ヒ
トカッパ軽鎖である。一部の実施形態において、修飾された抗体または抗体フラグメント
(例えば、FabまたはFab’)は、抗体または抗体フラグメント(例えば、Fabま
たはFab’)の軽鎖の位置107、108、109、126、143、145、152
、154、156、157、159、182、183、188、197、199、および
203から選択される、その定常領域上でのシステインによる1つ以上のアミノ酸の置換
を含み、当該位置は、EU系に従って番号を付けられており、当該軽鎖は、ヒトカッパ軽
鎖である。一部の実施形態において、修飾された抗体または抗体フラグメント(例えば、
FabまたはFab’)は、抗体または抗体フラグメント(例えば、FabまたはFab
’)の軽鎖の位置145、152、および197から選択される、その定常領域上でのシ
ステインによる1つ以上のアミノ酸の置換を含み、当該位置は、EU系に従って番号を付
けられており、当該軽鎖は、ヒトカッパ軽鎖である。一部の実施形態において、修飾され
た抗体または抗体フラグメント(例えば、FabまたはFab’)は、抗体または抗体フ
ラグメント(例えば、FabまたはFab’)の軽鎖の位置114および165から選択
される、その定常領域上でのシステインによる1つ以上のアミノ酸の置換を含み、当該位
置は、EU系に従って番号を付けられており、当該軽鎖は、ヒトカッパ軽鎖である。
たはFab’)は、抗体または抗体フラグメント(例えば、FabまたはFab’)の軽
鎖の位置143、145、147、156、159、163、168から選択されるその
定常領域上でのシステインによる1つ以上のアミノ酸の置換を含み、当該位置は、EU系
に従って番号を付けられており、当該軽鎖は、ヒトラムダ軽鎖である。一部の実施形態に
おいて、修飾された抗体または抗体フラグメント(例えば、FabまたはFab’)は、
抗体または抗体フラグメント(例えば、FabまたはFab’)の軽鎖の位置143(E
Uナンバリングによる)にシステインを含み、当該軽鎖は、ヒトラムダ軽鎖である。
たはFab’)は、その定常領域上でのシステインによる2つ以上のアミノ酸の置換の組
合せを含み、当該位置の組合せは、先で一覧にされたあらゆる位置から選択され得る。
たはFab’)は、以下の位置:重鎖の位置124、重鎖の位置152、重鎖の位置15
3、重鎖の位置155、重鎖の位置157、重鎖の位置164、重鎖の位置174、軽鎖
の位置114、軽鎖の位置129、軽鎖の位置142、軽鎖の位置159、軽鎖の位置1
61、または軽鎖の位置165の1つ以上にてシステインを含み、当該位置は、EU系に
従って番号を付けられており、当該軽鎖は、カッパ鎖である。一部の実施形態において、
修飾された抗体または抗体フラグメント(例えば、FabまたはFab’)は、以下の位
置:重鎖の位置124、重鎖の位置152、重鎖の位置153、重鎖の位置155、重鎖
の位置157、重鎖の位置164、重鎖の位置174、軽鎖の位置114、軽鎖の位置1
29、軽鎖の位置142、軽鎖の位置159、軽鎖の位置161、または軽鎖の位置16
5の4つにてシステインを含み、当該位置は、EU系に従って番号を付けられており、当
該軽鎖は、カッパ鎖である。
たはFab’)は、重鎖の位置152にてシステインを含み、当該位置は、EU系に従っ
て番号を付けられている。一部の実施形態において、修飾された抗体または抗体フラグメ
ント(例えば、FabまたはFab’)は、重鎖の位置124にてシステインを含み、当
該位置は、EU系に従って番号を付けられている。一部の実施形態において、修飾された
抗体または抗体フラグメント(例えば、FabまたはFab’)は、軽鎖の位置165に
てシステインを含み、当該位置は、EU系に従って番号を付けられており、当該軽鎖は、
カッパ鎖である。一部の実施形態において、修飾された抗体または抗体フラグメント(例
えば、FabまたはFab’)は、軽鎖の位置114にてシステインを含み、当該位置は
、EU系に従って番号を付けられており、当該軽鎖は、カッパ鎖である。一部の実施形態
において、修飾された抗体または抗体フラグメント(例えば、FabまたはFab’)は
、軽鎖の位置143にてシステインを含み、当該位置は、EU系に従って番号を付けられ
ており、当該軽鎖は、ラムダ鎖である。
たはFab’)は、重鎖の位置152および軽鎖の位置165にてシステインを含み、当
該位置は、EU系に従って番号を付けられており、当該軽鎖は、カッパ鎖である。一部の
実施形態において、修飾された抗体または抗体フラグメント(例えば、FabまたはFa
b’)は、重鎖の位置152および軽鎖の位置114にてシステインを含み、当該位置は
、EU系に従って番号を付けられており、当該軽鎖は、カッパ鎖である。一部の実施形態
において、修飾された抗体または抗体フラグメント(例えば、FabまたはFab’)は
、重鎖の位置152および軽鎖の位置143にてシステインを含み、当該位置は、EU系
に従って番号を付けられており、当該軽鎖は、ラムダ鎖である。一部の実施形態において
、修飾された抗体または抗体フラグメント(例えば、FabまたはFab’)は、重鎖の
位置124および位置152にてシステインを含み、当該位置は、EU系に従って番号を
付けられている。
たはFab’)は、以下の位置:重鎖の位置155、重鎖の位置189、重鎖の位置20
7、軽鎖の位置145、軽鎖の位置152、または軽鎖の位置197の1つ以上にてシス
テインを含み、当該位置は、EU系に従って番号を付けられており、当該軽鎖は、カッパ
鎖である。一部の実施形態において、修飾された抗体または抗体フラグメント(例えば、
FabまたはFab’)は、以下の位置:重鎖の位置155、重鎖の位置189、重鎖の
位置207、軽鎖の位置145、軽鎖の位置152、または軽鎖の位置197の2つ以上
(例えば、2、3、4つ)にてシステインを含み、当該位置は、EU系に従って番号を付
けられており、当該軽鎖は、カッパ鎖である。
たはFab’)は、以下の位置:重鎖の位置124、重鎖の位置152、重鎖の位置15
3、重鎖の位置155、重鎖の位置157、重鎖の位置164、重鎖の位置174、軽鎖
の位置114、軽鎖の位置129、軽鎖の位置142、軽鎖の位置159、軽鎖の位置1
61、または軽鎖の位置165の1つ以上にてシステインを含み、当該位置は、EU系に
従って番号を付けられており、当該軽鎖は、カッパ鎖である。一部の実施形態において、
修飾された抗体または抗体フラグメント(例えば、FabまたはFab’)は、以下の位
置:重鎖の位置124、重鎖の位置152、重鎖の位置153、重鎖の位置155、重鎖
の位置157、重鎖の位置164、重鎖の位置174、軽鎖の位置114、軽鎖の位置1
29、軽鎖の位置142、軽鎖の位置159、軽鎖の位置161、または軽鎖の位置16
5の2つ以上(例えば、2、3、4つ)にてシステインを含み、当該位置は、EU系に従
って番号を付けられており、当該軽鎖は、カッパ鎖である。
ト(例えばFab)は、配列番号118のアミノ酸配列を含む重鎖、および配列番号12
2のアミノ酸配列を含む軽鎖を含む。
ト(例えばFab)は、配列番号118のアミノ酸配列を含む重鎖、および配列番号12
3のアミノ酸配列を含む軽鎖を含む。
ト(例えばFab)は、配列番号124のアミノ酸配列を含む重鎖、および配列番号12
8のアミノ酸配列を含む軽鎖を含む。
ト(例えばFab)は、配列番号124のアミノ酸配列を含む重鎖、および配列番号12
9のアミノ酸配列を含む軽鎖を含む。
ト(例えばFab)は、配列番号130のアミノ酸配列を含む重鎖、および配列番号13
4のアミノ酸配列を含む軽鎖を含む。
ト(例えばFab)は、配列番号130のアミノ酸配列を含む重鎖、および配列番号13
5のアミノ酸配列を含む軽鎖を含む。
ト(例えばFab)は、配列番号136のアミノ酸配列を含む重鎖、および配列番号14
0のアミノ酸配列を含む軽鎖を含む。
ト(例えばFab)は、配列番号141のアミノ酸配列を含む重鎖、および配列番号14
5のアミノ酸配列を含む軽鎖を含む。
抗cKIT抗体または抗体フラグメント(例えば、FabまたはFab’)は、当該技
術において知られているあらゆる手段によって生成され得、以下に限定されないが、組換
え発現、化学合成、または完全長モノクローナル抗体(例えば、ハイブリドーマ生成また
は組換え生成によって得られ得る)の酵素的消化が挙げられる。組換え発現は、当該技術
において知られている適切なあらゆる宿主細胞、例えば、哺乳類宿主細胞、細菌宿主細胞
、酵母宿主細胞、昆虫宿主細胞に由来し得、または無細胞系(例えば、Sutro’s
Xpress CF(商標)Platform、http://www.sutrobi
o.com/technology/)によって製造され得る。
bまたはFab’)をコードするポリヌクレオチド、例えば、本明細書中に記載される、
相補性決定領域を含む重鎖または軽鎖の可変領域または可変セグメントをコードするポリ
ヌクレオチドを提供する。一部の態様において、重鎖可変領域(VH)をコードするポリ
ヌクレオチドは、配列番号11、37、55、70、および96からなる群から選択され
るポリヌクレオチドと少なくとも85%、89%、90%、91%、92%、93%、9
4%、95%、96%、97%、98%、99%、または100%の核酸配列同一性を有
する。一部の態様において、軽鎖可変領域(VL)をコードするポリヌクレオチドは、配
列番号24、48、83、および109からなる群から選択されるポリヌクレオチドと少
なくとも85%、89%、90%、91%、92%、93%、94%、95%、96%、
97%、98%、99%、または100%の核酸配列同一性を有する。
、57、72、および98のポリヌクレオチドと少なくとも85%、89%、90%、9
1%、92%、93%、94%、95%、96%、97%、98%、99%、または10
0%の核酸配列同一性を有する。一部の態様において、抗体軽鎖をコードするポリヌクレ
オチドは、配列番号26、50、85、および111のポリヌクレオチドと少なくとも8
5%、89%、90%、91%、92%、93%、94%、95%、96%、97%、9
8%、99%、または100%の核酸配列同一性を有する。
41、59、74、および100のポリヌクレオチドと少なくとも85%、89%、90
%、91%、92%、93%、94%、95%、96%、97%、98%、99%、また
は100%の核酸配列同一性を有する。一部の態様において、Fab’軽鎖をコードする
ポリヌクレオチドは、配列番号26、50、85、および111のポリヌクレオチドと少
なくとも85%、89%、90%、91%、92%、93%、94%、95%、96%、
97%、98%、99%、または100%の核酸配列同一性を有する。
bまたはFab’)の可変領域の配列のみをコードしてよい。また、抗体または抗体フラ
グメント(例えば、FabまたはFab’)の可変領域および定常領域の双方をコードし
てもよい。ポリヌクレオチド配列の一部が、例示される1つの抗cKIT抗体または抗体
フラグメント(例えば、FabまたはFab’)の重鎖および軽鎖の双方の可変領域を含
むポリペプチドをコードする。
存の配列(例えば、以下の実施例に記載される配列)のデノボ固相DNA合成によって、
またはPCR突然変異誘発によって生成され得る。核酸の直接的化学合成が、当該技術に
おいて知られている方法によって達成され得、例えば、Narang et al.,M
eth.Enzymol.68:90,1979のホスホトリエステル法;Brown
et al.,Meth.Enzymol.68:109,1979のホスホジエステル
法;Beaucage et al.,Tetra.Lett.,22:1859,19
81のジエチルホスホロアミダイト法;および米国特許第4,458,066号明細書の
固体支持法がある。PCRによるポリヌクレオチド配列への突然変異の導入は、例えば、
PCR Technology:Principles and Applicatio
ns for DNA Amplification,H.A.Erlich(Ed.)
,Freeman Press,NY,NY,1992;PCR Protocols:
A Guide to Methods and Applications,Inni
s et al.(Ed.),Academic Press,San Diego,C
A,1990;Mattila et al.,Nucleic Acids Res.
19:967,1991;およびEckert et al.,PCR Methods
and Applications 1:17,1991に記載されるようにして実行
され得る。
(例えば、FabまたはFab’)を生成するための発現ベクターおよび宿主細胞である
。種々の発現ベクターを使用して、抗cKIT抗体または抗体フラグメント(例えば、F
abまたはFab’)をコードするポリヌクレオチドを発現させることができる。ウイル
スベースの発現ベクターおよび非ウイルス発現ベクターの双方が、哺乳類宿主細胞におい
て抗体を生成するのに用いられ得る。非ウイルスベクターおよび非ウイルス系として、プ
ラスミドまたはエピソームベクター(典型的には、タンパク質またはRNAを発現するた
めの発現カセットを有する)およびヒト人工染色体が挙げられる(例えば、Harrin
gton et al.,Nat Genet.15:345,1997参照)。例えば
、哺乳類(例えばヒト)細胞における抗cKITポリヌクレオチドおよびポリペプチドの
発現に有用な非ウイルスベクターとして、pThioHis A,B & C、pcDN
A3.1/His、pEBVHis A,B & C(Invitrogen,San
Diego,CA)、MPSVベクター、および他のタンパク質を発現させるための当該
技術において知られている多数の他のベクターが挙げられる。有用なウイルスベクターと
して、レトロウイルス、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルスに基づ
くベクター、SV40、パピローマウイルス、HBPエプスタインバールウイルスに基づ
くベクター、ワクシニアウイルスベクター、およびセムリキ森林ウイルス(SFV)が挙
げられる。Brent et al.、前掲;Smith,Annu.Rev.Micr
obiol.49:807,1995;およびRosenfeld et al.,Ce
ll 68:143,1992参照。
る。典型例として、発現ベクターは、抗cKIT抗体または抗体フラグメント(例えば、
FabまたはFab’)をコードするポリヌクレオチドに作動可能に結合されているプロ
モータおよび他の調節配列(例えばエンハンサ)を含有する。一部の態様において、誘導
プロモータを使用して、挿入された配列の発現を、誘導条件下以外では防止する。誘導プ
ロモータとして、例えば、アラビノース、lacZ、メタロチオネインプロモータ、また
はヒートショックプロモータが挙げられる。形質転換された生物の培養体は、非誘導条件
下で、集団を、発現産物が宿主細胞によってより良好に許容されるコード配列について偏
らせることなく、増殖し得る。また、プロモータに加えて、他の調節要素が、抗cKIT
抗体または抗体フラグメント(例えば、FabまたはFab’)の効率的な発現に必要と
されてよく、または所望されてよい。当該要素として、典型的に、ATG開始コドンおよ
び隣接するリボソーム結合部位または他の配列が挙げられる。加えて、発現の効率が、使
用される細胞系に適したエンハンサの包含によって増強され得る(例えば、Scharf
et al.,Results Probl.Cell Differ.20:125
,1994;およびBittner et al.,Meth.Enzymol.,15
3:516,1987参照)。例えば、SV40エンハンサまたはCMVエンハンサを用
いて、哺乳類宿主細胞における発現を増大させることができる。
abまたはFab’)配列によってコードされるポリペプチドとの融合タンパク質を形成
するように、分泌シグナル配列位置を提供し得る。多くの場合、挿入される抗cKIT抗
体または抗体フラグメント(例えば、FabまたはFab’)配列は、ベクター内に含ま
れる前に、シグナル配列に結合される。また、抗cKIT抗体または抗体フラグメント(
例えば、FabまたはFab’)の軽鎖および重鎖の可変ドメインをコードする配列を受
け入れるのに用いられることとなるベクターは時折、定常領域またはその部分をコードす
る。そのようなベクターは、定常領域との融合タンパク質として可変領域を発現すること
によって、無傷の抗体またはそのフラグメントを生成し得る。
かつ発現させるための宿主細胞は、原核生物であっても真核生物であってもよい。大腸菌
(E.coli)は、本開示のポリヌクレオチドをクローニングして発現させるのに有用
な一原核生物宿主である。使用に適した他の微生物宿主として、桿菌、例えば枯草菌(B
acillus subtilis)、ならびに他の腸内細菌科(enterobact
eriaceae)、例えばサルモネラ(Salmonella)属、セラチア(Ser
ratia)属、および種々のシュードモナス(Pseudomonas)属の種が挙げ
られる。これらの原核生物宿主において、当業者であれば発現ベクターを構築することも
でき、これは典型的に、宿主細胞と適合する発現制御配列(例えば複製起点)を含有する
。加えて、任意の数の種々の周知のプロモータが存在することとなり、例えば、ラクトー
スプロモータ系、トリプトファン(trp)プロモータ系、ベータ-ラクタマーゼプロモ
ータ系、またはファージラムダ由来のプロモータ系がある。プロモータは典型的に、場合
によってはオペレータ配列と共に、発現を制御し、そしてリボソーム結合部位配列等を有
しており、転写および翻訳を開始して完了させる。また、他の微生物、例えば酵母を使用
して、抗cKIT抗体または抗体フラグメント(例えば、FabまたはFab’)ポリペ
プチドを発現させることもできる。バキュロウイルスベクターと組み合わせた昆虫細胞を
用いることもできる。
グメント(例えば、FabまたはFab’)ポリペプチドを発現させて生成することがで
きる。例えば、哺乳類宿主細胞は、内因性の免疫グロブリン遺伝子を発現するハイブリド
ーマ細胞株(例えば、実施例に記載されている骨髄腫ハイブリドーマクローン)であって
もよいし、外因性の発現ベクターを保有する哺乳類の細胞株(例えば、以下で例示される
SP2/0骨髄腫細胞)であってもよい。これらとして、死に至る標準的な、または不死
の標準的もしくは異常な、あらゆる動物細胞またはヒト細胞が挙げられる。例えば、無傷
の免疫グロブリンを分泌することができる適切ないくつかの宿主細胞株が開発されており
、CHO細胞株、種々のCOS細胞株、HeLa細胞、骨髄腫細胞株、形質転換されたB
細胞、およびハイブリドーマが挙げられる。ポリペプチドを発現させるための哺乳類組織
細胞培養の使用が、概して、例えば、Winnacker,From Genes to
Clones,VCH Publishers,N.Y.,N.Y.,1987におい
て考察されている。哺乳類宿主細胞用の発現ベクターは、発現制御配列、例えば、複製起
点、プロモータ、およびエンハンサ(例えば、Queen et al.,Immuno
l.Rev.89:49-68,1986参照)、ならびに必須のプロセシング情報部位
、例えば、リボソーム結合部位、RNAスプライス部位、ポリアデニル化部位、および転
写ターミネータ配列を含み得る。これらの発現ベクターは、通常、哺乳類の遺伝子に、ま
たは哺乳類のウイルスに由来するプロモータを含有する。適切なプロモータは、構成的で
あり得、細胞型特異的であり得、ステージ特異的であり得、かつ/または調整可能もしく
は調節可能であり得る。有用なプロモータとして、以下に限定されないが、メタロチオネ
インプロモータ、構成的アデノウイルス主要後期プロモータ、デキサメタゾン誘導MMT
Vプロモータ、SV40プロモータ、MRP polIIIプロモータ、構成的MPSV
プロモータ、テトラサイクリン誘導CMVプロモータ(例えばヒト即初期CMVプロモー
タ)、構成的CMVプロモータ、および当該技術において知られているプロモータ-エン
ハンサの組合せが挙げられる。
の型に応じて変わる。例えば、塩化カルシウム形質移入が、原核細胞に一般的に利用され
るが、リン酸カルシウム処理または電気穿孔法が、他の細胞宿主に用いられ得る(概して
、Sambrook et al.、前掲参照)。他の方法として、例えば、電気穿孔法
、リン酸カルシウム処理、リポソーム媒介形質転換、注射およびマイクロインジェクショ
ン、バリスティック法、ウイロゾーム、免疫リポソーム、ポリカチオン:核酸結合体、裸
のDNA、人工ビリオン、ヘルペスウイルス構造タンパク質VP22への融合(Elli
ot and O’Hare,Cell 88:223,1997)、剤によるDNA吸
収増強(agent-enhanced uptake of DNA)、ならびにイク
スビボ形質導入が挙げられる。多くの場合、組換えタンパク質の長期的多収産生のために
、安定した発現が所望されることとなる。例えば、抗cKIT抗体または抗体フラグメン
ト(例えば、FabまたはFab’)の鎖を安定して発現する細胞株が、ウイルスの複製
起点または内因性の発現要素を含有する発現ベクターおよび選択マーカー遺伝子を用いて
、調製され得る。ベクターの導入後、細胞を、富化培地中で1~2日間増殖させてから、
選択培地にスイッチすることができる。選択マーカーの目的は、選択に対する耐性を付与
することであり、そしてその存在により、選択培地において、導入された配列を首尾よく
発現する細胞の成長が可能となる。耐性を示す、安定して形質移入された細胞が、細胞型
に適した組織培養技術を用いて増殖され得る。
ラグメントを生成するため)、またはペプシン(Fab’フラグメントを生成するため)
その他を用いた、免疫グロブリン分子のタンパク質分解開裂によって生成され得る。また
、Fabフラグメントと比較して、Fab’フラグメントは、免疫グロブリン分子の2つ
の重鎖間にジスルフィド結合を形成する2つの天然システインを含むヒンジ領域を含有す
る。
本開示の結合体は、種々の用途に有用であり、以下に限定されないが、造血幹細胞の除
去を必要とする患者、例えば、造血幹細胞移植レシピエントにおいて、造血幹細胞を除去
する用途が挙げられる。したがって、本明細書中で提供されるのは、本明細書中に記載さ
れるいずれかの結合体の有効な量を、造血幹細胞の除去を必要とする患者に投与すること
による、患者において造血幹細胞を除去する方法である。また、本明細書中で提供される
のは、本明細書中に記載されるいずれかの結合体の有効な量を患者に投与して、患者に造
血幹細胞移植を実行する前に、結合体による、患者の循環系からの一掃のための十分な期
間を許容することによる、造血幹細胞移植患者(例えば移植レシピエント)のコンディシ
ョン調整方法である。結合体は、患者に静脈内投与され得る。また、提供されるのは、本
明細書中に記載される結合体または医薬組成物のいずれかの、造血幹細胞の除去を必要と
する患者において造血幹細胞を除去するための使用である。さらに提供されるのは、本明
細書中に記載される結合体または医薬組成物のいずれかの、造血幹細胞の除去を必要とす
る患者において造血幹細胞を除去するための医薬の製造における使用である。
的環境は、幹細胞微環境または幹細胞ニッチと呼ばれる。このニッチに含まれる間質細胞
および他の細胞は、可溶性の、かつ結合する要因を与え、これが多数の影響を及ぼす。造
血幹細胞とそのニッチとの相互作用について、種々のモデルが提唱されてきた。例えば、
幹細胞が分裂する場合に、たった1つの娘細胞がニッチ内に残って、他の娘細胞がニッチ
を去って分化するモデルが示唆されてきた。移植の効率が、内因性の造血幹細胞の選択的
な枯渇によって増強されることによって、ドナー幹細胞の移植のための幹細胞ニッチが開
き得ることが提唱されてきた(例えば、国際公開第2008/067115号パンフレッ
ト参照)。
、体の血液幹細胞を襲う広範な疾患、例えば白血病、重度の貧血、免疫欠乏、および一部
の酵素欠損疾患のための確立された処置である。これらの疾病により、多くの場合、患者
は、新しい、健康な血球によって骨髄が置き換えられなくてはならない。
だいの、適合血縁の、同ハプロの血縁または非血縁のボランティアドナーから幹細胞を受
け取ることを意味する。造血幹細胞移植が必要な患者の約30%が、組織型が適合性であ
るきょうだいを利用してきたと推定される。患者のその他70%は、非血縁のボランティ
アドナーのマッチング、または同ハプロの血縁ドナーのアベイラビリティに頼らなければ
ならない。ドナーおよび患者細胞の特性が比較可能であることが重要である。造血幹細胞
移植はまた、自己由来であってもよく、移植される細胞が対象自身に由来することとなる
、すなわち、ドナーとレシピエントが同じ個人である。さらに、移植は、同系であってよ
く、すなわち、遺伝的に同じ個人、例えば双子に由来してよい。更なる態様において、移
植は異種間であってよく、すなわち、異なる種に由来してよく、これは、例えば臓器移植
用の、同じ種のドナーが十分でない場合に、対象となる。
前処置またはコンディション調整の目的は、体内のできるだけ多くの不所望の細胞(例え
ば悪性/癌細胞)を除去すること、拒絶を最小にすること、かつ/または幹細胞ニッチを
、内因性のHSCの枯渇によって開けて、当該ニッチ中にドナー幹細胞を効率的に移植す
ることである。次に、ドナーの健康なHSCが、患者の静脈内に、または場合によっては
骨内に与えられる。しかしながら、不十分な移植、免疫拒絶、移植片対宿主疾患(GVH
D)、または感染症が挙げられる多くのリスクが、HSC移植に付随する。ドナーおよび
患者の細胞が、組織型に関して等しいと思われる、例えば、MHC分子がマッチする(ま
たは同ハプロである)といえども;これらの個人間になお軽微な差異があり、免疫細胞が
危険であると認められる場合がある。これは、新しい免疫系(新しい幹細胞由来の白血球
)が、新しい体を「異質である」と認めて、免疫攻撃を誘発することを意味する。移植片
対宿主疾患(GVHD)と呼ばれるこの反応は、患者にとって致命的になる虞がある。H
SC移植後の患者はまた、新しい骨髄が機能し始める前の白血球の不在に起因して、感染
のリスクが増大する。この期間は、場合によっては、新しい免疫系が成熟するまで何ヶ月
も続く場合がある。これらの日和見感染の一部が、致命的となる虞がある。
スクを低下させ、かつ種々の障害についての有効性を増大させることが必要とされている
。本明細書中で提供されるのは、新しい抗体薬物結合体であり、これは、移植の前に、レ
シピエントの内因性のHSCを、全てではないが他の免疫細胞を除いて、特異的に死滅さ
せることによって、部分的に活性な免疫防御を維持して、移植直後の感染と戦うが、同時
に、対象が、自身のHSC由来の新しい免疫細胞を形成できないことに起因する、間接的
な免疫抑制効果を提供する。前処置は、化学療法または放射線よりも軽度であり得、そし
て副作用があまり重篤でないので、移植患者においてGVHDをあまり誘導し得ない。
ンディション調整方法において、内因性の造血幹細胞を除去するのに用いられ得る。例え
ば、本発明の結合体は、幹細胞移植が有益であり得るあらゆる非悪性症状/障害、例えば
、重症無形成性貧血(SAA)、ウィスコット・アルドリッチ症候群、ハーラー症候群、
家族性食血細胞性リンパ球組織球形成症(FHL)、慢性肉芽腫症(CGD)、コストマ
ン症候群、重症免疫不全症候群(SCID)、他の自己免疫疾患、例えばSLE、多発性
硬化症、IBD、クローン病、潰瘍性大腸炎、シェーグレン症候群、脈管炎、狼瘡、重症
性筋無力症、ウェゲナー病、先天性代謝異常、および/または他の免疫不全を処置するの
に用いられ得る。
えば、血液病、血液悪性腫瘍、または固形腫瘍(例えば、腎癌、肝癌、膵癌)を処置する
のに用いられ得る。特許請求される方法および抗体で処置され得る血液疾患/悪性腫瘍の
共通する型は、白血病、リンパ腫、および骨髄異形成症候群である。白血病は、芽球細胞
と呼ばれる未発達の白血球の異常な増加によって特徴付けられる血液または骨髄の癌のタ
イプであり、用語白血病は:急性リンパ芽球性白血病(ALL)、急性骨髄性白血病(A
ML)、急性単球白血病(AMoL)、慢性リンパ性白血病(CLL)、慢性骨髄性白血
病(CML)、および他の白血病、例えば有毛細胞白血病(HCL)、T細胞前リンパ球
性白血病(T-PLL)、大型顆粒リンパ性白血病、および成人T細胞白血病を含む。本
発明の一態様において、処置される白血病は、急性白血病である。更なる態様において、
白血病は、ALL、AML、またはAMoLである。リンパ腫として、前駆体T細胞白血
病/リンパ腫、バーキットリンパ腫、濾胞性リンパ腫、びまん性大細胞型B細胞性リンパ
腫、マントル細胞リンパ腫、B細胞慢性リンパ性白血病/リンパ腫、MALTリンパ腫、
菌状息肉腫、末梢T細胞リンパ腫、他に規定されない限り、ホジキンリンパ腫のホジキン
リンパ腫混合細胞亜型の結節性硬化症形態が挙げられる。骨髄異形成症候群(MDS)は
、骨髄中の造血細胞が損傷を受けたときに生じる一群の症状の名前である。この損傷は、
1つ以上の血球型の数の低下に至る。MDSは、7つのカテゴリーに再分割される;単系
列の形成異常を伴う不応性血球減少(RCUD)、環状鉄芽球を伴う不応性貧血(RAR
S)、多系列の形成異常を伴う不応性血球減少(RCMD)、過剰な芽球-1を伴う不応
性貧血(RAEB-1)、過剰な芽球-2を伴う不応性貧血(RAEB-2)、骨髄異形
成症候群、分類不能(MDS-U)、および単独del(5q)を伴う骨髄異形成症候群
。
移植レシピエント)は、遺伝性の免疫不全疾患、自己免疫疾患、造血障害、または先天性
代謝異常を有し得る。
白血病(AML)、急性リンパ芽球性白血病(ALL)、急性単球白血病(AMoL)、
慢性骨髄性白血病(CML)、慢性リンパ性白血病(CLL)、骨髄増殖性疾患、骨髄異
形成症候群、多発性骨髄腫、非ホジキンリンパ腫、ホジキン病、無形成性貧血、赤芽球癆
、発作性夜間ヘモグロビン尿症、ファンコーニ貧血、サラセミアメジャー、鎌状赤血球貧
血、重症複合型免疫不全、ウィスコット・アルドリッチ症候群、血球貪食性リンパ組織球
増多症。
おり、これらは、遺伝的疾患の一クラスであり、炭水化物代謝、アミノ酸代謝、有機酸代
謝の先天性障害、またはリソソーム蓄積症が挙げられる。一部の実施形態において、先天
性代謝異常は、ムコ多糖症、ゴーシェ病、異染性ロイコジストロフィ、または副腎脳白質
ジストロフィから選択される。
るGISTを処置するのに用いられ得る。一部の実施形態において、本発明の結合体は、
野生型cKITを発現するGISTを処置するのに用いられ得る。一部の実施形態におい
て、本発明の結合体は、処置、例えば、イマチニブ(Glivec(登録商標)/Gle
evec(登録商標))に耐性を示すGISTを処置するのに用いられ得る。
特定の例において、本開示の抗体薬物結合体は、別のコンディション調整連隊、例えば
、放射線治療または化学療法と併用され得る。
(または鎮吐薬)、鎮痛剤、動員剤(mobilizing agent)、またはそれ
らの組合せと併用され得る。
midex(登録商標))、ビカルタミド(Casodex(登録商標))、硫酸ブレオ
マイシン(Blenoxane(登録商標))、ブスルファン(Myleran(登録商
標))、ブスルファン注射(Busulfex(登録商標))、カペシタビン(Xelo
da(登録商標))、N4-ペントキシカルボニル-5-デオキシ-5-フルオロシチジ
ン、カルボプラチン(Paraplatin(登録商標))、カルムスチン(BiCNU
(登録商標))、クロラムブシル(Leukeran(登録商標))、シスプラチン(P
latinol(登録商標))、クラドリビン(Leustatin(登録商標))、シ
クロスポリン(Sandimmune(登録商標)、Neoral(登録商標)、または
Restasis(登録商標))、シクロホスファミド(Cytoxan(登録商標)ま
たはNeosar(登録商標))、シタラビン、シトシンアラビノシド(Cytosar
-U(登録商標))、シタラビンリポゾーム注射(DepoCyt(登録商標))、ダカ
ルバジン(DTIC-Dome(登録商標))、ダクチノマイシン(Actinomyc
in D,Cosmegan)、塩酸ダウノルビシン(Cerubidine(登録商標
))、ダウノルビシンシトラートリポゾーム注射(DaunoXome(登録商標))、
デキサメタゾン、ドセタキセル(Taxotere(登録商標))、塩酸ドキソルビシン
(Adriamycin(登録商標)、Rubex(登録商標))、エトポシド(Vep
esid(登録商標))、リン酸フルダラビン(Fludara(登録商標))、5-フ
ルオロウラシル(Adrucil(登録商標)、Efudex(登録商標))、フルタミ
ド(Eulexin(登録商標))、テザシチビン、ゲムシタビン(ジフルオロデオキシ
シチジン)、ヒドロキシウレア(Hydrea(登録商標))、イダルビシン(Idam
ycin(登録商標))、イホスファミド(IFEX(登録商標))、イリノテカン(C
amptosar(登録商標))、L-アスパラギナーゼ(ELSPAR、(登録商標)
)、ロイコボリンカルシウム、メルファラン(Alkeran(登録商標))、6-メル
カプトプリン(Purinethol(登録商標))、メトトレキサート(Folex(
登録商標))、ミトキサントロン(Novantrone(登録商標))、マイロターグ
、パクリタキセル(Taxol(登録商標))、フェニックス(Yttrium90/M
X-DTPA)、ペントスタチン、ポリフェプロサン20カルムスチンインプラント(p
olifeprosan 20 with carmustine implant)(
Gliadel(登録商標))、クエン酸タモキシフェン(Nolvadex(登録商標
))、テニポシド(Vumon(登録商標))、6-チオグアニン、チオテパ、チラパザ
ミン(Tirazone(登録商標))、注射用の塩酸トポテカン(Hycamptin
(登録商標))、ビンブラスチン(Velban(登録商標))、ビンクリスチン(On
covin(登録商標))、およびビノレルビン(Navelbine(登録商標))が
挙げられる。
D47抗体またはそのフラグメントと組み合わせて用いられ得る。CD47とシグナル調
節タンパク質アルファ(SIRP)との相互作用を遮断する抗CD47ミクロボディが、
裸の抗cKIT抗体によって、内因性のHSCの枯渇を増強し得ることが報告された(C
hhabra et al.,Science Translational Medi
cine 8(351),351ra105)。
に特異的に結合する別の抗体またはそのフラグメント、例えば、抗CD45抗体もしくは
そのフラグメント、抗CD34抗体もしくはそのフラグメント、抗CD133抗体もしく
はそのフラグメント、抗CD59抗体もしくはそのフラグメント、または抗CD90抗体
もしくはそのフラグメントと組み合わせて用いられ得る。一部の実施形態において、本開
示の抗体薬物結合体は、Dyrk1aインヒビタ、例えば、Harmine、INDY、
ML 315ヒドロクロリド、ProINDY、Tocris(商標)TC-S 704
4、Tocris(商標)TG 003、FINDY、TBB、DMAT、CaNDYそ
の他と組み合わせて用いられ得る。
えば、グルココルチコイド、例えば、プレドニゾン、デキサメタゾン、およびヒドロコル
チゾン;細胞増殖抑制剤、例えば、アルキル化剤、代謝拮抗薬、メトトレキサート、アザ
チオプリン、メルカプトプリン、ダクチノマイシンその他;イムノフィリンに作用する薬
物、例えば、タクロリムス(Prograf(登録商標)、Astograf XL(登
録商標)、またはEnvarsus XR(登録商標))、シロリムス(ラパマイシンま
たはRapamune(登録商標))、およびエベロリムス;インターフェロン;オピオ
イド;TNF結合タンパク質;ミコフェノラート;フィンゴリモド;ミリオシン;その他
と組み合わせて用いられ得る。一部の実施形態において、本開示の抗体薬物結合体は、T
細胞を特異的に枯渇させる1つ以上の剤、例えば、フルダラビン、シクロスポリン、抗C
D52抗体、例えば、アレムツズマブ、抗胸腺細胞グロブリン(ATG)、抗CD3抗体
もしくはそのフラグメント、抗CD4抗体もしくはそのフラグメント、抗CD8抗体もし
くはそのフラグメント、または抗ヒトTcRα/β抗体もしくはそのフラグメントと組み
合わせて用いられ得る。T細胞枯渇治療は、移植の拒絶に至り得る宿主対移植片反応を低
下させることができる。
0、Mozobil(登録商標)としても知られている)、顆粒球-マクロファージコロ
ニー刺激因子(GM-CSF)、例えば、サルグラモスチム(Leukine(登録商標
))、または顆粒球-コロニー刺激因子(G-CSF)、例えば、フィルグラスチムまた
はペグフィルグラスチム(Zarzio(登録商標)、Zarxio(登録商標)、Ne
upogen(登録商標)、Neulasta(登録商標)、Nufil(登録商標)、
Religrast(登録商標)、Emgrast(登録商標)、Neukine(登録
商標)、Grafeel(登録商標)、Imumax(登録商標)、Filcad(登録
商標))から選択される1つ以上の剤と組み合わせて用いられ得る。
ての投薬レジメンにおいて、抗癌特性を有する第2の化合物と組み合わされる。医薬的組
合せ製剤または投薬レジメンの第2の化合物は、互いに悪影響を及ぼさないように、組合
せの結合体に対する補完的な活性を有し得る。
せ、または併用投与用の非固定組合せもしくはパーツのキットを指し、2つ以上の治療薬
は、同時に独立して、またはある時間間隔内で別々に投与され得、とりわけ当該時間間隔
により、組合せパートナーは、協働的な効果、例えば相乗効果を示し得る。
つ以上の治療薬の投与を指す。そのような投与は、実質的に同時の、例えば、活性成分の
比率が固定されている単一のカプセルでの、当該治療薬の同時投与を包含する。これ以外
にも、そのような投与は、各活性成分について複数回の、または別々のコンテナ(例えば
、カプセル、粉末、および液体)での同時投与を包含する。粉末および/または液体が、
投与前に所望の用量に再構成されても希釈されてもよい。加えて、そのような投与はまた
、各タイプの治療薬の、おおよそ同時での、または異なる時点での、逐次的な使用を包含
する。いずれにせよ、処置レジメンは、本明細書中に記載される症状または障害を処置す
る際に、薬物組合せの有益な効果を提供することとなる。
性成分が一緒に用いられる場合に達成される効果が、化合物を別々に用いることに由来す
る効果の和よりも大きいことを立証し得る。活性成分が:(1)同時調合されて、組み合
わされた、ユニット投薬量の製剤で同時に投与もしくは送達され;(2)交互に、もしく
は別々の製剤として同時に送達され;または(3)他の何らかのレジメンによる場合に、
相乗効果が達成され得る。交互療法で送達される場合、化合物が、例えば別々のシリンジ
での異なる注射によって、順次投与または送達される場合に、相乗効果が達成され得る。
一般に、交互療法の間、各活性成分の有効な投薬量が順次、すなわち連続的に投与される
が、併用療法において、2つ以上の活性成分の有効な投薬量が、一緒に投与される。
本明細書中に記載される1つ以上の抗体薬物結合体を含む医薬組成物または滅菌組成物
を調製するために、提供された結合体は、薬学的に許容可能なキャリアまたは賦形剤と混
合され得る。
ョン、または懸濁液の形態の、生理的に許容可能なキャリア、賦形剤、または安定化剤と
混合することによって、調製され得る(例えば、Hardman et al.,Goo
dman and Gilman’s The Pharmacological Ba
sis of Therapeutics,McGraw-Hill,New York
,N.Y.,2001;Gennaro,Remington:The Science
and Practice of Pharmacy,Lippincott,Wil
liams,and Wilkins,New York,N.Y.,2000;Avi
s,et al.(eds.),Pharmaceutical Dosage For
ms:Parenteral Medications,Marcel Dekker,
NY,1993;Lieberman,et al.(eds.),Pharmaceu
tical Dosage Forms:Tablets,Marcel Dekker
,NY,1990;Lieberman,et al.(eds.)Pharmaceu
tical Dosage Forms:Disperse Systems,Marc
el Dekker,NY,1990;Weiner and Kotkoskie,E
xcipient Toxicity and Safety,Marcel Dekk
er,Inc.,New York,N.Y.,2000参照)。
ある。特定の実施形態において、抗体結合体を含む医薬組成物は、抗体結合体、ヒスチジ
ン、スクロース、およびポリソルベート20を含有するバイアル内の凍結乾燥品である。
特定の実施形態において、抗体結合体を含む医薬組成物は、抗体結合体、コハク酸ナトリ
ウム、およびポリソルベート20を含有するバイアル内の凍結乾燥品である。特定の実施
形態において、抗体結合体を含む医薬組成物は、抗体結合体、トレハロース、シトラート
およびポリソルベート8を含有するバイアル内の凍結乾燥品である。凍結乾燥品は、注射
用に、例えば水、生理食塩水で再構成され得る。特定の実施形態において、溶液は、約5
.0のpHにて、抗体結合体、ヒスチジン、スクロース、およびポリソルベート20を含
む。別の特定の実施形態において、溶液は、抗体結合体、コハク酸ナトリウム、およびポ
リソルベート20を含む。別の特定の実施形態において、溶液は、約6.6のpHにて、
抗体結合体、トレハロース無水物、シトラート無水物、クエン酸、およびポリソルベート
8を含む。静脈内投与用に、得られた溶液は通常、キャリア溶液中にさらに希釈されるこ
ととなる。
組織代謝回転速度、病徴のレベル、実体の免疫原性、および生体マトリックス内での標的
細胞のアクセシビリティが挙げられる。特定の実施形態において、投与レジメンは、患者
に送達される治療薬の量を、副作用の許容可能なレベルに合わせて最大にする。したがっ
て、送達される生物製剤の量は、特定の実体、および処置されることとなる症状の重症度
に部分的に依存する。抗体、サイトカイン、および小分子の適切な用量を選択するガイダ
ンスが入手可能である(例えば、Wawrzynczak,Antibody Ther
apy,Bios Scientific Pub.Ltd,Oxfordshire,
UK,1996;Kresina(ed.),Monoclonal Antibodi
es,Cytokines and Arthritis,Marcel Dekker
,New York,N.Y.,1991;Bach(ed.),Monoclonal
Antibodies and Peptide Therapy in Autoi
mmune Diseases,Marcel Dekker,New York,N.
Y.,1993;Baert et al.,New Engl.J.Med.348:
601-608,2003;Milgrom et al.,New Engl.J.M
ed.341:1966-1973,1999;Slamon et al.,New
Engl.J.Med.344:783-792,2001;Beniaminovit
z et al.,New Engl.J.Med.342:613-619,2000
;Ghosh et al.,New Engl.J.Med.348:24-32,2
003;Lipsky et al.,New Engl.J.Med.343:159
4-1602,2000参照)。
置に影響を及ぼす、または処置に影響を及ぼすと予測されるパラメータまたは因子を用い
て、臨床医によってなされる。通常、用量は、適量よりも幾分少ない量から始めて、その
後、所望の、または最適な効果が達成されるまで、あらゆる負の副作用に対して、小さな
増分で増やされる。重要な診断尺度として、例えば、生成される炎症サイトカインの炎症
またはレベルの、病徴の尺度が挙げられる。
び投与様式にとって所望される治療反応を、患者に有毒であることなく達成するのに有効
である活性成分の量を得るように変わり得る。選択される投薬量レベルは、使用される本
発明の特定の組成物の活性、投与経路、投与の時点、使用されることとなる特定の化合物
の排泄速度、処置の期間、使用される特定の組成物と組み合わせて用いられる他の薬物、
化合物、および/または材料、処置されることとなる患者の年齢、性別、体重、症状、健
康状態、および先の病歴、ならびに当該医療技術において知られているような因子が挙げ
られる、種々の薬物動態学的因子に依存することとなる。
週の間隔での、または1週あたり1~7回、隔週、3週毎に1回、4週毎に1回、5週毎
に1回、6週毎に1回、7週毎に1回、もしくは8週毎に1回の用量によって、提供され
得る。用量は、静脈内に、皮下に、または骨内に提供されてよい。具体的な用量プロトコ
ルは、不所望の大きな副作用を回避する最大用量または用量頻度を包含するものである。
体重kg~100mg/kgであってよい。投薬量は、0.001mg/患者の体重kg
~50mg/kg、0.005mg/kg~20mg/kg、0.01mg/kg~20
mg/kg、0.02mg/kg~10mg/kg、0.05~5mg/kg、0.1m
g/kg~10mg/kg、0.1mg/kg~8mg/kg、0.1mg/kg~5m
g/kg、0.1mg/kg~2mg/kg、0.1mg/kg~1mg/kgであって
よい。抗体結合体の投薬量は、患者の体重キログラム(kg)に、投与されることとなる
用量mg/kgを乗じて算出され得る。
も1日、2日、3日、5日、10日、15日、30日、45日、2ヵ月、75日、3ヵ月
、4ヵ月、5ヵ月、または少なくとも6ヵ月区切られてよい。一部の実施形態において、
本発明の抗体結合体は、週に2回、週に1回、2週毎に1回、3週毎に1回、4週毎に1
回、またはより少ない頻度で投与される。
法、経路および用量、ならびに副作用の重症度等の要因に応じて変わり得る(例えば、M
aynard et al.,A Handbook of SOPs for Goo
d Clinical Practice,Interpharm Press,Boc
a Raton,Fla.,1996;Dent,Good Laboratory a
nd Good Clinical Practice,Urch Publ.,Lon
don,UK,2001参照)。
腔内、脳内、筋肉内、眼内、動脈内、脳脊髄内、病巣内投与によってもよいし、持続的放
出系またはインプラントによってもよい(例えば、Sidman et al.,Bio
polymers 22:547-556,1983;Langer et al.,J
.Biomed.Mater.Res.15:167-277,1981;Langer
,Chem.Tech.12:98-105,1982;Epstein et al.
,Proc.Natl.Acad.Sci.USA 82:3688-3692,198
5;Hwang et al.,Proc.Natl.Acad.Sci.USA 77
:4030-4034,1980;米国特許第6,350,466号明細書および米国特
許第6,316,024号明細書参照)。必要な場合、組成物はまた、可溶化剤もしくは
局所的麻酔薬、例えば注射部位の痛みを和らげるリドカイン、または双方を含んでもよい
。加えて、肺投与も使用され得、例えば、インヘラーまたはネブライザの使用、およびエ
アロゾル化剤での調合によるものがある。例えば、米国特許第6,019,968号明細
書、米国特許第5,985,320号明細書、米国特許第5,985,309号明細書、
米国特許第5,934,272号明細書、米国特許第5,874,064号明細書、米国
特許第5,855,913号明細書、米国特許第5,290,540号明細書、および米
国特許第4,880,078号明細書;ならびに国際公開第92/19244号パンフレ
ット、国際公開第97/32572号パンフレット、国際公開第97/44013号パン
フレット、国際公開第98/31346号パンフレット、および国際公開第99/669
03号パンフレット参照(これらの出願はそれぞれ、その全体が参照によって本明細書に
組み込まれる)。
射線(例えば全身照射(TBI))との同時投与または同時処置方法が、当該技術におい
て知られている(例えば、Hardman et al.,(eds.)(2001)G
oodman and Gilman’s The Pharmacological
Basis of Therapeutics,10.sup.th ed., McG
raw-Hill,New York,N.Y.;Poole and Peterso
n (eds.)(2001)Pharmacotherapeutics for A
dvanced Practice:A Practical Approach,Li
ppincott,Williams & Wilkins,Phila.,Pa.;C
habner and Longo(eds.)(2001)Cancer Chemo
therapy and Biotherapy,Lippincott,Willia
ms & Wilkins,Phila.,Pa.参照)。有効な量の治療薬が、病徴を
少なくとも10%;少なくとも20%;少なくとも約30%;少なくとも40%、または
少なくとも50%低下させ得る。
ら5分未満離れて、30分未満離れて、1時間離れて、約1時間離れて、約1~約2時間
離れて、約2時間~約3時間離れて、約3時間~約4時間離れて、約4時間~約5時間離
れて、約5時間~約6時間離れて、約6時間~約7時間離れて、約7時間~約8時間離れ
て、約8時間~約9時間離れて、約9時間~約10時間離れて、約10時間~約11時間
離れて、約11時間~約12時間離れて、約12時間~18時間離れて、18時間~24
時間離れて、24時間~36時間離れて、36時間~48時間離れて、48時間~52時
間離れて、52時間~60時間離れて、60時間~72時間離れて、72時間~84時間
離れて、84時間~96時間離れて、または96時間~120時間離れて施されてよい。
2つ以上の治療が、1回の同じ患者来院中に施されてよい。
の抗体結合体を単独で、または他の治療と組み合わせて含む投与プロトコルを提供する。
本発明の併用療法の治療は、対象に、同時に施されてもよいし、順次施されてもよい。本
発明の併用療法の治療はまた、周期的に施されてもよい。サイクリング治療は、第1の治
療をしばらくの間施してから、第2の治療をしばらくの間施し、そしてこの逐次的な施し
を繰り返して(すなわちサイクル)、治療(例えば剤)の1つに対する耐性の発達を低下
させて、治療(例えば剤)の1つの副作用を回避し、もしくは和らげ、かつ/または治療
の有効性を向上させることを包含する。
たは抗体結合体が、他の治療と一緒に作用して、普通に施されるよりも利益が増すような
順序で、かつ時間間隔内で、本発明の抗体またはそのフラグメントを含む医薬組成物が対
象に投与されることを意味する。例えば、各療法は、同時に、または異なる時点にてあら
ゆる順序で順次、対象に施されてよい;しかしながら、同時に施されないならば、所望の
治療効果をもたらすほど十分に近い時間で施されるべきである。各療法は、対象に別々に
、あらゆる適切な形態で、かつあらゆる適切な経路によって投与され得る。種々の実施形
態において、治療は、5分未満離れて、15分未満離れて、30分未満離れて、1時間未
満離れて、約1時間離れて、約1時間~約2時間離れて、約2時間~約3時間離れて、約
3時間~約4時間離れて、約4時間~約5時間離れて、約5時間~約6時間離れて、約6
時間~約7時間離れて、約7時間~約8時間離れて、約8時間~約9時間離れて、約9時
間~約10時間離れて、約10時間~約11時間離れて、約11時間~約12時間離れて
、24時間離れて、48時間離れて、72時間離れて、または1週離れて、対象に投与さ
れる。他の実施形態において、2つ以上の治療が、同じ患者来院中に施される。
薬は、対象に、別個の医薬組成物で同時に投与されてもよい。治療薬は、同じ投与経路ま
たは異なる投与経路によって、対象に投与されてよい。
それを考慮した種々の修飾または変更が、当業者に示唆されることとなり、かつ本願およ
び添付の特許請求の範囲の精神および範囲内に含まれ得ることが理解される。
部位特異的システイン突然変異を有する、または有していない抗cKit抗体および抗体
フラグメントの調製
以前に国際公開第2014150937号パンフレットおよび国際公開第201602
0791号パンフレットに記載されるようにして、ヒト抗cKIT抗体および抗体フラグ
メントを生成した。
レイベースのスクリーニングで単離したベクターから増幅して、ヒトIgG1重鎖および
ヒトカッパ軽鎖またはラムダ軽鎖の定常領域を含有する哺乳類発現ベクター中にクローニ
ングした。ベクターは、CMVプロモータおよびシグナルペプチド(重鎖用のMPLLL
LLPLLWAGALA(配列番号151)および軽鎖用のMSVLTQVLALLLL
WLTGTRC(配列番号152))、ならびに、細菌宿主、例えば大腸菌(E.col
i)DH5アルファ細胞中でのDNAの増幅、哺乳類細胞、例えばHEK293細胞中で
の一過性発現、または哺乳類細胞、例えばCHO細胞中への安定した形質移入に適したシ
グナル配列および選択配列を含有する。Cys突然変異を導入するために、部位特異的突
然変異誘発PCRを、重鎖コーディング配列または軽鎖コーディング配列の定常領域内の
特定の部位にて単一のCys残基を置換するように設計したオリゴで行った。Cys置換
突然変異の例として、重鎖のE152CもしくはS375C;カッパ軽鎖のE165Cも
しくはS114C;またはラムダ軽鎖のA143C(全てEUナンバリング)がある。場
合によっては、2つ以上のCys突然変異を組み合わせて、複数のCys置換、例えばH
C-E152C-S375C、ラムダLC-A143C-HC-E152C、カッパLC
-E165C-HC-E152C、またはカッパLC-S114C-HC-E152C(
全てEUナンバリング)を有する抗体を製造した。抗体フラグメントをコードするプラス
ミドを生成するために、突然変異誘発PCRを、重鎖定常領域の一部を除去し、または修
飾するように設計したオリゴで行った。例えば、Fabフラグメント用の発現構築体を製
造するために、終止コドンが残基221(EU番号)の直後にコードされるように、重鎖
定常領域の残基222~447(EUナンバリング)を除去するPCRを実行した。例え
ば、IgG1ヒンジの2つのCys残基を含むFab’フラグメント用の発現構築体を製
造するために、終止コドンが残基232(EU番号)の直後にコードされるように、重鎖
定常領域の残基233~447(EUナンバリング)を除去するPCRを実行した。
ントを、以前に記載される一過性形質移入法(Meissner,et al.,Bio
technol Bioeng.75:197-203(2001))を用いて、重鎖プ
ラスミドおよび軽鎖プラスミドを同時形質移入することによって、293 Freest
yle(商標)細胞中で発現させた。発現された抗体を、細胞上清から、適切な樹脂、例
えばプロテインA、プロテインG、Capto-L樹脂、またはLambdaFabSe
lect樹脂を用いた標準的な親和性クロマトグラフィ法によって精製した。これ以外に
も、重鎖ベクターおよび軽鎖ベクターをCHO細胞中に同時に形質移入することによって
、抗cKit抗体、抗体フラグメント、およびCys突然変異抗体または抗体フラグメン
トを、CHO内で発現させた。細胞は選択を経験し、そして次に、安定して形質移入され
た細胞を、抗体産生用に最適化された条件下で培養した。抗体を、上記のように細胞上清
から精製した。
抗体または抗体フラグメント上のチオール基(Cys側鎖)への反応のための反応性部
分、例えばマレイミド基、記載したリンカー、および官能部分、例えばオーリスタチンま
たは他の毒物で構成される化合物を、天然の、または以前に記載される方法(例えば、国
際公開第2014124316号パンフレット、国際公開第2015138615号パン
フレット、Junutula JR,et al.,Nature Biotechno
logy 26:925-932(2008))を用いて操作した抗体中のCys残基に
結合させた。
ルフィド)、例えばグルタチオン(GSH)および/またはシステインによって修飾され
る(Chen et al.2009)ので、最初に発現される修飾されたCysは、チ
オール反応性試薬、例えばマレイミド、またはブロモアセトアミド基もしくはヨードアセ
トアミド基に非反応性である。操作されたCys残基に結合するために、グルタチオン付
加物またはシステイン付加物が、ジスルフィドを還元することによって除去される必要が
あり、通常、発現された抗体内の全てのジスルフィドを還元することを要する。また、抗
体および抗体フラグメント中の天然のCys残基は、通常、抗体または抗体フラグメント
中の他のCys残基に対してジスルフィド結合を形成するので、ジスルフィドが還元され
るまで、チオール反応性試薬に対して非反応性である。ジスルフィドの還元は、最初に、
抗体を還元剤、例えばジチオスレイトール(DTT)、システイン、またはトリス(2-
カルボキシエチル)ホスフィンヒドロクロリド(TCEP-HCl)に曝すことによって
、達成され得る。場合によっては、還元剤を除去することで、抗体または抗体フラグメン
トの全ての天然のジスルフィド結合の再酸化が、官能抗体構造を回復かつ/または安定化
させ得る。
フィド結合、および操作されたCys残基のシステイン付加物またはGSH付加物間のジ
スルフィド結合が低下した場合、新たに調製したDTTを、Cys突然変異精製抗体に加
えて、10mMまたは20mMの最終濃度にした。DTTによる37℃での1時間の抗体
インキュベーションの後、混合物を、毎日のバッファ交換により3日間、PBSに対して
透析して、DTTを除去して、天然のジスルフィド結合を再酸化した。再酸化プロセスを
、逆相HPLCによって監視した。これは、抗体四量体を、個々の重鎖分子および軽鎖分
子から分離することができる。反応を、80℃に加熱したPRLP-S 4000Aカラ
ム(50mm×2.1mm、Agilent)上で分析して、カラム溶出を、0.1%T
FAを含有する水中30~60%アセトニトリルの直線勾配によって、1.5ml/分の
流量にて実行した。カラムからのタンパク質の溶出を、280nmにて監視した。再酸化
が完了するまで、透析を続けた。再酸化により、鎖内ジスルフィドおよび鎖間ジスルフィ
ドが回復する一方、透析により、新たに導入されたCys残基に連結したシステインおよ
びグルタチオンは、透析されて除かれる(dialyze away)。再酸化の後、マ
レイミド含有化合物を、PBSバッファ(pH7.2)中の再酸化された抗体または抗体
フラグメントに、操作されたCysに対して典型的には1.5:1、2:1、または5:
1の比率にて加えて、インキュベーションを1時間実行した。典型例として、過剰な遊離
化合物を、標準的な方法によるプロテインAまたは他の適切な樹脂上での精製に続く、P
BS中へのバッファ交換によって、除去した。
レジン法(on-resin method)を用いて還元かつ再酸化した。プロテイン
Aセファロースビーズ(抗体10mgあたり1ml)を、PBS(カルシウム塩もマグネ
シウム塩もない)中で平衡化してから、抗体サンプルにバッチモードで加えた。3.4g
のNaOHを250mlの0.5Mリン酸ナトリウムpH8.0に加えることによって調
製した溶液の10ml中に、850mgのシステインHClを溶解させることによって、
0.5Mシステインのストックを調製してから、20mMシステインを抗体/ビーズスラ
リーに加えて、室温にて30~60分間穏やかに混合した。ビーズを重力カラムにロード
して、PBSの50床容量で30分未満で洗浄した。次に、カラムを、PBSの1床容量
中に再懸濁したビーズでキャッピングした。再酸化の速度を調節するために、場合によっ
ては、50nM~1μM塩化銅を加えた。樹脂の小試験サンプルを取り出して、IgG溶
出バッファ(Thermo)中に溶出して、先で説明したRP-HPLCによって分析す
ることによって、再酸化の進行を監視した。再酸化が所望の完全性にまで進行したならば
、操作されたシステイン上に2~3モル過剰の化合物を加えることによって直ちに結合を
開始させることができ、混合物は、室温にて5~10分間反応し得、それからカラムを、
PBSの少なくとも20カラム容量で洗浄した。抗体結合体を、IgG溶出バッファで溶
出して、0.1容量の0.5Mリン酸ナトリウムpH8.0で中和して、PBSにバッフ
ァ交換した。一部の例において、樹脂上で抗体との結合を開始する代わりに、カラムを、
PBSの少なくとも20カラム容量で洗浄して、抗体を、IgG溶出バッファで溶出して
、バッファpH8.0で中和した。次に、抗体を、結合反応に用い、または今後の使用の
ために急速凍結した。
通常形成するものに、そして、抗体のヒンジ領域において、重鎖対重鎖の鎖間ジスルフィ
ド結合を通常形成するCys残基に、操作されたCys残基の不在下で、または、操作さ
れたCys残基に結合が向けられるのと同時に、結合することが所望される。これらの場
合、5倍過剰のTCEPを、ジスルフィド結合に加えることによって、抗体または抗体フ
ラグメントを還元して、サンプルを、37℃にて1時間インキュベートした。次に、サン
プルを、直ちに結合させ、または今後の結合のために<-60℃にて凍結した。マレイミ
ド含有化合物を、PBSバッファ(pH7.2)中の抗体または抗体フラグメントに、結
合に用いられるCys残基に対して典型的には2:1の比率にて加えて、インキュベーシ
ョンを1時間実行した。典型例として、過剰な遊離化合物を、脱塩カラムに続く、PBS
へのより大量のバッファ交換によって除去した。
ルオロフェニルエステルを含むリンカー-薬物化合物(例えば、化合物(7)、SMCC
-DM1、スルホ-SPDB-DM4、またはSPDB-DM4)と反応させることによ
って、リジン残基への結合を調製することができる。一例として、化合物(7)を、抗H
ER2 Fab-HC-E152C上のリジン残基に結合した。具体的には、抗HER2
Fab-HC-E152Cを、一過性形質移入によってHEK293細胞中で発現させ
た。Fabを、capto-L(GE Healthcare)親和性精製によって培地
から捕捉して、IgG溶出バッファ(Pierce)中に溶出して、超濃縮器(Amic
on)によってPBSにバッファ交換した。Fab溶液(5.8mg/ml)に、2倍の
モル過剰の化合物(7)を加えた。混合物を室温にて30分間インキュベートしてから、
混合物を50mMトリスpH8でクエンチした。次に、生じた結合体を、分取用SECに
よってPBS中に精製した。
一部の例において、抗体フラグメントを、先に記載されるように、発現の産物が抗体の
フラグメントであるような抗体重鎖コード配列の遺伝的操作によって生成した。他の例に
おいて、抗体を、完全長抗体の酵素的消化によって生成した。
ために、完全抗体を、固定化パパイン樹脂(ThermoFisher Scienti
fic)で、メーカーのプロトコルに従って処理した。手短に言えば、pH7.0に調整
した、新たに溶解した20mMシステイン-HClの消化バッファ中での平衡化によって
、固定化パパイン樹脂を調製する。抗体を、おおよそ10mg/mlに調整して、消化バ
ッファにバッファ交換して、樹脂に、樹脂1mlあたり4mgのIgGの比率にて加えて
、37℃にて5~7時間インキュベートする。次に、樹脂を取り出して、抗体フラグメン
トを、適切な親和性樹脂によって精製し、例えば、プロテインA樹脂への結合によって、
無傷のIgGおよびFcフラグメントをFabフラグメントから分離し、または分離を、
サイズ排除クロマトグラフィによって行う。
生成するために、完全抗体を、タンパク質分解酵素で処理した。手短に言えば、抗体を、
PBS中におおよそ10mg/mlにて調製する。酵素を、1:100の重量/重量比に
て加えて、37℃にて2時間インキュベートする。抗体フラグメントを、適切な親和性樹
脂によって精製し、例えば、無傷のIgGおよびFcフラグメントを、Fab’フラグメ
ントから、プロテインA樹脂への結合によって分離し、または分離を、サイズ排除クロマ
トグラフィによって行う。
抗体および抗体フラグメント結合体を分析して、結合の程度を判定した。化合物対抗体
比を、還元かつ脱グリコシル化された(必要に応じて)サンプルについてのLC-MSデ
ータから推測した。LC/MSにより、結合体サンプル中の抗体に取り付けられたリンカ
ー-ペイロード(化合物)の平均分子数の定量化が可能となる。高圧液体クロマトグラフ
ィ(HPLC)は、抗体を軽鎖および重鎖に分離し、そして還元条件下で、鎖あたりのリ
ンカー-ペイロード群の数に従って、重鎖(HC)および軽鎖(LC)を分離する。質量
スペクトルデータにより、混合物中の構成要素種、例えば、LC、LC+1、LC+2、
HC、HC+1、HC+2その他の同定が可能となる。LC鎖およびHC鎖上の平均ロー
ディングから、化合物対抗体の平均比率を、抗体結合体について算出することができる。
所定の結合体サンプルについての化合物対抗体比が、2つの軽鎖および2つの重鎖を含有
する四量体抗体に取り付けた化合物(リンカー-ペイロード)分子の平均数を表す。
び/またはProtein KW-803 5μm 300×8mm(Shodex)の
カラム上での分析サイズ排除クロマトグラフィ(AnSEC)を用いて、結合体をプロフ
ァイルした;凝集度を、分析サイズ排除クロマトグラフィに基づいて分析した。
抗cKIT Fab’-毒物DAR4結合体または抗Her2 Fab-毒物DAR4
対照結合体を生成するために、50mgの完全IgG(WT、導入したシステインなし)
を、タンパク質分解酵素で消化した。F(ab’)2フラグメントを、Superdex
-S200(GE Healthcare)カラム上でのSECによって精製した。これ
以外にも、抗HER2対照結合体または抗cKit Fab’-毒物DAR4結合体を生
成するために、Fab’HCをコードするベクターを、CHO中に、Fab’LCをコー
ドするベクターと同時形質移入した。発現されたFab’を、プロテインG樹脂上での捕
捉によって精製した。F(ab’)2またはFab’を、TCEPの付加(鎖間ジスルフ
ィドに対して5×過剰)によって還元して直ちに、本発明の化合物(遊離Cys残基に対
して2.5×過剰)と反応させた。反応を、RP-HPLCによって監視して、化合物の
追加の1×当量を、反応が完了するまで加えた。遊離化合物を、PD10脱塩カラム(G
E Healthcare)によって除去した。DARは、≧3.9であると実験的に判
定された。記載する実施例においてさらに研究した具体的な結合体を、表2中で一覧にす
る。
ab HC(E152CであるHC1~221、EUナンバリングによる)をコードする
ベクターを、Cys残基を導入したFab LC(カッパLC K107C、カッパLC
S114C、またはカッパLC E165C、EUナンバリングによる)をコードする
ベクターと、HEK293中に同時形質移入した。抗Her2 Fab-毒物DAR2対
照結合体を生成するために、Cys残基を導入したFab HC(E152CであるHC
1~222、およびC末端His6タグ(配列番号162)、EUナンバリングによる)
をコードするベクターを、Cys残基を導入したFab LCをコードするベクター(カ
ッパLC K107C、カッパLC S114C、またはカッパLC E165C、EU
ナンバリングによる)と、HEK293中に同時形質移入した。発現されたFabを、C
apto-L樹脂(GE Healthcare)上での捕捉、および標準的なIgG溶
出バッファ(Thermo)による溶出によって精製した。Fabを、Amiconウル
トラデバイスを用いて、PBSにバッファ交換した。FabをDTTで還元して、室温に
て再酸化した。鎖間ジスルフィド結合の再形成の後、Fabを、化合物6に結合させた(
遊離Cys残基に対して3×過剰)。反応を、室温にて30分間進めて、RP-HPLC
によって310nmでの検出で監視した。結合したFabを、プロテインA(抗her2
)またはcapto-L(抗cKit)の樹脂上で精製して、PBS+1%トリトンX-
100で洗浄して、大量のPBSで洗浄してから、IgG溶出バッファ中に溶出した。次
に、Fabを、Amiconウルトラデバイスを用いて、PBSにバッファ交換した。記
載する実施例においてさらに研究した具体的な結合体を、実験的に判定したDAR値と共
に、以下の表2中で一覧にする。
入したHC(E152CおよびS375C、EUナンバリングによる)をコードするベク
ターを、Fab LCをコードするベクターと、CHO中に同時形質移入した。抗Her
2 F(ab’)2-毒物DAR2対照結合体を生成するために、Cys残基を導入した
HC(E152CおよびS375C、EUナンバリングによる)をコードするベクターを
、Fab LCをコードするベクターと、HEK293中に同時形質移入した。発現され
たIgGを、プロテインAまたはmabselectsureの樹脂(GE Healt
hcare)上での捕捉、および標準的なIgG溶出バッファ(Thermo)による溶
出によって精製した。完全IgGを、DTTで室温にて還元して、RP-HPLCによっ
て監視して、DTTの除去の後に再酸化した。次に、再酸化したIgGを、タンパク質分
解酵素で消化して、F(ab’)2フラグメントを生成した。抗cKITフラグメントに
ついて、F(ab’)2を、Amiconウルトラデバイスを用いて、PBSにバッファ
交換した。抗HER2フラグメントについて、F(ab’)2画分を、分取用HICによ
って濃縮してから、Amiconウルトラデバイスを用いて、PBSにバッファ交換した
。F(ab’)2を、化合物4または化合物5に結合させた(遊離Cys残基に対して4
×過剰)。反応を、室温にて30分間進めて、RP-HPLCによって310nmでの検
出で監視した。結合したF(ab’)2を、capto-L(抗cKit Ab3)樹脂
上で精製して、PBS+1%トリトンX-100で洗浄して、大量のPBSで洗浄してか
ら、IgG溶出バッファ中に、または分取用SEC(抗her2および抗cKIT Ab
4)によって溶出した。次に、F(ab’)2を濃縮して、Amiconウルトラデバイ
スを用いて、PBSにバッファ交換した。記載する実施例においてさらに研究した具体的
な結合体を、実験的に判定したDAR値と共に、以下の表2中で一覧にする。
C(E152C、EUナンバリングによる)をコードするベクターを、Fab LCをコ
ードするベクターと、HEK293中に同時形質移入した。発現されたIgGを、プロテ
インA樹脂(GE Healthcare)上での捕捉、および標準的なIgG溶出バッ
ファ(Thermo)による溶出によって精製した。完全IgGを、DTTで室温にて還
元して、RP-HPLCによって監視して、DTTの除去後に再酸化した。IgGを、固
定化パパイン(Thermo)で消化して、Fabフラグメントを生成した。Fabを、
Amiconウルトラデバイスを用いて、PBSにバッファ交換した。Fabを、化合物
4に結合させた(遊離Cys残基に対して4×過剰)。反応を、室温にて30分間進めて
、RP-HPLCによって310nmでの検出で監視した。結合したFabを、分取用S
ECによってPBS中に精製した。
たFab HC(E152C、EUナンバリングによる)をコードするベクターを、Fa
b LCをコードするベクターと、HEK293中に同時形質移入した。発現されたFa
bを、Capto-L樹脂(GE Healthcare)上での捕捉、および標準的な
IgG溶出バッファ(Thermo)による溶出によって精製した。Fabを、Amic
onウルトラデバイスを用いて、PBSにバッファ交換した。Fabを、化合物7に結合
させた(Fabに対して2×モル過剰)。反応を、室温にて30分間進めて、RP-HP
LCによって310nmでの検出で監視した。結合を、50mMトリスpH8.0でクエ
ンチした。結合したFabを、分取用SECによってPBS中に精製した。
メインタンパク質の、そして結合アッセイ用のcKITサブドメイン1~3および4~5
の生成
ヒト、マウス、およびラットのcKIT細胞外ドメイン(ECD)を、GenBank
またはUniprotのデータベース由来のアミノ酸配列(以下の表3参照)に基づいて
遺伝子合成した。カニクイザルcKITおよび1ECD cDNAテンプレートを、種々
のカニクイザル組織由来のmRNAを用いて生成したアミノ酸配列情報(例えばZyag
en Laboratories;以下の表4)に基づいて遺伝子合成した。全ての合成
したDNAフラグメントを、適切な発現ベクター、例えば、精製を可能にするC末端タグ
を有するhEF1-HTLVベースのベクター(pFUSE-mIgG2A-Fc2)中
にクローニングした。
所望のcKIT組換えタンパク質を、以前に懸濁培養に適合した、HEK293由来の
細胞株(293FS)内で発現させて、無血清培地FreeStyle-293(Gib
co、カタログ#12338018)中で増やした。小スケールのタンパク質生成および
大スケールのタンパク質生成の双方を、一過性形質移入を介して、複数のシェーカーフラ
スコ(Nalgene)内で、それぞれ最大1Lまで、プラスミドキャリアとして293
Fectin(登録商標)(Life Technologies、カタログ#1234
7019)と共に実行した。総DNAおよび293Fectinを、1:1.5(w:v
)の比率にて用いた。DNA対培養液比は、1mg/Lであった。細胞培養上清を、形質
移入後3~4日で収穫して、遠心分離して、滅菌濾過してから精製した。
組換えFcタグ付きcKIT細胞外ドメインタンパク質(例えば、ヒトcKIT EC
D-Fc、ヒトcKIT(ECDサブドメイン1~3、4~5)-Fc、カニクイザルc
KIT-mFc、ラットcKIT-mFc、マウスcKIT-mFc)を、細胞培養上清
から精製した。澄明にした上清を、PBSで平衡化したプロテインAセファロース(登録
商標)カラムに通過させた。ベースラインにまで洗浄した後に、結合材料を、Pierc
e Immunopure(登録商標)低pH溶出バッファ、または100mMグリシン
(pH2.7)で溶出して、直ちに、1MトリスpH9.0の1/8溶出容量で中和した
。必要に応じて、Amicon(登録商標)Ultra 15mL遠心濃縮器を、10k
Dまたは30kDの名目上の分子量カットオフで用いて、プールしたタンパク質を濃縮し
た。次に、プールを、Superdex(登録商標)200 26/60カラムを用いた
SECによって精製して、凝集体を除去した。次に、精製したタンパク質を、SDS-P
AGEおよびSEC-MALLS(マルチアングルレーザー光散乱)によって特徴付けた
。濃度を、Vector NTIによって配列から算出される理論上の吸収係数を用いた
、280nmでの吸光度によって判定した。
cKIT抗体の結合部位の定義を補助するために、ヒトcKIT ECDを、サブドメ
イン1~3(リガンド結合ドメイン)およびサブドメイン4~5(二量体化ドメイン)に
分けた。どのサブドメインが結合されたかを判定するために、サンドイッチELISAア
ッセイを使用した。cKITサブドメイン1~3、サブドメイン4~5、または完全長c
KIT ECDに相当する、1×リン酸緩衝生理食塩水中に希釈した1μg/ml EC
Dを、96ウェルImmulon(登録商標)4-HBXプレート(Thermo Sc
ientific Cat#3855、Rockford、IL)上にコーティングして
、4℃にて一晩インキュベートした。プレートを、洗浄バッファ(0.01%Tween
-20(Bio-Rad 101-0781)入り1×リン酸緩衝生理食塩水(PBS)
)で3回洗浄した。プレートを、1×PBS中に希釈した280μl/ウェル3%ウシ血
清アルブミンで、室温にて2時間ブロックした。プレートを、洗浄バッファで3回洗浄し
た。抗体を、洗浄バッファ中に2μg/mlにて調製して、8ポイントについて5倍希釈
して、100μl/ウェルにてELISAプレートに3反復で加えた。プレートを、室温
にて1時間、200rpmで振盪するオービタルシェーカ上でインキュベートした。アッ
セイプレートを、洗浄バッファで3回洗浄した。二次抗体F(ab’)2フラグメントヤ
ギ抗ヒトIgG(H+L)(Jackson Immunoresearch Cat#
109-036-088、West Grove、PA)を、洗浄バッファ中に1:10
,000で調製して、100μl/ウェルにてELISAプレートに加えた。プレートを
、室温にて1時間、オービタルシェーカ上で200rpmにて振盪させて、二次抗体とイ
ンキュベートした。アッセイプレートを、洗浄バッファで3回洗浄した。ELISAシグ
ナルを発現させるために、100μl/ウェルのSure blue(登録商標)TMB
基質(KPL Cat#52-00-03、Gaithersburg、MD)をプレー
トに加えて、室温にて10分間インキュベートした。反応を止めるために、50μlの1
N塩酸を、各ウェルに加えた。吸光度を、Molecular Devices Spe
ctraMax(登録商標)M5プレートリーダーを用いて、450nmにて測定した。
各抗体の結合応答を判定するために、光学密度測定値を、Excelを用いて平均して、
標準偏差値を得てグラフ化した。cKITに対する個々の抗cKIT抗体の結合特性を、
表5中で見出すことができる。
cKIT種オーソログに対する、そしてまたヒトcKITに対する抗体の親和性を、B
iacore(登録商標)2000機器(GE Healthcare、Pittsbu
rgh、PA)をCM5センサーチップと用いたSPR技術を用いて判定した。
Biosciences、Lincoln、NE)を補充したHBS-P(0.01M
HEPES、pH7.4、0.15M NaCl、0.005%Surfactant
P20)を、ランニングバッファとして全ての実験に用いた。固定レベルおよび分析物
の相互作用を、応答単位(RU)によって測定した。パイロット実験を実行して、抗ヒト
Fc抗体(カタログナンバーBR100839、GE Healthcare、Pitt
sburgh、PA)の固定化の実現可能性、および試験抗体の捕捉を試験かつ確認する
。
る実験を実行して、遊離溶液中で結合するcKITタンパク質の能力を判定した。手短に
言えば、25μg/mlの抗ヒトFc抗体pH5を、CM5センサーチップ上に、アミン
結合を介して、双方のフローセルで5μl/分の流量にて、10,500RUに達するよ
うに固定した。次に、0.1~1μg/mlの試験抗体を、10μl/分にて1分間注入
した。抗体の捕捉レベルを、概して200RU未満に維持した。その後、3.125~5
0nMのcKIT受容体細胞外ドメイン(ECD)を、2倍で段階希釈して、参照フロー
セルおよび試験フローセルの双方にわたって40μl/分の流量にて3分間注入した。試
験したECDの表を、以下で一覧にする(表5)。ECD結合の解離を、10分間続けた
。各注入サイクルの後、チップ表面を、3M MgCl2で10μl/分にて30秒間再
生した。全ての実験を25℃にて実行して、応答データを、単純な1:1相互作用モデル
(Scrubber 2(登録商標)ソフトウェアバージョン2.0b(BioLogi
c Software)を用いた)と包括的にフィットさせて、速度(ka)、オフ-速
度(kd)、および親和性(KD)の推定値を得た。表6は、選択した抗cKIT抗体の
ドメイン結合および親和性を一覧にしている。
インビトロHSC生存度アッセイ
ヒト動員末梢血造血幹細胞(HSC)を、HemaCare(カタログナンバーM00
1F-GCSF-3)から得た。各バイアルの約100万細胞を解凍して、10mlの1
×HBSS中に希釈して、1200rpmにて7分間遠心分離した。細胞ペレットを、3
つの成長因子を含有する18mlの成長培地(StemSpan SFEM(StemC
ell Technologies、カタログナンバー09650)(それぞれ50ng
/mlのTPO(R&D Systems、カタログナンバー288-TP)、Flt3
リガンド(Life Technologies、カタログナンバーPHC9413)、
およびIL-6(Life Technologies、カタログナンバーPHC006
3)入り、アミノ酸(Gibco、カタログナンバー10378-016)を補充)中に
再懸濁させた。
(HyClone、カタログナンバーSH30228.01)中に再懸濁させて、プール
した。細胞を、300gにて10分間遠心分離した。細胞ペレットを、AutoMACS
バッファ(1×PBS+0.5%BSA+2mM EDTA)中に、40μl中1億細胞
の濃度にて再懸濁させた。リネージ抗体カクテル(Miltenyi、カタログナンバー
130-090-858)を、1億細胞あたり10μlの濃度にて加えた。細胞を、低温
室内で10分間インキュベートしてから、1億細胞あたり30μlのAutoMACSバ
ッファおよび20μlのビオチン化磁気ビーズを加えた。この新しい懸濁液を、低温室内
で15分間インキュベートした。細胞を、300gにて10分間遠心分離した。ペレット
を、2mlのAutoMACSバッファ中に再懸濁させて、細胞ストレーナに通過させた
。細胞を、「枯渇」プロトコルを用いてAutoMACS上で選択した。ソート由来の陰
性画分を、300gにて10分間遠心分離して、1mlのHBSS中に再懸濁させた。再
懸濁させた細胞を、抗CD45-PerCP-Cy5.5(Becton Dickin
son、カタログナンバー550994)、抗CD48-FITC(eBioscien
ce、カタログナンバー11-0481-82)、抗CD150-PE(BioLege
nd、カタログナンバー115904)、および抗Sca-1(Becton Dick
inson、カタログナンバー560653)で染色した。細胞を、室温にて30分間イ
ンキュベートして、300gにて5分間遠心分離して、700μlのFACSバッファ中
にソーティング用に再懸濁させた。Sca-1+細胞を、FACS Aria上で陽性ソ
ートした。ソートの後、細胞を、3つの成長因子を含有する成長培地(StemSpan
SFEM、50ng/mlのTPO(R&D Systems、カタログナンバー28
8-TP)、Flt3リガンド(Life Technologies、カタログナンバ
ーPHC9413)、およびIL-6(Life Technologies、カタログ
ナンバーPHC0063)入り、アミノ酸(Gibco、カタログナンバー10378-
016)を補充)中に入れた。
して、10μg/mlから始めて1:3で段階希釈した。先に由来する細胞を、各ウェル
に、45μlの最終容量にて加えた。細胞を、37℃、5%酸素にて7日間インキュベー
トした。培養終了後、アッセイプレートを1200rpmにて4分間遠心分離することに
よって、細胞を染色用に収穫した。次に、上清を吸引して、細胞を洗浄して、異なる38
4ウェルプレート(Greiner Bio-One TC処理済み、黒色透明フラット
、カタログナンバー781092)に移した。
kinson、カタログナンバー340666)および抗CD90-APC(Becto
n Dickinson、カタログナンバー559869)で染色して、洗浄して、FA
CSバッファ中に再懸濁させて、50μlの最終容量にした。マウス細胞アッセイ用に、
各ウェルを、抗CD45-PerCP-Cy5.5(Becton Dickinson
、カタログナンバー550994)、抗CD48-FITC(eBioscience、
カタログナンバー11-0481-82)、抗CD150-PE(BioLegend、
カタログナンバー115904)、抗cKIT-APC(Becton Dickins
on、カタログナンバー553356)、および抗Sca-1(Becton Dick
inson、カタログナンバー560653)で染色して、洗浄して、FACSバッファ
中に再懸濁させて、50μlの最終容量にした。次に、細胞を、Becton Dick
inson Fortessaフローサイトメータ上で分析して、分析用に定量化した。
して、HSCを死滅させた。FACSによる細胞の定量化は、PBSで、または抗体もし
くは抗体フラグメントのアイソタイプ対照毒物結合体で処理した対照ウェル中よりも、抗
cKIT-毒物結合体で処理したウェル中で、より少ない生存細胞を示した。データを、
図1、図2、および図9に示し、そして表7に要約する。本明細書中で用いた命名規則は
、J#であり、表2中に記載する特定の結合体No.に対応する。
成熟した肥満細胞を、動員末梢血由来のCD34+前駆体を用いて生成した。CD34
+細胞を、組換えヒト幹細胞因子(rhSCF、50ng/ml、Gibco)、組換え
ヒトインターロイキン6(rhIL-6、50ng/ml、Gibco)、組換えヒトI
L-3(30ng/ml、Peprotech)、GlutaMAX(2nm、Gibc
o)、ペニシリン(100u/ml、Hyclone)、およびストレプトマイシン(1
00μg/ml、Hyclone)を補充したStemSpan SFEM(StemC
ell Technologies)中で培養した。組換えhIl-3を、培養の第1週
の間のみ加えた。第3週の後、培地の半分を、毎週、rhIL-6(50ng/ml)お
よびrhSCF(50ng/ml)を含有するフレッシュな培地で置換した。成熟肥満細
胞の純度を、高親和性IgE受容体(FCεRI、eBioscience)およびCD
117(BD)の表面染色によって評価した。培養の第8週から第12週までの細胞を用
いた。
CF(50ng/ml)を有する、または有していない、rhIL-6(50ng/ml
)を含有する肥満細胞培地中で一晩インキュベートした。肥満細胞脱顆粒の陽性対照とし
て、細胞の一部を、ヒト骨髄腫IgE(100ng/ml、EMD Millipore
)で感作した。翌日、抗cKIT抗体もしくは抗体フラグメント、またはその毒物結合体
、マウスモノクローナル抗ヒトIgG1(Fab特異的、Sigma)、ヤギ抗ヒトIg
E(Abcam)、および化合物48/80(Sigma)希釈剤を、0.04%ウシ血
清アルブミン(BSA、Sigma)を補充したHEPES脱顆粒バッファ(10mM
HEPES、137mM NaCl、2.7mM KCl、0.4mM二塩基性リン酸ナ
トリウム、5.6mMグルコース、pHを7.4に調整、そして1.8mM塩化カルシウ
ムおよび1.3mM硫酸マグネシウムと混合)中に調製した。試験剤および抗IgG1を
、V底384ウェルアッセイプレート内で一緒に混合した一方、抗IgEおよび化合物4
8/80を単独で試験した。アッセイプレートを、37℃にて30分インキュベートした
。インキュベーションの間、細胞を、HEPES脱顆粒バッファ+0.04%BSAで3
回洗浄して、培地および非結合IgEを除去した。細胞を、HEPES脱顆粒バッファ+
0.04%BSA中に再懸濁させて、アッセイプレート内のウェルあたり3000細胞に
て播種して、50μlの最終反応容量にした。IgEで感作した細胞を、脱顆粒の陽性対
照として、抗IgEのみと用いた。アッセイプレートを、37℃にて30分インキュベー
トして、脱顆粒を起こさせた。このインキュベーションの間、3.5mg/mlのpNA
Gをクエン酸バッファ(40mMクエン酸、20mM二塩基性リン酸ナトリウム、pH4
.5)中で超音波処理することによって、p-ニトロ-N-アセチル-β-D-グルコサ
ミン(pNAG、Sigma)バッファを調製した。20μlの細胞上清を40μlのp
NAG溶液と平底384ウェルプレート内で混合することによって、β-ヘキソサミニダ
ーゼの放出を測定した。このプレートを、37℃にて1.5時間インキュベートして、反
応を、40μlの停止溶液(400mMグリシン、pH10.7)の付加によって停止し
た。プレートリーダーをλ=405nmにて用いて吸光度を読み、参照フィルタはλ=6
20nmであった。
細胞脱顆粒を引き起こしそうにない。さらに、FabまたはFab’フラグメントは、肥
満細胞脱顆粒を引き起こし得ないことが示唆される。Fab特異的抗体と架橋して直ぐに
(図3C~図3J)、抗cKIT Fab’-毒物DAR4フォーマットではなく完全長
IgGは、脱顆粒の増大を示す。このことは、FabまたはFab’フラグメントを認識
する既存の抗薬物抗体を患者が産生させ、または有する場合に観察され得るように、より
大きな複合体に結合かつ多量体化された場合でさえ、Fab’フラグメントが肥満細胞脱
顆粒を引き起こさないことを示唆している。
ヒトHSCに対するインビボ有効性について試験剤を評価するために、重度免疫不全の
マウス(NOD.Cg-Prkdcscid IL2rgtm1Wjl/SzJ、Jac
kson Laboratory、ストックナンバー005557、NSGとしても知ら
れている)に、亜致死照射(137Csガンマ発光体で250RADS)の後、ヒトHS
Cを移植した。CD34+造血幹細胞(HSC)を、AllCells(カタログナンバ
ーCB008F-S)から得た。各バイアルの約100万細胞を解凍して、10mlの1
×HBSS中に希釈して、1200rpmにて7分間遠心分離した。細胞ペレットを、H
BS中に100,000細胞/mlにて再懸濁させた。1マウスあたり総数20,000
細胞を、照射の24時間後に、レトロオービタル注射を介して移植した。ヒトHSCを、
NSGマウス内に、少なくとも4週間植え付けた。ヒトキメラ化パーセントを、血液サン
プルのフローサイトメトリによって判定した。このために、血液を以下の抗体で染色した
:抗ヒトCD45-e450(eBioscience、カタログ#48-0459-4
2)、抗マウスCD45-APC(Becton Dickinson、カタログ#55
9864抗ヒトCD33-Pe(Becton Dickinson、カタログ#347
787)、抗ヒトCD19-FITC(Becton Dickinson、カタログ#
555422)、および抗ヒトCD3-PeCy7(Becton Dickinson
、カタログ#557851)。ヒトキメラ化が確認されれば、ヒト化NSGマウスに、試
験剤を腹膜内に1日2回投薬した。ヒトキメラ化の程度を、投薬後に再評価した。ヒトH
SCの有無を評価するために、マウスを安楽死させて、骨髄を単離して、以下の抗体で染
色した:抗ヒトCD45-e450(eBioscience、カタログ#48-045
9-42)、抗マウスCD45-APC(Becton Dickinson、カタログ
#559864)、抗ヒトCD34-PE(Becton Dickinson、カタロ
グ#348057)、抗ヒトCD38-FITC(Becton Dickinson、
カタログ#340926)、抗ヒトCD11b-PE(Becton Dickinso
n、カタログ#555388)、抗ヒトCD33-PeCy7(Becton Dick
inson、カタログ#333946)、抗ヒトCD19-FITC(Becton D
ickinson、カタログ#555412)、および抗ヒトCD3-PeCy7(Be
cton Dickinson、カタログ#557851)。細胞集団を、フローサイト
メトリを介して評価して、FlowJoで分析した。
2、もしくは4日間、1日2回、またはアイソタイプ対照結合体J8を4日間、1日2回
投薬した。マウスを21日目に安楽死させて、骨髄を分析した。図4に示すように、ビヒ
クル(PBS)処理群との比較に基づいて、結合体J7で処理したマウスは、1日であっ
ても、ヒトHSC(ヒトCD45+、ヒトCD34+、ヒトCD38-)の枯渇を示した
一方、アイソタイプ対照結合体J8で処理したマウスは、処理前のヒト化の変動におそら
く起因して、多様なキメラ化を示した。
しくはJ3を、またはアイソタイプ対照結合体J6を2日間投薬した。マウスを21日目
に安楽死させて、骨髄を分析した。図5に示すように、抗cKIT結合体J1、J2、ま
たはJ3で処理したマウスは、ヒトHSC(ヒトCD45+、ヒトCD34+、ヒトCD
38-)の低下を示した一方、アイソタイプ対照結合体J6で処理したマウスは、多様な
キメラ化を示した。
Y、またはJZを2日間投薬した。マウスを21日目に安楽死させて、骨髄を分析した。
図13に示すように、抗cKIT結合体JW、JX、JY、またはJZで処理したマウス
は、ヒトHSC(ヒトCD45+、ヒトCD34+、ヒトCD38-)の低下を示した。
b’-毒物結合体が、HSCを骨髄から枯渇させることができたことを示している。抗c
KIT Fab-アマニチン結合体(例えばJ7)および抗cKIT Fab’-オーリ
スタチン結合体(例えば、J1、J2、J3、JW、JX、JY)は、ヒトHSCをイン
ビボ除去することができた。
マウスHSCに対するインビボ有効性について試験剤を評価するために、C57BL/
6Jマウス(雄、10週齢、Jackson Laboratory、ストック#000
664)に、試験剤を腹膜内に1日2回投薬した。血液学的プロファイルを、標準的な方
法による最後の服用後1日という早い時期に、または最後の服用後の21日目まで、評価
した。マウスHSCの有無を評価するために、マウスを安楽死させて、骨髄を単離して、
以下の抗体で染色した:抗マウスCD45-PerCP-Cy5.5(Becton D
ickinson、カタログ#550994)、抗マウスcKIT-APC(Becto
n Dickinson、カタログ#553356)、抗マウスCD48-FITC(e
Bioscience、カタログ#11-0481-82)、抗マウスCD150-PE
(BioLegend、カタログ#115904)、抗マウスSca-V450(Bec
ton Dickinson、カタログ#560653)、抗マウスLin-ビオチン(
Miltenyi、カタログ#120-001-547)、およびPe-Cy7-ストレ
プトアビジン(Becton Dickinson、カタログ#557598)。細胞集
団を、フローサイトメトリを介して評価して、FlowJoで分析した。
5(表2に記載)、またはPBSを4日間、1日2回投薬した。13日目に、骨髄分析の
ために、マウスを安楽死させた。抗cKIT結合体J4またはJ5で処理した群は、PB
S処理済みの対照群と比較して、骨髄中の幹細胞および前駆体(cKIT+)細胞のレベ
ルの有意な低下を示した(図6)。このことは、抗cKIT Fab’-オーリスタチン
結合体、例えばJ4またはJ5による処理が、正常なマウスにおいてHSCをインビボで
除去することができたことを実証している。
るのに十分であるかを判定するために、上記のように処理したマウスにその後、HSCを
移植することができる。例えば、抗cKIT Fab’-毒物結合体で処理したCD45
.2マウスに、CD45.1マウス由来のドナーHSCを、投薬のおおよそ1週後に移植
することができる。別の例において、抗cKIT Fab’-毒物結合体で処理したマウ
スを、免疫抑制剤、例えば、T細胞枯渇を引き起こす剤で、投薬のおおよそ1週後に、そ
してCD45.1マウス由来のドナーHSCを移植するおおよそ1~2日前に処理するこ
とができる。T細胞枯渇の一方法が、マウスに、1マウスあたり0.5mgの抗マウスT
CRβ鎖抗体(クローンH57-597;Biolegend)を2日間、1日4回投薬
するものである。血液サンプルを、投薬後の血液学的プロファイリングのために採ること
によって、T細胞枯渇を確認することができる。そのような例において、血液サンプル中
のCD45.1キメラ化を探索することによって、移植の進行を監視することとなる。そ
のような例において、CD45.1 HSCおよびCD45.2 HSCの集団を探索す
る骨髄分析のために、移植のおおよそ3~4ヵ月後または5~6ヵ月後にマウスを安楽死
させることによって、移植の成功を判定することができる。これ以外にも、第1の移植、
および十分に照射した宿主マウスに実行した第2の移植の少なくとも4または6ヵ月後に
マウスを安楽死させて、第2の移植後の血液サンプル中のCD45.1キメラ化を探索す
ることによって、移植の成功を判定することができる。
メント、ならびにそれらの結合体による、ヒト肥満細胞脱顆粒のインビトロアッセイ
実施例6に記載するように、成熟肥満細胞を生成して、抗cKIT抗体、ならびにF(
ab’)2フラグメントおよびFabフラグメント、またはそれらの毒物結合体で試験し
た。
5C)および化合物(4)と結合したF(ab’4)2(HC-E152C)フラグメン
トは、架橋された場合に、肥満細胞脱顆粒を引き起こした一方、Fab4(HC-E15
2C)フラグメントは、試験した全ての濃度にて、肥満細胞脱顆粒をトリガしなかった。
図7D~図7Fは、完全長抗cKIT Ab3(HC-E152C-S375C)および
化合物(3)と結合したF(ab’3)2(HC-E152C)フラグメントが、架橋さ
れた場合に、肥満細胞脱顆粒を引き起こした一方、化合物(4)と結合したFab3(E
152C)フラグメントが、全ての試験した濃度にて、肥満細胞脱顆粒をトリガしなかっ
たことを示している。このことは、Fabフラグメントを認識する既存の抗薬物抗体を患
者が産生させ、またはこれを有する場合に観察され得るように、より大きな複合体に結合
かつ多量体化された場合でさえ、Fabフラグメントまたはその結合体が、肥満細胞脱顆
粒を引き起こさないことを示唆している。他方、F(ab’)2フラグメントおよび結合
体は、より大きな複合体に結合かつ多量体化された場合、完全長抗cKIT抗体と類似の
レベルにて肥満細胞脱顆粒を引き起こす。
abフラグメントによるヒト肥満細胞脱顆粒のインビトロアッセイ
実施例6に記載するように、成熟肥満細胞を生成して、抗cKIT抗体、ならびにF(
ab’)2フラグメントおよびFabフラグメントで試験した。
グメントは、架橋された場合に、肥満細胞脱顆粒を引き起こした一方、Fab4(HC-
E152C)フラグメントは、試験した全ての濃度にて、肥満細胞脱顆粒をトリガしなか
った。図8D~図8Fは、完全長抗cKIT Ab1およびF(ab’1)2フラグメン
トが、架橋された場合に、肥満細胞脱顆粒を引き起こした一方、Fab1(HC-E15
2C)フラグメントが、試験した全ての濃度にて、肥満細胞脱顆粒をトリガしなかったこ
とを示している。図8G~図8Iは、完全長抗cKIT Ab2およびF(ab’2)2
フラグメントが、架橋された場合に、肥満細胞脱顆粒を引き起こした一方、Fab2(H
C-E152C)フラグメントが、試験した全ての濃度にて、肥満細胞脱顆粒をトリガし
なかったことを示している。図8J~図8Lは、完全長抗cKIT Ab3およびF(a
b’3)2フラグメントが、架橋された場合に、肥満細胞脱顆粒を引き起こした一方、F
ab3(HC-E152C)フラグメントが、試験した全ての濃度にて、肥満細胞脱顆粒
をトリガしなかったことを示している。このことは、Fabフラグメントを認識する既存
の抗薬物抗体を患者が産生させ、またはこれを有する場合に観察され得るように、より大
きな複合体に結合かつ多量体化された場合でさえ、Fabフラグメントが、肥満細胞脱顆
粒を引き起こさないことを示唆している。他方、F(ab’)2フラグメントは、より大
きな複合体に結合かつ多量体化された場合、完全長抗cKIT抗体と類似のレベルにて肥
満細胞脱顆粒を引き起こす。
特定の実験において、C57BL/6J(CD45.2、雄、10週齢、Jackso
n Laboratory、ストック#000664)マウスに、背中の皮下に配置した
ミニポンプ(Alzet、カタログ#2001)内の2.5、5、または10mg/ml
抗c-KIT Fab’5-(1)(Fab’-DAR4)を投薬した。ミニポンプは、
200μlの容量を保持しており、7日にわたって1μl/時の一定の速度にて注入した
。ミニポンプを、埋め込んだ7日後に取り出して、それ以上の薬物の投与を停止した。ミ
ニポンプ取出しの48時間後に、マウスに、CD45(CD45.1、B6.SJL-P
tprca Pepcb/BoyJ、雄、10週齢、Jackson Laborato
ry、ストック#002014)でコンジェニックにマークされているドナーマウス由来
の骨髄を移植した。CD45.1キメラ化を1ヵ月間隔で探索することによって、移植の
進行を末梢血中で監視した。この実験では、血中キメラ化を、図10に示すように4ヵ月
間監視した。末梢血中のキメラ化を、フローサイトメトリによって評価した。血液サンプ
ルを、抗mCD45.1-PerCP-Cy5.5(1:100、BD#560580)
、抗mCD45.2-BUV395(1:100、BD#564616)、抗Mac-P
E(1:500、BD#553331)、抗GR1-FITC(1:100、BD#55
3127)、抗B220-APC(1:400、BD#553092)、および抗CD3
-V450(1:100、BD#560801)で染色して、Fortessaフローサ
イトメータ(Becton Dickinson)上で捕捉して、FlowJoソフトウ
ェア(TreeStar)で分析した。キメラ化のレベルを、CD45.2(宿主)また
はCD45.1(ドナー)について陽性である集団を比較することによって判定した。総
ドナーキメラ化は、全白血球集団を表した。加えて、T細胞、B細胞、および骨髄細胞の
亜集団をさらに、ドナーキメラ化について評価した。T細胞ドナーキメラ化は、CD3+
細胞におけるCD45.2(宿主)対CD45.1(ドナー)の調査に基づいた。B細胞
ドナーキメラ化は、CD45R+細胞におけるCD45.2(宿主)対CD45.1(ド
ナー)の調査に基づいた。骨髄キメラ化は、Mac-1+/Gr-1+細胞におけるCD
45.2(宿主)対CD45.2(ドナー)の調査に基づいた。この実験は、抗cKit
-Fab’結合体でコンディションを整えたマウスに、骨髄、B細胞、およびT細胞系統
を再構成するドナー細胞を植え付けて、HSC移植の成功が示され得ることを示している
。
Laboratory、ストック#000664)マウスに、背中の皮下に配置したミ
ニポンプ(Alzet、カタログ#2001)内の2.5、5、もしくは10mg/ml
抗c-KIT Fab’5-(1)(Fab’-DAR4)、または10mg/ml抗c
-KIT Fab’5-mc-MMAF(Fab’-DAR4)を投薬した。ミニポンプ
は、200μlの容量を保持しており、7日にわたって1μl/時の一定の速度にて注入
した。ミニポンプを、埋め込んだ5日後に取り出して、それ以上の薬物の投与を停止した
。ミニポンプ取出し後の24時間以内に、マウスに、CD45(CD45.1、B6.S
JL-Ptprca Pepcb/BoyJ、雄、10週齢、Jackson Labo
ratory、ストック#002014)でコンジェニックにマークされているドナーマ
ウス由来の骨髄を移植した。CD45.1キメラ化を1ヵ月間隔で探索することによって
、移植の進行を末梢血中で監視した。この実験では、血中キメラ化を、図11に示すよう
に2ヵ月間監視した。末梢血中のキメラ化を、フローサイトメトリによって評価した。血
液サンプルを、抗mCD45.1-PerCP-Cy5.5(1:100、BD#560
580)、抗mCD45.2-BUV395(1:100、BD#564616)、抗M
ac-PE(1:500、BD#553331)、抗GR1-FITC(1:100、B
D#553127)、抗B220-APC(1:400、BD#553092)、および
抗CD3-V450(1:100、BD#560801)で染色して、Fortessa
フローサイトメータ(Becton Dickinson)上で捕捉して、FlowJo
ソフトウェア(TreeStar)で分析した。キメラ化のレベルを、CD45.2(宿
主)またはCD45.1(ドナー)について陽性である集団を比較することによって判定
した。総ドナーキメラ化は、全白血球集団を表した。加えて、末梢血中の骨髄細胞をさら
に、ドナーキメラ化について評価した。骨髄キメラ化は、Mac-1+/Gr-1+細胞
におけるCD45.2(宿主)対CD45.2(ドナー)の調査に基づいた。この実験は
、抗cKit-Fab’結合体でコンディションを整えたマウスに、ドナー細胞を植え付
けて、致死照射でコンディションを整えたマウスと同程度の骨髄コンパートメントの再構
成が成功し得ることを示している(図11B)。抗cKitでコンディションを整えたマ
ウスの総ドナーキメラ化の、照射したマウスに対するレベルの低下(図11A)は、長命
のCD45.2+B細胞およびT細胞を循環系から除去しない抗cKitコンディション
調整剤のより的を絞った(more targeted)性質におそらく起因する。
Laboratory、ストック#000664)マウスを、300RADSで照射し
た。3日後、背中の皮下に配置したミニポンプ(Alzet、カタログ#2001)内の
2.5または5mg/ml抗c-KIT Fab’5-(1)(Fab’-DAR4)を
投薬した。1群を、照射のみで処理し、そして1群を、2.5mg/ml抗c-KIT
Fab’5-(1)(Fab’-DAR4)のみで処理した。ミニポンプは、200μl
の容量を保持しており、7日にわたって1μl/時の一定の速度にて注入した。ミニポン
プを、埋め込んだ3日後に取り出して、それ以上の薬物の投与を停止した。ミニポンプ取
出し後の48時間以内に、マウスに、CD45(CD45.1、B6.SJL-Ptpr
ca Pepcb/BoyJ、雄、10週齢、Jackson Laboratory、
ストック#002014)でコンジェニックにマークされるドナーマウス由来の骨髄を移
植した。CD45.1キメラ化を1ヵ月間隔で探索することによって、移植の進行を末梢
血中で監視した。この実験では、血中キメラ化を、図12に示すように4ヵ月間監視した
。末梢血中のキメラ化を、フローサイトメトリによって評価した。血液サンプルを、抗m
CD45.1-PerCP-Cy5.5(1:100、BD#560580)、抗mCD
45.2-BUV395(1:100、BD#564616)、抗Mac-PE(1:5
00、BD#553331)、抗GR1-FITC(1:100、BD#553127)
、抗B220-APC(1:400、BD#553092)、および抗CD3-V450
(1:100、BD#560801)で染色して、Fortessaフローサイトメータ
(Becton Dickinson)上で捕捉して、FlowJoソフトウェア(Tr
eeStar)で分析した。キメラ化のレベルを、CD45.2(宿主)またはCD45
.1(ドナー)について陽性である集団を比較することによって判定した。総ドナーキメ
ラ化は、全白血球集団を表した。加えて、末梢血中の骨髄細胞をさらに、ドナーキメラ化
について評価した。骨髄キメラ化は、Mac-1+/Gr-1+細胞におけるCD45.
2(宿主)対CD45.2(ドナー)の調査に基づいた。この実験は、抗cKit-Fa
b’結合体がコンディション調整剤として、他の剤、例えば低線量照射と組み合わせて用
いられ得ること、そしてこのようにコンディションを整えたマウスへのドナー細胞の移植
が成功し得ることを示している。
属する分野に精通する専門家によって通常理解されるのと同じ意味を有する。
よび操作は、当業者に明らかであるように、それ自体知られている様式で実行され得、か
つ実行されてきた。ここでも例えば、本明細書中に記載される標準的なハンドブックおよ
び一般的な背景技術を、そして本明細書中で引用される更なる参考文献を参照する。特に
明記されない限り、本明細書中で引用される参考文献はそれぞれ、その全体が参照によっ
て組み込まれる。
の目的でのみ一例とされており、添付される特許請求の範囲、またはあらゆる対応する更
なる出願の特許請求の範囲の主題の範囲に関して、限定となることは意図されていない。
特に、種々の置換、変更、および修飾が、特許請求の範囲によって定義されるように、本
開示の精神および範囲から逸脱することなく本開示になされてよいことが、本発明者らに
よって意図されている。核酸出発材料、注目するクローン、またはライブラリ型の選択は
、本明細書中に記載される態様の知識を有する当業者にとってルーチン作業であると考え
られる。他の態様、利点、および修飾が、以下の特許請求の範囲の範囲内であるとみなさ
れる。当業者であれば、ルーチンの実験のみを用いて、本明細書中に記載される本発明の
特定の態様の多くの均等物を認識するであろうし、かつ確認することができる。そのよう
な均等物は、以下の特許請求の範囲によって包含されることが意図される。後に出願され
る対応する出願における特許請求の範囲の再起案(Redrafting)は、種々の国
々の特許法による制限による場合があり、特許請求の範囲の主題を放棄するものと解釈さ
れるべきでない。
本願明細書に記載の発明は、以下の態様を包含し得る。
[1]
式(I)の結合体、またはその薬学的に許容可能な塩であって;
A-(L B -(D) n ) y
式(I);
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
L B は、リンカーであり;
Dは、細胞毒性剤であり;
nは、1から10の整数であり、
yは、1から10の整数である、結合体。
[2]
nは、1、2、3、4、5、6、7、または8である、上記[1]に記載の結合体。
[3]
yは、1、2、3、または4である、上記[1]に記載の結合体。
[4]
各Dは、オーリスタチン、アマニチン、マイタンシノイド、またはサポリンから独立して選択される細胞毒性剤である、上記[1]~[3]のいずれか一項に記載の結合体。
[5]
各Dは、オーリスタチン、アマニチン、またはマイタンシノイドから独立して選択される細胞毒性剤である、上記[1]~[4]のいずれか一項に記載の結合体。
[6]
各Dは、オーリスタチンまたはアマニチンから独立して選択される細胞毒性剤である、上記[1]~[5]のいずれか一項に記載の結合体。
[7]
各L B は、切断可能なリンカーまたは切断可能でないリンカーから独立して選択される、上記[1]~[6]のいずれか一項に記載の結合体。
[8]
各L B は、切断可能なリンカーである、上記[1]~[7]のいずれか一項に記載の結合体。
[9]
各L B は、切断可能でないリンカーである、上記[1]~[7]のいずれか一項に記載の結合体。
[10]
式(C)の構造を有し:
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
yは、1から10の整数であり;
R 2 は、C 1 ~C 6 アルキルであり;
L 20 は、-L 1 R 40 であり;
L 1 は、-((CH 2 ) m O) p (CH 2 ) m X 1 L 4 -、-((CH 2 ) m O) p (CH 2 ) m X 2 L 4 -、-((CH 2 ) m O) p (CH 2 ) m -、-(CH 2 ) m -、-(CH 2 ) m X 1 (CH 2 ) m -、-(CH 2 ) m NHC(=O)(CH 2 ) m -、-(CH 2 ) m NHC(=O)(CH 2 ) m C(=O)NH(CH 2 ) m -、-((CH 2 ) m O) p (CH 2 ) m NHC(=O)(CH 2 ) m 、-((CH 2 ) m O) p CH 2 ) m C(=O)NH(CH 2 ) m -、X 3 X 4 C(=O)((CH 2 ) m O) p (CH 2 ) m -、-X 3 X 4 C(=O)(CH 2 ) m -、-X 3 C(=O)(CH 2 ) n NHC(=O)(CH 2 ) m -、-X 3 C(=O)(CH 2 ) m NHC(=O)((CH 2 ) m O) p (CH 2 ) m -、-(CH 2 ) m C(R 7 ) 2 -、-(CH 2 ) m C(R 7 ) 2 SS(CH 2 ) m NHC(=O)(CH 2 ) m -、または-(CH 2 ) m X 3 C(=O)(CH 2 ) m NHC(=O)((CH 2 ) m O) p (CH 2 ) m -であり;
L 4 は、-((CH 2 ) m であり;
X 1 は、
であり、式中、 * は、L 4 に対する付着点を示し;
X 2 は、
であり、式中、 * は、L 4 に対する付着点を示し;
X 3 は、
であり;
X 4 は、
であり;
R 40 は、
-NR 7 C(=O)CH 2 -、-NHC(=O)CH 2 -、-S(=O) 2 CH 2 CH 2 -、-(CH 2 ) 2 S(=O) 2 CH 2 CH 2 -、-NR 7 S(=O) 2 CH 2 CH 2 、-NR 7 C(=O)CH 2 CH 2 -、-NH-、-C(=O)-、-NHC(=O)-、-CH 2 NHCH 2 CH 2 -、-NHCH 2 CH 2 -、-S-、
であり;
各R 7 は、HおよびC 1 ~C 6 アルキルから独立して選択され;
各R 10 は、H、C 1 ~C 6 アルキル、F、Cl、および-OHから独立して選択され;
各R 11 は、H、C 1 ~C 6 アルキル、F、Cl、-NH 2 、-OCH 3 、-OCH 2 CH 3 、-N(CH 3 ) 2 、-CN、-NO 2 、および-OHから独立して選択され;
各R 12 は、H、C 1~6 アルキル、フルオロ、-C(=O)OHで置換されたベンジルオキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC 1~4 アルコキシ、および-C(=O)OHで置換されたC 1~4 アルキルから独立して選択され;
各R 15 は、H、-CH 3 、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14から独立して選択される、結合体。
[11]
から選択される、上記[10]に記載の結合体。
[12]
式(D)の構造を有し:
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
yは、1から10の整数であり;
R 1 は、
であり;
R 2 は、C 1 ~C 6 アルキルであり;
L 30 は、-L 5 R 40 であり;
L 4 は、-((CH 2 ) m であり;
L 5 は、-NHS(=O) 2 (CH 2 ) m X 1 L 4 、-NH((CH 2 ) m O) p (CH 2 ) m X 1 L 4 -、-NH((CH 2 ) m O) p (CH 2 ) m X 2 L 4 -、-NH((CH 2 ) m O) p (CH 2 ) m -、-NH(CH 2 ) m -、-NH(CH 2 ) m X 1 (CH 2 ) m -、-NH(CH 2 ) m NHC(=O)(CH 2 ) m -、-NH(CH 2 ) m NHC(=O)(CH 2 ) m C(=O)NH(CH 2 ) m -、-NH((CH 2 ) m O) p (CH 2 ) m NHC(=O)(CH 2 ) m 、-NH((CH 2 ) m O) p CH 2 ) m C(=O)NH(CH 2 ) m -、-NH(CH 2 ) n C(R 7 ) 2 -、-NH(CH 2 ) m C(R 7 ) 2 SS(CH 2 ) m NHC(=O)(CH 2 ) m -、または-NH(CH 2 ) m X 3 C(=O)(CH 2 ) m NHC(=O)((CH 2 ) m O) p (CH 2 ) m -であり;
X 1 は、
であり、式中、 * は、L 4 に対する付着点を示し;
X 2 は、
であり、式中、 * は、L 4 に対する付着点を示し;
R 40 は、
-NR 7 C(=O)CH 2 -、-NHC(=O)CH 2 -、-S(=O) 2 CH 2 CH 2 -、-(CH 2 ) 2 S(=O) 2 CH 2 CH 2 -、-NR 7 S(=O) 2 CH 2 CH 2 、-NR 7 C(=O)CH 2 CH 2 -、-NH-、-C(=O)-、-NHC(=O)-、-CH 2 NHCH 2 CH 2 -、-NHCH 2 CH 2 -、-S-、
であり;
各R 7 は、HおよびC 1 ~C 6 アルキルから独立して選択され;
各R 10 は、H、C 1 ~C 6 アルキル、F、Cl、および-OHから独立して選択され;
各R 11 は、H、C 1 ~C 6 アルキル、F、Cl、-NH 2 、-OCH 3 、-OCH 2 CH 3 、-N(CH 3 ) 2 、-CN、-NO 2 、および-OHから独立して選択され;
各R 12 は、H、C 1~6 アルキル、フルオロ、-C(=O)OHで置換されたベンジルオキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC 1~4 アルコキシ、および-C(=O)OHで置換されたC 1~4 アルキルから独立して選択され;
各R 15 は、H、-CH 3 、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14から独立して選択される、結合体。
[13]
から選択される、上記[12]に記載の結合体。
[14]
式(E)の構造を有し:
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
yは、1から10の整数であり;
Xは、S(=O)、S(=O) 2 、またはSであり;
R 5 は、H、-CH 3 、または-CD 3 であり;
R 6 は、-NH 2 または-OHであり;
L 40 は、-L 6 R 40 であり;
L 6 は、-((CH 2 ) m O) p (CH 2 ) m X 1 L 4 -、-((CH 2 ) m O) p (CH 2 ) m X 2 L 4 -、-L 4 NHC(=O)NH((CH 2 ) m O) p (CH 2 ) m X 1 L 4 -、-L 4 NHC(=O)NH((CH 2 ) m O) p (CH 2 ) m X 2 L 4 -、-((CH 2 ) m O) p (CH 2 ) m -、-(CH 2 ) m -、-(CH 2 ) m X 1 (CH 2 ) m -、-(CH 2 ) m NHC(=O)(CH 2 ) m -、-(CH 2 ) m NHC(=O)(CH 2 ) m C(=O)NH(CH 2 ) m -、-((CH 2 ) m O) p (CH 2 ) m NHC(=O)(CH 2 ) m 、-((CH 2 ) m O) p CH 2 ) m C(=O)NH(CH 2 ) m -、-(CH 2 ) m C(R 7 ) 2 -、または-(CH 2 ) m C(R 7 ) 2 SS(CH 2 ) m NHC(=O)(CH 2 ) m -であり;
L 4 は、-((CH 2 ) m であり;
X 1 は、
であり、式中、 * は、L 4 に対する付着点を示し;
X 2 は、
であり、式中、 * は、L 4 に対する付着点を示し;
R 40 は、
-NR 7 C(=O)CH 2 -、-NHC(=O)CH 2 -、-S(=O) 2 CH 2 CH 2 -、-(CH 2 ) 2 S(=O) 2 CH 2 CH 2 -、-NR 7 S(=O) 2 CH 2 CH 2 、-NR 7 C(=O)CH 2 CH 2 -、-NH-、-C(=O)-、-NHC(=O)-、-CH 2 NHCH 2 CH 2 -、-NHCH 2 CH 2 -、-S-、
であり;
各R 7 は、HおよびC 1 ~C 6 アルキルから独立して選択され;
各R 10 は、H、C 1 ~C 6 アルキル、F、Cl、および-OHから独立して選択され;
各R 11 は、H、C 1 ~C 6 アルキル、F、Cl、-NH 2 、-OCH 3 、-OCH 2 CH 3 、-N(CH 3 ) 2 、-CN、-NO 2 、および-OHから独立して選択され;
各R 12 は、H、C 1~6 アルキル、フルオロ、-C(=O)OHで置換されたベンジルオキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC 1~4 アルコキシ、および-C(=O)OHで置換されたC 1~4 アルキルから独立して選択され;
各R 15 は、H、-CH 3 、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14から独立して選択される、結合体。
[15]
から選択される、上記[14]に記載の結合体。
[16]
から選択され、
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり、
yは、1から10の整数である、結合体。
[17]
から選択され、
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり、yは、1から10の整数である、結合体。
[18]
前記抗体フラグメントは、ヒトcKITの細胞外ドメイン(配列番号112)に特異的に結合する、上記[1]~[17]のいずれか一項に記載の結合体。
[19]
前記抗体フラグメントは、ヒトcKITのドメイン1~3(配列番号113)中のエピトープに特異的に結合する、上記[1]~[17]のいずれか一項に記載の結合体。
[20]
前記抗体フラグメントは、FabまたはFab’である、上記[1]~[19]のいずれか一項に記載の結合体。
[21]
前記抗体フラグメントは:
(1)(i)(a)配列番号1のHCDR1(重鎖相補性決定領域1);(b)配列番号2のHCDR2(重鎖相補性決定領域2);および(c)配列番号3のHCDR3(重鎖相補性決定領域3)を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCDR1(軽鎖相補性決定領域1);(e)配列番号17のLCDR2(軽鎖相補性決定領域2);および(f)配列番号18のLCDR3(軽鎖相補性決定領域3)を含む軽鎖可変領域を含むFabまたはFab’;
(2)(i)(a)配列番号4のHCDR1;(b)配列番号5のHCDR2;(c)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号19のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号21のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(3)(i)(a)配列番号6のHCDR1;(b)配列番号2のHCDR2;(c)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(4)(i)(a)配列番号7のHCDR1;(b)配列番号8のHCDR2;(c)配列番号9のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号22のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号18のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(5)(i)(a)配列番号27のHCDR1;(b)配列番号28のHCDR2;(c)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(6)(i)(a)配列番号30のHCDR1;(b)配列番号31のHCDR2;(c)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号44のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号45のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(7)(i)(a)配列番号32のHCDR1;(b)配列番号28のHCDR2;(c)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(8)(i)(a)配列番号33のHCDR1;(b)配列番号34のHCDR2;(c)配列番号35のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号46のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号43のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(9)(i)(a)配列番号1のHCDR1;(b)配列番号51のHCDR2;(c)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(10)(i)(a)配列番号4のHCDR1;(b)配列番号52のHCDR2;(c)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号19のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号21のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(11)(i)(a)配列番号6のHCDR1;(b)配列番号51のHCDR2;(c)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(12)(i)(a)配列番号7のHCDR1;(b)配列番号53のHCDR2;(c)配列番号9のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号22のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号18のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(13)(i)(a)配列番号60のHCDR1;(b)配列番号61のHCDR2;(c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号75のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(14)(i)(a)配列番号63のHCDR1;(b)配列番号64のHCDR2;(c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号78のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号80のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(15)(i)(a)配列番号65のHCDR1;(b)配列番号61のHCDR2;(c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号75のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(16)(i)(a)配列番号66のHCDR1;(b)配列番号67のHCDR2;(c)配列番号68のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号81のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号77のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(17)(i)(a)配列番号86のHCDR1;(b)配列番号87のHCDR2;(c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号101のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(18)(i)(a)配列番号89のHCDR1;(b)配列番号90のHCDR2;(c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号104のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号106のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(19)(i)(a)配列番号91のHCDR1;(b)配列番号87のHCDR2;(c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号101のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(20)(i)(a)配列番号92のHCDR1;(b)配列番号93のHCDR2;(c)配列番号94のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号107のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号103のLCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(21)配列番号10を含む重鎖可変領域(VH)、および配列番号23を含む軽鎖可変領域(VL)を含むFabまたはFab’;
(22)配列番号36を含むVH、および配列番号47を含むVLを含むFabまたはFab’;
(23)配列番号54を含むVH、および配列番号23を含むVLを含むFabまたはFab’;
(24)配列番号69を含むVH、および配列番号82を含むVLを含むFabまたはFab’;
(25)配列番号95を含むVH、および配列番号108を含むVLを含むFabまたはFab’;
(26)配列番号14を含む重鎖、および配列番号25を含む軽鎖を含むFab’;
(27)配列番号40を含む重鎖、および配列番号49を含む軽鎖を含むFab’;
(28)配列番号58を含む重鎖、および配列番号25を含む軽鎖を含むFab’;
(29)配列番号73を含む重鎖、および配列番号84を含む軽鎖を含むFab’;
(30)配列番号99を含む重鎖、および配列番号110を含む軽鎖を含むFab’;
(31)配列番号118を含む重鎖、および配列番号122を含む軽鎖を含むFab;
(32)配列番号118を含む重鎖、および配列番号123を含む軽鎖を含むFab;
(33)配列番号124を含む重鎖、および配列番号128を含む軽鎖を含むFab;
(34)配列番号124を含む重鎖、および配列番号129を含む軽鎖を含むFab;
(35)配列番号130を含む重鎖、および配列番号134を含む軽鎖を含むFab;
(36)配列番号130を含む重鎖、および配列番号135を含む軽鎖を含むFab;
(37)配列番号136を含む重鎖、および配列番号140を含む軽鎖を含むFab;
(38)配列番号141を含む重鎖、および配列番号145を含む軽鎖を含むFab;
(39)配列番号119、120、または121から選択されるアミノ酸配列を含む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含むFab;
(40)配列番号125、126、または127から選択されるアミノ酸配列を含む重鎖、および配列番号49のアミノ酸配列を含む軽鎖を含むFab;
(41)配列番号131、132、または133から選択されるアミノ酸配列を含む重鎖、および配列番号25のアミノ酸配列を含む軽鎖を含むFab;
(42)配列番号137、138、または139から選択されるアミノ酸配列を含む重鎖、および配列番号84のアミノ酸配列を含む軽鎖を含むFab;
(43)配列番号142、143、または144から選択されるアミノ酸配列を含む重鎖、および配列番号110のアミノ酸配列を含む軽鎖を含むFab;
のいずれかから選択される、上記[1]~[17]および上記[20]のいずれか一項に記載の結合体。
[22]
前記抗体フラグメントは、ヒトFabもしくはヒトFab’、またはヒト化Fabもしくはヒト化Fab’である、上記[1]~[21]のいずれか一項に記載の結合体。
[23]
前記抗体フラグメントは、Fab’であり、前記リンカー(L B )は、前記Fab’のヒンジ領域中の天然のシステイン残基に取り付けられている、上記[1]~[9]のいずれか一項に記載の結合体。
[24]
前記抗体フラグメントは、定常領域中に導入された少なくとも1つの非天然のシステイ
ンを含み、前記リンカー(L B )は、前記非天然のシステインに取り付けられている、請
求項[1]~[9]のいずれか一項に記載の結合体。
[25]
前記抗体フラグメントは、Fab’であり、L 20 が、前記Fab’のヒンジ領域中の天然のシステイン残基に取り付けられている、上記[10]、[11]、[14]、および[15]のいずれか一項に記載の結合体。
[26]
前記抗体フラグメントは、定常領域中に導入された少なくとも1つの非天然のシステインを含み、L 20 が、前記非天然のシステインに取り付けられている、上記[10]、[11]、[14]、および[15]のいずれか一項に記載の結合体。
[27]
前記抗体フラグメントは、Fab’であり、L 30 が、前記Fab’のヒンジ領域中の天然のシステイン残基に取り付けられている、上記[12]または[13]に記載の結合体。
[28]
前記抗体フラグメントは、定常領域中に導入された少なくとも1つの非天然のシステインを含み、L 30 が、前記非天然のシステインに取り付けられている、上記[12]または[13]に記載の結合体。
[29]
前記抗体フラグメントは、位置(全ての位置がEUナンバリングによる):
(a)重鎖の位置152、
(b)カッパ軽鎖の位置114もしくは165、または
(c)ラムダ軽鎖の位置143
の1つ以上にてシステインを含む、上記[24]、[26]、および[28]のいずれか一項に記載の結合体。
[30]
前記結合体の半減期は、約24~48時間未満である、上記[1]~[29]のいずれか一項に記載の結合体。
[31]
前記結合体は、肥満細胞脱顆粒を誘導しない、上記[1]~[30]のいずれか一項に記載の結合体。
[32]
上記[1]~[31]のいずれか一項に記載の結合体、および薬学的に許容可能なキャリアを含む医薬組成物。
[33]
別の治療薬をさらに含む、上記[32]に記載の医薬組成物。
[34]
前記組成物は、凍結乾燥品である、上記[32]に記載の医薬組成物。
[35]
造血幹細胞の除去を必要とする患者において造血幹細胞を除去する方法であって、前記患者に、上記[1]~[31]のいずれか一項に記載の結合体、または上記[32]もしくは[33]に記載の医薬組成物の有効な量を投与することを含む方法。
[36]
前記患者は、造血幹細胞移植レシピエントである、上記[35]に記載の方法。
[37]
前記方法は、前記患者への造血幹細胞移植前に実行される、上記[36]に記載の方法。
[38]
造血幹細胞移植患者のコンディションを整える方法であって:前記患者に、上記[1]~[31]のいずれか一項に記載の結合体、または上記[32]もしくは[33]に記載の医薬組成物の有効な量を投与することと、前記患者に造血幹細胞移植を実行する前に、前記結合体による、前記患者の循環系からの一掃のための十分な期間を許容することとを含む方法。
[39]
前記患者は、遺伝性の免疫不全疾患、自己免疫疾患、造血障害、または先天性代謝異常を有する、上記[35]~[38]のいずれか一項に記載の方法。
[40]
前記造血障害は:急性骨髄性白血病(AML)、急性リンパ芽球性白血病(ALL)、急性単球白血病(AMoL)、慢性骨髄性白血病(CML)、慢性リンパ性白血病(CLL)、骨髄増殖性疾患、骨髄異形成症候群、多発性骨髄腫、非ホジキンリンパ腫、ホジキン病、無形成性貧血、赤芽球癆、発作性夜間ヘモグロビン尿症、ファンコーニ貧血、サラセミアメジャー、鎌状赤血球貧血、重症複合型免疫不全、ウィスコット・アルドリッチ症候群、血球貪食性リンパ組織球増多症から選択される、上記[39]に記載の方法。
[41]
前記先天性代謝異常は、ムコ多糖症、ゴーシェ病、異染性ロイコジストロフィ、または副腎脳白質ジストロフィから選択される、上記[39]に記載の方法。
[42]
前記患者は、重症無形成性貧血(SAA)、ウィスコット・アルドリッチ症候群、ハーラー症候群、FHL、CGD、コストマン症候群、重症免疫不全症候群(SCID)、他の自己免疫疾患、例えばSLE、多発性硬化症、IBD、クローン病、シェーグレン症候群、脈管炎、狼瘡、重症性筋無力症、ウェゲナー病、先天性代謝異常、および/または他の免疫不全から選択される非悪性疾患または症状を有する、上記[35]~[38]のいずれか一項に記載の方法。
[43]
前記患者は、骨髄異形成症候群(MDS)、急性リンパ芽球性白血病(ALL)、急性骨髄性白血病(AML)、急性単球白血病(AMoL)、慢性リンパ性白血病(CLL)、慢性骨髄性白血病(CML)、有毛細胞白血病(HCL)、T細胞前リンパ球性白血病(T-PLL)、大型顆粒リンパ性白血病、成人T細胞白血病、前駆体T細胞白血病/リンパ腫、バーキットリンパ腫、濾胞性リンパ腫、びまん性大細胞型B細胞性リンパ腫、マントル細胞リンパ腫、B細胞慢性リンパ性白血病/リンパ腫、MALTリンパ腫、菌状息肉腫、末梢T細胞リンパ腫、他に規定されない限り、ホジキンリンパ腫のホジキンリンパ腫混合細胞亜型の結節性硬化症形態から選択される悪性疾患または症状を有する、上記[35]~[38]のいずれか一項に記載の方法。
[44]
造血幹細胞の除去を必要とする患者において造血幹細胞を除去するための、上記[1]~[31]のいずれか一項に記載の結合体、または上記[31]もしくは[32]に記載の医薬組成物の使用。
[45]
造血幹細胞の除去を必要とする患者において造血幹細胞を除去するための医薬の製造における、上記[1]~[31]のいずれか一項に記載の結合体、または上記[31]もしくは[32]に記載の医薬組成物の使用。
[46]
ヒトcKITに特異的に結合する抗体または抗体フラグメントであって、前記抗体または前記抗体フラグメントは:
(1)(i)(a)配列番号1のHCDR1(重鎖相補性決定領域1);(b)配列番号2のHCDR2(重鎖相補性決定領域2);および(c)配列番号3のHCDR3(重鎖相補性決定領域3)を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCDR1(軽鎖相補性決定領域1);(e)配列番号17のLCDR2(軽鎖相補性決定領域2);および(f)配列番号18のLCDR3(軽鎖相補性決定領域3)を含む抗体もしくは抗体フラグメント;
(2)(i)(a)配列番号4のHCDR1;(b)配列番号5のHCDR2;(c)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号19のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号21のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(3)(i)(a)配列番号6のHCDR1;(b)配列番号2のHCDR2;(c)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(4)(i)(a)配列番号7のHCDR1;(b)配列番号8のHCDR2;(c)配列番号9のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号22のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号18のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(5)(i)(a)配列番号27のHCDR1;(b)配列番号28のHCDR2;(c)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(6)(i)(a)配列番号30のHCDR1;(b)配列番号31のHCDR2;(c)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号44のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号45のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(7)(i)(a)配列番号32のHCDR1;(b)配列番号28のHCDR2;(c)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(8)(i)(a)配列番号33のHCDR1;(b)配列番号34のHCDR2;(c)配列番号35のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号46のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号43のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(9)(i)(a)配列番号60のHCDR1;(b)配列番号61のHCDR2;(c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号75のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(10)(i)(a)配列番号63のHCDR1;(b)配列番号64のHCDR2;(c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号78のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号80のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(11)(i)(a)配列番号65のHCDR1;(b)配列番号61のHCDR2;(c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号75のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(12)(i)(a)配列番号66のHCDR1;(b)配列番号67のHCDR2;(c)配列番号68のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号81のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号77のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(13)(i)(a)配列番号86のHCDR1;(b)配列番号87のHCDR2;(c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号101のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(14)(i)(a)配列番号89のHCDR1;(b)配列番号90のHCDR2;(c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号104のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号106のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(15)(i)(a)配列番号91のHCDR1;(b)配列番号87のHCDR2;(c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号101のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(16)(i)(a)配列番号92のHCDR1;(b)配列番号93のHCDR2;(c)配列番号94のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号107のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号103のLCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(17)配列番号10を含む重鎖可変領域(VH)、および配列番号23を含む軽鎖可変領域(VL)を含む抗体もしくは抗体フラグメント;
(18)配列番号36を含むVH、および配列番号47を含むVLを含む抗体もしくは抗体フラグメント;
(19)配列番号69を含むVH、および配列番号82を含むVLを含む抗体もしくは抗体フラグメント;
(20)配列番号95を含むVH、および配列番号108を含むVLを含む抗体もしくは抗体フラグメント;
(21)配列番号14を含む重鎖、および配列番号25を含む軽鎖を含む抗体もしくは抗体フラグメント;
(22)配列番号40を含む重鎖、および配列番号49を含む軽鎖を含む抗体もしくは抗体フラグメント;
(23)配列番号73を含む重鎖、および配列番号84を含む軽鎖を含む抗体もしくは抗体フラグメント;
(24)配列番号99を含む重鎖、および配列番号110を含む軽鎖を含む抗体もしくは抗体フラグメント;
(25)配列番号118を含む重鎖、および配列番号122を含む軽鎖を含む抗体もしくは抗体フラグメント;
(26)配列番号118を含む重鎖、および配列番号123を含む軽鎖を含む抗体もしくは抗体フラグメント;
(27)配列番号124を含む重鎖、および配列番号128を含む軽鎖を含む抗体もしくは抗体フラグメント;
(28)配列番号124を含む重鎖、および配列番号129を含む軽鎖を含む抗体もしくは抗体フラグメント;
(29)配列番号130を含む重鎖、および配列番号134を含む軽鎖を含む抗体もしくは抗体フラグメント;
(30)配列番号130を含む重鎖、および配列番号135を含む軽鎖を含む抗体もしくは抗体フラグメント;
(31)配列番号136を含む重鎖、および配列番号140を含む軽鎖を含む抗体もしくは抗体フラグメント;
(32)配列番号141を含む重鎖、および配列番号145を含む軽鎖を含む抗体もしくは抗体フラグメント;
(33)配列番号12を含む重鎖、および配列番号25を含む軽鎖を含む抗体;
(34)配列番号38を含む重鎖、および配列番号49を含む軽鎖を含む抗体;
(35)配列番号71を含む重鎖、および配列番号84を含む軽鎖を含む抗体;または
(36)配列番号97を含む重鎖、および配列番号110を含む軽鎖を含む抗体
のいずれかから選択される、抗体または抗体フラグメント。
[47]
上記[46]に記載の抗体または抗体フラグメントをコードする核酸。
[48]
上記[47]に記載の核酸を含むベクター。
[49]
上記[48]に記載のベクターを含む宿主細胞。
[50]
抗体または抗体フラグメントを生成するプロセスであって、上記[49]に記載の宿主細胞を培養することと、前記培養から前記抗体または前記抗体フラグメントを回収することとを含むプロセス。
Claims (50)
- 式(I)の結合体、またはその薬学的に許容可能な塩であって;
A-(LB-(D)n)y
式(I);
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
LBは、リンカーであり;
Dは、細胞毒性剤であり;
nは、1から10の整数であり、
yは、1から10の整数である、結合体。 - nは、1、2、3、4、5、6、7、または8である、請求項1に記載の結合体。
- yは、1、2、3、または4である、請求項1に記載の結合体。
- 各Dは、オーリスタチン、アマニチン、マイタンシノイド、またはサポリンから独立し
て選択される細胞毒性剤である、請求項1~3のいずれか一項に記載の結合体。 - 各Dは、オーリスタチン、アマニチン、またはマイタンシノイドから独立して選択され
る細胞毒性剤である、請求項1~4のいずれか一項に記載の結合体。 - 各Dは、オーリスタチンまたはアマニチンから独立して選択される細胞毒性剤である、
請求項1~5のいずれか一項に記載の結合体。 - 各LBは、切断可能なリンカーまたは切断可能でないリンカーから独立して選択される
、請求項1~6のいずれか一項に記載の結合体。 - 各LBは、切断可能なリンカーである、請求項1~7のいずれか一項に記載の結合体。
- 各LBは、切断可能でないリンカーである、請求項1~7のいずれか一項に記載の結合
体。 - 式(C)の構造を有し:
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
yは、1から10の整数であり;
R2は、C1~C6アルキルであり;
L20は、-L1R40であり;
L1は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-((CH2)mO)p(CH2)m-、-(CH2)m-、-(
CH2)mX1(CH2)m-、-(CH2)mNHC(=O)(CH2)m-、-(C
H2)mNHC(=O)(CH2)mC(=O)NH(CH2)m-、-((CH2)m
O)p(CH2)mNHC(=O)(CH2)m、-((CH2)mO)pCH2)mC
(=O)NH(CH2)m-、X3X4C(=O)((CH2)mO)p(CH2)m-
、-X3X4C(=O)(CH2)m-、-X3C(=O)(CH2)nNHC(=O)
(CH2)m-、-X3C(=O)(CH2)mNHC(=O)((CH2)mO)p(
CH2)m-、-(CH2)mC(R7)2-、-(CH2)mC(R7)2SS(CH
2)mNHC(=O)(CH2)m-、または-(CH2)mX3C(=O)(CH2)
mNHC(=O)((CH2)mO)p(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
であり、式中、*は、L4に対する付着点を示し;
X2は、
であり、式中、*は、L4に対する付着点を示し;
X3は、
であり;
X4は、
であり;
R40は、
-NR7C(=O)CH2-、-NHC(=O)CH2-、-S(=O)2CH2CH2
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
であり;
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各R15は、H、-CH3、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される、結合体。 - 式(D)の構造を有し:
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
yは、1から10の整数であり;
R1は、
であり;
R2は、C1~C6アルキルであり;
L30は、-L5R40であり;
L4は、-((CH2)mであり;
L5は、-NHS(=O)2(CH2)mX1L4、-NH((CH2)mO)p(CH
2)mX1L4-、-NH((CH2)mO)p(CH2)mX2L4-、-NH((C
H2)mO)p(CH2)m-、-NH(CH2)m-、-NH(CH2)mX1(CH
2)m-、-NH(CH2)mNHC(=O)(CH2)m-、-NH(CH2)mNH
C(=O)(CH2)mC(=O)NH(CH2)m-、-NH((CH2)mO)p(
CH2)mNHC(=O)(CH2)m、-NH((CH2)mO)pCH2)mC(=
O)NH(CH2)m-、-NH(CH2)nC(R7)2-、-NH(CH2)mC(
R7)2SS(CH2)mNHC(=O)(CH2)m-、または-NH(CH2)mX
3C(=O)(CH2)mNHC(=O)((CH2)mO)p(CH2)m-であり;
X1は、
であり、式中、*は、L4に対する付着点を示し;
X2は、
であり、式中、*は、L4に対する付着点を示し;
R40は、
-NR7C(=O)CH2-、-NHC(=O)CH2-、-S(=O)2CH2CH2
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
であり;
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各R15は、H、-CH3、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される、結合体。 - 式(E)の構造を有し:
式中:
Aは、ヒトcKITに特異的に結合する抗体フラグメントであり;
yは、1から10の整数であり;
Xは、S(=O)、S(=O)2、またはSであり;
R5は、H、-CH3、または-CD3であり;
R6は、-NH2または-OHであり;
L40は、-L6R40であり;
L6は、-((CH2)mO)p(CH2)mX1L4-、-((CH2)mO)p(C
H2)mX2L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX1
L4-、-L4NHC(=O)NH((CH2)mO)p(CH2)mX2L4-、-(
(CH2)mO)p(CH2)m-、-(CH2)m-、-(CH2)mX1(CH2)
m-、-(CH2)mNHC(=O)(CH2)m-、-(CH2)mNHC(=O)(
CH2)mC(=O)NH(CH2)m-、-((CH2)mO)p(CH2)mNHC
(=O)(CH2)m、-((CH2)mO)pCH2)mC(=O)NH(CH2)m
-、-(CH2)mC(R7)2-、または-(CH2)mC(R7)2SS(CH2)
mNHC(=O)(CH2)m-であり;
L4は、-((CH2)mであり;
X1は、
であり、式中、*は、L4に対する付着点を示し;
X2は、
であり、式中、*は、L4に対する付着点を示し;
R40は、
-NR7C(=O)CH2-、-NHC(=O)CH2-、-S(=O)2CH2CH2
-、-(CH2)2S(=O)2CH2CH2-、-NR7S(=O)2CH2CH2、
-NR7C(=O)CH2CH2-、-NH-、-C(=O)-、-NHC(=O)-、
-CH2NHCH2CH2-、-NHCH2CH2-、-S-、
であり;
各R7は、HおよびC1~C6アルキルから独立して選択され;
各R10は、H、C1~C6アルキル、F、Cl、および-OHから独立して選択され;
各R11は、H、C1~C6アルキル、F、Cl、-NH2、-OCH3、-OCH2C
H3、-N(CH3)2、-CN、-NO2、および-OHから独立して選択され;
各R12は、H、C1~6アルキル、フルオロ、-C(=O)OHで置換されたベンジル
オキシ、-C(=O)OHで置換されたベンジル、-C(=O)OHで置換されたC1~
4アルコキシ、および-C(=O)OHで置換されたC1~4アルキルから独立して選択
され;
各R15は、H、-CH3、およびフェニルから独立して選択され;
各mは、1、2、3、4、5、6、7、8、9、および10から独立して選択され、
各pは、1、2、3、4、5、6、7、8、9、10、11、12、13、および14か
ら独立して選択される、結合体。 - 前記抗体フラグメントは、ヒトcKITの細胞外ドメイン(配列番号112)に特異的
に結合する、請求項1~17のいずれか一項に記載の結合体。 - 前記抗体フラグメントは、ヒトcKITのドメイン1~3(配列番号113)中のエピ
トープに特異的に結合する、請求項1~17のいずれか一項に記載の結合体。 - 前記抗体フラグメントは、FabまたはFab’である、請求項1~19のいずれか一
項に記載の結合体。 - 前記抗体フラグメントは:
(1)(i)(a)配列番号1のHCDR1(重鎖相補性決定領域1);(b)配列番号
2のHCDR2(重鎖相補性決定領域2);および(c)配列番号3のHCDR3(重鎖
相補性決定領域3)を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCD
R1(軽鎖相補性決定領域1);(e)配列番号17のLCDR2(軽鎖相補性決定領域
2);および(f)配列番号18のLCDR3(軽鎖相補性決定領域3)を含む軽鎖可変
領域を含むFabまたはFab’;
(2)(i)(a)配列番号4のHCDR1;(b)配列番号5のHCDR2;(c)配
列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号19のLC
DR1;(e)配列番号20のLCDR2;および(f)配列番号21のLCDR3を含
む軽鎖可変領域を含むFabまたはFab’;
(3)(i)(a)配列番号6のHCDR1;(b)配列番号2のHCDR2;(c)配
列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLC
DR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3を含
む軽鎖可変領域を含むFabまたはFab’;
(4)(i)(a)配列番号7のHCDR1;(b)配列番号8のHCDR2;(c)配
列番号9のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号22のLC
DR1;(e)配列番号20のLCDR2;および(f)配列番号18のLCDR3を含
む軽鎖可変領域を含むFabまたはFab’;
(5)(i)(a)配列番号27のHCDR1;(b)配列番号28のHCDR2;(c
)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42
のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR
3を含む軽鎖可変領域を含むFabまたはFab’;
(6)(i)(a)配列番号30のHCDR1;(b)配列番号31のHCDR2;(c
)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号44
のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号45のLCDR
3を含む軽鎖可変領域を含むFabまたはFab’;
(7)(i)(a)配列番号32のHCDR1;(b)配列番号28のHCDR2;(c
)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42
のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR
3を含む軽鎖可変領域を含むFabまたはFab’;
(8)(i)(a)配列番号33のHCDR1;(b)配列番号34のHCDR2;(c
)配列番号35のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号46
のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号43のLCDR
3を含む軽鎖可変領域を含むFabまたはFab’;
(9)(i)(a)配列番号1のHCDR1;(b)配列番号51のHCDR2;(c)
配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16のL
CDR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3を
含む軽鎖可変領域を含むFabまたはFab’;
(10)(i)(a)配列番号4のHCDR1;(b)配列番号52のHCDR2;(c
)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号19の
LCDR1;(e)配列番号20のLCDR2;および(f)配列番号21のLCDR3
を含む軽鎖可変領域を含むFabまたはFab’;
(11)(i)(a)配列番号6のHCDR1;(b)配列番号51のHCDR2;(c
)配列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16の
LCDR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3
を含む軽鎖可変領域を含むFabまたはFab’;
(12)(i)(a)配列番号7のHCDR1;(b)配列番号53のHCDR2;(c
)配列番号9のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号22の
LCDR1;(e)配列番号20のLCDR2;および(f)配列番号18のLCDR3
を含む軽鎖可変領域を含むFabまたはFab’;
(13)(i)(a)配列番号60のHCDR1;(b)配列番号61のHCDR2;(
c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号7
5のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCD
R3を含む軽鎖可変領域を含むFabまたはFab’;
(14)(i)(a)配列番号63のHCDR1;(b)配列番号64のHCDR2;(
c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号7
8のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号80のLCD
R3を含む軽鎖可変領域を含むFabまたはFab’;
(15)(i)(a)配列番号65のHCDR1;(b)配列番号61のHCDR2;(
c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号7
5のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCD
R3を含む軽鎖可変領域を含むFabまたはFab’;
(16)(i)(a)配列番号66のHCDR1;(b)配列番号67のHCDR2;(
c)配列番号68のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号8
1のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号77のLCD
R3を含む軽鎖可変領域を含むFabまたはFab’;
(17)(i)(a)配列番号86のHCDR1;(b)配列番号87のHCDR2;(
c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
01のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103の
LCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(18)(i)(a)配列番号89のHCDR1;(b)配列番号90のHCDR2;(
c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
04のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号106の
LCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(19)(i)(a)配列番号91のHCDR1;(b)配列番号87のHCDR2;(
c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
01のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103の
LCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(20)(i)(a)配列番号92のHCDR1;(b)配列番号93のHCDR2;(
c)配列番号94のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
07のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号103の
LCDR3を含む軽鎖可変領域を含むFabまたはFab’;
(21)配列番号10を含む重鎖可変領域(VH)、および配列番号23を含む軽鎖可変
領域(VL)を含むFabまたはFab’;
(22)配列番号36を含むVH、および配列番号47を含むVLを含むFabまたはF
ab’;
(23)配列番号54を含むVH、および配列番号23を含むVLを含むFabまたはF
ab’;
(24)配列番号69を含むVH、および配列番号82を含むVLを含むFabまたはF
ab’;
(25)配列番号95を含むVH、および配列番号108を含むVLを含むFabまたは
Fab’;
(26)配列番号14を含む重鎖、および配列番号25を含む軽鎖を含むFab’;
(27)配列番号40を含む重鎖、および配列番号49を含む軽鎖を含むFab’;
(28)配列番号58を含む重鎖、および配列番号25を含む軽鎖を含むFab’;
(29)配列番号73を含む重鎖、および配列番号84を含む軽鎖を含むFab’;
(30)配列番号99を含む重鎖、および配列番号110を含む軽鎖を含むFab’;
(31)配列番号118を含む重鎖、および配列番号122を含む軽鎖を含むFab;
(32)配列番号118を含む重鎖、および配列番号123を含む軽鎖を含むFab;
(33)配列番号124を含む重鎖、および配列番号128を含む軽鎖を含むFab;
(34)配列番号124を含む重鎖、および配列番号129を含む軽鎖を含むFab;
(35)配列番号130を含む重鎖、および配列番号134を含む軽鎖を含むFab;
(36)配列番号130を含む重鎖、および配列番号135を含む軽鎖を含むFab;
(37)配列番号136を含む重鎖、および配列番号140を含む軽鎖を含むFab;
(38)配列番号141を含む重鎖、および配列番号145を含む軽鎖を含むFab;
(39)配列番号119、120、または121から選択されるアミノ酸配列を含む重鎖
、および配列番号25のアミノ酸配列を含む軽鎖を含むFab;
(40)配列番号125、126、または127から選択されるアミノ酸配列を含む重鎖
、および配列番号49のアミノ酸配列を含む軽鎖を含むFab;
(41)配列番号131、132、または133から選択されるアミノ酸配列を含む重鎖
、および配列番号25のアミノ酸配列を含む軽鎖を含むFab;
(42)配列番号137、138、または139から選択されるアミノ酸配列を含む重鎖
、および配列番号84のアミノ酸配列を含む軽鎖を含むFab;
(43)配列番号142、143、または144から選択されるアミノ酸配列を含む重鎖
、および配列番号110のアミノ酸配列を含む軽鎖を含むFab;
のいずれかから選択される、請求項1~17および請求項20のいずれか一項に記載の結
合体。 - 前記抗体フラグメントは、ヒトFabもしくはヒトFab’、またはヒト化Fabもし
くはヒト化Fab’である、請求項1~21のいずれか一項に記載の結合体。 - 前記抗体フラグメントは、Fab’であり、前記リンカー(LB)は、前記Fab’の
ヒンジ領域中の天然のシステイン残基に取り付けられている、請求項1~9のいずれか一
項に記載の結合体。 - 前記抗体フラグメントは、定常領域中に導入された少なくとも1つの非天然のシステイ
ンを含み、前記リンカー(LB)は、前記非天然のシステインに取り付けられている、請
求項1~9のいずれか一項に記載の結合体。 - 前記抗体フラグメントは、Fab’であり、L20が、前記Fab’のヒンジ領域中の
天然のシステイン残基に取り付けられている、請求項10、11、14、および15のい
ずれか一項に記載の結合体。 - 前記抗体フラグメントは、定常領域中に導入された少なくとも1つの非天然のシステイ
ンを含み、L20が、前記非天然のシステインに取り付けられている、請求項10、11
、14、および15のいずれか一項に記載の結合体。 - 前記抗体フラグメントは、Fab’であり、L30が、前記Fab’のヒンジ領域中の
天然のシステイン残基に取り付けられている、請求項12または13に記載の結合体。 - 前記抗体フラグメントは、定常領域中に導入された少なくとも1つの非天然のシステイ
ンを含み、L30が、前記非天然のシステインに取り付けられている、請求項12または
13に記載の結合体。 - 前記抗体フラグメントは、位置(全ての位置がEUナンバリングによる):
(a)重鎖の位置152、
(b)カッパ軽鎖の位置114もしくは165、または
(c)ラムダ軽鎖の位置143
の1つ以上にてシステインを含む、請求項24、26、および28のいずれか一項に記載
の結合体。 - 前記結合体の半減期は、約24~48時間未満である、請求項1~29のいずれか一項
に記載の結合体。 - 前記結合体は、肥満細胞脱顆粒を誘導しない、請求項1~30のいずれか一項に記載の
結合体。 - 請求項1~31のいずれか一項に記載の結合体、および薬学的に許容可能なキャリアを
含む医薬組成物。 - 別の治療薬をさらに含む、請求項32に記載の医薬組成物。
- 前記組成物は、凍結乾燥品である、請求項32に記載の医薬組成物。
- 造血幹細胞の除去を必要とする患者において造血幹細胞を除去する方法であって、前記
患者に、請求項1~31のいずれか一項に記載の結合体、または請求項32もしくは33
に記載の医薬組成物の有効な量を投与することを含む方法。 - 前記患者は、造血幹細胞移植レシピエントである、請求項35に記載の方法。
- 前記方法は、前記患者への造血幹細胞移植前に実行される、請求項36に記載の方法。
- 造血幹細胞移植患者のコンディションを整える方法であって:前記患者に、請求項1~
31のいずれか一項に記載の結合体、または請求項32もしくは33に記載の医薬組成物
の有効な量を投与することと、前記患者に造血幹細胞移植を実行する前に、前記結合体に
よる、前記患者の循環系からの一掃のための十分な期間を許容することとを含む方法。 - 前記患者は、遺伝性の免疫不全疾患、自己免疫疾患、造血障害、または先天性代謝異常
を有する、請求項35~38のいずれか一項に記載の方法。 - 前記造血障害は:急性骨髄性白血病(AML)、急性リンパ芽球性白血病(ALL)、
急性単球白血病(AMoL)、慢性骨髄性白血病(CML)、慢性リンパ性白血病(CL
L)、骨髄増殖性疾患、骨髄異形成症候群、多発性骨髄腫、非ホジキンリンパ腫、ホジキ
ン病、無形成性貧血、赤芽球癆、発作性夜間ヘモグロビン尿症、ファンコーニ貧血、サラ
セミアメジャー、鎌状赤血球貧血、重症複合型免疫不全、ウィスコット・アルドリッチ症
候群、血球貪食性リンパ組織球増多症から選択される、請求項39に記載の方法。 - 前記先天性代謝異常は、ムコ多糖症、ゴーシェ病、異染性ロイコジストロフィ、または
副腎脳白質ジストロフィから選択される、請求項39に記載の方法。 - 前記患者は、重症無形成性貧血(SAA)、ウィスコット・アルドリッチ症候群、ハー
ラー症候群、FHL、CGD、コストマン症候群、重症免疫不全症候群(SCID)、他
の自己免疫疾患、例えばSLE、多発性硬化症、IBD、クローン病、シェーグレン症候
群、脈管炎、狼瘡、重症性筋無力症、ウェゲナー病、先天性代謝異常、および/または他
の免疫不全から選択される非悪性疾患または症状を有する、請求項35~38のいずれか
一項に記載の方法。 - 前記患者は、骨髄異形成症候群(MDS)、急性リンパ芽球性白血病(ALL)、急性
骨髄性白血病(AML)、急性単球白血病(AMoL)、慢性リンパ性白血病(CLL)
、慢性骨髄性白血病(CML)、有毛細胞白血病(HCL)、T細胞前リンパ球性白血病
(T-PLL)、大型顆粒リンパ性白血病、成人T細胞白血病、前駆体T細胞白血病/リ
ンパ腫、バーキットリンパ腫、濾胞性リンパ腫、びまん性大細胞型B細胞性リンパ腫、マ
ントル細胞リンパ腫、B細胞慢性リンパ性白血病/リンパ腫、MALTリンパ腫、菌状息
肉腫、末梢T細胞リンパ腫、他に規定されない限り、ホジキンリンパ腫のホジキンリンパ
腫混合細胞亜型の結節性硬化症形態から選択される悪性疾患または症状を有する、請求項
35~38のいずれか一項に記載の方法。 - 造血幹細胞の除去を必要とする患者において造血幹細胞を除去するための、請求項1~
31のいずれか一項に記載の結合体、または請求項31もしくは32に記載の医薬組成物
の使用。 - 造血幹細胞の除去を必要とする患者において造血幹細胞を除去するための医薬の製造に
おける、請求項1~31のいずれか一項に記載の結合体、または請求項31もしくは32
に記載の医薬組成物の使用。 - ヒトcKITに特異的に結合する抗体または抗体フラグメントであって、前記抗体また
は前記抗体フラグメントは:
(1)(i)(a)配列番号1のHCDR1(重鎖相補性決定領域1);(b)配列番号
2のHCDR2(重鎖相補性決定領域2);および(c)配列番号3のHCDR3(重鎖
相補性決定領域3)を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLCD
R1(軽鎖相補性決定領域1);(e)配列番号17のLCDR2(軽鎖相補性決定領域
2);および(f)配列番号18のLCDR3(軽鎖相補性決定領域3)を含む抗体もし
くは抗体フラグメント;
(2)(i)(a)配列番号4のHCDR1;(b)配列番号5のHCDR2;(c)配
列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号19のLC
DR1;(e)配列番号20のLCDR2;および(f)配列番号21のLCDR3を含
む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(3)(i)(a)配列番号6のHCDR1;(b)配列番号2のHCDR2;(c)配
列番号3のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号16のLC
DR1;(e)配列番号17のLCDR2;および(f)配列番号18のLCDR3を含
む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(4)(i)(a)配列番号7のHCDR1;(b)配列番号8のHCDR2;(c)配
列番号9のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号22のLC
DR1;(e)配列番号20のLCDR2;および(f)配列番号18のLCDR3を含
む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(5)(i)(a)配列番号27のHCDR1;(b)配列番号28のHCDR2;(c
)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42
のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR
3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(6)(i)(a)配列番号30のHCDR1;(b)配列番号31のHCDR2;(c
)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号44
のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号45のLCDR
3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(7)(i)(a)配列番号32のHCDR1;(b)配列番号28のHCDR2;(c
)配列番号29のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号42
のLCDR1;(e)配列番号17のLCDR2;および(f)配列番号43のLCDR
3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(8)(i)(a)配列番号33のHCDR1;(b)配列番号34のHCDR2;(c
)配列番号35のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号46
のLCDR1;(e)配列番号20のLCDR2;および(f)配列番号43のLCDR
3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(9)(i)(a)配列番号60のHCDR1;(b)配列番号61のHCDR2;(c
)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号75
のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCDR
3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(10)(i)(a)配列番号63のHCDR1;(b)配列番号64のHCDR2;(
c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号7
8のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号80のLCD
R3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(11)(i)(a)配列番号65のHCDR1;(b)配列番号61のHCDR2;(
c)配列番号62のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号7
5のLCDR1;(e)配列番号76のLCDR2;および(f)配列番号77のLCD
R3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(12)(i)(a)配列番号66のHCDR1;(b)配列番号67のHCDR2;(
c)配列番号68のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号8
1のLCDR1;(e)配列番号79のLCDR2;および(f)配列番号77のLCD
R3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(13)(i)(a)配列番号86のHCDR1;(b)配列番号87のHCDR2;(
c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
01のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103の
LCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(14)(i)(a)配列番号89のHCDR1;(b)配列番号90のHCDR2;(
c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
04のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号106の
LCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(15)(i)(a)配列番号91のHCDR1;(b)配列番号87のHCDR2;(
c)配列番号88のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
01のLCDR1;(e)配列番号102のLCDR2;および(f)配列番号103の
LCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(16)(i)(a)配列番号92のHCDR1;(b)配列番号93のHCDR2;(
c)配列番号94のHCDR3を含む重鎖可変領域;ならびに(ii)(d)配列番号1
07のLCDR1;(e)配列番号105のLCDR2;および(f)配列番号103の
LCDR3を含む軽鎖可変領域を含む抗体もしくは抗体フラグメント;
(17)配列番号10を含む重鎖可変領域(VH)、および配列番号23を含む軽鎖可変
領域(VL)を含む抗体もしくは抗体フラグメント;
(18)配列番号36を含むVH、および配列番号47を含むVLを含む抗体もしくは抗
体フラグメント;
(19)配列番号69を含むVH、および配列番号82を含むVLを含む抗体もしくは抗
体フラグメント;
(20)配列番号95を含むVH、および配列番号108を含むVLを含む抗体もしくは
抗体フラグメント;
(21)配列番号14を含む重鎖、および配列番号25を含む軽鎖を含む抗体もしくは抗
体フラグメント;
(22)配列番号40を含む重鎖、および配列番号49を含む軽鎖を含む抗体もしくは抗
体フラグメント;
(23)配列番号73を含む重鎖、および配列番号84を含む軽鎖を含む抗体もしくは抗
体フラグメント;
(24)配列番号99を含む重鎖、および配列番号110を含む軽鎖を含む抗体もしくは
抗体フラグメント;
(25)配列番号118を含む重鎖、および配列番号122を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(26)配列番号118を含む重鎖、および配列番号123を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(27)配列番号124を含む重鎖、および配列番号128を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(28)配列番号124を含む重鎖、および配列番号129を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(29)配列番号130を含む重鎖、および配列番号134を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(30)配列番号130を含む重鎖、および配列番号135を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(31)配列番号136を含む重鎖、および配列番号140を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(32)配列番号141を含む重鎖、および配列番号145を含む軽鎖を含む抗体もしく
は抗体フラグメント;
(33)配列番号12を含む重鎖、および配列番号25を含む軽鎖を含む抗体;
(34)配列番号38を含む重鎖、および配列番号49を含む軽鎖を含む抗体;
(35)配列番号71を含む重鎖、および配列番号84を含む軽鎖を含む抗体;または
(36)配列番号97を含む重鎖、および配列番号110を含む軽鎖を含む抗体
のいずれかから選択される、抗体または抗体フラグメント。 - 請求項46に記載の抗体または抗体フラグメントをコードする核酸。
- 請求項47に記載の核酸を含むベクター。
- 請求項48に記載のベクターを含む宿主細胞。
- 抗体または抗体フラグメントを生成するプロセスであって、請求項49に記載の宿主細
胞を培養することと、前記培養から前記抗体または前記抗体フラグメントを回収すること
とを含むプロセス。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662437622P | 2016-12-21 | 2016-12-21 | |
| US62/437,622 | 2016-12-21 | ||
| US201762520854P | 2017-06-16 | 2017-06-16 | |
| US62/520,854 | 2017-06-16 | ||
| JP2019533594A JP7181203B2 (ja) | 2016-12-21 | 2017-12-19 | 造血幹細胞を除去するための抗体薬物結合体 |
| PCT/IB2017/058159 WO2018116178A1 (en) | 2016-12-21 | 2017-12-19 | Antibody drug conjugates for ablating hematopoietic stem cells |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019533594A Division JP7181203B2 (ja) | 2016-12-21 | 2017-12-19 | 造血幹細胞を除去するための抗体薬物結合体 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2023015080A true JP2023015080A (ja) | 2023-01-31 |
Family
ID=60957364
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019533594A Active JP7181203B2 (ja) | 2016-12-21 | 2017-12-19 | 造血幹細胞を除去するための抗体薬物結合体 |
| JP2022167563A Pending JP2023015080A (ja) | 2016-12-21 | 2022-10-19 | 造血幹細胞を除去するための抗体薬物結合体 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019533594A Active JP7181203B2 (ja) | 2016-12-21 | 2017-12-19 | 造血幹細胞を除去するための抗体薬物結合体 |
Country Status (24)
| Country | Link |
|---|---|
| US (2) | US11357864B2 (ja) |
| EP (1) | EP3558389A1 (ja) |
| JP (2) | JP7181203B2 (ja) |
| KR (2) | KR20240093751A (ja) |
| CN (2) | CN117653740A (ja) |
| AU (1) | AU2017383458C1 (ja) |
| BR (1) | BR112019012483A2 (ja) |
| CA (1) | CA3045592A1 (ja) |
| CL (1) | CL2019001745A1 (ja) |
| CO (1) | CO2019006455A2 (ja) |
| CR (1) | CR20190296A (ja) |
| CU (1) | CU24644B1 (ja) |
| EA (1) | EA201991526A1 (ja) |
| EC (1) | ECSP19044625A (ja) |
| IL (2) | IL300567A (ja) |
| JO (1) | JOP20190155A1 (ja) |
| MA (1) | MA47231A (ja) |
| MX (1) | MX2019007582A (ja) |
| MY (1) | MY193985A (ja) |
| PE (1) | PE20191539A1 (ja) |
| PH (1) | PH12019501330A1 (ja) |
| SA (1) | SA519402188B1 (ja) |
| TW (2) | TWI778994B (ja) |
| WO (1) | WO2018116178A1 (ja) |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3452492A1 (en) * | 2016-05-05 | 2019-03-13 | Novartis AG | Amatoxin derivatives and conjugates thereof as inhibitors of rna polymerase |
| EP3472178A4 (en) * | 2016-06-17 | 2020-02-19 | Magenta Therapeutics, Inc. | COMPOSITION AND METHOD FOR DEPLYING CD117 + CELLS |
| JP2021526525A (ja) * | 2018-06-07 | 2021-10-07 | マジェンタ セラピューティクス インコーポレイテッドMagenta Therapeutics, Inc. | 抗体薬物コンジュゲート(adcs)を用いた治療方法 |
| AR115571A1 (es) * | 2018-06-20 | 2021-02-03 | Novartis Ag | Conjugados anticuerpo droga para ablación de células madre hematopoyéticas |
| CA3107383A1 (en) * | 2018-07-23 | 2020-01-30 | Magenta Therapeutics, Inc. | Use of anti-cd5 antibody drug conjugate (adc) in allogeneic cell therapy |
| WO2020023556A1 (en) * | 2018-07-23 | 2020-01-30 | Magenta Therapeutics, Inc. | Use of anti-cd137 antibody drug conjugate (adc) in allogeneic cell therapy |
| SG11202103568PA (en) * | 2018-10-23 | 2021-05-28 | Magenta Therapeutics Inc | Fc silenced antibody drug conjugates (adcs) and uses thereof |
| US20230053449A1 (en) * | 2018-10-31 | 2023-02-23 | Novartis Ag | Dc-sign antibody drug conjugates |
| CN113194991B (zh) * | 2018-11-26 | 2024-09-24 | 四十七公司 | 针对c-kit的人源化抗体 |
| WO2020121071A1 (en) * | 2018-12-12 | 2020-06-18 | Levim Biotech Llp | Acylation process for preparation of n-substituted peptide |
| CN114173820A (zh) * | 2019-06-04 | 2022-03-11 | 美真达治疗公司 | 用于治疗自身免疫疾病的方法和组合物 |
| US11596693B2 (en) | 2019-08-07 | 2023-03-07 | Mabplex International Co., Ltd | Antibody-drug conjugates and uses thereof |
| CN116183899B (zh) * | 2023-04-28 | 2023-06-30 | 天津市协和医药科技集团有限公司 | 一种吖啶酯标记抗体保存液的制备方法 |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| US4880078A (en) | 1987-06-29 | 1989-11-14 | Honda Giken Kogyo Kabushiki Kaisha | Exhaust muffler |
| US5677425A (en) | 1987-09-04 | 1997-10-14 | Celltech Therapeutics Limited | Recombinant antibody |
| AU666852B2 (en) | 1991-05-01 | 1996-02-29 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | A method for treating infectious respiratory diseases |
| US5934272A (en) | 1993-01-29 | 1999-08-10 | Aradigm Corporation | Device and method of creating aerosolized mist of respiratory drug |
| US6132764A (en) | 1994-08-05 | 2000-10-17 | Targesome, Inc. | Targeted polymerized liposome diagnostic and treatment agents |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US6019968A (en) | 1995-04-14 | 2000-02-01 | Inhale Therapeutic Systems, Inc. | Dispersible antibody compositions and methods for their preparation and use |
| US5985320A (en) | 1996-03-04 | 1999-11-16 | The Penn State Research Foundation | Materials and methods for enhancing cellular internalization |
| US5855913A (en) | 1997-01-16 | 1999-01-05 | Massachusetts Instite Of Technology | Particles incorporating surfactants for pulmonary drug delivery |
| US5985309A (en) | 1996-05-24 | 1999-11-16 | Massachusetts Institute Of Technology | Preparation of particles for inhalation |
| US5874064A (en) | 1996-05-24 | 1999-02-23 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| US6056973A (en) | 1996-10-11 | 2000-05-02 | Sequus Pharmaceuticals, Inc. | Therapeutic liposome composition and method of preparation |
| CA2277801C (en) | 1997-01-16 | 2002-10-15 | Massachusetts Institute Of Technology | Preparation of particles for inhalation |
| EP1724282B1 (en) | 1997-05-21 | 2013-05-15 | Merck Patent GmbH | Method for the production of non-immunogenic proteins |
| WO1998056915A2 (en) | 1997-06-12 | 1998-12-17 | Research Corporation Technologies, Inc. | Artificial antibody polypeptides |
| JP2002518432A (ja) | 1998-06-24 | 2002-06-25 | アドバンスト インハレーション リサーチ,インコーポレイテッド | 吸入器から放出される大多孔性粒子 |
| US7151164B2 (en) | 2002-02-14 | 2006-12-19 | Immunomedics, Inc. | Anti-CD20 antibodies and fusion proteins thereof and methods of use |
| ATE395413T1 (de) | 2001-12-03 | 2008-05-15 | Amgen Fremont Inc | Antikörperkategorisierung auf der grundlage von bindungseigenschaften |
| WO2004002425A2 (en) | 2002-06-28 | 2004-01-08 | Bio Transplant, Inc. | Process for promoting graft acceptance by depletion of hematopoietic stem cells |
| CN103864934A (zh) | 2003-03-24 | 2014-06-18 | 津莫吉尼蒂克斯公司 | 抗il-22ra抗体和结合伴侣以及在炎症中的使用方法 |
| TWI395754B (zh) | 2006-04-24 | 2013-05-11 | Amgen Inc | 人類化之c-kit抗體 |
| PL3255061T3 (pl) | 2006-11-03 | 2021-12-06 | The Board Of Trustees Of The Leland Stanford Junior University | Selektywna deplecja immunologiczna niszy endogennych komórek macierzystych do wszczepienia |
| WO2011005481A1 (en) | 2009-06-22 | 2011-01-13 | Medimmune, Llc | ENGINEERED Fc REGIONS FOR SITE-SPECIFIC CONJUGATION |
| US20120189633A1 (en) * | 2011-01-26 | 2012-07-26 | Kolltan Pharmaceuticals, Inc. | Anti-kit antibodies and uses thereof |
| KR102268351B1 (ko) | 2012-07-25 | 2021-06-22 | 셀덱스 쎄라퓨틱스, 인크. | 항-kit 항체 및 그의 용도 |
| PT2953976T (pt) | 2013-02-08 | 2021-06-23 | Novartis Ag | Sítios específicos de modificação de anticorpos para preparar imunoconjugados |
| US9789203B2 (en) * | 2013-03-15 | 2017-10-17 | Novartis Ag | cKIT antibody drug conjugates |
| CN106659800A (zh) * | 2014-03-12 | 2017-05-10 | 诺华股份有限公司 | 用于修饰抗体以制备免疫缀合物的特定位点 |
| CA2951368A1 (en) * | 2014-06-13 | 2015-12-17 | Novartis Ag | Auristatin derivatives and conjugates thereof |
| US10786578B2 (en) * | 2014-08-05 | 2020-09-29 | Novartis Ag | CKIT antibody drug conjugates |
| EP3215519A1 (en) * | 2014-11-06 | 2017-09-13 | Novartis AG | Amatoxin derivatives and conjugates thereof as inhibitors of rna polymerase |
| CN108137648A (zh) * | 2015-04-06 | 2018-06-08 | 哈佛学院校长同事会 | 用于非清髓性预处理的组合物和方法 |
| US20190194315A1 (en) * | 2015-06-17 | 2019-06-27 | Novartis Ag | Antibody drug conjugates |
| EP3472178A4 (en) | 2016-06-17 | 2020-02-19 | Magenta Therapeutics, Inc. | COMPOSITION AND METHOD FOR DEPLYING CD117 + CELLS |
-
2017
- 2017-06-16 JO JOP/2019/0155A patent/JOP20190155A1/ar unknown
- 2017-12-19 IL IL300567A patent/IL300567A/en unknown
- 2017-12-19 EP EP17829033.4A patent/EP3558389A1/en active Pending
- 2017-12-19 CN CN202311642832.9A patent/CN117653740A/zh active Pending
- 2017-12-19 BR BR112019012483A patent/BR112019012483A2/pt unknown
- 2017-12-19 KR KR1020247016376A patent/KR20240093751A/ko not_active Application Discontinuation
- 2017-12-19 TW TW106144615A patent/TWI778994B/zh active
- 2017-12-19 CA CA3045592A patent/CA3045592A1/en active Pending
- 2017-12-19 MY MYPI2019003457A patent/MY193985A/en unknown
- 2017-12-19 MA MA047231A patent/MA47231A/fr unknown
- 2017-12-19 CN CN201780079504.9A patent/CN110099697B/zh active Active
- 2017-12-19 WO PCT/IB2017/058159 patent/WO2018116178A1/en active Application Filing
- 2017-12-19 CU CU2019000061A patent/CU24644B1/es unknown
- 2017-12-19 US US16/470,897 patent/US11357864B2/en active Active
- 2017-12-19 TW TW111133640A patent/TWI852077B/zh active
- 2017-12-19 KR KR1020197020530A patent/KR20190099238A/ko not_active Application Discontinuation
- 2017-12-19 PE PE2019001291A patent/PE20191539A1/es unknown
- 2017-12-19 JP JP2019533594A patent/JP7181203B2/ja active Active
- 2017-12-19 MX MX2019007582A patent/MX2019007582A/es unknown
- 2017-12-19 AU AU2017383458A patent/AU2017383458C1/en active Active
- 2017-12-19 CR CR20190296A patent/CR20190296A/es unknown
- 2017-12-19 EA EA201991526A patent/EA201991526A1/ru unknown
-
2019
- 2019-06-13 PH PH12019501330A patent/PH12019501330A1/en unknown
- 2019-06-18 IL IL267478A patent/IL267478B2/en unknown
- 2019-06-19 CO CONC2019/0006455A patent/CO2019006455A2/es unknown
- 2019-06-20 SA SA519402188A patent/SA519402188B1/ar unknown
- 2019-06-20 CL CL2019001745A patent/CL2019001745A1/es unknown
- 2019-06-21 EC ECSENADI201944625A patent/ECSP19044625A/es unknown
-
2022
- 2022-06-06 US US17/833,077 patent/US20220305134A1/en active Pending
- 2022-10-19 JP JP2022167563A patent/JP2023015080A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7181203B2 (ja) | 造血幹細胞を除去するための抗体薬物結合体 | |
| TWI794230B (zh) | 抗cdh6抗體及抗cdh6抗體-藥物結合物、以及其製造方法 | |
| JP6898925B2 (ja) | Asct2特異的結合分子及びその使用 | |
| TW202011987A (zh) | 螯合型放射核種之抗體 | |
| TW202011988A (zh) | 螯合型放射核種之抗體及清除劑 | |
| US20210228731A1 (en) | Antibody drug conjugates for ablating hematopoietic stem cells | |
| RU2781444C2 (ru) | Конъюгаты антитела и лекарственного средства для разрушения гемопоэтических стволовых клеток | |
| US11999786B2 (en) | Anti-CD48 antibodies, antibody drug conjugates, and uses thereof | |
| NZ794433A (en) | Antibody drug conjugates for ablating hematopoietic stem cells | |
| EA044279B1 (ru) | Конъюгаты антитела и лекарственного средства для разрушения гемопоэтических стволовых клеток |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221116 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20221116 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230905 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20231017 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240227 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240528 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20240805 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20241028 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241029 |