JP2022552879A - (s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンおよびその塩を含む固形体、並びにそれを含む組成物およびそれを使用する方法 - Google Patents
(s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンおよびその塩を含む固形体、並びにそれを含む組成物およびそれを使用する方法 Download PDFInfo
- Publication number
- JP2022552879A JP2022552879A JP2022523516A JP2022523516A JP2022552879A JP 2022552879 A JP2022552879 A JP 2022552879A JP 2022523516 A JP2022523516 A JP 2022523516A JP 2022523516 A JP2022523516 A JP 2022523516A JP 2022552879 A JP2022552879 A JP 2022552879A
- Authority
- JP
- Japan
- Prior art keywords
- solid
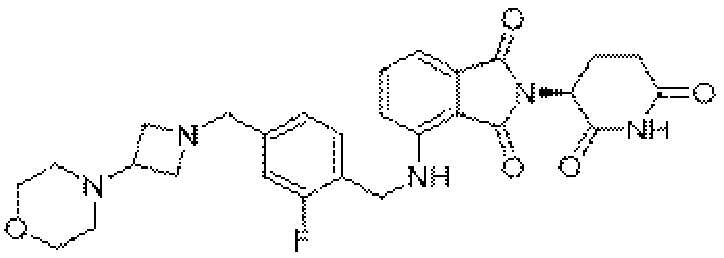
- compound
- salt
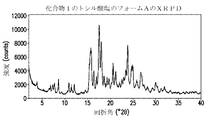
- xrpd pattern
- theta
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000007787 solid Substances 0.000 title claims abstract description 594
- 150000003839 salts Chemical class 0.000 title claims abstract description 222
- 238000000034 method Methods 0.000 title claims abstract description 196
- 239000000203 mixture Substances 0.000 title abstract description 76
- -1 (S)-2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindoline Chemical compound 0.000 title abstract description 24
- 239000012458 free base Substances 0.000 claims abstract description 99
- 229940125904 compound 1 Drugs 0.000 claims description 483
- 238000000634 powder X-ray diffraction Methods 0.000 claims description 200
- 238000011282 treatment Methods 0.000 claims description 163
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 claims description 101
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 claims description 95
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical class CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 claims description 69
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical class OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 claims description 60
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 claims description 58
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 58
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 claims description 58
- 208000002250 Hematologic Neoplasms Diseases 0.000 claims description 50
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical group Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 50
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical class [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 claims description 46
- 201000004085 CLL/SLL Diseases 0.000 claims description 42
- 208000023738 chronic lymphocytic leukemia/small lymphocytic lymphoma Diseases 0.000 claims description 42
- 150000002688 maleic acid derivatives Chemical class 0.000 claims description 32
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 27
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 26
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 23
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 23
- 201000007924 marginal zone B-cell lymphoma Diseases 0.000 claims description 20
- 208000021937 marginal zone lymphoma Diseases 0.000 claims description 20
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 claims description 18
- 208000017604 Hodgkin disease Diseases 0.000 claims description 17
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 17
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 17
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 17
- 208000011691 Burkitt lymphomas Diseases 0.000 claims description 15
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 15
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 claims description 14
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 13
- 201000000050 myeloid neoplasm Diseases 0.000 claims description 12
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 11
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 11
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 10
- 239000008194 pharmaceutical composition Substances 0.000 claims description 8
- 208000034578 Multiple myelomas Diseases 0.000 claims description 5
- 206010066476 Haematological malignancy Diseases 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 2
- 238000009472 formulation Methods 0.000 abstract description 14
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical group C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 abstract description 5
- 238000004519 manufacturing process Methods 0.000 abstract description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 abstract description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical group CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 63
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 60
- 229960003347 obinutuzumab Drugs 0.000 description 49
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 48
- 229960004641 rituximab Drugs 0.000 description 48
- 150000001875 compounds Chemical class 0.000 description 44
- 238000002474 experimental method Methods 0.000 description 44
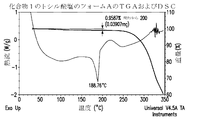
- 238000000113 differential scanning calorimetry Methods 0.000 description 41
- 201000010099 disease Diseases 0.000 description 41
- 238000002560 therapeutic procedure Methods 0.000 description 40
- 201000005787 hematologic cancer Diseases 0.000 description 39
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 39
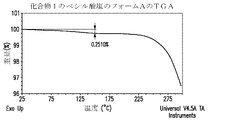
- 238000002411 thermogravimetry Methods 0.000 description 39
- 210000004027 cell Anatomy 0.000 description 38
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 37
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 36
- 239000000126 substance Substances 0.000 description 36
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 35
- 239000002904 solvent Substances 0.000 description 35
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 34
- 238000001757 thermogravimetry curve Methods 0.000 description 32
- 230000004083 survival effect Effects 0.000 description 30
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 28
- 239000000243 solution Substances 0.000 description 27
- 239000012453 solvate Substances 0.000 description 26
- 201000003444 follicular lymphoma Diseases 0.000 description 24
- 230000004044 response Effects 0.000 description 23
- 239000013078 crystal Substances 0.000 description 22
- 238000001938 differential scanning calorimetry curve Methods 0.000 description 22
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 21
- 238000010438 heat treatment Methods 0.000 description 21
- 230000002265 prevention Effects 0.000 description 20
- 230000004580 weight loss Effects 0.000 description 20
- 208000035475 disorder Diseases 0.000 description 19
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 18
- 235000019439 ethyl acetate Nutrition 0.000 description 18
- 239000011521 glass Substances 0.000 description 18
- 238000002844 melting Methods 0.000 description 17
- 230000008018 melting Effects 0.000 description 17
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 16
- 238000004458 analytical method Methods 0.000 description 16
- 239000002178 crystalline material Substances 0.000 description 16
- 238000001704 evaporation Methods 0.000 description 16
- 230000008020 evaporation Effects 0.000 description 16
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 16
- 239000000725 suspension Substances 0.000 description 16
- 239000002245 particle Substances 0.000 description 15
- 238000004090 dissolution Methods 0.000 description 14
- 239000003826 tablet Substances 0.000 description 14
- 239000002253 acid Substances 0.000 description 13
- 206010061818 Disease progression Diseases 0.000 description 12
- 206010028980 Neoplasm Diseases 0.000 description 12
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 12
- 230000005750 disease progression Effects 0.000 description 12
- 239000002775 capsule Substances 0.000 description 11
- 239000003517 fume Substances 0.000 description 11
- 239000000843 powder Substances 0.000 description 11
- 206010073478 Anaplastic large-cell lymphoma Diseases 0.000 description 10
- 229940124291 BTK inhibitor Drugs 0.000 description 10
- 208000032004 Large-Cell Anaplastic Lymphoma Diseases 0.000 description 10
- 210000003719 b-lymphocyte Anatomy 0.000 description 10
- 238000012512 characterization method Methods 0.000 description 10
- 238000000354 decomposition reaction Methods 0.000 description 10
- 150000004677 hydrates Chemical class 0.000 description 10
- 208000031223 plasma cell leukemia Diseases 0.000 description 10
- 230000000306 recurrent effect Effects 0.000 description 10
- 206010062113 splenic marginal zone lymphoma Diseases 0.000 description 10
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 9
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- 238000005481 NMR spectroscopy Methods 0.000 description 9
- 208000009359 Sezary Syndrome Diseases 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 230000006907 apoptotic process Effects 0.000 description 9
- 229910052799 carbon Inorganic materials 0.000 description 9
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- 230000036961 partial effect Effects 0.000 description 9
- 230000005855 radiation Effects 0.000 description 9
- 238000001179 sorption measurement Methods 0.000 description 9
- 238000003860 storage Methods 0.000 description 9
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 8
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 8
- 229920002472 Starch Polymers 0.000 description 8
- 239000012296 anti-solvent Substances 0.000 description 8
- 238000003556 assay Methods 0.000 description 8
- 230000034994 death Effects 0.000 description 8
- 235000019698 starch Nutrition 0.000 description 8
- 102000004121 Annexin A5 Human genes 0.000 description 7
- 108090000672 Annexin A5 Proteins 0.000 description 7
- 208000007660 Residual Neoplasm Diseases 0.000 description 7
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 7
- 229940092714 benzenesulfonic acid Drugs 0.000 description 7
- 210000001185 bone marrow Anatomy 0.000 description 7
- 238000001990 intravenous administration Methods 0.000 description 7
- 239000000314 lubricant Substances 0.000 description 7
- 238000001556 precipitation Methods 0.000 description 7
- 208000024891 symptom Diseases 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 238000002441 X-ray diffraction Methods 0.000 description 6
- 150000007513 acids Chemical class 0.000 description 6
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 6
- 230000001640 apoptogenic effect Effects 0.000 description 6
- 201000011510 cancer Diseases 0.000 description 6
- 235000010980 cellulose Nutrition 0.000 description 6
- 229920002678 cellulose Polymers 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 239000002552 dosage form Substances 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 239000011976 maleic acid Substances 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 239000008177 pharmaceutical agent Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 238000012216 screening Methods 0.000 description 6
- 239000002002 slurry Substances 0.000 description 6
- 238000001228 spectrum Methods 0.000 description 6
- 239000008107 starch Substances 0.000 description 6
- 229940032147 starch Drugs 0.000 description 6
- 239000000454 talc Substances 0.000 description 6
- 229910052623 talc Inorganic materials 0.000 description 6
- 235000012222 talc Nutrition 0.000 description 6
- 239000012129 DRAQ7 reagent Substances 0.000 description 5
- 206010025323 Lymphomas Diseases 0.000 description 5
- 238000001069 Raman spectroscopy Methods 0.000 description 5
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 5
- 239000008186 active pharmaceutical agent Substances 0.000 description 5
- 235000010443 alginic acid Nutrition 0.000 description 5
- 229920000615 alginic acid Polymers 0.000 description 5
- 239000002585 base Substances 0.000 description 5
- 239000011230 binding agent Substances 0.000 description 5
- 239000001913 cellulose Substances 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 239000003085 diluting agent Substances 0.000 description 5
- 238000011156 evaluation Methods 0.000 description 5
- 239000001530 fumaric acid Substances 0.000 description 5
- 238000001802 infusion Methods 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 229920000609 methyl cellulose Polymers 0.000 description 5
- 239000001923 methylcellulose Substances 0.000 description 5
- 235000010981 methylcellulose Nutrition 0.000 description 5
- 238000003801 milling Methods 0.000 description 5
- 230000000704 physical effect Effects 0.000 description 5
- 238000001953 recrystallisation Methods 0.000 description 5
- 239000007858 starting material Substances 0.000 description 5
- 238000002076 thermal analysis method Methods 0.000 description 5
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 4
- 229930195725 Mannitol Natural products 0.000 description 4
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 238000001516 cell proliferation assay Methods 0.000 description 4
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 4
- 238000003795 desorption Methods 0.000 description 4
- 239000007884 disintegrant Substances 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 238000000684 flow cytometry Methods 0.000 description 4
- 150000003840 hydrochlorides Chemical class 0.000 description 4
- 230000000977 initiatory effect Effects 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 238000002595 magnetic resonance imaging Methods 0.000 description 4
- 239000000594 mannitol Substances 0.000 description 4
- 235000010355 mannitol Nutrition 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 229910052757 nitrogen Inorganic materials 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 238000012545 processing Methods 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 230000003442 weekly effect Effects 0.000 description 4
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- LQFLJTHGXWWGRC-INIZCTEOSA-N 2-[(3S)-2,6-dioxopiperidin-3-yl]-4-[[2-fluoro-4-(hydroxymethyl)phenyl]methylamino]isoindole-1,3-dione Chemical compound O=C1NC(CC[C@@H]1N1C(C2=CC=CC(=C2C1=O)NCC1=C(C=C(C=C1)CO)F)=O)=O LQFLJTHGXWWGRC-INIZCTEOSA-N 0.000 description 3
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 3
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 3
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 3
- 238000004566 IR spectroscopy Methods 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 3
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 239000002202 Polyethylene glycol Substances 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 3
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 3
- 239000000654 additive Substances 0.000 description 3
- 230000001028 anti-proliverative effect Effects 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 239000001506 calcium phosphate Substances 0.000 description 3
- 235000011010 calcium phosphates Nutrition 0.000 description 3
- 239000001768 carboxy methyl cellulose Substances 0.000 description 3
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 3
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 3
- 230000003833 cell viability Effects 0.000 description 3
- 238000002591 computed tomography Methods 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 238000004807 desolvation Methods 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 238000002050 diffraction method Methods 0.000 description 3
- 229960004679 doxorubicin Drugs 0.000 description 3
- 238000001035 drying Methods 0.000 description 3
- WBJINCZRORDGAQ-UHFFFAOYSA-N formic acid ethyl ester Natural products CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 3
- 230000002489 hematologic effect Effects 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 description 3
- 229940011051 isopropyl acetate Drugs 0.000 description 3
- GWYFCOCPABKNJV-UHFFFAOYSA-N isovaleric acid Chemical compound CC(C)CC(O)=O GWYFCOCPABKNJV-UHFFFAOYSA-N 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 238000004020 luminiscence type Methods 0.000 description 3
- 235000019359 magnesium stearate Nutrition 0.000 description 3
- 230000003211 malignant effect Effects 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 238000000048 melt cooling Methods 0.000 description 3
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 3
- LYGJENNIWJXYER-UHFFFAOYSA-N nitromethane Chemical compound C[N+]([O-])=O LYGJENNIWJXYER-UHFFFAOYSA-N 0.000 description 3
- 238000000399 optical microscopy Methods 0.000 description 3
- 239000008188 pellet Substances 0.000 description 3
- 230000002085 persistent effect Effects 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 238000002600 positron emission tomography Methods 0.000 description 3
- 208000037821 progressive disease Diseases 0.000 description 3
- 238000011321 prophylaxis Methods 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 238000001878 scanning electron micrograph Methods 0.000 description 3
- 208000011581 secondary neoplasm Diseases 0.000 description 3
- 235000012239 silicon dioxide Nutrition 0.000 description 3
- 238000011172 small scale experimental method Methods 0.000 description 3
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 3
- 238000004611 spectroscopical analysis Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 230000003319 supportive effect Effects 0.000 description 3
- 239000000829 suppository Substances 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- 125000005490 tosylate group Chemical group 0.000 description 3
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 3
- 210000004881 tumor cell Anatomy 0.000 description 3
- 239000001993 wax Substances 0.000 description 3
- RNOAOAWBMHREKO-QFIPXVFZSA-N (7S)-2-(4-phenoxyphenyl)-7-(1-prop-2-enoylpiperidin-4-yl)-4,5,6,7-tetrahydropyrazolo[1,5-a]pyrimidine-3-carboxamide Chemical group C(C=C)(=O)N1CCC(CC1)[C@@H]1CCNC=2N1N=C(C=2C(=O)N)C1=CC=C(C=C1)OC1=CC=CC=C1 RNOAOAWBMHREKO-QFIPXVFZSA-N 0.000 description 2
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 2
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 2
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 2
- NZYDBVQXOGPDDU-QHCPKHFHSA-N 2-[(3S)-2,6-dioxopiperidin-3-yl]-4-[[2-fluoro-4-[(3-morpholin-4-ylazetidin-1-yl)methyl]phenyl]methylamino]isoindole-1,3-dione Chemical compound O=C1NC(CC[C@@H]1N1C(C2=CC=CC(=C2C1=O)NCC1=C(C=C(C=C1)CN1CC(C1)N1CCOCC1)F)=O)=O NZYDBVQXOGPDDU-QHCPKHFHSA-N 0.000 description 2
- AOYNUTHNTBLRMT-SLPGGIOYSA-N 2-deoxy-2-fluoro-aldehydo-D-glucose Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](F)C=O AOYNUTHNTBLRMT-SLPGGIOYSA-N 0.000 description 2
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 2
- XFZBITFWPRIYGF-INIZCTEOSA-N 4-[[4-(chloromethyl)-2-fluorophenyl]methylamino]-2-[(3S)-2,6-dioxopiperidin-3-yl]isoindole-1,3-dione Chemical compound ClCC1=CC(=C(CNC2=C3C(N(C(C3=CC=C2)=O)[C@@H]2C(NC(CC2)=O)=O)=O)C=C1)F XFZBITFWPRIYGF-INIZCTEOSA-N 0.000 description 2
- SEJLPXCPMNSRAM-GOSISDBHSA-N 6-amino-9-[(3r)-1-but-2-ynoylpyrrolidin-3-yl]-7-(4-phenoxyphenyl)purin-8-one Chemical group C1N(C(=O)C#CC)CC[C@H]1N1C(=O)N(C=2C=CC(OC=3C=CC=CC=3)=CC=2)C2=C(N)N=CN=C21 SEJLPXCPMNSRAM-GOSISDBHSA-N 0.000 description 2
- YXHLJMWYDTXDHS-IRFLANFNSA-N 7-aminoactinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=C(N)C=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 YXHLJMWYDTXDHS-IRFLANFNSA-N 0.000 description 2
- 108700012813 7-aminoactinomycin D Proteins 0.000 description 2
- ZKHQWZAMYRWXGA-KQYNXXCUSA-N Adenosine triphosphate Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)[C@H]1O ZKHQWZAMYRWXGA-KQYNXXCUSA-N 0.000 description 2
- ZKHQWZAMYRWXGA-UHFFFAOYSA-N Adenosine triphosphate Natural products C1=NC=2C(N)=NC=NC=2N1C1OC(COP(O)(=O)OP(O)(=O)OP(O)(O)=O)C(O)C1O ZKHQWZAMYRWXGA-UHFFFAOYSA-N 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 229940125814 BTK kinase inhibitor Drugs 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 241000207199 Citrus Species 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 229920002785 Croscarmellose sodium Polymers 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 101100239628 Danio rerio myca gene Proteins 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 229930091371 Fructose Natural products 0.000 description 2
- 239000005715 Fructose Substances 0.000 description 2
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 2
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 229920002907 Guar gum Polymers 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- 239000002177 L01XE27 - Ibrutinib Substances 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 2
- QIAFMBKCNZACKA-UHFFFAOYSA-N N-benzoylglycine Chemical compound OC(=O)CNC(=O)C1=CC=CC=C1 QIAFMBKCNZACKA-UHFFFAOYSA-N 0.000 description 2
- 206010061309 Neoplasm progression Diseases 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- 241000286209 Phasianidae Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 208000025316 Richter syndrome Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 2
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 229950009821 acalabrutinib Drugs 0.000 description 2
- WDENQIQQYWYTPO-IBGZPJMESA-N acalabrutinib Chemical group CC#CC(=O)N1CCC[C@H]1C1=NC(C=2C=CC(=CC=2)C(=O)NC=2N=CC=CC=2)=C2N1C=CN=C2N WDENQIQQYWYTPO-IBGZPJMESA-N 0.000 description 2
- 229960000583 acetic acid Drugs 0.000 description 2
- 229960001456 adenosine triphosphate Drugs 0.000 description 2
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 230000005735 apoptotic response Effects 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000000440 bentonite Substances 0.000 description 2
- 229910000278 bentonite Inorganic materials 0.000 description 2
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 239000000378 calcium silicate Substances 0.000 description 2
- 229910052918 calcium silicate Inorganic materials 0.000 description 2
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 2
- 235000013539 calcium stearate Nutrition 0.000 description 2
- 239000008116 calcium stearate Substances 0.000 description 2
- OYACROKNLOSFPA-UHFFFAOYSA-N calcium;dioxido(oxo)silane Chemical compound [Ca+2].[O-][Si]([O-])=O OYACROKNLOSFPA-UHFFFAOYSA-N 0.000 description 2
- 239000003729 cation exchange resin Substances 0.000 description 2
- 229940023913 cation exchange resins Drugs 0.000 description 2
- 238000000423 cell based assay Methods 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 239000007910 chewable tablet Substances 0.000 description 2
- 208000014514 chromosome 17p deletion Diseases 0.000 description 2
- 235000020971 citrus fruits Nutrition 0.000 description 2
- 229940110456 cocoa butter Drugs 0.000 description 2
- 235000019868 cocoa butter Nutrition 0.000 description 2
- 238000009838 combustion analysis Methods 0.000 description 2
- 238000012790 confirmation Methods 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 235000005822 corn Nutrition 0.000 description 2
- 229960001681 croscarmellose sodium Drugs 0.000 description 2
- 229960000913 crospovidone Drugs 0.000 description 2
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 2
- 238000002447 crystallographic data Methods 0.000 description 2
- 238000013211 curve analysis Methods 0.000 description 2
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000007547 defect Effects 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- 230000018044 dehydration Effects 0.000 description 2
- 238000006297 dehydration reaction Methods 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 238000007908 dry granulation Methods 0.000 description 2
- MVPICKVDHDWCJQ-UHFFFAOYSA-N ethyl 3-pyrrolidin-1-ylpropanoate Chemical compound CCOC(=O)CCN1CCCC1 MVPICKVDHDWCJQ-UHFFFAOYSA-N 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 235000010417 guar gum Nutrition 0.000 description 2
- 239000000665 guar gum Substances 0.000 description 2
- 229960002154 guar gum Drugs 0.000 description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 2
- 229960001507 ibrutinib Drugs 0.000 description 2
- XYFPWWZEPKGCCK-GOSISDBHSA-N ibrutinib Chemical group C1=2C(N)=NC=NC=2N([C@H]2CN(CCC2)C(=O)C=C)N=C1C(C=C1)=CC=C1OC1=CC=CC=C1 XYFPWWZEPKGCCK-GOSISDBHSA-N 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 2
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical compound CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 238000012417 linear regression Methods 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 238000000386 microscopy Methods 0.000 description 2
- XTEGVFVZDVNBPF-UHFFFAOYSA-N naphthalene-1,5-disulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1S(O)(=O)=O XTEGVFVZDVNBPF-UHFFFAOYSA-N 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- WWZKQHOCKIZLMA-UHFFFAOYSA-N octanoic acid Chemical compound CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 2
- 230000000737 periodic effect Effects 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 2
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 229920001592 potato starch Polymers 0.000 description 2
- 239000011164 primary particle Substances 0.000 description 2
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 2
- 238000010926 purge Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 238000004626 scanning electron microscopy Methods 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 229920003109 sodium starch glycolate Polymers 0.000 description 2
- 239000008109 sodium starch glycolate Substances 0.000 description 2
- 229940079832 sodium starch glycolate Drugs 0.000 description 2
- 229940045902 sodium stearyl fumarate Drugs 0.000 description 2
- 238000000935 solvent evaporation Methods 0.000 description 2
- 238000002336 sorption--desorption measurement Methods 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 238000011476 stem cell transplantation Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- TYFQFVWCELRYAO-UHFFFAOYSA-N suberic acid Chemical compound OC(=O)CCCCCCC(O)=O TYFQFVWCELRYAO-UHFFFAOYSA-N 0.000 description 2
- 238000000859 sublimation Methods 0.000 description 2
- 230000008022 sublimation Effects 0.000 description 2
- 239000002511 suppository base Substances 0.000 description 2
- 238000009121 systemic therapy Methods 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- 229950009104 tirabrutinib Drugs 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-M toluene-4-sulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-M 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 230000005751 tumor progression Effects 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 231100000747 viability assay Toxicity 0.000 description 2
- 238000003026 viability measurement method Methods 0.000 description 2
- 238000005550 wet granulation Methods 0.000 description 2
- 239000002023 wood Substances 0.000 description 2
- 229950007153 zanubrutinib Drugs 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- HAFWELDDNUXLCK-ODZAUARKSA-N (z)-but-2-enedioic acid;hydrate Chemical compound O.OC(=O)\C=C/C(O)=O HAFWELDDNUXLCK-ODZAUARKSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- RTBFRGCFXZNCOE-UHFFFAOYSA-N 1-methylsulfonylpiperidin-4-one Chemical compound CS(=O)(=O)N1CCC(=O)CC1 RTBFRGCFXZNCOE-UHFFFAOYSA-N 0.000 description 1
- YREROAPXUOXCGI-UHFFFAOYSA-N 2,5-dihydroxybenzoic acid Chemical compound OC(=O)C1=CC(O)=CC=C1O.OC(=O)C1=CC(O)=CC=C1O YREROAPXUOXCGI-UHFFFAOYSA-N 0.000 description 1
- KODVTNZMIHDFFL-UHFFFAOYSA-N 2-fluoro-4-(hydroxymethyl)benzaldehyde Chemical compound OCC1=CC=C(C=O)C(F)=C1 KODVTNZMIHDFFL-UHFFFAOYSA-N 0.000 description 1
- AEGZLYNAJWQQTO-UHFFFAOYSA-N 4-(azetidin-3-yl)morpholine;hydrochloride Chemical compound Cl.C1NCC1N1CCOCC1 AEGZLYNAJWQQTO-UHFFFAOYSA-N 0.000 description 1
- UVSMNLNDYGZFPF-QMMMGPOBSA-N 4-amino-2-[(3s)-2,6-dioxopiperidin-3-yl]isoindole-1,3-dione Chemical compound O=C1C=2C(N)=CC=CC=2C(=O)N1[C@H]1CCC(=O)NC1=O UVSMNLNDYGZFPF-QMMMGPOBSA-N 0.000 description 1
- WUBBRNOQWQTFEX-UHFFFAOYSA-N 4-aminosalicylic acid Chemical compound NC1=CC=C(C(O)=O)C(O)=C1 WUBBRNOQWQTFEX-UHFFFAOYSA-N 0.000 description 1
- UZOVYGYOLBIAJR-UHFFFAOYSA-N 4-isocyanato-4'-methyldiphenylmethane Chemical compound C1=CC(C)=CC=C1CC1=CC=C(N=C=O)C=C1 UZOVYGYOLBIAJR-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 229910000809 Alumel Inorganic materials 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- 101150017888 Bcl2 gene Proteins 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- LSPHULWDVZXLIL-UHFFFAOYSA-N Camphoric acid Natural products CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 239000005632 Capric acid (CAS 334-48-5) Substances 0.000 description 1
- 239000005635 Caprylic acid (CAS 124-07-2) Substances 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 238000003734 CellTiter-Glo Luminescent Cell Viability Assay Methods 0.000 description 1
- GHOKWGTUZJEAQD-UHFFFAOYSA-N Chick antidermatitis factor Natural products OCC(C)(C)C(O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 206010008805 Chromosomal abnormalities Diseases 0.000 description 1
- 208000031404 Chromosome Aberrations Diseases 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 102000007644 Colony-Stimulating Factors Human genes 0.000 description 1
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 1
- DSLZVSRJTYRBFB-UHFFFAOYSA-N Galactaric acid Natural products OC(=O)C(O)C(O)C(O)C(O)C(O)=O DSLZVSRJTYRBFB-UHFFFAOYSA-N 0.000 description 1
- 229910000530 Gallium indium arsenide Inorganic materials 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 239000007760 Iscove's Modified Dulbecco's Medium Substances 0.000 description 1
- 238000003109 Karl Fischer titration Methods 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 101100381525 Mus musculus Bcl6 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- AHVYPIQETPWLSZ-UHFFFAOYSA-N N-methyl-pyrrolidine Natural products CN1CC=CC1 AHVYPIQETPWLSZ-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 208000010995 Partial deletion of the long arm of chromosome 11 Diseases 0.000 description 1
- 208000010992 Partial deletion of the long arm of chromosome 13 Diseases 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-L Phosphate ion(2-) Chemical compound OP([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-L 0.000 description 1
- 206010036711 Primary mediastinal large B-cell lymphomas Diseases 0.000 description 1
- ODHCTXKNWHHXJC-GSVOUGTGSA-N Pyroglutamic acid Natural products OC(=O)[C@H]1CCC(=O)N1 ODHCTXKNWHHXJC-GSVOUGTGSA-N 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 238000001237 Raman spectrum Methods 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 238000003991 Rietveld refinement Methods 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 206010066901 Treatment failure Diseases 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 244000098338 Triticum aestivum Species 0.000 description 1
- 238000000441 X-ray spectroscopy Methods 0.000 description 1
- KXNLCSXBJCPWGL-UHFFFAOYSA-N [Ga].[As].[In] Chemical compound [Ga].[As].[In] KXNLCSXBJCPWGL-UHFFFAOYSA-N 0.000 description 1
- UOWHCAKKYIRMSX-UHFFFAOYSA-N [N].C1CNC1 Chemical compound [N].C1CNC1 UOWHCAKKYIRMSX-UHFFFAOYSA-N 0.000 description 1
- RQBGLYREDLMZMC-UHFFFAOYSA-N [N].C1COCCN1 Chemical compound [N].C1COCCN1 RQBGLYREDLMZMC-UHFFFAOYSA-N 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- ODHCTXKNWHHXJC-UHFFFAOYSA-N acide pyroglutamique Natural products OC(=O)C1CCC(=O)N1 ODHCTXKNWHHXJC-UHFFFAOYSA-N 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- 229960000250 adipic acid Drugs 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000012382 advanced drug delivery Methods 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- IAJILQKETJEXLJ-RSJOWCBRSA-N aldehydo-D-galacturonic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-RSJOWCBRSA-N 0.000 description 1
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 229960004909 aminosalicylic acid Drugs 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N anhydrous glutaric acid Natural products OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 235000015197 apple juice Nutrition 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 229960005261 aspartic acid Drugs 0.000 description 1
- 238000005102 attenuated total reflection Methods 0.000 description 1
- 238000000498 ball milling Methods 0.000 description 1
- 229960002707 bendamustine Drugs 0.000 description 1
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- FNAQSUUGMSOBHW-UHFFFAOYSA-H calcium citrate Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O FNAQSUUGMSOBHW-UHFFFAOYSA-H 0.000 description 1
- 239000001354 calcium citrate Substances 0.000 description 1
- 229960004256 calcium citrate Drugs 0.000 description 1
- WUKWITHWXAAZEY-UHFFFAOYSA-L calcium difluoride Chemical compound [F-].[F-].[Ca+2] WUKWITHWXAAZEY-UHFFFAOYSA-L 0.000 description 1
- 229910001634 calcium fluoride Inorganic materials 0.000 description 1
- 229960001714 calcium phosphate Drugs 0.000 description 1
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Inorganic materials [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 1
- LSPHULWDVZXLIL-QUBYGPBYSA-N camphoric acid Chemical compound CC1(C)[C@H](C(O)=O)CC[C@]1(C)C(O)=O LSPHULWDVZXLIL-QUBYGPBYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 238000012054 celltiter-glo Methods 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 238000009614 chemical analysis method Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 230000002113 chemopreventative effect Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229940068682 chewable tablet Drugs 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 229940047120 colony stimulating factors Drugs 0.000 description 1
- 239000000306 component Substances 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 239000000625 cyclamic acid and its Na and Ca salt Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- HCAJEUSONLESMK-UHFFFAOYSA-N cyclohexylsulfamic acid Chemical compound OS(=O)(=O)NC1CCCCC1 HCAJEUSONLESMK-UHFFFAOYSA-N 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 238000013500 data storage Methods 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- WGLUMOCWFMKWIL-UHFFFAOYSA-N dichloromethane;methanol Chemical compound OC.ClCCl WGLUMOCWFMKWIL-UHFFFAOYSA-N 0.000 description 1
- 238000007416 differential thermogravimetric analysis Methods 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000007907 direct compression Methods 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000007905 drug manufacturing Methods 0.000 description 1
- 229940126534 drug product Drugs 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 238000002003 electron diffraction Methods 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 230000005713 exacerbation Effects 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- DSLZVSRJTYRBFB-DUHBMQHGSA-N galactaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)C(O)=O DSLZVSRJTYRBFB-DUHBMQHGSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 238000004817 gas chromatography Methods 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 210000001280 germinal center Anatomy 0.000 description 1
- 210000001102 germinal center b cell Anatomy 0.000 description 1
- 230000009477 glass transition Effects 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 229920001903 high density polyethylene Polymers 0.000 description 1
- 239000004700 high-density polyethylene Substances 0.000 description 1
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 229940071870 hydroiodic acid Drugs 0.000 description 1
- 239000001341 hydroxy propyl starch Substances 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 235000013828 hydroxypropyl starch Nutrition 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 238000002329 infrared spectrum Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 229940045996 isethionic acid Drugs 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 238000002356 laser light scattering Methods 0.000 description 1
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 1
- 229960004942 lenalidomide Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 229920001684 low density polyethylene Polymers 0.000 description 1
- 229940031703 low substituted hydroxypropyl cellulose Drugs 0.000 description 1
- 239000004702 low-density polyethylene Substances 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 210000001370 mediastinum Anatomy 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- YZMHQCWXYHARLS-UHFFFAOYSA-N naphthalene-1,2-disulfonic acid Chemical compound C1=CC=CC2=C(S(O)(=O)=O)C(S(=O)(=O)O)=CC=C21 YZMHQCWXYHARLS-UHFFFAOYSA-N 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-N naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-N 0.000 description 1
- 230000017074 necrotic cell death Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000001683 neutron diffraction Methods 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 229940074355 nitric acid Drugs 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 229960002446 octanoic acid Drugs 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229940100691 oral capsule Drugs 0.000 description 1
- 229940096978 oral tablet Drugs 0.000 description 1
- 235000015205 orange juice Nutrition 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 238000002559 palpation Methods 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- 229940055726 pantothenic acid Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000003182 parenteral nutrition solution Substances 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 229940023488 pill Drugs 0.000 description 1
- 229920006316 polyvinylpyrrolidine Polymers 0.000 description 1
- 229920003124 powdered cellulose Polymers 0.000 description 1
- 235000019814 powdered cellulose Nutrition 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000002250 progressing effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- KZVLNAGYSAKYMG-UHFFFAOYSA-N pyridine-2-sulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=N1 KZVLNAGYSAKYMG-UHFFFAOYSA-N 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 238000013102 re-test Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000000565 sealant Substances 0.000 description 1
- 230000009291 secondary effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 238000004467 single crystal X-ray diffraction Methods 0.000 description 1
- 238000010583 slow cooling Methods 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 229910001467 sodium calcium phosphate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 235000010268 sodium methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 239000006104 solid solution Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000001694 spray drying Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 229940032330 sulfuric acid Drugs 0.000 description 1
- 238000004441 surface measurement Methods 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000007885 tablet disintegrant Substances 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 235000013337 tricalcium citrate Nutrition 0.000 description 1
- 231100000402 unacceptable toxicity Toxicity 0.000 description 1
- 238000002460 vibrational spectroscopy Methods 0.000 description 1
- 238000001845 vibrational spectrum Methods 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 239000003871 white petrolatum Substances 0.000 description 1
- 238000003963 x-ray microscopy Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
本明細書では、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン塩、およびその遊離塩基または塩を含む固形体に関する、製剤、製造方法、固形体および使用方法が提供される。【選択図】なし
Description
本出願は、2019年10月21日提出の米国仮出願番号第62/923,972号に対する優先権を主張し、その全体が参照によって本明細書に組み込まれる。
本明細書では、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン塩、およびその遊離塩基または塩を含む固形体が提供される。そのような塩および固形体を含む医薬組成物、並びに様々な障害を治療、予防、および処置するための、そのような塩および固形体の使用方法も本明細書で提供される。
医薬化合物の代替固形体は、製剤の物理的および化学的特性を調節または増強するための可能な手段として出現している。固形体における変化が、様々な物理的および化学的特性に影響を及ぼし、処理、製剤、安定性、バイオアベイラビリティ、保存、輸送(例えば、船舶輸送)、他の重要な薬学的特性における利点または欠点をもたらすと仮定すると、医薬化合物の固形体の同定および選択は複雑である。有用な医薬固形体には、結晶性固体および非晶質固体が挙げられ、製剤およびその投与方法によって決まる。非晶質固体は、長い範囲の構造秩序の欠如によって特徴付けられるのに対して、結晶性固体は、構造周期性によって特徴付けられる。望ましい医薬固形の種類は、具体的な適用によって決まる;非晶質固体は、時として、例えば、増強された溶解特性に基づいて選択されるのに対して、結晶性固体は、例えば、物理的または化学的安定性といった特性にとって望ましいことがある(例えば、S. R. Vippagunta et al., Adv. Drug. Deliv. Rev., (2001) 48:3-26; L. Yu, Adv. Drug. Deliv. Rev., (2001) 48:27-42を参照されたい)。
注目すべきことに、化合物の結晶型が存在するかどうかさえ、ましてや、うまくそれらを調製する方法を事前に予測することは可能ではない(例えば、Braga and Grepioni, 2005, “Making crystals from crystals: 英 green route to crystal engineering and Polymorphism,” Chem. Commun.:3635-3645(結晶工学に関して、指示があまり正確でない場合、および/または他の外的因子が製造方法に影響を及ぼす場合、結果物が予測不可能となることがある);Jones et al., 2006, Pharmaceutical Cocrystals: An Emerging Approach to Physical Property Enhancement,” MRS Bulletin 31:875-879(現在、最も単純な分子でさえ、その観察可能な多形の数を計算的に予測することは一般的に可能ではない);Price, 2004, “The computational prediction of pharmaceutical crystal structures and polymorphism,” Advanced Drug Delivery Reviews 56:301-319 (“Price”);およびBernstein, 2004, “Crystal Structure Prediction and Polymorphism,” ACA Transactions 39:14-23(いかなる程度の確信を持って、まして多形型でもない結晶構造を予測する能力を述べるには、いまだに多くのことを学習および実行する必要がある)を参照されたい)。
特定の有効医薬成分の塩型のタイプは、有効医薬成分のある特性に影響を及ぼすことがある。これらの特性には、溶解性、安定性、およびバイオアベイラビリティが挙げられる。
可能な固形体の多様性には、遊離塩基型および塩型の両方が挙げられ、特定の医薬化合物に関する物理的および化学的特性の潜在的多様性を創出する。固形体の発見および選択は、有効で安全かつ市場性のある医薬品の開発において非常に重要である。
本明細書では、下記:
で示される化合物1:化学名(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを含む、固形体(例えば、結晶型、非晶質型、多形またはその混合物)が提供される。
一つの実施形態において、前記固形体は、化合物1の遊離塩基を含む。一つの実施形態において、前記固形体は、本明細書で記載されるように、化合物1の遊離塩基のフォームAまたはフォームBである。
一つの実施形態において、前記固形体は、化合物1の塩を含む。
一つの実施形態において、前記固形体は、化合物1の塩酸塩を含む。一つの実施形態において、前記固形体は、本明細書で記載されるように、化合物1の塩酸塩のフォームAまたはフォームBである。
一つの実施形態において、前記固形体は、化合物1のフマル酸塩を含む。一つの実施形態において、前記固形体は、本明細書で記載されるように、化合物1のフマル酸塩のフォームAである。
一つの実施形態において、前記固形体は、化合物1のトシル酸塩を含む。一つの実施形態において、前記固形体は、本明細書で記載されるように、化合物1のトシル酸塩のフォームAである。
一つの実施形態において、前記固形体は、化合物1のマレイン酸塩を含む。一つの実施形態において、前記固形体は、本明細書で記載されるように、化合物1のマレイン酸塩のフォームAである。
一つの実施形態において、前記固形体は、化合物1のベシル酸塩を含む。一つの実施形態において、前記固形体は、本明細書で記載されるように、化合物1のベシル酸塩のフォームAである。
本明細書では、化合物1の塩も提供される。一つの実施形態において、前記塩は、塩酸塩、フマル酸塩、トシル酸塩、マレイン酸塩、またはベシル酸塩である。一つの実施形態において、前記塩は、結晶性である。一つの実施形態において、前記塩は、非晶質である。
本明細書で提供される固形体は、動物またはヒトに使用するための製剤の調製用有効医薬成分として有用である。それゆえ、本明細書における実施形態は、最終原薬としての、これらの固形体の使用を包含する。ある実施形態は、改善された特性、例えば、特に、最終製剤の製造、加工、製剤および/または保存に必要な、粉体流特性、圧縮特性、打錠特性、安定性特性、および賦形剤適合性特性を有する最終剤形の製造に有用な固形体を提供する。本明細書におけるある実施形態は、化合物1を有する単一成分結晶型、複合成分結晶型、単一成分非晶質型および/または複合成分非晶質型、並びに薬学的に許容される希釈剤、賦形剤または担体を含む医薬組成物を提供する。
本明細書で提供される化合物1を有し、少なくとも一つの医薬担体を任意に有する、有効濃度の固形体を含む、適切な経路および手段による投与のために製剤される医薬組成物も提供される。
本明細書では、血液悪性腫瘍を治療、予防または処置するために、本明細書で提供される化合物1を含む固形体を使用する方法も提供される。一つの実施形態において、前記方法は、血液悪性腫瘍を治療するためのものである。一つの実施形態において、前記方法は、血液悪性腫瘍を予防するためのものである。一つの実施形態において、前記方法は、血液悪性腫瘍を処置するためのものである。
一つの実施形態において、前記血液悪性腫瘍は、急性骨髄性白血病(AML)、急性リンパ性白血病(ALL)、多発性骨髄腫(MM)、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、ホジキンリンパ腫(HL)、T細胞リンパ腫(TCL)、バーキットリンパ腫(BL)、慢性リンパ性白血病/小リンパ球性リンパ腫(CLL/SLL)、辺縁帯リンパ腫(MZL)、または骨髄異形成症候群(MDS)である。
本明細書では、非ホジキンリンパ腫(NHL)を治療、予防または処置するために、本明細書で提供される化合物1を含む固形体を、単独またはリツキシマブと組み合わせて使用する方法も提供される。一つの実施形態において、前記方法は、NHLを治療するためのものである。一つの実施形態において、前記方法は、NHLを予防するためのものである。一つの実施形態において、前記方法は、NHLを処置するためのものである。
ある実施形態において、前記NHLは、びまん性大細胞型B細胞リンパ腫(DLBCL)、濾胞性リンパ腫(FL)、マントル細胞リンパ腫(MCL)、または原発性中枢神経系リンパ腫(PCNSL)である。
本明細書では、慢性リンパ性白血病(CLL)を治療、予防または処置するために、本明細書で提供される化合物1を含む固形体を、単独またはオビヌツズマブと組み合わせて使用する方法も提供される。一つの実施形態において、前記方法は、CLLを治療するためのものである。一つの実施形態において、前記方法は、CLLを予防するためのものである。一つの実施形態において、前記方法は、CLLを処置するためのものである。
本明細書では、小リンパ球性リンパ腫(SLL)を治療、予防または処置するために、本明細書で提供される化合物1を含む固形体を、単独またはオビヌツズマブと組み合わせて使用する方法も提供される。一つの実施形態において、前記方法は、SLLを治療するためのものである。一つの実施形態において、前記方法は、SLLを予防するためのものである。一つの実施形態において、前記方法は、SLLを処置するためのものである。
本明細書では、本明細書で提供される疾患を治療する方法に使用される化合物1の固形体または塩も提供され、前記方法は、治療的有効量の化合物1の前記固形体または塩を患者に投与することを特徴とする。本明細書では、本明細書で提供される疾患を治療する方法に使用される化合物1の前記固形体または塩を含む医薬組成物も提供される。
本明細書に記載される主題の、これらのおよび他の態様は、以下の「発明を実施するための形態」への参照によって明らかになるだろう。
1.定義
他に定義されない限り、本明細書で使用される全ての技術的および科学的用語は、当業者によって一般に理解されるものと同じ意味を有する。全ての特許、出願、公開出願および他の出版物は、参照によってそれらの全体が組み込まれる。本明細書における用語の定義が複数存在する場合、特に明記しない限り、本セクションにおける定義が優先される。
他に定義されない限り、本明細書で使用される全ての技術的および科学的用語は、当業者によって一般に理解されるものと同じ意味を有する。全ての特許、出願、公開出願および他の出版物は、参照によってそれらの全体が組み込まれる。本明細書における用語の定義が複数存在する場合、特に明記しない限り、本セクションにおける定義が優先される。
本出願、および本明細書並びに添付の請求項で使用されるように、不定冠詞「a」および「an」並びに定冠詞「the」は、文脈上明らかな場合を除き、複数の、および単数の指示対象を含む。
本明細書で使用されるように、「を含む(comprising)」および「を含む(including)」という用語は、同じ意味で用いられてもよい。「を含む(comprising)」および「を含む(including)」という用語は、言及されるように、記載される特徴または構成要素の存在を明示するものとして解釈されるべきであるが、一つ以上の特徴、もしくは構成要素、もしくはそれらの群の存在または追加を除外しない。さらに、「を含む(comprising)」および「を含む(including)」という用語は、「からなる(consisting of)」という用語によって包含される例を含むように意図される。したがって、「からなる(consisting of)」という用語は、本発明のより具体的な実施形態を提供するために、「を含む(comprising)」および「を含む(including)」という用語の代わりに用いられてもよい。
「からなる(consisting of)」という用語は、対象の事項が、それを構成する、記載される特徴または構成要素の、少なくとも90%、95%、97%、98%または99%を有するという意味である。もう一つの実施形態において、「からなる(consisting of)」という用語は、任意の後に続く記述の範囲から、達成されるべき技術的効果に必須でないものを除く任意の他の特徴または構成要素を除外する。
本明細書で使用されるように、「または(or)」という用語は、任意の一つまたは任意の組み合わせを意味する包括的な「または(or)」として解釈されるべきである。したがって、「A、BまたはC」は、以下のいずれかを意味する:「A;B;C;AおよびB;AおよびC;BおよびC;A、BおよびC」。この定義の例外は、要素、機能、手順または行為の組み合わせが、何らかの形で本質的に互いに排他的である場合にのみ生じるだろう。
本明細書で使用されるように、そして特別の定めのない限り、「約(about)」および「およそ(approximately)」という用語は、組成物または剤形の成分の用量、量、または重量パーセントに関連して用いられる場合、当業者によって、特定の用量、量、または重量パーセントから得られるものと同等の薬理学的効果を提供すると認識される用量、量、または重量パーセントを意味する。ある実施形態において、「約(about)」および「およそ(approximately)」という用語は、この文脈で用いられる場合、特定の用量、量、または重量パーセントの30%以内、20%以内、15%以内、10%以内、または5%以内の用量、量、または重量パーセントを意図する。
本明細書で使用されるように、そして特別の定めのない限り、「約(about)」および「およそ(approximately)」という用語は、特定の固形体を特徴付けるために提供される数値または値の範囲、例を挙げると、例えば、融解、脱水、脱溶媒和またはガラス転移温度などを記述する具体的な温度または温度範囲;例えば、温度または湿度の関数としての質量変化などの質量変化;例えば、質量または割合に換算した溶媒または水含有量;あるいは、例えば、IRまたはラマン分光法またはXRPDによる分析などにおけるピーク位置;に関連して用いられる場合、値または値の範囲が、前記特定の固形体を特徴付けながらも、当業者に合理的とみなされる程度まで逸脱することがあることを示す。例えば、特定の実施形態において、「約(about)」および「およそ(approximately)」という用語は、この文脈で用いられる場合、数値または値の範囲が、列挙される値または値の範囲の25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1.5%、1%、0.5%、または0.25%以内で変化することがあることを示す。例えば、いくつかの実施形態において、XRPDピーク位置の値は、前記特定のXRPDピークを特徴付けながらも、最大±0.2度2θまで変化することがある。本明細書で使用されるように、数値または値の範囲に先行するチルダ(すなわち、「~」)は、「約(about)」および「およそ(approximately)」を示す。
特別の定めのない限り、「粉末X線回折(X-ray powder diffraction)」、「粉末X線回折(powder X-ray diffraction)」、「PXRD」、および「XRPD」という用語は、本出願において同じ意味で用いられる。
本明細書で使用されるように、そして特別の定めのない限り、「固形体(solid form)」という用語および関連する用語は、主として液体または気体状態でない物理的形を示す。本明細書で使用されるように、「固形体(solid form)」および「固形体(solid forms)」という用語は、半固体を包含する。固形体は、結晶性、非晶質、部分的結晶性、部分的非晶質、またはそれらの混合物のいずれであってもよい。
本明細書で提供される固形体は、様々な程度の結晶化度または格子秩序を有し得る。本明細書で提供される固形体は、任意の特定の程度の結晶化度または格子秩序によって制限されず、0-100%の結晶性であり得る。結晶化度の程度を測定する方法は、Suryanarayanan, R., X-Ray Power Diffractometry, Physical Characterization of Pharmaceutical Salts, H.G. Brittain, Editor, Mercel Dekkter, Murray Hill, N.J., 1995, pp. 187 - 199に記載されるような技術分野における通常の技術を有する人に既知であり、その全体が参照によって本明細書に組み込まれる。いくつかの実施形態において、本明細書で提供される固形体は、約0、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95または100%の結晶性である。
本明細書で使用されるように、そして特別の定めのない限り、本明細書で使用される「結晶性(crystalline)」という用語および関連する用語は、物質、構成要素、薬品、または形を記述するために用いられる場合、物質、構成要素、薬品、または形が、例えば、X線回折によって決定されるように、実質的に結晶性であるという意味である。Remington:The Science and Practice of Pharmacy, 21st edition, Lippincott, Williams and Wilkins, Baltimore, MD (2005);The United States Pharmacopeia, 23rd edition, 1843-1844 (1995)を参照されたい。
本明細書で使用されるように、そして特別の定めのない限り、本明細書における「結晶型(crystal form)」、「結晶型(crystal forms)」という用語、および関連する用語は、結晶性である固形体を示す。結晶型は、単一成分結晶型および複合成分結晶型を含み、多形、溶媒和物、水和物、および他の分子複合体、並びに塩、塩の溶媒和物、塩の水和物、塩の共結晶、他の塩の分子複合体、ならびにそれらの多形が挙げられるが、これらに限らない。ある実施形態において、物質の結晶型は、非晶質型および/または他の結晶型を実質的に含まない。ある実施形態において、物質の結晶型は、重量ベースで、一つ以上の非晶質型および/または他の結晶型の、約1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%または50%以下を含むことがある。ある実施形態において、物質の結晶型は、物理的および/または化学的に純粋であり得る。ある実施形態において、物質の結晶型は、約99%、98%、97%、96%、95%、94%、93%、92%、91%または90%、物理的および/または化学的に純粋であり得る。
化合物を含む「単一成分(single-component)」固形体は、本質的に、その化合物からなる。化合物を含む「複合成分(multiple-component)」固形体は、有意な量の、一つ以上の、イオンおよび/または分子といった追加の種を固形体内に含む。例えば、ある実施形態において、化合物を含む結晶性複合成分固形体は、結晶格子中の定位置で非共有結合した一つ以上の種をさらに含む。もう一つ例を挙げると、ある実施形態において、化合物を含む非晶質複合成分固形体は、一つ以上のポリマーをさらに含み、前記化合物は、前記ポリマーを含む固体マトリックス中に分散している。
物質の結晶型は、多数の方法によって得ることができる。そのような方法には、溶融再結晶化、溶融冷却、溶媒再結晶化、例えば、ナノポアまたはキャピラリー内などの閉鎖空間内での再結晶化、例えば、ポリマー上などの表面またはテンプレート上での再結晶化、例えば、共結晶カウンター分子などの添加物存在下での再結晶化、脱溶媒和、脱水、急速な蒸発、急冷、徐冷、蒸気拡散、昇華、粉砕、および溶媒滴下粉砕が挙げられるが、これらに限らない。
特別の定めのない限り、本明細書における「多形(polymorph)」、「多形型(polymorphic form)」、「多形(polymorphs)」、「多形型(polymorphic forms)」という用語、および関連する用語は、同じ分子、分子群またはイオン群から本質的になる二つ以上の結晶型を示す。異なる結晶型のように、異なる多形は、例えば、融解温度、融解熱、溶解度、溶解速度、および/または振動スぺクトルなどの異なる物理的特性を有し得るが、これは、結晶格子中の前記分子群またはイオン群が、異なる配列または立体配座を有するためである。多形によって示される物理的特性の相違は、(製剤および薬品製造に重要な)保存安定性、圧縮性および密度、並びに溶解速度(バイオアベイラビリティに重要な因子)などの薬学的パラメーターに影響を及ぼし得る。安定性の相違は、化学的反応性の変化(例えば、ある多形を含む場合のほうが、別の多形を含む場合よりも急速に剤形が変色するような、異なる酸化)または機構変化(例えば、動態学的に好ましい多形が、熱力学的により安定な多形へと変化するにつれて、錠剤は、保存中に崩壊する)あるいは両方(例えば、ある多形の錠剤は、高湿度で崩壊の影響をより受けやすい)に起因し得る。溶解度/溶解の相違の結果、極端な場合には、ある多形転移は、効力の欠如をもたらし得、または別の極端な場合には、毒性をもたらし得る。さらに、結晶の物理的特性は、加工において重要となることがある(例えば、ある多形は、溶媒和物を形成しやすい場合があり、あるいはろ過および洗浄して不純物を取り除くことが困難な場合があり、粒子の形およびサイズ分布は、多形間で異なることがある)。
本明細書で使用されるように、そして特別の定めのない限り、本明細書で使用される「非晶質(amorphous)」、「非晶質型(amorphous form)」という用語、および関連する用語は、問題になっている物質、構成要素または薬品が、X線回折によって決定されるように、実質的に結晶性でないという意味である。特に、「非晶質型(amorphous form)」という用語は、無秩序な固形体、すなわち、長距離結晶性秩序を欠く固形体を言い表す。ある実施形態において、物質の非晶質型は、他の非晶質型および/または結晶型を実質的に含まないことがある。他の実施形態において、物質の非晶質型は、重量ベースで、一つ以上の他の非晶質型および/または結晶型の、約1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%または50%以下を含むことがある。ある実施形態において、物質の非晶質型は、物理的および/または化学的に純粋であり得る。ある実施形態において、物質の非晶質型は、約99%、98%、97%、96%、95%、94%、93%、92%、91%または90%、物理的および/または化学的に純粋であり得る。ある実施形態において、物質の非晶質型は、追加の構成要素または成分(例えば、添加物、ポリマー、または非晶質型をさらに安定化するはたらきをし得る賦形剤)を含み得る。ある実施形態において、非晶質型は、固溶体であることがある。
物質の非晶質型は、多数の方法によって得ることができる。そのような方法には、加熱、融解冷却、急速融解冷却、溶媒蒸発、急速溶媒蒸発、脱溶媒和、昇華、粉砕、ボールミル粉砕、凍結粉砕、噴霧乾燥、および凍結乾燥が挙げられるが、これらに限らない。
特別の定めのない限り、「溶媒和物(solvate)」および「溶媒和した(solvated)」という用語は、本明細書で使用されるように、溶媒和物を含む物質の固形体を示す。「水和物(hydrate)」および「水和した(hydrated)」という用語は、溶媒が水を含む溶媒和物を示す。「溶媒和物の多形(polymorphs of solvates)」は、特定の溶媒和物組成物についての複数の固形体の存在を示す。同様に、「水和物の多形(polymorphs of hydrates)」は、特定の水和物組成物についての複数の固形体の存在を示す。「脱溶媒和した溶媒和物(desolvated solvate)」という用語は、本明細書で使用されるように、溶媒和物から溶媒を除去することで製造され得る、物質の固形体を示す。「溶媒和物(solvate)」および「溶媒和した(solvated)」という用語は、本明細書で使用されるように、塩、共結晶、または分子複合体の溶媒和物を示すこともある。「水和物(hydrate)」および「水和した(hydrated)」という用語は、本明細書で使用されるように、塩、共結晶、または分子複合体の水和物を示すこともある。
結晶型および非晶質型を特徴付けるための技術には、熱重量分析(TGA)、示差走査熱量測定(DSC)、粉末X線回折法(XRPD)、単結晶X線回折法、振動分光法、例えば、赤外線(IR)およびラマン分光法、固体および溶液核磁気共鳴(NMR)分光法、光学顕微鏡法、ホットステージ光学顕微鏡法、走査型電子顕微鏡法(SEM)、電子結晶学および定量分析、粒径分析(PSA)、表面積分析、溶解度測定、溶解測定、元素分析およびカールフィッシャー分析が挙げられるが、これに限らない。特徴的な単位格子パラメーターは、単結晶回折および粉末回折といった、X線回折並びに中性子回折などの一つ以上の技術を用いて測定され得るが、これらに限らない。粉末回折データの分析に有用な技術には、リートベルト解析などの特性解析が挙げられ、例えば、複数の固相を含む試料中の単相に関連する回折ピークを分析するために用いられることがある。粉末回折データの分析に有用な他の技術には、単位格子インデックス化が挙げられ、当業者が、結晶性粉末を含む試料から単位格子パラメーターを割り出すことを可能にする。一つの実施形態において、XRPDパターンは、Cu Kα放射線を用いて得られる。一つの実施形態において、DSCのランプ速度(加熱速度)は、約10℃毎分である。一つの実施形態において、0.5-2.0℃毎分といった遅い加熱速度は、より正確なDSC試験に使用され得る。DSC試験に用いられるサンプルパンには、例えば、アルミニウム製、白金製、およびステンレス鋼製のパンが挙げられる。パンは、異なる形状、例えば、蓋のない、ピンホール付き、または密閉されたパンを有し得る。一つの実施形態において、TGAのランプ速度は、約10℃毎分である。
ある実施形態において、本明細書で提供される固形体、例えば、結晶または非晶質型は、実質的に純粋である、すなわち、他の固形体および/または化学的化合物を実質的に含まず、一つ以上の他の固形体、および/または他の化学的化合物を、重量パーセントで、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.75%、0.5%、0.25%または0.1%以下含む。
本明細書で使用されるように、そして別段の指示がない限り、他の化学的化合物、固形体、または組成物を実質的に含まない、化学的化合物、固形体、または組成物は、前記化合物、固形体、または組成物が、ある実施形態において、重量50%、45%、40%、35%、30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.05%、または0.01%以下で他の化合物、固形体、または組成物を含むという意味である。
本明細書で使用されるように、そして特別の定めのない限り、「実質的に物理的に純粋(substantially physically pure)」である固形体は、他の固形体を実質的に含まない。ある実施形態において、実質的に物理的に純粋である結晶型は、一つ以上の他の固形体を、重量ベースで、50%、45%、40%、35%、30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.05%、または0.01%以下含む。他の固形体の検出は、当業者に明らかな任意の方法によって達成され得、回折分析、熱分析、元素燃焼分析および/または分光分析が挙げられるが、これらに限らない。
本明細書で使用されるように、そして特別の定めのない限り、「実質的に化学的に純粋(substantially chemically pure)」である固形体は、他の化学的化合物(すなわち、化学的不純物)を実質的に含まない。ある実施形態において、実質的に化学的に純粋である固形体は、一つ以上の他の化学的化合物を、重量ベースで、50%、45%、40%、35%、30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.4%、0.3%、0.2%、0.1%、0.05%、または0.01%以下含む。他の化学的化合物の検出は、当業者に明らかな任意の方法によって達成され得、例えば、質量分光分析、分光分析、熱分析、元素燃焼分析および/またはクロマトグラフ分析などの化学的分析の方法が挙げられるが、これらに限らない。
固形体は、本明細書で提供される結晶型といった特定の固形体に特有の、異なる物理的特性評価データを示すことがある。これらの特性評価データは、例えば、粉末X線回折、示差走査熱量測定、熱重量分析、および核磁気共鳴分光法といった、当業者に既知の様々な技術によって得られることがある。これらの技術によって提供されるデータは、特定の固形体を同定するために使用されることがある。当業者は、これらの特性評価技術のうちの一つを行い、結果データが、本明細書で提供される参照データと「一致し」、特定の固形体の特性であると同定されるかどうか決定することによって、固形体が、本明細書で提供される型のうちの一つであるかどうか決定することができる。参照固形体のものと「一致する」特性評価データは、当業者によって、参照固形体と同一の固形体に相当すると理解される。データが「一致する」かどうか分析する際、当業者は、特定の特性評価データ点が、ある特定の固形体を特徴付けながらも、例えば、実験誤差および日常的なサンプル間の分析のばらつきによって、合理的な程度まで変化することがあるということを理解する。
本明細書で使用されるように、そして特別の定めのない限り、「薬学的に許容される塩(pharmaceutically acceptable salts)」という用語は、薬学的に許容される、無機酸および有機酸といった、相対的に無毒性の酸から調製される塩を示す。ある実施形態において、適切な酸には、酢酸、アジピン酸、4-アミノサリチル酸、アスコルビン酸、アスパラギン酸、ベンゼンスルホン酸、安息香酸、樟脳酸、カンファースルホン酸、カプリン酸、カプロン酸、カプリル酸、桂皮酸、炭酸、クエン酸、シクラミン酸、二水素リン酸、2,5-ジヒドロキシ安息香酸(ゲンチシン酸)、1,2-エタンジスルホン酸、エタンスルホン酸、フマル酸、ガラクツロン酸、グルコン酸、グルクロン酸、グルタミン酸、グルタル酸、グリコール酸、馬尿酸、臭化水素酸、塩酸、ヨウ化水素酸、イソ酪酸、イセチオン酸、乳酸、マレイン酸、リンゴ酸、マロン酸、マンデル酸、メタンスルホン酸、一水素炭酸、一水素-リン酸、一水素硫酸、ムチン酸、1,5-ナフタレンジスルホン酸、ニコチン酸、硝酸、シュウ酸、パモン酸、パントテン酸、リン酸、フタル酸、プロピオン酸、ピログルタミン酸、サリチル酸、スベリン酸、コハク酸、硫酸、酒石酸、トルエンスルホン酸、および同種のもの(例えば、 S. M. Berge et al., J. Pharm. Sci., 66:1-19 (1977);およびHandbook of Pharmaceutical Salts:Properties, Selection and Use, P. H. Stahl and C. G. Wermuth, Eds., (2002), Wiley, Weinheimを参照されたい)が挙げられるが、これらに限らない。ある実施形態において、適切な酸は、強酸(例えば、pKaが約1以下である)であり、塩酸、臭化水素酸、硫酸、硝酸、メタンスルホン酸、ベンゼンスルホン酸、トルエンスルホン酸、ナフタレンスルホン酸、ナフタレンジスルホン酸、ピリジン-スルホン酸、または他の置換スルホン酸が挙げられるが、これらに限らない。アスパラギン酸および同種のものといったアミノ酸、並びにアスピリン、イブプロフェン、サッカリン、および同種のものといった他の化合物などの、酸性の性質を有する他の相対的に無毒性の化合物の塩も含まれる。酸付加塩は、無溶媒または適切な溶媒中のいずれかで、化合物の中性型を十分な量の望ましい酸と接触させることによって得ることができる。固体として、塩は、結晶性または非晶質型、またはその混合物で存在し得る。塩は、多形型で存在することもある。
示された構造とその構造の名称の間に矛盾がある場合、示された構造に、より大きな重みが与えられるべきであるということに留意すべきである。
本明細書で使用されるように、そして別段の指示がない限り、「治療する(treating)」という用語は、障害、疾患もしくは状態、または障害、疾患もしくは状態に関連する一つ以上の症状の、全部または一部の緩和、あるいはこれらの症状のさらなる進行もしくは悪化の緩徐化または停止、或いは障害、疾患もしくは状態自体の原因を緩和または除去することを意味する。
本明細書で使用されるように、そして別段の指示がない限り、「予防する(preventing)」という用語は、障害、疾患もしくは状態の全部または一部の、発症、再発または伝播を遅延および/あるいは防止する;患者が障害、疾患、もしくは状態を獲得するのを防ぐ;または患者が障害、疾患、もしくは状態を獲得するリスクを減らす方法を意味する。
本明細書で使用されるように、そして別段の指示がない限り、「処置する(managing)」という用語は、特定の疾患もしくは障害に苦しんでいた患者における、その再発を予防すること、疾患もしくは障害に苦しんでいた患者が寛解のままでいる時間を延長すること、および/あるいは処置している疾患もしくは状態に関連する症状の、重症度の減少または回避を維持することを包含する。
本明細書で使用されるように、そして別段の指示がない限り、化合物に関連する「有効量(effective amount)」という用語は、障害、疾患もしくは状態、またはその症状を治療、予防、または処置することができる量を意味する。
本明細書で使用されるように、そして別段の指示がない限り、「患者(subject)」または「患者(patient)」という用語は、これらに限らないが、ウシ、サル、ウマ、ヒツジ、ブタ、ニワトリ、シチメンチョウ、ウズラ、ネコ、イヌ、マウス、ラット、ウサギまたはモルモットなどの動物を、一つの実施形態において哺乳動物を、もう一つの実施形態においてヒトを含む。
本明細書で使用されるように、そして別段の指示がない限り、「再発した(relapsed)」という用語は、治療に応答(例えば、完全寛解を達成)し、その後進行した障害、疾患、または状態を示す。治療は、一つ以上の治療法を含み得る。一つの実施形態において、前記障害、疾患または状態は、一つ以上の治療法で以前に治療されている。もう一つの実施形態において、前記障害、疾患または状態は、一つ、二つ、三つまたは四つの治療法で以前に治療されている。いくつかの実施形態において、前記障害、疾患または状態は、血液悪性腫瘍である。
一つの実施形態において、「再発性(relapsed)」DLBCLは、一つ以上の治療法で以前に治療されているDLBCLを示すことがある。一つの実施形態において、前記再発性DLBCLは、一つ、二つ、三つまたは四つの治療法で以前に治療されているDLBCLである。一つの実施形態において、前記再発性DLBCLは、二つ以上の治療法で以前に治療されているDLBCLである。
一つの実施形態において、「再発性(relapsed)」FLは、一つ以上の治療法で以前に治療されているFLを示すことがある。一つの実施形態において、前記再発性FLは、一つ、二つ、三つまたは四つの治療法で以前に治療されているFLである。一つの実施形態において、前記再発性FLは、二つ以上の治療法で以前に治療されているFLである。
本明細書で使用されるように、そして別段の指示がない限り、「難治性の(refractory)」という用語は、一つ以上の治療法を含み得る事前治療に応答していない障害、疾患、または状態を示す。一つの実施形態において、前記障害、疾患または状態は、一つ、二つ、三つまたは四つの治療法で以前に治療されている。一つの実施形態において、前記障害、疾患または状態は、二つ以上の治療法で以前に治療されており、レジメンを取り入れた最新の全身療法に対して完全寛解(CR)に満たない応答を得る。いくつかの実施形態において、前記障害、疾患または状態は、血液悪性腫瘍である。
一つの実施形態において、「再発性または難治性(relapsed or refractory)」CLL/SLLは、一つ以上の治療法で以前に治療されているCLL/SLLを示すことがある。一つの実施形態において、前記再発性または難治性CLL/SLLは、一つ、二つ、三つまたは四つの治療法で以前に治療されているCLL/SLLである。一つの実施形態において、前記再発性または難治性CLL/SLLは、二つ以上の治療法で以前に治療されているCLL/SLLである。一つの実施形態において、前記再発性または難治性CLL/SLLは、ブルトン型チロシンキナーゼ(BTK)阻害剤で以前に治療されているCLL/SLLである。一つの実施形態において、前記再発性または難治性CLL/SLLは、BTK阻害剤に対して再発性または難治性である。一つの実施形態において、前記BTK阻害剤は、イブルチニブである。一つの実施形態において、前記BTK阻害剤は、アカラブルチニブである。一つの実施形態において、前記BTK阻害剤は、ザヌブルチニブである。一つの実施形態において、前記BTK阻害剤は、チラブルチニブである。
がん、例えば、血液悪性腫瘍の文脈において、阻害は、疾患進行の阻害、腫瘍増殖の阻害、原発性腫瘍の減少、腫瘍関連症状の軽減、腫瘍分泌因子の阻害、原発性もしくは続発性腫瘍の出現の遅延、原発性もしくは続発性腫瘍の進行の緩徐化、原発性もしくは続発性腫瘍の発生の減少、疾患の二次的影響の重症度の緩徐化もしくは減少、腫瘍増殖の抑止および腫瘍の退縮、無増悪期間(TTP)の増加、無増悪生存期間(PFS)の増加、全生存期間(OS)の増加などによって評価されることがある。本明細書で使用されるように、OSは、治療開始から任意の原因による死亡までの時間を意味する。本明細書で使用されるように、TTPは、治療開始から腫瘍進行までの時間を意味し、TTPは、死亡を含まない。一つの実施形態において、PFSは、治療開始から腫瘍進行または死亡までの時間を意味する。一つの実施形態において、PFSは、化合物の最初の投与から疾患進行の最初の発生または任意の原因による死亡までの時間を意味する。一つの実施形態において、PFS率は、カプランマイヤー推定値を用いて算出される。無イベント生存期間(EFS)は、治療開始から、疾患進行、任意の理由による治療中止、または死亡といった、任意の治療失敗までの時間を意味する。一つの実施形態において、全奏効率(ORR)は、応答を達成する患者の割合を意味する。一つの実施形態において、ORRは、完全または部分寛解を達成する患者の割合の合計を意味する。一つの実施形態において、ORRは、最大応答≧部分寛解(PR)である患者の割合を意味する。一つの実施形態において、奏効期間(DoR)は、応答の達成から再発または疾患進行までの時間である。一つの実施形態において、DoRは、応答≧部分寛解(PR)の達成から再発または疾患進行までの時間である。一つの実施形態において、DoRは、応答の最初の記録時から進行性疾患の最初の記録時または死亡までの時間である。一つの実施形態において、DoRは、応答≧部分寛解(PR)の最初の記録時から進行性疾患の最初の記録時または死亡までの時間である。一つの実施形態において、奏効までの期間(TTR)は、化合物の最初の投与から応答の最初の記録時までの時間である。一つの実施形態において、TTRは、化合物の最初の投与から応答≧部分寛解(PR)の最初の記録時までの時間を意味する。極端な場合、完全な阻害は、予防または化学予防と呼ばれる。この文脈において、「予防(prevention)」という用語は、臨床的に明らかながんの発症を完全に予防すること、またはがんの前臨床的に明らかなステージの発症を予防することのいずれかを含む。悪性細胞への形質転換の予防、または前悪性細胞の悪性細胞への進行を停止もしくは逆行させることも、この定義によって包含されることが意図される。これは、がんを発症する危険性がある人の予防的な治療を含む。
ある実施形態において、NHLの治療は、悪性リンパ腫の国際ワークショップ基準(Cheson et al., J. Clin. Oncol., 2014, 32(27):3059-3068を参照されたい)およびフルオロデオキシグルコース-ポジトロン放出断層撮影(FDG-PET)スキャン解釈のドーヴィル基準(Itti et al., Eur. J. Nucl. Med. Mol. Imaging, 2013, 40(9):1312-20;Meignan et al., Leuk Lymphoma, 2014, 55(1):31-37)(「ルガーノ基準」)によって、表1-3に示す応答およびエンドポイントの定義を用いて評価されることがある。
CNS=中枢神経系;CSF=脳脊髄液;CT=コンピューター断層撮影;FDG=フルオロデオキシグルコース;GI=胃腸の;MRI=磁気共鳴画像法;PET=ポジトロン放出断層撮影;N/A=該当なし
a PET/CTは、骨髄病変の判定に適しており、他のリンパ節外部位の病変の示唆に富むとみなすことができる。これらの部位の生検確認は、必要ならば考慮され得る。
CMR=完全代謝反応;LDi=病変の最長横径;PPD=LDiおよび垂直径の外積;SDi=LDiに垂直な最短軸;SPD=様々な病変に対する垂直径の積和s;N/A=該当なし
a 骨髄病変がベースライン時の場合、CRに必要である
b 高い生理学的取り込みまたは脾臓もしくは骨髄内部での活性化;(例えば化学療法もしくは骨髄コロニー刺激因子)を伴う、ワルダイエル咽頭輪またはリンパ節外部位において、取り込みは、正常な縦隔および/または肝臓より大きいことがある。この状況では、初期病変部位における取り込みが周囲の正常組織より大きくない場合、CMRと推測され得る。
c FDG貪欲リンパ腫はPET-CTによって評価される反応を有するはずである。いくつかの疾患は、通常、CT単独で観察することができる(すなわち、辺縁帯リンパ腫)。
d PETは、造影診断CTとともに行われるべきであり、同時に行っても別々の手順に行ってもよい。
a ドーヴィル5段階評価(5PS)は、ホジキンリンパ腫(HL)およびある種の非ホジキンリンパ腫(NHL)における治療応答の初期診断および評価において、FDG-PET/CTを用いる、国際的に推奨される、臨床ルーチンおよび臨床試験の評価である。
a PET/CTは、骨髄病変の判定に適しており、他のリンパ節外部位の病変の示唆に富むとみなすことができる。これらの部位の生検確認は、必要ならば考慮され得る。
a 骨髄病変がベースライン時の場合、CRに必要である
b 高い生理学的取り込みまたは脾臓もしくは骨髄内部での活性化;(例えば化学療法もしくは骨髄コロニー刺激因子)を伴う、ワルダイエル咽頭輪またはリンパ節外部位において、取り込みは、正常な縦隔および/または肝臓より大きいことがある。この状況では、初期病変部位における取り込みが周囲の正常組織より大きくない場合、CMRと推測され得る。
c FDG貪欲リンパ腫はPET-CTによって評価される反応を有するはずである。いくつかの疾患は、通常、CT単独で観察することができる(すなわち、辺縁帯リンパ腫)。
d PETは、造影診断CTとともに行われるべきであり、同時に行っても別々の手順に行ってもよい。
一つの実施形態において、CLL/SLLの治療応答は、慢性リンパ性白血病基準についての国際ワークショップ(Hallek, M, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood, 131(25), 2745-2760 (2018)を参照されたい)によって評価されることがある(表4)。
CR=完全寛解(全ての基準を満たさなければならない);PD=進行性疾患(群Aまたは群Bの基準の少なくとも1つを満たさなければならない);PR=部分寛解(PRには、以前に異常であった場合、群Aのパラメーターの少なくとも2つおよび群Bの1つのパラメーターが改善されている必要がある;群AおよびB両方の、1つのパラメーターのみが治療前に異常である場合、1つのみが改善されている必要がある);SD=安定疾患(全ての基準を満たさなければならない;全身症状単体ではPDを定義しない)
a 6つ以下の(臨床試験におけるCTスキャンおよび身体検査によって、または一般診療における身体検査によって評価されるような)リンパ節の積和
b 脾臓の大きさは、13 cm未満の場合、正常とみなされる。しっかりと確立された、正常な肝臓のサイズの国際的な合意はない;したがって、肝臓のサイズは、臨床試験におけるイメージングおよび人手による触診によって評価され、研究プロトコルで用いられる定義に従って記録されるべきである。
a 6つ以下の(臨床試験におけるCTスキャンおよび身体検査によって、または一般診療における身体検査によって評価されるような)リンパ節の積和
b 脾臓の大きさは、13 cm未満の場合、正常とみなされる。しっかりと確立された、正常な肝臓のサイズの国際的な合意はない;したがって、肝臓のサイズは、臨床試験におけるイメージングおよび人手による触診によって評価され、研究プロトコルで用いられる定義に従って記録されるべきである。
一つの実施形態において、CLL/SLLの治療応答は、米国東海岸がん臨床試験グループ(ECOG)パフォーマンスステータスによって評価されることがある(表5)。
ECOG=米国東海岸がん臨床試験グループ、Robert Comis、MD、Group Chair
出典:Oken M, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol, 5(6):649-655 (1982)
出典:Oken M, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol, 5(6):649-655 (1982)
ある実施形態において、安定疾患またはその欠如は、患者症状の評価、身体検査、例えば、FDG-PET(フルオロデオキシグルコースポジトロン放出断層撮影)、PET/CT(ポジトロン放出断層撮影/コンピューター断層撮影)スキャン、脳および脊椎のMRI(磁気共鳴画像法)を用いて撮像されている腫瘍の視覚化、CSF(脳脊髄液)、眼科検査、硝子体液検体採取、網膜写真、骨髄検査および他の一般に認められた評価様式といった、当技術分野で既知の方法によって決定され得る。
本明細書で使用されるように、そして別段の指示がない限り、「共投与(co-administration)」および「と併用して(in combination with)」という用語は、同時に、同時的にまたは具体的な時間制限なく連続的にのいずれかによる、一つ以上の治療薬(例えば、本明細書で提供される化合物および別の抗がん剤または支持療法剤)の投与を含む。一つの実施形態において、前記剤は、細胞内にもしくは患者の体内に同時に存在するか、またはそれらの生物学的もしくは治療効果を同時に発揮する。一つの実施形態において、前記治療薬は、同じ組成物または単位剤形にある。もう一つの実施形態において、前記治療薬は、別々の組成物または単位剤形にある。
「支持療法剤(supportive care agent)」という用語は、別の治療薬を用いる治療に由来する有害作用を治療、予防、または処置する任意の物質を示す。
化合物1は、化学名(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを有する。化合物1を調製する方法は、米国出願番号第16/390,815号に記載されており、その全体が参照によって本明細書に組み込まれる。
一つの実施形態において、前記固形体は、化合物1の遊離塩基を含む。一つの実施形態において、前記固形体は、化合物1の塩を含む。一つの実施形態において、前記固形体は、化合物1の塩酸塩を含む。一つの実施形態において、前記固形体は、化合物1のフマル酸塩を含む。一つの実施形態において、前記固形体は、化合物1のトシル酸塩を含む。一つの実施形態において、前記固形体は、化合物1のマレイン酸塩を含む。一つの実施形態において、前記固形体は、化合物1のベシル酸塩を含む。
一つの実施形態において、前記固形体は、結晶性である。一つの実施形態において、前記固形体は、水和物である。一つの実施形態において、前記固形体は、無水物である。一つの実施形態において、前記固形体は、溶媒和物である。一つの実施形態において、前記固形体は、溶媒和していない。一つの実施形態において、前記固形体は、非晶質である。
提供される前記固形体は、当業者に既知である多数の方法を用いて特徴付けられることがあり、単結晶X線回折、粉末X線回折(PXRD)、顕微鏡法(例えば、光学顕微鏡法、走査型電子顕微鏡法(SEM))、熱分析((例えば、示差走査熱量測定(DSC)、熱重量分析(TGA)、およびホットステージ顕微鏡法)、動的水蒸気吸着(DVS)、分光法(例えば、赤外線、ラマン、および核磁気共鳴)、高速液体クロマトグラフィー(HPLC)が挙げられるが、これらに限らない。本明細書で提供される前記固形体の粒径および粒度分布は、レーザー光散乱技術といった従来の方法によって測定され得る。
本明細書では、化合物1の塩も提供される。一つの実施形態において、前記塩は、化合物1の塩酸塩である。一つの実施形態において、前記塩は、化合物1のフマル酸塩である。一つの実施形態において、前記塩は、化合物1のトシル酸塩である。一つの実施形態において、前記塩は、化合物1のマレイン酸塩である。一つの実施形態において、前記塩は、化合物1のベシル酸塩である。
任意の特定の理論に限定されるものではないが、前記酸は、一つ以上の、化合物1の塩基性窒素と関連する。任意の特定の理論に限定されるものではないが、化合物1のアゼチジン窒素のpKaは、約7.7であると推定され、化合物1のモルホリン窒素のpKaは、約2.12であると推定される。
本明細書で提供される前記固形体および塩の純度は、薄層クロマトグラフィー(TLC)、ゲル電気泳動、ガスクロマトグラフィー、高速液体クロマトグラフィー(HPLC)、および質量分析などの標準的な分析方法によって測定され得る。
任意の特定の理論によって限定されることを意図しないが、ある固形体および塩は、物理的特性、例えば、安定性、溶解度および溶解速度によって特徴付けられ、医薬および治療剤形に適している。さらに、任意の特定の理論によって限定されることを望まないが、ある固形体および塩は、ある固形体および塩を固体剤形の製造に適する状態にする特定の工程(例えば、収率、ろ過、洗浄、乾燥、粉砕、混合、打錠、流動性、溶解、製剤、および凍結乾燥)に影響を及ぼす物理的特性(例えば、密度、圧縮性、硬度、形態、劈開、粘着性、溶解度、水の取り込み、電気的特性、熱挙動、固体反応性、物理的安定性、および化学的安定性)によって特徴付けられる。そのような特性は、固体分析技術(例えば、X線回折、顕微鏡法、分光法および熱分析)などの、本明細書に記載され当技術分野で既知であるような、特定の分析化学的技術を用いて測定され得る。任意の特定の理論によって限定されることを意図しないが、本明細書で提供される、ある固形体および塩は、適切な医薬特性、例えば、医薬動態、医薬動力学、半減期、Cmax、およびバイオアベイラビリティを示す。そのような特性は、当業者に既知のアッセイを用いて測定され得る。
(a)化合物1の遊離塩基
いくつかの実施形態において、本明細書では、化合物1の遊離塩基が提供される。化合物1の遊離塩基は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性遊離塩基の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
いくつかの実施形態において、本明細書では、化合物1の遊離塩基が提供される。化合物1の遊離塩基は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性遊離塩基の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
一つの実施形態において、本明細書では、化合物1の遊離塩基を含む固形体が提供される。一つの実施形態において、前記固形体は、化合物1の遊離塩基の溶媒和物である。一つの実施形態において、前記固形体は、化合物1の遊離塩基の水和物である。一つの実施形態において、前記固形体は、化合物1の遊離塩基の非溶媒和型である。一つの実施形態において、前記固形体は、化合物1の遊離塩基の脱溶媒和型である。一つの実施形態において、前記固形体は、化合物1の遊離塩基の無水型(無水物)である。一つの実施形態において、前記固形体は、化合物1の遊離塩基の脱水型である。
(i)化合物1の遊離塩基のフォームA
ある実施形態において、本明細書では、化合物1の遊離塩基のフォームAが提供される。
ある実施形態において、本明細書では、化合物1の遊離塩基のフォームAが提供される。
一つの実施形態において、フォームAは結晶性である。一つの実施形態において、フォームAは、実質的に結晶性である。一つの実施形態において、フォームAは、中程度に結晶性である。一つの実施形態において、フォームA部分的に結晶性である。
フォームAの代表的なXRPDパターンを図1に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:4.5、11.4、12.6、13.3、15.3、15.9、18.1、19.1、20.1、20.9、21.6、22.6、23.9、25.4、26.3、28.1、および29.0°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16個、または全てによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ4.5、15.3、および18.1°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ13.3および15.9°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ20.1および20.9°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ20.1および20.9°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ4.5、13.3、15.3、15.9、18.1、19.1、20.1、20.9、21.6、および26.3°2θでピークを含む。
一つの実施形態において、本明細書では、およそ4.5°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ4.5、11.4、および12.6°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ4.5、11.4、12.6、13.3、および15.3°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ4.5、11.4、12.6、13.3、15.3、15.9、および18.1°2θでピークを含む。
一つの実施形態において、本明細書では、図1に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
フォームAの代表的な熱重量分析(TGA)および示差走査熱量測定(DSC)サーモグラムを図2に提供する。一つの実施形態において、本明細書では、化合物1の遊離塩基を含む固形体であって、約25℃から約50℃までの加熱で約1.3%の重量減少を、および約50℃から約200℃までの加熱で約1.4%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図2に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。
一つの実施形態において、本明細書では、化合物1の遊離塩基を含む固形体であって、DSCによって特徴付けられるような、約68℃のピーク温度を伴う第一の熱イベント(吸熱)、および約112℃のピーク温度を伴う第二の熱イベント(吸熱)を示す固形体が提供される。一つの実施形態において、本明細書では、図2に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。
一つの実施形態において、化合物1の遊離塩基のフォームAは、化合物1の遊離塩基を水中で(例えば、約40℃、約6日)スラリー化することにより調整される。
一つの実施形態において、本明細書では、化合物1の遊離塩基のフォームAおよび化合物1の非晶質遊離塩基を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の遊離塩基のフォームAおよび一つ以上の、本明細書で提供される化合物1の遊離塩基の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の遊離塩基のフォームAおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
(ii)化合物1の遊離塩基のフォームB
ある実施形態において、本明細書では、化合物1の遊離塩基のフォームBが提供される。
ある実施形態において、本明細書では、化合物1の遊離塩基のフォームBが提供される。
一つの実施形態において、フォームBは結晶性である。一つの実施形態において、フォームBは、実質的に結晶性である。一つの実施形態において、フォームBは、中程度に結晶性である。一つの実施形態において、フォームB部分的に結晶性である。
フォームBの代表的なXRPDパターンを図3に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:4.5、4.8、9.6、10.7、11.4、12.0、13.3、13.7、14.9、15.7、17.3、18.7、19.0、20.2、20.7、21.3、21.4、22.1、22.9、23.8、24.5、25.4、26.2、26.9、および28.2°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24個、または全てによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ4.8、9.6、および14.9°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ18.7および22.1°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ20.7および21.4°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ4.5、4.8、9.6、14.9、15.7、17.3、18.7、19.0、20.7、21.3、21.4、22.1、22.9、および28.2°2θでピークを含む。
一つの実施形態において、本明細書では、およそ4.5、4.8、および9.6°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ4.5、4.8、9.6、10.7、および11.4°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ4.5、4.8、9.6、10.7、11.4、13.3、および13.7°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ4.5、4.8、9.6、10.7、11.4、13.3、13.7、14.9、および15.7°2θでピークを含む。
一つの実施形態において、本明細書では、図3に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
フォームBの代表的な熱重量分析(TGA)および示差走査熱量測定(DSC)サーモグラムを図4に提供する。一つの実施形態において、本明細書では、化合物1の遊離塩基を含む固形体であって、約25℃から約225℃までの加熱で約0.9%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図4に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。
一つの実施形態において、本明細書では、化合物1の遊離塩基を含む固形体であって、DSCによって特徴付けられるような、約82℃のピーク温度を伴う第一の熱イベント(吸熱)、約107℃のピーク温度を伴う第二の熱イベント(吸熱)、および約138℃のピーク温度を伴う第三の熱イベント(吸熱)を示す固形体が提供される。一つの実施形態において、本明細書では、図4に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1の遊離塩基を含む固形体が提供される。
一つの実施形態において、化合物1の遊離塩基のフォームBは、溶媒がアセトンであり、反溶媒が水である溶媒/反溶媒系から(例えば、室温で)化合物1の遊離塩基を結晶化することにより調整される。
一つの実施形態において、本明細書では、化合物1の遊離塩基のフォームBおよび化合物1の非晶質遊離塩基を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の遊離塩基のフォームBおよび一つ以上の、本明細書で提供される化合物1の遊離塩基の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の遊離塩基のフォームBおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
(b)化合物1の塩酸塩
いくつかの実施形態において、本明細書では、化合物1の塩酸塩が提供される。化合物1の塩酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性塩酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
いくつかの実施形態において、本明細書では、化合物1の塩酸塩が提供される。化合物1の塩酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性塩酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
一つの実施形態において、本明細書では、化合物1の塩酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、化合物1の塩酸塩の溶媒和物である。一つの実施形態において、前記固形体は、化合物1の塩酸塩の水和物である。一つの実施形態において、前記固形体は、化合物1の塩酸塩の非溶媒和型である。一つの実施形態において、前記固形体は、化合物1の塩酸塩の脱溶媒和型である。一つの実施形態において、前記固形体は、化合物1の塩酸塩の無水型(無水物)である。一つの実施形態において、前記固形体は、化合物1の塩酸塩の脱水型である。
いくつかの実施形態において、前記固形体における化合物1の塩酸に対するモル比は、約1:1から約1:2に及ぶ。一つの実施形態において、前記モル比は、約1:2(すなわち、ビス塩酸塩)である。もう一つの実施形態において、前記モル比は、約1:1(すなわち、モノ塩酸塩)である。
(i)化合物1の塩酸塩のフォームA
ある実施形態において、本明細書では、化合物1の塩酸塩のフォームAが提供される。
ある実施形態において、本明細書では、化合物1の塩酸塩のフォームAが提供される。
一つの実施形態において、フォームAは結晶性である。一つの実施形態において、フォームAは、実質的に結晶性である。一つの実施形態において、フォームAは、中程度に結晶性である。一つの実施形態において、フォームA部分的に結晶性である。
一つの実施形態において、フォームAにおける化合物1の塩酸に対するモル比は、約1:1である。一つの実施形態において、フォームAは、化合物1のモノ塩酸塩である。
一つの実施形態において、フォームAは、化合物1の塩酸塩の水和物である。一つの実施形態において、フォームAは、化合物1の塩酸塩のチャネル水和物である。
化合物1の塩酸塩のフォームAの代表的なXRPDパターンを図5に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:4.2,7.8、11.1、12.4、15.1、15.5、16.3、17.1、17.3、17.9、18.2、18.9、19.2、20.1、20.4、20.7、21.7、22.4、23.0、24.4、24.8、25.7、27.5、28.1、29.1、29.8、30.2、および30.8°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25,26、27個、または全てによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ15.1、16.3、および20.7°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ7.8および22.4°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ18.2、18.9、および24.8°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ7.8、15.1、16.3、17.9、18.2、18.9、19.2、20.4、20.7、21.7、22.4、および24.8°2θでピークを含む。
一つの実施形態において、本明細書では、およそ4.2、7.8、および11.1°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ4.2、7.8、11.1、12.4、および15.1°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ4.2、7.8、11.1、12.4、15.1、15.5、および16.3°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ4.2、7.8、11.1、12.4、15.1、15.5、16.3、17.1、および17.3°2θでピークを含む。
一つの実施形態において、本明細書では、図5に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
化合物1の塩酸塩のフォームAの代表的な熱重量分析(TGA)および示差走査熱量測定(DSC)サーモグラムを図6に提供する。一つの実施形態において、本明細書では、化合物1の塩酸塩を含む固形体であって、約25℃から約200℃までの加熱で約1.5%の重量減少を、および約200℃から約230℃までの加熱で約2.7%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図6に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
一つの実施形態において、本明細書では、化合物1の塩酸塩を含む固形体であって、DSCによって特徴付けられるような、約218℃のピーク温度を伴う第一の熱イベント(吸熱)、および約227℃のピーク温度を伴う第二の熱イベント(発熱)を示す固形体が提供される。一つの実施形態において、本明細書では、図6に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。化合物1の塩酸塩のフォームAの融点は、結晶化度および結晶構造欠陥によって変化することがある。
化合物1の塩酸塩のフォームAの代表的な動的水蒸気吸着(DVS)等温線プロットを図7に提供する。一つの実施形態において、本明細書では、化合物1の塩酸塩を含む固形体であって、約0%から約95%の相対湿度(RH)の増加にさらされる場合、約3.0%の重量増加を示す固形体が提供される。一つの実施形態において、本明細書では、図7に示すDVS等温線プロットと一致するDVS等温線プロットによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
一つの実施形態において、化合物1の塩酸塩のフォームAは、小桿状体一次粒子の晶癖を有する。化合物1の塩酸塩のフォームAの代表的なSEM画像を図8に提供する。
一つの実施形態において、化合物1の塩酸塩のフォームAは、化合物1の塩酸塩を溶媒中でスラリー化することにより調製される。一つの実施形態において、化合物1の塩酸塩のフォームAは、化合物1の遊離塩基および塩酸を溶媒中でスラリー化することにより調製される。一つの実施形態において、前記溶媒は、アセトン、アセトニトリル、アニソール、DCM、DMAc、EtOH、EtOAc、ギ酸エチル、酢酸イソプロピル、MeOH、MEK、MTBE、2-MeTHF、ニトロメタン、NMP、2-プロパノール、テトラヒドロフラン、トルエン、水、アセトンおよび水の混合物(例えば、95/5 v/v)、アセトニトリルおよび水の混合物(例えば、95/5 v/v)、2-PrOHおよび水の混合物(例えば、95/5 v/v)、またはTHFおよび水の混合物(例えば、95/5 v/v)である。一つの実施形態において、前記溶媒は、アセトニトリルである。一つの実施形態において、前記スラリー化は、室温で行われる。一つの実施形態において、前記スラリー化は、約50℃で行われる。一つの実施形態において、前記スラリー化は、約1日から約7日までの期間で行われる。一つの実施形態において、前記スラリー化は、約2日間行われる。一つの実施形態において、前記スラリー化は、約7日間行われる。
一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームAおよび一つ以上の、化合物1の遊離塩基の型(例えば、非晶質型および結晶型)を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームAおよび化合物1の非晶質塩酸塩を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームAおよび一つ以上の、本明細書で提供される化合物1の塩酸塩の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームAおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
(ii)化合物1の塩酸塩のフォームB
ある実施形態において、本明細書では、化合物1の塩酸塩のフォームBが提供される。
ある実施形態において、本明細書では、化合物1の塩酸塩のフォームBが提供される。
一つの実施形態において、フォームBは結晶性である。一つの実施形態において、フォームBは、実質的に結晶性である。一つの実施形態において、フォームBは、中程度に結晶性である。一つの実施形態において、フォームB部分的に結晶性である。
化合物1の塩酸塩のフォームBの代表的なXRPDパターンを図9に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:6.7、11.6、13.5、14.2、14.6、16.5、17.2、17.5、18.1、18.5、19.6、20.3、21.1、21.6、21.9、22.4、23.2、23.7、24.2、24.8、26.1、26.7、27.0、27.7、28.2、29.5、および30.2°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26個、または全てによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ17.5、21.6、および24.8°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ21.1および27.0°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ14.6、17.2、および20.3°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ6.7、14.6、17.2、17.5、19.6、20.3、21.1、21.6、21.9、22.4、24.8、26.7、27.0、27.7、および29.5°2θでピークを含む。
一つの実施形態において、本明細書では、およそ6.7、11.6、および13.5°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ6.7、11.6、13.5、14.2、および14.6°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ6.7、11.6、13.5、14.2、14.6、16.5、および17.2°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ6.7、11.6、13.5、14.2、14.6、16.5、17.2、17.5、および18.1°2θでピークを含む。
一つの実施形態において、本明細書では、図9に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
化合物1の塩酸塩のフォームBの代表的な熱重量分析(TGA)および示差走査熱量測定(DSC)サーモグラムを図10に提供する。一つの実施形態において、本明細書では、化合物1の塩酸塩を含む固形体であって、約25℃から約175℃までの加熱で約1.6%の重量減少を、および約175℃から約230℃までの加熱で約5.3%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図10に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
一つの実施形態において、本明細書では、化合物1の塩酸塩を含む固形体であって、DSCによって特徴付けられるような、約230℃のピーク温度を伴う熱イベント(発熱)を示す固形体が提供される。一つの実施形態において、本明細書では、図10に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
一つの実施形態において、化合物1の塩酸塩のフォームBは、化合物1の遊離塩基および約2当量のHClをアセトニトリル中で(例えば、室温で約5日間)スラリー化することにより調製される。
一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームBおよび一つ以上の、化合物1の遊離塩基の型(例えば、非晶質型および結晶型)を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームBおよび化合物1の非晶質塩酸塩を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームBおよび一つ以上の、本明細書で提供される化合物1の塩酸塩の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1の塩酸塩のフォームBおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
(iii)化合物1の塩酸塩のフォームC
ある実施形態において、本明細書では、化合物1の塩酸塩のフォームCが提供される。化合物1の塩酸塩のフォームCの代表的なXRPDパターンを図21に提供する。一つの実施形態において、本明細書では、図21に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
ある実施形態において、本明細書では、化合物1の塩酸塩のフォームCが提供される。化合物1の塩酸塩のフォームCの代表的なXRPDパターンを図21に提供する。一つの実施形態において、本明細書では、図21に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1の塩酸塩を含む固形体が提供される。
(c)化合物1のフマル酸塩
いくつかの実施形態において、本明細書では、化合物1のフマル酸塩が提供される。化合物1のフマル酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性フマル酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
いくつかの実施形態において、本明細書では、化合物1のフマル酸塩が提供される。化合物1のフマル酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性フマル酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
一つの実施形態において、本明細書では、化合物1のフマル酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、化合物1のフマル酸塩の溶媒和物である。一つの実施形態において、前記固形体は、化合物1のフマル酸塩の水和物である。一つの実施形態において、前記固形体は、化合物1のフマル酸塩の非溶媒和型である。一つの実施形態において、前記固形体は、化合物1のフマル酸塩の脱溶媒和型である。一つの実施形態において、前記固形体は、化合物1のフマル酸塩の無水型(無水物)である。一つの実施形態において、前記固形体は、化合物1のフマル酸塩の脱水型である。
いくつかの実施形態において、前記固形体における化合物1のフマル酸に対するモル比は、約1:1から約1:2に及ぶ。一つの実施形態において、前記モル比は、約1:2(すなわち、ビスフマル酸塩)である。もう一つの実施形態において、前記モル比は、約1:1(すなわち、モノフマル酸塩)である。
(i)化合物1のフマル酸塩のフォームA
ある実施形態において、本明細書では、化合物1のフマル酸塩のフォームAが提供される。
ある実施形態において、本明細書では、化合物1のフマル酸塩のフォームAが提供される。
一つの実施形態において、フォームAは結晶性である。一つの実施形態において、フォームAは、実質的に結晶性である。一つの実施形態において、フォームAは、中程度に結晶性である。一つの実施形態において、フォームA部分的に結晶性である。
一つの実施形態において、フォームAにおける化合物1のフマル酸に対するモル比は、約1:2である。一つの実施形態において、フォームAは、化合物1のビスフマル酸塩である。
一つの実施形態において、フォームAは、化合物1のフマル酸塩の非溶媒和型である。
化合物1のフマル酸塩のフォームAの代表的なXRPDパターンを図11に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:11.7、12.2、12.8、13.8、14.5、14.7、15.0、15.2、16.6、17.1、17.3、17.7、17.9、18.3、19.0、19.4、20.1、20.5、20.7、21.4、22.3、22.9、23.2、23.4、23.7、24.3、24.7、24.9、25.8、26.6、および27.1°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30個、または全てによって特徴付けられる、化合物1のフマル酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ22.3、23.2、および23.4°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のフマル酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ17.9および25.8°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ11.7および18.3°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ11.7、15.0、17.9、18.3、19.4、20.1、22.3、22.9、23.2、23.4、および25.8°2θでピークを含む。
一つの実施形態において、本明細書では、およそ11.7、12.2、および12.8°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のフマル酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ11.7、12.2、12.8、13.8、および14.5°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ11.7、12.2、12.8、13.8、14.5、14.7、および15.0°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ11.7、12.2、12.8、13.8、14.5、14.7、15.0、15.2、および16.6°2θでピークを含む。
一つの実施形態において、本明細書では、図11に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のフマル酸塩を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
化合物1のフマル酸塩のフォームAの代表的な熱重量分析(TGA)および示差走査熱量測定(DSC)サーモグラムを図12に提供する。一つの実施形態において、本明細書では、化合物1のフマル酸塩を含む固形体であって、約25℃から約150℃までの加熱で約0.5%の重量減少を、および約150℃から約205℃までの加熱で約7.9%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図12に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1のフマル酸塩を含む固形体が提供される。
一つの実施形態において、本明細書では、化合物1のフマル酸塩を含む固形体であって、DSCによって特徴付けられるような、約198℃のピーク温度を伴う熱イベント(吸熱)を示す固形体が提供される。一つの実施形態において、任意の特定の理論に限定されるものではないが、前記熱イベントは、融解に対応する。一つの実施形態において、本明細書では、図12に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1のフマル酸塩を含む固形体が提供される。
一つの実施形態において、化合物1のフマル酸塩のフォームAは、化合物1のフマル酸塩を溶媒中でスラリー化することにより調製される。一つの実施形態において、化合物1のフマル酸塩のフォームAは、化合物1の遊離塩基およびフマル酸を溶媒中でスラリー化することにより調製される。一つの実施形態において、前記溶媒は、アセトン、アセトニトリル、アニソール、DCM、EtOH、EtOAc、ギ酸エチル、酢酸イソプロピル、MeOH、MEK、MTBE、2-MeTHF、ニトロメタン、2-プロパノール、テトラヒドロフラン、トルエン、水、アセトンおよび水の混合物(例えば、95/5 v/v)、アセトニトリルおよび水の混合物(例えば、95/5 v/v)、2-PrOHおよび水の混合物(例えば、95/5 v/v)、またはTHFおよび水の混合物(例えば、95/5 v/v)である。一つの実施形態において、前記溶媒は、アセトニトリルである。一つの実施形態において、前記スラリー化は、室温で行われる。一つの実施形態において、前記スラリー化は、約50℃で行われる。一つの実施形態において、前記スラリー化は、約1日から約7日までの期間で行われる。一つの実施形態において、前記スラリー化は、約2日間行われる。一つの実施形態において、前記スラリー化は、約7日間行われる。
一つの実施形態において、本明細書では、化合物1のフマル酸塩のフォームAおよび一つ以上の、化合物1の遊離塩基の型(例えば、非晶質型および結晶型)を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のフマル酸塩のフォームAおよび化合物1の非晶質フマル酸塩を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のフマル酸塩のフォームAおよび一つ以上の、化合物1のフマル酸塩の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のフマル酸塩のフォームAおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
(d)化合物1のトシル酸塩
いくつかの実施形態において、本明細書では、化合物1のトシル酸塩が提供される。化合物1のトシル酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性トシル酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
いくつかの実施形態において、本明細書では、化合物1のトシル酸塩が提供される。化合物1のトシル酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性トシル酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
一つの実施形態において、本明細書では、化合物1のトシル酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、化合物1のトシル酸塩の溶媒和物である。一つの実施形態において、前記固形体は、化合物1のトシル酸塩の水和物である。一つの実施形態において、前記固形体は、化合物1のトシル酸塩の非溶媒和型である。一つの実施形態において、前記固形体は、化合物1のトシル酸塩の脱溶媒和型である。一つの実施形態において、前記固形体は、化合物1のトシル酸塩の無水型(無水物)である。一つの実施形態において、前記固形体は、化合物1のトシル酸塩の脱水型である。
いくつかの実施形態において、前記固形体における化合物1のp-トルエンスルホン酸に対するモル比は、約1:1から約1:2に及ぶ。一つの実施形態において、前記モル比は、約1:2(すなわち、ビストシル酸塩)である。もう一つの実施形態において、前記モル比は、約1:1(すなわち、モノトシル酸塩)である。
(i)化合物1のトシル酸塩のフォームA
ある実施形態において、本明細書では、化合物1のトシル酸塩のフォームAが提供される。
ある実施形態において、本明細書では、化合物1のトシル酸塩のフォームAが提供される。
一つの実施形態において、フォームAは結晶性である。一つの実施形態において、フォームAは、実質的に結晶性である。一つの実施形態において、フォームAは、中程度に結晶性である。一つの実施形態において、フォームA部分的に結晶性である。
一つの実施形態において、フォームAにおける化合物1のp-トルエンスルホン酸に対するモル比は、約1:1である。一つの実施形態において、フォームAは、化合物1のモノトシル酸塩である。
一つの実施形態において、フォームAは、化合物1のトシル酸塩の非溶媒和型である。
化合物1のトシル酸塩のフォームAの代表的なXRPDパターンを図13に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:3.9、6.8、7.3、7.8、8.6、10.9、11.4、12.1、14.5、15.4、15.5、15.7、15.9、16.4、17.0、17.6、18.0、18.6、19.3、19.7、20.6、21.2、22.6、23.0、23.4、23.8、24.7、および25.0°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26個、または全てによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ17.6、18.0、および23.8°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ15.7および20.6°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ24.7および25.0°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ15.7、16.4、17.6、18.0、18.6、20.6、21.2、23.4、23.8、24.7、および25.0°2θでピークを含む。
一つの実施形態において、本明細書では、およそ3.9、6.8、および7.3°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ3.9、6.8、7.3、7.8、および8.6°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ3.9、6.8、7.3、7.8、8.6、10.9、および11.4°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ3.9、6.8、7.3、7.8、8.6、10.9、11.4、12.1、および14.5°2θでピークを含む。
一つの実施形態において、本明細書では、図13に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
化合物1のトシル酸塩のフォームAの代表的な熱重量分析(TGA)および示差走査熱量測定(DSC)サーモグラムを図14に提供する。一つの実施形態において、本明細書では、化合物1のトシル酸塩を含む固形体であって、約25℃から約200℃までの加熱で約1.0%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図14に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。
一つの実施形態において、本明細書では、化合物1のトシル酸塩を含む固形体であって、DSCによって特徴付けられるような、約189℃のピーク温度を伴う熱イベント(吸熱)を示す固形体が提供される。一つの実施形態において、任意の特定の理論に限定されるものではないが、前記熱イベントは、融解に対応する。一つの実施形態において、本明細書では、図14に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。
一つの実施形態において、化合物1のトシル酸塩のフォームAは、化合物1のトシル酸塩を溶媒中でスラリー化することにより調製される。一つの実施形態において、化合物1のトシル酸塩のフォームAは、化合物1の遊離塩基およびp-トルエンスルホン酸を溶媒中でスラリー化することにより調製される。一つの実施形態において、前記溶媒は、アセトン、アセトニトリル、アニソール、DCM、EtOH、EtOAc、ギ酸エチル、酢酸イソプロピル、MeOH、MEK、MTBE、2-MeTHF、ニトロメタン、2-プロパノール、テトラヒドロフラン、トルエン、水、アセトンおよび水の混合物(例えば、95/5 v/v)、または2-PrOHおよび水の混合物(例えば、95/5 v/v)である。一つの実施形態において、前記溶媒は、アセトニトリルである。一つの実施形態において、前記スラリー化は、室温で行われる。一つの実施形態において、前記スラリー化は、約50℃で行われる。一つの実施形態において、前記スラリー化は、約1日から約7日までの期間で行われる。一つの実施形態において、前記スラリー化は、約2日間行われる。一つの実施形態において、前記スラリー化は、約7日間行われる。
一つの実施形態において、本明細書では、化合物1のトシル酸塩のフォームAおよび一つ以上の、化合物1の遊離塩基の型(例えば、非晶質型および結晶型)を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のトシル酸塩のフォームAおよび化合物1の非晶質トシル酸塩を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のトシル酸塩のフォームAおよび一つ以上の、化合物1のトシル酸塩の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のトシル酸塩のフォームAおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
(ii)化合物1のトシル酸塩の追加の型
ある実施形態において、本明細書では、化合物1のトシル酸塩のフォームBが提供される。化合物1のトシル酸塩のフォームBの代表的なXRPDパターンを図22に(オーバーレイプロットの一部として)提供する。一つの実施形態において、本明細書では、図22に示すようなフォームBのXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。
ある実施形態において、本明細書では、化合物1のトシル酸塩のフォームBが提供される。化合物1のトシル酸塩のフォームBの代表的なXRPDパターンを図22に(オーバーレイプロットの一部として)提供する。一つの実施形態において、本明細書では、図22に示すようなフォームBのXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。
ある実施形態において、本明細書では、化合物1のトシル酸塩のフォームCが提供される。化合物1のトシル酸塩のフォームCの代表的なXRPDパターンを図22に(オーバーレイプロットの一部として)提供する。一つの実施形態において、本明細書では、図22に示すようなフォームCのXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。
ある実施形態において、本明細書では、化合物1のトシル酸塩のフォームDが提供される。化合物1のトシル酸塩のフォームDの代表的なXRPDパターンを図22に(オーバーレイプロットの一部として)提供する。一つの実施形態において、本明細書では、図22に示すようなフォームDのXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のトシル酸塩を含む固形体が提供される。
(e)化合物1のマレイン酸塩
いくつかの実施形態において、本明細書では、化合物1のマレイン酸塩が提供される。化合物1のマレイン酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性マレイン酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
いくつかの実施形態において、本明細書では、化合物1のマレイン酸塩が提供される。化合物1のマレイン酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性マレイン酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
一つの実施形態において、本明細書では、化合物1のマレイン酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、化合物1のマレイン酸塩の溶媒和物である。一つの実施形態において、前記固形体は、化合物1のマレイン酸塩の水和物である。一つの実施形態において、前記固形体は、化合物1のマレイン酸塩の非溶媒和型である。一つの実施形態において、前記固形体は、化合物1のマレイン酸塩の脱溶媒和型である。一つの実施形態において、前記固形体は、化合物1のマレイン酸塩の無水型(無水物)である。一つの実施形態において、前記固形体は、化合物1のマレイン酸塩の脱水型である。
いくつかの実施形態において、前記固形体における化合物1のマレイン酸に対するモル比は、約1:1から約1:2に及ぶ。一つの実施形態において、前記モル比は、約1:2(すなわち、ビスマレイン酸塩)である。もう一つの実施形態において、前記モル比は、約1:1(すなわち、モノマレイン酸塩)である。
(i)化合物1のマレイン酸塩のフォームA
ある実施形態において、本明細書では、化合物1のマレイン酸塩のフォームAが提供される。
ある実施形態において、本明細書では、化合物1のマレイン酸塩のフォームAが提供される。
一つの実施形態において、フォームAは結晶性である。一つの実施形態において、フォームAは、実質的に結晶性である。一つの実施形態において、フォームAは、中程度に結晶性である。一つの実施形態において、フォームA部分的に結晶性である。
一つの実施形態において、フォームAにおける化合物1のマレイン酸に対するモル比は、約1:1である。一つの実施形態において、フォームAは、化合物1のモノマレイン酸塩である。一つの実施形態において、フォームAにおける化合物1のマレイン酸に対するモル比は、約1:2である。一つの実施形態において、フォームAは、化合物1のビスマレイン酸塩である。一つの実施形態において、フォームAは、化合物1のモノマレイン酸塩およびビスマレイン酸塩の混合物である。
一つの実施形態において、フォームAは、化合物1のマレイン酸塩の非溶媒和型である。一つの実施形態において、フォームAは、化合物1のマレイン酸塩の溶媒和物である。
化合物1のマレイン酸塩のフォームAの代表的なXRPDパターンを図15に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:6.0、11.6、11.9、12.5、13.3、13.9、15.2、16.2、17.0、17.6、17.7、18.0、18.4、18.9、19.3、19.8、20.0、22.2、22.4、22.7、23.1、23.3、23.6、24.0、24.4、25.1、25.6、26.0、および26.9°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28個、または全てによって特徴付けられる、化合物1のマレイン酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ17.6、24.4、および26.9°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のマレイン酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ18.0、18.4、および19.3°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ19.8および24.0°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ11.9、17.6、18.0、18.4、19.3、19.8、24.0、24.4、25.1、26.0、および26.9°2θでピークを含む。
一つの実施形態において、本明細書では、およそ6.0、11.6、および11.9°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のマレイン酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ6.0、11.6、11.9、12.5、および13.3°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ6.0、11.6、11.9、12.5、13.3、13.9、および15.2°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ6.0、11.6、11.9、12.5、13.3、13.9、15.2、16.2、および17.0°2θでピークを含む。
一つの実施形態において、本明細書では、図15に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のマレイン酸塩を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
化合物1のマレイン酸塩のフォームAの代表的な熱重量分析(TGA)および示差走査熱量測定(DSC)サーモグラムを図16に提供する。一つの実施形態において、本明細書では、化合物1のマレイン酸塩を含む固形体であって、約25℃から約150℃までの加熱で約0.2%の重量減少を、および約150℃から約185℃までの加熱で約8.8%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図16に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1のマレイン酸塩を含む固形体が提供される。
一つの実施形態において、本明細書では、化合物1のマレイン酸塩を含む固形体であって、DSCによって特徴付けられるような、約174℃のピーク温度を伴う熱イベント(吸熱)を示す固形体が提供される。一つの実施形態において、任意の特定の理論に限定されるものではないが、前記熱イベントは、融解に対応する。一つの実施形態において、本明細書では、図16に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1のマレイン酸塩を含む固形体が提供される。
一つの実施形態において、化合物1のマレイン酸塩のフォームAは、化合物1の遊離塩基およびマレイン酸をアセトニトリル中で(例えば、室温で約5日間)スラリー化することにより調製される。
一つの実施形態において、本明細書では、化合物1のマレイン酸塩のフォームAおよび一つ以上の、化合物1の遊離塩基の型(例えば、非晶質型および結晶型)を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のマレイン酸塩のフォームAおよび化合物1の非晶質マレイン酸塩を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のマレイン酸塩のフォームAおよび一つ以上の、化合物1のマレイン酸塩の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のマレイン酸塩のフォームAおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
(f)化合物1のベシル酸塩
いくつかの実施形態において、本明細書では、化合物1のベシル酸塩が提供される。化合物1のベシル酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性ベシル酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
いくつかの実施形態において、本明細書では、化合物1のベシル酸塩が提供される。化合物1のベシル酸塩は、様々な固形体で存在し得ると考えられる。そのような固形体には、化合物1の結晶性ベシル酸塩の多形、溶媒和物および水和物などの結晶性固体、並びに非晶質固体、またはその混合物が挙げられる。
一つの実施形態において、本明細書では、化合物1のベシル酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、化合物1のベシル酸塩の溶媒和物である。一つの実施形態において、前記固形体は、化合物1のベシル酸塩の水和物である。一つの実施形態において、前記固形体は、化合物1のベシル酸塩の非溶媒和型である。一つの実施形態において、前記固形体は、化合物1のベシル酸塩の脱溶媒和型である。一つの実施形態において、前記固形体は、化合物1のベシル酸塩の無水型(無水物)である。一つの実施形態において、前記固形体は、化合物1のベシル酸塩の脱水型である。
いくつかの実施形態において、前記固形体における化合物1のベンゼンスルホン酸に対するモル比は、約1:1から約1:2に及ぶ。一つの実施形態において、前記モル比は、約1:2(すなわち、ビスベシル酸塩)である。もう一つの実施形態において、前記モル比は、約1:1(すなわち、モノベシル酸塩)である。
(i)化合物1のベシル酸塩のフォームA
ある実施形態において、本明細書では、化合物1のベシル酸塩のフォームAが提供される。
ある実施形態において、本明細書では、化合物1のベシル酸塩のフォームAが提供される。
一つの実施形態において、フォームAは結晶性である。一つの実施形態において、フォームAは、実質的に結晶性である。一つの実施形態において、フォームAは、中程度に結晶性である。一つの実施形態において、フォームA部分的に結晶性である。
化合物1のベシル酸塩のフォームAの代表的なXRPDパターンを図17に提供する。
一つの実施形態において、本明細書では、およそ以下の位置:6.9、7.8、8.5、10.9、11.3、12.1、13.2、14.6、15.1、15.7、16.2、16.5、16.9、17.4、17.9、18.3、19.3、19.8、20.5、21.1、21.9、22.7、23.8、24.9、25.1、25.9、26.7、および27.4°2θに位置するピークのうちの1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、 25、26、27個、または全てによって特徴付けられる、化合物1のベシル酸塩を含む固形体が提供される。一つの実施形態において、前記固形体は、前記ピークのうちの3個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの5個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの7個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの9個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの11個によって特徴付けられる。一つの実施形態において、前記固形体は、前記ピークのうちの全てによって特徴付けられる。
一つの実施形態において、本明細書では、およそ17.9、18.3、および23.8°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のベシル酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ15.7 および16.2°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ8.5および16.5°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ6.9、8.5、15.7、16.2、16.5、16.9、17.9、18.3、20.5、21.1、23.8、および25.1°2θでピークを含む。
一つの実施形態において、本明細書では、およそ6.9、7.8、および8.5°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のベシル酸塩を含む固形体が提供される。一つの実施形態において、前記XRPDパターンは、およそ6.9、7.8、8.5、10.9、および11.3°2θでピークを含む。一つの実施形態において、前記XRPDパターンは、およそ6.9、7.8、8.5、10.9、11.3、12.1、および13.2°2θでピークをさらに含む。一つの実施形態において、前記XRPDパターンは、およそ6.9、7.8、8.5、10.9、11.3、12.1、13.2、14.6、および15.1°2θでピークを含む。
一つの実施形態において、本明細書では、図17に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、化合物1のベシル酸塩を含む固形体が提供される。
一つの実施形態において、前記XRPDパターンは、Cu Kα放射線を用いて得られる。
化合物1のベシル酸塩のフォームAの代表的な熱重量分析(TGA)を図18に提供する。一つの実施形態において、本明細書では、化合物1のベシル酸塩を含む固形体であって、約25℃から約150℃までの加熱で約0.25%の重量減少を示す固形体が提供される。一つの実施形態において、本明細書では、図18に示すTGAサーモグラムと一致するTGAサーモグラムによって特徴付けられる、化合物1のベシル酸塩を含む固形体が提供される。
化合物1のベシル酸塩のフォームAの代表的な示差走査熱量測定(DSC)サーモグラムを図19に提供する。一つの実施形態において、本明細書では、化合物1のベシル酸塩を含む固形体であって、DSCによって特徴付けられるような、約164℃の開始温度を伴う熱イベント(吸熱)を示す固形体が提供される。一つの実施形態において、前記熱イベントは、約175℃のピーク温度も有する。一つの実施形態において、任意の特定の理論に限定されるものではないが、前記熱イベントは、融解に対応する。一つの実施形態において、本明細書では、図19に示すDSCサーモグラムと一致するDSCサーモグラムによって特徴付けられる、化合物1のベシル酸塩を含む固形体が提供される。
一つの実施形態において、化合物1のベシル酸塩のフォームAは、ベンゼンスルホン酸を化合物1の遊離塩基の溶液に、溶媒中で添加し、化合物1のベシル酸塩のフォームAの沈殿をもたらすことにより調製される。一つの実施形態において、前記溶媒は、アセトンである。一つの実施形態において、前記溶媒は、MEKである。一つの実施形態において、ベンゼンスルホン酸は、MEK溶液として添加される。
一つの実施形態において、本明細書では、化合物1のベシル酸塩のフォームAおよび一つ以上の、化合物1の遊離塩基の型(例えば、非晶質型および結晶型)を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のベシル酸塩のフォームAおよび化合物1の非晶質ベシル酸塩を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のベシル酸塩のフォームAおよび一つ以上の、化合物1のベシル酸塩の他の結晶型を含む固形体が提供される。一つの実施形態において、本明細書では、化合物1のベシル酸塩のフォームAおよび一つ以上の、本明細書で提供される化合物1の塩の型(例えば、非晶質または結晶性)を含む固形体が提供される。
3.使用方法
一つの実施形態において、本明細書では、治療的有効量の、本明細書で提供される化合物1の固形体または塩を患者に投与することを特徴とする、血液悪性腫瘍の治療方法が提供される。
一つの実施形態において、本明細書では、治療的有効量の、本明細書で提供される化合物1の固形体または塩を患者に投与することを特徴とする、血液悪性腫瘍の治療方法が提供される。
一つの実施形態において、本明細書では、治療的有効量の、本明細書で提供される化合物1の固形体または塩を患者に投与することを特徴とする、血液悪性腫瘍の予防方法が提供される。
一つの実施形態において、本明細書では、治療的有効量の、本明細書で提供される化合物1の固形体または塩を患者に投与することを特徴とする、血液悪性腫瘍の処置方法が提供される。
一つの実施形態において、前記血液悪性腫瘍は、白血病である。
一つの実施形態において、前記血液悪性腫瘍は、急性骨髄性白血病である。一つの実施形態において、前記急性骨髄性白血病は、B細胞急性骨髄性白血病である。
一つの実施形態において、前記血液悪性腫瘍は、急性リンパ性白血病である。
一つの実施形態において、前記血液悪性腫瘍は、慢性リンパ性白血病/小リンパ球性リンパ腫である。
一つの実施形態において、前記血液悪性腫瘍は、骨髄腫である。
一つの実施形態において、前記血液悪性腫瘍は、多発性骨髄腫である。一つの実施形態において、前記多発性骨髄腫は、形質細胞白血病(PCL)である。
一つの実施形態において、前記血液悪性腫瘍は、リンパ腫である。
一つの実施形態において、前記血液悪性腫瘍は、非ホジキンリンパ腫である。
一つの実施形態において、前記血液悪性腫瘍は、びまん性大細胞型B細胞リンパ腫である。
一つの実施形態において、前記血液悪性腫瘍は、T細胞リンパ腫である。一つの実施形態において、前記T細胞リンパ腫は、未分化大細胞型リンパ腫(ALCL)である。一つの実施形態において、前記T細胞リンパ腫は、セザリー症候群である。
一つの実施形態において、前記血液悪性腫瘍は、バーキットリンパ腫である。
一つの実施形態において、前記血液悪性腫瘍は、辺縁帯リンパ腫である。一つの実施形態において、前記辺縁帯リンパ腫は、脾辺縁帯リンパ腫(SMZL)である。
一つの実施形態において、前記血液悪性腫瘍は、ホジキンリンパ腫である。
一つの実施形態において、前記血液悪性腫瘍は、骨髄異形成症候群である。
一つの実施形態において、前記血液悪性腫瘍は、新たに診断されたものである。一つの実施形態において、前記血液悪性腫瘍は、再発性または難治性である。
一つの実施形態において、前記AMLは、新たに診断されたAMLである。一つの実施形態において、前記AMLは、再発性または難治性AMLである。一つの実施形態において、前記B細胞AMLは、新たに診断されたB細胞AMLである。一つの実施形態において、前記B細胞AMLは、再発性または難治性B細胞AMLである。
一つの実施形態において、前記ALLは、新たに診断されたALLである。一つの実施形態において、前記ALLは、再発性または難治性ALLである。
一つの実施形態において、前記MMは、新たに診断されたMMである。一つの実施形態において、前記MMは、再発性または難治性MMである。一つの実施形態において、前記PCLは、新たに診断されたPCLである。一つの実施形態において、前記PCLは、再発性または難治性PCLである。
一つの実施形態において、前記HLは、新たに診断されたHLである。一つの実施形態において、前記HLは、再発性または難治性HLである。
一つの実施形態において、前記NHLは、新たに診断されたNHLである。一つの実施形態において、前記NHLは、再発性または難治性NHLである。
一つの実施形態において、前記TCLは、新たに診断されたTCLである。一つの実施形態において、前記TCLは、再発性または難治性TCLである。一つの実施形態において、前記ALCLは、新たに診断されたALCLである。一つの実施形態において、前記ALCLは、再発性または難治性ALCLである。一つの実施形態において、前記セザリー症候群は、新たに診断されたセザリー症候群である。一つの実施形態において、前記セザリー症候群は、再発性または難治性セザリー症候群である。
一つの実施形態において、前記BLは、新たに診断されたBLである。一つの実施形態において、前記BLは、再発性または難治性BLである。
一つの実施形態において、前記MZLは、新たに診断されたMZLである。一つの実施形態において、前記MZLは、再発性または難治性MZLである。一つの実施形態において、前記SMZLは、新たに診断されたSMZLである。一つの実施形態において、前記SMZLは、再発性または難治性SMZLである。
一つの実施形態において、前記MDSは、新たに診断されたMDSである。一つの実施形態において、前記MDSは、再発性または難治性MDSである。
一つの実施形態において、本明細書では、本明細書で提供される血液悪性腫瘍を有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における完全寛解、部分寛解、または安定疾患を達成する方法が提供される。一つの実施形態において、本明細書では、本明細書で提供される血液悪性腫瘍を有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を達成する方法が提供される。一つの実施形態において、本明細書では、本明細書で提供される血液悪性腫瘍を有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における全生存期間の増加を達成する方法が提供される。一つの実施形態において、本明細書では、本明細書で提供される血液悪性腫瘍を有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無増悪生存期間の増加を達成する方法が提供される。一つの実施形態において、本明細書では、本明細書で提供される血液悪性腫瘍を有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無イベント生存期間の増加を達成する方法が提供される。一つの実施形態において、本明細書では、本明細書で提供される血液悪性腫瘍を有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無増悪期間の増加を達成する方法が提供される。一つの実施形態において、本明細書では、本明細書で提供される血液悪性腫瘍を有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無病生存期間の増加を達成する方法が提供される。一つの実施形態において、前記血液悪性腫瘍は、AML(例えば、B細胞AML)である。一つの実施形態において、前記血液悪性腫瘍は、ALLである。一つの実施形態において、前記血液悪性腫瘍は、CLL/SLLである。一つの実施形態において、前記血液悪性腫瘍は、MMである。一つの実施形態において、前記血液悪性腫瘍は、PCLである。一つの実施形態において、前記血液悪性腫瘍は、NHLである。一つの実施形態において、前記血液悪性腫瘍は、DLBCLである。一つの実施形態において、前記血液悪性腫瘍は、TCL(例えば、ALCLまたはセザリー症候群)である。一つの実施形態において、前記血液悪性腫瘍は、バーキットリンパ腫である。一つの実施形態において、前記血液悪性腫瘍は、HLである。一つの実施形態において、前記血液悪性腫瘍は、MZL(例えば、SMZL)である。一つの実施形態において、前記血液悪性腫瘍は、MDSである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、AMLの治療方法が提供される。一つの実施形態において、前記AMLは、B細胞AMLである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、AMLの予防方法が提供される。一つの実施形態において、前記AMLは、B細胞AMLである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、AMLの処置方法が提供される。一つの実施形態において、前記AMLは、B細胞AMLである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、ALLの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、ALLの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、ALLの処置方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MMの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MMの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MMの処置方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、PCLの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、PCLの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、PCLの処置方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、TCLの治療方法が提供される。一つの実施形態において、前記TCLは、ALCLである。一つの実施形態において、前記TCLは、セザリー症候群である。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、TCLの予防方法が提供される。一つの実施形態において、前記TCLは、ALCLである。一つの実施形態において、前記TCLは、セザリー症候群である。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、TCLの処置方法が提供される。一つの実施形態において、前記TCLは、ALCLである。一つの実施形態において、前記TCLは、セザリー症候群である。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、BLの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、BLの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、BLの処置方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、HLの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、HLの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、HLの処置方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MZLの治療方法が提供される。一つの実施形態において、前記MZLは、SMZLである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MZLの予防方法が提供される。一つの実施形態において、前記MZLは、SMZLである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MZLの処置方法が提供される。一つの実施形態において、前記MZLは、SMZLである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MDSの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MDSの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MDSの処置方法が提供される。
一つの実施形態において、本明細書では、非ホジキンリンパ腫(NHL)を治療、予防または処置するために、本明細書で提供される化合物1の固形体または塩を単独で、またはリツキシマブと併用して使用する方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、NHLの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、NHLの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、NHLの処置方法が提供される。
一つの実施形態において、前記NHLは、DLBCLである。一つの実施形態において、前記DLBCLは、原発性DLBCLである。一つの実施形態において、前記DLBCLは、活性化B細胞様DLBCL(ABC-DLBCL)である。一つの実施形態において、前記DLBCLは、胚中心B細胞様DLBCL(GCB-DLBCL)である。一つの実施形態において、前記DLBCLは、未分類DLBCLである。一つの実施形態において、前記DLBCLは、原発性縦隔B細胞型DLBCL(PMBL DLBCL)である。一つの実施形態において、前記DLBCLは、ダブルヒットDLBCL(DHIT DLBCL)であり、cMyc/Bcl-2変異DLBCLとも呼ばれる。一つの実施形態において、前記DLBCLは、cMyc/Bcl2/Bcl6再構成DLBCLとも呼ばれるトリプルヒットDLBCL(THIT DLBCL)である。
一つの実施形態において、前記NHLは、濾胞性リンパ腫(FL)である。
一つの実施形態において、前記NHLは、マントル細胞リンパ腫(MCL)である。
一つの実施形態において、前記NHLは、原発性中枢神経系リンパ腫(PCNSL)である。
ある実施形態において、前記NHLは、再発性または難治性NHLである。一つの実施形態において、前記NHLは、再発性NHLである。一つの実施形態において、前記NHLは、難治性NHLである。
ある実施形態において、前記NHL患者には、完全寛解(CR)を達成した後に疾患の進行を示す放射線学的証拠がある。ある実施形態において、前記NHL患者は、レジメンを取り入れた最新の全身療法に対してCRに満たない達成度であり、事前の幹細胞移植(SCT)の12か月以内に活動性疾患または疾患進行あるいは再発の放射線学的証拠がある。
ある実施形態において、前記NHL患者は、一つ以上の治療法が奏効しておらず、他の治療法の対象でない。ある実施形態において、前記患者は、少なくとも一つの事前治療を受けており、本明細書に記載される治療方法以外の任意の治療法に適さない。ある実施形態において、前記患者は、標準的な抗がん治療後に再発しているか、または治療中に進行している。
ある実施形態において、前記患者は、少なくとも一つの事前治療が奏効していない。ある実施形態において、前記患者は、少なくとも二つの事前治療が奏効していない。
一つの実施形態において、前記NHLは、再発性または難治性DLBCLである。一つの実施形態において、前記DLBCLは、再発性DLBCLである。一つの実施形態において、前記DLBCLは、難治性DLBCLである。一つの実施形態において、前記DLBCLは、再発性/難治性DLBCLである。一つの実施形態において、前記DLBCLは、ドキソルビシンに対して難治性である。一つの実施形態において、前記DLBCLは、ドキソルビシンに耐性がある。一つの実施形態において、前記DLBCLは、リツキシマブ、シクロホスファミド、ドキソルビシン、ビンクリスチン、プレドニゾン、エトポシド、ベンダムスチン、レナリドミド、ゲムシタビン、デキサメタゾン、イホスファミド、ポラツズマブ、またはCAR-Tのうちの一つ以上に対して難治性である。
一つの実施形態において、前記DLBCLは、二つ以上の事前治療法で治療される。
一つの実施形態において、前記DLBCLは、形質転換リンパ腫である。もう一つの実施形態において、前記DLBCLは、特定不能な(NOS)DLBCLである。
一つの実施形態において、前記NHLは、再発性または難治性FLである。一つの実施形態において、前記FLは、再発性FLである。一つの実施形態において、前記FLは、難治性FLである。
一つの実施形態において、前記FLは、一つ以上の事前治療法で治療される。一つの実施形態において、前記FLは、二つ以上の事前治療法で治療される。
一つの実施形態において、前記NHLは、再発性または難治性MCLである。一つの実施形態において、前記MCLは、再発性MCLである。一つの実施形態において、前記MCLは、難治性MCLである。
一つの実施形態において、前記MCLは、一つ以上の事前治療法で治療される。一つの実施形態において、前記MCLは、二つ以上の事前治療法で治療される。
一つの実施形態において、前記NHLは、再発性または難治性PCNSLである。一つの実施形態において、前記PCNSLは、再発性PCNSLである。一つの実施形態において、前記PCNSLは、難治性PCNSLである。
ある実施形態において、前記NHLは、新たに診断されたNHLである。ある実施形態において、前記NHLは、新たに診断されたびまん性大細胞型B細胞リンパ腫である。ある実施形態において、前記NHLは、新たに診断された濾胞性リンパ腫である。ある実施形態において、前記NHLは、新たに診断されたマントル細胞リンパ腫である。ある実施形態において、前記NHLは、新たに診断された原発性中枢神経系リンパ腫である。
ある実施形態において、本明細書で提供される前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書で提供される第一の治療法(例えば、本明細書で提供される化合物1の固形体または塩などの薬剤)は、患者への第二の治療法(例えば、リツキシマブ)の投与に先立って(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、1週間、2週間、3週間、4週間、5週間、6週間、8週間、または12週間前に)投与される。
一つの実施形態において、本明細書で提供される第一の治療法(例えば、本明細書で提供される化合物1の固形体または塩などの薬剤)は、患者への第二の治療法(例えば、リツキシマブ)の投与と同時に投与される。
一つの実施形態において、本明細書で提供される第一の治療法(例えば、本明細書で提供される化合物1の固形体または塩などの薬剤)は、患者への第二の治療法(例えば、リツキシマブ)の投与の後に(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、1週間、2週間、3週間、4週間、5週間、6週間、8週間、または12週間後に)投与される。
ある実施形態において、リツキシマブは、調製、投与、および保存情報の地域承認ラベルまたは薬学マニュアルに従って投与される。ある実施形態において、リツキシマブは、静脈内に投与される。ある実施形態において、リツキシマブは、皮下に投与される。ある実施形態において、リツキシマブは、IV注射またはIV注入を介して投与される。ある実施形態において、リツキシマブは、IV注入を介して投与される。
ある実施形態において、リツキシマブは、医師の判断に従う量で投与される。ある実施形態において、リツキシマブは、1日1回または2回投与される。ある実施形態において、リツキシマブは、約50から約1000mg/m2、約100から約750mg/m2、約250から約500mg/m2、約300から約400mg/m2までの量で投与される。ある実施形態において、リツキシマブは、1日あたり375mg/m2の量で投与される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、DLBCLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、DLBCLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、DLBCLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、FLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、FLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、FLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MCLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MCLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、MCLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、PCNSLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、PCNSLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、PCNSLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性DLBCLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性DLBCLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性DLBCLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性FLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性FLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性FLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性MCLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性MCLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性MCLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性PCNSLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性PCNSLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性PCNSLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、NHLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者におけるルガーノ応答基準によって決定されるような、完全寛解、部分寛解、または安定疾患を達成する方法が提供される。もう一つの実施形態において、本明細書では、NHLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、NHLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における全生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、NHLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無増悪生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、NHLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無イベント生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、NHLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無増悪期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、NHLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無病生存期間の増加を達成する方法が提供される。一つの実施形態において、前記方法は、治療的有効量のリツキシマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、慢性リンパ性白血病/小リンパ球性リンパ腫(CLL/SLL)を治療、予防または処置するために、本明細書で提供される化合物1の固形体または塩を単独で、またはオビヌツズマブと併用して使用する方法が提供される。
本明細書で使用されるように、そして別段の指示がない限り、「CLL/SLL」または「CLLおよび/またはSLL」は、CLL、またはSLL、あるいはCLLおよびSLLを意味する。一つの実施形態において、本明細書で提供される前記方法は、CLLを治療、予防または処置するためのものである。一つの実施形態において、本明細書で提供される前記方法は、SLLを治療、予防または処置するためのものである。一つの実施形態において、本明細書で提供される前記方法は、CLLおよびSLLを治療、予防または処置するためのものである。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、CLL/SLLの治療方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、CLL/SLLの予防方法が提供される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、CLL/SLLの処置方法が提供される。
一つの実施形態において、前記CLL/SLL患者は、一つ以上の治療法が奏効していない。一つの実施形態において、前記患者は、少なくとも一つの事前治療に奏効していない。一つの実施形態において、前記患者は、少なくとも二つの事前治療に奏効していない。一つの実施形態において、前記患者は、ブルトン型チロシンキナーゼ(BTK)阻害剤で以前に治療されている。一つの実施形態において、前記患者は、BTK阻害剤に対して再発性または難治性である。一つの実施形態において、前記BTK阻害剤は、イブルチニブである。一つの実施形態において、前記BTK阻害剤は、アカラブルチニブである。一つの実施形態において、前記BTK阻害剤は、ザヌブルチニブである。一つの実施形態において、前記BTK阻害剤は、チラブルチニブである。
一つの実施形態において、前記CLL/SLLは、新たに診断されたCLL/SLLである。一つの実施形態において、前記CLL/SLLは、再発性または難治性CLL/SLL(R/R CLL/SLL)である。
一つの実施形態において、前記CLLは、変異IGHV(免疫グロブリン重鎖遺伝子)によって特徴付けられる。一つの実施形態において、前記CLLは、非変異IGHVによって特徴付けられる
一つの実施形態において、前記CLLは、TP53(腫瘍タンパク質53)における一つ以上の変異によって特徴付けられる。一つの実施形態において、前記CLLは、野生型TP53によって特徴付けられる。
一つの実施形態において、前記CLLは、一つ以上の染色体異常、例えば、del(13q)、del(11q)、del(17p)、tri12、t(6;17)、del(11q22.3)、t(11;14)、del(18q)、およびt(14;19)によって特徴付けられる。一つの実施形態において、前記CLLは、del(17p)によって特徴付けられる。
一つの実施形態において、前記CLLは、リヒター形質転換(またの名をリヒター症候群)によって特徴付けられる
一つの実施形態において、本明細書で提供される前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書で提供される第一の治療法(例えば、本明細書で提供される化合物1の固形体または塩などの薬剤)は、患者への第二の治療法(例えば、オビヌツズマブ)の投与に先立って(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、120時間、144時間、1週間、2週間、3週間、4週間、5週間、6週間、8週間、または12週間前に)投与される。
一つの実施形態において、本明細書で提供される第一の治療法(例えば、本明細書で提供される化合物1の固形体または塩などの薬剤)は、患者への第二の治療法(例えば、オビヌツズマブ)の投与と同時に投与される。
一つの実施形態において、本明細書で提供される第一の治療法(例えば、本明細書で提供される化合物1の固形体または塩などの薬剤)は、患者への第二の治療法(例えば、オビヌツズマブ)の投与の後に(例えば、5分、15分、30分、45分、1時間、2時間、4時間、6時間、12時間、24時間、48時間、72時間、96時間、120時間、144時間、1週間、2週間、3週間、4週間、5週間、6週間、8週間、または12週間後に)投与される。
一つの実施形態において、オビヌツズマブは、調製、投与、および保存情報の地域承認ラベルまたは薬学マニュアルに従って投与される。一つの実施形態において、オビヌツズマブは、静脈内に投与される。一つの実施形態において、オビヌツズマブは、皮下に投与される。一つの実施形態において、オビヌツズマブは、静脈内(IV)注射またはIV注入を介して投与される。一つの実施形態において、オビヌツズマブは、IV注射を介して投与される。一つの実施形態において、オビヌツズマブは、IV注入を介して投与される。
一つの実施形態において、オビヌツズマブは、医師の判断に従う量で投与される。一つの実施形態において、オビヌツズマブは、1日1回投与される。一つの実施形態において、オビヌツズマブは、1日あたり約75mgから約1100mgまでの用量で投与される。一つの実施形態において、オビヌツズマブは、1日あたり約75mgから約125mg、1日あたり約800mgから約1000mg、または1日あたり約900mgから約1100mgまでの用量で投与される。一つの実施形態において、オビヌツズマブは、1日あたり約100mgの用量で投与される。一つの実施形態において、オビヌツズマブは、1日あたり約900mgの用量で投与される。一つの実施形態において、オビヌツズマブは、1日あたり約1000mgの用量で投与される。一つの実施形態において、オビヌツズマブは、第一の28日サイクルのday1に約100mg、第一の28日サイクルのday2に約900mg、並びに第一の28日サイクルのday8および15ならびに第二から第六の28日サイクルのday1のそれぞれに約1000mgの用量で投与される。一つの実施形態において、オビヌツズマブは、第一の28日サイクルのday1および2に併用で約1000mg、並びに第一の28日サイクルのday8および15ならびに第二から第六の28日サイクルのday1のそれぞれに約1000mgの用量で投与される。オビヌツズマブは、第六のサイクルを超えて投与され得る。一つの実施形態において、オビヌツズマブは、本明細書に記載されるような第一の28日サイクルに投与され、並びに第二から第十二の28日サイクルのday1に約1000mgで投与される。一つの実施形態において、オビヌツズマブは、本明細書に記載されるような第一の28日サイクルに投与され、並びに第二から第二十四の28日サイクルのday1に約1000mgで投与される。一つの実施形態において、オビヌツズマブは、本明細書に記載されるような第一の28日サイクルに投与され、並びに疾患の進行までその後の28日サイクルのday1に約1000mgで投与される。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、新たに診断されたCLL/SLLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、新たに診断されたCLL/SLLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、新たに診断されたCLL/SLLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性CLL/SLLの治療方法が提供される。一つの実施形態において、前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性CLL/SLLの予防方法が提供される。一つの実施形態において、前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、治療を必要とする患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、再発性または難治性CLL/SLLの処置方法が提供される。一つの実施形態において、前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
もう一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における慢性リンパ性白血病基準についての国際ワークショップによって決定されるような、完全寛解、部分寛解、または安定疾患を達成する方法が提供される。一つの実施形態において、微小残存病変(MRD)検出は、完全寛解(CR)の確認のために骨髄検査を受ける患者に行われることがある。一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における微小残存病変(MRD)陰性を達成する方法が提供される。一つの実施形態において、前記MRD陰性は、末梢血および/または骨髄で測定される。一つの実施形態において、前記MRD陰性は、最低3ヶ月間続く。もう一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における全生存期間、無増悪生存期間、無イベント生存期間、無増悪期間、または無病生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における全生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無増悪生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無イベント生存期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無増悪期間の増加を達成する方法が提供される。もう一つの実施形態において、本明細書では、CLL/SLLを有する患者に、治療的有効量の、本明細書で提供される化合物1の固形体または塩を投与することを特徴とする、患者における無病生存期間の増加を達成する方法が提供される。一つの実施形態において、前記方法は、治療的有効量のオビヌツズマブを患者に投与することをさらに特徴とする。
本明細書で提供される前記方法は、患者の年齢にかかわらず患者を治療することを包含する。いくつかの実施形態において、前記患者は、18歳以上である。他の実施形態において、前記患者は、18、25、35、40、45、50、55、60、65、または70歳以上である。他の実施形態において、前記患者は、65歳未満である。他の実施形態において、前記患者は、65歳以上である。
本明細書では、本明細書で提供される疾患の治療方法における使用のための化合物1の固形体または塩であって、前記方法が、治療的有効量の化合物1の前記固形体または塩を患者に投与することを特徴とする、化合物1の固形体または塩も提供される。本明細書では、本明細書で提供される疾患の治療方法における使用のための化合物1の前記固形体または塩を含む、医薬組成物も提供される。
4.医薬組成物および投与経路
本明細書で提供される化合物1の前記固形体または塩は、カプセル、マイクロカプセル、錠剤、顆粒剤、粉末、トローチ、丸剤、坐薬、注射、懸濁剤、シロップ、パッチ、クリーム、ローション、軟膏、ゲル、スプレー、溶液および乳剤といった、従来の製剤の形で患者に経口、局所または非経口投与され得る。適切な製剤は、希釈剤(例えば、スクロース、デンプン、マンニトール、ソルビトール、ラクトース、グルコース、セルロース、タルク、リン酸カルシウムまたは炭酸カルシウム)、結合剤(例えば、セルロース、メチルセルロース、ヒドロキシメチルセルロース、ポリプロピルピロリドン、ポリビニルピロリドン、ゼラチン、アラビアゴム、ポリエチレングリコール、スクロースまたはデンプン)、崩壊剤(例えば、デンプン、カルボキシメチルセルロース、ヒドロキシプロピルデンプン、低置換度ヒドロキシプロピルセルロース、重炭酸ナトリウム、リン酸カルシウムまたはクエン酸カルシウム)、滑沢剤(例えば、ステアリン酸マグネシウム、軽質無水ケイ酸、タルクまたはラウリル硫酸ナトリウム)、香味剤(例えば、クエン酸、メントール、グリシンまたはオレンジ粉末)、保存剤(例えば、安息香酸ナトリウム、重亜硫酸ナトリウム、メチルパラベンまたはプロピルパラベン)、安定剤(例えば、クエン酸、クエン酸ナトリウムまたは酢酸)、懸濁化剤(例えば、メチルセルロース、ポリビニルピロリドンまたはステアリン酸アルミニウム)、分散剤(例えば、ヒドロキシプロピルメチルセルロース)、水、およびベースワックス(例えば、ココアバター、白色ワセリンまたはポリエチレングリコール)などの、従来の有機または無機添加剤を用いる、一般に利用される方法により調製され得る。医薬組成物中の化合物の有効量は、経口および非経口投与の両方に対して望ましい効果を発揮するであろうレベルであり得る。
本明細書で提供される化合物1の前記固形体または塩は、カプセル、マイクロカプセル、錠剤、顆粒剤、粉末、トローチ、丸剤、坐薬、注射、懸濁剤、シロップ、パッチ、クリーム、ローション、軟膏、ゲル、スプレー、溶液および乳剤といった、従来の製剤の形で患者に経口、局所または非経口投与され得る。適切な製剤は、希釈剤(例えば、スクロース、デンプン、マンニトール、ソルビトール、ラクトース、グルコース、セルロース、タルク、リン酸カルシウムまたは炭酸カルシウム)、結合剤(例えば、セルロース、メチルセルロース、ヒドロキシメチルセルロース、ポリプロピルピロリドン、ポリビニルピロリドン、ゼラチン、アラビアゴム、ポリエチレングリコール、スクロースまたはデンプン)、崩壊剤(例えば、デンプン、カルボキシメチルセルロース、ヒドロキシプロピルデンプン、低置換度ヒドロキシプロピルセルロース、重炭酸ナトリウム、リン酸カルシウムまたはクエン酸カルシウム)、滑沢剤(例えば、ステアリン酸マグネシウム、軽質無水ケイ酸、タルクまたはラウリル硫酸ナトリウム)、香味剤(例えば、クエン酸、メントール、グリシンまたはオレンジ粉末)、保存剤(例えば、安息香酸ナトリウム、重亜硫酸ナトリウム、メチルパラベンまたはプロピルパラベン)、安定剤(例えば、クエン酸、クエン酸ナトリウムまたは酢酸)、懸濁化剤(例えば、メチルセルロース、ポリビニルピロリドンまたはステアリン酸アルミニウム)、分散剤(例えば、ヒドロキシプロピルメチルセルロース)、水、およびベースワックス(例えば、ココアバター、白色ワセリンまたはポリエチレングリコール)などの、従来の有機または無機添加剤を用いる、一般に利用される方法により調製され得る。医薬組成物中の化合物の有効量は、経口および非経口投与の両方に対して望ましい効果を発揮するであろうレベルであり得る。
本明細書で提供される化合物1の固形体または塩は、経口投与され得る。一つの実施形態において、経口投与される場合、本明細書で提供される化合物1の固形体または塩は、食事および水とともに投与される。もう一つの実施形態において、本明細書で提供される化合物1の前記固形体または塩は、水またはジュース(例えば、リンゴジュースもしくはオレンジジュース)中に分散し、溶液または懸濁液として経口で投与される。
本明細書で提供される化合物1の固形体または塩は、皮内に、筋肉内に、腹腔内に、経皮的(percutaneously)に、静脈内に、皮下に、鼻腔内に、硬膜外に、舌下に、脳内に、膣内に、経皮的(transdermally)に、直腸に、粘膜に、吸入によって、または耳、鼻、眼、もしくは皮膚に局所的に投与されることもある。前記投与方法は、医療関係者の裁量に委ねられ、一部、身体疾患の部位によって決まり得る。
一つの実施形態において、本明細書では、追加の賦形剤を含まず、本明細書で提供される化合物1の固形体または塩を含むカプセルが提供される。もう一つの実施形態において、本明細書では、有効量の、本明細書で提供される化合物1の固形体または塩および薬学的に許容される賦形剤を含み、前記薬学的に許容される賦形剤が、希釈剤、結合剤、崩壊剤、流動促進剤、滑沢剤、またはその混合物を含み得る、組成物が提供される。一つの実施形態において、前記組成物は、医薬組成物である。
前記組成物は、錠剤、チュアブル錠、カプセル、溶液、非経口溶液、トローチ、坐薬および懸濁液および同種のものの形をとり得る。組成物は、用量単位で、1日用量、または簡便な1日用量の一部を含むように製剤され得、単回の錠剤またはカプセルあるいは簡便な液量であり得る。一つの実施形態において、前記溶液は、水溶性塩から調製される。一般に、組成物の全ては、薬化学における既知の方法に従って調製される。カプセルは、本明細書で提供される化合物1の固形体または塩と適切な賦形剤を混合し、適正量の前記混合物をカプセルに充填することにより調製され得る。前記通常の賦形剤には、多数の異なる種類のデンプンといった不活性粉末物質、粉末セルロース、特に結晶セルロースおよび微結晶セルロース、フルクトース、マンニトールおよびスクロースといった糖類、小麦粉並びに類似の食用粉末が挙げられるが、これらに限らない。カプセルフィルは、湿式造粒または乾式造粒により調製されもし得る。
滑沢剤は、前記粉末がピンに粘着しないようにするために、カプセル形成に必要であり得る。前記滑沢剤は、タルク、ステアリン酸マグネシウムおよびカルシウム、ステアリルフマル酸ナトリウム、ステアリン酸並びに硬化植物油などの滑りやすい固体から選択され得る。崩壊剤は、湿ると膨潤してカプセルスラグを崩壊させ、前記化合物を放出する物質である。それらには、デンプン、粘土、セルロース、クロスポビドン、クロスカルメロースナトリウム、デンプングリコール酸ナトリウム、アルギンおよびゴムが挙げられる。さらにとりわけ、例えば、コーンおよびポテトスターチ、メチルセルロース、寒天、ベントナイト、木材セルロース、粉末状天然スポンジ、カチオン交換樹脂、アルギン酸、グアーガム、シトラスパルプおよびカルボキシメチルセルロースは、ラウリル硫酸ナトリウムと同様に使用され得る。流動促進剤が使用されることもあり、二酸化ケイ素、タルク、およびケイ酸カルシウムが挙げられる。
錠剤は、直接打錠、湿式造粒、または乾式造粒により調製され得る。それらの製剤は、通常、化合物だけでなく希釈剤、結合剤、滑沢剤および崩壊剤も組み込む。典型的な希釈剤には、例えば、様々な種類のデンプン、ラクトース、マンニトール、カオリン、リン酸または硫酸カルシウム、塩化ナトリウムなどの無機塩および粉糖が挙げられる。粉末セルロース誘導体もまた有用である。典型的な錠剤の結合剤は、デンプン、ゼラチン並びにラクトース、フルクトース、グルコースおよび同種のものといった糖類などの物質である。天然および合成ゴムもまた簡便であり、アカシア、アルギネート、メチルセルロース、ポリビニルピロリジンおよび同種のものが挙げられる。ポリエチレングリコール、エチルセルロースおよびワックスは、結合剤としてもはたらき得る。
滑沢剤は、前記錠剤および杵が臼中に粘着しないようにするために、錠剤形成に必要であり得る。前記滑沢剤は、タルク、ステアリン酸マグネシウムおよびカルシウム、ステアリルフマル酸ナトリウム、ステアリン酸並びに硬化植物油などの滑りやすい固体から選択され得る。錠剤崩壊剤は、湿ると膨潤して前記錠剤を崩壊させ、前記化合物を放出する物質である。それらには、デンプン、粘土、セルロース、クロスポビドン、クロスカルメロースナトリウム、デンプングリコール酸ナトリウム、アルギンおよびゴムが挙げられる。さらにとりわけ、例えば、コーンおよびポテトスターチ、メチルセルロース、寒天、ベントナイト、木材セルロース、粉末状天然スポンジ、カチオン交換樹脂、アルギン酸、グアーガム、シトラスパルプおよびカルボキシメチルセルロースは、ラウリル硫酸ナトリウムと同様に使用され得る。流動促進剤が使用されることもあり、二酸化ケイ素、タルク、およびケイ酸カルシウムが挙げられる。錠剤は、前記錠剤の溶解特性を修飾するために、香味料およびシーラントとして糖類で、または膜形成保護剤でコーティングされ得る。前記組成物は、例えば、前記製剤中にマンニトールなどの物質を用いることにより、チュアブル錠として製剤されることもある。
本明細書で提供される化合物1の固形体または塩を坐薬として投与することが望ましい場合、典型的な基剤が使用され得る。ココアバターは、伝統的な坐薬基剤であり、その融点をわずかに上昇させるために、ワックスの添加により修飾され得る。特に、様々な分子量のポリエチレングリコールを含む水混和性坐薬基剤は、広く用いられる。
本明細書で提供される化合物1の前記固形体または塩の効果は、適切な製剤により遅延または延長され得る。例えば、本明細書で提供される化合物1の前記固形体または塩のゆっくりと溶けるペレットは、錠剤もしくはカプセル中に、または徐放性埋め込み型装置として調製および組み込まれ得る。前記技術には、様々な異なる溶解速度のペレットを作成すること、およびカプセルに前記ペレットの混合物を充填することも挙げられる。錠剤またはカプセルは、予測可能な時間、溶解に抵抗するフィルムでコーティングされ得る。前記非経口製剤でさえ、本明細書で提供される化合物1の前記固形体または塩が血清中でゆっくりと分散することを可能とする油性または乳化ビークル中に、それを溶解または懸濁させることにより、長時間作用型にすることができる。
治療されるべき前記疾患の状態および前記患者の状態に応じて、本明細書で提供される化合物1の固形体または塩は、経口、非経口(例えば、筋肉内、腹腔内、静脈内、CIV、嚢内注射もしくは注入、皮下注射、またはインプラント)、吸入、経鼻、経膣、直腸、舌下、または局所(topical)(例えば、経皮もしくは局所(local))投与経路により投与されることがある。本明細書で提供される化合物1の固形体または塩は、単独で、またはそれぞれの投与経路に適する、薬学的に許容される賦形剤、担体、アジュバントおよびビークルとともに、適切な用量単位で製剤化されることがある。
一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、経口投与される。もう一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、非経口投与される。さらにもう一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、静脈内投与される。
本明細書で提供される化合物1の固形体または塩は、例えば、単回ボーラス注射、もしくは経口カプセル、錠剤もしくは丸剤などの単回投与として;または例えば、経時的な持続注入もしくは経時的な分割ボーラス投与など、経時的に送達され得る。本明細書で提供される化合物1の前記固形体または塩は、例えば、前記患者が安定疾患もしくは退縮を経験するまで、または前記患者が疾患進行もしくは許容されない毒性を経験するまで、必要ならば繰り返し投与され得る。
本明細書で提供される化合物1の固形体または塩は、1日1回(QD)投与されてもよく、1日2回(BID)、1日3回(TID)、および1日4回(QID)など、1日用量を複数回に分けてもよい。さらに、前記投与は、持続的(すなわち、連日にわたって毎日もしくは毎日)、間欠的、例えば、周期的(すなわち、数日間、数週間、もしくは数ヶ月間の、薬剤を用いない休息を含む)であり得る。本明細書で使用されるように、「毎日(daily)」という用語は、本明細書で提供される化合物1の固形体または塩などの治療化合物が、例えば、一定期間、毎日1回または2回以上投与されるという意味であることが意図される。「持続的(continuous)」という用語は、本明細書で提供される化合物1の固形体または塩などの治療化合物が、少なくとも7日から52週間の中断のない期間にわたって毎日投与されるという意味であることが意図される。本明細書で使用されるように、「間欠的(intermittent)」または「間欠的に(intermittently)」という用語は、規則的または不規則的間隔のいずれかで中断および開始するという意味であることが意図される。例えば、本明細書で提供される化合物1の固形体または塩の間欠投与は、1週間につき1から6日間の投与、周期的な投与(例えば、2から8週間連続の毎日投与後、最大1週間の投与をしない休息期間)、または隔日投与である。本明細書で使用されるように、「周期的(cycling)」という用語は、本明細書で提供される化合物1の固形体または塩などの治療化合物が、毎日または持続的に、しかし休息期間を伴って投与されるという意味であることが意図される。
いくつかの実施形態において、投与頻度は、約毎日1回から約毎月1回の範囲内である。ある実施形態において、投与は、1日1回、1日2回、1日3回、1日4回、1日置きに1回、1週間に2回、1週間に1回、2週間に1回、3週間に1回、または4週間に1回である。一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、1日1回投与される。もう一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、1日2回投与される。さらにもう一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、1日3回投与される。さらにもう一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、1日4回投与される。
ある実施形態において、本明細書で提供される前記方法は、1以上の7日治療サイクルでの、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。もう一つの実施形態において、本明細書で提供される前記方法は、7日サイクルのday1から5での、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。もう一つの実施形態において、本明細書で提供される前記方法は、7日サイクルのday1から3での、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。
ある実施形態において、本明細書で提供される前記方法は、1以上の14日治療サイクルでの、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。もう一つの実施形態において、本明細書で提供される前記方法は、14日サイクルのday1から7での、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。もう一つの実施形態において、本明細書で提供される前記方法は、14日サイクルのday1から10での、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。
ある実施形態において、本明細書で提供される前記方法は、1以上の28日治療サイクルでの、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。もう一つの実施形態において、本明細書で提供される前記方法は、28日サイクルのday1から21での、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。もう一つの実施形態において、本明細書で提供される前記方法は、28日サイクルのday1から5、day8から12、day15から19、およびday22から26での、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。もう一つの実施形態において、本明細書で提供される前記方法は、28日サイクルのday1から10およびday15から24での、治療的有効量の、本明細書で提供される化合物1の固形体または塩の投与を含む。
一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、5日間1日1回投与され、続いて2日間の休息がある。一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、3日間1日1回投与され、続いて4日間の休息がある。一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、7日間1日1回投与され、続いて7日間の休息がある。一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、10日間1日1回投与され、続いて4日間の休息がある。一つの実施形態において、本明細書で提供される化合物1の固形体または塩は、21日間1日1回投与され、続いて7日間の休息がある。
ある実施形態において、前記治療は、1以上の治療サイクルでの、治療的有効量のリツキシマブの投与を含む。一つの実施形態において、リツキシマブは、7日間に1回投与される。一つの実施形態において、リツキシマブは、4週間に1回投与される。一つの実施形態において、リツキシマブは、8週間に1回投与される。一つの実施形態において、リツキシマブは、第一の28日サイクルのday1、8、15、および22に投与され、並びに第二から第六の28日サイクルのday1に投与され、その後8週間に1回投与される。
一つの実施形態において、前記治療は、1以上の治療サイクルでの、治療的有効量のオビヌツズマブの投与を含む。一つの実施形態において、オビヌツズマブは、7日間に1回投与される。一つの実施形態において、オビヌツズマブは、1週間に1回投与される。一つの実施形態において、オビヌツズマブは、4週間に1回投与される。一つの実施形態において、オビヌツズマブは、第一の28日サイクルのday1、2、8、および15に投与され、並びに第二から第六の28日サイクルのday1に投与される。一つの実施形態において、オビヌツズマブは、第二から第十二の28日サイクルのday1に投与される。一つの実施形態において、オビヌツズマブは、第二から第二十四の28日サイクルのday1に投与される。一つの実施形態において、オビヌツズマブは、疾患の進行まで、その後の28日サイクルのday1に投与される。
一つの実施形態において、オビヌツズマブは、第一の28日サイクルのday1に約100mg、第一の28日サイクルのday2に約900mg、並びに第一の28日サイクルのday8および15のそれぞれに約1000mgの用量で投与される。一つの実施形態において、オビヌツズマブは、第一の28日サイクルのday1および2に併用で約1000mg、並びに第一の28日サイクルのday8および15のそれぞれに約1000mgの用量で投与される。一つの実施形態において、オビヌツズマブは、第二から第六の28日サイクルのday1に約1000mgの用量で投与される。一つの実施形態において、オビヌツズマブは、第二から第十二の28日サイクルのday1に約1000mgで投与される。一つの実施形態において、オビヌツズマブは、第二から第二十四の28日サイクルのday1に約1000mgで投与される。一つの実施形態において、オビヌツズマブは、疾患の進行まで、その後の28日サイクルのday1に約1000mgで投与される。
本明細書に記載される任意の治療サイクルは、少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30またはそれ以上のサイクルにわたって繰り返され得る。場合によっては、本明細書に記載されるような前記治療サイクルは、1から約24サイクル、約2から約16サイクル、または約2から約4サイクルを含む。場合によっては、本明細書に記載されるような治療サイクルは、1から約4サイクルを含む。いくつかの実施形態において、治療的有効量の、本明細書で提供される固形体もしくは化合物1の塩および/またはリツキシマブは、28日を1サイクルとして、1から13サイクル(約1年間)にわたって投与される。いくつかの実施形態において、治療的有効量の、本明細書で提供される固形体もしくは化合物1の塩および/またはリツキシマブは、28日を1サイクルとして、1から24サイクル(約2年間)にわたって投与される。いくつかの実施形態において、治療的有効量の、本明細書で提供される固形体もしくは化合物1の塩および/またはオビヌツズマブは、28日を1サイクルとして、1から13サイクル(約1年間)にわたって投与される。いくつかの実施形態において、治療的有効量の、本明細書で提供される固形体もしくは化合物1の塩および/またはオビヌツズマブは、28日を1サイクルとして、1から24サイクル(約2年間)にわたって投与される。場合によっては、前記周期的治療法は、サイクルの数に制限されず、前記治療法は、疾患進行まで継続される。サイクルは、場合によっては、本明細書に記載される、様々な投与期間および/または休息期間を含み得る。
1.(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(化合物1)の合成
(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン:2:1ジオキサン-MeOH(75 mL)中、(S)-4-アミノ-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(5.00 g,18.3 mmol)および2-フルオロ-4-(ヒドロキシメチル)ベンズアルデヒド(2.82 g,18.30 mmol)の懸濁液を0℃に冷却し、B10H14(4.92 g,40.3 mmol)を5分にわたって少量で添加した。反応フラスコにセプタムおよびニードルベントを装着(加圧)し、10分間勢いよく攪拌した。前記混合物を環境温度に到達させ、3時間攪拌した。前記混合物を濃縮し、残留物をシリカゲルクロマトグラフィー(0-10% MeOH-DCM)により精製し、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオンを黄色固体(4.23 g,56%)として得た。LCMS(ESI) m/z 411.8 [M+H]+
(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン:乾燥NMP(6mL)中、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-(ヒドロキシメチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(0.727 g,1.77 mmol)の溶液を0℃に冷却し、塩化メタンスルホニル(0.275 mL,3.35 mmol)およびDIEA(0.617 mL, 3.53 mmol)を連続的に添加した。前記反応混合物を環境温度に到達させ、18時間攪拌した。勢いよく混合しながら、前記反応混合物をゆっくりと、0℃に冷却したH2O(60mL)に添加した。結果として生じた懸濁液をろ過し、回収した固体をH2OおよびEt2Oで洗浄した。前記固体をEtOAc中に溶解させ、前記溶液をMgSO4で乾燥させ、ろ過し、濃縮して(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオンを黄色固体(0.600 g,79%)として得た。LCMS(ESI) m/z 430.0 [M+H]+
(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン:乾燥DMSO(1.0 mL)中、(S)-4-((4-(クロロメチル)-2-フルオロベンジル)アミノ)-2-(2,6-ジオキソピペリジン-3-イル)イソインドリン-1,3-ジオン(300 mg,0.698 mmol)の溶液に、4-(アゼチジン-3-イル)モルホリン塩酸塩(125 mg,0.698 mmol)およびDIEA(0.122 mL,0.698 mmol)を添加した。前記反応混合物を環境温度で18時間攪拌し、DMSO(1mL)で希釈した。前記溶液をキラル逆相クロマトグラフィーにより精製し、(S)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオン(89 mg,24%,97% ee)を得た。LCMS (ESI) m/z 536.2 [M+H]+
2.化合物1を用いる細胞アッセイ
以下は、代表的な非ホジキンリンパ腫(NHL)細胞株を用いて、化合物1の抗増殖活性およびアポトーシス効果を測定するために使用され得る、細胞アッセイの例である。
以下は、代表的な非ホジキンリンパ腫(NHL)細胞株を用いて、化合物1の抗増殖活性およびアポトーシス効果を測定するために使用され得る、細胞アッセイの例である。
SU-DHL-4細胞株を用いる細胞増殖および生存率アッセイ:以下の代表的なアッセイは、DLBCL細胞株、例えば、SU-DHL-4細胞株(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH[DSMZ]:カタログ番号ACC-495)を処置後120時間で使用する。SU-DHL-4の播種密度は、1536ウェルプレートにおけるアッセイ線形性を確保するために最適化され得る。
化合物1の濃度を上げながら(0.5nMから10μM)、アコースティックディスペンサー(EDC ATS-100)によって、空の1536ウェルプレートに、20点希釈方式(不等間隔のデータ点)でそれぞれ配置した。DMSO濃度は、最終アッセイ濃度が0.1%DMSOとなるように一定に保たれた。実験に先立って、SU-DHL-4細胞を10%FBS(fetal bovine serum:HyClone)入りのRPMI-1640(Roswell Park Memorial Institute-1640)培地中で培養し、培養フラスコの中で増殖させ、十分な量の出発物質を得た。細胞を1ウェルあたり5μL体積中500細胞にその後希釈し、化合物配置済み1536ウェルプレートに直接添加した。細胞を120時間、5%CO2中37℃で増殖させた。細胞の、化合物への曝露が始まった時(t0)に、1vol:2volの比での、Cell Titer-Glo(登録商標)発光細胞生存率アッセイを通じて、製造業者の指示(Promega Corporation,Madison,WI)に従って、生細胞中に存在するアデノシン-5’-三リン酸(ATP)によって産生される発光のレベルを定量化することで、初期生細胞数を評価した。120時間後に、Cell Titer-Glo(登録商標)および発光の読み取りにより、処置された細胞の細胞生存率を評価した。Activity Base(IDBS、アラメダ、カリフォルニア州)を用いて、全ての増殖阻害曲線を処理および評価した。4パラメーターロジスティックモデル(シグモイド用量反応モデル):
y=(A+((B-A)/(1+((C/x)^D))))
式中:
A=YMin
B=YMax
C=EC50
D=ヒルスロープ
IC50=YがDMSOコントロールの50%と等しいときの化合物の濃度
Y=発光単位として測定された細胞生存率、および
x=化合物の濃度
を用いて、細胞生存率IC50値を計算した。
y=(A+((B-A)/(1+((C/x)^D))))
式中:
A=YMin
B=YMax
C=EC50
D=ヒルスロープ
IC50=YがDMSOコントロールの50%と等しいときの化合物の濃度
Y=発光単位として測定された細胞生存率、および
x=化合物の濃度
を用いて、細胞生存率IC50値を計算した。
化合物1は、SU-DHL-4細胞増殖アッセイにおいてIC50<0.2μMの活性を有することが分かった。
血液学的細胞株を用いる細胞増殖および生存率アッセイ:以下の代表的な抗増殖アッセイは、以下の代表的な血液学的細胞株を用いる。384ウェルフローサイトメトリーアッセイを用いて、本明細書に記載される化合物1のin vitro増殖阻害活性を評価した。
ABC=活性化B細胞様;FBS=ウシ胎仔血清;GCB=胚中心B細胞;IMDM=イスコフ改変ダルベッコ培地;NEAA=非必須アミノ酸;RPMI=RPMI1640
前記細胞株を384ウェル平底プレートに播き、0.00015から10μMに及ぶ異なる化合物の濃度、またはジメチルスルホキシド(DMSO)コントロールを用いて評価した。前記DMSOの最終濃度は0.1%(v/v)であった。化合物1またはDMSOの添加および120時間のインキュベートの後に、アネキシンVおよび生細胞非透過性DNA色素、DRAQ7を用いて、フローサイトメトリー(Attune(登録商標),Thermo Fisher)により細胞数および細胞死を分析した。ホスファチジルセリンは、アポトーシスの初期に細胞膜の内層から外層に移行し、アネキシンVが、アポトーシスを起こした細胞の表面上に見られる、さらされた前記ホスファチジルセリンに結合する。生体染色色素DRAQ7は、無傷の生細胞により排除され、アポトーシスまたはネクローシスの結果として死んでいる細胞のみを染める。
Flow Jo_v10ソフトウェアを用いてフローサイトメトリーデータ分析をその後行い、生細胞(アネキシンVおよびDRAQ7ダブルネガティブ染色細胞)の数、並びにアポトーシスを起こした細胞(アネキシンVポジティブ細胞)の割合を条件ごとに割り出した。各濃度の生細胞数をDMSOコントロールに標準化(100%と見なす)して治療後に残った生細胞の割合を計算し、GraphPad Prism 7.03を用いてグラフに描いた。GraphPad Prism 7.03でlog(阻害剤)対標準化反応-可変傾斜分析を用いて非線形回帰曲線あてはめを行うことにより、IC50(50%阻害濃度)およびEmax(達成された最大効力)値を次に計算した。GraphPad Prism 7.03で曲線下面積分析を行うことにより、曲線下面積(AUC)を計算した。同様に、アポトーシス分析のために、DMSOと比較した、「初期」(アネキシンVポジティブおよびDRAQ7ネガティブ)および「後期」アポトーシス(アネキシンVおよびDRAQ7ポジティブ)細胞ゲートの両方を組み合わせたアポトーシスの割合を、GraphPad Prism 7.03を用いてグラフに描いた。GraphPad Prism 7.03でlog(アゴニスト)対標準化反応-可変傾斜分析を用いて曲線下面積分析および非線形回帰曲線あてはめを行うことにより、アポトーシス曲線由来のAUC、EC50(最大半量のアポトーシス応答を引き起こす化合物の濃度)およびYmax(達成されたアポトーシスの最大割合)値を計算した。
血液学的細胞株のパネルに対する用量反応増殖曲線および非線形曲線適合回帰を用いて、生細胞パーセントに対するIC50、AUCおよびEmax(生存率に対するEmaxは、低用量での100と高用量での0の間で変化し、前記高用量は、全ての生細胞の阻害に対応する)を割出し、用量反応アポトーシス曲線を用いて、アポトーシスパーセントに対するEC50、AUC、およびYmax(アポトーシスに対するYmaxは、低用量での0から、全ての細胞の死に対応する、より高用量での100まで様々である)を割り出した。腫瘍細胞を化合物1の段階希釈物(0.00015から10μM)またはジメチルスルホキシド(DMSO)コントロールに5日間さらした。アネキシンV/7-アミノアクチノマイシンD(7-AAD)フローサイトメトリーにより、全ての細胞株に対する生存率およびアポトーシスを割り出した。以下の表に示すように、化合物1は、実験したほとんど全ての血液学的細胞株において、抗増殖活性および/またはアポトーシス効果を有することが分かった。
AUC=曲線下面積;IC50=50%阻害濃度(μM);Emax=残存腫瘍細胞の割合として表される、達成された、腫瘍細胞排除の最大効力;EC50=最大半量のアポトーシス応答を引き起こす化合物濃度(μM);Ymax=化合物1の最大濃度における、計算されたコントロールのパーセント
3.分析方法
典型的な測定条件を以下に提供する:
典型的な測定条件を以下に提供する:
粉末X線回折(XRPD)
Rigaku Smart-Lab X線回折システムを、線源X線ビームを用いる反射Bragg-Brentano型に設定した。X線源は、Cu微小焦点X線管(Long Fine Focus tube)であり、40kvおよび44maで操作した。そのX線源は、試料に対して、高角度での狭い線から低角度での幅広い矩形へと変化する入射ビームプロファイルを提供する。ビーム整形スリットをX線線源上で使用し、最大ビームサイズが、X線に沿っておよびX線に垂直の両方向で10mm未満であることを確実にする。Bragg-Brentano型は、試料それ自体が集光光学素子として機能しながら、受動発散スリットおよび受光スリットにより制御される、平行集中型である。Bragg-Brentano型の固有の分解能は、回折計半径および使用する受光スリットの幅により一部決定される。通常、Rigaku Smart-Labは、ピーク幅が0.1°2θ以下になるように操作される。X線ビームの軸方向の発散は、入射および回折の両方のビーム経路中にある5.0度ソーラースリットにより制御される。
Rigaku Smart-Lab X線回折システムを、線源X線ビームを用いる反射Bragg-Brentano型に設定した。X線源は、Cu微小焦点X線管(Long Fine Focus tube)であり、40kvおよび44maで操作した。そのX線源は、試料に対して、高角度での狭い線から低角度での幅広い矩形へと変化する入射ビームプロファイルを提供する。ビーム整形スリットをX線線源上で使用し、最大ビームサイズが、X線に沿っておよびX線に垂直の両方向で10mm未満であることを確実にする。Bragg-Brentano型は、試料それ自体が集光光学素子として機能しながら、受動発散スリットおよび受光スリットにより制御される、平行集中型である。Bragg-Brentano型の固有の分解能は、回折計半径および使用する受光スリットの幅により一部決定される。通常、Rigaku Smart-Labは、ピーク幅が0.1°2θ以下になるように操作される。X線ビームの軸方向の発散は、入射および回折の両方のビーム経路中にある5.0度ソーラースリットにより制御される。
軽く手で押して粉末試料を低バックグラウンドのSiホルダー中に調製し、試料表面を平坦かつ試料ホルダーの基準面と同じ高さに保った。0.02°2θの有効なステップ幅で6°2θ毎分の連続走査を用いて、それぞれの試料を2から40°2θまでの範囲で分析した。
示差走査熱量測定(DSC)
TA Instruments社製のQ2000装置を用いてDSC分析を実行した。インジウムを用いて装置の温度較正を行った。それぞれの分析の間中、DSCセルを約50mL毎分の窒素パージ下に保ち続けた。標準的なクリンプアルミニウムパンの中に試料を入れ、10℃毎分の速さで、25℃から350℃まで加熱した。
TA Instruments社製のQ2000装置を用いてDSC分析を実行した。インジウムを用いて装置の温度較正を行った。それぞれの分析の間中、DSCセルを約50mL毎分の窒素パージ下に保ち続けた。標準的なクリンプアルミニウムパンの中に試料を入れ、10℃毎分の速さで、25℃から350℃まで加熱した。
熱重量(TG)分析
TA Instruments社製のQ50装置を用いてTG分析を実行した。M級分銅を用いて機器のバランスを較正し、アルメルを用いて温度較正を行った。窒素パージは、バランス時には約40mL毎分であり、加熱炉では約60mL毎分であった。事前に風袋重量を量った白金製パンの中にそれぞれの試料を入れ、10℃毎分の速さで、20℃から350℃まで加熱した。
TA Instruments社製のQ50装置を用いてTG分析を実行した。M級分銅を用いて機器のバランスを較正し、アルメルを用いて温度較正を行った。窒素パージは、バランス時には約40mL毎分であり、加熱炉では約60mL毎分であった。事前に風袋重量を量った白金製パンの中にそれぞれの試料を入れ、10℃毎分の速さで、20℃から350℃まで加熱した。
赤外線(IR)分光法
Nicolet 6700 FT-IRシステムでIRスペクトルを得た。Nicolet SMART iTR減衰全反射装置を用いて試料を分析した。
Nicolet 6700 FT-IRシステムでIRスペクトルを得た。Nicolet SMART iTR減衰全反射装置を用いて試料を分析した。
ラマン分光法
Nexus社製のラマンアクセサリモジュールに接続したNicolet 6700型分光計でフーリエ変換(FT)ラマンスペクトルを得た。この装置は、1024nmで作動するNd:YAGレーザー、CaF2ビームスプリッター、およびヒ化インジウムガリウム検出器で構成される。データ収集の制御およびスペクトルの処理のためにOMNICソフトウェアを使用した。分析用3インチガラス製NMRチューブに試料を詰めた。
Nexus社製のラマンアクセサリモジュールに接続したNicolet 6700型分光計でフーリエ変換(FT)ラマンスペクトルを得た。この装置は、1024nmで作動するNd:YAGレーザー、CaF2ビームスプリッター、およびヒ化インジウムガリウム検出器で構成される。データ収集の制御およびスペクトルの処理のためにOMNICソフトウェアを使用した。分析用3インチガラス製NMRチューブに試料を詰めた。
核磁気共鳴(NMR)分光法
パデュー大学の化学学部にあるBruker社製のDRX-500型分光計で1H NMRスペクトルを得た。物質をDMSO-d6中に溶解させることにより試料を調製した。溶液をろ過し、次のスペクトル獲得のために、試料をそれぞれの5mmNMRチューブの中に入れた。DRX-500で得られた、温度制御された(298K)1H NMRスペクトルは、499.89MHzの観測周波数で作動する5mmクライオプローブを利用した。
パデュー大学の化学学部にあるBruker社製のDRX-500型分光計で1H NMRスペクトルを得た。物質をDMSO-d6中に溶解させることにより試料を調製した。溶液をろ過し、次のスペクトル獲得のために、試料をそれぞれの5mmNMRチューブの中に入れた。DRX-500で得られた、温度制御された(298K)1H NMRスペクトルは、499.89MHzの観測周波数で作動する5mmクライオプローブを利用した。
DVS分析
DVS Advantage(Surface Measurement Systems社)を用いて動的水蒸気吸着(DVS)を測定した。等温線下(25℃)で、0から95%にわたるフルサイクルの標的RHで、試料をステップモードで分析した。等温線試験のために、水槽でチャンバー温度を25.0±1.0℃の一定温度に維持する。湿った窒素および乾燥した窒素の異なる流れを可変流量で混合することにより、試料チャンバー中の相対湿度を発生させる。10%のRH増加で分析を行った。サンプリングレートは1秒、データ保存レートは20秒である。dm/dtウィンドウは5分、最小安定性持続時間は10分、および最大ステージ時間は180分に、dm/dt(%)値は0.001に設定した。それぞれのRHに対応する試料の平衡重量を記録した。RHに対して平衡含水率をプロットすることにより収着等温線を得た。
DVS Advantage(Surface Measurement Systems社)を用いて動的水蒸気吸着(DVS)を測定した。等温線下(25℃)で、0から95%にわたるフルサイクルの標的RHで、試料をステップモードで分析した。等温線試験のために、水槽でチャンバー温度を25.0±1.0℃の一定温度に維持する。湿った窒素および乾燥した窒素の異なる流れを可変流量で混合することにより、試料チャンバー中の相対湿度を発生させる。10%のRH増加で分析を行った。サンプリングレートは1秒、データ保存レートは20秒である。dm/dtウィンドウは5分、最小安定性持続時間は10分、および最大ステージ時間は180分に、dm/dt(%)値は0.001に設定した。それぞれのRHに対応する試料の平衡重量を記録した。RHに対して平衡含水率をプロットすることにより収着等温線を得た。
4.遊離塩基多形スクリーニング
一群の化合物1遊離塩基出発物質の特性を明らかにした。XRPDにより非晶質であることが示された。TGAでは、200℃未満で7.3%の重量減少を示した。DSCでは、150℃未満でいくつかの小さな吸熱を示した。非晶質化合物1遊離塩基の代表的なXRPDパターンを図20に示す。
一群の化合物1遊離塩基出発物質の特性を明らかにした。XRPDにより非晶質であることが示された。TGAでは、200℃未満で7.3%の重量減少を示した。DSCでは、150℃未満でいくつかの小さな吸熱を示した。非晶質化合物1遊離塩基の代表的なXRPDパターンを図20に示す。
結晶性物質を生み出すために、様々な条件下で、化合物1遊離塩基出発物質を様々な溶媒と混合した。結果を以下の表に示す。
a.AS=反溶媒;E=蒸発;NC=非結晶化;RT=室温
b.NC=非結晶性,LC=低結晶化度,pk=ピーク
b.NC=非結晶性,LC=低結晶化度,pk=ピーク
2つの特有のXRPDパターンを、それぞれ、化合物1の遊離塩基のフォームAおよびフォームBと同定し、命名した。XRPD、DSC、TG、およびNMRにより、前記2つの型を分析した。データを以下の表に要約する。
5.塩スクリーニングナンバー1
結晶塩を生み出すために、様々な条件下で、化合物1遊離塩基出発物質を様々な対イオンと混合した。およそ15の異なる対イオンを塩スクリーンに使用したが、結果を以下の表に示す。
a.AS=反溶媒;P=沈殿;RT=室温;S/AS=溶媒/反溶媒;SL=スラリー化;G=粉砕;C=冷却;E=蒸発
b.NC=非結晶性,LC=低結晶化度;pk=ピーク;A,Bなど=型
結晶塩を生み出すために、様々な条件下で、化合物1遊離塩基出発物質を様々な対イオンと混合した。およそ15の異なる対イオンを塩スクリーンに使用したが、結果を以下の表に示す。
b.NC=非結晶性,LC=低結晶化度;pk=ピーク;A,Bなど=型
いくつかの物質は、新たな相形成を示唆するXRPDパターンを示すことが同定された。すなわち、前記パターンは、化合物1遊離塩基または使用した酸のどちらにも起因しないピークを含む。それらの実験で使用した酸は、フマル酸、塩酸、マレイン酸、およびp-トルエンスルホン酸である。
6.塩スクリーニングナンバー2
XRRD、TGA、DSC、およびDVSにより、一群の化合物1遊離塩基の特性を明らかにした。XRPDにより非晶質であることが確認された。TGAでは、分解前に200℃未満で数段階の重量減少を示した。動的水蒸気吸着(DVS)実験の結果は、化合物1非晶質遊離塩基が、75%未満のRHにおいて相対的に高い吸湿性を示すことを明らかにした。前記遊離塩基は、乾燥状態から最大90%RHに至るまでに、ゆっくりと着実に水分(~6.0% wt)を取り込んだ。脱着の間、90%RHから乾燥状態(0%RH)に至るまでに、含水率はゆっくりと減少した。収着/脱着は、2つのフルサイクルを通して、ほとんど可逆的であった。
XRRD、TGA、DSC、およびDVSにより、一群の化合物1遊離塩基の特性を明らかにした。XRPDにより非晶質であることが確認された。TGAでは、分解前に200℃未満で数段階の重量減少を示した。動的水蒸気吸着(DVS)実験の結果は、化合物1非晶質遊離塩基が、75%未満のRHにおいて相対的に高い吸湿性を示すことを明らかにした。前記遊離塩基は、乾燥状態から最大90%RHに至るまでに、ゆっくりと着実に水分(~6.0% wt)を取り込んだ。脱着の間、90%RHから乾燥状態(0%RH)に至るまでに、含水率はゆっくりと減少した。収着/脱着は、2つのフルサイクルを通して、ほとんど可逆的であった。
HCl塩
異なる溶媒に添加した塩酸を用いて、化合物1の結晶性HCl塩を探すためにいくつか実験を行った。
異なる溶媒に添加した塩酸を用いて、化合物1の結晶性HCl塩を探すためにいくつか実験を行った。
一つの実験において、49.2mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1.0mLのEtOAcを添加した。前記混合物はほとんど透明な溶液になり、その後0.8mLのEtOAc中0.1N HClを添加した。濁った懸濁液が観察され、その後、0.2mLの水中0.1N HClを添加した。ゆっくりと蒸発させるために、前記懸濁液をヒュームフードの中に置いた。固体が壁に張り付いた。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、10.5mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのEtOAcを添加した後、0.2mLのEtOAc中0.1N HClを添加した。前記混合物は濁っていた。ゆっくりと蒸発させるために、前記懸濁液をヒュームフードの中に置いた。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、16.6mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのEtOAcを添加した後、0.05mLの水、および0.345mLのEtOAc中0.1N HClを添加した。前記混合物は濁っていた。ゆっくりと蒸発させるために、前記懸濁液をヒュームフードの中に置くと、結晶性凝集体が生じた。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、25.6mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのアセトンを添加した後、0.45mLのアセトン中0.1N HClを添加すると、前記混合物は濁っていた。さらに、0.07mLの水中0.1N HClを添加した。前記混合物は透明な溶液になった。ゆっくりと蒸発させるために、前記溶液をヒュームフードの中に置いた。種懸濁液を導入すると沈殿が観察された。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、26.1mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのアセトンおよび0.07mLの水中0.1N HClを添加した後、0.45mLのアセトン中0.1N HClを添加した。前記混合物は透明な溶液であった。ゆっくりと蒸発させるために、前記溶液をヒュームフードの中に置くと、バイアル壁面のあちこちに、壁面と液体との間にある液体/気体界面の真上に結晶が成長した。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、44.2mgの化合物1遊離塩基を4mLガラスバイアル中で量り、2mLのEtOAcを添加した後、0.9mLのEtOAc中0.1N HClを添加した。前記混合物は濁っていた。ゆっくりと蒸発させるために、前記懸濁液をヒュームフードの中に置くと、結晶性凝集体が生じた。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定し、TGAおよびDSCにより、さらに特性を明らかにした。TGAプロファイルは、分解までの加熱で多段階の重量減少:100℃未満までに1.8%、100から200℃までに2.1%、および融点前後に1.5%を示した。DSCスペクトルは、相対的に低い温度(<100℃)での幅広い吸熱ピークを示し、固体の融解とそれに続くおそらく分解に起因する発熱ピークのため、204.9℃および213.0℃のそれぞれ開始温度およびピーク温度を伴う小さな吸熱ピークを示した。動的水蒸気吸着(DVS)プロファイルは、前記固体が、90%未満のRHにおいて中程度の吸湿性であることを示した。前記HCl塩は、乾燥状態から最大90%RHに至るまでに、ゆっくりと着実に水分(~2.9% wt)を取り込んだ。脱着の間、90から乾燥状態の0%RHに至るまでに、含水率はゆっくりと減少した。収着/脱着は、2つのフルサイクルを通して、ほとんど可逆的であった。NMRでは、塩の形成および微量の残留溶媒に起因するケミカルシフトを示した。
一つの実験において、53.9mgの化合物1遊離塩基を4mLガラスバイアル中で量り、2mLのEtOAcを添加した後、100μLの水中0.1N HCl、および1.0mLのEtOAc中0.1N HClを添加した。前記混合物は、粘着性の懸濁液であった。ゆっくりと蒸発させるために、前記懸濁液をヒュームフードの中に置くと、結晶性凝集体が生じた。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、26.5mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのアセトンを添加し、その後0.52mLのアセトン中0.1N HClを添加した。前記混合物は、透明な溶液のままであった。ゆっくりと蒸発させるために、前記溶液をヒュームフードの中に置くと、溶液中および底面上に結晶が成長した。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、26.2mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのEtOAcを最初に添加し、その後0.02mLの水を添加し、次に0.52mLのEtOAc中0.1N HClを添加した。前記混合物は濁った。XRPDにより前記固体粒子を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。それは、真空オーブン中で、35℃で乾燥させた後も同じ結晶型のままであった。
一つの実験において、上記のいくつかの実験から生成された固体粒子を4mLガラスバイアルの中に一緒に入れ、その後1mLの水を添加した。前記懸濁液をカバーし、平衡にするために、1週間にわたって室温で置いた。スラリー化後の前記固形体は、フォームAのままであり、その後TGA、DSC、およびDVSにより特性を明らかにした。TGAプロファイルは、分解までの加熱で多段階の重量減少、100℃未満までに0.7%、および融点前後に3.9%を示した。DSCスペクトルは、固体の融解とそれに続くおそらく分解に起因する発熱ピークのため、196.4℃および212.6℃のそれぞれ開始温度およびピーク温度を伴う幅広い吸熱ピークを示した。DVSプロファイルは、上述した以前の実験(44.2mgスケール)に由来する試料に類似していた。
一つの実験において、26.2mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのMEKを添加し、その後0.02mLの水中0.1N HClを添加した。前記混合物は透明な溶液になり、その後0.49mLのMEK中0.105N HClを添加した。前記混合物は直ちに濁った。XRPDにより前記固体粒子を分析し、TGAおよびDSCによっても前記固体試料を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。
一つの実験において、26.2mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのMEKを添加し、その後0.49mLのMEK中0.105N HClを添加した。前記混合物は透明な溶液になり、その後0.02mLの水中0.1N HClを添加した。前記混合物は直ちに濁った。XRPDにより前記固体粒子を分析し、TGAおよびDSCによっても前記固体試料を分析し、結晶性物質、すなわち化合物1の塩酸塩のフォームAであると決定した。TGAプロファイルは、分解までの加熱で多段階の重量減少、100℃未満までに0.8%、および融点前後に3.7%を示した。DSCスペクトルは、固体の融解とそれに続くおそらく分解に起因する発熱ピークのため、219.7℃および233.8℃のそれぞれ開始温度およびピーク温度を伴う幅広い吸熱ピークを示した。
一つの実験において、1.07gの化合物1遊離塩基をガラスビーカー中で量り、25mLのEtOAcを添加した後、20mLのEtOAc中0.1N HClを添加した。前記混合物は濁っていた。ゆっくりと蒸発させるために、前記懸濁液をヒュームフードの中に置いた。最初の固体は、XRPDにより非晶質であり、さらに1時間スラリー化すると、それは化合物1の塩酸塩の結晶性フォームAとなった。試料を真空オーブン中で終夜乾燥させ、その後水中で再スラリー化すると、最終生成物は、化合物1の塩酸塩のフォームAであった。
一つの実験において、0.455gの化合物1遊離塩基をガラスビーカー中で量り、5mLのMEKを添加した後、9.0mLのMEK中0.1N HClを添加した。前記混合物は濁っていた。ゆっくりと蒸発させるために、前記懸濁液をヒュームフードの中に置いた。最初の固体は、XRPDにより結晶性フォームAであった。
特定の理論に限定されるものではないが、これらの実験における、フォームAで観察される融点の開始およびピーク温度の変動は、結晶化度、結晶欠陥、および非晶質の含有率などの因子に起因する。
2XHCl塩
一つの実験において、45.5mgの化合物1遊離塩基を4mLガラスバイアル中で量り、0.9mLのアセトンを添加した。前記混合物は、透明になり、その後1.8mLのアセトン中0.1N HClを導入した。前記混合物は、透明な溶液のままであった。ゆっくりと蒸発させるために、前記溶液をヒュームフードの中に置くと、溶液中および底面上に結晶が成長した。この実験から得た固形体のXRPD(図21)は、モノ塩酸塩フォームAとは異なり、化合物1の塩酸塩のフォームCと命名する。前記固体は、TGA、DSC、およびDVSの異なるプロファイルも示した。TGAプロファイルは、分解までの加熱で多段階の重量減少:100℃未満までに3.8%および100から200℃までにさらに4.0%を示した。DSCスペクトルは、相対的に低い温度(<125℃)での幅広い吸熱イベントを示し、固体の融解とそれに続くおそらく分解に起因する発熱ピークのため、138.0℃および151.6℃のそれぞれ開始温度およびピーク温度を伴うさらなる吸熱ピークを示した。動的水蒸気吸着(DVS)プロファイルは、前記固体が、90%未満のRHにおいて高い吸湿性を有することを示した。前記固体試料は、乾燥状態から最大80%RHに至るまでに、ゆっくりと着実に水分(~8.0% wt)を取り込んだ後、80%RHから90%RHに至るまでに、急速に取り込んだ(~6.7%)。脱着の間、90から80%RHに至るまでに、含水率は急速に減少し(~7.0%)、その後、残りの水分は、相対湿度が乾燥状態(0%RH)まで減少する間に、着実に取り除かれた。
一つの実験において、45.5mgの化合物1遊離塩基を4mLガラスバイアル中で量り、0.9mLのアセトンを添加した。前記混合物は、透明になり、その後1.8mLのアセトン中0.1N HClを導入した。前記混合物は、透明な溶液のままであった。ゆっくりと蒸発させるために、前記溶液をヒュームフードの中に置くと、溶液中および底面上に結晶が成長した。この実験から得た固形体のXRPD(図21)は、モノ塩酸塩フォームAとは異なり、化合物1の塩酸塩のフォームCと命名する。前記固体は、TGA、DSC、およびDVSの異なるプロファイルも示した。TGAプロファイルは、分解までの加熱で多段階の重量減少:100℃未満までに3.8%および100から200℃までにさらに4.0%を示した。DSCスペクトルは、相対的に低い温度(<125℃)での幅広い吸熱イベントを示し、固体の融解とそれに続くおそらく分解に起因する発熱ピークのため、138.0℃および151.6℃のそれぞれ開始温度およびピーク温度を伴うさらなる吸熱ピークを示した。動的水蒸気吸着(DVS)プロファイルは、前記固体が、90%未満のRHにおいて高い吸湿性を有することを示した。前記固体試料は、乾燥状態から最大80%RHに至るまでに、ゆっくりと着実に水分(~8.0% wt)を取り込んだ後、80%RHから90%RHに至るまでに、急速に取り込んだ(~6.7%)。脱着の間、90から80%RHに至るまでに、含水率は急速に減少し(~7.0%)、その後、残りの水分は、相対湿度が乾燥状態(0%RH)まで減少する間に、着実に取り除かれた。
ベシル酸塩
一つの実験において、24.3mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのMEKを添加した。前記混合物は透明な溶液になり、0.5mLのMEK中0.1Nベンゼンスルホン酸を添加した。直ちに沈殿が観察された。結晶性物質すなわち化合物1のベシル酸塩のフォームAを顕微鏡で観察し、XRPDにより確認した。
一つの実験において、24.3mgの化合物1遊離塩基を4mLガラスバイアル中で量り、1mLのMEKを添加した。前記混合物は透明な溶液になり、0.5mLのMEK中0.1Nベンゼンスルホン酸を添加した。直ちに沈殿が観察された。結晶性物質すなわち化合物1のベシル酸塩のフォームAを顕微鏡で観察し、XRPDにより確認した。
一つの実験において、255.3mgの化合物1遊離塩基を4mLガラスバイアル中で量り、5mLのアセトンを添加した。前記混合物は透明な溶液になり、次に5.0mLのMEK中0.1Nベンゼンスルホン酸を添加した。直ちに沈殿が起こった。結晶性物質を顕微鏡で観察し、XRPD(図17)により確認した。TGAおよびDSCの両方を用いる熱分析によっても、前記固体の特性を明らかにした。TGAプロファイル(図18)は、最大150℃に至るまでの加熱で、重量減少が非常に小さい(0.25%)ことを示した。DSCスペクトル(図19)は、固体の融解に起因する、それぞれ、164.5℃および175.4℃の開始およびピーク温度を伴う吸熱ピークを示した。
7.化合物1の塩酸塩の調製および多形スクリーニング
3つの実験で、化合物1の遊離塩基から化合物1の塩酸塩を調製した。最初に、2つのスモールスケール実験(0.1gスケール)を行った(1日間アセトン中でスラリー化および1日間THF中でスラリー化)。両実験からの生成物が塩酸塩多形フォームAであることを確認した。化学量論比を割り出すために、両方の試料で、炭素、水素、窒素、および塩化物含有量を分析した。元素データ(図示せず)は、1:1 API:酸性塩と一致した。10gスケール(2日間アセトン中でスラリー化)で塩酸塩を次に作成し、さらに特性を明らかにした。特性評価データを以下の表に要約する。
a.1:1塩の理論値
3つの実験で、化合物1の遊離塩基から化合物1の塩酸塩を調製した。最初に、2つのスモールスケール実験(0.1gスケール)を行った(1日間アセトン中でスラリー化および1日間THF中でスラリー化)。両実験からの生成物が塩酸塩多形フォームAであることを確認した。化学量論比を割り出すために、両方の試料で、炭素、水素、窒素、および塩化物含有量を分析した。元素データ(図示せず)は、1:1 API:酸性塩と一致した。10gスケール(2日間アセトン中でスラリー化)で塩酸塩を次に作成し、さらに特性を明らかにした。特性評価データを以下の表に要約する。
多形を生み出すために、様々な条件下で、化合物1HCl塩固体を様々な溶媒と混合した。結果を以下の表に示す。この実験では、ただ一つの多形(化合物1HCl塩のフォームA)が同定された。
a.AS=反溶媒;NC=非結晶化;RH=相対湿度;RT=室温;E=蒸発
b.NC=非結晶性;pks=ピーク;A,Bなど=型
b.NC=非結晶性;pks=ピーク;A,Bなど=型
8.化合物1のフマル酸塩の調製および多形スクリーニング
一つの研究において、アセトンおよびヘキサンを要する沈殿実験から化合物1のフマル酸塩のフォームAを調製した。前記固体は5時間以内に結晶化し、2日間室温で攪拌させた。
一つの研究において、アセトンおよびヘキサンを要する沈殿実験から化合物1のフマル酸塩のフォームAを調製した。前記固体は5時間以内に結晶化し、2日間室温で攪拌させた。
もう一つの研究において、いくつかの実験で、化合物1の遊離塩基から化合物1のフマル酸塩を調製した。最初に、いくつかのスモールスケール実験を行った。環境温度で実行したスラリー化(250mgスケール、1日間室温で、アセトニトリル中でスラリー化、または6日間室温で、アセトニトリル中でスラリー化)により低結晶性物質を得た。スラリー化温度の上昇により高結晶性物質を得、生成物がフマル酸塩多形フォームAであることを確認した(30mgスケール、1日間50℃で、アセトニトリル中でスラリー化)。前記実験をラージスケール(3.2gスケール、3日間50℃で、アセトニトリル中でスラリー化)で繰り返し、結果として生じた物質の特性をさらに明らかにした。特性評価データを以下の表に要約する。
多形を生み出すために、様々な条件下で、化合物1フマル酸塩固体を様々な溶媒と混合した。結果を以下の表に示す。この実験では、ただ一つの多形(化合物1フマル酸塩のフォームA)が同定された。
a.AS=反溶媒;E=蒸発;NC=非結晶化;RH=相対湿度;RT=室温
b.NC=非結晶性;pks=ピーク;A,Bなど=型
b.NC=非結晶性;pks=ピーク;A,Bなど=型
9.化合物1のトシル酸塩の調製および多形スクリーニング
一つの研究において、アセトンおよびヘキサンを要する沈殿実験から化合物1のトシル酸塩のフォームAを調製した。前記固体は5時間以内に結晶化し、2日間室温で攪拌させた。
一つの研究において、アセトンおよびヘキサンを要する沈殿実験から化合物1のトシル酸塩のフォームAを調製した。前記固体は5時間以内に結晶化し、2日間室温で攪拌させた。
もう一つの研究において、いくつかの実験で、化合物1の遊離塩基から化合物1のトシル酸塩を調製した。最初に、一つのスモールスケール実験を行った(250mgスケール、1日間室温で、アセトニトリル中でスラリー化)。生成物がトシル酸塩多形フォームAであることを確認した。前記実験をラージスケール(3.4gスケール、3日間室温で、アセトニトリル中でスラリー化)で繰り返し、結果として生じた物質の特性をさらに明らかにした。特性評価データを以下の表に要約する。
多形を生み出すために、様々な条件下で、化合物1トシル酸塩固体を様々な溶媒と混合した。結果を以下の表に示す。この実験では、二つの多形が同定された:化合物1のトシル酸塩のフォームA(塩スクリーニングナンバー1由来の同じフォーム)および新たな、化合物1のトシル酸塩のフォームD。フォームDは、一つの実験で、非結晶性物質との混合物として得られたのみであった。トシル酸塩多形フォームA、B、C、およびDのオーバーレイプロットを図22に示す。
a.AS=反溶媒;NC=非結晶化;RH=相対湿度;RT=室温;E=蒸発
b.NC=非結晶性;pks=ピーク;A,Bなど=型
b.NC=非結晶性;pks=ピーク;A,Bなど=型
10.フォームの評価
(a)化合物1の塩酸塩のフォームAの評価
吸湿性:化合物1の塩酸塩のフォームAは、DVS(図7)によって特徴付けられた。それは、非常に低い湿度から水を取り込み始めた。水収着は、約1モルの水に相当する約3.0% w/wの取り込みの間、全ての湿度で着実に(ほとんど直線的に)起こり続けた。前記吸着水は、脱着の段階で放出され、乾燥段階でわずかなヒステリシスが観察された。前記固形体は、DVS後もフォームAのままであった。
(a)化合物1の塩酸塩のフォームAの評価
吸湿性:化合物1の塩酸塩のフォームAは、DVS(図7)によって特徴付けられた。それは、非常に低い湿度から水を取り込み始めた。水収着は、約1モルの水に相当する約3.0% w/wの取り込みの間、全ての湿度で着実に(ほとんど直線的に)起こり続けた。前記吸着水は、脱着の段階で放出され、乾燥段階でわずかなヒステリシスが観察された。前記固形体は、DVS後もフォームAのままであった。
せん断感受性:化合物1の塩酸塩のフォームAを700および1100ポンドで1分間圧迫し、XRPDにより分析した。前記固形体は、わずかに、より幅の広い回折ピークを有するが、同じ状態のままであった。
固体安定性:加速安定性評価プログラム(ASAP)を用いて、化合物1の塩酸塩のフォームAの固体安定性を評価した。強制分解の保存条件は、60-80℃および0-80%RHの間で最大2週間であった。ICH条件下での2回の光ストレス実験も固体で行った。前記固体試料の、化学的およびキラル安定性の両方を分析した。実験の最後に、前記化合物の結晶型をXRPDにより確認した。最も厳しい条件である80℃/70%RHの10日後とコントロールとの間で、結晶型の変化は観察されなかった。安定性実験の結果を以下の表に要約する。
80℃/0%RH条件の1週間および2週間後を除き、アッセイにおける有意な変化(<5%)は観察されなかった。80℃/0%RHのアッセイにおける純度の減少は、遊離塩基+HClに相当する分子量を有する分解生成物の成長に起因した。他の条件下のアッセイおよび分解生成物に関しては、化合物1塩酸塩は安定のままであった。光安定性条件下のアッセイにおける変化は、<4%であった。さらに、全条件にわたって、キラル純度における有意な変化は観察されず、高湿度条件下で0.2%の最大変化が観察された。これらのASAP安定性の結果は、化合物1の塩酸塩のフォームAが安定であると見なしてよいということを裏付けた。
晶癖:化合物1の塩酸塩のフォームAのSEM画像は、小桿状体一次粒子および凝集体を示す(図8)。
長期固体安定性:化合物1の塩酸塩のフォームA(HDPE容器の中に二重のLDPE袋で包装)最大3ヶ月間、25℃/60%RH、30℃/65%RH、および40℃/75%RHの保存条件で保管した。以下の表に示す安定性データは、25℃/60%RH、30℃/65%RHおよび40℃/75%RHの条件で3ヶ月間保管した化合物1の塩酸塩のフォームAの安定性を示す。したがって、25℃以下で保管する場合、12ヶ月間の再試験が提案される。
1.黄色粉末
2.フォームAと一致する
2.フォームAと一致する
(b)化合物1の他の型の評価
化合物1遊離塩基非晶質、トシル酸塩フォームA、ベシル酸塩フォームA、およびフマル酸塩フォームA(並びにHClフォームA)の固体安定性をストレス保存条件下で評価した。前記固体試料の、化学的およびキラル安定性の両方を分析した。実験の最後に、化合物1の結晶型をXRPDにより確認した。安定性実験の結果を以下の表に要約する。
化合物1遊離塩基非晶質、トシル酸塩フォームA、ベシル酸塩フォームA、およびフマル酸塩フォームA(並びにHClフォームA)の固体安定性をストレス保存条件下で評価した。前記固体試料の、化学的およびキラル安定性の両方を分析した。実験の最後に、化合物1の結晶型をXRPDにより確認した。安定性実験の結果を以下の表に要約する。
いくつかの溶媒における、化合物1遊離塩基非晶質、HClフォームA、フマル酸塩フォームA、およびトシル酸塩フォームAの溶解度を推定した。秤量した固体の一部にアリコートの試験溶媒を添加することにより実験を行った。溶解が起こったかどうかは、それぞれの溶媒アリコートの添加後、目視検査により判断した。試料を溶解するのに使用した総溶媒量を試料の重量で除することにより、溶解度数を算出した。多すぎる溶媒アリコートを使用したため、または溶解速度が遅いために、実際の溶解度は算出した数値よりも大きいことがある。溶解度数は、溶解が実験中に起こらなかった場合、「未満」として表される。溶解度数は、溶解が最初の溶媒アリコートの添加で起こった場合、「以上」として表される。結果を以下の表に示す。
本明細書で提供される実施形態は、提供される実施形態のいくつかの態様の説明として意図される、実施例で提供される特定の実施形態よって範囲が制限されるものではなく、機能的に同等な任意の実施形態は、本開示によって包含されるものである。実際、本明細書で提供される実施形態の様々な修正は、当業者にとって明らかとなるであろう、本明細書に示されるおよび記載されるものに加えて、添付の請求項の範囲内に含まれるよう意図される。
多くの参考文献が引用されており、その開示内容は、参照によってその全体が本明細書に組み込まれる。
Claims (47)
- 化合物1の遊離塩基を含む、請求項1に記載の固形体。
- 前記固形体が、およそ4.5、15.3、および18.1°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の遊離塩基のフォームAである、請求項2に記載の固形体。
- 前記XRPDパターンが、およそ13.3および15.9°2θでピークをさらに含む、請求項3に記載の固形体。
- 前記XRPDパターンが、およそ20.1および20.9°2θでピークをさらに含む、請求項4に記載の固形体。
- 前記固形体が、図1に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項3に記載の固形体。
- 前記固形体が、およそ4.8、9.6、および14.9°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の遊離塩基のフォームBである、請求項2に記載の固形体。
- 前記XRPDパターンが、およそ18.7および22.1°2θでピークをさらに含む、請求項7に記載の固形体。
- 前記XRPDパターンが、およそ20.7および21.4°2θでピークをさらに含む、請求項8に記載の固形体。
- 前記固形体が、図3に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項7に記載の固形体。
- 化合物1の塩酸塩を含む、請求項1に記載の固形体。
- 前記固形体が、およそ15.1、16.3、および20.7°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の塩酸塩のフォームAである、請求項11に記載の固形体。
- 前記XRPDパターンが、およそ7.8および22.4°2θでピークをさらに含む、請求項12に記載の固形体。
- 前記XRPDパターンが、およそ18.2、18.9、および24.8°2θでピークをさらに含む、請求項13に記載の固形体。
- 前記固形体が、図5に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項12に記載の固形体。
- およそ17.5、21.6、および24.8°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1の塩酸塩のフォームBである、請求項11に記載の固形体。
- 前記XRPDパターンが、およそ21.1および27.0°2θでピークをさらに含む、請求項16に記載の固形体。
- 前記XRPDパターンが、およそ14.6、17.2、および20.3°2θでピークをさらに含む、請求項17に記載の固形体。
- 前記固形体が、図9に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項16に記載の固形体。
- 化合物1のフマル酸塩を含む、請求項1に記載の固形体。
- 前記固形体が、およそ22.3、23.2、および23.4°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のフマル酸塩のフォームAである、請求項20に記載の固形体。
- 前記XRPDパターンが、およそ17.9および25.8°2θでピークをさらに含む、請求項21に記載の固形体。
- 前記XRPDパターンが、およそ11.7および18.3°2θでピークをさらに含む、請求項22に記載の固形体。
- 前記固形体が、図11に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項21に記載の固形体。
- 化合物1のトシル酸塩を含む、請求項1に記載の固形体。
- 前記固形体が、およそ17.6、18.0、および23.8°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のトシル酸塩のフォームAである、請求項25に記載の固形体。
- 前記XRPDパターンが、およそ15.7および20.6°2θでピークをさらに含む、請求項26に記載の固形体。
- 前記XRPDパターンが、およそ24.7および25.0°2θでピークをさらに含む、請求項27に記載の固形体。
- 前記固形体が、図13に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項26に記載の固形体。
- 化合物1のマレイン酸塩を含む、請求項1に記載の固形体。
- 前記固形体が、およそ17.6、24.4、および26.9°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のマレイン酸塩のフォームAである、請求項30に記載の固形体。
- 前記XRPDパターンが、およそ18.0、18.4および19.3°2θでピークをさらに含む、請求項31に記載の固形体。
- 前記XRPDパターンが、およそ19.8および24.0°2θでピークをさらに含む、請求項32に記載の固形体。
- 前記固形体が、図15に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項31に記載の固形体。
- 化合物1のベシル酸塩を含む、請求項1に記載の固形体。
- 前記固形体が、およそ17.9、18.3、および23.8°2θでピークを含むXRPDパターンによって特徴付けられる、化合物1のベシル酸塩のフォームAである、請求項35に記載の固形体。
- 前記XRPDパターンが、およそ15.7および16.2°2θでピークをさらに含む、請求項36に記載の固形体。
- 前記XRPDパターンが、およそ8.5および16.5°2θでピークをさらに含む、請求項37に記載の固形体。
- 前記固形体が、図17に示すXRPDパターンと一致するXRPDパターンによって特徴付けられる、請求項36に記載の固形体。
- 前記塩が、塩酸塩、フマル酸塩、トシル酸塩、マレイン酸塩、またはベシル酸塩である、請求項40に記載の塩。
- 前記塩が、結晶塩である、請求項40または41に記載の塩。
- 請求項1から39のいずれか1項に記載の固形体または請求項40から42のいずれか1項に記載の塩、および薬学的に許容される賦形剤または担体を含む、医薬組成物。
- 治療的有効量の、請求項1から39のいずれか1項に記載の固形体または請求項40から42のいずれか1項に記載の塩を、治療を必要とする患者に投与することを特徴とする、血液悪性腫瘍の治療方法。
- 前記血液悪性腫瘍が、急性骨髄性白血病(AML)、急性リンパ性白血病(ALL)、多発性骨髄腫(MM)、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、ホジキンリンパ腫(HL)、T細胞リンパ腫(TCL)、バーキットリンパ腫(BL)、慢性リンパ性白血病/小リンパ球性リンパ腫(CLL/SLL)、辺縁帯リンパ腫(MZL)、または骨髄異形成症候群(MDS)である、請求項44に記載の方法。
- 前記方法が、治療的有効量の前記固形体または前記塩を、治療を必要とする患者に投与することを特徴とする、血液悪性腫瘍の治療方法における使用のための、請求項1から39のいずれか1項に記載の固形体または請求項40から42のいずれか1項に記載の塩。
- 前記血液悪性腫瘍が、急性骨髄性白血病(AML)、急性リンパ性白血病(ALL)、多発性骨髄腫(MM)、非ホジキンリンパ腫(NHL)、びまん性大細胞型B細胞リンパ腫(DLBCL)、ホジキンリンパ腫(HL)、T細胞リンパ腫(TCL)、バーキットリンパ腫(BL)、慢性リンパ性白血病/小リンパ球性リンパ腫(CLL/SLL)、辺縁帯リンパ腫(MZL)、または骨髄異形成症候群(MDS)である、請求項46に記載の使用のための固形体または塩。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962923972P | 2019-10-21 | 2019-10-21 | |
| US62/923,972 | 2019-10-21 | ||
| PCT/US2020/056403 WO2021080931A1 (en) | 2019-10-21 | 2020-10-20 | Solid forms comprising (s)-2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindoline-1,3-dioneand salts thereof, and compositions comprising the same and their use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022552879A true JP2022552879A (ja) | 2022-12-20 |
| JPWO2021080931A5 JPWO2021080931A5 (ja) | 2023-10-23 |
Family
ID=73402146
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2022523516A Pending JP2022552879A (ja) | 2019-10-21 | 2020-10-20 | (s)-2-(2,6-ジオキソピペリジン-3-イル)-4-((2-フルオロ-4-((3-モルホリノアゼチジン-1-イル)メチル)ベンジル)アミノ)イソインドリン-1,3-ジオンおよびその塩を含む固形体、並びにそれを含む組成物およびそれを使用する方法 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US11578056B2 (ja) |
| EP (1) | EP4048666A1 (ja) |
| JP (1) | JP2022552879A (ja) |
| KR (1) | KR20220103950A (ja) |
| CN (2) | CN114929686A (ja) |
| AU (1) | AU2020369496A1 (ja) |
| BR (1) | BR112022007580A2 (ja) |
| CA (1) | CA3154956A1 (ja) |
| IL (1) | IL292375A (ja) |
| MX (1) | MX2022004687A (ja) |
| WO (1) | WO2021080931A1 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117425642A (zh) | 2021-06-21 | 2024-01-19 | 新基公司 | (s)-2-(2,6-二氧代哌啶-3-基)-4-((2-氟-4-((3-吗啉代氮杂环丁烷-1-基)甲基)苄基)氨基)异吲哚啉-1,3-二酮的制备方法 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104703978B (zh) * | 2012-08-09 | 2018-05-11 | 细胞基因公司 | 化合物的盐和固体形式及其组合物和使用方法 |
| EA202092248A1 (ru) * | 2018-04-23 | 2021-02-04 | Селджин Корпорейшн | Замещенные соединения 4-аминоизоиндолин-1,3-диона, их композиции и способы лечения ими |
| AR119715A1 (es) * | 2019-04-12 | 2022-01-05 | Celgene Corp | Métodos para tratar linfoma no hodgkin con el uso de 2-(2,6-dioxopiperidin-3-il)-4-((2-fluoro-4-((3-morfolinoazetidin-1-il)metil)bencil)amino)isoindolin-1,3-diona |
-
2020
- 2020-10-20 KR KR1020227016734A patent/KR20220103950A/ko unknown
- 2020-10-20 WO PCT/US2020/056403 patent/WO2021080931A1/en unknown
- 2020-10-20 CN CN202080088837.XA patent/CN114929686A/zh active Pending
- 2020-10-20 IL IL292375A patent/IL292375A/en unknown
- 2020-10-20 EP EP20807188.6A patent/EP4048666A1/en active Pending
- 2020-10-20 AU AU2020369496A patent/AU2020369496A1/en active Pending
- 2020-10-20 BR BR112022007580A patent/BR112022007580A2/pt unknown
- 2020-10-20 CA CA3154956A patent/CA3154956A1/en active Pending
- 2020-10-20 CN CN202211406021.4A patent/CN115677669A/zh active Pending
- 2020-10-20 MX MX2022004687A patent/MX2022004687A/es unknown
- 2020-10-20 JP JP2022523516A patent/JP2022552879A/ja active Pending
- 2020-10-20 US US17/075,359 patent/US11578056B2/en active Active
-
2023
- 2023-01-23 US US18/100,412 patent/US20230339901A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| WO2021080931A1 (en) | 2021-04-29 |
| WO2021080931A8 (en) | 2021-11-25 |
| MX2022004687A (es) | 2022-05-10 |
| KR20220103950A (ko) | 2022-07-25 |
| CN115677669A (zh) | 2023-02-03 |
| CN114929686A (zh) | 2022-08-19 |
| US11578056B2 (en) | 2023-02-14 |
| EP4048666A1 (en) | 2022-08-31 |
| BR112022007580A2 (pt) | 2022-07-05 |
| US20210115019A1 (en) | 2021-04-22 |
| US20230339901A1 (en) | 2023-10-26 |
| AU2020369496A1 (en) | 2022-04-28 |
| IL292375A (en) | 2022-06-01 |
| CA3154956A1 (en) | 2021-04-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6756617B2 (ja) | N−{4−[(6,7−ジメトキシキノリン−4−イル)オキシ]フェニル}−n’−(4−フルオロフェニル)シクロプロパン−1,1−ジカルボキサミドの結晶性固体形態、製造プロセス、及び使用方法 | |
| US11591345B2 (en) | Polymorphs and solid forms of (s)-2-((2-((s)-4-(difluoromethyl)-2-oxooxazolidin-3-yl)-5,6-dihydrobenzo[f]imidazo[1,2-d][1,4]oxazepin-9-yl)amino)propanamide, and methods of production | |
| AU2017203819B2 (en) | Polymorphs of 2-(4-(2-(1-isopropyl-3-methyl-1H-1,2,4-triazol-5-yl)-5,6-dihydrobenzo[f]imidazo[1,2-d][1,4]oxazepin-9-yl)-1H-pyrazol-1-yl)-2-methylpropanamide, methods of production, and pharmaceutical uses thereof | |
| US20230339901A1 (en) | Solid forms comprising (s)-2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindoline-1,3-dione and salts thereof, and compositions comprising and methods of using the same | |
| JP7448541B2 (ja) | 選択的エストロゲン受容体分解剤の新規な塩 | |
| EP3453384B1 (en) | Pharmaceutical tablet composition comprising bilastine | |
| BR112014025586B1 (pt) | Forma cristalina de (s)-4-amino-n-(1-(4-clorofenil)-3-hidroxipropil)-1-(7h-pirrolo[2,3-d] pirimidin4-il)piperidina-4-carboxamida, composições farmacêuticas compreendendo a mesma, seu uso e comprimido farmacêutico compreendendo a mesma | |
| KR20200140821A (ko) | 아베마시클립의 고체-상태 형태, 그의 용도 및 제조 | |
| EP3470062B1 (en) | Pharmaceutical tablet composition comprising bilastine polymorphic form 3 and magnesium aluminometasilicate | |
| EA046479B1 (ru) | Твердые формы, содержащие (s)-2-(2,6-диоксопиперидин-3-ил)-4-((2-фтор-4-((3-морфолиноазетидин-1-ил)метил)бензил)амино)изоиндолин-1,3-дион и его соли, композиции, содержащие их, и способы их применения | |
| EP3587421A1 (en) | Crystalline forms of (s)-4-(8-amino-3-(1-(but-2-ynoyl)pyrrolidin-2-yl)imidazo[1,5-alpha]pyrazin-1-yl-n-(pyridin-2-yl)benzamide | |
| US11504378B2 (en) | Pharmaceutical compositions comprising (S)-2-(2,6-dioxopiperidin-3-yl)-4-((2-fluoro-4-((3-morpholinoazetidin-1-yl)methyl)benzyl)amino)isoindoline-1,3-dione and methods of using the same | |
| TW201125861A (en) | CDC7 inhibitor salts | |
| EA047421B1 (ru) | Фармацевтические композиции, содержащие (s)-2-(2,6-диоксопиперидин-3-ил)-4-((2-фтор-4-((3-морфолиноазетидин-1-ил)метил)бензил)амино)изоиндолин-1,3-дион, и способы их применения |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20231013 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20231013 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20240903 |