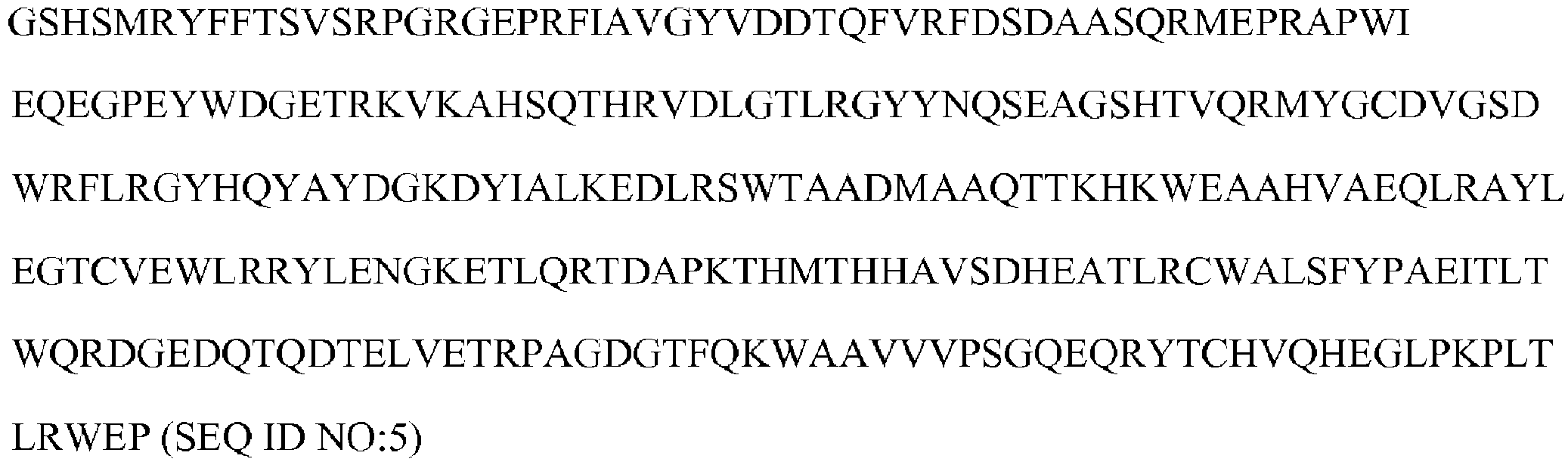JP2022046544A - synTacポリペプチド及びその使用 - Google Patents
synTacポリペプチド及びその使用 Download PDFInfo
- Publication number
- JP2022046544A JP2022046544A JP2021202405A JP2021202405A JP2022046544A JP 2022046544 A JP2022046544 A JP 2022046544A JP 2021202405 A JP2021202405 A JP 2021202405A JP 2021202405 A JP2021202405 A JP 2021202405A JP 2022046544 A JP2022046544 A JP 2022046544A
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- mhc
- cases
- terminal
- multimeric
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 1580
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 1479
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 1469
- 108700018351 Major Histocompatibility Complex Proteins 0.000 claims abstract description 287
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 claims abstract description 283
- 210000001744 T-lymphocyte Anatomy 0.000 claims abstract description 235
- 230000002519 immonomodulatory effect Effects 0.000 claims abstract description 125
- 238000000034 method Methods 0.000 claims abstract description 82
- 108060003951 Immunoglobulin Proteins 0.000 claims abstract description 53
- 102000018358 immunoglobulin Human genes 0.000 claims abstract description 53
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 22
- 239000000203 mixture Substances 0.000 claims abstract description 21
- 210000004899 c-terminal region Anatomy 0.000 claims description 108
- 150000007523 nucleic acids Chemical class 0.000 claims description 102
- 210000004027 cell Anatomy 0.000 claims description 97
- 102000039446 nucleic acids Human genes 0.000 claims description 91
- 108020004707 nucleic acids Proteins 0.000 claims description 91
- 230000001105 regulatory effect Effects 0.000 claims description 81
- 102000043129 MHC class I family Human genes 0.000 claims description 76
- 108091054437 MHC class I family Proteins 0.000 claims description 76
- 108010081355 beta 2-Microglobulin Proteins 0.000 claims description 34
- 230000000694 effects Effects 0.000 claims description 34
- 102100032101 Tumor necrosis factor ligand superfamily member 9 Human genes 0.000 claims description 32
- 108010082808 4-1BB Ligand Proteins 0.000 claims description 31
- 108091054438 MHC class II family Proteins 0.000 claims description 31
- 102000043131 MHC class II family Human genes 0.000 claims description 31
- 230000027455 binding Effects 0.000 claims description 31
- 238000006467 substitution reaction Methods 0.000 claims description 30
- 239000002773 nucleotide Substances 0.000 claims description 29
- 125000003729 nucleotide group Chemical group 0.000 claims description 29
- 239000013604 expression vector Substances 0.000 claims description 26
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 25
- 238000011282 treatment Methods 0.000 claims description 23
- 238000003259 recombinant expression Methods 0.000 claims description 22
- 108010076504 Protein Sorting Signals Proteins 0.000 claims description 20
- 206010028980 Neoplasm Diseases 0.000 claims description 17
- 101001019455 Homo sapiens ICOS ligand Proteins 0.000 claims description 15
- 102100034980 ICOS ligand Human genes 0.000 claims description 15
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 claims description 15
- 102100031988 Tumor necrosis factor ligand superfamily member 6 Human genes 0.000 claims description 15
- 201000011510 cancer Diseases 0.000 claims description 15
- 238000001727 in vivo Methods 0.000 claims description 13
- 238000000338 in vitro Methods 0.000 claims description 11
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 claims description 10
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 claims description 10
- 244000052769 pathogen Species 0.000 claims description 10
- 230000001717 pathogenic effect Effects 0.000 claims description 10
- 101150013553 CD40 gene Proteins 0.000 claims description 8
- 102100028972 HLA class I histocompatibility antigen, A alpha chain Human genes 0.000 claims description 8
- 102100028971 HLA class I histocompatibility antigen, C alpha chain Human genes 0.000 claims description 8
- 108010075704 HLA-A Antigens Proteins 0.000 claims description 8
- 108010058607 HLA-B Antigens Proteins 0.000 claims description 8
- 108010052199 HLA-C Antigens Proteins 0.000 claims description 8
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 claims description 8
- 101000764263 Homo sapiens Tumor necrosis factor ligand superfamily member 4 Proteins 0.000 claims description 7
- 102100027208 T-cell antigen CD7 Human genes 0.000 claims description 7
- 102100026890 Tumor necrosis factor ligand superfamily member 4 Human genes 0.000 claims description 7
- 102100032100 Tumor necrosis factor ligand superfamily member 8 Human genes 0.000 claims description 7
- 241000700605 Viruses Species 0.000 claims description 7
- 102100025221 CD70 antigen Human genes 0.000 claims description 6
- 102100035793 CD83 antigen Human genes 0.000 claims description 6
- 102100028967 HLA class I histocompatibility antigen, alpha chain G Human genes 0.000 claims description 6
- 108010024164 HLA-G Antigens Proteins 0.000 claims description 6
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 claims description 6
- 101000946856 Homo sapiens CD83 antigen Proteins 0.000 claims description 6
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 6
- 238000007920 subcutaneous administration Methods 0.000 claims description 6
- 230000002103 transcriptional effect Effects 0.000 claims description 6
- 239000013603 viral vector Substances 0.000 claims description 6
- 108010087819 Fc receptors Proteins 0.000 claims description 5
- 102000009109 Fc receptors Human genes 0.000 claims description 5
- 101000984189 Homo sapiens Leukocyte immunoglobulin-like receptor subfamily B member 2 Proteins 0.000 claims description 5
- 101000984186 Homo sapiens Leukocyte immunoglobulin-like receptor subfamily B member 4 Proteins 0.000 claims description 5
- 101000991061 Homo sapiens MHC class I polypeptide-related sequence B Proteins 0.000 claims description 5
- 101100207070 Homo sapiens TNFSF8 gene Proteins 0.000 claims description 5
- 108020003285 Isocitrate lyase Proteins 0.000 claims description 5
- 102100025583 Leukocyte immunoglobulin-like receptor subfamily B member 2 Human genes 0.000 claims description 5
- 102100025578 Leukocyte immunoglobulin-like receptor subfamily B member 4 Human genes 0.000 claims description 5
- 102000018170 Lymphotoxin beta Receptor Human genes 0.000 claims description 5
- 108010091221 Lymphotoxin beta Receptor Proteins 0.000 claims description 5
- 102100030301 MHC class I polypeptide-related sequence A Human genes 0.000 claims description 5
- 102100030300 MHC class I polypeptide-related sequence B Human genes 0.000 claims description 5
- 101100207071 Mus musculus Tnfsf8 gene Proteins 0.000 claims description 5
- 102000004338 Transferrin Human genes 0.000 claims description 5
- 108090000901 Transferrin Proteins 0.000 claims description 5
- 102100035284 Tumor necrosis factor receptor superfamily member 6B Human genes 0.000 claims description 5
- 210000003527 eukaryotic cell Anatomy 0.000 claims description 5
- 239000010445 mica Substances 0.000 claims description 5
- 229910052618 mica group Inorganic materials 0.000 claims description 5
- 239000012581 transferrin Substances 0.000 claims description 5
- 101000914496 Homo sapiens T-cell antigen CD7 Proteins 0.000 claims description 4
- 101000597785 Homo sapiens Tumor necrosis factor receptor superfamily member 6B Proteins 0.000 claims description 4
- 208000015181 infectious disease Diseases 0.000 claims description 4
- 238000007918 intramuscular administration Methods 0.000 claims description 4
- 238000001990 intravenous administration Methods 0.000 claims description 4
- 238000002955 isolation Methods 0.000 claims description 4
- 108020004999 messenger RNA Proteins 0.000 claims description 4
- 241000894006 Bacteria Species 0.000 claims description 3
- 208000035473 Communicable disease Diseases 0.000 claims description 3
- 108010039471 Fas Ligand Protein Proteins 0.000 claims description 3
- 238000012258 culturing Methods 0.000 claims description 3
- 230000003100 immobilizing effect Effects 0.000 claims description 3
- 238000007910 systemic administration Methods 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 25
- 102000015736 beta 2-Microglobulin Human genes 0.000 claims 4
- 102100028976 HLA class I histocompatibility antigen, B alpha chain Human genes 0.000 claims 2
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 claims 2
- 230000004936 stimulating effect Effects 0.000 abstract description 14
- 229920000642 polymer Polymers 0.000 abstract description 12
- 150000001413 amino acids Chemical group 0.000 description 256
- 102100027314 Beta-2-microglobulin Human genes 0.000 description 131
- 235000001014 amino acid Nutrition 0.000 description 111
- 101000937544 Homo sapiens Beta-2-microglobulin Proteins 0.000 description 110
- 241000282414 Homo sapiens Species 0.000 description 50
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 47
- 108090000623 proteins and genes Proteins 0.000 description 44
- 102000004169 proteins and genes Human genes 0.000 description 38
- 235000018102 proteins Nutrition 0.000 description 34
- 235000018417 cysteine Nutrition 0.000 description 25
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 25
- 230000014509 gene expression Effects 0.000 description 22
- -1 FasL polypeptide Proteins 0.000 description 17
- 201000010099 disease Diseases 0.000 description 17
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 17
- 102000004127 Cytokines Human genes 0.000 description 16
- 108090000695 Cytokines Proteins 0.000 description 16
- 239000013638 trimer Substances 0.000 description 16
- 239000000427 antigen Substances 0.000 description 15
- 108091007433 antigens Proteins 0.000 description 15
- 102000036639 antigens Human genes 0.000 description 15
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 14
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 14
- 239000003446 ligand Substances 0.000 description 14
- 108091028043 Nucleic acid sequence Proteins 0.000 description 13
- 230000006044 T cell activation Effects 0.000 description 12
- 239000013598 vector Substances 0.000 description 12
- 125000002228 disulfide group Chemical group 0.000 description 11
- 102100036255 Glucose-6-phosphatase 2 Human genes 0.000 description 10
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 10
- 101000930907 Homo sapiens Glucose-6-phosphatase 2 Proteins 0.000 description 10
- 241000699666 Mus <mouse, genus> Species 0.000 description 10
- 229960000074 biopharmaceutical Drugs 0.000 description 10
- 108010042215 OX40 Ligand Proteins 0.000 description 9
- 102000004473 OX40 Ligand Human genes 0.000 description 9
- 230000004927 fusion Effects 0.000 description 9
- 102000047279 human B2M Human genes 0.000 description 9
- 102000040430 polynucleotide Human genes 0.000 description 9
- 108091033319 polynucleotide Proteins 0.000 description 9
- 239000002157 polynucleotide Substances 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 8
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 8
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 8
- 239000012636 effector Substances 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 102000005962 receptors Human genes 0.000 description 8
- 108020003175 receptors Proteins 0.000 description 8
- 102000009410 Chemokine receptor Human genes 0.000 description 7
- 108050000299 Chemokine receptor Proteins 0.000 description 7
- 108091026890 Coding region Proteins 0.000 description 7
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 7
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 7
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 7
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 7
- 241000699670 Mus sp. Species 0.000 description 7
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 7
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 7
- 210000000612 antigen-presenting cell Anatomy 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 230000008685 targeting Effects 0.000 description 7
- 102000006390 HLA-B Antigens Human genes 0.000 description 6
- 101800001494 Protease 2A Proteins 0.000 description 6
- 101800001066 Protein 2A Proteins 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 238000000569 multi-angle light scattering Methods 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 230000001225 therapeutic effect Effects 0.000 description 6
- 239000003053 toxin Substances 0.000 description 6
- 231100000765 toxin Toxicity 0.000 description 6
- 108700012359 toxins Proteins 0.000 description 6
- 230000003612 virological effect Effects 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 5
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 229940079593 drug Drugs 0.000 description 5
- 238000000684 flow cytometry Methods 0.000 description 5
- 210000000428 immunological synapse Anatomy 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 238000002560 therapeutic procedure Methods 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- VDABVNMGKGUPEY-UHFFFAOYSA-N 6-carboxyfluorescein succinimidyl ester Chemical compound C=1C(O)=CC=C2C=1OC1=CC(O)=CC=C1C2(C1=C2)OC(=O)C1=CC=C2C(=O)ON1C(=O)CCC1=O VDABVNMGKGUPEY-UHFFFAOYSA-N 0.000 description 4
- 208000023275 Autoimmune disease Diseases 0.000 description 4
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 4
- 108020004414 DNA Proteins 0.000 description 4
- 239000004471 Glycine Substances 0.000 description 4
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 4
- 108091005461 Nucleic proteins Proteins 0.000 description 4
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 4
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 4
- 108091008874 T cell receptors Proteins 0.000 description 4
- 108050002568 Tumor necrosis factor ligand superfamily member 6 Proteins 0.000 description 4
- 230000005784 autoimmunity Effects 0.000 description 4
- 150000001945 cysteines Chemical class 0.000 description 4
- 230000016396 cytokine production Effects 0.000 description 4
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 210000005260 human cell Anatomy 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 210000000265 leukocyte Anatomy 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 210000003071 memory t lymphocyte Anatomy 0.000 description 4
- 239000011325 microbead Substances 0.000 description 4
- 239000002953 phosphate buffered saline Substances 0.000 description 4
- 230000004481 post-translational protein modification Effects 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 230000000638 stimulation Effects 0.000 description 4
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 3
- 108010088751 Albumins Proteins 0.000 description 3
- 102000009027 Albumins Human genes 0.000 description 3
- 108091023037 Aptamer Proteins 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 102100038078 CD276 antigen Human genes 0.000 description 3
- 101710185679 CD276 antigen Proteins 0.000 description 3
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 3
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 3
- HVLSXIKZNLPZJJ-TXZCQADKSA-N HA peptide Chemical compound C([C@@H](C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 HVLSXIKZNLPZJJ-TXZCQADKSA-N 0.000 description 3
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 description 3
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 description 3
- 101000986086 Homo sapiens HLA class I histocompatibility antigen, A alpha chain Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 230000003013 cytotoxicity Effects 0.000 description 3
- 231100000135 cytotoxicity Toxicity 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 239000000710 homodimer Substances 0.000 description 3
- 229920002674 hyaluronan Polymers 0.000 description 3
- 229960003160 hyaluronic acid Drugs 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 238000000120 microwave digestion Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 230000009870 specific binding Effects 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- 108091033409 CRISPR Proteins 0.000 description 2
- 238000010354 CRISPR gene editing Methods 0.000 description 2
- 102000005701 Calcium-Binding Proteins Human genes 0.000 description 2
- 108010045403 Calcium-Binding Proteins Proteins 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- XZWYTXMRWQJBGX-VXBMVYAYSA-N FLAG peptide Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)CC1=CC=C(O)C=C1 XZWYTXMRWQJBGX-VXBMVYAYSA-N 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- BCCRXDTUTZHDEU-VKHMYHEASA-N Gly-Ser Chemical compound NCC(=O)N[C@@H](CO)C(O)=O BCCRXDTUTZHDEU-VKHMYHEASA-N 0.000 description 2
- 101710154606 Hemagglutinin Proteins 0.000 description 2
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 2
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 2
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 description 2
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 2
- 229920001612 Hydroxyethyl starch Polymers 0.000 description 2
- 102100025390 Integrin beta-2 Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 102000002698 KIR Receptors Human genes 0.000 description 2
- 108010043610 KIR Receptors Proteins 0.000 description 2
- 108090001090 Lectins Proteins 0.000 description 2
- 102000004856 Lectins Human genes 0.000 description 2
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 description 2
- 102000018697 Membrane Proteins Human genes 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 2
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 108010076039 Polyproteins Proteins 0.000 description 2
- 101710176177 Protein A56 Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 102000018210 Recoverin Human genes 0.000 description 2
- 108010076570 Recoverin Proteins 0.000 description 2
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 2
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 description 2
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 2
- 210000000447 Th1 cell Anatomy 0.000 description 2
- 210000000068 Th17 cell Anatomy 0.000 description 2
- 210000004241 Th2 cell Anatomy 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 2
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 2
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 230000033289 adaptive immune response Effects 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000000090 biomarker Substances 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 230000004186 co-expression Effects 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 239000000356 contaminant Substances 0.000 description 2
- 230000000139 costimulatory effect Effects 0.000 description 2
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 238000001917 fluorescence detection Methods 0.000 description 2
- 229910052733 gallium Inorganic materials 0.000 description 2
- 210000002443 helper t lymphocyte Anatomy 0.000 description 2
- 239000000185 hemagglutinin Substances 0.000 description 2
- 229940050526 hydroxyethylstarch Drugs 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 229940072221 immunoglobulins Drugs 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000002523 lectin Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 239000013014 purified material Substances 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 210000003289 regulatory T cell Anatomy 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 230000008093 supporting effect Effects 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 230000032258 transport Effects 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- KUHSEZKIEJYEHN-BXRBKJIMSA-N (2s)-2-amino-3-hydroxypropanoic acid;(2s)-2-aminopropanoic acid Chemical compound C[C@H](N)C(O)=O.OC[C@H](N)C(O)=O KUHSEZKIEJYEHN-BXRBKJIMSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- ASJSAQIRZKANQN-CRCLSJGQSA-N 2-deoxy-D-ribose Chemical compound OC[C@@H](O)[C@@H](O)CC=O ASJSAQIRZKANQN-CRCLSJGQSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 108010011170 Ala-Trp-Arg-His-Pro-Gln-Phe-Gly-Gly Proteins 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 102000008102 Ankyrins Human genes 0.000 description 1
- 108010049777 Ankyrins Proteins 0.000 description 1
- 101710145634 Antigen 1 Proteins 0.000 description 1
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 1
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- 241000223836 Babesia Species 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 description 1
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 description 1
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 1
- 102100028990 C-X-C chemokine receptor type 3 Human genes 0.000 description 1
- 229930182476 C-glycoside Natural products 0.000 description 1
- 150000000700 C-glycosides Chemical class 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 102100032912 CD44 antigen Human genes 0.000 description 1
- 102100036008 CD48 antigen Human genes 0.000 description 1
- 102000000905 Cadherin Human genes 0.000 description 1
- 108050007957 Cadherin Proteins 0.000 description 1
- 101100505076 Caenorhabditis elegans gly-2 gene Proteins 0.000 description 1
- 108010028326 Calbindin 2 Proteins 0.000 description 1
- 108010041952 Calmodulin Proteins 0.000 description 1
- 102000000584 Calmodulin Human genes 0.000 description 1
- 108010032088 Calpain Proteins 0.000 description 1
- 102000007590 Calpain Human genes 0.000 description 1
- 102100021849 Calretinin Human genes 0.000 description 1
- 208000024172 Cardiovascular disease Diseases 0.000 description 1
- 102100031456 Centriolin Human genes 0.000 description 1
- 208000013641 Cerebrofacial arteriovenous metameric syndrome Diseases 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 201000003883 Cystic fibrosis Diseases 0.000 description 1
- 108010025905 Cystine-Knot Miniproteins Proteins 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- NBSCHQHZLSJFNQ-GASJEMHNSA-N D-Glucose 6-phosphate Chemical compound OC1O[C@H](COP(O)(O)=O)[C@@H](O)[C@H](O)[C@H]1O NBSCHQHZLSJFNQ-GASJEMHNSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 229910052692 Dysprosium Inorganic materials 0.000 description 1
- 241000223924 Eimeria Species 0.000 description 1
- 102000016942 Elastin Human genes 0.000 description 1
- 108010014258 Elastin Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 101150089023 FASLG gene Proteins 0.000 description 1
- 102100027286 Fanconi anemia group C protein Human genes 0.000 description 1
- 102000015212 Fas Ligand Protein Human genes 0.000 description 1
- 108010008177 Fd immunoglobulins Proteins 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- VFRROHXSMXFLSN-UHFFFAOYSA-N Glc6P Natural products OP(=O)(O)OCC(O)C(O)C(O)C(O)C=O VFRROHXSMXFLSN-UHFFFAOYSA-N 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 108020005004 Guide RNA Proteins 0.000 description 1
- 102100035943 HERV-H LTR-associating protein 2 Human genes 0.000 description 1
- 102100028970 HLA class I histocompatibility antigen, alpha chain E Human genes 0.000 description 1
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000834898 Homo sapiens Alpha-synuclein Proteins 0.000 description 1
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 1
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 description 1
- 101000916050 Homo sapiens C-X-C chemokine receptor type 3 Proteins 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 1
- 101000716130 Homo sapiens CD48 antigen Proteins 0.000 description 1
- 101000941711 Homo sapiens Centriolin Proteins 0.000 description 1
- 101001021491 Homo sapiens HERV-H LTR-associating protein 2 Proteins 0.000 description 1
- 101000986087 Homo sapiens HLA class I histocompatibility antigen, B alpha chain Proteins 0.000 description 1
- 101000986084 Homo sapiens HLA class I histocompatibility antigen, C alpha chain Proteins 0.000 description 1
- 101000986085 Homo sapiens HLA class I histocompatibility antigen, alpha chain E Proteins 0.000 description 1
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101001063392 Homo sapiens Lymphocyte function-associated antigen 3 Proteins 0.000 description 1
- 101000764535 Homo sapiens Lymphotoxin-alpha Proteins 0.000 description 1
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 description 1
- 101000884270 Homo sapiens Natural killer cell receptor 2B4 Proteins 0.000 description 1
- 101000622137 Homo sapiens P-selectin Proteins 0.000 description 1
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 1
- 101000633780 Homo sapiens Signaling lymphocytic activation molecule Proteins 0.000 description 1
- 101000652359 Homo sapiens Spermatogenesis-associated protein 2 Proteins 0.000 description 1
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 1
- 101001018021 Homo sapiens T-lymphocyte surface antigen Ly-9 Proteins 0.000 description 1
- 101100369992 Homo sapiens TNFSF10 gene Proteins 0.000 description 1
- 101000830600 Homo sapiens Tumor necrosis factor ligand superfamily member 13 Proteins 0.000 description 1
- 101000830596 Homo sapiens Tumor necrosis factor ligand superfamily member 15 Proteins 0.000 description 1
- 101000597779 Homo sapiens Tumor necrosis factor ligand superfamily member 18 Proteins 0.000 description 1
- 101000638255 Homo sapiens Tumor necrosis factor ligand superfamily member 8 Proteins 0.000 description 1
- 101000638251 Homo sapiens Tumor necrosis factor ligand superfamily member 9 Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 241000598436 Human T-cell lymphotropic virus Species 0.000 description 1
- 241000714260 Human T-lymphotropic virus 1 Species 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 108010008212 Integrin alpha4beta1 Proteins 0.000 description 1
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 description 1
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102100020881 Interleukin-1 alpha Human genes 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- 102000017578 LAG3 Human genes 0.000 description 1
- 101150030213 Lag3 gene Proteins 0.000 description 1
- 240000000759 Lepidium meyenii Species 0.000 description 1
- 235000000421 Lepidium meyenii Nutrition 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 101001089108 Lotus tetragonolobus Anti-H(O) lectin Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 102100030984 Lymphocyte function-associated antigen 3 Human genes 0.000 description 1
- 102100026238 Lymphotoxin-alpha Human genes 0.000 description 1
- 108090000362 Lymphotoxin-beta Proteins 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101100335765 Mus musculus G6pc2 gene Proteins 0.000 description 1
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 1
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 1
- 102000016349 Myosin Light Chains Human genes 0.000 description 1
- 108010067385 Myosin Light Chains Proteins 0.000 description 1
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 description 1
- 102100038082 Natural killer cell receptor 2B4 Human genes 0.000 description 1
- 102000010751 Neurocalcin Human genes 0.000 description 1
- 108010077960 Neurocalcin Proteins 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 102100023472 P-selectin Human genes 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 102000001675 Parvalbumin Human genes 0.000 description 1
- 108060005874 Parvalbumin Proteins 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- 241000224016 Plasmodium Species 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102100023087 Protein S100-A4 Human genes 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102000014128 RANK Ligand Human genes 0.000 description 1
- 108010025832 RANK Ligand Proteins 0.000 description 1
- 208000037323 Rare tumor Diseases 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 102000013674 S-100 Human genes 0.000 description 1
- 108700021018 S100 Proteins 0.000 description 1
- 102000014400 SH2 domains Human genes 0.000 description 1
- 108050003452 SH2 domains Proteins 0.000 description 1
- 206010039509 Scab Diseases 0.000 description 1
- 241000242678 Schistosoma Species 0.000 description 1
- 108090000184 Selectins Proteins 0.000 description 1
- 102000003800 Selectins Human genes 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 102100029215 Signaling lymphocytic activation molecule Human genes 0.000 description 1
- 101000873420 Simian virus 40 SV40 early leader protein Proteins 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 101100289792 Squirrel monkey polyomavirus large T gene Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 108010092262 T-Cell Antigen Receptors Proteins 0.000 description 1
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 description 1
- 210000000662 T-lymphocyte subset Anatomy 0.000 description 1
- 102100033447 T-lymphocyte surface antigen Ly-9 Human genes 0.000 description 1
- 102000046283 TNF-Related Apoptosis-Inducing Ligand Human genes 0.000 description 1
- 108700012411 TNFSF10 Proteins 0.000 description 1
- 241000223777 Theileria Species 0.000 description 1
- 102100036407 Thioredoxin Human genes 0.000 description 1
- 241000223996 Toxoplasma Species 0.000 description 1
- 101001023030 Toxoplasma gondii Myosin-D Proteins 0.000 description 1
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 108091061763 Triple-stranded DNA Proteins 0.000 description 1
- 102000013534 Troponin C Human genes 0.000 description 1
- 108010028230 Trp-Ser- His-Pro-Gln-Phe-Glu-Lys Proteins 0.000 description 1
- 102000012883 Tumor Necrosis Factor Ligand Superfamily Member 14 Human genes 0.000 description 1
- 108010065158 Tumor Necrosis Factor Ligand Superfamily Member 14 Proteins 0.000 description 1
- 102100024584 Tumor necrosis factor ligand superfamily member 12 Human genes 0.000 description 1
- 101710097155 Tumor necrosis factor ligand superfamily member 12 Proteins 0.000 description 1
- 102100024585 Tumor necrosis factor ligand superfamily member 13 Human genes 0.000 description 1
- 102100024587 Tumor necrosis factor ligand superfamily member 15 Human genes 0.000 description 1
- 102100035283 Tumor necrosis factor ligand superfamily member 18 Human genes 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- 108010079206 V-Set Domain-Containing T-Cell Activation Inhibitor 1 Proteins 0.000 description 1
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 1
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 1
- 102100038287 Visinin-like protein 1 Human genes 0.000 description 1
- 101710194459 Visinin-like protein 1 Proteins 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical class C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 229940125644 antibody drug Drugs 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 238000013475 authorization Methods 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 201000008680 babesiosis Diseases 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 229960000106 biosimilars Drugs 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 238000001815 biotherapy Methods 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- 238000002619 cancer immunotherapy Methods 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000011712 cell development Effects 0.000 description 1
- 230000022534 cell killing Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 239000002872 contrast media Substances 0.000 description 1
- 238000011443 conventional therapy Methods 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 102000003675 cytokine receptors Human genes 0.000 description 1
- 108010057085 cytokine receptors Proteins 0.000 description 1
- 206010052015 cytokine release syndrome Diseases 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000007402 cytotoxic response Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- KBQHZAAAGSGFKK-UHFFFAOYSA-N dysprosium atom Chemical compound [Dy] KBQHZAAAGSGFKK-UHFFFAOYSA-N 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 229920002549 elastin Polymers 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 230000000763 evoking effect Effects 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 238000010362 genome editing Methods 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- YMAWOPBAYDPSLA-UHFFFAOYSA-N glycylglycine Chemical compound [NH3+]CC(=O)NCC([O-])=O YMAWOPBAYDPSLA-UHFFFAOYSA-N 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000013090 high-throughput technology Methods 0.000 description 1
- 235000014304 histidine Nutrition 0.000 description 1
- 125000000487 histidyl group Chemical class [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 102000048974 human HLA-B Human genes 0.000 description 1
- 229940048921 humira Drugs 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 230000008102 immune modulation Effects 0.000 description 1
- 230000003832 immune regulation Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 208000000509 infertility Diseases 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 231100000535 infertility Toxicity 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 230000017730 intein-mediated protein splicing Effects 0.000 description 1
- 230000005732 intercellular adhesion Effects 0.000 description 1
- 230000009878 intermolecular interaction Effects 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 230000000622 irritating effect Effects 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 150000002603 lanthanum Chemical class 0.000 description 1
- 235000012902 lepidium meyenii Nutrition 0.000 description 1
- 108010003486 leucyl-leucyl-phenylalanyl-glycyl-tyrosyl-prolyl-valyl-tyrosyl-valine Proteins 0.000 description 1
- HWYHZTIRURJOHG-UHFFFAOYSA-N luminol Chemical compound O=C1NNC(=O)C2=C1C(N)=CC=C2 HWYHZTIRURJOHG-UHFFFAOYSA-N 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 108091027963 non-coding RNA Proteins 0.000 description 1
- 102000042567 non-coding RNA Human genes 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000007030 peptide scission Effects 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 229950004354 phosphorylcholine Drugs 0.000 description 1
- PYJNAPOPMIJKJZ-UHFFFAOYSA-N phosphorylcholine chloride Chemical compound [Cl-].C[N+](C)(C)CCOP(O)(O)=O PYJNAPOPMIJKJZ-UHFFFAOYSA-N 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 210000004986 primary T-cell Anatomy 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- AAEVYOVXGOFMJO-UHFFFAOYSA-N prometryn Chemical compound CSC1=NC(NC(C)C)=NC(NC(C)C)=N1 AAEVYOVXGOFMJO-UHFFFAOYSA-N 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000011092 protein amplification Methods 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 230000012743 protein tagging Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- QSHGUCSTWRSQAF-FJSLEGQWSA-N s-peptide Chemical compound C([C@@H](C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC(OS(O)(=O)=O)=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C1=CC=C(OS(O)(=O)=O)C=C1 QSHGUCSTWRSQAF-FJSLEGQWSA-N 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 230000019635 sulfation Effects 0.000 description 1
- 238000005670 sulfation reaction Methods 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 229910052713 technetium Inorganic materials 0.000 description 1
- GKLVYJBZJHMRIY-UHFFFAOYSA-N technetium atom Chemical compound [Tc] GKLVYJBZJHMRIY-UHFFFAOYSA-N 0.000 description 1
- 108010052178 teleocalcin Proteins 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 108010072106 tumstatin (74-98) Proteins 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 238000012795 verification Methods 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 230000002747 voluntary effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 229940055760 yervoy Drugs 0.000 description 1
- 230000004572 zinc-binding Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70539—MHC-molecules, e.g. HLA-molecules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/40—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Epidemiology (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Transplantation (AREA)
- Tropical Medicine & Parasitology (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
本出願は、参照することによってその全体が本明細書に組み込まれる、2014年6月18日に出願された米国仮特許出願第62/013,715号の恩典を主張する。
本発明は、国立衛生研究所、NIGMSによって与えられた認可番号3U54GM094662-02及び同5U01GM094665-02の下、政府支援を受けてなされた。政府は本発明に所定の権利を有する。
配列表が、2015年6月10日に作成された142KBサイズのテキストファイル「IMGN-E003WO_ST25.txt」としてここに提供される。本テキストファイルの内容は、参照することによってその全体が本明細書に組み込まれる。
本出願を通して、様々な出版物が角括弧で参照される。これら参考文献の完全な引用は、本明細書の文末を参照されたい。これら出版物の開示、並びに本明細書に参照されるすべての特許、公開特許公報、及び書籍は、参照することによってその全体が本願に組み込まれ、本願発明が属する技術をさらに十分に説明する。
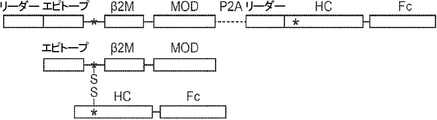
本発明は、第一のB2Mリーダー配列と同一のアミノ酸配列、これに隣接する候補エピトープペプチド、これに隣接する第一のアミノ酸リンカー配列、これに隣接する、ヒト天然B2Mペプチド配列と同一のアミノ酸配列、これに隣接する第二のアミノ酸リンカー配列、これに隣接するT細胞調節ドメインペプチド配列、これに隣接する第三のアミノ酸リンカー、これに隣接する第二のB2Mリーダー配列、これに隣接する、MHC重鎖と同一のアミノ酸配列、これに隣接する、免疫グロブリンFcドメインと同一のアミノ酸配列を含む、組み換えポリペプチドを提供する。
から選択されるアミノ酸配列を含む。いくつかの場合、該組み換えポリペプチドは、N末端からC末端の順にa)第一のリーダーペプチド;b)該エピトープ;c)該第一のMHCポリペプチド;d)該免疫調節ポリペプチド;e)該タンパク質分解的に開裂可能なリンカー、またはリボソームスキッピングシグナル;f)第二のリーダーペプチド;g)該第二のMHCポリペプチド;及びh)該免疫グロブリン(Ig)Fcポリペプチドを含む。いくつかの場合、該第一のリーダーペプチド及び該第二のリーダーペプチドは、β2-Mリーダーペプチドである。いくつかの場合、該ヌクレオチド配列は、転写調節因子に作動可能に連結されている。いくつかの場合、該転写調節因子は真核細胞中で機能的であるプロモーターである。いくつかの場合、該第一のMHCポリペプチド、または該エピトープと該第一のMHCポリペプチドとの間のリンカーは第一のCys残基を提供するためのアミノ酸置換を含みかつ該第二のMHCポリペプチドは第二のCys残基を提供するためのアミノ酸置換を含み、かつ該第一のCys残基及び該第二のCys残基は、該第一のMHCポリペプチドと該第二のMHCポリペプチドとの間にジスルフィド結合を提供する。本開示は、上述または本明細書の他の場所に記載の核酸のいずれか1つを含む組み換え発現ベクターを提供する。いくつかの場合、該組み換え発現ベクターは、ウイルスベクターである。いくつかの場合、該組み換え発現ベクターは、非ウイルスベクターである。本開示は、上述または本開示の他の場所に記載の組み換え発現ベクターによって遺伝子改変された宿主細胞を提供する。いくつかの場合、該宿主細胞はインビトロである。いくつかの場合、該宿主細胞は、該細胞が内因性MHCβ2ミクログロブリンポリペプチドを産生しないように遺伝子改変される。いくつかの場合、該宿主細胞はTリンパ球である。
[本発明1001]
a)N末端からC末端の順に
i)エピトープ;
ii)第一の主要組織適合複合体(MHC)ポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)任意で免疫グロブリン(Ig)Fcポリペプチドまたは非Ig骨格
を含む第二のポリペプチド
を含み、
A)前記第一のポリペプチドのC末端に;
B)前記第二のポリペプチドのN末端に;
C)前記第二のポリペプチドのC末端に;または
D)前記第一ポリペプチドのC末端及び前記第二のポリペプチドのN末端に
存在する1つ以上の免疫調節ドメインを含む、多量体ポリペプチド。
[本発明1002]
a)N末端からC末端の順に
i)エピトープ;
ii)第一のMHCポリペプチド;及び
iii)免疫調節ドメイン
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)Ig Fcポリペプチド
を含む第二のポリペプチド
を含む、本発明1001の多量体ポリペプチド。
[本発明1003]
a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)免疫調節ドメイン;
iii)第二のMHCポリペプチド;及び
ii)免疫グロブリン(Ig)Fcポリペプチド
を含む第二のポリペプチド
を含む、本発明1001の多量体ポリペプチド。
[本発明1004]
a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)Ig Fcポリペプチド;及び
iii)免疫調節ドメイン
を含む第二のポリペプチド
を含む、本発明1001の多量体ポリペプチド。
[本発明1005]
a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)免疫調節ドメイン
を含む第二のポリペプチド
を含む、本発明1001の多量体ポリペプチド。
[本発明1006]
a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)免疫調節ドメイン;及び
ii)第二のMHCポリペプチド
を含む第二のポリペプチド
を含む、本発明1001の多量体ポリペプチド。
[本発明1007]
a)N末端からC末端の順に
i)エピトープ;
ii)第一のMHCポリペプチド;及び
iii)免疫調節ドメイン
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド
を含む第二のポリペプチド
を含む、本発明1001の多量体ポリペプチド。
[本発明1008]
前記非Ig骨格が、XTENポリペプチド、トランスフェリンポリペプチド、Fc受容体ポリペプチド、エラスチン様ポリペプチド、シルク様ポリペプチド、またはシルクエラスチン様ポリペプチドである、本発明1001の多量体ポリペプチド。
[本発明1009]
前記第一のMHCポリペプチドがβ2ミクログロブリンポリペプチドであり;かつ前記第二のMHCポリペプチドがMHCクラスI重鎖ポリペプチドである、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1010]
前記β2ミクログロブリンポリペプチドが、SEQ ID NO:4に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、本発明1009の多量体ポリペプチド。
[本発明1011]
前記MHCクラスI重鎖ポリペプチドが、HLA-A、HLA-B、またはHLA-Cの重鎖である、本発明1008の多量体ポリペプチド。
[本発明1012]
前記MHCクラスI重鎖ポリペプチドが、SEQ ID NO:5に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、本発明1009の多量体ポリペプチド。
[本発明1013]
前記第一のMHCポリペプチドが、MHCクラスIIα鎖ポリペプチドであり;かつ前記第二のMHCポリペプチドが、MHCクラスIIβ鎖ポリペプチドである、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1014]
前記エピトープがT細胞エピトープである、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1015]
Fcポリペプチドを含み、かつ、前記Ig Fcポリペプチドが、IgG1 Fcポリペプチド、IgG2 Fcポリペプチド、IgG3 Fcポリペプチド、IgG4 Fcポリペプチド、IgA Fcポリペプチド、またはIgM Fcポリペプチドである、本発明1001から1007のいずれかの多量体ポリペプチド。
[本発明1016]
前記Ig Fcポリペプチドが、図24A~24Cに示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、本発明1015の多量体ポリペプチド。
[本発明1017]
前記第一のポリペプチド及び前記第二のポリペプチドが非共有結合的に会合している、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1018]
前記第一のポリペプチド及び前記第二のポリペプチドが共有結合的に連結されている、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1019]
前記共有結合がジスルフィド結合による、本発明1013の多量体ポリペプチド。
[本発明1020]
前記第一のMHCポリペプチド、または前記エピトープと前記第一のMHCポリペプチドとの間のリンカーが、第一のCys残基を提供するためのアミノ酸置換を含み、かつ前記第二のMHCポリペプチドが、第二のCys残基を提供するためのアミノ酸置換を含み、かつ、前記ジスルフィド結合が前記第一のCys残基と前記第二のCys残基との間に存在する、本発明1019の多量体ポリペプチド。
[本発明1021]
前記エピトープと前記第一のMHCポリペプチドとの間に挿入された第一のリンカーを含む、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1022]
前記免疫調節ポリペプチドが、4-1BBLポリペプチド、B7-1ポリペプチド、B7-2ポリペプチド、ICOS-Lポリペプチド、OX-40Lポリペプチド、CD80ポリペプチド、CD86ポリペプチド、PD-L1ポリペプチド、FasLポリペプチド、及びPD-L2ポリペプチドから選択される、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1023]
2つ以上の免疫調節ポリペプチドを含む、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1024]
前記2つ以上の免疫調節ポリペプチドがタンデムになっている、本発明1023の多量体ポリペプチド。
[本発明1025]
第三のポリペプチドを含み、前記第三のポリペプチドが、前記第一のポリペプチドまたは前記第二のポリペプチドの前記免疫調節ポリペプチドに対する少なくとも90%のアミノ酸配列同一性を有するアミノ酸配列を含む免疫調節ポリペプチドを含む、本発明1001から1008のいずれかの多量体ポリペプチド。
[本発明1026]
前記第三のポリペプチドが、前記第一のポリペプチドに共有結合的に連結されている、本発明1025の多量体ポリペプチド。
[本発明1027]
前記第二のポリペプチドが、N末端からC末端の順に
i)前記第二のMHCポリペプチド;
ii)前記Ig Fcポリペプチド;及び
iii)親和性タグ
を含む、本発明1001から1007のいずれかの多量体ポリペプチド。
[本発明1028]
i)組み換えポリペプチドが、N末端からC末端の順に
a)エピトープ;
b)第一の主要組織適合複合体(MHC)ポリペプチド;
c)免疫調節ポリペプチド;
d)タンパク質分解的に開裂可能なリンカー、もしくはリボソームスキッピングシグナル;
e)第二のMHCポリペプチド;及び
f)免疫グロブリン(Ig)Fcポリペプチド
を含むか、または
ii)前記組み換えポリペプチドが、N末端からC末端の順に
a)エピトープ;
b)第一のMHCポリペプチド;
c)タンパク質分解的に開裂可能なリンカー、もしくはリボソームスキッピングシグナル;
d)免疫調節ポリペプチド;
e)第二のMHCポリペプチド;及び
f)Ig Fcポリペプチド
を含む、
前記組み換えポリペプチドをコードするヌクレオチド配列を含む核酸。
[本発明1029]
前記第一のMHCポリペプチドがβ2ミクログロブリンポリペプチドであり;かつ前記第二のMHCポリペプチドがMHCクラスI重鎖ポリペプチドである、本発明1028の核酸。
[本発明1030]
前記β2ミクログロブリンポリペプチドが、SEQ ID NO:4に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、本発明1029の核酸。
[本発明1031]
前記MHCクラスI重鎖ポリペプチドが、HLA-A、HLA-B、またはHLA-Cの重鎖である、本発明1028の核酸。
[本発明1032]
前記MHCクラスI重鎖ポリペプチドが、SEQ ID NO:5に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、本発明1031の核酸。
[本発明1033]
前記第一のMHCポリペプチドがMHCクラスIIα鎖ポリペプチドであり;かつ前記第二のMHCポリペプチドがMHCクラスIIβ鎖ポリペプチドである、本発明1028の核酸。
[本発明1034]
前記エピトープがT細胞エピトープである、本発明1028の核酸。
[本発明1035]
前記Ig Fcポリペプチドが、IgG1 Fcポリペプチド、IgG2 Fcポリペプチド、IgG3 Fcポリペプチド、IgG4 Fcポリペプチド、IgA Fcポリペプチド、またはIgM Fcポリペプチドである、本発明1028の核酸。
[本発明1036]
前記Ig Fcポリペプチドが、図24A~24Cに示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、本発明1035の核酸。
[本発明1037]
前記免疫調節ポリペプチドが、4-1BBLポリペプチド、B7-1ポリペプチド、B7-2ポリペプチド、ICOS-Lポリペプチド、OX-40Lポリペプチド、CD80ポリペプチド、CD86ポリペプチド、PD-L1ポリペプチド、FasLポリペプチド、及びPD-L2ポリペプチドから選択される、本発明1028の核酸。
[本発明1038]
前記免疫調節ポリペプチドが、CD7、CD30L、CD40、CD70、CD83、HLA-G、MICA、MICB、HVEM、リンホトキシンβ受容体、3/TR6、ILT3、ILT4、及びHVEMから選択される、本発明1027の核酸。
[本発明1039]
前記タンパク質分解的に開裂可能なリンカーまたは前記リボソームスキッピングシグナルが、
から選択されるアミノ酸配列を含む、本発明1028の核酸。
[本発明1040]
前記組み換えポリペプチドが、N末端からC末端の順に
a)第一のリーダーペプチド;
b)前記エピトープ;
c)前記第一のMHCポリペプチド;
d)前記免疫調節ポリペプチド;
e)前記タンパク質分解的に開裂可能なリンカーまたは前記リボソームスキッピングシグナル;
f)第二のリーダーペプチド;
g)前記第二のMHCポリペプチド;及び
h)前記免疫グロブリン(Ig)Fcポリペプチド
を含む、本発明1028の核酸。
[本発明1041]
前記第一のリーダーペプチド及び前記第二のリーダーペプチドがβ2-Mリーダーペプチドである、本発明1040の核酸。
[本発明1042]
前記ヌクレオチド配列が転写調節因子に作動可能に連結されている、本発明1028の核酸。
[本発明1043]
前記転写調節因子が、真核細胞中で機能的であるプロモーターである、本発明1042の核酸。
[本発明1044]
前記第一のMHCポリペプチド、または前記エピトープと前記第一のMHCポリペプチドとの間のリンカーが、第一のCys残基を提供するためのアミノ酸置換を含み、かつ前記第二のMHCポリペプチドが、第二のCys残基を提供するためのアミノ酸置換を含み、かつ、前記第一のCys残基及び前記第二のCys残基が、前記第一のMHCポリペプチドと前記第二のMHCポリペプチドとの間にジスルフィド結合を提供する、本発明1028の核酸。
[本発明1045]
本発明1028から1044のいずれかの核酸を含む、組み換え発現ベクター。
[本発明1046]
ウイルスベクターまたは非ウイルスベクターである、本発明1045の組み換え発現ベクター。
[本発明1047]
本発明1045の組み換え発現ベクターによって遺伝子改変された宿主細胞。
[本発明1048]
インビトロである、本発明1047の宿主細胞。
[本発明1049]
内因性MHCβ2ミクログロブリンポリペプチドを産生しないように遺伝子改変されている、本発明1047の宿主細胞。
[本発明1050]
Tリンパ球である、本発明1047の宿主細胞。
[本発明1051]
a)N末端からC末端の順に
i)エピトープ;
ii)第一のMHCポリペプチド;及び
iii)免疫調節ドメイン
を含む第一のポリペプチドをコードするヌクレオチド配列を含む第一の核酸;並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)Ig Fcポリペプチド
を含む第二のポリペプチドをコードするヌクレオチド配列を含む第一の核酸
を含む、組成物。
[本発明1051]
a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチドをコードするヌクレオチド配列を含む第一の核酸;並びに
b)N末端からC末端の順に
i)免疫調節ドメイン
ii)第二のMHCポリペプチド;及び
iii)Ig Fcポリペプチド
を含む第二のポリペプチドをコードするヌクレオチド配列を含む第一の核酸
を含む、組成物。
[本発明1053]
前記第一の核酸及び/または前記第二の核酸が組み換え発現ベクター内に存在する、本発明1051または1052の組成物。
[本発明1054]
本発明1051から1053のいずれかの組成物によって遺伝子改変された宿主細胞。
[本発明1055]
a)47または54の宿主細胞が本発明1001の多量体ポリペプチドを合成するような条件下で、前記宿主細胞を培地中のインビトロで培養する段階;ならびに
b)前記宿主細胞から及び/または前記培地から前記多量体ポリペプチドを単離する段階
を含む、前記多量体ポリペプチドを産生する方法。
[本発明1056]
前記第二のポリペプチドが親和性タグを含み、かつ、前記単離する段階が、前記細胞によって産生された前記多量体ポリペプチドを前記親和性タグの結合パートナーと接触させることを含み、ここで前記結合パートナーが固定化されており、それによって前記多量体ポリペプチドを固定化する、本発明1055の方法。
[本発明1057]
固定化された前記多量体ポリペプチドを溶出する段階を含む、本発明1055の方法。
[本発明1058]
エピトープ特異的T細胞の活性を選択的に調節する方法であって、前記T細胞を、本発明1001の多量体ポリペプチドと接触させる段階を含み、前記接触させる段階が、前記エピトープ特異的T細胞の活性を選択的に調節する、方法。
[本発明1059]
前記免疫調節ポリペプチドが活性化ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞を活性化する、本発明1058の方法。
[本発明1060]
前記免疫調節ポリペプチドが阻害ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞を阻害する、本発明1058の方法。
[本発明1061]
前記接触させる段階がインビトロである、本発明1058の方法。
[本発明1062]
前記接触させる段階がインビボである、本発明1058の方法。
[本発明1063]
個体におけるエピトープ特異的T細胞の活性を選択的に調節する方法であって、前記個体に、個体におけるエピトープ特異的T細胞の活性を選択的に調節するのに有効な本発明1001の多量体ポリペプチドの有効量を投与する段階を含む、方法。
[本発明1064]
前記免疫調節ポリペプチドが活性化ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞を活性化する、本発明1063の方法。
[本発明1065]
前記エピトープががん関連エピトープであり、かつ前記投与する段階が、前記がん関連エピトープに特異的なT細胞の活性を選択的に増大させる、本発明1064の方法。
[本発明1066]
前記免疫調節ポリペプチドが阻害性ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞の活性を阻害する、本発明1063の方法。
[本発明1067]
前記エピトープが自己エピトープであり、かつ前記投与する段階が、前記自己エピトープに特異的なT細胞の活性を選択的に阻害する、本発明1066の方法。
[本発明1068]
個体における感染症を治療する方法であって、前記個体に、有効量の
a)本発明1001の多量体ポリペプチド;または
b)本発明1001の多量体ポリペプチドをコードするヌクレオチド配列を含む1つ以上の組み換え発現ベクター;もしくは
c)本発明1001の多量体ポリペプチドをコードするヌクレオチド配列を含む1つ以上のmRNA
を投与する段階を含み、
前記エピトープが病原体関連エピトープであり、前記免疫調節ポリペプチドが活性化ポリペプチドであり、かつ前記投与する段階が、個体において病原体関連エピトープ特異的T細胞の活性を選択的に調節するのに有効である、方法。
[本発明1069]
前記病原体がウイルス、細菌、または原生動物である、本発明1068の方法。
[本発明1070]
前記投与する段階が皮下投与である、本発明1063から1068のいずれかの方法。
[本発明1071]
前記投与する段階が静脈内投与である、本発明1063から1068のいずれかの方法。
[本発明1072]
前記投与する段階が筋肉内投与である、本発明1063から1068のいずれかの方法。
[本発明1073]
前記投与する段階が全身投与である、本発明1063から1068のいずれかの方法。
[本発明1074]
前記投与する段階が治療部位に対して遠位の投与である、本発明1063から1068のいずれかの方法。
[本発明1075]
前記投与する段階が局所投与である、本発明1063から1068のいずれかの方法。
[本発明1076]
前記投与する段階が治療部位または治療部位近傍での投与である、本発明1063から1068のいずれかの方法。
[本発明1077]
a)本発明1001から1027のいずれかの多量体ポリペプチド;及び
b)薬学的に許容される賦形剤
を含む組成物。
[本発明1078]
a)本発明1028から1034のいずれかの核酸、または本発明1045もしくは1046の組み換え発現ベクター;及び
b)薬学的に許容される賦形剤
を含む組成物。
本明細書で使用される「リーダー配列」は、ヒトB2Mリーダーを含めて、哺乳類細胞によってプロセッシングされうる任意のシグナルペプチドを含む。かかる配列は、当技術分野では周知である。
従来の免疫反応を反復する新規なタンパク質ベースの治療プラットフォーム、すなわち、T細胞活性化用の人工免疫学的シナプス(synTac)を本明細書に記載する。共刺激分子をMHC-エピトープに連結して、正確なT細胞の結合と、MOD分子部位に応じてクローン性T細胞活性化または阻害とを可能にする新規な融合タンパク質である。
本開示は、多量体(例えば、ヘテロ2量体、ヘテロ3量体)ポリペプチドを提供する。本開示は、本開示の多量体ポリペプチドのポリタンパク質前駆体を提供する。本開示は、前駆体遺伝子産物、例えば、本開示の多量体ポリペプチドのポリタンパク質前駆体、及び本開示の多量体ポリペプチドの2つ以上のポリペプチド鎖をコードするmRNA遺伝子産物を提供する。
を含む。
を含む。
本開示の多量体ポリペプチドは、例えばエピトープとMHCポリペプチドとの間、MHCポリペプチドと免疫調節ポリペプチドとの間、またはMHCポリペプチドとIg Fcポリペプチドとの間に挿入されたリンカーペプチドを含むことができる。
等を含むアミノ酸配列を含みうる。
を含む。
本開示の多量体ポリペプチドに存在するエピトープは約4アミノ酸から約25アミノ酸の長さを有することができ、例えば、該エピトープは4アミノ酸(aa)から10aa、10aaから15aa、15aaから20aa、または20aaから25aaの長さを有することができる。例えば、本開示の多量体ポリペプチドに存在するエピトープは、4アミノ酸(aa)、5aa、6aa、7aa、8aa、9aa、10aa、11aa、12aa、13aa、14aa、15aa、16aa、17aa、18aa、19aa、20aa、21aa、22aa、23aa、24aa、または25aaの長さを有することができる。いくつかの場合、本開示の多量体ポリペプチドに存在するエピトープは、5アミノ酸から10アミノ酸、例えば、5aa、6aa、7aa、8aa、9aa、または10aaの長さを有する。
上述の通り、本開示の多量体ポリペプチドは、MHCポリペプチドを含む。本開示のために、「主要組織適合複合体(MHC)ポリペプチド」という用語は、ヒトMHC(ヒト白血球抗原(HLA)とも呼ばれる)ポリペプチド、げっ歯類(例えば、マウス、ラット等)MHCポリペプチド、及び他の哺乳類種(例えば、ウサギ目、非ヒト霊長類、イヌ科、ネコ科、有蹄動物(例えば、ウマ、ウシ、ヒツジ、ヤギ等)等、様々な種のMHCポリペプチドを含むように意図されている。「MHCポリペプチド」という用語は、クラスIのMHCポリペプチド(例えば、β‐2ミクログロブリン及びMHCクラスI重鎖)及びMHCクラスIIポリペプチド(例えば、MHCクラスIIαポリペプチド及びMHCクラスIIβポリペプチド)を含むように意図されている。
のアミノ酸25~365に対する少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含みうる。
に対する少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含みうる。
本開示の多量体ポリペプチドの免疫調節ポリペプチドは、活性化免疫調節ポリペプチドまたは阻害性免疫調節ポリペプチドでありうる。いくつかの場合、本開示の多量体ポリペプチドは、単一の免疫調節ポリペプチドを含む。いくつかの場合、本開示の多量体ポリペプチドは、2つの免疫調節ポリペプチドを含む。いくつかの場合、該2つの免疫調節ポリペプチドは、ポリペプチド鎖内でタンデムになっている。いくつかの場合、該2つの免疫調節ポリペプチドは、別々のポリペプチド鎖中に存在する。いくつかの場合、該2つの免疫調節ポリペプチドは、別々のポリペプチド鎖中に存在して互いにジスルフィド結合されている。
本開示の多量体ポリペプチドは、Fcポリペプチドまたは別の適切な骨格ポリペプチドを含む。
本開示の多量体ポリペプチドのポリペプチド鎖は、上述したものに加えて1つ以上のポリペプチドを含むことができる。適切な追加ポリペプチドとしては、エピトープタグ及び親和性ドメインが挙げられる。該1つ以上の追加ポリペプチドは、本開示の多量体ポリペプチドのポリペプチド鎖のN末端に、本開示の多量体ポリペプチドのポリペプチド鎖のC末端に、または、本開示の多量体ポリペプチドのポリペプチド鎖の内部に含まれうる。
適切なエピトープタグとしては、限定されないが、ヘマグルチニン(HA;例えば、YPYDVPDYA(SEQ ID NO:23);FLAG(例えば、DYKDDDDK(SEQ ID NO:24);c-myc(例えば、EQKLISEEDL;SEQ ID NO:25)等が挙げられる。
親和性ドメインとしては、例えば、同定または精製に有用な、固体の担体に固定化されたもの等の、結合パートナーと相互作用できるペプチド配列が挙げられる。複数の連続するヒスチジン等の単一のアミノ酸をコードするDNA配列は、発現たんぱく質への融合時、ニッケルセファロース等の樹脂カラムへの高親和性結合による該組み換えタンパク質の一段階精製に用いられうる。典型的な親和性ドメインとしては、His5(HHHHH)(SEQ ID NO:26)、HisX6(HHHHHH)(SEQ ID NO:27)、C-myc(EQKLISEEDL)(SEQ ID NO:25)、Flag(DYKDDDDK)(SEQ ID NO:24)、StrepTag(WSHPQFEK)(SEQ ID NO:28)、ヘマグルチニン、例えば、HA Tag(YPYDVPDYA)(SEQ ID NO:23)、グルタチオン‐S‐トランスフェラーゼ(GST)、チオレドキシン、セルロース結合ドメイン、RYIRS(SEQ ID NO:30)、Phe-His-His-Thr(SEQ ID NO:31)、キチン結合ドメイン、S‐ペプチド、T7ペプチド、SH2ドメイン、C末端RNAタグ、
、金属結合ドメイン、例えば、亜鉛結合ドメインまたはカルシウム結合ドメイン、例えば、カルシウム結合タンパク質、例えば、カルモジュリン、トロポニンC、カルシニューリンB、ミオシン軽鎖、リカバリン、S-モジュリン、ビジニン、VILIP、ニューロカルシン、ヒポカルシン、フリクエニン、カルトラクチン、カルパインラージサブユニット、S100タンパク質、パルブアルブミン、カルビンジンD9K、カルビンジンD28K、及びカルレチニン由来のもの、インテイン、ビオチン、ストレプトアビジン、MyoD、Id、ロイシンジッパー配列、及びマルトース結合タンパク質が挙げられる。
本開示の多量体ポリペプチドは、該多量体ポリペプチドに共有結合的に連結した1つ以上の非ポリペプチド部分を含むことができる。適切な非ポリペプチド部分としては、例えば、生体適合性脂肪酸及びそれらの誘導体;ヒドロキシアルキルデンプン(HAS)、例えば、ヒドロキシエチルデンプン(HES);ポリエチレングリコール、;ヒアルロン酸(HA);ヘパロサンポリマー(HEP);ホスホリルコリン系ポリマー;デキストラン;ポリシアル酸(PSA)等が挙げられる。いくつかの場合、該非ポリペプチド部分は、該非ポリペプチド部分を含まない対照多量体ポリペプチドと比較して、該多量体ポリペプチドのインビボ半減期を延ばす。
本開示の多量体ポリペプチドに存在する免疫調節(「MOD」)ポリペプチドの特質に応じて、該多量体ポリペプチドは標的T細胞を活性化または阻害できる。本開示の多量体ポリペプチドは、該多量体ポリペプチドに存在するエピトープ特異的な標的T細胞を選択的に活性化または阻害する。「標的T細胞」としては、エピトープ特異的CD4+T細胞、エピトープ特異的CD8+T細胞が挙げられる。いくつかの場合、該標的CD4+T細胞はヘルパーT細胞(例えば、Th1、Th2、またはTh17細胞)である。いくつかの場合、該標的CD4+T細胞はCD4+/CD25+/FoxP3+制御性T(Treg)細胞である。いくつかの場合、該標的T細胞は、CD8+T細胞であり、細胞毒性T細胞である。いくつかの場合、該標的T細胞は、CD4+T細胞またはCD8+T細胞であることができ一般にCD45RO+である、メモリーT細胞である。いくつかの場合、該標的T細胞はNK-T細胞である。
本開示の多量体ポリペプチドの限定されない例としては以下が挙げられる。
本発明は、第一のB2Mリーダー配列と同一のアミノ酸配列、これに隣接する候補エピトープペプチド、これに隣接する第一のアミノ酸リンカー配列、これに隣接する、ヒト天然B2Mペプチド配列と同一のアミノ酸配列、これに隣接する第二のアミノ酸リンカー配列、これに隣接するT細胞調節ドメインペプチド配列、これに隣接する第三のアミノ酸リンカー、これに隣接する第二のB2Mリーダー配列、これに隣接する、MHC重鎖と同一のアミノ酸配列、これに隣接する、免疫グロブリンFcドメインと同一のアミノ酸配列を含む、組み換えポリペプチドを提供する。
を含む。実施形態において、該第二のアミノ酸リンカーは、
を含む。実施形態において、該第三のアミノ酸リンカーは、
を含む。
実施形態において、該第一のアミノ酸は、50アミノ酸以下から最低5アミノ酸までの任意のアミノ酸配列でよい。実施形態において、該第二のアミノ酸リンカーは、70アミノ酸以下から最低5アミノ酸までの任意のアミノ酸配列でよい。実施形態において、該第三のアミノ酸リンカーは、ウイルス2Aペプチド、または既知のプロテアーゼ開裂能のペプチド(例えば、限定されない実施形態において、フューリン開裂部位、タバコエッチ病ウイルス[TEV]配列、Precissionプロテアーゼ部位、またはトロンビンプロテアーゼ)でよい。実施形態において、該第一のアミノ酸は、
を含む。実施形態において、該第二のアミノ酸リンカーは、
を含む。実施形態において、該第三のアミノ酸リンカーは、
を含む。
;カテプシンBによって開裂される
;エプスタイン‐バーウイルスプロテアーゼによって開裂される
;MMP-3(ストロメライシン)によって開裂される
;MMP-7(マトリライシン)によって開裂される
;MMP-9によって開裂される
;サーモライシン様MMPによって開裂される
;マトリックスメタロプロテイナーゼ2(MMP-2)によって開裂される
;カテプシンLによって開裂される
;カテプシンDによって開裂される
;マトリックスメタロプロテイナーゼ1(MMP-1)によって開裂される
;ウロキナーゼ型プラスミノーゲン活性化因子によって開裂される
;膜型マトリックスメタロプロテイナーゼ1(MT-MMP)によって開裂される
;ストロメライシン3(またはMMP-11)、サーモライシン、フィブロブラストコラゲナーゼ、及びストロメライシン-1によって開裂される
;マトリックスメタロプロテイナーゼ13(コラゲナーゼ-3)によって開裂される
;組織型プラスミノーゲン活性化因子(tPA)によって開裂される
;ヒト前立腺特異的抗原によって開裂される
;カリクレイン(hK3)によって開裂される
;好中球エラスターゼによって開裂される
;並びにカルパイン(カルシウム活性化中性プロテアーゼ)によって開裂される
。適切なタンパク質分解的に開裂可能なリンカーのさらなる例として挙げられるのは、
である。適切なタンパク質分解的に開裂可能なリンカーのさらなる例として挙げられるのは、
である。
その機能的等価物、及びこれらの組合せが挙げられる。いくつかの実施形態では、該リンカーは、ピコルナウイルス2A様リンカー、ブタテッショウウイルス(P2A)のCHYSEL配列、ゾーシア・アシグナウイルス(T2A)、並びにこれらの組合せ、変異体、及び機能的等価物を含む。他の実施形態では、該リンカー配列は、Asp-Val/Ile-Glu-X-Asn-Pro-Gly2A-Pro2Bモチーフを含んでよく、これは該2Aグリシン及び該2Bプロリンの間で開裂する。本開示の意図に関して、
は、「タンパク質分解開裂部位」または「リボソームスキッピングシグナル」(CHYSEL)のどちらかと見なすことができる。例えば、Kim et al. (2011) PLoS ONE 6:e18556参照。該コードポリペプチドが2つのポリペプチド鎖として生成される機序は、該リンカーの自己開裂、リボソームスキッピング、または翻訳のシャントによる可能性がある。機序にかかわらず、本開示の多量体ポリペプチドの該少なくとも2つのポリペプチド鎖は、P2A、T2A、E2A、またはF2A配列を用いて作製されうる。適切なリンカーとしては、
等のアミノ酸配列、またはSEQ ID NO:64~67に規定したアミノ酸配列に対して1~5つのアミノ酸置換を有するアミノ酸配列(例えば、SEQ ID NO:64~67に規定したアミノ酸配列に対して1~5つの保存的アミノ酸置換を有するアミノ酸配列)を含むポリペプチドが挙げられる。適切なリンカーとしては、
等のアミノ酸配列、またはSEQ ID NO:64~67に規定したアミノ酸配列に対して1~10つのアミノ酸置換を有するアミノ酸配列(例えば、SEQ ID NO:64~67に規定したアミノ酸配列に対して1~10つの保存的アミノ酸置換を有するアミノ酸配列)を含むポリペプチドが挙げられる。
組み換えポリペプチドの実施形態において、該候補エピトープは7~20アミノ酸を含む。該組み換えポリペプチドの実施形態において、該エピトープポリペプチドは、MHCクラスIについては5~20アミノ酸である。実施形態において、該エピトープペプチドは、MHCクラスIにいては8~11アミノ酸である。実施形態において、該エピトープペプチドは、MHCクラスIIについては5~40アミノ酸である。実施形態において、該エピトープペプチドは、MHCクラスIIについては13~17アミノ酸である。実施形態において、該エピトープペプチドは、任意の天然由来もしくは変異ヒト配列、または任意の病原体由来配列である。
組み換えポリペプチドの実施形態において、該第一のB2Mリーダー配列及び/または第二のB2Mリーダー配列は、ヒトB2Mリーダー配列の配列を有する。
に対する少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含む。
を含む。
B2M残基12、HLA残基236;
B2M残基12、HLA残基237;
B2M残基8、HLA残基234;
B2M残基10、HLA残基235;
B2M残基24、HLA残基236;
B2M残基28、HLA残基232;
B2M残基98、HLA残基192;
B2M残基99、HLA残基234;
B2M残基3、HLA残基120;
B2M残基31、HLA残基96;
B2M残基53、HLA残基35;
B2M残基60、HLA残基96;
B2M残基60、HLA残基122;
B2M残基63、HLA残基27;
B2M残基Arg3、HLA残基Gly120;
B2M残基His31、HLA残基Gln96;
B2M残基Asp53、HLA残基Arg35;
B2M残基Trp60、HLA残基Gln96;
B2M残基Trp60、HLA残基Asp122;
B2M残基Tyr63、HLA残基Tyr27;
B2M残基Lys6、HLA残基Glu232;
B2M残基Gln8、HLA残基Arg234;
B2M残基Tyr10、HLA残基Pro235;
B2M残基Ser11、HLA残基Gln242;
B2M残基Asn24、HLA残基Ala236;
B2M残基Ser28、HLA残基Glu232;
B2M残基Asp98、HLA残基His192;及び
B2M残基Met99、HLA残基Arg234
(B2M及びHLA配列についてはSEQ ID NO:4及びSEQ ID NO:5参照)。
第一のリンカー部位Gly2、重鎖(HLA)部位Tyr84;
軽鎖(B2M)部位Arg12、HLA Ala236;及び/または
B2M残基Arg12、HLA残基Gly237。
組み換えポリペプチドの実施形態において、該免疫グロブリンFcドメインは、IgGのFcドメインである。該組み換えポリペプチドの実施形態において、該免疫グロブリンFcドメインは、IgAのFcドメインである。該組み換えポリペプチドの実施形態において、該免疫グロブリンFcドメインは、IgMのFcドメインである。該組み換えポリペプチドの実施形態において、該免疫グロブリンFcドメインは、ヒト免疫グロブリンのFcドメインである。該組み換えポリペプチドの実施形態において、該免疫グロブリンFcドメインは、IgG1のFcドメインである。
組み換えポリペプチドの実施形態において、該T細胞調節ドメインは阻害性ドメインである。
組み換えポリペプチドの実施形態において、これらはさらにそのC末端に隣接するHis-8タグを含む。
本明細書に記載の組み換えポリペプチドのいずれかをコードする核酸を提供する。実施形態において、該核酸はDNAである。実施形態において、該核酸はcDNAである。実施形態において、該核酸はRNAである。実施形態において、該核酸はmRNAである。
本開示は、本開示の多量体ポリペプチドをコードするヌクレオチド配列を含む核酸を提供する。上述の通り、いくつかの場合、本開示の多量体ポリペプチドの個々のポリペプチド鎖は、別々の核酸でコードされる。いくつかの場合、本開示の多量体ポリペプチドの別々のポリペプチド鎖をコードするヌクレオチド配列は、転写調節因子、例えば、真核細胞中で機能的であるプロモーター等の、構成的プロモーターまたは誘導プロモーターでありうるプロモーターに作動可能に連結されている。
本開示は、本開示の多量体ポリペプチドの少なくとも該第一のポリペプチド及び該第二のポリペプチドをコードするヌクレオチド配列を含む核酸を提供する。本開示の多量体ポリペプチドが第一、第二、及び第三のポリペプチドを含むいくつかの場合、該核酸は、該第一、第二、及び第三のポリペプチドをコードするヌクレオチド配列を含む。いくつかの場合、本開示の多量体ポリペプチドの該第一のポリペプチド及び該第二のポリペプチドをコードするヌクレオチド配列は、該第一のポリペプチドをコードする該ヌクレオチド配列と該第二のポリペプチドをコードする該ヌクレオチド該列との間に挿入されたタンパク質分解的に開裂可能なリンカーを含む。いくつかの場合、本開示の多量体ポリペプチドの該第一のポリペプチド及び該第二のポリペプチドをコードするヌクレオチド配列は、該第一のポリペプチドをコードするヌクレオチド配列と該第二のポリペプチドをコードするヌクレオチド配列との間に挿入された配列内リボソーム進入部位(IRES)を含む。いくつかの場合、本開示の多量体ポリペプチドの該第一のポリペプチド及び該第二のポリペプチドをコードするヌクレオチド配列は、該第一のポリペプチドをコードするヌクレオチド配列と該第二のポリペプチドをコードするヌクレオチド該列との間に挿入されたリボソームスキッピングシグナル(またはシス作用性ヒドロラーゼ因子、CHYSEL)を含む。核酸の実施例は後述するが、タンパク質分解的に開裂可能なリンカーが、本開示の多量体ポリペプチドの該第一のポリペプチド及び該第二のポリペプチドをコードするヌクレオチド配列の間に配置され;これら実施形態のいずれかにおいて、IRESまたはリボソームスキッピングシグナルを該タンパク質分解的に開裂可能なリンカーをコードするヌクレオチド配列の代わりに用いることができる。
本開示は、本開示の核酸を含む組み換え発現ベクターを提供する。いくつかの場合、該組み換え発現ベクターは、非ウイルスベクターである。いくつかの場合、該組み換え発現ベクターは、ウイルス構築物、例えば、組み換えアデノ随伴ウイルス構築物(例えば、米国特許第7,078,387号参照)、組み換えアデノウイルス構築物、組み換えレンチウイルス構築物、組み換えレトロウイルス構築物、非組込みウイルスベクター等である。
本明細書に記載の組み換えポリペプチドのいずれかをコードする核酸で形質転換された細胞を提供する。該組み換えポリペプチドのいずれかをコードする核酸で形質転換されうる細胞の例としては、限定されないが、ヒト胎児腎臓(HEK)、チャイニーズハムスター卵巣(CHO)、NS0(マウス骨髄腫)細胞、ヒト羊膜細胞(CAP、CAP-T)を含めた単離哺乳類細胞、酵母細胞(限定されないが、S. セレビシエ(S. cerevisiae)、ピキア・パストリス(Pichia pastoris)等)、植物細胞(限定されないが、タバコNT1、BY-2等)、昆虫細胞(限定されないが、SF9、S2、SF21、Tni(例えば、High5)等)、または細菌細胞(限定されないが、大腸菌(E. coli)等)が挙げられる。
本開示は、本開示の多量体ポリペプチドを産生する方法を提供する。本方法は、概して、該多量体ポリペプチドをコードするヌクレオチド配列を含む組み換え発現ベクターによって遺伝子改変されている宿主細胞を培地中で培養する段階;ならびに遺伝子改変された該宿主細胞及び/または該培地から該多量体ポリペプチドを単離する段階を含む。該多量体ポリペプチドをコードするヌクレオチド配列を含む組み換え発現ベクターによって遺伝子改変されている宿主細胞は、「発現宿主」とも称される。上述の通り、いくつかの場合、本開示の多量体ポリペプチドの個々のポリペプチド鎖は、別々の組み換え発現ベクターでコードされる。いくつかの場合、本開示の多量体ポリペプチドのすべてのポリペプチドは、単一の組み換え発現ベクターでコードされる。
本開示は、薬学的組成物を含めた、本開示の多量体ポリペプチドを含む組成物を提供する。本開示は、薬学的組成物を含めた、本開示の核酸または組み換え発現ベクターを含む組成物を提供する。
本開示の組成物は、本開示の多量体ポリペプチドに加えて、以下のうちの1つ以上を含むことができる:塩、例えば、NaCl、MgCl、KCl、MgSO4等;緩衝剤、例えば、トリス緩衝液、N‐(2‐ヒドロキシエチル)ピペラジン‐N'‐(2‐エタンスルホン酸)(HEPES)、2‐(N‐モルホリノ)エタンスルホン酸(MES)、2‐(N‐モルホリノ)エタンスルホン酸ナトリウム塩(MES)、3‐(N‐モルホリノ)プロパンスルホン酸(MOPS)、N‐トリス[ヒドロキシメチル]メチル‐3‐アミノプロパンスルホン酸(TAPS)等;安定剤;界面活性剤、例えば、非イオン性界面活性剤、例えばTween-20等;プロテアーゼインヒビター;グリセロール等。
本開示は、本開示の核酸または組み換え発現ベクターを含む組成物、例えば薬学的組成物を提供する。各種の薬学的に許容される賦形剤が当技術分野で周知であり、本明細書で詳述する必要はない。薬学的に許容される賦形剤は、様々な出版物に十分に記載されており、例えば、A. Gennaro (2000) "Remington: The Science and Practice of Pharmacy"第20版、Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H.C. Anselら編、第7版、Lippincott, Williams, & Wilkins;及びHandbook of Pharmaceutical Excipients (2000) A.H. Kibbeら編、第3版、Amer. Pharmaceutical Assoc.が挙げられる。
エピトープペプチドを認識するT細胞クローンを阻害する方法であって、該クローンのT細胞を、T細胞クローンの阻害に有効な量の本明細書に記載の組み換えペプチドと接触させる段階を含み、該組み換えペプチドが該エピトープペプチドを含み、かつ、阻害性ドメインであるT細胞調節ドメインを含む、方法も提供される。
エピトープペプチドを認識する自己反応性T細胞クローンの阻害による自己免疫疾患を治療する方法であって、該クローンのT細胞を、自己免疫疾患の治療に有効な量の本明細書に記載の組み換えペプチドと接触させる段階を含み、該組み換えペプチドが、該エピトープペプチドを含み、かつ、阻害性ドメインであるT細胞調節ドメインを含む、方法も提供される。
適切な製剤は上述の通りであり、適切な製剤は薬学的に許容される賦形剤を含む。いくつかの場合、適切な製剤は、a)本開示の多量体ポリペプチド;及びb)薬学的に許容される賦形剤を含む。いくつかの場合、適切な製剤は、a)本開示の多量体ポリペプチドをコードするヌクレオチド配列を含む核酸;及びb)薬学的に許容される賦形剤を含み;いくつかの場合、該核酸はmRNAである。いくつかの場合、適切な製剤は、a)本開示の多量体ポリペプチドの第一のポリペプチドをコードするヌクレオチド配列を含む第一の核酸;b)本開示の多量体ポリペプチドの第二のポリペプチドをコードするヌクレオチド配列を含む第二の核酸;及びc)薬学的に許容される賦形剤を含む。いくつかの場合、適切な製剤は、a)本開示の多量体ポリペプチドをコードするヌクレオチド配列を含む組み換え発現ベクター;及びb)薬学的に許容される賦形剤を含む。いくつかの場合、適切な製剤は、a)本開示の多量体ポリペプチドの第一のポリペプチドをコードするヌクレオチド配列を含む第一の組み換え発現ベクター;b)本開示の多量体ポリペプチドの第二のポリペプチドをコードするヌクレオチド配列を含む第二の組み換え発現ベクター;及びc)薬学的に許容される賦形剤を含む。
適切な用量は、様々な臨床学的要因を基に、主治医または他の有資格医療関係者によって決定されうる。医療分野で周知のように、いずれの患者に対する用量も、患者のサイズ、体表面積、年齢、投与される特定のポリペプチドまたは核酸、患者の性別、投与時間及び経路、全身状態、並びに同時投与される他の薬物等の多くの要因による。本開示の多量体ポリペプチドは、1回の投与当たり1ng/kg体重~20mg/kg体重、例えば、0.1mg/kg体重~10mg/kg体重、例えば、0.5mg/kg体重~5mg/kg体重の量で投与されうるが;しかしながら、特に上記の要因を考慮して、この典型的範囲を下回るまたは上回る用量も想定される。このレジメンが持続注入の場合、体重1kg当たり1分間に1μg~10mgの範囲でもよい。
活性物質(本開示の多量体ポリペプチド、本開示の核酸、または本開示の組み換え発現ベクター)は、インビボ及びエキソビボ法、並びに全身及び局所的投与経路を含めて、薬物送達に適した任意の可能な方法及び経路を用いて個体に投与される。
本開示の方法での治療に適した対象としては、がんであると診断された個体、がんの治療を受けたものの、該治療に反応しなかった個体、及びがんの治療を受け当初は応答したものの、その後該治療が効かなくなった個体を含めて、がんを有する個体が挙げられる。本開示の方法での治療に適した対象としては、感染症であると診断された個体、及び感染症に対する治療を受けたものの、該治療に応答しなかった個体を含めて、感染症(例えば、細菌、ウイルス、原生動物等の病原体による感染症)を有する個体が挙げられる。本開示の方法での治療に適した対象としては、細菌感染症であると診断された個体、及び細菌感染症に対する治療を受けたものの、該治療に応答しなかった個体を含めて、細菌感染症を有する個体が挙げられる。本開示の方法での治療に適した対象としては、ウイルス感染症であると診断された個体、及びウイルス感染症に対する治療を受けたものの、該治療に応答しなかった個体を含めて、ウイルス感染症を有する個体が挙げられる。本開示の方法での治療に適した対象としては、自己免疫疾患であると診断された個体、及び自己免疫疾患に対する治療を受けたものの、該治療に応答しなかった個体を含めて、自己免疫疾患を有する個体が挙げられる。
本開示の態様は、新規なタンパク質ベースの治療プラットフォーム、「synTac」に関し、これは、免疫学的シナプスの相互作用特異性及び調節シグナルを模倣する。synTacは、共刺激分子をMHC-エピトープに連結して、正確なT細胞の結合及びクローナルT細胞の活性化または阻害(図1)を可能にする、すなわち身体の天然の反応の可溶性型を可能にする、融合タンパク質である。このようにして、synTacは、エピトープ、二重特異性抗体、可溶性共刺激因子、及びADCの最良の点を組み合わせる。synTacは、MHC-エピトープによる高度に特異的な細胞標的化を可能にし、「一本鎖融合」設計で、遊離エピトープの交差提示を許さない(図2A~2C)。T細胞調節ドメイン(本明細書では「MOD」としても記載される)も共有結合的に結合され、該共刺激性結合の特質に応じて、活性化または阻害のどちらかを誘発する。これは、全般的ではなく抗原特異的なT細胞応答を誘発する。特に、該MODは、任意の既知の抗体、抗体フラグメント、共刺激分子、または文献で確認された他のペイロード(サイトカイン、毒素等)を含むことができ、T細胞への作用を発揮するために内在化させる必要がない。さらに、同じ細胞の表面に両方の標的が存在するため、従来の二重特異性抗体の「スペーシング問題」を解消する。
刺激性MOD(4-1BBL)受容体3量体発現:活性4-1BBL担持synTac生成のための最初の取り組みにより、軽鎖連結変異体(図3A)が活用された。これは、単一の形質移入として発現され(すべての断片が単一のプラスミドにコードされた)、ウイルスP2A配列によって分割され、かつ、高度に発現した十分に折りたたまれたタンパク質をもたらした(図6B、レーン5)。ゲルろ過プロファイルに加えて多角度光散乱(MALS)データによって、この最初の型は十分に折りたたまれた2量体である(図10B、図9Bに示す通り)ことが示唆された。TNFファミリーのリガンドである4-1BBLは、完全な活性のために3量体化(例えば、同じタンパク質の3つのコピー、すなわちホモ3量体)が必要である。3量体化を達成するため、この4-1BBL担持synTac構築物及び「遊離」4-1BBL(親和性タグを持たない4-1BBL単独[残基50~254、膜近位及びTNF相同ドメイン含有、図10A;図9A])をともに同一の細胞で発現させ(例えば、共発現)、図10Cに示すように天然の集合及び3量体化を可能にした(元のsynTac構築物が黒、遊離のBBLがグレー)(図9A及び図9B構築物の共発現)。ゲルろ過クロマトグラフィーに加えて多角度光散乱(MALS)データによって、この新型が所望の3量体であることが裏付けられた(図11A~11B、synTac番号40+51として表示)。後述(MOD最適化)するように、この4-1BBL構築物は、さらに発現及び精製プロファイルを改善して安定性及び再現性を向上させるように、さらに最適化されうる。
Claims (78)
- a)N末端からC末端の順に
i)エピトープ;
ii)第一の主要組織適合複合体(MHC)ポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)任意で免疫グロブリン(Ig)Fcポリペプチドまたは非Ig骨格
を含む第二のポリペプチド
を含み、
A)前記第一のポリペプチドのC末端に;
B)前記第二のポリペプチドのN末端に;
C)前記第二のポリペプチドのC末端に;または
D)前記第一ポリペプチドのC末端及び前記第二のポリペプチドのN末端に
存在する1つ以上の免疫調節ドメインを含む、多量体ポリペプチド。 - a)N末端からC末端の順に
i)エピトープ;
ii)第一のMHCポリペプチド;及び
iii)免疫調節ドメイン
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)Ig Fcポリペプチド
を含む第二のポリペプチド
を含む、請求項1に記載の多量体ポリペプチド。 - a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)免疫調節ドメイン;
iii)第二のMHCポリペプチド;及び
ii)免疫グロブリン(Ig)Fcポリペプチド
を含む第二のポリペプチド
を含む、請求項1に記載の多量体ポリペプチド。 - a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)Ig Fcポリペプチド;及び
iii)免疫調節ドメイン
を含む第二のポリペプチド
を含む、請求項1に記載の多量体ポリペプチド。 - a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)免疫調節ドメイン
を含む第二のポリペプチド
を含む、請求項1に記載の多量体ポリペプチド。 - a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)免疫調節ドメイン;及び
ii)第二のMHCポリペプチド
を含む第二のポリペプチド
を含む、請求項1に記載の多量体ポリペプチド。 - a)N末端からC末端の順に
i)エピトープ;
ii)第一のMHCポリペプチド;及び
iii)免疫調節ドメイン
を含む第一のポリペプチド、並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド
を含む第二のポリペプチド
を含む、請求項1に記載の多量体ポリペプチド。 - 前記非Ig骨格が、XTENポリペプチド、トランスフェリンポリペプチド、Fc受容体ポリペプチド、エラスチン様ポリペプチド、シルク様ポリペプチド、またはシルクエラスチン様ポリペプチドである、請求項1に記載の多量体ポリペプチド。
- 前記第一のMHCポリペプチドがβ2ミクログロブリンポリペプチドであり;かつ前記第二のMHCポリペプチドがMHCクラスI重鎖ポリペプチドである、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 前記β2ミクログロブリンポリペプチドが、SEQ ID NO:4に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、請求項9に記載の多量体ポリペプチド。
- 前記MHCクラスI重鎖ポリペプチドが、HLA-A、HLA-B、またはHLA-Cの重鎖である、請求項8に記載の多量体ポリペプチド。
- 前記MHCクラスI重鎖ポリペプチドが、SEQ ID NO:5に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、請求項9に記載の多量体ポリペプチド。
- 前記第一のMHCポリペプチドが、MHCクラスIIα鎖ポリペプチドであり;かつ前記第二のMHCポリペプチドが、MHCクラスIIβ鎖ポリペプチドである、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 前記エピトープがT細胞エピトープである、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- Fcポリペプチドを含み、かつ、前記Ig Fcポリペプチドが、IgG1 Fcポリペプチド、IgG2 Fcポリペプチド、IgG3 Fcポリペプチド、IgG4 Fcポリペプチド、IgA Fcポリペプチド、またはIgM Fcポリペプチドである、請求項1から7のいずれか一項に記載の多量体ポリペプチド。
- 前記Ig Fcポリペプチドが、図24A~24Cに示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、請求項15に記載の多量体ポリペプチド。
- 前記第一のポリペプチド及び前記第二のポリペプチドが非共有結合的に会合している、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 前記第一のポリペプチド及び前記第二のポリペプチドが共有結合的に連結されている、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 前記共有結合がジスルフィド結合による、請求項13に記載の多量体ポリペプチド。
- 前記第一のMHCポリペプチド、または前記エピトープと前記第一のMHCポリペプチドとの間のリンカーが、第一のCys残基を提供するためのアミノ酸置換を含み、かつ前記第二のMHCポリペプチドが、第二のCys残基を提供するためのアミノ酸置換を含み、かつ、前記ジスルフィド結合が前記第一のCys残基と前記第二のCys残基との間に存在する、請求項19に記載の多量体ポリペプチド。
- 前記エピトープと前記第一のMHCポリペプチドとの間に挿入された第一のリンカーを含む、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 前記免疫調節ポリペプチドが、4-1BBLポリペプチド、B7-1ポリペプチド、B7-2ポリペプチド、ICOS-Lポリペプチド、OX-40Lポリペプチド、CD80ポリペプチド、CD86ポリペプチド、PD-L1ポリペプチド、FasLポリペプチド、及びPD-L2ポリペプチドから選択される、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 2つ以上の免疫調節ポリペプチドを含む、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 前記2つ以上の免疫調節ポリペプチドがタンデムになっている、請求項23に記載の多量体ポリペプチド。
- 第三のポリペプチドを含み、前記第三のポリペプチドが、前記第一のポリペプチドまたは前記第二のポリペプチドの前記免疫調節ポリペプチドに対する少なくとも90%のアミノ酸配列同一性を有するアミノ酸配列を含む免疫調節ポリペプチドを含む、請求項1から8のいずれか一項に記載の多量体ポリペプチド。
- 前記第三のポリペプチドが、前記第一のポリペプチドに共有結合的に連結されている、請求項25に記載の多量体ポリペプチド。
- 前記第二のポリペプチドが、N末端からC末端の順に
i)前記第二のMHCポリペプチド;
ii)前記Ig Fcポリペプチド;及び
iii)親和性タグ
を含む、請求項1から7のいずれか一項に記載の多量体ポリペプチド。 - i)組み換えポリペプチドが、N末端からC末端の順に
a)エピトープ;
b)第一の主要組織適合複合体(MHC)ポリペプチド;
c)免疫調節ポリペプチド;
d)タンパク質分解的に開裂可能なリンカー、もしくはリボソームスキッピングシグナル;
e)第二のMHCポリペプチド;及び
f)免疫グロブリン(Ig)Fcポリペプチド
を含むか、または
ii)前記組み換えポリペプチドが、N末端からC末端の順に
a)エピトープ;
b)第一のMHCポリペプチド;
c)タンパク質分解的に開裂可能なリンカー、もしくはリボソームスキッピングシグナル;
d)免疫調節ポリペプチド;
e)第二のMHCポリペプチド;及び
f)Ig Fcポリペプチド
を含む、
前記組み換えポリペプチドをコードするヌクレオチド配列を含む核酸。 - 前記第一のMHCポリペプチドがβ2ミクログロブリンポリペプチドであり;かつ前記第二のMHCポリペプチドがMHCクラスI重鎖ポリペプチドである、請求項28に記載の核酸。
- 前記β2ミクログロブリンポリペプチドが、SEQ ID NO:4に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、請求項29に記載の核酸。
- 前記MHCクラスI重鎖ポリペプチドが、HLA-A、HLA-B、またはHLA-Cの重鎖である、請求項28に記載の核酸。
- 前記MHCクラスI重鎖ポリペプチドが、SEQ ID NO:5に示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、請求項31に記載の核酸。
- 前記第一のMHCポリペプチドがMHCクラスIIα鎖ポリペプチドであり;かつ前記第二のMHCポリペプチドがMHCクラスIIβ鎖ポリペプチドである、請求項28に記載の核酸。
- 前記エピトープがT細胞エピトープである、請求項28に記載の核酸。
- 前記Ig Fcポリペプチドが、IgG1 Fcポリペプチド、IgG2 Fcポリペプチド、IgG3 Fcポリペプチド、IgG4 Fcポリペプチド、IgA Fcポリペプチド、またはIgM Fcポリペプチドである、請求項28に記載の核酸。
- 前記Ig Fcポリペプチドが、図24A~24Cに示すアミノ酸配列に対する少なくとも85%のアミノ酸配列同一性を有するアミノ酸配列を含む、請求項35に記載の核酸。
- 前記免疫調節ポリペプチドが、4-1BBLポリペプチド、B7-1ポリペプチド、B7-2ポリペプチド、ICOS-Lポリペプチド、OX-40Lポリペプチド、CD80ポリペプチド、CD86ポリペプチド、PD-L1ポリペプチド、FasLポリペプチド、及びPD-L2ポリペプチドから選択される、請求項28に記載の核酸。
- 前記免疫調節ポリペプチドが、CD7、CD30L、CD40、CD70、CD83、HLA-G、MICA、MICB、HVEM、リンホトキシンβ受容体、3/TR6、ILT3、ILT4、及びHVEMから選択される、請求項27に記載の核酸。
- 前記組み換えポリペプチドが、N末端からC末端の順に
a)第一のリーダーペプチド;
b)前記エピトープ;
c)前記第一のMHCポリペプチド;
d)前記免疫調節ポリペプチド;
e)前記タンパク質分解的に開裂可能なリンカーまたは前記リボソームスキッピングシグナル;
f)第二のリーダーペプチド;
g)前記第二のMHCポリペプチド;及び
h)前記免疫グロブリン(Ig)Fcポリペプチド
を含む、請求項28に記載の核酸。 - 前記第一のリーダーペプチド及び前記第二のリーダーペプチドがβ2-Mリーダーペプチドである、請求項40に記載の核酸。
- 前記ヌクレオチド配列が転写調節因子に作動可能に連結されている、請求項28に記載の核酸。
- 前記転写調節因子が、真核細胞中で機能的であるプロモーターである、請求項42に記載の核酸。
- 前記第一のMHCポリペプチド、または前記エピトープと前記第一のMHCポリペプチドとの間のリンカーが、第一のCys残基を提供するためのアミノ酸置換を含み、かつ前記第二のMHCポリペプチドが、第二のCys残基を提供するためのアミノ酸置換を含み、かつ、前記第一のCys残基及び前記第二のCys残基が、前記第一のMHCポリペプチドと前記第二のMHCポリペプチドとの間にジスルフィド結合を提供する、請求項28に記載の核酸。
- 請求項28から44のいずれか一項に記載の核酸を含む、組み換え発現ベクター。
- ウイルスベクターまたは非ウイルスベクターである、請求項45に記載の組み換え発現ベクター。
- 請求項45に記載の組み換え発現ベクターによって遺伝子改変された宿主細胞。
- インビトロである、請求項47に記載の宿主細胞。
- 内因性MHCβ2ミクログロブリンポリペプチドを産生しないように遺伝子改変されている、請求項47に記載の宿主細胞。
- Tリンパ球である、請求項47に記載の宿主細胞。
- a)N末端からC末端の順に
i)エピトープ;
ii)第一のMHCポリペプチド;及び
iii)免疫調節ドメイン
を含む第一のポリペプチドをコードするヌクレオチド配列を含む第一の核酸;並びに
b)N末端からC末端の順に
i)第二のMHCポリペプチド;及び
ii)Ig Fcポリペプチド
を含む第二のポリペプチドをコードするヌクレオチド配列を含む第一の核酸
を含む、組成物。 - a)N末端からC末端の順に
i)エピトープ;及び
ii)第一のMHCポリペプチド
を含む第一のポリペプチドをコードするヌクレオチド配列を含む第一の核酸;並びに
b)N末端からC末端の順に
i)免疫調節ドメイン
ii)第二のMHCポリペプチド;及び
iii)Ig Fcポリペプチド
を含む第二のポリペプチドをコードするヌクレオチド配列を含む第一の核酸
を含む、組成物。 - 前記第一の核酸及び/または前記第二の核酸が組み換え発現ベクター内に存在する、請求項51または52に記載の組成物。
- 請求項51から53のいずれか一項に記載の組成物によって遺伝子改変された宿主細胞。
- a)47または54の宿主細胞が請求項1に記載の多量体ポリペプチドを合成するような条件下で、前記宿主細胞を培地中のインビトロで培養する段階;ならびに
b)前記宿主細胞から及び/または前記培地から前記多量体ポリペプチドを単離する段階
を含む、前記多量体ポリペプチドを産生する方法。 - 前記第二のポリペプチドが親和性タグを含み、かつ、前記単離する段階が、前記細胞によって産生された前記多量体ポリペプチドを前記親和性タグの結合パートナーと接触させることを含み、ここで前記結合パートナーが固定化されており、それによって前記多量体ポリペプチドを固定化する、請求項55に記載の方法。
- 固定化された前記多量体ポリペプチドを溶出する段階を含む、請求項55に記載の方法。
- エピトープ特異的T細胞の活性を選択的に調節する方法であって、前記T細胞を、請求項1に記載の多量体ポリペプチドと接触させる段階を含み、前記接触させる段階が、前記エピトープ特異的T細胞の活性を選択的に調節する、方法。
- 前記免疫調節ポリペプチドが活性化ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞を活性化する、請求項58に記載の方法。
- 前記免疫調節ポリペプチドが阻害ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞を阻害する、請求項58に記載の方法。
- 前記接触させる段階がインビトロである、請求項58に記載の方法。
- 前記接触させる段階がインビボである、請求項58に記載の方法。
- 個体におけるエピトープ特異的T細胞の活性を選択的に調節する方法であって、前記個体に、個体におけるエピトープ特異的T細胞の活性を選択的に調節するのに有効な請求項1に記載の多量体ポリペプチドの有効量を投与する段階を含む、方法。
- 前記免疫調節ポリペプチドが活性化ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞を活性化する、請求項63に記載の方法。
- 前記エピトープががん関連エピトープであり、かつ前記投与する段階が、前記がん関連エピトープに特異的なT細胞の活性を選択的に増大させる、請求項64に記載の方法。
- 前記免疫調節ポリペプチドが阻害性ポリペプチドであり、かつ前記多量体ポリペプチドが前記エピトープ特異的T細胞の活性を阻害する、請求項63に記載の方法。
- 前記エピトープが自己エピトープであり、かつ前記投与する段階が、前記自己エピトープに特異的なT細胞の活性を選択的に阻害する、請求項66に記載の方法。
- 個体における感染症を治療する方法であって、前記個体に、有効量の
a)請求項1に記載の多量体ポリペプチド;または
b)請求項1に記載の多量体ポリペプチドをコードするヌクレオチド配列を含む1つ以上の組み換え発現ベクター;もしくは
c)請求項1に記載の多量体ポリペプチドをコードするヌクレオチド配列を含む1つ以上のmRNA
を投与する段階を含み、
前記エピトープが病原体関連エピトープであり、前記免疫調節ポリペプチドが活性化ポリペプチドであり、かつ前記投与する段階が、個体において病原体関連エピトープ特異的T細胞の活性を選択的に調節するのに有効である、方法。 - 前記病原体がウイルス、細菌、または原生動物である、請求項68に記載の方法。
- 前記投与する段階が皮下投与である、請求項63から68のいずれか一項に記載の方法。
- 前記投与する段階が静脈内投与である、請求項63から68のいずれか一項に記載の方法。
- 前記投与する段階が筋肉内投与である、請求項63から68のいずれか一項に記載の方法。
- 前記投与する段階が全身投与である、請求項63から68のいずれか一項に記載の方法。
- 前記投与する段階が治療部位に対して遠位の投与である、請求項63から68のいずれか一項に記載の方法。
- 前記投与する段階が局所投与である、請求項63から68のいずれか一項に記載の方法。
- 前記投与する段階が治療部位または治療部位近傍での投与である、請求項63から68のいずれか一項に記載の方法。
- a)請求項1から27のいずれか一項に記載の多量体ポリペプチド;及び
b)薬学的に許容される賦形剤
を含む組成物。 - a)請求項28から34のいずれか一項に記載の核酸、または請求項45もしくは46に記載の組み換え発現ベクター;及び
b)薬学的に許容される賦形剤
を含む組成物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462013715P | 2014-06-18 | 2014-06-18 | |
| US62/013,715 | 2014-06-18 | ||
| JP2020009921A JP6995151B2 (ja) | 2014-06-18 | 2020-01-24 | synTacポリペプチド及びその使用 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020009921A Division JP6995151B2 (ja) | 2014-06-18 | 2020-01-24 | synTacポリペプチド及びその使用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022046544A true JP2022046544A (ja) | 2022-03-23 |
| JP7331075B2 JP7331075B2 (ja) | 2023-08-22 |
Family
ID=54936224
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016565693A Active JP6652932B2 (ja) | 2014-06-18 | 2015-06-15 | synTacポリペプチド及びその使用 |
| JP2019192453A Active JP6652680B2 (ja) | 2014-06-18 | 2019-10-23 | synTacポリペプチド及びその使用 |
| JP2020009921A Active JP6995151B2 (ja) | 2014-06-18 | 2020-01-24 | synTacポリペプチド及びその使用 |
| JP2021202405A Active JP7331075B2 (ja) | 2014-06-18 | 2021-12-14 | synTacポリペプチド及びその使用 |
Family Applications Before (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016565693A Active JP6652932B2 (ja) | 2014-06-18 | 2015-06-15 | synTacポリペプチド及びその使用 |
| JP2019192453A Active JP6652680B2 (ja) | 2014-06-18 | 2019-10-23 | synTacポリペプチド及びその使用 |
| JP2020009921A Active JP6995151B2 (ja) | 2014-06-18 | 2020-01-24 | synTacポリペプチド及びその使用 |
Country Status (16)
| Country | Link |
|---|---|
| US (5) | US20170058015A1 (ja) |
| EP (3) | EP3483179B1 (ja) |
| JP (4) | JP6652932B2 (ja) |
| KR (1) | KR102252119B1 (ja) |
| CN (3) | CN106456733B (ja) |
| AU (3) | AU2015277460B2 (ja) |
| CA (1) | CA2947489A1 (ja) |
| DK (2) | DK3157552T3 (ja) |
| ES (2) | ES2770330T3 (ja) |
| HU (2) | HUE047255T2 (ja) |
| IL (3) | IL248979B (ja) |
| PL (2) | PL3157552T3 (ja) |
| PT (2) | PT3157552T (ja) |
| SG (2) | SG11201609876TA (ja) |
| TW (3) | TWI795740B (ja) |
| WO (1) | WO2015195531A2 (ja) |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102208505B1 (ko) | 2012-12-11 | 2021-01-27 | 앨버트 아인슈타인 컬리지 오브 메디신 | 고처리량 수용체:리간드 확인을 위한 방법 |
| KR20180132663A (ko) * | 2016-03-02 | 2018-12-12 | 큐 바이오파마, 인크. | T-세포 조절 다량체 폴리펩타이드 및 이의 사용 방법 |
| AU2017225787B2 (en) * | 2016-03-03 | 2021-09-23 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptides and methods of use thereof |
| CA3022331A1 (en) * | 2016-05-18 | 2017-11-23 | Albert Einstein College Of Medicine, Inc. | Variant pd-l1 polypeptides, t-cell modulatory multimeric polypeptides, and methods of use thereof |
| SG11201808552XA (en) * | 2016-05-18 | 2018-10-30 | Cue Biopharma Inc | T-cell modulatory multimeric polypeptides and methods of use thereof |
| EP3497134A4 (en) * | 2016-08-11 | 2020-01-15 | The Council of the Queensland Institute of Medical Research | IMMUNE MODULATION COMPOUNDS |
| AU2017379900A1 (en) | 2016-12-22 | 2019-06-13 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptides and methods of use thereof |
| WO2018129474A1 (en) * | 2017-01-09 | 2018-07-12 | Cue Biopharma, Inc. | T-cell modulatory multimeric polypeptides and methods of use thereof |
| CN111010875B (zh) | 2017-03-15 | 2024-04-05 | 库尔生物制药有限公司 | 用于调节免疫应答的方法 |
| WO2018187190A1 (en) * | 2017-04-06 | 2018-10-11 | Albert Einstein College Of Medicine, Inc. | Precision activation of hiv-specific ctls to eliminate reactived latent t cells |
| GB2588249B (en) * | 2017-06-12 | 2023-01-04 | Sinai Health Sys | Allograft tolerance without the need for systemic immune suppression |
| CN107266581B (zh) * | 2017-06-13 | 2021-07-09 | 四川大学 | 藏猪il-12重组质粒增强pcv2疫苗免疫佐剂的制备方法及应用 |
| CN111278864A (zh) * | 2017-09-07 | 2020-06-12 | 库尔生物制药有限公司 | 抗原呈递多肽及其使用方法 |
| CA3070484A1 (en) * | 2017-09-07 | 2019-03-14 | Cue Biopharma, Inc. | Multimeric t-cell modulatory polypeptides and methods of use thereof |
| TW201925235A (zh) * | 2017-09-07 | 2019-07-01 | 美商信號生物製藥公司 | 具有化學結合位點之抗原呈現多肽及其使用方法 |
| CN111315768A (zh) * | 2017-09-07 | 2020-06-19 | 库尔生物制药有限公司 | 具有缀合位点的t细胞调节性多聚体多肽及其使用方法 |
| TW201925241A (zh) * | 2017-11-30 | 2019-07-01 | 美商格里佛診斷方法股份有限公司 | 用於監測對免疫檢查點抑制劑pd-1和pd-l1的抗體治療的免疫測定法和基因工程蛋白 |
| EP3737689A4 (en) | 2018-01-09 | 2021-12-01 | Cue Biopharma, Inc. | MULTIMERIC T CELL-MODULATING POLYPEPTIDES AND METHOD OF USING THEREOF |
| CN116514959A (zh) | 2018-03-24 | 2023-08-01 | 瑞泽恩制药公司 | 用于产生针对肽-mhc复合物的治疗性抗体的经过基因修饰的非人动物、其制造方法和用途 |
| US20220047710A1 (en) * | 2018-09-12 | 2022-02-17 | Washington University | Single chain constructs |
| US20220016181A1 (en) * | 2018-12-13 | 2022-01-20 | Sinai Health System | Immunomodulatory cells and uses thereof |
| EP3897690A4 (en) * | 2018-12-19 | 2022-09-28 | Cue Biopharma, Inc. | T-CELL MODULATING MULTIMERIC POLYPEPTIDES WITH CONJUGATION SITES AND METHODS OF USE |
| CN113286609A (zh) * | 2018-12-19 | 2021-08-20 | 库尔生物制药有限公司 | 多聚体t细胞调节多肽及其使用方法 |
| AU2019401183A1 (en) * | 2018-12-19 | 2021-08-12 | Cue Biopharma, Inc. | Multimeric T-cell modulatory polypeptides and methods of use thereof |
| JP2022522404A (ja) * | 2019-03-06 | 2022-04-19 | キュー バイオファーマ, インコーポレイテッド | T細胞調節抗原提示ポリペプチド及びその使用方法 |
| AU2020282736A1 (en) * | 2019-05-29 | 2021-10-28 | Cue Biopharma, Inc. | Multimeric T-cell modulatory polypeptides and methods of use thereof |
| WO2020257191A1 (en) * | 2019-06-19 | 2020-12-24 | Cue Biopharma, Inc. | Multimeric t-cell modulatory polypeptides and methods of use thereof |
| AU2020348373A1 (en) * | 2019-09-20 | 2022-02-24 | Cue Biopharma, Inc. | T-cell modulatory polypeptides and methods of use thereof |
| EP4048689A4 (en) * | 2019-10-23 | 2023-11-01 | Cue Biopharma, Inc. | T-CELL MODULATING CHIMERIC MOLECULES AND METHOD OF USE THEREOF |
| EP4077397A2 (en) | 2019-12-20 | 2022-10-26 | Regeneron Pharmaceuticals, Inc. | Novel il2 agonists and methods of use thereof |
| WO2021168122A1 (en) * | 2020-02-18 | 2021-08-26 | Institute For Systems Biology | Single chain trimer mhc class ii nucleic acids and proteins and methods of use |
| US20230212259A1 (en) * | 2020-02-21 | 2023-07-06 | 3T Biosciences, Inc. | Yeast display libraries, associated compositions, and associate methods of use |
| US20230126784A1 (en) * | 2020-03-06 | 2023-04-27 | Albert Einstein College Of Medicine | A method to generate chimeric antigen receptor (car) t-cells (car-t cells) from pathogen-specific cytotoxic lymphocytes to enable the subsequent in vivo modulation of their functional activity |
| IL296209A (en) | 2020-05-12 | 2022-11-01 | Cue Biopharma Inc | Multimeric t-cell modulatory polypeptides and methods of using them |
| AU2021271778A1 (en) * | 2020-05-12 | 2022-12-08 | Lg Chem, Ltd. | Multimeric T-cell modulatory polypeptides and methods of use thereof |
| WO2022056015A1 (en) * | 2020-09-09 | 2022-03-17 | Cue Biopharma, Inc. | Mhc class ii t-cell modulatory multimeric polypeptides and methods of use thereof |
| WO2022056014A1 (en) | 2020-09-09 | 2022-03-17 | Cue Biopharma, Inc. | Mhc class ii t-cell modulatory multimeric polypeptides for treating type 1 diabetes mellitus (t1d) and methods of use thereof |
| CN112725273A (zh) * | 2021-01-27 | 2021-04-30 | 河南省华隆生物技术有限公司 | 一种nk细胞及其制备方法和应用 |
| CN112852744A (zh) * | 2021-01-27 | 2021-05-28 | 河南省华隆生物技术有限公司 | 一种nk滋养层细胞及其制备方法和应用 |
| CN112779224A (zh) * | 2021-01-27 | 2021-05-11 | 河南省华隆生物技术有限公司 | 一种表达细胞因子组合物的nk滋养层细胞及其制备方法和应用 |
| CN112725284A (zh) * | 2021-01-27 | 2021-04-30 | 河南省华隆生物技术有限公司 | 一种nk滋养层细胞及其应用 |
| CA3215077A1 (en) * | 2021-04-07 | 2022-10-13 | Thomas J. Malia | Peptide-mhc-immunoglobulin multimers and methods of use thereof |
| EP4334453A1 (en) * | 2021-05-07 | 2024-03-13 | Institute for Systems Biology | Single chain trimer mhc class i nucleic acids and proteins and methods of use |
| WO2023022965A2 (en) | 2021-08-16 | 2023-02-23 | Regeneron Pharmaceuticals, Inc. | Novel il27 receptor agonists and methods of use thereof |
| WO2023126544A1 (en) * | 2022-01-03 | 2023-07-06 | Aarhus Universitet | Proteinaceous compound for generating specific cytotoxic t-cell effect |
| WO2023205728A2 (en) * | 2022-04-21 | 2023-10-26 | Institute For Systems Biology | Soluble single-chain dimers from cleavable single chain trimers |
| WO2023240109A1 (en) | 2022-06-07 | 2023-12-14 | Regeneron Pharmaceuticals, Inc. | Multispecific molecules for modulating t-cell activity, and uses thereof |
| WO2023240124A1 (en) | 2022-06-07 | 2023-12-14 | Regeneron Pharmaceuticals, Inc. | Pseudotyped viral particles for targeting tcr-expressing cells |
| WO2024059740A1 (en) * | 2022-09-14 | 2024-03-21 | Synthego Corporation | Genetically modified polynucleotides and cells expressing modified mhc proteins and uses thereof |
| WO2024159071A1 (en) | 2023-01-27 | 2024-08-02 | Regeneron Pharmaceuticals, Inc. | Modified rhabdovirus glycoproteins and uses thereof |
| WO2024182540A2 (en) | 2023-02-28 | 2024-09-06 | Regeneron Pharmaceuticals, Inc. | T cell activators and methods of use thereof |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000515363A (ja) * | 1996-01-31 | 2000-11-21 | スノール・モレキュラー・コーポレーション | Mhc複合体及びその用途 |
| JP2007530021A (ja) * | 2004-03-26 | 2007-11-01 | ウニヴェルシテート シュトゥットガルト | Tnfリガンドファミリーメンバーの組換えポリペプチドおよびその使用 |
| WO2008116468A2 (en) * | 2007-03-26 | 2008-10-02 | Dako Denmark A/S | Mhc peptide complexes and uses thereof in infectious diseases |
| JP2012516854A (ja) * | 2009-02-03 | 2012-07-26 | アムニクス オペレーティング インコーポレイテッド | 延長組換えポリペプチドおよび延長組換えポリペプチドを含む組成物 |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4501728A (en) | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5585362A (en) | 1989-08-22 | 1996-12-17 | The Regents Of The University Of Michigan | Adenovirus vectors for gene therapy |
| ATE237694T1 (de) | 1991-08-20 | 2003-05-15 | Us Gov Health & Human Serv | Adenovirus vermittelter gentransfer in den gastrointestinaltrakt |
| US5252479A (en) | 1991-11-08 | 1993-10-12 | Research Corporation Technologies, Inc. | Safe vector for gene therapy |
| FR2688514A1 (fr) | 1992-03-16 | 1993-09-17 | Centre Nat Rech Scient | Adenovirus recombinants defectifs exprimant des cytokines et medicaments antitumoraux les contenant. |
| CA2145641C (en) | 1992-12-03 | 2008-05-27 | Richard J. Gregory | Pseudo-adenovirus vectors |
| EP0705344B8 (en) | 1993-06-24 | 2006-05-10 | Advec Inc. | Adenovirus vectors for gene therapy |
| SK283703B6 (sk) | 1993-10-25 | 2003-12-02 | Canji, Inc. | Rekombinantný adenovírusový vektor a jeho použitie |
| US6211342B1 (en) * | 1996-07-18 | 2001-04-03 | Children's Hospital Medical Center | Multivalent MHC complex peptide fusion protein complex for stimulating specific T cell function |
| US20050003431A1 (en) * | 1996-08-16 | 2005-01-06 | Wucherpfennig Kai W. | Monovalent, multivalent, and multimeric MHC binding domain fusion proteins and conjugates, and uses therefor |
| US7078387B1 (en) | 1998-12-28 | 2006-07-18 | Arch Development Corp. | Efficient and stable in vivo gene transfer to cardiomyocytes using recombinant adeno-associated virus vectors |
| US6287860B1 (en) | 2000-01-20 | 2001-09-11 | Isis Pharmaceuticals, Inc. | Antisense inhibition of MEKK2 expression |
| CA2440773A1 (en) * | 2001-03-14 | 2002-09-19 | Dakocytomation Denmark A/S | Novel mhc molecule constructs, and methods of employing these constructs for diagnosis and therapy, and uses of mhc molecules |
| US7670595B2 (en) * | 2004-06-28 | 2010-03-02 | Merck Patent Gmbh | Fc-interferon-beta fusion proteins |
| US7855279B2 (en) | 2005-09-27 | 2010-12-21 | Amunix Operating, Inc. | Unstructured recombinant polymers and uses thereof |
| WO2007103515A2 (en) | 2006-03-06 | 2007-09-13 | Amunix, Inc. | Unstructured recombinant polymers and uses thereof |
| US8518697B2 (en) * | 2006-04-04 | 2013-08-27 | Washington University | Single chain trimers and uses therefor |
| MX2010001684A (es) | 2007-08-15 | 2010-04-21 | Amunix Inc | Composiciones y metodos para modificar propiedades de polipeptidos biologicamente activos. |
| EP2337795A2 (en) * | 2008-10-01 | 2011-06-29 | Dako Denmark A/S | Mhc multimers in cancer vaccines and immune monitoring |
| US8956619B2 (en) * | 2011-10-25 | 2015-02-17 | University Of Maryland, Baltimore County | Soluble CD80 as a therapeutic to reverse immune supression in cancer patients |
| MX354660B (es) | 2012-11-30 | 2018-03-14 | Roche Glycart Ag | Remocion de las celulas de cancer por celulas t citotoxicas, especificas de virus, en circulacion, usando proteinas multifuncionales que comprenden complejo de histocompatilibidad principal (mhc) clase i, dirigidas a celulas de cancer. |
-
2015
- 2015-06-15 SG SG11201609876TA patent/SG11201609876TA/en unknown
- 2015-06-15 DK DK15809277.5T patent/DK3157552T3/da active
- 2015-06-15 PT PT158092775T patent/PT3157552T/pt unknown
- 2015-06-15 EP EP18212805.8A patent/EP3483179B1/en active Active
- 2015-06-15 CA CA2947489A patent/CA2947489A1/en active Pending
- 2015-06-15 KR KR1020167034341A patent/KR102252119B1/ko active IP Right Grant
- 2015-06-15 PT PT182128017T patent/PT3480213T/pt unknown
- 2015-06-15 ES ES18212801T patent/ES2770330T3/es active Active
- 2015-06-15 US US15/306,678 patent/US20170058015A1/en not_active Abandoned
- 2015-06-15 HU HUE15809277A patent/HUE047255T2/hu unknown
- 2015-06-15 CN CN201580027510.0A patent/CN106456733B/zh active Active
- 2015-06-15 WO PCT/US2015/035777 patent/WO2015195531A2/en active Application Filing
- 2015-06-15 EP EP18212801.7A patent/EP3480213B1/en active Active
- 2015-06-15 SG SG10202006338UA patent/SG10202006338UA/en unknown
- 2015-06-15 AU AU2015277460A patent/AU2015277460B2/en active Active
- 2015-06-15 DK DK18212801.7T patent/DK3480213T3/da active
- 2015-06-15 JP JP2016565693A patent/JP6652932B2/ja active Active
- 2015-06-15 HU HUE18212801A patent/HUE048076T2/hu unknown
- 2015-06-15 CN CN202110210461.1A patent/CN113248624A/zh active Pending
- 2015-06-15 ES ES15809277T patent/ES2767259T3/es active Active
- 2015-06-15 EP EP15809277.5A patent/EP3157552B1/en active Active
- 2015-06-15 PL PL15809277T patent/PL3157552T3/pl unknown
- 2015-06-15 CN CN202110210453.7A patent/CN113248623A/zh active Pending
- 2015-06-15 PL PL18212801T patent/PL3480213T3/pl unknown
- 2015-06-17 TW TW110108178A patent/TWI795740B/zh active
- 2015-06-17 TW TW108133859A patent/TWI722576B/zh active
- 2015-06-17 TW TW104119612A patent/TWI696633B/zh active
-
2016
- 2016-11-15 IL IL248979A patent/IL248979B/en active IP Right Grant
-
2018
- 2018-06-06 US US16/001,153 patent/US20180282392A1/en not_active Abandoned
-
2019
- 2019-05-12 IL IL266570A patent/IL266570B/en active IP Right Grant
- 2019-05-16 AU AU2019203442A patent/AU2019203442B2/en active Active
- 2019-10-23 JP JP2019192453A patent/JP6652680B2/ja active Active
-
2020
- 2020-01-13 US US16/740,752 patent/US20200377569A1/en not_active Abandoned
- 2020-01-24 JP JP2020009921A patent/JP6995151B2/ja active Active
- 2020-06-11 IL IL275307A patent/IL275307B/en unknown
- 2020-08-25 US US17/001,847 patent/US20210238254A1/en active Pending
- 2020-09-09 US US17/015,282 patent/US20210047384A1/en active Pending
-
2021
- 2021-07-01 AU AU2021204594A patent/AU2021204594B2/en active Active
- 2021-12-14 JP JP2021202405A patent/JP7331075B2/ja active Active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2000515363A (ja) * | 1996-01-31 | 2000-11-21 | スノール・モレキュラー・コーポレーション | Mhc複合体及びその用途 |
| JP2007530021A (ja) * | 2004-03-26 | 2007-11-01 | ウニヴェルシテート シュトゥットガルト | Tnfリガンドファミリーメンバーの組換えポリペプチドおよびその使用 |
| WO2008116468A2 (en) * | 2007-03-26 | 2008-10-02 | Dako Denmark A/S | Mhc peptide complexes and uses thereof in infectious diseases |
| JP2012516854A (ja) * | 2009-02-03 | 2012-07-26 | アムニクス オペレーティング インコーポレイテッド | 延長組換えポリペプチドおよび延長組換えポリペプチドを含む組成物 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6995151B2 (ja) | synTacポリペプチド及びその使用 | |
| JP7560641B2 (ja) | 融合ポリペプチド、医薬組成物、核酸、宿主細胞、及び融合ポリペプチドを作成する方法 | |
| JP2022515330A (ja) | 多量体t細胞調節ポリペプチド及びその使用方法 | |
| WO2020132135A1 (en) | Multimeric t-cell modulatory polypeptides and methods of use thereof | |
| JP2021536256A (ja) | 修飾t細胞に対する条件的活性型キメラ抗原受容体 | |
| US20230241192A1 (en) | Multimeric t-cell modulatory polypeptides and methods of use thereof | |
| US20240376177A1 (en) | Multimeric t-cell modulatory polypeptides and methods of use thereof | |
| BR112016027897B1 (pt) | Polipeptídeo multimérico, proteína, método para modular seletivamente a atividade de uma célula t, composição e método para inibir seletivamente a atividade e/ou reduzir o número de uma célula t autorreativa |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220107 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220107 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20230216 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230512 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230712 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230809 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7331075 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |