JP2014509523A - Multifunctional bioreactor system and method for sorting and culturing cells - Google Patents
Multifunctional bioreactor system and method for sorting and culturing cells Download PDFInfo
- Publication number
- JP2014509523A JP2014509523A JP2014502558A JP2014502558A JP2014509523A JP 2014509523 A JP2014509523 A JP 2014509523A JP 2014502558 A JP2014502558 A JP 2014502558A JP 2014502558 A JP2014502558 A JP 2014502558A JP 2014509523 A JP2014509523 A JP 2014509523A
- Authority
- JP
- Japan
- Prior art keywords
- cells
- cell
- compartment
- chamber
- agitator
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 238000000034 method Methods 0.000 title claims description 30
- 238000012258 culturing Methods 0.000 title claims 3
- 230000010412 perfusion Effects 0.000 claims abstract description 13
- 230000001681 protective effect Effects 0.000 claims abstract 7
- 210000004027 cell Anatomy 0.000 claims description 156
- 239000011324 bead Substances 0.000 claims description 57
- 238000004113 cell culture Methods 0.000 claims description 33
- 239000000463 material Substances 0.000 claims description 32
- 239000000872 buffer Substances 0.000 claims description 26
- 239000002609 medium Substances 0.000 claims description 24
- 239000002699 waste material Substances 0.000 claims description 23
- 230000010261 cell growth Effects 0.000 claims description 18
- 239000012528 membrane Substances 0.000 claims description 18
- 239000012530 fluid Substances 0.000 claims description 14
- 239000006143 cell culture medium Substances 0.000 claims description 13
- 230000001464 adherent effect Effects 0.000 claims description 11
- 238000000926 separation method Methods 0.000 claims description 11
- 102000004169 proteins and genes Human genes 0.000 claims description 9
- 108090000623 proteins and genes Proteins 0.000 claims description 9
- 239000000725 suspension Substances 0.000 claims description 9
- 230000004069 differentiation Effects 0.000 claims description 8
- 230000012010 growth Effects 0.000 claims description 7
- 239000003153 chemical reaction reagent Substances 0.000 claims description 6
- 230000002016 colloidosmotic effect Effects 0.000 claims description 6
- 238000000502 dialysis Methods 0.000 claims description 6
- 230000003204 osmotic effect Effects 0.000 claims description 6
- 239000000243 solution Substances 0.000 claims description 6
- 230000007246 mechanism Effects 0.000 claims description 5
- 210000000130 stem cell Anatomy 0.000 claims description 5
- 230000005484 gravity Effects 0.000 claims description 4
- 239000001963 growth medium Substances 0.000 claims description 4
- 150000002605 large molecules Chemical class 0.000 claims description 4
- 229920002521 macromolecule Polymers 0.000 claims description 4
- 230000003068 static effect Effects 0.000 claims description 4
- 230000008901 benefit Effects 0.000 claims description 3
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 claims description 2
- 239000007995 HEPES buffer Substances 0.000 claims description 2
- 230000002776 aggregation Effects 0.000 claims description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 claims description 2
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 2
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 2
- 239000002771 cell marker Substances 0.000 claims 3
- 238000013019 agitation Methods 0.000 claims 2
- 239000006285 cell suspension Substances 0.000 claims 2
- 238000010907 mechanical stirring Methods 0.000 claims 2
- 238000012544 monitoring process Methods 0.000 claims 2
- 150000003384 small molecules Chemical class 0.000 claims 2
- 230000008467 tissue growth Effects 0.000 claims 2
- 238000005406 washing Methods 0.000 claims 2
- 241000238631 Hexapoda Species 0.000 claims 1
- 206010028980 Neoplasm Diseases 0.000 claims 1
- 229920002594 Polyethylene Glycol 8000 Polymers 0.000 claims 1
- 238000004115 adherent culture Methods 0.000 claims 1
- 238000005054 agglomeration Methods 0.000 claims 1
- 238000002306 biochemical method Methods 0.000 claims 1
- 239000000090 biomarker Substances 0.000 claims 1
- 210000004204 blood vessel Anatomy 0.000 claims 1
- 201000011510 cancer Diseases 0.000 claims 1
- 230000005779 cell damage Effects 0.000 claims 1
- 208000037887 cell injury Diseases 0.000 claims 1
- 210000004443 dendritic cell Anatomy 0.000 claims 1
- 210000001671 embryonic stem cell Anatomy 0.000 claims 1
- 210000002950 fibroblast Anatomy 0.000 claims 1
- 210000003494 hepatocyte Anatomy 0.000 claims 1
- 210000004408 hybridoma Anatomy 0.000 claims 1
- 230000006698 induction Effects 0.000 claims 1
- 239000007788 liquid Substances 0.000 claims 1
- 210000004698 lymphocyte Anatomy 0.000 claims 1
- 210000002901 mesenchymal stem cell Anatomy 0.000 claims 1
- 230000003287 optical effect Effects 0.000 claims 1
- 238000005457 optimization Methods 0.000 claims 1
- 230000008520 organization Effects 0.000 claims 1
- 238000000053 physical method Methods 0.000 claims 1
- 239000002244 precipitate Substances 0.000 claims 1
- 230000009467 reduction Effects 0.000 claims 1
- 230000035699 permeability Effects 0.000 description 4
- 230000008859 change Effects 0.000 description 3
- 239000000084 colloidal system Substances 0.000 description 3
- 238000011109 contamination Methods 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000035515 penetration Effects 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 229920000298 Cellophane Polymers 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- -1 but not limited to Substances 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 230000006727 cell loss Effects 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 239000012737 fresh medium Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 108090000672 Annexin A5 Proteins 0.000 description 1
- 102000004121 Annexin A5 Human genes 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 239000000696 magnetic material Substances 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 229920001187 thermosetting polymer Polymers 0.000 description 1
- 239000004634 thermosetting polymer Substances 0.000 description 1
- 239000004416 thermosoftening plastic Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M1/00—Apparatus for enzymology or microbiology
- C12M1/04—Apparatus for enzymology or microbiology with gas introduction means
- C12M1/06—Apparatus for enzymology or microbiology with gas introduction means with agitator, e.g. impeller
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/44—Multiple separable units; Modules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F29/00—Mixers with rotating receptacles
- B01F29/60—Mixers with rotating receptacles rotating about a horizontal or inclined axis, e.g. drum mixers
- B01F29/64—Mixers with rotating receptacles rotating about a horizontal or inclined axis, e.g. drum mixers with stirring devices moving in relation to the receptacle, e.g. rotating
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/25—Mixers with loose mixing elements, e.g. loose balls in a receptacle
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/25—Mixers with loose mixing elements, e.g. loose balls in a receptacle
- B01F33/251—Mixers with loose mixing elements, e.g. loose balls in a receptacle using balls as loose mixing element
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/35—Mixing after turning the mixing vessel upside down
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/45—Magnetic mixers; Mixers with magnetically driven stirrers
- B01F33/451—Magnetic mixers; Mixers with magnetically driven stirrers wherein the mixture is directly exposed to an electromagnetic field without use of a stirrer, e.g. for material comprising ferromagnetic particles or for molten metal
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/45—Magnetic mixers; Mixers with magnetically driven stirrers
- B01F33/452—Magnetic mixers; Mixers with magnetically driven stirrers using independent floating stirring elements
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C1/00—Magnetic separation
- B03C1/005—Pretreatment specially adapted for magnetic separation
- B03C1/01—Pretreatment specially adapted for magnetic separation by addition of magnetic adjuvants
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C1/00—Magnetic separation
- B03C1/02—Magnetic separation acting directly on the substance being separated
- B03C1/025—High gradient magnetic separators
- B03C1/031—Component parts; Auxiliary operations
- B03C1/033—Component parts; Auxiliary operations characterised by the magnetic circuit
- B03C1/0332—Component parts; Auxiliary operations characterised by the magnetic circuit using permanent magnets
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C1/00—Magnetic separation
- B03C1/02—Magnetic separation acting directly on the substance being separated
- B03C1/025—High gradient magnetic separators
- B03C1/031—Component parts; Auxiliary operations
- B03C1/033—Component parts; Auxiliary operations characterised by the magnetic circuit
- B03C1/0335—Component parts; Auxiliary operations characterised by the magnetic circuit using coils
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C1/00—Magnetic separation
- B03C1/02—Magnetic separation acting directly on the substance being separated
- B03C1/28—Magnetic plugs and dipsticks
- B03C1/288—Magnetic plugs and dipsticks disposed at the outer circumference of a recipient
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M1/00—Apparatus for enzymology or microbiology
- C12M1/42—Apparatus for the treatment of microorganisms or enzymes with electrical or wave energy, e.g. magnetism, sonic waves
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/34—Internal compartments or partitions
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M25/00—Means for supporting, enclosing or fixing the microorganisms, e.g. immunocoatings
- C12M25/14—Scaffolds; Matrices
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M25/00—Means for supporting, enclosing or fixing the microorganisms, e.g. immunocoatings
- C12M25/16—Particles; Beads; Granular material; Encapsulation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M27/00—Means for mixing, agitating or circulating fluids in the vessel
- C12M27/02—Stirrer or mobile mixing elements
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M29/00—Means for introduction, extraction or recirculation of materials, e.g. pumps
- C12M29/04—Filters; Permeable or porous membranes or plates, e.g. dialysis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M29/00—Means for introduction, extraction or recirculation of materials, e.g. pumps
- C12M29/10—Perfusion
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M35/00—Means for application of stress for stimulating the growth of microorganisms or the generation of fermentation or metabolic products; Means for electroporation or cell fusion
- C12M35/06—Magnetic means
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M41/00—Means for regulation, monitoring, measurement or control, e.g. flow regulation
- C12M41/30—Means for regulation, monitoring, measurement or control, e.g. flow regulation of concentration
- C12M41/36—Means for regulation, monitoring, measurement or control, e.g. flow regulation of concentration of biomass, e.g. colony counters or by turbidity measurements
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M41/00—Means for regulation, monitoring, measurement or control, e.g. flow regulation
- C12M41/48—Automatic or computerized control
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M47/00—Means for after-treatment of the produced biomass or of the fermentation or metabolic products, e.g. storage of biomass
- C12M47/04—Cell isolation or sorting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C2201/00—Details of magnetic or electrostatic separation
- B03C2201/18—Magnetic separation whereby the particles are suspended in a liquid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C2201/00—Details of magnetic or electrostatic separation
- B03C2201/26—Details of magnetic or electrostatic separation for use in medical or biological applications
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Sustainable Development (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Analytical Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Cell Biology (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Computer Hardware Design (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Immobilizing And Processing Of Enzymes And Microorganisms (AREA)
Abstract
本開示は、バイオリアクターに関し、さらに具体的には、細胞を成長させ、分離するためのバイオリアクターに関する。バイオリアクターは、少なくとも1つの反応チャンバーと、調節可能な磁場と、多機能細胞補助システムを備えており、さらに、任意要素の保護灌流システムと、任意要素のコンピューターによる制御システムとを備えていてもよい。 The present disclosure relates to bioreactors, and more specifically to bioreactors for growing and separating cells. The bioreactor comprises at least one reaction chamber, an adjustable magnetic field, a multifunctional cell assist system, and may further comprise an optional protective perfusion system and an optional computer controlled system. Good.
Description
本発明は、細胞培養および細胞選別のための多機能バイオリアクターに関する。 The present invention relates to a multifunctional bioreactor for cell culture and cell sorting.
本出願は、一般的に、バイオリアクターに関し、さらに具体的には、細胞を成長させ、分離するバイオリアクターに関する。 This application relates generally to bioreactors, and more specifically to bioreactors that grow and separate cells.
多くの種類の細胞、特に、造血幹細胞および免疫細胞は、培地中で有効に増殖させ、直接的に分化させ得る前に、元のサンプルから単離することが必要である。この単離手順は、細胞選別または細胞分離とも呼ばれる。以前、細胞選別および細胞培養は、それぞれ別個のシステムで行われており、この場合、まず標的細胞を単離し、次いで、培養容器に移す。この従来法は、用いるのが困難であり、細胞選別から細胞培養までに細胞が混入し、細胞が失われる危険性が高くなり、2つの完全に異なるデバイスおよびシステムが関与していた。新しいデザインを有する本願発明者の今回の発明によって、これら2つの異なる手順を1個の容器(チャンバー)で完了させることができ、そのため、混入および標的細胞の損失の危険性が最小限となり、操作効率が顕著に高まる。 Many types of cells, especially hematopoietic stem cells and immune cells, need to be isolated from the original sample before they can be effectively grown in culture and directly differentiated. This isolation procedure is also called cell sorting or cell separation. Previously, cell sorting and cell culture were each performed in separate systems, in which case the target cells are first isolated and then transferred to a culture vessel. This conventional method is difficult to use, has a high risk of cell contamination and cell loss from cell sorting to cell culture, and involved two completely different devices and systems. The present inventors' present invention with a new design allows these two different procedures to be completed in a single container (chamber), thus minimizing the risk of contamination and loss of target cells and operating. Efficiency is significantly increased.
ある種の細胞は、培養物中の剪断応力に非常に弱い。例えば、剪断応力によって、非特異的な分化が起こり、幹細胞培養物中のアポトーシスが増加することがあり、幹細胞の増殖効率および直接的分化を顕著に低減させる。剪断応力が大きくなると、タンパク質発現中に非特的なタンパク質が多く放出され、目的のタンパク質の培養物中での比率が小さくなり、そのため、タンパク質の精製が増大する。静置培養には、最小限の剪断応力はあるが、静置培養中の細胞は、通常は、培養容器の底部に存在し、細胞が高密度状態のとき、栄養が十分に行き渡らない細胞もあり、そのため、大規模な細胞増殖には適していない。ある種のバイオリアクター(例えば、NASAの回転壁式容器(RWV)バイオリアクター)は、剪断応力を減らすように設計された。しかし、これらのバイオリアクターは、細胞を連続的に移動させ、攪拌し、および/または機械攪拌することによって、細胞を懸濁状態に維持しなければならない。バイオリアクターの動きを止めると、細胞は底部のどこかに蓄積すると思われるが、均一には分布せず、ほとんどの細胞成長にとって有害である。したがって、これらのバイオリアクターでは剪断応力は小さいが、これらのバイオリアクターを動かしているとき、培養した細胞にこの小さな剪断応力が連続的にかかることになる。本願発明において、バイオリアクターが静置状態であるとき、培養チャンバーの底部または磁気ビーズの表面に細胞を均一に分布させることができる。したがって、本発明は、懸濁状態および静置状態の両方で細胞に最良の成長条件を与える。 Certain cells are very sensitive to shear stress in the culture. For example, shear stress can cause non-specific differentiation and increase apoptosis in stem cell culture, significantly reducing stem cell proliferation efficiency and direct differentiation. Increasing shear stress releases more non-specific protein during protein expression, reducing the ratio of the protein of interest in culture and thus increasing protein purification. Static culture has minimal shear stress, but the cells in static culture are usually located at the bottom of the culture vessel. Yes, and therefore not suitable for large-scale cell growth. Certain bioreactors (eg, NASA's rotating wall vessel (RWV) bioreactors) were designed to reduce shear stress. However, these bioreactors must maintain the cells in suspension by continuously moving, agitating, and / or mechanically agitating the cells. When the bioreactor stops moving, cells appear to accumulate somewhere in the bottom, but are not evenly distributed and are detrimental to most cell growth. Thus, the shear stress is small in these bioreactors, but when the bioreactor is moved, this small shear stress is continuously applied to the cultured cells. In the present invention, when the bioreactor is in a stationary state, the cells can be uniformly distributed on the bottom of the culture chamber or the surface of the magnetic beads. Thus, the present invention provides the best growth conditions for cells both in suspension and at rest.
ある種のバイオリアクターは、マグネットインペラーによって培地を機械攪拌し、細胞を懸濁状態に保持するように制御された磁気要素(特定的には、ブレードまたはバン)を使用する。この種のバイオリアクターは、特定の細胞の培養要求のために剪断応力をわざと高める。用途の違いに加え、本発明のバイオリアクターは、磁気要素であるブレードまたはケーンを使用せず、本発明のマグネットビーズは、マグネットビーズが磁場の中に存在しない場合には、実際には磁気を帯びておらず、磁場に置かれたときにのみ磁力を得ることができる。本発明のマグネットビーズは、インペラーによって制御されていないが、ビーズの移動に影響を及ぼす磁場強度の変化によって制御される。適切な微細環境(またはニッチと呼ばれる)は、ある種の細胞(例えば、幹細胞)の成長にとって非常に重要である。ある種のデバイスは、ニッチを作成するために固体材料を使用するか、またはニッチを作成するためにゲル状の物質を使用する。これらのデバイスを用い、細胞培養後に、特定の手順を用いて細胞をニッチから洗い出す必要があるか、または、ニッチを形成する材料を酵素で溶融または消化し、標的細胞を放出させなければならない。本願発明において、ビーズ間の空間は、通常は、細胞成長のためのニッチに由来し、磁場強度を変えることによってビーズが持ち上げられれば、細胞を簡単に放出させることができる。他の細胞培養システムは、ウェル状の培養プレート(例えば、一般的な96ウェル状プレート)、微細チャンバー(Hung 2005)または微細なふるい(Zhang 2009)によってニッチを構築することを試みている。本発明のバイオリアクターは、ビーズの移動によって、成長させるのに培地の流れを増すことが必要な細胞にとって、動的な微細環境が作られるため、ウェル状プレートよりも優れている。さらに、製造するときの課題が減り、使用後に滅菌することが簡単であり、ビーズの大きさを調整することによって、ニッチの大きさを簡単に修正することができるため、微細チャンバーおよび微細なふるいよりも優れている。 Some bioreactors use magnetic elements (specifically blades or buns) that are controlled to mechanically agitate the medium by a magnetic impeller and keep the cells in suspension. This type of bioreactor deliberately increases the shear stress for specific cell culture requirements. In addition to the different applications, the bioreactor of the present invention does not use a magnetic element blade or cane, and the magnetic bead of the present invention does not actually magnetize if the magnetic bead is not present in a magnetic field. It is not tinged and can only obtain magnetic force when placed in a magnetic field. The magnetic beads of the present invention are not controlled by the impeller, but are controlled by changes in magnetic field strength that affect the movement of the beads. An appropriate microenvironment (or called a niche) is very important for the growth of certain types of cells (eg, stem cells). Some devices use solid materials to create a niche or use a gel-like substance to create a niche. With these devices, after cell culture, the cells need to be washed out of the niche using a specific procedure, or the material that forms the niche must be melted or digested with enzymes to release the target cells. In the present invention, the space between the beads is usually derived from a niche for cell growth, and if the beads are lifted by changing the magnetic field strength, the cells can be easily released. Other cell culture systems have attempted to build a niche with well-like culture plates (eg, common 96-well plates), fine chambers (Hung 2005) or fine sieves (Zhang 2009). The bioreactor of the present invention is superior to well-like plates because the movement of beads creates a dynamic microenvironment for cells that require increased media flow to grow. In addition, there are fewer challenges in manufacturing, it is easier to sterilize after use, and the niche size can be easily modified by adjusting the bead size, so that the fine chamber and fine sieve Better than.
多くの細胞培容器(チャンバー)は、例えば、一般的な細胞培養フラスコ、気体透過性の袋、回転壁式容器などのバイオリアクターで使用するために設計されてきた。これらの容器は、細胞を希釈することができ、培地を変えることができるような一般的な灌流システムとともに使用することができる。しかし、これらの容器を用いて培地を変えている間、サイトカイン、タンパク質および細胞成長のための他の高価な物質および細胞産物が培地から同時に除去される。また、一般的な透析プロセスの効率は、十分なほど高くない。本発明で設計された細胞培養チャンバーは、浸透チャンバーと培養チャンバーの両側とのコロイド浸透力の差を利用し、特定の大きさのサイトカイン、ペプチド、タンパク質および他の材料を失うことなく、透析膜を通して迅速に培地を交換することができる。この細胞培養チャンバーの設計によって、新しい灌流手法が与えられ、勾配浸透灌流システムと呼ばれるシステムが与えられる。 Many cell culture vessels (chambers) have been designed for use in bioreactors such as, for example, common cell culture flasks, gas permeable bags, and rotating wall vessels. These containers can be used with common perfusion systems that can dilute cells and change media. However, while these media are used to change the media, cytokines, proteins and other expensive substances and cell products for cell growth are simultaneously removed from the media. Also, the efficiency of a typical dialysis process is not high enough. The cell culture chamber designed in the present invention takes advantage of the difference in colloid osmotic force between the permeation chamber and both sides of the culture chamber, without losing a specific size of cytokines, peptides, proteins and other materials. The medium can be changed quickly through. This cell culture chamber design provides a new perfusion technique and provides a system called the gradient osmotic perfusion system.
ほとんどのバイオリアクターは、接着性細胞または懸濁細胞のいずれかを培養するように設計された。部分的に接着性の細胞の成長を補助するようなバイオリアクターは、まだ報告されていない。本発明のバイオリアクターは、懸濁細胞、接着性細胞および部分的に接着性の細胞を含め、ほとんどのあらゆる細胞に使用することができる。 Most bioreactors were designed to culture either adherent cells or suspension cells. No bioreactor has yet been reported that supports the growth of partially adherent cells. The bioreactor of the present invention can be used for almost any cell, including suspension cells, adherent cells and partially adherent cells.
バイオリアクターの動きを制御するのにコンピューターを用いることが極めて一般的であり、多くのバイオリアクターは、プログラム処理可能である。本発明では、(1)磁場の強度および方向、(2)細胞培養チャンバーをひっくり返す周波数および速度、(3)上の(1)および(2)の結果としてのマグネットビーズの周波数および速度は、あらかじめ選択したプログラムおよび/または検出器から受け取ったデータに応答し、バイオリアクターにフィードバックを送り返すプログラムによって制御されることを強調しておく。 It is very common to use a computer to control the movement of a bioreactor, and many bioreactors can be programmed. In the present invention, (1) the strength and direction of the magnetic field, (2) the frequency and speed at which the cell culture chamber is turned over, (3) the frequency and speed of the magnetic beads as a result of (1) and (2) above are It is emphasized that the program is controlled by a program that responds to data received from the selected program and / or detector and sends feedback back to the bioreactor.
バイオリアクター制御におけるコンピューターの利用と同様に、ある特定の光源(例えば、レーザープロジェクター)を用いるいくつかの細胞密度検出器が、細胞培養中の細胞濃度を監視するために設計されてきた。検出器またはセンサーから得られたデータを用い、培地を変えることが必要な場合に細胞を希釈することが必要かどうかを決定する。本発明のバイオリアクターにおいて、細胞密度検出器は、一般的な光源を使用し、そのデータを特定的に使用して、磁場の強度、細胞培養チャンバーをひっくり返す速度および周波数を調整し、さらに、マグネットビーズの移動速度および周波数を間接的に調整する。 Similar to the use of computers in bioreactor control, several cell density detectors using certain light sources (eg, laser projectors) have been designed to monitor cell concentration during cell culture. Data obtained from the detector or sensor is used to determine whether it is necessary to dilute the cells when it is necessary to change the medium. In the bioreactor of the present invention, the cell density detector uses a general light source and uses the data specifically to adjust the strength of the magnetic field, the speed and frequency of overturning the cell culture chamber, and a magnet. Adjust the moving speed and frequency of the beads indirectly.
バイオリアクターは、典型的には、培養物内で細胞を成長させるために使用される。しかし、多くの種類の細胞は、培地中で有効に増殖させ、直接的に分化させ得る前に、元のサンプルから単離することが必要である。この単離手順は、細胞選別または細胞分離とも呼ばれる。典型的には、細胞選別および細胞培養は、別個のシステムで行われており、この場合、まず標的細胞を単離し、次いで、培養容器に移す。この従来法は、用いるのが困難であり、細胞選別から細胞培養までに細胞が混入し、細胞が失われる危険性が高くなり、2つの完全に異なるデバイスおよびシステムが関与している。 Bioreactors are typically used to grow cells in culture. However, many types of cells need to be isolated from the original sample before they can be effectively grown in culture and directly differentiated. This isolation procedure is also called cell sorting or cell separation. Typically, cell sorting and cell culture are performed in separate systems, where target cells are first isolated and then transferred to a culture vessel. This conventional method is difficult to use, has a high risk of cell contamination and cell loss from cell sorting to cell culture, and involves two completely different devices and systems.
さらに、多くのバイオリアクターは、バイオリアクターの内容物を混合するために、回転するインペラーなどを使用する。残念なことに、これにより、細胞を破壊しかねない剪断応力が細胞に加わり、システムの効率を低下させ、廃棄産物(例えば、非特異的なタンパク質の発現など)の放出を生じる。さらに、ある種のバイオリアクターでは、細胞培養チャンバーの底部または細胞培養チャンバーの他の位置で細胞が凝集することがある。これらの細胞が培養チャンバー内で凝集することは、効果的な細胞成長の妨げとなる。したがって、細胞に与えられる剪断応力も最小限にしつつ、細胞を成長させ、分離することができる効率的なバイオリアクターの顕著な必要性が存在する。 In addition, many bioreactors use rotating impellers or the like to mix the contents of the bioreactor. Unfortunately, this adds shear stress to the cells that can destroy the cells, reducing the efficiency of the system and resulting in the release of waste products (eg, non-specific protein expression). Further, in certain bioreactors, cells may aggregate at the bottom of the cell culture chamber or other locations in the cell culture chamber. Aggregation of these cells in the culture chamber hinders effective cell growth. Thus, there is a significant need for an efficient bioreactor that can grow and separate cells while also minimizing the shear stress applied to the cells.
一実施形態では、細胞を成長させ、分離するためのバイオリアクターシステムは、第1部分および第2部分を有する内側を含む細胞培養チャンバーと、培養チャンバーの内側に配置され、内側の第1部分と内側の第2部分の間を移動することが可能なアジテーターと、細胞培養チャンバーに連結し、内側の第1部分と内側の第2部分の間をアジテーターが移動するように操作可能な制御システムとを備える。 In one embodiment, a bioreactor system for growing and separating cells includes a cell culture chamber that includes an interior having a first portion and a second portion, an inner first portion disposed within the culture chamber, An agitator capable of moving between the inner second part and a control system coupled to the cell culture chamber and operable to move the agitator between the inner first part and the inner second part; Is provided.
別の実施形態では、細胞を成長させ、分離する方法は、第1部分および第2部分を有する内側を含むチャンバーを与えることと、内側の第1部分と内側の第2部分の間を移動することが可能なアジテーターを内側に配置することと、細胞培地をチャンバーの内側に運ぶことと、標的細胞をチャンバーの内側に移すことと、細胞と培地が混合するように、第1部分と第2部分との間をアジテーターを移動させることと、チャンバーの内側にあるかなりの量の標的細胞を維持しつつ、チャンバーの内側から廃棄物を除去することとを含む。 In another embodiment, a method for growing and separating a cell provides a chamber including an interior having a first portion and a second portion, and moves between an inner first portion and an inner second portion. The first part and the second part so that the agitator is capable of being placed inside, carrying the cell culture medium inside the chamber, transferring the target cells inside the chamber, and mixing the cells and medium. Moving the agitator between the portions and removing waste from the inside of the chamber while maintaining a significant amount of target cells inside the chamber.
さらに別の実施形態では、細胞培養チャンバーの内側は、細胞培地容器と流体が行き来できるように連結し、容器から細胞培地を受け取ることができるように作られた第1の区画と、アジテーターが内部に配置された第2の区画と、第1の区画と第2の区画との間に配置され、細胞培地が第1の区画から第2の区画へと選択的に流れることができるように作られた第1の膜と、バッファー容器と流体が行き来できるように連結し、バッファー容器からバッファーを受け取ることができるように作られ、さらに、廃棄物容器との流体が行き来できるように連結し、廃棄物が第3の容器から廃棄物容器に流れることができるように作られた第3の区画と、第2の区画と第3の区画との間に配置され、第2の区画から第3の区画へと培地および廃棄物が選択的に流れることができるように作られた第2の膜とを備える。 In yet another embodiment, the inside of the cell culture chamber is coupled to a fluid flow to and from the cell culture medium container, the first compartment is configured to receive the cell culture medium from the container, and the agitator is internal. And a second compartment disposed between the first compartment and the second compartment so that the cell culture medium can selectively flow from the first compartment to the second compartment. The first membrane is connected to the buffer container so that the fluid can go back and forth, and the buffer can be received from the buffer container, and further, the fluid can be connected to the waste container so that the fluid can go back and forth. A third compartment configured to allow waste to flow from the third container to the waste container, and disposed between the second compartment and the third compartment, and from the second compartment to the third compartment; Medium and waste into the compartment And a second film but made to be able to flow selectively.
以下の記載と合わせて考えた場合に、図面は、保護されることを望む発明の主題の理解を助ける目的で提示されている。 When considered in conjunction with the following description, the drawings are presented for the purpose of assisting in understanding the subject matter of the invention desired to be protected.
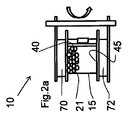
図1を参照すると、細胞を成長させ、分離するためのバイオリアクターシステム10が示されている。システム10は、細胞培養チャンバー15と、アジテーター20と、制御システム30とを備える。
Referring to FIG. 1, a
細胞培養チャンバー15は、細胞培養チャンバー内に配置された細胞培地内で標的細胞を受け入れ、成長させるための内側35と、第1末端40と、第2末端45とを備える。本明細書で使用する場合、「標的細胞」は、チャンバー15内に配置され、チャンバー15内で成長する細胞を指す。本開示には、標的細胞を成長させるという内容が与えられているが、このシステムを、化学物質または任意の他の適切な溶液または材料を混合するために使用してもよいことは理解されるだろう。さらに、第1末端40および第2末端45は、それぞれチャンバー15の上部および底部にあるものとして示されているが、末端40、45は、互いに任意の適切な配置に(例えば、水平な面に)あってもよく、それも本開示の範囲内にあることが理解されるだろう。以下に記載するように、チャンバー15は、1つ以上の内側区画を備えていてもよい。それに加え、当業者には明らかであろうが、チャンバー15は、剛性材料、可撓性材料、剛性材料と可撓性材料の組み合わせ、気体透過性材料または任意の他の適切な材料を含め、任意の適切な材料から作られていてもよい。チャンバー15は、さらに、チャンバーの内側35と1つ以上の容器との間を流体が行き来できるための1つ以上の出入口を備えていてもよい。実例となる容器としては、限定されないが、細胞培地容器、廃棄物容器、バッファー容器、CO2容器、または任意の他の適切な容器が挙げられる。
The
ここで図3を参照すると、実例となる代替的なチャンバー15が示されている。この実施形態では、チャンバー15は、第1の区画75と、第2の区画80と、第3の区画85とを備えている。第1の区画75は、培地を第1の区画に加え、および/または第1の区画から取り出すことができるように、第1の区画と1つ以上の容器(例えば、細胞培地容器)との間を流体が行き来できるような連結を与えるための1つ以上の出入口18a、バッファーを第1の区画に加え、および/または第1の区画から取り出すことができるようなバッファー容器、廃棄物を第1の区画75から取り出し得るような廃棄物容器、CO2を第1の区画に加え、および/または第1の区画から取り出すことができるようなCO2容器、または任意の他の適切な容器を備えていてもよい。第1の区画75と第2の区画80は、第1の膜90によって隔離されている。第1の膜90は、第1の区画75から第2の区画80へと培地を選択的に流すことができるように作られている。膜90は、貫通部、開口部または任意の他の適切な構造を含んでいてもよく、および/または第1の区画75から第2の区画80へと培地を流すことができるように他の様式で半透過性である。一実施形態では、膜90は、透析膜である。膜90は、限定されないが、セルロースおよびセロファンを含む任意の適切な材料から作られてもよい。
Referring now to FIG. 3, an illustrative
第2の区画80は、アジテーターを内部に保持し、アジテーターが、図1に関連してすでに記載したように区画内を移動し得るような構成である。標的細胞は、典型的には、第2の区画80でも同様に成長し、保持される。第2の区画80は、1つ以上の容器(例えば、第1の区画75に関して記載した種類の容器)の間を流体が行き来できるような連結を与えるための1つ以上の出入口18bを備えていてもよい。第2の区画80と第3の区画85は、第2の膜95によって隔離されていてもよい。第2の膜95は、第2の区画75から第3の区画85へと培地および/または廃棄物を選択的に流すことができるように作られている。膜95は、貫通部、開口部または任意の他の適切な構造を含んでいてもよく、および/または第2の区画80から第3の区画85へと培地および/または廃棄物を流すことができるように他の様式で半透過性である。一実施形態では、膜95は、透析膜である。膜95は、限定されないが、セルロースおよびセロファンを含む任意の適切な材料から作られてもよい。第3の区画85は、第3の区画85と、1つ以上の容器(例えば、第1の区画75に関して記載した種類の容器)との間を流体が行き来できるような連結を与えるための1つ以上の出入口18cを備えていてもよい。さらに、少なくとも1つの実施形態において、チャンバーの外側の少なくとも一部が、気体透過性材料から作られていてもよい。チャンバーの外側の少なくとも一部が気体透過性材料から作られている場合、システムは、ある場合、ただしすべてが必須ではないが、チャンバーへの直接的な気体注入と、培地のpHを維持する構成要素を含まない。第1の区画75および第3の区画85は、第2の区画80に対して任意の適切な位置に配置されていてもよく、本開示は、いかなる様式でも、第1の区画75と第3の区画80との間に配置された第2の区画80に限定されない。さらに、任意の適切な数の区画を使用してもよく、本開示は、3つの区画のみに限定されないことが理解されるだろう。
The
一実施形態では、比較的少量の大きな分子および/または大きな極性の分子を含む適切な溶液を含む培地が第1の区画75に与えられ、細胞成長のための適切なコロイド浸透性を有する同じ培地または同様の培地が第2の区画80に与えられる。適切な培地は、標的細胞を成長させ、または維持するために用いられる任意の培地であってもよい。第1の区画75および/または第2の区画80の培地と比較して、もっと大きなコロイド浸透力を作り出し、維持するために、もっと濃度が高い大きな分子および/または大きな極性の分子を含むバッファーが第3の区画85に与えられる。第3の区画85のためにもっと大きなコロイド浸透力を作り出し、維持するために用いられる材料としては、限定されないが、PEG 80000、アルブミン、他のタンパク質または任意の他の適切な材料または溶液が挙げられる。膜90、95は、同じ透過性を有していてもよく、または異なる透過性を有していてもよく、培地および/または新しい細胞の成長から出た廃棄物が、第1のチャンバー75および/または第2のチャンバー80から浸透によって第3のチャンバー85へと流れてもよい構成になっている。制御システムは、それぞれの区画75、80、85内に一定容積が維持され、一定の浸透力が維持され、第2の区画80への新しい培地の供給が維持されるように、1つ以上の区画75、80、85からの培地、バッファーおよび/または廃棄物の潅流および排出を制御してもよい。それに加え、任意の適切な検出デバイス、機構または方法による制御システムは、標的細胞の成長に関与する任意の適切なパラメーター、例えば、限定されないが、標的細胞の数の変化、pH、CO2、グルコース、カルシウム、カリウム、ナトリウム、温度、湿度または任意の他の適切な力を監視し、第2のチャンバー内のアジテーターの移動間隔、周波数および/または速度を調節し、および/または培地の量、培地の種類、バッファーの量、バッファーの種類、CO2の量を調節し、または、チャンバー内の標的細胞の成長を向上させるか、または促進するように、制御システムの測定に基づく任意の適切な調節を行ってもよい。
In one embodiment, a medium containing a suitable solution containing a relatively small amount of large molecules and / or large polar molecules is provided in the
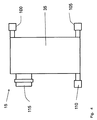
ここで図4を参照すると、別の実例となるチャンバー15が示されている。この実施形態では、チャンバーは、チャンバーの内側35と廃棄物容器との間を流体が行き来できるような連結を与えるための1つ以上の出入口100を備えていてもよい。チャンバー15は、さらに、チャンバーの内側35と細胞培地容器との間を流体が行き来できるような連結を与えるための1つ以上の出入口110を備えていてもよい。さらに、チャンバー15は、チャンバー内側35とバッファー容器との間を流体が行き来できるような連結を与えるための1つ以上の出入口110を備えていてもよい。さらに、チャンバーは、アジテーターをチャンバー内側35に受け入れるための1つ以上の出入口115をさらに備えていてもよい。一実施形態では、チャンバー15は、テフロン(登録商標)FEPから作られている。この具体的な実施形態は、標的細胞がアジテーターに接着するか、または他の様式で接続し、廃棄物がチャンバー内側35から流され、標的細胞がチャンバー内側35にとどまる場合に有用であろう。しかし、チャンバー15は、任意の適切な材料から作られていてもよく、それも本開示の範囲内にあることが理解されるだろう。
Referring now to FIG. 4, another
アジテーター20は、チャンバー内側35の中に配置され、チャンバーの第1末端40とチャンバーの第2末端45との間を移動することができる。または、アジテーター20は、チャンバー内側35の中で、任意の2つ以上の点の間、または2つ以上の部分の間を移動するような構成であってもよい。実例となる実施形態では、アジテーターは、複数のビーズ21を含む。ビーズ21を示す任意の実例となる実施形態が、任意の代替的なアジテーター構造を使用してもよく、それもまた本開示の範囲にあり、任意の具体的な実例となる実施形態が、アジテーターとしてビーズを排他的に使用することに限定されないことが理解されるだろう。一実施形態では、ビーズ21は、磁着性材料、例えば、シリコーンスチール、Fe3O4、または任意の他の適切な磁着性材料から作られる。本明細書で使用する場合、磁着性は、アジテーター(例えば、ビーズ)が、磁場にさらされると磁荷を保持するが、磁場からはずれると、または磁場がアジテーター近傍からはずれると、例えば、磁場発生器の電源を切ると、他の方法で磁荷を保持することはないことを意味する。磁着性材料は、典型的には、それぞれのビーズ21のコアを含む。次いで、磁着性コアを任意の適切な材料でコーティングしてもよい。一実施形態では、磁着性コアをポリスチレンでコーティングするが、磁着性コアを任意の適切な材料でコーティングしてもよく、それも本開示の範囲内にあることが理解されるだろう。例えば、限定されないが、磁着性コアを任意の適切な熱可塑性ポリマーまたは熱硬化性ポリマーでコーティングしてもよい。ビーズ21は、磁着性材料から作られるものとして示されているが、ビーズが、磁着性または非磁着性の任意の適切な材料から作られてもよく、それも本開示の範囲内にあることが理解されるだろう。さらに、ビーズ21が、それぞれ、チャンバー15内で細胞が成長するにつれて、標的細胞がビーズに接着するように任意の適切な材料でコーティングされてもよいことが理解されるだろう。さらに、標的細胞が接着するであろう特定の材料でコーティングされていないビーズも本開示の範囲に入ることが理解されるだろう。ある実施形態では、細胞培地内で浮遊するビーズ21を含むことが望ましいだろう。したがって、ビーズのコアは、空気だまりまたは気泡、軽い泡またはプラスチックまたはビーズ21が培地内で浮遊できるような任意の他の適切な材料を含んでいてもよい。
The
ビーズ21は、ビーズが積み重なったとき、1つ以上のニッチまたは微細環境がビーズ21の間にある空隙に形成されるか、または作られてもよいように作成されてもよい。ある実施形態では、これらのニッチは、ニッチ内でのさらなる標的細胞の成長を促進してもよい。一実施形態では、ビーズが実質的に球形の場合、それぞれのビーズ21の直径は、適切なニッチを作成するために1mm〜10mmであってもよい。しかし、ビーズ21は、ビーズ21が積み重ねられるとき、1つ以上の適切なニッチが作られてもよいように、任意の適切な大きさおよび/または形状を有していてもよいことが理解されるだろう。さらに、少なくともいくつかのニッチが、チャンバー内側のいくつかのビーズと1つ以上の壁との間に作られてもよいことが理解されるだろう。
The
代わりとなる実施形態では、図5に示されるように、アジテーター20aは、内部に複数の開口部22を有する平面部材21aであってもよい。平面部材21aの断面は、アジテーター20aがチャンバー内側35を移動し得るように、チャンバー15の断面形状と相補的であってもよい。開口部22は、アジテーター20aがチャンバー内側35の中を動くにつれて、アジテーター20aを通って培地が流れることができるものであってもよい。アジテーター20aは、磁着性材料または非磁着性材料から作られてもよく、浮遊性または非浮遊性であるように作られてもよく、および/またはビーズ20に関してすでに記載したようにコーティングされていてもよい。
In an alternative embodiment, as shown in FIG. 5, the
再び図1を参照すると、制御システム30は、システム10の操作を制御するためにコントローラー55およびコンピューター60のいずれかまたは両方を備えていてもよい。または、システム10を手動で動かしてもよい。制御システム30は、チャンバー15に脱着可能に接続するような構成である。制御システム30は、チャンバー15を受け入れるカセット50を備えていてもよいが、チャンバー15は、任意の適切な手段または構造(例えば、クリップ、フック、マグネット、フック−ループアセンブリ、フリクションフィットなど)によって制御システム50に接続していてもよく、それも本開示の範囲内にあることが理解されるだろう。
Referring again to FIG. 1, the
制御システム30は、さらに、光源2と、チャンバー15の中で細胞の数を検出し、チャンバー15の中の細胞数の変化などを検出し、その結果を制御システム30に報告するための細胞検出器9とを備えていてもよい。しかし、細胞の数または細胞の数の変化を監視する当該技術分野で既知の任意の検出器、機構または技術を使用してもよく、それも本開示の範囲内にあることが理解されるだろう。さらに、任意の適切な検出器、機構または方法による制御システム30は、標的細胞の成長に関与する任意の適切なパラメーター、例えば、限定されないが、標的細胞の数の変化、pH、CO2、グルコース、カルシウム、カリウム、ナトリウム、温度、湿度または任意の他の適切な因子を監視し、チャンバー内のアジテーターの移動周波数および/または速度を調節し、および/または培地の量、培地の種類、バッファーの量、バッファーの種類、CO2の量を調節し、または、チャンバー15内の標的細胞の成長を向上させるか、または促進するような任意の制御システムの測定に基づく任意の適切な調節を行ってもよい。
The
制御システム30は、アジテーターがチャンバー15の内側35の中を移動するように操作可能である。このことは、さまざまな様式で達成されてもよい。実例となる実施形態では、制御システムは、第1の位置と第2の位置との間をチャンバー15が回転するように操作可能なモーター65を備えている。以下に記載するように、第1の位置と第2の位置は、ほぼ180°離れているが、第1のおよび第2の位置が、互いに任意の適切な角度関係を有していてもよく、それも本開示の範囲内にあることが理解されるだろう。チャンバー15は、水平面で回転してもよく、垂直面で回転してもよく、または任意の適切な様式で回転し、ずれるか、すべるか、または他の様式で動き、チャンバー15の中をアジテーター20が移動してもよい。
The
それに加え、制御システム30は、チャンバー15内のビーズ21が動き、標的細胞および培養培地を混合するようにビーズ21または他のアジテーター20を励起させるために第1の磁場発生器70および第2の磁場発生器72を備えていてもよい。実例となる実施形態では、それぞれの磁場発生器は、電源を入れると磁場が発生し、電源を切ると磁場の発生が止む電磁石である。電源を入れると、それぞれの磁場発生器は、アジテーター20(例えば、ビーズ21)を電源が入った磁場発生器の方に引き寄せる。代わりとなる実施形態では、永久磁石を使用してもよく、この場合、制御システム30は、チャンバー15の近傍からマグネットをはずすか、または他の方法で、チャンバー15に入り込んだマグネットからの磁場を遮断するように操作することができる。実例となる実施形態が、チャンバー内でアジテーターを動かすためにチャンバーの回転および電磁石を使用する場合、チャンバーの回転を単独で使用してもよく、または電磁石を単独で使用してもよいことが理解されるだろう。さらに、チャンバー内でアジテーターを動かすための任意の技術を使用してもよく、それも本開示の範囲内にあることが理解されるだろう。
In addition, the
ここで図2a〜2fを参照すると、システム10の操作が非限定的な例によって示されている。標的細胞および細胞培地がチャンバー15の内側35に運ばれる。この実施形態では、ビーズ21は、浮遊性であり、チャンバー15内の細胞培地の上部付近に浮いている。図2aにおいて、第1の磁場発生器70の電源が入っており、ビーズ21は、チャンバー15の第1末端40付近に保持されている。次いで、チャンバー15を図2bに示すような位置まで約180°回転し、第1の磁場発生器70は、チャンバーの第1末端40付近にビーズ21を維持する。次いで、第1の磁場発生器70の電源を切ることによって、図2cに示すように、ビーズ21がチャンバー15の第2末端45に向かって浮き始める。ビーズ21が、標的細胞が接着するコーティングを含む実施形態では、片方の末端から他の末端へのビーズ21の移動によって、新しく成長した標的細胞が集まるだろう。廃棄物をチャンバー15から流しつつ、および/または新しい培地をチャンバー15に導入するとき、かなりの量の元々の標的細胞および新しく成長した標的細胞がチャンバー内にとどまるように、標的細胞をビーズ21に接着させてもよい。または、標的細胞に特異的な磁着性抗体をチャンバー15の内側に加えることによって、抗体が標的細胞に結合し、磁場がチャンバーに導入されるとき、抗体が結合した標的細胞は、磁着性ビーズ21および/または磁場発生器に隣接するチャンバー壁に脱着可能に接続するだろう。この実施形態では、結合していない細胞および/または廃棄物がチャンバーから流されつつ、および/またはかなりの量の元々の標的細胞および新しく成長した標的細胞がチャンバー15内にとどまるように、新しい培地をチャンバーに導入している間、磁場発生器70、72のいずれかまたは両方の電源を入れたままでもよい。または、磁気試薬(例えば、Annexin Vまたは他の適切な試薬)を使用し、ビーズに、システム10から流された損傷した細胞または死んだ細胞、健康な標的細胞に接続させてもよい。さらに、アジテーターを使用することなく、磁着性抗体および/または試薬をチャンバー15中で使用してもよく、それによって、チャンバーが流されるとき、標的細胞または損傷を受けた/死んだ細胞がチャンバーに保持されていてもよいことが理解されるだろう。
2a-2f, the operation of
再び図を参照すると、ビーズ21がチャンバーの第2末端45付近にある場合、第2の磁場発生器72の電源を入れることによって、ビーズ21は、チャンバーの第2末端45付近に保持され(図2d)、チャンバーは、図2eに示す位置まで回転する。次いで、第2の磁場発生器72の電源を切ることによって、図2fに示すように、ビーズ21がチャンバーの第1末端40に向かって浮くだろう。当業者によって理解されるように、このプロセス中に種々の添加剤、培地、バッファー、CO2などをチャンバーに任意の所与の点で選択的に加えてもよく、および/またはすでに記載したような制御システムによって行われる測定に基づいて、新しい細胞成長を促進または向上させるために、廃棄物を選択的に除去してもよい。
Referring again to the figure, if the
代わりとなる実施形態では、チャンバーが回転することによってビーズがチャンバー内を移動するように、さらに磁場をかけることなく、非浮遊性ビーズを使用してもよい。ここで、チャンバーが回転することによる重力および遠心力を使用し、チャンバー15内の2つ以上の点の間をビーズが動く。さらに別の代替例では、ビーズがチャンバー内の2つ以上の点の間を移動するように、チャンバー15を回転させることなく、第1の磁場発生器70および第2の磁場発生器72の電源を交互に入れてもよい。上の例はビーズ21をアジテーターとして使用するが、限定されないが、図5のものを含め、適切なデバイスをアジテーターとして使用してもよく、それも本開示の範囲内にあることが理解されるだろう。さらに、チャンバー内でアジテーターを移動させる任意の手段または技術を使用してもよく、それも本開示の範囲内にあることが理解されるだろう。
In an alternative embodiment, non-buoyant beads may be used without additional magnetic fields so that the beads move through the chamber as the chamber rotates. Here, the beads move between two or more points in the
さらに、チャンバー15が気体透過性材料から作られるか、またはそれ以外の様式で気体透過性部分を含む場合、システムが、CO2インキュベーターまたはCO2室の中に配置されていてもよいことが理解されるだろう。CO2インキュベーターまたはCO2室がなく、またはチャンバーになんら気体透過性部分がない場合、試薬(例えば、HEPES)を使用してもよく、または、CO2をCO2容器からチャンバーに直接注入してもよい。
Further, it is understood that if the
本発明およびその利点が特定の実例、非限定的な実施形態の観点で開示されてきたが、添付した特許請求の範囲によって定義される本発明の範囲から逸脱することなく、種々の変更、置き換え、入れ替え、改変を行うことができることを理解すべきである。任意の一実施形態と合わせて記載された任意の特徴を他の実施形態にも適用することができることが理解されるだろう。 Although the invention and its advantages have been disclosed in terms of specific examples, non-limiting embodiments, various modifications and substitutions have been made without departing from the scope of the invention as defined by the appended claims. It should be understood that replacements and modifications can be made. It will be understood that any feature described in conjunction with any one embodiment may be applied to other embodiments.
Claims (33)
第1部分および第2部分を有する内側を含み、細胞マーカーによる細胞分離、細胞成長および人工組織の成長の反応のための空間を与える1つの反応チャンバーと、
前記チャンバーの内側に配置され、内側の第1部分と内側の第2部分の間を移動することができる、磁着性アジテーターと、
細胞マーカーによる細胞分離を補助し、チャンバーの特定の内側位置にアジテーターをとどまらせ、または反応チャンバーの反転にともなって内側の第1部分と内側の第2部分の間を移動させるように操作可能な、調節可能な磁場とを少なくとも備える、バイオリアクターシステム。 A bioreactor system for separating cells based on cell markers and growing cells and artificial tissue,
One reaction chamber comprising an interior having a first part and a second part, and providing a space for the reaction of cell separation by cell markers, cell growth and artificial tissue growth;
A magnetizable agitator disposed inside the chamber and movable between an inner first portion and an inner second portion;
Operates to assist cell separation with cell markers, allowing the agitator to stay in a specific inner position of the chamber, or to move between the inner first part and the inner second part as the reaction chamber inverts A bioreactor system comprising at least an adjustable magnetic field.
細胞培地容器と流体が行き来できるように連結し、この容器から細胞培地を受け入れ、消し去ることができ、低コロイド浸透性溶液を含む、第1の区画(低浸透区域)と、
第1の区画に隣接し、さらに、細胞、アジテーター、試薬、バッファーおよび培地を受け入れ、消し去るための出入口になるように作られ、その内部にアジテーターが配置されている第2の区画(反応区画)と、
第1の区画と第2の区画の間に配置され、第1の区画から第2の区画へと細胞培地を選択的に流すことができるように作られた、第1の膜と、
第2の区画に隣接し、第3の区画が、バッファー容器からバッファーを受け入れることができるようにバッファー容器と流体が行き来できるように連結し、さらに、廃棄物が第3の容器から廃棄物容器へと流れることができるように廃棄物容器と流体が行き来できるように連結するように作られた、第3の区画(高浸透区画)と、
第2の区画と第3の区画との間に配置され、培地および廃棄物を第2の区画から第3の区画まで選択的に流すことができるように作られた、第2の膜と、
気体透過性材料で作られた反応チャンバーの側壁の少なくとも一部、pHを維持するための試薬を含む培地の1構成要素(例えば、HEPES)、またはチャンバーと接続した気体透過性システム、またはこれら3つの任意の組み合わせと、
バイオリアクターのカセットおよび任意のホルダーに配置された反応チャンバーの少なくとも一部とを備える、請求項1に記載のバイオリアクターシステム。 The inside of the reaction chamber is
A first compartment (low permeation zone), coupled to the fluid flow of the cell culture medium container, for receiving and erasing the cell culture medium from the container, comprising a low colloid osmotic solution;
A second compartment (reaction compartment) that is adjacent to the first compartment and that is designed to serve as an entrance / exit for receiving and erasing cells, agitators, reagents, buffers and media, and in which the agitator is placed. )When,
A first membrane disposed between the first compartment and the second compartment and made to allow selective flow of cell culture medium from the first compartment to the second compartment;
Adjacent to the second compartment, the third compartment is coupled to allow fluid to and from the buffer container so that the buffer can receive the buffer from the buffer container, and the waste is disposed from the third container to the waste container. A third compartment (high permeation compartment) designed to connect the waste container and fluid so that it can flow to
A second membrane disposed between the second compartment and the third compartment and made to allow selective flow of media and waste from the second compartment to the third compartment;
At least part of the side wall of the reaction chamber made of a gas permeable material, one component of a medium containing a reagent for maintaining pH (eg HEPES), or a gas permeable system connected to the chamber, or these 3 Any combination of
The bioreactor system of claim 1, comprising a bioreactor cassette and at least a portion of a reaction chamber located in an optional holder.
(1)全体的に剛性磁着性材料で作られ、裸である(コーティングされていない)か、または細胞の接続および細胞損傷の低減を含む任意の目的のために、不活性で剛性または硬質の材料でコーティングされるか、または
(2)少なくとも部分的に、磁場の中に置かれると磁性を帯びるが、磁場が消えるか、または反応領域からはずされると、磁性ではなくなるか、または磁性が非常に弱くなるような磁着性材料で作られ、
(3)ビーズについて、直径が1ミリメートルより大きく、請求項1および2の反応チャンバーの体積より小さい、請求項1に記載のバイオリアクターシステム。 A magnetic adherent agitator comprising a planar member having a plurality of beads or a plurality of openings,
(1) Made entirely of rigid magnetizable material, bare (uncoated), or inert, rigid or rigid for any purpose including cell attachment and cell damage reduction Or (2) at least partially magnetic when placed in a magnetic field, but becomes non-magnetic or magnetic when the magnetic field disappears or is removed from the reaction zone Made of magnetically adherent material that makes it very weak,
(3) The bioreactor system of claim 1, wherein the beads have a diameter greater than 1 millimeter and less than the volume of the reaction chamber of claims 1 and 2.
(1)電流および/または電圧を変えることによって、または電磁石の位置および向き(配向)を変えることによって、磁場を調節する電磁石によって作ることができるか、
(2)永久磁石の位置および向きを変えることによって磁場を変えるような永久磁石によって作ることができるか、または
(3)上の(1)および(2)の組み合わせによって作ることができる、請求項1に記載のバイオリアクター。 The adjustable magnetic field,
(1) Can be made by an electromagnet that adjusts the magnetic field by changing the current and / or voltage, or by changing the position and orientation (orientation) of the electromagnet,
(2) It can be made by a permanent magnet that changes the magnetic field by changing the position and orientation of the permanent magnet, or (3) it can be made by a combination of (1) and (2) above The bioreactor according to 1.
特異的な磁着性抗体または他の生体分子を標的細胞に結合させることと、
磁着性アジテーターまたはチャンバー壁のいずれかによって、または磁着性アジテーターおよびチャンバー壁の両方によって磁気的に標識された細胞を捕捉し、チャンバー壁が、請求項8の発生器(マグネットまたは電磁石)によって磁場が調節されるように作られていることと、
非標識細胞を捨てるか、または洗浄することと、
標的細胞を放出させることと、を含む、請求項13に記載の方法。 Cell separation by cell marker
Binding a specific magnetized antibody or other biomolecule to a target cell;
9. Capture cells magnetically labeled by either a magnetizable agitator or chamber wall, or by both the magnetizable agitator and chamber wall, wherein the chamber wall is by the generator of claim 8 (magnet or electromagnet). Made to adjust the magnetic field,
Discarding or washing unlabeled cells;
The method of claim 13, comprising releasing target cells.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161468573P | 2011-03-29 | 2011-03-29 | |
| US61/468,573 | 2011-03-29 | ||
| PCT/US2012/000182 WO2013048546A1 (en) | 2011-03-29 | 2012-03-29 | Multifunctional bioreactor system and methods for cell sorting and culturing |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014509523A true JP2014509523A (en) | 2014-04-21 |
| JP6083027B2 JP6083027B2 (en) | 2017-02-22 |
Family
ID=47996272
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014502558A Expired - Fee Related JP6083027B2 (en) | 2011-03-29 | 2012-03-29 | Multifunctional bioreactor system and method for sorting and culturing cells |
Country Status (8)
| Country | Link |
|---|---|
| EP (1) | EP2665807B1 (en) |
| JP (1) | JP6083027B2 (en) |
| KR (1) | KR20140006024A (en) |
| CN (1) | CN103298922B (en) |
| BR (1) | BR112013025086A2 (en) |
| HK (1) | HK1189026A1 (en) |
| MX (1) | MX2013011162A (en) |
| WO (1) | WO2013048546A1 (en) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016163544A (en) * | 2015-03-06 | 2016-09-08 | 株式会社Screenホールディングス | Culture carrier, culture vessel, and culture apparatus |
| JP2018191630A (en) * | 2017-05-15 | 2018-12-06 | 高雄醫學大學 | Cell separation and purification apparatus |
| JP2019528087A (en) * | 2016-08-21 | 2019-10-10 | アドヴァ バイオテクノロジー リミテッド | Bioreactor and use thereof |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103897985B (en) * | 2012-12-25 | 2016-08-10 | 中国科学院青岛生物能源与过程研究所 | living single cell sorting electronic control system |
| GB2520300A (en) * | 2013-11-15 | 2015-05-20 | Univ Loughborough | Cell Culture System |
| CN103642682B (en) * | 2013-12-20 | 2014-12-17 | 湖北民族学院 | High-efficiency biological reactor and dioscin high-efficiency biological hydrolysis method |
| CN104031834B (en) * | 2014-07-07 | 2015-12-02 | 太原理工大学 | A kind of photosynthetic bacterium successive reaction hydrogen production process |
| US10280390B2 (en) | 2014-12-22 | 2019-05-07 | Saint-Gobain Performance Plastics Corporation | System for culture of cells in a controlled environment |
| CN104694474B (en) * | 2015-03-31 | 2017-09-05 | 南京新诺丹生物技术有限公司 | A kind of cell culture processes |
| US20180291364A1 (en) | 2015-05-08 | 2018-10-11 | Biomagnetic Solutions Llc. | Apparatus and method for immunomagnetic cell separation |
| CN105132275A (en) * | 2015-09-28 | 2015-12-09 | 浙江大学舟山海洋研究中心 | Microorganism gathering device and application thereof |
| CN105754854B (en) * | 2016-03-30 | 2017-11-24 | 舟山医院 | A kind of stomach cancer cell culture instrument |
| CN107400631A (en) * | 2016-05-18 | 2017-11-28 | 纳维再生科技股份有限公司 | The cell isolation method of closed system, its cell culture bags and its cell separation apparatus |
| FI128522B (en) * | 2016-05-20 | 2020-07-15 | Ari Juhani Riihimaa | An apparatus and a method for growing invertebrates |
| IL291373B2 (en) * | 2016-07-11 | 2023-10-01 | Yissum Res Dev Co Of Hebrew Univ Jerusalem Ltd | Systems and methods for growing cells in vitro |
| CN106244451A (en) * | 2016-08-04 | 2016-12-21 | 江苏科技大学 | A kind of magnetic force biochemistry mixing reactor |
| IT201600083775A1 (en) * | 2016-08-09 | 2018-02-09 | Torino Politecnico | Apparatus for the determination and application of electromagnetic fields to influence cell growth in vitro |
| CN106237915B (en) * | 2016-08-16 | 2019-01-25 | 闫维新 | A kind of magnetic bead control device based on permanent magnet |
| CN106520669A (en) * | 2016-10-25 | 2017-03-22 | 浙江译美生物科技有限公司 | Directional differentiation culture system for stem cells |
| EP3587550A4 (en) * | 2017-02-27 | 2021-06-16 | Koji Tanabe | Cell processing system and cell processing device |
| CN106701577A (en) * | 2017-03-07 | 2017-05-24 | 南京新诺丹生物技术有限公司 | Multifunctional bioreactor used for cell culture and cell sorting |
| CN107164221B (en) * | 2017-04-28 | 2019-07-26 | 齐齐哈尔医学院 | The device of electromagnetic force heating damage spin dialysis cancer cells in blood |
| CN107058086B (en) * | 2017-05-26 | 2020-07-03 | 奥凯(苏州)生物技术有限公司 | Method and system for preventing cells from blocking culture device |
| CN107043701A (en) * | 2017-05-26 | 2017-08-15 | 奥凯(苏州)生物技术有限公司 | A kind of cell expansion system for improving cell inoculation dispersiveness |
| CN107043734B (en) * | 2017-05-26 | 2020-12-25 | 奥凯(苏州)生物技术有限公司 | Automatic cell collection method of cell amplification system |
| CN107189975B (en) * | 2017-05-26 | 2020-12-25 | 奥凯(苏州)生物技术有限公司 | Cell collection method of closed cell amplification system |
| CN107236669A (en) * | 2017-06-06 | 2017-10-10 | 北京呈诺医学科技有限公司 | A kind of the high efficiency culture systems and application process of mass cell production and culture |
| KR101886365B1 (en) * | 2017-06-19 | 2018-09-11 | 한국식품연구원 | Autonomous hygiene detection device, autonomous hygiene management system and autonomous hygiene management method |
| WO2019051486A1 (en) * | 2017-09-11 | 2019-03-14 | 3D Biotek, Llc | Large-scale bioreactor |
| CN107475111B (en) * | 2017-09-26 | 2020-07-14 | 上海莱威生物科技有限公司 | Pretreatment device for culturing human umbilical cord mesenchymal stem cells and related application thereof |
| CN107475110B (en) * | 2017-09-26 | 2020-07-14 | 上海莱威生物科技有限公司 | Pretreatment device for culturing human amniotic mesenchymal stem cells and culture method thereof |
| WO2019106207A1 (en) * | 2017-12-01 | 2019-06-06 | General Electric Company | Methods for cell enrichment and isolation |
| JP7433232B2 (en) * | 2017-12-20 | 2024-02-19 | ユニバーセルズ テクノロジーズ エス.エー. | Bioreactors and related methods |
| CN108753611B (en) * | 2018-06-06 | 2023-03-24 | 青岛农业大学 | Soft tissue digestion device for primary cell culture |
| CN109055210A (en) * | 2018-07-05 | 2018-12-21 | 曾小敏 | The device of inexpensive cell culture |
| US11447729B2 (en) * | 2018-12-21 | 2022-09-20 | Global Life Sciences Solutions Usa Llc | Apparatus and method for bioprocessing |
| CN110423676B (en) * | 2019-08-13 | 2023-04-14 | 华东理工大学 | Magnetically controlled bioreactor system for in vitro cell culture |
| KR102618894B1 (en) * | 2020-08-28 | 2023-12-29 | 주식회사 씨위드 | Cell culture device for cultured meat production |
| JPWO2022065401A1 (en) * | 2020-09-25 | 2022-03-31 | ||
| EP4339272A1 (en) | 2022-09-13 | 2024-03-20 | The Automation Partnership (Cambridge) Ltd. | Systems and methods for developing and optimizing cell culture processes |
| CN116286600A (en) * | 2023-02-02 | 2023-06-23 | 中国人民解放军空军军医大学 | Vitiligo cell magnetic bead sorting device |
| CN116814432B (en) * | 2023-08-29 | 2023-11-24 | 苏州赛普生物科技股份有限公司 | Cell closed culture device and method with high air permeability |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS61175999U (en) * | 1985-04-24 | 1986-11-01 | ||
| JP2003070458A (en) * | 2001-09-04 | 2003-03-11 | Mitsubishi Heavy Ind Ltd | Three-dimensional clinostat, cell culture apparatus, organism raising apparatus and material forming apparatus |
| JP2003519008A (en) * | 2000-01-04 | 2003-06-17 | シディキ,イクバル,ダブリュー. | Mixing / separating apparatus and method using magnetic particles |
| JP2004504023A (en) * | 2000-07-19 | 2004-02-12 | ゲムセル リミテッド(ソシエテ ドゥ ドロワ イルランデ) | Cell culture room and bioreactor for in vitro culture of animal cells |
| JP2004313008A (en) * | 2003-04-10 | 2004-11-11 | Pentax Corp | Method for cell culture and apparatus for cell culture |
| JP2004321133A (en) * | 2003-04-28 | 2004-11-18 | International Medical Center Of Japan | Cell production apparatus and method for producing cell |
| JP2007510433A (en) * | 2003-11-10 | 2007-04-26 | ウィルソン ウォルフ マニュファクチャリング コーポレイション | Partitioning device for cell culture, cell treatment and sample dialysis |
| JP2007535902A (en) * | 2003-07-17 | 2007-12-13 | グローバル セル ソリューションズ エルエルシー. | Automated cell culture system and method |
| WO2010109392A1 (en) * | 2009-03-23 | 2010-09-30 | Koninklijke Philips Electronics N.V. | Manipulation of magnetic particles in a biological sample |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS51151384A (en) * | 1975-06-20 | 1976-12-25 | Olympus Optical Co Ltd | Process for cultivating organic tissue or cells automatically |
| US5026650A (en) * | 1988-06-30 | 1991-06-25 | The United States Of Amercia As Represented By The Administrator Of The National Aeronautics And Space Administration | Horizontally rotated cell culture system with a coaxial tubular oxygenator |
| US8026096B1 (en) * | 1998-10-08 | 2011-09-27 | Protein Sciences Corporation | In vivo active erythropoietin produced in insect cells |
| CN1131304C (en) * | 1999-12-09 | 2003-12-17 | 中国科学院力学研究所 | Spacial dialyzing counterflow cell cultivator and cultivating method |
| WO2002042421A2 (en) * | 2000-11-21 | 2002-05-30 | Biocrystal, Ltd. | Cell culture apparatus and methods of use |
| US20040248291A1 (en) * | 2003-04-10 | 2004-12-09 | Pentax Corporation | Method for culturing cells, cell culture carriers and cell culture apparatus |
| WO2005003332A2 (en) * | 2003-06-30 | 2005-01-13 | University Of South Florida | Diamagnetically stabilised three-dimensional cell culture |
| US20060024776A1 (en) * | 2004-08-02 | 2006-02-02 | Mcmillian Ray | Magnetic particle capture of whole intact organisms from clinical samples |
-
2012
- 2012-03-29 JP JP2014502558A patent/JP6083027B2/en not_active Expired - Fee Related
- 2012-03-29 MX MX2013011162A patent/MX2013011162A/en not_active Application Discontinuation
- 2012-03-29 KR KR1020137023931A patent/KR20140006024A/en not_active Application Discontinuation
- 2012-03-29 WO PCT/US2012/000182 patent/WO2013048546A1/en active Application Filing
- 2012-03-29 EP EP12837029.3A patent/EP2665807B1/en not_active Not-in-force
- 2012-03-29 BR BR112013025086A patent/BR112013025086A2/en not_active Application Discontinuation
- 2012-03-29 CN CN201280001774.5A patent/CN103298922B/en active Active
-
2014
- 2014-03-04 HK HK14102141.8A patent/HK1189026A1/en not_active IP Right Cessation
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS61175999U (en) * | 1985-04-24 | 1986-11-01 | ||
| JP2003519008A (en) * | 2000-01-04 | 2003-06-17 | シディキ,イクバル,ダブリュー. | Mixing / separating apparatus and method using magnetic particles |
| JP2004504023A (en) * | 2000-07-19 | 2004-02-12 | ゲムセル リミテッド(ソシエテ ドゥ ドロワ イルランデ) | Cell culture room and bioreactor for in vitro culture of animal cells |
| JP2003070458A (en) * | 2001-09-04 | 2003-03-11 | Mitsubishi Heavy Ind Ltd | Three-dimensional clinostat, cell culture apparatus, organism raising apparatus and material forming apparatus |
| JP2004313008A (en) * | 2003-04-10 | 2004-11-11 | Pentax Corp | Method for cell culture and apparatus for cell culture |
| JP2004321133A (en) * | 2003-04-28 | 2004-11-18 | International Medical Center Of Japan | Cell production apparatus and method for producing cell |
| JP2007535902A (en) * | 2003-07-17 | 2007-12-13 | グローバル セル ソリューションズ エルエルシー. | Automated cell culture system and method |
| JP2007510433A (en) * | 2003-11-10 | 2007-04-26 | ウィルソン ウォルフ マニュファクチャリング コーポレイション | Partitioning device for cell culture, cell treatment and sample dialysis |
| WO2010109392A1 (en) * | 2009-03-23 | 2010-09-30 | Koninklijke Philips Electronics N.V. | Manipulation of magnetic particles in a biological sample |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016163544A (en) * | 2015-03-06 | 2016-09-08 | 株式会社Screenホールディングス | Culture carrier, culture vessel, and culture apparatus |
| JP2019528087A (en) * | 2016-08-21 | 2019-10-10 | アドヴァ バイオテクノロジー リミテッド | Bioreactor and use thereof |
| JP7116061B2 (en) | 2016-08-21 | 2022-08-09 | アドヴァ バイオテクノロジー リミテッド | Bioreactor and its use |
| JP2018191630A (en) * | 2017-05-15 | 2018-12-06 | 高雄醫學大學 | Cell separation and purification apparatus |
Also Published As
| Publication number | Publication date |
|---|---|
| CN103298922B (en) | 2014-11-19 |
| EP2665807A4 (en) | 2015-04-15 |
| WO2013048546A1 (en) | 2013-04-04 |
| JP6083027B2 (en) | 2017-02-22 |
| EP2665807A1 (en) | 2013-11-27 |
| KR20140006024A (en) | 2014-01-15 |
| MX2013011162A (en) | 2015-01-16 |
| CN103298922A (en) | 2013-09-11 |
| HK1189026A1 (en) | 2014-05-23 |
| BR112013025086A2 (en) | 2016-08-23 |
| EP2665807B1 (en) | 2018-10-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6083027B2 (en) | Multifunctional bioreactor system and method for sorting and culturing cells | |
| Yaman et al. | Magnetic force-based microfluidic techniques for cellular and tissue bioengineering | |
| US5989913A (en) | Culture vessel for growing or culturing cells, cellular aggregates, tissues and organoids and methods for using the same | |
| US6080581A (en) | Culture vessel for growing or culturing cells, cellular aggregates, tissues and organoids and methods for using same | |
| JP2023165752A (en) | Methods for cell enrichment and isolation | |
| AU2015200830B2 (en) | Methods and systems for manipulating particles using a fluidized bed | |
| JP5801806B2 (en) | Container for culturing cells | |
| US11332704B2 (en) | Culture device, culture system, and culture method | |
| EP2909303B1 (en) | Bioreactor system and methods for alternative cell culture between static and dynamic | |
| JP2007535902A (en) | Automated cell culture system and method | |
| KR20080031035A (en) | A rotatable perfused time varying electromagnetic force bioreactor and method of using the same | |
| US20130260364A1 (en) | Multifunctional Bioreactor system and methods for cell sorting and culturing | |
| US9365813B2 (en) | Bioreactor system and methods for alternative cell culture between static and dynamic | |
| ES2663225T3 (en) | Enrichment or isolation method of a target cell population | |
| EP3802775B1 (en) | Apparatus and process for the automated manufacturing of genetically engineered cells from biological fluids | |
| Pörtner et al. | Cultivation of mammalian cells in fixed-bed reactors | |
| Woon et al. | Expansion of Human Pluripotent Stem Cells in Stirred Tank Bioreactors | |
| EP1220891A1 (en) | Culture vessel for growing or culturing cells, cellular aggregates, tissues and organoids and methods for using same |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150327 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20151225 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160105 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150327 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160404 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160817 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161107 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20161130 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20161227 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20161227 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20161227 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6083027 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |