JP2004063277A - Host substance for phosphorescence emitting substance, and organic el element using it - Google Patents
Host substance for phosphorescence emitting substance, and organic el element using it Download PDFInfo
- Publication number
- JP2004063277A JP2004063277A JP2002220224A JP2002220224A JP2004063277A JP 2004063277 A JP2004063277 A JP 2004063277A JP 2002220224 A JP2002220224 A JP 2002220224A JP 2002220224 A JP2002220224 A JP 2002220224A JP 2004063277 A JP2004063277 A JP 2004063277A
- Authority
- JP
- Japan
- Prior art keywords
- group
- substance
- linear
- carbon atoms
- host
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 C*C(CC1)CCC1C1OC(C(CC(C2)C3OC(C4CCC(*)CC4)NN3)CC2C2OC(C3CCC(*C)CC3)NN2)NN1 Chemical compound C*C(CC1)CCC1C1OC(C(CC(C2)C3OC(C4CCC(*)CC4)NN3)CC2C2OC(C3CCC(*C)CC3)NN2)NN1 0.000 description 2
- QICBQQKBDSTUCC-CDENDSRHSA-N CCC(C)CC(C)C(B([C@@H](CC1)SC1C(CC(C1)C2SC(B(C3C(C)CC(C)CC3C)C3C(C)CC(C)CC3C)CC2)CC1C1S[C@H](B(C2C(C)CC(C)CC2C)C2C(C)C=C(C)CC2C)CC1)C1C(C)CC(C)CC1C)C Chemical compound CCC(C)CC(C)C(B([C@@H](CC1)SC1C(CC(C1)C2SC(B(C3C(C)CC(C)CC3C)C3C(C)CC(C)CC3C)CC2)CC1C1S[C@H](B(C2C(C)CC(C)CC2C)C2C(C)C=C(C)CC2C)CC1)C1C(C)CC(C)CC1C)C QICBQQKBDSTUCC-CDENDSRHSA-N 0.000 description 1
- WFLJQLPFQFRFHC-UHFFFAOYSA-N COC1(C(CCCC2)=C2C(CC2)C1CC2N(C1C=C(C(c2ccccc22)(OC)OC)C2=CC1)C1=CCCCC1)OC Chemical compound COC1(C(CCCC2)=C2C(CC2)C1CC2N(C1C=C(C(c2ccccc22)(OC)OC)C2=CC1)C1=CCCCC1)OC WFLJQLPFQFRFHC-UHFFFAOYSA-N 0.000 description 1
Images
Landscapes
- Electroluminescent Light Sources (AREA)
Abstract
Description
【0001】
【発明の属する技術分野】
本発明は、りん光発光性物質用ホスト物質およびそれを用いた有機エレクトロルミネッセンス素子に関する。
【0002】
【従来の技術】
エレクトロルミネッセンス素子(以下、「EL素子」という場合がある)は、ディスプレイや屋内照明、レーザー光源など様々な用途への応用が期待されている素子である。EL素子用材料としては無機物質と有機物質の両方が検討されているが、近年、特に、有機物質を用いる有機EL素子の開発が活発に行われている。有機物質は無機物質に比べて多様な化学修飾が可能であるため、適切な分子設計により、EL素子が必要とする物性および機能を発現することができると考えられる。有機EL素子をディスプレイ、屋内照明およびレーザー光源等に応用するためには、その素子が高い発光効率を有することが必要である。
【0003】
有機EL素子は、一般に、有機固体薄膜を二つの電極ではさんだ構造をもち、その動作原理は以下のように説明される。すなわち、直流電圧印加により陽極から正孔が、陰極から電子がそれぞれ有機層に注入され、有機層中で再結合し、その際に生じる励起種から発光が得られる。
【0004】
前記のような励起種から得られる発光には、励起一重項状態からの輻射失活に由来する蛍光と、励起三重項状態からの輻射失活に由来するりん光とがある。これまで主に用いられてきたEL素子用発光材料は、主に蛍光性物質であった[C.W. Tang, S. A. VanSlyke, Appl. Phys. Lett., 51, (1987) 913. 等]。しかし、電子と正孔との再結合により生じる励起一重項状態と励起三重項状態の比は1:3であり、励起一重項状態からの発光(蛍光)のみを用いた場合、励起三重項状態のエネルギーを無駄にしてしまうため発光効率が十分に高いとは言えない。
【0005】
近年、励起三重項状態のエネルギーを発光に変換する手法として、りん光発光性物質(りん光発光性材料)を用いる手法が提案されている[M.A. Baldo et al., Nature, 395 (1998) 151. 等]。有機EL素子に対しりん光発光性物質を用いることは、発光効率向上の有効な方法論である。
【0006】
これまでに報告されたりん光発光性物質のうち最も成功したのはイリジウム錯体である[M.A. Baldo et al., Appl. Phys. Lett., 75 (1999) 4. および S. Lamansky et al. J. Am. Chem. Soc., 123 (2001) 4304.等]。しかしながら、これらりん光発光性物質単独で薄膜を形成し発光層として用いた場合、有機EL素子の発光効率は低い。これは、りん光発光性物質の製膜性が低いことと励起状態の自己消光を起こしてしまうことが原因である。この問題を解消し高い発光効率を実現する方法として、少量のりん光発光性物質を大量の蛍光発光性物質(以下「ホスト」「ホスト物質」または「ホスト材料」という場合がある。)中に分散させる方法がある。
【0007】
高い発光効率を有し、しかも熱等に対し安定な有機EL素子を形成するために、前記ホスト物質に要求される性能としては、
1.正孔と電子の再結合サイトとなること。
2.ホスト物質からゲスト物質(りん光発光性物質)への励起エネルギーの移動が効率よく起こること。
3.均質なアモルファス薄膜を形成し、ガラス転移温度が高いこと。
等が挙げられる。
【0008】
これまでに、イリジウム錯体等のりん光発光性物質用のホスト物質としては、下記式(3)で表される4,4’−ジ(N−カルバゾリル)ビフェニルなど2、3の例が報告されている[M.A. Baldo et al., Appl. Phys. Lett., 75 (1999) 4.等]。
【化4】
【0009】
しかし、それらホスト物質は、有機EL素子に対する実用性が十分であるとは言えない。例えば、4,4’−ジ(N−カルバゾリル)ビフェニルは、薄膜の安定性が低く、均質なアモルファス薄膜を形成できないことが示されている[B.E. Koene et al., Chem. Mater., 10 (1998) 2235]。従って、十分に安定なEL素子を形成することはできない。
【0010】
以上の理由から、発光効率および安定性の高い有機EL素子を得るために、優れた性能を有するりん光発光性物質用ホスト物質の開発が必要とされている。
【0011】
【発明が解決しようとする課題】
したがって、本発明は、励起エネルギーの移動効率に優れ、かつ熱等に対する安定性が高いりん光発光性物質用ホスト物質を提供することを目的とする。
【0012】
【課題を解決するための手段】
前記課題を解決するために、本発明のりん光発光性物質用ホスト物質は、下記一般式(1)で表される物質である。
【化5】
ただし、式中、
R1〜R4は、それぞれ同一であるかまたは異なり、水素、ハロゲン、炭素数1〜6の直鎖もしくは分枝アルキル基、または炭素数1〜6の直鎖もしくは分枝アルコキシ基であり、
R5は、水素、任意にフェニル置換された炭素数1〜6の直鎖もしくは分枝アルキル基、任意にフェニル置換された炭素数1〜6の直鎖もしくは分枝アルコキシ基、フェニル基、またはフェノキシ基であり、
R6およびR7は、それぞれ同一であるかまたは異なり、水素、ハロゲン、任意にハロゲン置換された炭素数1〜6の直鎖もしくは分枝アルキル基、炭素数1〜6の直鎖もしくは分枝アルコキシ基、アミノ基、炭素数1〜6の直鎖もしくは分枝アルキルアミノ基、ジアルキルアミノ基(ただし、前記アルキル基は炭素数1〜6の直鎖もしくは分枝アルキル基であり、同一でも異なっていても良い)、炭素数1〜6の直鎖もしくは分枝アルカノイル基、シアノ基、またはニトロ基である。
【0013】
また、本発明の有機EL素子は、陰極と陽極との間に発光を示す有機層を含むEL素子であって、前記有機層のうち少なくとも一層がりん光発光性物質と本発明のりん光発光性物質用ホスト物質との混合物を含むEL素子である。なお、前記発光を示す有機層は、一層のみでも複数存在しても良い。また、陰極と陽極との間には、前記発光を示す有機層のみが存在しても良いし、発光を示さない有機層が存在しても良い。
【0014】
【発明の実施の形態】
次に、本発明の実施形態について説明する。
【0015】
(りん光発光性物質用ホスト物質)
前記一般式(1)で表される本発明のりん光発光性物質用ホスト物質は、例えば下記スキーム1にしたがって合成することができる。
【化6】
【0016】
以下、上記スキーム1について説明する。まず、前記一般式(4)で表されるフルオレン誘導体を準備する。式中、R6は前記式(1)で定義した通りである。次に、これをヨウ素化して、一般式(5)で表される2−ヨードフルオレン誘導体を得る。ヨウ素化の方法は特に限定されないが、例えばヨウ素、オルト過ヨウ素酸および硫酸の存在下、酢酸溶媒中で行うことができる。
【0017】
次に、2−ヨードフルオレン誘導体(5)の9位に置換基R1およびR2を順次導入して化合物(6)とする。R1およびR2は前記式(1)で定義した通りである。R1およびR2の導入方法は特に限定されず、公知の方法を用いることができるが、アルキル基の場合は、例えば、9位の水素をブチルリチウムにより脱離させてカルボアニオンを生成させ、次に、対応するヨウ化アルキルを加えて導入することができる。アルコキシ基の場合は、ベンジル位のアルコキシ化に通常用いられる方法、例えばハロゲン化の後アルコーリシス反応させる方法等を使用することができる。また、R1とR2が同種の置換基である場合は、一段階で導入することができる。
【0018】
そして、化合物(6)と、一般式(7)で表されるアニリン誘導体とをカップリング反応させて、一般式(8)で表されるアミンを得る。R5は前記式(1)で定義した通りである。このカップリング反応の方法は特に限定されず、公知の方法を用いることができるが、例えば、以下のようにして行うことができる。すなわち、まず、式(6)の2−ヨードフルオレン誘導体および式(7)のアニリン誘導体と、炭酸カリウム、銅紛および18−クラウン−6等の触媒と、溶媒とを混合し、窒素雰囲気下で加熱攪拌して反応させる。溶媒は特に限定されないが、例えばメシチレン等を用いることができる。反応温度および反応時間も特に限定されないが、例えば170℃で10時間反応させる。そして、溶媒を留去した後、残渣をシリカゲルカラムクロマトグラフィーで精製し、再結晶して、式(8)のアミンを得る。再結晶溶媒は特に限定されないが、例えば、トルエンとヘキサンの混合溶媒を用いることができる。
【0019】
さらに、もう一度同様の方法で、アミン(8)と2−ヨードフルオレン誘導体(9)とをカップリング反応させて、N,N−ビス(2−フルオレニル)アニリン誘導体(1)を得る。化合物(9)において、R3、R4およびR7は前記式(1)で定義した通りであり、化合物(6)と同様の方法により得ることができる。また、化合物(6)と(9)とが同一の化学式で表される場合は、アニリン誘導体(7)との一段階カップリング反応により化合物(1)を得ることができる。
【0020】
本発明のりん光発光性物質用ホスト物質は、下記一般式(2)で表されることが好ましい。
【化7】
ただし、式中、
R1〜R4は、それぞれ同一であるかまたは異なり、水素、炭素数1〜6の直鎖もしくは分枝アルキル基、または炭素数1〜6の直鎖もしくは分枝アルコキシ基であり、
R5は、水素、炭素数1〜6の直鎖もしくは分枝アルキル基、炭素数1〜6の直鎖もしくは分枝アルコキシ基、ベンジル基、またはフェノキシ基である。
【0021】
前記式(1)および(2)において、
R1〜R4が、それぞれ、水素、メチル基、エチル基、n−プロピル基、sec−プロピル基、n−ブチル基、sec−ブチル基、tert−ブチル基、メトキシ基、またはエトキシ基であり、
R5が、水素、メチル基、エチル基、n−プロピル基、sec−プロピル基、n−ブチル基、sec−ブチル基、tert−ブチル基、メトキシ基、エトキシ基、ベンジル基、またはフェノキシ基であることがより好ましい。
【0022】
また、本発明のりん光発光性物質用ホスト物質は、下記式A−1からA−6のいずれかで表される物質であることが特に好ましい。
【化8】
【0023】
(EL素子)
次に、本発明のりん光発光性物質用ホスト物質を用いた有機EL素子について説明する。
【0024】
本発明のりん光発光性物質用ホスト物質は、均質なアモルファス薄膜を形成し、比較的ガラス転移温度が高いため、熱等に対し安定な有機EL素子を容易に作製することができる。また、本発明のEL素子は、発光を示す有機層がりん光発光性物質と本発明のりん光発光性物質用ホスト物質との混合物を含むことにより、高い発光効率を示す。
【0025】
前記混合物中においては、ホスト物質内部で正孔と電子の再結合が起こり、ホスト物質の励起状態(一重項および三重項励起状態)が生じる。この一重項および三重項励起エネルギーがりん光発光性物質に移動し、りん光発光性物質から発光が得られる。前記混合物中のりん光発光性物質の含有率は特に限定されないが、より高い発光効率を得るためには0.1〜20重量%が好ましく、さらに好ましくは0.5〜15重量%、特に好ましくは1〜10%である。また、前記層は、前記混合物のみを含んでいても良いが、前記励起エネルギー移動を阻害しない限度においてその他の物質を含んでいても良い。前記その他の物質の含有量は、例えば、前記混合物の重量に対し50重量%以下である。
【0026】
本発明のEL素子の形態は特に限定されないが、例えば、図1〜図5の各図に示す形態が可能である。
【0027】
図1に、本発明のEL素子の一例を示す。図示の通り、このEL素子10は、基板1の上に、陽極2、発光層4および陰極7がこの順番で積層されている。陽極2および陰極3には、それぞれ導線8が接続されており、導線8の他端は電源(図示せず)に接続されている。
【0028】
図2に、本発明のEL素子のその他の一例を示す。図示の通り、EL素子10は、基板1の上に、陽極2、正孔輸送層3、発光層4および陰極7がこの順番で積層されている。それ以外は図1のEL素子と同様である。
【0029】
図3に、本発明のEL素子のさらにその他の一例を示す。図示の通り、EL素子10は、基板1の上に、陽極2、発光層4、電子輸送層6および陰極7がこの順番で積層されている。それ以外は図1のEL素子と同様である。
【0030】
図4に、本発明のEL素子のさらにその他の一例を示す。図示の通り、EL素子10は、基板1の上に、陽極2、正孔輸送層3、発光層4、電子輸送層6および陰極7がこの順番で積層されている。それ以外は図1のEL素子と同様である。
【0031】
図5に、本発明のEL素子のさらにその他の一例を示す。図示の通り、EL素子10は、基板1の上に、陽極2、正孔輸送層3、発光層4、正孔阻止層5、電子輸送層6および陰極7がこの順番で積層されている。それ以外は図1のEL素子と同様である。
【0032】
上記各EL素子において、陽極2は特に限定されないが、例えば、ITOにより形成された透明電極等が好ましい。陰極7も特に限定されないが、例えば、マグネシウム−銀合金電極、アルミニウム電極、カルシウム電極、リチウム/アルミニウム積層電極、またはフッ化リチウム/アルミニウム積層電極等が好ましい。基板1も特に限定されないが、例えばガラスが好ましく、また、PETフィルム等も使用可能である。
【0033】
上記各EL素子は、陽極2および陰極7に挟まれた各層のうち、少なくとも一層が、りん光発光性物質と本発明のりん光発光性物質用ホスト物質との混合物を含む。この混合物は発光層4に含まれることが好ましいが、それ以外の層が前記混合物を含み、りん光発光性物質に由来する発光を示しても良い。
【0034】
本発明のEL素子に用いるりん光発光性物質は特に限定されないが、例えばイリジウム錯体が好ましく、より好ましくは下記式で表される化合物トリス(2−フェニルピリジン)イリジウム(以下、略して「Ir(ppy)3」と呼ぶことがある)である。この化合物は、現在、りん光発光性物質として最も広く用いられている。
【化9】
【0035】
上記Ir(ppy)3以外のりん光発光性物質としては、例えば、ビス(2−(2’−チエニル)ピリジナト−N,C3’)アセチルアセトナト)イリジウム(下記式[a])、ビス(2−(2’−ベンゾチエニル)ピリジナト−N,C3’)アセチルアセトナト)イリジウム(下記式[b])、ビス(2,4−ジフェニルオキサゾラト−1,3−N,C2’)(アセチルアセトナト)イリジウム(下記式[c])、ビス(2−(1−ナフチル)ベンゾオキサゾラト−N,C2’)(アセチルアセトナト)イリジウム(下記式[d])、ビス(2−(2−ナフチル)ベンゾオキサゾラト−N,C2’)(アセチルアセトナト)イリジウム(下記式[e])、およびビス(2−フェニルオキサゾリナト−N,C2’)(アセチルアセトナト)イリジウム(下記式[f])等がある。上記6種のイリジウム錯体は、全て S. Lamansky et al, J. Am. Chem.Soc., 123 (2001) 4304. に記載されている。以下に、上記各イリジウム錯体の構造式を示す。
【0036】
【化10】
【0037】
前記各層に含まれる物質のうち、りん光発光性物質および本発明のりん光発光性物質用ホスト物質以外で好ましい物質としては、例えば、下記の物質がある。なお、以下に記載する学術文献は、すべて本発明者らの発明に係る文献である。
【0038】
正孔輸送材料としては、例えばトリアリールアミン誘導体が好ましく、より好ましくは、
4,4’,4”−トリス(3−メチルフェニルフェニルアミノ)トリフェニルアミン(以下、略して「m−MTDATA」と呼ぶことがある)[Chem. Lett., 1989, 1145.]や、
4,4’,4”−トリス(1−ナフチルフェニルアミノ)トリフェニルアミン(以下、略して「1−TNATA」と呼ぶことがある)および4,4’,4”−トリス(2−ナフチルフェニルアミノ)トリフェニルアミン(以下、略して「2−TNATA」と呼ぶことがある)[J. Lumin., 72−74, 985 (1997).]や、
4,4’,4”−トリス[ビフェニル−2−イル(フェニル)アミノ]トリフェニルアミン(以下、略して「o−PTDATA」と呼ぶことがある)、4,4’,4”−トリス[ビフェニル−3−イル(フェニル)アミノ]トリフェニルアミン(以下、略して「m−PTDATA」と呼ぶことがある)および4,4’,4”−トリス[ビフェニル−4−イル(3−メチルフェニル)アミノ]トリフェニルアミン(以下、略して「p−PMTDATA」と呼ぶことがある)[Synth. Met., 111, 387(2000)]や、
4,4’、4”−トリス[9,9−ジメチル−2−フルオレニル(フェニル)アミノ]トリフェニルアミン(以下、略して「TFATA」と呼ぶことがある)[Chem. Lett., 2000, 1834.]等である。以下に、上記各化合物の構造式を示す。
【0039】
【化11】
【化12】
【化13】
【化14】
【化15】
【化16】
【化17】
【0040】
ホールブロッキング材料(正孔阻止材料)としては、例えばトリフェニルベンゼン誘導体が好ましく、より好ましくは1,3,5−トリス(4−ビフェニリル)ベンゼン(以下、略してTBBと呼ぶことがある)、1,3,5−トリス(4−フルオロビフェニル−4’−イル)ベンゼン(以下、略してF−TBBと呼ぶことがある)、1,3,5−トリス(9,9−ジメチルフルオレン−2−イル)ベンゼン(以下、略してTFBと呼ぶことがある)および1,3,5−トリス[4−(9,9−ジメチルフルオレン−2−イル)フェニル]ベンゼン(以下、略してTFPBと呼ぶことがある)[Yasuhiko Shirota, Motoi Kinoshita, Kenji Okumoto, SPIE−Int. Soc. Opt. Eng., 4464 (2002) pp. 203−210, 2002.]等である(なお、F−TBBについては、Kenji Okumoto and Yasuhiko Shirota, Appl. Phys. Lett., 79 (2001) pp. 1231−1233.にも記載されている。)。以下に、上記各化合物の構造式を示す。
【0041】
【化18】
【化19】
【化20】
【化21】
【0042】
電子輸送材料として好ましいのは、例えば、
トリス(8−キノリノラト)アルミニウム(以下、略して「Alq3」と呼ぶことがある)や、
1,3,5−トリス(4−ターシャリーブチルフェニル―1,3,4−オキサジアゾリル)ベンゼン(以下、略して「TPOB」と呼ぶことがある)[J. Lumin., 72−74, 985 (1997).]や、
化合物1,3,5−トリス[5−(ジメシチルボリル)−2−チエニル]ベンゼン(以下、略して「TMB−TB」と呼ぶことがある)[Chem. Lett., 2001, 614.]や、
5,5’−ビス(ジメシチルボリル)−2,2’−ビチオフェン(以下、略して「BMB−2T」と呼ぶことがある)および5,5’’−ビス(ジメシチルボリル)−2,2’:5’,2’’−ターチオフェン(以下、略して「BMB−3T」と呼ぶことがある)[J. Am. Chem. Soc., 120, 9714 (1999).]等である。以下に上記各化合物の構造式を示す。
【0043】
【化22】
【化23】
【化24】
【化25】
【化26】
【0044】
前記各図のEL素子の製造方法は特に限定されず、基板1の上に、各構成要素を、公知の方法により順番に積層させて製造することができる。積層方法は特に限定されないが、正孔輸送層3、発光層4、正孔阻止層5および電子輸送層6に対しては、例えば、真空蒸着法(熱蒸着法)、スピンキャスト法によるコーティング(スピンコート法)、ソルベントキャスト法、または溶融状態を冷却する方法等が好ましい。本発明のりん光発光性物質用ホスト物質は優れた熱安定性を有しているため、特に、熱蒸着法またはスピンコート法により透明で均質なアモルファス薄膜を製膜することができる。陽極2および陰極7の積層方法も特に限定されず、公知の方法を用いることができる。
【0045】
前記各図のEL素子の使用方法も特に限定されないが、発光効率が高いため、ディスプレイ、屋内照明およびレーザー光源等に好ましく使用することができる。また、それ以外にも、前記の通り、本発明のEL素子は熱等に対する優れた安定性を有しているから、様々な用途への応用が期待できる。
【0046】
【実施例】
次に、本発明の実施例について説明する。
【0047】
(測定法)
核磁気共鳴(NMR)スペクトルは、商品名Inova−750(Varian社、1H測定時750MHz)を用いて測定した。ケミカルシフトは百万分率(ppm)で表している。内部標準0ppmには、テトラメチルシラン(TMS)を用いた。結合定数(J)は、ヘルツで示しており、略号s、d、t、q、mおよびbrは、それぞれ、一重線(singlet)、二重線(doublet)、三重線(triplet)、四重線(quartet)、多重線(multiplet)および広幅線(broad)を表す。質量分析(MS)は、商品名RP(Voyager社)を用い、MALDI−TOF/MS法により行った。元素分析は、商品名MT−5(柳本製作所)を用いて行った。カラムクロマトグラフィー分離には、シリカゲル(商品名ワコーゲルC−300、和光純薬工業株式会社)またはアルミナ(商品名Aluminium oxide 90 active basic (0.063−0.200)、Merck社)を用いた。全ての化学物質は、試薬級であり、東京化成工業株式会社、和光純薬工業株式会社、ナカライテスク株式会社、関東化学株式会社およびAldrich社から購入した。なお、以下のデータにおいて、融点は全て未補正値である。
【0048】
(合成)
以下に示す方法により、前記式A−1で表される化合物N,N−ビス(9,9−ジメチルフルオレン−2−イル)アニリン(以下、略して「F2PA」と呼ぶことがある)を合成した。
【0049】
(a) 2−ヨード−9,9−ジメチルフルオレンの合成
フルオレン 234 g (1.4 mol) 、ヨウ素 172 g (0.67 mol) 、 オルト過ヨウ素酸 51 g (0.24 mol)、硫酸 18 ml を酢酸 700 mlに溶解し、不活性ガス (窒素ガス) 雰囲気中、温度80℃で4時間攪拌した。反応終了後、溶媒をデカンテーションにより取り除いた。その後トルエンにより反応生成物を抽出し、5%亜硫酸水素ナトリウムで洗浄した。これをカラムクロマトグラフィー (展開溶媒: トルエン 充填剤: Basicアルミナ) およびトルエンからの再結晶により精製し、2−ヨードフルオレンを得た。質量分析により、M/e = 292 (M+)を確認した。
【0050】
次に、2−ヨードフルオレン280 g (0.95 mol) をテトラヒドロフラン 800 mlに溶解させ、カリウムtert−ブトキシド112 g (1.0 mol) を加え、温度0℃で20分間攪拌した。その後、ヨウ化メチル142 g (1.0 mol) を加えさらに20分間攪拌した。続けてもう一度カリウムtert−ブトキシド112 g (1.0 mol) を加え20分間攪拌し、ヨウ化メチル142 g (1.0 mol) を加え20分間攪拌した。反応後、テトラヒドロフランを減圧留去した後、トルエンで抽出した。生成物を減圧蒸留し、シリカゲルカラムクロマトグラフィー (展開溶媒: ヘキサン) により精製し、2−ヨード−9,9−ジメチルフルオレンを174.9 g 得た(フルオレンからの収率39 %)。質量分析により、M/e = 320 (M+)を確認した。
【0051】
(b) N,N−ビス(9,9−ジメチルフルオレン−2−イル)アニリン(F2PA)の合成
前記ステップ(a)で得られた2−ヨード−9,9−ジメチルフルオレン50 g (160 mmol)、 アニリン 6.0 g (65 mmol)、炭酸カリウム 50 g (360 mmol)、銅 10 g (160mmol)、18−クラウン−6 2 g (7.57 mmol) をメシチレン中、不活性ガス (窒素ガス) 雰囲気中、温度170℃で10時間攪拌した。反応終了後、トルエンで抽出、水洗し乾燥後、溶媒を留去した。生成物をシリカゲルカラムクロマトグラフィー(展開溶媒 トルエン : ヘキサン = 1 : 4)、およびヘキサンからの再沈殿により精製し、N,N−ビス(9,9−ジメチルフルオレン−2−イル)アニリン(F2PA)を得た。この化合物の物性値を以下に示す。
【0052】
MS:m/e = 477 (M+) 融点 203 ℃ 元素分析.計算値:C, 90.53; H, 6.54; N2.93.実測値:C, 90.38; H, 6.55; N 2.93. 1H NMR (750 MHz, THF−d8) δ(ppm) 7.74 (2H, d), 7.72 (2H, d), 7.49 (2H, d), 7.35−7.30 (6H,m), 7.27 (2H, t), 7.17 (2H, d), 7.07 (1H, t), 7.04 (2H,d), 1.41 (12H, s).
【0053】
さらに、この化合物F2PAのガラス転移温度(Tg)、およびAg/Ag+参照電極に対する酸化電位(Eox)を測定した。表1にその結果を示す。ガラス転移温度は示差走査熱量測定により測定し、酸化電位はサイクリックボルタンメトリーにより決定した。
【0054】
[表1]
【0055】
表1から分かる通り、F2PAは、82℃と比較的高いガラス転移温度を示し、また、正孔を受け入れるための適切な酸化電位(Ag/Ag+参照電極に対して0.51V)を示した。
【0056】
また、F2PAの蛍光スペクトルを測定し、りん光発光性物質Ir(ppy)3の吸収スペクトルと比較した。図6にその結果を示す。
【0057】
図6から分かる通り、F2PAの蛍光スペクトルは、りん光発光材料Ir(ppy)3の吸収スペクトルとの重なりが大きい。これは、F2PAからIr(ppy)3へのエネルギー移動が効率よく起こり得ることを示す。なお、F2PAは、青紫色領域(ピーク波長398nm)の発光を高い蛍光量子収率(0.56)で示すことから、青紫色発光物質としても使用可能であることが分かる。
【0058】
(EL素子)
次に、上記化合物F2PAを用いて、EL素子を作製し、その性能を評価した。
【0059】
以下の手順により、図5に示す構造を有するEL素子を作製した。すなわち、まず、ガラス基板1の上にITOガラス電極により陽極2が形成されている基盤を準備した。次に、陽極2の上に、前記化合物m−MTDATAを真空蒸着法により厚さ50nm(500オングストローム)となるように堆積させ、正孔輸送層3を形成した。このとき、正孔輸送層3の一部がガラス基板1の表面に接触するようにした。そして、正孔輸送層3の上に、Ir(ppy)3とF2PAとの混合物(Ir(ppy)3含有率10wt%)を、真空蒸着法により厚さ20nm(200オングストローム)となるように堆積させ、発光層4を形成した。次に、発光層4の上に、前記化合物F−TBBを真空蒸着法により厚さ20nm(200オングストローム)となるように堆積させ、正孔阻止層5を形成した。さらに、正孔阻止層5の上に、前記化合物Alq3を真空蒸着法により厚さ10nm(100オングストローム)となるように堆積させ、電子輸送層6(電子輸送性発光層)を形成した。そして、電子輸送性発光層6の上に、フッ化リチウム/アルミニウムよりなる面積4平方ミリメートルの電極を形成して陰極7(背面電極)とし、EL素子を作製した。
【0060】
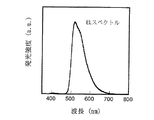
このようにして作製したEL素子に電圧を印加したところ、3ボルト以上の電圧印加により、Ir(ppy)3の発光に基づく緑色の発光を示した。図7に、6ボルトの電圧を印加したときの、室温・大気下における発光スペクトルを示す。
【0061】
さらに、上記EL素子の電圧−輝度特性および電圧−外部量子収率特性を測定した。図8にそれらの結果をまとめて示す。同図から分かる通り、このEL素子の最高輝度は10.0Vで56,900 cd m−2、70 cd m−2 発光時における発光効率は 12.3 lm W−1、量子収率は5.4%であり、高輝度・高効率の純緑色発光が得られた。さらに、高電圧においても外部量子収率があまり減少せず、安定な発光が得られた。
【0062】
以上、実施例に基づいて本発明を詳細に説明してきたが、本発明は上記実施例に限定されるものではなく、本発明の範囲を逸脱しない限りにおいてあらゆる変形や変更が可能である。
【0063】
【発明の効果】
以上詳述したように、本発明によれば、励起エネルギーの移動効率に優れ、かつ熱等に対する安定性が高いりん光発光性物質用ホスト物質を提供することができる。本発明のりん光発光性物質用ホスト物質は、均質なアモルファス薄膜を形成し、比較的ガラス転移温度が高いため、熱等に対し安定な有機EL素子を容易に作製することができる。本発明の有機EL素子は発光効率が高いため、特に、ディスプレイ、屋内照明およびレーザー光源等への使用に適し、その工業的価値は多大である。
【図面の簡単な説明】
【図1】本発明の有機EL素子の一例を示す断面図である。
【図2】本発明の有機EL素子のその他の一例を示す断面図である。
【図3】本発明の有機EL素子のさらにその他の一例を示す断面図である。
【図4】本発明の有機EL素子のさらにその他の一例を示す断面図である。
【図5】本発明の有機EL素子のさらにその他の一例を示す断面図である。
【図6】本発明のホスト物質F2PAの蛍光スペクトルと、りん光発光性物質Ir(ppy)3の吸収スペクトルとをあわせて示したグラフである。
【図7】本発明のEL素子の発光スペクトルの一例を示すグラフである。
【図8】本発明のEL素子の電圧−輝度特性および電圧−外部量子収率特性の一例を示すグラフである。
【符号の説明】
1 基板
2 陽極
3 正孔輸送層
4 発光層
5 正孔阻止層
6 電子輸送層
7 陰極
8 導線
10 EL素子[0001]
TECHNICAL FIELD OF THE INVENTION
The present invention relates to a host material for a phosphorescent substance and an organic electroluminescence device using the same.
[0002]
[Prior art]
2. Description of the Related Art Electroluminescent elements (hereinafter, sometimes referred to as “EL elements”) are elements that are expected to be applied to various uses such as displays, indoor lighting, and laser light sources. Both inorganic substances and organic substances have been studied as materials for EL elements. In recent years, in particular, organic EL elements using organic substances have been actively developed. Organic substances can be modified in a variety of ways as compared to inorganic substances, so it is considered that proper molecular design can exhibit physical properties and functions required of EL elements. In order to apply an organic EL element to a display, indoor lighting, a laser light source, and the like, the element needs to have high luminous efficiency.
[0003]
An organic EL element generally has a structure in which an organic solid thin film is sandwiched between two electrodes, and its operation principle is described as follows. That is, holes are injected from the anode and electrons are injected from the cathode into the organic layer by application of a DC voltage, and recombine in the organic layer. Light emission is obtained from excited species generated at that time.
[0004]
Emissions obtained from such excited species include fluorescence derived from radiation deactivation from the excited singlet state and phosphorescence derived from radiation deactivation from the excited triplet state. The light emitting materials for EL devices that have been mainly used so far have been mainly fluorescent substances [C. W. Tang, S.M. A. VanSlyke, Appl. Phys. Lett. , 51, (1987) 913. etc]. However, the ratio between the excited singlet state and the excited triplet state caused by recombination of electrons and holes is 1: 3, and when only light emission (fluorescence) from the excited singlet state is used, the excited triplet state This energy is wasted, so that the luminous efficiency cannot be said to be sufficiently high.
[0005]
In recent years, a method using a phosphorescent substance (phosphorescent material) has been proposed as a method for converting the energy of the excited triplet state into light emission [M. A. Baldo et al. , Nature, 395 (1998) 151. etc]. Using a phosphorescent substance for an organic EL device is an effective methodology for improving luminous efficiency.
[0006]
The most successful phosphorescent substance reported so far is the iridium complex [M. A. Baldo et al. , Appl. Phys. Lett. , 75 (1999) 4. And S. See Lamansky et al. J. Am. Chem. Soc. , 123 (2001) 4304. etc]. However, when a thin film is formed of these phosphorescent substances alone and used as a light emitting layer, the luminous efficiency of the organic EL element is low. This is because the phosphorescent substance has low film-forming property and self-quenching of the excited state occurs. As a method for solving this problem and achieving high luminous efficiency, a small amount of a phosphorescent substance is contained in a large amount of a fluorescent substance (hereinafter sometimes referred to as “host”, “host substance” or “host material”). There is a method of dispersing.
[0007]
In order to form an organic EL device having high luminous efficiency and stable against heat, etc., the performance required for the host material includes:
1. Become a recombination site for holes and electrons.
2. The transfer of excitation energy from the host substance to the guest substance (phosphorescent substance) occurs efficiently.
3. Form a homogeneous amorphous thin film and have a high glass transition temperature.
And the like.
[0008]
A few examples of host materials for phosphorescent substances such as iridium complexes have been reported so far, such as 4,4'-di (N-carbazolyl) biphenyl represented by the following formula (3). [M. A. Baldo et al. , Appl. Phys. Lett. , 75 (1999) 4. etc].
Embedded image
[0009]
However, these host materials cannot be said to be sufficiently practical for an organic EL device. For example, it has been shown that 4,4′-di (N-carbazolyl) biphenyl has low stability of a thin film and cannot form a homogeneous amorphous thin film [B. E. FIG. Koene et al. Chem., Chem. Mater. , 10 (1998) 2235]. Therefore, a sufficiently stable EL element cannot be formed.
[0010]
For the above reasons, in order to obtain an organic EL device having high luminous efficiency and stability, it is necessary to develop a host material for a phosphorescent substance having excellent performance.
[0011]
[Problems to be solved by the invention]
Therefore, an object of the present invention is to provide a host material for a phosphorescent substance which has excellent transfer efficiency of excitation energy and high stability against heat and the like.
[0012]
[Means for Solving the Problems]
In order to solve the above-mentioned problems, a host material for a phosphorescent substance of the present invention is a substance represented by the following general formula (1).
Embedded image
Where,
R 1 to R 4 are the same or different and each is hydrogen, halogen, a linear or branched alkyl group having 1 to 6 carbon atoms, or a linear or branched alkoxy group having 1 to 6 carbon atoms,
R 5 is hydrogen, optionally phenyl-substituted linear or branched alkyl group having 1 to 6 carbon atoms, optionally phenyl-substituted linear or branched alkoxy group having 1 to 6 carbon atoms, phenyl group, or A phenoxy group,
R 6 and R 7 are the same or different, and each is hydrogen, halogen, an optionally halogen-substituted linear or branched alkyl group having 1 to 6 carbon atoms, or a linear or branched alkyl group having 1 to 6 carbon atoms. Alkoxy group, amino group, linear or branched alkylamino group having 1 to 6 carbon atoms, dialkylamino group (provided that the alkyl group is a linear or branched alkyl group having 1 to 6 carbon atoms, and A C1-C6 linear or branched alkanoyl group, a cyano group, or a nitro group.
[0013]
The organic EL device of the present invention is an EL device including an organic layer that emits light between a cathode and an anode, wherein at least one of the organic layers has a phosphorescent substance and the phosphorescent light of the present invention. An EL element containing a mixture with a host material for an ionic substance. Note that the organic layer that emits light may be a single layer or a plurality of layers. Further, between the cathode and the anode, only the organic layer that emits the light may be present, or an organic layer that does not emit light may be present.
[0014]
BEST MODE FOR CARRYING OUT THE INVENTION
Next, an embodiment of the present invention will be described.
[0015]
(Host substance for phosphorescent substance)
The host material for a phosphorescent substance of the present invention represented by the general formula (1) can be synthesized, for example, according to the following
Embedded image
[0016]
Hereinafter,
[0017]
Next, substituents R 1 and R 2 are sequentially introduced into the 9-position of the 2-iodofluorene derivative (5) to obtain a compound (6). R 1 and R 2 are as defined in the above formula (1). The method for introducing R 1 and R 2 is not particularly limited, and a known method can be used. In the case of an alkyl group, for example, hydrogen at the 9-position is eliminated with butyllithium to form a carbanion, Then the corresponding alkyl iodide can be added and introduced. In the case of an alkoxy group, a method usually used for alkoxylation at the benzyl position, for example, a method of performing an alcoholysis reaction after halogenation can be used. When R 1 and R 2 are the same type of substituent, they can be introduced in one step.
[0018]
Then, the compound (6) is subjected to a coupling reaction with the aniline derivative represented by the general formula (7) to obtain an amine represented by the general formula (8). R 5 is as defined in the above formula (1). The method of the coupling reaction is not particularly limited, and a known method can be used. For example, the coupling reaction can be performed as follows. That is, first, a 2-iodofluorene derivative of the formula (6) and an aniline derivative of the formula (7), a catalyst such as potassium carbonate, copper powder and 18-crown-6, and a solvent are mixed, and the mixture is mixed under a nitrogen atmosphere. The mixture is reacted by heating and stirring. Although the solvent is not particularly limited, for example, mesitylene or the like can be used. The reaction temperature and the reaction time are not particularly limited, either. For example, the reaction is performed at 170 ° C. for 10 hours. After evaporating the solvent, the residue is purified by silica gel column chromatography and recrystallized to obtain an amine of the formula (8). Although the recrystallization solvent is not particularly limited, for example, a mixed solvent of toluene and hexane can be used.
[0019]
Further, the amine (8) and the 2-iodofluorene derivative (9) are subjected to a coupling reaction again by the same method to obtain an N, N-bis (2-fluorenyl) aniline derivative (1). In the compound (9), R 3 , R 4 and R 7 are as defined in the above formula (1), and can be obtained in the same manner as in the compound (6). When compounds (6) and (9) are represented by the same chemical formula, compound (1) can be obtained by a one-step coupling reaction with aniline derivative (7).
[0020]
The host material for a phosphorescent substance of the present invention is preferably represented by the following general formula (2).
Embedded image
Where,
R 1 to R 4 are the same or different, and each is hydrogen, a linear or branched alkyl group having 1 to 6 carbon atoms, or a linear or branched alkoxy group having 1 to 6 carbon atoms,
R 5 is hydrogen, a linear or branched alkyl group having 1 to 6 carbon atoms, a linear or branched alkoxy group having 1 to 6 carbon atoms, a benzyl group, or a phenoxy group.
[0021]
In the above formulas (1) and (2),
R 1 to R 4 are each hydrogen, methyl, ethyl, n-propyl, sec-propyl, n-butyl, sec-butyl, tert-butyl, methoxy, or ethoxy; ,
R 5 is hydrogen, methyl, ethyl, n-propyl, sec-propyl, n-butyl, sec-butyl, tert-butyl, methoxy, ethoxy, benzyl, or phenoxy; More preferably, there is.
[0022]
The host material for a phosphorescent substance of the present invention is particularly preferably a substance represented by any of the following formulas A-1 to A-6.
Embedded image
[0023]
(EL element)
Next, an organic EL device using the phosphorescent host material of the present invention will be described.
[0024]
Since the host material for a phosphorescent substance of the present invention forms a homogeneous amorphous thin film and has a relatively high glass transition temperature, an organic EL element which is stable against heat or the like can be easily produced. Further, the EL element of the present invention exhibits high luminous efficiency because the organic layer which emits light contains a mixture of the phosphorescent substance and the host substance for a phosphorescent substance of the present invention.
[0025]
In the mixture, recombination of holes and electrons occurs inside the host substance, and an excited state (singlet and triplet excited states) of the host substance is generated. The singlet and triplet excitation energy is transferred to the phosphorescent substance, and light is obtained from the phosphorescent substance. The content of the phosphorescent substance in the mixture is not particularly limited, but is preferably from 0.1 to 20% by weight, more preferably from 0.5 to 15% by weight, particularly preferably from 0.5 to 15% by weight in order to obtain higher luminous efficiency. Is 1 to 10%. The layer may contain only the mixture, but may contain other substances as long as the transfer of the excitation energy is not hindered. The content of the other substance is, for example, 50% by weight or less based on the weight of the mixture.
[0026]
Although the form of the EL element of the present invention is not particularly limited, for example, the forms shown in FIGS. 1 to 5 are possible.
[0027]
FIG. 1 shows an example of the EL device of the present invention. As shown, the
[0028]
FIG. 2 shows another example of the EL device of the present invention. As shown in the figure, an
[0029]
FIG. 3 shows still another example of the EL device of the present invention. As shown in the figure, the
[0030]
FIG. 4 shows still another example of the EL device of the present invention. As shown in the figure, an
[0031]
FIG. 5 shows still another example of the EL device of the present invention. As shown in the figure, an
[0032]
In each of the above EL elements, the
[0033]
In each of the EL elements, at least one of the layers sandwiched between the
[0034]
The phosphorescent substance used for the EL device of the present invention is not particularly limited. For example, an iridium complex is preferable, and more preferably, a compound represented by the following formula, tris (2-phenylpyridine) iridium (hereinafter, abbreviated as “Ir ( ppy) 3 ”). This compound is currently most widely used as a phosphorescent substance.
Embedded image
[0035]
Examples of the phosphorescent substance other than Ir (ppy) 3 include bis (2- (2′-thienyl) pyridinato-N, C 3 ′ ) acetylacetonato) iridium (the following formula [a]), (2- (2′-benzothienyl) pyridinato-N, C 3 ′ ) acetylacetonato) iridium (following formula [b]), bis (2,4-diphenyloxazolat-1,3-N, C 2 ' ) (Acetylacetonato) iridium (following formula [c]), bis (2- (1-naphthyl) benzoxazolat-N, C2 ' ) (acetylacetonato) iridium (following formula [d]), Bis (2- (2-naphthyl) benzoxazolat-N, C 2 ′ ) (acetylacetonato) iridium (following formula [e]), and bis (2-phenyloxazolinato-N, C 2 ′ ) (Acetylacetonato) There is the presence or absence (the following formula [f]). The above-mentioned six kinds of iridium complexes are all S.I. See Lamansky et al. Am. Chem. Soc. , 123 (2001) 4304. It is described in. The structural formulas of the above iridium complexes are shown below.
[0036]
Embedded image
[0037]
Among the substances contained in each of the above-mentioned layers, preferred substances other than the phosphorescent substance and the host substance for the phosphorescent substance of the present invention include, for example, the following substances. Note that the academic documents described below are all documents relating to the inventions of the present inventors.
[0038]
As the hole transport material, for example, a triarylamine derivative is preferable, and more preferably,
4,4 ′, 4 ″ -tris (3-methylphenylphenylamino) triphenylamine (hereinafter sometimes abbreviated as “m-MTDATA”) [Chem. Lett. , 1989, 1145. ]
4,4 ′, 4 ″ -tris (1-naphthylphenylamino) triphenylamine (hereinafter sometimes abbreviated as “1-TNATA”) and 4,4 ′, 4 ″ -tris (2-naphthylphenyl) Amino) triphenylamine (hereinafter sometimes abbreviated as “2-TNATA”) [J. Lumin. , 72-74, 985 (1997). ]
4,4 ′, 4 ″ -tris [biphenyl-2-yl (phenyl) amino] triphenylamine (hereinafter sometimes abbreviated as “o-PTDATA”), 4,4 ′, 4 ″ -tris [ Biphenyl-3-yl (phenyl) amino] triphenylamine (hereinafter sometimes abbreviated as "m-PTDATA") and 4,4 ', 4 "-tris [biphenyl-4-yl (3-methylphenyl ) Amino] triphenylamine (hereinafter sometimes abbreviated as “p-PMTDATA”) [Synth. Met. , 111, 387 (2000)],
4,4 ′, 4 ″ -Tris [9,9-dimethyl-2-fluorenyl (phenyl) amino] triphenylamine (hereinafter sometimes abbreviated as “TFATA”) [Chem. Lett. , 2000, 1834. ]. The structural formulas of the above compounds are shown below.
[0039]
Embedded image
Embedded image
Embedded image
Embedded image
Embedded image
Embedded image
Embedded image
[0040]
As the hole blocking material (hole blocking material), for example, a triphenylbenzene derivative is preferable, and 1,3,5-tris (4-biphenylyl) benzene (hereinafter sometimes abbreviated as TBB) is more preferable. , 3,5-tris (4-fluorobiphenyl-4'-yl) benzene (hereinafter sometimes abbreviated as F-TBB), 1,3,5-tris (9,9-dimethylfluoren-2-) Yl) benzene (hereinafter sometimes abbreviated as TFB) and 1,3,5-tris [4- (9,9-dimethylfluoren-2-yl) phenyl] benzene (hereinafter abbreviated as TFFB). [Yasuhiko Shirota, Motoi Kinoshita, Kenji Okumoto, SPIE-Int. Soc. Opt. Eng. , 4464 (2002) pp. 203-210, 2002. (F-TBB is also described in Kenji Okumoto and Yasushiko Shirota, Appl. Phys. Lett., 79 (2001) pp. 1231-1233.). The structural formulas of the above compounds are shown below.
[0041]
Embedded image
Embedded image
Embedded image
Embedded image
[0042]
Preferred as an electron transport material, for example,
Tris (8-quinolinolato) aluminum (hereinafter sometimes abbreviated as “Alq3”),
1,3,5-Tris (4-tert-butylphenyl-1,3,4-oxadiazolyl) benzene (hereinafter sometimes abbreviated as “TPOB”) [J. Lumin. , 72-74, 985 (1997). ]
5,5′-bis (dimesitylboryl) -2,2′-bithiophene (hereinafter sometimes abbreviated as “BMB-2T”) and 5,5 ″ -bis (dimesitylboryl) -2,2 ′: 5 ', 2''-terthiophene (hereinafter sometimes abbreviated as "BMB-3T") [J. Am. Chem. Soc. , 120, 9714 (1999). ]. The structural formulas of the above compounds are shown below.
[0043]
Embedded image
Embedded image
Embedded image
Embedded image
Embedded image
[0044]
The method for manufacturing the EL element shown in each of the drawings is not particularly limited, and the EL element can be manufactured by sequentially laminating the components on the
[0045]
The method of using the EL element shown in each of the drawings is not particularly limited. However, since the EL element has high luminous efficiency, it can be preferably used for a display, indoor lighting, a laser light source, and the like. In addition, as described above, since the EL element of the present invention has excellent stability against heat and the like, application to various uses can be expected.
[0046]
【Example】
Next, examples of the present invention will be described.
[0047]
(Measurement method)
The nuclear magnetic resonance (NMR) spectrum was measured using Inova-750 (trade name) (Varian, 750 MHz when measuring 1 H). Chemical shifts are expressed in parts per million (ppm). Tetramethylsilane (TMS) was used for 0 ppm of the internal standard. Coupling constants (J) are given in Hertz, and the abbreviations s, d, t, q, m and br are singlet, singlet, doublet, triplet, quadruple, respectively. Represents a quartet, a multiplet, and a broad. Mass spectrometry (MS) was performed by MALDI-TOF / MS method using RP (trade name, Voyager). Elemental analysis was performed using MT-5 (Yanagimoto Seisakusho). For column chromatography separation, silica gel (trade name: Wakogel C-300, Wako Pure Chemical Industries, Ltd.) or alumina (trade name: Aluminum oxide 90 active basic (0.063-0.200), Merck) was used. All chemicals were reagent grade and purchased from Tokyo Kasei Kogyo Co., Ltd., Wako Pure Chemical Industries, Ltd., Nacalai Tesque, Inc., Kanto Chemical Co., Ltd. and Aldrich. In the following data, all melting points are uncorrected values.
[0048]
(Synthesis)
The compound N, N-bis (9,9-dimethylfluoren-2-yl) aniline (hereinafter may be abbreviated as “F2PA”) represented by the formula A-1 is synthesized by the following method. did.
[0049]
(A) Synthesis of 2-iodo-9,9-dimethylfluorene 234 g (1.4 mol) of fluorene, 172 g (0.67 mol) of iodine, 51 g (0.24 mol) of orthoperiodic acid, sulfuric acid 18 ml of acetic acid was dissolved in 700 ml of acetic acid and stirred at 80 ° C. for 4 hours in an inert gas (nitrogen gas) atmosphere. After the completion of the reaction, the solvent was removed by decantation. Thereafter, the reaction product was extracted with toluene, and washed with 5% sodium bisulfite. This was purified by column chromatography (developing solvent: toluene, filler: basic alumina) and recrystallized from toluene to obtain 2-iodofluorene. M / e = 292 (M +) was confirmed by mass spectrometry.
[0050]
Next, 280 g (0.95 mol) of 2-iodofluorene was dissolved in 800 ml of tetrahydrofuran, 112 g (1.0 mol) of potassium tert-butoxide was added, and the mixture was stirred at a temperature of 0 ° C for 20 minutes. Thereafter, 142 g (1.0 mol) of methyl iodide was added, and the mixture was further stirred for 20 minutes. Subsequently, 112 g (1.0 mol) of potassium tert-butoxide was added again and stirred for 20 minutes, and 142 g (1.0 mol) of methyl iodide was added and stirred for 20 minutes. After the reaction, tetrahydrofuran was distilled off under reduced pressure, followed by extraction with toluene. The product was distilled under reduced pressure, and purified by silica gel column chromatography (developing solvent: hexane) to obtain 174.9 g of 2-iodo-9,9-dimethylfluorene (39% yield from fluorene). M / e = 320 (M +) was confirmed by mass spectrometry.
[0051]
(B) Synthesis of N, N-bis (9,9-dimethylfluoren-2-yl) aniline (F2PA) 50 g (160 mmol) of 2-iodo-9,9-dimethylfluorene obtained in the above step (a) ), Aniline 6.0 g (65 mmol), potassium carbonate 50 g (360 mmol), copper 10 g (160 mmol), 18-crown-62 g (7.57 mmol) in mesitylene in an inert gas (nitrogen Gas) The mixture was stirred in an atmosphere at a temperature of 170 ° C. for 10 hours. After completion of the reaction, the mixture was extracted with toluene, washed with water and dried, and the solvent was distilled off. The product was purified by silica gel column chromatography (developing solvent: toluene: hexane = 1: 4) and reprecipitation from hexane, and N, N-bis (9,9-dimethylfluoren-2-yl) aniline (F2PA) was purified. Got. The physical properties of this compound are shown below.
[0052]
MS: m / e = 477 (M +) melting point 203 [deg.] C Elemental analysis. Calculated: C, 90.53; H, 6.54; N 2.93. Found: C, 90.38; H, 6.55; N 2.93. 1 H NMR (750 MHz, THF-d 8 ) δ (ppm) 7.74 (2H, d), 7.72 (2H, d), 7.49 (2H, d), 7.35-7.30 (6H, m), 7.27 (2H, t), 7.17 (2H, d), 7.07 (1H, t), 7.04 (2H, d), 1.41 (12H, s) .
[0053]
Further, the glass transition temperature (Tg) of this compound F2PA and the oxidation potential (Eox) with respect to the Ag / Ag + reference electrode were measured. Table 1 shows the results. Glass transition temperature was measured by differential scanning calorimetry, and oxidation potential was determined by cyclic voltammetry.
[0054]
[Table 1]
[0055]
As can be seen from Table 1, F2PA exhibited a relatively high glass transition temperature of 82 ° C. and a suitable oxidation potential for accepting holes (0.51 V vs. Ag / Ag + reference electrode). .
[0056]
Further, the fluorescence spectrum of F2PA was measured and compared with the absorption spectrum of the phosphorescent substance Ir (ppy) 3. FIG. 6 shows the result.
[0057]
As can be seen from FIG. 6, the fluorescence spectrum of F2PA greatly overlaps with the absorption spectrum of the phosphorescent material Ir (ppy) 3. This indicates that energy transfer from F2PA to Ir (ppy) 3 can occur efficiently. Note that F2PA exhibits light emission in the blue-violet region (peak wavelength of 398 nm) with a high fluorescence quantum yield (0.56), which indicates that it can be used as a blue-violet light-emitting substance.
[0058]
(EL element)
Next, an EL element was manufactured using the above compound F2PA, and the performance was evaluated.
[0059]
An EL device having the structure shown in FIG. 5 was manufactured by the following procedure. That is, first, a substrate on which the
[0060]
When a voltage was applied to the EL element manufactured in this manner, green light was emitted based on Ir (ppy) 3 when a voltage of 3 V or more was applied. FIG. 7 shows an emission spectrum at room temperature and in the air when a voltage of 6 volts is applied.
[0061]
Further, the voltage-luminance characteristics and the voltage-external quantum yield characteristics of the EL device were measured. FIG. 8 summarizes the results. As can be seen from the figure, the maximum luminance at 10.0V 56,900 cd m -2 of the EL element, 70 cd m -2 luminous efficiency at the time of light emission 12.3 lm W -1,
[0062]
As described above, the present invention has been described in detail based on the embodiments. However, the present invention is not limited to the above embodiments, and various modifications and changes can be made without departing from the scope of the present invention.
[0063]
【The invention's effect】
As described in detail above, according to the present invention, it is possible to provide a host material for a phosphorescent substance which has excellent transfer efficiency of excitation energy and high stability against heat and the like. Since the host material for a phosphorescent substance of the present invention forms a homogeneous amorphous thin film and has a relatively high glass transition temperature, an organic EL element which is stable against heat or the like can be easily produced. Since the organic EL element of the present invention has high luminous efficiency, it is particularly suitable for use in displays, indoor lighting, laser light sources, and the like, and its industrial value is enormous.
[Brief description of the drawings]
FIG. 1 is a sectional view showing an example of an organic EL device of the present invention.
FIG. 2 is a sectional view showing another example of the organic EL device of the present invention.
FIG. 3 is a sectional view showing still another example of the organic EL device of the present invention.
FIG. 4 is a sectional view showing still another example of the organic EL device of the present invention.
FIG. 5 is a cross-sectional view showing still another example of the organic EL device of the present invention.
FIG. 6 is a graph showing the fluorescence spectrum of the host substance F2PA of the present invention and the absorption spectrum of the phosphorescent substance Ir (ppy) 3 together.
FIG. 7 is a graph showing an example of an emission spectrum of the EL device of the present invention.
FIG. 8 is a graph showing an example of a voltage-luminance characteristic and a voltage-external quantum yield characteristic of the EL device of the present invention.
[Explanation of symbols]
DESCRIPTION OF
Claims (6)
R1〜R4は、それぞれ同一であるかまたは異なり、水素、ハロゲン、炭素数1〜6の直鎖もしくは分枝アルキル基、または炭素数1〜6の直鎖もしくは分枝アルコキシ基であり、
R5は、水素、任意にフェニル置換された炭素数1〜6の直鎖もしくは分枝アルキル基、任意にフェニル置換された炭素数1〜6の直鎖もしくは分枝アルコキシ基、フェニル基、またはフェノキシ基であり、
R6およびR7は、それぞれ同一であるかまたは異なり、水素、ハロゲン、任意にハロゲン置換された炭素数1〜6の直鎖もしくは分枝アルキル基、炭素数1〜6の直鎖もしくは分枝アルコキシ基、アミノ基、炭素数1〜6の直鎖もしくは分枝アルキルアミノ基、ジアルキルアミノ基(ただし、前記アルキル基は炭素数1〜6の直鎖もしくは分枝アルキル基であり、同一でも異なっていても良い)、炭素数1〜6の直鎖もしくは分枝アルカノイル基、シアノ基、またはニトロ基である。A host substance for a phosphorescent substance represented by the following general formula (1).
R 1 to R 4 are the same or different and each is hydrogen, halogen, a linear or branched alkyl group having 1 to 6 carbon atoms, or a linear or branched alkoxy group having 1 to 6 carbon atoms,
R 5 is hydrogen, optionally phenyl-substituted linear or branched alkyl group having 1 to 6 carbon atoms, optionally phenyl-substituted linear or branched alkoxy group having 1 to 6 carbon atoms, phenyl group, or A phenoxy group,
R 6 and R 7 are the same or different, and each is hydrogen, halogen, an optionally halogen-substituted linear or branched alkyl group having 1 to 6 carbon atoms, or a linear or branched alkyl group having 1 to 6 carbon atoms. Alkoxy group, amino group, linear or branched alkylamino group having 1 to 6 carbon atoms, dialkylamino group (provided that the alkyl group is a linear or branched alkyl group having 1 to 6 carbon atoms, and A C1-C6 linear or branched alkanoyl group, a cyano group, or a nitro group.
R1〜R4は、それぞれ同一であるかまたは異なり、水素、炭素数1〜6の直鎖もしくは分枝アルキル基、または炭素数1〜6の直鎖もしくは分枝アルコキシ基であり、
R5は、水素、炭素数1〜6の直鎖もしくは分枝アルキル基、炭素数1〜6の直鎖もしくは分枝アルコキシ基、ベンジル基、またはフェノキシ基である。The host material for a phosphorescent substance according to claim 1, which is represented by the following general formula (2).
R 1 to R 4 are the same or different, and each is hydrogen, a linear or branched alkyl group having 1 to 6 carbon atoms, or a linear or branched alkoxy group having 1 to 6 carbon atoms,
R 5 is hydrogen, a linear or branched alkyl group having 1 to 6 carbon atoms, a linear or branched alkoxy group having 1 to 6 carbon atoms, a benzyl group, or a phenoxy group.
R5が、水素、メチル基、エチル基、n−プロピル基、sec−プロピル基、n−ブチル基、sec−ブチル基、tert−ブチル基、メトキシ基、エトキシ基、ベンジル基、またはフェノキシ基である、
請求項1または2に記載のりん光発光性物質用ホスト物質。R 1 to R 4 are each hydrogen, methyl, ethyl, n-propyl, sec-propyl, n-butyl, sec-butyl, tert-butyl, methoxy, or ethoxy; ,
R 5 is hydrogen, methyl, ethyl, n-propyl, sec-propyl, n-butyl, sec-butyl, tert-butyl, methoxy, ethoxy, benzyl, or phenoxy; is there,
The host material for a phosphorescent substance according to claim 1.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002220224A JP2004063277A (en) | 2002-07-29 | 2002-07-29 | Host substance for phosphorescence emitting substance, and organic el element using it |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002220224A JP2004063277A (en) | 2002-07-29 | 2002-07-29 | Host substance for phosphorescence emitting substance, and organic el element using it |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004063277A true JP2004063277A (en) | 2004-02-26 |
Family
ID=31940911
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002220224A Withdrawn JP2004063277A (en) | 2002-07-29 | 2002-07-29 | Host substance for phosphorescence emitting substance, and organic el element using it |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2004063277A (en) |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8247800B2 (en) * | 2004-12-03 | 2012-08-21 | Sumitomo Chemical Company, Limited | Triarylamine containing polymers and electronic devices |
| TWI397525B (en) * | 2008-07-30 | 2013-06-01 | Samsung Display Co Ltd | Amine-based compound, organic light emitting device comprising the amine-based compound, and flat panel display device including the organic light emitting device |
| CN106549112A (en) * | 2011-02-16 | 2017-03-29 | 株式会社半导体能源研究所 | Light-emitting component |
| JP2019033291A (en) * | 2012-03-14 | 2019-02-28 | 株式会社半導体エネルギー研究所 | Light-emitting element, illumination device, light-emitting device, display device, and electronic apparatus |
| JP2022060488A (en) * | 2013-03-27 | 2022-04-14 | 株式会社半導体エネルギー研究所 | Light-emitting device |
| JP7506245B2 (en) | 2015-06-17 | 2024-06-25 | 株式会社半導体エネルギー研究所 | Light-emitting element, display device, electronic device, and lighting device |
| US12048239B2 (en) | 2020-04-20 | 2024-07-23 | Samsung Sdi Co., Ltd. | Composition for organic optoelectronic device, organic optoelectronic device and display device |
| JP7581441B2 (en) | 2012-03-14 | 2024-11-12 | 株式会社半導体エネルギー研究所 | Light emitting element, lighting device, light emitting device, display device, and electronic device |
-
2002
- 2002-07-29 JP JP2002220224A patent/JP2004063277A/en not_active Withdrawn
Cited By (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8247800B2 (en) * | 2004-12-03 | 2012-08-21 | Sumitomo Chemical Company, Limited | Triarylamine containing polymers and electronic devices |
| TWI397525B (en) * | 2008-07-30 | 2013-06-01 | Samsung Display Co Ltd | Amine-based compound, organic light emitting device comprising the amine-based compound, and flat panel display device including the organic light emitting device |
| US11038135B2 (en) | 2011-02-16 | 2021-06-15 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| CN106549112A (en) * | 2011-02-16 | 2017-03-29 | 株式会社半导体能源研究所 | Light-emitting component |
| JP2018067733A (en) * | 2011-02-16 | 2018-04-26 | 株式会社半導体エネルギー研究所 | Light-emitting element |
| US12150325B2 (en) | 2011-02-16 | 2024-11-19 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| JP2019036759A (en) * | 2011-02-16 | 2019-03-07 | 株式会社半導体エネルギー研究所 | Light-emitting element |
| US11812626B2 (en) | 2011-02-16 | 2023-11-07 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| US10403839B2 (en) | 2011-02-16 | 2019-09-03 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element |
| JP2022119842A (en) * | 2012-03-14 | 2022-08-17 | 株式会社半導体エネルギー研究所 | Light-emitting element, lighting device, light-emitting device, display device, and electronic device |
| JP2019054292A (en) * | 2012-03-14 | 2019-04-04 | 株式会社半導体エネルギー研究所 | Light-emitting element, lighting device, light-emitting device, display device, and electronic apparatus |
| JP2019033291A (en) * | 2012-03-14 | 2019-02-28 | 株式会社半導体エネルギー研究所 | Light-emitting element, illumination device, light-emitting device, display device, and electronic apparatus |
| JP2021048408A (en) * | 2012-03-14 | 2021-03-25 | 株式会社半導体エネルギー研究所 | Light-emitting element |
| US11063232B2 (en) | 2012-03-14 | 2021-07-13 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, display device, electronic device, and lighting device |
| JP7581441B2 (en) | 2012-03-14 | 2024-11-12 | 株式会社半導体エネルギー研究所 | Light emitting element, lighting device, light emitting device, display device, and electronic device |
| JP7326535B2 (en) | 2012-03-14 | 2023-08-15 | 株式会社半導体エネルギー研究所 | Light-emitting elements, lighting devices, light-emitting devices, display devices, and electronic devices |
| JP7198953B2 (en) | 2013-03-27 | 2023-01-11 | 株式会社半導体エネルギー研究所 | light emitting device |
| US12127471B2 (en) | 2013-03-27 | 2024-10-22 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, electronic appliance, and lighting device |
| US11723264B2 (en) | 2013-03-27 | 2023-08-08 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, electronic appliance, and lighting device |
| JP2022060488A (en) * | 2013-03-27 | 2022-04-14 | 株式会社半導体エネルギー研究所 | Light-emitting device |
| JP7506245B2 (en) | 2015-06-17 | 2024-06-25 | 株式会社半導体エネルギー研究所 | Light-emitting element, display device, electronic device, and lighting device |
| JP7571339B2 (en) | 2015-06-17 | 2024-10-22 | 株式会社半導体エネルギー研究所 | Light emitting element, display device, electronic device, and lighting device |
| JP7571338B2 (en) | 2015-06-17 | 2024-10-22 | 株式会社半導体エネルギー研究所 | Light emitting element, display device, electronic device, and lighting device |
| US12048239B2 (en) | 2020-04-20 | 2024-07-23 | Samsung Sdi Co., Ltd. | Composition for organic optoelectronic device, organic optoelectronic device and display device |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI507396B (en) | Compounds for organic light emitting device and organic light emitting devices having the same | |
| TWI423961B (en) | Material for organic photoelectric device and organic photoelectric device including the same | |
| JP3949214B2 (en) | Organic electroluminescence device | |
| JP4395084B2 (en) | A novel blue light emitter for use in organic electroluminescent devices | |
| JP2019501986A (en) | Thermally activated delayed fluorescent material and its application in organic electroluminescent devices | |
| JP2004349245A (en) | Phenanthroline molecule condensed with oxazole, thiazole or imidazole in organic light emitting device (oled) | |
| JP3228502B2 (en) | Organic electroluminescence device | |
| KR20150102735A (en) | Organic electroluminescent device | |
| JP2002540210A (en) | Organometallic complex molecule and organic electroluminescent device using the same | |
| JP4717703B2 (en) | Compound and organic EL device | |
| KR20150066429A (en) | Organic Compound and Organic Light Emitting Diode Devices using the same | |
| CN109776334B (en) | Organic electroluminescent compounds, method of manufacturing the same and devices using the same | |
| JP5378397B2 (en) | Highly efficient blue electroluminescent compound and display device using the same | |
| KR101937932B1 (en) | Organic light emitting display device and method of manufacturing an organic light emitting display device | |
| JP2015115372A (en) | Material for organic electroluminescent devices, and organic electroluminescent device using the same | |
| JP2006128624A (en) | Light emitting element | |
| KR101311840B1 (en) | Novel tetiary aryl amine and organic electroluminescent device using the same | |
| JP2004292766A (en) | Organic electroluminescent element material | |
| KR20130120855A (en) | Using thiophen derivative as hole transporting mateial and organic electroluminescent device using the same | |
| KR101327301B1 (en) | Amine derivative as hole transporting material and organic electroluminescent device using the same | |
| JP2004063277A (en) | Host substance for phosphorescence emitting substance, and organic el element using it | |
| JPWO2005072017A1 (en) | HOST MATERIAL FOR ORGANIC ELECTROLUMINESCENT DEVICE AND ORGANIC ELECTROLUMINESCENT DEVICE | |
| JP2007308376A (en) | Fluorene compound and organic el element | |
| US20040146742A1 (en) | Organic electroluminescent material and electroluminescent device by using the same | |
| KR101537521B1 (en) | A novel phenylene typed compound and the organic electroluminescence display device using it |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A300 | Application deemed to be withdrawn because no request for examination was validly filed |
Free format text: JAPANESE INTERMEDIATE CODE: A300 Effective date: 20051004 |