ES2816057T3 - Procedimiento de preparación de la forma A de grapiprant - Google Patents
Procedimiento de preparación de la forma A de grapiprant Download PDFInfo
- Publication number
- ES2816057T3 ES2816057T3 ES17193737T ES17193737T ES2816057T3 ES 2816057 T3 ES2816057 T3 ES 2816057T3 ES 17193737 T ES17193737 T ES 17193737T ES 17193737 T ES17193737 T ES 17193737T ES 2816057 T3 ES2816057 T3 ES 2816057T3
- Authority
- ES
- Spain
- Prior art keywords
- grapiprant
- theta
- degrees
- approximately
- acetone
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Communicable Diseases (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Led Devices (AREA)
- Crystals, And After-Treatments Of Crystals (AREA)
- Ceramic Products (AREA)
- Inorganic Insulating Materials (AREA)
Abstract
Un procedimiento de preparación de una Forma A cristalina sustancialmente pura de grapiprant, comprendiendo el procedimiento: i. poner en contacto grapiprant a temperatura ambiente con un disolvente que comprende diclorometano y acetona para formar una solución saturada o casi saturada, en el que el disolvente comprende una relación volumen a volumen de 1:1 a 1:3 de diclorometano/acetona; y ii. formar cristales de la Forma A cristalina sustancialmente pura de grapiprant, en el que la Forma A cristalina exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta a 9,9 ± 0,15, 13,5 ± 0,15, 14,3 ± 0,15, 16,1 ± 0,15, 17,7 ± 0,15, 21,8 ± 0,15, 24,14 ± 0,15 y 25,8 ± 0,15; un perfil de calorimetría diferencial de barrido que ha mostrado una endoterma/exoterma a 155-170 °C; y un análisis termogravimétrico que muestra una pérdida de masa del 0,5-0,6 % cuando se calienta de 30 °C a 150 °C, en el que el difractómetro de rayos X está equipado con un tubo largo de rayos X de enfoque fino con una fuente de radiación de cobre Ka que funciona a 45 kV/40 mA y un monocromador de haz difractado montado frente a un detector de centelleo; y en el que "sustancialmente puro" significa que el polimorfo tiene una pureza del 95 % en peso como se define por difracción de rayos X en polvo.
Description
DESCRIPCIÓN
Procedimiento de preparación de la forma A de grapiprant
Campo técnico
La presente divulgación se refiere generalmente a polimorfos de grapiprant y procedimientos para su preparación.
Antecedentes
Los sólidos existen en formas amorfas o cristalinas. En el caso de formas cristalinas, las moléculas se colocan en sitios de enrejado tridimensional. Cuando un compuesto se recristaliza en una solución o suspensión, puede cristalizar con diferentes disposiciones de enrejado espacial y las diferentes formas cristalinas a veces se denominan "polimorfos". Las diferentes formas cristalinas de una sustancia dada pueden diferir entre sí con respecto a una o más propiedades químicas (por ejemplo, velocidad de disolución, solubilidad), propiedades biológicas (por ejemplo, biodisponibilidad, farmacocinética) y/o propiedades físicas (por ejemplo, resistencia mecánica, comportamiento de compactación, propiedades de flujo, tamaño de partícula, forma, punto de fusión, grado de hidratación o solvatación, tendencia al apelmazamiento, compatibilidad con excipientes). La variación de propiedades entre diferentes formas cristalinas normalmente significa que una forma cristalina puede ser más útil en comparación con otras formas. Por ejemplo, la Forma A, la Forma D y la Forma J de grapiprant se sabe que exhiben propiedades físicas diferentes entre sí.
Debido a que Grapiprant exhibe varias propiedades terapéuticas ventajosas, se desean formas mejoradas del compuesto, particularmente con respecto a la solubilidad mejorada, biodisponibilidad, facilidad de síntesis, capacidad para formularse fácilmente y/o estabilidad física. De esta manera, existe la necesidad de formas cristalinas mejoradas de grapiprant y procedimientos para preparar las diferentes formas.
Sumario
La presente invención se define en las reivindicaciones adjuntas. Adicionalmente, la presente divulgación abarca una forma cristalina de grapiprant seleccionada del grupo que consiste en Forma X, Forma X2, Forma X3, Forma F, Forma K, Forma L, Forma M y Forma N. La forma cristalina se selecciona del siguiente grupo:
i. Forma X, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 6,5, aproximadamente 10,1, aproximadamente 14,9, aproximadamente 15.3, aproximadamente 19,7, aproximadamente 20,3, aproximadamente 21,3, aproximadamente 22,7, aproximadamente 23,1 y aproximadamente 27,3;
ii. Forma X, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos a aproximadamente 33-80 °C y aproximadamente 110-140 °C;
iii. Forma X, que exhibe un análisis termogravimétrico que muestra una pérdida de masa del 12-13 % cuando se calienta desde aproximadamente 24 °C hasta aproximadamente 150 °C;
iv. Forma X2, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 10,2, aproximadamente 14,9, aproximadamente 16,8, aproximadamente 18.3, aproximadamente 21,8, aproximadamente 22,7, aproximadamente 23,9, aproximadamente 24,3, aproximadamente 25,9 y aproximadamente 26,4;
v. Forma X2, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 25-130 °C, en aproximadamente 130-150 °C y en aproximadamente 150-190 °C;
vi. Forma X2, que exhibe un análisis termogravimétrico que muestra una pérdida de masa del 14-15 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 150 °C;
vii. Forma X3, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 13,6, aproximadamente 21,0, aproximadamente 24,5 y aproximadamente 25,3;
viii. Forma X3, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 75-115 °C, en aproximadamente 135-150 °C y en aproximadamente 150-170 °C;
ix. Forma X3, que exhibe un análisis termogravimétrico que muestra una pérdida de masa del 10-11 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C;
x. Forma F, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 9,9, aproximadamente 14,8, aproximadamente 15,5, aproximadamente 18,0, aproximadamente 19,9, aproximadamente 20,4, aproximadamente 21,8, aproximadamente 23,5 y aproximadamente 27,7;
xi. Forma F, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos a aproximadamente 122 °C y aproximadamente 143 °C;
xii. Forma F, que exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 20,5 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C;
xiii. Forma K, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados
en grados 2-theta en aproximadamente 11,3, aproximadamente 15,9, aproximadamente 16,6, aproximadamente 18,2, aproximadamente 19,0, aproximadamente 21,7, aproximadamente 21,9, aproximadamente 25,7 y aproximadamente 29,0;
xiv. Forma K, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 48 °C, aproximadamente 95 °C y en aproximadamente 155 °C; xv. Forma K, que exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 8,7 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C;
xvi. Forma L, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 6,8, aproximadamente 11,1, aproximadamente 13,8, aproximadamente 16.7, aproximadamente 20,7, aproximadamente 23,2, aproximadamente 25,0, aproximadamente 26,0 y aproximadamente 26,3;
xvii. Forma L, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 106 °C;
xviii. Forma L, que exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 12,9 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C;
xix. Forma M, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 6,2, aproximadamente 6,5, aproximadamente 13,0, aproximadamente 18,9, aproximadamente 19,5, aproximadamente 27,4, aproximadamente 37,9, aproximadamente 38,0 y aproximadamente 39,7;
xx. Forma M, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 77 °C, en aproximadamente 99 °C y en aproximadamente 138 °C;
xxi. Forma M, que exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 13,6 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C;
xxii. Forma N, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 6,5, aproximadamente 9,9, aproximadamente 14,2, aproximadamente 14.8, aproximadamente 15,4, aproximadamente 17,7, aproximadamente 19,7, aproximadamente 20,3 y aproximadamente 23,4;
xxiii. Forma N, que exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos a aproximadamente 121 °C y aproximadamente 157 °C; y
xxiv. Forma N, que exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 11 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C.
Otro aspecto de la divulgación proporciona una composición farmacéutica, comprendiendo la composición al menos una forma cristalina de grapiprant y al menos un excipiente farmacéuticamente aceptable, en el que la forma cristalina de grapiprant se selecciona del grupo que consiste en la Forma X, Forma X2, Forma X3, Forma F, Forma K, Forma L, Forma M y Forma N. La forma cristalina puede seleccionarse del grupo descrito anteriormente.
La invención proporciona un procedimiento para preparar una Forma A cristalina sustancialmente pura de grapiprant. El procedimiento comprende poner en contacto grapiprant a temperatura ambiente con un disolvente que comprende diclorometano y acetona para formar una solución saturada o casi saturada, en el que el disolvente comprende una relación volumen a volumen de 1:1 a 1:3 de diclorometano/acetona. Se forman cristales de la Forma A cristalina sustancialmente pura de grapiprant, en los que la Forma A cristalina exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta a 9,9, 13,5, 14,3, 16,1, 17,7, 21,8, 24,14 y 25,8 (± 0,15 grados 2-theta); un perfil de calorimetría diferencial de barrido que ha mostrado una endoterma/exoterma a 155 170 °C; y un análisis termogravimétrico que muestra una pérdida de masa del 0,5-0,6 % cuando se calienta de 30 °C a 150 °C. En otras realizaciones, el disolvente puede comprender del 0 % en peso al 0,5 % en peso de agua.
Otros aspectos más de la divulgación proporcionan un procedimiento para preparar una Forma X cristalina sustancialmente pura de grapiprant. El procedimiento comprende poner en contacto grapiprant a 35 °C con un disolvente que comprende diclorometano/acetona en una relación en volumen a volumen de 1:0,5 a 1:5 para formar una suspensión.
Se describen otros aspectos e iteraciones de la divulgación con más detalle a continuación.
Breve descripción de los dibujos
La FIGURA 1 representa un diagrama de flujo del procedimiento para convertir las Formas cristalinas A, D, J, X, X2 y X3 de grapiprant.
La FIGURA 2 muestra las superposiciones de patrones de difracción de rayos X en polvo (XRPD) para las Formas polimórficas A, D, J, X, X2 y X3 de grapiprant. La intensidad máxima se representa gráficamente en función de los grados 2-theta.
La FIGURA 3 muestra los datos del análisis termogravimétrico (TGA) y de calorimetría diferencial de barrido (DSC) para la Forma A de grapiprant.
La FIGURA 4 muestra datos de TGA y DSC para la Forma D de grapiprant.
La FIGURA 5 muestra datos de TGA y DSC para la Forma J de grapiprant.
La FIGURA 6 muestra datos de TGA y DSC para la Forma X de grapiprant.
La FIGURA 7 muestra datos de TGA y DSC para la Forma X2 de grapiprant.
La FIGURA 8 muestra datos de TGA y DSC para la Forma X3 de grapiprant.
La FIGURA 9 muestra el perfil de solubilidad de la Forma A en un sistema disolvente de tetrahidrofurano (THF) y n-heptano.
La FIGURA 10 muestra el perfil de solubilidad de la Forma A en un sistema disolvente de diclorometano (DCM) y acetona.
La FIGURA 11 muestra los patrones de XRPD que demuestran que la Forma J se convierte en la Forma A después de calentarla a 120 °C.
La FIGURA 12 muestra los patrones de XRPD que demuestran que la Forma X se convierte en amorfa después de calentarla a 110 °C.
La FIGURA 13 muestra el patrón XRPD para la Forma polimórfica F de grapiprant. La intensidad máxima se representa gráficamente en función de los grados 2-theta.
La FIGURA 14 muestra datos de TGA y DSC para la Forma F de grapiprant.
La FIGURA 15 muestra el patrón XRPD para la Forma polimórfica K de grapiprant. La intensidad máxima se representa gráficamente en función de los grados 2-theta.
La FIGURA 16 muestra datos de TGA y DSC para la Forma K de grapiprant.
La FIGURA 17 muestra el patrón XRPD para la Forma polimórfica L de grapiprant. La intensidad máxima se representa gráficamente en función de los grados 2-theta.
La FIGURA 18 muestra datos de TGA y DSC para la Forma L de grapiprant.
La FIGURA 19 muestra el patrón XRPd para la Forma polimórfica M de grapiprant. La intensidad máxima se representa gráficamente en función de los grados 2-theta.
La FIGURA 20 muestra datos de TGA y DSC para la Forma M de grapiprant.
La FIGURA 21 muestra el patrón XRPD para la Forma polimórfica N de grapiprant. La intensidad máxima se representa gráficamente en función de los grados 2-theta.
La FIGURA 22 muestra datos de TGA y DSC para la Forma N de grapiprant.
La FIGURA 23 es una microfotografía que muestra la Forma polimórfica J como un cristal en placa. La barra de escala es 500 pm, lo que indica que el cristal tiene aproximadamente 500 pm de ancho y aproximadamente 1900 pm de largo.
Descripción detallada
Grapiprant es un antagonista del receptor de prostaglandina E2 subtipo 4 (EP4). Grapiprant tiene un número de registro CAS de 415903-37-6 y también se conoce diversamente como CJ-023.423, RQ-7, RQ-00000007, MR10A7, AAT-007, N-{2-[4-(2-etil-4,6-dimetil-1H-imidazo[4,5-c]piridin-1-il)fenil]etil}-N,-[(4-metilfenil)sulfonil]urea, N-[[[2-[4-(2-etil-4,6-dimetil-1H-imidazo[4,5-c]piridin-1-il)fenil]etil]amino]carbonil]-4-metil-bencenosulfonamida o 2-etil-4,6-dimetil-3-(4(2-(((((4-metilfenil)sulfonil)amino)carbonil)amino)etil)fenil)-3H-imidazo[4,5-c]piridina. La estructura química y la síntesis de grapiprant se describen en el documento WO 2002/032900 y las patentes de EE.UU. N.° 6.710.054, 7.141.580 y 7.479.564. Grapiprant tiene la siguiente estructura química:
Sin desear quedar ligado a teoría alguna, la prostaglandina E2 (PGE2) es un potente modulador implicado en la patogenia de una diversidad de enfermedades tales como inflamación, dolor, artritis y cáncer. PGE2 se une a al menos cuatro subtipos de receptor de PGE, designados EP1, EP2, EP3 y EP4. Los estudios de farmacología molecular han desvelado que todos los subtipos son receptores transmembrana 7 que pertenecen a la superfamilia de receptores acoplados a proteínas G. La activación de EP1 estimula la liberación de calcio intracelular; la estimulación de EP2 y EP4 activa en ambos la adenilato ciclasa pero difiere en su respuesta a ciertos ligandos; y la estimulación de EP3 inhibe la adenilato ciclasa mediante proteínas G inhibidoras.
In vivo, grapiprant inhibe la unión de [3H]PGE a receptores EP4 tanto humanos como de rata con una K¡ de 13 ± 4 y 20 ± 1 nM, respectivamente. Grapiprant es altamente selectivo para el receptor EP4 sobre otros subtipos de receptores de prostanoides humanos e inhibe la elevación evocada por PGE2 del AMPc intracelular en los receptores de EP4 de humano y de rata con pA2 de 8,3 ± 0,03 y 8,2 ± 0,2 nM, respectivamente. La administración oral de grapiprant reduce significativamente la hiperalgesia térmica inducida por la inyección intraplantar de PGE2 (DE50 = 12,8 mg/kg). Grapiprant es eficaz en modelos de dolor inflamatorio agudo y crónico. Grapiprant reduce significativamente la hiperalgesia mecánica inducida por el modelo de carragenina e invierte la respuesta al dolor inflamatorio crónico inducido por adyuvante completo de Freund. Tomado en conjunto, grapiprant es un antagonista
potente y selectivo de los receptores EP4 tanto humanos como de rata, produce efectos antihiperalgésicos en modelos animales de dolor inflamatorio.
Se ha descubierto que grapiprant puede existir como cualquiera de varios polimorfos. Los polimorfos se diferencian entre sí con respecto a sus propiedades físicas, datos espectrales, estabilidad y procedimientos de preparación. Ya se han descrito algunas formas cristalinas, por ejemplo Forma A, Forma B, Forma C, Forma D y Forma G como se describe en la patente de EE.UU. N-° 7.960.407 y solvato de acetato de etilo Forma I y Forma II como se describe en el documento WO 2012/157288. En el presente documento se describen tres nuevas formas cristalinas de grapiprant y se denominan a continuación en el presente documento, respectivamente, como Forma X, Forma X2, Forma X3, Forma F, Forma K, Forma L, Forma M y Forma N. También se proporcionan procedimientos para producir los diferentes polimorfos de grapiprant, incluyendo la Forma A, la Forma D y la Forma J.
(I) Formas cristalinas de Grapiprant
En una realización, grapiprant puede existir como Forma A anhidra. La Forma A cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 2. En particular, la Forma A exhibe picos de difracción en 5,326, 9,978, 12,599, 13,542, 13.803, 14,263, 16,121, 17,665, 18,053, 18,389, 19,126, 19,603, 20,314, 21,781, 22,949, 23,178, 23,663, 24,136, 25.803, 26,792, 27,160, 27,703, 28,125, 28,466, 29,326, 30,813, 31,699, 32,501, 33,219, 35,217, 36,285, 37,180, 38,079 y 39,141 grados 2-theta. Más específicamente, la Forma A tiene picos predominantes en aproximadamente 9,9, aproximadamente 13,5, aproximadamente 14,3, aproximadamente 16,1, aproximadamente 17,7, aproximadamente 21,8, aproximadamente 24,14 y aproximadamente 25,8 grados 2-theta (± 0,15 grados 2-theta). La forma A exhibe un perfil de calorimetría diferencial de barrido que tiene una endoterma/exoterma en aproximadamente 155-170 °C. La Forma A también exhibe un análisis termogravimétrico que muestra una pérdida de masa del 0,5-0,6 % cuando se calienta desde aproximadamente 30 °C hasta aproximadamente 150 °C.
En otra realización descrita en el presente documento, grapiprant puede existir como Forma D deshidrato. La Forma D cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 2. En particular, la Forma D exhibe picos de difracción en 7,179, 7,511, 9,642, 12,493, 12,598, 13,411, 14,318, 14,978, 15,402, 15,694, 16,053, 17,680, 18,202, 19,223, 19,746, 20,570, 20,888, 21,327, 21,792, 22,313, 22,766, 23,284, 23,284, 23,676, 24,450, 24,755, 25,902, 27,142, 28,159, 30,224, 30,904, 32,374, 32,725, 34,237, 34,237 y 36,142 grados 2-theta. Más específicamente, la Forma D tiene picos predominantes en aproximadamente 9,6, aproximadamente 12,5, aproximadamente 15,0, aproximadamente 15,4, aproximadamente 22,7 y aproximadamente 27,1 grados 2-theta (± 0,15 grados 2-theta). La Forma D exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 25-125 °C, en aproximadamente 125-155 °C y en aproximadamente 155-175 °C. La Forma D también exhibe un análisis termogravimétrico que muestra una pérdida de masa del 6-7 % cuando se calienta desde aproximadamente 24 °C hasta aproximadamente 69 °C.
En otra realización más descrita en el presente documento, grapiprant puede existir como Forma J solvato en diclorometano (DCM). La Forma J cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 2. En particular, la forma J exhibe picos de difracción en 6,601, 10,158, 10,847, 11,432, 13,119, 14,281, 15,039, 15,470, 16,287, 17,810, 19,661, 20,479, 20,864, 21,395, 22,098, 22,857, 23,295, 24,767, 26,292, 27,343, 28,280 y 36,158 grados 2-theta. Más específicamente, la Forma J tiene picos predominantes en aproximadamente 6,6, aproximadamente 13,1, aproximadamente 15,5, aproximadamente 19,7 y aproximadamente 22,9 grados 2-theta (± 0,15 grados 2-theta). La Forma J exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 25-105 °C, en aproximadamente 105-140 °C y en aproximadamente 140-190 °C. La Forma J también exhibe un análisis termogravimétrico que muestra una pérdida de masa del 10-11 % cuando se calienta desde aproximadamente 28 °C hasta aproximadamente 150 °C. La Forma J puede ser un cristal en placa.
En otra realización más, grapiprant puede existir como Forma X solvato en DCM/hidrato. La Forma X cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 2. En particular, la Forma X exhibe picos de difracción en 6,472, 10,062, 10,700, 11,282, 11,892, 12,097, 12,982, 13,285, 14,181, 14,926, 15,335, 16,164, 17,108, 17,730, 18,615, 19,577, 19,711, 20,315, 20,769, 21,313, 21,941, 22,712, 22,880, 23,142, 23,934, 24,359, 24,785, 26,121, 26,662, 27,261, 27,998, 28,622, 30,176, 31,793, 34,211, 35,970 y 37,491 grados 2-theta. Más específicamente, la Forma X tiene picos predominantes en aproximadamente 6,5, aproximadamente 10,1, aproximadamente 14,9, aproximadamente 15,3, aproximadamente 19,7, aproximadamente 20,3, aproximadamente 21,3, aproximadamente 22,7, aproximadamente 23,1 y aproximadamente 27,3 grados 2-theta (± 0,15 grados 2-theta). La forma X exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 33 80 °C y en aproximadamente 110-140 °C. La Forma X también exhibe un análisis termogravimétrico que muestra una pérdida de masa del 12-13% cuando se calienta desde aproximadamente 24 °C hasta aproximadamente 150 °C.
En una realización adicional descrita en el presente documento, grapiprant puede existir como Forma X2 solvato en DCM/hidrato. La Forma cristalina X2 exhibe un patrón de difracción de rayos X en polvo que comprende picos
característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 2. En particular, la Forma X2 exhibe picos de difracción en 10,227, 12,020, 12,855, 13,221, 13,703, 14,919, 15,667, 16,234, 16,809, 17,170, 18,283, 18,791, 19,259, 19,815, 20,587, 21,227, 21,489, 21,812, 22,659, 23,445, 23,884, 24,338, 24,743, 25,131, 25,883, 26,391, 26,946, 27,629, 28,621, 29,995, 30,964, 31,757, 32,607, 33,716, 34,920 y 35,788 grados 2-theta. Más específicamente, la Forma X2 tiene picos predominantes en aproximadamente 10,2, aproximadamente 14,9, aproximadamente 16,8, aproximadamente 18,3, aproximadamente 21,8, aproximadamente 22,7, aproximadamente 23,9, aproximadamente 24,3, aproximadamente 25,9 y aproximadamente 26,4 grados 2-theta (± 0,15 grados 2-theta). La Forma X2 exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 25-130 °C, en aproximadamente 130-150 °C y en aproximadamente 150-190 °C. La Forma X2 también exhibe un análisis termogravimétrico que muestra una pérdida de masa del 14 15 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 150 °C.
En una realización adicional más descrita en el presente documento, grapiprant puede existir como Forma X3 solvato/hidrato. La Forma cristalina X3 exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 2. En particular, la forma X3 exhibe picos de difracción en 8,498, 10,042, 12,468, 13,609, 14,303, 14,923, 16,086, 16,773, 18,086, 19,231, 20,463, 21,010, 22,995, 24,477, 25,257, 26,206, 27,448, 28,739 y 33,619 grados 2-theta. Más específicamente, la Forma X3 tiene picos predominantes en aproximadamente 13,6, aproximadamente 21,0, aproximadamente 24,5 y aproximadamente 25,3 grados 2-theta (± 0,15 grados 2-theta). La Forma X3 exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 75-115 °C, en aproximadamente 135-150 °C y en aproximadamente 150-170 °C. La Forma X3 también exhibe un análisis termogravimétrico que muestra una pérdida de masa del 10-11 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C.
En algunas realizaciones descritas en el presente documento, grapiprant puede existir como Forma F. La Forma F cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 13. En particular, la Forma F exhibe picos de difracción en 6,564, 8,047, 9,888, 11,430, 11,931, 13,152, 14,483, 14,759, 15,498, 16,129, 16,829, 17,669, 18,003, 18,288, 18,674, 19,111, 19,570, 19,924, 20,409, 21,835, 22,974, 23,485, 23,970, 24,564, 25,002, 26,284, 27,668, 28,158 y 34,174 (picos listados con intensidad pico relativa > 10%) grados 2-theta. Más específicamente, la Forma F tiene picos predominantes en aproximadamente 9,9, aproximadamente 14,8, aproximadamente 15,5, aproximadamente 18,0, aproximadamente 19,9, aproximadamente 20,4, aproximadamente 21,8, aproximadamente 23,5 y aproximadamente 27,7 grados 2-theta (± 0,15 grados 2-theta). La forma F exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 122 °C y en aproximadamente 143 °C. La Forma F también exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 20,5 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C.
En algunas realizaciones descritas en el presente documento, grapiprant puede existir como Forma K. La Forma K cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 15. En particular, la Forma K exhibe picos de difracción en 6,914, 9,683, 11,304, 12,380, 13,986, 14,391, 15,133, 15,942, 16,559, 16,870, 17,446, 17,771, 18,189, 19,044, 20,183, 21,714, 21,862, 22,498, 23,309, 24,054, 24,669, 25,083, 26,834, 27,836, 28,964, 31,968, 33,366 y 33,739 (picos listados con intensidad pico relativa > 10 %) grados 2-theta. Más específicamente, la Forma K tiene picos predominantes en aproximadamente 11,3, aproximadamente 15,9, aproximadamente 16,6, aproximadamente 18,2, aproximadamente 19,0, aproximadamente 21,7, aproximadamente 21,9, aproximadamente 25,7 y aproximadamente 29.0 grados 2-theta (± 0,15 grados 2-theta). La Forma K exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 48 °C, aproximadamente 95 °C y en aproximadamente 155 °C. La Forma K también exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 8,7 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C.
En algunas realizaciones descritas en el presente documento, grapiprant puede existir como Forma L. La Forma L cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 17. En particular, La forma L exhibe picos de difracción a 6,836, 11,066, 13,755, 16,720, 17,636, 20,315, 20,726, 21,305, 21,970, 23,216, 24,491, 24,969, 26,022, 26,282 y 36,864 (picos enumerados con intensidad de pico relativa> 1 %) grados 2-theta. Más específicamente, la Forma L tiene picos predominantes en aproximadamente 6,8, aproximadamente 11,1, aproximadamente 13,8, aproximadamente 16,7, aproximadamente 20,7, aproximadamente 23,2, aproximadamente 25,0, aproximadamente 26.0 y aproximadamente 26,3 grados 2-theta (± 0,15 grados 2-theta). La forma L exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 106 °C. La Forma L también exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 12,9 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C.
En algunas realizaciones descritas en el presente documento, grapiprant puede existir como Forma M. La Forma M cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 19. En particular, la forma M exhibe picos de difracción a 6,162, 6,458, 10,561, 12,981, 14,974, 18,874, 19,538, 21,380, 25,101, 26,176, 27,382, 36,386, 37,883, 37,994,
39,714 y 39,816 (picos enumerados con intensidad de pico relativa> 1 %) grados 2-theta. Más específicamente, la Forma M tiene picos predominantes en aproximadamente 6,2, aproximadamente 6,5, aproximadamente 13,0, aproximadamente 18,9, aproximadamente 19,5, aproximadamente 27,4, aproximadamente 37,9, aproximadamente 38,0 y aproximadamente 39,7 grados 2-theta (± 0,15 grados 2-theta). La Forma M exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 77 °C, en aproximadamente 99 °C y en aproximadamente 138 °C. La Forma M también exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 13,6% cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C.
En otras realizaciones descritas en el presente documento, grapiprant puede existir como Forma N. La Forma N cristalina exhibe un patrón de difracción de rayos X en polvo que comprende picos característicos expresados en grados 2-theta como se muestra en el diagrama de la Figura 21. En particular, La forma N exhibe picos de difracción en 6,357, 6,472, 9,943, 10,007, 10,760, 11,313, 12,016, 12,938, 14,182, 14,763, 15,353, 16,000, 17,737, 18,350, 19,067, 19,506, 19,737, 20,311, 20,590, 21,376, 21,688, 22,912, 23,368, 24,066, 24,476, 25,838, 27,165 y 27,508 (picos enumerados con intensidad de pico relativa> 10%) grados 2-theta. Más específicamente, la Forma N tiene picos predominantes en aproximadamente 6,5, aproximadamente 9,9, aproximadamente 14,2, aproximadamente 14,8, aproximadamente 15,4, aproximadamente 17,7, aproximadamente 19,7, aproximadamente 20,3 y aproximadamente 23,4 grados 2-theta (± 0,15 grados 2-theta). La forma N exhibe un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 121 °C y en aproximadamente 157 °C. La Forma N también exhibe un análisis termogravimétrico que muestra una pérdida de masa de aproximadamente el 11 % cuando se calienta desde aproximadamente 25 °C hasta aproximadamente 135 °C.
(II) Composiciones farmacéuticas
Otro aspecto de la divulgación descrita en el presente documento proporciona una composición farmacéutica que comprende al menos un polimorfo de grapiprant y al menos un excipiente farmacéuticamente aceptable. En algunas realizaciones, la composición farmacéutica puede comprender al menos una forma cristalina de grapiprant y al menos un excipiente farmacéuticamente aceptable, en el que la forma cristalina de grapiprant se selecciona del grupo que consiste en la Forma X, Forma X2, Forma X3, Forma F, Forma K, Forma L, Forma M, Forma N y combinaciones de las mismas. Las diferentes formas cristalinas de grapiprant se detallan anteriormente en la Sección (I).
Puede seleccionarse una diversidad de excipientes comúnmente usados en formulaciones farmacéuticas basándose en varios criterios tales como, por ejemplo, la forma de dosificación deseada y las propiedades del perfil de liberación de la forma de dosificación. Los ejemplos no limitantes de excipientes adecuados incluyen un agente seleccionado del grupo que comprende un aglutinante, una carga, un disgregante no efervescente, un disgregante efervescente, un conservante, un diluyente, un agente aromatizante, un edulcorante, un lubricante, un agente de dispersión oral, un agente colorante, un agente que enmascara el sabor, un modificador de pH, un estabilizante, un agente de compactación y combinaciones de cualquiera de estos agentes.
En una realización, el excipiente puede ser un aglutinante, que mantiene unida la composición farmacéutica hasta la administración. Los aglutinantes adecuados incluyen almidones, almidones pregelatinizados, gelatina, polivinilpirrolidona, celulosa, metilcelulosa, carboximetilcelulosa sódica, etilcelulosa, poliacrilamidas, poliviniloxoazolidona, polivinilalcoholes, alcohol de ácido graso C12-C18, polietilenglicol, polioles, sacáridos, oligosacáridos, polipéptidos, péptidos y combinaciones de los mismos.
En otra realización, el excipiente puede ser una carga, que añade volumen a la composición farmacéutica para facilitar lel volumen y una dosificación más precisa. Las cargas adecuadas incluyen carbohidratos, compuestos inorgánicos y polivinilpirrolidona. A modo de ejemplo no limitante, la carga puede ser sulfato cálcico, por ejemplo, sulfato cálcico tanto di- como tri-básico; almidón, carbonato cálcico, carbonato de magnesio, celulosa microcristalina, fosfato cálcico dibásico, carbonato de magnesio, óxido de magnesio, silicato cálcico, talco, almidones modificados, lactosa, sacarosa, manitol y sorbitol.
El excipiente puede ser un disgregante no efervescente, lo que permite que la composición farmacéutica se disuelva más fácilmente después de la administración sin desprendimiento de gas. Algunos ejemplos adecuados de disgregantes no efervescentes incluyen almidones (tales como almidón de maíz, almidón de patata y similares), almidones pregelatinizados y modificados de los mismos, edulcorantes, arcillas (tales como bentonita), celulosa microcristalina, alginatos, glicolato de almidón sódico y gomas (tales como agar, guar, algarroba, karaya, pecitina y tragacanto).
En otra realización, el excipiente puede ser un disgregante efervescente, lo que permite que la composición farmacéutica se disuelva más fácilmente durante de la administración con desprendimiento de gas. A modo de ejemplo no limitante, los disgregantes efervescentes adecuados incluyen bicarbonato sódico en combinación con ácido cítrico y bicarbonato sódico en combinación con ácido tartárico.
El excipiente puede comprender un conservante, que aumenta la estabilidad y la vida útil de almacenamiento de la composición farmacéutica, particularmente retrasando la degradación no deseada del principio activo. Algunos
ejemplos adecuados de conservantes incluyen antioxidantes (tales como alfa-tocoferol o ascorbato) y antimicrobianos (tales como parabenos, clorobutanol o fenol). En otras realizaciones, puede utilizarse un antioxidante tales como hidroxitolueno butilado (BHT) o hidroxianisol butilado (BHA).
En otra realización, el excipiente puede incluir un diluyente, que disminuye las concentraciones relativas de otros componentes dentro de la composición farmacéutica. Algunos diluyentes adecuados para su uso incluyen sacáridos farmacéuticamente aceptables tales como sacarosa, dextrosa, lactosa, celulosa microcristalina, fructosa, xilitol y sorbitol; alcoholes polihídricos; almidones; diluyentes de compresión directa prefabricados; y mezclas de cualquiera de los anteriores.
El excipiente puede incluir agentes aromatizantes. Algunos agentes aromatizantes pueden seleccionarse de aceites aromatizantes sintéticos y aromáticos aromatizantes y/o aceites naturales, extractos de plantas, de hojas, de flores, de frutas y combinaciones de los mismos. A modo de ejemplo, estos pueden incluir aceites de canela, aceite de gaulteria, aceites de menta, aceite de trébol, aceite de heno, aceite de anís, eucalipto, vainilla, aceites cítricos (tales como aceite de limón, aceite de naranja, aceite de uva y pomelo) y esencias de frutas (tales como manzana, melocotón, pera, fresa, frambuesa, cereza, ciruela, piña y albaricoque).
En otra realización, el excipiente puede incluir un edulcorante. A modo de ejemplo no limitante, el edulcorante puede seleccionarse de glucosa (jarabe de maíz), dextrosa, azúcar invertido, fructosa y mezclas de los mismos (cuando no se use como vehículo); sacarina y sus diversas sales como la sal de sodio; edulcorantes dipéptidos tales como aspartamo; compuestos de dihidrocalcona, glicirricina; edulcorantes derivados de la estevia; derivados de cloro de sacarosa tales como sucralosa; alcoholes de azúcar tañes como sorbitol, manitol, xilitol y similares. También se contemplan hidrolizados de almidón hidrogenado y el edulcorante sintético 3,6-dihidro-6-metil-1,2,3-oxatiazin-4-ona-2,2-dióxido, particularmente la sal de potasio (acesulfamo-K) y las sales de sodio y calcio de los mismos.
En algunas realizaciones, los agentes aromatizantes y/o enmascaradores del aroma pueden comprender una composición que comprende vainilla, tales como, pero no limitado a etil vainilina, vainilina (vainilina-RHD), sabor a vainilla natural (vainilina-Merck), sabor a vainilla idéntico al natural (vainilla-TG-old) y disolventes adecuados (por ejemplo, etanol y/o agua).
En otras realizaciones, los agentes aromatizantes y/o agentes enmascaradores del aroma pueden comprender uno o más seleccionados de pollo, beicon, ternera, cerdo, hígado, pescado, miel, caramelo y plátano.
En algunas realizaciones, la composición farmacéutica que puede formularse para administración oral puede incluir uno o más de los siguientes agentes aromatizantes y/o agentes enmascaradores del aroma (por ejemplo, agentes edulcorantes): sucralosa; una dispersión de regaliz, derivados de regaliz y extracto de regaliz (ácido glicirrícico/glicirricinato de monoamonio); MagnaSweet®; una mezcla de sacarina sódica y dihidrocalcona de neohesperidina (Optisweet™ SD), mezcla 97:3 (p/p) de sacarosa y maltodextrina (Di-Pac®), taumatina al 7 % (edulcorante) mezclada con una maltodextrina inactiva (Thaumatin T200X), taumatina pura (Talin-Pure), extracto de estevia rebaudiósido A (glucósidos de esteviol), neotamo y/o polioles (alcoholes de azúcar), tales como sorbitol, maltitol, isomalt, xilitol y glicerina.
Como se usa en el presente documento, "MagnaSweet®" se refiere a una composición que consiste esencialmente en uno o más edulcorantes seleccionados del grupo que consiste en ácido glicirrícico (GA), glicirricinato de monoamonio (MAG), rebaudiósido A y glicerina. En algunas realizaciones, MagnaSweet® consiste esencialmente en ácido glicirrícico (GA), glicirricinato de monoamonio (MAG), rebaudiósido A y glicerina. En otras realizaciones, MagnaSweet® consiste esencialmente en ácido glicirrícico (GA), glicirricinato de monoamonio (MAG) y glicerina. En algunas realizaciones, el MagnaSweet® comprende de aproximadamente el 0,5 % a aproximadamente el 25 % de GA/MAG, de aproximadamente el 0% a aproximadamente el 15% de rebaudiósido A y de aproximadamente el 75 % a aproximadamente el 99,5 % de glicerina. En otras realizaciones, el MagnaSweet® comprende de aproximadamente el 1,5% a aproximadamente el 17% de GA/MAG, de aproximadamente el 0% a aproximadamente el 7,5 % de rebaudiósido A y de aproximadamente el 83 % a aproximadamente el 91 % de glicerina. En realizaciones ejemplares, el MagnaSweet® comprende aproximadamente el 1,5% de GA/MAG, aproximadamente el 7,5 % de rebaudiósido A y aproximadamente el 91 % de glicerina. En otras realizaciones ejemplares, el MagnaSweet® comprende aproximadamente el 9 % de GA/MAG y aproximadamente el 91 % de glicerina. En otra realización ejemplar, el MagnaSweet® comprende aproximadamente el 17% de GA/MAG y aproximadamente el 83 % de glicerina.
En particular, algunos edulcorantes que contienen azúcar, tales como materiales que contienen sacarosa, sacarosa, glucosa, fructosa y maltodextrina, pueden degradar al menos parcialmente la capromorelina dentro de la composición. Por consiguiente, deben evitarse grandes concentraciones de algunos edulcorantes que contienen azúcar.
En realizaciones ejemplares, los agentes aromatizantes o agentes enmascarantes pueden comprender al menos uno de taumatina, sucralosa, neotamo, sacarina sódica, dihidrocalcona de neohesperidina, rebaudiósido A, glucósido de esteviol, regaliz, ácido glicirrícico, glicirriizinato de monoamonio, sacarosa, glucosa, fructosa, maltodextrina, sorbitol, maltitol, isomalt, glicerol y una composición que comprende vainilla.
El excipiente puede comprender un tensioactivo, que altera los parámetros de solubilidad de los otros componentes dentro de la composición farmacéutica. En diversas realizaciones, el tensioactivo puede ser un alcohol de poliéter de alquilarilo, tales como Triton™ X-100, Surfonic™ N-100 (nonoxainol-10) o Witconol™ NP-100; o un poloxámero, tales como Pluronic™, Synperonic™ o Kolliphor™. Otros ejemplos adecuados de tensioactivos incluyen, por ejemplo, ácido 2-acrilamido-2-metilpropano sulfónico, poliglucósido de alquilo, perfluorononanoato de amonio, cloruro de benzalconio (BAC), cloruro de bencetonio (BZT), 5-bromo-5-nitro-1,3-dioxano, bromuro de cetiltrimetilamonio (CTAB, bromuro de hexadeciltrimetilamonio, cloruro de cetiltrimetilamonio), cloruro de cetilpridinio (CPC), ciclohexil-1-hexil-maltopiranósido, decilmaltopiranósido, poliglucosa de decilo, cloruro de dimetildioctadecilamonio, bromuro de dioctadecildimetilamonio (DODAB), dipalmitoilfosfatidilcolina, óxido de laurildimetilamina, dodecilmaltopiranósido, amina de sebo polietoxilada de lauret sulfato de magnesio (POEA), diclorhidrato de octenidina, octilfenoxipolietoxietanol (Igepal ™ CA-630), octiltioglucopiranósido (OTG), hiel de buey, nonanoiloxibencenosulfonato de sodio, monolaurato de sorbitán, surfactina y bromuro de tonozonio. En realizaciones ejemplares, el tensioactivo puede ser un poloxámero o lauril sulfato de sodio.
En otra realización, el excipiente puede ser un lubricante, lo que permite una retirada más fácil de la composición farmacéutica de los moldes durante la fabricación y puede ayudar a la administración de la composición farmacéutica. Los ejemplos no limitantes adecuados de lubricantes incluyen estearato de magnesio, estearato cálcico, estearato de cinc, aceites vegetales hidrogenados, esterotex, monoestearato de polioxietileno, talco, polietilenglicol, benzoato sódico, laurilsulfato de sodio, lauril sulfato de magnesio y aceite mineral ligero.
El excipiente puede ser un potenciador de la dispersión, que ayuda a la dispersión de los componentes de la composición farmacéutica dentro del sujeto después de la administración. Los dispersantes adecuados pueden incluir almidón, ácido algínico, polivinilpirrolidonas, goma guar, caolín, bentonita, celulosa de madera purificada, glicolato de almidón sódico, silicato isoamorfo y celulosa microcristalina.
Dependiendo de la realización, puede ser deseable proporcionar un agente colorante, que ayude a la visualización e identificación de la composición farmacéutica. Algunos aditivos de color adecuados incluyen colores para alimentos, fármacos y cosméticos (FD&C), colores para fármacos y cosméticos (D&C) o colores externos para fármacos y cosméticos (Ext. D&C). Estos colores o tintes, junto con sus lacas correspondientes y ciertos colorantes naturales y derivados pueden ser adecuados para su uso en la presente invención dependiendo de la realización.
El excipiente puede incluir un agente que enmascara el sabor. Algunos materiales que enmascaran el sabor incluyen éteres de hidroxipropil celulosa (HPC); éteres de hidroxipropil celulosa poco sustituidos (L-HPC); éteres de hidroxipropil metil celulosa (HPMC); polímeros de metilcelulosa y mezclas de los mismos; alcohol polivinílico (PVA); hidroxietilcelulosas; carboximetilcelulosas y sales de los mismos; copolímeros de alcohol polivinílico y polietilenglicol; monoglicéridos o triglicéridos; polietilenglicoles; polímeros acrílicos; mezclas de polímeros acrílicos con éteres de celulosa; ftalato de acetato de celulosa; y combinaciones de los mismos.
En diversas realizaciones, el excipiente puede incluir un modificador de pH, que puede alterar el perfil de solubilidad y los parámetros de biodisponibilidad de los componentes dentro de la composición farmacéutica. En determinadas realizaciones, el modificador de pH puede incluir carbonato sódico o bicarbonato sódico.
La fracción en peso del excipiente o combinación de excipientes en la composición farmacéutica puede ser aproximadamente el 98 % o menos, aproximadamente el 95 % o menos, aproximadamente el 90 % o menos, aproximadamente el 85 % o menos, aproximadamente el 80 % o menos, aproximadamente el 75 % o menos, aproximadamente el 70 % o menos, aproximadamente el 65 % o menos, aproximadamente el 60 % o menos, aproximadamente el 55 % o menos, aproximadamente el 50 % o menos, aproximadamente el 45 % o menos, aproximadamente el 40 % o menos, aproximadamente el 35 % o menos, aproximadamente el 30 % o menos, aproximadamente el 25% o menos, aproximadamente el 20% o menos, aproximadamente el 15% o menos, aproximadamente el 10% o menos, aproximadamente el 5% o menos, aproximadamente el 2% o aproximadamente el 1 % o menos del peso total de la composición farmacéutica.
Las composiciones farmacéuticas detalladas en el presente documento pueden fabricarse en una o varias formas de dosificación. Algunas formas de dosificación orales adecuadas incluyen comprimidos, incluyendo comprimidos de suspensión, comprimidos masticables, comprimidos efervescentes o comprimidos encapsulados; píldoras; polvos tales como un polvo envasado estéril, un polvo dispensable y un polvo efervescente; cápsulas que incluyen cápsulas de gelatina duras o blandas tales como cápsulas de HPMC; pastillas para chupar; una bolsita; unas chispas; un polvo reconstituible o un batido; un trocisco; gránulos tales como gránulos sublinguales o bucales; gránulos; líquidos para administración oral o parenteral; suspensiones; emulsiones; semisólidos; o geles. Otras formas de dosificación adecuadas incluyen parches o sistemas transdérmicos. El sistema transdérmico puede ser un sistema matricial, un sistema de depósito o un sistema sin membranas de control de velocidad.
Las formas de dosificación pueden fabricar usando técnicas farmacológicas convencionales. Las técnicas farmacológicas convencionales incluyen, por ejemplo, uno o una combinación de procedimientos: (1) mezcla en seco, (2) compresión directa, (3) molienda, (4) granulación seca o no acuosa, (5) granulación húmeda o (6) fusión. Véase, por ejemplo, Lachman y col., The Theory and Practice of Industrial Pharmacy (1986). Otros procedimientos incluyen, por ejemplo, compresión, secado por pulverización, revestimiento de recipiente, granulación en fusión,
granulación, revestimiento Wurster, revestimiento tangencial, pulverización superior, extrusión, coacervación y similares.
La cantidad de principio activo que se administra a un sujeto puede variar y variará dependiendo de una diversidad de factores tales como la edad y la salud general del sujeto y el modo particular de administración. Aquellos expertos en la materia apreciarán que las dosis también pueden determinarse con la guía de Goodman & Goldman The Pharmacological Basis of Therapeutics, Décima Edición (2001), Apéndice II, pp. 475-493 y la Physicians' Desk Reference.
(III) Procedimientos para la preparación de polimorfos sustancialmente puros de grapiprant
Un aspecto adicional de la presente divulgación proporciona procedimientos para producir polimorfos de grapiprant sustancialmente puros. La frase "sustancialmente puro", como se usa en el presente documento, significa que el polimorfo tiene una pureza de aproximadamente el 95 % en peso, o más preferentemente aproximadamente el 97 % en peso, como se define por difracción de rayos X en polvo. Dicho de otra manera, el polimorfo no tiene más de aproximadamente el 5 % en peso, o más preferentemente no más de aproximadamente el 3 % en peso, de otro polimorfo de grapiprant. Los diferentes polimorfos de grapiprant se detallan anteriormente en la Sección (I).
La invención proporciona un procedimiento para preparar una Forma A cristalina sustancialmente pura de grapiprant que comprende poner en contacto el grapiprant a temperatura ambiente con un disolvente que comprende diclorometano y acetona para formar una solución saturada o casi saturada, en el que el disolvente comprende una relación volumen a volumen de 1:1 a 1:3 de diclorometano/acetona. Se forman cristales de la Forma A cristalina sustancialmente pura de grapiprant, en los que la Forma A cristalina exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta a 9,9, 13,5, 14,3, 16,1, 17,7, 21,8, 24,14 y 25,8 (+0,15 grados 2-theta); un perfil de calorimetría diferencial de barrido que ha mostrado una endoterma/exoterma a 155-170 °C; y un análisis termogravimétrico que muestra una pérdida de masa del 0,5-0,6 % cuando se calienta de 30 °C a 150 °C.
En otras realizaciones, la divulgación proporciona un procedimiento para preparar una Forma X cristalina sustancialmente pura de grapiprant. El procedimiento comprende poner en contacto grapiprant a 35 °C con un disolvente que comprende diclorometano/acetona (1:1, v/v) para formar una suspensión. Se forman cristales de la Forma X cristalina sustancialmente pura de grapiprant, en los que la forma cristalina X, que exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta en aproximadamente 6,5, aproximadamente 10,1, aproximadamente 14,9, aproximadamente 15,3, aproximadamente 19,7, aproximadamente 20,3, aproximadamente 21,3, aproximadamente 22,7, aproximadamente 23,1 y aproximadamente 27,3; un perfil de calorimetría diferencial de barrido que tiene eventos endotérmicos/exotérmicos en aproximadamente 33-80 °C y aproximadamente 110-140 °C; y un análisis termogravimétrico que muestra una pérdida de masa del 12-13% cuando se calienta de aproximadamente 24 °C a aproximadamente 150 °C. En realizaciones ejemplares, el procedimiento puede comprender además convertir la Forma X en la Forma A mediante una suspensión en diclorometano/acetona con una relación volumen a volumen de 1:1.
El disolvente usado en el procedimiento puede variar y variará dependiendo de la realización. En general, el disolvente puede ser un disolvente prótico, un disolvente aprótico o combinaciones de los mismos. Los disolventes próticos adecuados incluyen, pero no se limitan a, agua, alcohol metílico, alcohol etílico, alcohol isopropílico, alcohol n-propílico, alcohol isobutílico, alcohol n-butílico, alcohol s-butílico, alcohol f-butílico, ácido fórmico, ácido acético y combinaciones de los mismos. Los ejemplos no limitantes de disolventes apróticos adecuados incluyen acetona, acetonitrilo, diclorometano, tetrahidrofurano y combinaciones de los mismos. El grapiprant que se pone en contacto con el disolvente puede estar en forma sólida (por ejemplo, un polvo) o en forma líquida (por ejemplo, en una solución que comprende un codisolvente, o un aceite/gel/goma concentrado). La relación en peso de disolvente a grapiprant puede variar de aproximadamente 2 a aproximadamente 10, o más preferentemente de aproximadamente 4 a aproximadamente 7.
La temperatura del procedimiento puede variar y variará dependiendo de la realización. La temperatura de la etapa (a) puede variar de aproximadamente 4 °C a aproximadamente la temperatura de ebullición del disolvente. En una realización, la etapa (a) puede realizarse a una temperatura que varía de aproximadamente 4 °C a aproximadamente 25 °C. En otra realización, la etapa (a) puede realizarse a una temperatura que varía de aproximadamente 25 °C a aproximadamente 60 °C. En aún otra realización, la etapa (a) puede realizarse a una temperatura que varía de aproximadamente 60 °C a aproximadamente 100 °C. En una realización adicional, la etapa (a) puede realizarse a una temperatura que varía de aproximadamente 100 °C a aproximadamente 150 °C.
La temperatura de la etapa (b) también puede variar de aproximadamente -10 °C a aproximadamente 150 °C. En una realización, la etapa (b) puede realizarse a temperatura que varía de aproximadamente -10 °C a aproximadamente 20 °C. En otra de realización, la etapa (b) puede realizarse a una temperatura que varía de aproximadamente 20 °C a aproximadamente 50 °C. En una realización alternativa, la etapa (b) puede realizarse a una temperatura que varía de aproximadamente 50 °C a aproximadamente 100 °C. En otra realización alternativa, la etapa (b) puede realizarse a una temperatura que varía de aproximadamente 100 °C a aproximadamente 150 °C.
Los cristales de grapiprant sustancialmente puros pueden formarse mediante una diversidad de procedimientos, como se detalla en los Ejemplos. En algunas realizaciones, los cristales pueden formarse por "evaporación lenta". Para esto, el disolvente típicamente se evapora lentamente de modo que los cristales se forman lentamente. La tasa de evaporación puede reducirse colocando la solución saturada o casi saturada en un matraz con una abertura estrecha, cubriendo la abertura con papel o papel de aluminio que comprenda algunos orificios pequeños, o sellando la abertura con una tapa en la que se ha insertado una aguja. La evaporación del disolvente puede realizarse en presencia de aire o en un entorno inerte (es decir, en nitrógeno o argón). El disolvente puede evaporarse a presión atmosférica o a una presión que es inferior a la presión atmosférica.
En otras realizaciones, los cristales pueden formarse mediante "cristalización en caliente" o "recristalización en caliente". Para esto, la etapa (a) del procedimiento se lleva a cabo a temperatura elevada. Normalmente, la temperatura de esta etapa está en o cerca del punto de ebullición del disolvente. El disolvente puede retirarse a temperatura elevada, en el que los cristales precipitan fuera de la solución caliente. Como alternativa, la solución caliente puede dejarse enfriar, en la que los cristales precipitan fuera de la solución fría.
El procedimiento generalmente comprende además recoger los sólidos de grapiprant sustancialmente puro. Los sólidos pueden recogerse por filtración, centrifugación u otras técnicas bien conocidas en la técnica. El procedimiento puede comprender además secar los sólidos de grapiprant sustancialmente puro. Los sólidos pueden secarse al vacío a temperatura ambiente o a una temperatura elevada.
En algunas realizaciones, la Forma X cristalina de la base de grapiprant puede prepararse mediante cristalización de grapiprant en un disolvente que comprende diclorometano y acetona.
En algunas realizaciones, la Forma X2 cristalina de la base de grapiprant puede prepararse mediante cristalización de grapiprant en un disolvente que comprende de aproximadamente 1:1 hasta aproximadamente 1:4 de diclorometano/acetona con aproximadamente un 0 % en peso hasta aproximadamente un 0,5 %en peso de agua. En realizaciones ejemplares, la cristalización puede usar aproximadamente el 0,3 % en peso de agua.
En algunas realizaciones, la Forma cristalina X3 de grapiprant base puede prepararse secando la forma X2 de grapiprant.
Definiciones
Los compuestos descritos en el presente documento tienen centros asimétricos. Los compuestos de la presente divulgación que contienen un átomo sustituido asimétricamente pueden aislarse en forma ópticamente activa o racémica. Todas las formas quirales, diastereoméricas, racémicas y todas las formas isoméricas geométricas de una estructura se abarcan, a menos que se indique específicamente la estereoquímica o forma isomérica específica. El término "acilo", como se usa en el presente documento solo o como parte de otro grupo, denota el resto formado por la retirada del grupo hidroxi del grupo COOH de un ácido carboxílico orgánico, por ejemplo, RC(O)-, en el que R es R1, R1O-, R1R2N- o R1S-, R1 es hidrocarbilo, hidrocarbilo heterosustituido o heterociclo y R2 es hidrógeno, hidrocarbilo o hidrocarbilo sustituido.
El término "aciloxi", como se usa en el presente documento solo o como parte de otro grupo, denota un grupo acilo como se describió anteriormente unido a través de un enlace de oxígeno (O), por ejemplo, RC(O)O- en el que R es como se define en relación con el término "acilo".
El término "alquilo" como se usa en el presente documento describe grupos que son preferentemente alquilo inferior que contienen de uno a ocho átomos de carbono en la cadena principal y hasta 20 átomos de carbono. Pueden ser de cadena recta o ramificada o cíclica e incluyen metilo, etilo, propilo, isopropilo, butilo, hexilo y similares.
El término "alquenilo" como se usa en el presente documento describe grupos que son preferentemente alquenilo inferior que contienen de dos a ocho átomos de carbono en la cadena principal y hasta 20 átomos de carbono. Pueden ser de cadena recta o ramificada o cíclica e incluyen etenilo, propenilo, isopropenilo, butenilo, isobutenilo, hexenilo y similares.
El término "alquinilo" como se usa en el presente documento describe grupos que son preferentemente alquinilo inferior que contienen de dos a ocho átomos de carbono en la cadena principal y hasta 20 átomos de carbono. Pueden ser de cadena recta o ramificada e incluyen etinilo, propinilo, butinilo, isobutinilo, hexinilo y similares.
El término "aromático" como se usa en el presente documento solo o como parte de otro grupo denota anillo plano o sistema de anillo conjugado homo o heterocíclico opcionalmente sustituido que comprende electrones deslocalizados. Estos grupos aromáticos son preferentemente monocíclicos (por ejemplo, furano o benceno), grupos bicíclicos o tricíclicos que contienen de 5 a 14 átomos en la porción del anillo. El término "aromático" abarca los grupos "arilo" definidos a continuación.
Los términos "arilo" o "Ar" como se usan en el presente documento solos o como parte de otro grupo denotan grupos aromáticos homocíclicos opcionalmente sustituidos, preferentemente grupos monocíclicos o bicíclicos que contienen
de 6 a 10 carbonos en la porción del anillo, tales como fenilo, bifenilo, naftilo, fenilo sustituido, bifenilo sustituido o naftilo sustituido.
Los términos "carbociclo" o "carbocíclico" como se usan en el presente documento solos o como parte de otro grupo denotan anillo o sistema de anillo homocíclico, aromático o no aromático, opcionalmente sustituido en los cuales todos los átomos en el anillo son carbono, preferentemente con 5 o 6 átomos de carbono en cada anillo. Los sustituyentes ejemplares incluyen uno o más de los siguientes grupos: hidrocarbilo, hidrocarbilo sustituido, alquilo, alcoxi, acilo, aciloxi, alquenilo, alquenoxi, arilo, ariloxi, amino, amido, acetal, carbamilo, carbociclo, ciano, éster, éter, halógeno, heterociclo, hidroxi, ceto, cetal, fosfo, nitro y tio.
Los términos "halógeno" o "halo" como se usan en el presente documento solos o como parte de otro grupo se refieren a cloro, bromo, flúor y yodo.
El término "heteroátomo" se refiere a átomos distintos de carbono e hidrógeno.
El término "heteroaromático" como se usa en el presente documento solo o como parte de otro grupo indica grupos aromáticos opcionalmente sustituidos que tienen al menos un heteroátomo en al menos un anillo y preferentemente 5 o 6 átomos en cada anillo. El grupo heteroaromático tiene preferentemente 1 o 2 átomos de oxígeno y/o 1 a 4 átomos de nitrógeno en el anillo y está unido al resto de la molécula a través de un carbono. Los grupos ejemplares incluyen furilo, benzofurilo, oxazolilo, isoxazolilo, oxadiazolilo, benzoxazolilo, benzoxadiazolilo, pirrolilo, pirazolilo, imidazolilo, triazolilo, tetrazolilo, piridilo, pirimidilo, pirazinilo, piridazinilo, indolilo, isoindolilo, indolizinilo, benzoimidazolilo, indazolilo, benzotriazolilo, tetrazolopiridazinilo, carbazolilo, purinilo, quinolinilo, isoquinolinilo, imidazopiridilo y similares. Los sustituyentes ejemplares incluyen uno o más de los siguientes grupos: hidrocarbilo, hidrocarbilo sustituido, alquilo, alcoxi, acilo, aciloxi, alquenilo, alquenoxi, arilo, ariloxi, amino, amido, acetal, carbamilo, carbociclo, ciano, éster, éter, halógeno, heterociclo, hidroxi, ceto, cetal, fosfo, nitro y tio.
Los términos "heterociclo" o "heterocíclico" como se usan en el presente documento solos o como parte de otro grupo denotan grupos aromáticos o no aromáticos opcionalmente sustituidos, completamente saturados o insaturados, monocíclicos o bicíclicos, que tienen al menos un heteroátomo en al menos un anillo y preferentemente 5 o 6 átomos en cada anillo. El grupo heterociclo tiene preferentemente 1 o 2 átomos de oxígeno y/o 1 a 4 átomos de nitrógeno en el anillo, y está unido al resto de la molécula a través de un carbono o heteroátomo. Los grupos heterociclo ejemplares incluyen heteroaromáticos como se describió anteriormente. Los sustituyentes ejemplares incluyen uno o más de los siguientes grupos: hidrocarbilo, hidrocarbilo sustituido, alquilo, alcoxi, acilo, aciloxi, alquenilo, alquenoxi, arilo, ariloxi, amino, amido, acetal, carbamilo, carbociclo, ciano, éster, éter, halógeno, heterociclo, hidroxi, ceto, cetal, fosfo, nitro y tio.
Los términos "hidrocarburo" e "hidrocarbilo", como se usan en el presente documento, describen compuestos orgánicos o radicales que consisten exclusivamente en los elementos carbono e hidrógeno. Estos restos incluyen restos alquilo, alquenilo, alquinilo y arilo. Estos restos también incluyen restos alquilo, alquenilo, alquinilo y arilo sustituidos con otros grupos hidrocarbonados alifáticos o cíclicos, tales como alcarilo, alquenarilo y alquinarilo. A menos que se indique otra cosa, estos restos comprenden preferentemente de 1 a 20 átomos de carbono.
La frase "grupo protector de oxígeno" como se usa en el presente documento denota un grupo capaz de proteger un átomo de oxígeno (y por lo tanto, formar un grupo hidroxilo protegido), en el que el grupo protector puede retirarse, posterior a la reacción para la que se emplea protección, sin perturbar el resto de la molécula. Los ejemplos de grupos protectores de oxígeno incluyen éteres (por ejemplo, alilo, trifenilmetilo (tritilo o Tr), p-metoxibencilo (PMB), pmetoxifenilo (PMP)), acetales (por ejemplo, metoximetilo (MOM), p-metoxietoximetilo (MEM), tetrahidropiranilo (THP), etoxi etilo (EE), metiltiometilo (MTM), 2-metoxi-2-propilo (MOp), 2-trimetilsililetoximetil (SEM)), ésteres (por ejemplo, benzoato (Bz), carbonato de alilo, carbonato de 2,2,2-tricloroetilo (Troc), carbonato de 2-trimetilsililetilo), éteres de sililo (por ejemplo, trimetilsililo (TMS), trietilsililo (TES), triisopropilsililo (TIPS), trifenilsililo (TPS), tbutildimetilsililo (TBDMS), t-butildifenilsililo (TBDPS) y similares. Puede encontrarse una diversidad de grupos protectores de oxígeno y la síntesis de los mismos en "Protective Groups in Organic Synthesis" por T.W. Greene y P.G.M. Wuts, 3a ed., John Wiley & Sons, 1999.
Los restos "hidrocarbilo sustituido" descritos en el presente documento son restos hidrocarbilo que están sustituidos con al menos un átomo distinto de carbono, incluyendo restos en los que un átomo de la cadena de carbono está sustituido con un heteroátomo tales como nitrógeno, oxígeno, silicio, fósforo, boro o un átomo de halógeno, y restos en los que la cadena de carbono comprende sustituyentes adicionales. Estos sustituyentes incluyen alquilo, alcoxi, acilo, aciloxi, alquenilo, alquenoxi, arilo, ariloxi, amino, amido, acetal, carbamilo, carbociclo, ciano, éster, éter, halógeno, heterociclo, hidroxi, ceto, cetal, fosfo, nitro y tio.
Cuando se introducen elementos de la presente divulgación o la realización o realizaciones de la misma, los artículos "un", "una", "el", "la" y "dicho", "dicha" pretenden hacer referencia a uno o más de los elementos. Las expresiones "que comprende", "que incluye" y "que tiene" pretenden ser incluyentes y hacen referencia a que puede haber elementos adicionales además de los elementos enumerados.
Ejemplos
Los siguientes ejemplos se incluyen para demostrar determinadas realizaciones de la divulgación. Los expertos en la materia deben apreciar que las técnicas desveladas en los ejemplos representan técnicas descubiertas por los inventores que funcionan bien en la práctica de la divulgación.
Protocolos generales
Evaporación lenta. Para formar cristales por evaporación lenta, se preparó una solución saturada o casi saturada mezclando grapiprant en el disolvente o sistema disolvente apropiado. Se colocó un pequeño vial de la solución saturada/casi saturada en un desecador purgado con nitrógeno a temperatura ambiente. Después del crecimiento de los cristales, los cristales se filtraron del disolvente residual, si fuera necesario, usando un embudo de disco fritado o un embudo Büchner usando un papel de filtro Whatman n.° 1.
Cristalización en caliente. Para formar cristales por cristalización en caliente, el disolvente apropiado se calentó a ebullición o casi a ebullición, y se añadió lentamente grapiprant hasta que la solución estuvo saturada o casi saturada. Se dejó enfriar la solución a temperatura ambiente. Después del crecimiento de los cristales, los cristales se filtraron típicamente del disolvente usando un embudo de disco fritado. En algunos experimentos, se dejó después que los filtrados se evaporaran lentamente con purga de nitrógeno para estimular el crecimiento de cristales. En algunos casos, los cristales se secaron a temperaturas elevadas.
Experimentos en suspensión. La estabilidad de las formas cristalinas se analizó usando experimentos en suspensión. Una parte del disolvente de interés se saturó con grapiprant en un pequeño vial. Después se añadió grapiprant adicional al vial y la suspensión resultante se agitó usando una barra de agitación magnética.
Difracción de rayos X en polvo. El patrón de difracción de rayos X en polvo (XRPD) se determinó usando un difractómetro de rayos X. El instrumento estaba equipado con un tubo largo de rayos X de enfoque fino (con una fuente de radiación de cobre Ka que funciona a 45 kV/40 mA) y un monocromador de haz difractado montado frente a un detector de centelleo. Los parámetros del instrumento incluían un rango de barrido de 3,0 a 40,0 grados 2-theta, un tamaño de etapa de 0,02 grados 2-theta y un tiempo de exploración de 12,7 segundos por etapa. El instrumento se conectó con un ordenador para la adquisición y el análisis de datos. Cada muestra se trituró uniformemente con el borde de una espátula y se colocó sobre un soporte de fondo cero, de cuarzo.
Calorimetría diferencial de barrido. Se realizó calorimetría diferencial de barrido (DSC) usando un calorímetro diferencial de barrido. El instrumento se calibró usando indio. Cada muestra se pesó en un recipiente de muestra de aluminio hermético y se selló con una tapa estenopeica. Las muestras se calentaron desde 22 °C hasta la temperatura designada a una velocidad de 5 °C por minuto, a menos que se indique otra cosa.
Análisis termogravimétrico. El análisis termogravimétrico (TGA) se realizó con un analizador termogravimétrico equipado con un horno de gas desprendido revestido de cuarzo para experimentos TGA de infrarrojos por transformada de Fourier (FTIR). El espectrómetro FTIR para los análisis TGA-FTIR estaba equipado con un horno de interfaz TGA, célula de gas y una línea de transferencia. Cada muestra se pesó en un plato de muestra de aluminio y se colocó en el instrumento. Las muestras se calentaron desde temperatura ambiente hasta la temperatura designada a una velocidad de 10 °C por minuto, a menos que se indique otra cosa, con un flujo de nitrógeno de 50 ml por minuto. Para los experimentos TGA-FTIR, la línea de transferencia y el horno de interfaz TGA se mantuvieron a 150 °C. Se obtuvo una gráfica/análisis de Gram-Schmidt para cada experimento, con espectros individuales de gases evolucionados analizados con 16 barridos a una resolución de 8 cirr1. Se adquirió un fondo (16 barridos) antes de cada experimento.
Absorción de vapor de agua. Los datos se recogieron con un balance de absorción de vapor de agua. Una parte de la muestra seleccionada se pesó en un plato de muestra de platino y se colocó en el instrumento. La muestra se cicló de baja (5 %) humedad relativa (HR) a alta HR (95 %) a baja humedad (es decir, eventos de sorción y desorción) a una temperatura constante de 25 °C, en intervalos del 5 % de HR. La muestra se mantuvo en cada intervalo hasta que se cumplió la condición de equilibrio (es decir, 0,0005 % durante 3 min, con un máximo de 600 min).
Ejemplo 1: Exploración de polimorfos cristalinos de grapiprant
La forma A puede recristalizarse en THF/n-heptano mediante una adición de antidisolvente, proporcionando una pureza por HPLC del 98,9 % A con THF residual del 0,7 % en peso. El % en peso de diclorometano teórico (DCM) para DCM/grapiprant 1:1 es el 14,7 %. Las Tablas 1 y 2 a continuación resumen estos resultados. La forma A de grapiprant es más estable que la forma J (solvato de DCM) en DCM/acetona 1:1 (v/v). La forma J se convierte en la forma A en DCM/acetona 1:2 o calentando a 120 °C (véase la FIGURA 11). La forma A se convierte en la forma J en DCM/heptanos 2:1. La Forma J se convierte en la Forma X si se suspende en acetona o heptanos. La forma X se vuelve amorfa cuando se calienta a 110 °C. La reacción en THF consumió cantidades mucho mayores de material de partida de p-toluensulfonilisocianato que las requeridas en diclorometano.
La Forma X2 se convierte en Forma A en DCM/acetona en una proporción tan baja como 1:3 (v/v) con solo un 0,3 % en peso de agua en el producto. Normalmente no se añade agua y puede ser residual en la acetona. La adición de antidisolvente de 0:1 a 1:1 da una mezcla de las Formas A y J, o simplemente la Forma J, que puede convertirse en
la Forma A en acetona o DCM/acetona 1:1 a 1:2. Los productos cumplen con las especificaciones de disolvente residual. La adición simultánea a 1:2 o 1:3 de DCM/acetona da una mezcla de las Formas A y X2. La Forma X2 no puede convertirse fácilmente en la Forma X3. El disolvente residual no puede retirarse fácilmente.
En global, la Figura 1 resume la relación de cada forma polimórfica con la relación entre sí. La Forma J puede convertirse en la Forma D secando al aire (1). La Forma J puede convertirse en la Forma A mediante una suspensión en DCM/acetona (<1:2 v/v) a 25 °C (2). La Forma A puede convertirse en la Forma J por precipitación de DCM/n-heptano (2:1 v/v) (3). Las Formas A y D tienen un valor de aw de aproximadamente 0,6 a temperatura ambiente (4). La Forma X puede convertirse a partir de una mezcla en suspensión de la Forma D y la Forma J en DCM/acetona o DCM/n-heptano (2:1 v/v) a temperatura ambiente (5). La Forma X puede convertirse en la Forma A mediante una suspensión en DCM/acetona (1:1 v/v) (6). La Forma A puede convertirse en la Forma X mediante una suspensión en DCM/acetona (< 1:3 v/v (7) o 1:2 v/v con 0,3 % en peso de agua (8)). La Forma X2 puede convertirse en la Forma A mediante una suspensión en DCM/acetona (1:3 v/v con 0,3 % en peso de agua (9)). La Forma A puede convertirse en la Forma X2 mediante una suspensión en acetona con 0,3 % en peso de agua (10). La Forma X2 puede convertirse en la Forma X3 mediante secado (11). La Forma X2 también puede generarse mediante suspensión de las Formas A y X3 en DCM/acetona (1:3 v/v) con 0,3 % en peso de agua (12).
Algunos detalles adicionales experimentales se encuentran a continuación en las Tablas 1-13. Los Ejemplos 2-12 proporcionan más detalles sobre la caracterización de las Formas A, D, J, X, X2, X3, F, K, L, M y N, respectivamente.
Tabla 1: Sistemas de disolventes probados.
Tabla 2: Cristalización preliminar a través de la adición de antidisolvente en THF/n-heptano, usando 8,4 g de Forma A de grapiprant como material de partida.
Tabla 3: Sumario de la preparación y caracterización de nuevas formas.
Tabla 4: Conversión en suspensión en acetona del producto de la cristalización antidisolvente en
DCM/acetona.
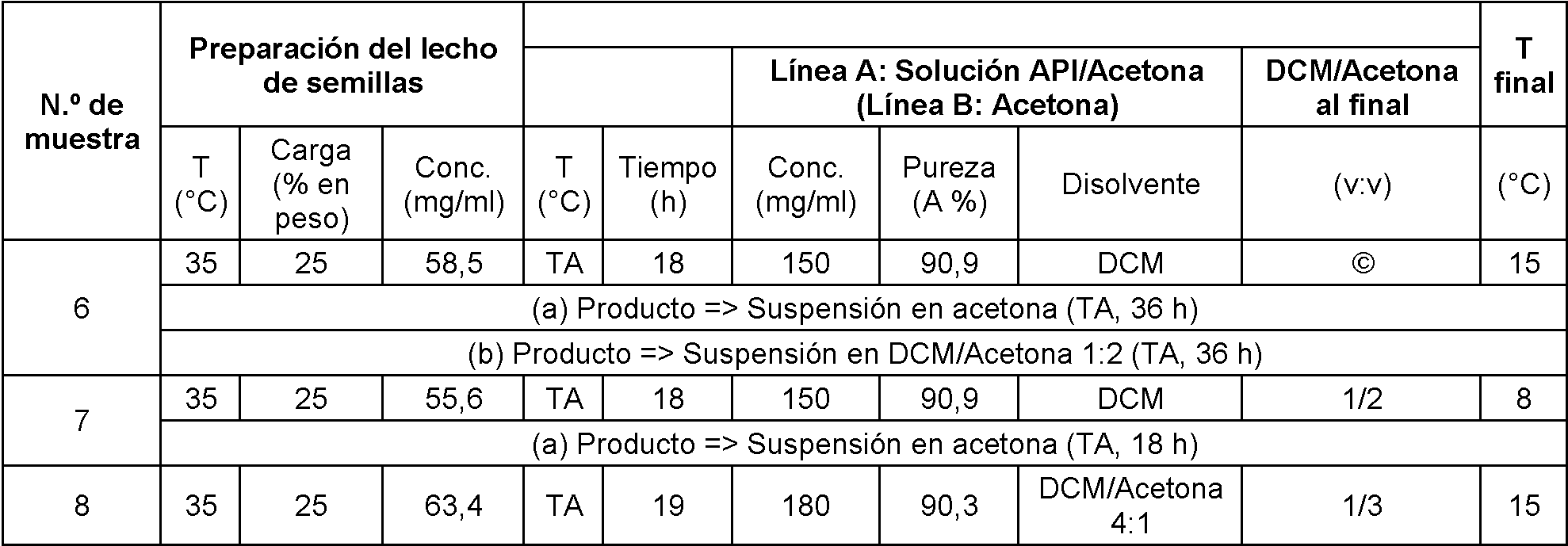
Tabla 5: Cristalización a través de adición simultánea a 1:2 y 1:3 de DCM/acetona.
Tabla 6: Resultados de la cristalización a través de la adición simultánea a 1:2 y 1:3 de DCM/acetona.
Tabla 7: Resultados de la cristalización mediante suspensión a temperatura ambiente.
Tabla 8: Resultados de la cristalización a través de suspensión a 50 °C.
Tabla 9: Resultados de la cristalización a través de enfriamiento.
Tabla 10: Resultados de la cristalización a través de la difusión de vapor líquido.
Tabla 11: Resultados de la cristalización a través de la adición de anti-disolvente.
Tabla 12: Resultados de la cristalización a través de evaporación.
Tabla 13: Resultados de la cristalización a través de evaporación.
Ejemplo 2 - Preparación y Caracterización de cristales de Forma A
La Forma A de grapiprant es un anhidrato, que tiene menos del 0,2 % en peso de agua. Los cristales de la Forma A se prepararon mediante (1) suspensión de la Forma J (Ejemplo 4) en diclorometano/acetona (v/v) 1:2 a 25 °C, (2) suspensión con la Forma X (Ejemplo 5) en diclorometano/acetona 1:1 (v/v) o suspensión con la Forma X2 (Ejemplo 6). (Véase también la Figura 1.)
La Figura 2 presenta el patrón de difracción de rayos X en polvo característico para la Forma A. La Forma A exhibió picos de difracción por encima del fondo en 5,326, 9,978, 12,599, 13,542, 13,803, 14,263, 16,121, 17,665, 18,053, 18,389, 19,126, 19,603, 20,314, 21,781, 22,949, 23,178, 23,663, 24,136, 25,803, 26,792, 27,160, 27,703, 28,125, 28,466, 29,326, 30,813, 31,699, 32,501, 33,219, 35,217, 36,285, 37,180, 38,079 y 39,141 grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 9,9, aproximadamente 13,5, aproximadamente 14,3, aproximadamente 16,1, aproximadamente 17,7, aproximadamente 21,8, aproximadamente 24,14 y aproximadamente 25,8 grados 2-theta (±0,15 grados 2-theta).
La Figura 3 presenta trazas de DSC de la Forma A que mostró una endoterma/exoterma en aproximadamente 155 170 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa del 0,5-0,6 % cuando se calentaron desde aproximadamente 30 °C hasta aproximadamente 150 °C. La pérdida de masa se identificó como acetona y diclorometano residuales.
La Figura 9 muestra el perfil de solubilidad de la Forma A en un sistema disolvente de tetrahidrofurano (THF) y nheptano y la Figura 10 muestra el perfil de solubilidad de la Forma A en un sistema disolvente de diclorometano y acetona. Estas solubilidades se evaluaron para indicar cómo se comportan los disolventes de recristalización en la recuperación global de materiales.
Ejemplo 3 - Preparación y Caracterización de cristales de Forma D
La forma D de grapiprant es un dihidrato, que tiene aproximadamente 6,5 en peso de agua. Los cristales de Forma D se prepararon mediante suspensión de la Forma A (Ejemplo 2) en agua. (Véase también la Figura 1.)
La Figura 2 presenta el patrón de difracción de rayos X en polvo característico para la Forma D. La Forma D exhibió picos de difracción por encima del fondo en 7,179, 7,511, 9,642, 12,493, 12,598, 13,411, 14,318, 14,978, 15,402, 15,694, 16,053, 17,680, 18,202, 19,223, 19,746, 20,570, 20,888, 21,327, 21,792, 22,313, 22,766, 23,284, 23,284, 23,676, 24,450, 24,755, 25,902, 27,142, 28,159, 30,224, 30,904, 32,374, 32,725, 34,237, 34,237 y 36,142 grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 9,6, aproximadamente 12,5, aproximadamente 15,0, aproximadamente 15,4, aproximadamente 22,7 y aproximadamente 27,1 grados 2-theta (±0,15 grados 2-theta).
La Figura 4 presenta trazas de DSC de la Forma D que mostraron eventos endotérmicos/exotérmicos en aproximadamente 25-125 °C, en aproximadamente 125-155 °C y aproximadamente a 155-175 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa del 6-7 % cuando se calentaron desde aproximadamente 24 °C hasta aproximadamente 69 °C. La pérdida de masa se identificó como agua.
Ejemplo 4 - Preparación y Caracterización de cristales de Forma J
La Forma J de grapiprant es un solvato de diclorometano (DCM), que tiene una cantidad de agua no identificada. Los cristales de Forma J se prepararon precipitando grapiprant en diclorometano/n-heptano 2:1 (2:1). (Véase también la Figura 1.) Como se muestra en la Figura 23, la Forma J puede tener la morfología cristalina de una placa. La Figura 2 presenta el patrón de difracción de rayos X en polvo característico para la Forma J. La Forma J exhibió picos de difracción por encima del fondo en 6,601, 10,158, 10,847, 11,432, 13,119, 14,281, 15,039, 15,470, 16,287,
17,810, 19,661, 20,479, 20,864, 21,395, 22,098, 22,857, 23,295, 24,767, 26,292, 27,343, 28,280 y 36,158 grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 6,6, aproximadamente 13,1, aproximadamente 15,5, aproximadamente 19,7 y aproximadamente 22,9 grados 2-theta (±0,15 grados 2-theta). La Figura 5 presenta trazas de DSC de la Forma J que mostraron eventos endotérmicos/exotérmicos en aproximadamente 25-105 °C, en aproximadamente 105-140 °C y aproximadamente a 140-190 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa del 10-11 % cuando se calentaron desde aproximadamente 28 °C hasta aproximadamente 150 °C. La pérdida de masa se identificó como diclorometano. Ejemplo 5 - Preparación y Caracterización de cristales de Forma X
La forma X de grapiprant es un solvato/hidrato de DCM, que tiene una cantidad de agua no identificada. Los cristales de Forma X se prepararon mediante suspensión de las Formas D y J en diclorometano/acetona 2:1 (v/v). (Véase también la Figura 1.)
La Figura 2 presenta el patrón de difracción de rayos X en polvo característico para la Forma X. La Forma X exhibió picos de difracción por encima del fondo en 6,472, 10,062, 10,700, 11,282, 11,892, 12,097, 12,982, 13,285, 14,181, 14,926, 15,335, 16,164, 17,108, 17,730, 18,615, 19,577, 19,711, 20,315, 20,769, 21,313, 21,941, 22,712, 22,880, 23,142, 23,934, 24,359, 24,785, 26,121, 26,662, 27,261, 27,998, 28,622, 30,176, 31,793, 34,211, 35,970 y 37,491 grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 6,5, aproximadamente 10,1, aproximadamente 14,9, aproximadamente 15,3, aproximadamente 19,7, aproximadamente 20,3, aproximadamente 21,3, aproximadamente 22,7, aproximadamente 23,1 y aproximadamente 27,3 grados 2-theta (±0,15 grados 2-theta). La Figura 6 presenta trazas de DSC de la Forma X que mostraron eventos endotérmicos/exotérmicos a aproximadamente 33-80 °C y aproximadamente 110-140 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa del 12-13 % cuando se calentaron desde aproximadamente 24 °C hasta aproximadamente 150 °C. La pérdida de masa se identificó como diclorometano y agua.
Ejemplo 6 - Preparación y Caracterización de cristales de Forma X2
La forma X2 de grapiprant es un solvato/hidrato de DCM, que tiene entre aproximadamente el 0 % y aproximadamente el 3,5 % en peso de agua. Los cristales de la Forma X2 se prepararon mediante una suspensión de la Forma A en diclorometano/acetona/agua 33:66:1 (v/v/v). (Véase también la Figura 1.)
La Figura 2 presenta el patrón de difracción de rayos X en polvo característico para la Forma X2. La forma X2 exhibió picos de difracción por encima del fondo en 10,227, 12,020, 12,855, 13,221, 13,703, 14,919, 15,667, 16,234, 16,809, 17,170, 18,283, 18,791, 19,259, 19,815, 20,587, 21,227, 21,489, 21,812, 22,659, 23,445, 23,884, 24,338, 24,743, 25,131, 25,883, 26,391, 26,946, 27,629, 28,621, 29,995, 30,964, 31,757, 32,607, 33,716, 34,920 y 35,788 grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 10,2, aproximadamente 14,9, aproximadamente 16,8, aproximadamente 18,3, aproximadamente 21,8, aproximadamente 22,7, aproximadamente 23,9, aproximadamente 24,3, aproximadamente 25,9 y aproximadamente 26,4 grados 2-theta (±0,15 grados 2-theta). La Figura 7 presenta trazas de DSC de la Forma X2 que mostraron eventos endotérmicos/exotérmicos en aproximadamente 25-130 °C, en aproximadamente 130-150 °C y aproximadamente a 150-190 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa del 14-15% cuando se calentaron desde aproximadamente 25 °C hasta aproximadamente 150 °C. La pérdida de masa se identificó como diclorometano y agua. (Véase también la FIGURA 1.)
Ejemplo 7 - Preparación y Caracterización de cristales de Forma X3
La forma X3 de grapiprant es un solvato/hidrato, que tiene entre aproximadamente el 1,1 % y aproximadamente el 2,4 % en peso de agua. Los cristales de la Forma X3 se prepararon secando la Forma X2 (Ejemplo 6) a temperatura ambiente o 45 °C. (Véase también la Figura 1.)
La Figura 2 presenta el patrón de difracción de rayos X en polvo característico para la Forma X3. La forma X3 exhibió picos de difracción por encima del fondo en 8,498, 10,042, 12,468, 13,609, 14,303, 14,923, 16,086, 16,773, 18,086, 19,231, 20,463, 21,010, 22,995, 24,477, 25,257, 26,206, 27,448, 28,739 y 33,619 grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 13,6, aproximadamente 21,0, aproximadamente 24,5 y aproximadamente 25,3 grados 2-theta (±0,15 grados 2-theta).
La Figura 8 presenta trazas de DSC de la Forma X3 que mostraron eventos endotérmicos/exotérmicos en aproximadamente 75-115 °C, en aproximadamente 135-150 °C y aproximadamente a 150-170 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa del 10-11 % cuando se calentaron desde aproximadamente 25 °C hasta aproximadamente 135 °C. La pérdida de masa se identificó como agua.
Ejemplo 8 - Preparación y Caracterización de cristales de Forma F
La forma F de grapiprant es un desolvato de cloroformo metastable, que tiene una cantidad de agua no identificada. Los cristales de forma F se prepararon mediante cristalización de grapiprant a partir de una suspensión en
diclorometano/cloroformo 2:3 (v/v) a temperatura ambiente, de 1:1 de acetona/cloroformo (v/v) o de 5:1 de cloroformo/acetona (v/v).
La Figura 13 presenta el patrón de difracción de rayos X en polvo característico para la Forma F. La Forma F exhibió picos de difracción por encima del fondo en 6,564, 8,047, 9,888, 11,430, 11,931, 13,152, 14,483, 14,759, 15,498, 16,129, 16,829, 17,669, 18,003, 18,288, 18,674, 19,111, 19,570, 19,924, 20,409, 21,835, 22,974, 23,485, 23,970, 24,564, 25,002, 26,284, 27,668, 28,158 y 34,174 (intensidad máxima relativa> 10%) grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 9,9, aproximadamente 14,8, aproximadamente 15,5, aproximadamente 18,0, aproximadamente 19,9, aproximadamente 20,4, aproximadamente 21,8, aproximadamente 23,5 y aproximadamente 27,7 grados 2-theta (±0,15 grados 2-theta).
La Figura 14 presenta trazas de DSC de la Forma F que mostraron eventos endotérmicos/exotérmicos a aproximadamente 122 °C y aproximadamente 143 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa de aproximadamente el 20,5 % cuando se calentaron desde aproximadamente 25 °C hasta aproximadamente 135 °C. La pérdida de masa se identificó como agua.
Ejemplo 9 - Preparación y Caracterización de cristales de Forma K
Forma K de grapiprant como una cantidad de agua no identificada. Los cristales de la Forma K se prepararon mediante cristalización de grapiprant en diclorometano/acetonitrilo 5:1 (v/v).
La Figura 15 presenta el patrón de difracción de rayos X en polvo característico para la Forma K. La Forma K exhibió picos de difracción por encima del fondo en 6,914, 9,683, 11,304, 12,380, 13,986, 14,391, 15,133, 15,942, 16,559, 16,870, 17,446, 17,771, 18,189, 19,044, 20,183, 21,714, 21,862, 22,498, 23,309, 24,054, 24,669, 25,083, 26,834, 27,836, 28,964, 31,968, 33,366 y 33,739 (intensidad máxima relativa> 10%) grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 11,3, aproximadamente 15,9, aproximadamente 16,6, aproximadamente 18,2, aproximadamente 19,0, aproximadamente 21,7, aproximadamente 21,9, aproximadamente 25,7 y aproximadamente 29,0 grados 2-theta (±0,15 grados 2-theta).
La Figura 16 presenta trazas de DSC de la Forma K que mostraron eventos endotérmicos/exotérmicos en aproximadamente 48 °C, en aproximadamente 95 °C y aproximadamente a 155 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa de aproximadamente el 8,7 % cuando se calentaron desde aproximadamente 25 °C hasta aproximadamente 135 °C. La pérdida de masa se identificó como agua.
Ejemplo 10 - Preparación y Caracterización de cristales de Forma L
La Forma L de grapiprant tiene una cantidad de agua no identificada. Los cristales de Forma L se prepararon mediante cristalización de grapiprant en diclorometano/acetonitrilo o en diclorometano/etanol.
La Figura 17 presenta el patrón de difracción de rayos X en polvo característico para la Forma L. La Forma L exhibió picos de difracción por encima del fondo en 6,836, 11,066, 13,755, 16,720, 17,636, 20,315, 20,726, 21,305, 21,970, 23,216, 24,491, 24,969, 26,022, 26,282 y 36,864 (intensidad máxima relativa> 1 %) grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 6,8, aproximadamente 11,1, aproximadamente 13,8, aproximadamente 16,7, aproximadamente 20,7, aproximadamente 23,2, aproximadamente 25,0, aproximadamente 26,0 y aproximadamente 26,3 grados 2-theta (±0,15 grados 2-theta).
La Figura 18 presenta trazas de DSC de la Forma L que mostró una endoterma/exoterma en aproximadamente 106 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa de aproximadamente el 12,9% cuando se calentaron desde aproximadamente 25 °C hasta aproximadamente 135 °C. La pérdida de masa se identificó como agua.
Ejemplo 11 - Preparación y Caracterización de cristales de Forma M
La Forma M de grapiprant tiene una cantidad de agua no identificada. Los cristales de la Forma M se prepararon mediante cristalización de grapiprant en diclorometano/acetona 7:3 (v/v).
La Figura 19 presenta el patrón de difracción de rayos X en polvo característico para la Forma M. La Forma M exhibió picos de difracción por encima del fondo en 6,162, 6,458, 10,561, 12,981, 14,974, 18,874, 19,538, 21,380, 25,101, 26,176, 27,382, 36,386, 37,883, 37,994, 39,714 y 39,816 (intensidad máxima relativa> 1 %) grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 6,2, aproximadamente 6,5, aproximadamente 13,0, aproximadamente 18,9, aproximadamente 19,5, aproximadamente 27,4, aproximadamente 37,9, aproximadamente 38,0 y aproximadamente 39,7 grados 2-theta (±0,15 grados 2-theta).
La Figura 20 presenta trazas de DSC de la Forma M que mostraron eventos endotérmicos/exotérmicos en aproximadamente 77 °C, en aproximadamente 99 °C y aproximadamente a 138 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa de aproximadamente el 13,6 % cuando se calentaron desde aproximadamente 25 °C hasta aproximadamente 135 °C. La pérdida de masa se identificó como agua.
Ejemplo 12 - Preparación y caracterización de cristales de forma N
La Forma N de grapiprant tiene una cantidad de agua no identificada. Los cristales de la Forma N se prepararon mediante cristalización de grapiprant de DCM/THF 5:1 (v/v).
La Figura 21 presenta el patrón de difracción de rayos X en polvo característico para la Forma N. La Forma N exhibió picos de difracción por encima del fondo en 6,357, 6,472, 9,943, 10,007, 10,760, 11,313, 12,016, 12,938, 14,182, 14,763, 15,353, 16,000, 17,737, 18,350, 19,067, 19,506, 19,737, 20,311, 20,590, 21,376, 21,688, 22,912, 23,368, 24,066, 24,476, 25,838, 27,165 y 27,508 (intensidad máxima relativa> 10%) grados 2-theta. Esta forma cristalina tuvo picos predominantes en aproximadamente 6,5, aproximadamente 9,9, aproximadamente 14,2, aproximadamente 14,8, aproximadamente 15,4, aproximadamente 17,7, aproximadamente 19,7, aproximadamente 20,3 y aproximadamente 23,4 grados 2-theta (±0,15 grados 2-theta).
La Figura 22 presenta trazas de DSC de la Forma N que mostraron eventos endotérmicos/exotérmicos a aproximadamente 121 °C y aproximadamente 157 °C. En la misma figura, las trazas de TGA exhibieron una pérdida de masa de aproximadamente el 11,1 % cuando se calentaron desde aproximadamente 25 °C hasta aproximadamente 135 °C. La pérdida de masa se identificó como agua.
Claims (2)
1. Un procedimiento de preparación de una Forma A cristalina sustancialmente pura de grapiprant, comprendiendo el procedimiento:
i. poner en contacto grapiprant a temperatura ambiente con un disolvente que comprende diclorometano y acetona para formar una solución saturada o casi saturada, en el que el disolvente comprende una relación volumen a volumen de 1:1 a 1:3 de diclorometano/acetona; y
ii. formar cristales de la Forma A cristalina sustancialmente pura de grapiprant,
en el que la Forma A cristalina exhibe un patrón de difracción de rayos X en polvo que tiene picos característicos expresados en grados 2-theta a 9,9 ± 0,15, 13,5 ± 0,15, 14,3 ± 0,15, 16,1 ± 0,15, 17,7 ± 0,15, 21,8 ± 0,15, 24,14 ± 0,15 y 25,8 ± 0,15;
un perfil de calorimetría diferencial de barrido que ha mostrado una endoterma/exoterma a 155-170 °C; y
un análisis termogravimétrico que muestra una pérdida de masa del 0,5-0,6 % cuando se calienta de 30 °C a 150 °C, en el que el difractómetro de rayos X está equipado con un tubo largo de rayos X de enfoque fino con una fuente de radiación de cobre Ka que funciona a 45 kV/40 mA y un monocromador de haz difractado montado frente a un detector de centelleo; y
en el que "sustancialmente puro" significa que el polimorfo tiene una pureza del 95 % en peso como se define por difracción de rayos X en polvo.
2. El procedimiento de la reivindicación 1, en el que el disolvente comprende del 0 % en peso al 0,5 % en peso de agua.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461949006P | 2014-03-06 | 2014-03-06 | |
| US201461996961P | 2014-07-30 | 2014-07-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2816057T3 true ES2816057T3 (es) | 2021-03-31 |
Family
ID=54016295
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES15758500T Active ES2755396T3 (es) | 2014-03-06 | 2015-03-05 | Formas cristalinas de grapiprant |
| ES17193737T Active ES2816057T3 (es) | 2014-03-06 | 2015-03-05 | Procedimiento de preparación de la forma A de grapiprant |
| ES19156369T Active ES2919346T3 (es) | 2014-03-06 | 2015-03-05 | Forma cristalina x2 de grapiprant |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES15758500T Active ES2755396T3 (es) | 2014-03-06 | 2015-03-05 | Formas cristalinas de grapiprant |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES19156369T Active ES2919346T3 (es) | 2014-03-06 | 2015-03-05 | Forma cristalina x2 de grapiprant |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US9265756B2 (es) |
| EP (4) | EP3295941B1 (es) |
| JP (2) | JP6535683B2 (es) |
| KR (2) | KR101771385B1 (es) |
| CN (11) | CN107501263A (es) |
| AU (1) | AU2015227064B2 (es) |
| CA (10) | CA2941019A1 (es) |
| DK (3) | DK3113773T3 (es) |
| ES (3) | ES2755396T3 (es) |
| MX (1) | MX367376B (es) |
| NZ (3) | NZ733225A (es) |
| PL (3) | PL3113773T3 (es) |
| PT (3) | PT3295941T (es) |
| RU (1) | RU2638931C1 (es) |
| TW (1) | TWI537270B (es) |
| WO (1) | WO2015134797A1 (es) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK3113774T3 (da) | 2014-03-06 | 2022-03-07 | Elanco Animal Health Incorporated | Sammensætninger af grapiprant og fremgangsmåder til anvendelse deraf |
| US12109218B2 (en) | 2014-12-09 | 2024-10-08 | Aratana Therapeutics, Inc. | Compositions of grapiprant and methods for using the same |
| CN112292128A (zh) | 2018-04-16 | 2021-01-29 | 阿瑞斯医疗有限公司 | Ep4抑制剂和其用途 |
| EP3820469A4 (en) * | 2018-07-11 | 2022-04-13 | Arrys Therapeutics, Inc. | EP4 INHIBITORS AND USE THEREOF |
| US20210315909A1 (en) * | 2018-07-11 | 2021-10-14 | Arrys Therapeutics, Inc. | Polymorphic compounds and uses thereof |
| US11254675B2 (en) * | 2019-08-12 | 2022-02-22 | Cadila Healthcare Limited | Process for preparation of grapiprant |
| WO2021226162A1 (en) | 2020-05-05 | 2021-11-11 | Arrys Therapeutics, Inc. | Ep4 antagonists and their use in the treatment of proliferative diseases |
| CN116283959A (zh) * | 2021-12-10 | 2023-06-23 | 江苏慧聚药业股份有限公司 | 格拉匹纶新晶型及其制备 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| HN2001000224A (es) | 2000-10-19 | 2002-06-13 | Pfizer | Compuestos de imidazol condensado con arilo o heteroarilo como agentes anti - inflamatorios y analgesicos. |
| MX2007011110A (es) * | 2005-03-11 | 2008-02-21 | Pfizer | Formas de cristal de un derivado de imidazol. |
| AU2006249847B2 (en) * | 2005-05-23 | 2012-12-20 | Novartis Ag | Crystalline and other forms of 4-amino-5-fluoro-3-[6-(4-methylpiperazin-1-yl)-1H-benzimidazol-2-yl]-1H-quinolin-2-one lactic acid salts |
| NZ577109A (en) * | 2006-12-15 | 2011-12-22 | Glaxo Group Ltd | Benzamide derivatives as ep4 receptor agonists |
| US8404736B2 (en) | 2008-08-14 | 2013-03-26 | Beta Pharma Canada Inc. | Heterocyclic amide derivatives as EP4 receptor antagonists |
| WO2012157288A1 (en) | 2011-05-18 | 2012-11-22 | Raqualia Pharma Inc. | Polymorph form of 4-{[4-({[4-(2,2,2-trifluoroethoxy)-1,2-benzisoxazol-3-yl]oxy}methyl)piperidin-1-yl]methyl}-tetrahydro-2h-pyran-4-carboxylic acid |
-
2015
- 2015-03-05 PL PL15758500T patent/PL3113773T3/pl unknown
- 2015-03-05 CN CN201710831795.4A patent/CN107501263A/zh not_active Withdrawn
- 2015-03-05 CN CN201710831494.1A patent/CN107573339A/zh not_active Withdrawn
- 2015-03-05 CA CA2941019A patent/CA2941019A1/en not_active Withdrawn
- 2015-03-05 CN CN201710832497.7A patent/CN107759591A/zh not_active Withdrawn
- 2015-03-05 CA CA2997692A patent/CA2997692A1/en not_active Abandoned
- 2015-03-05 DK DK15758500T patent/DK3113773T3/da active
- 2015-03-05 CN CN201710832416.3A patent/CN107759590A/zh not_active Withdrawn
- 2015-03-05 CN CN201710832196.4A patent/CN107759589A/zh active Pending
- 2015-03-05 CA CA3105571A patent/CA3105571A1/en active Pending
- 2015-03-05 CA CA2997703A patent/CA2997703A1/en not_active Abandoned
- 2015-03-05 CA CA3168877A patent/CA3168877A1/en active Pending
- 2015-03-05 MX MX2016011023A patent/MX367376B/es active IP Right Grant
- 2015-03-05 CA CA2997718A patent/CA2997718A1/en active Pending
- 2015-03-05 US US14/639,916 patent/US9265756B2/en active Active
- 2015-03-05 RU RU2016139096A patent/RU2638931C1/ru active
- 2015-03-05 ES ES15758500T patent/ES2755396T3/es active Active
- 2015-03-05 KR KR1020177000896A patent/KR101771385B1/ko active IP Right Grant
- 2015-03-05 CN CN201710831743.7A patent/CN107540671A/zh not_active Withdrawn
- 2015-03-05 PT PT171937378T patent/PT3295941T/pt unknown
- 2015-03-05 NZ NZ733225A patent/NZ733225A/en unknown
- 2015-03-05 CN CN201580002716.8A patent/CN105764508A/zh active Pending
- 2015-03-05 DK DK17193737.8T patent/DK3295941T3/da active
- 2015-03-05 EP EP17193737.8A patent/EP3295941B1/en active Active
- 2015-03-05 EP EP19156369.1A patent/EP3511000B1/en active Active
- 2015-03-05 NZ NZ724923A patent/NZ724923A/en unknown
- 2015-03-05 KR KR1020167024256A patent/KR101697914B1/ko active IP Right Grant
- 2015-03-05 ES ES17193737T patent/ES2816057T3/es active Active
- 2015-03-05 NZ NZ733234A patent/NZ733234A/en unknown
- 2015-03-05 EP EP19156370.9A patent/EP3520790A1/en not_active Withdrawn
- 2015-03-05 CA CA2997697A patent/CA2997697A1/en not_active Abandoned
- 2015-03-05 CN CN201710831540.8A patent/CN107501262A/zh active Pending
- 2015-03-05 CN CN201910653673.XA patent/CN110256426A/zh active Pending
- 2015-03-05 DK DK19156369.1T patent/DK3511000T3/da active
- 2015-03-05 PL PL19156369.1T patent/PL3511000T3/pl unknown
- 2015-03-05 JP JP2016555827A patent/JP6535683B2/ja active Active
- 2015-03-05 TW TW104107082A patent/TWI537270B/zh active
- 2015-03-05 EP EP15758500.1A patent/EP3113773B1/en active Active
- 2015-03-05 PL PL17193737T patent/PL3295941T3/pl unknown
- 2015-03-05 ES ES19156369T patent/ES2919346T3/es active Active
- 2015-03-05 CN CN201710831735.2A patent/CN107400132A/zh not_active Withdrawn
- 2015-03-05 CA CA2997741A patent/CA2997741A1/en not_active Abandoned
- 2015-03-05 PT PT191563691T patent/PT3511000T/pt unknown
- 2015-03-05 CA CA2997746A patent/CA2997746A1/en not_active Abandoned
- 2015-03-05 WO PCT/US2015/019043 patent/WO2015134797A1/en active Application Filing
- 2015-03-05 AU AU2015227064A patent/AU2015227064B2/en active Active
- 2015-03-05 PT PT157585001T patent/PT3113773T/pt unknown
- 2015-03-05 CN CN202110197159.7A patent/CN113087705A/zh active Pending
- 2015-03-05 CA CA2997694A patent/CA2997694C/en active Active
-
2017
- 2017-11-10 JP JP2017217662A patent/JP2018065819A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2816057T3 (es) | Procedimiento de preparación de la forma A de grapiprant | |
| WO2010033540A1 (en) | Crystalline forms of fentanyl alkaloid | |
| US8227483B2 (en) | Polymorphs of 6-beta-naltrexol |