DE102007045920B4 - Synergistische Wirkstoffkombinationen - Google Patents
Synergistische Wirkstoffkombinationen Download PDFInfo
- Publication number
- DE102007045920B4 DE102007045920B4 DE102007045920.5A DE102007045920A DE102007045920B4 DE 102007045920 B4 DE102007045920 B4 DE 102007045920B4 DE 102007045920 A DE102007045920 A DE 102007045920A DE 102007045920 B4 DE102007045920 B4 DE 102007045920B4
- Authority
- DE
- Germany
- Prior art keywords
- spp
- methyl
- formula
- phenyl
- der
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000000890 drug combination Substances 0.000 title claims description 5
- 230000002195 synergetic effect Effects 0.000 title description 11
- 150000001875 compounds Chemical class 0.000 claims abstract description 179
- -1 6-chloropyrid-3-yl Chemical group 0.000 claims abstract description 107
- 239000013543 active substance Substances 0.000 claims abstract description 29
- MNHVNIJQQRJYDH-UHFFFAOYSA-N 2-[2-(1-chlorocyclopropyl)-3-(2-chlorophenyl)-2-hydroxypropyl]-1,2-dihydro-1,2,4-triazole-3-thione Chemical compound N1=CNC(=S)N1CC(C1(Cl)CC1)(O)CC1=CC=CC=C1Cl MNHVNIJQQRJYDH-UHFFFAOYSA-N 0.000 claims abstract description 28
- ONCZDRURRATYFI-TVJDWZFNSA-N trifloxystrobin Chemical compound CO\N=C(\C(=O)OC)C1=CC=CC=C1CO\N=C(/C)C1=CC=CC(C(F)(F)F)=C1 ONCZDRURRATYFI-TVJDWZFNSA-N 0.000 claims abstract description 28
- BAZVSMNPJJMILC-UHFFFAOYSA-N triadimenol Chemical compound C1=NC=NN1C(C(O)C(C)(C)C)OC1=CC=C(Cl)C=C1 BAZVSMNPJJMILC-UHFFFAOYSA-N 0.000 claims abstract description 27
- GOFJDXZZHFNFLV-UHFFFAOYSA-N 5-fluoro-1,3-dimethyl-N-[2-(4-methylpentan-2-yl)phenyl]pyrazole-4-carboxamide Chemical compound CC(C)CC(C)C1=CC=CC=C1NC(=O)C1=C(F)N(C)N=C1C GOFJDXZZHFNFLV-UHFFFAOYSA-N 0.000 claims abstract description 25
- OAWUUPVZMNKZRY-UHFFFAOYSA-N cyprosulfamide Chemical compound COC1=CC=CC=C1C(=O)NS(=O)(=O)C1=CC=C(C(=O)NC2CC2)C=C1 OAWUUPVZMNKZRY-UHFFFAOYSA-N 0.000 claims abstract description 25
- ZQEIXNIJLIKNTD-UHFFFAOYSA-N methyl N-(2,6-dimethylphenyl)-N-(methoxyacetyl)alaninate Chemical compound COCC(=O)N(C(C)C(=O)OC)C1=C(C)C=CC=C1C ZQEIXNIJLIKNTD-UHFFFAOYSA-N 0.000 claims abstract description 25
- KUAZQDVKQLNFPE-UHFFFAOYSA-N thiram Chemical compound CN(C)C(=S)SSC(=S)N(C)C KUAZQDVKQLNFPE-UHFFFAOYSA-N 0.000 claims abstract description 25
- WZZLDXDUQPOXNW-UHFFFAOYSA-N propamocarb Chemical compound CCCOC(=O)NCCCN(C)C WZZLDXDUQPOXNW-UHFFFAOYSA-N 0.000 claims abstract description 23
- KVDJTXBXMWJJEF-UHFFFAOYSA-N fluopyram Chemical compound ClC1=CC(C(F)(F)F)=CN=C1CCNC(=O)C1=CC=CC=C1C(F)(F)F KVDJTXBXMWJJEF-UHFFFAOYSA-N 0.000 claims abstract description 22
- ONUFESLQCSAYKA-UHFFFAOYSA-N iprodione Chemical compound O=C1N(C(=O)NC(C)C)CC(=O)N1C1=CC(Cl)=CC(Cl)=C1 ONUFESLQCSAYKA-UHFFFAOYSA-N 0.000 claims abstract description 22
- PXMNMQRDXWABCY-UHFFFAOYSA-N 1-(4-chlorophenyl)-4,4-dimethyl-3-(1H-1,2,4-triazol-1-ylmethyl)pentan-3-ol Chemical compound C1=NC=NN1CC(O)(C(C)(C)C)CCC1=CC=C(Cl)C=C1 PXMNMQRDXWABCY-UHFFFAOYSA-N 0.000 claims abstract description 21
- UFEODZBUAFNAEU-NLRVBDNBSA-N fluoxastrobin Chemical compound C=1C=CC=C(OC=2C(=C(OC=3C(=CC=CC=3)Cl)N=CN=2)F)C=1C(=N/OC)\C1=NOCCO1 UFEODZBUAFNAEU-NLRVBDNBSA-N 0.000 claims abstract description 21
- ZQEIXNIJLIKNTD-GFCCVEGCSA-N metalaxyl-M Chemical compound COCC(=O)N([C@H](C)C(=O)OC)C1=C(C)C=CC=C1C ZQEIXNIJLIKNTD-GFCCVEGCSA-N 0.000 claims abstract description 21
- LDLMOOXUCMHBMZ-UHFFFAOYSA-N bixafen Chemical compound FC(F)C1=NN(C)C=C1C(=O)NC1=CC=C(F)C=C1C1=CC=C(Cl)C(Cl)=C1 LDLMOOXUCMHBMZ-UHFFFAOYSA-N 0.000 claims abstract description 20
- MUJOIMFVNIBMKC-UHFFFAOYSA-N fludioxonil Chemical compound C=12OC(F)(F)OC2=CC=CC=1C1=CNC=C1C#N MUJOIMFVNIBMKC-UHFFFAOYSA-N 0.000 claims abstract description 20
- 239000005783 Fluopyram Substances 0.000 claims abstract description 19
- 239000005867 Iprodione Substances 0.000 claims abstract description 19
- 239000005839 Tebuconazole Substances 0.000 claims abstract description 19
- 239000005846 Triadimenol Substances 0.000 claims abstract description 19
- CRFYLQMIDWBKRT-LPYMAVHISA-N pyribencarb Chemical compound C1=C(Cl)C(CNC(=O)OC)=CC(C(\C)=N\OCC=2N=C(C)C=CC=2)=C1 CRFYLQMIDWBKRT-LPYMAVHISA-N 0.000 claims abstract description 19
- 239000005781 Fludioxonil Substances 0.000 claims abstract description 18
- 239000005807 Metalaxyl Substances 0.000 claims abstract description 18
- 239000005821 Propamocarb Substances 0.000 claims abstract description 18
- 239000005825 Prothioconazole Substances 0.000 claims abstract description 18
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 claims abstract description 18
- OIPMQULDKWSNGX-UHFFFAOYSA-N bis[[ethoxy(oxo)phosphaniumyl]oxy]alumanyloxy-ethoxy-oxophosphanium Chemical compound [Al+3].CCO[P+]([O-])=O.CCO[P+]([O-])=O.CCO[P+]([O-])=O OIPMQULDKWSNGX-UHFFFAOYSA-N 0.000 claims abstract description 18
- LMVPQMGRYSRMIW-KRWDZBQOSA-N fenamidone Chemical compound O=C([C@@](C)(N=C1SC)C=2C=CC=CC=2)N1NC1=CC=CC=C1 LMVPQMGRYSRMIW-KRWDZBQOSA-N 0.000 claims abstract description 18
- HYVWIQDYBVKITD-UHFFFAOYSA-N tolylfluanid Chemical compound CN(C)S(=O)(=O)N(SC(F)(Cl)Cl)C1=CC=C(C)C=C1 HYVWIQDYBVKITD-UHFFFAOYSA-N 0.000 claims abstract description 18
- 239000005774 Fenamidone Substances 0.000 claims abstract description 17
- 239000005857 Trifloxystrobin Substances 0.000 claims abstract description 17
- WLPCAERCXQSYLQ-UHFFFAOYSA-N isotianil Chemical compound ClC1=NSC(C(=O)NC=2C(=CC=CC=2)C#N)=C1Cl WLPCAERCXQSYLQ-UHFFFAOYSA-N 0.000 claims abstract description 17
- OGYFATSSENRIKG-UHFFFAOYSA-N pencycuron Chemical compound C1=CC(Cl)=CC=C1CN(C(=O)NC=1C=CC=CC=1)C1CCCC1 OGYFATSSENRIKG-UHFFFAOYSA-N 0.000 claims abstract description 17
- TWFZGCMQGLPBSX-UHFFFAOYSA-N Carbendazim Natural products C1=CC=C2NC(NC(=O)OC)=NC2=C1 TWFZGCMQGLPBSX-UHFFFAOYSA-N 0.000 claims abstract description 16
- BREATYVWRHIPIY-UHFFFAOYSA-N amisulbrom Chemical compound CN(C)S(=O)(=O)N1C=NC(S(=O)(=O)N2C3=CC(F)=CC=C3C(Br)=C2C)=N1 BREATYVWRHIPIY-UHFFFAOYSA-N 0.000 claims abstract description 16
- PUYXTUJWRLOUCW-UHFFFAOYSA-N spiroxamine Chemical compound O1C(CN(CC)CCC)COC11CCC(C(C)(C)C)CC1 PUYXTUJWRLOUCW-UHFFFAOYSA-N 0.000 claims abstract description 16
- KWLVWJPJKJMCSH-UHFFFAOYSA-N 2-(4-chlorophenyl)-N-{2-[3-methoxy-4-(prop-2-yn-1-yloxy)phenyl]ethyl}-2-(prop-2-yn-1-yloxy)acetamide Chemical compound C1=C(OCC#C)C(OC)=CC(CCNC(=O)C(OCC#C)C=2C=CC(Cl)=CC=2)=C1 KWLVWJPJKJMCSH-UHFFFAOYSA-N 0.000 claims abstract description 15
- NWUWYYSKZYIQAE-ZBFHGGJFSA-N L-(R)-iprovalicarb Chemical compound CC(C)OC(=O)N[C@@H](C(C)C)C(=O)N[C@H](C)C1=CC=C(C)C=C1 NWUWYYSKZYIQAE-ZBFHGGJFSA-N 0.000 claims abstract description 15
- 239000005814 Pencycuron Substances 0.000 claims abstract description 14
- 239000005837 Spiroxamine Substances 0.000 claims abstract description 14
- 239000005843 Thiram Substances 0.000 claims abstract description 14
- QTYCMDBMOLSEAM-UHFFFAOYSA-N ipconazole Chemical compound C1=NC=NN1CC1(O)C(C(C)C)CCC1CC1=CC=C(Cl)C=C1 QTYCMDBMOLSEAM-UHFFFAOYSA-N 0.000 claims abstract description 14
- 229960002447 thiram Drugs 0.000 claims abstract description 14
- PPDBOQMNKNNODG-NTEUORMPSA-N (5E)-5-(4-chlorobenzylidene)-2,2-dimethyl-1-(1,2,4-triazol-1-ylmethyl)cyclopentanol Chemical compound C1=NC=NN1CC1(O)C(C)(C)CC\C1=C/C1=CC=C(Cl)C=C1 PPDBOQMNKNNODG-NTEUORMPSA-N 0.000 claims abstract description 13
- 239000005797 Iprovalicarb Substances 0.000 claims abstract description 13
- OBZIQQJJIKNWNO-UHFFFAOYSA-N tolclofos-methyl Chemical compound COP(=S)(OC)OC1=C(Cl)C=C(C)C=C1Cl OBZIQQJJIKNWNO-UHFFFAOYSA-N 0.000 claims abstract description 13
- PCCSBWNGDMYFCW-UHFFFAOYSA-N 5-methyl-5-(4-phenoxyphenyl)-3-(phenylamino)-1,3-oxazolidine-2,4-dione Chemical compound O=C1C(C)(C=2C=CC(OC=3C=CC=CC=3)=CC=2)OC(=O)N1NC1=CC=CC=C1 PCCSBWNGDMYFCW-UHFFFAOYSA-N 0.000 claims abstract description 12
- 239000005727 Amisulbrom Substances 0.000 claims abstract description 12
- 239000005784 Fluoxastrobin Substances 0.000 claims abstract description 12
- 239000005808 Metalaxyl-M Substances 0.000 claims abstract description 12
- WFDXOXNFNRHQEC-GHRIWEEISA-N azoxystrobin Chemical compound CO\C=C(\C(=O)OC)C1=CC=CC=C1OC1=CC(OC=2C(=CC=CC=2)C#N)=NC=N1 WFDXOXNFNRHQEC-GHRIWEEISA-N 0.000 claims abstract description 12
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 claims abstract description 12
- YKSNLCVSTHTHJA-UHFFFAOYSA-L maneb Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S YKSNLCVSTHTHJA-UHFFFAOYSA-L 0.000 claims abstract description 12
- UWVQIROCRJWDKL-UHFFFAOYSA-N oxadixyl Chemical compound CC=1C=CC=C(C)C=1N(C(=O)COC)N1CCOC1=O UWVQIROCRJWDKL-UHFFFAOYSA-N 0.000 claims abstract description 12
- IQGKIPDJXCAMSM-UHFFFAOYSA-N triazoxide Chemical compound N=1C2=CC=C(Cl)C=C2[N+]([O-])=NC=1N1C=CN=C1 IQGKIPDJXCAMSM-UHFFFAOYSA-N 0.000 claims abstract description 12
- XERJKGMBORTKEO-VZUCSPMQSA-N (1e)-2-(ethylcarbamoylamino)-n-methoxy-2-oxoethanimidoyl cyanide Chemical compound CCNC(=O)NC(=O)C(\C#N)=N\OC XERJKGMBORTKEO-VZUCSPMQSA-N 0.000 claims abstract description 11
- VGPIBGGRCVEHQZ-UHFFFAOYSA-N 1-(biphenyl-4-yloxy)-3,3-dimethyl-1-(1,2,4-triazol-1-yl)butan-2-ol Chemical compound C1=NC=NN1C(C(O)C(C)(C)C)OC(C=C1)=CC=C1C1=CC=CC=C1 VGPIBGGRCVEHQZ-UHFFFAOYSA-N 0.000 claims abstract description 11
- PFFIDZXUXFLSSR-UHFFFAOYSA-N 1-methyl-N-[2-(4-methylpentan-2-yl)-3-thienyl]-3-(trifluoromethyl)pyrazole-4-carboxamide Chemical compound S1C=CC(NC(=O)C=2C(=NN(C)C=2)C(F)(F)F)=C1C(C)CC(C)C PFFIDZXUXFLSSR-UHFFFAOYSA-N 0.000 claims abstract description 11
- ASMNSUBMNZQTTG-UHFFFAOYSA-N 5-chloro-7-(4-methylpiperidin-1-yl)-6-(2,4,6-trifluorophenyl)-[1,2,4]triazolo[1,5-a]pyrimidine Chemical compound C1CC(C)CCN1C1=C(C=2C(=CC(F)=CC=2F)F)C(Cl)=NC2=NC=NN12 ASMNSUBMNZQTTG-UHFFFAOYSA-N 0.000 claims abstract description 11
- 239000005730 Azoxystrobin Substances 0.000 claims abstract description 11
- 239000005738 Bixafen Substances 0.000 claims abstract description 11
- 239000005796 Ipconazole Substances 0.000 claims abstract description 11
- 239000005820 Prochloraz Substances 0.000 claims abstract description 11
- 239000005859 Triticonazole Substances 0.000 claims abstract description 11
- CJPQIRJHIZUAQP-MRXNPFEDSA-N benalaxyl-M Chemical compound CC=1C=CC=C(C)C=1N([C@H](C)C(=O)OC)C(=O)CC1=CC=CC=C1 CJPQIRJHIZUAQP-MRXNPFEDSA-N 0.000 claims abstract description 11
- WURGXGVFSMYFCG-UHFFFAOYSA-N dichlofluanid Chemical compound CN(C)S(=O)(=O)N(SC(F)(Cl)Cl)C1=CC=CC=C1 WURGXGVFSMYFCG-UHFFFAOYSA-N 0.000 claims abstract description 11
- VDLGAVXLJYLFDH-UHFFFAOYSA-N fenhexamid Chemical compound C=1C=C(O)C(Cl)=C(Cl)C=1NC(=O)C1(C)CCCCC1 VDLGAVXLJYLFDH-UHFFFAOYSA-N 0.000 claims abstract description 11
- UZCGKGPEKUCDTF-UHFFFAOYSA-N fluazinam Chemical compound [O-][N+](=O)C1=CC(C(F)(F)F)=C(Cl)C([N+]([O-])=O)=C1NC1=NC=C(C(F)(F)F)C=C1Cl UZCGKGPEKUCDTF-UHFFFAOYSA-N 0.000 claims abstract description 11
- GBOYJIHYACSLGN-UHFFFAOYSA-N fluopicolide Chemical compound ClC1=CC(C(F)(F)F)=CN=C1CNC(=O)C1=C(Cl)C=CC=C1Cl GBOYJIHYACSLGN-UHFFFAOYSA-N 0.000 claims abstract description 11
- PTCGDEVVHUXTMP-UHFFFAOYSA-N flutolanil Chemical compound CC(C)OC1=CC=CC(NC(=O)C=2C(=CC=CC=2)C(F)(F)F)=C1 PTCGDEVVHUXTMP-UHFFFAOYSA-N 0.000 claims abstract description 11
- TVLSRXXIMLFWEO-UHFFFAOYSA-N prochloraz Chemical compound C1=CN=CN1C(=O)N(CCC)CCOC1=C(Cl)C=C(Cl)C=C1Cl TVLSRXXIMLFWEO-UHFFFAOYSA-N 0.000 claims abstract description 11
- VPWGKZJMAGHQMR-OVVQPSECSA-N (2e)-2-[2-[6-(3-chloro-2-methylphenoxy)-5-fluoropyrimidin-4-yl]oxyphenyl]-2-methoxyimino-n-methylacetamide Chemical compound CNC(=O)C(=N\OC)\C1=CC=CC=C1OC1=NC=NC(OC=2C(=C(Cl)C=CC=2)C)=C1F VPWGKZJMAGHQMR-OVVQPSECSA-N 0.000 claims abstract description 10
- LDVVMCZRFWMZSG-OLQVQODUSA-N (3ar,7as)-2-(trichloromethylsulfanyl)-3a,4,7,7a-tetrahydroisoindole-1,3-dione Chemical compound C1C=CC[C@H]2C(=O)N(SC(Cl)(Cl)Cl)C(=O)[C@H]21 LDVVMCZRFWMZSG-OLQVQODUSA-N 0.000 claims abstract description 10
- YIKWKLYQRFRGPM-UHFFFAOYSA-N 1-dodecylguanidine acetate Chemical compound CC(O)=O.CCCCCCCCCCCCN=C(N)N YIKWKLYQRFRGPM-UHFFFAOYSA-N 0.000 claims abstract description 10
- FKWDSATZSMJRLC-UHFFFAOYSA-N Iminoctadine acetate Chemical compound CC([O-])=O.CC([O-])=O.CC([O-])=O.NC([NH3+])=NCCCCCCCC[NH2+]CCCCCCCCN=C(N)[NH3+] FKWDSATZSMJRLC-UHFFFAOYSA-N 0.000 claims abstract description 10
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical compound OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 claims abstract description 10
- 239000005847 Triazoxide Substances 0.000 claims abstract description 10
- VVSLYIKSEBPRSN-PELKAZGASA-N benthiavalicarb Chemical compound C1=C(F)C=C2SC([C@@H](C)NC(=O)[C@@H](NC(O)=O)C(C)C)=NC2=C1 VVSLYIKSEBPRSN-PELKAZGASA-N 0.000 claims abstract description 10
- CRQQGFGUEAVUIL-UHFFFAOYSA-N chlorothalonil Chemical compound ClC1=C(Cl)C(C#N)=C(Cl)C(C#N)=C1Cl CRQQGFGUEAVUIL-UHFFFAOYSA-N 0.000 claims abstract description 10
- RONFGUROBZGJKP-UHFFFAOYSA-N iminoctadine Chemical compound NC(N)=NCCCCCCCCNCCCCCCCCN=C(N)N RONFGUROBZGJKP-UHFFFAOYSA-N 0.000 claims abstract description 10
- ZLIBICFPKPWGIZ-UHFFFAOYSA-N pyrimethanil Chemical compound CC1=CC(C)=NC(NC=2C=CC=CC=2)=N1 ZLIBICFPKPWGIZ-UHFFFAOYSA-N 0.000 claims abstract description 10
- QGHREAKMXXNCOA-UHFFFAOYSA-N thiophanate-methyl Chemical compound COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC QGHREAKMXXNCOA-UHFFFAOYSA-N 0.000 claims abstract description 10
- ZQMRDENWZKMOTM-UHFFFAOYSA-N 2-butoxy-6-iodo-3-propylchromen-4-one Chemical compound C1=C(I)C=C2C(=O)C(CCC)=C(OCCCC)OC2=C1 ZQMRDENWZKMOTM-UHFFFAOYSA-N 0.000 claims abstract description 9
- BMEIGUQCIYLQRT-UHFFFAOYSA-N 2-chloro-4-[(2-fluoro-2-methylpropanoyl)amino]-n,n-dimethylbenzamide Chemical compound CN(C)C(=O)C1=CC=C(NC(=O)C(C)(C)F)C=C1Cl BMEIGUQCIYLQRT-UHFFFAOYSA-N 0.000 claims abstract description 9
- BMVBXRJVLUMWNN-MRVPVSSYSA-N 5-chloro-n-[(2r)-3-methylbutan-2-yl]-6-(2,4,6-trifluorophenyl)-[1,2,4]triazolo[1,5-a]pyrimidin-7-amine Chemical compound ClC1=NC2=NC=NN2C(N[C@H](C)C(C)C)=C1C1=C(F)C=C(F)C=C1F BMVBXRJVLUMWNN-MRVPVSSYSA-N 0.000 claims abstract description 9
- NUTKUZBTFOZHPW-UHFFFAOYSA-N 6-iodo-2-propoxy-3-propylchromen-4-one Chemical compound C1=C(I)C=C2C(=O)C(CCC)=C(OCCC)OC2=C1 NUTKUZBTFOZHPW-UHFFFAOYSA-N 0.000 claims abstract description 9
- 239000005964 Acibenzolar-S-methyl Substances 0.000 claims abstract description 9
- 239000005735 Benalaxyl-M Substances 0.000 claims abstract description 9
- 239000005747 Chlorothalonil Substances 0.000 claims abstract description 9
- 239000005756 Cymoxanil Substances 0.000 claims abstract description 9
- 239000005772 Famoxadone Substances 0.000 claims abstract description 9
- 239000005780 Fluazinam Substances 0.000 claims abstract description 9
- 239000005782 Fluopicolide Substances 0.000 claims abstract description 9
- 239000005785 Fluquinconazole Substances 0.000 claims abstract description 9
- 239000005786 Flutolanil Substances 0.000 claims abstract description 9
- 239000005790 Fosetyl Substances 0.000 claims abstract description 9
- 239000005816 Penthiopyrad Substances 0.000 claims abstract description 9
- 239000005828 Pyrimethanil Substances 0.000 claims abstract description 9
- 239000005845 Tolclofos-methyl Substances 0.000 claims abstract description 9
- UELITFHSCLAHKR-UHFFFAOYSA-N acibenzolar-S-methyl Chemical group CSC(=O)C1=CC=CC2=C1SN=N2 UELITFHSCLAHKR-UHFFFAOYSA-N 0.000 claims abstract description 9
- 239000006013 carbendazim Substances 0.000 claims abstract description 9
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 claims abstract description 9
- WXUZAHCNPWONDH-DYTRJAOYSA-N dimoxystrobin Chemical compound CNC(=O)C(=N\OC)\C1=CC=CC=C1COC1=CC(C)=CC=C1C WXUZAHCNPWONDH-DYTRJAOYSA-N 0.000 claims abstract description 9
- HKIOYBQGHSTUDB-UHFFFAOYSA-N folpet Chemical compound C1=CC=C2C(=O)N(SC(Cl)(Cl)Cl)C(=O)C2=C1 HKIOYBQGHSTUDB-UHFFFAOYSA-N 0.000 claims abstract description 9
- RYAUSSKQMZRMAI-ALOPSCKCSA-N (2S,6R)-4-[3-(4-tert-butylphenyl)-2-methylpropyl]-2,6-dimethylmorpholine Chemical compound C=1C=C(C(C)(C)C)C=CC=1CC(C)CN1C[C@H](C)O[C@H](C)C1 RYAUSSKQMZRMAI-ALOPSCKCSA-N 0.000 claims abstract description 8
- LQDARGUHUSPFNL-UHFFFAOYSA-N 1-[2-(2,4-dichlorophenyl)-3-(1,1,2,2-tetrafluoroethoxy)propyl]1,2,4-triazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(COC(F)(F)C(F)F)CN1C=NC=N1 LQDARGUHUSPFNL-UHFFFAOYSA-N 0.000 claims abstract description 8
- WKBPZYKAUNRMKP-UHFFFAOYSA-N 1-[2-(2,4-dichlorophenyl)pentyl]1,2,4-triazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(CCC)CN1C=NC=N1 WKBPZYKAUNRMKP-UHFFFAOYSA-N 0.000 claims abstract description 8
- STMIIPIFODONDC-UHFFFAOYSA-N 2-(2,4-dichlorophenyl)-1-(1H-1,2,4-triazol-1-yl)hexan-2-ol Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(O)(CCCC)CN1C=NC=N1 STMIIPIFODONDC-UHFFFAOYSA-N 0.000 claims abstract description 8
- HZJKXKUJVSEEFU-UHFFFAOYSA-N 2-(4-chlorophenyl)-2-(1H-1,2,4-triazol-1-ylmethyl)hexanenitrile Chemical compound C=1C=C(Cl)C=CC=1C(CCCC)(C#N)CN1C=NC=N1 HZJKXKUJVSEEFU-UHFFFAOYSA-N 0.000 claims abstract description 8
- UFNOUKDBUJZYDE-UHFFFAOYSA-N 2-(4-chlorophenyl)-3-cyclopropyl-1-(1H-1,2,4-triazol-1-yl)butan-2-ol Chemical compound C1=NC=NN1CC(O)(C=1C=CC(Cl)=CC=1)C(C)C1CC1 UFNOUKDBUJZYDE-UHFFFAOYSA-N 0.000 claims abstract description 8
- GKVQZPHJTZNANS-UHFFFAOYSA-N 2-ethoxy-6-iodo-3-propylchromen-4-one Chemical compound C1=C(I)C=C2C(=O)C(CCC)=C(OCC)OC2=C1 GKVQZPHJTZNANS-UHFFFAOYSA-N 0.000 claims abstract description 8
- SOUGWDPPRBKJEX-UHFFFAOYSA-N 3,5-dichloro-N-(1-chloro-3-methyl-2-oxopentan-3-yl)-4-methylbenzamide Chemical compound ClCC(=O)C(C)(CC)NC(=O)C1=CC(Cl)=C(C)C(Cl)=C1 SOUGWDPPRBKJEX-UHFFFAOYSA-N 0.000 claims abstract description 8
- MGSIJDCPNJZOHF-YFKPBYRVSA-N 5-chloro-6-(2,4,6-trifluorophenyl)-n-[(2s)-1,1,1-trifluoropropan-2-yl]-[1,2,4]triazolo[1,5-a]pyrimidin-7-amine Chemical compound ClC1=NC2=NC=NN2C(N[C@@H](C)C(F)(F)F)=C1C1=C(F)C=C(F)C=C1F MGSIJDCPNJZOHF-YFKPBYRVSA-N 0.000 claims abstract description 8
- ITBSXCCVPWUAHO-DHRITJCHSA-N 5-methoxy-2-methyl-4-[2-[[(e)-1-[3-(trifluoromethyl)phenyl]ethylideneamino]oxymethyl]phenyl]-1,2,4-triazol-3-one Chemical compound COC1=NN(C)C(=O)N1C1=CC=CC=C1CO\N=C(/C)C1=CC=CC(C(F)(F)F)=C1 ITBSXCCVPWUAHO-DHRITJCHSA-N 0.000 claims abstract description 8
- 239000005736 Benthiavalicarb Substances 0.000 claims abstract description 8
- 239000005745 Captan Substances 0.000 claims abstract description 8
- 239000005766 Dodine Substances 0.000 claims abstract description 8
- 239000005789 Folpet Substances 0.000 claims abstract description 8
- 239000005802 Mancozeb Substances 0.000 claims abstract description 8
- MKIMSXGUTQTKJU-UHFFFAOYSA-N Propamocarb hydrochloride Chemical compound [Cl-].CCCOC(=O)NCCC[NH+](C)C MKIMSXGUTQTKJU-UHFFFAOYSA-N 0.000 claims abstract description 8
- 239000005842 Thiophanate-methyl Substances 0.000 claims abstract description 8
- 239000011717 all-trans-retinol Substances 0.000 claims abstract description 8
- 235000019169 all-trans-retinol Nutrition 0.000 claims abstract description 8
- WYEMLYFITZORAB-UHFFFAOYSA-N boscalid Chemical compound C1=CC(Cl)=CC=C1C1=CC=CC=C1NC(=O)C1=CC=CN=C1Cl WYEMLYFITZORAB-UHFFFAOYSA-N 0.000 claims abstract description 8
- 229940117949 captan Drugs 0.000 claims abstract description 8
- HKMOPYJWSFRURD-UHFFFAOYSA-N chloro hypochlorite;copper Chemical compound [Cu].ClOCl HKMOPYJWSFRURD-UHFFFAOYSA-N 0.000 claims abstract description 8
- HAORKNGNJCEJBX-UHFFFAOYSA-N cyprodinil Chemical compound N=1C(C)=CC(C2CC2)=NC=1NC1=CC=CC=C1 HAORKNGNJCEJBX-UHFFFAOYSA-N 0.000 claims abstract description 8
- BQYJATMQXGBDHF-UHFFFAOYSA-N difenoconazole Chemical compound O1C(C)COC1(C=1C(=CC(OC=2C=CC(Cl)=CC=2)=CC=1)Cl)CN1N=CN=C1 BQYJATMQXGBDHF-UHFFFAOYSA-N 0.000 claims abstract description 8
- 229920000940 maneb Polymers 0.000 claims abstract description 8
- CIFWZNRJIBNXRE-UHFFFAOYSA-N mepanipyrim Chemical compound CC#CC1=CC(C)=NC(NC=2C=CC=CC=2)=N1 CIFWZNRJIBNXRE-UHFFFAOYSA-N 0.000 claims abstract description 8
- XWPZUHJBOLQNMN-UHFFFAOYSA-N metconazole Chemical compound C1=NC=NN1CC1(O)C(C)(C)CCC1CC1=CC=C(Cl)C=C1 XWPZUHJBOLQNMN-UHFFFAOYSA-N 0.000 claims abstract description 8
- CJPQIRJHIZUAQP-UHFFFAOYSA-N methyl N-(2,6-dimethylphenyl)-N-(phenylacetyl)alaninate Chemical compound CC=1C=CC=C(C)C=1N(C(C)C(=O)OC)C(=O)CC1=CC=CC=C1 CJPQIRJHIZUAQP-UHFFFAOYSA-N 0.000 claims abstract description 8
- CIEXPHRYOLIQQD-UHFFFAOYSA-N methyl N-(2,6-dimethylphenyl)-N-2-furoylalaninate Chemical compound CC=1C=CC=C(C)C=1N(C(C)C(=O)OC)C(=O)C1=CC=CO1 CIEXPHRYOLIQQD-UHFFFAOYSA-N 0.000 claims abstract description 8
- HIIRDDUVRXCDBN-OBGWFSINSA-N metominostrobin Chemical compound CNC(=O)C(=N\OC)\C1=CC=CC=C1OC1=CC=CC=C1 HIIRDDUVRXCDBN-OBGWFSINSA-N 0.000 claims abstract description 8
- STJLVHWMYQXCPB-UHFFFAOYSA-N propiconazole Chemical compound O1C(CCC)COC1(C=1C(=CC(Cl)=CC=1)Cl)CN1N=CN=C1 STJLVHWMYQXCPB-UHFFFAOYSA-N 0.000 claims abstract description 8
- QNBTYORWCCMPQP-JXAWBTAJSA-N (Z)-dimethomorph Chemical compound C1=C(OC)C(OC)=CC=C1C(\C=1C=CC(Cl)=CC=1)=C/C(=O)N1CCOCC1 QNBTYORWCCMPQP-JXAWBTAJSA-N 0.000 claims abstract description 7
- RQDJADAKIFFEKQ-UHFFFAOYSA-N 4-(4-chlorophenyl)-2-phenyl-2-(1,2,4-triazol-1-ylmethyl)butanenitrile Chemical compound C1=CC(Cl)=CC=C1CCC(C=1C=CC=CC=1)(C#N)CN1N=CN=C1 RQDJADAKIFFEKQ-UHFFFAOYSA-N 0.000 claims abstract description 7
- NQRFDNJEBWAUBL-UHFFFAOYSA-N N-[cyano(2-thienyl)methyl]-4-ethyl-2-(ethylamino)-1,3-thiazole-5-carboxamide Chemical compound S1C(NCC)=NC(CC)=C1C(=O)NC(C#N)C1=CC=CS1 NQRFDNJEBWAUBL-UHFFFAOYSA-N 0.000 claims abstract description 7
- NOTMCFVPRDIUAV-UHFFFAOYSA-N n-[2-(4-bromophenyl)phenyl]-4-(difluoromethyl)-2-methyl-1,3-thiazole-5-carboxamide Chemical compound S1C(C)=NC(C(F)F)=C1C(=O)NC1=CC=CC=C1C1=CC=C(Br)C=C1 NOTMCFVPRDIUAV-UHFFFAOYSA-N 0.000 claims abstract description 7
- IBSNKSODLGJUMQ-SDNWHVSQSA-N picoxystrobin Chemical compound CO\C=C(\C(=O)OC)C1=CC=CC=C1COC1=CC=CC(C(F)(F)F)=N1 IBSNKSODLGJUMQ-SDNWHVSQSA-N 0.000 claims abstract description 7
- QXJKBPAVAHBARF-BETUJISGSA-N procymidone Chemical compound O=C([C@]1(C)C[C@@]1(C1=O)C)N1C1=CC(Cl)=CC(Cl)=C1 QXJKBPAVAHBARF-BETUJISGSA-N 0.000 claims abstract description 7
- HZRSNVGNWUDEFX-UHFFFAOYSA-N pyraclostrobin Chemical compound COC(=O)N(OC)C1=CC=CC=C1COC1=NN(C=2C=CC(Cl)=CC=2)C=C1 HZRSNVGNWUDEFX-UHFFFAOYSA-N 0.000 claims abstract description 7
- BKBSMMUEEAWFRX-NBVRZTHBSA-N (E)-flumorph Chemical compound C1=C(OC)C(OC)=CC=C1C(\C=1C=CC(F)=CC=1)=C\C(=O)N1CCOCC1 BKBSMMUEEAWFRX-NBVRZTHBSA-N 0.000 claims abstract description 6
- WURBVZBTWMNKQT-UHFFFAOYSA-N 1-(4-chlorophenoxy)-3,3-dimethyl-1-(1,2,4-triazol-1-yl)butan-2-one Chemical compound C1=NC=NN1C(C(=O)C(C)(C)C)OC1=CC=C(Cl)C=C1 WURBVZBTWMNKQT-UHFFFAOYSA-N 0.000 claims abstract description 6
- GZNCWLFUAXRBFQ-UHFFFAOYSA-N 1-methyl-n-[2-(4-methylpentan-2-yl)phenyl]-4-(trifluoromethyl)pyrrole-3-carboxamide Chemical compound CC(C)CC(C)C1=CC=CC=C1NC(=O)C1=CN(C)C=C1C(F)(F)F GZNCWLFUAXRBFQ-UHFFFAOYSA-N 0.000 claims abstract description 6
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 claims abstract description 6
- 239000005734 Benalaxyl Substances 0.000 claims abstract description 6
- 239000005740 Boscalid Substances 0.000 claims abstract description 6
- 239000005752 Copper oxychloride Substances 0.000 claims abstract description 6
- 239000005757 Cyproconazole Substances 0.000 claims abstract description 6
- 239000005758 Cyprodinil Substances 0.000 claims abstract description 6
- 239000005760 Difenoconazole Substances 0.000 claims abstract description 6
- 239000005761 Dimethomorph Substances 0.000 claims abstract description 6
- 239000005762 Dimoxystrobin Substances 0.000 claims abstract description 6
- 239000005775 Fenbuconazole Substances 0.000 claims abstract description 6
- 239000005778 Fenpropimorph Substances 0.000 claims abstract description 6
- 239000005805 Mepanipyrim Substances 0.000 claims abstract description 6
- 239000005868 Metconazole Substances 0.000 claims abstract description 6
- 239000005811 Myclobutanil Substances 0.000 claims abstract description 6
- 239000005813 Penconazole Substances 0.000 claims abstract description 6
- 239000005818 Picoxystrobin Substances 0.000 claims abstract description 6
- 239000005822 Propiconazole Substances 0.000 claims abstract description 6
- 239000005869 Pyraclostrobin Substances 0.000 claims abstract description 6
- 239000005840 Tetraconazole Substances 0.000 claims abstract description 6
- 239000005863 Zoxamide Substances 0.000 claims abstract description 6
- 229940118790 boscalid Drugs 0.000 claims abstract description 6
- JHPLCHZJZZSZGU-KIBLKLHPSA-N n-[2-[3-fluoro-4-[(e)-methoxyiminomethyl]phenyl]phenyl]-1-methyl-3-(trifluoromethyl)pyrazole-4-carboxamide Chemical compound C1=C(F)C(/C=N/OC)=CC=C1C1=CC=CC=C1NC(=O)C1=CN(C)N=C1C(F)(F)F JHPLCHZJZZSZGU-KIBLKLHPSA-N 0.000 claims abstract description 6
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 claims abstract description 4
- JNPZQRQPIHJYNM-UHFFFAOYSA-N carbendazim Chemical compound C1=C[CH]C2=NC(NC(=O)OC)=NC2=C1 JNPZQRQPIHJYNM-UHFFFAOYSA-N 0.000 claims abstract 4
- 239000004480 active ingredient Substances 0.000 claims description 57
- 241000233866 Fungi Species 0.000 claims description 29
- 238000000034 method Methods 0.000 claims description 23
- 230000003032 phytopathogenic effect Effects 0.000 claims description 21
- 241001465754 Metazoa Species 0.000 claims description 18
- 241000607479 Yersinia pestis Species 0.000 claims description 18
- 230000009261 transgenic effect Effects 0.000 claims description 18
- 238000002156 mixing Methods 0.000 claims description 11
- RXDMAYSSBPYBFW-UHFFFAOYSA-N carpropamid Chemical compound C=1C=C(Cl)C=CC=1C(C)NC(=O)C1(CC)C(C)C1(Cl)Cl RXDMAYSSBPYBFW-UHFFFAOYSA-N 0.000 claims description 7
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims description 3
- FICAQKBMCKEFDI-UHFFFAOYSA-N 3,5-dimethyl-1,2-oxazole Chemical compound CC=1C=C(C)ON=1 FICAQKBMCKEFDI-UHFFFAOYSA-N 0.000 claims 1
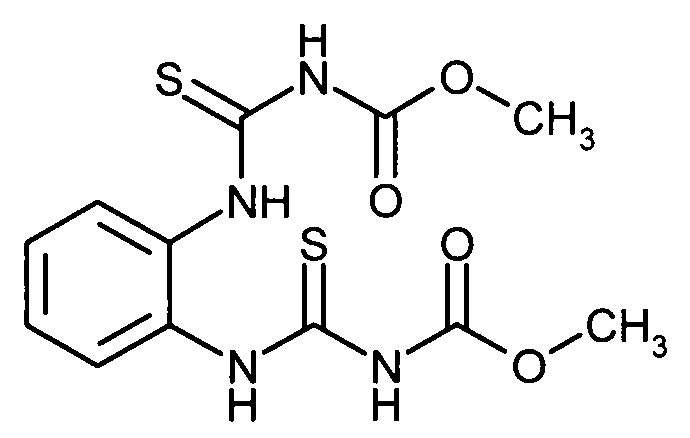
- RXDMAYSSBPYBFW-PKFCDNJMSA-N carpropamide Chemical compound N([C@@H](C)C=1C=CC(Cl)=CC=1)C(=O)[C@@]1(CC)[C@H](C)C1(Cl)Cl RXDMAYSSBPYBFW-PKFCDNJMSA-N 0.000 abstract description 16
- LNJNFVJKDJYTEU-UHFFFAOYSA-N diethofencarb Chemical compound CCOC1=CC=C(NC(=O)OC(C)C)C=C1OCC LNJNFVJKDJYTEU-UHFFFAOYSA-N 0.000 abstract description 6
- 239000005759 Diethofencarb Substances 0.000 abstract description 5
- ZHQZDQULYDJQBU-UHFFFAOYSA-N 6-chloro-7-[(3,5-dimethyl-1,2-oxazol-4-yl)sulfonyl]-2,2-difluoro-[1,3]dioxolo[4,5-f]benzimidazole Chemical compound CC1=NOC(C)=C1S(=O)(=O)N1C2=CC(OC(F)(F)O3)=C3C=C2N=C1Cl ZHQZDQULYDJQBU-UHFFFAOYSA-N 0.000 abstract description 3
- ZVXKYWHJBYIYNI-UHFFFAOYSA-N 1h-pyrazole-4-carboxamide Chemical compound NC(=O)C=1C=NNC=1 ZVXKYWHJBYIYNI-UHFFFAOYSA-N 0.000 abstract 2
- 241000196324 Embryophyta Species 0.000 description 242
- 108090000623 proteins and genes Proteins 0.000 description 59
- 239000000203 mixture Substances 0.000 description 54
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 45
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 38
- 238000009472 formulation Methods 0.000 description 37
- 102000004169 proteins and genes Human genes 0.000 description 36
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 33
- 230000000749 insecticidal effect Effects 0.000 description 31
- 239000000460 chlorine Substances 0.000 description 28
- 229910052801 chlorine Inorganic materials 0.000 description 28
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 25
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 25
- 230000000694 effects Effects 0.000 description 24
- 239000001257 hydrogen Substances 0.000 description 23
- 229910052739 hydrogen Inorganic materials 0.000 description 23
- 241000238631 Hexapoda Species 0.000 description 22
- 239000000126 substance Substances 0.000 description 21
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 19
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 18
- 240000008042 Zea mays Species 0.000 description 18
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 18
- 239000003995 emulsifying agent Substances 0.000 description 18
- 239000000463 material Substances 0.000 description 18
- 241000193388 Bacillus thuringiensis Species 0.000 description 17
- 229940097012 bacillus thuringiensis Drugs 0.000 description 17
- 239000004009 herbicide Substances 0.000 description 17
- 201000010099 disease Diseases 0.000 description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 16
- 230000001965 increasing effect Effects 0.000 description 16
- 229910052731 fluorine Inorganic materials 0.000 description 15
- 239000011737 fluorine Substances 0.000 description 15
- 150000003839 salts Chemical class 0.000 description 15
- 238000012360 testing method Methods 0.000 description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 15
- 230000000855 fungicidal effect Effects 0.000 description 14
- 239000002904 solvent Substances 0.000 description 14
- 102000004190 Enzymes Human genes 0.000 description 13
- 108090000790 Enzymes Proteins 0.000 description 13
- 244000005700 microbiome Species 0.000 description 13
- 230000009466 transformation Effects 0.000 description 13
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 12
- 150000002431 hydrogen Chemical class 0.000 description 12
- 238000002360 preparation method Methods 0.000 description 12
- 239000002023 wood Substances 0.000 description 12
- 241000223600 Alternaria Species 0.000 description 11
- 241000813090 Rhizoctonia solani Species 0.000 description 11
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 11
- 235000005822 corn Nutrition 0.000 description 11
- 125000004093 cyano group Chemical group *C#N 0.000 description 11
- 235000013399 edible fruits Nutrition 0.000 description 11
- 230000001976 improved effect Effects 0.000 description 11
- 239000000047 product Substances 0.000 description 11
- 241000238876 Acari Species 0.000 description 10
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 10
- 229920000742 Cotton Polymers 0.000 description 10
- 241000219146 Gossypium Species 0.000 description 10
- 108700019146 Transgenes Proteins 0.000 description 10
- 230000002068 genetic effect Effects 0.000 description 10
- 240000002791 Brassica napus Species 0.000 description 9
- 239000002270 dispersing agent Substances 0.000 description 9
- 230000002363 herbicidal effect Effects 0.000 description 9
- 239000003921 oil Substances 0.000 description 9
- 235000019198 oils Nutrition 0.000 description 9
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 8
- 235000010469 Glycine max Nutrition 0.000 description 8
- 244000068988 Glycine max Species 0.000 description 8
- 241000257303 Hymenoptera Species 0.000 description 8
- 241001481703 Rhipicephalus <genus> Species 0.000 description 8
- 125000000217 alkyl group Chemical group 0.000 description 8
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 8
- 229910052794 bromium Inorganic materials 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 8
- 239000012141 concentrate Substances 0.000 description 8
- 239000000975 dye Substances 0.000 description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 8
- 239000000417 fungicide Substances 0.000 description 8
- 238000010353 genetic engineering Methods 0.000 description 8
- 239000008187 granular material Substances 0.000 description 8
- 230000035772 mutation Effects 0.000 description 8
- 108010020183 3-phosphoshikimate 1-carboxyvinyltransferase Proteins 0.000 description 7
- 241000255925 Diptera Species 0.000 description 7
- 235000004341 Gossypium herbaceum Nutrition 0.000 description 7
- 240000002024 Gossypium herbaceum Species 0.000 description 7
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 7
- 241000700605 Viruses Species 0.000 description 7
- 235000016383 Zea mays subsp huehuetenangensis Nutrition 0.000 description 7
- 150000002170 ethers Chemical class 0.000 description 7
- 239000003112 inhibitor Substances 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 235000009973 maize Nutrition 0.000 description 7
- 239000010695 polyglycol Substances 0.000 description 7
- 229920000151 polyglycol Polymers 0.000 description 7
- 241000894007 species Species 0.000 description 7
- 238000001228 spectrum Methods 0.000 description 7
- 125000003762 3,4-dimethoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C(OC([H])([H])[H])C([H])=C1* 0.000 description 6
- 241000256186 Anopheles <genus> Species 0.000 description 6
- 241000193755 Bacillus cereus Species 0.000 description 6
- 235000011301 Brassica oleracea var capitata Nutrition 0.000 description 6
- 244000178937 Brassica oleracea var. capitata Species 0.000 description 6
- 235000004977 Brassica sinapistrum Nutrition 0.000 description 6
- 241000238887 Ornithodoros Species 0.000 description 6
- 241000238675 Periplaneta americana Species 0.000 description 6
- 241001608567 Phaedon cochleariae Species 0.000 description 6
- 241001361634 Rhizoctonia Species 0.000 description 6
- 241000256248 Spodoptera Species 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 239000000853 adhesive Substances 0.000 description 6
- 230000001070 adhesive effect Effects 0.000 description 6
- 125000002877 alkyl aryl group Chemical group 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- 244000038559 crop plants Species 0.000 description 6
- IXORZMNAPKEEDV-OBDJNFEBSA-N gibberellin A3 Chemical class C([C@@]1(O)C(=C)C[C@@]2(C1)[C@H]1C(O)=O)C[C@H]2[C@]2(C=C[C@@H]3O)[C@H]1[C@]3(C)C(=O)O2 IXORZMNAPKEEDV-OBDJNFEBSA-N 0.000 description 6
- 125000001188 haloalkyl group Chemical group 0.000 description 6
- 229910052736 halogen Inorganic materials 0.000 description 6
- 150000002367 halogens Chemical class 0.000 description 6
- 229910052500 inorganic mineral Inorganic materials 0.000 description 6
- 239000002917 insecticide Substances 0.000 description 6
- 244000052769 pathogen Species 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 230000035882 stress Effects 0.000 description 6
- 239000003053 toxin Substances 0.000 description 6
- 231100000765 toxin Toxicity 0.000 description 6
- 108700012359 toxins Proteins 0.000 description 6
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 5
- CAAMSDWKXXPUJR-UHFFFAOYSA-N 3,5-dihydro-4H-imidazol-4-one Chemical compound O=C1CNC=N1 CAAMSDWKXXPUJR-UHFFFAOYSA-N 0.000 description 5
- 108010000700 Acetolactate synthase Proteins 0.000 description 5
- 241000228212 Aspergillus Species 0.000 description 5
- 241000123650 Botrytis cinerea Species 0.000 description 5
- 0 CC(C)(CCC1Cc(cc2)ccc2Cl)C1(*1N=CN=C1)O Chemical compound CC(C)(CCC1Cc(cc2)ccc2Cl)C1(*1N=CN=C1)O 0.000 description 5
- 241000254173 Coleoptera Species 0.000 description 5
- 101710151559 Crystal protein Proteins 0.000 description 5
- 239000005764 Dithianon Substances 0.000 description 5
- 239000004606 Fillers/Extenders Substances 0.000 description 5
- 241000223218 Fusarium Species 0.000 description 5
- 241001006839 Globisporangium ultimum Species 0.000 description 5
- 206010061217 Infestation Diseases 0.000 description 5
- 241000256602 Isoptera Species 0.000 description 5
- 241000500881 Lepisma Species 0.000 description 5
- 239000005810 Metrafenone Substances 0.000 description 5
- 241001123663 Penicillium expansum Species 0.000 description 5
- 239000005823 Propineb Substances 0.000 description 5
- 241000228453 Pyrenophora Species 0.000 description 5
- 241000258242 Siphonaptera Species 0.000 description 5
- 229920002472 Starch Polymers 0.000 description 5
- 239000003905 agrochemical Substances 0.000 description 5
- 125000000129 anionic group Chemical group 0.000 description 5
- 230000006378 damage Effects 0.000 description 5
- 230000007123 defense Effects 0.000 description 5
- PYZSVQVRHDXQSL-UHFFFAOYSA-N dithianon Chemical compound S1C(C#N)=C(C#N)SC2=C1C(=O)C1=CC=CC=C1C2=O PYZSVQVRHDXQSL-UHFFFAOYSA-N 0.000 description 5
- AWZOLILCOUMRDG-UHFFFAOYSA-N edifenphos Chemical compound C=1C=CC=CC=1SP(=O)(OCC)SC1=CC=CC=C1 AWZOLILCOUMRDG-UHFFFAOYSA-N 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- GOWLARCWZRESHU-AQTBWJFISA-N ferimzone Chemical compound C=1C=CC=C(C)C=1C(/C)=N\NC1=NC(C)=CC(C)=N1 GOWLARCWZRESHU-AQTBWJFISA-N 0.000 description 5
- 239000000835 fiber Substances 0.000 description 5
- 125000001153 fluoro group Chemical group F* 0.000 description 5
- PVTHJAPFENJVNC-MHRBZPPQSA-N kasugamycin Chemical compound N[C@H]1C[C@H](NC(=N)C(O)=O)[C@@H](C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)[C@@H]1O PVTHJAPFENJVNC-MHRBZPPQSA-N 0.000 description 5
- AMSPWOYQQAWRRM-UHFFFAOYSA-N metrafenone Chemical compound COC1=CC=C(Br)C(C)=C1C(=O)C1=C(C)C=C(OC)C(OC)=C1OC AMSPWOYQQAWRRM-UHFFFAOYSA-N 0.000 description 5
- 239000011707 mineral Substances 0.000 description 5
- 235000015097 nutrients Nutrition 0.000 description 5
- KKMLIVYBGSAJPM-UHFFFAOYSA-L propineb Chemical compound [Zn+2].[S-]C(=S)NC(C)CNC([S-])=S KKMLIVYBGSAJPM-UHFFFAOYSA-L 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 239000002689 soil Substances 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000007921 spray Substances 0.000 description 5
- 239000008107 starch Substances 0.000 description 5
- 235000019698 starch Nutrition 0.000 description 5
- DQJCHOQLCLEDLL-UHFFFAOYSA-N tricyclazole Chemical compound CC1=CC=CC2=C1N1C=NN=C1S2 DQJCHOQLCLEDLL-UHFFFAOYSA-N 0.000 description 5
- 239000011701 zinc Substances 0.000 description 5
- 229910052725 zinc Inorganic materials 0.000 description 5
- WNZQDUSMALZDQF-UHFFFAOYSA-N 2-benzofuran-1(3H)-one Chemical compound C1=CC=C2C(=O)OCC2=C1 WNZQDUSMALZDQF-UHFFFAOYSA-N 0.000 description 4
- FSCWZHGZWWDELK-UHFFFAOYSA-N 3-(3,5-dichlorophenyl)-5-ethenyl-5-methyl-2,4-oxazolidinedione Chemical compound O=C1C(C)(C=C)OC(=O)N1C1=CC(Cl)=CC(Cl)=C1 FSCWZHGZWWDELK-UHFFFAOYSA-N 0.000 description 4
- 241001143309 Acanthoscelides obtectus Species 0.000 description 4
- 241000238818 Acheta domesticus Species 0.000 description 4
- 241000256111 Aedes <genus> Species 0.000 description 4
- PIGFYZPCRLYGLF-UHFFFAOYSA-N Aluminum nitride Chemical compound [Al]#N PIGFYZPCRLYGLF-UHFFFAOYSA-N 0.000 description 4
- 241000238679 Amblyomma Species 0.000 description 4
- 241001427556 Anoplura Species 0.000 description 4
- 241001640910 Anthrenus Species 0.000 description 4
- 241000239223 Arachnida Species 0.000 description 4
- 241001480748 Argas Species 0.000 description 4
- 241000244186 Ascaris Species 0.000 description 4
- 241000228197 Aspergillus flavus Species 0.000 description 4
- 241000131286 Attagenus Species 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- 241000221198 Basidiomycota Species 0.000 description 4
- 241000219310 Beta vulgaris subsp. vulgaris Species 0.000 description 4
- 241001573716 Blaniulus guttulatus Species 0.000 description 4
- 241000238657 Blattella germanica Species 0.000 description 4
- 235000003899 Brassica oleracea var acephala Nutrition 0.000 description 4
- 235000001169 Brassica oleracea var oleracea Nutrition 0.000 description 4
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 4
- 241000257163 Calliphora vicina Species 0.000 description 4
- 241001098608 Ceratophyllus Species 0.000 description 4
- 241000258920 Chilopoda Species 0.000 description 4
- 241000359266 Chorioptes Species 0.000 description 4
- 241001414836 Cimex Species 0.000 description 4
- 241001600093 Coniophora Species 0.000 description 4
- 241000782774 Coniothyrium glycines Species 0.000 description 4
- 241000256054 Culex <genus> Species 0.000 description 4
- 108020004414 DNA Proteins 0.000 description 4
- 241001481695 Dermanyssus gallinae Species 0.000 description 4
- 241001124144 Dermaptera Species 0.000 description 4
- 241000238710 Dermatophagoides Species 0.000 description 4
- 241001641895 Dermestes Species 0.000 description 4
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- 241000258963 Diplopoda Species 0.000 description 4
- 241000255581 Drosophila <fruit fly, genus> Species 0.000 description 4
- 241000371383 Fannia Species 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- 241000223194 Fusarium culmorum Species 0.000 description 4
- 241000223221 Fusarium oxysporum Species 0.000 description 4
- 241000255896 Galleria mellonella Species 0.000 description 4
- 241001660203 Gasterophilus Species 0.000 description 4
- 241000248126 Geophilus Species 0.000 description 4
- 229930191978 Gibberellin Natural products 0.000 description 4
- 241000790933 Haematopinus Species 0.000 description 4
- 241000258937 Hemiptera Species 0.000 description 4
- 241001466007 Heteroptera Species 0.000 description 4
- 241001480803 Hyalomma Species 0.000 description 4
- 241000257176 Hypoderma <fly> Species 0.000 description 4
- 206010021929 Infertility male Diseases 0.000 description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical class [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 4
- 241001149911 Isopoda Species 0.000 description 4
- 241000238681 Ixodes Species 0.000 description 4
- 239000005800 Kresoxim-methyl Substances 0.000 description 4
- 241000255777 Lepidoptera Species 0.000 description 4
- 241000228457 Leptosphaeria maculans Species 0.000 description 4
- 241001113970 Linognathus Species 0.000 description 4
- 241000257162 Lucilia <blowfly> Species 0.000 description 4
- 241001177134 Lyctus Species 0.000 description 4
- 208000007466 Male Infertility Diseases 0.000 description 4
- 241000555303 Mamestra brassicae Species 0.000 description 4
- 239000005804 Mandipropamid Substances 0.000 description 4
- 239000005809 Metiram Substances 0.000 description 4
- 241000952627 Monomorium pharaonis Species 0.000 description 4
- 241000257229 Musca <genus> Species 0.000 description 4
- 208000031888 Mycoses Diseases 0.000 description 4
- 241000721621 Myzus persicae Species 0.000 description 4
- 241001671714 Nezara Species 0.000 description 4
- 241000384103 Oniscus asellus Species 0.000 description 4
- 241000233654 Oomycetes Species 0.000 description 4
- 241000238814 Orthoptera Species 0.000 description 4
- 241000517325 Pediculus Species 0.000 description 4
- 241000682645 Phakopsora pachyrhizi Species 0.000 description 4
- 235000010627 Phaseolus vulgaris Nutrition 0.000 description 4
- 244000046052 Phaseolus vulgaris Species 0.000 description 4
- 241000722350 Phlebotomus <genus> Species 0.000 description 4
- 241000233614 Phytophthora Species 0.000 description 4
- 102000012338 Poly(ADP-ribose) Polymerases Human genes 0.000 description 4
- 108010061844 Poly(ADP-ribose) Polymerases Proteins 0.000 description 4
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 description 4
- 241000908127 Porcellio scaber Species 0.000 description 4
- 241001649229 Psoroptes Species 0.000 description 4
- 241001105129 Ptinus Species 0.000 description 4
- 241001509970 Reticulitermes <genus> Species 0.000 description 4
- 241000722251 Rhodnius Species 0.000 description 4
- 241001510236 Rhyparobia maderae Species 0.000 description 4
- 241000318997 Rhyzopertha dominica Species 0.000 description 4
- 241000509416 Sarcoptes Species 0.000 description 4
- 241000221662 Sclerotinia Species 0.000 description 4
- 241000256108 Simulium <genus> Species 0.000 description 4
- 241001494139 Stomoxys Species 0.000 description 4
- 229940100389 Sulfonylurea Drugs 0.000 description 4
- 241000255626 Tabanus <genus> Species 0.000 description 4
- 241001454293 Tetranychus urticae Species 0.000 description 4
- 241001414989 Thysanoptera Species 0.000 description 4
- 241000130771 Tinea pellionella Species 0.000 description 4
- 241000333690 Tineola bisselliella Species 0.000 description 4
- 241000511627 Tipula paludosa Species 0.000 description 4
- 241001414833 Triatoma Species 0.000 description 4
- 241001259047 Trichodectes Species 0.000 description 4
- 241000609108 Wohlfahrtia Species 0.000 description 4
- 241000353223 Xenopsylla cheopis Species 0.000 description 4
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 4
- 239000005870 Ziram Substances 0.000 description 4
- 241001414985 Zygentoma Species 0.000 description 4
- 230000036579 abiotic stress Effects 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 150000001298 alcohols Chemical class 0.000 description 4
- 150000001413 amino acids Chemical class 0.000 description 4
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 4
- JHRWWRDRBPCWTF-OLQVQODUSA-N captafol Chemical compound C1C=CC[C@H]2C(=O)N(SC(Cl)(Cl)C(Cl)Cl)C(=O)[C@H]21 JHRWWRDRBPCWTF-OLQVQODUSA-N 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 235000013339 cereals Nutrition 0.000 description 4
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 4
- 230000012173 estrus Effects 0.000 description 4
- FQKUGOMFVDPBIZ-UHFFFAOYSA-N flusilazole Chemical compound C=1C=C(F)C=CC=1[Si](C=1C=CC(F)=CC=1)(C)CN1C=NC=N1 FQKUGOMFVDPBIZ-UHFFFAOYSA-N 0.000 description 4
- 239000006260 foam Substances 0.000 description 4
- 125000002541 furyl group Chemical group 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 239000003448 gibberellin Substances 0.000 description 4
- XDDAORKBJWWYJS-UHFFFAOYSA-N glyphosate Chemical compound OC(=O)CNCP(O)(O)=O XDDAORKBJWWYJS-UHFFFAOYSA-N 0.000 description 4
- IGMNYECMUMZDDF-UHFFFAOYSA-N homogentisic acid Chemical compound OC(=O)CC1=CC(O)=CC=C1O IGMNYECMUMZDDF-UHFFFAOYSA-N 0.000 description 4
- UFHLMYOGRXOCSL-UHFFFAOYSA-N isoprothiolane Chemical compound CC(C)OC(=O)C(C(=O)OC(C)C)=C1SCCS1 UFHLMYOGRXOCSL-UHFFFAOYSA-N 0.000 description 4
- ZOTBXTZVPHCKPN-HTXNQAPBSA-N kresoxim-methyl Chemical compound CO\N=C(\C(=O)OC)C1=CC=CC=C1COC1=CC=CC=C1C ZOTBXTZVPHCKPN-HTXNQAPBSA-N 0.000 description 4
- 239000010985 leather Substances 0.000 description 4
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 4
- 229920000257 metiram Polymers 0.000 description 4
- 125000000449 nitro group Chemical class [O-][N+](*)=O 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 239000000123 paper Substances 0.000 description 4
- WBTYBAGIHOISOQ-UHFFFAOYSA-N pent-4-en-1-yl 2-[(2-furylmethyl)(imidazol-1-ylcarbonyl)amino]butanoate Chemical compound C1=CN=CN1C(=O)N(C(CC)C(=O)OCCCC=C)CC1=CC=CO1 WBTYBAGIHOISOQ-UHFFFAOYSA-N 0.000 description 4
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 4
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 4
- 238000003860 storage Methods 0.000 description 4
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 4
- YFNCATAIYKQPOO-UHFFFAOYSA-N thiophanate Chemical group CCOC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OCC YFNCATAIYKQPOO-UHFFFAOYSA-N 0.000 description 4
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 4
- 235000013311 vegetables Nutrition 0.000 description 4
- 230000017260 vegetative to reproductive phase transition of meristem Effects 0.000 description 4
- DUBNHZYBDBBJHD-UHFFFAOYSA-L ziram Chemical compound [Zn+2].CN(C)C([S-])=S.CN(C)C([S-])=S DUBNHZYBDBBJHD-UHFFFAOYSA-L 0.000 description 4
- XODZOJBRMYSETR-UHFFFAOYSA-N 2,3-dibutyl-6-chlorothieno[2,3-d]pyrimidin-4-one Chemical compound O=C1N(CCCC)C(CCCC)=NC2=C1C=C(Cl)S2 XODZOJBRMYSETR-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 229920000856 Amylose Polymers 0.000 description 3
- 241000411449 Anobium punctatum Species 0.000 description 3
- 241000239290 Araneae Species 0.000 description 3
- 241000235349 Ascomycota Species 0.000 description 3
- 241000228245 Aspergillus niger Species 0.000 description 3
- 235000016068 Berberis vulgaris Nutrition 0.000 description 3
- 241000335053 Beta vulgaris Species 0.000 description 3
- 241000238662 Blatta orientalis Species 0.000 description 3
- 241001465180 Botrytis Species 0.000 description 3
- 241000219198 Brassica Species 0.000 description 3
- 235000011303 Brassica alboglabra Nutrition 0.000 description 3
- 235000006008 Brassica napus var napus Nutrition 0.000 description 3
- 240000007124 Brassica oleracea Species 0.000 description 3
- 235000011302 Brassica oleracea Nutrition 0.000 description 3
- 241001157813 Cercospora Species 0.000 description 3
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 3
- 241000760356 Chytridiomycetes Species 0.000 description 3
- 241000222290 Cladosporium Species 0.000 description 3
- 241000222199 Colletotrichum Species 0.000 description 3
- 241001529717 Corticium <basidiomycota> Species 0.000 description 3
- 239000005754 Cyazofamid Substances 0.000 description 3
- 241000221785 Erysiphales Species 0.000 description 3
- 239000005776 Fenhexamid Substances 0.000 description 3
- 241000461774 Gloeosporium Species 0.000 description 3
- 239000005562 Glyphosate Substances 0.000 description 3
- 244000020551 Helianthus annuus Species 0.000 description 3
- 235000003222 Helianthus annuus Nutrition 0.000 description 3
- 241000832180 Hylotrupes bajulus Species 0.000 description 3
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 229920000881 Modified starch Polymers 0.000 description 3
- 239000004368 Modified starch Substances 0.000 description 3
- 241000244206 Nematoda Species 0.000 description 3
- 240000007594 Oryza sativa Species 0.000 description 3
- 235000007164 Oryza sativa Nutrition 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 241000228143 Penicillium Species 0.000 description 3
- 241001674048 Phthiraptera Species 0.000 description 3
- 241000233622 Phytophthora infestans Species 0.000 description 3
- 241001503460 Plasmodiophorida Species 0.000 description 3
- 241001281803 Plasmopara viticola Species 0.000 description 3
- 241000589516 Pseudomonas Species 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- 241000233639 Pythium Species 0.000 description 3
- 241000221696 Sclerotinia sclerotiorum Species 0.000 description 3
- 240000003768 Solanum lycopersicum Species 0.000 description 3
- 235000002595 Solanum tuberosum Nutrition 0.000 description 3
- 244000061456 Solanum tuberosum Species 0.000 description 3
- 241000256251 Spodoptera frugiperda Species 0.000 description 3
- 235000021536 Sugar beet Nutrition 0.000 description 3
- 241000561282 Thielaviopsis basicola Species 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 235000021307 Triticum Nutrition 0.000 description 3
- 244000098338 Triticum aestivum Species 0.000 description 3
- 102000005421 acetyltransferase Human genes 0.000 description 3
- 108020002494 acetyltransferase Proteins 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 230000000844 anti-bacterial effect Effects 0.000 description 3
- 239000003899 bactericide agent Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 238000009395 breeding Methods 0.000 description 3
- 230000001488 breeding effect Effects 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- YXKMMRDKEKCERS-UHFFFAOYSA-N cyazofamid Chemical compound CN(C)S(=O)(=O)N1C(C#N)=NC(Cl)=C1C1=CC=C(C)C=C1 YXKMMRDKEKCERS-UHFFFAOYSA-N 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 125000006576 di-(C1-C3-alkyl)-aminocarbonyl group Chemical group 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 238000007598 dipping method Methods 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 230000035558 fertility Effects 0.000 description 3
- 239000003337 fertilizer Substances 0.000 description 3
- 230000035784 germination Effects 0.000 description 3
- 239000003292 glue Substances 0.000 description 3
- 229940097068 glyphosate Drugs 0.000 description 3
- 238000003306 harvesting Methods 0.000 description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 3
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 230000002147 killing effect Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 235000019426 modified starch Nutrition 0.000 description 3
- 239000003973 paint Substances 0.000 description 3
- 239000006072 paste Substances 0.000 description 3
- 125000005506 phthalide group Chemical group 0.000 description 3
- 239000000049 pigment Substances 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- WHHIPMZEDGBUCC-UHFFFAOYSA-N probenazole Chemical compound C1=CC=C2C(OCC=C)=NS(=O)(=O)C2=C1 WHHIPMZEDGBUCC-UHFFFAOYSA-N 0.000 description 3
- 235000009566 rice Nutrition 0.000 description 3
- 229910052710 silicon Inorganic materials 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000009331 sowing Methods 0.000 description 3
- 238000005507 spraying Methods 0.000 description 3
- 238000005728 strengthening Methods 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- VJQYLJSMBWXGDV-UHFFFAOYSA-N tiadinil Chemical compound N1=NSC(C(=O)NC=2C=C(Cl)C(C)=CC=2)=C1C VJQYLJSMBWXGDV-UHFFFAOYSA-N 0.000 description 3
- PQHXFGUTAAIHOC-XZZSYSLUSA-N α-(methoxyimino)-n-methyl-2-[[[1-[3-(trifluoromethyl)phenyl]ethoxy]imino]methyl]benzeneacetamide Chemical compound CNC(=O)C(=N\OC)\C1=CC=CC=C1\C=N\OC(C)C1=CC=CC(C(F)(F)F)=C1 PQHXFGUTAAIHOC-XZZSYSLUSA-N 0.000 description 3
- ZMYFCFLJBGAQRS-IRXDYDNUSA-N (2R,3S)-epoxiconazole Chemical compound C1=CC(F)=CC=C1[C@@]1(CN2N=CN=C2)[C@H](C=2C(=CC=CC=2)Cl)O1 ZMYFCFLJBGAQRS-IRXDYDNUSA-N 0.000 description 2
- XDEHMKQLKPZERH-BYPYZUCNSA-N (2s)-2-amino-3-methylbutanamide Chemical compound CC(C)[C@H](N)C(N)=O XDEHMKQLKPZERH-BYPYZUCNSA-N 0.000 description 2
- 125000004455 (C1-C3) alkylthio group Chemical group 0.000 description 2
- 125000004504 1,2,4-oxadiazolyl group Chemical group 0.000 description 2
- 125000001376 1,2,4-triazolyl group Chemical group N1N=C(N=C1)* 0.000 description 2
- 125000004517 1,2,5-thiadiazolyl group Chemical group 0.000 description 2
- JWUCHKBSVLQQCO-UHFFFAOYSA-N 1-(2-fluorophenyl)-1-(4-fluorophenyl)-2-(1H-1,2,4-triazol-1-yl)ethanol Chemical compound C=1C=C(F)C=CC=1C(C=1C(=CC=CC=1)F)(O)CN1C=NC=N1 JWUCHKBSVLQQCO-UHFFFAOYSA-N 0.000 description 2
- YTOPFCCWCSOHFV-UHFFFAOYSA-N 2,6-dimethyl-4-tridecylmorpholine Chemical compound CCCCCCCCCCCCCN1CC(C)OC(C)C1 YTOPFCCWCSOHFV-UHFFFAOYSA-N 0.000 description 2
- YABFPHSQTSFWQB-UHFFFAOYSA-N 2-(4-fluorophenyl)-1-(1,2,4-triazol-1-yl)-3-(trimethylsilyl)propan-2-ol Chemical compound C=1C=C(F)C=CC=1C(O)(C[Si](C)(C)C)CN1C=NC=N1 YABFPHSQTSFWQB-UHFFFAOYSA-N 0.000 description 2
- XAYMVFWOJIOUTA-UHFFFAOYSA-N 2-[8-[8-(diaminomethylideneamino)octylamino]octyl]guanidine;2-dodecylbenzenesulfonic acid Chemical compound CCCCCCCCCCCCC1=CC=CC=C1S(O)(=O)=O.CCCCCCCCCCCCC1=CC=CC=C1S(O)(=O)=O.CCCCCCCCCCCCC1=CC=CC=C1S(O)(=O)=O.NC(N)=NCCCCCCCCNCCCCCCCCN=C(N)N XAYMVFWOJIOUTA-UHFFFAOYSA-N 0.000 description 2
- WRTHZGDBUWNFCS-UHFFFAOYSA-N 2-but-3-enoxy-6-iodochromen-4-one Chemical compound O1C(OCCC=C)=CC(=O)C2=CC(I)=CC=C21 WRTHZGDBUWNFCS-UHFFFAOYSA-N 0.000 description 2
- GMMOMHSLRVQSRX-UHFFFAOYSA-N 2-iodo-n-[2-(4-methylpentan-2-yl)phenyl]benzamide Chemical compound CC(C)CC(C)C1=CC=CC=C1NC(=O)C1=CC=CC=C1I GMMOMHSLRVQSRX-UHFFFAOYSA-N 0.000 description 2
- MEYCYYFOVOERCT-UHFFFAOYSA-N 2-iodochromen-4-one Chemical class C1=CC=C2OC(I)=CC(=O)C2=C1 MEYCYYFOVOERCT-UHFFFAOYSA-N 0.000 description 2
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 2
- LSBDFXRDZJMBSC-UHFFFAOYSA-N 2-phenylacetamide Chemical class NC(=O)CC1=CC=CC=C1 LSBDFXRDZJMBSC-UHFFFAOYSA-N 0.000 description 2
- GTKIGDZXPDCIKR-UHFFFAOYSA-N 2-phenylbenzamide Chemical class NC(=O)C1=CC=CC=C1C1=CC=CC=C1 GTKIGDZXPDCIKR-UHFFFAOYSA-N 0.000 description 2
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- OVFHHJZHXHZIHT-UHFFFAOYSA-N 3-(2,4-dichlorophenyl)-2-(1,2,4-triazol-1-yl)quinazolin-4-one Chemical compound ClC1=CC(Cl)=CC=C1N1C(=O)C2=CC=CC=C2N=C1N1N=CN=C1 OVFHHJZHXHZIHT-UHFFFAOYSA-N 0.000 description 2
- YINRVYFMJRYHQS-YSURURNPSA-N 3-(difluoromethyl)-n-[2-[3-fluoro-4-[(e)-methoxyiminomethyl]phenyl]phenyl]-1-methylpyrazole-4-carboxamide Chemical compound C1=C(F)C(/C=N/OC)=CC=C1C1=CC=CC=C1NC(=O)C1=CN(C)N=C1C(F)F YINRVYFMJRYHQS-YSURURNPSA-N 0.000 description 2
- DCOHNGVPSJBFBA-UHFFFAOYSA-N 3-butyl-6-iodo-2-propan-2-yloxychromen-4-one Chemical compound C1=C(I)C=C2C(=O)C(CCCC)=C(OC(C)C)OC2=C1 DCOHNGVPSJBFBA-UHFFFAOYSA-N 0.000 description 2
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 2
- WQMVTGCKCKMBSJ-UHFFFAOYSA-N 4-(difluoromethyl)-2-methyl-n-[2-[4-(trifluoromethyl)phenyl]phenyl]-1,3-thiazole-5-carboxamide Chemical compound S1C(C)=NC(C(F)F)=C1C(=O)NC1=CC=CC=C1C1=CC=C(C(F)(F)F)C=C1 WQMVTGCKCKMBSJ-UHFFFAOYSA-N 0.000 description 2
- SBUKOHLFHYSZNG-UHFFFAOYSA-N 4-dodecyl-2,6-dimethylmorpholine Chemical compound CCCCCCCCCCCCN1CC(C)OC(C)C1 SBUKOHLFHYSZNG-UHFFFAOYSA-N 0.000 description 2
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 2
- NRTLIYOWLVMQBO-UHFFFAOYSA-N 5-chloro-1,3-dimethyl-N-(1,1,3-trimethyl-1,3-dihydro-2-benzofuran-4-yl)pyrazole-4-carboxamide Chemical compound C=12C(C)OC(C)(C)C2=CC=CC=1NC(=O)C=1C(C)=NN(C)C=1Cl NRTLIYOWLVMQBO-UHFFFAOYSA-N 0.000 description 2
- BPJQBJUREDQRRC-UHFFFAOYSA-N 5-chloro-6-(2-chloro-6-fluorophenyl)-7-(4-methylpiperidin-1-yl)-[1,2,4]triazolo[1,5-a]pyrimidine Chemical compound C1CC(C)CCN1C1=C(C=2C(=CC=CC=2F)Cl)C(Cl)=NC2=NC=NN12 BPJQBJUREDQRRC-UHFFFAOYSA-N 0.000 description 2
- HTUXYLSVGUNMGT-UHFFFAOYSA-N 6-iodo-2-pentan-2-yloxy-3-propylchromen-4-one Chemical compound C1=C(I)C=C2C(=O)C(CCC)=C(OC(C)CCC)OC2=C1 HTUXYLSVGUNMGT-UHFFFAOYSA-N 0.000 description 2
- 241001580860 Acarapis Species 0.000 description 2
- 241000934067 Acarus Species 0.000 description 2
- 241000934064 Acarus siro Species 0.000 description 2
- 241001558864 Aceria Species 0.000 description 2
- 241001351288 Achroia grisella Species 0.000 description 2
- 241000819811 Acronicta major Species 0.000 description 2
- 241001506009 Aculops Species 0.000 description 2
- 241000079319 Aculops lycopersici Species 0.000 description 2
- 241001506414 Aculus Species 0.000 description 2
- 241001227264 Adoretus Species 0.000 description 2
- 241000256118 Aedes aegypti Species 0.000 description 2
- 241000256173 Aedes albopictus Species 0.000 description 2
- 241000484420 Aedia leucomelas Species 0.000 description 2
- 241001164222 Aeneolamia Species 0.000 description 2
- 241000902874 Agelastica alni Species 0.000 description 2
- 241000902467 Agonoscena Species 0.000 description 2
- 241001136265 Agriotes Species 0.000 description 2
- 241000218473 Agrotis Species 0.000 description 2
- 241000449794 Alabama argillacea Species 0.000 description 2
- 241001155864 Aleurolobus barodensis Species 0.000 description 2
- 241001136547 Aleurothrixus Species 0.000 description 2
- 241000223602 Alternaria alternata Species 0.000 description 2
- 241000213004 Alternaria solani Species 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 241001398046 Amphimallon solstitiale Species 0.000 description 2
- 241000839189 Amrasca Species 0.000 description 2
- 241000663922 Anasa tristis Species 0.000 description 2
- 241001147657 Ancylostoma Species 0.000 description 2
- 241000520197 Ancylostoma ceylanicum Species 0.000 description 2
- 241000498253 Ancylostoma duodenale Species 0.000 description 2
- 241000027431 Anoplophora Species 0.000 description 2
- 241000272517 Anseriformes Species 0.000 description 2
- 241000693245 Antestiopsis Species 0.000 description 2
- 241000254177 Anthonomus Species 0.000 description 2
- 241000625753 Anticarsia Species 0.000 description 2
- 241000625764 Anticarsia gemmatalis Species 0.000 description 2
- 241001414827 Aonidiella Species 0.000 description 2
- 241001124076 Aphididae Species 0.000 description 2
- 241001600407 Aphis <genus> Species 0.000 description 2
- 241001227591 Apogonia Species 0.000 description 2
- 244000105624 Arachis hypogaea Species 0.000 description 2
- 241000238901 Araneidae Species 0.000 description 2
- 241000838579 Arboridia Species 0.000 description 2
- 241001162025 Archips podana Species 0.000 description 2
- 241001480752 Argas persicus Species 0.000 description 2
- 241001480754 Argas reflexus Species 0.000 description 2
- 241000722809 Armadillidium vulgare Species 0.000 description 2
- 235000011330 Armoracia rusticana Nutrition 0.000 description 2
- 240000003291 Armoracia rusticana Species 0.000 description 2
- 241000238421 Arthropoda Species 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 241000668391 Aspidiella Species 0.000 description 2
- 241000387313 Aspidiotus Species 0.000 description 2
- 241000208838 Asteraceae Species 0.000 description 2
- 241000238708 Astigmata Species 0.000 description 2
- 241001437124 Atanus Species 0.000 description 2
- 241001530056 Athelia rolfsii Species 0.000 description 2
- 241001174347 Atomaria Species 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000982146 Atylotus Species 0.000 description 2
- 241001166626 Aulacorthum solani Species 0.000 description 2
- 241000223651 Aureobasidium Species 0.000 description 2
- 241000223678 Aureobasidium pullulans Species 0.000 description 2
- 241000221377 Auricularia Species 0.000 description 2
- 235000007319 Avena orientalis Nutrition 0.000 description 2
- 244000075850 Avena orientalis Species 0.000 description 2
- 208000035143 Bacterial infection Diseases 0.000 description 2
- 241001490249 Bactrocera oleae Species 0.000 description 2
- 241000254123 Bemisia Species 0.000 description 2
- 241001028523 Bentholebouria blatta Species 0.000 description 2
- 241001142392 Bibio Species 0.000 description 2
- 241000237359 Biomphalaria Species 0.000 description 2
- 244000309494 Bipolaris glycines Species 0.000 description 2
- 241000190150 Bipolaris sorokiniana Species 0.000 description 2
- 241001631693 Blattella asahinai Species 0.000 description 2
- 241001674044 Blattodea Species 0.000 description 2
- 241000929635 Blissus Species 0.000 description 2
- 241001480061 Blumeria graminis Species 0.000 description 2
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 2
- 241000322475 Bovicola Species 0.000 description 2
- 241000913391 Brachionus forficula Species 0.000 description 2
- 241000273316 Brachycaudus Species 0.000 description 2
- 241000273318 Brachycaudus cardui Species 0.000 description 2
- 241001088081 Brachycolus Species 0.000 description 2
- 235000014698 Brassica juncea var multisecta Nutrition 0.000 description 2
- 240000000385 Brassica napus var. napus Species 0.000 description 2
- 235000011299 Brassica oleracea var botrytis Nutrition 0.000 description 2
- 240000003259 Brassica oleracea var. botrytis Species 0.000 description 2
- 235000006618 Brassica rapa subsp oleifera Nutrition 0.000 description 2
- 241000219193 Brassicaceae Species 0.000 description 2
- 241001444260 Brassicogethes aeneus Species 0.000 description 2
- 241000941072 Braula Species 0.000 description 2
- 241000233685 Bremia lactucae Species 0.000 description 2
- 241000982105 Brevicoryne brassicae Species 0.000 description 2
- 241001643374 Brevipalpus Species 0.000 description 2
- 241001325378 Bruchus Species 0.000 description 2
- 241000244038 Brugia malayi Species 0.000 description 2
- 241000143302 Brugia timori Species 0.000 description 2
- 241000488564 Bryobia Species 0.000 description 2
- 241000398201 Bryobia praetiosa Species 0.000 description 2
- 241001517925 Bucculatrix Species 0.000 description 2
- 241000041029 Bulinus Species 0.000 description 2
- 241000931178 Bunostomum Species 0.000 description 2
- 241001491790 Bupalus piniaria Species 0.000 description 2
- 241000239324 Buthus occitanus Species 0.000 description 2
- 125000006577 C1-C6 hydroxyalkyl group Chemical group 0.000 description 2
- 241000257160 Calliphora Species 0.000 description 2
- 241000906761 Calocoris Species 0.000 description 2
- 241000333978 Caloglyphus Species 0.000 description 2
- 241001489688 Camponotus herculeanus Species 0.000 description 2
- 241000613201 Campylomma livida Species 0.000 description 2
- 241001350371 Capua Species 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 2
- 239000005746 Carboxin Substances 0.000 description 2
- NYSZJNUIVUBQMM-BQYQJAHWSA-N Cardamonin Chemical compound COC1=CC(O)=CC(O)=C1C(=O)\C=C\C1=CC=CC=C1 NYSZJNUIVUBQMM-BQYQJAHWSA-N 0.000 description 2
- 241000781521 Cavelerius Species 0.000 description 2
- 241001427143 Cavelerius excavatus Species 0.000 description 2
- 241000255579 Ceratitis capitata Species 0.000 description 2
- 241000134979 Ceratovacuna lanigera Species 0.000 description 2
- 241001414824 Cercopidae Species 0.000 description 2
- 241000530549 Cercospora beticola Species 0.000 description 2
- 241001658057 Cercospora kikuchii Species 0.000 description 2
- 241000113401 Cercospora sojina Species 0.000 description 2
- 241000437818 Cercospora vignicola Species 0.000 description 2
- 240000001817 Cereus hexagonus Species 0.000 description 2
- 241001450758 Ceroplastes Species 0.000 description 2
- 241000893172 Chabertia Species 0.000 description 2
- 241000221955 Chaetomium Species 0.000 description 2
- 241001515917 Chaetomium globosum Species 0.000 description 2
- 241001094931 Chaetosiphon fragaefolii Species 0.000 description 2
- 241001436125 Cheiridium Species 0.000 description 2
- 241001436044 Chelifer Species 0.000 description 2
- 241000871189 Chenopodiaceae Species 0.000 description 2
- 241000426499 Chilo Species 0.000 description 2
- VOPWNXZWBYDODV-UHFFFAOYSA-N Chlorodifluoromethane Chemical compound FC(F)Cl VOPWNXZWBYDODV-UHFFFAOYSA-N 0.000 description 2
- 241000907567 Choanephora Species 0.000 description 2
- 241000602352 Choanephora infundibulifera Species 0.000 description 2
- 241000255942 Choristoneura fumiferana Species 0.000 description 2
- 241000118402 Chromaphis juglandicola Species 0.000 description 2
- 241001367803 Chrysodeixis includens Species 0.000 description 2
- 241000669069 Chrysomphalus aonidum Species 0.000 description 2
- 241001124179 Chrysops Species 0.000 description 2
- 241001097338 Cicadulina Species 0.000 description 2
- 241001635683 Cimex hemipterus Species 0.000 description 2
- 241001327638 Cimex lectularius Species 0.000 description 2
- 241000221751 Claviceps purpurea Species 0.000 description 2
- 241001152840 Cleonus Species 0.000 description 2
- 241001327942 Clonorchis Species 0.000 description 2
- 241000098277 Cnaphalocrocis Species 0.000 description 2
- 241001478240 Coccus Species 0.000 description 2
- 241000933851 Cochliomyia Species 0.000 description 2
- 241001427559 Collembola Species 0.000 description 2
- 241001133184 Colletotrichum agaves Species 0.000 description 2
- 241001529387 Colletotrichum gloeosporioides Species 0.000 description 2
- 241000683561 Conoderus Species 0.000 description 2
- 241001126268 Cooperia Species 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- JJLJMEJHUUYSSY-UHFFFAOYSA-L Copper hydroxide Chemical compound [OH-].[OH-].[Cu+2] JJLJMEJHUUYSSY-UHFFFAOYSA-L 0.000 description 2
- 239000005750 Copper hydroxide Substances 0.000 description 2
- 241000304165 Cordylobia anthropophaga Species 0.000 description 2
- 241001212536 Cosmopolites Species 0.000 description 2
- 241000500845 Costelytra zealandica Species 0.000 description 2
- 241000720929 Creontiades dilutus Species 0.000 description 2
- 241001094916 Cryptomyzus ribis Species 0.000 description 2
- 241000195493 Cryptophyta Species 0.000 description 2
- 241001152745 Cryptorhynchus lapathi Species 0.000 description 2
- 241000258922 Ctenocephalides Species 0.000 description 2
- 241000490513 Ctenocephalides canis Species 0.000 description 2
- 241000258924 Ctenocephalides felis Species 0.000 description 2
- 241001124552 Ctenolepisma Species 0.000 description 2
- 241000256059 Culex pipiens Species 0.000 description 2
- 241000256057 Culex quinquefasciatus Species 0.000 description 2
- 241000256061 Culex tarsalis Species 0.000 description 2
- 241000134316 Culicoides <genus> Species 0.000 description 2
- 241000721021 Curculio Species 0.000 description 2
- 241000371644 Curvularia ravenelii Species 0.000 description 2
- 241000692095 Cuterebra Species 0.000 description 2
- 241001635274 Cydia pomonella Species 0.000 description 2
- 201000003808 Cystic echinococcosis Diseases 0.000 description 2
- 241000031930 Dactuliophora Species 0.000 description 2
- 241001260003 Dalbulus Species 0.000 description 2
- 241000268912 Damalinia Species 0.000 description 2
- 241001128004 Demodex Species 0.000 description 2
- 241001480824 Dermacentor Species 0.000 description 2
- 241001481694 Dermanyssus Species 0.000 description 2
- 241000202828 Dermatobia hominis Species 0.000 description 2
- 241001300085 Deroceras Species 0.000 description 2
- 241000489975 Diabrotica Species 0.000 description 2
- 241000108082 Dialeurodes Species 0.000 description 2
- 241000526124 Diaphorina Species 0.000 description 2
- 241001645342 Diaporthe citri Species 0.000 description 2
- 241000643949 Diaspis <angiosperm> Species 0.000 description 2
- 241001549096 Dichelops furcatus Species 0.000 description 2
- 241000577452 Dicrocoelium Species 0.000 description 2
- 241000180412 Dictyocaulus filaria Species 0.000 description 2
- 102000016680 Dioxygenases Human genes 0.000 description 2
- 108010028143 Dioxygenases Proteins 0.000 description 2
- 241000866683 Diphyllobothrium latum Species 0.000 description 2
- 241000511318 Diprion Species 0.000 description 2
- 239000005765 Dodemorph Substances 0.000 description 2
- 241001319090 Dracunculus medinensis Species 0.000 description 2
- 241000193907 Dreissena Species 0.000 description 2
- 241001595884 Drosicha Species 0.000 description 2
- 241001581005 Dysaphis Species 0.000 description 2
- 241001425477 Dysdercus Species 0.000 description 2
- 241001516600 Dysmicoccus Species 0.000 description 2
- 241000353522 Earias insulana Species 0.000 description 2
- 241000244170 Echinococcus granulosus Species 0.000 description 2
- 241000244163 Echinococcus multilocularis Species 0.000 description 2
- 241000223924 Eimeria Species 0.000 description 2
- 241000125118 Elsinoe fawcettii Species 0.000 description 2
- 241001568757 Elsinoe glycines Species 0.000 description 2
- 241000995023 Empoasca Species 0.000 description 2
- 241001222563 Empoasca onukii Species 0.000 description 2
- 241000498255 Enterobius vermicularis Species 0.000 description 2
- 241000488562 Eotetranychus Species 0.000 description 2
- 241000122098 Ephestia kuehniella Species 0.000 description 2
- 241001301805 Epilachna Species 0.000 description 2
- 241000079320 Epitrimerus Species 0.000 description 2
- 239000005767 Epoxiconazole Substances 0.000 description 2
- 241001558857 Eriophyes Species 0.000 description 2
- 241000917109 Eriosoma Species 0.000 description 2
- 241000588694 Erwinia amylovora Species 0.000 description 2
- 241001337814 Erysiphe glycines Species 0.000 description 2
- 241000510928 Erysiphe necator Species 0.000 description 2
- 241001515686 Erythroneura Species 0.000 description 2
- 241000588722 Escherichia Species 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 241000060469 Eupoecilia ambiguella Species 0.000 description 2
- 241000483001 Euproctis chrysorrhoea Species 0.000 description 2
- 241000515838 Eurygaster Species 0.000 description 2
- 241000239245 Euscelis Species 0.000 description 2
- 241000098297 Euschistus Species 0.000 description 2
- 241000216093 Eusimulium Species 0.000 description 2
- 241001034433 Eutetranychus Species 0.000 description 2
- 241001585293 Euxoa Species 0.000 description 2
- 241000953886 Fannia canicularis Species 0.000 description 2
- 241000322646 Felicola Species 0.000 description 2
- 241000233488 Feltia Species 0.000 description 2
- 239000005787 Flutriafol Substances 0.000 description 2
- 241000720914 Forficula auricularia Species 0.000 description 2
- 241000189565 Frankliniella Species 0.000 description 2
- 239000005791 Fuberidazole Substances 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 241000223195 Fusarium graminearum Species 0.000 description 2
- 241001149475 Gaeumannomyces graminis Species 0.000 description 2
- 241000585112 Galba Species 0.000 description 2
- 241000982383 Gametis jucunda Species 0.000 description 2
- 241000237858 Gastropoda Species 0.000 description 2
- 241001057692 Geococcus coffeae Species 0.000 description 2
- 239000005980 Gibberellic acid Substances 0.000 description 2
- 241001043186 Gibbium Species 0.000 description 2
- 241000257324 Glossina <genus> Species 0.000 description 2
- 229920001503 Glucan Polymers 0.000 description 2
- 241000308375 Graminicola Species 0.000 description 2
- 241001243091 Gryllotalpa Species 0.000 description 2
- 241001409809 Gymnosporangium sabinae Species 0.000 description 2
- 241000257224 Haematobia Species 0.000 description 2
- 241000562576 Haematopota Species 0.000 description 2
- 241000775881 Haematopota pluvialis Species 0.000 description 2
- 241000243976 Haemonchus Species 0.000 description 2
- 241000255990 Helicoverpa Species 0.000 description 2
- 241000256257 Heliothis Species 0.000 description 2
- 241000339323 Heliothrips Species 0.000 description 2
- 241001181532 Hemileia vastatrix Species 0.000 description 2
- 241001659688 Hercinothrips femoralis Species 0.000 description 2
- 241000920462 Heterakis Species 0.000 description 2
- 241001176496 Heteronychus arator Species 0.000 description 2
- 241000771999 Hippobosca Species 0.000 description 2
- 241001201623 Hofmannophila pseudospretella Species 0.000 description 2
- 241001288674 Holotrichia consanguinea Species 0.000 description 2
- 241001503238 Homalodisca vitripennis Species 0.000 description 2
- 241000957299 Homona magnanima Species 0.000 description 2
- 241001417351 Hoplocampa Species 0.000 description 2
- 240000005979 Hordeum vulgare Species 0.000 description 2
- 235000007340 Hordeum vulgare Nutrition 0.000 description 2
- 241001251909 Hyalopterus pruni Species 0.000 description 2
- 241000561960 Hybomitra Species 0.000 description 2
- 241000238729 Hydrotaea Species 0.000 description 2
- 241000115042 Hylamorpha elegans Species 0.000 description 2
- 241001464384 Hymenolepis nana Species 0.000 description 2
- 241001508566 Hypera postica Species 0.000 description 2
- 241001590577 Hypodectes Species 0.000 description 2
- 241000577499 Hypothenemus Species 0.000 description 2
- 241001058149 Icerya Species 0.000 description 2
- 241001595209 Idiocerus Species 0.000 description 2
- 241000761334 Idioscopus Species 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- 241000397365 Javesella pellucida Species 0.000 description 2
- 241000896288 Kakothrips Species 0.000 description 2
- 241001506109 Kalotermes Species 0.000 description 2
- 241001467800 Knemidokoptes Species 0.000 description 2
- 240000008415 Lactuca sativa Species 0.000 description 2
- 241000256686 Lasius <genus> Species 0.000 description 2
- 241000599116 Lasius fuliginosus Species 0.000 description 2
- 241000948337 Lasius niger Species 0.000 description 2
- 241000051764 Lasius umbratus Species 0.000 description 2
- 241001163604 Latheticus oryzae Species 0.000 description 2
- 241000238866 Latrodectus mactans Species 0.000 description 2
- 241000222418 Lentinus Species 0.000 description 2
- 241000222451 Lentinus tigrinus Species 0.000 description 2
- 241000669027 Lepidosaphes Species 0.000 description 2
- 241000258916 Leptinotarsa decemlineata Species 0.000 description 2
- 241000661345 Leptocorisa Species 0.000 description 2
- 241000560153 Leptoglossus phyllopus Species 0.000 description 2
- 241000555723 Leptosphaerulina Species 0.000 description 2
- 241001198950 Leptosphaerulina trifolii Species 0.000 description 2
- 241000272317 Lipaphis erysimi Species 0.000 description 2
- 241000692237 Lipoptena Species 0.000 description 2
- 241000322707 Liposcelis Species 0.000 description 2
- 241000594036 Liriomyza Species 0.000 description 2
- 241000966204 Lissorhoptrus oryzophilus Species 0.000 description 2
- 241001535742 Listrophorus Species 0.000 description 2
- 241000004742 Lithophane antennata Species 0.000 description 2
- 241000532753 Lixus Species 0.000 description 2
- 241000254023 Locusta Species 0.000 description 2
- 241000255134 Lutzomyia <genus> Species 0.000 description 2
- 241001414826 Lygus Species 0.000 description 2
- 241000721696 Lymantria Species 0.000 description 2
- 241000237354 Lymnaea Species 0.000 description 2
- 241000721715 Macrosiphum Species 0.000 description 2
- 241001344131 Magnaporthe grisea Species 0.000 description 2
- 241000927670 Mahanarva fimbriolata Species 0.000 description 2
- 241000255685 Malacosoma neustria Species 0.000 description 2
- 101000763602 Manilkara zapota Thaumatin-like protein 1 Proteins 0.000 description 2
- 101000763586 Manilkara zapota Thaumatin-like protein 1a Proteins 0.000 description 2
- 241001179564 Melanaphis sacchari Species 0.000 description 2
- 241001415013 Melanoplus Species 0.000 description 2
- 241000254099 Melolontha melolontha Species 0.000 description 2
- 241000771995 Melophagus Species 0.000 description 2
- 241000035436 Menopon Species 0.000 description 2
- 241001481698 Mesostigmata Species 0.000 description 2
- 241000131592 Metcalfiella Species 0.000 description 2
- 241000168713 Metopolophium dirhodum Species 0.000 description 2
- 241001497122 Migdolus Species 0.000 description 2
- 241001414825 Miridae Species 0.000 description 2
- 241001469521 Mocis latipes Species 0.000 description 2
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 2
- 241001094463 Monellia Species 0.000 description 2
- 241001094800 Monelliopsis Species 0.000 description 2
- 241000862466 Monilinia laxa Species 0.000 description 2
- 241001442208 Monochamus Species 0.000 description 2
- 241001459558 Monographella nivalis Species 0.000 description 2
- 241001351098 Morellia Species 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 101000966653 Musa acuminata Glucan endo-1,3-beta-glucosidase Proteins 0.000 description 2
- 241000257159 Musca domestica Species 0.000 description 2
- 241001373727 Myobia Species 0.000 description 2
- 241001477928 Mythimna Species 0.000 description 2
- 241000409991 Mythimna separata Species 0.000 description 2
- 241000721623 Myzus Species 0.000 description 2
- IUOKJNROJISWRO-UHFFFAOYSA-N N-(2-cyano-3-methylbutan-2-yl)-2-(2,4-dichlorophenoxy)propanamide Chemical compound CC(C)C(C)(C#N)NC(=O)C(C)OC1=CC=C(Cl)C=C1Cl IUOKJNROJISWRO-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 241000133263 Nasonovia ribisnigri Species 0.000 description 2
- 241000196499 Naupactus xanthographus Species 0.000 description 2
- 241000041821 Necrobia Species 0.000 description 2
- 241001137882 Nematodirus Species 0.000 description 2
- 241000556984 Neonectria galligena Species 0.000 description 2
- 241000359016 Nephotettix Species 0.000 description 2
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 2
- 244000061176 Nicotiana tabacum Species 0.000 description 2
- 108010019703 Nicotinamidase Proteins 0.000 description 2
- 241001556089 Nilaparvata lugens Species 0.000 description 2
- 241001385056 Niptus hololeucus Species 0.000 description 2
- 241000562097 Notoedres Species 0.000 description 2
- SCARISRKCRGDJL-UHFFFAOYSA-N O=P1OSO1 Chemical class O=P1OSO1 SCARISRKCRGDJL-UHFFFAOYSA-N 0.000 description 2
- 241000036147 Ochlerotatus taeniorhynchus Species 0.000 description 2
- 241000144610 Oculimacula acuformis Species 0.000 description 2
- 241000866537 Odontotermes Species 0.000 description 2
- 241001102020 Oebalus Species 0.000 description 2
- 241000510960 Oesophagostomum Species 0.000 description 2
- 241000488557 Oligonychus Species 0.000 description 2
- 241000243985 Onchocerca volvulus Species 0.000 description 2
- 241000565675 Oncomelania Species 0.000 description 2
- 241000777573 Oncometopia Species 0.000 description 2
- 241000963703 Onychiurus armatus Species 0.000 description 2
- 241001491877 Operophtera brumata Species 0.000 description 2
- 241000168255 Opiliones Species 0.000 description 2
- 241000242716 Opisthorchis Species 0.000 description 2
- 241001446191 Orthezia Species 0.000 description 2
- 241001250072 Oryctes rhinoceros Species 0.000 description 2
- 241000131101 Oryzaephilus surinamensis Species 0.000 description 2
- 241000975417 Oscinella frit Species 0.000 description 2
- 241000243795 Ostertagia Species 0.000 description 2
- 241001147398 Ostrinia nubilalis Species 0.000 description 2
- 241001480755 Otobius Species 0.000 description 2
- 241000790250 Otodectes Species 0.000 description 2
- 241001570894 Oulema oryzae Species 0.000 description 2
- 241001510250 Panchlora Species 0.000 description 2
- 241000486438 Panolis flammea Species 0.000 description 2
- 241000488585 Panonychus Species 0.000 description 2
- 241000919536 Panstrongylus Species 0.000 description 2
- 241001480233 Paragonimus Species 0.000 description 2
- 241000736122 Parastagonospora nodorum Species 0.000 description 2
- 241001516563 Paratrioza Species 0.000 description 2
- 241001523676 Parcoblatta Species 0.000 description 2
- 241001130603 Parlatoria <angiosperm> Species 0.000 description 2
- 241000721451 Pectinophora gossypiella Species 0.000 description 2
- 241000517307 Pediculus humanus Species 0.000 description 2
- 241000517306 Pediculus humanus corporis Species 0.000 description 2
- 241000721454 Pemphigus Species 0.000 description 2
- 241000256682 Peregrinus maidis Species 0.000 description 2
- 241001510004 Periplaneta australasiae Species 0.000 description 2
- 241001510001 Periplaneta brunnea Species 0.000 description 2
- 241001510010 Periplaneta fuliginosa Species 0.000 description 2
- 241001670203 Peronospora manshurica Species 0.000 description 2
- 241000201565 Peronospora viciae f. sp. pisi Species 0.000 description 2
- 241000233679 Peronosporaceae Species 0.000 description 2
- 241000218196 Persea Species 0.000 description 2
- 241000440445 Phakopsora meibomiae Species 0.000 description 2
- 241000250508 Phalangium Species 0.000 description 2
- 241001058119 Phenacoccus Species 0.000 description 2
- 241001432757 Philipomyia Species 0.000 description 2
- 241000916808 Phloeomyzus passerinii Species 0.000 description 2
- 241001401861 Phorodon humuli Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 241001525654 Phyllocnistis citrella Species 0.000 description 2
- 241000497192 Phyllocoptruta oleivora Species 0.000 description 2
- 241001517955 Phyllonorycter blancardella Species 0.000 description 2
- 241001640279 Phyllophaga Species 0.000 description 2
- 241000210649 Phyllosticta ampelicida Species 0.000 description 2
- 241001478707 Phyllosticta sojicola Species 0.000 description 2
- 241001516577 Phylloxera Species 0.000 description 2
- 241001149949 Phytophthora cactorum Species 0.000 description 2
- 241000255972 Pieris <butterfly> Species 0.000 description 2
- 241000690748 Piesma Species 0.000 description 2
- 241000940371 Piezodorus Species 0.000 description 2
- 241000669426 Pinnaspis aspidistrae Species 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 241000193804 Planococcus <bacterium> Species 0.000 description 2
- 241000595629 Plodia interpunctella Species 0.000 description 2
- 241000500437 Plutella xylostella Species 0.000 description 2
- 241000317981 Podosphaera fuliginea Species 0.000 description 2
- 241001337928 Podosphaera leucotricha Species 0.000 description 2
- 241000883286 Polydesmus Species 0.000 description 2
- 241000952063 Polyphagotarsonemus latus Species 0.000 description 2
- 241000222640 Polyporus Species 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- 241000254101 Popillia japonica Species 0.000 description 2
- 241000238705 Prostigmata Species 0.000 description 2
- 241001483625 Protopulvinaria pyriformis Species 0.000 description 2
- 235000005805 Prunus cerasus Nutrition 0.000 description 2
- 241001274600 Pseudacysta Species 0.000 description 2
- 241000721694 Pseudatomoscelis seriatus Species 0.000 description 2
- 241000669298 Pseudaulacaspis pentagona Species 0.000 description 2
- 241000722234 Pseudococcus Species 0.000 description 2
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 2
- 241001281805 Pseudoperonospora cubensis Species 0.000 description 2
- 241000342307 Pseudoperonospora humuli Species 0.000 description 2
- 241001415024 Psocoptera Species 0.000 description 2
- 241001016411 Psorergates Species 0.000 description 2
- 241000526145 Psylla Species 0.000 description 2
- 241001534486 Pterolichus Species 0.000 description 2
- 241001454908 Pteromalus Species 0.000 description 2
- 241000517309 Pthirus Species 0.000 description 2
- 241000517304 Pthirus pubis Species 0.000 description 2
- 241000221300 Puccinia Species 0.000 description 2
- 241001123569 Puccinia recondita Species 0.000 description 2
- 241001675082 Pulex Species 0.000 description 2
- 241000718000 Pulex irritans Species 0.000 description 2
- 241000812330 Pyrenochaeta Species 0.000 description 2
- 241000520648 Pyrenophora teres Species 0.000 description 2
- 241000932787 Pyrilla Species 0.000 description 2
- 241000918585 Pythium aphanidermatum Species 0.000 description 2
- 241000944747 Quesada gigas Species 0.000 description 2
- 239000005831 Quinoxyfen Substances 0.000 description 2
- 241001408411 Raillietia Species 0.000 description 2
- 241000173769 Ramularia collo-cygni Species 0.000 description 2
- 241000549289 Rastrococcus Species 0.000 description 2
- 241001481696 Rhipicephalus sanguineus Species 0.000 description 2
- 241000298314 Rhipiphorothrips cruentatus Species 0.000 description 2
- 241001617044 Rhizoglyphus Species 0.000 description 2
- 241000125162 Rhopalosiphum Species 0.000 description 2
- 241001515790 Rhynchosporium secalis Species 0.000 description 2
- 241000752065 Rhyzobius Species 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 241000914334 Sahlbergella singularis Species 0.000 description 2
- 241001450655 Saissetia Species 0.000 description 2
- 241000257190 Sarcophaga <genus> Species 0.000 description 2
- 241000304160 Sarcophaga carnaria Species 0.000 description 2
- 206010039509 Scab Diseases 0.000 description 2
- 241000253973 Schistocerca gregaria Species 0.000 description 2
- 241000722027 Schizaphis graminum Species 0.000 description 2
- 241000365762 Scirtothrips Species 0.000 description 2
- 241000522594 Scorpio maurus Species 0.000 description 2
- 241001157779 Scutigera Species 0.000 description 2
- 241001313237 Scutigerella immaculata Species 0.000 description 2
- 235000007238 Secale cereale Nutrition 0.000 description 2
- 244000082988 Secale cereale Species 0.000 description 2
- 241000669326 Selenaspidus articulatus Species 0.000 description 2
- 241001597359 Septoria apiicola Species 0.000 description 2
- 241001597349 Septoria glycines Species 0.000 description 2
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 2
- 239000005835 Silthiofam Substances 0.000 description 2
- 241000254181 Sitophilus Species 0.000 description 2
- 241000254179 Sitophilus granarius Species 0.000 description 2
- 241000254152 Sitophilus oryzae Species 0.000 description 2
- 241000254154 Sitophilus zeamais Species 0.000 description 2
- 241000336929 Sogata Species 0.000 description 2
- 241000176086 Sogatella furcifera Species 0.000 description 2
- 241000208292 Solanaceae Species 0.000 description 2
- 241000044136 Solenopotes Species 0.000 description 2
- 244000062793 Sorghum vulgare Species 0.000 description 2
- 241000532885 Sphenophorus Species 0.000 description 2
- 241001414853 Spissistilus festinus Species 0.000 description 2
- 241001250070 Sporisorium reilianum Species 0.000 description 2
- 241000191940 Staphylococcus Species 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 241001177161 Stegobium paniceum Species 0.000 description 2
- 241000371621 Stemphylium Species 0.000 description 2
- 241000514831 Stemphylium botryosum Species 0.000 description 2
- 241001161749 Stenchaetothrips biformis Species 0.000 description 2
- 241000283614 Stephanitis nashi Species 0.000 description 2
- 241001513492 Sternostoma Species 0.000 description 2
- 241001494115 Stomoxys calcitrans Species 0.000 description 2
- 241000098292 Striacosta albicosta Species 0.000 description 2
- 229930182692 Strobilurin Natural products 0.000 description 2
- 241000180126 Strongyloides fuelleborni Species 0.000 description 2
- 241000244177 Strongyloides stercoralis Species 0.000 description 2
- 241001301282 Succinea Species 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 241001649251 Supella Species 0.000 description 2
- 241001649248 Supella longipalpa Species 0.000 description 2
- 241000907561 Sydowia polyspora Species 0.000 description 2
- 241000883295 Symphyla Species 0.000 description 2
- 241000244159 Taenia saginata Species 0.000 description 2
- 241000244157 Taenia solium Species 0.000 description 2
- 241000189578 Taeniothrips Species 0.000 description 2
- 241000228448 Taphrina deformans Species 0.000 description 2
- 241000254109 Tenebrio molitor Species 0.000 description 2
- 241001374808 Tetramorium caespitum Species 0.000 description 2
- 241001454295 Tetranychidae Species 0.000 description 2
- 241001454294 Tetranychus Species 0.000 description 2
- 241000239292 Theraphosidae Species 0.000 description 2
- 241000028626 Thermobia domestica Species 0.000 description 2
- 241000865903 Thielaviopsis Species 0.000 description 2
- 241000722093 Tilletia caries Species 0.000 description 2
- 241000130764 Tinea Species 0.000 description 2
- 208000002474 Tinea Diseases 0.000 description 2
- 241001519477 Tinocallis Species 0.000 description 2
- 241001161507 Titanus Species 0.000 description 2
- 241001432111 Tomaspis Species 0.000 description 2
- 241001238451 Tortrix viridana Species 0.000 description 2
- 241000271862 Toxoptera Species 0.000 description 2
- 241000222355 Trametes versicolor Species 0.000 description 2
- 241000018137 Trialeurodes vaporariorum Species 0.000 description 2
- 241001414831 Triatoma infestans Species 0.000 description 2
- 241000254086 Tribolium <beetle> Species 0.000 description 2
- 241000243774 Trichinella Species 0.000 description 2
- 241000194297 Trichinella britovi Species 0.000 description 2
- 241000243776 Trichinella nativa Species 0.000 description 2
- 241000243779 Trichinella nelsoni Species 0.000 description 2
- 241000243777 Trichinella spiralis Species 0.000 description 2
- 241000223259 Trichoderma Species 0.000 description 2
- 241000223261 Trichoderma viride Species 0.000 description 2
- 241000255985 Trichoplusia Species 0.000 description 2
- 241001489151 Trichuris Species 0.000 description 2
- 241000790999 Trinoton Species 0.000 description 2
- 241001414858 Trioza Species 0.000 description 2
- 241000267823 Trogoderma Species 0.000 description 2
- 241001584775 Tunga penetrans Species 0.000 description 2
- 241001168740 Tychius Species 0.000 description 2
- 241000841223 Typhlocyba Species 0.000 description 2
- 241000333201 Typhula incarnata Species 0.000 description 2
- 241000132125 Tyrophagus Species 0.000 description 2
- 241000669245 Unaspis Species 0.000 description 2
- 241000254198 Urocerus gigas Species 0.000 description 2
- 241000157667 Urocystis occulta Species 0.000 description 2
- 241000221577 Uromyces appendiculatus Species 0.000 description 2
- 241000007070 Ustilago nuda Species 0.000 description 2
- 241000895647 Varroa Species 0.000 description 2
- 241000317942 Venturia <ichneumonid wasp> Species 0.000 description 2
- 241000228452 Venturia inaequalis Species 0.000 description 2
- 241000905623 Venturia oleaginea Species 0.000 description 2
- 241001274787 Viteus Species 0.000 description 2
- 241000061203 Werneckiella Species 0.000 description 2
- 241000244005 Wuchereria bancrofti Species 0.000 description 2
- 235000013447 Xanthosoma atrovirens Nutrition 0.000 description 2
- 240000001781 Xanthosoma sagittifolium Species 0.000 description 2
- 241000353224 Xenopsylla Species 0.000 description 2
- 241001604425 Xylotrechus Species 0.000 description 2
- 241000885034 Xyphon Species 0.000 description 2
- 241001466337 Yponomeuta Species 0.000 description 2
- 241001035865 Zabrus Species 0.000 description 2
- 230000000895 acaricidal effect Effects 0.000 description 2
- 239000000642 acaricide Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 2
- 125000003545 alkoxy group Chemical group 0.000 description 2
- 125000002947 alkylene group Chemical group 0.000 description 2
- 230000001857 anti-mycotic effect Effects 0.000 description 2
- 239000002543 antimycotic Substances 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- AKNQMEBLVAMSNZ-UHFFFAOYSA-N azaconazole Chemical compound ClC1=CC(Cl)=CC=C1C1(CN2N=CN=C2)OCCO1 AKNQMEBLVAMSNZ-UHFFFAOYSA-N 0.000 description 2
- 229950000294 azaconazole Drugs 0.000 description 2
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- RIOXQFHNBCKOKP-UHFFFAOYSA-N benomyl Chemical compound C1=CC=C2N(C(=O)NCCCC)C(NC(=O)OC)=NC2=C1 RIOXQFHNBCKOKP-UHFFFAOYSA-N 0.000 description 2
- 150000001556 benzimidazoles Chemical class 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- MITFXPHMIHQXPI-UHFFFAOYSA-N benzoxaprofen Natural products N=1C2=CC(C(C(O)=O)C)=CC=C2OC=1C1=CC=C(Cl)C=C1 MITFXPHMIHQXPI-UHFFFAOYSA-N 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 230000004790 biotic stress Effects 0.000 description 2
- 229910052796 boron Inorganic materials 0.000 description 2
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 2
- 150000003857 carboxamides Chemical class 0.000 description 2
- GYSSRZJIHXQEHQ-UHFFFAOYSA-N carboxin Chemical compound S1CCOC(C)=C1C(=O)NC1=CC=CC=C1 GYSSRZJIHXQEHQ-UHFFFAOYSA-N 0.000 description 2
- 239000011111 cardboard Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 150000008422 chlorobenzenes Chemical class 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 239000010941 cobalt Substances 0.000 description 2
- 229910017052 cobalt Inorganic materials 0.000 description 2
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 229910001956 copper hydroxide Inorganic materials 0.000 description 2
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 231100000517 death Toxicity 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 150000008056 dicarboxyimides Chemical class 0.000 description 2
- YEJGPFZQLRMXOI-PKEIRNPWSA-N diclocymet Chemical compound N#CC(C(C)(C)C)C(=O)N[C@H](C)C1=CC=C(Cl)C=C1Cl YEJGPFZQLRMXOI-PKEIRNPWSA-N 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 125000005805 dimethoxy phenyl group Chemical group 0.000 description 2
- 239000012990 dithiocarbamate Substances 0.000 description 2
- 150000004659 dithiocarbamates Chemical class 0.000 description 2
- JMXKCYUTURMERF-UHFFFAOYSA-N dodemorph Chemical compound C1C(C)OC(C)CN1C1CCCCCCCCCCC1 JMXKCYUTURMERF-UHFFFAOYSA-N 0.000 description 2
- 230000002222 downregulating effect Effects 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- DWRKFAJEBUWTQM-UHFFFAOYSA-N etaconazole Chemical compound O1C(CC)COC1(C=1C(=CC(Cl)=CC=1)Cl)CN1N=CN=C1 DWRKFAJEBUWTQM-UHFFFAOYSA-N 0.000 description 2
- AWYFNIZYMPNGAI-UHFFFAOYSA-L ethylenebis(dithiocarbamate) Chemical compound [S-]C(=S)NCCNC([S-])=S AWYFNIZYMPNGAI-UHFFFAOYSA-L 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- FKLFBQCQQYDUAM-UHFFFAOYSA-N fenpiclonil Chemical compound ClC1=CC=CC(C=2C(=CNC=2)C#N)=C1Cl FKLFBQCQQYDUAM-UHFFFAOYSA-N 0.000 description 2
- NBVXSUQYWXRMNV-UHFFFAOYSA-N fluoromethane Chemical compound FC NBVXSUQYWXRMNV-UHFFFAOYSA-N 0.000 description 2
- UYJUZNLFJAWNEZ-UHFFFAOYSA-N fuberidazole Chemical compound C1=COC(C=2NC3=CC=CC=C3N=2)=C1 UYJUZNLFJAWNEZ-UHFFFAOYSA-N 0.000 description 2
- 230000002538 fungal effect Effects 0.000 description 2
- 230000009368 gene silencing by RNA Effects 0.000 description 2
- 235000003869 genetically modified organism Nutrition 0.000 description 2
- IXORZMNAPKEEDV-UHFFFAOYSA-N gibberellic acid GA3 Natural products OC(=O)C1C2(C3)CC(=C)C3(O)CCC2C2(C=CC3O)C1C3(C)C(=O)O2 IXORZMNAPKEEDV-UHFFFAOYSA-N 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 239000003630 growth substance Substances 0.000 description 2
- 125000000262 haloalkenyl group Chemical group 0.000 description 2
- 125000004438 haloalkoxy group Chemical group 0.000 description 2
- 244000000013 helminth Species 0.000 description 2
- 238000003898 horticulture Methods 0.000 description 2
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 description 2
- 229920002674 hyaluronan Polymers 0.000 description 2
- 229940099552 hyaluronan Drugs 0.000 description 2
- 150000002460 imidazoles Chemical class 0.000 description 2
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 239000012770 industrial material Substances 0.000 description 2
- 208000000509 infertility Diseases 0.000 description 2
- 230000036512 infertility Effects 0.000 description 2
- 208000021267 infertility disease Diseases 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 2
- 125000001786 isothiazolyl group Chemical group 0.000 description 2
- 125000000842 isoxazolyl group Chemical group 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000001418 larval effect Effects 0.000 description 2
- 244000144972 livestock Species 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical class [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 2
- 108091040857 miR-604 stem-loop Proteins 0.000 description 2
- 230000000813 microbial effect Effects 0.000 description 2
- 235000019713 millet Nutrition 0.000 description 2
- 230000001483 mobilizing effect Effects 0.000 description 2
- 229910052750 molybdenum Inorganic materials 0.000 description 2
- 239000011733 molybdenum Substances 0.000 description 2
- 150000002780 morpholines Chemical class 0.000 description 2
- CMAIFALEQSKNFO-UHFFFAOYSA-N n-[2-(3,4-dichlorophenyl)-4-fluorophenyl]-3-(difluoromethyl)-3-methyl-1,2-dihydropyrazole-4-carboxamide Chemical compound FC(F)C1(C)NNC=C1C(=O)NC1=CC=C(F)C=C1C1=CC=C(Cl)C(Cl)=C1 CMAIFALEQSKNFO-UHFFFAOYSA-N 0.000 description 2
- JZEQFZVQDSBWBY-UHFFFAOYSA-N n-[2-(3,4-dichlorophenyl)phenyl]-2-methyl-4-(trifluoromethyl)-1,3-thiazole-5-carboxamide Chemical compound S1C(C)=NC(C(F)(F)F)=C1C(=O)NC1=CC=CC=C1C1=CC=C(Cl)C(Cl)=C1 JZEQFZVQDSBWBY-UHFFFAOYSA-N 0.000 description 2
- USOYHKJIXXCBHH-UHFFFAOYSA-N n-[2-(3,4-dichlorophenyl)phenyl]-5-fluoro-1,3-dimethylpyrazole-4-carboxamide Chemical compound CC1=NN(C)C(F)=C1C(=O)NC1=CC=CC=C1C1=CC=C(Cl)C(Cl)=C1 USOYHKJIXXCBHH-UHFFFAOYSA-N 0.000 description 2
- AYVPXJFRSYHRJX-UHFFFAOYSA-N n-[2-(4-chloro-3-fluorophenyl)phenyl]-4-(difluoromethyl)-2-methyl-1,3-thiazole-5-carboxamide Chemical compound S1C(C)=NC(C(F)F)=C1C(=O)NC1=CC=CC=C1C1=CC=C(Cl)C(F)=C1 AYVPXJFRSYHRJX-UHFFFAOYSA-N 0.000 description 2
- MUBNJDOORQHCRY-UHFFFAOYSA-N n-[5-(4-chlorophenyl)pyrimidin-4-yl]-2-iodo-n-(2-iodobenzoyl)benzamide Chemical compound C1=CC(Cl)=CC=C1C1=CN=CN=C1N(C(=O)C=1C(=CC=CC=1)I)C(=O)C1=CC=CC=C1I MUBNJDOORQHCRY-UHFFFAOYSA-N 0.000 description 2
- 101150038594 nodC gene Proteins 0.000 description 2
- 235000016709 nutrition Nutrition 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- JHIPUJPTQJYEQK-ZLHHXESBSA-N orysastrobin Chemical compound CNC(=O)C(=N\OC)\C1=CC=CC=C1CO\N=C(/C)\C(=N\OC)\C(\C)=N\OC JHIPUJPTQJYEQK-ZLHHXESBSA-N 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 230000003071 parasitic effect Effects 0.000 description 2
- 235000020232 peanut Nutrition 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 239000000575 pesticide Substances 0.000 description 2
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 230000008635 plant growth Effects 0.000 description 2
- 229920000157 polyfructose Polymers 0.000 description 2
- 229920005862 polyol Polymers 0.000 description 2
- 150000003077 polyols Chemical class 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 229920002689 polyvinyl acetate Polymers 0.000 description 2
- 239000011118 polyvinyl acetate Substances 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 235000012015 potatoes Nutrition 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 125000002206 pyridazin-3-yl group Chemical group [H]C1=C([H])C([H])=C(*)N=N1 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 150000003233 pyrroles Chemical class 0.000 description 2
- QJBZDBLBQWFTPZ-UHFFFAOYSA-N pyrrolnitrin Chemical compound [O-][N+](=O)C1=C(Cl)C=CC=C1C1=CNC=C1Cl QJBZDBLBQWFTPZ-UHFFFAOYSA-N 0.000 description 2
- WRPIRSINYZBGPK-UHFFFAOYSA-N quinoxyfen Chemical compound C1=CC(F)=CC=C1OC1=CC=NC2=CC(Cl)=CC(Cl)=C12 WRPIRSINYZBGPK-UHFFFAOYSA-N 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 239000003620 semiochemical Substances 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- MXMXHPPIGKYTAR-UHFFFAOYSA-N silthiofam Chemical compound CC=1SC([Si](C)(C)C)=C(C(=O)NCC=C)C=1C MXMXHPPIGKYTAR-UHFFFAOYSA-N 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 150000003871 sulfonates Chemical class 0.000 description 2
- 239000013589 supplement Substances 0.000 description 2
- 239000004308 thiabendazole Substances 0.000 description 2
- 235000010296 thiabendazole Nutrition 0.000 description 2
- WJCNZQLZVWNLKY-UHFFFAOYSA-N thiabendazole Chemical compound S1C=NC(C=2NC3=CC=CC=C3N=2)=C1 WJCNZQLZVWNLKY-UHFFFAOYSA-N 0.000 description 2
- 229960004546 thiabendazole Drugs 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 239000002562 thickening agent Substances 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000001131 transforming effect Effects 0.000 description 2
- 150000003852 triazoles Chemical class 0.000 description 2
- 229940116861 trichinella britovi Drugs 0.000 description 2
- 229940096911 trichinella spiralis Drugs 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- 210000002268 wool Anatomy 0.000 description 2
- RXDMAYSSBPYBFW-RULNRJAQSA-N (1S,3R)-2,2-dichloro-N-[(1R)-1-(4-chlorophenyl)ethyl]-1-ethyl-3-methylcyclopropanecarboxamide Chemical compound N([C@H](C)C=1C=CC(Cl)=CC=1)C(=O)[C@]1(CC)[C@@H](C)C1(Cl)Cl RXDMAYSSBPYBFW-RULNRJAQSA-N 0.000 description 1
- RXDMAYSSBPYBFW-ISTVAULSSA-N (1r,3s)-2,2-dichloro-n-[(1r)-1-(4-chlorophenyl)ethyl]-1-ethyl-3-methylcyclopropane-1-carboxamide Chemical compound N([C@H](C)C=1C=CC(Cl)=CC=1)C(=O)[C@@]1(CC)[C@H](C)C1(Cl)Cl RXDMAYSSBPYBFW-ISTVAULSSA-N 0.000 description 1
- YMGYZSKZZAFXJG-GMNNJQJHSA-N (2e)-2-methoxyimino-n-methyl-2-[2-[[(e)-1-[3-(trifluoromethyl)phenyl]ethylideneamino]oxymethyl]phenyl]acetamide Chemical compound CNC(=O)C(=N\OC)\C1=CC=CC=C1CO\N=C(/C)C1=CC=CC(C(F)(F)F)=C1 YMGYZSKZZAFXJG-GMNNJQJHSA-N 0.000 description 1
- BOBIZDGUDNVINH-HSZRJFAPSA-N (2r)-n-[2-[4-[3-(4-chlorophenyl)prop-2-ynoxy]-3-methoxyphenyl]ethyl]-2-(methanesulfonamido)-3-methylbutanamide Chemical compound COC1=CC(CCNC(=O)[C@H](NS(C)(=O)=O)C(C)C)=CC=C1OCC#CC1=CC=C(Cl)C=C1 BOBIZDGUDNVINH-HSZRJFAPSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- 125000006426 1-chlorocyclopropyl group Chemical group [H]C1([H])C([H])([H])C1(Cl)* 0.000 description 1
- FZNKJQNEJGXCJH-UHFFFAOYSA-N 1-methyl-3-(trifluoromethyl)pyrazole-4-carboxylic acid Chemical compound CN1C=C(C(O)=O)C(C(F)(F)F)=N1 FZNKJQNEJGXCJH-UHFFFAOYSA-N 0.000 description 1
- MIHIMHDNWHPVMF-UHFFFAOYSA-N 1-n,2-n-dimethoxypropane-1,2-diimine Chemical compound CON=CC(C)=NOC MIHIMHDNWHPVMF-UHFFFAOYSA-N 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- KBLAMUYRMZPYLS-UHFFFAOYSA-N 2,3-bis(2-methylpropyl)naphthalene-1-sulfonic acid Chemical class C1=CC=C2C(S(O)(=O)=O)=C(CC(C)C)C(CC(C)C)=CC2=C1 KBLAMUYRMZPYLS-UHFFFAOYSA-N 0.000 description 1
- ZFFMLCVRJBZUDZ-UHFFFAOYSA-N 2,3-dimethylbutane Chemical group CC(C)C(C)C ZFFMLCVRJBZUDZ-UHFFFAOYSA-N 0.000 description 1
- NILFJBSJBKCDOF-UHFFFAOYSA-N 2-(2,3-dihydro-1h-inden-5-yl)-n-[2-(3,4-dimethoxyphenyl)ethyl]-2-methoxyiminoacetamide Chemical compound C=1C=C2CCCC2=CC=1C(=NOC)C(=O)NCCC1=CC=C(OC)C(OC)=C1 NILFJBSJBKCDOF-UHFFFAOYSA-N 0.000 description 1
- OILIYWFQRJOPAI-UHFFFAOYSA-N 2-(2-chlorophenyl)-1h-benzimidazole Chemical compound ClC1=CC=CC=C1C1=NC2=CC=CC=C2N1 OILIYWFQRJOPAI-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- VBLANKWAHCHHPX-UHFFFAOYSA-N 2-(4-bromophenyl)-n-[2-(3,4-dimethoxyphenyl)ethyl]-2-methoxyiminoacetamide Chemical compound C=1C=C(Br)C=CC=1C(=NOC)C(=O)NCCC1=CC=C(OC)C(OC)=C1 VBLANKWAHCHHPX-UHFFFAOYSA-N 0.000 description 1
- OMKACZRYRKFLFN-UHFFFAOYSA-N 2-(4-chlorophenyl)-n-[2-(3,4-dimethoxyphenyl)ethyl]-2-methoxyiminoacetamide Chemical compound C=1C=C(Cl)C=CC=1C(=NOC)C(=O)NCCC1=CC=C(OC)C(OC)=C1 OMKACZRYRKFLFN-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- IAJOBQBIJHVGMQ-UHFFFAOYSA-N 2-amino-4-[hydroxy(methyl)phosphoryl]butanoic acid Chemical compound CP(O)(=O)CCC(N)C(O)=O IAJOBQBIJHVGMQ-UHFFFAOYSA-N 0.000 description 1
- SJFAQWKKPLXRFZ-UHFFFAOYSA-N 2-but-2-ynoxy-6-iodo-3-propylchromen-4-one Chemical compound C1=C(I)C=C2C(=O)C(CCC)=C(OCC#CC)OC2=C1 SJFAQWKKPLXRFZ-UHFFFAOYSA-N 0.000 description 1
- KDJVKWYVUGSJQR-UHFFFAOYSA-N 2-chloro-n-(1,1,3-trimethyl-2,3-dihydroinden-4-yl)pyridine-3-carboxamide Chemical compound C=12C(C)CC(C)(C)C2=CC=CC=1NC(=O)C1=CC=CN=C1Cl KDJVKWYVUGSJQR-UHFFFAOYSA-N 0.000 description 1
- RSEBUVRVKCANEP-UHFFFAOYSA-N 2-pyrroline Chemical compound C1CC=CN1 RSEBUVRVKCANEP-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- KKADPXVIOXHVKN-UHFFFAOYSA-M 3-(4-hydroxyphenyl)pyruvate Chemical compound OC1=CC=C(CC(=O)C([O-])=O)C=C1 KKADPXVIOXHVKN-UHFFFAOYSA-M 0.000 description 1
- JTXVSQZBGYBTRJ-UHFFFAOYSA-N 3-(4-methylphenyl)thiophen-2-amine Chemical compound C1=CC(C)=CC=C1C1=C(N)SC=C1 JTXVSQZBGYBTRJ-UHFFFAOYSA-N 0.000 description 1
- XRDDHGDZDKTDME-UHFFFAOYSA-N 4-amino-3-(2,2-difluoroethyl)-2h-furan-5-one Chemical compound NC1=C(CC(F)F)COC1=O XRDDHGDZDKTDME-UHFFFAOYSA-N 0.000 description 1
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 1
- 125000004860 4-ethylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000590 4-methylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- UHPMCKVQTMMPCG-UHFFFAOYSA-N 5,8-dihydroxy-2-methoxy-6-methyl-7-(2-oxopropyl)naphthalene-1,4-dione Chemical compound CC1=C(CC(C)=O)C(O)=C2C(=O)C(OC)=CC(=O)C2=C1O UHPMCKVQTMMPCG-UHFFFAOYSA-N 0.000 description 1
- PRZRAMLXTKZUHF-UHFFFAOYSA-N 5-oxo-n-sulfonyl-4h-triazole-1-carboxamide Chemical compound O=S(=O)=NC(=O)N1N=NCC1=O PRZRAMLXTKZUHF-UHFFFAOYSA-N 0.000 description 1
- OMJKVIFSWSQTGQ-UHFFFAOYSA-N 6,7-bis(aziridin-1-yl)quinazoline-5,8-dione Chemical compound C1CN1C=1C(=O)C2=NC=NC=C2C(=O)C=1N1CC1 OMJKVIFSWSQTGQ-UHFFFAOYSA-N 0.000 description 1
- TVSCFMXJYNZEER-UHFFFAOYSA-N 7-methoxy-11a-methyl-1,9b,10,11-tetrahydronaphtho[1,2-g]indole Chemical compound C1CC2(C)CC=NC2=C2C=CC3=CC(OC)=CC=C3C21 TVSCFMXJYNZEER-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- GJCOSYZMQJWQCA-UHFFFAOYSA-N 9H-xanthene Chemical compound C1=CC=C2CC3=CC=CC=C3OC2=C1 GJCOSYZMQJWQCA-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 241000589159 Agrobacterium sp. Species 0.000 description 1
- RGCKGOZRHPZPFP-UHFFFAOYSA-N Alizarin Natural products C1=CC=C2C(=O)C3=C(O)C(O)=CC=C3C(=O)C2=C1 RGCKGOZRHPZPFP-UHFFFAOYSA-N 0.000 description 1
- 241000123646 Allioideae Species 0.000 description 1
- 240000006108 Allium ampeloprasum Species 0.000 description 1
- 235000005254 Allium ampeloprasum Nutrition 0.000 description 1
- 244000291564 Allium cepa Species 0.000 description 1
- 235000002732 Allium cepa var. cepa Nutrition 0.000 description 1
- 244000144725 Amygdalus communis Species 0.000 description 1
- 229920000945 Amylopectin Polymers 0.000 description 1
- 241000208223 Anacardiaceae Species 0.000 description 1
- 241000294569 Aphelenchoides Species 0.000 description 1
- 241000208173 Apiaceae Species 0.000 description 1
- 235000017060 Arachis glabrata Nutrition 0.000 description 1
- 235000010777 Arachis hypogaea Nutrition 0.000 description 1
- 235000018262 Arachis monticola Nutrition 0.000 description 1
- 241001149932 Archaeognatha Species 0.000 description 1
- 241000237518 Arion Species 0.000 description 1
- 241001167018 Aroa Species 0.000 description 1
- 241001480043 Arthrodermataceae Species 0.000 description 1
- 241001225321 Aspergillus fumigatus Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108010016529 Bacillus amyloliquefaciens ribonuclease Proteins 0.000 description 1
- 101000878902 Bacillus thuringiensis Pesticidal crystal protein Cry6Aa Proteins 0.000 description 1
- 101000878906 Bacillus thuringiensis Pesticidal crystal protein Cry6Ba Proteins 0.000 description 1
- 101710183938 Barstar Proteins 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 241000219495 Betulaceae Species 0.000 description 1
- 241000238659 Blatta Species 0.000 description 1
- 241001480060 Blumeria Species 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241001669698 Bostrychus Species 0.000 description 1
- 241000167854 Bourreria succulenta Species 0.000 description 1
- 235000003351 Brassica cretica Nutrition 0.000 description 1
- 235000011293 Brassica napus Nutrition 0.000 description 1
- 235000004221 Brassica oleracea var gemmifera Nutrition 0.000 description 1
- 235000017647 Brassica oleracea var italica Nutrition 0.000 description 1
- 244000308368 Brassica oleracea var. gemmifera Species 0.000 description 1
- 244000304217 Brassica oleracea var. gongylodes Species 0.000 description 1
- 235000010149 Brassica rapa subsp chinensis Nutrition 0.000 description 1
- 244000221633 Brassica rapa subsp chinensis Species 0.000 description 1
- 235000000540 Brassica rapa subsp rapa Nutrition 0.000 description 1
- 235000003343 Brassica rupestris Nutrition 0.000 description 1
- 241000233684 Bremia Species 0.000 description 1
- 239000005741 Bromuconazole Substances 0.000 description 1
- 241000243770 Bursaphelenchus Species 0.000 description 1
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 1
- 241000498608 Cadophora gregata Species 0.000 description 1
- 229910021532 Calcite Inorganic materials 0.000 description 1
- 241001072697 Calonectria ilicicola Species 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 1
- 241000222122 Candida albicans Species 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 235000021538 Chard Nutrition 0.000 description 1
- 241000668556 Chionaspis Species 0.000 description 1
- 108700040089 Chitin synthases Proteins 0.000 description 1
- 241000027435 Chlorophorus Species 0.000 description 1
- 241001124134 Chrysomelidae Species 0.000 description 1
- 235000005979 Citrus limon Nutrition 0.000 description 1
- 244000131522 Citrus pyriformis Species 0.000 description 1
- 240000000560 Citrus x paradisi Species 0.000 description 1
- 241000221760 Claviceps Species 0.000 description 1
- 241000228437 Cochliobolus Species 0.000 description 1
- 235000013162 Cocos nucifera Nutrition 0.000 description 1
- 244000060011 Cocos nucifera Species 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 241001509962 Coptotermes formosanus Species 0.000 description 1
- 241000186031 Corynebacteriaceae Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241001506147 Cryptotermes brevis Species 0.000 description 1
- 240000008067 Cucumis sativus Species 0.000 description 1
- 235000010799 Cucumis sativus var sativus Nutrition 0.000 description 1
- 241000219104 Cucurbitaceae Species 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- 241001523681 Dendrobium Species 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 241001508802 Diaporthe Species 0.000 description 1
- 241000866066 Diaporthe caulivora Species 0.000 description 1
- 241001508801 Diaporthe phaseolorum Species 0.000 description 1
- MDNWOSOZYLHTCG-UHFFFAOYSA-N Dichlorophen Chemical compound OC1=CC=C(Cl)C=C1CC1=CC(Cl)=CC=C1O MDNWOSOZYLHTCG-UHFFFAOYSA-N 0.000 description 1
- 241001399709 Dinoderus minutus Species 0.000 description 1
- 241000399949 Ditylenchus dipsaci Species 0.000 description 1
- 239000004129 EU approved improving agent Substances 0.000 description 1
- 235000007351 Eleusine Nutrition 0.000 description 1
- 241000209215 Eleusine Species 0.000 description 1
- 241000125117 Elsinoe Species 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 241001480036 Epidermophyton floccosum Species 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 241000415266 Ernobius mollis Species 0.000 description 1
- 241000588698 Erwinia Species 0.000 description 1
- 101000999829 Escherichia coli (strain K12) NH(3)-dependent NAD(+) synthetase Proteins 0.000 description 1
- 241000219428 Fagaceae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 240000009088 Fragaria x ananassa Species 0.000 description 1
- 241000879295 Fusarium equiseti Species 0.000 description 1
- 241001208371 Fusarium incarnatum Species 0.000 description 1
- 241001149504 Gaeumannomyces Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 241001442498 Globodera Species 0.000 description 1
- 241001620302 Glomerella <beetle> Species 0.000 description 1
- 239000005561 Glufosinate Substances 0.000 description 1
- 108030006517 Glyphosate oxidoreductases Proteins 0.000 description 1
- 241001481828 Glyptocephalus cynoglossus Species 0.000 description 1
- 241000555709 Guignardia Species 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 241000221557 Gymnosporangium Species 0.000 description 1
- 241001181537 Hemileia Species 0.000 description 1
- 241000239389 Heterobostrychus brunneus Species 0.000 description 1
- 241001480224 Heterodera Species 0.000 description 1
- 241001124200 Heterotermes indicola Species 0.000 description 1
- 101000589450 Homo sapiens Poly(ADP-ribose) glycohydrolase Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229920001202 Inulin Polymers 0.000 description 1
- 241000758791 Juglandaceae Species 0.000 description 1
- 241001387516 Kalotermes flavicollis Species 0.000 description 1
- 239000005909 Kieselgur Substances 0.000 description 1
- 235000003228 Lactuca sativa Nutrition 0.000 description 1
- 241001470016 Laodelphax Species 0.000 description 1
- 241001470017 Laodelphax striatella Species 0.000 description 1
- 241000218195 Lauraceae Species 0.000 description 1
- 235000007849 Lepidium sativum Nutrition 0.000 description 1
- 244000211187 Lepidium sativum Species 0.000 description 1
- 241000228456 Leptosphaeria Species 0.000 description 1
- 229920001732 Lignosulfonate Polymers 0.000 description 1
- 241000234280 Liliaceae Species 0.000 description 1
- 235000004431 Linum usitatissimum Nutrition 0.000 description 1
- 240000006240 Linum usitatissimum Species 0.000 description 1
- 241001220360 Longidorus Species 0.000 description 1
- 241001518485 Lyctus africanus Species 0.000 description 1
- 241001043195 Lyctus brunneus Species 0.000 description 1
- 241000656865 Lyctus linearis Species 0.000 description 1
- 241001495426 Macrophomina phaseolina Species 0.000 description 1
- 241001344133 Magnaporthe Species 0.000 description 1
- 241000721708 Mastotermes darwiniensis Species 0.000 description 1
- 241001143352 Meloidogyne Species 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- 241001668538 Mollisia Species 0.000 description 1
- 241000237852 Mollusca Species 0.000 description 1
- 241001147402 Monachus Species 0.000 description 1
- 241001518729 Monilinia Species 0.000 description 1
- 241000005782 Monographella Species 0.000 description 1
- 241000218231 Moraceae Species 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 240000005561 Musa balbisiana Species 0.000 description 1
- 235000018290 Musa x paradisiaca Nutrition 0.000 description 1
- 241000234615 Musaceae Species 0.000 description 1
- 241000865901 Mycoleptodiscus Species 0.000 description 1
- 241000865904 Mycoleptodiscus terrestris Species 0.000 description 1
- 241000131448 Mycosphaerella Species 0.000 description 1
- 241001477931 Mythimna unipuncta Species 0.000 description 1
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- BAWFJGJZGIEFAR-NNYOXOHSSA-N NAD zwitterion Chemical compound NC(=O)C1=CC=C[N+]([C@H]2[C@@H]([C@H](O)[C@@H](COP([O-])(=O)OP(O)(=O)OC[C@@H]3[C@H]([C@@H](O)[C@@H](O3)N3C4=NC=NC(N)=C4N=C3)O)O2)O)=C1 BAWFJGJZGIEFAR-NNYOXOHSSA-N 0.000 description 1
- 241001226034 Nectria <echinoderm> Species 0.000 description 1
- 241000124176 Neocosmospora Species 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102000015532 Nicotinamide phosphoribosyltransferase Human genes 0.000 description 1
- 108010064862 Nicotinamide phosphoribosyltransferase Proteins 0.000 description 1
- 102000000780 Nicotinate phosphoribosyltransferase Human genes 0.000 description 1
- 108700040046 Nicotinate phosphoribosyltransferases Proteins 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- IOVCWXUNBOPUCH-UHFFFAOYSA-N Nitrous acid Chemical compound ON=O IOVCWXUNBOPUCH-UHFFFAOYSA-N 0.000 description 1
- 239000006057 Non-nutritive feed additive Substances 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 241000207834 Oleaceae Species 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 101000708283 Oryza sativa subsp. indica Protein Rf1, mitochondrial Proteins 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 240000000267 Pandorea jasminoides Species 0.000 description 1
- 235000008753 Papaver somniferum Nutrition 0.000 description 1
- 240000001090 Papaver somniferum Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 241001223281 Peronospora Species 0.000 description 1
- 240000007377 Petunia x hybrida Species 0.000 description 1
- 241000555275 Phaeosphaeria Species 0.000 description 1
- 241000440444 Phakopsora Species 0.000 description 1
- 241000286209 Phasianidae Species 0.000 description 1
- 241000233624 Phytophthora megasperma Species 0.000 description 1
- 241000203073 Phytoplasma sp. Species 0.000 description 1
- 235000010582 Pisum sativum Nutrition 0.000 description 1
- 240000004713 Pisum sativum Species 0.000 description 1
- 241000233626 Plasmopara Species 0.000 description 1
- 241000209504 Poaceae Species 0.000 description 1
- 241000896242 Podosphaera Species 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 102100032347 Poly(ADP-ribose) glycohydrolase Human genes 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241000193943 Pratylenchus Species 0.000 description 1
- 108010035004 Prephenate Dehydrogenase Proteins 0.000 description 1
- 241001384632 Priobium carpini Species 0.000 description 1
- 239000005824 Proquinazid Substances 0.000 description 1
- 108010009736 Protein Hydrolysates Proteins 0.000 description 1
- 235000009827 Prunus armeniaca Nutrition 0.000 description 1
- 244000018633 Prunus armeniaca Species 0.000 description 1
- 240000005809 Prunus persica Species 0.000 description 1
- 235000006040 Prunus persica var persica Nutrition 0.000 description 1
- 241000947836 Pseudomonadaceae Species 0.000 description 1
- 241000521936 Pseudomonas amygdali pv. lachrymans Species 0.000 description 1
- 241000589615 Pseudomonas syringae Species 0.000 description 1
- 241001281802 Pseudoperonospora Species 0.000 description 1
- 241001180370 Psylliodes chrysocephalus Species 0.000 description 1
- 241000396244 Ptilinus Species 0.000 description 1
- 241000220324 Pyrus Species 0.000 description 1
- 235000014443 Pyrus communis Nutrition 0.000 description 1
- 241000599030 Pythium debaryanum Species 0.000 description 1
- 241001505297 Pythium irregulare Species 0.000 description 1
- 241001622896 Pythium myriotylum Species 0.000 description 1
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 241000201375 Radopholus similis Species 0.000 description 1
- 241000173767 Ramularia Species 0.000 description 1
- 244000088415 Raphanus sativus Species 0.000 description 1
- 235000006140 Raphanus sativus var sativus Nutrition 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 241001509967 Reticulitermes flavipes Species 0.000 description 1
- 241000590363 Reticulitermes lucifugus Species 0.000 description 1
- 241000590379 Reticulitermes santonensis Species 0.000 description 1
- 241001633102 Rhizobiaceae Species 0.000 description 1
- 241001515786 Rhynchosporium Species 0.000 description 1
- 101710141795 Ribonuclease inhibitor Proteins 0.000 description 1
- 229940122208 Ribonuclease inhibitor Drugs 0.000 description 1
- 102100037968 Ribonuclease inhibitor Human genes 0.000 description 1
- 108010083644 Ribonucleases Proteins 0.000 description 1
- 102000006382 Ribonucleases Human genes 0.000 description 1
- 235000004789 Rosa xanthina Nutrition 0.000 description 1
- 241000220222 Rosaceae Species 0.000 description 1
- 241000855013 Rotylenchus Species 0.000 description 1
- 241001107098 Rubiaceae Species 0.000 description 1
- 241001093501 Rutaceae Species 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 244000007853 Sarothamnus scoparius Species 0.000 description 1
- 241000242678 Schistosoma Species 0.000 description 1
- 241001558929 Sclerotium <basidiomycota> Species 0.000 description 1
- 239000004113 Sepiolite Substances 0.000 description 1
- 241001533598 Septoria Species 0.000 description 1
- 241001177138 Sinoxylon Species 0.000 description 1
- 241001365173 Sirex juvencus Species 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 241001250060 Sphacelotheca Species 0.000 description 1
- 241000579741 Sphaerotheca <fungi> Species 0.000 description 1
- 241000011575 Spilocaea Species 0.000 description 1
- 241000950030 Sternechus Species 0.000 description 1
- 241000187747 Streptomyces Species 0.000 description 1
- 241000204060 Streptomycetaceae Species 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 108010043934 Sucrose synthase Proteins 0.000 description 1
- 108700006291 Sucrose-phosphate synthases Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 241000228446 Taphrina Species 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 241000352765 Thalloloma anguinum Species 0.000 description 1
- 241001122767 Theaceae Species 0.000 description 1
- 241000722133 Tilletia Species 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- 108090000992 Transferases Proteins 0.000 description 1
- VEAUDLLZYJVHRI-UHFFFAOYSA-N Trichlormethine Chemical compound Cl.ClCCN(CCCl)CCCl VEAUDLLZYJVHRI-UHFFFAOYSA-N 0.000 description 1
- 241001220308 Trichodorus Species 0.000 description 1
- 241000223238 Trichophyton Species 0.000 description 1
- 241001045770 Trichophyton mentagrophytes Species 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical group CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 1
- 235000019714 Triticale Nutrition 0.000 description 1
- 241000215579 Trogoxylon Species 0.000 description 1
- 241000855019 Tylenchorhynchus Species 0.000 description 1
- 241001267618 Tylenchulus Species 0.000 description 1
- 241001267621 Tylenchulus semipenetrans Species 0.000 description 1
- 241000959260 Typhula Species 0.000 description 1
- 239000012963 UV stabilizer Substances 0.000 description 1
- 241000510929 Uncinula Species 0.000 description 1
- 240000006064 Urena lobata Species 0.000 description 1
- 241000122724 Urocerus augur Species 0.000 description 1
- 241001154828 Urocystis <tapeworm> Species 0.000 description 1
- 241000221576 Uromyces Species 0.000 description 1
- 241000221566 Ustilago Species 0.000 description 1
- MNLAVFKVRUQAKW-UHFFFAOYSA-N VR nerve agent Chemical compound CCN(CC)CCSP(C)(=O)OCC(C)C MNLAVFKVRUQAKW-UHFFFAOYSA-N 0.000 description 1
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical class ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 1
- 241000726445 Viroids Species 0.000 description 1
- 235000014787 Vitis vinifera Nutrition 0.000 description 1
- 240000006365 Vitis vinifera Species 0.000 description 1
- 241000589634 Xanthomonas Species 0.000 description 1
- 241000589636 Xanthomonas campestris Species 0.000 description 1
- 241001272684 Xanthomonas campestris pv. oryzae Species 0.000 description 1
- 241000429635 Xestobium rufovillosum Species 0.000 description 1
- 241000201423 Xiphinema Species 0.000 description 1
- 241001510583 Xyleborus Species 0.000 description 1
- 241000964233 Zootermopsis nevadensis Species 0.000 description 1
- PCPQWYHRMVULIX-UHFFFAOYSA-P [1-[2,3-dihydroxy-4-[4-(oxoazaniumylmethylidene)pyridin-1-yl]butyl]pyridin-4-ylidene]methyl-oxoazanium;dinitrate Chemical compound [O-][N+]([O-])=O.[O-][N+]([O-])=O.C1=CC(=C[NH+]=O)C=CN1CC(O)C(O)CN1C=CC(=C[NH+]=O)C=C1 PCPQWYHRMVULIX-UHFFFAOYSA-P 0.000 description 1
- BTIIGNUPPKUQAP-UHFFFAOYSA-N [1-[2,3-dihydroxy-4-[4-(oxoazaniumylmethylidene)pyridin-1-yl]butyl]pyridin-4-ylidene]methyl-oxoazanium;diperchlorate Chemical compound [O-]Cl(=O)(=O)=O.[O-]Cl(=O)(=O)=O.C1=CC(=C[NH+]=O)C=CN1CC(O)C(O)CN1C=CC(=C[NH+]=O)C=C1 BTIIGNUPPKUQAP-UHFFFAOYSA-N 0.000 description 1
- DIYJBUVMRKUYSW-UHFFFAOYSA-N [1-[[2,2-bis(bromomethyl)-3-[[4-(oxoazaniumylmethylidene)pyridin-1-yl]methoxy]propoxy]methyl]pyridin-4-ylidene]methyl-oxoazanium;dichloride Chemical compound [Cl-].[Cl-].C1=CC(=C[NH+]=O)C=CN1COCC(CBr)(CBr)COCN1C=CC(=C[NH+]=O)C=C1 DIYJBUVMRKUYSW-UHFFFAOYSA-N 0.000 description 1
- VHVGFEDTMPYCSX-UHFFFAOYSA-N [1-[[2,2-dimethyl-3-[[4-(oxoazaniumylmethylidene)pyridin-1-yl]methoxy]propoxy]methyl]pyridin-4-ylidene]methyl-oxoazanium;dichloride Chemical compound [Cl-].[Cl-].C1=CC(=C[NH+]=O)C=CN1COCC(C)(C)COCN1C=CC(=C[NH+]=O)C=C1 VHVGFEDTMPYCSX-UHFFFAOYSA-N 0.000 description 1
- 241000222126 [Candida] glabrata Species 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000009418 agronomic effect Effects 0.000 description 1
- HFVAFDPGUJEFBQ-UHFFFAOYSA-M alizarin red S Chemical compound [Na+].O=C1C2=CC=CC=C2C(=O)C2=C1C=C(S([O-])(=O)=O)C(O)=C2O HFVAFDPGUJEFBQ-UHFFFAOYSA-M 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 125000006193 alkinyl group Chemical group 0.000 description 1
- 150000008055 alkyl aryl sulfonates Chemical class 0.000 description 1
- 150000004996 alkyl benzenes Chemical class 0.000 description 1
- 150000008051 alkyl sulfates Chemical class 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- 235000020224 almond Nutrition 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- DTOSIQBPPRVQHS-PDBXOOCHSA-N alpha-linolenic acid Chemical compound CC\C=C/C\C=C/C\C=C/CCCCCCCC(O)=O DTOSIQBPPRVQHS-PDBXOOCHSA-N 0.000 description 1
- 235000020661 alpha-linolenic acid Nutrition 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 150000001448 anilines Chemical class 0.000 description 1
- 150000008059 anilinopyrimidines Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 244000000054 animal parasite Species 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 230000000843 anti-fungal effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 229940091771 aspergillus fumigatus Drugs 0.000 description 1
- 229960000892 attapulgite Drugs 0.000 description 1
- 239000005667 attractant Substances 0.000 description 1
- 150000003851 azoles Chemical class 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 238000003287 bathing Methods 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- GINJFDRNADDBIN-FXQIFTODSA-N bilanafos Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCP(C)(O)=O GINJFDRNADDBIN-FXQIFTODSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 238000010352 biotechnological method Methods 0.000 description 1
- QKSKPIVNLNLAAV-UHFFFAOYSA-N bis(2-chloroethyl) sulfide Chemical compound ClCCSCCCl QKSKPIVNLNLAAV-UHFFFAOYSA-N 0.000 description 1
- CODNYICXDISAEA-UHFFFAOYSA-N bromine monochloride Chemical compound BrCl CODNYICXDISAEA-UHFFFAOYSA-N 0.000 description 1
- HJJVPARKXDDIQD-UHFFFAOYSA-N bromuconazole Chemical compound ClC1=CC(Cl)=CC=C1C1(CN2N=CN=C2)OCC(Br)C1 HJJVPARKXDDIQD-UHFFFAOYSA-N 0.000 description 1
- 230000001680 brushing effect Effects 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 229940095731 candida albicans Drugs 0.000 description 1
- 208000032343 candida glabrata infection Diseases 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical class OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 108010040093 cellulose synthase Proteins 0.000 description 1
- 239000003610 charcoal Substances 0.000 description 1
- ALLOLPOYFRLCCX-UHFFFAOYSA-N chembl1986529 Chemical compound COC1=CC=CC=C1N=NC1=C(O)C=CC2=CC=CC=C12 ALLOLPOYFRLCCX-UHFFFAOYSA-N 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 235000019693 cherries Nutrition 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 239000011093 chipboard Substances 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 125000000068 chlorophenyl group Chemical group 0.000 description 1
- 210000003763 chloroplast Anatomy 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 238000005253 cladding Methods 0.000 description 1
- 239000008199 coating composition Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000002826 coolant Substances 0.000 description 1
- 239000005068 cooling lubricant Substances 0.000 description 1
- 239000000498 cooling water Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 230000036576 dermal application Effects 0.000 description 1
- 230000037304 dermatophytes Effects 0.000 description 1
- GUJOJGAPFQRJSV-UHFFFAOYSA-N dialuminum;dioxosilane;oxygen(2-);hydrate Chemical compound O.[O-2].[O-2].[O-2].[Al+3].[Al+3].O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O GUJOJGAPFQRJSV-UHFFFAOYSA-N 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- 229960003887 dichlorophen Drugs 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 231100000676 disease causative agent Toxicity 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000010459 dolomite Substances 0.000 description 1
- 229910000514 dolomite Inorganic materials 0.000 description 1
- 235000021038 drupes Nutrition 0.000 description 1
- 244000078703 ectoparasite Species 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 125000000219 ethylidene group Chemical group [H]C(=[*])C([H])([H])[H] 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000003631 expected effect Effects 0.000 description 1
- 210000003414 extremity Anatomy 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000000834 fixative Substances 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- 230000009969 flowable effect Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 235000012055 fruits and vegetables Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 150000002357 guanidines Chemical class 0.000 description 1
- 210000004209 hair Anatomy 0.000 description 1
- 125000005347 halocycloalkyl group Chemical group 0.000 description 1
- 125000004461 halocycloalkylalkyl group Chemical group 0.000 description 1
- 150000005694 halopyrimidines Chemical class 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 235000012907 honey Nutrition 0.000 description 1
- BHEPBYXIRTUNPN-UHFFFAOYSA-N hydridophosphorus(.) (triplet) Chemical compound [PH] BHEPBYXIRTUNPN-UHFFFAOYSA-N 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- 239000001023 inorganic pigment Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- JYJIGFIDKWBXDU-MNNPPOADSA-N inulin Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)OC[C@]1(OC[C@]2(OC[C@]3(OC[C@]4(OC[C@]5(OC[C@]6(OC[C@]7(OC[C@]8(OC[C@]9(OC[C@]%10(OC[C@]%11(OC[C@]%12(OC[C@]%13(OC[C@]%14(OC[C@]%15(OC[C@]%16(OC[C@]%17(OC[C@]%18(OC[C@]%19(OC[C@]%20(OC[C@]%21(OC[C@]%22(OC[C@]%23(OC[C@]%24(OC[C@]%25(OC[C@]%26(OC[C@]%27(OC[C@]%28(OC[C@]%29(OC[C@]%30(OC[C@]%31(OC[C@]%32(OC[C@]%33(OC[C@]%34(OC[C@]%35(OC[C@]%36(O[C@@H]%37[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O%37)O)[C@H]([C@H](O)[C@@H](CO)O%36)O)[C@H]([C@H](O)[C@@H](CO)O%35)O)[C@H]([C@H](O)[C@@H](CO)O%34)O)[C@H]([C@H](O)[C@@H](CO)O%33)O)[C@H]([C@H](O)[C@@H](CO)O%32)O)[C@H]([C@H](O)[C@@H](CO)O%31)O)[C@H]([C@H](O)[C@@H](CO)O%30)O)[C@H]([C@H](O)[C@@H](CO)O%29)O)[C@H]([C@H](O)[C@@H](CO)O%28)O)[C@H]([C@H](O)[C@@H](CO)O%27)O)[C@H]([C@H](O)[C@@H](CO)O%26)O)[C@H]([C@H](O)[C@@H](CO)O%25)O)[C@H]([C@H](O)[C@@H](CO)O%24)O)[C@H]([C@H](O)[C@@H](CO)O%23)O)[C@H]([C@H](O)[C@@H](CO)O%22)O)[C@H]([C@H](O)[C@@H](CO)O%21)O)[C@H]([C@H](O)[C@@H](CO)O%20)O)[C@H]([C@H](O)[C@@H](CO)O%19)O)[C@H]([C@H](O)[C@@H](CO)O%18)O)[C@H]([C@H](O)[C@@H](CO)O%17)O)[C@H]([C@H](O)[C@@H](CO)O%16)O)[C@H]([C@H](O)[C@@H](CO)O%15)O)[C@H]([C@H](O)[C@@H](CO)O%14)O)[C@H]([C@H](O)[C@@H](CO)O%13)O)[C@H]([C@H](O)[C@@H](CO)O%12)O)[C@H]([C@H](O)[C@@H](CO)O%11)O)[C@H]([C@H](O)[C@@H](CO)O%10)O)[C@H]([C@H](O)[C@@H](CO)O9)O)[C@H]([C@H](O)[C@@H](CO)O8)O)[C@H]([C@H](O)[C@@H](CO)O7)O)[C@H]([C@H](O)[C@@H](CO)O6)O)[C@H]([C@H](O)[C@@H](CO)O5)O)[C@H]([C@H](O)[C@@H](CO)O4)O)[C@H]([C@H](O)[C@@H](CO)O3)O)[C@H]([C@H](O)[C@@H](CO)O2)O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JYJIGFIDKWBXDU-MNNPPOADSA-N 0.000 description 1
- 229940029339 inulin Drugs 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 150000003951 lactams Chemical class 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- AIHDCSAXVMAMJH-GFBKWZILSA-N levan Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)OC[C@@H]1[C@@H](O)[C@H](O)[C@](CO)(CO[C@@H]2[C@H]([C@H](O)[C@@](O)(CO)O2)O)O1 AIHDCSAXVMAMJH-GFBKWZILSA-N 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- 229920005610 lignin Polymers 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 229960004488 linolenic acid Drugs 0.000 description 1
- KQQKGWQCNNTQJW-UHFFFAOYSA-N linolenic acid Natural products CC=CCCC=CCC=CCCCCCCCC(O)=O KQQKGWQCNNTQJW-UHFFFAOYSA-N 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 239000004579 marble Substances 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- YLGXILFCIXHCMC-JHGZEJCSSA-N methyl cellulose Chemical compound COC1C(OC)C(OC)C(COC)O[C@H]1O[C@H]1C(OC)C(OC)C(OC)OC1COC YLGXILFCIXHCMC-JHGZEJCSSA-N 0.000 description 1
- 230000003641 microbiacidal effect Effects 0.000 description 1
- 229940124561 microbicide Drugs 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 239000011490 mineral wool Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 201000002266 mite infestation Diseases 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 229910052901 montmorillonite Inorganic materials 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 235000010460 mustard Nutrition 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- ZUHZZVMEUAUWHY-UHFFFAOYSA-N n,n-dimethylpropan-1-amine Chemical compound CCCN(C)C ZUHZZVMEUAUWHY-UHFFFAOYSA-N 0.000 description 1
- SFCRAUZCKNDIHE-UHFFFAOYSA-N n-[2-(3,4-dimethoxyphenyl)ethyl]-2-(4-ethylphenyl)-2-methoxyiminoacetamide Chemical compound C1=CC(CC)=CC=C1C(=NOC)C(=O)NCCC1=CC=C(OC)C(OC)=C1 SFCRAUZCKNDIHE-UHFFFAOYSA-N 0.000 description 1
- REUONIBEWFCMIR-UHFFFAOYSA-N n-[2-(3,4-dimethoxyphenyl)ethyl]-2-methoxyimino-2-(4-methylphenyl)acetamide Chemical compound C=1C=C(C)C=CC=1C(=NOC)C(=O)NCCC1=CC=C(OC)C(OC)=C1 REUONIBEWFCMIR-UHFFFAOYSA-N 0.000 description 1
- ARLSIVYGMXINCU-UHFFFAOYSA-N n-[2-(3,4-dimethoxyphenyl)ethyl]-2-methoxyimino-2-(5,6,7,8-tetrahydronaphthalen-2-yl)acetamide Chemical compound C=1C=C2CCCCC2=CC=1C(=NOC)C(=O)NCCC1=CC=C(OC)C(OC)=C1 ARLSIVYGMXINCU-UHFFFAOYSA-N 0.000 description 1
- ZBCYASQOTTWDIV-UHFFFAOYSA-N n-[2-(4-chlorophenyl)phenyl]-4-(difluoromethyl)-2-methyl-1,3-thiazole-5-carboxamide Chemical compound S1C(C)=NC(C(F)F)=C1C(=O)NC1=CC=CC=C1C1=CC=C(Cl)C=C1 ZBCYASQOTTWDIV-UHFFFAOYSA-N 0.000 description 1
- YEGIVZPZMYYGHT-UHFFFAOYSA-N n-[2-(4-methylpentan-2-yl)phenyl]-2-(trifluoromethyl)benzamide Chemical compound CC(C)CC(C)C1=CC=CC=C1NC(=O)C1=CC=CC=C1C(F)(F)F YEGIVZPZMYYGHT-UHFFFAOYSA-N 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- XGXNTJHZPBRBHJ-UHFFFAOYSA-N n-phenylpyrimidin-2-amine Chemical compound N=1C=CC=NC=1NC1=CC=CC=C1 XGXNTJHZPBRBHJ-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229950006238 nadide Drugs 0.000 description 1
- 239000005445 natural material Substances 0.000 description 1
- 229940042880 natural phospholipid Drugs 0.000 description 1
- 239000005645 nematicide Substances 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 1
- JOUIQRNQJGXQDC-ZYUZMQFOSA-L nicotinate D-ribonucleotide(2-) Chemical compound O1[C@H](COP([O-])([O-])=O)[C@@H](O)[C@@H](O)[C@@H]1[N+]1=CC=CC(C([O-])=O)=C1 JOUIQRNQJGXQDC-ZYUZMQFOSA-L 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 230000014075 nitrogen utilization Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 108020004707 nucleic acids Proteins 0.000 description 1
- 150000007523 nucleic acids Chemical class 0.000 description 1
- 102000039446 nucleic acids Human genes 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000008723 osmotic stress Effects 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 125000003854 p-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Cl 0.000 description 1
- 229910052625 palygorskite Inorganic materials 0.000 description 1
- 239000011087 paperboard Substances 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000010451 perlite Substances 0.000 description 1
- 235000019362 perlite Nutrition 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000029553 photosynthesis Effects 0.000 description 1
- 238000010672 photosynthesis Methods 0.000 description 1
- 239000001007 phthalocyanine dye Substances 0.000 description 1
- 230000000885 phytotoxic effect Effects 0.000 description 1
- 238000005554 pickling Methods 0.000 description 1
- 230000008121 plant development Effects 0.000 description 1
- 230000037039 plant physiology Effects 0.000 description 1
- 239000011120 plywood Substances 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000032361 posttranscriptional gene silencing Effects 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 235000013594 poultry meat Nutrition 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- FLVBXVXXXMLMOX-UHFFFAOYSA-N proquinazid Chemical compound C1=C(I)C=C2C(=O)N(CCC)C(OCCC)=NC2=C1 FLVBXVXXXMLMOX-UHFFFAOYSA-N 0.000 description 1
- 239000011814 protection agent Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 239000003531 protein hydrolysate Substances 0.000 description 1
- 239000008262 pumice Substances 0.000 description 1
- 125000004944 pyrazin-3-yl group Chemical group [H]C1=C([H])N=C(*)C([H])=N1 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- ZVJHJDDKYZXRJI-UHFFFAOYSA-N pyrroline Natural products C1CC=NC1 ZVJHJDDKYZXRJI-UHFFFAOYSA-N 0.000 description 1
- 229960002132 pyrrolnitrin Drugs 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 239000005871 repellent Substances 0.000 description 1
- 230000002940 repellent Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 229940043267 rhodamine b Drugs 0.000 description 1
- 239000003161 ribonuclease inhibitor Substances 0.000 description 1
- 230000005070 ripening Effects 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- 230000002786 root growth Effects 0.000 description 1
- 235000012045 salad Nutrition 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 150000004671 saturated fatty acids Chemical class 0.000 description 1
- 229910052624 sepiolite Inorganic materials 0.000 description 1
- 235000019355 sepiolite Nutrition 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 239000004544 spot-on Substances 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 235000021012 strawberries Nutrition 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- SSGGNFYQMRDXFH-UHFFFAOYSA-N sulfanylurea Chemical class NC(=O)NS SSGGNFYQMRDXFH-UHFFFAOYSA-N 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 150000003458 sulfonic acid derivatives Chemical class 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- RZRJACCZWZTYJY-UHFFFAOYSA-N tert-butylsulfanyl n,n-dimethylcarbamodithioate Chemical compound CN(C)C(=S)SSC(C)(C)C RZRJACCZWZTYJY-UHFFFAOYSA-N 0.000 description 1
- 239000004753 textile Substances 0.000 description 1
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical class NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- 230000001256 tonic effect Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 125000005270 trialkylamine group Chemical group 0.000 description 1
- 125000004205 trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 125000002348 vinylic group Chemical group 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 241000228158 x Triticosecale Species 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/34—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom
- A01N43/40—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with one nitrogen atom as the only ring hetero atom six-membered rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/365—Lactones
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
Description
- Die vorliegende Erfindung betrifft neue Wirkstoffkombinationen, die eine bekannte Verbindung der Formel (I) einerseits und mindestens einen bekannten fungiziden Wirkstoff andererseits enthalten und sehr gut zur Bekämpfung von unerwünschten tierischen Schädlingen wie Insekten sowie unerwünschten phytopathogenen Pilzen geeignet sind.
-
- A
- für Pyrid-2-yl oder Pyrid-4-yl steht oder für Pyrid-3-yl, welches gegebenenfalls in 6-Position substituiert ist durch Fluor, Chlor, Brom, Methyl, Trifluormethyl oder Trifluormethoxy oder für Pyridazin-3-yl, welches gegebenenfalls in 6-Position substituiert ist durch Chlor oder Methyl oder für Pyrazin-3-yl oder für 2-Chlor-pyrazin-5-yl oder für 1,3-Thiazol-5-yl, welches gegebenenfalls in 2-Position substituiert ist durch Chlor oder Methyl, oder
- A
- für einen Rest Pyrimidinyl, Pyrazolyl, Thiophenyl, Oxazolyl, Isoxazolyl, 1,2,4-Oxadiazolyl, Isothiazolyl, 1,2,4-Triazolyl oder 1,2,5-Thiadiazolyl steht, welcher gegebenenfalls durch Fluor, Chlor, Brom, Cyano, Nitro, C1-C4-Alkyl (welches gegebenenfalls durch Fluor und/oder Chlor substituiert ist), C1-C3-Alkylthio (welches gegebenenfalls durch Fluor und/oder Chlor substituiert ist), oder C1-C3-Alkylsulfonyl (welches gegebenenfalls durch Fluor und/oder Chlor substituiert ist), substituiert ist,
- A
- für einen Rest
- X
- für Halogen, Alkyl oder Halogenalkyl steht
- Y
- für Halogen, Alkyl, Halogenalkyl, Halogenalkoxy, Azido oder Cyan steht und
- R1
- für Alkyl, Halogenalkyl, Alkenyl, Halogenalkenyl, Alkinyl, Cycloalkyl, Cycloalkylalkyl, Halogencycloalkyl, Alkoxy, Alkoxyalkyl, oder Halogencycloalkylalkyl steht,
- Ferner ist schon bekannt, dass zahlreiche Triazol-Derivate, Anilin-Derivate, Dicarboximide und andere Heterocyclen zur Bekämpfung von Pilzen eingesetzt werden können (vgl.
EP-A 0 040 345 ,DE-A 22 01 063 ,DE-A 23 24 010 , Pesticide Manual, 9th. Edition (1991), Seiten 249 und 827,EP-A 0 382 375 ,EP-A 0515 901 ,DE-B2 2732257 ). Die Wirkung dieser Stoffe ist aber bei niedrigen Aufwandmengen nicht immer ausreichend. - Ferner ist bereits bekannt, dass 1-(3,5-Dimethyl-isoxazol-4-sulfonyl)-2-chlor-6,6-difluor-[1,3]-dioxolo-[4,5f]-benzimidazol fungizide Eigenschaften besitzt (vgl.
WO 97/06171 - Schließlich ist auch bekannt, dass substituierte Halogenpyrimidine fungizide Eigenschaften besitzen (vgl.
DE-A1-196 46 407 ,EP-B-712 396 - Es wurde nun gefunden, dass Wirkstoffkombinationen der Verbindung der Formel (I), in der A für 6-Chlor-pyrid-3-yl steht und R1 für 2,2-Difluor-ethyl steht (Verbindung der Formel (I-5)), und mindestens einem Wirkstoff, der aus den im Folgenden genannten Gruppen (2) bis (25) ausgewählt ist, synergistisch wirksam sind und sehr gute insektizide und fungizide Eigenschaften aufweisen.
-
- A1
- für eine der Gruppen
- A2
- für NH oder O steht,
- A3
- für N oder CH steht,
- L
- für eine der Gruppen
- R11
- für jeweils gegebenenfalls einfach oder zweifach, gleich oder verschieden durch Chlor, Cyano, Methyl oder Trifluormethyl substituiertes Phenyl, Phenoxy oder Pyridinyl, oder für 1-(4-Chlorphenyl)-pyrazol-3-yl oder für 1,2-Propandion-bis(O-methyloxim)-1-yl steht,
- R12
- für Wasserstoff oder Fluor steht;
-
- Q
- für Wasserstoff oder SH steht,
- m
- für 0 oder 1 steht,
- R13
- für Wasserstoff, Fluor, Chlor, Phenyl oder 4-Chlor-phenoxy steht,
- R14
- für Wasserstoff oder Chlor steht,
- A4
- für eine direkte Bindung, -CH2-, -(CH2)2-, -O-, für *-CH2-CHR17- oder *-CH=CR17- steht, wobei die mit * markierte Bindung mit dem Phenylring verknüpft ist, und
- R15 und R17
- dann zusammen für -CH2-CH2-CH[CH(CH3)2]- oder -CH2-CH2-C(CH3)2- stehen,
- A5
- für C oder Si (Silizium) steht,
- A4
- außerdem für -N(R17)- steht und A5 außerdem zusammen mit R15 und R16 für die Gruppe C=N-R18 steht, wobei R17 und R18 dann zusammen für die Gruppe
- R15
- für Wasserstoff, Hydroxy oder Cyano steht,
- R16
- für 1-Cyclopropylethyl, 1-Chlorcyclopropyl, C1-C4-Alkyl, C1-C6-Hydroxyalkyl, C1-C4-Alkylcarbonyl, C1-C2-Halogenalkoxy-C1-C2-alkyl, Trimethylsilyl-C1-C2-alkyl, Monofluorphenyl, oder Phenyl steht,
- R15 und R16
- außerdem zusammen für -O-CH2-CH(R18)-O-, -O-CH2-CH(R18)-CH2-, oder -O-CH-(2-Chlorphenyl)-stehen,
- R18
- für Wasserstoff, C1-C4-Alkyl oder Brom steht;
-
- Gruppe (5) Valinamide ausgewählt aus
- (5-1) Iprovalicarb
- (5-2) N1-[2-(4-{[3-(4-chlorophenyl)-2-propynyl]oxy}-3-methoxyphenyl)ethyl]-N2-(methylsulfonyl)-D-valinamid
- (5-3) Benthiavalicarb
-
- X
- für 2-Chlor-3-pyridinyl, für 1-Methylpyrazol-4-yl, welches in 3-Position durch Methyl oder Trifluormethyl und in 5-Position durch Wasserstoff oder Chlor substituiert ist, für 4-Ethyl-2-ethylamino-1,3-thiazol-5-yl, für 1-Methyl-cyclohexyl, für 2,2-Dichlor-1-ethyl-3-methyl-cyclopropyl, für 2-Fluor-2-propyl, 3,4-Dichlor-isothiazol-5-yl, 5,6-Dihydro-2-methyl-1,4-oxathiin-3-yl, 4-Methyl-1,2,3-thiadiazol-5-yl, 4,5-Dimethyl-2-trimethylsilyl-thiophen-3-yl, 1-Methylpyrrol-3-yl, welches in 4-Position durch Methyl oder Trifluormethyl und in 5-Position durch Wasserstoff oder Chlor substituiert ist, oder für Phenyl steht, welches einfach bis dreifach, gleich oder verschieden durch Chlor, Methyl oder Trifluormethyl substituiert ist, steht,
- Y
- für eine direkte Bindung, gegebenenfalls durch Chlor, Cyano oder Oxo substituiertes C1-C6-Alkandiyl (Alkylen), für C2-C6-Alkendiyl (Alkenylen) oder Thiophendiyl steht,
- Z
- für Wasserstoff, C1-C6-Alkyl oder die Gruppe
- A6
- für CH oder N steht,
- R20
- für Wasserstoff, Chlor, Cyano, C1-C6-Alkyl, durch gegebenenfalls einfach oder zweifach, gleich oder verschieden durch Chlor oder Di(C1-C3-alkyl)aminocarbonyl substituiertes Phenyl steht,
- R21
- für Wasserstoff, Chlor oder Isopropoxy steht,
- R22
- für Wasserstoff, Chlor, Hydroxy, Methyl, Trifluormethyl oder Di(C1-C3-alkyl)aminocarbonyl steht,
- R20 und R21
- außerdem gemeinsam für *-CH(CH3)-CH2-C(CH3)2- oder *-CH(CH3)-O-C(CH3)2-stehen, wobei die mit * markierte Bindung mit R20 verknüpft ist;
- Gruppe (7) Dithiocarbamate ausgewählt aus
- (7-1) Mancozeb
- (7-2) Maneb
- (7-3) Metiram
- (7-4) Propineb
- (7-5) Thiram
- (7-6) Zineb
- (7-7) Ziram
-
- *
- ein Kohlenstoffatom in der (R)- oder der (S)-Konfiguration, bevorzugt in der (S)-Konfiguration, kennzeichnet,
- R23
- für Benzyl, Furyl oder Methoxymethyl steht;
-
- R24
- für Methyl, Cyclopropyl oder 1-Propinyl steht;
-
- R25 und R26
- jeweils für Wasserstoff oder zusammen für -O-CF2-O- stehen,
- R27
- für Wasserstoff, C1-C4-Alkylaminocarbonyl oder für 3,5-Dimethylisoxazol-4-ylsulfonyl steht,
- R28
- für Chlor, Methoxycarbonylamino, Chlorphenyl, Furyl oder Thiazolyl steht;
-
- R29
- für n- oder iso-Propyl steht,
- R30
- für Di(C1-C2-alkyl)amino-C2-C4-alkyl oder Diethoxyphenyl steht,
- Gruppe (12): Dicarboximide ausgewählt aus
- (12-1) Captafol
- (12-2) Captan
- (12-3) Folpet
- (12-4) Iprodione
- (12-5) Procymidone
- (12-6) Vinclozolin
- Gruppe (13): Guanidine ausgewählt aus
- (13-1) Dodine
- (13-2) Guazatine
- (13-3) Iminoctadine triacetate
- (13-4) Iminoctadine tris(albesilate)
- Gruppe (14): Imidazole ausgewählt aus
- (14-1) Cyazofamid
- (14-2) Prochloraz
- (14-3) Triazoxide
- (14-4) Pefurazoate
- (14-5) Fenamidone
-
- R31 und R32
- unabhängig voneinander für Wasserstoff oder Methyl stehen,
- R33
- für C1-C14-Alkyl (bevorzugt C12-C14-Alkyl), C5-C12-Cycloalkyl (bevorzugt C10-C12-Cycloalkyl), Phenyl-C1-C4-alkyl, welches im Phenylteil durch Halogen oder C1-C4-Alkyl substituiert sein kann, oder für Acrylyl, welches durch Chlorphenyl und Dimethoxyphenyl substituiert ist, steht;
-
- R34
- für Chlor oder Cyano steht,
- R35
- für Chlor oder Nitro steht,
- R36
- für Chlor steht,
- R35 und R36
- außerdem gemeinsam für -O-CF2-O- stehen;
- Gruppe (17): (Thio)Phosphonate ausgewählt aus
- (17-1) Fosetyl-Al,
- (17-2) Phosphonsäure,
- (17-3) Tolclophos-methyl;
-
- R37
- für unsubstituiertes oder durch Fluor, Chlor, Brom, Methyl oder Ethyl substituiertes Phenyl, 2-Naphthyl, 1,2,3,4-Tetrahydronaphthyl oder Indanyl steht;
- Gruppe (19): Fungizide ausgewählt aus
- (19-1) Acibenzolar-S-methyl
- (19-2) Chlorothalonil
- (19-3) Cymoxanil
- (19-4) Edifenphos
- (19-5) Famoxadone
- (19-6) Fluazinam
- (19-7) Kupferoxychlorid
- (19-8) Kupferhydroxid
- (19-9) Oxadixyl
- (19-10) Spiroxamine
- (19-11) Dithianon
- (19-12) Metrafenone
- (19-14) 2,3-Dibutyl-6-chlor-thieno[2,3-d]pyrimidin-4(3H)on
- (19-15) Probenazole
- (19-16) Isoprothiolane
- (19-17) Kasugamycin
- (19-18) Phthalide
- (19-19) Ferimzone
- (19-20) Tricyclazole
- (19-21) Cyprosulfamide
- (19-22) Mandipropamid
- (19-23) Quinoxyfen (bekannt aus
EP-A 326 330 - (19-24) Proquinazid (bekannt aus
WO 94/26722 - Gruppe (20): (Thio)Harnstoff-Derivate ausgewählt aus
- (20-1) Pencycuron
- (20-2) Thiophanate-methyl
- (20-3) Thiophanate-ethyl
-
- A7
- für eine direkte Bindung oder -O- steht,
- A8
- für -C(=O)NH- oder -NHC(=O)- steht,
- R38
- für Wasserstoff oder C1-C4-Alkyl steht,
- R39
- für C1-C6-Alkyl steht;
-
- R40
- für C1-C6-Alkyl oder C2-C6-Alkenyl steht,
- R41
- für C1-C6-Alkyl steht,
- R40 und R41
- außerdem gemeinsam für C4-C5-Alkandiyl (Alkylen) stehen, welches einfach oder zweifach durch C1-C6-Alkyl substituiert ist,
- R42
- für Brom oder Chlor steht,
- R43 und R47
- unabhängig voneinander für Wasserstoff, Fluor, Chlor oder Methyl stehen,
- R44 und R46
- unabhängig voneinander für Wasserstoff oder Fluor stehen,
- R45
- für Wasserstoff, Fluor oder Methyl steht,
-
- R48
- für C1-C6-Alkyl steht,
- R49
- für C1-C6-Alkyl, C2-C6-Alkenyl oder C2-C6-Alkinyl steht;
-
- R50
- für Wasserstoff oder Fluor steht,
- R51
- für Fluor, Chlor, Brom, Methyl, Trifluormethyl, Trifluormethoxy, -CH=N-OMe oder -C(Me)=N-OMe steht,
- R52
- für Wasserstoff, Fluor, Chlor, Brom, Methyl oder Trifluormethyl steht, Het für einen der folgenden Reste Hetl bis Het7 steht:
- R53
- für Iod, Methyl, Difluormethyl oder Trifluormethyl steht,
- R54
- für Wasserstoff, Fluor, Chlor oder Methyl steht,
- R55
- für Methyl, Difluormethyl oder Trifluormethyl steht,
- R56
- für Chlor, Brom, Iod, Methyl, Difluormethyl oder Trifluormethyl steht,
- R57
- für Methyl oder Trifluormethyl steht.
- Gruppe (25): Sulfonamide
- (25-1) Amisulbrom
- Überraschenderweise ist die fungizide Wirkung der erfindungsgemäßen Wirkstoffkombinationen wesentlich höher als die Summe der Wirkungen der einzelnen Wirkstoffe. Es liegt also ein nicht vorhersehbarer, echter synergistischer Effekt vor und nicht nur eine Wirkungsergänzung.
- Überraschenderweise ist die insektizide Wirkung der erfindungsgemäßen Wirkstoffkombinationen ebenfalls wesentlich höher als die Summe der Wirkungen der einzelnen Wirkstoffe. Es liegt also ein nicht vorhersehbarer, echter synergistischer Effekt vor und nicht nur eine Wirkungsergänzung.
- Die erfindungsgemäßen Wirkstoffkombinationen enthalten neben der Verbindung der Formel (I) mindestens einen Wirkstoff der oben aufgeführten Gruppen (2) bis (25). Bevorzugt enthalten die erfindungsgemäßen Wirkstoffkombinationen genau eine Verbindung der Formel (I) und genau einen Wirkstoff der oben aufgeführten Gruppen (2) bis (25). Weiterhin bevorzugt sind Wirkstoffkombinationen, die eine Verbindung der Formel (I) und zwei Wirkstoffe der oben aufgeführten Gruppen (2) bis (25) enthalten.
- Im Einzelnen sei die folgende Verbindung der allgemeinen Formel (I) genannt:
- • Verbindung (1-5), 4-{[(6-Chlorpyrid-3-yl)methyl](2,2-difluorethyl)aminolfuran-2(5H)-on, besitzt die Formel
EP2007/002386 - Die Formel (II) umfasst folgende bevorzugte Kombinationspartner der Gruppe (2):
- (2-1) Azoxystrobin (bekannt aus
EP-A 0 382 375 ) der Formel - (2-2) Fluoxastrobin (bekannt aus
DE-A 196 02 095 ) der Formel - (2-3) (2E)-2-(2-{[6-(3-Chior-2-methylphenoxy)-5-fluor-4-pyrimidinyl]oxy}phenyl)-2-(methoxyimino)-N-methylethanamid (bekannt aus
DE-A 196 46 407 ,EP-B 0 712 396 ) der Formel - (2-4) Trifloxystrobin (bekannt aus
EP-A 0 460 575 ) der Formel - (2-5) (2E)-2-(Methoxyimino)-N-methyl-2-(2-{[({(1E)-1-[3-(trifluormethyl)phenyl]ethyliden}-amino)oxy]methyl}phenyl)ethanamid (bekannt aus
EP-A 0 569 384 ) der Formel - (2-6) (2E)-2-(Methoxyimino)-N-methyl-2-{2-[(E)-({1-[3-(trifluormethyl)phenyl]ethoxy}imino)-methyl]phenyl}ethanamid (bekannt aus
EP-A 0 596 254 ) der Formel - (2-7) Orysastrobin (bekannt aus
DE-A 195 39 324 ) der Formel - (2-8) 5-Methoxy-2-methyl-4-(2-{[({(1E)-1-[3-(trifluormethyl)phenyl]ethyliden}amino)oxy]-methyl}phenyl)-2,4-dihydro-3H-1,2,4-triazol-3-on (bekannt aus
WO 98/23155 - (2-9) Kresoxim-methyl (bekannt aus
EP-A 0 253 213 ) der Formel - (2-10) Dimoxystrobin (bekannt aus
EP-A 0 398 692 ) der Formel - (2-11) Picoxystrobin (bekannt aus
EP-A 0 278 595 ) der Formel - (2-12) Pyraclostrobin (bekannt aus
DE-A 44 23 612 ) der Formel - (2-13) Metominostrobin (bekannt aus
EP-A 0 398 692 ) der Formel - Die Formel (III) umfasst folgende bevorzugte Kombinationspartner der Gruppe (3):
- (3-1) Azaconazole (bekannt aus
DE-A 25 51 560 ) der Formel - (3-2) Etaconazole (bekannt aus
DE-A 25 51 560 ) der Formel - (3-3) Propiconazole (bekannt aus
DE-A 25 51 560 ) der Formel - (3-4) Difenoconazole (bekannt aus
EP-A 0 112 284 ) der Formel - (3-5) Bromuconazole (bekannt aus
EP-A 0 258 161 ) der Formel - (3-6) Cyproconazole (bekannt aus
DE-A 34 06 993 ) der Formel - (3-7) Hexaconazole (bekannt aus
DE-A 30 42 303 ) der Formel - (3-8) Penconazole (bekannt aus
DE-A 27 35 872 ) der Formel - (3-9) Myclobutanil (bekannt aus
EP-A 0 145 294 ) der Formel - (3-10) Tetraconazole (bekannt aus
EP-A 0 234 242 ) der Formel - (3-11) Flutriafol (bekannt aus
EP-A 0 015 756 ) der Formel - (3-12) Epoxiconazole (bekannt aus
EP-A 0 196 038 ) der Formel - (3-13) Flusilazole (bekannt aus
EP-A 0 068 813 ) der Formel - (3-14) Simeconazole (bekannt aus
EP-A 0 537 957 ) der Formel - (3-15) Prothioconazole (bekannt aus
WO 96/16048 - (3-16) Fenbuconazole (bekannt aus
DE-A 37 21 786 ) der Formel - (3-17) Tebuconazole (bekannt aus
EP-A 0 040 345 ) der Formel - (3-18) Ipconazole (bekannt aus
EP-A 0 329 397 ) der Formel - (3-19) Metconazole (bekannt aus
EP-A 0 329 397 ) der Formel - (3-20) Triticonazole (bekannt aus
EP-A 0 378 953 ) der Formel - (3-21) Bitertanol (bekannt aus
DE-A 23 24 010 ) der Formel - (3-22) Triadimenol (bekannt aus
DE-A 23 24 010 ) der Formel - (3-23) Triadimefon (bekannt aus
DE-A 22 01 063 ) der Formel - (3-24) Fluquinconazole (bekannt aus
EP-A 0 183 458 ) der Formel - (3-25) Quinconazole (bekannt aus
EP-A 0 183 458 ) der Formel - Die Formel (IV) umfasst folgende bevorzugte Kombinationspartner der Gruppe (4):
- (4-1) Dichlofluanid (bekannt aus
DE-A 11 93 498 ) der Formel - (4-2) Tolylfluanid (bekannt aus
DE-A 11 93 498 ) der Formel - Bevorzugte Kombinationspartner der Gruppe (5) sind
- (5-1) Iprovalicarb (bekannt aus
DE-A 40 26 966 ) der Formel - (5-3) Benthiavalicarb (bekannt aus
WO 96/04252 - Die Formel (V) umfasst folgende bevorzugte Kombinationspartner der Gruppe (6):
- (6-1) 2-Chloro-N-(1,1,3-trimethyl-indan-4-yl)-nicotinamid (bekannt aus
EP-A 0 256 503 ) der Formel - (6-2) Boscalid (bekannt aus
DE-A 195 31 813 ) der Formel - (6-3) Furametpyr (bekannt aus
EP-A 0 315 502 ) der Formel - (6-4) 1-Methyl-3-trifluormethy1-1H-pyrazol-4-carbonsäure-(3-p-tolyl-thiophen-2-yl)-amid (bekannt aus
EP-A 0 737 682 ) der Formel - (6-5) Ethaboxam (bekannt aus
EP-A 0 639 574 ) der Formel - (6-6) Fenhexamid (bekannt aus
EP-A 0 339 418 ) der Formel - (6-7) Carpropamid (bekannt aus
EP-A 0 341 475 ) der Formel - (6-8) 2-Chlor-4-(2-fluor-2-methyl-propionylamino)-N,N-dimethyl-benzamid (bekannt aus
EP-A 0 600 629 ) der Formel - (6-9) Fluopicolid (bekannt aus
WO 99/42447 - (6-10) Zoxamide (bekannt aus
EP-A 0 604 019 ) der Formel - (6-11) Isotianil (ISO-proposed) (bekannt aus
DE-OS 19750012 ) der Formel - (6-12) Carboxin (bekannt aus
US 3,249,499 ) der Formel - (6-13) Tiadinil (bekannt aus
US 6,616,054 ) der Formel - (6-14) Penthiopyrad (bekannt aus
EP-A 0 737 682 ) der Formel - (6-15) Silthiofam (bekannt aus
WO 96/18631 - (6-16) N-[2-(1,3-Dimethylbutyl)phenyl]-1-methyl-4-(trifluormethyl)-1H-pyrrol-3-carboxamid (bekannt aus
WO 02/38542 - (6-17) Flutolanil (bekannt aus
DE-A 27 31 522 ) der Formel - (6-18) N-[2-(1,3-dimethylbutyl)phenyl]-5-fluor-1,3-dimethyl-1H-pyrazol-4-carboxamid (bekannt aus
EP-A 1 414 803 ) der Formel - (6-20) N-[2-(1,3-dimethylbutyl)phenyl]-2-(trifluormethyl)benzamid (bekannt aus
EP-A 1 519 913 ) der Formel - (6-21) N-[2-(1,3-dimethylbutyl)phenyl]-2-iodbenzamid (bekannt aus
EP-A 1 519 913 ) der Formel - (6-22) N-(4'-chlor-3'-fluorbiphenyl-2-yl)-4-(difluormethyl)-2-methyl-1,3-thiazol-5-carboxamid (bekannt aus
EP-A 1 404 407 ) der Formel - (6-23) N-[5-(4-chlorphenyl)pyrimidin-4-yl]-2-iod-N-(2-iodbenzoyl)benzamid der Formel
- (6-24) N-(3',4'-dichlorbiphenyl-2-yl)-2-methyl-4-(trifluormethyl)-1,3-thiazol-5-carboxamid (bekannt aus
EP-A 1 474 406 ) der Formel - (6-25) Fluopyram (ISO-proposed) N-[2-[3-chloro-5-(trifluoromethyl)-2-pyridinyl]ethyl]-2-(trifluoromethyl)benzamide (bekannt aus
WO 2004016088 ) - Bevorzugte Kombinationspartner der Gruppe (7) sind
- (7-1) Mancozeb (bekannt aus
DE-A 12 34 704 ) mit dem IUPAC-Namen Manganese ethylenebis(dithiocarbamate) (polymeric) complex with zinc salt - (7-2) Maneb (bekannt aus
US 2,504,404 ) der Formel - (7-3) Metiram (bekannt aus
DE-A 10 76 434 ) mit dem IUPAC-Namen Zinc ammoniate ethylenebis(dithiocarbamate) - poly(ethylenethiuram disulfide) - (7-4) Propineb (bekannt aus
GB 935 981 - (7-5) Thiram (bekannt aus
US 1,972,961 ) der Formel - (7-6) Zineb (bekannt aus
DE-A 10 81 446 ) der Formel - (7-7) Ziram (bekannt aus
US 2,588,428 ) der Formel - Die Formel (VI) umfasst folgende bevorzugte Kombinationspartner der Gruppe (8):
- (8-1) Benalaxyl (bekannt aus
DE-A 29 03 612 ) der Formel - (8-2) Furalaxyl (bekannt aus
DE-A 25 13 732 ) der Formel - (8-3) Metalaxyl (bekannt aus
DE-A 25 15 091 ) der Formel - (8-4) Metalaxyl-M (bekannt aus
WO 96/01559 - (8-5) Benalaxyl-M der Formel
- Die Formel (VII) umfasst folgende bevorzugte Kombinationspartner der Gruppe (9):
- (9-1) Cyprodinil (bekannt aus
EP-A 0 310 550 ) der Formel - (9-2) Mepanipyrim (bekannt aus
EP-A 0 270 111 ) der Formel - (9-3) Pyrimethanil (bekannt aus
DD 151 404 - Die Formel (VIII) umfasst folgende bevorzugte Kombinationspartner der Gruppe (10):
- (10-1) 6-Chlor-5-[(3,5-dimethylisoxazol-4-yl)sulfonyl]-2,2-difluor-5H-[1,3]dioxolo[4,5-flbenzimidazol (bekannt aus
WO 97/06171 - (10-2) Benomyl (bekannt aus
US 3,631,176 ) der Formel - (10-3) Carbendazim (bekannt aus
US 3,010,968 ) der Formel - (10-4) Chlorfenazole der Formel
- (10-5) Fuberidazole (bekannt aus
DE-A 12 09 799 ) der Formel - (10-6) Thiabendazole (bekannt aus
US 3,206,468 ) der Formel - Die Formel (IX) umfasst folgende bevorzugte Kombinationspartner der Gruppe (11):
- (11-1) Diethofencarb (bekannt aus
EP-A 0 078 663 ) der Formel - (11-2) Propamocarb (bekannt aus
US 3,513,241 ) der Formel - (11-3) Propamocarb-hydrochloride (bekannt aus
US 3,513,241 ) der Formel - (11-4) Propamocarb-Fosetyl der Formel
- (11-5) Pyribencarb (ISO-proposed, KUF-1204) [[2-Chloro-5-[(1E)-1-[[(6-methyl-2-pyridinyl)methoxy]imino]ethyl]phenyl]methyl] carbamic acid methyl ester (bekannt aus
WO 2001010825 ) - Bevorzugte Kombinationspartner der Gruppe (12) sind
- (12-1) Captafol (bekannt aus
US 3,178,447 ) der Formel - (12-2) Captan (bekannt aus
US 2,553,770 ) der Formel - (12-3) Folpet (bekannt aus
US 2,553,770 ) der Formel - (12-4) Iprodione (bekannt aus
DE-A 21 49 923 ) der Formel - (12-5) Procymidone (bekannt aus
DE-A 20 12 656 ) der Formel - (12-6) Vinclozolin (bekannt aus
DE-A 22 07 576 ) der Formel - Bevorzugte Kombinationspartner der Gruppe (13) sind
- (13-1) Dodine (bekannt aus
GB 11 03 989 - (13-2) Guazatine (bekannt aus
GB 11 14 155 - (13-3) Iminoctadine triacetate (bekannt aus
EP-A 0 155 509 ) der Formel - Bevorzugte Kombinationspartner der Gruppe (14) sind
- (14-1) Cyazofamid (bekannt aus
EP-A 0 298 196 ) der Formel - (14-2) Prochloraz (bekannt aus
DE-A 24 29 523 ) der Formel - (14-3) Triazoxide (bekannt aus
DE-A 28 02 488 ) der Formel - (14-4) Pefurazoate (bekannt aus
EP-A 0 248 086 ) der Formel - (14-5) Fenamidone (bekannt aus
EP-A 00629616 - Die Formel (X) umfasst folgende bevorzugte Kombinationspartner der Gruppe (15):
- (15-1) Aldimorph (bekannt aus
DD 140 041 - (15-2) Tridemorph (bekannt aus
GB 988 630 - (15-3) Dodemorph (bekannt aus
DE-A 25 432 79 ) der Formel - (15-4) Fenpropimorph (bekannt aus
DE-A 26 56 747 ) der Formel - (15-5) Dimethomorph (bekannt aus
EP-A 0 219 756 ) der Formel - (15-6) Flumorph (bekannt aus
EP-A 0 860 438 ) der Formel - Die Formel (XI) umfasst folgende bevorzugte Kombinationspartner der Gruppe (16):
- (16-1) Fenpiclonil (bekannt aus
EP-A 0 236 272 ) der Formel - (16-2) Fludioxonil (bekannt aus
EP-A 0 206 999 ) der Formel - (16-3) Pyrrolnitrine (bekannt aus
JP 65-25876 - Bevorzugte Kombinationspartner der Gruppe (17) sind
- (17-1) Fosetyl-Al (bekannt aus
DE-A 24 56 627 ) der Formel - (17-2) Phosphonsäure (bekannte Chemikalie) der Formel
- (17-3) Tolclofos-methyl (bekannt aus
DE-A 25 01 040 ) der Formel - Die Formel (XII) umfasst folgende bevorzugte Kombinationspartner der Gruppe (18), welche aus
WO 96/23793 - (18-1) die Verbindung 2-(2,3-Dihydro-1H-inden-5-yl)-N-[2-(3,4-dimethoxyphenyl)ethyl]-2-(methoxyimino)acetamid der Formel
- (18-2) die Verbindung N-[2-(3,4-Dimethoxyphenyl)ethyl]-2-(methoxyimino)-2-(5,6,7,8-tetrahydronaphthalen-2-yl)acetamid der Formel
- (18-3) die Verbindung 2-(4-Chlorphenyl)-N-[2-(3,4-dimethoxyphenyl)ethyl]-2-(methoxyimino)-acetamid der Formel
- (18-4) die Verbindung 2-(4-Bromphenyl)-N-[2-(3,4-dimethoxyphenyl)ethyl]-2-(methoxyimino)-acetamid der Formel
- (18-5) die Verbindung 2-(4-Methylphenyl)-N-[2-(3,4-dimethoxyphenyl)ethyl]-2-(methoxyimino)-acetamid der Formel
- (18-6) die Verbindung 2-(4-Ethylphenyl)-N-[2-(3,4-dimethoxyphenyl)ethyl]-2-(methoxyimino)-acetamid der Formel
- Bevorzugte Kombinationspartner der Gruppe (19) sind
- (19-1) Acibenzolar-S-methyl (bekannt aus
EP-A 0 313 512 ) der Formel - (19-2) Chlorothalonil (bekannt aus
US 3,290,353 ) der Formel - (19-3) Cymoxanil (bekannt aus
DE-A 23 12 956 ) der Formel - (19-4) Edifenphos (bekannt aus
DE-A 14 93 736 ) der Formel - (19-5) Famoxadone (bekannt aus
EP-A 0 393 911 ) der Formel - (19-6) Fluazinam (bekannt aus
EP-A 0 031 257 ) der Formel - (19-7) Kupferoxychlorid
- (19-9) Oxadixyl (bekannt aus
DE-A 30 30 026 ) der Formel - (19-10) Spiroxamine (bekannt aus
DE-A 37 35 555 ) der Formel - (19-11) Dithianon (bekannt aus
JP-A 44-29464 - (19-12) Metrafenone (bekannt aus
EP-A 0 897 904 ) der Formel - (19-13) 2,3-Dibutyl-6-chlor-thieno[2,3-d]pyrimidin-4(3H)on (bekannt aus
WO 99/14202 - (19-14) Probenazole (bekannt aus
US 3,629,428 ) der Formel - (19-15) Isoprothiolane (bekannt aus
US 3,856,814 ) der Formel - (19-16) Kasugamycin (bekannt aus
GB 1 094 567 - (19-17) Phthalide (bekannt aus
JP-A 57-55844 - (19-18) Ferimzone (bekannt aus
EP-A 0 019 450 ) der Formel - (19-19) Tricyclazole (bekannt aus
DE-A 22 50 077 ) der Formel - (19-20) Cyprosulfamide der Formel
- (19-21) Mandipropamid (bekannt aus
WO 01/87822 - Bevorzugte Kombinationspartner der Gruppe (20) sind
- (20-1) Pencycuron (bekannt aus
DE-A 27 32 257 ) der Formel - (20-2) Thiophanate-methyl (bekannt aus
DE-A 18 06 123 ) der Formel - (20-3) Thiophanate-ethyl (bekannt aus
DE-A 18 06 123 ) der Formel - Bevorzugte Kombinationspartner der Gruppe (21) sind
- (21-1) Fenoxanil (bekannt aus
EP-A 0 262 393 ) der Formel - (21-2) Diclocymet (bekannt aus
JP-A 7-206608 - Bevorzugte Kombinationspartner der Gruppe (22) sind
- (22-1) 5-Chlor-N-[(1S)-2,2,2-trifluor-1-methylethyl]-6-(2,4,6-trifluorphenyl)[1,2,4]triazolo[1,5-a]-pyrimidin-7-amin (bekannt aus
US 5,986,135 ) der Formel - (22-2) 5-Chlor-N-[(1R)-1,2-dimethylpropyl]-6-(2,4,6-trifluorphenyl)[1,2,4]triazolo[1,5-a]pyrimidin-7-amin (bekannt aus
WO 02/38565 - (22-3) 5-Chlor-6-(2-chlor-6-fluorphenyl)-7-(4-methylpiperidin-1-yl)[1,2,4]triazolo[1,5-a]pyrimidin (bekannt aus
US 5,593,996 ) der Formel - (22-4) 5-Chlor-6-(2,4,6-trifluorphenyl)-7-(4-methylpiperidin-1-yl)[1,2,4]triazolo[1,5-a]pyrimidin (bekannt aus
DE-A 101 24 208 ) der Formel - Bevorzugte Kombinationspartner der Gruppe (23) sind
- (23-1) 2-Butoxy-6-iod-3-propyl-benzopyran-4-on (bekannt aus
WO 03/014103 - (23-2) 2-Ethoxy-6-iod-3-propyl-benzopyran-4-on (bekannt aus
WO 03/014103 - (23-3) 6-Iod-2-propoxy-3-propyl-benzopyran-4-on (bekannt aus
WO 03/014103 - (23-4) 2-But-2-inyloxy-6-iod-3-propyl-benzopyran-4-on (bekannt aus
WO 03/014103 - (23-5) 6-Iod-2-(1-methyl-butoxy)-3-propyl-benzopyran-4-on (bekannt aus
WO 03/014103 - (23-6) 2-But-3-enyloxy-6-iod-benzopyran-4-on (bekannt aus
WO 03/014103 - (23-7) 3-Butyl-6-iod-2-isopropoxy-benzopyran-4-on (bekannt aus
WO 03/014103 - Bevorzugte Kombinationspartner der Gruppe (24) sind
- (24-1) N-(3',4'-Dichlor-5-fluor-1,1'-biphenyl-2-yl)-3-(difluormethyl)-1-methyl-1H-pyrazol-4-carboxamid (bekannt aus
WO 03/070705 - (24-2) 3-(Difluormethyl)-N-{3'-fluor-4'-[(E)-(methoxyimino)methyl]-1,1'-biphenyl-2-yl}-1-methyl-1H-pyrazol-4-carboxamid (bekannt aus
WO 02/08197 - (24-3) 3-(Trifluormethyl)-N-{3'-fluor-4'-[(E)-(methoxyimino)methyl]-1,1'-biphenyt-2-yl}-1-methyl-1H-pyrazol-4-carboxamid (bekannt aus
WO 02/08197 - (24-4) N (3',4'-Dichlor-1,1'-biphenyl-2-yl)-5-fluor-1,3-dimethyl-1H pyrazol-4-carboxamid (bekannt aus
WO 00/14701 - (24-5) N-(4'-Chlor-3'-fluor-1,1'-biphenyl-2-yl)-2-methyl-4-(trifluonnethyl)-1,3-thiazo1-5-carboxamid (bekannt aus
WO 03/066609 - (24-6) N-(4'-Chlor-1,1'-biphenyl-2-yl)-4-(difluormethyl)-2-methyl-l,3-thiazol-5-carboxamid (bekannt aus
WO 03/066610 - (24-7) N-(4'-Brom-1,1'-biphenyl-2-yl)-4-(difluormethyl)-2-methyl-1,3-thiazol-5-carboxamid (bekannt aus
WO 03/066610 - (24-8) 4-(Difluormethyl)-2-methyl-N-[4'-(trifluormethyl)-1,1'-biphenyl-2-yl]-1,3-thiazol-5-carboxamid (bekannt aus
WO 03/066610 - (24-9) Bixafen (ISO-proposed) N-(3',4'-dichloro-5-fluoro[1,1'-biphenyl]-2-yl)-3-(difluoromethyl)-1-methyl-1H-pyrazole-4-carboxamide (bekannt aus
WO 2003070705 ) - Bevorzugter Kombinationspartner der Gruppe (25) ist
- (25-1) Amisulbrom (ISO-proposed, NC-224) 3-[(3-Bromo-6-fluoro-2-methyl-1H-indol-1-yl)sulfonyl]-N,N-dimethyl-1H-1,2,4-triazole-1-sulfonamid (bekannt aus
JP 2001187786 - Die Verbindung (6-7) Carpropamid besitzt drei asymmetrische substituierte Kohlenstoffatome. Die Verbindung (6-7) kann daher als Gemisch von verschiedenen Isomeren oder auch in Form einer einzigen Komponente vorliegen. Besonders bevorzugt sind die Verbindungen
(1S,3R)-2,2-Dichlor-N-[(1R)-1-(4-chlorphenyl)ethyl]-1-ethyl-3-methylcyclopropancarboxamid der Formel
(1R,3S)-2,2-Dichlor-N-[(1R)-1-(4-chlorphenyl)ethyl]-1-ethyl-3-methylcyclopropancarboxamid der Formel - Erfindungsgemäß enthalten die erfindungsgemäßen Wirkstoffkombinationen die Verbindung der Formel (I), in welcher A ausgewählt ist aus 6-Chlor-pyrid-3-yl, und R1 ausgewählt ist aus 2,2-Difluor-ethyl, und einen Wirkstoff ausgewählt aus den oben genannten Gruppen (2) bis (25).
- Als Kombinationspartner der Gruppen (2) bis (25) sind die folgenden Wirkstoffe besonders bevorzugt:
- (2-1) Azoxystrobin
- (2-2) Fluoxastrobin
- (2-3) (2E)-2-(2-{[6-(3-Chlor-2-methylphenoxy)-5-fluor-4-pyrimidinyl]oxy)phenyl)-2-(methoxyimino)-N-methylethanamid
- (2-4) Trifloxystrobin
- (2-5) (2E)-2-(Methoxyimin{[({(IE)-1-[3-(trifluormethyl)phenyl]ethyliden}amino)oxy]methyl}phenyl)ethanamid
- (2-6) (2E)-2-(Methoxyimino)-N-methyl-2-{2-[(E)-({1-[3-(trifluormethyl)phenyl]-ethoxy}imino)methyl]phenyl}ethanamid
- (2-8) 5-Methoxy-2-methyl-4-(2- {[({(1E)-1-[3-(trifluormethyl)phenyl]ethyliden}-amino)oxy]methyl}phenyl)-2,4-dihydro-3H-1,2,4-triazol-3-on
- (2-9) Kresoxim-methyl
- (2-10) Dimoxystrobin
- (2-11) Picoxystrobin
- (2-12) Pyraclostrobin
- (2-13) Metominostrobin
- (3-3) Propiconazole
- (3-4) Difenoconazole
- (3-6) Cyproconazole
- (3-7) Hexaconazole
- (3-8) Penconazole
- (3-9) Myclobutanil
- (3-10) Tetraconazole
- (3-12) Epoxiconazole
- (3-13) Flusilazole
- (3-15) Prothioconazole
- (3-16) Fenbuconazole
- (3-17) Tebuconazole
- (3-18) Ipconazole
- (3-19) Metconazole
- (3-20) Triticonazole
- (3-21) Bitertanol
- (3-22) Triadimenol
- (3-23) Triadimefon
- (3-24) Fluquinconazole
- (4-1) Dichlofluanid
- (4-2) Tolylfluanid
- (5-1) Iprovalicarb
- (5-3) Benthiavalicarb
- (6-2) Boscalid
- (6-5) Ethaboxam
- (6-6) Fenhexamid
- (6-7) Carpropamid
- (6-8) 2-Chlor-4-[(2-fluor-2-methylpropanoyl)amino]-N,N-dimethylbenzamid
- (6-9) Fluopicolid
- (6-10) Zoxamide
- (6-11) Isotianil
- (6-14) Penthiopyrad
- (6-16) N-[2-(1,3-Dimethylbutyl)phenyl]-1-methyl-4-(trifluormethyl)-1H-pyrrol-3-carboxarnid
- (6-17) Flutolanil
- (6-18) N-[2-(1,3-dimethylbutyl)phenyl]-5-fluor-1,3-dimethyl-IH-pyrazo1-4-carboxamid
- (6-25) Fluopyram
- (7-1) Mancozeb
- (7-2) Maneb
- (7-4) Propineb
- (7-5) Thiram
- (7-6) Zineb
- (8-1) Benalaxyl
- (8-2) Furalaxyl
- (8-3) Metalaxyl
- (8-4) Metalaxyl-M
- (8-5) Benalaxyl-M
- (9-1) Cyprodinil
- (9-2) Mepanipyrim
- (9-3) Pyrimethanil
- (10-1) 6-Chlor-5-[(3,5-dimethylisoxazol-4-yl)sulfonyl]-2,2-difluor-5H-[1,3]dioxolo[4,5-f]-benzimidazol
- (10-3) Carbendazim
- (11-1) Diethofencarb
- (11-2) Propamocarb
- (11-3) Propamocarb-hydrochloride
- (11-4) Propamocarb-Fosetyl
- (11-5) Pyribencarb
- (12-2) Captan
- (12-3) Folpet
- (12-4) Iprodione
- (12-5) Procymidone
- (13-1) Dodine
- (13-2) Guazatine
- (13-3) Iminoctadine triacetate
- (14-1) Cyazofamid
- (14-2) Prochloraz
- (14-3) Triazoxide
- (14-5) Fenamidone
- (15-4) Fenpropimorph
- (15-5) Dimethomorph
- (15-6) Flumorph
- (16-2) Fludioxonil
- (17-1) Fosetyl-Al
- (17-2) Phosphonsäure
- (17-3) Tolclofos-methyl
- (19-1) Acibenzolar-S-methyl
- (19-2) Chlorothalonil
- (19-3) Cymoxanil
- (19-5) Famoxadone
- (19-6) Fluazinam
- (19-7) Kupferoxychlorid
- (19-9) Oxadixyl
- (19-10) Spiroxamine
- (19-21) Cyprosulfamide
- (19-22) Mandipropamid
- (20-1) Pencycuron
- (20-2) Thiophanate-methyl
- (22-1) 5-Chlor-N-[(1S)-2,2,2-trifluor-1-methylethyl]-6-(2,4,6-trifluorphenyl)[1,2,4]triazolo[1,5-a]-pyrimidin-7-amin
- (22-2) 5-Chlor-N-[(1R)-1,2-dimethylpropyl]-6-(2,4,6-trifluorphenyl)[1,2,4]triazolo[1,5-a]pyrimidin-7-amin
- (22-4) 5-Chlor-6-(2,4,6-trifluorphenyl)-7-(4-methylpiperidin-1-yl)[1,2,4]triazolo[1,5-a]pyrimidin
- (23-1) 2-Butoxy-6-iod-3-propyl-benzopyran-4-on
- (23-2) 2-Ethoxy-6-iod-3-propyl-benzopyran-4-on
- (23-3) 6-Iod-2-propoxy-3-propyl-benzopyran-4-on
- (24-1) N-(3',4'-Dichlor-5-fluor-1,1'-biphenyl-2-yl)-3-(difluormethyl)-1-methyl-1H-pyrazol-4-carboxamid
- (24-3) 3-(Trifluormethyl)-N-{3'-fluor-4'-[(E)-(methoxyimino)methyl]-1,1'-biphenyl-2-yl}-1-methyl-1H-pyrazol-4-carboxamid
- (24-7) N-(4'-Brom-1,1'-biphenyl-2-yl)-4-(difluormethyl)-2-methyl-1,3-thiazol-5-carboxamid
- (24-9) Bixafen
- (25-1) Amisulbrom
- Als Kombinationspartner der Gruppen (2) bis (25) sind die folgenden Wirkstoffe ganz besonders bevorzugt:
- (2-1) Azoxystrobin
- (2-2) Fluoxastrobin
- (2-3) (2E)-2-(2-{[6-(3-Chlor-2-methylphenoxy)-5-fluor-4-pyrimidinyl]oxy)phenyl)-2-(methoxyimino)-N-methylethanamid
- (2-4) Trifloxystrobin
- (3-15) Prothioconazole
- (3-17) Tebuconazole
- (3-18) Ipconazole
- (3-20) Triticonazole
- (3-21) Bitertanol
- (3-22) Triadimenol
- (3-24) Fluquinconazole
- (4-1) Dichlofluanid
- (4-2) Tolylfluanid
- (5-1) Iprovalicarb
- (6-6) Fenhexamid
- (6-7) Carpropamid
- (6-9) Fluopicolid
- (6-11) Isotianil
- (6-14) Penthiopyrad
- (6-17) Flutolanil
- (6-18) N-[2-(1,3-dimethylbutyl)phenyl]-5-fluor-1,3-dimethyl-1H-pyrazo1-4-carboxamid
- (6-25) Fluopyram
- (7-4) Propineb
- (7-5) Thiram
- (8-3) Metalaxyl
- (8-4) Metalaxyl-M
- (8-5) Benalaxyl-M
- (9-3) Pyrimethanil
- (10-3) Carbendazim
- (11-2) Propamocarb
- (11-4) Propamocarb-Fosetyl
- (11-5) Pyribencarb
- (12-4) Iprodione
- (14-2) Prochloraz
- (14-3) Triazoxide
- (14-5) Fenamidone
- (16-2) Fludioxonil
- (17-1) Fosetyl-Al
- (17-3) Tolclofos-methyl
- (19-10) Spiroxamine
- (19-21) Cyprosulfamide
- (19-22) Mandipropamid
- (20-1) Pencycuron
- (22-4) 5-Chlor-6-(2,4,6-trifluorphenyl)-7-(4-methylpiperidin-1-yl)[1,2,4]triazolo[1,5-a]pyrimidin
- (24-1) N-(3',4'-Dichlor-5-fluor-1,1'-biphenyl-2-yl)-3-(difluormethyl)-3-methyl-1H-pyrazol-4-carboxamid
- (24-9) Bixafen
- (25-1) Amisulbrom
- Als Kombinationspartner der Gruppen (2) bis (25) sind die folgenden Wirkstoffe insbesondere bevorzugt:
- (2-1) Azoxystrobin
- (2-2) Fluoxastrobin
- (2-4) Trifloxystrobin
- (3-15) Prothioconazole
- (3-17) Tebuconazole
- (3-18) Ipconazole
- (3-20) Triticonazole
- (3-22) Triadimenol
- (4-2) Tolylfluanid
- (5-1) Iprovalicarb
- (6-7) Carpropamid
- (6-9) Fluopicolid
- (6-11) Isotianil
- (6-18) N-[2-(1,3-dimethylbutyl)phenyl]-5-fluor-1,3-dimethyl-1H-pyrazol-4-carboxamid
- (6-25) Fluopyram
- (7-5) Thiram
- (8-3) Metalaxyl
- (8-4) Metalaxyl-M
- (11-2) Propamocarb
- (11-5) Pyribencarb
- (12-4) Iprodione
- (14-5) Fenamidone
- (16-2) Fludioxonil
- (17-1) Fosetyl-Al
- (19-10) Spiroxamine
- (19-21) Cyprosulfamide
- (20-1) Pencycuron
- (24-1) N-(3',4'-Dichlor-5-fluor-1,1'-biphenyl-2-yl)-3-(difluormethyl)-1-methyl-1H-pyrazol-4-carboxamid
- (24-9) Bixafen
- (25-1) Amisulbrom
- Damit erhält man die in Tabelle 5 aufgeführten Kombinationen, wobei jede Kombination für sich eine bevorzugte erfindungsgemäße Ausführungsform darstellt.
Wirkstoffkombination enthaltend Nr. Wirkstoffkombination Verbindung der Formel I Wirkstoff der Gruppen 2 bis 25 5-1 1-5 und (2-1) Azoxystrobin 5-2 1-5 und (2-2) Fluoxastrobin 5-3 1-5 und (2-3) (2E)-2-(2-{[6-(3-Chlor-2-methylphenoxy)-5-fluor-4-pyrimidinyl]oxy}phenyl)-2-(methoxyimino)-N-methylethanamid 5-4 1-5 und (2-4) Trifloxystrobin 5-5 I-5 und (3-15) Prothioconazole 5-6 1-5 und (3-17) Tebuconazole 5-7 1-5 und (3-18) Ipconazole 5-8 1-5 und (3-20) Triticonazole 5-9 1-5 und (3-21) Bitertanol 5-10 1-5 und (3-22) Triadimenol 5-11 1-5 und (3-24) Fluquinconazole 5-12 I-5 und (4-1) Dichlofluanid 5-13 1-5 und (4-2) Tolylfluanid 5-14 1-5 und (5-1) Iprovalicarb 5-15 1-5 und (6-6) Fenhexamid 5-16 1-5 und (6-7) Carpropamid 5-17 1-5 und (6-9) Fluopicolid 5-18 1-5 und (6-11) Isotianil 5-19 1-5 und (6-14) Penthiopyrad 5-20 1-5 und (6-17) Flutolanil 5-21 1-5 (6-18) N-[2-(1,3-dimethylbutyl)phenyl]-5-fluor-1,3-dimethyl-1H-pyrazol-4-carboxamid 5-22 1-5 (6-25) Fluopyram 5-23 1-5 (7-4) Propineb 5-24 I-5 und (7-5) Thiram 5-25 1-5 und (8-3) Metalaxyl 5-26 I-5 und (8-4) Metalaxyl-M 5-27 I-5 und (8-5) Benalaxyl-M 5-28 I-5 und (9-3) Pyrimethanil 5-29 I-5 und (10-3) Carbendazim 5-30 1-5 und (11-2) Propamocarb 5-31 I-5 und (11-4) Propamocarb-Fosetyl 5-32 I-5 und (11-5) Pyribencarb 5-33 I-5 und (12-4) Iprodione 5-34 I-5 und (14-2) Prochloraz 5-35 I-5 und (14-3) Triazoxide 5-36 I-5 und (14-5) Fenamidone 5-37 I-5 und (16-2) Fludioxonil 5-38 I-5 und (17-1) Fosetyl-Al 5-39 I-5 und (17-3) Tolclofos-methyl 5-40 I-5 und (19-10) Spiroxamine 5-41 I-5 und (19-21) Cyprosulfamide 5-42 I-5 und (19-22) Mandipropamid 5-43 I-5 und (20-1) Pencycuron 5-44 I-5 und (22-4) 5-Chlor-6-(2,4,6-trifluorphenyl)-7-(4-methylpiperidin-1-yl)[1,2,4]triazolo[1,5-a]pyrimidin 5-45 I-5 und (24-1)N-(3',4'-Dichlor-5-fluor-1,1'-biphenyl-2-yl)-3-(difluormethyl)-1-methyl-1H-pyrazol-4-carboxamid 5-46 I-5 und (24-9) Bixafen 5-47 I-5 und (25-1) Amisulbrom - Hervorgehobene Ausführungsformen der Erfindung zur Behandlung von Saatgut sind Wirkstoffkombinationen enthaltend die Verbindung der Formel (I-5) und Fluoxastrobin (2-2) und/oder Trifloxystrobin (2-4) und/oder Prothioconazole (3-15) und/oder Tebuconazole (3-17) und/oder Ipconazole (3-18) und/oder Triticonazole (3-20) und/oder Triadimenol (3-22) und/oder Carpropamid (6-7) und/oder N-[2-(1,3-dimethylbutyl)phenyl]-5-fluor-1,3-dimethyl-1H-pyrazol-4-carboxamid (6-18) und/oder Thiram (7-5) und/oder Metalaxyl (8-3) und/oder Metalaxyl-M (8-4) und/oder N-({4-[(Cyclopropylamino)-carbonyl]-phenyl}-sulfonyl)-2-methoxy-benzamid (19-21) und/oder Pencycuron (20-1) und/oder N-(3',4'-Dichlor-5-fluor-1,1'-biphenyl-2-yl)-3-(difluormethyl)-1-methy)-1H-pyrazol-4-carboxamid (24-1).
- Die erfindungsgemäßen Wirkstoffkombinationen enthalten neben der Verbindung der Formel (I) mindestens einen Wirkstoff der Gruppen (2) bis (25). Sie können darüber hinaus auch weitere fungizid wirksame Zumischkomponenten enthalten.
- Wenn die Wirkstoffe in den erfindungsgemäßen Wirkstoffkombinationen in bestimmten Gewichtsverhältnissen vorhanden sind, zeigt sich der synergistische Effekt besonders deutlich. Jedoch können die Gewichtsverhältnisse der Wirkstoffe in den Wirkstoffkombinationen in einem relativ großen Bereich variiert werden. Im Allgemeinen enthalten die erfindungsgemäßen Kombinationen Verbindungen der Formel (I) und einen Kombinationspartner aus einer der Gruppen (2) bis (25) in den in der nachfolgenden Tabelle beispielhaft angegebenen Mischungsverhältnisse.
- Die Mischungsverhältnisse basieren auf Gewichtsverhältnissen. Das Verhältnis ist zu verstehen als Verbindung der Formel (I): Kombinationspartner
Kombinationspartner bevorzugtes Mischungsverhältnis besonders bevorzugtes Mischungsverhältnis Gruppe (2): Strobilurine 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (3): Triazole 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (4): Sulfenamide 500: 1 bis 1 : 25 250 : 1 bis 1: 1 Gruppe (5): Valinamide 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (6): Carboxamide ohne (6-6) 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (6-6): 500: 1 bis 1: 25 250 : 1 bis 1: 1 Gruppe (7): Dithiocarbamate 500: 1 bis 1 : 25 250 : 1 bis 1: 1 Gruppe (8): Acylalanine 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (9): Anilino-pyrimidine 500: 1 bis 1 : 25 250 1 bis 1: 1 Gruppe (10): Benzimidazole 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (11): Carbamate 500: 1 bis 1 : 25 250:1 bis 1:1 Gruppe (12): Gruppe (13): Dicarboximide Guanidine 500: 1 125: 1 bis bis 1 : 25 1 : 2000 250: 1 50 : 1 bis bis 1: 1 1 : 1000 Gruppe (14): Imidazole 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (15): Morpholine 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (16): Pyrrole 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (17): (Thio)Phosphonate 500: 1 bis 1 : 25 250 : 1 bis 1:1 Gruppe (18): Phenylethanamide 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-1): Acibenzolar-S-methyl 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-2): Chlorothalonil 500: 1 bis 1 : 25 250 : 1 bis 1:1 (19-3): Cymoxanil 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-4): Edifenphos 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-5): Famoxadone 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-6): Fluazinam 125: 1 bis 1 : 2000 50:1 bis 1 : 1000 (19-7): Kupferoxychlorid 500: 1 bis 1 : 25 250 : 1 bis 1 : 1 (19-8): Kupferhydroxid 500: 1 bis 1 : 25 250:1 bis 1:1 (19-9): Oxadixyl 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-10): Spiroxamine 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-11) Dithianon 500: 1 bis 1 : 25 250:1 bis 1:1 (19-12) Metrafenone 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-14): 2,3-Dibutyl-6-chlor-thieno-[2,3-d]pyrimidin-4(3H)on 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-15): Probenazole 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-16): Isoprothiolane 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-17): Kasugamycin 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-18): Phthalide 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-19): Ferimzone 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-20): Tricyclazole 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-21): Cyprosulfamide 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 (19-22) 2-(4-Chlorphenyl)-N-{2-[3-methoxy-4-(prop-2-in-l-yloxy)phenyl]ethyl} - 2-(prop-2-in-1-yloxy)acetamid 125: 1 bis 1 : 2000 50:1 bis 1:1000 Gruppe (20): (Thio)Harnstoff-Derivate 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (21): Amide 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (22): Triazolopvrimidine 125: 1 bis 1 : 2000 50:1 bis 1:1000 Gruppe (23): Iodochromone 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 Gruppe (24): Biphenylcarboxamide 125: 1 bis 1 : 2000 50 : 1 bis 1 : 1000 - Die Verbindungen der Formel (I) oder die Wirkstoffe aus den oben aufgeführten Gruppen (2) bis (25) mit wenigstens einem basischen Zentrum sind dazu in der Lage, beispielsweise Säureadditionssalze zu bilden, z.B. mit starken anorganischen Säuren wie Mineralsäuren, z.B. Perchlorsäure, Schwefelsäure, Salpetersäure, salpetriger Säure, einer Phosphorsäure oder einer Halogenwasserstoffsäure, mit starken organischen Carbonsäuren wie unsubstituierten oder substituierten, z.B. halogensubstituierten, C1-C4-Alkancarbonsäuren, z.B. Essigsäure, gesättigten oder ungesättigten Dicarbonsäuren, z.B. Oxalsäure, Malonsäure, Bernsteinsäure, Maleinsäure, Fumarsäure und Phthalsäure, Hydroxycarbonsäuren, z.B. Ascorbinsäure, Milchsäure, Äpfelsäure, Weinsäure und Citronensäure, oder Benzoesäure, oder mit organischen Sulfonsäuren wie unsubstituierten oder substituierten, z.B. halogensubstituierten, C1-C4-Alkan- oder Arylsulfonsäuren, z.B. Methan- oder p-Toluolsulfonsäure. Die Verbindungen der Formel (I) oder die Wirkstoffe aus den oben aufgeführten Gruppen (2) bis (25) mit wenigstens einer sauren Gruppe sind dazu in der Lage, zum Beispiel Salze mit Basen zu bilden, z.B. Metallsalze wie Alkali- oder Erdalkalisalze, z.B. Natrium-, Kalium- oder Magnesiumsalze, oder Salze mit Ammoniak oder einem organischen Amin wie Morpholin, Piperidin, Pyrrolidin, einem niederen Mono-, Di- oder Trialkylamin, z.B. Ethyl-, Diethyl-, Triethyl- oder Dimethylpropylamin, oder einem niederen Mono-, Di- oder Trihydroxyalkylamin, z.B. Mono-, Di- oder Triethanolamin. Darüber hinaus können gegebenenfalls entsprechende innere Salze gebildet werden. Im Rahmen der Erfindung sind agrochemisch vorteilhafte Salze bevorzugt. Angesichts der engen Beziehung zwischen den Verbindungen der Formel (I) oder den Wirkstoffen aus den oben aufgeführten Gruppen (2) bis (25) in freier Form und in Form ihrer Salze sollte oben und im folgenden jeder Verweis auf die freien Verbindungen der Formel (I) oder auf freie Wirkstoffe aus den oben aufgeführten Gruppen (2) bis (25) oder auf ihre Salze so verstanden werden, dass auch die entsprechenden Salze bzw. die freien Verbindungen der Formel (I) oder die freien Wirkstoffe aus den oben aufgeführten Gruppen (2) bis (25) eingeschlossen sind, wenn dies angebracht und zweckmäßig ist. Dies trifft entsprechend auch auf Tautomere der Verbindungen der Formel (I) bzw. der Wirkstoffe aus den oben aufgeführten Gruppen (2) bis (25) und auf ihre Salze zu.
- Im Rahmen der vorliegenden Erfindung steht der Begriff „Wirkstoffkombination“ für verschiedene Kombinationen von Verbindungen der Formel (I) und Wirkstoffen aus den oben aufgeführten Gruppen (2) bis (25), z.B. in Form einer einzelnen Fertigmischung („Ready-Mix“), in einer kombinierten Spraymischung, die zusammengesetzt ist aus getrennten Formulierungen der einzelnen Wirkstoffe, z.B. einer Tankmischung („Tank-Mix“) oder in einer kombinierten Verwendung der einzelnen Wirkstoffe, wenn diese sequentiell appliziert werden, z.B. nacheinander innerhalb eines angemessen kurzen Zeitraums, z.B. wenigen Stunden oder Tagen. Gemäß einer bevorzugten Ausführungsform ist die Reihenfolge der Applikation der Verbindungen der Formel (I) und der Wirkstoffe aus den oben aufgeführten Gruppen (2) bis (25) für die Ausführung der vorliegenden Erfindung nicht entscheidend.
- Beim Einsatz der erfindungsgemäßen Wirkstoffkombinationen als Fungizide, Insektizide oder Akarizide können die Aufwandmengen je nach Applikationsart innerhalb eines größeren Bereiches variiert werden. Die Aufwandmenge der erfindungsgemäßen Wirkstoffkombinationen beträgt bei der Behandlung von Pflanzenteilen, z.B. Blättern von 0,1 bis 10.000 g/ha, bevorzugt von 10 bis 1.000 g/ha, besonders bevorzugt von 50 bis 300 g/ha (bei Anwendung durch Gießen oder Tropfen kann die Aufwandmenge sogar verringert werden, vor allem wenn inerte Substrate wie Steinwolle oder Perlit verwendet werden); bei der Saatgutbehandlung von 2 bis 200 g pro 100 kg Saatgut, bevorzugt von 3 bis 150 g pro 100 kg Saatgut, besonders bevorzugt von 2,5 bis 25 g pro 100 kg Saatgut, ganz besonders bevorzugt von 2,5 bis 12,5 g pro 100 kg Saatgut; bei der Bodenbehandlung von 0,1 bis 10.000 g/ha, bevorzugt von 1 bis 5.000 g/ha.
- Diese Aufwandmengen seien nur beispielhaft und nicht limitierend im Sinne der Erfindung genannt.
- Die erfindungsgemäßen Wirkstoffkombinationen können eingesetzt werden, um Pflanzen innerhalb eines gewissen Zeitraumes nach der Behandlung gegen den Befall durch phytopathogene Pilze und/oder tierische Schädlinge zu schützen. Der Zeitraum, innerhalb dessen Schutz herbeigeführt wird, erstreckt sich im Allgemeinen auf 1 bis 28 Tage, bevorzugt auf 1 bis 14 Tage, besonders bevorzugt auf 1 bis 10 Tage, ganz besonders bevorzugt auf 1 bis 7 Tage nach der Behandlung der Pflanzen mit den Wirkstoffen bzw. auf bis zu 200 Tage nach einer Saatgutbehandlung.
- Die erfindungsgemäßen Wirkstoffkombinationen eignen sich bei guter Pflanzenverträglichkeit, günstiger Warmblütertoxizität und guter Umweltverträglichkeit zum Schutz von Pflanzen und Pflanzenorganen, zur Steigerung der Ernteerträge, Verbesserung der Qualität des Erntegutes und zur Bekämpfung von phytopathogenen Pilzen wie Plasmodiophoromycetes, Oomycetes, Chytridiomycetes, Zygomycetes, Ascomycetes, Basidiomycetes, Deuteromycetes usw. und von tierischen Schädlingen, insbesondere Insekten, Spinnentieren, Helminthen, Nematoden und Mollusken, die in der Landwirtschaft, im Gartenbau, bei der Tierzucht, in Forsten, in Gärten und Freizeiteinrichtungen, im Vorrats- und Materialschutz sowie auf dem Hygienesektor vorkommen. Sie können vorzugsweise als Pflanzenschutzmittel eingesetzt werden. Sie sind gegen normal sensible und resistente Arten sowie gegen alle oder einzelne Entwicklungsstadien wirksam.
- Die erfindungsgemäßen Wirkstoffkombinationen besitzen sehr gute fungizide Eigenschaften und lassen sich zur Bekämpfung von phytopathogenen Pilzen, wie Plasmodiophoromycetes, Oomycetes, Chytridiomycetes, Zygomycetes, Ascomycetes, Basidiomycetes, Deuteromycetes usw. einsetzen.
- Die erfindungsgemäßen Wirkstoffkombinationen eignen sich besonders gut zur Bekämpfung Phytophthora infestans, Plasmopara viticola und Botrytis cinerea.
- Beispielhaft, aber nicht begrenzend, seien einige Erreger von pilzlichen und bakteriellen Erkrankungen, die unter die oben aufgezählten Oberbegriffe fallen, genannt:
- Fungizide lassen sich im Pflanzenschutz zur Bekämpfung von Plasmodiophoromycetes, Oomycetes, Chytridiomycetes, Zygomycetes, Ascomycetes, Basidiomycetes und Deuteromycetes einsetzen.
- Bakterizide lassen sich im Pflanzenschutz zur Bekämpfung von Pseudomonadaceae, Rhizobiaceae, Enterobacteriaceae, Corynebacteriaceae und Streptomycetaceae einsetzen.
- Beispielhaft aber nicht begrenzend seien einige Erreger von pilzlichen und bakteriellen Erkrankungen, die unter die oben aufgezählten Oberbegriffe fallen, genannt:
- Erkrankungen, hervorgerufen durch Erreger des Echten Mehltaus wie z.B.
- Blumeria-Arten, wie beispielsweise Blumeria graminis;
- Podosphaera-Arten, wie beispielsweise Podosphaera leucotricha;
- Sphaerotheca-Arten, wie beispielsweise Sphaerotheca fuliginea;
- Uncinula-Arten, wie beispielsweise Uncinula necator;
- Erkrankungen, hervorgerufen durch Erreger von Rostkrankheiten wie z.B.
- Gymnosporangium-Arten, wie beispielsweise Gymnosporangium sabinae
- Hemileia-Arten, wie beispielsweise Hemileia vastatrix;
- Phakopsora-Arten, wie beispielsweise Phakopsora pachyrhizi und Phakopsora meibomiae;
- Puccinia-Arten, wie beispielsweise Puccinia recondita;
- Uromyces-Arten, wie beispielsweise Uromyces appendiculatus;
- Erkrankungen, hervorgerufen durch Erreger der Gruppe der Oomyceten wie z.B.
- Bremia-Arten, wie beispielsweise Bremia lactucae;
- Peronospora-Arten, wie beispielsweise Peronospora pisi oder P. brassicae;
- Phytophthora-Arten, wie beispielsweise Phytophthora infestans;
- Plasmopara-Arten, wie beispielsweise Plasmopara viticola;
- Pseudoperonospora-Arten, wie beispielsweise Pseudoperonospora humuli oder
- Pseudoperonospora cubensis;
- Pythium-Arten, wie beispielsweise Pythium ultimum;
- Blattfleckenkrankheiten und Blattwelken, hervorgerufen durch z.B.
- Alternaria-Arten, wie beispielsweise Alternaria solani;
- Cercospora-Arten, wie beispielsweise Cercospora beticola;
- Cladiosporum-Arten, wie beispielsweise Cladiosporium cucumerinum;
- Cochliobolus-Arten, wie beispielsweise Cochliobolus sativus
- (Konidienform: Drechslera, Syn: Helminthosporium);
- Colletotrichum-Arten, wie beispielsweise Colletotrichum lindemuthanium;
- Cycloconium-Arten, wie beispielsweise Cycloconium oleaginum;
- Diaporthe-Arten, wie beispielsweise Diaporthe citri;
- Elsinoe-Arten, wie beispielsweise Elsinoe fawcettii;
- Gloeosporium-Arten, wie beispielsweise Gloeosporium laeticolor;
- Glomerella-Arten, wie beispielsweise Glomerella cingulata;
- Guignardia-Arten, wie beispielsweise Guignardia bidwelli;
- Leptosphaeria-Arten, wie beispielsweise Leptosphaeria maculans;
- Magnaporthe-Arten, wie beispielsweise Magnaporthe grisea;
- Mycosphaerella-Arten, wie beispielsweise Mycosphaerelle graminicola;
- Phaeosphaeria-Arten, wie beispielsweise Phaeosphaeria nodorum;
- Pyrenophora-Arten, wie beispielsweise Pyrenophora teres;
- Ramularia-Arten, wie beispielsweise Ramularia collo-cygni;
- Rhynchosporium-Arten, wie beispielsweise Rhynchosporium secalis;
- Septoria-Arten, wie beispielsweise Septoria apii;
- Typhula-Arten, wie beispielsweise Typhula incarnata;
- Venturia-Arten, wie beispielsweise Venturia inaequalis;
- Wurzel- und Stengelkrankheiten, hervorgerufen durch z.B.
- Corticium-Arten, wie beispielsweise Corticium graminearum;
- Fusarium-Arten, wie beispielsweise Fusarium oxysporum;
- Gaeumannomyces-Arten, wie beispielsweise Gaeumannomyces graminis;
- Rhizoctonia-Arten, wie beispielsweise Rhizoctonia solani;
- Tapesia-Arten, wie beispielsweise Tapesia acuformis;
- Thielaviopsis-Arten, wie beispielsweise Thielaviopsis basicola;
- Ähren- und Rispenerkrankungen (inklusive Maiskolben), hervorgerufen durch z.B.
- Alternaria-Arten, wie beispielsweise Alternaria spp.;
- Aspergillus-Arten, wie beispielsweise Aspergillus flavus;
- Cladosporium-Arten, wie beispielsweise Cladosporium spp.;
- Claviceps-Arten, wie beispielsweise Claviceps purpurea;
- Fusarium-Arten, wie beispielsweise Fusarium culmorum;
- Gibberella-Arten, wie beispielsweise Gibberella zeae;
- Monographella-Arten, wie beispielsweise Monographella nivalis;
- Erkrankungen, hervorgerufen durch Brandpilze wie z.B.
- Sphacelotheca-Arten, wie beispielsweise Sphacelotheca reiliana;
- Tilletia-Arten, wie beispielsweise Tilletia caries;
- Urocystis-Arten, wie beispielsweise Urocystis occulta;
- Ustilago-Arten, wie beispielsweise Ustilago nuda;
- Fruchtfäule hervorgerufen durch z.B.
- Aspergillus-Arten, wie beispielsweise Aspergillus flavus;
- Botrytis-Arten, wie beispielsweise Botrytis cinerea;
- Penicillium-Arten, wie beispielsweise Penicillium expansum;
- Sclerotinia-Arten, wie beispielsweise Sclerotinia sclerotiorum;
- Verticilium-Arten, wie beispielsweise Verticilium alboatrum;
- Samen- und bodenbürtige Fäulen und Welken, sowie Sämlingserkrankungen, hervorgerufen durch z.B.
- Fusarium-Arten, wie beispielsweise Fusarium culmorum;
- Phytophthora Arten, wie beispielsweise Phytophthora cactorum;
- Pythium-Arten, wie beispielsweise Pythium ultimum;
- Rhizoctonia-Arten, wie beispielsweise Rhizoctonia solani;
- Sclerotium-Arten, wie beispielsweise Sclerotium rolfsii;
- Krebserkrankungen, Gallen und Hexenbesen, hervorgerufen durch z.B.
- Nectria-Arten, wie beispielsweise Nectria galligena;
- Welkeerkrankungen hervorgerufen durch z.B.
- Monilinia-Arten, wie beispielsweise Monilinia laxa;
- Deformationen von Blättern, Blüten und Früchten, hervorgerufen durch z.B.
- Taphrina-Arten, wie beispielsweise Taphrina deformans;
- Degenerationserkrankungen holziger pflanzen, hervorgerufen durch z.B.
- Esca-Arten, wie beispielsweise Phaemoniella clamydospora;
- Blüten- und Samenerkrankungen, hervorgerufen durch z.B.
- Botrytis-Arten, wie beispielsweise Botrytis cinerea;
- Erkrankungen von Pflanzenknollen, hervorgerufen durch z.B.
- Rhizoctonia-Arten, wie beispielsweise Rhizoctonia solani;
- Erkrankungen, hervorgerufen durch bakterielle Erreger wie z.B.
- Xanthomonas-Arten, wie beispielsweise Xanthomonas campestris pv. oryzae;
- Pseudomonas-Arten, wie beispielsweise Pseudomonas syringae pv. lachrymans;
- Erwinia-Arten, wie beispielsweise Erwinia amylovora;
- Bevorzugt können die folgenden Krankheiten von Soja-Bohnen bekämpft werden:
- Pilzkrankheiten an Blättern, Stängeln, Schoten und Samen verursacht durch z.B.
- Alternaria leaf spot (Alternaria spec. atrans tenuissima), Anthracnose (Colletotrichum gloeosporoides dematium var. truncatum), Brown spot (Septoria glycines), Cercospora leaf spot and blight (Cercospora kikuchii), Choanephora leaf blight (Choanephora infundibulifera trispora (Syn.)), Dactuliophora leaf spot (Dactuliophora glycines), Downy Mildew (Peronospora manshurica), Drechslera blight (Drechslera glycini), Frogeye Leaf spot (Cercospora sojina), Leptosphaerulina Leaf Spot (Leptosphaerulina trifolii), Phyllostica Leaf Spot (Phyllosticta sojaecola), Powdery Mildew (Microsphaera diffusa), Pyrenochaeta Leaf Spot (Pyrenochaeta glycines), Rhizoctonia Aerial, Foliage, and Web Blight (Rhizoctonia solani), Rust (Phakopsora pachyrhizi), Scab (Sphaceloma glycines), Stemphylium Leaf Blight (Stemphylium botryosum), Target Spot (Corynespora cassiicola).
- Pilzkrankheiten an Wurzeln und der Stängelbasis verursacht durch z.B.
- Black Root Rot (Calonectria crotalariae), Charcoal Rot (Macrophomina phaseolina), Fusarium Blight or Wilt, Root Rot, and Pod and Collar Rot (Fusarium oxysporum, Fusarium orthoceras, Fusarium semitectum, Fusarium equiseti), Mycoleptodiscus Root Rot (Mycoleptodiscus terrestris), Neocosmospora (Neocosmopspora vasinfecta), Pod and Stem Blight (Diaporthe phaseolorum), Stem Canker (Diaporthe phaseolorum var. caulivora), Phytophthora Rot (Phytophthora megasperma), Brown Stem Rot (Phialophora gregata), Pythium Rot (Pythium aphanidermatum, Pythium irregulare, Pythium debaryanum, Pythium myriotylum, Pythium ultimum), Rhizoctonia Root Rot, Stem Decay, and Damping-Off (Rhizoctonia solani), Sclerotinia Stem Decay (Sclerotinia sclerotiorum), Sclerotinia Southern Blight (Sclerotinia rolfsii), Thielaviopsis Root Rot (Thielaviopsis basicola).
- Dabei lassen sich die erfindungsgemäßen Wirkstoffkombinationen mit besonders gutem Erfolg zur Bekämpfung von Getreidekrankheiten, wie z.B. gegen Puccinia-Arten und von Krankheiten im Wein-, Obst- und Gemüseanbau, wie z.B. gegen Botrytis-, Venturia- oder Alternaria-Arten, einsetzen.
- Darüber hinaus weisen die erfindungsgemäßen Wirkstoffkombinationen auch sehr gute antimykotische Wirkungen auf. Sie besitzen ein sehr breites antimykotisches Wirkungsspektrum, insbesondere gegen Dermatophyten und Sprosspilze, Schimmel und diphasische Pilze (z.B. gegen Candida-Spezies wie Candida albicans, Candida glabrata) sowie Epidermophyton floccosum, Aspergillus-Spezies wie Aspergillus niger und Aspergillus fumigatus, Trichophyton-Spezies wie Trichophyton mentagrophytes, Microsporon-Spezies wie Microsporon canis und audouinii. Die Aufzählung dieser Pilze stellt keinesfalls eine Beschränkung des erfassbaren mykotischen Spektrums dar, sondern hat nur erläuternden Charakter.
- Darüber hinaus weisen die erfindungsgemäßen Wirkstoffkombinationen auch sehr gute insektizide Wirkungen auf. Sie besitzen ein sehr breites insektizies Wirkungsspektrum, insbesondere gegen folgende tierische Schädlinge:
- Aus der Ordnung der Anoplura (Phthiraptera) z.B. Damalinia spp., Haematopinus spp., Linognathus spp., Pediculus spp., Trichodectes spp.
- Aus der Klasse der Arachnida z.B. Acarus siro, Aceria sheldoni, Aculops spp., Aculus spp., Amblyomma spp., Argas spp., Boophilus spp., Brevipalpus spp., Bryobia praetiosa, Chorioptes spp., Dermanyssus gallinae, Eotetranychus spp., Epitrimerus pyri, Eutetranychus spp., Eriophyes spp., Hemitarsonemus spp., Hyalomma spp., Ixodes spp., Latrodectus mactans, Metatetranychus spp., Oligonychus spp., Ornithodoros spp., Panonychus spp., Phyllocoptruta oleivora, Polyphagotarsonemus latus, Psoroptes spp., Rhipicephalus spp., Rhizoglyphus spp., Sarcoptes spp., Scorpio maurus, Stenotarsonemus spp., Tarsonemus spp., Tetranychus spp., Vasates lycopersici.
- Aus der Klasse der Bivalva z.B. Dreissena spp.
- Aus der Ordnung der Chilopoda z.B. Geophilus spp., Scutigera spp.
- Aus der Ordnung der Coleoptera z.B. Acanthoscelides obtectus, Adoretus spp., Agelastica alni, Agriotes spp., Amphimallon solstitialis, Anobium punctatum, Anoplophora spp., Anthonomus spp., Anthrenus spp., Apogonia spp., Atomaria spp., Attagenus spp., Bruchidius obtectus, Bruchus spp., Ceuthorhynchus spp., Cleonus mendicus, Conoderus spp., Cosmopolites spp., Costelytra zealandica, Curculio spp., Cryptorhynchus lapathi, Dermestes spp., Diabrotica spp., Epilachna spp., Faustinus cubae, Gibbium psylloides, Heteronychus arator, Hylamorpha elegans, Hylotrupes bajulus, Hypera postica, Hypothenemus spp., Lachnosterna consanguinea, Leptinotarsa decemlineata, Lissorhoptrus oryzophilus, Lixus spp., Lyctus spp., Meligethes aeneus, Melolontha melolontha, Migdolus spp., Monochamus spp., Naupactus xanthographus, Niptus hololeucus, Oryctes rhinoceros, Oryzaephilus surinamensis, Otiorrhynchus sulcatus, Oxycetonia jucunda, Phaedon cochleariae, Phyllophaga spp., Popillia japonica, Premnotrypes spp., Psylliodes chrysocephala, Ptinus spp., Rhizobius ventralis, Rhizopertha dominica, Sitophilus spp., Sphenophorus spp., Sternechus spp., Symphyletes spp., Tenebrio molitor, Tribolium spp., Trogoderma spp., Tychius spp., Xylotrechus spp., Zabrus spp.
- Aus der Ordnung der Collembola z.B. Onychiurus armatus.
- Aus der Ordnung der Dermaptera z.B. Forficula auricularia.
- Aus der Ordnung der Diplopoda z.B. Blaniulus guttulatus.
- Aus der Ordnung der Diptera z.B. Aedes spp., Anopheles spp., Bibio hortulanus, Calliphora erythrocephala, Ceratitis capitata, Chrysomyia spp., Cochliomyia spp., Cordylobia anthropophaga, Culex spp., Cuterebra spp., Dacus oleae, Dermatobia hominis, Drosophila spp., Fannia spp., Gastrophilus spp., Hylemyia spp., Hyppobosca spp., Hypoderma spp., Liriomyza spp.. Lucilia spp., Musca spp., Nezara spp., Oestrus spp., Oscinella frit, Pegomyia hyoscyami, Phorbia spp., Stomoxys spp., Tabanus spp., Tannia spp., Tipula paludosa, Wohlfahrtia spp.
- Aus der Klasse der Gastropoda z.B. Arion spp., Biomphalaria spp., Bulinus spp., Deroceras spp., Galba spp., Lymnaea spp., Oncomelania spp., Succinea spp.
- Aus der Klasse der Helminthen z.B. Ancylostoma duodenale, Ancylostoma ceylanicum, Acylostoma braziliensis, Ancylostoma spp., Ascaris lubricoides, Ascaris spp., Brugia malayi, Brugia timori, Bunostomum spp., Chabertia spp., Clonorchis spp., Cooperia spp., Dicrocoelium spp, Dictyocaulus filaria, Diphyllobothrium latum, Dracunculus medinensis, Echinococcus granulosus, Echinococcus multilocularis, Enterobius vermicularis, Faciola spp., Haemonchus spp., Heterakis spp., Hymenolepis nana, Hyostrongulus spp., Loa Loa, Nematodirus spp., Oesophagostomum spp., Opisthorchis spp., Onchocerca volvulus, Ostertagia spp., Paragonimus spp., Schistosomen spp, Strongyloides fuelleborni, Strongyloides stercoralis, Stronyloides spp., Taenia saginata, Taenia solium, Trichinella spiralis, Trichinella nativa, Trichinella britovi, Trichinella nelsoni, Trichinella pseudopsiralis, Trichostrongulus spp., Trichuris trichuria, Wuchereria bancrofti.
- Weiterhin lassen sich Protozoen, wie Eimeria, bekämpfen.
- Aus der Ordnung der Heteroptera z.B. Anasa tristis, Antestiopsis spp., Blissus spp., Calocoris spp., Campylomma livida, Cavelerius spp., Cimex spp., Creontiades dilutus, Dasynus piperis, Dichelops furcatus, Diconocoris hewetti, Dysdercus spp., Euschistus spp., Eurygaster spp., Heliopeltis spp., Horcias nobilellus, Leptocorisa spp., Leptoglossus phyllopus, Lygus spp., Macropes excavatus, Miridae, Nezara spp., Oebalus spp., Pentomidae, Piesma quadrata, Piezodorus spp., Psallus seriatus, Pseudacysta persea, Rhodnius spp., Sahlbergella singularis, Scotinophora spp., Stephanitis nashi, Tibraca spp., Triatoma spp.
- Aus der Ordnung der Homoptera z.B. Acyrthosipon spp., Aeneolamia spp., Agonoscena spp., Aleurodes spp., Aleurolobus barodensis, Aleurothrixus spp., Amrasca spp., Anuraphis cardui, Aonidiella spp., Aphanostigma piri, Aphis spp., Arboridia apicalis, Aspidiella spp., Aspidiotus spp., Atanus spp., Aulacorthum solani, Bemisia spp., Brachycaudus helichrysii, Brachycolus spp., Brevicoryne brassicae, Calligypona marginata, Carneocephala fulgida, Ceratovacuna lanigera, Cercopidae, Ceroplastes spp., Chaetosiphon fragaefolii, Chionaspis tegalensis, Chlorita onukii, Chromaphis juglandicola, Chrysomphalus ficus, Cicadulina mbila, Coccomytilus halli, Coccus spp., Cryptomyzus ribis, Dalbulus spp., Dialeurodes spp., Diaphorina spp., Diaspis spp., Doralis spp., Drosicha spp., Dysaphis spp., Dysmicoccus spp., Empoasca spp., Eriosoma spp., Erythroneura spp., Euscelis bilobatus, Geococcus coffeae, Homalodisca coagulata, Hyalopterus arundinis, Icerya spp., Idiocerus spp., Idioscopus spp., Laodelphax striatellus, Lecanium spp., Lepidosaphes spp., Lipaphis erysimi, Macrosiphum spp., Mahanarva fimbriolata, Melanaphis sacchari, Metcalfiella spp., Metopolophium dirhodum, Monellia costalis, Monelliopsis pecanis, Myzus spp., Nasonovia ribisnigri, Nephotettix spp., Nilaparvata lugens, Oncometopia spp., Orthezia praelonga, Parabemisia myricae, Paratrioza spp., Parlatoria spp., Pemphigus spp., Peregrinus maidis, Phenacoccus spp., Phloeomyzus passerinii, Phorodon humuli, Phylloxera spp., Pinnaspis aspidistrae, Planococcus spp., Protopulvinaria pyriformis, Pseudaulacaspis pentagona, Pseudococcus spp., Psylla spp., Pteromalus spp., Pyrilla spp., Quadraspidiotus spp., Quesada gigas, Rastrococcus spp., Rhopalosiphum spp., Saissetia spp., Scaphoides titanus, Schizaphis graminum, Selenaspidus articulatus, Sogata spp., Sogatella furcifera, Sogatodes spp., Stictocephala festina, Tenalaphara malayensis, Tinocallis caryaefoliae, Tomaspis spp., Toxoptera spp., Trialeurodes vaporariorum, Trioza spp., Typhlocyba spp., Unaspis spp., Viteus vitifolii.
- Aus der Ordnung der Hymenoptera z.B. Diprion spp., Hoplocampa spp., Lasius spp., Monomorium pharaonis, Vespa spp.
- Aus der Ordnung der Isopoda z.B. Armadillidium vulgare, Oniscus asellus, Porcellio scaber.
- Aus der Ordnung der Isoptera z.B. Reticulitermes spp., Odontotermes spp.
- Aus der Ordnung der Lepidoptera z.B. Acronicta major, Aedia leucomelas, Agrotis spp., Alabama argillacea, Anticarsia spp., Barathra brassicae, Bucculatrix thurberiella, Bupalus piniarius, Cacoecia podana, Capua reticulana, Carpocapsa pomonella, Cheimatobia brumata, Chilo spp., Choristoneura fumiferana, Clysia ambiguella, Cnaphalocerus spp., Earias insulana, Ephestia kuehniella, Euproctis chrysorrhoea, Euxoa spp., Feltia spp., Galleria mellonella, Helicoverpa spp., Heliothis spp., Hofmannophila pseudospretella, Homona magnanima, Hyponomeuta padella, Laphygma spp., Lithocolletis blancardella, Lithophane antennata, Loxagrotis albicosta, Lymantria spp., Malacosoma neustria, Mamestra brassicae, Mocis repanda, Mythimna separata, Oria spp., Oulema oryzae, Panolis flammea, Pectinophora gossypiella, Phyllocnistis citrella, Pieris spp., Plutella xylostella, Prodenia spp., Pseudaletia spp., Pseudoplusia includens, Pyrausta nubilalis, Spodoptera spp., Thermesia gemmatalis, Tinea pellionella, Tineola bisselliella, Tortrix viridana, Trichoplusia spp.
- Aus der Ordnung der Orthoptera z.B. Acheta domesticus, Blatta orientalis, Blattella germanica, Gryllotalpa spp., Leucophaea maderae, Locusta spp., Melanoplus spp., Periplaneta americana, Schistocerca gregaria.
- Aus der Ordnung der Siphonaptera z.B. Ceratophyllus spp., Xenopsylla cheopis.
- Aus der Ordnung der Symphyla z.B. Scutigerella immaculata.
- Aus der Ordnung der Thysanoptera z.B. Baliothrips biformis, Enneothrips flavens, Frankliniella spp., Heliothrips spp., Hercinothrips femoralis, Kakothrips spp., Rhipiphorothrips cruentatus, Scirtothrips spp., Taeniothrips cardamoni, Thrips spp.
- Aus der Ordnung der Thysanura z.B. Lepisma saccharina.
- Zu den pflanzenparasitären Nematoden gehören z.B. Anguina spp., Aphelenchoides spp., Belonoaimus spp., Bursaphelenchus spp., Ditylenchus dipsaci, Globodera spp., Heliocotylenchus spp., Heterodera spp., Longidorus spp., Meloidogyne spp., Pratylenchus spp., Radopholus similis, Rotylenchus spp., Trichodorus spp., Tylenchorhynchus spp., Tylenchulus spp., Tylenchulus semipenetrans, Xiphinema spp.
- Im Materialschutz lassen sich die erfindungsgemäßen Wirkstoffkombinationen zum Schutz von technischen Materialien gegen Befall und Zerstörung durch unerwünschte Mikroorganismen einsetzen.
- Unter technischen Materialien sind im vorliegenden Zusammenhang nichtlebende Materialien zu verstehen, die für die Verwendung in der Technik zubereitet worden sind. Beispielsweise können technische Materialien, die durch erfindungsgemäße Wirkstoffe vor mikrobieller Veränderung oder Zerstörung geschützt werden sollen, Klebstoffe, Leime, Papier und Karton, Textilien, Leder, Holz, Anstrichmittel und Kunststoffartikel, Kühlschmierstoffe und andere Materialien sein, die von Mikroorganismen befallen oder zersetzt werden können. Im Rahmen der zu schützenden Materialien seien auch Teile von Produktionsanlagen, beispielsweise Kühlwasserkreisläufe, genannt, die durch Vermehrung von Mikroorganismen beeinträchtigt werden können. Im Rahmen der vorliegenden Erfindung seien als technische Materialien vorzugsweise Klebstoffe, Leime, Papiere und Kartone, Leder, Holz, Anstrichmittel, Kühlschmiermittel und Wärmeübertragungsflüssigkeiten genannt, besonders bevorzugt Holz.
- Als Mikroorganismen, die einen Abbau oder eine Veränderung der technischen Materialien bewirken können, seien beispielsweise Bakterien, Pilze, Hefen, Algen und Schleimorganismen genannt. Vorzugsweise wirken die erfindungsgemäßen Wirkstoffkombinationen gegen Pilze, insbesondere Schimmelpilze, holzverfärbende und holzzerstörende Pilze (Basidiomyceten) sowie gegen Schleimorganismen und Algen.
- Es seien beispielsweise Mikroorganismen der folgenden Gattungen genannt:
- Alternaria, wie Alternaria tenuis,
- Aspergillus, wie Aspergillus niger,
- Chaetomium, wie Chaetomium globosum,
- Coniophora, wie Coniophora puetana,
- Lentinus, wie Lentinus tigrinus,
- Penicillium, wie Penicillium glaucum,
- Polyporus, wie Polyporus versicolor,
- Aureobasidium, wie Aureobasidium pullulans,
- Sclerophoma, wie Sclerophoma pityophila,
- Trichoderma, wie Trichoderma viride,
- Escherichia, wie Escherichia coli,
- Pseudomonas, wie Pseudomonas aeruginosa,
- Staphylococcus, wie Staphylococcus aureus.
- Außerdem wurde gefunden, dass die erfindungsgemäßen Wirkstoffkombinationen eine hohe insektizide Wirkung gegen Insekten zeigen, die technische Materialien zerstören.
- Beispielhaft und vorzugsweise - ohne jedoch zu limitieren - seien die folgenden Insekten genannt:
- Käfer wie Hylotrupes bajulus, Chlorophorus pilosis, Anobium punctatum, Xestobium rufovillosum, Ptilinus pecticornis, Dendrobium pertinex, Ernobius mollis, Priobium carpini, Lyctus brunneus, Lyctus africanus, Lyctus planicollis, Lyctus linearis, Lyctus pubescens, Trogoxylon aequale, Minthes rugicollis, Xyleborus spec. Tryptodendron spec. Apate monachus, Bostrychus capucins, Heterobostrychus brunneus, Sinoxylon spec. Dinoderus minutus.
- Hautflügler wie Sirex juvencus, Urocerus gigas, Urocerus gigas taignus, Urocerus augur.
- Termiten wie Kalotermes flavicollis, Cryptotermes brevis, Heterotermes indicola, Reticulitermes flavipes, Reticulitermes santonensis, Reticulitermes lucifugus, Mastotermes darwiniensis, Zootermopsis nevadensis, Coptotermes formosanus.
- Borstenschwänze wie Lepisma saccharina.
- Unter technischen Materialien sind im vorliegenden Zusammenhang nicht-lebende Materialien zu verstehen, wie vorzugsweise Kunststoffe, Klebstoffe, Leime, Papiere und Kartone, Leder, Holz, Holzverarbeitungsprodukte und Anstrichmittel.
- Ganz besonders bevorzugt handelt es sich bei dem vor Insektenbefall zu schützenden Material um Holz und Holzverarbeitungsprodukte.
- Unter Holz und Holzverarbeitungsprodukten, welche durch die erfindungsgemäßen Wirkstoffkombinationen geschützt werden kann, ist beispielhaft zu verstehen: Bauholz, Holzbalken, Eisenbahnschwellen, Brückenteile, Bootsstege, Holzfahrzeuge, Kisten, Paletten, Container, Telefonmasten, Holzverkleidungen, Holzfenster und -türen, Sperrholz, Spanplatten, Tischlerarbeiten oder Holzprodukte, die ganz allgemein beim Hausbau oder in der Bautischlerei Verwendung finden.
- Die Wirkstoffkombinationen können als solche, in Form von Konzentraten oder allgemein üblichen Formulierungen wie Pulver, Granulate, Lösungen, Suspensionen, Emulsionen oder Pasten angewendet werden.
- Die genannten Formulierungen können in an sich bekannter Weise hergestellt werden, z.B. durch Vermischen der Wirkstoffe mit mindestens einem Lösungs- bzw. Verdünnungsmittel, Emulgator, Dispergier- und/oder Binde- oder Fixiermittels, Wasser-Repellent, gegebenenfalls Sikkative und UV-Stabilisatoren und gegebenenfalls Farbstoffen und Pigmenten sowie weiteren Verarbeitungshilfsmitteln.
- Die zum Schutz von Holz und Holzwerkstoffen verwendeten insektiziden Wirkstoffkombinationen oder Konzentrate enthalten den erfindungsgemäßen Wirkstoff in einer Konzentration von 0,0001 bis 95 Gew.-%, insbesondere 0,001 bis 60 Gew.-%.
- Die Menge der eingesetzten Wirkstoffkombinationen bzw. Konzentrate ist von der Art und dem Vorkommen der Insekten und von dem Medium abhängig. Die optimale Einsatzmenge kann bei der Anwendung jeweils durch Testreihen ermittelt werden. Im allgemeinen ist es jedoch ausreichend 0,0001 bis 20 Gew.-%, vorzugsweise 0,001 bis 10 Gew.-%, des Wirkstoffs, bezogen auf das zu schützende Material, einzusetzen.
- Die Wirkstoffkombinationen eignen sich auch zur Bekämpfung von tierischen Schädlingen, insbesondere von Insekten, Spinnentieren und Milben, die in geschlossenen Räumen, wie beispielsweise Wohnungen, Fabrikhallen, Büros, Fahrzeugkabinen u.ä. vorkommen. Sie können zur Bekämpfung dieser Schädlinge in Haushaltsinsektizid-Produkten verwendet werden. Sie sind gegen sensible und resistente Arten sowie gegen alle Entwicklungsstadien wirksam. Zu diesen Schädlingen gehören:
- Aus der Ordnung der Scorpionidea z.B. Buthus occitanus.
- Aus der Ordnung der Acarina z.B. Argas persicus, Argas reflexus, Bryobia ssp., Dermanyssus gallinae, Glyciphagus domesticus, Ornithodorus moubat, Rhipicephalus sanguineus, Trombicula alfreddugesi, Neutrombicula autumnalis, Dermatophagoides pteronissimus, Dermatophagoides forinae.
- Aus der Ordnung der Araneae z.B. Aviculariidae, Araneidae.
- Aus der Ordnung der Opiliones z.B. Pseudoscorpiones chelifer, Pseudoscorpiones cheiridium, Opiliones phalangium.
- Aus der Ordnung der Isopoda z.B. Oniscus asellus, Porcellio scaber.
- Aus der Ordnung der Diplopoda z.B. Blaniulus guttulatus, Polydesmus spp.
- Aus der Ordnung der Chilopoda z.B. Geophilus spp.
- Aus der Ordnung der Zygentoma z.B. Ctenolepisma spp., Lepisma saccharina, Lepismodes inquilinus.
- Aus der Ordnung der Blattaria z.B. Blatta orientalies, Blattella germanica, Blattella asahinai, Leucophaea maderae, Panchlora spp., Parcoblatta spp., Periplaneta australasiae, Periplaneta americana, Periplaneta brunnea, Periplaneta fuliginosa, Supella longipalpa.
- Aus der Ordnung der Saltatoria z.B. Acheta domesticus.
- Aus der Ordnung der Dermaptera z.B. Forficula auricularia.
- Aus der Ordnung der Isoptera z.B. Kalotermes spp., Reticulitermes spp.
- Aus der Ordnung der Psocoptera z.B. Lepinatus spp., Liposcelis spp.
- Aus der Ordnung der Coleptera z.B. Anthrenus spp., Attagenus spp., Dermestes spp., Latheticus oryzae, Necrobia spp., Ptinus spp., Rhizopertha dominica, Sitophilus granarius, Sitophilus oryzae, Sitophilus zeamais, Stegobium paniceum.
- Aus der Ordnung der Diptera z.B. Aedes aegypti, Aedes albopictus, Aedes taeniorhynchus, Anopheles spp., Calliphora erythrocephala, Chrysozona pluvialis, Culex quinquefasciatus, Culex pipiens, Culex tarsalis, Drosophila spp., Fannia canicularis, Musca domestica, Phlebotomus spp., Sarcophaga carnaria, Simulium spp., Stomoxys calcitrans, Tipula paludosa.
- Aus der Ordnung der Lepidoptera z.B. Achroia grisella, Galleria mellonella, Plodia interpunctella, Tinea cloacella, Tinea pellionella, Tineola bisselliella.
- Aus der Ordnung der Siphonaptera z.B. Ctenocephalides canis, Ctenocephalides felis, Pulex irritans, Tunga penetrans, Xenopsylla cheopis.
- Aus der Ordnung der Hymenoptera z.B. Camponotus herculeanus, Lasius fuliginosus, Lasius niger, Lasius umbratus, Monomorium pharaonis, Paravespula spp., Tetramorium caespitum.
- Aus der Ordnung der Anoplura z.B. Pediculus humanus capitis, Pediculus humanus corporis, Phthirus pubis.
- Aus der Ordnung der Heteroptera z.B. Cimex hemipterus, Cimex lectularius, Rhodinus prolixus, Triatoma infestans.
- Die Anwendung erfolgt in Aerosolen, drucklosen Sprühmitteln, z.B. Pump- und Zerstäubersprays, Nebelautomaten, Foggern, Schäumen, Gelen, Verdampferprodukten mit Verdampferplättchen aus Cellulose oder Kunststoff, Flüssigverdampfern, Gel- und Membranverdampfern, propellergetriebenen Verdampfern, energielosen bzw. passiven Verdampfungssystemen, Mottenpapieren, Mottensäckchen und Mottengelen, als Granulate oder Stäube, in Streuködern oder Köderstationen.
- Die erfindungsgemäßen Wirkstoffkombinationen wirken nicht nur gegen Pflanzen-, Hygiene- und Vorratsschädlinge, sondern auch auf dem veterinärmedizinischen Sektor gegen tierische Parasiten (Ektoparasiten) wie Schildzecken, Lederzecken, Räudemilben, Laufmilben, Fliegen (stechend und leckend), parasitierende Fliegenlarven, Läuse, Haarlinge, Federlinge und Flöhe. Zu diesen Parasiten gehören:
- Aus der Ordnung der Anoplurida z.B. Haematopinus spp., Linognathus spp., Pediculus spp., Phtirus spp., Solenopotes spp.
- Aus der Ordnung der Mallophagida und den Unterordnungen Amblycerina sowie Ischnocerina z.B. Trimenopon spp., Menopon spp., Trinoton spp., Bovicola spp., Werneckiella spp., Lepikentron spp., Damalina spp., Trichodectes spp., Felicola spp.
- Aus der Ordnung Diptera und den Unterordnungen Nematocerina sowie Brachycerina z.B. Aedes spp., Anopheles spp., Culex spp., Simulium spp., Eusimulium spp., Phlebotomus spp., Lutzomyia spp., Culicoides spp., Chrysops spp., Hybomitra spp., Atylotus spp., Tabanus spp., Haematopota spp., Philipomyia spp., Braula spp., Musca spp., Hydrotaea spp., Stomoxys spp., Haematobia spp., Morellia spp., Fannia spp., Glossina spp., Calliphora spp., Lucilia spp., Chrysomyia spp., Wohlfahrtia spp., Sarcophaga spp., Oestrus spp., Hypoderma spp., Gasterophilus spp., Hippobosca spp., Lipoptena spp., Melophagus spp.
- Aus der Ordnung der Siphonapterida z.B. Pulex spp., Ctenocephalides spp., Xenopsylla spp., Ceratophyllus spp.
- Aus der Ordnung der Heteropterida z.B. Cimex spp., Triatoma spp., Rhodnius spp., Panstrongylus spp.
- Aus der Ordnung der Blattarida z.B. Blatta orientalis, Periplaneta americana, Blattela germanica, Supella spp.
- Aus der Unterklasse der Acaria (Acarida) und den Ordnungen der Meta- sowie Mesostigmata z.B. Argas spp., Ornithodorus spp., Otobius spp., Ixodes spp., Amblyomma spp., Boophilus spp., Dermacentor spp., Haemophysalis spp., Hyalomma spp., Rhipicephalus spp., Dermanyssus spp., Raillietia spp., Pneumonyssus spp., Sternostoma spp., Varroa spp.
- Aus der Ordnung der Actinedida (Prostigmata) und Acaridida (Astigmata) z.B. Acarapis spp., Cheyletiella spp., Ornithocheyletia spp., Myobia spp., Psorergates spp., Demodex spp., Trombicula spp., Listrophorus spp., Acarus spp., Tyrophagus spp., Caloglyphus spp., Hypodectes spp., Pterolichus spp., Psoroptes spp., Chorioptes spp., Otodectes spp., Sarcoptes spp., Notoedres spp., Knemidocoptes spp., Cytodites spp., Laminosioptes spp.
- Die erfindungsgemäßen Wirkstoffkombinationen eignen sich auch zur Bekämpfung von Arthropoden, die landwirtschaftliche Nutztiere, wie z.B. Rinder, Schafe, Ziegen, Pferde, Schweine, Esel, Kamele, Büffel, Kaninchen, Hühner, Puten, Enten, Gänse, Bienen, sonstige Haustiere wie z.B. Hunde, Katzen, Stubenvögel, Aquarienfische sowie sogenannte Versuchstiere, wie z.B. Hamster, Meerschweinchen, Ratten und Mäuse befallen. Durch die Bekämpfung dieser Arthropoden sollen Todesfälle und Leistungsminderungen (bei Fleisch, Milch, Wolle, Häuten, Eiern, Honig usw.) vermindert werden, so dass durch den Einsatz der erfindungsgemäßen Wirkstoffkombinationen eine wirtschaftlichere und einfachere Tierhaltung möglich ist.
- Die Anwendung der erfindungsgemäßen Wirkstoffkombinationen geschieht im Veterinärsektor in bekannter Weise durch enterale Verabreichung in Form von beispielsweise Tabletten, Kapseln, Tränken, Drenchen, Granulaten, Pasten, Boli, des feed-through-Verfahrens, von Zäpfchen, durch parenterale Verabreichung, wie zum Beispiel durch Injektionen (intramuskulär, subcutan, intravenös, intraperitonal u.a.), Implantate, durch nasale Applikation, durch dermale Anwendung in Form beispielsweise des Tauchens oder Badens (Dippen), Sprühens (Spray), Aufgießens (Pour-on und Spot-on), des Waschens, des Einpuderns sowie mit Hilfe von wirkstoffhaltigen Formkörpern, wie Halsbändern, Ohrmarken, Schwanzmarken, Gliedmaßenbändern, Halftern, Markierungsvorrichtungen usw.
- Bei der Anwendung für Vieh, Geflügel, Haustiere etc. kann man die Wirkstoffkombinationen als Formulierungen (beispielsweise Pulver, Emulsionen, fließfähige Mittel), die die Wirkstoffe in einer Menge von 1 bis 80 Gew.-% enthalten, direkt oder nach 100 bis 10 000-facher Verdünnung anwenden oder sie als chemisches Bad verwenden.
- Die erfindungsgemäßen Wirkstoffkombinationen können gegebenenfalls in bestimmten Konzentrationen bzw. Aufwandmengen auch als Herbizide, Safener, Wachstumsregulatoren oder Mittel zur Verbesserung der Pflanzeneigenschaften, oder als Mikrobizide, beispielsweise als Fungizide, Antimykotika, Bakterizide, Virizide (einschließlich Mittel gegen Viroide) oder als Mittel gegen MLO (Mycoplasma-like-organism) und RLO (Rickettsia-like-organism) verwendet werden.
- Die Wirkstoffe können in die üblichen Formulierungen überführt werden, wie Lösungen, Emulsionen, Spritzpulver, wasser- und ölbasierte Suspensionen, Pulver, Stäubemittel, Pasten, lösliche Pulver, lösliche Granulate, Streugranulate, Suspensions-Emulsions-Konzentrate, Wirkstoff-imprägnierte Naturstoffe, Wirkstoff-imprägnierte synthetische Stoffe, Düngemittel sowie Feinstverkapselungen in polymeren Stoffen.
- Diese Formulierungen werden in bekannter Weise hergestellt, z.B. durch Vermischen der Wirkstoffe mit Streckmitteln, also flüssigen Lösungsmitteln und/oder festen Trägerstoffen, gegebenenfalls unter Verwendung von oberflächenaktiven Mitteln, also Emulgiermitteln und/oder Dispergiermitteln und/oder schaumerzeugenden Mitteln. Die Herstellung der Formulierungen erfolgt entweder in geeigneten Anlagen oder auch vor oder während der Anwendung.
- Als Hilfsstoffe können solche Stoffe Verwendung finden, die geeignet sind, dem Mittel selbst oder und/oder davon abgeleitete Zubereitungen (z.B. Spritzbrühen, Saatgutbeizen) besondere Eigenschaften zu verleihen, wie bestimmte technische Eigenschaften und/oder auch besondere biologische Eigenschaften. Als typische Hilfsmittel kommen in Frage: Streckmittel, Lösemittel und Trägerstoffe.
- Als Streckmittel eignen sich z.B. Wasser, polare und unpolare organische chemische Flüssigkeiten z.B. aus den Klassen der aromatischen und nicht-aromatischen Kohlenwasserstoffe (wie Paraffine, Alkylbenzole, Alkylnaphthaline, Chlorbenzole), der Alkohole und Polyole (die ggf. auch substituiert, verethert und/oder verestert sein können), der Ketone (wie Aceton, Cyclohexanon), Ester (auch Fette und Öle) und (poly-)Ether, der einfachen und substituierten Amine, Amide, Lactame (wie N-Alkylpyrrolidone) und Lactone, der Sulfone und Sulfoxide (wie Dimethylsulfoxid).
- Im Falle der Benutzung von Wasser als Streckmittel können z.B. auch organische Lösemittel als Hilfslösungsmittel verwendet werden. Als flüssige Lösemittel kommen im wesentlichen in Frage:
- Aromaten, wie Xylol, Toluol, oder Alkylnaphthaline, chlorierte Aromaten und chlorierte aliphatische Kohlenwasserstoffe, wie Chlorbenzole, Chlorethylene oder Methylenchlorid, aliphatische Kohlenwasserstoffe, wie Cyclohexan oder Paraffine, z.B. Erdölfraktionen, mineralische und pflanzliche Öle, Alkohole, wie Butanol oder Glykol sowie deren Ether und Ester, Ketone wie Aceton, Methylethylketon, Methylisobutylketon oder Cyclohexanon, stark polare Lösungsmittel, wie Dimethylsulfoxid, sowie Wasser.
- Erfindungsgemäß bedeutet Trägerstoff eine natürliche oder synthetische, organische oder anorganische Substanz, welcher fest oder flüssig sein kann, mit welchen die Wirkstoffe zur besseren Anwendbarkeit, insbesondere zum Aufbringen auf Pflanzen oder Pflanzenteile oder Saatgut, gemischt oder verbunden sind. Der feste oder flüssige Trägerstoff ist im Allgemeinen inert und sollte in der Landwirtschaft verwendbar sein.
- Als feste oder flüssige Trägerstoffe kommen in Frage:
z.B. Ammoniumsalze und natürliche Gesteinsmehle, wie Kaoline, Tonerden, Talkum, Kreide, Quarz, Attapulgit, Montmorillonit oder Diatomeenerde und synthetische Gesteinsmehle, wie hochdisperse Kieselsäure, Aluminiumoxid und Silikate, als feste Trägerstoffe für Granulate kommen in Frage: z.B. gebrochene und fraktionierte natürliche Gesteine wie Calcit, Marmor, Bims, Sepiolith, Dolomit sowie synthetische Granulate aus anorganischen und organischen Mehlen sowie Granulate aus organischem Material wie Papier, Sägemehl, Kokosnussschalen, Maiskolben und Tabakstängeln; als Emulgier- und/oder schaumerzeugende Mittel kommen in Frage: z.B. nichtionogene und anionische Emulgatoren, wie Polyoxyethylen-Fettsäure-Ester, Polyoxyethylen-Fettalkohol-Ether, z.B. Alkylaryl-polyglykolether, Alkylsulfonate, Alkylsulfate, Arylsulfonate sowie Eiweißhydrolysate; als Dispergiermittel kommen in Frage nicht-ionische und/oder ionische Stoffe, z.B. aus den Klassen der Alkohol-POE- und/oder POP-Ether, Säure- und/oder POP- POE-Ester, Alkyl-Aryl- und/oder POP- POE-Ether, Fett- und/oder POP- POE-Addukte, POE- und/oder POP-Polyol Derivate, POE- und/oder POP-Sorbitan- oder Zucker-Addukte, Alky- oder Aryl-Sulfate, Sulfonate und Phosphate oder die entsprechenden PO-Ether-Addukte. Ferner geeignete Oligo- oder Polymere, z.B. ausgehend von vinylischen Monomeren, von Acrylsäure, aus EO und/oder PO allein oder in Verbindung mit z.B. (poly-) Alkoholen oder (poly-) Aminen. Ferner können Einsatz finden Lignin und seine Sulfonsäure-Derivate, einfache und modifizierte Cellulosen, aromatische und/oder aliphatische Sulfonsäuren sowie deren Addukte mit Formaldehyd. - Es können in den Formulierungen Haftmittel wie Carboxymethylcellulose, natürliche und synthetische pulvrige, körnige oder latexförmige Polymere verwendet werden, wie Gummiarabicum, Polyvinylalkohol, Polyvinylacetat, sowie natürliche Phospholipide, wie Kephaline und Lecithine und synthetische Phospholipide.
- Es können Farbstoffe wie anorganische Pigmente, z.B. Eisenoxid, Titanoxid, Ferrocyanblau und organische Farbstoffe, wie Alizarin-, Azo- und Metallphthalocyaninfarbstoffe und Spurennährstoffe wie Salze von Eisen, Mangan, Bor, Kupfer, Kobalt, Molybdän und Zink verwendet werden.
- Weitere Additive können Duftstoffe, mineralische oder vegetabile gegebenenfalls modifizierte Öle, Wachse und Nährstoffe (auch Spurennährstoffe), wie Salze von Eisen, Mangan, Bor, Kupfer, Kobalt, Molybdän und Zink sein.
- Weiterhin enthalten sein können Stabilisatoren wie Kältestabilisatoren, Konservierungsmittel, Oxidationsschutzmittel, Lichtschutzmittel oder andere die chemische und/oder physikalische Stabilität verbessernde Mittel.
- Der Wirkstoffgehalt der aus den handelsüblichen Formulierungen bereiteten Anwendungsformen kann in weiten Bereichen variieren. Die Wirkstoffkonzentration der Anwendungsformen liegt im Bereich von 0,00000001 bis 97 Gew.-% Wirkstoff, vorzugsweise im Bereich von 0,0000001 bis 97 Gew.-%, besonders bevorzugt im Bereich von 0,000001 bis 83 Gew.-% oder 0,000001 bis 5 Gew.-% und ganz besonders bevorzugt im Bereich von 0,0001 bis 1 Gew.-%.
- Der erfindungsgemäßen Wirkstoffkombinationen können in ihren handelsüblichen Formulierungen sowie in den aus diesen Formulierungen bereiteten Anwendungsformen in Mischung mit anderen Wirkstoffen wie Insektiziden, Lockstoffen, Sterilantien, Bakteriziden, Akariziden, Nematiziden, Fungiziden, wachstumsregulierenden Stoffen, Herbiziden, Safenern, Düngemitteln oder Semiochemicals vorliegen.
- Auch eine Mischung mit anderen bekannten Wirkstoffen, wie Herbiziden, Düngemitteln, Wachstumsregulatoren, Safenern, Semiochemicals, oder auch mit Mitteln zur Verbesserung der Pflanzeneigenschaften ist möglich.
- Die erfindungsgemäßen Wirkstoffkombinationen können ferner beim Einsatz als Fungizide und/oder Insektizide in ihren handelsüblichen Formulierungen sowie in den aus diesen Formulierungen bereiteten Anwendungsformen in Mischung mit Synergisten vorliegen. Synergisten sind Verbindungen, durch die die Wirkung der Wirkstoffe gesteigert wird, ohne dass der zugesetzte Synergist selbst aktiv wirksam sein muss.
- Die erfindungsgemäßen Wirkstoffkombinationen können ferner beim Einsatz als Fungizide und/oder Insektizide in ihren handelsüblichen Formulierungen sowie in den aus diesen Formulierungen bereiteten Anwendungsformen in Mischungen mit Hemmstoffen vorliegen, die einen Abbau des Wirkstoffes nach Anwendung in der Umgebung der Pflanze, auf der Oberfläche von Pflanzenteilen oder in pflanzlichen Geweben vermindern.
- Die Anwendung geschieht in einer den Anwendungsformen angepassten üblichen Weise.
- Erfindungsgemäß können alle Pflanzen und Pflanzenteile behandelt werden. Unter Pflanzen werden hierbei alle Pflanzen und Pflanzenpopulationen verstanden, wie erwünschte und unerwünschte Wildpflanzen oder Kulturpflanzen (einschließlich natürlich vorkommender Kulturpflanzen). Kulturpflanzen können Pflanzen sein, die durch konventionelle Züchtungs- und Optimierungsmethoden oder durch biotechnologische und gentechnologische Methoden oder Kombinationen dieser Methoden erhalten werden können, einschließlich der transgenen Pflanzen und einschließlich der durch Sortenschutzrechte schützbaren oder nicht schützbaren Pflanzensorten. Unter Pflanzenteilen sollen alle oberirdischen und unterirdischen Teile und Organe der Pflanzen, wie Sproß, Blatt, Blüte und Wurzel verstanden werden, wobei beispielhaft Blätter, Nadeln, Stengel, Stämme, Blüten, Fruchtkörper, Früchte und Saatgut sowie Wurzeln, Knollen und Rhizome aufgeführt werden. Zu den Pflanzenteilen gehört auch Erntegut sowie vegetatives und generatives Vermehrungsmaterial, beispielsweise Früchte, Samen, Stecklinge, Knollen, Rhizome, Ableger, Saatgut, Brutzwiebeln, Absenker und Ausläufer.
- Die erfindungsgemäße Behandlung der Pflanzen und Pflanzenteile mit den Wirkstoffkombinationen erfolgt direkt oder durch Einwirkung auf deren Umgebung, Lebensraum oder Lagerraum nach den üblichen Behandlungsmethoden, z.B. durch Tauchen, Sprühen, Verdampfen, Vernebeln, Streuen, Aufstreichen, Injizieren und bei Vermehrungsmaterial, insbesondere bei Saatgut, weiterhin durch ein- oder mehrschichtiges Umhüllen. Dabei können die Wirkstoffkombinationen vor der Behandlung durch Mischen der einzelnen Wirkstoffe herstellt werden. Oder die Behandlung erfolgt nacheinander durch Einsatz zunächst einer Verbindung der Formel (I) gefolgt von der Behandlung mit einem Wirkstoff der Gruppen (2) bis (25). Es ist jedoch auch möglich die Pflanzen oder Pflanzenteile zunächst mit einem Wirkstoff der Gruppen (2) bis (25) zu behandeln und die Behandlung mit einer Verbindung der Formel I anzuschließen.
- Als Pflanzen, welche erfindungsgemäß behandelt werden können, seien folgende erwähnt: Baumwolle, Flachs, Weinrebe, Obst, Gemüse, wie Rosaceae sp. (beispielsweise Kernfrüchte wie Apfel und Birne, aber auch Steinfrüchte wie Aprikosen, Kirschen, Mandeln und Pfirsiche und Beerenfrüchte wie Erdbeeren), Ribesioidae sp., Juglandaceae sp., Betulaceae sp., Anacardiaceae sp., Fagaceae sp., Moraceae sp., Oleaceae sp., Actinidaceae sp., Lauraceae sp., Musaceae sp. (beispielsweise Bananenbäume und -plantagen), Rubiaceae sp. (beispielsweise Kaffee), Theaceae sp., Sterculiceae sp., Rutaceae sp. (beispielsweise Zitronen, Organen und Grapefruit); Solanaceae sp. (beispielsweise Tomaten), Liliaceae sp., Asteraceae sp. (beispielsweise Salat), Umbelliferae sp., Cruciferae sp., Chenopodiaceae sp., Cucurbitaceae sp. (beispielsweise Gurke), Alliaceae sp. (beispielsweise Lauch, Zwiebel), Papilionaceae sp. (beispielsweise Erbsen); Hauptnutzpflanzen, wie Gramineae sp. (beispielsweise Mais, Rasen, Getreide wie Weizen, Roggen, Reis, Gerste, Hafer, Hirse und Triticale), Asteraceae sp. (beispielsweise Sonnenblume), Brassicaceae sp. (beispielsweise Weißkohl, Rotkohl, Brokkoli, Blumenkohl, Rosenkohl, Pak Choi, Kohlrabi, Radieschen sowie Raps, Senf, Meerrettich und Kresse), Fabacae sp. (beispielsweise Bohne, Erdnüsse), Papilionaceae sp. (beispielsweise Sojabohne), Solanaceae sp. (beispielsweise Kartoffeln), Chenopodiaceae sp. (beispielsweise Zuckerrübe, Futterrübe, Mangold, Rote Rübe); Nutzpflanzen und Zierpflanzen in Garten und Wald; sowie jeweils genetisch modifizierte Arten dieser Pflanzen.
- Das erfindungsgemäße Behandlungsverfahren kann für die Behandlung von genetisch modifizierten Organismen (GMOs), z. B. Pflanzen oder Samen, verwendet werden. Genetisch modifizierte Pflanzen (oder transgene Pflanzen) sind Pflanzen, bei denen ein heterologes Gen stabil in das Genom integriert worden ist. Der Begriff „heterologes Gen“ bedeutet im wesentlichen ein Gen, das außerhalb der Pflanze bereitgestellt oder assembliert wird und das bei Einführung in das Zellkerngenom, das Chloroplastengenom oder das Hypochondriengenom der transformierten Pflanze dadurch neue oder verbesserte agronomische oder sonstige Eigenschaften verleiht, daß es ein interessierendes Protein oder Polypeptid exprimiert oder daß es ein anderes Gen, das in der Pflanze vorliegt bzw. andere Gene, die in der Pflanze vorliegen, herunterreguliert oder abschaltet (zum Beispiel mittels Antisense-Technologie, Cosuppressionstechnologie oder RNAi-Technologie [RNA Interference]). Ein heterologes Gen, das im Genom vorliegt, wird ebenfalls als Transgen bezeichnet. Ein Transgen, das durch sein spezifisches Vorliegen im Pflanzengenom definiert ist, wird als Transformations- bzw. transgenes Event bezeichnet.
- In Abhängigkeit von den Pflanzenarten oder Pflanzensorten, ihrem Standort und ihren Wachstumsbedingungen (Böden, Klima, Vegetationsperiode, Ernährung) kann die erfindungsgemäße Behandlung auch zu überadditiven („synergistischen“) Effekten führen. So sind zum Beispiel die folgenden Effekte möglich, die über die eigentlich zu erwartenden Effekte hinausgehen: verringerte Aufwandmengen und/oder erweitertes Wirkungsspektrum und/oder erhöhte Wirksamkeit der Wirkstoffe und Zusammensetzungen, die erfindungsgemäß eingesetzt werden können, besseres Pflanzenwachstum, erhöhte Toleranz gegenüber hohen oder niedrigen Temperaturen, erhöhte Toleranz gegenüber Trockenheit oder Wasser- oder Bodensalzgehalt, erhöhte Blühleistung, Ernteerleichterung, Reifebeschleunigung, höhere Erträge, größere Früchte, größere Pflanzenhöhe, intensiver grüne Farbe des Blatts, frühere Blüte, höhere Qualität und/oder höherer Nährwert der Ernteprodukte, höhere Zuckerkonzentration in den Früchten, bessere Lagerfähigkeit und/oder Verarbeitbarkeit der Ernteprodukte.
- In gewissen Aufwandmengen können die erfindungsgemäßen Wirkstoffkombinationen auch eine stärkende Wirkung auf Pflanzen ausüben. Sie eignen sich daher für die Mobilisierung des pflanzlichen Abwehrsystems gegen Angriff durch unerwünschte phytopathogene Pilze und/oder Mikroorganismen und/oder Viren. Dies kann gegebenenfalls einer der Gründe für die erhöhte Wirksamkeit der erfindungsgemäßen Kombinationen sein, zum Beispiel gegen Pilze. Pflanzenstärkende (resistenzinduzierende) Substanzen sollen im vorliegenden Zusammenhang auch solche Substanzen oder Substanzkombinationen bedeuten, die fähig sind, das pflanzliche Abwehrsystem so zu stimulieren, daß die behandelten Pflanzen, wenn sie im Anschluß daran mit unerwünschten phytopathogenen Pilzen und/oder Mikroorganismen und/oder Viren inokkuliert werde, einen beträchtlichen Resistenzgrad gegen diese unerwünschten phytopathogenen Pilze und/oder Mikroorganismen und/oder Viren aufweisen. Im vorliegenden Fall versteht man unter unerwünschten phytopathogenen Pilzen und/oder Mikroorganismen und/oder Viren phytopathogene Pilze, Bakterien und Viren. Die erfindungsgemäßen Substanzen lassen sich daher zum Schutz von Pflanzen gegen Angriff durch die erwähnten Pathogene innerhalb eines gewissen Zeitraums nach der Behandlung einsetzen. Der Zeitraum, über den eine Schutzwirkung erzielt wird, erstreckt sich im allgemeinen von 1 bis 10 Tagen, vorzugsweise 1 bis 7 Tagen, nach der Behandlung der Pflanzen mit den Wirkstoffen.
- Zu Pflanzen und Pflanzensorten, die vorzugsweise erfindungsgemäß behandelt werden, zählen alle Pflanzen, die über Erbgut verfügen, das diesen Pflanzen besonders vorteilhafte, nützliche Merkmale verleiht (egal, ob dies durch Züchtung und/oder Biotechnologie erzielt wurde).
- Pflanzen und Pflanzensorten, die ebenfalls vorzugsweise erfindungsgemäß behandelt werden, sind gegen einen oder mehrere biotische Streßfaktoren resistent, d. h. diese Pflanzen weisen eine verbesserte Abwehr gegen tierische und mikrobielle Schädlinge wie Nematoden, Insekten, Milben, phytopathogene Pilze, Bakterien, Viren und/oder Viroide auf.
- Pflanzen und Pflanzensorten, die ebenfalls erfindungsgemäß behandelt werden können, sind solche Pflanzen, die gegen einen oder mehrere abiotische Streßfaktoren resistent sind. Zu den abiotischen Streßbedingungen können zum Beispiel Dürre, Kälte- und Hitzebedingungen, osmotischer Streß, Staunässe, erhöhter Bodensalzgehalt, erhöhtes Ausgesetztsein an Mineralien, Ozonbedingungen, Starklichtbedingungen, beschränkte Verfügbarkeit von Stickstoffnährstoffen, beschränkte Verfügbarkeit von Phosphornährstoffen oder Vermeidung von Schatten zählen.
- Pflanzen und Pflanzensorten, die ebenfalls erfindungsgemäß behandelt werden können, sind solche Pflanzen, die durch erhöhte Ertragseigenschaften gekennzeichnet sind. Ein erhöhter Ertrag kann bei diesen Pflanzen z. B. auf verbesserter Pflanzenphysiologie, verbessertem Pflanzenwuchs und verbesserter Pflanzenentwicklung, wie Wasserverwertungseffizienz, Wasserhalteeffizienz, verbesserter Stickstoffverwertung, erhöhter Kohlenstoffassimilation, verbesserter Photosynthese, verstärkter Keimkraft und beschleunigter Abreife beruhen. Der Ertrag kann weiterhin durch eine verbesserte Pflanzenarchitektur (unter Streß- und nicht-Streß-Bedingungen) beeinflußt werden, darunter frühe Blüte, Kontrolle der Blüte für die Produktion von Hybridsaatgut, Keimpflanzenwüchsigkeit, Pflanzengröße, Internodienzahl und -abstand, Wurzelwachstum, Samengröße, Fruchtgröße, Schotengröße, Schoten- oder Ährenzahl, Anzahl der Samen pro Schote oder Ähre, Samenmasse, verstärkte Samenfüllung, verringerter Samenausfall, verringertes Schotenplatzen sowie Standfestigkeit. Zu weiteren Ertragsmerkmalen zählen Samenzusammensetzung wie Kohlenhydratgehalt, Proteingehalt, Ölgehalt und Ölzusammensetzung, Nährwert, Verringerung der nährwidrigen Verbindungen, verbesserte Verarbeitbarkeit und verbesserte Lagerfähigkeit.
- Pflanzen, die erfindungsgemäß behandelt werden können, sind Hybridpflanzen, die bereits die Eigenschaften der Heterosis bzw. des Hybrideffekts exprimieren, was im allgemeinen zu höherem Ertrag, höherer Wüchsigkeit, besserer Gesundheit und besserer Resistenz gegen biotische und abiotische Streßfaktoren führt. Solche Pflanzen werden typischerweise dadurch erzeugt, daß man eine ingezüchtete pollensterile Elternlinie (den weiblichen Kreuzungspartner) mit einer anderen ingezüchteten pollenfertilen Elternlinie (dem männlichen Kreuzungspartner) kreuzt. Das Hybridsaatgut wird typischerweise von den pollensterilen Pflanzen geerntet und an Vermehrer verkauft. Pollensterile Pflanzen können manchmal (z. B. beim Mais) durch Entfahnen (d. h. mechanischem Entfernen der männlichen Geschlechtsorgane bzw. der männlichen Blüten), produziert werden; es ist jedoch üblicher, daß die Pollensterilität auf genetischen Determinanten im Pflanzengenom beruht. In diesem Fall, insbesondere dann, wenn es sich bei dem gewünschten Produkt, da man von den Hybridpflanzen ernten will, um die Samen handelt, ist es üblicherweise günstig, sicherzustellen, daß die Pollenfertilität in Hybridpflanzen, die die für die Pollensterilität verantwortlichen genetischen Determinanten enthalten, völlig restoriert wird. Dies kann erreicht werden, indem sichergestellt wird, daß die männlichen Kreuzungspartner entsprechende Fertilitätsrestorergene besitzen, die in der Lage sind, die Pollenfertilität in Hybridpflanzen, die die genetischen Determinanten, die für die Pollensterilität verantwortlich sind, enthalten, zu restorieren. Genetische Determinanten für Pollensterilität können im Cytoplasma lokalisiert sein. Beispiele für cytoplasmatische Pollensterilität (CMS) wurden zum Beispiel für Brassica-Arten beschrieben (
WO 1992/005251 WO 1995/009910 WO 1998/27806 WO 2005/002324 WO 2006/021972 US 6,229,072 ). Genetische Determinanten für Pollensterilität können jedoch auch im Zellkerngenom lokalisiert sein. Pollensterile Pflanzen können auch mit Methoden der pflanzlichen Biotechnologie, wie Gentechnik, erhalten werden. Ein besonders günstiges Mittel zur Erzeugung von pollensterilen Pflanzen ist inWO 89/10396 - Die Fertilität kann dann durch Expression eines Ribonukleasehemmers wie Barstar in den Tapetumzellen restoriert werden (z. B.
WO 1991/002069 - Pflanzen oder Pflanzensorten (die mit Methoden der Pflanzenbiotechnologie, wie der Gentechnik, erhalten werden), die erfindungsgemäß behandelt werden können, sind herbizidtolerante Pflanzen, d. h. Pflanzen, die gegenüber einem oder mehreren vorgegebenen Herbiziden tolerant gemacht worden sind. Solche Pflanzen können entweder durch genetische Transformation oder durch Selektion von Pflanzen, die eine Mutation enthalten, die solch eine Herbizidtoleranz verleiht, erhalten werden.
- Herbizidtolerante Pflanzen sind zum Beispiel glyphosatetolerante Pflanzen, d. h. Pflanzen, die gegenüber dem Herbizid Glyphosate oder dessen Salzen tolerant gemacht worden sind. So können zum Beispiel glyphosatetolerante Pflanzen durch Transformation der Pflanze mit einem Gen, das für das Enzym 5-Enolpyruvylshikimat-3-phosphatsynthase (EPSPS) kodiert, erhalten werden. Beispiele für solche EPSPS-Gene sind das AroA-Gen (Mutante CT7) des Bakterium Salmonella typhimurium (Comai et al., Science (1983), 221, 370-371), das CP4-Gen des Bakteriums Agrobacterium sp. (Barry et al., Curr. Topics Plant Physiol. (1992), 7, 139-145), die Gene, die für eine EPSPS aus der Petunie (Shah et al., Science (1986), 233, 478-481), für eine EPSPS aus der Tomate (Gasser et al., J. Biol. Chem. (1988), 263, 4280-4289) oder für eine EPSPS aus Eleusine (
WO 2001/66704 EP-A 0837944 ,WO 2000/066746 WO 2000/066747 WO 2002/026995 US 5,776,760 undUS 5,463,175 beschrieben ist, kodiert. Glyphosatetolerante Pflanzen können auch dadurch erhalten werden, daß man ein Gen exprimiert, das für ein Glyphosate-acetyltransferase-Enzym, wie es in z. B.WO 2002/036782 WO 2003/092360 WO 2005/012515 WO 2007/024782 WO 2001/024615 WO 2003/013226 - Sonstige herbizidresistente Pflanzen sind zum Beispiel Pflanzen, die gegenüber Herbiziden, die das Enzym Glutaminsynthase hemmen, wie Bialaphos, Phosphinotricin oder Glufosinate, tolerant gemacht worden sind. Solche Pflanzen können dadurch erhalten werden, daß man ein Enzym exprimiert, das das Herbizid oder eine Mutante des Enzyms Glutaminsynthase, das gegenüber Hemmung resistent ist, entgiftet. Solch ein wirksames entgiftendes Enzym ist zum Beispiel ein Enzym, das für ein Phosphinotricin-acetyltransferase kodiert (wie zum Beispiel das bar- oder pat-Protein aus Streptomyces-Arten). Pflanzen, die eine exogene Phosphinotricin-acetyltransferase exprimieren, sind zum Beispiel in
US 5,561,236 ;US 5,648,477 ;US 5,646,024 ;US 5,273,894 ;US 5,637,489 ;US 5,276,268 ;US 5,739,082 ;US 5,908,810 undUS 7,112,665 beschrieben. - Weitere herbizidtolerante Pflanzen sind auch Pflanzen, die gegenüber den Herbiziden, die das Enzym Hydroxyphenylpyruvatdioxygenase (HPPD) hemmen, tolerant gemacht worden sind. Bei den Hydroxyphenylpyruvatdioxygenasen handelt es sich um Enzyme, die die Reaktion, in der para-Hydroxyphenylpyruvat (HPP) zu Homogentisat umgesetzt wird, katalysieren. Pflanzen, die gegenüber HPPD-Hemmern tolerant sind, können mit einem Gen, das für ein natürlich vorkommendes resistentes HPPD-Enzym kodiert, oder einem Gen, das für ein mutiertes HPPD-Enzym gemäß
WO 1996/038567 WO 1999/024585 WO 1999/024586 WO 1999/034008 WO 2002/36787 WO 2004/024928 - Weitere herbizidresistente Pflanzen sind Pflanzen, die gegenüber Acetolactatsynthase (ALS)-Hemmern tolerant gemacht worden sind. Zu bekannten ALS-Hemmern zählen zum Beispiel Sulfonylharnstoff, Imidazolinon, Triazolopyrimidine, Pyrimidinyloxy(thio)benzoate und/oder Sulfonylaminocarbonyltriazolinon-Herbizide. Es ist bekannt, daß verschiedene Mutationen im Enzym ALS (auch als Acetohydroxysäure-Synthase, AHAS, bekannt) eine Toleranz gegenüber unterschiedlichen Herbiziden bzw. Gruppen von Herbiziden verleihen, wie dies zum Beispiel bei Tranel und Wright, Weed Science (2002), 50, 700-712, jedoch auch in
US 5,605,011 ,US 5,378,824 ,US 5,141,870 undUS 5,013,659 , beschrieben ist. Die Herstellung von sulfonylharnstofftoleranten Pflanzen und imidazolinontoleranten Pflanzen ist inUS 5,605,011 ;US 5,013,659 ;US 5,141,870 ;US 5,767,361 ;US 5,731,180 ;US 5,304,732 ;US 4,761,373 ;US 5,331,107 ;US 5,928,937 ; undUS 5,378,824 ; sowie in der internationalen VeröffentlichungWO 1996/033270 WO 2004/040012 WO 2004/106529 WO 2005/020673 WO 2005/093093 WO 2006/007373 WO 2006/015376 WO 2006/024351 WO 2006/060634 WO 2007/024782 - Weitere Pflanzen, die gegenüber Imidazolinon und/oder Sulfonylharnstoff tolerant sind, können durch induzierte Mutagenese, Selektion in Zellkulturen in Gegenwart des Herbizids oder durch Mutationszüchtung erhalten werden, wie dies zum Beispiel für die Sojabohne in
US 5,084,082 , für Reis inWO 1997/41218 US 5,773,702 undWO 1999/057965 US 5,198,599 oder für die Sonnenblume inWO 2001/065922 - Pflanzen oder Pflanzensorten (die nach Methoden der pflanzlichen Biotechnologie, wie der Gentechnik, erhalten wurden), die ebenfalls erfindungsgemäß behandelt werden können, sind insektenresistente transgene Pflanzen, d.h. Pflanzen, die gegen Befall mit gewissen Zielinsekten resistent gemacht wurden. Solche Pflanzen können durch genetische Transformation oder durch Selektion von Pflanzen, die eine Mutation enthalten, die solch eine Insektenresistenz verleiht, erhalten werden.
- Der Begriff „insektenresistente transgene Pflanze“ umfaßt im vorliegenden Zusammenhang jegliche Pflanze, die mindestens ein Transgen enthält, das eine Kodiersequenz umfaßt, die für folgendes kodiert:
- 1) ein insektizides Kristallprotein aus Bacillus thuringiensis oder einen insektiziden Teil davon, wie die insektiziden Kristallproteine, die von Crickmore et al., Microbiology and Molecular Biology Reviews (1998), 62, 807-813, von Crickmore et al. (2005) in der Bacillus thuringiensis -Toxinnomenklatur aktualisiert, online bei: https://www.lifesci.sussex.ac.uk/Home/Neil_Crickmore/Bt/), zusammengestellt wurden, oder insektizide Teile davon, z.B. Proteine der Cry-Proteinklassen Cry1Ab, Cry1Ac, Cry1F, Cry2Ab, Cry3Ae oder Cry3Bb oder insektizide Teile davon; oder
- 2) ein Kristallprotein aus Bacillus thuringiensis oder einen Teil davon, der in Gegenwart eines zweiten, anderen Kristallproteins als Bacillus thuringiensis oder eines Teils davon insektizid wirkt, wie das binäre Toxin, das aus den Kristallproteinen Cy34 und Cy35 besteht (Moellenbeck et al., Nat. Biotechnol. (2001), 19, 668-72; Schnepf et al., Applied Environm. Microb. (2006), 71, 1765-1774); oder
- 3) ein insektizides Hybridprotein, das Teile von zwei unterschiedlichen insektiziden Kristallproteinen aus Bacillus thuringiensis umfaßt, wie zum Beispiel ein Hybrid aus den Proteinen von 1) oben oder ein Hybrid aus den Proteinen von 2) oben, z. B. das Protein Cry1A.105, das von dem Mais-Event MON98034 produziert wird (
WO 2007/027777 - 4) ein Protein gemäß einem der Punkte 1) bis 3) oben, in dem einige, insbesondere 1 bis 10, Aminosäuren durch eine andere Aminosäure ersetzt wurden, um eine höhere insektizide Wirksamkeit gegenüber einer Zielinsektenart zu erzielen und/oder um das Spektrum der entsprechenden Zielinsektenarten zu erweitern und/oder wegen Veränderungen, die in die Kodier- DNA während der Klonierung oder Transformation induziert wurden, wie das Protein Cry3Bb1 in Mais-Events MON863 oder MON88017 oder das Protein Cry3A im Mais-Event MIR 604; oder
- 5) ein insektizides sezerniertes Protein aus Bacillus thuringiensis oder Bacillus cereus oder einen insektiziden Teil davon, wie die vegetativ wirkenden insektentoxischen Proteine (vegetative insekticidal proteins, VIP), die unter https://www.lifesci.sussex.ac.uk/Home/Neil_Crickmore/Bt/vip.html angeführt sind, z. B. Proteine der Proteinklasse VIP3Aa; oder
- 6) ein sezerniertes Protein aus Bacillus thuringiensis oder Bacillus cereus, das in Gegenwart eines zweiten sezernierten Proteins aus Bacillus thuringiensis oder B. cereus insektizid wirkt, wie das binäre Toxin, das aus den Proteinen VIP1A und VIP2A besteht (
WO 1994/21795 - 7) ein insektizides Hybridprotein, das Teile von verschiedenen sezernierten Proteinen von Bacillus thuringiensis oder Bacillus cereus umfaßt, wie ein Hybrid der Proteine von 1) oder ein Hybrid der Proteine von 2) oben; oder
- 8) ein Protein gemäß einem der Punkte 1) bis 3) oben, in dem einige, insbesondere 1 bis 10, Aminosäuren durch eine andere Aminosäure ersetzt wurden, um eine höhere insektizide Wirksamkeit gegenüber einer Zielinsektenart zu erzielen und/oder um das Spektrum der entsprechenden Zielinsektenarten zu erweitern und/oder wegen Veränderungen, die in die Kodier- DNA während der Klonierung oder Transformation induziert wurden (wobei die Kodierung für ein insektizides Protein erhalten bleibt), wie das Protein VIP3Aa im Baumwoll-Event COT 102.
- Natürlich zählt zu den insektenresistenten transgenen Pflanzen im vorliegenden Zusammenhang auch jegliche Pflanze, die eine Kombination von Genen umfaßt, die für die Proteine von einer der oben genannten Klassen 1 bis 8 kodieren. In einer Ausführungsform enthält eine insektenresistente Pflanze mehr als ein Transgen, das für ein Protein nach einer der oben genannten 1 bis 8 kodiert, um das Spektrum der entsprechenden Zielinsektenarten zu erweitern oder um die Entwicklung einer Resistenz der Insekten gegen die Pflanzen dadurch hinauszuzögern, daß man verschiedene Proteine einsetzt, die für dieselbe Zielinsektenart insektizid sind, jedoch eine unterschiedliche Wirkungsweise, wie Bindung an unterschiedliche Rezeptorbindungsstellen im Insekt, aufweisen.
- Pflanzen oder Pflanzensorten (die nach Methoden der pflanzlichen Biotechnologie, wie der Gentechnik, erhalten wurden), die ebenfalls erfindungsgemäß behandelt werden können, sind gegenüber abiotischen Streßfaktoren tolerant. Solche Pflanzen können durch genetische Transformation oder durch Selektion von Pflanzen, die eine Mutation enthalten, die solch eine Streßresistenz verleiht, erhalten werden. Zu besonders nützlichen Pflanzen mit Streßtoleranz zählen folgende:
- a. Pflanzen, die ein Transgen enthalten, das die Expression und/oder Aktivität des Gens für die Poly(ADP-ribose)polymerase (PARP) in den Pflanzenzellen oder Pflanzen zu reduzieren vermag, wie dies in
WO 2000/004173 EP 04077984.5 EP 06009836.5 - b. Pflanzen, die ein streßtoleranzförderndes Transgen enthalten, das die Expression und/oder Aktivität der für PARG kodierenden Gene der Pflanzen oder Pflanzenzellen zu reduzieren vermag, wie dies z.B. in
WO 2004/090140 - c. Pflanzen, die ein streßtoleranzförderndes Transgen enthalten, das für ein in Pflanzen funktionelles Enzym des Nicotinamidadenindinukleotid-Salvage-Biosynthesewegs kodiert, darunter Nicotinamidase, Nicotinatphosphoribosyltransferase, Nicotinsäuremononukleotidadenyltransferase, Nicotinamidadenindinukleotidsynthetase oder Nicotinamidphosphoribosyltransferase, wie dies z. B. in
EP 04077624.7 WO 2006/133827 PCT/EP07/002433 - Pflanzen oder Pflanzensorten (die nach Methoden der pflanzlichen Biotechnologie, wie der Gentechnik, erhalten wurden), die ebenfalls erfindungsgemäß behandelt werden können, weisen eine veränderte Menge, Qualität und/oder Lagerfähigkeit des Ernteprodukts und/oder veränderte Eigenschaften von bestimmten Bestandteilen des Ernteprodukts auf, wie zum Beispiel:
- 1) Transgene Pflanzen, die eine modifizierte Stärke synthetisieren, die bezüglich ihrer chemischphysikalischen Eigenschaften, insbesondere des Amylosegehalts oder des Amylose/Amylopektin-Verhältnisses, des Verzweigungsgrads, der durchschnittlichen Kettenlänge, der Verteilung der Seitenketten, des Viskositätsverhaltens, der Gelfestigkeit, der Stärkekorngröße und/oder Stärkekornmorphologie im Vergleich mit der synthetisierten Stärke in Wildtyppflanzenzellen oder -pflanzen verändert ist, so daß sich diese modifizierte Stärke besser für bestimmte Anwendungen eignet. Diese transgenen Pflanzen, die eine modifizierte Stärke synthetisieren, sind zum Beispiel in
EP 0571427 ,WO 1995/004826 EP 0719338 ,WO 1996/15248 WO 1996/19581 WO 1996/27674 WO 1997/11188 WO 1997/26362 WO 1997/32985 WO 1997/42328 WO 1997/44472 WO 1997/45545 WO 1998/27212 WO 1998/40503 WO 99/58688 WO 1999/58690 WO 1999/58654 WO 2000/008184 WO 2000/008185 WO 2000/28052 WO 2000/77229 WO 2001/12782 WO 2001/12826 WO 2002/101059 WO 2003/071860 WO 2004/056999 WO 2005/030942 WO 2005/030941 WO 2005/095632 WO 2005/095617 WO 2005/095619 WO 2005/095618 WO 2005/123927 WO 2006/018319 WO 2006/103107 WO 2006/108702 WO 2007/009823 WO 2000/22140 WO 2006/063862 WO 2006/072603 WO 2002/034923 EP 06090134.5 EP 06090228.5 EP 06090227.7 EP 07090007.1 EP 07090009.7 WO 2001/14569 WO 2002/79410 WO 2003/33540 WO 2004/078983 WO 2001/19975 WO 1995/26407 WO 1996/34968 WO 1998/20145 WO 1999/12950 WO 1999/66050 WO 1999/53072 US 6,734,341 ,WO 2000/11192 WO 1998/22604 WO 1998/32326 WO 2001/98509 WO 2001/98509 WO 2005/002359 US 5,824,790 ,US 6,013,861 ,WO 1994/004693 WO 1994/009144 WO 1994/11520 WO 1995/35026 WO 1997/20936 - 2) Transgene Pflanzen, die Nichtstärkekohlenhydratpolymere synthetisieren, oder Nichtstärkekohlenhydratpolymere, deren Eigenschaften im Vergleich zu Wildtyppflanzen ohne genetische Modifikation verändert sind. Beispiele sind Pflanzen, die Polyfructose, insbesondere des Inulin- und Levantyps, produzieren, wie dies in
EP 0663956 ,WO 1996/001904 WO 1998/039460 WO 1999/024593 WO 1995/031553 US 2002/031826 ,US 6,284,479 ,US 5,712,107 ,WO 1997/047806 WO 1997/047807 WO 1997/047808 WO 2000/14249 WO 2000/73422 WO 2000/047727 EP 06077301.7 US 5,908,975 undEP 0728213 beschrieben ist. - 3) Transgene Pflanzen, die Hyaluronan produzieren, wie dies zum Beispiel in
WO 2006/032538 WO 2007/039314 WO 2007/039315 WO 2007/039316 JP 2006/304779 WO 2005/012529 - Pflanzen oder Pflanzensorten (die nach Methoden der pflanzlichen Biotechnologie, wie der Gentechnik, erhalten wurden), die ebenfalls erfindungsgemäß behandelt werden können, sind Pflanzen wie Baumwollpflanzen mit veränderten Fasereigenschaften. Solche Pflanzen können durch genetische Transformation oder durch Selektion von Pflanzen, die eine Mutation enthalten, die solche veränderten Fasereigenschaften verleiht, erhalten werden; dazu zählen:
- a) Pflanzen wie Baumwollpflanzen, die eine veränderte Form von Cellulosesynthasegenen enthalten, wie dies in
WO 1998/000549 - b) Pflanzen wie Baumwollpflanzen, die eine veränderte Form von rsw2- oder rsw3-homologen Nukleinsäuren enthalten, wie dies in
WO 2004/053219 - c) Pflanzen wie Baumwollpflanzen mit einer erhöhten Expression der Saccharosephosphatsynthase, wie dies in
WO 2001/017333 - d) Pflanzen wie Baumwollpflanzen mit einer erhöhten Expression der Saccharosesynthase, wie dies in
WO 02/45485 - e) Pflanzen wie Baumwollpflanzen bei denen der Zeitpunkt der Durchlaßsteuerung der Plasmodesmen an der Basis der Faserzelle verändert ist, z. B. durch Herunterregulieren der faserselektiven β-1,3-Glucanase, wie dies in
WO 2005/017157 - f) Pflanzen wie Baumwollpflanzen mit Fasern mit veränderter Reaktivität, z. B. durch Expression des N-Acetylglucosamintransferasegens, darunter auch nodC, und von Chitinsynthasegenen, wie dies in
WO 2006/136351 - Pflanzen oder Pflanzensorten (die nach Methoden der pflanzlichen Biotechnologie, wie der Gentechnik, erhalten wurden), die ebenfalls erfindungsgemäß behandelt werden können, sind Pflanzen wie Raps oder verwandte Brassica-Pflanzen mit veränderten Eigenschaften der Ölzusammensetzung. Solche Pflanzen können durch genetische Transformation oder durch Selektion von Pflanzen, die eine Mutation enthalten, die solche veränderten Öleigenschaften verleiht, erhalten werden; dazu zählen:
- a) Pflanzen wie Rapspflanzen, die Öl mit einem hohen Ölsäuregehalt produzieren, wie dies zum Beispiel in
US 5,969,169 ,US 5,840,946 oderUS 6,323,392 oderUS 6,063 ,947 beschrieben ist; - b) Pflanzen wie Rapspflanzen, die Öl mit einem niedrigen Linolensäuregehalt produzieren, wie dies in
US 6,270828 ,US 6,169,190 oderUS 5,965,755 beschrieben ist. - c) Pflanzen wie Rapspflanzen, die Öl mit einem niedrigen gesättigten Fettsäuregehalt produzieren, wie dies z. B. in
US 5,434,283 beschrieben ist. - Besonders nützliche transgene Pflanzen, die erfindungsgemäß behandelt werden können, sind Pflanzen mit einem oder mehreren Genen, die für ein oder mehrere Toxine kodieren, sind die transgenen Pflanzen, die unter den folgenden Handelsbezeichnungen angeboten werden: YIELD GARD® (zum Beispiel Mais, Baumwolle, Sojabohnen), KnockOut® (zum Beispiel Mais), BiteGard® (zum Beispiel Mais), BT-Xtra® (zum Beispiel Mais), StarLink® (zum Beispiel Mais), Bollgard® (Baumwolle), Nucotn® (Baumwolle), Nucotn 33B® (Baumwolle), NatureGard® (zum Beispiel Mais), Protecta® und NewLeaf® (Kartoffel). Herbizidtolerante Pflanzen, die zu erwähnen sind, sind zum Beispiel Maissorten, Baumwollsorten und Sojabohnensorten, die unter den folgenden Handelsbezeichnungen angeboten werden: Roundup Ready® (Glyphosatetoleranz, zum Beispiel Mais, Baumwolle, Sojabohne), Liberty Link® (Phosphinotricintoleranz, zum Beispiel Raps), IMI® (Imidazolinontoleranz) und SCS® (Sylfonylharnstofftoleranz), zum Beispiel Mais.
- Zu den herbizidresistenten Pflanzen (traditionell auf Herbizidtoleranz gezüchtete Pflanzen), die zu erwähnen sind, zählen die unter der Bezeichnung Clearfield® angebotenen Sorten (zum Beispiel Mais).
- Besonders nützliche transgene Pflanzen, die erfindungsgemäß behandelt werden können, sind Pflanzen, die Transformations-Events, oder eine Kombination von Transformations-Events, enthalten und die zum Beispiel in den Dateien von verschiedenen nationalen oder regionalen Behörden angeführt sind (siehe zum Beispiel https://gmoinfo.jrc.it/gmp_browse.aspx und https://www.agbios.com/dbase.php).
- Insbesondere eignen sich die erfindungsgemäßen Wirkstoffkombinationen zur Behandlung von Saatgut. Bevorzugt sind dabei die vorstehend als bevorzugt oder besonders bevorzugt genannten erfindungsgemäßen Kombinationen zu nennen. So entsteht ein großer Teil des durch phytopathogene Pilze und/oder tierische Schädlinge verursachten Schadens an Kulturpflanzen bereits durch den Befall des Saatguts während der Lagerung und nach dem Einbringen des Saatguts in den Boden sowie während und unmittelbar nach der Keimung der Pflanzen. Diese Phase ist besonders kritisch, da die Wurzeln und Sprosse der wachsenden Pflanze besonders empfindlich sind und bereits ein geringer Schaden zum Absterben der ganzen Pflanze führen kann. Es besteht daher ein insbesondere großes Interesse daran, das Saatgut und die keimende Pflanze durch den Einsatz geeigneter Mittel zu schützen.
- Die Bekämpfung von phytopathogenen Pilzen und/oder tierischen Schädlingen durch die Behandlung des Saatguts von Pflanzen ist seit langem bekannt und ist Gegenstand ständiger Verbesserungen. Dennoch ergeben sich bei der Behandlung von Saatgut eine Reihe von Problemen, die nicht immer zufrieden stellend gelöst werden können. So ist es erstrebenswert, Verfahren zum Schutz des Saatguts und der keimenden Pflanze zu entwickeln, die das zusätzliche Ausbringen von Pflanzenschutzmitteln nach der Saat oder nach dem Auflaufen der Pflanzen überflüssig machen. Es ist weiterhin erstrebenswert, die Menge des eingesetzten Wirkstoffs dahingehend zu optimieren, dass das Saatgut und die keimende Pflanze vor dem Befall durch phytopathogene Pilze und/oder tierische Schädlinge bestmöglich geschützt werden, ohne jedoch die Pflanze selbst durch den eingesetzten Wirkstoff zu schädigen. Insbesondere sollten Verfahren zur Behandlung von Saatgut auch die intrinsischen fungiziden und/oder insektiziden Eigenschaften transgener Pflanzen einbeziehen, um einen optimalen Schutz des Saatguts und auch der keimenden Pflanze bei einem minimalen Aufwand an Pflanzenschutzmitteln zu erreichen.
- Die vorliegende Erfindung bezieht sich daher insbesondere auch auf ein Verfahren zum Schutz von Saatgut und keimenden Pflanzen vor dem Befall durch phytopathogene Pilze und/oder tierische Schädlinge, indem das Saatgut mit einem erfindungsgemäßen Wirkstoffkombinationen behandelt wird. Das erfindungsgemäße Verfahren zum Schutz von Saatgut und keimenden Pflanzen vor dem Befall durch phytopathogene Pilze und/oder tierische Schädlinge umfasst ein Verfahren, in dem das Saatgut zur gleichen Zeit mit einer Verbindung der Formel (I) und einem Wirkstoff aus den oben aufgeführten Gruppen (2) bis (25) behandelt wird. Es umfasst auch ein Verfahren, in dem das Saatgut zu unterschiedlichen Zeiten mit einer Verbindung der Formel (I) und einem Wirkstoff aus den oben aufgeführten Gruppen (2) bis (25) behandelt wird.
- Die Erfindung bezieht sich ebenfalls auf die Verwendung der erfindungsgemäßen Wirkstoffkombinationen zur Behandlung von Saatgut zum Schutz des Saatguts und der keimenden Pflanze vor phytopathogenen Pilzen und/oder durch phytopathogene Pilze und/oder tierischen Schädlingen.
- Weiterhin bezieht sich die Erfindung auf Saatgut, welches zum Schutz vor phytopathogenen Pilzen und/oder tierischen Schädlingen mit einer erfindungsgemäßen Wirkstoffkombination behandelt wurde. Die Erfindung bezieht sich auch auf Saatgut, welches zur gleichen Zeit mit einer Verbindung der Formel (I) und einem Wirkstoff aus den oben aufgeführten Gruppen (2) bis (25) behandelt wurde. Die Erfindung bezieht sich weiterhin auf Saatgut, welches zu unterschiedlichen Zeiten mit einer Verbindung der Formel (I) und einem Wirkstoff aus den oben aufgeführten Gruppen (2) bis (25) behandelt wurde. Bei Saatgut, welches zu unterschiedlichen Zeiten mit einer Verbindung der Formel (I) und einem Wirkstoff aus den oben aufgeführten Gruppen (2) bis (25) behandelt wurde, können die einzelnen Wirkstoffe der erfindungsgemäßen Wirkstoffkombination in unterschiedlichen Schichten auf dem Saatgut enthalten sein. Dabei können die Schichten, die eine Verbindung der Formel (I) und einen Wirkstoff aus den oben aufgeführten Gruppen (2) bis (25) enthalten, gegebenenfalls durch eine Zwischenschicht getrennt sein. Die Erfindung bezieht sich auch auf Saatgut, bei dem eine Verbindung der Formel (I) und ein Wirkstoff aus den oben aufgeführten Gruppen (2) bis (25) als Bestandteil einer Umhüllung oder als weitere Schicht oder weitere Schichten zusätzlich zu einer Umhüllung aufgebracht sind.
- Einer der Vorteile der vorliegenden Erfindung ist es, dass aufgrund der besonderen systemischen Eigenschaften der erfindungsgemäßen Wirkstoffkombinationen die Behandlung des Saatguts mit diesen Wirkstoffkombinationen nicht nur das Saatgut selbst, sondern auch die daraus hervorgehenden Pflanzen nach dem Auflaufen vor phytopathogenen Pilzen und/oder tierischen Schädlingen schützt. Auf diese Weise kann die unmittelbare Behandlung der Kultur zum Zeitpunkt der Aussaat oder kurz danach entfallen.
- Ein weiterer Vorteil besteht in der synergistischen Erhöhung der insektiziden Wirksamkeit der erfindungsgemäßen Wirkstoffkombinationen gegenüber dem insektiziden Einzelwirkstoff, die über die zu erwartende Wirksamkeit der beiden einzeln angewendeten Wirkstoffe hinausgeht.
- Vorteilhaft ist auch die synergistische Erhöhung der fungiziden Wirksamkeit der erfindungsgemäßen Wirkstoffkombinationen gegenüber dem fungiziden Einzelwirkstoff, die über die zu erwartende Wirksamkeit des einzeln angewendeten Wirkstoffs hinausgeht. Damit wird eine Optimierung der Menge der eingesetzten Wirkstoffe ermöglicht.
- Ebenso ist es als vorteilhaft anzusehen, dass die erfindungsgemäßen Wirkstoffkombinationen insbesondere auch bei transgenem Saatgut eingesetzt werden können.
- Die erfindungsgemäßen Wirkstoffkombinationen eignen sich zum Schutz von Saatgut jeglicher Pflanzensorte wie bereits vorstehend genannt, die in der Landwirtschaft, im Gewächshaus, in Forsten oder im Gartenbau eingesetzt wird. Insbesondere handelt es sich dabei um Saatgut von Mais, Erdnuss, Canola, Raps, Mohn, Soja, Baumwolle, Rübe (z.B. Zuckerrübe und Futterrübe), Reis, Hirse, Weizen, Gerste, Hafer, Roggen, Sonnenblume, Tabak, Kartoffeln oder Gemüse (z.B. Tomaten, Kohlgewächs). Die erfindungsgemäßen Wirkstoffkombinationen eignen sich ebenfalls zur Behandlung des Saatguts von Obstpflanzen und Gemüse wie vorstehend bereits genannt. Besondere Bedeutung kommt der Behandlung des Saatguts von Mais, Soja, Baumwolle, Weizen und Canola oder Raps zu.
- Im Rahmen der vorliegenden Erfindung wird die erfindungsgemäße Wirkstoffkombination alleine oder in einer geeigneten Formulierung auf das Saatgut aufgebracht. Vorzugsweise wird das Saatgut in einem Zustand behandelt, in dem es so stabil ist, dass keine Schäden bei der Behandlung auftreten. Im Allgemeinen kann die Behandlung des Saatguts zu jedem Zeitpunkt zwischen der Ernte und der Aussaat erfolgen. Üblicherweise wird Saatgut verwendet, das von der Pflanze getrennt und von Kolben, Schalen, Stängeln, Hülle, Wolle oder Fruchtfleisch befreit wurde. So kann zum Beispiel Saatgut verwendet werden, das geerntet, gereinigt und bis zu einem Feuchtigkeitsgehalt von unter 15 Gew.-% getrocknet wurde. Alternativ kann auch Saatgut verwendet werden, das nach dem Trocknen z.B. mit Wasser behandelt und dann erneut getrocknet wurde.
- Im Allgemeinen muss bei der Behandlung des Saatguts darauf geachtet werden, dass die Menge der auf das Saatgut aufgebrachten erfindungsgemäßen Wirkstoffkombination und/oder weiterer Zusatzstoffe so gewählt wird, dass die Keimung des Saatguts nicht beeinträchtigt bzw. die daraus hervorgehende Pflanze nicht geschädigt wird. Dies ist vor allem bei Wirkstoffen zu beachten, die in bestimmten Aufwandmengen phytotoxische Effekte zeigen können.
- Die erfindungsgemäßen Mittel können unmittelbar aufgebracht werden, also ohne weitere Komponenten zu enthalten und ohne verdünnt worden zu sein. In der Regel ist es vorzuziehen, die Mittel in Form einer geeigneten Formulierung auf das Saatgut aufzubringen. Geeignete Formulierungen und Verfahren für die Saatgutbehandlung sind dem Fachmann bekannt und werden z.B. in den folgenden Dokumenten beschrieben:
US 4,272,417 A ,US 4,245,432 A ,US 4,808,430 A ,US 5,876,739 A ,US 2003/0176428 A1 WO 2002/080675 A1 WO 2002/028186 A2 - Die erfindungsgemäß verwendbaren Wirkstoffe können in die üblichen Beizmittel-Formulierungen überführt werden, wie Lösungen, Emulsionen, Suspensionen, Pulver, Schäume, Slurries oder andere Hüllmassen für Saatgut, sowie ULV-Formulierungen.
- Diese Formulierungen werden in bekannter Weise hergestellt, indem man die Wirkstoffe mit üblichen Zusatzstoffen vermischt, wie zum Beispiel übliche Streckmittel sowie Lösungs- oder Verdünnungsmittel, Farbstoffe, Netzmittel, Dispergiermittel, Emulgatoren, Entschäumer, Konservierungsmittel, sekundäre Verdickungsmittel, Kleber, Gibberelline und auch Wasser.
- Als Farbstoffe, die in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen enthalten sein können, kommen alle für derartige Zwecke üblichen Farbstoffe in Betracht. Dabei sind sowohl in Wasser wenig lösliche Pigmente als auch in Wasser lösliche Farbstoffe verwendbar. Als Beispiele genannt seien die unter den Bezeichnungen Rhodamin B, C.I. Pigment Red 112 und C.I. Solvent Red 1 bekannten Farbstoffe.
- Als Netzmittel, die in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen enthalten sein können, kommen alle zur Formulierung von agrochemischen Wirkstoffen üblichen, die Benetzung fördernden Stoffe in Frage. Vorzugsweise verwendbar sind Alkylnaphthalin-Sulfonate, wie Diisopropyl- oder Diisobutylnaphthalin-Sulfonate.
- Als Dispergiermittel und/oder Emulgatoren, die in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen enthalten sein können, kommen alle zur Formulierung von agrochemischen Wirkstoffen üblichen nichtionischen, anionischen und kationischen Dispergiermittel in Betracht. Vorzugsweise verwendbar sind nichtionische oder anionische Dispergiermittel oder Gemische von nichtionischen oder anionischen Dispergiermitteln. Als geeignete nichtionische Dispergiermittel sind insbesondere Ethylenoxid-Propylenoxid Blockpolymere, Alkylphenolpolyglykolether sowie Tristryrylphenolpolyglykolether und deren phosphatierte oder sulfatierte Derivate zu nennen. Geeignete anionische Dispergiermittel sind insbesondere Ligninsulfonate, Polyacrylsäuresalze und Arylsulfonat-Formaldehydkondensate.
- Als Entschäumer können in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen alle zur Formulierung von agrochemischen Wirkstoffen üblichen schaumhemmenden Stoffe enthalten sein. Vorzugsweise verwendbar sind Silikonentschäumer und Magnesiumstearat.
- Als Konservierungsmittel können in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen alle für derartige Zwecke in agrochemischen Mitteln einsetzbaren Stoffe vorhanden sein. Beispielhaft genannt seien Dichlorophen und Benzylalkoholhemiformal.
- Als sekundäre Verdickungsmittel, die in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen enthalten sein können, kommen alle für derartige Zwecke in agrochemischen Mitteln einsetzbaren Stoffe in Frage. Vorzugsweise in Betracht kommen Cellulosederivate, Acrylsäurederivate, Xanthan, modifizierte Tone und hochdisperse Kieselsäure.
- Als Kleber, die in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen enthalten sein können, kommen alle üblichen in Beizmitteln einsetzbaren Bindemittel in Frage. Vorzugsweise genannt seien Polyvinylpyrrolidon, Polyvinylacetat, Polyvinylalkohol und Tylose.
- Als Gibberelline, die in den erfindungsgemäß verwendbaren Beizmittel-Formulierungen enthalten sein können, kommen vorzugsweise die Gibberelline A1, A3 (= Gibberellinsäure), A4 und A7 infrage, besonders bevorzugt verwendet man die Gibberellinsäure. Die Gibberelline sind bekannt (vgl. R. Wegler „Chemie der Pflanzenschutz- und Schädlingsbekämpfungsmittel", Bd. 2, Springer Verlag, 1970, S. 401-412).
- Die erfindungsgemäß verwendbaren Beizmittel-Formulierungen können entweder direkt oder nach vorherigem Verdünnen mit Wasser zur Behandlung von Saatgut der verschiedensten Art, auch von Saatgut transgener Pflanzen, eingesetzt werden. Dabei können im Zusammenwirken mit den durch Expression gebildeten Substanzen auch zusätzliche synergistische Effekte auftreten.
- Zur Behandlung von Saatgut mit den erfindungsgemäß verwendbaren Beizmittel-Formulierungen oder den daraus durch Zugabe von Wasser hergestellten Zubereitungen kommen alle üblicherweise für die Beizung einsetzbaren Mischgeräte in Betracht. Im einzelnen geht man bei der Beizung so vor, dass man das Saatgut in einen Mischer gibt, die jeweils gewünschte Menge an Beizmittel-Formulierungen entweder als solche oder nach vorherigem Verdünnen mit Wasser hinzufügt und bis zur gleichmäßigen Verteilung der Formulierung auf dem Saatgut mischt. Gegebenenfalls schließt sich ein Trocknungsvorgang an.
- Die erfindungsgemäßen Wirkstoffkombinationen eignen sich auch zur Steigerung des Ernteertrages. Sie sind außerdem mindertoxisch und weisen eine gute Pflanzenverträglichkeit auf.
- Die erfindungsgemäßen Wirkstoffkombinationen weisen auch eine starke stärkende Wirkung in Pflanzen auf. Sie eignen sich daher zur Mobilisierung pflanzeneigener Abwehrkräfte gegen Befall durch unerwünschte Mikroorganismen.
- Unter pflanzenstärkenden (resistenzinduzierenden) Stoffen sind im vorliegenden Zusammenhang solche Substanzen zu verstehen, die in der Lage sind, das Abwehrsystem von Pflanzen so zu stimulieren, dass die behandelten Pflanzen bei nachfolgender Inokulation mit unerwünschten Mikroorganismen weitgehende Resistenz gegen diese Mikroorganismen entfalten.
- Unter unerwünschten Mikroorganismen sind im vorliegenden Fall phytopathogene Pilze, Bakterien und Viren zu verstehen. Die erfindungsgemäßen Stoffe können also eingesetzt werden, um Pflanzen innerhalb eines gewissen Zeitraumes nach der Behandlung gegen den Befall durch die genannten Schaderreger zu schützen. Der Zeitraum, innerhalb dessen Schutz herbeigeführt wird, erstreckt sich im Allgemeinen von 1 bis 10 Tage, vorzugsweise 1 bis 7 Tage nach der Behandlung der Pflanzen mit den Wirkstoffen.
- Die aufgeführten Pflanzen können besonders vorteilhaft erfindungsgemäß mit den erfindungsgemäßen Wirkstoffmischungen behandelt werden. Die bei den Wirkstoffkombinationen oben angegebenen Vorzugsbereiche gelten auch für die Behandlung dieser Pflanzen. Besonders hervorgehoben sei die Pflanzenbehandlung mit den im vorliegenden Text speziell aufgeführten Wirkstoffkombinationen.
- Die gute insektizide und fungizide Wirkung der erfindungsgemäßen Wirkstoffkombinationen geht aus den nachfolgenden Beispielen hervor. Während die einzelnen Wirkstoffe in ihrer Wirkung Schwächen aufweisen, zeigen die Kombinationen eine Wirkung, die über eine einfache Wirkungssummierung hinausgeht.
- Ein synergistischer Effekt liegt bei Insektiziden und Fungiziden immer dann vor, wenn die insektizide bzw. fungizide Wirkung der Wirkstoffkombinationen größer ist als die Summe der Wirkungen der einzeln applizierten Wirkstoffe.
- Die zu erwartende insektizide oder fungizide Wirkung für eine gegebene Kombination zweier Wirkstoffe kann nach S.R. Colby („Calculating Synergistic and Antagonistic Responses of Herbicide Combinations", Weeds 1967, 15, 20-22) wie folgt berechnet werden:
- Wenn
- X
- den Abtötungsgrad bzw. Wirkungsgrad, ausgedrückt in % der unbehandelten Kontrolle, beim Einsatz des Wirkstoffes A in einer Aufwandmenge von m ppm bzw. g/ha bedeutet,
- Y
- den Abtötungsgrad bzw. Wirkungsgrad, ausgedrückt in % der unbehandelten Kontrolle, beim Einsatz des Wirkstoffes B in einer Aufwandmenge von n ppm bzw. g/ha bedeutet und
- E
- den Abtötungsgrad bzw. Wirkungsgrad, ausgedrückt in % der unbehandelten Kontrolle, beim Einsatz der Wirkstoffe A und B in Aufwandmengen von m und n ppm bzw. g/ha bedeutet,
- Dabei wird der Abtötungsgrad bzw. Wirkungsgrad in % ermittelt. Es bedeutet 0 % ein Abtötungsgrad bzw. Wirkungsgrad, der demjenigen der Kontrolle entspricht, während ein Abtötungsgrad von 100 % bedeutet, dass alle Tiere tot sind und ein Wirkungsgrad von 100 % bedeutet, dass kein Befall beobachtet wird.
- Ist die tatsächliche fungizide oder insektizide Wirkung größer als berechnet, so ist die Kombination in ihrer Wirkung überadditiv, d.h. es liegt ein synergistischer Effekt vor. In diesem Fall muss der tatsächlich beobachtete Wirkungsgrad größer sein als der aus der oben angeführten Formel errechnete Wert für den erwarteten Wirkungsgrad (E).
- Beispiel A
- Myzus persicae -Test
Lösungsmittel: 78 Gewichtsteile Aceton 1,5 Gewichtsteile Dimethylformamid Emulgator: 0,5 Gewichtsteile Alkylarylpolyglykolether - Zur Herstellung einer zweckmäßigen Wirkstoffzubereitung vermischt man 1 Gewichtsteil Wirkstoff mit den angegebenen Mengen Lösungsmittel und Emulgator und verdünnt das Konzentrat mit emulgatorhaltigem Wasser auf die gewünschte Konzentration.
- Kohlblätter (Brassica oleracea), die stark von der Grünen Pfirsichblattlaus (Myzus persicae) befallen sind, werden durch Tauchen in die Wirkstoffzubereitung der gewünschten Konzentration behandelt.
- Nach der gewünschten Zeit wird die Abtötung in % bestimmt. Dabei bedeutet 100 %, dass alle Blattläuse abgetötet wurden; 0 % bedeutet, dass keine Blattläuse abgetötet wurden. Die ermittelten Abtötungswerte verrechnet man nach der Colby-Formel (siehe oben).
- Bei diesem Test zeigen z. B. die folgenden Wirkstoffkombinationen gemäß vorliegender Anmeldung eine synergistisch verstärkte Wirksamkeit im Vergleich zu den einzeln angewendeten Wirkstoffen: Tabelle A, Seite 1
Pflanzenschädigende Insekten Myzus persicae - Test Wirkstoff Konzentration in g/ha Abtötung in % nach 1d Verbindung (I-5) 0,8 50 Fluopyram 200 0 N-[2-(1,3-dimethylbutyl)phenyl]-5-fluoro-1,3-dimethyl-1H-pyrazole-4-carboxamide 200 0 Fenamidone 200 0 Fludioxonil 200 0 Iprodione 200 0 Isotianil 200 0 Metalaxyl 200 0 Propamocarb 200 0 Prothioconazole 200 0 Tebuconazole 200 0 Tolylfluanid 200 0 Triadimenol 200 0 Verbindung (I-5) + Fluopyram (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 70 50 Verbindung (I-5) + N-[2-(1,3-dimethylbutyl)phenyl]-5-fluoro-1,3-dimethyl-1H-pyrazole-4-carboxamide (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 90 50 Verbindung (I-5) + Fenamidone (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 90 50 Verbindung (I-5) + Fludioxonil (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 80 50 Verbindung (I-5) + Iprodione (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 70 50 Verbindung (I-5) + Metalaxyl (1 : 250) erfindungs gemäß 0,8 + 200 gef.* ber.** 80 50 Verbindung (I-5) + Propamocarb (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 70 50 Verbindung (I-5) + Prothioconazole (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 80 50 Verbindung (I-5) + Tebuconazole (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 90 50 Verbindung (I-5) + Tolylfluanid (1 : 250) erfindungsgemäß 0,8 + 200 gef.* ber.** 80 50 *gef. =gefundene Wirkung **ber. = nach der Colby-Formel berechnete Wirkung - Beispiel B
- Phaedon cochleariae - Larven -Test
Lösungsmittel: 78 Gewichtsteile Aceton 1,5 Gewichtsteile Dimethylformamid Emulgator: 0,5 Gewichtsteile Alkylarylpolyglykolether - Zur Herstellung einer zweckmäßigen Wirkstoffzubereitung vermischt man 1 Gewichtsteil Wirkstoff mit den angegebenen Mengen Lösungsmittel und Emulgator und verdünnt das Konzentrat mit emulgatorhaltigem Wasser auf die gewünschte Konzentration.
- Kohlblätter (Brassica oleracea) werden durch Tauchen in die Wirkstoffzubereitung der gewünschten Konzentration behandelt und mit Larven des Meerrettichblattkäfers (Phaedon cochleariae) besetzt, solange die Blätter noch feucht sind.
- Nach der gewünschten Zeit wird die Abtötung in % bestimmt. Dabei bedeutet 100 %, dass alle Käferlarven abgetötet wurden; 0 % bedeutet, dass keine Käferlarven abgetötet wurden. Die ermittelten Abtötungswerte verrechnet man nach der Colby-Formel ( siehe oben).
- Bei diesem Test zeigte die folgende Wirkstoffkombination gemäß vorliegender Anmeldung eine synergistisch verstärkte Wirksamkeit im Vergleich zu den einzeln angewendeten Wirkstoffen: Tabelle B, Seite 1
Pflanzenschädigende Insekten Phaedon cochleariae Larven - Test Wirkstoff Konzentration in g/ha Abtötung In % nach 2d Verbindung (I-5) 20 0 Fenamidone 200 0 Prothioconazole 200 0 Trifloxystrobin 200 0 Verbindung (I-5) + Fenamidone (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 33 0 Verbindung (I-5) + Prothioconazole (1 : 10) Erfindungsgemäß 20 + 200 gef.* ber.** 33 0 *gef =gefundeneWirkung **ber. = nach der Colby-Formel berechnete Wirkung Pflanzenschädigende Insekten Phaedon cochleariae Larven - Test Wirkstoff Konzentration in g/ha Abtötung In % nach 6d Verbindung (I-5) 20 0 Fluopyram 200 0 N-[2-(1,3-dimethylbutyl)phenyl]-5-fluoro-1,3-dimethyl-1H-pyrazole-4-carboxamide 200 0 Fludioxonil 200 17 Fosetyl-Al 200 0 Iprodione 200 0 Isotianil 200 0 Metalaxyl 200 0 Tebuconazole 200 0 Tolylfluanid 200 17 Triadimenol 200 0 Trifloxystrobin 200 33 Verbindung (I-5) + Fluopyram (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 33 0 Verbindung (I-5) + N-[2-(1,3-dimethylbutyl)phenyl]-5-fluoro-1,3-dimethyl-1H-pyrazole-4-carboxamide (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 50 0 Verbindung (I-5) + Fosetyl-Al (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 33 0 Verbindung (I-5) + Iprodione (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 50 0 Verbindung (I-5) + Isotianil (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 50 0 Verbindung (I-5) + Metalaxyl (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 33 0 Verbindung (I-5) + Tebuconazole (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 50 0 Verbindung (I-5) + Tolylfluanid (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 33 17 Verbindung (I-5) + Triadimenol (1 : 10) erfindungsgemäß 20 + 200 gef.* ber.** 100 0 Verbindung (I-5) + Trifloxystrobin (1 : 10) erfindungs gemäß 20 + 200 gef.* ber.** 67 33 *gef. =gefundeneWirkung **ber. = nach der Colby-Formel berechnete Wirkung - Beispiel C
- Spodoptera frugiperda - Larven -Test
Lösungsmittel: 78 Gewichtsteile Aceton 1,5 Gewichtsteile Dimethylformamid Emulgator: 0,5 Gewichtsteile Alkylarylpolyglykolether - Zur Herstellung einer zweckmäßigen Wirkstoffzubereitung vermischt man 1 Gewichtsteil Wirkstoff mit den angegebenen Mengen Lösungsmittel und Emulgator und verdünnt das Konzentrat mit emulgatorhaltigem Wasser auf die gewünschte Konzentration.
- Kohlblätter (Brassica oleracea) werden durch Spritzen mit der Wirkstoffzubereitung in der gewünschten Konzentration behandelt und mit Larven des Heerwurms (Spodoptera frugiperda) besetzt, solange die Blätter noch feucht sind.
- Nach der gewünschten Zeit wird die Abtötung in % bestimmt. Dabei bedeutet 100 %, dass alle Raupen abgetötet wurden; 0 % bedeutet, dass keine Raupen abgetötet wurden. Die ermittelten Abtötungswerte verrechnet man nach der Colby-Formel (siehe oben).
- Bei diesem Test zeigen die folgenden Wirkstoffkombinationen gemäß vorliegender Anmeldung eine synergistisch verstärkte Wirksamkeit im Vergleich zu den einzeln angewendeten Wirkstoffen: Tabelle C, Seite 1
Pflanzenschädigende Insekten Spodoptera frugiperda Larven - Test Wirkstoff Konzentration in g:/ha Abtötung In % nach 6d Fosetyl-Al 200 0 Tolylfluanid 200 0 *gef.=gefundene Wirkung **ber. = nach der Colby-Formel berechnete Wirkung - Beispiel D
- Tetranychus urticae - Test (OP-resistent/Spritzbehandlung)
Lösungsmittel: 78 Gewichtsteile Aceton 1,5 Gewichtsteile Dimethylformamid Emulgator: 0,5 Gewichtsteile Alkylarylpolyglykolether - Zur Herstellung einer zweckmäßigen Wirkstoffzubereitung vermischt man 1 Gewichtsteil Wirkstoff mit den angegebenen Mengen Lösungsmittel und Emulgator und verdünnt das Konzentrat mit emulgatorhaltigem Wasser auf die gewünschte Konzentration.
- Bohnenblattscheiben (Phaseolus vulgaris), die von allen Stadien der Gemeinen Spinnmilbe (Tetranychus urticae) befallen sind, werden mit einer Wirkstoffzubereitung der gewünschten Konzentration gespritzt.
- Nach der gewünschten Zeit wird die Wirkung in % bestimmt. Dabei bedeutet 100 %, dass alle Spinnmilben abgetötet wurden; 0 % bedeutet, dass keine Spinnmilben abgetötet wurden.
- Bei diesem Test zeigte die folgende Wirkstoffkombination gemäß vorliegender Anmeldung eine synergistisch verstärkte Wirksamkeit im Vergleich zu den einzeln angewendeten Wirkstoffen: Tabelle D, Seite 1
Pflanzenschädigende Milben Tetranychus urticae - Test Wirkstoff Konzentration in g/ha Abtötung in % nach 2d Verbindung (I-5) 100 20 Propamocarb 200 0 Triadimenol 200 0 Verbindung (I-5) + Triadimenol (1 : 2) erfindungsgemäß 100 + 200 40 ber. ** gef.* 0 *gef. =gefundene Wirkung **ber. = nach der Colby-Formel berechnete Wirkung Pflanzenschädigende Milben Tetranychus urticae - Test Wirkstoff Konzentration in g:/ha Abtötung in % nach 6d Verbindung (I-5) 100 0 Fluopyram 200 0 Fludioxonil 200 0 Iprodione 200 50 Isotianil 200 0 Metalaxyl 200 0 Propamocarb 200 0 Prothioconazole 200 0 Tebuconazole 200 70 Triadimenol 200 0 Verbindung (I-5) + Fluopyram (1 : 2) erfindungsgemäß 100 + 200 gef.* ber.** 70 0 Verbindung (I-5) + Fludioxonil (1 : 2) erfindungsgemäß 100 + 200 gef.* ber.** 70 0 Verbindung (I-5) + Iprodione (1 : 2) erfindungsgemäß 100 + 200 gef.* ber.** 70 50 Verbindung (I-5) + Isotianil (1 : 2) erfindungsgemäß 100 + 200 gef.* ber.** 80 0 Verbindung (I-5) + Propamocarb (1 : 2) erfindungsgemäß 100 + 200 gef.* ber.** 50 0 Verbindung (I-5) + Metalaxyl (1 : 2) erfindungsgemäß 100 + 200 gef.* ber.** 70 0 Verbindung (I-5) + Triadimenol (1 : 2) erfindungs gemäß 100 + 200 gef.* ber.** 80 0 *gef. =gefundene Wirkung **ber. = nach der Colby-Formel berechnete Wirkung
sowie das Carbamat Pyribencarb.
Claims (11)
- Wirkstoffkombinationen enthaltend die Verbindung der Formel (I)
- Wirkstoffkombinationen gemäß
Anspruch 1 , worin der Wirkstoff der Gruppen (2) bis (25) ausgewählt ist aus (2-4) Trifloxystrobin (3-15) Prothioconazole (3-17) Tebuconazole (6-9) Fluopicolid (6-25) Fluopyram (11-2) Propamocarb (16-2) Fludioxonil wobei die Verbindung der Formel (I) und der Wirkstoff der Gruppen (2) bis (16) im folgenden Mischungs-Gewichtsverhältnis vorliegen:Wirkstoff der Gruppe (2) - (25) Mischungs-Gewichtsverhältnis (2-4) Trifloxystrobin 50 : 1 bis 1 : 1000 (3-15) Prothioconazole, (3-17) Tebuconazole 50 : 1 bis 1 : 1000 (6-9) Fluopicolid, (6-25) Fluopyram 50 : 1 bis 1 : 1000 (11-2) Propamocarb 250 : 1 bis 1 : 1 (16-2) Fludioxonil 50 : 1 bis 1 : 1000 - Verwendung einer Wirkstoffkombination, wie in einem der
Ansprüche 1 bis2 definiert, zur Bekämpfung tierischer Schädlinge und/oder pflanzenpathogener Pilze. - Verfahren zum Schutz von Saatgut, dadurch gekennzeichnet, dass man eine Wirkstoffkombination, wie in einem der
Ansprüche 1 bis2 definiert, auf Saatgut einwirken lässt. - Verfahren nach
Anspruch 4 , dadurch gekennzeichnet, dass man eine Verbindung der Formel (I) und einen Wirkstoff der Gruppen (2) bis (25) gemäßAnspruch 1 oder2 zur gleichen Zeit auf Saatgut einwirken lässt. - Verfahren nach
Anspruch 4 , dadurch gekennzeichnet, dass man eine Verbindung der Formel (I) und einen Wirkstoff der Gruppen (2) bis (25) gemäßAnspruch 1 oder2 zu unterschiedlichen Zeiten auf Saatgut einwirken lässt. - Verwendung einer Wirkstoffkombination gemäß gemäß einem der
Ansprüche 1 bis2 zur Behandlung von transgenen Pflanzen. - Verwendung einer Wirkstoffkombination gemäß einem der
Ansprüche 1 bis2 zur Behandlung von Saatgut transgener Pflanzen. - Saatgut, welches mit einer Wirkstoffkombination gemäß einem der
Ansprüche 1 bis2 behandelt wurde. - Saatgut nach
Anspruch 9 , welches zur gleichen Zeit mit einer Verbindung der Formel (I) und einem Wirkstoff der Gruppen (2) bis (25) gemäßAnspruch 1 oder2 behandelt wurde. - Saatgut nach
Anspruch 9 , welches zu unterschiedlichen Zeiten mit einer Verbindung der Formel (I) und einem Wirkstoff der Gruppen (2) bis (25) gemäßAnspruch 1 oder2 behandelt wurde.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102007045920.5A DE102007045920B4 (de) | 2007-09-26 | 2007-09-26 | Synergistische Wirkstoffkombinationen |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102007045920.5A DE102007045920B4 (de) | 2007-09-26 | 2007-09-26 | Synergistische Wirkstoffkombinationen |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE102007045920A1 DE102007045920A1 (de) | 2009-04-09 |
| DE102007045920B4 true DE102007045920B4 (de) | 2018-07-05 |
Family
ID=40417920
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE102007045920.5A Active DE102007045920B4 (de) | 2007-09-26 | 2007-09-26 | Synergistische Wirkstoffkombinationen |
Country Status (1)
| Country | Link |
|---|---|
| DE (1) | DE102007045920B4 (de) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101647703B1 (ko) * | 2009-03-25 | 2016-08-11 | 바이엘 인텔렉쳐 프로퍼티 게엠베하 | 상승적 활성 성분 배합물 |
| WO2012088645A1 (en) * | 2010-12-31 | 2012-07-05 | Bayer Cropscience Ag | Method for improving plant quality |
| JP5760781B2 (ja) | 2011-07-13 | 2015-08-12 | 住友化学株式会社 | 有害節足動物防除組成物及び有害節足動物の防除方法 |
| WO2013037955A1 (en) * | 2011-09-16 | 2013-03-21 | Bayer Intellectual Property Gmbh | Use of acylsulfonamides for improving plant yield |
| WO2013156331A1 (en) | 2012-04-16 | 2013-10-24 | Basf Se | Synergistic compositions comprising pyraclostrobin and an insecticidal compound |
| CN103688980A (zh) * | 2012-09-27 | 2014-04-02 | 陕西美邦农药有限公司 | 一种含氟吡呋喃酮与拟除虫菊酯类的杀虫组合物 |
| JP6011597B2 (ja) * | 2014-11-11 | 2016-10-19 | 住友化学株式会社 | 有害節足動物防除組成物及び有害節足動物の防除方法 |
| CN104542611A (zh) * | 2014-12-19 | 2015-04-29 | 山东康乔生物科技有限公司 | 一种含有双炔酰菌胺的杀菌组合物 |
| CN106689144A (zh) * | 2016-11-22 | 2017-05-24 | 佛山市盈辉作物科学有限公司 | 含氟吡呋喃酮和戊唑醇的活性结合物 |
| CN109511661A (zh) * | 2017-09-20 | 2019-03-26 | 佛山市盈辉作物科学有限公司 | 含有丙硫菌唑、咯菌腈、氟吡呋喃酮的复配种子处理剂 |
Citations (306)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US947A (en) | 1838-09-25 | Machine fob dyeing yarn from the beam | ||
| US6063A (en) | 1849-01-30 | Improvement in baking apparatus | ||
| US1972961A (en) | 1931-05-26 | 1934-09-11 | Du Pont | Disinfectant |
| US2504404A (en) | 1946-06-12 | 1950-04-18 | Du Pont | Manganous ethylene bis-dithiocarbamate and fungicidal compositions containing same |
| US2553770A (en) | 1948-05-18 | 1951-05-22 | Standard Oil Dev Co | Parasiticidal compounds containing the nsccll3 group |
| US2588428A (en) | 1945-04-02 | 1952-03-11 | Goodrich Co B F | Complex amine products with dialkyl zinc dithiocarbamates as pesticides |
| DE1076434B (de) | 1957-08-17 | 1960-02-25 | Badische Anilin- S. Soda-Fabrik Aktiengesellschaft, Ludwigshafen/Rhein | Fungizide Mittel |
| DE1081446B (de) | 1955-09-20 | 1960-05-12 | Montedison Spa | Verfahren zur Herstellung von kristallinem Zinkaethylen-bisdithiocarbamat |
| US3010968A (en) | 1959-11-25 | 1961-11-28 | Du Pont | Process for manufacture of certain alkyl esters of benzimidazole carbamic acids |
| GB935981A (en) | 1960-12-28 | 1963-09-04 | Bayer Ag | Fungicidal carbamic acid salts |
| GB988630A (en) | 1961-02-22 | 1965-04-07 | Basf Ag | N-substituted morpholines having fungicidal activity |
| US3178447A (en) | 1964-05-05 | 1965-04-13 | California Research Corp | N-polyhaloalkylthio compounds |
| DE1193498B (de) | 1960-11-03 | 1965-05-26 | Bayer Ag | Verfahren zur Herstellung von Sulfensaeurederivaten |
| US3206468A (en) | 1963-11-15 | 1965-09-14 | Merck & Co Inc | Methods of preparing benzimidazoles |
| DE1209799B (de) | 1964-05-14 | 1966-01-27 | Bayer Ag | Saatgutbeizmittel gegen Fusariosen |
| US3249499A (en) | 1965-04-26 | 1966-05-03 | Us Rubber Co | Control of plant diseases |
| US3290353A (en) | 1963-04-01 | 1966-12-06 | Diamond Alkali Co | Halogenated aromatic nitriles |
| DE1234704B (de) | 1961-05-09 | 1967-02-23 | Rohm & Haas | Verfahren zur Herstellung von komplexen Mangansalzen der AEthylenbisdithiocarbaminsaeure |
| GB1094567A (en) | 1964-06-23 | 1967-12-13 | Zh Biseibutsu Kagaku Kenkyukai | Plant disease protective and curative compositions |
| GB1103989A (en) | 1967-02-10 | 1968-02-21 | Union Carbide Corp | Fungicidal concentrates |
| GB1114155A (en) | 1964-08-24 | 1968-05-15 | Evans Medical Ltd | Guanidino derivatives |
| DE1493736A1 (de) | 1965-08-26 | 1969-04-03 | Bayer Ag | Verfahren zur Herstellung von Dithiolphosphorsaeuretriestern |
| DE1806123A1 (de) | 1967-10-30 | 1969-06-04 | Nippon Soda Co | Bis (thioureido) benzole und ihre Metallsalze |
| US3513241A (en) | 1966-12-17 | 1970-05-19 | Schering Ag | Fungicidal and fungistatic n-(dialkylaminoalkyl) - carbamic acid and thiocarbamic acid esters |
| DE2012656A1 (de) | 1969-03-19 | 1971-09-30 | Sumitomo Chemical Company, Ltd., Osaka (Japan) | N-(3,5-Dihalogenphenyl)-imide, Verfahren zu ihrer Herstellung und ihre Verwendung als Mikrobicide |
| US3629428A (en) | 1967-09-07 | 1971-12-21 | Meiji Seika Kaisha | Pesticide for controlling bacterial and fungal diseases of rice plant |
| US3631176A (en) | 1970-07-20 | 1971-12-28 | Du Pont | Carbamoyl substituted 2-aminobenzimidazoles |
| DE2149923A1 (de) | 1970-10-06 | 1972-04-13 | Rhone Poulenc Sa | Neue Hydantoinderivate,ihre Herstellung und die fungiciden Zusammensetzungen,die sie enthalten |
| DE2250077A1 (de) | 1971-10-12 | 1973-04-19 | Lilly Co Eli | Verfahren zur herstellung von benzoxazol- und benzthiazolverbindungen und ihre verwendung zum pflanzenschutz |
| DE2201063A1 (de) | 1972-01-11 | 1973-07-26 | Bayer Ag | 1,2,4-triazolderivate, verfahren zu ihrer herstellung und ihre verwendung als fungizide |
| DE2207576A1 (de) | 1972-02-18 | 1973-08-23 | Basf Ag | Oxazolidinderivate |
| DE2312956A1 (de) | 1972-03-15 | 1973-09-20 | Du Pont | Mittel zum bekaempfen von flunguserkrankungen bei pflanzen |
| US3856814A (en) | 1971-02-02 | 1974-12-24 | Nihon Nohyaku Co Ltd | Olan-2-ylidenemalonates |
| DE2324010A1 (de) | 1973-05-12 | 1975-01-16 | Bayer Ag | Triazolyl-0,n-acetale, verfahren zu ihrer herstellung und ihre fungizide verwendung |
| DE2429523A1 (de) | 1973-06-21 | 1975-01-16 | Boots Co Ltd | Fungicide zubereitungen |
| DE2456627A1 (de) | 1973-12-14 | 1975-06-19 | Pepro | Fungizide auf alkylphosphit-basis |
| DE2501040A1 (de) | 1974-01-14 | 1975-07-17 | Sumitomo Chemical Co | Thiophosphorsaeureester, verfahren zu ihrer herstellung und ihre verwendung als fungizide |
| DE2513732A1 (de) | 1974-04-02 | 1975-10-16 | Ciba Geigy Ag | Mikrobizide und wachstumsregulierende mittel |
| DE2515091A1 (de) | 1974-04-09 | 1975-10-23 | Ciba Geigy Ag | Mikrobizide mittel |
| DE2551560A1 (de) | 1974-11-18 | 1976-05-20 | Janssen Pharmaceutica Nv | 1-(beta-aryl)-aethyl-1h-1,2,4-triazolketale und ihre salze, verfahren zu ihrer herstellung und fungizide mittel und pflanzenwuchsregulierende mittel |
| DE2543279A1 (de) | 1975-09-27 | 1977-04-07 | Basf Ag | Verfahren zur herstellung von n-substituierten tetrahydro-1.4-oxazinen |
| DE2731522A1 (de) | 1976-07-12 | 1978-01-19 | Nihon Nohyaku Co Ltd | Benzoylanilid-derivat, verfahren zu dessen herstellung und solches enthaltendes fungizid |
| DE2732257A1 (de) | 1976-07-20 | 1978-01-26 | Nihon Tokushu Noyaku Seizo Kk | Neue harnstoffe oder thioharnstoffe, verfahren zu ihrer herstellung und ihre verwendung als fungizide |
| DE2735872A1 (de) | 1976-08-10 | 1978-02-16 | Janssen Pharmaceutica Nv | 1-(2-arylaethyl)-1h-1,2,4-triazole, verfahren zu deren herstellung und diese verbindungen enthaltende fungizide mittel |
| DE2656747A1 (de) | 1976-12-15 | 1978-06-29 | Basf Ag | Morpholinderivate |
| DE2802488A1 (de) | 1978-01-20 | 1979-07-26 | Bayer Ag | 3-azolyl-benzotriazine und -benzotriazin-1-oxide, verfahren zu ihrer herstellung, sowie ihre verwendung zur bekaempfung von pflanzenkrankheiten |
| DE2903612A1 (de) | 1978-02-02 | 1979-08-09 | Montedison Spa | Neue acylaniline, deren herstellung und deren verwendung als fungizide |
| DD140041A1 (de) | 1978-08-22 | 1980-02-06 | Gerhard Rieck | Verfahren zur herstellung von langkettigen n-alkyl-dimethylmorpholinen |
| EP0015756A1 (de) | 1979-03-07 | 1980-09-17 | Imperial Chemical Industries Plc | Triazolverbindungen, Verfahren zu ihrer Herstellung, ihre Verwendung als Pflanzenfungizide und fungizide Zusammensetzungen, die sie enthalten |
| EP0019450A1 (de) | 1979-05-15 | 1980-11-26 | Takeda Chemical Industries, Ltd. | Pyrimidinderivate, ihre Herstellung und ihre Verwendungen in der Landwirtschaft |
| US4245432A (en) | 1979-07-25 | 1981-01-20 | Eastman Kodak Company | Seed coatings |
| DE3030026A1 (de) | 1980-08-08 | 1981-03-26 | Sandoz-Patent-GmbH, 79539 Lörrach | Fungizide |
| US4272417A (en) | 1979-05-22 | 1981-06-09 | Cargill, Incorporated | Stable protective seed coating |
| EP0031257A2 (de) | 1979-12-25 | 1981-07-01 | Ishihara Sangyo Kaisha Ltd. | Pyridylaniline |
| DE3042303A1 (de) | 1979-11-13 | 1981-08-27 | Sandoz-Patent-GmbH, 7850 Lörrach | Organische verbindungen, deren herstellung und verwendung |
| DD151404A1 (de) | 1980-06-13 | 1981-10-21 | Friedrich Franke | Fungizide mittel |
| EP0040345A1 (de) | 1980-05-16 | 1981-11-25 | Bayer Ag | 1-Hydroxyethyl-azol-Derivate, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Pflanzenwachstumsregulatoren und Fungizide |
| JPS5755844A (en) | 1980-09-11 | 1982-04-03 | Touwa Seikou Kk | Feeding mechanism for label tape of labeller |
| EP0068813A2 (de) | 1981-06-24 | 1983-01-05 | E.I. Du Pont De Nemours And Company | Fungizide 1,2,4-Triazol- und Imidazol-Derivate |
| EP0078663A2 (de) | 1981-10-29 | 1983-05-11 | Sumitomo Chemical Company, Limited | N-Phenylcarbamate mit fungizider Wirkung |
| EP0112284A2 (de) | 1982-11-16 | 1984-06-27 | Ciba-Geigy Ag | Neue Arylphenylether-derivate |
| DE3406993A1 (de) | 1983-03-04 | 1984-09-06 | Sandoz-Patent-GmbH, 7850 Lörrach | Neue azolderivate |
| EP0145294A2 (de) | 1983-11-10 | 1985-06-19 | Rohm And Haas Company | Substituierte Triazole, Verfahren zu deren Herstellung, deren Verwendung als Fungizide und diese enthaltende fungizide Zusammensetzungen |
| EP0155509A1 (de) | 1984-02-24 | 1985-09-25 | Dainippon Ink And Chemicals, Inc. | Landwirtschafts- und Gartenbaufungizid des Typs Guanidin und Verfahren zu seiner Herstellung |
| EP0183458A1 (de) | 1984-11-24 | 1986-06-04 | Schering Agrochemicals Limited | Fungizide Azolverbindungen |
| EP0196038A2 (de) | 1985-03-29 | 1986-10-01 | BASF Aktiengesellschaft | Azolylmethyloxirane - ihre Herstellung und Verwendung als Pflanzenschutzmittel |
| EP0206999A2 (de) | 1985-06-21 | 1986-12-30 | Ciba-Geigy Ag | Mikrobizide Mittel |
| EP0219756A1 (de) | 1985-10-09 | 1987-04-29 | Shell Internationale Researchmaatschappij B.V. | Neue Acrylsäureamide |
| EP0234242A2 (de) | 1986-01-23 | 1987-09-02 | MONTEDIPE S.r.l. | Fungizide Azolyl-Derivate |
| EP0236272A1 (de) | 1986-03-04 | 1987-09-09 | Ciba-Geigy Ag | Fungizide Verwendung eines Cyanopyrrol-Derivates |
| EP0248086A1 (de) | 1985-12-12 | 1987-12-09 | Ube Industries, Ltd. | Imidazolabkömmlinge, bakterizide, die diese enthalten und herstellungsverfahren |
| DE3721786A1 (de) | 1986-07-02 | 1988-01-07 | Rohm & Haas | Fungizide verbindung, verfahren zu ihrer herstellung und diese enthaltende mittel |
| EP0253213A1 (de) | 1986-07-16 | 1988-01-20 | BASF Aktiengesellschaft | Oximether und enthaltende Fungizide |
| EP0256503A2 (de) | 1986-08-12 | 1988-02-24 | Mitsubishi Kasei Corporation | Pyridincarboxamid-Derivate und ihre Verwendung als fungizides Mittel |
| EP0258161A2 (de) | 1986-08-22 | 1988-03-02 | Rhone-Poulenc Agrochimie | 2,5-Dihydrofuranderivate mit einem Triazol- oder Imidazorest, Verfahren zur Herstellung, Verwendung als Fungizid |
| EP0262393A1 (de) | 1986-08-29 | 1988-04-06 | Shell Internationale Researchmaatschappij B.V. | Aryloxycarbonsäurederivate, ihre Herstellung und Verwendung |
| EP0270111A1 (de) | 1986-12-03 | 1988-06-08 | Kumiai Chemical Industry Co., Ltd. | Pyrimidinderivate und diese enthaltende fungizide Mittel für Ackerbau und Gartenbau |
| US4761373A (en) | 1984-03-06 | 1988-08-02 | Molecular Genetics, Inc. | Herbicide resistance in plants |
| EP0278595A2 (de) | 1987-02-09 | 1988-08-17 | Zeneca Limited | Schimmelbekämpfungsmittel |
| DE3735555A1 (de) | 1987-03-07 | 1988-09-15 | Bayer Ag | Aminomethylheterocyclen |
| EP0298196A1 (de) | 1987-03-13 | 1989-01-11 | Ishihara Sangyo Kaisha, Ltd. | Imidazol-Verbindung und diese enthaltende biozide Zusammensetzungen |
| US4808430A (en) | 1987-02-27 | 1989-02-28 | Yazaki Corporation | Method of applying gel coating to plant seeds |
| EP0310550A1 (de) | 1987-09-28 | 1989-04-05 | Ciba-Geigy Ag | Schädlingsbekämpfungsmittel |
| EP0313512A2 (de) | 1987-08-21 | 1989-04-26 | Ciba-Geigy Ag | Benzothiadiazole und ihre Verwendung in Verfahren und Mitteln gegen Pflanzenkrankheiten |
| EP0315502A1 (de) | 1987-11-06 | 1989-05-10 | Sumitomo Chemical Company, Limited | Substituierte Carbonsäure-Derivate, Verfahren zu ihrer Herstellung und diese enthaltende Fungizide für Acker- und Gartenbau |
| EP0326330A2 (de) | 1988-01-29 | 1989-08-02 | DowElanco | Fungizide Chinnoline, Chinalozine und Cinnoline |
| EP0329397A1 (de) | 1988-02-16 | 1989-08-23 | Kureha Kagaku Kogyo Kabushiki Kaisha | Verfahren zur Herstellung von Azolylmethyl-cyclopentanol-Derivaten |
| EP0339418A2 (de) | 1988-04-29 | 1989-11-02 | Bayer Ag | Substituierte Cycloalkyl- bzw. Heterocyclyl-carbon-säureanilide |
| WO1989010396A1 (en) | 1988-04-28 | 1989-11-02 | Plant Genetic Systems N.V. | Plants with modified stamen cells |
| EP0341475A2 (de) | 1988-05-07 | 1989-11-15 | Bayer Ag | Stereoisomere von N-(R)-1-Aryl-ethyl)-1-alkyl-2,2-dichlo-cyclopropancarbonsäureamiden |
| JPH0225876A (ja) | 1988-07-15 | 1990-01-29 | Canon Inc | 現像装置 |
| EP0378953A1 (de) | 1988-12-29 | 1990-07-25 | Rhone-Poulenc Agrochimie | Benzyliden-azolylmethylcycloalkan und Anwendung als Fungizid |
| EP0382375A2 (de) | 1989-02-10 | 1990-08-16 | Zeneca Limited | Fungizides Mittel |
| EP0393911A1 (de) | 1989-04-21 | 1990-10-24 | E.I. Du Pont De Nemours And Company | Fungizide Oxazolidinone |
| EP0398692A2 (de) | 1989-05-17 | 1990-11-22 | SHIONOGI SEIYAKU KABUSHIKI KAISHA trading under the name of SHIONOGI & CO. LTD. | Alkoxyiminoacetamid-Derivate und ihre Verwendung als pilztötendes Mittel |
| WO1991002069A1 (en) | 1989-08-10 | 1991-02-21 | Plant Genetic Systems N.V. | Plants with modified flowers |
| US5013659A (en) | 1987-07-27 | 1991-05-07 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| EP0460575A1 (de) | 1990-06-05 | 1991-12-11 | Ciba-Geigy Ag | Aromatische Verbindungen |
| US5084082A (en) | 1988-09-22 | 1992-01-28 | E. I. Du Pont De Nemours And Company | Soybean plants with dominant selectable trait for herbicide resistance |
| DE4026966A1 (de) | 1990-08-25 | 1992-02-27 | Bayer Ag | Substituierte valinamid-derivate |
| WO1992005251A1 (fr) | 1990-09-21 | 1992-04-02 | Institut National De La Recherche Agronomique | Sequence d'adn conferant une sterilite male cytoplasmique, genome mitochondrial, genome nucleaire, mitochondrie et plante contenant cette sequence, et procede de preparation d'hybrides |
| EP0515901A1 (de) | 1991-05-28 | 1992-12-02 | BASF Aktiengesellschaft | Antimykotische Mittel, die Phenylessigsäurederivate enthalten |
| US5198599A (en) | 1990-06-05 | 1993-03-30 | Idaho Resarch Foundation, Inc. | Sulfonylurea herbicide resistance in plants |
| EP0537957A1 (de) | 1991-10-09 | 1993-04-21 | Sankyo Company Limited | Fungizide Silizium enthaltende Verbindungen, deren Herstellung und agrochemische und medizinische Verwendung |
| EP0539588A1 (de) | 1990-07-05 | 1993-05-05 | Nippon Soda Co., Ltd. | Aminderivat |
| EP0569384A1 (de) | 1991-01-30 | 1993-11-18 | Zeneca Ltd | Fungizide. |
| EP0571427A1 (de) | 1991-02-13 | 1993-12-01 | Hoechst Schering AgrEvo GmbH | Plasmide, die die DNA-Sequenzen für die Veränderung des Kohlenhijdrats bzw. Komposition in Pflanzen enthalten, sowie eine Pflanze... |
| US5273894A (en) | 1986-08-23 | 1993-12-28 | Hoechst Aktiengesellschaft | Phosphinothricin-resistance gene, and its use |
| US5276268A (en) | 1986-08-23 | 1994-01-04 | Hoechst Aktiengesellschaft | Phosphinothricin-resistance gene, and its use |
| WO1994004693A2 (en) | 1992-08-26 | 1994-03-03 | Zeneca Limited | Novel plants and processes for obtaining them |
| US5304732A (en) | 1984-03-06 | 1994-04-19 | Mgi Pharma, Inc. | Herbicide resistance in plants |
| WO1994009144A1 (en) | 1992-10-14 | 1994-04-28 | Zeneca Limited | Novel plants and processes for obtaining them |
| EP0596254A1 (de) | 1992-10-02 | 1994-05-11 | Mitsubishi Chemical Corporation | Methoxyiminoessigsäure-Derivate und Fungizide für Landwirtschaft und Gartenbau, die diese als aktive Bestandteile enthalten |
| WO1994011520A2 (en) | 1992-11-09 | 1994-05-26 | Zeneca Limited | Novel plants and processes for obtaining them |
| EP0600629A1 (de) | 1992-12-01 | 1994-06-08 | Rohm And Haas Company | N-Acetonylbenzamide und ihre Verwendung des Fungizide |
| EP0604019A1 (de) | 1992-12-18 | 1994-06-29 | Rohm And Haas Company | N-Acetonylbenzamide und ihre Anwendung als Fungizide |
| US5331107A (en) | 1984-03-06 | 1994-07-19 | Mgi Pharma, Inc. | Herbicide resistance in plants |
| WO1994021795A1 (en) | 1993-03-25 | 1994-09-29 | Ciba-Geigy Ag | Novel pesticidal proteins and strains |
| WO1994026722A1 (en) | 1993-05-12 | 1994-11-24 | E.I. Du Pont De Nemours And Company | Fungicidal fused bicyclic pyrimidinones |
| EP0629616A2 (de) | 1993-06-18 | 1994-12-21 | Rhone-Poulenc Agrochimie | Optisch aktive 2-Imidazoline-5-one- und 2-Imidazoline-5-thione-Derivate als Fungizide |
| US5378824A (en) | 1986-08-26 | 1995-01-03 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| WO1995004826A1 (en) | 1993-08-09 | 1995-02-16 | Institut Für Genbiologische Forschung Berlin Gmbh | Debranching enzymes and dna sequences coding them, suitable for changing the degree of branching of amylopectin starch in plants |
| EP0639574A1 (de) | 1993-08-16 | 1995-02-22 | Lucky Ltd. | 2-Aminothiazolcarboxamid Derivate, Verfahren zu deren Herstellung und deren Verwendung zur Bekämpfung von phytopathogenen Organismen |
| WO1995009910A1 (fr) | 1993-10-01 | 1995-04-13 | Mitsubishi Corporation | Gene identifiant un cytoplasme vegetal sterile et procede pour preparer un vegetal hybride a l'aide de celui-ci |
| US5434283A (en) | 1990-04-04 | 1995-07-18 | Pioneer Hi-Bred International, Inc. | Edible endogenous vegetable oil extracted from rapeseeds of reduced stearic and palmitic saturated fatty acid content |
| EP0663956A1 (de) | 1992-08-12 | 1995-07-26 | Hoechst Schering AgrEvo GmbH | Dna sequenzen, die zur bildung von polyfructanen (levanen) führen, plasmide mit entsprechenden sequenzen, sowie ein verfahren zur herstellung transgener pflanzen |
| WO1995026407A1 (en) | 1994-03-25 | 1995-10-05 | National Starch And Chemical Investment Holding Corporation | Method for producing altered starch from potato plants |
| US5463175A (en) | 1990-06-25 | 1995-10-31 | Monsanto Company | Glyphosate tolerant plants |
| WO1995031553A1 (en) | 1994-05-18 | 1995-11-23 | Institut Für Genbiologische Forschung Berlin Gmbh | DNA SEQUENCES CODING FOR ENZYMES CAPABLE OF FACILITATING THE SYNTHESIS OF LINEAR α-1,4 GLUCANS IN PLANTS, FUNGI AND MICROORGANISMS |
| WO1995035026A1 (en) | 1994-06-21 | 1995-12-28 | Zeneca Limited | Novel plants and processes for obtaining them |
| DE4423612A1 (de) | 1994-07-06 | 1996-01-11 | Basf Ag | 2-[(Dihydro)pyrazolyl-3'-oxymethylen]-anilide, Verfahren zu ihrer Herstelung und ihre Verwendung |
| WO1996001559A1 (en) | 1994-07-11 | 1996-01-25 | Ciba-Geigy Ag | Fungicidal composition and method of controlling fungus infestation |
| WO1996001904A1 (en) | 1994-07-08 | 1996-01-25 | Stichting Scheikundig Onderzoek In Nederland | Production of oligosaccharides in transgenic plants |
| WO1996004252A1 (fr) | 1994-08-03 | 1996-02-15 | Kumiai Chemical Industry Co., Ltd. | Derives amides aminoacides, procede d'obtention de ce derive, fongicide a usage agricole et horticole et procede de traitement fongicide |
| WO1996015248A1 (de) | 1994-11-10 | 1996-05-23 | Hoechst Schering Agrevo Gmbh | Dna-moleküle codierend enzyme, die an der stärkesynthese beteiligt sind, vektoren, bakterien, transgene pflanzenzellen und pflanzen enthaltend diese moleküle |
| WO1996016048A1 (de) | 1994-11-21 | 1996-05-30 | Bayer Aktiengesellschaft | Mikrobizide triazolyl-derivate |
| WO1996018631A1 (en) | 1994-12-15 | 1996-06-20 | Monsanto Company | Fungicides for the control of take-all disease of plants |
| WO1996019581A1 (en) | 1994-12-22 | 1996-06-27 | Hoechst Schering Agrevo Gmbh | Dna molecules coding for debranching enzymes derived from plants |
| EP0719338A1 (de) | 1993-09-09 | 1996-07-03 | Hoechst Schering AgrEvo GmbH | Dna-sequenzen kombination, die die bildung von modifizierter stärke in pflanzenzellen und pflanzen ermögliht |
| WO1996023793A1 (en) | 1995-01-30 | 1996-08-08 | Regents Of The University Of Minnesota | Delta opioid receptor antagonists |
| EP0728213A1 (de) | 1993-11-09 | 1996-08-28 | E.I. Du Pont De Nemours And Company | Transgene fruktan - anreichernde nutzpflanzen und verfahren zu ihrer herstellung |
| WO1996027674A1 (de) | 1995-03-08 | 1996-09-12 | Hoechst Schering Agrevo Gmbh | Modifizierte stärke aus pflanzen, pflanzen, die diese synthetisieren, sowie verfahren zu ihrer herstellung |
| US5561236A (en) | 1986-03-11 | 1996-10-01 | Plant Genetic Systems | Genetically engineered plant cells and plants exhibiting resistance to glutamine synthetase inhibitors, DNA fragments and recombinants for use in the production of said cells and plants |
| EP0737682A1 (de) | 1995-04-11 | 1996-10-16 | Mitsui Toatsu Chemicals, Incorporated | Substituierte Thiophenderivate und diese als aktiver Bestandteil enthaltenden Fungizide für Land- und Gartenbauwirtschaft |
| WO1996033270A1 (en) | 1995-04-20 | 1996-10-24 | American Cyanamid Company | Structure-based designed herbicide resistant products |
| WO1996034968A2 (en) | 1995-05-05 | 1996-11-07 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to plant starch composition |
| WO1996038567A2 (fr) | 1995-06-02 | 1996-12-05 | Rhone-Poulenc Agrochimie | Sequence adn d'un gene de l'hydroxy-phenyl pyruvate dioxygenase et obtention de plantes contenant un gene de l'hydroxy-phenyl pyruvate dioxygenase, tolerantes a certains herbicides |
| JPH096608A (ja) | 1995-06-22 | 1997-01-10 | Matsushita Electric Ind Co Ltd | ソフトウェア保護システム |
| US5593996A (en) | 1991-12-30 | 1997-01-14 | American Cyanamid Company | Triazolopyrimidine derivatives |
| WO1997006171A1 (de) | 1995-08-10 | 1997-02-20 | Bayer Aktiengesellschaft | Halogenbenzimidazole und ihre verwendung als mikrobizide |
| US5605011A (en) | 1986-08-26 | 1997-02-25 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| DE19531813A1 (de) | 1995-08-30 | 1997-03-06 | Basf Ag | Bisphenylamide |
| WO1997011188A1 (de) | 1995-09-19 | 1997-03-27 | Planttec Biotechnologie Gmbh | Pflanzen, die eine modifizierte stärke synthetisieren, verfahren zu ihrer herstellung sowie modifizierte stärke |
| DE19539324A1 (de) | 1995-10-23 | 1997-04-24 | Basf Ag | Phenylessigsäurederivate, Verfahren und Zwischenprodukte zu ihrer Herstellung und sie enthaltende Mittel |
| US5637489A (en) | 1986-08-23 | 1997-06-10 | Hoechst Aktiengesellschaft | Phosphinothricin-resistance gene, and its use |
| WO1997020936A1 (en) | 1995-12-06 | 1997-06-12 | Zeneca Limited | Modification of starch synthesis in plants |
| DE19602095A1 (de) | 1996-01-22 | 1997-07-24 | Bayer Ag | Halogenpyrimidine |
| WO1997026362A1 (de) | 1996-01-16 | 1997-07-24 | Planttec Biotechnologie Gmbh | Nucleinsäuremoleküle aus pflanzen codierend enzyme, die an der stärkesynthese beteiligt sind |
| WO1997032985A1 (de) | 1996-03-07 | 1997-09-12 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | Nucleinsäuremoleküle, codierend debranching-enzyme aus mais |
| WO1997041218A1 (en) | 1996-04-29 | 1997-11-06 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Herbicide resistant rice |
| WO1997042328A1 (de) | 1996-05-06 | 1997-11-13 | Planttec Biotechnologie Gmbh | Nucleinsäuremoleküle, die debranching-enzyme aus kartoffel codieren |
| WO1997044472A1 (de) | 1996-05-17 | 1997-11-27 | Planttec Biotechnologie Gmbh | Nucleinsäuremoleküle codierend lösliche stärkesynthasen aus mais |
| WO1997045545A1 (en) | 1996-05-29 | 1997-12-04 | Hoechst Schering Agrevo Gmbh | Nucleic acid molecules encoding enzymes from wheat which are involved in starch synthesis |
| WO1997047806A1 (en) | 1996-06-12 | 1997-12-18 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch in paper manufacture |
| WO1997047808A1 (en) | 1996-06-12 | 1997-12-18 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch in paper manufacture |
| WO1997047807A1 (en) | 1996-06-12 | 1997-12-18 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch in paper manufacture |
| WO1998000549A1 (en) | 1996-06-27 | 1998-01-08 | The Australian National University | MANIPULATION OF CELLULOSE AND/OR β-1,4-GLUCAN |
| US5712107A (en) | 1995-06-07 | 1998-01-27 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch and latexes in paper manufacture |
| US5731180A (en) | 1991-07-31 | 1998-03-24 | American Cyanamid Company | Imidazolinone resistant AHAS mutants |
| US5739082A (en) | 1990-02-02 | 1998-04-14 | Hoechst Schering Agrevo Gmbh | Method of improving the yield of herbicide-resistant crop plants |
| EP0837944A2 (de) | 1995-07-19 | 1998-04-29 | Rhone-Poulenc Agrochimie | Mutierte 5-enolpyruvylshikimat-3-phosphat synthase, für dieses protein kodierendes gen und dieses gen enthaltende transformierte pflanzen |
| DE19646407A1 (de) | 1996-11-11 | 1998-05-14 | Bayer Ag | Halogenpyrimidine |
| WO1998020145A2 (en) | 1996-11-05 | 1998-05-14 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to starch content of plants |
| WO1998022604A1 (en) | 1996-11-20 | 1998-05-28 | Pioneer Hi-Bred International, Inc. | Methods of producing high-oil seed by modification of starch levels |
| WO1998023155A1 (en) | 1996-11-26 | 1998-06-04 | E.I. Du Pont De Nemours And Company | Arthropodicidal and fungicidal cyclic amides |
| WO1998027212A1 (en) | 1996-12-19 | 1998-06-25 | Planttec Biotechnologie Gmbh | Novel nucleic acid molecules from maize and their use for the production of modified starch |
| US5773702A (en) | 1996-07-17 | 1998-06-30 | Board Of Trustees Operating Michigan State University | Imidazolinone herbicide resistant sugar beet plants |
| WO1998027806A1 (en) | 1996-12-24 | 1998-07-02 | Pioneer Hi-Bred International, Inc. | Oilseed brassica containing an improved fertility restorer gene for ogura cytoplasmic male sterility |
| WO1998032326A2 (en) | 1997-01-24 | 1998-07-30 | Pioneer Hi-Bred International, Inc. | Methods for $i(agrobacterium)-mediated transformation |
| EP0860438A1 (de) | 1997-02-21 | 1998-08-26 | Shenyang Research Institute of Chemical Industry | Fluorine enthaltende Diphenylacrylamid Microbizide |
| WO1998039460A1 (en) | 1997-03-04 | 1998-09-11 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Nucleic acid molecules from artichoke ($i(cynara scolymus)) encoding enzymes having fructosyl polymerase activity |
| WO1998040503A1 (en) | 1997-03-10 | 1998-09-17 | Planttec Biotechnologie Gmbh | Nucleic acid molecules encoding starch phosphorylase from maize |
| US5824790A (en) | 1994-06-21 | 1998-10-20 | Zeneca Limited | Modification of starch synthesis in plants |
| EP0712396B1 (de) | 1993-08-11 | 1998-11-04 | Bayer Ag | Substituierte azadioxacycloalkene und ihre verwendung als fungizide |
| US5840946A (en) | 1987-12-31 | 1998-11-24 | Pioneer Hi-Bred International, Inc. | Vegetable oil extracted from rapeseeds having a genetically controlled unusually high oleic acid content |
| EP0897904A1 (de) | 1997-08-20 | 1999-02-24 | American Cyanamid Company | Fungizide 2-Methoxybenzophenone |
| US5876739A (en) | 1996-06-13 | 1999-03-02 | Novartis Ag | Insecticidal seed coating |
| WO1999012950A2 (en) | 1997-09-06 | 1999-03-18 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to stability of plant starches |
| WO1999014202A2 (en) | 1997-09-12 | 1999-03-25 | Novartis Ag | Novel pyrimidin-4-one and pyrimidin-4-thione as fungicide |
| WO1999024586A1 (fr) | 1997-11-07 | 1999-05-20 | Aventis Cropscience S.A. | Hydroxy-phenyl pyruvate dioxygenase chimere, sequence d'adn et obtention de plantes contenant un tel gene, tolerantes aux herbicides |
| WO1999024593A1 (en) | 1997-11-06 | 1999-05-20 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Nucleic acid molecules which encode proteins having fructosyl transferase activity and methods for producing long-chain inulin |
| DE19750012A1 (de) | 1997-11-12 | 1999-05-20 | Bayer Ag | Isothiazolcarbonsäureamide |
| US5908810A (en) | 1990-02-02 | 1999-06-01 | Hoechst Schering Agrevo Gmbh | Method of improving the growth of crop plants which are resistant to glutamine synthetase inhibitors |
| WO1999034008A1 (fr) | 1997-12-24 | 1999-07-08 | Aventis Cropscience S.A. | Procede de preparation enzymatique d'homogentisate |
| US5928937A (en) | 1995-04-20 | 1999-07-27 | American Cyanamid Company | Structure-based designed herbicide resistant products |
| WO1999042447A1 (en) | 1998-02-19 | 1999-08-26 | Aventis Cropscience Uk Limited | 2-pyridylmethylamine derivatives useful as fungicides |
| US5965755A (en) | 1993-10-12 | 1999-10-12 | Agrigenetics, Inc. | Oil produced from the Brassica napus |
| US5969169A (en) | 1993-04-27 | 1999-10-19 | Cargill, Incorporated | Non-hydrogenated canola oil for food applications |
| WO1999053072A1 (en) | 1998-04-09 | 1999-10-21 | E.I. Du Pont De Nemours And Company | Starch r1 phosphorylation protein homologs |
| US5986135A (en) | 1998-09-25 | 1999-11-16 | American Cyanamid Company | Fungicidal trifluoromethylalkylamino-triazolopyrimidines |
| WO1999057965A1 (de) | 1998-05-14 | 1999-11-18 | Aventis Cropscience Gmbh | Sulfonylharnstoff-tolerante zuckerrübenmutanten |
| WO1999058690A2 (de) | 1998-05-08 | 1999-11-18 | Aventis Cropscience Gmbh | Nucleinsäuremoleküle codierend enzyme aus weizen, die an der stärkesynthese beteiligt sind |
| WO1999058654A2 (de) | 1998-05-13 | 1999-11-18 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | Transgene pflanzen mit veränderter aktivität eines plastidären adp/atp - translokators |
| WO1999058688A2 (de) | 1998-05-08 | 1999-11-18 | Aventis Cropscience Gmbh | Nucleinsäuremoleküle codierend enzyme aus weizen, die an der stärkesynthese beteiligt sind |
| WO1999066050A1 (en) | 1998-06-15 | 1999-12-23 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to plants and plant products |
| US6013861A (en) | 1989-05-26 | 2000-01-11 | Zeneca Limited | Plants and processes for obtaining them |
| WO2000004173A1 (en) | 1998-07-17 | 2000-01-27 | Aventis Cropscience N.V. | Methods and means to modulate programmed cell death in eukaryotic cells |
| WO2000008185A1 (de) | 1998-07-31 | 2000-02-17 | Aventis Cropscience Gmbh | Nukleinsäuremoleküle kodierend für beta-amylase, pflanzen, die eine modifizierte stärke synthetisieren, herstellungsverfahren und verwendungen |
| WO2000008184A1 (de) | 1998-07-31 | 2000-02-17 | Aventis Cropscience Gmbh | Pflanzen, die eine modifizierte stärke synthetisieren, verfahren zur herstellung der pflanzen, ihre verwendung sowie die modifizierte stärke |
| WO2000011192A2 (en) | 1998-08-25 | 2000-03-02 | Pioneer Hi-Bred International, Inc. | Plant glutamine: fructose-6-phosphate amidotransferase nucleic acids |
| WO2000014701A1 (en) | 1998-09-09 | 2000-03-16 | Sidney Samole | Apparatus and method for finding and identifying nighttime sky objects |
| WO2000014249A1 (en) | 1998-09-02 | 2000-03-16 | Planttec Biotechnologie Gmbh | Nucleic acid molecules encoding an amylosucrase |
| WO2000022140A1 (de) | 1998-10-09 | 2000-04-20 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | NUCLEINSÄUREMOLEKÜLE CODIEREND EIN VERZWEIGUNGSENZYM AUS BAKTERIEN DER GATTUNG NEISSERIA SOWIE VERFAHREN ZUR HERSTELLUNG VON α-1,6-VERZWEIGTEN α-1,4-GLUCANEN |
| WO2000028052A2 (en) | 1998-11-09 | 2000-05-18 | Planttec Biotechnologie Gmbh | Nucleic acid molecules from rice encoding an r1 protein and their use for the production of modified starch |
| WO2000047727A2 (en) | 1999-02-08 | 2000-08-17 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | Nucleic acid molecules encoding alternansucrase |
| WO2000066746A1 (en) | 1999-04-29 | 2000-11-09 | Syngenta Limited | Herbicide resistant plants |
| WO2000066747A1 (en) | 1999-04-29 | 2000-11-09 | Syngenta Limited | Herbicide resistant plants |
| WO2000073422A1 (en) | 1999-05-27 | 2000-12-07 | Planttec Biotechnologie Gmbh | Genetically modified plant cells and plants with an increased activity of an amylosucrase protein and a branching enzyme |
| WO2000077229A2 (en) | 1999-06-11 | 2000-12-21 | Aventis Cropscience Gmbh | R1 protein from wheat and the use thereof for the production of modified strach |
| WO2001010825A1 (fr) | 1999-08-05 | 2001-02-15 | Kumiai Chemical Industry Co., Ltd. | Derives de carbamate et bactericides destines a l'agriculture et a l'horticulture |
| WO2001012826A2 (de) | 1999-08-11 | 2001-02-22 | Aventis Cropscience Gmbh | Nukleinsäuremoleküle aus pflanzen codierend enzyme, die an der stärkesynthese beteiligt sind |
| WO2001012782A2 (de) | 1999-08-12 | 2001-02-22 | Aventis Cropscience Gmbh | Transgene pflanzenzellen und pflanzen mit veränderter aktivität des gbssi- und des be-proteins |
| WO2001014569A2 (de) | 1999-08-20 | 2001-03-01 | Basf Plant Science Gmbh | Erhöhung des polysaccharidgehaltes in pflanzen |
| WO2001017333A1 (en) | 1999-09-10 | 2001-03-15 | Texas Tech University | Transgenic fiber producing plants with increased expression of sucrose phosphate synthase |
| WO2001019975A2 (en) | 1999-09-15 | 2001-03-22 | National Starch And Chemical Investment Holding Corporation | Plants having reduced activity in two or more starch-modifying enzymes |
| WO2001024615A1 (en) | 1999-10-07 | 2001-04-12 | Valigen (Us), Inc. | Non-transgenic herbicide resistant plants |
| US6229072B1 (en) | 1995-07-07 | 2001-05-08 | Adventa Technology Ltd | Cytoplasmic male sterility system production canola hybrids |
| JP2001187786A (ja) | 1999-10-19 | 2001-07-10 | Nissan Chem Ind Ltd | トリアゾール化合物およびその製造法 |
| US6270828B1 (en) | 1993-11-12 | 2001-08-07 | Cargrill Incorporated | Canola variety producing a seed with reduced glucosinolates and linolenic acid yielding an oil with low sulfur, improved sensory characteristics and increased oxidative stability |
| US6284479B1 (en) | 1995-06-07 | 2001-09-04 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch and latexes in paper manufacture |
| WO2001066704A2 (en) | 2000-03-09 | 2001-09-13 | Monsanto Technology Llc | Methods for making plants tolerant to glyphosate and compositions thereof |
| WO2001065922A2 (en) | 2000-03-09 | 2001-09-13 | E. I. Du Pont De Nemours And Company | Sulfonylurea-tolerant sunflower plants |
| WO2001087822A1 (en) | 2000-05-17 | 2001-11-22 | Syngenta Participations Ag | Novel phenyl-propargylether derivatives |
| US6323392B1 (en) | 1999-03-01 | 2001-11-27 | Pioneer Hi-Bred International, Inc. | Formation of brassica napus F1 hybrid seeds which exhibit a highly elevated oleic acid content and a reduced linolenic acid content in the endogenously formed oil of the seeds |
| WO2001098509A2 (en) | 2000-06-21 | 2001-12-27 | Syngenta Participations Ag | Grain processing method and transgenic plants useful therein |
| WO2002008197A1 (de) | 2000-07-24 | 2002-01-31 | Bayer Cropscience Ag | Biphenylcarboxamide |
| WO2002026995A1 (en) | 2000-09-29 | 2002-04-04 | Syngenta Limited | Herbicide resistant plants |
| WO2002028186A2 (en) | 2000-10-06 | 2002-04-11 | Monsanto Technology, Llc | Seed treatment with combinations of insecticides |
| WO2002034923A2 (en) | 2000-10-23 | 2002-05-02 | Bayer Cropscience Gmbh | Monocotyledon plant cells and plants which synthesise modified starch |
| WO2002036782A2 (en) | 2000-10-30 | 2002-05-10 | Maxygen, Inc. | Novel glyphosate n-acetyltransferase (gat) genes |
| WO2002036787A2 (fr) | 2000-10-30 | 2002-05-10 | Bayer Cropscience S.A. | Plantes tolerantes aux herbicides par contournement de voie metabolique |
| WO2002038542A1 (en) | 2000-11-08 | 2002-05-16 | Syngenta Participations Ag | Pyrrolcarboxamides and pyrrolcarbothioamides and their agrochemical uses |
| WO2002038565A2 (de) | 2000-11-13 | 2002-05-16 | Basf Aktiengesellschaft | 7-(r)-amino-triazolopyrimidine, deren herstellung und verwendung zur bekämpfung von pflanzenpathogenen pilzen |
| WO2002045485A1 (en) | 2000-12-08 | 2002-06-13 | Commonwealth Scienctific And Industrial Research Organisation | Modification of sucrose synthase gene expression in plant tissue and uses therefor |
| WO2002079410A2 (en) | 2001-03-30 | 2002-10-10 | Basf Plant Science Gmbh | Glucan chain length domains |
| WO2002080675A1 (en) | 2001-03-21 | 2002-10-17 | Monsanto Technology, Llc | Treated plant seeds with controlled release of active agents |
| DE10124208A1 (de) | 2001-05-18 | 2002-11-21 | Bayer Ag | Verwendung von Triazolopyrimidin-Derivaten als Mikrobizide |
| WO2002101059A2 (en) | 2001-06-12 | 2002-12-19 | Bayer Cropscience Gmbh | Transgenic plants synthesising high amylose starch |
| WO2003014103A1 (en) | 2001-08-03 | 2003-02-20 | Bayer Cropscience S.A. | Iodobenzopyran-4-one derivatives having fungicidal activity |
| WO2003013226A2 (en) | 2001-08-09 | 2003-02-20 | Cibus Genetics | Non-transgenic herbicide resistant plants |
| WO2003033540A2 (en) | 2001-10-17 | 2003-04-24 | Basf Plant Science Gmbh | Starch |
| WO2003066610A1 (de) | 2002-02-04 | 2003-08-14 | Bayer Cropscience Aktiengesellschaft | Difluormethyl thiazolyl carboxanilide |
| WO2003066609A1 (de) | 2002-02-04 | 2003-08-14 | Bayer Cropscience Aktiengesellschaft | Disubstituierte thiazolylcarboxanilide und ihre verwendung als mikrobizide |
| WO2003070705A1 (de) | 2002-02-19 | 2003-08-28 | Bayer Cropscience Aktiengesellschaft | Disubstituierte pyrazolylcarboxanilide |
| WO2003071860A2 (en) | 2002-02-26 | 2003-09-04 | Bayer Cropscience Gmbh | Method for generating maize plants with an increased leaf starch content, and their use for making maize silage |
| US6616054B1 (en) | 2001-07-02 | 2003-09-09 | Bellsouth Intellectual Property Corporation | External power supply system, apparatus and method for smart card |
| US20030176428A1 (en) | 1998-11-16 | 2003-09-18 | Schneidersmann Ferdinand Martin | Pesticidal composition for seed treatment |
| WO2003092360A2 (en) | 2002-04-30 | 2003-11-13 | Verdia, Inc. | Novel glyphosate-n-acetyltransferase (gat) genes |
| WO2004016088A2 (en) | 2002-08-12 | 2004-02-26 | Bayer Cropscience S.A. | Novel 2-pyridylethylbenzamide derivative |
| WO2004024928A2 (fr) | 2002-09-11 | 2004-03-25 | Bayer Cropscience S.A. | Plantes transformees a biosynthese de prenylquinones amelioree |
| EP1404407A2 (de) | 2001-07-12 | 2004-04-07 | BMR Research & Development Limited | Vorrichtung zur elektrischen stimulation |
| EP1414803A1 (de) | 2001-07-25 | 2004-05-06 | Bayer CropScience AG | Pyrazolylkarboxanilide als fungizide |
| US6734341B2 (en) | 1999-09-02 | 2004-05-11 | Pioneer Hi-Bred International, Inc. | Starch synthase polynucleotides and their use in the production of new starches |
| WO2004040012A2 (en) | 2002-10-29 | 2004-05-13 | Basf Plant Science Gmbh | Compositions and methods for identifying plants having increased tolerance to imidazolinone herbicides |
| WO2004053219A2 (en) | 2002-12-05 | 2004-06-24 | Jentex Corporation | Abrasive webs and methods of making the same |
| WO2004056999A1 (en) | 2002-12-19 | 2004-07-08 | Bayer Cropscience Gmbh | Plant cells and plants which synthesize a starch with an increased final viscosity |
| WO2004078983A2 (en) | 2003-03-07 | 2004-09-16 | Basf Plant Science Gmbh | Enhanced amylose production in plants |
| WO2004090140A2 (en) | 2003-04-09 | 2004-10-21 | Bayer Bioscience N.V. | Methods and means for increasing the tolerance of plants to stress conditions |
| WO2004106529A2 (en) | 2003-05-28 | 2004-12-09 | Basf Aktiengesellschaft | Wheat plants having increased tolerance to imidazolinone herbicides |
| WO2005002324A2 (en) | 2003-07-04 | 2005-01-13 | Institut National De La Recherche Agronomique | Method of producing double low restorer lines of brassica napus having a good agronomic value |
| WO2005002359A2 (en) | 2003-05-22 | 2005-01-13 | Syngenta Participations Ag | Modified starch, uses, methods for production thereof |
| WO2005012515A2 (en) | 2003-04-29 | 2005-02-10 | Pioneer Hi-Bred International, Inc. | Novel glyphosate-n-acetyltransferase (gat) genes |
| WO2005012529A1 (ja) | 2003-07-31 | 2005-02-10 | Toyo Boseki Kabushiki Kaisha | ヒアルロン酸生産植物 |
| WO2005017157A1 (en) | 2003-08-15 | 2005-02-24 | Commonwealth Scientific And Industrial Research Organisation (Csiro) | Methods and means for altering fiber characteristics in fiber-producing plants |
| WO2005020673A1 (en) | 2003-08-29 | 2005-03-10 | Instituto Nacional De Technologia Agropecuaria | Rice plants having increased tolerance to imidazolinone herbicides |
| EP1519913A1 (de) | 2002-07-02 | 2005-04-06 | Bayer CropScience AG | Phenylbenzamide |
| WO2005030942A1 (en) | 2003-09-30 | 2005-04-07 | Bayer Cropscience Gmbh | Plants with reduced activity of a class 3 branching enzyme |
| WO2005030941A1 (en) | 2003-09-30 | 2005-04-07 | Bayer Cropscience Gmbh | Plants with increased activity of a class 3 branching enzyme |
| WO2005093093A2 (en) | 2004-03-22 | 2005-10-06 | Basf Aktiengesellschaft | Methods and compositions for analyzing ahasl genes |
| WO2005095619A1 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Plants with increased activity of multiple starch phosphorylating enzymes |
| WO2005095617A2 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Plants with increased activity of a starch phosphorylating enzyme |
| WO2005095618A2 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Plants with reduced activity of the starch phosphorylating enzyme phosphoglucan, water dikinase |
| WO2005095632A2 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Methods for identifying proteins with starch phosphorylating enzymatic activity |
| WO2005123927A1 (en) | 2004-06-21 | 2005-12-29 | Bayer Cropscience Gmbh | Plants that produce amylopectin starch with novel properties |
| WO2006007373A2 (en) | 2004-06-16 | 2006-01-19 | Basf Plant Science Gmbh | Polynucleotides encoding mature ahasl proteins for creating imidazolinone-tolerant plants |
| WO2006015376A2 (en) | 2004-08-04 | 2006-02-09 | Basf Plant Science Gmbh | Monocot ahass sequences and methods of use |
| WO2006018319A1 (en) | 2004-08-18 | 2006-02-23 | Bayer Cropscience Gmbh | Plants with increased plastidic activity of r3 starch-phosphorylating enzyme |
| WO2006021972A1 (en) | 2004-08-26 | 2006-03-02 | Dhara Vegetable Oil And Foods Company Limited | A novel cytoplasmic male sterility system for brassica species and its use for hybrid seed production in indian oilseed mustard brassica juncea |
| WO2006024351A1 (en) | 2004-07-30 | 2006-03-09 | Basf Agrochemical Products B.V. | Herbicide-resistant sunflower plants, plynucleotides encoding herbicide-resistant acetohydroxy acid synthase large subunit proteins, and methods of use |
| WO2006032538A1 (en) | 2004-09-23 | 2006-03-30 | Bayer Cropscience Gmbh | Methods and means for producing hyaluronan |
| DE102004047922A1 (de) * | 2004-10-01 | 2006-04-06 | Bayer Cropscience Ag | Wirkstoffe für die Saatgutbehandlung |
| WO2006060634A2 (en) | 2004-12-01 | 2006-06-08 | Basf Agrochemical Products, B.V. | Novel mutation involved in increased tolerance to imidazolinone herbicides in plants |
| WO2006063862A1 (en) | 2004-12-17 | 2006-06-22 | Bayer Cropscience Ag | Transformed plant expressing a dextransucrase and synthesizing a modified starch |
| WO2006072603A2 (en) | 2005-01-10 | 2006-07-13 | Bayer Cropscience Ag | Transformed plant expressing a mutansucrase and synthesizing a modified starch |
| WO2006103107A1 (en) | 2005-04-01 | 2006-10-05 | Bayer Cropscience Ag | Phosphorylated waxy potato starch |
| WO2006108702A1 (en) | 2005-04-08 | 2006-10-19 | Bayer Cropscience Ag | High-phosphate starch |
| JP2006304779A (ja) | 2005-03-30 | 2006-11-09 | Toyobo Co Ltd | ヘキソサミン高生産植物 |
| WO2006133827A2 (en) | 2005-06-15 | 2006-12-21 | Bayer Bioscience N.V. | Methods for increasing the resistance of plants to hypoxic conditions |
| WO2006136351A2 (en) | 2005-06-24 | 2006-12-28 | Bayer Bioscience N.V. | Methods for altering the reactivity of plant cell walls |
| WO2007009823A1 (en) | 2005-07-22 | 2007-01-25 | Bayer Cropscience Ag | Overexpression of starch synthase in plants |
| WO2007024782A2 (en) | 2005-08-24 | 2007-03-01 | Pioneer Hi-Bred International, Inc. | Compositions providing tolerance to multiple herbicides and methods of use thereof |
| WO2007027777A2 (en) | 2005-08-31 | 2007-03-08 | Monsanto Technology Llc | Nucleotide sequences encoding insecticidal proteins |
| WO2007039316A1 (en) | 2005-10-05 | 2007-04-12 | Bayer Cropscience Ag | Improved methods and means for producings hyaluronan |
| WO2007039314A2 (en) | 2005-10-05 | 2007-04-12 | Bayer Cropscience Ag | Plants with increased hyaluronan production |
| WO2007039315A1 (de) | 2005-10-05 | 2007-04-12 | Bayer Cropscience Ag | Pflanzen mit gesteigerter produktion von hyaluronan ii |
| JP4429464B2 (ja) | 2000-03-27 | 2010-03-10 | 株式会社小松製作所 | 流体−機械動力変換機器の内圧検出装置及びそれを具えたトルクコンバータ |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102006015470A1 (de) | 2006-03-31 | 2007-10-04 | Bayer Cropscience Ag | Substituierte Enaminocarbonylverbindungen |
| DE102006015467A1 (de) | 2006-03-31 | 2007-10-04 | Bayer Cropscience Ag | Substituierte Enaminocarbonylverbindungen |
| DE102006015468A1 (de) | 2006-03-31 | 2007-10-04 | Bayer Cropscience Ag | Substituierte Enaminocarbonylverbindungen |
-
2007
- 2007-09-26 DE DE102007045920.5A patent/DE102007045920B4/de active Active
Patent Citations (318)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US947A (en) | 1838-09-25 | Machine fob dyeing yarn from the beam | ||
| US6063A (en) | 1849-01-30 | Improvement in baking apparatus | ||
| US1972961A (en) | 1931-05-26 | 1934-09-11 | Du Pont | Disinfectant |
| US2588428A (en) | 1945-04-02 | 1952-03-11 | Goodrich Co B F | Complex amine products with dialkyl zinc dithiocarbamates as pesticides |
| US2504404A (en) | 1946-06-12 | 1950-04-18 | Du Pont | Manganous ethylene bis-dithiocarbamate and fungicidal compositions containing same |
| US2553770A (en) | 1948-05-18 | 1951-05-22 | Standard Oil Dev Co | Parasiticidal compounds containing the nsccll3 group |
| DE1081446B (de) | 1955-09-20 | 1960-05-12 | Montedison Spa | Verfahren zur Herstellung von kristallinem Zinkaethylen-bisdithiocarbamat |
| DE1076434B (de) | 1957-08-17 | 1960-02-25 | Badische Anilin- S. Soda-Fabrik Aktiengesellschaft, Ludwigshafen/Rhein | Fungizide Mittel |
| US3010968A (en) | 1959-11-25 | 1961-11-28 | Du Pont | Process for manufacture of certain alkyl esters of benzimidazole carbamic acids |
| DE1193498B (de) | 1960-11-03 | 1965-05-26 | Bayer Ag | Verfahren zur Herstellung von Sulfensaeurederivaten |
| GB935981A (en) | 1960-12-28 | 1963-09-04 | Bayer Ag | Fungicidal carbamic acid salts |
| GB988630A (en) | 1961-02-22 | 1965-04-07 | Basf Ag | N-substituted morpholines having fungicidal activity |
| DE1234704B (de) | 1961-05-09 | 1967-02-23 | Rohm & Haas | Verfahren zur Herstellung von komplexen Mangansalzen der AEthylenbisdithiocarbaminsaeure |
| US3290353A (en) | 1963-04-01 | 1966-12-06 | Diamond Alkali Co | Halogenated aromatic nitriles |
| US3206468A (en) | 1963-11-15 | 1965-09-14 | Merck & Co Inc | Methods of preparing benzimidazoles |
| US3178447A (en) | 1964-05-05 | 1965-04-13 | California Research Corp | N-polyhaloalkylthio compounds |
| DE1209799B (de) | 1964-05-14 | 1966-01-27 | Bayer Ag | Saatgutbeizmittel gegen Fusariosen |
| GB1094567A (en) | 1964-06-23 | 1967-12-13 | Zh Biseibutsu Kagaku Kenkyukai | Plant disease protective and curative compositions |
| GB1114155A (en) | 1964-08-24 | 1968-05-15 | Evans Medical Ltd | Guanidino derivatives |
| US3249499A (en) | 1965-04-26 | 1966-05-03 | Us Rubber Co | Control of plant diseases |
| DE1493736A1 (de) | 1965-08-26 | 1969-04-03 | Bayer Ag | Verfahren zur Herstellung von Dithiolphosphorsaeuretriestern |
| US3513241A (en) | 1966-12-17 | 1970-05-19 | Schering Ag | Fungicidal and fungistatic n-(dialkylaminoalkyl) - carbamic acid and thiocarbamic acid esters |
| GB1103989A (en) | 1967-02-10 | 1968-02-21 | Union Carbide Corp | Fungicidal concentrates |
| US3629428A (en) | 1967-09-07 | 1971-12-21 | Meiji Seika Kaisha | Pesticide for controlling bacterial and fungal diseases of rice plant |
| DE1806123A1 (de) | 1967-10-30 | 1969-06-04 | Nippon Soda Co | Bis (thioureido) benzole und ihre Metallsalze |
| DE2012656A1 (de) | 1969-03-19 | 1971-09-30 | Sumitomo Chemical Company, Ltd., Osaka (Japan) | N-(3,5-Dihalogenphenyl)-imide, Verfahren zu ihrer Herstellung und ihre Verwendung als Mikrobicide |
| US3631176A (en) | 1970-07-20 | 1971-12-28 | Du Pont | Carbamoyl substituted 2-aminobenzimidazoles |
| DE2149923A1 (de) | 1970-10-06 | 1972-04-13 | Rhone Poulenc Sa | Neue Hydantoinderivate,ihre Herstellung und die fungiciden Zusammensetzungen,die sie enthalten |
| US3856814A (en) | 1971-02-02 | 1974-12-24 | Nihon Nohyaku Co Ltd | Olan-2-ylidenemalonates |
| DE2250077A1 (de) | 1971-10-12 | 1973-04-19 | Lilly Co Eli | Verfahren zur herstellung von benzoxazol- und benzthiazolverbindungen und ihre verwendung zum pflanzenschutz |
| DE2201063A1 (de) | 1972-01-11 | 1973-07-26 | Bayer Ag | 1,2,4-triazolderivate, verfahren zu ihrer herstellung und ihre verwendung als fungizide |
| DE2207576A1 (de) | 1972-02-18 | 1973-08-23 | Basf Ag | Oxazolidinderivate |
| DE2312956A1 (de) | 1972-03-15 | 1973-09-20 | Du Pont | Mittel zum bekaempfen von flunguserkrankungen bei pflanzen |
| DE2324010A1 (de) | 1973-05-12 | 1975-01-16 | Bayer Ag | Triazolyl-0,n-acetale, verfahren zu ihrer herstellung und ihre fungizide verwendung |
| DE2429523A1 (de) | 1973-06-21 | 1975-01-16 | Boots Co Ltd | Fungicide zubereitungen |
| DE2456627A1 (de) | 1973-12-14 | 1975-06-19 | Pepro | Fungizide auf alkylphosphit-basis |
| DE2501040A1 (de) | 1974-01-14 | 1975-07-17 | Sumitomo Chemical Co | Thiophosphorsaeureester, verfahren zu ihrer herstellung und ihre verwendung als fungizide |
| DE2513732A1 (de) | 1974-04-02 | 1975-10-16 | Ciba Geigy Ag | Mikrobizide und wachstumsregulierende mittel |
| DE2515091A1 (de) | 1974-04-09 | 1975-10-23 | Ciba Geigy Ag | Mikrobizide mittel |
| DE2551560A1 (de) | 1974-11-18 | 1976-05-20 | Janssen Pharmaceutica Nv | 1-(beta-aryl)-aethyl-1h-1,2,4-triazolketale und ihre salze, verfahren zu ihrer herstellung und fungizide mittel und pflanzenwuchsregulierende mittel |
| DE2543279A1 (de) | 1975-09-27 | 1977-04-07 | Basf Ag | Verfahren zur herstellung von n-substituierten tetrahydro-1.4-oxazinen |
| DE2731522A1 (de) | 1976-07-12 | 1978-01-19 | Nihon Nohyaku Co Ltd | Benzoylanilid-derivat, verfahren zu dessen herstellung und solches enthaltendes fungizid |
| DE2732257A1 (de) | 1976-07-20 | 1978-01-26 | Nihon Tokushu Noyaku Seizo Kk | Neue harnstoffe oder thioharnstoffe, verfahren zu ihrer herstellung und ihre verwendung als fungizide |
| DE2732257B2 (de) | 1976-07-20 | 1980-07-03 | Nihon Tokushu Noyaku Seizo K.K., Tokio | Phenylharnstoffe oder Phenylthioharnstoffe, Verfahren zu ihrer Herstellung und ihre Verwendung zur Bekämpfung von Pilzen |
| DE2735872A1 (de) | 1976-08-10 | 1978-02-16 | Janssen Pharmaceutica Nv | 1-(2-arylaethyl)-1h-1,2,4-triazole, verfahren zu deren herstellung und diese verbindungen enthaltende fungizide mittel |
| DE2656747A1 (de) | 1976-12-15 | 1978-06-29 | Basf Ag | Morpholinderivate |
| DE2802488A1 (de) | 1978-01-20 | 1979-07-26 | Bayer Ag | 3-azolyl-benzotriazine und -benzotriazin-1-oxide, verfahren zu ihrer herstellung, sowie ihre verwendung zur bekaempfung von pflanzenkrankheiten |
| DE2903612A1 (de) | 1978-02-02 | 1979-08-09 | Montedison Spa | Neue acylaniline, deren herstellung und deren verwendung als fungizide |
| DD140041A1 (de) | 1978-08-22 | 1980-02-06 | Gerhard Rieck | Verfahren zur herstellung von langkettigen n-alkyl-dimethylmorpholinen |
| EP0015756A1 (de) | 1979-03-07 | 1980-09-17 | Imperial Chemical Industries Plc | Triazolverbindungen, Verfahren zu ihrer Herstellung, ihre Verwendung als Pflanzenfungizide und fungizide Zusammensetzungen, die sie enthalten |
| EP0019450A1 (de) | 1979-05-15 | 1980-11-26 | Takeda Chemical Industries, Ltd. | Pyrimidinderivate, ihre Herstellung und ihre Verwendungen in der Landwirtschaft |
| US4272417A (en) | 1979-05-22 | 1981-06-09 | Cargill, Incorporated | Stable protective seed coating |
| US4245432A (en) | 1979-07-25 | 1981-01-20 | Eastman Kodak Company | Seed coatings |
| DE3042303A1 (de) | 1979-11-13 | 1981-08-27 | Sandoz-Patent-GmbH, 7850 Lörrach | Organische verbindungen, deren herstellung und verwendung |
| EP0031257A2 (de) | 1979-12-25 | 1981-07-01 | Ishihara Sangyo Kaisha Ltd. | Pyridylaniline |
| EP0040345A1 (de) | 1980-05-16 | 1981-11-25 | Bayer Ag | 1-Hydroxyethyl-azol-Derivate, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Pflanzenwachstumsregulatoren und Fungizide |
| DD151404A1 (de) | 1980-06-13 | 1981-10-21 | Friedrich Franke | Fungizide mittel |
| DE3030026A1 (de) | 1980-08-08 | 1981-03-26 | Sandoz-Patent-GmbH, 79539 Lörrach | Fungizide |
| JPS5755844A (en) | 1980-09-11 | 1982-04-03 | Touwa Seikou Kk | Feeding mechanism for label tape of labeller |
| EP0068813A2 (de) | 1981-06-24 | 1983-01-05 | E.I. Du Pont De Nemours And Company | Fungizide 1,2,4-Triazol- und Imidazol-Derivate |
| EP0078663A2 (de) | 1981-10-29 | 1983-05-11 | Sumitomo Chemical Company, Limited | N-Phenylcarbamate mit fungizider Wirkung |
| EP0112284A2 (de) | 1982-11-16 | 1984-06-27 | Ciba-Geigy Ag | Neue Arylphenylether-derivate |
| DE3406993A1 (de) | 1983-03-04 | 1984-09-06 | Sandoz-Patent-GmbH, 7850 Lörrach | Neue azolderivate |
| EP0145294A2 (de) | 1983-11-10 | 1985-06-19 | Rohm And Haas Company | Substituierte Triazole, Verfahren zu deren Herstellung, deren Verwendung als Fungizide und diese enthaltende fungizide Zusammensetzungen |
| EP0155509A1 (de) | 1984-02-24 | 1985-09-25 | Dainippon Ink And Chemicals, Inc. | Landwirtschafts- und Gartenbaufungizid des Typs Guanidin und Verfahren zu seiner Herstellung |
| US4761373A (en) | 1984-03-06 | 1988-08-02 | Molecular Genetics, Inc. | Herbicide resistance in plants |
| US5304732A (en) | 1984-03-06 | 1994-04-19 | Mgi Pharma, Inc. | Herbicide resistance in plants |
| US5331107A (en) | 1984-03-06 | 1994-07-19 | Mgi Pharma, Inc. | Herbicide resistance in plants |
| EP0183458A1 (de) | 1984-11-24 | 1986-06-04 | Schering Agrochemicals Limited | Fungizide Azolverbindungen |
| EP0196038A2 (de) | 1985-03-29 | 1986-10-01 | BASF Aktiengesellschaft | Azolylmethyloxirane - ihre Herstellung und Verwendung als Pflanzenschutzmittel |
| EP0206999A2 (de) | 1985-06-21 | 1986-12-30 | Ciba-Geigy Ag | Mikrobizide Mittel |
| EP0219756A1 (de) | 1985-10-09 | 1987-04-29 | Shell Internationale Researchmaatschappij B.V. | Neue Acrylsäureamide |
| EP0248086A1 (de) | 1985-12-12 | 1987-12-09 | Ube Industries, Ltd. | Imidazolabkömmlinge, bakterizide, die diese enthalten und herstellungsverfahren |
| EP0234242A2 (de) | 1986-01-23 | 1987-09-02 | MONTEDIPE S.r.l. | Fungizide Azolyl-Derivate |
| EP0236272A1 (de) | 1986-03-04 | 1987-09-09 | Ciba-Geigy Ag | Fungizide Verwendung eines Cyanopyrrol-Derivates |
| US5648477A (en) | 1986-03-11 | 1997-07-15 | Plant Genetic Systems, N.V. | Genetically engineered plant cells and plants exhibiting resistance to glutamine synthetase inhibitors, DNA fragments and recombinants for use in the production of said cells and plants |
| US7112665B1 (en) | 1986-03-11 | 2006-09-26 | Bayer Bioscience N.V. | Genetically engineered plant cells and plants exhibiting resistance to glutamine synthetase inhibitors, DNA fragments and recombinants for use in the production of said cells and plants |
| US5646024A (en) | 1986-03-11 | 1997-07-08 | Plant Genetic Systems, N.V. | Genetically engineered plant cells and plants exhibiting resistance to glutamine synthetase inhibitors, DNA fragments and recombinants for use in the production of said cells and plants |
| US5561236A (en) | 1986-03-11 | 1996-10-01 | Plant Genetic Systems | Genetically engineered plant cells and plants exhibiting resistance to glutamine synthetase inhibitors, DNA fragments and recombinants for use in the production of said cells and plants |
| DE3721786A1 (de) | 1986-07-02 | 1988-01-07 | Rohm & Haas | Fungizide verbindung, verfahren zu ihrer herstellung und diese enthaltende mittel |
| EP0253213A1 (de) | 1986-07-16 | 1988-01-20 | BASF Aktiengesellschaft | Oximether und enthaltende Fungizide |
| EP0256503A2 (de) | 1986-08-12 | 1988-02-24 | Mitsubishi Kasei Corporation | Pyridincarboxamid-Derivate und ihre Verwendung als fungizides Mittel |
| EP0258161A2 (de) | 1986-08-22 | 1988-03-02 | Rhone-Poulenc Agrochimie | 2,5-Dihydrofuranderivate mit einem Triazol- oder Imidazorest, Verfahren zur Herstellung, Verwendung als Fungizid |
| US5276268A (en) | 1986-08-23 | 1994-01-04 | Hoechst Aktiengesellschaft | Phosphinothricin-resistance gene, and its use |
| US5273894A (en) | 1986-08-23 | 1993-12-28 | Hoechst Aktiengesellschaft | Phosphinothricin-resistance gene, and its use |
| US5637489A (en) | 1986-08-23 | 1997-06-10 | Hoechst Aktiengesellschaft | Phosphinothricin-resistance gene, and its use |
| US5605011A (en) | 1986-08-26 | 1997-02-25 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| US5378824A (en) | 1986-08-26 | 1995-01-03 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| EP0262393A1 (de) | 1986-08-29 | 1988-04-06 | Shell Internationale Researchmaatschappij B.V. | Aryloxycarbonsäurederivate, ihre Herstellung und Verwendung |
| EP0270111A1 (de) | 1986-12-03 | 1988-06-08 | Kumiai Chemical Industry Co., Ltd. | Pyrimidinderivate und diese enthaltende fungizide Mittel für Ackerbau und Gartenbau |
| EP0278595A2 (de) | 1987-02-09 | 1988-08-17 | Zeneca Limited | Schimmelbekämpfungsmittel |
| US4808430A (en) | 1987-02-27 | 1989-02-28 | Yazaki Corporation | Method of applying gel coating to plant seeds |
| DE3735555A1 (de) | 1987-03-07 | 1988-09-15 | Bayer Ag | Aminomethylheterocyclen |
| EP0298196A1 (de) | 1987-03-13 | 1989-01-11 | Ishihara Sangyo Kaisha, Ltd. | Imidazol-Verbindung und diese enthaltende biozide Zusammensetzungen |
| US5013659A (en) | 1987-07-27 | 1991-05-07 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| US5141870A (en) | 1987-07-27 | 1992-08-25 | E. I. Du Pont De Nemours And Company | Nucleic acid fragment encoding herbicide resistant plant acetolactate synthase |
| EP0313512A2 (de) | 1987-08-21 | 1989-04-26 | Ciba-Geigy Ag | Benzothiadiazole und ihre Verwendung in Verfahren und Mitteln gegen Pflanzenkrankheiten |
| EP0310550A1 (de) | 1987-09-28 | 1989-04-05 | Ciba-Geigy Ag | Schädlingsbekämpfungsmittel |
| EP0315502A1 (de) | 1987-11-06 | 1989-05-10 | Sumitomo Chemical Company, Limited | Substituierte Carbonsäure-Derivate, Verfahren zu ihrer Herstellung und diese enthaltende Fungizide für Acker- und Gartenbau |
| US5840946A (en) | 1987-12-31 | 1998-11-24 | Pioneer Hi-Bred International, Inc. | Vegetable oil extracted from rapeseeds having a genetically controlled unusually high oleic acid content |
| EP0326330A2 (de) | 1988-01-29 | 1989-08-02 | DowElanco | Fungizide Chinnoline, Chinalozine und Cinnoline |
| EP0329397A1 (de) | 1988-02-16 | 1989-08-23 | Kureha Kagaku Kogyo Kabushiki Kaisha | Verfahren zur Herstellung von Azolylmethyl-cyclopentanol-Derivaten |
| WO1989010396A1 (en) | 1988-04-28 | 1989-11-02 | Plant Genetic Systems N.V. | Plants with modified stamen cells |
| EP0339418A2 (de) | 1988-04-29 | 1989-11-02 | Bayer Ag | Substituierte Cycloalkyl- bzw. Heterocyclyl-carbon-säureanilide |
| EP0341475A2 (de) | 1988-05-07 | 1989-11-15 | Bayer Ag | Stereoisomere von N-(R)-1-Aryl-ethyl)-1-alkyl-2,2-dichlo-cyclopropancarbonsäureamiden |
| JPH0225876A (ja) | 1988-07-15 | 1990-01-29 | Canon Inc | 現像装置 |
| US5084082A (en) | 1988-09-22 | 1992-01-28 | E. I. Du Pont De Nemours And Company | Soybean plants with dominant selectable trait for herbicide resistance |
| EP0378953A1 (de) | 1988-12-29 | 1990-07-25 | Rhone-Poulenc Agrochimie | Benzyliden-azolylmethylcycloalkan und Anwendung als Fungizid |
| EP0382375A2 (de) | 1989-02-10 | 1990-08-16 | Zeneca Limited | Fungizides Mittel |
| EP0393911A1 (de) | 1989-04-21 | 1990-10-24 | E.I. Du Pont De Nemours And Company | Fungizide Oxazolidinone |
| EP0398692A2 (de) | 1989-05-17 | 1990-11-22 | SHIONOGI SEIYAKU KABUSHIKI KAISHA trading under the name of SHIONOGI & CO. LTD. | Alkoxyiminoacetamid-Derivate und ihre Verwendung als pilztötendes Mittel |
| US6013861A (en) | 1989-05-26 | 2000-01-11 | Zeneca Limited | Plants and processes for obtaining them |
| WO1991002069A1 (en) | 1989-08-10 | 1991-02-21 | Plant Genetic Systems N.V. | Plants with modified flowers |
| US5739082A (en) | 1990-02-02 | 1998-04-14 | Hoechst Schering Agrevo Gmbh | Method of improving the yield of herbicide-resistant crop plants |
| US5908810A (en) | 1990-02-02 | 1999-06-01 | Hoechst Schering Agrevo Gmbh | Method of improving the growth of crop plants which are resistant to glutamine synthetase inhibitors |
| US5434283A (en) | 1990-04-04 | 1995-07-18 | Pioneer Hi-Bred International, Inc. | Edible endogenous vegetable oil extracted from rapeseeds of reduced stearic and palmitic saturated fatty acid content |
| US5198599A (en) | 1990-06-05 | 1993-03-30 | Idaho Resarch Foundation, Inc. | Sulfonylurea herbicide resistance in plants |
| EP0460575A1 (de) | 1990-06-05 | 1991-12-11 | Ciba-Geigy Ag | Aromatische Verbindungen |
| US5463175A (en) | 1990-06-25 | 1995-10-31 | Monsanto Company | Glyphosate tolerant plants |
| US5776760A (en) | 1990-06-25 | 1998-07-07 | Monsanto Company | Glyphosate tolerant plants |
| EP0539588A1 (de) | 1990-07-05 | 1993-05-05 | Nippon Soda Co., Ltd. | Aminderivat |
| DE4026966A1 (de) | 1990-08-25 | 1992-02-27 | Bayer Ag | Substituierte valinamid-derivate |
| WO1992005251A1 (fr) | 1990-09-21 | 1992-04-02 | Institut National De La Recherche Agronomique | Sequence d'adn conferant une sterilite male cytoplasmique, genome mitochondrial, genome nucleaire, mitochondrie et plante contenant cette sequence, et procede de preparation d'hybrides |
| EP0569384A1 (de) | 1991-01-30 | 1993-11-18 | Zeneca Ltd | Fungizide. |
| EP0571427A1 (de) | 1991-02-13 | 1993-12-01 | Hoechst Schering AgrEvo GmbH | Plasmide, die die DNA-Sequenzen für die Veränderung des Kohlenhijdrats bzw. Komposition in Pflanzen enthalten, sowie eine Pflanze... |
| EP0515901A1 (de) | 1991-05-28 | 1992-12-02 | BASF Aktiengesellschaft | Antimykotische Mittel, die Phenylessigsäurederivate enthalten |
| US5767361A (en) | 1991-07-31 | 1998-06-16 | American Cyanamid Company | Imidazolinone resistant AHAS mutants |
| US5731180A (en) | 1991-07-31 | 1998-03-24 | American Cyanamid Company | Imidazolinone resistant AHAS mutants |
| EP0537957A1 (de) | 1991-10-09 | 1993-04-21 | Sankyo Company Limited | Fungizide Silizium enthaltende Verbindungen, deren Herstellung und agrochemische und medizinische Verwendung |
| US5593996A (en) | 1991-12-30 | 1997-01-14 | American Cyanamid Company | Triazolopyrimidine derivatives |
| EP0663956A1 (de) | 1992-08-12 | 1995-07-26 | Hoechst Schering AgrEvo GmbH | Dna sequenzen, die zur bildung von polyfructanen (levanen) führen, plasmide mit entsprechenden sequenzen, sowie ein verfahren zur herstellung transgener pflanzen |
| WO1994004693A2 (en) | 1992-08-26 | 1994-03-03 | Zeneca Limited | Novel plants and processes for obtaining them |
| EP0596254A1 (de) | 1992-10-02 | 1994-05-11 | Mitsubishi Chemical Corporation | Methoxyiminoessigsäure-Derivate und Fungizide für Landwirtschaft und Gartenbau, die diese als aktive Bestandteile enthalten |
| WO1994009144A1 (en) | 1992-10-14 | 1994-04-28 | Zeneca Limited | Novel plants and processes for obtaining them |
| WO1994011520A2 (en) | 1992-11-09 | 1994-05-26 | Zeneca Limited | Novel plants and processes for obtaining them |
| EP0600629A1 (de) | 1992-12-01 | 1994-06-08 | Rohm And Haas Company | N-Acetonylbenzamide und ihre Verwendung des Fungizide |
| EP0604019A1 (de) | 1992-12-18 | 1994-06-29 | Rohm And Haas Company | N-Acetonylbenzamide und ihre Anwendung als Fungizide |
| WO1994021795A1 (en) | 1993-03-25 | 1994-09-29 | Ciba-Geigy Ag | Novel pesticidal proteins and strains |
| US5969169A (en) | 1993-04-27 | 1999-10-19 | Cargill, Incorporated | Non-hydrogenated canola oil for food applications |
| WO1994026722A1 (en) | 1993-05-12 | 1994-11-24 | E.I. Du Pont De Nemours And Company | Fungicidal fused bicyclic pyrimidinones |
| EP0629616A2 (de) | 1993-06-18 | 1994-12-21 | Rhone-Poulenc Agrochimie | Optisch aktive 2-Imidazoline-5-one- und 2-Imidazoline-5-thione-Derivate als Fungizide |
| WO1995004826A1 (en) | 1993-08-09 | 1995-02-16 | Institut Für Genbiologische Forschung Berlin Gmbh | Debranching enzymes and dna sequences coding them, suitable for changing the degree of branching of amylopectin starch in plants |
| EP0712396B1 (de) | 1993-08-11 | 1998-11-04 | Bayer Ag | Substituierte azadioxacycloalkene und ihre verwendung als fungizide |
| EP0639574A1 (de) | 1993-08-16 | 1995-02-22 | Lucky Ltd. | 2-Aminothiazolcarboxamid Derivate, Verfahren zu deren Herstellung und deren Verwendung zur Bekämpfung von phytopathogenen Organismen |
| EP0719338A1 (de) | 1993-09-09 | 1996-07-03 | Hoechst Schering AgrEvo GmbH | Dna-sequenzen kombination, die die bildung von modifizierter stärke in pflanzenzellen und pflanzen ermögliht |
| WO1995009910A1 (fr) | 1993-10-01 | 1995-04-13 | Mitsubishi Corporation | Gene identifiant un cytoplasme vegetal sterile et procede pour preparer un vegetal hybride a l'aide de celui-ci |
| US6169190B1 (en) | 1993-10-12 | 2001-01-02 | Agrigenetics Inc | Oil of Brassica napus |
| US5965755A (en) | 1993-10-12 | 1999-10-12 | Agrigenetics, Inc. | Oil produced from the Brassica napus |
| EP0728213A1 (de) | 1993-11-09 | 1996-08-28 | E.I. Du Pont De Nemours And Company | Transgene fruktan - anreichernde nutzpflanzen und verfahren zu ihrer herstellung |
| US5908975A (en) | 1993-11-09 | 1999-06-01 | E. I. Du Pont De Nemours And Company | Accumulation of fructans in plants by targeted expression of bacterial levansucrase |
| US6270828B1 (en) | 1993-11-12 | 2001-08-07 | Cargrill Incorporated | Canola variety producing a seed with reduced glucosinolates and linolenic acid yielding an oil with low sulfur, improved sensory characteristics and increased oxidative stability |
| WO1995026407A1 (en) | 1994-03-25 | 1995-10-05 | National Starch And Chemical Investment Holding Corporation | Method for producing altered starch from potato plants |
| WO1995031553A1 (en) | 1994-05-18 | 1995-11-23 | Institut Für Genbiologische Forschung Berlin Gmbh | DNA SEQUENCES CODING FOR ENZYMES CAPABLE OF FACILITATING THE SYNTHESIS OF LINEAR α-1,4 GLUCANS IN PLANTS, FUNGI AND MICROORGANISMS |
| WO1995035026A1 (en) | 1994-06-21 | 1995-12-28 | Zeneca Limited | Novel plants and processes for obtaining them |
| US5824790A (en) | 1994-06-21 | 1998-10-20 | Zeneca Limited | Modification of starch synthesis in plants |
| DE4423612A1 (de) | 1994-07-06 | 1996-01-11 | Basf Ag | 2-[(Dihydro)pyrazolyl-3'-oxymethylen]-anilide, Verfahren zu ihrer Herstelung und ihre Verwendung |
| WO1996001904A1 (en) | 1994-07-08 | 1996-01-25 | Stichting Scheikundig Onderzoek In Nederland | Production of oligosaccharides in transgenic plants |
| WO1996001559A1 (en) | 1994-07-11 | 1996-01-25 | Ciba-Geigy Ag | Fungicidal composition and method of controlling fungus infestation |
| WO1996004252A1 (fr) | 1994-08-03 | 1996-02-15 | Kumiai Chemical Industry Co., Ltd. | Derives amides aminoacides, procede d'obtention de ce derive, fongicide a usage agricole et horticole et procede de traitement fongicide |
| WO1996015248A1 (de) | 1994-11-10 | 1996-05-23 | Hoechst Schering Agrevo Gmbh | Dna-moleküle codierend enzyme, die an der stärkesynthese beteiligt sind, vektoren, bakterien, transgene pflanzenzellen und pflanzen enthaltend diese moleküle |
| WO1996016048A1 (de) | 1994-11-21 | 1996-05-30 | Bayer Aktiengesellschaft | Mikrobizide triazolyl-derivate |
| WO1996018631A1 (en) | 1994-12-15 | 1996-06-20 | Monsanto Company | Fungicides for the control of take-all disease of plants |
| WO1996019581A1 (en) | 1994-12-22 | 1996-06-27 | Hoechst Schering Agrevo Gmbh | Dna molecules coding for debranching enzymes derived from plants |
| WO1996023793A1 (en) | 1995-01-30 | 1996-08-08 | Regents Of The University Of Minnesota | Delta opioid receptor antagonists |
| WO1996027674A1 (de) | 1995-03-08 | 1996-09-12 | Hoechst Schering Agrevo Gmbh | Modifizierte stärke aus pflanzen, pflanzen, die diese synthetisieren, sowie verfahren zu ihrer herstellung |
| EP0737682A1 (de) | 1995-04-11 | 1996-10-16 | Mitsui Toatsu Chemicals, Incorporated | Substituierte Thiophenderivate und diese als aktiver Bestandteil enthaltenden Fungizide für Land- und Gartenbauwirtschaft |
| US5928937A (en) | 1995-04-20 | 1999-07-27 | American Cyanamid Company | Structure-based designed herbicide resistant products |
| WO1996033270A1 (en) | 1995-04-20 | 1996-10-24 | American Cyanamid Company | Structure-based designed herbicide resistant products |
| WO1996034968A2 (en) | 1995-05-05 | 1996-11-07 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to plant starch composition |
| WO1996038567A2 (fr) | 1995-06-02 | 1996-12-05 | Rhone-Poulenc Agrochimie | Sequence adn d'un gene de l'hydroxy-phenyl pyruvate dioxygenase et obtention de plantes contenant un gene de l'hydroxy-phenyl pyruvate dioxygenase, tolerantes a certains herbicides |
| US5712107A (en) | 1995-06-07 | 1998-01-27 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch and latexes in paper manufacture |
| US20020031826A1 (en) | 1995-06-07 | 2002-03-14 | Nichols Scott E. | Glucan-containing compositions and paper |
| US6284479B1 (en) | 1995-06-07 | 2001-09-04 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch and latexes in paper manufacture |
| JPH096608A (ja) | 1995-06-22 | 1997-01-10 | Matsushita Electric Ind Co Ltd | ソフトウェア保護システム |
| US6229072B1 (en) | 1995-07-07 | 2001-05-08 | Adventa Technology Ltd | Cytoplasmic male sterility system production canola hybrids |
| EP0837944A2 (de) | 1995-07-19 | 1998-04-29 | Rhone-Poulenc Agrochimie | Mutierte 5-enolpyruvylshikimat-3-phosphat synthase, für dieses protein kodierendes gen und dieses gen enthaltende transformierte pflanzen |
| WO1997006171A1 (de) | 1995-08-10 | 1997-02-20 | Bayer Aktiengesellschaft | Halogenbenzimidazole und ihre verwendung als mikrobizide |
| DE19531813A1 (de) | 1995-08-30 | 1997-03-06 | Basf Ag | Bisphenylamide |
| WO1997011188A1 (de) | 1995-09-19 | 1997-03-27 | Planttec Biotechnologie Gmbh | Pflanzen, die eine modifizierte stärke synthetisieren, verfahren zu ihrer herstellung sowie modifizierte stärke |
| DE19539324A1 (de) | 1995-10-23 | 1997-04-24 | Basf Ag | Phenylessigsäurederivate, Verfahren und Zwischenprodukte zu ihrer Herstellung und sie enthaltende Mittel |
| WO1997020936A1 (en) | 1995-12-06 | 1997-06-12 | Zeneca Limited | Modification of starch synthesis in plants |
| WO1997026362A1 (de) | 1996-01-16 | 1997-07-24 | Planttec Biotechnologie Gmbh | Nucleinsäuremoleküle aus pflanzen codierend enzyme, die an der stärkesynthese beteiligt sind |
| DE19602095A1 (de) | 1996-01-22 | 1997-07-24 | Bayer Ag | Halogenpyrimidine |
| WO1997032985A1 (de) | 1996-03-07 | 1997-09-12 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | Nucleinsäuremoleküle, codierend debranching-enzyme aus mais |
| WO1997041218A1 (en) | 1996-04-29 | 1997-11-06 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Herbicide resistant rice |
| WO1997042328A1 (de) | 1996-05-06 | 1997-11-13 | Planttec Biotechnologie Gmbh | Nucleinsäuremoleküle, die debranching-enzyme aus kartoffel codieren |
| WO1997044472A1 (de) | 1996-05-17 | 1997-11-27 | Planttec Biotechnologie Gmbh | Nucleinsäuremoleküle codierend lösliche stärkesynthasen aus mais |
| WO1997045545A1 (en) | 1996-05-29 | 1997-12-04 | Hoechst Schering Agrevo Gmbh | Nucleic acid molecules encoding enzymes from wheat which are involved in starch synthesis |
| WO1997047808A1 (en) | 1996-06-12 | 1997-12-18 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch in paper manufacture |
| WO1997047806A1 (en) | 1996-06-12 | 1997-12-18 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch in paper manufacture |
| WO1997047807A1 (en) | 1996-06-12 | 1997-12-18 | Pioneer Hi-Bred International, Inc. | Substitutes for modified starch in paper manufacture |
| US5876739A (en) | 1996-06-13 | 1999-03-02 | Novartis Ag | Insecticidal seed coating |
| WO1998000549A1 (en) | 1996-06-27 | 1998-01-08 | The Australian National University | MANIPULATION OF CELLULOSE AND/OR β-1,4-GLUCAN |
| US5773702A (en) | 1996-07-17 | 1998-06-30 | Board Of Trustees Operating Michigan State University | Imidazolinone herbicide resistant sugar beet plants |
| WO1998020145A2 (en) | 1996-11-05 | 1998-05-14 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to starch content of plants |
| DE19646407A1 (de) | 1996-11-11 | 1998-05-14 | Bayer Ag | Halogenpyrimidine |
| WO1998022604A1 (en) | 1996-11-20 | 1998-05-28 | Pioneer Hi-Bred International, Inc. | Methods of producing high-oil seed by modification of starch levels |
| WO1998023155A1 (en) | 1996-11-26 | 1998-06-04 | E.I. Du Pont De Nemours And Company | Arthropodicidal and fungicidal cyclic amides |
| WO1998027212A1 (en) | 1996-12-19 | 1998-06-25 | Planttec Biotechnologie Gmbh | Novel nucleic acid molecules from maize and their use for the production of modified starch |
| WO1998027806A1 (en) | 1996-12-24 | 1998-07-02 | Pioneer Hi-Bred International, Inc. | Oilseed brassica containing an improved fertility restorer gene for ogura cytoplasmic male sterility |
| WO1998032326A2 (en) | 1997-01-24 | 1998-07-30 | Pioneer Hi-Bred International, Inc. | Methods for $i(agrobacterium)-mediated transformation |
| EP0860438A1 (de) | 1997-02-21 | 1998-08-26 | Shenyang Research Institute of Chemical Industry | Fluorine enthaltende Diphenylacrylamid Microbizide |
| WO1998039460A1 (en) | 1997-03-04 | 1998-09-11 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Nucleic acid molecules from artichoke ($i(cynara scolymus)) encoding enzymes having fructosyl polymerase activity |
| WO1998040503A1 (en) | 1997-03-10 | 1998-09-17 | Planttec Biotechnologie Gmbh | Nucleic acid molecules encoding starch phosphorylase from maize |
| EP0897904A1 (de) | 1997-08-20 | 1999-02-24 | American Cyanamid Company | Fungizide 2-Methoxybenzophenone |
| WO1999012950A2 (en) | 1997-09-06 | 1999-03-18 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to stability of plant starches |
| WO1999014202A2 (en) | 1997-09-12 | 1999-03-25 | Novartis Ag | Novel pyrimidin-4-one and pyrimidin-4-thione as fungicide |
| WO1999024593A1 (en) | 1997-11-06 | 1999-05-20 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Nucleic acid molecules which encode proteins having fructosyl transferase activity and methods for producing long-chain inulin |
| WO1999024585A1 (fr) | 1997-11-07 | 1999-05-20 | Aventis Cropscience S.A. | Hydroxy-phenyl pyruvate dioxygenase mutee, sequence d'adn et obtention de plantes contenant un tel gene, tolerantes aux herbicides |
| WO1999024586A1 (fr) | 1997-11-07 | 1999-05-20 | Aventis Cropscience S.A. | Hydroxy-phenyl pyruvate dioxygenase chimere, sequence d'adn et obtention de plantes contenant un tel gene, tolerantes aux herbicides |
| DE19750012A1 (de) | 1997-11-12 | 1999-05-20 | Bayer Ag | Isothiazolcarbonsäureamide |
| WO1999034008A1 (fr) | 1997-12-24 | 1999-07-08 | Aventis Cropscience S.A. | Procede de preparation enzymatique d'homogentisate |
| WO1999042447A1 (en) | 1998-02-19 | 1999-08-26 | Aventis Cropscience Uk Limited | 2-pyridylmethylamine derivatives useful as fungicides |
| WO1999053072A1 (en) | 1998-04-09 | 1999-10-21 | E.I. Du Pont De Nemours And Company | Starch r1 phosphorylation protein homologs |
| WO1999058690A2 (de) | 1998-05-08 | 1999-11-18 | Aventis Cropscience Gmbh | Nucleinsäuremoleküle codierend enzyme aus weizen, die an der stärkesynthese beteiligt sind |
| WO1999058688A2 (de) | 1998-05-08 | 1999-11-18 | Aventis Cropscience Gmbh | Nucleinsäuremoleküle codierend enzyme aus weizen, die an der stärkesynthese beteiligt sind |
| WO1999058654A2 (de) | 1998-05-13 | 1999-11-18 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | Transgene pflanzen mit veränderter aktivität eines plastidären adp/atp - translokators |
| WO1999057965A1 (de) | 1998-05-14 | 1999-11-18 | Aventis Cropscience Gmbh | Sulfonylharnstoff-tolerante zuckerrübenmutanten |
| WO1999066050A1 (en) | 1998-06-15 | 1999-12-23 | National Starch And Chemical Investment Holding Corporation | Improvements in or relating to plants and plant products |
| WO2000004173A1 (en) | 1998-07-17 | 2000-01-27 | Aventis Cropscience N.V. | Methods and means to modulate programmed cell death in eukaryotic cells |
| WO2000008184A1 (de) | 1998-07-31 | 2000-02-17 | Aventis Cropscience Gmbh | Pflanzen, die eine modifizierte stärke synthetisieren, verfahren zur herstellung der pflanzen, ihre verwendung sowie die modifizierte stärke |
| WO2000008185A1 (de) | 1998-07-31 | 2000-02-17 | Aventis Cropscience Gmbh | Nukleinsäuremoleküle kodierend für beta-amylase, pflanzen, die eine modifizierte stärke synthetisieren, herstellungsverfahren und verwendungen |
| WO2000011192A2 (en) | 1998-08-25 | 2000-03-02 | Pioneer Hi-Bred International, Inc. | Plant glutamine: fructose-6-phosphate amidotransferase nucleic acids |
| WO2000014249A1 (en) | 1998-09-02 | 2000-03-16 | Planttec Biotechnologie Gmbh | Nucleic acid molecules encoding an amylosucrase |
| WO2000014701A1 (en) | 1998-09-09 | 2000-03-16 | Sidney Samole | Apparatus and method for finding and identifying nighttime sky objects |
| US5986135A (en) | 1998-09-25 | 1999-11-16 | American Cyanamid Company | Fungicidal trifluoromethylalkylamino-triazolopyrimidines |
| WO2000022140A1 (de) | 1998-10-09 | 2000-04-20 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | NUCLEINSÄUREMOLEKÜLE CODIEREND EIN VERZWEIGUNGSENZYM AUS BAKTERIEN DER GATTUNG NEISSERIA SOWIE VERFAHREN ZUR HERSTELLUNG VON α-1,6-VERZWEIGTEN α-1,4-GLUCANEN |
| WO2000028052A2 (en) | 1998-11-09 | 2000-05-18 | Planttec Biotechnologie Gmbh | Nucleic acid molecules from rice encoding an r1 protein and their use for the production of modified starch |
| US20030176428A1 (en) | 1998-11-16 | 2003-09-18 | Schneidersmann Ferdinand Martin | Pesticidal composition for seed treatment |
| WO2000047727A2 (en) | 1999-02-08 | 2000-08-17 | Planttec Biotechnologie Gmbh Forschung & Entwicklung | Nucleic acid molecules encoding alternansucrase |
| US6323392B1 (en) | 1999-03-01 | 2001-11-27 | Pioneer Hi-Bred International, Inc. | Formation of brassica napus F1 hybrid seeds which exhibit a highly elevated oleic acid content and a reduced linolenic acid content in the endogenously formed oil of the seeds |
| WO2000066747A1 (en) | 1999-04-29 | 2000-11-09 | Syngenta Limited | Herbicide resistant plants |
| WO2000066746A1 (en) | 1999-04-29 | 2000-11-09 | Syngenta Limited | Herbicide resistant plants |
| WO2000073422A1 (en) | 1999-05-27 | 2000-12-07 | Planttec Biotechnologie Gmbh | Genetically modified plant cells and plants with an increased activity of an amylosucrase protein and a branching enzyme |
| WO2000077229A2 (en) | 1999-06-11 | 2000-12-21 | Aventis Cropscience Gmbh | R1 protein from wheat and the use thereof for the production of modified strach |
| WO2001010825A1 (fr) | 1999-08-05 | 2001-02-15 | Kumiai Chemical Industry Co., Ltd. | Derives de carbamate et bactericides destines a l'agriculture et a l'horticulture |
| WO2001012826A2 (de) | 1999-08-11 | 2001-02-22 | Aventis Cropscience Gmbh | Nukleinsäuremoleküle aus pflanzen codierend enzyme, die an der stärkesynthese beteiligt sind |
| WO2001012782A2 (de) | 1999-08-12 | 2001-02-22 | Aventis Cropscience Gmbh | Transgene pflanzenzellen und pflanzen mit veränderter aktivität des gbssi- und des be-proteins |
| WO2001014569A2 (de) | 1999-08-20 | 2001-03-01 | Basf Plant Science Gmbh | Erhöhung des polysaccharidgehaltes in pflanzen |
| US6734341B2 (en) | 1999-09-02 | 2004-05-11 | Pioneer Hi-Bred International, Inc. | Starch synthase polynucleotides and their use in the production of new starches |
| WO2001017333A1 (en) | 1999-09-10 | 2001-03-15 | Texas Tech University | Transgenic fiber producing plants with increased expression of sucrose phosphate synthase |
| WO2001019975A2 (en) | 1999-09-15 | 2001-03-22 | National Starch And Chemical Investment Holding Corporation | Plants having reduced activity in two or more starch-modifying enzymes |
| WO2001024615A1 (en) | 1999-10-07 | 2001-04-12 | Valigen (Us), Inc. | Non-transgenic herbicide resistant plants |
| JP2001187786A (ja) | 1999-10-19 | 2001-07-10 | Nissan Chem Ind Ltd | トリアゾール化合物およびその製造法 |
| WO2001065922A2 (en) | 2000-03-09 | 2001-09-13 | E. I. Du Pont De Nemours And Company | Sulfonylurea-tolerant sunflower plants |
| WO2001066704A2 (en) | 2000-03-09 | 2001-09-13 | Monsanto Technology Llc | Methods for making plants tolerant to glyphosate and compositions thereof |
| JP4429464B2 (ja) | 2000-03-27 | 2010-03-10 | 株式会社小松製作所 | 流体−機械動力変換機器の内圧検出装置及びそれを具えたトルクコンバータ |
| WO2001087822A1 (en) | 2000-05-17 | 2001-11-22 | Syngenta Participations Ag | Novel phenyl-propargylether derivatives |
| WO2001098509A2 (en) | 2000-06-21 | 2001-12-27 | Syngenta Participations Ag | Grain processing method and transgenic plants useful therein |
| WO2002008197A1 (de) | 2000-07-24 | 2002-01-31 | Bayer Cropscience Ag | Biphenylcarboxamide |
| WO2002026995A1 (en) | 2000-09-29 | 2002-04-04 | Syngenta Limited | Herbicide resistant plants |
| WO2002028186A2 (en) | 2000-10-06 | 2002-04-11 | Monsanto Technology, Llc | Seed treatment with combinations of insecticides |
| WO2002034923A2 (en) | 2000-10-23 | 2002-05-02 | Bayer Cropscience Gmbh | Monocotyledon plant cells and plants which synthesise modified starch |
| WO2002036787A2 (fr) | 2000-10-30 | 2002-05-10 | Bayer Cropscience S.A. | Plantes tolerantes aux herbicides par contournement de voie metabolique |
| WO2002036782A2 (en) | 2000-10-30 | 2002-05-10 | Maxygen, Inc. | Novel glyphosate n-acetyltransferase (gat) genes |
| WO2002038542A1 (en) | 2000-11-08 | 2002-05-16 | Syngenta Participations Ag | Pyrrolcarboxamides and pyrrolcarbothioamides and their agrochemical uses |
| WO2002038565A2 (de) | 2000-11-13 | 2002-05-16 | Basf Aktiengesellschaft | 7-(r)-amino-triazolopyrimidine, deren herstellung und verwendung zur bekämpfung von pflanzenpathogenen pilzen |
| WO2002045485A1 (en) | 2000-12-08 | 2002-06-13 | Commonwealth Scienctific And Industrial Research Organisation | Modification of sucrose synthase gene expression in plant tissue and uses therefor |
| WO2002080675A1 (en) | 2001-03-21 | 2002-10-17 | Monsanto Technology, Llc | Treated plant seeds with controlled release of active agents |
| WO2002079410A2 (en) | 2001-03-30 | 2002-10-10 | Basf Plant Science Gmbh | Glucan chain length domains |
| DE10124208A1 (de) | 2001-05-18 | 2002-11-21 | Bayer Ag | Verwendung von Triazolopyrimidin-Derivaten als Mikrobizide |
| WO2002101059A2 (en) | 2001-06-12 | 2002-12-19 | Bayer Cropscience Gmbh | Transgenic plants synthesising high amylose starch |
| US6616054B1 (en) | 2001-07-02 | 2003-09-09 | Bellsouth Intellectual Property Corporation | External power supply system, apparatus and method for smart card |
| EP1404407A2 (de) | 2001-07-12 | 2004-04-07 | BMR Research & Development Limited | Vorrichtung zur elektrischen stimulation |
| EP1414803A1 (de) | 2001-07-25 | 2004-05-06 | Bayer CropScience AG | Pyrazolylkarboxanilide als fungizide |
| WO2003014103A1 (en) | 2001-08-03 | 2003-02-20 | Bayer Cropscience S.A. | Iodobenzopyran-4-one derivatives having fungicidal activity |
| WO2003013226A2 (en) | 2001-08-09 | 2003-02-20 | Cibus Genetics | Non-transgenic herbicide resistant plants |
| WO2003033540A2 (en) | 2001-10-17 | 2003-04-24 | Basf Plant Science Gmbh | Starch |
| WO2003066609A1 (de) | 2002-02-04 | 2003-08-14 | Bayer Cropscience Aktiengesellschaft | Disubstituierte thiazolylcarboxanilide und ihre verwendung als mikrobizide |
| WO2003066610A1 (de) | 2002-02-04 | 2003-08-14 | Bayer Cropscience Aktiengesellschaft | Difluormethyl thiazolyl carboxanilide |
| EP1474406A1 (de) | 2002-02-04 | 2004-11-10 | Bayer CropScience Aktiengesellschaft | Disubstituierte thiazolylcarboxanilide und ihre verwendung als mikrobizide |
| WO2003070705A1 (de) | 2002-02-19 | 2003-08-28 | Bayer Cropscience Aktiengesellschaft | Disubstituierte pyrazolylcarboxanilide |
| WO2003071860A2 (en) | 2002-02-26 | 2003-09-04 | Bayer Cropscience Gmbh | Method for generating maize plants with an increased leaf starch content, and their use for making maize silage |
| WO2003092360A2 (en) | 2002-04-30 | 2003-11-13 | Verdia, Inc. | Novel glyphosate-n-acetyltransferase (gat) genes |
| EP1519913A1 (de) | 2002-07-02 | 2005-04-06 | Bayer CropScience AG | Phenylbenzamide |
| WO2004016088A2 (en) | 2002-08-12 | 2004-02-26 | Bayer Cropscience S.A. | Novel 2-pyridylethylbenzamide derivative |
| WO2004024928A2 (fr) | 2002-09-11 | 2004-03-25 | Bayer Cropscience S.A. | Plantes transformees a biosynthese de prenylquinones amelioree |
| WO2004040012A2 (en) | 2002-10-29 | 2004-05-13 | Basf Plant Science Gmbh | Compositions and methods for identifying plants having increased tolerance to imidazolinone herbicides |
| WO2004053219A2 (en) | 2002-12-05 | 2004-06-24 | Jentex Corporation | Abrasive webs and methods of making the same |
| WO2004056999A1 (en) | 2002-12-19 | 2004-07-08 | Bayer Cropscience Gmbh | Plant cells and plants which synthesize a starch with an increased final viscosity |
| WO2004078983A2 (en) | 2003-03-07 | 2004-09-16 | Basf Plant Science Gmbh | Enhanced amylose production in plants |
| WO2004090140A2 (en) | 2003-04-09 | 2004-10-21 | Bayer Bioscience N.V. | Methods and means for increasing the tolerance of plants to stress conditions |
| WO2005012515A2 (en) | 2003-04-29 | 2005-02-10 | Pioneer Hi-Bred International, Inc. | Novel glyphosate-n-acetyltransferase (gat) genes |
| WO2005002359A2 (en) | 2003-05-22 | 2005-01-13 | Syngenta Participations Ag | Modified starch, uses, methods for production thereof |
| WO2004106529A2 (en) | 2003-05-28 | 2004-12-09 | Basf Aktiengesellschaft | Wheat plants having increased tolerance to imidazolinone herbicides |
| WO2005002324A2 (en) | 2003-07-04 | 2005-01-13 | Institut National De La Recherche Agronomique | Method of producing double low restorer lines of brassica napus having a good agronomic value |
| WO2005012529A1 (ja) | 2003-07-31 | 2005-02-10 | Toyo Boseki Kabushiki Kaisha | ヒアルロン酸生産植物 |
| WO2005017157A1 (en) | 2003-08-15 | 2005-02-24 | Commonwealth Scientific And Industrial Research Organisation (Csiro) | Methods and means for altering fiber characteristics in fiber-producing plants |
| WO2005020673A1 (en) | 2003-08-29 | 2005-03-10 | Instituto Nacional De Technologia Agropecuaria | Rice plants having increased tolerance to imidazolinone herbicides |
| WO2005030942A1 (en) | 2003-09-30 | 2005-04-07 | Bayer Cropscience Gmbh | Plants with reduced activity of a class 3 branching enzyme |
| WO2005030941A1 (en) | 2003-09-30 | 2005-04-07 | Bayer Cropscience Gmbh | Plants with increased activity of a class 3 branching enzyme |
| WO2005095619A1 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Plants with increased activity of multiple starch phosphorylating enzymes |
| WO2005095617A2 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Plants with increased activity of a starch phosphorylating enzyme |
| WO2005095618A2 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Plants with reduced activity of the starch phosphorylating enzyme phosphoglucan, water dikinase |
| WO2005095632A2 (en) | 2004-03-05 | 2005-10-13 | Bayer Cropscience Gmbh | Methods for identifying proteins with starch phosphorylating enzymatic activity |
| WO2005093093A2 (en) | 2004-03-22 | 2005-10-06 | Basf Aktiengesellschaft | Methods and compositions for analyzing ahasl genes |
| WO2006007373A2 (en) | 2004-06-16 | 2006-01-19 | Basf Plant Science Gmbh | Polynucleotides encoding mature ahasl proteins for creating imidazolinone-tolerant plants |
| WO2005123927A1 (en) | 2004-06-21 | 2005-12-29 | Bayer Cropscience Gmbh | Plants that produce amylopectin starch with novel properties |
| WO2006024351A1 (en) | 2004-07-30 | 2006-03-09 | Basf Agrochemical Products B.V. | Herbicide-resistant sunflower plants, plynucleotides encoding herbicide-resistant acetohydroxy acid synthase large subunit proteins, and methods of use |
| WO2006015376A2 (en) | 2004-08-04 | 2006-02-09 | Basf Plant Science Gmbh | Monocot ahass sequences and methods of use |
| WO2006018319A1 (en) | 2004-08-18 | 2006-02-23 | Bayer Cropscience Gmbh | Plants with increased plastidic activity of r3 starch-phosphorylating enzyme |
| WO2006021972A1 (en) | 2004-08-26 | 2006-03-02 | Dhara Vegetable Oil And Foods Company Limited | A novel cytoplasmic male sterility system for brassica species and its use for hybrid seed production in indian oilseed mustard brassica juncea |
| WO2006032538A1 (en) | 2004-09-23 | 2006-03-30 | Bayer Cropscience Gmbh | Methods and means for producing hyaluronan |
| DE102004047922A1 (de) * | 2004-10-01 | 2006-04-06 | Bayer Cropscience Ag | Wirkstoffe für die Saatgutbehandlung |
| WO2006060634A2 (en) | 2004-12-01 | 2006-06-08 | Basf Agrochemical Products, B.V. | Novel mutation involved in increased tolerance to imidazolinone herbicides in plants |
| WO2006063862A1 (en) | 2004-12-17 | 2006-06-22 | Bayer Cropscience Ag | Transformed plant expressing a dextransucrase and synthesizing a modified starch |
| WO2006072603A2 (en) | 2005-01-10 | 2006-07-13 | Bayer Cropscience Ag | Transformed plant expressing a mutansucrase and synthesizing a modified starch |
| JP2006304779A (ja) | 2005-03-30 | 2006-11-09 | Toyobo Co Ltd | ヘキソサミン高生産植物 |
| WO2006103107A1 (en) | 2005-04-01 | 2006-10-05 | Bayer Cropscience Ag | Phosphorylated waxy potato starch |
| WO2006108702A1 (en) | 2005-04-08 | 2006-10-19 | Bayer Cropscience Ag | High-phosphate starch |
| WO2006133827A2 (en) | 2005-06-15 | 2006-12-21 | Bayer Bioscience N.V. | Methods for increasing the resistance of plants to hypoxic conditions |
| WO2006136351A2 (en) | 2005-06-24 | 2006-12-28 | Bayer Bioscience N.V. | Methods for altering the reactivity of plant cell walls |
| WO2007009823A1 (en) | 2005-07-22 | 2007-01-25 | Bayer Cropscience Ag | Overexpression of starch synthase in plants |
| WO2007024782A2 (en) | 2005-08-24 | 2007-03-01 | Pioneer Hi-Bred International, Inc. | Compositions providing tolerance to multiple herbicides and methods of use thereof |
| WO2007027777A2 (en) | 2005-08-31 | 2007-03-08 | Monsanto Technology Llc | Nucleotide sequences encoding insecticidal proteins |
| WO2007039316A1 (en) | 2005-10-05 | 2007-04-12 | Bayer Cropscience Ag | Improved methods and means for producings hyaluronan |
| WO2007039314A2 (en) | 2005-10-05 | 2007-04-12 | Bayer Cropscience Ag | Plants with increased hyaluronan production |
| WO2007039315A1 (de) | 2005-10-05 | 2007-04-12 | Bayer Cropscience Ag | Pflanzen mit gesteigerter produktion von hyaluronan ii |
Non-Patent Citations (10)
| Title |
|---|
| Barry et al., Curr. Topics Plant Physiol. (1992), 7, 139-145 |
| Comai et al., Science (1983), 221, 370-371 |
| Crickmore et al. (2005) in der Bacillus thuringiensis -Toxinnomenklatur aktualisiert, online bei: https://www.lifesci.sussex.ac.uk/Home/Neil_Crickmore/Bt/), zusammengestellt wurden, oder insektizide Teile davon, z.B. Proteine der Cry-Proteinklassen Cry1Ab, Cry1Ac, Cry1F, Cry2Ab, Cry3Ae oder Cry3Bb oder insektizide Teile davon |
| Crickmore et al., Microbiology and Molecular Biology Reviews (1998), 62, 807-813 |
| Gasser et al., J. Biol. Chem. (1988), 263, 4280-4289 |
| Moellenbeck et al., Nat. Biotechnol. (2001), 19, 668-72; Schnepf et al., Applied Environm. Microb. (2006), 71, 1765-1774 |
| R. Wegler „Chemie der Pflanzenschutz- und Schädlingsbekämpfungsmittel", Bd. 2, Springer Verlag, 1970, S. 401-412 |
| S.R. Colby („Calculating Synergistic and Antagonistic Responses of Herbicide Combinations", Weeds 1967, 15, 20-22) |
| Shah et al., Science (1986), 233, 478-481 |
| Tranel und Wright, Weed Science (2002), 50, 700-712 |
Also Published As
| Publication number | Publication date |
|---|---|
| DE102007045920A1 (de) | 2009-04-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2009342807B2 (en) | Synergistic combinations of active ingredients | |
| EP2205081B1 (de) | Wirkstoffkombinationen mit insektiziden und akariziden eigenschaften | |
| AU2010272872B2 (en) | Synergistic active substance combinations containing phenyl triazoles | |
| DE102007045920B4 (de) | Synergistische Wirkstoffkombinationen | |
| KR101361189B1 (ko) | 살충성을 갖는 활성 물질의 배합물 | |
| EP2194784B1 (de) | Wirkstoffkombinationen mit insektiziden und akariziden eigenschaften | |
| WO2009074230A1 (de) | Verwendung von wirkstoffkombinationen zur bekämpfung von tierischen schädlingen | |
| WO2010108504A1 (de) | Wirkstoffkombinationen mit insektiziden und akariziden eigenschaften | |
| WO2010108505A1 (de) | Wirkstoffkombinationen mit insektiziden und akariziden eigenschaften | |
| WO2010108508A2 (de) | Wirkstoffkombinationen mit insektiziden und akariziden eigenschaften | |
| WO2010108506A1 (de) | Wirkstoffkombinationen mit insektiziden und akariziden eigenschaften | |
| DE102007045953B4 (de) | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften | |
| DE102007045919B4 (de) | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften | |
| DE102007045955A1 (de) | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften | |
| DE102007045957A1 (de) | Wirkstoffkombinationen mit insektiziden und akarziden Eigenschaften | |
| CN104255733A (zh) | 具有协同作用的活性成分结合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| R012 | Request for examination validly filed | ||
| R012 | Request for examination validly filed |
Effective date: 20140830 |
|
| R081 | Change of applicant/patentee |
Owner name: BAYER INTELLECTUAL PROPERTY GMBH, DE Free format text: FORMER OWNER: BAYER CROPSCIENCE AG, 40789 MONHEIM, DE Effective date: 20141023 Owner name: BAYER CROPSCIENCE AKTIENGESELLSCHAFT, DE Free format text: FORMER OWNER: BAYER CROPSCIENCE AG, 40789 MONHEIM, DE Effective date: 20141023 |
|
| R016 | Response to examination communication | ||
| R016 | Response to examination communication | ||
| R018 | Grant decision by examination section/examining division | ||
| R081 | Change of applicant/patentee |
Owner name: BAYER CROPSCIENCE AKTIENGESELLSCHAFT, DE Free format text: FORMER OWNER: BAYER INTELLECTUAL PROPERTY GMBH, 40789 MONHEIM, DE |
|
| R020 | Patent grant now final |