CN1701116A - 益生细菌:发酵乳杆菌 - Google Patents
益生细菌:发酵乳杆菌 Download PDFInfo
- Publication number
- CN1701116A CN1701116A CNA038238330A CN03823833A CN1701116A CN 1701116 A CN1701116 A CN 1701116A CN A038238330 A CNA038238330 A CN A038238330A CN 03823833 A CN03823833 A CN 03823833A CN 1701116 A CN1701116 A CN 1701116A
- Authority
- CN
- China
- Prior art keywords
- lactobacillus fermentum
- mutation
- experimenter
- composition
- component
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 241000186840 Lactobacillus fermentum Species 0.000 title claims abstract description 123
- 229940012969 lactobacillus fermentum Drugs 0.000 title claims description 121
- 241000894006 Bacteria Species 0.000 title claims description 76
- 239000006041 probiotic Substances 0.000 title claims description 29
- 235000018291 probiotics Nutrition 0.000 title claims description 29
- 230000000529 probiotic effect Effects 0.000 title description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 41
- 208000024891 symptom Diseases 0.000 claims description 109
- 239000000203 mixture Substances 0.000 claims description 77
- 230000035772 mutation Effects 0.000 claims description 72
- 206010016766 flatulence Diseases 0.000 claims description 68
- 238000000034 method Methods 0.000 claims description 52
- 241000193830 Bacillus <bacterium> Species 0.000 claims description 49
- 206010012735 Diarrhoea Diseases 0.000 claims description 48
- 239000002775 capsule Substances 0.000 claims description 39
- 206010010774 Constipation Diseases 0.000 claims description 38
- 208000002551 irritable bowel syndrome Diseases 0.000 claims description 38
- 244000005700 microbiome Species 0.000 claims description 33
- 230000001717 pathogenic effect Effects 0.000 claims description 32
- 201000010099 disease Diseases 0.000 claims description 31
- 239000003795 chemical substances by application Substances 0.000 claims description 30
- 230000012010 growth Effects 0.000 claims description 26
- 230000001926 lymphatic effect Effects 0.000 claims description 22
- 239000000047 product Substances 0.000 claims description 20
- 230000002496 gastric effect Effects 0.000 claims description 18
- 235000013305 food Nutrition 0.000 claims description 16
- 239000002552 dosage form Substances 0.000 claims description 11
- 239000000284 extract Substances 0.000 claims description 11
- 201000004624 Dermatitis Diseases 0.000 claims description 10
- 208000010668 atopic eczema Diseases 0.000 claims description 10
- 239000001828 Gelatine Substances 0.000 claims description 9
- 229920000159 gelatin Polymers 0.000 claims description 9
- 235000019322 gelatine Nutrition 0.000 claims description 9
- SRBFZHDQGSBBOR-SOOFDHNKSA-N D-ribopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@@H]1O SRBFZHDQGSBBOR-SOOFDHNKSA-N 0.000 claims description 8
- 241000607142 Salmonella Species 0.000 claims description 7
- WQZGKKKJIJFFOK-PQMKYFCFSA-N alpha-D-mannose Chemical compound OC[C@H]1O[C@H](O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-PQMKYFCFSA-N 0.000 claims description 7
- 230000003042 antagnostic effect Effects 0.000 claims description 7
- 201000004700 rosacea Diseases 0.000 claims description 7
- FYGDTMLNYKFZSV-URKRLVJHSA-N (2s,3r,4s,5s,6r)-2-[(2r,4r,5r,6s)-4,5-dihydroxy-2-(hydroxymethyl)-6-[(2r,4r,5r,6s)-4,5,6-trihydroxy-2-(hydroxymethyl)oxan-3-yl]oxyoxan-3-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1[C@@H](CO)O[C@@H](OC2[C@H](O[C@H](O)[C@H](O)[C@H]2O)CO)[C@H](O)[C@H]1O FYGDTMLNYKFZSV-URKRLVJHSA-N 0.000 claims description 6
- 229920002498 Beta-glucan Polymers 0.000 claims description 6
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 6
- 229920000294 Resistant starch Polymers 0.000 claims description 6
- 238000000855 fermentation Methods 0.000 claims description 6
- 230000004151 fermentation Effects 0.000 claims description 6
- 239000008103 glucose Substances 0.000 claims description 6
- 235000021254 resistant starch Nutrition 0.000 claims description 6
- 150000003839 salts Chemical class 0.000 claims description 6
- 230000003248 secreting effect Effects 0.000 claims description 6
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 claims description 5
- 229920001685 Amylomaize Polymers 0.000 claims description 5
- 102100037850 Interferon gamma Human genes 0.000 claims description 5
- 108010074328 Interferon-gamma Proteins 0.000 claims description 5
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 claims description 5
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 5
- 229930006000 Sucrose Natural products 0.000 claims description 5
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 claims description 5
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 claims description 5
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 claims description 5
- 238000006243 chemical reaction Methods 0.000 claims description 5
- 235000015872 dietary supplement Nutrition 0.000 claims description 5
- 239000000835 fiber Substances 0.000 claims description 5
- 230000000968 intestinal effect Effects 0.000 claims description 5
- 239000008297 liquid dosage form Substances 0.000 claims description 5
- 235000012054 meals Nutrition 0.000 claims description 5
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 claims description 5
- -1 semi-lactosi Chemical compound 0.000 claims description 5
- 230000000638 stimulation Effects 0.000 claims description 5
- 239000005720 sucrose Substances 0.000 claims description 5
- 230000004083 survival effect Effects 0.000 claims description 5
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 claims description 4
- 206010000087 Abdominal pain upper Diseases 0.000 claims description 4
- 208000011231 Crohn disease Diseases 0.000 claims description 4
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 4
- 229930091371 Fructose Natural products 0.000 claims description 4
- 239000005715 Fructose Substances 0.000 claims description 4
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 claims description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 claims description 4
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 claims description 4
- 229930195725 Mannitol Natural products 0.000 claims description 4
- 241000589516 Pseudomonas Species 0.000 claims description 4
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 claims description 4
- 208000005392 Spasm Diseases 0.000 claims description 4
- 241000607598 Vibrio Species 0.000 claims description 4
- 241000700605 Viruses Species 0.000 claims description 4
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 claims description 4
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 claims description 4
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 claims description 4
- DLRVVLDZNNYCBX-ZZFZYMBESA-N beta-melibiose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@H](O)O1 DLRVVLDZNNYCBX-ZZFZYMBESA-N 0.000 claims description 4
- 210000000481 breast Anatomy 0.000 claims description 4
- 150000001875 compounds Chemical class 0.000 claims description 4
- 239000003814 drug Substances 0.000 claims description 4
- 239000008101 lactose Substances 0.000 claims description 4
- 239000000594 mannitol Substances 0.000 claims description 4
- 235000010355 mannitol Nutrition 0.000 claims description 4
- 230000003287 optical effect Effects 0.000 claims description 4
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 claims description 3
- 241000223935 Cryptosporidium Species 0.000 claims description 3
- 241000224431 Entamoeba Species 0.000 claims description 3
- 241000588724 Escherichia coli Species 0.000 claims description 3
- 229920001202 Inulin Polymers 0.000 claims description 3
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 3
- 230000002519 immonomodulatory effect Effects 0.000 claims description 3
- 230000002757 inflammatory effect Effects 0.000 claims description 3
- JYJIGFIDKWBXDU-MNNPPOADSA-N inulin Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)OC[C@]1(OC[C@]2(OC[C@]3(OC[C@]4(OC[C@]5(OC[C@]6(OC[C@]7(OC[C@]8(OC[C@]9(OC[C@]%10(OC[C@]%11(OC[C@]%12(OC[C@]%13(OC[C@]%14(OC[C@]%15(OC[C@]%16(OC[C@]%17(OC[C@]%18(OC[C@]%19(OC[C@]%20(OC[C@]%21(OC[C@]%22(OC[C@]%23(OC[C@]%24(OC[C@]%25(OC[C@]%26(OC[C@]%27(OC[C@]%28(OC[C@]%29(OC[C@]%30(OC[C@]%31(OC[C@]%32(OC[C@]%33(OC[C@]%34(OC[C@]%35(OC[C@]%36(O[C@@H]%37[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O%37)O)[C@H]([C@H](O)[C@@H](CO)O%36)O)[C@H]([C@H](O)[C@@H](CO)O%35)O)[C@H]([C@H](O)[C@@H](CO)O%34)O)[C@H]([C@H](O)[C@@H](CO)O%33)O)[C@H]([C@H](O)[C@@H](CO)O%32)O)[C@H]([C@H](O)[C@@H](CO)O%31)O)[C@H]([C@H](O)[C@@H](CO)O%30)O)[C@H]([C@H](O)[C@@H](CO)O%29)O)[C@H]([C@H](O)[C@@H](CO)O%28)O)[C@H]([C@H](O)[C@@H](CO)O%27)O)[C@H]([C@H](O)[C@@H](CO)O%26)O)[C@H]([C@H](O)[C@@H](CO)O%25)O)[C@H]([C@H](O)[C@@H](CO)O%24)O)[C@H]([C@H](O)[C@@H](CO)O%23)O)[C@H]([C@H](O)[C@@H](CO)O%22)O)[C@H]([C@H](O)[C@@H](CO)O%21)O)[C@H]([C@H](O)[C@@H](CO)O%20)O)[C@H]([C@H](O)[C@@H](CO)O%19)O)[C@H]([C@H](O)[C@@H](CO)O%18)O)[C@H]([C@H](O)[C@@H](CO)O%17)O)[C@H]([C@H](O)[C@@H](CO)O%16)O)[C@H]([C@H](O)[C@@H](CO)O%15)O)[C@H]([C@H](O)[C@@H](CO)O%14)O)[C@H]([C@H](O)[C@@H](CO)O%13)O)[C@H]([C@H](O)[C@@H](CO)O%12)O)[C@H]([C@H](O)[C@@H](CO)O%11)O)[C@H]([C@H](O)[C@@H](CO)O%10)O)[C@H]([C@H](O)[C@@H](CO)O9)O)[C@H]([C@H](O)[C@@H](CO)O8)O)[C@H]([C@H](O)[C@@H](CO)O7)O)[C@H]([C@H](O)[C@@H](CO)O6)O)[C@H]([C@H](O)[C@@H](CO)O5)O)[C@H]([C@H](O)[C@@H](CO)O4)O)[C@H]([C@H](O)[C@@H](CO)O3)O)[C@H]([C@H](O)[C@@H](CO)O2)O)[C@@H](O)[C@H](O)[C@@H](CO)O1 JYJIGFIDKWBXDU-MNNPPOADSA-N 0.000 claims description 3
- 229940029339 inulin Drugs 0.000 claims description 3
- 241000224489 Amoeba Species 0.000 claims description 2
- 206010012438 Dermatitis atopic Diseases 0.000 claims description 2
- 241000224467 Giardia intestinalis Species 0.000 claims description 2
- 241000589989 Helicobacter Species 0.000 claims description 2
- 241000714209 Norwalk virus Species 0.000 claims description 2
- 241000190932 Rhodopseudomonas Species 0.000 claims description 2
- 241000702670 Rotavirus Species 0.000 claims description 2
- 210000001015 abdomen Anatomy 0.000 claims description 2
- 201000008937 atopic dermatitis Diseases 0.000 claims description 2
- 229940085435 giardia lamblia Drugs 0.000 claims description 2
- 229920001206 natural gum Polymers 0.000 claims description 2
- 229920001542 oligosaccharide Polymers 0.000 claims description 2
- 150000002482 oligosaccharides Chemical class 0.000 claims description 2
- 208000035475 disorder Diseases 0.000 abstract description 10
- 210000000987 immune system Anatomy 0.000 abstract description 4
- 208000018522 Gastrointestinal disease Diseases 0.000 abstract description 3
- 235000019722 synbiotics Nutrition 0.000 description 99
- 229940068196 placebo Drugs 0.000 description 77
- 239000000902 placebo Substances 0.000 description 77
- 238000012360 testing method Methods 0.000 description 66
- 239000000306 component Substances 0.000 description 38
- 230000002829 reductive effect Effects 0.000 description 35
- 210000004027 cell Anatomy 0.000 description 34
- 230000001580 bacterial effect Effects 0.000 description 32
- 208000004998 Abdominal Pain Diseases 0.000 description 29
- 208000002881 Colic Diseases 0.000 description 29
- 241000305071 Enterobacterales Species 0.000 description 23
- 230000009467 reduction Effects 0.000 description 22
- 230000002550 fecal effect Effects 0.000 description 21
- 230000000694 effects Effects 0.000 description 19
- 239000000463 material Substances 0.000 description 19
- 238000001228 spectrum Methods 0.000 description 18
- 239000000243 solution Substances 0.000 description 17
- 235000015097 nutrients Nutrition 0.000 description 16
- 238000009472 formulation Methods 0.000 description 14
- 238000011160 research Methods 0.000 description 14
- 241000193403 Clostridium Species 0.000 description 13
- 238000002360 preparation method Methods 0.000 description 13
- 102000004169 proteins and genes Human genes 0.000 description 12
- 108090000623 proteins and genes Proteins 0.000 description 12
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 11
- 239000008272 agar Substances 0.000 description 11
- 210000002421 cell wall Anatomy 0.000 description 11
- 229920001817 Agar Polymers 0.000 description 10
- 241001148471 unidentified anaerobic bacterium Species 0.000 description 10
- 210000000936 intestine Anatomy 0.000 description 9
- 239000002516 radical scavenger Substances 0.000 description 9
- 241000699666 Mus <mouse, genus> Species 0.000 description 8
- 230000009286 beneficial effect Effects 0.000 description 8
- 150000001720 carbohydrates Chemical class 0.000 description 8
- 235000014633 carbohydrates Nutrition 0.000 description 8
- 230000001332 colony forming effect Effects 0.000 description 8
- 230000003203 everyday effect Effects 0.000 description 8
- 239000002207 metabolite Substances 0.000 description 8
- 238000012544 monitoring process Methods 0.000 description 8
- 241001465754 Metazoa Species 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 6
- 230000036541 health Effects 0.000 description 6
- 230000036039 immunity Effects 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 229940016286 microcrystalline cellulose Drugs 0.000 description 6
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 6
- 239000008108 microcrystalline cellulose Substances 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 5
- 241000186660 Lactobacillus Species 0.000 description 5
- 238000012423 maintenance Methods 0.000 description 5
- 230000035764 nutrition Effects 0.000 description 5
- 235000016709 nutrition Nutrition 0.000 description 5
- 229960001866 silicon dioxide Drugs 0.000 description 5
- 239000002689 soil Substances 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 241000222122 Candida albicans Species 0.000 description 4
- 241000193163 Clostridioides difficile Species 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 229940095731 candida albicans Drugs 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 238000001514 detection method Methods 0.000 description 4
- 235000005911 diet Nutrition 0.000 description 4
- 230000037213 diet Effects 0.000 description 4
- 230000012447 hatching Effects 0.000 description 4
- 230000001976 improved effect Effects 0.000 description 4
- 235000013336 milk Nutrition 0.000 description 4
- 239000008267 milk Substances 0.000 description 4
- 210000004080 milk Anatomy 0.000 description 4
- 244000052769 pathogen Species 0.000 description 4
- 239000002953 phosphate buffered saline Substances 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 230000004044 response Effects 0.000 description 4
- 239000000377 silicon dioxide Substances 0.000 description 4
- 235000012239 silicon dioxide Nutrition 0.000 description 4
- 210000000952 spleen Anatomy 0.000 description 4
- 210000002784 stomach Anatomy 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 235000013343 vitamin Nutrition 0.000 description 4
- 239000011782 vitamin Substances 0.000 description 4
- 229940088594 vitamin Drugs 0.000 description 4
- 229930003231 vitamin Natural products 0.000 description 4
- 150000003722 vitamin derivatives Chemical class 0.000 description 4
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 3
- 241000606125 Bacteroides Species 0.000 description 3
- 239000004380 Cholic acid Substances 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 241000605909 Fusobacterium Species 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 208000003251 Pruritus Diseases 0.000 description 3
- 208000037114 Symptom Flare Up Diseases 0.000 description 3
- 230000001464 adherent effect Effects 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 230000003115 biocidal effect Effects 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 235000019416 cholic acid Nutrition 0.000 description 3
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 3
- 229960002471 cholic acid Drugs 0.000 description 3
- 230000000875 corresponding effect Effects 0.000 description 3
- 235000015140 cultured milk Nutrition 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 3
- 230000002708 enhancing effect Effects 0.000 description 3
- 210000003608 fece Anatomy 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 239000002054 inoculum Substances 0.000 description 3
- 229910052500 inorganic mineral Inorganic materials 0.000 description 3
- 229940039696 lactobacillus Drugs 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 239000011707 mineral Substances 0.000 description 3
- 235000010755 mineral Nutrition 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000004321 preservation Methods 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 238000013207 serial dilution Methods 0.000 description 3
- 230000004936 stimulating effect Effects 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 230000003442 weekly effect Effects 0.000 description 3
- FUFLCEKSBBHCMO-UHFFFAOYSA-N 11-dehydrocorticosterone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 FUFLCEKSBBHCMO-UHFFFAOYSA-N 0.000 description 2
- 238000011725 BALB/c mouse Methods 0.000 description 2
- 241000186000 Bifidobacterium Species 0.000 description 2
- 102000016938 Catalase Human genes 0.000 description 2
- 108010053835 Catalase Proteins 0.000 description 2
- MFYSYFVPBJMHGN-ZPOLXVRWSA-N Cortisone Chemical compound O=C1CC[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 MFYSYFVPBJMHGN-ZPOLXVRWSA-N 0.000 description 2
- MFYSYFVPBJMHGN-UHFFFAOYSA-N Cortisone Natural products O=C1CCC2(C)C3C(=O)CC(C)(C(CC4)(O)C(=O)CO)C4C3CCC2=C1 MFYSYFVPBJMHGN-UHFFFAOYSA-N 0.000 description 2
- 241000194032 Enterococcus faecalis Species 0.000 description 2
- 241000186394 Eubacterium Species 0.000 description 2
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- 235000016383 Zea mays subsp huehuetenangensis Nutrition 0.000 description 2
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 239000008186 active pharmaceutical agent Substances 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 230000008485 antagonism Effects 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 210000003850 cellular structure Anatomy 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 235000013351 cheese Nutrition 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 239000008119 colloidal silica Substances 0.000 description 2
- 210000001072 colon Anatomy 0.000 description 2
- 229960004544 cortisone Drugs 0.000 description 2
- 230000013872 defecation Effects 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 238000000502 dialysis Methods 0.000 description 2
- 208000010643 digestive system disease Diseases 0.000 description 2
- 229940032049 enterococcus faecalis Drugs 0.000 description 2
- 210000000981 epithelium Anatomy 0.000 description 2
- 208000018685 gastrointestinal system disease Diseases 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 238000000265 homogenisation Methods 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 230000007365 immunoregulation Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000000976 ink Substances 0.000 description 2
- 238000011835 investigation Methods 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- 235000015141 kefir Nutrition 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 235000009973 maize Nutrition 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 230000002906 microbiologic effect Effects 0.000 description 2
- 244000005706 microflora Species 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical class OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 2
- 230000008855 peristalsis Effects 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 238000002203 pretreatment Methods 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 230000000630 rising effect Effects 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 238000007789 sealing Methods 0.000 description 2
- 150000004666 short chain fatty acids Chemical class 0.000 description 2
- 230000001148 spastic effect Effects 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000001256 tonic effect Effects 0.000 description 2
- 230000000007 visual effect Effects 0.000 description 2
- 239000000080 wetting agent Substances 0.000 description 2
- WNUUWQUNTSGWGN-UHFFFAOYSA-N 2-(cyclohexylcarbamoyloxy)ethyl 3-acetamido-2,4,6-triiodobenzoate Chemical compound CC(=O)NC1=C(I)C=C(I)C(C(=O)OCCOC(=O)NC2CCCCC2)=C1I WNUUWQUNTSGWGN-UHFFFAOYSA-N 0.000 description 1
- 206010000060 Abdominal distension Diseases 0.000 description 1
- 239000004382 Amylase Substances 0.000 description 1
- 108010065511 Amylases Proteins 0.000 description 1
- 102000013142 Amylases Human genes 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 1
- 241001112695 Clostridiales Species 0.000 description 1
- 241000193468 Clostridium perfringens Species 0.000 description 1
- 108010001682 Dextranase Proteins 0.000 description 1
- 241000157305 Dientamoeba Species 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 239000004278 EU approved seasoning Substances 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010067770 Endopeptidase K Proteins 0.000 description 1
- 241000194031 Enterococcus faecium Species 0.000 description 1
- 208000004262 Food Hypersensitivity Diseases 0.000 description 1
- 206010016946 Food allergy Diseases 0.000 description 1
- 206010017964 Gastrointestinal infection Diseases 0.000 description 1
- 241000224466 Giardia Species 0.000 description 1
- 229920002907 Guar gum Polymers 0.000 description 1
- SQUHHTBVTRBESD-UHFFFAOYSA-N Hexa-Ac-myo-Inositol Natural products CC(=O)OC1C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C(OC(C)=O)C1OC(C)=O SQUHHTBVTRBESD-UHFFFAOYSA-N 0.000 description 1
- 241000167880 Hirundinidae Species 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 108010015268 Integration Host Factors Proteins 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 240000001046 Lactobacillus acidophilus Species 0.000 description 1
- 241001075119 Lactobacillus fermentum Lf1 Species 0.000 description 1
- 240000006024 Lactobacillus plantarum Species 0.000 description 1
- 235000013965 Lactobacillus plantarum Nutrition 0.000 description 1
- 239000006154 MacConkey agar Substances 0.000 description 1
- 208000031888 Mycoses Diseases 0.000 description 1
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical class CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- QBKSWRVVCFFDOT-UHFFFAOYSA-N SJ000286711 Natural products CC(C)C1=C(O)C(O)=C(C=O)C2=C(O)C(C=3C(O)=C4C(C=O)=C(O)C(O)=C(C4=CC=3C)C(C)C)=C(C)C=C21 QBKSWRVVCFFDOT-UHFFFAOYSA-N 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 206010043189 Telangiectasia Diseases 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 229930003779 Vitamin B12 Natural products 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 206010048222 Xerosis Diseases 0.000 description 1
- WOYYTQHMNDWRCW-JGWLITMVSA-N [(2r,3r,4r,5s)-2,3,4,5-tetrahydroxy-6-phosphonooxyhexyl] dihydrogen phosphate Chemical compound OP(=O)(O)OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)COP(O)(O)=O WOYYTQHMNDWRCW-JGWLITMVSA-N 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 235000019418 amylase Nutrition 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 238000007486 appendectomy Methods 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 229960004217 benzyl alcohol Drugs 0.000 description 1
- 238000010876 biochemical test Methods 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 230000025938 carbohydrate utilization Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 235000019219 chocolate Nutrition 0.000 description 1
- 229940038704 clostridium perfringens Drugs 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000012531 culture fluid Substances 0.000 description 1
- 238000012136 culture method Methods 0.000 description 1
- 238000013016 damping Methods 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000011026 diafiltration Methods 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- 208000019836 digestive system infectious disease Diseases 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 229940009662 edetate Drugs 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000011049 filling Methods 0.000 description 1
- 239000013020 final formulation Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 235000020932 food allergy Nutrition 0.000 description 1
- 235000012041 food component Nutrition 0.000 description 1
- 239000005428 food component Substances 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- 235000011194 food seasoning agent Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 210000004051 gastric juice Anatomy 0.000 description 1
- 230000007160 gastrointestinal dysfunction Effects 0.000 description 1
- 230000002070 germicidal effect Effects 0.000 description 1
- 230000009422 growth inhibiting effect Effects 0.000 description 1
- 239000000665 guar gum Substances 0.000 description 1
- 235000010417 guar gum Nutrition 0.000 description 1
- 229960002154 guar gum Drugs 0.000 description 1
- 229920000591 gum Polymers 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 230000007366 host health Effects 0.000 description 1
- 244000052637 human pathogen Species 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 238000011081 inoculation Methods 0.000 description 1
- CDAISMWEOUEBRE-GPIVLXJGSA-N inositol Chemical compound O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](O)[C@@H]1O CDAISMWEOUEBRE-GPIVLXJGSA-N 0.000 description 1
- 229960000367 inositol Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 208000028774 intestinal disease Diseases 0.000 description 1
- 230000003871 intestinal function Effects 0.000 description 1
- 210000004347 intestinal mucosa Anatomy 0.000 description 1
- 210000002011 intestinal secretion Anatomy 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- KTIHOJLQNXISFY-UHFFFAOYSA-N iodic acid periodic acid Chemical compound I(=O)(=O)(=O)O.I(=O)(=O)O KTIHOJLQNXISFY-UHFFFAOYSA-N 0.000 description 1
- 230000001788 irregular Effects 0.000 description 1
- 238000009533 lab test Methods 0.000 description 1
- 229940072205 lactobacillus plantarum Drugs 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 150000002605 large molecules Chemical class 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 230000000116 mitigating effect Effects 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 239000006916 nutrient agar Substances 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 235000014594 pastries Nutrition 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-M periodate Chemical compound [O-]I(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-M 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 235000013406 prebiotics Nutrition 0.000 description 1
- 230000035935 pregnancy Effects 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 239000013014 purified material Substances 0.000 description 1
- 230000000452 restraining effect Effects 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- CDAISMWEOUEBRE-UHFFFAOYSA-N scyllo-inosotol Natural products OC1C(O)C(O)C(O)C(O)C1O CDAISMWEOUEBRE-UHFFFAOYSA-N 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 235000021391 short chain fatty acids Nutrition 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 238000004088 simulation Methods 0.000 description 1
- 230000036548 skin texture Effects 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 208000009056 telangiectasis Diseases 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 210000002438 upper gastrointestinal tract Anatomy 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000001018 virulence Effects 0.000 description 1
- 235000019163 vitamin B12 Nutrition 0.000 description 1
- 239000011715 vitamin B12 Substances 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 238000004383 yellowing Methods 0.000 description 1
- 235000013618 yogurt Nutrition 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/20—Bacteria; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/20—Bacteria; Culture media therefor
- C12N1/205—Bacterial isolates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/66—Microorganisms or materials therefrom
- A61K35/74—Bacteria
- A61K35/741—Probiotics
- A61K35/744—Lactic acid bacteria, e.g. enterococci, pediococci, lactococci, streptococci or leuconostocs
- A61K35/747—Lactobacilli, e.g. L. acidophilus or L. brevis
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/135—Bacteria or derivatives thereof, e.g. probiotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/06—Anti-spasmodics, e.g. drugs for colics, esophagic dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/14—Prodigestives, e.g. acids, enzymes, appetite stimulants, antidyspeptics, tonics, antiflatulents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/04—Amoebicides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2002/00—Food compositions, function of food ingredients or processes for food or foodstuffs
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23V—INDEXING SCHEME RELATING TO FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES AND LACTIC OR PROPIONIC ACID BACTERIA USED IN FOODSTUFFS OR FOOD PREPARATION
- A23V2400/00—Lactic or propionic acid bacteria
- A23V2400/11—Lactobacillus
- A23V2400/143—Fermentum
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12R—INDEXING SCHEME ASSOCIATED WITH SUBCLASSES C12C - C12Q, RELATING TO MICROORGANISMS
- C12R2001/00—Microorganisms ; Processes using microorganisms
- C12R2001/01—Bacteria or Actinomycetales ; using bacteria or Actinomycetales
- C12R2001/225—Lactobacillus
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Virology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Communicable Diseases (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Nutrition Science (AREA)
- Polymers & Plastics (AREA)
- Food Science & Technology (AREA)
- Molecular Biology (AREA)
- Epidemiology (AREA)
- Dermatology (AREA)
- Immunology (AREA)
- Pulmonology (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
Abstract
细菌发酵乳杆菌的变种及其在治疗受试者胃肠疾病、粘膜表面疾病或免疫系统或状况紊乱中的用途。
Description
技术领域
本发明涉及细菌发酵乳杆菌(Lactobacillus fermentum)变种、变种及其组分的制剂,以及它们在哺乳动物中预防和/或治疗疾病及促进哺乳动物健康的用途。
背景技术
整个说明书对现有技术的任何讨论不应认为是承认在本领域中此现有技术是广泛已知或形成一般常识的部分。
固有的细菌(indigenous bacteria)在预防某些细菌及真菌疾病中起主要作用。它们的此种作用是通过细菌拮抗作用,防止其它微生物在体内存在的过程实现的。参与此活性的机制包括直接竞争营养物,改变区域的酸度使其它微生物不适于生长,产生抑制性代谢产物及抗微生物化学品及通过防止其它微生物结合至宿主表面。
固有菌群也影响免疫系统。在无菌环境中饲养的动物显示低度发育及相对未分化的淋巴组织,低水平的免疫蛋白及对感染的初次应答,而不产生显著的二次应答。
这些微生物通过产生定居所需要的必需维生素及营养物、帮助降解复杂的营养物、保护宿主免受病原体侵袭以及刺激免疫系统而在宿主的健康中起重要作用。此外,认为肠中的微生物通过微生物产生的短链脂肪酸导致pH降低而有助于矿物质吸收及脂类代谢。这些短链脂肪酸是结肠生理的调节物并在维持正常肠功能中起重要作用。
胃肠道上部只包含与唾液及食物一起吞入的细菌。由于胃液的高度酸性,很少的生物体主要为乳杆菌可自正常胃中进行培养。小肠上部只包含相对稀少量的乳杆菌及肠球菌。胃肠道菌群逐渐变化直到变得与结肠中发现的菌群相似,主要为类杆菌属(Bacteroides)、双岐杆菌属(Bifidobacterium)、梭杆菌属(Fusobacterium)、乳杆菌属及真杆菌属(Eubacterium)。
身体的此种正常菌群是复杂的生态系统,它受饮食、微生物相互作用及宿主因素如肠蠕动及肠分泌调节。外部因素如应激、饮食变化及药物可影响正常菌群并改变存在的生物体类型或它们的代谢。如果将平衡破坏可对宿主产生有害影响并可引起疾病。
然而,有时失去平衡,侵入的病原体成功穿过身体的防御系统引起感染或引发不适当的免疫反应。同样宿主与固有菌群之间的平衡可在应用抗生素后受到破坏而导致正常的潜伏生物体的感染,例如发生鹅口疮(白色念珠菌(Candida albicans)感染)或艰难梭菌(Clostridium difficile)感染。
令人失望地是,抗生素表面上提供的“神奇的子弹(Magic Bullets)”失去了它们的一些作用。在过去30年中,抗生素抗性持续增加的问题成为主要的公共卫生问题。现今,一些抗生素几乎对某些微生物无效,而一些细菌对几乎所有已知抗生素药物具有抗性。
此外,大肠中固有微生物牵涉到肠易激综合征(IBS)的证据正在增加,所述肠易激综合征的特征为大便习惯改变、排便紊乱及腹胀。
显然需要备选及可能的补充治疗方法。
本发明的目的是克服或改善现有技术的至少一个缺点或提供有用的备选物。
发明概述
对与以前存在的发酵乳杆菌菌株及其它益生微生物相比较具有令人惊讶的有益特征的新益生细菌发酵乳杆菌变种进行了分离。由于它定居胃肠道的有益能力,它在预防和/或治疗胃肠道疾病中特别有用。此外此变种具有有益的免疫调节作用,所述免疫调节作用在肠中局部产生以及通过共同的粘膜免疫系统在全身的粘膜部位产生。由于粘膜免疫系统的普遍性,变种也可用于预防和/或治疗其它粘膜表面疾病及由于粘膜表面紊乱或免疫系统或受试者的状况紊乱导致的疾病。
根据本发明的第一方面,提供了具有以下特征的新发酵乳杆菌变种或其组分:
(a)它为革兰氏阳性、兼性杆菌,
(b)它发酵核糖、半乳糖、葡萄糖、果糖、甘露糖、麦芽糖、乳糖、蜜二糖、蔗糖、海藻糖、棉子糖、L-阿拉伯糖及甘露醇,
(c)它在pH1.5存活至少四小时,生长丢失不高于log3,
(d)它于37℃在存在0.5%胆汁盐中增殖导致光密度增加0.5至0.8,
(e)在明胶胶囊中于25℃保存时稳定,
(f)它以每mg组织log5 cfu以上粘附于淋巴集结,通过直接拮抗作用及通过引发免疫调节两者抑制病原体。
优选地,发酵乳杆菌变种菌株为VRI 003(保藏号NM02/31074)。
优选地,组分为细胞碎片、提取物、分泌物或经纯化组分。
根据本发明的第二方面,提供了包含根据第一方面所述的发酵乳杆菌变种或其组分及可药用载体的组合物。
优选地,组合物包含VRI 003菌株或其组分。在优选的实施方案中,组合物包含发酵乳杆菌变体的活细胞。然而,本领域技术人员清楚的是组合物也可包含乳杆菌变种的死细胞。在一个实施方案中,组合物包含的组分为细胞碎片、提取物、分泌物或经纯化组分。
用于制备此类细胞碎片、提取物、分泌物或经纯化组分的步骤是公知的。例如,可将细胞超声处理或可将细胞壁自身进行物理破坏和/或收集细胞内容物。可将整个细胞进行洗涤以提取表面组分及然后如果需要,将这些提取物进行分级。
优选地,将发酵乳杆菌与其它组分如益生素、不可消化膳食组分、膳食纤维或药学活性组分进行组合。更优选地,益生素包含或由菊粉、抗性淀粉、寡糖、树胶或β-葡聚糖组成。甚至更优选地,益生素为未经修饰的高直链玉米淀粉或β-葡聚糖。
组合物可制备为片剂、胶囊剂、粉剂、凝胶剂、糊剂、液体剂型、膳食添加剂或食物产品等。优选地,组合物以片剂或胶囊剂形式制备。
根据第三方面,本发明提供了用于预防和/或治疗胃肠疾病或其症状的方法,所述方法包括向需要此种治疗的受试者施用根据第一方面所述的发酵乳杆菌变种或其组分或施用根据第二方面所述的组合物的步骤。
优选的发酵乳杆菌为变种VRI 003。
术语“受试者”及“个体”在本说明书中可交替应用,并且在本发明上下文中的范围内包括任何哺乳动物,所述哺乳动物可发展或已经具有胃肠疾病和/或粘膜表面疾病和/或粘膜表面紊乱或任何原因引起的免疫系统紊乱导致的疾病。优选的用于施用本发明治疗剂的受试者为人、家养宠物及农用动物。
优选地,胃肠疾病为肠易激综合征(IBS)、炎性肠病、节段性回肠炎和/或其症状,例如腹泻、胃气胀、肠胃气胀、胃痉挛、腹痛或便秘。胃肠疾病可由细菌、病毒或原生动物这样的病原生物体引起。然而,它也可仅仅由不适当生物体定居胃肠道或通过炎性和/或自身免疫机制引起。
优选地,紊乱或疾病为病原体定居受试者胃肠道的结果。优选地,紊乱或疾病是如文中定义的高病原体负荷的结果。更优选地病原体为细菌、病毒或原生动物。最优选的,病原体为沙门氏菌属(Salmonella)、大肠杆菌(E.coli)、螺旋杆菌属(Helicobacter)、弧菌属(Vibrio)、假单胞菌属(Pseudomonas)、梭菌属(Clostridium)、类杆菌属;或病毒如诺沃克病毒或轮状病毒,或原生动物如隐孢子虫(Cryptosporidium)、内阿米巴(Entamoeba)、贾第虫(Giardia)及双核阿米巴(Dientamoeba)。
在本发明中,当受试者在以下情况时,可发生“高病原体负荷”:(a)受到病原体攻击,所述病原体的量在它们日常暴露的正常范围外;(b)受到毒力病原体攻击;(c)当受试者抵抗力降低时受到病原体攻击,例如在免疫系统被耗竭和/或当受试者的其它天然防御系统没有正常发挥功能时。由于例如应激或抗生素治疗,受试者的抵抗力可降低。
第四方面,本发明提供了用于预防和/或治疗粘膜表面疾病或其症状的方法,所述方法包括向需要此种治疗的受试者施用根据第一方面所述的发酵乳杆菌变种或其组分或施用根据第二方面所述组合物的步骤。
优选地,粘膜表面疾病为湿疹、玫瑰痤疮(roseaca)或遗传过敏性皮炎。
第五方面,本发明提供了在受试者中刺激IL-12产生的方法,所述方法包括向需要此种治疗的受试者施用根据第一方面所述的发酵乳杆菌变种或其组分,或施用根据第二方面所述的组合物的步骤。
第六方面,本发明提供了上调IFN-γ的方法,所述方法包括向需要此种治疗的受试者施用根据第一方面所述的有效量的发酵乳杆菌变种或其组分,或施用根据第二方面所述的组合物的步骤。
第七方面,本发明提供了在受试者中诱导Th1型反应的方法,所述方法包括向需要此种治疗的受试者施用根据第一方面所述的有效量的发酵乳杆菌变种或其组分,或施用根据第二方面所述的组合物的步骤。
第八方面,本发明提供了抑制病原体生长的方法,所述方法包括向需要此种治疗的受试者施用根据第一方面所述的有效量的发酵乳杆菌变种或其组分,或施用根据第二方面所述的组合物的步骤。
第九方面,本发明提供了调节胃肠道固有微生物的方法,所述方法包括向需要此种治疗的受试者施用根据第一方面所述的有效量的发酵乳杆菌变种或其组分,或施用根据第二方面所述的组合物的步骤。
根据欲治疗疾病的严重性、疾病原因、受试者的年龄及在本领域技术人员的技能范围内通过常规程序易于确定的其它标准临床参数的不同,所需剂量发生变化。
发酵乳杆菌变种或其组分或包含所述变种的组合物可通过任何已知方法进行施用,但优选经口施用。
发酵乳杆菌变种或包含所述变种或其组分的组合物可与一种或多种其它药学活性剂联合施用。变种或包含所述变种的组合物可与其它治疗剂同时(共同施用)施用或可以任何次序依次施用。
优选地将发酵乳杆菌变种或其组分或包含它的组合物每日施用。根据相关疾病的治疗过程、其原因及严重性,施用可一天进行几次或不经常施用(例如每两天或每三天施用一次)。本领域技术人员易于确定这些参数。
在本发明中,术语“稳定”在其范围内包括于25℃储存时每六个月成活力丢失不超过25%的范围。
在本文中,当谈及本发明发酵乳杆菌组分时所应用的术语“组分”包括但不限于细胞碎片、提取物、分泌物或来自细菌的经纯化物质。
除了本文另有需要外,本说明书及权利要求书中的单词“包含”等表示包括意义,与排除或无遗漏意义相反;即表示“包括,但不限于”。
附图简述
图1.不同浓度胆汁盐对发酵乳杆菌VRI 003的生长及成活力的作用。
图2.体外低pH对VRI 003培养物成活力的影响。
图3.乳杆菌种对小鼠淋巴集结的粘附。
图4及图5.提取自发酵乳杆菌VRI 003细胞的细胞壁蛋白质与发酵乳杆菌LMG细胞壁比较的二维分析,与发酵乳杆菌LMG(图5)比较时,显示VRI 003上调两个细胞壁蛋白质并下调许多其它细胞壁蛋白质的表达(图4),其中所述发酵乳杆菌LMG以前显示不粘附淋巴集结。
图6.发酵乳杆菌VRI 003的刺激对巨噬细胞产生细胞因子的影响。
图7.经口施用发酵乳杆菌VRI 003后淋巴集结细胞因子水平的增强。
图8.经口施用发酵乳杆菌VRI 003后,经口施用发酵乳杆菌VRI 003对脾中细胞因子水平的影响。
图9.发酵乳杆菌VRI 003在与低水活性抗性淀粉组合并于4℃、25℃及30℃在薄片-薄片泡包装的I号明胶胶囊中保存时的稳定性。
图10.在8周试验期间,来自4号IBS受试者粪便材料中细菌的变化。在基线期、安慰剂期、洗脱期(washout period)及合生素(Synbiotic)治疗期监测的微生物谱。结果用每mL菌落形成单位(cfu)表示。
图11.在8周试验期间,来自5号IBS受试者粪便材料中细菌的变化。在基线期、安慰剂期、洗脱期及合生素治疗期监测的微生物谱。结果用每mL菌落形成单位(cfu)表示。
图12.在8周试验期间,来自9号IBS受试者粪便材料中细菌的变化。在基线期、安慰剂期、洗脱期及合生素治疗期监测的微生物谱。结果用每mL菌落形成单位(cfu)表示。
图13.在8周试验期间,来自2号IBS受试者粪便材料中细菌的变化。在基线期、安慰剂期、洗脱期及合生素治疗期监测的微生物谱。结果用每mL菌落形成单位(cfu)表示。
图14.在8周试验期间,来自3号IBS受试者粪便材料中细菌的变化。在基线期、安慰剂期、洗脱期及合生素治疗期监测的微生物谱。结果用每mL菌落形成单位(cfu)表示。
图15.在8周试验期间,来自7号IBS受试者粪便材料中细菌的变化。在基线期、安慰剂期、洗脱期及合生素治疗期监测的微生物谱。结果用每mL菌落形成单位(cfu)表示。
图16.在8周试验期间,来自6号IBS受试者粪便材料中细菌的变化。在基线期、安慰剂期、洗脱期及合生素治疗期监测的微生物谱。结果用每mL菌落形成单位(cfu)表示。
发明详述
虽然对用益生素预防及治疗许多疾病进行了多种尝试,用益生素治疗胃肠疾病的证据变化非常大。现在发现具有以下特征的发酵乳杆菌变种或其组分在预防和/或治疗胃肠疾病和/或其症状中高度有效:
(a)它为革兰氏阳性、兼性杆菌,
(b)它发酵核糖、半乳糖、葡萄糖、果糖、甘露糖、麦芽糖、乳糖、蜜二糖、蔗糖、海藻糖、棉子糖、L-阿拉伯糖及甘露醇,
(c)它在pH1.5存活至少四小时,生长丢失不高于log3,
(d)于37℃在存在0.5%胆汁盐中导致光密度增加0.5至0.8,
(e)它在明胶胶囊中于25℃稳定保存,
(f)它以每mg组织log5 cfu以上粘附于淋巴集结,通过直接拮抗作用及通过引发免疫调节两者抑制病原体。优选地,变种为发酵乳杆菌VRI003。本发明也提供了用于预防和/或治疗胃肠疾病的方法,所述方法包括向受试者施用发酵乳杆菌变种或其组分,或施用包含变种的组合物。变种可与其它物质例如益生素、不可消化膳食组分、膳食纤维或药学活性化合物如阿司匹林及他汀类(statins)联合。
本发明的方法及组合物已研发为在治疗胃肠疾病中用于人及兽应用,但由于粘膜系统的共同性,可将该治疗应用于其它粘膜表面疾病及粘膜表面紊乱或免疫系统或受试者状态紊乱导致的疾病。无论用于人或家畜的治疗,根本原则是相同的,并且有利的是可应用本发明的治疗而不用考虑上述疾病的原因。
一般地,每日有效量在约108-1012个细菌且施用频率为每日一次或两次。对于长期施用,数量可例如低于上述范围;在其它条件下,可用高于上述范围的量。
发酵乳杆菌变种可通过已知方法,用常规可药用载体、赋形剂、溶剂或佐剂进行制剂。此类步骤及成分是公知的并在权威教科书及手册中进行了详细描述,例如“Remington:The Science and Practice of Pharmacy”,1995,Mack Publishing Co.Easton,PA 18042,美国,此处引用作为参考。
也可通过常规公知方法,将发酵乳杆菌变种或其组分制备成食物产品。
包含细菌的组合物包括活细菌、湿细菌、干细菌或细菌组分,其中所述细菌组分包括但不限于细胞碎片、提取物、分泌物及经纯化组分。
本发明的食物或饮料产品包含至少一种细菌、含有以同样细菌及其经加工产品作为有效成分的物质。
可用多种方法对组合物进行制剂以适于经口施用,例如以片剂、胶囊剂、液体、膳食添加剂、糊剂、凝胶剂、食物产品等的形式。其它剂型对本领域技术人员是显然的。
可将细菌用于食物或饮料产品中或可与其它食物材料及食物组分适当地以常规方法组合应用。
优选地,将组合物制成有或无其它组分的乳或基于乳的食物产品,所述其它组分为常规用于制备此类乳产品的组分。
本发明的组合物也可包括已知的抗氧化剂、缓冲剂或其它试剂如着色剂、调味剂、维生素或矿物质。可向组合物中加入增稠剂如玉米淀粉、瓜尔胶、黄原胶等。本发明治疗性组合物的优选额外组分可包括益生素如菊粉、不可消化膳食组分、膳食纤维、可药用化合物及其它营养物。也可包括膳食或添加酶如乳糖酶、淀粉酶、葡聚糖酶、过氧化氢酶等酶。优选的益生素包括未经修饰高直链玉米淀粉或β-葡聚糖。
将细菌与载体组合,所述载体与施用物种的胃肠组织或粘膜表面生理学相容。载体可包含用于制剂入片剂、胶囊剂或粉剂形式的基于固体的干物质;或载体可包含用于制剂入液体或凝胶形式的液体或基于凝胶的物质。载体的特定类型以及最终剂型部分取决于所选择的施用途径。
用于干剂型的一般载体包括但不限于:海藻糖、糊精麦芽糖复合剂、米粉、微晶纤维素(MCC)硬脂酸镁、肌醇、FOS、GOS、葡萄糖、蔗糖等载体,可将干剂型(例如粉剂)加入市售的食物(例如液体剂型、乳产品或水)。同样,剂型的特定类型取决于施用途径。
适当的液体或基于凝胶的载体包括但不限于:水及生理性盐溶液;尿素;醇类及其衍生物(例如甲醇、乙醇、丙醇、丁醇);二元醇(例如乙二醇、丙二醇等)。优选地,基于水的载体具有中性pH值(即pH7.0)。
载体中也可包括防腐剂,所述防腐剂包括羟苯甲酸甲酯、对羟苯甲酸丙酯、苯甲醇及乙二胺四乙酸盐。组合物中的载体可发生变化,条件是只要载体不显著干扰活性成分的药学活性。
本发明的方法包括向人或动物施用发酵乳杆菌变种或其组分,或施用包含所述变种或其组分的组合物以治疗和/或预防胃肠疾病或粘膜表面疾病及粘膜表面紊乱或免疫系统或受试者状况紊乱导致的疾病和/或与此类疾病相关的症状,例如肠易激综合征(IBS)、炎性肠疾病和/或其症状,如例如腹泻、胃气胀、肠胃气胀、腹痉挛、腹痛或便秘及湿疹或玫瑰痤疮。此种治疗可导致调节胃肠道的固有微生物。优选用片剂、胶囊剂、凝胶剂、液体剂型、粉剂、糊剂、膳食添加剂或食物产品等剂型进行施用,所有剂型通过应用本领域内公知的方法以包含本发明的治疗性组合物而制剂。
本发明优选的实施方案现在通过实施例的形式进行描述。
实施例
实施例1:来源及鉴定
VRI 003变种分离自健康受试者。在一系列实验室实验中,发现VRI003变种粘附到胃肠上皮组织。也显示对人胃肠病原体具有可论证作用,并对胆酸有抗性。VRI 003变种在低pH环境中也存活,并对胃蛋白酶及在营养物有限的情况下有抗性。
细菌变种VRI 003可在Rogosa琼脂(Oxoid)平板上于37℃厌氧培养箱内进行培养24小时。菌株通过连续在MRS琼脂(Oxoid)平板上于37℃厌氧培养箱内培养24小时进行转种,并在向培养液中加入甘油前,通过在MRS培养液中于37℃厌氧培养箱内传代培养24小时,将最终培养物在20%甘油中于-70℃进行储存。
变种VRI 003为过氧化氢酶阴性、革兰氏阳性杆菌,在包含葡萄糖的脑心浸液(BHI)(Oxoid)培养液中于厌氧条件生长时产生气体。因此广泛鉴定为异发酵乳杆菌并根据API糖类试剂盒(50 CHL试剂盒;Biomerieux;具有99.9%确定性的供应者数据及数据库)确定为发酵乳杆菌菌株。特别地,菌株VRI 003利用糖5、10、11、12、13、25、28、29、30、31、32及25。细胞为短杆状、革兰氏阳性并与发酵乳杆菌形态的描述相符。
根据布达佩斯条约,发乳杆菌菌株VRI 003于2002年8月27日保藏在澳大利亚政府分析实验室,位于澳大利亚,PO BOX 385,Pymble 2073,NSW,并且保藏物的保藏号为NM02/31074。
实施例2:菌株VKI 003的特征及描述
(i)菌落形态
当于37℃厌氧培养箱中在MRS(Oxoid)琼脂上生长时,菌落直径约1mm,为有光泽、圆顶形、不透明,并且当用接种环接触时显示有粘性。所述粘性可能是由于存在细胞外聚合物。将同样平板于37℃在需氧条件下孵育产生一些表面粗糙及边缘不规则的菌落。将这些粗糙菌落传代到MRS琼脂上并于37℃厌氧培养箱中孵育,产生接触有粘性的不透明、圆顶形、有光泽不透明菌落。
(ii)培养液中的生长
变种VRI 003在MRS(Oxoid)培养液或多种其它培养液中培养,当于37℃厌氧条件下生长时,产生粘稠培养液。
(iii)对胆酸的抗性
如图1所示,当将胆酸加入到MRS培养液(Oxoid)并将菌株于37℃厌氧条件下孵育8小时时,菌株VRI 003在存在0.5%及0.15%胆汁盐的条件下生长。
(iv)在低pH环境中存活
在用于测定应用前,将来自甘油储存液的VRI 003在MRS培养液中传代两次。在测定当天,将来自MRS培养液的培养物进行收获,通过于4000xg离心并将沉淀物用分别调整pH为1.5及2.0的Clark and Lubs缓冲液溶解,使光密度为0.4(对应于1×108CFU/mL)。生物体的存活通过在4小时期间每小时一取样,系列稀释并以100微升涂布MRS琼脂平板,然后将MRS平板于37℃厌氧孵育24小时进行确定。如图2所示,显示发酵乳杆菌菌株VRI 003比发酵乳杆菌菌株VRI 002存活性强,其在4小时期间于pH1.5时自每ml log 8.75cfu降至log 4.93cfu/ml。
(v)糖类利用
用API 50CHL糖类利用试剂盒以研究发酵乳杆菌VRI 003可利用哪种糖类,注意到随孵育时间与发酵乳杆菌菌株VRI 002的一些差异。孵育6小时后,如通过培养基变成黄色所定义的,VRI 003能利用以下糖:
核糖
半乳糖
葡萄糖
果糖
甘露糖
麦芽糖
乳糖
蜜二糖
蔗糖
海藻糖
棉子糖。
这时,VRI 002能利用除甘露糖外的所有以上糖类。
孵育6小时后,两个菌株能轻微利用Gluco Na Te。
通过18小时孵育,观察到在划线的含甘露糖区域发生变化,由此推断VRI 002利用甘露糖,但相对缓慢。
通过24小时孵育,VRI 003利用L-阿拉伯糖及甘露醇是清楚的。VRI002除此之外还开始利用两种其它的糖即鼠李糖及N-乙酰-葡糖胺。
48小时孵育后,VRI-003菌株利用所有Gluco Na Te,而VRI-002菌株只有非常轻微利用。
(vi)发酵乳杆菌VRI 003的粘附
(a)与淋巴集结的体外粘附
将放射性标记的VRI 003与淋巴集结体外孵育30分钟并对粘附水平进行定量。如图3所示,与实验室中发现的其它菌株(LA1-嗜酸乳杆菌(L.acidophilus)1、LA 2-嗜酸乳杆菌2、干酪乳杆菌(L casei)及VRI-002)相比,显示VRI 003对淋巴集结细胞结合增强。由于淋巴集结作为肠中免疫系统的取样部位,发酵乳杆菌VRI 003对淋巴集结的粘附作用增强表示此菌株的免疫刺激作用增强。
(b)蛋白质介导的发酵乳杆菌VRI 003对淋巴集结的粘附
为了对粘附淋巴集结机制的特征进行描述,在粘附测定前,将发酵乳杆菌细胞用蛋白酶及偏高碘酸盐(metaperiodate)进行预处理以确定蛋白质的多糖是否参与粘附。显示用偏高碘酸盐处理增强了粘附,因此不必为理论所束缚,仍可作出细胞外多糖不参与粘附,并且实际上降低粘附的结论。用蛋白酶处理发酵乳杆菌细胞极大降低了粘附,因此表示细胞壁蛋白质粘附淋巴集结。此外,在加入完整发酵乳杆菌细胞前加入细胞表面提取物到组织时,细胞表面提取物可显著阻断结合,证实发酵乳杆菌VRI 003细胞壁表面存在对淋巴集结具亲和性的分子。
表1.化学及酶处理发酵乳杆菌VRI 003和淋巴集结组织对粘附的影响
| 处理 | 粘附指数(%)a | |
| 发酵乳杆菌VRI 003 | 淋巴集结 | |
| 只用PBS蛋白酶K胰蛋白酶高碘酸盐碘酸盐缓冲液细胞表面蛋白质(5μg/ml)细胞表面蛋白质(50μg/ml)细胞表面蛋白质(100μg/ml) | 100±10.1333.48±5.67*48.69±5.22224.08±21.73*108.59±2.80100±0.8448.15±10.23*46.14±7.91*42.23±6.37* | 100±8.05120.76±0.2760.81±0.3864.24±6.6069.54±3.69100±12.50NDNDND |
a粘附指数表示为每mg淋巴集结湿重粘附细菌数的百分率。粘附对照组织表示100%粘附。
数据表示为平均数±平均标准误。在粘附测定前,发酵乳杆菌VRI 003或淋巴集结用多种处理进行预处理。
提取自发酵乳杆菌VIU 003细胞的细胞壁蛋白质及与以前显示不粘附淋巴集结的发酵乳杆菌LMG细胞壁比较的二维分析显示当与发酵乳杆菌LMG(图5)进行比较时, VRI 003上调两种细胞壁蛋白质及下调多种其它细胞壁蛋白质的表达(图4)。
(c)粘附人肠粘膜
将摄入明胶胶囊中的冷冻干燥粉剂(每天log 10-11,进行14天)的受试者进行内窥镜检查并对自小肠壁取活组织。将活组织进行洗涤并匀浆化,进行系列稀释并涂布到MRS琼脂用于分离粘附的乳杆菌。将经分离乳杆菌进行纯化并用VRI 003特异抗体证实为发酵乳杆菌VRI 003。
(vii)发酵乳杆菌VRI 003对免疫参数的影响
(a)发酵乳杆菌VRI 003对巨噬细胞的直接影响
制备源自骨髓的巨噬细胞并用不同浓度的发酵乳杆菌VRI 003刺激4小时。使用高浓度(感染复数MOI-260;浓度1)或低浓度(MOI-26;浓度2)的发酵乳杆菌VRI 003。
如自图6可看到的,巨噬细胞具有浓度反应依赖性细胞因子的释放。在刺激后第1天,与接受较低浓度发酵乳杆菌VRI 002或发酵乳杆菌VRI003的巨噬细胞相比,用较高浓度发酵乳杆菌VRI 002或发酵乳杆菌VRI003刺激的巨噬细胞产生显著较高的IL-12。对发酵乳杆菌VRI 003刺激作出反应的巨噬细胞产生的IL-10水平与产生的IL-12水平相比是非常低的。
由于巨噬细胞产生的IL-12及IL-10互相排斥,这是可以预料的。认为巨噬细胞产生的IL-12水平在确定针对抗原的免疫反应中起重要作用。胃肠道树突状细胞的局部环境中IL-12的存在引发T细胞的Th1型反应。此数据表明较高剂量的发酵乳杆菌VRI 003有能力使免疫反应倾向于Th1反应,并且这比用发酵乳杆菌VRI 002进行更有效。
(b)体内发酵乳杆菌VRI 003对免疫参数的影响
对BALB/c小鼠经口施用发酵乳杆菌VRI 003,每只小鼠每天施用1X109cfu。在不同时间点处死小鼠。将脾及淋巴集结进行切除并对免疫参数进行测定。
BALB/c小鼠经口施用发酵乳杆菌VRI 003 5天,每只小鼠每天施用1X109CFU。对照小鼠施用PBS。第6天将小鼠处死。将脾及淋巴集结进行切除并对免疫参数进行测定。
如图7显示的,与对照组及与实验中应用的其它实验室菌株(另一菌株为发酵乳杆菌LF1)相比,经口摄食发酵乳杆菌VRI 003 5天导致淋巴集结的IFN-γ及IL-12显著增强。图8显示摄食发酵乳杆菌VRI-003似乎不影响脾中的细胞因子水平。摄食发酵乳杆菌VRI 003小鼠的IL-12及IFN-γ水平与对照小鼠(摄食PBS)相似。因此在缺乏有效感染的正常小鼠中经口摄食发酵乳杆菌VRI 003刺激粘膜免疫,并用于引发它对肠病原体的最佳反应。
(viii)发酵乳杆菌VRI 003的冷冻干燥粉剂的稳定性
图9显示VRI 003与低水活性抗性淀粉组合在明胶胶囊中于25℃及30℃保存特别稳定。
(ix)粘附
虽然定居胃肠道的能力对益生菌株在消化道的活性功能不是必要条件,但这是一个所需特征。如果益生菌株可粘附到胃肠道上皮,它可在胃肠道定居即建立并生长在胃肠道中,并不断产生可介导有益作用的代谢产物。变种VRI 003当经口施用一些人时定居在人消化道。
(x)拮抗作用
通过体外病原体抑制研究,明显的是菌株产生抑制一些潜在病原体生长的代谢产物,所述病原体均包括许多株大肠杆菌(Escherichia coli)、鼠伤寒沙门氏菌(Salmanella typhimurium)、产气英膜梭菌(Clostridiumperfringens)、艰难梭菌(Clostridium difficile)、粪肠球菌(Enterococcusfaecium、Enterococcus faecalis)、白色念珠菌(Candida albicans)及金黄色葡萄球菌(Staphylococcus aureus)在内的革兰氏阴性及革兰氏阳性种。
不希望受任何特定的作用机制限制,对于益生菌株有效保护受试者免受来自胃肠道病原体的作用,可需要产生一些抑制病原体生长的代谢产物。将此对生长的抑制作用称为拮抗作用并可将拮抗性代谢产物分类为低或高分子量化合物。将三个不同的方法用于评估菌株VRI 003对一些人病原体的拮抗能力,所述三种方法为直接平板共培养测定、在来自乳杆菌的用过培养液(spent culture fluid)中的培养液培养及动物攻击模型。
通过用病原体覆盖乳杆菌的点接种物及在接种后测定病原体生长抑制区的大小,直接平板培养法用于筛选许多病原体。为了进一步用此方法对拮抗作用进行定量,将VRI 003与病原体在液体培养基中进行共培养并在24小时后,对活病原体细胞进行计数。区的大小用于定量抑制程度。
对菌株VRI 003的抑制活性也进行了测定,以确定乳杆菌的低或高分子量代谢产物是否介导了所检测的生长抑制作用。对VRI 003用过的细菌培养液进行收集并将一部分进行透析以只保留分子量大于8,000的化合物。在无或有透析残留物及未透析的经用过培养液中对所选择人病原体的生长进行研究。未经透析过滤的无菌用过培养液阻止病原体的生长,而透析液显示抑菌及杀菌作用。
自体外病原体抑制研究显示菌株产生抑制革兰氏阴性及革兰氏阳性种类的一些潜在病原体生长的代谢产物。在动物攻击研究中显示变种VR1003产生可抑制病原体并保护动物的低及高分子量代谢产物。用沙门氏菌攻击经口施用乳杆菌该菌株的小鼠阻止了在只施用沙门氏菌而不施用乳杆菌的对照小鼠中观察到的体重减轻。
实施例3:培养物及剂型
(i)培养物的生长
发酵乳杆菌变种VRI 003于37℃在发酵容器中生长。然后将容器冷却并将发酵培养液浓缩优选通过离心浓缩。将经收集培养物进行干燥优选通过冷冻干燥并随后进行粉碎。然后将经粉碎物质与主要赋形剂混合以产生每克干物质中所需水平的微生物。所使用的水平根据应用而定(范围高达每克log11)。然后通过将所有成分在混合器(优选V-混合器)中混合,将经标准化物质在剂型中进行应用。
(ii)剂型
(a)剂型A:基于高直链玉米的(合生素剂型)
发酵乳杆菌VRI 003 100mg
hi-maize 958(或1043) 170mg
硬脂酸 不超过4.5mg
二氧化硅 不超过4.5mg
(b)剂型B:基于微晶纤维素(MCC)的
发酵乳杆菌VRI 003 100mg
Avicell Ph 112(或等同物) 170mg
硬脂酸 不超过4.5mg
二氧化硅 不超过4.5mg
(c)剂型C:如A及B描述的基于高直链玉米或MCC的,用胶态二氧化硅(不超过4.5mg)代替二氧化硅或者为胶态二氧化硅及二氧化硅(不超过4.5mg)。
对于VRI 003的一个所需特征是它保持成活力,并在施药后具有在人胃肠道生长的能力。如以上概述的此特征为用于所需菌株的一个筛选标准。然而,这对于所需有益作用不是必需的。
在此方面另一重要因素为虽然菌株具有在胃肠道中多种条件下存活的能力,在大量生长并以产品形式进行分发时,菌株必需保持成活力及所需菌株特征。以上显示的所有结果是基于直接从活性生长的实验室培养物收获的VRI 003细胞。以下是在大量培养及冷冻干燥后以及在明胶胶囊中包封后,VRI 003的成活力及菌株特征分析。
(iii)经冷冻干燥VRI 003的成活力
大量生产及冷冻干燥后,通过分析每克干物质的菌落形成单位(CFU/g)对VRI 003的成活力进行确定。对在明胶胶囊中包封前及包封后的干粉剂均进行检查。对成活细胞数以十个单一1g粉剂样本进行确定。对十个胶囊的内容物也分别进行分析。
通过生产及包封,VRI 003的成活力仍保持高水平。干粉剂包含5.6×1010cfu/g且胶囊内容物包含4.15×1010CFU/g;结果用n=10的平均数表达。
当胶囊在薄片/薄片包装中储存时,于30℃及25℃储存6个月,注意到成活力降低1.5log或更少。
(iv)变种特征
将干粉剂及胶囊内容物在磷酸盐缓冲液(0.1M,pH7.2)中悬浮以产生100倍的稀释液。对以上概述的变种特征在此细菌悬液中进行检测。对于所有检测,将VRI 003的活性生长培养物包括在内作为内对照。如以下详细描述的,对于冷冻干燥粉剂或对于胶囊内容物,没有观察到菌株特征的明显降低。
此外,粉剂及胶囊内容物显示与实验室的生长对照培养物相似的粘附特征。
实施例4:有或无益生素时施用发酵乳杆菌VRI、VRI 003对肠易激综合征症状(IBS)及胃肠菌群谱的影响
(i)实验设计
参加者
交了书面试服志愿书(HREC 99264)后,七个IBS患者(2个男性及5个女性)参加了本研究。在开始本研究前三个月,所有患者没有施用抗生素。所有患者在参加本试验前通过医生检查显示存在IBS诊断标准及没有器质性疾病。所有患者在研究时是有症状的。
试验设计
单盲安慰剂期试验持续8周,其由3周安慰剂治疗期、接着2周洗脱期(无治疗)及最后3周合生素治疗期(即用包含VRI 003变种及益生素的制剂治疗)组成。较小组的患者用仅包含VRI 003的制剂进行治疗。
在本研究中,患者的饮食不受控制,但建议他们克制不要食用经发酵乳产品(例如酸乳酪及酸奶油)。试验的第一天需要来自患者的新鲜粪便样本以形成基线期,及然后在第21、35及56天(每一治疗期前及治疗期后)对患者的新鲜粪便样本进行收集。患者在试验的第一天完成原始调查表及此后在试验的每周患者完成周调查表。
一般的治疗方案如以下(提供用于合生素制剂,但对仅有VRI 003的制剂用相似的方案)。
胶囊及糖类
将空胶囊手工装填。胶囊的组装在层流柜中进行并在应用前,将材料在UV下灭菌15分钟。安慰剂胶囊包含微晶纤维素NF XVIII(MingtaiChemical Company Ltd,台湾),而益生素胶囊包含作为冷冻干燥粉的发酵乳杆菌(VRI 003)(1.67×1010 cfu.gm-1,DSM Moorebank,悉尼)。将经组装胶囊与两袋硅胶置于120mL样本瓶中。
将麦芽糖糊精(FieldstarTM,Goodman Fielder,悉尼)及抗性淀粉(CultureProTM 958,Penfold,澳大利亚)分别用作安慰剂及益生糖类。将糖类在层流柜中置于UV下15分钟,然后将样本称重(20g)并置于储存在干净房间的70mL样本瓶中。
调查表
原始调查表用于在开始试验前记录患者以前及现在的症状。要求患者对他们的症状包括腹泻、便秘、腹泻及便秘交替、肠胃气胀、胃气胀、痉挛性腹痛的严重性以0(无)到10(极其严重)分级。对有关肠紊乱的原因及缓解措施以及食物过敏性等其它问题也进行询问。
在试验期间的每周末,要求患者完成周调查表,所述周调查表再次要求他们对他们的症状以及任何肠紊乱性质进行分级。此外,对有关胶囊及糖类的消费量及明显作用也进行询问。
粪便材料的制备
收集来自IBS患者的粪便接种物,所述IBS患者在试验前三个月没有施用抗生素。将粪便收集到干净塑料容器中并在到达后转移到厌氧培养箱中。一份粪便与三份的半浓度Wilkin-Chalgrens(WC)培养液(Oxoid,CM643)在Seward stomacher bag中进行匀浆化。
细菌计数
在灭菌微离心管中,用半浓度Wilkin-Chalgrens(WC)培养液(Oxoid,CM643)十倍系列稀释,然后将10μL份一式三份逐滴涂布到不同培养基(表1)上。以估计粪便样本中存在的主要微生物群。根据制造者的说明制备培养基。将涂布到RCA平板上的样本先加热到90℃,进行10分钟。
表1.发酵中计数的细菌群
| 培养基 | 微生物 | 稀释度涂布 | 孵育 |
| 营养琼脂(NA;CM3*) | 总需氧菌 | 10-4至10-8 | O2,24小时 |
| 麦康基琼脂(MAC;CM7*) | 肠杆菌 | 10-4至10-8 | O2,24小时 |
| WC+血1琼脂(CM619*) | 总厌氧菌 | 10-4至10-8 | 无O2,48小时 |
| WC+血1+抗生素添加剂2(CM619) | 革兰氏阴性厌氧菌 | 10-4至10-8 | 无O2,48小时 |
| Rogosa琼脂(CM627*) | 乳杆菌 | 10-4至10-8 | 无O2,48小时 |
| 棉子糖双岐杆菌琼脂(RB;Hartemink,1995) | 双岐杆菌 | 10-4至10-8 | 无O2,48小时 |
| 加强的梭菌琼脂(RCA;CM151*) | 梭菌 | 10-1至10-5 | 无O2,72小时 |
*Oxoid
1 Oxoid去纤维蛋白血(每1L琼脂50mL)
2 Oxoid G-N厌氧选择性添加剂SR108B
(ii)仅施用或与益生素组合施用发酵乳杆菌VRI 003的作用-结果总结
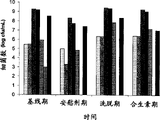
表2:仅施用或与益生素(高直链玉米淀粉)(抗性淀粉=RS)一起施用时,发酵乳杆菌VRI 003对IBS症状严重度的作用。结果表示为对应于无症状的“-”至“+”至“+++”,其中较严重症状显示为“+++”。
| 症状 | 基线期 | 安慰剂期 | VRI 003+RS | 仅有VRI 003 |
| 腹泻 | +++ | +++ | + | + |
| 胃气胀 | +++ | ++ | + | ++ |
甚至仅施用VRI 003时是有效的。然而,与仅施用益生素或仅施用β-葡聚糖相比,VRI 003与高直链玉米淀粉组合升高了VRI 003细菌水平并降低了某些细菌如沙门氏菌及梭菌的水平。
实施例5:在试验期间用来自IBS受试者材料的粪便微生物谱的变化
试验期间获得了总需氧菌、肠细菌、总厌氧菌、革兰氏阴性厌氧菌、乳杆菌、梭菌及双岐杆菌变化的结果。图上显示的时间点代表在试验开始(基线期)、安慰剂治疗期结束、洗脱期结束及合生素治疗期结束时的粪便微生物谱。关于结果,根据受试者常规经历的疾病症状,将他们分为主要为腹泻、主要为便秘、以及主要为便秘与腹泻交替这三个小组。因为在具有疾病的受试者症状上的广泛变异性,此分组允许对受试者进行适当评估(Akehurst和Kaltenthaler,2001)。然而,一个受试者不适合三个小组中的任一个,将其归入主要为肠胃气胀、胃气胀及痉挛性腹痛的单独组。
主要为腹泻的受试者
主要为腹泻受试者的粪便微生物谱的变化在图10(受试者4)、图11(受试者5)及图12(受试者9)中显示。
受试者4(图10):除了在洗脱期间总需氧菌增加了1log外,总需氧菌保持在1×105log cfu.mL-1的稳定水平。虽然在洗脱期结束时与总需氧菌数相比肠细菌开始显示了很大差异,最初检测到为1×105log cfu.mL-1的肠细菌数在合生素治疗期结束后,降低了1.5log。开始时均为5×108logcfu.mL-1的总厌氧菌及革兰氏阴性厌氧菌在合生素治疗期结束时显示增加了1log。乳杆菌最初检测到为1×107log cfu.mL-1,在安慰剂期及合生素治疗期结束时显示降低了2log,在洗脱期间,乳杆菌又有升高。在整个试验期间,未检测到梭菌,而自开始为5×107log cfu.mL-1双岐杆菌数在合生素治疗期,增加了1log。
受试者5(图11):最初检测为5×105log cfu.mL-1的总需氧菌在洗脱期及合生素治疗期增加了1log。除了在安慰剂治疗期结束时肠细菌数减少了2log外,在所有时间点期间肠细菌保持在与总需氧菌相似的水平(5×105log cfu.mL-1)。总厌氧菌及革兰氏阴性厌氧菌数虽然在安慰剂治疗期结束时降低了1至1.5log,但在试验期间该数保持1×109log cfu.mL-1的恒量水平。开始为1×106log cfu.mL-1的乳杆菌在安慰剂治疗期结束降低了1log,但在洗脱期结束时增加了3log,在合生素治疗期结束时又降低了1log。在试验开始检测到梭菌为1×103log cfu.mL-1并在试验的其余期为未检测到。开始为5×108log cfu.mL-1的双岐杆菌,在安慰剂期及合生素治疗期结束时降低了1log,但在洗脱期间增加了1log。
受试者9(图12):在基线期检测总需氧菌及肠细菌为1×107log cfu.mL-1并在合生素治疗期结束时缓慢降低1.5log。在基线期检测总厌氧菌及革兰氏阴性厌氧菌为5×108log cfu.mL-1,在安慰剂治疗期结束时增加1log并在研究的其余期保持在稳定水平。在基线期检测到乳杆菌为5×105log cfu.mL-1,然而在安慰剂治疗期为未检测到。在洗脱期结束时检测到乳杆菌又为5×103log cfu.mL-1并在合生素治疗期结束增加了1log。试验期间未检测到梭菌。双岐杆菌开始时为5×107log cfu.mL-1,在安慰剂治疗期结束时降低了1.5log,然而在洗脱期结束时又增加到5×108log cfu.mL-1并直至合生素治疗期结束时一直保持此水平。
主要为便秘的受试者
主要为便秘的受试者的粪便微生物谱的变化在图13(受试者2)及图14(受试者3)进行显示。
受试者2(图13):总需氧菌及肠细菌最初检测为1×107log cfu.mL-1,除了在安慰剂治疗期结束时肠细菌数增加1log外,在试验期间保持相似水平。总厌氧菌及革兰氏阴性厌氧菌在试验期保持1×108log cfu.mL-1的相似水平,在安慰剂治疗期结束时增加1log,在合生素治疗期结束时降低了0.5log。开始为1×103log cfu.mL-1的乳杆菌在安慰剂治疗期结束时增加了1log,但在洗脱期结束为未检测到并在合生素治疗期结束时又增加了3log,梭菌只在试验开始时为1×103log cfu.mL-1并在试验的其余期为未检测到。双岐杆菌开始检测为1×107log cfu.mL-1,在安慰剂治疗期结束时降低1.5log,然后在试验的其余期间为未检测到。
受试者3(图14):总需氧菌及肠细菌在试验期间保持5×104log cfu.mL-1的相似水平并在安慰剂治疗期结束时增加2log,但在合生素治疗期结束时降低1log。总厌氧菌及革兰氏阴性厌氧菌开始为1×107log cfu.mL-1并在合生素治疗期结束时继续稳定增加2log。在试验的开始检测到乳杆菌为1×104log cfu.mL-1,但然后在安慰剂治疗期结束时为未检测到。然而,乳杆菌在洗脱期结束显示增加4.5log并在合生素治疗期结束时又降低0.5log。梭菌只在安慰剂治疗期结束时检测到为1×104log cfu.mL-1并在试验的其余期为未检测到。开始为1×107log cfu.mL-1的双岐杆菌在安慰剂治疗期结束时为未检测到,但在洗脱期结束时又可检测到并在合生素治疗期结束时增加4.5log。
主要为腹泻与便秘交替的受试者
主要为腹泻与便秘交替的受试者的粪便微生物谱的变化在图15(受试者7)中进行显示。
受试者7(图15):最初检测为5×105log cfu.mL-1的总需氧菌及肠细菌在洗脱期结束时增加2log,但在合生素治疗期结束时降低1log。总厌氧菌及革兰氏阴性厌氧菌开始为5×108log cfu.mL-1并在试验期间保持稳定水平,直到合生素治疗期后总厌氧菌降低1log,而革兰氏阴性厌氧菌降低2log。除了合生素治疗期结束时检测到乳杆菌为5×103log cfu.mL-1外,试验的大部分时期未检测到乳杆菌。相反,只在开始检测到梭菌为1×103logcfu.mL-1。开始检测到双岐杆菌为5×106log cfu.mL-1,然而在安慰剂治疗期为未检测到,只在洗脱期间可检测到为5×107log cfu.mL-1并在合生素治疗期结束时增加0.5log。
其它:主要为肠胃气胀、胃气胀及痉挛性腹痛的受试者
主要为肠胃气胀、胃气胀及痉挛性腹痛的受试者的粪便微生物谱的变化在图16(受试者6)中进行显示。
受试者6(图16):总需氧菌及肠细菌最初检测为5×105log cfu.mL-1并直到合生素治疗期保持此水平,但在合生素治疗期总需氧菌及肠细菌增加2log的水平。在基线期检测到总厌氧菌及革兰氏阴性厌氧菌为1×108logcfu.mL-1并在安慰剂治疗期结束时增加1log,然后在研究的其余期保持此水平。研究期间乳杆菌保持1×104log cfu.mL-1的相对稳定水平。除了在合生素治疗期结束时检测到梭菌为5×103log cfu.mL-1外,在研究期间,未检测到梭菌。双岐杆菌开始为1×107log cfu.mL-1并在安慰剂治疗期结束时降低3log,在洗脱期间又增加到1×107log cfu.mL-1并在合生素治疗期结束时降低3log。
实施例6:试验期间IBS受试者症状严重度的变化
获得了包括腹泻、便秘、腹泻与便秘交替、以及肠胃气胀、胃气胀和痉挛性腹痛症状严重度变化的结果。每个症状按0至10进行分级,0表示没有症状,而10表示症状极其严重。结果按1至5级进行显示,1表示症状严重度轻及5表示症状严重度重。每周对所有受试者症状严重度的变化进行监测,然而,结果只显示代表基线期(试验开始)、安慰剂治疗期、洗脱期及合生素治疗期的时间点。根据受试者一般经历疾病的症状,又将受试者分为主要为腹泻、主要为便秘及主要为腹泻与便秘交替的小组。
主要为腹泻的受试者
主要为腹泻的受试者症状严重度的变化在表3(受试者4)、表4(受试者5)、表5(受试者9)进行显示。
受试者4(表3):在基线期腹泻的严重度极其高,然而,在安慰剂治疗期结束严重度降低了一半,在合生素治疗期结束进一步降低到低严重度。在基线期肠胃气胀及胃气胀为中严重度(3),在合生素治疗期结束最终降低到低严重度(1)。在基线期开始痉挛性腹痛也为低(2),在合生素治疗期结束时严重度进一步降低到1。
表3 8周试验期间受试者#4症状严重度的变化
在基线期、安慰剂期、洗脱期及合生素治疗期对症状的严重度进行监测,结果表示为+(低严重度)至+++++(高严重度)。
| 症状 | 基线期 | 安慰剂期 | 洗脱期 | 合生素期 |
| 腹泻 | +++++ | ++ | ++ | + |
| 便秘 | - | - | - | - |
| 肠胃气胀 | +++ | +++ | ++ | + |
| 胃气胀 | +++ | ++ | ++ | + |
| 痉挛性腹痛 | ++ | ++ | ++ | + |
受试者5(表4):在基线期时腹泻的严重度极其高并在安慰剂治疗期只轻微降低到4,其后保持在高严重度。在基线期肠胃气胀是低的,安慰剂治疗期间不存在,但在洗脱期及合生素治疗期分别又增加到1及2。在试验期间痉挛性腹痛的严重度保持在3的同等水平,但在洗脱期间降低了1级。在试验期间肠胃气胀及胃气胀的症状是不存在的。
表4 8周试验期间受试者#5症状严重度的变化
在基线期、安慰剂期、洗脱期及合生素治疗期对症状的严重度进行监测,结果表示为+(低严重度)至+++++(高严重度)。
| 症状 | 基线期 | 安慰剂期 | 洗脱期 | 合生素期 |
| 腹泻 | +++++ | ++++ | ++++ | ++++ |
| 便秘 | - | - | - | - |
| 肠胃气胀 | + | - | + | ++ |
| 胃气胀 | - | - | - | - |
| 痉挛性腹痛 | +++ | +++ | ++ | +++ |
受试者9(表5):在基线期时腹泻在中度范围(3)并且直至合生素治疗期时维持此严重度,合生素治疗期时降低了2到低严重度。除了安慰剂治疗期增加了1外,在试验期间便秘不存在。试验期间肠胃气胀也不存在,然而在洗脱期增加了3。在基线期为中严重度(3)的胃气胀,在安慰剂治疗期降低了1。然而,在洗脱期间其又增加了1并然后在合生素治疗期下降到低严重度(1)。在试验期间痉挛性腹痛是不存在的。
表5 8周试验期间受试者#9症状严重度的变化
在基线期、安慰剂期、洗脱期及合生素治疗期对症状的严重度进行监测,结果表示为+(低严重度)至+++++(高严重度)。
| 症状 | 基线期 | 安慰剂期 | 洗脱期 | 合生素期 |
| 腹泻 | +++ | +++ | +++ | + |
| 便秘 | - | + | - | - |
| 肠胃气胀 | - | - | +++ | - |
| 胃气胀 | +++ | ++ | +++ | + |
| 痉挛性腹痛 | - | - | - | - |
主要为便秘的受试者
主要为便秘的受试者症状严重度的变化在表6(受试者2)及表7(受试者3)进行显示。
受试者2(表6):在基线期及试验的大部分不存在的腹泻,在合生素治疗期增加到1。在基线期及安慰剂期及洗脱期,便秘、肠胃气胀及胃气胀保持在高严重度(5),而在合生素治疗期降低了1。在基线期及安慰剂治疗期,痉挛性腹痛为高严重度(4),但在洗脱期及合生素治疗期降低了3至低严重度。
表6 8周试验期间受试者#2症状严重度的变化
在基线期、安慰剂期、洗脱期及合生素治疗期对症状的严重度进行监测,结果表示为+(低严重度)至+++++(高严重度)。
| 症状 | 基线期 | 安慰剂期 | 洗脱期 | 合生素期 |
| 腹泻 | - | - | - | + |
| 便秘 | +++++ | +++++ | +++++ | ++++ |
| 肠胃气胀 | +++++ | +++++ | +++++ | ++++ |
| 胃气胀 | +++++ | +++++ | +++++ | ++++ |
| 痉挛性腹痛 | ++++ | ++++ | + | + |
受试者3(表7):在基线期时便秘开始为低严重度(2)并在安慰剂治疗期继续为此水平,但在洗脱期及合生素治疗期是不存在的。在基线期肠胃气胀开始为高严重度(5),在安慰剂治疗期降低到3并在洗脱期及合生素治疗期进一步降低到低严重度(2)。在基线期时胃气胀开始也为非常高严重度并在安慰剂期、洗脱期及合生素治疗期严重度分别降低到4、3及3。在基线期痉挛性腹痛开始为高严重度(4)并在安慰剂治疗期降低到低严重度(1),其后在试验的剩余期是不存在的。试验期间腹泻是不存在的。
表7 8周试验期间受试者#3症状严重度的变化
在基线期、安慰剂期、洗脱期及合生素治疗期对症状的严重度进行监测,结果表示为+(低严重度)至+++++(高严重度)。
| 症状 | 基线期 | 安慰剂期 | 洗脱期 | 合生素期 |
| 腹泻 | - | - | - | - |
| 便秘 | ++ | ++ | - | - |
| 肠胃气胀 | +++++ | +++ | ++ | ++ |
| 胃气胀 | +++++ | ++++ | +++ | +++ |
| 痉挛性腹痛 | ++++ | + | - | - |
主要为腹泻与便秘交替的受试者
主要为腹泻与便秘交替的受试者症状严重度的变化在表8(受试者7)进行显示。
受试者7(表8): 在基线期时腹泻开始为低严重度(1)但在洗脱期及合生素治疗期增加到2。在基线期时为低严重度(2)的便秘,在安慰剂期及洗脱期间降低了1,但在合生素治疗期增加到3。在基线期时肠胃气胀开始为低严重度(1)并在试验的大部分保持低水平,然而在合生素治疗期增加到3。胃气胀开始为低严重度(2)并在安慰剂治疗期降低到1,然而在洗脱期及合生素治疗期分别继续增加到3及4。除了在合生素治疗期痉挛性腹痛增加到中严重度(3)外,它在试验期间是不存在的。
表8 8周试验期间受试者#7症状严重度的变化
在基线期、安慰剂期、洗脱期及合生素治疗期对症状的严重度进行监测,结果表示为+(低严重度)至+++++(高严重度)。
| 症状 | 基线期 | 安慰剂期 | 洗脱期 | 合生素期 |
| 腹泻 | + | + | ++ | ++ |
| 便秘 | ++ | + | + | +++ |
| 肠胃气胀 | + | + | + | +++ |
| 胃气胀 | ++ | + | +++ | ++++ |
| 痉挛性腹痛 | - | - | - | +++ |
其它:主要为肠胃气胀、胃气胀及痉挛性腹痛的受试者
主要为肠胃气胀、胃气胀及痉挛性腹痛的受试者症状严重度的变化在表9(受试者6)中进行显示。
受试者6(表9):除了在合生素治疗期腹泻增加1而至低严重度外,腹泻在试验的大部分时期是不存在的。在基线期时肠胃气胀开始为中严重度(3)并在安慰剂期及洗脱期降低到低严重度(1),然而在合生素治疗期又一次增加到中严重度(3)。在基线期胃气胀开始也为中严重度(3)并在安慰剂治疗期变为不存在,然而在洗脱期及合生素治疗期分别又增加到1及3。在基线期时痉挛性腹痛开始为低严重度(2),在安慰剂治疗期是不存在的,但在洗脱期及合生素治疗期分别增加了1及3。试验期间便秘是不存在的。
表9 8周试验期间受试者#6症状严重度的变化
在基线期、安慰剂期、洗脱期及合生素治疗期对症状的严重度进行监测,结果表示为+(低严重度)至+++++(高严重度)。
| 症状 | 基线期 | 安慰剂期 | 洗脱期 | 合生素期 |
| 腹泻 | - | - | - | + |
| 便秘 | - | - | - | - |
| 肠胃气胀 | +++ | + | + | +++ |
| 胃气胀 | +++ | - | + | +++ |
| 痉挛性腹痛 | ++ | - | + | +++ |
讨论
试验期间用来自IBS受试者材料的粪便微生物谱的变化与症状严重度变化之间的相关性
临床试验持续了总共8周,前3周涉及由麦芽糖糊精胶囊和纤维素组成的安慰剂治疗期。接着的2周为没有任何治疗的洗脱期。最后3周涉及由VRI 003胶囊和RS组成的合生素治疗期。在试验开始时对粪便样本进行收集以建立基线期,其后在每个治疗期前及每个治疗期后进一步收集样本。此外,通过自0至10分级的评分系统,每个患者也完成周调查表以监测他们症状严重度的变化,所述0至10分级的评分系统中,0为不存在症状,而10为最严重症状。然后为了方便,将结果转换为1至5级并显示为基线期、安慰剂期、洗脱期及合生素治疗期的情况。
如Akehurst等人和Weston等人(Akehurst和Kaltenthaler,2001;Weston,等人,1993)显示的,根据患者症状的主要方面将患者分为3个亚组。因为在不同患者疾病中他们正常经历的症状的广泛变异性,因此将患者分为主要为腹泻、便秘或腹泻与便秘交替的亚组以因此对特定症状的变化进行评估。一个受试者(#6)特别显示不同于3个亚组中任何其它患者经历的症状,因此将其分到主要为肠胃气胀、胃气胀及痉挛性腹泻症状的其它组。
主要为腹泻的受试者
合生素治疗期结束时,显示受试者4所有症状严重度的普遍降低(表3),特别是腹泻,在基线期时开始为高严重度并然后在合生素治疗期结束时降低到低严重度。与此症状可能的相关性可在自基线期时的1×105log cfu.mL-1缓慢降低至合生素治疗期结束时的5×103log cfu.mL-1(图10)的肠细菌中见到。乳杆菌数似乎与受试者4显示的任一症状均不相关,然而在合生素治疗期观察到双岐杆菌增加了1log,这与以前讨论的双岐杆菌能利用RS相关。然而,双岐杆菌的增加导致腹泻的降低是不太可能的,如在安慰剂期间此症状严重度开始降低,因此可能是在此受试者中,肠细菌对腹泻的严重度具有较大影响。
在试验期间,显示受试者不表现任何症状严重度的总体降低(表4)。然而,可注意到在安慰剂治疗期,观察到没有肠胃气胀,这可与肠细菌数降低2log(图11)相关。此受试者的总体概况表明合生素治疗对其不提高任何有益作用,而安慰剂治疗期可对症状的严重度有一些有益作用。在洗脱期乳杆菌数增加了3log,但在合生素治疗期结束时降低了1log。洗脱期间乳杆菌的大量增加也可与在此期间受试者显示的痉挛性腹痛降低相关,其在合生素治疗期结束时严重度增加,并在此期间乳杆菌有较小降低。观察到乳杆菌增加与痉挛性腹痛降低的相关也与Nobaek等人的发现有关,所述Nobaek等人观察到施用植物乳杆菌(Lactobacillus plantarum)降低IBS患者的疼痛及肠胃气胀(Nobaek等人,2000)。在洗脱期也观察到双岐杆菌增加了1log,因为据推定双岐杆菌间接促进乳杆菌的生长,所以双岐杆菌增加也与乳杆菌的增加相关。虽然此受试者在合生素治疗期显示没有改善症状,周调查表的评论表明在治疗期间症状保持相同,而不是严重度增加。
试验结束显示受试者9所有症状的严重度整体改善(表5),特别是合生素治疗期结束时自中严重度降到低严重度的腹泻及胃气胀。此类症状的降低可与肠细菌从基线期至合生素治疗期结束时降低2log相关。也观察到在安慰剂治疗期结束后双岐杆菌增加了3log。然而,此增加在症状还保持中严重度的洗脱期间开始,因此双岐杆菌数对合生素治疗期症状的减轻没有作用。也观察到在合生素治疗期结束时乳杆菌数增加(1log),这可与症状严重度降低相关。双岐杆菌及乳杆菌的增加也可与施用显示促进双岐杆菌生长并因此促进乳杆菌生长的RS相关(Brown等人,2000)。
主要为便秘的受试者
受试者2除了洗脱期及合生素治疗期痉挛性腹痛严重度大大降低外,显示受试者2大部分症状没有得到改善。来自粪便微生物谱的结果(图13)显示在合生素治疗期,不能检测到双岐杆菌并在此时间观察到总需氧菌及肠细菌降低(1log)。这可能表明肠细菌的降低可降低痉挛性腹痛的症状,然而只可推测没有双岐杆菌也可与症状的降低相关,因为认为双岐杆菌对人肠有益。受试者2的粪便微生物谱也显示在合生素治疗期乳杆菌没有提高到较高数量。这可因为乳杆菌在受试者肠中的低起始数引起的,所述低起始数可需要较长时期刺激到较高数量。虽然受试者的症状没有显示整体改善,周调查表表明试验期间经历的症状保持稳定且严重度没有增加。
显示受试者3症状的严重度整体普遍改善(表7),特别是洗脱期及合生素治疗期结束时降低的便秘及痉挛性腹痛。此类症状的改善可与合生素治疗末期双岐杆菌数的大量增加(4log)(图5)相关。双岐杆菌的增加表明在合生素治疗期施用RS刺激了双岐杆菌的生长。也显示施用的膳食纤维(例如RS)通过膨胀粪便降低便秘症状(Lambert,等人,1991;Philips,等人,1995)。与双岐杆菌相比,虽然试验期间乳杆菌数低,如果试验延长较长时间,乳杆菌的数量可有较大程度增加。合生素治疗期结束时肠细菌也降低(1log),且虽然其降低较少,也可利于此类症状严重度的降低。
主要为腹泻与便秘交替的受试者
在安慰剂治疗期显示受试者7的所有症状改善(表6),而在合生素治疗期显示症状严重度增加。试验期间观察到肠细菌数逐渐增加(图15),表明肠细菌的增加可与症状如胃气胀及腹泻的上升相关。然而,应当考虑的重要方面为施用益生素如RS可能增加甚至健康受试者的胃气胀及肠胃气胀(Cummings等人,2001;Munster等人,1994),因此IBS受试者经历的此类症状的增加不是不可能的。也观察到在洗脱期间双岐杆菌数量增加,而在安慰剂治疗期不能检查到,表明双岐杆菌的增加大概可与此类症状的严重度增加相关。也观察到在RB培养基中检测到非常高量的双岐杆菌并注意到在此种平板上检测到除双岐杆菌外的其它种细菌,如乳杆菌种(Hartemink等人,1996)。因此对生长在RB培养基上的菌落需进行生物化学试验,以证实它们均为双岐杆菌种。
虽然合生素治疗期症状的严重度似乎增加,但来自周调查表的评述表明此类症状经历与基线期相比较是正常的。
其它:主要为肠胃气胀、胃气胀及痉挛性腹痛的受试者
对于受试者6(表9)观察到的症状严重度的变化(表9)显示此受试者在安慰剂治疗期经历了症状严重度的降低,而合生素治疗期显示似乎对症状具有不利作用。安慰剂治疗期,观察到双岐杆菌数降低,且乳杆菌数在较小程度上降低(图16)。安慰剂治疗期双岐杆菌数目降低3log,与肠胃气胀的降低及不存在胃气胀及痉挛性腹泻相对应。这只能表明尽管认为双岐杆菌为有益细菌,但它们可与此类症状的增加相关。也应当考虑施用益生素特别是RS显示胃气胀及肠胃气胀症状增加(Cummings,等人,2001;Munster,等人,1994),所述胃气胀及肠胃气胀症状增加为受试者6在合生素治疗期施用RS期间显示的症状。安慰剂治疗期症状严重度的普遍改善也可归因于纤维素引起的可能膨胀作用及因此易于排便。周调查表也表明受试者在洗脱期饮用了少量酒精,这可加重症状。此外,应当注意此受试者在合生素治疗期经历了应激,这也可增加症状的严重度,如其它人观察到的(Lidbeck和Nord,1994;Longstreth和Wolde-Tsadik,1993)。
粪便微生物谱的试验结果表明肠杆菌数的普遍降低与症状严重度的降低相关。乳杆菌数的增加也与一些症状的改善如肠胃气胀的降低(受试者5)相关。然而,乳杆菌在改善症状方面似乎不发挥非常主要作用。相比较而言,可显示双岐杆菌的增加与症状的严重度有一些相关性,但它可为混合作用。可观察到双岐杆菌的增加与便秘及痉挛性腹痛的降低(受试者#3)相关,然而双岐杆菌的增加也可与肠胃气胀及痉挛性腹痛的增加(受试者#7)相关。可能双岐杆菌的不同种涉及症状严重度的增加或降低,或可能不同的患者受定居的不同肠微生物影响,其中所述定居的不同肠微生物影响胃肠道中双岐杆菌水平。
试验提供了初步结果,所述初步结果证明当施用含VRI 003及RS的合生素剂型或仅施用VRI 003时,IBS患者的粪便微生物谱及症状严重度产生有利变化。
实施例7:湿疹的治疗
经医学诊断为严重湿疹的21岁女性患者表现为全身广泛皮疹及面颊毛细血管扩张。皮肤非常干燥并由于干燥感觉紧缩。目前治疗包括每日施用可的松乳膏及保湿剂。
用发酵乳杆菌VRI-003治疗,开始为每天早晨用3粒胶囊与食物及晚上用3粒胶囊与食物,每粒胶囊包含4.2×1010cfu。保湿剂及可的松乳膏照常应用。经口施用发酵乳杆菌2周后,用视觉模拟标度(visual analogscale,VAS;标度1-10,其中1=低且10=严重)显示湿疹严重度降低了2个单位,皮肤的红色减轻,用VAS显示过敏性降低了2个单位,皮肤纹理得到轻微改善。发痒也降低并观察到剥落减少。总体上,患者的生活质量得到改善。
实施例8:肠紊乱的湿疹患者
经医学诊断为湿疹的33岁男性患者,所述湿疹表现为发炎、发痒、皮肤干燥及开放性溃疡。以前治疗包括施用类固醇软膏。阑尾切除术后,受试者也经历了肠疾病。
用发酵乳杆菌VRI 003治疗,以天为基础,开始治疗时为早晨用3粒胶囊与食物及晚上用3粒胶囊与食物,每粒胶囊包含4.2×1010cfu。摄入发酵乳杆菌VRI 003 2周后,报道受试者与他的湿疹相关的搔痒降低。同样他的胃肠健康得到改善,即上厕所次数大大减少。
实施例9:具有慢性疲劳且矿物质及维生素吸收/利用率不好的节段性回肠炎
一个患有节段性回肠炎10多年的35-40岁女性,每天早晨及晚上施用3粒胶囊与食物(每粒胶囊包含4×1010cfu的发酵乳杆菌VRI 003),1周后腹泻、痉挛、腹痛、不断疲劳及液体潴留的症状大大降低。粪便变得成型。铁及维生素B12水平极好,因此证实肠中发酵乳杆菌003的存在改善了铁及维生素的吸收和/或生物利用率。
实施例10:益生发酵乳杆菌VRI-003对肠易激综合征(IBS)患者的作用
对IBS患者进行了随机、多中心、交叉试验以研究益生发酵乳杆菌VRI003在降低IBS中见到的胃肠紊乱严重度的作用。研究进行了整18周(完成试验后2周的随访),其中受试者接受活性及安慰剂治疗期。益生素治疗方案的详细情况如下:
| 周 | 治疗 |
| 0-2 | 基线期 |
| 4周 | 益生素期/安慰剂期 |
| 6周 | 洗脱期(无治疗) |
| 4周 | 益生素期/安慰剂期 |
本研究靶向于满足IBS Rome标准的,属于17-74岁年龄组的受试者,所述IBS Rome标准是通过医学顾问证实的。然而,研究排除了经历胃肠感染及任何其它类型器质性疾病(即肝病等)的患者。也强烈建议志愿者在参加研究时不摄入任何益生素。
患者历史:54岁,白种人,女性,自她十几岁患IBS。活动性IBS症状包括腹泻及胃气胀,特别是在晚上。当受试者1吃糖含量高的食物如蛋糕、面粉糕饼及巧克力时,她的症状加重。
治疗1:早晨及晚上随食物摄入1粒发酵乳杆菌VRI 003胶囊,每粒胶囊包含3×1010VRI-003/胶囊。
症状评估:早晨及晚上施用1粒发酵乳杆菌VRI-003胶囊导致规则的肠蠕动。粪便变得坚硬并且胃气胀的强度降低。然而,当食用饮食中富含糖的食物时,发酵乳杆菌VRI-003不降低症状的严重度,也不加重症状。
实施例11:发酵乳杆菌VRI 003对玫瑰痤疮症状的益处
具有活动性IBS及脸上有玫瑰痤疮的男性45-55岁患者,他的皮肤科医生对玫瑰痤疮的红色及损伤治疗多年。在用发酵乳杆菌VRI 003治疗IBS时(每天在明胶胶囊中含log10-11cfu),玫瑰痤疮引起的患者脸上的红色及损伤极大降低并能停止使用所有抗生素软膏及类固醇乳膏。在摄入发酵乳杆菌003时,他脸上的疾病减轻。
虽然本发明参考这些具体实施例进行了描述,本领域技术人员可以理解本发明可以许多其它形式具体体现。
Claims (32)
1.发酵乳杆菌(Lactobacillus fermentum)变种或其组分,其中所述发酵乳杆菌变种具有以下特征:
(a)它为革兰氏阳性、兼性杆菌,
(b)它发酵核糖、半乳糖、葡萄糖、果糖、甘露糖、麦芽糖、乳糖、蜜二糖、蔗糖、海藻糖、棉子糖、L-阿拉伯糖及甘露醇,
(c)它在pH1.5存活达4小时,生长丢失不高于log 3,
(d)它于37℃在存在0.5%胆汁盐中增殖导致光密度增加0.5至0.8,
(e)它在明胶胶囊中于25℃保存时稳定,
(f)它以每mg组织log 5cfu以上粘附于淋巴集结,通过直接拮抗作用及通过引发免疫调节两者抑制病原体。
2.根据权利要求1所述的发酵乳杆菌变种,其中所述变种为VRI003(保藏号NM02/31074)。
3.根据权利要求1所述的发酵乳杆菌变种的组分,其中所述组分为细胞碎片、提取物、分泌物或经纯化组分。
4.组合物,所述组合物包含根据权利要求1或2所述的发酵乳杆菌变种或包含根据权利要求1或3所述的发酵乳杆菌变种的组分,并包含可药用载体。
5.根据权利要求4所述的组合物,所述组合物进一步包含益生素、不可消化膳食组分、膳食纤维或药学活性化合物。
6.根据权利要求5所述的组合物,其中益生素为菊粉、抗性淀粉、寡糖、树胶或β-葡聚糖。
7.根据权利要求6所述的组合物,其中所述益生素为未经修饰的高直链淀粉或β-葡聚糖。
8.根据权利要求4至7中任意一项所述的组合物,其中所述组合物包含发酵乳杆菌变种的活细胞。
9.根据权利要求4至7中任意一项所述的组合物,其中所述组合物包含发酵乳杆菌变种的死细胞。
10.根据权利要求4至9中任意一项所述的组合物,所述组合物为片剂、胶囊剂、粉剂、糊剂、凝胶剂、液体剂型、膳食添加剂或食物产品的形式。
11.根据权利要求10所述的组合物,其中所述组合物为片剂形式。
12.根据权利要求10所述的组合物,其中所述组合物为食物产品形式。
13.根据权利要求12所述的组合物,其中所述食物产品为乳或基于乳的食物产品。
14.根据权利要求10所述的组合物,其中所述组合物为液体剂型形式。
15.根据权利要求10所述的组合物,其中所述组合物为膳食添加剂形式。
16.用于预防和/或治疗胃肠疾病或其症状的方法,所述方法包括向需要此种治疗的受试者施用根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的步骤。
17.根据权利要求16所述的方法,其中所述组合物为经口施用。
18.根据权利要求16或17所述的方法,其中所述胃肠疾病为肠易激综合征、炎性肠病、腹泻、胃气胀、肠胃气胀、腹痉挛、腹痛、便秘或节段性回肠炎。
19.根据权利要求16至18中任意一项所述的方法,其中所述胃肠疾病由病原体引起。
20.根据权利要求19所述的方法,其中所速胃肠疾病由细菌、病毒或原生动物引起。
21.根据权利要求20所述的方法,其中所述细菌为沙门氏菌属(Salmonella)、大肠杆菌(E.coli)、螺旋杆菌属(Helicobacter)、弧菌属(Vibrio)或假单胞菌属(Pseudomonas)。
22.根据权利要求20所述的方法,其中所述病毒为诺沃克病毒或轮状病毒。
23.根据权利要求20所述的方法,其中所述原生动物为隐孢子虫、内阿米巴、贾第虫或双核阿米巴。
24.用于预防和/或治疗粘膜表面疾病和/或其症状的方法,所述方法包括向需要此种治疗的受试者施用有效量的根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的步骤。
25.根据权利要求24所述的方法,其中所述疾病为湿疹、遗传过敏性皮炎或玫瑰痤疮。
26.根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的用途,用于制备治疗和/或预防胃肠疾病、粘膜表面疾病或其症状的药物。
27.在受试者中刺激IL-12产生的方法,所述方法包括向需要此种治疗的受试者施用根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的步骤。
28.上调IFN-γ的方法,所述方法包括向需要此种治疗的受试者施用根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的步骤。
29.在受试者中诱导Th1型反应的方法,所述方法包括向需要此种治疗的受试者施用根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的步骤。
30.抑制病原体生长的方法,所述方法包括向需要此种治疗的受试者施用根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的步骤。
31.调节胃肠道固有微生物的方法,所述方法包括向需要此种治疗的受试者施用根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的步骤。
32.根据权利要求1或2所述的发酵乳杆菌变种、根据权利要求1或3所述的发酵乳杆菌变种的组分或根据权利要求4至15中任意一项所述的组合物的用途,用于制备在受试者中刺激IL-12产生、上调IFN-γ、诱导Th1型反应、抑制病原体生长或调节胃肠道固有微生物的药物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2002951270 | 2002-09-06 | ||
| AU2002951270A AU2002951270A0 (en) | 2002-09-06 | 2002-09-06 | Probiotic Bacterium and Methods of Use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1701116A true CN1701116A (zh) | 2005-11-23 |
| CN100378214C CN100378214C (zh) | 2008-04-02 |
Family
ID=27671590
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB038238330A Expired - Lifetime CN100378214C (zh) | 2002-09-06 | 2003-09-08 | 益生细菌:发酵乳杆菌 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US20060067921A1 (zh) |
| EP (1) | EP1539927B1 (zh) |
| JP (1) | JP4455333B2 (zh) |
| KR (1) | KR20050057259A (zh) |
| CN (1) | CN100378214C (zh) |
| AT (1) | ATE426014T1 (zh) |
| AU (2) | AU2002951270A0 (zh) |
| BR (1) | BRPI0314060B1 (zh) |
| CA (1) | CA2497989C (zh) |
| DE (1) | DE60326738D1 (zh) |
| DK (1) | DK1539927T3 (zh) |
| ES (1) | ES2324532T3 (zh) |
| NZ (1) | NZ538640A (zh) |
| WO (1) | WO2004022727A1 (zh) |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008064521A1 (fr) * | 2006-11-30 | 2008-06-05 | Pharmapep Research & Development (Shenzhen) Co., Ltd. | Lactobacillus fermentum cms-h002 et son utilisation |
| CN103275920A (zh) * | 2013-05-16 | 2013-09-04 | 江南大学 | 一种提高乳酸菌粘附肠道上皮细胞能力的方法 |
| CN104381440A (zh) * | 2014-07-17 | 2015-03-04 | 西南民族大学 | 发酵乳杆菌Lactobacillus fermentum Lee工作发酵剂制品及其预防便秘保健用途 |
| CN104498383A (zh) * | 2014-05-28 | 2015-04-08 | 西南大学 | 一种可调节肠道运动、预防便秘的发酵乳杆菌Lactobacillus fermentum strain suo及其用途 |
| CN104531549A (zh) * | 2014-05-28 | 2015-04-22 | 西南大学 | 一种可调节肠道运动、预防便秘的发酵乳杆菌Lactobacillus fermentum zhao及其用途 |
| CN105518150A (zh) * | 2013-09-06 | 2016-04-20 | 索发股份公司 | 用于评价包含微生物的组合物对肠道微生物群的作用的方法 |
| US11400124B2 (en) | 2016-05-13 | 2022-08-02 | Sofar S.P.A. | Use of probiotics for improving protein absorption |
| US11464814B2 (en) | 2014-04-23 | 2022-10-11 | Sofar Spa | Topical composition for use in the treatment of inflammatory bowel disease |
| US11751597B2 (en) | 2019-11-05 | 2023-09-12 | Alfasigma S.P.A. | Compositions comprising bacterial strains for use in increasing the bioavailability of amino acids derived from proteins, and related food product methods and systems |
| US11752179B2 (en) | 2016-06-08 | 2023-09-12 | Alfasigma S.P.A. | Medical use of probiotics |
| US11839634B2 (en) | 2013-09-06 | 2023-12-12 | Alfasigma S.P.A. | Use of a composition comprising microorganisms to increase the intestinal production of butyric acid, folic acid or niacin and/or decrease the intestinal production of succinic acid |
| US11896631B2 (en) | 2016-12-16 | 2024-02-13 | Alfasigma S.P.A. | Probiotics for use in the treatment of diverticulosis and diverticular disease |
| EP4161558A4 (en) * | 2020-06-06 | 2024-06-19 | Quorum Innovations, LLC | MATERIALS AND METHODS FOR INHIBITING VIRAL INFECTION, INCLUDING CORONAVIRUS INFECTION |
Families Citing this family (42)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE19836339B4 (de) | 1998-08-11 | 2011-12-22 | N.V. Nutricia | Kohlenhydratmischung |
| AUPS057102A0 (en) * | 2002-02-15 | 2002-03-07 | Vri Biomedical Ltd | Compositions and methods for treatment of skin disorders |
| US20050026866A1 (en) * | 2002-08-02 | 2005-02-03 | Pawelek John M. | Agents and methods for treatment of disease by oligosaccharide targeting agents |
| WO2005030230A1 (en) * | 2003-09-30 | 2005-04-07 | Probiomics Limited | Compositions and methods for treatment or prevention of psoriasis and related disorders |
| EP1597978A1 (en) | 2004-05-17 | 2005-11-23 | Nutricia N.V. | Synergism of GOS and polyfructose |
| JP4823503B2 (ja) * | 2004-10-14 | 2011-11-24 | ジェンモント バイオテック インコーポレイテッド | Lactobacillusfermentumの新規微生物株GM−090、およびIFN−γ分泌の刺激および/またはアレルギーの処置のためのその使用。 |
| US7303745B2 (en) * | 2005-04-15 | 2007-12-04 | Bristol-Myers Squibb Company | Method for preventing or treating the development of respiratory allergies |
| JP2008540403A (ja) * | 2005-05-05 | 2008-11-20 | ルピン・リミテッド | セファロスポリンの安定化経口用医薬組成物 |
| ES2368344T3 (es) | 2005-05-18 | 2011-11-16 | Dsm Ip Assets B.V. | Composiciones para aplicación parenteral de microorganismos. |
| US7943328B1 (en) | 2006-03-03 | 2011-05-17 | Prometheus Laboratories Inc. | Method and system for assisting in diagnosing irritable bowel syndrome |
| US20080085524A1 (en) | 2006-08-15 | 2008-04-10 | Prometheus Laboratories Inc. | Methods for diagnosing irritable bowel syndrome |
| US9283297B2 (en) | 2006-11-17 | 2016-03-15 | Sca Hygiene Products Ab | Sanitary article comprising a microbe-inhibiting composition |
| EP2087094B1 (en) * | 2006-11-17 | 2014-02-26 | SCA Hygiene Products AB | Lactobacillus fermentum ess-1, dsm17851 and its use for the treatment and/or prevention of candidiasis and urinary tract infections |
| US9125768B2 (en) | 2006-11-17 | 2015-09-08 | Sca Hygiene Products Ab | Hygiene tissue comprising a microbe-inhibiting composition |
| EP2030623A1 (en) * | 2007-08-17 | 2009-03-04 | Nestec S.A. | Preventing and/or treating metabolic disorders by modulating the amount of enterobacteria |
| US20090110663A1 (en) * | 2007-10-24 | 2009-04-30 | Halow George M | Method for treatment of bowel disorders |
| JP4903680B2 (ja) * | 2007-12-13 | 2012-03-28 | 株式会社プロバイオインターナショナル | パンの製造方法 |
| FI20080321A0 (fi) * | 2008-04-25 | 2008-04-25 | Eino Elias Hakalehto | Menetelmä suoliston bakteeritasapainon ylläpitämiseksi |
| EP2147678A1 (en) * | 2008-07-21 | 2010-01-27 | Nestec S.A. | Probiotics to increase IgA secretion in infants born by caesarean section |
| US8816067B2 (en) | 2009-05-07 | 2014-08-26 | Tate & Lyle Ingredients France SAS | Compositions and methods for making alpha-(1,2)-branched alpha-(1,6) oligodextrans |
| NZ600258A (en) | 2009-12-22 | 2014-01-31 | Probi Ab | Non-fermented compositions comprising a cereal based fraction and a probiotic and uses thereof |
| TWI383798B (zh) * | 2010-04-27 | 2013-02-01 | Syngen Biotech Co Ltd | 改善口腔內細菌群的發酵乳酸桿菌SG-A95(Lactobacillus fermentum SG-A95)及其保健組合物 |
| HK1253538A1 (zh) * | 2010-08-04 | 2019-06-21 | Borody Thomas J | 用於糞便菌群植入的組合物及其製備和使用方法 |
| DE102011001052A1 (de) * | 2011-03-03 | 2012-09-06 | Böllhoff Verbindungstechnik GmbH | Befestigungseinrichtung mit Toleranzausgleich |
| WO2012141540A2 (ko) * | 2011-04-13 | 2012-10-18 | 씨제이제일제당 (주) | 바이러스 감염 억제 활성을 갖는 신규 분리한 락토바실러스 퍼멘텀 균주 |
| WO2012162496A1 (en) * | 2011-05-24 | 2012-11-29 | Northeastern University | Microbial growth factors |
| JP5928774B2 (ja) * | 2011-11-01 | 2016-06-01 | 株式会社大阪ソーダ | β−1,3−グルカンを含む過敏性腸症候群の下痢抑制剤、腹痛改善剤、及び大腸における痛覚過敏改善剤 |
| KR101452234B1 (ko) * | 2013-07-22 | 2014-10-22 | (주) 피엘바이오 | 장수마을 성인으로부터 분리한 배변활동에 도움을 주는 신규한 유산균 락토바실러스 퍼멘텀 |
| TWI829098B (zh) | 2015-01-02 | 2024-01-11 | 美商梅拉洛伊卡公司 | 細菌組成物 |
| US11166968B2 (en) * | 2015-09-29 | 2021-11-09 | Kimberly-Clark Worldwide, Inc. | Synergistic composition for maintenance of healthy balance of microflora |
| KR101937364B1 (ko) * | 2016-01-28 | 2019-01-11 | 경희대학교 산학협력단 | 면역조절 작용을 가는 사람 소화관 유래 신규 유산균 및 이의 용도 |
| CA3023867A1 (en) * | 2016-05-09 | 2017-11-16 | Biogaia Ab | Selection of bacterial strains useful in allergy treatment |
| TWI598103B (zh) | 2016-08-22 | 2017-09-11 | 景岳生物科技股份有限公司 | 改善困難梭狀桿菌感染症狀的發酵乳酸桿菌gmnl-296組合物及方法 |
| IT201600122724A1 (it) | 2016-12-02 | 2018-06-02 | Sofar Spa | Exopolysaccharides and uses thereof |
| CN110234325A (zh) | 2017-02-28 | 2019-09-13 | 金伯利-克拉克环球有限公司 | 用于维护微生物群落的健康平衡的协同组合物 |
| CN108450482B (zh) * | 2018-03-26 | 2020-06-12 | 景岳生物科技股份有限公司 | 提高抗逆境能力的植物生长调节剂及其用途 |
| CN111248276A (zh) * | 2018-11-30 | 2020-06-09 | 内蒙古伊利实业集团股份有限公司 | 一种高活菌数乳酸菌饮料及其制备方法 |
| CN109628346B (zh) * | 2018-12-29 | 2022-07-12 | 善恩康生物科技(苏州)有限公司 | 发酵乳杆菌cqpc04及其在制备发酵食品中的应用 |
| US20230323332A1 (en) | 2020-08-28 | 2023-10-12 | Chr. Hansen A/S | Microencapsulation of microbial culture using octenyl succinic anhydride starch-chitosan complex coacervate |
| WO2024015943A1 (en) * | 2022-07-13 | 2024-01-18 | Anagram Therapeutics, Inc. | Methods and compositions for treating congenital sucrase-isomaltase deficiency |
| KR20240046081A (ko) * | 2022-09-30 | 2024-04-08 | 주식회사 에이치이엠파마 | 락토바실러스 퍼멘텀 hem1036 균주를 유효성분으로 포함하는 암 치료 부작용 개선용 조성물 |
| CN116590175A (zh) * | 2023-04-12 | 2023-08-15 | 吉林省中科特殊食品创新研究院有限公司 | 一种发酵乳杆菌elf041及其应用 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6241983B1 (en) * | 1994-10-28 | 2001-06-05 | Metagenics, Inc. | Bacteria-and fiber-containing composition for human gastrointestinal health |
| US6506389B2 (en) * | 1995-10-20 | 2003-01-14 | Nederlandse Organisatie Voor Toegepast-Natuurwetenschappelijk Onderzoek (Tno) | Adherence factors of non pathogenic microorganisms and applications thereof for screening microorganisms for specific probiotic properties; novel pharmaceutical compositions and food additives comprising such microorganisms and adherence factors |
| EP1094164B1 (en) * | 1999-10-18 | 2008-12-10 | Armstrong World Industries, Inc. | Foamed composite panel with improved acoustics and durability |
| EP1296693A4 (en) * | 2000-06-19 | 2005-05-25 | Mucoprotec Pty Ltd | IMMUNOTHERAPY AND PROBIOTIC COMPOUNDS FOR THE TREATMENT OF BACTERIAL OR VIRAL INFECTIONS ON MUCOSAL SURFACES |
| AUPR101600A0 (en) * | 2000-10-25 | 2000-11-16 | Atheromastat Pty Ltd | Compositions and methods for diagnosis and treatment of cardiovascular disorders |
-
2002
- 2002-09-06 AU AU2002951270A patent/AU2002951270A0/en not_active Abandoned
-
2003
- 2003-09-08 JP JP2004533080A patent/JP4455333B2/ja not_active Expired - Lifetime
- 2003-09-08 CN CNB038238330A patent/CN100378214C/zh not_active Expired - Lifetime
- 2003-09-08 US US10/526,580 patent/US20060067921A1/en not_active Abandoned
- 2003-09-08 AT AT03793503T patent/ATE426014T1/de not_active IP Right Cessation
- 2003-09-08 ES ES03793503T patent/ES2324532T3/es not_active Expired - Lifetime
- 2003-09-08 NZ NZ538640A patent/NZ538640A/en not_active IP Right Cessation
- 2003-09-08 EP EP03793503A patent/EP1539927B1/en not_active Expired - Lifetime
- 2003-09-08 KR KR1020057003941A patent/KR20050057259A/ko not_active Application Discontinuation
- 2003-09-08 DK DK03793503T patent/DK1539927T3/da active
- 2003-09-08 WO PCT/AU2003/001176 patent/WO2004022727A1/en active Application Filing
- 2003-09-08 DE DE60326738T patent/DE60326738D1/de not_active Expired - Lifetime
- 2003-09-08 CA CA2497989A patent/CA2497989C/en not_active Expired - Lifetime
- 2003-09-08 AU AU2003258366A patent/AU2003258366B2/en not_active Expired
- 2003-09-08 BR BRPI0314060A patent/BRPI0314060B1/pt active IP Right Grant
-
2009
- 2009-04-02 US US12/384,336 patent/US20100074878A1/en not_active Abandoned
Cited By (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008064521A1 (fr) * | 2006-11-30 | 2008-06-05 | Pharmapep Research & Development (Shenzhen) Co., Ltd. | Lactobacillus fermentum cms-h002 et son utilisation |
| CN103275920A (zh) * | 2013-05-16 | 2013-09-04 | 江南大学 | 一种提高乳酸菌粘附肠道上皮细胞能力的方法 |
| CN103275920B (zh) * | 2013-05-16 | 2015-04-15 | 江南大学 | 一种提高乳酸菌粘附肠道上皮细胞能力的方法 |
| CN105518150A (zh) * | 2013-09-06 | 2016-04-20 | 索发股份公司 | 用于评价包含微生物的组合物对肠道微生物群的作用的方法 |
| US11839634B2 (en) | 2013-09-06 | 2023-12-12 | Alfasigma S.P.A. | Use of a composition comprising microorganisms to increase the intestinal production of butyric acid, folic acid or niacin and/or decrease the intestinal production of succinic acid |
| US11464814B2 (en) | 2014-04-23 | 2022-10-11 | Sofar Spa | Topical composition for use in the treatment of inflammatory bowel disease |
| CN104531549A (zh) * | 2014-05-28 | 2015-04-22 | 西南大学 | 一种可调节肠道运动、预防便秘的发酵乳杆菌Lactobacillus fermentum zhao及其用途 |
| CN104531549B (zh) * | 2014-05-28 | 2018-08-10 | 西南大学 | 一种可调节肠道运动、预防便秘的发酵乳杆菌Lactobacillus fermentum strain Zhao及其用途 |
| CN104498383A (zh) * | 2014-05-28 | 2015-04-08 | 西南大学 | 一种可调节肠道运动、预防便秘的发酵乳杆菌Lactobacillus fermentum strain suo及其用途 |
| CN104381440A (zh) * | 2014-07-17 | 2015-03-04 | 西南民族大学 | 发酵乳杆菌Lactobacillus fermentum Lee工作发酵剂制品及其预防便秘保健用途 |
| US11400124B2 (en) | 2016-05-13 | 2022-08-02 | Sofar S.P.A. | Use of probiotics for improving protein absorption |
| US11752179B2 (en) | 2016-06-08 | 2023-09-12 | Alfasigma S.P.A. | Medical use of probiotics |
| US11896631B2 (en) | 2016-12-16 | 2024-02-13 | Alfasigma S.P.A. | Probiotics for use in the treatment of diverticulosis and diverticular disease |
| US11751597B2 (en) | 2019-11-05 | 2023-09-12 | Alfasigma S.P.A. | Compositions comprising bacterial strains for use in increasing the bioavailability of amino acids derived from proteins, and related food product methods and systems |
| EP4161558A4 (en) * | 2020-06-06 | 2024-06-19 | Quorum Innovations, LLC | MATERIALS AND METHODS FOR INHIBITING VIRAL INFECTION, INCLUDING CORONAVIRUS INFECTION |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2002951270A0 (en) | 2002-09-19 |
| JP2005537791A (ja) | 2005-12-15 |
| CA2497989A1 (en) | 2004-03-18 |
| DK1539927T3 (da) | 2009-07-13 |
| ATE426014T1 (de) | 2009-04-15 |
| AU2003258366A1 (en) | 2004-03-29 |
| AU2003258366B2 (en) | 2007-01-25 |
| US20100074878A1 (en) | 2010-03-25 |
| EP1539927A4 (en) | 2005-09-21 |
| NZ538640A (en) | 2007-05-31 |
| WO2004022727A1 (en) | 2004-03-18 |
| BRPI0314060B1 (pt) | 2016-05-10 |
| KR20050057259A (ko) | 2005-06-16 |
| EP1539927A1 (en) | 2005-06-15 |
| US20060067921A1 (en) | 2006-03-30 |
| JP4455333B2 (ja) | 2010-04-21 |
| CA2497989C (en) | 2013-08-27 |
| EP1539927B1 (en) | 2009-03-18 |
| CN100378214C (zh) | 2008-04-02 |
| ES2324532T3 (es) | 2009-08-10 |
| BR0314060A (pt) | 2005-07-19 |
| DE60326738D1 (de) | 2009-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1701116A (zh) | 益生细菌:发酵乳杆菌 | |
| CN1094972C (zh) | 人类来源的乳酸杆菌菌株、它们的组合物及其应用 | |
| CN1308436C (zh) | 作为人体阴道中的益生微生物的乳酸产生细菌 | |
| CN1639317A (zh) | 益生菌唾液乳杆菌菌株 | |
| CN1849388A (zh) | 能够刺激粘膜免疫性的乳酸菌 | |
| CN1444647A (zh) | 宠物食物使用的新益生菌 | |
| CN1556853A (zh) | 益生菌干酪乳杆菌菌株 | |
| CN109929773B (zh) | 一株可用于富硒培养的双歧杆菌及其活性蛋白和应用 | |
| CN1561387A (zh) | 益生菌双歧杆菌菌株 | |
| CN1342196A (zh) | 用于治疗炎性疾病的双歧杆菌 | |
| CN1304313A (zh) | 含乳酸菌的组合物、药物和食物 | |
| CN101076585A (zh) | 细菌株系、包括该细菌株系的组合物和其益生菌用途 | |
| CN1568365A (zh) | 包含戊糖乳杆菌菌株的组合物及其用途 | |
| CN1913906A (zh) | 乳酸产生细菌和肺功能 | |
| CN1867258A (zh) | 一种稳定的液体益生组合物、其制备和应用 | |
| TW200406216A (en) | Novel acid-and bile salt-resistant Lactobacillus isolates having the ability to lower and assimilate cholesterol | |
| CN112218646A (zh) | 一种组合物及其应用 | |
| TWI719947B (zh) | 新穎的醋酸桿菌菌株及葡糖酸醋酸桿菌菌株與其等用於抑制黃嘌呤氧化酶之代謝產物 | |
| CN1511945A (zh) | 乳酸杆菌菌种及其分离选育方法和用途 | |
| JP2011004620A (ja) | ラクトバチルス属菌株及び前記菌株を含有する食品及び医薬品 | |
| JP4471355B2 (ja) | 乳酸菌、乳酸発酵生成物、飼料 | |
| CN1777670A (zh) | 具有产生谷氨酰胺的能力的双歧杆菌属的新菌株 | |
| JP6785324B2 (ja) | α−グルコシダーゼ阻害剤を多量生産するバチルス・リケニフォルミスNY1505菌株 | |
| CN1391905A (zh) | 一种治疗肠道疾病的微生物制剂 | |
| US11045507B2 (en) | Bifidobacterium animalis AMT30 strain and the composition containing the strain of Bifidobacterium animalis AMT30 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1083637 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: WD Ref document number: 1083637 Country of ref document: HK |
|
| CX01 | Expiry of patent term |
Granted publication date: 20080402 |
|
| CX01 | Expiry of patent term |