CN115151548A - 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 - Google Patents
作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 Download PDFInfo
- Publication number
- CN115151548A CN115151548A CN202180016904.1A CN202180016904A CN115151548A CN 115151548 A CN115151548 A CN 115151548A CN 202180016904 A CN202180016904 A CN 202180016904A CN 115151548 A CN115151548 A CN 115151548A
- Authority
- CN
- China
- Prior art keywords
- alkyl
- alkanediyl
- cycloalkyl
- cancer
- moiety
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 102000002689 Toll-like receptor Human genes 0.000 title abstract description 23
- 108020000411 Toll-like receptor Proteins 0.000 title abstract description 23
- 239000000556 agonist Substances 0.000 title abstract description 11
- 108010060825 Toll-Like Receptor 7 Proteins 0.000 title abstract description 7
- 102000008236 Toll-Like Receptor 7 Human genes 0.000 title abstract 2
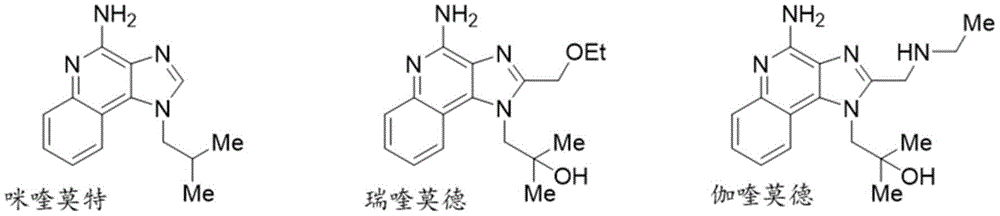
- APXRHPDHORGIEB-UHFFFAOYSA-N 1H-pyrazolo[4,3-d]pyrimidine Chemical class N1=CN=C2C=NNC2=C1 APXRHPDHORGIEB-UHFFFAOYSA-N 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims abstract description 96
- 230000001093 anti-cancer Effects 0.000 claims abstract description 12
- -1 C 2 -C 5 Alkenyl radical Chemical class 0.000 claims description 182
- 125000000217 alkyl group Chemical group 0.000 claims description 113
- 229910052739 hydrogen Inorganic materials 0.000 claims description 36
- 125000003118 aryl group Chemical group 0.000 claims description 32
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 24
- 238000000034 method Methods 0.000 claims description 23
- 206010028980 Neoplasm Diseases 0.000 claims description 22
- 229910052757 nitrogen Inorganic materials 0.000 claims description 16
- 229910052799 carbon Inorganic materials 0.000 claims description 15
- 201000011510 cancer Diseases 0.000 claims description 14
- 125000001072 heteroaryl group Chemical group 0.000 claims description 14
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 13
- 125000001424 substituent group Chemical group 0.000 claims description 13
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 12
- 239000002955 immunomodulating agent Substances 0.000 claims description 11
- 125000006645 (C3-C4) cycloalkyl group Chemical group 0.000 claims description 8
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 7
- 150000001602 bicycloalkyls Chemical group 0.000 claims description 7
- 229910052760 oxygen Inorganic materials 0.000 claims description 7
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 6
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 claims description 5
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 5
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 5
- 229910052731 fluorine Inorganic materials 0.000 claims description 5
- 201000000849 skin cancer Diseases 0.000 claims description 5
- 125000003341 7 membered heterocyclic group Chemical group 0.000 claims description 4
- 229940045513 CTLA4 antagonist Drugs 0.000 claims description 4
- 206010009944 Colon cancer Diseases 0.000 claims description 4
- 201000010536 head and neck cancer Diseases 0.000 claims description 4
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 4
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims description 4
- 206010005003 Bladder cancer Diseases 0.000 claims description 3
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 3
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 3
- 206010025323 Lymphomas Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 206010038389 Renal cancer Diseases 0.000 claims description 3
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 3
- 229960005386 ipilimumab Drugs 0.000 claims description 3
- 201000010982 kidney cancer Diseases 0.000 claims description 3
- 208000014018 liver neoplasm Diseases 0.000 claims description 3
- 201000005202 lung cancer Diseases 0.000 claims description 3
- 208000020816 lung neoplasm Diseases 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- 201000001441 melanoma Diseases 0.000 claims description 3
- 229960003301 nivolumab Drugs 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- 229960002621 pembrolizumab Drugs 0.000 claims description 3
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 3
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims description 2
- 208000017604 Hodgkin disease Diseases 0.000 claims description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 2
- 239000005557 antagonist Substances 0.000 claims description 2
- 206010017758 gastric cancer Diseases 0.000 claims description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 2
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 2
- 201000011549 stomach cancer Diseases 0.000 claims description 2
- 206010044412 transitional cell carcinoma Diseases 0.000 claims description 2
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 2
- 125000001475 halogen functional group Chemical group 0.000 claims 4
- 125000003003 spiro group Chemical group 0.000 claims 4
- 125000006527 (C1-C5) alkyl group Chemical group 0.000 claims 1
- 230000001024 immunotherapeutic effect Effects 0.000 abstract description 5
- 239000012646 vaccine adjuvant Substances 0.000 abstract description 4
- 229940124931 vaccine adjuvant Drugs 0.000 abstract description 4
- 238000011275 oncology therapy Methods 0.000 abstract 1
- 239000011541 reaction mixture Substances 0.000 description 118
- GTCAXTIRRLKXRU-UHFFFAOYSA-N methyl carbamate Chemical compound COC(N)=O GTCAXTIRRLKXRU-UHFFFAOYSA-N 0.000 description 108
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 105
- 239000000243 solution Substances 0.000 description 105
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 86
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 74
- 238000006243 chemical reaction Methods 0.000 description 65
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 63
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 62
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 51
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 50
- 239000012071 phase Substances 0.000 description 48
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical class CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 44
- 238000005481 NMR spectroscopy Methods 0.000 description 43
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 42
- 235000019439 ethyl acetate Nutrition 0.000 description 41
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 41
- 239000012267 brine Substances 0.000 description 37
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 37
- 239000007787 solid Substances 0.000 description 35
- 238000003818 flash chromatography Methods 0.000 description 34
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 32
- 239000000203 mixture Substances 0.000 description 31
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 description 31
- 239000000047 product Substances 0.000 description 30
- 125000006309 butyl amino group Chemical group 0.000 description 29
- 229920006395 saturated elastomer Polymers 0.000 description 28
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 26
- 239000013058 crude material Substances 0.000 description 26
- 239000001257 hydrogen Substances 0.000 description 24
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 23
- 239000002245 particle Substances 0.000 description 22
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 21
- 230000001960 triggered effect Effects 0.000 description 21
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 20
- 239000012074 organic phase Substances 0.000 description 20
- 238000001816 cooling Methods 0.000 description 18
- 239000000543 intermediate Substances 0.000 description 18
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 18
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 17
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 17
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 16
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 15
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 15
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 14
- 125000005843 halogen group Chemical group 0.000 description 14
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 13
- 239000012298 atmosphere Substances 0.000 description 13
- 239000003921 oil Substances 0.000 description 13
- 210000004027 cell Anatomy 0.000 description 12
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 11
- 125000002723 alicyclic group Chemical group 0.000 description 11
- 230000037396 body weight Effects 0.000 description 11
- 238000001023 centrifugal evaporation Methods 0.000 description 11
- 238000005119 centrifugation Methods 0.000 description 11
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 239000000460 chlorine Substances 0.000 description 10
- 125000004093 cyano group Chemical group *C#N 0.000 description 10
- 239000008194 pharmaceutical composition Substances 0.000 description 10
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 9
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 9
- 229910004298 SiO 2 Inorganic materials 0.000 description 9
- 230000004913 activation Effects 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 9
- 239000000872 buffer Substances 0.000 description 9
- 125000004432 carbon atom Chemical group C* 0.000 description 9
- 238000001704 evaporation Methods 0.000 description 9
- 230000008020 evaporation Effects 0.000 description 9
- 150000002431 hydrogen Chemical class 0.000 description 9
- 150000003839 salts Chemical class 0.000 description 9
- 238000003786 synthesis reaction Methods 0.000 description 9
- VXUYXOFXAQZZMF-UHFFFAOYSA-N titanium(IV) isopropoxide Chemical compound CC(C)O[Ti](OC(C)C)(OC(C)C)OC(C)C VXUYXOFXAQZZMF-UHFFFAOYSA-N 0.000 description 9
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 8
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 8
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 8
- 150000001412 amines Chemical class 0.000 description 8
- 230000008878 coupling Effects 0.000 description 8
- 238000010168 coupling process Methods 0.000 description 8
- 238000005859 coupling reaction Methods 0.000 description 8
- 201000010099 disease Diseases 0.000 description 8
- 239000000706 filtrate Substances 0.000 description 8
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 8
- MZRVEZGGRBJDDB-UHFFFAOYSA-N n-Butyllithium Substances [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- 238000011282 treatment Methods 0.000 description 8
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Natural products CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 7
- 125000001931 aliphatic group Chemical group 0.000 description 7
- 125000003342 alkenyl group Chemical group 0.000 description 7
- 125000003545 alkoxy group Chemical group 0.000 description 7
- 238000002648 combination therapy Methods 0.000 description 7
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 7
- 125000001188 haloalkyl group Chemical group 0.000 description 7
- 230000006698 induction Effects 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 6
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 208000035475 disorder Diseases 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 210000000987 immune system Anatomy 0.000 description 6
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 6
- 239000012044 organic layer Substances 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- 208000024891 symptom Diseases 0.000 description 6
- 125000000304 alkynyl group Chemical group 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 239000003153 chemical reaction reagent Substances 0.000 description 5
- 150000004795 grignard reagents Chemical class 0.000 description 5
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 5
- 102000045715 human TLR7 Human genes 0.000 description 5
- 108020004999 messenger RNA Proteins 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 239000011734 sodium Substances 0.000 description 5
- 150000003509 tertiary alcohols Chemical class 0.000 description 5
- OYVFNTSYOCHVOU-UHFFFAOYSA-N (4-bromo-2-methoxyphenyl)methoxy-tert-butyl-dimethylsilane Chemical compound COC1=CC(Br)=CC=C1CO[Si](C)(C)C(C)(C)C OYVFNTSYOCHVOU-UHFFFAOYSA-N 0.000 description 4
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 4
- 239000007818 Grignard reagent Substances 0.000 description 4
- NYHBQMYGNKIUIF-UUOKFMHZSA-N Guanosine Chemical compound C1=NC=2C(=O)NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O NYHBQMYGNKIUIF-UUOKFMHZSA-N 0.000 description 4
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 4
- 108091008036 Immune checkpoint proteins Proteins 0.000 description 4
- 102000037982 Immune checkpoint proteins Human genes 0.000 description 4
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 4
- PBCJIPOGFJYBJE-UHFFFAOYSA-N acetonitrile;hydrate Chemical compound O.CC#N PBCJIPOGFJYBJE-UHFFFAOYSA-N 0.000 description 4
- 125000004414 alkyl thio group Chemical group 0.000 description 4
- 125000005110 aryl thio group Chemical group 0.000 description 4
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 4
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 4
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 4
- 229940125773 compound 10 Drugs 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 4
- 230000009977 dual effect Effects 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 4
- 230000028993 immune response Effects 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 238000001802 infusion Methods 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 244000052769 pathogen Species 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 150000003384 small molecules Chemical class 0.000 description 4
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 4
- 125000006729 (C2-C5) alkenyl group Chemical group 0.000 description 3
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 3
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 3
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 3
- OZAIFHULBGXAKX-VAWYXSNFSA-N AIBN Substances N#CC(C)(C)\N=N\C(C)(C)C#N OZAIFHULBGXAKX-VAWYXSNFSA-N 0.000 description 3
- 102100032814 ATP-dependent zinc metalloprotease YME1L1 Human genes 0.000 description 3
- 108010014726 Interferon Type I Proteins 0.000 description 3
- 102000014150 Interferons Human genes 0.000 description 3
- 108010050904 Interferons Proteins 0.000 description 3
- 208000003445 Mouth Neoplasms Diseases 0.000 description 3
- 101800000795 Proadrenomedullin N-20 terminal peptide Proteins 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 230000003042 antagnostic effect Effects 0.000 description 3
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 description 3
- 235000019445 benzyl alcohol Nutrition 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- 125000001246 bromo group Chemical group Br* 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 3
- OGEBRHQLRGFBNV-RZDIXWSQSA-N chembl2036808 Chemical group C12=NC(NCCCC)=NC=C2C(C=2C=CC(F)=CC=2)=NN1C[C@H]1CC[C@H](N)CC1 OGEBRHQLRGFBNV-RZDIXWSQSA-N 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- IKGLACJFEHSFNN-UHFFFAOYSA-N hydron;triethylazanium;trifluoride Chemical compound F.F.F.CCN(CC)CC IKGLACJFEHSFNN-UHFFFAOYSA-N 0.000 description 3
- 125000002883 imidazolyl group Chemical group 0.000 description 3
- 229940079322 interferon Drugs 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 239000012139 lysis buffer Substances 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 239000003208 petroleum Substances 0.000 description 3
- 229950010773 pidilizumab Drugs 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 238000003753 real-time PCR Methods 0.000 description 3
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 3
- 229950010550 resiquimod Drugs 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 230000004936 stimulating effect Effects 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 125000001544 thienyl group Chemical group 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 229950007217 tremelimumab Drugs 0.000 description 3
- 230000004614 tumor growth Effects 0.000 description 3
- 229960005486 vaccine Drugs 0.000 description 3
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 3
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 2
- STELNDMAIYYQSV-UHFFFAOYSA-N (6-chloro-4-methoxypyridin-3-yl)methanol Chemical compound COC1=CC(Cl)=NC=C1CO STELNDMAIYYQSV-UHFFFAOYSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- YRCJPHJUFOJGOW-UHFFFAOYSA-N 2-chloro-5-(chloromethyl)-4-methoxypyridine Chemical compound COc1cc(Cl)ncc1CCl YRCJPHJUFOJGOW-UHFFFAOYSA-N 0.000 description 2
- WFOVEDJTASPCIR-UHFFFAOYSA-N 3-[(4-methyl-5-pyridin-4-yl-1,2,4-triazol-3-yl)methylamino]-n-[[2-(trifluoromethyl)phenyl]methyl]benzamide Chemical compound N=1N=C(C=2C=CN=CC=2)N(C)C=1CNC(C=1)=CC=CC=1C(=O)NCC1=CC=CC=C1C(F)(F)F WFOVEDJTASPCIR-UHFFFAOYSA-N 0.000 description 2
- WSDTVWXBTRGNDH-UHFFFAOYSA-N 3-methoxy-2-methyl-6-prop-1-en-2-ylpyridine Chemical compound COC1=CC=C(C(C)=C)N=C1C WSDTVWXBTRGNDH-UHFFFAOYSA-N 0.000 description 2
- MVOJMSXNCBJLFJ-UHFFFAOYSA-N 4-(bromomethyl)-3-methoxybenzonitrile Chemical compound COC1=CC(C#N)=CC=C1CBr MVOJMSXNCBJLFJ-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- IYHHRZBKXXKDDY-UHFFFAOYSA-N BI-605906 Chemical compound N=1C=2SC(C(N)=O)=C(N)C=2C(C(F)(F)CC)=CC=1N1CCC(S(C)(=O)=O)CC1 IYHHRZBKXXKDDY-UHFFFAOYSA-N 0.000 description 2
- 206010004593 Bile duct cancer Diseases 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- UHNRLQRZRNKOKU-UHFFFAOYSA-N CCN(CC1=NC2=C(N1)C1=CC=C(C=C1N=C2N)C1=NNC=C1)C(C)=O Chemical compound CCN(CC1=NC2=C(N1)C1=CC=C(C=C1N=C2N)C1=NNC=C1)C(C)=O UHNRLQRZRNKOKU-UHFFFAOYSA-N 0.000 description 2
- 101150013553 CD40 gene Proteins 0.000 description 2
- YKOQAQJRRPVQLW-UHFFFAOYSA-N COC=1C=C(C=CC=1C)C1(COC1)NS(=O)C(C)(C)C Chemical compound COC=1C=C(C=CC=1C)C1(COC1)NS(=O)C(C)(C)C YKOQAQJRRPVQLW-UHFFFAOYSA-N 0.000 description 2
- MIKUYHXYGGJMLM-GIMIYPNGSA-N Crotonoside Natural products C1=NC2=C(N)NC(=O)N=C2N1[C@H]1O[C@@H](CO)[C@H](O)[C@@H]1O MIKUYHXYGGJMLM-GIMIYPNGSA-N 0.000 description 2
- NYHBQMYGNKIUIF-UHFFFAOYSA-N D-guanosine Natural products C1=2NC(N)=NC(=O)C=2N=CN1C1OC(CO)C(O)C1O NYHBQMYGNKIUIF-UHFFFAOYSA-N 0.000 description 2
- 108700039887 Essential Genes Proteins 0.000 description 2
- 101000800483 Homo sapiens Toll-like receptor 8 Proteins 0.000 description 2
- 102000002227 Interferon Type I Human genes 0.000 description 2
- 102100031802 Interferon-induced GTP-binding protein Mx1 Human genes 0.000 description 2
- 229930194542 Keto Natural products 0.000 description 2
- 206010023825 Laryngeal cancer Diseases 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- CZPKOGBNXPNRGN-UHFFFAOYSA-N N(=[N+]=[N-])C(C)(C)C1=CC=C(C(=N1)C)OC Chemical compound N(=[N+]=[N-])C(C)(C)C1=CC=C(C(=N1)C)OC CZPKOGBNXPNRGN-UHFFFAOYSA-N 0.000 description 2
- POFVJRKJJBFPII-UHFFFAOYSA-N N-cyclopentyl-5-[2-[[5-[(4-ethylpiperazin-1-yl)methyl]pyridin-2-yl]amino]-5-fluoropyrimidin-4-yl]-4-methyl-1,3-thiazol-2-amine Chemical compound C1(CCCC1)NC=1SC(=C(N=1)C)C1=NC(=NC=C1F)NC1=NC=C(C=C1)CN1CCN(CC1)CC POFVJRKJJBFPII-UHFFFAOYSA-N 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- 229940124614 TLR 8 agonist Drugs 0.000 description 2
- 102100033110 Toll-like receptor 8 Human genes 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 2
- 208000006593 Urologic Neoplasms Diseases 0.000 description 2
- MOGQALDOFMBQQJ-UHFFFAOYSA-N [Si](C)(C)(C(C)(C)C)OCC1=C(C=C(C=C1)C1(CCC1)O)OC Chemical compound [Si](C)(C)(C(C)(C)C)OCC1=C(C=C(C=C1)C1(CCC1)O)OC MOGQALDOFMBQQJ-UHFFFAOYSA-N 0.000 description 2
- QPMKCIUFJDJDRW-UHFFFAOYSA-N [Si](C)(C)(C(C)(C)C)OCC1=C(C=C(C=C1)C1(CN(C1)C(=O)OCC1=CC=CC=C1)O)OC Chemical compound [Si](C)(C)(C(C)(C)C)OCC1=C(C=C(C=C1)C1(CN(C1)C(=O)OCC1=CC=CC=C1)O)OC QPMKCIUFJDJDRW-UHFFFAOYSA-N 0.000 description 2
- QAKUUINRYMVIEJ-UHFFFAOYSA-N [Si](C)(C)(C(C)(C)C)OCC1=C(C=C(C=C1)C1(COC1)O)OC Chemical compound [Si](C)(C)(C(C)(C)C)OCC1=C(C=C(C=C1)C1(COC1)O)OC QAKUUINRYMVIEJ-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- QBYJBZPUGVGKQQ-SJJAEHHWSA-N aldrin Chemical compound C1[C@H]2C=C[C@@H]1[C@H]1[C@@](C3(Cl)Cl)(Cl)C(Cl)=C(Cl)[C@@]3(Cl)[C@H]12 QBYJBZPUGVGKQQ-SJJAEHHWSA-N 0.000 description 2
- 125000002877 alkyl aryl group Chemical group 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 235000011114 ammonium hydroxide Nutrition 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 229950002916 avelumab Drugs 0.000 description 2
- FKSYYQMXMYAMOE-UHFFFAOYSA-N azetidin-3-yl acetate Chemical compound CC(=O)OC1CNC1 FKSYYQMXMYAMOE-UHFFFAOYSA-N 0.000 description 2
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 2
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 2
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 2
- 208000026900 bile duct neoplasm Diseases 0.000 description 2
- 239000004305 biphenyl Substances 0.000 description 2
- 235000010290 biphenyl Nutrition 0.000 description 2
- HQABUPZFAYXKJW-UHFFFAOYSA-N butan-1-amine Chemical compound CCCCN HQABUPZFAYXKJW-UHFFFAOYSA-N 0.000 description 2
- 238000002619 cancer immunotherapy Methods 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 208000006990 cholangiocarcinoma Diseases 0.000 description 2
- 229910052681 coesite Inorganic materials 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 229910052906 cristobalite Inorganic materials 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 125000000392 cycloalkenyl group Chemical group 0.000 description 2
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 241001493065 dsRNA viruses Species 0.000 description 2
- 229950009791 durvalumab Drugs 0.000 description 2
- 229950005627 embonate Drugs 0.000 description 2
- 150000002085 enols Chemical group 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 229950001109 galiximab Drugs 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 229940029575 guanosine Drugs 0.000 description 2
- 208000024348 heart neoplasm Diseases 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000002799 interferon inducing agent Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- FWXIZVVTJVNNRX-UHFFFAOYSA-H iron(3+);oxalate;hexahydrate Chemical compound O.O.O.O.O.O.[Fe+3].[Fe+3].[O-]C(=O)C([O-])=O.[O-]C(=O)C([O-])=O.[O-]C(=O)C([O-])=O FWXIZVVTJVNNRX-UHFFFAOYSA-H 0.000 description 2
- 125000000468 ketone group Chemical group 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 206010023841 laryngeal neoplasm Diseases 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 238000004811 liquid chromatography Methods 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- FRIJBUGBVQZNTB-UHFFFAOYSA-M magnesium;ethane;bromide Chemical compound [Mg+2].[Br-].[CH2-]C FRIJBUGBVQZNTB-UHFFFAOYSA-M 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- CRTSQMSTPZTUDW-UHFFFAOYSA-N methyl 6-chloro-4-methoxypyridine-3-carboxylate Chemical compound COC(=O)C1=CN=C(Cl)C=C1OC CRTSQMSTPZTUDW-UHFFFAOYSA-N 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- YHJXPVYNNYIEDO-UHFFFAOYSA-N oxetan-3-yl acetate Chemical compound CC(=O)OC1COC1 YHJXPVYNNYIEDO-UHFFFAOYSA-N 0.000 description 2
- 125000003566 oxetanyl group Chemical group 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000010926 purge Methods 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 229910000033 sodium borohydride Inorganic materials 0.000 description 2
- 239000012279 sodium borohydride Substances 0.000 description 2
- 238000001228 spectrum Methods 0.000 description 2
- 238000010186 staining Methods 0.000 description 2
- 229910052682 stishovite Inorganic materials 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000004797 therapeutic response Effects 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 229910052905 tridymite Inorganic materials 0.000 description 2
- MWKJTNBSKNUMFN-UHFFFAOYSA-N trifluoromethyltrimethylsilane Chemical compound C[Si](C)(C)C(F)(F)F MWKJTNBSKNUMFN-UHFFFAOYSA-N 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- 230000010472 type I IFN response Effects 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- JPSHPWJJSVEEAX-OWPBQMJCSA-N (2s)-2-amino-4-fluoranylpentanedioic acid Chemical compound OC(=O)[C@@H](N)CC([18F])C(O)=O JPSHPWJJSVEEAX-OWPBQMJCSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- HBEIHPSICGGZIF-UHFFFAOYSA-N (4-bromo-2-methoxyphenyl)methanol Chemical compound COC1=CC(Br)=CC=C1CO HBEIHPSICGGZIF-UHFFFAOYSA-N 0.000 description 1
- AZVWIMLQRLKLHH-UHFFFAOYSA-N (5-methyl-1,2-oxazol-3-yl)methanamine Chemical compound CC1=CC(CN)=NO1 AZVWIMLQRLKLHH-UHFFFAOYSA-N 0.000 description 1
- 125000006656 (C2-C4) alkenyl group Chemical group 0.000 description 1
- 125000006650 (C2-C4) alkynyl group Chemical group 0.000 description 1
- 125000006730 (C2-C5) alkynyl group Chemical group 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- ZKSRIPVNRIUEOM-UHFFFAOYSA-N 1,2-dihydropyrazolo[4,3-d]pyrimidin-3-one Chemical compound N1=CN=C2C(O)=NNC2=C1 ZKSRIPVNRIUEOM-UHFFFAOYSA-N 0.000 description 1
- IGERFAHWSHDDHX-UHFFFAOYSA-N 1,3-dioxanyl Chemical group [CH]1OCCCO1 IGERFAHWSHDDHX-UHFFFAOYSA-N 0.000 description 1
- JPRPJUMQRZTTED-UHFFFAOYSA-N 1,3-dioxolanyl Chemical group [CH]1OCCO1 JPRPJUMQRZTTED-UHFFFAOYSA-N 0.000 description 1
- 125000005940 1,4-dioxanyl group Chemical group 0.000 description 1
- 125000001140 1,4-phenylene group Chemical group [H]C1=C([H])C([*:2])=C([H])C([H])=C1[*:1] 0.000 description 1
- FHJATBIERQTCTN-UHFFFAOYSA-N 1-[4-amino-2-(ethylaminomethyl)imidazo[4,5-c]quinolin-1-yl]-2-methylpropan-2-ol Chemical compound C1=CC=CC2=C(N(C(CNCC)=N3)CC(C)(C)O)C3=C(N)N=C21 FHJATBIERQTCTN-UHFFFAOYSA-N 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- ITIRVXDSMXFTPW-UHFFFAOYSA-N 1H-imidazo[4,5-c]quinoline Chemical group C1=CC=CC2=C(NC=N3)C3=CN=C21 ITIRVXDSMXFTPW-UHFFFAOYSA-N 0.000 description 1
- VWXIHLCLIOQWRA-UHFFFAOYSA-N 1h-pteridin-2-one Chemical class N1=CC=NC2=NC(O)=NC=C21 VWXIHLCLIOQWRA-UHFFFAOYSA-N 0.000 description 1
- AQQSXKSWTNWXKR-UHFFFAOYSA-N 2-(2-phenylphenanthro[9,10-d]imidazol-3-yl)acetic acid Chemical compound C1(=CC=CC=C1)C1=NC2=C(N1CC(=O)O)C1=CC=CC=C1C=1C=CC=CC=12 AQQSXKSWTNWXKR-UHFFFAOYSA-N 0.000 description 1
- KFXDYZXVIHNBFD-UHFFFAOYSA-N 2-(thian-2-ylsulfonyl)thiane Chemical compound C1CCCSC1S(=O)(=O)C1CCCCS1 KFXDYZXVIHNBFD-UHFFFAOYSA-N 0.000 description 1
- YMZPQKXPKZZSFV-CPWYAANMSA-N 2-[3-[(1r)-1-[(2s)-1-[(2s)-2-[(1r)-cyclohex-2-en-1-yl]-2-(3,4,5-trimethoxyphenyl)acetyl]piperidine-2-carbonyl]oxy-3-(3,4-dimethoxyphenyl)propyl]phenoxy]acetic acid Chemical compound C1=C(OC)C(OC)=CC=C1CC[C@H](C=1C=C(OCC(O)=O)C=CC=1)OC(=O)[C@H]1N(C(=O)[C@@H]([C@H]2C=CCCC2)C=2C=C(OC)C(OC)=C(OC)C=2)CCCC1 YMZPQKXPKZZSFV-CPWYAANMSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- FMGIAMOOHWQISI-UHFFFAOYSA-N 3-(bromomethyl)-4-methoxybenzonitrile Chemical compound COC1=CC=C(C#N)C=C1CBr FMGIAMOOHWQISI-UHFFFAOYSA-N 0.000 description 1
- DTBKKESEAXYGMM-UHFFFAOYSA-N 3-bromo-2h-pyrazolo[4,3-d]pyrimidine Chemical compound N1=CN=C2C(Br)=NNC2=C1 DTBKKESEAXYGMM-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- ROADCYAOHVSOLQ-UHFFFAOYSA-N 3-oxetanone Chemical compound O=C1COC1 ROADCYAOHVSOLQ-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- 108010082808 4-1BB Ligand Proteins 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- VFOKSTCIRGDTBR-UHFFFAOYSA-N 4-amino-2-butoxy-8-[[3-(pyrrolidin-1-ylmethyl)phenyl]methyl]-5,7-dihydropteridin-6-one Chemical compound C12=NC(OCCCC)=NC(N)=C2NC(=O)CN1CC(C=1)=CC=CC=1CN1CCCC1 VFOKSTCIRGDTBR-UHFFFAOYSA-N 0.000 description 1
- SJISCEAZUHNOMD-UHFFFAOYSA-N 4-phenylcyclohexan-1-amine Chemical class C1CC(N)CCC1C1=CC=CC=C1 SJISCEAZUHNOMD-UHFFFAOYSA-N 0.000 description 1
- MZRUFMBFIKGOAL-UHFFFAOYSA-N 5-nitro-1h-pyrazole Chemical compound [O-][N+](=O)C1=CC=NN1 MZRUFMBFIKGOAL-UHFFFAOYSA-N 0.000 description 1
- WFSSNYXARPONJV-UHFFFAOYSA-N 6-aminopurin-8-one Chemical class NC1=NC=NC2=NC(=O)N=C12 WFSSNYXARPONJV-UHFFFAOYSA-N 0.000 description 1
- HUBRRMYRFLDKED-UHFFFAOYSA-N 6-bromo-3-methoxy-2-methylpyridine Chemical compound COC1=CC=C(Br)N=C1C HUBRRMYRFLDKED-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical compound CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- 102100031934 Adhesion G-protein coupled receptor G1 Human genes 0.000 description 1
- 208000006468 Adrenal Cortex Neoplasms Diseases 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 230000003844 B-cell-activation Effects 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- NUDVEYRRUZNWSB-UHFFFAOYSA-N C(C)(=O)OC1(CN(C1)C(=O)OCC1=CC=CC=C1)C1=CC(=C(C=C1)CO)OC Chemical compound C(C)(=O)OC1(CN(C1)C(=O)OCC1=CC=CC=C1)C1=CC(=C(C=C1)CO)OC NUDVEYRRUZNWSB-UHFFFAOYSA-N 0.000 description 1
- WAQMPUOKAQEIHC-NDEPHWFRSA-N C(C)(C)(C)[Si](OCC[C@H](CC)NC=1C2=C(N=C(N=1)NC(OC)=O)C=NN2CC1=C(C=C(C=C1)C#N)OC)(C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound C(C)(C)(C)[Si](OCC[C@H](CC)NC=1C2=C(N=C(N=1)NC(OC)=O)C=NN2CC1=C(C=C(C=C1)C#N)OC)(C1=CC=CC=C1)C1=CC=CC=C1 WAQMPUOKAQEIHC-NDEPHWFRSA-N 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 102100036008 CD48 antigen Human genes 0.000 description 1
- 101150028299 CD69 gene Proteins 0.000 description 1
- 102100025221 CD70 antigen Human genes 0.000 description 1
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 1
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- 206010007275 Carcinoid tumour Diseases 0.000 description 1
- 206010007279 Carcinoid tumour of the gastrointestinal tract Diseases 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 239000004381 Choline salt Substances 0.000 description 1
- 201000009047 Chordoma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 208000009798 Craniopharyngioma Diseases 0.000 description 1
- 101710093674 Cyclic nucleotide-gated cation channel beta-1 Proteins 0.000 description 1
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 108010067770 Endopeptidase K Proteins 0.000 description 1
- 206010014967 Ependymoma Diseases 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 235000004694 Eucalyptus leucoxylon Nutrition 0.000 description 1
- 244000166102 Eucalyptus leucoxylon Species 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 201000001342 Fallopian tube cancer Diseases 0.000 description 1
- 208000013452 Fallopian tube neoplasm Diseases 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 108010001498 Galectin 1 Proteins 0.000 description 1
- 102100021736 Galectin-1 Human genes 0.000 description 1
- 102100031351 Galectin-9 Human genes 0.000 description 1
- 101710121810 Galectin-9 Proteins 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 1
- 208000021309 Germ cell tumor Diseases 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 239000007821 HATU Substances 0.000 description 1
- 108010007712 Hepatitis A Virus Cellular Receptor 1 Proteins 0.000 description 1
- 102100034459 Hepatitis A virus cellular receptor 1 Human genes 0.000 description 1
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 1
- 101710083479 Hepatitis A virus cellular receptor 2 homolog Proteins 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000775042 Homo sapiens Adhesion G-protein coupled receptor G1 Proteins 0.000 description 1
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000716130 Homo sapiens CD48 antigen Proteins 0.000 description 1
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 1
- 101001019455 Homo sapiens ICOS ligand Proteins 0.000 description 1
- 101001138062 Homo sapiens Leukocyte-associated immunoglobulin-like receptor 1 Proteins 0.000 description 1
- 101001023712 Homo sapiens Nectin-3 Proteins 0.000 description 1
- 101001067833 Homo sapiens Peptidyl-prolyl cis-trans isomerase A Proteins 0.000 description 1
- 101000596234 Homo sapiens T-cell surface protein tactile Proteins 0.000 description 1
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 1
- 101000763579 Homo sapiens Toll-like receptor 1 Proteins 0.000 description 1
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 description 1
- 101000831496 Homo sapiens Toll-like receptor 3 Proteins 0.000 description 1
- 101000764622 Homo sapiens Transmembrane and immunoglobulin domain-containing protein 2 Proteins 0.000 description 1
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 1
- 101000679903 Homo sapiens Tumor necrosis factor receptor superfamily member 25 Proteins 0.000 description 1
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 1
- 238000009015 Human TaqMan MicroRNA Assay kit Methods 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 102100034980 ICOS ligand Human genes 0.000 description 1
- 101150008572 Ifit3 gene Proteins 0.000 description 1
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 102100027302 Interferon-induced protein with tetratricopeptide repeats 3 Human genes 0.000 description 1
- 241000764238 Isis Species 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 102000017578 LAG3 Human genes 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 101150030213 Lag3 gene Proteins 0.000 description 1
- 102100020943 Leukocyte-associated immunoglobulin-like receptor 1 Human genes 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- 206010062038 Lip neoplasm Diseases 0.000 description 1
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 1
- 101150112867 MX1 gene Proteins 0.000 description 1
- 208000032271 Malignant tumor of penis Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 208000002030 Merkel cell carcinoma Diseases 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101000574441 Mus musculus Alkaline phosphatase, germ cell type Proteins 0.000 description 1
- 101100286562 Mus musculus Ifit1 gene Proteins 0.000 description 1
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 1
- 101000597780 Mus musculus Tumor necrosis factor ligand superfamily member 18 Proteins 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical class CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 125000004633 N-oxo-pyridyl group Chemical group 0.000 description 1
- KCTZOTUQSGYWLV-UHFFFAOYSA-N N1C=NC=C2N=CC=C21 Chemical compound N1C=NC=C2N=CC=C21 KCTZOTUQSGYWLV-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- 102100035487 Nectin-3 Human genes 0.000 description 1
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 102000004473 OX40 Ligand Human genes 0.000 description 1
- 108010042215 OX40 Ligand Proteins 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 101150056612 PPIA gene Proteins 0.000 description 1
- 101150003085 Pdcl gene Proteins 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 102100034539 Peptidyl-prolyl cis-trans isomerase A Human genes 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 description 1
- 206010034811 Pharyngeal cancer Diseases 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 1
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 1
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 1
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 208000008938 Rhabdoid tumor Diseases 0.000 description 1
- 206010073334 Rhabdoid tumour Diseases 0.000 description 1
- 208000004337 Salivary Gland Neoplasms Diseases 0.000 description 1
- 206010061934 Salivary gland cancer Diseases 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 102100039367 T-cell immunoglobulin and mucin domain-containing protein 4 Human genes 0.000 description 1
- 101710174757 T-cell immunoglobulin and mucin domain-containing protein 4 Proteins 0.000 description 1
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 description 1
- 102100035268 T-cell surface protein tactile Human genes 0.000 description 1
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108700012920 TNF Proteins 0.000 description 1
- JXASPPWQHFOWPL-UHFFFAOYSA-N Tamarixin Natural products C1=C(O)C(OC)=CC=C1C1=C(OC2C(C(O)C(O)C(CO)O2)O)C(=O)C2=C(O)C=C(O)C=C2O1 JXASPPWQHFOWPL-UHFFFAOYSA-N 0.000 description 1
- 206010043276 Teratoma Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 108010060752 Toll-Like Receptor 8 Proteins 0.000 description 1
- 102100027010 Toll-like receptor 1 Human genes 0.000 description 1
- 102100024333 Toll-like receptor 2 Human genes 0.000 description 1
- 102100024324 Toll-like receptor 3 Human genes 0.000 description 1
- 102100025946 Transforming growth factor beta activator LRRC32 Human genes 0.000 description 1
- 101710169732 Transforming growth factor beta activator LRRC32 Proteins 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- 102100026224 Transmembrane and immunoglobulin domain-containing protein 2 Human genes 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 102100035283 Tumor necrosis factor ligand superfamily member 18 Human genes 0.000 description 1
- 102100032101 Tumor necrosis factor ligand superfamily member 9 Human genes 0.000 description 1
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 1
- 102100022203 Tumor necrosis factor receptor superfamily member 25 Human genes 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- BSMKBMRFFXSALR-SFHVURJKSA-N [Si](C1=CC=CC=C1)(C1=CC=CC=C1)(C(C)(C)C)OCC[C@H](CC)N Chemical compound [Si](C1=CC=CC=C1)(C1=CC=CC=C1)(C(C)(C)C)OCC[C@H](CC)N BSMKBMRFFXSALR-SFHVURJKSA-N 0.000 description 1
- PMYGAYBSCSJNTR-LJAQVGFWSA-N [Si](C1=CC=CC=C1)(C1=CC=CC=C1)(C(C)(C)C)OCC[C@H](CCC)NC=1C2=C(N=C(N=1)NC(OC)=O)C=NN2CC1=C(C=CC(=C1)C#N)OC Chemical compound [Si](C1=CC=CC=C1)(C1=CC=CC=C1)(C(C)(C)C)OCC[C@H](CCC)NC=1C2=C(N=C(N=1)NC(OC)=O)C=NN2CC1=C(C=CC(=C1)C#N)OC PMYGAYBSCSJNTR-LJAQVGFWSA-N 0.000 description 1
- 125000004062 acenaphthenyl group Chemical group C1(CC2=CC=CC3=CC=CC1=C23)* 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 230000008484 agonism Effects 0.000 description 1
- 230000001270 agonistic effect Effects 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 230000001668 ameliorated effect Effects 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 230000005975 antitumor immune response Effects 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 208000021780 appendiceal neoplasm Diseases 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 125000005018 aryl alkenyl group Chemical group 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 125000005015 aryl alkynyl group Chemical group 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 1
- 229960003852 atezolizumab Drugs 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000004069 aziridinyl group Chemical group 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- JUHORIMYRDESRB-UHFFFAOYSA-N benzathine Chemical class C=1C=CC=CC=1CNCCNCC1=CC=CC=C1 JUHORIMYRDESRB-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- VLMMTGKGDOAYER-UHFFFAOYSA-N benzyl 3-oxoazetidine-1-carboxylate Chemical compound C1C(=O)CN1C(=O)OCC1=CC=CC=C1 VLMMTGKGDOAYER-UHFFFAOYSA-N 0.000 description 1
- WXOQIRHYGZFGBS-UHFFFAOYSA-N benzyl azetidine-1-carboxylate Chemical compound C1CCN1C(=O)OCC1=CC=CC=C1 WXOQIRHYGZFGBS-UHFFFAOYSA-N 0.000 description 1
- KCXMKQUNVWSEMD-UHFFFAOYSA-N benzyl chloride Chemical compound ClCC1=CC=CC=C1 KCXMKQUNVWSEMD-UHFFFAOYSA-N 0.000 description 1
- 229940073608 benzyl chloride Drugs 0.000 description 1
- 150000005347 biaryls Chemical group 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 238000012925 biological evaluation Methods 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 230000031709 bromination Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 230000000711 cancerogenic effect Effects 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 208000002458 carcinoid tumor Diseases 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 235000019417 choline salt Nutrition 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 238000011220 combination immunotherapy Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940125961 compound 24 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 description 1
- 125000002944 cyanoaryl group Chemical group 0.000 description 1
- 125000002993 cycloalkylene group Chemical group 0.000 description 1
- SHQSVMDWKBRBGB-UHFFFAOYSA-N cyclobutanone Chemical compound O=C1CCC1 SHQSVMDWKBRBGB-UHFFFAOYSA-N 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 229950007409 dacetuzumab Drugs 0.000 description 1
- 229960002806 daclizumab Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 125000005265 dialkylamine group Chemical group 0.000 description 1
- 125000005509 dibenzothiophenyl group Chemical group 0.000 description 1
- 150000005332 diethylamines Chemical class 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 229940056913 eftilagimod alfa Drugs 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000012520 frozen sample Substances 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 229940124670 gardiquimod Drugs 0.000 description 1
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 1
- 238000003881 globally optimized alternating phase rectangular pulse Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 201000009277 hairy cell leukemia Diseases 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 201000010235 heart cancer Diseases 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 208000002672 hepatitis B Diseases 0.000 description 1
- 125000005549 heteroarylene group Chemical group 0.000 description 1
- 125000004366 heterocycloalkenyl group Chemical group 0.000 description 1
- 125000006588 heterocycloalkylene group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 239000012456 homogeneous solution Substances 0.000 description 1
- 102000045720 human TLR8 Human genes 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- USZLCYNVCCDPLQ-UHFFFAOYSA-N hydron;n-methoxymethanamine;chloride Chemical compound Cl.CNOC USZLCYNVCCDPLQ-UHFFFAOYSA-N 0.000 description 1
- 201000006866 hypopharynx cancer Diseases 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 229940045207 immuno-oncology agent Drugs 0.000 description 1
- 239000002584 immunological anticancer agent Substances 0.000 description 1
- 230000003308 immunostimulating effect Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 230000011488 interferon-alpha production Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 102000027411 intracellular receptors Human genes 0.000 description 1
- 108091008582 intracellular receptors Proteins 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229940099584 lactobionate Drugs 0.000 description 1
- JYTUSYBCFIZPBE-AMTLMPIISA-N lactobionic acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O JYTUSYBCFIZPBE-AMTLMPIISA-N 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 201000006721 lip cancer Diseases 0.000 description 1
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 1
- 229910003002 lithium salt Inorganic materials 0.000 description 1
- 159000000002 lithium salts Chemical class 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- CCERQOYLJJULMD-UHFFFAOYSA-M magnesium;carbanide;chloride Chemical compound [CH3-].[Mg+2].[Cl-] CCERQOYLJJULMD-UHFFFAOYSA-M 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 238000001465 metallisation Methods 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 230000001394 metastastic effect Effects 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- JEJMDUMJSZTJTI-UHFFFAOYSA-N methyl 4,6-dichloropyridine-3-carboxylate Chemical compound COC(=O)C1=CN=C(Cl)C=C1Cl JEJMDUMJSZTJTI-UHFFFAOYSA-N 0.000 description 1
- XMJHPCRAQCTCFT-UHFFFAOYSA-N methyl chloroformate Chemical compound COC(Cl)=O XMJHPCRAQCTCFT-UHFFFAOYSA-N 0.000 description 1
- KHBXLYPOXVQKJG-UHFFFAOYSA-N methyl n-[(methoxycarbonylamino)-methylsulfanylmethylidene]carbamate Chemical compound COC(=O)NC(SC)=NC(=O)OC KHBXLYPOXVQKJG-UHFFFAOYSA-N 0.000 description 1
- JZMJDSHXVKJFKW-UHFFFAOYSA-M methyl sulfate(1-) Chemical compound COS([O-])(=O)=O JZMJDSHXVKJFKW-UHFFFAOYSA-M 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 238000003032 molecular docking Methods 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- DAZSWUUAFHBCGE-KRWDZBQOSA-N n-[(2s)-3-methyl-1-oxo-1-pyrrolidin-1-ylbutan-2-yl]-3-phenylpropanamide Chemical compound N([C@@H](C(C)C)C(=O)N1CCCC1)C(=O)CCC1=CC=CC=C1 DAZSWUUAFHBCGE-KRWDZBQOSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 201000008106 ocular cancer Diseases 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000003356 phenylsulfanyl group Chemical group [*]SC1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000004885 piperazines Chemical class 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000002953 preparative HPLC Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- YAAWASYJIRZXSZ-UHFFFAOYSA-N pyrimidine-2,4-diamine Chemical class NC1=CC=NC(N)=N1 YAAWASYJIRZXSZ-UHFFFAOYSA-N 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 150000003248 quinolines Chemical class 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 201000002314 small intestine cancer Diseases 0.000 description 1
- 229940126586 small molecule drug Drugs 0.000 description 1
- KSAVQLQVUXSOCR-UHFFFAOYSA-M sodium lauroyl sarcosinate Chemical compound [Na+].CCCCCCCCCCCC(=O)N(C)CC([O-])=O KSAVQLQVUXSOCR-UHFFFAOYSA-M 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- TYFQFVWCELRYAO-UHFFFAOYSA-L suberate(2-) Chemical compound [O-]C(=O)CCCCCCC([O-])=O TYFQFVWCELRYAO-UHFFFAOYSA-L 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- QAZLUNIWYYOJPC-UHFFFAOYSA-M sulfenamide Chemical compound [Cl-].COC1=C(C)C=[N+]2C3=NC4=CC=C(OC)C=C4N3SCC2=C1C QAZLUNIWYYOJPC-UHFFFAOYSA-M 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- BCNZYOJHNLTNEZ-UHFFFAOYSA-N tert-butyldimethylsilyl chloride Chemical compound CC(C)(C)[Si](C)(C)Cl BCNZYOJHNLTNEZ-UHFFFAOYSA-N 0.000 description 1
- 125000000037 tert-butyldiphenylsilyl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1[Si]([H])([*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000006092 tetrahydro-1,1-dioxothienyl group Chemical group 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical class C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 125000002053 thietanyl group Chemical group 0.000 description 1
- WCNFFKHKJLERFM-UHFFFAOYSA-N thiomorpholinyl sulfone group Chemical group N1(CCSCC1)S(=O)(=O)N1CCSCC1 WCNFFKHKJLERFM-UHFFFAOYSA-N 0.000 description 1
- ZCAGUOCUDGWENZ-UHFFFAOYSA-N thiomorpholinyl sulfoxide group Chemical group N1(CCSCC1)S(=O)N1CCSCC1 ZCAGUOCUDGWENZ-UHFFFAOYSA-N 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 239000003970 toll like receptor agonist Substances 0.000 description 1
- YXFVVABEGXRONW-UHFFFAOYSA-N toluene Substances CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical class OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229950003036 vesatolimod Drugs 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000013389 whole blood assay Methods 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
根据式I或II的化合物可用作Toll样受体7(TLR7)的激动剂。(I)(II)此类化合物能够用于癌症治疗,尤其是与抗癌免疫治疗剂组合,或者用作疫苗佐剂。
Description
相关申请的交叉引用
本申请根据35U.S.C.§119(e)要求2020年7月29日提交的美国临时申请序列号63/058230和2020年1月27日提交的美国临时申请序列号62/966144的权益;将其公开内容通过引用并入本文。
背景技术
本公开文本涉及Toll样受体7(“TLR7”)激动剂及其缀合物以及此类激动剂及其缀合物的制备和使用方法。
Toll样受体(“TLR”)是识别病原体相关分子模式(“PAMP”)的受体,所述病原体相关分子模式是在某些种类的病原体中保守的小分子基序。TLR可以位于细胞表面或细胞内。通过结合其同源PAMP而激活TLR传递了宿主内存在相关病原体(即,感染)的信号并且刺激宿主的免疫系统以抵抗感染。人具有10种TLR,称为TLR1、TLR2、TLR3等。
通过激动剂激活TLR(其中TLR7是研究最多的)可以对疫苗和免疫治疗剂通过刺激总体免疫应答而在治疗除实际病原体感染以外的多种病症中的作用产生积极效果。因此,对TLR7激动剂在癌症免疫疗法中作为疫苗佐剂或作为增强剂的用途存在很大兴趣。参见例如,Vasilakos和Tomai 2013,Sato-Kaneko等人2017,Smits等人2008以及Ota等人2019。
TLR7(位于内体膜上的细胞内受体)识别与单链RNA病毒相关的PAMP。它的激活诱导I型干扰素(诸如IFNα和IFNβ)的分泌(Lund等人2004)。TLR7具有两个结合位点,一个用于单链RNA配体(等人2007),并且一个用于小分子诸如鸟苷(Zhang等人2016)。
TLR7可以与基于1H-咪唑并[4,5-c]喹啉骨架的鸟苷样合成激动剂(诸如咪喹莫特、瑞喹莫德和伽喹莫德(gardiquimod))结合并且被其激活。关于小分子TLR7激动剂的综述,参见Cortez和Va 2018。
基于喋啶酮分子骨架的合成TLR7激动剂也是已知的,如由维沙莫德(vesatolimod)所例示的(Desai等人2015)。
已经公开了经常根据通式(A)的基于嘌呤样骨架的其他合成TLR7激动剂:
其中R、R’和R”是结构变量,其中R”通常含有未经取代的或经取代的芳族或杂芳族环。
具有嘌呤样骨架的生物活性分子及其在治疗诸如纤维化、炎症性障碍、癌症或病原性感染的病症中的用途的公开文本包括:Akinbobuyi等人2015和2016;Barberis等人2012;Carson等人2014;Ding等人2016,2017a和2017b;Graupe等人2015;Hashimoto等人2009;He等人2019a和2019b;Holldack等人2012;Isobe等人2009a和2012;Poudel等人2019a和2019b;Pryde 2010;以及Young等人2019。
基团R”可以是吡啶基:Bonfanti等人2015a和2015b;Halcomb等人2015;Hirota等人2000;Isobe等人2002,2004,2006,2009a,2009b,2011和2012;Kasibhatla等人2007;Koga-Yamakawa等人2013;Musmuca等人2009;Nakamura 2012;Ogita等人2007;以及Yu等人2013。
存在式(A)的6,5-稠合环系统(即与咪唑五元环稠合的嘧啶六元环)被修饰的相关分子的公开文本。(a)Dellaria等人2007,Jones等人2010和2012,以及Pilatte等人2017披露了嘧啶环被吡啶环替代的化合物。(b)Chen等人2011,Coe等人2017,Poudel等人2020a和2020b,以及Zhang等人2018披露了咪唑环被吡唑环替代的化合物。(c)Cortez等人2017和2018;Li等人2018;以及McGowan等人2016a,2016b和2017披露了咪唑环被吡咯环替代的化合物。
Bonfanti等人2015b和2016以及Purandare等人2019披露了大环跨越嘌呤部分的两个环的TLR7调节剂:
TLR7激动剂可以与配偶体分子缀合,所述配偶体分子可以是例如磷脂、聚(乙二醇)(“PEG”)、抗体或另一种TLR(通常是TLR2)。示例性公开文本包括:Carson等人2013,2015和2016,Chan等人2009和2011,Cortez等人2017,Gadd等人2015,Lioux等人2016,Maj等人2015,Vernejoul等人2014,以及Zurawski等人2012。频繁的缀合位点是在式(A)的R”基团处。
Jensen等人2015披露了阳离子脂质媒介物用于递送TLR7激动剂的用途。
一些TLR7激动剂(包括瑞喹莫德)是双重TLR7/TLR8激动剂。参见例如,Beesu等人2017,Embrechts等人2018,Lioux等人2016,以及Vernejoul等人2014。
本说明书的结尾处列出了通过第一作者或发明人和年份对本文中引用的文献的完全引用。
发明内容
本说明书涉及具有1H-吡唑并[4,3d]嘧啶芳族系统的化合物,其具有作为TLR7激动剂的活性。
在一个方面,提供了一种具有根据式(I)或(II)的结构的化合物
其中
每个X独立地是N或CR2;
R1是(C1-C5烷基)、
(C2-C5烯基)、
(C1-C8烷二基)0-1(C3-C6环烷基)、
(C1-C8烷二基)0-1(C5-C10螺烷基)、
(C2-C8烷二基)OH、
(C2-C8烷二基)O(C1-C3烷基)、
(C1-C4烷二基)0-1(5-6元杂芳基)、
(C1-C4烷二基)0-1苯基、
(C1-C4烷二基)CF3、
(C2-C8烷二基)N[C(=O)](C1-C3烷基)、
或
(C2-C8烷二基)NRxRy;
每个R2独立地是H、O(C1-C3烷基)、S(C1-C3烷基)、SO2(C1-C3烷基)、C1-C3烷基、O(C3-C4环烷基)、S(C3-C4环烷基)、SO2(C3-C4环烷基)、C3-C4环烷基、Cl、F、CN或[C(=O)]0-1NRxRy;
R3是NH2、
NH[C(=O)]0-1(C1-C5烷基)、
N(C1-C5烷基)2、
NH[C(=O)]0-1(C1-C4烷二基)0-1(C3-C8环烷基)、
NH[C(=O)]0-1(C1-C4烷二基)0-1(C4-C10二环烷基)、
NH[C(=O)]0-1(C1-C4烷二基)0-1(C5-C10螺烷基)、
N(C3-C6环烷基)2、
N[C1-C3烷基]C(=O)(C1-C6烷基)、
NH(SO2)(C1-C5烷基)、
NH(SO2)(C1-C4烷二基)0-1(C3-C8环烷基)、
NH(SO2)(C1-C4烷二基)0-1(C4-C10二环烷基)、
NH(SO2)(C1-C4烷二基)0-1(C5-C10螺烷基)、
6元芳族或杂芳族部分、
5元杂芳族部分或
具有以下结构的部分:
R5是H、C1-C5烷基、C2-C5烯基、C3-C6环烷基、卤代、O(C1-C5烷基)、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基)、苯基、NH(C1-C5烷基)、5或6元杂芳基、
R6是NH2、
(NH)0-1(C1-C5烷基)、
N(C1-C5烷基)2、
(NH)0-1(C1-C4烷二基)0-1(C3-C8环烷基)、
(NH)0-1(C1-C4烷二基)0-1(C4-C10二环烷基)、
(NH)0-1(C1-C4烷二基)0-1(C5-C10螺烷基)、
N(C3-C6环烷基)2、
或
具有以下结构的部分:
R7和R8独立地是
C1-C4烷基、
C2-C4亚烷基、
C3-C4环烷基,
或者R7和R8与它们所键合的碳组合以形成3至7元环烷基部分;
Rx和Ry独立地是H或C1-C3烷基或者Rx和Ry与它们所键合的氮组合以形成3至7元杂环;
其中在R1、R2、R3、R5、R6、R7和R8中
烷基部分、烷二基部分、环烷基部分或下式的部分:
任选地被选自以下的一个或多个取代基取代:OH、卤代、CN、(C1-C3烷基)、O(C1-C3烷基)、C(=O)(C1-C3烷基)、SO2(C1-C3烷基)、NRxRy、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基);
并且
烷基、烷二基、环烷基或下式的部分:
能够具有被以下替代的CH2基团:O、SO2、CF2、C(=O)、NH、
N[C(=O)]0-1(C1-C3烷基)、
N[C(=O)]0-1(C1-C4烷二基)CF3、
N[C(=O)]0-1(C1-C4烷二基)OH、
或
N[C(=O)]0-1(C1-C4烷二基)0-1(C3-C5环烷基)。
本文公开的化合物具有作为TLR7激动剂的活性,并且一些化合物可以与抗体缀合,用于靶向递送至预期作用的靶组织或器官。还可以将其聚乙二醇化,以调节其药物特性。
本文公开的化合物或其缀合物或其聚乙二醇化衍生物可以用于通过向患有顺从通过激活免疫系统进行治疗的病症的受试者施用治疗有效量的这样的化合物或其缀合物或其聚乙二醇化衍生物(尤其是与疫苗或癌症免疫治疗剂组合)治疗这样的受试者。
具体实施方式
化合物
在一个方面,W是R3。
在一个方面,在式(I)中,以下部分:
在一个方面,在式(II)中,以下部分:
在一个方面,本公开文本的化合物是根据式(Ia),其中R1、R3、R7和R8是如关于式(I)所定义的:
在另一个方面,本公开文本的化合物是根据式(IIa),其中R1、R3、R7和R8是如关于式(II)所定义的:
在一个实施方案中,R7和R8各自是C1-C4烷基。在这样的情况下,R7和R8可以是但不一定是相同的C1-C4烷基。
在另一个实施方案中,R7和R8都是Me。
在另一个实施方案中,
在另一个实施方案中,R7和R8与它们所键合的碳组合以形成3至7元环烷基部分。任选地,这样的环烷基部分具有被O替代的CH2基团;优选地以形成氧杂环丁烷基环,使得
合适的基团R1的例子包括:
R2优选地是OMe、O(环丙基)或OCHF2,更优选地是OMe。
在一个方面,R5是H。
在一个方面,提供了根据式(Ia)或(IIa)的化合物
其中
并且
在另一个方面,提供了具有根据式(I’)或(II’)的结构的化合物
其中
每个X独立地是N或CR2;
R1是(C1-C5烷基)、
(C2-C5烯基)、
(C1-C8烷二基)0-1(C3-C6环烷基)、
(C1-C8烷二基)0-1(C5-C10螺烷基)、
(C2-C8烷二基)OH、
(C2-C8烷二基)O(C1-C3烷基)、
(C1-C4烷二基)0-1(5-6元杂芳基)、
(C1-C4烷二基)0-1苯基、
(C1-C4烷二基)CF3、
(C2-C8烷二基)N[C(=O)](C1-C3烷基)、
或
(C2-C8烷二基)NRxRy;
每个R2独立地是H、O(C1-C3烷基)、S(C1-C3烷基)、SO2(C1-C3烷基)、C1-C3烷基、O(C3-C4环烷基)、S(C3-C4环烷基)、SO2(C3-C4环烷基)、C3-C4环烷基、Cl、F、CN或[C(=O)]0-1NRxRy;
R5是H、C1-C5烷基、C2-C5烯基、C3-C6环烷基、卤代、O(C1-C5烷基)、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基)、苯基、NH(C1-C5烷基)、5或6元杂芳基、
R7和R8独立地是
C1-C4烷基、
C2-C4亚烷基、
C3-C4环烷基,
或者R7和R8与它们所键合的碳组合以形成3至7元环烷基部分;
Rx和Ry独立地是H或C1-C3烷基或者Rx和Ry与它们所键合的氮组合以形成3至7元杂环;其中在R1、R2、R5、R7和R8中
烷基部分、烷二基部分、环烷基部分或下式的部分:
任选地被选自以下的一个或多个取代基取代:OH、卤代、CN、(C1-C3烷基)、O(C1-C3烷基)、C(=O)(C1-C3烷基)、SO2(C1-C3烷基)、NRxRy、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基);
并且
烷基、烷二基、环烷基或下式的部分:
能够具有被以下替代的CH2基团:O、SO2、CF2、C(=O)、NH、
N[C(=O)]0-1(C1-C3烷基)、
N[C(=O)]0-1(C1-C4烷二基)CF3、
N[C(=O)]0-1(C1-C4烷二基)OH、
或
N[C(=O)]0-1(C1-C4烷二基)0-1(C3-C5环烷基)。
在另一个方面,提供了具有根据式(Ia’)的结构的化合物
其中
R1是
并且
本文公开的化合物的具体例子在下表A中示出。所述表格还提供了与生物活性有关的数据:人TLR7激动作用(报告)测定和/或在人全血中CD69基因的诱导,按下文提供的程序确定。最右列包含信息分析数据(质谱,HPLC保留时间和NMR)。在一个实施方案中,本公开文本的化合物具有(a)小于1,000nM的人TLR7(hTLR7)报告测定EC50值以及(b)小于1,000nM的人全血(hWB)CD69诱导EC50值。(在测定进行多次的情况下,所报告的值是平均值。)
药物组合物和施用
在另一个方面,提供了药物组合物,所述药物组合物包含与药学上可接受的载体或赋形剂一起配制的如本文公开的化合物或其缀合物。它可以任选地含有一种或多种另外的药物活性成分,诸如生物制剂或小分子药物。所述药物组合物可以在组合疗法中与另一种治疗剂(尤其是抗癌剂)一起施用。
所述药物组合物可以包含一种或多种赋形剂。可以使用的赋形剂包括载体、表面活性剂、增稠剂或乳化剂、固体粘合剂、分散或悬浮助剂、增溶剂、着色剂、调味剂、包衣、崩解剂、润滑剂、甜味剂、防腐剂、等渗剂及其组合。Gennaro编辑,Remington:The Scienceand Practice of Pharmacy,第20版(Lippincott Williams&Wilkins 2003)中教导了合适的赋形剂的选择和使用。
优选地,药物组合物适用于静脉内、肌内、皮下、肠胃外、脊髓或表皮施用(例如,通过注射或输注)。根据施用途径,可以将活性化合物包被在材料中以保护所述化合物免受可能使其失活的酸和其他天然条件的作用。短语“肠胃外施用”意指除了肠施用和外用施用之外的施用方式,通常通过注射进行,并且包括而不限于静脉内、肌内、动脉内、鞘内、囊内、眼眶内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外以及胸骨内注射和输注。可替代地,可以经由非肠胃外途径施用所述药物组合物,所述非肠胃外途径诸如外用、表皮或粘膜施用途径,例如鼻内、口服、阴道、直肠、舌下或外用。
药物组合物可以呈无菌水性溶液或分散体的形式。也可以将它们配制成微乳液、脂质体或适合于实现高药物浓度的其他有序结构。所述组合物也可以以冻干物(用于在施用前在水中重构)的形式提供。
可以与载体材料组合以产生单一剂型的活性成分的量将根据正在被治疗的受试者和特定的施用方式而变化并且将通常是产生治疗效果的该组合物量。通常,从百分比来说,此量的范围将是从约0.01%至约99%的活性成分,优选从约0.1%至约70%、最优选从约1%至约30%的活性成分,与药学上可接受的载体组合。
调整剂量方案以提供治疗反应。例如,可以施用单次推注,可以随时间施用几个分开的剂量,或者可以如由情况的紧急程度所指示的按比例减少或增加剂量。以剂量单位形式配制肠胃外组合物是尤其有利的,以便于施用和剂量的均匀。“剂量单位形式”是指适合作为单位剂量用于待治疗的受试者的物理上离散的单位;每个单位含有与所需的药物载体联合的经计算产生所需治疗反应的预定量的活性化合物。
所述剂量的范围是从约0.0001至100mg/kg宿主体重并且更通常0.01至5mg/kg宿主体重。例如,剂量可以是0.3mg/kg体重、1mg/kg体重、3mg/kg体重、5mg/kg体重或10mg/kg体重或者在1-10mg/kg或可替代地0.1至5mg/kg的范围内。示例性治疗方案是每周一次、每两周一次、每三周一次、每四周一次、每月一次、每3个月一次或每3至6个月一次的施用。优选的剂量方案包括使用以下给药时间表中的一种经由静脉内施用1mg/kg体重或3mg/kg体重:(i)每四周,持续六个剂量,然后每三个月;(ii)每三周;(iii)一次3mg/kg体重,然后是每三周1mg/kg体重。在一些方法中,调整剂量以达到约1-1000μg/mL并且在一些方法中约25-300μg/mL的血浆抗体浓度。
本发明的化合物的“治疗有效剂量”优选地导致疾病症状的严重程度的降低、无疾病症状时期的频率和持续时间的增加或对由于疾病困扰而引起的损伤或残疾的预防。例如,对于荷瘤受试者的治疗,相对于未经治疗的受试者,“治疗有效剂量”优选地抑制肿瘤生长至少约20%、更优选至少约40%、甚至更优选至少约60%、仍更优选至少约80%。治疗有效量的治疗化合物可以减小受试者的肿瘤大小或在其他方面改善受试者的症状,所述受试者通常是人,但是可以是另一种哺乳动物。在组合治疗中施用两种或更多种治疗剂的情况下,“治疗有效量”是指组合作为整体的功效,而不是单独地每种药剂的功效。
所述药物组合物可以是控释或缓释配制品,包括植入物、透皮贴剂和微囊化递送系统。可以使用可生物降解的可生物相容的聚合物,诸如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。参见例如,Sustained and Controlled Release DrugDelivery Systems,J.R.Robinson编辑,Marcel Dekker,Inc.,New York,1978。
可以经由诸如(1)无针皮下注射装置;(2)微量输注泵;(3)透皮装置;(4)输注装置;和(5)渗透装置的医疗装置施用治疗组合物。
在某些实施方案中,可以配制所述药物组合物以确保在体内的适当分布。例如,为了确保本发明的治疗化合物穿过血脑屏障,可以将它们配制在脂质体中,所述脂质体可以另外地包含靶向部分以增强向特定细胞或器官的选择性转运。
工业实用性和用途
本文公开的TLR7激动剂化合物可以用于治疗可通过激活TLR7而改善的疾病或病症。
在一个实施方案中,将TLR7激动剂与抗癌免疫治疗剂(也称为免疫肿瘤学药剂)组合使用。抗癌免疫治疗剂通过刺激身体的免疫系统以攻击和破坏癌细胞,尤其是通过激活T细胞来工作。免疫系统具有许多检查点(调节)分子,以帮助维持其攻击正当的靶细胞与防止其攻击健康的正常细胞之间的平衡。一些分子是刺激剂(上调剂),这意味着它们的参与促进T细胞激活并且增强免疫应答。其他分子是抑制剂(下调剂或制止剂),这意味着它们的参与抑制T细胞激活并且减轻免疫应答。激动性免疫治疗剂与刺激性检查点分子的结合可以导致后者的激活和针对癌细胞的免疫应答增强。相反,拮抗性免疫治疗剂与抑制性检查点分子的结合可以防止免疫系统被后者下调并且帮助维持针对癌细胞的强烈应答。刺激性检查点分子的例子是B7-1、B7-2、CD28、4-1BB(CD137)、4-1BBL、ICOS、CD40、ICOS-L、OX40、OX40L、GITR、GITRL、CD70、CD27、CD40、DR3和CD28H。抑制性检查点分子的例子是CTLA-4、PD-1、PD-L1、PD-L2、LAG-3、TIM-3、半乳凝素9、CEACAM-1、BTLA、CD69、半乳凝素-1、CD113、GPR56、VISTA、2B4、CD48、GARP、PD1H、LAIR1、TIM-1、CD96和TIM-4。
无论抗癌免疫治疗剂的作用方式是哪种,均可以通过总体上调免疫系统(诸如通过激活TLR7)来提高其有效性。因此,在一个实施方案中,本说明书提供了治疗癌症的方法,所述方法包括向患有这样的癌症的患者施用抗癌免疫治疗剂和如本文公开的TLR7激动剂的治疗有效组合。施用时间可以是同时的、顺序的或交替的。施用方式可以是全身的或局部的。可以经由缀合物以靶向的方式递送所述TLR7激动剂。
可以通过如上所述的组合治疗进行治疗的癌症包括急性髓系白血病、肾上腺皮质癌、卡波西肉瘤、淋巴瘤、肛门癌、阑尾癌、畸胎样/横纹肌样瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑癌、乳腺癌、支气管肿瘤、类癌瘤、心脏肿瘤、宫颈癌、脊索瘤、慢性淋巴细胞白血病、慢性骨髓增生性肿瘤、结肠癌、结直肠癌、颅咽管瘤、胆管癌、子宫内膜癌、室管膜瘤、食管癌、鼻腔神经胶质瘤、尤因肉瘤、眼癌、输卵管癌、胆囊癌、胃肠道类癌瘤、胃肠道间质瘤、生殖细胞瘤、毛细胞白血病、头颈癌、心脏癌症、肝癌、下咽癌、胰腺癌、肾癌、喉癌、慢性髓细胞性白血病、唇和口腔癌、肺癌、黑素瘤、梅克尔细胞癌、间皮瘤、口癌、口腔癌、骨肉瘤、卵巢癌、阴茎癌、咽喉癌、前列腺癌、直肠癌、唾液腺癌、皮肤癌、小肠癌、软组织肉瘤、睾丸癌、喉癌、甲状腺癌、尿道癌、子宫癌、阴道癌和外阴癌。
可以用于如本文公开的组合疗法的抗癌免疫治疗剂包括:AMG 557、AMP-224、阿替利珠单抗(atezolizumab)、阿维鲁单抗(avelumab)、BMS 936559、西米普利单抗(cemiplimab)、CP-870893、达西珠单抗(dacetuzumab)、度伐鲁单抗(durvalumab)、依诺妥珠单抗(enoblituzumab)、加利昔单抗(galiximab)、IMP321、伊匹单抗、鲁卡木单抗(lucatumumab)、MEDI-570、MEDI-6383、MEDI-6469、莫罗单抗(muromonab)-CD3、纳武单抗、派姆单抗、匹地利珠单抗(pidilizumab)、斯巴达珠单抗(spartalizumab)、曲美目单抗(tremelimumab)、乌瑞鲁单抗(urelumab)、乌托鲁单抗(utomilumab)、瓦立鲁单抗(varlilumab)、珀伽利珠单抗(vonlerolizumab)。下表B列出了它们的一个或多个替代名称(商标名称、曾用名、研究代码或同义词)和各自的靶检查点分子。
在用TLR7激动剂的组合治疗的一个实施方案中,所述抗癌免疫治疗剂是拮抗性抗CTLA-4、抗PD-1或抗PD-L1抗体。所述癌症可以是肺癌(包括非小细胞肺癌)、胰腺癌、肾癌、头颈癌、淋巴瘤(包括霍奇金淋巴瘤)、皮肤癌(包括黑素瘤和梅克尔皮肤癌)、尿路上皮癌(包括膀胱癌)、胃癌、肝细胞癌或结直肠癌。
在用TLR7激动剂的组合治疗的另一个实施方案中,所述抗癌免疫治疗剂是拮抗性抗CTLA-4抗体,优选伊匹单抗。
在用TLR7激动剂的组合治疗的另一个实施方案中,所述抗癌免疫治疗剂是拮抗性抗PD-1抗体,优选纳武单抗或派姆单抗。
本文公开的TLR7激动剂还可用作疫苗佐剂。
通过参考以下实施例可以进一步理解本发明的实践,所述实施例是通过说明而非限制的方式来提供的。
分析程序
NMR
以下条件用于获得质子核磁共振(NMR)谱:使用DMSO-d6或CDCl3作为溶剂和内标,在400Mz或500Mhz Bruker仪器中采集NMR谱。通过使用ADC Labs的ACD Spectrus版本2015-01或MestReNova软件分析原始NMR数据。
化学位移以相对于内部四甲基硅烷(TMS)或相对于由氘化NMR溶剂推断出的TMS位置的低场百万分率(ppm)报告。表观多重性报告为:单峰-s、双峰-d、三重峰-t、四重峰-q或多重峰-m。表现出展宽的峰进一步表示为br。积分是近似的。应当注意,积分强度、峰形、化学位移和耦合常数可以取决于溶剂、浓度、温度、pH和其他因素。此外,在NMR谱中与水或溶剂峰重叠或交换的峰可能不能提供可靠的积分强度。在一些情况下,可以使用水峰抑制获得NMR谱,水峰抑制可能导致重叠峰不可见或具有改变的形状和/或积分。
液相色谱
使用以下制备型和分析型(LC/MS)液相色谱方法:
分析型LC/MS程序A:柱:Waters XBridge C18,2.1mm x 50mm,1.7μm颗粒;流动相A:5:95乙腈:水(含10mM NH4OAc);流动相B:95:5乙腈:水(含10mM NH4OAc);温度:50℃;梯度:经3min 0%B至100%B,然后在100%B下保持0.50min;流速:1mL/min;检测:MS和UV(220nm)。
分析型LC/MS程序B:柱:Xbridge BEH C18 XP(50x2.1mm),2.5μm;流动相A:5:95CH3CN:H2O(含10mM NH4OAc);流动相B:95:5CH3CN:H2O(含10mM NH4OAc);温度:50℃;梯度:经3min 0-100%B;流速:1.1mL/min。
合成-通用程序
通常,本文公开的程序产生在吡唑并嘧啶环系统的1H或2H位置处烷基化的区域异构体(其也分别称为N1和N2区域异构体,暗指被烷基化的氮)的混合物。为简洁起见,为方便起见未示出N2区域异构体,但是应理解的是它们存在于最初的产物混合物中,并且稍后例如通过制备型HPLC进行分离。
可以在合成的早期分离区域异构体的混合物,并且用1H区域异构体进行剩余的合成步骤,或者可替代地,可以携带区域异构体的混合物进行合成,并且根据需要在后期进行分离。
可以通过合成有机化学领域的技术人员熟知的多种方法制备本公开文本的化合物。这些方法包括下文描述的那些或其变体。优选的方法包括但不限于下文在以下方案1-4中描述的那些。
方案1
可以通过以上方案1中概述的合成序列制备化合物10。还原硝基吡唑1以得到相应的胺2,然后与1,3-双(甲氧基羰基)-2-甲基-2-硫代异脲环化得到羟基吡唑并嘧啶3。使用BOP/DBU偶联条件引入胺以得到化合物4。随后使用NBS进行溴化得到溴吡唑并嘧啶5。使用苄基卤6进行烷基化得到N1和N2产物的混合物,将所述混合物分离,从而得到N1中间体7,将N1中间体7使用催化加氢脱溴以得到氰基中间体8,然后将氰基中间体8使用格氏试剂和异丙醇钛(IV)转化为gem-二烷基胺9。最后,使用氢氧化钠去除氨基甲酸甲酯得到目标化合物10。
方案2
可替代地,可以使用在以上方案2中描述的途径获得氰基中间体8。使用NBS将中间体3溴化以得到化合物11,将其使用苄基卤6烷基化以得到羟基中间体12。使用BOP/DBU掺入胺RaNH2,然后脱溴得到所需中间体8。
方案3
到化合物10的另一条替代途径在以上方案3中描述。使用格氏试剂和异丙醇钛(IV)将苯甲腈13转化为二烷基胺14。然后使用氯甲酸苄酯保护胺14以得到中间体15,将其使用NBS/AIBN转化为苄基溴16。使用在DMF中的Cs2CO3将苄基溴16附接到吡唑并嘧啶中间体11上。使用BOP/DBU将所得产物17用RaNH2胺化。这得到中间体18,将其使用催化加氢去除溴基团和CBz保护基团,然后使用氢氧化钠去除氨基甲酸甲酯而转化为最终化合物10。
以上方案用式(I)的区域异构体描绘。本领域技术人员将理解,相同的方案加以必要的修改可以适用于制备根据式(II)的化合物。
方案4
以上方案4示出了替代方法,其中将中间体16附接到含胺的吡唑并嘧啶5上,从而得到中间体18。如之前使用催化加氢和氢氧化钠使中间体18去保护得到目标化合物10。
方案5
中间体胺14的制备的进一步的替代方案在方案5中说明。可以将苄基卤19锂化并且与亚磺酰胺20一起淬灭,以提供受保护的胺21。使用在二噁烷中的HCl进行去保护得到呈盐酸盐的所需胺14。
方案6
可以按以上方案6制备对称的叔醇3(两个Ra基团相同)。将格氏试剂RaMgBr添加到化合物1(US 2020/0038403)中,然后去除氨基甲酸甲酯保护基团得到目标化合物3。
方案7
可以按以上方案7制备不对称的叔醇。将酯1水解为酸2,然后转化为Weinreb酰胺3。用格氏试剂RaMgBr将酰胺3转化为酮4。再一次用格氏试剂RbMgBr进行烷基化并且随后去除氨基甲酸甲酯保护基团产生不对称的叔醇6。
方案8
到叔醇的替代途径在以上方案8中示出。保护苯甲醇1(使用TBS基团作为范例)。用n-BuLi金属化化合物2中的溴位置并且与酮RaC(=O)RB一起淬灭产生醇3。(Ra和Rb可以相同或不同。)在步骤3中,保护叔醇(例如,作为乙酸酯)并且使苯甲醇去保护产生苯甲醇4,将其用亚硫酰氯转化为相应的苄基氯6。按步骤5进行偶联产生化合物6。(在C3处的溴基团有助于将偶联导向N1位置优先于N2位置。)加氢去除溴以及氨基甲酸酯保护基团的水解产生最终产物7。
合成-具体实施例
为了进一步说明上述内容,包括以下非限制性、以下示例性合成方案。在权利要求范围内的这些实施例的变化在本领域技术人员的能力范围内,并且被认为落入本公开文本的范围内。读者应认识到,被提供本公开文本并且是相关领域的技术人员的熟练技术人员将能够在没有穷举实施例的情况下制备和使用本文公开的化合物。
编号100及以上的化合物的分析数据可见于表A。
实施例1-化合物101
步骤1.向(7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(10g,37.8mmol)在DMF/MeCN(1:1,120mL)中的搅拌悬浮液中添加NBS(7.41g,41.6mmol)。将反应在室温下搅拌1h。添加水(150mL),并且将反应混合物再搅拌10min。将产物通过过滤收集并且用水(3x50mL)洗涤,从而得到呈固体的(3-溴-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(6.1g,17.77mmol,47.0%产率)。
LC-MS(ES,m/z):[M+H]+343.0,345.0。
1H NMR(400MHz,DMSO-d6)δ12.87(br s,1H),9.80(s,1H),7.57(br s,1H),3.62(s,3H),3.59-3.48(m,2H),1.62(quin,J=7.2Hz,2H),1.40(dq,J=14.9,7.3Hz,2H),0.94(t,J=7.4Hz,3H)
步骤2.在0℃下,向(3-溴-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1g,2.91mmol)和Cs2CO3(1.899g,5.83mmol)在DMF(10mL)中的搅拌悬浮液中添加4-(溴甲基)-3-甲氧基苯甲腈(0.527g,2.331mmol)在DMF(2mL)中的溶液。允许将反应混合物缓慢加温至室温,搅拌过夜,倒入饱和NaHCO3溶液(100mL)中,并且用EtOAc(3x40mL)萃取。将合并的有机相用盐水(3x40mL)洗涤,干燥(MgSO4),过滤,并且浓缩。快速色谱(80g SiO2柱,0至70%EtOAc的己烷溶液)得到呈固体的(3-溴-7-(丁基氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(320mg,0.655mmol,22.49%产率)。
LC-MS(ES,m/z):[M+H]+488.3,490.3。
1H NMR(400MHz,DMSO-d6)δ9.88(s,1H),7.53(s,1H),7.39-7.32(m,2H),6.77(d,J=7.7Hz,1H),5.78(s,2H),3.85(s,3H),3.63(s,3H),3.51(q,J=6.6Hz,2H),1.55(quin,J=7.3Hz,2H),1.21(sxt,J=7.4Hz,2H),0.86(t,J=7.4Hz,3H)。
步骤3.将(3-溴-7-(丁基氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(315mg,0.645mmol)悬浮在EtOH(15mL)中。添加10%钯碳(15mg)。将反应容器抽空并且用氢气吹扫六次。将反应混合物在氢气气氛下搅拌2h,过滤,并且蒸发至干,从而得到呈固体的(7-(丁基氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(264mg,0.645mmol,98%产率)。
LC-MS(ES,m/z):[M+H]+410.4。
1H NMR(400MHz,氯仿-d)δ9.99(br s,1H),8.73(br s,1H),8.03(s,1H),7.25-7.18(m,2H),7.11(s,1H),6.12(s,2H),3.89(s,3H),3.86(s,3H),3.80(q,J=6.8Hz,2H),1.64(quin,J=7.4Hz,2H),1.34-1.21(m,2H),0.89(t,J=7.4Hz,3H)
步骤4.将微波瓶用(7-(丁基氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(60mg,0.147mmol)和THF(2mL)装填。添加甲基溴化镁(0.293mL,0.879mmol)。在泡腾停止后,将小瓶加盖,并且将反应混合物在微波炉中加热至100℃持续10min。添加异丙醇钛(IV)(42mg,0.147mmol)和甲基溴化镁(0.293mL,0.879mmol),并且将反应混合物在100℃下再加热10min。在冷却后,将反应混合物用饱和NH4Cl溶液(20mL)淬灭并且用EtOAc(3x5mL)萃取。将合并的有机相用盐水(2x5mL)洗涤,干燥(MgSO4),过滤,并且浓缩。将残余物溶解在二噁烷(2mL)中,并且添加NaOH(0.440mL,2.198mmol)。将反应混合物在80℃下加热3小时。在冷却后,将反应混合物用5N HCl中和并且蒸发至干。将粗材料溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在2%B下保持0分钟,经20min 2%-42%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物101(9.2mg,0.024mmol,16%产率)。
实施例2-化合物102
步骤1.向(3-溴-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(2g,6.94mmol)在DMF(40mL)中的搅拌溶液中添加Cs2CO3(2.488g,7.64mmol)。在冰浴中冷却后,添加4-(溴甲基)-3-甲氧基苯甲腈(1.570g,6.94mmol)在DMF(10mL)中的溶液。允许将反应缓慢加温至室温并且搅拌过夜。将反应混合物倒入饱和NaHCO3溶液(200mL)和水(200mL)中,并且添加EtOAc(200mL)。由于溶解度非常低没有分层,将混合物过滤。将沉淀物用水(2x50mL)和MeCN(2x50mL)洗涤,从而得到呈固体的(3-溴-1-(4-氰基-2-甲氧基苄基)-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1.1g,2.54mmol,36.6%产率)。
LC-MS(ES,m/z):[M-H]=431.1,433.1。
1H NMR(400MHz,DMSO-d6)δ11.53(br s,2H),7.60-7.49(m,1H),7.43-7.29(m,1H),6.92(br d,J=7.7Hz,1H),5.73(s,2H),3.88(s,3H),3.75(s,3H)。
步骤2.向(3-溴-1-(4-氰基-2-甲氧基苄基)-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1g,2.308mmol)、(S)-1-((叔丁基二苯基甲硅烷基)氧基)己-3-胺(1.231g,3.46mmol)和BOP(1.531g,3.46mmol)在DMSO(20mL)中的搅拌溶液中添加DBU(1.044mL,6.92mmol)。将反应在60℃下搅拌1小时。在冷却后,将反应混合物倒入饱和NaHCO3溶液(100mL)中并且萃取到EtOAc(3x70mL)中。将合并的有机物用盐水(4x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(80g SiO2柱,0至50%EtOAc的己烷溶液)纯化,从而得到呈油状物的(S)-(3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1.091g,1.415mmol,61.3%产率)。
LC-MS(ES,m/z):[M+H]+=770.3,772.2。
1H NMR(400MHz,DMSO-d6)δ9.83(s,1H),7.58-7.53(m,2H),7.50-7.45(m,3H),7.43-7.33(m,4H),7.27-7.22(m,2H),7.11(dd,J=7.9,1.3Hz,1H),6.62(d,J=8.1Hz,1H),6.53(d,J=7.7Hz,1H),5.86-5.71(m,2H),3.81(s,3H),3.62-3.52(m,5H),1.87-1.77(m,2H),1.57-1.43(m,2H),1.15(br dd,J=17.6,10.8Hz,2H),0.92(s,9H),0.79(t,J=7.4Hz,3H)。
步骤3.向(S)-(3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1.08g,1.401mmol)在乙醇(70mL)中的溶液中添加10%钯碳(100mg)。将反应混合物抽空并且用氢气吹扫六次,然后将反应在氢气气氛下搅拌1小时。将反应通过CELITETM过滤(用乙醇(50mL)洗涤),并且将滤液蒸发至干。将粗材料使用快速色谱(40g SiO2柱,0至100%EtOAc的己烷溶液)纯化,从而得到183mg产物。将柱再洗脱(经25min 0至10%MeOH的DCM溶液),从而再得到435mg产物。将这两个批次合并,以得到呈固体的(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(618mg,0.893mmol,63.7%产率)。
LC-MS(ES,m/z):[M+H]+=692.4
1H NMR(400MHz,DMSO-d6)δ9.55(s,1H),7.95(s,1H),7.55(d,J=7.2Hz,2H),7.49-7.34(m,7H),7.23(t,J=7.4Hz,2H),7.01(d,J=8.1Hz,1H),6.36(d,J=8.6Hz,1H),6.29(d,J=7.7Hz,1H),5.81(d,J=2.4Hz,2H),4.57(br d,J=7.5Hz,1H),3.85(s,3H),3.61-3.58(m,3H),3.57-3.48(m,2H),1.86-1.72(m,2H),1.55-1.41(m,2H),1.20-0.97(m,2H),0.93(s,9H),0.77(t,J=7.4Hz,3H)。
步骤4.将微波瓶用(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(150mg,0.217mmol)和THF(7mL)装填。添加甲基溴化镁(0.361mL,1.084mmol),并且将小瓶加盖,并且将反应在微波炉中在80℃下加热20min。添加异丙醇钛(IV)(0.127mL,0.434mmol),然后添加更多的甲基溴化镁(0.361mL,1.084mmol)。在微波炉中,将反应在80℃下再加热20min。将反应混合物用NH4Cl溶液(10mL)淬灭并且萃取到EtOAc(3x5mL)中。将合并的有机物用盐水(5mL)洗涤,干燥(MgSO4),过滤并且浓缩,从而得到呈胶状物的(S)-(1-(4-(2-氨基丙-2-基)-2-甲氧基苄基)-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(150mg,0.145mmol,66.9%产率,70%纯度)。
LC-MS(ES,m/z):[M+H]+=724.4。
步骤5.将(S)-(1-(4-(2-氨基丙-2-基)-2-甲氧基苄基)-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(150mg,0.145mmol)溶解在二噁烷(4mL)中。添加三乙胺三氢氟酸盐(0.118mL,0.725mmol),并且将反应在70℃下搅拌1小时。然后添加NaOH(1.450mL,7.25mmol),并且将反应在80℃下再搅拌1小时。在冷却后,将反应混合物用5N HCl中和并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在2%B下保持0分钟,经20min 2%-42%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物102(22.2mg,0.050mmol,34.7%产率)。
实施例3-化合物103
步骤1.向(3-溴-1-(4-氰基-2-甲氧基苄基)-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(742mg,1.713mmol)、(5-甲基异噁唑-3-基)甲胺(288mg,2.57mmol)和BOP(1136mg,2.57mmol)在DMSO(10mL)中的搅拌溶液中添加DBU(0.775mL,5.14mmol)。将反应在60℃下搅拌1小时。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且萃取到EtOAc(3x70mL)中。将合并的有机物用盐水(4x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(80g SiO2柱,0至85%EtOAc的己烷溶液)得到呈固体的(3-溴-1-(4-氰基-2-甲氧基苄基)-7-(((5-甲基异噁唑-3-基)甲基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(295mg,0.559mmol,32.7%产率)。
LC-MS(ES,m/z):[M+H]+=527.1,529.1。
1H NMR(400MHz,DMSO-d6)δ10.03(s,1H),8.03(t,J=5.7Hz,1H),7.49(d,J=1.3Hz,1H),7.35(dd,J=7.7,1.3Hz,1H),6.87(d,J=7.9Hz,1H),6.21(d,J=0.9Hz,1H),5.78(s,2H),4.77(d,J=5.7Hz,2H),3.77(s,3H),3.74-3.58(m,3H),2.39-2.30(m,3H)。
步骤2.向(3-溴-1-(4-氰基-2-甲氧基苄基)-7-(((5-甲基异噁唑-3-基)甲基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(290mg,0.550mmol)在乙醇(15mL)中的搅拌溶液中添加10%钯碳(29mg)。将反应混合物抽空并且用氢气吹扫六次,然后将反应在氢气气氛下在室温下搅拌2小时。将反应混合物蒸发至干,并且将粗材料使用快速色谱(24gSiO2柱,0至10%MeOH的DCM溶液)纯化,从而得到呈固体的(3-溴-1-(4-氰基-2-甲氧基苄基)-7-(((5-甲基异噁唑-3-基)甲基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(290mg,0.550mmol)。
LC-MS(ES,m/z):[M+H]+=449.1。
1H NMR(400MHz,DMSO-d6)δ10.37(br s,1H),8.20(br s,1H),8.01(s,1H),7.50(d,J=1.3Hz,1H),7.32(dd,J=7.8,1.2Hz,1H),6.71(br d,J=7.5Hz,1H),6.16(s,1H),5.81(s,2H),4.76(br d,J=5.7Hz,2H),3.80(s,3H),3.69(s,3H),2.35(s,3H)。
步骤3.将微波瓶用(1-(4-氰基-2-甲氧基苄基)-7-(((5-甲基异噁唑-3-基)甲基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(70mg,0.156mmol)、THF(3mL)和甲基溴化镁(0.260mL,0.780mmol)装填。在微波炉中,将反应在80℃下加热20min。添加异丙醇钛(IV)(0.091mL,0.312mmol),然后添加甲基溴化镁(0.260mL,0.780mmol),并且将反应在微波炉中在70℃下再加热20min。添加更多的甲基溴化镁(0.260mL,0.780mmol),并且将反应在微波炉中在70℃下再加热30min。将反应混合物用NH4Cl溶液(10mL)淬灭并且萃取到EtOAc(3x5mL)中。将合并的有机物用盐水(3x5mL)洗涤,干燥(MgSO4),过滤并且浓缩。将残余物溶解在二噁烷(2mL)中,并且添加NaOH(0.937mL,4.68mmol)。将反应在80℃下搅拌2小时,然后允许冷却。将反应混合物使用5N HCl中和,然后蒸发至干,再溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在0%B下保持0分钟,经20min 0-40%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物103(5.3mg,0.012mmol,7.65%产率)。
实施例4-化合物104
步骤1.向(3-溴-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(2g,6.94mmol)在DMF(40mL)中的搅拌溶液中添加Cs2CO3(2.488g,7.64mmol)。在冰浴中冷却后,添加3-(溴甲基)-4-甲氧基苯甲腈(1.570g,6.94mmol)在DMF(10mL)中的溶液。允许将反应缓慢加温至室温并且搅拌过夜。将反应混合物在搅拌下缓慢倒入水(1L)中。将沉淀物过滤,用水(2x50mL)洗涤并且在真空下干燥,以提供呈灰色固体的(3-溴-1-(5-氰基-2-甲氧基苄基)-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(2.3g,5.31mmol,76%产率)。
LC-MS(ES,m/z):[M+H]=433.1。
1H NMR(400MHz,DMSO-d6)δ11.51(brs,2H),7.83(dd,J=8.6,2.2Hz,1H),7.35(d,J=2.1Hz,1H),7.23(d,J=8.6Hz,1H).,5.70(s,2H),3.88(s,3H),3.76(s,3H)。
步骤2.向(3-溴-1-(5-氰基-2-甲氧基苄基)-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(0.4g,0.923mmol)、(S)-1-((叔丁基二苯基甲硅烷基)氧基)己-3-胺(0.657g,1.847mmol)和BOP(0.613g,1.385mmol)在DMSO(9.23ml)中的搅拌溶液中添加DBU(0.418ml,2.77mmol)。将反应混合物在60℃下搅拌1h。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且萃取到EtOAc(3x70mL)中。将合并的有机相用盐水(4x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(Isco,40g SiO2柱,负载在DCM中,经30min0至50%EtOAc的己烷溶液)纯化,从而得到呈淡棕色固体的(S)-(3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(0.34g,0.441mmol,47.8%产率)。
LC-MS(ES,m/z):[M+H]+=770.3。
1H NMR(400MHz,DMSO-d6)δ9.58(s,1H),7.55(dd,J=8.6,2.2Hz,1H),7.37–7.31(m,2H),7.30–7.25(m,2H),7.20–7.10(m,4H),7.06–6.99(m,3H),6.94(d,J=8.6Hz,1H),6.48(d,J=8.4Hz,1H),5.61–5.32(m,2H),4.44(dq,J=11.5,5.6,4.1Hz,1H),3.51(s,3H),3.45(t,J=6.5Hz,2H),3.37(s,3H),1.67(m,2H),1.44–1.21(m,2H),1.09–0.89(m,2H),0.70(s,9H),0.59(t,J=7.3Hz,3H)。
步骤3.将(S)-(3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(0.34g,0.441mmol)溶解在EtOH(22.05ml)中。添加10%钯碳(33mg),并且将反应混合物抽空并且用氢气吹扫三次。将反应在氢气气氛下搅拌1小时。将反应通过CELITETM过滤(用乙醇(50mL)洗涤),并且将滤液蒸发,以得到呈白色固体的(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(300mg,0.434mmol,98%产率)。
LC-MS(ES,m/z):[M+H]+=692.3。
1H NMR(400MHz,DMSO-d6)δ8.08(s,1H),7.92(s,1H),7.85–7.76(m,1H),7.66–7.58(m,1H),7.52(ddt,J=18.0,6.9,1.5Hz,4H),7.46–7.32(m,5H),7.32–7.11(m,4H),5.95–5.63(m,2H),4.61(m,1H),3.82(s,3H),3.77(s,3H),3.73–3.61(m,2H),1.94(m,2H),1.59(m,2H),1.31–1.11(m,3H),0.92(s,9H),0.82(t,J=7.3Hz,3H)。
步骤4.将微波瓶用(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(50mg,0.072mmol)和THF(2mL)装填。添加甲基溴化镁(0.241mL,0.723mmol)。将小瓶加盖,并且将反应混合物在微波炉中在100℃下加热20min。添加异丙醇钛(IV)(0.042mL,0.145mmol),然后添加甲基溴化镁(0.120mL,0.361mmol)。在微波炉中,将反应混合物在100℃下再加热20min。LCMS显示出产物的形成。将反应混合物用EtOAc(50mL)稀释并且用饱和NH4Cl溶液(20mL)淬灭。将水层用EtOAc(2x10mL)萃取。将合并的有机相用盐水(5mL)洗涤,干燥(MgSO4),过滤并且浓缩,从而得到黄色胶状物,将其在Accq Prep 20x150 mm Xbridge柱上使用乙腈/水(0.1%TFA)进一步纯化。将含有所需产物的级分冻干,以提供(S)-(1-(5-(2-氨基丙-2-基)-2-甲氧基苄基)-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(25mg,0.035mmol,47.8%产率)。
LC-MS(ES,m/z):[M+H]+=724.4。
1H NMR(400MHz,DMSO-d6)δ9.43(brs,1H),8.33(s,2H),7.81(s,1H),7.59–7.47(m,3H),7.42(td,J=6.4,2.9Hz,3H),7.38–7.24(m,5H),7.19(t,J=7.4Hz,2H),7.00(d,J=8.8Hz,1H),6.84(d,J=2.6Hz,1H),6.19(d,J=8.4Hz,1H),5.75–5.39(m,2H),4.51(q,J=7.1Hz,1H),3.65(s,3H),3.61(t,J=1.6Hz,2H),3.51(s,3H),1.76m,2H),1.55(m,2H),1.43(m,2H),1.37(s,3H),1.35(s,3H),1.07(m,2H),0.86(s,9H),0.72(t,J=7.3Hz,3H)。
步骤5.将(S)-(1-(5-(2-氨基丙-2-基)-2-甲氧基苄基)-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(50mg,0.069mmol)溶解在二噁烷(2mL)中。添加三乙胺三氢氟酸盐(0.056mL,0.345mmol),并且将反应混合物在70℃下搅拌1h。然后添加NaOH(1.450mL,7.25mmol)。将反应混合物在80℃下再加热1h。在冷却后,将反应混合物用5N HCl中和并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在2%B下保持0分钟,经20min 2%-42%B,然后在100%B下保持0min;流速:20mL/min;柱温:25℃。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物104(18.6mg,60%产率)。
实施例5-化合物105
步骤1.向(3-溴-1-(5-氰基-2-甲氧基苄基)-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(500mg,1.154mmol)、丁-1-胺(0.172mL,1.731mmol)和BOP(766mg,1.731mmol)在DMSO(10mL)中的搅拌溶液中添加DBU(0.522mL,3.46mmol)。将反应在60℃下搅拌20min。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且用EtOAc(3x50mL)萃取。将合并的有机相用盐水(4x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(ISCO,40g SiO2柱,负载在DCM中,经30min 0至80%EtOAc的己烷溶液)纯化,从而得到呈淡棕色固体的(3-溴-7-(丁基氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(0.4g,0.819mmol,71.0%产率)。
LC-MS(ES,m/z):[M+H]+=488.1。
1H NMR(400MHz,DMSO-d6)δ9.87(s,1H),7.84(dd,J=8.6,2.2Hz,1H),7.41(t,J=5.6Hz,1H),7.35(d,J=2.1Hz,1H),7.22(d,J=8.7Hz,1H),5.71(s,2H),3.82(s,3H),3.64(s,3H),3.61–3.48(m,2H),1.61(tt,J=7.7,6.7Hz,2H),1.38–1.21(m,2H),0.89(t,J=7.4Hz,3H)。
步骤2.向(3-溴-7-(丁基氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(0.4g,0.819mmol)在乙醇(16.38ml)中的溶液中添加10%Pd/C(0.044g,0.041mmol)。将反应混合物抽空并且用氢气吹扫三次,然后在氢气气氛下搅拌过夜。将反应混合物过滤,并且将滤液蒸发至干。将粗材料使用快速色谱(ISCO,40g SiO2柱,固体负载,经20min 0-20%MeOH的DCM溶液)纯化,从而得到呈白色固体的(7-(丁基氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(270mg,0.659mmol,81%产率)。
LC-MS(ES,m/z):[M+H]+=410.2。
1H NMR(400MHz,DMSO-d6)δ11.38(s,1H),8.45(s,1H),8.04(s,1H),7.84(dd,J=8.6,2.2Hz,1H),7.30(d,J=2.1Hz,1H),7.23(d,J=8.6Hz,1H),5.80(s,2H),3.84(s,3H),3.80(s,3H),3.62(dt,J=7.9,5.9Hz,2H),1.60(p,J=7.3Hz,2H),1.29(h,J=7.3Hz,2H),0.89(t,J=7.4Hz,3H)。
步骤3.将微波瓶用(7-(丁基氨基)-1-(5-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(10mg,0.024mmol)和THF(1mL)装填。添加甲基溴化镁(0.144mL,0.488mmol)。将小瓶加盖,并且将反应在微波炉中在90℃下加热20min。添加异丙醇钛(IV)(0.014mL,0.049mmol),然后添加甲基溴化镁(0.072mL,10eq)。在微波炉中,将反应在80℃下加热20min。将反应混合物用NH4Cl溶液(1mL)淬灭并且浓缩。将残余物溶解在DMF(2mL)中,过滤并且在Accq Prep 30x150 mm Xbridge柱上纯化。将在15min时收集的50%乙腈/水(0.1%TFA)级分冻干,以提供呈白色固体的(1-(5-(2-氨基丙-2-基)-2-甲氧基苄基)-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯TFA盐(4mg,7.20μmol,29.5%产率)。
LC-MS(ES,m/z):[M+H]+=442.5。
步骤4.将(1-(5-(2-氨基丙-2-基)-2-甲氧基苄基)-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(9mg,0.020mmol)溶解在二噁烷(2mL)中。添加NaOH(0.041mL,0.408mmol),并且将反应在80℃下搅拌1h。在冷却后,将反应混合物用6N HCl中和并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在2%B下保持0分钟,经20min 2%-42%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25℃。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物105(3.4mg,8.10μmol,39.8%产率)。
实施例6-化合物106
步骤1.向(3-溴-1-(4-氰基-2-甲氧基苄基)-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1g,2.31mmol)、(S)-1-((叔丁基二苯基甲硅烷基)氧基)戊-3-胺(1.18g,3.46mmol)和BOP(1.53g,3.46mmol)在DMSO(20mL)中的搅拌溶液中添加DBU(1.04mL,6.92mmol)。将反应在60℃下搅拌1小时。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且萃取到EtOAc(3x70mL)中。将合并的有机物用盐水(4x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(80g SiO2柱,0至50%EtOAc的己烷溶液)纯化,从而得到呈胶状物的(S)-(3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)戊-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(320mg,0.42mmol,18.3%产率)。
LC-MS(ES,m/z):[M+H]+=756.2,758.2。
步骤2.向(S)-(3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)戊-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(320mg,0.42mmol)在乙醇(5mL)中的溶液中添加10%钯碳(32mg)。将反应混合物抽空并且用氢气吹扫六次,然后在氢气气氛下搅拌2小时。将反应混合物过滤并且浓缩。将粗材料使用快速色谱(40gSiO2柱,0至100%EtOAc的己烷溶液,然后是0至10%MeOH的DCM溶液)纯化,从而得到呈固体的(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)戊-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(120mg,0.18mmol,41.9%产率)。
LC-MS(ES,m/z):[M+H]+=678.3。
1H NMR(400MHz,DMSO-d6)δ9.58(s,1H),7.94(s,1H),7.56-7.51(m,2H),7.51-7.33(m,7H),7.24-7.18(m,2H),6.98(dd,J=7.7,1.3Hz,1H),6.42-6.31(m,2H),5.85-5.74(m,2H),4.54-4.44(m,1H),3.85-3.76(m,3H),3.66-3.55(m,3H),1.87-1.71(m,2H),1.55(quin,J=7.2Hz,2H),0.91(s,9H),0.75(t,J=7.4Hz,3H)。
步骤3.将微波瓶用(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)戊-3-基)氨基)-1-(4-氰基-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(115mg,0.17mmol)和THF(10mL)装填。添加甲基溴化镁(0.28mL,0.85mmol)溶液,将小瓶加盖,并且将反应在微波炉中在80℃下加热20min。添加异丙醇钛(IV)(0.1mL,0.34mmol),然后添加更多的甲基溴化镁(0.28mL,0.85mmol)溶液。在微波炉中,将反应在80℃下再加热20min。将反应混合物用饱和NH4Cl溶液(10mL)淬灭并且萃取到EtOAc(3x5mL)中。将合并的有机物用盐水(5mL)洗涤,干燥(MgSO4),过滤并且浓缩,从而得到呈胶状物的(S)-(1-(4-(2-氨基丙-2-基)-2-甲氧基苄基)-7-((1-((叔丁基二苯基甲硅烷基)氧基)戊-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(105mg,60%纯度,0.053mmol,52.3%产率)。
LC-MS(ES,m/z):[M+H]+=710.6。
步骤4.将(S)-(1-(4-(2-氨基丙-2-基)-2-甲氧基苄基)-7-((1-((叔丁基二苯基甲硅烷基)氧基)戊-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(105mg,0.148mmol)溶解在二噁烷(4mL)中。添加三乙胺三氢氟酸盐(0.120mL,0.739mmol),并且将反应在70℃下搅拌2小时。然后添加5N NaOH溶液(1.479mL,7.39mmol),并且将反应在70℃下再加热2小时。在冷却后,将反应混合物用5N HCl中和并且蒸发至干。将粗材料溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在0%B下保持0分钟,经20min 0-40%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物106(8.4mg,0.020mmol,13.5%产率)。
实施例7-化合物107二三氟乙酸盐
步骤1.将4-溴-2-甲氧基-1-甲苯(2g,9.95mmol)在四氢呋喃(90mL)中的搅拌溶液冷却至-78℃。添加正丁基锂(9.33mL,14.92mmol),并且将反应在-78℃下搅拌1小时。添加2-甲基-N-(氧杂环丁烷-3-亚基)丙烷-2-亚磺酰胺(1.918g,10.94mmol)在四氢呋喃(10mL)中的溶液,并且允许将反应缓慢加温至室温并且搅拌2小时。将反应混合物倒入饱和NH4Cl溶液(100mL)中并且萃取到EtOAc(3x50mL)中。将合并的有机物用盐水(3x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(80g SiO2柱,0至75%EtOAc的己烷溶液)纯化,从而得到呈胶状物的N-(3-(3-甲氧基-4-甲基苯基)氧杂环丁烷-3-基)-2-甲基丙烷-2-亚磺酰胺(937mg,3.15mmol,31.7%产率)。
LC-MS(ES,m/z):[M+H]+=298.2。
1H NMR(400MHz,DMSO-d6)δ7.16(d,J=7.7Hz,1H),7.00(d,J=7.6Hz,1H),6.98(s,1H),6.23(s,1H),5.00(t,J=6.2Hz,2H),4.89(d,J=6.6Hz,1H),4.67(d,J=6.2Hz,1H),3.79(s,3H),2.15(s,3H),1.20-1.07(m,9H)。
步骤2.向N-(3-(3-甲氧基-4-甲基苯基)氧杂环丁烷-3-基)-2-甲基丙烷-2-亚磺酰胺(700mg,2.354mmol)在二噁烷(25mL)中的搅拌溶液中添加4N HCl的二噁烷溶液(1.177mL,4.71mmol)。将反应在室温下搅拌20min。将产物滤出(用乙醚(100mL)洗涤),以得到呈固体的3-(3-甲氧基-4-甲基苯基)氧杂环丁烷-3-胺盐酸盐(501mg,2.181mmol,93%产率)。
LC-MS(ES,m/z):[M+H]+=194.2。
1H NMR(400MHz,DMSO-d6)δ9.24(br s,3H),7.34-7.10(m,2H),7.01(br s,1H),4.96(br s,4H),3.84(br s,3H),2.17(br s,3H)。
步骤3.将3-(3-甲氧基-4-甲基苯基)氧杂环丁烷-3-胺盐酸盐(500mg,2.177mmol)和DIPEA(0.950mL,5.44mmol)在DCM(25mL)中的溶液在冰浴中冷却。添加氯甲酸苄酯(0.340mL,2.394mmol),并且允许将反应加温至室温并且搅拌1小时。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且萃取到DCM(3x50mL)中。将合并的有机物用盐水(3x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(40g SiO2柱,0至50%EtOAc的己烷溶液)纯化,从而得到呈油状物的(3-(3-甲氧基-4-甲基苯基)氧杂环丁烷-3-基)氨基甲酸苄酯(475mg,1.451mmol,66.7%产率)。
LC-MS(ES,m/z):[M+H]+=328.2。
1H NMR(400MHz,DMSO-d6)δ8.54-8.36(m,1H),7.36(br s,5H),7.12(d,J=7.9Hz,1H),7.00-6.91(m,2H),5.02(br s,2H),4.82(d,J=6.6Hz,2H),4.72(d,J=6.4Hz,2H),3.73(s,3H),2.13(s,3H)。
步骤4.将(3-(3-甲氧基-4-甲基苯基)氧杂环丁烷-3-基)氨基甲酸苄酯(470mg,1.436mmol)、NBS(268mg,1.507mmol)和AIBN(47.1mg,0.287mmol)在CCl4(15mL)中的溶液加热至75℃并且在此温度下保持1小时。在冷却后,将反应混合物蒸发至干,并且将粗材料使用快速色谱(40g SiO2柱,0至40%EtOAc的己烷溶液)纯化,从而得到呈油状物的(3-(4-(溴甲基)-3-甲氧基苯基)氧杂环丁烷-3-基)氨基甲酸苄酯(175mg,0.431mmol,30.0%产率)。
LC-MS(ES,m/z):[M+H]+=406.2,408.1。
1H NMR(400MHz,DMSO-d6)δ8.57-8.45(m,1H),7.47-7.29(m,6H),7.09-6.98(m,2H),5.03(br s,2H),4.82(d,J=6.8Hz,2H),4.79-4.71(m,2H),4.68-4.62(m,2H),3.86-3.79(m,3H)。
步骤5.在0℃下,向(3-溴-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(120mg,0.417mmol)在DMF(2mL)中的搅拌溶液中添加Cs2CO3(204mg,0.625mmol),然后添加(3-(4-(溴甲基)-3-甲氧基苯基)氧杂环丁烷-3-基)氨基甲酸苄酯(169mg,0.417mmol)在DMF(1mL)中的溶液。允许将反应加温至室温并且搅拌过夜。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且萃取到EtOAc(3x50mL)中。将合并的有机物用盐水(3x40mL)洗涤,干燥(MgSO4),过滤并且浓缩,从而得到呈固体的(1-(4-(3-(((苄氧基)羰基)氨基)氧杂环丁烷-3-基)-2-甲氧基苄基)-3-溴-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(220mg,0.251mmol,60.3%产率,70%纯度)。
LC-MS(ES,m/z):[M+H]+=613.2,615.2。
步骤6.将(1-(4-(3-(((苄氧基)羰基)氨基)氧杂环丁烷-3-基)-2-甲氧基苄基)-3-溴-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(220mg,0.251mmol,70%纯度)、丁-1-胺(52.5mg,0.717mmol)、BOP(238mg,0.538mmol)和DBU(0.162mL,1.076mmol)在DMSO(4mL)中的溶液加热至60℃持续20min,然后冷却至室温。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且萃取到EtOAc(3x50mL)中。将合并的有机物用盐水(4x40mL)洗涤,干燥(MgSO4),过滤并且浓缩,从而得到呈油状物的(1-(4-(3-(((苄氧基)羰基)氨基)氧杂环丁烷-3-基)-2-甲氧基苄基)-3-溴-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(245mg,0.220mmol,87.6%产率,60%纯度)。
LC-MS(ES,m/z):[M+H]+=668.3,670.3。
步骤7.向(1-(4-(3-(((苄氧基)羰基)氨基)氧杂环丁烷-3-基)-2-甲氧基苄基)-3-溴-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(240mg,0.215mmol)在EtOH(10mL)中的溶液中添加10%钯碳(24mg)。将反应混合物抽空并且用H2吹扫六次,然后在H2气氛下搅拌24h。将反应混合物过滤并且蒸发至干。将残余物溶解在二噁烷(4mL)中,并且添加NaOH(1.077mL,5.38mmol)。将反应混合物在80℃下搅拌2h,冷却,使用5N HCl中和并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在10%B下保持0分钟,经20min 10%-50%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25℃。由MS和UV信号触发级分的收集。将含有产物的级分合并并且经由离心蒸发干燥。将材料用以下条件经由制备型LC/MS进一步纯化:柱:XBridgePhenyl,200mm x19mm,5μm颗粒;流动相A:5:95乙腈:水(含0.05%TFA);流动相B:95:5乙腈:水(含0.05%TFA);梯度:在5%B下保持0分钟,经20min 5%-55%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物107二三氟乙酸盐(22.2mg,0.032mmol,14.94%产率)。
实施例8-化合物108
步骤1.向(1-(4-(3-(((苄氧基)羰基)氨基)氧杂环丁烷-3-基)-2-甲氧基苄基)-3-溴-7-羟基-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(150mg,0.245mmol)、BOP(162mg,0.367mmol)和DBU(0.111mL,0.734mmol)在DMSO(2mL)中的搅拌溶液中添加(S)-1-((叔丁基二苯基甲硅烷基)氧基)己-3-胺(130mg,0.367mmol)在DMSO(2mL)中的溶液。将反应在60℃下搅拌1小时。将反应混合物用NaHCO3溶液(10mL)淬灭并且萃取到EtOAc(3x8mL)中。将合并的有机相用盐水(4x5mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(24g SiO2柱,0至60%EtOAc的己烷溶液)纯化,从而得到呈胶状物的(S)-(1-(4-(3-(((苄氧基)羰基)氨基)氧杂环丁烷-3-基)-2-甲氧基苄基)-3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(79mg,0.083mmol,34.0%产率)。
LC-MS(ES,m/z):[M+H]+=950.5,952.5。
步骤2.将(S)-(1-(4-(3-(((苄氧基)羰基)氨基)氧杂环丁烷-3-基)-2-甲氧基苄基)-3-溴-7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(79mg,0.083mmol)溶解在乙醇(10mL)中。添加10%钯碳(8mg)。将反应混合物抽空并且用H2吹扫六次,然后在H2气氛下搅拌16h。将反应混合物过滤并且蒸发至干。将残余物溶解在二噁烷(3mL)中,并且添加三乙胺三氢氟酸盐(0.135mL,0.831mmol)。将反应在60℃下搅拌2h。添加5N NaOH(0.665mL,3.32mmol),并且将反应在80℃下再搅拌2小时。在冷却后,将反应用5N HCl中和并且蒸发至干。将粗材料溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在3%B下保持0分钟,经20min 3%-43%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物108(15.0mg,0.034mmol,40.9%产率)。
实施例9-化合物110
向在4mL闪烁瓶中的4-((7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯甲酸甲酯(40mg,0.090mmol)在THF(1mL)中的搅拌溶液中添加甲基溴化镁(0.075mL,0.226mmol)。将反应在室温下搅拌30min并且用水(1mL)淬灭,然后搅拌10min并且蒸发至干。将粗材料溶解在二噁烷(1mL)中,并且添加NaOH(0.271mL,1.356mmol)。将反应混合物加热至80℃并且在此温度下保持过夜。在冷却后,将反应混合物用5N HCl(271uL)中和并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在14%B下保持0分钟,经20min 14%-54%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25℃。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物110(4.3mg,12%产率)。
类似地制备化合物111。
实施例10-化合物112
步骤1.向4-((7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯甲酸甲酯(500mg,1.130mmol)在THF(6mL)中的搅拌溶液中添加氢氧化锂(3.39mL,3.39mmol)。将反应混合物在30℃下搅拌过夜。由于反应不完全,添加更多的氢氧化锂(3.39mL,3.39mmol),并且将反应混合物在30℃下再搅拌24小时。将反应混合物蒸发至干并且使用反相快速色谱(50g C18柱,负载在DMSO/水/MeCN中,0至70%MeCN的水溶液(含0.05%甲酸))纯化,从而得到呈固体的4-((7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯甲酸(262mg,54%产率)。
1H NMR(400MHz,DMSO-d6)δ13.00(br s,1H),9.64(s,1H),7.90(s,1H),7.54-7.49(m,1H),7.43(dd,J=7.8,1.2Hz,1H),7.03(br t,J=5.4Hz,1H),6.53(d,J=7.9Hz,1H),5.80(s,2H),3.89(s,3H),3.63(s,3H),3.55-3.39(m,3H),1.58-1.44(m,2H),1.18(sxt,J=7.4Hz,2H),0.83(t,J=7.4Hz,3H)。
LC/MS[M+H]+429.18。
步骤2.向4-((7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯甲酸(262mg,0.612mmol)、HATU(256mg,0.673mmol)和N,O-二甲基羟胺盐酸盐(84mg,0.856mmol)的搅拌溶液中添加DIPEA(0.235mL,1.345mmol)。将反应在室温下搅拌1小时。将反应混合物倒入饱和NaHCO3溶液(30mL)中并且用EtOAc(3x30mL)萃取。将合并的有机相用盐水(4x20mL)洗涤,干燥(MgSO4),过滤并且浓缩,从而得到呈固体的(7-(丁基氨基)-1-(2-甲氧基-4-(甲氧基(甲基)氨基甲酰基)苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(280mg,97%产率)。
LC/MS[M+H]+472.22。
步骤3.向(7-(丁基氨基)-1-(2-甲氧基-4-(甲氧基(甲基)氨基甲酰基)苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(250mg,0.530mmol)在THF(4mL)中的搅拌溶液中添加甲基溴化镁(0.884mL,2.65mmol)。将反应在室温下搅拌30min。将反应混合物倒入饱和NH4Cl溶液(50mL)中并且用EtOAc(3x30mL)萃取。将合并的有机相用盐水(3x30mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(40g SiO2柱,负载在DCM中,0至10%MeOH的DCM溶液)得到呈固体的(1-(4-乙酰基-2-甲氧基苄基)-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(140mg,61%)。
1H NMR(400MHz,DMSO-d6)δ9.64(s,1H),7.90(s,1H),7.49(s,1H),7.48(d,J=7.5Hz,1H),7.06(br t,J=5.4Hz,1H),6.55(d,J=7.9Hz,1H),5.80(s,2H),3.90(s,3H),3.63(s,3H),3.52-3.43(m,2H),3.31(s,3H),1.53(quin,J=7.3Hz,2H),1.19(sxt,J=7.4Hz,2H),0.83(t,J=7.4Hz,3H)。
LC/MS[M+H]+425.1。
步骤4.将(1-(4-乙酰基-2-甲氧基苄基)-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(25mg,0.059mmol)溶解在THF(5mL)中。添加EtMgBr(39.1mg,0.293mmol)。将反应混合物在室温下搅拌30min,用MeOH(1mL)淬灭,并且蒸发至干。将残余物溶解在二噁烷(3mL)中。添加NaOH(0.234mL,1.172mmol),并且将反应在80℃下搅拌4h。在冷却后,将反应混合物用1N HCl中和,然后蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含10mM NH4OAc);流动相B:95:5乙腈:水(含10mM NH4OAc);梯度:在16%B下保持0分钟,经20min 16%-56%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有化合物112的级分合并并且经由离心蒸发干燥(3.9mg,17%产率)。
类似地制备化合物113。关于分析数据,参见表A。
实施例11-化合物114
步骤1.将(4-溴-2-甲氧基苯基)甲醇(5g,23.03mmol)、TBS-Cl(4.17g,27.6mmol)和咪唑(2.195g,32.2mmol)在DMF(50mL)中的溶液在室温下搅拌过夜。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且用EtOAc(3x70mL)萃取。将合并的有机相用盐水(4x50mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(120g柱,负载在DCM中,用DCM洗脱)得到呈无色液体的((4-溴-2-甲氧基苄基)氧基)(叔丁基)二甲基硅烷(6.766g,89%产率)。
1H NMR(400MHz,氯仿-d)δ7.22(d,J=8.2Hz,1H),7.00(dd,J=8.1,1.8Hz,1H),6.84(d,J=1.8Hz,1H),4.60-4.54(m,2H),3.76-3.68(m,3H),0.84(s,9H),0.00(s,6H)。
步骤2.将((4-溴-2-甲氧基苄基)氧基)(叔丁基)二甲基硅烷(2.66g,8.03mmol)在THF(40mL)中的溶液冷却至-78℃。经10min分批添加正丁基锂(3.37mL,8.43mmol)。将所得溶液在-78℃下搅拌15min。经5min分批添加氧杂环丁烷-3-酮(0.550g,7.63mmol)在THF(10mL)中的溶液。允许将反应混合物加温至室温并且搅拌过夜。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且用EtOAc(3x40mL)萃取。将合并的有机相用盐水(3x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(40g柱,负载在DCM中,0至60%EtOAc的己烷溶液)得到呈油状物的3-(4-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-甲氧基苯基)氧杂环丁烷-3-醇(1.36g,52%产率),其在静置时凝固。
1H NMR(400MHz,氯仿-d)δ7.40(d,J=7.7Hz,1H),7.07(dd,J=7.8,1.7Hz,1H),6.92(d,J=1.5Hz,1H),4.84-4.77(m,4H),4.68-4.58(m,2H),3.74(s,3H),1.93-1.87(m,1H),0.84(s,9H),0.00(s,6H)。
步骤3.将20mL闪烁瓶用3-(4-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-甲氧基苯基)氧杂环丁烷-3-醇(488mg,1.504mmol)、三乙胺(0.419mL,3.01mmol)、DMAP(18.37mg,0.150mmol)和DCM(5mL)装填。添加乙酸酐(0.156mL,1.654mmol)。将反应混合物在室温下搅拌1h。将反应混合物蒸发至干,然后再溶解在MeCN(2x5mL)中并且再次蒸发至干。将残余物溶解在MeCN(2mL)中。添加TBAF(3.01mL,3.01mmol)[1N,在THF中],并且将反应搅拌1小时。将反应混合物蒸发至干,然后溶解在MeCN(5mL)中并且蒸发至干两次。将粗材料使用快速色谱(40g柱,负载在DCM中,0至80%EtOAc的己烷溶液)纯化,从而得到呈固体的3-(4-(羟基甲基)-3-甲氧基苯基)氧杂环丁烷-3-基乙酸酯(158mg,42%产率)。
1H NMR(400MHz,CD3Cl)δ7.33(d,J=7.5Hz,1H),7.06-6.99(m,1H),5.07(d,J=8.1Hz,2H),4.96(d,J=7.9Hz,2H),4.71(s,2H),3.93(s,3H),2.17(s,3H),1.86(br s,1H),1.63(br s,1H)。
LC/MS[M+H]+253.08。
步骤4.将3-(4-(羟基甲基)-3-甲氧基苯基)氧杂环丁烷-3-基乙酸酯(150mg,0.595mmol)溶解在DCM(5mL)中。添加SOCl2(0.130mL,1.784mmol)。将反应在室温下搅拌1h。将反应混合物蒸发至干,然后从MeCN(5mL)中溶解并且蒸发两次。向(3-溴-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(190mg,0.554mmol)在DMF(2mL)中的搅拌溶液中添加Cs2CO3(361mg,1.108mmol),然后添加3-(4-(氯甲基)-3-甲氧基苯基)氧杂环丁烷-3-基乙酸酯(150mg,0.554mmol)在DMF(2mL)中的溶液。将反应混合物在室温下搅拌过夜。将反应用饱和NaHCO3溶液(10mL)淬灭并且用EtOAc(3x5mL)萃取。将合并的有机相用盐水(4x5mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(40g SiO2柱,负载在DCM中,0至15%MeOH的DCM溶液)得到3-(4-((3-溴-7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)氧杂环丁烷-3-基乙酸酯(220mg,34%,约50%纯,主要被2-区域异构体副产物污染)。
LC/MS[M-H]-575.1,577.0。
步骤5.将3-(4-((3-溴-7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)氧杂环丁烷-3-基乙酸酯(65mg,0.113mmol)溶解在EtOH(4mL)中。添加Pd/C(50mg)。将反应混合物抽空并且用氢气吹扫六次,然后在氢气气氛下搅拌过夜。将反应混合物过滤,并且将滤液蒸发至干。将残余物溶解在二噁烷(2mL)中。添加NaOH(0.349mL,1.745mmol)溶液,并且将反应混合物在80℃下搅拌3小时。在冷却后,将反应混合物用HCl中和并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含10mM NH4OAc);流动相B:95:5乙腈:水(含10mM NH4OAc);梯度:在8%B下保持0分钟,经20min8%-48%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物114(2.1mg,4.7%)。
实施例12-化合物115
将1-(4-((5-氨基-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)乙-1-酮(64mg,0.174mmol)溶解在THF(5mL)中。添加TBAF(0.521mL,0.521mmol),并且将反应在冰浴中冷却。分批添加(三氟甲基)三甲基硅烷(Ruppert试剂,0.126mL,1.737mmol)在THF(1mL)中的溶液。允许将反应混合物缓慢加温至室温并且搅拌1h。添加更多的(三氟甲基)三甲基硅烷(0.126mL,1.737mmol)。将反应混合物再搅拌30min。将反应用水(0.5mL)和MeOH(0.5mL)淬灭并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含0.1%TFA);流动相B:95:5乙腈:水(含0.1%TFA);梯度:在12%B下保持0分钟,经25min 12%-52%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25℃。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥。将材料用以下条件经由制备型LC/MS进一步纯化:柱:XBridge Phenyl,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含10mM NH4OAc);流动相B:95:5乙腈:水(含10mM NH4OAc);梯度:在28%B下保持0分钟,经20min 28%-68%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25℃。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物115(5.0mg,21%产率)。
实施例13-化合物116
步骤1.将((4-溴-2-甲氧基苄基)氧基)(叔丁基)二甲基硅烷(3g,9.05mmol)在THF(40mL)中的溶液冷却至-78℃。经10min分批添加正丁基锂(3.80mL,9.51mmol)。将所得溶液在-78℃下搅拌15min。经5min分批添加3-氧代氮杂环丁烷-1-甲酸苄酯(1.765g,8.60mmol)在THF(10mL)中的溶液。允许将反应混合物加温至室温并且搅拌过夜。将反应混合物倒入饱和NaHCO3溶液(100mL)中并且用EtOAc(3x40mL)萃取。将合并的有机相用盐水(3x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(40g SiO2柱,负载在DCM中,0至60%EtOAc的己烷溶液)得到呈油状物的3-(4-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-甲氧基苯基)-3-羟基氮杂环丁烷-1-甲酸苄酯(679mg,16.39%产率)。
1H NMR(400MHz,氯仿-d)δ7.38(d,J=7.9Hz,1H),7.27-7.17(m,5H),6.95(dd,J=7.9,1.5Hz,1H),6.81(d,J=1.5Hz,1H),5.03(s,2H),4.63(s,2H),4.28-4.11(m,4H),3.71(s,3H),0.84(s,9H),0.00(s,6H)。
步骤2.将20mL闪烁瓶用3-(4-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-甲氧基苯基)-3-羟基氮杂环丁烷-1-甲酸苄酯(680mg,1.486mmol)、三乙胺(0.414mL,2.97mmol)、DMAP(18.15mg,0.149mmol)和DCM(5mL)装填。添加乙酸酐(0.154mL,1.634mmol),并且将反应在室温下搅拌1h。将反应混合物蒸发至干,溶解在MeCN(5mL)中并且蒸发至干两次。将残余物溶解在MeCN(4mL)中。添加TBAF(2.97mL,2.97mmol,1N,在THF中),并且将反应混合物在室温下搅拌1h。将反应混合物蒸发至干,然后溶解在MeCN(5mL)中并且蒸发至干两次。将粗材料使用快速色谱(40g SiO2柱,负载在DCM中,0至60%EtOAc的己烷溶液)纯化,从而得到呈油状物的3-乙酰氧基-3-(4-(羟基甲基)-3-甲氧基苯基)氮杂环丁烷-1-甲酸苄酯(260mg,45%产率)。
1H NMR(400MHz,氯仿-d)δ7.38-7.27(m,6H),6.95(dd,J=7.7,1.8Hz,1H),6.88(d,J=1.5Hz,1H),5.13(s,2H),4.66(s,2H),4.47-4.39(m,4H),3.86(s,3H),2.10(s,3H)。
步骤3.将3-乙酰氧基-3-(4-(羟基甲基)-3-甲氧基苯基)氮杂环丁烷-1-甲酸苄酯(260mg,0.675mmol)溶解在DCM(5mL)中。添加SOCl2(0.059mL,0.810mmol),并且将反应在室温下搅拌1h。将反应混合物蒸发至干,溶解在MeCN(5mL)中并且再次蒸发,从而得到呈无色油状物的3-乙酰氧基-3-(4-(氯甲基)-3-甲氧基苯基)氮杂环丁烷-1-甲酸苄酯(270mg,0.669mmol,99%产率)。
步骤4.将20mL闪烁瓶用(3-溴-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(200mg,0.583mmol)、Cs2CO3(380mg,1.166mmol)和DMF(2mL)装填并且在冰浴中冷却。添加3-乙酰氧基-3-(4-(氯甲基)-3-甲氧基苯基)氮杂环丁烷-1-甲酸苄酯(130mg,0.322mmol)在DMF(3mL)中的溶液。允许将反应混合物缓慢加温至室温并且搅拌24h。添加水(10mL),并且将反应混合物萃取到EtOAc(3x5mL)中。将合并的有机相用盐水(4x5mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(24g SiO2柱,负载在DCM中,0至10%MeOH的DCM溶液)得到3-乙酰氧基-3-(4-((3-溴-7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)氮杂环丁烷-1-甲酸苄酯(163mg,20%产率,约50%,被2-区域异构体污染)。
LC/MS[M-H]-708.0,710.0。
步骤5.向3-乙酰氧基-3-(4-((3-溴-7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)氮杂环丁烷-1-甲酸苄酯(163mg,0.229mmol,1-和2-区域异构体的混合物)在乙醇(20mL)中的溶液中添加10%Pd/C(100mg)。将反应混合物抽空并且用氢气吹扫六次,然后在氢气气氛下搅拌2天。将反应混合物过滤并且蒸发至干。快速色谱(40g SiO2柱,负载在DCM中,0至20%MeOH的DCM溶液)得到呈固体的3-(4-((7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)氮杂环丁烷-3-基乙酸酯(20mg,0.040mmol,17.52%产率)。
1H NMR(400MHz,DMSO-d6)δ9.63(br s,1H),7.87(s,1H),7.17-6.92(m,3H),6.57(d,J=7.9Hz,1H),5.72(s,2H),4.28-4.16(m,4H),3.86(s,3H),3.63(s,3H),3.55-3.47(m,2H),2.08(s,3H),1.56(quin,J=7.3Hz,2H),1.25(sxt,J=7.4Hz,2H),0.91-0.84(m,3H)。
LC/MS[M+H]+498.25。
步骤6.将3-(4-((7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)氮杂环丁烷-3-基乙酸酯(20mg,0.040mmol)溶解在二噁烷(2mL)中。添加NaOH(0.201mL,1.005mmol),并且将反应混合物在80℃下搅拌2h。在冷却后,将反应混合物用HCl中和并且蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在4%B下保持0分钟,经20min 4%-44%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物116(3.5mg,22%产率)。
实施例14-化合物117
步骤1.将((4-溴-2-甲氧基苄基)氧基)(叔丁基)二甲基硅烷(2.75g,8.30mmol)在THF(40mL)中的溶液冷却至-78℃。经10min分批添加正丁基锂(3.49mL,8.72mmol)。将所得溶液在-78℃下搅拌15min。经5min分批添加环丁酮(0.611g,8.72mmol)在THF(10mL)中的溶液。允许将反应混合物加温至室温,搅拌过夜,并且倒入饱和NaHCO3溶液(100mL)中。用EtOAc(3x40mL)进行萃取提供合并的有机相,将其用盐水(3x40mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(80g SiO2柱,负载在DCM中,0至25%EtOAc的己烷溶液)得到呈油状物的1-(4-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-甲氧基苯基)环丁-1-醇(2.015g,75%产率),其在静置时凝固。
1H NMR(400MHz,氯仿-d)δ7.35(d,J=7.9Hz,1H),6.98(dd,J=7.7,1.5Hz,1H),6.87(d,J=1.5Hz,1H),4.64(s,2H),3.73(s,3H),2.50-2.42(m,2H),2.30-2.21(m,2H),1.95-1.81(m,1H),1.64-1.52(m,1H),0.86-0.83(m,9H),0.00(s,6H)。
步骤2.将20mL闪烁瓶用1-(4-(((叔丁基二甲基甲硅烷基)氧基)甲基)-3-甲氧基苯基)环丁-1-醇(2g,6.20mmol)、三乙胺(1.729mL,12.40mmol)、DMAP(0.076g,0.620mmol)和DCM(20mL)装填。添加乙酸酐(0.644mL,6.82mmol)。将反应混合物在室温下搅拌2h,并且蒸发至干。将残余物溶解在MeCN(5mL)中并且蒸发至干两次。将残余物再溶解在MeCN(8mL)中。添加TBAF(12.40mL,12.40mmol,1N,在THF中),并且将反应混合物搅拌1h。将反应混合物蒸发至干。将残余物溶解在MeCN(5mL)中并且蒸发至干两次。将粗材料使用快速色谱纯化,从而得到呈油状物的乙酸1-(4-(羟基甲基)-3-甲氧基苯基环丁酯(1.0g,64%产率)。
1H NMR(400MHz,氯仿-d)δ7.26(d,J=1.8Hz,1H),7.07(dd,J=7.8,1.7Hz,1H),6.98(d,J=1.3Hz,1H),4.67(s,2H),3.89(s,3H),2.70-2.55(m,4H),2.09-1.92(m,4H),1.74(dquin,J=11.2,8.8Hz,1H)。
步骤3.将乙酸1-(4-(羟基甲基)-3-甲氧基苯基)环丁酯(500mg,1.998mmol)溶解在DCM(10mL)中并且在冰浴中冷却。添加DIPEA(0.436mL,2.497mmol),然后添加甲磺酰氯(0.467mL,5.99mmol)。将反应混合物在0℃下搅拌30min,然后在室温下搅拌过夜。将反应混合物用饱和NaHCO3溶液(10mL)淬灭并且用DCM(2x5mL)萃取。将合并的有机相用NaHCO3溶液(10mL)和盐水(2x10mL)洗涤,干燥(MgSO4),过滤并且浓缩,从而得到呈油状物的乙酸1-(3-甲氧基-4-(((甲基磺酰基)氧基)甲基)苯基)环丁酯(498mg,76%产率)。
步骤4.在0℃下,向(3-溴-7-(丁基氨基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(650mg,1.894mmol)在DMF(2mL)中的搅拌溶液中添加Cs2CO3(1234mg,3.79mmol),然后添加乙酸1-(3-甲氧基-4-(((甲基磺酰基)氧基)甲基)苯基)环丁酯(498mg,1.515mmol)在DMF(1mL)中的溶液。允许将反应混合物加温至室温,搅拌72h,并且倒入饱和NaHCO3溶液(50mL)中。用EtOAc(3x40mL)进行萃取提供有机相,将其合并并且用盐水(4x30mL)洗涤,干燥(MgSO4),过滤并且浓缩。快速色谱(40g SiO2柱,负载在DCM中,0至65%EtOAc的己烷溶液)得到呈固体的乙酸1-(4-((3-溴-7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)环丁酯(242mg,22%产率)。
1H NMR(400MHz,DMSO-d6)δ9.86(s,1H),7.30(t,J=5.6Hz,1H),7.02-6.96(m,2H),6.73(d,J=7.7Hz,1H),5.68(s,2H),3.80(s,3H),3.63(s,3H),3.60-3.50(m,2H),3.32(s,2H),2.59-2.44(m,2H),1.96(s,3H),1.94-1.86(m,1H),1.77-1.65(m,1H),1.59(quin,J=7.3Hz,2H),1.27(sxt,J=7.4Hz,2H),0.88(t,J=7.4Hz,3H)。LC/MS[M+H]+575.37,577.37。
步骤5.将乙酸1-(4-((3-溴-7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯基)环丁酯(200mg,0.348mmol)溶解在EtOH(25mL)中。添加10%Pd/C(50mg)。将反应混合物抽空并且用氢气吹扫六次,在氢气气氛下搅拌过夜,过滤,并且蒸发至干。将残余物溶解在二噁烷(2mL)中。添加NaOH(0.242mL,1.208mmol),并且将反应加热至80℃并且在此温度下保持4小时。在冷却后,将反应混合物用5N HCl中和,然后蒸发至干。将残余物溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在16%B下保持0分钟,经20min 16%-56%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物117(22.5mg,16%产率)。
实施例15-化合物118
在-78℃下,经10min向异丙醇钛(IV)(257mg,0.904mmol)在THF(8mL)中的溶液中分批添加乙基溴化镁(2.71mL,2.71mmol)。将反应在-78℃下搅拌60min。然后添加4-((7-(丁基氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯甲酸甲酯(100mg,0.226mmol)在THF(1mL)中的溶液。允许将反应缓慢加温至室温并且搅拌过夜。将反应用水(20mL)淬灭,过滤并且用EtOAc(3x5mL)萃取。将合并的有机相用盐水(3x5mL)洗涤,干燥(MgSO4),过滤并且浓缩。将残余物溶解在二噁烷(2mL)中。添加NaOH(0.436mL,2.179mmol),并且将反应混合物在80℃下搅拌2小时。在冷却后,将它用HCl中和并且蒸发至干。将粗材料溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在19%B下保持0分钟,经20min 19%-59%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥。将材料用以下条件经由制备型LC/MS进一步纯化:柱:XBridgeC18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在20%B下保持0分钟,经20min 20%-60%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物118(9.4mg,11%产率)。
实施例16-化合物109
步骤1.将(S)-4-((7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-5-((甲氧基羰基)氨基)-1H-吡唑并[4,3-d]嘧啶-1-基)甲基)-3-甲氧基苯甲酸甲酯(30mg,0.041mmol;US 2020/0038403,图3A,化合物24)在THF(1mL)中的溶液用甲基氯化镁的THF溶液(0.069mL,0.207mmol)处理。将反应混合物搅拌1h,之后LCMS显示出反应完成。将反应用MeOH(1mL)淬灭,并且将溶剂蒸发。将粗产物按原样带到下一步。
步骤2.将(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-(4-(2-羟基丙-2-基)-2-甲氧基苄基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(26mg,0.036mmol)在二噁烷(0.5mL)中的溶液用NaOH(0.179mL,0.179mmol)处理并且在80℃下加热过夜,之后LCMS显示出氨基甲酸酯和TBDPS的去保护。通过缓慢添加6M HCl将反应中和至pH 7,并且将溶剂蒸发。将粗材料用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x 19mm,5μm颗粒;流动相A:5:95乙腈:水(含10mM NH4OAc);流动相B:95:5乙腈:水(含10mM NH4OAc);梯度:在11%B下保持0分钟,经20min11%-51%B,然后在100%B下保持4分钟;流速:20mL/min;柱温:25C。由MS和UV信号触发级分的收集。将含有所需化合物109的级分合并并且经由离心蒸发干燥。
实施例17-化合物119
步骤1.将小瓶用4,4,5,5-四甲基-2-(丙-1-烯-2-基)-1,3,2-二氧杂环戊硼烷(0.832g,4.95mmol)、6-溴-3-甲氧基-2-甲基吡啶(1g,4.95mmol)、[1,1'-双(二苯基膦基)二茂铁]二氯化钯(II)(0.362g,0.495mmol)、二噁烷(9.90ml)和水(2.475ml)装填。将反应混合物在65℃下加热过夜。将反应混合物倒入饱和NaHCO3溶液(10mL)中并且用EtOAc(3x5mL)萃取。将合并的有机相用盐水(3x5mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱(40g SiO2柱,负载在DCM中,0至20%EtOAc的己烷溶液)纯化,从而得到呈油状物的3-甲氧基-2-甲基-6-(丙-1-烯-2-基)吡啶(366mg,45%产率)。
LC/MS[M+H]+164.1。
步骤2.将草酸铁(III)六水合物(1766mg,4.48mmol)在水(70mL)中的悬浮液搅拌4小时以溶解固体材料。然后将溶液在冰浴中冷却并且用氮气脱气10min。添加叠氮化钠(437mg,6.73mmol)在EtOH(35mL)中的溶液,然后添加3-甲氧基-2-甲基-6-(丙-1-烯-2-基)吡啶(366mg,2.242mmol)在EtOH(35mL)中的溶液。将反应混合物在0℃下搅拌5min;然后分两批间隔5min添加硼氢化钠(254mg,6.73mmol)。将反应搅拌30min并且用氨溶液(40mL)淬灭并且在室温下再搅拌30min。将产物用DCM(3x50mL)萃取,并且将合并的有机相用盐水(50mL)洗涤,干燥(MgSO4),过滤并且浓缩。将粗材料使用快速色谱纯化,从而得到呈无色液体的6-(2-叠氮基丙-2-基)-3-甲氧基-2-甲基吡啶(290mg,63%产率)。
LC/MS[M+H]+207.2。
步骤3.向6-(2-叠氮基丙-2-基)-3-甲氧基-2-甲基吡啶(290mg,1.406mmol)在乙醇(7mL)中的溶液中添加10%钯碳(74.8mg,0.070mmol)。将反应混合物在氢气气氛下搅拌4h,通过CELITETM过滤并且浓缩。将残余物溶解在DCM(7mL)中并且冷却至0℃。添加DIPEA(0.737mL,4.22mmol),然后添加氯甲酸甲酯(0.218mL,2.81mmol)。将反应混合物在室温下搅拌过夜,用饱和NaHCO3溶液(20mL)淬灭并且用DCM(3x10mL)萃取。将合并的有机相用盐水(10mL)洗涤,干燥(MgSO4)并且浓缩。将粗材料使用快速色谱纯化,从而提供呈油状物的(2-(5-甲氧基-6-甲基吡啶-2-基)丙-2-基)氨基甲酸甲酯(219mg,65%产率)。
LC/MS[M+H]+239.2。
步骤4.向NBS(164mg,0.919mmol)和AIBN(15.09mg,0.092mmol)在四氯化碳(4mL)中的溶液中添加(2-(5-甲氧基-6-甲基吡啶-2-基)丙-2-基)氨基甲酸甲酯(219mg,0.919mmol)。将反应混合物在75℃下搅拌3h。在冷却后,将它蒸发至干并且使用快速色谱(24g SiO2柱,负载在DCM中,0至50%EtOAc的己烷溶液)纯化,从而得到(2-(6-(溴甲基)-5-甲氧基吡啶-2-基)丙-2-基)氨基甲酸甲酯(273mg,94%产率)。
LC/MS[M+H]+317.1,319.1。
步骤5.向(7-羟基-3-碘-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(288mg,0.861mmol)在DMF(5738μl)中的搅拌溶液中添加Cs2CO3(308mg,0.947mmol),然后添加(7-羟基-3-碘-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(288mg,0.861mmol)。将反应混合物在室温下搅拌过夜,用EtOAc(50mL)稀释,用盐水(2x20mL)洗涤,干燥(MgSO4),浓缩,并且使用快速色谱(0-20%MeOH/DCM)纯化。将含产物的级分浓缩,以提供呈固体的(7-羟基-3-碘-1-((3-甲氧基-6-(2-((甲氧基羰基)氨基)丙-2-基)吡啶-2-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(374mg,76%产率)。
LC/MS[M+H]+572.2。
步骤6.向(7-羟基-3-碘-1-((3-甲氧基-6-(2-((甲氧基羰基)氨基)丙-2-基)吡啶-2-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(94mg,0.165mmol)、(S)-3-氨基己-1-醇HCl(50.6mg,0.329mmol)和BOP(109mg,0.247mmol)在DMSO(1645μl)中的搅拌溶液中添加DBU(99μl,0.658mmol)。将反应混合物在室温下搅拌过夜,用EtOAc(30mL)稀释,用盐水(4x20mL)洗涤,干燥(MgSO4)并且浓缩。将粗材料使用快速色谱(24g SiO2柱,负载在DCM中,0至10%MeOH/DCM)纯化,从而得到呈固体的(S)-(7-((1-羟基己-3-基)氨基)-3-碘-1-((3-甲氧基-6-(2-((甲氧基羰基)氨基)丙-2-基)吡啶-2-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(64mg,58.0%产率)。
1H NMR(400MHz,DMSO-d6)δ9.84(s,1H),7.41(d,J=8.8Hz,1H),7.18(d,J=8.6Hz,1H),7.12(s,1H),6.66(d,J=8.6Hz,1H),5.98(d,J=17.6Hz,1H),5.80(d,J=17.6Hz,1H),4.43(br d,J=6.8Hz,1H),4.34(dd,J=6.6,4.6Hz,1H),3.87(s,3H),3.62(s,3H),3.46-3.40(m,4H),1.70-1.59(m,2H),1.55-1.45(m,1H),1.41(br d,J=9.2Hz,1H),1.14-0.96(m,8H),0.73-0.68(m,3H)。
LC/MS[M+H]+671.3。
步骤7.将(S)-(7-((1-羟基己-3-基)氨基)-3-碘-1-((3-甲氧基-6-(2-((甲氧基羰基)氨基)丙-2-基)吡啶-2-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(64mg,0.095mmol)溶解在EtOH(4772μl)中。添加10%钯碳(7.11mg,6.68μmol)。将反应混合物抽空,用氢气吹扫三次,并且在氢气气氛下搅拌过夜。将反应混合物通过CELITETM过滤(用乙醇(10mL)洗涤)。将滤液蒸发,以得到呈固体的(S)-(7-((1-羟基己-3-基)氨基)-1-((3-甲氧基-6-(2-((甲氧基羰基)氨基)丙-2-基)吡啶-2-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(52.0mg,100%产率)。
LC/MS[M+H]+=545.4。
步骤8.向(S)-(7-((1-羟基己-3-基)氨基)-1-((3-甲氧基-6-(2-((甲氧基羰基)氨基)丙-2-基)吡啶-2-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(52mg,0.095mmol)在MeOH(955μl)中的搅拌溶液中添加NaOH(191μL,1.910mmol)。将反应混合物在80℃下搅拌过夜,浓缩并且再溶解在二噁烷(1mL)中。然后将它用NaOH(0.2mL)处理并且在100℃下搅拌过夜。将反应冷却至0℃,用HCl(159μL,1.910mmol)淬灭并且浓缩。将粗材料溶解在DMF(2mL)中,过滤并且用以下条件经由制备型LC/MS纯化:柱:XBridge C18,200mm x19mm,5μm颗粒;流动相A:5:95乙腈:水(含NH4OAc);流动相B:95:5乙腈:水(含NH4OAc);梯度:在0%B下保持0分钟,经25min 0-40%B,然后在100%B下保持0分钟;流速:20mL/min;柱温:25C。由MS信号触发级分的收集。将含有所需产物的级分合并并且经由离心蒸发干燥,从而得到化合物119(6.2mg,15%产率)。
实施例18-化合物120
步骤1.在0℃下,向4,6-二氯烟酸甲酯(5g,24.27mmol)在THF(50mL)中的搅拌溶液中经2min逐滴添加甲醇钠(5.41mL,29.1mmol)。将反应混合物在0℃下搅拌5min,然后在室温下搅拌12h。将反应混合物在水(50mL)与乙酸乙酯(50mL)之间分配。将有机层分离出来,并且将水层用EtOAc(2x30mL)萃取。将合并的有机层用盐水溶液(100mL)洗涤,经无水Na2SO4干燥,过滤并且在真空下浓缩,以提供粗产物,将其通过快速色谱(40g硅胶柱,30%EtOAc的石油醚溶液)纯化,以提供呈灰白色固体的6-氯-4-甲氧基烟酸甲酯(3.4g,16.86mmol,69.5%产率)。
1H NMR(400MHz,DMSO-d6)δ=8.57(s,1H),7.37(s,1H),3.96(s,3H),3.82(s,3H)。LC-MS m/z 202.2[M+H]+。
步骤2.在0℃下,向6-氯-4-甲氧基烟酸甲酯(3.2g,15.87mmol)在THF(40mL)中的搅拌溶液中经10min以逐滴方式添加LiAlH4(31.7mL,31.7mmol)。在添加结束后,允许将反应混合物加温至室温并且搅拌2h。将反应混合物冷却并且通过依次逐滴添加水(1.0mL)、15%水性NaOH(1.0mL)和水(2.0mL)淬灭。在搅拌30min后,将混合物通过CELITETM垫过滤,将其用过量的EtOAc洗涤。将滤液在减压下浓缩,以得到残余物,将其用冷醚(15mL)洗涤并且干燥,以提供呈灰白色固体的(6-氯-4-甲氧基吡啶-3-基)甲醇(2.2g,12.67mmol,80%产率)。
1H NMR(400MHz,DMSO-d6)δ=8.20-8.14(m,1H),7.15-7.07(m,1H),5.20(t,J=5.5Hz,1H),4.46(d,J=5.5Hz,2H),3.90-3.86(m,3H)。LC-MS m/z 174.2[M+H]+。
步骤3.在0℃下,向(6-氯-4-甲氧基吡啶-3-基)甲醇(2.9g,16.71mmol)在DCM(30.0mL)中的搅拌溶液中添加TEA(4.66mL,33.4mmol)、MsCl(2.60mL,33.4mmol)和氯化锂(无水的,1.416g,33.4mmol)。将反应混合物在0℃下搅拌30min,然后在室温下搅拌3h。将反应混合物在DCM与水之间分配。将有机层用盐水溶液洗涤并且经Na2SO4干燥,过滤并且在减压下浓缩,以提供呈浅棕色油状物的2-氯-5-(氯甲基)-4-甲氧基吡啶(3.0g,9.22mmol,55.2%产率)。
1H NMR(400MHz,氯仿-d)δ=8.24-8.22(m,1H),6.86-6.84(m,1H),4.59-4.54(m,2H),3.96-3.95(s,3H)。LC-MS m/z 192.0[M+H]+。
步骤4.在0℃下,向(7-羟基-3-碘-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(5.0g,14.92mmol)在DMF(50.0mL)中的搅拌溶液中添加Cs2CO3(9.72g,29.8mmol)和2-氯-5-(氯甲基)-4-甲氧基吡啶(2.87g,14.92mmol)。将反应混合物在0℃下搅拌1h,然后添加水。将沉淀的固体过滤并且用过量的水洗涤,然后用石油醚洗涤。将固体在真空下干燥,以提供呈灰白色固体的(1-((6-氯-4-甲氧基吡啶-3-基)甲基)-7-羟基-3-碘-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(4.9g,8.79mmol,58.9%产率)。
1H NMR(400MHz,DMSO-d6)δ=11.69(br s,1H),11.40-11.34(m,1H),7.97-7.94(m,1H),7.23-7.19(m,1H),5.70-5.67(m,2H),3.88-3.84(m,3H),3.78-3.74(m,3H)。LC-MS m/z490.8[M+H]+。
步骤5.向(1-((6-氯-4-甲氧基吡啶-3-基)甲基)-7-羟基-3-碘-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(4.0g,8.15mmol)在DMSO(30.0mL)中的搅拌溶液中添加DBU(3.69mL,24.46mmol)、BOP(5.41g,12.23mmol)和(S)-1-((叔丁基二苯基甲硅烷基)氧基)己-3-胺(2.90g,8.15mmol)。将反应混合物在45℃下搅拌2h,然后在EtOAc与水之间分配。将有机层用盐水溶液洗涤,经Na2SO4干燥,过滤并且在减压下浓缩,以提供残余物。将粗化合物通过ISCO Combiflash色谱(通过用50%-100%乙酸乙酯的氯仿溶液洗脱)纯化,以提供呈浅棕色固体的(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-((6-氯-4-甲氧基吡啶-3-基)甲基)-3-碘-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(2.89g,3.25mmol,39.8%产率)。
1H NMR(400MHz,DMSO-d6)δ=9.74(s,1H),7.75(s,1H),7.59-7.55(m,2H),7.52-7.33(m,7H),7.28-7.22(m,2H),7.16(s,1H),6.75(d,J=8.5Hz,1H),5.78-5.59(m,2H),4.72-4.61(m,1H),3.73(s,3H),3.71-3.66(m,2H),3.59(s,3H),1.95-1.86(m,2H),1.66-1.47(m,2H),1.32-1.14(m,2H),0.93(s,9H),0.86-0.81(m,3H);LC-MS m/z 828.2[M+H]+。
步骤6.向(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-((6-氯-4-甲氧基吡啶-3-基)甲基)-3-碘-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1.65g,1.992mmol)在乙酸乙酯(10.0mL)和乙醇(10.0mL)的混合物中的搅拌溶液中添加Pd/C(1.060g,0.996mmol)。将反应混合物在室温下在氢气囊压力下搅拌16h。将反应混合物通过CELITETM床过滤。将CELITETM床用过量的甲醇洗涤。将滤液在减压下浓缩,以提供呈浅棕色固体的(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-((6-氯-4-甲氧基吡啶-3-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(1.5g,1.730mmol,87%产率)。
LC-MS m/z 702.2[M+H]+。
步骤7.向(S)-(7-((1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)氨基)-1-((6-氯-4-甲氧基吡啶-3-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5-基)氨基甲酸甲酯(0.5g,0.712mmol)在1,4-二噁烷(4.0mL)和水(1.0mL)的混合物中的搅拌溶液中添加Cs2CO3(0.696g,2.136mmol)、4,4,5,5-四甲基-2-(丙-1-烯-2-基)-1,3,2-二氧杂环戊硼烷(0.201mL,1.068mmol)和PdCl2(dppf).CH2Cl2加合物(0.058g,0.071mmol)。将反应混合物用氮气吹扫并且在100℃下搅拌16h。将反应混合物通过CELITETM床过滤。将滤液在EtOAc与水之间分配。将有机层用盐水溶液洗涤,经Na2SO4干燥,过滤并且在减压下浓缩,以提供残余物。将粗化合物通过ISCO Combiflash色谱(通过用40%-100%乙酸乙酯的氯仿溶液洗脱)纯化,以提供呈棕色半固体的(S)-N7-(1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)-1-((4-甲氧基-6-(丙-1-烯-2-基)吡啶-3-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5,7-二胺(162mg,0.229mmol,32.2%产率)。
1H NMR(400MHz,DMSO-d6)δ=7.61-7.48(m,7H),7.43-7.34(m,4H),7.31-7.25(m,2H),7.17(s,1H),5.86(s,1H),5.77-5.49(m,4H),5.27(s,1H),4.56-4.45(m,1H),3.86-3.83(m,3H),3.69-3.61(m,2H),2.08-2.05(m,3H),1.83-1.76(m,2H),1.49-1.40(m,2H),1.16-1.05(m,2H),0.96(s,9H),0.80-0.74(m,3H)。
LC-MS m/z 650.4[M+H]+。
步骤8.在室温下,将草酸铁(III)六水合物(0.606g,1.539mmol)在水(10.0mL)中搅拌2h以制备均质溶液。在0℃下,将此混合物用氮气脱气10min。向此混合物中添加THF(10.0mL)和叠氮化钠(0.200g,3.08mmol),然后添加(S)-N7-(1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)-1-((4-甲氧基-6-(丙-1-烯-2-基)吡啶-3-基)甲基)-1H-吡唑并[4,3-d]嘧啶-5,7-二胺(0.2g,0.308mmol)在THF(10.0mL)中的溶液。将反应混合物在0℃下搅拌5min。随后,经10min分两批添加硼氢化钠(0.075g,1.969mmol)。将反应混合物在0℃下搅拌30min,用氨溶液处理并且在室温下搅拌30min。将反应混合物在DCM与水之间分配。将有机层用盐水溶液洗涤,经Na2SO4干燥,过滤并且在减压下浓缩,以提供残余物。将粗化合物通过ISCO Combiflash色谱(通过用0-20%甲醇的氯仿溶液洗脱)纯化,以提供呈浅棕色半固体的(S)-1-((6-(2-氨基丙-2-基)-4-甲氧基吡啶-3-基)甲基)-N7-(1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)-1H-吡唑并[4,3-d]嘧啶-5,7-二胺(130mg,0.177mmol,57.6%产率)。
LC-MS m/z 667.2[M+H]+。
步骤9.在0℃下,向(S)-1-((6-(2-氨基丙-2-基)-4-甲氧基吡啶-3-基)甲基)-N7-(1-((叔丁基二苯基甲硅烷基)氧基)己-3-基)-1H-吡唑并[4,3-d]嘧啶-5,7-二胺(100.0mg,0.150mmol)在MeOH(3.0mL)中的搅拌溶液中添加浓HCl(1.0mL,1.500mmol)。将反应混合物在室温下搅拌1h并且在减压下浓缩,以提供残余物。将残余物用乙醚和石油醚磨碎,将固体在真空下干燥。将粗化合物通过反相制备型LC/MS(柱:Waters XBridge C18,19x150mm,5μm颗粒;流动相A:10mM NH4OAc;流动相B:乙腈;梯度:经20min 15%-55%B,然后在100%B下保持5分钟;流速:15mL/min)纯化。由MS和UV信号触发级分的收集。将含有所需产物的级分合并并且经由使用Genevac仪器离心蒸发干燥,以提供化合物120(11.1mg,0.026mmol,17.28%产率)。
实施例19-起始材料和中间体
下文的图1示出了用于制备可用作用于制备本文公开的TLR7激动剂的起始材料或中间体的化合物的方案。所述方案可以适用于制备其他类似的可以用作起始材料或中间体的化合物。所采用的试剂是本领域熟知的,并且在许多情况下,它们的使用已经在前述实施例中进行了展示。
图1
生物活性
可以通过以下程序测定本文公开的作为TLR7激动剂的化合物的生物活性。
人TLR7激动剂活性测定
此程序描述了用于测定在本说明书中公开的化合物的人TLR7(hTLR7)激动剂活性的方法。
将具有人TLR7分泌型胚胎碱性磷酸酶(SEAP)报告转基因的工程化人胚肾蓝细胞(HEK-BlueTMTLR细胞;Invivogen)悬浮在非选择性培养基(补充有10%胎牛血清(Sigma)的DMEM高葡萄糖(Invitrogen))中。将HEK-BlueTMTLR7细胞添加到384孔组织培养板的每个孔中(15,000个细胞/孔),并且在37℃、5%CO2下孵育16-18h。将化合物(100nl)分配到含有HEK-BlueTMTLR细胞的孔中,并且将经处理的孔在37℃、5%CO2下孵育。在处理18h后,将十微升的新鲜制备的Quanti-BlueTM试剂(Invivogen)添加到每个孔中,孵育30min(37℃,5%CO2),并且使用Envision读板仪(OD=620nm)测量SEAP水平。计算半数最大有效浓度值(EC50;在测定基线与最大值之间引起反应的一半的化合物浓度)。
人血液中I型干扰素基因(MX-1)和CD69的诱导
I型干扰素(IFN)MX-1基因和B细胞激活标记物CD69的诱导是在TLR7途径激活后发生的下游事件。以下是人全血测定,其测量响应于TLR7激动剂的诱导。
从人类受试者中收获肝素化的人全血,并且将其用1mM的测试TLR7激动剂化合物处理。将血液用RPMI 1640培养基稀释,并且使用Echo预加样(predot)10nL/孔,从而得到1uM的最终浓度(在10uL血液中有10nL)。在摇床上混合30秒后,将板盖住并且置于37℃室中过夜=17h。制备固定/裂解缓冲液(在H20中5x->1x,在37℃下加温;目录号BD 558049),并且保持perm缓冲液(在冰上),以备后用。
对于表面标记物(CD69)染色:制备表面Ab:0.045ul hCD14-FITC(ThermoFisher目录号MHCD1401)+0.6ul hCD19-ef450(ThermoFisher目录号48-0198-42)+1.5ul hCD69-PE(目录号BD555531)+0.855ul FACS缓冲液。添加3ul/孔,1000rpm旋转1min,并且在摇床上混合30秒,置于冰上30min。在用70uL预加温的1x固定/裂解缓冲液30min后停止刺激,并且使用Feliex伴侣重悬(15次,对每个板更换吸头)并且在37C下孵育10min。
在2000rpm下离心5min,用HCS板清洗器抽出,在摇床上混合30秒,然后用在dPBS中的70uL洗涤并且沉淀2次(2000rpm,持续5min),并且用在FACS缓冲液中的50ul洗涤,沉淀1次(2000rpm,持续5min)。在摇床上混合30秒。对于细胞内标记物(MX-1)染色:添加50ul BDPerm缓冲液III,并且在摇床上混合30秒。在冰上孵育30min(在黑暗中)。用50uL FACS缓冲液洗涤2次(在perm后,在2300rpm下旋转5min),然后在摇床上混合30秒。在20ul含有MX1抗体()(4812)-Alexa 647:Novus Biologicals#NBP2-43704AF647)20ul FACS缓冲液+0.8ulhIgG+0.04ul MX-1的FACS缓冲液中重悬。1000rpm旋转1min,在摇床上混合30秒,并且将样品在黑暗中在室温下孵育45min,然后用FACS缓冲液洗涤2次(在perm后,在2300rpm下旋转5min)。在20ul(每孔总计35uL)FACS缓冲液重悬,并且用箔纸覆盖,并且置于4℃下,以在第二天读数。在iQuePlus上读取板。将结果加载到工具集中,并且在curve master中生成IC50曲线。将y轴100%设置为1uM瑞喹莫德。
小鼠血液中TNF-α和I型IFN反应基因的诱导
TNF-α和I型IFN反应基因的诱导是在TLR7途径激活后发生的下游事件。以下是测量在小鼠全血中响应于TLR7激动剂的诱导的测定。
将肝素化的小鼠全血用含青霉素-链霉素的RPMI 1640培养基以5:4的比率稀释(50uL全血和40uL培养基)。将90uL体积的经稀释的血液转移到Falcon平底96孔组织培养板的孔中,并且将板在4℃下孵育1h。将100%DMSO储备溶液中的测试化合物在相同培养基中稀释20倍用于进行浓度反应测定,然后将10uL经稀释的测试化合物添加到孔中,使得最终DMSO浓度为0.5%。对照孔接受10uL含有5%DMSO的培养基。然后将板在37℃下在5%CO2培养箱中孵育17h。在孵育后,将100uL培养基添加到每个孔中。将板离心,并且取出130uL上清液用于通过ELISA(Invitrogen,目录号88-7324,Thermo-Fisher Scientific)测定TNFa的产生。将来自Invitrogen mRNA Catcher Plus试剂盒(目录号K1570-02)的70uL体积的含DTT的mRNA捕获裂解缓冲液(1x)添加到孔中剩余的70uL样品中,并且通过上下移液5次进行混合。然后将板在室温下摇动5-10min,然后向每个孔中添加2uL蛋白酶K(20mg/mL)。然后将板在室温下摇动15-20min。然后将板在-80℃下储存直到进一步处理。
将冷冻样品解冻,并且根据制造商的说明书,使用Invitrogen mRNA CatcherPlus试剂盒(目录号K1570-02)提取mRNA。使用Invitrogen SuperScript IV VILO MasterMix(目录号11756500),使用来自RNA提取的一半产率的mRNA在20μL逆转录酶反应中合成cDNA。使用来自ThermoFisher(Applied Biosystems)的QuantStudio实时PCR系统进行实时PCR。使用针对小鼠IFIT1、IFIT3、MX1和PPIA基因表达的商业化预设计的TaqMan测定和TaqMan Master Mix一式两份地运行所有实时PCR反应。将PPIA用作管家基因。遵循来自制造商的建议。通过平均管家基因(Ct)归一化所有原始数据(Ct),然后利用比较Ct(ΔΔCt)方法量化相对基因表达(RQ)用于进行实验分析。
定义
“脂族”意指直链或支链的饱和或不饱和的非芳族烃部分,其具有指定数量的碳原子(例如,如在“C3脂族”、“C1-5脂族”、“C1-C5脂族”或“C1至C5脂族”中,后三个短语与具有从1至5个碳原子的脂族部分同义)或者在未明确指定碳原子数量的情况下从1至4个碳原子(在不饱和脂族部分的情况下2至4个碳)。类似的理解适用于其他类型中的碳数量,如在C2-4烯烃、C4-C7脂环族等中。以类似的方式,诸如“(CH2)1-3”的术语应理解为对下标是1、2或3的简写,使得这样的术语代表CH2、CH2CH2和CH2CH2CH2。
“烷基”意指饱和的脂族部分,其中用于指定碳原子数量的相同惯例是可适用的。通过说明的方式,C1-C4烷基部分包括但不限于甲基、乙基、丙基、异丙基、异丁基、叔丁基、1-丁基、2-丁基等。“烷二基”(有时也称为“亚烷基”)意指烷基的二价对应物,诸如
“烯基”意指具有至少一个碳-碳双键的脂族部分,其中用于指定碳原子数量的相同惯例是可适用的。通过说明的方式,C2-C4烯基部分包括但不限于乙烯基(ethenyl/vinyl)、2-丙烯基(烯丙基或丙-2-烯基)、顺式-1-丙烯基、反式-1-丙烯基、E-(或Z-)2-丁烯基、3-丁烯基、1,3-丁二烯基(丁-1,3-二烯基)等。
“炔基”意指具有至少一个碳-碳三键的脂族部分,其中用于指定碳原子数量的相同惯例是可适用的。通过说明的方式,C2-C4炔基包括乙炔基(ethynyl/acetylenyl)、炔丙基(丙-2-炔基)、1-丙炔基、丁-2-炔基等。
“脂环族”意指具有从1至3个环的饱和或不饱和的非芳族烃部分,每个环具有从3至8个(优选地从3至6个)碳原子。“环烷基”意指每个环是饱和的脂环族部分。“环烯基”意指至少一个环具有至少一个碳-碳双键的脂环族部分。“环炔基”意指至少一个环具有至少一个碳-碳三键的脂环族部分。通过说明的方式,脂环族部分包括但不限于环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环庚基、环辛基和金刚烷基。优选的脂环族部分是环烷基部分,尤其是环丙基、环丁基、环戊基和环己基。“环烷二基”(有时也称为“环亚烷基”)意指环烷基的二价对应物。类似地,“二环烷二基”(或“二环亚烷基”)和“螺烷二基”(或“螺亚烷基”)是指二环烷基和螺烷基(或“螺环烷基”)的二价对应物。
“杂脂环族”意指这样的脂环族部分,其中在其至少一个环中,至多三个(优选地1至2个)碳已经被独立地选自N、O或S的杂原子替代,其中N和S任选地可以被氧化并且N任选地可以被季铵化。优选的脂环族部分由一个大小为5至6元的环组成。类似地,“杂环烷基”、“杂环烯基”和“杂环炔基”分别意指其至少一个环已经被如此修饰的环烷基、环烯基或环炔基部分。示例性杂脂环族部分包括氮杂环丙烷基、氮杂环丁烷基、1,3-二噁烷基、氧杂环丁烷基、四氢呋喃基、吡咯烷基、哌啶基、哌嗪基、四氢吡喃基、四氢噻喃基、四氢噻喃基砜、吗啉基、硫代吗啉基、硫代吗啉基亚砜、硫代吗啉基砜、1,3-二氧戊环基、四氢-1,1-二氧代噻吩基、1,4-二噁烷基、硫杂环丁烷基等。“杂环亚烷基”意指杂环烷基的二价对应物。
“烷氧基”、“芳氧基”、“烷硫基”和“芳硫基”分别意指-O(烷基)、-O(芳基)、-S(烷基)和-S(芳基)。例子分别是甲氧基、苯氧基、甲硫基和苯硫基。
除非指示较窄的含义,否则“卤素”或“卤代”意指氟、氯、溴或碘。
“芳基”意指具有单、双或三环环系统(优选地单环)的烃部分,其中每个环具有从3至7个碳原子,并且至少一个环是芳族的。环系统中的环可以彼此稠合(如在萘基中)或彼此键合(如在联苯基中),并且可以与非芳族环稠合或键合(如在茚满基或环己基苯基中)。通过进一步说明的方式,芳基部分包括但不限于苯基、萘基、四氢萘基、茚满基、联苯基、菲基、蒽基和苊基。“亚芳基”意指芳基的二价对应物,例如1,2-亚苯基、1,3-亚苯基或1,4-亚苯基。
“杂芳基”意指具有单、双或三环环系统(优选地5至7元单环)的部分,其中每个环具有从3至7个碳原子,并且至少一个环是含有从1至4个独立地选自N、O或S的杂原子的芳族环,其中N和S任选地可以被氧化并且N任选地可以被季铵化。这样的至少一个含有杂原子的芳族环可以与其他类型的环稠合(如在苯并呋喃基或四氢异喹啉基中),或者与其他类型的环直接键合(如在苯基吡啶基或2-环戊基吡啶基中)。通过进一步说明的方式,杂芳基部分包括吡咯基、呋喃基、噻吩基(thiophenyl/thienyl)、咪唑基、吡唑基、噁唑基、异噁唑基、噻唑基、异噻唑基、三唑基、四唑基、吡啶基、N-氧代吡啶基、哒嗪基、嘧啶基、吡嗪基、喹啉基、异喹啉炔基(isoquinolynyl)、喹唑啉基、噌啉基、喹唑啉基(quinozalinyl)、萘啶基、苯并呋喃基、吲哚基、苯并噻吩基、噁二唑基、噻二唑基、吩噻唑基(phenothiazolyl)、苯并咪唑基、苯并三唑基、二苯并呋喃基、咔唑基、二苯并噻吩基、吖啶基等。“杂亚芳基”意指杂芳基的二价对应物。
在指示部分可以被取代(诸如通过使用如在“未经取代或经取代的C1-C5烷基”或“任选经取代的杂芳基”中的短语“未经取代或经取代的”或“任选经取代的”)的情况下,这样的部分可以具有一个或多个独立选择的取代基,优选地数量为1至5、更优选地数量为1或2。考虑到取代基所附接的部分,本领域普通技术人员可以选择取代基和取代模式,以提供化学稳定的并且可以通过本领域已知的技术以及本文列出的方法合成的化合物。在部分被鉴定为“未经取代或经取代的”或“任选经取代的”的情况下,在一个优选实施方案中,这样的部分是未经取代的。
“芳基烷基”、“(杂脂环族)烷基”、“芳基烯基”、“芳基炔基”、“联芳基烷基”等意指被芳基、杂脂环族、联芳基等部分(视情况而定)取代的烷基、烯基或炔基部分(视情况而定),其中开放的(未满足的)化合价在烷基、烯基或炔基部分处,例如如在苄基、苯乙基、N-咪唑基乙基、N-吗啉代乙基等中。相反,“烷基芳基”、“烯基环烷基”等意指被烷基、烯基等部分(视情况而定)取代的芳基、环烷基等部分(视情况而定),例如如在甲基苯基(甲苯基)或烯丙基环己基中。“羟基烷基”、“卤代烷基”、“烷基芳基”、“氰基芳基”等意指被一个或多个鉴定的取代基(羟基、卤代等,视情况而定)取代的烷基、芳基等部分(视情况而定)。
例如,允许的取代基包括但不限于烷基(尤其是甲基或乙基)、烯基(尤其是烯丙基)、炔基、芳基、杂芳基、脂环族、杂脂环族、卤代(尤其是氟)、卤代烷基(尤其是三氟甲基)、羟基、羟基烷基(尤其是羟基乙基)、氰基、硝基、烷氧基、-O(羟基烷基)、-O(卤代烷基)(尤其是-OCF3)、-O(环烷基)、-O(杂环烷基)、-O(芳基)、烷硫基、芳硫基、=O、=NH、=N(烷基)、=NOH、=NO(烷基)、-C(=O)(烷基)、-C(=O)H、-CO2H、-C(=O)NHOH、-C(=O)O(烷基)、-C(=O)O(羟基烷基)、-C(=O)NH2、-C(=O)NH(烷基)、-C(=O)N(烷基)2、-OC(=O)(烷基)、-OC(=O)(羟基烷基)、-OC(=O)O(烷基)、-OC(=O)O(羟基烷基)、-OC(=O)NH2、-OC(=O)NH(烷基)、-OC(=O)N(烷基)2、叠氮基、-NH2、-NH(烷基)、-N(烷基)2、-NH(芳基)、-NH(羟基烷基)、-NHC(=O)(烷基)、-NHC(=O)H、-NHC(=O)NH2、-NHC(=O)NH(烷基)、-NHC(=O)N(烷基)2、-NHC(=NH)NH2、-OSO2(烷基)、-SH、-S(烷基)、-S(芳基)、-S(环烷基)、-S(=O)烷基、-SO2(烷基)、-SO2NH2、-SO2NH(烷基)、-SO2N(烷基)2等。
在被取代的部分是脂族部分的情况下,优选的取代基是芳基、杂芳基、脂环族、杂脂环族、卤代、羟基、氰基、硝基、烷氧基、-O(羟基烷基)、-O(卤代烷基)、-O(环烷基)、-O(杂环烷基)、-O(芳基)、烷硫基、芳硫基、=O、=NH、=N(烷基)、=NOH、=NO(烷基)、-CO2H、-C(=O)NHOH、-C(=O)O(烷基)、-C(=O)O(羟基烷基)、-C(=O)NH2、-C(=O)NH(烷基)、-C(=O)N(烷基)2、-OC(=O)(烷基)、-OC(=O)(羟基烷基)、-OC(=O)O(烷基)、-OC(=O)O(羟基烷基)、-OC(=O)NH2、-OC(=O)NH(烷基)、-OC(=O)N(烷基)2、叠氮基、-NH2、-NH(烷基)、-N(烷基)2、-NH(芳基)、-NH(羟基烷基)、-NHC(=O)(烷基)、-NHC(=O)H、-NHC(=O)NH2、-NHC(=O)NH(烷基)、-NHC(=O)N(烷基)2、-NHC(=NH)NH2、-OSO2(烷基)、-SH、-S(烷基)、-S(芳基)、-S(=O)烷基、-S(环烷基)、-SO2(烷基)、-SO2NH2、-SO2NH(烷基)和-SO2N(烷基)2。更优选的取代基是卤代、羟基、氰基、硝基、烷氧基、-O(芳基)、=O、=NOH、=NO(烷基)、-OC(=O)(烷基)、-OC(=O)O(烷基)、-OC(=O)NH2、-OC(=O)NH(烷基)、-OC(=O)N(烷基)2、叠氮基、-NH2、-NH(烷基)、-N(烷基)2、-NH(芳基)、-NHC(=O)(烷基)、-NHC(=O)H、-NHC(=O)NH2、-NHC(=O)NH(烷基)、-NHC(=O)N(烷基)2和-NHC(=NH)NH2。尤其优选的是苯基、氰基、卤代、羟基、硝基、C1-C4烷氧基、O(C2-C4烷二基)OH和O(C2-C4烷二基)卤代。
在被取代的部分是脂环族、杂脂环族、芳基或杂芳基部分的情况下,优选的取代基是烷基、烯基、炔基、卤代、卤代烷基、羟基、羟基烷基、氰基、硝基、烷氧基、-O(羟基烷基)、-O(卤代烷基)、-O(芳基)、-O(环烷基)、-O(杂环烷基)、烷硫基、芳硫基、-C(=O)(烷基)、-C(=O)H、-CO2H、-C(=O)NHOH、-C(=O)O(烷基)、-C(=O)O(羟基烷基)、-C(=O)NH2、-C(=O)NH(烷基)、-C(=O)N(烷基)2、-OC(=O)(烷基)、-OC(=O)(羟基烷基)、-OC(=O)O(烷基)、-OC(=O)O(羟基烷基)、-OC(=O)NH2、-OC(=O)NH(烷基)、-OC(=O)N(烷基)2、叠氮基、-NH2、-NH(烷基)、-N(烷基)2、-NH(芳基)、-NH(羟基烷基)、-NHC(=O)(烷基)、-NHC(=O)H、-NHC(=O)NH2、-NHC(=O)NH(烷基)、-NHC(=O)N(烷基)2、-NHC(=NH)NH2、-OSO2(烷基)、-SH、-S(烷基)、-S(芳基)、-S(环烷基)、-S(=O)烷基、-SO2(烷基)、-SO2NH2、-SO2NH(烷基)和-SO2N(烷基)2。更优选的取代基是烷基、烯基、卤代、卤代烷基、羟基、羟基烷基、氰基、硝基、烷氧基、-O(羟基烷基)、-C(=O)(烷基)、-C(=O)H、-CO2H、-C(=O)NHOH、-C(=O)O(烷基)、-C(=O)O(羟基烷基)、-C(=O)NH2、-C(=O)NH(烷基)、-C(=O)N(烷基)2、-OC(=O)(烷基)、-OC(=O)(羟基烷基)、-OC(=O)O(烷基)、-OC(=O)O(羟基烷基)、-OC(=O)NH2、-OC(=O)NH(烷基)、-OC(=O)N(烷基)2、-NH2、-NH(烷基)、-N(烷基)2、-NH(芳基)、-NHC(=O)(烷基)、-NHC(=O)H、-NHC(=O)NH2、-NHC(=O)NH(烷基)、-NHC(=O)N(烷基)2和-NHC(=NH)NH2。尤其优选的是C1-C4烷基、氰基、硝基、卤代和C1-C4烷氧基。
在陈述范围的情况下,如在“C1-C5烷基”或“5%至10%”中,这样的范围包括所述范围的端点,如在第一个实例中的C1和C5以及在第二个实例中的5%和10%。
除非具体指示特定的立体异构体(例如,通过在结构式中的相关立体中心处的加粗或加虚线的键,通过在结构式中将双键描绘为具有E或Z构型,或通过使用立体化学指定的命名法或符号),否则作为纯化合物及其混合物的所有立体异构体都包括在本发明的范围内。除非另外指示,否则外消旋体、单独的对映体(不论是光学纯的还是部分拆分的)、非对映体、几何异构体及其组合和混合物都被本发明涵盖。
本领域技术人员应理解,化合物可以具有互变异构体形式(例如,酮和烯醇形式)、共振形式和两性离子形式,所述形式等效于在本文使用的结构式中描绘的那些,并且所述结构式涵盖此类互变异构体形式、共振形式或两性离子形式。
“药学上可接受的酯”意指在体内(例如在人体中)水解产生母体化合物或其盐或者本身具有与母体化合物类似的活性的酯。合适的酯包括C1-C5烷基、C2-C5烯基或C2-C5炔基酯,尤其是甲基、乙基或正丙基酯。
“药学上可接受的盐”意指适用于药物配制品的化合物的盐。在化合物具有一个或多个碱性基团的情况下,所述盐可以是酸加成盐,诸如硫酸盐、氢溴酸盐、酒石酸盐、甲磺酸盐、马来酸盐、柠檬酸盐、磷酸盐、乙酸盐、双羟萘酸盐(恩波酸盐(embonate))、氢碘酸盐、硝酸盐、盐酸盐、乳酸盐、甲基硫酸盐、富马酸盐、苯甲酸盐、琥珀酸盐、甲磺酸盐、乳糖醛酸盐、辛二酸盐、甲苯磺酸盐等。在化合物具有一个或多个酸性基团的情况下,所述盐可以是诸如以下的盐:钙盐、钾盐、镁盐、葡甲胺盐、铵盐、锌盐、哌嗪盐、氨丁三醇盐、锂盐、胆碱盐、二乙胺盐、4-苯基环己胺盐、苯乍生盐、钠盐、四甲基铵盐等。多晶型结晶形式和溶剂化物也涵盖在本发明的范围内。
“受试者”是指动物,包括但不限于灵长类动物(例如,人)、猴、牛、猪、绵羊、山羊、马、狗、猫、兔、大鼠或小鼠。关于例如哺乳动物受试者(诸如人)的术语“受试者”和“患者”在本文中可互换地使用。
在治疗疾病或障碍的上下文中,术语“治疗”(“treat”、“treating”和“treatment”)意在包括减轻或消除障碍、疾病或病症,或与障碍、疾病或病症相关的一种或多种症状;或减慢障碍、疾病或病症或其一种或多种症状的进展、扩散或恶化。“癌症的治疗”是指以下作用中的一种或多种:(1)在一定程度上抑制肿瘤生长,包括(i)减慢和(ii)完全阻止生长;(2)减少肿瘤细胞的数量;(3)维持肿瘤大小;(4)减小肿瘤大小;(5)抑制,包括(i)减少、(ii)减慢或(iii)完全防止肿瘤细胞浸润到外周器官中;(6)抑制,包括(i)减少、(ii)减慢或(iii)完全防止转移;(7)增强抗肿瘤免疫应答,这可以导致(i)维持肿瘤大小、(ii)减小肿瘤大小、(iii)减慢肿瘤生长、(iv)减少、减慢或防止侵袭和/或(8)在一定程度上缓解与障碍相关的一种或多种症状的严重程度或数量。
在本说明书的式中,在其两个碳之间横穿芳族环的键意指附接至所述键的基团可以位于所述芳族环的任何位置,所述任何位置是通过除去隐含地在那里(或明确地在那里,如果写出来的话)的氢而变得可用的。通过说明的方式:
并且
本公开文本包括在本文描述的化合物中出现的原子的所有同位素。同位素包括具有相同原子序数但质量数不同的那些原子。通过一般举例而非限制的方式,氢的同位素包括氘和氚。碳的同位素包括13C和14C。本发明的同位素标记的化合物通常可以通过本领域技术人员已知的常规技术或通过与本文所述的那些类似的方法使用适当的同位素标记的试剂代替原本采用的未标记的试剂来制备。通过举例的方式,C1-C3烷基可以是未氘化的、部分氘化的或完全氘化的,并且“CH3”包括CH3、13CH3、14CH3、CH2T、CH2D、CHD2、CD3等。在一个实施方案中,化合物中的各种元素以其天然同位素丰度存在。
本领域技术人员应理解,某些结构可以绘制呈一种互变异构体形式或另一种互变异构体形式,例如酮与烯醇,并且这两种形式是等效的。
首字母缩略词和缩写
表C提供了在本说明书中使用的首字母缩略词和缩写及其含义的列表。
参考文献
下文提供了在本说明书中较早以缩写方式通过第一作者(或发明人)和日期引用的以下参考文献的完整引用。将这些参考文献中的每一个出于所有目的通过引用并入本文。
Akinbobuyi et al.,Tetrahedron Lett.2015,56,458,“Facile syntheses offunctionalized toll-like receptor 7agonists”.
Akinbobuyi et al.,Bioorg.Med.Chem.Lett.2016,26,4246,“Synthesis andimmunostimulatory activity of substituted TLR7 agonists.”
Barberis et al.,US 2012/0003298 A1(2012).
Beesu et al.,J.Med.Chem.2017,60,2084,“Identification of High-PotencyHuman TLR8 and Dual TLR7/TLR8 Agonists in Pyrimidine-2,4-diamines.”
et al.,J.Immunol.2007,178,4072,“Natural and SyntheticTLR7Ligands Inhibit CpG-A-and CpG-C-Oligodeoxynucleotide-Induced IFN-αProduction.”
Bonfanti et al.,US 2014/0323441 A1(2015)[2015a].
Bonfanti et al.,US 2015/0299221 A1(2015)[2015b].
Bonfanti et al.,US 2016/0304531 A1(2016).
Carson et al.,US 2013/0202629 A1(2013).
Carson et al.,US 8,729,088 B2(2014).
Carson et al.,US 9,050,376 B2(2015).
Carson et al.,US 2016/0199499 A1(2016).
Chan et al.,Bioconjugate Chem.2009,20,1194,“Synthesis andImmunological Characterization of Toll-Like Receptor 7Agonistic Conjugates.”
Chan et al.,Bioconjugate Chem.2011,22,445,“Synthesis andCharacterization of PEGylated Toll Like Receptor 7Ligands.”
Chen et al.,US 7,919,498 B2(2011).
Coe et al.,US 9,662,336 B2(2017).
Cortez and Va,Medicinal Chem.Rev.2018,53,481,“Recent Advances inSmall-Molecule TLR7 Agonists for Drug Discovery”.
Cortez et al.,US 2017/0121421 A1(2017).
Cortez et al.,US 9,944,649 B2(2018).
Dellaria et al.,WO 2007/028129 A1(2007).
Desai et al.,US 9,127,006 B2(2015).
Ding et al.,WO 2016/107536 A1(2016).
Ding et al.,US 2017/0273983 A1(2017)[2017a].
Ding et al.,WO 2017/076346 A1(2017)[2017b].
Gadd et al.,Bioconjugate Chem.2015,26,1743,“Targeted Activation ofToll-Like Receptors:Conjugation of a Toll-Like Receptor 7Agonist to aMonoclonal Antibody Maintains Antigen Binding and Specificity.”
Graupe et al.,US 8,993,755 B2(2015).
Embrechts et al.,J.Med.Chem.2018,61,6236,“2,4-Diaminoquinazolines asDual Toll Like Receptor(TLR)7/8Modulators for the Treatment of Hepatitis BVirus.”
Halcomb et al.,US 9,161,934 B2(2015).
Hashimoto et al.,US 2009/0118263 A1(2009).
He et al.,US 10,487,084B2(2019)[2019a].
He et al.,US 10,508,115B2(2019)[2019b].
Hirota et al.,US 6,028,076(2000).
Holldack et al.,US 2012/0083473 A1(2012).
Isobe et al.,US 6,376,501 B1(2002).
Isobe et al.,JP 2004137157(2004).
Isobe et al.,J.Med.Chem.2006,49(6),2088,“Synthesis and BiologicalEvaluation of Novel 9-Substituted-8-Hydroxyadenine Derivatives as PotentInterferon Inducers.”
Isobe et al.,US 7,521,454 B2(2009)[2009a].
Isobe et al.,US 2009/0105212 A1(2009)[2009b].
Isobe et al.,US 2011/0028715 A1(2011).
Isobe et al.,US 8,148,371 B2(2012).
Jensen et al.,WO 2015/036044 A1(2015).
Jones et al.,US 7,691,877 B2(2010).
Jones et al.,US 2012/0302598 A1(2012).
Kasibhatla et al.,US 7,241,890 B2(2007).
Koga-Yamakawa et al.,Int.J.Cancer 2013,132(3),580,“Intratracheal andoral administration of SM-276001:A selective TLR7 agonist,leads to antitumorefficacy in primary and metastatic models of cancer.”
Li et al.,US 9,902,730 B2(2018).
Lioux et al.,US 9,295,732 B2(2016).
Lund et al.,Proc.Nat’l Acad.Sci(USA)2004,101(15),5598,“Recognition ofsingle-stranded RNA viruses by Toll-like receptor 7.”
Maj et al.,US 9,173,935 B2(2015).
McGowan et al.,US 2016/0168150 A1(2016)[2016a].
McGowan et al.,US 9,499,549 B2(2016)[2016b].
McGowan et al.,J.Med.Chem.2017,60,6137,“Identification andOptimization of Pyrrolo[3,2-d]pyrimidine Toll-like Receptor 7(TLR7)SelectiveAgonists for the Treatment of Hepatitis B.”
Musmuca et al.,J.Chem.Information&Modeling 2009,49(7),1777,“Small-Molecule Interferon Inducers.Toward the Comprehension of the MolecularDeterminants through Ligand-Based Approaches.”
Nakamura et al.,Bioorg.Med.Chem.Lett.2013,13,669,“Synthesis andevaluation of 8-oxoadenine derivatives as potent Toll-like receptor agonistswith high water solubility.”
Ogita et al.,US 2007/0225303 A1(2007).
Ota et al.,WO 2019/124500 A1(2019).
Pilatte et al.,WO 2017/216293 A1(2017).
Poudel et al.,US 10,472,361 B2(2019)[2019a].
Poudel et al.,US 10,494,370 B2(2019)[2019b].
Poudel et al.,US 2020/0038403 A1(2020)[2020a].
Poudel et al.,US 2020/0039984 A1(2020)[2020b].
Purandare et al.,WO 2019/209811 A1(2019).
Pryde,US 7,642,350 B2(2010).
Sato-Kaneko et al.,JCI Insight 2017,2,e93397,“CombinationImmunotherapy with TLR Agonists and Checkpoint Inhibitors Suppresses Head andNeck Cancer”.
Smits et al.,The Oncologist 2008,13,859,“The Use of TLR7 and TLR8Ligands for the Enhancement of Cancer Immunotherapy”.
Vasilakos and Tomai,Expert Rev.Vaccines 2013,12,809,“The Use of Toll-like Receptor 7/8 Agonists as Vaccine Adjuvants”.
Vernejoul et al.,US 10,457,681 B2(2014).
Young et al.,US 2019/0055244 A1(2019).
Yu et al.,PLoS One 2013,8(3),e56514,“Toll-Like Receptor 7 Agonists:Chemical Feature Based Pharmacophore Identification and Molecular DockingStudies.”
Zhang et al.,Immunity 2016,45,737,“Structural Analysis Reveals thatToll-like Receptor 7Is a Dual Receptor for Guanosine and Single-StrandedRNA.”
Zhang et al.,WO 2018/095426 A1(2018)>
Zurawski et al.,US 2012/0231023 A1(2012).
前述具体实施方式包括主要或专门涉及本发明的特定部分或方面的段落。应理解,这是为了清楚和方便,特定特征可能在不只是公开它的段落中是相关的,并且本文中的公开内容包括在不同段落中找到的信息的所有适当组合。类似地,尽管本文中的各种附图和描述涉及本发明的具体实施方案,但应理解,在特定附图或实施方案的背景下公开了具体特征的情况下,也可以在另一个附图或实施方案的背景下、与另一个特征组合或总体上在本发明中在适当的程度上使用这样的特征。
此外,虽然已经根据某些优选实施方案具体描述了本发明,但本发明不限于此类优选实施方案。而是,本发明的范围由所附权利要求限定。
Claims (17)
1.一种化合物,所述化合物具有根据式I或式(II)的结构
其中
每个X独立地是N或CR2;
R1是(C1-C5烷基)、(C2-C5烯基)、(C1-C8烷二基)0-1(C3-C6环烷基)、(C1-C8烷二基)0-1(C5-C10螺烷基)、(C2-C8烷二基)OH、(C2-C8烷二基)O(C1-C3烷基)、(C1-C4烷二基)0-1(5-6元杂芳基)、(C1-C4烷二基)0-1苯基、(C1-C4烷二基)CF3、(C2-C8烷二基)N[C(=O)](C1-C3烷基)、或(C2-C8烷二基)NRxRy;
每个R2独立地是H、O(C1-C3烷基)、S(C1-C3烷基)、SO2(C1-C3烷基)、C1-C3烷基、O(C3-C4环烷基)、S(C3-C4环烷基)、SO2(C3-C4环烷基)、C3-C4环烷基、Cl、F、CN或[C(=O)]0-1NRxRy;
R3是NH2、NH[C(=O)]0-1(C1-C5烷基)、N(C1-C5烷基)2、NH[C(=O)]0-1(C1-C4烷二基)0-1(C3-C8环烷基)、NH[C(=O)]0-1(C1-C4烷二基)0-1(C4-C10二环烷基)、NH[C(=O)]0-1(C1-C4烷二基)0-1(C5-C10螺烷基)、N(C3-C6环烷基)2、N[C1-C3烷基]C(=O)(C1-C6烷基)、NH(SO2)(C1-C5烷基)、NH(SO2)(C1-C4烷二基)0-1(C3-C8环烷基)、NH(SO2)(C1-C4烷二基)0-1(C4-C10二环烷基)、NH(SO2)(C1-C4烷二基)0-1(C5-C10螺烷基)、6元芳族或杂芳族部分、5元杂芳族部分或
具有以下结构的部分:
R5是H、C1-C5烷基、C2-C5烯基、C3-C6环烷基、卤代、O(C1-C5烷基)、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基)、苯基、NH(C1-C5烷基)、5或6元杂芳基、
R6是NH2、(NH)0-1(C1-C5烷基)、N(C1-C5烷基)2、(NH)0-1(C1-C4烷二基)0-1(C3-C8环烷基)、(NH)0-1(C1-C4烷二基)0-1(C4-C10二环烷基)、(NH)0-1(C1-C4烷二基)0-1(C5-C10螺烷基)、N(C3-C6环烷基)2、或
具有以下结构的部分:
R7和R8独立地是
C1-C4烷基、C2-C4亚烷基、C3-C4环烷基,
或者R7和R8与它们所键合的碳组合以形成3至7元环烷基部分;
Rx和Ry独立地是H或C1-C3烷基或者Rx和Ry与它们所键合的氮组合以形成3至7元杂环;
其中在R1、R2、R3、R5、R6、R7和R8中烷基部分、烷二基部分、环烷基部分或下式的部分:
任选地被选自以下的一个或多个取代基取代:OH、卤代、CN、(C1-C3烷基)、O(C1-C3烷基)、C(=O)(C1-C3烷基)、SO2(C1-C3烷基)、NRxRy、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基);
并且
烷基、烷二基、环烷基或下式的部分:
能够具有被以下替代的CH2基团:O、SO2、CF2、C(=O)、NH、N[C(=O)]0-1(C1-C3烷基)、N[C(=O)]0-1(C1-C4烷二基)CF3、N[C(=O)]0-1(C1-C4烷二基)OH、或
N[C(=O)]0-1(C1-C4烷二基)0-1(C3-C5环烷基)。
3.根据权利要求1所述的化合物,其中R2是OMe。
4.根据权利要求1所述的化合物,其中R5是H。
10.一种治疗癌症的方法,所述方法包括向患有这样的癌症的患者施用抗癌免疫治疗剂和根据权利要求1或权利要求9所述的化合物的治疗有效组合。
11.根据权利要求10所述的方法,其中所述抗癌免疫治疗剂是拮抗性抗CTLA-4、抗PD-1或抗PD-L1抗体。
12.根据权利要求11所述的方法,其中所述癌症是肺癌(包括非小细胞肺癌)、胰腺癌、肾癌、头颈癌、淋巴瘤(包括霍奇金淋巴瘤)、皮肤癌(包括黑素瘤和梅克尔皮肤癌)、尿路上皮癌(包括膀胱癌)、胃癌、肝细胞癌或结直肠癌。
13.根据权利要求12所述的方法,其中所述抗癌免疫治疗剂是伊匹单抗、纳武单抗或派姆单抗。
14.一种化合物,所述化合物具有根据式(I’)或(II’)的结构
其中
每个X独立地是N或CR2;
R1是(C1-C5烷基)、(C2-C5烯基)、(C1-C8烷二基)0-1(C3-C6环烷基)、(C1-C8烷二基)0-1(C5-C10螺烷基)、(C2-C8烷二基)OH、(C2-C8烷二基)O(C1-C3烷基)、(C1-C4烷二基)0-1(5-6元杂芳基)、(C1-C4烷二基)0-1苯基、(C1-C4烷二基)CF3、(C2-C8烷二基)N[C(=O)](C1-C3烷基)、或(C2-C8烷二基)NRxRy;
每个R2独立地是H、O(C1-C3烷基)、S(C1-C3烷基)、SO2(C1-C3烷基)、C1-C3烷基、O(C3-C4环烷基)、S(C3-C4环烷基)、SO2(C3-C4环烷基)、C3-C4环烷基、Cl、F、CN或[C(=O)]0-1NRxRy;
R5是H、C1-C5烷基、C2-C5烯基、C3-C6环烷基、卤代、O(C1-C5烷基)、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基)、苯基、NH(C1-C5烷基)、5或6元杂芳基、
R7和R8独立地是
C1-C4烷基、C2-C4亚烷基、C3-C4环烷基,
或者R7和R8与它们所键合的碳组合以形成3至7元环烷基部分;
Rx和Ry独立地是H或C1-C3烷基或者Rx和Ry与它们所键合的氮组合以形成3至7元杂环;其中在R1、R2、R5、R7和R8中
烷基部分、烷二基部分、环烷基部分或下式的部分:
任选地被选自以下的一个或多个取代基取代:OH、卤代、CN、(C1-C3烷基)、O(C1-C3烷基)、C(=O)(C1-C3烷基)、SO2(C1-C3烷基)、NRxRy、(C1-C4烷二基)OH、(C1-C4烷二基)O(C1-C3烷基);
并且
烷基、烷二基、环烷基或下式的部分:
能够具有被以下替代的CH2基团:O、SO2、CF2、C(=O)、NH、N[C(=O)]0-1(C1-C3烷基)、N[C(=O)]0-1(C1-C4烷二基)CF3、N[C(=O)]0-1(C1-C4烷二基)OH、或N[C(=O)]0-1(C1-C4烷二基)0-1(C3-C5环烷基)。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202062966144P | 2020-01-27 | 2020-01-27 | |
| US62/966,144 | 2020-01-27 | ||
| US202063058230P | 2020-07-29 | 2020-07-29 | |
| US63/058,230 | 2020-07-29 | ||
| PCT/US2021/014980 WO2021154666A1 (en) | 2020-01-27 | 2021-01-26 | 1H-PYRAZOLO[4,3-d]PYRIMIDINE COMPOUNDS AS TOLL-LIKE RECEPTOR 7 (TLR7) AGONISTS |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN115151548A true CN115151548A (zh) | 2022-10-04 |
Family
ID=74595468
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202180016904.1A Pending CN115151548A (zh) | 2020-01-27 | 2021-01-26 | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20230348468A1 (zh) |
| EP (1) | EP4097100A1 (zh) |
| JP (1) | JP2023512206A (zh) |
| KR (1) | KR20220132593A (zh) |
| CN (1) | CN115151548A (zh) |
| WO (1) | WO2021154666A1 (zh) |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018095426A1 (zh) * | 2016-11-28 | 2018-05-31 | 江苏恒瑞医药股份有限公司 | 吡唑并杂芳基类衍生物、其制备方法及其在医药上的应用 |
| WO2019036023A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES AS IMMUNOSTIMULANT TOLL (TLR7) RECEPTOR 7 AGONISTS |
| WO2019035968A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES AS TOLL RECEPTOR 7 (TLR7) AGONISTS AS IMMUNOSTIMULANTS |
| WO2019035970A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES FOR USE AS TOLL 7 RECEPTOR IMMUNOSTIMULATING AGONISTS (TLR7) |
| WO2019035971A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES AS TOLL 7 RECEPTOR IMMUNOSTIMULATING AGONISTS (TLR7) |
| WO2019035969A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | TOLL RECEPTOR 7 (TLR7) AGONISTS COMPRISING A TRICYCLIC FRAGMENT, CONJUGATES CONTAINING SAME, RELATED METHODS AND USES THEREOF |
| WO2020028608A1 (en) * | 2018-08-03 | 2020-02-06 | Bristol-Myers Squibb Company | 1H-PYRAZOLO[4,3-d]PYRIMIDINE COMPOUNDS AS TOLL-LIKE RECEPTOR 7 (TLR7) AGONISTS AND METHODS AND USES THEREFOR |
Family Cites Families (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0882727B9 (en) | 1996-07-03 | 2005-06-15 | Sumitomo Pharmaceuticals Company, Limited | Novel purine derivatives |
| TW572758B (en) | 1997-12-22 | 2004-01-21 | Sumitomo Pharma | Type 2 helper T cell-selective immune response inhibitors comprising purine derivatives |
| JP4331944B2 (ja) | 2001-04-17 | 2009-09-16 | 大日本住友製薬株式会社 | 新規アデニン誘導体 |
| US7241890B2 (en) | 2001-10-30 | 2007-07-10 | Conforma Therapeutics Corporation | Purine analogs having HSP90-inhibiting activity |
| KR101111085B1 (ko) | 2002-09-27 | 2012-04-12 | 다이닛본 스미토모 세이야꾸 가부시끼가이샤 | 신규 아데닌 화합물 및 그 용도 |
| JP2004137157A (ja) | 2002-10-16 | 2004-05-13 | Sumitomo Pharmaceut Co Ltd | 新規アデニン誘導体を有効成分として含有する医薬 |
| WO2005092892A1 (ja) | 2004-03-26 | 2005-10-06 | Dainippon Sumitomo Pharma Co., Ltd. | 8−オキソアデニン化合物 |
| CA2607780A1 (en) | 2005-05-04 | 2006-11-09 | Pfizer Limited | Purine derivatives |
| EP1924581A1 (en) | 2005-09-02 | 2008-05-28 | Pfizer, Inc. | Hydroxy substituted 1h-imidazopyridines and methods |
| WO2007034817A1 (ja) | 2005-09-22 | 2007-03-29 | Dainippon Sumitomo Pharma Co., Ltd. | 新規アデニン化合物 |
| WO2007034917A1 (ja) | 2005-09-22 | 2007-03-29 | Dainippon Sumitomo Pharma Co., Ltd. | 新規なアデニン化合物 |
| MX2008010611A (es) | 2006-02-17 | 2008-11-12 | Pfizer Ltd | Derivados de 3-desazapurina como moduladores de receptores similares a toll. |
| PT2510946E (pt) | 2007-02-07 | 2015-11-23 | Univ California | Conjugados de agonistas sintéticos de tlr e suas utilizações |
| PE20081887A1 (es) | 2007-03-20 | 2009-01-16 | Dainippon Sumitomo Pharma Co | Nuevo compuesto de adenina |
| WO2008118454A2 (en) | 2007-03-23 | 2008-10-02 | Amgen Inc. | Derivatives of quinoline or benzopyrazine and their uses for the treatment of (inter alia) inflammatory diseases, autoimmune diseases or various kinds of cancer |
| PL2170888T3 (pl) | 2007-06-29 | 2015-09-30 | Gilead Sciences Inc | Pochodne puryn i ich zastosowanie jako modulatory receptora toll-podobnego 7 |
| EP2188280B1 (en) | 2007-08-03 | 2011-03-09 | Pfizer Limited | Imidazopyridinones |
| EA201692167A1 (ru) | 2008-12-09 | 2017-07-31 | Джилид Сайэнс, Инк. | Модуляторы толл-подобных рецепторов |
| US8729088B2 (en) | 2009-02-11 | 2014-05-20 | The Regents Of The University Of California | Toll-like receptor modulators and treatment of diseases |
| US8962652B2 (en) | 2009-10-22 | 2015-02-24 | Gilead Sciences, Inc. | Derivatives of purine or deazapurine useful for the treatment of (inter alia) viral infections |
| WO2011134668A1 (en) | 2010-04-30 | 2011-11-03 | Telormedix Sa | Phospholipid drug analogs |
| AU2011247359A1 (en) | 2010-04-30 | 2012-11-15 | Telormedix Sa | Methods for inducing an immune response |
| US20130202629A1 (en) | 2010-04-30 | 2013-08-08 | The Regents Of The University Of California | Uses of phospholipid conjugates of synthetic tlr7 agonists |
| WO2012038058A1 (en) | 2010-09-21 | 2012-03-29 | Telormedix Sa | Treatment of conditions by toll-like receptor modulators |
| US20120231023A1 (en) | 2011-03-08 | 2012-09-13 | Baylor Research Institute | Novel Vaccine Adjuvants Based on Targeting Adjuvants to Antibodies Directly to Antigen-Presenting Cells |
| US9556176B2 (en) | 2011-11-09 | 2017-01-31 | Janssen Sciences Ireland Uc | Purine derivatives for the treatment of viral infections |
| EA035790B1 (ru) | 2012-07-13 | 2020-08-11 | Янссен Сайенсиз Айрлэнд Юси | Макроциклические пурины для лечения вирусных инфекций |
| JP6196674B2 (ja) | 2012-08-24 | 2017-09-13 | グラクソスミスクライン・リミテッド・ライアビリティ・カンパニーGlaxoSmithKline LLC | ピラゾロピリミジン化合物 |
| BR112015007586B1 (pt) | 2012-10-10 | 2021-02-09 | Janssen Sciences Ireland Uc | derivados de pirrolo[3,2-d]pirimidina, seu uso e composição farmacêutica que os compreende |
| US9295732B2 (en) | 2013-02-22 | 2016-03-29 | Invivogen | Conjugated TLR7 and/or TLR8 and TLR2 polycationic agonists |
| PL2978429T3 (pl) | 2013-03-29 | 2017-08-31 | Janssen Sciences Ireland Uc | Deazapurynony makrocykliczne do leczenia infekcji wirusowych |
| EA034893B1 (ru) | 2013-06-27 | 2020-04-02 | Янссен Сайенсиз Айрлэнд Юси | Производные пирроло[3,2-d]пиримидина для лечения вирусных инфекций и других заболеваний |
| EP3033089A2 (en) | 2013-08-16 | 2016-06-22 | The Regents of The University of California | Uses of phospholipid conjugates of synthetic tlr7 agonists |
| WO2015036044A1 (en) | 2013-09-13 | 2015-03-19 | Telormedix Sa | Cationic lipid vehicles for delivery of tlr7 agonists for specific targeting of human cd14+ monocytes in whole blood |
| US9944649B2 (en) | 2014-05-01 | 2018-04-17 | Novartis Ag | Compounds and compositions as toll-like receptor 7 agonists |
| US9902730B2 (en) | 2014-05-01 | 2018-02-27 | Novartis Ag | Compounds and compositions as toll-like receptor 7 agonists |
| LT3190113T (lt) | 2014-08-15 | 2021-08-25 | Chia Tai Tianqing Pharmaceutical Group Co., Ltd. | Pirolopirimidino junginiai, naudotini kaip tlr7 agonistai |
| CN105732635A (zh) | 2014-12-29 | 2016-07-06 | 南京明德新药研发股份有限公司 | 一类Toll样受体7激动剂 |
| MA44334A (fr) | 2015-10-29 | 2018-09-05 | Novartis Ag | Conjugués d'anticorps comprenant un agoniste du récepteur de type toll |
| BR112018008880B1 (pt) | 2015-11-05 | 2023-01-17 | Chia Tai Tianqing Pharmaceutical Group Co., Ltd. | 7-(tiazol-5-il) pirrolopirimidina, seu uso, e composição farmacêutica |
| WO2017216293A1 (en) | 2016-06-16 | 2017-12-21 | Janssen Pharmaceutica Nv | Azabenzimidazole derivatives as pi3k beta inhibitors |
| WO2018139876A1 (ko) | 2017-01-26 | 2018-08-02 | 동화약품주식회사 | 신규한 [1, 2, 4] 트리아졸로 [4, 3-a]퀴녹살린 유도체, 이의 제조방법 및 이를 유효성분으로 함유하는 bet 단백질 관련 질환의 예방 또는 치료용 약학적 조성물 |
| RU2020124007A (ru) | 2017-12-21 | 2022-01-21 | Сумитомо Дайниппон Фарма Ко., Лтд. | Комбинированный препарат, включающий агонист tlr7 |
| WO2019209811A1 (en) | 2018-04-24 | 2019-10-31 | Bristol-Myers Squibb Company | Macrocyclic toll-like receptor 7 (tlr7) agonists |
-
2021
- 2021-01-26 CN CN202180016904.1A patent/CN115151548A/zh active Pending
- 2021-01-26 JP JP2022545790A patent/JP2023512206A/ja active Pending
- 2021-01-26 KR KR1020227029272A patent/KR20220132593A/ko active Search and Examination
- 2021-01-26 US US17/793,278 patent/US20230348468A1/en active Pending
- 2021-01-26 EP EP21705396.6A patent/EP4097100A1/en active Pending
- 2021-01-26 WO PCT/US2021/014980 patent/WO2021154666A1/en unknown
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018095426A1 (zh) * | 2016-11-28 | 2018-05-31 | 江苏恒瑞医药股份有限公司 | 吡唑并杂芳基类衍生物、其制备方法及其在医药上的应用 |
| WO2019036023A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES AS IMMUNOSTIMULANT TOLL (TLR7) RECEPTOR 7 AGONISTS |
| WO2019035968A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES AS TOLL RECEPTOR 7 (TLR7) AGONISTS AS IMMUNOSTIMULANTS |
| WO2019035970A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES FOR USE AS TOLL 7 RECEPTOR IMMUNOSTIMULATING AGONISTS (TLR7) |
| WO2019035971A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | 6-AMINO-7,9-DIHYDRO-8H-PURIN-8-ONE DERIVATIVES AS TOLL 7 RECEPTOR IMMUNOSTIMULATING AGONISTS (TLR7) |
| WO2019035969A1 (en) * | 2017-08-16 | 2019-02-21 | Bristol-Myers Squibb Company | TOLL RECEPTOR 7 (TLR7) AGONISTS COMPRISING A TRICYCLIC FRAGMENT, CONJUGATES CONTAINING SAME, RELATED METHODS AND USES THEREOF |
| WO2020028608A1 (en) * | 2018-08-03 | 2020-02-06 | Bristol-Myers Squibb Company | 1H-PYRAZOLO[4,3-d]PYRIMIDINE COMPOUNDS AS TOLL-LIKE RECEPTOR 7 (TLR7) AGONISTS AND METHODS AND USES THEREFOR |
Also Published As
| Publication number | Publication date |
|---|---|
| EP4097100A1 (en) | 2022-12-07 |
| KR20220132593A (ko) | 2022-09-30 |
| WO2021154666A1 (en) | 2021-08-05 |
| US20230348468A1 (en) | 2023-11-02 |
| JP2023512206A (ja) | 2023-03-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN115151548A (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 | |
| CN115643805B (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 | |
| CN115135655B (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 | |
| CN115279765B (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 | |
| CN115210235A (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 | |
| CN115135654A (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 | |
| CN115210236A (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 | |
| CN115151546A (zh) | 作为Toll样受体7(TLR7)激动剂的C3-取代的1H-吡唑并[4,3-d]嘧啶化合物 | |
| KR20220132601A (ko) | 톨-유사 수용체 7 (TLR7) 효능제로서의 1H-피라졸로[4,3-d]피리미딘 화합물 | |
| CN115279765A (zh) | 作为Toll样受体7(TLR7)激动剂的1H-吡唑并[4,3-d]嘧啶化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20221004 |