CN113166108A - 作为泛素特异性蛋白酶30(usp30)抑制剂的稠合吡咯啉 - Google Patents
作为泛素特异性蛋白酶30(usp30)抑制剂的稠合吡咯啉 Download PDFInfo
- Publication number
- CN113166108A CN113166108A CN201980080107.2A CN201980080107A CN113166108A CN 113166108 A CN113166108 A CN 113166108A CN 201980080107 A CN201980080107 A CN 201980080107A CN 113166108 A CN113166108 A CN 113166108A
- Authority
- CN
- China
- Prior art keywords
- group
- alkylene
- compound
- alkyl
- hydrogen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 101000748132 Homo sapiens Ubiquitin carboxyl-terminal hydrolase 30 Proteins 0.000 title claims abstract description 47
- 102100040052 Ubiquitin carboxyl-terminal hydrolase 30 Human genes 0.000 title claims abstract description 47
- 239000003112 inhibitor Substances 0.000 title abstract description 21
- 150000003236 pyrrolines Chemical class 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims abstract description 392
- 150000003839 salts Chemical class 0.000 claims abstract description 211
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 19
- 229910052739 hydrogen Inorganic materials 0.000 claims description 264
- 239000001257 hydrogen Substances 0.000 claims description 264
- 125000004429 atom Chemical group 0.000 claims description 210
- 125000001188 haloalkyl group Chemical group 0.000 claims description 186
- 229910052736 halogen Inorganic materials 0.000 claims description 185
- 150000002367 halogens Chemical class 0.000 claims description 185
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical class [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 145
- 125000002947 alkylene group Chemical group 0.000 claims description 136
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 113
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 108
- 150000002431 hydrogen Chemical class 0.000 claims description 107
- 125000001424 substituent group Chemical group 0.000 claims description 85
- -1 C2-C6Alkenyl radical Chemical class 0.000 claims description 69
- 229910052757 nitrogen Inorganic materials 0.000 claims description 63
- 238000000034 method Methods 0.000 claims description 49
- 150000003254 radicals Chemical class 0.000 claims description 42
- 229910052717 sulfur Inorganic materials 0.000 claims description 38
- 229910052760 oxygen Inorganic materials 0.000 claims description 36
- 125000005549 heteroarylene group Chemical group 0.000 claims description 30
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims description 28
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 claims description 24
- 125000000217 alkyl group Chemical group 0.000 claims description 22
- 229910052799 carbon Inorganic materials 0.000 claims description 22
- 125000001072 heteroaryl group Chemical group 0.000 claims description 22
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 20
- 125000003118 aryl group Chemical group 0.000 claims description 17
- 125000002768 hydroxyalkyl group Chemical group 0.000 claims description 16
- 208000018737 Parkinson disease Diseases 0.000 claims description 15
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 14
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 claims description 13
- 125000000041 C6-C10 aryl group Chemical group 0.000 claims description 13
- 125000004432 carbon atom Chemical group C* 0.000 claims description 13
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 13
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 9
- 230000002401 inhibitory effect Effects 0.000 claims description 9
- 125000004737 (C1-C6) haloalkoxy group Chemical group 0.000 claims description 8
- 229910004749 OS(O)2 Inorganic materials 0.000 claims description 8
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 6
- 125000006587 (C5-C10) heteroarylene group Chemical group 0.000 claims description 5
- 125000006577 C1-C6 hydroxyalkyl group Chemical group 0.000 claims description 4
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 4
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims description 3
- 125000006583 (C1-C3) haloalkyl group Chemical group 0.000 claims description 3
- 125000001475 halogen functional group Chemical group 0.000 claims 3
- 239000000203 mixture Substances 0.000 description 70
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 63
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 26
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 25
- 125000005843 halogen group Chemical group 0.000 description 22
- 239000007787 solid Substances 0.000 description 22
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 20
- WCYWZMWISLQXQU-UHFFFAOYSA-N methyl Chemical compound [CH3] WCYWZMWISLQXQU-UHFFFAOYSA-N 0.000 description 20
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 19
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 18
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 17
- 238000003556 assay Methods 0.000 description 17
- 239000000243 solution Substances 0.000 description 17
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 16
- 239000000758 substrate Substances 0.000 description 16
- 102000018390 Ubiquitin-Specific Proteases Human genes 0.000 description 15
- 108010066496 Ubiquitin-Specific Proteases Proteins 0.000 description 15
- 230000002438 mitochondrial effect Effects 0.000 description 14
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 13
- 239000012044 organic layer Substances 0.000 description 13
- 239000000126 substance Substances 0.000 description 13
- 101000619542 Homo sapiens E3 ubiquitin-protein ligase parkin Proteins 0.000 description 10
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 10
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-dimethylformamide Substances CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 10
- 238000004296 chiral HPLC Methods 0.000 description 10
- 102000045222 parkin Human genes 0.000 description 10
- 230000004900 autophagic degradation Effects 0.000 description 9
- 239000012267 brine Substances 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 210000001700 mitochondrial membrane Anatomy 0.000 description 9
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 9
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 8
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 8
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 8
- 239000003208 petroleum Substances 0.000 description 8
- 238000005160 1H NMR spectroscopy Methods 0.000 description 7
- 125000001153 fluoro group Chemical group F* 0.000 description 7
- 210000003470 mitochondria Anatomy 0.000 description 7
- 239000003921 oil Substances 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 101000605835 Homo sapiens Serine/threonine-protein kinase PINK1, mitochondrial Proteins 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 6
- 102100038376 Serine/threonine-protein kinase PINK1, mitochondrial Human genes 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 6
- 238000004587 chromatography analysis Methods 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 239000003814 drug Substances 0.000 description 6
- 239000000741 silica gel Substances 0.000 description 6
- 229910002027 silica gel Inorganic materials 0.000 description 6
- 238000010798 ubiquitination Methods 0.000 description 6
- 230000034512 ubiquitination Effects 0.000 description 6
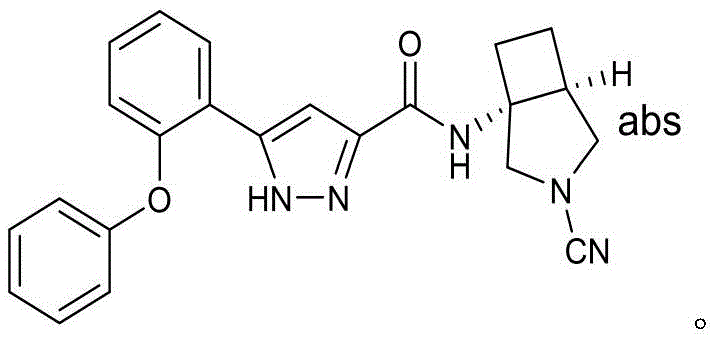
- PMTCGWBSBBSCSF-SJORKVTESA-N (1S,5R)-2-[3-(2-phenoxyphenyl)-1H-pyrazole-5-carbonyl]-2,6-diazabicyclo[3.2.1]octane-6-carbonitrile Chemical compound O(C1=CC=CC=C1)C1=C(C=CC=C1)C1=CC(=NN1)C(=O)N1[C@@H]2CN([C@H](CC1)C2)C#N PMTCGWBSBBSCSF-SJORKVTESA-N 0.000 description 5
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N DMSO-d6 Substances [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 5
- 239000007821 HATU Substances 0.000 description 5
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 125000005842 heteroatom Chemical group 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 239000011593 sulfur Substances 0.000 description 5
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 5
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 5
- PMTCGWBSBBSCSF-DLBZAZTESA-N (1R,5S)-2-[3-(2-phenoxyphenyl)-1H-pyrazole-5-carbonyl]-2,6-diazabicyclo[3.2.1]octane-6-carbonitrile Chemical compound O(C1=CC=CC=C1)C1=C(C=CC=C1)C1=CC(=NN1)C(=O)N1[C@H]2CN([C@@H](CC1)C2)C#N PMTCGWBSBBSCSF-DLBZAZTESA-N 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 4
- 102000001477 Deubiquitinating Enzymes Human genes 0.000 description 4
- 108010093668 Deubiquitinating Enzymes Proteins 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 229910052731 fluorine Inorganic materials 0.000 description 4
- 125000002950 monocyclic group Chemical group 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 125000006239 protecting group Chemical group 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- WYURNTSHIVDZCO-UHFFFAOYSA-N tetrahydrofuran Substances C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 4
- AVOWPOFIQZSVGV-UHFFFAOYSA-N (2-phenoxyphenyl)boronic acid Chemical compound OB(O)C1=CC=CC=C1OC1=CC=CC=C1 AVOWPOFIQZSVGV-UHFFFAOYSA-N 0.000 description 3
- BPXKZEMBEZGUAH-UHFFFAOYSA-N 2-(chloromethoxy)ethyl-trimethylsilane Chemical compound C[Si](C)(C)CCOCCl BPXKZEMBEZGUAH-UHFFFAOYSA-N 0.000 description 3
- ANIBXUWKPUVNAP-WAIKUNEKSA-N N-[(1S,5R)-3-cyano-3-azabicyclo[3.2.0]heptan-1-yl]-3-(2-phenoxyphenyl)-1H-pyrazole-5-carboxamide Chemical compound C(#N)N1C[C@@]2(CC[C@@H]2C1)NC(=O)C1=NNC(=C1)C1=C(C=CC=C1)OC1=CC=CC=C1 ANIBXUWKPUVNAP-WAIKUNEKSA-N 0.000 description 3
- 102000044159 Ubiquitin Human genes 0.000 description 3
- 108090000848 Ubiquitin Proteins 0.000 description 3
- 125000003545 alkoxy group Chemical group 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 238000010256 biochemical assay Methods 0.000 description 3
- 125000001246 bromo group Chemical group Br* 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 125000001309 chloro group Chemical group Cl* 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000013058 crude material Substances 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 125000002346 iodo group Chemical group I* 0.000 description 3
- RLDJSZKPUPTTNO-UHFFFAOYSA-N methyl 5-bromo-1h-pyrazole-3-carboxylate Chemical compound COC(=O)C=1C=C(Br)NN=1 RLDJSZKPUPTTNO-UHFFFAOYSA-N 0.000 description 3
- 230000004770 neurodegeneration Effects 0.000 description 3
- 239000006186 oral dosage form Substances 0.000 description 3
- 125000003566 oxetanyl group Chemical group 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 3
- 238000002953 preparative HPLC Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 3
- 125000006413 ring segment Chemical group 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 230000000087 stabilizing effect Effects 0.000 description 3
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 3
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- TWBPWBPGNQWFSJ-UHFFFAOYSA-N 2-phenylaniline Chemical group NC1=CC=CC=C1C1=CC=CC=C1 TWBPWBPGNQWFSJ-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 101000610640 Homo sapiens U4/U6 small nuclear ribonucleoprotein Prp3 Proteins 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- IAUODNLJNWKWLX-NYHFZMIOSA-N N-[(1R,5S)-3-cyano-3-azabicyclo[3.1.0]hexan-1-yl]-3-(2-phenoxyphenyl)-1H-pyrazole-5-carboxamide Chemical compound C(#N)N1C[C@]2(C[C@H]2C1)NC(=O)C1=NNC(=C1)C1=C(C=CC=C1)OC1=CC=CC=C1 IAUODNLJNWKWLX-NYHFZMIOSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 101001110823 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-A Proteins 0.000 description 2
- 101000712176 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-B Proteins 0.000 description 2
- 241000978776 Senegalia senegal Species 0.000 description 2
- 102100040374 U4/U6 small nuclear ribonucleoprotein Prp3 Human genes 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000004450 alkenylene group Chemical group 0.000 description 2
- 239000000908 ammonium hydroxide Substances 0.000 description 2
- 125000002619 bicyclic group Chemical group 0.000 description 2
- 125000000319 biphenyl-4-yl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- NEHMKBQYUWJMIP-UHFFFAOYSA-N chloromethane Chemical compound ClC NEHMKBQYUWJMIP-UHFFFAOYSA-N 0.000 description 2
- 210000000172 cytosol Anatomy 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 2
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- ROVTUJRZGCDHDL-UHFFFAOYSA-N tert-butyl 2-ethylheptanoate Chemical compound CCCCCC(CC)C(=O)OC(C)(C)C ROVTUJRZGCDHDL-UHFFFAOYSA-N 0.000 description 2
- UWNNZXDNLPNGQJ-UHFFFAOYSA-N tert-butyl 2-ethylhexanoate Chemical compound CCCCC(CC)C(=O)OC(C)(C)C UWNNZXDNLPNGQJ-UHFFFAOYSA-N 0.000 description 2
- GQSKZYIGXYODHM-UHFFFAOYSA-N tert-butyl 2-ethylpentanoate Chemical compound CCCC(CC)C(=O)OC(C)(C)C GQSKZYIGXYODHM-UHFFFAOYSA-N 0.000 description 2
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 235000019798 tripotassium phosphate Nutrition 0.000 description 2
- LRANPJDWHYRCER-UHFFFAOYSA-N 1,2-diazepine Chemical compound N1C=CC=CC=N1 LRANPJDWHYRCER-UHFFFAOYSA-N 0.000 description 1
- DUVWCPQAZCXDFC-UHFFFAOYSA-N 2,6-diazabicyclo[3.2.1]octan-2-yl-[3-(2-phenoxyphenyl)-1H-pyrazol-5-yl]methanone 2,2,2-trifluoroacetic acid Chemical compound FC(C(=O)O)(F)F.O(C1=CC=CC=C1)C1=C(C=CC=C1)C1=CC(=NN1)C(=O)N1C2CNC(CC1)C2 DUVWCPQAZCXDFC-UHFFFAOYSA-N 0.000 description 1
- JNGRENQDBKMCCR-UHFFFAOYSA-N 2-(3-amino-6-iminoxanthen-9-yl)benzoic acid;hydrochloride Chemical compound [Cl-].C=12C=CC(=[NH2+])C=C2OC2=CC(N)=CC=C2C=1C1=CC=CC=C1C(O)=O JNGRENQDBKMCCR-UHFFFAOYSA-N 0.000 description 1
- PMTCGWBSBBSCSF-UHFFFAOYSA-N 2-[3-(2-phenoxyphenyl)-1H-pyrazole-5-carbonyl]-2,6-diazabicyclo[3.2.1]octane-6-carbonitrile Chemical compound O(C1=CC=CC=C1)C1=C(C=CC=C1)C1=CC(=NN1)C(=O)N1C2CN(C(CC1)C2)C#N PMTCGWBSBBSCSF-UHFFFAOYSA-N 0.000 description 1
- SMHORIXQSMDYEY-UHFFFAOYSA-N 2-ethylheptanenitrile Chemical compound CCCCCC(CC)C#N SMHORIXQSMDYEY-UHFFFAOYSA-N 0.000 description 1
- 125000002471 4H-quinolizinyl group Chemical group C=1(C=CCN2C=CC=CC12)* 0.000 description 1
- 230000002407 ATP formation Effects 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000010565 Apoptosis Regulatory Proteins Human genes 0.000 description 1
- 108010063104 Apoptosis Regulatory Proteins Proteins 0.000 description 1
- LWSCLXMGVGSUJU-UHFFFAOYSA-N CC(C)C(C=C1C(C)C)=CC(C(C)C)=C1C(C=CC=C1)=C1P(C1CCCCC1)C1CCCCC1.Cl Chemical group CC(C)C(C=C1C(C)C)=CC(C(C)C)=C1C(C=CC=C1)=C1P(C1CCCCC1)C1CCCCC1.Cl LWSCLXMGVGSUJU-UHFFFAOYSA-N 0.000 description 1
- 101100190541 Caenorhabditis elegans pink-1 gene Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000798951 Homo sapiens Mitochondrial import receptor subunit TOM20 homolog Proteins 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 102000003960 Ligases Human genes 0.000 description 1
- 108090000364 Ligases Proteins 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 108010058682 Mitochondrial Proteins Proteins 0.000 description 1
- 102000006404 Mitochondrial Proteins Human genes 0.000 description 1
- 102100034007 Mitochondrial import receptor subunit TOM20 homolog Human genes 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 102000015499 Presenilins Human genes 0.000 description 1
- 108010050254 Presenilins Proteins 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- 108030003231 Rhomboid proteases Proteins 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 description 1
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000000181 anti-adherent effect Effects 0.000 description 1
- 239000003911 antiadherent Substances 0.000 description 1
- 239000002216 antistatic agent Substances 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 239000012131 assay buffer Substances 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 230000007320 autophagy mechanism Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 150000001602 bicycloalkyls Chemical group 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 230000004635 cellular health Effects 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 125000003016 chromanyl group Chemical group O1C(CCC2=CC=CC=C12)* 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- 238000006880 cross-coupling reaction Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 125000004856 decahydroquinolinyl group Chemical group N1(CCCC2CCCCC12)* 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- UKNZIQFPZSCIPW-UHFFFAOYSA-N dicyclohexyl-[2-[2,4,6-tri(propan-2-yl)phenyl]phenyl]phosphane methanesulfonic acid Chemical group CS(O)(=O)=O.CC(C)c1cc(C(C)C)c(c(c1)C(C)C)-c1ccccc1P(C1CCCCC1)C1CCCCC1 UKNZIQFPZSCIPW-UHFFFAOYSA-N 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 125000005879 dioxolanyl group Chemical group 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 238000007908 dry granulation Methods 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 230000030279 gene silencing Effects 0.000 description 1
- 238000012226 gene silencing method Methods 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 230000003907 kidney function Effects 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 230000003908 liver function Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- ZLNQQNXFFQJAID-UHFFFAOYSA-L magnesium carbonate Chemical compound [Mg+2].[O-]C([O-])=O ZLNQQNXFFQJAID-UHFFFAOYSA-L 0.000 description 1
- 239000001095 magnesium carbonate Substances 0.000 description 1
- 229910000021 magnesium carbonate Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000007102 metabolic function Effects 0.000 description 1
- 229940050176 methyl chloride Drugs 0.000 description 1
- 230000027829 mitochondrial depolarization Effects 0.000 description 1
- 230000004065 mitochondrial dysfunction Effects 0.000 description 1
- 230000021125 mitochondrion degradation Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- WOOWBQQQJXZGIE-UHFFFAOYSA-N n-ethyl-n-propan-2-ylpropan-2-amine Chemical compound CCN(C(C)C)C(C)C.CCN(C(C)C)C(C)C WOOWBQQQJXZGIE-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 230000000626 neurodegenerative effect Effects 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000007135 neurotoxicity Effects 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- SFJGCXYXEFWEBK-UHFFFAOYSA-N oxazepine Chemical compound O1C=CC=CC=N1 SFJGCXYXEFWEBK-UHFFFAOYSA-N 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 125000005545 phthalimidyl group Chemical group 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- HAMAGKWXRRTWCJ-UHFFFAOYSA-N pyrido[2,3-b][1,4]oxazin-3-one Chemical compound C1=CN=C2OC(=O)C=NC2=C1 HAMAGKWXRRTWCJ-UHFFFAOYSA-N 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 231100001274 therapeutic index Toxicity 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- NYERMPLPURRVGM-UHFFFAOYSA-N thiazepine Chemical compound S1C=CC=CC=N1 NYERMPLPURRVGM-UHFFFAOYSA-N 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 238000004724 ultra fast liquid chromatography Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/18—Bridged systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/4155—1,2-Diazoles non condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/52—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring condensed with a ring other than six-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains three hetero rings
- C07D487/18—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
- C07D491/107—Spiro-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Psychology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
本公开涉及USP30抑制剂化合物I、其药学上可接受的盐、包含其的药物组合物和涉及其的医药用途。
Description
相关申请的交叉参考
本申请要求2018年10月5日提交的美国临时专利申请第62/741,945号的优先权,所述申请的全部内容以引用的方式并入本文中。
技术领域
本公开涉及抑制泛素特异性蛋白酶30(USP30),包括抑制USP30的新颖化合物和抑制USP30的方法。所述化合物和相关方法适用于医药领域,包括新型疗法的开发(例如用于治疗与USP30的治疗性抑制相关的病况,如帕金森氏病(PD))。
背景技术
泛素化系统为影响多种细胞活动和生理过程的高度调节的过程。泛素化为可逆的过程,其由称为去泛素化酶(DUB)的一组蛋白质促进,DUB使泛素(Ub)从底物脱离。DUB由大约100种人类基因编码且分成六个家族,其中最大的家族为具有超过50个成员的泛素特异性蛋白酶(USP)。
泛素化调节线粒体动力学和生体合成,影响这些细胞器的丰度和功能。线粒体具有许多功能以维持哺乳动物的细胞健康,包括产生ATP。随着线粒体老化,其变得受损,丧失其代谢功能并开始释放促凋亡蛋白。线粒体经由线粒体自噬机制自调节其质量,所述机制是从细胞选择性去除受损的线粒体。线粒体蛋白质的泛素化被认为促进哺乳动物细胞中的线粒体动力学,可能是通过“标记(flagging)”那些蛋白质使其失活。泛素特异性蛋白酶30(USP30)嵌入线粒体外膜中,其在所述外膜中参与维持线粒体形态。USP30的过表达被认为可使得线粒体自噬减少。
PINK1和Parkin中的失活突变可损害线粒体自噬,并引起受损线粒体积聚和神经元毒性,这与帕金森氏病有关。USP30对抗Parkin的连接酶活性并且为线粒体自噬的负调控因子。预期USP30抑制会促进线粒体自噬且恢复线粒体健康。
发明内容
本公开提供了适用于抑制USP30的化合物,包括如本文中所定义的USP30抑制剂化合物。在一些实施方式中,本公开提供了一种式(I)化合物:
或其药学上可接受的盐,其中
Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(i)Ra和Rb在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基,其中所述C1-C2亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iii)Ra和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(v)Rb和Re在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vi)Rb和Rg在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xii)Re和Rf在一起形成=O;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiv)Rg和Rh与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;并且
Ar1为亚苯基或5-6元亚杂芳基,其中所述亚苯基或亚杂芳基被m个R1基团取代;并且
Ar2为亚苯基或5-10元亚杂芳基,其中所述亚苯基或亚杂芳基被n个R2基团取代;
L为-O-、-S-、-NR3-、-C(R4)2-、-S(O)2-或-S(O)-;
M为C1-C6烷基、C1-C6卤代烷基、3-6元环烷基、苯基或5-6元杂芳基,其中所述环烷基、苯基或杂芳基被p个R5基团取代;
R1、R2和R5在每次出现时独立地为卤基、氰基、NO2、氧代基、羟基、-R6、-OR6、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、-C1-C6亚烷基-R6、C1-C6烷氧基、C1-C6卤代烷氧基、-C0-C3亚烷基-NR6R7、-C0-C3亚烷基-NR7R8、-C0-C3亚烷基-C(O)NR6R7、-C0-C3亚烷基-C(O)NR7R8、-C0-C3亚烷基-NR7C(O)R6、-C0-C3亚烷基-NR7C(O)R8、-C0-C3亚烷基-NR7S(O)2R6、-C0-C3亚烷基-C(O)R6、-C0-C3亚烷基-C(O)R7、-C0-C3亚烷基-SR6、-C0-C3亚烷基-S(O)R6、-C0-C3亚烷基-S(O)2R6、-C0-C3亚烷基-S(O)2R7、-C0-C3亚烷基-S(O)2NR6R7、-C0-C3亚烷基-S(O)2NR7R8、-C0-C3亚烷基-NR7C(O)NR8R9、-C0-C3亚烷基-NR7S(O)2NR8R9、-C0-C3亚烷基-C(O)OR7、-C0-C3亚烷基-C(O)OR6、-C0-C3亚烷基-OC(O)R7、-C0-C3亚烷基-OC(O)R6、-C0-C3亚烷基-NR7C(O)OR8或-C0-C3亚烷基-NR7S(O)2R8;
R3为H、C1-C6烷基或C1-C6卤代烷基;
每个R4独立地为H、C1-C6烷基或C1-C6卤代烷基,或两个R4基团与其所连接的碳原子一起形成3-6元环烷基或杂环烷基;
每个R6独立地为5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基,其中所述杂芳基、杂环烷基、芳基或环烷基任选地被独立地选自下组的1-5个取代基取代:卤基、氧代基、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、C1-C6烷氧基、C1-C6卤代烷氧基、C2-C6烯基、C2-C6炔基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基、3-8元环烷基、-NR10C(O)NR11R12、-NR10R11、-C(O)R10、-NR10C(O)R11、-NR10C(O)OR11、-S(O)2R10、-C(O)NR10R11、-C(O)OR10、-S(O)2NR10R11、-NR10S(O)2R11、-OR10、-OC(O)R10、-OS(O)2R10、-OC(O)NR10R11、-OC(O)OR10、-OS(O)2NR10R11、-C(O)NR10C(O)NR11R12、-C(O)C(O)R10、-C(O)NR10C(O)R11、-C(O)NR10C(O)OR11、-C(O)S(O)2R10、-C(O)C(O)NR10R11、-C(O)C(O)OR10、-C(O)S(O)2NR10R11、-C(O)NR10S(O)2R11、-C1-C6亚烷基-R10、-C1-C6亚烷基-NR10C(O)NR11R12、-C1-C6亚烷基-NR10R11、-C1-C6亚烷基-C(O)R10、-C1-C6亚烷基-NR10C(O)R11、-C1-C6亚烷基-NR10C(O)OR11、-C1-C6亚烷基-S(O)2R10、-C1-C6亚烷基-C(O)NR10R11、-C1-C6亚烷基-C(O)OR10、-C1-C6亚烷基-S(O)2NR10R11、-C1-C6亚烷基-NR10S(O)2R11、-C1-C6亚烯基-R10、-C1-C6亚烯基-NR10C(O)NR11R12、-C1-C6亚烯基-NR10R11、-C1-C6亚烯基-C(O)R10、-C1-C6亚烯基-NR10C(O)R11、-C1-C6亚烯基-NR10C(O)OR11、-C1-C6亚烯基-S(O)2R10、-C1-C6亚烯基-C(O)NR10R11、-C1-C6亚烯基-C(O)OR10、-C1-C6亚烯基-S(O)2NR10R11和-C1-C6亚烯基-NR10S(O)2R11;
每个R7、R8和R9独立地为氢或C1-C6烷基;
每个R10、R11和R12独立地为氢、C1-C6烷基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基;
m为0-4;
n为0-4;并且
p为0-4。
在一些实施方式中,本公开提供了一种式(I-C)化合物:
或其药学上可接受的盐,其中R2、R5、n、p、Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,USP30抑制剂化合物为一种选自下组的化合物:
其中R2、R5、n和p如本文中关于式(I)所定义,或其药学上可接受的盐,如实施例1中所述的泛素-罗丹明110测定所测量,所述化合物具有约≤1μM(并且优选地≤0.5μM或≤0.1μM)并且>0.001μM的IC50值。在一些实施方式中,提供式(I-C)化合物,其中R2和R5均为氢。
在一些实施方式中,USP30抑制剂化合物为一种如下化学式的化合物:
其中R2、R5、n和p如本文中关于式(I)所定义,或其药学上可接受的盐,如实施例1中所述的泛素-罗丹明110测定所测量,所述化合物具有约≤1μM(并且优选地≤0.5μM或≤0.1μM)并且>0.001μM的IC50值。
在一些实施方式中,化合物为选自本文表1中所列的化合物的任何化合物。
具体实施方式
本公开涉及如本文所定义的式(I)化合物,其药学上可接受的盐,包含所述化合物、盐的药物组合物和涉及所述化合物、盐的医药用途。在一些实施方式中,式(I)化合物为USP30抑制剂化合物。在其它实施方式中,式(I)化合物适用于例如在生物测定中(例如,以下方面和实施方式中任一项并非USP30抑制剂化合物的化合物)作为分析工具和/或对照化合物。
USP30抑制剂化合物适用于开发针对帕金森氏病(PD)的新型疗法,并且适用于通过抑制USP30治疗疾病或病况(如PD)的方法。Parkin(E3泛素连接酶)和PINK1(激酶)为线粒体自噬的关键调节因子。在健康线粒体中,PINK1定位于线粒体外膜(MOM)并暴露于胞质溶胶受到快速输入至线粒体内膜(MIM)限制。一旦定位于MIM,PINK1便被若干蛋白酶,如早老素相关菱形样蛋白酶(PARL)加工,以产生PINK1的截短型式,其随后被蛋白酶体降解(Meissner等人,《自体吞噬(Autophagy.)》2015,11(9),1484-1498)。在线粒体去极化或功能障碍后,PINK1积聚于MOM中,经由泛素和Parkin两者的PINK1依赖性磷酸化来募集和活化Parkin。结果,活化的Parkin使MOM蛋白(如TOMM20)泛素化以触发线粒体自噬(Pickrell等人,《神经元(Neuron.)》2015,85(2),257-273)。USP30包埋于MOM中,其中其催化DUB域朝向胞质溶胶定向且已显示拮抗常见底物的Parkin介导的泛素化,因此反抗Parkin介导的线粒体自噬。USP30的基因沉默使得若干Parkin底物的泛素化增加,接着使得线粒体自噬增加。在模型生物体中,USP30耗尽能够拯救由致病性Parkin突变引起的线粒体自噬缺陷,以及恢复线粒体形态和功能,和多巴胺水平。(Nakamura等人,《细胞分子生物学(Mol BiolCell.)》2008,19(5),1903-1911;Bingol等人,《自然(Nature)》2014,510(7505):370-5)。因此,本文中所公开的化合物抑制USP30可呈现通过促进线粒体更新来治疗PD的新颖范例。
定义
如本文所用,术语“烷基”意指完全饱和的被取代或未被取代的烃链,包括直链烷基和支链烷基,并且具有与分子的其余部分的单个连接点。在一些实施方式中,直链或支链烷基在其主链中具有约1-20个碳原子(例如,针对直链的C1-C20,针对支链的C2-C20),并且可替代地,具有约1-10个。在一些实施方式中,烷基具有约1-8个碳原子。在一些实施方式中,烷基具有约1-6个碳原子。在一些实施方式中,烷基具有约1-5个碳原子。在一些实施方式中,烷基具有约1-4个碳原子。在一些实施方式中,烷基具有约1-3个碳原子。在一些实施方式中,烷基具有约1-2个碳原子。
如本文所用,术语“亚烷基”是指二价烷基。示例性亚烷基包括-CH2-、-CH2CH2-、-CH(CH3)-、-CH2CH(CH3)-、-CH(CH3)CH3)-等。在一些实施方式中,“亚烷基链”为聚亚甲基,即-(CH2)n-,其中n为正整数,优选1至6、1至4、1至3、1至2或2至3。被取代的亚烷基链为聚亚甲基,其中一个或多个亚甲基氢原子被取代基置换。
如本文所用,术语“烯基”是指如本文所定义,具有一个或多个双键的烷基。
如本文所用,术语“亚烯基”是指二价烯基。被取代的亚烯基链为含有至少一个双键的聚亚甲基,其中一个或多个氢原子被取代基置换。
如本文所用,术语“炔基”是指如本文所定义,具有一个或多个三键的烷基。
术语“芳基”是指具有总共五至十四个环成员的环系统,其中系统中的至少一个环为芳香族环,并且其中系统中的每个环含有3至7个环成员。术语“芳基”可与术语“芳基环”互换使用。在本公开的某些实施方式中,“芳基”是指芳环系统并且示例性基团包括苯基、联苯、萘基、蒽基等,其可以携有一个或多个取代基。如本文所用,在术语“芳基”的范围内还包含芳环与一个或多个非芳环稠合的基团,如茚满基、邻苯二甲酰亚胺基、萘酰亚胺基、啡啶基或四氢萘基等。
术语“亚芳基”是指二价芳基(例如,亚苯基)。
如本文所用,术语“环烷基”是指环状烷基(例如,单环烷基或双环烷基)。在一些实施方式中,“环烷基”是指单环C3-C8环烷基。在一些实施方式中,“环烷基”是指单环C3-C6环烷基。
术语“卤素”或“卤基”意指F、Cl、Br或I。
术语“杂芳基”是指具有5至10个环原子,优选5、6或9个环原子;在环阵列中具有6、10或14个π电子;并且除碳原子以外,具有一至五个杂原子的基团,其中术语“杂原子”是指氮、氧或硫,并且包括任何氧化形式的氮或硫,以及任何季铵化形式的碱性氮。示例性杂芳基包括噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、异噁唑基、噁二唑基、噻唑基、异噻唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、吲哚嗪基、嘌呤基、萘啶基和喋啶基。如本文所用,术语“杂芳基”还包括杂芳环与一个或多个芳基、环脂肪族基或杂环基环稠合的基团,其中连接基团或点位于杂芳环上。示例性基团包括吲哚基、异吲哚基、苯并噻吩基、苯并呋喃基、二苯并呋喃基、吲唑基、苯并咪唑基、苯并噻唑基、喹啉基、异喹啉基、噌啉基、酞嗪基、喹唑啉基、喹喔啉基、4H-喹嗪基、咔唑基、吖啶基、吩嗪基、吩噻嗪基、吩噁嗪基、四氢喹啉基、四氢异喹啉基和吡啶并[2,3-b]-1,4-噁嗪-3(4H)-酮。杂芳基可以为单环或双环的。术语“杂芳基(heteroaryl)”可与术语“杂芳环(heteroaryl ring)”、“杂芳基(heteroaryl group)”或“杂芳香族基(heteroaromatic)”互换使用,所述术语中的任一个包括任选被取代的环。
术语“亚杂芳基”是指二价杂芳基。
如本文所用,术语“杂环烷基”是指稳定的3至7元单环或7至10元双环部分,其饱和并且除碳原子以外,具有一个或多个,优选一至四个独立地选自氮、氧和硫的杂原子,包括任何氧化形式的氮或硫和任何季铵化形式的碱性氮。举例来说,在具有1-3个选自氧、硫或氮的杂原子的饱和环中,氮可以为N(如在3,4-二氢-2H-吡咯基中)、NH(如在吡咯烷基中)或+NR(如在N-取代的吡咯烷基中)。杂环烷基环可以在任何杂原子或碳原子处连接到其侧基,从而产生稳定结构,并且环原子中的任一个可以任选地被取代。杂环烷基的实施例包括四氢呋喃基、四氢噻吩基吡咯烷基、哌啶基、吡咯啉基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、噁唑烷基、哌嗪基、二噁烷基、二氧戊环基、二氮呯基、噁氮呯基、噻氮呯基、吗啉基和奎宁环基。术语“杂环烷基”还包括杂环烷基环与一个或多个芳基、杂芳基或环脂肪族环稠合的基团,如吲哚啉基、3H-吲哚基、苯并二氢吡喃基、啡啶基或四氢喹啉基,其中连接基团或点位于杂环烷基环上。
如本文所用,“USP30抑制剂化合物”是指在如实施例1中所述的针对USP30的泛素-罗丹明110测定中,IC50为约1微摩尔浓度或更小(即,IC50值≤1μM并且>0.001μM)的化合物。举例来说,USP30抑制剂可以为当在实施例1的生物化学测定中测试时,IC50值≤0.5μM并且>0.001μM的式(I)化合物。在一些实施方式中,USP30抑制剂为当在实施例1的生物化学测定中测试时,IC50值≤0.1μM并且>0.001μM的式(I)化合物。
如本文所用,术语“药学上可接受的盐”是指适合于在药学背景中使用的这类化合物的盐,即在合理的医学判断范围内,适合与人类和低等动物的组织接触使用,而不会产生不当的毒性、刺激性、过敏反应等,并与合理的效益/风险比相称的盐。药学上可接受的盐在所属领域中众所周知。例如,S.M.Berge等人在《药物科学杂志(J.PharmaceuticalSciences)》,66:1-19(1977)中详细描述了药学上可接受的盐。
除非另外说明,否则本文中所描绘的没有立体化学描述词的所有化学结构和化学名称应理解为包括由结构或名称描绘的化合物的所有立体异构(例如对映异构或非对映异构)形式,以及化合物的所有几何和构象异构形式;举例来说,每一立构中心的R和S构形。除非另外说明,否则此类结构和名称应理解为包括化合物的立体化学纯形式和对映异构体、非对映异构体或几何(或构象)异构体的任何混合物。除非另外说明,否则本公开的化合物的所有互变异构形式均在本公开的范围内。
除非另外说明,否则本文中所描绘的具有立体化学描述词(即,化学结构中的切割键和楔形键;化学名称中的(R)-和(S)-标识符)的所有化学结构和化学名称应理解为指代具有由立体化学描述词指示的相对立体化学(但不一定是绝对立体化学)的化合物。除非另外说明,否则此类结构和名称应理解为包括具有由立体化学描述词指示的相对立体化学的化合物的对映异构纯形式或对映异构体的任何混合物。在一些实施方式中,对映异构体以外消旋混合物形式存在。在其它实施方式中,具有由立体化学描述词所表明的绝对立体化学的对映异构体以基本上对映异构纯形式存在。在其它实施方式中,具有与由立体化学描述词所表明的绝对立体化学相反的绝对立体化学的对映异构体以基本上对映异构纯形式存在。
除非另外说明,否则本文中所描绘的具有立体化学描述词(即,化学结构中的切割键和楔形键;化学名称中的(R)-和(S)-标识符)和“绝对”描述词(“abs”)的所有化学结构和化学名称应理解为指代具有由立体化学描述词指示的绝对立体化学的化合物。除非另外说明,否则此类结构和名称应理解为包括呈对映异构纯形式或呈与其对映异构体的混合物形式的化合物。在一些实施方式中,对映异构体以外消旋混合物形式存在。在其它实施方式中,具有由立体化学描述词所指示的绝对立体化学的对映异构体以基本上对映异构纯形式存在。
除非另外说明,否则本文中所描绘的结构也意指包括仅在存在一个或多个同位素增浓原子方面不同的化合物。举例来说,包括由氘或氚置换氢或由13C或14C增浓的碳置换碳的具有本发明结构的化合物在本公开的范围内。
应了解,在整个本公开中,除非另外指明,否则提及式(I)化合物意图还包含式I-1、I-2、I-3、I-4、I-A、I-A-1、I-A-2、I-A-3、I-A-4、I-B、I-B-1、I-B-2、I-B-3、I-B-4、I-C、I-C-1、I-C-2、I-C-3、I-C-4、I-C-a、I-C-b、I-C-c、I-C-d、I-C-e、I-C-f、I-D、I-E、I-E-1、I-E-2、I-E-3、I-E-4、I-F-1、I-F-2、I-G-1、I-G-2、I-H-1、I-H-2、I-J-1、I-J-2、I-K-1、I-K-2、I-L-1、I-L-2、I-M、I-M-1、I-M-2、I-M-3和I-M-4,和本文中所公开的所述式的化合物物种。
本公开的化合物
在一个方面,本公开涉及一种式(I)化合物:
或其药学上可接受的盐,其中Ar1、Ar2、M、L、Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义。
在一些实施方式中,本公开提供式(I-1)化合物或其药学上可接受的盐:
其中Ar1、Ar2、M、L、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm和Rn各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-2)化合物或其药学上可接受的盐:
其中Ar1、Ar2、M、L、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述,并且
其中Rj和Rk各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-3)化合物或其药学上可接受的盐:
其中Ar1、Ar2、M、L、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm、Rn、Ro和Rp各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-4)化合物或其药学上可接受的盐:
其中Ar1、Ar2、M、L、Ra、Rb、Rd、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述,并且
其中Rq和Rr各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在另一方面,本公开涉及一种式(I-A)化合物:
或其药学上可接受的盐,其中:
X1为C或N;
X2在化合价允许时,为CH、CR1、O、S、N、NH或NR1;
X3在化合价允许时,为CH、CR1、O、S、N、NH或NR1;
X4为C或N;
X5在化合价允许时,为键、CH、CR1、O、S、N、NH或NR1;
X6在化合价允许时,为CH、CR1、O、S、N、NH或NR1;
Y1为C或N;
Y2为C或N;
Y3在化合价允许时,为CH、CR2、O、S、N、NH或NR2;
Y4在化合价允许时,为键、CH、CR2、O、S、N、NH或NR2;
Y5在化合价允许时,为CH、CR2、O、S、N、NH或NR2;
Y6在化合价允许时,为CH、CR2、O、S、N、NH或NR2,
条件是包含X1、X2、X3、X4、X5和X6的环为芳环,并且
包含Y1、Y2、Y3、Y4、Y5和Y6的环为芳环;
并且其中L、M、R1、R2、R5、Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开提供式(I-A-1)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm和Rn各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-A-2)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述,并且
其中Rj和Rk各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-A-3)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm、Rn、Ro和Rp各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-A-4)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、Ra、Rb、Rd、Rf、Rg和Rh全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述,并且
其中Rq和Rr各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在另一方面,本公开涉及一种式(I-B)化合物:
或其药学上可接受的盐,其中:
Y3为CH、CR2或N;
Y4为CH、CR2或N;
Y5为CH、CR2或N;
Y6为CH、CR2或N;并且
其中X1、X2、X3、X4、X6、L、M、Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开提供式(I-B-1)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X6、Y3、Y4、Y5、Y6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-B)所定义,并在本文关于式(I-B)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm和Rn各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-B-2)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X6、Y3、Y4、Y5、Y6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-B)所定义,并在本文关于式(I-B)的类别和亚类中单独和以组合方式描述,并且
其中Rj和Rk各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-B-3)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X6、Y3、Y4、Y5、Y6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-B)所定义,并在本文关于式(I-B)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm、Rn、Ro和Rp各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-B-4)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X6、Y3、Y4、Y5、Y6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-B)所定义,并在本文关于式(I-B)的类别和亚类中单独和以组合方式描述,并且
其中Rq和Rr各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在另一方面,本公开涉及一种式(I-C)化合物:
或其药学上可接受的盐,其中R2、R5、n、p、Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开提供式(I-C-1)化合物或其药学上可接受的盐:
其中R2、R5、n、p、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm和Rn各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-C-2)化合物或其药学上可接受的盐:
其中R2、R5、n、p、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述,并且
其中Rj和Rk各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-C-3)化合物或其药学上可接受的盐:
其中R2、R5、n、p、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm、Rn、Ro和Rp各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-C-4)化合物或其药学上可接受的盐:
其中R2、R5、n、p、Ra、Rb、Rd、Rf、Rg和Rh全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述,并且
其中Rq和Rr各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开涉及一种式(I-C)化合物或其药学上可接受的盐,其中所述化合物具有式(I-C-a):
其中R2、R5、n和p全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开涉及一种式(I-C)化合物或其药学上可接受的盐,其中所述化合物具有式(I-C-b):
其中R2、R5、n和p全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开涉及一种式(I-C)化合物或其药学上可接受的盐,其中所述化合物具有式(I-C-c):
其中R2、R5、n和p全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开涉及一种式(I-C)化合物或其药学上可接受的盐,其中所述化合物具有式(I-C-d):
其中R2、R5、n和p全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开涉及一种式(I-C)化合物或其药学上可接受的盐,其中所述化合物具有式(I-C-e):
其中R2、R5、n和p全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开涉及一种式(I-C)化合物或其药学上可接受的盐,其中所述化合物具有式(I-C-f):
其中R2、R5、n和p全部如关于上式(I-C)所定义,并在本文关于式(I-C)的类别和亚类中单独和以组合方式描述。
在另一方面,本公开涉及一种式(I-D)化合物:
或其药学上可接受的盐,其中Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述。
在另一方面,本公开涉及一种式(I-E)化合物:
或其药学上可接受的盐,其中Ra、Rb、Rc、Rd、Re、Rf和Rg全部如关于上式(I)所定义,并在本文关于式(I)的类别和亚类中单独和以组合方式描述。在一些实施方式中,本公开提供式(I-E-1)化合物或其药学上可接受的盐:
在一些实施方式中,在式(I-E-1)化合物的外消旋混合物通过实施例3,步骤6中所述的程序分离时,式(I-E-1)化合物具有第一洗脱异构体的绝对立体化学。在一些实施方式中,在式(I-E-1)化合物的外消旋混合物通过实施例3,步骤6中所述的程序分离时,式(I-E-1)化合物具有第二洗脱异构体的绝对立体化学。
在一些实施方式中,式(I-E-1)化合物为:
在一些实施方式中,式(I-E-1)化合物为:
在一些实施方式中,本公开提供式(I-E-2)化合物或其药学上可接受的盐:
在一些实施方式中,在式(I-E-2)化合物的外消旋混合物通过实施例4,步骤6中所述的程序分离时,式(I-E-2)化合物具有第一洗脱异构体的绝对立体化学。在一些实施方式中,在式(I-E-2)化合物的外消旋混合物通过实施例4,步骤6中所述的程序分离时,式(I-E-2)化合物具有第二洗脱异构体的绝对立体化学。
在一些实施方式中,式(I-E-2)化合物为:
在一些实施方式中,式(I-E-2)化合物为:
在一些实施方式中,本公开提供式(I-E-3)化合物或其药学上可接受的盐:
在一些实施方式中,在式(I-E-3)化合物的外消旋混合物通过实施例2,步骤7中所述的程序分离时,式(I-E-3)化合物具有第一洗脱异构体的绝对立体化学。在一些实施方式中,在式(I-E-3)化合物的外消旋混合物通过实施例2,步骤7中所述的程序分离时,式(I-E-3)化合物具有第二洗脱异构体的绝对立体化学。
在一些实施方式中,式(I-E-3)化合物为:
在一些实施方式中,式(I-E-3)化合物为:
在一些实施方式中,本公开提供式(I-E-4)化合物或其药学上可接受的盐:
在一些实施方式中,在式(I-E-4)化合物的外消旋混合物通过实施例2,步骤7中所述的程序分离时,式(I-E-4)化合物具有第一洗脱异构体的绝对立体化学。在一些实施方式中,在式(I-E-4)化合物的外消旋混合物通过实施例2,步骤7中所述的程序分离时,式(I-E-4)化合物具有第二洗脱异构体的绝对立体化学。
在一些实施方式中,式(I-E-4)化合物为:
在一些实施方式中,式(I-E-4)化合物为:
在另一方面,本公开涉及一种式(I-F-1)或(I-F-2)化合物:
或其药学上可接受的盐,其中X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、L和M全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,式(I-F-1)和(I-F-2)化合物以外消旋混合物形式存在。在其它实施方式中,式(I-F-1)或(I-F-2)化合物以基本上对映异构纯形式存在。式(I-F-1)和(I-F-2)化合物可通过手性HPLC,诸如通过实施例2,步骤7或实施例3,步骤6中所述的程序彼此分离。
在另一方面,本公开涉及一种式(I-G-1)或(I-G-2)化合物:
或其药学上可接受的盐,其中X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、L和M全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,式(I-G-1)和(I-G-2)化合物以外消旋混合物形式存在。在其它实施方式中,式(I-G-1)或(I-G-2)化合物以基本上对映异构纯形式存在。式(I-G-1)和(I-G-2)化合物可通过手性HPLC,诸如通过实施例2,步骤7或实施例4,步骤6中所述的程序彼此分离。
在另一方面,本公开涉及式(I-H-1)或(I-H-2)化合物:
或其药学上可接受的盐,其中X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、L和M全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,式(I-H-1)和(I-H-2)化合物以外消旋混合物形式存在。在其它实施方式中,式(I-H-1)或(I-H-2)化合物以基本上对映异构纯形式存在。式(I-H-1)和(I-H-2)化合物可通过手性HPLC,诸如通过实施例2,步骤7中所述的程序彼此分离。
在另一方面,本公开涉及式(I-J-1)或(I-J-2)化合物:
或其药学上可接受的盐,其中X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5、Y6、L和M全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,式(I-J-1)和(I-J-2)化合物以外消旋混合物形式存在。在其它实施方式中,式(I-J-1)或(I-J-2)化合物以基本上对映异构纯形式存在。式(I-J-1)和(I-J-2)化合物可通过手性HPLC,诸如通过实施例2,步骤7中所述的程序彼此分离。
在一些实施方式中,本公开提供式(I-K-1)或(I-K-2)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5和Y6全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开提供式(I-L-1)或(I-L-2)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Y1、Y2、Y3、Y4、Y5和Y6全部如关于上式(I-A)所定义,并在本文关于式(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开提供式(I-M)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh全部如关于上式(I)和(I-A)所定义,并在本文关于式(I)和(I-A)的类别和亚类中单独和以组合方式描述。
在一些实施方式中,本公开提供式(I-M-1)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-M)所定义,并在本文关于式(I-M)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm和Rn各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-M-2)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-M)所定义,并在本文关于式(I-M)的类别和亚类中单独和以组合方式描述,并且
其中Rj和Rk各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-M-3)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Ra、Rd、Re、Rf、Rg和Rh全部如关于上式(I-M)所定义,并在本文关于式(I-M)的类别和亚类中单独和以组合方式描述,并且
其中Rj、Rk、Rm、Rn、Ro和Rp各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开提供式(I-M-4)化合物或其药学上可接受的盐:
其中M、L、X1、X2、X3、X4、X5、X6、Ra、Rb、Rd、Rf、Rg和Rh全部如关于上式(I-M)所定义,并在本文关于式(I-M)的类别和亚类中单独和以组合方式描述,并且
其中Rq和Rr各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)或(I-4)化合物或其药学上可接受的盐,其中Ar1独立地为亚苯基或5-6元亚杂芳基,其中所述亚苯基或亚杂芳基被m个R1基团取代。在一些实施方式中,Ar1为被m个R1基团取代的亚苯基。在一些实施方式中,Ar1为被选自下组的1-2个R1基团取代的亚苯基:卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,Ar1为亚苯基。在一些实施方式中,Ar1为被m个R1基团取代的5-6元亚杂芳基。在一些实施方式中,Ar1为被选自下组的1-2个R1基团取代的5-6元亚杂芳基:卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,Ar1为被m个R1基团取代的5元亚杂芳基。在一些实施方式中,Ar1为吡唑。在一些实施方式中,Ar1为噻唑。在一些实施方式中,Ar1为被m个R1基团取代的6元亚杂芳基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中Ar2独立地为亚苯基或5-10元亚杂芳基,其中所述亚苯基或亚杂芳基被n个R2基团取代。在一些实施方式中,Ar2为亚苯基或5-6元亚杂芳基,其中所述亚苯基或亚杂芳基被n个R2基团取代。在一些实施方式中,Ar2为被n个R2基团取代的亚苯基。在一些实施方式中,Ar2为被选自下组的1-2个R2基团取代的亚苯基:卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,Ar2为亚苯基。在一些实施方式中,Ar2为被n个R2基团取代的5-10元亚杂芳基。在一些实施方式中,Ar2为被n个R2基团取代的5-6元亚杂芳基。在一些实施方式中,Ar2为被选自下组的1-2个R2基团取代的5-6元亚杂芳基:卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,Ar2为被n个R2基团取代的5元亚杂芳基。在一些实施方式中,Ar2为被n个R2基团取代的6元亚杂芳基。在一些实施方式中,Ar2为吡啶。在一些实施方式中,Ar2为被n个R2基团取代的7元亚杂芳基。在一些实施方式中,Ar2为被n个R2基团取代的8元亚杂芳基。在一些实施方式中,Ar2为被n个R2基团取代的9元亚杂芳基。在一些实施方式中,Ar2为被n个R2基团取代的10元亚杂芳基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中L为-O-、-S-、-NR3-、-C(R4)2-、-S(O)2-或-S(O)-。在一些实施方式中,L为-O-、-S-或-NH-。在一些实施方式中,L为-O-。在一些实施方式中,L为-S-。在一些实施方式中,L为-NR3-。在一些实施方式中,L为-NH-。在一些实施方式中,L为-C(R4)2-。在一些实施方式中,L为-CH2-。在一些实施方式中,L为-S(O)2-。在一些实施方式中,L为-S(O)-。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中M为C1-C6烷基、C1-C6卤代烷基、3-6元环烷基、苯基或5-6元杂芳基,其中所述环烷基、苯基或杂芳基被p个R5基团取代。在一些实施方式中,M为3-6元环烷基、苯基或5-6元杂芳基,其中所述环烷基、苯基或杂芳基被p个R5基团取代。在一些实施方式中,M为C1-C6烷基。在一些实施方式中,M为C1-C6卤代烷基。在一些实施方式中,M为被p个R5基团取代的3-6元环烷基。在一些实施方式中,M为3-6元环烷基。在一些实施方式中,M为被选自下组的1-2个R5基团取代的3-6元环烷基:卤基、氰基、羟基、C1-C6烷基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,M为被p个R5基团取代的苯基。在一些实施方式中,M为苯基。在一些实施方式中,M为被选自下组的1-2个R5基团取代的苯基:卤基、氰基、羟基、C1-C6烷基、C1-C6卤代烷基、C1-C6烷氧基和C1-C6羟烷基。在一些实施方式中,M为被氟取代的苯基。在一些实施方式中,M为被p个R5基团取代的5-6元杂芳基。在一些实施方式中,M为5-6元杂芳基。在一些实施方式中,M为被选自下组的1-2个R5基团取代的5-6元杂芳基:卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-C)、(I-C-1)、(I-C-2)、(I-C-3)、(I-C-4)、(I-C-a)、(I-C-b)、(I-C-c)、(I-C-d)、(I-C-e)、(I-C-f)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中R1、R2和R5在每次出现时独立地为卤基、氰基、NO2、氧代基、羟基、-R6、-OR6、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、-C1-C6亚烷基-R6、C1-C6烷氧基、C1-C6卤代烷氧基、-C0-C3亚烷基-NR6R7、-C0-C3亚烷基-NR7R8、-C0-C3亚烷基-C(O)NR6R7、-C0-C3亚烷基-C(O)NR7R8、-C0-C3亚烷基-NR7C(O)R6、-C0-C3亚烷基-NR7C(O)R8、-C0-C3亚烷基-NR7S(O)2R6、-C0-C3亚烷基-C(O)R6、-C0-C3亚烷基-C(O)R7、-C0-C3亚烷基-SR6、-C0-C3亚烷基-S(O)R6、-C0-C3亚烷基-S(O)2R6、-C0-C3亚烷基-S(O)2R7、-C0-C3亚烷基-S(O)2NR6R7、-C0-C3亚烷基-S(O)2NR7R8、-C0-C3亚烷基-NR7C(O)NR8R9、-C0-C3亚烷基-NR7S(O)2NR8R9、-C0-C3亚烷基-C(O)OR7、-C0-C3亚烷基-C(O)OR6、-C0-C3亚烷基-OC(O)R7、-C0-C3亚烷基-OC(O)R6、-C0-C3亚烷基-NR7C(O)OR8或-C0-C3亚烷基-NR7S(O)2R8。在一些实施方式中,R1在每次出现时独立地为卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,R1在每次出现时独立地为卤基(例如,氟、氯、溴或碘)。在一些实施方式中,R1在每次出现时为氟。在一些实施方式中,R1在每次出现时为氰基。在一些实施方式中,R1在每次出现时为羟基。在一些实施方式中,R1在每次出现时为C1-C6烷基。在一些实施方式中,R1在每次出现时为C1-C6烷氧基。在一些实施方式中,R1在每次出现时为C1-C6卤代烷基。
在一些实施方式中,R1在每次出现时为C1-C6羟烷基。在一些实施方式中,R2在每次出现时独立地为卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,R2在每次出现时独立地为卤基(例如,氟、氯、溴或碘)。在一些实施方式中,R2在每次出现时为氟。在一些实施方式中,R2在每次出现时为氰基。在一些实施方式中,R2在每次出现时为羟基。在一些实施方式中,R2在每次出现时为C1-C6烷基。
在一些实施方式中,R2在每次出现时为C1-C6烷氧基。在一些实施方式中,R2在每次出现时为C1-C6卤代烷基。在一些实施方式中,R2在每次出现时为C1-C6羟烷基。在一些实施方式中,R5在每次出现时独立地为卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。在一些实施方式中,R5在每次出现时独立地为卤基(例如,氟、氯、溴或碘)。在一些实施方式中,R5在每次出现时为氟。在一些实施方式中,R5在每次出现时为氰基。在一些实施方式中,R5在每次出现时为羟基。在一些实施方式中,R5在每次出现时为C1-C6烷基。在一些实施方式中,R5在每次出现时为C1-C6烷氧基。在一些实施方式中,R5在每次出现时为C1-C6卤代烷基。在一些实施方式中,R5在每次出现时为C1-C6羟烷基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中R3为H、C1-C6烷基或C1-C6卤代烷基。在一些实施方式中,R3为H。在一些实施方式中,R3为C1-C6烷基。在一些实施方式中,R3为C1-C6卤代烷基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中每个R4独立地为H、C1-C6烷基或C1-C6卤代烷基,或两个R4基团与其所连接的碳原子一起形成3-6元环烷基或杂环烷基。在一些实施方式中,每个R4为H。在一些实施方式中,两个R4基团与其所连接的碳原子一起形成3-6元环烷基。在一些实施方式中,两个R4基团与其所连接的碳原子一起形成3-6元杂环烷基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-C)、(I-C-1)、(I-C-2)、(I-C-3)、(I-C-4)、(I-C-a)、(I-C-b)、(I-C-c)、(I-C-d)、(I-C-e)、(I-C-f)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中每个R6为5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基,其中所述杂芳基、杂环烷基、芳基或环烷基任选地被独立地选自下组的1-5个取代基取代:卤基、氧代基、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、C1-C6烷氧基、C1-C6卤代烷氧基、C2-C6烯基、C2-C6炔基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基、3-8元环烷基、-NR10C(O)NR11R12、-NR10R11、-C(O)R10、-NR10C(O)R11、-NR10C(O)OR11、-S(O)2R10、-C(O)NR10R11、-C(O)OR10、-S(O)2NR10R11、-NR10S(O)2R11、-OR10、-OC(O)R10、-OS(O)2R10、-OC(O)NR10R11、-OC(O)OR10、-OS(O)2NR10R11、-C(O)NR10C(O)NR11R12、-C(O)C(O)R10、-C(O)NR10C(O)R11、-C(O)NR10C(O)OR11、-C(O)S(O)2R10、-C(O)C(O)NR10R11、-C(O)C(O)OR10、-C(O)S(O)2NR10R11、-C(O)NR10S(O)2R11、-C1-C6亚烷基-R10、-C1-C6亚烷基-NR10C(O)NR11R12、-C1-C6亚烷基-NR10R11、-C1-C6亚烷基-C(O)R10、-C1-C6亚烷基-NR10C(O)R11、-C1-C6亚烷基-NR10C(O)OR11、-C1-C6亚烷基-S(O)2R10、-C1-C6亚烷基-C(O)NR10R11、-C1-C6亚烷基-C(O)OR10、-C1-C6亚烷基-S(O)2NR10R11、-C1-C6亚烷基-NR10S(O)2R11、-C1-C6亚烯基-R10、-C1-C6亚烯基-NR10C(O)NR11R12、-C1-C6亚烯基-NR10R11、-C1-C6亚烯基-C(O)R10、-C1-C6亚烯基-NR10C(O)R11、-C1-C6亚烯基-NR10C(O)OR11、-C1-C6亚烯基-S(O)2R10、-C1-C6亚烯基-C(O)NR10R11、-C1-C6亚烯基-C(O)OR10、-C1-C6亚烯基-S(O)2NR10R11和-C1-C6亚烯基-NR10S(O)2R11。在一些实施方式中,每个R6独立地为任选地被取代的5-10元杂芳基。在一些实施方式中,每个R6独立地为任选地被取代的4-10元杂环烷基。在一些实施方式中,每个R6独立地为任选地被取代的6-10元芳基。在一些实施方式中,每个R6独立地为任选地被取代的3-8元环烷基。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-C)、(I-C-1)、(I-C-2)、(I-C-3)、(I-C-4)、(I-C-a)、(I-C-b)、(I-C-c)、(I-C-d)、(I-C-e)、(I-C-f)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中每个R7、R8和R9独立地为氢或C1-C6烷基。在一些实施方式中,每个R7、R8和R9独立地为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-C)、(I-C-1)、(I-C-2)、(I-C-3)、(I-C-4)、(I-C-a)、(I-C-b)、(I-C-c)、(I-C-d)、(I-C-e)、(I-C-f)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中每个R10、R11和R12独立地为氢、C1-C6烷基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基。在一些实施方式中,每个R10、R11和R12独立地为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)或(I-4)化合物或其药学上可接受的盐,其中m为0-4(即,m为0、1、2、3或4)。在一些实施方式中,m为0。在一些实施方式中,m为1。在一些实施方式中,m为2。在一些实施方式中,m为3。在一些实施方式中,m为4。在一些实施方式中,m为0、1或2。在一些实施方式中,m为1或2。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-C)、(I-C-1)、(I-C-2)、(I-C-3)、(I-C-4)、(I-C-a)、(I-C-b)、(I-C-c)、(I-C-d)、(I-C-e)、(I-C-f)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中n为0-4(即,n为0、1、2、3或4)。在一些实施方式中,n为0。在一些实施方式中,n为1。在一些实施方式中,n为2。在一些实施方式中,n为3。在一些实施方式中,n为4。在一些实施方式中,n为0、1或2。在一些实施方式中,n为1或2。
在一些实施方式中,本公开涉及一种式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-C)、(I-C-1)、(I-C-2)、(I-C-3)、(I-C-4)、(I-C-a)、(I-C-b)、(I-C-c)、(I-C-d)、(I-C-e)、(I-C-f)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中p为0-4(即,p为0、1、2、3或4)。在一些实施方式中,p为0。在一些实施方式中,p为1。在一些实施方式中,p为2。在一些实施方式中,p为3。在一些实施方式中,p为4。在一些实施方式中,p为0、1或2。在一些实施方式中,p为1或2。在一些实施方式中,n和p均为0。在一些实施方式中,m和n均为0。在一些实施方式中,m和n均为0。在一些实施方式中,m、n和p为0。在一些实施方式中,m和n为0,并且p为1。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Ra和Rb在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Ra和Rb在其所连接的原子之间形成C1-C4亚烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Ra和Rb在其所连接的原子之间形成C1亚烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Ra和Rb在其所连接的原子之间形成C2亚烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Ra和Rb在其所连接的原子之间形成C3亚烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Ra和Rb在其所连接的原子之间形成C4亚烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Ra和Re在其所连接的原子之间形成C1-C2亚烷基,其中所述C1-C2亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Ra和Re在其所连接的原子之间形成C1亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Ra和Re在其所连接的原子之间形成C2亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Ra和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Ra和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Rb、Rc、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Ra和Rg在其所连接的原子之间形成C1亚烷基;并且Rb、Rc、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Ra和Rg在其所连接的原子之间形成C2亚烷基;并且Rb、Rc、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Ra和Rg在其所连接的原子之间形成C3亚烷基;并且Rb、Rc、Rd、Re、Rf和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Rb和Rc在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Rc在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Rc在其所连接的原子之间形成C1亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Rc在其所连接的原子之间形成C2亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Rc在其所连接的原子之间形成C3亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Rc在其所连接的原子之间形成C4亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Rb和Re在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Rb和Re在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rc、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Re在其所连接的原子之间形成C1亚烷基;并且Ra、Rc、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Re在其所连接的原子之间形成C2亚烷基;并且Ra、Rc、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Rb和Re在其所连接的原子之间形成C3亚烷基;并且Ra、Rc、Rd、Rf、Rg和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Rb和Rg在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Rb和Rg在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rb和Rg在其所连接的原子之间形成C1亚烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rb和Rg在其所连接的原子之间形成C2亚烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rb和Rg在其所连接的原子之间形成C3亚烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rb和Rg在其所连接的原子之间形成C4亚烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成3元环烷基或4元杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成3-6元环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成3元环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成4元环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成5元环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成6元环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成3-6元杂环烷基环;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成3-6元杂环烷基环,其中所述3-6元杂环烷基环含有O、S或NH;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成3元杂环烷基环;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成4元杂环烷基环;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成氧杂环丁烷环;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成5元杂环烷基环;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd与其所连接的原子一起形成6元杂环烷基环;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Rd一起形成=O。在一些实施方式中,Rc和Rd一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Rc和Re在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Rc和Re在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Re在其所连接的原子之间形成C1亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Re在其所连接的原子之间形成C2亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Re在其所连接的原子之间形成C3亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢。在一些实施方式中,Rc和Re在其所连接的原子之间形成C4亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Rc和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rc和Rg在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rc和Rg在其所连接的原子之间形成C1亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rc和Rg在其所连接的原子之间形成C2亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢。在一些实施方式中,Rc和Rg在其所连接的原子之间形成C3亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成3-6元环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成3元环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成4元环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成5元环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成6元环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成3-6元杂环烷基环;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成3-6元杂环烷基环,其中所述3-6元杂环烷基环含有O、S或NH;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成3元杂环烷基环;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成4元杂环烷基环;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成氧杂环丁烷环;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成5元杂环烷基环;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf与其所连接的原子一起形成6元杂环烷基环;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。在一些实施方式中,Re和Rf在一起形成=O。在一些实施方式中,Re和Rf在一起形成=O;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Re和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Re和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自为氢。在一些实施方式中,Re和Rg在其所连接的原子之间形成C1亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自为氢。在一些实施方式中,Re和Rg在其所连接的原子之间形成C2亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自为氢。在一些实施方式中,Re和Rg在其所连接的原子之间形成C3亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Rg和Rh与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基。在一些实施方式中,Rg和Rh与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成3-6元环烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成3元环烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成4元环烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成5元环烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成6元环烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成3-6元杂环烷基环;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成3-6元杂环烷基环,其中所述3-6元杂环烷基环含有O、S或NH;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成3元杂环烷基环;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成4元杂环烷基环;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成氧杂环丁烷环;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成5元杂环烷基环;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh与其所连接的原子一起形成6元杂环烷基环;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。在一些实施方式中,Rg和Rh在一起形成=O。在一些实施方式中,Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基,其中所述C1-C2亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢;或
(vii)Rc和Rd与其所连接的原子一起形成3元环烷基或4元杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢;或
(ix)Rc和Re在其所连接的原子之间形成C1亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢;或
(x)Rc和Rg在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢;或
(xi)Re和Rf与其所连接的原子一起形成4元杂环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢;或
(xiii)Re和Rg在其所连接的原子之间形成C2亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf和Rg各自为氢;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Re、Rd、Rf和Rg各自为氢;或
(vii)Rc和Rd与其所连接的原子一起形成3元环烷基;并且Ra、Rb、Re、Rf和Rg各自为氢;或
(x)Rc和Rg在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Rb、Rd、Re和Rf各自为氢;或
(xi)Re和Rf与其所连接的原子一起形成4元杂环烷基;并且Ra、Rb、Rc、Rd和Rg各自为氢;或
(xiii)Re和Rg在其所连接的原子之间形成C2亚烷基;并且Ra、Rb、Rc、Rd和Rf各自独立地为氢。
在一些实施方式中,本公开涉及一种式(I)、(I-A)、(I-B)、(I-C)、(I-D)、(I-E)或(I-M)化合物或其药学上可接受的盐,其中选自: 在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为在一些实施方式中,为
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X1为C或N。在一些实施方式中,X1为C。在一些实施方式中,X1为N。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X2在化合价允许时,为CH、CR1、O、S、N、NH或NR1。在一些实施方式中,X2为CH。在一些实施方式中,X2为CR1。在一些实施方式中,X2为O。在一些实施方式中,X2为S。在一些实施方式中,X2为N。在一些实施方式中,X2为NH。在一些实施方式中,X2为NR1。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X3在化合价允许时,为CH、CR1、O、S、N、NH或NR1。在一些实施方式中,X3为CH。在一些实施方式中,X3为CR1。在一些实施方式中,X3为O。在一些实施方式中,X3为S。在一些实施方式中,X3为N。在一些实施方式中,X3为NH。在一些实施方式中,X3为NR1。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X4为C或N。在一些实施方式中,X4为C。在一些实施方式中,X4为N。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X5在化合价允许时,为键、CH、CR1、O、S、N、NH或NR1。在一些实施方式中,X5为键。在一些实施方式中,X5为CH。在一些实施方式中,X5为CR1。在一些实施方式中,X5为O。在一些实施方式中,X5为S。在一些实施方式中,X5为N。在一些实施方式中,X5为NH。在一些实施方式中,X5为NR1。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X6在化合价允许时,为CH、CR1、O、S、N、NH或NR1。在一些实施方式中,X6为CH。在一些实施方式中,X6为CR1。在一些实施方式中,X6为O。在一些实施方式中,X6为S。在一些实施方式中,X6为N。在一些实施方式中,X6为NH。在一些实施方式中,X6为NR1。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X1为C;X2为N;X3为NH;X4为C;X5为键;并且X6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X1为C;X2为N;X3为CH;X4为C;X5为键;并且X6为S。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)、(I-L-2)、(I-M)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中X1为C;X2为CH;X3为CH;X4为C;X5为CH;并且X6为C。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C或N。在一些实施方式中,Y1为C。在一些实施方式中,Y1为N。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y2为C或N。在一些实施方式中,Y2为C。在一些实施方式中,Y2为N。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y3在化合价允许时,为CH、CR2、O、S、N、NH或NR2。在一些实施方式中,Y3为CH。在一些实施方式中,Y3为CR2。在一些实施方式中,Y3为O。在一些实施方式中,Y3为S。在一些实施方式中,Y3为N。在一些实施方式中,Y3为NH。在一些实施方式中,Y3为NR2。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y4在化合价允许时,为键、CH、CR2、O、S、N、NH或NR2。在一些实施方式中,Y4为键。在一些实施方式中,Y4为CH。在一些实施方式中,Y4为CR2。在一些实施方式中,Y4为O。在一些实施方式中,Y4为S。在一些实施方式中,Y4为N。在一些实施方式中,Y4为NH。在一些实施方式中,Y4为NR2。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y5在化合价允许时,为CH、CR2、O、S、N、NH或NR2。在一些实施方式中,Y5为CH。在一些实施方式中,Y5为CR2。在一些实施方式中,Y5为O。在一些实施方式中,Y5为S。在一些实施方式中,Y5为N。在一些实施方式中,Y5为NH。在一些实施方式中,Y5为NR2。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y6在化合价允许时,为CH、CR2、O、S、N、NH或NR2。在一些实施方式中,Y6为CH。在一些实施方式中,Y6为CR2。在一些实施方式中,Y6为O。在一些实施方式中,Y6为S。在一些实施方式中,Y6为N。在一些实施方式中,Y6为NH。在一些实施方式中,Y6为NR2。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为CH;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CR2;Y4为CH;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为CR2;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为CH;Y5为CR2;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为N;Y4为CH;Y5为CH;并且Y6为CR2。在一些实施方式中,本公开涉及一种式(I-A)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为N;Y4为CH;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为N;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为CH;Y5为N;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-A)、(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-F-1)、(I-F-2)、(I-G-1)、(I-G-2)、(I-H-1)、(I-H-2)、(I-J-1)、(I-J-2)、(I-K-1)、(I-K-2)、(I-L-1)或(I-L-2)化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为CH;Y5为CH;并且Y6为N。
在一些实施方式中,本公开涉及一种式(I-A-1)、(I-A-2)、(I-A-3)、(I-A-4)、(I-B-1)、(I-B-2)、(I-B-3)、(I-B-4)、(I-C-1)、(I-C-2)、(I-C-3)、(I-C-4)、(I-M-1)、(I-M-2)、(I-M-3)或(I-M-4)化合物或其药学上可接受的盐,其中Rj、Rk、Rm、Rn、Ro、Rp、Rq和Rr在存在时各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。在一些实施方式中,Rj、Rk、Rm、Rn、Ro、Rp、Rq和Rr在存在时各自为氢。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中X1为C;X2为N;X3为NH;X4为C;并且X6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中X1为C;X2为N;X3为CH;X4为C;并且X6为S。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为CH;Y4为CH;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)或其药学上可接受的盐,其中Y3为CR2;Y4为CH;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为CH;Y4为CR2;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为CH;Y4为CH;Y5为CR2;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为CH;Y4为CH;Y5为CH;并且Y6为CR2。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为N;Y4为CH;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为CH;Y4为N;Y5为CH;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为CH;Y4为CH;Y5为N;并且Y6为CH。
在一些实施方式中,本公开涉及一种式(I-B)、(I-B-1)、(I-B-2)、(I-B-3)或(I-B-4)化合物或其药学上可接受的盐,其中Y3为CH;Y4为CH;Y5为CH;并且Y6为N。
在一些实施方式中,本公开涉及一种本文所提供的化合物或其药学上可接受的盐,其为如实施例1中所述的泛素-罗丹明110测定所测量,具有≤1μM并且>0.001μM的IC50值的USP30抑制剂化合物。
在另一方面,本公开涉及一种选自表1的化合物,或其药学上可接受的盐。表1中所列的每对化合物(即化合物1-a和1-b,化合物2-a和2-b等)以外消旋混合物形式获得,并且随后根据实施例2,步骤7中所述的程序通过手性HPLC或类似方法分离,获得基本上对映异构纯的独立化合物。对于每对化合物,第一化合物(即,化合物1-a,2-a等)为第一洗脱异构体,并且第二化合物(即,化合物1-b,2-b等)为第二洗脱异构体。立体化学描述词反映每种化合物的相对立体化学。每种化合物的绝对立体化学为任意指配的。在一些实施方式中,选自表1的化合物或其药学上可接受的盐以外消旋混合物形式存在。在一些实施方式中,选自表1的化合物或其药学上可接受的盐以基本上对映异构纯形式存在。
表1.本公开的化合物
在另一方面,本公开涉及一种选自表2的化合物,或其药学上可接受的盐。在一些实施方式中,化合物或其药学上可接受的盐以与其对映异构体的外消旋混合物形式存在。在一些实施方式中,化合物或其药学上可接受的盐以基本上对映异构纯形式存在。
在另一方面,本公开涉及选自表2的化合物的对映异构体,或其药学上可接受的盐。在一些实施方式中,对映异构体或其药学上可接受的盐以外消旋混合物形式存在。在一些实施方式中,对映异构体或其药学上可接受的盐以基本上对映异构纯形式存在。
表2.本公开的化合物
在一些实施方式中,本文所述的化合物以非盐形式提供。在一些实施方式中,本文所述的化合物以药学上可接受的盐形式提供。
在另一方面,本公开涉及一种通过包括以下的方法制备的化合物或其药学上可接受的盐:制备呈立体异构体的混合物形式的本公开化合物;根据实施例2,步骤7中所述的程序通过手性HPLC分离立体异构体;分离出一种或多种立体异构体,其为如实施例1中所述的泛素-罗丹明110测定所测量,IC50值≤1μM的USP30抑制剂化合物;并且任选地用酸或碱处理所分离的立体异构体,得到其药学上可接受的盐。
在一些实施方式中,化合物为第1洗脱异构体。在一些实施方式中,化合物为第2洗脱异构体。在一些实施方式中,化合物为第3洗脱异构体。在一些实施方式中,化合物为第4洗脱异构体。在一些实施方式中,化合物为第5、第6、第7或第8洗脱异构体。
在一些实施方式中,本公开化合物或其药学上可接受的盐为如实施例1中所述的泛素-罗丹明110测定所测量,IC50值≤1μM的USP30抑制剂化合物。在一些实施方式中,IC50值≤0.1μM。
药物组合物和施药途径
本公开还涉及一种药物组合物,其包括本文所提供的一种或多种化合物,或其药学上可接受的盐,和药学上可接受的载剂。在一些实施方式中,药物组合物包含治疗有效量的一种或多种化合物或其药学上可接受的盐。在一些实施方式中,药物组合物供用于治疗诸如帕金森氏病的神经退行性病症的方法中。
本文中所公开的化合物和药学上可接受的盐可以根据常规医药实践经由用于治疗剂的任何施药模式来施用。在一些实施方式中,本文所报告的药物组合物可以单位剂型提供。在一些实施方式中,本文所报告的药物组合物可以口服剂型提供。在一些实施方式中,本文所述的药物组合物可以如锭剂、胶囊、粉剂或扁囊剂的固体口服剂型提供。
本文所述的药物组合物可以根据常规混合、粒化或包衣方法制备。举例来说,口服剂型(例如锭剂)可以通过干式掺合或干式粒化来制备。按重量或体积计,本文所述的药物组合物可含有约0.1%至约99%、约5%至约90%或约1%至约20%的化合物或药学上可接受的盐。本文所述的药物组合物中所采用的药学上可接受的载剂可包含一种或多种药物赋形剂,如填充剂、崩解剂、润滑剂、助流剂、抗粘着剂、抗静电剂、表面活性剂或稳定添加剂。适合的固体载剂为所属领域中已知的,例如碳酸镁、硬脂酸镁、滑石、糖或乳糖。在一些药物的情况下,此类添加剂的存在促进药剂在溶液中的稳定性和分散性。稳定添加剂的适合但非限制性实施例包括阿拉伯胶、明胶、甲基纤维素、聚乙二醇、羧酸和其盐以及聚赖氨酸。在一些实施方式中,稳定化添加剂为阿拉伯胶、明胶和甲基纤维素。各种组合物的药学上可接受的载剂和制造方法的实施例可见于A.Gennaro(编),《雷明顿氏药物科学(Remington'sPharmaceutical Sciences)》,第18版,(1990),马克出版公司(Mack Publishing Co.),宾夕法尼亚州伊斯顿(Easton,Pa.)中。
本文所述的药物组合物可含有呈基本上纯形式的化合物或药学上可接受的盐,如至少60%纯,更适合地至少75%纯,优选至少85%纯并且最优选至少98%纯(w/w)。
本文所述的化合物和药学上可接受的盐优选地以治疗有效量(例如具有适合的有利治疗指数的量)施用。施用量和施用频率将根据以下调节:考虑到如患者的年龄、性别、条件和身材以及所治疗的医学病况的严重程度等因素的主治临床医师的判断;施药途径;患者的肾功能或肝功能;以及所采用的具体化合物或药学上可接受的盐。所属领域的一般技术人员的医师或兽医可以容易地对预防、对抗或阻止病况进展所需的药物的有效量进行确定并开处。为方便起见,必要时,总日剂量可以分开并且在一天当中逐份施用。
本文中所公开的化合物的用途
本公开还提供式(I)化合物的用途。式(I)化合物适用于医药。举例来说,本文所述的化合物和组合物为USP30抑制剂。不希望受任何特定理论所束缚,此类USP30抑制可以提供与USP30活性相关的疾病或病况的症状和/或潜在病因的治疗。在一些实施方式中,USP30抑制剂可用于治疗神经退行性和神经疾病或病况,如帕金森氏病。
本文提供治疗与泛素特异性蛋白酶(例如USP30)相关的疾病或病症的方法,其包括向有需要的患者施用治疗有效量的本文中所提供的化合物或组合物。在一些实施方式中,与泛素特异性蛋白酶(例如USP30)相关的疾病或病症为神经退行性疾病或病症(例如帕金森氏病)。
本公开还提供在有需要的患者中抑制泛素特异性蛋白酶(例如USP30)的方法,其包括向所述患者施用治疗有效量的本文中所提供的化合物或组合物。
本公开还提供治疗有需要的患者的神经退行性疾病或病症(例如帕金森氏病)的方法,其包括向所述患者施用治疗有效量的本文中所提供的化合物或组合物。
本公开还提供供用于在有需要的患者中抑制泛素特异性蛋白酶(例如USP30)的方法中的化合物。在一些实施方式中,本公开提供供用于治疗有需要的患者的神经退行性疾病或病症(例如帕金森氏病)的方法中的化合物。
本文中所公开的化合物的合成
本文中所公开的化合物和药学上可接受的盐可通过如部分地通过以下合成流程所阐述的有机合成领域中已知的方法制备。在下文所描述的流程中,应理解,根据化学方法的通用原理,必要时采用敏感性或反应性基团的保护基。根据有机合成的标准方法来操控保护基(T.W.Greene和P.G.M.Wuts,《有机合成中的保护基(Protective Groups inOrganic Synthesis)》,第三版,威立(Wiley),纽约1999)。这些基团在化合物合成的适宜阶段使用对所属领域的技术人员来说显而易见的方法去除。
一般来说,式(I)化合物可通过流程1中概述的方法、通过实施例2-4中所论述的具体程序和/或通过所属领域的技术人员另外已知的方法合成。流程1中所述的用于合成的起始物质为可商购的或可通过所属领域的技术人员已知的方法制备。
流程1.式I化合物的合成
(i)交叉偶联催化剂(例如XPhos-Pd)、碱(例如K3PO4)、溶剂(例如二噁烷、H2O)(X为离去基,例如Br;R为烷基,例如Me);(ii)碱(例如LiOH)、溶剂(例如THF、H2O);(iii)酰胺偶联剂(例如HATU)、碱(例如DIEA)、溶剂(例如DMF)(P为保护基,例如Boc);(iv)去保护条件(例如酸,例如CF3COOH)、溶剂(例如CH2Cl2);(v)氰化剂(例如BrCN)、碱(例如NaHCO3)。
示例性实施方式
以下编号的实施方式虽然是非限制性的,但例示本公开的某些方面:
1.一种式(I)化合物:
或其药学上可接受的盐,其中:
Ar1为亚苯基或5-6元亚杂芳基,其中所述亚苯基或亚杂芳基被m个R1基团取代;并且
Ar2为亚苯基或5-6元亚杂芳基,其中所述亚苯基或亚杂芳基被n个R2基团取代;
L为-O-、-S-、-NR3-、-C(R4)2-、-S(O)2-或-S(O)-;
M为3-6元环烷基、苯基或5-6元杂芳基,其中所述环烷基、苯基或杂芳基被p个R5基团取代;
R1、R2和R5在每次出现时独立地为卤基、氰基、NO2、氧代基、羟基、-R6、-OR6、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、-C1-C6亚烷基-R6、C1-C6烷氧基、C1-C6卤代烷氧基、-C0-C3亚烷基-NR6R7、-C0-C3亚烷基-NR7R8、-C0-C3亚烷基-C(O)NR6R7、-C0-C3亚烷基-C(O)NR7R8、-C0-C3亚烷基-NR7C(O)R6、-C0-C3亚烷基-NR7C(O)R8、-C0-C3亚烷基-NR7S(O)2R6、-C0-C3亚烷基-C(O)R6、-C0-C3亚烷基-C(O)R7、-C0-C3亚烷基-SR6、-C0-C3亚烷基-S(O)R6、-C0-C3亚烷基-S(O)2R6、-C0-C3亚烷基-S(O)2R7、-C0-C3亚烷基-S(O)2NR6R7、-C0-C3亚烷基-S(O)2NR7R8、-C0-C3亚烷基-NR7C(O)NR8R9、-C0-C3亚烷基-NR7S(O)2NR8R9、-C0-C3亚烷基-C(O)OR7、-C0-C3亚烷基-C(O)OR6、-C0-C3亚烷基-OC(O)R7、-C0-C3亚烷基-OC(O)R6、-C0-C3亚烷基-NR7C(O)OR8或-C0-C3亚烷基-NR7S(O)2R8;
R3为H、C1-C6烷基或C1-C6卤代烷基;
每个R4独立地为H、C1-C6烷基、C1-C6卤代烷基,或两个R4基团与其所连接的碳原子一起形成3-6元环烷基或杂环烷基;
每个R6独立地为5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基,其中所述杂芳基、杂环烷基、芳基或环烷基任选地被独立地选自下组的1-5个取代基取代:卤基、氧代基、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、C1-C6烷氧基、C1-C6卤代烷氧基、C2-C6烯基、C2-C6炔基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基、3-8元环烷基、-NR10C(O)NR11R12、-NR10R11、-C(O)R10、-NR10C(O)R11、-NR10C(O)OR11、-S(O)2R10、-C(O)NR10R11、-C(O)OR10、-S(O)2NR10R11、-NR10S(O)2R11、-OR10、-OC(O)R10、-OS(O)2R10、-OC(O)NR10R11、-OC(O)OR10、-OS(O)2NR10R11、-C(O)R10、-C(O)NR10C(O)NR11R12、-C(O)NR10R11、-C(O)C(O)R10、-C(O)NR10C(O)R11、-C(O)NR10C(O)OR11、-C(O)S(O)2R10、-C(O)C(O)NR10R11、-C(O)C(O)OR10、-C(O)S(O)2NR10R11、-C(O)NR10S(O)2R11、-C1-C6亚烷基-R10、-C1-C6亚烷基-NR10C(O)NR11R12、-C1-C6亚烷基-NR10R11、-C1-C6亚烷基-C(O)R10、-C1-C6亚烷基-NR10C(O)R11、-C1-C6亚烷基-NR10C(O)OR11、-C1-C6亚烷基-S(O)2R10、-C1-C6亚烷基-C(O)NR10R11、-C1-C6亚烷基-C(O)OR10、-C1-C6亚烷基-S(O)2NR10R11、-C1-C6亚烷基-NR10S(O)2R11、-C1-C6亚烯基-R10、-C1-C6亚烯基-NR10C(O)NR11R12、-C1-C6亚烯基-NR10R11、-C1-C6亚烯基-C(O)R10、-C1-C6亚烯基-NR10C(O)R11、-C1-C6亚烯基-NR10C(O)OR11、-C1-C6亚烯基-S(O)2R10、-C1-C6亚烯基-C(O)NR10R11、-C1-C6亚烯基-C(O)OR10、-C1-C6亚烯基-S(O)2NR10R11和-C1-C6亚烯基-NR10S(O)2R11;
每个R7、R8和R9独立地为氢或C1-C6烷基;
每个R10、R11和R12独立地为氢、C1-C6烷基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基;
m为0-4;
n为0-4;
p为0-4;
Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(i)Ra和Rb在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基,其中所述C1-C2亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iii)Ra和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(v)Rb和Re在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vi)Rb和Rg在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xii)Re和Rf在一起形成=O;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiv)Rg和Rh与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
2.根据实施方式1所述的化合物或其药学上可接受的盐,其中Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
3.根据实施方式1所述的化合物或其药学上可接受的盐,其中Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
4.根据实施方式1所述的化合物或其药学上可接受的盐,其中Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
5.根据实施方式1所述的化合物,其中所述化合物具有式(I-A):
或其药学上可接受的盐,其中:
X1为C或N;
X2为CH、CR1、O、S、N、NH或NR1;
X3为CH、CR1、O、S、N、NH或NR1;
X4为C或N;
X5为键、CH、CR1、O、S、N、NH或NR1;
X6为CH、CR1、O、S、N、NH或NR1;
Y1为C或N;
Y2为C或N;
Y3为CH、CR2、O、S、N、NH或NR2;
Y4为键、CH、CR2、O、S、N、NH或NR2;
Y5为CH、CR2、O、S、N、NH或NR2;
Y6为CH、CR2、O、S、N、NH或NR2;
Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基,其中所述C1-C2亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
6.根据实施方式5所述的化合物或其药学上可接受的盐,其中Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
7.根据实施方式5所述的化合物或其药学上可接受的盐,其中Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
8.根据实施方式5所述的化合物或其药学上可接受的盐,其中Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
9.根据实施方式5至8中任一项所述的化合物或其药学上可接受的盐,其中X1为C;X2为N;X3为NH;X4为C;X5为键;并且X6为CH。
10.根据实施方式5至9中任一项所述的化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为CH;Y5为CH;并且Y6为CH。
11.根据实施方式5至10中任一项所述的化合物或其药学上可接受的盐,其中L为O。
12.根据实施方式5至11中任一项所述的化合物或其药学上可接受的盐,其中M为被p个R5基团取代的苯基。
13.根据实施方式1所述的化合物,其中所述化合物具有式(I-B):
或其药学上可接受的盐,其中:
X1为C或N;
X2为CH、CR1、O、S、N、NH或NR1;
X3为CH、CR1、O、S、N、NH或NR1;
X4为C或N;
X6为CH、CR1、O、S、N、NH或NR1;
Y3为CH、CR2或N;
Y4为CH、CR2或N;
Y5为CH、CR2或N;
Y6为CH、CR2或N;
Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基,其中所述C1-C2亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
14.根据实施方式13所述的化合物或其药学上可接受的盐,其中Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
15.根据实施方式13所述的化合物或其药学上可接受的盐,其中Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
16.根据实施方式13所述的化合物或其药学上可接受的盐,其中Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基。
17.根据实施方式13至16中任一项所述的化合物或其药学上可接受的盐,其中X1为C;X2为N;X3为NH;X4为C;并且X6为CH。
18.根据实施方式13至17中任一项所述的化合物或其药学上可接受的盐,其中Y1为C;Y2为C;Y3为CH;Y4为CH;Y5为CH;且Y6为CH。
19.根据实施方式13至18中任一项所述的化合物或其药学上可接受的盐,其中L为O。
20.根据实施方式13至19中任一项所述的化合物或其药学上可接受的盐,其中M为被p个R5基团取代的苯基。
21.根据实施方式1所述的化合物,其中所述化合物具有式(I-C):
或其药学上可接受的盐,其中:
Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。
22.根据实施方式21所述的化合物或其药学上可接受的盐,其中Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢;或
(vii)Rc和Rd与其所连接的原子一起形成3元环烷基或4元杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢;或
(ix)Rc和Re在其所连接的原子之间形成C1亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢;或
(x)Rc和Rg在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢;或
(xi)Re和Rf与其所连接的原子一起形成4元杂环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢;或
(xiii)Re和Rg在其所连接的原子之间形成C2亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自为氢。
23.根据实施方式22所述的化合物或其药学上可接受的盐,其中Rc和Rg在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢。
24.根据实施方式22所述的化合物或其药学上可接受的盐,其中Rb和Rc在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。
25.根据实施方式22所述的化合物或其药学上可接受的盐,其中Rc和Rd与其所连接的原子一起形成3元环烷基或4元杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。
26.根据实施方式21至25中任一项所述的化合物或其药学上可接受的盐,其中n和p为0。
27.根据实施方式1所述的化合物或其药学上可接受的盐,其中所述化合物选自表1。
28.根据实施方式1所述的化合物或其药学上可接受的盐,其中所述化合物选自表2。
29.根据实施方式1至28中任一项所述的化合物或其药学上可接受的盐,其为如实施例1中所述的泛素-罗丹明110测定所测量,IC50值≤1μM的USP30抑制剂化合物。
30.根据实施方式29所述的化合物或其药学上可接受的盐,其中所述IC50值≤0.1μM。
31.一种式(I-C)化合物
或其药学上可接受的盐,其为如实施例1中所述的泛素-罗丹明110测定所测量,IC50值≤1μM并且>0.001μM的USP30抑制剂化合物,其中:
R2和R5在每次出现时独立地为卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基;
n为0-4;
p为0-4;
Rh为氢;
Ra、Rb、Rc、Rd、Re、Rf和Rg定义如下:
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf和Rg各自为氢;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Re、Rd、Rf和Rg各自为氢;或
(vii)Rc和Rd与其所连接的原子一起形成3元环烷基;并且Ra、Rb、Re、Rf和Rg各自为氢;或
(x)Rc和Rg在其所连接的原子之间形成C1-C2亚烷基;并且Ra、Rb、Rd、Re和Rf各自为氢;或
(xi)Re和Rf与其所连接的原子一起形成4元杂环烷基;并且Ra、Rb、Rc、Rd和Rg各自为氢;或
(xiii)Re和Rg在其所连接的原子之间形成C2亚烷基;并且Ra、Rb、Rc、Rd和Rf各自独立地为氢。
32.根据实施方式31所述的化合物或其药学上可接受的盐,其中所述化合物具有下式
33.根据实施方式31所述的化合物或其药学上可接受的盐,其中所述化合物具有下式
34.根据实施方式31所述的化合物或其药学上可接受的盐,其中所述化合物具有下式
35.根据实施方式31所述的化合物或其药学上可接受的盐,其中所述化合物具有下式
36.根据实施方式31至35中任一项所述的化合物或其药学上可接受的盐,其中n和p为0。
37.一种药物组合物,其包括根据实施方式1至36中任一项所述的化合物,或其药学上可接受的盐,和药学上可接受的载剂。
38.一种在有需要的患者中抑制泛素特异性蛋白酶的方法,其包括向所述患者施用治疗有效量的根据实施方式1至36中任一项所述的化合物或其药学上可接受的盐,或根据实施方式37所述的药物组合物。
39.根据实施方式38所述的方法,其中所述泛素特异性蛋白酶为USP30。
40.一种治疗有需要的患者的神经退行性病症的方法,其包括向所述患者施用治疗有效量的根据实施方式1至36中任一项所述的化合物或其药学上可接受的盐,或根据实施方式37所述的药物组合物。
41.根据实施方式40所述的方法,其中所述神经退行性病症为帕金森氏病。
42.根据实施方式1至36中任一项所述的化合物或其药学上可接受的盐,其供用于在有需要的患者中抑制泛素特异性蛋白酶的方法中。
43.根据实施方式42所述的化合物或药学上可接受的盐,其中所述泛素特异性蛋白酶为USP30。
44.根据实施方式1至36中任一项所述的化合物或其药学上可接受的盐,其供用于治疗有需要的患者的神经退行性病症的方法中。
45.根据实施方式44所述的化合物或药学上可接受的盐,其中所述神经退行性病症为帕金森氏病。
46.一种USP30抑制剂化合物,其具有下式:
或其药学上可接受的盐,其中:
R2和R5在每次出现时独立地为卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基或C1-C6羟烷基;
n为0-4;
p为0-4。
47.根据实施方式1至36或44至46中任一项所述的化合物,其具有如实施例1中所述的泛素-罗丹明110测定所测量,≤0.5μM并且>0.001μM的IC50值。
48.根据实施方式47所述的化合物,其具有如实施例1中所述的泛素-罗丹明110测定所测量,≤0.1μM并且>0.001μM的IC50值。
49.一种如本文所公开和提供的USP30抑制剂化合物。
50.根据实施方式49所述的USP30抑制剂化合物,其具有如实施例1中所述的泛素-罗丹明110测定所测量,≤1μM并且>0.001μM的IC50值。
实施例
通用方法
所用的所有溶剂均为可商购的并且无需进一步纯化即可使用。反应通常在氮气惰性气氛下使用无水溶剂运作。
使用Bruker Plus 400NMR光谱仪记录质子NMR光谱。氘化溶剂(DMSO-d6)通常含有0.03%至0.05%v/v四甲基硅烷,其用作参考信号(对于1H,设置在δ0.00处)。
LCMS分析在由UFLC 20-AD和LCMS 2020MS检测器组成的SHIMADZU LCMS上进行。所用柱为Shim-pack XR-ODS,2.2μm,3.0×50mm。仪器使用反相条件(乙腈/水,含有0.05%氨)。
缩写
除非另外指出,或在上下文另外规定的情况下,以下缩写应理解为具有以下含义:
δ 化学位移
ACN 乙腈
DIEA N,N-二异丙基乙胺
DMF N,N-二甲基甲酰胺
DCM 二氯甲烷或氯化甲烷
h 小时
1H NMR 质子核磁共振
HATU 六氟磷酸2-(3H-[1,2,3]三唑并[4,5-b]吡啶-3-基)-1,1,3,3-四甲基脲鎓
HPLC 高效液相色谱
Hz 赫兹
LCMS 液相色谱/质谱
min 分钟
MS 质谱
ppm 百万分率
RT 滞留时间
SEMCl 2-氯甲基2-(三甲基硅烷基)乙醚
TFA 三氟乙酸
THF 四氢呋喃
XPhos-Pd 氯(2-二环己基膦基-2′,4′,6′-三异丙基-1,1′-联苯)[2-(2′-氨基-1,1′-联苯)]钯(II)
XPhos-Pd-G3 甲磺酸(2-二环己基膦基-2′,4′,6′-三异丙基-1,1′-联苯)[2-(2′-氨基-1,1′-联苯)]钯(II)
实施例1:针对USP30活性的泛素-罗丹明110测定
在最终体积为9μL的测定缓冲液中进行测定,所述缓冲液含有20mM Tris-HCl(pH8.0,(1M Tris-HCl,pH 8.0溶液;Corning 46-031-CM))、1mM GSH(还原的L-谷胱甘肽,西格玛-奥德里奇(Sigma-Aldrich),G4251-100G)、0.03%BGG(0.22μM经过滤,西格玛(Sigma),G7516-25G)和0.01%Triton X-100(西格玛,T9284-10L)。将DMSO中的纳升量的10点、3倍连续稀释液预分配到1536测定板(康宁(Corning),#3724BC)中,使得最终测试浓度为25μM至1.3nM(分别为最高到最低剂量)。针对最大信号:背景优化浓度和培育时间,同时维持固定底物浓度下的初始速度条件。测定中的USP30(人类重组USP30,Boston Biochem,目录号E-582)的最终浓度为0.2nM。最终底物(Ub-Rh110;泛素-罗丹明110,UbiQ-126)浓度为25nM,[Ub-Rh110]<<Km。将3μL 2×USP30添加到测定板(用化合物预标印)中,预培育30分钟,并随后用3μL 2×Ub-Rh110处理。将板在室温下培育30分钟,之后添加3μL终止液(最终浓度为10mM柠檬酸(西格玛,251275-500G))。荧光在Envision(在485nm下激发并在535nm下发射;珀金埃尔默(Perkin Elmer))上或PheraSTAR(在485nm下激发并在535nm下发射;BMGLabtech)荧光读取器上读取。
对于所有测定模式,均基于以下方程式将数据报告为相比于对照孔的抑制%:%inh=1-((FLU-AveLow)/(AveHigh-AveLow)),其中FLU=测量的荧光,AveLow=无酶对照(n=16)的平均荧光,并且AveHigh=DMSO对照(n=16)的平均荧光。IC50值通过包含于Activity Base软件包:IDBS XE Designer Model205中所包括的标准4参数逻辑拟合算法的曲线拟合来测定。使用莱文贝格-马夸特(Levenburg Marquardt)算法拟合数据。
本文所述的化合物的所计算的IC50值报告于表3中,其中A表示<0.1μM的IC50,B表示0.1至1.0M的IC50,并且C表示>1.0μM的IC50。如果IC50≤1μM,那么USP30生物化学测定中的化合物被认为具有活性。
表3.泛素-罗丹明110测定中化合物的IC50值
| 化合物 | IC<sub>50</sub>(μM) |
| 1-a | B |
| 1b | A |
| 2-a | A |
| 2-b | C |
| 3-a | B |
| 3-b | A |
| 4-a | B |
| 4-b | B |
| 5-a | A |
| 5-b | B |
| 6-a | A |
| 6-b | B |
| 7-a | A |
| 7-b | B |
| 8-a | B |
| 8-b | B |
| 9-a | C |
| 9-b | C |
| 13-a | A |
| 13-b | A |
| 20-a | A |
| 20-b | A |
实施例2:(1S,5R)-2-(5-(2-苯氧基苯基)-1H-吡唑-3-羰基)-2,6-二氮杂双环
[3.2.1]辛烷-6-甲腈(1-a)和(1R,5S)-2-(5-(2-苯氧基苯基)-1H-吡唑-3-羰基)-2,6-二氮
杂双环[3.2.1]辛烷-6-甲腈(1-b)的制备
化合物1-a和1-b通过以下途径制备:
步骤1. 5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯
在0℃下在冰/水浴中,将2-氯甲基2-(三甲基硅烷基)乙醚(12.3mL,69.5mmol)添加到5-溴-1H-吡唑-3-甲酸甲酯(5.00g,23.2mmol)和K2CO3(18.0g,130mmol)于DMF(50mL)中的混合物中。在25℃下搅拌所得溶液14h。通过添加水(100mL)来淬灭反应。用乙酸乙酯(3×100mL)萃取所得混合物。将合并的有机层用盐水(100mL)洗涤,经无水硫酸钠干燥,过滤并真空浓缩。通过硅胶色谱(用15:1石油醚/乙酸乙酯洗脱)纯化残余物,获得呈黄色油状的5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(6.20g,79%)。LCMS(ES,m/z)335,337[M+H]+。
步骤2. 5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯
在100℃下在油浴中将5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(6.20g,18.4mmol)、(2-苯氧基苯基)硼酸(4.96g,23.2mmol)、XPhos-Pd(2.90g,3.68mmol)和K3PO4(11.7g,55.2mmol)于二噁烷(120mL)和H2O(24mL)中的溶液搅拌15h。在冷却到25℃之后,滤出固体。真空浓缩过滤物。用水(50mL)稀释残余物。用乙酸乙酯(3×50mL)萃取所得混合物。将合并的有机层经无水硫酸钠干燥,过滤并真空浓缩。通过反相色谱(柱:XBridge Shield RP18 OBD柱,5μm,30×150mm;流动相,A:水(含有10mmol/LNH4HCO3)和B:ACN(5%B到72%,历经20min);检测器:UV:220和254nm)纯化残余物,得到呈黄色固体状的5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(3.20g,41%)。LCMS(ES,m/z)425[M+H]+。
步骤3. 5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸
在50℃下将5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(1.40g,3.30mmol)和LiOH(0.810g,33.8mmol)于THF(60mL)和H2O(15mL)中的溶液搅拌4h。使混合物冷却到25℃并真空浓缩。用3N盐酸将残余物的pH值调整到5至6。通过过滤收集固体并在烘箱中干燥,获得呈灰白色固体状的5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸(1.05g,78%)。LCMS(ES,m/z)411[M+H]+。
步骤4. 2-[5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷-6-甲酸叔丁酯
在25℃下将5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸(150mg,0.366mmol)、HATU(210mg,0.541mmol)、2,6-二氮杂双环[3.2.1]辛烷-6-甲酸叔丁酯(75.0mg,0.346mmol)和DIEA(0.2mL,1.40mmol)于DMF(2mL)中的溶液搅拌3h。通过添加水(10mL)来淬灭反应。用乙酸乙酯(3×20mL)萃取所得混合物。将合并的有机层用盐水(20mL)洗涤,经无水硫酸钠干燥,过滤且减压浓缩。通过硅胶柱色谱(用1/1石油醚/乙酸乙酯洗脱)纯化残余物,得到呈白色固体状的2-[5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷-6-甲酸叔丁酯(100mg,45%)。LCMS(ES,m/z):605[M+H]+。
步骤5. 2-[5-(2-苯氧基苯基)-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷2,2,2-三氟乙酸酯
在25℃下将2-[5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷-6-甲酸叔丁酯(100mg,0.157mmol)和TFA(1mL)于DCM(2mL)中的溶液搅拌2h。真空浓缩所得混合物,得到呈无色油状的2-[5-(2-苯氧基苯基)-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷2,2,2-三氟乙酸酯(110mg,粗物质)。LCMS(ES,m/z):375[M+H]+。
步骤6. 2-[5-(2-苯氧基苯基)-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷-6-甲腈
溴化氰(17.8mg,0.170mmol)添加到2-[5-(2-苯氧基苯基)-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷2,2,2-三氟乙酸酯(80.0mg,0.170mmol)和NaHCO3(82.0mg,0.957mmol)于DMF(2mL)中的0℃混合物中。在25℃下搅拌所得混合物16h。通过添加水(10mL)来淬灭反应。用乙酸乙酯(3×20mL)萃取所得混合物。将合并的有机层经无水硫酸钠干燥,过滤并减压浓缩。通过制备型HPLC(柱:XBridge ShieldRP18 OBD柱,5μm、19×150mm;流动相A:水(含有10mmol/LNH4HCO3)和B:CH3CN(30%至55%,8分钟内);流速:25mL/min;检测器:220nm)纯化残余物,得到呈白色固体状的2-[5-(2-苯氧基苯基)-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷-6-甲腈(40.0mg,59%)。LCMS(ES,m/z):400[M+H]+。
步骤7.(1S,5R)-2-(5-(2-苯氧基苯基)-1H-吡唑-3-羰基)-2,6-二氮杂双环[3.2.1]辛烷-6-甲腈和(1R,5S)-2-(5-(2-苯氧基苯基)-1H-吡唑-3-羰基)-2,6-二氮杂双环[3.2.1]辛烷-6-甲腈
通过手性-HPLC(柱:CHIRALART Cellulose-SB,2×25cm,5μm;流动相A:正己烷和B:EtOH(在15min内保持50%);流速:20mL/min;检测器:254/220nm;RT1:8.911min和RT2:11.119min)分离2-[5-(2-苯氧基苯基)-1H-吡唑-3-羰基]-2,6-二氮杂双环[3.2.1]辛烷-6-甲腈(40.0mg,0.100mmol)。收集第一洗脱异构体(RT1=8.911min)且真空浓缩,随后冻干以获得绝对立体化学被任意指配为(1S,5R)-2-(5-(2-苯氧基苯基)-1H-吡唑-3-羰基)-2,6-二氮杂双环[3.2.1]辛烷-6-甲腈(1-a)的呈白色固体状的化合物(13.8mg,35%)。LCMS(ES,m/z):400[M+H]+;1H-NMR(DMSO-d6,400MHz)δ(ppm):13.63(br s,1H),7.86-7.85(m,1H),7.44-7.29(m,4H),7.13-6.90(m,5H),5.49-5.18(m,1H),4.65-4.31(m,1H),4.18-4.17(m,1H),3.65-3.46(m,3H),3.08-3.03(m,1H),1.86-1.72(m,4H)。收集第二洗脱异构体(RT2=11.119min)且真空浓缩,随后冻干以获得绝对立体化学被任意指配为(1R,5S)-2-(5-(2-苯氧基苯基)-1H-吡唑-3-羰基)-2,6-二氮杂双环[3.2.1]辛烷-6-甲腈(1-b)的呈白色固体状的化合物(14.8mg,37%)。LCMS(ES,m/z):400[M+H]+;1H-NMR(DMSO-d6,400MHz)δ(ppm):13.63(br s,1H),7.88-7.85(m,1H),7.44-7.29(m,4H),7.14-6.90(m,5H),5.48-5.17(m,1H),4.65-4.31(m,1H),4.18-4.17(m,1H),3.65-3.48(m,3H),3.08-3.03(m,1H),1.86-1.72(m,4H)。
表4中所阐述的化合物通过类似于化合物1-a和1-b的制备的方法制备。表4中所列的每对化合物(即化合物2-a和2-b,化合物3-a和3-b等)以外消旋混合物形式获得,并且随后根据实施例2,步骤7中所述的程序通过手性HPLC分离,获得基本上对映异构纯的独立化合物。每种对映异构体对的第一和第二洗脱对映异构体列于表4中。每种对映异构体的绝对立体化学为任意指配的。
表4.通过类似方法制备的另外化合物
实施例3:N-((1R,5S)-3-氰基-3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-
1H-吡唑-3-甲酰胺(6-a)和N-((1S,5R)-3-氰基-3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧
基苯基)-1H-吡唑-3-甲酰胺(6-b)的制备
化合物6-a和6-b通过以下途径制备:
步骤1. 5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯
将2-(三甲基硅烷基)乙氧基甲基氯(12.2mL,68.8mmol)逐滴添加到5-溴-1H-吡唑-3-甲酸甲酯(5.00g,24.5mmol)和碳酸钾(18.0g,130mmol)于DMF(10mL)中的0℃溶液中。在25℃下搅拌所得混合物14h。在0℃下用水(20mL)淬灭反应。用乙酸乙酯(3×30mL)萃取所得混合物。将合并的有机层用盐水(2×100mL)洗涤,经无水硫酸钠干燥,并加以过滤。真空浓缩过滤物。通过硅胶色谱(用15:1石油醚/乙酸乙酯洗脱)纯化残余物,获得呈黄色油状的5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(6.20g,76%)。LCMS(ES,m/z):335,337[M+H]+。
步骤2. 5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯
在100℃下在油浴中将5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(6.20g,18.5mmol)、(2-苯氧基苯基)硼酸(4.96g,23.2mmol)、XPhos-Pd-G3(3.12g,36.9mmol)和磷酸三钾(25.4mg,37.1mmol)于二噁烷(120mL)和水(24mL)中的溶液搅拌15h。将混合物冷却到25℃。真空浓缩所得混合物。用水(30mL)稀释残余物。用乙酸乙酯(3×30mL)萃取所得混合物。将合并的有机层经无水硫酸钠干燥,过滤并浓缩。通过反相色谱(柱:XBridge ShieldRP18 OBD柱,5μm,30×150mm;流动相,A:水(含有0.05%氢铵)和B:乙腈(5%B到72%,历经20min);检测器:UV 220和254nm)纯化残余物,得到呈黄色固体状的5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(3.20g,41%)。LCMS(ES,m/z):425[M+H]+。
步骤3. 5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸
在50℃下将5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(1.40g,3.30mmol)和氢氧化锂(810mg,34.0mmol)于THF(60.0mL)、水(15.0mL)和甲醇(30.0mL)中的溶液搅拌4h。将混合物冷却到25℃并真空浓缩。用3N盐酸水溶液将残余物的pH值调整到3-4。用乙酸乙酯(3×30mL)萃取所得混合物。将合并的有机层用盐水(2×100mL)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过硅胶色谱(用2:1石油醚/乙酸乙酯洗脱)纯化残余物,得到呈灰白色固体状的5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸(1.00g,74%)。LCMS(ES,m/z):411[M+H]+。
步骤4. 1-(5-(2-苯氧基苯基)-1-((2-(三甲基硅烷基)乙氧基)甲基)-1H-吡唑-3-甲酰胺基)-3-氮杂双环[3.2.0]庚烷-3-甲酸叔丁酯
在25℃下将5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸(300mg,0.723mmol)、1-氨基-3-氮杂双环[3.2.0]庚烷-3-甲酸叔丁酯(154mg,0.723mmol)、HATU(275mg,0.723mmol)和N,N-二异丙基乙胺(0.239mL,1.45mmol)于DMF(2mL)中的溶液搅拌40min。用水(5mL)淬灭反应。用乙酸乙酯(3×15mL)萃取所得混合物。将合并的有机层用盐水(2×30mL)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过硅胶色谱(用4:1石油醚/乙酸乙酯洗脱)纯化残余物,得到呈灰白色固体状的1-(5-(2-苯氧基苯基)-1-((2-(三甲基硅烷基)乙氧基)甲基)-1H-吡唑-3-甲酰胺基)-3-氮杂双环[3.2.0]庚烷-3-甲酸叔丁酯(350mg,80%)。LCMS(ES,m/z):605[M+H]+。
步骤5.N-(3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺2,2,2-三氟乙酸酯
在25℃下将1-(5-(2-苯氧基苯基)-1-((2-(三甲基硅烷基)乙氧基)甲基)-1H-吡唑-3-甲酰胺基)-3-氮杂双环[3.2.0]庚烷-3-甲酸叔丁酯(350mg,0.579mmol)于三氟乙酸(1mL)和二氯甲烷(3mL)中的溶液搅拌30min。真空浓缩所得混合物,得到呈棕色油状的N-(3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺2,2,2-三氟乙酸酯(360mg,粗物质)。LCMS(ES,m/z):375[M+H]+。
步骤6.N-((1R,5S)-3-氰基-3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(6-a)和N-((1S,5R)-3-氰基-3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(6-b)
将溴化氰(72.8mg,0.687mmol)逐滴添加到N-(3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺2,2,2-三氟乙酸酯(350mg,0.763mmol)和碳酸氢钠(785mg,9.25mmol)于DMF(2mL)中的0℃溶液中。在25℃下搅拌混合物1h。滤出固体。通过制备型HPLC(柱:XBridge Shield RP18 OBD柱,5μm,30×150mm;流动相,A:水(含有0.05%氢铵)和B:乙腈(35%B到65%,历经7min);检测器:UV 220和254nm)直接纯化过滤物,得到呈白色固体状的N-(3-氰基-3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(70.0mg)。通过手性-HPLC(柱:Chiralpak IG,2*25cm,5μm;流动相,A:MTBE和B:EtOH(在24min内维持15%);流速:20mL/min;检测器:220/254nm)分离这一物质。收集第一洗脱异构体,并且绝对立体化学被任意指配为(1R,5S):呈白色固体状的N-((1R,5S)-3-氰基-3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(RT1=10.9min)(6-a,28.5mg,10%)。LCMS(ES,m/z):400[M+H]+。1H-NMR(DMSO-d6,400MHz)δ(ppm):13.68-13.62(m,1H),8.92-8.61(m,1H),8.03-7.86(m,1H),7.42–7.23(m,4H),7.21-7.12(m,1H),7.03–6.89(m,4H),3.73–3.70(m,1H),3.68–3.56(m,1H),3.39-3.31(m,2H),3.08–3.05(m,1H),2.34-2.31(m,1H),2.20–2.08(m,2H),1.61-1.58(m,1H)。收集第二洗脱异构体,并且绝对立体化学被任意指配为(1S,5R):呈白色固体状的N-((1S,5R)-3-氰基-3-氮杂双环[3.2.0]庚-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(RT2=12.7min)(6-b,20.6mg,8%)。LCMS(ES,m/z):400[M+H]+。1H-NMR(DMSO-d6,400MHz)δ(ppm):13.68-13.62(m,1H),8.92-8.61(m,1H),8.03-7.86(m,1H),7.42–7.29(m,4H),7.21-7.12(m,1H),7.04–6.89(m,4H),3.73–3.70(m,1H),3.68–3.54(m,1H),3.39-3.31(m,2H),3.08–3.05(m,1H),2.34-2.31(m,1H),2.20–2.08(m,2H),1.61-1.58(m,1H)。替代地,第一和第二洗脱异构体的绝对立体化学可被任意地分别指配为(1S,5R)和(1R,5S)。
实施例4:N-((1S,5R)-3-氰基-3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-
1H-吡唑-3-甲酰胺(3-a)和N-((1R,5S)-3-氰基-3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧
基苯基)-1H-吡唑-3-甲酰胺(3-b)的制备
化合物3-a和3-b通过以下途径制备:
步骤1. 5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯
将2-(三甲基硅烷基)乙氧基甲基氯(12.2mL,68.8mmol)逐滴添加到5-溴-1H-吡唑-3-甲酸甲酯(5.00g,24.5mmol)和碳酸钾(18.0g,130mmol)于DMF(10mL)中的0℃溶液中。在25℃下搅拌所得混合物14h。在0℃下用水(20mL)淬灭反应。用乙酸乙酯(3×30mL)萃取所得混合物。将合并的有机层用盐水(2×100mL)洗涤,经无水硫酸钠干燥,并加以过滤。真空浓缩过滤物。通过硅胶色谱(用15:1石油醚/乙酸乙酯洗脱)纯化残余物,获得呈黄色油状的5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(6.20g,76%)。LCMS(ES,m/z):335,337[M+H]+。
步骤2. 5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯
在100℃下在油浴中将5-溴-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(6.20g,18.5mmol)、(2-苯氧基苯基)硼酸(4.96g,23.2mmol)、XPhos-Pd-G3(3.12g,36.9mmol)和磷酸三钾(25.4mg,37.1mmol)于二噁烷(120mL)和水(24mL)中的溶液搅拌15h。将混合物冷却到25℃。真空浓缩所得混合物。用水(30mL)稀释残余物。用乙酸乙酯(3×30mL)萃取所得混合物。将合并的有机层经无水硫酸钠干燥,过滤并浓缩。通过反相色谱(柱:XBridge ShieldRP18 OBD柱,5μm,30×150mm;流动相,A:水(含有0.05%氢铵)和B:乙腈(5%B到72%,历经20min);检测器:UV 220和254nm)纯化残余物,得到呈黄色固体状的5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(3.20g,41%)。LCMS(ES,m/z):425[M+H]+。
步骤3. 5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸
在50℃下将5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸甲酯(1.40g,3.30mmol)和氢氧化锂(810mg,34.0mmol)于THF(60.0mL)、水(15.0mL)和甲醇(30.0mL)中的溶液搅拌4h。将混合物冷却到25℃并真空浓缩。用3N盐酸水溶液将残余物的pH值调整到3-4。用乙酸乙酯(3×30mL)萃取所得混合物。将合并的有机层用盐水(2×100mL)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过硅胶色谱(用2:1石油醚/乙酸乙酯洗脱)纯化残余物,得到呈灰白色固体状的5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸(1.00g,74%)。LCMS(ES,m/z):411[M+H]+。
步骤4.(5-(2-苯氧基苯基)-1-((2-(三甲基硅烷基)乙氧基)甲基)-1H-吡唑-3-甲酰胺基)-3-氮杂双环[3.1.0]己烷-3-甲酸叔丁酯
在25℃下将5-(2-苯氧基苯基)-1-[[2-(三甲基硅烷基)乙氧基]甲基]-1H-吡唑-3-甲酸(300mg,0.723mmol)、1-氨基-3-氮杂双环[3.1.0]己烷-3-甲酸叔丁酯(145mg,0.723mmol)、HATU(278mg,0.723mmol)和N,N-二异丙基乙胺(0.242mL,1.47mmol)于DMF(3mL)中的溶液搅拌30min。在25℃下用水(10mL)淬灭反应。用乙酸乙酯(3×10mL)萃取所得混合物。将合并的有机层用盐水(2×30mL)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过硅胶色谱(用4:1石油醚/乙酸乙酯洗脱)纯化残余物,得到呈灰白色固体状的1-(5-(2-苯氧基苯基)-1-((2-(三甲基硅烷基)乙氧基)甲基)-1H-吡唑-3-甲酰胺基)-3-氮杂双环[3.1.0]己烷-3-甲酸叔丁酯(280mg,67%)。LCMS(ES,m/z):591[M+H]+。
步骤5.N-(3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺2,2,2-三氟乙酸酯
在25℃下将1-(5-(2-苯氧基苯基)-1-((2-(三甲基硅烷基)乙氧基)甲基)-1H-吡唑-3-甲酰胺基)-3-氮杂双环[3.1.0]己烷-3-甲酸叔丁酯(280mg,0.475mmol)于三氟乙酸(1mL)和二氯甲烷(3mL)中的溶液搅拌2h。真空浓缩所得混合物,得到呈黄色油状的N-(3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺2,2,2-三氟乙酸酯(285mg,粗物质)。LCMS(ES,m/z):361[M+H]+。
步骤6.N-((1S,5R)-3-氰基-3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(3-a)和N-((1R,5S)-3-氰基-3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(3-b)
将溴化氰(58.5mg,0.552mmol)逐滴添加到N-(3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺2,2,2-三氟乙酸酯(280mg,0.613mmol)和碳酸氢钠(653mg,7.69mmol)于DMF(2mL)中的0℃溶液。在25℃下搅拌混合物1h。将反应物冷却到0℃并且用水(10mL)淬灭。用乙酸乙酯(3×10mL)萃取所得混合物。将合并的有机层用盐水(20mL)洗涤,经无水硫酸钠干燥,过滤并浓缩。通过制备型HPLC(柱:XBridge ShieldRP18OBD柱,5μm,30×150mm;流动相,A:水(含有0.05%氢铵)和B:乙腈(28%B到48%,历经7min);检测器:UV 220和254nm)纯化残余物,得到呈白色固体状的N-(3-氰基-3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(60.0mg)。通过手性-HPLC(柱:Chiralpak IG,2*25cm,5μm;流动相,A:MTBE和B:EtOH(在10.5min内维持30%);流速:13mL/min;检测器:220/254nm)分离这一物质。收集第一洗脱异构体,并且绝对立体化学被任意指配为(1S,5R):呈粉色固体状的N-((1S,5R)-3-氰基-3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(RT1=6.45min)(3-a,30.3mg,14%)。LCMS(ES,m/z):386[M+H]+。1H-NMR(DMSO-d6,400MHz)δ(ppm):13.72-13.64(m,1H),9.08-8.70(m,1H),8.05–7.85(m,1H),7.44–7.29(m,4H),7.20–7.12(m,1H),7.04–6.87(m,4H),3.69-3.66(m,1H),3.57–3.48(m,3H),1.78–1.74(m,1H),1.17-1.14(m,1H),0.87-0.82(m,1H)。收集第二洗脱异构体,并且绝对立体化学被任意指配为(1R,5S);呈白色固体状的N-((1R,5S)-3-氰基-3-氮杂双环[3.1.0]己-1-基)-5-(2-苯氧基苯基)-1H-吡唑-3-甲酰胺(RT2=8.97min)(3-b,29.9mg,14%)。LCMS(ES,m/z):386[M+H]+。1H-NMR(DMSO-d6,400MHz)δ(ppm):13.72-13.64(m,1H),9.08-8.70(m,1H),8.05-7.85(m,1H),7.44–7.29(m,4H),7.22–7.12(m,1H),7.04–6.87(m,4H),3.69-3.66(m,1H),3.57–3.51(m,3H),1.78–1.74(m,1H),1.17-1.14(m,1H),0.87–0.82(m,1H)。替代地,第一和第二洗脱异构体的绝对立体化学可被任意地分别指配为(1R,5S)和(1S,5R)。
如所属领域的技术人员显而易见,可在不脱离范围的情况下对本文所述的实施方式进行多种修改和变化。本文所述的具体实施方式仅以实施例的方式给出。
Claims (49)
1.一种式(I)化合物:
或其药学上可接受的盐,其中
Ra、Rb、Rc、Rd、Re、Rf、Rg和Rh定义如下:
(i)Ra和Rb在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rc、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ii)Ra和Re在其所连接的原子之间形成C1-C2亚烷基,其中所述C1-C2亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iii)Ra和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Rb、Rc、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(iv)Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rd、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(v)Rb和Re在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rc、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vi)Rb和Rg在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rc、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(vii)Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(viii)Rc和Rd在一起形成=O;并且Ra、Rb、Re、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(ix)Rc和Re在其所连接的原子之间形成C1-C4亚烷基,其中所述C1-C4亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(x)Rc和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xi)Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xii)Re和Rf在一起形成=O;并且Ra、Rb、Rc、Rd、Rg和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiii)Re和Rg在其所连接的原子之间形成C1-C3亚烷基,其中所述C1-C3亚烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xiv)Rg和Rh与其所连接的原子一起形成3-6元环烷基或杂环烷基,其中所述3-6元环烷基或杂环烷基被选自下组的0-4个取代基取代:卤素、C1-C3烷基和C1-C3卤代烷基;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;或
(xv)Rg和Rh在一起形成=O;并且Ra、Rb、Rc、Rd、Re和Rf各自独立地为氢、卤素、C1-C3烷基或C1-C3卤代烷基;并且
Ar1为亚苯基或5-6元亚杂芳基,其中所述亚苯基或亚杂芳基被m个R1基团取代;并且
Ar2为亚苯基或5-10元亚杂芳基,其中所述亚苯基或亚杂芳基被n个R2基团取代;
L为-O-、-S-、-NR3-、-C(R4)2-、-S(O)2-或-S(O)-;
M为C1-C6烷基、C1-C6卤代烷基、3-6元环烷基、苯基或5-6元杂芳基,其中所述环烷基、苯基或杂芳基被p个R5基团取代;
R1、R2和R5在每次出现时独立地为卤基、氰基、NO2、氧代基、羟基、-R6、-OR6、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、-C1-C6亚烷基-R6、C1-C6烷氧基、C1-C6卤代烷氧基、-C0-C3亚烷基-NR6R7、-C0-C3亚烷基-NR7R8、-C0-C3亚烷基-C(O)NR6R7、-C0-C3亚烷基-C(O)NR7R8、-C0-C3亚烷基-NR7C(O)R6、-C0-C3亚烷基-NR7C(O)R8、-C0-C3亚烷基-NR7S(O)2R6、-C0-C3亚烷基-C(O)R6、-C0-C3亚烷基-C(O)R7、-C0-C3亚烷基-SR6、-C0-C3亚烷基-S(O)R6、-C0-C3亚烷基-S(O)2R6、-C0-C3亚烷基-S(O)2R7、-C0-C3亚烷基-S(O)2NR6R7、-C0-C3亚烷基-S(O)2NR7R8、-C0-C3亚烷基-NR7C(O)NR8R9、-C0-C3亚烷基-NR7S(O)2NR8R9、-C0-C3亚烷基-C(O)OR7、-C0-C3亚烷基-C(O)OR6、-C0-C3亚烷基-OC(O)R7、-C0-C3亚烷基-OC(O)R6、-C0-C3亚烷基-NR7C(O)OR8或-C0-C3亚烷基-NR7S(O)2R8;
R3为H、C1-C6烷基或C1-C6卤代烷基;
每个R4独立地为H、C1-C6烷基或C1-C6卤代烷基,或两个R4基团与其所连接的碳原子一起形成3-6元环烷基或杂环烷基;
每个R6为5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基,其中所述杂芳基、杂环烷基、芳基或环烷基任选地被独立地选自下组的1-5个取代基取代:卤基、氧代基、C1-C6烷基、C1-C6卤代烷基、C1-C6羟烷基、C1-C6烷氧基、C1-C6卤代烷氧基、C2-C6烯基、C2-C6炔基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基、3-8元环烷基、-NR10C(O)NR11R12、-NR10R11、-C(O)R10、-NR10C(O)R11、-NR10C(O)OR11、-S(O)2R10、-C(O)NR10R11、-C(O)OR10、-S(O)2NR10R11、-NR10S(O)2R11、-OR10、-OC(O)R10、-OS(O)2R10、-OC(O)NR10R11、-OC(O)OR10、-OS(O)2NR10R11、-C(O)NR10C(O)NR11R12、-C(O)C(O)R10、-C(O)NR10C(O)R11、-C(O)NR10C(O)OR11、-C(O)S(O)2R10、-C(O)C(O)NR10R11、-C(O)C(O)OR10、-C(O)S(O)2NR10R11、-C(O)NR10S(O)2R11、-C1-C6亚烷基-R10、-C1-C6亚烷基-NR10C(O)NR11R12、-C1-C6亚烷基-NR10R11、-C1-C6亚烷基-C(O)R10、-C1-C6亚烷基-NR10C(O)R11、-C1-C6亚烷基-NR10C(O)OR11、-C1-C6亚烷基-S(O)2R10、-C1-C6亚烷基-C(O)NR10R11、-C1-C6亚烷基-C(O)OR10、-C1-C6亚烷基-S(O)2NR10R11、-C1-C6亚烷基-NR10S(O)2R11、-C1-C6亚烯基-R10、-C1-C6亚烯基-NR10C(O)NR11R12、-C1-C6亚烯基-NR10R11、-C1-C6亚烯基-C(O)R10、-C1-C6亚烯基-NR10C(O)R11、-C1-C6亚烯基-NR10C(O)OR11、-C1-C6亚烯基-S(O)2R10、-C1-C6亚烯基-C(O)NR10R11、-C1-C6亚烯基-C(O)OR10、-C1-C6亚烯基-S(O)2NR10R11和-C1-C6亚烯基-NR10S(O)2R11;
每个R7、R8和R9独立地为氢或C1-C6烷基;
每个R10、R11和R12独立地为氢、C1-C6烷基、5-10元杂芳基、4-10元杂环烷基、6-10元芳基或3-8元环烷基;
m为0-4;
n为0-4;并且
p为0-4。
5.根据权利要求1至4中任一项所述的化合物,其中Rb和Rc在其所连接的原子之间形成C1-C4亚烷基,并且Ra、Rd、Re、Rf、Rg和Rh各自为氢。
9.根据权利要求6至8中任一项所述的化合物,其中Ra、Rd、Re、Rf、Rg、Rh、Rj、Rk、Rm和Rn各自为氢。
13.根据权利要求10至12中任一项所述的化合物,其中Ra、Rd、Re、Rf、Rg、Rh、Rj和Rk各自为氢。
17.根据权利要求14至16中任一项所述的化合物,其中Ra、Rd、Re、Rf、Rg、Rh、Rj、Rk、Rm、Rn、Ro和Rp各自为氢。
18.根据权利要求1至4中任一项所述的化合物,其中Rc和Re在其所连接的原子之间形成C1-C4亚烷基;并且Ra、Rb、Rd、Rf、Rg和Rh各自为氢。
22.根据权利要求19至21中任一项所述的化合物,其中Ra、Rb、Rd、Rf、Rg、Rh、Rq和Rr各自为氢。
23.根据权利要求1至4中任一项所述的化合物,其中Ra和Re在其所连接的原子之间形成C1-C2亚烷基;并且Rb、Rc、Rd、Rf、Rg和Rh各自为氢。
24.根据权利要求1至4中任一项所述的化合物,其中Rc和Rd与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Re、Rf、Rg和Rh各自为氢。
25.根据权利要求1至4中任一项所述的化合物,其中Rc和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rd、Re、Rf和Rh各自为氢。
26.根据权利要求1至4中任一项所述的化合物,其中Re和Rf与其所连接的原子一起形成3-6元环烷基或杂环烷基;并且Ra、Rb、Rc、Rd、Rg和Rh各自为氢。
27.根据权利要求1至4中任一项所述的化合物,其中Re和Rg在其所连接的原子之间形成C1-C3亚烷基;并且Ra、Rb、Rc、Rd、Rf和Rh各自为氢。
28.根据前述权利要求中任一项所述的化合物,其中Ar1为5-6元亚杂芳基。
29.根据权利要求28所述的化合物,其中Ar1为5元亚杂芳基。
30.根据权利要求1至27中任一项所述的化合物,其中Ar1为亚苯基。
31.根据前述权利要求中任一项所述的化合物,其中Ar2为5-10元亚杂芳基。
32.根据权利要求1至30中任一项所述的化合物,其中Ar2为亚苯基。
33.根据前述权利要求中任一项所述的化合物,其中L为-O-、-S-或-NH-。
34.根据权利要求33所述的化合物,其中L为-O-。
35.根据前述权利要求中任一项所述的化合物,其中M为3-6元环烷基、苯基或5-6元杂芳基,其中所述环烷基、苯基或杂芳基被p个R5基团取代。
36.根据权利要求35所述的化合物,其中M为被p个R5基团取代的苯基。
37.根据权利要求36所述的化合物,其中M为苯基。
38.根据前述权利要求中任一项所述的化合物,其中R1、R2和R5在每次出现时独立地选自卤基、氰基、羟基、C1-C6烷基、C1-C6烷氧基、C1-C6卤代烷基和C1-C6羟烷基。
39.根据前述权利要求中任一项所述的化合物,其中m为0。
40.根据前述权利要求中任一项所述的化合物,其中n为0。
41.根据前述权利要求中任一项所述的化合物,其中p为0或1。
42.根据权利要求41所述的化合物,其中p为0。
44.一种选自表1的化合物,或其药学上可接受的盐。
45.一种选自表2的化合物,或其药学上可接受的盐。
46.一种药物组合物,其包括根据权利要求1至45中任一项所述的化合物,或其药学上可接受的盐,和药学上可接受的载剂。
47.一种抑制有需要的患者的USP30的方法,其包括向所述患者施用治疗有效量的根据权利要求1至45中任一项所述的化合物或其药学上可接受的盐,或根据权利要求46所述的药物组合物。
48.一种治疗有需要的患者的神经退行性病症的方法,其包括向所述患者施用治疗有效量的根据权利要求1至45中任一项所述的化合物或其药学上可接受的盐,或根据权利要求46所述的药物组合物。
49.根据权利要求48所述的方法,其中所述神经退行性病症为帕金森氏病。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862741945P | 2018-10-05 | 2018-10-05 | |
| US62/741,945 | 2018-10-05 | ||
| PCT/US2019/054803 WO2020072964A1 (en) | 2018-10-05 | 2019-10-04 | Fused pyrrolines which act as ubiquitin-specific protease 30 (usp30) inhibitors |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN113166108A true CN113166108A (zh) | 2021-07-23 |
Family
ID=68296856
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201980080107.2A Pending CN113166108A (zh) | 2018-10-05 | 2019-10-04 | 作为泛素特异性蛋白酶30(usp30)抑制剂的稠合吡咯啉 |
Country Status (29)
| Country | Link |
|---|---|
| US (3) | US11535618B2 (zh) |
| EP (2) | EP4218934A1 (zh) |
| JP (1) | JP7530889B2 (zh) |
| KR (1) | KR20210072791A (zh) |
| CN (1) | CN113166108A (zh) |
| AU (1) | AU2019356011A1 (zh) |
| BR (1) | BR112021003620A2 (zh) |
| CA (1) | CA3110113A1 (zh) |
| CL (1) | CL2021000793A1 (zh) |
| CO (1) | CO2021005070A2 (zh) |
| CY (1) | CY1126067T1 (zh) |
| DK (1) | DK3860989T3 (zh) |
| EA (1) | EA202190960A1 (zh) |
| ES (1) | ES2945834T3 (zh) |
| FI (1) | FI3860989T3 (zh) |
| HR (1) | HRP20230409T1 (zh) |
| HU (1) | HUE062240T2 (zh) |
| IL (1) | IL281980A (zh) |
| LT (1) | LT3860989T (zh) |
| MA (1) | MA53816A (zh) |
| MX (1) | MX2021002981A (zh) |
| PE (1) | PE20211053A1 (zh) |
| PL (1) | PL3860989T3 (zh) |
| PT (1) | PT3860989T (zh) |
| RS (1) | RS64321B1 (zh) |
| SA (1) | SA521421645B1 (zh) |
| SG (1) | SG11202102815SA (zh) |
| SI (1) | SI3860989T1 (zh) |
| WO (1) | WO2020072964A1 (zh) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2020536863A (ja) | 2017-10-06 | 2020-12-17 | フォーマ セラピューティクス,インコーポレイテッド | ユビキチン特異的ペプチダーゼ30の阻害 |
| MX2020012180A (es) | 2018-05-17 | 2021-01-29 | Forma Therapeutics Inc | Compuestos biciclicos fusionados utiles como inhibidores de la peptidasa 30 especifica de ubiquitina. |
| CN113166108A (zh) | 2018-10-05 | 2021-07-23 | 福马治疗有限公司 | 作为泛素特异性蛋白酶30(usp30)抑制剂的稠合吡咯啉 |
| GB201912674D0 (en) | 2019-09-04 | 2019-10-16 | Mission Therapeutics Ltd | Novel compounds |
| WO2021204856A1 (en) | 2020-04-08 | 2021-10-14 | Mission Therapeutics Limited | N-cyanopyrrolidines with activity as usp30 inhibitors |
| CN115667252A (zh) | 2020-05-28 | 2023-01-31 | 特殊治疗有限公司 | 用于治疗线粒体功能障碍的作为usp30抑制剂的n-(1-氰基-吡咯烷-3-基)-5-(3-(三氟甲基)苯基)噁唑-2-甲酰胺衍生物和对应噁二唑衍生物 |
| BR112022019722A2 (pt) | 2020-06-04 | 2022-12-20 | Mission Therapeutics Ltd | N-cianopirrolidinas com atividade como inibidores de usp30 |
| WO2021249909A1 (en) | 2020-06-08 | 2021-12-16 | Mission Therapeutics Limited | 1-(5-(2-cyanopyridin-4-yl)oxazole-2-carbonyl)-4-methylhexahydropyrrolo[3,4-b]pyr role-5(1h)-carbonitrile as usp30 inhibitor for use in the treatment of mitochondrial dysfunction, cancer and fibrosis |
| GB202016800D0 (en) | 2020-10-22 | 2020-12-09 | Mission Therapeutics Ltd | Novel compounds |
| EP4441044A1 (en) | 2021-12-01 | 2024-10-09 | Mission Therapeutics Limited | Substituted n-cyanopyrrolidines with activity as usp30 inhibitors |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017103614A1 (en) * | 2015-12-17 | 2017-06-22 | Mission Therapeutics Limited | Novel Compounds |
| WO2017163078A1 (en) * | 2016-03-24 | 2017-09-28 | Mission Therapeutics Limited | 1-cyano-pyrrolidine derivatives as dbu inhibitors |
| CN107484415A (zh) * | 2015-03-30 | 2017-12-15 | 特殊治疗有限公司 | 作为usp30抑制剂的1‑氰基吡咯烷化合物 |
| WO2018060742A1 (en) * | 2016-09-30 | 2018-04-05 | Mission Therapeutics Limited | Cyanopyrrolidine derivatives with activity as inhibitors of usp30 |
Family Cites Families (188)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6576632B1 (en) | 1999-08-27 | 2003-06-10 | Pfizer Inc | Biaryl compounds useful as anticancer agents |
| US20030191279A1 (en) | 1999-08-27 | 2003-10-09 | Goldstein Steven Wayne | Urea derivatives useful as anticancer agents |
| CZ2002959A3 (cs) | 1999-09-17 | 2002-07-17 | Millennium Pharmaceuticals, Inc. | Inhibitory faktoru Xa |
| IL155155A0 (en) | 1999-09-17 | 2003-10-31 | Cor Therapeutics Inc | BENZAMIDES AND RELATED INHIBITORS OF FACTOR Xa |
| US6632815B2 (en) | 1999-09-17 | 2003-10-14 | Millennium Pharmaceuticals, Inc. | Inhibitors of factor Xa |
| WO2003020217A2 (en) | 2001-08-31 | 2003-03-13 | University Of Connecticut | Novel pyrazole analogs acting on cannabinoid receptors |
| MXPA02005100A (es) | 1999-10-18 | 2003-09-25 | Alexipharma Inc | Derivados de pirazol antagonistas de receptor de canabinoide. |
| WO2001064643A2 (en) | 2000-02-29 | 2001-09-07 | Cor Therapeutics, Inc. | BENZAMIDES AND RELATED INHIBITORS OF FACTOR Xa |
| CA2404630A1 (en) * | 2000-04-06 | 2001-10-18 | Merck Frosst Canada & Co. | Cathepsin cysteine protease inhibitors |
| PL362320A1 (en) | 2000-12-06 | 2004-10-18 | Aventis Pharma Deutschland Gmbh | Guanidine and amidine derivatives as factor xa inhibitors |
| EP1217000A1 (en) | 2000-12-23 | 2002-06-26 | Aventis Pharma Deutschland GmbH | Inhibitors of factor Xa and factor VIIa |
| AU2002317377A1 (en) | 2001-07-20 | 2003-03-03 | Cancer Research Technology Limited | Biphenyl apurinic/apyrimidinic site endonuclease inhibitors to treat cancer |
| EP2471533A1 (en) | 2002-06-27 | 2012-07-04 | Novo Nordisk A/S | Aryl carbonyl derivatives as therapeutic agents |
| BR0313266A (pt) | 2002-08-09 | 2005-06-21 | Astrazeneca Ab | Compostos, respectivos processos de preparação e uso, formulação farmacêutica e métodos de prevenção e/ou tratamento de um distúrbio mediado pelo receptor de mglur5 e de inibição da ativação de receptores de mglur5 |
| AU2003264018A1 (en) | 2002-08-09 | 2004-02-25 | Astrazeneca Ab | Compounds having an activity at metabotropic glutamate receptors |
| CN101928284A (zh) | 2003-03-14 | 2010-12-29 | 小野药品工业株式会社 | 含氮杂环衍生物以及包含所述化合物作为活性成分的药物 |
| AR043633A1 (es) | 2003-03-20 | 2005-08-03 | Schering Corp | Ligandos de receptores de canabinoides |
| CA2525547C (en) | 2003-05-14 | 2012-07-03 | Torreypines Therapeutics, Inc. | Compounds and uses thereof in modulating amyloid beta |
| GB0315111D0 (en) | 2003-06-27 | 2003-07-30 | Cancer Rec Tech Ltd | Substituted 5-membered ring compounds and their use |
| WO2005019200A2 (en) | 2003-08-14 | 2005-03-03 | Icos Corporation | Aryl piperidine derivatives as vla-1 integrin antagonists and uses thereof |
| GB0325956D0 (en) | 2003-11-06 | 2003-12-10 | Addex Pharmaceuticals Sa | Novel compounds |
| KR101104100B1 (ko) | 2003-11-19 | 2012-01-12 | 제이엔씨 석유 화학 주식회사 | 광 중합성 액정 조성물, 그의 중합체 또는 중합체 조성물및 광학보상 소자 |
| WO2005077373A2 (en) | 2004-02-03 | 2005-08-25 | Astrazeneca Ab | Treatment of gastro-esophageal reflux disease (gerd) |
| WO2005077368A2 (en) | 2004-02-03 | 2005-08-25 | Astrazeneca Ab | Treatment of gastro-esophageal reflux disease (gerd) |
| WO2005077345A1 (en) | 2004-02-03 | 2005-08-25 | Astrazeneca Ab | Compounds for the treatment of gastro-esophageal reflux disease |
| US7585881B2 (en) | 2004-02-18 | 2009-09-08 | Astrazeneca Ab | Additional heteropolycyclic compounds and their use as metabotropic glutamate receptor antagonists |
| BRPI0507501A (pt) | 2004-02-18 | 2007-06-26 | Astrazeneca Ab | composto, composição farmacêutica, uso do composto, método para o tratamento de distúrbios mediados por mglur5, e, método para inibir a ativação de receptores de mglur5 |
| AU2005221678B2 (en) | 2004-03-09 | 2008-10-09 | National Health Research Institutes | Pyrrolidine compounds |
| DE112005001070T5 (de) | 2004-05-21 | 2007-04-12 | Merck Patent Gmbh | Flüssigkristallverbindungen, Flüssigkristallmedium und Flüssigkristallanzeige |
| WO2005115374A1 (en) | 2004-05-29 | 2005-12-08 | 7Tm Pharma A/S | Crth2 receptor ligands for therapeutic use |
| CA2568766A1 (en) | 2004-05-29 | 2005-12-08 | 7Tm Pharma A/S | Crth2 receptor ligands for medicinal uses |
| WO2006015279A1 (en) | 2004-07-28 | 2006-02-09 | Neurogen Corporation | Heterocyclic diamine compounds as ligands of the melanin concentrating hormone receptor useful for the treatment of obesity, diabetes, eating and sexual disorders |
| PL382308A1 (pl) | 2004-08-25 | 2007-08-20 | Targegen, Inc. | Związki heterocykliczne i sposoby stosowania |
| ATE399832T1 (de) | 2004-09-06 | 2008-07-15 | Merck Patent Gmbh | Polymerisierbares flüssigkristallmaterial |
| DE102004051277A1 (de) | 2004-10-21 | 2006-04-27 | Merck Patent Gmbh | Heterocyclische Carbonylverbindungen |
| DE102004054666A1 (de) | 2004-11-12 | 2006-05-18 | Bayer Cropscience Gmbh | Substituierte Pyrazol-3-carboxamide, Verfahren zur Herstellung und Verwendung als Herbizide und Pflanzenwachstumsregulatoren |
| US7678913B2 (en) | 2004-12-07 | 2010-03-16 | Portola Pharmaceuticals, Inc. | Ureas as factor Xa inhibitors |
| EP1845972A4 (en) | 2005-01-10 | 2010-12-22 | Univ Connecticut | CANNAPINOID RECEPTORS APPLYING NOVEL HETEROPYRROL ANALOGS |
| JP5123668B2 (ja) | 2005-01-10 | 2013-01-23 | エグゼリクシス, インコーポレイテッド | 医薬品としての複素環カルボキサミド化合物 |
| GB2424881B (en) | 2005-04-07 | 2010-11-24 | Merck Patent Gmbh | Halophenyl derivatives of bisalkylfluorene |
| EP2527337A1 (en) | 2005-04-14 | 2012-11-28 | Bristol-Myers Squibb Company | Inhibitors of 11-beta hydroxysteroid dehydrogenase type I |
| AU2006247738A1 (en) | 2005-05-13 | 2006-11-23 | Eli Lilly And Company | Substituted N-arylpyrrolidines as selective androgen receptor modulators |
| GB0510139D0 (en) | 2005-05-18 | 2005-06-22 | Addex Pharmaceuticals Sa | Novel compounds B1 |
| WO2007024744A2 (en) | 2005-08-21 | 2007-03-01 | Exelixis, Inc. | Heterocyclic carboxamide compounds as steroid nuclear receptor ligands |
| US20070197532A1 (en) | 2005-11-18 | 2007-08-23 | Cao Sheldon X | Glucokinase activators |
| WO2008035209A2 (en) | 2006-05-30 | 2008-03-27 | Methylgene Inc. | Inhibitors of protein tyrosine kinase activity |
| CN101490001A (zh) | 2006-06-09 | 2009-07-22 | Icos股份有限公司 | 用作dp-2拮抗剂的取代的苯乙酸 |
| TW200815438A (en) | 2006-06-13 | 2008-04-01 | Bayer Schering Pharma Ag | Substituted pyrazolopyridines and salts thereof, pharmaceutical compositions comprising same, methods of preparing same and uses of same |
| TW200815437A (en) | 2006-06-13 | 2008-04-01 | Bayer Schering Pharma Ag | Substituted aminopyrazolopyridines and salts thereof, pharmaceutical compositions comprising same, methods of preparing same and uses of same |
| WO2008028553A1 (en) | 2006-09-02 | 2008-03-13 | Merck Patent Gmbh | Particle beam process for the alignment of reactive mesogens |
| EP2101760B1 (en) | 2006-12-08 | 2013-02-27 | Millennium Pharmaceuticals, Inc. | Unit dose formulations and methods of treating thrombosis with an oral factor xa inhibitor |
| AR064348A1 (es) | 2006-12-15 | 2009-04-01 | Bayer Schering Pharma Ag | 3-h-pirazolopiridinas y sales de estas, composiciones farmaceuticas que las comprenden, metodos para prepararlas y sus usos |
| CA2672438A1 (en) | 2006-12-20 | 2008-07-03 | Amgen Inc. | Substituted heterocycles and methods of use |
| CA2686951C (en) | 2007-05-22 | 2016-03-22 | Via Pharmaceuticals, Inc. | Diacylglycerol acyltransferase inhibitors |
| KR101077417B1 (ko) | 2007-06-12 | 2011-10-26 | 주식회사 엘지화학 | 위상차 필름, 이를 포함하는 편광판 및 액정 표시 장치 |
| US20090069288A1 (en) | 2007-07-16 | 2009-03-12 | Breinlinger Eric C | Novel therapeutic compounds |
| EP2017264A1 (de) | 2007-07-16 | 2009-01-21 | Bayer Cropscience Ag | Substituierte Phenylpropargylverbindungen, Verfahren zu deren Herstellung und deren Verwendung als Herbizide und Pflanzenwachstumsregulatoren |
| JP5057056B2 (ja) | 2007-08-03 | 2012-10-24 | Jsr株式会社 | 液晶配向剤、液晶配向膜の製造方法、ポリアミック酸およびポリイミドならびにジアミン化合物 |
| WO2009047105A1 (en) | 2007-10-10 | 2009-04-16 | Basf Se | Sulphonium salt initiators |
| JP2009108152A (ja) | 2007-10-29 | 2009-05-21 | Sumitomo Chemical Co Ltd | 重合性化合物および光学フィルム |
| WO2009078992A1 (en) | 2007-12-17 | 2009-06-25 | Amgen Inc. | Linear tricyclic compounds as p38 kinase inhibitors |
| JP2009149754A (ja) | 2007-12-20 | 2009-07-09 | Sumitomo Chemical Co Ltd | 重合性化合物および該重合性化合物を重合してなる光学フィルム |
| US20090270418A1 (en) | 2008-01-09 | 2009-10-29 | Marianne Sloss | Pyrazole pyrazine amine compounds as kinase inhibitors, compositions thereof and methods of treatment therewith |
| JP5219583B2 (ja) | 2008-03-31 | 2013-06-26 | 住友化学株式会社 | 組成物、光学フィルムとその製造方法、光学部材及び表示装置 |
| UY31770A1 (es) | 2008-04-18 | 2009-09-30 | Inhibidores de catepsina c | |
| SG10201510696RA (en) | 2008-06-27 | 2016-01-28 | Celgene Avilomics Res Inc | Heteroaryl compounds and uses thereof |
| JP5443720B2 (ja) | 2008-09-05 | 2014-03-19 | 住友化学株式会社 | 組成物、光学フィルム及びその製造方法、光学部材ならびに表示装置 |
| JP2010066630A (ja) | 2008-09-12 | 2010-03-25 | Sumitomo Chemical Co Ltd | 光学フィルムの製造方法及び光学フィルム |
| WO2010048149A2 (en) | 2008-10-20 | 2010-04-29 | Kalypsys, Inc. | Heterocyclic modulators of gpr119 for treatment of disease |
| MX2011006332A (es) | 2008-12-23 | 2011-06-27 | Abbott Lab | Compuestos antivirales. |
| JP5899607B2 (ja) | 2009-03-16 | 2016-04-06 | 住友化学株式会社 | 化合物、光学フィルム及び光学フィルムの製造方法 |
| KR101641385B1 (ko) | 2009-03-16 | 2016-07-20 | 스미또모 가가꾸 가부시끼가이샤 | 화합물, 광학 필름 및 광학 필름의 제조 방법 |
| JP2011006360A (ja) | 2009-06-26 | 2011-01-13 | Sumitomo Chemical Co Ltd | 化合物、光学フィルム及び光学フィルムの製造方法 |
| KR101256018B1 (ko) | 2009-08-20 | 2013-04-18 | 한국과학기술연구원 | 단백질 키나아제 저해활성을 갖는 1,3,6-치환된 인돌 화합물 |
| JP2011042606A (ja) | 2009-08-20 | 2011-03-03 | Sumitomo Chemical Co Ltd | 化合物、光学フィルム及び光学フィルムの製造方法 |
| US8669259B2 (en) | 2009-08-26 | 2014-03-11 | Merck Sharp & Dohme Corp. | Heterocyclic amide compounds as protein kinase inhibitors |
| EP2475254A4 (en) | 2009-09-11 | 2013-05-22 | Enanta Pharm Inc | HEPATITIS C-VIRUS HEMMER |
| WO2011053825A2 (en) | 2009-10-30 | 2011-05-05 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Compositions and methods for the treatment or prevention of mitochondrial diseases |
| EP2536283B8 (en) | 2010-02-18 | 2015-11-04 | vTv Therapeutics LLC | Phenyl-heteroaryl derivatives and methods of use thereof |
| NZ603156A (en) | 2010-03-30 | 2014-10-31 | Verseon Corp | Multisubstituted aromatic compounds as inhibitors of thrombin |
| AU2011253003B2 (en) | 2010-05-13 | 2014-05-01 | Amgen Inc. | Heteroaryloxyheterocyclyl compounds as PDE10 inhibitors |
| GB201010359D0 (en) | 2010-06-21 | 2010-08-04 | Univ Nottingham | Compounds for treating proliferative disorders |
| PL2598483T3 (pl) | 2010-07-29 | 2020-12-28 | Rigel Pharmaceuticals, Inc. | Związki heterocykliczne aktywujące ampk i sposoby ich zastosowania |
| EP2649075B1 (en) | 2010-12-08 | 2018-04-25 | The U.S.A. As Represented By The Secretary, Department Of Health And Human Services | Substituted pyrazolopyrimidines as glucocerebrosidase activators |
| JP5728921B2 (ja) | 2010-12-10 | 2015-06-03 | コニカミノルタ株式会社 | 光学フィルム、及びそれを用いた偏光板、液晶表示装置 |
| US20150158909A1 (en) | 2010-12-15 | 2015-06-11 | Abbevie Inc. | Anti-viral compounds |
| US20150232455A1 (en) | 2010-12-15 | 2015-08-20 | Allan C. Krueger | Anti-viral compounds |
| WO2012129562A2 (en) | 2011-03-24 | 2012-09-27 | The Scripps Research Institute | Compounds and methods for inducing chondrogenesis |
| US9499502B2 (en) | 2011-04-13 | 2016-11-22 | Merck Sharp & Dohme Corp. | 5-substituted iminothiazines and their mono- and dioxides as BACE inhibitors, compositions, and their use |
| KR20140030267A (ko) | 2011-05-23 | 2014-03-11 | 사노피 | N알킬 그룹을 함유하는 중수소화된 화합물의 제조방법 |
| WO2012166951A1 (en) | 2011-05-31 | 2012-12-06 | Receptos, Inc. | Novel glp-1 receptor stabilizers and modulators |
| CN103929961A (zh) | 2011-06-20 | 2014-07-16 | 美国阿尔茨海默病研究所公司 | 化合物及其治疗应用 |
| EP2723384B1 (en) | 2011-06-22 | 2018-08-29 | The General Hospital Corporation | Treatment of proteinopathies |
| BR112014007310A2 (pt) | 2011-09-27 | 2017-04-04 | Novartis Ag | 3-pirimidin-4-il-oxazolidin-2-onas como inibidores de idh mutante |
| EP2763532B1 (en) | 2011-10-05 | 2018-09-19 | The Board of Trustees of the Leland Stanford Junior University | Pi-kinase inhibitors with broad spectrum anti-infective activity |
| EP2788332A1 (en) | 2011-12-07 | 2014-10-15 | Amgen, Inc. | Bicyclic aryl and heteroaryl sodium channel inhibitors |
| WO2013106678A1 (en) | 2012-01-12 | 2013-07-18 | Envivo Pharmaceuticals, Inc. | Tetrasubstituted benzenes |
| TW201348231A (zh) | 2012-02-29 | 2013-12-01 | Amgen Inc | 雜雙環化合物 |
| JP5798066B2 (ja) | 2012-03-08 | 2015-10-21 | 富士フイルム株式会社 | 化合物、液晶組成物、高分子材料およびフィルム |
| US9013997B2 (en) | 2012-06-01 | 2015-04-21 | Broadcom Corporation | System for performing distributed data cut-through |
| EP2671885A1 (en) | 2012-06-05 | 2013-12-11 | Ares Trading S.A. | Imidazo-oxadiazole and Imidazo-thiadiazole derivatives |
| FR2992317B1 (fr) | 2012-06-22 | 2016-05-13 | Diverchim | Procede de preparation de peptides chiraux |
| EP2864444B1 (en) | 2012-06-26 | 2018-08-01 | Merck Patent GmbH | Method of preparing a birefringent polymer film |
| BR112015005369A2 (pt) | 2012-09-17 | 2017-08-08 | Hoffmann La Roche | inibidores de usp30 e métodos para sua utilização |
| US20150291554A1 (en) | 2012-11-02 | 2015-10-15 | Pfizer Inc. | Bruton's Tyrosine Kinase Inhibitors |
| EP2916842B1 (en) | 2012-11-07 | 2016-10-19 | F. Hoffmann-La Roche AG | Triazolo compounds |
| CN103012428A (zh) | 2013-01-08 | 2013-04-03 | 中国药科大学 | 4-(五元杂环并嘧啶/吡啶取代)氨基-1H-3-吡唑甲酰胺类CDK/Aurora双重抑制剂及其用途 |
| CA2905830C (en) | 2013-03-12 | 2022-01-18 | Curegenix Inc. | Quinazoline and naphthyridine derivatives useful in the treatment of cancer |
| CN104045552B (zh) | 2013-03-13 | 2019-06-11 | 江苏先声药业有限公司 | 作为神经保护剂的药用化合物 |
| WO2014159733A1 (en) | 2013-03-14 | 2014-10-02 | Curegenix, Inc. | Compounds for treatment of fibrosis diseases |
| BR112015023571A2 (pt) | 2013-03-15 | 2017-07-18 | Hoffmann La Roche | derivados de sulfamato e sulfamida de arila como moduladores rorc |
| US9393244B2 (en) | 2013-03-15 | 2016-07-19 | Georgetown University | Increasing parkin activity by administering a deubiquitinating enzyme inhibitor |
| JP2014232188A (ja) | 2013-05-29 | 2014-12-11 | コニカミノルタ株式会社 | セルロースアシレートフィルム、円偏光板及び画像表示装置 |
| CA2917767C (en) | 2013-07-12 | 2022-05-03 | Helmholtz-Zentrum Fur Infektionsforschung Gmbh | Cystobactamides |
| EP3024453A2 (en) | 2013-07-25 | 2016-06-01 | Fondazione Telethon | Inhibitors of fapp2 and uses thereof |
| WO2015010297A1 (en) | 2013-07-25 | 2015-01-29 | Agios Pharmaceuticals, Inc. | Therapeutically active compounds and their methods of use |
| KR101715090B1 (ko) | 2013-08-28 | 2017-03-13 | 한국화학연구원 | 신규한 화합물 또는 이의 약학적으로 허용가능한 염, 및 이를 유효성분으로 함유하는 인플루엔자 바이러스 감염으로 인한 질환의 예방 또는 치료용 약학적 조성물 |
| WO2015048547A2 (en) | 2013-09-26 | 2015-04-02 | Rigel Pharmaceuticals, Inc. | Methods for using and biomarkers for ampk-activating compounds |
| US9951056B2 (en) | 2013-09-30 | 2018-04-24 | Beijing Innocare Pharma Tech Co., Ltd. | Substituted nicotinamide inhibitors of BTK and their preparation and use in the treatment of cancer, inflammation and autoimmune disease |
| DK3060550T3 (da) | 2013-10-21 | 2019-07-22 | Merck Patent Gmbh | Heteroarylforbindelser som btk-inhibitorer og anvendelser deraf |
| CN105659121B (zh) | 2013-10-21 | 2019-04-30 | 默克专利股份有限公司 | 制备双折射聚合物膜的方法 |
| WO2015085238A1 (en) | 2013-12-05 | 2015-06-11 | The Regents Of The University Of California, A California Corporation | Inhibitors of lpxc |
| WO2015095104A1 (en) | 2013-12-18 | 2015-06-25 | Merck Sharp & Dohme Corp. | Iminothiadiazepane dioxide compounds as bace inhibitors, compositions, and their use |
| WO2015106292A1 (en) | 2014-01-13 | 2015-07-16 | Coferon, Inc. | Bcr-abl tyrosine-kinase ligands capable of dimerizing in an aqueous solution, and methods of using same |
| ES2726648T3 (es) | 2014-02-25 | 2019-10-08 | Univ Texas | Sales de moduladores heterocíclicos de la actividad del HIF para el tratamiento de enfermedades |
| JP6529986B2 (ja) | 2014-05-13 | 2019-06-12 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 重水素化ヘテロ環式化合物及びイメージング剤としてのその使用 |
| KR102412045B1 (ko) | 2014-05-22 | 2022-06-22 | 놀스 차이나 파마수티칼 컴퍼니., 엘티디. | 혈액응고인자 Xa 억제제로서의 히드라지드 화합물 |
| US9511142B2 (en) | 2014-06-11 | 2016-12-06 | VenatoRx Pharmaceuticals, Inc. | Beta-lactamase inhibitors |
| GB201410653D0 (en) | 2014-06-14 | 2014-07-30 | Mission Therapeutics Ltd | Methodologies for measuring isopeptidase activity in biological samples in a high throughput manner |
| WO2015197028A1 (en) | 2014-06-28 | 2015-12-30 | Sunshine Lake Pharma Co., Ltd. | Compounds as hepatitis c virus (hcv) inhibitors and uses thereof in medicine |
| JP2017525677A (ja) | 2014-07-07 | 2017-09-07 | ジェネンテック, インコーポレイテッド | 治療用化合物及びその使用方法 |
| US20170152226A1 (en) | 2014-07-16 | 2017-06-01 | Novogen Ltd. | Functionalised and substituted indoles as anti-cancer agents |
| WO2016019237A2 (en) | 2014-07-31 | 2016-02-04 | Pharmacyclics Llc | Inhibitors of bruton's tyrosine kinase |
| US9290457B2 (en) | 2014-07-31 | 2016-03-22 | Boehringer Ingelheim International Gmbh | Substituted dihydropyrimidinones and their use as inhibitors of neutrophil elastase activity |
| EP3189551B1 (de) | 2014-09-05 | 2021-01-27 | Merck Patent GmbH | Formulierungen und verfahren zur herstellung einer organischen elektrolumineszenzvorrichtung |
| WO2016040449A1 (en) | 2014-09-10 | 2016-03-17 | Raze Therapeutics, Inc. | 3-phosphoglycerate dehydrogenase inhibitors and uses thereof |
| GB201416754D0 (en) | 2014-09-23 | 2014-11-05 | Mission Therapeutics Ltd | Novel compounds |
| JP2016115940A (ja) | 2014-12-12 | 2016-06-23 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子および電子機器 |
| CN104557862B (zh) | 2014-12-15 | 2017-05-17 | 苏州云轩医药科技有限公司 | 具有Wnt信号通路抑制活性的杂环化合物 |
| JP6903580B2 (ja) | 2014-12-29 | 2021-07-14 | ザ ユナイテッド ステイツ オブ アメリカ, アズ リプレゼンテッド バイ ザ セクレタリー, デパートメント オブ ヘルス アンド ヒューマン サービシーズ | 乳酸脱水素酵素の小分子阻害剤及びその使用方法 |
| WO2016172631A2 (en) | 2015-04-24 | 2016-10-27 | President And Fellows Of Harvard College | Substrate selective inhibitors of insulin-degrading enzyme (ide) and uses thereof |
| WO2017002120A1 (en) | 2015-07-02 | 2017-01-05 | Yeda Research And Development Co. Ltd. | Selective inhibitors of senescent cells and uses thereof |
| WO2017010399A1 (ja) | 2015-07-10 | 2017-01-19 | 塩野義製薬株式会社 | RORγt阻害作用を有する化合物およびそれらを含有する医薬組成物 |
| US10669234B2 (en) | 2015-07-14 | 2020-06-02 | Mission Therapeutics Limited | Cyanopyrrolidines as dub inhibitors for the treatment of cancer |
| WO2017019817A1 (en) | 2015-07-29 | 2017-02-02 | Medivation Technologies, Inc. | Methods and compositions for targeted therapeutics |
| WO2017019822A1 (en) | 2015-07-29 | 2017-02-02 | Medivation Technologies, Inc. | Pellet composition containing repair cells |
| WO2017019830A1 (en) | 2015-07-29 | 2017-02-02 | Medivation Technologies, Inc. | Methods and compositions for targeted therapeutics |
| US11124483B2 (en) | 2015-09-02 | 2021-09-21 | The Regents Of The University Of California | HER3 ligands and uses thereof |
| CN108137489B (zh) | 2015-09-04 | 2020-11-20 | 美国陶氏益农公司 | 具有杀虫效用的分子,以及与其相关的中间体、组合物和方法 |
| WO2017066705A1 (en) | 2015-10-14 | 2017-04-20 | Aquinnah Pharmaceuticals, Inc. | Compounds, compositions and methods of use against stress granules |
| GB201521109D0 (en) | 2015-11-30 | 2016-01-13 | Mission Therapeutics Ltd | Novel compounds |
| CN108602806B (zh) | 2015-12-09 | 2022-07-12 | 研究三角协会 | 改进的爱帕琳肽受体(apj)激动剂及其用途 |
| JO3793B1 (ar) * | 2015-12-10 | 2021-01-31 | Janssen Pharmaceutica Nv | مثبطات تيروزين كاينيز بروتون وأساليب استخدامها |
| GB201522768D0 (en) | 2015-12-23 | 2016-02-03 | Mission Therapeutics Ltd | Novel compounds |
| CN106986859B (zh) | 2016-01-20 | 2020-02-11 | 广东东阳光药业有限公司 | 吲哚衍生物及其用途 |
| GB201602854D0 (en) * | 2016-02-18 | 2016-04-06 | Mission Therapeutics Ltd | Novel compounds |
| GB201603779D0 (en) | 2016-03-04 | 2016-04-20 | Mission Therapeutics Ltd | Novel compounds |
| HRP20230537T1 (hr) | 2016-03-16 | 2023-08-04 | Kura Oncology, Inc. | Supstituirani derivati tieno[2,3-d]pirimidina kao inhibitori za menin-mll i postupci za uporabu |
| GB201604647D0 (en) | 2016-03-18 | 2016-05-04 | Mission Therapeutics Ltd | Novel compounds |
| GB201604638D0 (en) | 2016-03-18 | 2016-05-04 | Mission Therapeutics Ltd | Novel compounds |
| CN107226805A (zh) | 2016-03-24 | 2017-10-03 | 北京天诚医药科技有限公司 | 芳香族酰胺类衍生物、其制备方法及其在医药上的应用 |
| AU2017289974B2 (en) | 2016-06-29 | 2021-08-12 | Bristol-Myers Squibb Company | Biarylmethyl heterocycles |
| CN107619388A (zh) | 2016-07-13 | 2018-01-23 | 南京天印健华医药科技有限公司 | 作为fgfr抑制剂的杂环化合物 |
| CN107619384B (zh) | 2016-07-13 | 2020-07-28 | 江苏恒瑞医药股份有限公司 | 苯并杂环衍生物、其制备方法及其在医药上的应用 |
| WO2018024188A1 (zh) | 2016-08-02 | 2018-02-08 | 上海迪诺医药科技有限公司 | 多环化合物、其制备方法、药物组合物及应用 |
| KR102605996B1 (ko) | 2016-08-30 | 2023-11-27 | 다우 글로벌 테크놀로지스 엘엘씨 | 아크롤레인의 농도의 저감 방법 |
| WO2018060689A1 (en) | 2016-09-27 | 2018-04-05 | Mission Therapeutics Limited | Cyanopyrrolidine derivatives with activity as inhibitors of usp30 |
| GB201616511D0 (en) | 2016-09-29 | 2016-11-16 | Mission Therapeutics Limited | Novel compounds |
| TWI771327B (zh) | 2016-10-05 | 2022-07-21 | 英商使命醫療公司 | 新穎化合物 |
| WO2018106818A1 (en) | 2016-12-07 | 2018-06-14 | Kura Oncology, Inc. | Methods of promoting beta cell proliferation |
| WO2018106820A1 (en) | 2016-12-07 | 2018-06-14 | Kura Oncology, Inc. | Methods of promoting beta cell proliferation |
| JP7101685B2 (ja) | 2017-01-20 | 2022-07-15 | レオ ファーマ アクティーゼルスカブ | 新規jakキナーゼ阻害剤としての二環式アミン |
| WO2018146116A1 (en) | 2017-02-08 | 2018-08-16 | Helmholtz-Zentrum Dresden - Rossendorf E.V. | In vivo stable hg-197(m) compounds, method for the production thereof and use thereof in nuclear medical diagnostics and endoradionuclide therapy (theranostics) |
| US10744213B2 (en) | 2017-02-14 | 2020-08-18 | Colossus Biopharma Consultants Company, Limited | Fluorescent compounds for imaging of blood vessels and blood flow, and an in vivo screen for pro- and anti-angiogenic agents |
| WO2018160891A1 (en) | 2017-03-01 | 2018-09-07 | Achillion Pharmaceutical, Inc. | Pharmaceutical compounds for treatment of medical disorders |
| WO2018157856A1 (zh) | 2017-03-03 | 2018-09-07 | 江苏豪森药业集团有限公司 | 酰胺类衍生物抑制剂及其制备方法和应用 |
| WO2018213150A1 (en) | 2017-05-15 | 2018-11-22 | Mitobridge, Inc. | Usp30 inhibitors |
| GB201708652D0 (en) | 2017-05-31 | 2017-07-12 | Mission Therapeutics Ltd | Novel compounds and uses |
| EP3642196B1 (en) | 2017-06-20 | 2022-08-17 | Mission Therapeutics Limited | Substituted cyanopyrrolidines with activity as dub inhibitors |
| JP2020536863A (ja) | 2017-10-06 | 2020-12-17 | フォーマ セラピューティクス,インコーポレイテッド | ユビキチン特異的ペプチダーゼ30の阻害 |
| GB2571731A (en) | 2018-03-06 | 2019-09-11 | Mission Therapeutics Ltd | Novel compounds and uses |
| MX2020012180A (es) | 2018-05-17 | 2021-01-29 | Forma Therapeutics Inc | Compuestos biciclicos fusionados utiles como inhibidores de la peptidasa 30 especifica de ubiquitina. |
| US11572374B2 (en) | 2018-08-14 | 2023-02-07 | Amgen Inc. | N-cyano-7-azanorbornane derivatives and uses thereof |
| CN113166108A (zh) | 2018-10-05 | 2021-07-23 | 福马治疗有限公司 | 作为泛素特异性蛋白酶30(usp30)抑制剂的稠合吡咯啉 |
| GB201905375D0 (en) | 2019-04-16 | 2019-05-29 | Mission Therapeutics Ltd | Novel compounds |
| GB201905371D0 (en) | 2019-04-16 | 2019-05-29 | Mission Therapeutics Ltd | Novel compounds |
| GB201912674D0 (en) * | 2019-09-04 | 2019-10-16 | Mission Therapeutics Ltd | Novel compounds |
| JP2022548594A (ja) | 2019-09-11 | 2022-11-21 | ビンシア・バイオサイエンシーズ・インコーポレイテッド | Usp30阻害剤及びその使用 |
-
2019
- 2019-10-04 CN CN201980080107.2A patent/CN113166108A/zh active Pending
- 2019-10-04 FI FIEP19791136.5T patent/FI3860989T3/fi active
- 2019-10-04 HU HUE19791136A patent/HUE062240T2/hu unknown
- 2019-10-04 HR HRP20230409TT patent/HRP20230409T1/hr unknown
- 2019-10-04 KR KR1020217013165A patent/KR20210072791A/ko unknown
- 2019-10-04 WO PCT/US2019/054803 patent/WO2020072964A1/en active Application Filing
- 2019-10-04 BR BR112021003620-2A patent/BR112021003620A2/pt unknown
- 2019-10-04 EA EA202190960A patent/EA202190960A1/ru unknown
- 2019-10-04 MA MA053816A patent/MA53816A/fr unknown
- 2019-10-04 LT LTEPPCT/US2019/054803T patent/LT3860989T/lt unknown
- 2019-10-04 RS RS20230494A patent/RS64321B1/sr unknown
- 2019-10-04 US US17/282,521 patent/US11535618B2/en active Active
- 2019-10-04 PT PT197911365T patent/PT3860989T/pt unknown
- 2019-10-04 EP EP23165482.3A patent/EP4218934A1/en active Pending
- 2019-10-04 PE PE2021000398A patent/PE20211053A1/es unknown
- 2019-10-04 PL PL19791136.5T patent/PL3860989T3/pl unknown
- 2019-10-04 JP JP2021518517A patent/JP7530889B2/ja active Active
- 2019-10-04 AU AU2019356011A patent/AU2019356011A1/en active Pending
- 2019-10-04 CA CA3110113A patent/CA3110113A1/en active Pending
- 2019-10-04 ES ES19791136T patent/ES2945834T3/es active Active
- 2019-10-04 DK DK19791136.5T patent/DK3860989T3/da active
- 2019-10-04 EP EP19791136.5A patent/EP3860989B1/en active Active
- 2019-10-04 MX MX2021002981A patent/MX2021002981A/es unknown
- 2019-10-04 SI SI201930533T patent/SI3860989T1/sl unknown
- 2019-10-04 SG SG11202102815SA patent/SG11202102815SA/en unknown
-
2021
- 2021-03-29 CL CL2021000793A patent/CL2021000793A1/es unknown
- 2021-04-01 IL IL281980A patent/IL281980A/en unknown
- 2021-04-04 SA SA521421645A patent/SA521421645B1/ar unknown
- 2021-04-21 CO CONC2021/0005070A patent/CO2021005070A2/es unknown
-
2022
- 2022-10-20 US US18/048,079 patent/US11814386B2/en active Active
-
2023
- 2023-06-02 CY CY20231100267T patent/CY1126067T1/el unknown
- 2023-09-27 US US18/476,249 patent/US20240132499A1/en active Pending
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107484415A (zh) * | 2015-03-30 | 2017-12-15 | 特殊治疗有限公司 | 作为usp30抑制剂的1‑氰基吡咯烷化合物 |
| WO2017103614A1 (en) * | 2015-12-17 | 2017-06-22 | Mission Therapeutics Limited | Novel Compounds |
| CN108368089A (zh) * | 2015-12-17 | 2018-08-03 | 特殊治疗有限公司 | 新化合物 |
| WO2017163078A1 (en) * | 2016-03-24 | 2017-09-28 | Mission Therapeutics Limited | 1-cyano-pyrrolidine derivatives as dbu inhibitors |
| CN108884068A (zh) * | 2016-03-24 | 2018-11-23 | 特殊治疗有限公司 | 作为dub抑制剂的1-氰基-吡咯烷衍生物 |
| WO2018060742A1 (en) * | 2016-09-30 | 2018-04-05 | Mission Therapeutics Limited | Cyanopyrrolidine derivatives with activity as inhibitors of usp30 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN113166108A (zh) | 作为泛素特异性蛋白酶30(usp30)抑制剂的稠合吡咯啉 | |
| CA2785923C (en) | Therapeutic compounds and related methods of use | |
| CN103764653B (zh) | 作为c-Kit激酶抑制剂的化合物和组合物 | |
| JP7449242B2 (ja) | ユビキチン特異的ペプチダーゼ30(usp30)阻害剤として有用な縮合二環化合物 | |
| JP7060298B1 (ja) | Mgat2阻害活性を有する縮合環誘導体 | |
| AU2021201424C1 (en) | Aminopyridine derivatives and their use as selective alk-2 inhibitors | |
| JP2014518853A (ja) | 新規な二環式窒素含有ヘテロアリールtgr5受容体調節因子 | |
| CN105399756A (zh) | Btk抑制剂及其用途 | |
| ES2562903T3 (es) | Nuevo compuesto que tiene actividad inhibidora de PARP | |
| EP3484867B1 (en) | Inhibitors of tryptophan 2,3-dioxygenase | |
| CA3166597A1 (en) | Muscarinic receptor 4 antagonists and methods of use | |
| EA045195B1 (ru) | Конденсированные пирролины, которые действуют как ингибиторы убиквитин-специфической протеазы 30 (usp30) | |
| CA2881110A1 (fr) | Pyrido[3,2-d]pyrimidines trisubstituees, leurs procedes de preparation et leurs utilisations en therapeutique |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |