CN112858527B - 盐酸普拉克索缓释片有关物质的检测方法 - Google Patents
盐酸普拉克索缓释片有关物质的检测方法 Download PDFInfo
- Publication number
- CN112858527B CN112858527B CN202110249500.9A CN202110249500A CN112858527B CN 112858527 B CN112858527 B CN 112858527B CN 202110249500 A CN202110249500 A CN 202110249500A CN 112858527 B CN112858527 B CN 112858527B
- Authority
- CN
- China
- Prior art keywords
- detection
- detection method
- solution
- pramipexole dihydrochloride
- diluent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N30/00—Investigating or analysing materials by separation into components using adsorption, absorption or similar phenomena or using ion-exchange, e.g. chromatography or field flow fractionation
- G01N30/02—Column chromatography
Landscapes
- Physics & Mathematics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Treatment Of Liquids With Adsorbents In General (AREA)
- Medicinal Preparation (AREA)
Abstract
本发明公开了盐酸普拉克索缓释片有关物质的检测方法,采用有机稀释剂和正相色谱体系,使杂质CD10503能够在检测过程中稳定不分解,可实现杂质CD10503的准确定量检测,更好地对盐酸普拉克索缓释片进行质量控制。
Description
技术领域
本发明涉及药物有关物质检测方法领域,特别是涉及盐酸普拉克索缓释片有关物质的检测方法。
背景技术
帕金森是一种多见于老人的身上的中枢神经系统转性病症,伴随着人口老龄化的加重,帕金森也愈来愈普遍。帕金森对患者的伤害巨大,会使患者内心闭锁,导致消沉的影响,也会给患者的家庭产生厚重的压力。
盐酸普拉克索,是一种胆碱抑制剂,研究表明,普拉克索可根据激话纹状体与黑质的多巴胺受体而影响纹状体神经细胞充放电頻率来缓解帕金森病人的运动障碍,现已用于临床治疗帕金森病及其综合征。
2014年8月,盐酸普拉克索缓释片(Pramipexole Dihydrochloride SustainedRelease Tablets)在中国上市,商品名为“森福罗”,进口规格为0.375mg、0.75mg、1.5mg、3.0mg、4.5mg,用于治疗原发性帕金森病的体征和症状。
众所周知,药物中的杂质含量决定着药物的品质,盐酸普拉克索缓释片中的杂质CD10503易水解成API和甲醛,为了保证药品质量,需严格的控制盐酸普拉克索缓释片中杂质CD10503的含量。
在盐酸普拉克索缓释片进口注册标准的有关物质方法中,采用反相HPLC方法对杂质CD10503进行了控制,限度为1.0%;但进口注册标准中使用到了磷酸盐水溶液、酶溶液,样品配制步骤繁琐,耗时较长,而该杂质易水解,很可能在配制过程中就发生降解,导致无法准确定量该杂质。
因此,对盐酸普拉克索缓释片中杂质CD10503的检测方法,还需进一步开发改进和完善。
发明内容
本发明的目的在于提供一种盐酸普拉克索缓释片有关物质的检测方法,检测过程中杂质CD10503稳定不分解,可对盐酸普拉克索缓释片更好地进行质量控制。
根据进口标准的记载,盐酸普拉克索缓释片中可能会存在杂质CD10503,需要对其含量进行控制,本发明发明人应用进口标准中的方法制备杂质CD10503的对照品溶液时(稀释剂为磷酸盐缓冲液)发现,杂质CD10503会水解生成普拉克索,而进口标准的供试品溶液制备和流动相均使用大量的磷酸盐缓冲液,CD10503必然也不稳定,会发生分解,则进口注册标准的反相色谱体系并不能准确定量盐酸普拉克索缓释片中的杂质CD10503。
在本发明中,发明人开发了全新的检测方法,采用有机稀释剂和正相色谱体系,杂质CD10503能够稳定不分解,可准确测定出CD10503的含量。
为了解决上述技术问题,本发明提供了盐酸普拉克索缓释片有关物质的检测方法,采用高效液相色谱进行定性或/和定量检测,液相色谱的检测条件包括:
色谱柱:纤维素-三(3,5-二氯苯基氨基甲酸酯)硅胶柱或等效色谱柱;
流动相:正己烷:乙醇:二乙胺体积比750~950:120~170:0.1~5,或正己烷:异丙醇:二乙胺体积比800~900:120~170:0.1~5;
洗脱方式:等度洗脱;
稀释剂:流动相,或正己烷:异丙醇:乙酸乙酯:二乙胺体积比500~700:250~350:200~300:0.1~5。
在本发明的具体实施方式中,流动相为正己烷:乙醇:二乙胺体积比850:150:1,或正己烷:异丙醇:二乙胺体积比850:150:1。
进一步地,流动相为正己烷:异丙醇:二乙胺体积比850:150:1。
进一步地,稀释剂为流动相,或正己烷:异丙醇:乙酸乙酯:二乙胺体积比600:300:100:1。
在本发明的一个具体实施方式中,稀释剂为正己烷:异丙醇:乙酸乙酯:二乙胺体积比600:300:100:1。
本发明通过实验验证,杂质CD10503在异丙醇:乙酸乙酯:二乙胺体积比600:300:100:1的溶液中,在室温条件下20h内,稳定性良好,可用于检测中的对照品和供试品制备。
进一步地,所述液相色谱检测条件还包括以下的i~iv中的一项或多项:
i色谱柱规格:4.6×250mm,3~5μm;
ii柱温:20~40℃;
iii流速:0.5~2.0ml/min;
iv检测波长:230~280nm。
在本发明的一个具体实施方式中,所述液相色谱检测条件还包括以下的i~iv中的一项或多项:
i色谱柱规格:4.6×250mm,5μm;
ii柱温:30℃;
iii流速:1.0ml/min;
iv检测波长:262±2nm。
本发明具体实施方式中使用的色谱柱商品名为CHIRALPAK IC,只要满足上述描述的色谱柱均可运用于本发明的检测方法,不限于该商品。
进一步地,进样量为5~50μl。
在本发明的具体实施方式中,进样量为20μl。
进一步地,所述检测方法,还包括制备供试品溶液或/和对照品溶液:将样品用稀释剂溶解并稀释到指定浓度。
进一步地,所述检测方法还包括以下内容:
(1)将对照溶液进样检测;
(2)将供试品溶液进样检测。
所述检测方法可使用面积归一化法、自身对照法、内标法、外标法等方法分析、计算检测结果。
在本发明的具体实施方式中,是采用外标法分析、计算检测结果。
本发明的有益效果是:
(1)采用本发明方法检测盐酸普拉克索缓释片,杂质CD10503在整个检测过程中稳定不分解,可实现杂质CD10503的准确定量检测,更好地对盐酸普拉克索缓释片进行质量控制。
(2)本发明简化了供试品溶液的制备,操作简单,系统适用性、专属性、检测限和定量限、线性和范围、精密度、准确度和耐用性均符合要求,为盐酸普拉克索缓释片的检测和质量控制提供了更简单、可靠的方法。
附图说明
图1是盐酸普拉克索缓释片进口注册标准典型图(杂质对照品叠图);
图2是盐酸普拉克索缓释片进口注册标准典型图(CD10503对照品);
图3是CD10503波长扫描图;
图4是普拉克索波长扫描图;
图5是CD10503稀释剂①图谱(条件1);
图6是CD10503稀释剂②图谱(条件1);
图7是CD10503对照液(10μg/mL)图谱(条件2);
图8是CD10503对照液(1μg/mL)图谱(条件2);
图9是CD10503对照液(1μg/mL)图谱(条件3);
图10是供试品加标溶液检测图谱(条件3)。
具体实施方法
下面通过具体实施方式和实验对本发明检测方法做进一步说明。
本实施例中:
PMH为普拉克索;
PMH缓释片为盐酸普拉克索缓释片;
杂质PMH-Z5、PMH-Z6、PMH-Z1为盐酸普拉克索缓释片中的已知杂质,结构如下:
实施例1
采用盐酸普拉克索缓释片进口注册标准方法:
色谱条件与系统适用性试验:用InertsilODS-3,(3.0mm×150mm,3μm)为填充剂;流动相A为磷酸盐缓冲液(取辛烷磺酸钠5.0g和磷酸二氢钾9.1g,加水1000ml使溶解,用磷酸调节pH值至3.0),流动相B为乙腈;照表1进行梯度洗脱,流速为每分钟0.5ml;柱温为30℃;使用二极管阵列检测器检测,检测波长分别为240nm,262nm和326nm。
表1
分别精密称取杂质PMH-Z5与PMH-Z6对照品混合物、PMH-Z1、PMH对照品适量,加溶剂(1)溶解,用磷酸盐缓冲液(pH2.0)稀释并制成每1ml含PMH-Z5、PMH-Z6、PMH-Z1和盐酸普拉克索各约0.15μg、0.15μg、0.15μg和15μg的溶液,作为系统适用性溶液。取系统适用性溶液100μl注入液相色谱仪,在262nm波长记录的色谱图中(图1),出峰顺序依次为杂质PMH-Z5、PMH-Z6、PMH-Z1和盐酸普拉克索。
分别精密称取杂质PMH-Z5与PMH-Z6对照品混合物、CD10503、PMH-Z1、PMH对照品适量,加溶剂(1)溶解,用磷酸盐缓冲液(pH2.0)稀释并制成每1ml含PMH-Z5、PMH-Z6、CD10503、PMH-Z1和盐酸普拉克索各约0.15μg、0.15μg、0.15μg、0.15μg和15μg的溶液,作为系统适用性溶液。取系统适用性溶液100μl注入液相色谱仪,在262nm波长记录色谱图,见图1,对比不含CD10503的溶液色谱图,新增的色谱峰即为CD10503的色谱峰。
再单独称取杂质CD10503,加溶剂(1)溶解,用磷酸盐缓冲液(pH2.0)稀释并制成0.2mg/ml的CD10503对照品溶液。取CD10503对照品溶液100μl注入液相色谱仪,在262nm波长记录色谱图,见图2,色谱图上有两个色谱峰(保留时间分别为23.531min、24.600min),对比可知,新增的色谱峰为普拉克索,说明在对照品溶液中,CD10503不稳定,易水解,该方法无法准确测定CD10503的含量。
注:溶剂(1)为甲醇-乙腈-磷酸(64:31:5)。
实施例2方法筛选
对CD10503、PMH进行波长扫描,结果见图3、图4,CD10503在266nm处有最大吸收,PMH在262nm处有最大吸收。
条件1:
(1)色谱条件:
表2
| 色谱柱 | CHIRALPAK AD-H,250×4.6mm,5.0μm(L-S-67) |
| 流动相: | 正己烷-乙醇-二乙胺(850∶150∶1) |
| 流速 | 1.0ml/min |
| 柱温 | 35℃ |
| 进样量 | 75μl |
| 稀释剂 | ①流动相②正己烷-二氯甲烷(85:15) |
| 波长 | 262nm |
| 运行时间 | 20min |
(2)溶液配制:
PMH对照品溶液:取PMH原料药约10mg加稀释剂①溶解并稀释至100ml。
CD10503对照品溶液:取CD10503 3.81mg加稀释剂①溶解并稀释至10ml。
CD10503对照品溶液:取CD10503 5.58mg加稀释剂②溶解并稀释至10ml。
(3)筛选结果
分别精密量取上述溶液75μl,注入液相色谱仪,记录色谱图,CD10503采用稀释剂①制备对照品的检测结果见图5,CD10503采用稀释剂②制备对照品的检测结果见图6。
结果表明,CD10503、PMH出峰时间分别为5.605min、14.630min;CD10503以稀释剂②作为溶剂时,溶剂效应严重。
对CD10503在稀释剂①中的稳定性进行考察,结果见表3。
表3
| 时间 | 0h | 2h | 4h | 6h | 8h | 10h |
| CD10503峰面积 | 15480504 | 14358250 | 13643095 | 13260661 | 13122572 | 12992215 |
由表3结果可知,CD10503以稀释剂①作为溶剂时,常温下10h内稳定性较差,可能是由于乙醇导致CD10503稳定性变差,因此还需对稀释剂进行调整。
条件2:
(1)色谱条件:
表3
(2)溶液配制:
CD10503储备液:取CD10503 10.54mg用稀释剂溶解并稀释至10ml。
CD10503对照液(10μg/ml):取CD10503储备液0.1ml稀释至10ml即得。
CD10503对照液(1μg/ml):取CD10503对照液(10μg/ml)1ml稀释至10ml即得。
(3)筛选结果
分别精密量取上述溶液75μl,注入液相色谱仪,记录色谱图,10μg/ml的检测图见图7,1μg/ml的检测图见图8。
实验结果表明,用乙酸乙酯替换乙醇后,1μg/ml的CD10503对照液中CD10503无法被检出,说明该方法灵敏度达不到要求,仍然需要调整。
条件3:
(1)色谱条件:
表4
(2)溶液配制:
CD10503对照液(0.1mg/ml):取1ml CD10503对照品,用稀释剂稀释至10ml即得。
CD10503对照液(1μg/ml):取CD10503对照液(0.1mg/ml)0.1ml,用稀释剂稀释至10ml即得。
供试品加标溶液A:取PMH缓释片(180601批)细粉658.70mg于10ml量瓶中,加稀释剂适量使分散,加入CD10503对照液(0.1mg/ml)0.1ml,超声10min,放冷,定容,摇匀后滤过,取续滤液即得。
供试品加标溶液B:取PMH缓释片(181101批)细粉234.34mg于10ml量瓶中,加稀释剂适量使分散,加入CD10503对照液(0.1mg/ml)0.1ml,超声10min,放冷,定容,摇匀后滤过,取续滤液即得。
(3)筛选结果
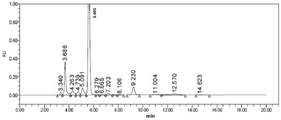
分别精密量取上述溶液20μl,注入液相色谱仪,记录色谱图。CD10503对照液(1μg/ml)的色谱图见图9,图中只有CD10503的色谱峰,说明采用正己烷-异丙醇-乙酸乙酯-二乙胺(600:300:100:1)做稀释剂,CD10503在配制过程中是稳定的。
供试品加标溶液B的色谱图见图10,有两个色谱峰,保留时间分别为7.957min、11.732min)。
对该方法的回收率、溶液稳定性进行测定,结果见表5、表6。
表5回收率结果
表6溶液稳定性结果
实验结果表明,该方法下CD10503 0.1μg/ml S/N为11.4,约为限度浓度的10%,灵敏度良好;在PMH缓释片(0.375mg和1.5mg)两规格回收率分别为104%和106%,在室温条件下20h内,对照品溶液及供试品加标溶液中CD10503的稳定性良好。因此,确定条件3为最佳检测条件。
实施例3方法验证
最佳分析方法:
精密称取盐酸普拉克索缓释片细粉适量(约相当于盐酸普拉克索1mg),置10ml量瓶中,加稀释剂[正己烷-异丙醇-乙酸乙酯-二乙胺(600∶300∶100∶1)]适量,振摇使分散,超声,加稀释剂定量稀释至刻度,摇匀,过滤,取续滤液作为供试品溶液;另精密称取CD10503对照品适量,加稀释剂溶解并定量稀释成每1ml中约含1μg的溶液,作为对照品溶液。照高效液相色谱法(中国药典2015年版四部通则0512)测定,以纤维素-三(3,5-二氯苯基氨基甲酸酯)硅胶为填充剂(CHIRALPAK IC,250mm×4.6mm,5μm或效能相当的色谱柱),以正己烷-异丙醇-二乙胺(850:150:1)为流动相;检测波长为262nm,流速为每分钟1.0ml,柱温30℃,运行时间25min。精密量取供试品溶液和对照品溶液20μl,注入液相色谱仪,记录色谱图。供试品溶液色谱图中如有与CD10503保留时间一致的色谱峰,按外标法以峰面积计算,不得过盐酸普拉克索标示量的1.0%。
方法学验证结果见表7
表7
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
Claims (6)
1.盐酸普拉克索缓释片有关物质的检测方法,其特征在于,采用高效液相色谱进行定性或/和定量检测,液相色谱的检测条件包括:
色谱柱:纤维素-三(3,5-二氯苯基氨基甲酸酯)硅胶柱或等效色谱柱;
流动相:正己烷:异丙醇:二乙胺体积比800~900:120~170:0.1~5;
洗脱方式:等度洗脱;
稀释剂:正己烷:异丙醇:乙酸乙酯:二乙胺体积比600:300:100:1;
所述液相色谱检测条件还包括以下的i~iv中的一项或多项:
i色谱柱规格:4.6×250mm,3~5μm;
ii柱温:20~40℃;
iii流速:0.5~2.0ml/min;
iv检测波长:262±2nm;
所述有关物质包括杂质CD10503,结构如下:
2.根据权利要求1所述的检测方法,其特征在于,流动相为正己烷:异丙醇:二乙胺体积比850:150:1。
3.根据权利要求1所述的检测方法,其特征在于,所述液相色谱检测条件还包括以下的i~iii中的一项或多项:
i色谱柱规格:4.6×250mm,5μm;
ii柱温:30℃;
iii流速:1.0ml/min。
4.根据权利要求1所述的检测方法,其特征在于,进样量为5~50µl。
5.根据权利要求4所述的检测方法,其特征在于,进样量为20µl。
6.根据权利要求1所述的检测方法,其特征在于,还包括制备供试品溶液或/和对照品溶液:将样品用稀释剂溶解并稀释到指定浓度。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110249500.9A CN112858527B (zh) | 2021-03-08 | 2021-03-08 | 盐酸普拉克索缓释片有关物质的检测方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110249500.9A CN112858527B (zh) | 2021-03-08 | 2021-03-08 | 盐酸普拉克索缓释片有关物质的检测方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN112858527A CN112858527A (zh) | 2021-05-28 |
| CN112858527B true CN112858527B (zh) | 2022-11-01 |
Family
ID=75994665
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110249500.9A Active CN112858527B (zh) | 2021-03-08 | 2021-03-08 | 盐酸普拉克索缓释片有关物质的检测方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN112858527B (zh) |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008074033A1 (en) * | 2006-12-14 | 2008-06-19 | Knopp Neurosciences, Inc. | Compositions and methods of using (r)-pramipexole |
| WO2010022140A1 (en) * | 2008-08-19 | 2010-02-25 | Knopp Neurosciences, Inc. | Compositions and methods of using (r)-pramipexole |
| CN101769902A (zh) * | 2008-12-29 | 2010-07-07 | 北京德众万全药物技术开发有限公司 | 一种hplc法分析分离盐酸普拉克索光学异构体的方法 |
| EP2508181A1 (en) * | 2006-12-14 | 2012-10-10 | Knopp Neurosciences, Inc. | Compositions and Methods Of Using (R)-Pramipexole |
| CN103698436A (zh) * | 2013-12-30 | 2014-04-02 | 四川科伦药业股份有限公司 | 盐酸普拉克索中对映异构体的检测方法及两者的分离方法 |
| CN104744400A (zh) * | 2012-11-22 | 2015-07-01 | 刘炜 | 用于治疗神经疾病的四氢苯并噻唑衍生物 |
| CN111487348A (zh) * | 2020-04-30 | 2020-08-04 | 珠海润都制药股份有限公司 | 一种采用盐酸普拉克索固体制剂配制的盐酸普拉克索溶液及其测定方法 |
| CN111721849A (zh) * | 2019-03-23 | 2020-09-29 | 齐鲁制药(海南)有限公司 | 一种测定盐酸普拉克索缓释片中主药含量的分析方法 |
-
2021
- 2021-03-08 CN CN202110249500.9A patent/CN112858527B/zh active Active
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2008074033A1 (en) * | 2006-12-14 | 2008-06-19 | Knopp Neurosciences, Inc. | Compositions and methods of using (r)-pramipexole |
| EP2508181A1 (en) * | 2006-12-14 | 2012-10-10 | Knopp Neurosciences, Inc. | Compositions and Methods Of Using (R)-Pramipexole |
| WO2010022140A1 (en) * | 2008-08-19 | 2010-02-25 | Knopp Neurosciences, Inc. | Compositions and methods of using (r)-pramipexole |
| CN101769902A (zh) * | 2008-12-29 | 2010-07-07 | 北京德众万全药物技术开发有限公司 | 一种hplc法分析分离盐酸普拉克索光学异构体的方法 |
| CN104744400A (zh) * | 2012-11-22 | 2015-07-01 | 刘炜 | 用于治疗神经疾病的四氢苯并噻唑衍生物 |
| CN103698436A (zh) * | 2013-12-30 | 2014-04-02 | 四川科伦药业股份有限公司 | 盐酸普拉克索中对映异构体的检测方法及两者的分离方法 |
| CN111721849A (zh) * | 2019-03-23 | 2020-09-29 | 齐鲁制药(海南)有限公司 | 一种测定盐酸普拉克索缓释片中主药含量的分析方法 |
| CN111487348A (zh) * | 2020-04-30 | 2020-08-04 | 珠海润都制药股份有限公司 | 一种采用盐酸普拉克索固体制剂配制的盐酸普拉克索溶液及其测定方法 |
Non-Patent Citations (3)
| Title |
|---|
| Physicochemical Factors Governing the Partition of Pramipexole and Its Five Impurities in Microemulsion Liquid Chromatographic Systems;Ana M. Vemić等;《J. Braz. Chem. Soc》;20121231;第23卷(第11期);第2084-2092页 * |
| 正相高效液相色谱法拆分普拉克索对映异构体;杨庆云等;《药物分析杂志》;20141231;第34卷(第11期);摘要,第2-3节,图2 * |
| 毛细管电泳在手性药物分析中的应用和机理研究;刘长海;《中国优秀博硕士学位论文全文数据库(硕士)》;20050615(第6期);第22-31页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CN112858527A (zh) | 2021-05-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN109870521B (zh) | 一种正相色谱法分离磷酸奥司他韦对映异构体的方法 | |
| CN111983113A (zh) | 一种检测依折麦布辛伐他汀片中6-氧代辛伐他汀含量的方法 | |
| CN115097023A (zh) | 佐米胺有关物质的高效液相色谱检测方法 | |
| CN112666304B (zh) | 一种艾司奥美拉唑钠药物中对映异构体的检测方法 | |
| CN113866337B (zh) | 一种分离与测定磷酸奥司他韦同分异构体的质量分析方法 | |
| WO2022116971A1 (zh) | 一种复方苦参注射液的活性成分的含量及指纹图谱的检测方法 | |
| CN112858527B (zh) | 盐酸普拉克索缓释片有关物质的检测方法 | |
| CN115060832A (zh) | 奥卡西平口服混悬液中奥卡西平及防腐剂含量检测方法 | |
| CN111487348B (zh) | 一种采用盐酸普拉克索固体制剂配制的盐酸普拉克索溶液及其测定方法 | |
| CN113049687B (zh) | 一种盐酸氨溴索原料和注射液有关物质的检测方法 | |
| CN113533578A (zh) | 一种盐酸溴己新片中有关物质的质量控制方法 | |
| CN114518423B (zh) | 一种用于检测盐酸多巴胺注射液中杂质的方法 | |
| CN113514588B (zh) | 注射用双半胱乙酯有关物质的高效液相色谱分析方法 | |
| CN113514589B (zh) | 注射用亚锡葡庚糖酸钠有关物质的高效液相色谱分析方法 | |
| CN113655150B (zh) | 盐酸倍他司汀中氮氧自由基哌啶醇的检测方法 | |
| CN113125626B (zh) | 一种从左乙拉西坦口服液中检测右旋异构体的hplc方法 | |
| CN111007191B (zh) | 磺胺甲噁唑和/或甲氧苄啶的含量、其有关物质的检测方法和应用 | |
| CN112415123B (zh) | 一种左乙拉西坦原料或氯化钠注射液中左乙拉西坦对映异构体的检测方法 | |
| CN111595961B (zh) | 一种维生素b2有关物质的检测方法 | |
| CN114689737A (zh) | 一种s-邻氯苯甘氨酸甲酯酒石酸盐有关物质的分析方法 | |
| CN111579688A (zh) | 一种测定盐酸达泊西汀中对映异构体含量的方法 | |
| CN111812227B (zh) | 一种多巴丝肼复方制剂中苄丝肼杂质a的分析方法 | |
| CN112611819B (zh) | 一种苯磷硫胺原料及其制剂中有关物质的测定方法 | |
| CN117074579B (zh) | 一种氨磺必利口服溶液有关物质的分析方法 | |
| CN113686977B (zh) | 复方芬苯达唑制剂中有关物质的测定方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |