CN112625126A - 抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用 - Google Patents
抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用 Download PDFInfo
- Publication number
- CN112625126A CN112625126A CN202110029650.9A CN202110029650A CN112625126A CN 112625126 A CN112625126 A CN 112625126A CN 202110029650 A CN202110029650 A CN 202110029650A CN 112625126 A CN112625126 A CN 112625126A
- Authority
- CN
- China
- Prior art keywords
- hafnia alvei
- yolk
- antibody
- yolk antibody
- alvei
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 210000002969 egg yolk Anatomy 0.000 title claims abstract description 120
- CJNBYAVZURUTKZ-UHFFFAOYSA-N hafnium(IV) oxide Inorganic materials O=[Hf]=O CJNBYAVZURUTKZ-UHFFFAOYSA-N 0.000 title claims abstract description 37
- 238000002360 preparation method Methods 0.000 title abstract description 11
- 241000588729 Hafnia alvei Species 0.000 claims abstract description 85
- 230000003053 immunization Effects 0.000 claims abstract description 32
- 239000000427 antigen Substances 0.000 claims abstract description 30
- 102000036639 antigens Human genes 0.000 claims abstract description 30
- 108091007433 antigens Proteins 0.000 claims abstract description 30
- 235000013345 egg yolk Nutrition 0.000 claims abstract description 25
- 235000013601 eggs Nutrition 0.000 claims abstract description 22
- 201000010099 disease Diseases 0.000 claims abstract description 11
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 11
- 230000002265 prevention Effects 0.000 claims abstract 2
- 239000000243 solution Substances 0.000 claims description 31
- 102000002322 Egg Proteins Human genes 0.000 claims description 26
- 108010000912 Egg Proteins Proteins 0.000 claims description 26
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 claims description 20
- 239000000284 extract Substances 0.000 claims description 17
- 239000007788 liquid Substances 0.000 claims description 13
- 238000000034 method Methods 0.000 claims description 13
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical class N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 claims description 10
- 238000000502 dialysis Methods 0.000 claims description 10
- 238000002156 mixing Methods 0.000 claims description 10
- 239000000203 mixture Substances 0.000 claims description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 10
- 238000007865 diluting Methods 0.000 claims description 9
- 239000008367 deionised water Substances 0.000 claims description 8
- 229910021641 deionized water Inorganic materials 0.000 claims description 8
- 238000010790 dilution Methods 0.000 claims description 7
- 239000012895 dilution Substances 0.000 claims description 7
- 230000001804 emulsifying effect Effects 0.000 claims description 7
- 235000015097 nutrients Nutrition 0.000 claims description 7
- 239000006228 supernatant Substances 0.000 claims description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 6
- 238000003756 stirring Methods 0.000 claims description 6
- 238000001914 filtration Methods 0.000 claims description 5
- 230000000415 inactivating effect Effects 0.000 claims description 5
- 230000002779 inactivation Effects 0.000 claims description 5
- 238000010257 thawing Methods 0.000 claims description 5
- 230000003321 amplification Effects 0.000 claims description 4
- 239000000706 filtrate Substances 0.000 claims description 4
- 238000003199 nucleic acid amplification method Methods 0.000 claims description 4
- 230000001376 precipitating effect Effects 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 210000004027 cell Anatomy 0.000 claims 2
- 241000257303 Hymenoptera Species 0.000 abstract description 22
- 230000000694 effects Effects 0.000 abstract description 5
- 239000003814 drug Substances 0.000 abstract description 2
- 208000015181 infectious disease Diseases 0.000 abstract description 2
- 238000002649 immunization Methods 0.000 description 14
- 241000256844 Apis mellifera Species 0.000 description 13
- 239000002671 adjuvant Substances 0.000 description 12
- 239000000843 powder Substances 0.000 description 12
- 240000004355 Borago officinalis Species 0.000 description 11
- 235000007689 Borago officinalis Nutrition 0.000 description 11
- 238000005406 washing Methods 0.000 description 10
- 230000001580 bacterial effect Effects 0.000 description 9
- 238000002474 experimental method Methods 0.000 description 9
- 238000002965 ELISA Methods 0.000 description 7
- 239000003242 anti bacterial agent Substances 0.000 description 7
- 229940088710 antibiotic agent Drugs 0.000 description 7
- 239000008055 phosphate buffer solution Substances 0.000 description 7
- 235000012907 honey Nutrition 0.000 description 6
- 210000000481 breast Anatomy 0.000 description 5
- 210000003205 muscle Anatomy 0.000 description 5
- 241000287828 Gallus gallus Species 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 239000013642 negative control Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 229960005486 vaccine Drugs 0.000 description 4
- 241000193830 Bacillus <bacterium> Species 0.000 description 3
- 231100000111 LD50 Toxicity 0.000 description 3
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 3
- 235000013305 food Nutrition 0.000 description 3
- 239000001963 growth medium Substances 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 239000012460 protein solution Substances 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 108090000623 proteins and genes Proteins 0.000 description 3
- 238000001542 size-exclusion chromatography Methods 0.000 description 3
- 241000228197 Aspergillus flavus Species 0.000 description 2
- 241000271566 Aves Species 0.000 description 2
- 238000009631 Broth culture Methods 0.000 description 2
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 241000607142 Salmonella Species 0.000 description 2
- 206010040047 Sepsis Diseases 0.000 description 2
- 241000589970 Spirochaetales Species 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- 238000005349 anion exchange Methods 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 244000052616 bacterial pathogen Species 0.000 description 2
- 230000003385 bacteriostatic effect Effects 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- MYSWGUAQZAJSOK-UHFFFAOYSA-N ciprofloxacin Chemical compound C12=CC(N3CCNCC3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 MYSWGUAQZAJSOK-UHFFFAOYSA-N 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 210000003278 egg shell Anatomy 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 231100000636 lethal dose Toxicity 0.000 description 2
- 230000031700 light absorption Effects 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000006916 nutrient agar Substances 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 238000012856 packing Methods 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 208000013223 septicemia Diseases 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 229940126680 traditional chinese medicines Drugs 0.000 description 2
- GSDSWSVVBLHKDQ-UHFFFAOYSA-N 9-fluoro-3-methyl-10-(4-methylpiperazin-1-yl)-7-oxo-2,3-dihydro-7H-[1,4]oxazino[2,3,4-ij]quinoline-6-carboxylic acid Chemical compound FC1=CC(C(C(C(O)=O)=C2)=O)=C3N2C(C)COC3=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-UHFFFAOYSA-N 0.000 description 1
- 206010000060 Abdominal distension Diseases 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 241000193755 Bacillus cereus Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 241000037740 Coptis chinensis Species 0.000 description 1
- 235000009917 Crataegus X brevipes Nutrition 0.000 description 1
- 235000013204 Crataegus X haemacarpa Nutrition 0.000 description 1
- 235000009685 Crataegus X maligna Nutrition 0.000 description 1
- 235000009444 Crataegus X rubrocarnea Nutrition 0.000 description 1
- 235000009486 Crataegus bullatus Nutrition 0.000 description 1
- 235000017181 Crataegus chrysocarpa Nutrition 0.000 description 1
- 235000009682 Crataegus limnophila Nutrition 0.000 description 1
- 235000004423 Crataegus monogyna Nutrition 0.000 description 1
- 240000000171 Crataegus monogyna Species 0.000 description 1
- 235000002313 Crataegus paludosa Nutrition 0.000 description 1
- 235000009840 Crataegus x incaedua Nutrition 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- 241000588731 Hafnia Species 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 239000004100 Oxytetracycline Substances 0.000 description 1
- 206010034203 Pectus Carinatum Diseases 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 240000003152 Rhus chinensis Species 0.000 description 1
- 235000014220 Rhus chinensis Nutrition 0.000 description 1
- 240000004534 Scutellaria baicalensis Species 0.000 description 1
- 235000017089 Scutellaria baicalensis Nutrition 0.000 description 1
- 235000019764 Soybean Meal Nutrition 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- KIPLYOUQVMMOHB-MXWBXKMOSA-L [Ca++].CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O.CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O Chemical group [Ca++].CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O.CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O KIPLYOUQVMMOHB-MXWBXKMOSA-L 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 229940038481 bee pollen Drugs 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 238000009395 breeding Methods 0.000 description 1
- 230000001488 breeding effect Effects 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 210000001669 bursa of fabricius Anatomy 0.000 description 1
- 229960004682 cefoperazone Drugs 0.000 description 1
- GCFBRXLSHGKWDP-XCGNWRKASA-N cefoperazone Chemical compound O=C1C(=O)N(CC)CCN1C(=O)N[C@H](C=1C=CC(O)=CC=1)C(=O)N[C@@H]1C(=O)N2C(C(O)=O)=C(CSC=3N(N=NN=3)C)CS[C@@H]21 GCFBRXLSHGKWDP-XCGNWRKASA-N 0.000 description 1
- 229960000484 ceftazidime Drugs 0.000 description 1
- NMVPEQXCMGEDNH-TZVUEUGBSA-N ceftazidime pentahydrate Chemical compound O.O.O.O.O.S([C@@H]1[C@@H](C(N1C=1C([O-])=O)=O)NC(=O)\C(=N/OC(C)(C)C(O)=O)C=2N=C(N)SC=2)CC=1C[N+]1=CC=CC=C1 NMVPEQXCMGEDNH-TZVUEUGBSA-N 0.000 description 1
- 229960001668 cefuroxime Drugs 0.000 description 1
- JFPVXVDWJQMJEE-IZRZKJBUSA-N cefuroxime Chemical compound N([C@@H]1C(N2C(=C(COC(N)=O)CS[C@@H]21)C(O)=O)=O)C(=O)\C(=N/OC)C1=CC=CO1 JFPVXVDWJQMJEE-IZRZKJBUSA-N 0.000 description 1
- 235000013339 cereals Nutrition 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 229940126678 chinese medicines Drugs 0.000 description 1
- 229960003405 ciprofloxacin Drugs 0.000 description 1
- 210000001520 comb Anatomy 0.000 description 1
- 239000000498 cooling water Substances 0.000 description 1
- 239000000287 crude extract Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 239000000385 dialysis solution Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003640 drug residue Substances 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 229960001625 furazolidone Drugs 0.000 description 1
- PLHJDBGFXBMTGZ-WEVVVXLNSA-N furazolidone Chemical compound O1C([N+](=O)[O-])=CC=C1\C=N\N1C(=O)OCC1 PLHJDBGFXBMTGZ-WEVVVXLNSA-N 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- 239000007952 growth promoter Substances 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000012160 loading buffer Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 235000013622 meat product Nutrition 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- OGJPXUAPXNRGGI-UHFFFAOYSA-N norfloxacin Chemical compound C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCNCC1 OGJPXUAPXNRGGI-UHFFFAOYSA-N 0.000 description 1
- 229960001180 norfloxacin Drugs 0.000 description 1
- 229960001699 ofloxacin Drugs 0.000 description 1
- 229960000625 oxytetracycline Drugs 0.000 description 1
- IWVCMVBTMGNXQD-PXOLEDIWSA-N oxytetracycline Chemical compound C1=CC=C2[C@](O)(C)[C@H]3[C@H](O)[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O IWVCMVBTMGNXQD-PXOLEDIWSA-N 0.000 description 1
- 235000019366 oxytetracycline Nutrition 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 239000002574 poison Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 235000013594 poultry meat Nutrition 0.000 description 1
- 239000012474 protein marker Substances 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 239000010865 sewage Substances 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000004455 soybean meal Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 229960005404 sulfamethoxazole Drugs 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- JLKIGFTWXXRPMT-UHFFFAOYSA-N sulphamethoxazole Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1 JLKIGFTWXXRPMT-UHFFFAOYSA-N 0.000 description 1
- 235000011149 sulphuric acid Nutrition 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- IWVCMVBTMGNXQD-UHFFFAOYSA-N terramycin dehydrate Natural products C1=CC=C2C(O)(C)C3C(O)C4C(N(C)C)C(O)=C(C(N)=O)C(=O)C4(O)C(O)=C3C(=O)C2=C1O IWVCMVBTMGNXQD-UHFFFAOYSA-N 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 229940126673 western medicines Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/12—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria
- C07K16/1203—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-negative bacteria
- C07K16/1228—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-negative bacteria from Enterobacteriaceae (F), e.g. Citrobacter, Serratia, Proteus, Providencia, Morganella, Yersinia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/02—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies from eggs
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56911—Bacteria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/23—Immunoglobulins specific features characterized by taxonomic origin from birds
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/195—Assays involving biological materials from specific organisms or of a specific nature from bacteria
- G01N2333/24—Assays involving biological materials from specific organisms or of a specific nature from bacteria from Enterobacteriaceae (F), e.g. Citrobacter, Serratia, Proteus, Providencia, Morganella, Yersinia
- G01N2333/275—Hafnia (G)
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Molecular Biology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Cell Biology (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Microbiology (AREA)
- Communicable Diseases (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Oncology (AREA)
- Pharmacology & Pharmacy (AREA)
- Biotechnology (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
本发明属于生物制药领域,涉及一种抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用。本发明的抗蜂房哈夫尼菌卵黄抗体为利用灭活蜂房哈夫尼菌为抗原免疫产蛋鸡,收集所述免疫蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到。本发明的抗蜂房哈夫尼菌卵黄抗体对感染蜂房哈夫尼菌的中蜂具有显著的预防效果和治疗效果;抗体纯化后可制成药品,用于治疗蜜蜂因感染蜂房哈夫尼菌引起的相关疾病。
Description
技术领域
本发明属于生物制药领域,具体涉及一种抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用。
背景技术
蜂房哈夫尼菌(Hafnia alvei)是一种革兰氏阴性杆状病原菌,与食物腐败关系密切,为冷藏肉制品、乳制品和水产品等食品腐败变质中的优势腐败菌株。蜂房哈夫尼菌病是严重威胁蜜蜂种群的传染性疾病,且已被证明可致蜜蜂败血症,在蜜蜂群中经常被发现,具有传播速度快、危害程度严重、病程持续时间长、污染蜂产品等特点。现有技术从蜜蜂的消化道和组织分离出蜂房哈夫尼菌,并通过实验将蜂房哈夫尼菌接种到蜜蜂的胸部,对蜜蜂进行感染,发现此菌造成了蜜蜂的败血症,且死亡率超过90%。蜂房哈夫尼病菌常见于蜜蜂春繁季节,该季节湿度较大、温差变化较大,蜜蜂采食了含该菌的污水或花粉感染,患病的成蜂污染巢脾,进而造成蜜蜂大量死亡。受感染蜜蜂的主要症状表现为蜂腹部膨大、行动迟缓、飞行无力、下痢等。
目前,蜂农通常通过中药水煎液进行预防和治疗蜂房哈夫尼菌病,采用的中药包括五倍子、黄连、黄芩、山楂、艾叶和连翘等;还有采用中西医结合的方法,使用头孢类、四环素类和氨基糖苷类的抗生素,如庆大霉素、呋喃唑酮、复方新诺明、氧氟沙星、诺氟沙星、环丙沙星、氨苄西林、头孢呋辛、头孢他啶和头孢哌酮等。大多数经磺胺类药物和四环素处理的动物所生产的食品都有最高残留限量(Minimal Risk Levels,MRLs),但蜂蜜及其它蜂产品中却没有MRLs。所以,很多蜂农为了保证蜂蜜的成活率和产蜜量,会使用相对高剂量的抗生素来治疗已受感染的蜜蜂,或者使用低剂量的抗生素作为“生长促进剂”,这就造成了抗生素很容易在蜂蜜中残留和超标。长期使用这种治疗方式更易造成蜜蜂的耐药性以及蜂蜜中这些抗生素的超标和残留。而残留有抗生素的蜂蜜被人食用后,可能在消费者体内直接产生毒性反应,或者产生过敏反应,或导致人体对抗生素耐药。
当鸟类受到外来抗原刺激后,法氏囊内的B细胞分化成为浆细胞,分泌特异性抗体进入血液循环,当血液流经卵巢时,特异性抗体在卵细胞中逐渐蓄积,形成卵黄抗体(Immunoglobulin of yolk,IgY)。作为一种免疫球蛋白,卵黄抗体在卵孵育过程中和孵育后能对幼鸟和幼禽起到保护作用。卵黄抗体的优势主要体现在:通过与抗原特异性结合,发挥抗菌和抗病毒作用;不会产生药物残留;生产技术较为成熟,产量高;可以减少对动物的应激,提高动物的福利。目前,卵黄抗体在畜牧业上已经得到较广泛的关注和应用,但在蜜蜂相关疾病治疗方面的应用却未见报道。
发明内容
本发明的目的在于提供一种抗蜂房哈夫尼菌卵黄抗体。
本发明的再一目的在于提供上述抗蜂房哈夫尼菌卵黄抗体的制备方法。
本发明的再一目的在于提供上述抗蜂房哈夫尼菌卵黄抗体的应用。
根据本发明具体实施方式的抗蜂房哈夫尼菌卵黄抗体,所述卵黄抗体为利用灭活蜂房哈夫尼菌为抗原免疫产蛋鸡,收集所述产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到。
根据本发明具体实施方式的抗蜂房哈夫尼菌卵黄抗体,所述卵黄抗体由包括以下步骤的方法制备得到:
(1)制备抗原:将蜂房哈夫尼菌灭活,作为抗原;
(2)免疫蛋鸡:将灭活的蜂房哈夫尼菌与棒状纳米氢氧化铝按照质量比为1:0.5~1.5混合乳化后,首次免疫产蛋鸡,再进行第二次、第三次加强免疫,收集鸡蛋;其中,棒状纳米氢氧化铝为长径800~1000纳米、短径200~300纳米的棒状氢氧化铝;
其中,第二次、第三次加强免疫用弗氏不完全佐剂,也可以用氢氧化铝佐剂。每次免疫间隔14天,完成免疫后第10天开始收集鸡蛋,于4℃冰箱保存。
(3)分离纯化卵黄,得到卵黄抗体。
根据本发明具体实施方式的抗蜂房哈夫尼菌卵黄抗体,步骤(1)中,将蜂房哈夫尼菌在营养肉汤中扩增培养至菌液浓度1~6×1010CFU/ml,最佳菌液浓度在4×1010CFU/ml时收集菌体,热灭活后用生理盐水稀释至1~6×108CFU/ml,最佳浓度是4×108CFU/ml,所得灭活蜂房哈夫尼菌为抗原。
根据本发明具体实施方式的抗蜂房哈夫尼菌卵黄抗体,步骤(3)中,在收集鸡蛋的卵黄液中加入9-10倍体积去离子水稀释,优化的稀释比例为10倍,调节pH至5.0,于-20℃冰箱中冷冻过夜;解冻后离心收集上清,用0.22μm的过滤膜(器)过滤,收集滤液,得到卵黄抗体粗提物;对卵黄抗体粗提物进一步纯化,得到抗蜂房哈夫尼菌卵黄抗体。
根据本发明具体实施方式的抗蜂房哈夫尼菌卵黄抗体,卵黄抗体粗提物纯化方法为:向卵黄抗体粗提物中加入饱和硫酸铵溶液至终浓度的45~75%,最佳是55%,搅拌均匀后4℃过夜,准确存放时间是12小时,4℃条件下离心,之后加入适量PBS溶液重悬,再次缓慢加入饱和硫酸铵溶液至终浓度的45~75%,最佳是33%,搅拌均匀后室温过夜,最佳环境温度是24℃,在室温下离心,用去离子水稀释沉淀至原体积,得到卵黄抗体提取液,得到的卵黄抗体提取液用透析袋充分透析,得到抗蜂房哈夫尼菌卵黄抗体。
根据本发明的具体实施方式的抗蜂房哈夫尼菌卵黄抗体的制备方法,所述制备方法包括以下步骤:
(1)制备抗原:将蜂房哈夫尼菌灭活,作为抗原;
(2)免疫蛋鸡:将灭活的蜂房哈夫尼菌与棒状纳米氢氧化铝按照质量比为1:0.5~1.5混合乳化后,首次免疫产蛋鸡,再进行第二次、第三次加强免疫,收集鸡蛋,其中,棒状纳米氢氧化铝为长径800~1000纳米、短径200~300纳米的棒状氢氧化铝;
(3)分离纯化卵黄,得到卵黄抗体。
根据本发明的具体实施方式的抗蜂房哈夫尼菌卵黄抗体的制备方法,将蜂房哈夫尼菌在营养肉汤中扩增培养至菌液浓度1~6×1010CFU/mL,热灭活后用生理盐水稀释至1~6×108CFU/mL,得到灭活蜂房哈夫尼菌抗原。
根据本发明的具体实施方式的抗蜂房哈夫尼菌卵黄抗体的制备方法,在收集鸡蛋的卵黄液中加入9~10倍体积去离子水稀释,调节pH至5.0,于-20℃冰箱中冷冻过夜;解冻后离心收集上清,过滤,收集滤液,得到卵黄抗体粗提物;对卵黄抗体粗提物进一步纯化,得到抗蜂房哈夫尼菌卵黄抗体。
根据本发明的具体实施方式的抗蜂房哈夫尼菌卵黄抗体的制备方法,向卵黄抗体粗提物中加入饱和硫酸铵溶液至终浓度的45~75%,搅拌均匀后,4℃过夜,4℃条件下离心,加入PBS溶液重悬,再次加入饱和硫酸铵溶液至终浓度的45-75%,搅拌均匀后,室温过夜,在室温下离心,用去离子水稀释沉淀至原体积,得到卵黄抗体提取液,得到的卵黄抗体提取液用透析袋充分透析,得到抗蜂房哈夫尼菌卵黄抗体。
一种检测方法抗蜂房哈夫尼菌卵黄抗体的效价,采用间接酶联免疫吸附试验(ELISA)检测抗蜂房哈夫尼菌卵黄抗体的效价。具体包括如下步骤:以2×108CFU/ml蜂房哈夫尼菌包被酶标板,每孔100μL,4℃包被过夜,PBST洗涤5次,后加入含1%BSA的封闭液,37℃封闭4h。洗涤5次后加入倍比稀释的抗蜂房哈夫尼菌卵黄抗体,同时设置空白对照和阴性对照,37℃孵育1h。洗涤5次后,加入辣根过氧化物酶标记的羊抗鸡二抗,37℃孵育1h。洗涤5次后,加入TMB显色液,37℃避光显色10min。然后2M H2SO4终止反应后用酶标仪在波长450nm处读取OD值。待测样品与阴性对照吸光值比值大于2.1判定为阳性,最大阳性稀释度为抗体效价。
PBST洗涤液为吐温-20与PBS缓冲液体积比1:2000的比例混合得到。
本发明的抗蜂房哈夫尼菌卵黄抗体可应用于预防和治疗蜂房哈夫尼菌引起疾病方面,可用于开发蜂房哈夫尼菌检测试剂盒和免疫学上的免疫诊断。
本发明的有益效果:
本发明选择棒状纳米氢氧化铝为佐剂,棒状纳米氢氧化铝的规格介于纳米和微米尺寸之间,能有效负载蜂房哈夫尼菌大分子抗原。棒状纳米氢氧化铝与蜂房哈夫尼菌全菌抗原乳化后首次免疫产蛋鸡,可以快速激活母鸡的免疫应答,从而提高蜂房哈夫尼菌抗原的免疫原性,得到的卵黄抗体效价高、纯度高,且对蜂房哈夫尼菌具有较强的抑制作用,并具有良好的特异性,同时抗体的制备方法简便,有利于低成本、大批量生产。本发明得到的卵黄抗体可用于由蜂房哈夫尼菌引起的疾病的预防和治疗,以及开发蜂房哈夫尼菌检测试剂盒及免疫诊断。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明抗蜂房哈夫尼菌特异性卵黄抗体的非还原性SDS-PAGE凝胶电泳检测结果,泳道1:国产蛋白Marker,泳道2:纯化的抗蜂房哈夫尼菌卵黄抗体IgY;
图2为抗蜂房哈夫尼菌卵黄抗体饲喂保护实验生存曲线图,其中,A为无抗体组,B为非特异性IgY粉组,C为土霉素组,D为特异性IgY粉组。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
实施例1制备抗蜂房哈夫尼菌卵黄抗体
1.1培养蜂房哈夫尼菌并灭活制备抗原
接种蜂房哈夫尼菌于营养琼脂固体培养基,37℃倒置培养12h后,挑取单菌落接种于营养肉汤培养基中,在37℃,180rpm条件下,摇床振荡培养12h后,调节营养肉汤培养基中的蜂房哈夫尼菌菌量为4×1010CFU/ml,然后离心分离得到蜂房哈夫尼菌沉淀。将沉淀用生理盐水重悬洗净2次后,得到蜂房哈夫尼菌菌量为4×1010CFU/ml的菌悬液。70℃恒温水浴灭活1.5h,即得到灭活的蜂房哈夫尼菌抗原,于4℃冰箱备用。
1.2免疫蛋鸡并收集鸡蛋
将蛋鸡进行初次免疫和2~3次加强免疫。
初次免疫步骤为:将灭活蜂房哈夫尼菌加入等量的弗氏完全佐剂,充分乳化后对母鸡进行注射免疫,特别是使用棒状纳米氢氧化铝为佐剂,按照与抗原1:1比列乳化后首次免疫产蛋鸡;
加强免疫步骤为:将灭活的蜂房哈夫尼菌抗原加入等量的弗氏不完全佐剂(或市售的常规氢氧化铝佐剂),充分乳化后对蛋鸡进行注射免疫,每次免疫间隔14天,完成免疫后第10天开始收集鸡蛋,于4℃冰箱保存。
1.3蜂房哈夫尼菌菌体灭活作为疫苗免疫产前母鸡
实验动物:50只130日龄雌性罗曼蛋鸡,随机分为5组,包括4个实验组和1个对照组,每组10只。单次免疫抗原体积为100uL,分别第0d、14d、28d胸部肌肉注射。
实验组1:每只鸡胸部肌肉免疫100uL蜂房哈夫尼菌菌体抗原疫苗;
实验组2:每只鸡胸部肌肉免疫100uL蜂房哈夫尼菌菌体抗原+棒状纳米铝佐剂疫苗;
实验组3:每只鸡胸部肌肉免疫100uL蜂房哈夫尼菌菌体抗原+普通铝佐剂疫苗;
实验组4:每只鸡胸部肌肉免疫100uL蜂房哈夫尼菌菌体抗原+弗氏佐剂疫苗;
对照组1:每只鸡胸部肌肉免疫100uL生理盐水。
首免后的早期(第7天)采集首免母鸡血清,采用公认的ELISA法检测抗体滴度的结果见表1。
表1 免疫结果对比数据
结果如表1所示,在首免后的早期(第7天),生理盐水组、普通铝佐剂和弗氏佐剂组三个组抗体滴度分别是0.01、89.0、125.0,而本发明采用棒状纳米氢氧化铝辅佐的蜂房哈夫尼菌抗原所产生的抗体滴度达256.0,能更有效地引起机体产生免疫反应,产生更多的保护性抗体。
1.4分离纯化卵黄抗体
用酒精将免疫鸡蛋的蛋壳擦拭干净后破壳并分离卵黄,然后对卵黄加入冷却水,稀释10倍。用0.1mol/L盐酸溶液调节pH至5.0,于-20℃冰箱中冷冻过夜,去脂。次日解冻,将卵黄稀释液转入离心管中,10,000r/min,4℃,离心10min,取上清液即为水溶性组分(WSF)并测量体积。
将分离出的卵黄液使用硫酸铵沉淀法进行纯化以获得抗体。根据测量的WSF体积,缓慢加入饱和硫酸铵溶液至终浓度为55%,避免局部盐度过高而造成蛋白质变性,置于磁力搅拌器上搅拌混匀。10,000r/min,4℃离心15min,弃上清液,加入适量PBS溶液重悬,重复上述步骤再次缓慢加入33%的硫酸铵溶液,搅拌混匀后,4℃静置过夜,10,000r/min,4℃离心15min,弃上清液。加入少量PBS溶液重悬,转移入透析袋中。透析袋使用前应在透析液中浸泡,并确定透析袋不漏方可使用。将装有蛋白溶液的透析袋置于透析液中,4℃充分透析,每12h更换透析液一次。待透析完成后,使用0.22μm的过滤器过滤除菌,最终获得的IgY溶液,分装存于-20℃冰箱中备用。
将过滤后的卵黄抗体液在-80℃条件下预冻2h,然后在真空度20Pa下,冷冻干燥,24h后得到纯化的抗蜂房哈夫尼菌卵黄抗体冻干粉。
实施例2卵黄抗体的效价检测
采用间接酶联免疫吸附法(ELISA)检测效价,用2×108CFU/ml蜂房哈夫尼菌包被酶标板,每孔100μL,4℃包被过夜,PBST洗涤5次,后加入含1%BSA的封闭液,37℃封闭4h。洗涤5次后加入倍比稀释的抗蜂房哈夫尼菌卵黄抗体,同时设置空白对照和阴性对照,37℃孵育1h。洗涤5次后,加入辣根过氧化物酶标记的羊抗鸡二抗,37℃孵育1h。洗涤5次后,加入TMB显色液,37℃避光显色10min。然后2M H2SO4终止反应后用酶标仪读取450nm的OD值。
待测样品与阴性对照吸光值比值大于2.1判定为阳性,最大阳性稀释度为抗体效价。
本发明制备的抗蜂房哈夫尼菌卵黄抗体效价为1:600000。
实施例3鉴定卵黄抗体浓度和纯度
取纯化蛋白液10mL,稀释10倍后,用BCA蛋白浓度测定试剂盒测定浓度,测得蛋白浓度为9.862mg/mL。取蛋白液15μL与等量2×loading Buffer混匀后沸水浴10min,进行12%还原性SDS-PAGE电泳。
结果如图1所示,抗体IgY的重链,轻链分别位于65KD、30KD条带处,总分子量约为180KD。
用YMC-BioPro Q75阴离子交换填料和YMC-Pack Diol-200体积排阻色谱柱从蛋黄提取物中分离纯化IgY抗体。具体是:首先用YMC-BioPro Q75阴离子交换填料分离富集;然后用YMC-Pack Diol-200体积排阻色谱柱分离纯化,进一步用体积排阻色谱法分析获得的纯化物。
结果显示:从蛋黄粗提物中分离纯化得到的卵黄抗体IgY纯度达到99.3%。
实施例4体外抑菌试验
将蜂房哈夫尼菌接种于营养肉汤培养基中,37℃,180rpm摇床培养,调节菌浓度至2×108CFU/ml,分别取150μL抗蜂房哈夫尼菌卵黄抗体和非特异性卵黄抗体(由市售的普通鸡蛋中提取得到),加入等量菌液混匀后置于37℃培养箱结合15min,取100μL涂布营养琼脂平板,各设置3个重复,37℃倒置培养24h后拍照计数。
抑菌实验表明:加入卵黄抗体的一组能明显抑制蜂房哈夫尼菌的生长,其菌量是加入非特异性卵黄抗体组的1/4-1/5。
实施例5抗蜂房哈夫尼菌卵黄抗体在治疗由蜂房哈夫尼菌引起疾病的效果
5.1确定半数致死量
对250只健康的蜜蜂进行饲喂,设4个实验组和1个对照组,每组各50只。实验组分别使用1014、1015、1016、1017CFU/ml浓度的蜂房哈夫尼菌进行攻毒实验,实验组饲喂1mL含蜂房哈夫尼菌的蜂粮,对照组饲喂不含菌液的蜂粮,其中蜂粮由60%大豆粉、20%蜂花粉、20%食用白糖(蔗糖)组成。记录各组蜜蜂死亡数,计算各组死亡率。
结果见表1:
表1半数致死量测定实验
结果如表1所示,在饲喂攻毒实验中,随着菌浓度的增加死亡率显著增加,死亡率与蜂房哈夫尼菌浓度有剂量依赖性。最后计算得蜂房哈夫尼菌的半数致死量LD50=2×1016CFU/ml。
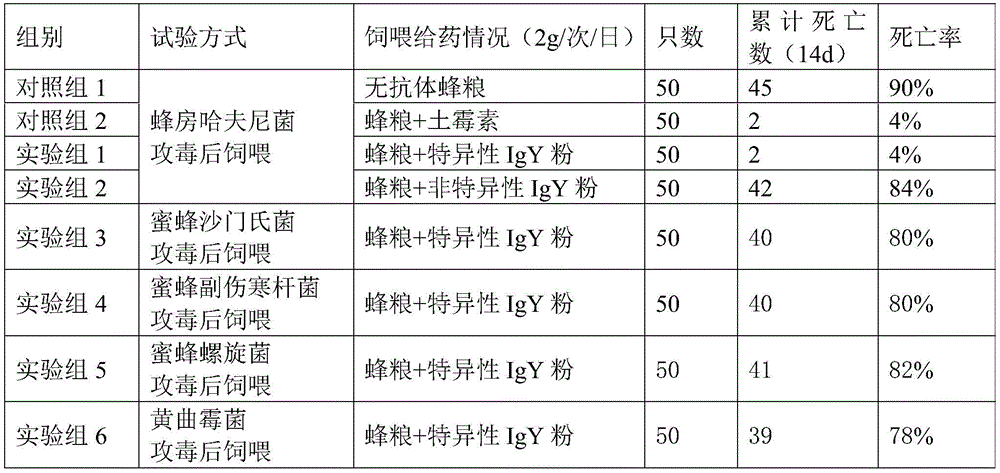
5.2饲喂保护试验
饲喂治疗试验先以半数致死量浓度的蜂房哈夫尼菌菌液对蜜蜂进行攻毒,再饲喂添加含1%特异性IgY粉的蜂粮(实验组1),以非特异性IgY粉为空白对照(实验组2),以无抗体蜂粮为对照组1,以添加土霉素的蜂粮为阳性对照(对照组2)。
用非蜂房哈夫尼菌的致病菌以半数致死量浓度对蜜蜂进行攻毒,考察本发明卵黄抗体的特异性,具体为:蜜蜂沙门氏菌攻毒后,饲喂含1%特异性IgY粉的蜂粮(实验组3);蜜蜂副伤寒杆菌攻毒后,饲喂含1%特异性IgY粉的蜂粮(实验组4);蜜蜂螺旋菌攻毒后,饲喂含1%特异性IgY粉的蜂粮(实验组5);黄曲霉菌攻毒后,饲喂含1%特异性IgY粉的蜂粮(实验组6)。
其中,特异性IgY是指抗蜂房哈夫尼菌特异性卵黄抗体,由本发明制备得到的纯化的抗蜂房哈夫尼菌卵黄抗体冻干粉用PBS,蜂粮稀释至实验浓度后使用。所述的非特异性IgY是指抗蜂房哈夫尼菌非特异性卵黄抗体,由市售的普通鸡蛋中提取得到。结果见表2、图2。
表2 饲喂保护试验
如图2可知,饲喂3天内,A组和B组的蜜蜂幼虫出现大量死亡,而C组和D组在7天内几乎没有出现死亡情况,其中C组在14天后存活48只,保护率为96%,表明按本发明制备的抗蜜蜂幼虫芽孢杆菌卵黄抗体,对受高浓度蜂房哈夫尼菌攻击的蜜蜂幼虫有明显的保护作用和延迟死亡的作用,能够运用于预防和治疗蜜蜂幼虫由蜂房哈夫尼均菌导致的疾病,可以开发预防和治疗由蜂房哈夫尼菌导致的疾病的蜜蜂蜂粮和药物。
由表2结果可知,将特异性IgY粉,通过饲喂方式给患病蜜蜂施用后,症状明显减轻,死亡率显著降低,说明抗蜂房哈夫尼菌卵黄抗体对由蜂房哈夫尼菌引起病症具有良好的保护作用。而用蜜蜂沙门氏菌、蜜蜂副伤寒杆菌、蜜蜂螺旋菌、黄曲霉菌对蜜蜂进行攻毒后,再饲喂特异性IgY粉,蜜蜂的死亡率与对照组1、实验组2的死亡率基本相同,说明本发明抗蜂房哈夫尼菌特异性卵黄抗体具有良好的特异性。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
Claims (10)
1.抗蜂房哈夫尼菌卵黄抗体,其特征在于,所述卵黄抗体为利用灭活蜂房哈夫尼菌为抗原免疫产蛋鸡,收集所述产蛋鸡的鸡蛋,并从免疫鸡蛋卵黄中分离和纯化得到。
2.根据权利要求1所述的抗蜂房哈夫尼菌卵黄抗体,其特征在于,所述卵黄抗体由包括以下步骤的方法制备得到:
(1)制备抗原:将蜂房哈夫尼菌灭活,作为抗原;
(2)免疫蛋鸡:将灭活的蜂房哈夫尼菌与棒状纳米氢氧化铝按照质量比为1:0.5~1.5混合乳化后,首次免疫产蛋鸡,再进行第二次、第三次加强免疫,收集鸡蛋;其中,棒状纳米氢氧化铝为长径800~1000纳米、短径200~300纳米的棒状氢氧化铝;
(3)分离纯化卵黄,得到卵黄抗体。
3.根据权利要求2所述的抗蜂房哈夫尼菌卵黄抗体,其特征在于,步骤(1)中,将蜂房哈夫尼菌在营养肉汤中扩增培养至菌液浓度1~6×1010CFU/mL,热灭活后用生理盐水稀释至1~6×108CFU/mL,得到灭活蜂房哈夫尼菌抗原。
4.根据权利要求2所述的抗蜂房哈夫尼菌卵黄抗体,其特征在于,步骤(3)中,在收集鸡蛋的卵黄液中加入9~10倍体积去离子水稀释,调节pH至5.0,于-20℃冰箱中冷冻过夜;解冻后离心收集上清,过滤,收集滤液,得到卵黄抗体粗提物;对卵黄抗体粗提物进一步纯化,得到抗蜂房哈夫尼菌卵黄抗体。
5.根据权利要求4所述的抗蜂房哈夫尼菌卵黄抗体,其特征在于,向卵黄抗体粗提物中加入饱和硫酸铵溶液至终浓度的45~75%,搅拌均匀后,4℃过夜,4℃条件下离心,加入PBS溶液重悬,再次加入饱和硫酸铵溶液至终浓度的45-75%,搅拌均匀后,室温过夜,在室温下离心,用去离子水稀释沉淀至原体积,得到卵黄抗体提取液,将得到的卵黄抗体提取液用透析袋充分透析,得到抗蜂房哈夫尼菌卵黄抗体。
6.权利要求1所述的抗蜂房哈夫尼菌卵黄抗体的制备方法,其特征在于,所述制备方法包括以下步骤:
(1)制备抗原:将蜂房哈夫尼菌灭活,作为抗原;
(2)免疫蛋鸡:将灭活的蜂房哈夫尼菌与棒状纳米氢氧化铝按照质量比为1:0.5~1.5混合乳化后,首次免疫产蛋鸡,再进行第二次、第三次加强免疫,收集鸡蛋;其中,棒状纳米氢氧化铝为长径800~1000纳米、短径200~300纳米的棒状氢氧化铝;
(3)分离纯化卵黄,得到卵黄抗体。
7.根据权利要求6所述的抗蜂房哈夫尼菌卵黄抗体的制备方法,其特征在于,将蜂房哈夫尼菌在营养肉汤中扩增培养至菌液浓度1~6×1010CFU/mL,热灭活后用生理盐水稀释至1~6×108CFU/mL,得到灭活蜂房哈夫尼菌抗原。
8.根据权利要求6所述的抗蜂房哈夫尼菌卵黄抗体的制备方法,其特征在于,在收集鸡蛋的卵黄液中加入9~10倍体积去离子水稀释,调节pH至5.0,于-20℃冰箱中冷冻过夜;解冻后离心收集上清,过滤,收集滤液,得到卵黄抗体粗提物;对卵黄抗体粗提物进一步纯化,得到抗蜂房哈夫尼菌卵黄抗体。
9.根据权利要求6所述的抗蜂房哈夫尼菌卵黄抗体的制备方法,其特征在于,向卵黄抗体粗提物中加入饱和硫酸铵溶液至终浓度的45~75%,搅拌均匀后,4℃过夜,4℃条件下离心,加入PBS溶液重悬,再次加入饱和硫酸铵溶液至终浓度的45-75%,搅拌均匀后,室温过夜,在室温下离心,用去离子水稀释沉淀至原体积,得到卵黄抗体提取液,得到的卵黄抗体提取液用透析袋充分透析,得到抗蜂房哈夫尼菌卵黄抗体。
10.权利要求1所述的抗蜂房哈夫尼菌卵黄抗体在预防和治疗蜂房哈夫尼菌引起疾病方面的应用。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110029650.9A CN112625126A (zh) | 2021-01-11 | 2021-01-11 | 抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110029650.9A CN112625126A (zh) | 2021-01-11 | 2021-01-11 | 抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN112625126A true CN112625126A (zh) | 2021-04-09 |
Family
ID=75293740
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110029650.9A Pending CN112625126A (zh) | 2021-01-11 | 2021-01-11 | 抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN112625126A (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113265351A (zh) * | 2021-05-11 | 2021-08-17 | 昆明理工大学 | 一株乳杆菌w8172及其应用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060275764A1 (en) * | 2002-12-03 | 2006-12-07 | Aarhus Universitet | Method for determining predisposition to manifestation of immune system related diseases |
| CN105198989A (zh) * | 2015-09-30 | 2015-12-30 | 大连理工大学 | 抗黄海希瓦氏菌卵黄抗体及其制备方法 |
| CN108324939A (zh) * | 2018-03-06 | 2018-07-27 | 重庆大学 | 一种棒状纳米氢氧化铝佐剂的制备方法及应用 |
| WO2020109490A1 (en) * | 2018-11-28 | 2020-06-04 | Targedys | Hafnia alvei formulations |
-
2021
- 2021-01-11 CN CN202110029650.9A patent/CN112625126A/zh active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060275764A1 (en) * | 2002-12-03 | 2006-12-07 | Aarhus Universitet | Method for determining predisposition to manifestation of immune system related diseases |
| CN105198989A (zh) * | 2015-09-30 | 2015-12-30 | 大连理工大学 | 抗黄海希瓦氏菌卵黄抗体及其制备方法 |
| CN108324939A (zh) * | 2018-03-06 | 2018-07-27 | 重庆大学 | 一种棒状纳米氢氧化铝佐剂的制备方法及应用 |
| WO2020109490A1 (en) * | 2018-11-28 | 2020-06-04 | Targedys | Hafnia alvei formulations |
Non-Patent Citations (5)
| Title |
|---|
| YINGLI CHEN等: "Aluminum (oxy) Hydroxide Nanorods Activate an Early Immune Response in Pseudomonas aeruginosa Vaccine", 《ACS APPL. MATER. INTERFACES》 * |
| 上海群己生物科技有限公司: "PAB0025:Hafnia alvei哈夫尼菌 antibody", 《上海群己生物科技有限公司》 * |
| 朱香萍等: "对虾鳗弧菌卵黄抗体(IgY)的制备及其对人工感染的保护研究", 《海洋科学》 * |
| 邱吉宇等: "贵州中蜂蜂房哈夫尼菌的分离鉴定及药敏试验", 《中国畜牧兽医》 * |
| 郭鑫主编: "《动物免疫学试验教程》", 28 February 2017 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113265351A (zh) * | 2021-05-11 | 2021-08-17 | 昆明理工大学 | 一株乳杆菌w8172及其应用 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8198067B2 (en) | Delivery of disease control in aquaculture and agriculture using microbes containing bioactive proteins | |
| CN101343320B (zh) | 抗副溶血弧菌的鸡卵黄抗体、其制备方法及应用 | |
| CN105198988A (zh) | 抗灿烂弧菌卵黄抗体及其制备方法 | |
| Xu et al. | Immunomodulatory effects of chicken egg yolk antibodies (IgY) against experimental Shewanella marisflavi AP629 infections in sea cucumbers (Apostichopus japonicus) | |
| KR102047784B1 (ko) | 송아지 소화기성 질병의 예방 또는 치료용 난황항체 제조방법, 이에 의해 제조된 난황항체 및 이의 용도 | |
| JPH0657663B2 (ja) | 多機能特異的抗体の製造方法 | |
| Zhang et al. | Passive protection of Japanese pufferfish (Takifugu rubripes) against Vibrio harveyi infection using chicken egg yolk immunoglobulins (IgY) | |
| Chen et al. | Effects of antibacterial compound of Saccharomyces cerevisiae from koumiss on immune function and caecal microflora of mice challenged with pathogenic Escherichia coli O8 | |
| US6162441A (en) | Method for the production of anti-escherichia. coli O157 : H7 antibody | |
| CN104606675A (zh) | 一种禽用多联特异性卵黄抗体及转移因子的制备方法 | |
| CN100412092C (zh) | 一种抗大肠杆菌的鸡卵黄抗体及其制备方法与应用 | |
| CN112625126A (zh) | 抗蜂房哈夫尼菌卵黄抗体及其制备方法和应用 | |
| Park et al. | Immunological efficacy of Vibrio vulnificus bacterins given as an oral vaccine in the flounder, Paralichthys olivaceus | |
| KR20210060688A (ko) | 새우 폐사 방지용 난황항체의 제조방법 | |
| Kumaran et al. | The production and influence of anti-Vibrio parahaemolytics IgY against experimental infection of V. parahaemolyticus in cultured Fenneropenaeus indicus | |
| KR100267746B1 (ko) | 돼지 대장균 설사증 예방 및 치료용 난황항체를 이용한 경구용 면역제제 | |
| KR100422074B1 (ko) | 항 대장균, 살모넬라 엔테라이티디스, 살모넬라티피뮤리움 및 헬리코박터 피로리의 특수면역단백질을공유한 계란 생산방법 및 상기 생산방법으로 생산된 계란,난황 및 상기 항-혼합균 특수면역단백질을 함유한요구르트 및 아이스크림 | |
| CN112625127A (zh) | 抗蜜蜂幼虫芽孢杆菌卵黄抗体及其制备方法和应用 | |
| RU2683027C2 (ru) | Поливалентная иммунизирующая и/или терапевтическая композиция для применения при бактериальных инфекциях или пищевом отравлении, в частности сальмонеллёзе, способ получения этой композиции, её применение и вакцина, содержащая эту композицию | |
| Chae et al. | Effects of egg yolk antibodies produced in response to different antigenic fractions of E. coli O157: H7 on E. coli suppression | |
| CN102977209A (zh) | 一种防治奶牛乳房炎的多价卵黄免疫球蛋白的制备方法及应用 | |
| RU2145353C1 (ru) | Штамм бактерий moraxella bovis "г97-вниви", используемый для изготовления диагностикумов и вакцин против инфекционного кератоконъюнктивита крупного рогатого скота | |
| KR100353473B1 (ko) | 이 콜라이 오일오칠 에이치 칠 균의 항체 제조방법 | |
| KR100403282B1 (ko) | 항-대장균 및 항-헬리코박터 피로리 혼합특수면역단백질함유 난황과 알로에분말, 녹차추출물분말및 들깨잎분말을 함유한 헬리코박터 피로리 성장억제식품조성물 및 상기 조성물을 함유한 요구르트 | |
| CN116751290A (zh) | 抗创伤弧菌、河流弧菌和霍乱弧菌卵黄抗体的制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20210409 |
|
| RJ01 | Rejection of invention patent application after publication |