CN111509224B - 一种联动改性的富锂锰基正极材料及其制备方法 - Google Patents
一种联动改性的富锂锰基正极材料及其制备方法 Download PDFInfo
- Publication number
- CN111509224B CN111509224B CN202010310251.5A CN202010310251A CN111509224B CN 111509224 B CN111509224 B CN 111509224B CN 202010310251 A CN202010310251 A CN 202010310251A CN 111509224 B CN111509224 B CN 111509224B
- Authority
- CN
- China
- Prior art keywords
- lithium
- rich manganese
- preparation
- calcination
- cathode material
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/50—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese
- H01M4/505—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese of mixed oxides or hydroxides containing manganese for inserting or intercalating light metals, e.g. LiMn2O4 or LiMn2OxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
- H01M10/0525—Rocking-chair batteries, i.e. batteries with lithium insertion or intercalation in both electrodes; Lithium-ion batteries
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/62—Selection of inactive substances as ingredients for active masses, e.g. binders, fillers
- H01M4/628—Inhibitors, e.g. gassing inhibitors, corrosion inhibitors
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/021—Physical characteristics, e.g. porosity, surface area
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/026—Electrodes composed of, or comprising, active material characterised by the polarity
- H01M2004/028—Positive electrodes
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Inorganic Chemistry (AREA)
- Materials Engineering (AREA)
- Manufacturing & Machinery (AREA)
- Battery Electrode And Active Subsutance (AREA)
Abstract
本发明公开了一种联动改性的富锂锰基正极材料及其制备方法,属于锂离子电池正极材料技术领域。联动改性的富锂锰基正极材料具有核壳球状结构,内核为铈掺杂的层状富锂锰基正极材料,亚表层为尖晶石型Li4Mn5O12,表层为富含氧缺陷的Li2CeO3材料,其制备方法为:将铈盐经过煅烧去除结晶水后与过渡金属氧化物前驱体分散于有机溶剂中,加热,搅拌,干燥,再与锂盐研磨均匀后煅烧,即得同时具有较好的晶格稳定性和电极/电解液界面稳定性的联动改性的富锂锰基正极材料,克服现有正极材料表面碱度高、倍率性能差、循环过程中容量和电压衰减严重等问题,且该正极材料的制备方法简单,成本低,有利于大规模生产。
Description
技术领域
本发明涉及一种锂离子电池富锂锰基正极材料及其制备方法,具体涉及一种联动改性的富锂锰基正极材料及其制备方法,属于锂离子电池材料技术领域。
背景技术
锂离子电池作为一种新型的二次电源,具有比能量高、无记忆效应、循环寿命长、环境污染小等优点,为能源网络的蓬勃发展注入了新鲜的血液。锂离子电动汽车是新能源汽车家族中的重要组成部分,高能量密度锂离子动力电池作为电动汽车的“心脏”,可以有效克服电动汽车领域“里程焦虑”的问题。近年来,锂离子动力电池的需求量呈爆发式增长,据统计,2019年我国动力电池产量累计为85.4GWh,较2018年同比累计增长21%,高能量密度正极材料作为锂离子动力电池的关键部分,受到了研究者的广泛关注。
富锂锰基正极材料在过渡金属阳离子与氧阴离子氧化还原的耦合作用下具有较高的比容量(~250mAh g-1),是最有潜力的下一代高能量密度锂离子电池正极材料之一。氧阴离子氧化还原包含体相内的可逆氧化还原()和表面的不可逆晶格氧流失(O2-→O2)。然而,不可逆晶格氧流失在循环过程中会诱发过渡金属的不可逆迁移与晶格扭曲,最终导致正极材料的容量衰减、放电电压下降以及电化学反应过程的动力学缓慢等问题。此外,Ni4+在高压充电状态下具有较高的活性,诱发电极/电解液界面的副反应发生,使得电极表面的过渡金属溶解、不可逆迁移与结构畸变。电极/电解液界面副反应与不可逆晶格氧流失的协同作用会加剧正极材料的容量衰减、放电电压下降以及反应动力学迟缓。因此,当前最大的挑战是不仅要诱发氧阴离子氧化还原,而且要稳定氧化还原过程中引起的结构变化与晶格氧流失。
申请公开号为CN 110492095 A(申请号为201910747712.2)的中国发明专利申请公开了一种锂离子电池富锂锰基正极材料的掺杂改性方法,所述实施例中的富锂锰基正极材料为Li[Li0.2Mn0.53Ni0.13Co0.13Sn0.01]O2。具体改性步骤如下:(1)将1mol/L的镍、钴、锰和锡的氯化物盐溶液与沉淀剂碳酸钠溶液以及氨水分别加入反应器中,控制沉淀过程的pH为8.0,沉淀温度为55℃,搅拌速度800r/min,陈化时间6h,静置24h,多次洗涤后,90℃真空干燥8h,获得相应的碳酸盐前驱体;(2)将获得的碳酸盐前驱体与质量过量系数为5%的一水合氢氧化锂研磨0.5h,置于空气气氛的管式炉中煅烧,以3℃/min的升温速率升温至450℃,恒温5h,然后继续升温至850℃,恒温12h,自然冷却后获得富锂锰基正极材料。该方法采用传统的共沉淀法实现晶格掺杂,在一定程度上可以提高晶体结构的稳定性;但是,所制备的正极材料在循环过程中会直接与电解液接触,电极/电解液界面发生的副反应会进一步诱发晶格氧流失、过渡金属溶解与迁移,从而加速富锂锰基正极材料在循环过程中的容量衰减与电压下降。
申请公开号为CN 108172808 A(申请号为201810039772.4.2)的中国发明专利申请公开了一种锂离子电池富锂锰基正极材料表面改性的方法,所述实施例中的富锂锰基正极材料为Li[Li0.2Mn0.54Ni0.13Co0.13]O2。具体改性步骤如下:(1)将一定量的富锂锰基正极材料分散到二次水溶剂中,超声震荡形成均匀的混合分散液;(2)将一定量的六水合硝酸铈与五水氯化锡溶解到二次水溶剂中,搅拌均匀,然后加入NaOH溶液,将体系的pH调节至12;(3)将上述两种溶液混合均匀后,经180℃水热反应12h,洗涤干燥后,获得富锂锰基前驱体材料;(4)将前驱体在500~600℃下煅烧4~6h,自然冷却后获得铈锡复合物表面改性的富锂锰基正极材料。该方法通过水热法实现表面复合物包覆,在一定程度上可以稳定电极/电解液的界面,抑制充放电过程中的副反应发生;但是,该方法所制备的正极材料的本体晶格结构尚未获得优化,在循环过程中容易引发晶格扭曲,进而诱发相变,使得循环过程中的电压与容量衰减严重。因此,寻求一种“多重-联动”的富锂锰基正极材料的改性方法对于改善富锂锰基正极材料的循环过程中的容量衰减与电压降至关重要。
发明内容
针对现有技术中富锂锰基正极材料存在的上述缺陷,本发明的第一个目的是在于提供一种同时具有较好的晶格稳定性和电极/电解液界面稳定性的联动改性的富锂锰基正极材料,不但可以抑制循环过程中晶格氧流失,而且可以抑制过渡金属溶解与迁移,从而可以缓解富锂锰基正极材料在循环过程中的容量衰减与电压下降,可以有效克服现有正极材料存在表面碱度高、倍率性能差、循环过程中容量和电压衰减严重等问题。
本发明还提供了一种联动改性的富锂锰基正极材料的制备方法,该方法工艺步骤简单、原料成本低,有利于大规模推广生产。
为了实现上述技术目的,本发明提供了一种联动改性的富锂锰基正极材料,其具有微米级核壳球状结构;其中,内核由铈掺杂的层状富锂锰基正极材料构成,所述层状富锂锰基正极材料的化学通式为xLi2MnO3·(1-x)LiTMO2,其中,TM为Ni、Co和Mn中的至少一种元素,0.2≤x≤0.8,壳层包括亚表层和表层,所述亚表层由尖晶石型Li4Mn5O12构成,所述表层由富含氧缺陷的Li2CeO3材料构成。
作为一个优选的方案,Li2CeO3材料与层状富锂锰基正极材料的质量比为1~10:100。
本发明还提供了一种联动改性的富锂锰基正极材料的制备方法,其包括以下步骤:
1)将铈盐经过脱除结晶水,得到脱水铈盐;
2)将脱水铈盐与过渡金属氧化物前驱体材料置于有机溶剂介质中通过加热搅拌方式混合均匀,干燥,得到混合前驱体材料;
3)将混合前驱体材料与锂源研磨混合,煅烧,即得。
作为一个优选的方案,所述铈盐包括六水硝酸铈、十水草酸铈、七水氯化铈中至少一种。这些铈盐为市面上常见的,可以直接购买获得的。
作为一个优选的方案,所述过渡金属氧化物前驱体材料为过渡金属碳酸盐、过渡金属草酸盐、过渡金属氢氧化物中至少一种;所述过渡金属包括Ni、Co和Mn中的至少一种。
作为一个优选的方案,所述有机溶剂包括甲醇、乙醇、正丙醇、异丙醇中至少一种。优选的有机溶剂主要为短链醇,采用这些醇类作为介质对脱水铈盐与过渡金属氧化物前驱体材料的润湿性能好,可以促进两者混合均匀,且容易挥发脱除。
作为一个优选的方案,所述锂源包括碳酸锂、一水合氢氧化锂、氢氧化锂、硝酸锂中至少一种。这些锂源为制备正极材料过程中常见的锂源。
作为一个优选的方案,所述铈盐脱除结晶水的过程为:将铈盐置于200~400℃的温度范围及空气气氛下,煅烧2~5h。大量实验表明,将铈盐中的结晶水深度脱除,在后续的高温煅烧过程中可以诱导尖晶石相的形成,从而形成了在层状富锂锰基正极材料与富含氧缺陷的Li2CeO3材料之间形成了尖晶石型Li4Mn5O12过渡层。铈盐煅烧脱水过程采用的加热装置为马弗炉、管式炉或竖炉。煅烧过程中的升温速度为3~10℃/min,通过控制煅烧条件可以高效脱除铈盐中的结晶水。
作为一个优选的方案,所述过渡金属氧化物前驱体材料和脱水铈盐及有机溶剂介质的初始液固体积质量比为20~50mL/g。
作为一个优选的方案,所述加热搅拌的条件为:搅拌转速为300~500r/min,搅拌时间为5~8h,加热温度为60~100℃。
作为一个优选的方案,所述锂源的质量过量系数为3~10%。锂源的质量过量系数是以将过渡金属氧化物前驱体材料及铈盐全部转化成相应锂盐所需锂源的理论质量为100%计量,过量3~10%。
作为一个优选的方案,所述研磨混合时间为0.5~1h。
作为一个优选的方案,所述煅烧采用两段煅烧方式:第一段煅烧为在500~700℃下煅烧5~10h,第二段煅烧为在800~900℃下煅烧10~15h;所述煅烧在氧化气氛中进行。第一段煅烧的目的主要是使锂源分解成氧化物,便于第二段煅烧的固溶反应,而第二段煅烧目的是使前驱体分解成氧化物的同时与锂源的分解产物充分发生固溶反应,第二段煅烧过程有利于尖晶石型Li4Mn5O12的形成。煅烧过程采用管式炉或竖炉进行煅烧。煅烧过程中氧气流量控制为0.5~2m3/h,煅烧过程中升温速度为3~10℃/min。煅烧完成后采用自然冷却方式。
作为一个优选的方案,所述干燥的温度为60~100℃,干燥时间为18~24h。干燥过程一般采用真空干燥箱或鼓风干燥箱。
相对现有技术,本发明的技术方案带来的有益效果如下:
(1)本发明提供的联动改性的富锂锰基正极材料可以同步获得多重改性优势,铈盐在同步锂化过程中会扩散至前驱体的亚表层内部,促进过渡金属的迁移,从而诱导Li4Mn5O12尖晶石相的生成,同时利用铈离子的氧化性,可以将亚表层中的Ni2+氧化至Ni3+,降低层状材料中的锂/镍混排度,稳定富锂锰基正极材料的层状结构,促进锂离子的嵌入、脱出,提高富锂锰基正极材料的循环稳定性。此外,Ce掺杂进入锰基正极材料中会形成Ce-O键,另一方面Ce和相邻原子之间由于存在静电作用也会产生伪键合作用,稳定晶格氧演变,抑制充电过程中的晶格氧流失,最终协同抑制富锂锰基正极材料在循环过程中的容量衰减与电压降。
(2)本发明提供的联动改性的富锂锰基正极材料可以同步获得多重改性优势,亚表层的Ce掺杂会诱发过过渡金属迁移,诱导形成具有三维通道结构和较弱姜泰勒效应的富锂尖晶石锰酸锂(Li4Mn5O12)的形成。层状结构与尖晶石结构具有相似的氧密排堆积形式,两相共存会自发形成异质结,进而诱导内建电场的产生,内建电场可以促进电荷的重排,从而促进电荷的转移和抑制层状结构中氧阴离子的外迁,进一步抑制充电过程中的晶格氧流失,从而提升电极材料的放电容量下降与电压降。
(3)本发明提供的联动改性的富锂锰基正极材料可以同步获得多重改性优势,表层的铈盐与锂盐在高温下会反应生成具有氧空位的Li2CeO3,空位的存在会降低电极与电解液界面处的电荷转移能垒,促进锂离子在界面位点的键合,加速锂离子的扩散;表面均匀的Li2CeO3包覆可以有效抑制电解液与电极活性材料的直接接触,可以抑制电极/电解液界面的副反应发生,缓解表层过渡金属溶解与迁移,从而提升电极材料的循环稳定性。
(4)本发明提供的联动改性的富锂锰基正极材料可以同步获得多重改性优势,将联动改性的富锂锰基正极材料用于锂离子电池电化学性能测试,结果表明,在2~4.8V,2C电流密度下循环300次后(1C=250mA/g),容量保持率高达96.1%,平均放电电压降仅为0.57V,说明本发明材料作为锂离子电池正极材料具有优异的放电比容量保持率与卓越的平均放电电压稳定性。
(5)本发明提供的联动改性的富锂锰基正极材料的制备工艺简单,稀土原料和工艺成本低廉,易于推广,是一种有效抑制富锂锰基正极材料在循环过程中容量衰减与电压降的方法。
附图说明
图1为对比例1所得样品(LMO)的扫描电镜图;
图2为实施例2所得样品(LMO-3%LCO)的扫描电镜图;
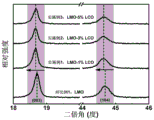
图3为对比例1及实施例1~3所得样品的X射线衍射图谱;
图4为对比例1及实施例1~3所得样品的X射线衍射局部放大图谱;
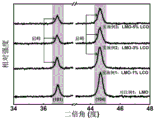
图5为对比例1及实施例1~3所得样品的X射线衍射肩峰对比图谱;
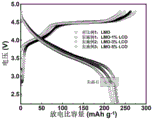
图6为对比例1及实施例1~3所得样品作为电极材料的首圈充放电曲线;
图7为对比例1及实施例1~3所得样品作为电极材料在2C电流密度下循环300次后的放电中压曲线;
图8为对比例1及实施例1~3所得样品作为电极材料在2C电流密度下循环300次后的质量能量密度曲线;
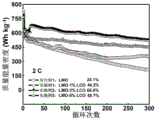
图9为对比例1及实施例1~3所得样品作为电极材料在2C电流密度下循环300次后放电比容量曲线;
图10为对比例2所得样品作为电极材料在0.1C电流密度下的首圈充放电曲线;
图11为对比例3所得样品作为电极材料在0.1C电流密度下的首圈充放电曲线;
图12为实施例4所得样品作为电极材料在0.1C电流密度下的首圈充放电曲线。
具体实施方式
结合实施例和附图对本发明内容做进一步详细说明,但本发明的实施方式不限于此。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的其它所有实施例,都属于本发明保护范围。
本实施例所使用的高纯氧气的纯度为99.99%,前驱体采用商业购买的碳酸盐复合物(Mn0.672Ni0.164Co0.164CO3),本发明实施例中所使用的原料或化学试剂,如无特殊说明,均通过常规商业途径获得。
本发明一种联动改性的富锂锰基正极材料及其制备方法具体实施方式,一般包括以下步骤:
(1)将含结晶水的铈盐置于加热装置中,在空气气氛下,以升温速度为3~10℃/min升温至200~400℃温度下,煅烧2~5h,获得无水铈盐;含结晶水的铈盐为市面上常见的铈盐,一般都含结晶水,如六水硝酸铈、十水草酸铈、七水氯化铈;含水铈盐进行脱水处理可以采用马弗炉、管式炉或竖炉等加热装置;
(2)将前驱体与步骤(1)中获得的无水铈盐均匀分散于有机溶剂中,液固比为20~50mL/g,加热至60~100℃,在搅拌转速为300~500r/min的条件下,搅拌5~8h,使铈盐充分溶解,然后将分散均匀的溶液置于干燥箱中干燥,干燥箱采用鼓风干燥或真空干燥,干燥的温度为60~100℃,干燥时间为18~24h,获得改性前驱体;前驱体可以替换为不同比例的镍钴锰的碳酸盐、草酸盐或氢氧化物;有机溶剂一般为短链醇类,如甲醇、乙醇、正丙醇、异丙醇等,这些有机溶剂最好是进行出水预处理;前驱体与无水铈盐的用量以生成的Li2CeO3材料与层状富锂锰基正极材料的质量比为1~10:100计量;
(3)将步骤(2)中获得的改性前驱体与锂源在干燥环境中充分研磨0.5~1h,使其混合均匀;锂源包括碳酸锂、一水合氢氧化锂、氢氧化锂、硝酸锂等常见的含锂化合物;锂源的质量过量系数为3~10%;
(4)将步骤(3)中所得的混合物置于煅烧装置中在氧气气氛下进行煅烧处理,煅烧结束后,随炉冷却至室温,获得目标样品;煅烧采用两段煅烧方式:第一段煅烧为在500~700℃下煅烧5~10h,第二段煅烧为在800~900℃下煅烧10~15h;所述煅烧在氧化气氛中进行,煅烧过程采用管式炉或竖炉进行煅烧,煅烧过程中氧气流量控制为0.5~2m3/h,煅烧过程中升温速度为3~10℃/min。
为了充分理解本发明,下文将结合说明书附图和较佳的实施例对本发明做更全面和细致的描述,但本发明的保护范围并不限于以下具体实施例。
除非另有定义,本发明中所使用的所有专业术语与本领域技术人员通常理解的含义相同。本发明中所使用的专业术语只是为了描述具体实施例,并不是在限制本发明的保护范围。
除非另有特殊说明,本发明中应用到的各种原料、试剂、设备和仪器等均可在市场上购买得到或者经现有技术制备得到。
以下实施例中含结晶水的铈盐脱水过程为:将Ce(NO3)3·6H2O置于管式炉中,在空气气氛下,以升温速度为5℃/min升温至300℃温度下,煅烧3h,获得无水铈盐Ce(NO3)3。
对比例1
(1)将2g前驱体Mn0.672Ni0.164Co0.164CO3与1.02g LiOH·H2O置于玛瑙研钵中,在干燥环境中研磨1h,然后将研磨均匀的混合物转移至刚玉方舟中,然后置于氧气气氛的管式炉中煅烧,煅烧条件为5℃/min升温至500℃,恒温5h后,5℃/min升温至900℃,恒温12h,随炉冷却至室温,获得对比样品,命名为LMO。
对比例2
(1)取2g前驱体Mn0.672Ni0.164Co0.164CO3与0.03g的Ce(NO3)3·6H2O均匀分散于50mL乙醇溶液中,50℃加热搅拌4h,然后将分散液置于70℃的鼓风干燥箱中干燥12h,获得改性后的前驱体。
(2)将步骤(1)获得的改性前驱体与1.02g LiOH·H2O置于玛瑙研钵中,在干燥环境中研磨1h,将研磨均匀的混合物转移至刚玉方舟中,然后置于氧气气氛的管式炉中煅烧,煅烧条件为5℃/min升温至500℃,恒温5h后,5℃/min升温至900℃,恒温12h,随炉冷却至室温,获得理论质量分数为1%的Li2CeO3联动改性的富锂锰基正极,命名为LMO-1。
对比例3
(1)取2g前驱体Mn0.672Ni0.164Co0.164CO3与0.012g的Ce(NO3)3均匀分散于50mL去离子水中,50℃加热搅拌4h,然后将分散液置于70℃的鼓风干燥箱中干燥12h,获得改性后的前驱体。
(2)将步骤(1)获得的改性前驱体与1.02g LiOH·H2O置于玛瑙研钵中,在干燥环境中研磨1h,将研磨均匀的混合物转移至刚玉方舟中,然后置于氧气气氛的管式炉中煅烧,煅烧条件为5℃/min升温至500℃,恒温5h后,5℃/min升温至900℃,恒温12h,随炉冷却至室温,获得理论质量分数为1%的Li2CeO3联动改性的富锂锰基正极,命名为LMO-2。
实施例1
一种联动改性的富锂锰基正极材料及其制备方法,包括以下步骤:
(1)取2g前驱体Mn0.672Ni0.164Co0.164CO3与0.012g脱水后的Ce(NO3)3均匀分散于50mL乙醇溶液中,50℃加热搅拌4h,然后将分散液置于70℃的鼓风干燥箱中干燥12h,获得改性后的前驱体。
(2)将步骤(1)获得的改性前驱体与1.02g LiOH·H2O置于玛瑙研钵中,在干燥环境中研磨1h,将研磨均匀的混合物转移至刚玉方舟中,然后置于氧气气氛的管式炉中煅烧,煅烧条件为5℃/min升温至500℃,恒温5h后,5℃/min升温至900℃,恒温12h,随炉冷却至室温,获得理论质量分数为1%的Li2CeO3联动改性的富锂锰基正极,命名为LMO-1%LCO。
实施例2
一种联动改性的富锂锰基正极材料及其制备方法,包括以下步骤:
(1)取2g前驱体Mn0.672Ni0.164Co0.164CO3与0.036g脱水后的Ce(NO3)3均匀分散于50mL无水乙醇溶液中,50℃加热搅拌4h,然后将分散液置于70℃的鼓风干燥箱中干燥12h,获得改性后的前驱体。
(2)将步骤(1)获得的改性前驱体与1.02g LiOH·H2O置于玛瑙研钵中,在干燥环境中研磨1h,将研磨均匀的混合物转移至刚玉方舟中,然后将研磨均匀的混合物置于氧气气氛的管式炉中煅烧,煅烧条件为5℃/min升温至500℃,恒温5h后,5℃/min升温至900℃,恒温12h,随炉冷却至室温,获得理论质量分数为3%的Li2CeO3联动改性的富锂锰基正极,命名为LMO-3%LCO。
实施例3
一种联动改性的富锂锰基正极材料及其制备方法,包括以下步骤:
(1)取2g前驱体Mn0.672Ni0.164Co0.164CO3与0.06g脱水后的Ce(NO3)3均匀分散于50mL乙醇溶液中,50℃加热搅拌4h,然后将分散液置于70℃的鼓风干燥箱中干燥12h,获得改性后的前驱体。
(2)将步骤(1)获得的改性前驱体与1.02g LiOH·H2O置于玛瑙研钵中,在干燥环境中研磨1h,将研磨均匀的混合物转移至刚玉方舟中,然后将研磨均匀的混合物置于氧气气氛的管式炉中煅烧,煅烧条件为5℃/min升温至500℃,恒温5h后,5℃/min升温至900℃,恒温12h,随炉冷却至室温,获得理论质量分数为5%的Li2CeO3联动改性的富锂锰基正极材料,命名为LMO-5%LCO。
实施例4
一种联动改性的富锂锰基正极材料及其制备方法,包括以下步骤:
(1)取2g前驱体Mn0.672Ni0.164Co0.164CO3与0.06g脱水后的Ce(NO3)3均匀分散于50mL乙醇溶液中,50℃加热搅拌4h,然后将分散液置于70℃的鼓风干燥箱中干燥12h,获得改性后的前驱体。
(2)将步骤(1)获得的改性前驱体与1.02g LiOH·H2O置于玛瑙研钵中,在干燥环境中研磨1h,将研磨均匀的混合物转移至刚玉方舟中,然后将研磨均匀的混合物置于氧气气氛的管式炉中煅烧,煅烧条件为5℃/min升温至500℃,恒温5h后,5℃/min升温至700℃,恒温12h,随炉冷却至室温,获得理论质量分数为5%的Li2CeO3联动改性的富锂锰基正极材料,命名为LMO-5%LCO-1。
图1为对比例1所得样品的扫描电镜图,由图1可知,所获得的微米球正极材料由一次纳米颗粒团聚而成,二次颗粒大小为10μm左右,一次颗粒大小为100nm左右,一次颗粒表面较为光滑。
图2为实施例2所得样品的扫描电镜图,由图2可知,经改性后二次颗粒表面变得较为粗糙,该现象主要是由表面包覆所引起。
图3为对比例1及实施例1~3所得样品的X射线衍射图谱,由图3可知,所获得样品均为层状结构,对应的空间群为R-3m,此外,在20-25°范围内的超晶格衍射峰对应的空间群为C2/m(Li2MnO3)。实施例所得样品的X射线衍射峰强度相对于对比例所得样品的X射线衍射峰强度呈现出明显的下降趋势,该现象表明Li2CeO3被成功的包覆在了基体材料的表面。
图4为对比例1及实施例1~3所得样品的X射线衍射图谱的局部放大图,由图4可知,实施例所得样品较对比例所得样品的X射线衍射图谱呈现出明显的小角度偏移,该现象主要是由Ce掺杂到体相材料的晶格中所引起,Ce掺杂以后会使晶胞参数增大;此外,Ce掺杂会在体相内形成的较强的Ce-O键,同时,由于原子之间的相互作用,也会形成伪键合作用,该系列特性会提高层状材料的结构稳定性和抑制晶格氧的流失,有利于缓解该材料作为锂离子电池正极材料在循环过程中的容量衰减与电压降。
图5为对比例1与实施例1~3所得样品的X射线衍射肩峰分析图谱,由图5可知,Ce掺杂在亚表层诱导形成了富锂尖晶石Li4Mn5O12,该尖晶石结构具有三维的锂离子通道和较弱的姜泰勒效应,可以显著提高复合材料的结构稳定性和电化学稳定性。
包覆层之间存在相界面,相界面会诱发内建电场产生,一方面会促进电荷的转移,另一方面会抑制体相氧负离子的外迁,进而提升该复合材料的电化学性能。Li2CeO3包覆层具有丰富的氧空位,一方面可以阻止电极材料与电解液之间的直接接触,抑制过渡金属溶解与迁移,进而抑制电极材料的结构重构,另一方面会促进锂离子在电极与电解液界面活性位点的键合,促进锂离子的扩散,进而提升电极材料的电化学性能。
将对比例1与实施例1~4所获得样品用作锂离子电池正极材料。具体方式为:将所制备的正极粉末与乙炔黑(导电剂)、聚偏氟乙烯(PVDF,粘接剂)按照8:1:1的质量比混合,滴加适量的N-甲基吡咯烷酮(NMP)作为分散剂,研磨成浆料;随后将浆料均匀涂覆在铝箔上,120℃真空干燥12h,转移至氩气气氛手套箱中备用。
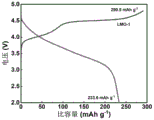
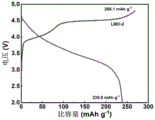
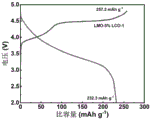
在氩气气氛手套箱中组装半电池。以金属锂为对电极,以LiPF6/碳酸乙烯酯(EC:DMC:DEC=1:1:1)为电解液,组装规格为CR2016型扣式电池,使用恒流充放电模式进行充放电,图6为0.1C(1C=250mA/g)电流密度下的首圈充放电曲线,首圈放电容量分别为232.2(LMO)、231.2(LMO-1%LCO)、226.3(LMO-3%LCO)、218.5(LMO-1%LCO)mAh/g,对应的库伦效率分别为84.5%、88.0%、91.0%、91.8%。由图6可知,改性后的样品的充电比容量明显降低,且库伦效率显著提高,表明电极材料在充电过程中的氧流失得到了明显的抑制。实施例1~3所得样品的放电曲线出现了明显的尖晶石结构放电特征,表面该联动改性策略可以有效诱导尖晶石相的形成。
图7为对比例1与实施例1~3所得样品在2C电流密度下循环300次后的电压降曲线,由图7可知,改性后的样品在循环过程中有良好的电压稳定特性,表明该发明方法可以有效抑制电极材料在循环过程中的电压降。
图8为对比例1与实施例1~3所得样品在2C电流密度下循环300次后的能量密度变化曲线,由图8可知,相对实施例2所得样品经过300次循环后,能量密度的循环保持率为66.8%,显著高于对比实施例1所得样品的25.1%。
图9为对比例1与实施例1~3所得样品在2C电流密度下循环300次后的放电比容量变化曲线,由图9可知,相对实施例2所得样品的容量保持率高达96.1%,对比例1所得样品的放电容量保持率仅为46.3%,表明该发明方法可以有效抑制电极材料在循环过程中的容量衰减。
图10为对比例2所得样品在0.1C电流密度下的首圈充放电曲线,与实施例1中所得样品对比可知,结晶水的去除有利于尖晶石相的形成。
图11为对比例3所得样品在0.1C电流密度下的首圈充放电曲线,与实施例1中所得样品的充放电曲线对比可知,分散剂的种类会影响尖晶石相的形成。
图12为实施例4所得样品在0.1C电流密度下的首圈充放电曲线,与实施例3中所得样品的充放电曲线对比可知,二段煅烧温度会影响尖晶石相的形成。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上的实施例仅是对本发明的优选实施方式进行描述,其描述较为详细和具体,并非对本发明的范围进行限定。应该指出的是,在不脱离本发明设计精神的前提下,本领域普通工程技术人员对本发明的技术方案作出的各种变型和改进,均应落入本发明的权利要求书确定的保护范围内。因此,本发明的保护范围以所附权利要求为准。
Claims (10)
1.一种联动改性的富锂锰基正极材料,具有微米级核壳球状结构,其特征在于:其中,内核由铈掺杂的层状富锂锰基正极材料构成,所述层状富锂锰基正极材料的化学通式为xLi2MnO3·(1-x)LiTMO2,其中,TM为Ni、Co和Mn中的至少一种元素,0.2≤x≤0.8,壳层包括亚表层和表层,所述亚表层由尖晶石型Li4Mn5O12构成,所述表层由富含氧缺陷的Li2CeO3材料构成。
2.根据权利要求1所述的一种联动改性的富锂锰基正极材料,其特征在于:Li2CeO3材料与层状富锂锰基正极材料的质量比为1~10:100。
3.权利要求1或2所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:包括以下步骤:
1)将铈盐经过脱除结晶水,得到脱水铈盐;
2)将脱水铈盐与过渡金属氧化物前驱体材料置于有机溶剂介质中通过加热搅拌方式混合均匀,干燥,得到混合前驱体材料;
3)将混合前驱体材料与锂源研磨混合,煅烧,即得。
4.根据权利要求3所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:
所述铈盐包括六水硝酸铈、十水草酸铈、七水氯化铈中至少一种;
所述过渡金属氧化物前驱体材料为过渡金属碳酸盐、过渡金属草酸盐、过渡金属氢氧化物中至少一种;所述过渡金属包括Ni、Co和Mn中的至少一种;
所述有机溶剂包括甲醇、乙醇、正丙醇、异丙醇中至少一种;
所述锂源包括碳酸锂、一水合氢氧化锂、氢氧化锂、硝酸锂中至少一种。
5.根据权利要求3或4所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:所述铈盐脱除结晶水的过程为:将铈盐置于200~400℃温度及空气气氛下,煅烧2~5h。
6.根据权利要求3或4所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:所述过渡金属氧化物前驱体材料和脱水铈盐及有机溶剂介质的初始液固体积质量比为20~50mL/g。
7.根据权利要求3或4所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:所述加热搅拌的条件为:搅拌转速为300~500r/min,搅拌时间为5~8h,加热温度为60~100℃。
8.根据权利要求3或4所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:所述锂源的质量过量系数为3~10%。
9.根据权利要求3或4所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:所述研磨混合时间为0.5~1h。
10.根据权利要求3或4所述的一种联动改性的富锂锰基正极材料的制备方法,其特征在于:所述煅烧采用两段煅烧方式:第一段煅烧为在500~700℃下煅烧5~10h,第二段煅烧为在800~900℃下煅烧10~15h;所述煅烧在氧化气氛中进行。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202010310251.5A CN111509224B (zh) | 2020-04-17 | 2020-04-17 | 一种联动改性的富锂锰基正极材料及其制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202010310251.5A CN111509224B (zh) | 2020-04-17 | 2020-04-17 | 一种联动改性的富锂锰基正极材料及其制备方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN111509224A CN111509224A (zh) | 2020-08-07 |
| CN111509224B true CN111509224B (zh) | 2021-07-23 |
Family
ID=71871084
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202010310251.5A Active CN111509224B (zh) | 2020-04-17 | 2020-04-17 | 一种联动改性的富锂锰基正极材料及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN111509224B (zh) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113571679A (zh) * | 2021-07-21 | 2021-10-29 | 福州大学 | 一种尖晶石氧化物包覆富锂锰基正极材料 |
| CN113745478A (zh) * | 2021-08-26 | 2021-12-03 | 中南大学 | 一种电极材料及其制备方法和应用 |
| CN114420935A (zh) * | 2022-03-29 | 2022-04-29 | 浙江帕瓦新能源股份有限公司 | 一种改性的正极材料及其改性方法 |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103035904A (zh) * | 2012-12-21 | 2013-04-10 | 浙江工业大学 | 一种改性锰酸锂材料及其制备方法和应用 |
| CN108172808A (zh) * | 2018-01-16 | 2018-06-15 | 北京科技大学 | 一种铈锡复合氧化物包覆富锂锰基正极材料的改性方法 |
| WO2019027673A2 (en) * | 2017-08-03 | 2019-02-07 | Nanograf Corporation | COMPOSITE ANODE MATERIAL COMPRISING SURFACE-STABILIZED ACTIVE MATERIAL PARTICLES AND METHODS OF MANUFACTURING THE SAME |
| CN110085827A (zh) * | 2019-04-23 | 2019-08-02 | 中国电力科学研究院有限公司 | 一种富锂锰基正极材料及其制备方法和应用 |
| CN110582875A (zh) * | 2017-11-06 | 2019-12-17 | 株式会社Lg化学 | 包含尖晶石结构的锂锰基正极活性材料的正极材料、正极和锂二次电池 |
| EP3613707A2 (en) * | 2018-08-22 | 2020-02-26 | Ecopro Bm Co., Ltd. | Positive electrode active material and lithium secondary battery comprising the same |
| CN110911663A (zh) * | 2019-11-13 | 2020-03-24 | 惠州学院 | 一种富锂锰基复合锂电池正极材料及其制作方法 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104157831B (zh) * | 2014-08-19 | 2016-08-24 | 哈尔滨工业大学 | 一种核壳结构的尖晶石镍锰酸锂、层状富锂锰基复合正极材料及其制备方法 |
| CN106784655B (zh) * | 2016-11-29 | 2019-02-15 | 北京科技大学 | 一种改善富锂锰基正极材料性能的包覆改性方法 |
| CN108091843B (zh) * | 2017-12-11 | 2020-07-10 | 广东工业大学 | 一种核壳结构的富锂锰基复合正极材料及其制备方法 |
| CN109904402A (zh) * | 2017-12-11 | 2019-06-18 | 中国科学院大连化学物理研究所 | 一种富锂锰基材料及其制备和应用 |
| CN109585833A (zh) * | 2018-12-05 | 2019-04-05 | 桑德集团有限公司 | 富锂锰基改性材料及其制备方法与正极材料 |
| CN110416534B (zh) * | 2019-07-19 | 2023-05-23 | 蜂巢能源科技有限公司 | 富锂锰基正极材料及其制备方法和应用 |
| CN110635121B (zh) * | 2019-09-26 | 2021-04-27 | 中国科学院过程工程研究所 | 一种复合锂离子电池正极材料、其制备方法和用途 |
| CN110911687A (zh) * | 2019-12-09 | 2020-03-24 | 中南大学 | 一种稀土元素改性的锂离子电池正极材料及制备方法和应用 |
| CN110931775A (zh) * | 2019-12-19 | 2020-03-27 | 海安常州大学高新技术研发中心 | 一种富锂锰基正极材料的改性方法 |
-
2020
- 2020-04-17 CN CN202010310251.5A patent/CN111509224B/zh active Active
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103035904A (zh) * | 2012-12-21 | 2013-04-10 | 浙江工业大学 | 一种改性锰酸锂材料及其制备方法和应用 |
| WO2019027673A2 (en) * | 2017-08-03 | 2019-02-07 | Nanograf Corporation | COMPOSITE ANODE MATERIAL COMPRISING SURFACE-STABILIZED ACTIVE MATERIAL PARTICLES AND METHODS OF MANUFACTURING THE SAME |
| CN110582875A (zh) * | 2017-11-06 | 2019-12-17 | 株式会社Lg化学 | 包含尖晶石结构的锂锰基正极活性材料的正极材料、正极和锂二次电池 |
| CN108172808A (zh) * | 2018-01-16 | 2018-06-15 | 北京科技大学 | 一种铈锡复合氧化物包覆富锂锰基正极材料的改性方法 |
| EP3613707A2 (en) * | 2018-08-22 | 2020-02-26 | Ecopro Bm Co., Ltd. | Positive electrode active material and lithium secondary battery comprising the same |
| CN110085827A (zh) * | 2019-04-23 | 2019-08-02 | 中国电力科学研究院有限公司 | 一种富锂锰基正极材料及其制备方法和应用 |
| CN110911663A (zh) * | 2019-11-13 | 2020-03-24 | 惠州学院 | 一种富锂锰基复合锂电池正极材料及其制作方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN111509224A (zh) | 2020-08-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN110233253B (zh) | 一种二元掺杂的单晶三元正极材料及其制备方法 | |
| CN112599783B (zh) | 一种硒掺杂的富锂锰基正极材料及其制备方法和应用 | |
| CN102244236A (zh) | 一种锂离子电池富锂正极材料的制备方法 | |
| CN102201573A (zh) | 一种核壳结构锂离子电池富锂正极材料及其制备方法 | |
| CN110911687A (zh) | 一种稀土元素改性的锂离子电池正极材料及制备方法和应用 | |
| CN113422033A (zh) | 一种钇离子掺杂氧化钇包覆改性的富锂锰基正极材料、制备方法及应用 | |
| CN111509224B (zh) | 一种联动改性的富锂锰基正极材料及其制备方法 | |
| CN113451582B (zh) | 一种钨、硫共掺杂改性富锂锰基正极材料及其制备方法 | |
| CN108598394B (zh) | 碳包覆磷酸钛锰钠微米球及其制备方法和应用 | |
| CN103078099A (zh) | 一种锂离子电池正极材料及其制备方法 | |
| CN103606663A (zh) | 一种倍率型富锂复合正极材料及其制备方法 | |
| CN101704681B (zh) | 一种尖晶石结构钛酸锂的制备方法 | |
| CN113078316B (zh) | 钼酸锂包覆的富锂锰基正极材料及其制备方法和应用 | |
| CN114655999B (zh) | 一种对富锂层状氧化物正极材料进行原位表面结构调控的方法 | |
| CN114229921B (zh) | Al2O3-ZrO2包覆的富锂锰基正极材料及其制备方法 | |
| CN114671471A (zh) | 一种尖晶石/层状异质结构改性无钴富锂锰基正极材料及其制备方法 | |
| CN112242515B (zh) | 一种改性富锂锰基层状氧化物正极材料的制备方法和应用 | |
| CN103594699B (zh) | 微米级单晶锰基材料、其制备方法及使用其的锂离子电池 | |
| CN115057427B (zh) | 一种金属单原子掺杂C/Se复合正极材料及其制备方法与应用 | |
| CN114242969B (zh) | 一种层状无钴锰基锂离子电池正极材料及其制备方法与应用 | |
| CN114613959B (zh) | 一种阴阳离子共修饰富锂锰基复合材料、制备方法和应用 | |
| CN116639740A (zh) | 一种无钴富锂锰基正极材料及其制备方法 | |
| CN116154174A (zh) | 一种多相复合层状锰基正极材料及制备方法 | |
| GB2621290A (en) | Template growth method for preparing lithium cobaltate precursor and use thereof | |
| CN116190593A (zh) | 一种混相结构的锂电池正极材料及其制备方法和应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |