CN108822015B - β-胡萝卜素的合成方法 - Google Patents
β-胡萝卜素的合成方法 Download PDFInfo
- Publication number
- CN108822015B CN108822015B CN201810818995.0A CN201810818995A CN108822015B CN 108822015 B CN108822015 B CN 108822015B CN 201810818995 A CN201810818995 A CN 201810818995A CN 108822015 B CN108822015 B CN 108822015B
- Authority
- CN
- China
- Prior art keywords
- reaction
- carotene
- molecular sieve
- beta
- phosphonium salt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 title claims abstract description 47
- 235000013734 beta-carotene Nutrition 0.000 title claims abstract description 47
- 239000011648 beta-carotene Substances 0.000 title claims abstract description 47
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 title claims abstract description 47
- 229960002747 betacarotene Drugs 0.000 title claims abstract description 47
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 title claims abstract description 47
- 238000000034 method Methods 0.000 title claims abstract description 24
- 230000002194 synthesizing effect Effects 0.000 title claims description 10
- 238000006243 chemical reaction Methods 0.000 claims abstract description 67
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 claims abstract description 43
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 claims abstract description 36
- 239000007787 solid Substances 0.000 claims abstract description 32
- 150000004714 phosphonium salts Chemical class 0.000 claims abstract description 24
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims abstract description 23
- 239000002808 molecular sieve Substances 0.000 claims abstract description 23
- 239000001301 oxygen Substances 0.000 claims abstract description 23
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 23
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 claims abstract description 23
- 239000003054 catalyst Substances 0.000 claims abstract description 15
- 150000001875 compounds Chemical class 0.000 claims abstract description 14
- 238000005691 oxidative coupling reaction Methods 0.000 claims abstract description 14
- 238000005859 coupling reaction Methods 0.000 claims abstract description 13
- 150000003682 vanadium compounds Chemical class 0.000 claims abstract description 11
- 239000003444 phase transfer catalyst Substances 0.000 claims abstract description 10
- 235000019169 all-trans-retinol Nutrition 0.000 claims abstract description 7
- 239000011717 all-trans-retinol Substances 0.000 claims abstract description 7
- 239000012074 organic phase Substances 0.000 claims abstract description 7
- 239000003513 alkali Substances 0.000 claims abstract description 5
- 230000035484 reaction time Effects 0.000 claims abstract description 5
- 230000015572 biosynthetic process Effects 0.000 claims abstract description 4
- 238000003786 synthesis reaction Methods 0.000 claims abstract description 4
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 claims description 30
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 27
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 17
- -1 tetrafluoroborate Chemical compound 0.000 claims description 13
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 claims description 12
- KWYUFKZDYYNOTN-UHFFFAOYSA-M potassium hydroxide Substances [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 claims description 12
- XEZNGIUYQVAUSS-UHFFFAOYSA-N 18-crown-6 Chemical compound C1COCCOCCOCCOCCOCCO1 XEZNGIUYQVAUSS-UHFFFAOYSA-N 0.000 claims description 11
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 11
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 10
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 claims description 9
- 239000003960 organic solvent Substances 0.000 claims description 9
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 claims description 9
- 229920001223 polyethylene glycol Polymers 0.000 claims description 8
- 239000002202 Polyethylene glycol Substances 0.000 claims description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 7
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims description 6
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 6
- 239000000203 mixture Substances 0.000 claims description 6
- 239000012071 phase Substances 0.000 claims description 5
- 229910000027 potassium carbonate Inorganic materials 0.000 claims description 5
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 4
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 claims description 4
- 229910003206 NH4VO3 Inorganic materials 0.000 claims description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 claims description 4
- 229910052783 alkali metal Inorganic materials 0.000 claims description 4
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 claims description 4
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 claims description 4
- 239000002904 solvent Substances 0.000 claims description 4
- ZUHZGEOKBKGPSW-UHFFFAOYSA-N tetraglyme Chemical compound COCCOCCOCCOCCOC ZUHZGEOKBKGPSW-UHFFFAOYSA-N 0.000 claims description 4
- XQQZRZQVBFHBHL-UHFFFAOYSA-N 12-crown-4 Chemical compound C1COCCOCCOCCO1 XQQZRZQVBFHBHL-UHFFFAOYSA-N 0.000 claims description 3
- VFTFKUDGYRBSAL-UHFFFAOYSA-N 15-crown-5 Chemical compound C1COCCOCCOCCOCCO1 VFTFKUDGYRBSAL-UHFFFAOYSA-N 0.000 claims description 3
- 150000007514 bases Chemical class 0.000 claims description 3
- 239000007788 liquid Substances 0.000 claims description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 3
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 claims description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 claims description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims description 2
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical group COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 claims description 2
- 229910021144 KVO3 Inorganic materials 0.000 claims description 2
- 229910019501 NaVO3 Inorganic materials 0.000 claims description 2
- 229910019142 PO4 Inorganic materials 0.000 claims description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 claims description 2
- 125000002723 alicyclic group Chemical group 0.000 claims description 2
- 125000001931 aliphatic group Chemical group 0.000 claims description 2
- 229910000288 alkali metal carbonate Inorganic materials 0.000 claims description 2
- 150000008041 alkali metal carbonates Chemical class 0.000 claims description 2
- 150000008044 alkali metal hydroxides Chemical class 0.000 claims description 2
- 229910000318 alkali metal phosphate Inorganic materials 0.000 claims description 2
- 125000003118 aryl group Chemical group 0.000 claims description 2
- 229940077388 benzenesulfonate Drugs 0.000 claims description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 claims description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 2
- 229910000024 caesium carbonate Inorganic materials 0.000 claims description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 2
- YSSSPARMOAYJTE-UHFFFAOYSA-N dibenzo-18-crown-6 Chemical compound O1CCOCCOC2=CC=CC=C2OCCOCCOC2=CC=CC=C21 YSSSPARMOAYJTE-UHFFFAOYSA-N 0.000 claims description 2
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 claims description 2
- XGZVUEUWXADBQD-UHFFFAOYSA-L lithium carbonate Chemical compound [Li+].[Li+].[O-]C([O-])=O XGZVUEUWXADBQD-UHFFFAOYSA-L 0.000 claims description 2
- 229910052808 lithium carbonate Inorganic materials 0.000 claims description 2
- 239000003208 petroleum Substances 0.000 claims description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 claims description 2
- 239000010452 phosphate Substances 0.000 claims description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 claims description 2
- RPDAUEIUDPHABB-UHFFFAOYSA-N potassium ethoxide Chemical compound [K+].CC[O-] RPDAUEIUDPHABB-UHFFFAOYSA-N 0.000 claims description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 claims description 2
- CMZUMMUJMWNLFH-UHFFFAOYSA-N sodium metavanadate Chemical compound [Na+].[O-][V](=O)=O CMZUMMUJMWNLFH-UHFFFAOYSA-N 0.000 claims description 2
- 238000001308 synthesis method Methods 0.000 claims description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 claims description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 claims description 2
- 229910000404 tripotassium phosphate Inorganic materials 0.000 claims description 2
- 229910000406 trisodium phosphate Inorganic materials 0.000 claims description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 claims 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 claims 1
- 235000021317 phosphate Nutrition 0.000 claims 1
- UWHCKJMYHZGTIT-UHFFFAOYSA-N tetraethylene glycol Chemical compound OCCOCCOCCOCCO UWHCKJMYHZGTIT-UHFFFAOYSA-N 0.000 claims 1
- 239000000047 product Substances 0.000 abstract description 15
- 239000007800 oxidant agent Substances 0.000 abstract description 8
- 230000003647 oxidation Effects 0.000 abstract description 8
- 238000007254 oxidation reaction Methods 0.000 abstract description 8
- 230000001590 oxidative effect Effects 0.000 abstract description 8
- 238000009776 industrial production Methods 0.000 abstract description 4
- 230000008569 process Effects 0.000 abstract description 4
- 239000000758 substrate Substances 0.000 abstract description 4
- 239000006227 byproduct Substances 0.000 abstract description 3
- 230000003197 catalytic effect Effects 0.000 abstract description 3
- 239000004721 Polyphenylene oxide Substances 0.000 abstract description 2
- 230000009286 beneficial effect Effects 0.000 abstract description 2
- 230000000694 effects Effects 0.000 abstract description 2
- 239000007789 gas Substances 0.000 abstract description 2
- 229910021645 metal ion Inorganic materials 0.000 abstract description 2
- 229920000570 polyether Polymers 0.000 abstract description 2
- 239000002351 wastewater Substances 0.000 abstract description 2
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 29
- 235000019155 vitamin A Nutrition 0.000 description 29
- 239000011719 vitamin A Substances 0.000 description 29
- 229940045997 vitamin a Drugs 0.000 description 29
- 238000001914 filtration Methods 0.000 description 28
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 24
- 239000012043 crude product Substances 0.000 description 24
- 238000001816 cooling Methods 0.000 description 23
- 239000013078 crystal Substances 0.000 description 16
- 238000001035 drying Methods 0.000 description 16
- 238000010438 heat treatment Methods 0.000 description 14
- 238000003756 stirring Methods 0.000 description 13
- 239000000706 filtrate Substances 0.000 description 12
- 238000004128 high performance liquid chromatography Methods 0.000 description 12
- 238000006317 isomerization reaction Methods 0.000 description 12
- 238000002156 mixing Methods 0.000 description 12
- 229910052757 nitrogen Inorganic materials 0.000 description 12
- 238000010992 reflux Methods 0.000 description 12
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 10
- CMSYDJVRTHCWFP-UHFFFAOYSA-N triphenylphosphane;hydrobromide Chemical compound Br.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 CMSYDJVRTHCWFP-UHFFFAOYSA-N 0.000 description 10
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 10
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 8
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- 150000001299 aldehydes Chemical class 0.000 description 6
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 4
- CDXSJGDDABYYJV-UHFFFAOYSA-N acetic acid;ethanol Chemical compound CCO.CC(O)=O CDXSJGDDABYYJV-UHFFFAOYSA-N 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 238000002425 crystallisation Methods 0.000 description 4
- 230000008025 crystallization Effects 0.000 description 4
- 238000005406 washing Methods 0.000 description 4
- YYGVWYKSYSKWET-UHFFFAOYSA-N C1(=CC=CC=C1)S(=O)(=O)[O-].C1(=CC=CC=C1)[PH+](C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound C1(=CC=CC=C1)S(=O)(=O)[O-].C1(=CC=CC=C1)[PH+](C1=CC=CC=C1)C1=CC=CC=C1 YYGVWYKSYSKWET-UHFFFAOYSA-N 0.000 description 3
- 239000012295 chemical reaction liquid Substances 0.000 description 3
- 238000006482 condensation reaction Methods 0.000 description 3
- 229960000342 retinol acetate Drugs 0.000 description 3
- QGNJRVVDBSJHIZ-QHLGVNSISA-N retinyl acetate Chemical compound CC(=O)OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C QGNJRVVDBSJHIZ-QHLGVNSISA-N 0.000 description 3
- 235000019173 retinyl acetate Nutrition 0.000 description 3
- 239000011770 retinyl acetate Substances 0.000 description 3
- PLIKAWJENQZMHA-UHFFFAOYSA-N 4-aminophenol Chemical compound NC1=CC=C(O)C=C1 PLIKAWJENQZMHA-UHFFFAOYSA-N 0.000 description 2
- DXZAIXOZCUYCQT-UHFFFAOYSA-N 5-(bromomethyl)-3-hydroxy-2,2,4,4-tetramethyl-1-oxidoimidazol-1-ium Chemical compound CC1(C)N(O)C(C)(C)[N+]([O-])=C1CBr DXZAIXOZCUYCQT-UHFFFAOYSA-N 0.000 description 2
- XTEGARKTQYYJKE-UHFFFAOYSA-M Chlorate Chemical compound [O-]Cl(=O)=O XTEGARKTQYYJKE-UHFFFAOYSA-M 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- NCYCYZXNIZJOKI-OVSJKPMPSA-N Retinaldehyde Chemical compound O=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C NCYCYZXNIZJOKI-OVSJKPMPSA-N 0.000 description 2
- 238000007239 Wittig reaction Methods 0.000 description 2
- BGYBTGDDOPTJSB-UHFFFAOYSA-N acetic acid;ethane-1,2-diol Chemical compound CC(O)=O.OCCO BGYBTGDDOPTJSB-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- WQYVRQLZKVEZGA-UHFFFAOYSA-N hypochlorite Chemical compound Cl[O-] WQYVRQLZKVEZGA-UHFFFAOYSA-N 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 235000020945 retinal Nutrition 0.000 description 2
- 239000011604 retinal Substances 0.000 description 2
- SYXYWTXQFUUWLP-UHFFFAOYSA-N sodium;butan-1-olate Chemical compound [Na+].CCCC[O-] SYXYWTXQFUUWLP-UHFFFAOYSA-N 0.000 description 2
- YGNORFLIQAXXCM-UHFFFAOYSA-N sulfuric acid;triphenylphosphane Chemical compound OS([O-])(=O)=O.C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1 YGNORFLIQAXXCM-UHFFFAOYSA-N 0.000 description 2
- AVCVDUDESCZFHJ-UHFFFAOYSA-N triphenylphosphane;hydrochloride Chemical compound [Cl-].C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1 AVCVDUDESCZFHJ-UHFFFAOYSA-N 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- LEONUFNNVUYDNQ-UHFFFAOYSA-N vanadium atom Chemical compound [V] LEONUFNNVUYDNQ-UHFFFAOYSA-N 0.000 description 2
- NCYCYZXNIZJOKI-UHFFFAOYSA-N vitamin A aldehyde Natural products O=CC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C NCYCYZXNIZJOKI-UHFFFAOYSA-N 0.000 description 2
- MCSXGCZMEPXKIW-UHFFFAOYSA-N 3-hydroxy-4-[(4-methyl-2-nitrophenyl)diazenyl]-N-(3-nitrophenyl)naphthalene-2-carboxamide Chemical compound Cc1ccc(N=Nc2c(O)c(cc3ccccc23)C(=O)Nc2cccc(c2)[N+]([O-])=O)c(c1)[N+]([O-])=O MCSXGCZMEPXKIW-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- 150000004347 all-trans-retinol derivatives Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003674 animal food additive Substances 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- ZJVJZSWVDUZQPR-UHFFFAOYSA-N benzenesulfonic acid;ethane-1,2-diol Chemical compound OCCO.OS(=O)(=O)C1=CC=CC=C1 ZJVJZSWVDUZQPR-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 229940006460 bromide ion Drugs 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910001882 dioxygen Inorganic materials 0.000 description 1
- VTIIJXUACCWYHX-UHFFFAOYSA-L disodium;carboxylatooxy carbonate Chemical compound [Na+].[Na+].[O-]C(=O)OOC([O-])=O VTIIJXUACCWYHX-UHFFFAOYSA-L 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-M iodide Chemical compound [I-] XMBWDFGMSWQBCA-UHFFFAOYSA-M 0.000 description 1
- 229940006461 iodide ion Drugs 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- CUQOHAYJWVTKDE-UHFFFAOYSA-N potassium;butan-1-olate Chemical compound [K+].CCCC[O-] CUQOHAYJWVTKDE-UHFFFAOYSA-N 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- ODZPKZBBUMBTMG-UHFFFAOYSA-N sodium amide Chemical compound [NH2-].[Na+] ODZPKZBBUMBTMG-UHFFFAOYSA-N 0.000 description 1
- 229940045872 sodium percarbonate Drugs 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N sulfuric acid Substances OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C403/00—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone
- C07C403/24—Derivatives of cyclohexane or of a cyclohexene or of cyclohexadiene, having a side-chain containing an acyclic unsaturated part of at least four carbon atoms, this part being directly attached to the cyclohexane or cyclohexene or cyclohexadiene rings, e.g. vitamin A, beta-carotene, beta-ionone having side-chains substituted by six-membered non-aromatic rings, e.g. beta-carotene
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/28—Phosphorus compounds with one or more P—C bonds
- C07F9/54—Quaternary phosphonium compounds
- C07F9/5442—Aromatic phosphonium compounds (P-C aromatic linkage)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/12—Systems containing only non-condensed rings with a six-membered ring
- C07C2601/16—Systems containing only non-condensed rings with a six-membered ring the ring being unsaturated
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
β‑胡萝卜素的合成方法,由维生素A醇或其衍生物制备得到有机膦盐,在钒化合物催化剂和分子筛存在下,于氧气氛围中,发生分子间氧化偶联反应,得β‑胡萝卜素。采用清洁环保、经济易得、便捷安全的含氧气体作为氧化剂,对环境没有危害,成本低,利于工业化生产。采用钒化合物做催化剂,显著降低偶联反应时间;采用分子筛做助催化剂,降低催化剂使用量,提高催化氧化效果,减少含金属离子废水的排放。加入聚醚类相转移催化剂可引发非均相反应体系中底物间的反应;固态碱性化合物与其形成络合物而被溶解于有机相中参与反应,有效控制有机相中碱的溶解度,促进反应进行的同时抑制副产物的产生,增加种产物的产量,从而达到提高收率的目的。
Description
技术领域
本发明涉及β-胡萝卜素,尤其是涉及β-胡萝卜素的合成方法。
背景技术
β-胡萝卜素是维生素A源物质,可用于医药、食品、化妆品、饲料添加剂、染料行业,具有很好的市场前景。
国内关于β-胡萝卜素合成的研究报道很多,根据反应路线的不同,可将β-胡萝卜素的合成路线分为C19+C2+C19、C15+C10+C15及C20+C20缩合反应。其中由维生素A醇或其衍生物与三苯基膦反应得到的有机膦盐是β-胡萝卜素的重要中间体,他可以进一步发生C20+C20 Wittig缩合反应制备β-胡萝卜素,也可以在氧化剂的存在下发生自身分子间氧化偶联反应制备β-胡萝卜素;
Wittig缩合反应路线:维生素A醇或其衍生物与三芳香基膦反应得到的有机膦盐,该有机膦盐进一步与维生素A醛通过Wittig反应缩合得到β-胡萝卜素。该工艺中Wittig反应要求无水无氧,条件苛刻,且维生素A醛化学性质不稳定,不易工业制备。反应式如下:
氧化偶联反应是在两分子的VA膦盐之间氧化偶联得到β-胡萝卜素。由于β-胡萝卜素结构对称,因此两分子有机膦盐之间进行氧化偶联反应制备β-胡萝卜素的工艺路线更为简洁。
反应式如下:
通过氧化偶联反应制备β-胡萝卜素的现有技术中,中国专利CN101081829A公开使用维生素A醇或其衍生物的有机膦盐在氧化剂存在下进行偶联反应得到β-胡萝卜素,使用的氧化剂为次氯酸盐,氯酸盐,双氧水,过碳酸钠,氧气或空气;所述物质在水相和有机溶剂构成的两相体系中反应,由于反应过程中,有机膦盐会经历的动态平衡,该动态平衡的右端为膦叶立德,磷叶立德对水等质子性溶剂非常敏感,遇水或加热易分解。所以在含水体系中进行上述氧化偶联反应,因中间体的不稳定性,目标产物收率不高。
氧气是一种公认的绿色氧化剂,反应产物为水,具有经济实用环保等优点,现有技术曾报道过有关氧气在维生素A有机膦盐进行氧化偶联反应中的应用,但据现有研究结果表明,分子氧作为氧化剂在上述偶联反应不仅反应速率慢,产物收率低,有时甚至不反应。
发明内容
鉴于现有技术的上述不足,本发明的目的在于提供操作简便、反应条件温和、成本低、收率较高、适用于工业化生产的β-胡萝卜素的制备方法。
本发明的具体步骤如下:
由维生素A醇或其衍生物制备得到有机膦盐,在钒化合物催化剂和分子筛存在下,于氧气氛围中,发生分子间氧化偶联反应,得β-胡萝卜素。
所述分子间氧化偶联反应在有机溶剂、相转移催化剂和碱性化合物构成的固液两相反应体系中进行,反应路线如下:
其中,R1、R2、R3是芳族基团、脂肪族、脂环族基团,所述R1、R2、R3是苯基、苯甲基、环己基或丁基;为无机强酸的酸根或有机强酸的酸根,所述可选自硫酸氢根、硫酸根、四氟硼酸根、磷酸根、乙酸根、甲苯磺酸根、苯磺酸根等中的一种,优选氯离子、溴离子或碘离子等。
所述有机膦盐在相转移催化剂的作用下与碱性化合物反应生成膦叶立德,部分中间体叶立德在催化剂作用下被氧化为相应的VA醛;随后,VA醛与另一部分膦叶立德反应生成目标产物β-胡萝卜素;中间体醛和膦叶立德是在碱性化合物催化下边消耗边生成,可有效避免醛自身缩合等副产物的生成。
所述钒化合物可选自VO(acac)2、VO(OAc)2、VO(hfac)2、NH4VO3、NaVO3、KVO3、V2O5、VO(OEt)3、VO(OPr)3、VO(Oi-Pr)3等中的至少一种,优选VO(acac)2、VO(OAc)2、NH4VO3、V2O5等中的至少一种,最好为VO(acac)2。
所述分子筛可选自3A分子筛、4A分子筛、5A分子筛等中的至少一种。
所述碱性化合物可选自碱金属氢氧化物、碱金属醇盐、碱金属碳酸盐、碱金属磷酸盐、碱金属有机酸盐等中的至少一种;优选K2CO3、Na2CO3、Cs2CO3、Li2CO3、NaOH、KOH、LiOH、K3PO4、Na3PO4、BuOK、BuONa、NaOAc、KOAc、EtONa、EtOK等中的至少一种,最好为K2CO3、NaOH、KOH、EtONa、BuONa等中的至少一种。
所述相转移催化剂可选自12-冠醚-4、15冠醚-5、18-冠醚-6、二苯并-18-冠醚-6、平均分子量为1000聚乙二醇、平均分子量为1500聚乙二醇、平均分子量为2000聚乙二醇、三缩四乙二醇、三缩四乙二醇二甲醚等中的至少一种。
所述有机溶剂可选自甲苯、二氯甲烷、氯仿、苯、二氯乙烷、正己烷、四氢呋喃、石油醚、甲醚、甲基叔丁酯等中的至少一种。
所述有机膦盐与催化剂的摩尔比可为1︰(0.01~1)。
所述有机膦盐以毫摩尔(mmol)计与分子筛以质量克(g)计的比可为1︰(0.1~0.5)。
所述有机膦盐与碱的摩尔比可为1︰(1.5~3)。
所述有机膦盐与相转移催化剂的摩尔比可为1︰(1.5~3)。
所述有机膦盐与有机溶剂的摩尔体积比(mol/L)可为1︰(10~30)。
所述偶联反应的反应温度可为10~60℃,优选25~40℃。
所述偶联反应的反应时间可为2~8h;优选2~4h。
所述分子间氧化偶联反应后,可待反应液冷却分层除去固体,有机相水洗、浓缩回收溶剂后得到的红色固体即为β-胡萝卜素和膦氧化合物组成的混合物,该混合物用醇类(如甲醇)洗除去膦氧化合物,然后进行重结晶或在溶剂中加热,再进行各种顺式混合物向全反式结构的重排处理等。
本发明具有以下优点:
1、采用清洁环保、经济易得、便捷安全的含氧气体作为氧化剂,对环境没有危害,成本低,利于工业化生产。
2、采用钒化合物做催化剂,显著降低偶联反应时间;采用分子筛做助催化剂,降低催化剂使用量,提高催化氧化效果,减少含金属离子废水的排放。
3、反应可采用碳酸盐,避免使用LDA、丁基锂、氨基钠等有机强碱性化合物。
4、反应采用在有机溶剂、相转移催化剂和碱性化合物性构成的固液两相反应体系中进行,可有效控制反应有机相中碱的溶解度,避免碱浓度过高引发的VA醛自身缩合及产物分子共轭双键被破坏等副反应,提高标的产物收率;
5、反应条件温和,勿需受严苛的无水无氧反应条件的限制,操作简单、安全系数高;反应产生的三废容易处理,相较其他方法更加绿色环保。
具体实施方式
下面结合实施例对本发明作进一步的说明。
实施例1:偶联反应制备β-胡萝卜素
取90g维生素A醋酸酯油(221.3万IU/g,0.208mol)及48.4g苯胺(0.52mol)溶于1100ml乙醇中,配成维生素A醋酸酯-乙醇溶液。在三口烧瓶中分别加入218.2g三苯基膦(0.832mol)和2300ml乙醇,降温至10℃以下,滴液漏斗缓慢滴加31.0g浓硫酸(0.316mol),控制滴加温度为10℃以下,滴加完毕继续搅拌2h。加入维生素A醋酸酯-乙醇溶液,25℃反应24h,得到维生素A三苯基氯化膦溶液。然后减压浓缩,再加入200ml丙酮溶解,放入冰箱中24h结晶,结晶过滤、洗涤、干燥,得到维生素A三苯基膦硫酸盐(下同)。
将维生素A三苯基膦硫酸盐(1.0mmol)、VO(acac)2(0.1mmol)、3A分子筛(0.3g)、18-冠醚-6(2.0mmol)和K2CO3(2.0mmol)加入甲苯中(20ml),反应液在通氧气保持常压的情况下于40℃下搅拌反应6h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶;采用GB5009.83-2016的方法进行分析(检测方法下同),含量99.0%(HPLC);总收率84%。
实施例2
取90g维生素A醋酸酯油(221.3万IU/g、0.208mol)及48.4g苯胺(0.52mol)溶于1100ml乙醇中,配成维生素A醋酸酯-乙醇溶液。在三口烧瓶中分别加入218.2g三苯基膦(0.832mol)和2300ml乙醇,降温至10℃,滴液漏斗缓慢滴加51.5ml浓盐酸(质量浓度37.5%,0.624mol),控制滴加温度为10℃,滴加完毕继续搅拌2h。加入维生素A醋酸酯-乙醇溶液,25℃反应24h,得到维生素A三苯基氯化膦溶液。然后减压浓缩,再加入200ml丙酮溶解,放入冰箱中24h结晶,结晶过滤、洗涤、干燥,得到维生素A三苯基膦溴氢酸盐(下同)。
将维生素A三苯基膦盐酸盐(1.0mmol)、VO(OAc)2(0.1mmol)、4A分子筛(0.3g)、18-冠醚-6(2.0mmol)和EtONa(2.0mmol)加入无水甲醇中(20ml),反应液在通氧气保持常压的情况下于40℃下搅拌反应8h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量99.1%(HPLC);总收率70%。
实施例3
取90.96g维生素A醇(294.97万IU/g、0.281mol)及15.4ml吡啶(0.191mol)溶于500ml甲醇,配成维生素A醇-甲醇溶液。在三口烧瓶中分别加入三苯基膦77.4g(0.295mol)和1000ml甲醇,降温至0℃,滴液漏斗缓慢滴加45.4ml HBr(质量浓度为47%,0.393mol),控制滴加温度为0℃,滴加完毕继续搅拌2h,加入维生素A醇-甲醇溶液,10℃反应24h。然后减压浓缩,再加入200ml丙酮溶解,放入冰箱中24h结晶,结晶过滤、洗涤、干燥,得到维生素A三苯基膦溴氢酸盐(下同)。
将维生素A三苯基膦溴氢酸盐(1.0mmol)、NH4VO3(0.1mmol)、4A分子筛(0.3g)、12-冠醚-4(2.0mmol)和KOH(2.0mmol)加入四氢呋喃中(20ml),反应液在通氧气保持常压的情况下于40℃下搅拌反应5h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量98.7%(HPLC);总收率72%。
实施例4
取90g维生素A醋酸酯油(221.3万IU/g、0.208mol)及22.7g对氨基苯酚(0.208mol)溶于380ml乙二醇中,配成维生素A醋酸酯-乙二醇溶液。在三口烧瓶中分别加入95.5g三苯基膦(0.364mol)和880ml乙二醇,降温至10℃,滴液漏斗缓慢滴加277.4g苯磺酸乙二醇溶液(质量浓度19.6%,0.344mol),控制滴加温度为10℃,滴加完毕继续搅拌2h。加入维生素A醋酸酯-乙二醇溶液,25℃反应40h,得到维生素A三苯基膦苯磺酸盐溶液。然后减压浓缩,再加入200ml丙酮溶解,放入冰箱中24h结晶,结晶过滤、洗涤、干燥,将维生素A三苯基膦苯磺酸盐(下同)。
将维生素A三苯基膦苯磺酸盐(1.0mmol)、V2O5(0.1mmol)、3A分子筛(0.3g)、18-冠醚-6(2.0mmol)和BuONa(2.0mmol)加入二氯甲烷中(20ml),反应液在通氧气保持常压的情况下于40℃下搅拌反应6h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量99.2%(HPLC);总收率68%。
实施例5
将维生素A三苯基膦溴氢酸盐(1.0mmol)、VO(acac)2(0.1mmol)、3A分子筛(0.3g)、18-冠醚-6(2.0mmol)和KOH(2.0mmol)加入甲苯中(20ml),反应液在通氧气保持常压的情况下于40℃下搅拌反应4h。之后,待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量99.0%(HPLC);总收率91%。
实施例6
将维生素A三苯基膦盐酸盐(1.0mmol)、VO(OAc)2(0.1mmol)、4A分子筛(0.3g)、15-冠醚-5(2.0mmol)和K2CO3(2.0mmol)加入正己烷中(20ml),上述反应液在通氧气保持常压的情况下于40℃下搅拌反应5h。之后,待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量98.5%(HPLC);总收率74%。
实施例7
将维生素A三苯基膦溴氢酸盐(1.0mmol)、VO(acac)2(0.1mmol)、3A分子筛(0.3g)、聚乙二醇(0.01mmol)和KOH(2.5mmol)加入甲基叔丁酯(20ml),反应液在通氧气保持微正压的情况下于40℃下搅拌反应7h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量98.9%(HPLC);总收率82%。
实施例1~7所采用的反应底物和相应的收率如表1所示。
表1
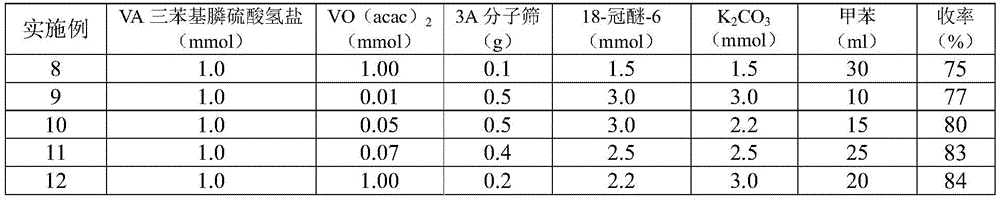
实施例8
将维生素A三苯基膦溴氢酸盐(1.0mmol)、VO(acac)2(1.0mmol)、3A分子筛(0.1g)、18-冠醚-6(1.5mmol)和KOH(1.5mmol)加入甲苯(30ml)中,反应液在通氧气保持微正压的情况下于10℃下搅拌反应6h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量98.8%(HPLC);总收率75%。
实施例9
将维生素A三苯基膦溴氢酸盐(1.0mmol)、VO(acac)2(0.01mmol)、3A分子筛(0.5g)、18-冠醚-6(3.0mmol)和KOH(3.0mmol)加入甲苯(10ml)中,反应液在通氧气保持微正压的情况下于60℃下搅拌反应2h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量99.0%(HPLC);总收率77%。
实施例10
将维生素A三苯基膦溴氢酸盐(1.0mmol)、VO(acac)2(0.05mmol)、3A分子筛(0.5g)、18-冠醚-6(3.0mmol)和KOH(2.2mmol)加入甲苯(15ml)中,反应液在通氧气保持微正压的情况下于25℃下搅拌反应3h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量98.7%(HPLC);总收率80%。
实施例11
将维生素A三苯基膦溴氢酸盐(1.0mmol)、VO(acac)2(0.07mmol)、3A分子筛(0.4g)、18-冠醚-6(2.5mmol)和KOH(2.5mmol)加入甲苯(25ml)中,反应液在通氧气保持微正压的情况下于50℃下搅拌反应2h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,含量98.5%(HPLC);总收率83%。
实施例12
将维生素A三苯基膦溴氢酸盐(1.0mmol)、VO(acac)2(1.0mmol)、3A分子筛(0.2g)、18-冠醚-6(2.2mmol)和KOH(3.0mmol)加入甲苯(20ml)中,反应液在通氧气保持微正压的情况下于30℃下搅拌反应3h。待反应液冷却至室温,过滤除去固体残余物,将滤液抽真空浓缩。所得固体即为目标产物β-胡萝卜素粗品,将此粗品氮气保护下溶解在正己烷中回流加热12h进行各种顺式化合物向全反式结构异构化处理,之后冷却过滤,烘干得深红色结晶,纯度为99.1%(HPLC);总收率84%。
实施例9~12所采用的反应底物投料比和相应的收率如表2所示。
表2
实施例13~17
当不加入分子筛时,分别以与实施例8~12相同的方式分别实施了实施例13~17;相应产物的收率如表3所示。
表3
由表3可以看出,当不适用分子筛时,收率大幅度降低;由此证明了分子筛对本发明的必需性。分子筛具有表面积大、孔分布均匀、表面化学性质丰富等优点,是催化剂载体的一种理想选择,反应体系中添加分子筛可以减少催化剂钒化合物使用量,且可实现在常温或加热温度较低的情况催化氧化偶联反应的进行,另外分子筛本体也容易从反应体系中分离出来重复使用。
实施例18~19
当在空气氛围下进行时,分别以与实施例11~12相同的方式分别实施了实施例18~19;相应产物的收率如表4所示。
表4
由表4可知,当反应在空气氛围下进行时,反应无法进行或者收率极低,由此证明氧气氛围对于本发明的必需性。氧气作为氧化剂,成本低,原料易得,经济实用,适于工业化生产。
实施例20~22
考察反应中不添加催化剂钒化合物的情形,分别与实施例10~12相同的方式分别实施了实施例20~22;相应产物的收率如表5所示。
表5
由表5可知,当反应在不添加钒化合物时,反应进行的很缓慢,目标产物收率很低,由此证明钒化合物对于提高反应速度和转化率的重要性。含钒化合物是一类热稳定性和化学稳定性都很高的化合物,同时也是一种优良的选择性氧化催化剂,能选择性将氧化产物停留在醛或酮而不进行深度氧化。本发明中添加含钒化合物做反应的催化剂,可以极大缩短氧气作为氧化剂进行偶联反应所需要的时间,同时提高反应的选择性,防止深度氧化;氧化过程中不引入其他杂质,产物容易分离。
本发明中,加入聚醚类相转移催化剂可引发非均相反应体系中底物间的反应;固态碱性化合物与其形成络合物而被溶解于有机相中参与反应,有效控制有机相中碱的溶解度,促进反应进行的同时抑制副产物的产生,增加种产物的产量,从而达到提高收率的目的。
Claims (11)
1.β-胡萝卜素的合成方法,其特征在于其具体步骤如下:
由维生素A醇制备得到有机膦盐,在钒化合物催化剂和分子筛存在下,于氧气氛围中,发生分子间氧化偶联反应,得β-胡萝卜素;
所述分子间氧化偶联反应在有机溶剂、相转移催化剂和碱性化合物构成的固液两相反应体系中进行,反应路线如下:
其中,R1、R2、R3是芳族基团、脂肪族、脂环族基团;所述Xθ选自硫酸氢根、硫酸根、四氟硼酸根、磷酸根、乙酸根、甲苯磺酸根、苯磺酸根、氯离子、溴离子或碘离子中的一种;
所述相转移催化剂选自12-冠醚-4、15冠醚-5、18-冠醚-6、二苯并-18-冠醚-6、平均分子量为1000的聚乙二醇、平均分子量为1500的聚乙二醇、平均分子量为2000的聚乙二醇、三缩四乙二醇、三缩四乙二醇二甲醚中的至少一种;
所述钒化合物选自VO(acac)2、VO(OAc)2、VO(hfac)2、NH4VO3、NaVO3、KVO3、V2O5、VO(OEt)3、VO(OPr)3、VO(Oi-Pr)3中的至少一种。
2.如权利要求1所述β-胡萝卜素的合成方法,其特征在于所述R1、R2、R3是苯基、环己基或丁基。
3.如权利要求1所述β-胡萝卜素的合成方法,其特征在于所述分子筛选自3A分子筛、4A分子筛、5A分子筛中的至少一种。
4.如权利要求1所述β-胡萝卜素的合成方法,其特征在于所述碱性化合物选自碱金属氢氧化物、碱金属醇盐、碱金属碳酸盐、碱金属磷酸盐、碱金属有机酸盐中的至少一种。
5.如权利要求4所述β-胡萝卜素的合成方法,其特征在于所述碱性化合物选自K2CO3、Na2CO3、Cs2CO3、Li2CO3、NaOH、KOH、LiOH、K3PO4、Na3PO4、BuOK、BuONa、NaOAc、KOAc、EtONa、EtOK中的至少一种。
6.如权利要求1所述β-胡萝卜素的合成方法,其特征在于所述有机溶剂选自甲苯、二氯甲烷、氯仿、苯、二氯乙烷、正己烷、四氢呋喃、石油醚、甲醚、甲基叔丁酯中的至少一种。
7.如权利要求1所述β-胡萝卜素的合成方法,其特征在于所述有机膦盐与催化剂的摩尔比为1︰(0.01~1);所述有机膦盐与分子筛的配比为1︰(0.1~0.5),其中有机膦盐以毫摩尔计算,分子筛以质量克计算;所述有机膦盐与碱的摩尔比为1︰(1.5~3);所述有机膦盐与相转移催化剂的摩尔比为1︰(1.5~3);所述有机膦盐与有机溶剂的摩尔体积比为1︰(10~30),其中有机膦盐以摩尔计算,有机溶剂以体积升计算。
8.如权利要求1所述β-胡萝卜素的合成方法,其特征在于所述偶联反应的反应温度为10~60℃;所述偶联反应的反应时间为2~8h。
9.如权利要求8所述β-胡萝卜素的合成方法,其特征在于所述偶联反应的反应温度为25~40℃;所述偶联反应的反应时间为2~4h。
10.如权利要求1所述β-胡萝卜素的合成方法,其特征在于所述分子间氧化偶联反应后,待反应液冷却分层除去固体,有机相水洗、浓缩回收溶剂后得到的红色固体即为β-胡萝卜素和膦氧化合物组成的混合物,该混合物用醇类洗除去膦氧化合物,然后进行重结晶或在溶剂中加热,再进行各种顺式混合物向全反式结构的重排处理。
11.如权利要求10所述β-胡萝卜素的合成方法,其特征在于所述醇类为甲醇。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201810818995.0A CN108822015B (zh) | 2018-07-24 | 2018-07-24 | β-胡萝卜素的合成方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201810818995.0A CN108822015B (zh) | 2018-07-24 | 2018-07-24 | β-胡萝卜素的合成方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108822015A CN108822015A (zh) | 2018-11-16 |
| CN108822015B true CN108822015B (zh) | 2020-09-11 |
Family
ID=64140081
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201810818995.0A Active CN108822015B (zh) | 2018-07-24 | 2018-07-24 | β-胡萝卜素的合成方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN108822015B (zh) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110452147B (zh) * | 2019-07-30 | 2021-07-23 | 万华化学集团股份有限公司 | 一种β-胡萝卜素的制备方法 |
| WO2022056827A1 (zh) * | 2020-09-18 | 2022-03-24 | 厦门金达威维生素有限公司 | 一种β-胡萝卜素的制备方法 |
| CN113321604B (zh) * | 2021-06-23 | 2023-01-13 | 万华化学集团股份有限公司 | 一种β-胡萝卜素的制备方法 |
| CN113651743B (zh) * | 2021-08-30 | 2023-03-14 | 万华化学集团股份有限公司 | 一种β-胡萝卜素的制备方法 |
| CN113801049B (zh) * | 2021-08-30 | 2022-08-05 | 万华化学集团股份有限公司 | 一种一锅法制备β-胡萝卜素的方法 |
| CN114534729B (zh) * | 2022-03-07 | 2024-05-03 | 万华化学集团股份有限公司 | 一种催化剂及其制备方法和其在电化学法制备β-胡萝卜素中的应用 |
| CN114957075B (zh) * | 2022-06-13 | 2023-09-19 | 万华化学集团股份有限公司 | 一种β-胡萝卜素的制备方法 |
| CN116217454A (zh) * | 2023-01-05 | 2023-06-06 | 万华化学集团股份有限公司 | 一种虾青素的制备方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101081829A (zh) * | 2006-06-02 | 2007-12-05 | 浙江医药股份有限公司新昌制药厂 | β-胡萝卜素的合成工艺 |
-
2018
- 2018-07-24 CN CN201810818995.0A patent/CN108822015B/zh active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101081829A (zh) * | 2006-06-02 | 2007-12-05 | 浙江医药股份有限公司新昌制药厂 | β-胡萝卜素的合成工艺 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN108822015A (zh) | 2018-11-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108822015B (zh) | β-胡萝卜素的合成方法 | |
| US20080269459A1 (en) | Process for the Preparation of a Dicarboxylic Acid | |
| US4233460A (en) | Alkoxyalkanoic acid preparation | |
| CN101709026A (zh) | 一种3-甲基-2-丁烯醛的合成方法 | |
| CN110452147A (zh) | 一种β-胡萝卜素的制备方法 | |
| Fihri et al. | Diphosphines of dppf‐Type Incorporating Electron‐Withdrawing Furyl Moieties Substantially Improve the Palladium‐Catalysed Amination of Allyl Acetates | |
| CN103435463B (zh) | 一种四相相转移催化制备9-芴酮的方法 | |
| CN113999196B (zh) | 一种4-(2-硝基苯基)二苯并[b,d]呋喃的制备方法 | |
| CN112939804B (zh) | 一种有机胺氧化物的制备方法 | |
| CN113861034A (zh) | 2-氟-3-硝基苯甲酸的制备方法 | |
| CN113563189A (zh) | 一种一步法高效催化co2转化碳酸二甲酯催化剂的方法 | |
| CN109092375B (zh) | 环己烷直接氧化制己二酸的自由基稳定剂 | |
| CN102120726B (zh) | 一种制备(2e)-2-氰基-3-(3,4-二羟基-5-硝基苯)-n,n-二乙基-2-丙烯酰胺的新方法 | |
| EP2248794A1 (en) | Process for production of dialcohol, process for production of allylhalide compound, and allylchloride compound | |
| CN106431885B (zh) | 顺丁烯二酸酐混合溶剂臭氧化合成乙醛酸的方法 | |
| CN114635145B (zh) | 一种酰亚胺衍生物的电化学制备方法 | |
| CN115304477B (zh) | 一种芳香族羧酸酯的制备方法 | |
| CN102219676B (zh) | Co偶联制草酸酯的方法 | |
| CN115340475B (zh) | 一种1-氧化二苯基二氮烯或其衍生物的制备方法 | |
| CN102219681B (zh) | Co气相偶联制草酸酯的方法 | |
| CN115850275B (zh) | 一种利用光催化三组分反应合成唑吡坦的方法 | |
| CN110713442A (zh) | 一种邻硝基苯甲醛的制备方法 | |
| JPH0832647B2 (ja) | 1級アルコールからアルデヒドの製造法 | |
| CN112125795B (zh) | 环己烷氧化制己二酸的方法 | |
| CN109092357B (zh) | 环己烷直接氧化合成己二酸的催化剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |