CN1067651A - 嘧啶或三嗪类衍生物、它们的制备方法和应用它们作为除草剂 - Google Patents
嘧啶或三嗪类衍生物、它们的制备方法和应用它们作为除草剂 Download PDFInfo
- Publication number
- CN1067651A CN1067651A CN92104403A CN92104403A CN1067651A CN 1067651 A CN1067651 A CN 1067651A CN 92104403 A CN92104403 A CN 92104403A CN 92104403 A CN92104403 A CN 92104403A CN 1067651 A CN1067651 A CN 1067651A
- Authority
- CN
- China
- Prior art keywords
- compound
- formula
- group
- represent
- definition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/54—1,3-Diazines; Hydrogenated 1,3-diazines
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/64—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with three nitrogen atoms as the only ring hetero atoms
- A01N43/66—1,3,5-Triazines, not hydrogenated and not substituted at the ring nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/56—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/60—Three or more oxygen or sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D251/00—Heterocyclic compounds containing 1,3,5-triazine rings
- C07D251/02—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings
- C07D251/12—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D251/26—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hetero atoms directly attached to ring carbon atoms
- C07D251/30—Only oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D251/00—Heterocyclic compounds containing 1,3,5-triazine rings
- C07D251/02—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings
- C07D251/12—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D251/26—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with only hetero atoms directly attached to ring carbon atoms
- C07D251/38—Sulfur atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Plural Heterocyclic Compounds (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
本发明公开了式(I)所示的嘧啶或三嗪类化合
物、制备它们的方法以及含有它们作为有效成分的除
草剂,
式(I)中R1、R2、R3、R4、R5、R6,X次及Z的定
义与说明书中所述的相同。
Description
本发明是关于含有新的嘧啶或三嗪类衍生物如3-烷氧基丁酰基咪唑衍生物、3-烷氧基链烷酰胺衍生物、3-烷氧基链烷酸衍生物和2-嘧啶基-硫代链烷酸衍生物作为有效成分的除草剂。
为了促进节省农田劳动和增加农作物产量,迄今已经研制了许多种除草剂。但是,一般的除草剂在除草效果方面不能满足需要,例如对于农作物(如棉花)缺乏选择性除草作用,并且就对生物的安全性来讲也不能十分令人满意。因此,为了解决上述问题,需要研制新的除草剂。
本发明嘧啶或三嗪类的3-烷氧基丁酰基咪唑衍生物、3-烷氧基链烷酰胺衍生物和3-烷氧基链烷酸衍生物是新的化合物,并且它们的除草作用仍未被人们所知。
作为与本发明的2-嘧啶基硫代链烷酸衍生物类似的化合物是已知的,例如日本临时专利公开说明书No.85262/1990公开的化合物,并且还已知这些化合物具有除草作用。但是,这些化合物的除草效果是不能满足需要的,因此需要研制新的具有更优良活性的除草剂。
本发明的目的是提供新的嘧啶或三嗪类衍生物、它们的制备方法和含有该类化合物作为有效成分的除草剂。
为了解决上述问题,本发明的发明人进行了广泛的研究,并且最终发现,新的嘧啶或三嗪类衍生物对一年生水稻植物杂草和一年生阔叶杂
草显示出更良好的除草效果,并且对作物(如棉花)显示出选择性,此外还发现,制备它们的方法收率高,结果完成了本发明。
下面叙述本发明。
第一方面,本发明是关于下式(Ⅰ)所示3-烷氧基链烷酸衍生物,
其中R1代表氰基、卤原子、羟基或-O-R7,这里R7代表低级烷基、低级链烯基、低级炔基、卤素低级烷基或氰基-低级烷基;
R2代表氢原子或低级烷基;
R3代表氢原子或低级烷基;
R4代表1-咪唑基、-NHSO2-R8(这里R8代表低级烷基或可以有一个取代基的苯基)、羟基、低级烷氧基或苄氧基(当Z为氮原子时);或者1-咪唑基、-NHSO2-R8(这里R8的定义同上)、羟基、OK、可以有一个取代基的低级烷氧基、低级链烯氧基、低级炔氧基、可以有一个取代基的环烷氧基、苯氧基、苄氧基、低级烷硫基、苯硫基或烷基亚磺酰氨基(当Z为-CH=基团时);
R5代表低级烷氧基;
R6代表低级烷氧基或低级烷基;
X代表氧原子或硫原子;
Z代表氮原子或-CH=基团。
第二方面,本发明是关于下式(Ⅰa)所示3-烷氧基丁酰基咪唑
衍生物,
其中R7、R3、X和Z各自的定义同上。
第三方面,本发明是关于下式(Ⅰb)所示3-烷氧基链烷酰胺衍生物,
其中R7、R3、R8、X和Z各自的定义同上。
第四方面,本发明是关于下式(Ⅰc)所示三嗪衍生物,
其中R4′代表羟基、低级烷氧基或苄氧基;R2、R6、R7和X各自的定义同上。
第五方面,本发明是关于下式(Ⅰd)所示2-嘧啶基硫代链烷酸衍生物,
其中R1′代表氰基或卤原子;
R2代表低级烷基;
R4″代表羟基、OK、可以有一个取代基的低级烷氧基、低级链烯氧基、低级炔氧基、可以有一个取代基的环烷氧基、苯氧基、苄氧基、低级烷硫基、苯硫基、1-咪唑基或-NHSO2-R8,这里R8的定义同上;
R6′代表低级烷氧基;
R3和R5各自的定义同上。
第六方面,本发明是关于下式(Ⅰe)所示3-羟基-2-嘧啶基硫代链烷酸衍生物,
其中R2、R3、R4″、R5和R6′各自的定义同上。
第七方面,本发明是关于制备上述式(Ⅰa)所示3-烷氧基链烷
酸衍生物的方法,该方法包括使下式(Ⅱ)所示化合物与N,N′-羰基二咪唑反应,
其中R7、R3、X和Z各自的定义同上。
第八方面,本发明是关于制备上述式(Ⅰb)所示3-烷氧基链烷酰胺衍生物的方法,该方法包括使上述式(Ⅰa)所示3-烷氧基链烷酸衍生物与下述式(Ⅲ)所示化合物反应,
其中R8的定义同上。
第九方面,本发明是关于制备上述式(Ⅰc)所示三唑衍生物的方法,该方法包括使下述式(Ⅳ)所示化合物与下述式(Ⅴ)所示化合物反应,
式(Ⅳ)中,R2、R4′、R7和X各自的定义同上,
式(Ⅴ)中,R6的定义同上。
第十方面,本发明是关于制备上述式(Ⅰc)所示咪唑衍生物的方法,该方法包括使下述式(Ⅵ)所示化合物与下述式(Ⅶ)所示化合物反应,
式(Ⅵ)中,R2、R4′和R7各自的定义同上,R9代表低级烷基、取代的苯基或卤素-低级烷基,
式(Ⅶ)中,R6的定义同上。
第十一方面,本发明是关于制备上述式(Ⅰc)所示三唑衍生物的方法,该方法包括使下述式(Ⅷ)所示化合物进行酯交换,
其中R2、R6、R7和X各自的定义同上,R10代表低级烷基。
第十二方面,本发明是关于制备上述式(Ⅰc)所示三唑衍生物的
方法,该方法包括使下述式(Ⅸ)所示化合物进行氢解,
其中R2、R6、R7和X各自的定义同上。
第十三方面,本发明是关于制备下述式(Ⅰd′)所示3-卤素-2-嘧啶基硫代链烷酸衍生物的方法,该方法包括使上述(Ⅰe)所示3-羟基-2-嘧啶基硫代链烷酸衍生物与卤化剂反应,
式中Y代表卤原子;R2、R3、R4″、R5和R6′各自的定义同上。
第十四方面,本发明是关于制备下述式(Ⅰd″)所示3-氰基-2-嘧啶基硫代链烷酸衍生物的方法,该方法包括使上述(Ⅰd′)所示3-卤素-2-嘧啶基硫代链烷酸衍生物(Ⅰd′)与氰化剂反应,
式中R2、R3、R4″、R5和R6′各自的定义同上。
第十五方面,本发明是关于制备上述式(Ⅰe)所示3-羟基-2-嘧啶基硫代链烷酸衍生物的方法,该方法包括使式(Ⅹ)所示化合物与下述式(Ⅺ)所示化合物反应,
式(Ⅹ)中,R2和R3各自的定义同上,
式(Ⅺ)中,R4″、R5和R6′各自的定义同上。
第十六方面,本发明是关于含有上述式(Ⅰ)所示嘧啶或三嗪类衍生物作为有效成分的除草剂。
下面详细说明本发明。
新的嘧啶或三嗪类衍生物(Ⅰ)包括本发明所需的式(Ⅰa)~(Ⅰe)化合物,以及作为其起始原料的式(Ⅱ)~(Ⅶ)化合物,下面叙述R1、R1′、R2、R3、R4、R4′、R4″、R5、R6、R6′、R7、R8、X、Y和Z。
作为R1,可以提到的有氰基、卤原子(氟、氯、溴和碘原子)、羟基或-O-R7。作为R7,可以提到的有低级烷基、低级链烯基、低级炔基、卤素-低级烷基和氰基-低级烷基;作为低级烷基,有1~6个碳原子的直链或支链的烷基较好,有1~4个碳原子的更好,尤其
好的是有1~3个碳原子的(如甲基、乙基、正丙基和异丙基);作为低级链烯基,有2~6个碳原子的直链或支链的链烯基较好,有2~5个碳原子的更好,尤其好的是有2~3个碳原子的(如丙烯基);作为低级炔基,有2~6个碳原子的直链或支链的炔基较好,有2-5个碳原子的更好,尤其好的是有2~3个碳原子的(如丙炔基);作为卤素-低级烷基,有1~6个碳原子的直链或支链的卤素烷基较好(作为卤原子,可以提到的有氟、氯、溴和碘原子,但是氯原子是更好的),有1~5个碳原子的更好,尤其好的是有1~3个碳原子的(如氯乙基和氯丙基);作为氰基-低级烷基,有1~6个碳原子的直链或支链的氰基烷基较好,有1~5个碳原子的更好,尤其好的是有1~3个碳原子的(如氰基乙基)。
作为R2,可以提到的有低级烷基,并且有1~6个碳原子的直链或支链的低级烷基是较好的,有1~4个碳原子的更好,尤其好的是有1~3个碳原子的(如甲基、乙基、正丙基和异丙基),最好的是甲基。
作为R3,可以提到的有氢原子和低级烷基,并且有1~6个碳原子的直链或支链的低级烷基是较好的,有1~4个碳原子的更好,尤其好的是有1~3个碳原子的(如甲基和乙基)。
当Z代表氮原子时,作为R4,可以提到的有1-咪唑基(如式Ⅰa所示)、-NHSO2-R8(烷基磺酰氨基或芳基磺酰氨基),这里R8代表低级烷基或可以有一个取代基的苯基(如式Ⅰb所示)、羟基、低级烷氧基或苄氧基(如式Ⅰc所示)。R8的低级烷基较好的是有1~6个碳原子的直链或支链的烷基,有1~4个碳原子的更好(如甲基、乙基、正丙基、异丙基和正丁基)。作为R8的苯基取代基,可以提到的是例如有1~6个碳原子的直链或支链的烷基(有1~4个碳原子的更
好,最好的是甲基)和卤原子(氟、氯、溴和碘原子,氯原子较好)。较好的低级烷氧基是有1~6个碳原子的直链或支链的烷氧基,有1~4个碳原子的更好,尤其好的是有1~3个碳原子的(如甲氧基和乙氧基)。
当Z代表-CH=时,作为R4可以提到的有1-咪唑基(如式Ⅰa所示)、-NHSO2-R8(如式Ⅰb所示)、羟基、OK、可以有一个取代基的低级烷氧基、低级链烯氧基、低级炔氧基、可以有一个取代基的环烷氧基、苯氧基、苄氧基、低级烷硫基、苯硫基或烷基亚磺酰氨基(如式Ⅰd和Ⅰe所示)。这里R8同以上所述。作为低级烷氧基、低级烷硫基和烷基磺酰氨基中碳的数目,有1~6个碳原子的直链或支链的较好,有1~4个碳原子的更好,尤其好的是有1~3个碳原子;作为低级烷氧基的取代基,可以提到的是有1~6个(有1~4个较好,有1~3个更好)碳原子的直链或支链的低级烷氧基和低级烷基甲硅烷基(如三甲基甲硅烷基);作为低级链烯基,有2-6个碳原子的直链或支链的较好,有2~4个碳原子的更好,尤其好的是有2~3个碳原子的(如丙烯基);作为低级炔基,有2~6个碳原子的较好,有2~4个碳原子的更好,尤其好的是有2~3个碳原子的(如丙炔基);作为环烷氧基,有3~10个碳原子的较好,有3~8个碳原子的更好,尤其好的是有4~6个碳原子的;作为环烷基的取代基,可以提到的有卤原子,较好的是氯原子。
作为R5,可以提到的有甲氧基(如式Ⅰa~Ⅰc所示),或有1~6个碳原子的直链或支链的低级烷氧基,低级烷氧基中碳原子的数目是1~4个碳原子较好,有1~3个碳原子的更好(如甲氧基)。
作为R6,可以提到的有甲氧基(如式Ⅰa和Ⅰb所示),或低级烷
基或低级烷氧基(如式Ⅰc~Ⅰe所示)。作为低级烷基,可以提到的是有1~6个碳原子的直链或支链的烷基,有1~4个碳原子的更好,尤其好的是有1~3个碳原子的(如甲基和乙基),较好的低级烷氧基是有1~6个碳原子的直链或支链的烷氧基,有1~4个碳原子的较好,尤其好的是有1~3个碳原子的(如甲氧基和乙氧基)。
作为式(Ⅵ)的R9,可以提到的有低级烷基、取代的苯基和卤素-低级烷基,作为低级烷基和卤素-低级烷基,较好是有1~6个碳原子的直链或支链的,有1~4个碳原子的更好,尤其好的是有1~3个碳原子的(如甲基和乙基);作为取代苯基的取代基,可以提到的是有1~6个碳原子的直链或支链的烷基,有1~4个碳原子的较好,有1~3个碳原子的更好。
作为式(Ⅷ)中的R10,可以提到的有低级烷基,有1~6个碳原子的直链或支链的较好,有1~4个碳原子的更好,尤其好的是有1~3个碳原子的(如甲基和乙基)。
作为X,可以提到的有氧原子和硫原子。
作为Z,可以提到的有氮原子和-CH=(methyn,1-基-1-亚甲基)。
作为式(Ⅰd)中的Y,可以提到的有卤原子(如氟、氯、溴和碘原子,但较好的是氯原子)。
基于所需新的嘧啶或三嗪衍生物(Ⅰ)具有不对称碳原子,因此本发明包括其光学异构体。
化合物(Ⅰ)可以按例如下述制备方法1~11进行制备。
制备方法1:
其中R3、R7、X和Z各自的定义同上。
化合物(Ⅰa)可以通过在溶剂中将起始化合物(Ⅱ)与N,N′-羰基二咪唑反应制得。
化合物(Ⅱ)可以容易地制备,例如可以按照日本专利申请No.279328/1990所示方法,使2-羟基链烷酸衍生物或2-巯基链烷酸衍生物与2-甲基磺酰基吡啶或2-氯三嗪反应制得
其中R3、R7、X和Z各自的定义同上,并且W代表氯原子或CH3SO2-。
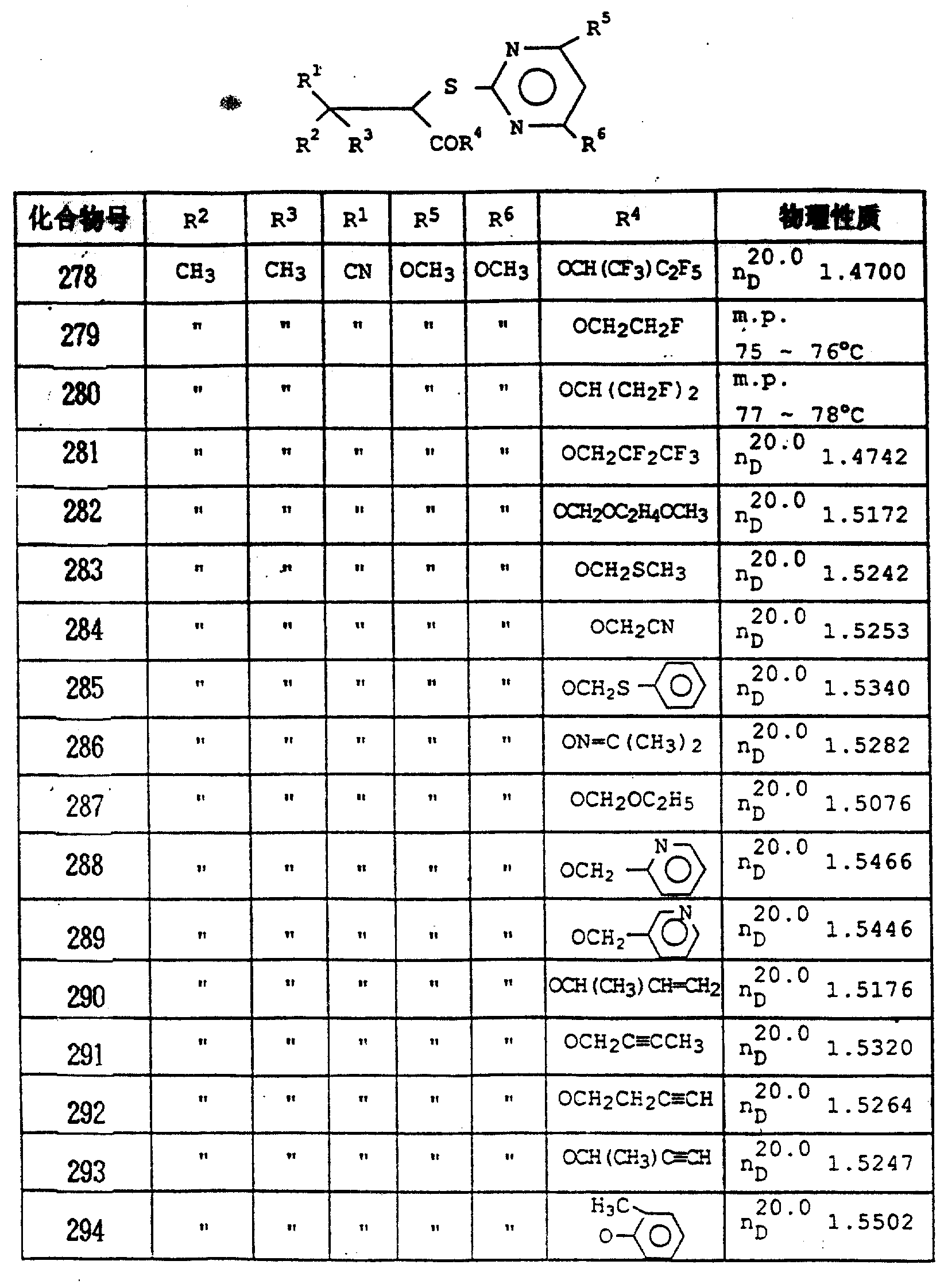
作为化合物(Ⅱ),可以提到的有例如包括表1所示相应于化合物No.1~38各类取代基团的各个化合物(以化合物(Ⅱ)1~(Ⅱ)38表示),例如,对应于化合物No.1的化合物(Ⅱ)以化合物(Ⅱ)1表示,并且该化合物(Ⅱ)1意指化合物(Ⅱ)中R7为CH3,R3为H,X为0和Z为CH。
溶剂不是特别受限制的,只要该溶剂不直接地参与本反应,并且可以包括例如水;醚类,如乙醚、四氢呋喃和1,4-二噁烷;酮类,如丙酮、甲乙酮和甲基异丁基酮;腈类,如乙腈;偶极非质子传递溶剂,如N,N-二甲基甲酰胺、N,N′-二甲基-2-咪唑啉酮和二甲基亚砜;卤代烷类,如氯仿如二氯甲烷;以及上述溶剂的混合液。
制备化合物(Ⅰa)的反应可以在反应液浓度为5~80%的情况下进行。
在上述制备方法中,应用的起始化合物(Ⅱ)与N,N′-羰基二咪唑的比例为0.5~2摩尔,每摩尔起始化合物(Ⅱ)用1~1.5摩尔N,N-羰基二咪唑较好。
反应温度不是特别受限制的,只要温度达到所用溶剂的沸点或低于该沸点,但是反应通常在0~80℃进行,以5~50℃较好。
反应时间依上述浓度和温度而变化,但通常在0.5~10小时之内完成。
作为化合物(Ⅰa),可以提到的有例如包括表1所示相应于化合物No.1~38各类取代基团的各个化合物(以化合物1~38表示),例如对应于化合物No.1的化合物(Ⅰ)以化合物1表示,并且该化合物1意指化合物(Ⅰ)中R7为CH3,R3为H,X为氧和Z为CH。
制备方法2:
其中R3、R7、R8、X和Z各自的定义同上。
化合物(Ⅰb)可以在溶剂中于碱存在下,通过化合物(Ⅰa)与式(Ⅲ)所示的烷基磺酰胺或芳基磺酰胺反应制得。
式(Ⅲ)化合物可以通过相应的磺酰氯与氨反应容易地制备。
作为化合物(Ⅲ),可以提到的有例如包括表1所示相应于化合物No.39~140各类取代基团的各个化合物(以化合物(Ⅲ)39~(Ⅲ)140表示),例如,对应于化合物No.41的化合物(Ⅲ)以化合物(Ⅲ)41表示,并且该化合物(Ⅲ)41意指化合物(Ⅲ)中R8为CH3。
溶剂不是特别受限制的,只要该溶剂不直接地参与本反应,并且可以包括醚类,如乙醚、四氢呋喃和1,4-二噁烷;酮类,如丙酮、甲乙酮和甲基异丁基酮;腈类,如乙腈;偶极非质子传递溶剂,如N,N-二甲基甲酰胺、N,N′-二甲基-2-咪唑啉酮和二甲基亚砜;以及上述溶剂的混合液。
作为碱,可以提到的有例如无机碱,如氨基钠、氢氧化钠、氢氧化钾、碳酸钾、碳酸钠和氢化钠。
制备化合物(Ⅰb)的反应可以在反应液浓度为5~80%的情况
下进行。
在该制备方法中,应用的起始化合物(Ⅰa)与化合物(Ⅲ)的比例为0.5~2摩尔,每摩尔起始化合物(Ⅰa)用1~1.5摩尔化合物(Ⅲ)较好。
反应温度不是特别受限制的,只要温度达到所用溶剂的沸点或低于该沸点,但是反应通常在0~50℃进行。
反应时间依上述浓度和温度而变化,但是通常可以在1~10小时内完成。
作为化合物(Ⅰb),可以提到的有例如包括表1所示相应于化合物No.39~140各类取代基团的各个化合物(以化合物39-140表示),例如对应于化合物No.41的化合物(Ⅰ)以化合物41表示,并且该化合物41意指化合物(Ⅰ)中R7为CH3,R3为H,R8为CH3,X为硫和Z为CH。
制备方法3:
其中R2、R4′、R6、R7和X各自的定义同上。
化合物(Ⅰc)一般可以在溶剂中于碱存在下,通过起始化合物(Ⅳ)与起始化合物(Ⅴ)反应制得。
其中X为氧原子的化合物(Ⅳ)可以容易地制得,例如,如下所示,
由环氧链烷酸酯(按“Tetrahedron Letter”,第36号,第3761页(1972年)或“Org.Syn.”Ⅳ,第459页制备)于醇中在酸催化剂(硫酸或对甲苯磺酸)存在下反应制得,
其中R2、R4′和R7各自的定义同上。
其中X为硫原子的化合物(Ⅳ)也可以按以下所示,通过化合物(Ⅳ′)与氢硫化钠于极性溶剂中反应容易地制得,
其中R2、R4′、R7和R9各自的定义同上。
作为化合物(Ⅳ),可以提到的有例如包括表1所示相应于化合物No.141、144、145、148、149、150、153、154、157、158、159、162、163、164、165、167、168、169、171、172、175、176、179和180各类取代基团的各个化合物(分别以化合物(Ⅳ)141、(Ⅳ)144、(Ⅳ)145、(Ⅳ)148、(Ⅳ)149、(Ⅳ)150、(Ⅳ)153、(Ⅳ)154、(Ⅳ)157、(Ⅳ)158、(Ⅳ)159、(Ⅳ)162、(Ⅳ)163、(Ⅳ)164、(Ⅳ)165、(Ⅳ)167、(Ⅳ)168、(Ⅳ)169、(Ⅳ)171、(Ⅳ)172、(Ⅳ)175、(Ⅳ)176、(Ⅳ)179和(Ⅳ)180表示),例如,对应于化合物No.144的化合物(Ⅳ)以化合物(Ⅳ)144表示,并且该化
合物(Ⅳ)144意指化合物(Ⅳ)中R7为CH3,R2为H,R4′为OH,X为S。
其中R6为烷氧基的化合物(Ⅴ)可以容易地制备,例如按以下所示通过氰尿酸与烷基醇盐反应制得,
其中R11代表烷基,M代表碱金属。
其中R6为烷基的化合物(Ⅴ)可以容易地制备,例如按以下所示通过氰尿酸与格利雅试剂反应,并且再与甲醇钠反应,
其中R12代表烷基,Y代表卤原子。
作为化合物(Ⅴ),可以提到的有例如包括表1所示相应于化合物No.141、144、145、148、149、150、153、154、157、158、159、162、163、164、165、167、168、169、171、172、175、176、179
和180各类取代基团的各个化合物(分别以化合物(Ⅴ)141、(Ⅴ)144、(Ⅴ)145、(Ⅴ)148、(Ⅴ)149、(Ⅴ)150、(Ⅴ)153、(Ⅴ)154、(Ⅴ)157、(Ⅴ)158、(Ⅴ)159、(Ⅴ)162、(Ⅴ)163、(Ⅴ)164、(Ⅴ)165、(Ⅴ)167、(Ⅴ)168、(Ⅴ)169、(Ⅴ)171、(Ⅴ)172、(Ⅴ)175、(Ⅴ)176、(Ⅴ)179和(Ⅴ)180表示),例如,对应于化合物No.144的化合物(Ⅴ)以化合物(Ⅴ)144表示,并且该化合物(Ⅴ)144意指化合物(Ⅴ)中R6为OCH3。
溶剂不是特别受限制的,只要该溶剂不直接参与本反应,并且可以包括例如水;醚类,如 乙醚、四氢呋喃和1,4-二噁烷;酮类,如丙酮、甲乙酮和甲基异丁基酮;腈类,如乙腈;偶极非质子传递溶剂,如N,N-二甲基甲酰胺、N,N′-二甲基-2-咪唑啉酮和二甲基亚砜;以及上述溶液的混合液。
作为碱,可以提到的是有机碱,如三乙胺、吡啶和N,N-二乙基苯胺;无机碱,如氨基钠、氢氧化钠、氢氧化钾、碳酸钾、碳酸钠和氢化钠。
制备化合物(Ⅰc)的反应可以在反应液浓度为5~80%的情况下进行。
在该制备方法中,应用的起始化合物(Ⅳ)和(Ⅴ)的比例为0.5~2摩尔,每摩尔起始化合物(Ⅳ)用1~1.5摩尔起始化合物(Ⅴ)较好。
反应温度不是特别受限制的,只要达到所用溶剂的沸点或低于该沸点,反应通常在0~50℃进行,加热可以使反应时间缩短。
反应时间依上述浓度和温度而变化,但是通常在0.5~10小时内完成。
作为化合物(Ⅰc),可以提到的有例如包括表1所示相应于化合物No.141~180各类取代基团的各个化合物(以化合物141~180表示),例如,对应于化合物No.144的化合物(Ⅰ)以化合物144表示,并且该化合物144意指化合物(Ⅰ)中R7为CH3,R2为H,R4′为OH,R6为OCH3,X为S。
制备方法4:
其中R2、R6、R7和R9各自的定义同上。
用起始化合物(Ⅷ)和(Ⅸ)代替制备方法(3)中的化合物(Ⅳ)和(Ⅴ),并使化合物(Ⅷ)和(Ⅸ)反应,可以制得化合物(Ⅰc)。
化合物(Ⅷ)可以按以下所示在合适的溶剂中,于碱催化剂存在下,通过化合物(Ⅳ′)与磺酰氯反应容易地制备,
其中R2、R4′、R7和R9各自的定义同上。
作为化合物(Ⅷ),可以提到的有例如包括表1所示相应于化合物No.144、148、153、157、158、162、164、167、
168、171、175、179和180各类取代基团的各个化合物(分别以化合物(Ⅷ)144、(Ⅷ)148、(Ⅷ)153、(Ⅷ)157、(Ⅷ)158、(Ⅷ)162、(Ⅷ)164、(Ⅷ)167、(Ⅷ)168、(Ⅷ)171、(Ⅷ)175、(Ⅷ)179和(Ⅷ)180表示),例如,对应于化合物No.148的化合物(Ⅷ)以化合物(Ⅷ)148表示,并且该化合物(Ⅷ)148意指化合物(Ⅷ)中R2和R7均为CH3,R9为相应的4-甲基苯基。
化合物(Ⅸ)可以在水或醇中,在加热和搅拌的条件下,通过将氢硫化钠加到化合物(Ⅵ)中容易地制得。
作为化合物(Ⅸ),可以提到的有例如包括表1所示相应于化合物No.144、148、153、157、158、162、164、167、168、171、175、179、180各类取代基团的各个化合物(分别以化合物(Ⅸ)144、(Ⅸ)148、(Ⅸ)153、(Ⅸ)157、(Ⅸ)158、(Ⅸ)162、(Ⅸ)164、(Ⅸ)167、(Ⅸ)168、(Ⅸ)171、(Ⅸ)175、(Ⅸ)179和(Ⅸ)180表示),例如,对应于化合物No.148的化合物(Ⅸ)以化合物(Ⅸ)148表示,并且该化合物(Ⅸ)148意指化合物(Ⅸ)中R6为OCH3。
可以用制备方法3中相同的溶剂、碱、反应温度和时间进行本反应。
制备方法5:
其中R2、R4′、R6和R7各自的定义同上,并且R13代表低级烷基。
一般来讲,化合物(Ⅰc)可以在溶剂中,用四烃氧基钛作为催化剂,通过化合物(Ⅹ)与苄醇进行酯交换反应容易地制备。
化合物(Ⅹ)例如可以按上述制备方法3容易地制备。
作为化合物(Ⅹ),可以提到的有例如包括表1所示相应于化合物No.142、146、151、155、160、166、170、173和177各类取代基团的各个化合物(分别以化合物(Ⅹ)142、(Ⅹ)146、(Ⅹ)151、(Ⅹ)155、(Ⅹ)160、(Ⅹ)166、(Ⅹ)170、(Ⅹ)173和(Ⅹ)177表示),例如,对应于化合物No.151的化合物(Ⅹ)以化合物(Ⅹ)151表示,并且该化合物(Ⅹ)151意指化合物(Ⅹ)中R2为CH3,R7为C2H5,R4′为
和R6为OCH3。
溶剂不是特别受限制的,只要该溶剂不直接地参与该反应,并且可以包括例如芳香烃类,如苯、甲苯和二甲苯。
作为催化剂,可以提到的有四异丙氧基钛和四正丙氧基钛。
可以在反应液浓度为5~80%的情况下制备化合物(Ⅰc)。
在该制备方法中,应用的起始化合物(Ⅹ)和苄醇的比例为1~3摩尔,每摩尔起始化合物(Ⅹ)用1.5~2摩尔苄醇较好。
反应温度不是特别受限制的,只要达到所用溶剂的沸点或低于该沸点,但是反应通常可以在70~150℃下进行。
反应时间依上述浓度和温度而改变,但是一般在2~20小时内完成。
制备方法6:
其中R2、R6、R7和X各自的定义同上。
化合物(Ⅰc)可以通过在常压下,应用钯-炭作为催化剂,使化合物(Ⅸ)进行氢解容易地制得。
化合物(Ⅸ)可以例如按照制备方法5容易地制备。
作为化合物(Ⅸ),可以提到的有例如包括表1所示相应于化合物No.143、147、152、156、161、174和178各类取代基团的各个化合物(分别以化合物(Ⅸ)143、(Ⅸ)147、(Ⅸ)152、(Ⅸ)156、(Ⅸ)161、(Ⅸ)174和(Ⅸ)178表示),例如对应于化合物No.147的化合物(Ⅸ)以化合物(Ⅸ)147表示,并且该化合物(Ⅸ)147意指化合物(Ⅸ)中R2为CH3,R6为OCH3,R7为CH3。
溶剂不是特别受限制的,只要该溶剂不直接地参与该反应,并且可以包括例如氯化或未氯化的芳香烃,如苯、甲苯、二甲苯和氯苯;醚类,如四氢呋喃;醇类,如甲醇和乙醇。
作为催化剂,可以提到的有钯-炭。
制备化合物(Ⅰc)可以在反应液浓度为5~80%的情况下进行。
反应温度不是特别受限制的,只要达到所用溶剂的沸点或低于该沸点,但是反应通常可以在10~80℃进行,在20~50℃进行更好。
反应时间依上述浓度和温度而改变,但是通常可以在0.5~12小时内完成。
制备方法7:
在式(Ⅰ)中其中R1代表Y的化合物(Ⅰd′)可以通过3-羟基-2-嘧啶基硫代链烷酸衍生物(Ⅰe)与卤化剂反应制备。
化合物(Ⅰe)可以在溶剂中于锂存在下,通过式(Ⅹ)相应的酮与式(Ⅺ)的2-嘧啶基硫代乙酸酯反应制得。
作为化合物(Ⅹ),可以应用市场上购买的。
作为化合物(Ⅹ),可以提到的有例如包括表1所示相应于化合物No.181~195各类取代基团的各个化合物(分别以化合物(Ⅹ)181~(Ⅹ)195表示),例如,对应于化合物No.181的化合物(Ⅹ)以化合物(Ⅹ)181表示,并且该化合物(Ⅹ)181意指化合物(Ⅹ)中R2和R3均为CH3的化合物。
化合物(Ⅺ)可以于溶剂中,在碱存在下,通过巯基乙酸酯与4,6-二甲氧基-2-甲磺酰基嘧啶制备。
作为化合物(Ⅺ),可以提到的有例如包括表1所示相应于化合物No.181~195各类取代基团的各个化合物(分别以化合物(Ⅺ)181~(Ⅺ)195表示),例如,对应于化合物No.181的化合物(Ⅺ)以化合物(Ⅺ)181表示,并且该化合物(Ⅺ)181意指化合物(Ⅺ)中R5和R6′均为OCH3,R4″为OC2H4Si(CH3)3。
可以在反应液浓度为10~80%的情况下制备化合物(Ⅰe)。在该制备方法中,应用的起始化合物(Ⅹ)和(Ⅺ)的比例为1~2摩
尔,每摩尔起始化合物(Ⅹ)用1.1~1.2摩尔起始化合物(Ⅺ)较好。溶剂可以包括例如二噁烷、四氢呋喃(THF)、乙醚和己烷。反应温度为-60°~-20℃较好。在氮气流和搅拌的情况下,反应时间可以为1~3小时。
作为化合物(Ⅰe),可以提到的有例如包括表1所示相应于化合物No.181~195各类取代基团的各个化合物(分别以化合物(Ⅰe)181~(Ⅰe)195表示),例如,相应于化合物No.181的化合物(Ⅰe)以化合物(Ⅰe)181表示,并且该化合物(Ⅰe)181意指化合物(Ⅰe)中R2和R3均为CH3,R5和R6′均为OCH3和R4″为OC2H5。
制备化合物(Ⅰd′)方法中,作为卤化剂可以提到的有亚硫酰氯、亚硫酰溴、三氯化磷、三溴化磷、三碘化磷、氢碘酸、1,1,2,2-四氟乙二胺、二氢三氟化四丁基鏻、三氟化二甲氨基硫和草酰氯。反应可以在反应液浓度为5~80%进行。起始化合物(Ⅰe)与卤化剂的比例为1~3摩尔,每摩尔起始化合物(Ⅰe)用1.1~1.5摩尔卤化剂较好。应用溶剂时,溶剂不是特别受限制的,只要该溶剂不与卤化剂反应,并且可以包括例如醚类,如乙醚、THF和二噁烷;卤代脂肪烃,如二氯甲烷和氯仿。反应温度不是特别受限制的,但通常为0~100℃,以0~50℃较好。反应时间可以依上述浓度和温度而变化,但在搅拌情况下通常为0.5~3小时。
作为化合物(Ⅰd′),可以提到的有例如包括表1所示相应于化合物No.196~218各类取代基团的各个化合物(分别以化合物(Ⅰd′)196~(Ⅰd′)218表示),例如,对应于化合物No.196的化合物(Ⅰd′)以化合物(Ⅰd′)196表示,并且该化合物(Ⅰd′)196
意指化合物(Ⅰd′)中R2和R3均为CH3,R5和R6′均为OCH3,R4″为OC2H5和X为F。
制备方法8:
在式(Ⅰ)中R1代表CN的化合物(Ⅰd″)可以通过3-卤代-2-嘧啶基硫代链烷酸衍生物(Ⅰd′)与氰化剂反应制备。
在制备化合物(Ⅰd″)的方法中,作为氰化剂可以提到的有氰化钠、氰化钾和氰化铜。反应可以在反应液浓度为10~80%的情况下进行。起始化合物(Ⅰd′)和氰化剂的比例为1~2摩尔,每摩尔起始化合物(Ⅰd′)用1.1~1.5摩尔氰化剂较好。溶剂不是特别受限制的,只要它能与少量水混溶,并且可以包括例如DMF(N,N-二甲基甲酰胺)、DMSO(二甲基亚砜)、DMAC(N,N-二甲基乙酰胺)、1,3-二甲基-2-咪唑啉酮、丙酮、乙腈、甲醇和乙醇。反应温度不是特别受限制的,但以0~50℃较好。反应时间可以依上述浓度和温度而变化,但是在搅拌的情况下通常为0.5~3小时。
作为用以上方法制备的化合物(Ⅰd″),可以提到的有例如包括表1所示相应于化合物No.220到232、234、235、241到243、247、248、253到254、257、258、261、262、264到267、269到271、290到293以及306各类取代基团的各个化合物(分别以化合物(Ⅰd″)220~232、(Ⅰd″)234~235、(Ⅰd″)241~243、(Ⅰd″)247~249、(Ⅰd″)253~254、(Ⅰd″)257~258、(Ⅰd″)261~262、(Ⅰd)264~267、(Ⅰd″)269~271、(Ⅰd″)290~293和(Ⅰd″)306表示),例如,对应于化合物No.220的化合物(Ⅰd″)以化合物(Ⅰd″)220表示,并且该化合物(Ⅰd″)220意
指(Ⅰd″)中R2和R3均为CH3,R4″、R5和R6′均为OCH3。
制备方法9:
下式(Ⅰd″′)所示化合物,
式(Ⅰ)中R1代表CN和R4代表羟基的化合物(Ⅰd″′)可以在溶剂中,通过3-氰基-3-嘧啶基硫代链烷酸酯衍生物(Ⅰd″)与碱反应制得。
在制备化合物(Ⅰd″′)中,作为碱,可以提到的有氢氧化钠和氢氧化钾。可以在反应液浓度为10~80%的情况下进行反应。起始化合物(Ⅰd″)与碱的比例为1~2摩尔,每摩尔起始化合物(Ⅰd″)用1~1.2摩尔碱较好。溶剂不是特别受限制的,只要该溶剂能与少量水混溶,并且可以包括例如DMF、DMSO、DMAC、1,3-二甲基-2-咪唑啉酮、丙酮、乙腈、甲醇和乙醇。反应温度不是特别受限制的,但在0~60℃较好。反应时间可以依上述浓度和温度而变化,但是在搅拌情况下通常为1~6小时。
作为用以上方法制得的化合物(Ⅰd″′),可以提到的有例如包括表1所示相应于化合物No.219、252和260各类取代基团的各个化合物(分别以化合物(Ⅰd″′)219、(Ⅰd″′)252和(Ⅰd′)260表示),例如,对应于化合物No.219的化合物(Ⅰd″′)以化合物(Ⅰd″′)219表示,并且该化合物(Ⅰd″′)219意指化合物(Ⅰd″′)
中R2和R3均为CH3,R5和R6′均为OCH3和R4″为OH。
制备方法10:
化合物(Ⅰd)可以在溶剂中,于缩合剂存在下,在有或没有碱及有氰化剂存在的情况下,通过化合物(Ⅰd″′)与醇、硫醇或胺反应制得。
在制备化合物(Ⅰd)中,作为缩合剂,可以提到的有DCC(二环己基碳二亚胺)、WSC(1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐、羰基二咪唑和氰基磷酸二乙酯。反应可以在反应液浓度为10~80%的情况下进行。起始化合物(Ⅰd″′)和缩合剂的比例为1~2摩尔,每摩尔起始化合物(Ⅰd″′)用1~1.1摩尔缩合剂较好。作为碱,可以提到的有三乙胺和氢化钠,可以将它们加到起始化合物(Ⅰd″′)中,其量为1~2摩尔,每摩尔起始化合物(Ⅰd″′)用1~1.2摩尔较好。溶剂不是特别受限制的,只要该溶剂是非水溶剂,其中较好的是二氯甲烷、氯仿、甲苯、苯、THF和乙醚。反应温度不是特别受限制的,但是最好为0℃~室温。反应时间可以依上述浓度和温度而变化,但是在搅拌的情况下通常为0.5~6小时。
作为用上述制备方法得到的化合物(Ⅰd),可以提到的有例如表1所示相应于化合物No.220~243、247~248、251、253~258、261~267、269~273、276~281以及289~304、各类取代基团的各个化合物(分别以化合物(Ⅰd)220~243、(Ⅰd)247~248、(Ⅰd)251、(Ⅰd)253~258、(Ⅰd)261~267、(Ⅰd)269~273、(Ⅰd)276~281、(Ⅰd)289~304、表示),例如,对应于化合物No.241的化合物(Ⅰd)以化合物(Ⅰd)241表示,并且该化合物(Ⅰd)241意指化合物(Ⅰd)中R1
为CN,R2和R3均为CH3,R4″为NHSO2CH3,R5和R6′均为OCH3。
制备方法11:
在有或没有催化剂存在下,在有碱存在时,通过式(Ⅻ)所示化合物的金属盐或胺盐与卤素取代的烷基化合物反应,可以制得化合物(Ⅰd),
在该制备方法中,作为催化剂,可以提到的有冠醚(如18-冠-6-醚)和季胺盐(如溴化四丁基铵);作为碱,可以提到的有氢氧化钠、氢氧化钾、氢化钠、金属钠和三乙胺。作为卤素取代的烷基化合物,可以提到的有甲氧基甲基氯化物、甲氧基乙氧基甲基氯化物、新戊酰氧甲基氯化物以及甲基硫甲基氯化物。反应可以在反应液浓度为10~80%的情况下进行。起始化合物(Ⅻ)和碱的比例为1~2摩尔,每摩尔起始化合物(Ⅻ)用1~1.1摩尔碱较好。溶剂不是特别受限制的,可以包括例如DMF、DMSO、甲苯、苯、二氯甲烷、氯仿、乙腈、THF和乙醚。反应温度不是特别受限制的,但0~100℃较好。反应时间可以依上述浓度和温度而变化,但是在搅拌下通常为0.5~6小时。
作为以上方法制得的化合物(Ⅰd),可以提到的有例如包括表1所示相应于化合物No.244~246、249~250.268、274~275、282~287以及305各类取代基团的各个化合
物(分别以化合物(Ⅰd)244~246、(Ⅰd)249~250、(Ⅰd)268、(Ⅰd)274~275、(Ⅰd)282~287、以及(Ⅰd)305表示),例如对应于化合物No.244的化合物(Ⅰd)以化合物(Ⅰd)244表示,并且该化合物(Ⅰd)244意指化合物(Ⅰd)中R1′为CN,R2和R3均为CH3、R4″为OCH2OCH3,R5和R6′均为OCH3。
含有化合物(Ⅰ)作为有效成分的除草剂具有高度的选择性,并且还显示出良好的除草效果。
即本发明的除草剂对生长在稻田和旱田的一年生杂草和多年生杂草具有良好的除草效果,并且对于一年生杂草如蟋蟀草(甜茅禾草)、稗和狗尾草(绿黍),一年生阔叶杂草如园叶牵牛、藜(白藜)、苋和绒毛草以及多年生杂草,如阿拉伯高粱、藨草及沙草的除草效果尤为显著。
本发明的除草剂对上述杂草具有良好的除草效果,但是在上述处理浓度下对农作物(如棉花)却无化学伤害。
本发明的除草剂含有化合物(Ⅰ)作为有效成分。
化合物(Ⅰ)可以单独地应用,但是按照一般的方法与载体、表面活性剂、分散剂和辅助剂混合配制成组合物,如粉剂、乳化剂、细颗粒剂、颗粒剂、可湿性粉剂、油悬浮剂或气溶胶剂应用较好。
作为载体,可以提到的有例如固体载体,如滑石、云母、膨润土、粘土、高岭土、硅藻土、白炭黑、蛭石、白云石、沸石、熟石灰、硅砂、硅酐、硫酸铵、尿素、木屑、淀粉和纤维素;液体载体有例如烃类(煤油和矿物油)、芳香烃类(苯、甲苯和二甲苯)、氯化烃类(氯仿和四氯化碳)、醚类(二噁烷和四氢呋喃)、酮类(丙酮、环己酮和异佛尔酮)、酯类(乙酸乙酯、乙二醇乙酸酯和马来酸二丁酯)、醇类(甲醇、正己醇和乙二醇)、极性溶剂(二甲基甲酰胺和二甲基亚砜)及水;气
体载体如空气、氮气、二氧化碳和氟利昂(在气体载体的情况下,可以进行混合喷雾)。
应用表面活性剂以改进植物对本发明除草剂的附着和吸收,改进本发明除草剂的分散、乳化和扩散特征,作为表面活性剂可以提到的有非离子的、阳离子的、阴离子的或两性的表面活性剂(如醇硫酸酯、烷基磺酸酯、木素磺酸酯和聚氧乙烯乙二醇醚)。此外,为了改进制剂的性质,可以应用羧甲基纤维素、聚乙二醇或阿拉伯树胶作为辅助剂。
在本发明除草剂的配制中,除了上述载体、表面活性剂、分散剂和辅助剂之外,还可以根据有关的目的各别地应用其他农用化学品(杀菌剂和杀虫剂)、肥料和土壤调节剂,也可以组成合适的组合物。
当将本发明化合物(Ⅰ)配制成制剂时,有效成分的浓度(按重量计)通常为:乳剂,1~50%;粉剂,0.3~25%;可湿性粉剂,1-90%;颗粒剂,0.5~5%;油分散剂,0.5~5%;气溶胶剂,0.1~5%。
上述制剂可以提供各种用途,根据各自的目的,将上述制剂稀释到合适的浓度,并且将它们喷雾到植物的茎和/或叶上、土壤和稻田表面,或者直接施用。
实例
通过下面的实例详细叙述本发明,但是本发明的范围不受这些实例的限制。
实例1
(1)1-(3-乙氧基-2-(4,6-二甲氧基嘧啶-2-基)氧-3-甲基丁酰)咪唑(化合物12)的合成
将19.4克(0.12摩尔)N,N-羰基二咪唑溶于100ml
二氯甲烷中,混合物保持在5℃。向混合物中滴加30.0克(0.1摩尔)3-乙氧基-2-(4,6-二甲氧基嘧啶-2-基)氧-3-甲基丁酸溶于100ml N,N-二甲基甲酰胺(DMF)中的溶液,混合物于室温搅拌0.5小时。
搅拌完毕,二氯甲烷层用水洗涤,并经硫酸钠干燥,在减压下除去二氯甲烷。所得的结晶用正己烷洗涤,得到29.8克(产率85%)标题化合物,为白色结晶。
(2) 1-(2-(4,6-二甲氧-2-基)硫代-3-甲氧基-3-甲基丁酰)咪唑(化合物7)的合成
将19.4克(0.12摩尔)N,N-羰基二咪唑溶于150ml二氯甲烷中,混合物保持在5℃。向混合物中滴加30.2克(0.1摩尔)2-(4,6-二甲氧-2-基)硫代-3-甲氧基-3-甲基丁酸溶于100ml DMF中的溶液,混合物于5℃搅拌1小时。
搅拌完毕,将反应混合物加到100ml水中,并用乙酸乙酯萃取。乙酸乙酯层用饱和盐水溶液洗涤,并经硫酸钠干燥,在减压下除去乙酸乙酯。所得的结晶用正己烷洗涤,得到30.0克(产率85%)标题化合物,为白色结晶。
(3) 2-(4,6-二甲氧基嘧啶-2-基)-硫代-3-甲氧基-3-甲基-N-甲磺酰基丁酰胺(化合物47)的合成
将氢化钠(0.1摩尔,4克60%氢化钠的油溶液)悬浮于50mlN,N-二甲基甲酰胺(DMF)中,向悬浮液中滴加9.5克(0.1摩尔)甲磺酰胺溶于50ml DMF中的溶液。混合物搅拌2小时。搅拌完毕,向混合物中滴加35.2克(0.1摩尔)1-(2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲氧基-3-甲基丁酰)咪唑
溶于100ml DMF中的溶液。滴加完毕将混合物于室温搅拌1小时。
向反应混合物中加入水和1N盐酸(300ml),混合物用乙酸乙酯萃取。乙酸乙酯层用饱和盐水溶液洗涤,并经硫酸钠干燥,在减压下除去乙酸乙酯。所得的残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯∶甲醇=1∶1∶0.1洗脱,得到28.4克(产率75%)标题化合物,为白色结晶。
(4) 3-乙氧基-2-(4,6-二甲氧基嘧啶-2-基)氧-3-甲基-N-甲磺酰基丁酰胺(化合物67)的合成
将19.4克(0.12摩尔)羰基二咪唑溶于50ml N,N-二甲基甲酰胺(DMF)中,混合物保持在5℃。向混合物中滴加30克(0.1摩尔)3-乙氧基-2-(4,6-二甲氧基嘧啶-2-基)氧-3-甲基丁酸酯溶于100ml DMF中的溶液。滴加完毕,将混合物搅拌0.5小时。于0℃向混合物中加入9.5克(0.1摩尔)甲磺酰胺和氢化钠(0.1摩尔,4克60%氢化钠的油溶液)。将混合物搅拌1小时。
向反应混合物中加入水和1N盐酸(300ml),混合物用乙酸乙酯萃取。乙酸乙酯层用饱和盐水溶液洗涤,并经硫酸钠干燥,在减压下除去乙酸乙酯。所得的残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯∶甲醇=1∶1∶0.1洗脱,得到30.0克(产率80%)标题化合物,为白色结晶。
(5) 2-(4,6-二甲氧基-S-三嗪-2-基)氧-3-乙氧基-3-甲基丁酸乙酯(化合物154)的合成
按制备方法3所述的方法合成本发明化合物(Ⅰc)
将14.4克(0.1摩尔)2,3-环氧-3-甲基丁酸乙酯溶于40ml乙醇中,然后向其中加入0.5ml硫酸(作为催化剂)。混合物于30℃搅拌2小时。
随后在减压下除去过量的乙醇,残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析,用正己烷∶乙酸乙酯=7∶3洗脱,得到3-乙氧基-2-羟基-3-甲基丁酸乙酯。于5℃将该产物加到0.1摩尔氢化钠(4克60%氢化钠的油溶液)在100ml四氢呋喃的悬浮液中,混合物搅拌30分钟。搅拌完毕,向混合物中滴加17.5克(0.1摩尔)2-氯-4,6-二甲氧基-S-三嗪溶于50ml四氢呋喃中的溶液,混合物于20℃搅拌1小时。
将反应混合物加到水中,并用乙酸乙酯萃取。乙酸乙酯层用饱和盐水溶液洗涤,并经硫酸钠干燥,在减压下除去乙酸乙酯。所得残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯=3∶1洗脱,得到26.3克(产率80%)标题化合物,为无色油状产物。
(6) 2-(4,6-二甲氧基-S-三嗪-2-基)氧-3-乙氧基-3-甲基丁酸苄酯(化合物155)的合成
按制备方法5所述方法合成标题化合物(Ⅰc)。
将32.9克(0.1摩尔)化合物154(由上面合成方法(5)制得)和16.2克(0.15摩尔)苄醇溶于200ml甲苯中。向该溶液中加入3ml四异丙氧基钛作为催化剂。混合物加热回流6小时,同时除去回流期间释出的乙醇。
然后将反应混合物冷却至室温。甲苯层用水洗涤,在减压下除去甲
苯。所得残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K制造)层析分离,用正己烷∶乙酸乙酯=3∶1洗脱,得到33.3克(产率85%)标题化合物,为无色油状产物。
(7) 2-(4,6-二甲氧基-S-三嗪-2-基)氧-3-乙氧基-3-甲基丁酸(化合物156)的合成
按制备方法6所述方法合成本发明化合物(Ⅰc)。
将39.2克(0.1摩尔)化合物155(由上面合成方法(6)制得)溶于200ml乙醇中,加入0.5克钯炭作为催化剂。混合物于室温(20℃)搅拌1小时,同时通入氢气。然后滤除催化剂,浓缩母液,得到28.6克(产率95%)标题化合物,为无色油状产物。
(8) 2-(4,6-二甲氧基-S-三嗪-2-基)硫代-3-乙氧基-3-甲基丁酸(化合物157)的合成
按制备方法3所述的方法合成标题化合物(Ⅰc)
将17.8克(0.1摩尔)3-乙氧基-2-巯基-3-甲基丁酸溶于1N氢氧化钠中。向溶液中加入17.5克(0.1摩尔)2-氯-4,6-二甲氧基-S-三嗪溶于100ml丙酮中的溶液,混合物于室温(20℃)搅拌1小时。
将反应混合物加到100ml5N盐酸水溶液中,并用乙酸乙酯萃取。乙酸乙酯层用饱和盐水溶液洗涤,并经硫酸钠干燥,在减压下除去乙酸乙酯。所得的残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯∶乙酸=1∶1∶0.1洗脱,得到23.7克(产率75%)标题化合物,为无色透明的油状产物。
(9) 2-(4,6-二甲氧基-S-三嗪-2-基)硫代-3-
甲氧基-3-甲基丁酸(化合物148)的合成
按制备方法4所述的方法合成标题化合物(Ⅰc)。
向150ml N,N′-二甲基甲酰胺中加入30.2克(0.1摩尔)3-甲氧基-3-甲基-2-对甲苯磺酰氧基丁酸和17.3克(0.1摩尔)4,6-二甲氧基-2-巯基-S-三嗪,然后向其中再加入13.8克(0.1摩尔)碳酸钾。混合物于50℃搅拌2小时。
将反应混合物加到水中,并用乙酸乙酯萃取。乙酸乙酯层用饱和盐水溶液洗涤,并经硫酸钠干燥,在减压下除去乙酸乙酯。所得的残余物经柱(Wako gel C-200(商品名),Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯∶乙酸=1∶1∶0.1洗脱,得到24.2克(产率80%)标题化合物,为白色结晶。
(10) 2-(4,6-二甲氧基嘧啶-2-基)硫代-3-羟基-3-甲基丁酸乙酯(化合物(Ⅰe)181)的合成
按制备方法7所述合成化合物(Ⅰe)的方法合成标题化合物。
将25.8克(0.1摩尔)(4,6-二甲氧基嘧啶-2-基)硫代乙酸乙酯溶于300ml四氢呋喃(THF)中。在氮气流下于-78℃向溶液中滴加110ml(0.11摩尔)双(三甲基甲硅烷基)氨基锂-1M THF溶液,然后再各其中加入6.4克(0.11摩尔)丙酮。将混合物搅拌1小时。随后,将反应混合物升温至0℃。混合物倒入水中,向其中加入500ml乙酸乙酯。乙酸乙酯层经萃取、用水洗涤和干燥。在减压下除去THF和乙酸乙酯,所得残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯=5∶1洗脱,得到24.6克(产率78%)标题化合物,为无色透明粘稠状液体。
物理性质:反射光系数为1.5230(20℃)
(11) 3-氯-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸乙酯的合成(化合物215)
按制备方法7合成化合物(Ⅰd)。
将16.8克(53毫摩尔)化合物(Ⅰe)181(由上面合成方法(10)制得)溶于100ml乙酸乙酯中,于室温下向溶液中滴加6.5克(55毫摩尔)亚硫酰氯。将混合物搅拌1小时。随后,反应混合物倒入冰水中,用水洗涤,进一步用水洗涤2次,然后干燥。减压下除去乙酸乙酯,所得残余物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯=8∶1洗脱,得到14.2克(产率80%)标题化合物,为白色结晶。
(12) 3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸乙酯(化合物221)的合成
按制备方法7合成化合物(Ⅰd)。
将3.4克(10毫摩尔)化合物215(由上面合成方法(11)制得)溶于30ml DMF中,向该溶液中加入12毫摩尔氰化钠溶液(0.6克氰化钠溶于2ml水的溶液)。混合物于60℃搅拌3小时。随后,反应混合物倒入水中,并用100ml甲苯萃取。甲苯层用水洗涤5次,并干燥,在减压下除去甲苯。
所得的油状产物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯=8∶1洗脱,得到2.1克(产率65%)标题化合物,为白色结晶。
(13) 3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸(化合物219)的合成
按制备方法9合成化合物(Ⅰd)。
将1.0克(3毫摩尔)化合物221(由上面合成方法(12)制得)溶于10ml丙酮中,向该溶液中加入氢氧化钠溶液(0.2克氢氧化钠溶于10ml水的溶液)。混合物于室温搅拌5小时。随后,将反应混合物倒入水中,用1N盐酸溶液中和,并用乙醚萃取。乙醚层用水洗涤并干燥,在减压下除去乙醚,得到0.7克(产率78%)标题化合物,为白色结晶。
(14) 3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸丙酯(化合物222)的合成
按制备方法10合成化合物(Ⅰd)。
将0.6克(2毫摩尔)化合物219(由上面合成方法(13)制得)和0.2克(3毫摩尔)丙醇溶于30ml无水二氯甲烷中,于5℃向溶液中加入0.4克(2毫摩尔)WSC。混合物搅拌30分钟。随后,将反应混合物倒入水中,用水洗涤并干燥,在减压下除去二氯甲烷。
所得油状产物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯=8∶1洗脱,得到0.5克(产率74%)标题化合物,为白色结晶。
(15)3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酰-1-咪唑(化合物240)的合成
按制备方法10合成化合物(Ⅰd)。
将1.0克(3.4毫摩尔)化合物219(由上面合成方法(13)制得)溶于30ml无水二氯甲烷中。于室温向溶液中加入0.6克(3.4毫摩尔)羰基二咪唑,混合物搅拌30分钟。再向其中加入
5ml水,将混合物搅拌5分钟。随后,用滤纸从反应混合物中分离除去水,在减压下除去二氯甲烷,得到1.1克(产率90%)标题化合物,为淡棕色结晶。
(16) 3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基-N-甲磺酰基丁酰胺(化合物241)
按制备方法10合成化合物(Ⅰd)。
将0.8克(2.2毫摩尔)化合物240(由上面合成方法(13)制得)和0.3克(3毫摩尔)甲磺酰胺溶于20ml DMF中,于5℃向溶液中加入0.1克(25毫摩尔)氢化钠。混合物于室温搅拌1小时。随后,反应混合物倒入水中,用柠檬酸水溶液中和,用80ml氯仿萃取。氯仿层用水洗涤5次并干燥,在减压下除去氯仿,得到半固体状物质。
向该半固体状物质中加入30ml己烷,将混合物静置。过滤收集所得的结晶,并干燥,得到7.1克(产率87%)标题化合物,为白色结晶。
(17)3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸钾(化合物245)的合成
按制备方法11合成化合物(Ⅰd)。
将0.23克磨碎的氢氧化钾溶于20ml甲醇中,向溶液中加入1.0克(3.4毫摩尔)化合物219(由上面合成方法(13)制得)溶于20ml甲醇的溶液。混合物于室温搅拌30分钟。随后,在减压下除去甲醇,得到白色固体状物质。
将该固体物质加到30ml甲苯中,并充分洗涤。滤除去甲苯,残余物经干燥得到1.0克(产物98%)标题化合物,为白色结晶。
(18)3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸(叔丁基羰氧基甲基)酯(化合物246)的合成
按制备方法11合成化合物(Ⅰd)。
将1.0克(3毫摩尔)化合物245(由上面合成方法(17)制得)、0.5克(3.3毫摩尔)新戊酸氯甲基酯、1.0克(6毫摩尔)碘化钾和0.1克冠醚溶于50ml甲苯中,使混合物沸腾回流5小时。随后,将反应混合物倒入水中,用水洗涤,并干燥,在减压下除去甲苯,得到淡黄色油状产物。
所得的油状产物经柱(Wako gel C-200(商品名),由Wako Junyaku K.K.制造)层析分离,用正己烷∶乙酸乙酯=1∶8洗脱,得到0.9克(产率73%)无色透明的油状产物。
(19) 合成表1中其他的化合物(Ⅰ)
按合成方法(1)~(11)中任何一个相同的方法制备表1所示的标题化合物(Ⅰ)。
表1
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
表1(续)
实例2
(1)制备颗粒剂
使8份重量的化合物5与30份重量的膨润土、59份重量的滑石、1份重量的Neopelex粉(商品名,由Kao K.K.生产)和2份重量的木素磺酸钠一起均匀地混合,然后将混合物与加入的少量水一起混合成团,接着制粒和干燥,得到颗粒剂。
(2)制备可湿性粉剂
使50份重量化合物7与46份重量高岭土、2份重量Neopelex粉(商品名,Kao K.K.生产)和2份重量Demol N(商品名,由Kao K.K.生产)均匀地混合,然后使混合物粉碎成粉末,得到可湿性粉剂。
(3)制备乳化剂
将30份重量化合物12加到60份重量二甲苯、5份重量二甲基甲酰胺和5份重量Sorpol 3005X(商品名,由Toho Kagaku Kogyo生产)中,并均匀地混合使其溶解,得到乳化剂。
(4)制备粉剂
将5份重量化合物24与50份重量滑石和45份重量粘土均匀地混合,得到粉剂。
实例3
(1)稻田除草试验
用Ube土壤(冲积土)装填Wagner罐,每个罐的面积为1/5000公亩,并且播种杂草(稗、藨草和沙草)种子或植入块茎。然后使罐子充有水,其深度为3厘米。
将按照实例2制得的表1中各所需化合物(Ⅰ)的可湿性粉剂用水稀释,用吸管逐滴施药,在稗的一叶阶段施用的各个除草剂中化合物
(Ⅰ)的有效浓度为20克/公亩。将上述植物置于平均温度为25℃的温室中3周,然后考察其除草效果。用日本临时专利公开说明书No.85262/1990中公开的化合物No.155(下式ⅩⅢ)作为对比化合物,其配制方法同以上所述,
按照6个等级评价除草效果,结果与未经处理的区域相比较,0:无效(正常生长),1:很少杀伤,2:稍有杀伤,3:中等杀伤,4:严重杀伤,5:全部杀死。
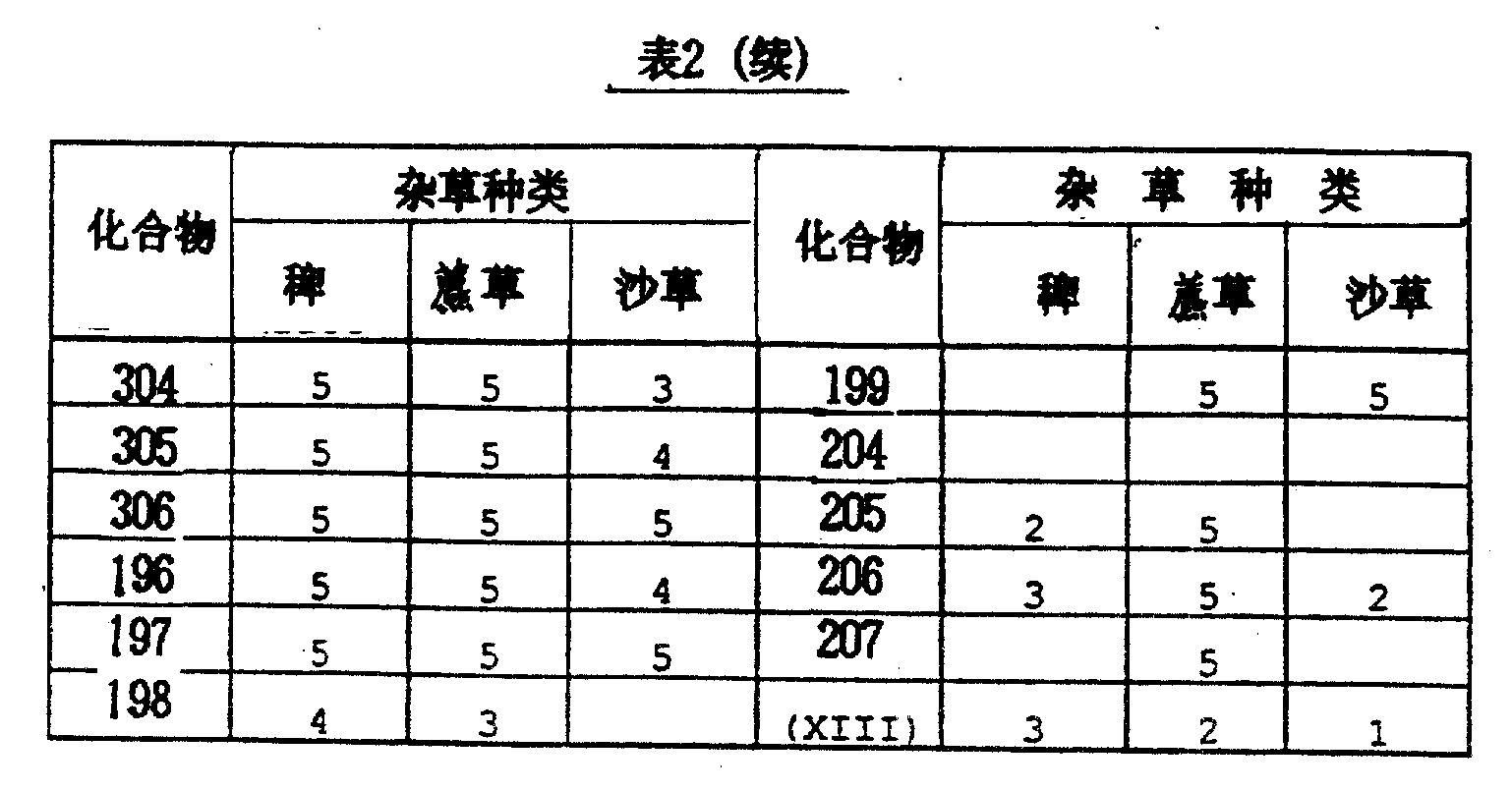
结果见表2。
(2)旱田的土壤处理试验
用Ube土壤(冲积土)装填Wagner罐,每个罐的面积为1/5000公亩,然后播种棉花、大豆、蟋蟀草、稗绒毛草、藜、苋、园叶牵牛、苍耳和狗尾草的种子,并用土壤复盖。
将按照实例2制得的表1中各所需化合物(Ⅰ)的可湿性粉剂用水稀释并均匀地喷洒在各罐土壤表面,使各除草剂中化合物(Ⅰ)的有效浓度为20克/公亩。将上述植物置于平均温度为25℃的温室中3周,然后考察其除草效果。
按照稻田除草试验(1)所述评价方法评价除草效果,本试验结果和(1)中应用的对比药物的结果列于表3。
(3)旱田叶子的喷雾试验
用火山灰土装填Wanger罐,每个罐的面积为1/5000公亩,然后播种蟋蟀草、稗、绒毛草、藜、苋、园叶牵牛、苍耳、狗尾草、棉花和大豆的种子,并用土壤复盖,让其生长二周。
将按照实例2制得的表1中各所需化合物(Ⅰ)的可湿性粉剂用水稀释到浓度为2000ppm,并且其中含有500ppm展着剂Neoesterin(商品名,由Kumiai Kagaku公司生产),然后均匀地喷雾到上述各植物上。将上述植物置于平均温度为25℃的温室中3周后,评价其除草效果。
按照稻田除草试验(1)所述评价方法评价其除草效果,本试验结果和(1)中应用的对比药物的结果列于表4。
(4)在低浓度下对旱田叶的喷雾试验
用火山灰土壤装填Wanger罐,每个罐的面积为1/5000公亩,然后播种棉花、蟋蟀草、稗、绒毛草、藜、苋和园叶牵牛的种子,并用土壤复盖,让其生长2周。
将按照实例2制得的表1中各所需化合物(Ⅰ)的可湿性粉剂用水稀释到浓度为125ppm,并且其中含有500ppm展着剂Neoesterin(商品名,由Kumiai Kagaku公司生产),然后均匀地喷雾到上述各植物上。将上述植物置于平均温度为25℃的温室中3周后,评价其除草效果。
按照旱田除草试验(1)所述评价方法评价除草效果,结果列于表5。
本发明新的3-烷氧基链烷酸衍生物对于一年生和多年生杂草具有很好的选择性,并且还显示出良好的除草效果,对于一年生杂草和阔叶杂草尤其有效。
Claims (17)
1、式(Ⅰ)所示的嘧啶或三嗪类化合物,
其中R1代表氰基、卤原子、羟基或-O-R7,这里R7代表低级烷基、低级链烯基、低级炔基、卤素-低级烷基或氰基-低级烷基;
R2代表氢原子或低级烷基;
R3代表氢原子或低级烷基;
R4代表1-咪唑基、-NHSO2-R8(这里R8代表低级烷基或可以有一个取代基的苯基)、羟基.低级烷氧基或苄氧基(当Z为氮原子时);或者1-咪唑基、-NHSO2-R8(这里R8的定义同上)、羟基、OK、可以有一个取代基的低级烷氧基、低级链烯氧基、低级炔氧基、可以有一个取代基的环烷氧基、苯氧基、苄氧基、低级烷硫基、苯硫基或烷基亚磺酰氨基(当Z为-CH=基团时);
R5代表低级烷氧基;
R6代表低级烷氧基或低级烷基;
X代表氧原子或硫原子;
Z代表氮原子或-CH=基团。
2、根据权利要求1所述的化合物,其中该化合物为式(Ⅰa)所示的3-烷氧基丁酰咪唑,
其中R7、R3、X和Z各自的定义同权利要求1。
4、根据权利要求1所述的化合物,其中该化合物为式(Ⅰc)所示的三嗪化合物,
其中R4′代表羟基、低级烷氧基或苄氧基,R2、R6、R7和X各自的定义同权利要求1。
7、根据权利要求1所述的化合物,其中该化合物系选自
1-(2-(4,6-二甲氧基-2-基)硫代-3-甲氧基-3-甲基丁酰)-咪唑(化合物7),
1-(3-乙氧基-2-(4,6-二甲氧基嘧啶-2-基)氧-3-甲基丁酰)咪唑(化合物12),
2-(4,6-二甲氧基嘧啶-2-基)-硫代-3-甲氧基-3-甲基-N-甲磺酰基丁酰胺(化合物47),
3-乙氧基-2-(4,6-二甲氧基嘧啶-2-基)氧-3-甲基-N-甲磺酰基丁酰胺(化合物67),
2-(4,6-二甲氧基-S-三嗪-2-基)硫代-3-甲氧基-3-甲基丁酸(化合物148),
2-(4,6-二甲氧基-S-三嗪-2-基)-氧-3-乙氧基-3-甲基丁酸乙酯(化合物154),
2-(4,6-二甲氧基-S-三嗪-2-基)-氧-3-乙氧基-3-甲基丁酸苄酯(化合物155),
2-(4,6-二甲氧基-S-三嗪-2-基)-氧-3-乙氧基-3-甲基丁酸(化合物156),
3-氰基-2-(4,6-二甲氧基嘧啶-2-基)-硫代-3-甲基丁酸(化合物181),
3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸乙酯(化合物183),
3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸丙酯(化合物184),
3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酰-1-咪唑(化合物202),
3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基-N-甲磺酰基丁酰胺(化合物203),
3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸钾(化合物207),
3-氰基-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸(叔丁基羰氧基甲基)酯(化合物208),以及
3-氯-2-(4,6-二甲氧基嘧啶-2-基)硫代-3-甲基丁酸乙酯(化合物227)。
15、制备式(Ⅰd″)所示3-氰基-2-嘧啶基硫代链烷酸的方法,
式中R2代表低级烷基;
R4″代表羟基、OK、可以有一个取代基的低级烷氧基、低级链烯氧基、低级炔氧基、可以有一个取代基的环烷氧基、苯氧基、苄氧基、低级烷硫基、苯硫基、1-咪唑基或-NHSO2-R8,这里R8的定义同权利要求1;
R6′代表低级烷氧基;
R3和R5各自的定义同权利要求1,
该方法包括使权利要求14所述的3-卤代-2-嘧啶基硫代链烷酸与氰化剂反应。
17、含有作为有效成分的权利要求1所述化合物(Ⅰ)和除草上有用载体的除草剂。
Applications Claiming Priority (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP232595/91 | 1991-06-07 | ||
| JP3232594A JP2730022B2 (ja) | 1991-06-07 | 1991-06-07 | 3−アルコキシブチリルイミダゾール誘導体、その製造法及び除草剤 |
| JP23259691 | 1991-06-07 | ||
| JP232594/91 | 1991-06-07 | ||
| JP23259591 | 1991-06-07 | ||
| JP232596/91 | 1991-06-07 | ||
| JP24853391 | 1991-06-25 | ||
| JP248533/91 | 1991-06-25 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1067651A true CN1067651A (zh) | 1993-01-06 |
Family
ID=27477502
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN92104403A Pending CN1067651A (zh) | 1991-06-07 | 1992-06-06 | 嘧啶或三嗪类衍生物、它们的制备方法和应用它们作为除草剂 |
Country Status (4)
| Country | Link |
|---|---|
| US (2) | US5387575A (zh) |
| EP (1) | EP0517215B1 (zh) |
| CN (1) | CN1067651A (zh) |
| DE (1) | DE69226813T2 (zh) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1042422C (zh) * | 1992-07-21 | 1999-03-10 | 宇部兴产株式会社 | 3-烷氧基-n-环烷基磺酰基链烷酰胺衍生物及其制备方法和含其的除草剂组合物 |
| CN1070701C (zh) * | 1994-03-31 | 2001-09-12 | 巴斯福股份公司 | 用作药物的嘧啶或三嗪羧酸衍生物 |
| CN1072221C (zh) * | 1993-04-23 | 2001-10-03 | 巴斯福股份公司 | 3-卤-3-杂芳基羧酸衍生物、制备它们的方法和中间体 |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0541041A1 (de) * | 1991-11-07 | 1993-05-12 | Hoechst Schering AgrEvo GmbH | Pyrimidinyl- oder Triazinyl-oxy-(oder -thio)-carbonsäurederivate, Verfahren zu ihrer Herstellung und Verwendung als Herbizide oder Pflanzenwachstumsregulatoren |
| EP0562510A1 (de) * | 1992-03-27 | 1993-09-29 | Hoechst Aktiengesellschaft | Optisch aktive Pyrimidinyl- oder Triazinyl-oxy-(oder -thio)-carbonsäurederivate, Verfahren zur ihrer Herstellung und Verwendung als Herbizide oder Pflanzenwachstumsregulatoren |
| US5376620A (en) * | 1992-04-17 | 1994-12-27 | Ube Industries, Ltd. | Sulfonamide derivative, process for preparing the same and herbicide using the same |
| EP0601155A1 (en) * | 1992-06-17 | 1994-06-15 | Novartis AG | Pyrimidinyl-and triazinyl compounds with herbicidal activity |
| DE4313413A1 (de) * | 1993-04-23 | 1994-10-27 | Basf Ag | 3-(Het)aryloxy(thio)-Carbonsäurederivate, Verfahren und Zwischenprodukte zu ihrer Herstellung |
| DE4313412A1 (de) * | 1993-04-23 | 1994-10-27 | Basf Ag | 3-(Het)aryl-Carbonsäurederivate, Verfahren und Zwischenprodukte zu ihrer Herstellung |
| JPH0710848A (ja) * | 1993-06-24 | 1995-01-13 | Nippon Bayeragrochem Kk | シアノ含有ピリミジン誘導体及び除草剤 |
| DE4329911A1 (de) * | 1993-09-04 | 1995-03-09 | Basf Ag | Substituierte Milchsäurederivate mit einem N-organischen Rest in beta-Position |
| WO1996000219A1 (en) * | 1994-06-27 | 1996-01-04 | Ciba-Geigy Ag | Pyrimidinyl- and triazinyl-oxy and thio-3-haloalkyl-propionic acid derivatives as herbicides |
| DE19533023B4 (de) | 1994-10-14 | 2007-05-16 | Basf Ag | Neue Carbonsäurederivate, ihre Herstellung und Verwendung |
| DE69613460T2 (de) * | 1995-02-27 | 2001-11-22 | Kaken Pharmaceutical Co., Ltd. | Verfahren zur herstellung von 3-(substituiert phenyl)-5-alkyliden-1,3-oxazolidin-2,4-dion-derivaten |
| DE19536891A1 (de) * | 1995-10-04 | 1997-04-10 | Basf Ag | Neue Aminosäurederivate, ihre Herstellung und Verwendung |
| EP0802193B1 (de) * | 1996-04-09 | 2001-10-17 | Lonza AG | Verfahren zur Herstellung von substituierten Pyrimidinen |
| ZA200807344B (en) | 2006-02-27 | 2009-07-29 | It Crimes Cc | Method and system for registering a device |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4311513A (en) * | 1979-08-24 | 1982-01-19 | Ciba-Geigy Corporation | Herbicidal α-phenoxypropionylazoles, compositions containing them, and method of use thereof |
| GB8912700D0 (en) * | 1989-06-02 | 1989-07-19 | Shell Int Research | Herbicidal compounds |
| DE68914197T2 (de) * | 1988-06-20 | 1994-11-10 | Ihara Chemical Ind Co | Alkansäurederivate und herbizide Mittel. |
| JP2771604B2 (ja) * | 1988-06-20 | 1998-07-02 | クミアイ化学工業株式会社 | 除草剤及びその有効成分となる新規なアルカン酸誘導体 |
| JPH02135963A (ja) * | 1988-11-17 | 1990-05-24 | Nec Corp | 最適経路選択方式 |
| DE3924259A1 (de) * | 1989-07-19 | 1991-01-31 | Schering Ag | Substituierte (alpha)-pyrimidinyloxy(thio)- und (alpha)-triazinyloxy(thio)carbonsaeurederivate, verfahren zu ihrer herstellung und ihre verwendung als mittel mit herbizider, fungizider und pflanzenwachstumsregulierender wirkung |
| IL94999A (en) * | 1989-07-19 | 1994-10-07 | Schering Ag | History of Acid (A-pyrimidinyloxy) Theo (and A-triazinyloxy) Theo (carboxylic, and herbicides containing them) |
| GB8917476D0 (en) * | 1989-07-31 | 1989-09-13 | Shell Int Research | Sulphonamide herbicides |
| JPH03200772A (ja) * | 1989-12-28 | 1991-09-02 | Kumiai Chem Ind Co Ltd | アルカン酸アミド誘導体及び除草剤 |
| GB9015916D0 (en) * | 1990-07-19 | 1990-09-05 | Schering Agrochemicals Ltd | Herbicides |
| CA2053603A1 (en) * | 1990-10-19 | 1992-04-20 | Katsumasa Harada | 3-alkoxyalkanoic acid derivative, process for preparing the same and herbicide using the same |
| DE4108029A1 (de) * | 1991-03-13 | 1992-09-17 | Bayer Ag | Triazinyl-substituierte acrylsaeureester |
| US5376620A (en) * | 1992-04-17 | 1994-12-27 | Ube Industries, Ltd. | Sulfonamide derivative, process for preparing the same and herbicide using the same |
-
1992
- 1992-06-04 EP EP92109457A patent/EP0517215B1/en not_active Expired - Lifetime
- 1992-06-04 DE DE69226813T patent/DE69226813T2/de not_active Expired - Fee Related
- 1992-06-05 US US07/894,557 patent/US5387575A/en not_active Expired - Fee Related
- 1992-06-06 CN CN92104403A patent/CN1067651A/zh active Pending
-
1994
- 1994-10-21 US US08/326,830 patent/US5529977A/en not_active Expired - Fee Related
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1042422C (zh) * | 1992-07-21 | 1999-03-10 | 宇部兴产株式会社 | 3-烷氧基-n-环烷基磺酰基链烷酰胺衍生物及其制备方法和含其的除草剂组合物 |
| CN1072221C (zh) * | 1993-04-23 | 2001-10-03 | 巴斯福股份公司 | 3-卤-3-杂芳基羧酸衍生物、制备它们的方法和中间体 |
| CN1070701C (zh) * | 1994-03-31 | 2001-09-12 | 巴斯福股份公司 | 用作药物的嘧啶或三嗪羧酸衍生物 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0517215A1 (en) | 1992-12-09 |
| EP0517215B1 (en) | 1998-09-02 |
| US5387575A (en) | 1995-02-07 |
| DE69226813D1 (de) | 1998-10-08 |
| US5529977A (en) | 1996-06-25 |
| DE69226813T2 (de) | 1999-02-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1060478C (zh) | 新的取代的吡唑衍生物 | |
| CN1208325C (zh) | 2-嘧啶氧基-n-脲基苯基苄胺类化合物、制备方法及其用途 | |
| CN1052308A (zh) | 异唑啉,其制备方法以及作为植物保护剂的应用 | |
| CN1067651A (zh) | 嘧啶或三嗪类衍生物、它们的制备方法和应用它们作为除草剂 | |
| CN1039808A (zh) | 新型除草剂 | |
| CN1079735A (zh) | 芳基吡唑杀真菌剂 | |
| CN86106238A (zh) | 新的硝基亚甲基衍生物 | |
| CN1038643A (zh) | 带杂环的2-烷氧苯氧基硫酰脲类和它们作为除草剂或植物生长调节剂的应用 | |
| CN1073440A (zh) | 新的取代的吡唑基吡唑,其制备方法,以及它们的中间体,和它们作为除草剂的用途 | |
| CN86104173A (zh) | 新型5-咪唑羧酸衍生物的制备方法和它们的使用 | |
| CN1053236A (zh) | 吡啶磺酰脲类除草剂和植物生长调节剂,它们的制备方法和应用 | |
| CN1028714C (zh) | 含嘧啶衍生物作为活性成分的除草剂组合物 | |
| CN1238352C (zh) | 制备吡啶化合物的方法 | |
| CN1023319C (zh) | 制备1h-咪唑-5-羧酸衍生物的方法 | |
| CN1048852A (zh) | 新的取代的α-嘧啶氧(硫)基-和α-三嗪氧(硫)基羧酸衍生物,它们的制备方法,以及它们作为除草剂,杀菌剂和植物生长调节剂的应用 | |
| CN1015363B (zh) | 以缩氨基脲类化合物为活性成分的除莠组合物 | |
| CN86108483A (zh) | 1、2、4-三唑-3-甲酰胺化合物,其制备方法及含有该化合物的除草组合物 | |
| CN1086697C (zh) | 作为除草剂的取代的2-芳基-1,2,4-三嗪-3,5-二(硫)酮类 | |
| CN1092774A (zh) | 二氢苯并呋喃衍生物及其制备和用途 | |
| CN87100152A (zh) | 除草的化合物 | |
| CN1282331A (zh) | 除草的3-(吲哚-4-基)嘧啶二酮衍生物 | |
| CN1016963B (zh) | 以苯磺酰胺为活性成分的除草剂组合物 | |
| CN1046941C (zh) | 吡啶酰胺衍生物,其制法、组合物及作为除草剂的用途 | |
| CN1016661B (zh) | 含吡啶磺酰胺的除草组合物 | |
| CN1111241A (zh) | 乙-咪唑啉-5-酮衍生物杀真菌剂 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| AD01 | Patent right deemed abandoned | ||
| C20 | Patent right or utility model deemed to be abandoned or is abandoned |