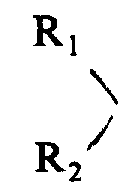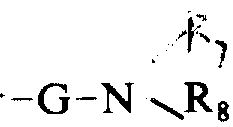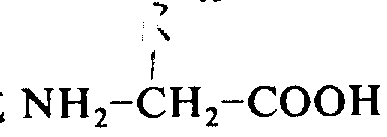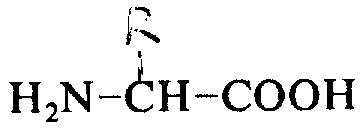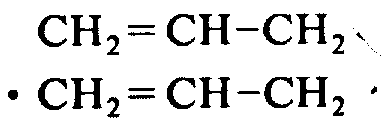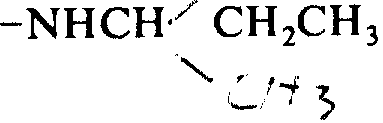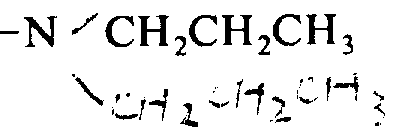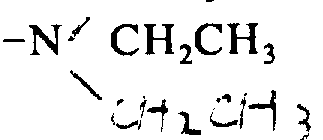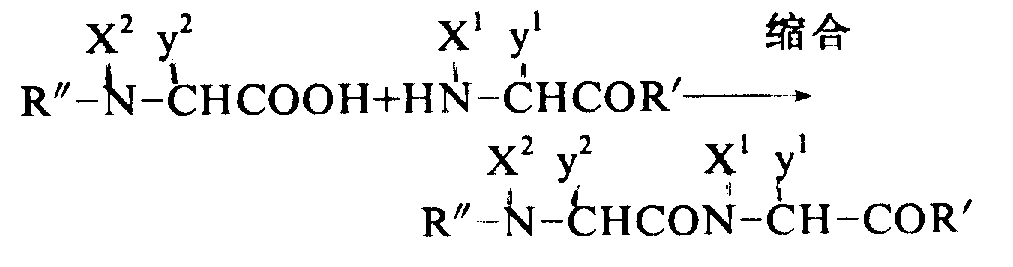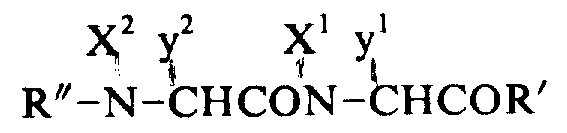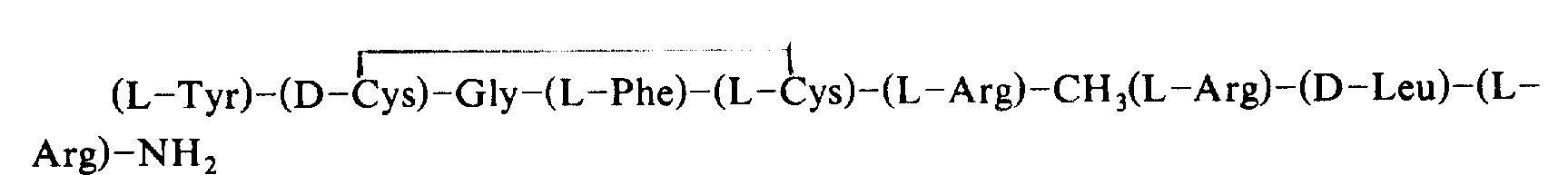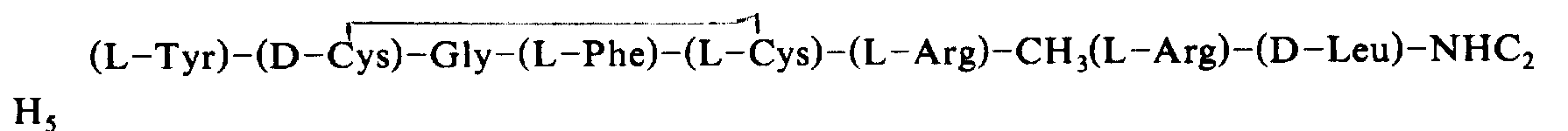CN1029684C - 一种新肽及其制造方法 - Google Patents
一种新肽及其制造方法 Download PDFInfo
- Publication number
- CN1029684C CN1029684C CN85109722A CN85109722A CN1029684C CN 1029684 C CN1029684 C CN 1029684C CN 85109722 A CN85109722 A CN 85109722A CN 85109722 A CN85109722 A CN 85109722A CN 1029684 C CN1029684 C CN 1029684C
- Authority
- CN
- China
- Prior art keywords
- arginine
- glycine
- leu
- tolylsulfonyl
- bright
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/665—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans derived from pro-opiomelanocortin, pro-enkephalin or pro-dynorphin
- C07K14/675—Beta-endorphins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/665—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans derived from pro-opiomelanocortin, pro-enkephalin or pro-dynorphin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S930/00—Peptide or protein sequence
- Y10S930/01—Peptide or protein sequence
- Y10S930/26—Containing cys-cys disulfide bridge between nonadjacent cysteine residues
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Toxicology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Pain & Pain Management (AREA)
- Neurosurgery (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Neurology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
制造由7-10个氨基酸构成的相当敌诺芬(Dynorphine)衍生物新肽的方法。该肽可医用,特别是可用来制造止疼药。
Description
本发明涉及具极好药效的肽,特别是具下列通式的肽,及其制造方法。
其中R1和R2可以是相同或不相同的基团,每个代表一个氢或一个低碳烷基或烷芳基;A代表一个D-氨基酸、甘氨酸或肌氨酸,假如D-氨基酸是D-半胱氨酸,则其与L-半胱氨酸或D-半胱氨酸在5位上,通过双硫键相连,形成一个分子内闭环;B代表L-苯丙氨酸或D-苯丙氨酸,其中苯环可被取代,而形成一个它们的α-N-烷基衍生物;C代表一个L-氨基酸,D-半胱氨酸或一个α-N-烷基衍生物;D和E分别代表L型或D型碱性氨基酸或一个α-N-烷基衍生物;F代表一个-OR3基团(其中R3是氢或低碳烷基),或一个
基团(其中R4和R5是相同或不同的,分别代表氢或一个低碳烷基),或一个-G-OR6(其中G是一个α-氨基酸,β-丙氨酸,γ-氨基丁酸或一个α-N-烷基的衍生物,而R6代表氢或一个低碳烷基),或一个
的基团(其中G如上定义,R7和R8可以是相同或不同的基团,分别代表氢或一个低碳烷基),或一个-G-L-精氨酸-OR9或-G-D-精氨酸-OR9基团(其中G如上定义,R9代表氢或一个低碳烷基),或一个-G-L-精氨酸
或-G-D-精氨酸
或-G-D-精氨酸
基团(其中G如上定义,H是一个中性氨基酸或一个酸性氨基酸,R12是氢或一个低碳烷基),或一个-G-精氨酸-I-OR13基团(其中I是D-氨基酸,R13是氢或一个低碳烷基,假定:组成上式肽链的所有氨基酸不都同时代表通式
的L-氨基酸。(其中R代表由式
衍生的氨基酸结构式中相应的基团,或它们的药学上可接受的盐。本发明还涉及该肽及含有它们的药物的制造方法。
组成这些肽的氨基酸包括D型和L型氨基酸,除非另有说明,氨基酸均为L型氨基酸。这里用的符号与肽化学领域通用者具有相同的含意,它们命名如下:
Tyr:酪氨酸
Gly:甘氨酸
Sar:肌氨酸
Cys:半胱氨酸
Phe:苯丙氨酸
Arg:精氨酸
Leu:亮氨酸
Ile:异亮氨酸
Nle:正亮氨酸
Met:蛋氨酸
Met(O):蛋氨酸砜
Ser:丝氨酸
Val:缬氨酸
homo-Arg:高精氨酸
Orn:鸟氨酸
Glu:谷氨酸
Trp:色氨酸
Asp:天冬氨酸
Alo:丙氨酸
Pro:脯氨酸
Gln:谷氨酰胺
Aib:2-氨基异丁酸
Phe(p-Cl):对-氯苯丙氨酸
Phe(p-Br):对-溴苯丙氨酸
Phe(p-No2):对-硝苯丙氨酸
Phe(p-I):对-碘苯丙氨酸
Phe(p-F):对-氟苯丙氨酸
Phe(p-CH3):对-甲苯丙氨酸
Phe(P-CH3O):对-甲苯苯丙氨酸
Phe(P-CF3):对-三氟甲苯丙氨酸
Boc:叔-丁氧碳酰(羰)基
Z:苯氧碳酰(羰)基
Cl2Bzl:2,6-二氯苄基
CH3BZl:4-甲苄基
TOS:对-甲苯磺酰基
BZL:苄基
吗啡止痛作用机制的研究发现:活体内含有所谓内源性类吗啡物质,这些物质控制疼痛、精神活动等各种感觉。进行了一系列的研究后,分离出类鸦片肽的脑啡肽和内啡肽等物质,并测定了它们的结构。此后,这方面进一步研究发现了诸如β-新内啡肽、β-卡索吗啡、Kyotorphin,dermorphin和dynorphin等新的类鸦片肽。
在它们当中,dynorphin是本发明的一些发明者发现的,是具有下述结构的一种类鸦片状。
H-酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-亮氨酸-精氨酸-脯氨酸-赖氨酸-亮氨酸-赖氨酸-色氨酸-天冬氨酸-天冬酰胺-谷氨酰胺-OH
Dynorphin是一种对K-受体有特异性的天然类鸦片肽,而且作为止痛药,它没有耐药性和成瘾性等副作用。
然而,dynorphin具有的一个缺点是静脉注射时不能显示止痛作用,因为它在血液中不稳定。
此外,由于dynorphin是一种具有相对较长链的肽,所以需要一种链较短且活性度更高的肽。
发明者集中研究具有比dynorphin短的肽链,静脉和皮下注射都能显示止痛作用的肽,最后发现:用含有7到9个氨基酸组成下述通式Ⅰ的新肽,可以达到此目的。
本发明提供了下列通式的肽:
其中R1和R2可以相同或不同,它们分别代表一个氢原子或一个低碳烷基或烷芳基;A代表一个D-氨基酸、甘氨酸或肌氨酸,假如该D-氨基酸是D-半胱氨酸,则其与L-半胱氨酸或D-半胱氨酸,在5位上,通过双硫键相连,形成一个分子内闭环;B代表L-苯丙氨酸或D-苯丙氨酸,其中的苯环可被取代,而形成一个它们的α-N-烷基衍生物;C代表一个L-氨基酸,D-半胱氨酸或一个α-N-烷基衍生物;D和E分别代表一个L型或D型碱性氨基酸或一个α-N-烷基衍生物;F代表式-OR3的一个基团(其中R3是氢或一个低碳烷基),或一个式
的基团(其中R4和R5为相同或不同,分别代表氢或一个低碳烷基),或一个式-G-DR6的基团(其中G是一个α-氨基酸,β-丙氨酸,γ-氨基丁酸,或是α-N-烷基及其衍生物,R6代表氢或一个低碳烷基),或一个式
的基团(其中G如上定义,R7和R8可以相同或不同,分别代表氢或一个低碳烷基),或一个式-G-L-精氨酸-OR9或式-G-D-精氨酸-OR9的基团(其中G如上定义,R9代表氢或一个低碳烷基),或一个式G-L-精氨酸
或式-G-D-精氨酸
的基团(其中G如上定义,R10和R11可以相同或不同,分别代表氢或一个低碳烷基),或一个式-G-H-OR12的基团(其中G如上定义,H是一个中性氨基酸或酸性氨基酸,R12是氢或一个低碳烷基),或一个式-G-精氨酸-I-OR13的基团(其中I是D-氨基酸,R13是氢或一个低碳烷基),假定:构成上式肽的所有氨基酸不都同时代表下式的L-氨基酸。
这里药学上可接受的盐的例子,包括诸如:盐酸盐、硫酸盐、溴氢酸盐、碘氢酸盐等无机盐,以及诸如:顺丁烯二酸盐、反丁烯二酸盐、琥珀酸盐、醋酸盐、丙二酸盐、柠檬酸盐和苯甲酸盐等有机盐。
因此,本发明的目的是提供一种药用的,特别是止疼药用的新肽。
本发明的另一个目的是提供制造作为药物的新肽的方法。
本发明的再一个目的是提供一种含有该新肽的止痛药。
在上述给R1到R11定义中的术语“低碳烷基”指的是含有1到6个碳原子烷基的直链、分支链、环链或含烷基的环链,诸如:甲基、乙基、正-丙基、异丙基、正-丁基、异-丁基、1-甲丙基、叔-丁基、环丙甲基、正-戊基、1-乙丙基、异戌基和正-己基。上述R1和R2定义中的术语“低碳烷芳基”指的是上述相应烷基的某些位上含有双键。在给氨基酸定义时,在α-N-烷基衍生物中的术语“烷基”具有上述低碳烷基相同的含义。
本发明的化合物(Ⅰ)的结构特征在于肽中组成它的所有氨基酸均为具有通式
的L-氨基酸的情况被排除,(其中R代表一个相当于除掉
基团一个氨基酸结构的基团)也就是说,组成该肽的氨基酸至少有一个α-N-烷基氨基酸或D-氨基酸。
本发明的化合物,至少含一个α-N-烷基氨基酸或D-氨基酸,则不再有上述dynorphin及其衍生物的严重缺点,如静脉注射时不显示止痛作用。因为它们在血液中是稳定的。因此,在活体中具高度稳定性,特别是可作为止疼药使用,本发明的化合物是很有价值的。
本发明化合物(Ⅰ)中的A并不限于D-氨基酸。但优选的例子包括D-蛋氨酸、D-苯丙氨酸、D-丝氨酸、D-半胱氨酸和D-苏氨酸。
定义B时,L-苯丙氨酸和D-苯丙氨酸中苯环的取代基,优选的是硝基,卤素如:溴、碘、氟、三氟甲基,低碳烷基和低碳烷氧基。
定义C时,氨基酸不限于L-氨基酸,但优选的例子包括:L-亮氨酸、L-异亮氨酸、L-正亮氨酸、L-叔-亮氨酸、L-蛋氨酸砜、L-丝氨酸、L-半胱氨酸、L-缬氨酸。
在定义D和E时,优选的L-和D-碱性氨基酸包括:L-和D-精氨酸、L-和D-赖氨酸、L-和D-高精氨酸和L-和D-鸟氨酸。此外,定义E时这些氨基酸优选的例子中还包括这些碱性氨基酸的α-N-烷基衍生物。
在式(Ⅰ)中G的α-氨基酸可以是任何氨基酸。优选的包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸、半胱氨酸、蛋氨酸、天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺、脯氨酸、赖氨酸、鸟氨酸、精氨酸、组氨酸、苯丙氨酸、酪氨酸、色氨酸、叔-亮氨酸、2-氨基异丁酸和α-甲基亮氨酸。作为G的氨基酸基团,当它有不对称碳原子时,即以D-形式也可以L-形式存在。最好是:L-异亮氨酸、L-亮氨酸、L-丙氨酸、L-天冬氨酸、L-脯氨酸、L-叔-亮氨酸、D-丙氨酸、D-缬氨酸、D-亮氨酸、D-谷氨酸、D-脯氨酸、2-氨基异丁酸和α-甲基亮氨酸。
式中H可为任何中性或酸性氨基酸基团,当其有不对称碳原子时,包括有D型和L型。优选的是:甘氨酸、肌氨酸、L-丙氨酸、D-丙氨酸、L-苯丙氨酸、D-苯丙氨酸、L-天冬氨酸和D-天冬氨酸。
任何氨基酸均可用于式中的I。优选的为:D-脯氨酸、D-丙氨酸和D-谷氨酸。
为了便于理想本发明,下面列举了本发明的样板化合物,但本发明并不局限于此。
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-NH2
·酪氨酸-D-蛋氨酸-甘氨酸-对-氯苯丙氨酸-亮氨酸-鸟氨酸-D-精氨酸-D-丙氨酸-NHCH2CH2CH3
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-精氨酸-NHCH2CH3
·CH3酪氨酸-D-赖氨酸-甘氨酸-苯丙氨酸-酪氨酸-精氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·酪氨酸-D-丙氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-精氨酸-精氨酸-D-谷氨酸-精氨酸-NH2
·CH2=CH-CH2酪氨酸-D-苏氨酸-甘氨酸-对-三氟甲苯丙氨酸-缬氨酸-精氨酸-鸟氨酸-甘氨酸-OCH2(CH2)2CH3
·CH3(CH2)4CH2酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-正-亮氨酸-精氨酸-高精氨酸-肌氨酸-OC(CH3)3
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-蛋氨酸砜-精氨酸-CH3-精氨酸-D-亮氨酸-精氨酸-NH2
·酪氨酸-D-半胱氨酸-甘氨酸-苯丙-D-半胱氨酸-精氨酸-CH3-精氨酸-D-亮氨酸-NHCH2CH3
·酪氨酸-肌氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH(CH2)5CH3
·CH3CH2酪氨酸-D-精氨酸-甘氨酸-对-溴苯丙氨酸-正亮氨酸-CH3-精氨酸-CH3精氨酸-精氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-叔-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-NHCH2CH3
·酪氨酸-D-酪氨酸-甘氨酸-苯丙氨酸-甘氨酸-D-精氨酸-天冬酰胺-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-CH3亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·酪氨酸-D-丝氨酸-甘氨酸-苯丙氨酸-丝氨酸-精氨酸-CH3精氨酸-D-亮氨酸-NHCH2CH3
·CH2=CH-CH2酪氨酸-D-天冬氨酸-甘氨酸-对-碘苯丙氨酸-丙氨酸-精氨酸-D-精氨酸-色氨酸-OCH2CH3
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-精氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-D-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-对-硝苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-精氨酸-NHCH2CH3
·酪氨酸-D-谷氨酸-对-氯苯丙氨酸-天冬氨酸-精氨酸-CH3鸟氨酸-CH3异亮氨酸-D-精氨酸-NHCH2CH2CH3
·CH3CH2酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-苯丙氨酸-精氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-对-溴苯丙氨酸-正亮氨酸-精氨酸-精氨酸-组氨酸-精氨酸-NH2
·酪氨酸-D-
-精氨酸-D-精氨酸-赖氨酸-D-精氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-OCH2CH3
·CH3-CH=CH酪氨酸-甘氨酸-甘氨酸-对-硝苯丙氨酸-蛋氨酸-精氨酸-精氨酸-苯丙氨酸-精氨酸-NHCH3
·CH3酪氨酸-D-丙氨酸-甘氨酸-CH3苯丙氨酸-蛋氨酸砜-精氨酸-CH3精氨酸-异亮氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-CH3苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·酪氨酸-D-丙氨酸-甘氨酸-苯丙氨酸-CH3蛋氨酸-精氨酸-精氨酸-亮氨酸-精氨酸-NHCH2CH3
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-蛋氨酸-赖氨酸-CH3赖氨酸-蛋氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-苏氨酸-精氨酸-NH2
·酪氨酸-D-丝氨酸-甘氨酸-对-氟苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-天冬酰胺-NHCH3
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-谷氨酰胺-NH2
·CH3酪氨酸-D-丙氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮-NH2
·酪氨酸-D-丝氨酸-甘氨酸-苯丙氨酸-脯氨酸-D-鸟氨酸-精氨酸-CH3丙氨酸-D-精氨酸-NH2
·酪氨酸-D-丙氨酸-甘氨酸-C2H5对-氟苯丙氨酸-蛋氨酸-精氨酸-精氨酸-D-色氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-CH3精氨酸-CH3精氨酸-D-赖氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NHCH2CH3
·酪氨酸-D-蛋氨酸-甘氨酸-对-硝苯丙氨酸-亮氨酸-D-精氨酸-精氨酸-D-脯氨酸-精氨酸-OCH2CH3
·△-CH2酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-缬氨酸-赖氨酸-CH3赖氨酸-谷氨酸-D-精氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-对-硝苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·CH3酪氨酸-D-脯氨酸-甘氨酸-苯丙氨酸-叔-亮氨酸-鸟氨酸-CH3鸟氨酸-蛋氨酸-精氨酸-NH2
·酪氨酸-D-色氨酸-甘氨酸-对-硝苯丙氨酸-蛋氨酸-精氨酸C2H5精氨酸-丙氨酸-精氨酸-NHCH3
·CH3酪氨酸-甘氨酸-甘氨酸-对-硝苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-NHCH2CH3
·酪氨酸-D-组氨酸-甘氨酸-苯丙氨酸-蛋氨酸砜-赖氨酸-精氨酸-D-组氨酸-精氨酸-NH2
·CH3酪氨酸-D-亮氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-丝氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-CH3精氨酸-精氨酸-D-亮氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-NHCH2CH3
·酪氨酸-D-丝氨酸-甘氨酸-对-氯苯丙氨酸-亮氨酸-鸟氨酸-鸟氨酸-苏氨酸-D-精氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-NH2
·CH3CH2酪氨酸-甘氨酸-甘氨酸-对-氟苯丙氨酸-蛋氨酸-精氨酸-高精氨酸-甘氨酸-NHCH3
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-OCH2CH3
·酪氨酸-D-缬氨酸-甘氨酸-对-硝苯丙氨酸-谷氨酰胺-精氨酸-精氨酸-D-缬氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-NHCH2CH(CH3)CH2CH3
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-赖氨酸-CH3精氨酸-D-亮氨酸-NH2
·酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3赖氨酸-酪氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-蛋氨酸-精氨酸-CH3精氨酸-缬氨酸-NH2
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-精氨酸-D-亮氨酸-NH2
·CH2=CH-CH2酪氨酸-D-谷氨酰胺-甘氨酸-苯丙氨酸-赖氨酸-D-精氨酸-精氨酸-CH3亮氨酸
·CH2酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-高精氨酸-精氨酸-D-亮氨酸-NH2
·酪氨酸-D-丙氨酸-甘氨酸-CH3苯丙氨酸-蛋氨酸砜-精氨酸-精氨酸-D-天冬氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-脯氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-赖氨酸-CH3精氨酸-CH3异亮氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-2-氨基异丁酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3赖氨酸-D-丙氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-赖氨酸-CH3赖氨酸-CH2缬氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-NHCH2CH2CH2COOH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-CH3亮-OC2H5
·CH3CH2酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-脯氨酸-丙氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-肌氨酸-OH
·CH2=CH-CH2酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-CH3异亮氨酸-D-赖氨酸-OH
·△-CH2酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨
酸-精氨酸-D-脯氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-丙氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-CH3丙氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-异亮氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-天冬氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-谷氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-CH3异亮-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-肌氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-β-丙氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-天冬氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-苯丙氨酸-OH
·CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-精氨酸-D-谷氨酸-OH
本发明的肽可通过任何合宜的方法合成。通过一般的液相法或固相法可合成该肽的保护性肽。通常优选的方法是保护氨基酸侧链上的一个功能基团。最后再除掉所有的保护基。氨基酸侧链上功能基的保护基包括以前报道的所有保护基,其中较典型的是:甲苯磺酰(TOS)、亚硝基(NO2)、苄基(BZL)、叔-丁基(But)、苯氧羰基(Z)和叔-丁氧羰基(BOC)。
所有以前报道过的保护基均可作为氨基酸α-氨基的保护基。然而,最好是选择组合的保护基,这样,α-氨基的保护基可被有选择性的除去而不会影响侧链上其他功能基的保护基。例如,当用叔-丁氧羰基作为α-氨基的保护基时,最好再用苄基或苯氧羰基作为侧链功能基的保护基。当选用苯氧羰基作为α-氨基的保护基时,则选用叔-丁基或叔-丁氧羰基为侧链功能基的保护基。当酪氨酸N端的氨基二烃基化时,在其没有任何进一步保护的情况下,也可保留下来。为抑制外消旋作用,保护性肽要逐步合成,其中所有氨基酸都从C端开始顺序键合,或在甘氨酸位上将各片段缩合。当然也可在所需的位上将片段缩合。
无论本发明的固相或液相方法,保护基都需从肽上除去,然后通过下式所示的重复反应将肽纯化。此法步骤,将以液相法为例,表示如下:
其中X1和X2均可代表氢或一个烷基,y1和y2代表一个氨基酸侧链,而R′和R″代表一个保护基或一个肽残基。
(1)形成肽键的反应:
肽键可以通过以前报道过的任何方法来形成。一般应用的方法包括活化式
所示的酸的羧基,可用叠氮法、二环己基碳化二亚胺(DCC)法,混合酸酐法或活化酯法等。然后使活化的化合物与式
所示的含氨基化合物起反应。反应条件,诸如反应溶剂、温度等可根据活化羧基的方法而改变。作为一种典型缩合法的混合酸酐法如下进行:将一种通式:HN-CHCOR′所示的酸,溶在一种诸如二甲基甲酰胺、四氢呋喃或乙酸乙酯的非质子传递剂中,将该溶液置于约-20℃下冷却,再连续加入相同克分子数的N-甲基吗啉和氯碳酸乙酯。5分钟后,加入等克分子数的,通式
的含氨基化合物。混合液在-15-0℃下搅拌2到5小时,然后用通常方法处理,得到下式含保护基的肽:
(2)从氨基除去保护基:
通过用酸、碱和肼的一般催化反应脱去保护基。根据α-氨基的不同保护基选择最优的方法。脱去苯氧羰基和叔-丁氧羰基的催化反应一般用三氟乙酸。下面详述用三氟乙酸脱去叔-丁氧羰基的具体实施方法:
在0.25ml的苯甲醚和5ml的三氟乙酸混合液中,加入1克下列通式的α-N-丁氧羰基肽:
在冰水中冷却。将混合液搅拌60分钟,然后用乙醚处理,得到一个式
所示肽的三氟乙酸酯,该产物溶在一种溶剂中,然后用胺,诸如三乙胺去中加,得到的化合物再进行以下的反应。
(3)脱去整个保护基:
通过重复上述缩合反应及脱去α-氨基的保护基而加长了肽链。然后,就要脱去所有的保护基以得到目的肽的粗提取液。脱保护基是通过常规的用液态氨或碱金属溶液,在催化反应中完成的。也可以用酸溶液、碱溶液或肼。实际上,要根据保护基的不同选择不同的溶液。最常用的是在氟氢酸中脱去保护基,详细过程如下:
把1克有保护基的肽溶在大约含0.5ml苯甲醚的30ml氟氢酸中,所得溶液置于密闭的氟氢酸反应器中,于-15-0℃下搅拌60分钟,然后把氟氢酸从反应器中蒸馏出去。残留物用乙醚洗涤,然后溶于水中。所得溶液经Amberlite IRA-93(醋酸型树脂)处理、冷冻干燥,从而得到脱去保护基的粗肽。
(4)纯化粗肽:
纯化粗肽可用离子交换层析、凝胶过滤、分配层析、反向分配层析和高效液相层析等一般的方法进行。比如,用下述的高效液相层析法进行粗肽的纯化:将100毫克粗肽装入以Nucleosil 5C 18为载体的柱子里,柱高250mm,直径20mm。然后用含0.05%盐酸(H2O-CH2CN)的缓冲液洗脱。在紫外光210纳米波长处有一个目的肽高峰,收集后冷冻干燥,而得到纯化的肽。
当肽分子中含两个半胱氨酸或D-半胱氨酸时,在纯化前,先把粗肽用空气或过氧化氢氧化,从而可得到高纯的闭环产物。
下面生动的实验将进一步说明:本发明的化合物作为药物的作用。
实验1:止痛试验
把被试化合物溶在生理盐水中,给ddY品系雄性小鼠(体重20~27克,通常每个实验组用8只)行静脉或皮下注射。止痛效果以刺尾试验观测之。
刺尾试验中,①用一个能施加300克压力的夹子,夹在包括肛粘膜的小鼠尾部,测量被夹子夹痛,反应出现的时间。试验前,通过鼠尾对小夹子的伤害感受度来选择小鼠,3秒钟内不感到疼痛的小鼠,试验中不能选用。6分钟以上才感受到疼痛,作为有止痛效果的标准。
ED50值(对50%的小鼠有止痛效果的该药用量(是根据Lit-chfield和Wilcoxon方法计算出的。
②结果:见表1和表2,表1表示静脉注射的结果。表2表示皮下注射的结果。
表1和表2中试验用化合物的号码相当于下述各例中生产的最终化合物的号码。
(注1):尾刺法是根据Takagi,H等人发表在《日本药学杂志》16卷,287-294页,1966年。
(注2):Litchfild-Wilcoxon法是根据Litchfiled,J.T.和Wilcoxon发表在J.Pharmacol.Exp.Ther.,96卷,99-113页,1949年。
表1
试验用化合物号 尾刺法(静脉)
(相当于最终样品号) ED50(mg/kg)
1 0.75
2 0.24
5 3.4
6 4.3
7 3.9
8 3.3
10 1.2
18 4.5
19 2.0
21 0.8
22 3.0
24 0.22
25 1.8
27 0.7
28 0.7
29 2.0
dynorphine(1-13) >25.0
表2
试验用化合物号 尾刺法(皮下)
(样品号) ED50(毫克/公斤)
1 1.0
2 0.44
21 0.8
24 0.32
27 0.8
28 1.5
实验2:类鸦片活性
本发明化合物的类鸦片活性是根据T.Oka,K.Negishi,M.Suda,T.Matsumiya,T.Inaza和M.Ueki等人发表在“欧洲药物学杂志”73卷,235页,1980年的方法,即用兔输精管的方法来进行的。在本试验中,把空气注入成熟雄兔的耳静脉中,兔立即死亡,然后剖腹取出左、右输精管。把精子从输精管挤入林格氏液内。切取每一个输精管的一部分,即从近前列腺的一端切取2.5厘米长。将切下的输精管小段,用线悬在一个6ml的恒温玻璃器皿内,用具有铂电极的电刺激装置以0.1赫兹、90伏刺激1毫秒。电刺激引起的收缩通过传感器记录下来。
类鸦片活性就是根据药物抑制电刺激引起的收缩来测定的。
对50%的小鼠收缩有抑制作用的药物浓度称之为IC50,见表3。
从表3可看到,该化合物与dynorphin A相比较,显示非常有效的活性。
进而,该化合物对抑制豚鼠回肠纵行肌的收缩以及小鼠输精管的收缩也有强大的活性。
表3
试验用化合物 兔输精管法
样品序号 IC50(Nm)
1 3.5
2 0.04
3 6.03
6 4.5
8 6.2
19 2.8
24 0.08
25 0.58
27 2.0
28 6.5
dynorphin A(1-17) 17.4
通过上述药物试验,很显然该肽化合物里具有类似的类鸦片活性,而且活性很强。静脉或皮下注射均能产生明显止痛效果。
由于dynorphin在血液中不稳定,迄今在报道中dynorphin及其衍生物的静脉注射并不产生止痛效果。本发明的价值就在于该药无论静脉注射或皮下注射均可产生强止痛效果。
本发明1号及2号样品的肽类化合物的毒性(最小致死量)与有效剂量之间的关系,
见表4。
本项发明的肽类化合物具有明显止痛效果,作为药物可广泛用于治疗。
表4 小鼠皮下注射有效量与最小致死量
试验化合物 尾刺法 最小致死量
样品号 ED50mg/kg mg/kg
1 1.0 100
2 0.44 20
本发明作为止痛药时,可以口服也可肠道外使用:如静脉、皮下或肌肉注射、栓剂、舌下含片等。用药量取决于病情、年龄、性别、体重、对药的敏感性、疾病阶段、给药途径、给药间隔、制剂性质、处方和制备的不同、活性或成分的不同而改变。药量虽无特殊限定,但通常大约为0.1到1000毫克,最佳为300毫克。
本发明可制成注射剂、坐药、舌下含片、胶囊和片剂。
在制作注射剂时,需加入一些添加剂,如酸碱度控制剂、缓冲剂、悬浮剂、稳定剂、助溶剂、等渗剂和防腐剂,并通过通常方法制成静脉、皮下或肌肉的注射剂。需要的话,还可用常规方法冷冻干燥。
悬浮剂包括甲基纤维素、聚山梨醇酯60、羟乙基纤维素、阿拉伯胶、黄芪胶粉、羧甲基纤维素的钠盐和聚氧乙烯山梨聚糖单月桂酯。
溶剂包括聚氧乙烯硬化的蓖麻油、聚山梨醇酯80、菸酰胺、聚氧乙烯山梨聚糖单月桂酯,Macrogol和蓖麻油脂肪酸乙酯。
稳定剂包括亚硫酸钠、异亚硫酸钠和乙醚。防腐剂包括甲基-对-羟基安息酸酯,乙基-对-羟基安息酸酯,山梨酸,苯酚,甲酚和氯甲酚。
参照下列典型样品进一步说明本项发明,但本发明决不止于此。
例1:
1)合成CH3酪氨酸-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸-CH3精氨酸-D-亮氨酸-NHC2C5。
将25克叔-丁氧羟基-D-亮氨酸-OH·H2O溶于200毫升的四氢呋喃中,所得溶液在-20℃下冷却。并向溶液中加入11毫升N-甲基吗啉和9.56毫升氯碳酸乙酯。5分钟后,再加70%乙胺溶液12.9毫升。把混合液在大约-5℃下搅拌2小时,浓缩后将残留物溶于乙酸乙酯,再用碳酸氢钠溶液和水连续洗涤。浓缩至干燥,得到24.5克叔-丁氧羧基-D-亮氨酸-NHC2H5。
熔点:103-106℃
薄层层析:Rf值0.77(乙酸乙酯)
旋光度:〔α〕D=+20.0°(C=1,甲醇)
C13H26N2O3的元素分析:
C H N
计算值(%) 60.44 10.14 10.84
测定值(%) 60.42 10.33 10.86
2)合成苄氧碳酰-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5
将1.43克苄氧碳酰-CH3精氨酸(对-甲苯磺酰)-OH,〔α〕D=-15°(C=1,二甲基甲酰胺),(根据:P.Quitt等人的方法从组氨酸-精氨酸(对-甲苯磺酰)-OH合成的,刊在瑞士化学学报32卷,327页,1963年)溶在15毫升的四氢呋喃中。冷却到-30℃后,加入0.33毫升N-甲基吗啉和0.29毫升氯碳酸乙酯,5分钟后加入含817毫克CF3COOH-组氨酸-D-毫氨酸-NHC2H5(在苯甲醚中用CF3COOH处理叔-丁氧羧基
-D-亮氨酸-NHC2H5来合成的)和0.83毫升溶在四氢呋喃中的三乙胺。然后,将混合液置于大约-5℃下搅拌2小时。浓缩后,残留物溶在乙酸乙酯中,用碳酸氢钠溶液和水连续洗涤,浓缩干燥,从而得到1.58克透明的苄氧碳酰-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5。
薄层层析:Rf值0.68(溶剂为甲醇/氯仿,1∶7)
旋光度:〔α〕D=0±0.5°(C=1,甲醇)
C30H44N6O6S的元素分析:
C H N
计算值(%) 58.42 7.19 13.63
测定值(%) 58.29 7.19 13.40
3)合成叔-丁氧碳酰-精氨酸(对-甲基磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5:
把有钯/碳存在时,催化还原苄氧碳酰-CH3精(对-甲苯磺酰)-D-亮氨酸-NHC2H5得到的CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H51.1克,叔-丁氧碳酰-精氨酸(对-甲苯磺酰)-OH983克,和372毫克的N-羟基苯并三唑溶在4毫升的二甲基甲酰胺中。用冰冷却后,溶液内加入520毫克二环己基碳化二亚胺,混合液在冰箱内搅拌一天,再在室温下搅拌1天。把形成的沉淀过滤,浓缩滤液。残留物根据硅胶柱层析法纯化(洗脱液:甲醇/氯仿=1/15),从而得到1.2克透明的叔-丁氧碳酰-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5
薄层层析:Rf值0.64(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-20.6°(C=1,甲醇)
C40H64N10O9S2·H2O的元素分析:
C H N
计算值(%) 52.72 7.30 15.37
测定值(%) 52.82 7.22 15.06
4)合成叔-丁氧碳酰-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5
把1.64克叔-丁氧碳酸-亮氨酸-OH·H2O溶在12毫升二甲基甲酰胺中。溶液冷却到-20℃,加入0.726毫升N-甲基吗啉和0.631毫升氯碳酸乙酯。5分钟后,把在苯甲醚中用CF3COOH处理叔-丁氧碳酰-精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5得到的4.986克CF3COOH-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5和12毫升二甲基甲酰胺中的0.726毫升的N-甲基吗啉加入上述溶液。混合液在大约-5℃下搅拌2小时。浓缩后,残留物溶在乙酸乙酯中,用碳酸氢钠水溶液洗涤,然后,用水洗涤。浓缩后,用甲醇/乙醚使之固化。从而得到5.283克叔-丁氧碳酰-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5
熔点:120-125℃(dec)
薄层层析:Rf值0.66(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-25.8°(C=1,甲醇)
C46H75N11O10S2·CH3OH的元素分析:
C H N
计算值(%) 54.36 7.67 14.84
测定值(%) 54.49 7.63 14.62
5)合成叔-丁氧碳酰-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对
-甲苯磺酰)-D-亮氨酸-NHC2H5
将1.465克叔-丁氧碳酰-苯丙氨酸-OH溶于12毫升二甲基甲酰胺中。冷却到-30℃。把0.608毫升的N-甲基吗啉和0.528毫升的氯碳酸乙酯加入溶液。5分钟后,把在苯甲醚中用CF3COOH处理叔-丁氧磺酰-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5合成的CF3COOH·H-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H54.691克,和含有0.608毫升N-甲基吗啉的二甲基甲酰胺液12毫升一起加入上述溶液。混合液在约-5℃下,搅拌2小时,浓缩后,残留物溶于乙酸乙酯中,用碳酸氢钠溶液和水连续洗涤。浓缩后用甲醇/乙醇固化。得到5.072克叔-丁氧碳酰-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5。
熔点:127-132℃(dec)
薄层层析:Rf值0.66(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-25.4(C=1,甲醇)
C55H84N12O11S2·CH3OH的元素分析:
C H N
计算值(%) 56.74 7.48 14.18
测定值(%) 56.64 7.33 13.86
6)合成叔-丁氧碳酰-CH3酪氨酸(氯2苄基)-甘氨酸-甘氨酸-OH
根据S.T.Cheung等人方法合成的叔-丁氧碳酰-CH3酪氨酸(氯2苄基)-OH9.09克,〔α〕D=-49°(C=1,C2H5OH)(加拿大化学杂志,55卷,906页,1977年)和2.53克N-羟基琥珀酰胺共溶在150毫升的四氢呋喃中。用冰冷却后,把4.12克二氯己基碳化二亚胺加入溶液,混合液在冰箱中搅拌过夜。滤出形成的白色结晶,将2.91克的H-甘氨酸-甘氨酸-OH和38毫升的1.848克碳酸氢钠水溶液加入过滤液。混合液在室温下搅拌2天,然后浓缩,并加入稀柠檬酸液和乙酸乙酯,分离出乙酸乙酯的一层,水洗并浓缩之。以硅胶柱层析纯化产物,用甲醇/氯仿=1/3,洗脱,乙醚/己烷固化。最后得到9.23克叔-丁氧碳酰-CH3酪氨酸(氯2苄基)-甘氨酸-甘氨酸-OH。
熔点:70-80℃(dec)
薄层层析:Rf值0.79(甲醇/乙酸/氯仿4∶1∶12)
旋光度:〔α〕D=-47°(C=1,甲醇)
C26H31N3O7Cl2·1/2C2H5OC2H5的元素分析:
C H N
计算值(%) 55.54 5.99 6.94
测定值(%) 55.45 5.81 6.89
7)合成叔-丁氧碳酰-CH3酪氨酸(氯2苄基)-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5。
把682毫克的叔-丁氧碳酰-CH3酪氨酸(氯2苄基)-甘酸-甘氨酸-OH和195毫克N-羟基苯并三唑溶于4毫升的二甲甲酰胺中。用冰冷却之,加入272毫克二氯环己基碳化二亚胺,搅拌2小时,加入在苯甲醚中用CF3COOH处理叔-丁氧碳酰-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5而合成的CF3COOH·H-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H51.167克和含0.132毫升N-甲基吗啉的8毫升二甲基甲酰胺到上述溶液。混合液在冰箱中搅拌过夜。将形成的沉淀过滤,浓缩滤液,用硅胶柱层析法
纯化之(洗脱液:甲醇/氯仿=1/20)。以甲醇/乙醚固化之,得到1.391克叔-丁氧碳酰-CH3酪氨酸(氯2苄基)-甘氨酸-甘氨酸-苯丙氨酸-亮氨酸-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-NHC2H5。
熔点:130-135℃(dec)
薄层层析:Rf值0.64(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-35.3°(C=1,甲醇)
C76H105N15O15S2Cl2·CH3OH·H2O的元素分析:
C H N
计算值(%) 55.92 6.77 12.70
测定值(%) 56.06 6.49 12.52
8)合成CH3酪-甘-甘-苯丙-亮-精-CH3-精-D-亮-NHC2H5
-5℃下,在一个封闭的氟氢酸反应器中把220毫克的叔-丁氧碳酰-CH3酪(氯2苄基)-甘-甘-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-亮-NHC2H5溶在含0.2毫升苯甲醚的10毫升氟氢酸中。溶液搅拌1小时,然后把氟氢酸从反应系统中蒸出。残留物用乙醚洗涤,再溶于水中。溶液用Amberlite IRA-93处理后,冷冻干燥。所得120毫克粗肽用高效液相层析纯化〔用nucleosil 5c 18,2φ25cm,洗脱剂为0.1%盐酸(水-CH3CN,81/91)〕,最后冷冻干燥,得到70毫克CH3酪-甘-甘-苯丙-亮-精-CH3精-D-亮-NHC2H5
薄层层析:Rf值0.70(丁醇/乙酸/吡啶/水,15∶5∶5∶8)
旋光度:〔α〕D=-21.8°(C=0.4,0.01N-Hcl)
质谱分析(FAB):1036(〔M+H〕+)
氨基酸分析:甘:1.87(2) 亮:1.96(2)
苯丙:1.00(1) 精:0.95(1)
(由CH3酪和CH3精产生的峰未被计算)。
例2.合成酪-D-半胱-精-CH3精-D-亮-精-NH2
1)合成叔-丁氧碳酰-D-亮-精(对-甲苯磺酰)-NH2:
把2.493克叔-丁氧碳酰-D-亮-OH·H2O溶于10毫升的二甲基甲酰胺。溶液冷却到-20℃,加入1.1毫升的N-甲基吗啉和0.96毫升的氯碳酸乙酯。5分钟后,将含4.414克CF3COOH·H-精(对甲苯磺酰)-NH2的溶液和含1.65毫升N-甲基吗啉的20毫升二甲基甲酰胺加入溶液。将混合液于-5℃下搅拌2小时。浓缩后将残留物溶于乙酸乙酯,并用碳酸氢钠液和水连续洗涤。浓缩后,加入乙醚固化产品。从而得到4.96克叔-丁氧碳酰-D-亮-精(对-甲苯磺酰)-NH2。
熔点:110-12℃(dec)
薄层层析:Rf值0.49(甲醇/氯仿,1∶7)
旋光度:〔α〕D=+13°(C=1,甲醇)
C24H40N6O6S·1/3H2O的元素分析:
C H N
计算值(%) 52.73 7.50 15.37
测定值(%) 52.77 7.60 15.14
2)合成苯氧碳酰-CH3精(对-甲苯磺酰)-D-亮-精(对-甲苯磺酰)-NH2
将3.336克苯氧碳酰-CH3精(对-甲苯磺酰)-OH溶于30毫升的四氢呋喃。将溶液冷却到-20℃,加入0.77毫升N-甲基吗啉和0.67毫升的氯碳酸乙酯。5分钟后,把用含苯甲醚的CF3COOH处理合成的CF3COOH·H-D-亮-精(对-甲苯磺酰)
-NH23.882克的溶液,和含1.17毫升三乙胺的30毫升四氢呋喃加入溶液。在-5℃下,将混合液搅拌2小时。浓缩后用甲醇/水固化之,得到6.14克苯氧碳酰-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2。
熔点:100-113℃(dec)
薄层层析:Rf值0.44(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-3.4°(C=1,甲醇)
C41H58N10O9S2·CH3OH元素的分析:
C H N
计算值(%) 54.18 6.71 15.04
测定值(%) 54.12 6.62 14.85
3)合成叔-丁氧碳酰-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-亮-精(对-甲苯磺酰)-NH2
把有钯/碳催化还原苯氧碳酰-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2得到的4.73克CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2,2.912克的叔-丁氧碳酰-精氨酸(对-甲苯磺酰)OH和1.1克N-羟基苯并三唑溶于17毫升的二甲基甲酰胺中。用冰冷却溶液后,加入1.543克二环己基碳化二亚胺。混合液在冰箱中搅拌一天,然后再在室温下搅拌一天。将形成的沉淀滤出,浓缩滤液。残留物用硅胶柱层析纯化(洗脱剂为甲醇/氯仿=1/15)。然后用乙醚固化。从而得到4.917克叔-丁氧碳酰-精氨酸(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2。
熔点:131-136℃(dec)
薄层层析:Rf值0.44(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-16.7°(C=1,甲醇)
C51H78N14O12S3·H2O的元素分析:
C H N
计算值(%) 51.32 6.76 16.43
测定值(%) 51.15 6.54 16.48
4)合成叔-丁氧碳酰-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2:
将747毫克叔-丁氧碳酰-半胱氨酸(CH3苄基)-OH溶于4毫升二甲基甲酰胺中。溶液冷却到-20℃,再加入0.254毫升N-甲基吗啉和0.221毫升氯碳酸乙酯。5分钟后,将含2.49克用含苯甲醚的CF3COOH处理叔-丁氧碳酰-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2而合成的CF3COOH·H-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2的溶液及含0.277毫升N-甲基吗啉的6毫升二甲基甲酰胺加入溶液。混合液置于大约-5℃下搅拌2小时。浓缩后将混合液溶于乙酸乙酯,并用碳酸氢钠和水连续洗涤。进一步浓缩后,用甲醇/乙醚固化产物,从而得到2.548克叔-丁氧碳酰半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2。
熔点:126-132℃(dec)
薄层层析:Rf值0.51(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-20.6°(C=1,甲醇)
C62H91N15O13S4·CH3OH·H2O的元素分析:
C H N
计算值(%) 52.81 6.82 14.66
测定值(%) 52.78 6.43 14.29
5)合成叔-丁氧碳酰-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精(对-甲苯磺酰)-NH2。
将467毫克叔-丁氧碳酰-苯丙氨酸-OH溶于二甲基甲酰胺。将溶液冷却到-20℃,把0.194毫升N-甲基吗啉和0.168毫升氯碳酸乙酯加入溶液。5分钟后,把含2.234克用含苯甲醚的CF3·COOH处理叔-丁氧碳酰-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2而合成的CF3·COOH·H-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-NH2的溶液和含0.211毫升二甲基甲酰胺加入溶液,所得混合液在大约-5℃下搅拌2小时。浓缩后残留物溶于乙酸乙酯中,然后用碳酸氢钠水溶液及水连续洗涤。进一步浓缩后,用甲醇/乙醚固化产物,得到2.126克叔-丁氧碳酰-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-亮氨酸-精(对-甲苯磺酰)-NH2。
熔点:124-130℃(dec)
薄层层析:Rf值0.56(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-18.9°(C=1,甲醇)
C17H100N16O14S4·5/2CH3OH的元素分析:
C H N
计算值(%) 54.83 6.89 13.91
测定值(%) 54.62 6.34 13.64
6)合成叔-丁氧碳酰-D-半胱氨酸(CH3苄基)-甘氨酸-OC2H5
将3.233克叔-丁氧碳酰-D-半胱氨酸(CH3苄基)-OH溶于15毫升的二甲基甲酰胺。把溶液冷却到-20℃,加入1.1毫升N-甲基吗啉和0.956毫升氯碳酸乙酯。5分钟后,加入含1.396克Hcl·H-甘氨酸-OC2H5溶液和含1.1毫升N-甲基吗啉的20毫升二甲基甲酰胺。混合液置于大约-5℃下搅拌2小时。浓缩后,残留物溶于乙酸乙酯中,并用碳酸氢钠水溶液和水连续洗涤。然后固化产物,从而得到3.6克叔-丁氧碳酰-D-半胱氨酸-甘氨酸-OC2H5。
熔点:80-82℃
薄层层析:Rf值0.74(氯仿/乙酸乙酯,2∶1)
旋光度:〔α〕D=+30.2°(C=1,甲醇)
C20H30N2O5S的元素分析:
C H N
计算值(%) 58.51 7.37 6.82
测定值(%) 58.35 7.23 6.69
7)合成叔-丁氧碳酰-酪氨酸(氯2苄基)-D-半胱氨酸(CH3苄基)-甘氨酸-OC2H5。
把2.068克叔-丁氧碳酰-酪氨酸(氯2苄基)-OH溶于20毫升的四氢呋喃。溶液冷却至-20℃,加入0.517毫升N-甲基吗啉和0.45毫升氯碳酸乙酯。5分钟后,把含1.94克用含苯甲醚的CF3COOH处理的叔-丁氧碳酰-D-半胱氨酸(CH3苄基)-甘氨酸-OC2H5合成的CF3COOH·H-D-半胱氨酸(CH3苄基)-甘氨酸-OC2H5溶液和含1毫升三乙胺的20毫升四氢呋喃加入溶液。把混合液在大约-5℃下,搅拌2小时。浓缩
后,加水形成沉淀,过滤,沉淀并将其溶在甲醇与氯仿的混合液中。浓缩后,加入乙醚固化产物。这样,得到2.661克叔-丁氧碳酰-酪氨酸(氯2苄基)-D-半胱氨酸(CH3苄基)-甘氨酸-OC2H5。
熔点:149-150℃
薄层层析:Rf值0.63(氯仿/乙酸乙酯,2∶1)
旋光度:〔α〕D=+17.0°(C=1,二甲基甲酰胺)
C36H43N3O7SCl2元素分析:
C H N
计算值(%) 59.01 5.91 5.73
测定值(%) 58.94 5.75 5.62
8)合成叔-丁氧碳酰-酪氨酸(氯2苄基)-D-半胱氨酸-(CH3苄基)-甘氨酸-OH:
将2.345克叔-丁氧碳酰-酪氨酸(氯2苄基)-D-半胱氨酸(CH3苄基)-甘氨酸-OC2H5溶于30毫升四氢呋喃,然后加入3.2毫升N-NaOH,室温下搅拌1小时,再加入N-Hcl3.2毫升,浓缩混合液。加水固化产品从而得到1.899克叔-丁氧碳酰-酪(氯2苄基)-D-半胱(CH3苄基)-甘氨酸-OH。
熔点:133-138℃(dec)
薄层层析:Rf值0.25(甲醇/氯仿,1∶7)
旋光度:〔α〕D=+35.8°(C=1,甲醇)
C34H39N3O7Scl2元素分析:
C H N
计算值(%) 57.95 5.58 5.96
测定值(%) 57.81 5.33 5.92
9)合成叔-丁氧碳酰-酪(氯2苄基)-D-半胱(CH3苄基)-甘氨酸-苯丙氨酸-半胱(CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2:
将983毫升叔-丁氧碳酰-酪氨酸(氯2苄基)-D-半胱氨酸(CH3苄基)-甘氨酸-OH和226毫克N-羟基苯并三唑溶于5毫升的二甲基甲酰胺中。冰下冷却,加入316毫克二环己基碳化二亚胺,搅拌2小时后,把含有1.94克,用含苯醚的CF3COOH处理叔-丁氧碳酰-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2合成的CF3COOH·H-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2的溶液和含0.167毫升N-甲基吗啉的10毫升二甲基甲酰胺加入上述溶液。在冰箱内搅拌过夜,沉淀过滤。经硅胶柱层析(甲醇/氯仿=1/20洗脱)纯化后,用甲醇/乙醚固化,得到2.0克叔-丁氧碳酰-酪氨酸(氯2苄基)-D-半胱氨酸(CH3苄基)-甘氨酸-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-D-亮氨酸-精氨酸(对-甲苯磺酰)-NH2。
熔点:123-130℃(dec)
薄层层析:Rf值0.60(甲醇/氯仿=1/7)
旋光度:〔α〕D=-17.5°(C=1,二甲基甲酰胺)
C100H129N19O18S5cl2·C2H5OC2H5·3/2CH3OH的元素分析:
C H N
计算值(%) 56.60 6.52 11.89
测定值(%) 56.38 6.18 11.72
将515毫克叔-丁氧碳酰-酪氨酸(氯2苄基)D-半胱氨酸(CH3苄基)-甘氨酸-苯丙氨酸-半胱氨酸(CH3苄基)-精氨酸(对-甲苯磺酰)-CH3精氨酸(对-甲苯磺酰)-NH2,在-5℃下,溶于在密闭的氟氢酸反应器中含2毫升苯甲醚的20毫升氟氢酸中。搅拌2小时,然后将氟氢酸蒸出反应器。残留物以乙醚洗涤,再溶于水。溶液用Amberlite IRA-93处理,然后冷冻干燥。取此干燥产物320毫克溶于1.3升水中。用氨水将溶液的pH调至8,引入空气搅拌2天,调pH至6,然后冷冻干燥。所得粗肽用高效液相层析法纯化〔Nucleosil 5C 18,2φ×25cm,洗脱剂为0.05%Hcl(H2O/CH3CN,88/12)〕,经冷冻干燥后,得140毫克酪氨酸-D-
-精氨酸-CH3精氨酸-D-亮氨酸-精氨酸-NH2。
薄层层析:Rf值0.56(丁醇/乙酸/吡啶/水=15∶5∶5∶8)
旋光度:〔α〕D=-29°(C=0.4,0.01N-Hcl)
质谱分析(FAB):1183(〔M+H〕+)
氨基酸分析:
甘氨酸:1.02(1),半胱氨酸:1.83(2),
亮氨酸:1.94(1),酪氨酸:0.80(1),
苯丙氨酸:1.00(1),精氨酸:2.06(2)
(CH3精氨酸的峰值没有计算)
例3到29:
表1所示化合物可如例1和例2用同样的常规液相方法合成。在这些试验中,clgnorphiue衍生物在1到3位被修正的(酪氨酸-甘氨酸-甘氨酸),在4到7位上被修正的(苯丙氨酸-亮氨酸-精氨酸-精氨酸),在4到8位修正的(苯丙氨酸-亮氨酸-精氨酸-精氨酸-异亮氨酸)及在4到9位修正的(苯丙氨酸-亮氨酸-精氨酸-精氨酸-异亮氨酸-精氨酸)每条肽链均从C端开始,逐步合成出来,然后在1到3位的衍生物和4到7,4到8或4到9位的衍生物通过DCC-HOBt法或混合酸酐法而缩合在一起。所有保护基均用氟氢酸(HF)除去,再用逆相载体的高效液相色谱纯化产品。在例24中,所有保护基均用氟氢酸(HF)除去,化合物用空气氧化,然后,用制备性高效液相色谱纯化。合成每个保护基的反应路线,示于图1到图5之中。
上述的目的肽的旋光度〔α〕20 D,薄层层析Rf值,氨基酸分析结果,均示在表6。
表5
例号 化合物
3 CH3酪-甘-甘-苯丙-亮-精-精-NH2
4 CH3酪-甘-甘-苯丙-亮-精-精-NHCH2CH(CH3)CH2CH3
5 CH3酪-甘-甘-苯丙-亮-精-精-D-亮-OH
6 CH3酪-甘-甘-苯丙-亮-精-精-D-亮-OC2H5
7 CH3酪-甘-甘-苯丙-亮-精-精-D-亮-NH2
8 CH3酪-甘-甘-苯丙-亮-精-精-D-亮-NHC2H5
9 CH3酪-甘-甘-苯丙-亮-精-精-D-亮-NH(CH2)5CH3
10 CH3酪-甘-甘-对-硝苯丙-亮-精-精-D-亮-NH2
11 CH3酪-甘-甘-苯丙-亮-高精-精-D-亮-NH2
12 CH3酪-D-丙-甘-苯丙-亮-精-精-D-亮-NH2
13 CH3酪-甘-甘-CH3苯丙-亮-精-精-D-亮-NH2
14 CH3酪-甘-甘-苯丙-CH3亮-精-精-D-亮-NH2
15 CH3酪-甘-甘-D-苯丙-亮-精-精-D-亮-NH2
16 酪-D-丙-甘-苯丙-亮-精-精-D-亮-NH2
17 酪-肌-甘-苯丙-亮-精-精-D-亮-NH2
18 CH3酪-甘-甘-苯丙-亮-CH3精-精-D-亮-NH2
19 CH3酪-甘-甘-苯丙-亮-精-CH3精-D-亮-NH2
20 CH3酪-甘-甘-苯丙-叔-亮-精-CH3精-D-亮-NHC2H5
21 CH3酪-甘-甘-对-硝苯丙-亮-精-CH3精-D-亮-NHC2H5
22 CH3酪-甘-甘-苯丙-亮-赖-CH3精-D-亮-NH2
23 酪-D-丝-甘-苯丙-丝-精-CH3-D-亮-NHC2H5
25 CH3酪-甘-甘-苯丙-亮-精-精-D-亮-精-NH2
26 CH3酪-甘-甘-苯丙-亮-精-精-D-亮-精-NH2
27 CH3酪-甘-甘-苯丙-亮-精-CH3精-D-亮-精-NHC2H5
28 CH3酪-甘-甘-对-硝苯丙-亮-精-CH3精-D-亮-精-NHC2H5
29 CH3酪-甘-甘苯丙-磺蛋-精-CH3精-D-亮-精-NH2
叔-亮:(CH3)3CCH(NH2)COOH
高精:NH2C(=NH)NHCH2CH2CH2CH2CH(NH2)COOH
肌:CH3NHCH2COOH
图1、图2见文后
A:酪(氯2苄),CH3酪(氯2苄)。
B:甘,D-丙,肌
C:苯丙,D-苯丙,CH3苯丙,对-硝苯丙,
D:亮,CH3亮
E:精(对-甲苯磺酰),高精(对-甲苯磺酰)
R:氧苄,OC2H5,NH2,NHC2H5,NH(CH2)5CH3
在例11和例18中,Z-高精(TOS)OH和Z-CH3精(TOS)OH分别被用作为E氨基酸的保护氨基酸。(图3见文后)
A:酪(氯2苄),CH3酪(氯2苄)
B:甘,D-丝(苄),D-半胱(CH3苄)
C:苯丙,对-硝苯丙
D:亮,叔-亮,丝(苄),半胱(CH3苄)
E:精(对-甲苯磺酰),赖(苯氧碳酰)
R:NH2,NHC2H5
(图4、图5见文后)
表6
例 旋光度 薄层层析
氨基酸分析
号 〔α〕20 DRf值
3 -6.7° 0.53 甘1.97,亮1.03,苯丙1.00,精2.30
4 -12.1° 0.62 甘1.96,亮1.00,苯丙1.00,精2.01
5 -1.8° 0.65 甘2.01,亮2.00,苯丙1.00,精1.99
6 +0.8° 0.63 甘1.94,亮1.96,苯丙1.00,精1.97
7 -7.5° 0.62 甘1.95,亮1.96,苯丙1.00,精1.97
8 +5.0° 0.64 甘1.91,亮2.14,苯丙1.00,精2.78
9 +1.0° 0.68 甘1.92,亮1.95,苯丙1.00,精1.98
10 +3.4° 0.59 甘1.97,亮2.00,苯丙1.00,精2.01
11 -4.2° 0.61 甘1.95,亮1.96,苯丙1.00,精1.01
12 +13.9° 0.68 甘1.01,亮1.96,苯丙1.00,精1.98,丙1.00,
13 -17.2° 0.68 甘1.92,亮2.00,苯丙1.00,精2.03
14 -11.5° 0.61 甘1.99,亮1.02,苯丙1.00,精2.03
15 -12.0° 0.67 甘1.90,亮1.93,苯丙1.00,精1.94
16 +15.0° 0.69 甘1.07,亮1.97,丙苯1.00,精1.99,丙1.03酪0.95
17 -3.8° 0.64 甘1.00,亮1.98,丙苯1.00,精2.00,酪0.89
18 -19.7° 0.59 甘1.93,亮1.91,丙苯1.00,精0.98,
19 -33.4° 0.62 甘1.92,亮1.95,丙苯1.00,精0.99,
20 -19.1° 0.70 甘2.00,亮1.01,丙苯1.00,精0.99,
21 -16.6° 0.69 甘1.99,亮2.00,丙苯,精0.99,
22 -23.3° 0.62 甘1.97,亮1.99,丙苯1.00,精,赖1.03
23 -4.8° 0.65 甘1.01,亮1.00,丙苯1.00,精1.01,丝1.72,酪1.00
24 -29.1° 0.70 甘1.01,亮1.05,丙苯1.00,精1.02,酪0.82,半胱1.89
25 -7.8° 0.64 甘2.03,亮2.08,丙苯1.00,精3.22
26 -6.1° 0.43 甘1.93,亮0.98,丙苯1.00,精2.95,谷0.98
27 -31.8° 0.62 甘1.94,亮1.90,丙苯1.00,精1.91
28 -27.2° 0.52 甘1.96,亮2.00,丙苯,精2.03,
29 -23.0° 0.46 甘2.00,亮1.00,丙苯1.00,精1.97,
在氨基酸分析中,仅计算了甘、亮、苯丙、精、丙、酪、赖、丝、半胱和谷的比例。
〔α〕20 D旋光度测定条件:C=0.4 0.01N-Hcl
TLC·Rf值测定条件:丁醇/乙酸/吡啶/水=15∶5∶5∶8
例30:合成CH3酪-甘-甘-苯丙-亮-精-CH3精-D-丙-OH:
1)合成苯氧碳酰-CH3精(对-甲苯磺酰)-D-丙-OBut:
将3.336克苯氧碳酰-CH3精(对-甲苯磺酰)OH溶于20毫升的四氢呋喃中。把溶液冷却到-30℃。再向溶液加入0.77毫升N-甲基吗啉和0.669毫升的氯碳酸乙酯。5分钟后,加入含1.272克Hcl-H-D-丙-OBut的溶液和含1.16毫升的N-甲基吗啉的20毫升四氢呋喃。混合液在-5℃搅拌2小时。浓缩后,残留物溶于乙酸乙酯中,用碳酸氢钠水溶液和水连续洗涤。浓缩干燥后,得到4.16克透明的苯氧碳酰-CH3精(对-甲苯磺酰)-D-丙-OBut。
TLC·Bf值:0.69(甲醇/氯仿=1/7)
旋光度:〔α〕D=-15.5°(C=1,甲醇)
C29H41N5O7S的成分分析:
C H N
计算值(%) 57.70 6.85 11.60
测定值(%) 57.54 6.59 11.31
2)合成苯氧碳酰-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut
将钯/碳催化还原苯氧碳酰-CH3精(对-甲苯磺酰)-D-丙-OBut得到的CH3精(对-甲苯磺酰)-D-丙-OBut2.87克,苯氧碳酰-精(对-甲苯磺酰)OH3.392克,和N-羟基苯并三唑1.188克溶于10毫升的二甲基甲酰胺中。用冰冷却后,加入1.662克二环己基碳化二亚胺。混合液在冰箱中搅拌二天。形成的沉淀过滤之,然后浓缩滤液。残留物用硅胶柱层析提纯(洗脱剂:甲醇/氯仿=1/20),从而得到2.04克透明的苯氧碳酰-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut。
TLC·Rf值:0.57(甲醇/氯仿=1/7)
旋光度:〔α〕D=-31.6°(C=1,甲醇)
C42H59N9O10S1·1/2HO的元素分析:
C H N
计算值(%) 54.65 6.62 13.66
测定值(%) 54.64 6.48 13.72
3)合成苯氧碳酰-亮-精(对-甲苯磺酰)-CH2精(对-甲苯磺酰)-D-丙-OBut:
将0.629克苯氧碳酰-亮-OH溶于15毫升的二甲基甲酰胺中,将溶液冷却到-20℃,再加0.261毫升N-甲基吗啉和0.227毫升氯碳酸乙酯。5分钟后,把含1.76克由钯/碳催化还原苯氧碳酰-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut制出的Hcl-H-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut的溶液和含0.356毫升N-甲基吗啉的15毫升的二甲基甲酰胺加入上述溶液。混合液置-5℃搅拌2小时。浓缩后,残留物溶乙酯中,然后用碳酸氢钠水溶液和水连续洗涤。浓缩干燥后,得到2.11克透明的苯氧碳酰-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut。
TLC:Rf值0.57(甲醇/氯仿=1∶7)
旋光度:〔α〕D=-36.2°(C=1,甲醇)
C48H70N10O11S2·1/2CH3COOC2H2的元素分析:
C H N
计算值(%) 56.06 6.96 13.07
测定值(%) 56.02 6.85 13.08
4)合成苯氧碳酰-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut
将苯氧碳酰-苯丙-OH595毫克溶于15毫升二甲基甲酰胺中,将溶液冷却到-20℃,加入0.219毫升N-甲基吗啉和0.190毫升氯碳酸乙酯。5分钟后,把含1.68克,钯/碳催化还原苯氧碳酰-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut制出的,Hcl·H-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut和含0.299毫升N-甲基吗啉的15毫升的二甲基甲酰胺混入上液,-5℃下搅拌2小时,浓缩后,将残留物溶于乙酸乙酯中,并用碳酸氢钠水溶液和水连续洗涤。把溶剂蒸出,再加乙醚,移出上清,浓缩干燥,得到1.87克透明的苯氧碳酰-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut。
TLC:Rf值0.61(甲醇/氯仿=1∶7)
旋光度:〔α〕D=-34.7°(C=1,甲醇)
C57H79N11O12S2·C2H5OC2H5元素分析:
C H N
计算值(%) 58.68 7.19 12.34
测定值(%) 58.66 6.83 12.42
5)合成叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut
将969毫克叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-OH溶于12毫升的二甲基甲酰胺中。将溶液冷却到-20℃。将0.188毫升N-甲基吗啉和0.163毫升的氯碳酸乙酯加入溶液。5分钟后,将含1.67克,钯/碳催化还原苯氧碳酰-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut制出的,Hcl-H-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-D-丙-OBut溶液和含0.256毫升N-甲基吗啉的15毫升二甲基甲酰胺混在一起,混合液在大约-5℃下,搅拌2小时。浓缩后,残留物在乙酸乙酯中,用碳酸氢钠水溶液和水连续洗涤。减压蒸出溶剂,用甲醇/乙醚固化残留物,从而得到2.196克叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-苯丙-亮-精(对-甲苯磺酰)-CH3精(对甲苯磺酰)-D-丙-OBut。
熔点:130-135℃(dec)
TLC:Rf值0.61(甲醇/氯仿=1∶7)
旋光度:〔α〕D=-40.7°(C=1,甲醇)
C75H102N14O16S2cl2·2CH3OH元素分析:
C H N
计算值(%) 55.89 6.70 11.85
测定值(%) 55.95 6.42 11.78
6)合成CH3酪-甘-甘-苯丙-亮-精-CH3精-D-丙-OH
将200毫克叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-D-丙-OBut溶于10毫升氟氢酸中,于-5℃下,在含0.2毫升苯甲醚的密闭的氟氢酸反应器中,溶液搅拌1小时,然后把氟氢酸从反应系统中蒸出。残留物用乙醚洗涤,然后溶于水,溶液用Amberlite IRA-93处理,经冷冻干燥,得出120毫克粗肽,经用高效液相层析纯出〔Nucleosil 5C 18,2φ×25公分,用0.05%Hcl(H2O/CH3,CN,92/8)洗脱〕后,冷冻干燥,得到60毫克CH3酪-甘-甘-苯丙-亮-精-CH3精-D-丙-OH。
TLC:Rf值0.54(乙醇/乙酸/吡啶/水,15∶5∶5∶8)
旋光度:〔α〕D=-35.1°(C=0.4,0.01N-Hcl)
质谱分析(FAB):967(〔M+H〕+)
氨基酸分析:
甘1.95(2),亮1.00(1),苯丙1.00(1),
精0.99(1),丙1.01(1)
(CH3酪和CH3精的峰值没有计算。)
例31:合成CH3酪-甘-甘-苯丙-亮-精-CH3精-CH3丙-OH:
1)合成苯氧碳酰-CH3精(对-甲苯磺酰)-CH3-丙-OBut:
将4.508克苯氧碳酰-CH3精(对-甲苯磺酰)-OH,1.683克H·cl·CH3丙-OBut,1.533克N-羟基苯并三唑和1.04毫升的N-甲基吗啉溶在10毫升二甲基甲酰胺中。用冰冷却后,加入2.144克二环己基碳化二亚胺,然后将混合液在冰箱中搅拌过夜。滤出形成的沉淀,浓缩滤液,残留物溶于乙酸乙酯,然后用柠檬酸水溶液,碳酸氢钠水溶液和水连续洗涤。浓缩干燥,得到4.24克透明的苯氧碳酰-CH3-精(对-甲苯磺酰)-CH3丙-OBut
TLC:Rf值0.61(甲醇/氯仿,1∶7)
旋光度:〔α〕D=-57.8°(C=1,甲醇)
C30H43N5O7S的元素分析:
C H N
计算值(%) 58.33 7.02 11.33
测定值(%) 58.11 6.88 11.41
2)合成苯氧碳酰-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut:
将用钯/碳催化还原苯氧碳酰-CH3精(对-甲苯磺酰)-CH3现-OBut制出的CH3精(对-甲苯磺酰)-CH3丙-OBut2.90克,与3.329克苯氧碳酰-精(对-甲苯磺酰)-OH,和1.166克N-羟基苯并三唑溶于10毫升的二甲基甲酰胺中。用冰冷却后,加入1.359克二环己基碳化二亚胺。混合液在冰箱中搅拌两天。滤出形成的沉淀,浓缩滤液。残留物用硅胶柱层析纯化(用甲醇/氯仿=1/15洗脱),得到2.1克透明的苯氧碳酰-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)CH3丙-OBut。
ILC:Rf值0.46(甲醇/氯仿=1/7)
旋光度:〔α〕D=-57.1°(C=1,甲醇)
C43H61N9O10S2·3/2H2O的元素分析:
C H N
计算值(%) 54.07 6.75 13.20
测定值(%) 54.10 6.35 13.18
3)合成苯氧碳酰-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut:
将247克苯氧碳酰-亮-OH溶于10毫升二甲基甲酰胺中。溶液冷却到-20℃,加入0.102毫升N-甲基吗啉和0.089毫升氯碳酸乙酯。5分钟后,将含700毫克钯/碳催化还原苯氧碳酰-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut制出的Hcl·H-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)CH3-丙-OBut的溶液和含0.139毫升N-甲基吗啉的10毫升的二甲基甲酰胺加入上液。混合液在大约-5℃下搅拌2小时。浓缩后,残留物溶于乙酸乙酯,然后用碳酸氢钠水溶液和水连续洗涤。蒸出溶剂,加入乙醚,移出上清浓缩干燥,得到透明的苯氧碳酰-亮-精(对-甲苯磺酰)-CH3精(对-甲
苯磺酰)-CH3丙-OBut0.86克。
TLC:Rf值0.48(甲醇/氯仿=1/7)
旋光度:〔α〕D=-60.3°(C=1,甲醇)
C49H72N10O11S2·C2H5OC2H5的元素分析:
C H N
计算值(%) 57.07 7.41 12.55
测定值(%) 56.83 7.02 12.64
4)合成苯氧碳酰-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut
将224毫克苯氧碳酰-苯丙-OH溶于7毫升的二甲基甲酰胺。将溶液冷却到-20℃。再加入0.082毫升N-甲基吗啉和0.071毫升氯酸乙酯。5分钟后,将含640毫克的钯/碳催化还原苯氧碳酰-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut制出的Hcl·H-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut的溶液和含0.112毫升N-甲基吗啉的7毫升二甲基甲酰胺加入上述溶液。混合液在大约-5℃下,搅拌2小时。浓缩后,残留物溶于乙酸乙酯。然后用碳酸氢钠水溶液和水连续洗涤。蒸出溶剂,加入乙醚,移出上清,浓缩干燥,得到770毫克透明的苯氧碳酸-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut。
TLC:Rf值0.54(甲醇/氯仿=1/7)
旋光度:〔α〕D=-59.6°(C=1,甲醇)
C58H81N11O12S2·C2H5OC2H5的元素分析:
C H N
计算值(%) 58.98 7.26 12.20
测定值(%) 58.68 6.91 12.24
5)合成叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut:
将350毫克叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-OH溶于5毫升的二甲基甲酰胺中。将溶液冷却到-20℃,再加入0.068毫升N-甲基吗啉和0.059毫升的氯碳酸乙酯。5分钟后,把含610毫克,钯/碳催化还原苯氧碳酰-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut制出的,Hcl·H-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut的溶液和含0.092毫升N-甲基吗啉的6毫升的二甲基甲酰胺加入上述溶液。混合液在大约-5℃,搅拌2小时。浓缩后,残留物溶于乙酸乙酯,然后用碳酸氢钠水溶液和水连续洗涤。浓缩后,再用甲醇/乙醚固化,得到760毫克叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut。
熔点:125-133℃(dec)
TLC:Rf值0.55(甲醇/氯仿=1/7)
旋光度:〔α〕D=-56.4°(C=1,甲醇)
C76H104N14O16S2Cl2·1/2C2H5OC2H5
计算值(%) 57.06 6.69 11.94
测定值(%) 56.71 6.46 11.49
6)合成CH3酪-甘-甘-苯丙-亮-精-CH3精-CH3丙-OH:
将210毫升叔-丁氧碳酰-CH3酪(氯2苄)-甘-甘-苯丙-亮-精(对-甲苯磺酰)-CH3精(对-甲苯磺酰)-CH3丙-OBut,在一个密闭的氟化氢反应器中,于-5℃下,
溶于含0.2毫升苯甲醚的10毫升氟氢酸中。搅拌此液1小时,然后从反应系统中蒸出氟化氢,用醚洗残留物,再把它溶于水。溶液经用Amberlite IRA-93处理后,冷冻干燥。得到的130毫克粗肽用高效液相层析法纯化〔Nucleosil 5C 18,2φ×25cm,洗脱液为0.05%Hcl(HO/CN CN,91∶9)〕,冷冻干燥,得到50毫克CH3酪-甘-甘-苯丙-亮-精-CH3精-CH3丙-OH。
TLC:Rf值0.54(丁醇/乙酸/吡啶/水=15∶5∶5∶8)
旋光度:〔α〕20 D=-64.7°(C=0.4,0.01N-Hcl)
质谱(FAB):981(〔M+H〕+)
氨基酸分析:
甘氨酸1.92(2),亮氨酸1.04(1),苯丙1.00(1),精氨酸0.986(1)
(CH3精氨酸、CH3丙氨酸和CH3酪氨酸的峰值没有计算。)
例32到41:
表7所示化合物是用与例30和31相同的液相方法合成的。在这些试验中,在1到3位(酪氨酸-甘氨酸-甘氨酸)上修正的dynorphin衍生物,在4到8位的(苯丙氨酸-亮氨酸-精氨酸-精氨酸-异亮氨酸),及在4到9位上(苯丙氨酸-亮氨酸-精氨酸-精氨酸-异亮氨酸-精氨酸),在4到10位上(苯丙氨酸-亮氨酸-精氨酸-精氨酸-异亮氨酸-精氨酸-脯氨酸)修正的dynorphin衍生物都是在每一个肽的C末端开始逐步合成的。然后,1到3位、4到8位,4到9位或4到10位的衍生物用DCC-HOBt法或混合酸酐法缩合在一起。所有保护基均用氟化氢除去,产物用有逆相载体的预制高效液相层析提纯。各个保护肽合成的反应路线,示在图6到图8。
测得的目的肽的旋光度〔α〕20 D、TLC·Rf值和氨基酸分析结果均示在表8。
表7
样品号 化合物
32 CH3酪-甘-甘-苯丙-亮-精-CH3精-异亮-OH
33 CH3酪-甘-甘-苯丙-亮-精-CH3精-天冬-OH
34 CH3酪-甘-甘-苯丙-亮-精-CH3精-D-亮-OH
35 CH3酪-甘-甘-苯丙-亮-精-CH3精-D-谷-OH
36 CH3酪-甘-甘-苯丙-亮-精-CH3精-CH3异亮-OH
37 CH3酪-甘-甘-苯丙-亮-精-CH3精-肌-OH
38 CH3酪-甘-甘-苯丙-亮-精=CH3精-β-丙-OH
39 CH3酪-甘-甘-苯丙-亮-精-CH3精-D-亮-天冬-OH
40 CH3酪-甘-甘-苯丙-亮-精-CH3精-D-亮-苯丙-OH
41 CH3酪-甘-甘-苯丙-亮-精-CH3精-D-亮-精-D-谷-OH
(图6、图7、图8见文后)
表8
样品 旋光度 薄层层析
氨基酸分析
号 〔α〕20 DTLC·Rf值
32 -10.6 0.63 甘1.96,亮1.05,苯丙1.00,精1.01,异亮0.00
33 -35.4 0.48 甘1.96,亮0.99,苯丙1.00,精0.99,天冬1.01
34 -32.4 0.68 甘1.95,亮1.95,苯丙1.00,精0.99
35 -30.8 0.51 甘1.93,亮1.00,苯丙1.00,精1.00,谷1.01
36 -67.1 0.63 甘1.95,亮0.97,苯丙1.00,精0.96
37 -23.9 0.51 甘1.97,亮1.01,苯丙1.00,精1.00
38 -29.2 0.56 甘1.96,亮1.01,苯丙1.00,精1.01
39 -28.6 0.58 甘1.96,亮1.98,苯丙1.00,精1.00,天冬1.06
40 -25.0 0.70 甘1.93,亮2.01,苯丙2.00,精0.96
41 -30.8 0.51 甘1.96,亮1.97,苯丙1.00,精1.99,谷1.01
在氨基酸分析时,只计算了甘氨酸,亮氨酸,苯丙氨酸,精氨酸,异亮氨酸,天冬氨酸和谷氨酸。
旋光度:〔α〕20 D测定时,C=0.4,0.01N-HCl。
TLC·Rf值测定时,丁醇/乙酸/吡啶/水=15∶5∶5∶8。
一些得到的样品化合物,则以上述同样方法试验之。
表9
样品号 尾刺法 ED50(mg/kg)
静脉 皮下
30 0.7 1.9
31 0.5 1.2
34 2.1 0.9
36 0.2 0.4
38 1.7 0.6
dynorphin(1-13) >25.0
表10
样品号 兔输精管法IC50(nM)
30 17.8
31 24.5
36 11.2
dynophin A(1-17) 17.4
表11
样品号 尾刺法ED50最小致死量
(mg/kg) (mg/kg)
30 1.9 >100
31 1.2 >100
36 0.6 >100
Claims (13)
1、制备下式多肽或其药学上可接受的盐的方法:
R1(L-Tyr)-A-Gly-B-C-D-E-F
其中R1作为L-Tyr的α-氨基上的取代基代表氢或低级烷基;A为Gly或D-Cys,条件是当A为Gly时R1为低级烷基,当A为D-Gys时它通过S-S键与第5位的L-Cys键合以形成分子内闭环且R1为氢;B为L-Phe,其中苯环的对位可被硝基取代;C选自L-Leu、α-N-低级烷基L-Leu、L-Cys或L-Met(O),条件是当A为D-Cys时,C为L-Cys且C通过所说S-S键与A键合;D选自L-Arg、α-N-低级烷基L-Arg或L-Lys;E为L-Arg或α-N-低级烷基L-Arg;F为-NH2、-(D-Leu)-OR2、-(D-Leu)-NHR3或-(D-Leu)-(L-Arg)-NHR4,其中R2、R3和R4可相同或不同,且为氢或低级烷基;其特征在于先用合适方法形成有保护基的形式,然后再脱掉保护基从而得到上式肽,需要的话,还可用通常方法把多肽转化为它们的药学上可接受的盐。
2、根据权利要求1的方法,其中多肽具有下式
CH3(L-Tyr)-Gly-Gly-(L-Phe)-(L-Leu)-(L-Arg)-CH3(L-Arg)-(D-Leu)-NHC2H5
其中CH3(L-Tyr)或CH3(L-Arg)表示甲基与每一氨基酸的α-氨基连接。
4、根据权利要求1的方法,其中多肽具有下式
CH3(L-Tyr)-Gly-Gly-(L-Phe)-(L-Leu)-(L-Arg)-CH3(L-Arg)-(D-Leu)-NH2
其中CH3(L-Tyr)或CH3(L-Arg)表示甲基与每一氨基酸的α-氨基连接。
6、根据权利要求1的方法,其中多肽具有下式
CH3(L-Tyr)-Gly-Gly-(L-Phe)-(L-Leu)-(L-Arg)-CH3(L-Arg)-(D-Leu)-(L-Arg)-NHC2H5
7、根据权利要求1的方法,其中序列R1(L-Tyr)-A-Gly-为CH3(L-Tyr)-Gly-Gly-。
8、根据权利要求1的方法,其中序列B-C-D-E-为-(L-Phe)-(L-Leu)-(L-Arg)-CH3(L-Arg)。
10、根据权利要求1的方法,其中序列R1(L-Tyr)-A-Gly-B-C-D-E-为CH3(L-Tyr)-Gly-Gly-(L-phe)-(L-Leu)-(L-Arg)-CH3(L-Arg)-。
11、根据权利要求1的方法,其中A为Gly。
12、根据权利要求1的方法,其中F为-NH2。
13、根据权利要求1的方法,其中F为-(D-Leu)-OR2、-(D-Leu)-NHR3或-(D-Leu)-(L-Arg)-NHR4。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP59236076A JPH0680079B2 (ja) | 1984-11-09 | 1984-11-09 | ポリペプチド |
| JP236076/84 | 1984-11-09 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN85109722A CN85109722A (zh) | 1986-10-08 |
| CN1029684C true CN1029684C (zh) | 1995-09-06 |
Family
ID=16995360
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN85109722A Expired - Lifetime CN1029684C (zh) | 1984-11-09 | 1985-11-02 | 一种新肽及其制造方法 |
Country Status (21)
| Country | Link |
|---|---|
| US (1) | US4707468A (zh) |
| EP (2) | EP0181001B1 (zh) |
| JP (1) | JPH0680079B2 (zh) |
| KR (1) | KR880000765B1 (zh) |
| CN (1) | CN1029684C (zh) |
| AT (1) | ATE135712T1 (zh) |
| AU (1) | AU588837B2 (zh) |
| CA (1) | CA1267997A (zh) |
| DE (1) | DE3588095T2 (zh) |
| DK (1) | DK171300B1 (zh) |
| ES (1) | ES8800272A1 (zh) |
| FI (1) | FI92935C (zh) |
| GR (1) | GR852689B (zh) |
| HU (1) | HU203563B (zh) |
| IL (1) | IL76924A (zh) |
| NO (1) | NO169347C (zh) |
| NZ (1) | NZ214122A (zh) |
| PH (1) | PH23847A (zh) |
| PT (1) | PT81441B (zh) |
| SU (1) | SU1433415A3 (zh) |
| ZA (1) | ZA858456B (zh) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2673376A1 (fr) * | 1991-03-01 | 1992-09-04 | Lefesvre Andre | Composition pharmaceutique pour le traitement des tumeurs de kaposi. |
| US5817628A (en) * | 1992-12-02 | 1998-10-06 | The Rockefeller University | Dynorphin a suppression of natural killer cell activity |
| SE9401596D0 (sv) * | 1994-05-06 | 1994-05-06 | Astra Ab | New compounds |
| JP3385147B2 (ja) * | 1996-01-31 | 2003-03-10 | ユニ・チャーム株式会社 | 男性用尿とり袋 |
| WO1997049422A1 (en) * | 1996-06-24 | 1997-12-31 | The Rockefeller University | Method of using ligands of the kappa opioid receptor |
| JP4394279B2 (ja) * | 1998-03-09 | 2010-01-06 | ジーランド ファーマ アクティーゼルスカブ | 酵素加水分解に対する傾向が減少した薬理学的に活性なペプチド複合体 |
| US6232287B1 (en) * | 1998-03-13 | 2001-05-15 | The Burnham Institute | Molecules that home to various selected organs or tissues |
| IL137820A (en) * | 2000-08-10 | 2009-06-15 | S I S Shulov Inst For Science | Pharmaceutical composition for topical administration comprising an analgesic peptide |
| EP2210598B1 (en) * | 2000-08-25 | 2013-09-18 | Research Corporation Technologies, Inc. | Anticonvulsant amino acids for the treatment of pain |
| EP1243262B1 (en) * | 2001-03-20 | 2006-05-31 | Schwarz Pharma Ag | Novel use of a peptide class of compound for treating non-neuropathic inflammatory pain |
| ES2185606T3 (es) * | 2001-03-21 | 2003-05-01 | Sanol Arznei Schwarz Gmbh | Nuevo uso de una clase de compuestos peptidicos para tratamiento de la alodinia u otros tipos diferentes de dolor cronico o fantasma. |
| US7491702B2 (en) * | 2001-04-18 | 2009-02-17 | The Open University | Polypeptides related to amyloid precursor protein, pharmaceutical compositions thereof, and methods of treatment using the same |
| US7622446B2 (en) * | 2001-04-18 | 2009-11-24 | The Open University | Polypeptides, derivatives and uses thereof |
| MXPA06011937A (es) | 2004-04-16 | 2007-01-26 | Sanol Arznei Schwarz Gmbh | Uso de compuestos peptidicos para la profilaxis y el tratamiento de dolor de cabeza cronico. |
| JP2008510758A (ja) * | 2004-08-27 | 2008-04-10 | シュヴァルツ・ファーマ・アーゲー | 骨肉腫の痛み、化学療法誘発性及びヌクレオシド誘発性の痛みを治療するためのペプチド化合物の新規使用 |
| EP1754476A1 (en) * | 2005-08-18 | 2007-02-21 | Schwarz Pharma Ag | Lacosamide (SPM 927) for treating myalgia, e.g. fibromyalgia |
| US20070043120A1 (en) * | 2005-08-18 | 2007-02-22 | Bettina Beyreuther | Therapeutic combination for painful medical conditions |
| US20070048372A1 (en) * | 2005-08-18 | 2007-03-01 | Srz Properties, Inc. | Method for treating non-inflammatory osteoarthritic pain |
| GB2432586B (en) * | 2005-11-25 | 2010-01-13 | Univ Open | Treatment of neurodegenerative disorders |
| KR20150003925A (ko) | 2006-06-15 | 2015-01-09 | 유씨비 파르마 게엠베하 | 상승적 항경련 효과를 갖는 약제학적 조성물 |
| US20100184698A1 (en) * | 2007-09-11 | 2010-07-22 | Dorian Bevec | Use of a deslorelin and mastoparan as a therapeutic agent |
| RU2010113982A (ru) * | 2007-09-11 | 2011-10-20 | Мондобайотек Лабораториз Аг (Li) | Применение пептида в качестве терапевтического средства |
| EP3574892A4 (en) * | 2017-06-14 | 2020-08-12 | Bio Solution Co., Ltd. | COSMETIC COMPOSITION FOR WRINKLE REDUCTION OR INFLAMMATION PREVENTION WITH THE SUBSTANCE P |
| EP3681900A4 (en) | 2017-09-11 | 2021-09-08 | Protagonist Therapeutics, Inc. | OPIOID AGONIST PEPTIDES AND THEIR USES |
| US20240301023A1 (en) * | 2020-07-01 | 2024-09-12 | PreveCeutical Medical Inc. | Peptides and uses thereof |
| RU2760133C1 (ru) * | 2021-04-22 | 2021-11-22 | Федеральное государственное бюджетное учреждение науки "Научный центр биомедицинских технологий Федерального медико-биологического агентства". | Амиды гептапептида для лечения HMGB1-зависимых заболеваний |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4254106A (en) * | 1976-01-26 | 1981-03-03 | Burroughs Wellcome Co. | Biologically active amides |
| FI70228C (fi) * | 1976-01-26 | 1986-09-15 | Wellcome Found | Foerfarande foer framstaellning av en enkefalin-analog-peptid |
| US4123523A (en) * | 1976-06-21 | 1978-10-31 | Imperial Chemical Industries Limited | Analgesic and sedative polypeptides |
| US4371463A (en) * | 1977-02-17 | 1983-02-01 | The United States Of America As Represented By The Department Of Health And Human Services | Enzyme-resistant opiate pentapeptides |
| US4081434A (en) * | 1977-03-11 | 1978-03-28 | Hoffmann-La Roche Inc. | Novel analogs of β-endorphin |
| US4127533A (en) * | 1977-06-16 | 1978-11-28 | Coy David Howard | Novel octapeptides, intermediates therefor, and compositions and methods employing said octapeptides |
| US4139504A (en) * | 1977-06-16 | 1979-02-13 | Coy David Howard | Novel nonapeptides, intermediates therefor, and compositions and methods employing said nonapeptides |
| GB1604850A (en) * | 1977-11-24 | 1981-12-16 | Wellcome Found | Biologically active peptides |
| US4148786A (en) * | 1978-06-26 | 1979-04-10 | American Home Products Corporation | Analgesic polypeptide |
| US4178284A (en) * | 1978-12-11 | 1979-12-11 | American Home Products Corporation | Octapeptides |
| DE2936099A1 (de) * | 1979-09-06 | 1981-04-02 | Victor Dipl.- Chem. 8000 München Brantl | Pharmakologisch aktive peptide |
| EP0044451B1 (en) * | 1980-07-17 | 1984-04-18 | Sandoz Ag | Novel pentapeptides, processes for their production, pharmaceutical compositions comprising said pentapeptides and their use |
| JPS57134451A (en) * | 1981-02-13 | 1982-08-19 | Suntory Ltd | Peptide opioide |
| EP0076676B1 (en) * | 1981-10-05 | 1986-12-30 | Tni Pharmaceuticals, Inc. | Process for using endorphins as antitumour agents |
| US4462941A (en) * | 1982-06-10 | 1984-07-31 | The Regents Of The University Of California | Dynorphin amide analogs |
| JPS59141547A (ja) * | 1983-02-01 | 1984-08-14 | Eisai Co Ltd | 鎮痛作用を有する新規ペプタイドおよび製法 |
| US4518711A (en) * | 1983-05-16 | 1985-05-21 | Gibson-Stephens Institute | Conformationally constrained cyclic enkephalin analogs with delta receptor specificity |
-
1984
- 1984-11-09 JP JP59236076A patent/JPH0680079B2/ja not_active Expired - Lifetime
-
1985
- 1985-10-28 FI FI854227A patent/FI92935C/fi not_active IP Right Cessation
- 1985-11-02 CN CN85109722A patent/CN1029684C/zh not_active Expired - Lifetime
- 1985-11-04 ZA ZA858456A patent/ZA858456B/xx unknown
- 1985-11-04 IL IL76924A patent/IL76924A/xx not_active IP Right Cessation
- 1985-11-04 PH PH33004A patent/PH23847A/en unknown
- 1985-11-04 KR KR8508213A patent/KR880000765B1/ko not_active IP Right Cessation
- 1985-11-06 AU AU49389/85A patent/AU588837B2/en not_active Ceased
- 1985-11-06 HU HU854270A patent/HU203563B/hu not_active IP Right Cessation
- 1985-11-06 PT PT81441A patent/PT81441B/pt not_active IP Right Cessation
- 1985-11-06 SU SU3974503A patent/SU1433415A3/ru active
- 1985-11-07 GR GR852689A patent/GR852689B/el unknown
- 1985-11-07 ES ES548667A patent/ES8800272A1/es not_active Expired
- 1985-11-07 NO NO854435A patent/NO169347C/no not_active IP Right Cessation
- 1985-11-07 DK DK513385A patent/DK171300B1/da not_active IP Right Cessation
- 1985-11-08 NZ NZ214122A patent/NZ214122A/xx unknown
- 1985-11-08 DE DE3588095T patent/DE3588095T2/de not_active Expired - Fee Related
- 1985-11-08 EP EP85114226A patent/EP0181001B1/en not_active Expired - Lifetime
- 1985-11-08 US US06/796,390 patent/US4707468A/en not_active Expired - Lifetime
- 1985-11-08 EP EP94107769A patent/EP0614913A3/en not_active Withdrawn
- 1985-11-08 CA CA000494974A patent/CA1267997A/en not_active Expired - Fee Related
- 1985-11-08 AT AT85114226T patent/ATE135712T1/de not_active IP Right Cessation
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1029684C (zh) | 一种新肽及其制造方法 | |
| CN1183158C (zh) | Exendin类似物,其制备方法及含有它们的药物制剂 | |
| CN1166403C (zh) | 多相催化蛋白酶的抑制剂 | |
| CN1132845C (zh) | 获得具有正确键合的胱氨酸键的胰岛素前体的改进的方法 | |
| CN1158305C (zh) | 增强了锌结合力的胰岛素衍生物 | |
| CN86101268A (zh) | 新的肽酶抑制剂的制备方法 | |
| CN1041950A (zh) | 新型肽酶抑制剂 | |
| CN88100378A (zh) | 新的肽酶抑制剂 | |
| CN1042918A (zh) | 具有缓激肽拮抗剂作用的肽类 | |
| CN1044820A (zh) | 胰岛素类似物 | |
| CN1050198A (zh) | 新的肽酶和异构酶抑制剂 | |
| CN1217724A (zh) | 降钙素片段的重组制备方法和其在制备降钙素和相关类似物中的用途 | |
| CN1902226A (zh) | 单链胰岛素 | |
| CN1329620A (zh) | 胰高血糖素样肽-1的类似物 | |
| CN1524956A (zh) | 用于产生l-赖氨酸的方法 | |
| CN1535264A (zh) | 精氨酸衍生物 | |
| CN1065874C (zh) | 新的肽及其制备和应用 | |
| CN1195776C (zh) | 肥胖症的治疗 | |
| CN1665931A (zh) | 从膜转运序列衍生的自身聚集或自身团聚嵌合蛋白 | |
| CN1049166A (zh) | Magainin肽的取代类似物 | |
| CN1150028C (zh) | 三-、四-、五-和多肽以及它们作为抗抑郁剂的治疗应用 | |
| CN1099040A (zh) | 线性粘合抑制剂 | |
| CN87102538A (zh) | 与斯柏葛埃林有关的新化合物及其制备方法 | |
| CN1054857C (zh) | 具有胃肠道运动刺激活性的胃动素样多肽 | |
| CN1612891A (zh) | 修饰肽的制造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CX01 | Expiry of patent term |