CN102186495A - 用于增强调理吞噬作用的肺炎球菌p4肽在对病原体应答中的应用 - Google Patents
用于增强调理吞噬作用的肺炎球菌p4肽在对病原体应答中的应用 Download PDFInfo
- Publication number
- CN102186495A CN102186495A CN200980137625XA CN200980137625A CN102186495A CN 102186495 A CN102186495 A CN 102186495A CN 200980137625X A CN200980137625X A CN 200980137625XA CN 200980137625 A CN200980137625 A CN 200980137625A CN 102186495 A CN102186495 A CN 102186495A
- Authority
- CN
- China
- Prior art keywords
- target
- pathogen
- peptide
- antibody
- conditioning
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/164—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/53—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with three nitrogens as the only ring hetero atoms, e.g. chlorazanil, melamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- A61K38/1725—Complement proteins, e.g. anaphylatoxin, C3a or C5a
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/40—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum bacterial
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/42—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum viral
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Marine Sciences & Fisheries (AREA)
- Zoology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Virology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
本发明公开了用于增强对目标病原体的调理吞噬作用的方法。所公开的方法包括向对象给药分离的P4肽,所述P4肽包括SEQ ID NO:1所显示的氨基酸序列,以及任选的特异性结合目标病原体表面上存在的抗原的分离的调理性抗体或其片段。在某些实例中,也给药分离的补体蛋白或其片段(例如补体蛋白的C3a、C3b、iC3b、C3d、C4b或C5a片段)。还公开了含有分离的P4肽和特异性结合目标病原体表面上存在的抗原的一种或多种分离的调理性抗体或其片段的组合物。在某些实例中,组合物还包含分离的补体蛋白或其片段,例如C3a、C3b、iC3b、C3d、C4b或C5a中的一种或多种。
Description
与相关申请的交叉参考
本申请要求2008年7月31日提交的美国临时专利申请No.61/085,208的优先权,所述申请在此以其全文引为参考。
技术领域
本公开涉及用于治疗和/或预防病原性感染、具体来说用于增强调理性抗体在病原体的调理吞噬中的有效性的组合物和方法。
背景技术
在过去的一个世纪中,对抗感染例如病毒感染、真菌感染、细菌感染等的药剂的开发,已在全世界大大增加了平均寿命。但是,病原体不断发展出避开或绕过现有治疗方法的途径。例如,传统抗生素例如青霉素和相关化合物的广泛使用,已导致发展出对这些传统抗生素具有抗性的细菌,例如耐甲氧西林金黄色葡萄球菌(Staphylococcus aureus)(MRSA)的出现。同样地,病毒病原体例如HIV,能够在几个复制周期内就获得对抗病毒剂的抗性。
为了对抗病原体千变万化的局面和不断出现的对现有疗法的抗性,制药公司的标准做法是开发不断增加的一系列小分子治疗药剂。作为供选方案,已经开发了通过引发针对靶病原体的抗体应答来刺激身体对抗感染的疫苗。
抗体通过识别并结合病原体上的抗原以促进通过被称为吞噬作用的过程移除或“清除”病原体,来对抗病原体攻击执行保护,在所述吞噬作用中,吞噬细胞(例如中性粒细胞和巨噬细胞)识别、吞食并随后破坏病原体。但是,一些病原体,例如某些细菌,能够避开吞噬作用。 细菌能够产生抑制吞噬细胞附着的“荚膜”。调理性抗体通过在被称为调理作用的过程中与荚膜或细菌上的其他靶抗原结合,来克服这些防御机制。这触发了补体级联,产生一组具有调理和裂解活性的血清蛋白质。调理性抗体与补体成分例如C3a和C5a一起结合细菌,使细菌极其吸引吞噬细胞,并增加了细菌从血流的清除率。最近的研究已经利用到调理性抗体,通过纯化调理性抗体并向对象给药这些抗体来治疗感染。尽管调理性抗体的使用在治疗和/或预防病原体感染方面显示出一些希望,但对于增加这些抗体的功效以例如减少获得治疗有效性结果所需的调理性抗体的量上,存在着需求。本文公开的方法满足了这些需求。
发明概述
本文公开的方法涉及增强调理性抗体的调理性质以增加病原体的调理吞噬作用。这种增强是基于一个意外的发现,即包含SEQ ID NO:1所显示的氨基酸序列的P4肽增加了效应细胞将调理性抗体结合的病原体内化的能力。因为P4肽以不加区别的方式增加效应细胞调理吞噬被调理性抗体结合的病原体的能力,因此通过使用特异性针对任何目标病原体的调理性抗体,P4肽能有潜力用于靶向任何目标病原体。在具体实例中,P4肽与特异性针对(例如特异性结合)所选目标病原体的调理性抗体共同给药。因此,本文公开的方法能够用于抑制和/或治疗来自任何目标病原体的感染。
所公开的在对象中增强对目标病原体的调理吞噬作用的方法,包括向对象给药治疗有效量的含有SEQ ID NO:1所显示氨基酸序列的分离P4肽。也可以向对象给药特异性结合目标病原体表面上存在的抗原的治疗有效量的分离的调理性抗体或其片段(或甚至多种调理性抗体),用来例如靶向目标病原体。通过给药P4肽,增加了调理性抗体的调理活性(不论调理性抗体是由对象产生还是给药于对象),从而增强了对目标病原体的调理吞噬作用。在所公开的方法的某些实例中,还向对象给药分离的补体蛋白或其片段(例如补体蛋白的C3a、C3b、 iC3b、C3d、C4b或C5a片段)。在所公开的方法的某些实施方案中,还向对象给药抗生素。
通过使用与所选目标病原体结合的调理性抗体(或与几种目标病原体结合的抗体),所公开的方法可用于增强对任何目标病原体的调理吞噬作用,其中所述目标病原体是例如目标细菌病原体、目标病毒病原体、病毒感染的细胞或目标真菌病原体,例如在术语概述中阐释的目标病原体。在具体实例中,目标病原体是肺炎链球菌(Streptococcus pneumoniae)、化脓性链球菌(Streptococcus pyogenes)、脑膜炎奈瑟菌(Neisseria meningitides)、或金黄色葡萄球菌(Staphylococcus aureus),例如耐甲氧西林金黄色葡萄球菌(MRSA)。在某些实例中,使用药物增强对任何目标病原体的调理吞噬作用,用于例如治疗目标病原体的感染,所述目标病原体是例如目标细菌病原体、目标病毒病原体、病毒感染的细胞或目标真菌病原体,例如在术语概述中阐释的目标病原体。
还公开了用于治疗和/或抑制目标病原体感染、用于制造药物和/或用作药物的组合物,例如治疗组合物。所公开的治疗组合物包含治疗有效量的含有SEQ ID NO:1所显示氨基酸序列的分离的P4肽,以及治疗有效量的特异性结合目标病原体表面上存在的抗原的一种或多种分离的调理性抗体或其片段。在某些实施方案中,所公开的治疗组合物包括治疗有效量的分离的补体蛋白或其片段,例如C3a、C3b、iC3b、C3d、C4b或C5a中的一种或多种。在某些实施方案中,所公开的治疗组合物包括治疗有效量的抗生素。
从下面参考附图进行的详细描述中,本发明的上述以及其他的目的、特点和优点将变得更加明了。
附图简述
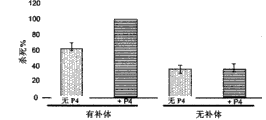
图1A-1C是一组条形图,证实了P4介导的体外调理吞噬作用的增 强。图1A是显示抗体浓度对调理吞噬作用的影响的条形图。在1∶8稀释的γ-球蛋白下,肺炎链球菌(Streptococcus pneumoniae)血清型3(WU2)的调理吞噬性杀死(OPK)与对照相比增加35%;这种效应随着稀释而滴度下降,在1∶32稀释下与对照获得的结果平行。图1B是显示补体对调理吞噬作用的影响的条形图。不论是否存在P4,体外OPK都需要仔兔补体。无补体的分析组接受热失活的补体(56℃下30分钟)。图1C是显示P4浓度对调理吞噬作用的影响的条形图。随着P4浓度的增加,可以观察到肺炎链球菌(S.pneumonia)血清型3(WU2)与对照相比OPK的逐渐增加。使用1∶8稀释的γ-球蛋白作为血清特异性IgG的来源。
图2A-2C是一组条形图,证实了通过流式细胞术测定到的P4介导的体外调理吞噬作用的增强。图2A是条形图,证实了P4(100μg/mL)在HL-60衍生的粒细胞中增加呼吸爆发。使用自产(in-house)质量控制血清(QC2)测试了用OXYBURST 标记的肺炎链球菌血清型23F荚膜多糖(Ps)包被的珠子被粒细胞的调理吞噬性摄取(OPU)。OXYBURST 信号的峰值位于1∶3200的血清稀释度处。图2B是条形图,证实了在QC2存在下,P4(100μg/mL)增加了用肺炎链球菌血清型14的Ps包被的珠子被从人类血液新鲜分离的粒细胞的OPU。图2C是条形图,证实了在自产质量控制血清QC268存在下,P4(100μg/mL)增加了用脑膜炎奈瑟菌(N.meningitidis)A的Ps包被的珠子被HL-60衍生的单核细胞的OPU。
图3是证明了P4与血清型特异性IgG针对致命性鼻内肺炎链球菌血清型3(WU2)激惹提供保护作用的图。在激惹后72和96小时时静脉内(iv)注射P4(100μg/小鼠)和γ-球蛋白(100μL/小鼠),提供了针对致命性肺炎链球菌WU2感染的高度显著的保护作用(80%;P<.001),有效性其次的是通过腹膜内(ip)途径给药(60%;P<.001)。
图4是证实了各种治疗分支中的小鼠和对照小鼠在暴露于肺炎链球菌血清型3(WU2)后的存活率的图。P4和γ-球蛋白(IVIG)混合物的单剂iv注射与头孢曲松(Ceft)的ip注射,与未处理的对照相比提供了非常显著的保护作用(100%;P<0.05)。
图5是显示了对以前用P4组合疗法援救、在第28天时用肺炎链球菌 血清型3(WU2)重新感染的小鼠(◆)影响的图。在2天后给药单剂P4、γ-球蛋白(IVIG)和头孢曲松。所有动物(100%)都得到保护。
图6是一组条形图,显示了使用从感染后1和2小时的小鼠或从未感染小鼠分离的外周血PMN进行的体外调理吞噬性杀死分析(OPKA)的结果。γ-球蛋白(IVIG)被用作血清型特异性抗体的来源。与使用来自未接受P4的对照小鼠的PMN相比,加入P4使肺炎链球菌血清型3(WU2)的调理吞噬杀死增加了≥80%(P<0.05)。
序列
在随附的序列名单中列出的氨基酸序列,使用用于氨基酸的标准三字母编码来显示。
SEQ ID NO:1是示例性P4肽的氨基酸序列。
详细描述
I.术语概述
除非另外指明,否则技术术语按照常规用法使用。分子生物学中的常见术语的定义可见于:Benjamin Lewin,《基因VII》(Genes VII),由牛津大学出版社(Oxford University Press)出版,1999;Kendrew等主编,《分子生物学百科全书》(The Encyclopedia of Molecular Biology),由Blackwell Science Ltd.出版,1994;和Robert A.Meyers主编,《分子生物学和生物技术:全面桌面参考》(Molecular Biology and Biotechnology:a Comprehensive Desk Reference),由VCH Publishers,Inc.出版,1995;以及其他类似参考书。
当在本文中使用时,除非上下文明确另有指明,否则不带具体数量指示的名词既指单数、也指复数。例如,术语“P4肽”包括单个或多个肽,并可以被认为与词组“至少一个P4肽”等价。
本文中使用的术语“包含”意味着“包括”。因此,“包含P4肽”意味 着“包括P4肽”,不排除其他要素。
此外应该理解,除非另有指明,否则对于核酸或多肽所给出的所有碱基大小或氨基酸大小以及所有的分子量或分子质量值,都是近似值,提供其是为了说明性目的。尽管与本文所述的相似或等价的方法和材料均可以使用,但下面描述了特别适合的方法和材料。在有冲突的情况下,以本说明书包括术语的解释为准。此外,材料、方法和实例仅仅是说明性的,而不打算是限制性的。
为了便于审阅本公开的各种实施方案,提供了下列术语的解释:
给药:通过选定的途径将组合物导入对象中。例如,如果所选途径是静脉内,那么通过将组合物导入对象的静脉中进行组合物给药。同样地,如果给药途径是鼻内,组合物通过鼻给药。
动物:活的多细胞有脊椎或无脊椎生物体,类别包括例如哺乳动物和鸟类。术语哺乳动物包括人类和非人类哺乳动物二者。同样地,术语“对象”包括人类和兽医对象,例如非人类灵长动物。因此,向对象给药可以包括向人类对象给药。兽医对象的具体实例包括家养动物(例如猫和狗)、家畜(例如牛、马、猪、绵羊和山羊)、实验室动物(例如小鼠、兔、大鼠、沙鼠、豚鼠和非人类灵长动物)以及鸟类、爬行类和鱼类等。
抗生素:抑制细菌生长和/或杀死细菌的化合物、组合物或物质。术语抗生素也可用于指称一种以上抗生素。可用于本公开的方法和组合物的抗生素的实例包括但不限于氨基糖苷类(例如阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、链霉素、妥布霉素和巴龙霉素);安沙霉素类(例如格尔德霉素和除莠霉素);碳头孢烯类(例如氯碳头孢、厄他培南、多尼培南、亚胺培南/西司他汀和美罗培南);头孢菌素类(例如头孢羟氨苄、头孢唑啉、头孢噻吩、头孢氨苄、头孢克 洛、头孢孟多、头孢西丁、头孢丙烯、头孢呋辛、头孢克肟、头孢地尼、头孢妥仑、头孢哌酮、头孢噻肟、头孢泊肟、头孢他啶、头孢布烯、头孢唑肟、头孢曲松、头孢吡肟和头孢托罗);糖肽类(例如替考拉宁和万古霉素);大环内酯类(例如阿奇霉素、克拉霉素、地红霉素、红霉素、罗红霉素、醋竹桃霉素、泰利霉素和壮观霉素);单酰胺菌素类(例如氨曲南);青霉素类(例如阿莫西林、氨苄青霉素、阿洛西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、甲氧西林、萘夫西林、苯唑西林、青霉素、哌拉西林和替卡西林);多肽类(例如杆菌肽、粘杆菌素和多粘菌素b);喹诺酮类(例如环丙沙星、依诺沙星、加替沙星、左氧氟沙星、洛美沙星、莫西沙星、诺氟沙星、氧氟沙星、曲伐沙星、格帕沙星和司帕沙星);磺胺类(例如磺胺米隆、百浪多息(已废止)、乙酰磺胺、磺胺甲噻二唑、磺胺二甲异噁唑(已废止)、柳氮磺胺吡啶、磺胺异噁唑、甲氧苄啶和甲氧苄啶-磺胺甲基异噁唑);四环素类(例如地美环素、多西环素、米诺环素、土霉素和四环素);以及其他(例如胂凡纳明、氯霉素、克林霉素、林可霉素、乙胺丁醇、磷霉素、夫西地酸、呋喃唑酮、异烟肼、利奈唑胺、甲硝唑、莫匹罗星、呋喃妥因、平板霉素、吡嗪酰胺、奎奴普汀/达福普汀、利福平、甲砜霉素和替硝唑)。
抗原:能够在哺乳动物中刺激抗体(例如功能性抗体)产生或T细胞应答的化合物、组合物或物质,包括注射、吸收或通过其他方法导入到哺乳动物中的组合物。实例包括但不限于含有抗原决定簇、例如被免疫细胞识别的抗原决定簇的肽类、脂类、多糖和核酸。在某些实例中,抗原包括源自于目标病原体的肽。示例性病原体包括细菌、真菌、病毒和寄生虫。来自目标病原体的抗原可用于产生特异性结合目标病原体并参与对病原体的调理吞噬作用的调理性抗体。
抗体:免疫球蛋白及其免疫活性部分(“片段”),例如包含与抗原特异性结合(发生免疫反应)的抗原结合位点的分子。天然存在的抗体(例如IgG、IgM和IgA)包括4条多肽链,两条重链(H)和两 条轻链(L)通过二硫键互相连接。其免疫活性部分的实例包括但不限于Fab、Fab′、F(ab′)2、Fabc和Fv部分。功能性抗体是特异性结合抗原例如病原体表面上存在的抗原、能够有效允许补体固着、并且也与效应细胞相互作用的抗体,其中抗体与效应细胞的相互作用引起效应细胞将抗体内化以及对病原体的调理吞噬作用。
细菌病原体:引起疾病的细菌(病原性细菌)。可以按照本公开的方法增强针对其调理吞噬作用的病原性细菌,包括但不限于下列细菌中的任一种或多种(或其任何组合):鲍曼不动杆菌(Acinetobacter baumanii)、放线杆菌菌种(Actinobacillus sp.)、放线菌纲(Actinomycetes)、放线菌属(Actinomyces sp.)(例如伊氏放线菌(Actinomyces israelii)和内氏放线菌(Actinomyces naeslundii))、气单胞菌属(Aeromonas sp.)(例如嗜水气单胞菌(Aeromonas hydrophila)、维罗纳气单胞菌温和生物变种(Aeromonas veronii biovar sobria)(温和气单胞菌Aeromonas sobria)和豚鼠气单胞菌(Aeromonas caviae))、嗜吞噬细胞无形体(Anaplasma phagocytophilum)、边缘无浆体(Anaplasma marginale)、木糖氧化产碱菌(Alcaligenes xylosoxidans)、鲍曼不动杆菌(Acinetobacter baumanii)、伴放线放线杆菌(Actinobacillus actinomycetemcomitans)、芽孢杆菌属(Bacillus sp.)(例如炭疽芽孢杆菌(Bacillus anthracis)、蜡状芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、苏云金杆菌(Bacillus thuringiensis)和嗜热脂肪芽孢杆菌(Bacillus stearothermophilus))、拟杆菌属(Bacteroides sp.)(例如脆弱拟杆菌(Bacteroides fragilis))、巴尔通氏体属(Bartonella sp.)(例如杆菌状巴尔通氏体(Bartonella bacilliformis)和汉氏巴尔通氏体(Bartonella henselae))、双歧杆菌属(Bifidobacterium sp.)、包特氏菌属(Bordetella sp.)(例如百日咳包特氏菌(Bordetella pertussis)、副百日咳包特氏菌(Bordetella parapertussis)和支气管炎包特氏菌(Bordetella bronchiseptica))、疏螺旋体属(Borrelia sp.)(例如回归热螺旋体(Borrelia recurrentis)和伯氏疏螺旋体(Borrelia burgdorferi))、布鲁氏菌属(Brucella sp.) (例如流产布鲁氏菌(Brucella abortus)、犬布鲁氏菌(Brucella canis)、马尔他布鲁氏菌(Brucella melintensis)和猪布鲁氏菌(Brucella suis))、伯克霍尔德氏菌属(Burkholderia sp.)(例如类鼻疽伯克霍尔德氏菌(Burkholderia pseudomallei)和洋葱伯克霍尔德氏菌(Burkholderia cepacia))、弯曲杆菌属(Campylobacter sp.)(例如空肠弯曲杆菌(Campylobacter jejuni)、大肠弯曲杆菌(Campylobacter coli)、红嘴鸥弯曲杆菌(Campylobacter lari)和胎儿弯曲杆菌(Campylobacter fetus))、二氧化碳噬纤维菌属(Capnocytophaga sp.)、人类心杆菌(Cardiobacterium hominis)、沙眼衣原体(Chlamydia trachomatis)、肺炎嗜衣原体(Chlamydophila pneumoniae)、鹦鹉热衣原体(Chlamydophila psittaci)、柠檬酸杆菌属(Citrobacter sp.)、伯纳特氏柯克斯氏体(Coxiella burnetii)、棒状杆菌属(Corynebacterium sp.)(例如白喉棒状杆菌(Corynebacterium diphtheriae)、杰氏棒状杆菌(Corynebacterium jeikeum)和棒状杆菌(Corynebacterium))、梭状芽胞杆菌属(Clostridium sp.)(例如产气荚膜梭状芽胞杆菌(Clostridium perfringens)、艰难梭状芽胞杆菌(Clostridium difficile)、肉毒梭状芽胞杆菌(Clostridium botulinum)和破伤风梭状芽胞杆菌(Clostridium tetani))、啮蚀艾肯氏菌(Eikenella corrodens)、肠杆菌属(Enterobacter sp.)(例如产气肠杆菌(Enterobacter aerogenes)、集聚肠杆菌(Enterobacter agglomerans)、阴沟肠杆菌(Enterobacter cloacae)和大肠埃希氏菌(Escherichia coli),包括机会致病性大肠埃希氏菌例如肠毒性大肠埃希氏菌(enterotoxigenic E.coli)、肠侵袭性大肠埃希氏菌(enteroinvasive E.coli)、肠致病性大肠埃希氏菌(enteropathogenic E.coli)、肠出血性大肠埃希氏菌(enterohemorrhagic E.coli)、肠聚集性大肠埃希氏菌(enteroaggregative E.cColi)和尿路致病性大肠埃希氏菌(uropathogenic E.coli))、肠球菌属(Enterococcus sp.)(例如粪肠球菌(Enterococcus faecalis)和屎肠球菌(Enterococcus faecium))、埃里希体菌属(Ehrlichia sp.)(例如查菲埃里希体(Ehrlichia chafeensia)和犬埃里希体(Ehrlichia canis))、猪红斑丹毒丝菌(Erysipelothrix rhusiopathiae)、真杆菌属(Eubacterium sp.)、土拉 弗朗西斯菌(Francisella tularensis)、具核梭杆菌(Fusobacterium nucleatum)、阴道加德纳氏菌(Gardnerella vaginalis)、麻疹孪生球菌(Gemella morbillorum)、嗜血杆菌属(Haemophilus sp.)(例如流感嗜血杆菌(Haemophilus influenzae)、杜克雷嗜血杆菌(Haemophilus ducreyi)、埃及嗜血杆菌(Haemophilus aegyptius)、副流感嗜血杆菌(Haemophilus parainfluenzae)、溶血嗜血杆菌(Haemophilus haemolyticus)和副溶血嗜血杆菌(Haemophilus parahaemolyticus))、螺杆菌属(Helicobacter sp.)(例如幽门螺杆菌(Helicobacter pylori)、同性恋螺杆菌(Helicobacter cinaedi)和芬纳尔螺杆菌(Helicobacter fennelliae))、金氏金格杆菌(Kingella kingii)、克雷伯氏菌属(Klebsiella sp.)(例如肺炎克雷伯氏菌(Klebsiella pneumoniae)、肉芽肿克雷伯氏菌(Klebsiella granulomatis)和产酸克雷伯氏菌(Klebsiella oxytoca))、乳酸杆菌属(Lactobacillus sp.)、单核增生性李斯特菌(Listeria monocytogenes)、问号钩端螺旋体(Leptospira interrogans)、嗜肺军团菌(Legionella pneumophila)、问号钩端螺旋体(Leptospira interrogans)、消化链球菌属(Peptostreptococcus sp.)、溶血曼海姆菌(Mannheimia hemolytica)、卡他莫拉菌(Moraxella catarrhalis)、摩根氏菌属(Morganella sp.)、动弯杆菌属(Mobiluncus sp.)、微球菌属(Micrococcus sp.)、分枝杆菌属(Mycobacterium sp.)(例如麻风分枝杆菌(Mycobacterium leprae)、结核分枝杆菌(Mycobacterium tuberculosis)、副结核分枝杆菌(Mycobacterium paratuberculosis)、胞内分枝杆菌(Mycobacterium intracellulare)、鸟分枝杆菌(Mycobacterium avium)、牛分枝杆菌(Mycobacterium bovis)和海洋分枝杆菌(Mycobacterium marinum))、支原体菌属(Mycoplasm sp.)(例如肺炎支原体(Mycoplasma pneumoniae)、人型支原体(Mycoplasma hominis)和生殖道支原体(Mycoplasma genitalium))、诺卡菌属(Nocardia sp.)(例如星形诺卡菌(Nocardia asteroides)、盖尔森基兴诺卡菌(Nocardia cyriacigeorgica)和巴西诺卡菌(Nocardia brasiliensis))、奈瑟菌属(Neisseria sp.)(例如淋病奈瑟菌(Neisseria gonorrhoeae)和脑膜炎奈瑟菌(Neisseria meningitidis))、多杀巴斯 德杆菌(Pasteurella multocida)、类志贺邻单胞菌(Plesiomonas shigelloides)、普氏菌属(Prevotella sp.)、卟啉菌属(Porphyromonas sp.)、产黑普氏菌(Prevotella melaninogenica)、变形杆菌属(Proteus sp.)(例如普通变形杆菌(Proteus vulgaris)和奇异变形杆菌(Proteus mirabilis))、普罗威登斯菌属(Providencia sp.)(例如产碱普罗威登斯菌(Providencia alcalifaciens)、雷氏普罗威登斯菌(Providencia rettgeri)和斯氏普罗威登斯菌(Providencia stuartii))、铜绿假单胞菌(Pseudomonas aeruginosa)、痤疮丙酸杆菌(Propionibacterium acnes)、马红球菌(Rhodococcus equi)、立克次氏体菌属(Rickettsia sp.)(例如立氏立克次氏体(Rickettsia rickettsii)、小株立克次氏体(Rickettsia akari)和普氏立克次氏体(Rickettsia prowazekii))、恙虫病东方体(Orientia tsutsugamushi)(旧称:恙虫热立克次氏体(Rickettsia tsutsugamushi)和斑疹伤寒立克次氏体(Rickettsia typhi))、红球菌属(Rhodococcus sp.)、粘质沙雷氏菌(Serratia marcescens)、嗜麦芽寡养单孢菌(Stenotrophomonas maltophilia)、沙门氏菌属(Salmonella sp.)(例如肠道沙门氏菌(Salmonella enterica)、伤寒沙门氏菌(Salmonella typhi)、副伤寒沙门氏菌(Salmonella paratyphi)、肠炎沙门氏菌(Salmonella enteritidis)、猪霍乱沙门氏菌(Salmonella cholerasuis)和鼠伤寒沙门氏菌(Salmonella typhimurium))、沙雷氏菌属(Serratia sp.)(例如粘质沙雷氏菌(Serratia marcesans)和液化沙雷氏菌(Serratia liquifaciens))、志贺氏菌属(Shigella sp.)(例如痢疾志贺氏菌(Shigella dysenteriae)、福氏志贺氏菌(Shigella flexneri)、鲍氏志贺氏菌(Shigella boydii)和索氏志贺菌(Shigella sonnei))、葡萄球菌属(Staphylococcus sp.)(例如金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、溶血性葡萄球菌(Staphylococcus hemolyticus)、腐生葡萄球菌(Staphylococcus saprophyticus))、链球菌属(Streptococcus sp.)(例如肺炎链球菌(Streptococcus pneumoniae)(例如耐氯霉素肺炎链球菌血清型4(chloramphenicol-resistant serotype 4 Streptococcus pneumoniae)、耐壮观霉素肺炎链球菌血清型6B(spectinomycin-resistant serotype 6B Streptococcus pneumoniae)、耐链霉素肺炎链球菌血清型9V(streptomycin-resistant serotype 9V Streptococcus pneumoniae)、耐红霉素肺炎链球菌血清型14(erythromycin-resistant serotype 14 Streptococcus pneumoniae)、耐奥普托欣肺炎链球菌血清型14(optochin-resistant serotype 14 Streptococcus pneumoniae)、耐利福平肺炎链球菌血清型18C(rifampicin-resistant serotype 18C Streptococcus pneumoniae)、耐四环素肺炎链球菌血清型19F(tetracycline-resistant serotype 19F Streptococcus pneumoniae)、耐青霉素肺炎链球菌血清型19F(penicillin-resistant serotype 19F Streptococcus pneumoniae)和耐甲氧苄啶肺炎链球菌血清型23F(trimethoprim-resistant serotype 23F Streptococcus pneumoniae)、耐氯霉素肺炎链球菌血清型4(chloramphenicol-resistant serotype 4 Streptococcus pneumoniae)、耐壮观霉素肺炎链球菌血清型6B(spectinomycin-resistant serotype 6B Streptococcus pneumoniae)、耐链霉素肺炎链球菌血清型9V(streptomycin-resistant serotype 9V Streptococcus pneumoniae)、耐奥普托欣肺炎链球菌血清型14(optochin-resistant serotype 14 Streptococcus pneumoniae)、耐利福平肺炎链球菌血清型18C(rifampicin-resistant serotype 18C Streptococcus pneumoniae)、耐青霉素肺炎链球菌血清型19F(penicillin-resistant serotype 19F Streptococcus pneumoniae)或耐甲氧苄啶肺炎链球菌血清型23F(trimethoprim-resistant serotype 23F Streptococcus pneumoniae))、无乳链球菌(Streptococcus agalactiae)、变形链球菌(Streptococcus mutans)、化脓性链球菌(Streptococcus pyogenes)、A群链球菌(Group A streptococci)、化脓性链球菌(Streptococcus pyogenes)、B群链球菌(Group B streptococci)、无乳链球菌(Streptococcus agalactiae)、C群链球菌(Group C streptococci)、咽峡炎链球菌(Streptococcus anginosus)、类马链球菌(Streptococcus equismilis)、D群链球菌(Group D streptococci)、牛链球菌(Streptococcus bovis)、F群链球菌(Group F streptococci)和咽峡炎链球菌(Streptococcus anginosus)、G群链球菌(Group G streptococci))、鼠咬热螺菌(Soirillum minus)、念珠 链杆菌(Streptobacillus moniliformi)、密螺旋体属(Treponema sp.)(例如斑点病密螺旋体(Treponema carateum)、极细密螺旋体(Treponema petenue)、梅毒密螺旋体(Treponema pallidum)和地方性密螺旋体(Treponema endemicum))、正惠普尔养障体(Tropheryma whippelii)、解脲支原体(Ureaplasma urealyticum)、韦荣氏球菌属(Veillonella sp.)、弧菌属(Vibrio sp.)(例如霍乱弧菌(Vibrio cholerae)、副溶血性弧菌(Vibrio parahemolyticus)、创伤弧菌(Vibrio vulnificus)、副溶血性弧菌(Vibrio parahemolyticus)、创伤弧菌(Vibrio vulnificus)、溶藻弧菌(Vibrio alginolyticus)、拟态弧菌(Vibrio mimicus)、霍氏弧菌(Vibrio hollisae)、河流弧菌(Vibrio fluvialis)、麦奇尼科夫氏弧菌(Vibrio metchnikovii)、美人鱼弧菌(Vibrio damsela)和弗氏弧菌(Vibrio furnisii))、耶尔森氏菌属(Yersinia sp.)(例如小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)、鼠疫耶尔森氏菌(Yersinia pestis)和假结核耶尔森氏菌(Yersinia pseudotuberculosis)),以及嗜麦芽黄单孢菌(Xanthomonas maltophilia)等。
细胞:植物、动物、昆虫、细菌或真菌细胞。
保守氨基酸取代在本技术领域中是公知的,其提供功能上类似的氨基酸,下面的6个组每个含有彼此保守取代的氨基酸:
1)丙氨酸(A)、丝氨酸(S)、苏氨酸(T);
2)天冬氨酸(D)、谷氨酸(E);
3)天冬酰胺(N)、谷氨酰胺(Q);
4)精氨酸(R)、赖氨酸(K);
5)异亮氨酸(I)、亮氨酸(L)、甲硫氨酸(M)、缬氨酸(V);以及
6)苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W)。
蛋白中不是所有的残基位置都耐受本来是“保守的”取代。例如,如果氨基酸残基对于蛋白功能是必需的,那么即使本来是保守的取代 也可能破坏该活性。
补体:参与免疫防御的血浆蛋白系统。在被抗原-抗体复合物活化后,补体蛋白裂解抗原性细胞,吸引吞噬细胞,并辅助通过调理吞噬作用破坏抗原性细胞。在哺乳动物中,补体系统由一系列约25种蛋白构成,所述蛋白通过促进调理吞噬作用或通过刺穿细菌细胞膜,在破坏细菌中起到“补充”抗体活性的作用。补体还通过例如清除被调理性抗体结合的病原体,来帮助身体摆脱抗原-调理性抗体复合物。
补体蛋白以无活性形式在血液中循环。当第一种补体物质被引发时,通常是由与抗原互锁的抗体引发。因为每种组分被相继激活,它在被称为“补体级联”的一系列顺序精确的细致调控的步骤中作用于下一种组分。
补体片段(例如C3a、C3b、iC3b、C3d、C4b或C5a,其在补体活化过程中变得与抗原结合)通过结合特异性细胞表面受体(例如中性粒细胞和巨噬细胞上的Fc受体和C3b受体,以及巨噬细胞上的C3d受体)触发调理吞噬作用。在某些实例中,效应细胞对抗体/抗原复合物的调理吞噬作用的活性被P4肽的存在所增强。
效应细胞:能够结合抗体/抗原复合物并将这些复合物内化的细胞。在具体实例中,效应细胞表达与抗体/抗原复合物结合并促进内化的Fc受体,例如FcγRI、FcγRII和FcγRIII。在某些实例中,效应细胞源自于个体的血清(例如外周血白细胞PBL)或源自于体外培养。效应细胞的实例包括但不限于:巨噬细胞、单核吞噬细胞、自然杀伤细胞和粒细胞例如中性粒细胞和嗜曙红细胞。在具体实例中,效应细胞是分化的人类早幼粒细胞性白血病细胞,例如分化的HL-60细胞。
表位:抗原决定簇。它们是具有抗原性、以便能够引发特异性免疫应答的分子上的特定化学基团或肽序列。抗体结合特定抗原性表位, 例如病原体表面上的表位。
外源:从其所给药的对象之外的来源获得的物质,例如分离的调理性抗体或其片段的补体蛋白。例如,当外源的分离的调理性抗体按照本文描述的方法和组合物给药于对象时,不能获得该分离的抗体,例如从它所给药的同一个对象中分离出。
真菌病原体:引起疾病的真菌。可以按照本公开的方法增强对其调理吞噬作用的真菌病原体的实例包括但不限于红色毛癣菌(Trichophyton rubrum)、石膏样毛癣菌(T.mentagrophytes)、絮状表皮癣菌(Epidermophyton floccosum)、犬小孢子菌(Microsporum canis)、糠秕孢子菌(Pityrosporum orbiculare)(秕糠马拉色癣菌Malassezia furfur)、假丝酵母属(Candida sp.)(例如白色假丝酵母(Candida albicans))、曲霉属(Aspergillus sp.)(例如烟曲霉(Aspergillus fumigatus)、黄曲霉(Aspergillus fiavus)和棒状曲霉(Aspergillus clavatus))、隐球菌属(Cryptococcus sp.)(例如新型隐球菌(Cryptococcus neoformans)、格特隐球菌(Cryptococcus gattii)、罗伦隐球菌(Cryptococcus laurentii)和浅白隐球菌(Cryptococcus albidus))、组织胞浆菌属(Histoplasma sp.)(例如荚膜组织胞浆菌(Histoplasma capsulatum))、肺孢子虫属(Pneumocystis sp.)(例如耶氏肺孢子虫(Pneumocystis jirovecii))和葡萄穗霉属(Stachybotrys)(例如纸葡萄穗霉(Stachybotrys chartarum))等。
抑制或治疗疾病:在处于疾病例如病原体感染如细菌、真菌或病毒病原体感染的风险的对象中,抑制疾病或病症的全面发生。“治疗”是指在疾病或病理状况已经开始发生后改善其体征或症状的治疗性干预。术语“改善”在指称疾病或病理状况时,是指治疗的任何可观察到的有益效果。有益效应可以表现为例如在易感对象中延迟疾病的临床症状的发生、降低疾病的一些或所有临床症状的严重性、减慢疾病的发展、改善对象的整体健康或身体状况、或具体疾病特异性的本技术领 域公知的其他参数。“预防性”治疗是向未表现出疾病体征或仅表现出早期体征的对象提供的、旨在降低发生病症的风险的治疗。
分离的:“分离的”生物组分(例如蛋白,例如P4肽、抗体或补体蛋白)已经与组分天然存在于其中的其他生物组分、例如其他染色体和染色体外DNA、RNA和蛋白质基本上分离开或从中纯化出来。已被“分离”的蛋白或肽包括通过标准纯化方法纯化的蛋白。术语还包括通过在宿主细胞中重组表达而制备的蛋白或肽,以及化学合成的蛋白或肽。分离不要求绝对纯度,并且可以包括至少50%分离,例如至少75%、80%、90%、95%、98%、99%或甚至100%分离的蛋白或肽分子。
调理素:变得附着于病原体例如细菌、真菌或病毒病原体的表面、被中性粒细胞和巨噬细胞的表面受体所识别并且增加对微生物的吞噬作用效率的分子。调理素包括被吞噬细胞上的Fcγ受体所识别的IgG抗体,以及被CR1(CD35)和白细胞整合蛋白Mac-1所识别的补体蛋白片段。
调理吞噬作用:在存在特异性血清调理素的情况下,调理素附着于微生物表面以靶定微生物用于被效应细胞(例如巨噬细胞和单核细胞)吞噬的过程。调理素包括结合特定抗原并诱导它们被效应细胞吞噬的任何物质。示例性的调理素包括调理性抗体(特异性针对抗原的IgM、IgG1、IgG2、IgG3和IgA免疫球蛋白)和某些补体片段(C3a、C3b、iC3b、C3d、C4b或C5a,其在补体活化过程中成为与抗原结合),二者都通过结合特异性细胞表面受体(例如中性粒细胞和巨噬细胞上的Fc受体和C3b受体,以及巨噬细胞上的C3d受体)来引发吞噬作用。在某些实例中,效应细胞对抗体/抗原复合物的调理吞噬作用的活性,被P4肽的存在所增强。
肽:由化学连接在一起的氨基酸、氨基酸类似物构成的任何化合物。本文中使用的肽包括氨基酸的低聚物、氨基酸类似物或小和大的 肽,包括多肽或蛋白。任何氨基酸链,不论长度如何或是否翻译后修饰(例如糖基化或磷酸化)。“肽”适用的氨基酸聚合物是天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物,以及其中一个或多个氨基酸残基是非天然氨基酸的氨基酸聚合物,例如相应的天然存在的氨基酸的人造化学模拟物。在某些实施方案中,肽是P4肽,其可以包括但不限于任何本文描述的修饰。“残基”是指通过酰胺键或酰胺键模拟物掺入到多肽中的氨基酸或氨基酸模拟物。肽具有氨基末端(N-末端)和羧基末端(C-末端)。“肽”可以与多肽或蛋白互换使用,并且在本文中可互换地用于指称氨基酸残基的聚合物。
氨基酸一般通过酰胺连键(CONH)化学连接在一起。此外,氨基酸可以通过其他化学键连接在一起。例如,用于氨基酸或氨基酸类似物的连键可以包括CH2NH-、-CH2S-、-CH2-CH2-、-CH=CH--(顺式和反式)、-COCH2--、-CH(OH)CH2-和-CHH2SO-。(这些和其他连键可见于:Spatola,《氨基酸、肽和蛋白质的化学和生物化学》(Chemistry and Biochemistry of Amino Acids,Peptides,and Proteins),B.Weinstein主编,Marcel Dekker,New York,p.267(1983);Spatola,A.F.,Vega Data(1983年3月),Vol.1,第3期,“肽骨架修饰”(Peptide Backbone Modifications)(一般性综述);Morley,Trends Pharm Sci pp.463-468,1980;Hudson等,Int J Pept Prot Res 14:177-185,1979;Spatola等,Life Sci 38:1243-1249,1986;Harm J.Chem.Soc Perkin Trans.1307-314,1982;Almquist等,J.Med.Chem.23:1392-1398,1980;Jennings-White等,Tetrahedron Lett 23:2533,1982;Holladay等,Tetrahedron.Lett 24:4401-4404,1983;以及Hruby Life Sci 31:189-199,1982)。
肽可以通过各种化学技术进行修饰,以产生具有与未修饰蛋白基本上相同的活性、并任选具有其他所需性质的衍生物。例如,蛋白的羧酸基团,不论是羧基末端还是侧链,都可以提供成可药用的阳离子盐的形式,或酯化以形成C1-C16酯,或转变成式NR1R2的酰胺,其中R1和R2各自独立地是H或C1-C16烷基,或组合形成杂环、例如5或6 员环。蛋白的氨基,不论是氨基末端还是侧链,都可以是可药用的酸加成盐的形式,例如HCl、HBr、乙酸、苯甲酸、甲苯磺酸、马来酸、酒石酸和其他有机酸盐,或者可以修饰成C1-C16烷基或二烷基氨基或进一步转化成酰胺。
蛋白侧链的羟基可以使用公知的技术转化成C1-C16烷氧基或C1-C16酯。蛋白侧链的苯环或酚环可以用一个或多个卤素原子例如氟、氯、溴或碘取代,或用C1-C16烷基、C1-C16烷氧基、羧酸及其酯或这些羧酸的酰胺取代。蛋白侧链的亚甲基可以延长成同源的C2-C4亚烷基。硫醇可以用众多公知的保护基团中的任一种、例如乙酰胺基团进行保护。本技术领域的专业人员还将知道用于将环状结构导入到肽中以选择和提供对结构的构型限制、产生增加的稳定性的方法。
可药用载体:可用于本公开的方法的可药用载体是常规载体。E.W.Martin的《Remington药物学》(Remington’s Pharmaceutical Sciences),Mack Publishing Co.,Easton,PA,第15版(1975年),描述了适合于肽和蛋白例如P4肽、调理性抗体和补体蛋白或其片段的药物递送的组合物和制剂。
一般来说,载体的性质取决于所使用的具体给药方式。例如,肠胃外制剂通常包含可注射流体,其包括可药用和生理可接受的流体例如水、生理盐水、平衡盐溶液、葡萄糖水、甘油等作为介质。对于固体组合物(例如粉剂、丸剂、片剂或胶囊形式)来说,常规的无毒性固体载体可以包括例如药用级甘露糖醇、乳糖、淀粉或硬脂酸镁。除了生物中性载体之外,待给药的药物组合物可以包含少量无毒性辅助物质,例如润湿或乳化剂、防腐剂和pH缓冲剂等,例如乙酸钠或失水山梨糖醇单月桂酸酯。
药剂或药物:当适当给药于对象时能够诱导所需治疗或预防效应的化学化合物或组合物。
血清型:由针对表面上表达的抗原决定簇的抗血清所定义的单细胞生物体、例如细菌的基因型。也可以指抗原本身。
特异性结合:当指称调理素(例如调理性抗体时),是指在蛋白和其他生物物质的异源群体存在下,能够确定靶蛋白、肽或多糖的存在的结合反应。因此,在指定条件下,抗体优先结合特定靶蛋白、肽或多糖(例如病原体表面上存在的抗原,例如细菌荚膜多糖),而不以显著量结合样品或对象中存在的其他蛋白或多糖。
序列同一性/相似性:根据序列之间的同一性或相似性来表示的两个或多个核酸序列、或两个或多个氨基酸序列之间的同一性/相似性。序列同一性可以根据同一性百分数来度量;百分数越高,序列越一致。当使用标准方法比对时,核酸或氨基酸序列的同源物或直向同源物具有相对高度的序列同一性/相似性。
比对序列用于比较的方法在本技术领域中是公知的。各种程序和比对算法描述在下列文献中:Smith & Waterman,Adv.Appl.Math.2:482,1981;Needleman & Wunsch,J.Mol.Biol.48:443,1970;Pearson & Lipman,Proc.Natl.Acad.Sci.USA 85:2444,1988;Higgins & Sharp,Gene,73:237-44,1988;Higgins & Sharp,CABIOS 5:151-3,1989;Corpet等,Nuc.Acids Res.16:10881-90,1988;Huang等,Computer Appls.in the Biosciences 8,155-65,1992;以及Pearson等,Meth.Mol.Bio.24:307-31,1994。Altschul等,J.Mol.Biol.215:403-10,1990,提出了关于序列比对方法和同源性计算的详细考虑。
NCBI的基本局部比对搜索工具(Basic Local Alignment Search Tool)(BLAST)(Altschul等,J.Mol.Biol.215:403-10,1990)可以从几个来源获得,包括国家生物技术信息中心(National Center for Biotechnology Information)(NCBI,国立医学图书馆(National Library of Medicine),Building 38A,Room 8N805,Bethesda,MD 20894)和互联网上,用于与序列分析程序blastp、blastn、blastx、tblastn和tblastx结合使用。Blastn用于比较核酸序列,而blastp用于比较氨基酸序列。其他信息可以在NCBI网站上找到。
一旦比对后,通过对两个序列中存在的一致核苷酸或氨基酸残基的位置数进行计数,来确定匹配数。通过用匹配数除以所鉴定序列中显示的序列的长度,或除以节段长度(例如来自所鉴定序列中显示的序列的100个连续的核苷酸或氨基酸残基),然后将得到的值乘以100,来确定百分序列同一性。例如,与具有1554个核苷酸的测试序列比对时具有1166个匹配的肽序列,与测试序列的同一性是75.0%(1166÷1554*100=75.0)。将百分序列同一性值取整到最接近的十分位数。例如,75.11、75.12、75.13和75.14向下取整75.1,而75.15、75.16、75.17、75.18和75.19向上取整到75.2。长度值总是整数。
治疗有效量:足以在被治疗对象中实现所需效应的特定物质(例如P4肽、调理性抗体、抗生素和/或补体蛋白)的量。例如,这可以是抑制或治疗病原体感染、例如细菌病原体感染所必需的量。当给药于对象时,一般将使用能够获得显示出实现所需体外效应的靶组织浓度的剂量。
治疗有效量的物质例如P4肽、调理性抗体和/或补体蛋白,可以例如在治疗过程中每日以单剂或几剂给药。但是,组合物的有效量取决于所应用的化合物或肽、被治疗的对象、疾病的严重性和类型、以及组合物的给药方式。例如,组合物的治疗有效量可以在约0.01mg/kg体重至约1g/kg体重之间变化。
病毒:在活细胞内部增殖的微小感染性生物体。病毒基本上由蛋白外壳包围核酸核心构成,并具有只在活细胞内部复制的能力。“病毒复制”是通过发生至少一个病毒生命周期来产生更多的病毒。病毒可以 破坏宿主细胞的正常功能,致使细胞以病毒决定的方式运转。例如,病毒感染可能导致细胞产生细胞因子或对细胞因子做出响应,而未感染的细胞通常将不会如此。在某些实例中,病毒是病原体。可以按照本公开的方法增强对其调理吞噬作用的病毒病原体的具体实例包括但不限于沙粒病毒(例如瓜纳里托病毒、拉沙病毒、胡宁病毒、马丘波病毒和沙比亚病毒)、动脉炎病毒、Roniviruses、星状病毒、布尼亚病毒(例如克里米亚-刚果出血热病毒和汉坦病毒)、杆状RNA病毒、双RNA病毒、博纳病毒(例如博纳病病毒)、雀麦花叶病毒、杯状病毒、青霉病毒、冠状病毒(例如冠状病毒和SARS)、囊状病毒、线形病毒、豇豆花叶病毒、双顺反子病毒、黄病毒(例如黄热病毒、西尼罗病毒、丙型肝炎病毒和登革热病毒)、线状病毒(例如埃博拉病毒和马堡病毒)、Flexiviruses、肝炎病毒(例如戊型肝炎病毒)、人腺病毒(例如人类腺病毒A-F)、人星状病毒、人BK多瘤病毒、人博卡病毒、人冠状病毒(例如人冠状病毒HKU1、NL63和OC43)、人肠道病毒(例如人肠道病毒A-D)、人红细胞病毒V9、人泡沫病毒、人疱疹病毒(例如人疱疹病毒1(1型单纯性疱疹病毒)、人疱疹病毒2(2型单纯性疱疹病毒)、人疱疹病毒3(水痘带状疱疹病毒)、1型人疱疹病毒4(1型爱泼斯坦-巴尔(Epstein-Barr)病毒)、2型人疱疹病毒4(2型爱泼斯坦-巴尔病毒)、人疱疹病毒5株AD169、人疱疹病毒5株Merlin株、人疱疹病毒6A、人疱疹病毒6B、人疱疹病毒7、M型人疱疹病毒8、P型人疱疹病毒8和人巨细胞病毒)、人免疫缺陷病毒(HIV)(例如HIV 1和HIV 2)、人偏肺病毒、人乳头瘤病毒组(例如人乳头瘤病毒-1、人乳头瘤病毒-18、人乳头瘤病毒-2、人乳头瘤病毒-54、人乳头瘤病毒-61、人乳头瘤病毒-cand90、人乳头瘤病毒RTRX7、10型人乳头瘤病毒、101型人乳头瘤病毒、103型人乳头瘤病毒、107型人乳头瘤病毒、16型人乳头瘤病毒、24型人乳头瘤病毒、26型人乳头瘤病毒、32型人乳头瘤病毒、34型人乳头瘤病毒、4型人乳头瘤病毒、41型人乳头瘤病毒、48型人乳头瘤病毒、49型人乳头瘤病毒、5型人乳头瘤病毒、50型人乳头瘤病毒、53型人乳头瘤病毒、60型人乳头瘤病毒、63型人乳头瘤病毒、6b型人乳头瘤病毒、7型人乳头瘤病毒、71型人 乳头瘤病毒、9型人乳头瘤病毒、92型人乳头瘤病毒和96型人乳头瘤病毒)、人副流感病毒(例如人副流感病毒1-3)、人副肠孤病毒、人细小病毒(例如人细小病毒4和人细小病毒B19)、人呼吸道合胞病毒、人鼻病毒(例如人鼻病毒A和人鼻病毒B)、人泡沫反转录病毒、人嗜T淋巴细胞病毒(例如人嗜T淋巴细胞病毒1和人嗜T淋巴细胞病毒2)、人多瘤病毒、减毒病毒、轻小病毒、黄矮病毒、淋巴细胞脉络丛脑膜炎病毒(LCM)、Marnaviruses、裸露核糖核酸病毒(Narnaviruses)、套式病毒目、诺达病毒、正粘病毒(例如流感病毒)、分病毒、副粘病毒(例如麻疹病毒和腮腺炎病毒)、微小核糖核酸病毒(例如脊髓灰质炎病毒、感冒病毒和甲肝病毒)、马铃薯Y病毒、痘病毒(例如天花和牛痘)、伴生病毒、呼肠弧病毒(例如轮状病毒)、弹状病毒(例如狂犬病病毒)、弹状病毒(例如水泡性口炎病毒)、四病毒、披膜病毒(例如风疹病毒和罗斯河病毒)、番茄丛矮病毒、全病毒、芜菁黄花叶病毒、诺如病毒、牛疱疹病毒包括牛疱疹病毒(BHV)和恶性卡他热病毒(MCFV),等等。在某些实例中,病毒感染的细胞被调理吞噬。
II.几个实施方案的概述
本公开涉及增强对病原体的调理性应答的方法,以及用于靶向目标病原体进行调理吞噬作用的组合物。调理吞噬作用是抗体和补体或补体组分与病原体结合(或调理作用),随后通过效应细胞与抗体/抗原复合物的结合由效应细胞摄入感染物。
在保护性免疫应答过程中,产生了与感染物结合并也为效应细胞的摄入和清除提供手段的功能性抗体。特异性结合目标病原体表面上的抗原的功能性抗体(调理性抗体)可以被纯化并给药于对象,以便通过靶向目标病原体以被对象自身的效应细胞进行调理来治疗和/或抑制对象中的感染。尽管这种疗法显示出希望,但典型情况下必须给药大剂量调理性抗体才能达到所需的病原体清除效果。因此,对于增强针对调理性抗体的调理性应答的方法,存在着需求。
为了满足这一需求,本文公开了使用P4肽,在与通过特异性结合靶病原体表面上的抗原来靶向所述病原体的调理性抗体一起给药时,增强效应细胞对调理性抗体的调理性应答的方法。P4肽源自于肺炎链球菌PsaA蛋白的7号链、12号α-螺旋和8号链,但是相对于PsaA蛋白的天然序列来说含有点突变以提高等电点和增强结合。考虑到P4肽最初被开发用于抑制肺炎链球菌被鼻咽细胞的内化(参见国际专利公布2006/127020),本文所公开的P4肽增强效应细胞对病原体的调理作用这一发现,是特别令人吃惊和意外的。此外,正如本文所公开的,还发现P4肽与抗生素的共同给药,协同增加了抗生素的有效性。由于这种协同行为,在与P4肽组合时有可能使用较低剂量的抗生素,同时仍维持抗生素的有效性。
A 治疗方法
公开了在对象中增强对目标病原体的调理吞噬作用的方法,例如,用以增强对目标病原体的调理吞噬作用以在对象中抑制和/或治疗目标病原体感染。目标病原体可以是在前面的术语概述中讨论过的任何细菌、病毒或真菌病原体。在具体实例中,该方法被用于在感染有病原体(例如病毒、细菌或真菌病原体)(或具有病原体感染风险)的对象中增强调理吞噬作用。在具体实例中,病原体是细菌病原体,例如链球菌(例如肺炎链球菌)、葡萄球菌(例如金黄色葡萄球菌)或脑膜炎球菌(例如脑膜炎奈瑟菌)。在某些实例中,所选的治疗对象具有病原体(例如病毒、细菌或真菌病原体)感染或具有发生所述感染的风险。在某些实例中,所选的对象具有链球菌感染(例如肺炎链球菌感染)或具有所述感染的风险。在某些实例中,所选的对象具有葡萄球菌感染(例如金黄色葡萄球菌感染)或具有所述感染的风险。在某些实例中,所选的对象具有脑膜炎球菌感染(例如脑膜炎奈瑟菌感染)或具有所述感染的风险。在某些实例中,所选的治疗对象未被表达肺炎球菌表面黏附素A(PsaA)蛋白的病原体感染,例如所选对象未被肺炎链球菌感染。所述方法包括向对象给药治疗有效量的分离的 P4肽,所述P4肽包含与显示为LFVESSVKRRPMKTVSQDTNIPIYAQIF(SEQ ID NO:1)的氨基酸序列具有至少95%同一性,例如至少96%、至少97%、至少99%、至少99%同一性或甚至100%同一性的氨基酸序列,以及任选治疗有效量的特异性结合目标病原体(例如上面列出的细菌、病毒或真菌目标病原体)表面上存在的抗原的一种或多种分离的调理性抗体或其片段。在某些实例中,P4肽的长度在约27至约200个氨基酸之间,例如长度不超过28、29、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190或200个氨基酸,或甚至更长,例如长度为27-50、40-60、50-70、60-80、70-90、80-100、90-110、100-120、110-130、120-140、130-140、140-160、150-170、160-180、170-190或180-200个氨基酸。在某些实例中,P4肽由SEQ ID NO:1所显示的氨基酸序列构成。在某些实例中,向对象给药P4肽。在某些实例中,向对象给药P4肽和特异性结合目标病原体表面上存在的抗原的一种或多种分离的调理性抗体或其片段。在某些实例中,向具有被病毒感染的细胞的对象给药P4肽,以例如增强对表达来自目标病毒病原体的细胞表面蛋白的细胞的调理吞噬作用。在某些实例中,P4肽包括与SEQ ID NO:1显示的氨基酸序列相比具有不超过一个或两个氨基酸改变、例如保守取代的氨基酸序列。设想了可以利用将使得到的肽仍然能够增强对目标病原体的调理吞噬作用的氨基酸序列改变,例如通过保守取代。还设想到融合蛋白,其包含与异源氨基酸序列融合的P4肽。在某些实例中,P4肽被脂质化,例如用棕榈酸等脂质化。示例性的药物组合物描述在下面的B部分中。还设想了本公开的药物组合物的各种给药方式(参见下面的B部分)。
P4肽的给药增强了对象(以及特别是对象的效应细胞)调理吞噬目标病原体的能力,所述目标病原体被调理性抗体或其片段、例如由对象(例如被病原体感染的对象)产生的调理性抗体和/或给药于对象的分离的调理性抗体特异性结合。在某些实例中,向对象给药调理性抗体或其片段和P4肽。调理性抗体或其片段和P4肽的给药可以任何次序或甚至同时进行,例如作为单一药物制剂或作为多个药物制剂共 同给药,所述多个药物制剂例如含有治疗有效量的P4肽的药物组合物和含有治疗有效量的特异性结合目标病原体的调理性抗体或其片段(或甚至多种调理性抗体,例如各自特异性结合单一目标病原体的多种调理性抗体,或其中每种调理性抗体特异性结合不同目标病原体或单一目标病原体的多种血清型的多种调理性抗体,或其任何组合)的组合物,或甚至同时含有治疗有效量的P4肽和治疗有效量的调理性抗体或其片段(或多种调理性抗体)的组合物。
正如本文所公开的,P4肽与抗生素的联合给药增加了抗生素的有效性,例如允许使用较低剂量和/或增加细菌的清除。总的来说,任何抗生素都可用于本公开的方法。可以使用的抗生素的实例包括但不限于氨基糖苷类(例如阿米卡星、庆大霉素、卡那霉素、新霉素、奈替米星、链霉素、妥布霉素和巴龙霉素);安沙霉素类(例如格尔德霉素和除莠霉素);碳头孢烯类抗生素(例如氯碳头孢、厄他培南、多尼培南、亚胺培南/西司他汀和美罗培南);头孢菌素类(例如头孢羟氨苄、头孢唑啉、头孢噻吩、头孢氨苄、头孢克洛、头孢孟多、头孢西丁、头孢丙烯、头孢呋辛、头孢克肟、头孢地尼、头孢妥仑、头孢哌酮、头孢噻肟、头孢泊肟、头孢他啶、头孢布烯、头孢唑肟、头孢曲松、头孢吡肟和头孢托罗);糖肽类(例如替考拉宁和万古霉素);大环内酯类(例如阿奇霉素、克拉霉素、地红霉素、红霉素、罗红霉素、醋竹桃霉素、泰利霉素和壮观霉素);单酰胺菌素类(例如氨曲南);青霉素类(例如阿莫西林、氨苄青霉素、阿洛西林、羧苄青霉素、氯唑西林、双氯西林、氟氯西林、美洛西林、甲氧西林、萘夫西林、苯唑西林、青霉素、哌拉西林和替卡西林);多肽类(例如杆菌肽、粘杆菌素和多粘菌素b);喹诺酮类(例如环丙沙星、依诺沙星、加替沙星、左氧氟沙星、洛美沙星、莫西沙星、诺氟沙星、氧氟沙星、曲伐沙星、格帕沙星和司帕沙星);磺胺类(例如磺胺米隆、百浪多息(已废止)、乙酰磺胺、磺胺甲噻二唑、磺胺二甲异噁唑(已废止)、柳氮磺胺吡啶、磺胺异噁唑、甲氧苄啶和甲氧苄啶-磺胺甲基异噁唑);四环素类(例如地美环素、多西环素、米诺环素、土霉素和四环素); 以及其他(例如胂凡纳明、氯霉素、克林霉素、林可霉素、乙胺丁醇、磷霉素、夫西地酸、呋喃唑酮、异烟肼、利奈唑胺、甲硝唑、莫匹罗星、呋喃妥因、平板霉素、吡嗪酰胺、奎奴普汀/达福普汀、利福平、甲砜霉素和替硝唑)。在某些实例中,向对象给药抗生素(或一种以上抗生素)和P4肽。抗生素或其片段和P4肽的给药可以任何次序或甚至同时进行,例如作为单一药物制剂或作为多个制剂共同给药,所述多个制剂例如含有治疗有效量的P4肽的药物组合物和含有治疗有效量的特异性针对目标病原体的抗生素的组合物。在某些实例中,向患者给药调理性抗体或其片段、P4肽和抗生素。调理性抗体或其片段、P4肽和抗生素的给药可以以任何次序或甚至同时进行,例如作为单一药物制剂或作为多个制剂共同给药,所述多个制剂例如含有治疗有效量的P4肽的药物组合物、含有治疗有效量的特异性针对目标病原体的抗生素的组合物,以及含有治疗有效量的特异性结合目标病原体的调理性抗体或其片段(或甚至多种调理性抗体,例如各自特异性结合单一目标病原体的多种调理性抗体,或其中每种调理性抗体特异性结合不同目标病原体或单一目标病原体的多种血清型的多种调理性抗体,或其任何组合)的组合物,或甚至含有治疗有效量的P4肽和治疗有效量的调理性抗体或其片段(或多种调理性抗体)和治疗有效量的特异性针对目标病原体的抗生素的组合物。
补体蛋白及其片段通过结合调理性抗体并促进效应细胞的调理作用,辅助对病原体的调理吞噬作用。因此,在某些实例中,也向对象给药药物有效量的分离的补体蛋白或其片段,例如C3a、C3b、iC3b、C3d、C4b或C5a中的一种或多种。在某些实例中,选择具有补体缺陷的对象给药药物有效量的分离的补体蛋白或其片段。在某些实例中,通过鼻内途径和/或静脉内途径给药治疗有效量的分离的P4肽。在某些实施方案中,通过鼻内途径和/或静脉内途径给药治疗有效量的调理性抗体或其片段。在某些实例中,通过鼻内途径和/或静脉内途径给药药物有效量的分离的补体蛋白或其片段,例如C3a、C3b、iC3b、C3d、C4b或C5a中的一种或多种。
因为P4肽不特异性针对任何单一病原体,因此可以配制本公开的P4肽和治疗组合物,以期通过提供靶向任何目标病原体的调理性抗体或其片段,例如通过提供特异性结合目标病原体表面上存在的抗原的调理性抗体或其片段(例如治疗有效量的调理性抗体或其片段)、或向产生调理性抗体的对象例如被病原体感染或已被病原体感染的对象提供P4肽,来增强对任何目标病原体的调理吞噬作用。产生调理性抗体的方法在下面的C部分中给出。在某些实例中,目标病原体是细菌病原体,并且提供了治疗有效量的特异性结合细菌病原体的调理性抗体。在某些实例中,目标病原体是肺炎链球菌。在其他实例中,目标病原体是脑膜炎奈瑟菌。在其他实例中,目标病原体是金黄色葡萄球菌,例如耐甲氧西林的金黄色葡萄球菌(MRSA)。在某些实例中,目标病原体是病毒病原体,并且提供了治疗有效量的特异性结合病毒病原体或被病毒病原体感染的细胞的调理性抗体。在某些实例中,目标病原体是真菌病原体,并且提供了治疗有效量的特异性结合真菌病原体的调理性抗体。
B.治疗组合物
P4肽可以体外、离体(ex vivo)或体内给药于细胞或对象。希望将P4肽制备成适合于目标应用、例如抑制或治疗病原体感染、例如上面术语概述中讨论过的病原体感染的药物组合物。因此,本文包括了含有P4肽(和在某些情况下的调理性抗体或其片段、抗生素和/或补体蛋白或其片段)的药物或药物组合物的制备方法。P4肽可以制备成用于单独或与其他活性成分、例如抗生素(例如上面A部分中描述的抗生素)和/或其他蛋白一起给药,例如与调理性抗体、抗生素(或甚至多种抗生素)和/或补体蛋白(或甚至特异性针对不同病原体(被病原体感染的细胞)的多种调理性抗体,和/或补体蛋白,或其片段)一起给药。在某些实例中,治疗组合物包括P4肽。在某些实例中,治疗组合物包括调理性抗体。在某些实例中,治疗组合物包括抗生素。在某些实例中,治疗组合物包括调理性抗体和P4肽。在某些实例中,治疗 组合物包括调理性抗体、P4肽和抗生素。在某些实例中,治疗组合物包括补体蛋白或其片段。在某些实例中,治疗组合物包括补体蛋白或其片段和P4肽。在某些实例中,治疗组合物包括补体蛋白或其片段、抗生素和P4肽。在某些实例中,治疗组合物包括补体蛋白或其片段、调理性抗体、抗生素和P4肽。在某些实例中,治疗组合物包括补体蛋白或其片段和调理性抗体。当向对象给药P4肽和调理性抗体和/或抗生素和/或补体蛋白时,给药可以同时或顺序进行。P4肽和调理性抗体和/或抗生素和/或补体蛋白的顺序给药可以相隔任何时间量,只要P4肽的给药增强调理性抗体的调理活性即可。也考虑到了本文描述的组合物的多次给药。
在某些实施方案中,所公开的治疗组合物包括治疗有效量的分离的P4肽,所述P4肽包含与SEQ ID NO:1所显示的氨基酸序列具有至少95%同一性、例如至少96%、至少97%、至少98%、至少99%或甚至100%同一性的氨基酸序列,以及任选治疗有效量的特异性结合目标病原体表面上存在的抗原的一种或多种分离的调理性抗体或其片段。在某些实例中,治疗组合物还包含治疗有效量的抗生素,或甚至一种以上的抗生素。在某些实例中,治疗组合物还包含治疗有效量的分离的补体蛋白或其片段,例如C3a、C3b、iC3b、C3d、C4b或C5a中的一种或多种。
典型情况下,药物组合物(用作药物或用于制造药物)的制备需要制备基本上不含热原以及可能对人类或动物有害的任何其他杂质的药物组合物。典型情况下,药物组合物含有适合的盐和缓冲剂,以使组合物的组分稳定并允许P4肽与对象的细胞相互作用。
治疗组合物的给药可以通过任何常用途径,只要可以通过该途径到达靶组织即可。这包括口、鼻(例如鼻内)、眼、颊、肠、玻璃体内或其他黏膜(例如直肠或阴道)或局部给药。可供选择地,给药可以通过常位、皮内皮下、肌肉内、肠胃外腹膜内或静脉内注射途径。 这样的药物组合物通常作为包含生理可接受的载体、缓冲剂或其他赋形剂的可药用组合物给药。
治疗组合物可以提供成肠胃外、例如用于注射或输注的组合物。这样的组合物一般通过将所需纯度的P4肽与可药用载体、例如在所使用的剂量和浓度下对接受者无毒性并且与制剂中的其他成分相容的载体混合成单位剂量的可注射形式(溶液、悬液或乳液)来配制。此外,可以将P4肽(和/或调理性抗体,和/或抗生素,和/或补体蛋白或其片段)悬浮在水性载体中,例如在pH为约3.0至约8.0、优选pH为约3.5至约7.4、3.5至6.0或3.5至约5.0的等渗缓冲溶液中。可用的缓冲液包括柠檬酸钠-柠檬酸和磷酸钠-磷酸、以及乙酸钠/乙酸缓冲液。P4肽,任选与赋形剂、调理性抗体、抗生素和/或补体蛋白或其片段一起,也可采取冻干物的形式,并可以在肠胃外给药前通过加入适合的溶剂来制成溶液。溶液,例如用于例如肠胃外给药的溶液,也可以用作输注溶液。
药物组合物可以包括(例如溶解或悬浮)在可药用载体或赋形剂中的有效量(例如治疗有效量)的P4肽、补体蛋白、抗生素和/或调理性抗体。可药用载体和/或可药用赋形剂在本技术领域中是已知的,并描述在例如E.W.Martin的《Remington药物学》(Remington’s Pharmaceutical Sciences),Mack Publishing Co.,Easton,PA,第15版(1975)中。
载体的性质取决于所使用的具体给药方式。例如,肠胃外制剂通常包含可注射流体,所述可注射流体包括可药用和生理可接受的流体例如水、生理盐水、平衡盐溶液、葡萄糖水、甘油等作为介质。对于固体组合物(例如粉剂、丸剂、片剂或胶囊形式)来说,常规的无毒性固体载体可以包括例如药用级甘露糖醇、乳糖、淀粉或硬脂酸镁。此外,待给药的药物组合物可以包含少量无毒性辅助物质,例如润湿或乳化剂、防腐剂和pH缓冲剂等,例如乙酸钠或失水山梨糖醇单月桂 酸酯。
本文中使用的“可药用载体”包括任何和所有溶剂、分散介质、涂层、抗细菌和抗真菌剂、等渗和吸收延迟剂等。这类介质和药剂在药物活性物质中的应用在本技术领域中是公知的。任何常规介质或药剂,除了与活性成分不相容的情况之外,都可考虑用于药物组合物中。也可以在组合物中掺入增补的活性成分。例如,某些药物组合物可以在水中包含与适合的表面活性剂例如羟丙基纤维素混合的P4肽。也可以在甘油、液体聚乙二醇及其混合物中和油中制备分散体。在平常的储存和使用条件下,这些制剂含有防腐剂以阻止微生物的生长。
其他制剂适合于口服给药。口服制剂可以包含赋形剂例如药用级甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。组合物(药物)典型地采取溶液、悬液、气溶胶或粉末的形式。示例性制剂可见于美国专利公布No.20020031527。当途径是局部途径时,形式可以是霜剂、软膏、油膏或喷剂。
打算使用本公开的药物组合物和方法治疗的典型对象包括人类以及非人类灵长动物或其他动物。为了鉴定根据本公开的方法进行预防或治疗的对象,使用认可的筛选方法在对象中确定与目标或怀疑的疾病或病症(例如与特定目标病原体相关的感染)相关的风险因素,或确定已患的疾病或病症的状态。这些筛选方法包括例如诊断方法,例如在本技术领域中可用的或公知的用于检测和/或表征疾病相关标志物的各种ELISA和其他免疫分析方法。这些以及其他常规方法允许临床医生选择需要使用本公开的方法和药物组合物治疗的患者。
药物组合物的有效量根据所计划的目标、例如抑制和/或治疗人类或非人类对象的病原性感染来确定。本公开的药物组合物的给药可用于预防性或治疗性目的。当预防性提供时,药物组合物在任何症状出现之前提供。化合物的预防性给药用于阻止或改善任何后续的疾病过 程。当治疗性提供时,化合物在疾病或感染的症状发作时(或其后不久)提供。
对于预防性和治疗性目的来说,药物组合物可以单次推注(bolus)递送、通过在一段较长时期内连续递送(例如连续的透皮、黏膜或静脉内递送)、或以重复给药方案(例如通过每小时、每日或每周重复给药方案)向对象给药。治疗有效剂量的化合物可以在长期预防或治疗方案中作为重复药剂提供,以产生临床显著结果,从而改善与本文提出的目标疾病或病症相关的一种或多种症状或可检测到的状况。就此而言,有效剂量的确定典型基于动物模型研究,然后进行人类临床试验,并通过在对象中明显降低目标疾病症状或状况的发生或严重性的给药方案来指导。这方面的适合的模型包括例如鼠类、大鼠、猪、猫、非人类灵长动物和本技术领域已知的其他认可的动物模型对象。可供选择地,有效剂量可以使用体外模型(例如免疫和组织病理分析)来确定。使用这样的模型,只需要常规的计算和调整就可确定给药治疗有效量P4肽的适合浓度和剂量(例如有效改善目标感染的一种或多种症状的量)。
适合的剂量将根据下列因素而异:对象的特征例如对象是人类还是非人类、年龄、体重和与对象的条件或状态有关的其他健康考虑,给药方式、途径,和剂量次数以及药物组合物包含单独的P4肽还是还包含调理性抗体和/或抗生素和/或补体蛋白,给药的时间和途径,同时给药的其他药物或治疗,以及治疗组合物在对象中引发所需活性或生物响应的特定药理学。可以调整剂量方案,以提供最优的预防或治疗响应。治疗有效量也是其中化合物和/或其他生物活性剂的任何有毒或有害副作用被以临床术语而言的治疗有益效应胜过的量。在本公开的方法和制剂中,P4肽和/或其他生物活性剂的治疗有效量的非限制性范围是约0.01mg/kg体重至约10mg/kg体重,例如约0.05mg/kg至约5mg/kg体重,或约0.2mg/kg至约2mg/kg体重。
包含本公开的治疗药剂的治疗组合物可以通过泵递送(参见Langer,同上;Sefton,CRC Crit.Ref.Biomed.Eng.14:201,1987;Buchwald等,Surgery 88:507,1980;Saudek等,N.Engl.J.Med.321:574,1989),或通过连续皮下输注例如使用微型泵来递送。也可以使用静脉内溶液袋(intravenous bag solution)。选择适合剂量的一个因素是通过本文公开的方法测量得到的、被执业医师视为适合的结果。其他受控释放系统在Langer(Science 249:1527-33,1990)中讨论。
在一个实例中,泵是植入式的(参见例如美国专利No.6,436,091、5,939,380和5,993,414)。使用可植入的药物输注装置为患者提供治疗药剂的恒定和长期的剂量或输注。这样的装置可以分类成主动或被动式的。
主动式药物或可编程输注装置的特点在于用于将药剂递送到患者系统中的泵或计量系统。目前可用的这种主动式输注装置的实例是Medtronic SYNCHROMEDTM可编程泵。相反,被动式输注装置的特点不是泵,而是依赖于加压的药物储池递送目标药剂。这种装置的实例包括Medtronic ISOMEDTM。
在具体实例中,包含本公开的治疗药剂的治疗组合物通过持续释放系统给药。持续释放系统的适合的实例包括适合的聚合材料(例如采用成形物件例如薄膜或微囊形式的半透性聚合物基质)、适合的疏水性材料(例如作为在可接受的油中的乳液)或离子交换树脂,以及微溶衍生物(例如微溶的盐)。持续释放组合物可以口服、肠胃外、脑池内、腹膜内、局部(例如通过粉剂、软膏、凝胶、滴剂或透皮贴片)或作为口或鼻喷剂来给药。持续释放基质包括聚丙交酯(美国专利No.3,773,919、EP 58,481)、L-谷氨酸和γ-乙基-L-谷氨酸酯的共聚物(Sidman等,Biopolymers 22:547-556,1983)、聚(甲基丙烯酸2-羟乙基酯)(Langer等,J.Biomed.Mater.Res.15:167-277,1981;Langer,Chem.Tech.12:98-105,1982)、乙烯-乙酸乙烯酯(Langer等,同上) 或聚-D-(-)-3-羟基丁酸(EP 133,988)。
聚合物可用于离子控制的释放。用于受控药物递送的各种可降解和不可降解的聚合基质在本技术领域中是已知的(Langer,Accounts Chem.Res.26:537,1993)。例如,嵌段共聚物泊洛沙姆407在低温下作为粘稠但仍可流动的液体存在,而在体温下形成半固体凝胶。它已被显示是用于重组白介素-2和脲酶的配制和持续递送的有效介质(Johnston等,Pharm.Res.9:425,1992;和Pec,J.Parent.Sci.Tech.44(2):58,1990)。可供选择地,羟基磷灰石已被用作微载体,用于蛋白的受控释放(Ijntema等,Int.J.Pharm.112:215,1994)。另一方面,脂质体被用于脂类包囊的药物的受控释放以及药物定向(Betageri等《脂质体药物递送系统》(Liposome Drug Delivery Systems),Technomic Publishing Co.,Inc.,Lancaster,PA,1993)。大量用于治疗性蛋白的受控递送的其他系统是已知的(例如美国专利No.5,055,303、美国专利No.5,188,837、美国专利No.4,235,871、美国专利No.4,501,728、美国专利No.4,837,028、美国专利No.4,957,735和美国专利No.5,019,369、美国专利No.5,055,303、美国专利No.5,514,670、美国专利No.5,413,797、美国专利No.5,268,164、美国专利No.5,004,697、美国专利No.4,902,505、美国专利No.5,506,206、美国专利No.5,271,961、美国专利No.5,254,342和美国专利No.5,534,496)。
可以制备药物组合物(药物)用于预防性方案中并给药于人类或非人类对象,以针对病原体(或多种病原体)的感染进行保护。因此,药物组合物典型地包含药物有效量的P4肽和任选的药物有效量的调理性抗体或其片段、和/或抗生素和/或补体蛋白或其片段。在某些情况下,组合物在感染后给药,以例如治疗感染、增加病原体清除,在这种应用中,药物组合物以治疗有效量给药。治疗有效量是用于在对象中获得所需效应的组合物的量。例如,这可以是抑制病原体感染、增加病原体从对象的清除或者阻止或可测量地改变对象的病原体感染的外在症状所需的组合物的量。当给药于对象时,一般使用将达到已显示出 实现体外或体内效应的靶组织浓度的剂量。
C.调理性抗体
免疫原、例如免疫原性多糖或免疫原性多肽(例如源自于病原体例如病毒、细菌或真菌病原体如上面列出的病毒、细菌或真菌病原体的免疫原性多糖或免疫原性肽)或其片段或保守变体,可用于产生与病原体表面上的表位发生免疫反应或结合、例如结合特定抗原并诱导效应细胞对靶病原体的调理吞噬作用的调理性抗体。包括多克隆调理性抗体、基本上由具有不同表位特异性的合并的调理性单隆抗体构成的抗体,以及不同的单克隆调理性抗体制剂。
多克隆抗体的制备对于本技术领域的专业人员来说是公知的。参见例如Green等,“多克隆抗血清的生产”(Production of polyclonal Antisera),Manson主编的《免疫化学方法》(Immunochemical Protocols)第1-5页,Humana Press 1992;Coligan等,“在兔、大鼠、小鼠和仓鼠中生产多克隆抗血清”(Production of polyclonal Antisera in Rabbits,Rats,Mice and Hamsters),《免疫学现代方法》(Current Protocols in Immunology)第2.4.1节,1992。
单克隆抗体的制备同样是常规的。参见例如Kohler & Milstein,Nature 256:495,1975;Coligan等,2.5.1-2.6.7节;以及Harlow等,《抗体实验指南》(Antibodies:a Laboratory Manual)第726页,Cold Spring Harbor Pub.,1988。简单来说,可以如下获得单克隆抗体:用包含抗原(例如源自于病原体的抗原)的组合物注射小鼠,通过取出血清样品验证抗体生产的存在,取出脾脏获得B淋巴细胞,将B淋巴细胞与骨髓瘤细胞融合以产生杂交瘤,克隆杂交瘤,筛选产生针对抗原的抗体的阳性克隆以及从杂交瘤培养物分离抗体。单克隆抗体可以通过各种已确立的技术从杂交瘤培养物分离和纯化。这样的分离技术包括使用蛋白A琼脂糖凝胶的亲和层析、尺寸排阻层析和离子交换层析。参见例如Coligan等,第2.7.1-2.7.12节和第2.9.1-2.9.3节;Barnes等,“免 疫球蛋白G(IgG)的纯化”(Purification of Immunoglobulin G(IgG)),《分子生物学方法》(Methods in Molecular Biology)第10卷79-104页,Humana Press,1992。
单克隆抗体的体外和体内倍增方法对于本技术领域的专业人员来说是公知的。体外倍增可以在适合的培养基中进行,例如Dulbecco修改的Eagle培养基或RPMI 1640培养基,任选增补有哺乳动物血清例如胎牛血清或微量元素和生长维持增补剂例如正常小鼠的腹腔渗出细胞、脾细胞、胸腺细胞或骨髓巨噬细胞。体外生产提供相对纯的抗体制备物,并允许规模放大以生产大量目标抗体。大规模杂交瘤培养可以通过在气升式反应器、连续搅拌反应器中的均相悬浮培养或在固定或截留细胞培养中来进行。体内倍增可以通过将细胞克隆注射到与亲代细胞组织相容的哺乳动物例如同系基因小鼠中,以引起产生抗体的肿瘤的生长来进行。任选地,在注射前将动物用烃、特别是油类例如降植烷(四甲基十五烷)致敏。在1到3周后,从动物的体液回收目标单克隆抗体。
抗体也可以源自于类人灵长动物抗体。用于在狒狒中产生治疗有用抗体的通用技术,可见于例如WO 91/11465,1991和Losman等,Int.J.Cancer 46:310,1990。
可供选择地,特异性结合源自于病原体的多肽的抗体,可以源自于人源化单克隆抗体。人源化单克隆抗体通过将来自于小鼠免疫球蛋白的重链和轻链可变区的互补性决定区转移到人类可变结构域中,然后将框架区中的人类残基用鼠类对应物代替。使用源自于人源化单克隆抗体的抗体组分免除了与鼠类恒定区的免疫原性相关的潜在问题。用于克隆鼠类免疫球蛋白可变结构域的通用技术描述在例如Orlandi等,Proc.Nat′l Acad.Sci.U.S.A.86:3833,1989中。用于生产人源化单克隆抗体的技术描述在例如Jones等,Nature 321:522,1986;Riechmann等,Nature 332:323,1988;Verhoeyen等,Science 239:1534,1988;Carter 等,Proc.Nat′l Acad.Sci.U.S.A.89:4285,1992;Sandhu,Crit.Rev.Biotech.12:437,1992;和Singer等,J.Immunol.150:2844,1993中。
抗体可以源自于从组合免疫球蛋白文库分离的人类抗体片段。参见例如Barbas等,《方法:酶学方法指南》(Methods:a Companion to Methods in Enzymology)Vol.2,119页,1991;Winter等,Ann.Rev.Immunol.12:433,1994。可用于生产人类免疫球蛋白噬菌体文库的克隆和表达载体,可以从例如STRATAGENE Cloning Systems公司(La Jolla,CA)获得。
此外,抗体可以源自于人类单克隆抗体。这样的抗体从已被“工程化改造”以对抗原激惹做出应答而产生特异性人类抗体的转基因小鼠获得。在该技术中,将人类重链和轻链基因座的元件引入源自于胚胎干细胞系的小鼠种系中,所述胚胎干细胞系含有定向破坏的内源重链和轻链基因座。转基因小鼠能够合成对人类抗原特异的人类抗体,并且小鼠可用于产生分泌人类抗体的杂交瘤。用于从转基因小鼠获得人类抗体的方法描述在Green等,Nature Genet.7:13,1994;Lonberg等,Nature 368:856,1994;和Taylor等,Int.Immunol.6:579,1994中。
抗体包括完整分子及其能够结合表位决定簇的片段,例如Fab、F(ab′)2和Fv。制造这些片段的方法是本领域已知的。(参见例如Harlow和Lane,《抗体实验指南》(Antibodies:A Laboratory Manual),Cold Spring Harbor Laboratory,New York,1988)。表位是抗原上与抗体的互补位结合的任何抗原决定簇。表位决定簇通常由分子例如氨基酸或糖侧链的化学活性表面基团组构成,并通常具有特定的三维结构特征以及特定的电荷特征。
抗体片段可以通过抗体的蛋白水解作用或通过在大肠杆菌(E.coli)中表达编码所述片段的DNA来制备。抗体片段可以通过常规方法,用胃蛋白酶或木瓜蛋白酶消化完整抗体来获得。例如,可以通过 用胃蛋白酶对抗体进行酶切割以提供被称为F(ab′)2的5S片段,来产生抗体片段。该片段可以使用硫醇还原剂以及任选的用于切开二硫键所产生的巯基的阻断基团来进一步切割,以产生3.5S的Fab′单价片段。可供选择地,使用胃蛋白酶的酶切割直接产生两个单价Fab′片段和一个Fc片段(参见美国专利No.4,036,945和美国专利No.4,331,647以及其中包含的参考文献;Nisonhoff等,Arch.Biochem.Biophys.89:230,1960;Porter,Biochem.J.73:119,1959;Edelman等,《酶学方法》(Methods in Enzymology),第1卷,422页,Academic Press,1967;和Coligan等,第2.8.1-2.8.10和2.10.1-2.10.4节)。
也可以使用其他切割抗体的方法,例如分离重链以形成单价轻链-重链片段、片段的进一步切割、或其他酶、化学或遗传技术,只一要片段与完整抗体所识别的抗原结合即可。
例如,Fv片段包含联合的VH和VL链。该联合可以是非共价的(Inbar等,Proc.Nat′l Acad.Sci.U.S.A.69:2659,1972)。可供选择地,可变链可以通过分子间二硫键相连或通过化学物质例如戊二醛交联。参见例如Sandhu,同上。优选,Fv片段包含通过肽接头相连的VH和VL链。这些单链抗原结合蛋白(sFv)通过构建包含由寡核苷酸相连的、编码VH和VL结构域的DNA序列的结构基因来制备。将结构基因插入到表达载体中,随后将表达载体导入宿主细胞例如大肠杆菌中。重组的宿主细胞合成具有桥连两个V结构域的接头肽的单一多肽链。用于生产sFv的方法在本技术领域中是已知的(参见Whitlow等,《方法:酶学方法指南》(Methods:a Companion to Methods in Enzymology)Vol.2,97页,1991;Bird等,Science 242:423,1988;美国专利No.4,946,778;Pack等,Bio/Technology 11:1271,1993;和Sandhu,同上)。
另一种形式的抗体片段是编码单个互补性决定区(CDR)的肽。CDR肽(“最小识别单位”)可以通过构建编码目标抗体的CDR的基因来获得。这种基因通过例如使用聚合酶链反应从抗体产生细胞的RNA 合成可变区来制备(Larrick等,《方法:酶学方法指南》(Methods:a Companion to Methods in Enzymology)Vol.2,106页,1991)。
抗体可以使用完整多肽、含有目标小肽或多糖的片段作为免疫抗原来制备。用于免疫动物的多肽或肽可以源自于在宿主细胞中产生的基本上纯化的多肽、体外翻译的cDNA或化学合成,如果需要,其可以与载体蛋白接合。这种常用的与肽化学偶联的载体包括匙孔血蓝蛋白(KLH)、甲状腺球蛋白、牛血清白蛋白(BSA)和破伤风类毒素。然后将偶联的肽用于免疫动物(例如小鼠、大鼠或兔)。
多克隆或单克隆抗体可以通过例如结合到基质上并从基质洗脱来进一步纯化,所述基质结合有将针对它们产生抗体的多肽或肽。本技术领域的专业人员将了解在免疫学技术领域中用于纯化和/或浓缩多克隆抗体以及单克隆抗体的各种常用技术(参见例如Coligan等,《免疫学现代方法》(Current Protocols in Immunology)的第9单元,Wiley Interscience,1991)。
也可以使用模拟表位的抗独特型抗体技术来生产单克隆抗体。例如,针对第一种单克隆抗体制造的抗独特型单克隆抗体,将在高变区中具有结合结构域作为被第一个单克隆抗体结合的表位的“图像”。
抗体可以通过克隆技术制备。适合的克隆和测序技术的实例,以及足以指导专业技术人员许多克隆实践的说明,可见于下列文献:Sambrook等,《分子克隆实验指南》(Molecular Cloning:A Laboratory Manual)第2版,Vols.1-3,Cold Spring Harbor Laboratory(1989);Berger和Kimmel主编,《分子克隆技术指导》(Guide to Molecular Cloning Techniques),Academic Press,Inc.,San Diego CA(1987);或Ausubel等主编,《分子生物学现代方法》(Current Protocols in Molecular Biology),Greene Publishing and Wiley-Interscience,NY(1987)。来自生物试剂和实验设备制造商的产品信息也提供有用的信息。这些制造 商包括SIGMA化学品公司((Saint Louis,MO)、R&D systems(Minneapolis,MN)、Pharmacia LKB Biotechnology(Piscataway,NJ)、CLONTECH oratories,Inc.(Palo Alto,CA)、Chem Genes Corp.、Aldrich化学品公司(Milwaukee,WI)、Glen Research,Inc.、GIBCO BRL Life Technologies,Inc.(Gaithersburg,MD)、Fluka Chemica-Biochemika Analytika(Fluka Chemie AG,Buchs,瑞士)、INVITROGENTM(San Diego,CA)和Applied Biosystems(Foster City,CA),以及专业技术人员所知的许多其他商业来源。
源自于病原体的、适合用作免疫原以产生调理性抗体的基本上纯的靶抗原,通过纯化或重组表达来分离(参见D部分)。通过例如在Amicon过滤装置上浓缩到每毫升几微克的水平,来调整最终制备物中的蛋白浓度。然后可以按照Harlow和Lane(《抗体实验指南》(Antibodies,A Laboratory Manual),Cold Spring Harbor Press.1988)所述,制备针对蛋白的单克隆或多克隆抗体。
可供选择地,可以针对合成的肽产生抗体,所述合成肽在可商购的肽合成仪上根据靶或内化受体多肽的预测氨基酸或已知序列来合成(Harlow和Lane,《抗体实验指南》(Antibodies,A Laboratory Manual),Cold Spring Harbor Press.1988)。
单克隆抗体可以通过各种已确立的技术从杂交瘤培养物分离和纯化。这样的分离技术包括使用蛋白A琼脂糖凝胶的亲和层析、尺寸排阻层析和离子交换层析。参见例如Coligan等,第2.7.1-2.7.12和2.9.1-2.9.3节;Barnes等,“免疫球蛋白G(IgG)的纯化”(Purification of Immunoglobulin G(IgG)),《分子生物学方法》(Methods in Molecular Biology)第10卷第79-104页中,Humana Press,1992。
多克隆或单克隆抗体可以通过例如结合到基质上并从基质洗脱来进一步纯化,所述基质结合有要针对它们产生抗体的多肽或肽。本技 术领域的专业人员将了解在免疫学技术领域中用于纯化和/或浓缩多克隆抗体以及单克隆抗体的各种常用技术(参见例如Coligan等,《免疫学现代方法》(Current Protocols in Immunology)的第9单元,Wiley Interscience,1991)。
为了通过Western印迹法确定给定抗体制备物(例如在小鼠中生产的)特异性结合目标的靶或内化受体多肽,从鼠类骨髓瘤细胞提取含有靶或内化受体多肽的全细胞蛋白,并将其在SDS-聚丙烯酰胺凝胶上电泳。然后将蛋白转移到膜(例如硝酸纤维素)上,并将待测抗体制备物与膜温育。在清洗膜以除去非特异性结合的抗体后,使用与酶例如碱性磷酸酶接合的抗小鼠抗体检测特异性结合的抗体的存在;施加底物5-溴-4-氯-3-吲哚基磷酸盐/硝基四氮唑蓝,通过免疫集中的碱性磷酸酶导致产生了致密的蓝色化合物。通过这种技术,与靶或内化受体多肽特异性结合的抗体将显示出结合于靶或内化受体多肽条带上(所述条带将集中在凝胶上由其分子量所决定的既定位置处)。可能发生抗体与其他蛋白(例如血清靶蛋白)的非特异性结合,并可以作为弱的信号在Western印迹上检测到。本技术领域的专业人员通过在Western印迹上获得的相对于由抗体-靶或内化受体多肽的特异性结合产生的强的主要信号来说弱的信号和/或不相关部分,认识到这种结合的非特异性本质。
D.肽的生产
P4肽、补体肽和源自于病原体的肽,可以通过克隆技术来制备。适合的克隆和测序技术的实例,以及足以指导专业技术人员许多克隆实践的说明,可见于:Sambrook等,《分子克隆实验指南》(Molecular Cloning:A Laboratory Manual)第2版,Vols.1-3,Cold Spring Harbor Laboratory(1989);Berger和Kimmel主编,《分子克隆技术指导》(Guide to Molecular Cloning Techniques),Academic Press,Inc.,San Diego CA(1987);或Ausubel等主编,《分子生物学现代方法》(Current Protocols in Molecular Biology),Greene Publishing and Wiley-Interscience,NY(1987)。来自生物试剂和实验设备制造商的产品信息也提供有用的信息。这些制造商包括SIGMA化学品公司((Saint Louis,MO)、R&D systems(Minneapolis,MN)、Pharmacia LKB Biotechnology(Piscataway,NJ)、CLONTECH oratories,Inc.(Palo Alto,CA)、Chem Genes Corp.、Aldrich化学品公司(Milwaukee,WI)、Glen Research,Inc.、GIBCO BRL Life Technologies,Inc.(Gaithersburg,MD)、Fluka Chemica-Biochemika Analytika(Fluka Chemie AG,Buchs,瑞士)、INVITROGENTM(San Diego,CA)和Applied Biosystems(Foster City,CA),以及专业技术人员所知的许多其他商业来源。在某些实例中。肽、例如补体肽,从对象、例如从对象的血液级份、例如从对象获得的血清来纯化。
在某些实施方案中,肽从例如用编码肽或其部分的多核苷酸转化或转染的细胞通过重组产生。用于操作编码本公开的肽或其部分的核酸并将其插入到用于表达多肽的载体中的方法,在本技术领域中是公知的(参见例如Sambrook等,《分子克隆实验指南》(Molecular Cloning,a Laboratory Manual),第2版,Cold Spring Harbor Press,Cold Spring Harbor,N.Y.,1989,和Ausubel等,《分子生物学现代方法》(Current Protocols in Molecular Biology),Greene Publishing Associates and John Wiley & Sons,New York,N.Y.,1994)。
编码本公开的肽或其部分的核酸构建物可以插入到质粒中。但是,其他载体(例如病毒载体、噬菌体、粘粒等),也可用于复制核酸。在本公开的情况下,核酸构建物典型是表达载体,其含有促进宿主被插入的遗传序列有效转录的启动子序列。表达载体典型含有复制原点、启动子以及允许转化细胞的表型筛选的特定核酸序列。
更通常情况下,编码本公开的肽或其部分的多核苷酸序列,可以与能够在导入宿主细胞后驱动核酸表达的任何启动子和/或增强子可操作连接。启动子是指导核酸转录的一系列核酸控制序列。包括组成型 和诱导型启动子(参见例如Bitter等,Methods in Enzymology 153:516-544,1987)。
通过将DNA转移到适合的宿主中,可以在体外表达编码肽或其部分的DNA序列。细胞可以是原核或真核细胞。宿主可以包括微生物、酵母、昆虫和哺乳动物生物体。术语还包括对象宿主细胞的任何后代。稳定转移——意味着外来DNA在宿主中连续维持——的方法,在本技术领域中是已知的。
用重组DNA转化宿主细胞,可以通过本技术领域的普通专业人员所公知的常规技术来进行。当宿主是原核生物例如大肠杆菌时,可以通过在指数生长期后收获细胞,然后使用本技术领域公知的程序通过CaCl2方法进行处理,来制备能够摄取DNA的感受态细胞。可供选择地,也可以使用MgCl2或RbCl。如果需要,转化也可以在形成宿主细胞的原生质体后进行,或通过电穿孔来进行。
当宿主是真核生物时,可以使用DNA转染方法例如磷酸钙共沉淀、常规机械程序例如包裹在脂质体中的质粒、或病毒载体的微注射、电穿孔、插入。真核细胞也可以用编码肽或其部分的多核苷酸和编码选择性表型的第二种外源DNA分子例如单纯性疱疹病毒胸腺嘧啶激酶基因进行共转染。另一种方法是使用真核的病毒载体例如猿猴病毒40(SV40)或牛乳头状瘤病毒来瞬时感染或转化真核细胞并表达蛋白(参见例如《真核病毒载体》(Eukaryotic Viral Vectors),Cold Spring Harbor Laboratory,Gluzman主编,1982)。然后可以使用本技术领域已知的方法从宿主细胞纯化肽。
源自于病原体和/或P4肽的免疫原性肽,也可以例如通过化学合成,利用本技术领域中已知的多种手动或自动合成方法中的任一种来生产。例如,在0.25毫摩尔(mmol)规模上进行的固相肽合成(SPPS),使用Applied Biosystems公司的431A型肽合成仪,并使用9-芴甲氧羰 基(Fmoc)氨基末端保护,与二环己基碳二亚胺/羟基苯并三唑或2-(1H-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐/羟基苯并三唑(HBTU/HOBT)偶联,并对于羧基末端酸使用对羟甲基苯氧基甲基聚苯乙烯(HMP)或Sasrin树脂,或对于羧基末端酰胺使用Rink酰胺树脂。
Fmoc衍生的氨基酸,从适合的前体氨基酸通过在三氟乙酸中的三苯基甲醇进行三苯甲基化,然后按照Atherton等,《固相肽合成》(Solid Phase Peptide Synthesis),IRL Press:Oxford,1989中的描述通过Fmoc衍生作用来制备。
使用1%TFA在二氯甲烷中的溶液切割Sasrin树脂结合的肽,以产生被保护的肽。当适宜时,通过在其中氨基酸侧链被保护的新生肽中使用叠氮磷酸二苯酯将氨基末端的游离胺与羧基末端的游离酸进行反应,将被保护的肽前体在氨基和羧基末端之间环化。
通常使用含有三氟乙酸(TFA)、任选还包含比例为100∶5∶5∶2.5的水、苯甲硫醚和乙二硫醇的溶液在室温下处理0.5-3小时,将HMP或Rink酰胺树脂结合的产物切下,并使含有被保护侧链的环化肽去保护。
粗品肽通过制备型高压液相色谱(HPLC)纯化,例如使用Waters Delta-Pak C18柱,并使用含有0.1%TFA的水通过改变乙腈进行梯度洗脱。在柱洗脱后,从洗脱级份中蒸发掉乙腈,然后将其冷冻干燥。如此生产和纯化的每种产物的身份,可以通过快原子轰击质谱术(FABMS)或电喷雾质谱术(ESMS)来证实。
通过这种方法生产的肽可用于为衍生出免疫原性肽的病原体产生调理性抗体。抗体的调理能力的测定方法,可以通过本技术领域的专业人员已知的方法来确定,例如在国际专利申请No. PCT/US2006/015499和美国专利申请No.11/910,517中描述的方法,所述专利申请在此以其全文引为参考。
提供了下面的实施例以说明某些实施方案的具体特点。但是,下面描述的具体特点不应被解释为对本公开范围的限制,而是作为实例,本技术领域的普通专业人员将能够识别出其等价物。
实施例
实施例1
本实施例描述了证明P4肽增强调理吞噬作用的试验。
材料与方法
肽的合成。被命名为P4、P6和P7的肽的氨基酸序列以前已被描述(参见例如Rajam等,Microb Pathog 2008;44:186-96;Romero-Steiner等,Vaccine 2006;24:3224-31)。具有游离N-和C-末端的纯肽在疾病控制和预防中心(Centers for Disease Control and Prevention(CDC))和Emory大学微量化学机构(Emory University Microchemical Facility)合成并冷冻干燥。在本实施例中使用的肽在Advanced ChemTech 396多路肽合成仪上利用标准和修改的9-芴甲氧羰基方案合成。将冷冻干燥的肽重悬浮在焦碳酸二乙酯(DEPC)水中,超声处理3分钟进行溶解,并储存在-70℃下。从P4序列产生了两种肽P6和/或P7。这些肽对所测试的真核细胞没有活化效应(参见Rajam等,Microb Pathog 44:186-96,2008)。这些肽在本实施例中描述的所有体外试验中用作阴性对照。
在本实施例中使用的种特异性抗体。球蛋白(Gamunex )已用作肺炎球菌血清型特异性多糖(Ps)抗体的来源(参见例如Rajam等,Clin Vaccine Immunol,14:1223-7,2007;Romero-Steiner等,Clin Diagn Lab Immunol 10:1019-24,2003)。QC2、QC5和QC268是CDC自产的质控人类血清,对于靶生物体具有指定的滴度(参见例如Martinez等,Clin Diagn Lab Immunol 9:485-8,2002;Martinez等,Clin Vaccine Immunol 13:459-66,2006)。如Srivastava等(Hybridoma 2000;19:23-31)描述的特异性针对肺炎球菌表面黏附素A的单克隆抗体8G12G11B10(8G12),也用作抗链球菌蛋白抗体的来源。对这些血清进行筛选以确保存在特异性抗体,并证实P4介导的免疫增强的特异性。体外试验设计包括对存在或不存在P4的情况下调理吞噬杀死(OPK)或摄取的变化进行直接比较。
OPK分析。在本实施例中,如Romero-Steiner等,Clin Diagn Lab Immunol,4:415-22,1997中所述,参比OPK分析与分化成粒细胞的人类早幼粒白血病细胞(HL-60)一起使用。用作肺炎链球菌血清型3(WU2)的血清型特异性抗体来源的γ-球蛋白在本分析中的增殖、储存和使用,如Romero-Steiner等,Clin Vaccine Immunol,13:165-9,2006和Rajam等,Clin Vaccine Immunol,14:1223-7,2007所述。在预调理阶段,向OPK分析混合物加入P4肽溶液(100μg/mL),对照孔代之以接受10μL DEPC水。也使用γ-球蛋白或8G12,利用肺炎链球菌血清型6B、15B、15C和19A评估了P4介导的OPK的增强。
流式细胞调理吞噬摄取分析。流式细胞调理吞噬分析(fOPA)使用分化成粒细胞或单核细胞的HL-60细胞,按照Martinez等,Clin Diagn Lab Immunol 9:485-8,2002;Martinez等,Clin Vaccine Immunol 13:459-66,2006;和Mezzatesta等,Infect Immun 42:99-105,1983的描述进行。使用自产的质控血清(QC5和QC268)分别作为抗肺炎链球菌血清型14和脑膜炎奈瑟菌A的荚膜Ps的血清型特异性抗体的来源。如Martinez等,Clin Diagn Lab Immunol 9:485-8,2002和Martinez等,Clin Vaccine Immunol 13:459-66,2006所述,将聚苯乙烯珠子与肺炎链球菌和非肺炎链球菌抗原共价连接,并用于fOPA中。在预调理阶段,向fOPA混合物加入P4肽溶液(100μg/mL),对照孔代之以接受10μL DEPC水。
肺炎链球菌分离株的OXYBURST 标记。为了证实在效应细胞中对P4介导的活化做出响应,细胞内呼吸爆发的增加,使用了 OXYBURST 示记的肺炎链球菌分离株。将一满环肺炎链球菌血清型23F的冷冻储用物,在增补有0.5%酵母提取物(THYE)的Todd-Hewitt肉汤(Difco)中生长过夜(在37℃和5%CO2下)。将一满环过夜培养物转移到1mL新鲜的THYE肉汤中,并温育3小时。从该培养物中取200μL转移到5mL THYE肉汤中并温育3小时,然后取1mL转移到5mLTHYE肉汤中并另外温育3小时(所有温育在37℃和5%CO2下进行)。在第三次传代后,将细菌悬液以6000g离心10分钟,并重悬浮在1mL 0.01mol/L磷酸盐缓冲的盐水(PBS)中。将OXYBURST 染色剂(INVITROGEN )用1mL去离子水复溶,并取50μL加入到1-mL细菌悬液中。使其在旋转摇床中在4℃下充分混合过夜。然后,将OXYBURST 标记的细菌悬液在PBS中洗涤两次,并代替聚苯乙烯珠作为抗原来源用于fOPA中。在本分析中使用了自产的质控血清(QC2)。
从人类血液分离多形核白细胞。肝素化的静脉血从Emory献血服务部(Emory Blood Donor Services)获得。使用白细胞分离试剂盒HISTOPAQUE -1119(Sigma),按照制造商推荐的方法从血液分离粒细胞。
小鼠种系。Swiss Webster(ND4-SW)种系的小鼠(Mus musculus)从Charles River Laboratories获得。在本研究中使用的小鼠为6-10周龄。所有实验得到机构委员会的批准,并按照用于动物实验的机构论理准则和安全准则进行。。
细菌菌株。肺炎链球菌WU2(血清型3)用于小鼠感染。该肺炎链球菌分离株从CDC的链球菌参比实验室(Streptococcal Reference Laboratory)筛选。简单来说,将肺炎链球菌分离株(冷冻储用物)在血琼脂板(添加5%绵羊血的血琼脂基质)上划线,并温育(在37℃和5%CO2中)18-24小时。使用接种环刮取血琼脂上的肺炎链球菌菌落,并在5mL THYE肉汤中生长~4小时(在37℃和5%CO2中),直到对数中期(492nm处光密度读数为0.5-0.6)。将该培养物(1.5mL)在2-mL 聚丙烯螺旋盖管中以10,000g离心5分钟,并将湿沉淀团重悬浮在1mL的0.1mol/L PBS(pH 7.2)中。将1-mL细菌悬液置于冰上并用于感染。也将其用PBS稀释10-6,并在血琼脂板上对活细菌载量进行计数。平均活细菌载量为4X107个细胞/mL。
鼻内感染。利用Briles等,J Infect Dis 188:339-48,2003描述的方法使用肺炎链球菌对小鼠进行鼻内感染。简单来说,对小鼠腹膜内注射20μL KETASET (100mg/mL盐酸开他敏;Wyeth)。当小鼠昏睡后,将40μL前面制备的细菌悬液逐滴靠近鼻施加,使小鼠吸入感染。
腹膜内(ip)和静脉内(iv)疗法。每只小鼠用4X107个肺炎链球菌WU2细胞感染,在48小时时在50%-60%的动物中产生濒死特征。在72小时时,所有被感染的小鼠濒死(n=60;濒死分值2-3[参见下文])。在感染后72和96小时时,将40只动物用γ-球蛋白被动免疫(100μL/小鼠;iv,n=20,ip,n=20)。在允许发生可能的体内预调理的20分钟时间后,通过iv或ip途径使20只被动免疫的小鼠(静脉内(iv),n=10;腹膜内(ip),n=10)接受P4(100μg;100μL/小鼠)。对照小鼠只给予DEPC水(100μL)或P4。开始时,测试1、10、100和1000μg的P4肽在小鼠中的毒性。将P4以100μL的恒定体积ip注射到10周龄ND4-SW小鼠中。即使在1000μg/小鼠的剂量下,P4也对小鼠没有明显的毒性效应。
濒死特征的计分。每天两次对小鼠进行监测,并对濒死特征进行目测计分。以5到0的等级为小鼠进行排序,其中5表示健康,皮毛、皮肤、眼睛、呼吸和活动/移动正常;4表示健康,但是开始看起来有病,毛皮起皱;3表示有病、皮毛起皱、活动减少;2表示病情严重、皮毛起皱、活动减少、有眼分泌物;1表示接近死亡、皮毛起皱、很少或不活动、有眼分泌物、呼吸减少(因此将这些动物安乐死);以及0表示死亡。
细胞因子分析。将P4处理的和对照的小鼠杀死并去头。从颈根部将血液快速收集在冷冻管中,并将其在4℃放置30分钟。然后将管以1000g离心10分钟。收集血清样品并立即用于细胞因子分析。利用基于LUMINEX 的LINCOPLEXTM小鼠22种细胞因子试剂盒(MCYTO-70K-PMX22;LINCO Research),使用制造商推荐的方案分析小鼠血清中的细胞因子。
统计学。除非另外指明,否则所有体外实验在3个独立的分析日进行三份平行试验。体内激惹实验重复>5次。处理后濒死动物的数量记录到166小时,并使用用于平均值的成对样品的t检验(Microsoft Excel 2003)分析数据在各个组之间的显著性差异。
结果
OPK分析。测试了P4肽在体外增强调理吞噬作用的潜力,数据在图1中给出。图1A中呈现的数据显示出P4介导的肺炎链球菌血清型3(WU2)的OPK的增加依赖于抗体浓度。尽管在γ-球蛋白1∶8稀释下观察到OPK增加了35%,但随着抗血清的稀释,效果逐渐降低(图1A)。P4介导的OPK的增加是补体依赖性的,因为在不存在补体源的情况下,没有观察到使用P4相对于对照的OPK的增加(图1B)。P4介导的OPK的增加依赖于反应混合物中P4的浓度。尽管在增补5μg/mL P4时没有观察到OPK的变化,但随着P4浓度的增加观察到了逐渐增加(对于10μg/mL来说为8%,对于50μg/mL来说为30%;对于100μg/mL来说为35%)。在100μg/mL浓度下,P4介导的OPK的增加达到平台(图1C)。使用γ-球蛋白或8G12作为特异性抗体来源,用肺炎链球菌血清型6B、15B、15C和19A时也记录到相似的P4介导的OPK的增加。
调理吞噬性摄取(OPU)分析。利用OXYBURST 标记的肺炎链球菌血清型23F(DS3848-03),通过吞噬细胞内呼吸爆发的改变测试了P4介导的调理吞噬作用的增强。P4介导的OPU增加的特征为吞噬细胞内呼吸爆发随着抗体稀释而逐渐降低(图2A)。图2B和2C中呈现的 数据显示,在存在抗原特异性抗体和补体的情况下,P4在活化不同效应细胞和增强OPU方面具有多能性。从新鲜人类血液分离的粒细胞使肺炎链球菌血清型14的Ps珠的OPU增加≥50%,其随着抗体的稀释而逐渐降低(对于1∶64来说为52%;对于1∶128来说为48%;对于1∶256来说为25%;对于1∶512来说为5%)(图2B)。图2C显示出在存在特异性抗体和效应细胞的情况下,P4能够增强对非肺炎链球菌抗原的体外调理吞噬作用。使用分化成单核细胞的HL-60细胞,记录到包被了脑膜炎奈瑟菌AP的珠子的OPU存在P4介导的增加(图2C)。
体内研究。将肺炎链球菌WU2感染的小鼠在感染后72和96小时时用γ-球蛋白和/或P4进行被动免疫。尽管未治疗的小鼠具有10%的存活率(10只中的1只),但单用γ-球蛋白治疗(iv和ip两者)的小鼠具有30%的存活率。另一方面,使用γ-球蛋白和P4通过iv治疗的10只小鼠中的8只(80%)(P<.001)和通过ip治疗的10只小鼠中的6只(60%)(P<.001),表现出从菌血症和濒临死亡的完全恢复(图3)。小鼠血清样品的细胞因子分析显示,在获救动物中细胞因子水平没有一致的模式或变化。
实施例2
本实施例描述了P4肽和抗生素的共同给药作为新的治疗方法来治疗严重肺炎球菌感染的评估。
材料与方法
在本实施例中使用的细菌、肽、抗体和抗生素。按照以前的描述使用肺炎链球菌血清型3(WU2)感染小鼠(Rajam等,J.Infect.Dis.199:1233-1238,1999)。按照以前的描述合成、纯化和制备了P4——一种28个氨基酸的肽,用于组合疗法(Carlone等,Microb.Pathog.44:186-196,2008)。使用γ-球蛋白(静脉内免疫球蛋白[IVIG];Gamunex,Telecris,NC)作为Pnc血清型特异性多糖抗体的来源(Frasch和Scott Clin.Diagn.Lab.Immunol.11:1158-1164,2004;Rajam等,Clin.Vaccine Immunol.14:1223-1227,2007;Romero-Steiner等,Clin.Diagn.Lab.Immunol.10:1019-1024,2003)。将一种广谱头孢菌素——头孢曲松(目录号C5793;Sigma-Aldrich,St.Louis,MO)溶解在磷酸盐缓冲的盐水(0.01M)中,并在磷酸盐缓冲的盐水中制备用于小鼠接种的工作溶液。
在本实施例中使用的小鼠。在本研究中使用了6到10周龄的雌性Swiss Webster小鼠(Charles River Laboratories,Wilmington,MA)。所有实验得到机构实验动物管理和使用委员会(Institutional Animal Care and Use Committee)(IACUC)批准,并按照用于动物实验的机构论理准则和安全准则执行。
鼻内感染。采用Briles等,2003描述的方法,使用Pnc分离株对小鼠进行鼻内感染。简单来说,对小鼠腹膜内(ip)注射20μl 100mg/ml盐酸开他敏(KETASET Wyeth)。当小鼠昏睡后,将40μl细菌悬液(~2.1X107个细胞/小鼠)逐滴靠近鼻施加,使小鼠吸入细菌。小鼠肮脏结合隆背体态或嗜睡标明濒死。大多数小鼠(80%)在暴露后48小时濒死。将濒死小鼠分成表1中显示的各种对照和治疗组(n=10/组)。对照组包括未治疗的动物或只接受P4、只接受IVIG、或只接受头孢曲松(0.3、3.0、300或3,000μg/小鼠)的动物。治疗组包括接受单一接种物的小鼠,所述接种物含有P4和IVIG,并含有或不含有三种不同剂量(0.3、3.0或300μg/小鼠)之一的头孢曲松。
组合疗法。使用Tailveiner固定器(型号TV-150;Braintree Scientific,Braintree,MA)将小鼠固定。使用25号针头和1-ml注射器静脉内(iv)给药IVIG和/或P4。首先给药IVIG(100-μl体积/小鼠),在20分钟后接着给药P4(每只小鼠50μg,在100-μl体积中)。在P4给药后30分钟给药头孢曲松(ip,100-μl体积/小鼠)。在治疗后7天或(在重复感染研究中)36天中,每天监测动物疾病发展的临床体征。对于重复治疗来说,将使用P4组合疗法挽救的小鼠在治疗后第28天重新感染,并再次用P4组合疗法治疗。尽管对照组中25到30%的小鼠在第一次激惹后存 活,但它们后来或者死于感染,或病入膏肓并因此被人道地安乐死。因此,没有来自第一次激惹的对照小鼠用于重复治疗。
菌血症测试。收集来自P4治疗和未治疗小鼠的血样(Rajam等,J.Infect.Dis.199:1233-1238,2009),将100-μl等份的肝素化血样铺在血琼脂板(添加5%绵羊血加庆大霉素[2.5mg/升]的血琼脂基质)上。将板在37℃和5%CO2中温育18到24小时,并对细菌进行计数。
P4增强的调理吞噬作用。我们使用了以前由Romero-Steiner等所描述的(Romero-Steiner等,Clin.Diagn.Lab.Immunol.4:415-422,1997)、使用从小鼠分离的多形核白细胞(PMN)(Devi等,Indian J.Physiol.Pharmacol.39:354-360,1995)的体外调理吞噬性杀死分析(OPKA)。从感染(用Pnc WU2)后1和2小时的小鼠或从未感染对照中,按照以前的描述(Frasch和Scott,2004)收集外周血样品,并分离白细胞衣级份(Devi等,1995)用作效应细胞来源。使用γ-球蛋白(Gamunex,Telecris,NC)作为血清型特异性抗体来源。肺炎链球菌血清型3(WU2)按照以前的描述(Rajam等,2007;Romero-Steiner,2006)繁殖、储存和用于本分析中。在预调理阶段向OPKA混合物加入100-μg/ml P4肽溶液,而对照孔接受焦炭酸二乙酯水。
用于抗P4 IgG的ELISA。在感染后14天从用P4疗法治疗的小鼠收集血液样品,并采用以前描述的方法(Rajam,2009)分离血清级份。酶联免疫吸附分析(ELISA)按照以前的描述并做少量修改后进行(Scott等,Clin.Diagn.Lab.Immunol.12:1195-1201,2005;Scott等,J.Infect.Dis.186:220-226,2002),以检测和定量抗蛋白的免疫球蛋白G(IgG)。简单来说,将ELISA板用浓度为5-μg/ml的P4肽包被。将板在4℃温育过夜,并用于检测和定量小鼠血清中的抗P4 IgG。使用辣根过氧化物酶标记的抗小鼠IgG(Sigma,St.Louis,MO)作为报告抗体。使用SUREBLUE 3,3’,5,5’-四甲基联苯胺(KPL,Gaithersburg,MD)作为底物,并使用1N HCl作为终止溶液。样品测定三份平行样,并包含适合 的阳性和阴性对照。
统计学。体内组合疗法实验重复3到5次,重复疗法执行一次。分别记录组合和重复疗法后直到7天和36天的濒死动物的数量,并在MICROSOFT Excel 2003中使用用于平均值的成对双样品t检验来分析数据在各个组之间的显著性差异。
结果
组合疗法。未治疗的对照小鼠(n=10)在168小时时具有30%的存活率。用3,000μg头孢曲松单独治疗的小鼠具有90%的存活率(图4)。另一方面,单独的较低剂量(300、3.0和0.3μg)的头孢曲松或P4提供的保护作用差,存活率与未治疗对照组的相当。用浓度为50μg的P4与IVIG一起单剂治疗濒死小鼠,产生70%的存活率(图4)。低剂量(300μg)头孢曲松与这种IVIG-P4治疗混合物的组合,将小鼠存活率增加到100%,明显好于未治疗对照(P<0.05)(图4)。
重复疗法。将用组合(P4、IVIG和头孢曲松)疗法从致命的肺炎链球菌WU2感染挽救的小鼠(n=10),在28天后用肺炎链球菌WU2重新感染,并在它们表现出濒死时用组合疗法重新治疗。P4介导的组合疗法挽救了所有被感染的动物(图5)。
菌血症测试。从P4治疗和未治疗的小鼠抽取血液样品并进行菌血症测试。来自未治疗对照小鼠的血样含有的细菌载量太高而无法计数。来自治疗动物的样品没有菌血症。
P4增强的调理吞噬作用。使用来自感染或未感染小鼠的PMN进行了OPKA。在存在血清型特异性IgG的情况下,与对照水平相比,添加P4显著增加(达到>80%;P<0.05)了Pnc(WU2)的体外调理吞噬性杀死(图6)。
用于抗P4 IgG的ELISA。使用小鼠IgG特异性ELISA测试了来自P4治疗小鼠的血清样品的抗P4抗体。所有样品的抗P4IgG均为阴性。
表1:研究设计
an=10/组。所有组以~2.1X107个细胞/40μl/小鼠鼻内接受肺炎链球菌(S.pneumoniae)血清型3(WU2)。
biv给药在100-μl体积中的50μg P4和100μl γ-球蛋白;头孢曲松以表明的剂量在100-μl体积中ip给药。+,包含在治疗混合物中;-,未包含在治疗混合物中。
实施例3
使用P4肽治疗对象
本实施例描述了可用于治疗患有目标病原体(例如术语概述中列出的病原体)感染或具有其感染风险的对象的方法,所述感染可以通过给药一种或多种P4肽以及任选的调理性抗体和/或补体蛋白,通过对目标病原体的调理吞噬作用进行治疗。在某些实例中,所述一种或多种P4肽不与调理性抗体和/或补体蛋白一同给药。在具体实例中,方法 包括筛选患有、据认为患有病原体感染或具有病原体感染的风险(例如由于免疫力受损、生理状态或暴露于病原体)的对象。可以对感染状态未知的对象进行检查,以确定他们是否具有感染,例如使用血清学测试、身体检查、酶联免疫吸附分析(ELISA)、放射学筛查或本技术领域的专业人员已知的其他诊断技术。在某些实例中,筛选具有病原体感染或具有获得病原体感染的风险的对象,所述病原体不表达肺炎球菌表面黏附素A(PsaA),例如对象不具有肺炎链球菌感染。选择被发现(或已知)具有病原体感染并因此可以通过给药P4肽治疗的对象来接受P4肽。也可以选择具有发生病原体感染的风险的对象,例如年老、免疫受损和非常年轻的对象,例如婴儿。
向所选的治疗对象给药治疗量的P4肽。P4肽可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重或甚至更高的剂量。但是,具体的剂量可以由训练有素的临床医生决定。药剂可以给药几剂,例如连续地、每日、每周或每月给药。
给药方式可以是本技术领域中使用的任何方式。给药于对象的药剂量可以由临床医生确定,并可能取决于待治疗的具体对象。本文中提供了示例性的具体量(但本公开不限于这些剂量)。
实施例4
使用P4肽和调理性抗体治疗对象
本实施例描述了可用于治疗患有目标病原体(例如术语概述中列出的病原体)感染或具有其感染风险的对象的方法,所述感染可以通过给药一种或多种P4肽和特异性结合目标病原体表面上存在的抗原的调理性抗体,通过对目标病原体的调理吞噬作用进行治疗。在具体实例中,方法包括筛选患有、据认为患有病原体感染或具有病原体感染的风险的对象。可以对感染状态未知的对象进行检查,以确定他们是 否具有感染,例如使用血清学测试、身体检查、酶联免疫吸附分析(ELISA)、放射学筛查或本技术领域的专业人员已知的其他诊断技术。在某些实例中,使用血清学测试、或使用特异性针对目标病原体的核酸探针或甚至可以同时鉴定几种病原体的一组核酸探针例如阵列,来筛查对象以鉴定具体的目标病原体。选择的对象被发现(或已知)具有来自目标病原体例如肺炎链球菌、化脓性链球菌、脑膜炎奈瑟菌或金黄色葡萄球菌例如耐甲氧西林的金黄色葡萄球菌(MRSA)的病原性感染,并因此可以通过给药P4肽联合特异性针对所检测目标病原体的调理性抗体治疗,使其接受P4肽和特异性针对目标病原体的调理性抗体。也可以选择具有发生病原体感染的风险的对象,例如暴露于已知目标病原体、年老、免疫受损和非常年轻的对象,例如婴儿。
向所选的治疗对象给药治疗量的P4肽。P4肽可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。向对象给药治疗量的特异性针对所鉴定的目标病原体的调理性抗体。调理性抗体可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。但是,具体的剂量可以由有训练有素的临床医生决定。P4肽可以与调理性抗体同时或顺序给药。P4肽和/或调理性抗体可以一剂或几剂给药,例如连续地、每日、每周或每月给药。当顺序给药时,P4肽和调理性抗体给药的时间间隔可以是数秒、数分钟、数小时、数日或甚至数周。
给药方式可以是本技术领域中使用的任何方式。给药于对象的药剂量可以由临床医生确定,并可能取决于所治疗的具体对象。本文中提供了示例性的具体量(但本公开不限于这些剂量)。
实施例5
使用抗生素、P4肽和调理性抗体的组合治疗对象
本实施例描述了可用于治疗患有目标病原体(例如术语概述中列出的病原体)感染或具有其感染风险的对象的方法,所述感染可以通过给药一种或多种P4肽和特异性结合目标病原体表面上存在的抗原的调理性抗体,通过对目标病原体的调理吞噬作用进行治疗。在具体实例中,方法包括筛选患有、据认为患有病原体感染或具有病原体感染的风险的对象。可以对感染状态未知的对象进行检查,以确定他们是否具有感染,例如使用血清学测试、身体检查、酶联免疫吸附分析(ELISA)、放射学筛查或本技术领域的专业人员已知的其他诊断技术。在某些实例中,使用血清学测试、或使用特异性针对目标病原体的核酸探针或甚至可以同时鉴定几种病原体的一组核酸探针例如阵列,来筛查对象以鉴定具体的目标病原体。选择的对象被发现(或已知)具有来自目标病原体例如肺炎链球菌、化脓性链球菌、脑膜炎奈瑟菌或金黄色葡萄球菌例如耐甲氧西林的金黄色葡萄球菌(MRSA)的病原性感染,并因此可以通过给药P4肽联合抗生素和特异性针对所检测的目标病原体的调理性抗体来治疗,将其给药P4肽和抗生素以及特异性针对目标病原体的调理性抗体。也可以选择具有发生病原体感染的风险的对象,例如暴露于已知目标病原体、年老、免疫受损和非常年轻的对象,例如婴儿。
向所选的治疗对象给药治疗量的P4肽。P4肽可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。向对象给药治疗量的特异性针对所鉴定的目标病原体的调理性抗体。调理性抗体可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。但是,具体的剂量可以由有训练有素的临床医生决定。向所选的治疗对象给药治疗量的P4肽。抗生素可以用每剂1μg/kg体重至约1mg/kg体重(取决于诸如抗生素的效力和/或类型等因素)的剂量给药,例如 每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。P4肽可以与抗生素和调理性抗体同时或顺序给药。
给药方式可以是本技术领域中使用的任何方式。给药于对象的药剂量可以由临床医生确定,并可能取决于所治疗的具体对象。本文中提供了示例性的具体量(但本公开不限于这些剂量)。
实施例6
使用P4肽和抗生素治疗对象
本实施例描述了可用于治疗患有目标病原体(例如术语概述中列出的病原体)感染或具有其感染风险的对象的方法,所述感染可以通过给药一种或多种P4肽和特异性结合目标病原体表面上存在的抗原的调理性抗体,通过对目标病原体的调理吞噬作用进行治疗。在具体实例中,方法包括筛选患有、据认为患有病原体感染或具有病原体感染的风险的对象。可以对感染状态未知的对象进行检查,以确定他们是否具有感染,例如使用血清学测试、身体检查、酶联免疫吸附分析(ELISA)、放射学筛查或本技术领域的专业人员已知的其他诊断技术。在某些实例中,使用血清学测试、或使用特异性针对目标病原体的核酸探针或甚至可以同时鉴定几种病原体的一组核酸探针例如阵列,来筛查对象以鉴定具体的目标病原体。选择的对象被发现(或已知)具有来自目标病原体例如肺炎链球菌、化脓性链球菌、脑膜炎奈瑟菌或金黄色葡萄球菌例如耐甲氧西林的金黄色葡萄球菌(MRSA)的病原性感染,并因此可以通过给药P4肽联合特异性针对所检测的目标病原体的抗生素治疗,对其给药P4肽和特异性针对目标病原体的抗生素。也可以选择具有发生病原体感染的风险的对象,例如暴露于已知目标病原体、年老、免疫受损和非常年轻的对象,例如婴儿。
向所选的治疗对象给药治疗量的P4肽。P4肽可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg 体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。向对象给药治疗量的特异性针对所鉴定的目标病原体的调理性抗体。抗生素可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。但是,具体的剂量可以由有训练有素的临床医生决定。P4肽可以与抗生素同时或顺序给药。P4肽和/或抗生素可以用一剂或几剂给药,例如连续地、每日、每周或每月给药。当顺序给药时,P4肽和抗生素给药的时间间隔可以是数秒、数分钟、数小时、数日或甚至数周。
给药方式可以是本技术领域中使用的任何方式。给药于对象的药剂量可以由临床医生确定,并可能取决于所治疗的具体对象。本文中提供了示例性的具体量(但本公开不限于这些剂量)。
实施例7
使用P4肽治疗具有肺炎风险的对象
本实施例描述了可用于治疗患有肺炎或具有肺炎风险的对象的方法,所述肺炎来自例如已知引起肺炎的病原体,例如肺炎链球菌。在具体实例中,方法包括筛选患有、据认为患有引起肺炎例如肺炎球菌疾病的病原体感染如肺炎链球菌感染或具有所述感染风险的对象。可以选择具有发生病原体感染的风险的对象,例如暴露于已知目标病原体、年老、免疫受损的(例如处在免疫抑制疗法中或HIV感染的)和非常年轻的对象,例如婴儿。可以将肺炎球菌感染例如肺炎链球菌感染的风险增加,与对抗肺炎链球菌的定植、吸入或侵袭的非特异性和特异性防御机制的缺陷相关联。这种缺陷的实例包括咳嗽反射降低、纤毛功能不良和免疫缺陷例如低γ球蛋白血症、补体缺陷、白细胞减少症或无脾。其他风险因子包括痴呆、癫痫病、当前吸食烟草例如吸烟、饮酒、充血性心力衰竭、脑血管疾病、收容和慢性阻塞性肺病(COPD)。在例如无脾对象中,侵入性肺炎球菌疾病的风险为每年约十万分之五百。
向所选的治疗对象给药治疗量的P4肽。P4肽可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。在某些实例中,还向对象给药治疗量的特异性针对所鉴定的目标病原体的调理性抗体。调理性抗体可以用每剂1μg/kg体重至约1mg/kg体重的剂量给药,例如每剂1μg/kg体重-100μg/kg体重、每剂100μg/kg体重-500μg/kg体重、或每剂500μg/kg体重-1000μg/kg体重的剂量。但是,具体的剂量可以由有训练有素的临床医生决定。P4肽可以与调理性抗体同时或顺序给药。P4肽和/或调理素抗体可以给药一剂或几剂,例如连续地、每日、每周或每月给药。当顺序给药时,P4肽和调理性抗体给药的时间间隔可以是数秒、数分钟、数小时、数日或甚至数周。
给药方式可以是本技术领域中使用的任何方式。给药于对象的药剂量可以由临床医生确定,并可取决于所治疗的具体对象。本文中提供了示例性的具体量(但本公开不限于这些剂量)。
尽管在描述本公开时强调了具体的实施方案,但对于本技术领域的专业人员来说,显然可以使用这些具体实施方案的变化形式,并且打算可以不按本文的具体描述来实践本公开。结合本发明的具体情况、实施方案或实施例描述的特点、特征、化合物、化学部分或实例,应该被理解为可适用于本发明的任何其他情况、实施方案或实施例。因此,本公开包括由下面的权利要求书所定义的本公开的精神和范围内所涵盖的所有修改。
Claims (34)
1.一种增强对象对目标病原体的调理吞噬作用的方法,所述方法包含:
选择患有目标病原体感染或具有发生目标病原体感染的风险的治疗对象;
向对象给药治疗有效量的分离的P4肽,所述P4肽包含与SEQ ID NO:1所显示的氨基酸序列有至少95%同一性的氨基酸序列;
向对象给药治疗有效量的、特异性结合目标病原体表面上存在的抗原的一种或多种外源的分离调理性抗体或其片段,从而增强对目标病原体的调理吞噬作用。
2.一种治疗和/或抑制对象目标病原体感染的方法,所述方法包含:
向对象给药分离的P4肽,所述P4肽包含与SEQ ID NO:1所显示的氨基酸序列有至少95%同一性的氨基酸序列;
向对象给药特异性结合目标病原体表面上存在的抗原的一种或多种分离的调理性抗体或其片段,从而在对象中治疗和/或抑制目标病原体感染。
3.一种在对象中增强对不表达肺炎球菌表面黏附素A(PsaA)蛋白的目标病原体的调理吞噬作用的方法,所述方法包含:
选择患有不表达肺炎球菌表面黏附素A(PsaA)蛋白的目标病原体感染或有发生所述目标病原体感染的风险的治疗对象;
向对象给药治疗有效量的分离的P4肽,所述P4肽包含与SEQ ID NO:1所显示的氨基酸序列有至少95%同一性的氨基酸序列,从而增强对目标病原体的调理吞噬作用。
4.权利要求3的方法,还包含向对象给药治疗有效量的、特异性结合目标病原体表面上存在的抗原的一种或多种外源的分离的调理性抗体或其片段。
5.权利要求1-4任一项的方法,其中P4肽包含SEQ ID NO:1所显示的氨基酸序列。
6.权利要求1-4任一项的方法,其中P4肽由SEQ ID NO:1所显示的氨基酸序列构成。
7.权利要求1-6任一项的方法,还包含向对象给药治疗有效量的用于目标病原体的抗生素。
8.权利要求7的方法,其中抗生素包括头孢曲松。
9.权利要求1-8任一项的方法,还包含向对象给药治疗有效量的分离的补体蛋白或其片段。
10.权利要求9的方法,其中补体蛋白片段补体是C3a、C3b、iC3b、C3d、C4b或C5a中的一种或多种。
11.权利要求1-10任一项的方法,其中分离的P4肽经鼻内途径、静脉内途径、局部途径、肠途径、肠胃外途径或玻璃体内途径中的一种或多种给药。
12.权利要求1-11任一项的方法,其中目标病原体是目标细菌病原体。
13.权利要求12的方法,其中目标细菌病原体是脑膜炎奈瑟菌(Neisseria meningitides)、化脓性链球菌(Streptococcus pyogenes)或金黄色葡萄球菌(Staphylococcus aureus)。
14.权利要求13的方法,其中金黄色葡萄球菌是耐甲氧西林金黄色葡萄球菌(MRSA)。
15.权利要求1-2任一项的方法,其中目标病原体是肺炎链球菌(Streptococcus pneumoniae)。
16.权利要求1-11任一项的方法,其中目标病原体是目标病毒病原体或病毒感染的目标细胞。
17.权利要求1-11任一项的方法,其中目标病原体是目标真菌病原体。
18.权利要求1-17任一项的方法,其中方法是抑制和/或治疗目标病原体的感染的方法。
19.权利要求1-18任一项的方法,还包含给药特异性结合一种或多种其他目标病原体表面上存在的抗原的一种或多种其他外源的分离的调理性抗体,从而增强对其他目标病原体的调理吞噬作用。
20.一种治疗组合物,其包含:
治疗有效量的分离的P4肽,所述P4肽包含与SEQ ID NO:1所显示的氨基酸序列有至少95%同一性的氨基酸序列;以及
治疗有效量的、特异性结合目标病原体表面上存在的抗原的一种或多种外源的分离的调理性抗体或其片段。
21.权利要求20的治疗组合物,其中P4肽包含SEQ ID NO:1所显示的氨基酸序列。
22.权利要求20的治疗组合物,其中P4肽由SEQ ID NO:1所显示的氨基酸序列构成。
23.权利要求20-22任一项的治疗组合物,所述治疗组合物还包含治疗有效量的用于目标病原体的抗生素。
24.权利要求23的方法,其中抗生素包括头孢曲松。
25.权利要求20-24任一项的治疗组合物,还包含治疗有效量的分离的补体蛋白或其片段。
26.权利要求25的治疗组合物,其中补体蛋白片段是C3a、C3b、iC3b、C3d、C4b或C5a中的一种或多种。
27.权利要求20-26任一项的治疗组合物,其中目标病原体是目标细菌病原体。
28.权利要求27的治疗组合物,其中目标细菌病原体是肺炎链球菌、化脓性链球菌、脑膜炎奈瑟菌或金黄色葡萄球菌。
29.权利要求28的治疗组合物,其中金黄色葡萄球菌是耐甲氧西林金黄色葡萄球菌(MRSA)。
30.权利要求20-26任一项的治疗组合物,其中目标病原体是目标病毒病原体或病毒病原体感染的目标细胞。
31.权利要求20-26任一项的治疗组合物,其中目标病原体是目标真菌病原体。
32.权利要求20-31任一项的治疗组合物,其用于制备治疗目标病原体感染的药物。
33.权利要求20-31任一项的治疗组合物,其用作治疗目标病原体感染的药物。
34.权利要求20-33任一项的组合物,其中组合物被配制用于鼻内、静脉内、局部、肠、肠胃外或玻璃体内给药。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US8520808P | 2008-07-31 | 2008-07-31 | |
| US61/085,208 | 2008-07-31 | ||
| PCT/US2009/052384 WO2010014888A2 (en) | 2008-07-31 | 2009-07-31 | Methods of enhancing opsonophagocytosis in response to a pathogen |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN102186495A true CN102186495A (zh) | 2011-09-14 |
| CN102186495B CN102186495B (zh) | 2014-11-26 |
Family
ID=41268303
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200980137625.XA Expired - Fee Related CN102186495B (zh) | 2008-07-31 | 2009-07-31 | 用于增强调理吞噬作用的肺炎球菌p4肽在对病原体应答中的应用 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US8431134B2 (zh) |
| EP (1) | EP2323684B1 (zh) |
| CN (1) | CN102186495B (zh) |
| ES (1) | ES2493040T3 (zh) |
| HK (1) | HK1160391A1 (zh) |
| WO (1) | WO2010014888A2 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109646435A (zh) * | 2019-01-11 | 2019-04-19 | 山东省农业科学院奶牛研究中心 | 厄他培南钠在制备防治牛传染性鼻气管炎药物中的应用 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111065388A (zh) * | 2017-09-07 | 2020-04-24 | 默沙东公司 | 肺炎球菌多糖及其在免疫原性多糖-载体蛋白缀合物中的用途 |
| EP4351735A2 (en) * | 2021-06-07 | 2024-04-17 | Janssen Biotech, Inc. | Materials and methods for differentiating creb regulated transcription coactivator 3 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006127020A1 (en) * | 2005-05-19 | 2006-11-30 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Health And Human Services, Centers For Disease Control And Prevention | FUNCTIONAL EPITOPES OF STREPTOCOCCUS PNEUMONIAE PsaA ANTIGEN AND USES THEREOF |
-
2009
- 2009-07-31 CN CN200980137625.XA patent/CN102186495B/zh not_active Expired - Fee Related
- 2009-07-31 WO PCT/US2009/052384 patent/WO2010014888A2/en active Application Filing
- 2009-07-31 EP EP09791040.0A patent/EP2323684B1/en active Active
- 2009-07-31 US US13/056,522 patent/US8431134B2/en active Active
- 2009-07-31 ES ES09791040.0T patent/ES2493040T3/es active Active
-
2012
- 2012-01-30 HK HK12100841.7A patent/HK1160391A1/zh not_active IP Right Cessation
-
2013
- 2013-03-27 US US13/851,508 patent/US9101582B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006127020A1 (en) * | 2005-05-19 | 2006-11-30 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Health And Human Services, Centers For Disease Control And Prevention | FUNCTIONAL EPITOPES OF STREPTOCOCCUS PNEUMONIAE PsaA ANTIGEN AND USES THEREOF |
Non-Patent Citations (2)
| Title |
|---|
| ROMERO-STEINER S ET AL: "Inhibition of pneumococcal adherence to human nasopharyngeal epithelial cells by anti-PsaA antibodies", 《CLIN DIAGNOS LAB IMMUNOL》 * |
| ROMERO-STEINER S ET AL: "Standardization of an opsonophagocytic assay for the measurement offunctional antibody activity against streptococcus pneumoniae using differentiated HL-60 cells", 《CLINICAL AND DIAGNOSTIC LABORATORY IMMUNOLOGY》 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109646435A (zh) * | 2019-01-11 | 2019-04-19 | 山东省农业科学院奶牛研究中心 | 厄他培南钠在制备防治牛传染性鼻气管炎药物中的应用 |
| CN109646435B (zh) * | 2019-01-11 | 2021-08-03 | 山东省农业科学院奶牛研究中心 | 厄他培南钠在制备防治牛传染性鼻气管炎药物中的应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2010014888A2 (en) | 2010-02-04 |
| WO2010014888A3 (en) | 2010-04-15 |
| ES2493040T3 (es) | 2014-09-11 |
| US8431134B2 (en) | 2013-04-30 |
| US20130195893A1 (en) | 2013-08-01 |
| US20110195075A1 (en) | 2011-08-11 |
| CN102186495B (zh) | 2014-11-26 |
| US9101582B2 (en) | 2015-08-11 |
| EP2323684A2 (en) | 2011-05-25 |
| HK1160391A1 (zh) | 2012-08-17 |
| EP2323684B1 (en) | 2014-05-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Nie et al. | Outer membrane protein A (OmpA) as a potential therapeutic target for Acinetobacter baumannii infection | |
| JP6694269B2 (ja) | S.アウレウス(S.aureus)表面決定基に対する抗体 | |
| CN103037885B (zh) | 与蛋白A(SpA)变体相关的组合物和方法 | |
| US10155820B2 (en) | Anti-endoglin antibodies and uses thereof | |
| CN111704672B (zh) | 抗血浆激肽释放酶抗体 | |
| EP2860191B1 (en) | Human monoclonal antibody against S. aureus derived alpha-toxin and its use in treating or preventing abscess formation | |
| CN104892753B (zh) | 一种中和人感染h7n9甲型流感病毒的抗体及其用途 | |
| BRPI1010307B1 (pt) | Polipeptídeos variantes de proteína a (spa), composição imunogênica compreendendo os mesmos, vacina, método de produção da referida vacina, bem como uso dos referidos polipeptídeos | |
| CN104640878B (zh) | 交叉反应的金黄色葡萄球菌抗体 | |
| US9926375B2 (en) | Anti-endoglin antibodies and uses thereof | |
| CA2687681A1 (en) | Antigen-binding proteins targeting s. aureus orf0657n | |
| US20160244511A1 (en) | Cross-reactive staphylococcus aureus antibody sequences | |
| Ter Meulen | Monoclonal antibodies in infectious diseases: clinical pipeline in 2011 | |
| US20160168237A1 (en) | Method for treating a complement mediated disorder caused by an infectious agent in a patient | |
| CN116693673B (zh) | 广谱抗SARS和SARS-CoV-2的纳米抗体、多价纳米抗体及其应用 | |
| WO2023008553A1 (ja) | 変異型コロナウイルスに対するニワトリ抗体 | |
| JP2022512647A (ja) | 抗黄色ブドウ球菌(Staphylococcus aureus)抗体の組み合わせ | |
| Yeaman et al. | Applying convergent immunity to innovative vaccines targeting Staphylococcus aureus | |
| Pan et al. | Development of horse neutralizing immunoglobulin and immunoglobulin fragments against Junín virus | |
| CN102186495A (zh) | 用于增强调理吞噬作用的肺炎球菌p4肽在对病原体应答中的应用 | |
| Zou et al. | Pore-forming alpha-hemolysin efficiently improves the immunogenicity and protective efficacy of protein antigens | |
| Scafa-Udriste et al. | Updates on Staphylococcal Vaccines | |
| CN108484760B (zh) | 一种抗蓖麻毒素免疫球蛋白F(ab’)2及其制备方法 | |
| US20240218056A1 (en) | Nucleocapsid-specific antibodies and methods for the treatment and prevention of sars-cov-2 infection therewith | |
| US20240285753A1 (en) | Epitope-scaffold immunogens for pancoronavirus vaccines |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1160391 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1160391 Country of ref document: HK |
|
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20141126 Termination date: 20200731 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |