Koolstof
Koolstof (Latijn: carbonium) is een scheikundig element met symbool C en atoomnummer 6. Het is een niet-metaal dat in verschillende vormen, allotropen, voorkomt. In de natuur komen de allotropen diamant, grafiet, amorfe koolstof en het zeldzame lonsdaleïet voor. Fullerenen zijn synthetische vormen van koolstof.
Geschiedenis
[bewerken | brontekst bewerken]Koolstof werd al in de prehistorische oudheid ontdekt en gebruikt in de vorm van houtskool, dat bereid werd door organisch materiaal (meestal hout) te verhitten in een zuurstofarme omgeving. Het Engelse carbon is dan ook afgeleid van het Latijnse woord voor houtskool.
Ook diamant, een andere allotroop van koolstof, is al lang bekend. Pas sinds enkele decennia is het mogelijk diamant synthetisch te vervaardigen. Fullereen, een derde allotroop, werd in de jaren 80 ontdekt tijdens het bestuderen van het massa-spectrum van een proef waarbij een laser koolstof deed verdampen.
Het was de Franse scheikundige Antoine Lavoisier die wist dat carbon pur (zuivere koolstof) een chemisch element was. Halverwege de achttiende eeuw was algemeen bekend dat diamant bij hoge temperaturen brandt. Maar Lavoisier toonde aan dat het verbrandingsproduct kooldioxide is, wat inhield dat diamant zuivere koolstof is. In 1779 ontdekte de Zweedse scheikundige Carl Wilhelm Scheele dat ook grafiet zuivere koolstof is.
Voorkomen
[bewerken | brontekst bewerken]Koolstof komt voor in de vorm van koolwaterstoffen, met name de fossiele brandstoffen aardgas en aardolie. Uit aardolie wordt in de petrochemische industrie onder andere benzine en kerosine gedestilleerd en het dient als basis voor veel synthetische stoffen, waaronder plastics.
Toepassingen
[bewerken | brontekst bewerken]Andere toepassingen zijn:
- De isotoop 14C (ontdekt op 27 februari 1940) wordt gebruikt bij koolstof-14-datering.
- Grafiet vormt het "streepvormend" deel in potloden, waarbij ook nog klei wordt toegevoegd voor stevigheid.
- Diamanten (pure koolstof) vinden toepassing in (kostbare) sieraden en worden om hun hardheid onder andere toegepast in boorkoppen.
- Bij de productie van staal is koolstof een van de stoffen die met het ijzererts wordt gemengd.
- In kernreactors wordt grafiet in staven toegepast om het kernsplijtingsproces te modereren, ofwel beheersbaar te houden.
- De chemische en structurele eigenschappen van fullerenen maken dat voor deze koolstofcomplexen misschien een veelbelovende rol is weggelegd in de nanotechnologie.
- In fijnverdeelde toestand (actieve kool) heeft kool een hoog specifiek oppervlak en kan gebruikt worden als absorbeermiddel. Het wordt wel gebruikt als filtermateriaal om vloeistoffen te ontkleuren en zelfs ingeslikt om gifstoffen uit het maag-darmkanaal te verwijderen ('Norit').
- Elektronicaweerstanden (grafietweerstand); koolstof is weliswaar een goede stroomgeleider, maar een dun laagje kan als weerstand dienen. Wel neemt de weerstand met toenemende temperatuur toe. (Hoe krachtiger de stroom, hoe hoger de temperatuur, en hoe hoger de weerstand.) Grafiet heeft daarbij als voordeel dat het temperatuurverhoging goed doorstaat.
- Koolhydraten als ethanol, suikers als sacharose, glucose, fructose, zetmeel enz.
- Plantaardige oliën en vetten en de verwerking daarvan in voeding en oleochemie.
- Als allerbelangrijkste: het element koolstof is onmisbaar voor alle levende wezens: alle organische verbindingen bevatten het element koolstof.
- Formule 1-auto's zijn van koolstofvezel gemaakt
Opmerkelijke eigenschappen
[bewerken | brontekst bewerken]Koolstof is een vierwaardig element dat in grote hoeveelheden op aarde voorkomt. Het heeft de unieke eigenschap zich stabiel met andere koolstofatomen te kunnen binden tot ringen en ketens, vertakt of onvertakt.
De vier belangrijkste allotropen zijn:
- grafiet, een van de zachtste bekende vaste stoffen, met een hardheid van 1,5, maar in de vorm van koolstofvezel wel met een hoge treksterkte;
- diamant, het hardste natuurlijke mineraal dat we kennen, met een hardheid van 10,0 op de hardheidsschaal van Mohs;
- amorf koolstof;
- fullerenen, synthetische holle structuren met elektrochemische eigenschappen die interessant zijn voor toepassing in nanotechnologie.
Daarnaast zijn er nog exotischer vormen ontdekt zoals lonsdaleïet, glasachtig koolstof en starre, rechte ketens als 'carbyne' (met alternerende enkelvoudige en drievoudige bindingen) en cumuleen (met alleen dubbele bindingen).
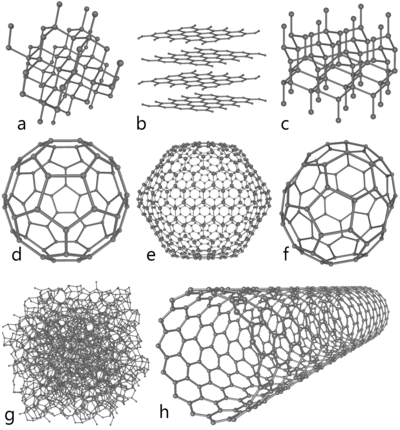
Bij normale druk vormt koolstof grafiet. Hierbij vormt elk koolstofatoom bindingen met drie andere koolstofatomen. Deze verbindingen liggen alle in hetzelfde vlak, dat bestaat uit gefuseerde hexagonale ringen, net als bij aromatische koolwaterstoffen. De twee bekende vormen van grafiet, alfa-hexagonaal en bèta-rombohedraal, hebben identieke fysische eigenschappen, maar verschillen in kristalstructuur. Natuurlijk grafiet kan tot 30% uit de bètavorm bestaan. Synthetisch grafiet bevat alleen de alfavorm. De alfavorm kan overgaan in de bètavorm door mechanische behandeling. Boven 1000 °C gaat de bètavorm weer over in de alfavorm.
Grafiet geleidt elektriciteit (door de delokalisatie van het p-orbitaal). Grafiet is zeer zacht en bestaat uit lagen die makkelijk over elkaar heen glijden, omdat de binding tussen de lagen alleen door vanderwaalskrachten wordt gevormd. De sterkte binnen een laag is wel weer groot, een eigenschap die bij koolstofvezels ('linten' van grafiet) tot uiting komt.
Bij zeer hoge druk kan de tweede allotrope vorm, diamant, ontstaan. In diamant vormt elk koolstofatoom bindingen met vier andere koolstofatomen. Diamant heeft dezelfde kubische structuur als silicium en germanium. De sterkte van de koolstof-koolstofbindingen maken diamant, samen met het iso-elektronische boornitride de hardst bekende verbindingen, die uiterst krasbestendig zijn.
Bij kamertemperatuur verloopt de overgang van grafiet naar diamant extreem traag. Onder sommige omstandigheden kristalliseert koolstof als Lonsdaleïet, een vorm die overeenkomsten vertoont met diamant, maar hexagonaal is.
Koolstof komt in zeer veel verschillende verbindingen voor, in alle organische levensvormen en vormt de basis voor de organische chemie. Koolstof heeft ook de interessante eigenschap dat het chemische verbindingen met zichzelf en talloze andere elementen kan aangaan (het aantal koolstofverbindingen is theoretisch onbeperkt). Koolstof vormt in verbinding met zuurstof onder andere CO2, dat van essentieel belang is voor plantengroei. In verbinding met waterstof vormt het zogenaamde koolwaterstoffen. Hiertoe behoren ook de vetzuren, waarvan vele onmisbaar zijn voor leven. Ook worden veel koolwaterstoffen als fossiele brandstoffen aangetroffen.
Koolstof is om vele redenen een bijzonder element. De verschillende toestanden lopen uiteen van een van de zachtst bekende materialen (grafiet) tot een van de hardste (diamant). Koolstof gaat gemakkelijk verbindingen aan met veel andere kleine atomen, waaronder ook andere koolstofatomen. Er zijn zo'n 10 miljoen koolstofverbindingen bekend. Koolstofverbindingen vormen de basis voor al het leven op aarde. De koolstof-stikstofcyclus is een van de processen die in de zon en andere sterren energie levert.
Koolstof werd niet gevormd bij het ontstaan van het heelal (in de Big Bang) vanwege het feit dat er drie botsingen tussen alfadeeltjes (heliumkernen) nodig zijn om koolstof te vormen. Het heelal koelde daarvoor in het begin te snel af. De vorming van koolstof vindt daarom voornamelijk in sterren plaats.
Fullerenen zijn genoemd naar de architect Buckminster Fuller, die soortgelijke constructies in architectonische ontwerpen introduceerde, en worden om dezelfde reden ook wel "buckyballs" en "buckytubes" genoemd. Fullerenen hebben een grafietachtige structuur, maar in plaats van een zuivere hexagonale opeenstapeling komen er ook pentagonale en mogelijk heptagonale ordeningen van koolstofatomen in voor, waardoor de lagen zich vormen tot bollen, ellipsen en cilinders. Aan de eigenschappen van fullerenen valt nog veel te ontdekken.
Verschijning
[bewerken | brontekst bewerken]Er zijn als gezegd zo'n 10 miljoen koolstofverbindingen bekend. Koolstof komt in grote hoeveelheden voor in sterren (en dus de zon), kometen en in de atmosfeer van veel planeten. Sommige meteorieten bevatten microscopisch kleine diamanten die gevormd zijn toen het zonnestelsel nog een protoplanetaire schijf was.
Koolstof komt in diverse verbindingen voor in de aardatmosfeer (als koolzuurgas), in water (als koolzuur), op de zeebodem (methaanhydraat) en in de aardkorst (steenkool, aardolie). In combinatie met kleinere hoeveelheden calcium, magnesium en ijzer komt koolstof op aarde ook in grote hoeveelheden voor in carbonaat en rotsgesteenten als kalksteen, dolomiet, marmer, etc.
Economische winning van grafiet vindt vooral plaats in China, India, Brazilië, Noord-Korea en Canada. [2]
Natuurlijke diamanten worden gevonden in oude vulkanische gesteenten, opgesloten in het mineraal kimberliet. De meeste diamanten worden gedolven in Afrika, vooral in Zuid-Afrika, Namibië, Botswana, de Republiek Congo en Sierra Leone. Verder worden diamanten gevonden in Canada, de Russische Poolzee, Brazilië en in Noord- en West-Australië.
Isotopen
[bewerken | brontekst bewerken]| Stabielste isotopen | |||||
|---|---|---|---|---|---|
| Iso | RA (%) | Halveringstijd | VV | VE (MeV) | VP |
| 11C | syn | 20,39 min | β+ | 1,982 | 11B |
| 12C | 98,89 | stabiel met 6 neutronen | |||
| 13C | 1,11 | stabiel met 7 neutronen | |||
| 14C | syn | 5730 j | β− | 0,156 | 14N |
Het element komt op aarde van nature als twee stabiele isotopen voor: 12C en 13C. Daarnaast is er een radioactief isotoop 14C (Koolstof 14) dat in de atmosfeer voortdurend aangemaakt wordt door kernreacties ten gevolge van de kosmische straling. Koolstof-14-datering wordt veel gebruikt om archeologische vondsten te dateren.
Ionen
[bewerken | brontekst bewerken]Strikt genomen komen er van koolstof geen vrije ionen voor, van koolstof zijn echter wel diverse oxidatiegetallen bekend.
| Oxidatiegetal | Toelichting |
|---|---|
| −4 | bijvoorbeeld in methaan |
| −3 | bijvoorbeeld in ethaan |
| −2 | bijvoorbeeld in etheen |
| −1 | bijvoorbeeld in ethyn |
| 0 | Vrij element, komt in de natuur voor als grafiet en diamant, maar ook in verbindingen als formaldehyde |
| +1 | bijvoorbeeld het centrale koolstofatoom in 2-methylpropan-2-ol |
| +2 | bijvoorbeeld in koolstofmonoxide of het centrale koolstofatoom in aceton |
| +3 | bijvoorbeeld het koolstofatoom in carbonzuren als azijnzuur en stearinezuur |
| +4 | bijvoorbeeld in koolstofdioxide of tetrachloormethaan |
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Koolstof wordt (beperkt) gebruikt als voedseladditief. In de EU is dit toegestaan onder E-nummer E153.
Roetuitstoot door onder andere het verkeer bestaat voor een belangrijk deel uit koolstof. Koolstof is daarmee een component van fijnstof.
Naast de talloze koolstofverbindingen zonder welke het leven op aarde niet mogelijk zou zijn, zijn er ook veel toxische koolstofverbindingen, waaronder:
- koolstofmonoxide (CO) dat onder andere voorkomt in uitlaatgassen van verbrandingsmotoren;
- het cyanide-ion (CN−), dat soms in mijnen wordt aangetroffen, maar ook een belangrijke toepassing heeft bij de productie van polymeren als polyurethaan.
Organische gassen zoals etheen (CH2=CH2) en methaan (CH4) zijn explosief en brandbaar wanneer ze met lucht (zuurstof) gemengd zijn.
- Vrijwel alle niet-ionaire koolstofverbindingen zijn in meer of mindere mate brandbaar.
Overzicht van koolstof-elementverbindingen
[bewerken | brontekst bewerken]Door de centrale plaats die koolstof in de organische chemie inneemt, en het feit dat het, net als zuurstof, met een groot aantal elementen directe bindingen kan aangaan, zijn de verschillende koolstof-elementverbindingen ook zelf uitgebreid onderwerp van studie geworden. In onderstaande tabel zijn de verwijzingen naar de verschillende studiegebieden in het periodiek systeem opgenomen.
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | CAr | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| Standaard verbinding in de organische chemie | Ruime toepassingen in de chemie |
| Academisch interessant, maar beperkte toepassing | Binding onbekend of niet beschreven |

