Emtricitabine
| Emtricitabine | ||||
|---|---|---|---|---|
| Chemische structuur | ||||
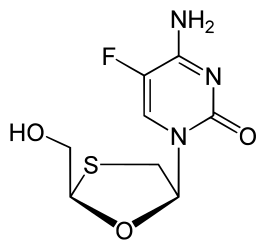
| ||||
| Farmaceutische gegevens | ||||
| Beschikbaarheid (F) | 93% | |||
| Metabolisatie | lever | |||
| Halveringstijd (t1/2) | 10 uur | |||
| Uitscheiding | renaal (86%) en fecaal (14%) | |||
| Gebruik | ||||
| Geneesmiddelengroep | antiretroviraal middel | |||
| Subklasse | nucleoside-analoge reversetranscriptaseremmer | |||
| Merknamen | Emtriva | |||
| Indicaties | HIV-1-infectie | |||
| Voorschrift/recept | ja | |||
| Toediening | oraal | |||
| Dosering | diverse | |||
| Databanken | ||||
| CAS-nummer | 147127-20-6 | |||
| ATC-code | J05AF09 | |||
| PubChem | 60877 | |||
| DrugBank | DB00879 | |||
| Chemische gegevens | ||||
| Molecuulformule | C8H10FN3O3S | |||
| IUPAC-naam | 4-amino-5-fluoro-1-[(2R,5S)-2-(hydroxymethyl)-1,3-oxathiolan-5-yl]-1,2-dihydropyrimidin-2-one | |||
| Molmassa | 247,248 g/mol | |||
| ||||
Emtricitabine, ook bekend als FTC, is een geneesmiddel dat gebruikt wordt voor de behandeling van hiv (als onderdeel van HAART). Binnen de antiretrovirale middelen behoort Emtricitabine tot de klasse van nucleoside-analoge reversetranscriptaseremmers.
De stof is opgenomen in de lijst van essentiële geneesmiddelen van de WHO.
Toedieningsvormen
[bewerken | brontekst bewerken]Emtricitabine is beschikbaar in capsules (200 mg) en als oplossing voor oraal gebruik (10 mg/mL).[1] Het wordt echter vooral toegepast als onderdeel van een de volgende combinatiepreparaten:
- Tenofovir disoproxil/emtricitabine (Truvada)
- Emtricitabine/tenofovir disoproxil/efavirenz (Atripla)
- Emtricitabine/rilpivirine/tenofovir disoproxil (Eviplera, Complera)
- Elvitegravir/cobicistat/emtricitabine/tenofovir disoproxil (Stribild)
De patenthouder van Emtricitabine is Gilead Sciences, die het middel op de markt brengt als Emtriva en in de bovengenoemde combinatiepreparaten.
Geschiedenis
[bewerken | brontekst bewerken]Emtricitabine werd ontdekt door de aan Emory University verbonden wetenschappers Dennis C. Liotta, Raymond F. Schinazi en Woo-Baeg Choi. Emory gaf het middel in 1996 in licentie aan Triangle Pharmaceuticals, een bedrijf dat in 2003 werd overgenomen door Gilead Sciences.[2] Gilead zette de ontwikkeling van emtricitabine voort en bracht het in 2003 op de markt.[3] Een jaar later werd emtricitabine in één tablet gecombineerd met het eveneens door Gilead geproduceerde tenofovir disoproxil. Dit combinatiepreparaat met de naam Truvada groeide uit tot een van de meest toegepaste middelen bij de behandeling van hiv.
Bijwerkingen
[bewerken | brontekst bewerken]De meest voorkomende bijwerkingen van emtricitabine zijn hoofdpijn, diarree, misselijkheid en spierpijn en -zwakheid. Als ernstige, zij het zeldzame bijwerking van het middel kan melkzuuracidose optreden.[4]
- ↑ Gilead Sciences - Emtriva
- ↑ Leaf, Clifton, "The Law of Unintended Consequences", Fortune Magazine, 19 september 2005. Gearchiveerd op 5 juni 2023.
- ↑ Goedgekeurd door de FDA (Verenigde Staten) op 2 juli 2003 (FDA Drug Approval Package) en in de Europese Unie op 24 oktober 2003 (EMA - Emtriva).
- ↑ Bijsluiter Emtriva. Gearchiveerd op 14 juni 2018. Geraadpleegd op 28 juni 2023.
