Hidrogen bromida
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC pilihan
Hidrogen bromida | |||
| Nama IUPAC sistematik
Bromana[1] | |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| 3587158 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.090 | ||
| Nombor EC |
| ||
| KEGG | |||
| MeSH | Hydrobromic+Acid | ||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| Nombor PBB | 1048 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
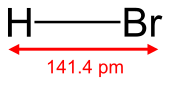
| HBr | |||
| Jisim molar | 80.91 g·mol−1 | ||
| Rupa bentuk | Gas tidak berwarna | ||
| Bau | Menusuk hidung | ||
| Ketumpatan | 3.6452 kg/m3 (0 °C, 1013 mbar)[2] | ||
| Takat lebur | −86.9 °C (−124.4 °F; 186.2 K) | ||
| Takat didih | −66.8 °C (−88.2 °F; 206.3 K) | ||
| 221 g/100 mL (0 °C) 204 g/100 mL (15 °C) 193 g/100 mL (20 °C) 130 g/100 mL (100 °C) | |||
| Keterlarutan | boleh larut dalam alkohol dan pelarut organik | ||
| Tekanan wap | 2.308 MPa (pada 21 °C) | ||
| Keasidan (pKa) | ~–9 [3] | ||
| Kebesan (pKb) | ~23 | ||
Indeks biasan (nD)
|
1.325 | ||
| Struktur | |||
| Bentuk molekul | Linear | ||
| Momen dwikutub | 820 mD | ||
| Termokimia | |||
| Muatan haba tentu, C | 350.7 mJ K-1 g-1 | ||
| Entropi molar piawai S |
198.696-198.704 J K-1 mol-1[4] | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
-36.45--36.13 kJ mol-1[4] | ||
| Bahaya | |||
| Piktogram GHS |  
| ||
| Perkataan isyarat GHS | Danger | ||
| H314, H335 | |||
| P261, P280, P305+351+338, P310 | |||
| NFPA 704 (berlian api) | |||
| Sebatian berkaitan | |||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Hidrogen bromida ialah molekul dwiatom dengan formula kimia HBr. HBr ialah gas dalam keadaan piawai. Asid hidrobromik terbentuk apabila HBr dilarutkan dalam air. Sebaliknya, HBr boleh dibebaskan daripada larutan asid hidrobromik dengan penambahan agen penyahhidratan, tetapi tidak melalui penyulingan. Oleh itu, hidrogen bromida dan asid hidrobromik bukan bahan yang sama, tetapi kedua-duanya berkait. Biasanya, ahli kimia merujuk kepada asid hidrobromik dengan nama "HBr", dan walaupun ia boleh difahami oleh kebanyakan ahli kimia, penggunaan ini tidak tepat dan boleh mengelirukan mereka yang kurang pakar.
Ciri-ciri fizikal
[sunting | sunting sumber]Pada suhu bilik, HBr ialah gas tidak boleh terbakar dengan bau yang menusuk hidung. Ia membentuk wasap dalam udara lembap kerana membentuk asid hidrobromik. HBr sangat terlarut dalam air; ia membentuk larutan asid hidrobromik yang berkepekatan 68.85% HBr mengikut berat pada suhu bilik. Larutan akua yang berkandungan 47.6% HBr mengikut berat membentuk campuran didih malar (azeotrop terbalik) yang mendidih pada suhu 124.3 °C. Pendidihan larutan yang kurang tertumpu membebaskan H2O sehingga komposisi campuran didih malar dicapai.
Kegunaan
[sunting | sunting sumber]Terdapat banyak kegunaan HBr dalam sintesis kimia. Misalnya, HBr digunakan untuk penghasilan alkil bromida daripada alkohol:
- ROH + HBr → RBr + H2O
HBr ditambahkan kepada alkena dan membentuk bromoalkana, kumpulan penting sebatian organobromin:
- RCH=CH2 + HBr → RCH(Br)-CH3
HBr ditambahkan kepada alkuna untuk membentuk bromoalkena. Stereokimia jenis penambahan ini biasanya anti:
- RC≡CH + HBr → RC(Br)=CH2
HBr ditambahkan kepada haloalkena untuk membentuk dihaloalkana geminal. (Jenis penambahan ini mematuhi aturan Markovnikov):
- RC(Br)=CH2 + HBr → RC(Br2)-CH3
Juga, HBr digunakan untuk membuka epoksida dan lakton, dan dalam sintesis bromoasetal. Tambahan lagi, HBr memangkin banyak tindak balas organik.[5][6][7][8]
HBr telah dicadangkan untuk digunakan dalam bateri jenis aliran skala utiliti.[9]
Penyediaan peringkat industri
[sunting | sunting sumber]Hidrogen bromida (dan asid hidrobromik) dihasilkan dalam skala yang lebih kecil daripada sebatian florida yang serupa. Dalam penyediaan peringkat industri utama, hidrogen dan bromin digabungkan pada suhu di antara 200-400 °C. Tindak balas ini biasanya dimangkin oleh platinum atau asbestos.[6][10]
Sintesis makmal
[sunting | sunting sumber]HBr boleh disintesis melalui pelbagai kaedah. Ia boleh dihasilkan di makmal melalui penyulingan larutan natrium atau kalium bromida dengan asid fosforik atau asid sulfurik cair:[11]
- 2KBr + H2SO4 → K2SO4 + 2HBr
Asid sulfurik pekat tidak berkesan kerana HBr yang terbentuk akan teroksida dan membebaskan gas bromin:
- 2HBr + H2SO4 → Br2 + SO2 + 2H2O
Asid ini boleh disediakan melalui kaedah-kaedah lain juga seperti tindak balas bromin sama ada dengan fosforus atau sulfur, dan air:[11]
- 2Br2 + S + 2H2O → 4HBr + SO2
Selain itu, HBr boleh dihasilkan melalui pembrominan tetralina (1,2,3,4-tetrahidronaftalena):[12]
- C10H12 + 4Br2 → C10H8Br4 + 4HBr
Hidrogen bromida juga boleh dibentuk oleh penurunan bromin oleh asid fosforus:[6]
- Br2 + H3PO3 + H2O → H3PO4 + 2HBr
Hidrogen bromida kontang boleh dihasilkan dalam skala kecil melalui termolisis trifenilfosfonium bromida dalam xilena merefluks.[5]
HBr yang disediakan menggunakan kaedah-kaedah di atas boleh dicemari oleh Br2, yang boleh dikeluarkan dengan menyalurkan gas tersebut melalui lingkaran Cu atau melalui fenol.[10]
Rujukan
[sunting | sunting sumber]- ^ "Hydrobromic Acid - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004. Identification and Related Records. Dicapai pada 10 November 2011.
- ^ Templat:GESTIS
- ^ Perrin, D. D. Dissociation constants of inorganic acids and bases in aqueous solution. Butterworths, London, 1969.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 0-618-94690-X.
- ^ a b Hercouet, A.;LeCorre, M. (1988) Triphenylphosphonium bromide: A convenient and quantitative source of gaseous hydrogen bromide. Synthesis, 157-158.
- ^ a b c Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford, Great Britain; 1997; pp. 809-812.
- ^ Carlin, William W. Templat:US Patent, April 3, 1979
- ^ Vollhardt, K. P. C.; Schore, N. E. Organic Chemistry: Structure and Function; 4th Ed.; W. H. Freeman and Company: New York, NY; 2003.
- ^ https://www1.eere.energy.gov/hydrogenandfuelcells/pdfs/30535ag.pdf
- ^ a b Ruhoff, J. R.; Burnett, R. E.; Reid, E. E. "Hydrogen Bromide (Anhydrous)" Organic Syntheses, Vol. 15, p.35 (Coll. Vol. 2, p.338).
- ^ a b Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ WebElements: Hydrogen Bromide