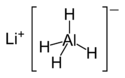
Tetraidroalluminato di litio
| Tetraidroalluminato di litio | |
|---|---|
 | |
| Nome IUPAC | |
| tetraidroalluminato di litio | |
| Abbreviazioni | |
| LAH | |
| Nomi alternativi | |
| litio alluminio idruro, idruro di litio e alluminio, alanato di litio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | LiAlH4 |
| Peso formula (u) | 37,95 |
| Aspetto | cristalli bianchi (puro) polvere grigia (prodotto commerciale) igroscopico |
| Numero CAS | |
| Numero EINECS | 240-877-9 |
| PubChem | 28112 |
| SMILES | [Li+].[AlH4-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,917 |
| Solubilità in acqua | reagisce violentemente |
| Temperatura di fusione | 150 °C (423 K) decomposizione |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −191 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 125 °C (398 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 260 - 314 |
| Consigli P | 223 - 231+232 - 280 - 305+351+338 - 370+378 - 422 [1][2] |
Il tetraidroalluminato di litio o litio alluminio idruro, comunemente abbreviato come LAH, è il composto inorganico di formula LiAlH4. Fu preparato per la prima volta da Finholt, Bond e Schlesinger nel 1947.[3] Il composto è usato come riducente in sintesi organica, specie per ridurre esteri, acidi carbossilici e ammidi. È un solido che reagisce pericolosamente con l'acqua liberando idrogeno gassoso (H2). Alcuni suoi derivati sono stati studiati al fine di immagazzinare idrogeno.
Proprietà
[modifica | modifica wikitesto]Il tetraidroalluminato di litio è un solido bianco, ma i campioni commerciali sono in genere grigi per la presenza di impurezze.[4] Può essere purificato per ricristallizzazione da etere dietilico; per operazioni su larga scala si usa un estrattore Soxhlet. Nelle sintesi si usa comunemente il composto impuro grigio, dato che le impurezze sono innocue e possono essere facilmente separate dai prodotti organici. Il tetraidroalluminato di litio in polvere è piroforico, mentre non lo è in cristalli più grossi.[5] Alcuni campioni commerciali contengono olio minerale per inibire la reazione con l'umidità atmosferica, ma in genere il prodotto è chiuso in sacchi di plastica a prova di umidità.[6]
Il tetraidroalluminato di litio reagisce con l'umidità atmosferica, e violentemente con l'acqua, sviluppando idrogeno:[4]
La reazione è un metodo utile per produrre idrogeno in laboratorio. Vecchi campioni di tetraidroalluminato di litio rimasti esposti all'aria sono spesso di colore bianco perché hanno assorbito abbastanza acqua da produrre una miscela di idrossido di litio e idrossido di alluminio, che sono entrambi bianchi.[7]
Stabilità
[modifica | modifica wikitesto]Il tetraidroalluminato di litio è stabile a temperatura ambiente in aria secca, ma si decompone rapidamente in presenza di umidità. Oltre i 100 °C si decompone, formando Li3AlH6 e altri prodotti. Lo studio del meccanismo di decomposizione ha evidenziato un processo a tre stadi:[8][9][10]

La reazione R1 inizia con la fusione del tetraidroalluminato di litio nell'intervallo di temperature 150−170 °C,[11][12][13] subito seguita dalla decomposizione con formazione del solido Li3AlH6, anche se è noto che la reazione R1 può avvenire anche a temperatura minore del punto di fusione del tetraidroalluminato di litio.[13] A circa 200 °C Li3AlH6 si decompone formando idruro di litio (LiH) (R2) e alluminio,[8][10][13] che poi si convertono in LiAl sopra i 400 °C (R3).[10] R1 è una reazione irreversibile. R3 è reversibile, con una pressione di equilibrio di circa 0,25 bar a 500 °C. R1 e R2 possono avvenire a temperatura ambiente con catalizzatori adatti.[14]
Solubilità
[modifica | modifica wikitesto]Il tetraidroalluminato di litio è solubile in molti eteri, ma tende a decomporsi spontaneamente a causa della presenza di impurezze presenti anche in quantità catalitica. In THF è meno solubile, ma più stabile, e di conseguenza in genere si preferisce usare THF anziché eteri.[15]
Struttura
[modifica | modifica wikitesto]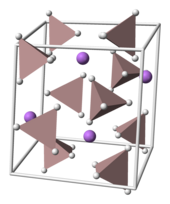
Il tetraidroalluminato di litio cristallizza nel gruppo spaziale monoclino P21/c (gruppo n°14). La cella elementare è definita dalle costanti di reticolo a = 4,82 Å, b = 7,81 Å e c = 7,92 Å con α = γ = 90° e β = 112°. Nel solido i centri Li+ sono attorniati da cinque tetraedri AlH4−. I centri Li+ sono legati ad un atomo di idrogeno di ciascuno dei tetraedri formando una disposizione a bipiramide. A pressione molto elevata (>2,2 GPa) si può avere una transizione di fase ottenendo la forma β-LAH.[16]
Sintesi
[modifica | modifica wikitesto]Il tetraidroalluminato di litio fu originariamente preparato facendo reagire idruro di litio e cloruro di alluminio:[3][4]
Oltre a questo metodo, la sintesi industriale[17] prevede di sintetizzare dapprima il sodio alluminio idruro a partire dagli elementi a temperatura e pressione elevata:
Il tetraidroalluminato di litio è quindi ottenuto per metatesi con cloruro di litio (LiCl):
Applicazioni
[modifica | modifica wikitesto]In chimica organica
[modifica | modifica wikitesto]Il tetraidroalluminato di litio è molto usato in chimica organica, dato che può reagire come riducente con più di 60 gruppi funzionali.[4] Nonostante questa versatilità, l'uso del tetraidroalluminato di litio è in declino, spesso sostituito da reagenti più selettivi e più economici come i boroidruri e altri idruri di alluminio come Na[AlEt2H2] e Na[Al(OCH2CH2OMe)2H2].[18] Il tetraidroalluminato di litio è più potente del boroidruro di sodio, NaBH4, perché il legame Al−H è più debole del legame B−H.[19] In genere viene usato in soluzione di etere dietilico, con successivo trattamento acido. Converte esteri, acidi carbossilici, aldeidi e chetoni nei corrispondenti alcoli. Analogamente converte ammidi, nitroderivati, nitrili, immine, ossime e azidi nelle rispettive ammine. Riduce i cationi di ammonio quaternario nelle corrispondenti ammine terziarie.
Il tetraidroalluminato di litio è usato soprattutto per ridurre esteri[20][21] e acidi carbossilici[22] ad alcoli primari; prima dell'avvento del tetraidroalluminato di litio questa conversione era difficile e richiedeva l'uso di sodio metallico in etanolo bollente (riduzione di Bouveault-Blanc). Anche aldeidi e chetoni[23] possono essere ridotti ad alcoli con tetraidroalluminato di litio, ma di solito si opera con reagenti più blandi come NaBH4; chetoni α,β-insaturi sono ridotti ad alcoli allilici.[24] Quando si usa il tetraidroalluminato di litio per ridurre epossidi, il reagente attacca l'estremità dell'epossido con meno ingombro sterico, e in genere si ottiene un alcol secondario o terziario.
La riduzione parziale di cloruri acilici per ottenere le corrispondenti aldeidi non si può effettuare con il tetraidroalluminato di litio perché quest'ultimo riduce direttamente all'alcol primario. Bisogna usare invece il litio alluminio tri(t-butossi)idruro, che reagisce più velocemente con il cloruro acilico che con l'aldeide.

Usando il tetraidroalluminato di litio si possono preparare ammine per riduzione di ammidi,[25][26] ossime,[27] nitrili, nitrocomposti o azidi alchiliche.
Il tetraidroalluminato di litio riduce anche gli alogenuri alchilici ad alcani, ma questa reazione viene usata raramente.[28][29] Gli ioduri alchilici reagiscono più velocemente, i bromuri alchilici sono meno veloci, e i cloruri alchilici ancora meno. Gli alogenuri primari sono più reattivi di quelli secondari. Gli alogenuri terziari reagiscono solo in alcuni casi.[30]
Il tetraidroalluminato di litio non riduce alcheni e areni semplici. Gli alchini sono ridotti solo se vicini ad un gruppo alcolico.[31]
In chimica inorganica
[modifica | modifica wikitesto]Il tetraidroalluminato di litio è molto usato per preparare idruri degli elementi dei gruppi principali e dei metalli di transizione, a partire da alogenuri metallici. Ad esempio si può preparare idruro di sodio, NaH, usando il cloruro di sodio, NaCl, con la seguente reazione:[32]
Il tetraidroalluminato di litio reagisce con leganti inorganici tipo NH3, PH3 e AsH3 riducendoli e coordinandoli.[32] Ad esempio
Immagazzinamento di idrogeno
[modifica | modifica wikitesto]Il tetraidroalluminato di litio contiene il 10,6% in peso di idrogeno ed è quindi un materiale su cui si sta speculando per immagazzinare idrogeno su futuri veicoli alimentati con pile a combustibile. Questi studi si sono intensificati da quando si è trovato che NaAlH4 drogato con titanio assorbe reversibilmente idrogeno.[33] Un notevole sforzo di ricerca è stato rivolto ad accelerare la cinetica di decomposizione drogando il materiale con un catalizzatore e usando un mulino a biglie.[34] Per sfruttare totalmente la quantità di idrogeno presente occorre deidrogenare anche l'intermedio LiH. Data la sua elevata stabilità termodinamica, questa reazione si può ottenere solo ad una temperatura oltre 400 °C, che non è considerata praticabile su un veicolo. Se ci si accontenta di arrivare a LiH + Al come prodotti finali, la capacità di immagazzinare idrogeno si riduce al 7,96% in peso. Un altro problema da risolvere per chiudere il ciclo è riformare tetraidroalluminato di litio; questo processo richiede pressioni di idrogeno molto elevate, oltre 10000 bar,[34] perché il tetraidroalluminato di litio è un composto relativamente poco stabile. Basando un ciclo sulla sola reazione R2 (vedi sopra), cioè usando Li3AlH6 come materiale di partenza, si otterrebbe un immagazzinamento del 5,6% in peso di idrogeno in un singolo processo. Sinora i vari tentativi in tal senso non hanno avuto successo.
Sicurezza
[modifica | modifica wikitesto]Come tutti gli idruri dei metalli alcalini e alcalino terrosi, anche il tetraidroalluminato di litio è pericoloso perché è corrosivo e infiammabile. A contatto con la pelle provoca gravi ustioni. La reazione con l'acqua è violenta e fortemente esotermica, così che l'idrogeno gassoso liberato può infiammarsi spontaneamente.[35]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 25.03.2014
- ^ In caso di incendio usare sabbia secca, prodotto chimico secco oppure schiuma resistente all'alcool per l'estinzione.
- ^ a b (EN) A.E. Finholt, A.C. Bond Jr. e H.I. Schlesinger, Lithium aluminum hydride, aluminum hydride and lithium gallium hydride, and some of their applications in organic and inorganic chemistry, in J. Am. Chem. Soc., vol. 69, n. 5, 1947, pp. 1199–1203, DOI:10.1021/ja01197a061.
- ^ a b c d (EN) G.C. Gerrans e P. Hartmann-Petersen, Sasol encyclopaedia of science and technology, New Africa Books, 2007, ISBN 1-86928-384-8.
- ^ (EN) R. Keese, M. Brändle e T.P. Toube, Practical organic synthesis: a student's guide, John Wiley and Sons, 2006, ISBN 0-470-02966-8.
- ^ (EN) A. Andreasen, T. Vegge e A.S. Pedersen, Dehydrogenation kinetics of as-received and ball-milled LiAlH4, in J. Solid State Chem., vol. 178, n. 12, 2005, pp. 3672-3678, DOI:10.1016/j.jssc.2005.09.027.
- ^ (EN) R. P.Pohanish, Sittig's handbook of toxic and hazardous chemicals and carcinogens, 5ª ed., Norwich, N.Y., William Andrew, 2008, ISBN 978-0-8155-1553-1.
- ^ a b (EN) T.N. Dymova, D.P. Aleksandrov, V. N. Konoplev, T.A. Silina e A.S. Sizareva, Russ. J. Coord. Chem., vol. 20, 1994, p. 1230.
- ^ (EN) J.A. Dilts e E.C. Ashby, Thermal decomposition of complex metal hydrides, in Inorg. Chem., vol. 11, n. 6, 1972, pp. 1230-1236, DOI:10.1021/ic50112a015.
- ^ a b c (EN) D. Blanchard, H. W. Brinks, B. C. Hauback e P. Norby, Desorption of LiAlH4 with Ti- and V-based additives, in Mat. Sci. Eng. B, vol. 108, n. 1-2, 2004, pp. 54-59, DOI:10.1016/j.mseb.2003.10.114.
- ^ (EN) J. Chen, N. Kuriyama, Q. Xu, H. T. Takeshita e T. Sakai, Reversible hydrogen storage via titanium-catalyzed LiAlH4 and Li3AlH6, in J. Phys. Chem. B, vol. 105, n. 45, 2001, pp. 11214–11220, DOI:10.1021/jp012127w.
- ^ (EN) V.P. Balema, V.K. Pecharskya e K.W. Dennis, Solid state phase transformations in LiAlH4 during high-energy ball-milling, in Journal of Alloys and Compounds, vol. 313, n. 1-2, 2000, pp. 69-74, DOI:10.1016/S0925-8388(00)01201-9.
- ^ a b c (EN) A. Andreasen, Effect of Ti-doping on the dehydrogenation kinetic parameters of lithium aluminum hydride, in Journal of Alloys and Compounds, vol. 419, n. 1-2, 2006, pp. 40-44, DOI:10.1016/j.jallcom.2005.09.067.
- ^ (EN) V.P. Balema, J.W. Wiench, K.W. Dennis, M. Pruski e V.K. Pecharsky, Titanium catalyzed solid-state transformations in LiAlH4 during high-energy ball-milling, in Journal of Alloys and Compounds, vol. 329, n. 1-2, 2001, pp. 108-114, DOI:10.1016/S0925-8388(01)01570-5.
- ^ (EN) V.I. Mikheeva e E.A. Troyanovskaya, Solubility of lithium aluminum hydride and lithium borohydride in diethyl ether, in Russ. Chem. Bull., vol. 20, n. 12, 1971, pp. 2497-2500, DOI:10.1007/BF00853610.
- ^ (EN) O.M. Løvvik, S.M. Opalka, H.W. Brinks e B.C. Hauback, Crystal structure and thermodynamic stability of the lithium alanates LiAlH4 and Li3AlH6, in Phys. Rev. B, vol. 69, n. 13, 2004, p. 134117, DOI:10.1103/PhysRevB.69.134117.
- ^ (EN) Greenwood, N.N. e Earnshaw, A., Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- ^ (EN) Red-Al, Sodium bis(2-methoxyethoxy)aluminumhydride, su organic-chemistry.org. URL consultato il 2 febbraio 2011.
- ^ (EN) W.G. Brown, Reductions by lithium aluminum hydride, in R. Adams (a cura di), Organic Reactions, Vol. 6, New York, John Wiley, 1951, ISBN.
- ^ (EN) M.T. Reetz, M.W. Drewes e R. Schwickardi, Preparation of enantiomerically pure α-N,N-dibenzylamino aldehydes: S-2-(N,N-dibenzylamino)-3-phenylpropanal, in Org. Synth., vol. 76, 1999, p. 110. URL consultato il 2 febbraio 2011.
- ^ (EN) R. Oi e K.B. Sharpless, 3-((1S)-1,2-dihydroxyethyl)-1,5-dihydro-3H-2,4-benzodioxepine, in Org. Synth., vol. 73, 1996, p. 1. URL consultato il 2 febbraio 2011.
- ^ (EN) B. Koppenhoefer e V. Schurig, (R)-alkyloxiranes of high enantiomeric purity from (S)-2-chloroalkanoic acids via (S)-2-chloro-1-alkanols: (R)-methyloxirane, in Org. Synth., vol. 66, 1988, p. 160. URL consultato il 2 febbraio 2011.
- ^ (EN) J.P. Barnier, J. Champion e J.M. Conia, Cyclopropanecarboxaldehyde, in Org. Synth., vol. 60, 1981, p. 25. URL consultato il 2 febbraio 2011.
- ^ (EN) I. Elphimoff-Felkin e P. Sarda, Reductive cleavage of allylic alcohols, ethers, or acetates to olefins: 3-methylcyclohexene, in Org. Synth., vol. 56, 1977, p. 101. URL consultato il 2 febbraio 2011.
- ^ (EN) D. Seebach, H.-O. Kalinowski, W. Langer, G. Crass e E.-M. Wilka, Chiral media for asymmetric solvent inductions. (S,S)-(+)-1,4-bis(dimethylamino)-2,3-dimethoxybutane from (R,R)-(+)-diethyl tartrate, in Org. Synth., vol. 61, 1983, p. 24. URL consultato il 2 febbraio 2011.
- ^ (EN) C.H. Park e H.E. Simmons, Macrocyclic diimines: 1,10-diazacyclooctadecane, in Org. Synth., vol. 54, 1974, p. 88. URL consultato il 2 febbraio 2011.
- ^ (EN) Y.K. Chen, S.J. Jeon, P.J. Walsh e W.A. Nugent, (2S)-(−)-3-exo-(Morpholino)isoborneol, in Org. Synth., vol. 82, 2005, p. 87. URL consultato il 2 febbraio 2011.
- ^ (EN) J.E. Johnson, R.H. Blizzard e H.W. Carhart, Hydrogenolysis of alkyl halides by lithium aluminum hydride, in J. Am. Chem. Soc., vol. 70, n. 11, 1948, pp. 3664–3665, DOI:10.1021/ja01191a035.
- ^ (EN) S. Krishnamurthy e H.C. Brown, Selective reductions. 28. The fast reaction of lithium aluminum hydride with alkyl halides in tetrahydrofuran. A reappraisal of the scope of the reaction, in J. Org. Chem., vol. 47, n. 2, 1982, pp. 276-280, DOI:10.1021/jo00341a018.
- ^ (EN) W. Carruthers, Some modern methods of organic synthesis, 3ª ed., Cambridge University Press, 1987, ISBN 0-521-31117-9.
- ^ (EN) P.A. Wender, D.A. Holt e S. Mc N. Sieburth, 2-Alkenyl carbinols from 2-halo ketones: 2-E-propenylcyclohexanol, in Org. Synth., vol. 64, 1986, p. 10. URL consultato il 2 febbraio 2011.
- ^ a b (EN) P. Patnaik, Handbook of inorganic chemicals, McGraw-Hill, 2003, ISBN 978-0-07-049439-8.
- ^ (EN) B. Bogdanovic e M. Schwickardi, Ti-doped alkali metal aluminium hydrides as potential novel reversible hydrogen storage materials, in Journal of Alloys and Compounds, vol. 253-254, 1997, pp. 1-9, DOI:10.1016/S0925-8388(96)03049-6.
- ^ a b (EN) R.A. Varin, T. Czujko e Z.S. Wronski, Nanomaterials for solid state hydrogen storage, Berlino, Springer, 2008, ISBN 978-0-387-77711-5.
- ^ Scheda di sicurezza di LiAlH4 (PDF), su carloerbareagenti.com. URL consultato il 3 febbraio 2011.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Tetraidroalluminato di litio
Wikimedia Commons contiene immagini o altri file su Tetraidroalluminato di litio
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) lithium aluminum hydride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.













![{\displaystyle {\ce {LiAlH + NH3 <=> Li[Al(NH2)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6e69b93e438bb9572f680940039576de8150262)