Tantalio
| Tantalio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | tantalio, Ta, 73 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | metalli di transizione | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 5 (VB), 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 16 650 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Durezza | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 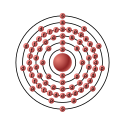 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 4F3/2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 180,94788 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calc.) | 145(200) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 138 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio di van der Waals | 142,5 pm[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Xe]4f145d3 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per livello energetico | 2, 8, 18, 32, 11, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 5, 4, 3, 2, −1 (mediamente acido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | cubica a corpo centrato | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 3 290 K (3 020 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 5 731 K (5 458 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 1,085×10−5 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 743 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 31,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 0,776 Pa a 3 269 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 3400 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 140 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 7,61×106/m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 57,5 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 761 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 500 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il tantalio è l'elemento chimico di numero atomico 73 e il suo simbolo è Ta.
È un metallo di transizione duro e duttile, lucido, di colore blu-grigio, molto resistente alla corrosione, soprattutto all'attacco degli acidi, ed è un buon conduttore di calore ed elettricità. È piuttosto raro in natura e si trova nei minerali tantalite-(Mg), tantalite-(Fe) e tantalite-(Mn). Il tantalio ha moltissime applicazioni: si usa in strumenti chirurgici, negli impianti di protesi intracorporee, perché non reagisce con i fluidi del corpo, ma anche nella realizzazione di condensatori di ridotte dimensioni per il mondo dell'elettronica di consumo e la telefonia mobile. Viene inoltre utilizzato nell'alta orologeria per la produzione di casse per orologi da polso.[2][3]
Caratteristiche
[modifica | modifica wikitesto]Il tantalio è molto resistente alla corrosione: per temperature al di sotto dei 150 °C lo si può considerare del tutto immune agli attacchi chimici, perfino a sostanze estremamente aggressive come l'acqua regia, e può essere intaccato soltanto dall'acido fluoridrico, da soluzioni acide contenenti lo ione fluoruro e da triossido di zolfo libero. Il tantalio ha un punto di fusione molto alto, superato soltanto dal tungsteno e dal renio (punto di fusione 3 290 K, punto di ebollizione 5 731 K). Il tantalio forma ossidi con stato di ossidazione +5 (Ta2O5, più stabile) e +4 (TaO2).
Applicazioni
[modifica | modifica wikitesto]L'uso principale per il tantalio, in forma di polvere metallica, è nella produzione di componenti elettronici, soprattutto condensatori al tantalio, di dimensioni molto ridotte in rapporto alla loro capacità. Questi vengono impiegati in quasi tutti i dispositivi elettronici portatili, come telefoni cellulari, computer portatili, lettori DVD, fotocamere e videocamere digitali ed elettronica per l'automobile.
Il tantalio è anche utilizzato in una grande varietà di leghe con alto punto di fusione, forte resistenza e buona duttilità. In lega con altri metalli è utilizzato anche per la fabbricazione di utensili al carburo per la lavorazione dei metalli e nella produzione di superleghe per motori a reazione, strumentazione per laboratori chimici e reattori nucleari e parti di missili.
Altri usi:
- La sua duttilità rende possibile farne fili finissimi, usati come riscaldatori elettrici per fare evaporare altri metalli, come l'alluminio.
- Per la sua inerzia chimica, il tantalio si usa anche per i ferri chirurgici e per le clips da sutura chirurgica.
- L'ossido di tantalio viene impiegato per vetri ad alto indice di rifrazione usati nelle lenti degli apparecchi fotografici.
- Il tantalio si usa anche per realizzare parti di forni sottovuoto.
- Il tantalio viene utilizzato per la preparazione di impianti chimici grazie alla sua elevata resistenza alla corrosione.
- In medicina si utilizza in componenti protesiche di anca, ginocchio e spalla
Storia
[modifica | modifica wikitesto]Il tantalio (dal greco antico Tantalos) fu scoperto in Svezia nel 1802 da Anders Ekeberg e isolato nel 1824 circa da Jöns Berzelius.[4] Molti chimici del tempo pensavano che il niobio e il tantalio fossero lo stesso elemento: questa opinione venne confutata nel 1844 e nel 1866, quando i ricercatori dimostrarono che l'acido niobico e l'acido tantalico erano due composti diversi.
I primi ricercatori furono capaci soltanto di isolare il metallo impuro: il primo tantalio metallico relativamente puro e duttile fu prodotto da Werner von Bolton nel 1903. I filamenti di tantalio furono usati nelle lampadine elettriche finché non vennero sostituiti da quelli in tungsteno.[5]
Il nome fu scelto da Ekeberg e deriva dal personaggio mitico di Tantalo (greco Τάνταλος Tántalos), padre di Niobe nella mitologia greca, che fu condannato dopo la sua morte a restare immerso nell'acqua fino alle ginocchia, mentre sopra di lui crescevano dei frutti perfetti che lo avrebbero tentato per l'eternità: se si chinava per bere, l'acqua spariva, e se alzava le braccia per cogliere i frutti, i rami che li reggevano si alzavano oltre la sua portata. In un certo senso questo somiglia al comportamento chimico del tantalio, che non si scioglie negli acidi.[5]
Guerra del coltan
[modifica | modifica wikitesto]Il coltan, abbreviazione della columbite-tantalite o columbo-tantalite, miscela di due ossidi ad alto tenore di tantalio, è presente in gran quantità nella zona orientale del Congo. La gestione dell'estrazione e del traffico di questo ed altri minerali (oro, cassiterite ecc.) da parte di organizzazioni paramilitari e guerriglieri africani, con relativo sfruttamento della manodopera locale, contribuisce all'instabilità decennale della zona e alla guerra civile. Le stesse Nazioni Unite sono impegnate in loco, prima nella missione MONUC e poi dal 2010 nella missione MONUSCO.[6] Nelle fonti giornalistiche tale conflitto viene spesso definito "guerra del Coltan", a partire da rapporti ONU che nel 2001 portarono alla luce la questione.[7]
Negli anni diverse aziende multinazionali sono state accusate di contribuire a tale traffico,[8] fino ad arrivare a forme di certificazione della provenienza.[9] Malgrado i milioni di morti causati dai conflitti, le ampie violazioni dei diritti umani riscontrate e il coinvolgimento del settore delle nuove tecnologie, la questione trova peraltro scarso spazio sui media.[10]
Disponibilità
[modifica | modifica wikitesto]Il tantalio si trova soprattutto nel minerale tantalite [(Fe, Mn) Ta2O6] ed euxenite-(Y) (altri minerali: samarskite e fergusonite). La tantalite si trova molto spesso mescolata con la columbite in un minerale chiamato columbite-tantalite (colloquialmente coltan).
Giacimenti di tantalio commercialmente sfruttati esistono in Australia, Brasile, Canada, Repubblica Democratica del Congo, Mozambico, Nigeria, Portogallo e Thailandia.
La separazione del tantalio dal niobio richiede un processo lungo, composto di molte fasi complicate. La produzione commerciale di questo elemento può sfruttare uno di molti metodi diversi, fra cui l'elettrolisi di fluorotantalato di potassio fuso o la sua riduzione con sodio, o la reazione fra carburo di tantalio e ossido di tantalio. Il tantalio si estrae anche come sottoprodotto dell'estrazione dello stagno.
| I maggiori produttori di tantalio nel 2019[11] | ||
|---|---|---|
| Posizione | Paese | Produzione (tonnellate) |
| 1 | 580 | |
| 2 | 430 | |
| 3 | 336 | |
| 4 | 180 | |
| 5 | 76 | |
| 6 | 70 | |
| 7 | 67 | |
| 8 | 38 | |
| 9 | 26 | |
Composti
[modifica | modifica wikitesto]Gli scienziati del Los Alamos National Laboratory americano hanno sviluppato un materiale composito di carburo di tantalio e grafite che si è dimostrato uno dei materiali più duri mai fabbricati dall'uomo.
Isotopi
[modifica | modifica wikitesto]Il tantalio reperibile in natura consiste di due isotopi: il Ta-181 (99,988%),[12][13] che è stabile, e il raro[14] Ta-180m (0,012%).[15] Quest'ultimo rappresenta lo stato eccitato del nuclide Ta-180, ossia un suo isomero nucleare (termine tecnico della fisica nucleare). L'isotopo Ta-180m, che ha spin 9-, è il primo stato eccitato di Ta-180, che ha spin1+. Questo stato eccitato Ta-180m si diseccita decadendo a Ta-180 per via elettromagnetica emettendo radiazione gamma di 77,2 keV. L'emivita per questo processo è estremamente elevata e per questo è difficile da misurare: è stimata in oltre 7·1015 anni.[15] Un importante fattore responsabile di un'emivita così lunga è il notevole divario di momento angolare nucleare tra lo stato eccitato e quello fondamentale,[16] e un altro è il piccolo divario energetico, cioè il piccolo guadagno di stabilità in seguito ad decadimento. Il Ta-180 così formatosi, a differenza di Ta-181, ha protoni e neutroni entrambi dispari e, anche per questo, è instabile: decade per l'85% per cattura elettronica a dare Hf-180 (stabile), e per il 15% per decadimento beta a dare W-180 (soggetto a decadimento alfa, ma osservativamente stabile), con un'emivita di 8,154 ore.[15] Il risultato è che il Ta-180 è l'unico isotopo ad essere presente in natura praticamente solo in uno stato eccitato.
Precauzioni
[modifica | modifica wikitesto]La polvere di questo metallo può incendiarsi e perfino esplodere, se riscaldata.
Note
[modifica | modifica wikitesto]- ^ Tantalo, su lenntech.it. URL consultato il 27 aprile 2013.
- ^ 26325TS.OO.D005CR.01 - Royal Oak Collezione, su Audemars Piguet - Le Brassus. URL consultato il 26 marzo 2018 (archiviato dall'url originale il 4 luglio 2018).
- ^ F.P.Journe Chronomètre Bleu | Calibre 1304, su www.fpjourne.com. URL consultato il 20 maggio 2024.
- ^ Icilio Guareschi, Jöns Jacob Berzelius e la sua opera scientifica: Brevi cenni sulla Chimica nella prima metà del secolo XIX (PDF), su liberliber.it, Torino, Unione Tipografico-Editrice, 1915.
- ^ a b Tantalio, su treccani.it, Treccani. URL consultato il 27 ottobre 2015.
- ^ MONUSCO, su un.org, ONU. URL consultato il 27 ottobre 2015.
- ^ Michael Nest, 1. Facts, figures and myths, in Coltan, John Wiley & Sons, 2013, ISBN 9780745637716.
- ^ Mineral firms 'fuel Congo unrest', su news.bbc.co.uk, BBC, 21 luglio 2009. URL consultato il 27 ottobre 2015.
- ^ What Is Coltan?, su abcnews.go.com, ABC. URL consultato il 27 ottobre 2015.
- ^ Mariagrazia Scaringella, Il costo umano di uno smartphone e tutto ciò che gira attorno al coltan, in la Repubblica, 19 luglio 2013. URL consultato il 27 ottobre 2015.
- ^ Statistiche sulla produzione di tantalio por USGS
- ^ Livechart - Table of Nuclides - Nuclear structure and decay data, su www-nds.iaea.org. URL consultato il 9 marzo 2022.
- ^ (DE) Markus Pfeifer, The Tantalum isotope inventory of terrestrial and early solar system materials, Universität zu Köln, 2017. URL consultato il 9 marzo 2022.
- ^ (EN) Mikael Hult, Joël Gasparro e Gerd Marissens, Underground search for the decay of Ta 180 m, in Physical Review C, vol. 74, n. 5, 27 novembre 2006, pp. 054311, DOI:10.1103/PhysRevC.74.054311. URL consultato il 9 marzo 2022.
- ^ a b c Livechart - Table of Nuclides - Nuclear structure and decay data, su www-nds.iaea.org. URL consultato il 9 marzo 2022.
- ^ (EN) V. Rakopoulos, M. Lantz e A. Solders, First isomeric yield ratio measurements by direct ion counting and implications for the angular momentum of the primary fission fragments, in Physical Review C, vol. 98, n. 2, 13 agosto 2018, pp. 024612, DOI:10.1103/PhysRevC.98.024612. URL consultato il 9 marzo 2022.
Bibliografia
[modifica | modifica wikitesto]- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «tantalio»
Wikizionario contiene il lemma di dizionario «tantalio» Wikimedia Commons contiene immagini o altri file sul tantalio
Wikimedia Commons contiene immagini o altri file sul tantalio
Collegamenti esterni
[modifica | modifica wikitesto]- tantalio, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) tantalum, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN, FR) Tantalio, su Enciclopedia canadese.
- (EN) Tantalio, su periodic.lanl.gov, Los Alamos National Laboratory. URL consultato il 23 aprile 2005 (archiviato dall'url originale l'11 gennaio 2010).
- (EN) Tantalio, su WebElements.com.
- (EN) Tantalio, su EnvironmentalChemistry.com.
- (EN) Tantalum-Niobium International Study Center, su tanb.org.
| Controllo di autorità | LCCN (EN) sh85132346 · GND (DE) 4059023-9 · J9U (EN, HE) 987007558428505171 · NDL (EN, JA) 00572700 |
|---|

