Dimercaprolo
| Dimercaprolo | |
|---|---|
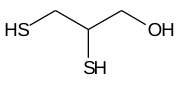 | |
 | |
| Nome IUPAC | |
| 2,3-disulfanilpropan-1-olo | |
| Nomi alternativi | |
| 2,3-dimercapto-1-propanolo, British anti-Lewisite, DMP, ditioglicerolo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H8S2O |
| Massa molecolare (u) | 124,225 |
| Numero CAS | |
| Numero EINECS | 200-433-7 |
| Codice ATC | V03 |
| PubChem | 3080 |
| DrugBank | DBDB06782 |
| SMILES | C(C(CS)S)O |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| Frasi H | 301 - 315 - 319 - 335 [1] |
| Consigli P | 261 - 301+310 - 305+351+338 |
Il dimercaprolo (o ditioglicerina) è un agente chelante dei metalli,[2] originariamente sintetizzato come antidoto della lewisite, un veleno chimico a uso bellico, ormai obsoleto, contenente arsenico.[3] È un alcol ed un ditiolo, ed è un composto irritante che si presenta come un liquido giallastro dall'odore caratteristico. Il composto è stato sintetizzato dai chimici che lavoravano presso la Oxford University nel corso della seconda guerra mondiale.[4][5][6] Al giorno d'oggi la molecola è utilizzata in ambito medico per il trattamento dell'avvelenamento da arsenico, mercurio, oro, piombo, antimonio, e di altri metalli tossici.[7] In passato è stato utilizzato per il trattamento della malattia di Wilson, una malattia genetica caratterizzata dalla tendenza dell'organismo a trattenere rame.[8][9][10]
Farmacodinamica
[modifica | modifica wikitesto]L'arsenico e altri metalli sono in grado di reagire con i residui tiolo di diversi enzimi metabolici, creando un complesso chelante che porta all'inibizione dell'enzima.[11] I gruppi sulfidrilici del dimercaprolo formano complessi solubili con i metalli (in particolare con arsenico, mercurio, oro) i quali non sono più in grado di legarsi ai ligandi dell'organismo, quali ad esempio gli enzimi che presentano anch'essi gruppi sulfidrilici (il gruppo funzionale proprio dei tioli o mercaptani). Il complesso metallo-chelante è formato da due molecole di dimercaprolo e da un atomo di metallo (2:1). Perché la terapia con dimercaprolo abbia successo si devono mantenere costanti i livelli plasmatici dell'agente chelante in modo che si possa formare continuamente il complesso che deve poter essere eliminato rapidamente. La somministrazione del farmaco dovrebbe avvenire quanto prima possibile, poiché il composto è molto più efficace nel prevenire l'inattivazione dei gruppi SH che nel riattivarli. Non è dimostrata l'attività del dimercaprolo nell'avvelenamento da antimonio, bismuto e tallio.

Farmacocinetica
[modifica | modifica wikitesto]Il dimercaprolo non può essere somministrato per via orale. A seguito di iniezione intramuscolare si raggiungono concentrazioni plasmatiche massime (Cmax) entro 30-60 minuti. Il composto viene assorbito anche dopo applicazione topica. Nell'organismo la molecola si distribuisce in tutti i tessuti biologici, in particolare negli spazi intracellulari, con concentrazioni più elevate nel fegato e nei reni. L'emivita plasmatica è breve, si ritiene inferiore alle 2 ore. La quota di dimercaprolo che non è eliminata in forma di complesso, viene metabolizzata rapidamente a composti inattivi che sono escreti attraverso l'emuntorio renale e le feci. Una parte del composto viene escreto in forma di glucuronide. Nell'organismo umano il farmaco è eliminato completamente entro 4 ore dalla somministrazione. Il complesso dimercaprolo-metallo si dissocia facilmente in ambiente acido liberando i due componenti che risultano entrambi nefrotossici. Al fine di prevenire la dissociazione e proteggere i reni dalla possibile tossicità alcuni Autori propongono di alcalinizzare le urine durante la terapia con dimercaprolo.
Tossicologia
[modifica | modifica wikitesto]Studi sperimentali sugli animali (ratto) hanno messo in evidenza una DL50 pari a 86,7 mg/kg peso corporeo, quando somministrato per via endovenosa, e di 105 mg/kg, quando somministrato per via intramuscolare.
Usi clinici
[modifica | modifica wikitesto]Il dimercaprolo è indicato nel trattamento dell'avvelenamento acuto da arsenico, oro e mercurio. In combinazione con edetato di calcio e di sodio è impiegato nel trattamento dell'avvelenamento acuto da piombo.[12][13][14]
Effetti collaterali e indesiderati
[modifica | modifica wikitesto]Gli effetti collaterali che si registrano più comunemente sono l'ipertensione arteriosa e la tachicardia. In diversi pazienti è possibile osservare disturbi gastrointestinali (nausea, vomito, dolore addominale) sensazione di bruciore localizzata a livello di labbra, bocca, gola, irritazione e bruciore agli occhi, lacrimazione, congiuntivite, scialorrea, parestesie (formicolio) alle estremità, senso di oppressione toracica, dolori e spasmi muscolari, rinorrea, sudorazione profusa, agitazione. Si può verificare inoltre dolore in sede di iniezione e comparsa di ascessi sterili. Nei bambini possono comparire febbre (che può essere persistente durante tutta la durata della terapia) e transitoria granulocitopenia. Il dimercaprolo provoca anemia emolitica nei soggetti portatori di deficit di glucosio 6-fosfato deidrogenasi.[15]
Gli effetti collaterali sono dose-dipendenti e nella maggior parte dei casi temporanei e reversibili. Dosi elevate possono condurre a coma e morte.[16] La somministrazione orale di 30–60 mg di efedrina solfato un'ora prima di ciascuna iniezione di dimercaprolo sembra alleviare gli effetti collaterali. Gli antistaminici possono essere efficaci nel trattamento di alcuni effetti indesiderati.
Controindicazioni
[modifica | modifica wikitesto]Il dimercaprolo sembra controindicato nei soggetti affetti da intossicazione da metilmercurio. Non deve essere impiegato come antidoto negli avvelenamenti da cadmio, ferro o selenio (senza fonte): con questi metalli forma infatti dei complessi che si sono dimostrati altamente nefrotossici. Deve essere usato con cautela nei pazienti affetti da ipertensione arteriosa o da alterazioni della funzione renale (insufficienza renale).
Dosi terapeutiche
[modifica | modifica wikitesto]Il dimercaprolo si somministra per iniezione intramuscolare profonda. Nelle forme lievi di avvelenamento da arsenico e da oro, si somministrano per intramuscolo 2,5 mg/kg peso corporeo ogni sei ore per due giorni, ogni 12 ore il terzo giorno e ogni 24 ore per i dieci giorni successivi.
Nelle forme più gravi di avvelenamento da arsenico e da oro, si somministrano 3 mg/kg ogni quattro ore per due giorni, ogni sei ore il terzo giorno e ogni dodici ore nei dieci giorni successivi.
Nelle intossicazioni acute da mercurio una dose iniziale di 5 mg/kg è seguita dalla somministrazione di 2,5 mg/kg, 1 o 2 volte al giorno, per dieci giorni consecutivi. Nell'encefalopatia acuta da piombo, si somministrano 4 mg/kg ogni 4 ore per due giorni e, successivamente, ogni 6-12 per 2-7 giorni. In concomitanza si somministra, sempre per via intramuscolare e ricorrendo a siti d'iniezione differenti, edetato di calcio e sodio.
Note
[modifica | modifica wikitesto]- ^ 2,3-Dimercapto-1-propanol for complexometry, for spectrophotometric det. of Cu, ≥98.0% | Sigma-Aldrich
- ^ A.K.M. Anisuzzaman, L.N. Owen, Dithiols. Part XXIII. Optically active forms of 2,3-dimercaptopropanol and related thiols, in J. Chem. Soc., 1967, pp. 1021-1026.
- ^ LA. Stocken, RH. Thompson, British anti-lewisite; arsenic derivatives of thiol proteins., in Biochem J, vol. 40, n. 4, Lug 1946, pp. 529-35, PMID 20273638.
- ^ RA. Peters, LA. Stocken; RH. Thompson, British anti-lewisite (BAL)., in Nature, vol. 156, 1945, pp. 616-9, PMID 21006485.
- ^ LL. Waters, C. Stock, Bal (British anti-lewisite)., in Science, vol. 102, n. 2658, Dic 1945, pp. 601-6, PMID 21004953.
- ^ JA. Vilensky, K. Redman, British anti-Lewisite (dimercaprol): an amazing history., in Ann Emerg Med, vol. 41, n. 3, Mar 2003, pp. 378-83, DOI:10.1067/mem.2003.72, PMID 12605205.
- ^ FW. Oehme, British anti-lewisite (BAL), the classic heavy metal antidote., in Clin Toxicol, vol. 5, n. 2, 1972, pp. 215-22, DOI:10.3109/15563657208991000, PMID 4559017.
- ^ D. Denny-Brown, H. Porter, The effect of BAL (2,3-dimercaptopropanol) on hepatolenticular degeneration (Wilson's disease)., in N Engl J Med, vol. 245, n. 24, Dic 1951, pp. 917-25, DOI:10.1056/NEJM195112132452401, PMID 14882450.
- ^ JN. Cumings, The effects of B.A.L. in hepatolenticular degeneration., in Brain, vol. 74, n. 1, Mar 1951, pp. 10-22, PMID 14830662.
- ^ JM. Walshe, Treatment of Wilson's disease: the historical background., in QJM, vol. 89, n. 7, Lug 1996, pp. 553-5, PMID 8759497.
- ^ M. Goldman, JC. Dacre, Lewisite: its chemistry, toxicology, and biological effects., in Rev Environ Contam Toxicol, vol. 110, 1989, pp. 75-115, PMID 2692088.
- ^ JJ. Chisolm, The use of chelating agents in the treatment of acute and chronic lead intoxication in childhood., in J Pediatr, vol. 73, n. 1, JLug 1968, pp. 1-38, PMID 4969284.
- ^ RF. Bell, JC. Gilliland; WS. Dunn, Urinary mercury and lead excretion in a case of mercurialism; differential excretion after administration of edathamil calcium and dimercaprol., in AMA Arch Ind Health, vol. 11, n. 3, Mar 1955, pp. 231-3, PMID 14349410.
- ^ ME. O'Connor, CaEDTA vs CaEDTA plus BAL to treat children with elevated blood lead levels., in Clin Pediatr (Phila), vol. 31, n. 7, Lug 1992, pp. 386-90, PMID 1617861.
- ^ N. Janakiraman, RA. Seeler; JE. Royal; MF. Chen, Hemolysis during BAL chelation therapy for high blood lead levels in two G6PD deficient children., in Clin Pediatr (Phila), vol. 17, n. 6, Giu 1978, pp. 485-7, PMID 417891.
- ^ P. Zvirblis, RI. Ellin, Acute systemic toxicity of pure dimercaprol and trimercaptopropane., in Toxicol Appl Pharmacol, vol. 36, n. 2, Mag 1976, pp. 297-9, PMID 1273847.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su dimercaprolo
Wikimedia Commons contiene immagini o altri file su dimercaprolo
Collegamenti esterni
[modifica | modifica wikitesto]- 2,3-dimercapto-1-propanòlo, su sapere.it, De Agostini.
- (EN) dimercaprol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 7520691-2 |
|---|
