Էպօքսիդ
| Ենթակատեգորիա | էպոքսիդային միացություն | |
|---|---|---|
| Մասն է | էպօքսիդի հիդրոլիզի ակտիվություն, էպոքսիդի մետաբոլիզմային գործընթաց | |
| SMARTS notation | C1OC1 | |
| Պատրաստման մեթոդ | էպօքսիդացում | |

Էպօքսիդ, օրգանական քիմիայում ցիկլային եթեր, որտեղ եթերը կազմում է երեք ատոմ օղակ՝ երկու ատոմ ածխածնի և մեկ ատոմ թթվածնի։ Այս եռանկյուն կառուցվածքն ունի օղակների զգալի լարվածություն, ինչը էպօքսիդները դարձնում է բարձր ռեակտիվ, ավելի շատ, քան մյուս եթերները: Դրանք արտադրվում են մեծ մասշտաբով բազմաթիվ կիրառությունների համար: Ընդհանուր առմամբ, ցածր մոլեկուլային քաշի էպօքսիդները անգույն են և ոչ բևեռային, հաճախ ցնդող[1]։
Անվանակարգ
[խմբագրել | խմբագրել կոդը]Էպօքսիդային ֆունկցիոնալ խումբ պարունակող միացությունը կարելի է անվանել էպօքսիդ, օքսիրան և էթօքսիլին։ Պարզ էպօքսիդները հաճախ կոչվում են օքսիդներ: Այսպիսով, էթիլենի էպօքսիդը (C2H4) էթիլենի օքսիդն է (C2H4O): Շատ միացություններ ունեն չնչին անուններ. Օրինակ, էթիլենի օքսիդը կոչվում է «օքսիրան»: Որոշ անուններ ընդգծում են էպօքսիդային ֆունկցիոնալ խմբի առկայությունը, ինչպես 1,2-էպօքսիհեպտան միացության մեջ, որը կարելի է անվանել նաև 1,2-հեպտեն օքսիդ։
Էպօքսիդային պրեկուրսորներից ձևավորված պոլիմերը կոչվում է էպօքսիդ: Այնուամենայնիվ, խեժի մեջ պարունակվող էպօքսիդային խմբերից քչերը գոյատևում են ամրացման գործընթացում:
Սինթեզ
[խմբագրել | խմբագրել կոդը]Արդյունաբերական ոլորտում գերիշխող էպօքսիդներն են էթիլենի օքսիդը և պրոպիլենօքսիդը, որոնք արտադրվում են համապատասխանաբար մոտավորապես 15 և 3 միլիոն տոննա/տարի մասշտաբներով։
Էթիլենի օքսիդից բացի, էպոօքսիդների մեծ մասը առաջանում է, երբ պերօքսիդացված ռեակտիվները մեկ թթվածնի ատոմ են նվիրաբերում ալկենին: Անվտանգության նկատառումները ազդում են այս ռեակցիաների վրա, քանի որ օրգանական պերօքսիդները հակված են ինքնաբուխ տարրալուծման կամ նույնիսկ այրման:
Ինչպես տ-բութիլ հիդրոպերօքսիդը, այնպես էլ էթիլբենզոլի հիդրոպերօքսիդը կարող են օգտագործվել որպես թթվածնի աղբյուրներ պրոպիլենային օքսիդացման ժամանակ (չնայած կատալիզատոր նույնպես պահանջվում է, և արդյունաբերական արտադրողների մեծամասնությունը դրա փոխարեն օգտագործում է ջրաքլորացում)[2]։
Էթիլենի օքսիդացում
[խմբագրել | խմբագրել կոդը]Էթիլենի օքսիդի արդյունաբերությունը արտադրում է էթիլենի և թթվածնի փոխազդեցությունից: Սովորաբար օգտագործվում են փոփոխված տարասեռ արծաթի կատալիզատորներ[3]։ Համաձայն ռեակցիայի մեխանիզմի, որն առաջարկվել է 1974 թվականին [4] առնվազն մեկ էթիլենի մոլեկուլ ամբողջությամբ օքսիդացված է յուրաքանչյուր վեցի համար, որոնք վերածվում են էթիլենի օքսիդի.
Միայն էթիլենն է թերի այրման ժամանակ արտադրում էպօքսիդ: Այլ ալկենները չեն կարողանում փոխազդել, նույնիսկ պրոպիլենը, թեև TS-1-ի օգնությամբ արծաթի կատալիզատորները կարող են ընտրովիորեն էպօքսիդացնել պրոպիլենը[5]։
Օրգանական պերօքսիդներ և մետաղական կատալիզատորներ
[խմբագրել | խմբագրել կոդը]Մետաղական կոմպլեքսները օգտակար կատալիզատորներ են ջրածնի պերօքսիդի և ալկիլ հիդրոպերօքսիդների մասնակցությամբ էպօքսիդացման համար: Մետաղով կատալիզացված էպօքսիդացումներն առաջին անգամ ուսումնասիրվել են՝ օգտագործելով տերտ-բութիլ հիդրոպերօքսիդ (TBHP)[6]։ Տերտ-բութիլ հիդրոպերօքսիդի միացումը մետաղի հետ (M) առաջացնում է ակտիվ մետաղի պերօքսի համալիր, որը պարունակում է MOOR խումբ, որն այնուհետև փոխանցում է O կենտրոնը ալկենին[7]։
Վանադիումի (II) օքսիդը կատալիզացնում է էպոօքսիդացումը հատուկ քիչ փոխարինված ալկեններում[8]։
Նուկլեոֆիլային էպօքսիդացում
[խմբագրել | խմբագրել կոդը]Էլեկտրոնների պակաս ունեցող ալկենոնները, ինչպիսիք են էնոնները և ակրիլային ածանցյալները, կարող են էպօքսիդացվել՝ օգտագործելով նուկլեոֆիլ թթվածնային միացություններ, ինչպիսիք են պերօքսիդները: Ռեակցիան երկաստիճան մեխանիզմ է։ Սկզբում թթվածինը կատարում է նուկլեոֆիլ զուգակցված հավելում` կայունացված կարբանիոն ստանալու համար: Այնուհետև այս կարբանիոնը հարձակվում է նույն թթվածնի ատոմի վրա՝ նրանից առանձնացնելով հեռացող խումբը, որպեսզի փակի էպոօքսիդի օղակը:
Ստացում պերօքսիկարբոքսիլաթթուներից
[խմբագրել | խմբագրել կոդը]Պերօքսիկարբոքսիլաթթուները, որոնք ավելի էլեկտրոֆիլ են, քան մյուս պերօքսիդները, առանց մետաղական կատալիզատորների միջամտության ալկենները վերածում են էպօքսիդների։ Մասնագիտացված կիրառություններում դիօքսիրանի ռեակտիվները (օրինակ՝ դիմեթիլդիօքսիրանը) գործում են նույն կերպ, բայց ավելի պայթուցիկ են:
Տիպիկ լաբորատոր գործողությունները օգտագործում են Պրիլեժաևի ռեակցիան[9][10]։ Այս մոտեցումը ներառում է ալկենի օքսիդացում պերօքսաթթվի հետ, ինչպիսին մետա-քլորոպերօքսիբենզոյաթթուն է: Պատկերավոր է ստիրոլի էպօքսիդացումը պերբենզոյաթթվով դեպի ստիրոլի օքսիդ[11]․
Ռեակցիայի ստերեոքիմիան բավականին զգայուն է։ Կախված ռեակցիայի մեխանիզմից և ալկենի սկզբնական նյութի երկրաչափությունից, կարող են ձևավորվել ցիս և/կամ տրանսէպօքսիդային դիաստերեոմերներ։ Բացի այդ, եթե սկզբնական նյութում առկա են այլ ստերեոկենտրոններ, դրանք կարող են ազդել էպօքսիդացման ստերեոքիմիայի վրա:
Փոխազդեցը տեղի է ունենում այն բանի միջոցով, որը սովորաբար հայտնի է որպես «Թիթեռների մեխանիզմ»[12]։ Թիթեռի մեխանիզմը թույլ է տալիս O−O սիգմա աստղի ուղեծրի իդեալական դիրքավորումը C−C π էլեկտրոնների հարձակման համար[13]։ Քանի որ երկու կապերը կոտրվել և ձևավորվել են էպօքսիդային թթվածնի հետ, սա պաշտոնապես կոարկտատային անցումային վիճակի օրինակ է:
Ասիմետրիկ էպօքսիդացիաներ
[խմբագրել | խմբագրել կոդը]Քիրալային էպօքսիդները հաճախ կարող են ստացվել էնանտոսելեկտիվ կերպով պրոքիրալ ալկեններից: Շատ մետաղական համալիրներ տալիս են ակտիվ կատալիզատորներ, բայց ամենակարևորը ներառում է տիտանը, վանադիումը և մոլիբդենը[14][15]։
Հիդրոպերօքսիդները նույնպես օգտագործվում են կատալիտիկ էնանտոսելեկտիվ էպօքսիդացումներում, ինչպիսիք են ոչ սուր էպօքսիդացումը և Յակոբսենի էպօքսիդացումը: Ոչ սուր էպօքսիդացման հետ մեկտեղ այս ռեակցիաները օգտակար են քիրալային էպօքսիդների էնանտոսելեկտիվ սինթեզի համար: Օքսազիրիդինի ռեակտիվները կարող են օգտագործվել նաև ալկեններից էպօքսիդներ ստանալու համար:
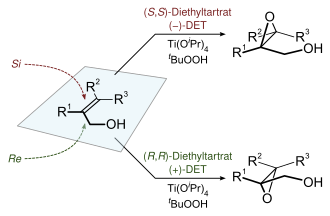
Սուր էպօքսիդացման ռեակցիան առաջնակարգ էնանտոսելեկտիվ քիմիական ռեակցիաներից մեկն է: Այն օգտագործվում է առաջնային և երկրորդային ալիլային սպիրտներից 2,3-էպօքսիալ սպիրտներ պատրաստելու համար[16][17]։
Դեհիդրոհալոգենացում և այլ γ հեռացումներ
[խմբագրել | խմբագրել կոդը]
Հալոհիդրինները փոխազդում են հիմքի հետ՝ առաջացնելով էպօքսիդներ[19]։ Ռեակցիան ինքնաբուխ է, քանի որ օղակի լարվածության ներդրման էներգետիկ արժեքը (13 կկալ/մոլ) փոխհատուցվում է նոր ներդրված C-O կապի ավելի մեծ կապի էնթալպիայով (երբ համեմատվում է ճեղքված C-հալոգեն կապի հետ):
Կանխատեսվում է, որ երկրորդային հալոհիդրիններից էպօքսիդների առաջացումը տեղի կունենա ավելի արագ, քան առաջնային հալոհիդրիններից՝ երկրորդային հալոհիդրինում էնտրոպիկ ազդեցությունների ավելացման պատճառով, իսկ երրորդային հալոհիդրինները արձագանքում են (եթե ընդհանրապես հնարավոր է լինում) չափազանց դանդաղ՝ ստերիկ կուտակման պատճառով[20]։
Սկսած պրոպիլեն քլորոհիդրինից՝ պրոպիլեն օքսիդի համաշխարհային պաշարների մեծ մասը առաջանում է այս ճանապարհով[2]։

Էպօքսիդի ներմոլեկուլային ձևավորման ռեակցիան Դարզենսի ռեակցիայի առանցքային քայլերից մեկն է:
Ջոնսոն–Կորի–Չայկովսկի ռեակցիայի ժամանակ էպօքսիդները առաջանում են կարբոնիլային խմբերից և սուլֆոնիումի իլիդներից։ Այս ռեակցիայում քլորիդի փոխարեն հեռացող խումբն է սուլֆոնիումը:
Կենսասինթեզ
[խմբագրել | խմբագրել կոդը]Էպօքսիդները բնության մեջ հազվադեպ են: Դրանք սովորաբար առաջանում են ալկենների թթվածնացման միջոցով՝ ցիտոքրոմ P450-ի ազդեցությամբ[21] (բայց կարճատև էպոքսեյկոզատրիենաթթուները գործում են որպես ազդանշանային մոլեկուլներ[22] և համանման էպoքսիդոկոզապենտաենաթթուներ և էպոքսիիկոսատետրաենաթթուներ)։
Արենի օքսիդները միջանկյալ նյութեր են ցիտոքրոմ P450-ով արենների օքսիդացման մեջ: Պրոքիրալ արենների համար (նաֆտալին, տոլուոլ, բենզոատներ, բենզոպիրեն) էպօքսիդները հաճախ ստանում են բարձր էնանտիէլեկտիվությամբ։
Ռեակցիաներ
[խմբագրել | խմբագրել կոդը]Օղակների բացման ռեակցիաները գերակշռում են էպօքսիդների ռեակտիվության մեջ:.
Հիդրոլիզ և նուկլեոֆիլների ավելացում
[խմբագրել | խմբագրել կոդը]Էպօքսիդները փոխազդում են նուկլեոֆիլների լայն տեսականիով, օրինակ՝ սպիրտների, ջրի, ամինների, թիոլների և նույնիսկ հալոգենիդների հետ։ Երկու հաճախ գրեթե համարժեք հարձակման վայրերի առկայության դեպքում էպօքսիդները «անմխիթար ենթաշերտերի» օրինակ են[23]։ Ասիմետրիկ էպօքսիդներում օղակի բացման ռեգիոընտրողականությունը հիմնականում հետևում է SN2 հարձակման օրինաչափությանը նվազագույն փոխարինված ածխածնի վրա[24], բայց կարող է ազդել կարբոկացիոն կայունության վրա թթվային պայմաններում[25]։ Ռեակցիաների այս դասը էպօքսիդային սոսինձների և գլիկոլների արտադրության հիմքն է[18]։
Լիթիումի ալյումինի հիդրիդը կամ ալյումինի հիդրիդը, երկուսն էլ նվազեցնում են էպօքսիդները հիդրիդի պարզ նուկլեոֆիլ հավելման միջոցով (H−), առաջացնում են համապատասխան սպիրտ[26]։
Պոլիմերացում և օլիգոմերացում
[խմբագրել | խմբագրել կոդը]Էպօքսիդների պոլիմերացումը տալիս է պոլիեթերներ։ Օրինակ, էթիլենի օքսիդը պոլիմերացվում է և ստանում է պոլիէթիլեն գլիկոլ, որը նաև հայտնի է որպես պոլիէթիլենային օքսիդ: Ալկոհոլի կամ ֆենոլի ռեակցիան էթիլենօքսիդի հետ՝ էթօքսիլացումը, լայնորեն օգտագործվում է մակերեսային ակտիվ նյութեր արտադրելու համար[27]․
- ROH + n C2H4O → R(OC2H4)nOH
Անհիդրիդների հետ էպօքսիդների փոխարկման արդյունքում առաջանում են պոլիէսթերներ[28]․
Մետաղացում և թթվածինացում
[խմբագրել | խմբագրել կոդը]Լիթիացիոն օղակը բաժանում է β-լիթիոալկօքսիդների[29]:
Էպօքսիդները կարող են թթվածինազրկվել օքսոֆիլ ռեակտիվների միջոցով՝ կոնֆիգուրացիայի կորստով կամ պահպանմամբ[30]: Վոլֆրամի հեքսաքլորիդի և n-բութիլիթիումի համադրությունը առաջացնում է ալկեն[31][32]։
Թիուրիայով մշակվելիս էպօքսիդները վերածվում են էպիսուլֆիդի (թիիրանների):
Այլ փոխարկումներ
[խմբագրել | խմբագրել կոդը]- Էպօքսիդները ենթարկվում են օղակի ընդլայնման ռեակցիաների, որոնք պատկերված են ածխածնի երկօքսիդի ներդրմամբ՝ ցիկլային կարբոնատներ ստանալու համար:
- Սպիրտին հարող էպօքսիդը կարող է ենթարկվել Փեյնի վերադասավորման հիմքում:
Օգտագործում
[խմբագրել | խմբագրել կոդը]-
Բիսֆենոլ Ա դիգլիցիդիլ եթերը սովորական կենցաղային «էպօքսիդային» բաղադրիչ է:
-
Էպօքսիդ գլիկիդոլի քիմիական կառուցվածքը սովորական քիմիական միջանկյալ նյութ է:
-
Էպոթիլոնները բնական էպօքսիդներ են:
-
3,4-էպօքսիցիկլոհեքսիլմեթիլ-3',4'-էպօքսիցիկլոհեքսան կարբոքսիլատ, ծածկույթների նախորդող.[33]
-
Էպօքսիդացված լինոլեին, էպօքսիդացված սոյայի յուղի (ESBO) հիմնական բաղադրիչը, որը առևտրային առումով կարևոր պլաստիկացնող միջոց է։
-
Բենզոլի օքսիդը հավասարակշռված է օքսեպինի իզոմերի հետ:
Անվտանգություն
[խմբագրել | խմբագրել կոդը]Էպօքսիդները ալկիլացնող նյութեր են, որոնցից շատերը դարձնում են խիստ թունավոր[34]։
Գրականություն
[խմբագրել | խմբագրել կոդը]- Massingill, J. L.; Bauer, R. S. (2000-01-01). «Epoxy Resins». In Craver, Clara D.; Carraher, Charles E. (eds.). Applied Polymer Science: 21st Century. Oxford: Pergamon. էջեր 393–424. doi:10.1016/b978-008043417-9/50023-4. ISBN 978-0-08-043417-9. Վերցված է 2023-12-20-ին.
Ծանոթագրություն
[խմբագրել | խմբագրել կոդը]- ↑ «Ullmann's Encyclopedia of Industrial Chemistry». Wikipedia (անգլերեն). 2024-06-25.
- ↑ 2,0 2,1 Dietmar Kahlich, Uwe Wiechern, Jörg Lindner "Propylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim.
- ↑ Sajkowski, D. J.; Boudart, M. (1987). «Structure Sensitivity of the Catalytic Oxidation of Ethene by Silver». Catalysis Reviews. 29 (4): 325–360. doi:10.1080/01614948708078611.
- ↑ Kilty P. A.; Sachtler W. M. H. (1974). «The mechanism of the selective oxidation of ethylene to ethylene oxide». Catalysis Reviews: Science and Engineering. 10: 1–16. doi:10.1080/01614947408079624.
- ↑ Nijhuis, T. Alexander; Makkee, Michiel; Moulijn, Jacob A.; Weckhuysen, Bert M. (1 May 2006). «The Production of Propene Oxide: Catalytic Processes and Recent Developments». Industrial & Engineering Chemistry Research. 45 (10): 3447–3459. doi:10.1021/ie0513090. hdl:1874/20149. S2CID 94240406.
- ↑ Indictor N., Brill W. F. (1965). «Metal Acetylacetonate Catalyzed Epoxidation of Olefins with t-Butyl Hydroperoxide». J. Org. Chem. 30 (6): 2074. doi:10.1021/jo01017a520.
- ↑ Thiel W. R. (1997). «Metal catalyzed oxidations. Part 5. Catalytic olefin epoxidation with seven-coordinate oxobisperoxo molybdenum complexes: a mechanistic study». Journal of Molecular Catalysis A: Chemical. 117: 449–454. doi:10.1016/S1381-1169(96)00291-9.
- ↑ Taber, Douglass (25 Sep 2006). «Selective reactions of Alkenes». Organic Chemistry Highlights.
- ↑ March, Jerry. 1985. Advanced Organic Chemistry, Reactions, Mechanisms and Structure. 3rd ed. John Wiley & Sons. 0-471-85472-7.
- ↑ Nikolaus Prileschajew (1909). «Oxydation ungesättigter Verbindungen mittels organischer Superoxyde» [Oxidation of unsaturated compounds by means of organic peroxides]. Berichte der Deutschen Chemischen Gesellschaft (գերմաներեն). 42 (4): 4811–4815. doi:10.1002/cber.190904204100.
- ↑ Կաղապար:OrgSynth
- ↑ Paul D. Bartlett (1950). «Recent work on the mechanisms of peroxide reactions». Record of Chemical Progress. 11: 47–51.
- ↑ John O. Edwards (1962). Peroxide Reaction Mechanisms. Interscience, New York. էջեր 67–106.
- ↑ Berrisford, D. J.; Bolm, C.; Sharpless, K. B. (2003). «Ligand-Accelerated Catalysis». Angew. Chem. Int. Ed. Engl. 95 (10): 1059–1070. doi:10.1002/anie.199510591.
- ↑ Sheldon R. A. (1980). «Synthetic and mechanistic aspects of metal-catalysed epoxidations with hydroperoxides». Journal of Molecular Catalysis. 1: 107–206. doi:10.1016/0304-5102(80)85010-3.
- ↑ Katsuki, T.; Sharpless, K. B. (1980). «The first practical method for asymmetric epoxidation». J. Am. Chem. Soc. 102 (18): 5974–5976. doi:10.1021/ja00538a077.
- ↑ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Synth., Coll. Vol. 7, p. 461 (1990); Vol. 63, p. 66 (1985). (Article Արխիվացված 2013-09-27 Wayback Machine)
- ↑ 18,0 18,1 Pham, Ha Q.; Marks, Maurice J. (2005). «Epoxy Resins». Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a09_547.pub2. ISBN 978-3527306732.
- ↑ Կաղապար:OrgSynth
- ↑ Silva, P.J. (2023). «Computational insights into the spontaneity of epoxide formation from halohydrins and other mechanistic details of Williamson's ether synthesis». Chem. J. Mold. 18 (2): 87–95. doi:10.19261/cjm.2023.1083.
- ↑ Thibodeaux C. J. (2012). «Enzymatic Chemistry of Cyclopropane, Epoxide, and Aziridine Biosynthesis». Chem. Rev. 112 (3): 1681–1709. doi:10.1021/cr200073d. PMC 3288687. PMID 22017381.
- ↑ Boron WF (2003). Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders. էջ 108. ISBN 978-1-4160-2328-9.
- ↑ Կաղապար:March6th
- ↑ Warren, Stuart; Wyatt, Paul (2008). Organic Synthesis: the disconnection approach (2nd ed.). Wiley. էջ 39.
- ↑ Rzepa, Henry (28 April 2013). «How to predict the regioselectivity of epoxide ring opening». Chemistry with a twist.
- ↑ Bruce Rickborn and Wallace E. Lamke (1967). «Reduction of epoxides. II. The lithium aluminum hydride and mixed hydride reduction of 3-methylcyclohexene oxide». J. Org. Chem. 32 (3): 537–539. doi:10.1021/jo01278a005.
- ↑ Kosswig, Kurt (2002). «Surfactants». In Elvers, Barbara; և այլք: (eds.). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim, GER: Wiley-VCH. doi:10.1002/14356007.a25_747. ISBN 978-3527306732.
- ↑ Julie M. Longo; Maria J. Sanford; Geoffrey W. Coates (2016). «Ring-Opening Copolymerization of Epoxides and Cyclic Anhydrides with Discrete Metal Complexes: Structure–Property Relationships». Chem. Rev. 116 (24): 15167–15197. doi:10.1021/acs.chemrev.6b00553. PMID 27936619.
- ↑ B. Mudryk; T. Cohen (1995). «1,3-Diols From Lithium Β-lithioalkoxides Generated By The Reductive Lithiation Of Epoxides: 2,5-dimethyl-2,4-hexanediol». Org. Synth. 72: 173. doi:10.15227/orgsyn.072.0173.
- ↑ Takuya Nakagiri; Masahito Murai; Kazuhiko Takai (2015). «Stereospecific Deoxygenation of Aliphatic Epoxides to Alkenes under Rhenium Catalysis». Org. Lett. 17 (13): 3346–9. doi:10.1021/acs.orglett.5b01583. PMID 26065934.
- ↑ K. Barry Sharpless, Martha A. Umbreit (1981). «Deoxygenation of Epoxides with Lower Valent Tungsten Halides: trans-Cyclododecene». Org. Synth. 60: 29. doi:10.15227/orgsyn.060.0029.
- ↑ K. Barry Sharpless; Martha A. Umbreit; Marjorie T. Nieh; Thomas C. Flood (1972). «Lower valent tungsten halides. New class of reagents for deoxygenation of organic molecules». J. Am. Chem. Soc. 94 (18): 6538–6540. doi:10.1021/ja00773a045.
- ↑ Sasaki, Hiroshi (February 2007). «Curing properties of cycloaliphatic epoxy derivatives». Progress in Organic Coatings. 58 (2–3): 227–230. doi:10.1016/j.porgcoat.2006.09.030.
- ↑ Niederer, Christian; Behra, Renata; Harder, Angela; Schwarzenbach, René P.; Escher, Beate I. (2004). «Mechanistic approaches for evaluating the toxicity of reactive organochlorines and epoxides in green algae». Environmental Toxicology and Chemistry. 23 (3): 697–704. doi:10.1897/03-83. PMID 15285364. S2CID 847639.








![3,4-էպօքսիցիկլոհեքսիլմեթիլ-3',4'-էպօքսիցիկլոհեքսան կարբոքսիլատ, ծածկույթների նախորդող.[33]](https://upload.wikimedia.org/wikipedia/commons/thumb/0/0e/Diepoxyester.svg/120px-Diepoxyester.svg.png)
