Szulfámsav
| Szulfámsav | |||
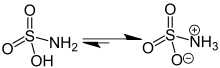 A szulfámsav tautomériája | |||
 A semleges szulfámsav pálcikamodellje |
 Az ikerionos szulfámsav pálcikamodellje | ||

| |||
| IUPAC-név | Szulfámsav | ||
| Más nevek | amido-kénsav, kénsav-amid, amido-szulfonsav, szulfamidsav, szulfaminsav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 5329-14-6 | ||
| PubChem | 5987 | ||
| ChemSpider | 5767 | ||
| EINECS-szám | 226-218-8 | ||
| ChEBI | 9330 | ||
| RTECS szám | WO5950000 | ||
| |||
| |||
| InChIKey | IIACRCGMVDHOTQ-UHFFFAOYSA-N | ||
| ChEMBL | 68253 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | H3NSO3 | ||
| Moláris tömeg | 97,10 g/mol | ||
| Megjelenés | fehér kristály | ||
| Sűrűség | 2,15 g/cm³ | ||
| Olvadáspont | 205 °C bomlik | ||
| Oldhatóság (vízben) | közepes, lassan hidrolizál | ||
| Savasság (pKa) | 1,0[1] | ||
| Veszélyek | |||
| MSDS | ICSC 0328 | ||
| EU osztályozás | irritáló (Xi) | ||
| EU Index | 016-026-00-0 | ||
| R mondatok | R36/38 R52/53 | ||
| S mondatok | (S2) S26 S28 S61 | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A szulfámsav, más néven amido-kénsav, kénsav-amid erős egyértékű szervetlen sav. Az ammónia és a kénsav savamidja. Sói a szulfamátok.
Fehér, kristályos, szagtalan, nem higroszkópos anyag.
Tulajdonságok
[szerkesztés]Híg vizes oldata szobahőmérsékleten hónapokig stabilis, de magasabb hőmérsékleten hidrolizál:
- H[H2NSO3] + H2O → NH4HSO4
205 °C-on megolvad, 210 °C-on elkezd bomlani. 260 °C felett gyorsan bomlik kén-di- és -tri-oxidra, nitrogénre, ammóniára, vízre és más összetevőkre.
Vízben és formamidban oldódik, éterben, acetonban, metanolban, tömény kénsavban kevéssé. 70%-os kénsavban gyakorlatilag oldhatatlan.
Sói semleges vagy lúgos oldatban még forrásponton is stabilisak. A szervetlen sók általában jól oldódnak vízben, beleértve az ólom- és bárium-szulfamátot, melyek szulfátjai vízben oldhatatlanok.
Klorátion hatására nitrogénre bomlik:
Tömény salétromsavval:
Savanyú közegben a nitriteket elbontja nitrogén keletkezése közben:
Ezt a reakciót nitritek eltávolítására használják pl. a textiliparban, diazo(en) színezékek előállítása során.
Előállítás
[szerkesztés]Ipari méretekben vízmentes kénsavval vagy híg óleummal:
A reakció erősen exoterm.
Felhasználás
[szerkesztés]Az építőiparban tisztítószerként, a cement- és habarcsmaradékok eltávolítására használják.[2]
Szövetek, papír, cellulózfilmek gyúlékonyságának csökkentésére alkalmas, mivel nem keményedik, és nem kristályosodik a felületen az öregedésük során sem.
A szulfamátsók oldékonysága kihasználható bizonyos ércek és ásványok kivonására és tisztítására.
A mezőgazdaságban a szulfámsav alkalmas a talaj lúgosságának megváltoztatására. Az anyag szilárd volta megkönnyíti a kezelését, a benne levő nitrogén pedig beépül a talajba.
Uszodákban és hűtőtornyokban az oldott klór/HOCl mennyiségének beállítására és vízkőoldásra használják.
Jegyzetek
[szerkesztés]- ↑ (1960) „828. Sulphur?nitrogen compounds. Part I. The hydrolysis of sulphamate ion in perchloric acid”. Journal of the Chemical Society (Resumed), 4236. o. DOI:10.1039/JR9600004236.
- ↑ Custom Building Products 16 oz. Sulfamic Acid Cleaner Archiválva 2013. március 27-i dátummal a Wayback Machine-ben (Homedepot)
Források
[szerkesztés]- N. N. Greenwood – A. Earnshaw: Az elemek kémiája. Nemzeti Tankönyvkiadó, 2004., 999–1001. oldal. ISBN 963-19-5255-X
- Sulfamic Acid Information (Wuxi Yangheng Chemical Co., Ltd.)
- Leallyn B. Clapp: Sulfamic acid and its uses (Journal of Chemical Edication)
- W. E. Gordon, and Martin E. Cupery: Sulfamic Acid. Industrial Applications (Industrial and Engineering Chemistry)
- Sulphamic Acid (Ravi Raj Chemicals)
- Sulfamic Acid (Chemicalland)
- Sulfamic acid (ChemicalBook)
További információk
[szerkesztés]- Biztonsági adatlap (Santa Cruz Biotechnology, Inc.)
- Biztonsági adatlap[halott link] (Columbus Chemical Industries Inc.)
