Nucleófilo
Un nucleófilo é unha especie química que doa un par de electróns a un electrófilo para formar un enlace químico nunha reacción. Todas as moléculas ou ións cun par de electróns libres ou polos menos un enlace pi poden actuar como nucleófilos. Como os nucleófilos doan electróns, son por definición bases de Lewis.
Nucleofílico é un adxectivo que se usa para referirse aos nucleófilos. A nucleofilia (ou ás veces forza nucleófila) refírese ao carácter nucleófilo dunha substancia e utilízase para comparar a afinidade de átomos e o seu poder como nucleófilos.
As reaccións necleofílicas neutras con solventes como alcohois e auga denomínanse solvólises. Unha das reaccións nas que poden tomar parte os nucleófilos son as substitucións nucleofílicas, nas que un nucleófilo é atraído por unha carga positiva parcial ou total.
Os nucleófilos ambidentados son aqueles que teñen dous posibles centros de reacción, como por exemplo o tiocianato (SCN-).
Historia
[editar | editar a fonte]Os termos nucleófilo e electrófilo foron introducidos por Christopher Kelk Ingold en 1929,[1] e substituíron os termos propostos algo antes, en 1925, por A. J. Lapworth anionoide e cationoide.[2]
A palabra nucleófilo deriva de núcleo e do grego φιλος, filos, "amigo de".
Propiedades
[editar | editar a fonte]A nucleofilia é a forza como nucleófilo que ten unha especie química. É un concepto de cinética química e mídese comparando constantes de velocidade. Na nucleofilia inflúen a carga, a basicidade, a polarizabilidade e os impedimentos estéricos do nucleófilo e a natureza do disolvente. En xeral, a nucleofilia aumenta coa carga negativa, a basicidade e a polarizabilidade e diminúe por causa do impedimento estérico e coa maior solvatación (mellor un disolvente polar aprótico).
En xeral, nunha ringleira (período) da Táboa periódica, canto máis básico é o ión (canto maior é o pKa do seu ácido conxugado) máis reactivo é como nucleófilo. Nunha columna (grupo) da Táboa periódica, a polarizabilidade é máis importante na determinación da nucleofilia: Canto máis fácil é alterar a nube de electróns que rodea o núcleo do átomo ou a molécula, máis rapidamente reaccionará; por exemplo, o ión ioduro (I−) é máis nucleofílico ca o ión fluoruro (F−).
Para entendelo mellor podemos fixarnos nestes exemplos:
- Efecto da carga:
- HO- > H2O;
- NH2- > NH3
- Efecto da basicidade:
- NH3 > H2O;
- NH2- > HO-;
- CH3S- > Cl-
Podemos ver nestes exemplos como a nucleofilia diminúe cara á dereita da táboa periódica.
- Efecto da polarizabilidade e do disolvente:
- I- > Br- > Cl-
O anión ioduro cunha "nube electrónica" máis voluminosa é máis polarizable. O anión cloruro máis pequeno ademais é solvatado mellor polo disolvente.
- O efecto da polarizabilidade, do tamaño do átomo nucleófilo obsérvase claramente en especies neutras nas que o efecto da solvatación non é tan importante coma nas especies cargadas:
- PH3 > NH3; H2Se > H2S > H2O
Podemos ver con este exemplo como a nucleofilia aumenta ao descender pola táboa periódica.
- O efecto do impedimento estérico:
- CH3O- > (CH3)3CO-
Medida da nucleofilia
[editar | editar a fonte]Ideáronse moitos esquemas para tratar de cuantificar a forza nucleofílica relativa. Obtéñense datos empíricos medindo a velocidade de reacción dun gran número de reaccións nas que interveñen un gran número de nucleófilos e electrófilos. Os nucleófilos que presentan o chamado efecto alfa omítense xeralmente neste tipo de tratamentos. Téñense utilizado diversas ecuacións.
Ecuación de Swain-Scott
[editar | editar a fonte]O primeiro intento que se ideou para medir a nucleofilia foi a aplicación da ecuación de Swain–Scott[3][4] obtida en 1953:
Esta relación de enerxía libre relaciona a constante de velocidade de reacción de pseudo-primeira orde (en auga a 25 °C) dunha reacción, chamada k, normalizada á velocidade de reacción, k0, dunha reacción estándar coa auga como nucleófilo, cunha constante nucleofílica n para un nucleófilo dado e unha constante de substrato s que depende da sensibilidade dun substrato ao ataque nucleofílico (definida como 1 para o bromuro de metilo).
Este tratamento dá lugar aos seguintes valores para anións nucleófilos típicos: acetato 2,7, cloruro 3,0, azida 4,0, hidróxido 4,2, anilina 4,5, ioduro 5,0, e tiosulfato 6,4. Constantes de substrato típicas son 0,66 para o tosilato de etilo, 0,77 para a β-propiolactona, 1,00 para o 2,3-epoxipropanol, 0,87 para o cloruro de bencilo, e 1,43 para o cloruro de benzoilo.
A ecuación predí que, nun desprazamento nucleofílico en cloruro de bencilo, o anión azida reacciona 3000 veces máis rápido ca a auga.
Ecuación de Ritchie
[editar | editar a fonte]A ecuación de Ritchie obtívose en 1972, e é outra relación de enerxías libres:[5][6][7]
onde N+ é o parámetro dependente de nucleófilo e k0 é a constante da velocidade de reacción para a auga. Nesta ecuación, non aparece ningún parámetro dependente do substrato como era s na ecuación de Swain–Scott. A ecuación establece que dous nucleófilos reaccionan coa mesma reactividade relativa sen importar cal sexa a natureza do electrófilo, o cal é unha violación do principio de reactividade-selectividade. Por esta razón, a esta ecuación chámaselle a relación de selectividade constante.
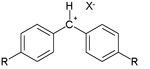
Na publicación orixinal os datos foron obtidos por reaccións de nucleófilos seleccionados con carbocatións electrófilos seleccionados como os catións tropilio ou diazonio:
ou ións (que non se mostran) baseados no verde malaquita. Desde entón describíronse moitos outros tipos de reaccións.
Valores típicos de Ritchie de N+ (en metanol) son: 0,5 para o metanol, 5,9 para o anión cianuro, 7,5 para o anión metóxido, 8,5 para o anión azida, e 10,7 para o anión tiofenol. Os valores para as reactividades de catión relativas son -0,4 para o catión verde malaquita, +2,6 para o catión bencenodiazonio,e +4,5 para o catión tropilio.
Ecuación de Mayr-Patz
[editar | editar a fonte]A ecuación de Mayr-Patz data de 1994, e é:[8]
A constante de velocidade de reacción de segunda orde k a 20 °C para unha reacción está relacionada cun parámetro N de nucleofilia, un parámetro E de electrofilia, e un parámetro s de pendente dependente de nucleófilo. A constante s é definida como 1 con 2-metil-1-penteno como nucleófilo.
Moitas das constantes deriváronse da reacción dos chamadso ións benzhidrilo como electrófilos:[9]
e un conxunto de varios nucleófilos π:
Valores típicos de E son +6,2 para R = cloro, +5,90 para R = hidróxeno, 0 para R = metoxi e -7,02 para R = dimetilamina.
Valores típicos de N con s entre parénteses son -4,47 (1,32) para a substitución electrofílica aromática a tolueno (1), -0,41 (1,12) para a adición electrofílica a 1-fenil-2-propeno (2), e 0,96 (1) para a adición a 2-metil-1-penteno (3), -0,13 (1,21) para a reacción co trifenilalilsilano (4), 3,61 (1,11) para a reacción co 2-metilfurano (5), +7,48 (0,89) para a reacción co isobuteniltributilestanano (6) e +13,36 (0,81) para a reacción coa enamina 7.[10]
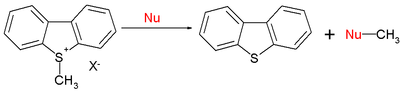
A gama de reaccións orgánicas tamén inclúe reaccións SN2:[11]
Con E = -9,15 para o ión S-metildibenzotiofenio, valores de nucleófilo típicos N (s) son 15,63 (0,64) para a piperidina, 10,49 (0,68) para o metóxido, e 5,20 (0,89) para a auga. En resumo, a nucleofilia cara aos centros sp2 ou sp3 segue o mesmo patrón.
Ecuación unificada
[editar | editar a fonte]Nun esforzo de unificar as ecuacións antes descritas, a ecuación de Mayr reescríbese así:[11]
onde sE é o parámetro de pendente dependente de electrófilo e sN o parámetro de pendente dependente de nucleófilo. Esta ecuación pode á súa vez reescribirse de distintos xeitos:
- con sE = 1 para carbocatións esta ecuación é igual á ecuación orixinal de Mayr-Patz de 1994,
- con sN = 0,6 para a maioría dos nucleófilos n a ecuación convértese en
- ou a ecuación orixinal de Scott-Swain escrita como:
- con sE = 1 para carbocatións e sN = 0,6 a ecuación queda así:
- ou a ecuación orixinal de Ritchie escrita como:
Tipos de nucleófilos
[editar | editar a fonte]Exemplos de nucleófilos son anións como o Cl−, ou compostos cun par solitario de electróns como o NH3 (amoníaco).
No exemplo de máis abaixo, o oxíxeno dun ión hidróxido doa un par de electróns ao enlace co carbono ao final da molécula de bromopropano. O enlace entre o carbono e o bromo sofre despois unha fisión heterolítica, e o átomo de bromo capta o electrón que se doa e convértese en ión bromuro (Br−), porque ocorre unha reacción SN2 por ataque lateral. Isto significa que o ión hidróxido ataca o átomo de carbono desde o outro lado, exactamente o oposto ca o ión bromuro. Debido a este ataque lateral, as reaccións SN2 dan lugar á inversión da configuración do electrófilo. Se o electrófilo é quiral, manterá normalmente a súa quiralidade, aínda que a configuración do produto da SN2 está invertida comparada coa do electrófilo orixinal.
Un nucleófilo ambivalente é aquel que pode atacar desde dous (ou máis) lugares, dando lugar a dous (ou máis) produtos. Por exemplo, o ión tiocianato (SCN−) pode atacar desde o seu xofre ou desde o seu nitróxeno. Por esta razón, a reacción SN2 dun haluro de alquilo co SCN− a miúdo produce unha mestura de RSCN (un tiocianato de alquilo) e RNCS (un isotiocianato de alquilo). Consideracións similares aplícanse na síntese de nitrilo de Kolbe.
Carbono
[editar | editar a fonte]Os nucleófilos de carbono son haluros metálicos de alquilo que se encontran na reacción de Grignard, reacción de Blaise, reacción de Reformatsky, e reacción de Barbier, reactivos organolitio, e anións dun alquino terminal.
Un enol é tamén un nucleófilo de carbono. A formación dun enol está catalizada por ácidos ou bases. Os enois son nucleófilos ambivalentes, pero, en xeral, son nucleofílicos no átomo de carbono alfa. Os enois utilízanse comunmente en reaccións de condensación, como a condensación de Claisen e a condensación aldólica.
Oxíxeno
[editar | editar a fonte]Exemplos de nucleófilos de oxíxeno son a auga (H2O), anión hidróxido, alcohois, anións alcóxido, peróxido de hidróxeno, e anións carboxilato. O ataque nucleofílico non ten lugar durante o establecemento de enlaces de hidróxeno intermoleculares.
Xofre
[editar | editar a fonte]Os nucleófilos de xofre máis usados son: sulfuro de hidróxeno e os seus sales, tioles (RSH), anións tiolato (RS−), anións de ácidos tiolcarboxílicos (RC(O)-S−), e anións de ditiocarbonatos (RO-C(S)-S−) e ditiocarbamatos (R2N-C(S)-S−).
En xeral, o xofre é moi nucleofílico porque ten un gran tamaño, o que o fai facilmente polarizable, e os seus pares de electróns solitarios son doadamente accesibles.
Nitróxeno
[editar | editar a fonte]Entre os nucleófilos de nitróxeno están o amoníaco, azida, aminas, e nitritos.
Notas
[editar | editar a fonte]- ↑ Ingold, C. K. Recl. TraV. Chim. Pays-Bas 1929
- ↑ Lapworth, A. Nature 1925, 115, 625
- ↑ Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides C. Gardner Swain, Carleton B. Scott J. Am. Chem. Soc.; 1953; 75(1); 141-147. Abstract
- ↑ Gold Book definición de Swain-Scott
- ↑ Gold Book definición de (Ritchie)
- ↑ Nucleophilic reactivities toward cations Calvin D. Ritchie Acc. Chem. Res.; 1972; 5(10); 348-354. Abstract
- ↑ Cation-anion combination reactions. XIII. Correlation of the reactions of nucleophiles with esters Calvin D. Ritchie J. Am. Chem. Soc.; 1975; 97(5); 1170–1179. Abstract
- ↑ Scales of Nucleophilicity and Electrophilicity: A System for Ordering Polar Organic and Organometallic Reactions Angewandte Chemie International Edition in English, Vol. 33, No. 9, P. 938-957 doi 10.1002/anie.199409381
- ↑ Reference Scales for the Characterization of Cationic Electrophiles and Neutral NucleophilesHerbert Mayr, Thorsten Bug, Matthias F. Gotta, Nicole Hering, Bernhard Irrgang, Brigitte Janker, Bernhard Kempf, Robert Loos, Armin R. Ofial, Grigoriy Remennikov, and Holger Schimmel J. Am. Chem. Soc.; 2001; 123(39) pp 9500 – 9512; (Article) doi 10.1021/ja010890y
- ↑ Unha base de datos para os parámetros de reactividade en Internet mantida polo grupo de Mayr está dispoñible en https://www.cup.uni-muenchen.de/oc/mayr/
- ↑ 11,0 11,1 Towards a General Scale of Nucleophilicity? Thanh Binh Phan, Martin Breugst, Herbert Mayr, Angewandte Chemie International Edition Volume 45, Issue 23 , Pages 3869 – 3874 2006 doi 10.1002/anie.200600542