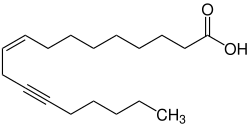
Crepeninsäure
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Crepeninsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C18H30O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 278,44 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Crepeninsäure ist eine ungesättigte Fettsäure, die neben einer Doppel- auch eine Dreifachbindung aufweist. Sie ist ein Isomer der Ximeninsäure, Calendulasäure, Punicinsäure und der α-Linolensäure. Sie gehört in die Gruppe der Alkin- und der Alkensäuren sowie zu den Eninen.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Crepeninsäure kommt vor allem in den Samenölen aus verschiedenen Arten und Gattungen der Korbblütler vor, wie bei Pippau (Crepis spp.) oder in dem von Picris comosa in Konzentration von bis zu 75 %. Wobei die Menge bei den verschiedenen Arten stark schwanken kann. Auch bei Saussurea candicans findet sich eine hohe Konzentration.[3] Aber auch in einigen Arten der Gattung Afzelia in der Familie der Hülsenfrüchtler finden sich bis über 20 %.[4][5][6][7][8][9][10][11][12][13][14][15]
-
Frucht von Afzelia africana
-
Ixora chinensis
Sie kommt außerdem in den Wurzeln von Atractylodes macrocephala und Atractylodes lancea[16] vor, sowie in größeren Mengen in Ixora chinensis, einem Rötegewächs.[17]
Zwischen den Fettsäureestern verschiedener Pflanzen wurden Unterschiede im Aufbau festgestellt, so tragen die Glyceride in Jurinea mollis und Atractylodes lancea vergleichsweise wenig Crepeninsäure am C2 des Glycerins, in Crepis rubra hingegen viel.[16] Es wird vermutet, dass Crepeninsäure ein wichtiges Intermediat bei der Biosynthese anderer natürlich vorkommender Alkinverbindungen ist.[18]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]In Crepis alpina wurde ein Enzym nachgewiesen, eine Variante der FAD2-Desaturase, das in den Samen Linolsäure durch Dehydrogenierung in Crepeninsäure überführt.[5] Analoge Gene kommen auch in der Petersilie, der Sonnenblume und im Gemeinen Efeu vor. Es wurde gezeigt, dass das entsprechende Gen in der Sonnenblume durch Pilzbefall aktiviert wurde.[19] Der Reaktionsmechanismus wurde durch Expression eines entsprechenden Gens in Saccharomyces cerevisiae und Inkubation mit verschiedenen Isomeren von deuterium-markierter Linolsäure untersucht. Der beobachtete primäre kinetische Isotopeneffekt spricht dafür, dass ein sequenzieller Mechanismus vorliegt und zunächst ein Proton am C12 abstrahiert wird.[20]
In Crepis rubra hingegen wurde Ölsäure zu Crepeninsäure umgesetzt, nicht jedoch Linolsäure, was dafür spricht, dass in diesem Fall Linolsäure kein metabolisches Intermediat ist. Hier wurde auch nachgewiesen, dass zu Beginn der Blüte wenig Crepeninsäure vorliegt, die Menge aber mit der Zeit zunimmt, bis sie die Hauptfettsäure darstellt.[21]
Die Biosynthese wurde auch im Pilz Tricholoma grammopodium durch 14C-Isotopenmarkierung untersucht, wobei Ölsäure und Linolsäure als biosynthetische Vorläufer identifiziert wurden.[18]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Eine Synthese der Crepeninsäure geht von 1-Heptin aus. Dieses wird mit Ethylenoxid sowie elementarem Lithium in flüssigem Ammoniak zu Non-3-in-1-ol[22] umgesetzt. Der Alkohol kann mit Triphenylphosphindibromid zum Bromid umgesetzt werden. Die Reaktion mit Triphenylphosphin in Benzol oder Toluol ergibt das Triphenylphosphoniumbromid. Dieses kann mit Butyllithium in Diethylether zum Ylid deproniert und anschließend mit 9-Oxononansäuremethylester[23] (Herstellung durch Ozonolyse von Methyloleat) zum Crepeninsäuremethylester umgesetzt werden (Wittig-Reaktion). Reaktion mit Kaliumhydroxid in Ethanol unter Stickstoffatmosphäre ergibt die freie Säure.[24]

Die Eignung verschiedener Pflanzen zur Produktion von Crepeninsäure wurde untersucht. Crepis alpina lieferte hier die besten Resultate. Die Samen sind zwar sehr klein, enthalten aber überwiegend Crepeninsäure in ihrem Öl.[6] Genetisch modifizierte Acker-Schmalwand (Arabidopsis thaliana) kann große Menge an Crepeninsäure synthetisieren, diese tritt allerdings insbesondere in Form von Phospholipiden auf und weniger in Form von Triglyceriden.[25] Ebenso konnte durch genetisch modifizierte Sojapflanzen Crepeninsäure synthetisiert werden.[19]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Crepeninsäure ist ein starker Cyclooxygenase-Inhibitor und inhibiert außerdem Phospholipase und Lipoxygenase.[8][10]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Crepeninsäure ist sehr leicht autoxidierbar.[7] Die Doppelbindung kann durch Peressigsäure epoxidiert werden.[24]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Santa Cruz Biotechnology: Crepenynic acid | CAS 2277-31-8 | SCBT - Santa Cruz Biotechnology, abgerufen am 24. Juni 2023
- ↑ Frank D. Gunstone, Fred B. Padley, John L. Harwood: The Lipid Handbook. Second Edition, Chapman & Hall, 1994, ISBN 0-412-43320-6, S. 319.
- ↑ 9-Octadecen-12-ynoic acid, (9Z)- bei PlantFA Database.
- ↑ F. R. Earle, A. S. Barclay, I. A. Wolff: Compositional variation in seed oils of the Crepis genus. In: Lipids. Band 1, Nr. 5, September 1966, S. 325–327, doi:10.1007/BF02532675.
- ↑ a b Jeong-Won Nam, T. Joseph Kappock: Cloning and transcriptional analysis of Crepis alpina fatty acid desaturases affecting the biosynthesis of crepenynic acid. In: Journal of Experimental Botany. Band 58, Nr. 6, April 2007, S. 1421–1432, doi:10.1093/jxb/erm005.
- ↑ a b G. A. White, B. C. Willingham, Wheeler Calhoun: Agronomic evaluation of prospective new crop species III.Crepis alpina — source of crepenynic acid. In: Economic Botany. Band 27, Nr. 3, Juli 1973, S. 320–322, doi:10.1007/BF02907534.
- ↑ a b K. L. Mikolajczak, C. R. Smith, M. O. Bagby, I. A. Wolff: A New Type of Naturally Occurring Polyunsaturated Fatty Acid. In: The Journal of Organic Chemistry. Band 29, Nr. 2, Februar 1964, S. 318–322, doi:10.1021/jo01025a016.
- ↑ a b D.H. Nugteren, E. Christ-Hazelhof: Naturally occurring conjugated octadecatrienoic acids are strong inhibitors of prostaglandin biosynthesis. In: Prostaglandins. Band 33, Nr. 3, März 1987, S. 403–417, doi:10.1016/0090-6980(87)90022-0.
- ↑ Nanzad Tsevegsuren, William W. Christie, Dorothy Lösel: Tanacetum (Chrysanthemum) corymbosum seed oil—A rich source of a novel conjugated acetylenic acid. In: Lipids. Band 33, Nr. 7, Juli 1998, S. 723–727, doi:10.1007/s11745-998-0262-2.
- ↑ a b Kevin D. Croft, Lawrence J. Beilin, Glenn L. Ford: Differential inhibition of thromboxane B2 and leukotriene 84 biosynthesis by two naturally occurring acetylenic fatty acids. In: Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism. Band 921, Nr. 3, Oktober 1987, S. 621–624, doi:10.1016/0005-2760(87)90091-9.
- ↑ Glenn L. Ford, Frank B. Whitfield, Keith H. Walker: Fatty acid composition ofIxiolaena brevicompta F. Muell. Seed Oil. In: Lipids. Band 18, Nr. 1, Januar 1983, S. 103–105, doi:10.1007/BF02534700.
- ↑ C. R. Smith: Saussurea candicans seed oil—Alternative source of crepenynic acid. In: Lipids. Band 9, Nr. 8, August 1974, S. 640–641, doi:10.1007/BF02532514.
- ↑ F. D. Gunstone, D. Kilcast, R. G. Powell, G. M. Taylor: Afzelia cuanzensis seed oil: a source of crepenynic and 14,15-dehydrocrepenynic acid. In: Chemical Communications. Nr. 6, 1967, S. 295, doi:10.1039/c19670000295.
- ↑ F. D. Gunstone, S. R. Steward, J. A. Cornelius, T. W. Hammonds: New Tropical Seed Oils. IV—Component acids of leguminous and other seed oils including useful sources of crepenynic and dehydrocrepenynic acid. In: Journal of the Science of Food and Agriculture. Band 23, Nr. 1, Januar 1972, S. 53–60, doi:10.1002/jsfa.2740230108.
- ↑ H. B. S. Conacher, f. D. Gunstone: Fatty acids: XXII1 partial synthesis of racemic helenynolic acid from crepenynic acid by a possible biosynthetic route and the discovery ofcis-9,10-epoxyoctadec-12-ynoic acid inHelichrysum bracteatum seed oil2. In: Lipids. Band 5, Nr. 1, Januar 1970, S. 137–141, doi:10.1007/BF02531108.
- ↑ a b Jin-Yue Sun, Xu Guo, Mark A. Smith: Identification of Crepenynic Acid in the Seed Oil of Atractylodes lancea and A. macrocephala. In: Journal of the American Oil Chemists’ Society. Band 94, Nr. 5, Mai 2017, S. 655–660, doi:10.1007/s11746-017-2974-2.
- ↑ Huang Minquan: AC18 conjugated tetraenoic acid from Ixora chinensis seed oil. In: Phytochemistry. Band 29, Nr. 4, Januar 1990, S. 1317–1319, doi:10.1016/0031-9422(90)85452-L.
- ↑ a b J. D. Bu'Lock, G. N. Smith: The origin of naturally-occurring acetylenes. In: Journal of the Chemical Society C: Organic. 1967, S. 332, doi:10.1039/j39670000332.
- ↑ a b Edgar B. Cahoon, Judy A. Schnurr, Errol A. Huffman, Robert E. Minto: Fungal responsive fatty acid acetylenases occur widely in evolutionarily distant plant families: Fungal responsive fatty acid acetylenases. In: The Plant Journal. Band 34, Nr. 5, Juni 2003, S. 671–683, doi:10.1046/j.1365-313X.2003.01757.x.
- ↑ Darwin W. Reed, Devin R. Polichuk, Peter H. Buist et al.: Mechanistic Study of an Improbable Reaction: Alkene Dehydrogenation by the Δ12 Acetylenase of Crepis alpina. In: Journal of the American Chemical Society. Band 125, Nr. 35, 1. September 2003, S. 10635–10640, doi:10.1021/ja036489o.
- ↑ W. G. Haigh, L. J. Morris, A. T. James: Acetylenic acid biosynthesis in Crepis rubra. In: Lipids. Band 3, Nr. 4, Juli 1968, S. 307–312, doi:10.1007/BF02530929.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-Nonin-1-ol: CAS-Nr.: 31333-13-8, EG-Nr.: 250-573-8, ECHA-InfoCard: 100.045.961, PubChem: 123437, ChemSpider: 110033, Wikidata: Q72496669.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Methyl-9-oxononanoat: CAS-Nr.: 1931-63-1, PubChem: 74732, ChemSpider: 67304, Wikidata: Q63409104.
- ↑ a b R. W. Bradshaw, A. C. Day, Ewart R. H. Jones, C. B. Page, V. Thaller, R. A. Vere Hodge: Natural acetylenes. Part XXXII. A synthesis of crepenynic acid (octadec-9-en-12-ynoic acid). In: Journal of the Chemical Society C: Organic. 1971, S. 1156, doi:10.1039/j39710001156.
- ↑ Stefan Thomæus, Anders S Carlsson, Sten Stymne: Distribution of fatty acids in polar and neutral lipids during seed development in Arabidopsis thaliana genetically engineered to produce acetylenic, epoxy and hydroxy fatty acids. In: Plant Science. Band 161, Nr. 5, Oktober 2001, S. 997–1003, doi:10.1016/S0168-9452(01)00500-3.



