Berylliumsulfat
Udseende
| Berylliumsulfat | |
|---|---|
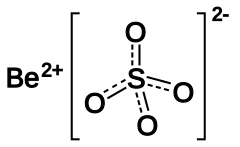 | |
| Generelt | |
| Molekylformel | BeSO4 |
| Molarmasse | 105,075 g/mol (vandfrit) 177,136 g/mol (tetrahydrat) |
| CAS-nummer | |
| PubChem | |
| SMILES | [Be+2].[O-]S([O-])(=O)=O |
| InChI | 1/Be.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 KQHXBDOEECKORE-NUQVWONBAA (InChIKey) |
| E-nummer | E-201 |
| Kemiske egenskaber | |
| Massefylde | 2,44 g/cm3 (vandfrit) 1,71 g/cm3 (tetrahydrat) |
| Opløselighed i vand | 36,2 g/100 mL (0 °C) 40,0 g/100 mL (20 °C) 54,3 g/100 mL (60 °C) |
| Opløselighed | Uopløseligt i alkohol |
| Smeltepunkt | 110 (tetrahydrat, −2H2O) 400 °C (dihydrat, dehydr.) 550–600 nedbrydes |
| Kogepunkt | 2500 (anhydrat) 580 °C (tetrahydrat) |
| Refraktionsindeks | 1,4374 (tetrahydrat) |
| Struktur | |
| Termokemi | |
| DeltaHf | -1197 kJ/mol |
| Std. molar entropi S | 90 J/mol K |
| Sikkerhed | |
| EU klassifikation | Carc. Cat. 2 Meget giftigt (T+) Miljøskadeligt (N) |
| R-sætninger | R49, R25, R26, R36/37/38, R43, R48/23, R51/53 |
| S-sætninger | S53, S45 |
| Flammepunkt | Ikke-brændbart |
| LD50 | 82 mg/kg (rotte, oralt) 80 mg/kg (mus, oralt)[1] |
| Beslægtede stoffer | |
| Andre anioner | AndreAnioner |
| Andre kationer | Magnesiumsulfat Calciumsulfat Strontiumsulfat Bariumsulfat |
| Andre forbindelser | AndreFunk |
| Relaterede forbindelser | SeOgsåForb |
| Hvis ikke andet er angivet, er data givet for stoffer i standardtilstanden (ved 25 °C, 100 kPa) | |
Berylliumsulfat ses normalt som tetrahydratet, BeSO4·4H2O er et hvidt, krystallisk fast stof. Det blev for første gang isoleret i 1815 af Jons Jakob Berzelius.[2]
Berylliumsulfat kan forberedes ved at behandle en vandig opløsning af et hvilket som helst berylliumsalt med svovlsyre, fulgt af fordampning af opløsningen og krystallisering. Det hydrerede produkt kan konverteres til vandfrit salt ved at ophede det til 400 °C.[3] Tetrahydratet indeholdet en tetraedrisk Be(OH2)42+ enhed og sulfatanioner. Be2+-kationens lille størrelse afgør antallet af vandmolekyler der kan koordineres. Dette står i kontrast til den analoge magnesiumsalt, MgSO4·6H2O som indeholder en oktaedrisk Mg(OH2)62+ unit.[4]
Noter
[redigér | rediger kildetekst]- ^ "Berylliumforbindelser (som Be)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Lathrop Parsons, Charles (1909), The Chemistry and Literature of Beryllium, London, s. 29-33.
- ^ Patnaik, Pradyot (2002), Handbook of Inorganic Chemicals, McGraw-Hill, ISBN 0-07-049439-8.
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
Eksterne henvisninger
[redigér | rediger kildetekst]- International Chemical Safety Card 1351
- IARC Monograph "Beryllium and Beryllium Compounds" Arkiveret 15. oktober 2005 hos Wayback Machine
- IPCS Health & Safety Guide 44
- IPCS Environmental Health Criteria 106: Beryllium
- IPCS CICAD 32
| Spire Denne artikel om kemi er en spire som bør udbygges. Du er velkommen til at hjælpe Wikipedia ved at udvide den. |
