Ymdoddbwynt
| Mae yna wybodaeth gwerthfawr yn yr erthygl hon, diolch am eich cyfraniad! Ond i gyrraedd safon arferol, derbyniol Wicipedia, gellir mynd yr ail gam. Os na chaiff yr erthygl ei gwella'n ddigonol ymhen wythnos neu ddwy wedi 28 Rhagfyr 2024, fe all gael ei dileu. Os caiff yr erthygl ei gwella'n sylweddol, wedyn mae croeso i chi dynnu'r neges hon oddi ar y dudalen. Ceir rhestr o erthyglau sydd angen eu gwella yma. Sut mae ei gwella? Dyma restr o hanfodion pob erthygl; beth am dreulio ychydig o amser yn mynd drwy'r cyngor hwn? Gweler hefyd ein canllawiau Arddull ac Amlygrwydd. |
 | |
| Enghraifft o'r canlynol | thermal property |
|---|---|
| Math | tymheredd |
Ymdoddbwynt (hefyd toddbwynt) sylwedd yw'r tymheredd y mae yn newid cyflwr arno o solet i hylif. Ar yr ymdoddbwynt y mae'r cyflyrau solet a hylif yn cydfodoli mewn cydbwysedd. Mae ymdoddbwynt sylwedd yn dibynnu ar wasgedd ac caiff fel arfer ei bennu ar wasgedd safonol fel 1 atmosffer neu 100 kPa.
Pan ystyrir ei fod tymheredd y newid gwrthdro o hylif i solet, cyfeirir ato fel y rhewbwynt. O achos gallu'r sylweddau i oroeri, gall y rhewbwynt ymddangos fod yn is na'i werth gwirioneddol yn hawdd.
Thermodynameg
[golygu | golygu cod]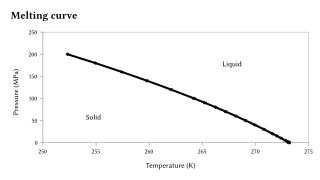
Er mwyn i solet ymdoddi, mae angen gwres i godi ei dymheredd i'r ymdoddbwynt. Fodd bynnag, mae angen darparu rhagor o wres er mwyn i'r ymdoddi ddigwydd: gelwir hyn yn wres ymdoddi, ac mae'n enghraifft o wres cudd.
O ran thermodynameg, ar yr ymdoddbwynt y mae'r newid yn egni rhydd Gibbs (ΔG) y defnydd yn sero, ond mae enthalpi'r defnydd (H) ac ei entropi'n (S) cynyddu (ΔH, ΔS > 0). Mae ffenomen ymdoddi yn digwydd pan fydd egni rhydd Gibbs yr hylif yn dod yn is na'r solet ar gyfer y defnydd hwnnw. Ar wahanol wasgeddau mae hyn yn digwydd ar dymheredd penodol. Gellir dangos hefyd bod:
Yma saif T, ΔS a ΔH yn ôl eu trefn dros y tymheredd ar yr ymdoddbwynt, newid entropi'r ymdoddi a newid enthalpi'r ymdoddi.
Mae'r ymdoddbwynt yn sensitif i newidiadau mawr iawn o wasgedd, ond mae'r sensitifrwydd hwn yn llai drwy drefnau maint na'r berwbwynt, oherwydd fod y trosi solet-hylif yn cynrychioli newid bach yn unig o gyfaint. Os, fel y gwelir yn y fwyaf o achosion, mae sylwedd yn fwy dwys yn y cyflwr solet nag yn y hylif, bydd yr ymdoddbwynt yn cynyddu'n gyson â chynnydd gwasgedd. Pe amgen, mae'r ymddygiad gwrthdro yn digwydd. Yn nodedig, dyma'r achos o ddwfr, fel y dangosir yn graff i'r dde, ond hefyd o Si, Ge, Ga, Bi. Gyda newidiadau mawr iawn o wasgedd, gwelir newidiadau sylweddol i'r ymdoddbwynt. Er enghraifft, ymdoddbwynt y silicon ar wasgedd amgylchynol (0.1 MPa) yw 1415 °C, ond mae'n gostwng i 1000 °C ar wasgeddau o fwy na 10 GPa.
Defnyddir ymdoddbwyntiau'n aml i nodweddu cyfansoddion organig ac anorganig ac i ganfod eu purdeb. Mae ymdoddbwynt y sylwedd pur bob amser yn uwch ac mae ganddo amrediad llai nag ymdoddbwynt y sylwedd amhur neu na chymysgeddau'n fwy cyffredinol. Po uchaf yw maint y cydrannau eraill, isaf yw'r ymdoddbwynt ac ehangaf yw'r amrediad o ymdoddbwyntiau, y cyfeirir ato'n aml fel yr ‘amrediad pastiog’ (pasty range). Gelwir y tymheredd y mae ymdoddi'r cymysgedd yn dechrau ynddo yn solidws a gelwir y tymheredd y mae'r ymdoddi'n gyflawn arno yn licwidws. Mae ewtectigion yn fathau arbennig o gymysgeddau sy'n ymddwyn fel cyflyrau sengl. Maent yn ymdoddi'n sydyn ar dymheredd cyson i ffurfio hylif o'r un cyfansoddiad. Yn lle hynny, wrth oeri hylif gyda'r cyfansoddiad ewtectig, bydd yn ymsoledu fel crisialau cymysg bach (mân-ronynnog) wedi'u wasgaru'n unffurf a gyda'r un cyfansoddiad.
Mewn cyferbyniad â soledau crisialog, nid oes gan wydrau ymdoddbwynt; wrth wresogi maent yn cael eu trosi gwydr llyfn i hylif gludiog. Ar ôl rhagor o wresogi, maent yn meddalu'n raddol, a gall hyn gael ei nodweddu gan rai pwyntiau meddalu.

