Tecneci
| Tecneci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
43Tc
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gris metàl·lic brillant Injecció de 99mTc  Línies espectrals del tecneci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Tecneci, Tc, 43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 7, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 98(0) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d5 5s2 2, 8, 18, 13, 2 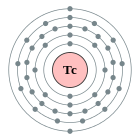
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
11 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 2.430 K, 2.157 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 4.538 K, 4.265 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 33,29 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 585,2 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 24,27 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor extrapolat | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 7, 6, 5, 4, 3[1], 2, 1[2], -1, -3 (òxid àcid fort) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,9 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 702 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.470 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.850 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 147±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 50,6 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 16,200 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-26-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del tecneci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El tecneci (del grec, tekhnetos, 'artificial')[3] és un element químic de nombre atòmic 43 situat en el grup 7 de la taula periòdica dels elements. Se simbolitza com Tc. Es tracta d'un metall de transició, gris argentat, radioactiu, que només s'ha trobat en molt petites quantitats en la naturalesa (en un principi es va pensar que no existia en la naturalesa) i que s'obté de forma sintètica. La principal aplicació és en medicina, en tècniques de diagnosi.[4][5]
No té isòtops estables i, per tant, és molt estrany de trobar-lo en la naturalesa.
Història
[modifica]
El químic rus Dmitri I. Mendeléiev (1834-1907) predigué que a la taula periòdica, hi faltava, entre altres, un element que havia de ser semblant al manganès i l'anomenà ekamanganès. Els investigadors es llançaren a cercar-lo i molts es van sentir tan segurs que s'atreviren a batejar el «nou» element, fent que l'element de Z = 43 sigui el que més noms ha rebut en la història. Abans de la publicació de la taula periòdica el 1869 ja s'havia fet tres suposats descobriments de l'element 43: el 1828 l'anomenaren polini, el 1846 limeni i el 1847 pel·lopi. Després de 1869, es tornà a reivindicar la seva troballa. El 1877, el químic rus Serge Kern afirmà haver trobat l'element en una mena de platí i l'anomenà davyi, en homenatge al químic anglès Humphry Davy (1778-1829). El 1881 es reivindicà el seu aïllament, anomenant-lo eka-manganès, com Mendeléiev. El 1905, el químic japonès Masataka Ogawa (1865-1930) publicà l'observació de l'espectre de l'element 43, al qual anomenà niponi; encara que no era el tecneci, és possible que observàs per primer cop l'espectre del reni (Z = 75). Altres descripcions del seu aïllament es produïren després de les investigacions de Moseley que, efectivament, indicaven que hi hauria d'haver un element al buit que correspon a Z = 43. El 1917 l'anomenaren neomolibdè, el 1924 moseli i el 1925 masuri. Aquest darrer nom fou present a les taules periòdiques molts anys, ja que es donà credibilitat a aquest descobriment per l'enorme prestigi i rigor científic dels investigadors, els alemanys Walter Noddack (1893-1960), Ida Tacke (1896-1978) i Otto Berg (1873-1939), que havien bombardejat una mostra del mineral columbita (mineral de Nb i de Fe amb traces d'urani) amb un feix d'electrons. Analitzant l'espectre de raigs X, van deduir que havien obtingut l'element Z = 43, que no reeixiren a aïllar. Els experiments no es pogueren reproduir, però en aquells experiments també aïllaren el reni (Z = 75), del qual sí que van rebre la prioritat del descobriment.[6]

No fou fins al 1937 que un grup de científics italians liderats pel químic Carlo Perrier (1886-1948) i pel físic Emilio G. Segrè (1905-1989), de la Universitat de Palerm a Sicília, finalment trobaren l'element que faltava. L'any anterior, Segrè havia visitat el ciclotró d'Ernest Lawrence (1901-1958) de la Universitat de Califòrnia a Berkeley, als Estats Units, un accelerador de partícules que s'utilitzava per trencar àtoms. I a principis de 1937, Lawrence envià a Segrè un tros de làmina deflectora del ciclotró, fet de molibdè, element número 42, només un protó per sota de l'ekamanganès, que havia estat bombardejada amb nuclis de deuteri (deuterons). Els científics italians aconseguiren aïllar dos isòtops radioactius de l'element 43, de nombres màssics 95 i 97, i l'anomenaren tecneci.[7][8] Les reaccions que havien tengut lloc són:[9]
El mot tecneci prové del llatí científic technetium, i aquest del grec τεχνητός technētós ‘artificial’ i del llatí científic –ium ‘–io’.[4] Fou el primer element produït artificialment. El desenvolupament de l'energia nuclear a mitjan segle xx va permetre de generar les primeres mostres d'aquest element per mitjà de reaccions nuclears.[8]

L'isòtop del tecneci de semivida més llarga la té de 4,2 milions d'anys, el que significa que qualsevol àtom de tecneci d'ençà que es formà la Terra fa 4.570 milions d'anys hauria desaparegut. El 1952, Paul W. Merrill (1887-1961), un astrònom dels Observatoris Monts Wilson i Palomar de Califòrnia examinà la llum emesa per les estrelles gegants vermelles trobà que els espectres contenien línies que mostraven que les estrelles eren riques en tecneci.[10] Com que tots els isòtops del tecneci tenen una vida relativament curta en comparació amb l'edat de les estrelles, i especialment en comparació amb l'edat de les gegants vermelles que són estrelles al final de la seva vida, només podria significar que aquest element s'estava formant dins de l'estrella mateixa. Això demostrà que les estrelles són els forns on es fabriquen els elements químics (nucleosíntesi estel·lar).[11]
Abundància i obtenció
[modifica]
Malgrat que se'l va descobrir mitjançant una síntesi, és producte de la fissió espontània de l'urani 238 i encara que no hi ha isòtops estables de tecneci, normalment es pot trobar al voltant d'un nanogram de tecneci per cada 5 quilos de mineral d'urani, pechblenda. El 1962, el tecneci 99 s'aïllà i identificà en una pechblenda procedent d'Àfrica, en molt petites quantitats, com a producte de la fissió espontània de l'urani 238. Aquest descobriment fou fet per B.T. Kenna i P.K. Kuroda. El 1972 també es descobrí tecneci al reactor nuclear natural d'Oklo, Gabon.[9]
Algunes estrelles gegants roges, com ara R dels Bessons, R d'Andròmeda o TX Piscium, presenten una línia d'emissió en l'espectre electromagnètic corresponent a la presència de tecneci. Les estrelles on s'ha detectat tecneci són estels de tipus S, tipus N i tipus M.[9]
El tecneci 99 s'obté com a residu dels reactors nuclears, i se separa de la resta de productes de la fissió nuclear.
Propietats
[modifica]
Propietats físiques
[modifica]El tecneci és un metall gris argentat que té un punt de fusió de 2 157 °C, un punt d'ebullició de 4 265 °C i una densitat estimada d'11,5 g/cm³.[12]
Propietats químiques
[modifica]La configuració electrònica del tecneci és [Kr]4d⁵5s2 i els estats d'oxidació més freqüents que té són +4, +5, +6 i +7.
El tecneci és menys reactiu a l'aire que el manganès, que està immediatament per sobre del tecneci a la taula periòdica. És aproximadament tan reactiu com el reni metàl·lic, que es troba immediatament per sota del tecneci a la taula periòdica. Com a tal, només perd brillantor lentament en contacte amb l'aire humit. Però no reacciona amb l'aigua en condicions normals. A la pràctica, el tecneci sovint se subministra com a pols o com a esponja, i en aquesta forma és molt més reactiu. Quan s'escalfa amb oxigen, el resultat és òxid de tecneci(VII):[13]

Quan s'escalfa amb fluor, el resultat és una barreja de fluorur de tecneci(VI) i fluorur de tecneci(VII):[13]
El tecneci metall es dissol en aigua de brom tèbia.
De manera similar al reni, immediatament per sota del tecneci a la taula periòdica, el tecneci és insoluble en àcid clorhídric i àcid fluorhídric. Es dissol en àcid nítric i en àcid sulfúric concentrat, tots dos oxidants, per formar solucions d'àcid pertecnècic. En aquesta forma, el tecneci es troba en estat d'oxidació formal +7.[13]
Compostos
[modifica]Òxids i pertecnetats
[modifica]El pertecnetat és una de les formes més accessibles de tecneci.[14] Té una estructura semblant al permanganat, però és en contrast menys oxidant.
L'àcid conjugat del pertecnetat és l'àcid pertecnètic o HTcO4, l'anhidre del qual és l'òxid de tecneci(VII) o Tc2O7. L'òxid de tecneci(VII) és un òxid metàl·lic amb una estructura centrosimètrica, anàleg a l'òxid de manganès(IV).
Isòtops
[modifica]Es coneixen cinquanta-quatre isòtops i isòmers del tecneci, amb nombres màssics que oscil·len entre 85 i 121. Del 101 al 112 es generen en la fissió de l'urani 235 als reactors nuclears. El tecneci 97 es desintegra per captura electrònica i amb un període de semidesintegració de t½ = 4,21 × 106 anys és l'isòtop de semivida més llarga. La reacció de desintegració dona molibdè 97:[15]
El segueix el tecneci 98 amb una semivida de t½ = 4,2 × 106 anys i el tecneci 99 amb t½ = 2,11 × 10⁵ anys, que es desintegren per emissió d'electrons (desintegració β-) en ruteni 98 i ruteni 99, respectivament. Les reaccions són:[15]

L'isòtop isomèric tecneci 95m, amb una semivida de t½ = 61 dies, és útil per al treball de traçador, ja que produeix raigs gamma energètics.[12] En medicina el més emprat és el tecneci 99m que es desintegra també per emissió de raigs gamma d'un 140 keV:[15]
El tecneci 99m, és molt inestable (t½ = 6 h) i es genera als hospitals amb uns generadors, dissenyats el 1958 al Brookhaven National Laboratory,[16] de reduïdes dimensions on el molibdè 99, amb una semivida de t½ = 66 h es desintegra en tecneci 99m amb l'emissió d'una partícula β-:[17]
Ambdós elements s'han de separar posteriorment mitjançant cromatografia. El molibdè forma l'anió molibdat i el tecneci el pertecneciat . La diferència de càrregues fa que el molibdat sigui retingut per un substrat d'òxid d'alumini, mentre el pertecneciat no ho és.[17]
Aplicacions
[modifica]
El tecneci té moltes aplicacions potencials, com en el cas dels acers —els quals protegiria de la corrosió—, però a causa dels problemes de produir-lo (en reactors nuclears), aquestes aplicacions són molt limitades.
En medicina s'empren compostos amb l'isòtop 99mTc com radiofàrmacs (o radiotraçadors). Aquest isòtop s'obté per mitjà de generadors de 99Mo/99mTc, amb un període de semidesintegració de 6 hores; un temps adequat perquè s'acumuli en l'òrgan que es vol estudiar i, d'altra banda, no perduri gaire temps en l'organisme. També és un emissor gamma, amb una energia d'uns 140 KeV, per la qual cosa pot ser detectat per mitjà d'un comptador de centelleig, i això permet d'interpretar la imatge aconseguida.[17]
Es preparen diferents compostos, per reducció de pertecneciats juntament amb altres molècules, segons quin sigui l'òrgan que es vulgui estudiar. Per exemple, amb bifosfonats, aquests compostos s'acumulen en els teixits ossis, mentre que si s'utilitzen pertecneciats directament, aquests s'acumulen en la glàndula tiroide.[17]
Precaucions
[modifica]No és habitual de trobar-se amb compostos que continguin aquest element, ja que és molt rar en la naturalesa. Tots els isòtops de tecneci són radioactius i, per tant, nocius per a la salut. El tecneci no té cap funció biològica.[18]
Referències
[modifica]- ↑ «Technetium: technetium(III) iodide compound data». OpenMOPAC.net. [Consulta: 10 desembre 2007].
- ↑ «Technetium: technetium(I) fluoride compound data». OpenMOPAC.net. [Consulta: 10 desembre 2007].
- ↑ Setford, Steve. 1001 dades sobre la ciència. Molino, 2005. ISBN 9788427224773.
- ↑ 4,0 4,1 «tecneci». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana. [Consulta: 14 març 2023].
- ↑ «Technetium | Radioactive, Synthetic, Transition Metal» (en anglès). Britannica. [Consulta: 15 octubre 2023].
- ↑ Herradón García, B «Z = 43, tecnecio, Tc. El elemento más peculiar de la tabla periódica». An. Quím., 115, 2, 2019, pàg. 105.
- ↑ Perrier, C.; Segrè, E. «Radioactive Isotopes of Element 43» (en anglès). Nature, 140, 3535, 7-1937, pàg. 193–194. DOI: 10.1038/140193b0. ISSN: 0028-0836.
- ↑ 8,0 8,1 «Technetium - Element information, properties and uses». Periodic Table. Royal Society of Chemistry. [Consulta: 14 març 2023].
- ↑ 9,0 9,1 9,2 Schwochau, Klaus. Technetium : chemistry and radiopharmaceutical applications. Weinheim: Wiley-VCH, 2000. ISBN 978-3-527-61336-6.
- ↑ Merrill, S. Paul W. «Spectroscopic Observations of Stars of Class» (en anglès). The Astrophysical Journal, 116, 7-1952, pàg. 21. DOI: 10.1086/145589. ISSN: 0004-637X.
- ↑ Emsley, John. Nature's Building Blocks : an a-Z Guide to the Elements.. 2a edició. Oxford: Oxford University Press, Incorporated, 2011. ISBN 978-0-19-257046-8.
- ↑ 12,0 12,1 W.M. Haynes. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 95a edició. Boca Raton, Florida: CRC Press, 2014. ISBN 978-1-4822-0867-2.
- ↑ 13,0 13,1 13,2 Winter, Mark. «Technetium, reactions of elements». WebElements. The University of Sheffield and WebElements Ltd. [Consulta: 15 març 2023].
- ↑ Rard, J.A. «Critical review of the chemistry and thermodynamics of technetium and some of its inorganic compounds and aqueous species» (en anglès). Office of Scientific and Technical Information, 15-09-1983. DOI: 10.2172/5580852.
- ↑ 15,0 15,1 15,2 «Z = 43». NuDat 3. National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 15 març 2023].
- ↑ Tucker, W; Greene, M; Weiss, A; Murrenhoff, A «METHODS OF PREPARATION OF SOME CARRIER-FREE RADIOISOTOPES INVOLVING SORPTION ON ALUMINA». Transactions American Nuclear Society, 1, 29-05-1958, pàg. 160–161.
- ↑ 17,0 17,1 17,2 17,3 Nave, R. «Technetium-99m». HyperPhysics. Georgia State University.
- ↑ López López, Gregorio. «Tecnecio» (en castellà). Academia de Ciencias de la Región de Murcia. Arxivat de l'original el 2021-12-07. [Consulta: 17 juliol 2023].
Vegeu també
[modifica]Enllaços externs
[modifica]- webelements.com - Tecneci (anglès)
- environmentalchemistry.com - Tecneci (anglès)
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||
















