Butà
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 58,078 Da i 58,07825032 Da |
| Trobat en el tàxon | |
| Estructura química | |
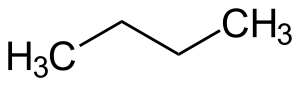
| Fórmula química | C₄H₁₀ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Densitat | 0,6 g/cm³ (a 31 °F, líquid) |
| Velocitat del so | 1.034 m/s (−0,5 °C, líquid) |
| Punt de fusió | −138 °C −138,29 °C |
| Punt d'ebullició | −1 °C (a 760 Torr) 272,7 K (a 1 atm) −0,5 °C (a 101,325 kPa) |
| Entropia molar estàndard | 310,2 J/(mol K) |
| Pressió de vapor | 2,05 atm (a 20 °C) |
| Perill | |
| Límit inferior d'explosivitat | 1,6 vol% |
| Límit superior d'explosivitat | 8,4 vol% |
| Temperatura d'autoignició | 372 °C |
| Límit d'exposició mitjana ponderada en el temps | 1.900 mg/m³ (10 h, cap valor) |
| Punt d'inflamabilitat | −76 °F −60 °C |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Classe de perill ONU | 2.1 |
| Altres | |
| gas inflamable i cancerigen | |
El butà és un compost químic del grup dels hidrocarburs, la qual molècula està constituïda per quatre àtoms de carboni enllaçats linealment i deu àtoms d'hidrogen enllaçats als carbonis, la qual fórmula molecular és . És un alcà, un hidrocarbur saturat, amb només enllaços covalents simples. És inflamable, gasós a temperatura ambient i es liqua a pressió atmosfèrica a –0,5 °C. El butà presenta dos isòmers l'n-butà i l'isobutà o metilpropà. S'empra majoritàriament com a combustible.
Història
[modifica]El butà fou preparat per primera vegada el 1849 per part del químic anglès Edward Frankland (1825-1889). Frankland tractà iodoetà amb zinc i obtingué el butà, malgrat que no l'identificà correctament, segons la reacció:[1][2]
El 1910 el químic estatunidenc Walter O. Snelling (1880-1965), expert en explosius de l'Oficina de Mines dels Estats Units, investigà els vapors que provenien d'un respirador del tanc de gasolina d'un Ford Model T, recentment comprat. El propietari havia omplit el depòsit amb un determinat volum de gasolina, però quedà reduït a la meitat quan arribà a casa. Per estudiar els vapors, Snelling omplí un recipient de vidre amb la gasolina del vehicle. Quan tornà al laboratori, descobrí que s'havien format vapors volàtils dins del recipient, fent que el tap de suro que el tapava sortís repetidament. Inicià un estudi amb aquests gasos vaporosos per trobar mètodes per controlar-los i mantenir-los. Després de separar el gas en els seus components líquids i gasosos, descobrí que el butà era un component de la barreja de gasos liquats. Aviat observà que el butà es podia utilitzar per a la il·luminació, el tall de metall i la cuina. Aquest descobriment inicià la indústria del butà.[3]
Estructura molecular
[modifica]
La molècula de butà és angular, els quatre àtoms de carboni es troben units mitjançant enllaços covalents simples, alineats. L'angle entre dos enllaços d'un mateix carboni és de 109,5°, d'acord amb els orbitals atòmics híbrids sp3 de cada carboni. La longitud d'aquests enllaços C–C és de 153 pm. L'entalpia d'enllaç d'aquests enllaços és de 83 kcal/mol. La resta d'enllaços que formen els carbonis, fins a assolir un total de quatre per a cadascun, són enllaços amb els àtoms d'hidrogen, també enllaços covalents simples. Els carbonis empren els orbitals híbrids sp3, mentre que els hidrògens empren els seus orbitals atòmics s. Les longituds d'aquests enllaços C–H és de 110 pm i la seva entalpia de 99 kcal/mol.[4]
Els enllaços són pràcticament apolars a causa de la poca diferència d'electronegativitat del carboni i de l'hidrogen, 2,55 i 2,20 respectivament,[5] amb un moment dipolar negligible (μ = 0,05 D) per la qual cosa la molècula pot considerar-se apolar.[6] Aquesta característica la fa soluble en dissolvents polars (benzè, tetraclorur de carboni…) i poc soluble en dissolvents polars (aigua, amoníac…). Les forces entre molècules són les febles forces de dispersió de London, a conseqüència de les quals el butà té punts de fusió i ebullició baixos, –138,3 °C i –0,50 °C, respectivament.[7]

Isomerisme conformacional
[modifica]El butà presenta isomerisme conformacional. Tanmateix la rotació dels seus enllaços C–C és prou elevada perquè no es pugui observar aquesta subtilesa estructural en la majoria de condicions. Hi ha quatre conformacions: l'alternada o anti-periplanar que correspon a una situació que, mirant en la direcció C–C dels carbonis centrals es veuen tots els àtoms d'hidrogen i grups metil, , correspon a un mínim d'energia; l'eclipsada o sin-periplanar, els grups metil dels extrems estan alineats, és la de major energia de repulsió. Les altres dues (sinclinal i anticlinal) corresponen a un mínim i un màxim relatius. Aquesta característica estructural fa que els sis àtoms d'hidrogen dels carbonis laterals no siguin equivalents als quatre àtoms d'hidrogen del carboni central (els àtoms d'hidrogen d'un mateix àtom de carboni sí que són equivalents).[8] La barrera rotacional, això és l'energia que cal superar per poder girar en el moment de màxim aproximament dels àtoms, és de 19 kJ/mol o 3,9 kcal/mol, superior a la del propà (14,2 kJ/mol o 3,4 kcal/mol).[9]

Isomerisme estructural
[modifica]Per altra banda hi ha dos isòmers estructurals del butà, el butà pròpiament dit o n-butà, i el metilpropà o isobutà. Són dos alcans semblants, ja que tenen la mateixa massa molar i fórmula molecular , però la diferència en la seva estructura molecular fa que tenguin propietats físiques diferenciades. Per exemple els punts de fusió, –138,3 °C i –159 °C, pel n-butà i per l'isobutà respectivament; els punts d'ebullició, –0,50 °C i –12 °C, respectivament; etc.[10]
Estat natural i obtenció
[modifica]Tant l'n-butà com l'isobutà són presents al gas natural i al petroli. Els butans presents en el gas natural es poden separar de les grans quantitats de components gasosos de baixa ebullició, com el metà i l'età, per absorció en un oli lleuger. Els butans així obtinguts es poden treure de l'absorbent juntament amb el propà i comercialitzar-los com a gas liquat de petroli (GLP), o bé es poden separar del propà i, després, entre si per destil·lació fraccionada. Els butans formats per altres processos de refineria també es recuperen per absorció en un oli lleuger.[11]
Propietats
[modifica]Propietats físiques
[modifica]El butà a temperatura ambient és un gas incolor, el seu punt de fusió és –138,3 °C i el seu punt d'ebullició –0,50 °C. És poc soluble en aigua, només 61,2 mg/L a 25 °C i molt soluble en etanol, dietilèter i cloroform. És inflamable, té un punt d'ignició de –60 °C i una temperatura d'autoignició de 287 °C. No és corrosiu.[12]
Propietats químiques
[modifica]Combustió
[modifica]El butà, com la resta d'alcans, reacciona amb l'oxigen de l'aire produint diòxid de carboni i aigua, amb una entalpia de combustió de –2 877,5 kJ/mol[13] (calor que es desprèn de cremar-se 1 mol de butà, 58,1 g). No es produeixen substàncies tòxiques, només diòxid de carboni i aigua. La reacció de combustió és:
Deshidrogenació
[modifica]La deshidrogenació del butà produeix buta-1,3-diè , but-1-è i but-2-è, .[14] La reacció té lloc mitjançant catàlisi heterogènia, emprant-se dos tipus de catalitzadors: a) els que contenen platí mesclat amb altres substàncies com l'estany, i b) els basats en òxid de crom(III), , també mesclat amb d'altres substàncies (òxid d'alumini, òxid de zirconi(IV)…).[15] Les condicions òptimes d'aquesta reacció són altes temperatures i baixes pressions.[16]
Halogenació
[modifica]El butà, com els altres alcans, reacciona amb els halògens (X = F, Cl, Br i I) substituint un o més hidrògens per l'halogen. La reacció té lloc mitjançant un mecanisme radicalari i es necessita l'activació mitjançant llum o calor.El resultat és una mescla de productes amb àtoms d'halògens en totes les posicions. Els hidrògens terciaris, dels grups metil , són els més reactius.[17]
Isomerització
[modifica]
La isomerització té gran importància en les operacions de refinació de petroli. El procés converteix l'n-butà en isobutà, que es pot alquilar i produir hidrocarburs líquids en la gamma d'ebullició de la gasolina, que té molta demanda. El procés consisteix a posar en contacte el butà amb un catalitzador, que pot ser clorur d'alumini amb àcid clorhídric o un catalitzador que conté platí. Tots dos són molt reactius i poden provocar reaccions secundàries no desitjades juntament amb la isomerització desitjada. Aquestes reaccions no desitjades es controlen mitjançant tècniques com l'addició d'inhibidors a l'alimentació d'hidrocarburs o la realització de la reacció en presència d'hidrogen.[18]
Piròlisi
[modifica]Si s'escalfa butà a altes temperatures (700 °C–840 °C) es descompon en propè , etè , metà i hidrogen . A 500 °C les proporcions respectives de cada producte són: 71 %, 21 %, 8 % i < 1 %. El mecanisme de descomposició és radicalari, generant-se inicialment els radicals , i . Les reaccions de la piròlisi són:[19]
Aplicacions
[modifica]Petroquímica
[modifica]El butà és emprat en la indústria petroquímica com a matèria primera per obtenir altres composts. Composts oxigenats: àcid acètic, , metanol, , etanol, , àcid propanoic, , àcid butanoic, , acetona, i butanona, . Deshidrogenant el butà s'obtenen butens, , i butadiens, .[14]
Indústria del petroli
[modifica]
La isomerització del n-butà a isobutà és important en la indústria del petroli perquè proporciona matèria primera per a l'alquilació. L'alquilació és un procés en què es transfereix un grup alquil a altres molècules. Pel que fa al refinament de la gasolina, l'alquilació es refereix a la combinació d'iso-butà amb alquens com el propè i els butens per produir alcans de cadena ramificada. Aquests composts representen un material de barreja d'alt octanatge que augmenta l'índex d'octà de la gasolina. Els alcans de cadena recta tenen poc octanatge i produeixen cops (combustió prematura) en motors de combustió interna. A través reaccions d'alquilació, els alcans de cadena recta es converteixen en alcans ramificats i es ramifiquen augmenta la qualificació d'octans. Isooctà, 2,2,4-trimetilpentà, amb un índex d'octanatge de 100, s'obtenen a través de la reacció d'alquilació de l'isobutà i l'isobutè.[10]
Combustible
[modifica]
El butà comercial està compost per un mínim del 80 % de n-butà i isobutà, i un màxim del 20 % de propà, 2 % d'età, 1,5 % de pentans, un 20 % d'alquens. La concentració de dialquens, especialment el buta-1,3-diè, ha de ser inferior a 1000 ppm,[20] ja que és carcinògen. Com que és inodor per detectar fuites i evitar accidents conté metilmercaptà, , un compost gasós d'olor fort i desagradable, detectat immediatament pels consumidors.[21] El seu poder calorífic està entre 10 700 kcal/kg i 11 800 kcal/kg.[20] Pur produeix una flama relativament freda i el seu punt d'ebullició de –0,50 °C implica que no es vaporitza bé per sota d'aquesta temperatura. L'ús del butà com a combustible per a estufes, cuina i escalfadors d'aigua durant l'estiu o en zones de baixa latitud no presenta problemes, però a l'hivern o en zones geogràfiques que experimenten temperatures fredes, el butà és un combustible ineficient perquè condensa a –0,50 °C, una temperatura massa elevada. Per superar aquest problema, s'utilitzen mescles butà-propà amb un 20–40 % de propà. Un altre desavantatge d'utilitzar aquesta mescla de combustibles és el pes del contenidor de combustible. El propà té una ebullició inferior i una pressió de vapor més elevada que el butà a la mateixa temperatura. El combustible de propà pur requereix una paret més gruixuda que afegeix pes als dipòsits.[10]
També forma part d'altres combustibles comercials. En el propà comercial pot arribar a representar un 20 % del volum, i en el gas liquat del petroli (GLP) destinat a automoció, pot arribar al 80 %.[20] El butà també s'afegeix a la gasolina a l'hivern per millorar el rendiment en temperatures fredes.[10]
Color butà
[modifica]Les bombones de butà a Espanya són de color taronja, mentre que a altres països són de diferents colors (blaves, grises, verdes,...). El color taronja és degut al fet que Benito Cid de la Llave, el primer director de la 'Factoría de Butanos', que havia fundat José Álvarez Sánchez l'any 1958 a Cartagena,[22] va decidir que les bombones fossin del color de les taronges, com a element representatiu d'Espanya. Malgrat algunes reticències inicials, el color va triomfar, i alguns dissenyadors i modistes el van introduir en la moda com a color butà.[23]
Referències
[modifica]- ↑ Roscoe, E.F.; Schlorlemmer, C. A Treatise on Chemistry (en anglès). 3. D. Appleton, 1888.
- ↑ Ihde, Aaron J. The development of modern chemistry. Nova York: Dover, 1984. ISBN 0-486-64235-6.
- ↑ «History» (en anglès americà), 06-04-2011. [Consulta: 19 març 2021].
- ↑ Ege, Seyhan. Química orgánica. Barcelona: Editorial Reverté, 2008. ISBN 978-84-291-9225-4.
- ↑ Burns, Ralph A. Fundamentos de química. 4a ed. México, D.F.: Pearson, 2003. ISBN 970-26-0281-5.
- ↑ Ouellette, Robert J. Principles of organic chemistry, 2015. ISBN 978-0-12-802634-2.
- ↑ Smith, Michael, October 17-. A Q&A approach to organic chemistry, 2020. ISBN 978-1-000-06089-8.
- ↑ Gutsche, C. David. Fundamentos de química orgánica. Barcelona: Reverté, 1979. ISBN 84-291-7475-3.
- ↑ Carey, Francis A. Advanced organic chemistry. 4th ed. Nova York: Kluwer Academic/Plenum Pub, 2000-©2001. ISBN 0-306-46242-7.
- ↑ 10,0 10,1 10,2 10,3 Myers, Richard L. The 100 most important chemical compounds : a reference guide. Westport, Conn.: Greenwood Press, 2007. ISBN 978-0-313-08057-9.
- ↑ Britannica, The Editors of Encyclopaedia. Butane. Encyclopedia Britannica, 20 octubre 2014 [Consulta: 22 març 2021].
- ↑ PubChem. «Butane» (en anglès). [Consulta: 22 març 2021].
- ↑ «Butane» (en anglès). NIST Standard Reference Data. National Institute of Standards and Technology. [Consulta: 21 març 2021].
- ↑ 14,0 14,1 Myers, Richard L. The 100 most important chemical compounds : a reference guide. Westport, Conn.: Greenwood Press, 2007. ISBN 978-0-313-08057-9.
- ↑ Resasco, Daniel E. Dehydrogenation – Heterogeneous (en anglès). American Cancer Society, 2002. DOI 10.1002/0471227617.eoc074. ISBN 978-0-471-22761-8.
- ↑ Weissermel, Klaus. Industrial organic chemistry. 4th completely rev. ed. Weinheim: Wiley-VCH, 2003. ISBN 3-527-30578-5.
- ↑ Solomons, T. W. Graham. Química orgánica. 1. ed. Mexico: Limusa, 1979. ISBN 968-18-0982-3.
- ↑ Speight, J.G.. «Chapter 3 - Refining Chemistry». A: The Refinery of the Future (en anglès). Boston: William Andrew Publishing, 2011, p. 81–116. DOI 10.1016/b978-0-8155-2041-2.10003-7. ISBN 978-0-8155-2041-2.
- ↑ Moldoveanu, Serban C. «Chapter 2 - Pyrolysis of Hydrocarbons». A: Pyrolysis of Organic Molecules (en anglès). 2a. Elsevier, 2019, p. 35–161. DOI 10.1016/b978-0-444-64000-0.00002-0. ISBN 978-0-444-64000-0.
- ↑ 20,0 20,1 20,2 «BOE.es - BOE-A-2006-2779 Real Decreto 61/2006, de 31 de enero, por el que se determinan las especificaciones de gasolinas, gasóleos, fuelóleos y gases licuados del petróleo y se regula el uso de determinados biocarburantes.». [Consulta: 23 març 2021].
- ↑ Manual de prácticas de Medicina Bucal. Barcelona: Universitat de Barcelona, 2020. ISBN 978-84-9168-505-0.
- ↑ «España es el país de las naranjas; por eso se decidió ese color para las bombonas de butano». La Verdad Digital, S.L..
- ↑ «¿Por qué las bombonas de butano son de color naranja?». Cope, 09-03-2020.
Enllaços externs
[modifica]- n-Butane a GESTIS Substance database Arxivat 2016-03-03 a Wayback Machine. (anglès)(alemany)












![{\displaystyle {\ce {(1) X2 ->[llum, \, calor] 2X.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ebdbc1d42281f489ba686fdc4f9285eeffbc983)





















