Actina
| Actina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
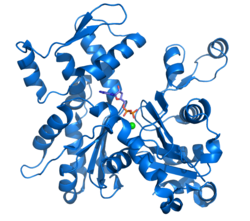
| Actina G (codi PDB 1j6z). Es representen en el centre actiu les molècules d'ADP i el catió divalent.[1] | |||||||||
| Identificadors | |||||||||
| Símbol | Actin | ||||||||
| Pfam | PF00022 | ||||||||
| InterPro | IPR004000 | ||||||||
| PROSITE | PDOC00340 | ||||||||
| SCOP | 2btf | ||||||||
| |||||||||

L'actina és una proteïna globular que forma els microfilaments, un dels tres components fonamentals del citoesquelet de les cèl·lules eucariotes. S'expressa a totes les cèl·lules dels organismes pluricel·lulars, especialment a les fibres musculars, en les quals participa en la contracció muscular juntament amb la miosina i altres elements. Pot trobar-se en forma lliure, anomenada actina G, o formant part de polímers lineals anomenats microfilaments o actina F, que són essencials per a funcions cel·lulars tan importants com la mobilitat i la contracció de la cèl·lula durant la divisió cel·lular.
La importància capital de l'actina s'entén pel fet que un elevat percentatge del contingut proteic d'una cèl·lula és d'actina i que la seva seqüència està molt conservada, és a dir, ha canviat molt poc al llarg de l'evolució. Per ambdues raons es pot dir que la seva estructura ha estat optimitzada. Se'n poden destacar dos trets peculiars: és un enzim que hidrolitza ATP, la "moneda universal de l'energia" dels processos biològics, fent-ho molt lentament, però al mateix temps necessita aquesta molècula per mantenir la seva integritat estructural. Adquireix la seva forma eficaç en un procés de plegament gairebé dedicat. A més, és la proteïna que estableix més interaccions amb altres proteïnes de totes les conegudes, fet que li permet exercir funcions molt variades que arriben a gairebé tots els aspectes de la vida cel·lular. La miosina és un exemple de proteïna que uneix actina; un altre exemple és la vil·lina, que pot entrellaçar l'actina en feixos o bé pot tallar els filaments d'actina, depenent de la concentració de catió calci en el seu entorn.[3]
L'actina forma microfilaments en un procés dinàmic que proporciona una bastida que dota la cèl·lula d'una forma amb possibilitat de remodelar-se ràpidament en resposta al seu entorn o senyals de l'organisme, per exemple, augmentant la superfície cel·lular per a l'absorció o proporcionant suport a l'adhesió de les cèl·lules per a formar teixits. Sobre aquesta bastida es poden ancorar altres enzims, orgànuls com el cili, dirigir la deformació de la membrana cel·lular externa que permet la ingestió cel·lular o la citocinesi. També pot generar moviment, ja sigui per ella mateixa o ajudada per motors moleculars. D'aquesta manera contribueix a processos com el transport intracel·lular de vesícules i orgànuls i la contracció muscular, o la migració cel·lular, important en el desenvolupament embrionari, en la reparació de ferides o en la invasivitat del càncer. L'origen evolutiu d'aquesta proteïna es remunta a les cèl·lules procariotes, on poden trobar equivalents. Finalment, també és important en el control de l'expressió gènica.
Un bon nom de malalties tenen com a base alteracions genètiques en al·lels dels gens que governen la producció de l'actina o de les seves proteïnes associades, i també són essencials en el procés d'infecció d'alguns microorganismes patògens. Les mutacions en els diferents gens d'actina presents en humans ocasionen miopaties, variacions en la grandària i la funció cardíaca i sordesa. Els components del citoesquelet també tenen relació amb la patogenicitat de bacteris intracel·lulars i virus, especialment en processos relacionats amb l'evasió de la resposta del sistema immunitari.[4]
Història
[modifica]
L'actina va ser observada experimentalment per primera vegada el 1887 per William D. Halliburton, qui va extraure una proteïna muscular que coagulava preparacions de miosina i la denominà «ferment de la miosina».[5] No obstant això, Halliburton va ser incapaç d'efectuar la caracterització de les seves observacions, i per això el descobriment s'atribueix a Brunó Ferenc Straub, que en aquells moments era un jove bioquímic que treballava al laboratori d'Albert Szent-Györgyi a l'Institut de química mèdica de la Universitat de Szeged, Hongria.
El 1942, Straub va desenvolupar una nova tècnica per a l'extracció de proteïnes musculars que li permetia aïllar quantitats substancials d'actina relativament pura. Aquest mètode és el mateix que essencialment s'utilitza en els laboratoris de l'actualitat. Szent-Györgyi havia descrit prèviament una forma més viscosa de miosina, produïda per extraccions lentes en músculs, com "miosina activada" i, ja que la proteïna de Straub produïa l'efecte activador, la va denominar «actina». La viscositat disminuïa si s'afegia ATP a la barreja d'ambdues proteïnes, coneguda com a actomiosina. El treball d'ambdós no va poder ser publicat en els països occidentals a causa de l'ambient bèl·lic de la Segona Guerra Mundial, i va sortir a la llum el 1945 quan va ser publicat com a suplement de l'Acta Physiologica Scandinavica.[6] Straub va continuar treballant amb l'actina fins al 1950, publicant que podia unir-se a l'ATP i que, durant la polimerització de la proteïna per a formar microfilaments, s'hidrolitzava a ADP + Pi, el qual romania unit al microfilament. Straub va suggerir que aquesta reacció ocupava un paper en la contracció muscular, però això només és cert en el cas del múscul llis i no va ser verificat experimentalment fins al 2001.[7][8]
La seqüència d'aminoàcids va ser completada per Elzinga i col·laboradors el 1973,[9] i l'estructura cristal·logràfica de l'actina G va ser determinada el 1990 per Kabsch i col·laboradors, tot i tractar-se d'un cocristall en el qual formava un complex amb la desoxirribonucleasa I;[10] es proposà un model el mateix any per a l'actina F per Holmes i els seus col·laboradors.[11] Aquest procediment de cocristal·lització amb diferents proteïnes va ser emprat repetidament durant els següents anys, fins que el 2001 s'aconseguí cristal·litzar la proteïna aïllada juntament amb ADP. Va ser possible gràcies a l'ocupació d'un conjugat de rodamina que impedia la polimerització bloquejant l'aminoàcid cys-374.[12] Aquell mateix any es va produir la defunció de Christine Oriol-Audit, la investigadora que el 1977 va aconseguir cristal·litzar per primera vegada l'actina en absència d'ABPs. Els cristalls van resultar massa petits per a la tecnologia de l'època.[13]
Tot i que actualment no existeix un model d'alta resolució de la forma filamentosa, l'equip de Sawaya va realitzar el 2008 una aproximació més exacta basant-se en múltiples cristalls dels dímers d'actina que contacten en diferents llocs.[14] Aquest model va ser refinat pel mateix autor i per Lorenz. Altres enfocaments, com l'ús de microscopia crioelectrònica o radiació per sincrotró han permès recentment augmentar el nivell de resolució i comprendre amb major profunditat la naturalesa de les interaccions i els canvis conformants implicats en la formació dels filaments d'actina.[15][16]
Estructura
[modifica]L'actina és una de les proteïnes més abundants entre els eucariotes i es troba present en tot el citoplasma.[3] De fet, en les fibres musculars representa el 20% en pes total de les proteïnes, i en altres cèl·lules animals està entre l'1 i el 5%. No obstant això, no existeix un únic tipus d'actina, sinó que els seus gens codificants estan definits per una família multigènica (família que, en plantes, alberga més de 60 elements, entre gens i pseudogens i, en humans, més de 30).[17] Això significa que la informació genètica de cada individu té instruccions per generar variants de l'actina (anomenades isoformes) que posseeixen funcions lleugerament diferents. D'aquesta manera, els organismes eucariotes expressen diferents gens que donen lloc a: l'actina α, que es troba en estructures contràctils; l'actina β, a la vora en expansió de les cèl·lules que empren la projecció d'estructures mòbils com a mètode de mobilitat; i l'actina γ, en els filaments de les fibres d'estrès.[18] A més de les similituds existents entre les isoformes d'un organisme, també hi ha una conservació evolutiva pel que fa a estructura i funció entre organismes de dominis diferents de l'eucariota: en bacteris es coneix l'homòleg MreB, una proteïna que és capaç de polimeritzar en microfilaments,[16] i en arqueus hi ha un representant (Ta0583) encara més semblant a les actines d'eucariotes.[19]
L'actina es presenta a la cèl·lula en dues formes: com a monòmers globulars denominats actina G i com a polímers filamentosos anomenats actina F (és a dir, filaments compostos de multitud de monòmers d'actina G). L'actina F també es pot denominar microfilament. A cada bri d'actina s'uneix una molècula d'adenosina trifosfat (ATP) o d'adenosina difosfat (ADP) al seu torn associada a un catió Mg2+. De les diferents combinacions possibles entre les formes d'actina i el nucleòtid trifosfat, en la cèl·lula predominen l'actina G-ATP i l'actina F-ADP.[20][21]
Actina G
[modifica]Pel que fa a la seva estructura molecular, l'actina G té una aparença globular al microscopi electrònic de rastreig, no obstant això, mitjançant la cristal·lografia de raigs X es pot apreciar que està composta de dos lòbuls separats per una esquerda, l'estructura conforma el plec ATPasa, un centre de catàlisi enzimàtica capaç d'unir l'ATP i Mg² i hidrolitzar el primer a ADP més fosfat. Aquest plec és un motiu estructural conservat que també està present en altres proteïnes que interaccionen amb nucleòtids trifosfat com l'hexoquinasa (un enzim del metabolisme energètic) o les proteïnes Hsp70 (una família de proteïnes que contribueixen que altres proteïnes tinguin estructures funcionals).[22] L'actina G només és funcional quan posseeix o bé ADP o bé ATP en la seva esquerda, no obstant això, en la cèl·lula predomina l'estat unit a l'ATP quan l'actina es troba lliure.[20]

L'actina cristal·litzada per Kabsch, que és la més utilitzada com a model en estudis estructurals (ja que va ser la primera a ser purificada) procedeix del múscul esquelètic del conill. Té unes dimensions aproximades de 67 x 40 x 37 Å, una massa molecular de 41785 UMA i un punt isoelèctric estimat en 4,8. La seva càrrega neta a pH = 7 és de -7.[23] [24]
- Estructura primària
La seqüència d'aminoàcids completa d'aquest tipus d'actina va ser determinada per Elzinga i col·laboradors el 1973 i afinada en treballs posteriors pel mateix autor. Conté 374 residus d'aminoàcids. El seu extrem N-terminal és molt àcid. Comença amb un aspartat acetilat en el seu grup amina, mentre que el seu C-terminal és bàsic, format per una fenilalanina precedida per una cisteïna de certa importància funcional. Tots dos extrems se situen en una posició molt propera dins del subdomini I. Pel que fa a aminoàcids anòmals, cal destacar una Nτ-metilhistidina en la posició 73.[23]
- Estructura terciària-dominis
Està formada per dos dominis coneguts com a gran i petit, separats per una esquerda en el centre se situa el lloc d'unió a l'ATP-ADP + Pi. Per sota d'aquest hi ha una escotadura de menor profunditat anomenada solc. Quant es troben en forma nativa, malgrat el seu nom, tots dos tenen una mida equiparable.[9]
En els estudis topològics, per convenció, la proteïna s'orienta de manera que el domini major queda a l'esquerra, mentre que el menor se situa a la dreta. En aquesta posició, el domini petit es divideix al seu torn en el subdomini I (posició inferior, residus 1-32, 70-144 i 338-374) i subdomini II (posició superior, residus 33-69). El domini major també es divideix en dos, el subdomini III (inferior, residus 145-180 i 270-337) i el subdomini IV (superior, residus 181-269). La zona exposada dels subdominis I i III es denomina extrem "barbat", mentre que a la dels subdominis II i IV se l'anomena extrem "en punta de fletxa". Aquesta denominació fa referència al fet que a causa de la petita massa del subdomini 2, l'actina adquireix polaritat, que es discutirà posteriorment en parlar de la dinàmica d'acoblament. Alguns autors nomenen els subdominis com Ia, Ib, IIa i IIb, respectivament.[25]
- Altres estructures destacades
- L'estructura supersecundària més destacada és una β-làmina de cinc cadenes que es compon d'un β-meandre i una unitat β-α β dextrogira. És present en ambdós dominis, fet que suggereix que la proteïna va sorgir per duplicació gènica.[10]
- El lloc d'unió a l'adenosin nucleòtid es troba entre dues estructures en forma de forqueta β que pertanyen als dominis 1 i 3. Els residus implicats són Asp11-Lys18 i Asp154-His161, respectivament.
- Just a sota del nucleòtid es troba el lloc d'unió al catió divalent, que in vivo és amb més probabilitat el Mg2+ o el Ca2+ mentre que in vitro és el format per una estructura quelant en què contribueixen la Lys18 i dos oxígens dels fosfats α i β del nucleòtid. Aquest calci està coordinat amb sis molècules d'aigua que es troben retingudes pels aminoàcids Asp11, Asp154, i Gln137. Juntament amb el nucleòtid forma un complex que restringeix els moviments d'una regió anomenada frontissa o hinge, situada entre els residus 137 i 144, mantenint d'aquesta manera la forma nativa de la proteïna, fins al punt que la seva retirada desnaturalitza el monòmer d'actina. Aquesta regió també és important, perquè determina les conformacions "oberta" o "tancada" de l'esquerda de la proteïna.[12][25]
- Amb gairebé tota probabilitat hi ha almenys tres centres més amb menor afinitat (intermèdia) i uns altres de baixa afinitat per cations divalents. S'ha especulat sobre el paper d'aquests centres en la polimerització de l'actina actuant en l'etapa d'activació.[25]
- En el subdomini 2 hi ha una estructura, anomenada bucle-D o D-loop pel fet que s'uneix a l'ADNasa I, situada entre els residus His40 i Gly48 que apareix com un element desordenat en la majoria dels cristalls i com una làmina β quan està formant complex amb l'ADNasa I. Segons Domínguez et al., L'esdeveniment clau de la polimerització seria la propagació d'un canvi conformacional des del centre d'unió al nucleòtid fins a aquest domini, que passaria de ser un bucle a una hèlix. Aquesta teoria, però, sembla rebutjada per altres treballs.[12][26]
Actina F
[modifica]Una descripció clàssica afirma que l'actina F té una estructura filamentosa interpretable com una hèlix levogira monocatenaria amb gir de 166º i increment de 27,5 Å o bé com una hèlix dextrogira bicatenaria amb mig pas de rosca de 350-380 Å, estant cada actina envoltada de quatre.[27] La simetria del polímer d'actina, que és d'unes 2,17 subunitats per volta d'hèlix és incompatible amb la formació de cristalls, que només és possible quan aquestes són exactament 2, 3, 4 o 6 subunitats per volta. Per tant, s'han d'efectuar models que interpretin dades procedents de tècniques que salven aquests inconvenients, com la microscòpia electrònica, la criomicroscòpia electrònica, cristalls de dímers en diferents posicions o difracció de raigs X.[16] Parlar d'una "estructura" no és correcte per una cosa tan dinàmica com un filament d'actina: en realitat s'hauria de parlar de diferents estats estructurals, entre els quals la dada més constant és l'increment de 27,5 Å, mentre que la rotació de les subunitats mostra una considerable variabilitat, i és normal observar desplaçaments de fins al 10% de la seva posició ideal. Algunes proteïnes, com la cofilina, semblen incrementar l'angle de gir, però novament es pot interpretar que, en lloc d'això, estabilitzen alguns "estats estructurals" normals. Aquests podrien ser importants en el procés de la polimerització.[28]
Pel que fa al radi de gir o gruix del filament, les mesures són més controvertides: mentre que els primers models li assignaven una longitud de 25 Å, dades actuals de difracció de raigs X recolzats per criomicroscòpia electrònica coincideixen en uns 23,7 Å. Aquests mateixos estudis han determinat amb força precisió els punts de contacte entre monòmers. Uns s'estableixen amb unitats de la mateixa cadena, entre l'extrem "barbat" d'un monòmer i l'extrem "en punta de fletxa" del següent, mentre que els monòmers de cadenes adjacents fan contacte lateralment mitjançant projeccions del subdomini 4, sent les més importants la formada pel C-terminal i un enllaç hidròfob format per tres cossos en els quals intervenen els residus 39-42, 201-203 i 286. Per formar part d'un filament, segons aquest model, els monòmers estarien en una configuració anomenada "plana", en què els subdominis giren entre si, i que també sembla trobar-se a l'homòleg bacterià de l'actina MreB.[16]
Ja que totes les subunitats d'un microfilament apunten cap al mateix extrem, es diu que el polímer presenta polaritat en la seva estructura. Aquest fet ha creat una convenció: l'extrem que posseeix una subunitat d'actina exposant el lloc pel qual uneix ATP al medi se l'anomena «extrem (-)» mentre que l'oposat, en el qual l'esquerda està dirigida a un altre monòmer adjacent, rep el nom d'«extrem (+)».[18] La denominació «en punta de fletxa» i «barbat» dels extrems dels microfilaments es deu al seu aspecte al microscopi electrònic de transmissió quan es processen mitjançant una tècnica anomenada «decoració». Aquest mètode consisteix en l'addició d'elements S1 de la miosina en teixits fixats amb àcid tànnic, aquesta miosina s'uneix de forma polar als monòmers d'actina, cosa que dona lloc a una configuració semblant a fletxes amb plomes al llarg de tot el seu fust, on el fust correspondria a l'actina i les plomes a la miosina. D'aquesta manera, l'extrem del microfilament que queda sense miosina sobresortint s'interpreta com la punta de la fletxa, mentre l'oposat s'anomena barbat.[29]
Al múscul, el filament helicoidal de l'actina F conté també una molècula de tropomiosina, una proteïna d'una longitud de 40 nanòmetres que s'enrotlla al voltant de l'hèlix d'actina F. Durant l'estat de repòs cel·lular, la tropomiosina recobreix els llocs actius de l'actina de manera que no s'aconsegueix la interacció actina-miosina que produeix la contracció muscular. Unides al llarg del fil de tropomiosina hi ha altres molècules proteiques, les troponines, complexos de tres polímers: troponina I, troponina T i troponina C.[30]
Plegament
[modifica]
L'actina pot adquirir espontàniament una gran part de la seva estructura terciària.[32] No obstant això, mostra un comportament molt especial i gairebé únic en la forma en què adquireix la seva forma plenament funcional a partir de la seva forma nativa acabada de sintetitzada. La raó d'una ruta tan especial podria ser la necessitat d'evitar la presència de monòmers d'actina mal plegats, que serien tòxics, ja que podrien actuar com a terminadors inadequats de la polimerització. En qualsevol cas, és clau per a l'estabilitat del citoesquelet, i no només això, sinó que podria ser un procés essencial per a la coordinació del cicle cel·lular.[33][34]
Per això empra obligadament un tipus de xaperonina (proteïna que ajuda a altres a plegar-se) citosòlica del grup II, la CCT, formada per un doble anell de vuit subunitats diferents (heterooctamèric) que es distingeix de les altres xaperones moleculars, i en especial de la seva homòloga arqueobactèria GroEL en el fet que no necessita una co-xaperona que actuï com a tapadora sobre la cavitat central catalítica. Accepta substrats unint-se a ells mitjançant dominis específics, de manera que en principi es va pensar que era exclusiva d'actina i tubulina, encara que actualment s'ha vist per immunoprecipitació que almenys interacciona amb un gran nom de polipèptids, possiblement com a substrats. Actua mitjançant canvis conformacionals dependents d'ATP, necessitant a vegades diverses rondes d'alliberament i catàlisi per completar el seu treball.[35]
Per al seu correcte plegament, l'actina i la tubulina també necessiten específicament el concurs d'una altra proteïna, la prefoldina, un complex heterohexamèric (format per sis subunitats diferents), i tan específicament que fins i tot hi ha coevolucionat. En el cas de l'actina, se li uneix immediatament mentre encara s'està traduint, aproximadament quan té una longitud de 145 aminoàcids, que són els corresponents al domini N-terminal.[36]
S'empren subunitats de reconeixement diferent per l'actina i la tubulina, encara solapades. Probablement en el cas de l'actina es tracta de les subunitats PFD3 i PFD4 que s'uneixen a l'actina en dos llocs, l'I, entre els residus 60-79 i el II, entre els residus 170-198. L'actina es reconeix, es carrega i es lliura a la CCT en conformació oberta per la part interna de l'extrem dels "tentacles" de la prefoldina (vegeu imatge i nota al peu).[n. 1] El contacte en el moment del lliurament és tan breu que no s'arriba a formar un complex ternari, alliberant la prefoldina immediatament.[31]

Posteriorment, la xaperonina citosòlica (CCT) efectua el plegament de l'actina de forma seqüencial, i formant unions amb les subunitats, en comptes de tancar-la en la seva cavitat.[n. 2] Per a això té zones específiques de reconeixement en el seu domini β apical. La primera etapa del plegament consistiria en el reconeixement dels residus 245-249. Posteriorment, altres determinants hi establirien contacte.[37] Tant l'actina com la tubulina s'uneixen a la CCT en conformacions obertes en absència d'ATP. En el cas de l'actina, a cada canvi conformacional s'uneix a dues subunitats, a diferència de la tubulina, que ho fa a quatre. L'actina té seqüències d'unió específiques, interaccionant amb les subunitats CCTδ i β o bé amb CCTδ i CCTε. Després de la unió d'AMP-PNP a la CCT, els substrats van movent-se per la cavitat de la xaperonina. Sembla també que en el cas de l'actina fa falta la proteïna CAP com un possible cofactor en els estadis finals del plegament de l'actina.[34]
Encara no es coneix amb exactitud la regulació d'aquest procés, però se sap que la proteïna PhLP3 (proteïna semblant a la fosducina) regula la seva activitat inhibint-la, mitjançant la formació d'un complex ternari.[35]
Mecanisme catalític de l'ATPasa
[modifica]L'actina és una ATPasa, és a dir, un enzim que hidrolitza ATP. Aquest conjunt d'enzims es caracteritzen per actuar amb extrema lentitud. Se sap que aquesta ATPasa és "activa" o, cosa que és el mateix, la seva velocitat augmenta unes 40.000 vegades quan l'actina forma part d'un filament.[28] Un valor de referència per a aquesta taxa d'hidròlisi sota certes condicions ideals seria de 0,3 s-1. Posteriorment, el Pi romandria molt de temps unit a l'actina costat de l'ADP, alliberant-se a prop de l'extrem del filament.[38]
Avui dia no es coneixen els detalls moleculars concrets del mecanisme catalític. Encara que hi ha molta polèmica sobre aquest tema, sembla clar que per a la hidròlisi d'ATP cal una conformació "tancada", i es creu que apropa els residus implicats a la distància adequada.[28] Un dels residus clau seria Glu137, situat al subdomini 1. La seva funció seria ancorar la molècula d'aigua que produeix un atac nucleofílic a l'enllaç del fosfat γ de l'ATP, mentre el nucleòtid s'uneix fortament als subdominis 3 i 4. La lentitud del procés catalític es deuria a la gran distància i posició esbiaixada d'aquesta molècula d'aigua que fa al seu reactant. Amb molta probabilitat, el canvi conformacional que es produeix per rotació de dominis entre les formes G i F de l'actina apropa la Glu137, permetent la seva hidròlisi. Segons aquest model, la polimerització i la funció ATPasa estarien desacoblades en un primer moment.[16]
Dinàmica d'acoblament
[modifica]
L'actina F combina les qualitats de ser resistent i dinàmica. A diferència d'altres polímers, com l'ADN, que mantenen units els seus elements constitutius mitjançant enllaços covalents, en els filaments d'actina els monòmers s'acoblen per enllaços més febles de tipus no covalent. Això, que en principi debilita l'estructura, ja que es podria trencar per agitació tèrmica, se soluciona mitjançant els enllaços laterals amb els monòmers veïns. Al mateix temps, els enllaços febles mantenen l'avantatge que els extrems del filament poden alliberar o incorporar fàcilment monòmers, de manera que es poden remodelar ràpidament i canviar l'estructura cel·lular de la qual són responsables en resposta a estímuls ambientals. Això últim i el mecanisme bioquímic pel qual s'efectua és el que es coneix com a "dinàmica d'acoblament".[4]
- Estudis in vitro
Els estudis de la dinàmica d'addicció i pèrdua de subunitats dels microfilaments s'han realitzat in vitro (és a dir, al laboratori, fora de sistemes mòbils), ja que el polímer d'actina resultant dona lloc a la mateixa actina F produïda in vivo, on aquest procés està controlat per multitud de proteïnes per respondre a les necessitats mòbils, de manera que seria molt difícil observar les seves condicions bàsiques.[39] In vitro, aquest fet es produeix de forma seqüencial: primer, es dona una «fase d'activació», on la unió i intercanvi de cations divalents en llocs específics de l'actina G, unit a ATP, produeixen un canvi conformacional, conegut a vegades com Actina G o monòmer d'actina F, ja que és més semblant a les unitats que se situen en el filament.[25] Això la prepara per a la següent «fase de nucleació», en la qual l'actina G dona lloc a petits fragments inestables d'actina F capaços de polimeritzar-se. Inicialment es formen dímers i trímers de manera inestable. Quant el nom d'aquests és prou gran, té lloc la «fase d'elongació», on el filament es forma i creix ràpidament mitjançant l'addició reversible de nous monòmers a ambdós extrems.[40] Finalment, en l'«equilibri estacionari», els monòmers d'actina G s'intercanvien en els extrems del microfilament sense que variï la longitud total del polímer.[3] En aquesta última fase es defineix la «concentració crítica Cc» com la relació entre les constants d'acoblament i desacoblament (es tracta, doncs, d'una constant de dissociació), i representa la concentració d'actina G en la qual la dinàmica d'addició i eliminació de monòmers no produeix una modificació en la longitud del microfilament. En les condicions usuals in vitro, Cc és de 0,1 μM,[41] cosa que significa que a valors grans es dona una polimerització ja valors menors, una despolimerització.[42]
- Paper de la hidròlisi d'ATP
Un assumpte important que introduït en l'apartat anterior és el fet que, encara que l'actina hidrolitza ATP, tot sembla indicar que això no intervé en l'acoblament, ja que, d'una banda, la hidròlisi es produeix en gran manera a l'interior del filament, i de l'altra, l'ADP també pot polimeritzar-se. Això planteja la qüestió de comprendre quin és el procés termodinàmicament desfavorable que requereix una despesa d'energia tan ingent. L'anomenat "cicle de l'actina", que lliga la hidròlisi a la polimerització, consisteix en l'addició de monòmers d'actina G-ATP preferentment a l'extrem barbat, creant un flux de monòmers cap a l'extrem en punta de fletxa en el qual es coneix com "trenament" (threadmilling, en anglès), on els monòmers estarien en forma d'actina F-ADP i serien alliberats, intercanviant posteriorment aquest ADP per ATP i tancant d'aquesta manera el cicle.
Poc després de l'addició, es produeix la hidròlisi de l'ATP de forma relativament ràpida. Hi ha dues hipòtesis sobre com es produeix, l'estocàstica, en la qual la hidròlisi es produiria a l'atzar influïda en certa manera per les molècules veïnes, i la vectorial, en la qual només es produiria en el límit amb altres molècules que ja han hidrolitzat el seu ATP. En qualsevol cas, no s'allibera el Pi resultant, sinó que roman un temps unit no de manera covalent a l'actina ADP, de manera que existirien tres espècies d'actina en un filament: ATP-actina, ADP + Pi-actina i ADP-actina.[38] El contingut d'un filament en cadascuna d'aquestes espècies depèn de la seva longitud i estat: al començament de l'elongació, el filament té una composició aproximadament equivalent de monòmers amb ATP i ADP + Pi i una petita quantitat al costat de l'extrem (-) d'actina ADP. A mesura que s'assoleix l'estat estacionari, la situació s'inverteix, estant la major part del filament amb ADP i l'extrem (+) pràcticament només amb ADP + Pi, amb l'ATP reduït a l'extrem.[43]
Si es comparen els filaments d'actina-ADP purs amb aquells que incorporen ATP, en els primers les constants crítiques són similars en ambdós extrems, mentre que en els altres dos nucleòtids la Cc són diferents, sent major en l'extrem (+), amb la qual es donen les següents situacions:[18]
- Per concentracions d'actina G-ATP menors a la concentració crítica de l'extrem (+) (és a dir, Cc +) no es produeix l'elongació del filament.
- Per concentracions d'actina G-ATP majors que la concentració crítica de l'extrem (-) (és a dir, Cc -) però menors a la concentració crítica de l'extrem (+) (o Cc +) l'elongació es dona en l'extrem (+).
- Per concentracions d'actina G-ATP majors que la concentració crítica de l'extrem (-) (o Cc-) el microfilament creix en ambdós extrems.
Per tant, es pot deduir que l'energia de la hidròlisi s'utilitza per a crear un veritable "estat estacionari", és a dir, d'un flux en lloc d'un simple equilibri, la qual cosa dota de dinamisme, polaritat i força de tracció al filament, cosa que justifica la despesa pel guany de funcions biològiques essencials.[38] A més, la configuració dels diferents tipus de monòmers és detectada per les proteïnes d'unió a l'actina que controlen aquest dinamisme, com es veurà en la propera secció.[44]
Proteïnes associades
[modifica]
In vivo, el citoesquelet d'actina no està compost exclusivament d'actina, sinó que per la seva generació, permanència i funció requereix altres proteïnes, que es denominen proteïnes d'unió a l'actina (ABP, actin binding proteins) i intervenen en la seva polimerització i despolimerització, en la seva estabilitat, en la seva organització en feixos o xarxes, en la seva fragmentació i en la seva destrucció.[3] La diversitat d'aquestes proteïnes és tal, que es considera que l'actina és la proteïna que participa en la majoria d'interaccions proteïna-proteïna de quantes es coneixen.[46] Per exemple, hi ha elements que segresten l'actina G, impedint la seva incorporació als microfilaments. De la mateixa manera, hi ha proteïnes que estimulen la seva polimerització o que doten de complexitat a les xarxes en síntesis.[18]
- La timosina β4 és una proteïna de 5 kDa capaç d'unir-se a l'actina G-ATP en una estequiometria 1:1, això vol dir que una unitat de timosina β4 s'uneix a una altra d'actina G, en aquesta proporció. El seu paper és impedir la incorporació dels monòmers al polímer en creixement.[47]
- La profilina és una proteïna citosòlica de 15 kDa que també s'uneix en estequiometria 1:1 als monòmers d'actina G-ATP, però la seva funció és diferent: facilita l'intercanvi de nucleòtids ATP per ADP. A més, està implicada en altres funcions cel·lulars, com la unió de repeticions de Pro en altres proteïnes o de lípids que actuen com a segons missatgers.[48][49]

Altres proteïnes d'unió a actina regulen la longitud dels microfilaments realitzant talls en ells, la qual cosa dona lloc a nous extrems actius per a la polimerització. És a dir, si un microfilament, que posseeix dos extrems els quals poden unir-se o dissociar monòmers, és tallat dues vegades, resulten tres nous microfilaments amb sis extrems, la nova situació afavoreix la dinàmica d'acoblament i desacoblament. Entre aquestes proteïnes destaquen la gelsolina i la cofilina. Cal ressaltar que primer realitzen el tall mitjançant canvis en la conformació del monòmer d'actina al que s'uneixen en el polímer, quedant després recobrint el nou extrem (+) generat, el que impedeix l'agregat o l'intercanvi de noves subunitats d'actina G i, ja que els extrems (-) queden sense recobrir, afavoreixen la despolimerització dels filaments.[51]
Un altre tipus de proteïnes d'unió a l'actina recobreixen els extrems de l'actina F per tal d'estabilitzar-los, sense capacitat de trencar-los. Exemples d'aquestes proteïnes són CapZ (que uneix els extrems (+) segons els nivells de Ca2 + / calmodulina de la cèl·lula, nivells que depenen de senyals externs i internes de la cèl·lula i que intervenen en la regulació de les seves funcions biològiques)[52] o la tropomodulina (que uneix els extrems (-)). La tropomodulina és essencial com estabilitzador de l'actina F present en les miofibrilles dels sarcòmers del múscul, estructures caracteritzades per la seva gran estabilitat.[53]

El complex Arp2/3 es troba àmpliament difós en tots els organismes eucariotes.[55] Està compost per set subunitats, algunes de les quals tenen una topologia clarament relacionada amb la seva funció biològica: dues de les seves subunitats, anomenades «ARP2» i «ARP3», tenen una estructura molt semblant als mateixos monòmers d'actina. Aquesta homologia permet a ambdues unitats comportar-se com a agents nucleants de la polimerització dels monòmers d'actina G a actina F. A més, aquest complex és necessari per establir estructures dendrítiques i en anastomosi (és a dir, bifurcades o en xarxa), per tant més complexes, d'actina F.[56]
Inhibidors químics
[modifica]
Existeixen diverses toxines que interfereixen amb la dinàmica de les actines, tant despolimerizant-les (latrunculina i citocalasina D) com estabilizant-les (faloidina):
- La latrunculina, una toxina produïda per porífers, s'uneix a l'actina G impedint la seva unió als microfilaments.[57]
- La citocalasina D, un alcaloide produït per fongs, s'uneix a l'extrem (+) de l'actina F impedint l'addició de nous monòmers.[58] S'han descrit efectes de la citocalasina D, intervinguts per la disrupció de la dinàmica d'actines, en l'activitat de p53 (en animals)[59] o en respostes gravitròpiques (en plantes).[60]
- La faloidina, una toxina aïllada del fong Amanita phalloides, s'uneix a la interfície existent entre els monòmers d'actina adjacents del polímer d'actina F, la qual cosa evita la despolimerització d'aquest.[58]
Funcions i localització
[modifica]L'actina com a proteïna es troba tant en el citoplasma com al nucli cel·lular.[61] Aquesta localització està regulada per les vies de transducció de senyals que integren els estímuls que la cèl·lula rep i que permet la reestructuració de les xarxes d'actina en resposta a aquells. En Dictyostelium, s'ha referit la intervenció de la ruta de fosfoinosítits intervinguda per la fosfolipasa D.[62] Els filaments d'actina són especialment abundants i estables en les fibres musculars. Dins del sarcòmer (la unitat morfològica i fisiològica de les fibres musculars) l'actina es disposa en les bandes I i A, en aquesta última, es presenta conjuntament amb la miosina.[63]
Citoesquelet
[modifica]
Els microfilaments intervenen en el moviment de totes les cèl·lules mòbils, fins i tot les no musculars, ja que s'ha descrit que els fàrmacs que desorganitzen l'actina F (com les citocalasines) afecten l'activitat d'aquestes cèl·lules. Com a proteïna, l'actina suposa el 2% del total de proteïnes en hepatòcits, el 10% en fibroblasts, el 15% a amebes i fins al 50-80% en plaquetes activades.[64] Existeixen diferents grups d'actina, amb estructura i funció lleugerament diferents. D'aquesta manera, l'actina α és exclusiva de fibres musculars, i la present en altres cèl·lules sol ser del tipus β i γ. A més, l'actina de diferent tipus de la α sol posseir una alta taxa de recanvi que provoca que la major part d'ella no formi part d'estructures permanents. Així, els microfilaments en les cèl·lules no musculars apareixen de dues formes:[65]
- Xarxes de microfilaments. Sota la membrana plasmàtica és comú en cèl·lules animals l'aparició d'una escorça cel·lular poblada per multitud de microfilaments que exclou la presència d'orgànuls. Aquestes xarxes estan en relació amb abundants receptors cel·lulars que transdueixen senyals de l'exterior de la cèl·lula.
- Feixos de microfilaments. Aquests microfilaments, disposats en xarxes, són de major longitud i, en associació amb proteïnes contràctils com la miosina no muscular, intervenen en el desplaçament de substàncies a nivell intracel·lular.
Llevats
[modifica]En llevats, el citoesquelet d'actina és clau durant els processos d'endocitosi, citocinesi, determinació de la polaritat cel·lular i durant la morfogènesi. Aquests fets, a més de dependre de l'actina, impliquen de 20 a 30 proteïnes associades, altament conservades evolutivament, així com multitud de molècules de senyalització; aquests elements permeten, en combinació, un assemblatge especialment i temporalment modulat que defineix la biologia cel·lular en resposta a estímuls interns i externs.[66]
Els llevats posseeixen tres grans tipus d'elements productes de l'associació de l'actina: pegats, cables i anells que, tot i detectar durant llargs períodes, es veuen sotmesos a un equilibri dinàmic a causa de la contínua polimerització i despolimerització. Com proteïnes accessòries, tenen una cofilina/ADF de 16 kDa (codificiada per un únic gen, denominat COF1), Aip1, un cofactor de la cofilina que afavoreix el desencadellat dels microfilaments, Srv2/CAP, un regulador de la dinàmica relacionat amb proteïnes adenilat ciclases, una profilina d'aproximadament 14 kDa que s'associa als monòmers d'actina, i tinfilina, una proteïna de 40 kDa implicada en l'organització de les estructures tipus pedaç.[66]
Plantes
[modifica]Els estudis de genòmica de plantes han revelat l'existència d'isovariants proteiques dins de la família de gens de l'actina, dins d'Arabidopsis thaliana, una magnoliòpsida emprada com a organisme model, hi ha almenys deu tipus d'actines, nou de tubulines α, sis de tubulines β, sis de profilines i dotzenes de miosines. Tal diversitat s'explica d'acord amb la necessitat evolutiva de posseir variants lleugerament diferents en la seva pauta d'expressió temporal i espacial, no obstant això, la majoria d'elles s'expressen conjuntament en els teixits analitzats. L'entramat de xarxes d'actina es distribueix per tot el citoplasma de les cèl·lules cultivades in vitro, amb un reforç entorn del nucli que es connecta, mitjançant radis, a l'escorça cel·lular; aquest entramat és altament dinàmic, amb un polimeritzat i despolimerizat continu.[67]

Si bé les cèl·lules vegetals posseeixen generalment una paret que defineix la seva morfologia i impedeix el seu moviment, els seus microfilaments generen les forces necessàries per a diverses activitats cel·lulars, per exemple, els corrents citoplasmàtics generats pels microfilaments i les miosines. A més, l'actina intervé en el moviment d'orgànuls i morfogènesi cel·lular, processos que inclouen la divisió cel·lular, l'elongació i la diferenciació.[69]
Pel que fa a les proteïnes associades al citoesquelet d'actina presents en plantes cal esmentar:[69] la vil·lina, una proteïna de la família de la gelsolina/severina, capaç de tallar microfilaments i unir monòmers d'actina en presència del catió calci; la fimbrina, un element capaç de reconèixer i unir monòmers d'actina i que intervé en la formació d'entramats (mitjançant una regulació diferent de la pròpia de cèl·lules animals i llevats);[70] les formines, proteïnes capaces d'actuar com a agent nucleant de la polimerització a actina F; la miosina, típic motor molecular propi d'eucariotes que, en Arabidopsis thaliana, està codificat per 17 gens classificats en dues classes diferents; CHUP1, capaç d'unir actina i implicat en la distribució espacial dels cloroplasts en la cèl·lula; KAM1/MUR3, una proteïna que defineix la morfologia del complex de Golgi així com la composició en xiloglucans de la paret cel·lular; NtWLIM1, proteïna que faculta l'aparició d'estructures aovillades d'actina; i ERD10, que participa en l'associació entre orgànuls delimitats per membranes i els microfilaments i que sembla tenir un paper especialment rellevant en presència de l'estrès.
Contracció muscular
[modifica]
Al múscul, el filament helicoidal de l'actina F conté també una molècula de tropomiosina, una proteïna d'una longitud de 40 nanòmetres que s'enrotlla al voltant de l'hèlix d'actina F. Durant l'estat de repòs cel·lular, la tropomiosina recobreix els llocs actius de l'actina de manera que no s'aconsegueix la interacció actina-miosina (aquesta interacció dona lloc a un lliscament entre tots dos que, per coordinació de moltes còpies d'aquests elements disposats en els músculs, produeix la seva contracció). Unides al llarg del bri de tropomiosina hi ha altres molècules proteiques, les troponines, complexos de tres polímers: troponina I, troponina T i troponina C.[30] La funció moduladora de la tropomiosina depèn de la interacció amb la troponina en presència d'ions de Ca2+.[71]
L'actina, juntament amb la miosina, intervé en la contracció i relaxació dels músculs, constituint les dues al voltant del 90% de les proteïnes musculars.[72] El procés global es dispara mitjançant un senyal extern, típicament mitjançant un potencial d'acció excitador del múscul que alberga les cèl·lules especialitzades riques en filaments d'actina i miosina en el seu interior. El cicle de contracció-relaxació respon als següents passos:[73]
- Despolarització del sarcolema i transmissió del potencial d'acció a través dels túbuls T.
- Obertura de canals de Ca2+ del reticle sarcoplàsmic.
- Augment de la concentració citosòlica de Ca2+ i interacció d'aquests cations amb la troponina causant una modificació en la seva conformació, que altera al seu torn l'estructura de la tropomiosina, que recobreix el lloc actiu de l'actina, permetent l'establiment dels enllaços creuats miosina-actina (aquesta última present com a filaments prims).[30]
- Moviment dels caps de miosina sobre els filaments prims, tant de forma independent com a depenent d'ATP. Aquest últim mecanisme, intervingut per l'activitat ATPasa dels caps de miosina, provoca el moviment dels filaments d'actina cap al disc Z.
- Captura del Ca2+ per part del reticle sarcoplàsmic, que provoca un nou canvi conformacional en la tropomiosina que inhibeix la interacció actina-miosina.[72]
Altres processos biològics
[modifica]L'estudi clàssic de la funció de l'actina el circumscriu el manteniment del citoesquelet i, per això, a l'organització i moviment dels orgànuls i determinació de la forma cel·lular.[65] Tanmateix, el paper de l'actina és bastant més ampli en la fisiologia cel·lular eucariota; més encara, existeixen elements semblants en procariotes.
- Citocinesi: En les cèl·lules animals i de llevats, la divisió cel·lular sol comportar la separació de la cèl·lula mare en dues cèl·lules filles mitjançant la constricció de la seva zona equatorial. En aquest procés intervé un anell contràctil d'actina, miosina i actinina α.[74] En el llevat de fissió Schizosaccharomyces pombe, l'actina s'acobla activament en l'anell contràctil amb la participació d'Arp3, la formina Cdc12, profilina i WASP, si bé intervenen també microfilaments preformats. Un cop constituït l'anell, l'estructura es manté en un continu ensamblat/desencadellat que, amb l'ajut del complex Arp2/3 i de les formines, esdevé un procés central de la citocinesi.[75] El conjunt d'anell contràctil, microtúbuls del fus acromàtic i el material dens perifèric s'anomena «cos de Fleming» o «cos intermedi».[65]
- Apoptosi: Durant la mort cel·lular programada, la família de proteases anomenades ICE/ced-3 (de la família de les proteases conversores d'interleuquina-1β) degraden in vivo l'actina en dos fragments de 15 kDa i 31 kDa, la qual cosa suposa un dels mecanismes de destrucció de la viabilitat cel·lular en què es basa l'apoptosi.[76] També s'ha citat aquesta destrucció mitjançant la proteasa calpaïna;[77] tant és així, que l'ús d'inhibidors de la calpaina disminueix la proteòlisi de l'actina i, fins i tot, la degradació de l'ADN (un altre dels elements característics de l'apoptosi)[78] d'altra banda, la inducció del procés d'apoptosi mitjançant un estrès passa per la reorganització del citoesquelet d'actina (cosa que implica també la seva polimerització), donant lloc a les estructures denominades fibres d'estrès; aquest fet està senyalitzat mitjançant la via de les MAP kinases.[79]

- Adhesió cel·lular i desenvolupament: L'adhesió entre cèl·lules és una característica dels organismes pluricel·lulars que sustenta la capacitat d'especialització tissular i, per això, l'augment de la complexitat d'aquells. Les unions cel·lulars dels epitelis empren el citoesquelet d'actina, dins de cada cèl·lula, i les cadherines, com a elements extracel·lulars, amb una connexió entre ambdues intervingudes per catenines.[80] La interrupció de la dinàmica d'actines repercuteix en el desenvolupament dels organismes; de fet, l'actina és un element tan crucial que, generalment, es disposa de sistemes de gens redundants. Per exemple, els exemplars de Dictyostelium els quals se'ls havia privat del gen de l'actinina α o del factor gelificant no mostraven un fenotip anòmal possiblement pel fet que una de les proteïnes podia realitzar la funció de l'altra, en canvi, en els dobles mutants, mancats d'ambdues, el desenvolupament es va veure alterat.[81]
- Modulació de l'expressió gènica: L'estat de polimerització d'actina influeix en la pauta d'expressió gènica. L'any 1997, en treballs emprant cèl·lules de Schwann es va detectar que la despolimerització intervinguda per citocalasina D provocava una pauta d'expressió peculiar dels gens implicats en la mielinització d'aquest tipus de cèl·lules nervioses.[82] Quan als organismes unicel·lulars, en alguna de les seves fases vitals s'ha demostrat que l'actina F també modifica el transcriptoma en el fong Candida albicans.[83] A més, proteïnes semblants a l'actina exerceixen un paper regulador durant l'espermatogènesi al ratolí[84] i, en llevats, s'ha proposat un paper de proteïnes semblants a actina en la modulació epigenètica.[85] De fet, l'actina és capaç, juntament amb un tipus de miosina nuclear d'interaccionar amb ARN polimerases i altres enzims de la maquinària transcripcional i actuar així com a iniciador de la transcripció.[61]
- Dinàmica d'estereocilis: Alguns tipus de cèl·lules desenvolupen en la seva superfície unes fines evaginacions filiformes amb funció mecanosensorial denominades estereocil·lis. Per exemple, aquests orgànuls són els implicats en el sentit de l'oïda en l'òrgan de Corti. Com a característica principal, aquestes estructures tenen una longitud que pot modificar-se.[86] Pel que fa a la seva arquitectura molecular, els estereocil·lis posseeixen un nucli paracristal·lí d'actina en equilibri dinàmic amb els monòmers presents en el citosol adjacent. Al llarg d'aquest nucli es disposen miosines dels tipus VI i VIIa, mentre que la miosina XVa ho està en els seus extrems i en quantitats proporcionals a la longitud de l'estereocil·li.[87]
Patologia molecular
[modifica]En la majoria dels mamífers existeixen sis gens diferents d'actina. Dos d'ells estan relacionats amb el citoesquelet (ACTB i ACTG1) mentre que les quatre restants ho estan amb el múscul esquelètic (ACTA1), el múscul llis (acta2), el múscul llis entèric (ACTG2) i amb el múscul cardíac (ACTC1). Les mutacions que afecten a aquests gens eren desconegudes fins al 1998, i s'ha vist que produeixen miopaties, variacions en la grandària i la funció cardíaca i sordesa. Així mateix, l'actina del citoesquelet està implicada en el mecanisme de patogenicitat de múltiples agents infecciosos, inclòs el VIH. La immensa majoria de les mutacions que afecten a l'actina són de tipus puntual i tenen un efecte dominant, excepte almenys sis mutacions de miopatia nemalínica. Això és a causa que en molts casos la varietat mutant del monòmer d'actina actua fent de "capping", és a dir, com a terminador de l'elongació de l'actina F.[25]
Relacionada amb ACTA1
[modifica]L'ACTA1 és el gen que codifica la isoforma α de l'actina humana present principalment en el múscul esquelètic, tot i que també s'expressa en el múscul cardíac i en la glàndula tiroides.[88] La seva seqüència consta de set exons, que produeixen cinc transcrits coneguts.[89] El 2006, l'ENMC (European Neuromuscular Centre) havia publicat 116 mutacions relacionades amb patologies, conegudes com a actinopaties. La major part d'elles consisteixen en substitucions puntuals d'aminoàcids, que en molts casos poden ser associats amb el fenotip que determina la severitat i el curs de l'afecció.[25][89]

Es manifesten alterant l'estructura i la funció del múscul esquelètic produint tres formes de miopatia: miopatia nemalínica tipus 3, miopatia congènita amb excés de microfilaments (CM) i miopatia congènita amb desproporció de tipus de fibra (CFTDM). També s'ha detectat mutacions que produeixen miopatia amb cores (zones desproveïdes d'activitat oxidativa).[91] Encara que els seus fenotips són similars, a més de la miopatia nemalínica típica i la de bastons intranuclears, alguns especialistes distingeixen un tipus de miopatia anomenada actínica de la miopatia nemalínica. A la primera s'acumulen agregats d'actina en lloc dels típics bastons. És important assenyalar que un pacient pot mostrar més d'un d'aquests fenotips en la biòpsia.[92] Els símptomes més habituals consisteixen en una morfologia facial típica (fàcies miopàtica), debilitat muscular i retard en el desenvolupament motor i dificultats respiratòries. El curs, la gravetat i l'edat d'aparició són molt variables, i es troben formes de miopatia solapades. A la miopatia nemalínica apareixen unes estructures no patognomòniques en diverses localitzacions de les fibres musculars tipus 1 conegudes com a "bastons nemalínics", amb una composició similar als discos z del sarcòmer.[93]
La patogènesi és molt variada. Moltes mutacions es donen a la zona d'esquerda de l'actina, properes al lloc d'unió per nucleòtids, mentre que altres es donen en domini 2, o bé a les zones d'interacció amb les proteïnes associades, la qual cosa explica la gran varietat d'agregats que es formen en aquests casos, com cossos nemalínics, intranuclears o cossos zebra.[25] A la miopatia nemalínica es produeixen canvis en el plegament i en les propietats d'agregació de l'actina, i també en l'expressió d'altres proteïnes associades. En algunes variants en les quals es troben cossos intranuclears, el canvi en el plegament oculta el senyal d'exportació nuclear, de manera que l'agregació de la forma mutant d'actina es produeix en el nucli cel·lular.[94] En canvi, sembla que en les mutacions d'ACTA1 que donen lloc a CFTDM està més afectada la funció sarcomèrica que l'estructura en si.[95] Treballs recents tracten d'aclarir l'aparent paradoxa que no existeixi una correlació clara entre l'abundància de bastons i la debilitat muscular. Sembla que algunes mutacions particulars són capaces d'induir una major taxa d'apoptosi en les fibres musculars tipus II.[33]

De múscul llis
[modifica]Existeixen dues isoformes que codifiquen actines del múscul llis:
L'ACTG2 codifica la isoforma més llarga d'actina, amb nou exons, un d'ells, el situat en l'extrem 5', que no es tradueix.[96] Es tracta d'una γ actina que s'expressa en el múscul llis entèric. No s'han trobat mutacions que es corresponguin a patologies amb aquest gen, tot i que s'ha vist mitjançant microarrays que és la proteïna que, amb diferència, més augmenta la seva expressió en els casos de resistència a la quimioteràpia amb cisplatí.[97]
L'ACTA2 codifica una actina α localitzada en el múscul llis, i també en el múscul llis vascular. S'ha vist que una mutació, la MYH11, podria ser responsable d'almenys un 14% dels casos d'aneurismes d'aorta toràcica hereditària, concretament el tipus 6, ja que la variant mutada produeix un mal acoblament dels filaments i una reducció de la capacitat de contracció del múscul llis vascular. S'observa en aquests individus degeneració aòrtica medial, amb àrees de desorganització i hiperplàsia, i estenosi de les vases vasorum de l'aorta.[98] El nom d'afeccions en què podria estar implicat aquest gen està en augment. Se li ha relacionat amb la malaltia de Moyamoya, i sembla que algunes mutacions en heterocigosi podrien conferir predisposició a moltes patologies vasculars, com l'aneurisma d'aorta toràcica i la cardiopatia isquèmica.[99] L'actina α de múscul llis també és un interessant marcador per avaluar la progressió de la cirrosi hepàtica.[100]
De múscul cardíac
[modifica]L'ACTC1 és el gen que codifica la isoforma de l'actina α present en el múscul cardíac. Es va seqüenciar per primera vegada per Hamada i col·laboradors el 1982, observant-se que estava interromput per cinc introns.[101] Va ser el primer gen dels sis on es van trobar al·lels implicats en processos patològics.[102]

S'han descrit diversos trastorns estructurals que comporten una disfunció cardíaca associada a mutacions puntuals en aquest gen, com miocardiopatia dilatada tipus 1R i la miocardiopatia hipertròfica tipus 11. Recentment s'ha vist que alguns defectes atrials septals també podrien estar relacionats.[104][105]
En el cas de la cardiomiopatia dilatada, s'han estudiat dos casos en els quals en ambdós es produeix una substitució en aminoàcids molt conservats pertanyents als dominis que s'uneixen als discos Z i intercalats, la qual cosa porta a la hipòtesi que la dilatació es produeix per un defecte de transmissió de la força contràctil en els miòcits.[27][102]
Les alteracions de l'ACTC1 són responsables de menys del 5% de les cardiomiopaties hipertròfiques.[106] S'han demostrat també l'existència de diverses mutacions puntuals:[107]
- Mutació E101K: canvis de càrrega neta i formació d'enllaç electroestàtic feble en la posició d'unió de l'actomiosina.
- P166A: zona d'interacció entre monòmers d'actina.
- A333P: zona d'interacció actina-miosina.
La patogènesi sembla obeir a un mecanisme compensatori: les proteïnes mutants actuarien com un "tòxic" amb un efecte dominant, disminuint la capacitat de contracció amb un rendiment mecànic anormal, de manera que la hipertròfia, que sol ser tardana, seria conseqüència d'una resposta normal del múscul cardíac a l'estrès.[108]
Recentment s'han trobat mutacions d'ACTC1 implicades en dos processos patològics: la miocardiopatia restrictiva idiopàtica infantil,[109] i el miocardi ventricular esquerre no compacte.[110]
D'actines citoplasmàtiques
[modifica]L'ACTB és un locus molt complex. Hi ha multitud de pseudogens repartits per tot el genoma, i la seva seqüència conté sis exons que poden donar lloc fins a 21 transcrits diferents per splicing alternatiu, coneguts com a actines β. En congruència amb aquesta complexitat, també els seus productes tenen localitzacions i formen part de processos molt diferents (citoesquelet, complex NuA4 histona-aciltransferasa, nucli cel·lular) i pel mateix també se li ha associat al mecanisme de gran quantitat de processos patològics (carcinomes, distonia juvenil, mecanismes d'infeccions, malformacions en el sistema nerviós i invasivitat de neoplasmas, entre altres)[111] s'ha trobat una nova forma d'actina, l'actina κ, que sembla substituir l'actina β en processos tumorals.[112]

Fins al moment s'han pogut detectar tres processos patològics que es deuen a una alteració directa de la seqüència d'un gen:
- L'hemangiopericitoma amb translocació t (7; 12) (p22; q13) és una afecció rara on es produeix una fusió per translocació del gen ACTB sobre GLI1 en el cromosoma 12.[114]
- La distonia de debut juvenil és una malaltia degenerativa rara, amb afectació sistèmica del sistema nerviós central, i especialment d'àrees neocorticals i talàmiques, on es poden apreciar un tipus d'inclusions eosinofíliques en forma de bastó. Els individus afectats presenten un fenotip amb malformacions en la línia mitjana, pèrdua auditiva sensorial i distonia. Es deuen a una mutació puntual que canvia l'aminoàcid arginina en posició 183 per un triptòfan. Això altera la interacció de l'actina amb el sistema ADF/cofilina, que regula la dinàmica de formació del citoesquelet neuronal.[115]
- S'ha trobat una mutació puntual amb caràcter dominant que produeix disfunció dels neutròfils i infeccions recurrents. Sembla que la mutació modifica el domini d'unió amb la profilina i altres proteïnes reguladores. L'afinitat per la profilina en aquest al·lel està molt reduïda.[116]
ACTG1 és el locus que codifica la proteïna de l'actina γ citosòlica responsable de la formació de microfilaments del citoesquelet. Conté 6 exons, donant lloc a 22 mRNAs diferents, fet que produeix 4 isoformes completes, possiblement expressades d'una forma depenent de teixit. També té dos promotors alternatius.[117] S'ha vist que les seqüències traduïdes d'aquest locus i el de l'actina β són més semblants del que s'esperava, suggerint una seqüència ancestral comuna que va patir duplicació i conversió gènica.[118]
Des del punt de vista patològic, ha estat associat a processos com l'amiloïdosi, la retinitis pigmentosa, mecanismes d'infecció, malalties renals i diverses pèrdues auditives congènites.[117]
Relacionades amb sis mutacions puntuals autosòmiques-dominants en la seqüència, es troben diverses formes de pèrdues d'audició, especialment la sensorineural tipus 20/26. Sembla que afecten de forma específica als estereocilis de les cèl·lules ciliades de l'òrgan de Corti. L'actina β és la proteïna més abundant en els teixits humans, però no en les cèl·lules ciliades, la qual cosa explicaria la localització de la patologia. D'altra banda, sembla que la major part d'aquestes mutacions afecten zones d'unió amb altres proteïnes, especialment l'actomiosina.[25] Alguns experiments suggereixen que el mecanisme patogènic d'aquest tipus de sordesa és perquè l'actina F seria més sensible de l'habitual a la cofilina.[119]
D'altra banda, encara que no es té constància de cap cas, se sap que l'actina γ també s'expressa en el múscul esquelètic, i encara que en quantitats molt petites, els models animals han mostrat que la seva absència podria donar lloc a miopaties.[120]
Altres mecanismes patològics
[modifica]Alguns agents infecciosos utilitzen l'actina, especialment la citoplasmàtica, en el seu cicle de vida. En bacteris bàsicament existeixen dues formes:
- Listeria monocytogenes, algunes espècies de Rickettsia, Shigella flexneri i altres gèrmens intracel·lulars escapen dels vacúols fagocítics mitjançant el recobriment amb una càpsula curta de filaments d'actina. En el cas de L. monocytogenes i S. flexneri, generen a partir d'ells un deixant en forma de "cua de cometa" que permet la seva mobilitat. Hi ha lleugeres diferències en el mecanisme molecular de polimerització de la «cua en cometa» depenent de l'espècie del bacteri. Es poden observar diferents velocitats de desplaçament, per exemple, amb un màxim per Listeria i Shigella.[121] Molts experiments han assajat aquest mecanisme in vitro. Aquests mostren que no s'empra cap proteïna motora tipus miosina, i sembla que la propulsió s'adquireix per la pressió exercida per la polimerització que té lloc prop de la paret del microorganisme, que prèviament s'ha envoltat d'ABPs propis de la cèl·lula hoste, que en la seva configuració mínima es tractaria del complex Arp2/3, proteïnes Ena-VASP, cofil·lina, una proteïna taponant i promotors de la nucleació, com el complex de la vinculina. Mitjançant aquests moviments formen protrusions que aconsegueixen les cèl·lules veïnes, infectant-les al seu torn, de manera que el sistema immunitari només pot combatre la infecció mitjançant la immunitat cel·lular. La ruta del moviment podria ser deguda a la modificació de la curvatura i desramificació dels filaments.[122] Altres espècies, com Mycobacterium marinum i Burkholderia pseudomallei, també són capaces de polimeritzar localment l'actina cel·lular per facilitar el seu desplaçament mitjançant un mecanisme que pivota sobre el complex Arp2/3; més encara, el virus vacunal o Vaccinia virus també empra elements del citoesquelet d'actina per disseminació.[123]
- Pseudomonas aeruginosa és capaç de formar un biofilm protector amb el qual escapa de les defenses de l'organisme, en especial dels neutròfils i dels antibiòtics, emprant ADN i filaments d'actina de l'hoste.[124]
A més de l'exemple citat anteriorment, en els passos inicials de la internalització d'alguns virus, notablement el VIH, s'estimula la polimerització de l'actina, per exemple inactivant la cofil·lina.[125]
En els processos d'invasió de les cèl·lules canceroses, les protrusions basades en actina exerceixen un paper encara no determinat.[126]
Evolució
[modifica]El citoesquelet eucariota mostra alguns components de gran semblança al llarg de l'escala filogenètica, especialment l'actina i la tubulina. Per exemple, la proteïna codificada pel gen ACTG2 d'humans posseeix una equivalència absoluta amb els ortòlegs presents en rata i ratolí, tot i que a nivell de nucleòtids la identitat disminueix al 92%.[127] Tanmateix, sí que hi ha grans diferències amb els equivalents en procariotes (FtsZ i MreB), que, al seu torn, presenten una identitat de seqüència d'entre un 40-50% entre les diferents espècies de bacteris i arqueus. Alguns autors suggereixen que la proteïna ancestral que va donar lloc al model bàsic d'actina eucariota s'assembla a les proteïnes del citoesquelet bacterià presents actualment.[128]

Alguns autors ressalten que l'actina, la tubulina i les histones, un tipus de proteïnes implicades en l'estabilització i regulació de l'ADN, presenten similituds en la seva capacitat d'unir nucleòtids i en el seu funcionament basat en l'aprofitament del moviment brownià, més encara, suggereixen que tots ells podrien derivar d'un ancestre comú,[129] per tant, els mecanismes evolutius van diversificar la proteïna ancestral en les variants avui presents, conservant, entre d'altres, les actines com a molècules eficaces per abordar processos biològics antics i essencials, com l'endocitosi.[130]
Equivalents en bacteris
[modifica]Si bé els bacteris no tenen un citoesquelet comparable en complexitat al dels eucariotes, s'han descrit proteïnes d'alta similitud amb els monòmers i polímers d'actina. La proteïna MreB de bacteris polimeritza en filaments prims, no helicoidals i, rarament, en estructures helicoidals semblants a l'actina F.[16] Més encara, la seva estructura cristal·lina és molt semblant a l'actina G (quant a conformació tridimensional), i fins i tot hi ha equivalències entre els protofilaments de MreB i l'actina F. El citoesquelet bacterià també posseeix entre els seus components les proteïnes FtsZ, semblants a la tubulina.[131]
Per tant, els bacteris posseeixen un citoesquelet amb elements homòlegs a l'actina (per exemple, MreB, PARM, i MamK), si bé la seqüència aminoacídica d'aquestes proteïnes divergeix de les presents en cèl·lules animals. Tanmateix, MreB i PARM posseeixen una alta similitud estructural amb l'actina eucariota. Els microfilaments, altament dinàmics, generats mitjançant agregació de MreB i PARM són essencials per a la viabilitat cel·lular i participen en la morfogènesi de la cèl·lula, segregació del genòfor i polaritat cel·lular. PARM, un homòleg de l'actina codificada en un plasmidi, intervé en la gestió de l'ADN plasmídic.[132]
Aplicacions
[modifica]L'aprofitament de l'actina en els laboratoris de ciència i tecnologia deriven de la seva participació com riel de motors moleculars com la miosina (ja sigui en el múscul com a fora d'ell), i de la seva presència necessària per al funcionament cel·lular. Quant a la clínica, atès que algunes variants anòmales de l'actina estan relacionats amb l'aparició de patologies, la seva detecció és un criteri de diagnòstic.
- Nanotecnologia: els sistemes actina-miosina actuen com a motors moleculars que permeten el transport de vesícules i orgànuls al llarg del citoplasma. Hi ha experiments que aprofiten aquesta capacitat dinàmica fins i tot in vitro, és a dir, en sistemes acel·lulars, per la qual cosa s'ha postulat una aplicació nanotecnològica del sistema. La idea subjacent és emprar els microfilaments com rails sobre els quals una o més proteïnes motores es llisquin transportant una determinada càrrega, és a dir, definir un circuit espacial pel qual pugui transportar de forma dirigida i més o menys controlada una determinada càrrega. Quant a aplicacions generals, es parla del transport dirigit de molècules per aconseguir el seu alliberament en llocs concrets, la qual cosa permetria a l'assemblatge de nanoestructures de manera controlada.[133] Aquestes capacitats podrien ser aplicades en xips d'investigació com els lab-on-a-xip, en nanocomponents mecànics i en nanotransformadors d'energia mecànica en elèctrica.[134]
- Control intern en tècniques de biologia molecular, com el western blot i la PCR en temps real: Com que la funció de l'actina és necessària per a la supervivència cel·lular, es va postular que la seva quantitat està tan controlada a nivell de producció cel·lular que pot assumir-se que la seva transcripció (és a dir, el grau d'expressió dels seus gens) i traducció, (que és la generació de proteïna) és pràcticament constant, independentment de les condicions experimentals. Per això, en els estudis de quantificació de proteïnes (western blot) i de transcrits (PCR en temps real) sol realitzar més de la quantificació del gen d'interès, la d'un gen de referència, com l'esmentada actina. Dividint la quantitat del gen d'interès per la de l'actina és possible obtenir una quantitat relativa comparable entre diferents experiments,[135] sempre que l'expressió d'aquesta última no variï; cal destacar que l'actina no sempre presenta l'estabilitat desitjada en la seva expressió.[136]
- Clínica: alguns al·lels de l'actina són causants de patologies, per la qual cosa s'han desenvolupat tècniques per a la seva detecció. A més, l'actina es pot emprar com a marcador indirecte en patologia quirúrgica: és possible emprar variacions en pauta de localització en els teixits com a marcadors d'invasió de neoplàsies, vasculitis i altres.[137] També, per la seva relació amb l'aparell contràctil muscular, l'atròfia provoca la disminució dels seus nivells en el múscul esquelètic, per la qual cosa pot emprar com a marcador d'aquest fenomen.[138]
- Tecnologia dels aliments: la determinació de la qualitat d'alguns aliments processats, com els embotits, passa per la quantificació del seu contingut en carn. Clàssicament s'ha utilitzat un mètode basat en la detecció de la 3-metilhistidina en hidrolitzats d'aquests productes, ja que es tracta d'un compost present en l'actina i la cadena pesant de la miosina F (ambdós components majoritaris del múscul). La generació en l'animal del compost es deu a la metilació de residus d'histidina presents en ambdues proteïnes.[139][140]
Notes
[modifica]- ↑ En aquest enllaç s'observa un model de la prefoldina amb l'actina encaixada entre els "tentacles" de les seves subunitats.
- ↑ En el següent enllaç d'un treball de Jaime Martín-Benito i José María Valpuesta, del centro nacional de Biotecnologia del CSIC, es pot apreciar la configuració en doble anell de la xaperonina CCT, així com les seves subunitats.
Referències
[modifica]- ↑ «Uncomplexed Actin, Protein Data Bank» (en anglès). [Consulta: 10 juliol 2012].
- ↑ Holmes, K.C.; Popp, D.; Gebhard, W.; Kabsch, W. «Atomic model of the actin filament» (w) (en anglès). Nature, 347, 6288, 1990, p. 44–49. DOI: 10.1038/347044a0.
- ↑ 3,0 3,1 3,2 3,3 Marc Maillet Biología celular (castellà). Publicat pelsevier España, 2002; pàg 132. ISBN 84-458-1105-3
- ↑ 4,0 4,1 Alberts et al. Biología molecular de la célula (en castellà). Barcelona: Omega, 2004. ISBN 84-282-1351-8.
- ↑ Halliburton, William D. «On muscle plasma» (en anglès). J. Physio., 8, 1887.
- ↑ Szent-Gyorgyi, A. (1945) Studies on muscle. Acta Physiol Scandinav 9 (suplement. 25)
- ↑ Straub, F.B; Feuer, G. «Adenosinetriphosphate the functional group of actin» (en anglès). Biochim.Biophys. Acta., 1950. PMID: 2673365.
- ↑ Bárány, M., Barron, J.T., Gu, L., i Bárány, K. «Exchange of the actin-bound nucleotide in intact arterial smooth muscle» (en anglès). J. Biol. Chem., 276, 51, 2001. PMID: 11602582.
- ↑ 9,0 9,1 Elzinga, M.; Collins, J.H.; Kuehl, W.M.; Adelstein, R.S. «Complete amino-acid sequence of actin of rabbit skeletal muscle». Proceedings of the National Academy of Sciences, 70, 9, 1973, p. 2687–2691 [Consulta: 29 juny 2009].
- ↑ 10,0 10,1 Kabsch W, Mannherz HG, Suck D, Pai EF, Holmes KC. «Atomic structure of the actin:DNase I complex.». Nature, 347, 6288, 1990. PMID: 2395459.
- ↑ Holmes KC, Popp D, Gebhard W, Kabsch W «Atomic model of the actin filament». Nature, 347, 6288, 1990. PMID: 2395461.
- ↑ 12,0 12,1 12,2 12,3 «cognom =Domínguez The crystal structure of uncomplexed actin in the ADP state» (en anglès) p. 708-11, juliol 2001.
- ↑ Oriol, C; Dubord, C y Landon, F «Crystallization of native striated-muscle actin» (en anglès). FEBS Lett., 73, 1, gener 1977, pàg. 89-91. PMID: 320040.
- ↑ Sawaya MR, Kudryashov DS, Pashkov I, Adisetiyo H, Reisler E, Yeates TO. «Multiple crystal structures of actin dimers and their implications for interactions in the actin filament». Acta Crystallogr D Biol Crystallogr., 2008. PMID: 18391412.
- ↑ Narita; Takeda S, Yamashita A, Maéda Y. «Structural basis of actin filament capping at the barbed-end: a cryo-electron microscopy study» (PDF) (en anglès). Embo J, 25, 23, novembre 2006, pàg. 5626-33 [Consulta: 18 febrer 2012].
- ↑ 16,0 16,1 16,2 16,3 16,4 16,5 Toshiro Oda, Mitsusada Iwasa, Tomoki Aihara, Yuichiro Maéda i Akihiro Narita (2009): The nature of the globular- to fibrous-actin transition. Nature 457, 441-445 (22 gener 2009) | doi:10.1038/nature07685
- ↑ Ponte, P.; Gunning, P.; Blau, H.; Kedes, L. «Human actin genes are single copy for alpha-skeletal and alpha-cardiac actin but multicopy for β- and γ-cytoskeletal genes: 3' untranslated regions are isotype specific but are conserved in evolution». Molecular and Cellular Biology, 3, 10, 1983, p. 1783–1791.
- ↑ 18,0 18,1 18,2 18,3 Lodish et al.. Biología celular y molecular (en castellà). Buenos Aires: Médica Panamericana, 2005. ISBN 950-06-1374-3.
- ↑ Futoshi Hara, Kan Yamashiro, Naoki Nemoto, Yoshinori Ohta, Shin-ichi Yokobori, Takuo Yasunaga, Shin-ichi Hisanaga i Akihiko Yamagishi. (2007): An Actin Homolog of the Archaeon Thermoplasma acidophilum That Retains the Ancient Characteristics of Eukaryotic Actin Arxivat 2009-12-15 a Wayback Machine.. Journal of Bacteriology, p. 2039-2045, Vol. 189, No. 5 doi:10.1128/JB.01454-06
- ↑ 20,0 20,1 Graceffa, Philip; Dominguez, Roberto «Crystal Structure of Monomeric Actin in the ATP State: STRUCTURAL BASIS OF NUCLEOTIDE-DEPENDENT ACTIN DYNAMICS». Journal of Biological Chemistry, 278, 36, 2003, p. 34172–34180. DOI: 10.1074/jbc.M303689200.
- ↑ Reisler, E. «Actin molecular structure and function». Curr Opin Cell Biol, 5, 1, 1993, p. 41–7. DOI: 10.1016/S0955-0674(05)80006-7.
- ↑ «NCBI Conserved Domains: ATP binding site» (en anglès). [Consulta: 18 febrer 2012].
- ↑ 23,0 23,1 Elzinga; Collins, JH «The primary structure of actin from rabbit skeletal muscle. Completion and analysis of the amino acid sequence» (en anglès). J Biol Chem., 250, 15, agost 1975.
- ↑ Elzinga; Collins JH, Kuehl WM, Adelstein RS. «Complete amino-acid sequence of actin of rabbit skeletal muscle» (PDF) (en anglès). Proc Natl Acad Sci USA, 70, 9, setembre 1973.
- ↑ 25,0 25,1 25,2 25,3 25,4 25,5 25,6 25,7 Cristóbal G. Dos Remedios, Deepak Chhabra. Actin-binding Proteins and Disease (en anglès). Springer, 2008. ISBN 0-387-71747-1.. Vegeu a Google Books.
- ↑ Rould; Wan Q, Joel PB, Lowey S, Trybus KM. «Crystal structures of expressed non-polymerizable monomeric actin in the ADP and ATP states». J Biol chem, 281, 42, octubre 2006. Arxivat de l'original el 2019-09-25. DOI: 10.1074/jbc.M601973200 [Consulta: 17 desembre 2010]. Arxivat 2019-09-25 a Wayback Machine.
- ↑ 27,0 27,1 «23». A: Bioquímica: Libro de texto con aplicaciones clínicas (en castellà). 4. Reverte, 2004, p. 1021. ISBN 8429172084 [Consulta: 18 febrer 2012].
- ↑ 28,0 28,1 28,2 Egelman; Reisler, E «Actin structure and function: what we still do not understand». J Biol Chem, 282, 50, desembre 2007. Arxivat de l'original el 2009-05-25. DOI: 10.1074/jbc.R700030200 [Consulta: 18 febrer 2012]. Arxivat 2009-05-25 a Wayback Machine.
- ↑ DA Begg, R Rodewald y LI Rebhun (1978): The visualization of actin filament polarity in thin sections. Evidence for the uniform polarity of membrane-associated filaments. The Journal of Cell Biology, Vol 79, 846-852.
- ↑ 30,0 30,1 30,2 Arthur C. Guyton, John E. Hall Tratado de fisiología médica (castellà). Publicat pelsevier España, 2007; pàg 76. ISBN 84-8174-926-5
- ↑ 31,0 31,1 Simons, CT; Staes A, Rommelaere H, Ampe C, Lewis SA, Cowan NJ «Selective contribution of eukaryotic prefoldin subunits to actin and tubulin binding» (en anglès). J Biol Chem., 279, 6, febrero 2004, pàg. 4196-203. Arxivat de l'original el 2019-09-25. DOI: 10.1074/jbc.M306053200. PMID: 14634002 [Consulta: 17 desembre 2010]. Arxivat 2019-09-25 a Wayback Machine.
- ↑ Martín-Benito; Boskovic J, Gómez-Puertas P, Carrascosa JL, Simons CT, Lewis SA, Bartolini F, Cowan NJ, Valpuesta JM. «Structure of eukaryotic prefoldin and of its complexes with unfolded actin and the cytosolic chaperonin CCT» (en anglès). EMBO J, 21, 23, desembre 2002, pàg. 6377-86. DOI: 10.1093/emboj/cdf640. PMID: 12456645.
- ↑ 33,0 33,1 Vandamme, D; Lambert E, Waterschoot D, Cognard C, Vandekerckhove J, Ampe C, Constantin B, Rommelaere H. «alpha-Skeletal muscle actin nemaline myopathy mutants cause cell death in cultured muscle cells» (en anglès). Biochim Biophys Acta., 1793, 7, julio 2009, pàg. 1259-71. PMID: 19393268.
- ↑ 34,0 34,1 Brackley; Grantham J «Activities of the chaperonin containing TCP-1 (CCT): implications for cell cycle progression and cytoskeletal organisation» (en anglès). Cell Stress Chaperones, 14, 1, gener 2009, pàg. 23-31. DOI: 10.1007/s12192-008-0057-x. PMID: 18595008.
- ↑ 35,0 35,1 Stirling, PC; Cuéllar J, Alfaro GA, El Khadali F, Beh CT, Valpuesta JM, Melki R, Leroux MR «PhLP3 modulates CCT-mediated actin and tubulin folding via ternary complexes with substrates» (en anglès). J Biol Chem, 281, 11, marzo 2006, pàg. 7012-21. Arxivat de l'original el 2019-09-25. DOI: 10.1074/jbc.M513235200. PMID: 16415341 [Consulta: 17 desembre 2010]. Arxivat 2019-09-25 a Wayback Machine.
- ↑ Hansen, WJ; Cowan NJ, Welch WJ. «Prefoldin-nascent chain complexes in the folding of cytoskeletal proteins» (en anglès). J Cell Biol.. 265-7, 145, abril 1999, pàg. 2. PMID: 10209023.
- ↑ Neirynck; Waterschoot D, Vandekerckhove J, Ampe C, Rommelaere H «Actin interacts with CCT via discrete binding sites: a binding transition-release model for CCT-mediated actin folding». J Mol Biol., 355, 1, gener 2006, pàg. 124-38. PMID: 16300788.
- ↑ 38,0 38,1 38,2 Vavylonis, D; Yang Q, O'Shaughnessy B. «Actin polymerization kinetics, cap structure, and fluctuations» (en anglès). Proc Natl Acad Sci U S A., 102, 24, junio 2005, pàg. 8543-8. DOI: 10.1073/pnas.0501435102. PMID: 15939882.
- ↑ Kawamura, M.; Maruyama, K. «Electron Microscopic Particle Length of F-Actin Polymerized in Vitro». Journal of Biochemistry, 67, 3, 1970, p. 437.
- ↑ «Chapter 12: The Cytoskeleton and Cell Movement». A: The cell: a molecular approach (en anglès). ASM Press, Washington, 2007. ISBN 0878932194.
- ↑ «Taula de les constants d'associació i dissociació de les diferents espècies de monòmers al filament d'actina, segons la literatura científica.».
- ↑ Kirschner, M.W. «Implications of treadmilling for the stability and polarity of actin and tubulin polymers in vivo» (w). The Journal of Cell Biology, 86, 1, 1980, p. 330–334.
- ↑ Cells (Google books) (en anglès). Jones & Bartlett Publishers, 2006. ISBN 9780763739058.
- ↑ Zhang, Duan-Sun; Valeria Piazza, Benjamin J. Perrin, Agnieszka K. Rzadzinska, J. Collin Poczatek, Mei Wang, Haydn M. Prosser, James M. Ervasti, David P. Corey, Claude P. Lechene «Multi-isotope imaging mass spectrometry reveals slow protein turnover in hair-cell stereocilia» (en anglès). Nature, 481, 7382, 15-01-2012, pàg. 520-524. DOI: 10.1038/nature10745. ISSN: 1476-4687 0028-0836, 1476-4687.
- ↑ THE STRUCTURE OF CRYSTALLINE PROFILIN-BETA-ACTIN Protein Data Bank
- ↑ Domínguez, R «Actin-binding proteins--a unifying hypothesis». Trends Biochem Sci., 29, 11, novembre 2004, pàg. 572-8. PMID: 15501675.
- ↑ , <https://www.molbiolcell.org/cgi/content/abstract/3/9/1015>
- ↑ Witke, W., Podtelejnikov, A., Di Nardo, A., Sutherland, J., Gurniak, C., Dotti, C., and M. Mann (1998) In Mouse Brain Profilin I and Profilin II Associate With Regulators of the Endocytic Pathway and Actin Assembly. The EMBO Journal 17(4): 967-976 Entrez PubMed 9463375
- ↑ Carlsson L, Nyström LE, Sundkvist I, Markey F, Lindberg U. (1977) Actin polymerizability is influenced by profilin, a low molecular weight protein in non-muscle cells. J. Mol. Biol. 115:465-483 Entrez PubMed 563468
- ↑ Kiselar, J., Janmey, P., Almo, S., Chance, M. «Visualizing the Ca2+-dependent activation of gelsolin by using synchrotron footprinting» (en anglès). PNAS, 100, 7, 2003, pàg. 3942–3947. DOI: 10.1073/pnas.0736004100. PMID: 12655044.
- ↑ , doi:10.1073/pnas.97.13.6936, <https://www.pnas.org/cgi/content/full/pnas;97/13/6936> «Còpia arxivada». Arxivat de l'original el 2019-09-25. [Consulta: 1r maig 2022].
- ↑ , doi:10.1021/bi00447a036, <https://pubs.acs.org/doi/abs/10.1021/bi00447a036>
- ↑ , doi:10.1083/jcb.127.6.1627, <https://www.jcb.org/cgi/reprint/127/6/1627.pdf>
- ↑ Robinson RC, Turbedsky K, Kaiser DA, Marchand JB, Higgs HN, Choe S, Pollard TD. (2001) Crystal structure of Arp2/3 complex (anglès). Science 294(5547):1679-84.
- ↑ Mullins, R. D.; Pollard, T.D. «Structure and function of the Arp2/3 complex» (en anglès). ingentaconnect. Elsevier, 9, 2, 4-1999, pàg. 244–249. Arxivat de l'original el 2014-11-07. DOI: 10.1016/S0959-440X(99)80034-7 [Consulta: 27 desembre 2012].
- ↑ Laura M Machesky; Kathleen L Gould «The Arp2/3 complex: a multifunctional actin organizer» (en anglès). ScienceDirect, 11, 1, 2-1999, pàg. 117-121. Arxivat de l'original el 2009-07-05. DOI: doi:10.1016/S0955-0674(99)80014-3 [Consulta: 27 desembre 2012].
- ↑ Latrunculin alters the actin-monomer subunit interface to prevent polymerization, doi:10.1038/35014075, <https://www.era.lib.ed.ac.uk/retrieve/1796/Mclaughlin.pdf>
- ↑ 58,0 58,1 Effects of cytochalasin and phalloidin on actin, doi:10.1083/jcb.105.4.1473, <https://www.jcb.org/cgi/reprint/105/4/1473.pdf>
- ↑ Disruption of actin microfilaments by cytochalasin D leads to activation of p53, doi:10.1016/S0014-5793(98)00692-9, <https://linkinghub.elsevier.com/retrieve/pii/S0014579398006929>
- ↑ Cytochalasin D does not inhibit gravitropism in roots, doi:10.2307/2446614, <https://www.amjbot.org/cgi/reprint/84/11/1530.pdf>[Enllaç no actiu]
- ↑ 61,0 61,1 Actin and myosin as transcription factors, doi:10.1016/j.gde.2006.02.001, <https://linkinghub.elsevier.com/retrieve/pii/S0959437X06000232>
- ↑ Phospholipase D activity is essential for actin localization and actin-based motility in Dictyostelium, doi:10.1042/BJ20050085, <https://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1184553>
- ↑ Randall, D.; Burggren, W. et French, K.. Eckert Fisiología animal (en anglès). 4ª. ISBN 84-486-0200-5.
- ↑ Pujol-Moix. Trombocitopenias (en castellà). 2da. Elsevier, Espanya, 2001, p. 25. ISBN 8481745952.
- ↑ 65,0 65,1 65,2 Paniagua, R.; Nistal, M.; Sesma, P.; Álvarez-Uría, M.; Fraile, B.; Anadón, R. i José Sáez, F.. Citología e histología vegetal y animal (en anglès). McGraw-Hill Interamericana de España, S.A.U., 2002. ISBN 84-486-0436-9.
- ↑ 66,0 66,1 The Yeast Actin Cytoskeleton: from Cellular Function to Biochemical Mechanism, doi:10.1128/MMBR.00013-06, <https://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1594590>
- ↑ Isovariant Dynamics Expand and Buffer the Responses of Complex Systems: The Diverse Plant Actin Gene Family, <https://www.plantcell.org/cgi/content/full/11/6/995>
- ↑ Entrada PDBe per a 1unc. EBI.
- ↑ 69,0 69,1 Actin microfilament dynamics and actin side-binding proteins in plants, doi:10.1016/j.pbi.2007.08.012, <https://lmbiologia.campusnet.unito.it/didattica/att/a29a.1275.file.pdf>[Enllaç no actiu]
- ↑ AtFim1 is an actin filament crosslinking protein from Arabidopsis thaliana, DOI 10.1046/j.1365-313x.2000.00907.x
- ↑ Antoni Bayés de Luna, VV Staff, José López-Sendón, Fause Attie, Eduardo Alegría Ezquerra Cardiología Clínica (castellà). Publicat per Elsevier Espanya, 2002; pàg 19. ISBN 84-458-1179-7
- ↑ 72,0 72,1 John W. Baynes, Marek H. Dominiczak Bioquímica médica (castellà). Publicat per Elsevier Espanya, 2007; pàg 268. ISBN 84-8174-866-8
- ↑ Randall, D.; Burggren, W. et French, K.. Eckert Fisiología animal (en castellà). 4ª. ISBN 84-486-0200-5.
- ↑ Alpha-actinin localization in the cleavage furrow during cytokinesis, doi:10.1083/jcb.79.1.268, <https://www.jcb.org/cgi/reprint/79/1/268.pdf>
- ↑ Actin dynamics in the contractile ring during cytokinesis in fission yeast, <https://adsabs.harvard.edu/abs/2002Natur.419...82P>
- ↑ Actin cleavage by CPP-32/apopain during the development of apoptosis, doi:10.1038/sj.onc.1200919, <https://www.nature.com/onc/journal/v14/n9/abs/1200919a.html>
- ↑ Calpain and caspase: can you tell the difference?, doi:10.1016/S0166-2236(99)01479-4, <https://www.mbi.ufl.edu/ctbis/wang/Wang71TINS2000.pdf>[Enllaç no actiu]
- ↑ Calpain inhibitors, but not caspase inhibitors, prevent actin proteolysis and DNA fragmentation during apoptosis, <https://jcs.biologists.org/cgi/reprint/111/6/713.pdf>
- ↑ SAPK2/p38-dependent F-Actin Reorganization Regulates Early Membrane Blebbing during Stress-induced Apoptosis, <https://www.jcb.org/cgi/content/full/143/5/1361>
- ↑ Quantitative analysis of cadherin-catenin-actin reorganization during development of cell-cell adhesion, doi:10.1083/jcb.135.6.1899, <https://www.jcb.org/cgi/reprint/135/6/1899.pdf>
- ↑ Redundancy in the microfilament system: abnormal development of Dictyostelium cells lacking two F-actin cross-linking proteins, <https://www.ncbi.nlm.nih.gov/pubmed/1732064>
- ↑ Actin Plays a Role in Both Changes in Cell Shape and Gene- Expression Associated with Schwann Cell Myelination, <https://www.jneurosci.org/cgi/content/full/17/1/241>
- ↑ Role of Actin Cytoskeletal Dynamics in Activation of the Cyclic AMP Pathway and HWP1 Gene Expression in Candida albicans, doi:10.1128/EC.00188-07, <https://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2043390>
- ↑ Novel Actin-Like Proteins T-ACTIN 1 and T-ACTIN 2 Are Differentially Expressed in the Cytoplasm and Nucleus of Mouse Haploid Germ Cells, doi:10.1095/biolreprod.103.015867, <https://www.biolreprod.org/cgi/reprint/69/2/475.pdf>[Enllaç no actiu]
- ↑ Epigenetic effects on yeast transcription caused by mutations in an actin-related protein present in the nucleus, doi:10.1101/gad.10.5.604, <https://www.genesdev.org/cgi/reprint/10/5/604.pdf>
- ↑ Dynamic length regulation of sensory stereocilia, <https://linkinghub.elsevier.com/retrieve/pii/S1084952108000451>
- ↑ An actin molecular treadmill and myosins maintain stereocilia functional architecture and self-, <https://jcb.rupress.org/cgi/content/full/164/6/887>
- ↑ Su AI, Wiltshire T, Batalov S, Lapp H, Ching KA, Block D, Zhang J, Soden R, Hayakawa M, Kreiman G, Cooke MP, Walker JR, Hogenesch JB «A gene atlas of the mouse and human protein-encoding transcriptomes» (en anglès). Proc Natl Acad Sci USA, 101, 2004. Arxivat de l'original el 2018-10-15. PMID: 15075390 [Consulta: 29 desembre 2012].
- ↑ 89,0 89,1 «Uniprot ACTA1» (en anglès).
- ↑ 90,0 90,1 Friederike S. Bathe, Heidi Rommelaere i Laura M. Machesky (2007): Phenotypes of Myopathy-related Actin Mutants in differentiated C2C12 Myotubes. BMC Cell Biology, 8:2. doi:10.1186/1471-2121-8-2
- ↑ Kaindl AM, Rüschendorf F, Krause S, Goebel HH, Koehler K, Becker C, Pongratz D, Müller-Höcker J, Nürnberg P, Stoltenburg-Didinger G, Lochmüller H, Huebner A. «Missense mutations of ACTA1 cause dominant congenital myopathy with cores» (en anglèsurl =). J Med Genet., 41, 2004. PMID: 15520409.
- ↑ Sparrow, JC; Nowak KJ, Durling HJ, Beggs AH, Wallgren-Pettersson C, Romero N, Nonaka I, Laing NG. «Muscle disease caused by mutations in the skeletal muscle alpha-actin gene (ACTA1)» (en anglès). Neuromuscul Disord., 13, 8, septiembre 2003, pàg. 519-31. PMID: 12921789.
- ↑ North, Kathryn «Nemaline Myopathy» (en anglès). Gene Reviews, 2002.
- ↑ Ilkovski B, Nowak KJ, Domazetovska A, Maxwell AL, Clement S, Davies KE, Laing NG, North KN, Cooper ST. «Evidence for a dominant-negative effect in ACTA1 nemaline myopathy caused by abnormal folding, aggregation and altered polymerization of mutant actin isoforms» (en anglès). Hum. Mol. Genet., 13, 2004. PMID: 15198992.
- ↑ Clarke NF, Ilkovski B, Cooper S, Valova VA, Robinson PJ, Nonaka I, Feng JJ, Marston S, North K «The pathogenesis of ACTA1-related congenital fiber type disproportion» (en anglès). Ann Neurol, 61, 6, 2007. PMID: 17387733.
- ↑ «Structure, chromosome location, and expression of the human smooth muscle (enteric type) γ-actin gene: evolution of six human actin genes» (en anglès). Mol Cell Biol., 11, 6, 1991. PMID: 1710027.
- ↑ Watson MB, Lind MJ, Smith L, Drew PJ, Cawkwell L. «Expression microarray analysis reveals genes associated with in vitro resistance to cisplatin in a cell line model» (en anglès). Acta Oncol., 46, 5, 2007. PMID: 17562441.
- ↑ Guo DC, Pannu H, Tran-Fadulu V, Papke CL, Yu RK, Avidan N, Bourgeois S, Estrera AL, Safi HJ, Sparks E, Amor D, Ades L, McConnell V, Willoughby CE, Abuelo D, Willing M, Lewis RA, Kim DH, Scherer S, Tung PP, Ahn C, Buja LM, Raman CS, Shete SS, Milewicz DM. «Mutations in smooth muscle alpha-actin (ACTA2) lead to thoracic aortic aneurysms and dissections» (en anglès). Nature Genet., 39, 12, 2007. PMID: 17994018.
- ↑ Guo; Papke CL, Tran-Fadulu V, Regalado ES, Avidan N, Johnson RJ, Kim DH, Pannu H, Willing MC, Sparks E, Pyeritz RE, Singh MN, Dalman RL, Grotta JC, Marian AJ, Boerwinkle EA, Frazier LQ, LeMaire SA, Coselli JS, Estrera AL, Safi HJ, Veeraraghavan S, Muzny DM, Wheeler DA, Willerson JT, Yu RK, Shete SS, Scherer SE, Raman CS, Buja LM, Milewicz DM. «Mutations in smooth muscle alpha-actin (ACTA2) cause coronary artery disease, stroke, and Moyamoya disease, along with thoracic aortic disease» (en anglès). Am J Human Genet, 5, maig 2009, pàg. 617-27. PMID: 19409525.
- ↑ Akpolat N, Yahsi S, Godekmerdan A, Yalniz M, Demirbag K «The value of alpha-SMA in the evaluation of hepatic fibrosis severity in hepatitis B infection and cirrhosis development: a histopathological and immunohistochemical study» (en anglès). Histopathology, 47, 3, 2005. PMID: 16115228.
- ↑ Hamada H, Petrino MG, Kakunaga T. «Molecular structure and evolutionary origin of human cardiac muscle actin gene» (en anglès). Proc Natl Acad Sci U S A., 79, 19, 1982. PMID: 6310553.
- ↑ 102,0 102,1 Olson TM, Michels VV, Thibodeau SN, Tai YS, Keating MT. «Actin mutations in dilated cardiomyopathy, a heritable form of heart failure.» (en anglès). Science, 280, 5364, 1998. PMID: 9563954.
- ↑ Xia X-G, Zhou H, Samper E, Melov S, Xu Z (2006) Pol II–Expressed shRNA Knocks Down Sod2 Gene Expression and Causes Phenotypes of the Gene Knockout in Mice. PLoS Genet 2(1): e10. doi:10.1371/journal.pgen.0020010
- ↑ «OMIM 102540» (en anglès).
- ↑ Matsson H, Eason J, Bookwalter CS, Klar J, Gustavsson P, Sunnegårdh J, Enell H, Jonzon A, Vikkula M, Gutiérrez I, Granados-Riveron J, Pope M, Bu'Lock F, Cox J, Robinson TE, Song F, Brook DJ, Marston S, Trybus KM, Dahl N. «Alpha-cardiac actin mutations produce atrial septal defects.» (en anglès). Hum Mol Genet., 17, 2, 2008. PMID: 17947298.
- ↑ [Kabaeva,Z]. «Genetic analysis in hypertrophic cardiomyopathy: missense mutations in the ventricular myosin regulatory light chain gene» (Disertació) (en anglès). Universidad Humboldt de Berlín, gener 2003.
- ↑ Olson TM, Doan TP, Kishimoto NY, Whitby FG, Ackerman MJ, Fananapazir L. Inherited and de novo mutations in the cardiac actin gene cause hypertrophic cardiomyopathy (anglès). J Mol Cell Cardiol 2000; 32:1687-1694.
- ↑ «Cardiomiopatía hipertrófica familiar: Genes, mutaciones y modelos animales. Revisión.» (en castellà). Invest. clín, mar. 2004, vol.45, no.1, p.69-100, març 2004.
- ↑ Kaski JP, Syrris P, Burch M, Tomé-Esteban MT, Fenton M, Christiansen M, Andersen PS, Sebire N, Ashworth M, Deanfield JE, McKenna WJ, Elliott PM. «Idiopathic restrictive cardiomyopathy in children is caused by mutations in cardiac sarcomere protein genes» (en anglès). Heart, 94, 11, 2008. PMID: 18467357.
- ↑ Klaassen S, Probst S, Oechslin E, Gerull B, Krings G, Schuler P, Greutmann M, Hürlimann D, Yegitbasi M, Pons L, Gramlich M, Drenckhahn JD, Heuser A, Berger F, Jenni R, Thierfelder L. «Mutations in sarcomere protein genes in left ventricular noncompaction» (en anglès). Circulation, 117, 22, 2008. PMID: 1850600.
- ↑ «ACEVieW:Homo sapiens complex locus ACTB, encoding actin, β.» (en anglès).
- ↑ Chang KW, Yang PY, Lai HY, Yeh TS, Chen TC, Yeh CT. «Identification of a novel actin isoform in hepatocellular carcinoma» (en anglès). Hepatol Res., 36, 1, 2006. PMID: 16824795.
- ↑ Kristy L Williams, Masuma Rahimtula yKaren M Mearow. Hsp27 and axonal growth in adult sensory neurons in vitro BMC Neuroscience 2005, 6:24doi:10.1186/1471-2202-6-24
- ↑ «Pericytoma with t(7;12)» (en anglès). Atlas of Genetics and Cytogenetics in Oncology and Haematology. [Consulta: 12 juliol 2013].
- ↑ Procaccio V, Salazar G, Ono S, Styers ML, Gearing M, Dávila A, Jiménez R, Juncos J, Gutekunst CA, Meroni G, Fontanella B, Sontag E, Sontag JM, Faundez V, Wainer BH. «A mutation of β -actin that alters depolymerization dynamics is associated with autosomal dominant developmental malformations, deafness, and dystonia» (en anglès). Am J Hum Genet, 78, 6, 2006. PMID: 16685646.
- ↑ Nunoi H, Yamazaki T, Tsuchiya H, Kato S, Malech HL, Matsuda I, Kanegasaki S. «A heterozygous mutation of β-actin associated with neutrophil dysfunction and recurrent infection» (en anglès). Proc Natl Acad Sci U S A., 96, 15, 1999. PMID: 10411937.
- ↑ 117,0 117,1 «ACEVIEW ACTG1» (en anglès).
- ↑ Erba HP, Gunning P, Kedes L. «Nucleotide sequence of the human γ cytoskeletal actin mRNA: anomalous evolution of vertebrate non-muscle actin genes.» (en anglès). Nucleic Acids Res., 14, 13, 1986. PMID: 373740.
- ↑ Bryan, KE; Rubenstein, PA «Allele-specific Effects of Human Deafness {γ}-Actin Mutations (DFNA20/26) on the Actin/Cofilin Interaction» (en anglès). J Biol Chem., 284, 27, juliol 2009, pàg. 18260-9. PMID: 19419963.
- ↑ Sonnemann KJ, Fitzsimons DP, Patel JR, Liu Y, Schneider MF, Moss RL, Ervasti JM. «Cytoplasmic γ-actin is not required for skeletal muscle development but its absence leads to a progressive myopathy.» (en anglès). Dev Cell, 11, 3, 2006. PMID: 16950128.
- ↑ A comparative study of the actin-based motilities of the pathogenic bacteria Listeria monocytogenes, Shigella flexneriand Rickettsia conorii, <https://jcs.biologists.org/cgi/reprint/112/11/1697.pdf>
- ↑ Lambrechts, A; Gevaert K, Cossart P, Vandekerckhove J, Van Troys M. «Listeria comet tails: the actin-based motility machinery at work» (en anglès). Trends Cell Biol., 18, 5, maig 2008, pàg. 220-7. PMID: 18396046.
- ↑ Actin-based motility of intracellular pathogens, <https://linkinghub.elsevier.com/retrieve/pii/S1369527404001675>
- ↑ Parks, QM; Young RL, Poch KR, Malcolm KC, Vasil ML, Nick JA. «Neutrophil enhancement of Pseudomonas aeruginosa biofilm development: human F-actin and DNA as targets for therapy» (en anglès). J med microbiol, abril 2009, pàg. 492-502 pmid=19273646. DOI: 10.1099/jmm.0.005728-0.
- ↑ Liu; Belkina NV, Shaw S. «HIV infection of T cells: actin-in and actin-out» (en anglès). Sci Signal., 2, abril 2009. PMID: 19366992.
- ↑ Machesky LM; Tang HR «Actin-Based Protrusions: Promoters or Inhibitors of Cancer Invasion?» (en anglès). Cancer Cell., 16, 1, juliol 2009, pàg. 5-7. PMID: 19573806.
- ↑ The nucleotide sequence of a human smooth muscle (enteric type) γ-actin cDNA., <https://www.pubmedcentral.nih.gov/picrender.fcgi?artid=360182>
- ↑ Evolution of the cytoskeleton, <https://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2630885>
- ↑ Are histones, tubulin, and actin derived from a common ancestral protein?, DOI 10.1007/s00709-008-0305-z
- ↑ Actin and endocytosis: mechanisms and phylogeny, doi:10.1016/j.ceb.2009.01.0, <https://linkinghub.elsevier.com/retrieve/pii/S0955067409000076>
- ↑ Prokaryotic origin of the actin cytoskeleton, doi:10.1038/35092500, <https://www2.mrc-lmb.cam.ac.uk/ss/Amos_L/group/PDF/MreB%20Nature.pdf> Arxivat 2007-04-18 a Wayback Machine. «Còpia arxivada». Arxivat de l'original el 2007-04-18. [Consulta: 1r maig 2022].
- ↑ Carballido-lopez, Rut «The Bacterial Actin-Like Cytoskeleton». Microbiology and Molecular Biology Reviews, 70, 4, 2006, pàg. 888–909. DOI: 10.1128/MMBR.00014-06. PMID: 17158703.
- ↑ Light-controlled molecular shuttles made from motor proteins carrying cargo on engineered surfaces, DOI 10.1021/nl015521e
- ↑ Actin-Based Molecular Motors for Cargo Transportation in Nanotechnology—Potentials and Challenges, <https://ieeexplore.ieee.org/xpls/abs_all.jsp?arnumber=1528636>
- ↑ Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F (2002) Accurate normalisation of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes Arxivat 2020-05-27 a Wayback Machine.. Gen. Biol. 3: 1–12.
- ↑ ß-Actin, <https://linkinghub.elsevier.com/retrieve/pii/S0890850801903767>
- ↑ Immunohistochemical localization of actin: Applications in surgical pathology, <https://www.ajsp.com/pt/re/ajsp/abstract.00000478-198101000-00013.htm>
- ↑ Atrophy responses to muscle inactivity. II. Molecular markers of protein deficits, <https://jap.physiology.org/cgi/content/full/95/2/791> Arxivat 2009-10-21 a Wayback Machine.
- ↑ Current advances in proteomic analysis and its use for the resolution of poultry meat quality, <https://www.animalscience.com/uploads/additionalFiles/QualityOfPoultryMeat/27.pdf>
- ↑ Methods and Instruments in Applied Food Analysis, <https://orton.catie.ac.cr/cgi-bin/wxis.exe/?IsisScript=BFHIA.xis> Arxivat 2016-08-12 a Wayback Machine. «Còpia arxivada». Arxivat de l'original el 2016-08-12. [Consulta: 31 desembre 2012].
