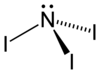
Trijodek azotu
| |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny |
NI | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
394,72 g/mol | ||||||||||||
| Wygląd |
ciemnoczerwone ciało stałe | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS | |||||||||||||
| PubChem | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Podobne związki | |||||||||||||
| Inne aniony | |||||||||||||
| Inne kationy | |||||||||||||
Trijodek azotu, NI
3 – nieorganiczny związek chemiczny azotu i jodu.
Czysty trijodek azotu jest w warunkach normalnych ciemnoczerwonym ciałem stałym. Czysty NI
3 po raz pierwszy został uzyskany w 1990 roku w wyniku reakcji azotku boru z roztworem fluorku jodu (otrzymanym in situ z ciekłego fluoru i jodu) w trichlorofluorometanie w temperaturze −30 °C i wyizolowany po usunięciu rozpuszczalnika przez sublimację w −20 °C[1]:
- BN + 3IF → NI
3 + BF
3
Jest związkiem bardzo nietrwałym i rozkłada się szybko w postaci czystej i w roztworze w 0 °C, stopniowy rozkład następuje również w −78 °C, trwały jest dopiero w −196 °C[1].
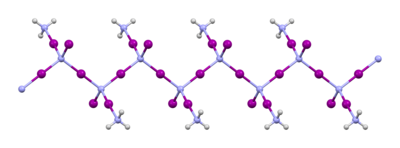
Amoniakat trijodku azotu
[edytuj | edytuj kod]W wyniku reakcji roztworu jodu z wodą amoniakalną powstaje czarny amoniakat NI
3·NH
3. Jest trwalszy o ok. 30 kJ/mol od wolnego NI
3. Nie da się z niego usunąć cząsteczek amoniaku i uzyskać wolnego jodku[1]. W takiej formie został otrzymany w roku 1813 przez odkrywcę jodu, Bernarda Courtois[2]. Jego budowa została potwierdzona w roku 1905[3]. Struktura krystaliczna amoniakatu składa się z zygzakowatych łańcuchów złożonych ze współwierzchołkowych tetraedrów NI
4. Pomiędzy łańcuchami ulokowane są cząsteczki amoniaku.
Jest substancją niezwykle niestabilną, rozkładającą się w sposób wybuchowy pod wpływem lekkiego dotyku. Małe ilości trijodku azotu są syntetyzowane w celach pokazowych, ze względu na wysoką niestabilność nie ma zastosowań praktycznych. Suchy wybucha przy minimalnym bodźcu mechanicznym, np. dotknięciu ptasim piórem, dlatego wszelkie manipulacje należy przeprowadzać z substancją zwilżoną wodą. Eksploduje także pod wpływem cząstek alfa i produktów spontanicznego rozszczepienia jądra atomowego, czym wyróżnia się spośród innych związków wybuchowych (azydku ołowiu, azydku srebra, azydku kadmu i acetylenku srebra)[4].
Reakcję rozkładu trijodku azotu ilustruje równanie:
- 2NI
3 → N
2↑ + 3I
2↑ (ΔH = −290 kJ/mol)
NI
3·NH
3 zostawia po wybuchu pomarańczowe do fioletowych plamy jodu trudne do zmycia wodą (można je usunąć roztworem tiosiarczanu sodu).
Przypisy
[edytuj | edytuj kod]- ↑ a b c Inis Tornieporth-Oetting, Thomas Klapötke, Nitrogen Triiodide, „Angewandte Chemie International Edition in English”, 29 (6), 1990, s. 677–679, DOI: 10.1002/anie.199006771 (ang.).
- ↑ Tatsuo Kaiho, Iodine Chemistry and Applications, Wiley, 2014, s. 59, DOI: 10.1002/9781118909911, ISBN 978-1-118-46629-2 (ang.).
- ↑ Oswald Silberrad, The constitution of nitrogen iodide, „Journal of the Chemical Society, Transactions”, 87 (0), 1905, s. 55–66, DOI: 10.1039/CT9058700055 (ang.).
- ↑ F.P. Bowden, The initiation of explosion by neutrons, α-particles, and fission products, „Proceedings of the Royal Society of London A: Mathematical, Physical and Engineering Sciences”, 246 (1245), 1958, s. 216–219, DOI: 10.1098/rspa.1958.0123 (ang.).
Linki zewnętrzne
[edytuj | edytuj kod]- Trijodek azotu – dlaczego wybucha (ang.)
- Andrzej Kasperowicz, Halogenopochodne amoniaku [online], Chemfan [dostęp 2009-11-27].