WO2021167428A1 - 리튬 이차 전지용 비수 전해액 및 이를 포함하는 리튬 이차전지 - Google Patents
리튬 이차 전지용 비수 전해액 및 이를 포함하는 리튬 이차전지 Download PDFInfo
- Publication number
- WO2021167428A1 WO2021167428A1 PCT/KR2021/002207 KR2021002207W WO2021167428A1 WO 2021167428 A1 WO2021167428 A1 WO 2021167428A1 KR 2021002207 W KR2021002207 W KR 2021002207W WO 2021167428 A1 WO2021167428 A1 WO 2021167428A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- secondary battery
- aqueous electrolyte
- lithium secondary
- lithium
- battery
- Prior art date
Links
- 229910052744 lithium Inorganic materials 0.000 title claims abstract description 74
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 title claims abstract description 70
- 239000011255 nonaqueous electrolyte Substances 0.000 title claims abstract description 58
- 229910003002 lithium salt Inorganic materials 0.000 claims abstract description 27
- 159000000002 lithium salts Chemical class 0.000 claims abstract description 27
- 239000003960 organic solvent Substances 0.000 claims description 39
- 150000001875 compounds Chemical class 0.000 claims description 38
- 239000000654 additive Substances 0.000 claims description 34
- 230000000996 additive effect Effects 0.000 claims description 23
- 238000000034 method Methods 0.000 claims description 11
- 229910052739 hydrogen Inorganic materials 0.000 claims description 10
- 239000001257 hydrogen Substances 0.000 claims description 10
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 claims description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 5
- 229910052736 halogen Inorganic materials 0.000 claims description 5
- 150000002367 halogens Chemical class 0.000 claims description 5
- 125000003342 alkenyl group Chemical group 0.000 claims description 4
- 125000000217 alkyl group Chemical group 0.000 claims description 4
- 125000000304 alkynyl group Chemical group 0.000 claims description 4
- 229910052794 bromium Inorganic materials 0.000 claims description 4
- 229910052801 chlorine Inorganic materials 0.000 claims description 4
- 229910052731 fluorine Inorganic materials 0.000 claims description 4
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 4
- 229910052740 iodine Inorganic materials 0.000 claims description 4
- 229910016467 AlCl 4 Inorganic materials 0.000 claims description 3
- 229910017008 AsF 6 Inorganic materials 0.000 claims description 3
- 229910020366 ClO 4 Inorganic materials 0.000 claims description 3
- 229910018286 SbF 6 Inorganic materials 0.000 claims description 3
- 150000001450 anions Chemical class 0.000 claims description 3
- 150000001768 cations Chemical class 0.000 claims description 3
- -1 Lewis base compound Chemical class 0.000 abstract description 35
- 238000000354 decomposition reaction Methods 0.000 abstract description 25
- 239000003792 electrolyte Substances 0.000 abstract description 23
- 239000000243 solution Substances 0.000 abstract description 9
- 238000002161 passivation Methods 0.000 abstract description 7
- 239000002879 Lewis base Substances 0.000 abstract description 6
- 238000004519 manufacturing process Methods 0.000 abstract description 6
- 230000006378 damage Effects 0.000 abstract description 4
- 229910001290 LiPF6 Inorganic materials 0.000 abstract description 2
- 238000004090 dissolution Methods 0.000 abstract description 2
- 230000002000 scavenging effect Effects 0.000 abstract description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 32
- 239000010408 film Substances 0.000 description 22
- 238000003860 storage Methods 0.000 description 22
- 239000004020 conductor Substances 0.000 description 18
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 17
- 230000000052 comparative effect Effects 0.000 description 16
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 14
- 239000011230 binding agent Substances 0.000 description 14
- HBBGRARXTFLTSG-UHFFFAOYSA-N Lithium ion Chemical compound [Li+] HBBGRARXTFLTSG-UHFFFAOYSA-N 0.000 description 13
- 238000007600 charging Methods 0.000 description 13
- 229910001416 lithium ion Inorganic materials 0.000 description 13
- 239000007773 negative electrode material Substances 0.000 description 12
- 239000007787 solid Substances 0.000 description 12
- 238000007599 discharging Methods 0.000 description 11
- 229910052751 metal Inorganic materials 0.000 description 11
- 239000002184 metal Substances 0.000 description 11
- 230000000694 effects Effects 0.000 description 10
- JBTWLSYIZRCDFO-UHFFFAOYSA-N ethyl methyl carbonate Chemical compound CCOC(=O)OC JBTWLSYIZRCDFO-UHFFFAOYSA-N 0.000 description 10
- KMTRUDSVKNLOMY-UHFFFAOYSA-N Ethylene carbonate Chemical compound O=C1OCCO1 KMTRUDSVKNLOMY-UHFFFAOYSA-N 0.000 description 9
- 229910002804 graphite Inorganic materials 0.000 description 9
- 239000010439 graphite Substances 0.000 description 9
- 239000007774 positive electrode material Substances 0.000 description 9
- 239000002002 slurry Substances 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- 229910013870 LiPF 6 Inorganic materials 0.000 description 8
- 229910052782 aluminium Inorganic materials 0.000 description 8
- 229910052799 carbon Inorganic materials 0.000 description 8
- 239000011267 electrode slurry Substances 0.000 description 8
- 230000014759 maintenance of location Effects 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 7
- 239000010949 copper Substances 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 239000011572 manganese Substances 0.000 description 7
- 229910044991 metal oxide Inorganic materials 0.000 description 7
- 150000004706 metal oxides Chemical class 0.000 description 7
- 239000000203 mixture Substances 0.000 description 7
- 239000010936 titanium Substances 0.000 description 7
- 229910052719 titanium Inorganic materials 0.000 description 7
- VAYTZRYEBVHVLE-UHFFFAOYSA-N 1,3-dioxol-2-one Chemical compound O=C1OC=CO1 VAYTZRYEBVHVLE-UHFFFAOYSA-N 0.000 description 6
- 239000002033 PVDF binder Substances 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 239000002131 composite material Substances 0.000 description 6
- 230000006866 deterioration Effects 0.000 description 6
- 239000008151 electrolyte solution Substances 0.000 description 6
- 229910052759 nickel Inorganic materials 0.000 description 6
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 229910052723 transition metal Inorganic materials 0.000 description 6
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 5
- 229910013063 LiBF 4 Inorganic materials 0.000 description 5
- 229910012258 LiPO Inorganic materials 0.000 description 5
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 229920001577 copolymer Polymers 0.000 description 5
- 229910052802 copper Inorganic materials 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 239000000835 fiber Substances 0.000 description 5
- 239000007789 gas Substances 0.000 description 5
- 150000002739 metals Chemical class 0.000 description 5
- 230000002829 reductive effect Effects 0.000 description 5
- 238000007086 side reaction Methods 0.000 description 5
- ZPFAVCIQZKRBGF-UHFFFAOYSA-N 1,3,2-dioxathiolane 2,2-dioxide Chemical compound O=S1(=O)OCCO1 ZPFAVCIQZKRBGF-UHFFFAOYSA-N 0.000 description 4
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 4
- 239000005977 Ethylene Substances 0.000 description 4
- 229910013188 LiBOB Inorganic materials 0.000 description 4
- 229910019142 PO4 Inorganic materials 0.000 description 4
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 4
- 238000001994 activation Methods 0.000 description 4
- 239000011149 active material Substances 0.000 description 4
- 229910045601 alloy Inorganic materials 0.000 description 4
- 239000000956 alloy Substances 0.000 description 4
- 229910021383 artificial graphite Inorganic materials 0.000 description 4
- 239000006229 carbon black Substances 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 150000005676 cyclic carbonates Chemical class 0.000 description 4
- 150000002148 esters Chemical group 0.000 description 4
- 239000010452 phosphate Substances 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 229910001220 stainless steel Inorganic materials 0.000 description 4
- 239000010935 stainless steel Substances 0.000 description 4
- 239000010409 thin film Substances 0.000 description 4
- 150000003624 transition metals Chemical class 0.000 description 4
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 3
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 229910004406 Li(Ni0.6Mn0.2CO0.2)O2 Inorganic materials 0.000 description 3
- 229910010941 LiFSI Inorganic materials 0.000 description 3
- 229910013528 LiN(SO2 CF3)2 Inorganic materials 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 239000006227 byproduct Substances 0.000 description 3
- 239000003575 carbonaceous material Substances 0.000 description 3
- 238000007872 degassing Methods 0.000 description 3
- 238000009831 deintercalation Methods 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 238000009830 intercalation Methods 0.000 description 3
- 229910052742 iron Inorganic materials 0.000 description 3
- 229910052745 lead Inorganic materials 0.000 description 3
- 229910003473 lithium bis(trifluoromethanesulfonyl)imide Inorganic materials 0.000 description 3
- VDVLPSWVDYJFRW-UHFFFAOYSA-N lithium;bis(fluorosulfonyl)azanide Chemical compound [Li+].FS(=O)(=O)[N-]S(F)(=O)=O VDVLPSWVDYJFRW-UHFFFAOYSA-N 0.000 description 3
- QSZMZKBZAYQGRS-UHFFFAOYSA-N lithium;bis(trifluoromethylsulfonyl)azanide Chemical compound [Li+].FC(F)(F)S(=O)(=O)[N-]S(=O)(=O)C(F)(F)F QSZMZKBZAYQGRS-UHFFFAOYSA-N 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 229910021382 natural graphite Inorganic materials 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 229920000573 polyethylene Polymers 0.000 description 3
- 229910052709 silver Inorganic materials 0.000 description 3
- 229910000314 transition metal oxide Inorganic materials 0.000 description 3
- OQYOVYWFXHQYOP-UHFFFAOYSA-N 1,3,2-dioxathiane 2,2-dioxide Chemical compound O=S1(=O)OCCCO1 OQYOVYWFXHQYOP-UHFFFAOYSA-N 0.000 description 2
- FSSPGSAQUIYDCN-UHFFFAOYSA-N 1,3-Propane sultone Chemical compound O=S1(=O)CCCO1 FSSPGSAQUIYDCN-UHFFFAOYSA-N 0.000 description 2
- IFDLFCDWOFLKEB-UHFFFAOYSA-N 2-methylbutylbenzene Chemical compound CCC(C)CC1=CC=CC=C1 IFDLFCDWOFLKEB-UHFFFAOYSA-N 0.000 description 2
- YEJRWHAVMIAJKC-UHFFFAOYSA-N 4-Butyrolactone Chemical compound O=C1CCCO1 YEJRWHAVMIAJKC-UHFFFAOYSA-N 0.000 description 2
- BJWMSGRKJIOCNR-UHFFFAOYSA-N 4-ethenyl-1,3-dioxolan-2-one Chemical compound C=CC1COC(=O)O1 BJWMSGRKJIOCNR-UHFFFAOYSA-N 0.000 description 2
- SBLRHMKNNHXPHG-UHFFFAOYSA-N 4-fluoro-1,3-dioxolan-2-one Chemical compound FC1COC(=O)O1 SBLRHMKNNHXPHG-UHFFFAOYSA-N 0.000 description 2
- 229920000049 Carbon (fiber) Polymers 0.000 description 2
- OIFBSDVPJOWBCH-UHFFFAOYSA-N Diethyl carbonate Chemical compound CCOC(=O)OCC OIFBSDVPJOWBCH-UHFFFAOYSA-N 0.000 description 2
- 239000002000 Electrolyte additive Substances 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- 239000002841 Lewis acid Substances 0.000 description 2
- 229910004437 Li(Ni0.8Mn0.1Co0.1)O2 Inorganic materials 0.000 description 2
- 229910013684 LiClO 4 Inorganic materials 0.000 description 2
- 229910012851 LiCoO 2 Inorganic materials 0.000 description 2
- 229910014689 LiMnO Inorganic materials 0.000 description 2
- 229910013398 LiN(SO2CF2CF3)2 Inorganic materials 0.000 description 2
- 229910013716 LiNi Inorganic materials 0.000 description 2
- 229910013290 LiNiO 2 Inorganic materials 0.000 description 2
- 229920000265 Polyparaphenylene Polymers 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 239000006230 acetylene black Substances 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 229910052783 alkali metal Inorganic materials 0.000 description 2
- 150000001340 alkali metals Chemical class 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 150000001342 alkaline earth metals Chemical class 0.000 description 2
- 229910003481 amorphous carbon Inorganic materials 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 229910052796 boron Inorganic materials 0.000 description 2
- 229910052795 boron group element Inorganic materials 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 239000004917 carbon fiber Substances 0.000 description 2
- 229910052800 carbon group element Inorganic materials 0.000 description 2
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 2
- 239000006231 channel black Substances 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- NJLLQSBAHIKGKF-UHFFFAOYSA-N dipotassium dioxido(oxo)titanium Chemical compound [K+].[K+].[O-][Ti]([O-])=O NJLLQSBAHIKGKF-UHFFFAOYSA-N 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 238000004070 electrodeposition Methods 0.000 description 2
- FKRCODPIKNYEAC-UHFFFAOYSA-N ethyl propionate Chemical compound CCOC(=O)CC FKRCODPIKNYEAC-UHFFFAOYSA-N 0.000 description 2
- 229920001973 fluoroelastomer Polymers 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 239000006232 furnace black Substances 0.000 description 2
- JBFHTYHTHYHCDJ-UHFFFAOYSA-N gamma-caprolactone Chemical compound CCC1CCC(=O)O1 JBFHTYHTHYHCDJ-UHFFFAOYSA-N 0.000 description 2
- GAEKPEKOJKCEMS-UHFFFAOYSA-N gamma-valerolactone Chemical compound CC1CCC(=O)O1 GAEKPEKOJKCEMS-UHFFFAOYSA-N 0.000 description 2
- 229910052732 germanium Inorganic materials 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 229910052738 indium Inorganic materials 0.000 description 2
- 230000002427 irreversible effect Effects 0.000 description 2
- 239000003273 ketjen black Substances 0.000 description 2
- 239000006233 lamp black Substances 0.000 description 2
- 150000007517 lewis acids Chemical class 0.000 description 2
- AMXOYNBUYSYVKV-UHFFFAOYSA-M lithium bromide Chemical compound [Li+].[Br-] AMXOYNBUYSYVKV-UHFFFAOYSA-M 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical group [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- ACFSQHQYDZIPRL-UHFFFAOYSA-N lithium;bis(1,1,2,2,2-pentafluoroethylsulfonyl)azanide Chemical compound [Li+].FC(F)(F)C(F)(F)S(=O)(=O)[N-]S(=O)(=O)C(F)(F)C(F)(F)F ACFSQHQYDZIPRL-UHFFFAOYSA-N 0.000 description 2
- IGILRSKEFZLPKG-UHFFFAOYSA-M lithium;difluorophosphinate Chemical compound [Li+].[O-]P(F)(F)=O IGILRSKEFZLPKG-UHFFFAOYSA-M 0.000 description 2
- VGYDTVNNDKLMHX-UHFFFAOYSA-N lithium;manganese;nickel;oxocobalt Chemical compound [Li].[Mn].[Ni].[Co]=O VGYDTVNNDKLMHX-UHFFFAOYSA-N 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 239000002905 metal composite material Substances 0.000 description 2
- 229910052750 molybdenum Inorganic materials 0.000 description 2
- 150000002825 nitriles Chemical class 0.000 description 2
- 239000004745 nonwoven fabric Substances 0.000 description 2
- SUSQOBVLVYHIEX-UHFFFAOYSA-N phenylacetonitrile Chemical compound N#CCC1=CC=CC=C1 SUSQOBVLVYHIEX-UHFFFAOYSA-N 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 229920006254 polymer film Polymers 0.000 description 2
- 229920000098 polyolefin Polymers 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- RUOJZAUFBMNUDX-UHFFFAOYSA-N propylene carbonate Chemical compound CC1COC(=O)O1 RUOJZAUFBMNUDX-UHFFFAOYSA-N 0.000 description 2
- 229910052761 rare earth metal Inorganic materials 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 239000004627 regenerated cellulose Substances 0.000 description 2
- 238000005096 rolling process Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 229910052712 strontium Inorganic materials 0.000 description 2
- 229920003048 styrene butadiene rubber Polymers 0.000 description 2
- IAHFWCOBPZCAEA-UHFFFAOYSA-N succinonitrile Chemical compound N#CCCC#N IAHFWCOBPZCAEA-UHFFFAOYSA-N 0.000 description 2
- BFKJFAAPBSQJPD-UHFFFAOYSA-N tetrafluoroethene Chemical group FC(F)=C(F)F BFKJFAAPBSQJPD-UHFFFAOYSA-N 0.000 description 2
- TXEYQDLBPFQVAA-UHFFFAOYSA-N tetrafluoromethane Chemical compound FC(F)(F)F TXEYQDLBPFQVAA-UHFFFAOYSA-N 0.000 description 2
- 239000006234 thermal black Substances 0.000 description 2
- 238000005979 thermal decomposition reaction Methods 0.000 description 2
- 229910052718 tin Inorganic materials 0.000 description 2
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- 239000011701 zinc Substances 0.000 description 2
- 239000011787 zinc oxide Substances 0.000 description 2
- HFZLSTDPRQSZCQ-UHFFFAOYSA-N 1-pyrrolidin-3-ylpyrrolidine Chemical compound C1CCCN1C1CNCC1 HFZLSTDPRQSZCQ-UHFFFAOYSA-N 0.000 description 1
- KTPHYLJFAZNALV-UHFFFAOYSA-N 2,3,4-trifluorobenzonitrile Chemical compound FC1=CC=C(C#N)C(F)=C1F KTPHYLJFAZNALV-UHFFFAOYSA-N 0.000 description 1
- GKPHNZYMLJPYJJ-UHFFFAOYSA-N 2,3-difluorobenzonitrile Chemical compound FC1=CC=CC(C#N)=C1F GKPHNZYMLJPYJJ-UHFFFAOYSA-N 0.000 description 1
- DAVJMKMVLKOQQC-UHFFFAOYSA-N 2-(2-fluorophenyl)acetonitrile Chemical compound FC1=CC=CC=C1CC#N DAVJMKMVLKOQQC-UHFFFAOYSA-N 0.000 description 1
- UHOPWFKONJYLCF-UHFFFAOYSA-N 2-(2-sulfanylethyl)isoindole-1,3-dione Chemical compound C1=CC=C2C(=O)N(CCS)C(=O)C2=C1 UHOPWFKONJYLCF-UHFFFAOYSA-N 0.000 description 1
- JHQBLYITVCBGTO-UHFFFAOYSA-N 2-(4-fluorophenyl)acetonitrile Chemical compound FC1=CC=C(CC#N)C=C1 JHQBLYITVCBGTO-UHFFFAOYSA-N 0.000 description 1
- GDHXJNRAJRCGMX-UHFFFAOYSA-N 2-fluorobenzonitrile Chemical compound FC1=CC=CC=C1C#N GDHXJNRAJRCGMX-UHFFFAOYSA-N 0.000 description 1
- LWLOKSXSAUHTJO-UHFFFAOYSA-N 4,5-dimethyl-1,3-dioxolan-2-one Chemical compound CC1OC(=O)OC1C LWLOKSXSAUHTJO-UHFFFAOYSA-N 0.000 description 1
- LSUWCXHZPFTZSF-UHFFFAOYSA-N 4-ethyl-5-methyl-1,3-dioxolan-2-one Chemical compound CCC1OC(=O)OC1C LSUWCXHZPFTZSF-UHFFFAOYSA-N 0.000 description 1
- AEKVBBNGWBBYLL-UHFFFAOYSA-N 4-fluorobenzonitrile Chemical compound FC1=CC=C(C#N)C=C1 AEKVBBNGWBBYLL-UHFFFAOYSA-N 0.000 description 1
- AUXJVUDWWLIGRU-UHFFFAOYSA-N 4-propyl-1,3-dioxolan-2-one Chemical compound CCCC1COC(=O)O1 AUXJVUDWWLIGRU-UHFFFAOYSA-N 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- 229910015902 Bi 2 O 3 Inorganic materials 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 229910000925 Cd alloy Inorganic materials 0.000 description 1
- 229920002943 EPDM rubber Polymers 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 229910005793 GeO 2 Inorganic materials 0.000 description 1
- 229910003936 Li(Ni0.5Mn0.3Co0.2)O2 Inorganic materials 0.000 description 1
- 229910004427 Li(Ni0.7Mn0.15Co0.15)O2 Inorganic materials 0.000 description 1
- 229910004424 Li(Ni0.8Co0.15Al0.05)O2 Inorganic materials 0.000 description 1
- 229910010238 LiAlCl 4 Inorganic materials 0.000 description 1
- 229910010090 LiAlO 4 Inorganic materials 0.000 description 1
- 229910015015 LiAsF 6 Inorganic materials 0.000 description 1
- 229910013733 LiCo Inorganic materials 0.000 description 1
- 229910015645 LiMn Inorganic materials 0.000 description 1
- 229910015644 LiMn 2 - z Ni Inorganic materials 0.000 description 1
- 229910015643 LiMn 2 O 4 Inorganic materials 0.000 description 1
- 229910015872 LiNi0.8Co0.1Mn0.1O2 Inorganic materials 0.000 description 1
- 229910012513 LiSbF 6 Inorganic materials 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 1
- RJUFJBKOKNCXHH-UHFFFAOYSA-N Methyl propionate Chemical compound CCC(=O)OC RJUFJBKOKNCXHH-UHFFFAOYSA-N 0.000 description 1
- RFFFKMOABOFIDF-UHFFFAOYSA-N Pentanenitrile Chemical compound CCCCC#N RFFFKMOABOFIDF-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 229910008326 Si-Y Inorganic materials 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 1
- 229910006773 Si—Y Inorganic materials 0.000 description 1
- 229910020997 Sn-Y Inorganic materials 0.000 description 1
- 229910006404 SnO 2 Inorganic materials 0.000 description 1
- 229910008859 Sn—Y Inorganic materials 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- NXPZICSHDHGMGT-UHFFFAOYSA-N [Co].[Mn].[Li] Chemical compound [Co].[Mn].[Li] NXPZICSHDHGMGT-UHFFFAOYSA-N 0.000 description 1
- PFYQFCKUASLJLL-UHFFFAOYSA-N [Co].[Ni].[Li] Chemical compound [Co].[Ni].[Li] PFYQFCKUASLJLL-UHFFFAOYSA-N 0.000 description 1
- RLTFLELMPUMVEH-UHFFFAOYSA-N [Li+].[O--].[O--].[O--].[V+5] Chemical compound [Li+].[O--].[O--].[O--].[V+5] RLTFLELMPUMVEH-UHFFFAOYSA-N 0.000 description 1
- XHCLAFWTIXFWPH-UHFFFAOYSA-N [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] XHCLAFWTIXFWPH-UHFFFAOYSA-N 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- BTGRAWJCKBQKAO-UHFFFAOYSA-N adiponitrile Chemical compound N#CCCCCC#N BTGRAWJCKBQKAO-UHFFFAOYSA-N 0.000 description 1
- NDPGDHBNXZOBJS-UHFFFAOYSA-N aluminum lithium cobalt(2+) nickel(2+) oxygen(2-) Chemical compound [Li+].[O--].[O--].[O--].[O--].[Al+3].[Co++].[Ni++] NDPGDHBNXZOBJS-UHFFFAOYSA-N 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229910052787 antimony Inorganic materials 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- 229910052790 beryllium Inorganic materials 0.000 description 1
- 229910021475 bohrium Inorganic materials 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- IAQRGUVFOMOMEM-UHFFFAOYSA-N butene Natural products CC=CC IAQRGUVFOMOMEM-UHFFFAOYSA-N 0.000 description 1
- KVNRLNFWIYMESJ-UHFFFAOYSA-N butyronitrile Chemical compound CCCC#N KVNRLNFWIYMESJ-UHFFFAOYSA-N 0.000 description 1
- 229910052793 cadmium Inorganic materials 0.000 description 1
- 229910052792 caesium Inorganic materials 0.000 description 1
- 239000011329 calcined coke Substances 0.000 description 1
- 239000006182 cathode active material Substances 0.000 description 1
- 239000006257 cathode slurry Substances 0.000 description 1
- 239000003610 charcoal Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- CKFRRHLHAJZIIN-UHFFFAOYSA-N cobalt lithium Chemical compound [Li].[Co] CKFRRHLHAJZIIN-UHFFFAOYSA-N 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 230000007797 corrosion Effects 0.000 description 1
- 238000005260 corrosion Methods 0.000 description 1
- 150000001923 cyclic compounds Chemical class 0.000 description 1
- VBWIZSYFQSOUFQ-UHFFFAOYSA-N cyclohexanecarbonitrile Chemical compound N#CC1CCCCC1 VBWIZSYFQSOUFQ-UHFFFAOYSA-N 0.000 description 1
- SVPZJHKVRMRREG-UHFFFAOYSA-N cyclopentanecarbonitrile Chemical compound N#CC1CCCC1 SVPZJHKVRMRREG-UHFFFAOYSA-N 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- IEJIGPNLZYLLBP-UHFFFAOYSA-N dimethyl carbonate Chemical compound COC(=O)OC IEJIGPNLZYLLBP-UHFFFAOYSA-N 0.000 description 1
- VUPKGFBOKBGHFZ-UHFFFAOYSA-N dipropyl carbonate Chemical compound CCCOC(=O)OCCC VUPKGFBOKBGHFZ-UHFFFAOYSA-N 0.000 description 1
- 239000007772 electrode material Substances 0.000 description 1
- 229940093499 ethyl acetate Drugs 0.000 description 1
- CYEDOLFRAIXARV-UHFFFAOYSA-N ethyl propyl carbonate Chemical compound CCCOC(=O)OCC CYEDOLFRAIXARV-UHFFFAOYSA-N 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 229910052730 francium Inorganic materials 0.000 description 1
- 239000013538 functional additive Substances 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- PVADDRMAFCOOPC-UHFFFAOYSA-N germanium monoxide Inorganic materials [Ge]=O PVADDRMAFCOOPC-UHFFFAOYSA-N 0.000 description 1
- 239000003365 glass fiber Substances 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 229910052735 hafnium Inorganic materials 0.000 description 1
- 229910021385 hard carbon Inorganic materials 0.000 description 1
- 229910021473 hassium Inorganic materials 0.000 description 1
- SDAXRHHPNYTELL-UHFFFAOYSA-N heptanenitrile Chemical compound CCCCCCC#N SDAXRHHPNYTELL-UHFFFAOYSA-N 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229910021432 inorganic complex Inorganic materials 0.000 description 1
- 239000010954 inorganic particle Substances 0.000 description 1
- 230000002687 intercalation Effects 0.000 description 1
- 230000016507 interphase Effects 0.000 description 1
- 229910052741 iridium Inorganic materials 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 150000007527 lewis bases Chemical class 0.000 description 1
- DEUISMFZZMAAOJ-UHFFFAOYSA-N lithium dihydrogen borate oxalic acid Chemical compound B([O-])(O)O.C(C(=O)O)(=O)O.C(C(=O)O)(=O)O.[Li+] DEUISMFZZMAAOJ-UHFFFAOYSA-N 0.000 description 1
- HSZCZNFXUDYRKD-UHFFFAOYSA-M lithium iodide Inorganic materials [Li+].[I-] HSZCZNFXUDYRKD-UHFFFAOYSA-M 0.000 description 1
- 229910002102 lithium manganese oxide Inorganic materials 0.000 description 1
- FRMOHNDAXZZWQI-UHFFFAOYSA-N lithium manganese(2+) nickel(2+) oxygen(2-) Chemical compound [O-2].[Mn+2].[Ni+2].[Li+] FRMOHNDAXZZWQI-UHFFFAOYSA-N 0.000 description 1
- RSNHXDVSISOZOB-UHFFFAOYSA-N lithium nickel Chemical compound [Li].[Ni] RSNHXDVSISOZOB-UHFFFAOYSA-N 0.000 description 1
- 229910000686 lithium vanadium oxide Inorganic materials 0.000 description 1
- VLXXBCXTUVRROQ-UHFFFAOYSA-N lithium;oxido-oxo-(oxomanganiooxy)manganese Chemical compound [Li+].[O-][Mn](=O)O[Mn]=O VLXXBCXTUVRROQ-UHFFFAOYSA-N 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 239000006051 mesophase pitch carbide Substances 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 229940017219 methyl propionate Drugs 0.000 description 1
- KKQAVHGECIBFRQ-UHFFFAOYSA-N methyl propyl carbonate Chemical compound CCCOC(=O)OC KKQAVHGECIBFRQ-UHFFFAOYSA-N 0.000 description 1
- PYLWMHQQBFSUBP-UHFFFAOYSA-N monofluorobenzene Chemical compound FC1=CC=CC=C1 PYLWMHQQBFSUBP-UHFFFAOYSA-N 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- YKYONYBAUNKHLG-UHFFFAOYSA-N n-Propyl acetate Natural products CCCOC(C)=O YKYONYBAUNKHLG-UHFFFAOYSA-N 0.000 description 1
- 229910052758 niobium Inorganic materials 0.000 description 1
- 239000011356 non-aqueous organic solvent Substances 0.000 description 1
- YSIMAPNUZAVQER-UHFFFAOYSA-N octanenitrile Chemical compound CCCCCCCC#N YSIMAPNUZAVQER-UHFFFAOYSA-N 0.000 description 1
- 229910052762 osmium Inorganic materials 0.000 description 1
- MHYFEEDKONKGEB-UHFFFAOYSA-N oxathiane 2,2-dioxide Chemical compound O=S1(=O)CCCCO1 MHYFEEDKONKGEB-UHFFFAOYSA-N 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 1
- 229940090181 propyl acetate Drugs 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 229920001384 propylene homopolymer Polymers 0.000 description 1
- 150000002910 rare earth metals Chemical class 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 229910052701 rubidium Inorganic materials 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 229910021481 rutherfordium Inorganic materials 0.000 description 1
- 229910052706 scandium Inorganic materials 0.000 description 1
- 229910021477 seaborgium Inorganic materials 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 229910000077 silane Inorganic materials 0.000 description 1
- 150000004756 silanes Chemical class 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910021384 soft carbon Inorganic materials 0.000 description 1
- 239000007784 solid electrolyte Substances 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 150000008053 sultones Chemical class 0.000 description 1
- 229910052715 tantalum Inorganic materials 0.000 description 1
- 229910052713 technetium Inorganic materials 0.000 description 1
- UFHILTCGAOPTOV-UHFFFAOYSA-N tetrakis(ethenyl)silane Chemical compound C=C[Si](C=C)(C=C)C=C UFHILTCGAOPTOV-UHFFFAOYSA-N 0.000 description 1
- 229910001428 transition metal ion Inorganic materials 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- CBIQXUBDNNXYJM-UHFFFAOYSA-N tris(2,2,2-trifluoroethyl) phosphite Chemical compound FC(F)(F)COP(OCC(F)(F)F)OCC(F)(F)F CBIQXUBDNNXYJM-UHFFFAOYSA-N 0.000 description 1
- 229910052721 tungsten Inorganic materials 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 1
- 229910001935 vanadium oxide Inorganic materials 0.000 description 1
- 235000015041 whisky Nutrition 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
- 229910052726 zirconium Inorganic materials 0.000 description 1
- PAPBSGBWRJIAAV-UHFFFAOYSA-N ε-Caprolactone Chemical compound O=C1CCCCCO1 PAPBSGBWRJIAAV-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/056—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes
- H01M10/0564—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes the electrolyte being constituted of organic materials only
- H01M10/0566—Liquid materials
- H01M10/0567—Liquid materials characterised by the additives
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
- H01M10/0525—Rocking-chair batteries, i.e. batteries with lithium insertion or intercalation in both electrodes; Lithium-ion batteries
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/056—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes
- H01M10/0564—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes the electrolyte being constituted of organic materials only
- H01M10/0566—Liquid materials
- H01M10/0568—Liquid materials characterised by the solutes
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/42—Methods or arrangements for servicing or maintenance of secondary cells or secondary half-cells
- H01M10/52—Removing gases inside the secondary cell, e.g. by absorption
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M50/00—Constructional details or processes of manufacture of the non-active parts of electrochemical cells other than fuel cells, e.g. hybrid cells
- H01M50/40—Separators; Membranes; Diaphragms; Spacing elements inside cells
- H01M50/46—Separators, membranes or diaphragms characterised by their combination with electrodes
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M2300/00—Electrolytes
- H01M2300/0017—Non-aqueous electrolytes
- H01M2300/0025—Organic electrolyte
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Definitions
- the present invention relates to a non-aqueous electrolyte solution for a lithium secondary battery comprising a non-aqueous electrolyte and an additive having an excellent initial film formation effect while having an excellent effect of removing decomposition products generated from lithium salts, and a lithium secondary battery having improved initial battery efficiency and self-discharge characteristics by including the same it's about
- a secondary battery-based technology In the case of secondary batteries, interest is emerging because they can be miniaturized enough to be applied to personal IT devices, and can be applied to electric vehicles and power storage devices.
- a lithium ion battery which is a battery system with the highest theoretical energy density, is in the spotlight and is currently being applied to various devices.
- Lithium ion batteries do not directly apply lithium metal to the electrode, but instead consist of a positive electrode made of a transition metal oxide containing lithium, a negative electrode made of a carbon-based material such as graphite that can store lithium, and a medium that delivers lithium ions. It is composed of an electrolyte solution and a separator.
- the double electrolyte is known as a component that greatly affects the stability and safety of a battery, many studies are being conducted on it.
- the electrolyte solution for a lithium ion battery is composed of a lithium salt, an organic solvent dissolving the same, and a functional additive, and appropriate selection of these components is important in order to improve the electrochemical properties of the battery.
- Representative lithium salts currently used include LiPF 6 , LiBF 4 , LiFSI (lithium fluorosulfonyl imide, LiN(SO 2 F) 2 ), LiTFSI (lithium (bis)trifluoromethanesulfonyl imide, LiN(SO 2 CF 3 ) 2 ) or LiBOB ( lithium bis(oxalate) borate, LiB(C 2 O 4 ) 2 ), and the like, and the organic solvent is an ester-based organic solvent or an ether-based organic solvent.
- lithium ion batteries have disadvantages in that performance deteriorates due to an increase in resistance and a decrease in capacity during charging and discharging or storage at high temperatures.
- one of the causes of this problem is a side reaction that occurs due to deterioration of the electrolyte at a high temperature, especially deterioration due to decomposition of lithium salt.
- the by-products of these salts decompose the coatings formed on the surfaces of the positive and negative electrodes after activation, there is a problem in that the passivation ability of the coatings is lowered.
- the electrolyte is additionally decomposed during storage and the charged graphite is self-discharged, and consequently, the potential of the battery is lowered.
- acids such as HF and PF 5 generated by thermal decomposition of LiPF 6 , a lithium salt widely used in lithium ion batteries, deteriorate the film or electrode surface. For this reason, when the electrode surface is deteriorated, transition metal elution occurs in the anode to increase resistance, and capacity may decrease due to loss of redox centers. Moreover, in the case of eluted metal ions, they are electrodeposited on the negative electrode and consume electrons due to metal electrodeposition and further electrolyte decomposition, thereby increasing irreversible capacity, which not only decreases cell capacity, but also increases resistance and may cause self-discharge of the graphite negative electrode. have.
- an electrolyte solution additive containing a functional group that can easily undergo reductive decomposition in the electrolyte solution is introduced, or a factor that can affect the passivation ability, for example
- a method for removing decomposition products (HF, PF 5, etc.) of lithium salts generated by heat or moisture has been proposed.
- An object of the present invention is to provide a non-aqueous electrolyte additive that rapidly reacts with an acid as a Lewis base compound and has an excellent effect of forming a SEI film and removing decomposition products generated inside the non-aqueous electrolyte, and a non-aqueous electrolyte for a lithium secondary battery comprising the same.
- an object of the present invention is to provide a lithium secondary battery with improved initial efficiency and self-discharge characteristics.
- the present invention relates to a non-aqueous electrolyte for a lithium secondary battery.
- a first aspect of the present invention relates to the non-aqueous electrolyte, wherein the non-aqueous electrolyte includes a compound represented by the following [Formula 1] as a lithium salt, an organic solvent, and an additive.
- Q is absent or is a substituted or unsubstituted C 1 to C 10 alkyl group
- A1, A2 and A 3 are each independently hydrogen or a substituted or unsubstituted C 1 to C 10 alkyl group.
- Q is a chain or branched alkyl group, an alkenyl group, or an alkynyl group.
- a third aspect of the present invention wherein Q is at least one hydrogen is substituted with a halogen element selected from Cl, F, Br and I.
- the additive comprises a compound represented by the following [Formula 1a].
- the lithium salt comprises Li + as a cation, and F - , Cl - , Br - , I - , NO 3 as an anion. - , N(CN) 2 - , BF 4 - , ClO 4 - , AlO 4 - , AlCl 4 - , PF 6 - , SbF 6 - , AsF 6 - , B 10 Cl 10 - , BF 2 C 2 O 4 - , BC 4 O 8 - , PF 4 C 2 O4 - , PF 2 C 4 O 8 - , (CF 3 ) 2 PF 4 - , (CF 3 ) 3 PF 3 - , (CF 3 ) 4 PF 2 - , (CF 3 ) 5 PF - , (CF 3 ) 6 P - , CF 3 SO 3 - , C 4 F 9 SO 3 - , N(CN) 2 - , BF 4 - , ClO 4
- the additive is included in an amount of 0.1 wt% to 2 wt% relative to 100 wt% of the non-aqueous electrolyte for a lithium secondary battery.
- the additive is contained in an amount of 0.3 wt% to 1.5 wt%, based on 100 wt% of the non-aqueous electrolyte for a lithium secondary battery.
- An eighth aspect of the present invention relates to a lithium secondary battery, wherein the battery includes a positive electrode, a negative electrode, a separator, and a non-aqueous electrolyte for a lithium secondary battery, wherein the non-aqueous electrolyte is according to any one of the first to seventh aspects.
- a Lewis base compound as an electrolyte additive in the preparation of a non-aqueous electrolyte
- HF and PF 5 formed as a decomposition product of a lithium salt (LiPF 6 ) mainly used in a non-aqueous electrolyte are removed (scavenging) and high temperature During storage, the passivation ability of the SEI membrane can be maintained.
- the non-aqueous electrolyte containing the Lewis base compound as an additive the self-discharge phenomenon caused by the dissolution of the positive electrode and the destruction of the SEI film of the negative electrode can be improved, and thus a lithium secondary battery with improved battery performance can be manufactured.
- Example 1 is a graph showing a differential capacity curve according to Experimental Example 1 of Example 1 and Comparative Example 1 of the present invention.
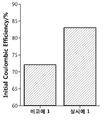
- Example 2 is a result showing the initial efficiency during the activation process according to Experimental Example 2 of Example 1 and Comparative Example 1 of the present invention.
- Example 3 is a result showing the drop of the initial OCV (open-circuit-voltage) according to Experimental Example 3 of Example 1 and Comparative Example 1 of the present invention.
- a film having a passivation ability is formed on the surfaces of the positive and negative electrodes to improve high-temperature storage characteristics.
- the film may be deteriorated by acids such as HF and PF 5 generated by thermal decomposition of anions such as LiPF 6 , a lithium salt widely used in lithium ion batteries.
- acids such as HF and PF 5 generated by thermal decomposition of anions such as LiPF 6 , a lithium salt widely used in lithium ion batteries.
- the eluted transition metal ions in the case of the eluted transition metal ions, they not only consume electrons by electrodeposition on the cathode reacting in the strong reduction potential band, but also destroy the SEI film when electrodeposited. Accordingly, as the surface of the anode is exposed, the resistance of the anode increases, and an additional electrolyte decomposition reaction is caused. As a result, there is a problem in that the capacity of the cell is continuously decreased while the irreversible capacity is increased.
- an object of the present invention is to provide a non-aqueous electrolyte having excellent film-forming ability and a lithium secondary battery including the same.
- an embodiment of the present invention provides a non-aqueous electrolyte for a lithium secondary battery comprising a lithium salt, an organic solvent, and a compound represented by the following [Formula 1] as an additive.
- Q may be absent or may be a substituted or unsubstituted C 1 to C 10 alkyl group.
- Q may be a chain or branched alkyl group, an alkenyl group, or an alkynyl group.
- at least one hydrogen may be substituted with a halogen element selected from Cl, F, Br, and I.
- A1, A2, and A3 may each independently be hydrogen or a substituted or unsubstituted C1-C10 alkyl group.
- the lithium salt may be used without limitation, those commonly used in the preparation of an electrolyte for a lithium secondary battery, for example, Li + as a cation.
- the lithium salt is LiCl, LiBr, LiI, LiBF 4 , LiClO 4 , LiAlO 4 , LiAlCl 4 , LiPF 6 , LiSbF 6 , LiAsF 6 , LiPO 2 F 2 , LiB 10 Cl 10 , LiBOB (LiB(C 2 O 4 ) 2 ), LiCF 3 SO 3 , LiTFSI (LiN(SO 2 CF 3 ) 2 ), LiFSI (LiN(SO 2 F) 2 ), LiCH 3 SO 3 , LiCF 3 CO 2 , LiCH 3 CO 2 and LiBETI (LiN(SO 2 CF 2 CF 3 ) 2 at least one selected from the group consisting of 2 .
- the lithium salt is LiPO 2 F 2 , LiBF 4 , LiClO 4 , LiPF 6 , LiBOB (LiB(C 2 O 4 ) 2 ), LiCF 3 SO 3 , LiTFSI (LiN(SO 2 CF 3 ) 2 ), LiFSI (LiN(SO 2 F) 2 ), and LiBETI (LiN(SO 2 CF 2 CF 3 ) 2 It may include a single substance or a mixture of two or more selected from the group consisting of.
- the lithium salt may be appropriately changed within the range that can be used in general, but in order to obtain an optimal effect of forming a film for preventing corrosion of the electrode surface, it is contained in a concentration of 0.8 M to 4.0 M, specifically 1.0 M to 3.0 M in the electrolyte.
- the concentration of the lithium salt is less than 0.8 M, the effect of improving the low-temperature output of the lithium secondary battery and improving the cycle characteristics during high-temperature storage is insignificant.
- the organic solvent may include a cyclic carbonate-based organic solvent, a linear carbonate-based organic solvent, or a mixed organic solvent thereof.
- the cyclic carbonate-based organic solvent is a high-viscosity organic solvent, which has a high dielectric constant and can well dissociate lithium salts in the electrolyte, and specific examples thereof include ethylene carbonate (EC), propylene carbonate (PC), 1,2-butylene. At least one organic solvent selected from the group consisting of carbonate, 2,3-butylene carbonate, 1,2-pentylene carbonate, 2,3-pentylene carbonate and vinylene carbonate, among them, ethylene carbonate may include.
- the linear carbonate-based organic solvent is an organic solvent having a low viscosity and a low dielectric constant, and representative examples thereof include dimethyl carbonate (DMC), diethyl carbonate (DEC), dipropyl carbonate, ethylmethyl carbonate ( EMC), at least one organic solvent selected from the group consisting of methyl propyl carbonate and ethyl propyl carbonate may be used, and specifically, ethyl methyl carbonate (EMC) may be included.
- DMC dimethyl carbonate
- DEC diethyl carbonate
- EMC ethylmethyl carbonate
- EMC ethyl methyl carbonate
- the organic solvent is a linear ester-based organic solvent and a cyclic ester in at least one carbonate-based organic solvent selected from the group consisting of the cyclic carbonate-based organic solvent and the linear carbonate-based organic solvent in order to prepare an electrolyte having a high ionic conductivity. It may further include at least one or more ester-based organic solvents selected from the group consisting of organic solvents.
- linear ester-based organic solvent examples include at least one organic solvent selected from the group consisting of methyl acetate, ethyl acetate, propyl acetate, methyl propionate, ethyl propionate, propyl propionate and butyl propionate.
- cyclic ester-based organic solvent at least one organic solvent selected from the group consisting of ⁇ -butyrolactone, ⁇ -valerolactone, ⁇ -caprolactone, ⁇ -valerolactone, ⁇ -caprolactone, can be heard
- an organic solvent commonly used in the electrolyte solution for lithium secondary batteries may be added without limitation, if necessary.
- at least one organic solvent of an ether-based organic solvent, an amide-based organic solvent , and a nitrile-based organic solvent may be further included.
- the non-aqueous electrolyte for a lithium secondary battery of the present invention may include a compound represented by the following [Formula 1] as an additive.
- Q may be absent or may be a substituted or unsubstituted C 1 to C 10 alkyl group.
- Q may be a chain or branched alkyl group, an alkenyl group, or an alkynyl group.
- at least one hydrogen may be substituted with a halogen element selected from Cl, F, Br, and I.
- A1, A2, and A3 may each independently be hydrogen or a substituted or unsubstituted C1-C10 alkyl group.
- the compound represented by the formula (1) may be a compound represented by the following formula (1a) as a representative example.
- the compound represented by Formula 1 may be included in a range of 0.1 wt% to 2 wt% based on the total weight of the non-aqueous electrolyte solution.
- it may include 0.1 wt% or more, 0.2 wt% or more, 0.3 wt% or 0.5 wt% or more within the above range.
- it may be included in the range of 1.7 wt% or less, 1.5 wt% or less, or 1.2 wt% or less within the above range.
- carbon in the cyclic compound is hydrogen (H) bonded, and the existence of such hydrogen is obvious to those skilled in the art.
- a secondary battery with improved overall performance may be manufactured.
- the content of the compound represented by Formula 1 is less than 0.1% by weight, HF or PF 5 may be initially removed, but as time passes, the removal effect becomes insignificant and the initial SEI formation effect by the additive is significantly reduced.
- the content of the compound represented by Formula 1 exceeds 2.0 wt %, side reactions and by-products due to an excess of additives may occur, thereby increasing the resistance of the secondary battery when stored at a high temperature.
- the content of the compound represented by Formula 1 is 0.1 wt% or more to 2 wt% or less, specifically 0.1 wt% to 1.7 wt%, more specifically 0.3 wt% to 1.5 wt% Acids such as HF and PF 5 , which are decomposition products of lithium salts, can be more effectively removed while minimizing disadvantages such as side reactions, capacity reduction, and resistance increase.
- the compound represented by Formula 1 included as an electrolyte additive in the present specification is a Lewis base-based compound including an imidazole functional group, by-products that cause battery deterioration at high temperatures, for example, due to decomposition of lithium salts
- the generated Lewis acid eg HF or PF 5
- High-temperature storage characteristics can be improved.
- the ability to form SEI, an organic/inorganic complex, is also excellent.
- the non-aqueous electrolyte for a lithium secondary battery of the present invention prevents the anode from decaying due to decomposition of the non-aqueous electrolyte in a high-output environment, or has low-temperature high-rate discharge characteristics, high-temperature stability, overcharge prevention, and battery expansion inhibition effect at high temperature.
- additional additives may be further included in the non-aqueous electrolyte solution if necessary.
- additional additives include cyclic carbonate compounds, halogen-substituted carbonate compounds, sultone compounds, sulfate compounds, phosphate compounds, borate compounds, nitrile compounds, benzene compounds, amine compounds, and silane compounds. At least one or more additional additives selected from the group consisting of compound and lithium salt-based compounds may be included.
- the cyclic carbonate-based compound may include vinylene carbonate (VC) or vinylethylene carbonate.
- the halogen-substituted carbonate-based compound may include fluoroethylene carbonate (FEC).
- the sultone-based compound is 1,3-propane sultone (PS), 1,4-butane sultone, ethenesultone, 1,3-propene sultone (PRS), 1,4-butene sultone, and 1-methyl-1,3 - at least one compound selected from the group consisting of propene sultone.
- the sulfate-based compound may include ethylene sulfate (Esa), trimethylene sulfate (TMS), or methyl trimethylene sulfate (MTMS).
- Esa ethylene sulfate
- TMS trimethylene sulfate
- MTMS methyl trimethylene sulfate
- the phosphate-based compound is lithium difluoro (bisoxalato) phosphate, lithium difluorophosphate (LiPO 2 F 2 ), tetramethyl trimethyl silyl phosphate, trimethyl silyl phosphite, tris (2,2,2-trifluoro and at least one compound selected from the group consisting of roethyl)phosphate and tris(trifluoroethyl)phosphite.
- the borate-based compound may include tetraphenylborate and lithium oxalyldifluoroborate.
- the nitrile-based compound is succinonitrile, adiponitrile, acetonitrile, propionitrile, butyronitrile, valeronitrile, caprylonitrile, heptanenitrile, cyclopentane carbonitrile, cyclohexane carbonitrile, 2-fluorobenzo Nitrile, 4-fluorobenzonitrile, difluorobenzonitrile, trifluorobenzonitrile, phenylacetonitrile, 2-fluorophenylacetonitrile, and 4-fluorophenylacetonitrile, Propargyl 1H-imidazole-1-carboxylate At least one compound selected from the group consisting of
- the benzene-based compound may include fluorobenzene
- the amine-based compound may include triethanolamine or ethylenediamine
- the silane-based compound may include tetravinylsilane.
- the lithium salt-based compound is a compound different from the lithium salt included in the non-aqueous electrolyte, and is selected from the group consisting of LiPO 2 F 2 , LiODFB, LiBOB (lithium bisoxalatoborate (LiB(C 2 O 4 ) 2 ) and LiBF 4 ). one or more compounds.
- the LiBF 4 When the LiBF 4 is included, generation of a gas that may be generated due to the decomposition of the electrolyte during storage at a high temperature is suppressed, thereby improving the high-temperature stability of the secondary battery.
- two or more of the additional additives may be mixed and used, and may be included in an amount of 0.01 to 50% by weight, specifically 0.01 to 20% by weight, based on the total weight of the non-aqueous electrolyte.
- the content of the additional additive is less than 0.01% by weight, the effect of improving the low-temperature output and high-temperature storage and high-temperature life characteristics of the battery is insignificant, and when the content of the additional additive exceeds 50% by weight, the excess additive is Therefore, there is a possibility that side reactions may occur excessively during charging and discharging of the battery.
- the additives for forming the SEI film when added in excess, they may not be sufficiently decomposed at a high temperature, so that unreacted substances may be generated or precipitated in the electrolyte at room temperature. Accordingly, a side reaction in which the lifespan or resistance characteristic of the secondary battery is deteriorated may occur.
- a lithium secondary battery comprising the non-aqueous electrolyte for a lithium secondary battery of the present invention.
- the lithium secondary battery of the present invention can be manufactured by forming an electrode assembly in which a positive electrode, a negative electrode, and a separator are sequentially stacked between the positive and negative electrodes, stored in a battery case, and then adding the non-aqueous electrolyte of the present invention.
- the method for manufacturing the lithium secondary battery of the present invention may be manufactured and applied according to a conventional method known in the art, and will be described in detail below.
- the positive electrode may be prepared by coating a positive electrode slurry including a positive electrode active material, a binder, a conductive material, and a solvent on a positive electrode current collector, followed by drying and rolling.
- the positive electrode current collector is not particularly limited as long as it has conductivity without causing a chemical change in the battery.
- stainless steel, aluminum, nickel, titanium, calcined carbon, or carbon on the surface of aluminum or stainless steel. , nickel, titanium, silver, etc. may be used.
- the positive active material is a compound capable of reversible intercalation and deintercalation of lithium, and specifically may include a lithium composite metal oxide including lithium and one or more metals such as cobalt, manganese, nickel or aluminum. have. More specifically, the lithium composite metal oxide is a lithium-manganese oxide (eg, LiMnO 2 , LiMn 2 O 4 , etc.), a lithium-cobalt-based oxide (eg, LiCoO 2 , etc.), lithium-nickel-based oxide (eg, LiNiO 2 ), lithium-nickel-manganese oxide (eg, LiNi 1-Y Mn Y O 2 (0 ⁇ Y ⁇ 1), LiMn 2-z Ni z O 4 (0 ⁇ Z) ⁇ 2), lithium-nickel-cobalt-based oxide (eg, LiNi 1-Y1 Co Y1 O 2 (0 ⁇ Y1 ⁇ 1), lithium-manganese-cobalt-based oxide (eg, LiCo 1-Y2 Mn Y2) O
- the lithium composite metal oxide is LiCoO 2 , LiMnO 2 , LiNiO 2 , lithium nickel manganese cobalt oxide (eg, Li(Ni 0.6 Mn 0.2 Co 0.2 )O 2 , Li(Ni 0.5) Mn 0.3 Co 0.2 )O 2 , or Li(Ni 0.8 Mn 0.1 Co 0.1 )O 2 , etc.), or lithium nickel cobalt aluminum oxide (eg, Li(Ni 0.8 Co 0.15 Al 0.05 )O 2 ) etc.), etc.
- the lithium composite metal oxide is Li(Ni 0.6 Mn 0.2 Co 0.2 )O 2 , Li (Ni 0.5 Mn 0.3 Co 0.2 )O 2 , Li(Ni 0.7 Mn 0.15 Co 0.15 )O 2 , or Li(Ni 0.8 Mn 0.1 Co 0.1 )O 2
- the lithium composite metal oxide is Li(Ni 0.6 Mn 0.2 Co 0.2 )O 2 , Li (Ni 0.5 Mn
- the positive active material may be included in an amount of 80 wt% to 99 wt%, specifically, 90 wt% to 99 wt%, based on the total weight of the solid content in the cathode slurry. At this time, when the content of the positive active material is 80% by weight or less, the energy density may be lowered, and thus the capacity may be lowered.
- the binder is a component that assists in bonding between the active material and the conductive material and bonding to the current collector, and is typically added in an amount of 1 to 30% by weight based on the total weight of the solid content in the positive electrode slurry.
- binders include polyvinylidene fluoride, polyvinyl alcohol, carboxymethylcellulose (CMC), starch, hydroxypropylcellulose, regenerated cellulose, polyvinylpyrrolidone, tetrafluoroethylene, polyethylene, polypropylene, ethylene-propylene-diene ether monomer, styrene-butadiene rubber, fluororubber, various copolymers, and the like.
- the conductive material is a material that imparts conductivity without causing a chemical change to the battery, and may be added in an amount of 1 to 20% by weight based on the total weight of the solid content in the positive electrode slurry.
- the conductive material include carbon powder such as carbon black, acetylene black, Ketjen black, channel black, furnace black, lamp black, or thermal black; Graphite powder, such as natural graphite, artificial graphite, or graphite with a highly developed crystal structure; conductive fibers such as carbon fibers and metal fibers; conductive powders such as carbon fluoride powder, aluminum powder, and nickel powder; conductive whiskeys such as zinc oxide and potassium titanate; conductive metal oxides such as titanium oxide; A conductive material such as a polyphenylene derivative may be used.
- the solvent may include an organic solvent such as N-methyl-2-pyrrolidone (NMP), and may be used in an amount having a desirable viscosity when the positive active material and optionally a binder and a conductive material are included.
- NMP N-methyl-2-pyrrolidone
- the solid content concentration in the positive electrode slurry including the positive electrode active material and optionally the binder and the conductive material may be 10% to 60% by weight, preferably 20% to 50% by weight.
- the negative electrode may be prepared by coating a negative electrode slurry including a negative electrode active material, a binder, a conductive material, and a solvent on an anode current collector, followed by drying and rolling.
- the negative electrode current collector may generally have a thickness of 3 to 500 ⁇ m.
- Such a negative current collector is not particularly limited as long as it has high conductivity without causing a chemical change in the battery, and for example, copper, stainless steel, aluminum, nickel, titanium, calcined carbon, copper or stainless steel.
- the surface treated with carbon, nickel, titanium, silver, etc., an aluminum-cadmium alloy, etc. may be used.
- the bonding force of the negative electrode active material may be strengthened by forming fine irregularities on the surface, and may be used in various forms such as a film, a sheet, a foil, a net, a porous body, a foam, and a non-woven body.
- the negative active material is lithium metal, a carbon material capable of reversibly intercalating/deintercalating lithium ions, a metal or an alloy of these metals and lithium, a metal composite oxide, and lithium doping and de-doping. It may include at least one selected from the group consisting of materials and transition metal oxides.
- any carbon-based negative active material generally used in lithium ion secondary batteries may be used without particular limitation, and representative examples thereof include crystalline carbon, Amorphous carbon or these may be used together.
- the crystalline carbon include graphite such as amorphous, plate-like, flake, spherical or fibrous natural graphite or artificial graphite, and examples of the amorphous carbon include soft carbon (low-temperature calcined carbon). or hard carbon, mesophase pitch carbide, and calcined coke.
- Examples of the above metals or alloys of these metals and lithium include Cu, Ni, Na, K, Rb, Cs, Fr, Be, Mg, Ca, Sr, Si, Sb, Pb, In, Zn, Ba, Ra, Ge, Al. And a metal selected from the group consisting of Sn or an alloy of these metals and lithium may be used.
- metal composite oxide examples include PbO, PbO 2 , Pb 2 O 3 , Pb 3 O 4 , Sb 2 O 3 , Sb 2 O 4 , Sb 2 O 5 , GeO, GeO 2 , Bi 2 O 3 , Bi 2 O 4 . , Bi 2 O 5 , Li x Fe 2 O 3 (0 ⁇ x ⁇ 1), Li x WO 2 (0 ⁇ x ⁇ 1) and Sn x Me 1-x Me' y O z (Me: Mn, Fe, Pb, Ge; Me': Al, B, P, Si, elements of groups 1, 2, and 3 of the periodic table, halogen; 0 ⁇ x ⁇ 1;1 ⁇ y ⁇ 3; 1 ⁇ z ⁇ 8) One selected from may be used.
- Examples of the material capable of doping and dedoping lithium include Si, SiO x (0 ⁇ x ⁇ 2), Si-Y alloy (wherein Y is an alkali metal, alkaline earth metal, group 13 element, group 14 element, transition metal, An element selected from the group consisting of rare earth elements and combinations thereof, but not Si), Sn, SnO 2 , Sn-Y (wherein Y is an alkali metal, an alkaline earth metal, a group 13 element, a group 14 element, a transition metal, a rare earth) It is an element selected from the group consisting of elements and combinations thereof, and is not Sn) and the like, and at least one of them and SiO 2 may be mixed and used.
- the element Y includes Mg, Ca, Sr, Ba, Ra, Sc, Y, Ti, Zr, Hf, Rf, V, Nb, Ta, Db, Cr, Mo, W, Sg, Tc, Re, Bh, Fe, Pb, Ru, Os, Hs, Rh, Ir, Pd, Pt, Cu, Ag, Au, Zn, Cd, B, Al, Ga, Sn, In, Ge, P, As, Sb, Bi, S, Se, It may be selected from the group consisting of Te, Po, and combinations thereof.
- transition metal oxide examples include lithium-containing titanium composite oxide (LTO), vanadium oxide, and lithium vanadium oxide.
- the negative active material may be included in an amount of 80% to 99% by weight based on the total weight of the solids in the negative electrode slurry.
- the binder is a component that assists in bonding between the conductive material, the active material, and the current collector, and is typically added in an amount of 1 to 30% by weight based on the total weight of the solid content in the negative electrode slurry.
- binders include polyvinylidene fluoride, polyvinyl alcohol, carboxymethylcellulose (CMC), starch, hydroxypropylcellulose, regenerated cellulose, polyvinylpyrrolidone, tetrafluoroethylene, polyethylene, polypropylene, ethylene-propylene-diene monomer, styrene-butadiene rubber, fluororubber, and various copolymers thereof.
- the conductive material is a component for further improving the conductivity of the negative electrode active material, and may be added in an amount of 1 to 20 wt% based on the total weight of the solid content in the negative electrode slurry.
- a conductive material is not particularly limited as long as it has conductivity without causing chemical change in the battery, and for example, carbon black, acetylene black, Ketjen black, channel black, furnace black, lamp black, or thermal black.
- Graphite powder such as natural graphite, artificial graphite, or graphite with a highly developed crystal structure
- conductive fibers such as carbon fibers and metal fibers
- conductive powders such as carbon fluoride powder, aluminum powder, and nickel powder
- conductive whiskers such as zinc oxide and potassium titanate
- conductive metal oxides such as titanium oxide
- a conductive material such as a polyphenylene derivative may be used.
- the solvent may include water or an organic solvent such as NMP or alcohol, and may be used in an amount having a desirable viscosity when the negative electrode active material and, optionally, a binder and a conductive material are included.
- the solid content concentration in the slurry including the negative electrode active material and optionally the binder and the conductive material may be 50 wt% to 75 wt%, preferably 50 wt% to 65 wt%.
- the separator included in the lithium secondary battery of the present invention is a conventional porous polymer film generally used, for example, ethylene homopolymer, propylene homopolymer, ethylene/butene copolymer, ethylene/hexene copolymer, and ethylene/methacrylate.
- a porous polymer film made of a polyolefin-based polymer such as a copolymer may be used alone or by laminating them, or a conventional porous nonwoven fabric, for example, a nonwoven fabric made of high-melting glass fiber, polyethylene terephthalate fiber, etc. may be used.
- the present invention is not limited thereto.
- the external shape of the lithium secondary battery of the present invention is not particularly limited, but may be a cylindrical shape using a can, a prismatic shape, a pouch type, or a coin type.
- EC ethylene carbonate
- EMC ethyl methyl carbonate
- the cathode active material LiNi 0.8 Co 0.1 Mn 0.1 O 2
- the conductive material carbon black and the binder polyvinylidene fluoride (PVDF) were mixed with the solvent N-methyl-2-pyrrolidone in a weight ratio of 97.5:1:1.5. (NMP) to prepare a positive electrode mixture slurry (solid content: 50% by weight).
- NMP solvent N-methyl-2-pyrrolidone
- the positive electrode mixture slurry was applied to a 12 ⁇ m-thick aluminum (Al) thin film, which is a positive electrode current collector, and dried, followed by roll press to prepare a positive electrode.
- binder SBR-CMC
- conductive material carbon black
- An electrode assembly was prepared by sequentially stacking the prepared positive electrode, the polyolefin-based porous separator coated with inorganic particles (Al 2 O 3 ) and the negative electrode.
- the assembled electrode assembly was accommodated in a battery case, and the non-aqueous electrolyte composition was injected to prepare a pouch-type lithium secondary battery.
- EC ethylene carbonate
- EMC ethyl methyl carbonate
- Example 1 The secondary batteries prepared in Example 1 and Comparative Example 1 were each charged to an SOC of 30% at 0.1 C CC-CV and activated, followed by degassing.
- the differential capacity curve obtained by first differentiating the capacitance-voltage curve obtained during activation is shown in FIG. 1 .
- Example 1 in the lithium secondary battery of Example 1 having the non-aqueous electrolyte of the present invention containing additives, a decomposition peak at which electrolyte decomposition occurs initially was confirmed, and after such decomposition, additional It was confirmed that the peak due to decomposition of the electrolyte was significantly reduced. Therefore, it was confirmed that the electrolyte of Example 1 formed a film more effectively in the initial stage than the electrolyte of Comparative Example 1.
- the secondary batteries prepared in Example 1 and Comparative Example 1 were each charged to an SOC of 30% at 0.1 C CC-CV and activated, followed by degassing. Then, using a PNE-0506 charger and discharger (manufacturer: PNE Solution, 5 V, 6 A), the one-time full-discharge capacity is measured, and the initial coulombic efficiency (discharge) through the obtained charge and discharge capacity capacity/fill capacity) was measured.
- Example 2 it was confirmed that the lithium secondary battery of Example 1 having the non-aqueous electrolyte of the present invention containing the additive effectively suppressed the electrolyte decomposition in the initial stage, and thus the initial efficiency was confirmed to be quite high, which is immediately when the battery is manufactured. This means that there is less energy loss.
- the secondary batteries prepared in Example 1 and Comparative Example 1 were each charged to an SOC of 30% at 0.1 C CC-CV and activated, followed by degassing. Then, using a PNE-0506 charger and discharger (manufacturer: PNE Solution, 5 V, 6 A), the one-time full-discharge capacity is measured, and the initial coulombic efficiency (discharge) through the obtained charge and discharge capacity capacity/fill capacity) was measured. Thereafter, three cycles of charging and discharging were performed and the battery was fully charged to measure the degree of self-discharge of the battery.
- PNE-0506 charger and discharger manufactured: PNE Solution, 5 V, 6 A
- Ethylene carbonate (EC): ethyl methyl carbonate (EMC) was mixed in a volume ratio of 30:70 to prepare a non-aqueous organic solvent, and LiPF 6 was dissolved to a concentration of 1.0M.
- the compound represented by Formula 1a was added in an amount of 0.2 wt %, respectively, based on the total weight of the non-aqueous electrolyte.
- VC vinylene carbonate
- PS 1,3-propane sultone
- Esa ethylene sulfate
- LiDFP lithium difluorophosphate
- PRS 1,3-propene sultone
- HS02, CAS 83395-38-4 Propargyl 1H-imidazole-1-carboxylate
- the positive active material Li(Ni 0.6 Mn 0.2 Co 0.2 )O 2
- the conductive material carbon black
- the binder polyvinylidene fluoride
- NMP N-methyl-2-pyrroly
- a positive electrode active material slurry solid content concentration of 50% by weight
- the positive electrode active material slurry was applied to a positive electrode current collector (Al thin film) having a thickness of 100 ⁇ m, dried, and roll press was performed to prepare a positive electrode.
- a negative active material artificial graphite
- binder PVDF
- conductive material carbon black
- the positive electrode and the negative electrode prepared by the above method were sequentially laminated together with a polyethylene porous film to prepare an electrode assembly, then put it in a battery case, inject the non-aqueous electrolyte, and seal the lithium secondary battery (battery capacity 2100 mAh) prepared.
- a lithium secondary battery was prepared in the same manner as in Example 2, except that 0.5 wt% of Chemical Formula 1a was added during the preparation of the non-aqueous electrolyte.
- a lithium secondary battery was manufactured in the same manner as in Example 2, except that Chemical Formula 1a was not added during the preparation of the non-aqueous electrolyte.
- the lithium secondary batteries prepared in Examples 2, 3 and Comparative Example 2 were each formed at a current of 210 mA (0.1 C rate), and then gas in the battery was removed (degas process). Thereafter, it was charged at 25° C. under the condition of 0.33C/4.2V constant current/constant voltage (CC/CV) 4.2V/0.05C, and discharged at 0.33C/2.5V constant current.
- CC/CV constant current/constant voltage
- the discharge capacity measured using a PNE-0506 charger/discharger (manufacturer: PNE Solution, 5V, 6A) after cell assembly and before high-temperature storage was defined as the initial discharge capacity.
- each secondary battery was set to SOC 100% charged state and stored at 60° C. for 12 weeks.
- Capacity retention was measured by substituting the measured initial discharge capacity and the discharge capacity after high-temperature storage into Equation (1) below, and the results are shown in Table 1 below.
- Capacity retention rate (%) (discharge capacity/initial discharge capacity after high-temperature storage) ⁇ 100
- the lithium secondary batteries prepared in Examples 2, 3 and Comparative Example 2 were each formed at a current of 210 mA (0.1 C rate), and then gas in the battery was removed (degas process). After that, the battery was charged and discharged at 0.33C/4.2V constant current-constant voltage 4.2V/0.05C at 25°C to adjust the charge state of the battery by 50% SOC, and then a discharge pulse was given at 2.5C constant current for 30 seconds.
- the voltage drop shown in was measured using a PNE-0506 charger/discharger (manufacturer: PNE Solution, 5V, 6A) to obtain an initial resistance value. Thereafter, the charge state of the battery was adjusted by 100% SOC by charging under the condition of 0.33C/4.2V constant current-constant voltage 4.2V/0.05C in a voltage driving range of 2.5V to 4.2V.
- each secondary battery was left at 60° C. for 12 weeks.
- the resistance increase rate (%) for each secondary battery was calculated from the ratio of the initial resistance to the increased resistance after high-temperature storage, and it is shown in Table 1 below.
- the lithium secondary batteries prepared in Examples 2, 3 and Comparative Example 2 were each formed at a current (0.1 C rate) of 210 mA, and then gas in the battery was removed (degas process). Thereafter, it was charged at 45° C. under the condition of 0.33C/4.2V constant current/constant voltage (CC/CV) 4.2V/0.05C, and discharged at 0.33C/2.5V constant current. At this time, the discharge capacity measured using a PNE-0506 charger/discharger (manufacturer: PNE Solution, 5V, 6A) after cell assembly and before high-temperature storage was defined as the initial discharge capacity.
- PNE-0506 charger/discharger manufactured using a PNE-0506 charger/discharger (manufacturer: PNE Solution, 5V, 6A) after cell assembly and before high-temperature storage was defined as the initial discharge capacity.
- Capacity retention rate (%) (discharge capacity after 200 cycles/initial discharge capacity) ⁇ 100
- the lithium secondary batteries prepared in Examples 2, 3 and Comparative Example 2 were each formed at a current of 210 mA (0.1 C rate), and then gas in the battery was removed (degas process). After that, charge and discharge at 0.33C/4.2V constant current-constant voltage 4.2V/0.05C at 45°C to adjust the charge state of the battery by 50% SOC, and then give a discharge pulse at 2.5C constant current for 30 seconds.
- the voltage drop shown in was measured using a PNE-0506 charger/discharger (manufacturer: PNE Solution, 5V, 6A) to obtain an initial resistance value.
- the measured initial resistance value and the initial resistance value after 200 cycles are substituted into the following equation (4) to calculate the resistance increase rate (%), and this It is shown in Table 1 below.
- Example 2 Formula 1a 0.2 wt% 94.52 3.06 94.29 -4.67
- Example 3 Formula 1a 0.5 wt% 94.97 -5.19 94.34 -6.60 Comparative Example 2 - 94.20 3.37 93.97 1.90
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- Physics & Mathematics (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- General Physics & Mathematics (AREA)
- Inorganic Chemistry (AREA)
- Materials Engineering (AREA)
- Secondary Cells (AREA)
Abstract
본 발명은 루이스 염기 화합물이 첨가된 비수전해액에 대한 것이다. 상기 비수전해액은 리튬염(LiPF 6)의 분해산물로 형성되는 HF와 PF 5를 제거(scavenging) 하여, 고온 저장 시 SEI 막의 부동태 능력을 유지할 수 있다. 또한, 양극의 용출 및 음극의 SEI 막의 파괴에 의한 자가 방전 현상을 개선하여 전지 성능이 향상된 리튬 이차전지를 제조할 수 있다. 이에 더하여 초기 피막을 우수하게 형성함으로써 추가적인 전해질 분해를 억제하여 초기 효율이 개선된 이차 전지를 제공할 수 있다.
Description
본원 출원은 2020년 2월 21일 출원된 한국특허출원 제10-2020-0021885호에 기초한 우선권을 주장한다. 본 발명은 리튬염으로부터 발생된 분해 산물 제거 효과가 우수하면서, 초기 피막 형성 효과가 우수한 비수전해액 첨가제를 포함하는 리튬 이차전지용 비수전해액과 이를 포함함으로써 전지 초기 효율과 자가 방전 특성이 향상된 리튬 이차전지에 관한 것이다.
정보사회의 발달로 인한 개인 IT 디바이스와 전산망이 발달되고 이에 수반하여 전반적인 사회의 전기에너지에 대한 의존도가 높아지면서, 전기 에너지를 효율적으로 저장하고 활용하기 위한 기술 개발이 요구되고 있다.
이를 위해 개발된 기술 중 여러 용도에 가장 적합한 기술이 이차전지 기반 기술이다. 이차전지의 경우 개인 IT 디바이스 등에 적용될 수 있을 정도로 소형화가 가능하며, 전기자동차, 전력 저장 장치 등에 적용될 수도 있기 때문에 이에 대한 관심이 대두되고 있다. 이런 이차전지 기술 중, 이론적으로 에너지 밀도가 가장 높은 전지 시스템인 리튬 이온 전지가 각광을 받고 있으며, 현재 여러 디바이스에 적용되고 있다.
리튬 이온 전지는 리튬 금속을 직접 전극에 적용하는 대신, 리튬을 함유하고 있는 전이금속 산화물로 이루어진 양극과, 리튬을 저장할 수 있는 흑연 등의 탄소계 소재로 이루어진 음극과, 리튬 이온을 전달하는 매개체가 되는 전해액, 및 세퍼레이터로 구성되어 있다.
이중 전해액이 전지의 안정성(stability)과 안전성(safety) 등에 큰 영향을 주는 구성 성분으로 알려지면서, 이에 대해 많은 연구가 진행되고 있다.
리튬 이온 전지용 전해액은 리튬염과 이를 용해시키는 유기용매, 그리고 기능성 첨가제 등으로 구성되는데, 전지의 전기화학적 특성을 개선하기 위해서는 이 구성 요소들의 적합한 선정이 중요하다. 현재 사용되는 대표적인 리튬염으로는 LiPF
6, LiBF
4, LiFSI (lithium fluorosulfonyl imide, LiN(SO
2F)
2), LiTFSI (lithium (bis)trifluoromethanesulfonyl imide, LiN(SO
2CF
3)
2) 또는 LiBOB (lithium bis(oxalate) borate, LiB(C
2O
4)
2) 등이 있으며, 유기용매는 에스터(etser)계 유기용매 또는 에테르(ether)계 유기용매 등이 이용되고 있다.
한편, 리튬 이온 전지는 고온에서의 충방전 혹은 저장 시 저항 증가와 용량 감퇴가 일어나 성능이 열화되는 단점이 있다. 이때, 이러한 문제의 원인 중 하나로 제시되고 있는 것이 고온에서 전해액의 열화로 발생하는 부반응, 그 중에서도 리튬염의 분해로 인한 열화이다. 이러한 염의 부산물이 활성화 후 양극 및 음극의 표면에 형성된 피막을 분해시킬 경우, 피막의 부동태(passivation) 능력을 떨어뜨리는 문제가 존재하며, 이로 인하여 전해액의 추가적인 분해와 이에 수반된 자가 방전을 유발시키는 문제가 있다.
리튬 이온 전지의 전극 소재 중 특히 음극의 경우 흑연계 음극을 사용하는 경우가 대부분인데, 흑연의 경우 작동 전위가 0.3 V (
vs. Li/Li
+) 이하로 리튬 이온 전지에 사용되는 전해액의 전기화학적 안정창(Electrochemical stability window)보다 낮다. 따라서, 현재 사용되는 전해액이 먼저 환원되어 분해된다. 이렇게 환원 분해된 전해액 산물은 리튬 이온은 투과시키지만, 전해액의 추가적인 분해는 억제하는 Solid electrolyte interphase (SEI) 막을 형성하게 된다.
그러나 상기 SEI 막이 추가적인 전해액 분해를 억제시킬 수 있을 정도로 충분한 부동태 능력을 갖추지 못하는 경우, 저장 중에 전해액이 추가적으로 분해되고 충전된 흑연이 자가 방전되면서, 결론적으로 전지의 전위가 저하되는 단점이 있다.
예컨대, 리튬 이온 전지에 널리 사용되는 리튬염인 LiPF
6의 열분해로 생성되는 HF와 PF
5와 같은 산(acid)은 피막 혹은 전극 표면을 열화시킨다. 이로 인해, 전극 표면이 열화되면 양극에서는 전이금속 용출이 발생하여 저항이 증가하고, 레독스 센터(redox center)를 소실하여 용량이 감퇴할 수 있다. 더욱이, 용출된 금속 이온의 경우 음극에 전착되어 금속의 전착과 추가적인 전해질 분해로 인한 전자를 소모시켜 비가역 용량이 증가하여, 셀 용량을 감퇴시킬 뿐만 아니라, 저항 증가 및 흑연 음극의 자가 방전을 유발할 수 있다.
따라서, 최근 고온에서 SEI 막의 손상을 억제하고 부동태 능력을 유지하기 위하여, 전해액 내에 환원 분해가 잘 발생할 수 있는 기능기를 포함하는 전해액 첨가제를 도입하거나, 또는 부동태 능력에 영향을 줄 수 있는 인자, 예를 들면 열 또는 수분 등에 의해 발생하는 리튬염의 분해산물 (HF, PF
5 등)을 제거할 수 있는 방법이 제안되고 있다.
본 발명은 루이스 염기 화합물인 것으로서 산과 빠르게 반응하고 SEI피막 형성 효과 및 비수전해액 내부에서 발생된 분해 산물 제거 효과가 우수한 비수전해액 첨가제 및 이를 포함하는 리튬 이차전지용 비수전해액을 제공하고자 한다.
또한, 상기 비수전해액 첨가제 및 전해액을 포함함으로써, 초기 효율과 자가 방전 특성이 향상된 리튬 이차전지를 제공하고자 한다.
본 발명은 리튬 이차전지용 비수전해액에 대한 것이다.
본 발명의 제1 측면은 상기 비수전해액에 대한 것으로서, 상기 비수전해액은 리튬염, 유기용매 및 첨가제로 하기 [화학식 1]로 표시되는 화합물을 포함한다.
[화학식 1]
상기 [화학식 1]에서, Q는 없거나 치환 또는 비치환된 탄소수 1 내지 10의 알킬기이고, 상기 A1, A2 및 A3는 각각 독립적으로 수소 또는 치환 또는 비치환된 탄소수 1 내지 10의 알킬기이다.
본 발명의 제2 측면은, 상기 제1 측면에 있어서, 상기 Q는 사슬형 또는 분지형의 알킬기, 알케닐기 또는 알키닐기인 것이다.
본 발명의 제3 측면은, 상기 제2 측면에 있어서, 상기 Q는 적어도 하나의 수소가 Cl, F, Br 및 I 중 선택된 할로겐 원소로 치환된 것이다.
본 발명의 제4 측면은, 상기 제1 내지 제3 측면 중 어느 하나에 있어서, 상기 첨가제는 하기 [화학식 1a]로 표시되는 화합물을 포함하는 것이다.
[화학식 1a]
본 발명의 제5 측면은, 상기 제1 내지 제4 측면 중 어느 하나에 있어서, 상기 리튬염은 양이온으로 Li
+를 포함하고, 음이온으로는 F
-, Cl
-, Br
-, I
-, NO
3
-, N(CN)
2
-, BF
4
-, ClO
4
-, AlO
4
-, AlCl
4
-, PF
6
-, SbF
6
-, AsF
6
-, B
10Cl
10
-, BF
2C
2O
4
-, BC
4O
8
-, PF
4C
2O4
-, PF
2C
4O
8
-, (CF
3)
2PF
4
-, (CF
3)
3PF
3
-, (CF
3)
4PF
2
-, (CF
3)
5PF
-, (CF
3)
6P
-, CF
3SO
3
-, C
4F
9SO
3
-, CF
3CF
2SO
3
-, (CF
3SO
2)
2N
-, (FSO
2)
2N
-, CF
3CF
2(CF
3)
2CO
-, (CF
3SO
2)
2CH
-, CH
3SO
3
-, CF
3(CF
2)
7SO
3
-, CF
3CO
2
-, CH
3CO
2
-, PO
2F
2
-,
SCN
- 및 (CF
3CF
2SO
2)
2N
-로 이루어진 군으로부터 선택된 적어도 어느 하나를 포함하는 것이다.
본 발명의 제6 측면은, 상기 제1 내지 제5 측면 중 어느 하나에 있어서, 상기 리튬 이차전지용 비수전해액 100 중량% 대비 상기 첨가제가 0.1 중량% 내지 2 중량%로 포함되는 것이다.
본 발명의 제7측면은, 상기 제1 내지 제6 측면 중 어느 하나에 있어서, 상기 리튬 이차전지용 비수전해액 100 중량% 대비 상기 첨가제가 0.3 중량% 내지 1.5 중량%로 포함되는 것이다.
본 발명의 제8 측면은 리튬 이차 전지에 대한 것으로서, 상기 전지는 양극, 음극, 분리막 및 리튬 이차전지용 비수전해액을 포함하며, 상기 비수전해액은 제1 내지 제7 측면 중 어느 하나에 따른 것이다.
본 발명에 따르면, 비수전해액 제조 시에 루이스 염기 화합물을 전해액 첨가제로 포함함으로써, 비수전해액에 주로 사용되는 리튬염(LiPF
6)의 분해산물로 형성되는 HF와 PF
5를 제거(scavenging) 하여, 고온 저장 시 SEI 막의 부동태 능력을 유지할 수 있다. 또한, 상기 루이스 염기 화합물을 첨가제로 포함하는 비수전해액을 포함함으로써, 양극의 용출 및 음극의 SEI 막의 파괴에 의한 자가 방전 현상을 개선하여 전지 성능이 향상된 리튬 이차전지를 제조할 수 있다. 이에 더하여 초기 피막을 우수하게 형성함으로써 추가적인 전해질 분해를 억제하여 초기 효율이 개선된 이차 전지를 제공할 수 있다.
본 명세서에 첨부되는 다음의 도면은 본 발명의 바람직한 실시예를 예시하는 것이며, 전술한 발명의 내용과 함께 본 발명의 기술 사상을 더욱 이해시키는 역할을 하는 것이므로, 본 발명은 그러한 도면에 기재된 사항에만 한정되어 해석되어서는 아니다.
도 1은 본 발명의 실시예 1 및 비교예 1의 실험예 1에 따른 미분 용량 곡선을 나타낸 그래프이다.
도 2는 본 발명의 실시예 1 및 비교예 1의 실험예 2에 따른 활성화 공정시의 초기 효율을 나타낸 결과이다.
도 3은 본 발명의 실시예 1 및 비교예 1의 실험예 3에 따른 초기 OCV (open-circuit-voltage)의 강하를 나타낸 결과이다.
이하, 본 발명을 더욱 상세하게 설명한다.
본 명세서 및 청구범위에 사용된 용어나 단어는 통상적이거나 사전적인 의미로 한정해서 해석되어서는 아니 되며, 발명자는 그 자신의 발명을 가장 최선의 방법으로 설명하기 위해 용어의 개념을 적절하게 정의할 수 있다는 원칙에 입각하여 본 발명의 기술적 사상에 부합하는 의미와 개념으로 해석되어야만 한다.
리튬 이차전지는 초기 충방전 시에 비수전해액이 분해되면서, 양극 및 음극 표면에 부동태 능력을 가지는 피막이 형성되어 고온 저장 특성을 향상시킨다. 하지만, 피막은 리튬 이온 전지에 널리 사용되는 리튬염인 LiPF
6 등의 음이온 열분해로 생성되는 HF와 PF
5와 같은 산에 의해 열화될 수 있다. 이러한 산의 공격에 의하여 양극에서는 전이금속 원소의 용출이 발생하면서 표면의 구조 변화로 전극 표면의 저항이 증가하고, 레독스 센터인 금속 원소들이 소실되면서 이론 용량이 줄어들어 발현 용량이 감소할 수 있다. 또한, 이렇게 용출된 전이금속 이온의 경우 강한 환원 전위 대역에서 반응하는 음극에 전착되어 전자를 소모할 뿐만 아니라, 전착될 때 SEI 막을 파괴한다. 이에 따라 음극 표면이 노출되면서 음극의 저항이 증가하고, 추가적인 전해질 분해 반응을 야기한다. 그 결과, 비가역 용량이 증가하면서 셀의 용량이 지속적으로 저하되시는 문제가 존재한다.
이에, 본 발명에서는 비수전해액 첨가제로 루이스 염기 화합물을 포함함으로써, 리튬염의 분해로 인하여 야기되는 산을 제거하여, 고온 저장 시 SEI 막의 열화나 양극에서의 전이금속 용출 등을 방지할 수 있으면서, 활물질 표면 피막 형성 능력이 우수한 비수전해액 및 이를 포함하는 리튬 이차전지를 제공하고자 한다.
리튬 이차전지용 비수전해액
구체적으로, 본 발명의 일 실시예에서는 리튬염, 유기용매 및 첨가제로 하기 [화학식 1]로 표시되는 화합물을 포함하는 리튬 이차전지용 비수전해액을 제공한다.
[화학식 1]
상기 [화학식 1]에서, Q는 없거나 치환 또는 비치환된 탄소수 1 내지 10의 알킬기일 수 있다. 본 발명의 일 실시양태에 있어서, 상기 Q는 사슬형 또는 분지형의 알킬기, 알케닐기 또는 알키닐기일 수 있다. 한편, 상기 Q는 적어도 하나의 수소가 Cl, F, Br 및 I 중 선택된 할로겐 원소로 치환될 수 있다. 한편, 본 발명의 일 실시양태에 있어서, A1, A2 및 A3는 각각 독립적으로 수소이거나, 치환 또는 비치환된 탄소수 1 내지 10의 알킬기일 수 있다.
(1) 리튬염
먼저, 본 발명의 일 실시예에 따른 리튬 이차전지용 비수전해액에 있어서, 상기 리튬염은 리튬 이차전지용 전해액 제조시에 통상적으로 사용되는 것들이 제한 없이 사용될 수 있으며, 예를 들어 양이온으로 Li
+를 포함하고, 음이온으로는 F
-, Cl
-, Br
-, I
-, NO
3
-, N(CN)
2
-, BF
4
-, ClO
4
-, AlO
4
-, AlCl
4
-, PF
6
-, SbF
6
-, PO
2F
2
-AsF
6
-, B
10Cl
10
-, BF
2C
2O
4
-, BC
4O
8
-, PF
4C
2O
4
-, PF
2C
4O
8
-, (CF
3)
2PF
4
-, (CF
3)
3PF
3
-, (CF
3)
4PF
2
-, (CF
3)
5PF
-, (CF
3)
6P
-, CF
3SO
3
-, C
4F
9SO
3
-, CF
3CF
2SO
3
-, (CF
3SO
2)
2N
-, (FSO
2)
2N
-, CF
3CF
2(CF
3)
2CO
-, (CF
3SO
2)
2CH
-, CH
3SO
3
-, CF
3(CF
2)
7SO
3
-, CF
3CO
2
-, CH
3CO
2
-, SCN
- 및 (CF
3CF
2SO
2)
2N
-로 이루어진 군으로부터 선택된 적어도 어느 하나를 들 수 있다. 구체적으로, 상기 리튬염은 LiCl, LiBr, LiI, LiBF
4, LiClO
4, LiAlO
4, LiAlCl
4, LiPF
6, LiSbF
6, LiAsF
6, LiPO
2F
2,
LiB
10Cl
10, LiBOB (LiB(C
2O
4)
2), LiCF
3SO
3, LiTFSI (LiN(SO
2CF
3)
2), LiFSI (LiN(SO
2F)
2), LiCH
3SO
3, LiCF
3CO
2, LiCH
3CO
2 및 LiBETI (LiN(SO
2CF
2CF
3)
2로 이루어진 군으로부터 선택된 적어도 어느 하나 이상을 들 수 있다. 구체적으로 리튬염은 LiPO
2F
2,
LiBF
4, LiClO
4, LiPF
6, LiBOB (LiB(C
2O
4)
2), LiCF
3SO
3, LiTFSI (LiN(SO
2CF
3)
2), LiFSI (LiN(SO
2F)
2) 및 LiBETI (LiN(SO
2CF
2CF
3)
2로 이루어진 군으로부터 선택된 단일물 또는 2종 이상의 혼합물을 포함할 수 있다.
상기 리튬염은 통상적으로 사용 가능한 범위 내에서 적절히 변경할 수 있으나, 최적의 전극 표면의 부식 방지용 피막 형성 효과를 얻기 위하여, 전해액 내에 0.8 M 내지 4.0 M의 농도, 구체적으로 1.0M 내지 3.0M 농도로 포함될 수 있다.
상기 리튬염의 농도가 0.8 M 미만이면, 리튬 이차전지의 저온 출력 개선 및 고온 저장 시 사이클 특성 개선의 효과가 미미하고, 4.0 M 농도를 초과하면 비수전해액의 점도가 증가함에 따라 전해액 함침성이 저하될 수 있다.
(2) 유기용매
본 명세서에 따른 리튬 이차전지용 비수전해액에 있어서, 상기 유기용매는 환형 카보네이트계 유기용매, 선형 카보네이트계 유기용매 또는 이들의 혼합 유기용매를 포함할 수 있다.
상기 환형 카보네이트계 유기용매는 고점도의 유기용매로서 유전율이 높아 전해질 내의 리튬염을 잘 해리시킬 수 있는 유기용매로서, 그 구체적인 예로 에틸렌 카보네이트(EC), 프로필렌 카보네이트(PC), 1,2-부틸렌 카보네이트, 2,3-부틸렌 카보네이트, 1,2-펜틸렌 카보네이트, 2,3-펜틸렌 카보네이트 및 비닐렌 카보네이트로 이루어진 군으로부터 선택되는 적어도 하나 이상의 유기용매를 포함할 수 있으며, 이 중에서도 에틸렌 카보네이트를 포함할 수 있다.
또한, 상기 선형 카보네이트계 유기용매는 저점도 및 저유전율을 가지는 유기용매로서, 그 대표적인 예로 디메틸 카보네이트(dimethyl carbonate, DMC), 디에틸 카보네이트(diethyl carbonate, DEC), 디프로필 카보네이트, 에틸메틸 카보네이트(EMC), 메틸프로필 카보네이트 및 에틸프로필 카보네이트로 이루어진 군으로부터 선택되는 적어도 하나 이상의 유기용매를 사용할 수 있으며, 구체적으로 에틸메틸 카보네이트(EMC)를 포함할 수 있다.
또한, 상기 유기용매는 높은 이온 전도율을 갖는 전해액을 제조하기 위하여, 상기 환형 카보네이트계 유기용매 및 선형 카보네이트계 유기용매로 이루어진 군으로부터 선택된 적어도 하나 이상의 카보네이트계 유기용매에 선형 에스테르계 유기용매 및 환형 에스테르계 유기용매로 이루어진 군으로부터 선택된 적어도 하나 이상의 에스테르계 유기용매를 추가로 포함할 수도 있다
이러한 선형 에스테르계 유기용매는 그 구체적인 예로 메틸 아세테이트, 에틸 아세테이트, 프로필 아세테이트, 메틸 프로피오네이트, 에틸 프로피오네이트, 프로필 프로피오네이트 및 부틸 프로피오네이트로 이루어진 군으로부터 선택되는 적어도 하나 이상의 유기용매를 들 수 있다.
또한, 상기 환형 에스테르계 유기용매로는 γ-부티로락톤, γ-발레로락톤, γ-카프로락톤, σ-발레로락톤, ε-카프로락톤과 같은 이루어진 군으로부터 선택되는 적어도 하나 이상의 유기용매를 들 수 있다.
한편, 상기 유기용매는 필요에 따라 리튬 이차전지용 전해액에 통상적으로 사용되는 유기용매를 제한 없이 추가하여 사용할 수 있다. 예를 들면, 에테르계 유기용매, 아미드계 유기용매 및 니트릴계 유기용매 중 적어도 하나 이상의 유기용매를 추가로 포함할 수도 있다.
(3) 첨가제
본 발명의 리튬 이차전지용 비수전해액은 첨가제로 하기 [화학식 1]로 표시되는 화합물을 포함할 수 있다.
[화학식 1]
상기 화학식 1에서, Q는 없거나 치환 또는 비치환된 탄소수 1 내지 10의 알킬기일 수 있다. 본 발명의 일 실시양태에 있어서, 상기 Q는 사슬형 또는 분지형 알킬기, 알케닐기, 알키닐기일 수 있다. 한편, 본 발명의 일 실시양태에 있어서, 상기 Q는 적어도 하나의 수소가 Cl, F, Br 및 I 중 선택된 할로겐 원소로 치환될 수 있다. 한편, 본 발명의 일 실시양태에 있어서, A1, A2 및 A3는 각각 독립적으로 수소이거나, 치환 또는 비치환된 탄소수 1 내지 10의 알킬기일 수 있다.
상기 화학식 1로 표시되는 화합물은 대표적인 예로 하기 화학식 1a로 표시되는 화합물일 수 있다.
[화학식 1a]
본 발명의 일 실시양태에 있어서, 상기 화학식 1로 표시되는 화합물은 비수전해액 전체 중량을 기준으로 0.1 중량% 내지 2 중량%의 범위로 포함할 수 있다. 예를 들어, 상기 범위 내에서 0.1중량% 이상, 0.2 중량% 이상, 0.3중량% 또는 0.5 중량% 이상 포함할 수 있다. 또한, 상기 범위 내에서 1.7 중량% 이하, 1.5 중량% 이하, 또는 1.2 중량% 이하의 범위로 포함될 수 있다. 상기 화학식 1a에서 고리 화합물 중 탄소는 수소(H)가 결합되어 있는 것이며, 이와 같은 수소의 존재는 당업자에게 자명한 것이다.
상기 화학식 1로 표시되는 화합물이 상기 범위로 포함되는 경우, 제반 성능이 더욱 향상된 이차전지를 제조할 수 있다. 예컨대, 상기 화학식 1로 표시되는 화합물 함량이 0.1 중량% 미만이면 HF 혹은 PF
5를 초기에 제거할 수는 있으나, 시간이 지날수록 제거 효과가 미미해질 뿐만 아니라 첨가제에 의한 초기 SEI 형성 효과가 현저히 떨어질 수 있다. 또한, 상기 화학식 1로 표시되는 화합물 함량이 2.0 중량%를 초과하는 경우에는 과량의 첨가제에 의한 부반응 및 부산물이 발생하여 고온 저장 시에 이차전지의 저항이 증가될 수 있다.
따라서, 상기 화학식 1로 표시되는 화합물의 함량이 0.1 중량% 이상 내지 2 중량% 이하, 구체적으로 0.1 중량% 내지 1.7 중량%, 보다 구체적으로 0.3 중량% 내지 1.5 중량%로 포함되는 경우에 첨가제에 의한 부반응, 용량 저하 및 저항 증가 등의 단점을 최대한 억제하면서, 리튬염의 분해산물인 HF와 PF
5 등의 산을 보다 효과적으로 제거할 수 있다.
본 명세서에서 전해액 첨가제로 포함되는 상기 화학식 1로 표시되는 화합물은 이미다졸(imidazole) 작용기를 포함하는 루이스 염기 기반의 화합물이므로, 고온에서 전지의 열화의 원인을 야기하는 부산물, 예컨대 리튬염의 분해로 인하여 발생하는 루이스 산 (예컨대, HF또는 PF
5)을 용이하게 제거(scavenging)할 수 있다. 그 결과, 루이스 산으로부터 기인하는 양극 혹은 음극 표면 피막의 화학 반응으로 인한 열화 거동을 억제할 수 있으므로, 피막의 파괴에 의한 전지의 추가적인 전해액 분해를 막을 수 있고, 나아가 이차전지의 자가 방전을 완화하여 고온 저장 특성을 향상시킬 수 있다. 이에 더하여 상기 화합물은 C=O 작용기가 포함되어, 일반적으로 리튬 이온 전지에 활용되고 있는 용매군에 용해도가 우수하면서도, Li 염과 결합이 용이하게 가능하여 환원 분해시 음극 표면을 보호할 수 있는 Li-유/무기 복합체인 SEI의 형성 능력 또한 우수하다.
(4) 부가적 첨가제
또한, 본 발명의 리튬 이차전지용 비수전해액은 고출력의 환경에서 비수전해액이 분해되어 음극 붕괴가 유발되는 것을 방지하거나, 저온 고율방전 특성, 고온 안정성, 과충전 방지, 고온에서의 전지 팽창 억제 효과 등을 더욱 향상시키기 위하여, 필요에 따라 상기 비수전해액 내에 부가적 첨가제들을 추가로 포함할 수 있다.
이러한 부가적 첨가제는 그 대표적인 예로 환형 카보네이트계 화합물, 할로겐 치환된 카보네이트계 화합물, 설톤계 화합물, 설페이트계 화합물, 포스페이트계 화합물, 보레이트계 화합물, 니트릴계 화합물, 벤젠계 화합물, 아민계 화합물, 실란계 화합물 및 리튬염계 화합물로 이루어진 군으로부터 선택된 적어도 하나 이상의 부가적 첨가제를 포함할 수 있다.
상기 환형 카보네이트계 화합물은 비닐렌카보네이트(VC) 또는 비닐에틸렌 카보네이트를 들 수 있다. 상기 할로겐 치환된 카보네이트계 화합물은 플루오로에틸렌 카보네이트(FEC))를 들 수 있다.
상기 설톤계 화합물은 1,3-프로판 설톤(PS), 1,4-부탄 설톤, 에텐설톤, 1,3-프로펜 설톤(PRS), 1,4-부텐 설톤 및 1-메틸-1,3-프로펜 설톤으로 이루어진 군으로부터 선택된 적어도 하나 이상의 화합물을 들 수 있다.
상기 설페이트계 화합물은 에틸렌 설페이트(Ethylene Sulfate; Esa), 트리메틸렌설페이트 (Trimethylene sulfate; TMS), 또는 메틸트리메틸렌설페이트 (Methyl trimethylene sulfate; MTMS)을 들 수 있다.
상기 포스페이트계 화합물은 리튬 디플루오로(비스옥살라토)포스페이트, 리튬 디플루오로포스페이트(LiPO
2F
2), 테트라메틸 트리메틸 실릴 포스페이트, 트리메틸 실릴 포스파이트, 트리스(2,2,2-트리플루오로에틸)포스페이트 및 트리스(트리플루오로에틸) 포스파이트로 이루어진 군으로부터 선택된 1종 이상의 화합물을 들 수 있다.
상기 보레이트계 화합물은 테트라페닐보레이트, 리튬 옥살릴디플루오로보레이트를 들 수 있다.
상기 니트릴계 화합물은 숙시노니트릴, 아디포니트릴, 아세토니트릴, 프로피오니트릴, 부티로니트릴, 발레로니트릴, 카프릴로니트릴, 헵탄니트릴, 사이클로펜탄 카보니트릴, 사이클로헥산 카보니트릴, 2-플루오로벤조니트릴, 4-플루오로벤조니트릴, 다이플루오로벤조니트릴, 트리플루오로벤조니트릴, 페닐아세토니트릴, 2-플루오로페닐아세토니트릴, 및 4-플루오로페닐아세토니트릴, Propargyl 1H-imidazole-1-carboxylate로 이루어진 군에서 선택되는 적어도 하나 이상의 화합물을 들 수 있다.
상기 벤젠계 화합물은 플루오로벤젠을 들 수 있고, 상기 아민계 화합물은 트리에탄올아민 또는 에틸렌디아민 등을 들 수 있으며, 상기 실란계 화합물로 테트라비닐실란을 들 수 있다.
상기 리튬염계 화합물은 상기 비수전해액에 포함되는 리튬염과 상이한 화합물로서, LiPO
2F
2, LiODFB, LiBOB(리튬 비스옥살레이토보레이트(LiB(C
2O
4)
2) 및 LiBF
4로 이루어진 군으로부터 선택된 1종 이상의 화합물을 들 수 있다.
이러한 부가적 첨가제 중, 비닐렌 카보네이트, 비닐에틸렌 카보네이트 또는 숙시노 니트릴을 포함하는 경우에 이차전지의 초기 활성화 공정시 음극 표면에 보다 견고한 SEI 피막을 형성할 수 있다.
상기 LiBF
4를 포함하는 경우에는 고온 저장시 전해액의 분해로 인하여 생성될 수 있는 가스 발생을 억제하여, 이차전지의 고온 안정성을 향상시킬 수 있다.
한편, 상기 부가적 첨가제들은 2 종 이상이 혼합되어 사용될 수 있으며, 비수전해액 전체 중량을 기준으로 0.01 내지 50 중량%, 구체적으로 0.01 내지 20 중량%로 포함될 수 있다. 상기 부가적 첨가제의 함량이 0.01 중량%보다 적으면 전지의 저온 출력 개선 및 고온 저장 특성 및 고온 수명 특성 개선의 효과가 미미하고, 상기 부가적 첨가제의 함량이 50 중량%를 초과하면 과량의 첨가제에 의해 전지의 충방전시 부반응이 과도하게 발생할 가능성이 있다. 특히, 상기 SEI 막 형성용 첨가제들이 과량으로 첨가될 시에 고온에서 충분히 분해되지 못하여, 상온에서 전해액 내에서 미반응물이 생성되거나, 또는 석출된 채로 존재하고 있을 수 있다. 이에 따라 이차전지의 수명 또는 저항특성이 저하되는 부반응이 발생될 수 있다.
리튬 이차전지
또한, 본 발명의 또 다른 일 실시예에서는 본 발명의 리튬 이차전지용 비수전해액을 포함하는 리튬 이차전지를 제공한다.
한편, 본 발명의 리튬 이차전지는 양극, 음극 및 양극과 음극 사이에 세퍼레이터가 순차적으로 적층되어 있는 전극 조립체를 형성하여 전지 케이스에 수납한 다음, 본 발명의 비수전해액을 투입하여 제조할 수 있다.
이러한 본 발명의 리튬 이차전지를 제조하는 방법은 당 기술 분야에 알려진 통상적인 방법에 따라 제조되어 적용될 수 있으며, 구체적으로 후술하는 바와 같다.
(1) 양극
상기 양극은 양극 집전체 상에 양극활물질, 바인더, 도전재 및 용매 등을 포함하는 양극 슬러리를 코팅한 다음, 건조 및 압연하여 제조할 수 있다.
상기 양극 집전체는 당해 전지에 화학적 변화를 유발하지 않으면서 도전성을 가진 것이라면 특별히 제한되는 것은 아니며, 예를 들어, 스테인리스 스틸, 알루미늄, 니켈, 티탄, 소성 탄소, 또는 알루미늄이나 스테인리스 스틸의 표면에 카본, 니켈, 티탄, 은 등으로 표면 처리한 것 등이 사용될 수 있다.
상기 양극 활물질은 리튬의 가역적인 인터칼레이션 및 디인터칼레이션이 가능한 화합물로서, 구체적으로는 코발트, 망간, 니켈 또는 알루미늄과 같은 1종 이상의 금속과 리튬을 포함하는 리튬 복합금속 산화물을 포함할 수 있다. 보다 구체적으로, 상기 리튬 복합금속 산화물은 리튬-망간계 산화물(예를 들면, LiMnO
2, LiMn
2O
4 등), 리튬-코발트계 산화물(예를 들면, LiCoO
2 등), 리튬-니켈계 산화물(예를 들면, LiNiO
2 등), 리튬-니켈-망간계 산화물(예를 들면, LiNi
1-YMn
YO
2(0<Y<1), LiMn
2-zNi
zO
4(0<Z<2), 리튬-니켈-코발트계 산화물(예를 들면, LiNi
1-Y1Co
Y1O
2(0<Y1<1), 리튬-망간-코발트계 산화물(예를 들면, LiCo
1-Y2Mn
Y2O
2(0<Y2<1), LiMn
2-z1Co
z1O
4(0<Z1<2), 리튬-니켈-망간-코발트계 산화물(예를 들면, Li(Ni
pCo
qMn
r1)O
2(0<p<1, 0<q<1, 0<r1<1, p+q+r1=1) 또는 Li(Ni
p1Co
q1Mn
r2)O
4(0<p1<2, 0<q1<2, 0<r2<2, p1+q1+r2=2), 또는 리튬-니켈-코발트-전이금속(M) 산화물(예를 들면, Li(Ni
p2Co
q2Mn
r3M
S2)O
2(M은 Al, Fe, V, Cr, Ti, Ta, Mg 및 Mo로 이루어지는 군으로부터 선택되고, p2, q2, r3 및 s2는 각각 독립적인 원소들의 원자분율로서, 0<p2<1, 0<q2<1, 0<r3<1, 0<s2<1, p2+q2+r3+s2=1이다) 등을 들 수 있으며, 이들 중 어느 하나 또는 둘 이상의 화합물이 포함될 수 있다. 이 중에서도 전지의 용량 특성 및 안정성을 높일 수 있다는 점에서 상기 리튬 복합금속 산화물은 LiCoO
2, LiMnO
2, LiNiO
2, 리튬 니켈망간코발트 산화물(예를 들면, Li(Ni
0.6Mn
0.2Co
0.2)O
2, Li(Ni
0.5Mn
0.3Co
0.2)O
2, 또는 Li(Ni
0.8Mn
0.1Co
0.1)O
2 등), 또는 리튬 니켈코발트알루미늄 산화물(예를 들면, Li(Ni
0.8Co
0.15Al
0.05)O
2 등) 등일 수 있으며, 리튬 복합금속 산화물을 형성하는 구성원소의 종류 및 함량비 제어에 따른 개선 효과의 현저함을 고려할 때 상기 리튬 복합금속 산화물은 Li(Ni
0.6Mn
0.2Co
0.2)O
2, Li(Ni
0.5Mn
0.3Co
0.2)O
2, Li(Ni
0.7Mn
0.15Co
0.15)O
2 또는 Li(Ni
0.8Mn
0.1Co
0.1)O
2 등일 수 있으며, 이들 중 어느 하나 또는 둘 이상의 혼합물이 사용될 수 있다.
상기 양극 활물질은 양극 슬러리 중 고형분의 전체 중량을 기준으로 80 중량% 내지 99 중량%, 구체적으로 90 중량% 내지 99 중량%로 포함될 수 있다. 이때, 상기 양극 활물질의 함량이 80 중량% 이하인 경우 에너지 밀도가 낮아져 용량이 저하될 수 있다.
상기 바인더는 활물질과 도전재 등의 결합과 집전체에 대한 결합에 조력하는 성분으로서, 통상적으로 양극 슬러리 중 고형분의 전체 중량을 기준으로 1 내지 30 중량%로 첨가된다. 이러한 바인더의 예로는, 폴리비닐리덴플루오라이드, 폴리비닐알코올, 카르복시메틸셀룰로우즈(CMC), 전분, 히드록시프로필셀룰로우즈, 재생 셀룰로우즈, 폴리비닐피롤리돈, 테트라플루오로에틸렌, 폴리에틸렌, 폴리프로필렌, 에틸렌-프로필렌-디엔 테르 모노머, 스티렌-부타디엔 고무, 불소 고무, 다양한 공중합체 등을 들 수 있다.
또한, 상기 도전재는 당해 전지에 화학적 변화를 유발하지 않으면서 도전성을 부여하는 물질로서, 양극 슬러리 중 고형분의 전체 중량을 기준으로 1 내지 20 중량%로 첨가될 수 있다.
이러한 도전재는 그 대표적인 예로 카본블랙, 아세틸렌 블랙, 케첸 블랙, 채널 블랙, 퍼니스 블랙, 램프 블랙, 또는 서멀 블랙 등의 탄소 분말; 결정구조가 매우 발달된 천연 흑연, 인조흑연, 또는 그라파이트 등의 흑연 분말; 탄소 섬유나 금속 섬유 등의 도전성 섬유; 불화 카본 분말, 알루미늄 분말, 니켈 분말 등의 도전성 분말; 산화아연, 티탄산 칼륨 등의 도전성 위스키; 산화티탄 등의 도전성 금속 산화물; 폴리페닐렌 유도체 등의 도전성 소재 등이 사용될 수 있다.
또한, 상기 용매는 NMP(N-methyl-2-pyrrolidone) 등의 유기용매를 포함할 수 있으며, 상기 양극 활물질 및 선택적으로 바인더 및 도전재 등을 포함할 때 바람직한 점도가 되는 양으로 사용될 수 있다. 예를 들면, 양극 활물질 및 선택적으로 바인더 및 도전재를 포함하는 양극 슬러리 중의 고형분 농도가 10 중량% 내지 60 중량%, 바람직하게 20 중량% 내지 50 중량%가 되도록 포함될 수 있다.
(2) 음극
상기 음극은 음극 집전체 상에 음극활물질, 바인더, 도전재 및 용매 등을 포함하는 음극 슬러리를 코팅한 다음, 건조 및 압연하여 제조할 수 있다.
상기 음극 집전체는 일반적으로 3 내지 500㎛의 두께를 가질 수 있다. 이러한 음극 집전체는, 당해 전지에 화학적 변화를 유발하지 않으면서 높은 도전성을 가지는 것이라면 특별히 제한되는 것은 아니며, 예를 들어, 구리, 스테인리스 스틸, 알루미늄, 니켈, 티탄, 소성 탄소, 구리나 스테인리스 스틸의 표면에 카본, 니켈, 티탄, 은 등으로 표면 처리한 것, 알루미늄-카드뮴 합금 등이 사용될 수 있다. 또한, 양극 집전체와 마찬가지로, 표면에 미세한 요철을 형성하여 음극 활물질의 결합력을 강화시킬 수도 있으며, 필름, 시트, 호일, 네트, 다공질체, 발포체, 부직포체 등 다양한 형태로 사용될 수 있다.
또한, 상기 음극활물질은 리튬 금속, 리튬 이온을 가역적으로 인터칼레이션/디인터칼레이션할 수 있는 탄소 물질, 금속 또는 이들 금속과 리튬의 합금, 금속 복합 산화물, 리튬을 도프 및 탈도프할 수 있는 물질 및 전이 금속 산화물로 이루어진 군으로부터 선택된 적어도 하나 이상을 포함할 수 있다.
상기 리튬 이온을 가역적으로 인터칼레이션/디인터칼레이션할 수 있는 탄소 물질로는, 리튬 이온 이차전지에서 일반적으로 사용되는 탄소계 음극 활물질이라면 특별히 제한 없이 사용할 수 있으며, 그 대표적인 예로는 결정질 탄소, 비정질 탄소 또는 이들을 함께 사용할 수 있다. 상기 결정질 탄소의 예로는 무정형, 판상, 인편상(flake), 구형 또는 섬유형의 천연 흑연 또는 인조 흑연과 같은 흑연을 들 수 있고, 상기 비정질 탄소의 예로는 소프트 카본(soft carbon: 저온 소성 탄소) 또는 하드 카본(hard carbon), 메조페이스 피치 탄화물, 소성된 코크스 등을 들 수 있다.
상기 금속 또는 이들 금속과 리튬의 합금으로는 Cu, Ni, Na, K, Rb, Cs, Fr, Be, Mg, Ca, Sr, Si, Sb, Pb, In, Zn, Ba, Ra, Ge, Al 및 Sn으로 이루어진 군에서 선택되는 금속 또는 이들 금속과 리튬의 합금이 사용될 수 있다.
상기 금속 복합 산화물로는 PbO, PbO
2, Pb
2O
3, Pb
3O
4, Sb
2O
3, Sb
2O
4, Sb
2O
5, GeO, GeO
2, Bi
2O
3, Bi
2O
4, Bi
2O
5, Li
xFe
2O
3(0≤x≤1), Li
xWO
2(0≤x≤1) 및 Sn
xMe
1-xMe'
yO
z (Me: Mn, Fe, Pb, Ge; Me': Al, B, P, Si, 주기율표의 1족, 2족, 3족 원소, 할로겐; 0<x≤1; 1≤y≤3; 1≤z≤8) 로 이루어진 군에서 선택되는 것이 사용될 수 있다.
상기 리튬을 도프 및 탈도프할 수 있는 물질로는 Si, SiO
x(0<x≤2), Si-Y 합금(상기 Y는 알칼리 금속, 알칼리 토금속, 13족 원소, 14족 원소, 전이금속, 희토류 원소 및 이들의 조합으로 이루어진 군에서 선택되는 원소이며, Si은 아님), Sn, SnO
2, Sn-Y(상기 Y는 알칼리 금속, 알칼리 토금속, 13족 원소, 14족 원소, 전이금속, 희토류 원소 및 이들의 조합으로 이루어진 군에서 선택되는 원소이며, Sn은 아님) 등을 들 수 있고, 또한 이들 중 적어도 하나와 SiO
2를 혼합하여 사용할 수도 있다. 상기 원소 Y로는 Mg, Ca, Sr, Ba, Ra, Sc, Y, Ti, Zr, Hf, Rf, V, Nb, Ta, Db, Cr, Mo, W, Sg, Tc, Re, Bh, Fe, Pb, Ru, Os, Hs, Rh, Ir, Pd, Pt, Cu, Ag, Au, Zn, Cd, B, Al, Ga, Sn, In, Ge, P, As, Sb, Bi, S, Se, Te, Po 및 이들의 조합으로 이루어진 군에서 선택될 수 있다.
상기 전이 금속 산화물로는 리튬 함유 티타늄 복합 산화물(LTO), 바나듐 산화물, 리튬 바나듐 산화물 등을 들 수 있다.
상기 음극 활물질은 음극 슬러리 중 고형분의 전체 중량을 기준으로 80 중량% 내지 99중량%로 포함될 수 있다.
상기 바인더는 도전재, 활물질 및 집전체 간의 결합에 조력하는 성분으로서, 통상적으로 음극 슬러리 중 고형분의 전체 중량을 기준으로 1 내지 30 중량%로 첨가된다. 이러한 바인더의 예로는, 폴리비닐리덴플루오라이드, 폴리비닐알코올, 카르복시메틸셀룰로우즈(CMC), 전분, 히드록시프로필셀룰로우즈, 재생 셀룰로우즈, 폴리비닐피롤리돈, 테트라플루오로에틸렌, 폴리에틸렌, 폴리프로필렌, 에틸렌-프로필렌-디엔 모노머, 스티렌-부타디엔 고무, 불소 고무, 이들의 다양한 공중합체 등을 들 수 있다.
상기 도전재는 음극 활물질의 도전성을 더욱 향상시키기 위한 성분으로서, 음극 슬러리 중 고형분의 전체 중량을 기준으로 1 내지 20 중량%로 첨가될 수 있다. 이러한 도전재는 당해 전지에 화학적 변화를 유발하지 않으면서 도전성을 가진 것이라면 특별히 제한되는 것은 아니며, 예를 들어, 카본블랙, 아세틸렌 블랙, 케첸 블랙, 채널 블랙, 퍼니스 블랙, 램프 블랙, 또는 서멀 블랙 등의 탄소 분말; 결정구조가 매우 발달된 천연 흑연, 인조흑연, 또는 그라파이트 등의 흑연 분말; 탄소 섬유나 금속 섬유 등의 도전성 섬유; 불화 카본 분말, 알루미늄 분말, 니켈 분말 등의 도전성 분말; 산화아연, 티탄산 칼륨 등의 도전성 위스커; 산화티탄 등의 도전성 금속 산화물; 폴리페닐렌 유도체 등의 도전성 소재 등이 사용될 수 있다.
상기 용매는 물 또는 NMP, 알코올 등의 유기용매를 포함할 수 있으며, 상기 음극 활물질 및 선택적으로 바인더 및 도전재 등을 포함할 때 바람직한 점도가 되는 양으로 사용될 수 있다. 예를 들면, 음극 활물질 및 선택적으로 바인더 및 도전재를 포함하는 슬러리 중의 고형분 농도가 50 중량% 내지 75 중량%, 바람직하게 50 중량% 내지 65 중량%가 되도록 포함될 수 있다.
(3) 세퍼레이터
본 발명의 리튬 이차전지에 포함되는 상기 세퍼레이터는 일반적으로 사용되는 통상적인 다공성 고분자 필름, 예를 들어 에틸렌 단독중합체, 프로필렌 단독중합체, 에틸렌/부텐 공중합체, 에틸렌/헥센 공중합체 및 에틸렌/메타크릴레이트 공중합체 등과 같은 폴리올레핀계 고분자로 제조한 다공성 고분자 필름을 단독으로 또는 이들을 적층하여 사용할 수 있으며, 또는 통상적인 다공성 부직포, 예를 들어 고융점의 유리 섬유, 폴리에틸렌테레프탈레이트 섬유 등으로 된 부직포를 사용할 수 있으나, 이에 한정되는 것은 아니다.
본 발명의 리튬 이차전지의 외형은 특별한 제한이 없으나, 캔을 사용한 원통형, 각형, 파우치(pouch)형 또는 코인(coin)형 등이 될 수 있다.
이하, 본 발명을 구체적으로 설명하기 위해 실시예를 들어 상세하게 설명하기로 한다. 그러나 본 발명에 따른 실시예는 여러 가지 다른 형태로 변형될 수 있으며, 본 발명의 범위가 아래에서 상술하는 실시예에 한정되는 것으로 해석되어서는 안 된다. 본 발명의 실시예는 당업계에서 평균적인 지식을 가진 자에게 본 발명을 보다 완전하게 설명하기 위해서 제공되는 것이다.
실시예 1
1. 비수 전해액 제조
1.0 M LiPF
6가 용해된 유기용매 (에틸렌 카보네이트(EC): 에틸 메틸 카보네이트(EMC)=3:7 부피비) 98.5g에 상기 화학식 1a로 표시되는 화합물 0.5g 및 에틸렌설페이트 1.0g을 첨가하여 본 발명의 비수전해액을 제조하였다.
2. 전극 조립체의 제조
양극 활물질(LiNi
0.8Co
0.1Mn
0.1O
2)과 도전재 카본 블랙(carbon black) 및 바인더 폴리비닐리덴플루오라이드(PVDF)를 97.5:1:1.5 중량비로 용매인 N-메틸-2-피롤리돈(NMP)에 첨가하여 양극 혼합물 슬러리(고형분 함량: 50 중량%)를 제조하였다. 상기 양극 혼합물 슬러리를 12㎛ 두께의 양극 집전체인 알루미늄(Al) 박막에 도포 및 건조한 후, 롤 프레스(roll press)를 실시하여 양극을 제조하였다.
음극 활물질 (SiO:그라파이트=5.5:94.5 중량비), 바인더인 SBR-CMC, 도전재인 카본 블랙(carbon black)을 95:3.5:1.5 중량비로 용매인 물에 첨가하여 음극 혼합물 슬러리(고형분 함량: 60 중량%)를 제조하였다. 상기 음극 혼합물 슬러리를 6㎛ 두께의 음극 집전체인 구리(Cu) 박막에 도포 및 건조한 후, 롤 프레스(roll press)를 실시하여 음극을 제조하였다.
상기 제조된 양극, 무기물 입자(Al
2O
3)가 도포된 폴리올레핀계 다공성 분리막 및 음극을 순차적으로 적층하여 전극조립체를 제조하였다.
3. 이차 전지 제조
전지 케이스 내에 상기 조립된 전극 조립체를 수납하고, 상기 비수 전해액용 조성물을 주액하여 파우치형 리튬 이차 전지를 제조하였다.
비교예 1
1.0 M LiPF6가 용해된 유기용매 (에틸렌 카보네이트(EC): 에틸 메틸 카보네이트(EMC)=3:7 부피비) 99.0 g에 에틸렌 설페이트 1.0 g을 첨가하여 비수전해액을 제조하였다. 여기에서 제조된 비수 전해액을 사용한 것을 제외하고는 실시예 1과 동일한 방법으로 전지를 제조하였다.
실험예
실험예 1 미분 용량 곡선 평가
상기 실시예 1과 비교예 1에서 제조된 이차전지를 각각 0.1 C CC-CV로 SOC 30%까지 충전하여 활성화한 후, 디가스를 진행하였다. 활성화시 얻어진 용량-전압 곡선을 1차 미분하여 얻어진 미분 용량 곡선을 도 1에 나타내었다.
도 1을 살펴보면, 첨가제가 포함된 본 발명의 비수전해액을 구비한 실시예 1의 리튬 이차전지는 초기에 전해액 분해가 일어나는 분해 피크(peak)가 확인되었고, 이러한 분해 이후에 더 높은 전압에서의 추가적인 전해액 분해에 의한 피크(peak)가 상당히 감소한 것을 확인할 수 있었다. 따라서, 실시예 1의 전해액이 비교예 1의 전해액에 비하여 초기에 더 효과적으로 피막을 형성한 것을 확인할 수 있었다.
실험예 2 초기 쿨롱 효율 평가
상기 실시예 1과 비교예 1에서 제조된 이차전지를 각각 0.1 C CC-CV로 SOC 30%까지 충전하여 활성화한 후, 디가스를 진행하였다. 이어서, PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5 V, 6 A)를 사용하여 1회 만충-만방전 용량을 측정하고, 이렇게 얻어진 충전 용량과 방전 용량을 통하여 초기 쿨롱 효율 (방전 용량 / 충전 용량)을 측정하였다.
도 2를 살펴보면, 첨가제가 포함된 본 발명의 비수전해액을 구비한 실시예 1의 리튬 이차전지는 초기에 전해질 분해를 효과적으로 억제하였기에, 초기 효율이 상당히 높게 확인됨을 확인할 수 있었고, 이는 곧 전지 제조시에 발생하는 에너지 손실이 적음을 의미한다.
실험예 3 OCV drop 평가
상기 실시예 1과 비교예 1에서 제조된 이차전지를 각각 0.1 C CC-CV로 SOC 30%까지 충전하여 활성화한 후, 디가스를 진행하였다. 이어서, PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5 V, 6 A)를 사용하여 1회 만충-만방전 용량을 측정하고, 이렇게 얻어진 충전 용량과 방전 용량을 통하여 초기 쿨롱 효율 (방전 용량 / 충전 용량)을 측정하였다. 이후, 3 사이클 충방전을 진행하고 만충전하여 전지의 자가방전 정도를 측정하였다.
도 3을 살펴보면, 첨가제가 포함된 본 발명의 비수전해액을 구비한 실시예 1의 리튬 이차전지는 초기에 피막을 비교예 1의 이차전지에 비하여 더 효과적으로 형성하였기에, 활물질의 자가 방전에 의한 OCV 강하가 상당히 억제된 것을 확인할 수 있다.
실시예 2
1. 비수전해액 제조
에틸렌 카보네이트(EC):에틸메틸카보네이트(EMC)를 30:70 부피비로 혼합하여 비수성 유기 용매를 제조하고, LiPF
6를 농도가 1.0M이 되도록 용해시켰다. 여기에 상기 화학식 1a로 표시되는 화합물을 비수전해액 총 중량을 기준으로 각각 0.2중량%가 되도록 첨가하였다.
상기 첨가제 외에 비닐렌 카보네이트(VC) 0.5중량%, 1,3-프로판 설톤(PS) 0.5중량%, 에틸렌 설페이트(Esa) 1중량%, 리튬 디플루오로포스페이트(LiDFP, LiPO
2F
2) 2중량%, 1,3-프로펜 설톤(PRS) 0.2중량%, Propargyl 1H-imidazole-1-carboxylate(HS02, CAS 83395-38-4) 0.1중량%를 첨가하여 비수전해액을 제조하였다.
2. 전극 제조
양극 활물질(Li(Ni
0.6Mn
0.2Co
0.2)O
2), 도전재(카본 블랙) 및 바인더(폴리비닐리덴플루오라이드)를 90:5:5 중량 비율로 용제인 N-메틸-2-피롤리돈(NMP)에 첨가하여 양극 활물질 슬러리 (고형분 농도 50 중량%)를 제조하였다. 상기 양극 활물질 슬러리를 두께가 100㎛인 양극 집전체 (Al 박막)에 도포하고, 건조하고 롤 프레스(roll press)를 실시하여 양극을 제조하였다.
음극 활물질(인조 흑연), 바인더(PVDF), 도전재(카본 블랙)를 95:2:3 중량 비율로 용제인 NMP에 첨가하여 음극 활물질 슬러리(고형분 농도 60 중량%)를 제조하였다. 상기 음극 활물질 슬러리를 두께가 90㎛인 음극 집전체 (Cu 박막)에 도포하고, 건조하고 롤 프레스(roll press)를 실시하여 음극을 제조하였다.
3. 이차전지 제조
전술한 방법으로 제조한 양극과 음극을 폴리에틸렌 다공성 필름과 함께 순차적으로 적층하여 전극조립체를 제조한 다음, 이를 전지 케이스에 넣고 상기 비수전해액을 주액하고, 밀봉하여 리튬 이차전지(전지용량 2100 mAh)를 제조하였다.
실시예 3
비수 전해액 제조 시 화학식 1a를 0.5중량% 첨가하는 것을 제외하고는, 상기 실시예 2와 동일한 방법으로 리튬 이차 전지를 제조하였다.
비교예 2
비수 전해액 제조 시 화학식 1a를 첨가하지 않은 것을 제외하고는, 상기 실시예 2와 동일한 방법으로 리튬 이차 전지를 제조하였다.
실험예 4 고온(60℃) 저장 후 용량 유지율 평가
실시예 2, 실시예 3 및 비교예 2에서 제조된 리튬 이차전지를 각각 210 mA 전류(0.1 C rate)로 포메이션(formation)을 진행한 뒤, 전지 내 가스를 제거하였다(degas 공정). 이후 25℃에서 0.33C/4.2V 정전류/정전압(CC/CV) 4.2V/0.05C 조건으로 충전하고, 0.33C/2.5V 정전류로 방전하였다. 이때, 셀 조립 후 및 고온 저장 전에 PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5V, 6A)를 사용하여 측정된 방전 용량을 초기 방전용량으로 정의하였다.
이어서, 각각의 이차전지를 SOC 100% 충전 상태로 설정한 후 60℃에 12주 저장하였다.
그 다음, 25℃에서 0.33C/4.2V 정전류/정전압(CC/CV) 4.2V /0.05C 조건으로 충전하고 0.33C/2.5V 정전류로 방전하고, PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5V, 6A)를 사용하여 방전 용량을 측정하였다. 이때, 측정된 용량을 고온 저장 후 방전용량으로 정의하였다.
측정된 초기 방전 용량 및 고온 저장 후 방전 용량을 하기 식 (1)에 대입하여 용량 유지율(capacity retention)을 측정하고, 그 결과를 하기 표 1에 기재하였다.
식 (1): 용량 유지율(%) = (고온 저장 후 방전 용량/초기 방전 용량)Х100
실험예 5
고온(60℃) 저장 후 저항 증가율 평가
실시예 2, 실시예 3 및 비교예 2에서 제조된 리튬 이차전지를 각각 210 mA 전류(0.1 C rate)로 포메이션(formation)을 진행한 뒤, 전지 내 가스를 제거하였다(degas 공정). 이후 25℃에서 0.33C/4.2 V 정전류-정전압 4.2 V/0.05C 조건으로 충전 및 0.33C 방전하여 SOC 50%만큼 전지의 충전 상태를 맞춘 후 2.5C 정전류로 30초간 방전 펄스(pulse)를 준 상태에서 나타나는 전압 강하를 PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5V, 6A)를 사용하여 측정하여 초기 저항값을 얻었다. 이후 2.5V 내지 4.2V 전압 구동 범위에서 0.33C/4.2V 정전류-정전압 4.2 V/0.05C 조건으로 충전하여 SOC 100%만큼 전지의 충전 상태를 맞추었다.
그 다음, 각각의 이차전지를 60℃에서 12주간 방치하였다.
이어서, PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5V, 6A)를 사용하여 0.33C/4.2 V 정전류-정전압 4.2 V/0.05C 조건으로 충전 및 0.33C 방전으로 SOC 50%만큼 전지의 충전 상태를 맞춘 후 2.5C 정전류로 30초간 방전 펄스(pulse)를 준 상태에서 나타나는 전압 강하를 측정하여 고온 저장 후 저항값을 얻었다.
하기 식 (2)를 이용하여 초기 저항 대비 고온 저장 후 증가한 저항의 비율로부터 각각의 이차전지에 대한 저항 증가율(%)을 산출하고, 이를 하기 표 1에 나타내었다.
식 (2): 저항 증가율(%)={(고온 저장 후 저항-초기 저항)/초기저항}Х100
실험예 6
고온(45℃) 충방전 후 용량 유지율 평가
실시예 2, 실시예 3 및 비교예 2에서 제조된 리튬 이차전지를 각각 210 mA 전류(0.1 C rate)로 포메이션(formation)을 진행한 뒤, 전지 내 가스를 제거하였다(degas 공정). 이후 45℃에서 0.33C/4.2V 정전류/정전압(CC/CV) 4.2V/0.05C 조건으로 충전하고, 0.33C/2.5V 정전류로 방전하였다. 이때, 셀 조립 후 및 고온 저장 전에 PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5V, 6A)를 사용하여 측정된 방전 용량을 초기 방전용량으로 정의하였다.
상기 충방전 과정을 1사이클로 하여 총 200사이클의 충방전을 수행한 후, 측정된 초기 방전 용량 및 200사이클 후 방전 용량을 하기 식 (3)에 대입하여 용량 유지율(capacity retention)을 측정하고, 그 결과를 하기 표 1에 기재하였다.
식 (3): 용량 유지율(%)=(200사이클 후 방전 용량/초기 방전 용량)Х100
실험예 7
고온(45℃) 충방전 후 저항 증가율 평가
실시예 2, 실시예 3 및 비교예 2에서 제조된 리튬 이차전지를 각각 210 mA 전류(0.1 C rate)로 포메이션(formation)을 진행한 뒤, 전지 내 가스를 제거하였다(degas 공정). 이후 45℃에서 0.33C/4.2 V 정전류-정전압 4.2V /0.05C 조건으로 충전 및 0.33C 방전하여 SOC 50%만큼 전지의 충전 상태를 맞춘 후 2.5C 정전류로 30초간 방전 펄스(pulse)를 준 상태에서 나타나는 전압 강하를 PNE-0506 충방전기(제조사: (주)PNE 솔루션, 5V, 6A)를 사용하여 측정하여 초기 저항값을 얻었다.
상기 충방전 과정을 1사이클로 하여 총 200사이클의 충방전을 수행한 후, 측정된 초기 저항값 및 200사이클 후 초기 저항값을 하기 식 (4)에 대입하여 저항 증가율(%)을 산출하고, 이를 하기 표 1에 나타내었다.
식 (4): 저항 증가율(%)={(200사이클 후 저항-초기 저항)/초기저항}Х100
| 항목 | 고온 저장 후 | 200사이클 충방전 후 | |||
| No. | 첨가제
유무 및 함량 |
용량 유지율(%) | 저항 증가율(%) | 용량 유지율(%) | 저항 증가율(%) |
| 실시예 2 | 화학식1a 0.2중량% | 94.52 | 3.06 | 94.29 | -4.67 |
| 실시예 3 | 화학식1a 0.5중량% | 94.97 | -5.19 | 94.34 | -6.60 |
| 비교예 2 | - | 94.20 | 3.37 | 93.97 | 1.90 |
상기 [표 1]에서 확인할 수 있는 바와 같이 실시예의 전지에서 저장특성 및 수명 특성이 비교예의 전지에 대해서 우수한 것으로 확인되었다. 이로부터 초기 SEI 피막이 잘 형성되고 피막 열화가 억제되는 경우 전지의 저장 및 사이클 성능이 개선되는 것을 알 수 있다.
Claims (8)
- 제1항에 있어서,상기 Q는 사슬형 또는 분지형의 알킬기, 알케닐기 또는 알키닐기인 것인 리튬 이차전지용 비수전해액.
- 제2항에 있어서,상기 Q는 적어도 하나의 수소가 Cl, F, Br 및 I 중 선택된 할로겐 원소로 치환된 것인 리튬 이차전지용 비수전해액.
- 청구항 1에 있어서,상기 리튬염은 양이온으로 Li +를 포함하고, 음이온으로는 F -, Cl -, Br -, I -, NO 3 -, N(CN) 2 -, BF 4 -, ClO 4 -, AlO 4 -, AlCl 4 -, PF 6 -, SbF 6 -, AsF 6 -, B 10Cl 10 -, BF 2C 2O 4 -, BC 4O 8 -, PF 4C 2O4 -, PF 2C 4O 8 -, (CF 3) 2PF 4 -, (CF 3) 3PF 3 -, (CF 3) 4PF 2 -, (CF 3) 5PF -, (CF 3) 6P -, CF 3SO 3 -, C 4F 9SO 3 -, CF 3CF 2SO 3 -, (CF 3SO 2) 2N -, (FSO 2) 2N -, CF 3CF 2(CF 3) 2CO -, (CF 3SO 2) 2CH -, CH 3SO 3 -, CF 3(CF 2) 7SO 3 -, CF 3CO 2 -, CH 3CO 2 -, PO 2F 2 -, SCN - 및 (CF 3CF 2SO 2) 2N -로 이루어진 군으로부터 선택된 적어도 어느 하나를 포함하 는 것인 리튬 이차전지용 비수전해액.
- 제1항에 있어서,상기 리튬 이차전지용 비수전해액 100 중량% 대비 상기 첨가제가 0.1 중량% 내지 2 중량%로 포함되는 것인 리튬 이차전지용 비수전해액.
- 제1항에 있어서,상기 리튬 이차전지용 비수전해액 100 중량% 대비 상기 첨가제가 0.3 중량% 내지 1.5 중량%로 포함되는 것인 리튬 이차전지용 비수전해액.
- 양극, 음극, 분리막 및 제1항에 따른 리튬 이차전지용 비수전해액을 포함하는 리튬 이차 전지.
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP21757497.9A EP4060781A4 (en) | 2020-02-21 | 2021-02-22 | NON-AQUEOUS ELECTROLYTE SOLUTION FOR A LITHIUM SECONDARY BATTERY AND LITHIUM SECONDARY BATTERY THEREOF |
| JP2022519030A JP7378601B2 (ja) | 2020-02-21 | 2021-02-22 | リチウム二次電池用非水電解液及びそれを含むリチウム二次電池 |
| CN202180006190.6A CN114641883B (zh) | 2020-02-21 | 2021-02-22 | 锂二次电池用非水性电解液和包含它的锂二次电池 |
| US17/787,727 US20230095613A1 (en) | 2020-02-21 | 2021-02-22 | Non-Aqueous Electrolyte Solution for Lithium Secondary Battery and Lithium Secondary Battery Comprising Same |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR20200021885 | 2020-02-21 | ||
| KR10-2020-0021885 | 2020-02-21 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2021167428A1 true WO2021167428A1 (ko) | 2021-08-26 |
Family
ID=77392050
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/KR2021/002207 WO2021167428A1 (ko) | 2020-02-21 | 2021-02-22 | 리튬 이차 전지용 비수 전해액 및 이를 포함하는 리튬 이차전지 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20230095613A1 (ko) |
| EP (1) | EP4060781A4 (ko) |
| JP (1) | JP7378601B2 (ko) |
| KR (1) | KR20210106923A (ko) |
| CN (1) | CN114641883B (ko) |
| WO (1) | WO2021167428A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113948774A (zh) * | 2021-10-18 | 2022-01-18 | 九江天赐高新材料有限公司 | 一种功率型锂二次电池电解液及电池 |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115911544B (zh) * | 2021-08-16 | 2024-03-01 | 张家港市国泰华荣化工新材料有限公司 | 一种非水电解液及锂电池 |
| WO2024065582A1 (zh) * | 2022-09-30 | 2024-04-04 | 宁德新能源科技有限公司 | 电化学装置及电子装置 |
| WO2024167007A1 (ja) * | 2023-02-09 | 2024-08-15 | 三井化学株式会社 | 電池用非水電解液、リチウム二次電池前駆体、リチウム二次電池、及び、リチウム二次電池の製造方法 |
| CN117039151A (zh) * | 2023-08-15 | 2023-11-10 | 张家港市国泰华荣化工新材料有限公司 | 一种锂离子电池电解液及含有其的锂离子电池 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007126262A1 (en) * | 2006-04-27 | 2007-11-08 | Kyungwon Enterprise Co., Ltd. | Anion receptor, and electrolyte using the same |
| JP2014127354A (ja) * | 2012-12-26 | 2014-07-07 | Fujifilm Corp | 非水二次電池用電解液および非水二次電池、電解液用添加剤 |
| US9166249B2 (en) * | 2010-12-22 | 2015-10-20 | California Institute Of Technology | Fluoride ion battery compositions |
| KR20190008100A (ko) * | 2017-07-14 | 2019-01-23 | 주식회사 엘지화학 | 비수전해액 첨가제, 이를 포함하는 리튬 이차전지용 비수전해액 및 리튬 이차전지 |
| KR20190127946A (ko) * | 2017-04-04 | 2019-11-13 | 아르끄마 프랑스 | 리튬 염 혼합물 및 배터리 전해질로서의 그것의 사용 |
| KR20200021885A (ko) | 2018-08-21 | 2020-03-02 | 아즈빌주식회사 | 압력 센서 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH1055822A (ja) * | 1996-08-08 | 1998-02-24 | Hitachi Ltd | リチウム2次電池及び電源装置 |
| JP2002359002A (ja) * | 2001-05-30 | 2002-12-13 | Mitsubishi Chemicals Corp | 非水系電解液二次電池及びそれに用いる非水系電解液 |
| US20120171576A1 (en) * | 2010-12-29 | 2012-07-05 | Industrial Technology Research Institute | Non-aqueous electrolyte and lithium secondary battery including the same |
| CN102867989A (zh) * | 2011-07-06 | 2013-01-09 | 中国科学院过程工程研究所 | 一种改善电池高温性能的非水电解液离子液体添加剂 |
| EP2824750B1 (en) * | 2013-07-08 | 2019-01-30 | Samsung SDI Co., Ltd. | Silicon-containing compound used in electrolytes for lithium secondary batteries |
| CN105428703B (zh) * | 2015-12-30 | 2019-05-28 | 浙江南都电源动力股份有限公司 | 一种含添加剂的锂离子电池 |
| JP6767151B2 (ja) * | 2016-04-12 | 2020-10-14 | 旭化成株式会社 | 非水系電解液及び非水系二次電池 |
| KR102477644B1 (ko) * | 2017-07-03 | 2022-12-15 | 주식회사 엘지에너지솔루션 | 전해질 첨가제 및 이를 포함하는 리튬 이차전지용 비수전해액 |
| JP2019185979A (ja) * | 2018-04-06 | 2019-10-24 | ダイキン工業株式会社 | 電解液、電気化学デバイス、リチウムイオン二次電池及びモジュール |
-
2021
- 2021-02-22 KR KR1020210023560A patent/KR20210106923A/ko unknown
- 2021-02-22 US US17/787,727 patent/US20230095613A1/en active Pending
- 2021-02-22 EP EP21757497.9A patent/EP4060781A4/en active Pending
- 2021-02-22 JP JP2022519030A patent/JP7378601B2/ja active Active
- 2021-02-22 CN CN202180006190.6A patent/CN114641883B/zh active Active
- 2021-02-22 WO PCT/KR2021/002207 patent/WO2021167428A1/ko unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007126262A1 (en) * | 2006-04-27 | 2007-11-08 | Kyungwon Enterprise Co., Ltd. | Anion receptor, and electrolyte using the same |
| US9166249B2 (en) * | 2010-12-22 | 2015-10-20 | California Institute Of Technology | Fluoride ion battery compositions |
| JP2014127354A (ja) * | 2012-12-26 | 2014-07-07 | Fujifilm Corp | 非水二次電池用電解液および非水二次電池、電解液用添加剤 |
| KR20190127946A (ko) * | 2017-04-04 | 2019-11-13 | 아르끄마 프랑스 | 리튬 염 혼합물 및 배터리 전해질로서의 그것의 사용 |
| KR20190008100A (ko) * | 2017-07-14 | 2019-01-23 | 주식회사 엘지화학 | 비수전해액 첨가제, 이를 포함하는 리튬 이차전지용 비수전해액 및 리튬 이차전지 |
| KR20200021885A (ko) | 2018-08-21 | 2020-03-02 | 아즈빌주식회사 | 압력 센서 |
Non-Patent Citations (2)
| Title |
|---|
| CAS, no. 83395-38-4 |
| See also references of EP4060781A4 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113948774A (zh) * | 2021-10-18 | 2022-01-18 | 九江天赐高新材料有限公司 | 一种功率型锂二次电池电解液及电池 |
| CN113948774B (zh) * | 2021-10-18 | 2023-12-22 | 九江天赐高新材料有限公司 | 一种功率型锂二次电池电解液及电池 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20210106923A (ko) | 2021-08-31 |
| CN114641883B (zh) | 2024-05-28 |
| JP2022551058A (ja) | 2022-12-07 |
| JP7378601B2 (ja) | 2023-11-13 |
| EP4060781A4 (en) | 2024-07-10 |
| CN114641883A (zh) | 2022-06-17 |
| US20230095613A1 (en) | 2023-03-30 |
| EP4060781A1 (en) | 2022-09-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| WO2021167428A1 (ko) | 리튬 이차 전지용 비수 전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2019156539A1 (ko) | 리튬 이차전지용 비수전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2018135889A1 (ko) | 리튬 이차전지용 비수 전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2023027547A1 (ko) | 리튬 이차전지용 비수 전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2021040388A1 (ko) | 비수 전해질 및 이를 포함하는 리튬 이차전지 | |
| WO2019151724A1 (ko) | 고온 저장 특성이 향상된 리튬 이차전지 | |
| WO2022092688A1 (ko) | 리튬 이차전지용 비수전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2023085843A1 (ko) | 비수 전해질용 첨가제를 포함하는 비수 전해질 및 이를 포함하는 리튬 이차 전지 | |
| WO2020213962A1 (ko) | 리튬 이차전지용 비수전해액 첨가제, 이를 포함하는 리튬 이차전지용 비수전해액 및 리튬 이차전지 | |
| WO2022260222A1 (ko) | 리튬 이차전지용 비수전해액 | |
| WO2021049872A1 (ko) | 리튬 이차전지용 비수전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2020149677A1 (ko) | 비수전해액 첨가제, 이를 포함하는 리튬 이차전지용 비수전해액 및 리튬 이차전지 | |
| WO2020096411A1 (ko) | 리튬 이차전지용 비수성 전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2023075379A1 (ko) | 비수 전해질용 첨가제, 이를 포함하는 비수 전해질 및 리튬 이차전지 | |
| WO2021256825A1 (ko) | 리튬 이차전지용 비수 전해액 첨가제 및 이를 포함하는 리튬 이차전지용 비수 전해액 및 리튬 이차전지 | |
| WO2023063648A1 (ko) | 리튬 이차전지용 비수 전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2023121028A1 (ko) | 비수 전해질용 첨가제를 포함하는 비수 전해질 및 이를 포함하는 리튬 이차전지 | |
| WO2023014174A1 (ko) | 비수 전해질용 첨가제를 포함하는 비수 전해질 및 이를 포함하는 리튬 이차전지 | |
| WO2021241976A1 (ko) | 이차전지용 전해액 첨가제, 이를 포함하는 리튬 이차전지용 비수 전해액 및 리튬 이차전지 | |
| WO2021194220A1 (ko) | 이차전지용 전해액 첨가제, 이를 포함하는 리튬 이차전지용 비수 전해액 및 리튬 이차전지 | |
| WO2020222469A1 (ko) | 리튬 이차 전지용 비수 전해질 및 이를 포함하는 리튬 이차 전지 | |
| WO2021101174A1 (ko) | 리튬 이차전지용 비수전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2021049875A1 (ko) | 리튬 이차전지용 비수전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2021091215A1 (ko) | 리튬 이차전지용 비수전해액 및 이를 포함하는 리튬 이차전지 | |
| WO2023191572A1 (ko) | 리튬 이차전지용 비수성 전해액 및 이를 포함하는 리튬 이차전지 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 21757497 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2022519030 Country of ref document: JP Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 2021757497 Country of ref document: EP Effective date: 20220615 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |