WO2016067522A1 - Nonaqueous electrolyte secondary battery - Google Patents
Nonaqueous electrolyte secondary battery Download PDFInfo
- Publication number
- WO2016067522A1 WO2016067522A1 PCT/JP2015/004968 JP2015004968W WO2016067522A1 WO 2016067522 A1 WO2016067522 A1 WO 2016067522A1 JP 2015004968 W JP2015004968 W JP 2015004968W WO 2016067522 A1 WO2016067522 A1 WO 2016067522A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- lithium
- positive electrode
- transition metal
- tungsten
- negative electrode
- Prior art date
Links
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M50/00—Constructional details or processes of manufacture of the non-active parts of electrochemical cells other than fuel cells, e.g. hybrid cells
- H01M50/40—Separators; Membranes; Diaphragms; Spacing elements inside cells
- H01M50/409—Separators, membranes or diaphragms characterised by the material
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
- H01M10/0525—Rocking-chair batteries, i.e. batteries with lithium insertion or intercalation in both electrodes; Lithium-ion batteries
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/50—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese
- H01M4/505—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese of mixed oxides or hydroxides containing manganese for inserting or intercalating light metals, e.g. LiMn2O4 or LiMn2OxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/52—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron
- H01M4/525—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron of mixed oxides or hydroxides containing iron, cobalt or nickel for inserting or intercalating light metals, e.g. LiNiO2, LiCoO2 or LiCoOxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M50/00—Constructional details or processes of manufacture of the non-active parts of electrochemical cells other than fuel cells, e.g. hybrid cells
- H01M50/40—Separators; Membranes; Diaphragms; Spacing elements inside cells
- H01M50/409—Separators, membranes or diaphragms characterised by the material
- H01M50/443—Particulate material
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Definitions
- the proportion of the tungsten element that dissolves in the lithium-containing transition metal oxide is preferably 0.01 to 3.0 mol%, more preferably 0.03 to 2%, based on the transition metal excluding lithium in the lithium-containing transition metal oxide. It is preferably 0.0 mol%, more preferably 0.05 to 1.0 mol%.
- the lithium transition metal oxide may contain other additive elements.
- additive elements include boron, magnesium, aluminum, titanium, vanadium, iron, copper, zinc, niobium, zirconium, tin, tantalum, sodium, potassium, barium, strontium, calcium, and the like.
- the positive electrode containing the positive electrode active material is preferably composed of a positive electrode current collector and a positive electrode mixture layer formed on the positive electrode current collector.
- the positive electrode mixture layer preferably contains a binder and a conductive agent in addition to the positive electrode active material particles.
- a conductive thin film particularly a metal foil or alloy foil that is stable in the potential range of the positive electrode such as aluminum, or a film having a metal surface layer such as aluminum is used.
- Example 1 (Experiment 1) [Preparation of positive electrode active material] A hydroxide represented by [Ni 0.5 Co 0.20 Mn 0.30 ] (OH) 2 obtained by coprecipitation was baked at 500 ° C. to obtain a nickel cobalt manganese composite oxide. Next, lithium carbonate, the nickel cobalt manganese composite oxide obtained above, tungsten oxide (WO 3 ), lithium, the total amount of nickel, cobalt and manganese, and the molar ratio of tungsten to 1.20: The mixture was mixed in a Ishikawa type mortar so as to be 1: 0.005. Thereafter, the mixture was pulverized after heat treatment at 900 ° C.
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Manufacturing & Machinery (AREA)
- Battery Electrode And Active Subsutance (AREA)
- Secondary Cells (AREA)
Abstract
Provided is a nonaqueous electrolyte secondary battery which is suppressed in the generation of a gas during the charge/discharge cycles.
A nonaqueous electrolyte secondary battery which is provided with a positive electrode, a negative electrode, a separator that is arranged between the positive electrode and the negative electrode, and a nonaqueous electrolyte, and wherein: the positive electrode is provided with a positive electrode active material that contains a lithium transition metal oxide; the positive electrode contains tungsten oxide; tungsten is solid-solved in the lithium transition metal oxide; tungsten oxide adheres to the surface of the lithium transition metal oxide; and negative electrode contains lithium titanate. It is preferable that tungsten in the tungsten oxide contained in the positive electrode is 0.01-3.0% by mole relative to the transition metals other than lithium in the lithium transition metal oxide.
Description
本発明は、非水電解質二次電池に関する。
The present invention relates to a non-aqueous electrolyte secondary battery.
現在、非水電解質二次電池は、携帯電話、ノートパソコン、スマートフォン等の移動情報端末といったコンシュマー用途に加えて、電動工具、電気自動車(EV)、ハイブリッド電気自動車(HEV、PHEV)等の動力用電源としても注目されており、さらなる用途拡大が見込まれている。こうした動力用電源では、長時間の使用が可能となるような高容量化や、比較的短時間に大電流充放電を繰り返す場合の出力特性の向上が求められる。
Currently, non-aqueous electrolyte secondary batteries are used for power sources such as power tools, electric vehicles (EV), and hybrid electric vehicles (HEV, PHEV) in addition to consumer applications such as mobile information terminals such as mobile phones, notebook computers, and smartphones. It is also attracting attention as a power source, and further expansion of applications is expected. Such a power source is required to have a high capacity so that it can be used for a long time and to improve output characteristics when a large current is repeatedly charged and discharged in a relatively short time.
また、下記特許文献1のように、リチウム電位に対して約1.5Vという、炭素材料に比べて貴な電位でリチウムイオンの挿入・脱離反応が起こるチタン酸リチウムを負極活物質として用いる、非水電解質二次電池が提案されており、優れた入出力特性を有するため、新たな用途への期待が高まっている。
Further, as in Patent Document 1 below, lithium titanate in which insertion / extraction reaction of lithium ions occurs at a noble potential compared to a carbon material of about 1.5 V with respect to the lithium potential is used as the negative electrode active material. Non-aqueous electrolyte secondary batteries have been proposed and have excellent input / output characteristics, so that expectations for new applications are increasing.
ここで、負極にチタン酸リチウムを用いると、炭素からなる負極を用いるときに比べ、電池の使用初期にガス発生量が多くなるという課題がある。これは、チタン酸リチウムの表面の水酸基が、水素結合により水分を吸着しやすく、周囲の水分が電池内部に持ち込まれてしまうためである。電池内部の水分は、電解質塩等と反応してフッ化水素酸(HF)が生成するため、電解液溶媒や活物質の分解を招き、ガス発生量が多くなる。電池の出力を上げることを目的に表面積の大きな活物質を用いると、水分の持ち込み量も増える。また、水分の持ち込み量を減らすよう、製造工程により高度なドライ環境を用意すると、製造コストが上がってしまう。
Here, when lithium titanate is used for the negative electrode, there is a problem that the amount of gas generation is increased at the initial use of the battery, compared with the case of using a negative electrode made of carbon. This is because the hydroxyl group on the surface of lithium titanate easily adsorbs moisture by hydrogen bonding, and surrounding moisture is brought into the battery. The moisture inside the battery reacts with the electrolyte salt and the like to generate hydrofluoric acid (HF), which causes decomposition of the electrolyte solvent and the active material, and increases the amount of gas generated. If an active material with a large surface area is used for the purpose of increasing the output of the battery, the amount of moisture brought in will also increase. In addition, if an advanced dry environment is prepared in the manufacturing process so as to reduce the amount of moisture brought in, the manufacturing cost increases.
下記特許文献2には、ガス発生を抑制するため、チタン酸リチウムの物性を制御する方法が開示されている。
The following Patent Document 2 discloses a method for controlling physical properties of lithium titanate in order to suppress gas generation.
しかしながら、上記特許文献1及び2に開示された技術を用いても、ガス発生を抑制することは難しかった。
However, even if the techniques disclosed in Patent Documents 1 and 2 are used, it is difficult to suppress gas generation.
上記課題を解決すべく、本発明の一局面によれば、非水電解質二次電池は、正極と、負極と、正極と負極との間に配置されたセパレータと、非水電解質とを備える非水電解質二次電池であって、前記正極はリチウム遷移金属酸化物を含む正極活物質を備え、前記正極は酸化タングステンを含み、前記リチウム遷移金属酸化物にタングステンが固溶し、かつ、前記リチウム遷移金属酸化物の表面に酸化タングステンが付着し、前記負極はチタン酸リチウムを含む。
In order to solve the above-described problem, according to one aspect of the present invention, a nonaqueous electrolyte secondary battery includes a positive electrode, a negative electrode, a separator disposed between the positive electrode and the negative electrode, and a nonaqueous electrolyte. A water electrolyte secondary battery, wherein the positive electrode includes a positive electrode active material including a lithium transition metal oxide, the positive electrode includes tungsten oxide, tungsten is dissolved in the lithium transition metal oxide, and the lithium Tungsten oxide adheres to the surface of the transition metal oxide, and the negative electrode contains lithium titanate.
本発明の一局面によれば、充放電サイクル時のガス発生が抑制された非水電解質二次電池が提供される。
According to one aspect of the present invention, a nonaqueous electrolyte secondary battery in which gas generation during a charge / discharge cycle is suppressed is provided.
本発明の実施形態について以下に説明する。本実施形態は本発明を実施する一例であって、本発明は本実施形態に限定されるものではなく、その要旨を変更しない範囲において適宜変更して実施することが可能である。
Embodiments of the present invention will be described below. The present embodiment is an example for carrying out the present invention, and the present invention is not limited to the present embodiment, and can be appropriately modified and implemented without departing from the scope of the present invention.
<非水電解質二次電池>
本発明の実施形態に係る非水電解質二次電池の一例としては、リチウムを吸蔵及び放出可能な正極と、リチウムを吸蔵及び放出可能な負極と、非水電解質とを備える。本実施形態の一例である非水電解質二次電池は、例えば、正極および負極がセパレータを介して巻回もしくは積層された電極体と、液状の非水電解質である電解液とが電池外装缶に収容された構成を有するが、これに限定されるものではない。以下に、非水電解質二次電池の各構成部材について詳述する。 <Nonaqueous electrolyte secondary battery>
An example of a nonaqueous electrolyte secondary battery according to an embodiment of the present invention includes a positive electrode capable of inserting and extracting lithium, a negative electrode capable of inserting and extracting lithium, and a nonaqueous electrolyte. In the nonaqueous electrolyte secondary battery as an example of this embodiment, for example, an electrode body in which a positive electrode and a negative electrode are wound or stacked with a separator interposed therebetween, and an electrolytic solution that is a liquid nonaqueous electrolyte are provided in a battery outer can. Although it has the accommodated structure, it is not limited to this. Below, each structural member of a nonaqueous electrolyte secondary battery is explained in full detail.
本発明の実施形態に係る非水電解質二次電池の一例としては、リチウムを吸蔵及び放出可能な正極と、リチウムを吸蔵及び放出可能な負極と、非水電解質とを備える。本実施形態の一例である非水電解質二次電池は、例えば、正極および負極がセパレータを介して巻回もしくは積層された電極体と、液状の非水電解質である電解液とが電池外装缶に収容された構成を有するが、これに限定されるものではない。以下に、非水電解質二次電池の各構成部材について詳述する。 <Nonaqueous electrolyte secondary battery>
An example of a nonaqueous electrolyte secondary battery according to an embodiment of the present invention includes a positive electrode capable of inserting and extracting lithium, a negative electrode capable of inserting and extracting lithium, and a nonaqueous electrolyte. In the nonaqueous electrolyte secondary battery as an example of this embodiment, for example, an electrode body in which a positive electrode and a negative electrode are wound or stacked with a separator interposed therebetween, and an electrolytic solution that is a liquid nonaqueous electrolyte are provided in a battery outer can. Although it has the accommodated structure, it is not limited to this. Below, each structural member of a nonaqueous electrolyte secondary battery is explained in full detail.
[正極]
正極は、リチウム遷移金属酸化物を含む正極活物質を備え、前記リチウム遷移金属酸化物にタングステンが固溶し、前記正極は酸化タングステンを含み、前記リチウム遷移金属酸化物の表面に酸化タングステンが付着している。 [Positive electrode]
The positive electrode includes a positive electrode active material containing a lithium transition metal oxide, tungsten is dissolved in the lithium transition metal oxide, the positive electrode contains tungsten oxide, and tungsten oxide adheres to the surface of the lithium transition metal oxide. is doing.
正極は、リチウム遷移金属酸化物を含む正極活物質を備え、前記リチウム遷移金属酸化物にタングステンが固溶し、前記正極は酸化タングステンを含み、前記リチウム遷移金属酸化物の表面に酸化タングステンが付着している。 [Positive electrode]
The positive electrode includes a positive electrode active material containing a lithium transition metal oxide, tungsten is dissolved in the lithium transition metal oxide, the positive electrode contains tungsten oxide, and tungsten oxide adheres to the surface of the lithium transition metal oxide. is doing.
上記構成によれば、電池の使用初期の充放電時において、正極活物質上に、電解液の分解物からなる被膜が形成して、HFによる正極活物質の腐食及び金属溶出が抑制される。これにより、正極活物質の腐食部分と電解液との更なる反応が抑制され、H2ガス、COガス及びCO2ガス等が発生するのが抑制される。
According to the said structure, the film which consists of a decomposition product of electrolyte solution forms on a positive electrode active material at the time of charging / discharging of the use initial stage of a battery, and the corrosion and metal elution of a positive electrode active material by HF are suppressed. Thus, further reaction of the corrosion portion of the positive electrode active material and the electrolyte solution is suppressed, H 2 gas, that CO gas and CO 2 gas or the like is generated is suppressed.
リチウム遷移金属酸化物の表面には、酸化タングステンが点在して付着していることが好ましく、表面に均一に点在して付着していることがより好ましい。
It is preferable that tungsten oxide is scattered and attached to the surface of the lithium transition metal oxide, and more preferably, it is uniformly scattered and attached to the surface.
酸化タングステンとしては、具体的には、WO3、WO2、W2O3が挙げられる。中でも、価数が大きく、少量で被膜が形成されやすいWO3がより好ましい。
Specific examples of tungsten oxide include WO 3 , WO 2 , and W 2 O 3 . Among these, WO 3 is more preferable because it has a large valence and can easily form a film with a small amount.
正極に含まれる酸化タングステンにおけるタングステン元素の割合は、リチウム遷移金属酸化物中において、リチウムを除く遷移金属に対し、0.01~3.0モル%であることが好ましく、さらに0.03~2.0モル%が好ましく、特に0.05~1.0モル%であることがより好ましい。正極に含まれる酸化タングステンの量が少ないと、ガス発生の抑制が不十分になる傾向があり、酸化タングステンの量が多くなりすぎると、容量が低下する傾向がある。なお、リチウム含有遷移金属酸化物上へ被膜を形成しやすくする観点から、正極に含まれる酸化タングステンは、その殆どがリチウム遷移金属酸化物上に付着していることが好ましい。
The ratio of the tungsten element in the tungsten oxide contained in the positive electrode is preferably 0.01 to 3.0 mol% with respect to the transition metal excluding lithium in the lithium transition metal oxide, and more preferably 0.03 to 2%. It is preferably 0.0 mol%, more preferably 0.05 to 1.0 mol%. If the amount of tungsten oxide contained in the positive electrode is small, the suppression of gas generation tends to be insufficient, and if the amount of tungsten oxide is too large, the capacity tends to decrease. From the viewpoint of easily forming a film on the lithium-containing transition metal oxide, most of the tungsten oxide contained in the positive electrode is preferably attached on the lithium transition metal oxide.
リチウム含有遷移金属酸化物にタングステンが固溶しているとは、タングステン元素が、リチウム含有遷移金属酸化物活物質中のニッケルやコバルトの一部と置換し、リチウム含有遷移金属酸化物の内部(結晶中)に存在している状態のことである。
The fact that tungsten is in solid solution in the lithium-containing transition metal oxide means that the tungsten element replaces a part of nickel or cobalt in the lithium-containing transition metal oxide active material, and the inside of the lithium-containing transition metal oxide ( In the crystal).
リチウム含有遷移金属酸化物に固溶するタングステン元素の割合は、リチウム含有遷移金属酸化物のリチウムを除く遷移金属に対して、0.01~3.0モル%が好ましく、さらに0.03~2.0モル%が好ましく、特に0.05~1.0モル%であることがより好ましい。固溶するタングステンの量が少ないと、被膜形成が不十分になる傾向があり、固溶するタングステンの量が多くなりすぎると、容量が低下する傾向がある。
The proportion of the tungsten element that dissolves in the lithium-containing transition metal oxide is preferably 0.01 to 3.0 mol%, more preferably 0.03 to 2%, based on the transition metal excluding lithium in the lithium-containing transition metal oxide. It is preferably 0.0 mol%, more preferably 0.05 to 1.0 mol%. When the amount of solid solution tungsten is small, film formation tends to be insufficient, and when the amount of solid solution tungsten is too large, the capacity tends to decrease.
リチウム含有遷移金属酸化物の粉末を切断もしくは表面を削るなどして、一次粒子内部をオージェ電子分光法(Auger electron spectroscopy;AES)、二次イオン質量分析
法(Secondary Ion Mass Spectrometry;SIMS)、透過型電子顕微鏡(Transmission Electron Microscope; TEM)-エネルギー分散型X線分析(Energy dispersive X-ray spectrometry;EDX)などを用いてタングステンの定性、定量分析を行うと、リチウム含有遷移金属酸化物にタングステンが固溶していることや、固溶量を確認することができる。 By cutting or scraping the surface of the lithium-containing transition metal oxide powder, the inside of the primary particle is Auger electron spectroscopy (AES), secondary ion mass spectrometry (SIMS), transmission When qualitative and quantitative analysis of tungsten is performed using Transmission Electron Microscope (TEM) -Energy dispersive X-ray spectrometry (EDX), tungsten is found in the lithium-containing transition metal oxide. It can be confirmed that the solid solution is present or the amount of the solid solution.
法(Secondary Ion Mass Spectrometry;SIMS)、透過型電子顕微鏡(Transmission Electron Microscope; TEM)-エネルギー分散型X線分析(Energy dispersive X-ray spectrometry;EDX)などを用いてタングステンの定性、定量分析を行うと、リチウム含有遷移金属酸化物にタングステンが固溶していることや、固溶量を確認することができる。 By cutting or scraping the surface of the lithium-containing transition metal oxide powder, the inside of the primary particle is Auger electron spectroscopy (AES), secondary ion mass spectrometry (SIMS), transmission When qualitative and quantitative analysis of tungsten is performed using Transmission Electron Microscope (TEM) -Energy dispersive X-ray spectrometry (EDX), tungsten is found in the lithium-containing transition metal oxide. It can be confirmed that the solid solution is present or the amount of the solid solution.
リチウム含有遷移金属酸化物にタングステンを固溶させる方法としては、ニッケルコバルトマンガンの酸化物と水酸化リチウムや炭酸リチウムなどのリチウム化合物と、酸化タングステンなどのタングステン化合物を混ぜて焼成する方法が挙げられる。焼成温度として650℃以上1000℃以下であることが好ましく、特に700℃から950℃であることが好ましい。これは650℃未満では水酸化リチウムの分解反応が十分でなく反応が進行しにくく、1000℃以上になると、カチオンミキシングが活発になり、Li+の拡
散を阻害してしまうため比容量が低下したり、負荷特性が乏しくなってしまうからである。 Examples of a method for dissolving tungsten in a lithium-containing transition metal oxide include a method in which a nickel cobalt manganese oxide, a lithium compound such as lithium hydroxide or lithium carbonate, and a tungsten compound such as tungsten oxide are mixed and fired. . The firing temperature is preferably from 650 ° C. to 1000 ° C., particularly preferably from 700 ° C. to 950 ° C. When the temperature is lower than 650 ° C., the decomposition reaction of lithium hydroxide is not sufficient and the reaction does not proceed easily. When the temperature is higher than 1000 ° C., the cation mixing becomes active and the diffusion of Li + is inhibited. This is because the load characteristics are poor.
散を阻害してしまうため比容量が低下したり、負荷特性が乏しくなってしまうからである。 Examples of a method for dissolving tungsten in a lithium-containing transition metal oxide include a method in which a nickel cobalt manganese oxide, a lithium compound such as lithium hydroxide or lithium carbonate, and a tungsten compound such as tungsten oxide are mixed and fired. . The firing temperature is preferably from 650 ° C. to 1000 ° C., particularly preferably from 700 ° C. to 950 ° C. When the temperature is lower than 650 ° C., the decomposition reaction of lithium hydroxide is not sufficient and the reaction does not proceed easily. When the temperature is higher than 1000 ° C., the cation mixing becomes active and the diffusion of Li + is inhibited. This is because the load characteristics are poor.
正極にリチウム遷移金属酸化物の表面に酸化タングステンを付着させる方法としては、リチウム含有遷移金属複合酸化物と酸化タングステンをあらかじめ機械的に混合して付着させる方法の他、導電剤と結着剤を混練する工程で酸化タングステンを添加する方法が挙げられる。
As a method of attaching tungsten oxide to the surface of the lithium transition metal oxide on the positive electrode, in addition to a method of attaching the lithium-containing transition metal composite oxide and tungsten oxide in advance by mechanical mixing, a conductive agent and a binder are used. A method of adding tungsten oxide in the kneading step may be mentioned.
リチウム含有遷移金属複合酸化物としては、平均粒径2~30μmの粒子が挙げられ、この粒子は、100nmから10μmの一次粒子が結合した二次粒子の形態でもよい。なお、本発明における平均粒径は、例えば、散乱式粒度分布測定装置(HORIBA製)で測定することができる。
Examples of the lithium-containing transition metal composite oxide include particles having an average particle diameter of 2 to 30 μm, and the particles may be in the form of secondary particles in which primary particles of 100 nm to 10 μm are bonded. In addition, the average particle diameter in this invention can be measured with the scattering type particle size distribution measuring apparatus (made by HORIBA), for example.
酸化タングステンの平均粒径はリチウム含有遷移金属複合酸化物の平均粒径より小さいことが好ましく、特に、1/4より小さいことが好ましい。酸化タングステンがリチウム含有遷移金属複合酸化物より大きいと、リチウム含有遷移金属複合酸化物との接触面積が小さくなり効果が十分に発揮されない恐れがある。
The average particle diameter of tungsten oxide is preferably smaller than the average particle diameter of the lithium-containing transition metal composite oxide, and particularly preferably smaller than ¼. If tungsten oxide is larger than the lithium-containing transition metal composite oxide, the contact area with the lithium-containing transition metal composite oxide becomes small, and the effect may not be sufficiently exhibited.
リチウム遷移金属酸化物としては、遷移金属として、例えば、ニッケル(Ni)、マンガン(Mn)、コバルト(Co)からなる群から選択される少なくとも1種を含有するものが挙げられる。また、リチウム遷移金属酸化物は、アルミニウム(Al)、マグネシウム(Mg)等の非遷移金属を含有していてもよい。具体例としては、コバルト酸リチウム、Ni-Co-Mn系、Ni-Co-Al系、Ni-Mn-Al系等のリチウム遷移金属酸化物等が挙げられる。また、リチウム遷移金属酸化物としては、鉄(Fe)、マンガン(Mn)などを含むオリビン型のリチウム遷移金属複合酸化物(LiMPO4で表され、MはFe、Mn、Co、Niから選択される)を用いてもよい。また、これらを単独で用いてもよいし、混合して用いてもよい。
Examples of the lithium transition metal oxide include those containing at least one selected from the group consisting of nickel (Ni), manganese (Mn), and cobalt (Co) as the transition metal. Further, the lithium transition metal oxide may contain a non-transition metal such as aluminum (Al) or magnesium (Mg). Specific examples thereof include lithium transition metal oxides such as lithium cobaltate, Ni—Co—Mn, Ni—Co—Al, and Ni—Mn—Al. The lithium transition metal oxide is represented by an olivine type lithium transition metal composite oxide (LiMPO 4 ) containing iron (Fe), manganese (Mn), etc., and M is selected from Fe, Mn, Co, and Ni. May be used. These may be used alone or in combination.
上記の中でも、Ni-Co-Mn系のリチウム遷移金属酸化物が特に好ましく用いられる。出力特性及び回生特性に優れるためである。Ni-Co-Mn系のリチウム遷移金属酸化物の例としては、NiとCoとMnとのモル比が、1:1:1であったり、5:2:3、4:4:2、5:3:2、6:2:2、55:25:20、7:2:1、7:1:2、8:1:1である等を用いることができる。特に、正極容量を増大させることができるようにするためには、NiやCoの割合がMnより多いものを用いることが好ましく、特にNiとCoとMnのモルの総和に対するNiとMnのモル率の差が、0.04%以上のものであることが好ましい。
Among these, Ni—Co—Mn lithium transition metal oxides are particularly preferably used. This is because the output characteristics and the regeneration characteristics are excellent. Examples of the Ni—Co—Mn lithium transition metal oxide include a molar ratio of Ni, Co, and Mn of 1: 1: 1, 5: 2: 3, 4: 4: 2, 5 : 3: 2, 6: 2: 2, 55:25:20, 7: 2: 1, 7: 1: 2, 8: 1: 1, and the like. In particular, in order to be able to increase the positive electrode capacity, it is preferable to use a material in which the ratio of Ni or Co is larger than that of Mn, and in particular, the molar ratio of Ni and Mn to the sum of the moles of Ni, Co and Mn. The difference is preferably 0.04% or more.
上記Ni-Co-Al系のリチウム遷移金属酸化物の例としては、NiとCoとAlとの比が、82:15:3、82:12:6、80:10:10、80:15:5、87:9:4、90:5:5、95:3:2である等を用いることができる。
Examples of the Ni—Co—Al based lithium transition metal oxide include Ni: Co: Al ratios of 82: 15: 3, 82: 12: 6, 80:10:10, and 80:15: 5, 87: 9: 4, 90: 5: 5, 95: 3: 2, and the like can be used.
尚、上記リチウム遷移金属酸化物は、他の添加元素を含んでいてもよい。添加元素の例としては、ホウ素、マグネシウム、アルミニウム、チタン、バナジウム、鉄、銅、亜鉛、ニオブ、ジルコニウム、錫、タンタル、ナトリウム、カリウム、バリウム、ストロンチウム、カルシウム等が挙げられる。
Note that the lithium transition metal oxide may contain other additive elements. Examples of additive elements include boron, magnesium, aluminum, titanium, vanadium, iron, copper, zinc, niobium, zirconium, tin, tantalum, sodium, potassium, barium, strontium, calcium, and the like.
正極活物質としては、上記正極活物質の粒子を単独で用いる場合に限定されない。上記正極活物質と他の正極活物質とを混合させて使用することも可能である。当該正極活物質としては、可逆的にリチウムイオンを挿入・脱離可能な化合物であれば特に限定されず、例えば、安定した結晶構造を維持したままリチウムイオンの挿入脱離が可能であるコバルト酸リチウム、ニッケルコバルトマンガン酸リチウムなどの層状構造を有するものや、リチウムマンガン酸化物、リチウムニッケルマンガン酸化物などのスピネル構造を有するものや、オリビン構造を有するもの等を用いることができる。尚、同種の正極活物質のみを用いる場合や異種の正極活物質を用いる場合において、正極活物質としては、同一の粒径のものを用いても良く、また、異なる粒径のものを用いてもよい。
The positive electrode active material is not limited to the case where the positive electrode active material particles are used alone. It is also possible to use a mixture of the positive electrode active material and another positive electrode active material. The positive electrode active material is not particularly limited as long as it is a compound capable of reversibly inserting and desorbing lithium ions. For example, cobalt acid capable of inserting and desorbing lithium ions while maintaining a stable crystal structure. Those having a layered structure such as lithium and nickel cobalt lithium manganate, those having a spinel structure such as lithium manganese oxide and lithium nickel manganese oxide, and those having an olivine structure can be used. In addition, when using only the same kind of positive electrode active material or when using different types of positive electrode active materials, the positive electrode active materials may be of the same particle diameter or of different particle diameters. Also good.
上記正極活物質を含む正極は、正極集電体と、正極集電体上に形成された正極合剤層とで構成されることが好適である。正極合剤層には、正極活物質粒子の他に、結着剤、導電剤を含むことが好ましい。正極集電体には、例えば、導電性を有する薄膜体、特にアルミニウムなどの正極の電位範囲で安定な金属箔や合金箔、アルミニウムなどの金属表層を有するフィルムが用いられる。
The positive electrode containing the positive electrode active material is preferably composed of a positive electrode current collector and a positive electrode mixture layer formed on the positive electrode current collector. The positive electrode mixture layer preferably contains a binder and a conductive agent in addition to the positive electrode active material particles. For the positive electrode current collector, for example, a conductive thin film, particularly a metal foil or alloy foil that is stable in the potential range of the positive electrode such as aluminum, or a film having a metal surface layer such as aluminum is used.
結着剤としては、フッ素系高分子、ゴム系高分子等が挙げられる。例えば、フッ素系高分子としてポリテトラフルオロエチレン(PTFE)、ポリフッ化ビニリデン(PVdF)、またはこれらの変性体等、ゴム系高分子としてエチレンープロピレンーイソプレン共重合体、エチレンープロピレンーブタジエン共重合体等が挙げられる。これらを単独で用いてもよく、2種以上を組み合わせて用いてもよい。結着剤は、カルボキシメチルセルロース(CMC)、ポリエチレンオキシド(PEO)等の増粘剤と併用されてもよい。
Examples of the binder include fluorine-based polymers and rubber-based polymers. For example, polytetrafluoroethylene (PTFE), polyvinylidene fluoride (PVdF), or modified products thereof as fluorine-based polymers, ethylene-propylene-isoprene copolymer, ethylene-propylene-butadiene copolymer as rubber-based polymers Examples include coalescence. These may be used alone or in combination of two or more. The binder may be used in combination with a thickener such as carboxymethyl cellulose (CMC) or polyethylene oxide (PEO).
導電剤としては、例えば、炭素材料としてカーボンブラック、アセチレンブラック、ケッチェンブラック、黒鉛、気相成長炭素(VGCF)、カーボンナノチューブ、カーボンナノファイバー等の炭素材料が挙げられる。これらを単独で用いてもよく、2種以上組み合わせて用いてもよい。
Examples of the conductive agent include carbon materials such as carbon black, acetylene black, ketjen black, graphite, vapor grown carbon (VGCF), carbon nanotube, and carbon nanofiber. These may be used alone or in combination of two or more.
[負極]
本発明の実施形態に係る負極に用いる負極活物質としては、チタン酸リチウムを用いる。チタン酸リチウムとしては、スピネル結晶構造を有するチタン酸リチウムを用いることが好ましい。スピネル結晶構造を有するチタン酸リチウムとしては、Li4+XTi5O12(0≦X≦3)が例示される。スピネル結晶構造を有するチタン酸リチウムは、リチウムの挿入脱離に伴う膨張収縮が小さく、劣化しにくい。従って、スピネル結晶構造を有するチタン酸リチウムを負極活物質として用いると、耐久性に秀でた電池が得られる。スピネル構造を有することは、X線回折などにより容易に確認することができる。 [Negative electrode]
Lithium titanate is used as the negative electrode active material used for the negative electrode according to the embodiment of the present invention. As lithium titanate, it is preferable to use lithium titanate having a spinel crystal structure. Examples of lithium titanate having a spinel crystal structure include Li 4 + X Ti 5 O 12 (0 ≦ X ≦ 3). Lithium titanate having a spinel crystal structure is small in expansion and contraction due to insertion / extraction of lithium and hardly deteriorates. Therefore, when lithium titanate having a spinel crystal structure is used as the negative electrode active material, a battery having excellent durability can be obtained. Having a spinel structure can be easily confirmed by X-ray diffraction or the like.
本発明の実施形態に係る負極に用いる負極活物質としては、チタン酸リチウムを用いる。チタン酸リチウムとしては、スピネル結晶構造を有するチタン酸リチウムを用いることが好ましい。スピネル結晶構造を有するチタン酸リチウムとしては、Li4+XTi5O12(0≦X≦3)が例示される。スピネル結晶構造を有するチタン酸リチウムは、リチウムの挿入脱離に伴う膨張収縮が小さく、劣化しにくい。従って、スピネル結晶構造を有するチタン酸リチウムを負極活物質として用いると、耐久性に秀でた電池が得られる。スピネル構造を有することは、X線回折などにより容易に確認することができる。 [Negative electrode]
Lithium titanate is used as the negative electrode active material used for the negative electrode according to the embodiment of the present invention. As lithium titanate, it is preferable to use lithium titanate having a spinel crystal structure. Examples of lithium titanate having a spinel crystal structure include Li 4 + X Ti 5 O 12 (0 ≦ X ≦ 3). Lithium titanate having a spinel crystal structure is small in expansion and contraction due to insertion / extraction of lithium and hardly deteriorates. Therefore, when lithium titanate having a spinel crystal structure is used as the negative electrode active material, a battery having excellent durability can be obtained. Having a spinel structure can be easily confirmed by X-ray diffraction or the like.
チタン酸リチウムの比表面積は、BET法による測定で、2m2/g以上であることが好ましい。さらに好ましくは、3m2/g以上、より好ましくは4m2/g以上である。比表面積が小さくなると、水分の電池内部への持ち込み量が少なくなり、本発明におけるガス抑制効果が発現しにくくなる傾向があると共に、入出力特性が不十分となる傾向がある。また、チタン酸リチウムの比表面積は、大きすぎると結晶性が悪化し、耐久性を損なう傾向があることから、8m2/g以下であることが好ましい。
The specific surface area of lithium titanate is preferably 2 m 2 / g or more as measured by the BET method. More preferably, it is 3 m < 2 > / g or more, More preferably, it is 4 m < 2 > / g or more. When the specific surface area is reduced, the amount of moisture brought into the battery is reduced, and the gas suppression effect in the present invention tends to be hardly exhibited, and the input / output characteristics tend to be insufficient. Further, if the specific surface area of lithium titanate is too large, the crystallinity deteriorates and the durability tends to be impaired, and therefore, it is preferably 8 m 2 / g or less.
チタン酸リチウム中のTi元素の一部はTiとは異なる1種以上の元素で置換されていてもよい。リチウム含有チタン酸化物のTi元素の一部をTiとは異なる1種以上の元素で置換することにより、リチウム含有チタン酸化物よりも大きな不可逆容量率を有し、負極規制の非水電解質二次電池を実現することができる。
A part of Ti element in lithium titanate may be substituted with one or more elements different from Ti. By replacing a part of the Ti element of the lithium-containing titanium oxide with one or more elements different from Ti, it has a larger irreversible capacity ratio than the lithium-containing titanium oxide, and a non-aqueous electrolyte secondary electrode regulated by a negative electrode A battery can be realized.
チタン酸リチウムとしては、平均粒子径0.1~10μmの粒子が挙げられる。
Examples of lithium titanate include particles having an average particle size of 0.1 to 10 μm.
負極活物質としてチタン酸リチウムを用いる場合、負極合剤中にフッ化黒鉛が含まれることが好ましい。負極合剤中にフッ化黒鉛が含まれることによって、負極の電位変化によって電池電圧が放電終止電圧に達する、非水電解質二次電池を得ることができる。したがって、正極の電位変化に伴った電解液の分解反応を減らすことができるため、ガス発生量を低減させることができる。
When lithium titanate is used as the negative electrode active material, it is preferable that graphite fluoride is contained in the negative electrode mixture. By including fluorinated graphite in the negative electrode mixture, it is possible to obtain a nonaqueous electrolyte secondary battery in which the battery voltage reaches the end-of-discharge voltage due to the potential change of the negative electrode. Therefore, since the decomposition reaction of the electrolytic solution accompanying the change in the potential of the positive electrode can be reduced, the amount of gas generated can be reduced.
負極活物質としては、チタン酸リチウムを単独で用いることが好ましい。ただし、チタン酸リチウムと他の負極活物質とを混合させて使用することも可能である。当該負極活物質としては、可逆的にリチウムイオンを挿入・脱離可能な化合物であれば特に限定されず、例えば、炭素材料、あるいはリチウムと合金を形成可能な金属またはその金属を含む合金化合物等を用いることができる。チタン酸リチウムと他の負極活物質とを混合して使用する場合、その好ましい混合比率は、80質量%~100質量%である。
It is preferable to use lithium titanate alone as the negative electrode active material. However, it is also possible to use a mixture of lithium titanate and another negative electrode active material. The negative electrode active material is not particularly limited as long as it is a compound that can reversibly insert and desorb lithium ions. For example, a carbon material, a metal capable of forming an alloy with lithium, or an alloy compound containing the metal, etc. Can be used. When lithium titanate and other negative electrode active materials are mixed and used, the preferable mixing ratio is 80% by mass to 100% by mass.
負極活物質を含む負極は、例えば、負極活物質と、結着剤とを水あるいは適当な溶媒で混合し、負極集電体に塗布し、乾燥し、圧延することにより得られる。負極集電体には、導電性を有する薄膜体、負極の電位範囲で安定な金属箔や合金箔、金属表層を有するフィルム等を用いることが好適である。負極活物質としてチタン酸リチウムを用いる場合、アルミニウム箔が好ましいが、例えば、銅箔、ニッケル箔、またはステンレス箔などを用いてもよい。また、負極集電体は、前記の正極集電体と同様の形状であってもよい。
The negative electrode containing the negative electrode active material can be obtained, for example, by mixing a negative electrode active material and a binder with water or an appropriate solvent, applying the mixture to a negative electrode current collector, drying, and rolling. As the negative electrode current collector, it is preferable to use a conductive thin film, a metal foil or alloy foil that is stable within the potential range of the negative electrode, a film having a metal surface layer, or the like. When lithium titanate is used as the negative electrode active material, an aluminum foil is preferable. For example, a copper foil, a nickel foil, or a stainless steel foil may be used. The negative electrode current collector may have the same shape as the positive electrode current collector.
[セパレータ]
本発明の実施形態に係るセパレータとしては、例えば、ポリプロピレン製やポリエチレン製のセパレータ、ポリプロピレン-ポリエチレンの多層セパレータ、表面にアラミド系樹脂等の樹脂が塗布されたセパレータなどを用いることができる。セパレータとしては、セルロースを含むセパレータを用いることが好ましい。セルロースを含むセパレータとしては、セルロース繊維からなる紙状シートを用いることができる。 [Separator]
As the separator according to the embodiment of the present invention, for example, a polypropylene or polyethylene separator, a polypropylene-polyethylene multilayer separator, a separator having a surface coated with a resin such as an aramid resin, or the like can be used. As the separator, a separator containing cellulose is preferably used. As the separator containing cellulose, a paper-like sheet made of cellulose fibers can be used.
本発明の実施形態に係るセパレータとしては、例えば、ポリプロピレン製やポリエチレン製のセパレータ、ポリプロピレン-ポリエチレンの多層セパレータ、表面にアラミド系樹脂等の樹脂が塗布されたセパレータなどを用いることができる。セパレータとしては、セルロースを含むセパレータを用いることが好ましい。セルロースを含むセパレータとしては、セルロース繊維からなる紙状シートを用いることができる。 [Separator]
As the separator according to the embodiment of the present invention, for example, a polypropylene or polyethylene separator, a polypropylene-polyethylene multilayer separator, a separator having a surface coated with a resin such as an aramid resin, or the like can be used. As the separator, a separator containing cellulose is preferably used. As the separator containing cellulose, a paper-like sheet made of cellulose fibers can be used.
正極とセパレータとの界面、又は、負極とセパレータとの界面には、無機物のフィラーからなる層を形成することができる。フィラーとしては、チタン、アルミニウム、ケイ素、マグネシウム等を単独もしくは複数用いた酸化物やリン酸化合物、またその表面が水酸化物等で処理されているものを用いることができる。
A layer made of an inorganic filler can be formed at the interface between the positive electrode and the separator or at the interface between the negative electrode and the separator. As the filler, it is possible to use an oxide or a phosphoric acid compound using titanium, aluminum, silicon, magnesium or the like alone or plurally, and a material whose surface is treated with a hydroxide or the like.
[非水電解質]
非水電解質の溶媒としては、エチレンカーボネート、プロピレンカーボネート、ブチレンカーボネート、ビニレンカーボネート等の環状カーボネートや、ジメチルカーボネート、エチルメチルカーボネート、ジエチルカーボネート等の鎖状カーボネートを用いることができる。また、これらの水素の一部または全部をフッ素化されているものも用いることが可能である。特に、ガス発生を抑制するために、環状カーボネートを含むことが好ましい。環状カーボネートが含まれていると、リチウム含有遷移金属酸化物の表面に良質な被膜が形成されるため、HFによる正極活物質の腐食及び金属溶出が抑制され、サイクル時のガス発生が抑制される。 [Nonaqueous electrolyte]
As the non-aqueous electrolyte solvent, cyclic carbonates such as ethylene carbonate, propylene carbonate, butylene carbonate, and vinylene carbonate, and chain carbonates such as dimethyl carbonate, ethyl methyl carbonate, and diethyl carbonate can be used. In addition, those in which part or all of these hydrogens are fluorinated can be used. In particular, in order to suppress gas generation, it is preferable to include a cyclic carbonate. When the cyclic carbonate is contained, a good-quality film is formed on the surface of the lithium-containing transition metal oxide, so that corrosion of the positive electrode active material and metal elution by HF are suppressed, and gas generation during the cycle is suppressed. .
非水電解質の溶媒としては、エチレンカーボネート、プロピレンカーボネート、ブチレンカーボネート、ビニレンカーボネート等の環状カーボネートや、ジメチルカーボネート、エチルメチルカーボネート、ジエチルカーボネート等の鎖状カーボネートを用いることができる。また、これらの水素の一部または全部をフッ素化されているものも用いることが可能である。特に、ガス発生を抑制するために、環状カーボネートを含むことが好ましい。環状カーボネートが含まれていると、リチウム含有遷移金属酸化物の表面に良質な被膜が形成されるため、HFによる正極活物質の腐食及び金属溶出が抑制され、サイクル時のガス発生が抑制される。 [Nonaqueous electrolyte]
As the non-aqueous electrolyte solvent, cyclic carbonates such as ethylene carbonate, propylene carbonate, butylene carbonate, and vinylene carbonate, and chain carbonates such as dimethyl carbonate, ethyl methyl carbonate, and diethyl carbonate can be used. In addition, those in which part or all of these hydrogens are fluorinated can be used. In particular, in order to suppress gas generation, it is preferable to include a cyclic carbonate. When the cyclic carbonate is contained, a good-quality film is formed on the surface of the lithium-containing transition metal oxide, so that corrosion of the positive electrode active material and metal elution by HF are suppressed, and gas generation during the cycle is suppressed. .
環状カーボネートとしては、プロピレンカーボネートを用いることが好ましい。プロピレンカーボネートは分解されにくいため、ガス発生量が低減される。また、プロピレンカーボネートを用いると、優れた低温入出力特性が得られる。負極活物質として炭素材料を用いる場合、プロピレンカーボネートが含まれると、不可逆な充電反応が起きる虞があるため、プロピレンカーボネートと共にエチレンカーボネートやフルオロエチレンカーボネートを用いることが好ましい。負極活物質としてチタン酸リチウムを用いる場合は、不可逆な充電反応が起きにくいため、環状カーボネートに占めるプロピレンカーボネートの割合は大きいほうが好ましく、例えば、環状カーボネートに占めるプロピレンカーボネートの割合は80%以上、より好ましくは90%以上である。
As the cyclic carbonate, it is preferable to use propylene carbonate. Since propylene carbonate is difficult to be decomposed, the amount of gas generated is reduced. Further, when propylene carbonate is used, excellent low-temperature input / output characteristics can be obtained. When a carbon material is used as the negative electrode active material, if propylene carbonate is contained, an irreversible charging reaction may occur. Therefore, it is preferable to use ethylene carbonate or fluoroethylene carbonate together with propylene carbonate. When lithium titanate is used as the negative electrode active material, since the irreversible charging reaction does not easily occur, the proportion of propylene carbonate in the cyclic carbonate is preferably larger. For example, the proportion of propylene carbonate in the cyclic carbonate is 80% or more, more Preferably it is 90% or more.
また、低粘度、低融点でリチウムイオン伝導度の高い非水系溶媒として、環状カーボネートと鎖状カーボネートとの混合溶媒を用いることが好ましい。更に、この混合溶媒における環状カーボネートと鎖状カーボネートとの体積比は、2:8~5:5の範囲に規制することが好ましい。
Further, it is preferable to use a mixed solvent of a cyclic carbonate and a chain carbonate as a non-aqueous solvent having a low viscosity, a low melting point and high lithium ion conductivity. Furthermore, the volume ratio of the cyclic carbonate to the chain carbonate in this mixed solvent is preferably regulated in the range of 2: 8 to 5: 5.
また、酢酸メチル、酢酸エチル、酢酸プロピル、プロピオン酸メチル、プロピオン酸エチル、γ-ブチロラクトン等のエステルを含む化合物を上記の溶媒とともに使用することができる。また、プロパンスルトン等のスルホン基を含む化合物;1,2-ジメトキシエタン、1,2-ジエトキシエタン、テトラヒドロフラン、1,3-ジオキサン、1,4-ジオキサン、2-メチルテトラヒドロフラン等のエーテルを含む化合物を上記の溶媒とともに使用することができる。また、ブチロニトリル、バレロニトリル、n-ヘプタンニトリル、スクシノニトリル、グルタロニトリル、アジポニトリル、ピメロニトリル、1,2,3-プロパントリカルボニトリル、1,3,5-ペンタントリカルボニトリル等のニトリルを含む化合物;ジメチルホルムアミド等のアミドを含む化合物等を上記の溶媒とともに用いることもできる。また、これらの水素原子Hの一部がフッ素原子Fにより置換されている溶媒も用いることができる。
Further, compounds containing esters such as methyl acetate, ethyl acetate, propyl acetate, methyl propionate, ethyl propionate, and γ-butyrolactone can be used together with the above solvents. Also, compounds containing a sulfone group such as propane sultone; ethers such as 1,2-dimethoxyethane, 1,2-diethoxyethane, tetrahydrofuran, 1,3-dioxane, 1,4-dioxane, 2-methyltetrahydrofuran The compounds can be used with the above solvents. Also includes nitriles such as butyronitrile, valeronitrile, n-heptanenitrile, succinonitrile, glutaronitrile, adiponitrile, pimeonitrile, 1,2,3-propanetricarbonitrile, 1,3,5-pentanetricarbonitrile, etc. Compound: A compound containing an amide such as dimethylformamide can be used together with the above solvent. A solvent in which some of these hydrogen atoms H are substituted with fluorine atoms F can also be used.
一方、非水電解質の溶質としては、例えば、LiPF6、LiBF4、LiCF3SO3、LiN(FSO2)2、LiN(CF3SO2)2、LiN(C2F5SO2)2、LiN(CF3SO2)(C4F9SO2)、LiC(C2F5SO2)3、及びLiAsF6などを用いることができる。更にフッ素含有リチウム塩に、フッ素含有リチウム塩以外のリチウム塩〔P、B、O、S、N、Clの中の一種類以上の元素を含むリチウム塩(例えば、LiClO4、LiPO2F2等)〕を加えたものを用いても良い。特に、構造式にF元素を含む電解質塩を用いると、より一層、HFによる正極活物質の腐食及び金属溶出が抑制される。
On the other hand, as the solute of the non-aqueous electrolyte, for example, LiPF 6 , LiBF 4 , LiCF 3 SO 3 , LiN (FSO 2 ) 2 , LiN (CF 3 SO 2 ) 2 , LiN (C 2 F 5 SO 2 ) 2 , LiN (CF 3 SO 2) ( C 4 F 9 SO 2), LiC (C 2 F 5 SO 2) 3, and LiAsF 6 or the like can be used. Further, a lithium salt other than the fluorine-containing lithium salt [a lithium salt containing one or more elements among P, B, O, S, N, and Cl (for example, LiClO 4 , LiPO 2 F 2, etc.) )] May be used. In particular, when an electrolyte salt containing an F element in the structural formula is used, corrosion of the positive electrode active material and metal elution due to HF are further suppressed.
以下、実験例を挙げ、本発明の実施例をより具体的に詳細に説明するが、本発明は以下の実施例に限定されるものではなく、その要旨を変更しない範囲において適宜変更して実施できるものである。
Hereinafter, examples of the present invention will be described in more detail in detail with reference to experimental examples. However, the present invention is not limited to the following examples, and may be appropriately modified and implemented without departing from the scope of the present invention. It can be done.
(実験1)
(実験例1)
[正極活物質の作製]
共沈により得られた[Ni0.5Co0.20Mn0.30](OH)2で表される水酸化物を500℃で焼成して、ニッケルコバルトマンガン複合酸化物を得た。次に、炭酸リチウムと、上記で得たニッケルコバルトマンガン複合酸化物と、酸化タングステン(WO3)とを、リチウムと、ニッケル、コバルト及びマンガンの総量と、タングステンとのモル比が1.20:1:0.005になるように、石川式らいかい乳鉢にて混合した。その後、この混合物を空気雰囲気中にて900℃で20時間熱処理後に粉砕することにより、タングステンを固溶させたLi1.07[Ni0.465Co0.186Mn0.279]O2で表されるリチウムニッケルマンガンコバルト複合酸化物を得た。得られた粉末は、走査型電子顕微鏡(SEM)による観察により、酸化タングステン(WO3)の未反応物が残っていないことを確認した。 (Experiment 1)
(Experimental example 1)
[Preparation of positive electrode active material]
A hydroxide represented by [Ni 0.5 Co 0.20 Mn 0.30 ] (OH) 2 obtained by coprecipitation was baked at 500 ° C. to obtain a nickel cobalt manganese composite oxide. Next, lithium carbonate, the nickel cobalt manganese composite oxide obtained above, tungsten oxide (WO 3 ), lithium, the total amount of nickel, cobalt and manganese, and the molar ratio of tungsten to 1.20: The mixture was mixed in a Ishikawa type mortar so as to be 1: 0.005. Thereafter, the mixture was pulverized after heat treatment at 900 ° C. for 20 hours in an air atmosphere, and expressed as Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 in which tungsten was dissolved. Lithium nickel manganese cobalt composite oxide was obtained. The obtained powder was confirmed by observation with a scanning electron microscope (SEM) to leave no unreacted tungsten oxide (WO 3 ).
(実験例1)
[正極活物質の作製]
共沈により得られた[Ni0.5Co0.20Mn0.30](OH)2で表される水酸化物を500℃で焼成して、ニッケルコバルトマンガン複合酸化物を得た。次に、炭酸リチウムと、上記で得たニッケルコバルトマンガン複合酸化物と、酸化タングステン(WO3)とを、リチウムと、ニッケル、コバルト及びマンガンの総量と、タングステンとのモル比が1.20:1:0.005になるように、石川式らいかい乳鉢にて混合した。その後、この混合物を空気雰囲気中にて900℃で20時間熱処理後に粉砕することにより、タングステンを固溶させたLi1.07[Ni0.465Co0.186Mn0.279]O2で表されるリチウムニッケルマンガンコバルト複合酸化物を得た。得られた粉末は、走査型電子顕微鏡(SEM)による観察により、酸化タングステン(WO3)の未反応物が残っていないことを確認した。 (Experiment 1)
(Experimental example 1)
[Preparation of positive electrode active material]
A hydroxide represented by [Ni 0.5 Co 0.20 Mn 0.30 ] (OH) 2 obtained by coprecipitation was baked at 500 ° C. to obtain a nickel cobalt manganese composite oxide. Next, lithium carbonate, the nickel cobalt manganese composite oxide obtained above, tungsten oxide (WO 3 ), lithium, the total amount of nickel, cobalt and manganese, and the molar ratio of tungsten to 1.20: The mixture was mixed in a Ishikawa type mortar so as to be 1: 0.005. Thereafter, the mixture was pulverized after heat treatment at 900 ° C. for 20 hours in an air atmosphere, and expressed as Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 in which tungsten was dissolved. Lithium nickel manganese cobalt composite oxide was obtained. The obtained powder was confirmed by observation with a scanning electron microscope (SEM) to leave no unreacted tungsten oxide (WO 3 ).
タングステンを固溶させたLi1.07[Ni0.465Co0.186Mn0.279]O2と、酸化タングステン(WO3)を、ハイビスディスパーミックス(プライミクス社製)を用いて混合し、正極活物質を作製した。この際、Li1.07[Ni0.465Co0.186Mn0.279]O2中におけるニッケル、コバルト及びマンガンの総量と、酸化タングステン(WO3)中のタングステンとのモル比が、1:0.05の割合となるよう混合した。得られた正極活物質中における、ニッケル、コバルト及びマンガンの総量と、固溶しているタングステンと、酸化タングステンとして含まれるタングステンは、モル比で1:0.005:0.005である。
Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 in which tungsten is solid-dissolved and tungsten oxide (WO 3 ) are mixed using a Hibis Disper mix (manufactured by Primics), A positive electrode active material was prepared. At this time, the molar ratio of the total amount of nickel, cobalt and manganese in Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 to tungsten in tungsten oxide (WO 3 ) is 1 : Mixed so that the ratio was 0.05. The total amount of nickel, cobalt, and manganese, solid solution tungsten, and tungsten contained as tungsten oxide in the obtained positive electrode active material are in a molar ratio of 1: 0.005: 0.005.
[正極極板の作製]
上記正極活物質と導電剤としてのアセチレンブラックと結着剤としてのポリフッ化ビニリデンとを質量比が93.5:5:1.5となるように秤量し、分散媒としてのN-メチル-2-ピロリドンを加えて、これらを混練して正極合剤スラリーを調製した。次いで、上記正極合剤スラリーを、アルミニウム箔からなる正極集電体の両面に塗布し、これを乾燥させた後、圧延ローラーにより圧延し、さらにアルミニウム製の集電タブを取り付けることにより、正極集電体の両面に正極合剤層が形成された正極極板を作製した。得られた正極極板について、走査型電子顕微鏡(SEM)にて観察したところ、平均粒径が150nmの酸化タングステン粒子が、リチウムニッケルマンガンコバルト複合酸化物粒子の表面に付着していた。 [Preparation of positive electrode plate]
The positive electrode active material, acetylene black as a conductive agent, and polyvinylidene fluoride as a binder are weighed so that the mass ratio is 93.5: 5: 1.5, and N-methyl-2 as a dispersion medium. -Pyrrolidone was added and these were kneaded to prepare a positive electrode mixture slurry. Next, the positive electrode mixture slurry is applied to both surfaces of a positive electrode current collector made of an aluminum foil, dried, and then rolled with a rolling roller, and a current collector tab made of aluminum is further attached. A positive electrode plate having a positive electrode mixture layer formed on both sides of the electric body was produced. When the obtained positive electrode plate was observed with a scanning electron microscope (SEM), tungsten oxide particles having an average particle size of 150 nm were adhered to the surface of the lithium nickel manganese cobalt composite oxide particles.
上記正極活物質と導電剤としてのアセチレンブラックと結着剤としてのポリフッ化ビニリデンとを質量比が93.5:5:1.5となるように秤量し、分散媒としてのN-メチル-2-ピロリドンを加えて、これらを混練して正極合剤スラリーを調製した。次いで、上記正極合剤スラリーを、アルミニウム箔からなる正極集電体の両面に塗布し、これを乾燥させた後、圧延ローラーにより圧延し、さらにアルミニウム製の集電タブを取り付けることにより、正極集電体の両面に正極合剤層が形成された正極極板を作製した。得られた正極極板について、走査型電子顕微鏡(SEM)にて観察したところ、平均粒径が150nmの酸化タングステン粒子が、リチウムニッケルマンガンコバルト複合酸化物粒子の表面に付着していた。 [Preparation of positive electrode plate]
The positive electrode active material, acetylene black as a conductive agent, and polyvinylidene fluoride as a binder are weighed so that the mass ratio is 93.5: 5: 1.5, and N-methyl-2 as a dispersion medium. -Pyrrolidone was added and these were kneaded to prepare a positive electrode mixture slurry. Next, the positive electrode mixture slurry is applied to both surfaces of a positive electrode current collector made of an aluminum foil, dried, and then rolled with a rolling roller, and a current collector tab made of aluminum is further attached. A positive electrode plate having a positive electrode mixture layer formed on both sides of the electric body was produced. When the obtained positive electrode plate was observed with a scanning electron microscope (SEM), tungsten oxide particles having an average particle size of 150 nm were adhered to the surface of the lithium nickel manganese cobalt composite oxide particles.
[負極活物質の作製]
市販試薬であるLiOH・H2OとTiO2の原料粉末を、Li/Tiのモル混合比が化学量論比よりもややLi過剰となるように秤量し、これらを乳鉢で混合した。原料のTiO2には、アナターゼ型の結晶構造を有するものを用いた。混合後の原料粉末をAl2O3製のるつぼに入れ、大気雰囲気中で850℃の熱処理を12時間行い、Li4Ti5O12を得た。 [Production of negative electrode active material]
LiOH · H 2 O and TiO 2 raw material powders, which are commercially available reagents, were weighed so that the Li / Ti molar mixing ratio was slightly more Li than the stoichiometric ratio, and these were mixed in a mortar. As the raw material TiO 2 , one having an anatase type crystal structure was used. The mixed raw material powder was put in an Al 2 O 3 crucible and heat-treated at 850 ° C. for 12 hours in an air atmosphere to obtain Li 4 Ti 5 O 12 .
市販試薬であるLiOH・H2OとTiO2の原料粉末を、Li/Tiのモル混合比が化学量論比よりもややLi過剰となるように秤量し、これらを乳鉢で混合した。原料のTiO2には、アナターゼ型の結晶構造を有するものを用いた。混合後の原料粉末をAl2O3製のるつぼに入れ、大気雰囲気中で850℃の熱処理を12時間行い、Li4Ti5O12を得た。 [Production of negative electrode active material]
LiOH · H 2 O and TiO 2 raw material powders, which are commercially available reagents, were weighed so that the Li / Ti molar mixing ratio was slightly more Li than the stoichiometric ratio, and these were mixed in a mortar. As the raw material TiO 2 , one having an anatase type crystal structure was used. The mixed raw material powder was put in an Al 2 O 3 crucible and heat-treated at 850 ° C. for 12 hours in an air atmosphere to obtain Li 4 Ti 5 O 12 .
熱処理後の材料をるつぼから取り出して乳鉢にて粉砕し、Li4Ti5O12の粗粉末を得た。得られたLi4Ti5O12粗粉末の粉末X線回折(リガク製)による測定を行ったところ、空間群がFd3mに帰属されるスピネル型構造からなる単相の回折パターンが得られた。
The heat-treated material was taken out from the crucible and pulverized in a mortar to obtain a coarse powder of Li 4 Ti 5 O 12 . When the obtained Li 4 Ti 5 O 12 coarse powder was measured by powder X-ray diffraction (manufactured by Rigaku), a single-phase diffraction pattern having a spinel structure in which the space group was attributed to Fd3m was obtained.
得られたLi4Ti5O12粗粉末を用いて、ジェットミル粉砕および分級の処理を行った。得られた粉末は、走査型電子顕微鏡(SEM)による観察から、粒径が0.7μm程度の単粒子に粉砕されていることを確認した。
The obtained Li 4 Ti 5 O 12 coarse powder was used for jet mill pulverization and classification. It was confirmed that the obtained powder was pulverized into single particles having a particle size of about 0.7 μm from observation with a scanning electron microscope (SEM).
分級処理後のLi4Ti5O12粉末を、比表面積測定装置(トライスターII 3020、島津製作所製)を用いてBET比表面積を測定したところ、6.8m2/gであった。
When the BET specific surface area of the Li 4 Ti 5 O 12 powder after the classification treatment was measured using a specific surface area measurement device (Tristar II 3020, manufactured by Shimadzu Corporation), it was 6.8 m 2 / g.
[負極極板の作製]
上記の方法により得られたLi4Ti5O12と、導電剤としてのカーボンブラックと、結着剤としてのポリフッ化ビニリデンと、添加剤としてのフッ化黒鉛(ダイキン工業製、(CF)n)とを、質量比で、Li4Ti5O12:アセチレンブラック:PVdF:(CF)n=100:7:3:2.33となるように秤量し、分散媒としてのN-メチル-2-ピロリドンを加えて、これらを混練して負極合剤スラリーを調製した。次いで、上記負極合剤スラリーを、アルミニウム箔からなる負極集電体の両面に塗布し、これを乾燥させた後、圧延ローラーにより圧延し、さらにニッケル製の集電タブを取り付けることにより、負極集電体の両面に負極合剤層が形成された負極極板を作製した。 [Production of negative electrode plate]
Li 4 Ti 5 O 12 obtained by the above method, carbon black as a conductive agent, polyvinylidene fluoride as a binder, and graphite fluoride as an additive (manufactured by Daikin Industries, (CF) n ) Are weighed so that, by mass ratio, Li 4 Ti 5 O 12 : acetylene black: PVdF: (CF) n = 100: 7: 3: 2.33, N-methyl-2- Pyrrolidone was added and these were kneaded to prepare a negative electrode mixture slurry. Next, the negative electrode mixture slurry is applied to both surfaces of a negative electrode current collector made of aluminum foil, dried, and then rolled with a rolling roller, and further a nickel current collecting tab is attached to thereby prepare a negative electrode current collector. A negative electrode plate in which a negative electrode mixture layer was formed on both sides of the electric body was produced.
上記の方法により得られたLi4Ti5O12と、導電剤としてのカーボンブラックと、結着剤としてのポリフッ化ビニリデンと、添加剤としてのフッ化黒鉛(ダイキン工業製、(CF)n)とを、質量比で、Li4Ti5O12:アセチレンブラック:PVdF:(CF)n=100:7:3:2.33となるように秤量し、分散媒としてのN-メチル-2-ピロリドンを加えて、これらを混練して負極合剤スラリーを調製した。次いで、上記負極合剤スラリーを、アルミニウム箔からなる負極集電体の両面に塗布し、これを乾燥させた後、圧延ローラーにより圧延し、さらにニッケル製の集電タブを取り付けることにより、負極集電体の両面に負極合剤層が形成された負極極板を作製した。 [Production of negative electrode plate]
Li 4 Ti 5 O 12 obtained by the above method, carbon black as a conductive agent, polyvinylidene fluoride as a binder, and graphite fluoride as an additive (manufactured by Daikin Industries, (CF) n ) Are weighed so that, by mass ratio, Li 4 Ti 5 O 12 : acetylene black: PVdF: (CF) n = 100: 7: 3: 2.33, N-methyl-2- Pyrrolidone was added and these were kneaded to prepare a negative electrode mixture slurry. Next, the negative electrode mixture slurry is applied to both surfaces of a negative electrode current collector made of aluminum foil, dried, and then rolled with a rolling roller, and further a nickel current collecting tab is attached to thereby prepare a negative electrode current collector. A negative electrode plate in which a negative electrode mixture layer was formed on both sides of the electric body was produced.
[非水電解質の調製]
PC(プロピレンカーボネート)とEMC(エチルメチルカーボネート)とDMC(ジメチルカーボネート)とを25:35:40の体積比で混合した混合溶媒に、溶質としてのLiPF6を1.2モル/リットルの割合で溶解させた。 [Preparation of non-aqueous electrolyte]
In a mixed solvent in which PC (propylene carbonate), EMC (ethyl methyl carbonate), and DMC (dimethyl carbonate) were mixed at a volume ratio of 25:35:40, LiPF 6 as a solute was added at a ratio of 1.2 mol / liter. Dissolved.
PC(プロピレンカーボネート)とEMC(エチルメチルカーボネート)とDMC(ジメチルカーボネート)とを25:35:40の体積比で混合した混合溶媒に、溶質としてのLiPF6を1.2モル/リットルの割合で溶解させた。 [Preparation of non-aqueous electrolyte]
In a mixed solvent in which PC (propylene carbonate), EMC (ethyl methyl carbonate), and DMC (dimethyl carbonate) were mixed at a volume ratio of 25:35:40, LiPF 6 as a solute was added at a ratio of 1.2 mol / liter. Dissolved.
[電池の作製]
このようにして得た正極および負極を、セルロースからなるセパレータを介して対向するように巻取って巻取り体を作製し、105℃150分の条件で真空乾燥した後、アルゴン雰囲気下のグローブボックス中にて、巻取り体を非水電解質とともにアルミニウムラミネートに封入することにより、電池A1を作製した。電池A1の設計容量は18.5mAhであった。 [Production of battery]
The positive electrode and the negative electrode thus obtained are wound so as to face each other with a separator made of cellulose, and a wound body is produced. After vacuum drying at 105 ° C. for 150 minutes, a glove box in an argon atmosphere Inside, the wound body was encapsulated in an aluminum laminate together with a non-aqueous electrolyte to produce a battery A1. The design capacity of the battery A1 was 18.5 mAh.
このようにして得た正極および負極を、セルロースからなるセパレータを介して対向するように巻取って巻取り体を作製し、105℃150分の条件で真空乾燥した後、アルゴン雰囲気下のグローブボックス中にて、巻取り体を非水電解質とともにアルミニウムラミネートに封入することにより、電池A1を作製した。電池A1の設計容量は18.5mAhであった。 [Production of battery]
The positive electrode and the negative electrode thus obtained are wound so as to face each other with a separator made of cellulose, and a wound body is produced. After vacuum drying at 105 ° C. for 150 minutes, a glove box in an argon atmosphere Inside, the wound body was encapsulated in an aluminum laminate together with a non-aqueous electrolyte to produce a battery A1. The design capacity of the battery A1 was 18.5 mAh.
(実験例2)
正極活物質の作製において、タングステンを固溶させたLi1.07[Ni0.465Co0.186Mn0.279]O2に、WO3を混合しなかったこと以外は、上記実験例1と同様にして電池A2を作製した。 (Experimental example 2)
Experimental Example 1 except that WO 3 was not mixed with Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 in which tungsten was dissolved in the production of the positive electrode active material. A battery A2 was produced in the same manner as described above.
正極活物質の作製において、タングステンを固溶させたLi1.07[Ni0.465Co0.186Mn0.279]O2に、WO3を混合しなかったこと以外は、上記実験例1と同様にして電池A2を作製した。 (Experimental example 2)
Experimental Example 1 except that WO 3 was not mixed with Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 in which tungsten was dissolved in the production of the positive electrode active material. A battery A2 was produced in the same manner as described above.
(実験例3)
正極活物質の作製において、混合物を空気雰囲気中にて900℃で20時間熱処理する際に、WO3を加えなかったこと以外、即ち、Li1.07[Ni0.465Co0.186Mn0.279]O2にタングステンを固溶させなかったこと以外は、上記実験例1と同様にして電池A3を作製した。 (Experimental example 3)
In the preparation of the positive electrode active material, when the mixture was heat-treated at 900 ° C. for 20 hours in an air atmosphere, except that WO 3 was not added, that is, Li 1.07 [Ni 0.465 Co 0.186 Mn 0 .279 ] Battery A3 was produced in the same manner as in Experimental Example 1 except that tungsten was not dissolved in O 2 .
正極活物質の作製において、混合物を空気雰囲気中にて900℃で20時間熱処理する際に、WO3を加えなかったこと以外、即ち、Li1.07[Ni0.465Co0.186Mn0.279]O2にタングステンを固溶させなかったこと以外は、上記実験例1と同様にして電池A3を作製した。 (Experimental example 3)
In the preparation of the positive electrode active material, when the mixture was heat-treated at 900 ° C. for 20 hours in an air atmosphere, except that WO 3 was not added, that is, Li 1.07 [Ni 0.465 Co 0.186 Mn 0 .279 ] Battery A3 was produced in the same manner as in Experimental Example 1 except that tungsten was not dissolved in O 2 .
(実験例4)
正極活物質の作製において、Li1.07[Ni0.465Co0.186Mn0.279]O2にタングステンを固溶させず、かつ、得られたLi1.07[Ni0.465Co0.186Mn0.279]O2に、WO3を混合しなかったこと以外は、上記実験例1と同様にして電池A4を作製した。 (Experimental example 4)
In production of the positive electrode active material, tungsten was not dissolved in Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 , and the obtained Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 was not mixed with WO 3 to produce a battery A4 in the same manner as in Experimental Example 1 described above.
正極活物質の作製において、Li1.07[Ni0.465Co0.186Mn0.279]O2にタングステンを固溶させず、かつ、得られたLi1.07[Ni0.465Co0.186Mn0.279]O2に、WO3を混合しなかったこと以外は、上記実験例1と同様にして電池A4を作製した。 (Experimental example 4)
In production of the positive electrode active material, tungsten was not dissolved in Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 , and the obtained Li 1.07 [Ni 0.465 Co 0.186 Mn 0.279 ] O 2 was not mixed with WO 3 to produce a battery A4 in the same manner as in Experimental Example 1 described above.
(実験)
<充放電条件>
電池A1~電池A4の各電池について、以下の条件で25サイクル充放電した。
(充放電条件)
1サイクル目の充放電条件:25℃の温度条件下において、0.19It(3.5mA)の充電電流で電池電圧が2.65Vまで定電流充電を行い、次に0.19It(3.5mA)の放電電流で1.5Vまで定電流放電した。
2サイクル目~5サイクル目の充放電条件:25℃の温度条件下において、1.95It(36mA)の充電電流で電池電圧が2.65Vまで定電流充電を行い、更に電池電圧2.65Vの定電圧で電流が0.03It(0.5mA)になるまでになるまで定電圧充電を行った。次に、各セルを1.95It(36mA)の放電電流で1.5Vまで定電流放電した。
尚、上記充電と放電との間の休止間隔は10分間とした。 (Experiment)
<Charging / discharging conditions>
The batteries A1 to A4 were charged and discharged for 25 cycles under the following conditions.
(Charge / discharge conditions)
Charging / discharging conditions for the first cycle: Under a temperature condition of 25 ° C., the battery voltage was charged to 2.65 V with a charging current of 0.19 It (3.5 mA), and then 0.19 It (3.5 mA). ) Was discharged at a constant current up to 1.5V.
Charging / discharging conditions for the 2nd to 5th cycles: Under a temperature condition of 25 ° C., the battery voltage was constant-current charged to 2.65V with a charging current of 1.95 It (36 mA), and further the battery voltage of 2.65V Constant voltage charging was performed until the current reached 0.03 It (0.5 mA) at a constant voltage. Next, each cell was discharged at a constant current to 1.5 V with a discharge current of 1.95 It (36 mA).
The pause interval between the charge and discharge was 10 minutes.
<充放電条件>
電池A1~電池A4の各電池について、以下の条件で25サイクル充放電した。
(充放電条件)
1サイクル目の充放電条件:25℃の温度条件下において、0.19It(3.5mA)の充電電流で電池電圧が2.65Vまで定電流充電を行い、次に0.19It(3.5mA)の放電電流で1.5Vまで定電流放電した。
2サイクル目~5サイクル目の充放電条件:25℃の温度条件下において、1.95It(36mA)の充電電流で電池電圧が2.65Vまで定電流充電を行い、更に電池電圧2.65Vの定電圧で電流が0.03It(0.5mA)になるまでになるまで定電圧充電を行った。次に、各セルを1.95It(36mA)の放電電流で1.5Vまで定電流放電した。
尚、上記充電と放電との間の休止間隔は10分間とした。 (Experiment)
<Charging / discharging conditions>
The batteries A1 to A4 were charged and discharged for 25 cycles under the following conditions.
(Charge / discharge conditions)
Charging / discharging conditions for the first cycle: Under a temperature condition of 25 ° C., the battery voltage was charged to 2.65 V with a charging current of 0.19 It (3.5 mA), and then 0.19 It (3.5 mA). ) Was discharged at a constant current up to 1.5V.
Charging / discharging conditions for the 2nd to 5th cycles: Under a temperature condition of 25 ° C., the battery voltage was constant-current charged to 2.65V with a charging current of 1.95 It (36 mA), and further the battery voltage of 2.65V Constant voltage charging was performed until the current reached 0.03 It (0.5 mA) at a constant voltage. Next, each cell was discharged at a constant current to 1.5 V with a discharge current of 1.95 It (36 mA).
The pause interval between the charge and discharge was 10 minutes.
<ガス発生量の算出>
充放電前及び5サイクル充放電後の各電池について、アルキメデス法に基づき、大気中における電池質量と水中における電池質量の差を測定し、電池にかかる浮力(体積)を算出した。充放電試験前の浮力と5サイクル充放電試験後の浮力の差をガス発生量とした。 <Calculation of gas generation amount>
About each battery before charging / discharging and after 5 cycles charging / discharging, based on the Archimedes method, the difference of the battery mass in air | atmosphere and the battery mass in water was measured, and the buoyancy (volume) concerning a battery was computed. The difference between the buoyancy before the charge / discharge test and the buoyancy after the 5-cycle charge / discharge test was defined as the amount of gas generated.
充放電前及び5サイクル充放電後の各電池について、アルキメデス法に基づき、大気中における電池質量と水中における電池質量の差を測定し、電池にかかる浮力(体積)を算出した。充放電試験前の浮力と5サイクル充放電試験後の浮力の差をガス発生量とした。 <Calculation of gas generation amount>
About each battery before charging / discharging and after 5 cycles charging / discharging, based on the Archimedes method, the difference of the battery mass in air | atmosphere and the battery mass in water was measured, and the buoyancy (volume) concerning a battery was computed. The difference between the buoyancy before the charge / discharge test and the buoyancy after the 5-cycle charge / discharge test was defined as the amount of gas generated.
正極活物質中にタングステンが固溶し、且つ、正極活物質表面に酸化タングステンが付着している正極活物質を用い、チタン酸リチウムからなる負極活物質を用いた電池A1は、タングステン固溶及び酸化タングステン付着を行わなかった正極活物質を用いた電池A4と比較して、ガス発生量が少なかった。一方、タングステンが固溶した正極活物質と、チタン酸リチウムからなる負極活物質を用いた電池A2や、酸化タングステンが付着した正極活物質と、チタン酸リチウムからなる負極活物質を用いた電池A3は、電池A4と比較してガス発生量が多かった。
A battery A1 using a positive electrode active material in which tungsten is solid-dissolved in the positive electrode active material and tungsten oxide is attached to the surface of the positive electrode active material, and using a negative electrode active material made of lithium titanate, Compared to battery A4 using a positive electrode active material that was not attached with tungsten oxide, the amount of gas generated was small. On the other hand, a battery A2 using a positive electrode active material in which tungsten is dissolved and a negative electrode active material made of lithium titanate, or a battery A3 using a positive electrode active material to which tungsten oxide is adhered and a negative electrode active material made of lithium titanate. Produced more gas than the battery A4.
電池A1~A3においては、タングステンの有する触媒作用により、リチウムニッケルコバルトマンガン複合酸化物上での電解液の酸化分解が促進され、分解物被膜が生成したと考えられる。電池A1においては、電解液の酸化分解によって、HFから正極活物質を保護する機能の高い分解物被膜が生成したため、ガス発生量が少なくなったと考えられる。一方、電池A2及びA3においては、電池A1と同様、正極活物質上に分解物被膜が生成するものの、この被膜によっては、HFと正極活物質との反応が抑制されず、ガス発生量が増えたと考えられる。
In the batteries A1 to A3, it is considered that the catalytic action of tungsten promotes the oxidative decomposition of the electrolytic solution on the lithium nickel cobalt manganese composite oxide, thereby forming a decomposition product film. In the battery A1, it is considered that the amount of gas generation was reduced because the decomposition film having a high function of protecting the positive electrode active material from HF was generated by the oxidative decomposition of the electrolytic solution. On the other hand, in the batteries A2 and A3, as in the battery A1, a decomposition product film is formed on the positive electrode active material. However, depending on this film, the reaction between HF and the positive electrode active material is not suppressed, and the amount of gas generation increases. It is thought.
電池A4においては、被膜形成が進まないため、HFにより正極活物質が腐食してしまい、ガス発生を抑制することができなかったと考えられる。
In Battery A4, since film formation does not proceed, it is considered that the positive electrode active material was corroded by HF, and gas generation could not be suppressed.
電池A1~A4においては、セパレータとしてセルロース製のセパレータを用いたが、セパレータとしてポリオレフィン等を用いても、同様の傾向があると推測される。ただし、セルロース製のセパレータは、ポリオレフィン等よりも吸着水が多いので、セルロース製のセパレータを用いたほうが、ガス発生を抑制する効果は、より一層発揮されると考えられる。
In the batteries A1 to A4, a cellulose separator was used as the separator, but it is estimated that the same tendency can be obtained even when polyolefin or the like is used as the separator. However, since the cellulose separator has more adsorbed water than polyolefin or the like, it is considered that the effect of suppressing gas generation is further exhibited by using the cellulose separator.
(参考実験1)
(実験例5)
塊状の黒鉛粉末と、増粘剤としてのカルボキシメチルセルロース(CMC)と、結着剤としてのスチレンブタジエンゴム(SBR)とを、質量比で、黒鉛:CMC:SBR=100:1:1.5となるように秤量し、分散媒としての水を加えて、これらを混練して負極合剤スラリーを調製したこと、銅箔からなる負極集電体の両面に負極合剤スラリーを塗布したこと、及び、EC(エチレンカーボネート)とEMC(エチルメチルカーボネート)とDMC(ジメチルカーボネート)を3:3:4の体積比で混合した混合溶媒に、溶質としてのLiPF6を1.0モル/リットルの割合で溶解させた非水電解質を用いたこと以外は、実験例1と同様にして、電池B1を作製した。塊状の黒鉛粉末のBET比表面積は6.6m2/gであった。 (Reference Experiment 1)
(Experimental example 5)
Lumped graphite powder, carboxymethyl cellulose (CMC) as a thickening agent, and styrene butadiene rubber (SBR) as a binder, in a mass ratio, graphite: CMC: SBR = 100: 1: 1.5 And adding water as a dispersion medium, kneading them to prepare a negative electrode mixture slurry, applying a negative electrode mixture slurry on both sides of a negative electrode current collector made of copper foil, and EC (ethylene carbonate), EMC (ethyl methyl carbonate) and DMC (dimethyl carbonate) mixed in a volume ratio of 3: 3: 4, LiPF 6 as a solute at a ratio of 1.0 mol / liter A battery B1 was produced in the same manner as in Experimental Example 1, except that the dissolved nonaqueous electrolyte was used. The BET specific surface area of the massive graphite powder was 6.6 m 2 / g.
(実験例5)
塊状の黒鉛粉末と、増粘剤としてのカルボキシメチルセルロース(CMC)と、結着剤としてのスチレンブタジエンゴム(SBR)とを、質量比で、黒鉛:CMC:SBR=100:1:1.5となるように秤量し、分散媒としての水を加えて、これらを混練して負極合剤スラリーを調製したこと、銅箔からなる負極集電体の両面に負極合剤スラリーを塗布したこと、及び、EC(エチレンカーボネート)とEMC(エチルメチルカーボネート)とDMC(ジメチルカーボネート)を3:3:4の体積比で混合した混合溶媒に、溶質としてのLiPF6を1.0モル/リットルの割合で溶解させた非水電解質を用いたこと以外は、実験例1と同様にして、電池B1を作製した。塊状の黒鉛粉末のBET比表面積は6.6m2/gであった。 (Reference Experiment 1)
(Experimental example 5)
Lumped graphite powder, carboxymethyl cellulose (CMC) as a thickening agent, and styrene butadiene rubber (SBR) as a binder, in a mass ratio, graphite: CMC: SBR = 100: 1: 1.5 And adding water as a dispersion medium, kneading them to prepare a negative electrode mixture slurry, applying a negative electrode mixture slurry on both sides of a negative electrode current collector made of copper foil, and EC (ethylene carbonate), EMC (ethyl methyl carbonate) and DMC (dimethyl carbonate) mixed in a volume ratio of 3: 3: 4, LiPF 6 as a solute at a ratio of 1.0 mol / liter A battery B1 was produced in the same manner as in Experimental Example 1, except that the dissolved nonaqueous electrolyte was used. The BET specific surface area of the massive graphite powder was 6.6 m 2 / g.
(実験例6)
負極合剤スラリーを実験例5と同様に調整したこと、及び、実験例5と同様の負極集電体と非水電解質を用いたこと以外は、実験例2と同様にして、電池B2を作製した。 (Experimental example 6)
A battery B2 was produced in the same manner as in Experimental Example 2, except that the negative electrode mixture slurry was adjusted in the same manner as in Experimental Example 5 and that the same negative electrode current collector and nonaqueous electrolyte as in Experimental Example 5 were used. did.
負極合剤スラリーを実験例5と同様に調整したこと、及び、実験例5と同様の負極集電体と非水電解質を用いたこと以外は、実験例2と同様にして、電池B2を作製した。 (Experimental example 6)
A battery B2 was produced in the same manner as in Experimental Example 2, except that the negative electrode mixture slurry was adjusted in the same manner as in Experimental Example 5 and that the same negative electrode current collector and nonaqueous electrolyte as in Experimental Example 5 were used. did.
(実験例7)
負極合剤スラリーを実験例5と同様に調整したこと、及び、実験例5と同様の負極集電体と非水電解質を用いたこと以外は、実験例3と同様にして、電池B3を作製した。 (Experimental example 7)
A battery B3 was produced in the same manner as in Experimental Example 3, except that the negative electrode mixture slurry was adjusted in the same manner as in Experimental Example 5 and that the same negative electrode current collector and nonaqueous electrolyte as in Experimental Example 5 were used. did.
負極合剤スラリーを実験例5と同様に調整したこと、及び、実験例5と同様の負極集電体と非水電解質を用いたこと以外は、実験例3と同様にして、電池B3を作製した。 (Experimental example 7)
A battery B3 was produced in the same manner as in Experimental Example 3, except that the negative electrode mixture slurry was adjusted in the same manner as in Experimental Example 5 and that the same negative electrode current collector and nonaqueous electrolyte as in Experimental Example 5 were used. did.
(実験例8)
負極合剤スラリーを実験例5と同様に調整したこと、及び、実験例5と同様の負極集電体と非水電解質を用いたこと以外は、実験例4と同様にして、電池B4を作製した。 (Experimental example 8)
A battery B4 was produced in the same manner as in Experimental Example 4 except that the negative electrode mixture slurry was adjusted in the same manner as in Experimental Example 5 and that the same negative electrode current collector and nonaqueous electrolyte as in Experimental Example 5 were used. did.
負極合剤スラリーを実験例5と同様に調整したこと、及び、実験例5と同様の負極集電体と非水電解質を用いたこと以外は、実験例4と同様にして、電池B4を作製した。 (Experimental example 8)
A battery B4 was produced in the same manner as in Experimental Example 4 except that the negative electrode mixture slurry was adjusted in the same manner as in Experimental Example 5 and that the same negative electrode current collector and nonaqueous electrolyte as in Experimental Example 5 were used. did.
なお、負極活物質としてチタン酸リチウムを用いた実験例1~4においては、溶媒としてPCを含む電解液を用いているのに対し、負極活物質として黒鉛を用いた実験例5~8においては、溶媒としてECを含む電解液を用いている。これは、負極活物質として炭素材料を用いる場合、PCが含まれると、不可逆な充電反応が起きる虞があるためである。
In Experimental Examples 1 to 4 using lithium titanate as the negative electrode active material, an electrolytic solution containing PC as a solvent was used, whereas in Experimental Examples 5 to 8 using graphite as the negative electrode active material, An electrolytic solution containing EC as a solvent is used. This is because when a carbon material is used as the negative electrode active material, if PC is included, an irreversible charging reaction may occur.
(実験)
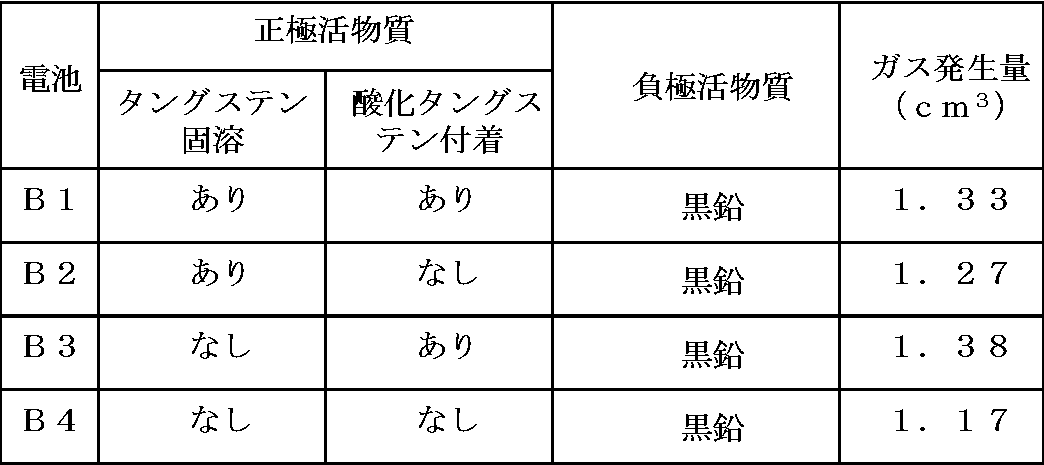
上記実験1と同様にして、電池B1~B4について、5サイクル充放電後のガス発生量を算出した。 (Experiment)
In the same manner as in Experiment 1, the amount of gas generated after 5 cycles of charge and discharge was calculated for batteries B1 to B4.
上記実験1と同様にして、電池B1~B4について、5サイクル充放電後のガス発生量を算出した。 (Experiment)
In the same manner as in Experiment 1, the amount of gas generated after 5 cycles of charge and discharge was calculated for batteries B1 to B4.
負極活物質としてチタン酸リチウムを用いた場合、電池A1と電池A2及び電池A3とを比較すると、電池A1のガス発生量が少なかったのに対し、負極活物質として黒鉛を用いた場合は、電池B4におけるガス発生量が最も少なかった。
When lithium titanate was used as the negative electrode active material, the amount of gas generated in battery A1 was small when battery A1, battery A2, and battery A3 were compared. When graphite was used as the negative electrode active material, the battery The amount of gas generated in B4 was the smallest.
電池B1~B3においては、電池A1~A3と同様、タングステンの有する触媒作用により、リチウムニッケルコバルトマンガン複合酸化物上での電解液の酸化分解が促進され、分解物被膜が生成する際にガスが発生すると考えられる。ここで、電池B1において生成する被膜は、電池B2や電池B3で生成する分解物被膜と比較して、HFから正極活物質を保護しやすいものの、電池B1~B4においては、負極活物質として黒鉛を用いるため、電池内部に混入する水分が少なく、HFの生成も少なく、このため、電池B1のガス発生量が電池B4のガス発生量よりも少なくなることがなかったと考えられる。
In the batteries B1 to B3, as in the batteries A1 to A3, the catalytic action of tungsten promotes the oxidative decomposition of the electrolytic solution on the lithium nickel cobalt manganese composite oxide, and gas is generated when the decomposition product film is formed. It is thought to occur. Here, the coating produced in the battery B1 is easier to protect the positive electrode active material from HF than the decomposition product coating produced in the battery B2 or the battery B3, but in the batteries B1 to B4, graphite is used as the negative electrode active material. Therefore, it is considered that the amount of gas generated in the battery B1 did not become smaller than the amount of gas generated in the battery B4.
電池B4においては、正極にタングステンが含まれていない。このため、電池B1~B3と比較して、電解液の酸化分解による分解物生成反応及び分解物生成時のガス発生が少ないため、電池B4におけるガス発生量が最も少なかったと考えられる。
Battery B4 does not contain tungsten in the positive electrode. For this reason, compared with the batteries B1 to B3, it is considered that the amount of gas generated in the battery B4 was the smallest because the decomposition product generation reaction due to the oxidative decomposition of the electrolytic solution and the generation of gas during the generation of the decomposition product were small.
表1及び表2から、負極活物質としてチタン酸リチウムを用い、正極活物質中にタングステンが固溶し、且つ、正極活物質表面に酸化タングステンが存在するときにのみ、特異的にガス発生量が減ることがわかる。
From Tables 1 and 2, lithium titanate is used as the negative electrode active material, and only when a solid solution of tungsten is present in the positive electrode active material and tungsten oxide is present on the surface of the positive electrode active material, a specific amount of gas generated Can be seen to decrease.
負極活物質として黒鉛を用いた電池B1~B4では、負極活物質としてチタン酸リチウムを用いた電池A1~A4と比較して、ガス発生量は少なかった。これは、黒鉛とチタン酸リチウムと比較した場合、黒鉛表面に存在する水酸基が少ないため、電池内部への水分の持込が少なかったためと考えられる。なお、黒鉛を用いた場合には、チタン酸リチウムを用いた場合と比べて優れた入出力特性が得られない。
The batteries B1 to B4 using graphite as the negative electrode active material produced less gas than the batteries A1 to A4 using lithium titanate as the negative electrode active material. This is presumably because when compared with graphite and lithium titanate, there were few hydroxyl groups present on the surface of the graphite, so there was less moisture in the battery. When graphite is used, excellent input / output characteristics cannot be obtained as compared with the case where lithium titanate is used.
Claims (7)
- 正極と、負極と、正極と負極との間に配置されたセパレータと、非水電解質とを備える非水電解質二次電池であって、
前記正極はリチウム遷移金属酸化物を含む正極活物質を備え、
前記正極は酸化タングステンを含み、
前記リチウム遷移金属酸化物にタングステンが固溶し、前記リチウム遷移金属酸化物の表面に酸化タングステンが付着し、
前記負極はチタン酸リチウムを含む、非水電解質二次電池。 A non-aqueous electrolyte secondary battery comprising a positive electrode, a negative electrode, a separator disposed between the positive electrode and the negative electrode, and a non-aqueous electrolyte,
The positive electrode comprises a positive electrode active material containing a lithium transition metal oxide,
The positive electrode includes tungsten oxide;
Tungsten is dissolved in the lithium transition metal oxide, tungsten oxide adheres to the surface of the lithium transition metal oxide,
The negative electrode is a non-aqueous electrolyte secondary battery containing lithium titanate. - 前記チタン酸リチウムのBET比表面積は2.0m2/g以上である、請求項1に記載の非水電解質二次電池。 The nonaqueous electrolyte secondary battery according to claim 1, wherein the lithium titanate has a BET specific surface area of 2.0 m 2 / g or more.
- 前記正極に含まれる酸化タングステンにおけるタングステン元素は、前記リチウム遷移金属酸化物中におけるリチウムを除く遷移金属に対し、0.01~3.0モル%である、請求項1または2に記載の非水電解質二次電池。 The non-aqueous solution according to claim 1, wherein the tungsten element in the tungsten oxide contained in the positive electrode is 0.01 to 3.0 mol% with respect to the transition metal excluding lithium in the lithium transition metal oxide. Electrolyte secondary battery.
- 前記リチウム遷移金属酸化物に固溶するタングステン元素は、前記リチウム遷移金属酸化物中におけるリチウムを除く遷移金属に対し、0.01~3.0モル%である、請求項1~3のいずれかに記載の非水電解質二次電池。 The tungsten element dissolved in the lithium transition metal oxide is 0.01 to 3.0 mol% with respect to the transition metal excluding lithium in the lithium transition metal oxide. The non-aqueous electrolyte secondary battery described in 1.
- 前記酸化タングステンはWO3を含む、請求項1~4のいずれかに記載の非水電解質二次電池。 The tungsten oxide comprises WO 3, a non-aqueous electrolyte secondary battery according to any one of claims 1-4.
- 前記リチウム遷移金属酸化物は、ニッケル、コバルト及びマンガンを含む、請求項1~5のいずれかに記載の非水電解質二次電池。 6. The nonaqueous electrolyte secondary battery according to claim 1, wherein the lithium transition metal oxide contains nickel, cobalt, and manganese.
- 前記セパレータは、セルロースを含む、請求項1~6のいずれかに記載の非水電解質二次電池。 The non-aqueous electrolyte secondary battery according to any one of claims 1 to 6, wherein the separator includes cellulose.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014218789 | 2014-10-28 | ||
| JP2014-218789 | 2014-10-28 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2016067522A1 true WO2016067522A1 (en) | 2016-05-06 |
Family
ID=55856891
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2015/004968 WO2016067522A1 (en) | 2014-10-28 | 2015-09-30 | Nonaqueous electrolyte secondary battery |
Country Status (1)
| Country | Link |
|---|---|
| WO (1) | WO2016067522A1 (en) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016170756A1 (en) * | 2015-04-22 | 2016-10-27 | パナソニックIpマネジメント株式会社 | Nonaqueous electrolyte secondary battery |
| WO2017094238A1 (en) * | 2015-11-30 | 2017-06-08 | パナソニックIpマネジメント株式会社 | Nonaqueous electrolyte secondary battery |
| JP2017107762A (en) * | 2015-12-10 | 2017-06-15 | 日立オートモティブシステムズ株式会社 | Secondary battery |
| WO2019176389A1 (en) * | 2018-03-13 | 2019-09-19 | 三洋電機株式会社 | Non-aqueous electrolyte secondary battery |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013131437A (en) * | 2011-12-22 | 2013-07-04 | Nichia Chem Ind Ltd | Positive electrode composition for nonaqueous electrolyte secondary battery and method for producing positive electrode slurry for nonaqueous electrolyte secondary battery |
| JP2013161644A (en) * | 2012-02-03 | 2013-08-19 | Toyota Motor Corp | Lithium secondary battery |
| JP2013235653A (en) * | 2012-05-02 | 2013-11-21 | Toyota Motor Corp | Sealed nonaqueous electrolyte secondary battery |
| JP2014063668A (en) * | 2012-09-21 | 2014-04-10 | Fujifilm Corp | Electrolyte for nonaqueous secondary battery and secondary battery |
| JP2014183031A (en) * | 2013-03-21 | 2014-09-29 | Toyota Motor Corp | Lithium ion secondary battery, and method for manufacturing the same |
| WO2014155990A1 (en) * | 2013-03-26 | 2014-10-02 | 三洋電機株式会社 | Positive electrode for nonaqueous electrolyte secondary batteries, and nonaqueous electrolyte secondary battery |
| JP2014194842A (en) * | 2011-07-26 | 2014-10-09 | Panasonic Corp | Lithium ion secondary battery |
-
2015
- 2015-09-30 WO PCT/JP2015/004968 patent/WO2016067522A1/en active Application Filing
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014194842A (en) * | 2011-07-26 | 2014-10-09 | Panasonic Corp | Lithium ion secondary battery |
| JP2013131437A (en) * | 2011-12-22 | 2013-07-04 | Nichia Chem Ind Ltd | Positive electrode composition for nonaqueous electrolyte secondary battery and method for producing positive electrode slurry for nonaqueous electrolyte secondary battery |
| JP2013161644A (en) * | 2012-02-03 | 2013-08-19 | Toyota Motor Corp | Lithium secondary battery |
| JP2013235653A (en) * | 2012-05-02 | 2013-11-21 | Toyota Motor Corp | Sealed nonaqueous electrolyte secondary battery |
| JP2014063668A (en) * | 2012-09-21 | 2014-04-10 | Fujifilm Corp | Electrolyte for nonaqueous secondary battery and secondary battery |
| JP2014183031A (en) * | 2013-03-21 | 2014-09-29 | Toyota Motor Corp | Lithium ion secondary battery, and method for manufacturing the same |
| WO2014155990A1 (en) * | 2013-03-26 | 2014-10-02 | 三洋電機株式会社 | Positive electrode for nonaqueous electrolyte secondary batteries, and nonaqueous electrolyte secondary battery |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016170756A1 (en) * | 2015-04-22 | 2016-10-27 | パナソニックIpマネジメント株式会社 | Nonaqueous electrolyte secondary battery |
| WO2017094238A1 (en) * | 2015-11-30 | 2017-06-08 | パナソニックIpマネジメント株式会社 | Nonaqueous electrolyte secondary battery |
| US10553856B2 (en) | 2015-11-30 | 2020-02-04 | Panasonic Intellectual Property Management Co., Ltd. | Nonaqueous electrolyte secondary battery |
| JP2017107762A (en) * | 2015-12-10 | 2017-06-15 | 日立オートモティブシステムズ株式会社 | Secondary battery |
| CN108370027A (en) * | 2015-12-10 | 2018-08-03 | 日立汽车系统株式会社 | Secondary cell |
| WO2019176389A1 (en) * | 2018-03-13 | 2019-09-19 | 三洋電機株式会社 | Non-aqueous electrolyte secondary battery |
| JPWO2019176389A1 (en) * | 2018-03-13 | 2021-02-25 | 三洋電機株式会社 | Non-aqueous electrolyte secondary battery |
| JP7232814B2 (en) | 2018-03-13 | 2023-03-03 | 三洋電機株式会社 | Non-aqueous electrolyte secondary battery |
| US11811059B2 (en) | 2018-03-13 | 2023-11-07 | Panasonic Energy Co., Ltd. | Nonaqueous electrolyte secondary battery |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6688996B2 (en) | Non-aqueous electrolyte secondary battery | |
| JP6493409B2 (en) | Non-aqueous electrolyte secondary battery | |
| WO2016136212A1 (en) | Nonaqueous electrolyte secondary cell | |
| JP6793368B2 (en) | Non-aqueous electrolyte secondary battery | |
| JP6919646B2 (en) | Lithium ion secondary battery | |
| JP2019169286A (en) | Positive electrode active material for lithium ion secondary battery, and lithium ion secondary battery | |
| JPWO2015152113A1 (en) | Graphite negative electrode active material, negative electrode and lithium ion secondary battery | |
| WO2016136227A1 (en) | Nonaqueous electrolyte secondary battery | |
| JP6799813B2 (en) | Non-aqueous electrolyte secondary battery | |
| US10411265B2 (en) | Lithium ion secondary battery and method of manufacturing same | |
| CN106716685B (en) | Positive electrode for nonaqueous electrolyte secondary battery and nonaqueous electrolyte secondary battery using same | |
| CN106663780B (en) | Positive electrode for nonaqueous electrolyte secondary battery and nonaqueous electrolyte secondary battery | |
| JP6697377B2 (en) | Lithium ion secondary battery | |
| WO2016121350A1 (en) | Non-aqueous electrolyte secondary battery positive electrode and non-aqueous electrolyte secondary battery | |
| JP6572882B2 (en) | Positive electrode for non-aqueous electrolyte secondary battery and non-aqueous electrolyte secondary battery | |
| WO2016067522A1 (en) | Nonaqueous electrolyte secondary battery | |
| WO2015025887A1 (en) | Negative electrode for lithium ion secondary batteries, and lithium ion secondary battery | |
| JP2014116217A (en) | Lithium ion secondary battery cathode and lithium ion secondary battery |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 15855430 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| NENP | Non-entry into the national phase |
Ref country code: JP |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 15855430 Country of ref document: EP Kind code of ref document: A1 |