Anthranilamide
Die vorliegende Erfindung betrifft neue Anthranilamide, mehrere Verfahren zu ihrer Herstellung und ihre Verwendung als Wirkstoffe, insbesondere ihre Verwendung als Schädlingsbekämpfungsmittel.
Es ist bereits bekannt, dass bestimmte Anthranilamide Insektizide Eigenschaften besitzen (NL 9202078, WO 01/70671, WO 02/094791, JP 3-212834, WO 03/015519, WO 03/016284, WO 03/015518, WO 03/024222, WO 03/016282, WO 03/016283, WO 03/062226, WO 03/027099, WO 2004/033468, WO 2004/046129). Die Wirksamkeit dieser Stoffe ist gut, lässt aber in manchen Fällen zu wünschen übrig.
Es wurden nun neue Anthranilamide der Formel (I)
gefunden, in welcher A1 und A2 unabhängig voneinander für Sauerstoff oder Schwefel stehen, X1 für N oder CR10 steht, X2 für NR", O oder C(R")2 steht, R1 für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschie¬ den substituiertes C1-C6-AIlCyI, C2-C6-Alkenyl, C2-C6-Alkinyl oder C3-C6-Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus Halogen, Cyano, Nitro, Hydroxy, C,-C4-Alkoxy, CrC4-Alkylthio, CrC4-Alkylsulfinyl, C,-C4-Alkylsul- fonyl, C2-C4-Alkoxycarbonyl, Ci-C4-Alkylamino, C2-C3-Dialkylamino, C3-C6-Cycloalkyl- amino oder (C1-C4-Alkyl)C3-C6-cycloalkylamino, R2 für Wasserstoff, C1-C6-AIlCyI, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, C1-C4- Alkoxy, Ci-C4-Alkylamino, C2-C8-Dialkylamino, Q-Cή-Cycloalkylamino, C2-C6- Alkoxycar- bonyl oder C2-C6-Alkylcarbonyl steht, R3 für Wasserstoff, R12 oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder ver¬ schieden substituiertes C1-C6-AIkVl, C2-C6- Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, Halogen, Cyano, Nitro, Hydroxy, Ci-C4-Alkoxy, CrC4-Halogenalkoxy, CrC4-Alkylthio, CrC4-Alkyl- sulfinyl, CrC4-Alkylsulfonyl, C2-C6-Alkoxycarbonyl, C2-C6-Alkylcarbonyl, C3-C6-Trialkyl-
silyl, R12, Phenyl, Phenoxy oder einem 5- oder 6-gliedrigen heteroaromatischen Ring, wobei jeder Phenyl-, Phenoxy- und 5- oder 6-gliedrige heteroaromatische Ring gegebenenfalls substituiert sein kann durch ein bis drei Reste W oder einen oder mehrere Reste R13, oder R2 und R3 miteinander verbunden sein können und den Ring M bilden, R4 für Wasserstoff, C,-C6-Alkyl, C2-C6-Alkenyl, C2-C6-A]kinyl, C3-C6-Cycloalkyl, C1-C6-HaIo- genalkyl, C2-C6-Halogenalkenyl, C2-C6-Halogenalkinyl, C3-C6-Halocycloalkyl, Halogen, Cyano, Nitro, Hydroxy, C1-C4-AIkOXy, CrC4-Halogenalkoxy, Ci-C4-Alkylthio, C1-C4- Alkylsulfinyl, CrC4-Alkylsulfonyl, C,-C4-Halogenalkylthio, CrC4-Halogenalkylsulfinyl, Cr Gt-Halogenalkylsulfonyl, CrC4-Alkylamino, C2-C8-Dialkylamino, C3-C6-Cycloalkylamino, C3-C6-Trialkylsilyl steht oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Phenyl, Benzyl oder Phenoxy steht, wobei die Substituenten unab¬ hängig voneinander ausgewählt sein können aus CrC4-Alkyl, C2-C4- Alkenyl, C2-C4-Alkinyl, C3-C6-Cycloalkyl, CrC4-Halogenalkyl, C2-C4-Halogenalkenyl, C2-C4-Halogenalkinyl, C3-C6- Halocycloalkyl, Halogen, Cyano, Nitro, CrC4-Alkoxy, CrC4-Halogenalkoxy, CrC4-Alkyl- thio, CrC4-Alkylsulfmyl, CrC4-Alkylsulfonyl, CrC4-Alkylamino, C2-C8-Dialkylamino, C3- C6-Cycloalkylamino, C3-C6-(Alkyl)cycloalkylamino, C2-C4-Alkylcarbonyl, C2-C6-Alkoxy- carbonyl, C2-C6-Alkylaminocarbonyl, Q-Cs-Dialkylaminocarbonyl oder C3-C6-Trialkylsilyl, R5 und R8 jeweils unabhängig voneinander für Wasserstoff, Halogen oder für jeweils gegebenenfalls substituiertes CrC4-Alkyl, C,-C4-Halogenalkyl, CrC4-Halogenalkoxy, R13, G, J, -OJ, -OG, -S(O)P-J, -S(O)P-G, -S(O)p-phenyl stehen, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder aus R13, CrC10-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C1-C4-AIkOXy oder Q-Q-Alkylthio, wobei jeder Substituent durch einen oder mehrere Substituenten unabhängig voneinander ausgewählt aus G, J, R6, Halogen, Cyano, Nitro, Amino, Hydroxy, C1-C4-AIkOXy, Ci-C4-Halogenalkoxy, Ci-Q-Alkylthio, C1-C4- Alkylsulfmyl, CrC4-Alkylsulfonyl, CrC4-Halogenalkylthio, CrC4-Halogenalkylsulfinyl, C1- C4-Halogenalkylsulfonyl, CrC4-Alkylamino, C2-C8-Dialkylamino, C3-C6-Trialkylsilyl, Phenyl oder Phenoxy substituiert sein kann, wobei jeder Phenyl- oder Phenoxy-Ring gegebe¬ nenfalls substituiert sein kann und wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, R6 unabhängig voneinander für -C^E^R20, -LC^E^R20, -C(=E')LR20, -LCC=E^LR20, -OP(=Q)(OR20)2, -SO2LR19 oder -LSO2LR20 steht, wobei jedes E1 unabhängig voneinander für O, S, N-R16, N-OR16, N-N(R16)2, N-S=O, N-CN oder N-NO2 steht, R7 für Wasserstoff, CrC4-Alkyl, C,-C4-Halogenalkyl, Halogen, CrC4-Alkoxy, CrC4-Halogen- alkoxy, CrC4-Alkylthio, C1-C4-Alkylsulfinyl, CrC4-Alkylsulfonyl, C,-C4-Halogenalkylthio, Ci-GrHalogenalkylsulfmyl, CrC4-Halogenalkylsulfonyl steht,
R9 für Wasserstoff, C,-C6-Alkyl, C3-C6-Cycloalkyl, CrC6-Halogenalkyl, C,-C6-Alkoxy, C1-C6-Ha- logenalkoxy, Ci-C6-Alkylthio, CrC6-Alkylsulfinyl, C,-C6-Alkylsulfonyl oder für einfach oder mehrfach substituiertes Phenyl oder Benzyl steht, wobei die Substituenten unabhängig vonein¬ ander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, R10 für Wasserstoff, C,-C4-Alkyl, C,-C4-Halogenalkyl, Halogen, Cyano oder C,-C4-Halogen- alkoxy steht, R11 jeweils unabhängig voneinander für Wasserstoff oder für jeweils gegebenenfalls ein- oder mehrfach, gleich oder verschieden substituiertes CrC6-Alkyl, C2-C6-Alkenyl, C2-C6- Alkinyl, C3-C6-Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, G, J, Halogen, Cyano, Nitro, Hydroxy, CrC4-Alkoxy, CrC4-Halogenalkoxy, CrC4-Alkylthio, Ci-C4-Alkylsulfinyl, CrC4-Alkylsulfonyl, C2-C6-Alkoxycarbonyl, C2-C6- Alkylcarbonyl, C3-C6-Trialkylsilyl, R12; oder für G, J oder einfach oder mehrfach substituiertes Phenyl oder Benzyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, R12 jeweils unabhängig voneinander für jeweils gegebenenfalls einfach bis dreifach substituiertes C,-C6-Alkylthio, CrC6-Alkylsulfenyl, CrC6-Halogenalkythio, Ci-C6-Halogenalkylsulfenyl, Phenylthio oder Phenylsulfenyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus der Liste W, -S(O)nN(R17)2, -C(=O)R14, -L(C=O)R15, -S(C=O)LR15, -C(O)LR14, -S(O)nNR14C(O)R14, -S(O)nNR14C(O)LR15 oder -S(O)nNR14S(O)2LR15, R13 jeweils unabhängig voneinander für -B(OR18)2, Amino, SH, Thiocyanato, C3-C8-Trialkylsilyl- oxy, C-C-Alkyldisulfide, -SF5, -C(=E)R20, -LC(=E)R20, -C(=E)LR20, -LC(=E)LR20, -OP(OJ(OR20)2, -SO2LR20 oder -LSO2LR20 steht, R14 jeweils unabhängig voneinander für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Ci-C6-Alkyl, C2-C6- Alkenyl, C2-C6-Alkinyl oder C3-C6-Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, Halogen, Cyano, Nitro, Hydroxy, CrC4-Alkoxy, CrC4-Alkylsulfinyl, Ci- C4-Alkylsulfonyl, Ci-C4-Alkylamino, C2-C8-Dialkylamino, C3-C6-Cycloalkylamino oder (Ci- C4-Alkyl)C3-C6-cycloalkylamino, R15 jeweils unabhängig voneinander für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Ci-C20-Alkyl, C2-C20-Alkenyl, C2-C20-Alkinyl oder C3-C6- Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, Halogen, Cyano, Nitro, Hydroxy, C,-C4-Alkoxy, Ci-C4-Alkylsulfinyl, C,-C4-Alkylsul- fonyl, Ci-C4-Alkylamino, C2-C8-Dialkylamino, C3-C6-Cycloalkylamino oder (CrC4-Alkyl)C3- C6-cycloalkylamino oder für gegebenenfalls substituiertes Phenyl, wobei die Substituenten
unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, R16 jeweils unabhängig voneinander für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Ci-Cö-Halogenalkyl oder Ci-C6-Alkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus Cyano, Nitro, Hydroxy, C,-C4-Alkoxy, C,-C4-Halogenalkoxy, C,-C4-Alkylthio, CrC4-Alkylsulfinyl, C,-C4- Alkylsulfonyl, CrC4-Halogenalkylthio, C|-C4-Halogenalkylsulfmyl, CrC4-Halogenalkylsul- fonyl, Ci-C4-Alkylamino, C2-C8-Dialkylamino, C2-C6-Alkoxycarbonyl, C2-C6-Alkylcarbonyl, C3-C6-Tπalkylsilyl oder gegebenenfalls substituiertes Phenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, oder N(R16)2 für einen Cyclus steht, der den Ring M bildet, R17 für Ci-Ci2-Alkyl oder C,-C12-Halogenalkyl steht, oder N(R17)2 für einen Cyclus steht, der den Ring M bildet, R18 jeweils unabhängig voneinander für Wasserstoff oder Ci-C4-Alkyl steht, oder B(OR18)2 für einen Ring steht, worin die beiden Sauerstoffatome über eine Kette mit zwei bis drei Kohlenstoffatomen verbunden sind, die gegebenenfalls durch einen oder zwei Substituenten unabhängig voneinander ausgewählt aus Methyl oder C2-C6-Alkoxycarbonyl substituiert sind, R19 jeweils unabhängig voneinander für Wasserstoff, CrC6-Alkyl oder Q-Q-Halogenalkyl steht, oder N(R14)(R19) für einen Cyclus steht, der den Ring M bildet, R20 jeweils unabhängig voneinander für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Ci-Cβ-Alkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus Cyano, Nitro, Halogen, Hydroxy, Cr C4-Alkoxy, C,-C4-Halogenalkoxy, C,-C4-Alkylthio, C,-C4-Alkylsulfinyl, d-Q-Alkylsulfo- nyl, Ci-Q-Halogenalkylthio, CrC4-Halogenalkylsulfmyl, Ci-C4-Halogenalkylsulfonyl, Q- C4-Alkylamino, C2-C8-Dialkylammo, CO2H, C2-C6-Alkoxycarbonyl, C2-C6-Alkylcarbonyl, C3-C6-Trialkylsilyl; oder für gegebenenfalls substituiertes Phenyl steht wobei die Substituen¬ ten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W, E jeweils unabhängig voneinander für O, S, N-R16, N-OR16, N-N(R16)2, N-S=O, N-CN oder N- NO2 steht, G jeweils unabhängig voneinander für einen 5- oder 6-ghedπgen nicht-aromatischen carbocyc- lischen oder heterocychschen Ring steht, der gegebenenfalls ein oder zwei Rmggheder aus der Gruppe C(=O), N, O, S, SO oder S(=O)2 enthalten und gegebenenfalls durch ein bis vier Substituenten unabhängig voneinander ausgewählt aus Ci-C3-AIlCyI, Ci-C3-Halogenalkyl, Halogen, Cyano, Nitro oder Ci-C2-Alkoxy substituiert sein kann, oder unabhängig voneinan-
der für C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C7-Cycloalkyl, (Cyano)C3-C7-cycloalkyl, (C,-C4- Alkyl)C3-C6-cycloalkyl, (C3-C6-Cycloalkyl)Ci-C4-alkyl steht, wobei jedes Cycloalkyl, (Al- kyl)cycloalkyl und (Cycloalkyl)alkyl gegebenenfalls durch ein oder mehrere Halogenatome substituiert sein kann, J jeweils unabhängig voneinander für einen gegebenenfalls substituierten 5- oder 6-gliedrigen heteroaromatischen Ring steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, L jeweils unabhängig voneinander für O oder NR19 steht, M jeweils für einen gegebenenfalls einfach bis vierfach substituierten Ring steht, der zusätzlich zu dem Stickstoffatom, mit dem das Substituentenpaar R14 und R19, (R16)2 oder (R17)2 verbun¬ den ist, zwei bis sechs Kohlenstoffatome und gegebenenfalls zusätzlich ein weiteres Stick¬ stoff-, Schwefel- oder Sauerstoffatom enthält und wobei die Substituenten unabhängig von¬ einander ausgewählt sein können aus CrC2-Alkyl, Halogen, Cyano, Nitro oder Ci-C2- Alkoxy, Q für O oder S steht, W jeweils unabhängig voneinander für Ci-C4-Alkyl, C2-C4-Alkenyl, C2-C4-Alkinyl, C3-C6- Cycloalkyl, Ci-C4-Halogenalkyl, C2-C4-Halogenalkenyl, C2-C4-Halogenalkinyl, C3-C6-HaIo- gencycloalkyl, Halogen, Cyano, Nitro, Ci-C4-Alkoxy, Ci-C4-Halogenalkoxy, C]-C4-Alkyl- thio, Ci-C4-Alkylsulfinyl, Ci-C4-Alkylsulfonyl, Ci-C4-Alkylamino, C2-C8-Dialkylamino, C3- Cö-Cycloalkylamino, (C1-C4-Alkyl)C3-C6-cycloalkylamino, C2-C4-Alkylcarbonyl, C2-C6- Alkoxycarbonyl, CO2H, C2-C6-Alkylaminocarbonyl, Q-Cg-Dialkylammocarbonyl oder C3- C6-Trialkylsilyl steht, n jeweils unabhängig voneinander für 1 oder 2 steht, p jeweils unabhängig voneinander für 0, 1 oder 2 steht,
wobei für den Fall, dass (a) R5 für Wasserstoff, C,-C6-Alkyl, CrC6-Halogenalkyl, C2-C6-Halogenal- kenyl, C2-C6-Halogenalkinyl, Ci-C4-Halogenalkoxy, CrC4-Halogenalkylthio oder Halogen steht und (b) R8 für Wasserstoff, CrC6-Alkyl, C,-C6-Halogenalkyl, C2-C6-Halogenalkenyl, C2-C6-Halogenalki- nyl, Ci-C4-Halogenalkoxy, Ci-C4-Halogenalkylthio, Halogen, C2-C4-Alkylcarbonyl, C2-C6-Alkoxy- carbonyl, C2-C6-Alkylaminocarbonyl oder C3-C8 Dialkylaminocarbonyl steht, (c) mindestens ein Sub- stituent ausgewählt aus R6, R12 und R13 vorhanden ist und (d), wenn R13 nicht vorhanden ist, min¬ destens ein R6 oder R12 unterschiedlich zu C2-C6- Alkylcarbonyl, C2-C6 Alkoxycarbonyl, C2-C6- Alkylaminocarbonyl und C3-C8-Dialkylaminocarbonyl ist, und die Verbindungen der allgemeinen Formel (I) außerdem N-Oxide und Salze umfassen.
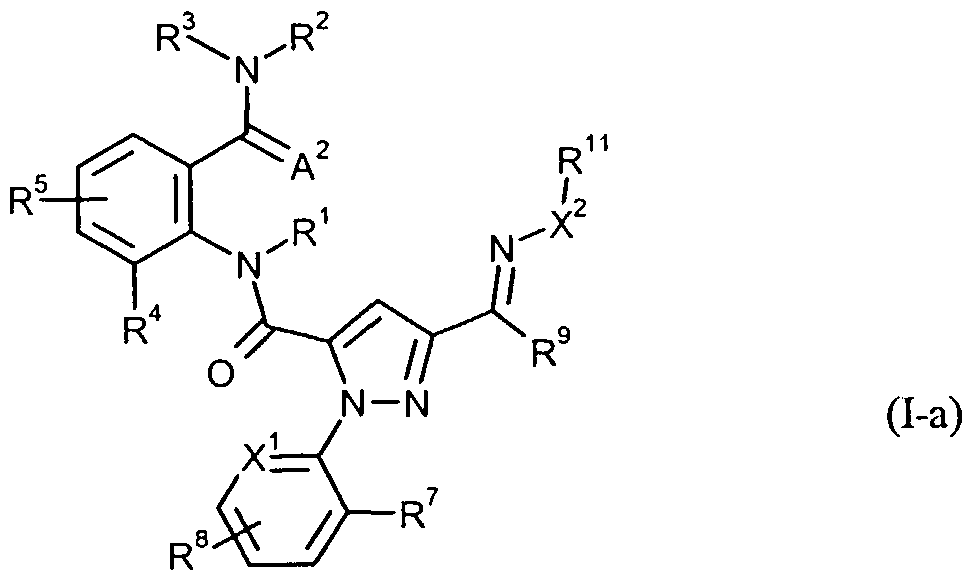
Weiterhin wurde gefunden, dass man Anthranilamide der Formel (I) nach einem der folgenden Ver¬ fahren erhält. Anthranilamide der Formel (I-a)
in welcher A2, X1, X2, R1, R2, R3, R4, R5, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, werden erhalten, indem man (A) Anthranilamide der Formel (II)
in welcher A
2, R
1, R
2, R
3, R
4 und R
5 die oben angegebenen Bedeutungen haben, mit Arylpyrazol-Derivaten der Formel (III)
in welcher X
1, X
2, R
7, R
8, R
9 und R
11 die oben angegebenen Bedeutungen haben, in Gegenwart eines Säurebindemittels umsetzt, oder
(B) Anthranilamide der Formel (II)
in welcher A , R , R , R , R und R die oben angegebenen Bedeutungen haben,
mit Arylpyrazol-Derivaten der Formel (IV)
in welcher X1, X2, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, in Gegenwart eines Kondensationsmittels umsetzt.
Anthranilamide der Formel (I-b)
in welcher A2, X1, X2, R1, R2, R3, R4, R5, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, werden erhalten, indem man (C) Anthranilamide der Formel (I-a)
in welcher A2, X1, X2, R1, R2, R3, R4, R5, R7, R8, R9 und Ru die oben angegebenen Bedeutungen haben, mit einem Schwefelungsreagenz umsetzt.
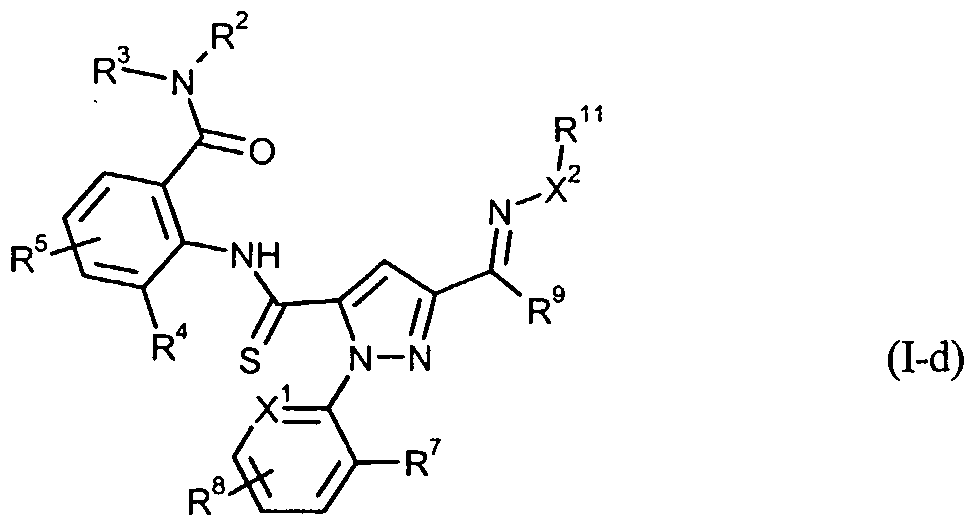
Anthranilamide der Formel (I-c)
in welcher X1, X2, R2, R3, R4, R5, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, werden erhalten, indem man (D) Benzoxazinone der Formel (V)
in welcher X1, X2, R4, R5, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, mit einem Amin der Formel (VI)
RVRΪ (VI) H in welcher R2 und R3 die oben angegebenen Bedeutungen haben, in Gegenwart eines Verdünnungsmittels umsetzt.
Anthranilamide der Formel (I-d)
in welcher X
1, X
2, R
2, R
3, R
4, R
5, R
7, R
8, R
9 und R
11 die oben angegebenen Bedeutungen haben, werden erhalten, indem man (E) Anthranilamide der Formel (I-c)
in welcher X1, X2, R2, R3, R4, R5, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, mit einem Schwefelungsreagenz umsetzt.
Schließlich wurde gefunden, dass die erfindungsgemäßen Verbindungen der Formel (I) sehr gute insektizide Eigenschaften besitzen und sich sowohl im Pflanzenschutz als auch im Materialschutz zur Bekämpfung unerwünschter Schädlinge, wie Insekten verwenden lassen.
Die erfindungsgemäßen Verbindungen können gegebenenfalls als Mischungen verschiedener mög¬ licher isomerer Formen, insbesondere von Stereoisomeren, wie z. B. E- und Z-, threo- und erythro-, sowie optischen Isomeren, gegebenenfalls aber auch von Tautomeren vorliegen. Es werden sowohl die E- als auch die Z-Isomeren, wie auch die threo- und erythro-, sowie die optischen Isomeren, be¬ liebige Mischungen dieser Isomeren, sowie die möglichen tautomeren Formen beansprucht.
Die erfindungsgemäßen Anthranilamide sind durch die Formel (I) allgemein definiert. Bevorzugte Restedefinitionen der vorstehenden und nachfolgend genannten Formeln sind im Folgenden angegeben. Diese Definitionen gelten für die Endprodukte der Formel (I) wie für alle Zwischen¬ produkte gleichermaßen.
A1 steht bevorzugt für Sauerstoff. A1 steht außerdem bevorzugt für Schwefel. A2 steht bevorzugt für Sauerstoff. A2 steht außerdem bevorzugt für Schwefel. A1 und A2 stehen besonders bevorzugt gleichzeitig für Sauerstoff.
X1 steht bevorzugt für N. X1 steht außerdem bevorzugt für CR10.
X2 steht bevorzugt für NR1 ' oder O.
X2 steht besonders bevorzugt für NR". X2 steht außerdem besonders bevorzugt für O.
R1 steht bevorzugt für Wasserstoff, C,-C6-Alkyl, C2-C6-Alkenyl, C2-C6-Alkinyl, C3-C6-Cyclo- alkyl, C,-C6-Halogenalkyl, C2-C6-Halogena]kenyl, C2-C6-Halogenalkinyl, C, -C4-AIkOXy-C, - C4-alkyl, Ci-GrAlkylthio-CrQ-alkyl, CrC4-Alkylsulfinyl-C|-C4-alkyl oder C,-C4-Alkylsul- fonyl-CrC4-alkyl- R1 steht besonders bevorzugt für Wasserstoff, Methyl, Cyclopropyl, Methoxymethyl, Methylthiomethyl, Methyl sulfinylmethyl oder Methylsulfonylmethyl. R1 steht ganz besonders bevorzugt für Wasserstoff.
R2 steht bevorzugt für Wasserstoff oder CrC6-Alkyl. R2 steht besonders bevorzugt für Wasserstoff oder Methyl. R2 steht ganz besonders bevorzugt für Wasserstoff.
R3 steht bevorzugt für CrC6-A]kyl, für einfach durch R6 substituiertes C,-C6-Alkyl, für C2-C6- Alkenyl, C2-C6-Alkinyl, C3-C6-Cycloalkyl, CrC6-Halogenalkyl, C2-C6-Halogenalkenyl, C2- C6-Halogenalkinyl, CrC4-Alkoxy-C,-C4-alkyl, CrC4-Alkylthio-C,-C4-alkyl, C1-C4- Alkylsulfmyl-C,-C4-alkyl oder CrC4-Alkylsulfonyl-CrC4-alkyl. R3 steht besonders bevorzugt für C1-C6-AIkYl oder für einfach durch R6 substituiertes C1-C6-AIkYl. R3 steht ganz besonders bevorzugt für C1-C4-AIlCyI (Methyl, Ethyl, n-Propyl, iso-Propyl, n-Butyl, iso-Butyl, sec-Butyl oder tert-Butyl). R3 steht insbesondere bevorzugt für Methyl oder iso-Propyl.
R4 steht bevorzugt für CrC4-Alkyl, CrC4-Halogenalkyl, Halogen, C,-C4-Alkoxy, C1-C4-HaIo- genalkoxy, Ci-C4-Alkylthio oder CrCt-Halogenalkylthio. R4 steht besonders bevorzugt für C1-C4-AIlCyI, CrC2-Halogenalkyl, Halogen oder Q-C2-HaIo- genalkoxy. R4 steht ganz besonders bevorzugt für Methyl, Trifluormethyl, Fluor, Chlor, Brom, Iod oder Trifluormethoxy.
R5 und R8 stehen jeweils unabhängig voneinander bevorzugt für Wasserstoff, Halogen oder für jeweils gegebenenfalls substituiertes Ci-C4-Alkyl, CrC4-Halogenalkyl, CrC4-Halogen- alkoxy, R13, G, J, -OJ, -OG, -S(O)p-J, -S(O)P-G, -S(O)p-phenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder aus R13, C1- C6-Alkyl, C2-C4-Alkenyl, C2-C4-Alkinyl, Ci-C4-Alkoxy oder C,-C4-Alkylthio,
R5 und R8 stehen jeweils unabhängig voneinander besonders bevorzugt für Wasserstoff, C1-C4-AIlCyI, CrC3-Halogenalkyl, Ci-C3-Halogenalkoxy, G oder J. R5 und R8 stehen jeweils unabhängig voneinander ganz besonders bevorzugt Wasserstoff, Fluor, Chlor, Brom, Iod, Trifluormethyl oder Trifluormethoxy.
R7 steht bevorzugt für Wasserstoff, C1-C4-AIlCyI, CrC4-Halogenalkyl, Halogen, C1-C4-AIkOXy, C1-C4-Halogenalkoxy, CrC4-Alkylthio oder CrC4-Halogenalkylthio. R7 steht besonders bevorzugt für Wasserstoff, CrC4-Alkyl, C|-C4-Halogenalkyl oder Halogen. R7 steht ganz besonders bevorzugt für Wasserstoff, Methyl, Ethyl, n-Propyl, iso-Propyl, Tn- fluormethyl, Fluor, Chlor oder Brom. R7 steht insbesondere bevorzugt für Chlor oder Brom.
R9 steht bevorzugt für Wasserstoff, CrC6-Alkyl, C3-C6-Cycloalkyl, Q-Q-Halogenalkyl oder für jeweils gegebenenfalls einfach bis vierfach, gleich oder verschieden substituiertes Phenyl oder Benzyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13. R9 steht besonders bevorzugt für Wasserstoff, C1-C6-AIlCyI, CrC6-Cycloalkyl, Q-Cβ-Halogen- alkyl, oder für jeweils gegebenenfalls einfach bis dreifach, gleich oder verschieden C1-C4- Alkyl, C2-C4-Alkenyl, C2-C4-Alkinyl, C3-C6-Cycloalkyl, C,-C4-Halogenalkyl, C2-C4-Halogen- alkenyl, C2-C4-Halogenalkinyl, C3-C6-Halocycloalkyl, Halogen, Cyano, Nitro, CrC4-Alkoxy, CrC4-Halogenalkoxy oder -SF5 substituiertes Phenyl oder Benzyl. R9 steht ganz besonders bevorzugt für Wasserstoff, Methyl, Ethyl, n-Propyl, iso-Propyl, n-Butyl, iso-Butyl, sec-Butyl, tert-Butyl, Cyclopropyl, Trifluormethyl, oder für jeweils gegebenenfalls einfach bis dreifach, gleich oder verschieden durch C1-C2-AIlCyI, C]-C3-Halogenalkyl, HaIo- gen oder Q-Q-Halogenalkoxy substituiertes Phenyl oder Benzyl. R9 steht insbesondere bevorzugt für Wasserstoff, Methyl oder Trifluormethyl.
R10 steht bevorzugt für Wasserstoff, C,-C4-Alkyl, CrC2-Halogenalkyl, Halogen oder C1-C4-HaIo- genalkoxy. R10 steht besonders bevorzugt für Wasserstoff, Methyl, Trifluormethyl, Fluor, Chlor, Brom oder Trifluormethoxy. R10 steht ganz besonders bevorzugt für Wasserstoff, Fluor oder Chlor.
R11 steht unabhängig voneinander bevorzugt für Wasserstoff oder für jeweils gegebenenfalls ein- oder mehrfach, gleich oder verschieden substituiertes Ci-Cβ-Alkyl, C2-C6-Alkenyl, C3-C6- Alkinyl, C3-C6-Cycloalkyl, wobei die Substituenten unabhängig voneinander ausgewählt sein
können aus R6, G, J, Fluor, Chlor, Brom, Iod, Cyano, Nitro, Hydroxy, CrC4-Alkoxy, C1-C4- Halogenalkoxy, C,-C4-Alkylthio, C,-C4-Alkylsulfinyl, CrC4-Alkylsulfonyl, C2-C6-AIk- oxycarbonyl, C2-C6- Alkylcarbonyl, C3-C6-Trialkylsilyl, R12; oder für G, J oder einfach oder mehrfach substituiertes Phenyl oder Benzyl, wobei die Substituenten unabhängig voneinan- der ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, R11 steht unabhängig voneinander besonders bevorzugt für Wasserstoff oder für jeweils gegebe¬ nenfalls ein- oder mehrfach, gleich oder verschieden substituiertes Methyl, Ethyl, n-Propyl, iso-Propyl, n-Butyl, iso-Butyl, sec-Butyl, tert-Butyl, Vinyl, Allyl, Propargyl, Cyclopropyl, Cyclobutyl, Cyclopentyl, Cyclohexyl, wobei die Substituenten unabhängig voneinander aus- gewählt sein können aus R6, G, J, Fluor, Chlor, Brom, Cyano, Hydroxy, Methoxy, Ethoxy, n- Propoxy, iso-Propoxy, Trifluormethoxy, Methylthio, Ethylthio, n-Propylthio, iso-Propylthio, Methoxycarbonyl, Methylcarbonyl, Trimethylsilyl, R12; oder für G, J oder einfach oder mehrfach substituiertes Phenyl oder Benzyl, wobei die Substituenten unabhängig voneinan¬ der ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, R11 steht ganz besonders bevorzugt für Methyl, Ethyl, n-Propyl, iso-Propyl, Cyclopropyl, n- Butyl, iso-Butyl, sec-Butyl, tert-Butyl, C2-C4-Halogenalkyl oder für einfach oder mehrfach substituiertes Phenyl oder Benzyl, wobei die Substituenten unabhängig voneinander ausge¬ wählt sein können aus ein bis drei Resten Ci-C4-Alkyl, Halogen, Ci-C4-Halogenalkyl oder C1- C4-Halogenalkoxy,
R12 steht bevorzugt für C,-C4-Alkylthio, C,-C4-Alkylsulfenyl, CrC4-Halogenalkythio, C1-C4-Ha- logenalkylsulfenyl; jeweils gegebenenfalls einfach bis dreifach substituiertes Phenylthio oder Phenylsulfenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus der Liste W; -S(O)„N(R17)2, -C(=O)R14, -L(C=O)R15, -S(C=O)LR15, -C(=O)LR14, -S(O)nNR14C(O)R14, -S(O)nNR14C(=O)LR15 oder -S(O)nNR14S(O)2LR15. R12 steht besonders bevorzugt für CrC4-Alkylthio, CrC4-Halogenalkythio, Phenylthio oder SN(R17)2, -C(=O)R14, -L(C=O)R15, -C(=O)LR14, -SNR14C(=O)R14.
R13 steht bevorzugt für -B(OR18)2, Amino, SH, C3-C6-Trialkylsilyloxy, CrC4-Alkyldisulfide, -SF5, -C(=E)R20, -LC(=E)R20, -C(=E)LR20, -LC(=E)LR20, -OP(=Q)(OR20)2, -SO2LR20 oder - LSO2LR20. R13 steht besonders bevorzugt für -SF5, -C(=O)R20, -LC(O)R20, -C(O)LR20 oder -LC(O)LR20.
R14 steht bevorzugt für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes CrC4-Alkyl, C2-Q-Alkenyl, C3-C6-Alkinyl oder C3-C6- Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können
aus R6, Fluor, Chlor, Brom, Cyano, Nitro, Hydroxy, CrC4-Alkoxy, C1-C4-Alkylsulfmyl, C,- C4-Alkylsulfonyl, C1-C4-Alkylamino, C2-C8-Dialkylamino, C3-C6-Cycloalkylamino oder (Cr C4-Alkyl)C3-C6-cycloalkylamino. R14 steht besonders bevorzugt für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Methyl, Ethyl, n-Propyl, iso-Propyl, n-Butyl, iso-Butyl, sec-Butyl, tert-Butyl, Vinyl, Allyl, Propargyl, Cyclopropyl, Cyclobutyl, Cyclopen- tyl, Cyclohexyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, Fluor, Chlor, Brom, Cyano, Hydroxy, Methoxy, Ethoxy, n-Propoxy, iso-Propoxy. R14 steht ganz besonders bevorzugt Wasserstoff, Methyl, Ethyl, n-Propyl, iso-Propyl, n-Butyl, iso-Butyl, sec-Butyl, tert-Butyl, Cyclopropyl, Cyclobutyl, Cyclopentyl, Cyclohexyl oder Tn- fluormefhyl.
R15 steht bevorzugt für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Ci-Cβ-Alkyl, C2-C6- Alkenyl, C2-C6- Alkinyl oder C3-C6-Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, Fluor, Chlor, Brom, Cyano, Hydroxy, CrC4-Alkoxy, Ci-C4-Alkylsulfinyl, Ci-C4-Alkylsulfonyl, CrC4- Alkylammo, C2-C8-Dialkylamino, C3-C6-Cycloalkylamino oder (Ci-C4-Alkyl)C3-C6-cycloal- kylamino oder für gegebenenfalls einfach bis vierfach substituiertes Phenyl, wobei die Sub¬ stituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13. R15 steht besonders bevorzugt für C,-C4-Alkyl, C,-C4-Halogenalkyl, C2-C4-Alkenyl, C2-C4- Alkinyl, Q-Q-Cycloalkyl, C,-C4-Alkoxy, C,-C4-Halogenalkoxy, C,-C4-Alkylsulfmyl, C1-C4- Alkylsulfonyl, CrC4-Alkylammo, C2-C8-Dialkylamino oder für gegebenenfalls einfach bis vierfach substituiertes Phenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W.
R16 steht bevorzugt für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes CrC4-Halogenalkyl oder CrC4-Alkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus Cyano, Hydroxy, CrC2- Alkoxy, C,-C2-Halogenalkoxy, CrC2-Alkylthio, C,-C2-Alkylsulfinyl, CrC2-Alkylsulfonyl, Q-Cz-Halogenalkylthio, CrC2-Halogenalkylsulfinyl, CrC2-Halogenalkylsulfonyl, CrC2- Alkylamino, C2-C6-Dialkylammo, C2-C4-Alkoxycarbonyl, C2-C4-Alkylcarbonyl, C3-C6-Tπal- kylsilyl oder gegebenenfalls einfach bis vierfach substituiertes Phenyl, wobei die Substituen¬ ten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, oder N(R16)2 für einen Cyclus, der den Ring M bildet.
R16 steht besonders bevorzugt für Ci-C4-Alkyl oder für gegebenenfalls einfach bis vierfach substituiertes Phenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W.
R17 steht bevorzugt für CrC8-Alkyl oder C,-C8-Halogenalkyl, oder N(R17)2 für einen Cyclus, der den Ring M bildet. R17 steht besonders bevorzugt für Ci-C6-Alkyl oder Ci-C6-Halogenalkyl, oder N(RI7)2 für einen Cyclus, der den Ring M bildet.
R18 steht bevorzugt für Wasserstoff oder Ci-Q-Alkvl. R18 steht besonders bevorzugt für Wasserstoff oder Methyl .
R19 steht bevorzugt für Wasserstoff oder CrC6-Alkyl. R19 steht besonders bevorzugt für Wasserstoff oder C i -C4-Alkyl . R19 steht ganz besonders bevorzugt für Wasserstoff, Methyl, Ethyl, n-Propyl oder iso-Propyl.
R20 steht bevorzugt für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Ci-C6-Alkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus Cyano, Nitro, Hydroxy, Ci-C4-Alkoxy, C]-C4-HaIo- genalkoxy, C,-C4-Alkylthio, CrC4-Alkylsulfinyl, CrC4-Alkylsulfonyl, C,-C4-Halogen- alkylthio, C]-C4-Halogenalkylsulfinyl, CrC4-Halogenalkylsulfonyl, CrC4-Alkylamino, C2- Cs-Dialkylamino, CO2H, C2-C6- Alkoxycarbonyl, C2-C6- Alkylcarbonyl, C3-C6-Tπalkylsilyl oder gegebenenfalls substituiertes Phenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W, Ci-C6-Halogenalkyl, C3-C6-Cycloalkyl oder jeweils gegebenenfalls ein- bis dreifach durch W substituiertes Phenyl oder Pyπdyl. R20 steht besonders bevorzugt für Wasserstoff, CrC6-Alkyl oder für gegebenenfalls substituiertes Phenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W.
G steht bevorzugt für einen 5- oder 6-ghedπgen nicht-aromatischen carbocych sehen oder heteroeychschen Ring, der gegebenenfalls ein oder zwei Ringglieder aus der Gruppe C(=O), N, O, S, SO oder S(=O)2 enthalten und gegebenenfalls durch em bis vier Substituenten unabhängig voneinander ausgewählt aus C]-C3-Alkyl, Q-QrHalogenalkyl, Halogen, Cyano, Nitro oder CrC2-Alkoxy substituiert sein kann, oder unabhängig voneinander für C2-C6- Alkenyl, C2-C6-Alkinyl, C3-C7-Cycloalkyl, (Cyano)C3-C7-cycloalkyl, (CrC4-Alkyl)C3-C6- cycloalkyl, (C3-C6-Cycloalkyl)Ci-C4-alkyl steht, wobei jedes Cycloalkyl, (Alkyl)cycloalkyl
und (Cycloalkyl)alkyl gegebenenfalls durch ein oder mehrere Halogenatome substituiert sein kann. G steht besonders bevorzugt für einen 5- oder 6-gliedrigen nicht-aromatischen heterocyclischen Ring der Reihe G-I bis G-35 [Q1 = O, S, NH oder N(C,-C2-alkyl)],
■9
G-1 -ς G-2> -ς G-?3 - G-4 -ς G-5 G-6
G-7 G-8 G-9 G-10 G-11 G-12
G-1
■€ v> - N 3 G-14 G-15 G-16 G-17 G-18
G-19 G-20 G-21 G-22 G-23 G-24
wobei jeder 5- oder 6-gliedrige nicht-aromatische heteroeyclische Ring unabhängig vonein¬ ander ausgewählt aus Ci-C3-Alkyl, CrC3-Halogenalkyl, Halogen, Cyano, Nitro oder Ci-C2- Alkoxy substituiert sein kann.
J steht jeweils unabhängig voneinander bevorzugt für einen gegebenenfalls substituierten 5- oder 6-gliedrigen heteroaromatischen Ring, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus d-C3-Alkyl, Ci-C3-Halogenalkyl, Halogen, Cyano, Nitro oder CrC2-Halogenalkoxy, oder unabhängig voneinander für C2-C6-Alkenyl, C2-C6-Alkinyl, C3- C7-Cycloalkyl, (Cyano)C3-C7-cycloalkyl, (C,-C4-Alkyl)C3-C6-cycloalkyl, (C3-C6-Cyclo-
alkyl)Ci-C4-alkyl steht, wobei jedes Cycloalkyl, (Alkyl)cycloalkyl und (Cycloalkyl)alkyl ge¬ gebenenfalls durch ein oder mehrere Halogenatome substituiert sein kann. steht jeweils unabhängig voneinander besonders bevorzugt für einen gegebenenfalls substitu¬ ierten 5- oder 6-gliedrigen aromatischen heterocyclischen Ring der Reihe J-I bis J^48, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus Ci-C3-Alkyl, C1-C3- Halogenalkyl, Halogen, Cyano, Nitro oder Ci-C2-Halogenalkoxy.
J-7 J-8 J-9 J-10 J-11 J-12
J-13 J-14 J-15 J-16 J-17 J-18
J-19 J-20 J-21 J-22 J-23 J-24
J-25 J-26 J-27 J-28 J-29 J-30
J-31 J-32 J-33 J-34 J-35 J-36
J-37 J-38 J-39 J-40 J-41 J-42
J-43 J-44 J-45 J-46 J-47
L steht bevorzugt für O. L steht außerdem bevorzugt für NR
19.
M steht bevorzugt für einen gegebenenfalls einfach bis vierfach substituierten Ring, der zusätz- lieh zu dem Stickstoffatom, mit dem das Substituentenpaar R14 und R19, (R16)2 oder (R17)2 verbunden ist, zwei bis sechs Kohlenstoffatome und gegebenenfalls zusätzlich ein weiteres Stickstoff-, Schwefel- oder Sauerstoffatom enthält und wobei die Substituenten unabhängig voneinander ausgewählt sein können aus CrC2-Alkyl, Halogen, Cyano, Nitro oder Ci-C2- Alkoxy. M steht besonders bevorzugt für -CH2CH2CH2-, -CH2CH2CH2CH2-, -CH2CH2OCH2CH2-, -CH2CH2SCH2CH2-, CH2CH2N(CH3)CH2CH2-.
Q steht bevorzugt für O. Q steht außerdem bevorzugt für S.
W steht bevorzugt für C,-C4-Alkyl, C2-C4-Alkenyl, C2-C4-Alkinyl, C3-C6-Cycloalkyl, C1-C4-Ha- logenalkyl, C2-C4-Halogenalkenyl, C2-C4-Halogenalkinyl, C3-C6-Halocycloalkyl, Halogen, Cyano, Nitro, C,-C4-Alkoxy, C,-C4-Halogenalkoxy, CrC4-Alkylthio, C,-C4-Alkylsulfmyl, Cr C4-Alkylsulfonyl, Ci-C4-Alkylamino, Q-Cg-Dialkylamino, C3-C6-Cycloalkylamino, (Ci-C4- Alkyl)C3-C6-cycloalkylamino, C2-C4-Alkylcarbonyl, C2-C6-Alkoxycarbonyl, CO2H, C2-C6- Alkylaminocarbonyl, C3-C8-Dialkylaminocarbonyl oder C3-C6-Trialkylsilyl steht. W steht besonders bevorzugt für CrC4-Alkyl, CrC4-Halogenalkyl, Halogen, CrC4-Halogen- alkoxy. W steht ganz besonders bevorzugt für Methyl, Ethyl, n-Propyl oder iso-Propyl, Trifluormethyl, Fluor, Chlor, Brom, Trifluoralkoxy.
n steht bevorzugt für 1. n steht außerdem bevorzugt für 2.
p steht bevorzugt für 0. p steht außerdem bevorzugt für 1. p steht außerdem bevorzugt für 2.
Hervorgehoben sind Verbindungen der Formel (I- 1)
. j .
in welcher X2, R2, R3, R4, R5, R7, R9 und R11 die oben angegebenen allgemeinen, bevorzugten, besonders bevorzugten, ganz besonders bevorzugten bzw. insbesondere bevorzugten Bedeutungen haben.
Bevorzugt sind Verbindungen der Formel (I- 1), in welcher X2 für NR1 Oder O steht, R2 für Wasserstoff oder CrC6-Alkyl steht, R3 für C]-C6-Alkyl steht, das gegebenenfalls mit einem R6 substituiert ist, R4 für C,-C4-Alkyl, CrC2-Halogenalkyl, C,-C2-Halogenalkoxy oder Halogen steht, R5 für Wasserstoff, Ci-C4-Alkyl, Ci-C3-Halogenalkyl, Ci-C3-Halogenalkoxy oder Halogen oder für jeweils gegebenenfalls substituiertes J, -OJ steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder aus R13, R6 unabhängig voneinander für -C(=E)R20, -LC(=E)R20, -C(=E)LR20, -LC(=E)LR20, -OP(=O)(OR20)2, -SO2LR19 oder -LSO2LR20 steht, R7 für Wasserstoff, C,-C4-Alkyl, CrC4-Halogenalkyl oder Halogen steht, R9 für Wasserstoff, CrC6-Alkyl, C3-C6-Cycloalkyl, Q-Ce-Halogenalkyl oder für ein- oder mehrfach substituiertes Phenyl oder Benzyl steht, wobei wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13 R11 unabhängig voneinander für Wasserstoff oder für jeweils gegebenenfalls ein- oder mehrfach substituiertes CrC6-Alkyl, C2-C6- Alkenyl, C2-C6- Alkinyl, C3-C6-Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, G, J, Halogen, Cyano, Nitro, Hydroxy, C,-C4-Alkoxy, CrC4-Halogenalkoxy, CrC4-Alkylthio, Ci-C4-Alkylsulfmyl, CrC-Alkylsulfonyl, C2-C6- Alkoxycarbonyl, C2-C6-Alkylcarbonyl, C3-C6-Trialkylsilyl, R12; oder für G, J oder ein- der mehrfach substituiertes Phenyl oder Benzyl steht, wobei die Sub¬ stituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, R12 für C-C-Alkylthio, C,-C4-Halogenalkythio, Phenylthio oder SN(R17)2, -C(=O)R14, -L(C=O)R15, -C(=O)LR14, -SNRI4C(=O)R14 steht,R13 jeweils unabhängig voneinander für
-B(OR18)2, Amino, SH, Thiocyanato, C3-C8-Tπalkylsilyloxy, Ci-C4-Alkyldisulfide, -SF5, -C(=E)R20, -LC(=E)R20, -C(=E)LR20, -LC(=E)LR20, -OP(=O)(OR20)2, -SO2LR20 oder - LSO2LR20 steht, R14 jeweils unabhängig voneinander für Wasserstoff oder für jeweils gegebenenfalls einfach oder mehrfach, gleich oder verschieden substituiertes Ci-Cβ-Alkyl, C2-C6- Alkenyl, C2-C6-Alkinyl oder C3-C6-Cycloalkyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus R6, Halogen, Cyano, Nitro, Hydroxy, CrC4-Alkoxy, Ci-C4-Alkylsulfinyl, C1- C4-Alkylsulfonyl, CrC4-Alkylamino, C2-C8-Dialkylamino, C3-C6-Cycloalkylamino oder (Cr C4-Alkyl)C3-C6-cycloalkylamino, R15 jeweils unabhängig voneinander für Wasserstoff oder für jeweils gegebenenfalls substitu¬ iertes CpCö-Halogenalkyl oder C|-C6-Alkyl steht, wobei die Substituenten unabhängig von¬ einander ausgewählt sein können aus Cyano, C]-C4-Alkoxy, CrC4-Halogenalkoxy, C1-C4- Alkylthio, C,-C4-Alkylsulfmyl, C,-C4-Alkylsulfonyl, C,-C4-Halogenalkylthio, C1-C4-HaIo- genalkylsulfinyl oder CrC4-Halogenalkylsulfonyl, R16 steht besonders bevorzugt für CrC4-Alkyl oder für gegebenenfalls einfach bis vierfach substituiertes Phenyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W, R17 für CrC6-Alkyl, CrC6-Halogenalkyl oder N(RI7)2 für einen Cyclus steht, der den Ring M bildet R18 jeweils für Wasserstoff oder C1 -C4-Alkyl steht, R19 jeweils unabhängig voneinander für Wasserstoff oder CrC6-Alkyl steht, R20 für Wasserstoff, CrC6-Alkyl oder für gegebenenfalls substituiertes Phenyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W, E jeweils unabhängig voneinander für O, S, N-R16, N-OR16, N-N(R16)2, N-S=O, N-CN oder N- NO2 steht, G für einen 5- oder 6-ghedπgen nicht-aromatischen heterocychschen Ring der Reihe G-I bis G- 35 steht [Q1 = O, S, NH oder N(C,-C2-alkyl)], wobei jeder 5- oder 6-ghedπge nicht¬ aromatische heterocyclische Ring unabhängig voneinander ausgewählt aus Q-Q-Alkyl, C1- C3-Halogenalkyl, Halogen, Cyano, Nitro oder CrC2-Alkoxy substituiert sein kann, J jeweils unabhängig voneinander für einen gegebenenfalls substituierten 5- oder 6-ghedπgen aromatischen heterocychschen Ring der Reihe J-I bis J-48 steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus CrC3-Alkyl, CrC3-Halogenalkyl, Halogen, Cyano, Nitro oder CrC2-Halogenalkoxy. L jeweils unabhängig voneinander für O oder NR19 steht, M für -CH2CH2CH2-, -CH2CH2CH2CH2-, -CH2CH2OCH2CH2-, -CH2CH2SCH2CH2-, -CH2CH2N(CH3)CH2CH2-,
W jeweils unabhängig voneinander für CrC4-Alkyl, C2-C4-Alkenyl, C2-C4-Alkinyl, C3-C6- Cycloalkyl, CrC4-Halogenalkyl, C2-C4-Halogenalkenyl, C2-C4-Halogenalkinyl, C3-C6-HaIo- cycloalkyl, Halogen, Cyano, Nitro, Ci-C4-Alkoxy, C,-C4-Halogenalkoxy, Ci-C4-Alkylthio, C,-C4-Alkylsulfinyl, CrC4-Alkylsulfonyl, CrC4-Alkylammo, C2-C8-Dialkylamino, C3-C6- Cycloalkylamino, (Ci-C4-Alkyl)C3-C6-cycloalkylamino, C2-C4-Alkylcarbonyl, C2-C6- Alkoxycarbonyl, CO2H, C2-C6-Alkylaminocarbonyl, C3-C8-Dialkylaminocarbonyl oder C3- C6-Trialkylsilyl steht.
Besonders bevorzugt sind Verbindungen der Formel (I- 1), in welcher X2 für NR11 oder O steht, R2 für Wasserstoff oder Methyl steht, R3 für C,-C4-Alkyl steht, R4 für Methyl, Trifluormethyl, Trifluormethoxy, Fluor, Chlor, Brom oder Iod steht, R5 für Wasserstoff, Fluor, Chlor, Brom, Iod, Trifluormethyl oder Trifluormethoxy steht, R7 für Chlor oder Brom steht, R9 für Wasserstoff, C,-C6-Alkyl, d-C6-Halogenalkyl, oder für Phenyl- oder Benzylring steht, wobei jeder Phenyl- oder Benzylring gegebenenfalls substituiert sein kann und wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten C1-C4- Alkyl, CrC4-Halogenalkyl, Halogen, Cyano, Nitro, CrC4-Alkoxy, CrC4-Halogenalkoxy oder -SF5, R11 unabhängig voneinander für Methyl, Ethyl, n-Propyl, iso-Propyl, Cyclopropyl, n-Butyl, iso- Butyl, sec-Butyl, tert-Butyl, C2-C4-Halogenalkyl- oder für einfach oder mehrfach substituiertes Phenyl oder Benzyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten Ci-C4-Alkyl, Halogen, Cyano, Nitro, Ci-C4- Halogenalkyl oder Ci-C4-Halogenalkoxy,
Ganz besonders bevorzugt sind Verbindungen der Formel (I- 1), in welcher X2 für NR11 oder O steht, R2 für Wasserstoff oder Methyl steht, R3 für Methyl, Ethyl, n-Propyl, iso-Propyl, Cyclopropyl, n-Butyl, sec-Butyl, iso-Butyl, oder tert- Butyl steht, R4 für Methyl, Fluor, Chlor oder Brom steht, R5 für Fluor, Chlor, Brom, Iod, Trifluormethyl oder Trifluormethoxy steht, R7 für Chlor oder Brom steht, R9 für Wasserstoff, Methyl, Trifluormethyl, Ethyl, n-Propyl, iso-Propyl, Cyclopropyl, n-Butyl, sec-Butyl, iso-Butyl, tert-Butyl oder für einen Phenyl- oder Benzylring steht, wobei jeder
Phenyl- oder Benzylring gegebenenfalls substituiert sein kann und wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten Methyl, Trifluormethyl, Ethyl, iso-Propyl, Fluor, Brom, Chlor, Iod, Cyano, Nitro, Trifluoralkoxy oder -SF5, R11 unabhängig voneinander für Methyl, Ethyl, n-Propyl, iso-Propyl, Cyclopropyl, n-Butyl, iso- Butyl, sec-Butyl, tert-Butyl, CH2CF3 oder für einfach oder mehrfach substituiertes Phenyl oder Benzyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten Methyl, Ethyl, iso-Propyl, Fluor, Chlor, Brom, Iod, Cyano, Nitro, Trifluormethyl, Trifluoralkoxy,
Bevorzugt sind außerdem Anthranilamide der Formel (I), in welcher A1 und A2 für Sauerstoff stehen. Bevorzugt sind außerdem Anthranilamide der Formel (I), in welcher R1 für Wasserstoff steht. Bevorzugt sind außerdem Anthranilamide der Formel (I), in welcher R2 für Wasserstoff steht.
Gesättigte Kohlenwasserstoffreste wie Alkyl können, auch in Verbindung mit Heteroatomen, wie z.B. in Alkoxy, soweit möglich, jeweils geradkettig oder verzweigt sein.
Durch Halogen substituierte Reste, z.B. Halogenalkyl, sind einfach oder mehrfach bis zur maximal möglichen Substituentenzahl halogeniert. Bei mehrfacher Halogenierung können die Halogenatome gleich oder verschieden sein. Halogen steht dabei für Fluor, Chlor, Brom oder Iod, insbesondere für Fluor, Chlor oder Brom.
Bevorzugt, besonders bevorzugt oder ganz besonders bevorzugt sind Verbindungen, welche jeweils die unter bevorzugt, besonders bevorzugt oder ganz besonders bevorzugt genannten Substituenten tragen.
Gesättigte oder ungesättigte Kohlenwasserstoffreste wie Alkyl oder Alkenyl können, auch in Verbin¬ dung mit Heteroatomen, wie z.B. in Alkoxy, soweit möglich, jeweils geradkettig oder verzweigt sein.
Gegebenenfalls substituierte Reste können einfach oder mehrfach substituiert sein, wobei bei Mehr¬ fachsubstitutionen die Substituenten gleich oder verschieden sein können.
Die oben aufgeführten allgemeinen oder in Vorzugsbereichen aufgeführten Restedefinitionen bzw. Erläuterungen können jedoch auch untereinander, also zwischen den jeweiligen Bereichen und Vor- zugsbereichen beliebig kombiniert werden. Sie gelten für die Endprodukte sowie für die Vor- und Zwischenprodukte entsprechend.
Erläuterung der Verfahren und Zwischenprodukte Verfahren (A) Verwendet man beispielsweise 2-Amino-5-chloro-N-isopropyl-3-methyl-benzamid und 2-(3-Chlor- pyridin-2-yl)-5-(methoxyimino-methyl)-2H-pyrazol-3-carbonylchlorid als Ausgangsstoffe, so kann der Verlauf des erfindungsgemäßen Verfahrens (A) durch das folgende Formelschema veran¬ schaulicht werden.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (A) als Ausgangsstoffe benötigten An- thranilamide sind durch die Formel (H) allgemein definiert. In dieser Formel (II) stehen A
2, R
1, R
2, R
3, R
4 und R
5 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevor¬ zugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfin¬ dungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Anthranilamide der Formel (H) sind bekannt (vgl. z.B. WO 03/016284).
Die bei der Durchführung des erfindungsgemäßen Verfahrens (A) weiterhin als Ausgangsstoffe benötigten Arylpyrazol-Derivate sind durch die Formel (111) allgemein definiert. In dieser Formel (DI) stehen X1, X2, R7, R8, R9 und R" bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. ins¬ besondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfindungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Arylpyrazol-Derivate der Formel (HI) sind neu. Sie lassen sich beispielsweise herstellen, indem man (F) Arylpyrazol-Derivate der Formel (IV)
in welcher X
1, X
2, R
7, R
8, R
9 und R
11 die oben angegebenen Bedeutungen haben, mit einem Chloπerungsmittel (z B. Thionylchloπd und Oxalylchloπd) in Gegenwart eines inerten Verdiinnungsmittels (zB Toluol und Dichlormethan) in Gegenwart von einer katalytischen Menge von N,N-Dimethylformarmd umsetzt.
Arylpyrazol-Deπvate der Formel (IV) sind neu. Sie werden unten im Zusammenhang mit dem erfin¬ dungsgemäßen Verfahren (B) ausführlicher beschrieben
Das erfindungsgemäße Verfahren (A) wird in Gegenwart eines Säurebindemittels durchgeführt. Hierzu eignen sich alle für solche Kupplungsreaktionen üblichen anorganischen oder organischen Basen Vorzugsweise verwendbar sind Erdalkalimetall- oder Alkahmetallhydπde, -hydroxide, -amide, -alkoholate, -acetate, -carbonate oder -hydrogencarbonate, wie beispielsweise Natriumhydrid, Natnumamid, Lithiumdπsopropylamid, Natπum-methylat, Natπum-ethylat, Kahum-tert.-butylat, Natriumhydroxid, Kahumhydroxid, Natnumacetat, Natπumcarbonat, Kahumcarbonat, Kahum- hydrogencarbonat, Natπumhydrogencarbonat oder Ammoniumcarbonat, sowie tertiäre Amine, wie Tnmethylamin, Tnethylamm, Tπbutylamin, Dnsopropylethylamm, N,N-Dimethylanilm, N,N- Dimethyl-benzylamin, Pyπdm, N-Methylpipeπdm, N-Methylmoφhohn, N,N-Dimethylaminopyπdm, Diazabicyclooctan (DABCO), Diazabicyclononen (DBN) oder Diazabicycloundecen (DBU). Ebenso lassen sich gegebenenfalls polymer-gestützte Säurebindemittel, wie z.B. polymer-gebundenes Diisopropylamin und polymer-gebundenes Dimethylammopyπdin einsetzen.
Das erfindungsgemäße Verfahren (A) kann gegebenenfalls in Gegenwart eines für solche Reaktionen üblichen inerten organischen Verdünnungsmittel durchgeführt werden. Hierzu gehören vorzugsweise aliphatische, ahcychsche oder aromatische Kohlenwasserstoffe, wie beispielsweise Petrolether, Hexan, Heptan, Cyclohexan, Methylcyclohexan, Benzol, Toluol, Xylol oder Decalm; halogenierte Kohlenwasserstoffe, wie beispielsweise Chlorbenzol, Dichlorbenzol, Dichlormethan, Chloroform, Tetrachlormethan, Dichlorethan oder Tπchlorethan; Ether, wie Diethylether, Dnsopropylether, Methyl-t-butylether, Methyl-t-amylether, Dioxan, Tetrahydrofuran, 1,2- Dimethoxyethan, 1,2- Diethoxyethan oder Anisol; Ketone, wie Aceton, Butanon, Methyl-isobutylketon oder Cyclohexanon; Nitnle, wie Acetonitnl, Propionitπl, n- oder i-Butyronitπl oder Benzonitπl; Amide, wie N,N-Dime-
- -
thylformamid, N,N-Dimethylacetamid, N-Methylformanilid, N-Methylpyrrolidon oder Hexamethyl- phosphorsäuretriamid; deren Gemische mit Wasser oder reines Wasser. Besonders bevorzugt verwendbar sind Tetrahydrofuran, Dioxan, Diethylether und Dichlormethan.
Die Reaktionstemperaturen können bei der Durchführung des erfindungsgemäßen Verfahrens (A) in einem größeren Bereich variiert werden. Im Allgemeinen arbeitet man bei Temperaturen von 00C bis 1500C, vorzugsweise bei Temperaturen von 00C bis 80°C.
Zur Durchführung des erfindungsgemäßen Verfahrens (A) zur Herstellung der Verbindungen der Formel (I) setzt man pro Mol eines Anthranilamids der Formel (II) im Allgemeinen 0,8 bis 15 Mol, vorzugsweise 0,8 bis 8 Mol an Arylpyrazol-Derivat der Formel (ID) ein.
Verfahren (B) Verwendet man beispielsweise 2-Amino-5-chloro-N-isopropyl-3-rnethyl-benzamid und 2-(3-Chlor- pyridin-2-yl)-5-(methoxyimino-methyl)-2H-pyrazol-3-carbonsäure als Ausgangsstoffe, so kann der Verlauf des erfindungsgemäßen Verfahrens (B) durch das folgende Formelschema veranschaulicht werden.
Die bei der Durchführung des erfϊndungsgemäßen Verfahrens (B) als Ausgangsstoffe benötigten An- thranilamide der Formel (H) sind bereits in Zusammenhang mit dem erfindungsgemäßen Verfahren (A) beschrieben worden.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (B) weiterhin als Ausgangsstoffe benötigten Arylpyrazol-Derivate sind durch die Formel (IV) allgemein definiert. In dieser Formel (IV) stehen X1, X2, R7, R8, R9 und R11 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfindungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Arylpyrazol-Derivate der Formel (IV) sind neu. Sie werden beispielsweise erhalten, indem man (G) substituierte Arylpyrazole der Formel (VII)
in welcher X1, X2, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, in Gegenwart einer Base (z.B. Lithiumdiisopropylamid, LDA) und gegebenenfalls in Gegen¬ wart eines Verdünnungsmittels (z.B. Tetrahydrofuran) carboxyliert.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (G) als Ausgangsstoffe benötigten substituierten Arylpyrazole sind durch die Formel (VIT) allgemein definiert. In dieser Formel (VΗ) stehen X1, X2, R7, R8, R9 und R11 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. ins¬ besondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfindungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Substituierte Arylpyrazole der Formel (VIT) sind neu. Sie lassen sich beispielsweise herstellen, indem man (H) Arylpyrazole der Formel (VIU)
in welcher X1, R7, R8 und R9 die oben angegebenen Bedeutungen haben, mit Aminen der Formel (IX) R11 H,N-X (K)
in welcher X2 und R11 die oben angegebenen Bedeutungen haben, in Gegenwart eines Verdünnungsmittels (z.B. Pyridin) umsetzt.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (H) als Ausgangsstoffe benötigten Amine sind durch die Formel (DC) allgemein definiert. In dieser Formel (IX) stehen X2 und R11 bevor-
zugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfindungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Amine der Formel (IX) sind bekannt (teilweise sogar kommerziell erhältlich) oder können nach bekannten Verfahren erhalten werden [vgl. z.B. Methoden der Organischen Chemie (Houben Weyl) Thieme, Stuttgart, 1990, Band E 16 a, Teil I].
Die bei der Durchfuhrung des erfindungsgemäßen Verfahrens (H) weiterhin als Ausgangsstoffe benötigten Arylpyrazole sind durch die Formel (VHT) allgemein definiert. In dieser Formel (VHI) stehen X1, R7, R8 und R9 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesonde¬ re bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der er¬ findungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Arylpyrazole der Formel (VÜI-b)
in welcher X1, R7 und R8 die oben angegebenen Bedeutungen haben und R9b für C,-C6-Alkyl, C3-C6-Cycloalkyl, C,-C6-Halogenalkyl, C1-C6-AIkOXy, Ci-C6-Halogenalkoxy, CrQ-Alkylthio, CrC6-Alkylsulfinyl, CrC6-Alkylsulfonyl oder für einfach oder mehrfach substituiertes Phenyl oder Benzyl steht, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13, werden beispielsweise erhalten, indem man (J) Arylpyrazole der Formel (Vπi-a)
in welcher X1, R7 und R8 die oben angegebenen Bedeutungen haben, zunächst mit organometallischen Reagenzien der Formel (X)
- -
M1R9b (X) in welcher R9b die oben angegebenen Bedeutungen hat und M1 für MgCl, MgBr oder Me3Si steht, gegebenenfalls in Gegenwart eines Verdünnungsmittels (z.B. Tetrahydrofuran) umsetzt und die so erhaltenen Arylpyrazole der Formel (XI)
in welcher X1, R7, R8 und R9b die oben angegebenen Bedeutungen haben, in Gegenwart eines Oxidationsmittels (z.B. Dess-Martin-Periodinan) umsetzt.
In den Formeln (Vffl-b), (X) und (XI) steht R9b bevorzugt für C,-C6-Alkyl, C3-C6-Cycloalkyl, Q-Cβ-Halogenalkyl oder für jeweils gegebenen¬ falls einfach bis vierfach, gleich oder verschieden substituiertes Phenyl oder Benzyl, wobei die Substituenten unabhängig voneinander ausgewählt sein können aus ein bis drei Resten W oder einem oder mehreren Resten R13; besonders bevorzugt für Ci-C6-Alkyl, C1-C6- Cycloalkyl, Q-Q-Halogenalkyl, CrC6-Alkoxy, CrC6-Halogenalkoxy, oder für jeweils gegebe¬ nenfalls einfach bis dreifach, gleich oder verschieden CrC4-Alkyl, C2-C4-Alkenyl, C2-C4- Alkinyl, C3-C6-Cycloalkyl, C,-C4-Halogenalkyl, C2-C4-Halogenalkenyl, C2-C4-Halogen- alkinyl, C3-C6-Halocycloalkyl, Halogen, Cyano, Nitro, C1-C4-AIkOXy, CrC4-Halogenalkoxy oder -SF5 substituiertes Phenyl oder Benzyl; ganz besonders bevorzugt für Methyl, Ethyl, n- Propyl, iso-Propyl, n-Butyl, iso-Butyl, sec-Butyl, tert-Butyl, Cyclopropyl, Trifluormethyl, Methoxy, Phenyl oder Benzyl; insbesondere bevorzugt für Wasserstoff, Methyl oder Tri¬ fluormethyl.
Organometallische Reagenzien der Formel (X) sind bekannt.
Arylpyrazole der Formel (VIE-a)
in welcher X
1, R
7 und R
8 die oben angegebenen Bedeutungen haben, werden beispielsweise erhalten, indem man (K) ein Acetal der Formel (XH)
in welcher X
1, R
7 und R
8 die oben angegebenen Bedeutungen haben und R
21 für C,-C
4-Alkyl steht, in Gegenwart einer Säure (z B. Ameisensäure) und gegebenenfalls in Gegenwart eines Ver¬ dünnungsmittels (z.B Wasser) umsetzt.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (K) als Ausgangsstoffe benötigten Acetale sind durch die Formel (XH) allgemein definiert. In dieser Formel (XU) stehen X1, R7 und R8 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevorzugt für diejeni¬ gen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfmdungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden R21 steht bevorzugt Methyl oder Ethyl.
Acetale der Formel (XIT) können beispielsweise erhalten werden, indem man (L) ein Pyrazol der Formel (XIU)
in welcher R
21 die oben angegebenen Bedeutungen hat, mit einem Aromaten der Formel (XTV)
sdm welcher X1, R7 und R8 die oben angegebenen Bedeutungen haben und HaI für Halogen steht, in Gegenwart einer Base (z.B. Kahumcarbonat) und m Gegenwart eines Verdünnungsmittels (z.B. Dimethylformamid) umsetzt.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (L) als Ausgangsstoffe benötigten Pyrazole sind durch die Formel (XIH) allgemein definiert. In dieser Formel (XHI) steht R21 bevorzugt für Methyl oder Ethyl.
Pyrazole der Formel (XSI) sind bekannt oder lassen sich nach bekannten Verfahren erhalten (vgl. z.B. Chem. Ber. 1964, 97, 3407-3417).
Die bei der Durchführung des erfindungsgemäßen Verfahrens (L) weiterhin als Ausgangsstoffe benötigten Aromaten sind durch die Formel (XTV) allgemein definiert. In dieser Formel (XIV) stehen X1, R7 und R8 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevor¬ zugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfin¬ dungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden. X steht bevorzugt für Chlor oder Brom.
Aromaten der Formel (XIV) sind bekannt (teilweise sogar kommerziell erhältlich) oder können nach bekannten Verfahren erhalten werden (vgl. z.B. Heterocycles 1986, 24, 3213-3221).
Arylpyrazol-Derivate der Formel (IV) lassen sich außerdem herstellen, indem man (M) Pyrazoline der Formel (XV)
in welcher X1, X2, R7, R8, R9, R11 und R21 die oben angegebenen Bedeutungen haben, zunächst in Gegenwart einer katalytischen Menge einer Säure (z.B. Schwefelsäure) und in Gegenwart eines organischen Lösungsmittels (z.B. Ethanol) dehydratisiert und anschließend in Gegenwart einer Base (bevorzugt eines Alkoxids wie Lithium-, Natrium- oder Kalium- hydroxid) in einem Verdünnungsmittel (bevorzugt einem Gemisch aus Wasser und Alkohol wie Ethanol) verseift.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (M) als Ausgangsstoffe benötigten Pyrazoline sind durch die Formel (XV) allgemein definiert. In dieser Formel (XV) stehen X1, X2, R7, R8, R9 und R11 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevor¬ zugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfin-
dungsgemaßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden R21 steht bevorzugt für Methyl oder Ethyl.
Pyrazoline der Formel (XV) sind neu. Sie werden beispielsweise erhalten, indem man (N) Verbindungen der Formel (XVI)
in welcher X1, X2, R7, R8, R9, R11 und R21 die oben angegebenen Bedeutungen haben, in Gegenwart einer Base (z B. Tetrabutylammoniumfluond) und m Gegenwart eines Verdün¬ nungsmittels (z B. Dimethylsulfoxid) cychsiert
Die bei der Durchführung des erfindungsgemäßen Verfahrens (N) als Ausgangsstoffe benötigten Ver¬ bindungen sind durch die Formel (XVI) allgemein definiert. In dieser Formel (XVI) stehen X1, X2, R7, R8, R9 und R" bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere be¬ vorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfin- dungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden R21 steht bevorzugt für Methyl oder Ethyl
Verbindungen der Formel (XVI) sind neu. Sie werden erhalten, indem man (O) Hydrazone der Formel (XVII)
in welcher X1, X2, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, mit Oxalsäuremonoesterchloriden der Formel (XVIlI)
m welcher R
21 die oben angegebenen Bedeutungen hat, in Gegenwart einer Base (z.B. Tπethylamin) und in Gegenwart eines Verdünnungsmittels (z.B Tetrahydrofuran) umsetzt.
Die bei der Durchfuhrung des erfindungsgemäßen Verfahrens (O) als Ausgangsstoffe benötigten Oxalsäuremonoesterchloride sind durch die Formel (XVIII) allgemein definiert. In dieser Formel (XVm) steht R
21 bevorzugt für Methyl oder Ethyl.
Oxalsäuremonoesterchloride der Formel (XVIlI) sind bekannte Synthesechemikalien.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (O) weiterhin als Ausgangsstoffe benötigten Hydrazone sind durch die Formel (XVII) allgemein definiert. In dieser Formel (XVII) stehen X1, X2, R7, R8, R9 und R11 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. ins- besondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschrei¬ bung der erfindungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Hydrazone der Formel (XVII) sind neu. Sie werden erhalten, indem man (P) Hydrazine der Formel (XIX)
in welcher X1, R7 und R8 die oben angegebenen Bedeutungen haben, mit Ketonen der Formel (XX)
in welcher X
2, R
9 und R
1 ' die oben angegebenen Bedeutungen haben, gegebenenfalls in Gegenwart eines Verdünnungsmittels (z.B. Ethanol) kondensiert.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (P) als Ausgangsstoffe benötigten Hydrazine sind durch die Formel (XDC) allgemein definiert. Li dieser Formel (XDC) stehen X1, R7 und R8 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfindungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Hydrazine der Formel (XDC) sind bekannt.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (P) weiterhin als Ausgangsstoffe benö¬ tigten Ketone sind durch die Formel (XX) allgemein definiert. In dieser Formel (XX) stehen X2, R9
und R11 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfindungsgemaßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden
Ketone der Formel (XX) sind bekannt oder können nach bekannten Verfahren erhalten werden (vgl. z B. J Chem Soc Perkin Trans 2 1991, 11, 1809-1818).
Das erfindungsgemaße Verfahren (B) wird in Gegenwart eines Kondensationsmitteis durchgeführt. Hierzu eignen sich alle für solche Kupplungsreaktionen üblichen Mittel Beispielhaft genannt seien Säurehalogenidbildner wie Phosgen, Phosphortπbromid, Phosphortπchloπd, Phosphorpentachlond, Phosphoroxychloπd oder Thionylchloπd; Anhydπdbildner wie Chlorameisensäureethylester, Chlor- ameisensäuremethylester, Chlorameisensäureisopropylester, Chlorameisensäureisobutylester oder Me- thansulfonylchloπd; Carbodiimide, wie
(DCC) oder andere übliche Kondensationsmittel, wie Phosphorpentoxid, Polyphosphorsäure, l,r-Carbonyldnmidazol, 2-Ethoxy-N- ethoxycarbonyl-l,2-dihydrochinolin (EEDQ), Tπphenylphosphin/Tetrachlorkohlenstoff, Brom- tπpyrrohdinophosphonium-hexafluorophosphat, Bis(2-oxo-3-oxazohdinyl)phosphinchloπd oder Benzotπazol-l-yloxytπs(dimethylamino)-phosphonium-hexafluoφhosphat. Polymer gestutzte Re¬ agenzien, wie z B. polymer-gebundenes Cyclohexylcarbodiimid, können ebenfalls verwendet werden
Das erfindungsgemaße Verfahren (B) wird gegebenenfalls in Gegenwart eines Katalysators durchgeführt. Beispielsweise genannt seien 4-Dimethylaminopyridin, 1-Hydroxy-benzotnazol oder Dimethylformamid.
Das erfindungsgemäße Verfahren (B) kann gegebenenfalls in Gegenwart eines für solche Reaktionen üblichen inerten organischen Verdünnungsmittel durchgeführt werden. Hierzu gehören vorzugsweise aliphatische, alicychsche oder aromatische Kohlenwasserstoffe, wie beispielsweise Petrolether, Hexan, Heptan, Cyclohexan, Methylcyclohexan, Benzol, Toluol, Xylol oder Decahn; halogenierte Kohlenwasserstoffe, wie beispielsweise Chlorbenzol, Dichlorbenzol, Dichlormethan, Chloroform, Tetrachlormethan, Dichlorethan oder Tπchlorethan; Ether, wie Diethylether, Dnsopropylether, Methyl-t-butylether, Methyl-t-amylether, Dioxan, Tetrahydrofuran, 1,2- Dimethoxyethan, 1,2- Diethoxyethan oder Anisol; Ketone, wie Aceton, Butanon, Methyl-isobutylketon oder Cyclohexanon; Nitπle, wie Acetomtπl, Propiomtπl, n- oder i-Butyronitπl oder Benzomtπl; Amide, wie N,N-Dime- thylformarrad, N,N-Dimethylacetamid, N-Methylformanihd, N-Methylpyrrolidon oder Hexamethyl- phosphorsäuretπamid; deren Gemische mit Wasser oder reines Wasser. Besonders bevorzugt verwendbar sind Dichlormethan und N,N-Dimethylformamid.
Die Reaktionstemperaturen können bei der Durchführung des erfindungsgemäßen Verfahrens (A) in einem größeren Bereich variiert werden. Im Allgemeinen arbeitet man bei Temperaturen von 00C bis 1500C, vorzugsweise bei Temperaturen von 00C bis 80°C.
Zur Durchführung des erfindungsgemäßen Verfahrens (B) zur Herstellung der Verbindungen der Formel (1) setzt man pro Mol eines Anthranilamids der Formel (U) im Allgemeinen 0,8 bis 15 Mol, vorzugsweise 0,8 bis 8 Mol an Arylpyrazol-Derivat der Formel (FV) ein.
Verfahren (C) und (E) Verwendet man beispielsweise 2-(3-Chlorpyridin-2-yl)-5-(methoxyiminomethyl)-2H-pyrazol-3-car- bonsäure-(4-chlor-2-isopropylcarbamoyl-6-methylphenyl)amid als Ausgangsstoff und Lawsson's Reagenz als Schwefelungsmittel, so kann der Verlauf der erfindungsgemäßen Verfahren (C) und (E) durch das folgende Formelschema veranschaulicht werden.
Die bei der Durchführung der erfindungsgemäßen Verfahren (C) und (E) als Ausgangsstoffe benötigten Anthranilamide sind durch die Formeln (I-a) und (I-c) allgemein definiert. In diesen Formeln (I-a) und (I-c) stehen A
2, X
1, X
2, R
1, R
2, R
3, R
4, R
5, R
7, R
8, R
9 und R
11 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfindungsgemäßen Stoffe der Formel (I) als be¬ vorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Die Anthranilamide der Formeln (I-a) und (I-c) sind Untergruppen der Anthranilamide der Formel (I) und können nach den Verfahren (A), (B) und (D) erhalten werden.
Als Schwefelungsreagenz können alle für solche Reaktionen üblichen Reagenzien verwendet werden. Vorzugsweise verwendbar sind Phosphorpentasulfid und Lawesson's Reagenz.
- -
Verfahren (D) Verwendet man 5-(6-Chlor-8-methyl-4-oxo-4H-benzo[J][l,3]oxazin-2-yl)-l-(3-chlorpyridin-2-yl)- lH-pyrazol-3-carbaldehyd-O-methyloxim und /so-Propylamin so kann der Verlauf des erfindungsge¬ mäßen Verfahrens (D) durch das folgende Formelschema veranschaulicht werden.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (D) als Ausgangsstoffe benötigten Benzoxazinone sind durch die Formel (V) allgemein definiert. In dieser Formel (V) stehen X
1, X
2, R
4, R
5, R
7, R
8, R
9 und R
1 ' bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere bevorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfin¬ dungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Benzoxazinone der Formel (V) sind neu. Sie werden beispielsweise erhalten, indem man (Q) Arylpyrazol-Derivaten der Formel (FV)
in welcher X1, X2, R7, R8, R9 und R11 die oben angegebenen Bedeutungen haben, mit Anthranilsäuren der Formel (XXI)
in welcher R
4 und R
5 die oben angegebenen Bedeutungen haben,
in Anwesenheit einer Base (z.B. Tπethylamm) und in Gegenwart eines Sulfonsäurechlorids (z.B. Methansulfonsäurechlorid) sowie gegebenenfalls in Gegenwart eines Verdünnungs¬ mittels (z.B. Acetonitπl) umsetzt.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (Q) als Ausgangsstoffe benötigten Arylpyrazole der Formel (FV) sind bereits oben in Zusammenhang mit dem erfindungsgemäßen Ver¬ fahren (B) beschrieben worden.
Die bei der Durchführung des erfindungsgemäßen Verfahrens (Q) weiterhin als Ausgangsstoffe benötigten Anthranilsäuren sind durch die Formel (XXI) allgemein definiert. In dieser Formel (XXI) stehen R4 und R5 bevorzugt, besonders bevorzugt, ganz besonders bevorzugt bzw. insbesondere be¬ vorzugt für diejenigen Bedeutungen, die bereits im Zusammenhang mit der Beschreibung der erfin¬ dungsgemäßen Stoffe der Formel (I) als bevorzugt, besonders bevorzugt usw. für diese Reste genannt wurden.
Anthranilsäuren der Formel (XXI) sind bekannt oder können nach bekannten Verfahren erhalten werden (vgl. z.B. Org Synth 1963, Coli Vol. IV, 872; J Org Chem 1952, 17, 149).
Alle erfindungsgemäßen Verfahren werden im Allgemeinen unter Normaldruck durchgeführt. Es ist jedoch auch möglich, unter erhöhtem oder vermindertem Druck - im Allgemeinen zwischen 0,1 bar und 10 bar - zu arbeiten.
Die Wirkstoffe eignen sich bei guter Pflanzenverträglichkeit, günstiger Warmblütertoxizität und guter Umweltverträglichkeit zum Schutz von Pflanzen und Pflanzenorganen, zur Steigerung der Ernteerträge, Verbesserung der Qualität des Erntegutes und zur Bekämpfung von tierischen Schädlingen, insbesondere Insekten, Spinnentieren und Nematoden, die m der Landwirtschaft, in For¬ sten, in Gärten und Freizeiteinπchtungen, im Vorrats- und Mateπalschutz sowie auf dem Hygiene¬ sektor vorkommen. Sie können vorzugsweise als Pflanzenschutzmittel eingesetzt werden. Sie sind gegen normal sensible und resistente Arten sowie gegen alle oder einzelne Entwicklungsstadien wirksam. Zu den oben erwähnten Schädlingen gehören: Aus der Ordnung der Isopoda z.B. Oniscus asellus, Armadilhdium vulgäre, Porcelho scaber. Aus der Ordnung der Dφlopoda z.B. Blaniulus guttulatus. Aus der Ordnung der Chilopoda z.B. Geophilus carpophagus, Scutigera spp. Aus der Ordnung der Symphyla z.B. Scutigerella Immaculata. Aus der Ordnung der Thysanura z.B. Lepisma sacchaπna. Aus der Ordnung der Collembola z.B. Onychiurus armatus.
Aus der Ordnung der Orthoptera z.B Acheta domesticus, Gryllotalpa spp., Locusta migratoπa migratoπoides, Melanoplus spp., Schistocerca gregaπa Aus der Ordnung der Blattana z B. Blatta oπentalis, Peπplaneta ameπcana, Leucophaea maderae, Blattella germanica Aus der Ordnung der Dermaptera z.B Forficula aunculaπa. Aus der Ordnung der Isoptera z.B. Reticulitermes spp. Aus der Ordnung der Phthiraptera z B Pediculus humanus corporis, Haematopinus spp., Linognathus spp., Tπchodectes spp , Damahnia spp Aus der Ordnung der Thysanoptera z B. Hercinothnps femorahs, Thπps tabaci, Thπps palmi, Frankhniella accidentahs. Aus der Ordnung der Heteroptera z.B. Eurygaster spp , Dysdercus intermedius, Piesma quadrata, Cimex lectulaπus, Rhodnius prohxus, Tπatoma spp. Aus der Ordnung der Homoptera z B. Aleurodes brassicae, Bemisia tabaci, Tπaleurodes vaporano- rum, Aphis gossypn, Brevicoryne brassicae, Cryptomyzus πbis, Aphis fabae, Aphis pomi, Eπosoma lanigerum, Hyalopterus arundmis, Phylloxera vastatπx, Pemphigus spp., Macrosiphum avenae, Myzus spp., Phorodon humuh, Rhopalosiphum padi, Empoasca spp., Euscehs bilobatus, Nephotettix cmcticeps, Lecanium corni, Saissetia oleae, Laodelphax srπatellus, Nilaparvata lugens, Aonidiella aurantn, Aspidiorus hederae, Pseudococcus spp , Psylla spp. Aus der Ordnung der Lepidoptera z.B. Pectmophora gossypiella, Bupalus pmiaπus, Cheimatobia brumata, Lithocolletis blancardella, Hyponomeuta padella, Plutella xylostella, Malacosoma neustπa, Euproctis chrysorrhoea, Lymantπa spp , Bucculatπx thurbeπella, Phyllocnistis citrella, Agrotis spp., Euxoa spp , Feltia spp., Eaπas msulana, Heliothis spp , Mamestra brassicae, Panohs flammea, Spodo- ptera spp., Tπchoplusia ni, Carpocapsa pomonella, Pieπs spp., Chilo spp., Pyrausta nubilahs, Ephes- tia kuehniella, Galleπa mellonella, Tineola bisselhella, Tinea pelhonella, Hofmannophila pseudo- spretella, Cacoecia podana, Capua reticulana, Choπstoneura fumiferana, Clysia ambiguella, Homona magnamma, Tortπx vindana, Cnaphalocerus spp., Oulema oryzae. Aus der Ordnung der Coleoptera z.B Anobium punctatum, Rhizopertha dominica, Bruchidius obtectus, Acanthoscelides obtecrus, Hylotrupes bajulus, Agelastica alm, Leptmotarsa decemlmeata, Phaedon cochleanae, Diabrotica spp., Psylhodes chrysocephala, Epilachna vanvestis, Atomaπa spp., Oryzaephilus suπnamensis, Anthonomus spp., Sitophilus spp., Otiorrhynchus sulcatus, Cosmopolites sordidus, Ceuthorrhynchus assimihs, Hypera postica, Dermestes spp., Trogoderma spp., Anthrenus spp., Attagenus spp., Lyctus spp., Mehgethes aeneus, Ptmus spp., Niptus hololeucus, Gibbium psylloides, Tπbolium spp., Tenebπo mohtor, Agπotes spp., Conoderus spp., Melolontha melolontha, Amphimallon solstitiahs, Costelytra zealandica, Lissorhoptrus oryzophilus. Aus der Ordnung der Hymenoptera z.B. Dipπon spp , Hoplocampa spp., Lasius spp., Monomoπum pharaonis, Vespa spp.
Aus der Ordnung der Diptera z.B. Aedes spp., Anopheles spp , Culex spp., Drosophila melanogaster, Musca spp., Fannia spp., Calhphora erythrocephala, Lucilia spp., Chrysomyia spp., Cuterebra spp., Gastrophilus spp., Hyppobosca spp., Stomoxys spp., Oestrus spp., Hypoderma spp., Tabanus spp., Tannia spp., Bibio hortulanus, Oscinella fπt, Phorbia spp., Pegomyia hyoscyami, Ceratitis capitata, Dacus oleae, Tφula paludosa, Hylemyia spp., Liπomyza spp. Aus der Ordnung der Sφhonaptera z B. Xenopsylla cheopis, Ceratophyllus spp. Aus der Klasse der Arachmda z.B. Scorpio maurus, Latrodectus mactans, Acarus siro, Argas spp., Ornithodoros spp., Dermanyssus gallmae, Eπophyes πbis, Phyllocoptruta oleivora, Boophilus spp , Rhipicephalus spp., Amblyomma spp., Hyalomma spp., Ixodes spp , Psoroptes spp., Choπoptes spp., Sarcoptes spp., Tarsonemus spp., Bryobia praetiosa, Panonychus spp., Tetranychus spp., Hemitarso- nemus spp., Brevipalpus spp. Zu den pflanzenparasitären Nematoden gehören z.B. Pratylenchus spp., Radopholus similis, Ditylen- chus dipsaci, Tylenchulus semipenetrans, Heterodera spp , Globodera spp., Meloidogyne spp., Aphelenchoides spp., Longidorus spp., Xφhmema spp., Tπchodorus spp., Bursaphelenchus spp.
Die erfindungsgemäßen Verbindungen der Formel (I) zeichnen sich insbesondere durch eine hervorragende Wirkung gegen Raupen und Käferlarven aus.
Die erfindungsgemäßen Verbindungen können gegebenenfalls m bestimmten Konzentrationen bzw. Aufwandmengen auch als Herbizide und Mikrobizide, beispielsweise als Fungizide, Antimykotika und Bakterizide verwendet werden. Sie lassen sich gegebenenfalls auch als Zwischen- oder Vorprodukte für die Synthese weiterer Wirkstoffe einsetzen.
Erfindungsgemäß können alle Pflanzen und Pflanzenteile behandelt werden. Unter Pflanzen werden hierbei alle Pflanzen und Pflanzenpopulationen verstanden, wie erwünschte und unerwünschte Wild¬ pflanzen oder Kulturpflanzen (einschließlich natürlich vorkommender Kulturpflanzen). Kulturpflan¬ zen können Pflanzen sein, die durch konventionelle Züchtungs- und Optimierungsmethoden oder durch biotechnologische und gentechnologische Methoden oder Kombinationen dieser Methoden er¬ halten werden können, einschließlich der transgenen Pflanzen und einschließlich der durch Sorten- schutzrechte schützbaren oder nicht schützbaren Pflanzensorten. Unter Pflanzenteilen sollen alle obeπrdischen und unteπrdischen Teile und Organe der Pflanzen, wie Spross, Blatt, Blüte und Wurzel verstanden werden, wobei beispielhaft Blätter, Nadeln, Stängel, Stämme, Blüten, Fruchtkörper, Früchte und Samen sowie Wurzeln, Knollen und Rhizome aufgeführt werden. Zu den Pflanzenteilen gehört auch Erntegut sowie vegetatives und generatives Vermehrungsmaterial, beispielsweise Steck- lmge, Knollen, Rhizome, Ableger und Samen.
Die erfindungsgemäße Behandlung der Pflanzen und Pflanzenteile mit den Wirkstoffen erfolgt direkt oder durch Einwirkung auf deren Umgebung, Lebensraum oder Lagerraum nach den üblichen Be¬ handlungsmethoden, z.B durch Tauchen, Sprühen, Verdampfen, Vernebeln, Streuen, Aufstreichen, Injizieren und bei Vermehrungsmatenal, insbesondere bei Samen, weiterhin durch ein- oder mehr- schichtiges Umhüllen.
Die Wirkstoffe können in die üblichen Formulierungen überführt werden, wie Lösungen, Emulsionen, Spritzpulver, Suspensionen, Pulver, Stäubemittel, Pasten, lösliche Pulver, Granulate, Suspensions-Emulsions-Konzentrate, Wirkstoff-imprägnierte Natur- und synthetische Stoffe sowie Feinstverkapselungen m polymeren Stoffen.
Diese Formulierungen werden in bekannter Weise hergestellt, z B. durch Vermischen der Wirkstoffe mit Streckmitteln, also flüssigen Lösungsmitteln und/oder festen Trägerstoffen, gegebenenfalls unter Verwendung von oberflächenaktiven Mitteln, also Emulgiermitteln und/oder Dispergiermitteln und/oder schaumerzeugenden Mitteln.
Im Falle der Benutzung von Wasser als Streckmittel können z.B. auch organische Lösungsmittel als Hilfslosungsmittel verwendet werden. Als flüssige Lösungsmittel kommen im wesentlichen in Frage- Aromaten, wie Xylol, Toluol, oder Alkylnaphthalme, chloπerte Aromaten und chlorierte ahphatische Kohlenwasserstoffe, wie Chlorbenzole, Chlorethylene oder Methylenchloπd, ahphatische Kohlen¬ wasserstoffe, wie Cyclohexan oder Paraffine, z B. Erdölfraktionen, mineralische und pflanzliche Öle, Alkohole, wie Butanol oder Glykol sowie deren Ether und Ester, Ketone wie Aceton, Methylethyl- keton, Methyhsobutylketon oder Cyclohexanon, stark polare Lösungsmittel, wie Dimethylformamid und Dimethylsulfoxid, sowie Wasser.
Als feste Trägerstoffe kommen in Frage: z.B. Ammoniumsalze und natürliche Gesteinsmehle, wie Kaoline, Tonerden, Talkum, Kreide, Quarz, Attapulgit, Montmonllonit oder Diatomeenerde und synthetische Gesteinsmehle, wie hochdisperse Kieselsäure, Aluminiumoxid und Silikate, als feste Trägerstoffe für Granulate kommen m Frage: z.B. gebrochene und fraktionierte natürliche Gesteine wie Calcit, Marmor, Bims, Sepiohth, Dolomit sowie synthetische Granulate aus anorganischen und organischen Mehlen sowie Granulate aus organischem Material wie Sägemehl, Kokosnussschalen, Maiskolben und Tabakstängeln; als Emulgier- und/oder schaumerzeugende Mittel kommen in Frage: z.B. nichtionogene und anionische Emulgatoren, wie Polyoxyethylen-Fettsäure-Ester, Polyoxyethylen-Fettalkohol-Ether, z.B. Alkylaryl-polyglykolether, Alkylsulfonate, Alkylsulfate, Arylsulfonate sowie Einweißhydrolysate; als Dispergiermittel kommen in Frage- z.B. Lignin-Sulfitablaugen und Methylcellulose.
- -
Es können in den Formulierungen Haftmittel wie Carboxymethylcellulose, natürliche und syntheti¬ sche pulvrige, körnige oder latexförmige Polymere verwendet werden, wie Gummiarabicum, PoIy- vinylalkohol, Polyvinylacetat, sowie natürliche Phosphohpide, wie Kephahne und Lecithme und synthetische Phospholipide. Weitere Additive können mineralische und vegetabile Ole sein.
Es können Farbstoffe wie anorganische Pigmente, z B. Eisenoxid, Titanoxid, Ferrocyanblau und organische Farbstoffe, wie Ahzaπn-, Azo- und Metallphthalocyanmfarbstoffe und Spurennährstoffe wie Salze von Eisen, Mangan, Bor, Kupfer, Kobalt, Molybdän und Zink verwendet werden.
Die Formulierungen enthalten im allgemeinen zwischen 0,1 und 95 Gew.-% Wirkstoff, vorzugsweise zwischen 0,5 und 90 %.
Der erfϊndungsgemaße Wirkstoff kann in seinen handelsüblichen Formulierungen sowie in den aus diesen Formulierungen bereiteten Anwendungsformen in Mischung mit anderen Wirkstoffen, wie In- sektiziden, Lockstoffen, Steπlantien, Bakteriziden, Akanziden, Nematoden, Fungiziden, wachs- tumsreguherenden Stoffen oder Herbiziden vorliegen. Zu den Insektiziden zählen beispielsweise Phosphorsäureester, Carbamate, Carbonsäureester, chlorierte Kohlenwasserstoffe, Phenylharnstoffe, durch Mikroorganismen hergestellte Stoffe u a.
Besonders gunstige Mischpartner sind z B. die folgenden- Fungizide: 2-Phenylphenol; 8-Hydroxyquinoline sulfate; Acibenzolar-S-methyl; Aldimorph, Amidoflumet; Ampro- pylfos; Ampropylfos-potassium; Andopπm; Amlazine; Azaconazole; Azoxystrobin; Benalaxyl; Be- nodanil; Benomyl; Benthiavahcarb-isopropyl; Benzamacπl; Benzamacπl-isobutyl; Bilanafos; Brna- pacryl, Biphenyl; Bitertanol; Blasticidin-S; Boscahd; Bromuconazole, Bupinmate; Buthiobate, Butyl- armne; Calcium polysulfide; Capsimycin; Captafol; Captan; Carbendazim; Carboxin; Caφroparrud; Carvone; Chinomethionat; Chlobenthiazone; Chlorfenazole; Chloroneb; Chlorothalonil; Chlozohnate; Clozylacon; Cyazofamid; Cyflufenamid; Cymoxanil; Cyproconazole; Cyprodinil; Cyprofuram; Dagger G; Debacarb; Dichlofluanid; Dichlone; Dichlorophen; Diclocymet; Diclomezine; Dicloran; Di- ethofencarb; Difenoconazole; Difiumetonm; Dimethinmol; Dimethomorph; Dimoxystrobin; Dinicon- azole; Diniconazole-M; Dinocap; Diphenylamine; Dipyπthione; Ditahmfos; Dithianon; Dodine; Dra- zoxolon; Edifenphos; Epoxiconazole; Ethaboxam; Ethiπmol; Etπdiazole; Famoxadone; Fenamidone; Fenapanil; Fenanmol; Fenbuconazole; Fenfuram; Fenhexamid; Fenitropan; Fenoxanil; Fenpicloml; Fenpropidin; Fenpropimoφh; Ferbam; Fluazinam; Flubenzimine; Fludioxonil; Flumetover; Flumoφh; Fluoromide; Fluoxastrobin; Fluquinconazole; Fluφπmidol; Flusilazole; Flusulfanude; Flutolanil; Flutπafol; Folpet; Fosetyl-Al; Fosetyl-sodium; Fubeπdazole; Furalaxyl; Furametpyr; Furcarbanil;
- -
Furmecyclox; Guazatine; Hexachlorobenzene; Hexaconazole; Hymexazol; Imazahl; Imibenconazole; Iminoctadme tnacetate; Irranoctadine tπs(albesilate); Iodocarb; Ipconazole; Iprobenfos; Iprodione; Iprovahcarb; Irumamycin; Isoprothiolane; Isovaledione; Kasugamycm, Kresoxim-methyl; Mancozeb; Maneb; Mefeπmzone, Mepanipyπm; Meproml; Metalaxyl; Metalaxyl-M; Metconazole; Metha- sulfocarb; Methfuroxam; Mehram; Metorrunostrobin, Metsulfovax; Mildiomycm; Myclobutanil; Myclozohn; Natamycin; Nicobifen, Nitrothal-isopropyl; Noviflumuron; Nuaπmol, Ofurace; Orysa- strobin; Oxadixyl; Oxohmc acid; Oxpoconazole; Oxycarboxm; Oxyfenthiin; Paclobutrazol; Pefura- zoate, Penconazole; Pencycuron; Phosdiphen; Phthahde; Picoxystrobm; Piperalin; Polyoxms; PoIy- oxoπm; Probenazole, Prochloraz; Procymidone; Propamocarb, Propanosine-sodium; Propiconazole; Propmeb; Proqumazid; Prothioconazole; Pyraclostrobm; Pyrazophos; Pyπfenox; Pyπmethanil; Pyro- quilon; Pyroxyfur; Pyrrolmtπne; Quinconazole; Quinoxyfen; Quintozene; Simeconazole; Spiroxarmne; Sulfiir; Tebuconazole; Tecloftalam; Tecnazene; Tetcyclacis; Tetraconazole; Thiabendazole, Thicyofen; Thifluzarrade; Thiophanate-methyl; Thiram; Tioxymid; Tolclofos-methyl; Tolylfluanid; Tπadimefon; Tπadimenol; Tπazbutil; Tπazoxide; Tπcyclamide; Tπcyclazole; Tπdemoφh; Tπfloxystrobm; Tπflu- mizole; Tπfoπne; Tπticonazole; Uniconazole; Vahdamycin A; Vmclozolin; Zineb; Ziram; Zoxamide; (2S)-N-[2-[4-[[3-(4-Chlθφhenyl)-2-propnyl]oxy]-3-methoxyphenyl]ethyl]-3-methyl-2-[(methylsulfo- nyl)amino]-butanamid; l-(l-Naphthahnyl)-lH-pyrrol-2,5-dion; 2,3,5,6-Tetrachlor-4-(methylsulfonyl)- pyπdm; 2-Ammo^4-methyl-N-phenyl-5-thiazolcarboxamid; 2-Chlor-N-(2,3-dihydro-l,l,3-tnrnethyl-lH- inden-4-yl)-3-pyndincarboxamid; 3,4,5-Tπchlor-2,6-pyπdindicarbonitπl; Actinovate; cis-l-(4-Chlor- phenyl)-2-(lH-l,2,4-tnazol-l-yl)-cycloheptanol; Methyl l-(2,3-dihydro-2,2-dimethyl-lH-mden-l-yl)- 1 H-imidazol-5-carboxylat; Monokahumcarbonat; N-(O-MeIhOXy-S-PyHdUIyI)-CyCIoPrOPaHCaTbOXaITUd; N-Butyl-8-(l,l-dimethylethyl)-l-oxaspiro[4 5]decan-3-amin; Natπumtetracarbonat; sowie Kupfersalze und -Zubereitungen, wie Bordeaux mixture; Copper hydroxide, Copper naphthe- nate; Copper oxychloπde; Copper sulfate; Cufraneb; Cuprous oxide; Mancopper; Oxine-copper.
Bakterizide: Bronopol, Dichlorophen, Nitrapynn, Nickel-Dimethyldithiocarbamat, Kasugamycm, Octhihnon, Furancarbonsäure, Oxytetracyclin, Probenazol, Streptomycin, Tecloftalam, Kupfersulfat und andere Kupfer-Zubereitungen.
Insektizide / Akarizide / Nematizide: 1 Acetylcholmesterase (AChE) Inhibitoren 1.1 Carbamate (z B. Alanycarb, Aldicarb, Aldoxycarb, Allyxycarb, Aminocarb, Azamethiphos, Bendiocarb, Benfuracarb, Bufencarb, Butacarb, Butocarboxim, Butoxycarboxim, Carbaryl, Carbofuran, Carbosulfan, Chloethocarb, Coumaphos, Cyanofenphos, Cyanophos, Dimetilan, Ethiofencarb, Fenobucarb, Fenothiocarb, Formetanate, Furathiocarb, Isoprocarb, Metam-sodium,
Methiocarb, Methomyl, Metolcarb, Oxamyl, Piπmicarb, Promecarb, Propoxur, Thiodicarb, Thiofanox, Tπazamate, Tπmethacarb, XMC, Xylylcarb) 1 2 Organophosphate (z.B Acephate, Azamethiphos, Azinphos (-methyl, -ethyl), Bromophos-ethyl, Bromfenvinfos (-methyl), Butathiofos, Cadusafos, Carbophenothion, Chlorethoxyfos, Chlorfen- vinphos, Chlormephos, Chloφyπfos (-methyl/-ethyl), Coumaphos, Cyanofenphos, Cyanophos, Chlorfenvinphos, Demeton-S-methyl, Demeton-S-methylsulphon, Diahfos, Diazinon, Dichlofenthion, Dichlorvos/DDVP, Dicrotophos, Dimethoate, Dimethylvmphos, Dioxabenzofos, Disulfoton, EPN, Ethion, Ethoprophos, Etπmfos, Famphur, Fenamiphos, Fenitrothion, Fensulfothion, Fenthion, Flupy- razofos, Fonofos, Formothion, Fosmethilan, Fosthiazate, Heptenophos, Iodofenphos, Iprobenfos, Isazofos, Isofenphos, Isopropyl O-salicylate, Isoxathion, Malathion, Mecarbam, Methacπfos, Metha- midophos, Methidathion, Mevmphos, Monocrotophos, Naled, Omethoate, Oxydemeton-methyl, Para- thion (-methyl/-ethyl), Phenthoate, Phorate, Phosalone, Phosmet, Phosphamidon, Phosphocarb, Phoxim, Pinmiphos (-methyl/-ethyl), Profenofos, Propaphos, Propetamphos, Prothiofos, Prothoate, Pyraclofos, Pyπdaphenthion, Pyπdathion, Qumalphos, Sebufos, Sulfotep, Sulprofos, Tebupiπmfos, Temephos, Terbufos, Tetrachlorvinphos, Thiometon, Tπazophos, Tπclorfon, Vamidothion) 2 Natrium-Kanal-Modulatoren / Spannungsabhangige Natnwn-Kanal-Blocker 2 1 Pyrethroide (z B. Acπnathπn, Allethπn (d-cis-trans, d-trans), Beta-Cyfluthπn, Bifenthπn, Bio- allethπn, Bioallethπn-S-cyclopentyl-isomer, Bioethanomethπn, Biopermethπn, Bioresmethπn, ChIo- vaporthπn, Cis-Cypermethπn, Cis-Resmethπn, Cis-Permethπn, Clocythπn, Cycloprothπn, Cyflu- thπn, Cyhalothπn, Cypermethπn (alpha-, beta-, theta-, zeta-), Cyphenothπn, DDT, Deltamethπn, Em- penthπn (lR-isomer), Esfenvalerate, Etofenprox, Fenfluthπn, Fenpropathπn, Fenpyπthnn, Fen- valerate, Flubrocythπnate, Flucythπnate, Flufenprox, Flumethπn, Fluvahnate, Fubfenprox, Gamma- Cyhalothnn, Imiprothπn, Kadethπn, Lambda-Cyhalothπn, Metofluthπn, Permethπn (eis-, trans-), Phenothπn (lR-trans isomer), Prallethπn, Profluthπn, Protπfenbute, Pyresmethπn, Resmethπn, RU 15525, Silafluofen, Tau-Fluvalinate, Tefluthπn, Terallethπn, Tetramethπn (lR-isomer), Tralome- thπn, Transfluthπn, ZXI 8901, Pyrethπns (pyrethrum)) 2.2 Oxadiazme (z.B Indoxacarb) 3 Acetylcholιn-Rezeptor-Agonιsten/-Antagonιsten 3 1 Chloronicohnyle/Neonicotinoide (z.B. Acetamipπd, Clothianidm, Dmotefuran, Imidaclopnd, Ni- tenpyram, Nithiazine, Thiaclopπd, Thiamethoxam) 3.2 Nicotine, Bensultap, Cartap 4 A cetylchohn-Rezeptor-Modulatoren 4.1 Spinosyne (z B. Spinosad) 5 GABA-gesteuerte Chlond-Kanal-Antagonisten 5.1 Cyclodiene Organochloπne (z.B. Camphechlor, Chlordane, Endosulfan, Gamma-HCH, HCH, Heptachlor, Lindane, Methoxychlor
5.2 Fiprole (z.B. Acetoprole, Ethiprole, Fipronil, Vaniliprole) 6. Chlorid-Kanal-Aktivatoren 6.1 Mectine (z.B. Abamectin, Avermectin, Emamectin, Emamectin-benzoate, Ivermectin, Milbe- mectin, Milbemycin) 7. Juvenilhormon-Mimetika (z.B. Diofenolan, Epofenonane, Fenoxycarb, Hydroprene, Kinoprene, Methoprene, Pyriproxifen, Triprene) 8. Ecdysonagonisten/disruptoren 8.1 Diacylhydrazine (z.B. Chromafenozide, Halofenozide, Methoxyfenozide, Tebufenozide) 9. Inhibitoren der Chitinbiosynthese 9.1 Benzoylharnstoffe (z.B. Bistrifluron, Chlofluazuron, Diflubenzuron, Fluazuron, Flucycloxuron, Flufenoxuron, Hexaflumuron, Lufenuron, Novaluron, Noviflumuron, Penfluron, Teflubenzuron, Tri- flumuron) 9.2 Buprofezin 9.3 Cyromazine 10. Inhibitoren der oxidativen Phosphorylierung, ATP-Disruptoren 10.1 Diafenthiuron 10.2 Organotine (z.B. Azocyclotin, Cyhexatin, Fenbutatin-oxide) 11. Entkoppler der oxidativen Phoshorylierung durch Unterbrechung des H-Protongradienten 11.1 Pyrrole (z.B. Chlorfenapyr) 11.2 Dinitrophenole (z.B. Binapacyrl, Dinobuton, Dinocap, DNOC) 12. Seite-I-Elektronentransportinhibitoren 12.1 METI's (z.B. Fenazaquin, Fenpyroximate, Pyrimidifen, Pyridaben, Tebufenpyrad, Tolfenpyrad) 12.2 Hydramethylnone 12.3 Dicofol 13. Seite-II-Elektronentransportinhibitoren 13.1 Rotenone 14. Seite-III-Elektronentransportinhibitoren 14.1 Acequinocyl, Fluacrypyrim 75. Mikrobielle Disruptoren der Insektendarmmembran Bacillus thuringiensis-Stämme 16. Inhibitoren der Fettsynthese 16.1 Tetronsäuren (z.B. Spirodiclofen, Spiromesifen) 16.2 Tetramsäuren [z.B. 3-(2,5-Dimethylphenyl)-8-methoxy-2-oxo-l-azaspiro[4.5]dec-3-en-4-yl ethyl carbonate (alias: Carbonic acid, 3-(2,5-dimethylphenyl)-8-methoxy-2-oxo-l-azaspiro[4.5]dec-3-en-4-
yl ethyl ester, CAS-Reg.-No.: 382608-10-8) and Carbonic acid, cis-3-(2,5-dimethylphenyl)-8- methoxy-2-oxo-l-azaspiro[4.5]dec-3-en-4-yl ethyl ester (CAS-Reg.-No.: 203313-25-1)] 17. Carboxamide (z.B. Flomcamid) 18 Oktopaminerge Agonisten (z.B. Amitraz) 19. Inhibitoren der Magnesium-stimulierten ATPase (z.B. Propargite) 20. Phthalamide (z.B. N2-[l,l-Dimethyl-2-(methylsulfonyl)ethy]]-3-iod-N'-[2-methyl-4-[l,2,2,2-tetrafluor-l-(tnfluor- methyl)ethyl]phenyl]-l,2-benzenedicarboxamide (CAS-Reg.-No.: 272451-65-7)) 21. Nereistoxin-Analoge (z.B. Thiocyclam hydrogen Oxalate, Thiosultap-sodium) 22 Bwlogika, Hormone oder Pheromone (z.B. Azadirachtm, Bacillus spec, Beauveπa spec, Codlemone, Metarrhizium spec, Paecilomyces spec, Thuπngiensin, Verticillium spec.) 23. Wirkstoffe mit unbekannten oder nicht spezifischen Wirkmechanismen 23.1 Begasungsmittel (z.B. Aluminium phosphide, Methyl bromide, Sulfuryl fluonde) 23 2 Selektive Fraßhemmer (z.B. Cryolite, Flomcamid, Pymetrozine) 23.3 Milbenwachstumsinhibitoren (z B. Clofentezine, Etoxazole, Hexythiazox) 23.4 Amidoflumet, Benclothiaz, Benzoximate, Bifenazate, Bromopropylate, Buprofezin, Chmomethi- onat, Chlordimeform, Chlorobenzilate, Chloropicπn, Clothiazoben, Cycloprene, Dicyclaml, Fenoxa- cπm, Fentπfanil, Flubenzirmne, Flufeneπm, Flutenzin, Gossyplure, Hydramethylnone, Japonilure, Metoxadiazone, Petroleum, Piperonyl butoxide, Potassium oleate, Pyπdalyl, Sulfluramid, Tetradifon, Tetrasul, Tπarathene, Verbutm
ferner die Verbindung 3-Methyl-phenyl-propylcarbamat (Tsumacide Z), die Verbindung 3-(5-Chlor- 3-pyπdinyl)-8-(2,2,2-tπfluorethyl)-8-azabicyclo[3.2.1]octan-3-carbonitπl (CAS-Reg.-Nr. 185982-80- 3) und das entsprechende 3-endo-Isomere (CAS-Reg.-Nr. 185984-60-5) (vgl. WO-96/37494, WO- 98/25923), sowie Präparate, welche insektizid wirksame Pflanzenextrakte, Nematoden, Pilze oder Viren enthalten.
Auch eine Mischung mit anderen bekannten Wirkstoffen, wie Herbiziden, Düngemitteln, Wachstumsregulatoren, Safenern oder Semiochemicals ist möglich.
Die erfindungsgemäßen Wirkstoffe können ferner beim Einsatz als Insektizide in ihren handels¬ üblichen Formulierungen sowie in den aus diesen Formulierungen bereiteten Anwendungsformen in Mischung mit Synergisten vorliegen. Synergisten sind Verbindungen, durch die die Wirkung der Wirkstoffe gesteigert wird, ohne dass der zugesetzte Synergist selbst aktiv wirksam sein muss.
Die erfindungsgemäßen Wirkstoffe können ferner beim Einsatz als Insektizide in ihren handelsübli¬ chen Formulierungen sowie in den aus diesen Formulierungen bereiteten Anwendungsformen in Mi¬ schungen mit Hemmstoffen vorliegen, die einen Abbau des Wirkstoffes nach Anwendung in der Um¬ gebung der Pflanze, auf der Oberfläche von Pflanzenteilen oder in pflanzlichen Geweben vermindern.
Der Wirkstoffgehalt der aus den handelsüblichen Formulierungen bereiteten Anwendungsformen kann in weiten Bereichen variieren. Die Wirkstoffkonzentration der Anwendungsformen kann von 0,0000001 bis zu 95 Gew.-% Wirkstoff, vorzugsweise zwischen 0,0001 und 1 Gew.-% liegen.
Die Anwendung geschieht in einer den Anwendungsformen angepassten üblichen Weise.
Bei der Anwendung gegen Hygiene- und Vorratsschädlinge zeichnet sich der Wirkstoff durch eine hervorragende Residualwirkung auf Holz und Ton sowie durch eine gute Alkalistabilität auf gekalkten Unterlagen aus.
Wie bereits oben erwähnt, können erfindungsgemäß alle Pflanzen und deren Teile behandelt werden. In einer bevorzugten Ausführungsform werden wild vorkommende oder durch konventionelle biolo¬ gische Zuchtmethoden, wie Kreuzung oder Protoplastenfusion erhaltenen Pflanzenarten und Pflan¬ zensorten sowie deren Teile behandelt. In einer weiteren bevorzugten Ausführungsform werden transgene Pflanzen und Pflanzensorten, die durch gentechnologische Methoden gegebenenfalls in Kombination mit konventionellen Methoden erhalten wurden (Genetically Modified Organisms) und deren Teile behandelt. Der Begriff „Teile" bzw. „Teile von Pflanzen" oder „Pflanzenteile" wurde oben erläutert.
Besonders bevorzugt werden erfindungsgemäß Pflanzen der jeweils handelsüblichen oder in Gebrauch befindlichen Pflanzensorten behandelt. Unter Pflanzensorten versteht man Pflanzen mit neuen Ei¬ genschaften („Traits"), die sowohl durch konventionelle Züchtung, durch Mutagenese oder durch re- kombinante DNA-Techniken gezüchtet worden sind. Dies können Sorten, Bio- und Genotypen sein.
Je nach Pflanzenarten bzw. Pflanzensorten, deren Standort und Wachstumsbedingungen (Böden, Klima, Vegetationsperiode, Ernährung) können durch die erfindungsgemäße Behandlung auch über-
additive („synergistische") Effekte auftreten. So sind beispielsweise erniedrigte Aufwandmengen und/oder Erweiterungen des Wirkungsspektrums und/oder eine Verstärkung der Wirkung der erfin- dungsgemäß verwendbaren Stoffe und Mittel, besseres Pflanzenwachstum, erhöhte Toleranz gegen¬ über hohen oder niedrigen Temperaturen, erhöhte Toleranz gegen Trockenheit oder gegen Wasser- bzw. Bodensalzgehalt, erhöhte Blühleistung, erleichterte Ernte, Beschleunigung der Reife, höhere Ernteerträge, höhere Qualität und/oder höherer Ernährungswert der Ernteprodukte, höhere Lager¬ fähigkeit und/oder Bearbeitbarkeit der Ernteprodukte möglich, die über die eigentlich zu erwartenden Effekte hinausgehen.
Zu den bevorzugten erfindungsgemäß zu behandelnden transgenen (gentechnologisch erhaltenen) Pflanzen bzw. Pflanzensorten gehören alle Pflanzen, die durch die gentechnologische Modifikation genetisches Material erhielten, welches diesen Pflanzen besondere vorteilhafte wertvolle Eigenschaf¬ ten („Traits") verleiht. Beispiele für solche Eigenschaften sind besseres Pflanzenwachstum, erhöhte Toleranz gegenüber hohen oder niedrigen Temperaturen, erhöhte Toleranz gegen Trockenheit oder gegen Wasser- bzw. Bodensalzgehalt, erhöhte Blühleistung, erleichterte Ernte, Beschleunigung der Reife, höhere Ernteerträge, höhere Qualität und/oder höherer Ernährungswert der Ernteprodukte, höhere Lagerfähigkeit und/oder Bearbeitbarkeit der Ernteprodukte. Weitere und besonders hervorge¬ hobene Beispiele für solche Eigenschaften sind eine erhöhte Abwehr der Pflanzen gegen tierische und mikrobielle Schädlinge, wie gegenüber Insekten, Milben, pflanzenpathogenen Pilzen, Bakterien und/oder Viren sowie eine erhöhte Toleranz der Pflanzen gegen bestimmte herbizide Wirkstoffe. Als Beispiele transgener Pflanzen werden die wichtigen Kulturpflanzen, wie Getreide (Weizen, Reis), Mais, Soja, Kartoffel, Baumwolle, Tabak, Raps sowie Obstpflanzen (mit den Früchten Äpfel, Birnen, Zitrusfrüchten und Weintrauben) erwähnt, wobei Mais, Soja, Kartoffel, Baumwolle, Tabak und Raps besonders hervorgehoben werden. Als Eigenschaften („Traits") werden besonders hervorgehoben die erhöhte Abwehr der Pflanzen gegen Insekten, Spinnentiere, Nematoden und Schnecken durch in den Pflanzen entstehende Toxine, insbesondere solche, die durch das genetische Material aus Bacillus Thuringiensis (z.B. durch die Gene CryΙA(a), CryIA(b), CryΙA(c), CryllA, CryfflA, CrymB2, Cry9c Cry2Ab, Cry3Bb und CrylF sowie deren Kombinationen) in den Pflanzen erzeugt werden (im Fol¬ genden „Bt Pflanzen"). Als Eigenschaften („Traits") werden auch besonders hervorgehoben die er- höhte Abwehr von Pflanzen gegen Pilze, Bakterien und Viren durch Systemische Akquirierte Resis¬ tenz (SAR), Systemin, Phytoalexine, Elicitoren sowie Resistenzgene und entsprechend exprimierte Proteine und Toxine. Als Eigenschaften („Traits") werden weiterhin besonders hervorgehoben die er¬ höhte Toleranz der Pflanzen gegenüber bestimmten herbiziden Wirkstoffen, beispielsweise Imidazo- linonen, Sulfonylharnstoffen, Glyphosate oder Phosphinotricin (z.B. ,,PAT"-Gen). Die jeweils die ge- wünschten Eigenschaften („Traits") verleihenden Gene können auch in Kombinationen miteinander in den transgenen Pflanzen vorkommen. Als Beispiele für „Bt Pflanzen" seien Maissorten, Baum-
wollsorten, Sojasorten und Kartoffelsorten genannt, die unter den Handelsbezeichnungen YIELD GARD® (z.B. Mais, Baumwolle, Soja), KnockOut® (z.B. Mais), StarLink® (z.B. Mais), Bollgard® (Baumwolle), Nucotn® (Baumwolle) und NewLeaf® (Kartoffel) vertrieben werden. Als Beispiele für Herbizid-tolerante Pflanzen seien Maissorten, Baumwollsorten und Sojasorten genannt, die unter den Handelsbezeichnungen Roundup Ready® (Toleranz gegen Glyphosate z.B. Mais, Baumwolle, Soja), Liberty Link® (Toleranz gegen Phosphinotricin, z.B. Raps), 1MI® (Toleranz gegen Imidazolinone) und STS® (Toleranz gegen Sulfonylharnstoffe z.B. Mais) vertrieben werden. Als Herbizid resistente (konventionell auf Herbizid-Toleranz gezüchtete) Pflanzen seien auch die unter der Bezeichnung Clearfield® vertriebenen Sorten (z.B. Mais) erwähnt. Selbstverständlich gelten diese Aussagen auch für in der Zukunft entwickelte bzw. zukünftig auf den Markt kommende Pflanzensorten mit diesen oder zukünftig entwickelten genetischen Eigenschaften („Traits").
Die aufgeführten Pflanzen können besonders vorteilhaft erfindungsgemäß mit den Verbindungen der allgemeinen Formel (I) bzw. den erfindungsgemäßen Wirkstoffmischungen behandelt werden. Die bei den Wirkstoffen bzw. Mischungen oben angegebenen Vorzugsbereiche gelten auch für die Be¬ handlung dieser Pflanzen. Besonders hervorgehoben sei die Pflanzenbehandlung mit den im vorhe¬ genden Text speziell aufgeführten Verbindungen bzw. Mischungen.
Die erfindungsgemäßen Wirkstoffe wirken nicht nur gegen Pflanzen-, Hygiene- und Vorratsschäd- ünge, sondern auch auf dem veterinärmedizinischen Sektor gegen tieπsche Parasiten (Ektoparasiten) wie Schildzecken, Lederzecken, Räudemilben, Laufmilben, Fliegen (stechend und leckend), para¬ sitierende Fhegenlarven, Läuse, Haarlinge, Federlinge und Flöhe. Zu diesen Parasiten gehören: Aus der Ordnung der Anopluπda z.B. Haematopinus spp., Linognathus spp., Pediculus spp., Phtirus spp., Solenopotes spp. Aus der Ordnung der Mallophagida und den Unterordnungen Amblyceπna sowie Ischnoceπna z.B. Tπmenopon spp., Menopon spp., Tπnoton spp., Bovicola spp., Werneckiella spp., Lepikentron spp., Damahna spp., Tπchodectes spp., Fehcola spp. Aus der Ordnung Diptera und den Unterordnungen Nematoceπna sowie Brachyceπna z.B. Aedes spp., Anopheles spp., Culex spp., Simuhum spp., Eusimuhum spp., Phlebotomus spp., Lutzomyia spp., Cuhcoides spp., Chrysops spp., Hybomitra spp., Atylotus spp., Tabanus spp., Haematopota spp., Philipomyia spp., Braula spp., Musca spp., Hydrotaea spp., Stomoxys spp., Haematobia spp., Morelha spp., Fannia spp., Glossina spp., Calliphora spp., Luciha spp., Chrysomyia spp., Wohlfahrtia spp., Sarcophaga spp., Oestrus spp., Hypoderma spp., Gasterophilus spp., Hippobosca spp., Lipoptena spp., Melophagus spp. Aus der Ordnung der Siphonaptenda z.B. Pulex spp., Ctenocephahdes spp., Xenopsylla spp., Ceratophyllus spp.
Aus der Ordnung der Heteropteπda z B Cimex spp , Tπatoma spp., Rhodnius spp , Panstrongylus SPP- Aus der Ordnung der Blattanda z.B. Blatta oπentahs, Peπplaneta ameπcana, Blattela germanica, Supella spp. Aus der Unterklasse der Acaπ (Acaπna) und den Ordnungen der Meta- sowie Mesostigmata z.B. Argas spp., Ornithodorus spp., Otobius spp., Ixodes spp , Amblyomma spp., Boophilus spp., Dermacentor spp., Haemophysahs spp , Hyalomma spp , Rhφicephalus spp., Dermanyssus spp., Railhetia spp , Pneumonyssus spp , Stemostoma spp , Varroa spp. Aus der Ordnung der Actmedida (Prostigmata) und Λcaπdida (Astigmata) z B Acarapis spp., Cheyletiella spp., Omithocheyletia spp., Myobia spp., Psorergates spp., Demodex spp., Trombicula spp., Listrophorus spp., Acarus spp., Tyrophagus spp , Caloglyphus spp , Hypodectes spp., Pterolichus spp., Psoroptes spp., Chonoptes spp., Otodectes spp., Sarcoptes spp , Notoedres spp., Knemidocoptes spp., Cytodites spp , Laminosioptes spp.
Die erfindungsgemäßen Wirkstoffe der Formel (I) eignen sich auch zur Bekämpfung von Arthropo¬ den, die landwirtschaftliche Nutztiere, wie z B. Rinder, Schafe, Ziegen, Pferde, Schweine, Esel, Kamele, Büffel, Kaninchen, Hühner, Puten, Enten, Gänse, Bienen, sonstige Haustiere wie z B Hunde, Katzen, Stubenvögel, Aquarienfische sowie so genannte Versuchstiere, wie z.B. Hamster, Meerschweinchen, Ratten und Mäuse befallen. Durch die Bekämpfung dieser Arthropoden sollen Todesfalle und Leistungsminderungen (bei Fleisch, Milch, Wolle, Häuten, Eiern, Honig usw.) ver¬ mindert werden, so dass durch den Einsatz der erfindungsgemäßen Wirkstoffe eine wirtschaftlichere und einfachere Tierhaltung möglich ist.
Die Anwendung der erfindungsgemäßen Wirkstoffe geschieht im Veterinärsektor in bekannter Weise durch enterale Verabreichung in Form von beispielsweise Tabletten, Kapseln, Tränken, Drenchen, Granulaten, Pasten, BoIi, des feed-through-Verfahrens, von Zäpfchen, durch parenterale Verabrei¬ chung, wie zum Beispiel durch Injektionen (intramuskulär, subcutan, intravenös, intraperitonal u.a.), Implantate, durch nasale Applikation, durch dermale Anwendung in Form beispielsweise des Tauchens oder Badens (Dippen), Sprühens (Spray), Aufgießens (Pour-on und Spot-on), des Wa- schens, des Einpuderns sowie mit Hilfe von wirkstoffhaltigen Formkörpern, wie Halsbändern, Ohr¬ marken, Schwanzmarken, Gliedmaßenbändern, Halftern, Markierungsvornchtungen usw.
Bei der Anwendung für Vieh, Geflügel, Haustiere etc. kann man die Wirkstoffe der Formel (T) als Formulierungen (beispielsweise Pulver, Emulsionen, fließfähige Mittel), die die Wirkstoffe in einer Menge von 1 bis 80 Gew.-% enthalten, direkt oder nach 100 bis 10 000-facher Verdünnung anwenden oder sie als chemisches Bad verwenden.
Außerdem wurde gefunden, dass die erfindungsgemäßen Verbindungen eine hohe insektizide Wir¬ kung gegen Insekten zeigen, die technische Materialien zerstören.
Beispielhaft und vorzugsweise - ohne jedoch zu limitieren - seien die folgenden Insekten genannt: Käfer wie Hylotrupes bajulus, Chlorophorus pilosis, Anobium punctatum, Xestobium rufovillosum, Ptihnus pecticornis, Dendrobium pertinex, Ernobius molhs, Pπobium caφini, Lyctus brunneus, Lyctus afncanus, Lyctus planicolhs, Lyctus lmeaπs, Lyctus pubescens, Trogoxylon aequale, Minthes rugicollis, Xyleborus spec Tryptodendron spec. Apate monachus, Bostrychus capucins, Heterobostrychus brunneus, Smoxylon spec Dinoderus minutus; Hautflugler wie Sirex juvencus, Urocerus gigas, Urocerus gigas taignus, Urocerus augur; Termiten wie Kalotermes flavicolhs, Cryptotermes brevis, Heterotermes indicola, Reticuhtermes flavipes, Reticuhtermes santonensis, Reticuhtermes lucifugus, Mastotermes darwmiensis, Zootermopsis nevadensis, Coptotermes formosanus; Borstenschwänze wie Lepisma saccharina.
Unter technischen Materialien sind im vorliegenden Zusammenhang nicht-lebende Materialien zu verstehen, wie vorzugsweise Kunststoffe, Klebstoffe, Leime, Papiere und Kartone, Leder, Holz, Holzverarbeitungsprodukte und Anstrichmittel.
Ganz besonders bevorzugt handelt es sich bei dem vor Insektenbefall zu schützenden Material um Holz und Holzverarbeitungsprodukte.
Unter Holz und Holzverarbeitungsprodukten, welche durch das erfindungsgemäße Mittel bzw. dieses enthaltende Mischungen geschützt werden kann, ist beispielhaft zu verstehen: Bauholz, Holzbalken, Eisenbahnschwellen, Brückenteile, Bootsstege, Holzfahrzeuge, Kisten, Palet¬ ten, Container, Telefonmasten, Holzverkleidungen, Holzfenster und -türen, Sperrholz, Spanplatten, Tischlerarbeiten oder Holzprodukte, die ganz allgemein beim Hausbau oder in der Bautischlerei Verwendung finden.
Die Wirkstoffe können als solche, in Form von Konzentraten oder allgemein üblichen Formulierun¬ gen wie Pulver, Granulate, Lösungen, Suspensionen, Emulsionen oder Pasten angewendet werden.
Die genannten Formulierungen können in an sich bekannter Weise hergestellt werden, z.B. durch Vermischen der Wirkstoffe mit mindestens einem Lösungs- bzw. Verdünnungsmittel, Emulgator, Dispergier- und/oder Binde- oder Fixiermittel, Wasser-Repellent, gegebenenfalls Sikkative und UV-
Stabilisatoren und gegebenenfalls Farbstoffen und Pigmenten sowie weiteren Verarbeitungshilfs¬ mitteln.
Die zum Schutz von Holz und Holzwerkstoffen verwendeten insektiziden Mittel oder Konzentrate enthalten den erfindungsgemäßen Wirkstoff in einer Konzentration von 0,0001 bis 95 Gew.-%, insbesondere 0,001 bis 60 Gew.-%.
Die Menge der eingesetzten Mittel bzw. Konzentrate ist von der Art und dem Vorkommen der Insekten und von dem Medium abhängig. Die optimale Einsatzmenge kann bei der Anwendung jeweils durch Testreihen ermittelt werden. Im allgemeinen ist es jedoch ausreichend 0,0001 bis 20 Gew.-%, vorzugsweise 0,001 bis 10 Gew.-%, des Wirkstoffs, bezogen auf das zu schützende Mateπal, einzusetzen.
Als Lösungs- und/oder Verdünnungsmittel dient ein organisch-chemisches Lösungsmittel oder Lösungsmittelgemisch und/oder ein öliges oder ölartiges schwer flüchtiges organisch-chemisches Lösungsmittel oder Lösungsmittelgemisch und/oder ein polares organisch-chemisches Lösungsmittel oder Lösungsmittelgemisch und/oder Wasser und gegebenenfalls einen Emulgator und/oder Netz¬ mittel.
Als organisch-chemische Lösungsmittel werden vorzugsweise ölige oder ölartige Lösungsmittel mit einer Verdunstungszahl über 35 und einem Flammpunkt oberhalb 300C, vorzugsweise oberhalb 45°C, eingesetzt. Als derartige schwerflüchtige, wasserunlösliche, ölige und ölartige Lösungsmittel werden entsprechende Mineralöle oder deren Aromatenfraktionen oder mineralölhaltige Lösungs- mittelgemische, vorzugsweise Testbenzm, Petroleum und/oder Alkylbenzol verwendet.
Vorteilhaft gelangen Mineralöle mit einem Siedebereich von 170 bis 2200C, Testbenzm mit einem Siedebereich von 170 bis 2200C, Spindelöl mit einem Siedebereich von 250 bis 3500C, Petroleum bzw. Aromaten vom Siedebereich von 160 bis 2800C, Terpentinöl und dgl. zum Einsatz.
In einer bevorzugten Ausfuhrungsform werden flüssige aliphatische Kohlenwasserstoffe mit einem Siedebereich von 180 bis 2100C oder hochsiedende Gemische von aromatischen und alrphatischen Kohlenwasserstoffen mit einem Siedebereich von 180 bis 2200C und/oder Spindeöl und/oder Monochlornaphthalin, vorzugsweise α-Monochlornaphthahn, verwendet.
Die organischen schwerflüchtigen öligen oder ölartigen Lösungsmittel mit einer Verdunstungszahl über 35 und einem Flammpunkt oberhalb 300C, vorzugsweise oberhalb 45°C, können teilweise durch
leicht oder mittelflüchtige organisch-chemische Lösungsmittel ersetzt werden, mit der Maßgabe, daß das Lösungsmittelgemisch ebenfalls eine Verdunstungszahl über 35 und einen Flammpunkt oberhalb 300C, vorzugsweise oberhalb 45°C, aufweist und dass das Insektizid-Fungizid-Gemisch in diesem Lösungsmittelgemisch löslich oder emulgierbar ist.
Nach einer bevorzugten Ausführungsform wird ein Teil des organisch-chemischen Lösungsmittel oder Lösungsmittelgemisches oder ein aliphatisches polares organisch-chemisches Lösungsmittel oder Lösungsmittelgemisch ersetzt. Vorzugsweise gelangen Hydroxyl- und/oder Ester- und/oder Ethergruppen enthaltende aliphatische organisch-chemische Lösungsmittel wie beispielsweise Glycolether, Ester oder dgl. zur Anwendung.
Als organisch-chemische Bindemittel werden im Rahmen der vorliegenden Erfindung die an sich be¬ kannten wasserverdünnbaren und/oder in den eingesetzten organisch-chemischen Lösungsmitteln lös¬ lichen oder dispergier- bzw. emulgierbaren Kunstharze und/oder bindende trocknende Öle, insbeson- dere Bindemittel bestehend aus oder enthaltend ein Acrylatharz, ein Vmylharz, z.B. Polyvinylacetat, Polyesterharz, Polykondensations- oder Polyadditionsharz, Polyurethanharz, Alkydharz bzw. modifi¬ ziertes Alkydharz, Phenolharz, Kohlenwasserstoffharz wie Inden-Cumaronharz, Siliconharz, trock¬ nende pflanzliche und/oder trocknende Öle und/oder physikalisch trocknende Bindemittel auf der Basis eines Natur- und/oder Kunstharzes verwendet.
Das als Bindemittel verwendete Kunstharz kann in Form einer Emulsion, Dispersion oder Lösung, eingesetzt werden. Als Bindemittel können auch Bitumen oder bituminöse Substanzen bis zu 10 Gew.-%, verwendet werden. Zusätzlich können an sich bekannte Farbstoffe, Pigmente, wasserabweisende Mittel, Geruchskorπgenüen und Inhibitoren bzw. Korrosionsschutzmittel und dgl. eingesetzt werden.
Bevorzugt ist gemäß der Erfindung als organisch-chemische Bindemittel mindestens ein Alkydharz bzw. modifiziertes Alkydharz und/oder ein trocknendes pflanzliches Öl im Mittel oder im Konzentrat enthalten. Bevorzugt werden gemäß der Erfindung Alkydharze mit einem Ölgehalt von mehr als 45 Gew.-%, vorzugsweise 50 bis 68 Gew.-%, verwendet.
Das erwähnte Bindemittel kann ganz oder teilweise durch ein Fixierungsmittel(gemisch) oder em Weichmacher(gemisch) ersetzt werden. Diese Zusätze sollen einer Verflüchtigung der Wirkstoffe sowie einer Kristallisation bzw. Ausfällen vorbeugen. Vorzugsweise ersetzen sie 0,01 bis 30 % des Bindemittels (bezogen auf 100 % des eingesetzten Bindemittels).
- -
Die Weichmacher stammen aus den chemischen Klassen der Phthalsäureester wie Dibutyl-, Dioctyl- oder Benzylbutylphthalat, Phosphorsäureester wie Tributylphosphat, Adipinsäureester wie Di-(2- ethylhexyl)-adipat, Stearate wie Butylstearat oder Amylstearat, Oleate wie Butyloleat, Glyceπnether oder hohermolekulare Glykolether, Glyceπnester sowie p-Toluolsulfonsäureester.
Fixierungsmittel basieren chemisch auf Polyvmylalkylethern wie z.B. Polyvinylmethylether oder Ketonen wie Benzophenon, Ethylenbenzophenon.
Als Lösungs- bzw. Verdünnungsmittel kommt insbesondere auch Wasser in Frage, gegebenenfalls in Mischung mit einem oder mehreren der oben genannten organisch-chemischen Lösungs- bzw. Verdünnungsmittel, Emulgatoren und Dispergatoren.
Ein besonders effektiver Holzschutz wird durch großtechnische Imprägnierverfahren, z B. Vakuum, Doppelvakuum oder Druckverfahren, erzielt.
Die anwendungsfertigen Mittel können gegebenenfalls noch weitere Insektizide und gegebenenfalls noch ein oder mehrere Fungizide enthalten.
Als zusätzliche Zumischpartner kommen vorzugsweise die in der WO 94/29 268 genannten Insektizide und Fungizide in Frage. Die in diesem Dokument genannten Verbindungen sind ausdrücklicher Bestandteil der vorliegenden Anmeldung.
Als ganz besonders bevorzugte Zumischpartner können Insektizide, wie Chlorpynphos, Phoxim, Silafluofm, Alphamethπn, Cyfluthπn, Cypermethπn, Deltamethnn, Permethπn, Imidaclopπd, Nl-25, Flufenoxuron, Hexaflumuron, Transfluthπn, Thiaclopπd, Methoxyfenozide, Tπflumuron, Clothia- nidm, Spinosad, Tefluthπn, sowie Fungizide wie Epoxyconazole, Hexaconazole, Azaconazole, Pro- piconazole, Tebuconazole, Cyproconazole, Metconazole, Imazahl, Dichlorfluanid, Tolylfluanid, 3- Iod-2-propinyl-butylcarbamat, N-Octyl-isothiazohn-3-on und 4,5-Dichlor-N-octyhsothiazohn-3-on, sein.
Zugleich können die erfindungsgemäßen Verbindungen zum Schutz vor Bewuchs von Gegenständen, insbesondere von Schiffskörpern, Sieben, Netzen, Bauwerken, Kaianlagen und Signalanlagen, welche mit See- oder Brackwasser m Verbindung kommen, eingesetzt werden. Bewuchs durch sessile Oligochaeten, wie Kalkröhrenwürmer sowie durch Muscheln und Arten der Gruppe Ledamorpha (Entenmuscheln), wie verschiedene Lepas- und Scalpellum- Arten, oder durch Arten der Gruppe Balanomorpha (Seepocken), wie Baianus- oder Pollicipes-Species, erhöht den Rei-
- -
bungswiderstand von Schiffen und führt in der Folge durch erhöhten Energieverbrauch und darüber hinaus durch häufige Trockendockaufenthalte zu einer deutlichen Steigerung der Betriebskosten.
Neben dem Bewuchs durch Algen, beispielsweise Ectocarpus sp. und Ceramium sp., kommt insbe- sondere dem Bewuchs durch sessile Entomostraken-Gruppen, welche unter dem Namen Cirripedia (Rankenflusskrebse) zusammengefasst werden, besondere Bedeutung zu.
Es wurde nun überraschenderweise gefunden, dass die erfindungsgemäßen Verbindungen allein oder in Kombination mit anderen Wirkstoffen, eine hervorragende Antifouling (Antibewuchs)-Wirkung aufweisen.
Durch Einsatz von erfindungsgemäßen Verbindungen allein oder in Kombination mit anderen Wirk¬ stoffen, kann auf den Einsatz von Schwermetallen wie z.B. in Bis(trialkylzinn)-sulfiden, Tri-M-butyl- zinnlaurat, Tri-/7-butylzinnchlorid, Kupfer(I)-oxid, Triethylzinnchlorid, Tri-π-butyl(2-phenyl-4-chlor- phenoxy)-zinn, Tributylzinnoxid, Molybdändisulfid, Antimonoxid, polymerem Butyltitanat, Phenyl- (bispyridin)-wismutchlorid, Tri-n-butylzmnfluorid, Manganethylenbisthiocarbamat, Zinkdimethyldi- thiocarbamat, Zinkethylenbisthiocarbamat, Zink- und Kupfersalze von 2-Pyridinthiol-l-oxid, Bisdi- methyldithiocarbamoylzinkethylenbisthiocarbamat, Zinkoxid, Kupfer(I)-ethylen-bisdithiocarbamat, Kupferthiocyanat, Kupfernaphthenat und Tributylzinnhalogeniden verzichtet werden oder die Kon- zentration dieser Verbindungen entscheidend reduziert werden.
Die anwendungsfertigen Antifoulingfarben können gegebenenfalls noch andere Wirkstoffe, vorzugs¬ weise Algizide, Fungizide, Herbizide, Molluskizide bzw. andere Antifouling-Wirkstoffe enthalten.
Als Kombinationspartner für die erfindungsgemäßen Antifouling-Mittel eignen sich vorzugsweise: Algizide wie 2-/erΛ-Burylamino-4-cyclopropylamino-6-methylthio-l,3,5-triazin, Dichlorophen, Di- uron, Endothal, Fentinacetat, Isoproturon, Methabenzthiazuron, Oxyfluorfen, Quinoclamine und Ter- butryn; Fungizide wie BenzotöJthiophencarbonsäurecyclohexylamid-S^-dioxid, Dichlofluanid, FIu- orfolpet, 3-Iod-2-propinyl-butylcarbamat, Tolylfluanid und Azole wie Azaconazole, Cyproconazole, Epoxyconazole, Hexaconazole, Metconazole, Propiconazole und Tebuconazole; Molluskizide wie Fentinacetat, Metaldehyd, Methiocarb, Niclosamid, Thiodicarb und Trimethacarb, Fe-chelate; oder herkömmliche Antifouling-Wirkstoffe wie 4,5-Dichlor-2-octyl-4-isothiazolin-3-on, Diiodmethyl- paratrylsulfon, 2-(N,N-Dimethylthiocarbamoylthio)-5-nitrothiazyl, Kalium-, Kupfer-, Natrium- und Zinksalze von 2-Pyridinthiol-l-oxid, Pyridin-triphenylboran, Tetrabutyldistannoxan, 2,3,5,6-Tetra- chlor-4-(methylsulfonyl)-pyridin, 2,4,5,6-Tetrachloroisophthalonitril, Tetramethylthiuramdisulfid und 2,4,6-Trichlorphenylmaleinimid.
Die verwendeten Antifoulmg-Mittel enthalten die erfindungsgemäßen Wirkstoff der erfindungs¬ gemäßen Verbindungen in einer Konzentration von 0,001 bis 50 Gew.-%, insbesondere von 0,01 bis 20 Gew.-%.
Die erfindungsgemäßen Antifouling-Mittel enthalten desweiteren die üblichen Bestandteile wie z.B. in Ungerer, Chem. Ind. 1985, 37, 730-732 und Williams, Antifouhng Manne Coatings, Noyes, Park Ridge, 1973 beschrieben.
Antifouhng-Anstnchmittel enthalten neben den algiziden, fungiziden, molluskiziden und erfindungs- gemäßen insektiziden Wirkstoffen insbesondere Bindemittel.
Beispiele für anerkannte Bindemittel sind Polyvinylchlorid in einem Lösungsmittelsystem, chlorierter Kautschuk in einem Lösungsmittelsystem, Acrylharze in einem Lösungsrrattelsystem insbesondere in einem wässrigen System, Vinylchloπd/Vinylacetat-Copolymersysteme in Form wässriger Dispersio- nen oder in Form von organischen Lösungsmittelsystemen, Butadien/Styrol/Acrylnitπl-Kautschuke, trocknende Öle, wie Leinsamenöl, Harzester oder modifizierte Hartharze in Kombination mit Teer oder Bitumina, Asphalt sowie Epoxyverbindungen, geπnge Mengen Chlorkautschuk, chloriertes Polypropylen und Vmylharze.
Gegebenenfalls enthalten Anstrichmittel auch anorganische Pigmente, organische Pigmente oder Farbstoffe, welche vorzugsweise in Seewasser unlöslich sind. Ferner können Anstrichmittel Materia¬ hen, wie Kolophonium enthalten, um eine gesteuerte Freisetzung der Wirkstoffe zu ermöglichen. Die Anstriche können ferner Weichmacher, die rheologischen Eigenschaften beeinflussende Modifizie- rungsmittel sowie andere herkömmliche Bestandteile enthalten. Auch in Self-Pohshmg-Antifouhng- Systemen können die erfindungsgemäßen Verbindungen oder die oben genannten Mischungen eingearbeitet werden.
Die Wirkstoffe eignen sich auch zur Bekämpfung von tierischen Schädlingen, insbesondere von In¬ sekten, Spinnentieren und Milben, die in geschlossenen Räumen, wie beispielsweise Wohnungen, Fa- brikhallen, Büros, Fahrzeugkabinen u.a. vorkommen. Sie können zur Bekämpfung dieser Schädlinge allem oder in Kombination mit anderen Wirk- und Hilfsstoffen m Haushaltsinsektizid-Produkten verwendet werden. Sie sind gegen sensible und resistente Arten sowie gegen alle Entwicklungs¬ stadien wirksam. Zu diesen Schädlingen gehören: Aus der Ordnung der Scorpionidea z.B. Buthus occitanus. Aus der Ordnung der Acaπna z.B. Argas persicus, Argas reflexus, Bryobia ssp., Dermanyssus gallinae, Glyciphagυs domesticus, Ormthodorus moubat, Rhipicephalus sanguineus, Trombicula
alfreddugesi, Neutrombicula autumnahs, Dermatophagoides pteronissimus, Dermatophagoides foπnae Aus der Ordnung der Araneae z B Aviculanidae, Araneidae. Aus der Ordnung der Opihones z B Pseudoscorpiones chehfer, Pseudoscorpiones cheiπdium, Opihones phalangium Aus der Ordnung der Isopoda z.B. Oniscus asellus, Porcelho scaber. Aus der Ordnung der Diplopoda z.B. Blanmlus guttulatus, Polydesmus spp Aus der Ordnung der Chilopoda z.B. Geophilus spp Aus der Ordnung der Zygentoma z B Ctenolepisma spp., Lepisma sacchaπna, Lepismodes mquilinus. Aus der Ordnung der Blattaπa z B. Blatta onentahes, Blattella germamca, Blattella asahmai, Leucophaea maderae, Panchlora spp., Parcoblatta spp , Peπplaneta australasiae, Peπplaneta ameπcana, Peπplaneta brunnea, Peπplaneta fuhginosa, Supella longipalpa. Aus der Ordnung der Saltatoπa z.B. Acheta domesticus. Aus der Ordnung der Dermaptera z.B. Forfϊcula auπculana. Aus der Ordnung der Isoptera z B. Kalotermes spp , Reticuhtermes spp. Aus der Ordnung der Psocoptera z.B. Lepinatus spp., Liposcehs spp. Aus der Ordnung der Coleoptera z B Anthrenus spp., Attagenus spp., Dermestes spp , Latheticus oryzae, Necrobia spp., Ptinus spp., Rhizopertha domimca, Sitophilus granaπus, Sitophilus oryzae, Sitophilus zeamais, Stegobium paniceum. Aus der Ordnung der Diptera z B. Aedes aegypti, Aedes albopictus, Aedes taeniorhynchus, Anopheles spp., Calliphora erythrocephala, Chrysozona pluviahs, Culex qumquefasciatus, Culex pipiens, Culex tarsahs, Drosophila spp., Fannia camculaπs, Musca domestica, Phlebotomus spp., Sarcophaga carnaπa, Simuhum spp., Stomoxys calcitrans, Tφula paludosa. Aus der Ordnung der Lepidoptera z.B. Achroia gπsella, Galleπa mellonella, Plodia mteφunctella, Tinea cloacella, Tinea pelhonella, Tmeola bisselliella. Aus der Ordnung der Siphonaptera z.B. Ctenocephahdes canis, Ctenocephahdes felis, Pulex lintans, Tunga penetrans, Xenopsylla cheopis. Aus der Ordnung der Hymenoptera z.B. Camponotus herculeanus, Lasius fühginosus, Lasius niger, Lasius umbratus, Monomoπum pharaonis, Paravespula spp., Tetramoπum caespitum. Aus der Ordnung der Anoplura z.B. Pediculus humanus capitis, Pediculus humanus corpoπs, Phthirus pubis. Aus der Ordnung der Heteroptera z.B. Cimex hemipterus, Cimex lectulaπus, Rhodinus prohxus, Tπatoma mfestans.
Die Anwendung im Bereich der Haushaltsinsektizide erfolgt allein oder in Kombination mit anderen geeigneten Wirkstoffen wie Phosphorsäureestern, Carbamaten, Pyrethroiden, Neo-nicotinoiden, Wachstumsregulatoren oder Wirkstoffen aus anderen bekannten Insektizidklassen.
Die Anwendung erfolgt in Aerosolen, drucklosen Sprühmitteln, z.B. Pump- und Zerstäubersprays, Nebelautomaten, Foggern, Schäumen, Gelen, Verdampferprodukten mit Verdampferplättchen aus Cellulose oder Kunststoff, Flüssigverdampfern, Gel- und Membranverdampfern, propellergetriebe¬ nen Verdampfern, energielosen bzw. passiven Verdampfungssystemen, Mottenpapieren, Mottensäck- chen und Mottengelen, als Granulate oder Stäube, in Streuködern oder Köderstationen.
Die Herstellung und die Verwendung der erfindungsgemäßen Stoffe geht aus den folgenden Beispielen hervor.
- -
Herstellungsbeispiele
Beispiel 1
Zu einer Lösung von 140 mg (325 μmol) 5-(6-Chlor-8-methyl-4-oxo-4H-benzo[d][l,3]oxazin-2-yl)-l- (3-chloφyridin-2-yl)-lH-pyrazol-3-carbaldehyd-O-rnethyloxirn in 1.4 ml Tetrahydrofuran werden 58 mg (976 μmol) /so-Propylamin langsam zugetropft. Man lässt das Gemisch 5 min bei 55°C rühren und entfernt anschließend das Lösungsmittel im Vakuum. Nach Flash-Chromatograhie des Rückstands an Kieselgel mit Cyclohexan/Ethylacetat (Gradient von 4 : 1 nach 3 : 1) werden 90 mg (E/Z-Gemisch ca. 12.5 : 1, 57% der Theorie) von 2-(3-Chlθφyridin-2-yl)-5-(methoxyiminornethyl)- 2H-pyrazol-3-carbonsäure-(4-chlor-2-isopropylcarbamoyl-6-methylphenyl)amid als farbloser Fest¬ stoff erhalten [logP (ΗCOOΗ): 2.94].
Analog dem oben aufgeführten Beispiel 1 sowie der allgemeinen Beschreibung werden folgende Ver¬ bindungen der Formel (1-1) erhalten.
Tabelle 1
Bsp.-Nr. R2 R3 R4 R5 R7 R9 R11 X2 logP 1-1-2 Η /Pr Me Br Cl Η Me O 3.11 1-1-3 Η /Pr Me I Cl Η Me O 3.29 1-1-4 Η /Pr Cl Cl Cl Η Me O 2.94 1-1-5 Η /Pr Me Cl Cl Η Et O . 3.39
- -
Bsp.-Nr. R2 R3 R4 R5 R7 R9 Rπ X2 logP 1-1-6 H /Pr Me Cl Cl H /Pr O 3.69 1-1-7 H /Pr Me Cl Cl H /Bu O 4.18 1-1-8 H Me Me Cl Cl H Et O 2.85 1-1-9 H Me Me Cl Cl H /Pr O 3.18 1-1-10 H zPr Me Cl Cl CF3 Me O 4.88
Herstellung von Ausgangsstoffen der Formel (V) Beispiel (V-I)
Unter Argon wird bei 00C zu einer Lösung von 47 mg (420 μmol) Methansulfonsäurechlorid in 1.4 ml Acetonitril eine Mischung von 110 mg (392 μmol) 2-(3-Chlθφyridin-2-yl)-5-(methoxyimino- methyl)-2H-pyrazol-3-carbonsäure in 1.4 ml Acetonitril und 40 mg (392 μmol) Triethylamin langsam zugetropft. Man lässt 20 min bei dieser Temperatur nachrühren und gibt 73 mg (392 μmol) 2-Amino- 5-chlor-3-methylbenzoesäure hinzu. Nach 5 min Nachrühren wird eine Mischung von 79 mg (784 μmol) Triethylamin und 0.1 ml Acetonitril langsam zugetropft. Nach weiteren 50 min Nachrüh¬ ren werden weitere 47 mg (420 μmol) Methansulfonsäurechlorid zugegeben. Man lässt langsam auf Raumtemperatur erwärmen und für 16 Stunden nachrühren. Es wird mit 20 ml Wasser versetzt und die ausgefallenen Kristalle abgesaugt. Man erhält 140 mg (83 % der Theorie) von 5-(6-Chlor-8- methyl-4-oxo-4H-benzo[t/][l,3]oxazin-2-yl)-l-(3-chloφyridin-2-yl)-lH-pyrazol-3-carbaldehyd-O-me- thyloxim als farblosen Feststoff [logP (ΗCOOΗ): 4.22].
Herstellung von Ausgangsstoffen der Formel (IV) Beispiel (IV-I) H,
(IV-I)
Unter Argon wird eine Lösung von 4.24 g (17.9 mmol) l-(3-Chlorpyridin-2-yl)-lH-pyrazol-3-carb- aldehyd-0-methyloxim in 50 ml trockenem TΗF auf -78°C abgekühlt und tropfenweise mit 9.95 ml (17.9 mmol) Lithiumdiisopropyamid (1.8 M Lösung in Tetrahydrofuran/Ηeptan/Ethylbenzol) ver¬ setzt. Man lässt 15 min bei dieser Temperatur rühren und versetzt dann mit einem Überschuss an Trockeneis (4 Pellets). Nach weiteren 30 min Rühren lässt man die gelbe Suspension langsam auf -200C erwärmen (Gasentwicklung) und quencht vorsichtig mit 200 ml Eiswasser. Die wässrige Phase wird mit wenig Essigsäureethylester extrahiert und die organische Phase verworfen. Anschließend wird die wässrige Phase mit konzentrierter Salzsäure auf pH = 2 eingestellt und erschöpfend mit Essigsäureethylester extrahiert. Man erhält 3.00 g (E/Z-Gemisch ca. 2.5 : 1, 60 % der Theorie) an 2- (3-Chloφyridin-2-yl)-5-(methoxyiminomethyl)-2H-pyrazol-3-carbonsäure als beigen Feststoff, der ohne weitere Reinigung eingesetzt wird [logP (ΗCOOΗ): 1.57].
Herstellung von Ausgangsstoffen der Formel (VIT) Beispiel (VII-I)
Zu einer Mischung von 4.00 g (19.3 mmol) l-(3-Chlθφyridin-2-yl)-lH-pyrazol-3-carbaldehyd in 15 ml Pyridin werden 2.14 g (28.9 mmol) Methoxyaminhydrochlorid gegeben, und die entstandene Lösung wird anschließend 1 h refluxiert. Nach dem Abkühlen auf Raumtemperatur wird das Lösungsmittel im Vakuum entfernt und der Rückstand mit 150 ml gesättigter Natriumhydrogen- carbonat-Lösung versetzt. Man extrahiert dreimal mit je 50 ml Essigsäureethylester und trocknet die vereinigten organischen Phasen über Magnesiumsulfat. Man erhält 4.1 1 g (E/Z-Gemisch ca. 2.5 : 1, 89 % der Theorie) an l-(3-Chlorpyridin-2-yl)-lH-pyrazol-3-carbaldehyd O-methyloxim als beigen Feststoff, der ohne weitere Reinigung eingesetzt wird [logP (ΗCOOΗ): 2.09].
Herstellung von Ausgangsstoffen der Formel (VITD Beispiel (VTJ-I )
Eine Mischung von 123 ml Ameisensäure und 31 ml Wasser wird mit 17.1 g (67 5 mmol) 3-Chlor-2- (3-dimethoxymethylpyrazol-l-yl)pyridin versetzt und anschließend 1 h auf 65°C erwärmt. Nach dem Abkühlen auf Raumtemperatur werden die Lösungsmittel im Vakuum entfernt, der Rückstand mit Eiswasser versetzt und die ausgefallenen Kristalle abgesaugt. Man erhält 12.2 g (85 % der Theorie) an l-(3-Chlθφyπdin-2-yl)-lH-pyrazol-3-carbaldehyd als gelben Feststoff [logP (ΗCOOΗ): 1.48].
Herstellung von Ausgangsstoffen der Formel (XH) Beispiel OQI- 1)
Zu einer Lösung von 21.6 g (146 mmol) 2,3-Dichlorpyndin und 18.9 g (133 mmol) 3-Dimethoxy- methyl-lH-ρyrazol m 67 ml Dimethylformamid werden 36.7 g (266 mmol) Kahumcarbonat gegeben, und die Suspension anschließend für 19 h bei 115°C erhitzt. Nach dem Abkühlen auf Raumtempera¬ tur gibt man die Reaktionsmischung auf Eiswasser und extrahiert dreimal mit je 100 ml Essigsäure- ethylester Die vereinigten organischen Phasen werden über Magnesiumsulfat getrocknet und der Rückstand an Kieselgel mit Cyclohexan/Ethylacetat (Gradient von 2 : 1 nach 1 : 1), jeweils mit 2 % Tπethylamin, chromatographiert. Man erhält 12.9 g (38 % der Theorie) an 3-Chlor-2-(3-dimethoxy- methylpyrazol-l-yl)pyπdm als gelbes Öl [logP (ΗCOOΗ): 2.09].
Die Bestimmung der in den voranstehenden Tabellen und Ηerstellungsbeispielen angegebenen logP- Werte erfolgt gemäß EEC-Directive 79/831 Annex V.A8 durch ΗPLC (Ηigh Performance Liquid Chromatography) an einer Phasenumkehrsäule (C 18) Temperatur: 43°C. Die Bestimmung erfolgt im sauren Bereich bei pΗ 2.3 mit 0,1 % wässriger Phosphorsäure und Acetomtπl als Eluenten; linearer Gradient von 10 % Acetonitπl bis 95 % Acetonitπl. Die Bestimmung mit der LC-MS im sauren Bereich erfolgt bei pH 2,7 mit 0,1 % wässriger Ameisensäure und Acetonitril (enthält 0,1 % Ameisensäure) als Eluenten; linearer Gradient von 10 % Acetonitπl bis 95 % Acetonitπl Die Eichung erfolgt mit unverzweigten Alkan-2-onen (mit 3 bis 16 Kohlenstoffatomen), deren logP- Werte bekannt sind (Bestimmung der logP-Werte anhand der Retentionszeiten durch lineare Inter¬ polation zwischen zwei aufeinanderfolgenden Alkanonen). Die lambda-max-Werte wurden an Hand der UV-Spektren von 200 nm bis 400 nm in den Maxima der chromatographischen Signale ermittelt.
- -
Anwendungsbeispiele
Beispiel A: Phaedon-Test (Spritzbehandlung)
Lösungsmittel: 78 Gewichtsteile Aceton 1 ,5 Gewichtsteile Dimethylformamid Emulgator: 0,5 Gewichtsteile Alkylarylpolyglykolether
Zur Herstellung einer zweckmäßigen Wirkstoffzubereitung vermischt man 1 Gewichtsteil Wirkstoff mit den angegebenen Mengen Lösungsmittel und Emulgator und verdünnt das Konzentrat mit emul- gatorhaltigem Wasser auf die gewünschte Konzentration.
Chinakohlblattscheiben (Brassica pekinensis) werden mit einer Wirkstoffzubereitung der gewünsch¬ ten Konzentration gespritzt und nach dem Abtrocknen mit Larven des Meerrettichblattkäfers (Phaedon cochleariae) besetzt.
Nach der gewünschten Zeit wird die Wirkung in % bestimmt. Dabei bedeutet 100 %, dass alle Käferlarven abgetötet wurden; 0 % bedeutet, dass keine Käferlarve abgetötet wurde.
Bei diesem Test zeigen z. B. die folgende Verbindung der Herstellungsbeispiele gute Wirksamkeit:
Tabelle A Pflanzen schädigende Insekten Phaedon-Test (Spritzbehandlung)
100 100
Beispiel B: Spodoptera frugiperda-Test (Spritzbehandlung)
Lösungsmittel: 78 Gewichtsteile Aceton 1 ,5 Gewichtsteile Dimethylformamid Emulgator: 0,5 Gewichtsteile Alkylarylpolyglykolether
Zur Herstellung einer zweckmäßigen Wirkstoffzubereitung vermischt man 1 Gewichtsteil Wirkstoff mit den angegebenen Mengen Lösungsmittel und Emulgator und verdünnt das Konzentrat mit emul- gatorhaltigem Wasser auf die gewünschte Konzentration.
Maisblattscheiben (Zea mays) werden mit einer Wirkstoffzubereitung der gewünschten Konzentra¬ tion gespritzt und nach dem Abtrocknen mit Raupen des Heerwurms (Spodoptera frugiperda) besetzt.
Nach der gewünschten Zeit wird die Wirkung in % bestimmt. Dabei bedeutet 100 %, dass alle Raupen abgetötet wurden; 0 % bedeutet, dass keine Raupe abgetötet wurde.
Bei diesem Test zeigen z. B. die folgende Verbindung der Herstellungsbeispiele gute Wirksamkeit:
Tabelle B Pflanzen schädigende Insekten Spodoptera frugiperda-Test (Spritzbehandlung)