TW202039489A - Mat2a之雜雙環抑制劑及用於治療癌症之使用方法 - Google Patents
Mat2a之雜雙環抑制劑及用於治療癌症之使用方法 Download PDFInfo
- Publication number
- TW202039489A TW202039489A TW108148080A TW108148080A TW202039489A TW 202039489 A TW202039489 A TW 202039489A TW 108148080 A TW108148080 A TW 108148080A TW 108148080 A TW108148080 A TW 108148080A TW 202039489 A TW202039489 A TW 202039489A
- Authority
- TW
- Taiwan
- Prior art keywords
- cancer
- alkyl
- group
- compound
- membered
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/20—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/78—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in position 2
- C07D239/80—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Abstract
本發明提供如本發明中所述的根據式I、式II之化合物及其醫藥學上可接受之鹽、互變異構體及/或同位素物。該等化合物為甲硫胺酸腺苷轉移酶異構體2A(MAT2A)之抑制劑。亦提供醫藥組成物及使用該等化合物治療癌症之方法,該等癌症包括缺失編碼甲硫基腺苷磷酸化酶(MTAP)之基因的一些癌症。
Description
本發明為關於MAT2A之雜雙環抑制劑及用於治療癌症之使用方法。[ 相關申請案之交叉引用 ]
本申請案主張2018年12月27日申請的美國臨時專利申請案第62/785,519號之優先權,其揭示內容全部併入本文中。
亦稱為S-腺苷甲硫胺酸合成酶之甲硫胺酸腺苷轉移酶(MAT)為催化S-腺苷甲硫胺酸(SAM或AdoMet)自甲硫胺酸及ATP合成之細胞酶;將催化視為甲硫胺酸循環的速率限制步驟。SAM為多元胺生合成中之丙胺基供體、DNA甲基化之主要甲基供體,且參與基因轉錄及細胞增殖以及次級代謝物之產生。
指定為MAT1A及MAT2A之兩種基因分別編碼兩種不同催化MAT同功異型物。第三基因MAT2B編碼MAT2A調節次單元。MAT1A在成人肝臟中特異性地表現,而MAT2A則廣泛分佈。因為MAT同功異型物的不同之處在於催化動力學及調節特性,所以MAT1A表現細胞比MAT2A表現細胞具有顯著更高的SAM含量。已發現MAT2A促進劑的低甲基化及組蛋白乙醯化使得MAT2A表現上調。
在肝細胞癌(HCC)中,出現MAT1A下調及MAT2A上調,此稱為MAT1A:MAT2A切換。伴隨著MAT2B上調之切換產生較低SAM含量,此為肝癌細胞提供生長優勢。因為MAT2A在促進肝癌細胞生長中起關鍵作用,所以其為抗腫瘤療法之目標。近期研究已展示藉由使用較小干擾性RNA來沉默實質上遏制生長且誘導肝癌細胞之細胞凋亡。參見例如,T. Li 等人,J. Cancer
7(10) (2016) 1317-1327。
作為MTAP缺失型之一些癌細胞株對MAT2A抑制特別敏感。Marjon等人 (Cell Reports 15(3) (2016) 574-587)。MTAP (甲硫基腺苷磷酸化酶(methylthioadenosine phosphorylase))為在正常組織中廣泛表現且催化甲硫基腺苷(MTA)轉化成腺嘌呤及5-甲硫核糖-1-磷酸酯之酶。補救腺嘌呤以產生單磷酸腺苷,且將5-甲硫核糖-1-磷酸酯轉化成甲硫胺酸及甲酸酯。由於此補救途徑,所以MTA在例如用諸如L-丙胺菌素之抗代謝物阻斷新生嘌呤合成時可充當替代嘌呤源。
MAT2A在缺乏MTAP缺失之額外癌症中失調,該等癌症包括肝細胞癌及白血病。J. Cai等人,Cancer Res.
58 (1998) 1444-1450; T. S. Jani等人,Cell. Res.
19 (2009) 358-369。經由RNA干涉使MAT2A表現沉默對若干癌症模型產生抗增殖作用。H. Chen 等人,Gastroenterology
133 (2007) 207-218; Q. Liu 等人 Hepatol.Res.
37 (2007) 376-388。
許多人類及鼠類惡性細胞缺乏MTAP活性。不僅在組織培養細胞中發現MTAP缺乏症而且缺乏症亦存在於原發性白血病、神經膠質瘤、黑色素瘤、胰臟癌、非小細胞肺癌(NSCLC)、膀胱癌、星形細胞瘤、骨肉瘤、頭頸癌、黏液軟骨肉瘤、卵巢癌、子宮內膜癌、乳癌、軟組織肉瘤、非何杰金氏淋巴瘤(non-Hodgkin lymphoma)及間皮瘤。為人類MTAP編碼之基因映射至人類染色體9p上的區域9p21。此區域亦含有腫瘤抑制基因p16INK4A (亦稱為CDKN2A)及pl5INK4B。此等基因為分別作為細胞週期素D依賴型激酶cdk4及cdk6之抑制劑的p16及p15編碼。
p16INK4A轉錄本可替代地為剪接至編碼pl4ARF之轉錄本中的替代讀框(alternative reading frame,ARF)。pl4ARF結合至MDM2且防止p53降解(Pomerantz等人(1998) Cell 92:713-723)。9p21染色體區域受到關注,此係因為其在各種癌症中頻繁同型結合地缺失,該等癌症包括白血病、NSLC、胰臟癌、神經膠質瘤、黑色素瘤及間皮瘤。缺失通常使多於一種基因失活。舉例而言,Cairns 等人 ((1995)Nat. Gen.
11:210-212)報導,在研究超過500種原發性腫瘤之後,此類腫瘤中經鑑別的幾乎所有缺失涉及含有MTAP、pl4ARF及P16INK4A之170 kb區域。Carson 等人 (WO 99/67634)報導,腫瘤發展階段與編碼MTAP之基因及編碼p16的基因之純合性損失之間存在相關性。舉例而言,報導MTAP基因而非p16INK4A之缺失指示發展初期時的癌症,而報導為p16及MTAP編碼之基因的缺失指示腫瘤發展較晚期時的癌症。在一些骨肉瘤患者中,MTAP基因在診斷時存在但在稍後時間點缺失(Garcia-Castellano 等人,Clin. Cancer Res
. 8(3) 2002 782-787)。
本發明提供抑制MAT2A之化合物。該等化合物及其醫藥組成物適用於治療各種癌症之方法,該等癌症包括難以用標準治療治療之癌症,標準治療諸如手術、放射療法、化學療法及激素療法。
在式I中,X1
為N或CR5
,且X2
為N或CR6
,其中X1
及X2
不同時為N。
L為O、S、NR或一鍵。取代基R為H或C1
-C6
烷基。
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中R1
中之任何烷基為直鏈或支鏈的。
另外,R1
視情況經1至6個鹵基取代。當X1
為N,X2
為CR6
,L為NR或S,R為H且R1
為C1
-C6
烷基時,則R1
經1至6個鹵基取代。
替代地,在一具體例中,當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4環成員獨立地選自N、O及S),其視情況經一或多個RA
取代。
R2
及R3
獨立地選自由以下組成之群:視情況經取代之C6
-C10
芳基、視情況經取代之C3
-C6
碳環基、視情況經取代之5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及視情況經取代之3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S)。
R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
及-CN。
在其他態樣中,R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
、-NRA
C(O)NRA
RB
及-CN。在另外態樣中,R2
及/或R3
為-NRA
C(O)NRA
RB
。
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
。
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
。
R6
係選自由以下組成之群:H、C1
-C6
烷基(視情況經一或多個鹵基取代)、-O(C1
-C6
烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
。
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基) (其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)。
在RA
及RB
中,各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由以下組成之群的取代基取代:氘、羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S))、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基、-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基)。各烷基、烯基、芳基及雜環烷基取代基視情況經選自由組成之群的一或多個取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基。
RC
及RD
各自獨立地選自H及C1
-C6
烷基。
其中
X1
為N或CR5
;
X2
為N或CR6
,其中X1
及X2
不同時為N;
L為O、S、NR或鍵;
R為H或C1
-C6
烷基;
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中R1
中之任何烷基為直鏈或支鏈的,R1
視情況經1至6個鹵基取代;且當X1
為N,X2
為CR6
,L為NR或S,R為H且R1
為C1
-C6
烷基時,則R1
經1至6個鹵基取代;
或當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4個環成員獨立地選自N、O及S),其視情況經一或多個RA
取代;
R2
及R3
獨立地選自由以下組成之群:C6
-C10
芳基、C3
-C6
碳環基、5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S),其中R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
及-CN;
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
;
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
;
R6
係選自由以下組成之群:H、C1
-C6
烷基(視情況經一或多個鹵基取代)、-O(C1
-C6
烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
;
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S);其中RA
及RB
之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由以下組成之群的取代基取代:氘、羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S))、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基),其中各烷基、烯基、芳基及雜環烷基視情況經一或多個選自由組成之群的取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基;
RC
及RD
各自獨立地選自H及C1
-C6
烷基;
或其醫藥學上可接受之鹽。
其中
X1
為N或CR5
;
X2
為N或CR6
,其中X1
及X2
不同時為N;
L為O、S、NR或鍵;
R為H或C1
-C6
烷基;
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中R1
中之任何烷基為直鏈或支鏈的,R1
視情況經1至6個鹵基取代;且當X1
為N,X2
為CR6
,L為NR或S,R為H且R1
為C1
-C6
烷基時,則R1
經1至6個鹵基取代;
或當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4個環成員獨立地選自N、O及S),其視情況經一或多個RA
取代;
R2
及R3
獨立地選自由以下組成之群:C6
-C10
芳基、C3
-C6
碳環基、5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S),其中R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
、-NRA
C(O)NRA
RB
及-CN;
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
;
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
;
R6
係選自由以下組成之群:H、C1
-C6
烷基(視情況經一或多個鹵基取代)、-O(C1
-C6
烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
;
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S);其中RA
及RB
之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由以下組成之群的取代基取代:氘、羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S))、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基),其中各烷基、烯基、芳基及雜環烷基視情況經一或多個選自由組成之群的取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基;
RC
及RD
各自獨立地選自H及C1
-C6
烷基;
或其醫藥學上可接受之鹽。
在式II中,X1
為N且X2
為CR6
,X1
為CR5
且X2
為CR6
,X1
及X2
均為N,或X1
為CR5
且X2
為CR6
。
L為O、S、NR或一鍵。取代基R為H或C1
-C6
烷基。
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中R1
中之任何烷基為直鏈或支鏈的。R1
視情況經1至6個鹵基取代。
在一具體例中,當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4環成員獨立地選自N、O及S),其視情況經一或多個RA
取代。
R2
及R3
獨立地選自由以下組成之群:C6
-C10
芳基、C3
-C6
碳環基、5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S)。R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
及-CN。
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
。
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
。
R6
係選自由以下組成之群:H、C1
-C6
烷基(視情況經一或多個鹵基取代)、-O(C1
-C6
烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
。
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基) (其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)。
RA
及RB
之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由組成之群的取代基取代:羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S))、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基、-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基)。各烷基、烯基、芳基及雜環烷基取代基視情況經選自由組成之群的一或多個取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基。
RC
及RD
各自獨立地選自H及C1
-C6
烷基。
在另一具體例中,本發明提供一種醫藥組成物,其包含治療有效量之如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物;及醫藥學上可接受之載劑。
根據一另外具體例,本發明提供一種用於治療罹患癌症個體之癌症的方法,其包含向個體投與有效量之MAT2A抑制劑,其為如本文所述之化合物或醫藥學上可接受之鹽、互變異構體及/或同位素物。
在另一個具體例中,本發明亦提供一種用於抑制細胞中S-腺苷甲硫胺酸(SAM)合成之方法,其包含將有效量之如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物引入至細胞中。
在另一個具體例中,本發明亦提供一種用於抑制個體中S-腺苷甲硫胺酸(SAM)合成之方法,其包含向個體投與有效量之如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物。
在另一具體例中,本發明提供一種用於治療罹患癌症個體之癌症的方法,其包含向個體投與有效量之如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物。
根據再一具體例,本發明提供一種用於治療罹患癌症個體之癌症的方法,其中癌症特徵為與其中存在甲硫基腺苷磷酸化酶(MTAP)基因或蛋白及/或其充分起作用之癌症相比,MTAP基因表現減少或不存在、不存在MTAP基因或MTAP蛋白功能降低。該方法包含向個體投與治療有效量之如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物。
在一具體例中,本發明提供一種用於抑制S-腺苷甲硫胺酸(SAM)合成的如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物。
另一具體例為一種用於治療罹患癌症個體之癌症的如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物。
另一具體例為一種供用於治療罹患癌症個體之癌症中的如本文所述之化合物或其醫藥學上可接受之鹽、互變異構體及/或同位素物。
本發明亦提供如本文所述之化合物或其醫藥學上可接受之鹽之用途,其供製造用於治療癌症之藥劑。
本文中所描述之化合物為MAT2A抑制劑。因此本發明不僅關於符合式I或式II之此類化合物,且亦關於其醫藥組成物、互變異構體及/或同位素物。該等化合物及組成物適用於治療癌症。一些癌症包括各種MTAP缺失型癌症,亦即特徵為MTAP基因不存在或缺失或MTAP蛋白功能降低之彼等癌症。定義
「烷基」係指包括1至約20個碳原子之直鏈或支鏈烴基。舉例而言,烷基可具有1至10個碳原子或1至6個碳原子。例示性烷基包括直鏈烷基,諸如甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一基、十二基及類似者,且包括直鏈烷基之支鏈異構體,例如(但不限於)-CH(CH3
)2
、-CH(CH3
)(CH2
CH3
)、-CH(CH2
CH3
)2
、-C(CH3
)3
、C(CH2
CH3
)3
、-CH2
CH(CH3
)2
、-CH2
CH(CH3
)(CH2
CH3
)、--CH2
CH(CH2
CH3
)2
、-CH2
C(CH3
)3
、-CH2
C(CH2
CH3
)3
、-CH(CH3
)CH(CH3
)(CH2
CH3
)、-CH2
CH2
CH(CH3
)2
、-CH2
CH2
CH(CH3
)(CH2
CH3
)、-CH2
CH2
CH(CH2
CH3
)2
、-CH2
CH2
C(CH3
)3
、-CH2
CH2
C(CH2
CH3
)3
、-CH(CH3
)CH2
CH(CH3
)2
、-CH(CH3
)CH(CH3
)CH(CH3
)2
及類似者。因此,烷基包括第一烷基、第二烷基及第三烷基。烷基可未經取代或視情況經如本文中下文所描述的一或多個取代基取代。
片語「經取代之烷基」係指在例如1、2、3、4、5或甚至6個位置之一或多個位置處經如本文中所描述的取代基取代之烷基,其取代基附接於任何可獲得的原子處以產生穩定化合物。「視情況經取代之烷基」係指烷基或經取代之烷基。
術語「鹵素」、「鹵化物」及「鹵基」中之每一者係指-F、-Cl、-Br或-I。
術語「烯基」係指包括2至約20個碳原子且具有1至3個、1至2個或至少一個碳碳雙鍵之直鏈或支鏈烴基。烯基可未經取代或視情況經如本文中下文所描述的一或多個取代基取代。
「經取代之烯基」係指在例如1、2、3、4、5或甚至6個之1或多個位置處經如本文中所描述的取代基取代的烯基,其取代基附接於任何可獲得的原子處以產生穩定化合物。「視情況經取代之烯基」係指烯基或經取代之烯基。
「炔烴」或「炔基」係指具有指定數目之碳原子及至少一個參鍵之直鏈或支鏈不飽和烴。(C2
-C8
)炔基之實例包括(但不限於)乙炔、丙炔、1-丁炔、2-丁炔、1-戊炔、2-戊炔、1-己炔、2-己炔、3-己炔、1-庚炔、2-庚炔、3-庚炔、1-辛炔、2-辛炔、3-辛炔及4-辛炔。炔基可為未經取代或視情況經如本文中下文所描述的一或多個取代基取代。
「經取代之炔基」係指在例如1、2、3、4、5或甚至6個位置之1或多個位置處經如本文中所描述的取代基取代之炔基,其取代基附接於任何可獲得的原子以產生穩定化合物。「視情況經取代之炔基」係指炔基或經取代之炔基。
術語「烷氧基」係指具有指定數目之碳原子的-O-烷基。例如,(C1
-C6
)烷氧基包括-O-甲基、-O-乙基、-O-丙基、-O-異丙基、-O-丁基、-O-仲-丁基、-O-第三-丁基、-O-戊基、-O-異戊基、-O-新戊基、-O-己基、-O-異己基及-O-新己基。
術語「碳環基」係指單環、雙環、三環或多環3員至14員環系統,其為飽和的,諸如「環烷基」,或為不飽和的,諸如「環烯基」。術語「環烯基」具體地係指環狀烯基,諸如C3
-C6
-環烯基。碳環基可經由任何原子附接。舉例而言,碳環基亦涵蓋稠環,其中,舉例而言,碳環基稠合至如本文中所定義之芳基或雜芳環。碳環基的代表性實例包括(但不限於)環丙基、環丁基、環戊基、環己基、環丙烯基、環丁烯基、環戊烯基、環己烯基、苯基、萘基、蒽基、苯并呋喃基及苯并噻吩基。碳環基可未經取代或視情況經如本文中下文所描述的一或多個取代基取代。
「經取代之碳環基」係指在例如1、2、3、4、5或甚至6個位置之1或多個位置處經如本文中所描述的取代基取代之碳環基,其取代基附接於任何可獲得的原子以產生穩定化合物。「視情況經取代之碳環基」係指碳環基或經取代之碳環基。
「芳基」在單獨使用或用作另一術語之一部分時意謂是否稠合的碳環芳族基,該碳環芳族基具有指定之碳原子數目或若未指定數目,則具有至多14個碳原子,諸如C6
-C14
芳基。特定芳基為苯基、萘基、聯苯基、菲基、稠四苯基及類似者(參見例如,Lang’s Handbook of Chemistry
(Dean, J. A.編) 第13版 表7-2 [1985])。特定芳基為苯基。「芳基」亦包括視情況與碳環基環稠合之芳環系統,如本文所定義。芳基可未經取代或視情況經如本文中下文所描述的一或多個取代基取代。
「經取代之芳基」為獨立經附接在任何可獲得的原子處以產生穩定化合物之一或多個取代基取代的芳基,其中取代基如本文中所描述。「視情況經取代之芳基」係指芳基或經取代之芳基。
術語「雜原子」係指N、O及S。含有N或S原子之本發明化合物可視情況氧化成相應N-氧化物、亞碸或碸化合物。
「雜芳基」單獨或與本文中所描述的任何其他部分組合係指含有諸如5或6之5至10個環原子的單環芳環結構或具有8至10個原子含有獨立地選自由以下組成之群之諸如1至4、1至3或1至2的一或多個雜原子之雙環芳族基:O、S及N。雜芳基亦意欲包括經氧化之S或N,諸如亞磺醯基、磺醯基及第三環氮之N-氧化物。碳或雜原子為使得產生穩定化合物之雜芳環結構之附接點。雜芳基之實例包括(但不限於)吡啶基、嗒𠯤基、吡𠯤基、喹㗁啉基(quinaoxalyl)、吲哚𠯤基、苯并[b]噻吩基、喹唑啉基、嘌呤基、吲哚基、喹啉基、嘧啶基、吡咯基、吡唑基、㗁唑基、噻唑基、噻吩基、異㗁唑基、㗁噻二唑基、異噻唑基、四唑基、咪唑基、三唑基、呋喃基、苯并呋喃基及吲哚基。雜芳基可未經取代或視情況經如本文中下文所描述的一或多個取代基取代。
「經取代之雜芳基」為雜芳基,除非另外指示,否則該雜芳基獨立地經附接在任何可獲得的原子處以產生穩定化合物之例如1、2、3、4或5、亦如1、2或3個取代基、亦如1個取代基的一或多個取代基取代,其中取代基如本文中所描述。「視情況經取代之雜芳基」係指雜芳基或經取代之雜芳基。
「雜環烷基」意謂具有諸如3至6個之3至14個原子的飽和或不飽和非芳族單環、雙環、三環或多環環系統,其中該環中的1至3個碳原子經O、S或N雜原子置換。雜環烷基視情況與具有5至6個環成員之芳基或雜芳基稠合,且包括經氧化之S或N,諸如亞磺醯基、磺醯基及第三環氮之N-氧化物。雜環烷基環之附接點在使得保持穩定環之碳或雜原子處。雜環烷基之實例包括(但不限於) N-𠰌啉基、四氫呋喃基、二氫吡啶基、哌啶基、吡咯啶基、哌𠯤基、二氫苯并呋喃基及二氫吲哚基。雜環烷基可未經取代或視情況經如本文中下文所描述的一或多個取代基取代。
「視情況經取代之雜環烷基」表示經附接於任何可獲得的原子處以產生穩定化合物之例如1、2或3個取代基之1至3個取代基取代的雜環烷基,其中取代基如本文中所描述。
術語「腈」或「氰基」可互換地使用且係指與雜芳環、芳環及雜環烷基環的碳原子結合之-CN基團。
術語「側氧基」係指附接至飽和或不飽和部分之=O原子。=O原子可附接至作為環狀或非環狀部分之一部分的碳、硫或氮原子。
「羥基(hydroxyl或hydroxy)」係指-OH基團。
取代基-CO2
H可經諸如以下之生物電子等排替代物置換:
及類似者,其中R具有與如本文中所定義之RA
相同的定義。參見例如,
The Practice of Medicinal Chemistry (Academic Press: New York, 1996), 第203頁處。
本文中所描述之化合物可以各種異構體形式存在,包括構型、幾何及構形異構體,包括例如順式或反式構形。化合物亦可以一或多種互變異構形式存在,包括單互變異構體及互變異構體混合物兩者。術語「異構體」意欲涵蓋本發明之化合物的所有異構體形式,包括化合物之互變異構形式。本發明之化合物亦可以開鏈或環化形式存在。在一些情況下,環化形式中之一或多者可由水損失引起。開鏈及環化形式之特定組成物可取決於如何分離、儲存或投與化合物。舉例而言,化合物可在酸性條件下主要以開鏈形式存在但在中性條件下環化。所有形式均包括在本發明中。
本文中所描述之一些化合物可具有不對稱中心且因此以不同對映異構體及非對映異構體形式存在。如本文所述之化合物可呈光學異構體或非對映異構體形式。因此,本發明涵蓋如本文中所描述的化合物及其用途,該等化合物呈其光學異構體、非對映異構體及其混合物形式,包括外消旋混合物。本發明化合物之光學異構體可藉由已知技術獲得,該等已知技術諸如不對稱合成、對掌性層析、模擬移動床技術或經由通過採用光學活性解析劑來化學分離立體異構體。
除非另外指示,否則術語「立體異構體」意謂實質上不含化合物之其他立體異構體的彼化合物之一種立體異構體。因此,具有一個對掌性中心之立體異構純化合物將實質上不含化合物之相反對映異構體。具有兩個對掌性中心之立體異構純化合物將實質上不含該化合物之其他非對映異構體。典型立體異構純化合物包含大於約80重量%之化合物的一種立體異構體及小於約20重量%之化合物的其他立體異構體,例如大於約90重量%之化合物之一種立體異構體及小於約10重量%的化合物之其他立體異構體,或大於約95重量%之化合物的一種立體異構體及小於約5重量%之化合物之其他立體異構體,或大於約97重量%化合物的一種立體異構體及小於約3重量%之化合物之其他立體異構體,或大於約99重量%的化合物之一種立體異構體及小於約1重量%之化合物的其他立體異構體。如上文所描述之立體異構體可視為包含本文中所描述的其各別重量百分比存在之兩種立體異構體的組成物。
若所描繪結構與給予該結構之名稱之間存在不一致,則以所描繪結構為準。另外,若結構或結構的一部分之立體化學性未用例如粗體或短劃線指示,則該結構或該結構的部分應解釋為涵蓋其所有立體異構體。然而,在一些情況下,在多於一個對掌性中心存在時,結構及名稱可表示為單一對映異構體以幫助描述相對立體化學性。熟習有機合成技藝者將理解,化合物是否根據用於製備其之方法製備為單一對映異構體。
如本文所用,術語「同位素物」為經同位素增濃之化合物。如本文所用且除非另外指示,否則術語「經同位素增濃」係指原子具有除該原子之天然充足的同位素組成以外之同位素組成。“「經同位素增濃」亦可指化合物含有至少一種以下原子,該原子具有除該原子之天然同位素組成以外之同位素組成。在同位素物中,「同位素增濃度」係指分子中的給定原子之代替該原子之天然同位素組成的特定同位素之量的併入百分比。舉例而言,在給定位置之1%之氘增濃意謂在給定樣品中有1%之分子在該指定位置含有氘。由於氘之自然存在的分佈為約0.0156%,因此使用非增濃起始物質合成之化合物中之任何位置處的氘增濃度為約0.0156%。
因此,如本文所用且除非另外指示,否則術語「同位素增濃因數」係指指定同位素之同位素組成與天然同位素組成之間的比率。
關於本文所提供之化合物,當特定原子之位置表示為具有氘或「D」或「2
H」時,應理解,該位置處之氘之豐度實質上大於氘之天然豐度,其為約0.015%。在特定具體例中,指定為具有氘之位置的最低同位素增濃因數通常為在各指定氘原子處至少1000 (15%氘併入)、至少2000 (30%氘併入)、至少3000 (45%氘併入)、至少3500 (52.5%氘併入)、至少4000 (60%氘併入)、至少4500 (67.5%氘併入)、至少5000 (75%氘併入)、至少5500 (82.5%氘併入)、至少6000 (90%氘併入)、至少6333.3 (95%氘併入)、至少6466.7 (97%氘併入)、至少6600 (99%氘併入)或至少6633.3 (99.5 %氘併入)。本文所提供之化合物之同位素增濃度及同位素增濃因數可使用一般熟習本技藝者已知的習知分析方法測定,包括質譜及核磁共振光譜。
如本文所用且除非另外相反規定,否則,術語「化合物」係包括性的,原因在於其涵蓋化合物或其醫藥學上可接受之鹽、立體異構體、同位素物及/或互變異構體。因此,舉例而言,式I或式II之化合物包括該化合物之同位素物之醫藥學上可接受之鹽。
在本說明書中,「醫藥學上可接受之鹽」為本文所述之化合物之醫藥學上可接受的、有機或無機酸或鹼鹽。代表性醫藥學上可接受之鹽包括例如鹼金屬鹽,鹼土鹽,銨鹽,水溶性及非水溶性鹽,諸如乙酸鹽、胺芪磺酸鹽(amsonate) (4,4-二胺二苯乙烯-2,2-二磺酸鹽)、苯磺酸鹽、苯甲酸鹽、碳酸氫鹽、硫酸氫鹽、酒石酸氫鹽、硼酸鹽、溴化物、丁酸鹽、鈣鹽、乙二胺四乙酸鈣、樟腦磺酸鹽、碳酸鹽、氯化物、檸檬酸鹽、克拉維酸鹽(clavulariate)、二鹽酸鹽、乙二胺四乙酸鹽、乙二磺酸鹽、硫酸月桂酸鹽(estolate)、乙磺酸鹽、反丁烯二酸鹽、葡庚糖酸鹽、葡糖酸鹽、麩胺酸鹽、乙內醯胺苯胂酸鹽、六氟磷酸鹽、己基間苯二酚酸鹽(hexylresorcinate)、海卓胺(hydrabamine)、氫溴酸鹽、鹽酸鹽、羥基萘甲酸鹽、碘化物、羥乙磺酸鹽(isothionate)、乳酸鹽、乳糖酸鹽、月桂酸鹽、蘋果酸鹽、順丁烯二酸鹽、杏仁酸鹽、甲磺酸鹽、甲基溴化物、甲基硝酸鹽、甲基硫酸鹽、半乳糖二酸鹽、萘磺酸鹽、硝酸鹽、N-甲基葡糖胺銨鹽、3-羥基-2-萘甲酸鹽、油酸鹽、草酸鹽、棕櫚酸鹽、雙羥萘酸鹽(1,1-亞甲基-雙-2-羥基-3-萘甲酸鹽,恩波酸鹽(einbonate))、泛酸鹽、磷酸鹽/二磷酸鹽、苦味酸鹽、聚半乳糖醛酸鹽、丙酸鹽、對甲苯磺酸鹽、水楊酸鹽、硬脂酸鹽、次乙酸鹽、丁二酸鹽、硫酸鹽、磺基水楊酸鹽(sulfosaliculate)、蘇拉酸鹽(suramate)、丹寧酸鹽、酒石酸鹽、茶氯酸鹽、甲苯磺酸鹽、三乙基碘化物及戊酸鹽。醫藥學上可接受之鹽在其結構中可具有多於一個帶電原子。在此實例中,醫藥學上可接受之鹽可具有多種相對離子。因此,醫藥學上可接受之鹽可具有一或多個帶電原子及/或一或多個相對離子。
術語「治療(treat、treating及treatment)」係指與疾病相關聯之疾病或症狀的改善或根除。在某些具體例中,此類術語係指使疾病之擴散或惡化最小化,該最小化由向患有此類疾病之患者投與一或多種預防劑或治療劑產生。
術語「預防(prevent、preventing及prevention)」係指預防患者之疾病的發作、復發或擴散,該預防由投與預防劑或治療劑引起。
術語「有效量」係指在疾病之治療或預防中足夠提供治療效益或預防效益或延遲或使與疾病相關的症狀減至最少的如本文所述之化合物或其他活性成分之量。此外,關於如本文所述之化合物的治療有效量意謂單獨或與其他療法組合的,在疾病之治療或預防中提供治療效益的治療劑之量。與如本文所述之化合物結合使用,術語可涵蓋改善總體療法、減少或避免疾病之症狀或病因或增強另一治療劑之治療功效或與另一治療劑之協同作用的量。
「患者」或「個體」包括動物,諸如人類、牛、馬、綿羊、羔羊、豬、雞、火雞、鵪鶉、貓、狗、小鼠、大鼠、家兔或天竺鼠。根據一些具體例,動物為哺乳動物,諸如非靈長類及靈長類(例如,猴及人類)。在一個具體例中,患者為人類,諸如人類嬰兒、兒童、青少年或成人。
「抑制劑」意謂預防或減少SAM合成之量的化合物。在一具體例中,抑制劑與MAT2A結合。化合物
在式I中,X1
為N或CR5
,且X2
為N或CR6
,其中X1
及X2
不同時為N。
L為O、S、NR或一鍵。取代基R為H或C1
-C6
烷基。
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中R1
中之任何烷基為直鏈或支鏈的。
另外,R1
視情況經1至6個鹵基取代。當X1
為N,X2
為CR6
,L為NR或S,R為H且R1
為C1
-C6
烷基時,則R1
經1至6個鹵基取代。
替代地,在一具體例中,當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4環成員獨立地選自N、O及S),其視情況經一或多個RA
取代。
R2
及R3
獨立地選自由以下組成之群:視情況經取代之C6
-C10
芳基、視情況經取代之C3
-C6
碳環基、視情況經取代之5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及視情況經取代之3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S)。
R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
及-CN。在一些具體例中,R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
、-NRA
C(O)NRA
RB
及-CN。在其他具體例中,R2
及/或R3
為-NRA
C(O)NRA
RB
。
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
。
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
。
R6
係選自由以下組成之群:H;視情況經一或多個鹵基取代之C1
-C6
烷基;及視情況經選自由以下組成之群的一或多個取代基取代之-O(C1
-C6
烷基):鹵基、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
。
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基) (其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)。
在RA
及RB
中,各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由以下組成之群的取代基取代:氘、羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S))、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基、-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基)。各烷基、烯基、芳基及雜環烷基取代基視情況經選自由組成之群的一或多個取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基。
RC
及RD
各自獨立地選自H及C1
-C6
烷基。
在式II中,X1
為N且X2
為CR6
,X1
為CR5
且X2
為CR6
,X1
及X2
均為N,或X1
為CR5
且X2
為CR6
。
L為O、S、NR或一鍵。取代基R為H或C1
-C6
烷基。
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中R1
中之任何烷基為直鏈或支鏈的。R1
視情況經1至6個鹵基取代。
在一具體例中,當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4環成員獨立地選自N、O及S),其視情況經一或多個RA
取代。
R2
及R3
獨立地選自由以下組成之群:視情況經取代之C6
-C10
芳基、視情況經取代之C3
-C6
碳環基、視情況經取代之5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及視情況經取代視情況經取代之3員至14員雜環烷基(其中1至4個雜環烷基成員獨立地選自N、O及S)。R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N-RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
及-CN。
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
。
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
。
R6
係選自由以下組成之群:H;視情況經一或多個鹵基取代之C1
-C6
烷基;及視情況經一或多個以下取代之-O(C1
-C6
烷基):鹵基、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
。
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基) (其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)。
RA
及RB
之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由組成之群的取代基取代:羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基、-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基)。各烷基、烯基、芳基及雜環烷基視情況經一或多個選自由以下組成之群的取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基。
RC
及RD
各自獨立地選自H及C1
-C6
烷基。
在一些式I化合物中,根據一具體例,X1
為N且X2
為CR6
。在其他具體例中,X1
為CR5
且X2
為CR6
。在另其他具體例中,X1
為CR5
且X2
為N。替代地,X1
為CR5
且X2
為CR6
。
在一些式II化合物中,根據各個具體例,X1
為N且X2
為CR6
。其他具體例提供均呈N之X1
及X2
。在其他具體例中,X1
為CR5
且X2
為CR6
。
結合本文中所述之任何具體例,根據一個具體例,R4
及R5
(存在時)中之每一者獨立地選自H及C1
-C6
烷基。此外,R6
(存在時)係選自由以下組成之群:H、視情況經一或多個鹵基取代之C1
-C6
烷基、C1
-C6
烷氧基、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
(其中RA
及RB
獨立地選自H及C1
-C6
烷基)。
在各個具體例中,視情況與本文中所述之任何其他具體例組合,R4
、R5
及R6
(存在時)中之至少一者為H。因此,舉例而言,至少R4
為H,R5
為H或R6
為H。滿足本文中之任何具體例中所述之結構要求,例示性化合物亦為其中R4
、R5
及R6
(當存在時)中之每一者為H之化合物。
根據視情況與任何其他具體例組合的另一具體例,本發明提供化合物R2
為視情況經取代之C6
-C10
芳基或視情況經取代之5員至10員雜芳基。因此,舉例而言,R2
為視情況經取代之C6
-C10
芳基,諸如視情況經取代之苯基。替代地,R2
為視情況經取代之5員至10員雜芳基,且其中1個環成員為N。R2
之一實例為視情況經取代之吡啶基。
根據多個具體例,一小類化合物為其中R3
為視情況經取代之3員至14員雜環烷基或視情況經取代之5員至10員雜芳基之化合物。R3
之實例包括苯并噻唑基、苯并異噻唑基、苯并㗁唑基、吡啶基、吡啶酮基、嗒𠯤基、苯并咪唑基、苯并三唑基、吲唑基、喹㗁啉基、喹啉基、喹唑啉基、咪唑并吡啶基、吡唑并吡啶基、三唑并吡啶基、㖕啉基、異㗁唑基、吡唑基、苯并呋喃基、二氫苯并呋喃基、二氫苯并二氧雜環己烯基及四氫苯并二氧雜環己烯基,其中前述部分中之任一者視情況經取代。
在其他具體例中,R3
為視情況經取代之C6
-C10
芳基。在此情況下,R3
之一實例為視情況經取代之苯基。
視情況與任何其他具體例組合,本發明之一些具體例提供其中R2
為視情況經取代之苯基且R3
為視情況經取代之3員至14員雜環烷基或視情況經取代之5員至10員雜芳基的化合物。
在一具體例中,如任何其他具體例中所述之化合物為其中L為O或NR之化合物。視情況與此具體例組合,R1
為視情況經取代之C1
-C6
烷基或視情況經取代之C3
-C6
-碳環基。一示例性具體例為其中R1
為視情況經1至3個F取代之C1
-C3
烷基之具體例。
在視情況與本文中所述之任何其他具體例組合的各個具體例中,L為O或NR且R為H;R1
為C1
-C3
烷基,其視情況經1至3個F取代;R2
為視情況經取代之3員至14員雜環烷基或視情況經取代之5員至10員雜芳基(其中1個雜環烷基或雜芳基成員為N)或視情況經取代之C6
-C10
芳基;R3
為視情況經取代之3員至14員雜環烷基;視情況經取代之5員至10員雜芳基,其中1至3個雜環烷基或雜芳基成員獨立地選自N、O及S;或視情況經取代之C6
-C10
芳基;且R4
、R5
及R6
(當存在時)中之每一者為H。
舉例而言,L為NR。替代地或另外,R2
為視情況經取代之苯基;且R3
為視情況經取代之5員至10員雜芳基,其中1至3個雜芳基成員獨立地選自N、O及S。舉例而言,R3
係選自由以下組成之群:視情況經取代之苯并噻唑基、苯并異噻唑基、苯并㗁唑基、吡啶基、吡啶酮基、嗒𠯤基、苯并咪唑基、苯并三唑基、吲唑基、喹㗁啉基、喹啉基、喹唑啉基、咪唑并吡啶基、吡唑并吡啶基、三唑并吡啶基、㖕啉基、異㗁唑基、吡唑基、苯并呋喃基、二氫苯并呋喃基、二氫苯并二氧雜環己烯基及四氫苯并二氧雜環己烯基,其中任一者可視情況經取代。
在其他具體例中,R2
為視情況經取代之5員至10員雜芳基,其中1至3個雜芳基成員獨立地選自N、O及S;且R3
為視情況經取代之苯基。在另其他具體例中,R2
及R3
獨立地為視情況取代之苯基。
在各個具體例中,本發明提供式I及式II化合物之特定實施例及其醫藥學上可接受之鹽、互變異構體及/或同位素物,如下表1及表2及表3及表4中分別所闡述。
表
1
:式
I
化合物之實施例
| 101 | |||
| 102 | 195 | ||
| 103 | 196 | ||
| 104 | 197 | ||
| 105 | 198 | ||
| 106 | 199 | ||
| 107 | 200 | ||
| 108 | 201 | ||
| 109 | 202 | ||
| 110 | 203 | ||
| 111 | 204 | ||
| 112 | 205 | ||
| 113 | 206 | ||
| 114 | 207 | ||
| 115 | 208 | ||
| 116 | 209 | ||
| 117 | 210 | ||
| 118 | 211 | ||
| 119 | 212 | ||
| 120 | 213 | ||
| 121 | 214 | ||
| 122 | 215 | ||
| 123 | 216 | ||
| 124 | 217 | ||
| 125 | 218 | ||
| 126 | 219 | ||
| 127 | 220 | ||
| 128 | 221 | ||
| 129 | 222 | ||
| 130 | 223 | ||
| 131 | 224 | ||
| 132 | 225 | ||
| 133 | 226 | ||
| 135 | 227 | ||
| 136 | 228 | ||
| 137 | 229 | ||
| 138 | 230 | ||
| 139 | 231 | ||
| 140 | 232 | ||
| 141 | 233 | ||
| 142 | 234 | ||
| 143 | 235 | ||
| 144 | 236 | ||
| 145 | 237 | ||
| 146 | 238 | ||
| 147 | 239 | ||
| 148 | 240 | ||
| 149 | 241 | ||
| 150 | 242 | ||
| 151 | 243 | ||
| 152 | 244 | ||
| 153 | 245 | ||
| 154 | 246 | ||
| 155 | 247 | ||
| 157 | 248 | ||
| 158 | 249 | ||
| 159 | 250 | ||
| 160 | 251 | ||
| 161 | 252 | ||
| 162 | 253 | ||
| 163 | 254 | ||
| 164 | 255 | ||
| 165 | 256 | ||
| 166 | 257 | ||
| 167 | 258 | ||
| 168 | 259 | ||
| 169 | 260 | ||
| 170 | 261 | ||
| 171 | 262 | ||
| 172 | 263 | ||
| 173 | 264 | ||
| 174 | 265 | ||
| 175 | 266 | ||
| 176 | 267 | ||
| 177 | 269 | ||
| 178 | 270 | ||
| 179 | 271 | ||
| 180 | 272 | ||
| 181 | 273 | ||
| 182 | 274 | ||
| 183 | 275 | ||
| 184 | 276 | ||
| 185 | 277 | ||
| 186 | 278 | ||
| 187 | 279 | ||
| 188 | 280 | ||
| 189 | 281 | ||
| 190 | 282 | ||
| 191 | 283 | a | |
| 192 | 286 | ||
| 193 | 294 | ||
| 194 | 295 |
表
3
:式
I
及式
II
化合物之實施例
| 實施例 | 結構 | 實施例 | 結構 |
| 401 | 420 | ||
| 402 | 421 | ||
| 403 | 422 | ||
| 404 | 423 | ||
| 405 | 424 | ||
| 406 | 425 | ||
| 407 | 427 | ||
| 408 | 428 | ||
| 409 | 429 | ||
| 410 | 430 | ||
| 411 | 431 | ||
| 413 | 432 | ||
| 414 | 433 | ||
| 415 | 434 | ||
| 416 | 435 | ||
| 417 | 436 | ||
| 418 | 437 | ||
| 419 | 438 |
本發明亦提供一種醫藥組成物,其包含治療有效量之與醫藥學上可接受之載劑摻合的一或多種根據式I、式II之化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物。在一些具體例中,根據醫藥調配之公認實務,組成物進一步含有一或多種額外治療劑、醫藥學上可接受之賦形劑、稀釋劑、佐劑、穩定劑、乳化劑、防腐劑、著色劑、緩衝劑或風味賦予劑。
在一個具體例中,醫藥組成物包含選自表1及表2中所示之化合物的化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物;以及醫藥學上可接受之載劑。
本發明之醫藥組成物以與良好醫學實務一致的方式調配、給藥且投與。在此上下文中,考慮因素包括所治療之特定病症、所治療之特定個體、個體的臨床病狀、病症起因、藥劑遞送位點、投與方法、投與時程及醫學從業者已知之其他因素。
所投與之化合物(或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物)的「治療有效量」藉由此類考慮因素進行調節且為對癌症施加細胞毒性作用或抑制MAT2A活性或兩者所必需之最少量。此量可總體上低於對正常細胞或個體有毒的量。通常,所投與之本發明之化合物(或其醫藥學上可接受之鹽、立體異構體或互變異構體)的初始治療有效量在每天每公斤患者體重約0.01至約200 mg或約0.1至約20 mg範圍內,其中典型初始範圍為約0.3至約15毫克/公斤/天。諸如錠劑及膠囊之口服單位劑型可含有約1 mg至約1000 mg本發明之化合物(或其醫藥學上可接受之鹽、立體異構體或互變異構體)。在另一具體例中,此類劑型含有約50 mg至約500 mg本發明之化合物(或其醫藥學上可接受之鹽、立體異構體或互變異構體)。在又一具體例中,此類劑型含有約25 mg至約200 mg本發明之化合物(或其醫藥學上可接受之鹽、立體異構體或互變異構體)。在再一具體例中,此類劑型含有約10 mg至約100 mg本發明之化合物(或其醫藥學上可接受之鹽、立體異構體或互變異構體)。在另一具體例中,此類劑型含有約5 mg至約50 mg本發明之化合物(或其醫藥學上可接受之鹽、立體異構體或互變異構體)。
本發明組成物可以劑量單位調配物形式經口、局部、非經腸、藉由吸入或噴霧或經直腸投與。如本文所用之術語非經腸包括皮下注射、靜脈內、肌肉內、胸骨內注射或輸注技術。
如本文所述之適合口服組成物包括(但不限於)錠劑、糖衣錠、口含錠、水溶液或油性懸浮液、可分散散劑或顆粒、乳液、硬或軟膠囊、糖漿或酏劑。
在另一態樣中,亦涵蓋適用於單一單位劑量之醫藥組成物,其包含本發明化合物或其醫藥學上可接受之立體異構體、鹽或互變異構體及醫藥學上可接受之載劑。
適用於經口使用之本發明組成物可根據本技藝已知用於製造醫藥組成物之任何方法來製備。舉例而言,本發明化合物之液體調配物含有選自由以下組成之群的一或多種試劑:甜味劑、調味劑、著色劑及防腐劑,以提供MAT2A抑制劑之醫藥學上適口之製劑。
針對錠劑組成物,與無毒的醫藥學上可接受之賦形劑混合的本發明化合物用於製造錠劑。此類賦形劑之實例包括(但不限於)惰性稀釋劑,諸如碳酸鈣、碳酸鈉、乳糖、磷酸鈣或磷酸鈉;粒化劑及崩解劑,例如玉米澱粉或褐藻酸;黏合劑,例如澱粉、明膠或阿拉伯膠;及潤滑劑,例如硬脂酸鎂、硬脂酸或滑石。錠劑可不包覆包衣或其可藉由已知之包衣技術包覆包衣以延遲在胃腸道中之崩解及吸收,且藉此提供所需時間段之持續治療作用。舉例而言,可採用時間延遲材料,諸如單硬脂酸甘油酯或二硬脂酸甘油酯。
用於經口使用之調配物亦可以硬明膠膠囊形式呈現,其中活性成分與惰性固體稀釋劑(例如碳酸鈣、磷酸鈣或高嶺土)混合;或以軟明膠膠囊形式呈現,其中活性成分與水或油狀介質(例如花生油、液體石蠟或橄欖油)混合。
針對水性懸浮液,本發明之化合物與適用於維持穩定懸浮液之賦形劑混合。此類賦形劑之實例包括(但不限於)羧甲基纖維素鈉、甲基纖維素、羥丙基甲基纖維素、海藻酸鈉、聚乙烯吡咯啶酮、黃蓍膠及阿拉伯膠。
口服懸浮液亦可含有分散劑或潤濕劑,諸如天然存在之磷脂,例如卵磷脂;或環氧烷與脂肪酸之縮合產物,例如聚氧乙烯硬脂酸酯;或環氧乙烷與長鏈脂族醇的縮合產物,例如十七伸乙基氧基十六醇;或環氧乙烷與衍生自脂肪酸及己醣醇之偏酯的縮合產物,諸如聚氧乙烯山梨糖醇單油酸酯;或環氧乙烷與衍生自脂肪酸及己醣醇酸酐之偏酯的縮合產物,例如聚乙烯脫水山梨糖醇單油酸酯。水性懸浮液亦可含有一或多種防腐劑,例如對羥基苯甲酸乙酯或對羥基苯甲酸正丙酯;一或多種著色劑;一或多種調味劑;及一或多種甜味劑,諸如蔗糖或糖精。
可藉由使本發明之化合物懸浮於植物油(例如花生油、橄欖油、芝麻油或椰子油)中或礦物油(諸如液體石蠟)中來調配油性懸浮液。油性懸浮液可含有增稠劑,例如蜂蠟、硬石蠟或鯨蠟醇。
可添加甜味劑(諸如上述之彼等甜味劑)及調味劑,以提供適口之口服製劑。此等組成物可藉由添加抗氧化劑諸如抗壞血酸來保存。
適用於藉由添加水製備水性懸浮液之可分散散劑及顆粒提供與分散或潤濕劑、懸浮劑及一或多種防腐劑摻合之本發明化合物。合適之分散劑或潤濕劑及懸浮劑由上文已提及之彼等例示。亦可存在其他賦形劑,例如甜味劑、調味劑以及著色劑。
本發明之醫藥組成物亦可呈水包油乳液形式。油相可為植物油,例如橄欖油或花生油;或礦物油,例如液體石蠟,或此等之混合物。適合之乳化劑可為天然產生之膠狀物,例如阿拉伯膠或黃蓍膠;天然產生之磷脂,例如大豆、卵磷脂;及衍生自脂肪酸及己醣醇,酸酐之酯或偏酯,例如脫水山梨糖醇單油酸酯;及該等偏酯與氧化乙烯之縮合反應產物,例如聚氧乙烯脫水山梨糖醇單油酸酯。乳液亦可含有甜味劑及調味劑。
糖漿及酏劑可利用例如丙三醇、丙二醇、山梨糖醇或蔗糖之甜味劑來調配。此類調配物亦可含有緩和劑、防腐劑、調味劑及著色劑。醫藥組成物可呈無菌可注射液、水性懸浮液或油性懸浮液形式。該懸浮液可根據已知技術使用上文已提及之合適的分散劑或潤濕劑及懸浮劑來調配。無菌可注射製劑亦可為於非經腸可接受之無毒稀釋劑或溶劑中的無菌可注射溶液或懸浮液,例如呈於1,3-丁二醇中之溶液的形式。在可接受之媒劑及溶劑中,可採用的有水、林格氏溶液(Ringer's solution)及等張氯化鈉溶液。此外,無菌不揮發性油習知地用作溶劑或懸浮介質。出於此目的,可採用任何溫和不揮發性油,包括合成單甘油酯或二甘油酯。此外,諸如油酸之脂肪酸可用於製備可注射劑。
通式I或式II之化合物亦可以用於經直腸投與藥物之栓劑形式投與。此等組成物可藉由將藥物與適合的無刺激性賦形劑混合來製備,該賦形劑在常溫下為固體但在直腸溫度下為液體且因而將在直腸中熔融以釋放藥物。此類物質為可可脂及聚乙二醇。
用於非經腸投與之組成物於無菌介質中投與。取決於所使用之媒劑及調配物中藥物之濃度濃度,非經腸調配物可為懸浮液或含有經溶解藥物的溶液。諸如局部麻醉劑、防腐劑及緩衝劑之佐劑亦可添加至非經腸組成物中。使用方法
MAT2A酶在細胞中催化自甲硫胺酸及ATP合成S-腺苷甲硫胺酸(SAM)。因此,在本發明之另一具體例中,提供一種抑制細胞中SAM合成之方法,其包含將有效量之式I或式II之化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物引入至細胞中。在本發明之其他具體例中,提供一種抑制細胞中SAM合成之方法,其包含將有效量之至少一種本文所述之化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物引入至細胞中。在一些具體例中,細胞處於個體中。在一些具體例中,式I或式II化合物用於鑑別例如在用於結合至MAT2A或用於抑制SAM產生的競爭檢定中作為MAT2A抑制劑之其他化合物。藉由具有可偵測標記之測試化合物與MAT2A結合或抑制SAM產生可在本發明之未標記化合物存在及不存在的情況下量測。
本發明亦提供一種用於治療罹患癌症個體之癌症的方法,該方法包含向個體投與有效量之如本文所述之MAT2A抑制劑化合物。在一些具體例中,MAT2A抑制劑為式I或式II之化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物。在一具體例中,視情況與任何其他具體例組合,個體為哺乳動物,諸如人類。
在一具體例中,癌症為MTAP缺失型癌症。在一些具體例中,癌症為選自由以下組成之群的癌症:間皮瘤、神經母細胞瘤、腸癌(諸如直腸癌、結腸癌、家族性腺瘤多發性息肉癌及遺傳性非多發性息肉結腸直腸癌)、食道癌、唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、髓質甲狀腺癌、乳頭狀甲狀腺癌、腎癌、腎實質癌、卵巢癌、子宮頸癌、子宮體癌、子宮內膜癌、絨毛膜癌、胰臟癌、前列腺癌、膀胱癌、睪丸癌、乳癌、泌尿癌、黑色素瘤、腦瘤、頭頸癌、淋巴瘤、急性淋巴性白血病(ALL)、慢性淋巴性白血病(CLL)、急性骨髓性白血病(AML)、慢性骨髓性白血病(CML)、肝細胞癌、膽囊癌、支氣管癌、小細胞肺癌(SCLC)、非小細胞肺癌(NSCLC)、多發性骨髓瘤(MM)、基底癌、畸胎瘤、視網膜母細胞瘤、脈絡膜黑色素瘤、精原細胞瘤、橫紋肌肉瘤、骨肉瘤、軟骨肉瘤、肌肉瘤、脂肉瘤、纖維肉瘤、尤文氏肉瘤(Ewing sarcoma)及漿細胞瘤。
在其他具體例中,癌症係選自肺癌、非小細胞肺癌、細支氣管肺泡細胞肺癌、骨癌、胰臟癌、皮膚癌、頭頸癌、皮膚或眼內黑色素瘤、子宮癌、卵巢癌、直腸癌、肛門區癌、胃癌(stomach cancer)、胃癌(gastric cancer)、結腸癌、乳癌、子宮癌、輸卵管癌、子宮內膜癌、子宮頸癌、陰道癌、外陰癌、何杰金氏病(Hodgkin’s Disease)、食道癌、小腸癌、內分泌系統癌、甲狀腺癌、副甲狀腺癌、腎上腺癌、軟組織肉瘤、尿道癌、陰莖癌、前列腺癌、膀胱癌、腎臟或尿管癌、腎細胞癌、腎盂癌、間皮瘤、肝細胞癌、膽道癌、慢性或急性白血病、淋巴球性淋巴瘤、中樞神經系統(CNS)腫瘤、脊軸腫瘤、腦幹神經膠質瘤、多形性膠質母細胞瘤、星形細胞瘤、神經鞘瘤、室管膜瘤、神經管胚細胞瘤、脊膜瘤、鱗狀細胞癌、垂體腺瘤,其包括以上癌中之任一者之耐藥及/或難治性形式或以上癌中的一或多者之組合。
在一些具體例中,癌症係選自由以下組成之群:B細胞急性淋巴球性白血病(B-ALL)、間皮瘤、淋巴瘤、胰臟癌、肺癌、胃癌、食道癌、膀胱癌、腦癌、頭頸癌、黑色素瘤及乳癌。
在其他具體例中,肺癌為非小細胞肺癌、小細胞肺癌、肺腺癌及肺鱗狀細胞癌。
在其他具體例中,乳癌為三陰性乳癌(TNBC)。
在其他具體例中,腦癌為選自由以下組成之群的腦瘤:神經膠質瘤、神經膠母細胞瘤、星形細胞瘤、脊膜瘤、神經管胚細胞瘤、周圍神經外胚瘤及顱咽管瘤。
在另其他具體例中,癌症為選自由以下組成之群的淋巴瘤:套細胞淋巴瘤、何杰金氏淋巴瘤、非何杰金氏淋巴瘤、伯基特淋巴瘤(Burkitt lymphoma)、彌漫性大B細胞淋巴瘤(DLBCL)及成人T細胞白血病/淋巴瘤(ATLL)。如本文中所用,表現成人T細胞白血病/淋巴瘤係指可在身體之血液(白血病)、淋巴結(淋巴瘤)、皮膚或多個區域中發現的罕見且通常侵略性之T細胞淋巴瘤。
如下文所大體描述,甲硫基腺苷磷酸化酶(MTAP)為在所有正常組織中發現之催化甲硫基腺苷(MTA)轉化成腺嘌呤及5-甲硫核糖-1-磷酸酯之酶。補救腺嘌呤以產生單磷酸腺苷,且將5-甲硫核糖-1-磷酸酯轉化成甲硫胺酸及甲酸酯。由於此補救途徑,所以MTA在例如用諸如L-丙胺菌素之抗代謝物阻斷新生嘌呤合成時可充當替代嘌呤源。許多人類及鼠類惡性細胞缺乏MTAP活性。不僅在組織培養細胞中發現MTAP缺乏症而且缺乏症亦存在於原發性白血病、神經膠質瘤、黑色素瘤、胰臟癌、非小細胞肺癌(NSCLC)、膀胱癌、星形細胞瘤、骨肉瘤、頭頸癌、黏液軟骨肉瘤、卵巢癌、子宮內膜癌、乳癌、軟組織肉瘤、非何杰金氏淋巴瘤及間皮瘤。舉例而言,MTAP缺失(亦即,MTAP缺失型)之癌細胞的增殖藉由用使用MAT2A之小分子抑制劑確認的shRNA阻斷MAT2A表現來抑制。K. Marjon 等人,Cell Reports
15 (2016) 574-587,其以引用之方式併入本文中。無MTAP或MTAP缺失型癌症為MTAP基因已缺失或損失或以其它方式去活化之癌症或MTAP蛋白具有降低或減弱之功能或存在減少的癌症。
因此,在本發明之一具體例中,提供一種治療個體之癌症的方法,其中癌症之特徵為與MTAP基因及/或蛋白存在且完全起作用的癌症相比或與帶有野生型MTAP基因之癌症相比,MTAP表現減少或不存在或MTAP基因不存在或MTAP蛋白之功能降低。該方法包含向個體投與治療有效量之式I或式II化合物或其醫藥學上可接受之鹽、立體異構體或互變異構體。
在另一具體例中,提供一種治療個體之MTAP缺失型癌症之方法,該方法包含向個體投與有效量之式I、式II化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物。在一具體例中,MTAP缺失型癌症係選自白血病、神經膠質瘤、黑色素瘤、胰臟癌、非小細胞肺癌(NSCLC)、膀胱癌、星形細胞瘤、骨肉瘤、頭頸癌、黏液軟骨肉瘤、卵巢癌、子宮內膜癌、乳癌、軟組織肉瘤、淋巴瘤及間皮瘤。
在一具體例中,MTAP缺失型癌症為胰臟癌。在另一具體例中,MTAP缺失型癌症係選自膀胱癌、黑色素瘤、腦癌、肺癌、胰臟癌、乳癌、肝癌、食道癌、胃癌、結腸癌、頭頸癌、腎癌、結腸癌、彌漫性大B細胞淋巴瘤(DLBCL)、急性淋巴母細胞白血病(ALL)、套細胞淋巴瘤(MCL)、多形性膠質母細胞瘤(GBM)及非小細胞肺癌(NSCLC)。
對MTAP零位細胞株之基因組分析顯示併入KRAS突變或p53突變之細胞株對MAT2A抑制敏感。因此,本發明之一具體例提供一種用於治療個體之癌症之方法,其中癌症之特徵為MTAP表現減少或不存在或MTAP基因不存在或MTAP蛋白之功能降低,該方法包含向個體投與治療有效量之式I或式II化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物,其中該癌症之進一步特徵為存在突變體KRAS或突變體p53。在一具體例中,提供一種治療個體之具有突變體KRAS或突變體p53之MTAP缺失癌症的方法,其包含向個體投與有效量之式I或式II之化合物或其醫藥學上可接受之鹽、立體異構體、互變異構體及/或同位素物。舉例而言,癌症為MTAP缺失且KRAS突變體、MTAP缺失且p53突變體或MTAP缺失、KRAS突變體及p53突變體中之每一者。
術語「突變體KRAS」或「KRAS突變」係指併入改變其正常功能之活化突變及編碼此蛋白質的基因之KRAS蛋白。例如,突變體KRAS蛋白可在位置12或13處併入單一胺基酸取代。在一特定具體例中,KRAS突變體併入G12X或G13X取代,其中X表示指定位置處之任何胺基酸變化。在一特定具體例中,取代為G12V、G12R、G12C或G13D。在另一具體例中,取代為G13D。藉由「突變體p53」或「p53突變」意謂併入抑制或消除其腫瘤抑制劑功能之突變的p53蛋白(或編碼該蛋白質之基因)。在一具體例中,該p53突變為Y126_splice、K132Q、M133K、R174fs、R175H、R196*、C238S、C242Y、G245S、R248W、R248Q、I255T、D259V、S261_splice、R267P、R273C、R282W、A159V或R280K。在一具體例中,前述癌症為非小細胞肺癌(NSCLC)、胰臟癌、頭頸癌、胃癌、乳癌、結腸癌或卵巢癌。
在另一具體例中,本文中所揭示之化合物適用作用於分解疾病相關之蛋白質的配位體。此方法之實例為PROTAC (蛋白分解靶向嵌合體(PROteolysis TArgeting Chimera))。PROTAC為包含選自本文中所揭示之能夠結合目標蛋白的化合物中之一者的配位體部分及藉由E3接合酶識別且聚泛素化的接合酶靶向部分,諸如肽部分(稱為降解決定子)兩者之雙功能分子。因此,PROTAC與目標蛋白非共價地結合,且經由降解決定子募集E3接合酶,此使得所結合目標聚泛素化且降解。大量公開案描述PROTAC在包括腫瘤學之各種治療領域中之臨床前使用。參見例如,Lu 等人Chemistry & Biology
22 (2015) 755-763。
態樣
態樣1. 一種根據式I之化合物:(I
)
其中
X1
為N或CR5
;
X2
為N或CR6
,其中X1
及X2
不同時為N;
L為O、S、NR或鍵;
R為H或C1
-C6
烷基;
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中
R1
中之任何烷基為直鏈或支鏈的,
R1
視情況經1至6個鹵基取代;及
當X1
為N,X2
為CR6
,L為NR或S,R為H且R1
為C1
-C6
烷基時,則R1
經1至6個鹵基取代;
或當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4個環成員獨立地選自N、O及S),其視情況經一或多個RA
取代;
R2
及R3
獨立地選自由以下組成之群:C6
-C10
芳基、C3
-C6
碳環基、5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S),
其中R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N- RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
及-CN;
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
;
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
;
R6
係選自由以下組成之群:H、C1
-C6
烷基(視情況經一或多個鹵基取代)、-O(C1
-C6
烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
;
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S);
其中RA
及RB
之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由組成之群的取代基取代:羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基、-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基),其中各烷基、烯基、芳基及雜環烷基視情況經一或多個選自由組成之群的取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基,
RC
及RD
各自獨立地選自H及C1
-C6
烷基;
或其醫藥學上可接受之鹽。
態樣2. 一種根據式II之化合物:(II
)
其中
X1
為N且X2
為CR6
,或X1
為CR5
且X2
為CR6
,X1
及X2
均為N,或X1
為CR5
且X2
為CR6
;
L為O、S、NR或鍵;
R為H或C1
-C6
烷基;
R1
係選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C3
-C6
碳環基、-(C1
-C6
烷基)(C3
-C6
碳環基)及-(C1
-C6
烷基)(C3
-C6
-環烯基),其中
R1
中之任何烷基為直鏈或支鏈的,
R1
視情況經1至6個鹵基取代;
或當L為NR時,則R及R1
可與L一起組合形成3員至6員雜環烷基(其中1至4個環成員獨立地選自N、O及S),其視情況經一或多個RA
取代;
R2
及R3
獨立地選自由以下組成之群:C6
-C10
芳基、C3
-C6
碳環基、5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S),
其中R2
及R3
獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA
、ORA
、鹵基、-N=N- RA
、-NRA
RB
、-(C1
-C6
烷基)NRA
RB
、-C(O)ORA
、-C(O)NRA
RB
、-OC(O)RA
及-CN;
R4
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、側氧基、-CN及-NRC
RD
;
R5
係選自由以下組成之群:H、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
-炔基、鹵基、-CN及-NRC
RD
;
R6
係選自由以下組成之群:H、C1
-C6
烷基(視情況經一或多個鹵基取代)、-O(C1
-C6
烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
;
RA
及RB
獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1
-C6
烷基、C1
-C6
烷氧基、C2
-C6
烯基、C2
-C6
炔基、-NH2
、-S(O)0-2
-(C1
-C6
烷基)、-S(O)0-2
-(C6
-C10
芳基)、-C(O)(C1
-C6
烷基)、-C(O)(C3
-C14
碳環基)、-C3
-C14
碳環基、-(C1
-C6
烷基)(C3
-C14
碳環基)、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S);
其中RA
及RB
之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由組成之群的取代基取代:羥基、鹵基、-NR’2
(其中各R’獨立地選自由以下組成之群:C1
-C6
烷基、C2
-C6
烯基、C2
-C6
炔基、C6
-C10
芳基、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)、-NHC(O)(OC1
-C6
烷基)、-NO2
、-CN、側氧基、-C(O)OH、-C(O)O(C1
-C6
烷基)、-C1
-C6
-烷基(C1
-C6
烷氧基)、-C(O)NH2
、C1
-C6
烷基、-C(O)C1
-C6
烷基、-OC1
-C6
烷基、-Si(C1
-C6
烷基)3
、-S(O)0-2
-(C1
-C6
烷基)、C6
-C10
芳基、-(C1
-C6
烷基)(C6
-C10
芳基)、3員至14員雜環烷基及-(C1
-C6
烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6
-C14
芳基),其中RA
及RB
中之各烷基、烯基、芳基及雜環烷基視情況經一或多個選自由以下組成之群的取代基取代:羥基、-OC1
-C6
烷基、鹵基、-NH2
、-(C1
-C6
烷基)NH2
、-C(O)OH、CN及側氧基,
RC
及RD
各自獨立地選自H及C1
-C6
烷基;
或其醫藥學上可接受之鹽。
態樣3. 如態樣1之化合物,其中X1
為N且X2
為CR6
。
態樣4. 如態樣1之化合物,其中X1
為CR5
且X2
為CR6
。
態樣5. 如態樣1之化合物,其中X1
為CR5
且X2
為N。
態樣6. 如態樣2之化合物,其中X1
為CR5
且X2
為CR6
。
態樣7. 如態樣2之化合物,其中X1
為N且X2
為CR6
。
態樣8. 如態樣2之化合物,其中X1
及X2
均為N。
態樣9. 如態樣2之化合物,其中X1
為CR5
且X2
為CR6
。
態樣10. 如態樣1至9中任一項之化合物,其中R4
及R5
(存在時)中之每一者獨立地選自H及C1
-C6
烷基,且R6
(存在時)係選自由以下組成之群:H、視情況經一或多個鹵基取代之C1
-C6
烷基、C1
-C6
烷氧基、-(C1
-C6
烷基)NRA
RB
及-NRA
RB
(其中RA
及RB
獨立地選自H及C1
-C6
烷基)。
態樣11. 如態樣1至9中任一項之化合物,其中R4
、R5
及R6
(存在時)中之至少一者為H。
態樣12. 如態樣1至11中任一項之化合物,其中R4
為H。
態樣13. 如態樣1至11中任一項之化合物,其中R5
為H。
態樣14. 如態樣1至11中任一項之化合物,其中R6
為H。
態樣15. 如態樣1至14中任一項之化合物,其中R4
、R5
及R6
(存在時)中之每一者為H。
態樣16. 如態樣1至15中任一項之化合物,其中R2
為C6
-C10
芳基或5員至10員雜芳基。
態樣17. 如態樣16之化合物,其中R2
為C6
-C10
芳基。
態樣18. 如態樣17之化合物,其中R2
為苯基。
態樣19. 如態樣16之化合物,其中R2
為5員至10員雜芳基,且其中1個環成員為N。
態樣20. 如態樣19之化合物,其中R2
為吡啶基。
態樣21. 如態樣1至20中任一項之化合物,其中R3
為3員至14員雜環烷基或5員至10員雜芳基。
態樣22. 如態樣21之化合物,其中R3
係選自由以下組成之群:苯并噻唑基、苯并異噻唑基、苯并㗁唑基、吡啶基、吡啶酮基、嗒𠯤基(pyradazinyl)、苯并咪唑基、苯并三唑基、吲唑基、喹㗁啉基、喹啉基、喹唑啉基、咪唑并吡啶基、吡唑并吡啶基、三唑并吡啶基、㖕啉基、異㗁唑基、吡唑基、苯并呋喃基、二氫苯并呋喃基、二氫苯并二氧雜環己烯基及四氫苯并二氧雜環己烯基。
態樣23. 如態樣1至20中任一項之化合物,其中R3
為C6
-C10
芳基。
態樣24. 如態樣23之化合物,其中R3
為苯基。
態樣25. 如態樣1至15中任一項之化合物,其中R2
為苯基且R3
為3員至14員雜環烷基或5員至10員雜芳基。
態樣26. 如態樣1至25中任一項之化合物,其中L為O或NR。
態樣27. 如態樣26之化合物,其中R1
為C1
-C6
烷基或C3
-C6
-碳環基。
態樣28. 如態樣26或27之化合物,其中R1
為視情況經1至3個F取代之C1
-C3
烷基。
態樣29. 如態樣1至9中任一項之化合物,其中
L為O或NR且R為H;
R1
為視情況經1至3個F取代之C1
-C3
烷基;
R2
為3員至14員雜環烷基或5員至10員雜芳基(其中1個雜環烷基或雜芳基成員為N)或C6
-C10
芳基;
R3
為3員至14員雜環烷基;5員至10員雜芳基,其中1至3個雜環烷基或雜芳基成員獨立地選自N、O及S;或C6
-C10
芳基;及
R4
、R5
及R6
(存在時)中之每一者為H。
態樣30. 如態樣29之化合物,其中L為NR。
態樣31. 如態樣29或30之化合物,其中
R2
為視情況經取代之苯基;及
R3
為視情況經取代之5員至10員雜芳基,其中1至3個雜芳基成員獨立地選自N、O及S。
態樣32. 如態樣29或30之化合物,其中
R2
為視情況經取代之5員至10員雜芳基,其中1至3個雜芳基成員獨立地選自N、O及S;及
R3
為視情況經取代之苯基。
態樣33. 如態樣31之化合物,其中R3
係選自由以下組成之群:視情況經取代之苯并噻唑基、苯并異噻唑基、苯并㗁唑基、吡啶基、吡啶酮基、嗒𠯤基、苯并咪唑基、苯并三唑基、吲唑基、喹㗁啉基、喹啉基、喹唑啉基、咪唑并吡啶基、吡唑并吡啶基、三唑并吡啶基、㖕啉基、異㗁唑基、吡唑基、苯并呋喃基、二氫苯并呋喃基、二氫苯并二氧雜環己烯基及四氫苯并二氧雜環己烯基。
態樣34. 如態樣29或30之化合物,其中R2
及R3
獨立地為視情況取代之苯基。
態樣35. 如態樣1之化合物,其中該化合物係選自下表:
| 101 | |||
| 102 | 195 | ||
| 103 | 196 | ||
| 104 | 197 | ||
| 105 | 198 | ||
| 106 | 199 | ||
| 107 | 200 | ||
| 108 | 201 | ||
| 109 | 202 | ||
| 110 | 203 | ||
| 111 | 204 | ||
| 112 | 205 | ||
| 113 | 206 | ||
| 114 | 207 | ||
| 115 | 208 | ||
| 116 | 209 | ||
| 117 | 210 | ||
| 118 | 211 | ||
| 119 | 212 | ||
| 120 | 213 | ||
| 121 | 214 | ||
| 122 | 215 | ||
| 123 | 216 | ||
| 124 | 217 | ||
| 125 | 218 | ||
| 126 | 219 | ||
| 127 | 220 | ||
| 128 | 221 | ||
| 129 | 222 | ||
| 130 | 223 | ||
| 131 | 224 | ||
| 132 | 225 | ||
| 133 | 226 | ||
| 135 | 227 | ||
| 136 | 228 | ||
| 137 | 229 | ||
| 138 | 230 | ||
| 139 | 231 | ||
| 140 | 232 | ||
| 141 | 233 | ||
| 142 | 234 | ||
| 143 | 235 | ||
| 144 | 236 | ||
| 145 | 237 | ||
| 146 | 238 | ||
| 147 | 239 | ||
| 148 | 240 | ||
| 149 | 241 | ||
| 150 | 242 | ||
| 151 | 243 | ||
| 152 | 244 | ||
| 153 | 245 | ||
| 154 | 246 | ||
| 155 | 247 | ||
| 157 | 248 | ||
| 158 | 249 | ||
| 159 | 250 | ||
| 160 | 251 | ||
| 161 | 252 | ||
| 162 | 253 | ||
| 163 | 254 | ||
| 164 | 255 | ||
| 165 | 256 | ||
| 166 | 257 | ||
| 167 | 258 | ||
| 168 | 259 | ||
| 169 | 260 | ||
| 170 | 261 | ||
| 171 | 262 | ||
| 172 | 263 | ||
| 173 | 264 | ||
| 174 | 265 | ||
| 175 | 266 | ||
| 176 | 267 | ||
| 177 | 269 | ||
| 178 | 270 | ||
| 179 | 271 | ||
| 180 | 272 | ||
| 181 | 273 | ||
| 182 | 274 | ||
| 183 | 275 | ||
| 184 | 276 | ||
| 185 | 277 | ||
| 186 | 278 | ||
| 187 | 279 | ||
| 188 | 280 | ||
| 189 | 281 | ||
| 190 | 282 | ||
| 191 | 283 | a | |
| 192 | 286 | ||
| 193 | 294 | ||
| 194 | 295 |
態樣37. 一種醫藥組成物,其包含治療有效量之如態樣1至36中任一項之化合物或其醫藥學上可接受之鹽及醫藥學上可接受之載劑。
態樣38. 一種用於治療罹患癌症個體之癌症的方法,其包含向個體投與有效量之如態樣1至36中任一項之MAT2A抑制劑化合物或其醫藥學上可接受之鹽。
態樣39. 如態樣38之方法,其中該癌症為MTAP缺失型癌症。
態樣40. 一種用於抑制細胞中S-腺苷甲硫胺酸(SAM)合成之方法,其包含將有效量之如態樣1至36中任一項之化合物或其醫藥學上可接受之鹽引入至細胞中。
態樣41. 如態樣40之方法,其中細胞處於個體中。
態樣42. 一種用於抑制個體中之S-腺苷甲硫胺酸(SAM)合成之方法,其包含向個體投與有效量之至少一種如態樣1至36中任一項之化合物或其鹽。
態樣43. 一種用於治療罹患癌症個體之癌症的方法,其包含向個體投與有效量之如態樣1至36中任一項之化合物。
態樣44. 如態樣43之方法,其中該癌症為MTAP缺失型癌症。
態樣45. 如態樣38、39、43或44之方法,其中該癌症係選自由以下組成之群:間皮瘤、神經母細胞瘤、直腸癌、結腸癌、家族性腺瘤多發性息肉癌及遺傳性非多發性息肉結腸直腸癌、食道癌、唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、髓質甲狀腺癌、乳頭狀甲狀腺癌、腎癌、腎實質癌、卵巢癌、子宮頸癌、子宮體癌、子宮內膜癌、絨毛膜癌、胰臟癌、前列腺癌、膀胱癌、睾丸癌、乳癌、泌尿癌、黑色素瘤、腦瘤、淋巴瘤、頭頸癌、急性淋巴性白血病(ALL)、慢性淋巴性白血病(CLL)、急性骨髓性白血病(AML)、慢性骨髓性白血病(CML)、肝細胞癌、膽囊癌、支氣管癌、小細胞肺癌、非小細胞肺癌、多發性骨髓瘤、基底癌、畸胎瘤、視網膜母細胞瘤、脈絡膜黑色素瘤、精原細胞瘤、橫紋肌肉瘤、骨肉瘤、軟骨肉瘤、肌肉瘤、脂肉瘤、纖維肉瘤、尤文氏肉瘤及漿細胞瘤。
態樣46. 如態樣43或44之方法,其中該癌症係選自由以下組成之群:B細胞急性淋巴球性白血病(B-ALL)、間皮瘤、淋巴瘤、胰臟癌、肺癌、胃癌、食道癌、膀胱癌、腦癌、頭頸癌、黑色素瘤及乳癌。
態樣47. 如態樣46之方法,其中該癌症為肺癌,其係選自由以下組成之群:非小細胞肺癌、小細胞肺癌、肺腺癌及肺鱗狀細胞癌。
態樣48. 如態樣46之方法,其中該癌症為選自由以下組成之群的腦瘤:神經膠質瘤、神經膠母細胞瘤、星形細胞瘤、脊膜瘤、神經管胚細胞瘤、周圍神經外胚瘤及顱咽管瘤。
態樣49. 如態樣46之方法,其中該癌症為三陰性乳癌(TNBC)。
態樣50. 如態樣46之方法,其中該癌症為選自由以下組成之群的淋巴瘤:套細胞淋巴瘤、何杰金氏淋巴瘤、非何杰金氏淋巴瘤、伯基特淋巴瘤、彌漫性大B細胞淋巴瘤及成人T細胞白血病/淋巴瘤。
態樣51. 一種用於治療罹患癌症個體之癌症的方法,其中該癌症特徵為與其中存在甲硫基腺苷磷酸化酶 (MTAP)基因或蛋白及/或其充分起作用之癌症相比,MTAP基因表現減少或不存在、不存在該MTAP基因或MTAP蛋白功能降低,該方法包含向該個體投與治療有效量之如態樣1至36中任一項之化合物或其醫藥學上可接受之鹽。
態樣52. 如態樣1至36中任一項之化合物或其醫藥學上可接受之鹽,其用於抑制S-腺苷甲硫胺酸(SAM)合成。
態樣53. 如態樣1至36中任一項之化合物或其醫藥學上可接受之鹽,其用於治療罹患癌症個體之癌症。
態樣54. 如態樣53之化合物,其中該癌症為MTAP缺失型癌症。
態樣55. 如態樣53或54之化合物,其中該癌症係選自由以下組成之群:間皮瘤、神經母細胞瘤、直腸癌、結腸癌、家族性腺瘤多發性息肉癌及遺傳性非多發性息肉結腸直腸癌、食道癌、唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、髓質甲狀腺癌、乳頭狀甲狀腺癌、腎癌、腎實質癌、卵巢癌、子宮頸癌、子宮體癌、子宮內膜癌、絨毛膜癌、胰臟癌、前列腺癌、膀胱癌、睾丸癌、乳癌、泌尿癌、黑色素瘤、腦瘤、淋巴瘤、頭頸癌、急性淋巴性白血病(ALL)、慢性淋巴性白血病(CLL)、急性骨髓性白血病(AML)、慢性骨髓性白血病(CML)、肝細胞癌、膽囊癌、支氣管癌、小細胞肺癌、非小細胞肺癌、多發性骨髓瘤、基底癌、畸胎瘤、視網膜母細胞瘤、脈絡膜黑色素瘤、精原細胞瘤、橫紋肌肉瘤、骨肉瘤、軟骨肉瘤、肌肉瘤、脂肉瘤、纖維肉瘤、尤文氏肉瘤及漿細胞瘤。
態樣56. 如態樣53或54之化合物,其中該癌症係選自由以下組成之群:B細胞急性淋巴球性白血病(B-ALL)、間皮瘤、淋巴瘤、胰臟癌、肺癌、胃癌、食道癌、膀胱癌、腦癌、頭頸癌、黑色素瘤及乳癌。
態樣57. 如態樣56之化合物,其中該癌症為肺癌,其係選自由以下組成之群:非小細胞肺癌、小細胞肺癌、肺腺癌及肺鱗狀細胞癌。
態樣58. 如態樣56之化合物,其中該癌症為三陰性乳癌(TNBC)。
態樣59. 如態樣56之化合物,其中該癌症為選自由以下組成之群的腦瘤:神經膠質瘤、神經膠母細胞瘤、星形細胞瘤、脊膜瘤、神經管胚細胞瘤、周圍神經外胚瘤及顱咽管瘤。
態樣60. 如態樣56之化合物,其中該癌症為選自由以下組成之群的淋巴瘤:套細胞淋巴瘤、何杰金氏淋巴瘤、非何杰金氏淋巴瘤、伯基特淋巴瘤、彌漫性大B細胞淋巴瘤(DLBCL)及成人T細胞白血病/淋巴瘤。實施例
將參考以下實施例更充分地理解本發明。然而,該等實施例不應視為限制本發明之範疇。
單位及術語列表:
| anhy. | 無水 |
| aq. | 水溶液 |
| min | 分鐘 |
| mL | 毫升 |
| mmol | 微莫耳 |
| mol | 莫耳 |
| MS | 質譜法 |
| NMR | 核磁共振 |
| TLC | 薄層層析 |
| HPLC | 高效液相層析 |
| RT (r.t.) | 室溫 |
NMR光譜
| Hz | 赫茲 |
| δ | 化學位移 |
| J | 耦合常數 |
| s | 單峰 |
| d | 二重峰 |
| t | 三重峰 |
| q | 四重峰 |
| m | 多重峰 |
| br | 寬峰 |
| qd | 四重二重峰 |
| dquin | 雙重五重峰 |
| dd | 雙重二重峰 |
| dt | 雙三重峰 |
溶劑及試劑:
| CHCl3 | 氯仿 |
| DCM | 二氯甲烷 |
| DMF | 二甲基甲醯胺 |
| Et2 O | 乙醚 |
| EtOH | 乙醇 |
| EtOAc | 乙酸乙酯 |
| EA | 乙酸乙酯 |
| MeOH | 甲醇 |
| MeCN | 乙腈 |
| PE | 石油醚 |
| THF | 四氫呋喃 |
| AcOH | 乙酸 |
| HCl | 鹽酸 |
| H2 SO4 | 硫酸 |
| NH4 Cl | 氯化銨 |
| KOH | 氫氧化鉀 |
| NaOH | 氫氧化鈉 |
| K2 CO3 | 碳酸鉀 |
| Na2 CO3 | 碳酸鈉 |
| TFA | 三氟乙酸 |
| Na2 SO4 | 硫酸鈉 |
| NaBH4 | 硼氫化鈉 |
| NaHCO3 | 碳酸氫鈉 |
| LiHMDS | 六甲基二矽烷基胺基鋰 |
| NaHMDS | 六甲基二矽烷基胺基鈉 |
| LAH | 氫化鋁鋰 |
| NaBH4 | 硼氫化鈉 |
| LDA | 二異丙胺基鋰 |
| Et3 N | 三乙胺 |
| DMAP | 4-(二甲胺基)吡啶 |
| DIPEA | N,N -二異丙基乙胺 |
| NH4 OH | 氫氧化銨 |
| EDCI | 1-乙基-3-(3-二甲胺基丙基)碳二亞胺 |
| HOBt | 1-羥基苯并三唑 |
| HATU | O -(7-氮雜苯并三唑-1-基)-N,N,N',N' -四-甲基脲 |
| Xphos | 2-二環己基膦基-2′,4′,6′-三異丙基聯苯 |
| BINAP | 2,2’-雙(二苯基磷烷基)-1,1’-聯萘 |
通用實驗
在以下實施例中,試劑及溶劑購自商業來源(諸如Alfa、Acros、Sigma Aldrich、TCI及Shanghai Chemical Reagent Company),且除非另外說明,否則未經進一步純化即使用。急驟層析在Ez Purifier III上使用具有200至300目矽膠粒子之管柱進行。分析型及製備型薄層層析(TLC)盤為HSGF 254 (0.15至0.2 mm厚,Shanghai Anbang Company, China)。核磁共振(NMR)光譜在Brucker AMX-400 NMR (Brucker,Switzerland)上獲得。化學位移以距四甲基矽烷之低場區的百萬分率(ppm,δ)為單位來報導。質譜用來自Waters LCT TOF Mass Spectrometer (Waters,USA)之電噴霧電離(ESI)得出。在Agilent 1200液相層析(Agilent, USA,管柱:Ultimate 4.6 mm × 50 mm,5 µm,移動相A:含於水中之0.1%甲酸;移動相B:乙腈)上記錄HPLC層析。在Initiator 2.5微波合成儀(Biotage, Sweden)上進行微波反應。
經由描繪為通用程序I之流程獲得結構1.6
之化合物。以腈1.1
開始,使用鹼介導之芳族取代將所需R1
基團引入結構1.2
中。隨後使用銅介導之N-C交叉偶合反應將所需R2
基團引入結構1.3
中。隨後在氫化條件下還原腈1.3
,得到二胺1.4
。使用CDI將二胺1.4
轉化為環脲1.5
。最後,使用銅介導之N-C交叉偶合引入所需R3
基團,得到結構1.6
之化合物。
步驟 A :
2-胺基-6-乙氧基菸鹼腈
向2-胺基-6-氯菸鹼腈(5.0 g,32.6 mmol,1.0當量)於EtOH (30 mL)中之溶液中逐份添加EtONa (6.7 g,97.8 mmol,3.0當量),隨後將反應混合物在室溫下攪拌30分鐘。藉由LC-MS (ESI)監測反應進程,完成後,用冰水(50 mL)淬滅反應,過濾所得沈澱物,收集濾餅且減壓乾燥,得到呈黃色固體狀之2-胺基-6-乙氧基菸鹼腈(3.9 g,73%產率)。LC-MS (ESI) :m/z
252 [M+H]+
。
步驟 B :
2-((4-(二氟甲氧基)苯基)胺基)-6-乙氧基菸鹼腈
將2-胺基-6-乙氧基菸鹼腈(3.9 g,23.9 mmol,1.0當量)、CuI (4.4 g,23.9 mmol,1.0當量)、CsF (10.7 g,71.7 mmol,3.0當量)、1-溴-4-(二氟甲氧基)苯(7.8 g,35.1 mmol,1.5當量)及N1
,N2
-二甲基環己烷-1,2-二胺(6.8 g,47.8 mmol,2.0當量)於MeCN (50 ml)中之混合物在100 ℃在N2
氛圍下攪拌15小時。用H2
O (100 ml)稀釋反應混合物,用EtOAc (100 mL × 3)萃取,用鹽水(50 ml)洗滌合併之有機層,經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之2-((4-(二氟甲氧基)苯基)胺基)-6-乙氧基菸鹼腈(3.7 g,51%產率)。LC-MS (ESI):m/z
306 [M+H]+
。
步驟 C :
2-((4-(二氟甲氧基)苯基)胺基)-6-乙氧基菸鹼腈
向2-((4-(二氟甲氧基)苯基)胺基)-6-乙氧基菸鹼腈(1.0 g,3.2 mmol,1.0當量)於MeOH (40 mL)中之溶液中添加雷尼鎳(300 mg)及濃 NH4
OH (4 mL),將反應混合物在H2
氣囊(1atm)下在室溫下攪拌15小時。藉由LC-MS監測反應進程,完成後,經由短Celite®
墊過濾催化劑,減壓濃縮濾液,得到呈淡黃色油狀之粗3-(胺甲基)-N-(4-(二氟甲氧基)苯基)-6-乙氧基吡啶-2-胺(1.0 g),其不經進一步純化即用於下一步驟。LC-MS (ESI):m/z
310 [M+H]+
。
步驟 D :
1-(4-(二氟甲氧基)苯基)-7-乙氧基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向3-(胺甲基)-N-(4-(二氟甲氧基)苯基)-6-乙氧基吡啶-2-胺(1.0 g,3.2 mmol,1.0當量)於無水 DMF (20 mL)中之溶液中一次性添加CDI (1.1 g,6.4 mmol,2.0當量)及t-BuOK (1.45 g,12.8 mmol,4.0當量),將所得混合物在60℃下在N2
氛圍下攪拌4小時。藉由LC-MS監測反應進程,完成後,用冰水(50 mL)淬滅反應,用DCM(40 mL × 3)萃取,經Na2
SO4
乾燥合併之有機層,減壓濃縮,,且藉由急驟矽膠管柱層析純化,得到呈白色固體狀之1-(4-(二氟甲氧基)苯基)-7-乙氧基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(0.9 g,83%產率)。LC-MS (ESI):m/z
336 [M+H]+
。
步驟 E :
1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(咪唑并[1,2-a]吡啶-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將1-(4-(二氟甲氧基)苯基)-7-乙氧基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(50 mg,0.15 mmol,1.0當量)、6-溴咪唑并[1,2-a]吡啶(44 mg,0.22 mmol,1.5當量)、CsF (45 mg,0.3 mmol,2.0當量)、CuI (28 mg,0.15 mmol,1.0當量)及N1
,N2
-二甲基環己烷-1,2-二胺(42 mg,0.3 mmol,2.0當量)於MeCN (3 mL)中之混合物在60℃下在N2
氛圍下攪拌15小時。用EtOAc (40 mL)稀釋反應混合物,用H2
O (2 × 10 mL)洗滌,經Na2
SO4
乾燥,減壓濃縮,且藉由RP-製備型HPLC純化,得到1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(咪唑并[1,2-a]吡啶-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 101
)。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 8.75 (s, 1H), 7.96 (s, 1H), 7.72-7.50 (m, 3H), 7.46-7.33 (m, 3H), 7.30 (t,J HF
= 76 Hz, 1H), 7.28-7.13 (m, 2H), 6.44 (d,J
= 8.0 Hz, 1H), 4.92 (s, 2H), 3.86 (q,J
= 8.0 Hz, 2H), 1.05 (t,J
= 8.0 Hz, 3H)。
LC-MS (ESI)
:m/z
452 [M+H]+
。
上文關於通用程序 I
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
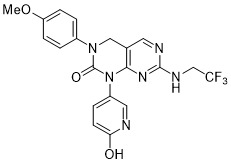
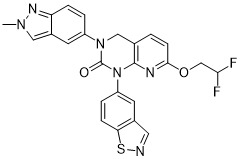
通用程序II:
| 化合物編號 | 結構 | 特徵 |
| 實施例102 | 3-(苯并[d]噻唑-6-基)-7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 472.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.39 (s, 1H), 8.24 (d, J = 2.4 Hz, 1H), 8.10 (d, J = 8.8 Hz, 1H), 7.67 (d, J = 8.0 Hz, 1H), 7.63 (dd, J = 8.8 Hz, 2.4 Hz, 1H), 7.28 (d, J = 8.8 Hz, 2H), 7.00 (d, J = 8.8 Hz, 2H), 6.55 (d, J = 8.4 Hz, 1H), 6.02 (tt, JHF = 55.6 Hz, J = 4.0 Hz, 1H), 5.00 (s, 2H), 4.07 (td, JHF = 14.8 Hz, J = 4.0 Hz, 2H). |
| 實施例103 | 7-(2,2-二氟乙氧基)-3-(3-(甲氧基-d3)-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 502.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.81 (d, J = 1.4 Hz, 1H), 7.66 (d, J = 8.1 Hz, 1H), 7.37 (d, J = 9.2 Hz, 1H), 7.25 (d, J = 8.8 Hz, 2H), 7.18 (dd, J = 9.2 Hz, 1.9 Hz, 1H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 55.4 Hz, J = 4.0 Hz, 1H), 4.93 (s, 2H), 4.08 (td, JHF = 14.5 Hz, J = 4.0 Hz, 2H), 3.87 (s, 3H). |
| 實施例104 | 7-(2,2-二氟乙氧基)-3-(3-甲氧基-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 499.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.81 (d, J = 1.3 Hz, 1H), 7.66 (d, J = 8.1 Hz, 1H), 7.37 (d, J = 9.3 Hz, 1H), 7.25 (d, J = 8.9 Hz, 2H), 7.18 (dd, J = 9.3 Hz, 1.9 Hz, 1H), 6.99 (d, J = 8.9 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 55.4 Hz, J = 3.8 Hz, 1H), 4.92 (s, 2H), 4.28 (s, 3H), 4.07 (td, JHF = 14.4 Hz, J = 3.9 Hz, 2H), 3.87 (s, 3H). |
| 實施例105 | 7-(2,2-二氟乙氧基)-3-(2,3-二甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 483.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.67 (s, 1H), 7.65 (s, 1H), 7.48 (d, J = 9.1 Hz, 1H), 7.29-7.19 (m, 3H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 55.5 Hz, J = 3.9 Hz, 1H), 4.92 (s, 2H), 4.07 (td, JHF = 14.5 Hz, J = 3.9 Hz, 2H), 4.05 (s, 3H), 2.60 (s, 3H). |
| 實施例106 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(吡唑并[1,5-a]吡啶-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 452.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.62 (d, J =7.6 Hz, 1H), 7.98 (d, J = 2.0 Hz, 1H), 7.66 (d, J = 2.4 Hz, 1H), 7.63 (d, J = 8.0 Hz, 1H), 7.43 (d, J = 8.8 Hz, 2H), 7.31 (t, JHF = 74.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 2H), 7.02 (dd, J = 7.2 Hz, 2.4 Hz, 1H), 6.59 (d, J = 2.0 Hz, 1H), 6.45 (d, J = 8.0 Hz, 1H), 4.98 (s, 2H), 3.86 (q, J = 7.2 Hz, 2H), 1.06 (t, J = 7.2 Hz, 3H). |
| 實施例107 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(1-甲基-6-側氧基-1,6-二氫吡啶-3-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 443.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.91 (s, 1H), 7.56 (t, J = 8.0 Hz, 2H), 7.30 (t, JHF = 74.4 Hz, 1H), 7.36-7.23 (m, 4H), 6.41 (t, J = 8.0 Hz, 2H), 4.77 (s, 2H), 3.85 (q, J = 6.4 Hz, 2H), 3.43 (s, 3H), 1.04 (t, J = 6.4 Hz, 3H). |
| 實施例108 | 3-([1,2,4]三唑[4,3-a]吡啶-6-基)-1-(4-(二氟甲氧基)苯基)-7-乙氧基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 453.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.27 (s, 1H), 8.76 (s, 1H), 7.79 (d, J = 8.8 Hz, 1H), 7.61 (d, J = 8.0 Hz, 1H), 7.54 (d, J = 9.6 Hz, 1H), 7.42 (d, J = 8.8 Hz, 2H), 7.30 (t, JHF = 74.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 2H), 6.46 (d, J = 8.0 Hz, 1H), 4.94 (s, 2H), 3.87 (q, J = 7.2 Hz, 2H), 1.05 (t, J = 7.2 Hz, 3H). |
| 實施例109 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(吡唑并[1,5-a]吡啶-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 467.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.02 (d, J = 9.2 Hz, 1H), 7.93 (d, J = 1.6 Hz, 1H), 7.63 (d, J = 8.4 Hz, 1H), 7.50 (d, J = 8.0 Hz, 1H), 7.42 (d, J = 8.8 Hz, 2H), 7.31 (t, JHF = 74.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 2H), 6.45 (d, J = 8.0 Hz, 1H), 5.01 (s, 2H), 4.30 (s, 3H), 3.87 (q, J = 7.2 Hz, 2H), 1.06 (t, J = 7.2 Hz, 3H). |
| 實施例110 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲基-2H-苯并[d][1,2,3]三唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 467.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.92 (s, 1H), 7.88 (d, J = 9.2 Hz, 1H), 7.62 (d, J = 8.0 Hz, 1H), 7.52 (d, J = 8.8 Hz, 1H), 7.42 (d, J = 8.4 Hz, 2H), 7.31 (t, JHF = 74.0 Hz, 1H), 7.25 (d, J = 8.4 Hz, 2H), 6.43 (d, J = 8.0 Hz, 1H), 5.00 (s, 2H), 4.50 (s, 3H), 3.86 (q, J = 7.2 Hz, 2H), 1.06 (t, J = 7.2 Hz, 3H). |
| 實施例111 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲氧基吡啶-4-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 443.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.10 (d, J = 5.6 Hz, 1H), 7.63 (d, J = 8.0 Hz, 1H), 7.43 (d, J = 8.8 Hz, 2H), 7.32 (t, JHF = 74.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 2H), 7.12 (d, J = 5.6 Hz, 1H), 6.83 (d, J = 1.6 Hz, 1H), 6.45 (d, J = 8.0 Hz, 1H), 4.95 (s, 2H), 3.86 (q, J = 7.2 Hz, 2H), 3.85 (s, 3H), 1.05 (t, J = 7.2 Hz, 3H). |
| 實施例112 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(喹啉-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 463.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.89 (d, J = 2.4 Hz, 1H), 8.37 (d, J = 8.0 Hz, 1H), 8.02 (s, 1H), 8.00 (s, 1H), 7.88 (dd, J = 9.2 Hz, 2.4 Hz, 1H), 7.65 (d, J = 8.0 Hz, 1H), 7.56 (dd, J = 8.4 Hz, 4.0 Hz, 1H), 7.45 (d, J = 8.8 Hz, 2H), 7.31 (t, JHF = 74.0 Hz, 1H), 7.27 (d, J = 8.8 Hz, 2H), 6.46 (d, J = 8.0 Hz, 1H), 5.07 (s, 2H), 3.88 (q, J = 7.2 Hz, 2H), 1.07 (t, J = 7.2 Hz, 3H). |
| 實施例113 | 1-(4-(1H-1,2,4-三唑-5-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 (經由通用程序 IV (步驟 F )使用3-(4-溴苯基)-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑(Ref:WO2008156726 A1)合成且用TFA脫保護) | LC-MS (ESI): m/z 496.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 14.34 (s, 1H), 8.43 (s, 1H), 8.05 (d, J = 8.4 Hz, 2H), 7.38-7.33 (m, 5H), 7.07 (t, J = 6.8 Hz, 1H), 6.96 (d, J = 8.8 Hz, 2H), 6.25 (d, J = 8.0 Hz, 1H), 4.76 (s, 2H), 3.77 (s, 3H), 3.73-3.62 (m, 2H). |
| 實施例114 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 (經由通用程序 IV (步驟 F )使用3-(4-溴苯基)-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑(Ref:WO2008156726 A1)合成且用TFA脫保護) | LC-MS (ESI): m/z 520.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 14.43 (s, 1H), 8.72-8.23 (m, 3H), 8.06 (d, J = 8.0 Hz, 2H), 7.70 (s, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.40 (d, J = 8.0 Hz, 2H), 7.29 (d, J = 8.8 Hz, 1H), 7.09 (s, 1H), 6.26 (d, J = 8.0 Hz, 1H), 4.85 (s, 2H), 4.17 (s, 3H), 3.75-3.66 (m, 2H). |
| 實施例115 | 3-(2-環丙基-2H-吲唑-5-基)-7-(2,2-二氟乙氧基)-1-(4-甲氧基-d3-苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 495.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.47 (s, 1H), 7.68-7.63 (m, 2H), 7.55 (d, J = 9.2 Hz, 1H), 7.28-7.23 (m, 3H), 6.99 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.01 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 4.92 (s, 2H), 4.15 (hept, J = 4.0 Hz, 1H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 1.31-1.24 (m, 2H), 1.15-1.05 (m, 2H). |
| 實施例116 | 4-(7-乙氧基-1-(4-甲氧基苯基)-2-側氧基-1,2-二氫吡啶并[2,3-d]嘧啶-3(4H)-基)苯甲腈 | LC-MS: m/z 401.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.86 (d, J = 8.8 Hz, 2H), 7.64-7.58 (m, 3H), 7.26 (d, J = 8.8 Hz, 2H), 6.99 (d, J = 9.2 Hz, 2H), 6.43 (d, J = 8.0 Hz, 1H), 4.95 (s, 2H), 3.87 (q, J = 7.2 Hz, 2H), 3.80 (s, 3H), 1.06 (t, J = 7.2 Hz, 3H). |
| 實施例117 | 乙氧基-3-(4-氟苯基)-1-(4-甲氧基苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 394.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.57 (d, J = 8.4 Hz, 1H), 7.49-7.42 (m, 2H), 7.27-7.19 (m, 4H), 6.98 (d, J = 8.8 Hz, 2H), 6.40 (d, J = 8.4 Hz, 1H), 4.85 (s, 2H), 3.86 (q, J = 7.2 Hz, 2H), 3.79 (s, 3H), 1.06 (t, J = 7.2 Hz, 3H). |
| 實施例118 | 7-(2,2-二氟乙氧基)-3-(2-異丙基-2H-吲唑-5-基)-1-(4-甲氧基-d3-苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 497.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.41 (s, 1H), 7.68 (d, J = 1.6 Hz, 1H), 7.65 (d, J = 8.4 Hz, 1H), 7.60 (d, J = 8.8 Hz, 1H), 7.28-7.24 (m, 3H), 6.99 (d, J = 8.8 Hz, 2H), 6.52 (d, J = 8.0 Hz, 1H), 6.01 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.92 (s, 2H), 4.82 (hept, J = 6.8 Hz, 1H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 1.55 (d, J = 6.8 Hz, 6H). |
| 實施例119 | 7-(2,2-二氟乙氧基)-3-(2-(2,2-二氟乙基)-2H-吲唑-5-基)-1-(4-甲氧基-d3-苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 519.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.46 (s, 1H), 7.74 (d, J = 1.2 Hz, 1H), 7.66 (d, J = 8.4 Hz, 1H), 7.62 (d, J = 9.2 Hz, 1H), 7.32 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 2H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.51 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 6.01 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.97 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 4.94 (s, 2H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例120 | 7-(2,2-二氟乙氧基)-1-(4-甲氧基-d3-苯基)-3-(2-(2,2,2-三氟乙基)-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 537.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.52 (s, 1H), 7.76 (s, 1H), 7.68-7.61 (m, 2H), 7.36 (d, J = 8.8 Hz, 1H), 7.27 (d, J = 8.8 Hz, 2H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.01 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 5.50 (q, J = 4.8 Hz, 2H), 4.94 (s, 2H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例121 | 乙氧基-1-(4-甲氧基苯基)-3-(4-(甲胺基)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 405.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.54 (d, J = 6.8 Hz, 1H), 7.18 (d, J = 7.6 Hz, 2H), 7.09 (d, J = 7.2 Hz, 2H), 6.96 (d, J = 6.8 Hz, 2H), 6.53 (d, J = 6.8 Hz, 2H), 6.36 (d, J = 7.6 Hz, 1H), 5.66 (s, 1H), 4.74 (s, 2H), 3.84 (q, J = 6.4 Hz, 2H), 3.78 (s, 3H), 2.67 (s, 3H), 1.06 (t, J = 6.4 Hz, 3H). |
| 實施例122 | 乙氧基-1-(4-甲氧基苯基)-3-(4-甲基-3,4-二氫-2H-苯并[b][1,4]㗁𠯤-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 447.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.54 (d, J = 8.4 Hz, 1H), 7.19 (d, J = 9.2 Hz, 2H), 6.97 (d, J = 9.2 Hz, 2H), 6.71 (d, J = 2.0 Hz, 1H), 6.66 (d, J = 8.0 Hz, 1H), 6.57 (dd, J = 8.4 Hz, 2.4 Hz, 1H), 6.37 (d, J = 8.0 Hz, 1H), 4.77 (s, 2H), 4.22 (t, J = 4.4 Hz, 2H), 3.85 (q, J = 6.8 Hz, 2H), 3.78 (s, 3H), 3.23 (t, J = 4.4 Hz, 2H), 2.82 (s, 3H), 1.06 (t, J = 6.4 Hz, 3H). |
| 實施例123 | 7-(2,2-二氟乙氧基)-1-(4-甲氧基-d3-苯基)-3-(2-丙基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 497.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.38 (s, 1H), 7.69 (s, 1H), 7.65 (d, J = 8.4 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.29-7.22 (m, 3H), 6.99 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.93 (s, 2H), 4.38 (t, J = 6.8 Hz, 2H), 4.07 (td, JHF = 14.4 Hz, 3.6 Hz, 2H), 2.01-1.86 (m, 2H), 0.86 (t, J = 7.2 Hz, 3H). |
| 實施例124 | 7-(2,2-二氟乙氧基)-3-(2-乙基-2H-吲唑-5-基)-1-(4-甲氧基-d3-苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 483.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.39 (s, 1H), 7.69 (d, J = 1.2 Hz, 1H), 7.66 (d, J = 8.0 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.29-7.23 (m, 3H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.4 Hz, 1H), 6.02 (tt, JHF = 56.0 Hz, 4.0 Hz, 1H), 4.93 (s, 2H), 4.45 (t, J = 7.2 Hz, 2H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 1.51 (t, J = 7.2 Hz, 3H). |
| 實施例125 | 7-(2,2-二氟乙氧基)-3-(2-(2-甲氧乙基)-2H-吲唑-5-基)-1-(4-甲氧基-d3-苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 512.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.37 (s, 1H), 7.70 (d, J = 1.6 Hz, 1H), 7.66 (d, J = 8.0 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.30-7.22 (m, 3H), 7.00 (d, J = 9.2 Hz, 2H), 6.53 (d, J = 8.4 Hz, 1H), 6.02 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.93 (s, 2H), 4.58 (t, J = 5.6 Hz, 2H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 3.82 (t, J = 5.6 Hz, 2H), 3.23 (s, 3H). |
| 實施例126 | 4-(7-乙氧基-1-(4-甲氧基苯基)-2-側氧基-1,2-二氫吡啶并[2,3-d]嘧啶-3(4H)-基)-N-甲基苯甲醯胺 | LC-MS: m/z 433.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.43 (q, J = 4.8 Hz, 1H), 7.85 (d, J = 8.4 Hz, 2H), 7.60 (d, J = 8.0 Hz, 2H), 7.49 (d, J = 8.8 Hz, 2H), 7.22 (d, J = 8.8 Hz, 2H), 6.99 (d, J = 8.8 Hz, 2H), 6.41 (d, J = 8.0 Hz, 1H), 4.93 (s, 2H), 3.87 (q, J = 7.2 Hz, 2H), 3.80 (s, 3H), 2.78 (d, J = 4.8 Hz, 3H), 1.07 (t, J = 7.2 Hz, 3H). |
| 實施例127 | 7-乙氧基-1-(4-甲氧基苯基)-3-(噻唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 383.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.68 (s, 1H), 7.74 (s, 1H), 7.65 (d, J = 8.8 Hz, 1H), 7.23 (d, J = 8.8 Hz, 2H), 7.01 (d, J = 8.8 Hz, 2H), 6.48 (d, J = 8.0 Hz, 1H), 5.08 (s, 2H), 3.84 (q, J = 6.8 Hz, 2H), 3.80 (s, 3H), 1.05 (t, J = 6.8 Hz, 3H). |
| 實施例128 | 7-(2,2-二氟乙氧基)-1-(4-甲氧基-d3-苯基)-3-(2-(3,3,3-三氟丙基)-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 551.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.48 (s, 1H), 7.71 (d, J = 1.6 Hz, 1H), 7.65 (d, J = 8.0 Hz, 1H), 7.60 (d, J = 9.2 Hz, 1H), 7.30 (dd, J = 9.2Hz, 2.0 Hz, 1H), 7.26 (d, J = 8.4 Hz, 2H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.94 (s, 2H), 4.72 (t, J = 6.8 Hz, 2H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 3.12-2.98 (m, 2H). |
| 實施例129 | 7-(2,2-二氟乙氧基)-3-(2-(2-氟乙基)-2H-吲唑-5-基)-1-(4-甲氧基-d3-苯基)-3,4-二氫吡啶并[2,3-d]嘧啶7-2(1H)-酮 | LC-MS: m/z 501.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.43 (s, 1H), 7.72 (s, 1H), 7.66 (d, J = 8.0 Hz, 1H), 7.61 (d, J = 9.2 Hz, 1H), 7.30 (dd, J = 9.2Hz, 2.0 Hz, 1H), 7.26 (d, J = 8.4 Hz, 2H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.4 Hz, 1H), 6.01 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.97 (t, J = 4.4 Hz, 1H), 4.93 (s, 2H), 4.85 (t, J = 4.4 Hz, 1H), 4.79 (t, J = 4.4 Hz, 1H), 4.73 (t, J = 4.4 Hz, 1H), 4.07 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例130 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(4-甲氧基苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 442.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.58 (d, J = 8.0 Hz, 1H), 7.37 (d, J = 8.8 Hz, 2H), 7.33 (d, J = 9.2 Hz, 2H), 7.29 (t, JHF = 74.0 Hz, 1H), 7.23 (d, J = 8.8 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 6.40 (d, J = 8.0 Hz, 1H), 4.83 (s, 2H), 3.85 (q, J = 7.2 Hz, 2H), 3.76 (s, 3H), 1.05 (t, J = 7.2 Hz, 3H). |
| 實施例401 | 7-(2,2-二氟乙氧基)-3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 483 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.66 (d, J = 8.1 Hz, 1H), 7.55 (d, J = 1.8 Hz, 1H), 7.50 (d, J = 8.5 Hz, 1H), 7.29-7.21 (m, 2H), 7.18 (dd, J = 8.5 Hz, 2.0 Hz, 1H), 7.04-6.96 (m, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.01 (tt, JHF = 55.6 Hz, J = 3.9 Hz, 1H), 4.93 (s, 2H), 4.07 (td, JHF = 14.4 Hz, J = 3.9 Hz, 2H), 3.72 (s, 3H), 2.52 (s, 3H). |
| 實施例402 | 3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 501 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.13 (d, J = 4.4 Hz, 1H), 7.65 (d, J = 1.6 Hz, 1H), 7.52-7.58 (m, 2H), 7.26 (dd, J = 8.4 Hz, 1.6 Hz, 1H), 7.21 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 4.84 (s, 2H), 4.02-3.87 (m, 2H), 3.75 (s, 3H), 2.58 (s, 3H). |
經由描繪為通用程序II之流程獲得結構2.5
之化合物。以醛2.1
開始,使用還原胺化引入所需R3
基團,得到胺2.2
。隨後在鹼性條件下將胺2.2
環化成脲2.3
。所需R1
及R2
基團隨後藉由鈀介導之C-X偶合,產生化合物2.4
,之後藉由銅介導之C-N偶合,得到化合物2.5
(方法A),或藉由銅介導之C-N偶合,產生化合物2.6
,之後藉由鈀介導之C-X偶合,得到2.5
(方法B)引入。
步驟 A :
(6-氯-3-(((2-甲基-2H-吲唑-5-基)胺基)甲基)吡啶-2-基)胺基甲酸第三丁酯
向(6-氯-3-甲醯基吡啶-2-基)胺基甲酸第三丁酯(市售) (3.8 g,15 mmol,1.0當量)及2-甲基-2H-吲唑-5-胺(2.0 g,14 mmol,0.93當量)於DCE (50 mL)中之溶液中添加AcOH (3.26 g,54 mmol,3.6當量),將反應混合物在室溫下攪拌5小時。隨後將反應混合物冷卻至0℃,以若干份添加NaBH(OAc)3
(8.64 g,41 mmol,2.7當量)。添加之後,將混合物升溫至室溫且再攪拌16小時。用冰冷卻之NaHCO3
(飽和水溶液) (30 mL)淬滅反應,用EtOAc (50 mL × 3)萃取,用鹽水(30 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,且藉由急驟矽膠管柱層析純化,得到呈淡綠色固體狀之(6-氯-3-(((2-甲基-2H-吲唑-5-基)胺基)甲基)吡啶-2-基)胺基甲酸第三丁酯(3.2 g,61%產率)。LC-MS (ESI):m/z
388 [M+H]+
。
步驟 B :
7-氯-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將(6-氯-3-(((2-甲基-2H-吲唑-5-基)胺基)甲基)吡啶-2-基)胺基甲酸第三丁酯(3.2 g,8.25 mmol,1.0當量)及K2
CO3
(11.4 g,82.5 mmol,10.0當量)於二㗁烷(40 mL)中之混合物在100 ℃下攪拌16小時。藉由LC-MS監測反應進程,完成後,用冰水(50 mL)淬滅反應混合物,收集沈澱物且減壓乾燥,得到呈白色固體狀之7-氯-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(2.2 g,85%產率)。LC-MS (ESI):m/z
314 [M+H]+
。
步驟 C :
7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將7-氯-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(2.2 g,7.0 mmol,1.0當量)、Cs2
CO3
(6.86 g,21 mmol,3.0當量)、Pd2
(dba)3
(0.64 g,0.70 mmol,0.1當量)及t-BuXPhos (0.6 g,1.4 mmol,0.2當量)於EtOH (300 mL)及甲苯(30 mL)中之混合物在80℃下在N2
氛圍下攪拌16小時。藉由LC-MS監測反應進程,完成後,經由短Celite®
墊過濾反應混合物,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(2.0 g,88%產率)。LC-MS (ESI):m/z
324 [M+H]+
。
步驟 D :
1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(50 mg,0.15 mmol,1.0當量)、1-溴-4-(二氟甲氧基)苯(35 mg,0.15 mmol,1.0當量)、CsF (70 mg,0.45 mmol,3.0當量)、CuI (29 mg,0.15 mmol,1.0當量)及N1
,N2
-二甲基環己烷-1,2-二胺(44 mg,0.3 mmol,2.0當量)於DMSO (3 mL)中之混合物在100 ℃下在N2
氛圍下攪拌16小時。用H2
O (10 mL)稀釋反應混合物,用EtOAc (10 mL × 3)洗滌,用鹽水(10 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 131
)。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.35 (s, 1H), 7.69 (d,J
= 1.6 Hz, 1H), 7.59 (t,J
= 8.4 Hz, 2H), 7.39 (t,J
= 8.8 Hz, 2H), 7.30 (t,J HF
= 74 Hz, 1H), 7.28 (dd,J
= 9.6 Hz, 2.0 Hz, 1H), 7.24 (d,J
= 8.8 Hz, 2H), 6.42 (d,J
= 8.0 Hz, 1H), 4.91 (s, 2H), 4.17 (s, 3H), 3.86 (q,J
= 7.2 Hz, 2H), 1.06 (t,J
= 7.2 Hz, 3H)。
LC-MS (ESI)
:m/z
466 [M+H]+
。
步驟 A :
7-氯-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向7-氯-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(1.0 g,3.19 mmol,1.0當量)於DMSO (15 mL)中之溶液中添加1-碘-4-甲氧基苯(0.90 g,3.82 mmol,1.2當量)、CuI (0.61 g,3.19 mmol,1.0當量)、CsF (1.45 g,9.56 mmol,3.0當量)及N1
,N2
-二甲基環己烷-1,2-二胺(0.91 g,6.37 mmol,2.0當量),將反應混合物在100℃下在N2
氛圍下攪拌16小時。藉由LC-MS監測進展,完成後,用H2
O (20 mL)稀釋反應,用EtOAc (40 mL × 3)萃取,經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之7-氯-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(900 mg,57%產率)。LC-MS (ESI):m/z
420 [M+H]+
。
步驟 B :
7-(乙硫基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
7-氯-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(50 mg,0.12 mmol,1.0當量)、Pd(OAc)2
(3 mg,0.012 mmol,0.1當量)、t-BuXPhos (10 mg,0.024 mmol,0.2當量)及Cs2
CO3
(116 mg,0.36 mmol,3.0當量)於DMSO (3 mL)中之混合物,用氮氣對系統進行脫氣,隨後經由注射器添加乙硫醇(0.3 mL),在密封管中進行反應,且在70 ℃下攪拌16小時。藉由LC-MS監測進展,完成後,用H2
O (20 mL) 稀釋反應,用EtOAc (40 mL × 3)萃取,經Na2
SO4
乾燥,減壓濃縮,且藉由RP-製備型HPLC純化,得到7-(乙硫基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 132
)。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.35 (s, 1H), 7.69 (s, 1H), 7.57 (d,J
= 9.2 Hz, 1H), 7.51 (d,J
= 7.6 Hz, 1H), 7.27 (d,J
= 8.8 Hz, 1H), 7.23 (d,J
= 8.8 Hz, 2H), 7.00 (d,J
= 8.8 Hz, 2H), 6.88 (d,J
= 7.6 Hz, 1H), 4.93 (s, 2H), 4.17 (s, 3H), 3.79 (s, 3H), 2.64 (q,J
= 7.2 Hz, 2H), 0.92 (t,J
= 7.2 Hz, 3H)。
LC-MS (ESI)
:m/z
446 [M+H]+
。
上文關於通用程序 II ( 方法 A)
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例133 | 1-(4-溴苯基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 514.2, 516.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.70-7.63 (m, 4H), 7.58 (d, J = 8.8 Hz, 1H), 7.35 (d, J = 8.4 Hz, 2H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 6.56 (d, J = 8.0 Hz, 1H), 6.05 (tt, JHF = 55.2 Hz, J = 3.6 Hz, 1H), 4.94 (s, 2H), 4.17 (s, 3H), 4.08 (td, JHF = 14.4 Hz, J = 3.6 Hz, 2H). |
| 實施例135 | 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 469.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.22 (s, 1H), 7.66 (t, J = 7.7 Hz, 3H), 7.27 (d, J = 8.8 Hz, 3H), 7.01 (d, J = 8.8 Hz, 2H), 6.54 (d, J = 8.0 Hz, 1H), 6.03 (tt, JHF = 55.6 Hz, J = 3.8 Hz, 1H), 4.96 (s, 2H), 4.08 (td, JHF = 14.6 Hz, J = 3.8 Hz, 2H), 3.84 (s, 3H). |
| 實施例136 | 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 469.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.69 (d, J = 1.5 Hz, 1H), 7.66 (d, J = 8.1 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.30-7.23 (m, 3H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 55.4 Hz, J = 3.9 Hz, 1H), 4.93 (s, 2H), 4.17 (s, 3H), 4.07 (td, JHF = 14.5, J = 3.9 Hz, 2H). |
| 實施例137 | 7-乙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 433.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.40 (s, 1H), 7.74 (d, J = 1.6 Hz, 1H), 7.65 (d, J = 6.0 Hz, 1H), 7.63 (d, J = 7.2 Hz, 1H), 7.33 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.29 (d, J = 8.8 Hz, 2H), 7.04 (d, J = 8.8 Hz, 2H), 6.46 (d, J = 8.0 Hz, 1H), 4.96 (s, 2H), 4.23 (s, 3H), 3.93 (q, J = 7.2 Hz, 2H), 1.13 (t, J = 7.2 Hz, 3H). |
| 實施例138 | 7-乙氧基-1-(4-甲氧基苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 430.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.20 (s, 1H), 7.65 (d, J = 7.6 Hz, 2H), 7.58 (d, J = 8.0 Hz, 1H), 7.26 (d, J = 2.0 Hz, 1H), 7.23 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 6.40 (d, J = 8.0 Hz, 1H), 4.92 (s, 2H), 3.85 (q, J = 7.0 Hz, 2H), 3.83 (s, 3H), 3.79 (s, 3H), 1.07 (t, J = 7.0 Hz, 3H). |
| 實施例139 | 7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 466.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.21 (s, 1H), 7.70-7.62 (m, 3H), 7.30-7.23 (m, 3H), 7.03-6.97 (m, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 56.0 Hz, J = 3.6 Hz, 1H), 4.95 (s, 2H), 4.08 (td, JHF = 14.4 Hz, J = 3.6 Hz, 2H), 3.83 (s, 3H), 3.79 (s, 3H). |
| 實施例140 | 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 502.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.22 (s, 1H), 7.72-7.62 (m, 3H), 7.45-7.40 (m, 2H), 7.29-7.26 (m, 3H), 7.28 (t, JHF = 74.0 Hz, 1H), 6.56 (d, J = 8.0 Hz, 1H), 6.03 (tt, JHF = 56.0 Hz, J = 4.0 Hz, 1H), 4.97 (s, 2H), 4.07 (td, JHF = 14.8 Hz, J = 4.0 Hz, 2H), 3.83 (s, 3H). |
| 實施例141 | 7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-1-(4-(三氟甲氧基)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 466.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.69 (d, J = 1.6 Hz, 1H), 7.66 (d, J = 8.0 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.30-7.21 (m, 3H), 7.00 (d, J = 8.8 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 6.01 (tt, JHF = 55.6 Hz, J = 4.0 Hz, 1H), 4.93 (s, 2H), 4.17 (s, 3H), 4.07 (td, JHF = 14.4 Hz, J = 4.0 Hz, 2H), 3.79 (s, 3H). |
| 實施例142 | 7-乙氧基-1-(6-甲氧基吡啶-3-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 431.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 8.23 (d, J = 5.6 Hz, 1H), 7.70 (d, J = 1.6 Hz, 1H), 7.62 (d, J = 8.0 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.27 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.01 (dd, J = 5.6 Hz, 1.6 Hz, 1H), 6.88 (s, 1H), 6.46 (d, J = 8.4 Hz, 1H), 4.91 (s, 2H), 4.17 (s, 3H), 3.90 (q, J = 6.8 Hz, 2H), 3.89 (s, 3H), 1.1 (t, J = 6.8 Hz, 3H). |
| 實施例143 | 7-乙氧基-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 430.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.69 (d, J = 1.6 Hz, 1H), 7.59 (d, J = 6.0 Hz, 1H), 7.57 (d, J = 6.8 Hz, 1H), 7.27 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.23 (d, J = 8.8 Hz, 2H), 6.99 (d, J = 8.8 Hz, 2H), 6.40 (d, J = 8.0 Hz, 1H), 4.90 (s, 2H), 4.17 (s, 3H), 3.87 (q, J = 6.8 Hz, 2H), 3.80 (s, 3H), 1.08 (t, J = 6.8 Hz, 3H). |
| 實施例144 | 7-環丙基-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 478.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 7.70 (d, J = 2.0 Hz, 1H), 7.66 (d, J = 8.0 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.38 (d, J = 8.8 Hz, 2H), 7.31-7.22 (m, 3H), 7.27 (t, JHF = 74.0 Hz, 1H), 6.58 (d, J = 8.0 Hz, 1H), 4.94 (s, 2H), 4.18 (s, 3H), 3.72-3.68 (m, 1H), 0.58-0.53 (m, 4H). |
| 實施例145 | 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 502.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.71 (s, 1H), 7.68 (d, J = 8.4 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.40 (d, J = 8.8 Hz, 2H), 7.34-7.20 (m, 3H), 7.29 (t, JHF = 72 Hz, 1H), 6.55 (d, J = 8.8 Hz, 1H), 6.02 (tt, JHF = 60 Hz, J = 3.6 Hz, 1H), 4.95 (s, 2H), 4.17 (s, 3H), 4.07 (td, JHF = 14.4 Hz, J = 3.6 Hz, 2H). |
| 實施例146 | 1-(4-氯苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 434.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.69 (d, J = 1.6 Hz, 1H), 7.64-7.54 (m, 2H), 7.50 (d, J = 8.8 Hz, 2H), 7.38 (d, J = 8.8 Hz, 2H), 7.26 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 6.42 (d, J = 8.4 Hz, 1H), 4.91 (s, 2H), 4.17 (s, 3H), 3.87 (q, J = 7.2 Hz, 2H), 1.07 (t, J = 7.2 Hz, 3H). |
| 實施例147 | 7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-1-(6-(三氟甲氧基)吡啶-3-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 485.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.40 (d, J = 2.4 Hz, 1H), 8.37 (s, 1H), 8.10 (dd, J = 8.8 Hz, 2.8 Hz, 1H), 7.73 (d, J = 2.0 Hz, 1H), 7.65 (d, J = 8.4 Hz, 1H), 7.60 (d, J = 8.8 Hz, 1H), 7.43 (d, J = 8.4 Hz, 1H), 7.31 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 6.48 (d, J = 8.0 Hz, 1H), 4.95 (s, 2H), 4.18 (s, 3H), 3.88 (q, J = 7.2 Hz, 2H), 1.07 (t, J = 7.2 Hz, 3H). |
| 實施例148 | 7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-1-(2-(三氟甲基)嘧啶-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 470.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.25 (s, 2H), 8.39 (s, 1H), 7.77 (s, 1H), 7.70 (d, J = 7.6 Hz, 1H), 7.62 (d, J = 8.4 Hz, 1H), 7.33 (d, J = 8.4 Hz, 1H), 6.56 (d, J = 7.6 Hz, 1H), 4.99 (s, 2H), 4.19 (s, 3H), 3.91 (q, J = 6.4 Hz, 2H), 1.10 (t, J = 6.4 Hz, 3H). |
| 實施例149 | 1-(6-(二氟甲基)吡啶-3-基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 451.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.70 (d, J = 2.0 Hz, 1H), 8.36 (s, 1H), 8.07 (dd, J = 8.4 Hz, 2.4 Hz, 1H), 7.82 (d, J = 8.4 Hz, 1H), 7.73 (d, J = 1.2 Hz, 1H), 7.65 (d, J = 8.4 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.31 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.04 (t, JHF = 55.2 Hz, 1H), 6.48 (d, J = 8.4 Hz, 1H), 4.95 (s, 2H), 4.17 (s, 3H), 3.85 (q, J = 6.8 Hz, 2H), 1.05 (t, J = 6.8 Hz, 3H). |
| 實施例150 | 7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-1-(6-(三氟甲基)吡啶-3-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 469.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.81 (d, J = 2.4 Hz, 1H), 8.37 (s, 1H), 8.18 (dd, J = 8.0 Hz, 2.0 Hz, 1H), 8.05 (d, J = 8.4 Hz, 1H), 7.74 (d, J = 1.2 Hz, 1H), 7.66 (d, J = 8.4 Hz, 1H), 7.60 (d, J = 9.2 Hz, 1H), 7.31 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 6.50 (d, J = 8.4 Hz, 1H), 4.96 (s, 2H), 4.17 (s, 3H), 3.86 (q, J = 7.2 Hz, 2H), 1.05 (t, J = 7.2 Hz, 3H). |
| 實施例151 | 7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 415.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.51 (d, J = 5.6 Hz, 1H), 8.35 (s, 1H), 7.70 (d, J = 1.2 Hz, 1H), 7.62 (d, J = 8.4 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.30 (d, J = 1.2 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.23 (dd, J = 5.2 Hz, 1.6 Hz, 1H), 6.46 (d, J = 8.0 Hz, 1H), 4.92 (s, 2H), 4.17 (s, 3H), 3.87 (q, J = 7.2 Hz, 2H), 2.5 (s, 3H), 1.09 (t, J = 7.2 Hz, 3H). |
| 實施例152 | 1-(6-環丙基吡啶-3-基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 441.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.33 -8.30 (m, 2H), 7.68 (s, 1H), 7.66 – 7.52 (m, 3H), 7.36 (d, J = 8.3 Hz, 1H), 7.26 (d, J = 9.6 Hz, 1H), 6.42 (d, J = 8.1 Hz, 1H), 4.90 (s, 2H), 4.15 (s, 3H), 3.85 (q, J = 6.9 Hz, 2H), 2.17-2.10 (m, 1H), 1.05 (t, J = 7.1 Hz, 3H), 1.01 – 0.91 (m, 4H). |
| 實施例153 | 1-(4-(4H-1,2,4-三唑-3-基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 467.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 14.13 (s, 1H), 8.64 (s, 1H), 8.35 (s, 1H), 8.09 (d, J = 8.2 Hz, 2H), 7.71 (s, 1H), 7.61 (d, J = 8.2 Hz, 1H), 7.58 (d, J = 9.1 Hz, 1H), 7.52 (d, J = 7.3 Hz, 1H), 7.42 (d, J = 8.0 Hz, 1H), 7.29 (d, J = 9.3 Hz, 1H), 6.43 (d, J = 8.0 Hz, 1H), 4.93 (s, 2H), 4.17 (s, 3H), 3.85 (q, J = 7.0 Hz, 2H), 1.05 (t, J = 7.0 Hz, 3H). |
| 實施例154 | 1-(4-(4H-1,2,4-三唑-3-基)苯基)-7-乙氧基-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 467.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 14.19 (s, 1H), 8.55 (s, 1H), 8.19 (s, 1H), 8.07 (d, J = 8.1 Hz, 2H), 7.66 (s, 1H), 7.64 (d, J = 8.8 Hz, 1H), 7.60 (d, J = 8.2 Hz, 1H), 7.44 (d, J = 8.1 Hz, 2H), 7.27 (d, J = 8.8 Hz, 1H), 6.42 (d, J = 8.2 Hz, 1H), 4.94 (s, 2H), 3.84 (q, J = 6.9 Hz, 2H), 3.82 (s, 3H), 1.03 (t, J = 6.9 Hz, 3H). |
| 實施例155 | 1-(4-(4H-1,2,4-三唑-3-基)苯基)-7-乙氧基-3-(4-甲氧基苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 443.1 [M+H]+. 1H NMR (400 MHz, Chloroform-d) δ 8.07 (s, 1H), 7.90 (d, J = 8.1 Hz, 2H), 7.40 – 7.31 (m, 5H), 6.95 (d, J = 7.3 Hz, 2H), 6.36 (d, J = 7.9 Hz, 1H), 4.84 (s, 2H), 3.90 – 3.79 (m, 5H), 1.08 (t, J = 7.1 Hz, 3H). (triazole NH not observed) |
| 實施例403 | 7-(2,2-二氟乙氧基)-1-(1-甲基-1H-苯并[d]咪唑-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 490 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 8.20 (s, 1H), 7.70 (d, J = 1.7 Hz, 1H), 7.67 (d, J = 8.1 Hz, 1H), 7.61 (s, 1H), 7.60 (d, J = 8.7 Hz, 1H), 7.56 (d, J = 9.2 Hz, 1H), 7.29 (dd, J = 9.2 Hz, 1.8 Hz, 1H), 7.23 (dd, J = 8.5 Hz, 1.5 Hz, 1H), 6.51 (d, J = 8.0 Hz, 1H), 5.91 (tt, JHF = 55.5 Hz, J = 3.8 Hz, 1H), 4.96 (s, 2H), 4.16 (s, 3H), 3.95 (td, JHF = 14.5 Hz, 3.8 Hz, 2H), 3.86 (s, 3H). |
| 實施例404 | 1-(1H-苯并[d]咪唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 476 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 12.51 (s, 1H), 8.33 (s, 1H), 8.24 (s, 1H), 7.70 (s, 1H), 7.66 (d, J = 8.1 Hz, 1H), 7.56 (d, J = 9.2 Hz, 1H), 7.55 (s, 2H), 7.28 (d, J = 9.1 Hz, 1H), 7.14 (s, 1H), 6.51 (d, J = 8.0 Hz, 1H), 5.89 (t, JHF = 55.4 Hz, 1H), 4.95 (s, 2H), 4.15 (s, 3H), 3.94 (td, JHF = 14.5 Hz, J = 3.5 Hz, 2H). |
| 實施例405 | 7-(2,2-二氟乙氧基)-1-(1H-吲唑-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 476 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 13.15 (s, 1H), 8.35 (s, 1H), 8.10 (s, 1H), 7.75 (s, 1H), 7.72 (s, 1H), 7.68 (d, J = 8.0 Hz, 1H), 7.60 (d, J = 3.5 Hz, 1H), 7.57 (d, J = 3.9 Hz, 1H), 7.31 (d, J = 4.8 Hz, 1H), 7.28 (s, 1H), 6.53 (d, J = 8.0 Hz, 1H), 5.93 (tt, JHF = 55.3 Hz, J = 3.8 Hz, 1H), 4.97 (s, 2H), 4.17 (s, 3H), 3.96 (td, JHF = 14.4, J = 3.8 Hz, 2H). |
| 實施例406 | 1-(4-(二氟甲氧基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 495 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.35 (d, J = 8.2 Hz, 1H), 7.32 (d, J = 8.7 Hz, 2H), 7.30 (d, J = 8.6 Hz, 2H), 7.24 (t, JHF = 7.2 Hz, 1H), 7.21 (d, J = 8.6 Hz, 2H), 7.06 (d, J = 3.6 Hz, 1H), 6.95 (d, J = 8.7 Hz, 2H), 6.23 (d, J = 8.1 Hz, 1H), 4.74 (s, 2H), 3.76 (s, 3H), 3.73-3.59 (m, 2H). |
| 實施例407 | 1-(4-氯苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 463 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.44 (d, J = 8.3 Hz, 2H), 7.34 (d, J = 8.2 Hz, 1H), 7.30 (d, J = 8.7 Hz, 2H), 7.26 (d, J = 8.4 Hz, 2H), 7.07 (t, J = 6.4 Hz, 1H), 6.94 (d, J = 8.7 Hz, 2H), 6.22 (d, J = 8.1 Hz, 1H), 4.72 (s, 2H), 3.75 (s, 3H), 3.71-3.59 (m, 2H). |
| 實施例408 | 3-(苯并[d]噻唑-6-基)-7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 505 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.39 (s, 1H), 8.25 (s, 1H), 8.11 (d, J = 8.8 Hz, 1H), 7.69 (d, J = 8.4 Hz, 1H), 7.63 (d, J = 8.8 Hz, 1H), 7.44 (d, J = 8.4 Hz, 2H), 7.29 (d, J = 8.4 Hz, 2H), 7.27 (t, JHF = 73.6 Hz, 1H), 6.57 (d, J = 8.0 Hz, 1H), 6.01 (tt, JHF = 55.6 Hz, J = 3.2 Hz, 1H), 5.01 (s, 2H), 4.07 (td, JHF = 14.4 Hz, J = 3.6 Hz, 2H). |
| 實施例409 | 3-(苯并[d]噻唑-6-基)-1-(4-溴苯基)-7-(2,2-二氟乙氧基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 518 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.40 (s, 1H), 8.25 (s, 1H), 8.10 (d, J = 9.2 Hz, 1H), 7.72-7.61 (m, 4H), 7.37 (d, J = 8.0 Hz, 2H), 6.58 (d, J = 8.0 Hz, 1H), 6.05 (t, JHF = 15.6 Hz, J = 3.2 Hz, 1H), 5.01 (s, 2H), 4.09 (td, JHF = 14.8 Hz, J = 3.2 Hz, 2H). |
| 實施例410 5-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-吲哚-3-甲腈(Ref:WO2018215316) | 5-(7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-2-側氧基-3,4-二氫吡啶并[2,3-d]嘧啶-1(2H)-基)-1H-吲哚-3-甲腈 | LC-MS: m/z 500 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 12.28 (s, 1H), 8.34 (s, 1H), 8.28 (s, 1H), 7.73-7.54 (m, 5H), 7.28 (dd, J = 8.9 Hz, 1.9 Hz, 2H), 6.53 (d, J = 8.0 Hz, 1H), 5.93 (tt, JHF = 55.6 Hz, J = 3.8 Hz, 1H), 4.96 (s, 2H), 4.16 (s, 3H), 3.97 (td, JHF = 14.5, J = 3.8 Hz, 2H). |
| 實施例411 | 1-(2-胺基苯并[d]㗁唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 492 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.69 (s, 1H), 7.65 (d, J = 8.1 Hz, 1H), 7.57 (d, J = 9.1 Hz, 1H), 7.43 (s, 2H), 7.37 (d, J = 8.4 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 1.7 Hz, 1H), 7.16 (d, J = 1.7 Hz, 1H), 6.92 (dd, J = 8.4 Hz, 1.8 Hz, 1H), 6.51 (d, J = 8.0 Hz, 1H), 6.02 (tt, JHF = 55.6 Hz, J = 3.6 Hz, 1H), 4.93 (s, 2H), 4.16 (s, 3H), 4.01 (td, JHF = 14.4 Hz, J = 3.6 Hz, 2 H). |
| 實施例412 | 1-(4-(7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-2-側氧基-3,4-二氫吡啶并[2,3-d]嘧啶-1(2H)-基)苯基)脲 | LC-MS: m/z 494 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.81 (s, 1H), 8.35 (s, 1H), 7.69 (d, J = 1.4 Hz, 1H), 7.66 (d, J = 8.1 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.48 (d, J = 8.8 Hz, 2H), 7.26 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.17 (d, J = 8.8 Hz, 2H), 6.52 (d, J = 8.0 Hz, 1H), 6.12 (tt, JHF = 55.4 Hz, J = 3.8 Hz, 1H), 5.91 (s, 2H), 4.92 (s, 2H), 4.17 (s, 3H), 4.09 (td, JHF = 14.5 Hz, J = 3.8 Hz, 2H). |
上文關於通用程序 II ( 方法 B)
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例157 | 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(N-𠰌啉基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 471.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.66 (d, J = 1.2 Hz, 1H), 7.55 (d, J = 9.2 Hz, 1H), 7.45 (d, J = 8.4 Hz, 1H), 7.25 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.19 (d, J = 8.8 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 6.43 (d, J = 8.4 Hz, 1H), 4.83 (s, 2H), 4.16 (s, 3H), 3.78 (s, 3H), 3.57-3.52 (m, 4H), 3.16-3.10 (m, 4H). |
| 實施例158 | 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(吡咯啶-1-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 455.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.32 (s, 1H), 7.65 (d, J = 1.6 Hz, 1H), 7.55 (d, J = 9.2 Hz, 1H), 7.36 (d, J = 8.4 Hz, 1H), 7.25 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.19 (d, J = 8.8 Hz, 2H), 6.94 (d, J = 9.2 Hz, 2H), 6.04 (d, J = 8.0 Hz, 1H), 4.80 (s, 2H), 4.16 (s, 3H), 3.78 (s, 3H), 3.12-3.02 (m, 4H), 1.85-1.75 (m, 4H). |
| 實施例159 | 7-(二乙胺基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 457.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.66 (d, J = 1.6 Hz, 1H), 7.55 (d, J = 8.8 Hz, 1H), 7.33 (d, J = 8.4 Hz, 1H), 7.25 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.18 (d, J = 8.8 Hz, 2H), 6.95 (d, J = 9.2 Hz, 2H), 6.17 (d, J = 8.4 Hz, 1H), 4.79 (s, 2H), 4.16 (s, 3H), 3.78 (s, 3H), 3.16 (q, J = 6.8 Hz, 4H), 0.86 (q, J = 6.8 Hz, 6H). |
| 實施例160 | 7-(二甲胺基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 429.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.66 (d, J = 1.2 Hz, 1H), 7.55 (d, J = 9.2 Hz, 1H), 7.38 (d, J = 8.4 Hz, 1H), 7.25 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.19 (d, J = 9.2 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 6.23 (d, J = 8.4 Hz, 1H), 4.81 (s, 2H), 4.16 (s, 3H), 3.78 (s, 3H), 2.74 (s, 6H). |
| 實施例161 | 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)硫基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 500.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.70 (d, J = 1.6 Hz, 1H), 7.59 (d, J = 8.0 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.29 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.21 (d, J = 8.8 Hz, 2H), 7.04 (d, J = 7.6 Hz, 1H), 7.00 (d, J = 9.2 Hz, 2H), 4.97 (s, 2H), 4.17 (s, 3H), 3.78 (s, 3H), 3.70 (q, J = 10.4 Hz, 2H). |
| 實施例162 | 7-(環丁胺基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 455.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.32 (s, 1H), 7.64 (d, J = 1.2 Hz, 1H), 7.54 (d, J = 9.2 Hz, 1H), 7.28-7.22 (m, 2H), 7.17 (d, J = 8.8 Hz, 1H), 6.96 (d, J = 8.8 Hz, 2H), 6.54 (d, J = 6.8 Hz, 1H), 6.02 (d, J = 8.0 Hz, 1H), 4.76 (s, 2H), 4.16 (s, 3H), 3.79 (s, 3H), 3.76-3.63 (m, 2H), 2.00-1.88 (m, 2H), 1.78-1.65 (m, 2H), 1.59-138 (m, 2H). |
| 實施例163 | 7-(2-氟乙氧基)-1-(4-甲氧基-d3-苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 451.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.68 (d, J = 1.2 Hz, 1H), 7.62 (d, J = 8.4 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.29-7.21 (m, 3H), 6.98 (d, J = 8.8 Hz, 2H), 6.48 (d, J = 7.6 Hz, 1H), 4.91 (s, 2H), 4.54 (t, J = 4.0 Hz, 1H), 4.42 (t, J = 4.0 Hz, 1H), 4.17 (s, 3H), 4.08 (t, J = 4.0 Hz, 1H), 4.01 (t, J = 4.0 Hz, 1H). |
| 實施例164 | 7-(環丙基甲氧基)-1-(4-甲氧基-d3-苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 459.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.68 (d, J = 1.6 Hz, 1H), 7.59-7.54 (m, 2H), 7.27 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.21 (d, J = 8.8 Hz, 2H), 6.97 (d, J = 8.8 Hz, 2H), 6.40 (d, J = 8.0 Hz, 1H), 4.90 (s, 2H), 4.17 (s, 3H), 3.69 (d, J =7.2 Hz, 2H), 1.03-0.93 (m, 1H), 0.40-0.33 (m, 2H), 0.07-0.01 (m, 2H). |
| 實施例165 | 1-(4-甲氧基-d3-苯基)-3-(2-甲基-2H-吲唑-5-基)-7-丙氧基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 447.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.68 (d, J = 1.2 Hz, 1H), 7.59-7.54 (m, 2H), 7.27 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.23 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 6.39 (d, J = 8.0 Hz, 1H), 4.90 (s, 2H), 4.17 (s, 3H), 3.78 (t, J = 7.2 Hz, 2H), 1.45 (q, J = 7.2 Hz, 2H), 0.72 (t, J = 7.2 Hz, 3H). |
| 實施例166 | 1-(4-甲氧基-d3-苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(3,3,3-三氟丙氧基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 447.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.69 (d, J = 1.6 Hz, 1H), 7.62 (d, J = 8.0 Hz, 1H), 7.58 (d, J = 8.8 Hz, 1H), 7.29-7.22 (m, 3H), 6.98 (d, J = 8.8 Hz, 2H), 6.44 (d, J = 8.0 Hz, 1H), 4.92 (s, 2H), 4.17 (s, 3H), 4.04 (t, J = 6.4 Hz, 2H), 2.52-2.39 (m, 2H). |
| 實施例167 | 7-異丙氧基-1-(4-甲氧基-d3-苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 447.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.68 (d, J = 1.6 Hz, 1H), 7.58-7.53 (m, 2H), 7.27 (dd, J = 8.8 Hz, 2.0 Hz, 1H), 7.23 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 6.34 (d, J = 8.0 Hz, 1H), 4.89 (s, 2H), 4.52 (hept, J = 6.4 Hz, 1H), 4.17 (s, 3H), 1.05 (d, J = 6.4 Hz, 6H). |
| 實施例168 | 7-((1,1-二氟丙-2-基)氧基)-1-(4-甲氧基-d3-苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 483.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.69 (s, 1H), 7.64 (d, J = 8.0 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.32-7.25 (m, 3H), 7.24 (t, JHF = 74.0 Hz, 1H), 6.99 (d, J = 8.4 Hz, 1H), 6.48 (d, J = 8.4 Hz, 1H), 5.98 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.92 (s, 2H), 4.65-4.51 (m, 1H), 4.17 (s, 3H), 1.07 (d, J = 6.4Hz, 3H). |
| 實施例169 | 7-(2,2-二氟乙氧基)-1-(1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 475.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 11.15 (s, 1H), 8.35 (s, 1H), 7.70 (d, J = 1.6 Hz, 1H), 7.66 (d, J = 8.0 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.49 (d, J = 1.6 Hz, 1H), 7.43 (d, J = 8.8 Hz, 1H), 7.37 (t, J = 6.8 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.03 (dd, J = 8.4 Hz, 2.0 Hz, 1H), 6.51 (d, J = 8.0 Hz, 1H), 6.46-6.43 (m, 1H), 5.92 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 4.96 (s, 2H), 4.17 (s, 3H), 3.96 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例170 | 1-(苯并[d]噻唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 493.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.44 (s, 1H), 8.36 (s, 1H), 8.24 (d, J = 8.4 Hz, 1H), 8.11 (d, J = 1.6 Hz, 1H), 7.73 (d, J = 1.6 Hz, 1H), 7.71 (d, J = 8.4 Hz, 1H), 7.59 (d, J = 8.8 Hz, 1H), 7.50 (dd, J = 8.8 Hz, 2.0 Hz, 1H), 7.32 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 6.56 (d, J = 8.4 Hz, 1H), 5.93 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.99 (s, 2H), 4.17 (s, 3H), 3.97 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例171 | 7-(2,2-二氟乙氧基)-1-(咪唑并[1,2-a]吡啶-6-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 476.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.73 (s, 1H), 8.36 (s, 1H), 7.98 (s, 1H), 7.73-7.69 (m, 2H), 7.62-7.56 (m, 3H), 7.32-7.24 (m, 2H), 6.60 (d, J = 8.0 Hz, 1H), 6.10 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 4.97 (s, 2H), 4.17 (s, 3H), 4.10 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例172 | 7-(2,2-二氟乙氧基)-1-(1-甲基-1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 489.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.70 (d, J = 1.2 Hz, 1H), 7.66 (d, J = 9.2 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.50 (d, J = 1.6 Hz, 1H), 7.47 (d, J = 8.8 Hz, 1H), 7.35 (d, J = 3.2 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.09 (dd, J = 8.4 Hz, 1.6 Hz, 1H), 6.51 (d, J = 8.0 Hz, 1H), 6.45 (d, J = 2.8 Hz, 1H), 5.93 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.95 (s, 2H), 4.17 (s, 3H), 3.96 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 3.82 (s, 3H). |
| 實施例173 | 7-(2,2-二氟乙氧基)-1-(1-甲基-1H-苯并[d]咪唑-6-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 490.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 8.22 (s, 1H), 7.72 (d, J = 2.0 Hz, 1H), 7.70 (d, J = 3.2 Hz, 1H), 7.68 (d, J = 3.6 Hz, 1H), 7.63 (d, J = 1.6 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.29 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.18 (dd, J = 8.8 Hz, 1.6 Hz, 1H), 6.54 (d, J = 7.6 Hz, 1H), 5.95 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.97 (s, 2H), 4.17 (s, 3H), 3.97 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 3.84 (s, 3H). |
| 實施例174 | 1-([1,2,4]三唑并[1,5-a]吡啶-6-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 477.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.21 (s, 1H), 8.56 (s, 1H), 8.37 (s, 1H), 7.91 (d, J = 9.6 Hz, 1H), 7.79 (dd, J = 9.6 Hz, 1.6 Hz, 1H), 7.75-7.71 (m, 2H), 7.60 (d, J = 8.8 Hz, 1H), 7.32 (dd, J = 9.2 Hz, 1.2 Hz, 1H), 6.62 (d, J = 8.0 Hz, 1H), 6.08 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.99 (s, 2H), 4.17 (s, 3H), 4.08 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例175 | 7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-1-(喹啉-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 487.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.00 (d, J = 3.2 Hz, 1H), 8.53 (d, J = 3.6 Hz, 1H), 8.37 (s, 1H), 8.14-8.07 (m, 2H), 7.83 (dd, J = 9.2 Hz, 1.6 Hz, 1H), 7.75-7.70 (m, 2H), 7.65 (dd, J = 8.0 Hz, 4.0 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.32 (dd, J = 8.8 Hz, 1.6 Hz, 1H), 6.59 (d, J = 8.0 Hz, 1H), 5.96 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 5.01 (s, 2H), 4.17 (s, 3H), 3.96 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例176 | 1-(苯并[d]異噻唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 493.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.14 (s, 1H), 8.36 (s, 1H), 8.29 (d, J = 8.4 Hz, 1H), 8.24 (s, 1H), 7.74-7.69 (m, 2H), 7.62 (dd, J = 8.8 Hz, 1.2 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.31 (dd, J = 9.2 Hz, 1.6 Hz, 1H), 6.57 (d, J = 8.0 Hz, 1H), 5.96 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 5.00 (s, 2H), 4.17 (s, 3H), 3.97 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例177 | 1-(苯并[c]異噻唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 493.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.78 (s, 1H), 8.36 (s, 1H), 7.94 (s, 1H), 7.82 (d, J = 9.2 Hz, 1H), 7.74-7.68 (m, 2H), 7.59 (d, J = 9.2 Hz, 1H), 7.47 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.31 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 6.57 (d, J = 8.0 Hz, 1H), 6.01 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 4.98 (s, 2H), 4.17 (s, 3H), 4.01 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例178 | 7-(2,2-二氟乙氧基)-1-(4-甲氧基環己-1-烯-1-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 470.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.64 (d, J = 2.0 Hz, 1H), 7.60 (d, J = 8.0 Hz, 1H), 7.56 (d, J = 9.2 Hz, 1H), 7.21 (dd, J = 9.2 Hz, 1.6 Hz, 1H), 6.52 (d, J = 8.0 Hz, 1H), 6.37 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 5.63-5.59 (m, 1H), 4.81 (dd, J = 20.0 Hz, 14.0 Hz, 2H), 4.52 (td, JHF = 14.8 Hz, 2.4 Hz, 2H), 4.17 (m, 3H), 3.57-3.50 (m, 1H), 3.29 (s, 3H), 2.52-2.19 (m, 3H), 2.16-2.06 (m, 1H), 2.01-1.92 (m, 1H), 1.80-1.69 (m, 1H). |
| 實施例179 | 1-(1H-苯并[d][1,2,3]三唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 477.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 8.01-7.95 (m, 2H), 7.75-7.68 (m, 2H), 7.58 (d, J = 8.8 Hz, 1H), 7.42 (d, J = 8.8 Hz, 1H), 7.31 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 6.56 (d, J = 8.4 Hz, 1H), 5.93 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.99 (s, 2H), 4.17 (s, 3H), 3.95 (td, JHF = 14.4 Hz, 3.6 Hz, 2H), 三唑質子未出現。 |
經由描繪為通用程序III之流程獲得結構3.7
(情況I-IV)之化合物。以芳基氯3.1
開始,使用鹼介導之芳族取代引入所需R2
基團以產生胺3.2
。隨後將芳基酸3.2
轉化為韋因萊醯胺(Weinreb amide)3.3
,其隨後使用氫化物源還原為醛3.4
。隨後使用還原胺化引入所需R3
基團以產生二胺3.5
。隨後伴隨鈀介導之C-X偶合反應引入所需R1
基團以產生二胺3.6
。隨後二胺3.6
與CDI反應以形成環脲3.7
。
步驟 A :
5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-甲酸
向4-甲氧基苯胺(1.28 g,10.4 mmol,2.0當量)於無水THF (10 mL)中之溶液中在-78 ℃下在N2
氛圍下經由注射器添加LiHMDS (1M於THF中,10.4 mL,10.4 mmol,2.0當量)。在相同溫度下再攪拌0.5小時之後,經由注射器在10分鐘內添加3,5-二氯吡𠯤-2-甲酸(1.0 g,5.2 mmol,1.0當量)於無水 THF (5 mL)中之溶液。在-78℃下再攪拌0.5小時之後,將反應混合物升溫至室溫且攪拌18小時。用水(20 mL)淬滅混合物,隨後藉由添加稀釋HCl (2N,水溶液)調整pH = 2。用EtOAc (10 mL × 3)萃取所得混合物。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,減壓濃縮,且藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-甲酸(1.3 g,90%產率)。LC-MS (ESI):m/z
280 [M+H]+
。
步驟 B :
5-氯-N-甲氧基-3-((4-甲氧苯基)胺基)-N-甲基吡𠯤-2-甲醯胺
將5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-甲酸(1.70 g,6.08 mmol,1.0當量)、N,O
-二甲基羥胺鹽酸鹽(0.89 g,9.12 mmol,1.5當量)、DIPEA (3.14 g,24.31 mmol,4.0當量)及HATU (3.46 g,9.12 mmol,1.5當量)於DCM (10 mL)中之溶液在室溫下攪拌隔夜。藉由添加H2
O (20 mL)淬滅所得混合物,隨後用DCM (30 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,且藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之5-氯-N-甲氧基-3-((4-甲氧苯基)胺基)-N-甲基吡𠯤-2-甲醯胺 (1.26 g,64%產率)。LC-MS (ESI):m/z
323 [M+H]+
。
步驟 C :
5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-甲醛
向5-氯-N-甲氧基-3-((4-甲氧苯基)胺基)-N-甲基吡𠯤-2-甲醯胺(1.26 g,3.9 mmol,1.0當量)於無水 THF (15 mL)中之溶液中在-78 ℃下在N2
氛圍下經由注射器添加DIBAL-H (1.5 M於甲苯中,3.9 mL,5.86 mmol,1.5當量)。將混合物在-78℃下再攪拌0.5小時。藉由LC-MS監測反應進程,完成後,用NH4
Cl (飽和水溶液) (20 mL)淬滅反應混合物且用EtOAc (10 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層 且經Na2
SO4
乾燥,減壓濃縮,得到5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-甲醛(1.6 g,粗物質),其不經進一步純化即用於下一步驟。LC-MS (ESI):m/z
264 [M+H]+
。
步驟 D :
N-((5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-基)甲基)-2-甲基-2H-吲唑-5-胺
將5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-甲醛(1.6 g,6.07 mmol,1.0當量)、2-甲基-2H-吲唑-5-胺(0.89 g,6.07 mmol,1.0當量)及AcOH (1.5 mL,24.27 mmol,4.0當量)於DCE (10 mL)中之溶液在室溫下攪拌隔夜。隨後在0℃下以若干份添加NaBH(OAc)3
(3.86 g,18.20 mmol,3.0當量),添加之後,將混合物升溫至室溫且攪拌隔夜。藉由添加冰水(10 mL)淬滅反應且用EtOAc (30 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層 且經Na2
SO4
乾燥,用(30 mL)鹽水洗滌且經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之N-((5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-基)甲基)-2-甲基-2H-吲唑-5-胺(1.25 g,52%產率)。LC-MS (ESI):m/z
395 [M+H]+
。
步驟 E :
N-((5-(2,2-二氟乙氧基)-3-((4-甲氧苯基)胺基)吡𠯤-2-基)甲基)-2-甲基-2H-吲唑-5-胺
將N-((5-氯-3-((4-甲氧苯基)胺基)吡𠯤-2-基)甲基)-2-甲基-2H-吲唑-5-胺(600 mg,1.52 mmol,1.0當量)、2,2-二氟乙-1-醇(374 mg,4.56 mmol,3.0當量)、Pd(OAc)2
(68 mg,0.304 mmol,0.2當量)、t-BuXPhos (129 mg,0.304 mmol,0.2當量)及Cs2
CO3
(1.49 g,4.56 mmol,3.0當量)於DMSO (10 mL)中之溶液在100 ℃下在密封管中在N2
氛圍下攪拌隔夜。濃縮所得混合物且藉由矽膠管柱純化殘餘物,得到呈黃色固體狀之N-((5-(2,2-二氟乙氧基)-3-((4-甲氧苯基)胺基)吡𠯤-2-基)甲基)-2-甲基-2H-吲唑-5-胺(250 mg,37%產率)。LC-MS (ESI):m/z
441 [M+H]+
。
步驟 F :
7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喋啶-2(1H)-酮
將N-((5-(2,2-二氟乙氧基)-3-((4-甲氧苯基)胺基)吡𠯤-2-基)甲基)-2-甲基-2H-吲唑-5-胺(280 mg,0.64 mmol,1.0當量)、CDI (206 mg,1.27 mmol,2.0當量)及t-BuOK (285 mg,2.55 mmol,4.0當量)於DMF (10 mL)中之溶液在50 ℃下攪拌4小時。濃縮所得混合物且藉由RP-製備型HPLC純化殘餘物,得到7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喋啶-2(1H)-酮( 實施例 180)
。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 8.36 (s, 1H), 7.93 (s, 1H), 7.76 (d, J = 1.2 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.37-7.22 (m, 3H), 7.04-6.99 (d, J = 8.8 Hz, 2H), 6.15 (tt, JHF
= 54.8 Hz, J = 3.6 Hz, 1H), 5.03 (s, 2H), 4.30-4.03 (m, 2H), 4.18 (s, 3H), 3.80 (s, 3H)。
LC-MS (ESI)
:m/z
467 [M+H]+
。
上文關於通用程序 III
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例181( 情況I) | 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS (ESI): m/z 470.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 7.93 (s, 1H), 7.76 (d, J = 1.6 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.37-7.18 (m, 3H), 7.01 (d, J = 8.8 Hz, 2H), 6.15 (tt, JHF = 55.2 Hz, J = 3.6 Hz, 1H), 5.03 (s, 2H), 4.29-4.01 (m, 2H), 4.17 (s, 3H). |
| 實施例182( 情況I) | 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS (ESI): m/z 503.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.37 (s, 1H), 7.96 (s, 1H), 7.77 (d, J = 1.6 Hz, 1H), 7.60 (d, J = 9.2 Hz, 1H), 7.46 (d, J = 8.8 Hz, 2H), 7.32-7.27 (m, 3H), 7.31 (t, JHF = 73.8 Hz, 1H), 6.15 (tt, JHF = 56 Hz, J = 3.6 Hz, 1H), 5.04 (s, 2H), 4.18 (td, JHF = 14.8 Hz, J = 3.6 Hz, 2H), 4.17 (s, 3H). |
| 實施例183( 情況I) | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS (ESI): m/z 467.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.37 (s, 1H), 7.83 (s, 1H), 7.77 (s, 1H), 7.60 (d, J = 9.2 Hz, 1H), 7.45 (d, J = 8.4 Hz, 2H), 7.32 (t, JHF = 74.8 Hz, 1H), 7.30-7.26 (m, 3H), 5.02 (s, 2H), 4.18 (s, 3H), 3.97 (q, J = 6.8 Hz, 2H), 1.13 (t, J = 6.8 Hz, 3H). |
| 實施例184( 情況II) 使用2,6-二氯-5-氟菸鹼酸作為起始物質。 | 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-6-氟-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 520.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 7.77 (d, J = 2.0 Hz, 1H), 7.70 (d, J = 2.0 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.43 (d, J = 9.2 Hz, 2H), 7.28 (t, JHF = 74.0 Hz, 1H), 7.29-7.23 (m, 3H), 6.07 (tt, JHF = 55.2 Hz, 4.0 Hz, 1H), 4.94 (s, 2H), 4.17 (s, 3H), 4.15 (td, JHF = 14.4 Hz, 4.0 Hz, 2H). |
| 實施例185( 情況III) 使用2,6-二氯-4-甲基菸鹼酸作為起始物質。 | 7-(2,2-二氟乙氧基)-1-(4-甲氧基-d3-苯基)-5-甲基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 483.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.73 (d, J = 1.6 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.22 (d, J = 8.8 Hz, 1H), 6.98 (d, J = 8.4 Hz, 2H), 6.41 (s, 1H), 5.97 (tt, JHF = 55.6 Hz, 4.0 Hz, 1H), 4.88 (s, 2H), 4.17 (s, 3H), 4.03 (td, JHF = 14.4 Hz, 4.0 Hz, 2H), 2.21 (s, 3H). |
| 實施例186( 情況I) | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(4-甲氧基苯基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS: m/z 443.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.81 (s, 1H), 7.42 (d, J = 8.8 Hz, 2H), 7.38 (d, J = 8.8 Hz, 2H), 7.31 (t, JHF = 74.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 2H), 6.97 (d, J = 8.8 Hz, 2H), 4.93 (s, 2H), 3.95 (q, J = 7.2 Hz, 2H), 3.77 (s, 3H), 1.12 (t, J = 7.2 Hz, 3H). |
| 實施例187( 情況IV) 使用4,6-二氯菸鹼酸作為起始物質。 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 466.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.99 (s, 1H), 7.70 (d, J = 1.2 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.46 (d, J =8.8 Hz, 2H), 7.35 (d, J= 8.8 Hz, 2H), 7.34 (t, JHF = 74.0 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 5.33 (s, 1H), 4.96 (s, 2H), 4.21 (q, J = 7.2 Hz, 2H), 4.17 (s, 3H), 1.21 (t, J = 7.2 Hz, 3H). |
| 實施例413 (情況I) | 1-(4-氯苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS: m/z 435 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.82 (s, 1H), 7.75 (s, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.52 (d, J = 8.6 Hz, 2H), 7.41 (d, J = 8.6 Hz, 2H), 7.29 (dd, J = 9.1 Hz, 1.6 Hz, 1H), 5.00 (s, 2H), 4.16 (s, 3H), 3.95 (q, J = 7.0 Hz, 2H), 1.13 (t, J = 7.0 Hz, 3H). |
| 實施例414 (情況I) | 1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS: m/z 520 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.41 (s, 1H), 7.80 (s, 1H), 7.68 (s, 1H), 7.64 (d, J = 8.8 Hz, 2H), 7.43 (d, J = 8.4 Hz, 2H), 7.36 (d, J = 9.0 Hz, 1H), 7.32 (t, JHF = 76.2 Hz, 1H), 7.30 (d, J = 8.4 Hz, 2H), 4.97 (s, 2H), 4.23 (s, 3H), 3.83-3.74 (m, 2H). |
| 實施例415 (情況I) | 1-(4-(二氟甲氧基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS: m/z 496 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.62 (s, 1H), 7.57 (t, J = 6.4 Hz, 1H), 7.39-7.31 (m, 4H), 7.27 (t, JHF = 74.4 Hz, 1H), 7.23 (d, J = 9.2 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 4.83 (s, 2H), 3.77 (s, 3H), 3.75-3.68 (m, 2H). |
| 實施例416 (情況I) | 1-(4-氯苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS: m/z 464 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 7.63 (s, 1H), 7.59 (t, J = 6.4 Hz, 1H), 7.49 (d, J = 8.4 Hz, 2H), 7.39-7.30 (m, 4H), 6.97 (d, J = 8.8 Hz, 2H), 4.83 (s, 2H), 3.77 (s, 3H), 3.76-3.69 (m, 2H). |
| 實施例417 (情況I) | 7-乙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喋啶-2(1H)-酮 | LC-MS: m/z 434 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 7.80 (s, 1H), 7.75 (s, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.32-7.24 (m, 3H), 7.00 (d, J = 8.8 Hz, 2H), 4.99 (s, 2H), 4.17 (s, 3H), 3.96 (q, J = 6.8 Hz, 2H), 1.14 (t, J = 7.2 Hz, 3H). |
| 實施例418 (情況IV) | 1-(4-氯苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 | LC-MS: m/z 434 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.99 (s, 1H), 7.70 (s, 1H), 7.62 (d, J = 7.6 Hz, 2H), 7.57 (d, J = 9.2 Hz, 1H), 7.44 (d, J = 8.0 Hz, 2H), 7.28 (d, J = 9.2 Hz, 1H), 5.35 (s, 1H), 4.96 (s, 2H), 4.21 (q, J = 6.8 Hz, 2H), 4.17 (s, 3H), 1.22 (t, J = 6.8 Hz, 3H). |
經由描繪為通用程序IV之流程獲得結構4.7
之化合物。以醛4.1
開始,使用還原胺化引入所需R3
基團以產生二胺4.2
。使二胺4.2
經歷CDI以形成環脲4.3
。隨後以兩種方式中之一者安置所需R1
及R2
。在方法A中,藉由與脲4.3
之銅介導之C-N偶合反應引入所需R2
基團(視情況經保護)以產生化合物4.4
。隨後將硫醇4.4
氧化成碸4.5
,且隨後使用鹼介導之芳族取代反應與所需R1
置換,得到化合物4.6
。若需要,隨後使化合物4.6
脫保護,得到化合物4.7
。在方法B中,將硫醇4.3
氧化成碸4.8
,且隨後使用鹼介導之芳族取代反應與所需R1
置換,得到化合物4.9
。隨後藉由與脲4.9
之銅介導之C-N偶合反應引入所需R2
基團(視情況經保護)以產生化合物4.6
。若需要,隨後使化合物4.6
脫保護,得到化合物4.7
。
步驟 A :
5-(((4-甲氧苯基)胺基)甲基)-2-(甲硫基)嘧啶-4-胺
將4-胺基-2-(甲硫基)嘧啶-5-甲醛(1.14 g,6.74 mmol,1.0當量)、4-甲氧基苯胺 (0.91 g,7.42 mmol,1.1當量)及AcOH (1.2 mL,20.23 mmol,3.0當量)溶解於DCE/MeOH (6 mL/6 mL)中,在室溫下攪拌3小時。隨後以若干份在0℃下添加NaBH3
CN (0.47 g,7.42 mmol,1.1當量),隨後將反應混合物升溫至室溫且攪拌隔夜。用冰水(10 mL)淬滅反應,且用DCM (20 mL × 3)萃取,經Na2
SO4
乾燥合併之有機層,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈灰色固體狀之 5-(((4-甲氧苯基)胺基)甲基)-2-(甲硫基)嘧啶-4-胺(1.7 g,91%產率)。LC-MS (ESI):m/z
277 [M+H]+
。
步驟 B :
3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將5-(((4-甲氧苯基)胺基)甲基)-2-(甲硫基)嘧啶-4-胺(0.83 g,3.0 mmol,1.0當量)溶解於於無水 DMF (20 mL)中。以若干份添加t-BuOK (1.35 g,1.2 mol,4.0當量)及CDI (0.97 g,6.01 mmol,2.0當量)。將反應混合物加熱至50℃且攪拌4小時。用冰水(20 mL)處理反應混合物,收集所得沈澱物且用H2
O (10 mL × 3)洗滌,減壓乾燥,得到呈白色固體狀之3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
5-(((4-甲氧苯基)胺基)甲基)-2-(甲硫基)嘧啶-4-胺(0.69 g,76%產率)。LC-MS (ESI):m/z
303 [M+H]+
。
步驟 C :
3-(4-甲氧基苯基)-7-(甲硫基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在室溫下向3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(
604 mg,2.0 mmol,1.0當量)於MeCN (8 mL)中之溶液中添加CuI(190 mg,1.0 mmol,0.5當量)、CsF (912 mg,6.0 mmol,3.0當量)、N1
,N2
-二甲基環己烷-1,2-二胺(284 mg,2.0 mmol,1.0當量)及3-(4-溴苯基)-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑(Ref:WO2008156726 A1) (850 mg,2.4 mmol,1.2當量),且將混合物在100℃下攪拌16小時。隨後用冰水(20 mL)淬滅反應混合物且用EtOAc (20 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物混合物,得到呈白色固體狀之3-(4-甲氧基苯基)-7-(甲硫基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(580 mg,50%產率)。LC-MS (ESI):m/z
576 [M+H]+
。
步驟 D :
3-(4-甲氧基苯基)-7-(甲磺醯基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在室溫下以若干份向3-(4-甲氧基苯基)-7-(甲硫基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(676 mg,1.1 mmol,1.0當量)於DCM (10 mL)中之溶液中添加m
-CPBA (571 mg,3.3 mmol,3.0當量)。將所得混合物在室溫下再攪拌2小時。隨後用NaHSO3
(飽和水溶液) (30 mL)淬滅過量m
-CPBA用DCM (10 mL × 3)萃取所得混合物。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之3-(4-甲氧基苯基)-7-(甲磺醯基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(600 mg,90%產率)。LC-MS (ESI):m/z
608 [M+H]+
。
步驟 E :
7-((2,2-二氟乙基)胺基)-3-(4-甲氧基苯基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在室溫下向3-(4-甲氧基苯基)-7-(甲磺醯基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(130 mg,0.21 mmol,1.0當量)於DMSO (5 mL)中之溶液中添加CsF (32 mg,0.21 mmol,1.0當量)、DIPEA (0.18 mL,1.07 mmol,5.0當量)及2,2,2-三氟乙胺(109 mg,1.1 mmol,5.0當量)。在密封管中將所得混合物在80℃下攪拌16小時。隨後用冰水(10 mL)淬滅反應混合物且用DCM (10 mL × 3)萃取。用鹽水(15 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之7-((2,2-二氟乙基)胺基)-3-(4-甲氧基苯基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(30 mg,23%產率)。LC-MS (ESI):m/z
609 [M+H]+
。
步驟 F :
1-(4-(1H-1,2,4-三唑-3-基)苯基)-7-((2,2-二氟乙基)胺基)-3-(4-甲氧基苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在0 ℃下向7-((2,2-二氟乙基)胺基)-3-(4-甲氧基苯基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(30 mg,0.05 mmol,1.0當量)於DCM (2 mL)中之溶液中添加TFA (0.5 mL)。隨後將反應混合物在室溫下攪拌5小時。減壓蒸發大部分溶劑。用MeOH (2 mL)稀釋殘餘物,添加濃 NH4
OH (0.5 mL)且在室溫下攪拌2小時。隨後減壓濃縮反應混合物。藉由RP-製備型HPLC純化殘餘物,得到1-(4-(1H-1,2,4-三唑-3-基)苯基)-7-((2,2-二氟乙基)胺基)-3-(4-甲氧基苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮( 實施例 188)
。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 14.23 (bs, 1H), 8.69-8.35 (m, 1H), 8.12-8.07 (m, 3H), 7.43 (d, J = 8.0 Hz, 2H), 7.69-7.08 (m, 1H), 7.36 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 5.88 (bs, 1H), 4.78 (s, 2H), 3.78 (s, 3H), 3.70-3.50 (m, 2H)。
LC-MS (ESI)
:m/z
479 [M+H]+
。
步驟 A :
3-(4-甲氧基苯基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在室溫下以若干份向3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(0.8 g,2.65 mmol,1.0當量)於DCM (20 mL)中之溶液中添加3-氯過氧苯甲酸(2.28 g,13.24 mmol,5.0當量)。將混合物在40℃下攪拌3小時。用NaHSO3
(飽和水溶液) (50 mL)淬滅反應混合物以消耗過量m
-CPBA,隨後用冰水(20 mL)淬滅反應混合物且用EtOAc (20 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,且藉由急驟矽膠管柱層析純化殘餘物混合物,得到呈白色固體狀之3-(4-甲氧基苯基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(0.8 g,90%產率)。LC-MS (ESI):m/z
335 [M+H]+
。
步驟 B :
3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在密封瓶中將3-(4-甲氧基苯基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(0.1 g,0.3 mmol,1.0當量)、CsF (0.14 g,0.9 mmol,3.0當量)、DIPEA (0.19 g,1.497 mmol,5.0當量)及2,2,2-三氟乙-1-胺(0.59 g,5.99 mmol,20當量)於DMSO (2 mL)中之混合物在80℃下攪拌24小時。隨後減壓移除過量2,2,2-三氟乙-1-胺,添加冰水(20 mL)且用EtOAc (10 mL × 3)萃取。用鹽水(10 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物混合物,得到呈棕色固體狀之3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(55 mg,52%產率)。LC-MS (ESI):m/z
354 [M+H]+
。
步驟 C :
3-(4-甲氧基苯基)-1-(4-(甲基磺醯基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
向3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(35 mg,0.1 mmol,1.0當量)及1-溴-4-(甲基磺醯基)苯(47 mg,0.2 mmol,2.0當量)於MeCN (2 mL)中之混合物中添加N1
,N2
-二甲基環己烷-1,2-二胺(17 mg,0.1 mmol,1.0當量)、CsF (27 mg,0.2 mmol,2.0當量)及CuI (11 mg,0.1 mmol,1.0當量)。將混合物在110℃下在微波照射下在N2
下氛圍攪拌1小時。使混合物冷卻至室溫且用水(15 mL)淬滅且用EtOAc (20 mL × 3)萃取 經Na2
SO4
乾燥合併之有機層,減壓濃縮,且藉由RP-製備型HPLC純化殘餘物,得到3-(4-甲氧基苯基)-1-(4-(甲基磺醯基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮( 實施例 189)
。
1 H NMR
(400 MHz, CDCl3
) δ (ppm): 8.04 (s, 1H), 8.03 (d, J = 8.6 Hz, 2H), 7.53 (d, J = 8.5 Hz, 2H), 7.28 (d, J = 8.9 Hz, 2H), 6.94 (d, J = 8.9 Hz, 2H), 5.23 (bs, 1H), 4.79 (s, 2H), 4.25-3.54 (m, 2H), 3.08 (s, 3H), 2.35 (s, 3H)。
LC-MS (ESI)
:m/z
508 [M+H]+
。
上文關於通用程序 IV ( 方法 A)
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例190 | 1-(4-(二氟甲氧基)苯基)-7-(乙胺基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 466.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 8.06 (s, 1H), 7.69 (d, J = 1.2 Hz, 1H), 7.57 (d, J = 8.8 Hz, 1H), 7.37 (d, J = 8.8 Hz, 2H), 7.30 (t, JHF = 74.0 Hz, 1H), 7.26 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.23 (d, J = 8.8 Hz, 2H), 6.83 (bs, 1H), 4.80 (s, 2H), 4.17 (s, 3H), 3.14-2.92 (m, 2H), 0.99-0.83 (m, 3H). |
| 實施例191 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(2,2,2-三氟乙氧基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 522.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 14.20 (bs, 1H), 8.62 (s, 1H), 8.39 (s, 1H), 8.38 (s, 1H), 8.12 (d, J = 8.0 Hz, 2H), 7.76 (d, J = 1.2 Hz, 1H), 7.61 (d, J = 8.8 Hz, 1H), 7.53-7.42 (m, 2H), 7.31 (dd, J = 9.2, 2.0 Hz, 1H), 5.00 (s, 2H), 4.83 (q, JHF = 9.2 Hz, 2H), 4.18 (s, 3H). |
| 實施例192 | 1-(4-(2H-1,2,3-三唑-4-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及4-(4-溴苯基)-2-((2-(三甲基矽烷基)乙氧基)甲基)-2H-1,2,3-三唑(Ref:WO2008156726 A1)合成) | LC-MS (ESI): m/z 497.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.38 (s, 1H), 8.13 (s, 1H), 7.92 (d, J = 8.4 Hz, 2H), 7.49 (bs, 1H), 7.38 (d, J = 8.4 Hz, 2H), 7.35 (d, J = 8.8 Hz, 2H), 6.97 (d, J = 8.8 Hz, 2H), 4.78 (s, 2H), 4.00-3.60 (m, 2H), 3.77 (s, 3H). |
| 實施例193 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 497.0 [M+H]+. 1H NMR (400 MHz, TFA-D1) δ: 9.38 (s, 1H), 8.14 (d, J = 8.0 Hz, 2H), 8.04 (s, 1H), 7.53 (d, J = 8.4 Hz, 2H), 7.23 (dd, J = 8.8 Hz, 1.6 Hz, 2H), 7.00 (dd, J = 8.8 Hz, 1.6 Hz, 2H), 4.87 (s, 2H), 3.84 (d, J = 1.6 Hz, 3H), 3.65 (q, J = 7.6 Hz, 2H). |
| 實施例194 | 3-(4-甲氧基苯基)-1-(1H-吡唑-4-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及4-溴-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-吡唑(Ref:Journal of Organic Chemistry, 81(2), 689-698; 2016)合成) | LC-MS (ESI): m/z 420.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 12.83 (s, 1H), 8.11 (s, 1H), 7.81 (s, 1H), 7.60 (s, 1H), 7.48 (s, 1H), 7.31 (dd, J = 6.8 Hz, 2.0 Hz, 2H), 7.96 (dd, J = 6.8 Hz, 2.0 Hz, 2H), 4.71 (s, 2H), 4.05-3.83 (m, 2H), 3.77 (s, 3H). |
| 實施例195 | 1-(4-(1H-吡唑-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及4-(4-溴苯基)-1-(四氫-2H-哌喃-2-基)-1H-吡唑(Ref:PCT Int. Appl., 2014151899, 2014年9月25日)合成) | LC-MS (ESI): m/z 496.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 13.32 and 12.93 (two sets of s, 1H in totals), 8.13 (s, 1H), 7.86 (d, J = 7.6 Hz, 2H), 7.78 (s, 1H), 7.54 (bs, 1H), 7.37-7.32 (m, 4H), 6.98 (d, J = 8.8 Hz, 2H), 6.75 (d, J = 2.0 Hz, 1H), 4.78 (s, 2H), 4.11-3.60 (m, 2H), 3.77 (s, 3H). |
| 實施例196 | 1-(4-(1H-咪唑-4-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及4-(4-溴苯基)-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-咪唑(Ref:PCT Int. Appl., 2010027500, 2010年3月11日)合成) | LC-MS (ESI): m/z 496.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.13 (d, J = 10.8 Hz, 2H), 7.81 (d, J = 8.0 Hz, 2H), 7.73 (s, 1H), 7.61 (s, 1H), 7.47 (bs, 1H), 7.34 (d, J = 8.8 Hz, 2H), 7.25 (d, J = 8.0 Hz, 2H), 6.97 (d, J = 8.8 Hz, 2H), 4.77 (s, 2H), 4.05-3.53 (m, 2H), 3.77 (s, 3H). |
| 實施例197 | 1-(6-羥基吡啶-3-基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及5-溴-1-((2-(三甲基矽烷基)乙氧基)甲基)吡啶-2(1H)-酮(Ref:PCT Int. Appl., 2015066188, 2015年5月07日)合成) | LC-MS (ESI): m/z 447.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 11.69 (s, 1H), 8.11 (s, 1H), 7.62 (bs, 1H), 7.42 (s, 1H), 7.37 (dd, J = 9.6 Hz, 2.8 Hz, 1H), 7.32 (d, J = 8.8 Hz, 2H), 6.97 (d, J = 8.8 Hz, 2H), 6.35 (d, J = 9.6 Hz, 1H), 4.72 (s, 2H), 4.10-3.67 (m, 2H), 3.77 (s, 3H). |
| 實施例419 | 7-(乙胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 433 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 8.03 (s, 1H), 7.68 (d, J = 1.6 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.25 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.22-7.15 (m, 2H), 7.01-6.93 (m, 2H), 6.80 (s, 1H), 4.78 (s, 2H), 4.16 (s, 3H), 3.08 (s, 2H), 0.99 (s, 3H). |
| 實施例420 | 7-((2,2-二氟乙基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 469 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 8.09 (s, 1H), 7.69 (d, J = 1.5 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.26 (dd, J = 9.2 Hz, 2.0 Hz, 2H), 7.22 (d, J = 8.8 Hz, 2H), 7.02-6.94 (m, 2H), 5.85 (br, 1H), 4.82 (s, 2H), 4.17 (s, 3H), 3.55 (s, 2H). |
上文關於通用程序 IV( 方法 B)
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例198 | 3-(4-甲氧基苯基)-1-(4-(甲硫基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 476.1 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 7.99 (s, 1H), 7.32 (d, J = 8.4 Hz, 2H), 7.28 (d, J = 8.8 Hz, 2H), 7.20 (d, J = 8.8 Hz, 2H), 6.92 (d, J = 8.8 Hz, 2H), 5.19 (s, 1H), 4.75 (s, 2H), 4.15-3.83 (m, 2H), 3.81 (s, 3H), 2.51 (s, 3H). |
| 實施例199 | 3-(4-甲氧基苯基)-1-(4-丙醯基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 486.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.14 (s, 1H), 8.04 (d, J = 8.0 Hz, 2H), 7.45 (bs, 1H), 7.47 (d, J = 8.0 Hz, 2H), 7.35 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 4.79 (s, 2H), 4.15-3.62 (m, 2H), 3.77 (s, 3H), 3.09 (q, J = 7.2 Hz, 2H), 1.12 (t, J = 7.2 Hz, 3H). |
| 實施例200 | 1-(苯并[b]噻吩-2-基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 486.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.18 (s, 1H), 7.95-7.92 (m, 1H), 7.86-7.83 (m, 1H), 7.63 (bs, 1H), 7.40-7.37 (m, 3H), 7.36 (d, J = 9.2 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 4.78 (s, 2H), 4.15-3.72 (m, 2H), 3.77 (s, 3H). |
| 實施例201 | 1-(4-(二甲胺基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 473.2 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 7.96 (s, 1H), 7.29 (d, J = 9.2 Hz, 2H), 7.12 (d, J = 8.8 Hz, 2H), 6.91 (d, J = 9.2 Hz, 2H), 6.76 (d, J = 9.2 Hz, 2H), 5.20 (t, J = 6.8 Hz, 1H), 4.74 (s, 2H), 4.01-3.85 (m, 2H), 3.81 (s, 3H), 2.98 (s, 6H). |
| 實施例202 | 1-(4-(羥甲基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 460.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.12 (s, 1H), 7.47 (bs, 1H), 7.37 (d, J = 8.4 Hz, 2H), 7.33 (d, J = 8.8 Hz, 2H), 7.23 (d, J = 8.0 Hz, 2H), 6.97 (d, J = 9.2 Hz, 2H), 5.31 (t, J = 5.2 Hz, 1H), 4.76 (s, 2H), 4.54 (d, J = 5.2 Hz, 2H), 4.05-3.85 (m, 2H), 3.77 (s, 3H). |
| 實施例203 | 4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯 | LC-MS (ESI): m/z 488.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.14 (s, 1H), 8.03 (d, J = 8.4 Hz, 2H), 7.52 (bs, 1H), 7.48 (d, J = 8.4 Hz, 2H), 7.35 (d, J = 9.2 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 4.78 (s, 2H), 3.89 (s, 3H), 3.77 (s, 3H), 4.00-3.50 (m, 2H). |
| 實施例204 | 1-(4-胺基苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 445.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.12 (s, 1H), 7.51 (bs, 1H), 7.37 (d, J = 8.8 Hz, 2H), 7.01 (d, J = 8.8 Hz, 2H), 6.92 (d, J = 8.4 Hz, 2H), 6.63 (d, J = 8.4 Hz, 2H), 5.19 (bs, 2H), 4.77 (s, 2H), 4.15-3.78 (m, 2H), 3.82 (s, 3H). |
| 實施例205 | 2-(4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯基)乙酸甲酯 | LC-MS (ESI): m/z 502.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.12 (s, 1H), 7.48 (bs, 1H), 7.34 (d, J = 8.8 Hz, 4H), 7.24 (d, J = 8.0 Hz, 2H), 6.97 (d, J = 8.8 Hz, 2H), 4.76 (s, 2H), 4.14-3.80 (m, 2H), 3.77 (s, 3H), 3.74 (s, 2H), 3.64 (s, 3H). |
| 實施例206 | 1-(4-(2-羥乙基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 474.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.10 (s, 1H), 7.45 (bs, 1H), 7.33 (d, J = 8.8 Hz, 2H), 7.27 (d, J = 8.0 Hz, 2H), 7.17 (d, J = 8.4 Hz, 2H), 6.96 (d, J = 9.2 Hz, 2H), 4.75 (s, 2H), 4.70 (s, 1H), 4.12-3.78 (m, 2H), 3.76 (s, 3H), 3.64 (s, 2H), 2.77 (t, J = 7.2 Hz, 2H). |
| 實施例207 | 1-(4-(異噻唑-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 513.1 [M+H]+. 1H NMR (400 MHz, CDCl3-d) δ: 8.42 (d, J = 1.6 Hz, 1H), 7.96 (s, 1H), 7.62 (d, J = 8.4 Hz, 2H), 7.37 (d, J = 1.6 Hz, 1H), 7.32 (d, J = 8.4 Hz, 2H), 7.23 (d, J = 8.8 Hz, 2H), 6.87 (d, J = 8.8 Hz, 2H), 5.11 (bs, 1H), 4.71 (s, 2H), 3.95-3.57 (m, 2H), 3.75 (s, 3H). |
| 實施例208 | 1-(3-甲氧基苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 460.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.10 (s, 1H), 7.50 (br s, 1H), 7.37-7.29 (m, 3H), 6.99-6.92 (m, 3H), 6.90-6.83 (m, 2H), 4.75 (s, 2H), 4.06-3.67 (m, 2H), 3.76 (s, 3H), 3.75 (s, 3H). |
| 實施例209 | 1-(4-(甲氧基甲基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 474.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.10 (s, 1H), 7.50 (br s, 1H), 7.37 (d, J = 8.4 Hz, 2H), 7.33 (d, J = 8.8 Hz, 2H), 7.26 (d, J = 7.6 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 4.76 (s, 2H), 4.45 (s, 2H), 4.03-3.60 (m, 2H), 3.76 (s, 3H), 3.32 (s, 3H). |
| 實施例210 | 3-(4-甲氧基苯基)-1-(4-(噻唑-4-基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 513.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.22 (d, J = 1.6 Hz, 1H), 8.23 (d, J = 2.0 Hz, 1H), 8.13 (s, 1H), 8.05 (d, J = 8.8 Hz, 2H), 7.49 (br s, 1H), 7.45-7.32 (m, 4H), 6.97 (d, J = 8.8 Hz, 2H), 4.78 (s, 2H), 4.05-3.60 (m, 2H), 3.77 (s, 3H). |
| 實施例211 | 1-(4-(1H-吡唑-4-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 496.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 12.97 (br s, 1H), 8.35-7.88 (m, 2H), 8.12 (s, 1H), 7.66 (d, J = 8.8 Hz, 2H), 7.50 (br s, 1H), 7.34 (d, J = 8.8 Hz, 2H), 7.26 (d, J = 8.4 Hz, 2H), 6.97 (d, J = 8.8 Hz, 2H), 4.77 (s, 2H), 4.09-3.65 (m, 2H), 3.77 (s, 3H). |
| 實施例212 | 1-(4-異丙基苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 472.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.10 (s, 1H), 7.50 (br s, 1H), 7.33 (d, J = 9.2 Hz, 1H), 7.30 (d, J = 8.0 Hz, 2H), 7.18 (d, J = 8.0 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 4.76 (s, 2H), 4.13-3.53 (m, 2H), 3.70 (s, 3H), 2.94 (hept, J = 6.8 Hz, 1H), 1.23 (d, J = 6.8 Hz, 6H). |
| 實施例213 | 1-(4-環丙基苯基)-3-(咪唑并[1,2-a]吡啶-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 480.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.74 (s, 1H), 8.15 (s, 1H), 8.12 (s, 1H), 7.96 (s, 1H), 7.62-7.54 (m, 2H), 7.35 (dd, J = 9.6 Hz, 2.0 Hz, 1H), 7.16 (d, J = 8.8 Hz, 2H), 7.13 (d, J = 8.8 Hz, 2H), 4.84 (s, 2H), 4.05-3.60 (m, 2H), 1.98-1.90 (m, 1H), 1.00-0.95 (m, 2H), 0.71-0.65 (m, 2H). |
經由描繪為通用程序V之流程獲得結構5.7
之化合物。以芳基氯5.1
開始,使用鹼介導之芳族取代反應引入所需R1
基團以產生5.2
。藉由與脲5.2
之銅介導之C-N偶合反應引入所需R2
基團(視情況經保護)以產生化合物5.3 。
使用氫化條件將腈5.3
還原為胺5.4
。使用CDI將二胺5.4
轉化為環脲5.5
。藉由與脲5.5
之銅介導之C-N偶合反應引入所需R3
基團(視情況經保護)以產生化合物5.6 。
若需要,使化合物5.6
脫保護,得到化合物5.7
。
步驟 A :
4-胺基-2-((2,2,2-三氟乙基)胺基)嘧啶-5-甲腈
在室溫下向4-胺基-2-氯嘧啶-5-甲腈(1.0 g,6.5 mmol,1.0當量)於DMSO (10 mL)中之溶液中添加2,2,2-三氟乙-1-胺(1.9 g,19.5 mmol,3.0當量)及DIPEA (2.5 g,19.5 mmol,3.0當量),且將反應混合物在密封管中在80℃下攪拌2小時。隨後用冰水(30 mL)淬滅反應混合物且用EtOAc (50 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-胺基-2-((2,2,2-三氟乙基)胺基)嘧啶-5-甲腈(1.3 g,93%產率)。LC-MS (ESI):m/z
218 [M+H]+
。
步驟 B :
2-((2,2,2-三氟乙基)胺基)-4-((4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)胺基)嘧啶-5-甲腈
在室溫下向4-胺基-2-((2,2,2-三氟乙基)胺基)嘧啶-5-甲腈(
1.1 g,5.1 mmol,1.0當量)於MeCN (10 mL)中之溶液中添加CuI(960 mg,5.1 mmol,1.0當量)、CsF (2.3 g,15.3 mmol,3.0當量)、N1
,N2
-二甲基環己烷-1,2-二胺(1.1 g,7.7 mmol,1.5當量)及3-(4-溴苯基)-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑(Ref:WO2008156726 A1)(
2.7 g,7.7 mmol,1.5當量),且將所得混合物在100℃下再攪拌16小時。隨後用冰水(30 mL)淬滅反應混合物且用EtOAc (50 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之2-((2,2,2-三氟乙基)胺基)-4-((4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)胺基)嘧啶-5-甲腈(1.8 g,72%產率)。LC-MS (ESI):m/z
491 [M+H]+
。
步驟 C :
5-(胺甲基)-N2-(2,2,2-三氟乙基)-N4-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)嘧啶-2,4-二胺
在室溫下向2-((2,2,2-三氟乙基)胺基)-4-((4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)胺基)嘧啶-5-甲腈(800 mg,1.6 mmol,1.0當量)於NH3
-THF (7 mol/L,10 mL,7.0 mmol,4.4當量)中之溶液中添加雷尼鎳(180 mg)。將反應混合物在室溫下伴隨H2
氣囊(1 atm)攪拌16小時。完成後,藉由過濾移除催化劑,且減壓濃縮濾液,得到呈白色固體狀之粗5-(胺甲基)-N2-(2,2,2-三氟乙基)-N4-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)嘧啶-2,4-二胺(800 mg),其不經進一步純化即用於下一步驟。LC-MS (ESI):m/z
495 [M+H]+
。
步驟 D :
7-((2,2,2-三氟乙基)胺基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在室溫下向5-(胺甲基)-2-(甲硫基)-N-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)嘧啶-4-胺(800 mg,1.6 mmol,1.0當量)於DCM (10 mL)中之溶液中添加CDI (520 mg,3.2 mmol,2.0當量)及t-BuOK (718 mg,6.4 mmol,4.0當量)。且將反應混合物在室溫下攪拌16小時。隨後用冰水(30 mL)淬滅反應混合物且用DCM (30 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮。藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之7-((2,2,2-三氟乙基)胺基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(750 mg,90%產率)。LC-MS (ESI):m/z
521 [M+H]+
。
步驟 E :
3-(2,3-二氫苯并[b][1,4]二氧雜環己烯-6-基)-7-((2,2,2-三氟乙基)胺基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在室溫下向7-((2,2,2-三氟乙基)胺基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(
50 mg,0.1 mmol,1.0當量)於MeCN (2 mL)中之溶液中添加CuI(20 mg,0.1 mmol,1.0當量)、CsF (46 mg,0.3 mmol,3.0當量)、N1
,N2
-二甲基環己烷-1,2-二胺(21 mg,0.15 mmol,1.5當量)及6-溴-2,3-二氫苯并[b][1,4]二氧雜環己烯(
32 mg,0.15 mmol,1.5當量),且將所得混合物在90℃下攪拌16小時。隨後用冰水(30 mL)淬滅反應混合物且用EtOAc (30 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之3-(2,3-二氫苯并[b][1,4]二氧雜環己烯-6-基)-7-((2,2,2-三氟乙基)胺基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(50 mg,77%產率)。LC-MS (ESI):m/z
655 [M+H]+
。
步驟 F :
1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2,3-二氫苯并[b][1,4]二氧雜環己烯-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在室溫下向3-(2,3-二氫苯并[b][1,4]二氧雜環己烯-6-基)-7-((2,2,2-三氟乙基)胺基)-1-(4-(1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-1,2,4-三唑-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(50 mg,0.08 mmol,1.0當量)於DCM(3 mL)中之溶液中添加TFA (0.5 mL)。將所得混合物再攪拌16小時。在減壓下蒸發大部分溶劑,用MeOH (1 mL)稀釋殘餘物,添加濃 NH4
OH (0.5 mL),且在室溫下攪拌2小時。隨後減壓濃縮反應混合物。藉由RP-製備型HPLC純化粗殘餘物,得到1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2,3-二氫苯并[b][1,4]二氧雜環己烯-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮( 實施例 214)
。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 14.16 (s, 1H), 8.46 (s, 1H), 8.12 (s, 1H), 8.07 (d, J = 8.4 Hz, 2H), 7.53-7.41 (m, 3H), 6.97 (s, 1H), 6.89 (s, 2H), 4.76 (s, 2H), 4.26 (s, 4H), 4.10-3.52 (m, 2H)。
LC-MS (ESI)
:m/z
525 [M+H]+
。
上文關於通用程序 V
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例215 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(4-(甲氧基-d3)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 500.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.41 (s, 1H), 8.08 (s, 1H), 8.05 (d, J = 8.4 Hz, 2H), 7.38 (d, J = 8.0 Hz, 2H), 7.31 (d, J = 8.8 Hz, 2H), 6.95 (d, J = 8.2 Hz, 2H), 4.74 (s, 2H), 3.86-3.58 (m, 2H). |
| 實施例216 | 1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 520.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 8.14 (s, 1H), 7.71 (d, J = 1.2 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.45 (bs, 1H), 7.38 (d, J = 8.4 Hz, 2H), 7.30 (t, JHF = 74.4 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.24 (d, J = 8.8 Hz, 2H), 4.84 (s, 2H), 4.17 (s, 3H), 4.08-3.57 (m, 2H). |
| 實施例217 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基苯并[d]噻唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 538.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 14.20 (bs, 1H), 8.60 (bs, 1H), 8.16 (s, 1H), 8.13 (d, J = 2.0 Hz, 1H), 8.08 (d, J = 8.4 Hz, 2H), 7.93 (d, J = 8.8 Hz, 1H), 7.56 (dd, J = 8.8 Hz, 2.4 Hz, 1H), 7.50-7.38 (m, 3H), 4.91 (s, 2H), 4.08-3.55 (m, 2H), 2.81 (s, 3H). |
| 實施例218 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 521.0 [M+H]+。 1H NMR (400 MHz, DMSO-d6 ) δ: 14.50及14.13 (兩組s, 總共1H), 8.64及8.08 (兩組s, 總共1H), 8.23 (s, 1H), 8.16 (s, 1H), 8.10-8.06 (m, 2H), 7.69-7.65 (m, 2H), 7.52 (bs, 1H), 7.50 (d, J = 8.0 Hz, 1H), 7.40 (d, J = 8.4 Hz, 1H), 7.29 (dd, J = 8.4 Hz, 2.0 Hz, 1H), 4.89 (s, 2H), 4.10-3.68 (m, 2H), 3.84 (s, 3H). |
| 實施例219 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(苯并[d]噻唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 524.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.41 (s, 1H), 8.46 (s, 1H), 8.27 (d, J = 2.0 Hz, 1H), 8.17 (s, 1H), 8.11 (d, J = 8.8 Hz, 1H), 8.09 (d, J = 8.4 Hz, 2H), 7.65 (dd, J = 8.8, 2.0 Hz, 1H), 7.54 (bs, 1H), 7.46 (d, J = 8.4 Hz, 2H), 4.93 (s, 2H), 3.94-3.70 (m, 2H). |
| 實施例220 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 521.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 14.19 (bs, 1H), 8.62-8.40 (m, 1H), 8.37 (s, 1H), 8.16 (s, 1H), 8.08 (d, J = 8.4 Hz, 2H), 7.73 (d, J = 1.6 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.46 (bs, 1H), 7.44 (d, J = 7.6 Hz, 2H), 7.29 (dd, J = 9.2 Hz, 1.6 Hz, 1H), 4.87 (s, 2H), 4.18 (s, 3H), 4.03-3.53 (m, 2H). |
| 實施例221 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(1-甲基-6-側氧基-1,6-二氫吡啶-3-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 498.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.43 (s, 1H), 8.13 (s, 1H), 8.07 (d, J = 8.4 Hz, 2H), 7.93 (d, J = 2.8 Hz, 1H), 7.56 (dd, J = 9.6, 2.8 Hz, 1H), 7.50 (bs, 1H), 7.38 (d, J = 8.0 Hz, 2H), 6.42 (d, J = 9.6 Hz, 1H), 4.73 (s, 2H), 4.00-3.50 (m, 2H), 3.44 (s, 3H). |
| 實施例222 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(咪唑并[1,2-a]吡啶-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 507.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.78 (d, J = 1.2 Hz, 1H), 8.47 (s, 1H), 8.25 (bs, 1H), 8.16 (s, 1H), 8.09 (d, J = 8.8 Hz, 2H), 7.98 (s, 1H), 7.62-7.59 (m, 2H), 7.44 (d, J = 8.0 Hz, 2H), 7.39 (dd, J = 9.6 Hz, 2.0 Hz, 1H), 4.88 (s, 2H), 3.41-3.38 (m, 2H). |
| 實施例223 | 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(喹啉-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 518.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.90 (dd, J = 4.4 Hz, 1.6 Hz, 1H), 8.47 (s, 1H), 8.39 (d, J = 8.4 Hz, 1H), 8.20 (s, 1H), 8.11 (d, J = 8.4 Hz, 2H), 8.04-8.01 (m, 2H), 7.90 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.58-7.55 (m, 1H), 7.50 (bs, 1H), 7.49 (d, J = 8.0 Hz, 2H), 5.01 (s, 2H), 4.07-4.82 (m, 2H). |
| 實施例224 | 1-(4-(二氟甲氧基)苯基)-3-(嗒𠯤-4-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 468.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 9.43 (s, 1H), 9.20 (d, J = 5.6 Hz, 1H), 8.20 (s, 1H), 7.69-7.67 (m, 1H), 7.55 (bs, 1H), 7.45 (d, J = 8.4 Hz, 2H), 7.33 (t, JHF = 74.0 Hz, 1H), 7.29 (d, J = 8.4 Hz, 2H), 4.97 (s, 2H), 4.10-3.58 (m, 2H). |
| 實施例225 | 1-(4-(二氟甲氧基)苯基)-3-(咪唑并[1,2-a]吡啶-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 506.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 , 0.6 HCO2H salt) δ: 8.81 (s, 1H), 8.15 (s, 1H), 8.14 (HCO2H, s, 0.6H), 8.03 (s, 1H), 7.70 (s, 1H), 7.65 (d, J = 9.6 Hz, 1H), 7.53 (bs, 1H), 7.49-7.46 (m, 1H), 7.39 (d, J = 8.4 Hz, 2H), 7.30 (t, JHF = 74.0 Hz, 1H), 7.26 (d, J = 8.8 Hz, 2H), 4.86 (s, 2H), 4.07-3.28 (m, 2H). |
| 實施例226 | 1-(4-環丙基苯基)-3-(喹啉-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 491.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.89 (dd, J = 4.4 Hz, 1.6 Hz, 1H), 8.38 (d, J = 8.8 Hz, 1H), 8.17 (s, 1H), 8.02-7.99 (m, 2H), 7.86 (dd, J = 9.2 Hz, 2.4 Hz, 1H), 7.56 (dd, J = 8.4 Hz, 4.0 Hz, 1H), 7.21 (d, J = 8.4 Hz, 2H), 7.15 (d, J = 8.4 Hz, 2H), 4.98 (s, 2H), 3.98-3.70 (m, 2H), 2.05-1.89 (m, 1H), 1.02-0.94 (m, 2H), 0.72-0.68 (m, 2H). |
| 實施例227 | 1-(4-(二氟甲氧基)苯基)-3-(喹啉-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 517.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.90 (dd, J = 4.0 Hz, 1.6 Hz, 1H), 8.38 (d, J = 8.0 Hz, 1H), 8.19 (s, 1H), 8.02 (d, J = 8.4 Hz, 1H), 8.01 (s, 1H), 7.88 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.57 (dd, J = 8.0 Hz, 4.0 Hz, 1H), 7.50 (bs, 1H), 7.44 (d, J = 8.8 Hz, 2H), 7.32 (t, JHF = 73.6 Hz, 1H), 7.27 (d, J = 8.8 Hz, 2H), 5.00 (s, 2H), 4.00-3.50 (m, 2H). |
| 實施例228 | 1-(4-甲氧基苯基)-3-(2-甲氧基吡啶-4-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 461.2[M+H]+. 1H NMR (400 MHz, CDCl3-d) δ: 8.04 (d, J = 6.0 Hz, 1H), 7.98 (s, 1H), 7.13 (d, J = 9.2 Hz, 2H), 6.97 (dd, J = 5.6 Hz, 2.0 Hz, 1H), 6.93 (d, J = 8.8 Hz, 2H), 6.64 (d, J = 2.0 Hz, 1H), 5.14 (bs, 1H), 4.73 (s, 2H), 3.92-3.78 (m, 2H), 3.88 (s, 3H), 3.79 (s, 3H). |
| 實施例229 | 3-([1,2,4]三唑[4,3-a]吡啶-6-基)-1-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 471 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 8.80 (s, 1H), 8.27 (d, J = 0.8 Hz, 1H), 8.06 (s, 1H), 7.81 (d, J = 10.0 Hz, 1H), 7.38 (dd, J = 10.0 Hz, 2.0 Hz, 1H), 7.19 (d, J = 8.8 Hz, 2H), 7.00 (d, J = 8.8 Hz, 2H), 5.27 (bs, 1H), 4.83 (s, 2H), 4.13-3.66 (m, 2H), 3.86 (s, 3H). |
| 實施例230 | 1-(4-甲氧基苯基)-3-(吡啶-4-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 431.0 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 8.61 (s, 2H), 8.09 (s, 1H), 7.47 (s, 2H), 7.20 (d, J = 8.8 Hz, 2H), 7.01 (d, J = 8.8 Hz, 2H), 5.35 (bs, 1H), 4.87 (s, 2H), 4.18-3.67 (m, 2H), 3.86 (s, 3H). |
| 實施例231 | 1-(4-甲氧基苯基)-3-(1H-吡唑-4-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 (經由通用程序 V (步驟F )由4-碘-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-吡唑合成且用TFA脫保護) | LC-MS (ESI): m/z 420.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 12.75 (bs, 1H), 8.13 (s, 1H), 7.82 (s, 2H), 7.44 (s, 1H), 7.18 (d, J = 8.8 Hz, 2H), 6.99 (d, J = 8.9 Hz, 2H), 4.81 (s, 2H), 4.14-3.66 (m, 2H), 3.80 (s, 3H). |
| 實施例232 | 1-(4-甲氧基苯基)-3-(1-甲基-6-側氧基-1,6-二氫吡啶-3-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 461.0 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 8.01 (s, 1H), 7.44 (d, J = 2.8 Hz, 1H), 7.39 (dd, J = 9.6 Hz, 3.2 Hz, 1H), 7.15 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 6.61 (d, J = 9.6 Hz, 1H), 5.26 (bs, 1H), 4.68 (s, 2H), 4.03-3.68 (m, 2H), 3.85 (s, 3H), 3.54 (s, 3H). |
| 實施例233 | 1-(4-甲氧基苯基)-3-(喹㗁啉-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 482.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.96 (d, J = 1.6 Hz, 1H), 8.93 (d, J = 1.6 Hz, 1H), 8.18 (s, 1H), 8.08 (d, J = 9.2 Hz, 1H), 8.07 (s, 1H), 8.01 (dd, J = 9.2 Hz, 2.4 Hz, 1H), 7.55 (bs, 1H), 7.29 (d, J = 8.8 Hz, 2H), 7.01 (d, J = 8.8 Hz, 2H), 5.05 (s, 2H), 4.13-3.65 (m, 2H), 3.80 (s, 3H). |
| 實施例234 | 3-(1H-苯并[d]咪唑-5-基)-1-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 (經由通用程序 V (步驟F )由5-溴-1-((2-(三甲基矽烷基)乙氧基)甲基)-1H-苯并[d]咪唑合成且用TFA脫保護) | LC-MS (ESI): m/z 470.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35-8.21 (m, 2H), 8.11 (s, 1H), 7.72-7.58 (m, 2H), 7.53-7.37 (m, 1H), 7.32-7.17 (m, 1H), 7. 22 (d, J = 8.0 Hz, 2H), 6.98 (d, J = 8.0 Hz, 2H), 4.84 (s, 2H), 3.79 (s, 3H), 4.00-3.50 (m, 2H). |
| 實施例421 | 1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 487 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 8.11 (s, 1H), 7.69 (d, J = 1.4 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.48 (s, 1H), 7.26 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.21 (d, J = 8.8 Hz, 2H), 7.02-6.93 (m, 2H), 4.83 (s, 2H), 4.17 (s, 3H), 3.92 (s, 2H). |
| 實施例422 | 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 484 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 8.11 (s, 1H), 7.69 (s, 1H), 7.57 (d, J = 9.1 Hz, 1H), 7.44 (s, 1H), 7.26 (dd, J = 9.1 Hz, 1.8 Hz, 1H), 7.21 (d, J = 8.7 Hz, 2H), 6.98(d, J = 8.8 Hz, 2H), 4.83 (s, 2H), 4.17 (s, 3H), 3.95 (s, 2H), 3.78 (s, 3H). |
| 實施例423 | 1-(4-(甲氧基-d3)苯基)-3-(2-(甲基-d3)-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 490 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 8.11 (s, 1H), 7.69 (d, J = 1.4 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.45 (s, 1H), 7.26 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.21 (d, J = 8.8 Hz, 2H), 6.97 (d, J = 8.9 Hz, 2H), 4.83 (s, 2H), 3.89 (s, 2H). |
| 實施例424 | 1-(4-(二氟甲氧基)苯基)-3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 534 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.14 (s, 1H), 7.56 (d, J = 1.7 Hz, 1H), 7.51 (d, J = 8.5 Hz, 1H), 7.29 (t, JHF = 76 Hz, 1H), 7.38-7.11 (m, 5H), 4.84 (s, 2H), 3.73 (s, 2H), 3.71(s, 3H), 2.52 (s, 3H). |
經由描繪為通用程序VI之流程獲得結構6.6
之化合物。以醛6.1
開始,使用還原胺化引入所需R3
基團以產生化合物6.2
。藉由使胺6.2
與合適異氰酸酯反應引入所需R2
基團以產生非環脲6.3
。使用鹼介導之芳族取代反應將非環脲6.3
轉化為環脲6.4
。隨後將芳基硫醇6.4
氧化成碸6.5
,且使用鹼介導之芳族取代反應引入所需R1
基團(視情況經保護,當X = NH時),得到化合物6.6
。
步驟 A :
N-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-4-甲氧基苯胺
將4-氯-2-(甲硫基)嘧啶-5-甲醛(0.94 g,5.0 mmol,1.0當量)、4-甲氧基苯胺(0.62 g,5.0 mmol,1.0當量)及AcOH (0.9 mL,15.0 mmol,3.0當量)溶解於DCE (6 mL)中,將所得混合物在室溫下攪拌3小時,隨後在0℃下以若干份添加NaBH(OAc)3
(1.17 g,5.5 mmol,1.1當量),添加之後,將反應混合物升溫至室溫且攪拌隔夜。用冰水(10 mL)淬滅反應混合物且用DCM (20 mL × 3)萃取,用鹽水(30 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈灰色固體狀之N-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-4-甲氧基苯胺 (1.33 g,90%產率)。LC-MS (ESI):m/z
296 [M+H]+
。
步驟 B :
1-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-3-(4-(二氟甲氧基)苯基)-1-(4-甲氧苯基)脲
向N-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-4-甲氧基苯胺(130 mg,0.44 mmol,1.0當量)於DCM (5 mL)中之溶液添加1-(二氟甲氧基)-4-異氰酸酯基苯(163 mg,0.88 mmol,2.0當量)且在室溫下攪拌隔夜。隨後減壓濃縮反應混合物,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之1-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-3-(4-(二氟甲氧基)苯基)-1-(4-甲氧苯基)脲(120 mg,57%產率)。LC-MS (ESI):m/z
481 [M+H]+
。
步驟 C :
1-(4-(二氟甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
向1-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-3-(4-(二氟甲氧基)苯基)-1-(4-甲氧苯基)脲(120 mg,0.25 mmol,1.0當量)於THF (5 mL)中之溶液添加t-BuOK (84 mg,0.75 mmol,3.0當量)且在室溫下攪拌1小時。隨後用冰水(10 mL)處理反應混合物,用EtOAc (10 mL × 3)萃取,經Na2
SO4
乾燥合併之有機層,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色油狀之1-(4-(二氟甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(80 mg,72%產率)。LC-MS (ESI):m/z
445 [M+H]+
。
1-(4-(二氟甲氧基)苯基)-3-(4-甲氧基苯基)-7-(2,2,2-三氟乙胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 235
)係由1-(4-(二氟甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及2,2,2-三氟乙胺經由通用程序 IV
(步驟 D 、 E
)合成。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 8.12 (s, 1H), 7.69-7.39 (m, 1H), 7.38-7.31 (m, 4H), 7.30 (t, JHF
= 74.0 Hz, 1H), 7.24 (d, J = 8.8 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 4.76 (s, 2H), 4.19-3.49 (m, 2H), 3.77 (s, 3H)。
LC-MS (ESI)
:m/z
496 [M+H]+
。
1-(4-溴苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在0℃下向(2,2,2-三氟乙基)胺基甲酸第三丁酯(150 mg,0.753 mmol)於THF (2.510 ml)中之溶液中添加氫化鈉(36.1 mg,0.904 mmol)且攪拌10分鐘,隨後再升溫至室溫30分鐘。將0.5 ml此混合物(約0.15 mmol,1.5當量)逐滴添加至含有1-(4-溴苯基)-3-(4-甲氧基苯基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(50 mg,0.102 mmol,1.0當量,使用通用程序VI步驟A至D產生)於THF (0.5 ml)中之溶液之另一反應瓶中,且將所得反應混合物攪拌30分鐘直至藉由LCMS監測反應完成以形成(8-(4-溴苯基)-6-(4-甲氧基苯基)-7-側氧基-5,6,7,8-四氫嘧啶并[4,5-d]嘧啶-2-基)(2,2,2-三氟乙基)胺基甲酸第三丁酯。向此反應混合物添加HCl (150 µl,0.600 mmol)之二㗁烷溶液,隨後再將所得混合物加熱至60℃持續30分鐘直至完成Boc脫保護。隨後用固態碳酸氫鈉(86 mg,1.022 mmol)淬滅反應且與矽膠混合。濃縮之後移除有機溶劑。將粗物質乾載且藉由管柱層析純化,得到1-(4-溴苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮。(實施例 236
)
1H NMR
(400 MHz, 氯仿-d) δ 8.00 (s, 1H), 7.57 (d, J = 8.7 Hz, 2H), 7.28 (d, J = 9.0 Hz, 2H), 7.17 (d, J = 8.7 Hz, 2H), 6.93 (d, J = 9.0 Hz, 2H), 5.14 (brs, 1H), 4.75 (s, 2H), 3.90 (brs, 2H), 3.81 (s, 3H)。
LC-MS (ESI)
: m/z 510.0 [M+H]+
。
上文關於通用程序 VI
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例237 | 3-(咪唑并[1,2-a]吡啶-6-基)-1-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4,4a,8a-四氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 470.2 [M+H]+. 1H NMR (400 MHz, DMSO) δ: 8.75 (d, J = 1.2 Hz, 1H), 8.35 (s, 1H), 8.12 (s, 1H), 7.96 (s, 1H), 7.61 (d, J = 1.0 Hz, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.36 (dd, J = 9.6 Hz, 2.0 Hz, 1H), 7.21 (d, J = 8.8 Hz, 2H), 6.99 (d, J = 9.2 Hz, 2H), 4.84 (s, 2H), 4.15-3.86 (m, 2H), 3.79 (s, 3H). |
| 實施例238 | 1-(4-甲氧基苯基)-3-(5-甲氧基吡啶-2-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 461.0 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 8.10 (d, J = 3.2 Hz, 1H), 8.07 (s, 1H), 7.72 (d, J = 8.8 Hz, 1H), 7.23 (dd, J = 9.2 Hz, 3.2 Hz, 1H), 7.21 (d, J = 8.8 Hz, 2H), 7.00 (d, J = 8.8 Hz, 2H), 5.22-5.11 (m, 1H), 5.02 (s, 2H), 4.01-3.91 (m, 2H), 3.86 (s, 3H), 3.85 (s, 3H). |
| 實施例239 | 1-(4-甲氧基苯基)-3-(6-甲氧基吡啶-3-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 461.2 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.23 (d, J = 2.4 Hz, 1H), 8.10 (s, 1H), 7.79 (dd, J = 8.8 Hz, 2.8 Hz, 1H), 7.45 (s, 1H), 7.20 (d, J = 8.8 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 6.87 (d, J = 9.2 Hz, 1H), 4.79 (s, 2H), 4.05-3.62 (m, 2H), 3.86 (s, 3H), 3.78 (s, 3H). |
| 實施例240 | 3-(4-甲氧基苯基)-1-(喹啉-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 481.2 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 8.96 (dd, J = 4.4 Hz, 2.0 Hz, 1H), 8.18-8.15 (m, 2H), 8.04 (s, 1H), 7.83 (d, J = 2.0 Hz, 1H), 7.63 (dd, J = 8.8 Hz, 2.4 Hz, 1H), 7.43 (dd, J = 8.4 Hz, 4.4 Hz, 1H), 7.32 (d, J = 8.8 Hz, 2H), 6.94 (d, J = 9.2 Hz, 2H), 5.13 (bs, 1H), 4.82 (s, 2H), 4.00-3.63 (m, 2H), 3.82 (s, 3H). |
| 實施例241 | 1-(4-甲氧基苯基)-3-(喹啉-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 481.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.89 (s, 1H), 8.37 (d, J = 8.0 Hz, 1H), 8.16 (s, 1H), 8.01 (d, J = 9.6 Hz, 2H), 7.86 (d, J = 8.8 Hz, 1H), 7.56 (dd, J = 8.0 Hz, 4.0 Hz, 1H), 7.50 (bs, 1H), 7.26 (d, J = 8.0 Hz, 2H), 7.00 (d, J = 8.4 Hz, 2H), 4.98 (s, 2H), 4.15-3.85 (m, 2H), 3.80 (s, 3H). |
| 實施例242 | 1-(4-環丙基苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 470.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 , 0.7 HCOOH salt.) δ: 8.41 (s, 0.7H), 8.10 (s, 1H), 7.45 (bs, 1H), 7.33 (d, J = 8.8 Hz, 2H), 7.13 (s, 4H), 6.96 (d, J = 8.8 Hz, 2H), 4.75 (s, 2H), 4.19-3.63 (m, 2H), 3.77 (s, 3H), 2.01-1.91 (m, 1H), 1.03-0.93 (m, 2H), 0.74-0.64 (m, 2H). |
| 實施例243 | 3-(4-甲氧基苯基)-1-(對甲苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 444.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.10 (s, 1H), 7.50 (bs, 1H), 7.33 (d, J = 9.2 Hz, 2H), 7.24 (d, J = 8.0 Hz, 2H), 7.15 (d, J = 8.4 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 4.75 (s, 2H), 4.15-3.73 (m, 2H), 3.77 (s, 3H), 2.35 (s, 3H). |
| 實施例244 | 3-(4-甲氧基苯基)-7-(甲硫基)-1-(對甲苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 393.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.35 (d, J = 8.8 Hz, 2H), 7.26 (d, J = 8.0 Hz, 2H), 7.19 (d, J = 8.0 Hz, 2H), 6.98 (d, J = 8.8 Hz, 2H), 4.87 (s, 2H), 3.77 (s, 3H), 2.36 (s, 3H), 2.20 (s, 3H). |
| 實施例245 | 1-(3,4-二氯苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 498.0 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 8.01 (s, 1H), 7.52 (d, J = 8.4 Hz, 1H), 7.44 (d, J = 2.4 Hz, 1H), 7.31-7.26 (m, 2H), 7.16 (dd, J = 8.4 Hz, 2.4 Hz, 1H), 6.93 (d, J = 8.8 Hz, 2H), 5.43-5.12 (m, 1H), 4.75 (s, 2H), 4.05-3.76 (m, 2H), 3.82 (s, 3H). |
| 實施例246 (R4 = OMe) | 5-甲氧基-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 514.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.71 (d, J = 1.2 Hz, 1H), 7.57 (d, J = 9.6 Hz, 1H), 7.43 (br s, 1H), 7.25 (dd, J = 9.2 Hz, 1.6 Hz, 1H), 7.16 (d, J = 8.8 Hz, 2H), 6.95 (d, J = 8.8 Hz, 2H), 4.66 (s, 2H), 4.16 (s, 3H), 4.05-3.60 (m, 2H), 3.87 (s, 3H), 3.77 (s, 3H). |
| 實施例247 (R4 = Me) | 1-(4-甲氧基苯基)-5-甲基-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 498.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.35 (s, 1H), 7.73 (s, 1H), 7.58 (d, J = 9.2 Hz, 1H), 7.45 (br s, 1H), 7.27 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.16 (d, J = 8.8 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 4.82 (s, 2H), 4.17 (s, 3H), 4.00-3.60 (m, 2H), 3.78 (s, 3H), 2.21 (s, 3H). |
| 實施例248 | 7-(環己基胺基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 484.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 8.01 (s, 1H), 7.68 (s, 1H), 7.57 (d, J = 8.8 Hz, 1H), 7.25 (dd, J = 9.2 Hz, 1.6 Hz, 1H), 7.19 (d, J = 8.8 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 6.90-6.45 (m, 1H), 4.77 (s, 2H), 4.16 (s, 3H), 3.78 (s, 3H), 3.01-2.80 (m, 1H), 1.80-1.43 (m, 5H), 1.25-0.83 (m, 5H). |
| 實施例249 (經由步驟F) | 1-(4-羥苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 446.1 [M+H]+ 。 1H NMR (400 MHz, 氯仿-d) δ 7.88 (s, 1H), 7.20 (d, J = 9.0 Hz, 2H), 7.01 (d, J = 8.8 Hz, 2H), 6.86 (d, J = 9.0 Hz, 2H), 6.82 (d, J = 8.8 Hz, 2H), 4.68 (s, 2H), 3.75 (s, J = 1.2 Hz, 3H), 3.32 – 3.30 (m, 2H). |
| 實施例250 (經由步驟F) | 3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-1-(4-(三氟甲基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 498.1 [M+H]+ 。 1H NMR (400 MHz, 氯仿-d) δ 7.93 (s, 1H), 7.73 (d, J = 8.3 Hz, 2H), 7.42 (d, J = 8.3 Hz, 2H), 7.28 (d, J = 9.0 Hz, 2H), 6.94 (d, J = 9.0 Hz, 2H), 4.79 (s, 2H), 3.82 (s, 3H), 3.75 (brs, 2H). |
| 實施例251 (經由步驟F) | 4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲腈 | LC-MS (ESI): m/z 455.1 [M+H]+ 。 1H NMR (400 MHz, 氯仿-d) δ 7.99 (s, 1H), 7.75 (d, J = 8.5 Hz, 2H), 7.43 (d, J = 8.5 Hz, 2H), 7.27 (d, J = 8.9 Hz, 2H), 6.94 (d, J = 8.9 Hz, 2H), 4.79 (s, 2H), 3.82 (s, 3H), 3.75 (brs, 2H). |
| 實施例252 (經由步驟F) | 1-(4-氯苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 464.0 [M+H]+ 。 1H NMR (400 MHz, 氯仿-d) δ 7.91 (s, 1H), 7.43 (d, J = 8.7 Hz, 2H), 7.27 (d, J = 9.0 Hz, 2H), 7.21 (d, J = 8.7 Hz, 2H), 6.94 (d, J = 9.0 Hz, 2H), 4.77 (s, 2H), 3.82 (s, 3H), 3.77 (brs, 2H). |
| 實施例253 (經由步驟F) | 1-(2,3-二氫苯并呋喃-5-基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 472.1 [M+H]+ 。 1H NMR (400 MHz, 氯仿-d) δ 7.84 (s, 1H), 7.28 (d, J = 9.0 Hz, 2H), 7.07 (d, J = 2.1 Hz, 1H), 7.02 – 6.89 (m, 3H), 6.84 (d, J = 8.4 Hz, 1H), 4.76 (s, 2H), 4.63 (t, J = 8.7 Hz, 2H), 3.82 (s, 5H), 3.23 (t, J = 8.7 Hz, 2H). |
| 實施例254 (經由步驟F) | 1-(苯并[b]噻吩-5-基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 486.1 [M+H]+ 。 1H NMR (400 MHz, 氯仿-d) δ 7.95 (d, J = 8.6 Hz, 1H), 7.89 (s, 1H), 7.75 (d, J = 2.0 Hz, 1H), 7.51 (d, J = 5.5 Hz, 1H), 7.34 (dd, J = 5.5, 0.7 Hz, 1H), 7.30 (d, J = 9.0 Hz, 2H), 7.23 (dd, J = 8.6, 2.0 Hz, 1H), 6.94 (d, J = 9.0 Hz, 2H), 4.81 (s, 2H), 3.82 (s, 3H), 3.78 (brs, 2H). |
| 實施例255 (經由步驟F) | 1,3-雙(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 460.1 [M+H]+ 1H NMR (400 MHz, 氯仿-d) δ 7.98 (s, 1H), 7.29 (d, J = 8.9 Hz, 2H), 7.19 (d, J = 8.9 Hz, 2H), 6.96 (d, J = 8.9 Hz, 2H), 6.92 (d, J = 9.0 Hz, 2H), 5.13 (brs, 1H), 4.75 (s, 2H), 3.59 (brs, 2H), 3.84 (s, 3H), 3.80 (s, 3H). |
| 實施例256 (經由步驟F) | 3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-1-(4-(三氟甲氧基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 514.1 [M+H]+ 。 1H NMR (400 MHz, 氯仿-d) δ 8.01 (s, 1H), 7.35 – 7.27 (m, 6H), 6.93 (d, J = 9.0 Hz, 2H), 5.17 (brs, 1H), 4.77 (s, 2H), 3.83 (brs, 2H), 3.81 (s, 3H). |
| 實施例425 | 1-(4-溴苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS: m/z 533 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 8.14 (s, 1H), 7.70 (d, J = 1.4 Hz, 1H), 7.64 (d, J = 8.6 Hz, 2H), 7.58 (d, J = 9.2 Hz, 2H), 7.33-7.24 (m, 3H), 4.84 (s, 2H), 4.17 (s, 3H), 4.04-3.62 (m, 2H). |
經由描繪為通用程序VII之流程獲得結構7.6
之化合物。使胺7.1
(由通用程序VII,步驟A獲得)與氯甲酸甲酯反應以產生胺基甲酸酯7.2
。使用鹼介導之芳族取代反應引入所需R2
基團,以產生化合物7.3
。使用鹼介導之環化將化合物7.3
轉化為環脲7.4
。隨後將芳基硫醇7.4
氧化成碸7.5
,且使用鹼介導之芳族取代反應引入所需R1
基團,得到化合物7.6
。
步驟 A :
(4-氯-2-(甲硫基)嘧啶-5-基)甲基(4-甲氧苯基)胺基甲酸甲酯
在0℃下經由注射器向N-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-4-甲氧基苯胺(500 mg,1.7 mmol,1.0當量,由通用程序VI,步驟A獲得)及K2
CO3
(701 mg,5.1mmol, 3.0當量)於甲苯(20 mL)中之溶液中添加氯甲酸甲酯(240 mg,2.6 mmol,1.5當量)。在室溫下攪拌所得溶液隔夜。隨後用冰水(10 mL)處理反應混合物,用EtOAc (10 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之(4-氯-2-(甲硫基)嘧啶-5-基)甲基(4-甲氧苯基)胺基甲酸甲酯(580 mg,97%產率)。LC-MS (ESI):m/z
354 [M+H]+
。
步驟 B :
甲基-4-甲氧基苯基((4-(5-甲氧基吡啶-2-基胺基)-2-(甲硫基)嘧啶-5-基)甲基)胺基甲酸酯
在-65℃下經由注射器在10分鐘內向(4-氯-2-(甲硫基)嘧啶-5-基)甲基(4-甲氧苯基)胺基甲酸甲酯(300 mg,0.8 mmol,1.0當量)及5-甲氧基吡啶-2-胺(158 mg,1.3 mmol,1.6當量)於THF (10 mL)中之溶液中添加LiHMDS (1.0 M於THF中,2.4 mL,2.4 mmol,3.0當量)。添加之後,將反應混合物升溫至室溫且再攪拌4小時。隨後用H2
O (15 mL)淬滅反應,用EtOAc (20 mL × 3)萃取,用鹽水(30 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之甲基-4-甲氧基苯基((4-(5-甲氧基吡啶-2-基胺基)-2-(甲硫基)嘧啶-5-基)甲基)胺基甲酸酯(135 mg,36%產率)。LC-MS (ESI):m/z
442 [M+H]+
。
步驟 C :
3-(4-甲氧基苯基)-1-(5-甲氧基吡啶-2-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
甲基-4-甲氧基苯基((4-(5-甲氧基吡啶-2-基胺基)-2-(甲硫基)嘧啶-5-基)甲基)胺基甲酸酯(135 mg,0.3 mmol,1.0當量)及K2
CO3
(2.1 g,15.3 mmol,51.0當量)之DMF (20 mL)溶液。將混合物在130℃下攪拌48小時。減壓濃縮反應混合物,用H2
O (20 mL)處理殘餘物,用EtOAc (30 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層且經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之3-(4-甲氧基苯基)-1-(5-甲氧基吡啶-2-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(100 mg,80%產率)。LC-MS (ESI):m/z
410 [M+H]+
。
3-(4- 甲氧基苯基 )-1-(5- 甲氧基吡啶 -2- 基 )-7-(2,2,2- 三氟乙胺基 )-3,4- 二氫嘧啶并 [4,5-d] 嘧啶 -2(1H)- 酮 ( 實施例 257)
係由3-(4-甲氧基苯基)-1-(5-甲氧基吡啶-2-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及2,2,2-三氟乙胺經由通用程序 IV
(步驟 D 、 E
)合成。
1 H NMR
(400 MHz, CDCl3
) δ (ppm): 8.28 (d, J = 2.4 Hz, 1H), 7.99 (s, 1H), 7.40-7.27 (m, 4H), 6.92 (d, J = 8.7 Hz, 2H), 5.25 (br s, 1H), 4.76 (s, 2H), 4.01-3.71 (m, 2H, 重疊), 3.91 (s, 3H), 3.81 (s, 3H)。
LC-MS
(ESI):m/z
461 [M+H]+
.
上文關於通用程序 VII
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例258 | 1-(4-甲氧基環己基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 466.2 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 7.90 (s, 1H), 7.21 (d, J = 8.8 Hz, 2H), 6.92 (d, J = 9.2 Hz, 2H), 5.34 (bs, 1H), 4.70-4.62 (m, 1H), 4.54 (s, 2H), 4.18-4.09 (m, 2H), 3.81 (s, 3H), 3.36 (s, 3H), 3.21-3.16 (m, 1H), 2.63-2.53 (m, 2H), 2.18-2.15 (m, 2H), 1.82-1.79 (m, 2H), 1.38-1.27 (m, 2H). |
| 實施例259 | 1-(6-(二氟甲氧基)吡啶-3-基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 497.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.23 (d, J = 2.0 Hz, 1H), 8.15 (s, 1H), 7.93 (dd, J = 8.8 Hz, 2.4 Hz, 1H), 7.67 (d, JHF = 72.4 Hz, 1H), 7.55 (bs, 1H), 7.34 (d, J = 8.8 Hz, 2H), 7.19 (d, J = 8.8 Hz, 1H), 6.97 (d, J = 8.8 Hz, 2H), 4.78 (s, 2H), 4.05-3.53 (m, 2H), 3.77 (s, 3H). |
| 實施例260 | 1-(咪唑并[1,2-a]吡啶-6-基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 470.1 [M+H]+. 1H NMR (400 MHz, CDCl3) δ: 8.14 (s, 1H), 7.97 (s, 1H), 7.60-7.52 (m, 3H), 7.21 (d, J = 8.8 Hz, 2H), 7.04 (d, J = 9.2 Hz, 1H), 6.87 (d, J = 8.8 Hz, 2H), 5.19 (s, 1H), 4.71 (s, 2H), 4.04-3.55 (m, 2H), 3.75 (s, 3H). |
| 實施例261 | 3-(4-甲氧基苯基)-1-(6-甲氧基吡啶-3-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 461.0 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.13 (s, 1H), 8.09 (d, J = 2.4 Hz, 1H), 7.67 (dd, J = 8.4 Hz, 2.4 Hz, 1H), 7.53 (bs, 1H), 7.35 (d, J = 9.2 Hz, 2H), 6.97 (d, J = 9.2 Hz, 2H), 6.90 (d, J = 8.8 Hz, 1H), 4.77 (s, 2H), 4.11-3.78 (m, 2H), 3.89 (s, 3H), 3.77 (s, 3H). |
經由描繪為通用程序VIII之流程獲得結構8.6
之化合物。以芳基氯8.1
開始,使用鹼介導之芳族取代反應引入所需R2
基團(視情況經保護)以產生雜芳基胺8.2
。藉由在鹼性條件下使胺基-酯8.2
與合適異氰酸酯反應引入所需R3
基團以形成環脲8.3
。將芳基硫醇8.3
氧化成碸8.4
,且使用鹼介導之芳族取代反應引入所需R1
基團,得到化合物8.5
。若需要,隨後使化合物8.5
脫保護,得到化合物8.6
。
步驟 A :
4-((4-(苯甲氧基)苯基)胺基)-2-(甲硫基)嘧啶-5-甲酸乙酯
在室溫下向4-氯-2-(甲硫基)嘧啶-5-甲酸乙酯(1.0 g,4.3 mmol,1.0當量)於DMSO (10 mL)中之溶液中添加4-(苯甲氧基)苯胺(950 mg,4.7 mmol,1.1當量)及DIPEA (1.6 g,12.9 mmol,3.0當量)。將反應混合物在80℃下攪拌2小時。隨後用冰水(50 mL)淬滅反應混合物且用EtOAc (50 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-((4-(苯甲氧基)苯基)胺基)-2-(甲硫基)嘧啶-5-甲酸乙酯(1.6 g,95%產率)。LC-MS (ESI):m/z
396 [M+H]+
。
步驟 B :
1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮
在室溫下向4-((4-(苯甲氧基)苯基)胺基)-2-(甲硫基)嘧啶-5-甲酸乙酯(1.0 g,2.5 mmol,1.0當量)於DMF (10 mL)中之溶液中添加1-異氰酸酯基-4-甲氧基苯 (560 mg,3.7 mmol,1.5當量)及K2
CO3
(690 mg,5.0 mmol,2.0當量)。將所得混合物攪拌16小時。隨後用冰水(10 mL)淬滅反應混合物且用EtOAc (20 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟管柱層析純化殘餘物,得到呈白色固體狀之1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮(300 mg,24%產率)。LC-MS (ESI):m/z
499 [M+H]+
。
步驟 C :
1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲基磺醯基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮
在室溫下以若干份向1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮(300 mg,0.6 mmol,1.0當量)於DCM (10 mL)中之溶液中添加m
-CPBA (310 mg,1.8 mmol,3.0當量)。將所得混合物攪拌2小時。隨後用NaHSO3
(飽和水溶液) (10 mL)淬滅反應混合物,用DCM (20 mL × 2)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由管柱層析純化殘餘物,得到呈白色固體狀之1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲基磺醯基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮(260 mg,82%產率)。LC-MS (ESI):m/z
531 [M+H]+
。
步驟 D :
1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮
在室溫下向1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲基磺醯基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮(260 mg,0.5 mmol,1.0當量)於DMSO(5 mL)中之溶液中添加CsF (74 mg,0.5 mmol,1.0當量)、DIPEA (194 mg,1.5 mmol,3.0當量)及2,2,2-三氟乙胺 (150 mg,1.5 mmol,3.0當量)。在密封管中將所得混合物在80℃下攪拌16小時。隨後用冰水(30 mL)淬滅反應混合物且用DCM (30 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮(100 mg,36%產率)。LC-MS (ESI):m/z
550 [M+H]+
。
步驟 E :
1-(4-羥苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮
在室溫下向1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮(50 mg,0.1 mmol,1.0當量)於MeOH (5 mL)中之溶液中添加5% wt Pd/C (10% w/w,5 mg)。且將反應混合物在室溫下在H2
氛圍(1 atm)下攪拌16小時。完成後,藉由過濾移除催化劑,且減壓濃縮濾液。(粗物質LC-MS顯示,形成約30%過還原之加合物(M+2+H)+
),隨後將粗混合物再溶解於無水 THF (5 mL)中,及一次性添加DDQ (45 mg),將所得混合物在室溫下再攪拌2小時。隨後用NaHSO3
(飽和水溶液) (10 mL)淬滅反應混合物,用EtOAc (10 mL × 3)萃取所得混合物。用鹽水(10 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮。藉由RP-製備型HPLC純化粗殘餘物,得到1-(4-羥苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮(實施例 262
)。
1 H NMR
(400 MHz, DMSO-d6
) (以下描繪之兩種互變異構體之混合物,比率:大約
1:1) δ (ppm): 9.69 (m, 1H, 重疊), 8.87及8.82 (兩組s, 總共1H), 8.75-8.70及8.50-8.45 (兩組m, 總共1H), 7.33-7.03 (多個雙重峰, 6H), 6.91-6.78 (m, 2H), 4.24-4.08 (m, 1H), 3.85-3.75 (m, 1H), 3.78 (s, 3H, 重疊)。
經由描繪為通用程序IX之流程獲得結構之化合物9.5
。以醛9.1
開始,使用還原胺化引入所需R3
基團以產生胺9.2
。藉由使胺9.2
與合適異氰酸酯反應引入所需R3
基團以形成非環脲9.3
。隨後使化合物9.3
經歷鹼性條件以形成環脲9.4
。隨後經由鹼介導之親核取代(情況I)或鈀介導之C-X偶合(情況II)引入所需R1
基團,得到化合物9.5
。
步驟 A :
3-(4-氯苯基)-1-((2,4-二氯嘧啶-5-基)甲基)-1-(2-甲基-2H-吲唑-5-基)脲
將2,4-二氯嘧啶-5-甲醛(500 mg,2.83 mmol,1.0當量)溶解於DCM (7 ml),且隨後添加乙酸(485 µl,8.48 mmol,3.0當量)。將混合物冷卻至0℃,之後添加2-甲基-2H-吲唑-5-胺(416 mg,2.83 mmol,1.0當量)。在0℃下,一次性添加三乙醯氧基硼氫化鈉(898 mg,4.24 mmol,2.0當量)。如LC-MS所監測完全反應(偵測到m/z
308 [M+H]+
)之後,將反應混合物直接用於步驟B。
步驟 B :
3-(4-氯苯基)-1-((2,4-二氯嘧啶-5-基)甲基)-1-(2-甲基-2H-吲唑-5-基)脲
將1-氯-4-異氰酸酯基苯(434 mg,2.83 mmol,2.0當量)添加至來自步驟A之反應混合物之粗3-(4-氯苯基)-1-((2,4-二氯嘧啶-5-基)甲基)-1-(2-甲基-2H-吲唑-5-基)脲(粗物質,435 mg,1.4 mmol,1.0當量)。30分鐘之後,將矽膠添加至反應混合物,在樣品濃縮至乾燥。乾載粗固體且藉由管柱層析純化,得到3-(4-氯苯基)-1-((2,4-二氯嘧啶-5-基)甲基)-1-(2-甲基-2H-吲唑-5-基)脲 (366.2 mg,0.793 mmol,56.1 %產率). LC-MS (ESI):m/z
461 [M+H]+
。
步驟 C :
7-氯-1-(4-氯苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將3-(4-氯苯基)-1-((2,4-二氯嘧啶-5-基)甲基)-1-(2-甲基-2H-吲唑-5-基)脲 (330.3 mg,0.715 mmol,1.0當量)溶解於THF中且冷卻至0℃,隨後添加KOt
Bu (96 mg,0.858 mmol,1.2當量)。將混合物升溫至室溫。攪拌15分鐘之後,添加另一0.2當量KOt
Bu,且將反應混合物加熱至60℃。加熱20分鐘之後,反應完成。將矽膠添加至反應混合物,其隨後減壓濃縮。乾載粗固體且藉由管柱層析純化,得到7-氯-1-(4-氯苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮,其得到收集且濃縮為產物(248.7 mg,0.585 mmol,82 %產率)。LC-MS (ESI):m/z
425 [M+H]+
。
步驟 D :
1-(4-氯苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將7-氯-1-(4-氯苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(50 mg,0.118 mmol,1.0當量)溶解於DMSO (392 µl)中,快速添加氟化銫(35.7 mg,0.235 mmol,2.0當量)、DIPEA (41.1 µl,0.235 mmol,2.0當量)及2,2,2-三氟乙-1-胺(46.1 µl,0.588 mmol,4.0當量)。隨後密封反應且加熱至110℃持續5小時。隨後藉由乙酸乙酯稀釋反應混合物且用DI水洗滌。收集有機層且經硫酸鈉乾燥。過濾之後,用矽膠濃縮溶液,隨後乾載且藉由管柱層析純化,得到1-(4-氯苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 263
)。
1H NMR
(400 MHz, 氯仿-d) δ 8.02 (s, 1H), 7.89 (s, 1H), 7.71 (d, J = 9.2 Hz, 1H), 7.61 (s, 1H), 7.42 (d, J = 8.6 Hz, 2H), 7.28 - 7.24 (m, 3H), 5.16 (brs, 1H), 4.83 (s, 2H), 4.22 (s, 3H), 3.90 (brs, 2H)。LC-MS (ESI)
: m/z 488.0 [M+H]+
。
步驟 E :
1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將7-氯-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(50 mg,0.110 mmol,1.0當量)、參(二亞苄基丙酮)二鈀(0)氯仿加合物(5.68 mg,5.48 µmol,0.05當量,由通用程序IX,步驟A至C獲得)、第三丁醇鈉(15.81 mg,0.165 mmol,1.5當量)及二環己基(2',4',6'-三異丙基-[1,1'-聯苯]-2-基)膦(5.23 mg,10.97 µmol,0.1當量)溶解於二㗁烷(366 µl)中。將2,2,2-三氟乙-1-胺 (43.0 µl,0.548 mmol,5.0當量)添加至所得混合物。用蓋密封小瓶且加熱至100℃持續3小時。將矽膠直接添加至粗反應混合物,其隨後濃縮,乾載且藉由管柱層析純化,得到1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 264
)。
1H NMR
(400 MHz, DMSO-d6
) δ 8.33 (s, 1H), 7.67 (s, 1H), 7.56 (d, J = 9.1 Hz, 1H), 7.37 (d, J = 8.2 Hz, 1H), 7.32 (d, J = 8.4 Hz, 2H), 7.28 (t, JH-F = 63.6 Hz 1H), 7.25 (s, 1H), 7.21 (d, J = 8.4 Hz, 2H), 7.09 - 7.03 (m, 1H), 6.24 (d, J = 8.2 Hz, 1H), 4.82 (s, 2H), 4.16 (s, 3H), 3.67 (p, J = 9.6 Hz, 2H)。
LC-MS (ESI)
: m/z 519.1 [M+H]+
。
上文關於通用程序 IX
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例265 (情況I) | 7-((環丙基甲基)胺基)-1-(4-羥苯基)-3-(4-甲氧基苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 417.8 [M+H]+。 1H NMR (400 MHz, 氯仿-d) δ 7.93 (s, 1H), 7.29 (d, J = 9.0 Hz, 2H), 7.05 (d, J = 8.7 Hz, 2H), 6.93 (d, J = 9.0 Hz, 2H), 6.71 (d, J = 8.7 Hz, 2H), 5.09 (t, J = 5.6 Hz, 1H), 4.71 (s, 2H), 3.81 (s, 3H), 3.02 (br s, 2H), 0.93-0.86 (m, 1H), 0.41 (d, J = 7.7 Hz, 2H), 0.10 (br s, 2H). |
| 實施例266 (情況I) | 7-((環丙基甲基)胺基)-3-(4-甲氧基苯基)-1-(吡啶-4-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 402.8 [M+H]+。 1H NMR (400 MHz, 氯仿-d) δ 8.78 – 8.60 (m, 2H), 7.98 (s, 1H), 7.32 – 7.29 (m, 2H), 7.28 (d, J = 9.0 Hz, 2H), 6.93 (d, J = 9.0 Hz, 2H), 5.08 (s, 1H), 4.74 (s, 2H), 3.81 (s, 3H), 3.01 (brs, 2H), 0.92 (brs, 1H), 0.44 (brs, 2H), 0.11 (brs, 2H). |
| 實施例267 (情況I) | 7-((環丙基甲基)胺基)-1,3-雙(4-甲氧基苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 431.9 [M+H]+。 1H NMR (400 MHz, 氯仿-d) δ 7.93 (s, 1H), 7.28 (d, J = 9.0 Hz, 2H), 7.20 (d, J = 8.9 Hz, 2H), 6.96 (d, J = 8.9 Hz, 2H), 6.91 (d, J = 8.9 Hz, 2H), 5.08 (brs, 1H), 4.71 (s, 2H), 3.84 (s, 3H), 3.80 (s, 3H), 3.05 (s, 2H), 1.00-0.78 (m, 1H), 0.43 (d, J = 7.7 Hz, 2H), 0.11 (s, 2H). |
| 實施例268 (情況II) | 1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 519.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.32 (s, 1H), 7.85 (s, 1H), 7.66 (s, 1H), 7.54 (d, J = 9.2 Hz, 1H), 7.43 (d, J = 7.8 Hz, 2H), 7.34 (t, JH-F = 74.6 Hz 1H), 7.32 (d, J = 7.8 Hz, 3H), 7.25 (d, J = 9.2 Hz, 1H), 7.01 (t, J = 6.4 Hz, 1H), 5.41 (s, 1H), 4.85 (s, 2H), 4.15 (s, 3H), 4.10-4.00 (m, 2H). |
| 實施例269 (情況II) | 1-(4-(二氟甲氧基)苯基)-7-(乙胺基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 465.1 [M+H]+。 1H NMR (400 MHz, 氯仿-d) δ 7.86 (s, 1H), 7.68 (d, J = 9.2 Hz, 1H), 7.60 (s, 1H), 7.35 (d, J = 8.7 Hz, 2H), 7.30 (d, J = 9.2 Hz, 1H), 7.20 -7.16 (m, 3H), 6.53 (t, JH-F = 74.1 Hz, 1H), 6.01 (d, J = 7.7 Hz, 1H), 4.80 (s, 2H), 4.30 (t, J = 5.7 Hz, 1H), 4.21 (s, 3H), 3.05 (td, J = 7.2, 5.7 Hz, 2H), 1.09 (t, J = 7.2 Hz, 3H). |
| 實施例270 (情況II) | 1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(2,2,2-三氟乙氧基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 520.0 [M+H]+. 1H NMR (400 MHz, Chloroform-d) δ 7.89 (s, 1H), 7.71 (d, J = 9.2 Hz, 1H), 7.62 (s, 1H), 7.42 (d, J = 8.0 Hz, 1H), 7.34 (d, J = 8.6 Hz, 2H), 7.30 (d, J = 9.2, 1H), 7.21 (d, J = 8.6 Hz, 2H), 6.53 (t, JH-F = 73.8 Hz, 1H), 6.50 (d, J = 8.0 Hz, 1H), 4.91 (s, 2H), 4.28 (q, J = 8.5 Hz, 2H), 4.22 (s, 3H). |
| 實施例271 (情況II) | 1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 519.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.20 (s, 1H), 7.64 -7.62 (m, 2H), 7.37 (d, J = 8.1 Hz, 1H), 7.33 (d, J = 8.5 Hz, 2H), 7.26 (t, JH-F = 68.7 Hz, 1H), 7.25 (s, 1H), 7.22 (d, J = 8.5 Hz, 2H), 7.07 (d, J = 4.7 Hz, 1H), 6.25 (d, J = 8.6 Hz, 1H), 4.85 (s, 2H), 3.83 (s, 3H), 3.77-3.60 (m, 2H). |
| 實施例272 (情況II) | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 466.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.20 (s, 1H), 7.66 – 7.63 (m, 2H), 7.60 (d, J = 8.2 Hz, 1H), 7.40 (d, J = 8.4 Hz, 2H), 7.29 (t, JH-F = 71.2 Hz, 1H), 7.28-7.24 (m, 3H), 6.42 (d, J = 7.7 Hz, 1H), 4.94 (s, 2H), 3.91-3.81 (m, 5H), 1.06 (t, J = 7.0 Hz, 3H). |
| 實施例273 (情況II) | 1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-7-(2,2,2-三氟乙氧基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 520.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.21 (s, 1H), 7.71 (d, J = 8.1 Hz, 1H), 7.67-7.64 (m, 2H), 7.41 (d, J = 8.2, 2H), 7.30-7.24 (m, 4H), 6.61 (d, J = 8.1 Hz, 1H), 4.98 (s, 2H), 4.51 (q, J = 9.1 Hz, 2H), 3.83 (s, 3H). |
| 實施例274 (情況II) | 1-(4-(二氟甲氧基)苯基)-7-(乙胺基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 465.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.17 (s, 1H), 7.62 -7.60 (m, 2H), 7.33 (d, J = 8.6 Hz, 2H), 7.30-7.13 (m, 5H), 6.34 (t, J = 5.6 Hz, 1H), 6.06 (d, J = 8.2 Hz, 1H), 4.79 (s, 2H), 3.81 (s, 3H), 2.88 -2.81 (m, 2H), 0.85 (t, J = 7.1 Hz, 3H). |
| 實施例275 (情況II) | 1-(6-(二氟甲氧基)吡啶-3-基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | LC-MS (ESI): m/z 467.1 [M+H]+. 1H NMR (400 MHz, DMSO-d6 ) δ 8.34 (s, 1H), 8.25 (s, 1H), 7.96 (dd, J = 8.6, 1H), 7.75 (t, JH-F = 72.9 Hz, 1H)), 7.69 (s, 1H), 7.61 (d, J = 8.2 Hz, 1H), 7.57 (d, J = 9.2 Hz, 1H), 7.27 (d, J = 9.2 Hz, 1H), 7.18 (d, J = 8.6 Hz, 1H), 6.44 (d, J = 8.2 Hz, 1H), 4.92 (s, 2H), 4.15 (s, 3H), 3.87 (q, J = 7.0 Hz, 2H), 1.08 (t, J = 7.0 Hz, 3H). |
合成
4-(3-(4-
甲氧基苯基
)-2-
側氧基
-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-1(2H)-
基
)
苯甲醯胺
(
實施例
276)
步驟 A :
4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯
將1-(4-溴苯基)-3-(4-甲氧基苯基)-7-(2,2,2-三氟乙胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由N-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-4-甲氧基苯胺及1-溴-4-異氰酸酯基苯經由通用程序 VI ( 步驟 B 至 E)
合成) (355 mg,0.7 mmol,1.0當量)、TEA (212 mg,2.1 mmol,3.0當量)及Pd(dppf)Cl2
(51 mg,0.07 mmol,0.1當量)於甲苯/MeOH (10 mL,10/1)中之混合物在100℃下在CO氛圍下攪拌14小時。隨後將反應混合物倒入H2
O (10 mL)且用EtOAc (10 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯(300 mg,88%產率)。LC-MS (ESI):m/z
488 [M+H]+
。
步驟 B :
4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸
將4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯(292 mg,0.6 mmol,1.0當量)及LiOH (水溶液) (1N,6 mL,6 mmol,10.0當量)於THF (6 mL)中之溶液在室溫下攪拌隔夜。添加稀HCl (1 N,水溶液)以調整pH = 6,用EtOAc (10 mL × 3)萃取所得混合物。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸(244 mg,86%產率)。LC-MS (ESI):m/z
474 [M+H]+
。
步驟 C :
4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲醯胺
將4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸(47 mg,0.1 mmol,1.0當量)、NH4
Cl (32 mg,0.6 mmol,6.0當量)、DIPEA (77 mg,0.6 mmol,6.0當量)及HATU (76 mg,0.2 mmol,2.0當量)於DCM (3 mL)中之混合物在室溫下攪拌1小時。隨後將反應混合物倒入H2
O (10 mL)且用DCM (10 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲醯胺( 實施例 276)
。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 8.19 (s, 1H), 8.09 (s, 1H), 7.99 (d,J
= 8.4 Hz, 2H), 7.56 (br s, 1H), 7.45-7.40 (m, 3H), 7.40 (d,J
= 8.8 Hz, 2H), 7.03 (d,J
= 8.8 Hz, 2H), 4.83 (s, 2H), 4.00-3.50 (m, 2H), 3.83 (s, 3H)。
LC-MS (ESI)
:m/z
473 [M+H]+
。
合成
4-(3-(4-
甲氧基苯基
)-2-
側氧基
-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-1(2H)-
基
)-N-
甲基苯甲醯胺
(
實施例
277)
遵循獲得實施例 276
之程序(步驟C)。因此,4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)-N-甲基苯甲醯胺( 實施例 277)
係由4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸(實施例 276 ,
步驟B)
及甲胺鹽酸鹽合成。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 8.56 (q,J
= 4.0 Hz, 1H), 8.19 (s, 1H), 7.95 (d,J
= 8.4 Hz, 2H), 7.55 (br s, 1H), 7.44 (d,J
= 8.4 Hz, 2H), 7.40 (d,J
= 8.8 Hz, 2H), 7.03 (d,J
= 9.2 Hz, 2H), 4.77 (s, 2H), 4.00-3.50 (m, 2H), 3.76 (s, 3H), 2.80 (d,J
= 4.4 Hz, 3H)。
LC-MS (ESI)
:m/z
487 [M+H]+
。
合成
1-(4-(1-
羥基環丙基
)
苯基
)-3-(4-
甲氧基苯基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2(1H)-
酮
(
實施例
278)
步驟 A :
4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯
在0 ℃下向4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯(實施例 276 ,
步驟A) (500 mg,1.03 mmol,1.0當量)於DMF (5 mL)中之溶液中添加NaH (60%於礦物油中,82 mg,2.06 mmol,2.0當量)。在0 ℃下攪拌混合物0.5小時。隨後添加SEMCl (256 mg,1.53 mmol,1.49當量)。將反應混合物在室溫下攪拌1小時且在0 ℃下用NH4
Cl (飽和水溶液) (10 mL)淬滅。隨後用EtOAc (10 mL × 3)萃取反應混合物。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯(550 mg,87%產率)。LC-MS (ESI):m/z
618 [M+H]+
。
步驟 B :
1-(4-(1-羥基環丙基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在-78℃下向4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸甲酯(240 mg,0.39 mmol,1.0當量)於乙醚(3 mL)中之溶液中逐滴添加異丙醇鈦(IV)(222 mg,0.78 mmol,2.0當量)。10分鐘後,逐滴添加EtMgBr (1M於THF中,2.3 mL,2.33 mmol,6.0當量)。隨後使所得混合物升溫至室溫且再攪拌4小時。用NH4
Cl (飽和水溶液) (10 mL)淬滅所得混合物且用EtOAc (10 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到1-(4-(1-羥基環丙基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(74 mg,31%產率)。LC-MS ESI m/z= 616 [M+H]+
。
步驟 C :
1-(4-(1-羥基環丙基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 278
)係由1-(4-(1-羥基環丙基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮經由通用程序 IV ( 方法 A ,步驟 F)
合成。
1 H NMR
(400 MHz, CDCl3
) δ (ppm): 7.92 (s, 1H), 7.31 (d,J
= 8.4 Hz, 2H), 7.22 (d,J
= 9.2 Hz, 2H), 7.19-7.16 (m, 2H), 6.85 (d,J
= 9.2 Hz, 2H), 5.10 (br s, 1H), 4.69 (s, 2H), 3.95-3.59 (m, 2H), 3.74 (s, 3H), 1.27-1.21 (m, 2H), 1.05-0.99 (m, 2H)。
LC-MS (ESI)
:m/z
486 [M+H]+
。
合成
3-(4-
甲氧基苯基
)-1-(4-(2-
側氧基
-1,2-
二氫吡啶
-3-
基
)
苯基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2(1H)-
酮
(
實施例
279)
步驟 A :
1-(4-(2-氟吡啶-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將1-(4-溴苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由N-((4-氯-2-(甲硫基)嘧啶-5-基)甲基)-4-甲氧基苯胺及1-溴-4-異氰酸酯基苯經由通用程序 VI ( 步驟 B 至 E)
合成) (101 mg,0.2 mmol,1.0當量)、(6-氟吡啶-3-基)硼酸(56 mg,0.4 mmol,2.0當量)、Pd(dppf)Cl2
(15 mg,0.02 mmol,0.1當量)及K2
CO3
(83 mg,0.6 mmol,3.0當量)於DMF (5 mL)中之混合物在100 ℃下在N2
氛圍下攪拌14小時。將反應混合物冷卻至室溫,用水(10 mL)稀釋,用EtOAc (10 mL × 3)萃取。用鹽水(2 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之1-(4-(2-氟吡啶-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(100 mg,95%產率)。LC-MS (ESI):m/z
525 [M+H]+
。
步驟 B :
3-(4-甲氧基苯基)-1-(4-(2-側氧基-1,2-二氫吡啶-3-基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將1-(4-(2-氟吡啶-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(53 mg,0.1 mmol,1.0當量)於HCl (1N,水溶液) (3 mL)中之溶液在100 ℃下攪拌2小時。減壓濃縮反應混合物且藉由RP-製備型HPLC直接純化,得到3-(4-甲氧基苯基)-1-(4-(2-側氧基-1,2-二氫吡啶-3-基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 279
)。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 11.78 (br s, 1H), 8.13 (s, 1H), 7.80 (d,J
= 8.4 Hz, 2H), 7.70 (dd,J
= 10.0 Hz, 2.0 Hz, 1H), 7.53 (br s, 1H), 7.41 (dd,J
= 10.0 Hz, 2.0 Hz, 1H), 7.35 (d,J
= 8.8 Hz, 2H), 7.30 (d,J
= 8.4 Hz, 2H), 6.97 (d,J
= 9.2 Hz, 2H), 6.32 (t,J
= 6.4 Hz, 1H), 4.77 (s, 2H), 4.07-3.81 (m, 2H), 3.77 (s, 3H)。
LC-MS (ESI)
:m/z
523 [M+H]+
。
合成
1-(4-(1H-
吡咯
-3-
基
)
苯基
)-3-(4-
甲氧基苯基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2(1H)-
酮
(
實施例
280)
步驟 A :
呈白色固體狀之3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-1-(4-(1-(三異丙基矽烷基)-1H-吡咯-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮係經由相似程序經由實施例 279 ( 步驟 A)
由1-(4-溴苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及3-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)-1-(三異丙基矽烷基)-1H-吡咯(Ref:Eur. J. Med. Chem
.,2015
,103
, 105-122)合成。LC-MS (ESI):m/z
651 [M+H]+
。
步驟 B :
1-(4-(1H-吡咯-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-1-(4-(1-(三異丙基矽烷基)-1H-吡咯-3-基)苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(65 mg,0.1 mmol)於TFA/DCM混合物(3 mL,1/5, v/v)中之溶液在室溫下攪拌14小時。隨後減壓濃縮反應混合物且藉由RP-製備型HPLC純化,得到1-(4-(1H-吡咯-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 280
)。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 10.95 (s, 1H), 8.11 (s, 1H), 7.57 (d,J
= 8.4 Hz, 2H), 7.48 (br s, 1H), 7.34 (d,J
= 8.8 Hz, 2H), 7.25 (d,J
= 2.0 Hz, 1H), 7.18 (d,J
= 8.4 Hz, 2H), 6.97 (d,J
= 8.8 Hz, 2H), 6.81 (dd,J
= 4.4 Hz, 2.4 Hz, 1H), 6.46 (dd,J
= 4.0 Hz, 2.4 Hz, 1H), 4.76 (s, 2H), 4.15-3.68 (m, 2H), 3.77 (s, 3H)。
LC-MS (ESI)
:m/z
495 [M+H]+
。
合成
1-(4-(2-
羥基環丙基
)
苯基
)-3-(4-
甲氧基苯基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2(1H)-
酮
(
實施例
281)
將3-(4-甲氧基苯基)-1-(4-(2-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)環丙基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(由3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮及2-(2-(4-溴苯基)環丙基)-4,4,5,5-四甲基-1,3,2-二㗁硼烷(Ref:Organic and Biomolecular Chemistry,2016
,14
, 6591-6595)經由通用程序 IV ( 方法 B ,步驟 C)
合成) (100 mg,0.17 mmol,1.0當量)及H2
O2
(30%於H2
O中,0.34 mL,3.4 mmol,20當量)於MeOH (3 mL)中之溶液在0 ℃下攪拌2小時。隨後用水(10 mL)稀釋反應混合物且用EtOAc (10 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到1-(4-(2-羥基環丙基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 281
)。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 8.11 (s, 1H), 7.33 (d,J
= 8.8 Hz, 2H), 7.13 (d,J
= 8. 4 Hz, 2H), 7.05 (d,J
= 8.4 Hz, 2H), 6.96 (d,J
= 8.8 Hz, 2H), 4.76 (s, 2H), 3.95-3.83 (m, 2H), 3.77 (s, 3H), 3.39-3.33 (m, 1H), 2.00-1.93 (m, 1H), 1.15-1.09 (m, 1H), 0.98-0.93 (m, 1H)。
LC-MS (ESI)
:m/z
486 [M+H]+
。
合成
7-
乙氧基
-1-(6-(
氟甲基
)
吡啶
-3-
基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-3,4-
二氫吡啶并
[2,3-d]
嘧啶
-2(1H)-
酮
(
實施例
282)
在0℃下向7-乙氧基-1-(6-(羥甲基)吡啶-3-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(由7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮及(5-溴吡啶-2-基)甲醇經由通用程序 II ( 方法 A ,步驟 D)
合成) (112 mg,0.26 mmol,1.0當量)於DCM (10 mL)中之溶液中添加DAST (84 mg,0.52 mmol,2.0當量)。隨後將反應混合物攪拌30分鐘。用冰水(10 mL)淬滅所得混合物,且用EtOAc (10 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到7-乙氧基-1-(6-(氟甲基)吡啶-3-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 282
)。
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): 8.57 (d,J
= 2.4 Hz, 1H), 8.36 (s, 1H), 7.92 (dd,J
= 8.0 Hz, 2.4 Hz, 1H), 7.72 (dd,J
= 2.0 Hz, 0.8 Hz, 1H), 7.66-7.55 (m, 3H), 7.30 (dd,J
= 9.2 Hz, 2.0 Hz, 1H), 6.46 (d,J
= 8.0 Hz, 1H), 5.54 (d,JHF
= 48.0 Hz, 2H), 4.94 (s, 2H), 4.17 (s, 3H), 3.86 (q,J
= 7.2 Hz, 2H), 1.07 (t,J
= 7.2 Hz, 3H)。
LC-MS (ESI)
:m/z
433 [M+H]+
。
合成
1-(
苯并
[d]
㗁唑
-5-
基
)-7-(2,2-
二氟乙氧基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-3,4-
二氫吡啶并
[2,3-d]
嘧啶
-2(1H)-
酮
(
實施例
283)
步驟 A :
7-(2,2-二氟乙氧基)-1-(4-羥基-3-硝基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(500 mg,1.39 mmol,1.0當量) (經由通用程序 II , 方法 A , 步驟 A 至 C
獲得)於DMSO (2 mL)中之溶液中添加CsF (630 mg,4.08 mmol,3.0當量)、N1
,N2
-二甲基環己烷-1,2-二胺(395 mg,2.78 mmol,2.0當量)及CuI (264 mg,1.39 mmol,1.0當量)將反應混合物在100 ℃下在N2
氛圍下攪拌16小時。藉由LC-MS監測反應進程,完成後,用水(20 mL)稀釋反應混合物且用EtOAc (30 mL × 3)萃取,用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之7-(2,2-二氟乙氧基)-1-(4-羥基-3-硝基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(432 mg,56%產率)。LC-MS (ESI):m/z
497 [M+H]+
步驟 B :
1-(3-胺基-4-羥苯基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向7-(2,2-二氟乙氧基)-1-(4-羥基-3-硝基苯基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮(200 mg,0.4 mmol,1.0當量)於MeOH (2 mL)中之溶液中添加乙酸(0.5 mL)及鋅(79 mg,1.20 mmol,3.0當量),將反應混合物在室溫下攪拌2小時。用水(10 mL)稀釋反應混合物,且用EtOAc (10 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之1-(3-胺基-4-羥苯基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(138 mg,73 %產率)。LC-MS (ESI):m/z
467 [M+H]+
。
步驟 C :
1-(苯并[d]㗁唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將1-(3-胺基-4-羥苯基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮(118 mg,0.25 mmol,1.0當量)於HC(OEt)3
(4 mL)中之懸浮液在120 ℃下攪拌8小時。藉由LC-MS監測反應進程,完成後,減壓移除過量HC(OEt)3
,用水(20 mL)稀釋殘餘物且用EtOAc (20 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到1-(苯并[d]㗁唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 283
)。LC-MS (ESI):m/z
477 [M+H]+
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.79 (s, 1H), 8.36 (s, 1H), 7.86-7.81 (m, 2H), 7.72 (d,J
= 2.0 Hz, 1H), 7.69 (d,J
= 8.0 Hz, 1H), 7.58 (d,J
= 9.2 Hz, 1H), 7.45 (dd,J
= 8.8 Hz, 1.6 Hz, 1H), 7.30 (dd,J
= 9.2 Hz, 1.6 Hz, 1H), 6.55 (d,J
= 8.0 Hz, 1H), 5.94 (tt,J HF
= 55.2 Hz,J
= 4.0 Hz, 1H), 4.98 (s, 2H), 4.17 (s, 3H), 3.97 (td,J HF
= 14.4 Hz,J
= 3.6 Hz, 2H)。
合成
6-
氯
-7-(2,2-
二氟乙氧基
)-1-(4-(
二氟甲氧基
)
苯基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-3,4-
二氫喹唑啉
-2(1H)-
酮
(
實施例
284)
步驟 A :
5-氯-4-氟-2-硝基苯甲醛
在0℃下向3-氯-4-氟苯甲醛 (1 g,6.30 mmol,1.0當量)於H2
SO4
(4 mL)中之溶液中小心添加HNO3
(1 mL),將反應混合物升溫至室溫且再攪拌2小時。將反應混合物倒於冰水(10 mL)上且用EtOAc (40 mL × 3)萃取,用鹽水(30 ml)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之5-氯-4-氟-2-硝基苯甲醛 (960 mg,75%產率)。
步驟 B :
5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲醛
向5-氯-4-氟-2-硝基苯甲醛 (50 mg,0.24 mmol,1.0當量)於乙腈(4 mL)中之溶液中添加K2
CO3
(68 mg,0.49 mmol,2.0當量)及2,2-二氟乙-1-醇(24 mg,0.29 mmol,1.2當量),將反應混合物在80℃下攪拌15小時。用H2
O (10 ml)稀釋反應混合物,用EtOAc (10 mL × 3)萃取,用鹽水(10 ml)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲醛 (25 mg,38%產率)。LC-MS (ESI):m/z
266 [M+H]+
。
步驟 C
:N-(5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲基)-2-甲基-2H-吲唑-5-胺
向5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲醛 (400 mg,1.50 mmol,1.0當量)及2-甲基-2H-吲唑-5-胺(244 mg,1.65 mmol,1.1當量)於DCE (4 mL)中之混合物中添加MgSO4
(1807 mg,15.06 mmol,10.0當量)及HOAc (361 mg,6.02 mmol,4.0當量),將反應混合物在25℃下攪拌16小時。在0℃下以若干份添加NaBH(OAc)3
(477 mg,2.25 mmol,3.0當量),其後,使反應混合物升溫至室溫且再攪拌4小時。藉由LC-MS監測反應進程,完成後,用NaHCO3
(飽和水溶液) (20 mL)淬滅反應,用EtOAc (20 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈淡黃色固體狀之N-(5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲基)-2-甲基-2H-吲唑-5-胺(472 mg,79%產率)。LC-MS (ESI):m/z
397 [M+H]+
。
步驟 D :
N-(5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲基)-2-甲基-2H-吲唑-5-胺
向N-(5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲基)-2-甲基-2H-吲唑-5-胺(2.0 g,5.04 mmol,1.0當量)於MeOH (10 mL)中之溶液中添加Pd/C (200 mg,10% wt,濕),將反應混合物在H2
氣囊(1atm)下在25℃下攪拌3小時。藉由TLC監測反應進程,完成後,藉由過濾經由短Celite®
墊移除催化劑,減壓濃縮濾液,且藉由急驟矽膠管柱層析純化殘餘物,得到呈灰白色固體狀之N-(5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲基)-2-甲基-2H-吲唑-5-胺(800 mg,43%)。LC-MS (ESI):m/z
367 [M+H]+
。
步驟 E :
6-氯-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮
在0 ℃下向N-(5-氯-4-(2,2-二氟乙氧基)-2-硝基苯甲基)-2-甲基-2H-吲唑-5-胺(300 mg,0.81 mmol,1.0當量)於THF (5 mL)中之溶液中添加添加三光氣(97 mg,0.32 mmol,0.4當量),升溫至室溫且攪拌16小時。用NaHCO3
(飽和水溶液) (20 mL)淬滅反應,用EtOAc (40 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之6-氯-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮(130 mg,40%產率)。LC-MS (ESI):m/z
367 [M+H]+
。
步驟 F :
6-氯-7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮
向6-氯-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-1,2,3,4-四氫喹唑啉-2-酮(87 mg,0.22 mmol,1.0當量)於二㗁烷(3 mL)中之溶液中添加1-溴-4-(二氟甲氧基)苯(74 mg,0.33 mmol,1.5當量)、CsF (101 mg,0.66 mmol,3.0當量)、N1
,N2
-二甲基環己烷-1,2-二胺(63 mg,0.44 mmol,2.0當量)及CuI (42 mg,0.22 mmol,1.0當量),在90 ℃下在N2
氛圍下攪拌反應混合物16小時。用H2
O (20 mL)稀釋反應混合物,用EtOAc (20 mL × 3)萃取,經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到6-氯-7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮(實施例 284
)。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.34 (s, 1H), 7.66 (d,J
= 1.2 Hz, 1H), 7.56 (d,J
= 9.2 Hz, 1H), 7.50-7.43 (m, 3H), 7.35 (t,J HF
= 74.0 Hz, 1H), 7.33 (d,J
= 8.8 Hz, 2H), 7.25 (dd,J
= 9.2 Hz, 2.0 Hz, 1H), 6.28 (tt,J HF
= 54.0 Hz,J
= 3.2 Hz, 1H), 5.92 (s, 1H), 4.93 (s, 2H), 4.17 (s, 3H), 4.09 (td,J HF
= 14.8 Hz,J
= 3.2 Hz, 2H)。
LC-MS (ESI)
:m/z
535 [M+H]+
。
合成
7-(2,2-
二氟乙氧基
)-1-(4-(
二氟甲氧基
)
苯基
)-6-
氟
-3-(2-
甲基
-2H-
吲唑
-5-
基
)-3,4-
二氫喹唑啉
-2(1H)-
酮
(
實施例
285)
步驟 A :
4-溴-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸
在-78 ℃下向4-(二氟甲氧基)苯胺(269 mg,1.6 mmol,2.0當量)於THF (6 mL)中之溶液中添加LiHMDS (2.53 mL,2.53 mmol,1M,3.2當量),攪拌30分鐘之後,逐滴添加4-溴-2,5-二氟苯甲酸(200 mg,0.8 mmol,1.0當量)於THF (2 mL)中之溶液。使所得混合物升溫至室溫且攪拌16小時。藉由LC-MS監測反應進程,完成後,用H2
O (10 mL)淬滅反應混合物,用稀HCl (1N,水溶液)調整水層pH = 2,用EtOAc (30 mL × 3)萃取,用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-溴-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸(167 mg,53%產率)。LC-MS (ESI):m/z
376 [M+H]+
。
步驟 B
:4-溴-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸甲酯
在0 ℃下向4-溴-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸(860 mg,2.28 mmol,1.0當量)及Cs2
CO3
(1.5 g,4.57 mmol,2.0當量)於DMF (5 mL)之混合物中逐滴添加CH3
I (645 mg,4.56 mmol,2.0當量),將反應混合物攪拌30分鐘。藉由LC-MS監測反應進程,完成後,用H2
O (20 mL)稀釋反應混合物,用EtOAc (30 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-溴-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸甲酯(780 mg,87 %產率)。
LC-MS (ESI):m/z
390 [M+H]+
。
步驟 C
:2-((4-(二氟甲氧基)苯基)胺基)-5-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲酸甲酯
向4-溴-2-{[4-(二氟甲氧基)苯基]胺基}-5-氟苯甲酸甲酯(500 mg,1.28 mmol,1.0當量)及4,4,5,5-四甲基-2-(四甲基-1,3,2-二氧雜硼雜環戊-2-基)-1,3,2-二㗁硼烷 (488 mg,1.92 mmol,1.5當量)於二㗁烷(6 mL)中之混合物中添加KOAc (354 mg,2.56 mmol,2.0當量)及Pd(dppf)Cl2
(87 mg,0.12 mmol,0.1當量),將反應混合物在90 ℃下在N2
氛圍下攪拌4小時。用H2
O (20 mL)稀釋反應混合物,用EtOAc (20 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈無色油狀之2-((4-(二氟甲氧基)苯基)胺基)-5-氟-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲酸甲酯(518 mg,92%產率)。LC-MS (ESI):m/z
438 [M+H]+
。
步驟 D :
2-((4-(二氟甲氧基)苯基)胺基)-5-氟-4-羥基苯甲酸甲酯
向2-{[4-(二氟甲氧基)苯基]胺基}-5-氟-4-(四甲基-1,3,2-二氧雜硼雜環戊-2-基)苯甲酸甲酯(518 mg,1.18 mmol,1.0當量)於THF (4 mL)中之溶液中添加AcOH (0.2 mL)及H2
O2
(30%,1 mL),將反應混合物在25 ℃下攪拌1小時。如由TLC (石油醚/EtOAc =10:1)偵測完成反應。完成後,在0℃下用Na2
SO3
(飽和水溶液) (10 mL)淬滅過量H2
O2
,用EtOAc (20 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到2-((4-(二氟甲氧基)苯基)胺基)-5-氟-4-羥基苯甲酸甲酯(310 mg,80 %產率). LC-MS (ESI):m/z
328 [M+H]+
。
步驟 E :
4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸甲酯
向2-{[4-(二氟甲氧基)苯基]胺基}-5-氟-4-羥基苯甲酸甲酯(310 mg,0.94 mmol,1.0當量)及Cs2
CO3
(621 mg,1.89 mmol,2.0當量)於DMF (4 mL)中之混合物中添加1,1-二氟-2-碘乙烷(364 mg,1.89 mmol,2.0當量),將反應混合物在100℃下攪拌2小時。藉由LC-MS監測反應進程,完成後,用H2
O (20 mL)稀釋反應混合物,用EtOAc (15 mL × 3)萃取,用鹽水(10 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸甲酯(258 mg,70%產率)。LC-MS (ESI):m/z
392 [M+H]+
。
步驟 F :
(4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯基)甲醇
在0℃下向LiAlH4
(76 mg,1.99 mmol,3.0當量)於THF (3 mL)中之懸浮液中逐滴添加4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲酸甲酯(260 mg,0.66 mmol,1.0當量)於THF (1 mL)中之溶液,將反應混合物升溫至室溫且攪拌2小時。藉由LC-MS監測反應進程,完成後,將反應混合物冷卻至0℃,用水(0.1 mL)、NaOH水溶液(0.1 mL,15%)及H2
O (0.3 mL)依序淬滅,隨後經由短Celite®
墊過濾,減壓濃縮濾液,藉由急驟矽膠管柱層析純化殘餘物,得到呈無色油狀之(4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯基)甲醇(230 mg,95%產率)。LC-MS (ESI):m/z
364 [M+H]+
。
步驟 G :
4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲醛
以若干份向(4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯基)甲醇(250 mg,0.69 mmol,1.0當量)於CHCl3
(5 mL)中之溶液中添加MnO2 (
897 mg,10.3 mmol,15.0當量),將反應混合物在40℃下攪拌16小時。藉由LC-MS監測反應進程,完成後,經由短Celite®
墊過濾過量MnO2
,減壓濃縮濾液,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲醛(70 mg,28%產率)。LC-MS (ESI): m/z 362 [M+H]+
。
步驟 H :
N-(4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲基)-2-甲基-2H-吲唑-5-胺
向-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲醛 (44 mg,0.12 mmol,1.0當量)於DCE (10 mL)中之溶液中添加2-甲基-2H-吲唑-5-胺(
22 mg,0.15 mmol,1.2當量)及AcOH (29 mg,0.49 mmol,4.0當量),將反應混合物在室溫下攪拌15小時。隨後將反應混合物冷卻至0℃,一次性添加NaBH(OAc)3
(77 mg,0.36 mmol,3.0當量),將反應混合物升溫至室溫且攪拌3小時。藉由LC-MS監測反應進程,完成後,用冰水(10 mL)淬滅反應且用DCM (20 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由管柱層析純化殘餘物,得到呈淡綠色固體狀之N-(4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲基)-2-甲基-2H-吲唑-5-胺(48 mg,80%產率)。LC-MS(ESI): m/z 493 [M+H]+
.
步驟 I :
7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-6-氟-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮
在0℃下向N-(4-(2,2-二氟乙氧基)-2-((4-(二氟甲氧基)苯基)胺基)-5-氟苯甲基)-2-甲基-2H-吲唑-5-胺(
50 mg,0.1 mmol,1.0當量)於THF (2 mL)中之溶液中添加三光氣(30 mg,0.1 mmol,1.0當量),將反應混合物升溫至室溫且攪拌1小時。藉由LC-MS監測反應進程,完成後,用冰冷卻之NaHCO3
(飽和水溶液) (10 mL)淬滅反應混合物,用EtOAc (20 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-6-氟-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮(實施例 285
)。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.34 (s, 1H), 7.65 (s, 1H), 7.55 (d,J
= 9.2 Hz, 1H), 7.46 (d,J
= 8.8 Hz, 2H), 7.35 (t, JHF
= 74.0 Hz, 1H), 7.34-7.24 (m, 4H), 6.27 (tt,J HF
= 54.0 Hz, 3.2 Hz, 1H), 5.94 (d,J HF
= 7.2 Hz, 1H), 4.93 (s, 2H), 4.16 (s, 3H), 4.13 (td,J HF
= 14.8 Hz,J
= 3.2 Hz, 2H)。
LC-MS
(ESI): m/z 519 [M+H]+
.
合成
7-(2,2-
二氟乙氧基
)-1-(4-(
甲氧基
-d3)
苯基
)-4-
甲基
-3-(2-
甲基
-2H-
吲唑
-5-
基
)-3,4-
二氫吡啶并
[2,3-d]
嘧啶
-2(1H)-
酮
(
實施例
286)
步驟 A :
1-(6-(2,2-二氟乙氧基)-2-((4-(甲氧基-d3)苯基)胺基)吡啶-3-基)乙-1-酮
在0℃下在N2
氛圍下向6-(2,2-二氟乙氧基)-3-異氰基-N-(4-(甲氧基-d3)苯基)吡啶-2-胺 (500 mg,1.62 mmol,1.0當量) (經由通用程序 I ,步驟 A 至 B
製備)於THF (20 mL)中之溶液中逐滴添加CH3
Li (5.1 mL,8.1 mmol,1.6 M,5.0當量),將反應混合物攪拌2小時。藉由TLC監測反應。完成後,用H2
O (10 mL)淬滅反應,用EtOAc (20 mL × 3)萃取,用鹽水(10 mL)洗滌合併之有機層且經Na2
SO4
乾燥,且減壓濃縮,藉由急驟管柱層析純化殘餘物,得到呈黃色固體狀之1-(6-(2,2-二氟乙氧基)-2-((4-(甲氧基d3)苯基)胺基)吡啶-3-基)乙-1-酮(250 mg,48%)。LC-MS (ESI):m/z
326.1 [M+H]+
。
步驟 B :
1-(6-(2,2-二氟乙氧基)-2-((4-(甲氧基-d3)苯基)胺基)吡啶-3-基)乙-1-酮肟
向1-(6-(2,2-二氟乙氧基)-2-((4-(甲氧基-d3)苯基)胺基)吡啶-3-基)乙-1-酮(250 mg,0.77 mmol,1.0當量)及羥胺鹽酸鹽(267 mg,3.85 mmol,5.0當量)於MeOH (5 mL)之混合物中添加NaOH (215 mg,5.39 mmol,7.0當量),將反應混合物在60℃下攪拌6小時。用H2
O (20 mL)淬滅反應混合物且用EA (20 mL × 3)萃取,用鹽水(10 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,且藉由急驟管柱層析純化,得到呈黃色固體狀之1-(6-(2,2-二氟乙氧基)-2-((4-(甲氧基-d3)苯基)胺基)吡啶-3-基)乙-1-酮肟(220 mg,84%產率)。LC-MS (ESI):m/z
341.1 [M+H]+
。
步驟 C :
3-(1-胺乙基)-6-(2,2-二氟乙氧基)-N-(4-(甲氧基-d3)苯基)吡啶-2-胺
在60℃下向1-(6-(2,2-二氟乙氧基)-2-((4-(甲氧基-d3)苯基)胺基)吡啶-3-基)乙-1-酮肟(220 mg,0.65 mmol,1.0當量)及Zn (420 mg,6.50 mmol,10當量)於MeOH (15 mL)中之混合物中逐滴添加濃鹽酸(1.0 mL),將反應混合物在60℃下攪拌3小時。隨後將反應混合物冷卻至0℃,用H2
O (20 mL)稀釋且過濾用EtOAc (10 mL × 3)洗滌濾餅,用EtOAc (20 mL × 3)萃取濾液。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟管柱層析純化殘餘物,得到呈棕色油狀之3-(1-胺乙基)-6-(2,2-二氟乙氧基)-N-(4-(甲氧基-d3)苯基)吡啶-2-胺(170 mg,81%產率)。LC-MS (ESI):m/z
327.2 [M+H]+
。
步驟 D :
7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-4-甲基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向3-(1-胺乙基)-6-(2,2-二氟乙氧基)-N-(4-(甲氧基-d3)苯基)吡啶-2-胺(170 mg,0.52 mmol,1.0當量)於THF (10 mL)中之溶液中添加CDI (169 mg,1.04 mmol,2.0當量)及t-BuOK (117 mg,1.04 mmol,2.0當量),將反應混合物在65℃下攪拌2小時。隨後用H2
O (20 mL)淬滅反應混合物且用EtOAc (20 mL × 3)萃取,用鹽水(10 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟管柱層析純化殘餘物,得到呈白色固體狀之7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-4-甲基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(130 mg,71%產率)。LC-MS (ESI): m/z = 353.1 [M+H]+
。
步驟 E :
7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-4-甲基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-4-甲基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(100 mg,0.28 mmol,1.0當量)於DMSO (6 mL)中之溶液中添加5-溴-2-甲基-2H-吲唑 (418 mg,1.99 mmol,7.0當量)、N1
,N2
-二甲基環己烷-1,2-二胺(81 mg,0.57 mmol,2.0當量)、CuI (109 mg,0.57 mmol,2.0當量)、NaI (85 mg,0.57 mmol,2.0當量)及Cs2
CO3
(185 mg,0.57 mmol,2.0當量),將反應混合物在N2
氛圍下在140℃下攪拌8小時且在110℃下攪拌15小時。用H2
O (15 mL)稀釋反應物且用EtOAc (20 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-4-甲基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.35 (s, 1H), 7.73-7.66 (m, 2H), 7.60 (d,J
= 8.8 Hz, 1H), 7.25 (d,J
= 8.8 Hz, 2H), 7.20 (dd,J
= 9.2 Hz, 1.6 Hz, 1H), 6.99 (d,J
= 8.8 Hz, 2H), 6.54 (d,J
= 8.4 Hz, 1H), 6.02 (tt,J HF
= 55.6 Hz,J
= 4.0 Hz, 1H), 5.04 (q,J
= 6.4 Hz, 1H), 4.17 (s, 3H), 4.15-3.97 (m, 2H), 1.44 (d,J
= 6.4 Hz, 3H)。
LC-MS
(ESI): m/z = 483.2 [M+H]+
.
在0℃下在N2
氛圍下向7-氯-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(109 mg,0.26 mmol,1.0當量)及Fe(acac)3
(93 mg,0.26 mmol,1.0當量)於THF (5 mL)及NMP (1 mL)之混合物中逐滴添加溴化正丙基鎂(1 M於乙醚中,4.0 mL,4.0 mmol,15.4當量)。將混合物在室溫下攪拌隔夜且用冰水(10 mL)小心淬滅。用EtOAc (10 mL × 3)萃取粗混合物。用鹽水(20 mL)洗滌合併之有機層 且經Na2
SO4
乾燥,減壓濃縮。藉由RP-製備型HPLC純化粗殘餘物,得到1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-丙基-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮( 實施例 294)
。
1
H NMR (400 MHz, DMSO-d6
) δ: 8.34 (s, 1H), 7.67 (d,J
= 1.5 Hz, 1H), 7.56 (dd,J
= 8.3 Hz, 3.8 Hz, 2H), 7.26 (dd,J
= 9.2 Hz, 2.0 Hz, 1H), 7.19 (d,J
= 8.8 Hz, 2H), 6.97 (d,J
= 8.8 Hz, 2H), 6.87 (d,J
= 7.5 Hz, 1H), 4.94 (s, 2H), 4.17 (s, 3H), 3.80 (s, 3H), 2.43 (t,J
= 7.5 Hz, 2H), 1.54-1.37 (m, 2H), 0.79 (t,J
= 7.3 Hz, 3H)。
LC-MS (ESI):m/z
428.1 [M+H]+
。
在-78℃下向7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 141
) (150 mg,0.32 mmol,1.0當量)於DCM (4 mL)中之溶液中逐滴添加BBr3
(403 mg,1.61 mmol,5.0當量),將反應混合物在-78℃下攪拌0.5小時,隨後將其升溫至0℃。藉由添加NaHCO3
(飽和水溶液) (10 mL)淬滅反應,用DCM (10 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到7-(2,2-二氟乙氧基)-1-(4-羥苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(實施例 295
)。
1
H NMR (400 MHz, DMSO-d6
) δ: 9.50 (s, 1H), 8.34 (s, 1H), 7.68 (d,J
= 1.6 Hz, 1H), 7.65 (d,J
= 8.4 Hz, 1H), 7.57 (d,J
= 9.2 Hz, 1H), 7.26 (dd,J
= 9.2 Hz, 2.0 Hz, 1H), 7.12 (d,J
= 8.8 Hz, 2H), 6.82 (d,J
= 8.8 Hz, 2H), 6.51 (d,J
= 8.0 Hz, 1H), 6.03 (tt,J HF
= 55.6 Hz,J
= 4.0 Hz, 1H), 4.92 (s, 2H), 4.17 (s, 3H), 4.08 (td,J HF
= 14.4 Hz,J
= 4.0 Hz, 2H)。LC-MS (ESI):m/z
452.2 [M+H]+
。
合成
7-(2,2-
二氟乙氧基
)-1-(4-
甲氧基環己基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-1H,2H,3H,4H-
吡啶并
[2,3-d]
嘧啶
-2-
酮
(
實施例
427)
步驟 A :
7-(2,2-二氟乙氧基)-1-(4-甲氧基環己-1-烯-1-基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮
向7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮(400 mg,1.11 mmol,1.0當量)於DMSO (8mL)中之溶液中添加Cs2
CO3
(1.09 g,3.33 mmol,3.0當量)、CuI (212 mg,1.11 mmol,1.0當量)、(1R,2R)-N1,N2-二甲基環己烷-1,2-二胺(315 mg,2.22mmol,2.0當量)及三氟甲烷磺酸4-甲氧基環己-1-烯-1-基酯(Ref:J. Am. Chem. Soc.
,2018
,140
, 2446-2449) (579 mg 2.22 mmol,2.0當量),將混合物在100℃下在N2
氛圍下攪拌12小時。完成後,用水(50 mL)淬滅反應且用EtOAc (80 mL × 3)萃取。經Na2
SO4
乾燥合併之有機層,過濾,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之7-(2,2-二氟乙氧基)-1-(4-甲氧基環己-1-烯-1-基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮(480 mg,92%)。LC-MS (ESI): m/z
470 [M+H]+
。
步驟 B :
7-(2,2-二氟乙氧基)-1-(4-甲氧基環己基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮
向7-(2,2-二氟乙氧基)-1-(4-甲氧基環己-1-烯-1-基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮(120 mg,0.25 mmol,1.0當量)於MeOH (8 mL)中之溶液中添加PtO2
(12 mg,0.05 mmol,0.2當量),用H2
使反應混合物脫氣且在50℃下在H2
氛圍(1 atm)下攪拌12小時。如由LCMS所示,反應完成。經由短Celite®
墊過濾反應混合物,減壓濃縮濾液,藉由RP-製備型HPLC純化殘餘物,得到7-(2,2-二氟乙氧基)-1-(4-甲氧基環己基)-3-(2-甲基-2H-吲唑-5-基)-1H,2H,3H,4H-吡啶并[2,3-d]嘧啶-2-酮( 實施例 427)
。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm):8.30 (s, 1H), 7.57 (d,J
= 8.5 Hz, 1H), 7.57 (s, 1H), 7.53 (d,J
= 9.1 Hz, 1H), 7.16 (d,J
= 9.2 Hz, 1H), 6.50 (d,J
= 8.0 Hz, 1H), 6.40 (tt,J HF
= 55.5 Hz,J
= 3.8 Hz, 1H), 4.69 (s, 2H), 4.62 (td,J HF
= 14.9 Hz,J
= 3.5 Hz, 2H), 4.55-4.45 (m, 1H), 4.15 (s, 3H), 3.22 (s, 3H), 3.24-3.18 (m, 1H), 2.90-2.72 (m, 2H), 2.01-1.96 (m, 2H), 1.50-1.38 (m, 4H)。
LC-MS (ESI)
:m/z
472.6 [M+H]+
。
合成
1-(4-(
二氟甲氧基
)
苯基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫吡啶并
[3,2-d]
嘧啶
-2(1H)-
酮
(
實施例
428)
步驟 A :
2-3-溴-5-((2,2,2-三氟乙基)胺基)氰基吡啶
向2-3-溴-5-氟氰基吡啶(5.0 g,24.9 mmol,1.0當量)及DIEA (9.7 g,74.6 mmol,3.0當量)於DMF (50 mL)中之溶液中添加2,2,2-三氟乙-1-胺(7.4 g,74.6 mmol,3.0當量),將反應混合物密封在管中且在100℃下攪拌15小時。隨後將反應混合物倒入H2
O (50 mL)且用EtOAc (50 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈淡黃色固體狀之2-3-溴-5-((2,2,2-三氟乙基)胺基)氰基吡啶(4.5 g,65%產率)。LC-MS (ESI): m/z
280, 282 [M+H]+
。
步驟 B :
2-3-溴-5-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)氰基吡啶
在0℃下以若干份向2-3-溴-5-((2,2,2-三氟乙基)胺基)氰基吡啶(1.13 g,4.04 mmol,1.0當量)於DMF (10 mL)中之溶液中添加NaH (60% wt懸浮於礦物油中) (323 mg,8.07 mmol,2.0當量),將反應混合物在室溫下攪拌0.5小時。隨後將反應混合物冷卻至0℃且逐滴添加SEMCl (807 mg,4.84 mmol,1.2當量),使反應混合物升溫至室溫且再攪拌2小時。完成後,將反應混合物倒入冰水(30 mL),用EtOAc (40 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈淡黃色油狀之2-3-溴-5-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)氰基吡啶(1.1 g,66%)。LC-MS (ESI): m/z
410, 412 [M+H]+
。
步驟 C :
2-3-((4-(二氟甲氧基)苯基)胺基)-5-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)氰基吡啶
將2-3-溴-5-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)氰基吡啶(400 mg,0.97 mmol,1.0當量)、4-(二氟甲氧基)苯胺(155 mg,0.97 mmol,1.0當量)、RuPhos-Pd-G3預催化劑(81 mg,0.097 mmol,0.1當量)及K2
CO3
(269 mg,1.95 mmol,2.0當量)於甲苯(5 mL)中之混合物在100℃下攪拌15小時。隨後用H2
O (15 mL)稀釋反應混合物且用EtOAc (20 mL × 3)萃取,用鹽水(15 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈淡黃色油狀之2-3-((4-(二氟甲氧基)苯基)胺基)-5-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)氰基吡啶(200 mg,42%)。LC-MS (ESI): m/z
489 [M+H]+
。
步驟 D :
2-(胺甲基)-N3-(4-(二氟甲氧基)苯基)-N5-(2,2,2-三氟乙基)-N5-((2-(三甲基矽烷基)乙氧基)甲基)吡啶-3,5-二胺
向2-3-((4-(二氟甲氧基)苯基)胺基)-5-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)氰基吡啶(90 mg,0.18 mmol,1.0當量)於MeOH (3 mL)中之溶液中添加雷尼鎳 (30 mg)用H2
使反應混合物脫氣,隨後添加NH4
OH (1 mL),將反應混合物在室溫下在H2
氛圍(1 atm)下攪拌5小時。經由短Celite®
墊過濾反應混合物,減壓濃縮濾液,得到呈棕色油狀之2-(胺甲基)-N3-(4-(二氟甲氧基)苯基)-N5-(2,2,2-三氟乙基)-N5-((2-(三甲基矽烷基)乙氧基)甲基)吡啶-3,5-二胺(90 mg,粗物質),其不經進一步純化即用於下一步驟。LC-MS (ESI): m/z
493 [M+H]+
。
步驟 E :
1-4-(二氟甲氧基)苯基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮
向2-(胺甲基)-N3-(4-(二氟甲氧基)苯基)-N5-(2,2,2-三氟乙基)-N5-((2-(三甲基矽烷基)乙氧基)甲基)吡啶-3,5-二胺(90 mg,0.18 mmol,1.0當量)於DMF (2 mL)中之溶液中添加CDI (89 mg,0.54 mmol,3.0當量)及t-BuOK (82 mg,0.72 mmol,4.0當量),將反應混合物在50℃下攪拌5小時。隨後將反應混合物倒入冰水(10 mL)且用EtOAc (20 mL × 3)萃取,用鹽水(15 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之1-(4-(二氟甲氧基)苯基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮(52 mg,53%)。LC-MS (ESI): m/z
519 [M+H]+
。
步驟 F :
1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮
用N2
使1-(4-(二氟甲氧基)苯基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮(52 mg,0.1 mmol,1.0當量)、5-溴-2-甲基-2H-吲唑 (32 mg,0.15 mmol,1.5當量)、N1,N2-二甲基環己烷-1,2-二胺(29 mg,0.2 mmol,2.0當量)、CuI (19 mg,0.1 mmol,1.0當量)及CsF (46 mg,0.3 mmol,3.0當量)於DMSO (1.5 mL)中之混合物脫氣,且在100℃下在N2
氛圍下攪拌3小時。隨後用水(10 mL)稀釋反應混合物且用EtOAc (20 mL × 3)萃取,用鹽水(15 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮(18 mg,28%)。LC-MS (ESI): m/z
649 [M+H]+
。
步驟 G :
1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮
向1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)((2-(三甲基矽烷基)乙氧基)甲基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮(18 mg,0.028 mmol,1.0當量)於DCM (1 mL)中之溶液中添加TFA (0.5 mL),將反應混合物在室溫下攪拌5小時。隨後減壓濃縮反應混合物,用DCM (20 mL)稀釋殘餘物,用NaHCO3
(飽和水溶液) (10 mL)洗滌,減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮( 實施例 428)
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.33 (s, 1H), 7.75 (s, 1H), 7.70 (s, 1H), 7.56 (d,J
= 9.2 Hz, 1H), 7.45 (d,J
= 8.5 Hz, 2H), 7.35 (t,J HF
= 75.4 Hz, 1H), 7.34 (d,J
= 8.5 Hz, 2H), 7.28 (d,J
= 9.2 Hz, 1H), 6.44 (t,J
= 6.8 Hz, 1H), 5.94 (s, 1H), 4.90 (s, 2H), 4.16 (s, 3H), 3.92-3.80 (m, 2H)。
LC-MS (ESI)
:m/z
519 [M+H]+
。
合成
7-(2,2-
二氟乙氧基
)-1-(
反
-4-
甲氧基環己基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-3,4-
二氫吡啶并
[2,3-d]
嘧啶
-2(1H)-
酮
(
實施例
429)
步驟 A :
6-(2,2-二氟乙氧基)-N-甲氧基-2-((反-4-甲氧基環己基)胺基)-N-甲基菸鹼醯胺
向6-氯-N-甲氧基-2-((反-4-甲氧基環己基)胺基)-N-甲基菸鹼醯胺(由2,6-二氯菸鹼酸及反-4-甲氧基環己-1-胺經由脲通用程序 III ( 步驟 A 及 B)
合成) (210 mg,0.64 mmol,1.0當量)於甲苯/2,2-二氟乙-1-醇(5 mL,10/1, v/v)中之溶液中添加Cs2
CO3
(626 mg,1.92 mmol,3.0當量)、Pd(OAc)2
(14 mg,0.064 mmol,0.1當量)及t-BuXPhos (54 mg,0.13 mmol,0.2當量),用N2
使反應混合物脫氣且在100℃下在N2
氛圍下攪拌3小時。隨後將反應混合物倒入H2
O (10 mL)且用EtOAc (20 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之6-(2,2-二氟乙氧基)-N-甲氧基-2-((反-4-甲氧基環己基)胺基)-N-甲基菸鹼醯胺(170 mg,71%)。LC-MS (ESI): m/z
374 [M+H]+
。
步驟 B :
6-(2,2-二氟乙氧基)-2-((反-4-甲氧基環己基)胺基)菸鹼醛
在-65℃下向6-(2,2-二氟乙氧基)-N-甲氧基-2-((反-4-甲氧基環己基)胺基)-N-甲基菸鹼醯胺(170 mg,0.455 mmol,1.0當量)於THF (3 mL)中之溶液中添加LiAlH4
(52 mg,1.37 mmol,3.0當量),將反應混合物在-65℃下攪拌2小時。用NH4
Cl (飽和水溶液) (5 mL)淬滅反應,隨後使升溫至室溫,用EtOAc (20 mL × 3)萃取。用鹽水(10 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈無色油狀之6-(2,2-二氟乙氧基)-2-((反-4-甲氧基環己基)胺基)菸鹼醛(105 mg,73%)。LC-MS (ESI): m/z
315 [M+H]+
。
步驟 C :
N-((6-(2,2-二氟乙氧基)-2-((反-4-甲氧基環己基)胺基)吡啶-3-基)甲基)-2-甲基-2H-吲唑-5-胺
向6-(2,2-二氟乙氧基)-2-((反-4-甲氧基環己基)胺基)菸鹼醛(104 mg,0.33 mmol,1.0當量)及2-甲基-2H-吲唑-5-胺(58 mg,0.4 mmol,1.2當量)於DCE (3 mL)中之溶液中添加MgSO4
(398 mg,3.3 mmol,10.0當量)及AcOH (79 L,1.32 mmol,4.0當量),將反應混合物在室溫下攪拌15小時。隨後將反應混合物冷卻至0℃,一次性添加NaBH(OAc)3
(210 mg,0.99 mmol,3.0當量),使所得混合物升溫至室溫且攪拌5小時。完成後,在0℃下用水性NaHCO3
(飽和水溶液) (10 mL)淬滅反應混合物,且用EtOAc (15 mL × 3)萃取,經Na2
SO4
乾燥合併之有機層且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈淡綠色固體狀之N-((6-(2,2-二氟乙氧基)-2-((反-4-甲氧基環己基)胺基)吡啶-3-基)甲基)-2-甲基-2H-吲唑-5-胺(70 mg,47%)。LC-MS (ESI): m/z
446 [M+H]+
。
步驟 D :
7-(2,2-二氟乙氧基)-1-(反-4-甲氧基環己基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
在0℃下向N-((6-(2,2-二氟乙氧基)-2-((反-4-甲氧基環己基)胺基)吡啶-3-基)甲基)-2-甲基-2H-吲唑-5-胺(50 mg,0.112 mmol,1.0當量)及DIEA (58 mg,0.45 mmol,4.0當量)於THF (2 mL)中之溶液中添加三光氣(13 mg,45 mol,0.4當量),將反應混合物在50℃下攪拌3小時,隨後冷卻至室溫,添加t-BuOK (25 mg,0.22 mmol,2.0當量)且將反應混合物在室溫下再攪拌2小時。完成後,將反應混合物倒入冰水(10 mL)且用EtOAc (15 mL × 3)萃取,經Na2
SO4
乾燥合併之有機層且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到7-(2,2-二氟乙氧基)-1-(反-4-甲氧基環己基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮( 實施例 429)
。
1 H NMR
(400 MHz, CDCl3
) δ (ppm): 7.87 (s, 1H), 7.68 (d,J
= 9.2 Hz, 1H), 7.51 (s, 1H), 7.33 (d,J
= 8.0 Hz, 1H), 7.25-7.21 (m, 1H), 6.45 (d,J
= 7.6 Hz, 1H), 6.13 (t,J HF
= 54.8 Hz, 1H), 4.66 (s, 2H), 4.64-4.47 (m, 3H), 4.22 (s, 3H), 3.36 (s, 3H), 3.25-3.15 (m, 1H), 2.63-2.54 (m, 2H), 2.23-2.16 (m, 2H), 1.90-1.85 (m, 2H), 1.40-1.31 (m, 2H)。
LC-MS (ESI)
:m/z
472 [M+H]+
。
合成
5-
胺基
-1-(4-(
甲氧基
-d3)
苯基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2(1H)-
酮
(
實施例
430)
步驟 A :
4-氯-6-((4-(甲氧基-d3)苯基)胺基)-2-(甲硫基)嘧啶-5-甲醛
向4-(甲氧基-d3
)苯胺(2.5 g,19.82 mmol,1.0當量)於THF (70 mL)中之溶液中添加Et3
N (3.0 g,30.0 mmol,1.5當量),將反應混合物在0℃下攪拌10分鐘。隨後添加4,6-二氯-2-(甲硫基)嘧啶-5-甲醛(4.4 g,19.82 mmol,1.0當量),將混合物升溫至室溫且攪拌2小時。減壓濃縮反應混合物,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之4-氯-6-((4-(甲氧基-d3
)苯基)胺基)-2-(甲硫基)嘧啶-5-甲醛(5.9 g,97%)。
LC-MS (ESI): m/z
313 [M+H]+
。
1 H NMR
(400 MHz, CDCl3
) δ (ppm): 11.05 (s, 1H), 10.23 (s, 1H), 7.49-7.43 (m, 2H), 6.87-6.79 (m, 2H), 2.44 (s, 3H)。
步驟 B :
(4-氯-6-((4-(甲氧基-d3)苯基)胺基)-2-(甲硫基)嘧啶-5-基)甲醇
在0℃下向4-氯-6-((4-(甲氧基-d3
)苯基)胺基)-2-(甲硫基)嘧啶-5-甲醛(1.3 g,4.16 mmol,1.0當量)於THF (10 mL)及水(2 mL)中之溶液中添加NaBH4
(0.24 g,6.23 mmol,1.0當量)。隨後將混合物在20℃下攪拌4小時。用水(40 mL)淬滅反應混合物且用EtOAc (40 mL × 3)萃取,經無水Na2
SO4
乾燥合併之有機層,過濾,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之(4-氯-6-((4-(甲氧基-d3
)苯基)胺基)-2-(甲硫基)嘧啶-5-基)甲醇(600 mg,46%)。LC-MS (ESI): m/z
315 [M+H]+
。
步驟 C :
5-(疊氮基甲基)-6-氯-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺
向(4-氯-6-((4-(甲氧基-d3
)苯基)胺基)-2-(甲硫基)嘧啶-5-基)甲醇(720 mg,2.29 mmol,1.0當量)於DCM/甲苯(1/1, v/v) (16 mL)中之溶液中添加DBU (696 mg,4.57 mmol,2.0當量),將反應混合物冷卻至0℃,且添加DPPA (1.1 g,4.57 mmol,2.0當量),隨後將反應混合物在室溫下攪拌15小時。完成後,用H2
O (30 mL)稀釋反應混合物且用DCM (40 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈淡黃色油狀之5-(疊氮基甲基)-6-氯-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(370mg,48%)。LC-MS (ESI)
:m/z
340 [M+H]+
。
步驟 D :
5-(胺甲基)-6-氯-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺
向5-(疊氮基甲基)-6-氯-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(370 mg,1.09 mmol,1.0當量)於THF (4 mL)中之溶液中添加H2
O (39 L,2.18 mmol,2.0當量)及PPh3
(571 mg,2.18 mmol,2.0當量),將反應混合物在室溫下攪拌3小時。完成後,用水(20 mL)稀釋反應混合物,用EtOAc (40 mL × 3)萃取。合併合併之有機層且用鹽水(20 mL)洗滌,經Na2
SO4
乾燥且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈淡黃色油狀之5-(胺甲基)-6-氯-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(280mg,82%)。LC-MS (ESI)
:m/z
314 [M+H]+
。
步驟 E :
5-氯-1-(4-(甲氧基-d3
)苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在0℃下一次性向5-(胺甲基)-6-氯-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(280 mg,0.89 mmol,1.0當量)及Et3
N (361 mg,3.57 mmol,4.0當量)於DCM (5 mL)中之溶液中添加三光氣(132 mg,0.45 mmol,0.5當量),將反應混合物在室溫下攪拌2小時。完成後,藉由添加冰冷卻之NaHCO3
(飽和水溶液) (30 mL)淬滅反應混合物,用EtOAc (30 mL × 3)萃取合併合併之有機層且用鹽水(15 mL)洗滌,經Na2
SO4
乾燥且 減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之5-氯-1-(4-(甲氧基-d3
)苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(250 mg,82%)。LC-MS (ESI)
:m/z
340 [M+H]+
。
步驟 F :
5-氯-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
向5-氯-1-(4-(甲氧基-d3
)苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(500 mg,1.47 mmol,1.0當量)及(2-甲基-2H-吲唑-5-基)硼酸(388 mg,2.21 mmol,1.5當量)於DMF (10 mL)中之溶液中添加Cu(OAc)2
(267 mg,1.47 mmol,1.0當量)及吡啶(141 L,1.77 mmol,1.2當量),將反應混合物在50℃下在空氣氛圍下攪拌24小時。經由短Celite®
墊過濾反應混合物,用H2
O (40 mL)稀釋濾液,用EtOAc (20 mL × 3)萃取,經Na2
SO4
乾燥合併之有機層,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之5-氯-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(310 mg,45%)。LC-MS (ESI)
:m/z
470 [M+H]+
。
步驟 G :
5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將5-氯-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(450 mg,0.96 mmol,1.0當量)、(3,4-二甲氧基苯基)甲胺(240 mg,1.44 mmol,1.5當量)及K2
CO3
(397 mg,2.87 mmol,3.0當量)於DMAc (10 mL)中之混合物在80℃下攪拌2小時。TLC顯示反應完成。用水(30 ml)稀釋反應物,用DCM (30mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,過濾,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(320 mg,56%)。LC-MS (ESI)
:m/z
601 [M+H]+
。
步驟 H :
5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在0℃下向5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(100 mg,0.17 mmol,1.0當量)於DCM (4mL)中之溶液中逐份添加m
CPBA (103 mg,0.51 mmol,3.0當量),將反應混合物在0℃下攪拌2小時。完成後,用Na2
S2
O3
(飽和水溶液) (10 mL)淬滅混合物,用DCM (20 mL × 3)萃取。用鹽水(10 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,過濾,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈灰白色固體狀之5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(90mg,84%)。LC-MS (ESI)
:m/z
633 [M+H]+
。
步驟 I :
5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(90 mg,0.14 mmol,1.0當量)、CsF (22 mg,0.14 mmol,1.0當量)、DIEA (55 mg,0.43 mmol,3.0當量)及2,2,2-三氟乙-1-胺(70 mg,0.71 mmol,5.0當量)於DMSO (6 mL)中之混合物在密封管中在100℃下攪拌12小時。隨後將Cs2
CO3
(139 mg,0.43 mmol,3.0當量)添加至混合物,隨後在100℃下再攪拌12小時。用水(20mL)稀釋反應混合物,用DCM (30 mL× 3)萃取。用鹽水(10 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,過濾,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(70 mg,77%)。LC-MS (ESI)
:m/z
652 [M+H]+
。
步驟 J :
5-胺基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3
)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(60 mg,0.09 mmol,1.0當量)於TFA (4mL)中之溶液在50℃下攪拌15小時。減壓濃縮反應混合物,用DCM (30 mL)稀釋殘餘物,用NaHCO3
(飽和水溶液) (10mL)及鹽水(10mL)洗滌,經無水Na2
SO4
乾燥,過濾且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到5-胺基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 430
)。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm):8.35 (s, 1H), 7.69 (s, 1H), 7.57 (d,J
= 9.2 Hz, 1H), 7.30-7.24 (m, 1H), 7.12 (d,J
= 8.8 Hz, 2H), 6.92 (d,J
= 8.8 Hz, 2H), 6.77 (s, 1H), 6.38 (s, 2H), 4.61 (s, 2H), 4.16 (s, 3H), 3.76 (s, 2H)。
LC-MS (ESI)
:m/z
502 [M+H]+
。
合成
7-(2,2-
二氟乙氧基
)-3-(2-
甲氧基
-1-
甲基
-1H-
苯并
[d]
咪唑
-6-
基
)-1-(4-(
甲氧基
-d3)
苯基
)-3,4-
二氫吡啶并
[2,3-d]
嘧啶
-2(1H)-
酮
(
實施例
431)
步驟 A :
3-(4-胺基-3-(甲胺基)苯基)-7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3
)苯基)-3-(3-(甲胺基)-4-硝基苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(170 mg,0.35 mmol,1.0當量) (由5-溴-N-甲基-2-硝基苯胺及7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮經由脲通用程序 I ( 步驟 E)
合成)於EtOAc (8 mL)中之溶液中添加10% Pd/C (20 mg)用H2
使反應混合物脫氣,在室溫下在H2
氛圍(1 atm)下攪拌12小時。經由短Celite®
墊過濾反應混合物,減壓濃縮濾液,得到呈棕色油狀之3-(4-胺基-3-(甲胺基)苯基)-7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(110 mg,粗物質)其不經進一步純化即可直接用於下一步驟。LC-MS (ESI): m/z
459 [M+H]+
。
步驟 B :
7-(2,2-二氟乙氧基)-3-(2-甲氧基-1-甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將3-(4-胺基-3-(甲胺基)苯基)-7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(40 mg,0.087 mmol,1.0當量)及四甲氧基甲烷(1 mL)在100℃下在密封管中在N2
氛圍下攪拌12小時。將反應混合物倒入H2
O (20 mL)且用DCM (15 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到7-(2,2-二氟乙氧基)-3-(2-甲氧基-1-甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮( 實施例 431)
。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm):7.65 (d,J
= 8.1 Hz, 1H), 7.43 (d,J
= 2.0 Hz, 1H), 7.40 (d,J
= 8.4 Hz, 1H), 7.29-7.19 (m, 2H), 7.13 (dd,J
= 8.4 Hz, 2.0 Hz, 1H), 7.05-6.95 (m, 2H), 6.52 (d,J
= 8.0 Hz, 1H), 6.00 (tt,J HF
= 55.6 Hz,J
= 3.9 Hz, 1H), 4.90 (s, 2H), 4.10 (s, 3H), 4.05 (td,J HF
= 14.5 Hz,J
= 3.9 Hz, 2H), 3.53 (s, 3H)。
LC-MS (ESI)
:m/z
499 [M+H]+
。
合成
1-(4-(
甲氧基
-d3)
苯基
)-3-(2-
甲基
-2H-
吲唑
-5-
基
)-5-(
甲胺基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2(1H)-
酮
(
實施例
432)
步驟 A :
5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在0℃下一次性向5-((2,4-二甲氧基苯甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(200 mg,0.33 mmol,1.0當量)於DMF (6 mL)中之溶液中添加NaH (60%於礦物油中) (40 mg,0.99 mmol,3.0當量),將反應混合物在0℃下再攪拌30分鐘。隨後經由注射器添加MeI (140 mg,0.99 mmol,3.0當量),將所得混合物在0℃下攪拌2小時。完成後,用冰水(20 mL)淬滅反應且用DCM (20 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈灰白色固體狀之5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(170mg,83%)。LC-MS (ESI):m/z
615 [M+H]+
步驟 B :
5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
在0℃下以若干份向5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(170 mg,0.28 mmol,1.0當量)於DCM (4 mL)中之溶液中添加m
CPBA (168 mg,0.83 mmol,3.0當量),將反應混合物在0℃下攪拌2小時。用Na2
S2
O3
(飽和水溶液) (10mL)淬滅反應,用DCM (10 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈灰白色固體狀之5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(12 0mg,66%)。LC-MS (ESI):m/z
647 [M+H]+
。
步驟 C :
5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(120 mg,0.18 mmol,1.0當量)、CsF (28 mg,0.18 mmol,1.0當量)、DIEA (71 mg,0.54 mmol,3.0當量)及2,2,2-三氟乙-1-胺 (89 mg,0.90 mmol,5.0當量)於DMSO (6 mL)中之混合物在100℃下在密封管中攪拌12小時。隨後添加Cs2
CO3
(176 mg,0.54 mmol,3.0當量),將所得混合物在100℃下再攪拌12小時。用水(20 mL)稀釋反應混合物,用DCM (10 mL × 3)萃取。用鹽水(20 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,過濾,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(80mg,67%)。LC-MS (ESI):m/z
666 [M+H]+
。
步驟 D :
1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-5-(甲胺基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將5-((2,4-二甲氧基苯甲基)(甲基)胺基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(80mg,0.12 mmol,1.0當量)於TFA (4 mL)中之溶液在50℃下攪拌15小時。減壓濃縮反應混合物,用DCM (20 mL)稀釋殘餘物,用NaHCO3
(飽和水溶液) (10 mL)及鹽水(10 mL)洗滌,經無水Na2
SO4
乾燥,過濾且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-5-(甲胺基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮( 實施例 432)
。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 8.30 (s, 1H), 7.67 (s, 1H), 7.56 (d,J
= 9.2 Hz, 1H), 7.24 (dd,J
= 9.2 Hz, 2.0 Hz, 1H), 7.08 (d,J
= 8.9 Hz, 2H), 6.91 (d,J
= 8.9 Hz, 2H), 4.56 (s, 2H), 4.13 (s, 3H), 3.43 (s, 2H), 2.77 (s, 3H)。
LC-MS (ESI)
:m/z
516.1 [M+H]+
。
合成
3-(2-
甲基
-2H-
吲唑
-5-
基
)-1-(6-
甲基吡啶
-3-
基
)-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2(1H)-
酮
(
實施例
433)
步驟 A :
4-((6-甲基吡啶-3-基)胺基)-2-(甲硫基)嘧啶-5-甲醛
向4-氯-2-(甲基硫基)嘧啶-5-甲醛(1.0 g,5.3 mmol,1.0當量)於DMF (10 mL)中之溶液中添加DIEA (1.02 g,8.0 mmol,1.5當量)及6-甲基吡啶-3-胺(573 mg,5.3 mmol,1.0當量),將反應混合物在0℃下攪拌20分鐘,隨後將其升溫至室溫且再攪拌14小時。完成後,用H2
O (50 mL)稀釋反應混合物,用EtOAc (20 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層 且經Na2
SO4
乾燥,減壓濃縮,藉由急驟層析純化殘餘物,得到呈白色固體狀之4-[(6-甲基吡啶-3-基)胺基]-2-(甲基硫基)嘧啶-5-甲醛(1.21 g,88 %)。LC-MS (ESI)
:m/z
261 [M+H]+
。
步驟 B :
2-甲基-N-((4-((6-甲基吡啶-3-基)胺基)-2-(甲硫基)嘧啶-5-基)甲基)-2H-吲唑-5-胺
在0 ℃下向4--2-(甲基硫基)嘧啶-5-甲醛(750 mg,2.9 mmol, 1.0當量) and 2-甲基-2H-吲唑-5-胺(466 mg,3.2 mmol 1.1當量)於DCE/MeOH (6 mL,1/1, v/v)中之溶液中添加HOAc (0.5 mL,8.7 mmol,3.0當量)。將混合物在室溫下攪拌30分鐘,隨後在0℃下以若干份添加NaBH3
CN (908 mg,14.4 mmol,5.0當量),添加之後,將反應混合物升溫至室溫,且在同一溫度下再攪拌1小時。完成後,藉由添加NaHCO3 (飽和水溶液) (20 mL)淬滅反應混合物,用EtOAc (30 mL × 3)萃取,用鹽水(50 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由急驟層析純化殘餘物,得到呈白色固體狀之2-甲基-N-({4--2-(甲基硫基)嘧啶-5-基}甲基)-2H-吲唑-5-胺(1.01 g,90%)。LC-MS (ESI)
:m/z
392 [M+H]+
。
步驟 C :
3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
向2-甲基-N-({4--2-(甲基硫基)嘧啶-5-基}甲基)-2H-吲唑-5-胺(550 mg,1.4 mmol,1.0當量)於1,4-二㗁烷(5 mL)中之溶液中添加三光氣(250 mg,0.84 mmol,0.6當量)、DIPEA (725 mg,5.6 mmol,4.0當量)及DMAP (17 mg,0.14 mmol,0.1當量),將所得混合物在80℃下攪拌4小時。完成後,藉由添加2 N HCl(水溶液)將pH調節至約6,隨後用H2
O (50 mL)稀釋,用EtOAc (20 mL × 3)萃取,用鹽水(30 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由急驟層析純化殘餘物,得到呈白色固體狀之3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-7-(甲基硫基)-1H,2H,3H,4H-二次偶氮基嘧啶-2-酮(446 mg,76%)。LC-MS (ESI)
:m/z
418 [M+H]+
。
步驟 D :
3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
向3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-7-(甲基硫基)-1H,2H,3H,4H-二次偶氮基嘧啶-2-酮(100 mg,0.24 mmol,1.0當量)於DCM (1 mL)中之溶液中一次性添加m
CPBA (97 mg,0.48 mmol,2.0當量),將反應混合物在室溫下攪拌1小時,完成後,用Na2
S2
O4
(飽和水溶液)淬滅反應以破壞過量氧化劑,用EtOAc (10 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮藉由急驟矽膠層析純化殘餘物,得到呈白色固體狀之7-甲磺醯基-3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-1H,2H,3H,4H-二次偶氮基嘧啶-2-酮(106 mg,98%)。LC-MS (ESI)
:m/z
450 [M+H]+
。
步驟 E :
3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 433
)
向7-甲磺醯基-3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-1H,2H,3H,4H-二次偶氮基嘧啶-2-酮(108 mg,0.24 mmol,1.0當量)於DMSO (1 mL)中之溶液中添加DIEA (155 mg,1.2 mmol,5.0當量)、2,2,2-三氟乙-1-胺 (119 mg,1.2 mmol,5當量)、CsF (37 mg,0.24 mmol,1.0當量),將反應混合物在100℃下攪拌14小時。完成後,用H2
O (10 mL)稀釋反應混合物,用EtOAc (10 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層且經Na2
SO4
乾燥且減壓濃縮,藉由RP-製備型HPLC純化殘餘物,得到3-(2-甲基-2H-吲唑-5-基)-1-(6-甲基吡啶-3-基)-7--1H,2H,3H,4H-二次偶氮基嘧啶-2-酮。(實施例 433
)
1 H NMR
(400 MHz, DMSO-d6
) δ (ppm): δ: 8.37 (d, J = 2.4 Hz, 1H), 8.36 (s, 1H), 8.15 (s, 1H), 7.71 (d, J = 1.4 Hz, 1H), 7.66 (dd, J = 8.1 Hz, 2.4 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.50 (br, 1H) 7.35 (d, J = 8.2 Hz, 1H), 7.28 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 4.85 (s, 2H), 4.17 (s, 3H), 3.82 (br, 2H), 2.51 (s, 3H)。
LC-MS (ESI)
:m/z
469 [M+H]+。
合成
3-(1,2-
二甲基
-1H-
苯并
[d]
咪唑
-6-
基
)-7-
異丙氧基
-1-(4-(
甲氧基
-d3)
苯基
)-3,4-
二氫吡啶并
[2,3-d]
嘧啶
-2(1H)-
酮
(
實施例
434)
步驟 A :
7-氯-3-(3,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
將7-氯-3-(3,4-二甲氧基苯甲基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(300 mg,0.9 mmol,1.0當量)、1-溴-4-(甲氧基-d3
)苯(256 mg,1.4 mmol,1.5當量)、CuI (171 mg,0.9 mmol,1.0當量)、(1R,2R)-N1,N2-二甲基環己烷-1,2-二胺(256 mg,1.8 mmol,2.0當量)、CsF (410 mg,2.7 mmol,3.0當量)及ACN (4 mL)之混合物在85℃下在N2
氛圍下攪拌14小時。完成後,減壓濃縮反應混合物,藉由矽膠管柱純化殘餘物,得到呈棕色固體狀之7-氯-3-(3,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(200 mg,50%)。
LC-MS (ESI): m/z
443 [M+H]+
。
步驟 B :
3-(3,4-二甲氧基苯甲基)-7-異丙氧基-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向7-氯-3-(3,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3
)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(150 mg,0.34 mmol,1.0當量)、Pd(OAc)2
(7.6 mg,0.03 mmol,0.1當量)、t-BuXPhos (28.8 mg,0.07 mmol,0.2當量)於i-PrOH (4 mL)及甲苯(1 mL)中之溶液中添加Cs2
CO3
(331 mg,1 mmol,3.0當量)。將混合物在80 ℃下在N2
氛圍下攪拌14小時,完成後,減壓濃縮反應混合物,藉由急驟管柱純化殘餘物,得到呈白色固體狀之3-(3,4-二甲氧基苯甲基)-7-異丙氧基-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(45 mg,29%)。LC-MS (ESI)
:m/z
467 [M+H]+
。
步驟 C :
7-異丙氧基-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮
向3-(3,4-二甲氧基苯甲基)-7-異丙氧基-1-(4-(甲氧基-d3
)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(50 mg,0.1 mmol,1.0當量)於TFA (4 mL)中之溶液中緩慢添加CF3
SO3
H (47 μL,0.5 mmol,5.0當量)。將混合物在室溫下攪拌3小時。藉由添加冰冷卻之NaHCO3
(飽和水溶液) (10 mL)淬滅反應,隨後用EtOAc (10 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之7-異丙氧基-1-(4-(甲氧基-d3
)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(30 mg,88%)。LC-MS (ESI)
:m/z
317 [M+H]+
。
步驟 D :
3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-7-異丙氧基-1-(4-(甲氧基-d3
)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮( 實施例 434)
將化合物7-異丙氧基-1-(4-(甲氧基-d3
)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮(30 mg,0.1 mmol,1.0當量)、6-溴-1,2-二甲基-1H-苯并[d]咪唑(32 mg,0.14 mmol,1.5當量)、CuI (19 mg,0.1 mmol,1.0當量)、(1R,2R)-N1,N2-二甲基環己烷-1,2-二胺(27 mg,0.2 mmol,2.0當量)、Cs2
CO3
(93 mg,0.3 mmol,3.0當量)及二㗁烷(1.5 mL)之混合物添加至密封管中,在微波(150 W)下在120℃下照射所得混合物1.5小時。減壓濃縮反應混合物,藉由RP-製備型HPLC純化殘餘物,得到3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-7-異丙氧基-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮( 實施例 434) 。
1 H NMR
(400 MHz, DMSO-d6
) δ: 7.57 (d, J = 6.4 Hz, 1H), 7.55 (s, 1H), 7.50 (d, J = 8.8 Hz, 1H), 7.22 (d, J = 9.2 Hz, 2H), 7.17 (dd, J = 8.8 Hz, 2.0 Hz, 1H), 6.98 (d, J = 9.2 Hz, 2H), 6.34 (d, J = 8.0 Hz, 1H), 4.89 (s, 2H), 4.55-4.49 (m, 1H), 3.72 (s, 3H), 2.52 (s, 3H), 1.05 (d, J = 6.4 Hz, 6H)。
LC-MS (ESI)
:m/z
461 [M+H]+
。
合成
3-(1,2-
二甲基
-1H-
苯并
[d]
咪唑
-6-
基
)-1-(4-(
甲氧基
-d3)
苯基
)-5-
甲基
-7-((2,2,2-
三氟乙基
)
胺基
)-3,4-
二氫嘧啶并
[4,5-d]
嘧啶
-2 (1H)-
酮
(
實施例
435)
步驟 C :
4-氯-6-((4-(甲氧基-d3)苯基)胺基)-2-向(甲硫基)嘧啶-5-甲醛4-(甲氧基-d3
)苯胺(2.5 g,19.82 mmol,1.0當量)之無水THF (30 mL)溶液添加Et3
N (4.12 mL,29.73 mmol,1.5當量),用冰水浴將所得混合物冷卻至0℃且再攪拌30分鐘,隨後在0℃下逐滴添加4,6-二氯-2-(甲硫基)嘧啶-5-甲醛(4.4 g,19.82 mmol,1.0當量)之無水THF (10 mL)溶液,隨後升溫至室溫且再攪拌2小時。完成後,藉由添加H2
O (30 mL)淬滅反應,用EtOAc (20 mL × 3)萃取,用稀HCl (0.5 N,水溶液) (10 mL)、鹽水(20 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之4-氯-6-((4-(甲氧基-d3
)苯基)胺基)-2-(甲硫基)嘧啶-5-甲醛(5.9 g,97%)。LC-MS (ESI)
:m/z
313 [M+H]+
步驟 B :
(E)-6-氯-5-(((2,4-二甲氧基苯甲基)亞胺基)甲基)-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺
向4-氯-6-((4-(甲氧基-d3
)苯基)胺基)-2-(甲硫基)嘧啶-5-甲醛(6.6 g,21.2 mmol,1.0當量)之無水DCE (100 ml)溶液添加2,4-二甲氧基苯基)甲胺(3.34 mL,22.3 mmol,1.05當量)、研磨4Å分子篩(5 g)及數滴AcOH,將所得混合物在室溫下攪拌14小時。完成後,藉由過濾移除分子篩,減壓濃縮濾液,得到呈黃色濃稠油狀之粗(E)-6-氯-5-(((2,4-二甲氧基苯甲基)亞胺基)甲基)-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(10 g,粗物質),其不經進一步純化即用於下一步驟。LC-MS (ESI): m/z
462 [M+H]+
。
步驟 C :
6-氯-5-(((2,4-二甲氧基苯甲基)胺基)甲基)-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(E)-6-氯-5-(((2,4-二甲氧基苯甲基)亞胺基)甲基)-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(8.0 g,17.35 mmol,1.0當量)溶解於無水DCE (100 mL)且用冰水浴冷卻至0℃,隨後在30分鐘內以若干份添加NaBH3
CN (5.47 g,86.8 mmol,5.0當量),添加之後,將反應混合物升溫至室溫,且再攪拌3小時。完成後,藉由添加冰水(100 mL)小心地淬滅反應混合物,用DCM (100 mL × 5)萃取。用鹽水(200 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之6-氯-5-(((2,4-二甲氧基苯甲基)胺基)甲基)-N-(4-(甲氧基-d3
)苯基)-2-(甲硫基)嘧啶-4-胺(5.2 g,65%)。LC-MS (ESI): m/z
464 [M+H]+
。
步驟 D :
5-氯-3-(2,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3
)苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將6-氯-5-(((2,4-二甲氧基苯甲基)胺基)甲基)-N-(4-(甲氧基-d3)苯基)-2-(甲硫基)嘧啶-4-胺(5.2 g,11.2 mmol,1.0當量)及DIEA (7.224 g,56.0 mmol,5.0當量)溶解於無水THF(50 mL)中,用冰水浴將混合物冷卻至0℃,隨後經由注射器逐滴添加三光氣(1.99 g,6.7 mmol,0.6當量)之THF (5 mL)溶液。添加之後,將反應混合物升溫至室溫且再攪拌1小時。完成後,藉由添加NaHCO3
(飽和水溶液) (50 mL)淬滅反應,用EtOAc (50 mL × 3)萃取,用鹽水(50 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,且藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之5-氯-3-(2,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3
)苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(4.2 g,76%)。LC-MS (ESI): m/z
490 [M+H]+。
步驟 E :
3-(2,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3
)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
向5-氯-3-(2,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3
)苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(1.5 g,3.07 mmol,1.0當量)、2,4,6-三甲基-1,3,5,2,4,6-三氧雜三硼雜環己烷(385 mg,3.07 mmol,1.0當量)及K2
CO3
(1.3 g,9.21 mmol,3.0當量)於DMF (20 mL)中之混合物中添加Pd(dppf)Cl2
(449 mg,0.62 mmol,0.2當量),且將所得混合物在100 ℃下在N2
氛圍下攪拌14小時。完成後,經由短Celite®
墊過濾反應混合物,減壓濃縮濾液,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之3-(2,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3
)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(670 mg,47%)。LC-MS (ESI): m/z
470 [M+H]+
。
步驟 F :
1-(4-(甲氧基-d3)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將3-(2,4-二甲氧基苯甲基)-1-(4-(甲氧基-d3)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(670 mg,1.43 mmol,1.0當量)溶解於無水TFA (5 mL)將所得混合物在室溫下攪拌3小時。減壓濃縮反應以移除過量TFA,且將殘餘物再溶解於EtOAc (10 mL)中,添加NaHCO3
(飽和水溶液)直至水層呈pH = 8,隨後用EtOAc (10 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之1-(4-(甲氧基-d3
)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(400 mg,88%)。LC-MS (ESI): m/z
320 [M+H]+
。
步驟 G :
3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3
)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將1-(4-(甲氧基-d3
)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(400 mg,1.25 mmol,1.0當量)、6-溴-1,2-二甲基-1H-苯并[d]咪唑(Ref:Bioorg. Med. Chem.
,2016
,24
, 2486-2503) (395 mg,1.88 mmol,1.5當量)、CuI (239 mg,1.25 mmol,1.0當量)、Cs2
CO3
(1.23 mg,3.75 mmol,3.0當量)及反-N1
,N2
-二甲基環己烷-1,2-二胺(357 mg,2.508 mmol,2.0當量)之混合物懸浮於無水ACN (10 mL)中,將所得混合物在100℃下攪拌14小時。完成後,藉由添加H2
O (20 mL)淬滅反應,且用EtOAc (20 mL × 3)萃取。用鹽水(10 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3
)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(250 mg,43%)。LC-MS (ESI): m/z
464 [M+H]+
。
步驟 H :
3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-5-甲基-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮
將3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3
)苯基)-5-甲基-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(250 mg,0.54 mmol,1.0當量)溶解於無水DCM (10 mL)且用冰水浴冷卻至0℃,隨後以若干份添加m
CPBA (70% wt) (280 mg,1.62 mmol,3.0當量),添加之後,將混合物升溫至室溫且再攪拌14小時。完成後,藉由添加NaHSO3
飽和水溶液淬滅過量m
CPBA (直至KI-澱粉測試紙不再呈藍色),隨後用EtOAc (10 mL × 3)萃取。用鹽水(10 mL)洗滌合併之有機層,經無水Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-5-甲基-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(100 mg,37%)。LC-MS (ESI): m/z
496 [M+H]+
。
步驟 I :
3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-5-甲基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 435
)
將3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-5-甲基-7-(甲磺醯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(100 mg,0.202 mmol,1.0當量)、DIEA (166 µL,1.01 mmol,5.0當量)、CsF (30 mg,0.202 mmol,1.0當量)及2,2,2-三氟乙-1-胺(80 µL,1.01 mmol,5.0當量)溶解於DMSO (5 mL)中,使所得混合物在微波照射(150 W)下在100℃下2小時。完成後,減壓濃縮反應混合物,藉由RP-製備型HPLC純化殘餘物,得到3-(1,2-二甲基-1H-苯并[d]咪唑-6-基)-1-(4-(甲氧基-d3)苯基)-5-甲基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮(實施例 435)
1 H NMR
(400 MHz, DMSO-d6
) δ 8.36 (s, 1H), 7.57 (d, J = 1.6 Hz, 1H), 7.51 (d, J = 8.4 Hz, 1H), 7.20 (dd, J = 8.8 Hz, 2.0 Hz, 1H), 7.16 (d, J = 8.8 Hz, 2H), 6.96 (d, J = 8.8 Hz, 2H), 4.82 (s, 2H), 3.88-3.79 (m, 2H), 3.72 (s, 3H), 2.53 (s, 3H), 2.20 (s, 3H)。
LC-MS (ESI)
:m/z
515 [M+H]+
。
可經由描繪為通用程序X之流程獲得結構之化合物10.5
。以起始物質醛10.1
開始,可進行還原胺化以引入所需R3
基團。所得二胺10.2
可隨後與CDI反應以形成環脲10.3
。可隨後經由銅介導之C-N偶合反應引入所需R2
基團,得到10.4
。最後,可用鈀介導之C-X偶合反應安置所需R1
基團,得到結構10.5
之化合物。
步驟 A :
N-(2-胺基-4-溴苯甲基)-2-甲基-2H-吲唑-5-胺
在0℃下向2-胺基-4-溴苯甲醛(500 mg,2.5 mmol,1.0當量)及2-甲基-2H-吲唑-5-胺(368 mg,2.5 mmol,1.0當量)於DCM (15 mL)中之混合物中添加AcOH (600 mg,10 mmol,4.0當量)。將反應混合物在室溫下攪拌3小時。隨後將反應混合物冷卻至0℃,在30分鐘內以若干份添加NaBH(OAc)3
(1657 mg,7.5 mmol,3.0當量),添加之後,將反應混合物升溫至室溫且攪拌5小時。藉由在0℃下添加NaHCO3
(飽和水溶液) (15 mL)來淬滅反應,用EtOAc (20 mL × 3)萃取。經Na2
SO4
乾燥合併之有機層,減壓濃縮,藉由矽膠管柱層析純化,得到呈棕色固體狀之N-(2-胺基-4-溴苯甲基)-2-甲基-2H-吲唑-5-胺(650 mg,78.5%產率)。LC-MS (ESI): m/z= 331, 333 [M+H]+
。
步驟 B :
7-溴-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮
向N-(2-胺基-4-溴苯甲基)-2-甲基-2H-吲唑-5-胺(650 mg,1.9 mmol,1.0當量)於THF (15 mL)中之溶液中添加CDI (477 mg,2.9 mmol,1.5當量),將反應混合物在80℃下攪拌8小時。藉由LC-MS (ESI)監測反應進程,完成後,用冰水(15 mL)淬滅反應且用EtOAc (20 mL × 3)萃取, 用鹽水(20 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈棕色固體狀之 7-溴-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮(450 mg,66%產率)。LC-MS (ESI): m/z = 357, 359 [M+H]+
。
步驟 C :
7-溴-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮
向7-溴-3-(2-甲基-2H-吲唑-5-基)-1,2,3,4-四氫喹唑啉-2-酮(150 mg,0.42 mmol,1.0當量)於DMF (5mL)中之溶液中添加1-(二氟甲氧基)-4-碘苯(340 mg,1.26 mmol,3.0當量)、Cs2
CO3
(410 mg,1.26 mmol,3.0當量)、CuI (80 mg,0.42 mmol,1.0當量)及N1
,N2
-二甲基環己烷-1,2-二胺(0.13 mL,0.84 mmol,2.0當量),將反應混合物在 N2
氛圍下在100℃下攪拌24小時。藉由LC-MS (ESI)監測反應進程,完成後,用水(15 mL)稀釋反應物且用EtOAc (20 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,藉由急驟矽膠管柱層析純化粗殘餘物,得到呈黃色油狀之7-溴-1-[4-(二氟甲氧基)苯基]-3-(2-甲基-2H-吲唑-5-基)-1,2,3,4-四氫喹唑啉-2-酮(65 mg,31%產率)。LC-MS (ESI): m/z= 499, 501 [M+H]+
。
步驟 D :
1-[4-(二氟甲氧基)苯基]-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-1,2,3,4-四氫喹唑啉-2-酮
向7-溴-1-[4-(二氟甲氧基)苯基]-3-(2-甲基-2H-吲唑-5-基)-1,2,3,4-四氫喹唑啉-2-酮(55 mg,0.11 mmol,1.0當量)於甲苯(7 mL)及EtOH (0.7 mL)中之溶液中添加Cs2
CO3
(108 mg,0.33 mmol,3.0當量)、Pd(OAc)2
(3 mg,0.011 mmol,0.1當量)及t-BuXPhos (9 mg,0.022 mmol,0.2當量),將反應混合物在 N2
氛圍下在100 ℃下攪拌12小時。藉由LC-MS (ESI)監測反應進程,完成後,用水(10 mL)稀釋反應物且用EtOAc (20 mL × 3)萃取,用鹽水(20 mL)洗滌合併之有機層且經Na2
SO4
乾燥,減壓濃縮,藉由製備型HPLC純化粗殘餘物,得到1-[4-(二氟甲氧基)苯基]-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-1,2,3,4-四氫喹唑啉-2-酮 (實施例 287
)。LC-MS (ESI):m/z
465.1 [M+H]+
1 H NMR
(400 MHz, CDCl3
) δ (ppm): 7.96 (s, 1H), 7.76 (d,J
= 9.2 Hz, 1H), 7.66 (s, 1H), 7.48 (d,J
= 8.8 Hz, 1H), 7.38 (d,J
= 8.4 Hz, 2H), 7.25 (d,J
= 8.4 Hz, 2H), 7.06 (d,J
= 8.4 Hz, 1H), 6.57 (dd,J
= 9.6 Hz, 2.0 Hz, 1H), 6.56 (t,J HF
= 74.0 Hz, 1H), 5.89 (d,J
= 2.0 Hz, 1H), 4.91 (s, 2H), 4.34 (s, 3H), 3.89 (q,J
= 7.2 Hz, 2H), 1.33 (t,J
= 7.2 Hz, 3H)。
上文關於通用程序 X
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例288 | 1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喹唑啉-2(1H)-酮 | LC-MS (ESI): m/z 518.1 [M+H]+。 1H NMR (400 MHz, 氯仿-d) δ 7.86 (s, 1H), 7.68 (d, J = 9.2 Hz, 1H), 7.59 (s, 1H), 7.39 (d, J = 8.3 Hz, 2H), 7.31 (d, J = 9.2 Hz, 1H), 7.24 (d, J = 8.3 Hz, 2H), 6.99 (d, J = 8.1 Hz, 1H), 6.56 (t, J = 73.6 Hz, 1H), 6.35 (d, J = 8.1 Hz, 1H), 5.62 (s, 1H), 4.87 (s, 2H), 4.21 (s, 3H), 3.87 (t, J = 6.8 Hz, 1H), 3.67 3-58 (m, 2H). |
| 實施例436 | 1-(4-氯苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喹唑啉-2(1H)-酮 | LC-MS: m/z 486 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.64 (s, 1H), 7.59 (d, J = 8.4 Hz, 2H), 7.54 (d, J = 9.1 Hz, 1H), 7.40 (d, J = 8.5 Hz, 2H), 7.26 (d, J = 7.7 Hz, 1H), 7.03 (d, J = 8.4 Hz, 1H), 6.40 (d, J = 10.0 Hz, 1H), 6.23 (t, J = 7.2 Hz, 1H), 5.60 (d, J = 2.0 Hz, 1H), 4.84 (s, 2H), 4.17 (s, 3H), 3.81-3.72 (m, 2H). |
| 實施例437 | 1-(4-氯苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 | LC-MS: m/z 433 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.33 (s, 1H), 7.66 (s, 1H), 7.60 (d, J = 8.4 Hz, 2H), 7.55 (d, J = 9.2 Hz, 1H), 7.42 (d, J = 8.0 Hz, 2H), 7.26 (d, J = 9.6 Hz, 1H), 7.20 (d, J = 8.4 Hz, 1H), 6.61 (d, J = 8.0 Hz, 1H), 5.62 (s, 1H), 4.91 (s, 2H), 4.16 (s, 3H), 3.85 (q, J = 6.8 Hz, 2H), 1.22 (t, J = 6.8 Hz, 3H). |
下表提供式 II
之預示性化合物之清單,其可使用上文所示之通用程序 X
或本文所述之其他程序之組合使用一般技術合成。
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基苯并[d]噻唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-7-(乙胺基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-(4H-1,2,4-三唑-3-基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-乙氧基-1-(6-(氟甲基)吡啶-3-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-乙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(2,3-二甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(3-甲氧基-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(3-(甲氧基-d3)-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-溴苯基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-丙基-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-異丙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(2-乙基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-(2-甲氧乙基)-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-5-甲基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(4-甲氧基苯基)-5-甲基-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 1-(苯并[d]噻唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(1-甲基-1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
| 7-((1,1-二氟丙-2-基)氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫喹唑啉-2(1H)-酮 |
可經由描繪為通用程序XI之流程獲得結構之化合物11.6
。以芳基氟化物11.1
開始,可用鹼介導之芳族取代引入所需R1
基團以產生化合物11.2
。可隨後經由鈀介導之C-N偶合反應引入所需R2
基團以產生芳基胺11.3
。可隨後用氫化物源還原腈11.3
以產生二胺11.4
。可隨後使用三光氣環化二胺11.4
以產生環脲11.5
。最後,可用銅介導之C-N偶合反應引入所需R3
基團,得到結構11.5
之化合物。
步驟 A : 2-
3-溴-5-乙氧基氰基吡啶
向3-溴-5-氟吡啶-2-甲腈(1.0 g,4.9 mmol,1.0當量)於EtOH (5 mL)中之溶液中逐份添加EtONa (339 mg,4.9 mmol,1.0當量),隨後將反應混合物在室溫下攪拌3小時。藉由LC-MS (ESI)監測反應進程,完成後,隨後將反應混合物冷卻至室溫,且減壓濃縮,用水(30 mL)稀釋殘餘物,用DCM (20 mL × 2)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈黃色固體狀之3-溴-5-乙氧基吡啶-2-甲腈(620 mg,55%產率)。LC-MS (ESI):m/z
228 [M+H]+
步驟 B :
2-3-((4-(二氟甲氧基)苯基)胺基)-5-乙氧基氰基吡啶
向3-溴-5-乙氧基吡啶-2-甲腈(200 mg,0.88 mmol,1.0當量)於甲苯(5 mL)中之溶液中添加Cs2
CO3
(867 mg,2.64 mmol,3.0當量)、BINAP (55 mg,0.09 mmol,0.1當量)、Pd(OAc)2
(20 mg,0.09 mmol,0.1當量)及4-(二氟甲氧基)苯胺(140 mg,0.88 mmol,0.1當量),將反應混合物在90 ℃下在N2
氛圍下攪拌15小時。用H2
O (20 ml)稀釋反應混合物,用EtOAc (20 mL × 3)萃取,用鹽水(30 ml)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈固體狀之2-3-((4-(二氟甲氧基)苯基)胺基)-5-乙氧基氰基吡啶(122 mg,45%產率)。LC-MS (ESI):m/z
306 [M+H]+
。
步驟 C :
2-(胺甲基)-N-(4-(二氟甲氧基)苯基)-5-乙氧基吡啶-3-胺
在0 ℃下向LiAlH4
(115 mg,3.02 mmol,2.0當量)於THF (4 mL)中之懸浮液中逐滴添加2-3-((4-(二氟甲氧基)苯基)胺基)-5-乙氧基氰基吡啶(462 mg,1.51 mmol,1.0當量)於THF (1 mL)中之溶液,將反應混合物在0℃下攪拌0.5小時。藉由TLC監測反應進程,完成後,用無水THF(10 mL)稀釋反應物且用水(0.12 mL)、NaOH水溶液 (0.12 mL,15% wt)及水(0.36 mL)依序淬滅,隨後添加無水Na2
SO4
(5 g),將所得混合物再劇烈攪拌30分鐘,經由短Celite®
墊過濾,減壓濃縮濾液,藉由急驟矽膠管柱層析純化殘餘物,得到2-(胺甲基)-N-(4-(二氟甲氧基)苯基)-5-乙氧基吡啶-3-胺 (272 mg,58%產率)。LC-MS (ESI):m/z
310 [M+H]+
。
步驟 D :
1-(4-(二氟甲氧基)苯基)-7-乙氧基-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮
向2-(胺甲基)-N-(4-(二氟甲氧基)苯基)-5-乙氧基吡啶-3-胺 (100 mg,0.31 mmol,1.0當量)於THF (4 mL)中之溶液中添加三光氣(78 mg,0.26 mmol,2.0當量),將反應混合物在室溫下攪拌4小時。藉由LC-MS (ESI)監測反應進程,完成後,用水(15 mL)淬滅反應且用乙酸乙酯(20 mL × 3)萃取。用鹽水(30 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由急驟矽膠管柱層析純化殘餘物,得到呈白色固體狀之1-(4-(二氟甲氧基)苯基)-7-乙氧基-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 (80 mg,74%產率)。LC-MS (ESI):m/z
336 [M+H]+
。
步驟 E :
1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(4-甲氧基苯基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮
將1-(4-(二氟甲氧基)苯基)-7-乙氧基-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮(40 mg,0.12 mmol,1.0當量)、1-碘-4-甲氧基苯(42 mg,0.18 mmol,1.5當量)、CuI (23 mg,0.12 mmol,1.0當量)、N1
,N2
-二甲基環己烷-1,2-二胺(34 mg,0.24 mmol,2.0當量)及CsF (54 mg,0.36 mmol,3.0當量)於DMSO (2 mL)中之混合物在N2
氛圍下在100 ℃下攪拌16小時。用EtOAc (40 mL)稀釋反應混合物,用H2
O (2 × 10 mL)洗滌,經Na2
SO4
乾燥,減壓濃縮,且藉由RP-製備型HPLC純化,得到1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(4-甲氧基苯基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮(實施例 289
)。LC-MS (ESI):m/z
442 [M+H]+
。
1 H NMR
(400 MHz, DMSO-d 6
) δ (ppm): 7.91 (d,J
= 2.4 Hz, 1H), 7.46 (d,J
= 8.8 Hz, 2H), 7.38-7.30 (m, 4H), 7.34 (t,J HF
= 73.8 Hz, 1H), 6.96 (d,J
= 8.8 Hz, 2H), 5.95 (d,J
= 2.4 Hz, 1H), 4.91 (s, 2H), 3.95 (q,J
= 6.8 Hz, 2H), 3.77 (s, 3H), 1.24 (t,J
= 6.8 Hz, 3H)。
上文關於通用程序 XI
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例290 | 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 | LC-MS: m/z 466.2 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.92 (d, J = 2.4 Hz, 1H), 7.72 (d, J = 1.2 Hz, 1H), 7.57 (d, J = 8.8 Hz, 1H), 7.48 (d, J =8.8 Hz, 2H), 7.35 (t, JHF = 74.0 Hz, 1H), 7.33 (d, J= 9.2 Hz, 2H), 7.29 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 5.97 (d, J = 2.4 Hz, 1H), 4.99 (s, 2H), 4.17 (s, 3H), 3.96 (q, J = 6.8 Hz, 2H), 1.25 (t, J = 6.8 Hz, 3H). |
| 實施例291 | 1-(4-氯苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 | LC-MS: m/z 434.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.34 (s, 1H), 7.92 (d, J = 2.0 Hz, 1H), 7.72 (s, 1H), 7.61 (d, J = 8.8 Hz, 2H), 7.57 (d, J = 9.2 Hz, 1H), 7.46 (d, J = 8.8 Hz, 2H), 7.29 (dd, J = 9.2 Hz, 1.6 Hz, 1H), 6.00 (d, J = 2.0 Hz, 1H), 4.98 (s, 2H), 4.17 (s, 3H), 3.95 (q, J = 6.8 Hz, 2H), 1.25 (t, J = 6.8 Hz, 3H). |
下表提供式 II
之預示性化合物之清單,其可使用上文所示之通用程序 XI
或本文所述之其他程序之組合使用一般技術合成。
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基苯并[d]噻唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-7-(乙胺基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-(4H-1,2,4-三唑-3-基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-乙氧基-1-(6-(氟甲基)吡啶-3-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-乙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(2,3-二甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(3-甲氧基-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(3-(甲氧基-d3)-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-溴苯基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-丙基-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-異丙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(2-乙基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-(2-甲氧乙基)-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(苯并[d]噻唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(1-甲基-1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 7-((1,1-二氟丙-2-基)氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[3,2-d]嘧啶-2(1H)-酮 |
可經由描繪為通用程序XII之流程獲得結構之化合物12.7
。以芳基氯12.1
開始,可經由鹼介導之芳族取代引入所需R2
基團以產生化合物12.2
。可隨後a氫化物源還原芳基酯12.2
以產生醇12.3
。可隨後將醇12.3
氧化成醛12.4
。可經由與醛12.4
之還原胺化引入所需R3
基團以產生二胺12.5
。可隨後使用CDI環化二胺12.5
以產生環脲12.6
。最後,可用鈀介導之C-X偶合反應引入所需R1
基團,得到結構12.7
之化合物。
步驟 A :
6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-甲酸甲酯
向4,6-二氯嗒𠯤-3-甲酸甲酯(1.0 g,4.8 mmol,1.0當量)於二㗁烷(15 mL)中之溶液中添加4-(二氟甲氧基)苯胺(850 mg,5.3 mmol,1.1當量)及DIPEA (1.370 g,10.6 mmol,2.2當量),將反應混合物在100℃下攪拌20小時。隨後用冰水(40 mL)淬滅反應混合物且用EtOAc (100 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由管柱層析純化殘餘物,得到呈白色固體狀之6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-甲酸甲酯(1100 mg,69%產率)。LC-MS (ESI): m/z 330 [M+H]+
。
步驟 B :
(6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-基)甲醇
在0℃下向6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-甲酸甲酯(500 mg,1.5 mmol,1.0當量)於THF (6 mL)及MeOH (4 mL)中之溶液中添加NaBH4
(288 mg,7.5 mmol,5.0當量)及CaCl2 (
370 mg,3.0 mmol,2.0當量)。將反應混合物升溫至室溫且攪拌2小時。藉由LC-MS (ESI)監測反應進程,完成後,用冰水(20 mL)淬滅反應混合物且用EtOAc (50 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥,且減壓濃縮,藉由管柱層析純化殘餘物,得到呈白色固體狀之(6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-基)甲醇(420 mg,92%產率)。LC-MS (ESI): m/z 302 [M+H]+
。
步驟 C :
6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-甲醛
向(6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-基)甲醇(420 mg,1.4 mmol,1.0當量)於CHCl3
(10 mL)中之溶液中添加MnO2
(1.21 g,14.0 mmol,10.0當量),將反應混合物在室溫下攪拌16小時。藉由LC-MS監測反應進程,完成後,MnO2
藉由過濾經由短Celite®
墊移除,減壓濃縮濾液,得到呈白色固體狀之粗6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-甲醛(380 mg),其不經進一步純化即用於下一步驟。LC-MS (ESI): m/z 300 [M+H]+
。
步驟 D :
N-((6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-基)甲基)-2-甲基-2H-吲唑-5-胺
向6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-甲醛(380 mg,1.3 mmol,1.0當量)於DCM (10 mL)中之溶液中添加2-甲基-2H-吲唑-5-胺(
190 mg,1.3 mmol,1.0當量)及AcOH (80 mg,1.3 mmol,1.0當量),將反應混合物在室溫下攪拌1小時。隨後將反應混合物冷卻至0℃,添加NaBH3
CN (82 mg,1.3 mmol,1.0當量),將反應混合物升溫至室溫且攪拌1小時。藉由LC-MS監測反應進程,完成後,用冰水(15 mL)淬滅反應且用DCM (50 mL × 2)萃取。用鹽水(20 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由管柱層析純化殘餘物,得到呈白色固體狀之N-((6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-基)甲基)-2-甲基-2H-吲唑-5-胺(480 mg,88%產率)。LC-MS(ESI): m/z 431 [M+H]+
。
步驟 E :
3-氯-5-(4-(二氟甲氧基)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮
向N-((6-氯-4-((4-(二氟甲氧基)苯基)胺基)嗒𠯤-3-基)甲基)-2-甲基-2H-吲唑-5-胺(
480 mg,1.1 mmol,1.0當量)於THF (10 mL)中之溶液中添加CDI(360 mg,2.1 mmol,2.0當量)及t-BuOK(
250 mg,2.2 mmol,2.0當量),將反應混合物在60 ℃下攪拌2小時。藉由LC-MS監測反應進程,完成後,用冰水(15 mL)淬滅反應混合物且用EtOAc (50 mL × 3)萃取。用鹽水(50 mL)洗滌合併之有機層,經Na2
SO4
乾燥且減壓濃縮,藉由管柱層析純化殘餘物,得到呈白色固體狀之3-氯-5-(4-(二氟甲氧基)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮(450 mg,88%產率)。LC-MS (ESI): m/z 457 [M+H]+
。
步驟 F :
5-(4-(二氟甲氧基)苯基)-3-乙氧基-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮
將3-氯-5-(4-(二氟甲氧基)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮(50 mg,0.11 mmol,1.0當量)、Pd(OAc)2
(2.44 mg,0.011 mmol,0.1當量)、t-BuXPhos (10 mg,0.022 mmol 0.2當量)及Cs2
CO3
(107 mg,0.33 mmol,3.0當量)於EtOH (2 mL)及甲苯(2 mL)中之混合物在N2
氛圍下在100 ℃下攪拌15小時。藉由LC-MS監測反應進程,完成後,用水(10 mL)稀釋反應混合物且用EtOAc (20 mL × 3)萃取。經Na2
SO4
乾燥合併之有機層且減壓濃縮,藉由管柱層析及製備型HPLC純化殘餘物,得到5-(4-(二氟甲氧基)苯基)-3-乙氧基-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮(實施例 292
)。LC-MS (ESI): m/z = 467 [M+H]+
。
1 H NMR
(400 MHz, DMSO-d 6
) δ: 8.37 (s, 1H), 7.78 (d,J
= 1.6 Hz, 1H), 7.60 (d,J
= 9.6 Hz, 1H), 7.50 (d,J
= 8.4 Hz, 2H), 7.36 (d,J
= 8.8 Hz, 2H), 7.34 (t,J HF
= 74.0 Hz, 1H), 7.31 (dd,J
= 9.6 Hz, 2.0 Hz, 1H), 5.54 (s, 1H), 5.17 (s, 2H), 4.40 (q,J
= 6.8 Hz, 2H), 4.18 (s, 3H), 1.29 (t,J
= 6.8 Hz, 3H)。
上文關於通用程序 XII
所闡述之程序用於藉由使用適當起始物質合成以下化合物:
| 化合物編號 | 結構 | 特徵 |
| 實施例293 | 5-(4-(二氟甲氧基)苯基)-7-(2-甲基-2H-吲唑-5-基)-3-((2,2,2-三氟乙基)胺基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 | LC-MS: m/z 520.1 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.36 (s, 1H), 7.75 (d, J = 1.6 Hz, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.50 (d, J = 8.8 Hz, 2H), 7.37 (d, J = 8.8 Hz, 2H), 7.36 (t, JHF = 74.0 Hz, 1H), 7.30 (dd, J = 9.2 Hz, 2.0 Hz, 1H), 7.23 (t, J = 6.4 Hz, 1H), 5.65 (s, 1H), 5.07 (s, 2H), 4.30-4.18 (m, 2H), 4.17 (s, 3H). |
| 實施例438 | 3-乙氧基-5-(4-乙氧基苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 | LC-MS: m/z 445 (M+H)+. 1H NMR (400 MHz, DMSO-d6 ) δ: 8.37 (s, 1H), 7.77 (s, 1H), 7.59 (d, J = 9.2 Hz, 1H), 7.31 (d, J = 8.4 Hz, 3H), 7.08 (d, J = 8.0 Hz, 2H), 5.51 (s, 1H), 5.16 (s, 2H), 4.39 (q, J = 6.8 Hz, 2H), 4.18 (s, 3H), 4.09 (q, J = 6.8 Hz, 2H), 1.36 (t, J = 6.8 Hz, 3H), 1.29 (t, J = 6.8 Hz, 3H). |
下表提供式 II
之預示性化合物之清單,其可使用上文所示之通用程序 XII
或本文所述之其他程序之組合使用一般技術合成。
| 5-(4-(1H-1,2,4-三唑-3-基)苯基)-7-(2-甲基苯并[d]噻唑-6-基)-3-((2,2,2-三氟乙基)胺基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(4-(二氟甲氧基)苯基)-7-(1-甲基-1H-苯并[d]咪唑-6-基)-3-((2,2,2-三氟乙基)胺基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(4-(二氟甲氧基)苯基)-3-(乙胺基)-7-(1-甲基-1H-苯并[d]咪唑-6-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(4-(1H-1,2,4-三唑-3-基)苯基)-7-(2-甲基-2H-吲唑-5-基)-3-((2,2,2-三氟乙基)胺基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(4-(1H-1,2,4-三唑-3-基)苯基)-7-(4-甲氧基苯基)-3-((2,2,2-三氟乙基)胺基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(4-(4H-1,2,4-三唑-3-基)苯基)-3-乙氧基-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-乙氧基-5-(6-(氟甲基)吡啶-3-基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(4-(二氟甲氧基)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(4-甲氧基苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(4-(二氟甲氧基)苯基)-7-(1-甲基-1H-苯并[d]咪唑-6-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(4-甲氧基苯基)-7-(1-甲基-1H-苯并[d]咪唑-6-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-乙氧基-5-(4-(甲氧基-d3)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(4-(甲氧基-d3)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(4-(甲氧基-d3)苯基)-7-(1-甲基-1H-苯并[d]咪唑-6-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-7-(2,3-二甲基-2H-吲唑-5-基)-5-(4-(甲氧基-d3)苯基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-7-(3-甲氧基-2-甲基-2H-吲唑-5-基)-5-(4-(甲氧基-d3)苯基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-7-(3-(甲氧基-d3)-2-甲基-2H-吲唑-5-基)-5-(4-(甲氧基-d3)苯基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(4-溴苯基)-3-(2,2-二氟乙氧基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(4-甲氧基苯基)-7-(2-甲基-2H-吲唑-5-基)-3-丙基-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-異丙氧基-5-(4-(甲氧基-d3)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-7-(2-乙基-2H-吲唑-5-基)-5-(4-(甲氧基-d3)苯基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(4-(甲氧基-d3)苯基)-7-(2-(2-甲氧乙基)-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(1H-吲哚-5-基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 5-(苯并[d]噻唑-5-基)-3-(2,2-二氟乙氧基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-(2,2-二氟乙氧基)-5-(1-甲基-1H-吲哚-5-基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
| 3-((1,1-二氟丙-2-基)氧基)-5-(4-(甲氧基-d3)苯基)-7-(2-甲基-2H-吲唑-5-基)-7,8-二氫嘧啶并[5,4-c]嗒𠯤-6(5H)-酮 |
下表提供式 II
之預示性化合物之清單,其可使用通用程序 III ( 情況 IV) 、通用程序 IX ( 情況 II)
或本文所述之其他程序之組合使用一般技術合成。
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基苯并[d]噻唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-(二氟甲氧基)苯基)-7-(乙胺基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-(1H-1,2,4-三唑-3-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-(4H-1,2,4-三唑-3-基)苯基)-7-乙氧基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-乙氧基-1-(6-(氟甲基)吡啶-3-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(二氟甲氧基)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-甲氧基苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-乙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(1-甲基-1H-苯并[d]咪唑-6-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(2,3-二甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(3-甲氧基-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(3-(甲氧基-d3)-2-甲基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-溴苯基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-丙基-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-異丙氧基-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-3-(2-乙基-2H-吲唑-5-基)-1-(4-(甲氧基-d3)苯基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-(2-甲氧乙基)-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(4-(甲氧基-d3)苯基)-5-甲基-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(4-甲氧基苯基)-5-甲基-3-(2-甲基-2H-吲唑-5-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 1-(苯并[d]噻唑-5-基)-7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-(2,2-二氟乙氧基)-1-(1-甲基-1H-吲哚-5-基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
| 7-((1,1-二氟丙-2-基)氧基)-1-(4-(甲氧基-d3)苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[4,3-d]嘧啶-2(1H)-酮 |
生物化學分析
Mat2A蛋白使用選殖至pFASTBAC1載體(Invitrogen,Carlsbad,CA)中之Bac至Bac系統藉由SF9感染細胞中之重組桿狀病毒表現。重組MAT2A使用HP Ni瓊脂糖凝膠管柱層析自150 g感染細胞之細胞裂解物分離。重組MAT2A均二聚體用250及500 mM咪唑溶離,且含有MAT2A之溶離份藉由十二烷基硫酸鈉聚丙烯醯胺凝膠電泳鑑別且經彙集。
對於測定化合物抗MAT2A均二聚體之抑制效力而言,將蛋白質在檢定緩衝液(50 mM Tris,pH 8.0,50 mM KCl,15 mM MgCl2,0.3 mM EDTA,0.005% [w/v]牛血清白蛋白[BSA])中稀釋至4 μg/mL。測試化合物在100%二甲亞碸(DMSO)中以50×所需最終濃度製備。將1 μL體積的化合物稀釋液添加至40 μL酶稀釋液,且使混合物在25℃下平衡60分鐘。酶檢定藉由添加10 μL受質混合物(500 μM ATP,pH 7.0,400 μML-甲硫胺酸於1×檢定緩衝液中)起始,且混合物在25℃下培育另外60分鐘。使反應中斷,且利用酶以化學計量藉由產生S-腺苷甲硫胺酸(SAM)所釋放的經釋放磷酸酯使用PiColorLock Gold套組(Innova Biosciences,UK)來量測。絕對產物量藉由與pH 8.0的磷酸鉀緩衝液之標準曲線進行比較來測定。
在前述檢定中測試本文所揭示之具體化合物且測定其伴隨根據以下評分之IC50
抑制MAT2A:(A)小於100 nM (> 40%最大抑制),(B)100 nM與1 µM之間(> 38%最大抑制),(C) 1 µM與10 µM之間(> 40%最大抑制)及(D)大於10 µM,如下表5中所示。
細胞靶接合檢定
(SAM)
細胞中之MAT2A活性的量測藉由對其酶活性產物SAM的豐度直接定量來進行。癌細胞用候選MAT2A抑制劑處理適合培育期,且細胞隨後使用淬滅任何其他酶活性之試劑裂解。收集包括SAM之可溶代謝物,且SAM自身直接地自溶胞物使用定量LC-MS/MS量測。
典型檢定使用HCT116人類結腸癌細胞株(可購自Horizon Discovery)進行,該細胞株經基因工程改造以使MTAP基因缺失。因為確定了MTAP基因之損失預測對MAT2A抑制劑的敏感性,所以利用此細胞株。細胞在96孔盤中以適當細胞密度鋪板。在24小時之後,細胞隨後用候選MAT2A抑制劑處理。在添加至細胞之前,化合物首先以100% DMSO連續稀釋,通常地作為以具有包括僅DMSO對照的10個劑量點之500×頂部劑量開始之3倍連續稀釋。化合物隨後藉由將於DMSO中之5 µL化合物添加至495 µL細胞培養基轉移至細胞培養基中的工作儲備液培養盤。此工作儲備液隨後經由另一5倍稀釋藉由在培養基中將25 µL工作儲備液添加至100 µL細胞而添加至細胞。在化合物添加之後,將細胞在37 ℃/5% CO2
下培育72小時。
為了在化合物處理之後對SAM水準進行定量,將細胞在碳酸銨緩衝液(75 mM,在pH 7.4下)溫和地洗滌一次,置放於乾冰上,且用代謝物萃取緩衝液(80%低溫甲醇及20%水(v/v),其中具有200 ng/mL氘化d3-SAM之處於1 M最終濃度的乙酸作為內部對照)裂解。在4℃ 下以3,200 rpm離心30分鐘之後,上清液經收集且儲存於-80 ℃下直至藉由液相層析以及串聯質譜分析(LC-MS/MS)分析為止。LC-MS/MS分析使用以正離子噴霧模式操作且配備有Waters UPLC Acquity (Waters,Milford,MA,USA) BEH醯胺管柱之API6500質譜儀(Sciex,Framingham,MA,USA)進行。分別使用m/z 399.2→250.1及402.2→250.1之質量躍遷對獲得SAM及d3-SAM標準的多反應監測資料。在典型LC-MS/MS分析中,25%移動相A (呈5:95 (v/v)之乙腈及水以及1%甲酸及10 mM乙酸銨)及75%移動相B (呈95:5 (v/v)的乙腈及水以及1%甲酸及10 mM乙酸銨)之初始流動速率為0.5 ml/min,在75%至35%移動相B、25%至65%移動相A的情況下0.2至0.5分鐘,處於0.5 min 65%移動相A及35%移動相B,在35%至75%移動相B、65%至25%移動相A之情況下1.0至1.1分鐘,在1.5分鐘總運行時間之情況下處於1.1 min 25%移動相A及75%移動相B。
在前述檢定中測試本文所揭示之具體化合物且測定其伴隨根據以下評分之IC50
抑制SAM:(A)小於100 nM (> 60%最大抑制),(B)100 nM與1 µM之間(> 60%最大抑制),(C)大於或等於1 µM(> 60%最大抑制),及(NT)未測得,如下表5中所示。
抑制細胞增殖之檢定
測試化合物對癌細胞生長之影響藉由用化合物處理癌症細胞4天且隨後使用基於ATP之細胞增殖讀數(Cell Titer Glo,Promega Corporation)量測增殖來評定。
在典型檢定中,僅在MTAP缺失狀態中變化之同基因對HCT116人類結腸癌細胞株(HCT116MTAP+/+及HCT116 MTAP-/-)以適當細胞密度鋪板於96孔盤中。在24小時之後,細胞隨後用候選MAT2A抑制劑處理。在添加至細胞之前,化合物首先以100% DMSO連續稀釋,通常地作為以具有包括僅DMSO對照的10個劑量點之500×頂部劑量開始之3倍連續稀釋。化合物隨後藉由將於DMSO中之5 µL化合物添加至495 µL細胞培養基轉移至細胞培養基中的工作儲備液培養盤。此工作儲備液隨後經由另一5倍稀釋藉由在培養基中將25 µL工作儲備液添加至100 µL細胞而添加至細胞。在化合物添加之後,細胞在37 ℃/5% CO2下培育4天。
為了量測細胞增殖抑制,使細胞平衡至室溫30分鐘,且隨後用125 μL Cell Titer Glo試劑處理。盤隨後覆蓋有鋁箔且搖晃15分鐘以確保徹底混合且完全細胞裂解。發光信號隨後使用基於培養盤之光度計Veritas版本1.9.2使用ATP標準曲線來量測以確認每次運行的檢定再現性。此發光量測藉由自各數據點減去自存儲體(無細胞)孔所量測之ATP發光信號且除以在針對空白孔中之信號經調整的0.2% DMSO對照孔中所量測之ATP發光信號來轉化成增殖指數。化合物活性隨後表示為相對於培養盤內DMSO對照組相對於以莫耳(M)為單位之化合物濃度log10的增殖百分比變化。
在前述檢定中測試本文所揭示之具體化合物且測定其伴隨根據以下評分之IC50
抑制細胞增殖:(A)小於100 nM (對於MTAP -/-,> 30%最大抑制;對於MTAP +/+,>10%最大抑制),(B)100 nM與1 µM之間 (對於MTAP -/-,>30%最大抑制;對於MTAP +/+,> 10%最大抑制),(C
)大於或等於1 µM,且(NT
)未測得,如下表5a及表5b中所示。
表
5a
| 實施例 | 酶抑制 | 細胞72 小時SAM 抑制 (MTAP -/-) | 4 天相對生長抑制 (MTAP -/-) | 4 天相對生長抑制 (MTAP +/+) |
| 101 | A | B | B | C |
| 102 | A | A | B | C |
| 103 | A | A | A | C |
| 104 | A | A | A | B |
| 105 | A | A | A | B |
| 106 | A | A | B | C |
| 107 | A | B | B | C |
| 108 | A | B | B | C |
| 109 | A | A | B | C |
| 110 | A | A | B | C |
| 111 | A | NT | NT | NT |
| 112 | A | B | B | C |
| 113 | A | A | A | C |
| 114 | A | A | A | C |
| 115 | A | B | A | C |
| 116 | C | NT | NT | NT |
| 117 | B | NT | NT | NT |
| 118 | A | B | A | C |
| 119 | A | A | B | C |
| 120 | A | B | B | C |
| 121 | C | NT | NT | NT |
| 122 | A | B | B | C |
| 123 | A | A | B | C |
| 124 | A | A | A | C |
| 125 | A | A | A | C |
| 126 | B | NT | NT | NT |
| 127 | B | NT | NT | NT |
| 128 | A | B | B | C |
| 129 | A | B | B | C |
| 130 | A | B | B | C |
| 131 | A | A | B | B |
| 132 | A | B | B | C |
| 133 | A | A | A | C |
| 135 | A | A | A | C |
| 136 | A | A | A | B |
| 137 | A | A | A | C |
| 138 | A | A | B | C |
| 139 | A | A | A | C |
| 140 | A | A | A | C |
| 141 | A | A | A | B |
| 142 | A | A | B | C |
| 143 | A | A | B | C |
| 144 | A | A | B | C |
| 145 | A | A | A | C |
| 146 | A | A | B | C |
| 147 | A | B | B | C |
| 148 | B | NT | NT | NT |
| 149 | A | B | A | C |
| 150 | A | NT | NT | NT |
| 151 | B | NT | NT | NT |
| 152 | A | A | B | C |
| 153 | A | A | A | C |
| 154 | A | A | B | B |
| 155 | A | A | B | B |
| 157 | B | NT | NT | NT |
| 158 | B | NT | NT | NT |
| 159 | C | NT | NT | NT |
| 160 | B | NT | NT | NT |
| 161 | A | B | B | C |
| 162 | A | B | B | C |
| 163 | A | B | B | C |
| 164 | A | B | B | C |
| 165 | A | B | B | C |
| 166 | B | NT | NT | NT |
| 167 | A | A | A | C |
| 168 | A | A | A | C |
| 169 | A | A | A | C |
| 170 | A | A | A | B |
| 171 | A | NT | NT | NT |
| 172 | A | A | A | B |
| 173 | B | NT | NT | NT |
| 174 | B | NT | NT | NT |
| 175 | A | A | B | B |
| 176 | A | B | B | C |
| 177 | A | A | B | C |
| 178 | A | A | A | B |
| 179 | A | C | C | C |
| 180 | A | A | A | B |
| 181 | A | A | A | C |
| 182 | A | A | B | B |
| 183 | A | A | B | C |
| 184 | A | B | B | C |
| 185 | A | A | A | B |
| 186 | A | B | A | B |
| 187 | B | C | C | C |
| 188 | A | B | B | C |
| 189 | B | NT | NT | NT |
| 190 | A | B | B | C |
| 191 | A | NT | NT | NT |
| 192 | B | NT | NT | NT |
| 193 | A | A | B | C |
| 194 | C | NT | NT | NT |
| 195 | A | B | B | C |
| 196 | A | B | B | C |
| 197 | C | NT | NT | NT |
| 198 | A | NT | NT | NT |
| 199 | B | NT | NT | NT |
| 200 | A | NT | NT | NT |
| 201 | A | NT | NT | NT |
| 202 | B | B | B | C |
| 203 | B | NT | NT | NT |
| 204 | B | NT | NT | NT |
| 205 | C | NT | NT | NT |
| 206 | A | B | B | C |
| 207 | C | NT | NT | NT |
| 208 | B | NT | NT | NT |
| 209 | B | NT | NT | NT |
| 210 | B | NT | NT | NT |
| 211 | B | NT | NT | NT |
| 212 | B | NT | NT | NT |
| 213 | A | NT | NT | NT |
| 214 | A | A | B | C |
| 215 | A | A | B | C |
| 216 | A | A | A | C |
| 217 | A | A | A | C |
| 218 | A | B | B | C |
| 219 | A | A | B | C |
| 220 | A | B | B | C |
| 221 | B | NT | NT | NT |
| 222 | A | NT | NT | NT |
| 223 | A | A | B | C |
| 224 | C | NT | NT | NT |
| 225 | A | NT | NT | NT |
| 226 | A | NT | NT | NT |
| 227 | B | NT | NT | NT |
| 228 | A | B | B | C |
| 229 | A | NT | NT | NT |
| 230 | A | NT | NT | NT |
| 231 | B | B | C | C |
| 232 | B | C | C | C |
| 233 | A | B | B | NT |
| 234 | A | B | B | C |
| 235 | A | B | B | C |
| 236 | A | B | C | C |
| 237 | A | B | B | C |
| 238 | B | NT | NT | NT |
| 239 | B | NT | NT | NT |
| 240 | B | NT | NT | NT |
| 241 | A | B | B | C |
| 242 | A | B | B | C |
| 243 | B | NT | NT | NT |
| 244 | C | NT | NT | NT |
| 245 | C | NT | NT | NT |
| 246 | A | B | B | C |
| 247 | A | A | A | B |
| 248 | C | NT | NT | NT |
| 249 | B | NT | NT | NT |
| 250 | B | B | C | C |
| 251 | C | NT | NT | NT |
| 252 | B | B | C | C |
| 253 | B | NT | NT | NT |
| 254 | B | NT | NT | NT |
| 255 | A | B | B | C |
| 256 | B | NT | NT | NT |
| 257 | B | NT | NT | NT |
| 258 | B | NT | NT | NT |
| 259 | B | NT | NT | NT |
| 260 | C | NT | NT | NT |
| 261 | B | B | C | C |
| 262 | B | NT | NT | NT |
| 263 | A | NT | NT | NT |
| 264 | A | A | A | C |
| 265 | C | NT | NT | NT |
| 266 | C | NT | NT | NT |
| 267 | B | NT | NT | NT |
| 268 | A | B | C | C |
| 269 | A | B | B | C |
| 270 | A | A | B | C |
| 271 | A | A | A | A |
| 272 | A | A | B | C |
| 273 | A | B | B | C |
| 274 | A | A | A | C |
| 275 | A | B | B | B |
| 276 | B | NT | NT | NT |
| 277 | C | NT | NT | NT |
| 278 | B | NT | NT | NT |
| 279 | B | NT | NT | NT |
| 280 | B | NT | NT | NT |
| 281 | B | NT | NT | NT |
| 282 | A | A | A | C |
| 283 | A | B | B | B |
| 284 | B | NT | NT | NT |
| 285 | A | B | B | C |
| 286 | B | NT | NT | NT |
| 287 | A | B | B | B |
| 288 | A | B | B | C |
| 289 | B | C | C | C |
| 290 | A | B | B | C |
| 291 | B | B | C | C |
| 292 | C | NT | NT | NT |
| 293 | B | NT | NT | NT |
| 294 | A | A | A | C |
| 295 | A | A | B | C |
| 401 | A | A | A | C |
| 402 | A | A | A | B |
| 403 | A | A | B | C |
| 404 | A | B | B | C |
| 405 | A | A | B | C |
| 406 | A | B | B | C |
| 407 | B | C | C | C |
| 408 | A | A | B | C |
| 409 | A | A | A | B |
| 410 | A | A | B | C |
| 411 | A | A | A | C |
| 412 | A | A | A | C |
| 413 | A | A | B | C |
| 414 | A | A | A | C |
| 415 | A | B | B | B |
| 416 | A | B | B | C |
| 417 | A | A | B | B |
| 418 | B | NT | NT | NT |
| 419 | A | B | B | B |
| 420 | A | A | B | B |
| 421 | A | A | A | C |
| 422 | A | A | A | C |
| 423 | A | A | A | C |
| 424 | A | A | B | C |
| 425 | A | A | A | C |
| 427 | C | NT | NT | NT |
| 428 | A | A | A | C |
| 429 | A | B | B | C |
| 430 | A | A | A | C |
| 431 | A | A | B | C |
| 432 | A | A | A | C |
| 433 | A | NT | NT | NT |
| 434 | A | A | A | B |
| 435 | A | NT | NT | NT |
| 436 | B | B | B | C |
| 437 | A | B | B | C |
| 438 | >10 μM | NT | NT | NT |
表
5b
| 其他實施例 | 酶抑制 |
| 1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮 | D |
| 4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)-N,N-二甲基苯甲醯胺 | B |
| 1-(4-(1-羥基-2-甲基丙-2-基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | B |
| 7-(環戊胺基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | B |
| 1-(4-(2-羥丙基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | B |
| 3-(4-氯苯基)-7-乙氧基-1-(4-甲氧基苯基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | D |
| 4-(3-(4-甲氧基苯基)-2-側氧基-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-1(2H)-基)苯甲酸 | D |
| 1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮 | D |
| 7-((環丙基甲基)胺基)-3-(4-甲氧基苯基)-1-苯基-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 3-(4-甲氧基苯基)-1-(4-(噻吩-3-基)苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 1-(3-溴苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 3-(4-甲氧基苯基)-1-(5-甲氧基嘧啶-2-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 1-(4-(苯甲氧基)苯基)-3-(4-甲氧基苯基)-7-(甲基磺醯基)嘧啶并[4,5-d]嘧啶-2,4(1H,3H)-二酮 | D |
| 1-(4-氯-3-(三氟甲基)苯基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 1-([1,1'-聯苯]-4-基)-3-(4-甲氧基苯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-7-(苯胺基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | D |
| 3-(4-甲氧基苯基)-1-(嗒𠯤-4-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 7-(吖呾-1-基)-1-(4-甲氧基苯基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | D |
| 7-(2,2-二氟乙氧基)-3-(2-甲基-2H-吲唑-5-基)-3,4-二氫吡啶并[2,3-d]嘧啶-2(1H)-酮 | D |
| 1-(4-氯-3-(三氟甲基)苯基)-3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 3-(4-甲氧基苯基)-1-(2-側氧基哌啶-4-基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 1-(3-溴苯基)-3-(4-甲氧基苯基)-7-(甲硫基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 3-(4-甲氧基苯基)-1-(甲磺醯基)-7-((2,2,2-三氟乙基)胺基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
| 1-(4-羥苯基)-7-(1H-咪唑-1-基)-3-(4-甲氧基苯基)-3,4-二氫嘧啶并[4,5-d]嘧啶-2(1H)-酮 | D |
下表6比較所選根據本發明之化合物對之分析結果。
無
無
Claims (63)
- 一種根據式I之化合物,(I ) 其中 X1 為N或CR5 ; X2 為N或CR6 ,其中X1 及X2 不同時為N; L為O、S、NR或鍵; R為H或C1 -C6 烷基; R1 係選自由以下組成之群:C1 -C6 烷基、C2 -C6 烯基、C3 -C6 碳環基、-(C1 -C6 烷基)(C3 -C6 碳環基)及-(C1 -C6 烷基)(C3 -C6 -環烯基),其中 R1 中之任何烷基為直鏈或支鏈的, R1 視情況經1至6個鹵基取代;及 當X1 為N,X2 為CR6 ,L為NR或S,R為H且R1 為C1 -C6 烷基時,則R1 經1至6個鹵基取代; 或當L為NR時,則R及R1 可與L一起組合形成3員至6員雜環烷基(其中1至4個環成員獨立地選自N、O及S),其視情況經一或多個RA 取代; R2 及R3 獨立地選自由以下組成之群:C6 -C10 芳基、C3 -C6 碳環基、5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S), 其中,R2 及R3 獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA 、ORA 、鹵基、-N=N-RA 、-NRA RB 、-(C1 -C6 烷基)NRA RB 、-C(O)ORA 、-C(O)NRA RB 、-OC(O)RA 及-CN; R4 係選自由以下組成之群:H、C1 -C6 烷基、C1 -C6 烷氧基、C2 -C6 烯基、C2 -C6 -炔基、鹵基、側氧基、-CN及-NRC RD ; R5 係選自由以下組成之群:H、C1 -C6 烷基、C1 -C6 烷氧基、C2 -C6 烯基、C2 -C6 -炔基、鹵基、-CN及-NRC RD ; R6 係選自由以下組成之群:H、C1 -C6 烷基(視情況經一或多個鹵基取代)、-O(C1 -C6 烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1 -C6 烷基)NRA RB 及-NRA RB ; RA 及RB 獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1 -C6 烷基、C1 -C6 烷氧基、C2 -C6 烯基、C2 -C6 炔基、-NH2 、-S(O)0-2 -(C1 -C6 烷基)、-S(O)0-2 -(C6 -C10 芳基)、-C(O)(C1 -C6 烷基)、-C(O)(C3 -C14 碳環基)、-C3 -C14 碳環基、-(C1 -C6 烷基)(C3 -C14 碳環基)、C6 -C10 芳基、3員至14員雜環烷基及-(C1 -C6 烷基)-(3員至14員雜環烷基) (其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S); 其中,RA 及RB 之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由以下組成之群的取代基取代:氘、羥基、鹵基、-NR’2 (其中各R’獨立地選自由以下組成之群:C1 -C6 烷基、C2 -C6 烯基、C2 -C6 炔基、C6 -C10 芳基、3員至14員雜環烷基及-(C1 -C6 烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S))、-NHC(O)(OC1 -C6 烷基)、-NO2 、 -CN、側氧基、-C(O)OH, -C(O)O(C1 -C6 烷基)、-C1 -C6 -烷基(C1 -C6 烷氧基)、-C(O)NH2 、C1 -C6 烷基-C(O)C1 -C6 烷基、-OC1 -C6 烷基、-Si(C1 -C6 烷基)3 、-S(O)0-2 -(C1 -C6 烷基)、C6 -C10 芳基、-(C1 -C6 烷基)(C6 -C10 芳基)、3員至14員雜環烷基及-(C1 -C6 烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6 -C14 芳基), 其中,各烷基、烯基、芳基及雜環烷基視情況經一或多個選自由以下組成之群的取代基取代:羥基、-OC1 -C6 烷基、鹵基、-NH2 、-(C1 -C6 烷基)NH2 、-C(O)OH、CN及側氧基; RC 及RD 各自獨立地選自H及C1 -C6 烷基; 或其醫藥學上可接受之鹽。
- 一種根據式II之化合物:(II ) 其中 X1 為N且X2 為CR6 ,或X1 為CR5 且X2 為CR6 ,X1 及X2 均為N,或X1 為CR5 且X2 為CR6 ; L為O、S、NR或鍵; R為H或C1 -C6 烷基; R1 係選自由以下組成之群:C1 -C6 烷基、C2 -C6 烯基、C3 -C6 碳環基、-(C1 -C6 烷基)(C3 -C6 碳環基)及-(C1 -C6 烷基)(C3 -C6 -環烯基),其中 R1 中之任何烷基為直鏈或支鏈的, R1 視情況經1至6個鹵基取代; 或當L為NR時,則R及R1 可與L一起組合形成3員至6員雜環烷基(其中1至4個環成員獨立地選自N、O及S),其視情況經一或多個RA 取代; R2 及R3 獨立地選自由以下組成之群:C6 -C10 芳基、C3 -C6 碳環基、5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)及3員至14員雜環烷基(其中1至4雜環烷基成員獨立地選自N、O及S), 其中R2 及R3 獨立且視情況經選自由以下組成之群的一或多個取代基取代:RA 、ORA 、鹵基、-N=N-RA 、-NRA RB 、-(C1 -C6 烷基)NRA RB 、-C(O)ORA 、-C(O)NRA RB 、-OC(O)RA 及-CN; R4 係選自由以下組成之群:H、C1 -C6 烷基、C1 -C6 烷氧基、C2 -C6 烯基、C2 -C6 -炔基、鹵基、側氧基、-CN及-NRC RD ; R5 係選自由以下組成之群:H、C1 -C6 烷基、C1 -C6 烷氧基、C2 -C6 烯基、C2 -C6 -炔基、鹵基、-CN及-NRC RD ; R6 係選自由以下組成之群:H、C1 -C6 烷基(視情況經一或多個鹵基取代)、-O(C1 -C6 烷基) (視情況經一或多個鹵基取代)、-OH、鹵基、-CN、-(C1 -C6 烷基)NRA RB 及-NRA RB ; RA 及RB 獨立地選自由以下組成之群:H、-CN、-羥基、側氧基、C1 -C6 烷基、C1 -C6 烷氧基、C2 -C6 烯基、C2 -C6 炔基、-NH2 、-S(O)0-2 -(C1 -C6 烷基)、-S(O)0-2 -(C6 -C10 芳基)、-C(O)(C1 -C6 烷基)、-C(O)(C3 -C14 碳環基)、-C3 -C14 碳環基、-(C1 -C6 烷基)(C3 -C14 碳環基)、C6 -C10 芳基、3員至14員雜環烷基及-(C1 -C6 烷基)-(3員至14員雜環烷基)(其中1至4個雜環烷基成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S); 其中,RA 及RB 之各烷基、烷氧基、烯基、炔基、芳基、碳環基、雜環烷基及雜芳基部分視情況經一或多個選自由組成之群的取代基取代:羥基、鹵基、-NR’2 (其中各R’獨立地選自由以下組成之群:C1 -C6 烷基、C2 -C6 烯基、C2 -C6 炔基、C6 -C10 芳基、3員至14員雜環烷基及-(C1 -C6 烷基)-(3員至14員雜環烷基)(其中1至4個環成員獨立地選自N、O及S)及5員至10員雜芳基(其中1至4個雜芳基成員獨立地選自N、O及S)、-NHC(O)(OC1 -C6 烷基)、-NO2 、-CN、側氧基、-C(O)OH、-C(O)O(C1 -C6 烷基)、-C1 -C6 -烷基(C1 -C6 烷氧基)、-C(O)NH2 、C1 -C6 烷基、-C(O)C1 -C6 烷基、-OC1 -C6 烷基、-Si(C1 -C6 烷基)3 、-S(O)0-2 -(C1 -C6 烷基)、C6 -C10 芳基、-(C1 -C6 烷基)(C6 -C10 芳基)、3員至14員雜環烷基及-(C1 -C6 烷基)-(3員至14員雜環)(其中1至4個雜環成員獨立地選自N、O及S)及-O(C6 -C14 芳基), 其中,RA 及RB 中之各烷基、烯基、芳基及雜環烷基視情況經一或多個選自由以下組成之群的取代基取代:羥基、-OC1 -C6 烷基、鹵基、-NH2 、-(C1 -C6 烷基)NH2 、-C(O)OH、CN及側氧基, RC 及RD 各自獨立地選自H及C1 -C6 烷基; 或其醫藥學上可接受之鹽。
- 如請求項1之化合物,其中,X1 為N且X2 為CR6 。
- 如請求項1之化合物,其中,X1 為CR5 且X2 為CR6 。
- 如請求項1之化合物,其中,X1 為CR5 且X2 為N。
- 如請求項2之化合物,其中,X1 為CR5 且X2 為CR6 。
- 如請求項2之化合物,其中,X1 為N且X2 為CR6 。
- 如請求項2之化合物,其中,X1 及X2 均為N。
- 如請求項2之化合物,其中,X1 為CR5 且X2 為CR6 。
- 如請求項1至9中任一項之化合物,其中,R4 及R5 (存在時)中之每一者獨立地選自H及C1 -C6 烷基,且R6 (存在時)係選自由以下組成之群:H、視情況經一或多個鹵基取代之C1 -C6 烷基、C1 -C6 烷氧基、 -(C1 -C6 烷基)NRA RB 及-NRA RB (其中RA 及RB 獨立地選自H及C1 -C6 烷基)。
- 如請求項1至9中任一項之化合物,其中,R4 、R5 及R6 (存在時)中之至少一者為H。
- 如請求項1至11中任一項之化合物,其中,R4 為H。
- 如請求項1至11中任一項之化合物,其中,R5 為H。
- 如請求項1至11中任一項之化合物,其中,R6 為H。
- 如請求項1至14中任一項之化合物,其中,R4 、R5 及R6 (存在時)中之每一者為H。
- 如請求項1至15中任一項之化合物,其中,R2 為視情況經取代之C6 -C10 芳基或視情況經取代之5員至10員雜芳基。
- 如請求項16之化合物,其中,R2 為視情況經取代之C6 -C10 芳基。
- 如請求項17之化合物,其中,R2 為視情況經取代之苯基。
- 如請求項16之化合物,其中,R2 為視情況經取代之5員至10員雜芳基,且其中1個環成員為N。
- 如請求項19之化合物,其中,R2 為視情況經取代之吡啶基。
- 如請求項1至20中任一項之化合物,其中,R3 為視情況經取代之3員至14員雜環烷基或視情況經取代之5員至10員雜芳基。
- 如請求項21之化合物,其中,R3 係選自由以下組成之群:苯并噻唑基、苯并異噻唑基、苯并㗁唑基、吡啶基、吡啶酮基、嗒𠯤基、苯并咪唑基、苯并三唑基、吲唑基、喹㗁啉基、喹啉基、喹唑啉基、咪唑并吡啶基、吡唑并吡啶基、三唑并吡啶基、㖕啉基、異㗁唑基、吡唑基、苯并呋喃基、二氫苯并呋喃基、二氫苯并二氧雜環己烯基及四氫苯并二氧雜環己烯基,其中任一者可視情況經取代。
- 如請求項1至20中任一項之化合物,其中,R3 為視情況經取代之C6 -C10 芳基。
- 如請求項23之化合物,其中,R3 為視情況經取代之苯基。
- 如請求項1至15中任一項之化合物,其中,R2 為視情況經取代之苯基且R3 為視情況經取代之3員至14員雜環烷基或視情況經取代之5員至10員雜芳基。
- 如請求項1至25中任一項之化合物,其中,L為O或NR。
- 如請求項26之化合物,其中,R1 為視情況經取代之C1 -C6 烷基或視情況經取代之C3 -C6 碳環基。
- 如請求項26或27之化合物,其中,R1 為視情況經1至3個F取代之C1 -C3 烷基。
- 如請求項1至9中任一項之化合物,其中, L為O或NR且R為H; R1 為視情況經1至3個F取代之C1 -C3 烷基; R2 為視情況經取代之3員至14員雜環烷基或視情況經取代之5員至10員雜芳基(其中1個雜環烷基或雜芳基成員為N)或視情況經取代之C6 -C10 芳基; R3 為視情況經取代之3員至14員雜環烷基;視情況經取代之5員至10員雜芳基,其中1至3個雜環烷基或雜芳基成員獨立地選自N、O及S;或視情況經取代之C6 -C10 芳基;及 R4 、R5 及R6 (存在時)中之每一者為H。
- 如請求項29之化合物,其中,L為NR。
- 如請求項29或30之化合物,其中, R2 為視情況經取代之苯基;及 R3 為視情況經取代之5員至10員雜芳基,其中1至3個雜芳基成員獨立地選自N、O及S。
- 如請求項29或30之化合物,其中, R2 為視情況經取代之5員至10員雜芳基,其中1至3個雜芳基成員獨立地選自N、O及S;及 R3 為視情況經取代之苯基。
- 如請求項31之化合物,其中,R3 係選自由以下組成之群:視情況經取代之苯并噻唑基、苯并異噻唑基、苯并㗁唑基、吡啶基、吡啶酮基、嗒𠯤基、苯并咪唑基、苯并三唑基、吲唑基、喹㗁啉基、喹啉基、喹唑啉基、咪唑并吡啶基、吡唑并吡啶基、三唑并吡啶基、㖕啉基、異㗁唑基、吡唑基、苯并呋喃基、二氫苯并呋喃基、二氫苯并二氧雜環己烯基及四氫苯并二氧雜環己烯基,其中任一者可視情況經取代。
- 如請求項29或30之化合物,其中,R2 及R3 獨立地為視情況取代之苯基。
- 如請求項1之化合物,或其醫藥學上可接受之鹽,其中,該化合物係選自下表:
101 102 195 103 196 104 197 105 198 106 199 107 200 108 201 109 202 110 203 111 204 112 205 113 206 114 207 115 208 116 209 117 210 118 211 119 212 120 213 121 214 122 215 123 216 124 217 125 218 126 219 127 220 128 221 129 222 130 223 131 224 132 225 133 226 135 227 136 228 137 229 138 230 139 231 140 232 141 233 142 234 143 235 144 236 145 237 146 238 147 239 148 240 149 241 150 242 151 243 152 244 153 245 154 246 155 247 157 248 158 249 159 250 160 251 161 252 162 253 163 254 164 255 165 256 166 257 167 258 168 259 169 260 170 261 171 262 172 263 173 264 174 265 175 266 176 267 177 269 178 270 179 271 180 272 181 273 182 274 183 275 184 276 185 277 186 278 187 279 188 280 189 281 190 282 191 283 a 192 286 193 294 194 295 。 - 一種醫藥組成物,其包含治療有效量之請求項1至37中任一項之化合物或其醫藥學上可接受之鹽及醫藥學上可接受之載劑。
- 一種用於治療罹患癌症個體之癌症的方法,其包含向個體投與有效量之請求項1至37中任一項之MAT2A抑制劑化合物或其醫藥學上可接受之鹽。
- 如請求項39之方法,其中,該癌症為MTAP缺失型癌症。
- 如請求項39或40之方法,其中,該癌症係選自由以下組成之群:間皮瘤、神經母細胞瘤、直腸癌、結腸癌、家族性腺瘤多發性息肉癌及遺傳性非多發性息肉結腸直腸癌、食道癌、唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、髓質甲狀腺癌、乳頭狀甲狀腺癌、腎癌、腎實質癌、卵巢癌、子宮頸癌、子宮體癌、子宮內膜癌、絨毛膜癌、胰臟癌、前列腺癌、膀胱癌、睾丸癌、乳癌、泌尿癌、黑色素瘤、腦瘤、淋巴瘤、頭頸癌、急性淋巴性白血病(ALL)、慢性淋巴性白血病(CLL)、急性骨髓性白血病(AML)、慢性骨髓性白血病(CML)、肝細胞癌、膽囊癌、支氣管癌、小細胞肺癌、非小細胞肺癌、多發性骨髓瘤、基底癌、畸胎瘤、視網膜母細胞瘤、脈絡膜黑色素瘤、精原細胞瘤、橫紋肌肉瘤、骨肉瘤、軟骨肉瘤、肌肉瘤、脂肉瘤、纖維肉瘤、尤文氏肉瘤(Ewing sarcoma)及漿細胞瘤。
- 如請求項39或40之方法,其中,該癌症係選自由以下組成之群:B細胞急性淋巴球性白血病(B-ALL)、間皮瘤、淋巴瘤、胰臟癌、肺癌、胃癌、食道癌、膀胱癌、腦癌、頭頸癌、黑色素瘤及乳癌。
- 如請求項42之方法,其中,該癌症為肺癌,其係選自由以下組成之群:非小細胞肺癌、小細胞肺癌、肺腺癌及肺鱗狀細胞癌。
- 如請求項42之方法,其中,該癌症為選自由以下組成之群的腦瘤:神經膠質瘤、神經膠母細胞瘤、星形細胞瘤、脊膜瘤、神經管胚細胞瘤、周圍神經外胚瘤及顱咽管瘤。
- 如請求項42之方法,其中,該癌症為三陰性乳癌(TNBC)。
- 如請求項42之方法,其中,該癌症為選自由以下組成之群的淋巴瘤:套細胞淋巴瘤、何杰金氏淋巴瘤、非何杰金氏淋巴瘤、伯基特淋巴瘤、彌漫性大B細胞淋巴瘤及成人T細胞白血病/淋巴瘤。
- 一種用於治療罹患癌症個體之癌症的方法,其中,該癌症特徵為與其中存在甲硫基腺苷磷酸化酶 (MTAP)基因或蛋白及/或其充分起作用之癌症相比,MTAP基因表現減少或不存在、不存在該MTAP基因或MTAP蛋白功能降低,該方法包含向該個體投與治療有效量之請求項1至37中任一項之化合物或其醫藥學上可接受之鹽。
- 如請求項1至37中任一項之化合物,或其醫藥學上可接受之鹽,其用於治療罹患癌症個體之癌症。
- 如請求項48之化合物,或其醫藥學上可接受之鹽,其中,該癌症為MTAP缺失型癌症。
- 如請求項48或49之化合物,或其醫藥學上可接受之鹽,其中,該癌症係選自由以下組成之群:間皮瘤、神經母細胞瘤、直腸癌、結腸癌、家族性腺瘤多發性息肉癌及遺傳性非多發性息肉結腸直腸癌、食道癌、唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、髓質甲狀腺癌、乳頭狀甲狀腺癌、腎癌、腎實質癌、卵巢癌、子宮頸癌、子宮體癌、子宮內膜癌、絨毛膜癌、胰臟癌、前列腺癌、膀胱癌、睾丸癌、乳癌、泌尿癌、黑色素瘤、腦瘤、淋巴瘤、頭頸癌、急性淋巴性白血病(ALL)、慢性淋巴性白血病(CLL)、急性骨髓性白血病(AML)、慢性骨髓性白血病(CML)、肝細胞癌、膽囊癌、支氣管癌、小細胞肺癌、非小細胞肺癌、多發性骨髓瘤、基底癌、畸胎瘤、視網膜母細胞瘤、脈絡膜黑色素瘤、精原細胞瘤、橫紋肌肉瘤、骨肉瘤、軟骨肉瘤、肌肉瘤、脂肉瘤、纖維肉瘤、尤文氏肉瘤及漿細胞瘤。
- 如請求項48或49之化合物,或其醫藥學上可接受之鹽,其中,該癌症係選自由以下組成之群:B細胞急性淋巴球性白血病(B-ALL)、間皮瘤、淋巴瘤、胰臟癌、肺癌、胃癌、食道癌、膀胱癌、腦癌、頭頸癌、黑色素瘤及乳癌。
- 如請求項51之化合物,或其醫藥學上可接受之鹽,其中,該癌症為肺癌,其係選自由以下組成之群:非小細胞肺癌、小細胞肺癌、肺腺癌及肺鱗狀細胞癌。
- 如請求項51之化合物,或其醫藥學上可接受之鹽,其中,該癌症為三陰性乳癌(TNBC)。
- 如請求項51之化合物,或其醫藥學上可接受之鹽,其中,該癌症為選自由以下組成之群的腦瘤:神經膠質瘤、神經膠母細胞瘤、星形細胞瘤、脊膜瘤、神經管胚細胞瘤、周圍神經外胚瘤及顱咽管瘤。
- 如請求項51之化合物,或其醫藥學上可接受之鹽,其中,該癌症為選自由以下組成之群的淋巴瘤:套細胞淋巴瘤、何杰金氏淋巴瘤、非何杰金氏淋巴瘤、伯基特淋巴瘤、彌漫性大B細胞淋巴瘤(DLBCL)及成人T細胞白血病/淋巴瘤。
- 一種請求項1至37中任一項之化合物或其醫藥學上可接受之鹽之用途,其供製造用於治療癌症之藥劑。
- 如請求項56之用途,或其醫藥學上可接受之鹽,其中,該癌症為MTAP缺失型癌症。
- 如請求項56或57之用途,或其醫藥學上可接受之鹽,其中,該癌症係選自由以下組成之群:間皮瘤、神經母細胞瘤、直腸癌、結腸癌、家族性腺瘤多發性息肉癌及遺傳性非多發性息肉結腸直腸癌、食道癌、唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、髓質甲狀腺癌、乳頭狀甲狀腺癌、腎癌、腎實質癌、卵巢癌、子宮頸癌、子宮體癌、子宮內膜癌、絨毛膜癌、胰臟癌、前列腺癌、膀胱癌、睾丸癌、乳癌、泌尿癌、黑色素瘤、腦瘤、淋巴瘤、頭頸癌、急性淋巴性白血病(ALL)、慢性淋巴性白血病(CLL)、急性骨髓性白血病(AML)、慢性骨髓性白血病(CML)、肝細胞癌、膽囊癌、支氣管癌、小細胞肺癌、非小細胞肺癌、多發性骨髓瘤、基底癌、畸胎瘤、視網膜母細胞瘤、脈絡膜黑色素瘤、精原細胞瘤、橫紋肌肉瘤、骨肉瘤、軟骨肉瘤、肌肉瘤、脂肉瘤、纖維肉瘤、尤文氏肉瘤及漿細胞瘤。
- 如請求項56或57之用途,或其醫藥學上可接受之鹽,其中,該癌症係選自由以下組成之群:B細胞急性淋巴球性白血病(B-ALL)、間皮瘤、淋巴瘤、胰臟癌、肺癌、胃癌、食道癌、膀胱癌、腦癌、頭頸癌、黑色素瘤及乳癌。
- 如請求項59之用途,或其醫藥學上可接受之鹽,其中,該癌症為肺癌,其係選自由以下組成之群:非小細胞肺癌、小細胞肺癌、肺腺癌及肺鱗狀細胞癌。
- 如請求項59之用途,或其醫藥學上可接受之鹽,其中,該癌症為三陰性乳癌(TNBC)。
- 如請求項59之用途,或其醫藥學上可接受之鹽,其中,該癌症為選自由以下組成之群的腦瘤:神經膠質瘤、神經膠母細胞瘤、星形細胞瘤、脊膜瘤、神經管胚細胞瘤、周圍神經外胚瘤及顱咽管瘤。
- 如請求項59之用途,或其醫藥學上可接受之鹽,其中,該癌症為選自由以下組成之群的淋巴瘤:套細胞淋巴瘤、何杰金氏淋巴瘤、非何杰金氏淋巴瘤、伯基特淋巴瘤、彌漫性大B細胞淋巴瘤(DLBCL)及成人T細胞白血病/淋巴瘤。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862785574P | 2018-12-27 | 2018-12-27 | |
| US62/785,574 | 2018-12-27 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| TW202039489A true TW202039489A (zh) | 2020-11-01 |
Family
ID=69400626
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW108148080A TW202039489A (zh) | 2018-12-27 | 2019-12-27 | Mat2a之雜雙環抑制劑及用於治療癌症之使用方法 |
Country Status (21)
| Country | Link |
|---|---|
| US (1) | US20220098203A1 (zh) |
| EP (1) | EP3902804A1 (zh) |
| JP (1) | JP2022516882A (zh) |
| KR (1) | KR20220050832A (zh) |
| CN (1) | CN113474347A (zh) |
| AR (1) | AR115296A1 (zh) |
| AU (1) | AU2019414446A1 (zh) |
| BR (1) | BR112021012599A2 (zh) |
| CA (1) | CA3124678A1 (zh) |
| CL (1) | CL2021001722A1 (zh) |
| CO (1) | CO2021009882A2 (zh) |
| CR (1) | CR20210409A (zh) |
| EA (1) | EA202191800A1 (zh) |
| IL (1) | IL284324A (zh) |
| JO (1) | JOP20210171A1 (zh) |
| MA (1) | MA54609A (zh) |
| MX (1) | MX2021007833A (zh) |
| PE (1) | PE20212303A1 (zh) |
| SG (1) | SG11202106627WA (zh) |
| TW (1) | TW202039489A (zh) |
| WO (1) | WO2020139992A1 (zh) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210103498A (ko) | 2018-12-10 | 2021-08-23 | 아이디어야 바이오사이언시스 인코포레이티드 | 메티오닌 아데노실트랜스퍼라제 2a 억제제로서 2-옥소퀴나졸린 유도체 |
| PE20212090A1 (es) * | 2018-12-27 | 2021-11-04 | Les Laboratoires Servier Sas | Inhibidores aza-heterobiciclicos de mat2a y metodos de uso para tratar el cancer |
| CA3177164A1 (en) * | 2020-04-28 | 2021-11-04 | Peter Sennhenn | Bicyclic kinase inhibitors and uses thereof |
| CN115867541A (zh) * | 2020-06-22 | 2023-03-28 | 豪夫迈·罗氏有限公司 | 氨基嘧啶酮衍生物 |
| WO2022052924A1 (zh) * | 2020-09-11 | 2022-03-17 | 上海凌达生物医药有限公司 | 一类含氮稠环类化合物的制备方法和用途 |
| US20240124454A1 (en) * | 2020-12-31 | 2024-04-18 | Nanjing Zaiming Pharmaceutical Co., Ltd. | Tricyclic compound and use thereof |
| CN115141202A (zh) * | 2021-03-29 | 2022-10-04 | 武汉人福创新药物研发中心有限公司 | 嘧啶并吡嗪酮化合物及其用途 |
| CN118434722A (zh) | 2021-10-20 | 2024-08-02 | 英矽智能科技知识产权有限公司 | 甲硫氨酸腺苷转移酶2a(mat2a)抑制剂及其用途 |
| EP4434989A1 (en) * | 2021-12-21 | 2024-09-25 | Nanjing Chia Tai Tianqing Pharmaceutical Co., Ltd. | Methionine adenosyltransferase 2a heterocyclic inhibitor |
| IL314207A (en) * | 2022-01-26 | 2024-09-01 | Suzhou Genhouse Bio Co Ltd | MAT2A inhibitor for the treatment of MTAP deletion type cancer |
| TW202342024A (zh) * | 2022-03-11 | 2023-11-01 | 大陸商賽諾哈勃藥業(成都)有限公司 | 甲硫胺酸腺苷轉移酶抑制劑、其藥物組合物及應用 |
| GB202204913D0 (en) | 2022-04-04 | 2022-05-18 | Cambridge Entpr Ltd | antiviral therapy |
| KR20240051860A (ko) | 2022-10-13 | 2024-04-22 | 한미약품 주식회사 | 신규한 트리사이클 유도체 화합물 및 이의 용도 |
| WO2024183778A1 (zh) * | 2023-03-06 | 2024-09-12 | 甘李药业股份有限公司 | 一种甲硫氨酸腺苷转移酶2a抑制剂及其医药用途 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6576420B1 (en) | 1998-06-23 | 2003-06-10 | Regents Of The University Of California | Method for early diagnosis of, and determination of prognosis in, cancer |
| PT1123295E (pt) * | 1998-10-23 | 2005-01-31 | Hoffmann La Roche | Heterociclos de azoto biciclicos |
| HUP0203564A3 (en) * | 1999-10-21 | 2004-07-28 | Hoffmann La Roche | Heteroalkylamino-substituted bicyclic nitrogen heterocycles as inhibitors of p38 protein kinease, process for their preparation and pharmaceutical compositions containing them |
| PA8577501A1 (es) * | 2002-07-25 | 2004-02-07 | Warner Lambert Co | Inhibidores de quinasas |
| US7084270B2 (en) * | 2002-08-14 | 2006-08-01 | Hoffman-La Roche Inc. | Pyrimido compounds having antiproliferative activity |
| US7112676B2 (en) * | 2002-11-04 | 2006-09-26 | Hoffmann-La Roche Inc. | Pyrimido compounds having antiproliferative activity |
| BRPI0409366A (pt) * | 2003-04-10 | 2006-04-25 | Hoffmann La Roche | compostos de pirimido |
| US7897762B2 (en) * | 2006-09-14 | 2011-03-01 | Deciphera Pharmaceuticals, Llc | Kinase inhibitors useful for the treatment of proliferative diseases |
| JP5478488B2 (ja) | 2007-06-20 | 2014-04-23 | メルク・シャープ・アンド・ドーム・コーポレーション | Janusキナーゼの阻害剤 |
| CN104418860B (zh) * | 2013-08-20 | 2016-09-07 | 中国科学院广州生物医药与健康研究院 | 嘧啶并杂环类化合物及其药用组合物和应用 |
| PE20190761A1 (es) * | 2016-08-31 | 2019-06-05 | Agios Pharmaceuticals Inc | Inhibidores de procesos metabolicos celulares |
| WO2019029541A1 (zh) * | 2017-08-08 | 2019-02-14 | 南京药捷安康生物科技有限公司 | 成纤维细胞生长因子受体抑制剂及其用途 |
| CN111936499B (zh) * | 2018-03-30 | 2023-09-19 | 法国施维雅药厂 | Mat2a的杂二环抑制剂和用于治疗癌症的方法 |
-
2019
- 2019-12-27 MX MX2021007833A patent/MX2021007833A/es unknown
- 2019-12-27 JP JP2021538125A patent/JP2022516882A/ja active Pending
- 2019-12-27 BR BR112021012599-0A patent/BR112021012599A2/pt not_active Application Discontinuation
- 2019-12-27 AU AU2019414446A patent/AU2019414446A1/en not_active Abandoned
- 2019-12-27 PE PE2021001090A patent/PE20212303A1/es unknown
- 2019-12-27 WO PCT/US2019/068653 patent/WO2020139992A1/en active Application Filing
- 2019-12-27 KR KR1020217023830A patent/KR20220050832A/ko unknown
- 2019-12-27 SG SG11202106627WA patent/SG11202106627WA/en unknown
- 2019-12-27 JO JOP/2021/0171A patent/JOP20210171A1/ar unknown
- 2019-12-27 US US17/418,406 patent/US20220098203A1/en active Pending
- 2019-12-27 MA MA054609A patent/MA54609A/fr unknown
- 2019-12-27 EP EP19845797.0A patent/EP3902804A1/en not_active Withdrawn
- 2019-12-27 CN CN201980092839.3A patent/CN113474347A/zh active Pending
- 2019-12-27 AR ARP190103901A patent/AR115296A1/es unknown
- 2019-12-27 EA EA202191800A patent/EA202191800A1/ru unknown
- 2019-12-27 CR CR20210409A patent/CR20210409A/es unknown
- 2019-12-27 TW TW108148080A patent/TW202039489A/zh unknown
- 2019-12-27 CA CA3124678A patent/CA3124678A1/en active Pending
-
2021
- 2021-06-23 IL IL284324A patent/IL284324A/en unknown
- 2021-06-25 CL CL2021001722A patent/CL2021001722A1/es unknown
- 2021-07-27 CO CONC2021/0009882A patent/CO2021009882A2/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| MA54609A (fr) | 2022-04-06 |
| US20220098203A1 (en) | 2022-03-31 |
| PE20212303A1 (es) | 2021-12-10 |
| KR20220050832A (ko) | 2022-04-25 |
| CN113474347A (zh) | 2021-10-01 |
| AR115296A1 (es) | 2020-12-16 |
| MX2021007833A (es) | 2021-10-26 |
| CR20210409A (es) | 2022-01-24 |
| IL284324A (en) | 2021-08-31 |
| BR112021012599A2 (pt) | 2021-09-08 |
| CA3124678A1 (en) | 2020-07-02 |
| WO2020139992A1 (en) | 2020-07-02 |
| EA202191800A1 (ru) | 2021-09-13 |
| JOP20210171A1 (ar) | 2023-01-30 |
| CO2021009882A2 (es) | 2021-10-29 |
| CL2021001722A1 (es) | 2022-02-18 |
| JP2022516882A (ja) | 2022-03-03 |
| SG11202106627WA (en) | 2021-07-29 |
| AU2019414446A1 (en) | 2021-07-15 |
| EP3902804A1 (en) | 2021-11-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TW202039489A (zh) | Mat2a之雜雙環抑制劑及用於治療癌症之使用方法 | |
| TWI719437B (zh) | Mat2a之雜雙環抑制劑及治療癌症之使用方法 | |
| TWI816962B (zh) | Mat2a之雜雙環抑制劑及用於治療癌症之使用方法 | |
| JP6785819B2 (ja) | Kras g12c阻害剤及びその使用方法 | |
| JP2021073269A (ja) | 細胞代謝過程の阻害剤 | |
| JP2022534989A (ja) | Mat2aの複素二環式阻害剤、およびがんの治療のための使用方法 | |
| CN110662536B (zh) | 激酶网络抑制剂及其用途 | |
| JP2024514844A (ja) | Myt1阻害剤を含む併用治療 | |
| JP2024502886A (ja) | がんを処置及び/又は予防するためのsos1阻害薬の医薬組合せ | |
| RU2809987C2 (ru) | Гетероциклические ингибиторы mat2a и способы применения для лечения рака | |
| OA20638A (en) | Aza-heterobicyclic inhibitors Of MAT2A and methods of use for treating cancer. | |
| EA046111B1 (ru) | Гетероциклические ингибиторы mat2a и способы применения для лечения рака |