TW201840552A - 作為atx抑制劑之新穎雙環化合物 - Google Patents
作為atx抑制劑之新穎雙環化合物 Download PDFInfo
- Publication number
- TW201840552A TW201840552A TW107108794A TW107108794A TW201840552A TW 201840552 A TW201840552 A TW 201840552A TW 107108794 A TW107108794 A TW 107108794A TW 107108794 A TW107108794 A TW 107108794A TW 201840552 A TW201840552 A TW 201840552A
- Authority
- TW
- Taiwan
- Prior art keywords
- group
- alkyl
- compound
- pyridine
- carbonyl
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/485—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4858—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Inorganic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Ophthalmology & Optometry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Abstract
Description
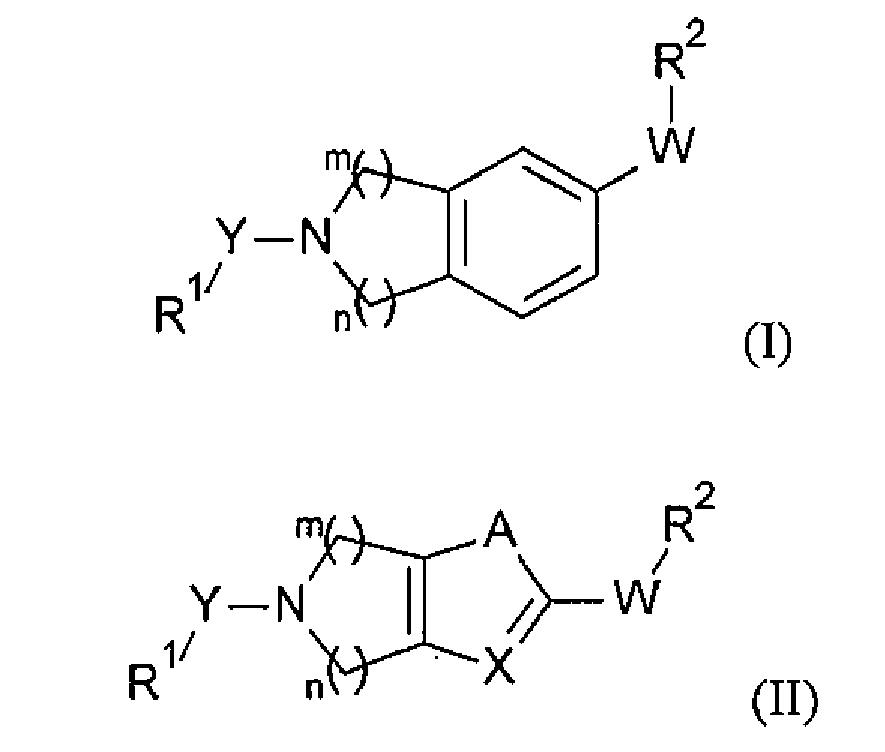
本發明係關於適用於在哺乳動物中進行治療或預防之有機化合物,且尤其係關於自分泌運動因子(ATX)抑制劑,其為溶血磷脂酸(LPA)產生之抑制劑,因此為LPA含量及相關信號傳導之調節劑,該等物質用於治療或預防腎病、肝病、發炎性病狀、神經系統之病狀、呼吸系統之病狀、血管及心血管病狀、纖維化疾病、癌症、眼部病狀、代謝病狀、慢性瘙癢之膽汁鬱積形式及其他形式以及急性及慢性器官移植排斥。 本發明提供式(I)或(II)之新穎化合物:其中 R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之苯基, ii) 經R3
、R4
及R5
取代之苯基-C1 - 6
烷基, iii) 經R3
、R4
及R5
取代之苯氧基-C1 - 6
烷基, iv) 經R3
、R4
及R5
取代之苯基-C2 - 6
烯基, v) 經R3
、R4
及R5
取代之苯基-C2 - 6
炔基, vi) 經R3
、R4
及R5
取代之吡啶基, vii) 經R3
、R4
及R5
取代之吡啶基-C1 - 6
烷基, viii) 經R3
、R4
及R5
取代之吡啶基-C2 - 6
烯基, ix) 經R3
、R4
及R5
取代之吡啶基-C2 - 6
炔基, x) 經R3
、R4
及R5
取代之噻吩基; xi) 經R3
、R4
及R5
取代之噻吩基-C1 - 6
烷基, xii) 經R3
、R4
及R5
取代之噻吩基-C2 - 6
烯基,及 xiii) 經R3
、R4
及R5
取代之噻吩基-C2 - 6
炔基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A係選自由以下組成之群: i) -O-,及 ii) -S-; X係選自由以下組成之群: i) -N-,及 ii) -CH-; W係選自由以下組成之群: i) -C(O)-,及 ii) -S(O)2
-; R2
係選自環系統O、AO、AW、AX、AY及AZ;; R3
係選自由以下組成之群: i) 鹵素, ii) 羥基, iii) 氰基、C1-6
烷基, iv) C1-6
烷氧基, v) C1-6
烷氧基-C1-6
烷基, vi) 鹵基-C1-6
烷氧基, vii) 鹵基-C1-6
烷基, viii) 羥基-C1-6
烷基, ix) C3-8
環烷基, x) C3-8
環烷基-C1-6
烷基, xi) C3-8
環烷基-C1-6
烷氧基, xii) C3-8
環烷氧基, xiii) C3-8
環烷氧基-C1-6
烷基, xiv) C1-6
烷胺基, xv) C1-6
烷基羰胺基, xvi) C3-8
環烷基羰胺基, xvii) C1-6
烷基四唑基, xviii) C1-6
烷基四唑基-C1-6
烷基,及 xix) 雜環烷基-C1-6
烷氧基; R4
及R5
係獨立地選自由以下組成之群: i) H, ii) 鹵素, iii) 羥基, iv) 氰基, v) C1-6
烷基, vi) C1-6
烷氧基, vii) C1-6
烷氧基-C1-6
烷基, viii) 鹵基-C1-6
烷氧基, ix) 鹵基-C1-6
烷基, x) 羥基-C1-6
烷基, xi) C3-8
環烷基, xii) C3-8
環烷基-C1-6
烷基, xiii) C3-8
環烷基-C1-6
烷氧基, xiv) C3-8
環烷氧基, xv) C3-8
環烷氧基-C1-6
烷基, xvi) C1-6
烷基羰胺基, xvii) C3-8
環烷基羰胺基, xviii) C1-6
烷基四唑基, xix) C1-6
烷基四唑基-C1-6
烷基,及 xx) 雜環烷基-C1-6
烷氧基; R6
係選自由以下組成之群: i) H, ii) C1-6
烷基,及 iii) C3-8
環烷基; m及n係獨立地選自1、2及3; r為1、2或3; 或醫藥學上可接受之鹽。
自分泌運動因子(Autotaxin;ATX)為一種分泌型酶(亦稱為外核苷酸焦磷酸酶/磷酸二酯酶2或溶血磷脂酶D),其對於將溶血磷脂醯膽鹼(lysophosphatidyl choline;LPC)轉化為生物活性信號傳導分子溶血磷脂酸(lysophosphatidic acid;LPA)很重要。已展示血漿LPA水準與ATX活性相當有關,因此ATX被認為是胞外LPA之重要來源。使用原型ATX抑制劑之早期實驗已展示此類化合物能夠抑制小鼠血漿中之LPA合成活性。在20世紀70年代及20世紀80年代早期進行之研究已證實,LPA可誘發廣泛範圍之細胞反應;包括平滑肌細胞收縮、血小板活化、細胞增殖、趨化性及其他。LPA經由信號傳導至若干G蛋白偶聯受體(G protein coupled receptor;GPCR)調節其效果;第一成員最初表示為Edg (內皮細胞分化基因)受體或心室區基因-1 (vzg-1)但現在稱作LPA受體。原型基團現在由LPA1/Edg-2/VZG-1、LPA2/Edg-4及LPA3/Edg-7組成。近年來,已描述三種額外LPA受體LPA4/p2y9/GPR23、LPA5/GPR92及LPA6/p2Y5,相較於原型LPA1-3受體,其與核苷酸選擇性嘌呤型受體更緊密相關。ATX-LPA信號傳導軸參與各種生理學及病理生理學功能,包括例如神經系統功能、血管發育、心血管生理學、生殖、免疫系統功能、慢性發炎、腫瘤轉移及進展、器官纖維化以及肥胖及/或其他代謝疾病(諸如糖尿病)。因此,ATX活性增加及/或LPA含量增加、改變之LPA受體表現及改變之對LPA之反應可有助於多種與ATX/LPA軸有關之不同病理生理學病狀的引發、進展及/或結果。
根據本發明,式(I)化合物或其醫藥學上可接受之鹽及酯可用於治療或預防與自分泌運動因子之活性及/或溶血磷脂酸(LPA)之生物活性相關的疾病、病症或病狀。 本文之式(I)化合物或其醫藥學上可接受之鹽及酯抑制自分泌運動因子活性,因此抑制LPA產生且調節LPA含量及相關信號傳導。本文中所描述之自分泌運動因子抑制劑適用作治療或預防如下疾病或病狀之藥劑,其中ATX活性及/或LPA信號傳導參與、包括於疾病之病源或病理中或者與疾病之至少一種症狀相關。ATX-LPA軸例如參與血管生成、慢性發炎、自體免疫疾病、纖維化疾病、癌症及腫瘤轉移及進展、眼部病狀、代謝病狀(諸如肥胖及/或糖尿病)、諸如慢性瘙癢之膽汁鬱積形式或其他形式之病狀以及急性及慢性器官移植排斥。 本發明之目的在於:式(I)化合物以及其前述鹽及酯,以及其作為治療活性物質之用途;用於製造該等化合物、中間物、醫藥組合物、含有該等化合物、其醫藥學上可接受之鹽或酯之藥劑的方法;該等化合物、鹽或酯用於治療或預防與ATX活性及/或溶血磷脂酸(LPA)之生物活性相關的病症或病狀(尤其治療或預防腎病、肝病、發炎性病狀、神經系統病狀、呼吸系統病狀、血管及心血管病狀、纖維化疾病、癌症、眼部病狀、代謝病狀、慢性搔癢病之膽汁鬱積性及其他形式以及急性及慢性器官移植排斥)的用途;以及該等化合物、鹽或酯用於產生用於治療或預防腎病、肝病、發炎性病狀、神經系統病狀、呼吸系統病狀、血管及心血管病狀、纖維化疾病、癌症、眼部病狀、代謝病狀、慢性搔癢病之膽汁鬱積性及其他形式以及急性及慢性器官移植排斥之藥物的用途。更特定言之,式(I)化合物及其前述鹽及酯,以及其作為治療活性物質之用途;製備該等化合物、中間物、醫藥組合物、含有該等化合物、其醫藥學上可接受之鹽或酯之藥劑的方法;該等化合物、鹽或酯用於治療或預防眼部病狀(更特定言之青光眼)之用途。
術語「C2
-C6
烯基」表示具有至少一個雙鍵之2至6個碳原子的單價直鏈或分支鏈烴基。在特定實施例中,烯基具有2至4個碳原子及至少一個雙鍵。烯基之實例包括乙烯基、丙烯基、丙-2-烯基、異丙烯基、正丁烯基及異丁烯基。特定烯基為乙烯基。 術語「C1
-C6
烷氧基」表示式-O-R'之基團,其中R'為C1
-C6
烷基。C1
-C6
烷氧基之實例包括甲氧基、乙氧基、正丙氧基、異丙氧基、正丁氧基、異丁氧基及第三丁氧基。 術語「C1
-C6
烷氧基-C1
-C6
烷基」表示其中C1
-C6
烷基之至少一個氫原子經C1
-C6
烷氧基置換的C1
-C6
烷基。特定實例為甲氧基甲基、甲氧基乙基、乙氧基甲基、乙氧基乙基、異丙氧基甲基及異丙氧基乙基。 術語「C1
-C6
烷基」表示具有1至6個碳原子之單價直鏈或分支鏈飽和烴基。C1
-C6
烷基之實例包括甲基、乙基、丙基、異丙基、正丁基、異丁基、第二丁基、第三丁基及戊基。特定烷基包括甲基、異丙基及第三丁基。 術語「C1
-C6
烷胺基」表示其中氮原子經一個H原子及一個C1
-C6
烷基取代的胺基。實例為其中C1
-C6
烷基係選自甲基、乙基、丙基、異丙基、正丁基、第二丁基及第三丁基之基團。 術語「C1
-C6
烷基羰基」表示式-C(O)-R'之基團,其中R'為C1
-C6
烷基。C1
-C6
烷基羰基之實例包括其中R'為甲氧基、乙氧基、正丙氧基、異丙氧基、正丁氧基、異丁氧基及第三丁氧基的基團。 術語「C1
-C6
烷基羰胺基」表示其中氮原子經一個H原子及C1
-C6
烷基羰基取代的胺基。特定實例為其中氮原子經H及第三丁基羰基取代的胺基。 術語「C1
-C6
烷基四唑基」表示其中一個氮原子經C1
-C6
烷基取代的四唑基。特定實例為其中一個氮原子經甲基取代的四唑基。 術語「C1
-C6
烷基四唑基-C1
-C6
烷基」表示其中一個H原子經C1
-C6
烷基四唑基置換的C1
-C6
烷基。特定實例為其中一個氮原子經甲基四唑基取代的甲基或乙基。 術語「C2
-C6
炔基」表示具有至少一個參鍵的2至6個碳原子之單價直鏈或分支鏈烴基。在特定實施例中,炔基具有2至4個碳原子及至少一個參鍵。特定實例為乙炔基。 術語「胺基」表示-NH2
基團。 術語「氰基」表示C≡N基團。 術語「C3
-C8
環烷氧基」表示式-O-R'之基團,其中R'為C3
-C8
環烷基。特定實例為其中R'為環丙基的基團。 術語「C3
-C8
環烷氧基-C1
-C6
烷基」表示其中C1
-C6
烷基之至少一個氫原子經C3
-C8
環烷氧基置換的C1
-C6
烷基。特定實例為其中C3
-C8
環烷氧基為環丙氧基的甲基或乙基。 術語「C3
-C8
環烷基」表示具有3至8個環碳原子之單價飽和單環或雙環烴基。雙環意謂由具有兩個共用碳原子之兩個飽和碳環組成之環系統。單環環烷基之實例為環丙基、環丁烷基、環戊基、環己基或環庚基。雙環C3
-C8
環烷基之實例為雙環[2.2.1]庚烷基或雙環[2.2.2]辛烷基。特定C3 - 8
環烷基為環丙基。 術語「C1
-C6
烷氧基」表示式-O-R'之基團,其中R'為C1
-C6
烷基。C1
-C6
烷氧基之實例包括甲氧基、乙氧基、正丙氧基、異丙氧基、正丁氧基、異丁氧基及第三丁氧基。 術語「C3
-C8
環烷基-C1
-C6
烷氧基」表示其中C1
-C6
烷基之至少一個氫原子經C3
-C8
環烷基置換的C1
-C6
烷基。特定實例為其中至少一個氫原子經環丙基置換的甲氧基或乙氧基。 術語「C3
-C8
環烷基羰基」表示式-C(O)-R'之基團,其中R'為C3
-C8
環烷基。C3
-C8
環烷基羰基之實例為其中R'為環丙基的基團。 術語「C3
-C8
環烷基羰胺基」表示其中氮原子經一個H原子及C3
-C8
環烷基羰基取代的胺基。特定實例為其中氮原子經H及環丙基取代的胺基。 術語「鹵基-C1
-C6
烷氧基」表示其中C1
-C6
烷氧基之至少一個氫原子經相同或不同鹵素原子置換之C1
-C6
烷氧基。特定實例為二氟甲氧基、三氟甲氧基、二氟乙氧基及三氟乙氧基。更特定實例為三氟甲氧基。 術語「鹵素」及「鹵基」在本文中可互換使用且表示氟、氯、溴或碘。特定鹵素為氯。 術語「鹵基-C1
-C6
烷基」表示其中C1
-C6
烷基之至少一個氫原子經相同或不同鹵素原子置換之C1
-C6
烷基。特定實例為二氟甲基、三氟甲基、二氟乙基及三氟乙基。更特定實例為三氟甲基。 單獨或組合形式之術語「雜環烷基」表示具有4至9個環原子之單價飽和或部分不飽和單環或雙環系統,該等環原子包含1、2或3個選自N、O及S之環雜原子,剩餘環原子為碳。雙環意謂由具有兩個共用環原子之兩個環組成,亦即分隔兩個環之橋為單鍵或具有一或兩個環原子之鏈。單環飽和雜環烷基之實例為4,5-二氫-噁唑基、氧雜環丁烷基、氮雜環丁烷基、吡咯啶基、2-側氧基-吡咯啶-3-基、四氫呋喃基、四氫-噻吩基、吡唑啶基、咪唑啶基、噁唑啶基、異噁唑啶基、噻唑啶基、哌啶基、四氫哌喃基、四氫硫哌喃基、哌嗪基、嗎啉基、硫代嗎啉基、1,1-二側氧基-硫代嗎啉-4-基、氮雜環庚烷基、二氮雜環庚烷基、高哌嗪基或氧氮雜環庚烷基。雙環飽和雜環烷基之實例為8-氮雜-雙環[3.2.1]辛基、啶基、8-氧雜-3-氮雜-雙環[3.2.1]辛基、9-氮雜-雙環[3.3.1]壬基、3-氧雜-9-氮雜-雙環[3.3.1]壬基或3-硫雜-9-氮雜-雙環[3.3.1]壬基。部分不飽和雜環烷基之實例為二氫呋喃基、咪唑啉基、二氫-噁唑基、四氫-吡啶基或二氫哌喃基。特定實例為四氫哌喃基。 術語「雜環烷基-C1
-C6
烷氧基」表示其中烷氧基之至少一個氫原子經雜環烷基置換的C1
-C6
烷氧基。特定實例為四氫哌喃基甲氧基。 術語「羥基」表示-OH基團。 術語「羥基-C1
-C6
烷氧基」表示其中C1
-C6
烷氧基之一個氫原子經羥基置換的C1
-C6
烷氧基。特定實例為羥基乙氧基及羥基丙氧基。 術語「羥基-C1
-C6
烷基」表示其中C1
-C6
烷基之一個氫原子經羥基置換的C1
-C6
烷基。特定實例為羥甲基及羥乙基。 術語「苯氧基」表示式-O-R'之基團,其中R'為苯基。 術語「苯氧基-C1
-C6
烷基」表示其中C1
-C6
烷基之一個氫原子經苯氧基置換的C1 - 6
烷基。特定實例為苯氧基甲基。 術語「苯基-C1
-C6
烷基」表示其中C1
-C6
烷基之一個氫原子經苯基置換的C1
-C6
烷基。特定實例為苯甲基。 術語「苯基-C2
-C6
烯基」表示其中C2
-C6
烯基之一個氫原子經苯基置換的C2
-C6
烯基。特定實例為苯乙基烯基。 術語「苯基-C2
-C6
炔基」表示其中C2
-C6
炔基之一個氫原子經苯基置換的C2
-C6
炔基。特定實例為苯乙基炔基。 術語「吡啶基-C1
-C6
烷基」表示其中C1
-C6
烷基之一個氫原子經吡啶基置換的C1
-C6
烷基。特定實例為吡啶基甲基。 術語「吡啶基-C2
-C6
烯基」表示其中C2
-C6
烯基之一個氫原子經吡啶基置換的C2
-C6
烯基。特定實例為吡啶基伸乙基。 術語「吡啶基-C2
-C6
炔基」表示其中C2
-C6
炔基之一個氫原子經吡啶基置換的C2
-C6
炔基。特定實例為吡啶基乙炔基。 術語「噻吩基-C1
-C6
烷基」表示其中C1
-C6
烷基之一個氫原子經噻吩基置換的C1
-C6
烷基。特定實例為噻吩基甲基。 術語「噻吩基-C2
-C6
烯基」表示其中C2
-C6
烯基之一個氫原子經噻吩基置換的C2
-C6
烯基。特定實例為噻吩基乙烯基。 術語「噻吩基-C2
-C6
炔基」表示其中C2
-C6
炔基之一個氫原子經噻吩基置換的C2
-C6
炔基。特定實例為噻吩基乙炔基。 術語「醫藥學上可接受之鹽」係指保留游離鹼或游離酸之生物學有效性及特性,不會在生物學上或其他方面不適宜的鹽。該等鹽用以下形成:無機酸,諸如鹽酸、氫溴酸、硫酸、硝酸、磷酸及類似物,尤其鹽酸;及有機酸,諸如乙酸、丙酸、乙醇酸、丙酮酸、草酸、順丁烯二酸、丙二酸、琥珀酸、反丁烯二酸、酒石酸、檸檬酸、苯甲酸、肉桂酸、杏仁酸、甲烷磺酸、乙烷磺酸、對甲苯磺酸、水楊酸、N-乙醯基半胱胺酸及類似物。另外,此等鹽可藉由將無機鹼或有機鹼添加至游離酸中製備。衍生自無機鹼之鹽包括(但不限於)鈉鹽、鉀鹽、鋰鹽、銨鹽、鈣鹽、鎂鹽及類似物。衍生自有機鹼之鹽包括(但不限於)以下之鹽:一級胺、二級胺及三級胺;經取代之胺,包括天然存在之經取代胺;環胺及鹼性離子交換樹脂,諸如異丙胺、三甲胺、二乙胺、三乙胺、三丙胺、乙醇胺、離胺酸、精胺酸、N-乙基哌啶、哌啶、聚亞胺樹脂及類似物。式(I)化合物之特定醫藥學上可接受之鹽為鹽酸鹽、甲烷磺酸鹽及檸檬酸鹽。 「醫藥學上可接受之酯」意謂通式(I)化合物可在官能基處進行衍生以提供能夠在活體內轉化回母化合物之衍生物。此類化合物之實例包括生理學上可接受且代謝上不穩定之酯衍生物,諸如甲氧基甲酯、甲硫基甲酯及特戊醯氧基甲酯。另外,能夠在活體內產生通式(I)之母化合物且與代謝上不穩定之酯類似的通式(I)化合物之任何生理學上可接受之等效物均在本發明之範疇內。 術語「保護基」(protecting group;PG)在合成化學中慣常與其相關之含義中表示選擇性阻斷多官能化合物中之反應位點以使得化學反應可在另一未保護反應位點處選擇性進行的基團。保護基可在適當時間移除。例示性保護基為胺基保護基、羧基保護基或羥基保護基。特定保護基為第三丁氧基羰基(Boc)、苯甲氧基羰基(Cbz)、茀基甲氧基羰基(Fmoc)及苯甲基(Bn)。其他特定保護基為第三丁氧基羰基(Boc)及茀基甲氧基羰基(Fmoc)。更特定保護基為第三丁氧基羰基(Boc)。 縮寫uM意謂微莫耳且等效於符號µM。 縮寫uL意謂微升且等效於符號µL。 縮寫ug意謂微克且等效於符號µg。 式(I)化合物可含有數個不對稱中心且可以光學純對映異構體、對映異構體混合物(諸如外消旋體)、光學純非對映異構體、非對映異構體混合物、非對映異構外消旋體或非對映異構外消旋體之混合物的形式存在。 根據Cahn-Ingold-Prelog定則,不對稱碳原子可具有「R」或「S」構型。 此外,本發明之一個實施例提供如本文所描述之式(I)化合物及其醫藥學上可接受之鹽或酯,尤其如本文所描述之式(I)化合物及其醫藥學上可接受之鹽,更特定言之如本文所描述之式(I)化合物。 本發明之一特定實施例提供如本文中所描述的根據式(I)或(II)之化合物,其中 R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之苯基-C1 - 6
烷基, ii) 經R3
、R4
及R5
取代之吡啶基,及 iii) 經R3
、R4
及R5
取代之吡啶基-C1 - 6
烷基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A係選自由以下組成之群: i) -O-,及 ii) -S-; X係選自由以下組成之群: i) -N-,及 ii) -CH-; W為-C(O)-; R2
係選自環系統O、AO及AW;; R3
係選自由以下組成之群: i) C1-6
-烷基羰胺基,及 ii) 四氫哌喃基-C1-6
烷氧基; R4
係選自由以下組成之群: i) 氰基, ii) C3-8
環烷基,及 iii) 鹵基-C1-6
烷基; R5
係選自由以下組成之群: i) H,及 ii) 鹵素; m及n係獨立地選自1及2; 或醫藥學上可接受之鹽。 本發明之一特定實施例提供如本文中所描述的根據式(I)或(II)之化合物,其中R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之苯基-C1 - 6
烷基, ii) 經R3
、R4
及R5
取代之吡啶基,及 iii) 經R3
、R4
及R5
取代之吡啶基-C1 - 6
烷基。 本發明之另一實施例提供如本文中所描述的根據式(I)之化合物,其中R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之苯基-C1 - 6
烷基,及 ii) 經R3
、R4
及R5
取代之吡啶基。 本發明之一特定實施例提供如本文中所描述的根據式(I)之化合物,其中Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-。 本發明之一更特定實施例提供如本文中所描述的根據式(I)之化合物,其中A係選自由以下組成之群: i) -O-,及 ii) -S-。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中A為-O-。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中X為-N-。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中W為-C(O)-。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中X係選自由以下組成之群: i) -N-,及 ii) -CH-。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中R2
係選自環系統O、AO及AW。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中R2
係選自環系統O及AO。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中R3
係選自由以下組成之群: i) C1-6
-烷基羰胺基,及 ii) 四氫哌喃基-C1-6
烷氧基。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中R4
係選自由以下組成之群: i) 氰基, ii) C3-8
環烷基,及 iii) 鹵基-C1-6
烷基。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中R4
係選自由以下組成之群: i) 氰基,及 ii) C3-8
環烷基。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中R5
係選自由以下組成之群: i) H,及 ii) 鹵素。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中m及n係獨立地選自1及2。 本發明之另一特定實施例提供如本文中所描述的根據式(I)之化合物,其中m及n均為1。 本發明之一特定實施例提供如本文中所描述的根據式I(a)之化合物,其中 R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之苯基-C1 - 6
烷基,及 ii) 經R3
、R4
及R5
取代之吡啶基; Y係選自由以下組成之群: iii) -OC(O)-,及 iv) -C(O)-; A為-O-; X為N; W為-C(O)-; R2
係選自環系統O及AO;; R3
係選自由以下組成之群: i) C1-6
-烷基羰胺基,及 ii) 四氫哌喃基-C1-6
烷氧基; R4
係選自由以下組成之群: i) 氰基,及 ii) C3-8
環烷基; R5
係選自由以下組成之群: i) H,及 ii) 鹵素; m及n均為1; 或醫藥學上可接受之鹽。 本發明之一特定實施例提供如本文中所描述的根據式(I)之化合物。 本發明之一特定實施例提供如本文中所描述的根據式(II)之化合物。 本發明之一特定實施例提供如本文中所描述的根據式(I)之化合物,其中 R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之吡啶基,及 ii) 經R3
、R4
及R5
取代之吡啶基-C1 - 6
烷基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; W為-C(O)-; R2
係選自環系統O、AO及AW;; R3
係選自由以下組成之群: i) C1-6
-烷基羰胺基,及 ii) 四氫哌喃基-C1-6
烷氧基; R4
係選自由以下組成之群: i) C3-8
環烷基,及 ii) 鹵基-C1-6
烷基; R5
為H; m係選自1及2; N為1; 或醫藥學上可接受之鹽。 本發明之一特定實施例提供如本文中所描述的根據式(I)之化合物,其中 其中 R1
為經R3
、R4
及R5
取代之吡啶基; Y為-C(O)-; W為-C(O)-; R2
係選自環系統O;; R3
為四氫哌喃基-C1-6
烷氧基; R4
為C3-8
環烷基; R5
為H; m及n均為1; 或醫藥學上可接受之鹽。 本發明之一特定實施例提供如本文中所描述的根據式(II)之化合物,其中 R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之苯基-C1 - 6
烷基, ii) 經R3
、R4
及R5
取代之吡啶基,及 iii) 經R3
、R4
及R5
取代之吡啶基-C1 - 6
烷基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A係選自由以下組成之群: i) -O-,及 ii) -S-; X係選自由以下組成之群: i) -N-,及 ii) -CH-; W為-C(O)-; R2
係選自環系統O、AO及AW;; R3
係選自由以下組成之群: i) C1-6
-烷基羰胺基,及 ii) 四氫哌喃基-C1-6
烷氧基; R4
係選自由以下組成之群: i) 氰基, ii) C3-8
環烷基,及 iii) 鹵基-C1-6
烷基; R5
係選自由以下組成之群: i) H,及 ii) 鹵素; m為1; n選自1及2; 或醫藥學上可接受之鹽。 本發明之一特定實施例提供如本文中所描述的根據式(II)之化合物,其中 R1
係選自由以下組成之群: i) 經R3
、R4
及R5
取代之苯基-C1 - 6
烷基,及 ii) 經R3
、R4
及R5
取代之吡啶基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A為-O-; X為-N-; W為-C(O)-; R2
係選自環系統O及AO;; R3
係選自由以下組成之群: i) C1-6
-烷基羰胺基,及 ii) 四氫哌喃基-C1-6
烷氧基; R4
係選自由以下組成之群: i) 氰基,及 ii) C3-8
環烷基; R5
係選自由以下組成之群: i) H,及 ii) 鹵素; m及n均為1; 或醫藥學上可接受之鹽。 如本文中所描述的式(I)化合物之特定實例係選自 [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-3,4-二氫-1H-異喹啉-6-基]-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-6,7-二氫-4H-[1,3]噻唑并[5,4-c]吡啶-5-基]甲酮; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-基)甲酮; 1-[2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-羰基]哌啶-4-磺醯胺; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(3-羥基-6,7-二氫-4H-[1,2]噁唑并[4,5-c]吡啶-5-基)甲酮; 5-(4-胺磺醯基哌啶-1-羰基)-1,3-二氫異吲哚-2-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 5-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-1,3-二氫異吲哚-2-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 5-(3-羥基-6,7-二氫-4H-[1,2]噁唑并[4,5-c]吡啶-5-羰基)-1,3-二氫異吲哚-2-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 2-(4-胺磺醯基哌啶-1-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; 1-[5-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-4,6-二氫吡咯并[3,4-d][1,3]噻唑-2-羰基]哌啶-4-磺醯胺; 1-[5-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-4,6-二氫噻吩并[2,3-c]吡咯-2-羰基]哌啶-4-磺醯胺; 2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[5-氯-4-氰基-2-(2,2-二甲基丙醯基胺基)苯基]甲酯; 2-(4-胺磺醯基哌啶-1-羰基)-4,6-二氫噻吩并[2,3-c]吡咯-5-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 及其醫藥學上可接受之鹽。 如本文中所描述的式(I)化合物之其他特定實例係選自 [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; 2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[5-氯-4-氰基-2-(2,2-二甲基丙醯基胺基)苯基]甲酯; 及其醫藥學上可接受之鹽。 用於製造如本文中所描述的式(I)化合物的方法為本發明之一目的。 本發明之式(I)化合物之製備可以依序或彙集合成途徑進行。本發明之合成展示於以下通用流程中。進行所得產物之反應及純化所需之技能為熟習此項技術者所已知。在反應期間產生對映異構體或非對映異構體之混合物的情況下,此等對映異構體或非對映異構體可藉由本文所描述或熟習此項技術者已知之方法(諸如(對掌性)層析或結晶)來分離。用於以下方法之描述的取代基及指數具有本文中所給出之意義。 可使用本領域中熟知之方法由胺前驅體1
及適當之反應劑合成通式(I)之化合物。 本發明之式(I)化合物之製備可以依序或彙集合成途徑進行。本發明之合成展示於以下通用流程中。進行所得產物之反應及純化所需之技能為熟習此項技術者所已知。在反應期間產生對映異構體或非對映異構體之混合物的情況下,此等對映異構體或非對映異構體可藉由本文所描述或熟習此項技術者已知之方法(諸如(對掌性)層析或結晶)來分離。用於以下方法之描述的取代基及指數具有本文中所給出之意義。 本發明提供式(I)或(II)之新穎化合物:可使用本領域中熟知之方法由胺前驅體1
及適當之反應劑合成通式(I)之化合物。舉例而言,使胺1A
或1B
與式R1
-COOH (2
)之合適羧酸反應,分別產生式(I)及式(II)化合物,其中Y為-C(O)-。該反應在諸如1,1'-羰基二咪唑、N,N'-二環己基碳化二亞胺、1-(3-二甲胺基丙基)-3-乙基-碳化二亞胺鹽酸鹽、O-(苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽、O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽或溴基-參-吡咯啶基-鏻六氟磷酸鹽之偶合劑存在下在諸如二氯甲烷、四氫呋喃、N,N-二甲基甲醯胺、N-甲基吡咯啶酮及其混合物之非質子性溶劑中於-40℃與80℃之間的溫度下在諸如三乙胺、二異丙基乙胺、4-甲基嗎啉及/或4-(二甲胺基)吡啶之鹼存在或不存在下進行。 亦可使胺1A
或1B
與諸如式R1
-COCl (3
)之醯基氯化物的合適醯基化反應劑反應以分別產生式(I)及式(II)化合物,其中Y為-C(O)-。該反應在諸如二氯甲烷、四氫呋喃或N,N-二甲基甲醯胺之溶劑中在諸如三乙胺或4-甲基嗎啉之鹼存在下在0℃與80℃之間的溫度下進行。 替代地,使胺1A
或1B
與式R1
-O-C(O)-Cl (4
)之合適氯甲酸酯或式(5
)之咪唑-1-甲酸酯反應,分別產生式(I)及式(II)化合物,其中Y為-OC(O)-。該反應在諸如二氯甲烷、四氫呋喃、N,N-二甲基甲醯胺、乙腈、丙酮、水或其混合物之合適溶劑中在例如三乙胺、二異丙基乙胺、吡啶、碳酸氫鉀、碳酸鉀之鹼存在下於0℃與溶劑或溶劑混合物之沸點之間的溫度下進行。 氯甲酸酯4為可商購的或可由式R1
-OH之對應醇藉由與光氣或光氣等效物(例如,雙光氣、三光氣)反應來合成,如文獻中所描述。 咪唑-1-甲酸酯5
由式R1
-OH之對應醇藉由與1,1'-羰基二咪唑反應來合成。反應在室溫下於諸如二氯甲烷、四氫呋喃或乙腈之溶劑中進行。咪唑-1-甲酸酯5
通常未分離而直接與如上文所描述之胺1A
或1B
反應。 式R1
-OH之醇為可商購的或可藉由本文所描述或此項技術中已知的方法產生。 羧酸(2
)及醯基鹵化物(3
)為可商購的或可如本文中或文獻中所描述製備。 通式1A
之胺由適當地經保護之前驅體6A
合成。類似地,通式1B
之胺由經適當保護之前驅體6B
合成。 合適保護基(PG)為第三丁氧基羰基或苯甲氧基羰基。中間物6A
或6B
之去除保護基可使用此項技術中已知的方法及反應劑進行。 舉例而言,在PG為苯甲氧基羰基之情況下,去除保護基可藉由在1巴與100巴之間的壓力下於活性炭上諸如鈀之合適催化劑之存在下在20℃與150℃之間的溫度下於諸如甲醇或乙醇之溶劑中氫化而進行。 替代地,在PG為第三丁氧基羰基之情況下,去除保護基可在例如鹽酸或三氟乙酸之合適酸存在下於諸如水、2-丙醇、二氯甲烷或1,4-二噁烷之溶劑中在0℃與30℃之間的溫度下進行。 其中W為-C(O)-之胺基甲酸酯6A
由通式6AA
表示。其中W為-C(O)-之胺基甲酸酯6B
由通式6BA
表示。R2
、m及n如上文所定義。醯胺6AA
由羧酸7AA
藉由與式H-O
、H-AO
、H-AW
、H-AX
、H-AY
或H-AZ
之胺偶合反應來產生。類似地,醯胺6BA
由羧酸7BA
藉由與式H-O
、H-AO
、H-AW
、H-AX
、H-AY
或H-AZ
之胺偶合反應來產生。該反應在諸如1,1'-羰基二咪唑、N,N'-二環己基碳化二亞胺、1-(3-二甲胺基丙基)-3-乙基-碳化二亞胺鹽酸鹽、O-(苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽、O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽或溴基-參-吡咯啶基-鏻六氟磷酸鹽之偶合劑存在下在諸如二氯甲烷、四氫呋喃、N,N-二甲基甲醯胺、N-甲基吡咯啶酮及其混合物之非質子性溶劑中於-40℃與80℃之間的溫度下在諸如三乙胺、二異丙基乙胺、4-甲基嗎啉及/或4-(二甲胺基)吡啶之鹼存在或不存在下進行。 羧酸7AA
及7BA
為可商購的或可如本文中或文獻中所描述來產生。 其中W為-S(O)2
-之胺基甲酸酯6A
由通式6AB
表示。其中W為-S(O)2
-之胺基甲酸酯6B
由通式6BB
表示。R2
、m及n如上文所定義。磺醯胺6BA
由磺醯氯7BA
藉由與式H-O
、H-AO
、H-AW
、H-AX
、H-AY
或H-AZ
之胺反應來產生。類似地,磺醯胺6BB
由磺醯氯7BB
藉由與式H-O
、H-AO
、H-AW
、H-AX
、H-AY
或H-AZ
之胺反應來產生。反應在例如吡啶或三乙胺之鹼存在下於例如二氯甲烷、四氫呋喃或N,N-二甲基甲醯胺之合適溶劑中在-20℃與+50℃之間的溫度下進行。磺醯氯7BA
及7BB
為可商購的或可如本文中或文獻中所描述來產生。 其中W為-C(O)-之式(I)化合物由通式8A
表示。其中W為-C(O)-之式(II)化合物由通式8B
表示。R1
、R2
、m及n如上文所定義。醯胺8A
亦可使用此項技術中已知之方法由羧酸9A
藉由與式H-O
、H-AO
、H-AW
、H-AX
、H-AY
或H-AZ
之胺偶合反應來產生。類似地,醯胺8B
由羧酸9B
藉由與式H-O
、H-AO
、H-AW
、H-AX
、H-AY
或H-AZ
之胺偶合反應來產生。 舉例而言,此反應在諸如1,1'-羰基二咪唑、N,N'-二環己基碳化二亞胺、1-(3-二甲胺基丙基)-3-乙基-碳化二亞胺鹽酸鹽、O-(苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽、O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽或溴基-參-吡咯啶基-鏻六氟磷酸鹽之偶合劑存在下在諸如二氯甲烷、四氫呋喃、N,N-二甲基甲醯胺、N-甲基吡咯啶酮及其混合物之非質子性溶劑中於-40℃與80℃之間的溫度下在諸如三乙胺、二異丙基乙胺、4-甲基嗎啉及/或4-(二甲胺基)吡啶之鹼存在或不存在下進行。 替代地,反應在兩個步驟中進行,其中首先使用此項技術中已知的方法及反應劑(例如,亞硫醯二氯或乙二醯氯)將羧酸9A
或9B
轉化為酸氯化物10A
或10B
。隨後使酸氯化物10A
或10B
與式H-O
、H-AO
、H-AW
、H-AX
、H-AY
或H-AZ
之胺於例如二氯甲烷、乙腈或N,N-二甲基甲醯胺之合適溶劑中在例如三乙胺、吡啶及/或4-(二甲胺基)之鹼存在下於-40℃與+100℃之間的溫度下反應。羧酸10A
可由對應酯前驅體11A
(其中Ra
為低碳數烷基,例如甲基、乙基或第三丁基)使用此項技術中已知的方法及反應劑來產生。類似地,羧酸10A
可由對應酯前驅體11B
(其中Ra
為低碳數烷基,例如甲基或乙基)使用本領域中已知之方法及反應劑來產生。舉例而言,在Ra
為甲基或乙基之情況下,反應在例如氫氧化鉀、氫氧化鈉或氫氧化鋰之鹼存在下於諸如水、甲醇、乙醇、四氫呋喃或其混合物之溶劑中在20℃與100℃之間的溫度下進行。替代地,在Ra
為第三丁基之情況下,反應在例如甲酸、鹽酸或三氟乙酸之酸存在下、視情況在例如甲醇、2-丙醇或二氯甲烷之合適溶劑存在下進行。可使用本領域中熟知之方法由式12A
之胺前驅體及適當反應劑合成式11A
化合物。類似地,式11B
化合物可使用本領域中熟知之方法由式12B
之胺前驅體及適當反應劑合成。舉例而言,使胺12A
與式R1
-COOH (2
)之合適羧酸反應,產生式11A
化合物,其中Y為-C(O)-。類似地,使胺12B
分別與式R1
-COOH (2
)之合適羧酸反應,產生式11B
化合物,其中Y為-C(O)-。該反應在諸如1,1'-羰基二咪唑、N,N'-二環己基碳化二亞胺、1-(3-二甲胺基丙基)-3-乙基-碳化二亞胺鹽酸鹽、O-(苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽、O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽或溴基-參-吡咯啶基-鏻六氟磷酸鹽之偶合劑存在下在諸如二氯甲烷、四氫呋喃、N,N-二甲基甲醯胺、N-甲基吡咯啶酮及其混合物之非質子性溶劑中於-40℃與80℃之間的溫度下在諸如三乙胺、二異丙基乙胺、4-甲基嗎啉及/或4-(二甲胺基)吡啶之鹼存在或不存在下進行。 胺12A
亦可與諸如式R1
-COCl (3
)之醯基氯化物的合適醯基化反應劑反應以產生式11A
化合物,其中Y為-C(O)-。胺12B
亦可與諸如式R1
-COCl (3
)之醯基氯化物的合適醯基化反應劑反應以產生式11B
化合物,其中Y為-C(O)-。該反應在諸如二氯甲烷、四氫呋喃或N,N-二甲基甲醯胺之溶劑中在諸如三乙胺或4-甲基嗎啉之鹼存在下在0℃與80℃之間的溫度下進行。 替代地,使胺12A
與式R1
-CH2
-O-C(O)-Cl (4
)之合適氯甲酸酯反應或與式5
之咪唑-1-甲酸酯反應,產生式11A
化合物,其中Y為-OC(O)-。替代地,使胺12B
與式R1
-CH2
-O-C(O)-Cl (4
)之合適氯甲酸酯反應或與式5
之咪唑-1-甲酸酯反應,產生式11B
化合物,其中Y為-OC(O)-。該反應在諸如二氯甲烷、四氫呋喃、N,N-二甲基甲醯胺、乙腈、丙酮、水或其混合物之合適溶劑中在例如三乙胺、二異丙基乙胺、吡啶、碳酸氫鉀、碳酸鉀之鹼存在下於0℃與溶劑或溶劑混合物之沸點之間的溫度下進行。 替代地,可使胺12A
與光氣或光氣等效物(例如,三光氣)在鹼(例如,吡啶)存在下於合適溶劑(例如,二氯甲烷)中在-78℃與+20℃之間的溫度下反應為對應N-氯羰基胺13A
。隨後使N-氯羰基胺13A
與式R1
-OH之醇反應,產生式11A
化合物,其中Y為-OC(O)-。類似地,可使胺12B
與光氣或光氣等效物(例如,三光氣)在鹼(例如,吡啶)存在下於合適溶劑(例如,二氯甲烷)中在-78℃與+20℃之間的溫度下反應為對應N-氯羰基胺13B
。隨後使N-氯羰基胺13B
與式R1
-OH之醇反應,產生式11B
化合物,其中Y為-OC(O)-。此反應於合適溶劑(例如,含乙腈之二氯甲烷)中在合適鹼(例如,氫化鈉、吡啶或聚苯乙烯-鍵結2-第三丁胺基-2-二乙胺基-1,3-二甲基全氫化-1,3,2-二氮雜鄰雜苯)存在下於20℃與溶劑之沸點之間的溫度下進行。 通式12A
之胺由適當地經保護之前驅體14A
合成。類似地,通式12B
之胺由經適當保護之前驅體14A
合成。合適保護基(PG)為第三丁氧基羰基或苯甲氧基羰基。中間物14A
及14B
之去除保護基可使用此項技術中已知的方法及反應劑進行。 舉例而言,在PG為苯甲氧基羰基之情況下,去除保護基可藉由在1巴與100巴之間的壓力下於活性炭上諸如鈀之合適催化劑之存在下在20℃與150℃之間的溫度下於諸如甲醇或乙醇之溶劑中氫化而進行。 替代地,在PG為第三丁氧基羰基之情況下,去除保護基可在例如鹽酸或三氟乙酸之合適酸存在下於諸如水、2-丙醇、二氯甲烷或1,4-二噁烷之溶劑中在0℃與30℃之間的溫度下進行。 酯14A
及14B
為可商購的或可藉由如本文中或文獻中所描述之方法來產生。 此外,本發明之一實施例在於一種製備如上文所定義之式(I)化合物的方法,其包含化合物式(II)或(III)在式(IV)化合物存在下之反應,其中R1
、R2
、Y、W、A、X、m及n如本文所定義,在Y為-C(O)-之情況下,G則為鹵素或羥基,且在Y為-OC(O)-之情況下,G則為氯。特定言之,在鹼存在下、於諸如二氯甲烷或二甲基甲醯胺之溶劑中且在包含於0℃與回流之間、特定言之室溫與回流之間的溫度下,且在偶合劑之存在下。 此外,本發明之一目的在於如本文中所描述之式(I)化合物,其用作治療活性物質。 同樣,本發明之一目的在於一種醫藥組合物,其包含如本文中所描述之式(I)化合物及治療惰性載劑。 本發明之一特定實施例為如本文中所描述之式(I)之化合物,其用於治療或預防眼部病狀,尤其青光眼。 本發明亦係關於如本文中所描述之式(I)化合物之用途,其用於製備用於治療或預防眼部病狀、尤其青光眼之藥劑。 此外,本發明之一目的在於一種用於治療或預防眼部病狀、尤其青光眼之方法,該方法包含投與有效量之如本文中所描述之式(I)化合物。 腎病包括(但不限於)有或無蛋白尿之急性腎損傷及慢性腎病,包括末期腎病(ESRD)。更詳細而言,其包括肌酐清除率降低及腎小球濾過率降低、微量白蛋白尿、白蛋白尿及蛋白尿、存在或不存在顯著細胞過多的腎小球硬化合併網狀腎小球膜基質增大(尤其糖尿病腎病變及澱粉樣變性)、腎小球毛細管局部血栓(尤其血栓性微血管病)、全身類纖維素性壞死、局部缺血性病變、惡性腎硬化(諸如局部缺血性收縮、腎血流減少及腎動脈病)、毛細管內細胞(內皮及腎小球膜)及/或毛細管外細胞(新月體)(如腎小球腎炎實體中)之腫脹及增殖、局部區段性腎小球硬化、IgA腎病、血管炎/全身性疾病以及急性及慢性腎臟移植排斥。 肝病包括(但不限於)肝硬化、肝淤血(hepatic congestion)、膽汁鬱積性肝病(包括瘙癢)、非酒精性脂肪變性肝炎以及急性及慢性肝移植排斥。 發炎性病狀包括(但不限於)關節炎、骨關節炎、多發性硬化、全身性紅斑狼瘡、發炎性腸病、異常排氣病症及類似疾病以及發炎性氣管疾病(諸如特發性肺部纖維化(IPF)、慢性阻塞性肺病(COPD)或慢性支氣管哮喘)。 呼吸系統之其他病狀包括(但不限於)不同病源之其他彌漫性實質性肺病,包括醫原性藥物誘發性纖維化、職業及/或環境誘發性纖維化、全身性疾病及血管炎、肉芽腫性疾病(類肉瘤病、過敏性肺炎)、膠原蛋白血管疾病、肺泡蛋白沈積症、蘭格漢氏細胞肉芽腫(Langerhans cell granulomatosis)、肺淋巴管平滑肌增生症、遺傳性疾病(哈布二氏症候群(Hermansky-Pudlak Syndrome)、結節性硬化症、神經纖維瘤、代謝貯積病症、家族性間質性肺病)、輻射誘發性纖維化、矽肺病、石棉誘發性肺纖維化或急性呼吸窘迫症候群(ARDS)。 神經系統之病狀包括(但不限於)神經痛、精神分裂症、神經發炎(例如,膠質化)、外周及/或自主(糖尿病性)神經病及類似者。 血管病狀包括(但不限於)動脈粥樣硬化、血栓性血管疾病以及血栓性微血管病、增生性動脈病(諸如黏液性胞外基質包圍之膨脹肌內膜細胞及結節狀增厚)、動脈粥樣硬化、血管順應性降低(諸如僵硬、心室順應性降低及血管順應性降低)、內皮細胞功能不良及類似病狀。 心血管病狀包括(但不限於)急性冠狀動脈症候群、冠心病、心肌梗塞、動脈及肺高血壓、心律不整(諸如心房顫動)、中風及其他血管損傷。 纖維化疾病包括(但不限於)心肌及血管纖維化、腎纖維化、肝纖維化、肺纖維化、皮膚纖維化、硬皮病及包裹性腹膜炎。 癌症及癌轉移包括(但不限於)乳癌、卵巢癌、肺癌、前列腺癌、間皮瘤、神經膠質瘤、肝癌、胃腸癌及其進展及轉移性侵襲。 眼部病狀包括(但不限於)增生性及非增生性(糖尿病性)視網膜病乾型及濕型老年性黃斑部病變(AMD)、黃斑水腫、中央動脈/靜脈阻塞、創傷性損傷、青光眼及類似病狀。特定言之,眼部病狀為青光眼。 代謝病狀包括(但不限於)肥胖及糖尿病。 此外,本發明之一實施例提供根據所描述之方法中之任一者製造的如本文中所描述之式(I)化合物。檢定程序
產生有或無HIS標記之人類全長ATX自分泌運動因子 ( ATX - ENPP2 ) 選殖 :
由市售人類造血細胞總RNA製備cDNA且將其用作重疊PCR之模板來產生有或無3'-6×His標記之全長人類ENPP2 ORF。將此等全長插入序列選殖至pcDNA3.1V5-His TOPO (Invitrogen)載體中。驗證數種單純系之DNA序列。使用來自正確全長純系之DNA轉染Hek293細胞以驗證蛋白質表現。所編碼之ENPP2的序列符合Swissprot條目Q13822,其有或無額外C端6×His標記。ATX 醱酵 :
在20 L受控攪拌槽生物反應器(Sartorius)中藉由大規模短暫轉染產生重組蛋白。在細胞生長及轉染期間,溫度、攪拌器速度、pH值及溶解氧濃度分別維持在37℃、120 rpm、7.1及30% DO。將FreeStyle 293-F細胞(Invitrogen)培養於FreeStyle 293培養基(Invitrogen)中之懸浮液中,且使用X-tremeGENE Ro-1539 (commercial product, Roche Diagnostics)作為錯合劑用以上質體DNA以約1-1.5×10E6個細胞/毫升轉染。將細胞饋入濃縮培養液(J Immunol Methods 194 (1996), 19, 1-199 (第193頁))中,在轉染後72小時藉由丁酸鈉(2 mM)誘導且在轉染後96小時收集。藉由西方墨點法、酶檢定及/或分析型IMAC層析來分析表現。在流通式熱交換器中冷卻細胞懸浮液至4℃後,藉由經由Zeta Plus 60M02 E16 (Cuno)及Sartopore 2 XLG (Sartorius)過濾器裝置過濾進行細胞分離及上清液無菌過濾。在純化前將上清液儲存在4℃下。ATX 純化 :
藉由添加Brij 35至0.02%之最終濃度且藉由使用1 M HCl將pH值調節至7.0來調節20公升培養物上清液以進行超濾。隨後首先將上清液經由0.2 µm Ultran-Pilot Open Channel PES過濾器(Whatman)微濾,之後經由Ultran-Pilot Screen Channel PES過濾器用30 kDa MWCO (Whatman)濃縮至1公升。在IMAC層析前,添加NiSO4
至1 mM之最終濃度。隨後將澄清上清液施用於先前於50 mM Na2
HPO4
pH 7.0、0.5 M NaCl、10%甘油、0.3% CHAPS、0.02% NaN3
中平衡的HisTrap管柱(GE Healthcare)。分別用含有20 mM、40 mM及50 mM咪唑之相同緩衝液逐步洗滌管柱。隨後使用在15個管柱體積中達0.5 M咪唑的線性梯度溶離蛋白質。彙集含有ATX之溶離份且使用配備有30 kDa PES濾膜之Amicon單元濃縮。藉由尺寸排阻層析於Superdex S-200製備級(XK 26/100) (GE Healthcare)於20 mM BICINE pH 8.5、0.15 M NaCl、10%甘油、0.3% CHAPS、0.02% NaN3
中進一步純化蛋白質。純化後蛋白質之最終產率為每公升培養物上清液5-10 mg ATX。將蛋白質儲存在-80℃下。 人類ATX酶抑制檢定 ATX抑制藉由螢光驟冷檢定使用經特別標記之受質類似物(MR121受質)量測。為獲得此MR121受質,用MR121螢光團(CAS 185308-24-1,1-(3-羧丙基)-11-乙基-1,2,3,4,8,9,10,11-八氫-二吡啶并[3,2-b:2',3'-i]吩嗪-13-鎓)於乙醇胺側之游離胺上標記經BOC及TBS保護之6-胺基-己酸(R)-3-({2-[3-(2-{2-[2-(2-胺基-乙氧基)-乙氧基]-乙氧基}-乙氧基)-丙醯基胺基]-乙氧基}-羥基-磷醯氧基)-2-羥基-丙酯(Ferguson等人, Org Lett 2006, 8 (10), 2023),隨後在去除保護基後,接著用色胺酸於胺基己酸側上標記。 檢定工作溶液如下製備: 檢定緩衝液(50 mM Tris-HCl、140 mM NaCl、5 mM KCl、1 mM CaCl2
、1 mM MgCl2
、0.01% Triton-X-100、pH 8.0; ATX溶液:ATX (標記人類His)儲備溶液(1.08 mg/mL,於20 mM二甘胺酸,pH 8.5、0.15 M NaCl、10%甘油、 0.3% CHAPS、0.02% NaN3
中),用檢定緩衝液稀釋至1.4-2.5×最終濃度; MR121受質溶液:MR121受質儲備溶液(含800 µM MR121受質之DMSO),用檢定緩衝液稀釋至2-5×最終濃度。 於384孔樣本培養盤(Corning Costar #3655)中獲得測試化合物(含10 mM儲備液之DMSO,8 µL)且用8 µL DMSO稀釋。藉由將8 µL化合物溶液轉移至下一列直至列O來製備逐列連續稀釋液。將化合物及對照溶液混合五次且將2 µL轉移至384孔檢定培養盤(Corning Costar # 3702)。隨後,添加15 µL 41.7 nM ATX溶液(30 nM最終濃度),混合五次,隨後在30℃下培育15分鐘。添加10 µL MR121受質溶液(1 µM最終濃度),混合30次,隨後在30℃下培育15分鐘。隨後每2分鐘量測螢光,持續1小時(Perkin Elmer培養盤:視覺多模式讀取器);光強度:2.5%;暴露時間:1.4秒,濾光片:Fluo_630/690 nm,且根據此等讀取結果計算IC50
值。
如本文中所描述之式(I)化合物及其醫藥學上可接受之鹽或酯的IC50
值在0.00001 µM與1000 µM之間,特定化合物之IC50
值在0.0005 µM與500 µM之間,其他特定化合物之IC50
值在0.0005 µM與50 µM之間,更特定化合物之IC50
值在0.0005 µM與5 µM之間。此等結果藉由使用上文所描述之酶檢定獲得。 式(I)化合物及其醫藥學上可接受之鹽可用作藥劑(例如,呈醫藥製劑形式)。醫藥製劑可內部投與,諸如經口(例如以錠劑、包衣錠劑、糖衣藥丸、硬明膠膠囊及軟明膠膠囊、溶液、乳液或懸浮液形式)、經鼻(例如以經鼻噴霧劑形式)、經直腸(例如以栓劑形式)或局部經眼(例如以溶液、軟膏、凝膠或水溶性聚合插入物形式)。然而,投與亦可非經腸進行,諸如肌肉內、靜脈內或眼內(例如以無菌注射溶液形式)。 式(I)化合物及其醫藥學上可接受之鹽可用醫藥學惰性無機或有機佐劑處理以產生錠劑、包衣錠劑、糖衣藥丸、硬明膠膠囊、注射溶液或局部調配物。乳糖、玉米澱粉或其衍生物、滑石、硬脂酸或其鹽等可例如用作此類用於錠劑、糖衣藥丸及硬明膠膠囊之佐劑。 軟明膠膠囊之合適佐劑為例如植物油、蠟、脂肪、半固體物質及液體多元醇等。 用於產生溶液及糖漿之合適佐劑為例如水、多元醇、蔗糖、轉化糖、葡萄糖等。 注射溶液之合適佐劑為例如水、醇、多元醇、甘油、植物油等。 栓劑之合適佐劑為例如天然或硬化油、蠟、脂肪、半固體或液體多元醇等。 局部眼部調配物之合適佐劑為例如環糊精、甘露糖醇或此項技術中已知之多種其他載劑及賦形劑。 此外,醫藥製劑可含有防腐劑、增溶劑、增黏物質、穩定劑、濕潤劑、乳化劑、甜味劑、著色劑、調味劑、用於改變滲透壓之鹽、緩衝液、掩蔽劑或抗氧化劑。其亦可仍含有其他有治療價值之物質。 劑量可在寬界限內變化且當然將適合各特定情況下之個別要求。一般而言,在經口投與約0.1毫克至20毫克/公斤體重、較佳地約0.5毫克至4毫克/公斤體重(例如,約300毫克/人)之日劑量的情況下,應適當劃分成可由例如相同量組成之較佳1至3個個別劑量。在局部投與之情況下,調配物可含有0.001重量%至15重量%藥劑,且可為0.1至25 mg之所需劑量可藉由每天或每週單次劑量或藉由每天多次劑量(2至4次)或藉由每週多次劑量投與。然而,應顯而易見,在經展示而指示出時,本文所給之上限或下限可被超出。 本發明在下文中藉由實例加以說明,該等實例無限制特徵。 在獲得作為對映異構體之混合物的製備性實例情況下,純淨對映異構體可藉由本文所描述之方法或藉由熟習此項技術者已知之方法(諸如對掌性層析或結晶)來獲得。實例
若未另外規定,則所有實例及中間物在氮氣氛圍下製備。實例 1 [2-[2- 環丙基 -6-( 噁烷 -4- 基甲氧基 ) 吡啶 -4- 羰基 ]-3,4- 二氫 -1H- 異喹啉 -6- 基 ]-(1,4,6,7- 四氫三唑并 [4,5-c] 吡啶 -5- 基 ) 甲酮 在室溫下向1,2,3,4-四氫異喹啉-6-基(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮鹽酸鹽(中間物1;50 mg,156 µmol)於N,N-二甲基甲醯胺(4 ml)中之溶液中添加4-甲基嗎啉(94.9 mg,938 µmol)、2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-甲酸(CAS-RN 1810776-23-8;43.4 mg,156 µmol)及O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽(59.5 mg,156 µmol),隨後在16 h後使反應混合物分配於碳酸氫鈉飽和水溶液與乙酸乙酯及2-甲基四氫呋喃之混合物之間。用氯化銨溶液及鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,梯度為二氯甲烷至二氯甲烷/甲醇/25%氨氣水溶液90:10:2.5)產生標題化合物(71 mg,84%)。白色泡沫,MS: 543.4 (M+H)+
。 根據實例1用適當胺替換1,2,3,4-四氫異喹啉-6-基(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮鹽酸鹽及用適當羧酸替換2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-甲酸來製備以下實例。
實例2[2-[2- 環丙基 -6-( 噁烷 -4- 基甲氧基 ) 吡啶 -4- 羰基 ]-1,3- 二氫異吲哚 -5- 基 ]-(3- 羥基 -5,7- 二氫 -4H-[1,2] 噁唑并 [5,4-c] 吡啶 -6- 基 ) 甲酮: 在室溫下向2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-甲酸(中間物2;60 mg,142 µmol)於N,N-二甲基甲醯胺(4 ml)中之混合物中添加4-甲基嗎啉(115 mg,1.14 mmol)、4,5,6,7-四氫-[1,2]噁唑并[5,4-c]吡啶-3-醇鹽酸鹽(CAS-RN 64603-91-4;32.6 mg,184.6 µmol)及O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽(75.6 mg,198.8 µmol),隨後在16 h後使反應混合物分配於氯化銨飽和水溶液與二氯甲烷之間。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,梯度為二氯甲烷至二氯甲烷/甲醇9:1)產生標題化合物(46 mg,61%)。黃色泡沫,MS: 545.3 (M+H)+
。 根據實例2用適當羧酸替換2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-甲酸及用適當胺替換4,5,6,7-四氫-[1,2]噁唑并[5,4-c]吡啶-3-醇鹽酸鹽來製備以下實例。 實例 3 [2- 環丙基 -6-( 噁烷 -4- 基甲氧基 ) 吡啶 -4- 基 ]-[2-(3- 羥基 -5,7- 二氫 -4H-[1,2] 噁唑并 [5,4-c] 吡啶 -6- 羰基 )-4,6- 二氫吡咯并 [3,4-d][1,3] 噁唑 -5- 基 ] 甲酮: 在室溫下向5,6-二氫-4H-吡咯并[3,4-d][1,3]噁唑-2-基-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-基)甲酮鹽酸鹽(中間物4;60 mg,173 µmol)於N,N-二甲基甲醯胺(4 ml)中之混合物中添加4-甲基嗎啉(140 mg,1.38 mmol)、2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-甲酸(CAS-RN 1810776-23-8;47.9 mg,173 µmol)及O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽(65.7 mg,173 µmol),隨後在16 h後使反應混合物分配於氯化銨飽和水溶液與二氯甲烷之間。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,梯度為二氯甲烷至二氯甲烷/甲醇9:1)產生標題化合物(40 mg,43%)。淺黃色泡沫,MS: 536.3 (M+H)+
。 根據實例3用適當胺替換5,6-二氫-4H-吡咯并[3,4-d][1,3]噁唑-2-基-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-基)甲酮鹽酸鹽及用適當羧酸替換2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-甲酸來製備以下實例。 實例 4 2-(1,4,6,7- 四氫三唑并 [4,5-c] 吡啶 -5- 羰基 )-4,6- 二氫吡咯并 [3,4-d][1,3] 噁唑 -5- 甲酸 [3-(2,2- 二甲基丙醯基胺基 )-5-( 三氟甲基 ) 吡啶 -2- 基 ] 甲酯: 向N-[2-(羥甲基)-5-(三氟甲基)吡啶-3-基]-2,2-二甲基丙醯胺(中間物5;92.2 mg,334 µmol)於乙腈(10 mL)之溶液中添加1,1'-羰基二咪唑(54.1 mg,334 µmol)。將反應混合物加熱至50℃,維持3小時。添加三乙胺(153 mg,1.52 mmol)及5,6-二氫-4H-吡咯并[3,4-d][1,3]噁唑-2-基(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮鹽酸鹽(中間物4.1;90 mg,334 µmol)且將反應混合物加熱至回流。隨後在15 h後,使反應混合物分配於氯化銨飽和水溶液與乙酸乙酯之間。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,乙酸乙酯/庚烷7:3)產生標題化合物(121 mg,71%)。淺黃色泡沫,MS: 561.4 (M-H)-
。 根據實例4用適當醇替換N-[2-(羥甲基)-5-(三氟甲基)吡啶-3-基]-2,2-二甲基丙醯胺(中間物5)及用適當胺替換5,6-二氫-4H-吡咯并[3,4-d][1,3]噁唑-2-基(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮鹽酸鹽(中間物4.1)來製備以下實例。 實例 4.02 2-(4- 胺磺醯基哌啶 -1- 羰基 )-4,6- 二氫噻吩并 [2,3-c] 吡咯 -5- 甲酸 [3-(2,2- 二甲基丙醯基胺基 )-5-( 三氟甲基 ) 吡啶 -2- 基 ] 甲酯及 2,2- 二甲基 -N-[2-[[2-(4- 胺磺醯基哌啶 -1- 羰基 )-4,6- 二氫噻吩并 [2,3-c] 吡咯 -5- 基 ] 甲基 ]-5-( 三氟甲基 ) 吡啶 -3- 基 ] 丙醯胺: 向N-[2-(羥甲基)-5-(三氟甲基)吡啶-3-基]-2,2-二甲基丙醯胺(中間物5;60.5 mg,219 µmol)於乙腈(8 ml)中之溶液中添加1,1'-羰基二咪唑(35.5 mg,219 µmol)。將反應混合物加熱至50℃,維持3小時。添加三乙胺(121 mg,1.19 mmol)及1-(5,6-二氫-4H-噻吩并[2,3-c]吡咯-2-羰基)哌啶-4-磺醯胺鹽酸鹽(中間物1.5;70 mg,199 µmol)且將反應混合物加熱至回流。隨後在15 h後,使反應混合物分配於氯化銨飽和水溶液與乙酸乙酯之間。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(Gemini NX 3u 50×4.6 mm)產生標題化合物(47 mg,38%)。白色泡沫,MS: 618.3 (M+H)+
。中間物 1 1,2,3,4- 四氫異喹啉 -6- 基 (1,4,6,7- 四氫三唑并 [4,5-c] 吡啶 -5- 基 ) 甲酮鹽酸鹽 步驟 1 : 6 -( 1 , 4 , 6 , 7 - 四氫三唑并 [ 4 , 5 - c ] 吡啶 - 5 - 羰基 )- 3 , 4 - 二氫 - 1H - 異喹啉 - 2 - 甲酸第三丁酯
在室溫下向2-[(2-甲基丙-2-基)氧基羰基]-3,4-二氫-1H-異喹啉-6-甲酸(CAS-RN 170097-67-3;300 mg,1.08 mmol)於N,N-二甲基甲醯胺(5 ml)中之溶液中添加4-甲基嗎啉(547 mg,5.41 mmol)、4,5,6,7-四氫-1H-[1,2,3]三唑并[4,5-c]吡啶(CAS-RN 706757-05-3;141 mg,1.08 mmol)及O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽(411 mg,1.08 mmol),隨後在18 h後使反應混合物分配於碳酸氫鈉飽和水溶液與乙酸乙酯及2-甲基四氫呋喃之混合物之間。用氯化銨溶液及鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,梯度為二氯甲烷至二氯甲烷/甲醇/25%氨氣水溶液90:10:2.5)產生標題化合物(278 mg,67%)。白色泡沫,MS: 384.3 (M+H)+
。步驟 2 : 1 , 2 , 3 , 4 - 四氫異喹啉 - 6 - 基 ( 1 , 4 , 6 , 7 - 四氫三唑并 [ 4 , 5 - c ] 吡啶 - 5 - 基 ) 甲酮鹽酸鹽
向6-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-3,4-二氫-1H-異喹啉-2-甲酸第三丁酯(263 mg,686 µmol)於2-丙醇(3 ml)中之溶液中添加氯化氫溶液(5-6 M於2-丙醇中,3.84 ml)。在室溫下攪拌反應混合物2 h。將溶劑全部蒸發以產生標題化合物(219 mg,100%)。白色固體,LC/MS: 284.1 (M+H)+
。 根據中間物1用適當羧酸替換2-[(2-甲基丙-2-基)氧基羰基]-3,4-二氫-1H-異喹啉-6-甲酸及用適當胺替換4,5,6,7-四氫-1H-[1,2,3]三唑并[4,5-c]吡啶來製備以下中間物。 中間物 2 2-[2- 環丙基 -6-( 噁烷 -4- 基甲氧基 ) 吡啶 -4- 羰基 ]-1,3- 二氫異吲哚 -5- 甲酸 步驟 1 : 2 -[ 2 - 環丙基 - 6 -( 噁烷 - 4 - 基甲氧基 ) 吡啶 - 4 - 羰基 ]- 1 , 3 - 二氫異吲哚 - 5 - 甲酸甲酯
在室溫下向2,3-二氫-1H-異吲哚-5-甲酸甲酯鹽酸鹽(CAS-RN 127168-93-8;400 mg,1.78 mmol)於N,N-二甲基甲醯胺(6 ml)中之溶液中添加4-甲基嗎啉(1.08 g,10.7 mmol)、2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-甲酸(CAS-RN 1810776-23-8;493 mg,1.78 mmol)及O-(7-氮雜苯并三唑-1-基)-N,N,N',N'-四甲六氟-磷酸鹽(676 mg,1.78 mmol),隨後在18 h後使反應混合物分配於碳酸氫鈉飽和水溶液與乙酸乙酯及2-甲基四氫呋喃之混合物之間。用氯化銨溶液及鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,梯度為二氯甲烷至二氯甲烷/甲醇/25%氨氣水溶液90:10:2.5)產生標題化合物(770 mg,89%)。黃色油狀物,MS: 437.2 (M+H)+
。步驟 2 : 2 -[ 2 - 環丙基 - 6 -( 噁烷 - 4 - 基甲氧基 ) 吡啶 - 4 - 羰基 ]- 1 , 3 - 二氫異吲哚 - 5 - 甲酸
向2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-甲酸甲酯(742 mg,1.7 mmol)於四氫呋喃及甲醇中之溶液中添加氫氧化鋰溶液(2 M於水中,5.1 ml,10.2 mmol)。在室溫下攪拌反應混合物3 h。使反應混合物分配於水與二乙基醚之間。用氯化氫溶液(1 M於水中)酸化水層且用乙酸乙酯萃取。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發以產生標題化合物(663 mg,92%)。灰白色泡沫,MS: 423.2 (M+H)+
。中間物 3 2-[[3-(2,2- 二甲基丙醯基胺基 )-5-( 三氟甲基 ) 吡啶 -2- 基 ] 甲氧基羰基 ]-1,3- 二氫異吲哚 -5- 甲酸 步驟 1 : 1 , 3 - 二氫異吲哚 - 2 , 5 - 二甲酸 2 - O -[[ 3 -( 2 , 2 - 二甲基丙醯基胺基 )- 5 -( 三氟甲基 ) 吡啶 - 2 - 基 ] 甲基 ] 5 - O - 甲酯
向2,3-二氫-1H-異吲哚-5-甲酸甲酯鹽酸鹽(CAS-RN 127168-93-8;200 mg,889 µmol)及三乙胺(180 mg,1.78 mmol)於二氯甲烷(4 ml)中之溶液中添加1,1'-羰基二咪唑。1 h後,在室溫下使反應混合物分配於水與二氯甲烷之間。用檸檬酸溶液(0.25 M於水中)、水及鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。將固體懸浮於四氫呋喃(4 ml)且添加N-[2-(羥甲基)-5-(三氟甲基)吡啶-3-基]-2,2-二甲基丙醯胺(中間物5,246 mg,889 µmol)於四氫呋喃(4 ml)及第三丁醇鉀溶液(2 M於2-甲基四氫呋喃中;889 µmol)中之溶液。隨後在30 min後使反應混合物分配於氯化銨飽和水溶液與乙酸乙酯之間。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,梯度為二氯甲烷至二氯甲烷/甲醇/25%氨氣水溶液90:10:2.5)產生標題化合物(364 mg,85%)。淺黃色泡沫,MS: 480.2 (M+H)+
。步驟 2 : 2 -[[ 3 -( 2 , 2 - 二甲基丙醯基胺基 )- 5 -( 三氟甲基 ) 吡啶 - 2 - 基 ] 甲氧基羰基 ]- 1 , 3 - 二氫異吲哚 - 5 - 甲酸
類似於中間物2步驟2用1,3-二氫異吲哚-2,5-二甲酸2-O-[[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲基]5-O-甲酯替換2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-甲酸酯來產生標題化合物。淺黃色泡沫,MS: 464.3 (M+H)+
。中間物 3.1 5-[[3-(2,2- 二甲基丙醯基胺基 )-5-( 三氟甲基 ) 吡啶 -2- 基 ] 甲氧基羰基 ]-4,6- 二氫吡咯并 [3,4-d][1,3] 噁唑 -2- 甲酸
類似於中間物3用5,6-二氫-4H-吡咯并[3,4-d][1,3]噁唑-2-甲酸乙酯鹽酸鹽替換2,3-二氫-1H-異吲哚-5-甲酸酯鹽酸鹽來產生標題化合物。淺黃色泡沫。MS: 457.1 (M+H)+
。中間物 4 5,6- 二氫 -4H- 吡咯并 [3,4-d][1,3] 噁唑 -2- 基 -(3- 羥基 -5,7- 二氫 -4H-[1,2] 噁唑并 [5,4-c] 吡啶 -6- 基 ) 甲酮鹽酸鹽 步驟 1 : 2 -( 3 - 羥基 - 5 , 7 - 二氫 - 4H -[ 1 , 2 ] 噁唑并 [ 5 , 4 - c ] 吡啶 - 6 - 羰基 )- 4 , 6 - 二氫吡咯并 [ 3 , 4 - d ][ 1 , 3 ] 噁唑 - 5 - 甲酸第三丁酯 :
在0℃下向5-[(2-甲基丙-2-基)氧基羰基]-4,6-二氫吡咯并[3,4-d][1,3]噁唑-2-甲酸(CAS-RN 1211529-86-6;308 mg,1.21 mmol)於二氯甲烷(5 ml)中之懸浮液中添加乙二醯氯(235 mg,1.82 mmol)及催化量之N,N-二甲基甲醯胺。1 h後在室溫下用二氯甲烷(5 ml)稀釋混合物且在0℃下將其添加至4,5,6,7-四氫-[1,2]噁唑并[5,4-c]吡啶-3-醇鹽酸鹽(CAS-RN 64603-91-4;214 mg,1.21 mmol)及N,N-二異丙基乙胺(1.57 g,12.1 mmol)於N,N-二甲基甲醯胺中之混合物。15 h後使反應混合物分配於氯化銨飽和水溶液與二氯甲烷之間。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,梯度為二氯甲烷至二氯甲烷/甲醇9:1)產生標題化合物(239 mg,52%)。淺黃色泡沫,MS: 377.1 (M+H)+
。步驟 2 : 5 , 6 - 二氫 - 4H - 吡咯并 [ 3 , 4 - d ][ 1 , 3 ] 噁唑 - 2 - 基 -( 3 - 羥基 - 5 , 7 - 二氫 - 4H -[ 1 , 2 ] 噁唑并 [ 5 , 4 - c ] 吡啶 - 6 - 基 ) 甲酮鹽酸鹽
類似於中間物1步驟2用2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸第三丁酯替換6-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-3,4-二氫-1H-異喹啉-2-甲酸第三丁酯來產生標題化合物。淺黃色泡沫,MS: 277.1 (M+H)+
。中間物 4.1 5,6- 二氫 -4H- 吡咯并 [3,4-d][1,3] 噁唑 -2- 基 (1,4,6,7- 四氫三唑并 [4,5-c] 吡啶 -5- 基 ) 甲酮鹽酸鹽
類似於中間物4用4,5,6,7-四氫-1H-[1,2,3]三唑并[4,5-c]吡啶替換4,5,6,7-四氫-[1,2]噁唑并[5,4-c]吡啶-3-醇鹽酸鹽(CAS-RN 64603-91-4)來產生標題化合物。淺黃色泡沫,MS: 361.2。中間物 5 N-[2-( 羥甲基 )-5-( 三氟甲基 ) 吡啶 -3- 基 ]-2,2- 二甲基丙醯胺 步驟 1 : 3 - 特戊醯胺基 - 5 -( 三氟甲基 ) 吡啶甲酸甲酯
在0℃下向3-胺基-5-(三氟甲基)吡啶甲酸甲酯(CAS-RN 866775-17-9;2.00 g,8.63 mmol)於吡啶(25 mL)中之棕色溶液中添加特戊醯氯(2.08 g,17.3 mmol)。在20 min之後移除冰浴,隨後在5 h後使反應混合物分配於1 M鹽酸溶液與乙酸乙酯之間。用水和鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠;庚烷-乙酸乙酯梯度)得到標題化合物(2.46 g,92%)。淺黃色固體,MS: 305.1 (M+H)+
。步驟 2 : N -( 2 -( 羥甲基 ) - 5 -( 三氟甲基 ) 吡啶 - 3 - 基 ) 特戊醯胺
向3-特戊醯胺基-5-(三氟甲基)吡啶甲酸甲酯(2.45 g,8.05 mmol)於四氫呋喃(60 mL)中之透明淺黃色溶液中添加氯化鈣(1.79 g,16.1 mmol)於乙醇(60 mL)中之溶液,隨後經30 min之時段分3份添加硼氫化鈉(914 mg,24.2 mmol)。在室溫下攪拌白色懸浮液90 min,隨後使其分配於水與氯化銨飽和水溶液之間。用鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠,庚烷-乙酸乙酯梯度)得到標題化合物(1.97 g,89%)。淺黃色黏性油狀物,MS: 277.1 (M+H)+
。中間物 6 N -[ 4 - 氯 - 5 - 氰基 - 2 -( 羥甲基 ) 苯基 ]- 2 , 2 - 二甲基丙醯胺 步驟 1 : 4 - 溴 - 5 - 氯 - 2 - 特戊醯胺基苯甲酸甲酯
類似於中間產物5 步驟1由2-胺基-4-溴-5-氯苯甲酸甲酯(CAS-RN 1445322-56-4)產生標題化合物。白色固體。MS: 350.0 (M+H)+
。步驟 2 : 5 - 氯 - 4 - 氰基 - 2 - 特戊醯胺基苯甲酸甲酯
在130℃下在微波照射下將4-溴-5-氯-2-特戊醯胺基苯甲酸甲酯(3.14 g,9.01 mmol)、參(二苯亞甲基丙酮)二鈀(0)(82.5 mg,90.1 µmol)、1,1'-雙(二苯基膦基)二茂鐵(150 mg,270 µmol)及氰化鋅(582 mg,4.95 mmol)、鋅粉末(23.6 mg,360 µmol)及乙酸鋅(66.1 mg,360 µmol)於N,N-二甲基甲醯胺(48 mL)及水(1.5 mL)中之混合物加熱20 min。在真空下移除不溶物質且濃縮濾液後,使殘餘物分配於50%碳酸氫鈉水溶液與乙酸乙酯之間。用水和鹽水洗滌有機層,經硫酸鎂乾燥,過濾且蒸發。層析(矽膠;庚烷-二氯甲烷梯度)產生標題化合物(2.00 g,75%)。淺黃色固體。MS: 295.1 (M+H)+
。步驟 3 : N -( 4 - 氯 - 5 - 氰基 - 2 -( 羥甲基 ) 苯基 ) 特戊醯胺
類似於中間產物5步驟2由5-氯-4-氰基-2-特戊醯胺基苯甲酸甲酯產生標題化合物。淺黃色固體。MS: 267.1 (M+H)+
。實例 A
式(I)化合物可以原本已知之方式用作活性成分來產生以下組成之錠劑:每 錠
活性成分 200 mg 微晶纖維素 155 mg 玉米澱粉 25 mg 滑石 25 mg 羥丙基甲基纖維素20 mg
425 mg實例 B
式(I)化合物可以原本已知之方式用作活性成分來產生以下組成之膠囊:每膠囊
活性成分 100.0 mg 玉米澱粉 20.0 mg 乳糖 95.0 mg 滑石 4.5 mg 硬脂酸鎂0.5 mg
220.0 mg
Claims (32)
- 一種式(I)或(II)化合物其中 R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之苯基, ii) 經R3 、R4 及R5 取代之苯基-C1 - 6 烷基, iii) 經R3 、R4 及R5 取代之苯氧基-C1 - 6 烷基, iv) 經R3 、R4 及R5 取代之苯基-C2 - 6 烯基, v) 經R3 、R4 及R5 取代之苯基-C2 - 6 炔基, vi) 經R3 、R4 及R5 取代之吡啶基, vii) 經R3 、R4 及R5 取代之吡啶基-C1 - 6 烷基, viii) 經R3 、R4 及R5 取代之吡啶基-C2 - 6 烯基, ix) 經R3 、R4 及R5 取代之吡啶基-C2 - 6 炔基, x) 經R3 、R4 及R5 取代之噻吩基; xi) 經R3 、R4 及R5 取代之噻吩基-C1 - 6 烷基, xii) 經R3 、R4 及R5 取代之噻吩基-C2 - 6 烯基,及 xiii) 經R3 、R4 及R5 取代之噻吩基-C2 - 6 炔基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A係選自由以下組成之群: i) -O-,及 ii) -S-; X係選自由以下組成之群: i) -N-,及 ii) -CH-; W係選自由以下組成之群: i) -C(O)-,及 ii) -S(O)2 -; R2 係選自環系統O、AO、AW、AX、AY及AZ;; R3 係選自由以下組成之群: i) 鹵素, ii) 羥基, iii) 氰基、C1-6 烷基, iv) C1-6 烷氧基, v) C1-6 烷氧基-C1-6 烷基, vi) 鹵基-C1-6 烷氧基, vii) 鹵基-C1-6 烷基, viii) 羥基-C1-6 烷基, ix) C3-8 環烷基, x) C3-8 環烷基-C1-6 烷基, xi) C3-8 環烷基-C1-6 烷氧基, xii) C3-8 環烷氧基, xiii) C3-8 環烷氧基-C1-6 烷基, xiv) C1-6 烷胺基, xv) C1-6 烷基羰胺基, xvi) C3-8 環烷基羰胺基, xvii) C1-6 烷基四唑基, xviii) C1-6 烷基四唑基-C1-6 烷基,及 xix) 雜環烷基-C1-6 烷氧基; R4 及R5 係獨立地選自由以下組成之群: i) H, ii) 鹵素, iii) 羥基, iv) 氰基, v) C1-6 烷基, vi) C1-6 烷氧基, vii) C1-6 烷氧基-C1-6 烷基, viii) 鹵基-C1-6 烷氧基, ix) 鹵基-C1-6 烷基, x) 羥基-C1-6 烷基, xi) C3-8 環烷基, xii) C3-8 環烷基-C1-6 烷基, xiii) C3-8 環烷基-C1-6 烷氧基, xiv) C3-8 環烷氧基, xv) C3-8 環烷氧基-C1-6 烷基, xvi) C1-6 烷基羰胺基, xvii) C3-8 環烷基羰胺基, xviii) C1-6 烷基四唑基, xix) C1-6 烷基四唑基-C1-6 烷基,及 xx) 雜環烷基-C1-6 烷氧基; R6 係選自由以下組成之群: i) H, ii) C1-6 烷基,及 iii) C3-8 環烷基; m及n係獨立地選自1、2及3; r為1、2或3; 或醫藥學上可接受之鹽。
- 如請求項1之化合物,其中 R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之苯基-C1 - 6 烷基, ii) 經R3 、R4 及R5 取代之吡啶基,及 iii) 經R3 、R4 及R5 取代之吡啶基-C1 - 6 烷基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A係選自由以下組成之群: i) -O-,及 ii) -S-; X係選自由以下組成之群: i) -N-,及 ii) -CH-; W為-C(O)-; R2 係選自環系統O、AO及AW;; R3 係選自由以下組成之群: i) C1-6 烷基羰胺基,及 ii) 四氫哌喃基-C1-6 烷氧基; R4 係選自由以下組成之群: i) 氰基, ii) C3-8 -環烷基,及 iii) 鹵基-C1-6 烷基; R5 係選自由以下組成之群: i) H,及 ii) 鹵素; m及n係獨立地選自1及2; 或醫藥學上可接受之鹽。
- 如請求項1或2之化合物,其中R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之苯基-C1 - 6 烷基, ii) 經R3 、R4 及R5 取代之吡啶基,及 iii) 經R3 、R4 及R5 取代之吡啶基-C1 - 6 烷基。
- 如請求項1或2之化合物,其中R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之苯基-C1 - 6 烷基,及 ii) 經R3 、R4 及R5 取代之吡啶基。
- 如請求項1或2之化合物,其中Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-。
- 如請求項1或2之化合物,其中A係選自由以下組成之群: i) -O-,及 ii) -S-。
- 如請求項1或2之化合物,其中A為-O-。
- 如請求項1或2之化合物,其中X為-N-。
- 如請求項1或2之化合物,其中W為-C(O)-。
- 如請求項1或2之化合物,其中R2 係選自環系統O、AO及AW。
- 如請求項1或2之化合物,其中R2 係選自環系統O及AO。
- 如請求項1或2之化合物,其中R3 係選自由以下組成之群: i) C1-6 烷基羰胺基,及 ii) 四氫哌喃基-C1-6 烷氧基。
- 如請求項1或2之化合物,其中R4 係選自由以下組成之群: i) 氰基, ii) C3-8 環烷基,及 iii) 鹵基-C1-6 烷基。
- 如請求項1或2之化合物,其中R4 係選自由以下組成之群: i) 氰基,及 ii) C3-8 環烷基。
- 如請求項1或2之化合物,其中R5 係選自由以下組成之群: i) H,及 ii) 鹵素。
- 如請求項1或2之化合物,其中m及n係獨立地選自1及2。
- 如請求項1或2之化合物,其中m及n均為1。
- 如請求項1之化合物,其中 R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之苯基-C1 - 6 烷基,及 ii) 經R3 、R4 及R5 取代之吡啶基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A為-O-; X為N; W為-C(O)-; R2 係選自環系統O及AO;; R3 係選自由以下組成之群: i) C1-6 烷基羰胺基,及 ii) 四氫哌喃基-C1-6 烷氧基; R4 係選自由以下組成之群: i) 氰基,及 ii) C3-8 環烷基; R5 係選自由以下組成之群: i) H,及 ii) 鹵素; m及n均為1; 或醫藥學上可接受之鹽。
- 如請求項1之化合物,其具有式(I),或醫藥學上可接受之鹽。
- 如請求項1之化合物,其具有式(II),或醫藥學上可接受之鹽。
- 如請求項1之化合物,其具有式(I),其中 R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之吡啶基,及 ii) 經R3 、R4 及R5 取代之吡啶基-C1 - 6 烷基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; W為-C(O)-; R2 係選自環系統O、AO及AW;; R3 係選自由以下組成之群: i) C1-6 烷基羰胺基,及 ii) 四氫哌喃基-C1-6 烷氧基; R4 係選自由以下組成之群: i) C3-8 環烷基,及 ii) 鹵基-C1-6 烷基; R5 為H; m係選自1及2; n為1; 或醫藥學上可接受之鹽。
- 如請求項1之化合物,其具有式(I),其中 R1 為經R3 、R4 及R5 取代之吡啶基; Y為-C(O)-; W為-C(O)-; R2 係選自環系統O;; R3 為四氫哌喃基-C1-6 烷氧基; R4 為C3-8 環烷基; R5 為H; m及n均為1; 或醫藥學上可接受之鹽。
- 如請求項1之化合物,其具有式(II),其中 R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之苯基-C1 - 6 烷基, ii) 經R3 、R4 及R5 取代之吡啶基,及 iii) 經R3 、R4 及R5 取代之吡啶基-C1 - 6 烷基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A係選自由以下組成之群: i) -O-,及 ii) -S-; X係選自由以下組成之群: i) -N-,及 ii) -CH-; W為-C(O)-; R2 係選自環系統O、AO及AW;; R3 係選自由以下組成之群: i) C1 - 6 烷基羰胺基,及 ii) 四氫哌喃基-C1 - 6 烷氧基; R4 係選自由以下組成之群: i) 氰基, ii) C3-8 環烷基,及 iii) 鹵基-C1-6 烷基; R5 係選自由以下組成之群: i) H,及 ii) 鹵素; m為1; n選自1及2; 或醫藥學上可接受之鹽。
- 如請求項1之化合物,其具有式(II),其中 R1 係選自由以下組成之群: i) 經R3 、R4 及R5 取代之苯基-C1 - 6 烷基,及 ii) 經R3 、R4 及R5 取代之吡啶基; Y係選自由以下組成之群: i) -OC(O)-,及 ii) -C(O)-; A為-O-; X為-N-; W為-C(O)-; R2 係選自環系統O及AO;; R3 係選自由以下組成之群: i) C1-6 烷基羰胺基,及 ii) 四氫哌喃基-C1-6 烷氧基; R4 係選自由以下組成之群: i) 氰基,及 ii) C3-8 環烷基; R5 係選自由以下組成之群: i) H,及 ii) 鹵素; m及n均為1; 或醫藥學上可接受之鹽。
- 2及18至24中任一項之化合物,其係選自 [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-3,4-二氫-1H-異喹啉-6-基]-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-6,7-二氫-4H-[1,3]噻唑并[5,4-c]吡啶-5-基]甲酮; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-基)甲酮; 1-[2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-羰基]哌啶-4-磺醯胺; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(3-羥基-6,7-二氫-4H-[1,2]噁唑并[4,5-c]吡啶-5-基)甲酮; 5-(4-胺磺醯基哌啶-1-羰基)-1,3-二氫異吲哚-2-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 5-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-1,3-二氫異吲哚-2-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 5-(3-羥基-6,7-二氫-4H-[1,2]噁唑并[4,5-c]吡啶-5-羰基)-1,3-二氫異吲哚-2-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 2-(4-胺磺醯基哌啶-1-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; 1-[5-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-4,6-二氫吡咯并[3,4-d][1,3]噻唑-2-羰基]哌啶-4-磺醯胺; 1-[5-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-4,6-二氫噻吩并[2,3-c]吡咯-2-羰基]哌啶-4-磺醯胺; 2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[5-氯-4-氰基-2-(2,2-二甲基丙醯基胺基)苯基]甲酯; 2-(4-胺磺醯基哌啶-1-羰基)-4,6-二氫噻吩并[2,3-c]吡咯-5-甲酸[3-(2,2-二甲基丙醯基胺基)-5-(三氟甲基)吡啶-2-基]甲酯; 及其醫藥學上可接受之鹽。
- 2及18至24中任一項之化合物,其係選自 [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; [2-[2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-羰基]-1,3-二氫異吲哚-5-基]-(1,4,6,7-四氫三唑并[4,5-c]吡啶-5-基)甲酮; [2-環丙基-6-(噁烷-4-基甲氧基)吡啶-4-基]-[2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-基]甲酮; 2-(3-羥基-5,7-二氫-4H-[1,2]噁唑并[5,4-c]吡啶-6-羰基)-4,6-二氫吡咯并[3,4-d][1,3]噁唑-5-甲酸[5-氯-4-氰基-2-(2,2-二甲基丙醯基胺基)苯基]甲酯; 及其醫藥學上可接受之鹽。
- 一種製備如請求項1至26中任一項之化合物的方法,其包含式(II)或(III)化合物在式(IV)化合物存在下之反應,其中R1 、R2 、Y、W、A、X、m及n如請求項1至24中任一項中所定義,且在Y為-C(O)-之情況下,G則為鹵素或羥基,且在Y為-OC(O)-之情況下,G則為氯基。
- 2及18至24中任一項之化合物,其用作治療活性物質。
- 一種醫藥組合物,其包含如請求項1至26中任一項之化合物及治療惰性載劑。
- 2及18至24中任一項之化合物,其用於治療或預防眼部病狀。
- 一種如請求項1至26中任一項之化合物之用途,其用於製備用於治療或預防眼部病狀之藥劑。
- 2及18至24中任一項之化合物,其根據如請求項27之方法製得。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| ??17161254.2 | 2017-03-16 | ||
| EP17161254 | 2017-03-16 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| TW201840552A true TW201840552A (zh) | 2018-11-16 |
Family
ID=58347252
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW107108794A TW201840552A (zh) | 2017-03-16 | 2018-03-15 | 作為atx抑制劑之新穎雙環化合物 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US10882857B2 (zh) |
| EP (1) | EP3596060B1 (zh) |
| JP (1) | JP7090099B2 (zh) |
| CN (1) | CN110382484B (zh) |
| AR (1) | AR111524A1 (zh) |
| TW (1) | TW201840552A (zh) |
| WO (1) | WO2018167113A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI842923B (zh) * | 2019-07-01 | 2024-05-21 | 比利時商優稀美生物醫藥股份有限公司 | 作為d1正向異位調節劑之經取代的四氫異喹啉衍生物 |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2504607C2 (ru) | 2007-05-31 | 2014-01-20 | Конинклейке Филипс Электроникс Н.В. | Фиксирующее устройство для гладильной системы |
| MY180688A (en) | 2012-06-13 | 2020-12-07 | Hoffmann La Roche | New diazaspirocycloalkane and azaspirocycloalkane |
| JP6285444B2 (ja) | 2012-09-25 | 2018-02-28 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 新規な二環式誘導体 |
| AR095079A1 (es) | 2013-03-12 | 2015-09-16 | Hoffmann La Roche | Derivados de octahidro-pirrolo[3,4-c]-pirrol y piridina-fenilo |
| WO2015078803A1 (en) | 2013-11-26 | 2015-06-04 | F. Hoffmann-La Roche Ag | NEW OCTAHYDRO-CYCLOBUTA [1,2-c;3,4-c']DIPYRROL-2-YL |
| SG11201607845RA (en) | 2014-03-26 | 2016-10-28 | Hoffmann La Roche | Condensed [1,4]diazepine compounds as autotaxin (atx) and lysophosphatidic acid (lpa) production inhibitors |
| SG11201607839UA (en) | 2014-03-26 | 2016-10-28 | Hoffmann La Roche | Bicyclic compounds as autotaxin (atx) and lysophosphatidic acid (lpa) production inhibitors |
| MA41898A (fr) | 2015-04-10 | 2018-02-13 | Hoffmann La Roche | Dérivés de quinazolinone bicyclique |
| MX2020004504A (es) | 2015-09-04 | 2021-11-10 | Hoffmann La Roche | Derivados de fenoximetilo. |
| CN107922415B (zh) | 2015-09-24 | 2022-04-15 | 豪夫迈·罗氏有限公司 | 新的作为双重atx/ca抑制剂的二环化合物 |
| JP6846414B2 (ja) | 2015-09-24 | 2021-03-24 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Atx阻害剤としての二環式化合物 |
| BR112018006034A2 (pt) | 2015-09-24 | 2018-10-09 | Hoffmann La Roche | compostos bicíclicos como inibidores de atx |
| AU2016328365B2 (en) | 2015-09-24 | 2020-04-23 | F. Hoffmann-La Roche Ag | New bicyclic compounds as dual ATX/CA inhibitors |
| RU2019132254A (ru) | 2017-03-16 | 2021-04-16 | Ф. Хоффманн-Ля Рош Аг | Гетероциклические соединения, пригодные в качестве дуальных ингибиторов atx/ca |
| EP3596060B1 (en) | 2017-03-16 | 2023-09-20 | F. Hoffmann-La Roche AG | New bicyclic compounds as atx inhibitors |
| WO2024043741A1 (ko) | 2022-08-25 | 2024-02-29 | 주식회사 레고켐 바이오사이언스 | 오토탁신 저해 화합물 및 이를 함유하는 약제학적 조성물 |
Family Cites Families (149)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1252898B (de) | 1965-06-12 | 1967-10-26 | Bayer Ag | Verfahren zur Herstellung von Copolymerisaten des Trioxans |
| IT1176613B (it) | 1984-08-14 | 1987-08-18 | Ravizza Spa | Derivati piperazinici farmacologicamente attivi e processo per la loro preparazione |
| US5240928A (en) | 1989-07-03 | 1993-08-31 | Merck & Co., Inc. | Substituted quinazolinones as angiotensin II antagonists |
| DE3930262A1 (de) | 1989-09-11 | 1991-03-21 | Thomae Gmbh Dr K | Kondensierte diazepinone, verfahren zu ihrer herstellung und diese verbindungen enthaltende arzneimittel |
| KR910009330B1 (ko) | 1989-10-23 | 1991-11-11 | 재단법인 한국화학연구소 | 항균작용을 갖는 퀴놀린계 화합물과 그의 제조방법 |
| CA2037630C (en) | 1990-03-07 | 2001-07-03 | Akira Morimoto | Nitrogen-containing heterocylic compounds, their production and use |
| US5470975A (en) | 1990-10-16 | 1995-11-28 | E.R. Squibb & Sons, Inc. | Dihydropyrimidine derivatives |
| US5290780A (en) | 1991-01-30 | 1994-03-01 | American Cyanamid Co. | Angiotensin II receptor blocking 2,3,6 substituted quinazolinones |
| US5238942A (en) | 1991-05-10 | 1993-08-24 | Merck & Co., Inc. | Substituted quinazolinones bearing acidic functional groups as angiotensin ii antagonists |
| DE4121214A1 (de) | 1991-06-27 | 1993-01-14 | Bayer Ag | 7-azaisoindolinyl-chinolon- und -naphthyridoncarbonsaeure-derivate |
| US5202322A (en) | 1991-09-25 | 1993-04-13 | Merck & Co., Inc. | Quinazolinone and pyridopyrimidine a-II antagonists |
| US5532243A (en) | 1992-02-14 | 1996-07-02 | The Dupont Merck Pharmaceutical Company | Antipsychotic nitrogen-containing bicyclic compounds |
| US5358951A (en) | 1993-04-23 | 1994-10-25 | American Cyanamid Company | Angiotensin II receptor blocking 2, 3, 6 substituted quinazolinones |
| DE4407047A1 (de) | 1994-03-03 | 1995-09-07 | Merck Patent Gmbh | Acetamide |
| US20010016657A1 (en) | 1997-03-18 | 2001-08-23 | Smithkline Beecham P.L.C. | Substituted isoquinoline derivatives and their use as anticonvulsants |
| BR9908351A (pt) | 1998-02-04 | 2001-11-20 | Banyu Pharma Co Ltd | Compostos, processo para a preparação dosmesmos, e, composição farmacêutica |
| JP2001039950A (ja) | 1999-07-30 | 2001-02-13 | Banyu Pharmaceut Co Ltd | N−アシル環状アミン誘導体 |
| AU1244001A (en) | 1999-10-27 | 2001-05-08 | Cor Therapeutics, Inc. | Pyridyl-containing spirocyclic compounds as inhibitors of fibrinogen-dependent platelet aggregation |
| ES2234692T3 (es) | 1999-11-09 | 2005-07-01 | Societe De Conseils De Recherches Et D'applications Scientifiques (S.C.R.A.S.) | Producto que comprende un inhibidor de la transduccion de las señales de las proteinas g heterotrimetricas en asociacion con otro agente anti-canceroso para una utilizacion terapeutica en el tratamiento del cancer. |
| CA2440803A1 (en) | 2001-03-07 | 2002-09-12 | Pfizer Products Inc. | Modulators of chemokine receptor activity |
| EP1499306A4 (en) | 2002-04-12 | 2007-03-28 | Merck & Co Inc | BICYCLIC AMIDE |
| US20050256159A1 (en) | 2002-10-11 | 2005-11-17 | Astrazeneca Ab | 1,4-disubstituted piperidine derivatives and their use as 11,betahsd1 inhibitors |
| GB0303852D0 (en) | 2003-02-19 | 2003-03-26 | Pfizer Ltd | Triazole compounds useful in therapy |
| WO2005023762A1 (en) | 2003-09-04 | 2005-03-17 | Abbott Laboratories | Pyrrolidine-2-carbonitrile derivatives and their use as inhibitors of dipeptidyl peptidase-iv (dpp-iv) |
| SE0302811D0 (sv) | 2003-10-23 | 2003-10-23 | Astrazeneca Ab | Novel compounds |
| GB0324790D0 (en) | 2003-10-24 | 2003-11-26 | Astrazeneca Ab | Amide derivatives |
| US7226951B2 (en) | 2003-12-17 | 2007-06-05 | Allergan, Inc. | Compounds having selective cytochrome P450RAI-1 or selective cytochrome P450RAI-2 inhibitory activity and methods of obtaining the same |
| KR100610731B1 (ko) | 2004-02-24 | 2006-08-09 | 한국과학기술연구원 | T-형 칼슘 채널 차단제로서 유용한 3,4-디히드로퀴나졸린유도체 및 그의 제조 방법 |
| WO2005084667A1 (en) | 2004-03-03 | 2005-09-15 | Chemocentryx, Inc. | Bicyclic and bridged nitrogen heterocycles |
| DK1761542T3 (da) | 2004-06-09 | 2008-04-28 | Hoffmann La Roche | Octahydropyrrolo[3,4-C] pyrrolderivater og anvendelsen deraf som antivirusmidler |
| WO2006015985A1 (en) | 2004-08-10 | 2006-02-16 | Janssen Pharmaceutica N.V. | Hiv inhibiting 1,2,4-triazin-6-one derivatives |
| EP1793868B1 (en) | 2004-09-23 | 2010-12-29 | Guerbet | Liposomal contrast agents for cest imaging |
| US7410949B2 (en) | 2005-01-18 | 2008-08-12 | Hoffmann-La Roche Inc. | Neuropeptide-2 receptor (Y-2R) agonists and uses thereof |
| GB0504019D0 (en) | 2005-02-26 | 2005-04-06 | Astrazeneca Ab | Amide derivatives |
| MX2007013469A (es) | 2005-04-28 | 2008-01-22 | Wyeth Corp | Forma ii polimorfa de tanaproget. |
| US7737279B2 (en) | 2005-05-10 | 2010-06-15 | Bristol-Myers Squibb Company | 1,6-dihydro-1,3,5,6-tetraaza-as-indacene based tricyclic compounds and pharmaceutical compositions comprising same |
| TW200800999A (en) | 2005-09-06 | 2008-01-01 | Astrazeneca Ab | Novel compounds |
| AU2006293605B2 (en) | 2005-09-23 | 2011-05-19 | Pfizer Products Inc. | Pyridinaminosulfonyl substituted benzamides as inhibitors of cytochrome P450 3A4 (CYP3A4) |
| EP2657235A1 (en) | 2005-10-28 | 2013-10-30 | Ono Pharmaceutical Co., Ltd. | Compound containing basic group and use thereof |
| EP1961744B1 (en) | 2005-11-18 | 2013-04-17 | Ono Pharmaceutical Co., Ltd. | Basic group-containing compound and use thereof |
| JP2007176809A (ja) | 2005-12-27 | 2007-07-12 | Hideaki Natsukari | 複素環置換アミド化合物、その製造法および医薬組成物 |
| AU2007214602A1 (en) | 2006-02-15 | 2007-08-23 | F. Hoffmann-La Roche Ag | Heterocyclic antiviral compounds |
| US20070208001A1 (en) | 2006-03-03 | 2007-09-06 | Jincong Zhuo | Modulators of 11- beta hydroxyl steroid dehydrogenase type 1, pharmaceutical compositions thereof, and methods of using the same |
| JP2008031064A (ja) | 2006-07-27 | 2008-02-14 | Astellas Pharma Inc | ジアシルピペラジン誘導体 |
| AU2007296634B2 (en) | 2006-09-11 | 2012-09-20 | Merck Sharp & Dohme B.V. | Quinazolinone and isoquinolinone acetamide derivatives |
| CN101541795A (zh) | 2006-09-15 | 2009-09-23 | 先灵公司 | 用于治疗疼痛、糖尿病和脂类代谢紊乱的螺-稠合氮杂环丁烷衍生物 |
| WO2008034731A1 (en) | 2006-09-18 | 2008-03-27 | F. Hoffmann-La Roche Ag | Octahydropyrrolo [3, 4-c] pyrrole derivatives an their use as antiviral agents |
| US8735411B2 (en) | 2006-10-02 | 2014-05-27 | Abbvie Inc. | Macrocyclic benzofused pyrimidine derivatives |
| TWI454262B (zh) | 2006-11-02 | 2014-10-01 | Targacept Inc | 菸鹼乙醯膽鹼受體亞型選擇性之二氮雜雙環烷類醯胺 |
| CA2669884A1 (en) | 2006-11-15 | 2008-05-22 | High Point Pharmaceuticals, Llc | Novel 2-(2-hydroxyphenyl)benzimidazoles useful for treating obesity and diabetes |
| TW200831085A (en) | 2006-12-13 | 2008-08-01 | Merck & Co Inc | Non-nucleoside reverse transcriptase inhibitors |
| EP1975165A1 (de) | 2007-03-27 | 2008-10-01 | Boehringer Ingelheim Pharma GmbH & Co. KG | Substituierte Pyrrolidinamide, deren Herstellung und deren Verwendung als Arzneimittel |
| CN101657433A (zh) | 2007-03-29 | 2010-02-24 | 弗·哈夫曼-拉罗切有限公司 | 非核苷逆转录酶抑制剂 |
| CL2008001002A1 (es) | 2007-04-11 | 2008-10-17 | Actelion Pharmaceuticals Ltd | Compuestos derivados de oxazolidinona; composicion farmaceutica que comprende a dichos compuestos; y su uso para preparar un medicamento para tratar una infeccion bacteriana. |
| CA2685543A1 (en) | 2007-04-27 | 2008-11-13 | Sanofi-Aventis | 2-heteroaryl-pyrrolo[3,4-c]pyrrole derivatives and their use as scd inhibitors |
| AU2008285652B2 (en) | 2007-08-07 | 2013-09-05 | AbbVie Deutschland GmbH & Co. KG | Quinoline compounds suitable for treating disorders that respond to modulation of the serotonin 5-HT6 receptor |
| DE102007047737A1 (de) | 2007-10-05 | 2009-04-30 | Merck Patent Gmbh | Piperidin- und Piperazinderivate |
| AU2008317473B2 (en) * | 2007-10-19 | 2014-07-17 | Bausch + Lomb Ireland Limited | Compositions and methods for treatment of diabetic retinopathy |
| PA8802501A1 (es) | 2007-10-31 | 2009-06-23 | Janssen Pharmaceutica Nv | Diaminas en puente o fusionadas sustituidas con arilo como moduladores de leucotrieno, hidrolasa |
| JP2009161449A (ja) | 2007-12-28 | 2009-07-23 | Lion Corp | Ppar活性促進剤並びに美容用飲食品、皮膚外用剤及び医薬 |
| CA2727914A1 (en) | 2008-06-19 | 2009-12-23 | Banyu Pharmaceutical Co., Ltd. | Spirodiamine-diaryl ketoxime derivative technical field |
| US8673917B2 (en) | 2008-09-09 | 2014-03-18 | Sanofi | 2-heteroaryl-pyrrolo [3,4-C]pyrrole derivatives, and use thereof as SCD inhibitors |
| TW201020247A (en) | 2008-11-06 | 2010-06-01 | Gruenenthal Gmbh | Substituierte disulfonamide |
| EP2358677B1 (en) | 2008-11-17 | 2014-01-08 | F. Hoffmann-La Roche AG | Naphthylacetic acids used as crth2 antagonists or partial agonists |
| DE102008059578A1 (de) | 2008-11-28 | 2010-06-10 | Merck Patent Gmbh | Benzo-Naphtyridin Verbindungen |
| EP2352732B1 (en) | 2008-12-01 | 2013-02-20 | Merck Patent GmbH | 2,5-DIAMINO-SUBSTITUTED PYRIDO[4, 3-d]PYRIMIDINES AS AUTOTAXIN INHIBITORS AGAINST CANCER |
| TW201035102A (en) | 2009-03-04 | 2010-10-01 | Gruenethal Gmbh | Sulfonylated tetrahydroazolopyrazines and their use as medicinal products |
| EP2404918B1 (en) | 2009-03-05 | 2016-11-30 | Daiichi Sankyo Company, Limited | Pyridine derivative as ppary inhibitor |
| US20120010186A1 (en) | 2009-03-23 | 2012-01-12 | Merck Frosst Canada Ltd. | Heterocyclic compounds as inhibitors of stearoyl-coenzyme a delta-9 desaturase |
| TW201038572A (en) | 2009-03-25 | 2010-11-01 | Gruenenthal Gmbh | Substituted spiro-amide compounds |
| JP5779172B2 (ja) | 2009-04-02 | 2015-09-16 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | オートタキシン阻害剤 |
| JP5591318B2 (ja) | 2009-04-02 | 2014-09-17 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツング | オートタキシン阻害剤としてのピペリジンおよびピペラジン誘導体 |
| WO2010112116A1 (de) | 2009-04-02 | 2010-10-07 | Merck Patent Gmbh | Heterocyclische verbindungen als autotaxin-inhibitoren |
| FR2945534B1 (fr) | 2009-05-12 | 2012-11-16 | Sanofi Aventis | DERIVES DE CYCLOPENTAL[c]PYRROLE-2-CARBOXYLATES, LEUR PREPARATION ET LEUR APPLICATION EN THERAPEUTIQUE |
| CA2763099A1 (en) | 2009-05-22 | 2010-11-25 | Exelixis, Inc. | Benzoxazepines based p13k/mt0r inhibitors against proliferative diseases |
| US20120083476A1 (en) | 2009-06-05 | 2012-04-05 | Janssen Pharmaceutica Nv | Heteroaryl-substituted spirocyclic diamine urea modulators of fatty acid amide hydrolase |
| DE102009033392A1 (de) | 2009-07-16 | 2011-01-20 | Merck Patent Gmbh | Heterocyclische Verbindungen als Autotaxin-Inhibitoren II |
| CN102574822A (zh) | 2009-08-04 | 2012-07-11 | 阿米拉制药公司 | 作为溶血磷脂酸受体拮抗剂的化合物 |
| UA107360C2 (en) | 2009-08-05 | 2014-12-25 | Biogen Idec Inc | Bicyclic aryl sphingosine 1-phosphate analogs |
| AR079022A1 (es) | 2009-11-02 | 2011-12-21 | Sanofi Aventis | Derivados de acido carboxilico ciclico sustituidos con acilamino, su uso como productos farmaceuticos, composicion farmaceutica y metodo de preparacion |
| EP2521450B1 (en) | 2010-01-07 | 2015-02-25 | E.I. Du Pont De Nemours And Company | Fungicidal heterocyclic compounds |
| US8815869B2 (en) | 2010-03-18 | 2014-08-26 | Abbvie Inc. | Lactam acetamides as calcium channel blockers |
| AU2011228699B2 (en) | 2010-03-19 | 2016-05-19 | Pfizer Inc. | 2,3 dihydro-1H-inden-1-yl- 2,7-diazaspiro [3.5] nonane derivatives and their use as antagonists or inverse agonists of the Ghrelin receptor |
| JP5827677B2 (ja) | 2010-03-26 | 2015-12-02 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | オートタキシン阻害剤としてのベンゾナフチリジンアミン |
| GB201008005D0 (en) | 2010-05-13 | 2010-06-30 | Sentinel Oncology Ltd | Pharmaceutical compounds |
| WO2011151461A2 (en) | 2010-06-04 | 2011-12-08 | B.S.R.C. "Alexander Fleming" | Autotaxin pathway modulation and uses thereof |
| AR082590A1 (es) | 2010-08-12 | 2012-12-19 | Hoffmann La Roche | Inhibidores de la tirosina-quinasa de bruton |
| CA2711136C (en) | 2010-08-17 | 2012-05-29 | Imperial Oil Resources Limited | Feed delivery system for a solid-liquid separation vessel |
| WO2012024620A2 (en) | 2010-08-20 | 2012-02-23 | Amira Pharmaceuticals, Inc. | Autotaxin inhibitors and uses thereof |
| JP6039559B2 (ja) | 2010-09-02 | 2016-12-07 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | Lpa受容体アンタゴニストとしてのピラゾロピリジノン誘導体 |
| ES2590682T3 (es) | 2010-12-02 | 2016-11-23 | Shanghai De Novo Pharmatech Co Ltd. | Derivados heterocíclicos, procesos de preparación y usos médicos de los mismos |
| ES2553610T3 (es) | 2010-12-14 | 2015-12-10 | Electrophoretics Limited | Inhibidores de la caseína cinasa 1 delta (CK1delta) |
| JP2014513077A (ja) | 2011-04-05 | 2014-05-29 | アミラ ファーマシューティカルス,インコーポレーテッド | 線維症、疼痛、癌、ならびに呼吸器、アレルギー性、神経系または心血管疾患の治療に有用な3−または5−ビフェニル−4−イルイソキサゾールに基づく化合物 |
| WO2012166415A1 (en) | 2011-05-27 | 2012-12-06 | Amira Pharmaceuticals, Inc. | Heterocyclic autotaxin inhibitors and uses thereof |
| WO2013033059A1 (en) | 2011-08-29 | 2013-03-07 | Bristol-Myers Squibb Company | Spiro bicyclic diamine derivatives as hiv attachment inhibitors |
| WO2013054185A1 (en) | 2011-10-13 | 2013-04-18 | Pfizer, Inc. | Pyrimidine and pyridine derivatives useful in therapy |
| JPWO2013065712A1 (ja) | 2011-10-31 | 2015-04-02 | 東レ株式会社 | ジアザスピロウレア誘導体及びその医薬用途 |
| US8809552B2 (en) | 2011-11-01 | 2014-08-19 | Hoffmann-La Roche Inc. | Azetidine compounds, compositions and methods of use |
| CA2856946C (en) | 2011-12-02 | 2016-08-02 | Phenex Pharmaceuticals Ag | Pyrrolo carboxamides as modulators of orphan nuclear receptor rar-related orphan receptor-gamma (rory, nr1f3) activity and for the treatment of chronic inflammatory and autoimmunediseases |
| TWI638802B (zh) | 2012-05-24 | 2018-10-21 | 芬蘭商奧利安公司 | 兒茶酚o-甲基轉移酶活性抑制化合物 |
| SG10201610416TA (en) | 2012-06-13 | 2017-01-27 | Incyte Corp | Substituted tricyclic compounds as fgfr inhibitors |
| MY180688A (en) | 2012-06-13 | 2020-12-07 | Hoffmann La Roche | New diazaspirocycloalkane and azaspirocycloalkane |
| RU2665462C2 (ru) | 2012-06-27 | 2018-08-30 | Ф. Хоффманн-Ля Рош Аг | Соединения 5-азаиндазола и способы их применения |
| EP2877166B1 (en) | 2012-07-27 | 2018-02-28 | Biogen MA Inc. | 1-[7-(cis-4-methyl-cyclohexyloxy)-8-trifluoromethyl-naphthalen-2-ylmethyl]-piperidine-4-carboxylic acid derivatives as autotaxin (ATX) modulators for treating inflammations and autoimmune disorders |
| JP6324380B2 (ja) | 2012-07-27 | 2018-05-16 | バイオジェン・エムエイ・インコーポレイテッドBiogen MA Inc. | S1p調節剤および/またはatx調節剤である化合物 |
| AR092211A1 (es) | 2012-09-24 | 2015-04-08 | Merck Patent Ges Mit Beschränkter Haftung | Derivados de hidropirrolopirrol |
| JP6285444B2 (ja) | 2012-09-25 | 2018-02-28 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 新規な二環式誘導体 |
| SI2900269T1 (sl) | 2012-09-25 | 2018-10-30 | Bayer Pharma Aktiengesellschaft | Kombinacija regorafeniba in acetilsalicilne kisline za zdravljenje kolorektalnega raka |
| AR092742A1 (es) | 2012-10-02 | 2015-04-29 | Intermune Inc | Piridinonas antifibroticas |
| KR102189560B1 (ko) | 2012-10-25 | 2020-12-11 | 테트라 디스커버리 파트너스 엘엘씨 | Pde4 의 헤테로아릴 저해제 |
| EA201591239A1 (ru) | 2012-12-31 | 2015-10-30 | Кадила Хелзкэр Лимитед | Замещенные фталазин-1(2h)-оновые производные в качестве селективных ингибиторов поли(адф-рибоза)полимеразы-1 |
| JPWO2014133112A1 (ja) | 2013-03-01 | 2017-02-02 | 国立大学法人 東京大学 | オートタキシン阻害活性を有する8−置換イミダゾピリミジノン誘導体 |
| US10035800B2 (en) | 2013-03-12 | 2018-07-31 | Abbvie Inc. | Substituted 1,4,10-triazadibenzo[cd,f]azulenes, substituted 1,4,5,10-tetraazadibenzo[cd,f]azulenes and substituted 1,4,5,7,10-pentaazadibenzo[cd,f]azulenes as bromodomain inhibitors |
| AR095079A1 (es) | 2013-03-12 | 2015-09-16 | Hoffmann La Roche | Derivados de octahidro-pirrolo[3,4-c]-pirrol y piridina-fenilo |
| TWI593692B (zh) | 2013-03-12 | 2017-08-01 | 美國禮來大藥廠 | 四氫吡咯并噻嗪化合物 |
| KR20150126043A (ko) | 2013-03-12 | 2015-11-10 | 어큐셀라 인코포레이티드 | 안과 질환 및 장애 치료용 치환된 3-페닐프로필아민 유도체 |
| AR095328A1 (es) | 2013-03-15 | 2015-10-07 | Biogen Idec Inc | Agentes de modulación de s1p y/o atx |
| WO2014179564A1 (en) | 2013-05-01 | 2014-11-06 | Vitae Pharmaceuticals, Inc. | Thiazalopyrrolidine inhibitors of ror-gamma |
| PE20160521A1 (es) | 2013-07-18 | 2016-05-20 | Novartis Ag | Inhibidores de autotaxina que comprenden un nucleo ciclico de anillo heteroaromatico-bencil-amida |
| TR201807411T4 (tr) | 2013-10-17 | 2018-06-21 | Vertex Pharma | DNA-PK inhibitörleri. |
| KR102515248B1 (ko) | 2013-11-22 | 2023-03-29 | 사브레 테라퓨틱스 엘엘씨 | 오토탁신 억제제 화합물 |
| AR098475A1 (es) | 2013-11-26 | 2016-06-01 | Bayer Cropscience Ag | Compuestos pesticidas y usos |
| WO2015078803A1 (en) | 2013-11-26 | 2015-06-04 | F. Hoffmann-La Roche Ag | NEW OCTAHYDRO-CYCLOBUTA [1,2-c;3,4-c']DIPYRROL-2-YL |
| JP2017515794A (ja) | 2014-03-26 | 2017-06-15 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | 殺菌剤としての置換[1,2,4]トリアゾール及びイミダゾール化合物 |
| JO3512B1 (ar) | 2014-03-26 | 2020-07-05 | Astex Therapeutics Ltd | مشتقات كينوكسالين مفيدة كمعدلات لإنزيم fgfr كيناز |
| SG11201607839UA (en) | 2014-03-26 | 2016-10-28 | Hoffmann La Roche | Bicyclic compounds as autotaxin (atx) and lysophosphatidic acid (lpa) production inhibitors |
| SG11201607845RA (en) | 2014-03-26 | 2016-10-28 | Hoffmann La Roche | Condensed [1,4]diazepine compounds as autotaxin (atx) and lysophosphatidic acid (lpa) production inhibitors |
| AP2016009496A0 (en) | 2014-04-04 | 2016-10-31 | X-Rx Inc | Substituted spirocydic inhibitors of autotaxin |
| WO2016031987A1 (ja) | 2014-08-29 | 2016-03-03 | 国立大学法人東京大学 | オートタキシン阻害活性を有するピリミジノン誘導体 |
| EA031967B1 (ru) | 2014-10-14 | 2019-03-29 | Вайтаи Фармасьютиклз, Инк. | ДИГИДРОПИРРОЛОПИРИДИНОВЫЕ ИНГИБИТОРЫ ROR-γ |
| AU2016217851A1 (en) | 2015-02-15 | 2017-08-03 | F. Hoffmann-La Roche Ag | 1-(het)arylsulfonyl-(pyrrolidine or piperidine)-2-carboxamide derivatives and their use as TRPA1 antagonists |
| MA41898A (fr) | 2015-04-10 | 2018-02-13 | Hoffmann La Roche | Dérivés de quinazolinone bicyclique |
| WO2016181408A2 (en) | 2015-05-11 | 2016-11-17 | Cadila Healthcare Limited | NOVEL SHORT-CHAIN PEPTIDES AS KAPPA (κ) OPIOID RECEPTORS (KOR) AGONIST |
| CN104927727B (zh) | 2015-07-06 | 2017-01-11 | 香山红叶建设有限公司 | 一种玻璃幕墙用结构密封胶及其制备方法 |
| PL415078A1 (pl) | 2015-09-04 | 2017-03-13 | Oncoarendi Therapeutics Spółka Z Ograniczoną Odpowiedzialnością | Podstawione aminotriazole przydatne jako inhibitory kwaśnej chitynazy ssaków |
| MX2020004504A (es) | 2015-09-04 | 2021-11-10 | Hoffmann La Roche | Derivados de fenoximetilo. |
| AU2016328365B2 (en) | 2015-09-24 | 2020-04-23 | F. Hoffmann-La Roche Ag | New bicyclic compounds as dual ATX/CA inhibitors |
| BR112018006034A2 (pt) | 2015-09-24 | 2018-10-09 | Hoffmann La Roche | compostos bicíclicos como inibidores de atx |
| JP6846414B2 (ja) | 2015-09-24 | 2021-03-24 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Atx阻害剤としての二環式化合物 |
| CN107922415B (zh) | 2015-09-24 | 2022-04-15 | 豪夫迈·罗氏有限公司 | 新的作为双重atx/ca抑制剂的二环化合物 |
| CN108513588A (zh) | 2015-09-24 | 2018-09-07 | Ionis制药公司 | Kras表达的调节剂 |
| US10385057B2 (en) | 2015-11-20 | 2019-08-20 | Lundbeck La Jolla Research Center, Inc. | Pyrazole compounds and methods of making and using same |
| WO2017087863A1 (en) | 2015-11-20 | 2017-05-26 | Abide Therapeutics, Inc. | Pyrazole compounds and methods of making and using same |
| SG10201913450PA (en) | 2015-11-25 | 2020-03-30 | Dana Farber Cancer Inst Inc | Bivalent bromodomain inhibitors and uses thereof |
| AU2016362040B2 (en) | 2015-12-01 | 2019-10-10 | Nihon Nohyaku Co., Ltd. | 3H-pyrrolopyridine compound, N-oxide thereof or salt thereof, agricultural and horticultural insecticide comprising the compound and method for using the same |
| WO2018107113A1 (en) | 2016-12-09 | 2018-06-14 | Goh Johnson | Remote controlled movable pet feeder device |
| RU2019132254A (ru) | 2017-03-16 | 2021-04-16 | Ф. Хоффманн-Ля Рош Аг | Гетероциклические соединения, пригодные в качестве дуальных ингибиторов atx/ca |
| EP3596060B1 (en) | 2017-03-16 | 2023-09-20 | F. Hoffmann-La Roche AG | New bicyclic compounds as atx inhibitors |
| MD3483164T2 (ro) | 2017-03-20 | 2020-07-31 | Forma Therapeutics Inc | Compoziții pirolopirolice ca activatori ai piruvat kinazei (PKR) |
-
2018
- 2018-03-14 EP EP18711890.6A patent/EP3596060B1/en active Active
- 2018-03-14 JP JP2019550608A patent/JP7090099B2/ja active Active
- 2018-03-14 CN CN201880017034.8A patent/CN110382484B/zh active Active
- 2018-03-14 WO PCT/EP2018/056324 patent/WO2018167113A1/en unknown
- 2018-03-15 AR ARP180100600A patent/AR111524A1/es unknown
- 2018-03-15 TW TW107108794A patent/TW201840552A/zh unknown
-
2019
- 2019-09-12 US US16/569,459 patent/US10882857B2/en active Active
-
2020
- 2020-09-28 US US17/034,240 patent/US11673888B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI842923B (zh) * | 2019-07-01 | 2024-05-21 | 比利時商優稀美生物醫藥股份有限公司 | 作為d1正向異位調節劑之經取代的四氫異喹啉衍生物 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20200002336A1 (en) | 2020-01-02 |
| WO2018167113A1 (en) | 2018-09-20 |
| CN110382484A (zh) | 2019-10-25 |
| JP7090099B2 (ja) | 2022-06-23 |
| JP2020514357A (ja) | 2020-05-21 |
| US10882857B2 (en) | 2021-01-05 |
| US11673888B2 (en) | 2023-06-13 |
| EP3596060A1 (en) | 2020-01-22 |
| AR111524A1 (es) | 2019-07-24 |
| EP3596060B1 (en) | 2023-09-20 |
| EP3596060C0 (en) | 2023-09-20 |
| CN110382484B (zh) | 2022-12-06 |
| US20210009589A1 (en) | 2021-01-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TW201840552A (zh) | 作為atx抑制劑之新穎雙環化合物 | |
| TWI633087B (zh) | 新穎二氮雜螺環烷及氮雜螺環烷 | |
| AU2019257457B2 (en) | Bicyclic compounds as autotaxin (ATX) and lysophosphatidic acid (LPA) production inhibitors | |
| US10800786B2 (en) | Bicyclic compounds as ATX inhibitors | |
| EP3353180B1 (en) | Bicyclic compounds as atx inhibitors | |
| EP2970256B1 (en) | New octahydro-pyrrolo[3,4-c]-pyrrole derivatives and analogs thereof as autotaxin inhibitors | |
| NZ722157B2 (en) | Bicyclic compounds as autotaxin (atx) and lysophosphatidic acid (lpa) production inhibitors |