RU2504362C2 - Системы доставки лекарственных веществ, включающие в себя слабоосновные лекарственные вещества и органические кислоты - Google Patents
Системы доставки лекарственных веществ, включающие в себя слабоосновные лекарственные вещества и органические кислоты Download PDFInfo
- Publication number
- RU2504362C2 RU2504362C2 RU2010141726/15A RU2010141726A RU2504362C2 RU 2504362 C2 RU2504362 C2 RU 2504362C2 RU 2010141726/15 A RU2010141726/15 A RU 2010141726/15A RU 2010141726 A RU2010141726 A RU 2010141726A RU 2504362 C2 RU2504362 C2 RU 2504362C2
- Authority
- RU
- Russia
- Prior art keywords
- pharmaceutical composition
- release
- layer
- granules
- pharmaceutically acceptable
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4178—1,3-Diazoles not condensed 1,3-diazoles and containing further heterocyclic rings, e.g. pilocarpine, nitrofurantoin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1617—Organic compounds, e.g. phospholipids, fats
- A61K9/1623—Sugars or sugar alcohols, e.g. lactose; Derivatives thereof; Homeopathic globules
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1635—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/167—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction with an outer layer or coating comprising drug; with chemically bound drugs or non-active substances on their surface
- A61K9/1676—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction with an outer layer or coating comprising drug; with chemically bound drugs or non-active substances on their surface having a drug-free core with discrete complete coating layer containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
- A61K9/2081—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets with microcapsules or coated microparticles according to A61K9/50
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
- A61K9/5042—Cellulose; Cellulose derivatives, e.g. phthalate or acetate succinate esters of hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5073—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings
- A61K9/5078—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals having two or more different coatings optionally including drug-containing subcoatings with drug-free core
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5084—Mixtures of one or more drugs in different galenical forms, at least one of which being granules, microcapsules or (coated) microparticles according to A61K9/16 or A61K9/50, e.g. for obtaining a specific release pattern or for combining different drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Hospice & Palliative Care (AREA)
- Otolaryngology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Настоящее изобретение направлено на фармацевтические композиции и способы изготовления таких композиций, где композиции включают в себя совокупность частиц с синхронизированным импульсным высвобождением (СИВ-частиц) и частиц с быстрым высвобождением (БВ-частиц). Каждая СИВ-частица включает в себя сердцевину, покрытую СИВ-слоем; сердцевина включает в себя слабоосновное плохорастворимое лекарственное вещество и фармацевтически приемлемую органическую кислоту, которые отделены друг от друга слоем с замедленным высвобождением. Каждая БВ-частица включает в себя гранулу, содержащую слабоосновное плохорастворимое лекарственное вещество, фармацевтически приемлемое полимерное связывающее вещество, по меньшей мере, одно вспомогательное вещество и, по меньшей мере, один разрыхлитель. В качестве органической кислоты предпочтительно используется фумаровая кислота. БВ-гранулы объединены с СИВ-гранулами в единую фармацевтическую форму, например в капсулу. Лекарственная форма по изобретению имеет улучшенный профиль высвобождения слабоосновных плохорастворимых лекарственных веществ и пригодна для орального введения один раз в день. 5 н. и 27 з.п. ф-лы, 11 ил., 2 табл., 8 пр.
Description
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет предварительной заявки на патент США №61/035840, поданной 12 марта 2008 г., и заявки на патент США №12/209285, поданной 12 сентября 2008 г., которые посредством ссылки в полной мере включены в настоящее описание.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Для произведения желаемого фармакологического эффекта необходимо сделать лекарственное вещество доступным в соответствующих концентрациях в месте приложения действия в организме. На данную доступность оказывает влияние множество факторов, включающее количество вводимого лекарственного вещества, скорость абсорбции лекарственного вещества, распределение (связывание или локализация) в тканях, метаболизм лекарственного вещества и удаление из организма.
Для лекарственных форм лекарственного вещества, вводимых перорально, абсорбция лекарственного вещества происходит в желудочно-кишечном тракте. При прохождении через желудочно-кишечный тракт лекарственное вещество должно высвобождаться из лекарственной формы и становиться доступным в растворе в желаемом месте абсорбции или рядом с ним. Скорость, с которой лекарственное вещество высвобождается из лекарственной формы и переходит в раствор, важна для кинетики абсорбции лекарственного вещества. Лекарственная форма и, следовательно, лекарственное вещество в ходе прохождения подвергаются воздействию изменяющихся значений pH, изменяющегося, например, от pH 1,2 (натощак, однако pH желудка после потребления пищи увеличивается до 4,0) до около 7,4 в других частях пищеварительного тракта (pH желчи: 7,0-7,4, а pH кишечника: 5-7). Кроме того, время прохождения лекарственной формы в различных частях пищеварительного тракта может значительно изменяться в зависимости от размера лекарственной формы и превалирующих локальных условий. Другие факторы, оказывающие влияние на абсорбцию лекарственных веществ, включают собственные физико-химические свойства субстанции лекарственного вещества, такие как ее рКд, растворимость, энергия кристаллической решетки и удельная поверхность, а также собственные характеристики желудочно-кишечного тракта, такие как свойства содержимого полостей (pH, поверхностное натяжение, объем, возбудимость и буферность) и изменения, которые происходят после приема пищи. Поэтому часто трудно добиться высвобождения лекарственных веществ с постоянной скоростью.
Традиционные пероральные лекарственные формы часто составляются как лекарственные формы «с мгновенным высвобождением», в которых в основном вся доза лекарственного вещества высвобождается из лекарственной формы в течение чрезвычайно короткого промежутка времени, например, в течение нескольких минут, после введения. Следовательно, концентрация лекарственного вещества в плазме, как правило, быстро возрастает до пиковой концентрации, а затем снижается по мере того, как лекарственное вещество абсорбируется в тканях, превращается в процессе обмена веществ и/или выводится из организма. Концентрация в плазме является общей характеристикой конкретного лекарственного вещества, обусловленной конкретными физическими и метаболическими свойствами лекарственного вещества. Как правило, лекарственное вещество оказывает терапевтическое действие в течение некоторой части периода времени, когда концентрация лекарственного вещества в плазме увеличивается, достигает пикового значения и снижается, т.е. тогда когда концентрация лекарственного вещества в плазме достигает или превышает концентрацию, необходимую для клинической эффективности. Если концентрация в плазме слишком высока, могут возникать нежелательные побочные эффекты, а когда концентрация лекарственного вещества в плазме падает ниже клинически эффективного уровня, терапевтические эффекты исчезают.
Таким образом, для обеспечения клинической эффективности и одновременно минимизации побочных эффектов может оказаться необходимым введение нескольких доз лекарственной формы с мгновенным высвобождением с целью поддержания клинически эффективных уровней в плазме в течение требуемого периода времени и одновременно минимизации побочных эффектов, обусловленных избыточными уровнями в плазме.
С целью минимизации количества доз, вводимых для лечения конкретного заболевания, разработаны лекарственные формы с замедленным, или продленным, высвобождением. Лекарственные формы с замедленным высвобождением, как правило, высвобождают лекарственное вещество в течение длительного периода времени по сравнению с лекарственными формами с мгновенным высвобождением. Разработано множество различных типов пероральных лекарственных форм, включающих диффузионные системы, такие как емкостные устройства и матричные устройства, системы растворения, такие как инкапсулированные растворяющиеся системы (включая, например, "таблетки очень маленького времени действия") и матричные растворяющиеся системы, комбинации диффузионных и растворяющихся систем, осмотические системы и системы на основе ионообменных смол, которые описаны в «Remington's Pharmaceutical Sciences», издание 1990 г., стр.1682-1685.
Основные и кислотные лекарственные вещества характеризуются зависимыми от pH профилями растворимости, варьирующими более чем на 2 порядка в интервале физиологических значений pH. Например, слабоосновный ондансетрона гидрохлорид, антагонист 5-НТ3-рецепгоров серотонина, легкорастворим в желудочных соках с низкими значениями pH, однако практически нерастворим при pH>6. Поэтому принимаемые один раз в день традиционные системы доставки лекарственных веществ, такие как матричные таблегированные составы, содержащие один или несколько регулирующих скорость растворения полимеров или гидрофобных восков, покрытых мембранами монолитных лекарственных форм или многочастичных лекарственных форм, не высвобождают ондансетрон в среде кишечного тракта с относительно высокими значениями pH и поэтому непригодны для одноразовой дневной дозировки.
Органические кислоты используются для улучшения биологической доступности, для уменьшения меж- и внутрисубъектной вариабельности, а также для минимизации влияния пищи на слабоосновные лекарственные вещества. В литературе также описаны лекарственные формы, содержащие множество частиц и включающие в себя слабоосновные лекарственные вещества, которые обеспечивают профили с продленным высвобождением. Данные лекарственные формы, как правило, получаются путем гранулирования или нанесения на лекарственное вещество слоя одной или нескольких органических кислот и последующего нанесения на полученные частицы покрытия для продленного высвобождения. Однако подобные лекарственные формы непригодны для одноразовой дневной дозировки, так как они не способны поддерживать достаточно высокую концентрацию лекарственного вещества в плазме, по меньшей мере, частично, поскольку высвобождение органической кислоты недостаточно пролонгировано для обеспечения улучшенного растворения слабоосновного лекарственного вещества. Кроме того, в данных композициях слабоосновные лекарственные вещества могут в ходе обработки и хранения образовывать различные уровни солей с органическими кислотами, что может оказывать влияние на свойства высвобождения лекарственного вещества.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Фармацевтические композиции согласно настоящему изобретению обеспечивают улучшенные профили высвобождения лекарственных веществ для слабоосновных плохорастворимых лекарственных веществ, пригодных для одноразовой дневной дозировки. Фармацевтические композиции согласно настоящему изобретению предусматривают совокупность частиц с быстрым высвобождением (БВ), которые быстро высвобождают лекарственное вещество в желудочно-кишечном тракте, в сочетании с совокупностью частиц с синхронизированным импульсным высвобождением (СИВ)у что обеспечивает клинически эффективные уровни лекарственного вещества в плазме в течение продолжительного периода времени, пригодных для одноразовой дневной дозировки.
В одном из вариантов осуществления изобретения фармацевтические композиции согласно настоящему изобретению включают в себя множество БВ- и СИВ-частиц, где каждая СИВ-частица включает в себя сердцевину, покрытую СИВ-слоем; сердцевина включает в себя слабоосновное плохорастворимое лекарственное вещество и фармацевтически приемлемую органическую кислоту, которые отделены друг от друга слоем замедленного высвобождения (ЗВ); каждая БВ-частица включает в себя слабоосновное плохорастворимое лекарственное вещество и высвобождает, по меньшей мере, около 80% вес. слабоосновного плохорастворимого лекарственного вещества примерно за 5 минут при тестировании растворения с использованием метода растворения согласно Фармакопее США (USP) (Прибор 2: лопасти при 50 об./мин.) и двухстадийная среда растворения при 37°С (первые 2 часа в 0,1 н HCl с последующим испытанием в буфере при pH 6,8).
В других вариантах СИВ-частицы включают в себя инертную сердцевину (например, гранулу сахара) с последовательно нанесенными на нее слоем фармацевтически приемлемой органической кислоты и фармацевтически приемлемого связывающего вещества, слоем замедленного высвобождения (ЗВ) (например, включающим в себя фармацевтически приемлемый нерастворимый в воде полимер, который, необязательно, пластифицирован фармацевтически приемлемым пластификатором)у слоем лекарственного вещества, включающим в себя слабоосновное нерастворимое лекарственное вещество и фармацевтически приемлемое связывающее вещество; необязательно, изолирующим слоем (например, включающим в себя водорастворимый полимер), необязательно, вторым ЗВ-слоем и СИВ-слоем (например, включающим в себя нерастворимый в воде полимер, кишечнорастворимый полимер и, необязательно, фармацевтически приемлемый пластификатор).
Еще в одном из вариантов осуществления изобретения БВ-частицы включают в себя инертную сердцевину (например, гранулу сахара, необязательно, имеющую меньший средний диаметр и инертную сердцевину СИВ-частиц), покрытую слоем слабоосновного плохорастворимого лекарственного вещества и фармацевтически приемлемого связывающего вещества.
Еще в одном из вариантов осуществления изобретения БВ-частицы включают в себя слабоосновное плохорастворимое лекарственное вещество, гранулированное в присутствии фармацевтически приемлемого полимерного связывающего вещества, фармацевтически приемлемую органическую кислоту и, по меньшей мере, одно вспомогательное вещество.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1.А - иллюстрирует поперечное сечение одного из вариантов осуществления покрытой ЗВ-слоем частицы, содержащей органическую кислоту.
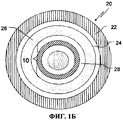
Фиг.1.Б - иллюстрирует поперечное сечение одного из вариантов осуществления СИВ-частицы, включающей в себя покрытую ЗВ-слоем сердцевину, содержащую органическую кислоту.
Фиг.2 - изображает профили высвобождения фумаровой кислоты и ондансетрона гидрохлорида из ЗВ-частиц (партия №1084-060-MB гранулы лекарственного вещества, нанесенного на сердцевины, содержащие фумаровую кислоту, и покрытые 60/40 ЕС-10/ПЭГ 400, 10% вес., Пример 1), и из СИВ-частиц (партия №1292-034: лекарственное вещество с МВ-гранулами, нанесенное на сердцевину, содержащую фумаровую кислоту, и покрытое слоями 75/25 ЕС-10/ПЭГ 400, 5% вес.), покрытое слоями ЕС-10/НР-55/ТЕС в соотношении 63/22/15, 15% вес.. Пример 6).
Фиг.3 - иллюстрирует профили высвобождения ондансетрона гидрохлорида из СИВ-частиц из Примера 2.
Фиг.4 иллюстрирует профили высвобождения из МдВ-капсул, включающих в себя МВ- и СИВ-гранулы в весовом соотношении 35/65 из Примера 3.
Фиг.5 - сопоставление смоделированных профилей МдВ-капсул ондансетрона в плазме из Примера 3 с фактическими профилями в плазме, наблюдаемыми в поисковом исследовании ФК в Примере 4.
Фиг.6 - сопоставление фактических профилей в плазме, наблюдаемых в поисковом исследовании ФК в Примере 4.
Фиг.7 - иллюстрирует профили ондансетрона в плазме, соответствующие МВ-частям МдВ-капсул, в сравнении с первой дозой препарата Zofran®, наблюдаемой в поисковом исследовании ФК в Примере 4.
Фиг.8 - иллюстрирует профили высвобождения МВ-частей МдВ-капсул (PF EA0001) in vitro из Примера 4 в сравнении с препаратом Zofran® при тестировании растворения в 0,1н. HCl при различных температурах.
Фиг.9 - иллюстрирует профили высвобождения препарата Zofran® in vitro в сравнении с МВ-гранулами (РЕ364ЕА0004) из Примера 3, БВ-частиц (частиц с быстрым высвобождением) лекарственного вещества (гранулы, покрытые слоем лекарственного вещества, партия №1117-126 из Примера 5.Б) или гранул (партия №1117-185 из примера 5.В) при тестировании растворения при pH 6,8.
Фиг.10 - иллюстрирует профили высвобождения лекарственного вещества из составов МдВ-капсул из Примера 3 (PF380EA0001, PF381EA0001 и PF382EA0001) в сравнении с составами МдВ-капсул из Примера 6. (PF391EA0001, PF392EA0001 и PF379EA0001).
Фиг.11 - иллюстрирует временные зависимости концентрации ондансетрона в плазме для составов МдВ-капсул (PF391EA0001, PF392EA0001 и PF379EA0001), включающих в себя БВ-гранулы (гранулы с быстрым высвобождением) и СИВ-гранулы из Примера 7.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предварительная заявка на патент США №60/762750, поданная 27 января 2006 г., предварительная заявка на патент США №60/762766, поданная 27 января 2006 г., заявка на патент США №11/768167, поданная 29 января 2007 г., и заявка на патент США №11/668408, поданная 29 января 2007 г., посредством ссылки в полной мере включены в настоящее описание.
Вышеприведенные заявки, а также все остальные документы, на которые ссылаются здесь, посредством ссылки в полной мере включены в настоящее описание. Цитирование любого документа не следует истолковывать как его признание уровнем техники по отношению к данному изобретению.
Термин «слабоосновное плохорастворимое лекарственное вещество» относится к основному лекарственному веществу, его фармацевтически приемлемым солям, полиморфам, сольватам, сложным эфирам, стереоизомерам и их смесям. Термин «слабоосновный» относится к лекарственным веществам, которые легкорастворимы или имеют растворимость, вплоть до средней, при кислотных значениях pH, однако плохорастворимы или практически нерастворимы при нейтральных или щелочных значениях pH, а также имеют значения pKa в интервале от 5 до 14. Например, ондансетрона гидрохлорид содержит α-гидроксилированный вторичный амин с рКа 7,4. Данные о зависимости растворимости от pH для типичных слабоосновных лекарственных веществ представлены ниже в Таблице 1. Например, ондансетрона гидрохлорид легкорастворим при pH менее 2, однако имеет растворимость менее 50 мкмоль/мл при pH 6,8 и выше. Илоперидон имеет растворимость в 0,1н HCl (соляной кислоте) около 3 мг/мл, однако при pH 6,8 его растворимость составляет лишь около 30 мкг/мл. Клоназепам практически нерастворим при физиологических значениях pH.
В Таблице 1 приведен перечень улучшения растворимости слабоосновных лекарственных веществ в органических кислых буферах. Можно идентифицировать три четко выраженные группы. Лекарственные вещества Группы А, представленной ондансетрона гидрохлоридом, проявляют резкое увеличение растворимости слабоосновного лекарственного вещества в буфере, содержащем следовые количества фумаровой кислоты. Например, растворимость ондансетрона в буфере, содержащем лишь 0,05 мг/мл фумаровой кислоты, составляет 26 мг/мл и остается неизменной вплоть до увеличения концентрации фумаровой кислоты в буфере до 5 мг/мл. Для лекарственных веществ Группы Б, представленной илоперидоном, карведилолом и ламотригином, растворимость слабоосновного лекарственного вещества возрастает при увеличении концентрации органической кислоты. Кроме того, широко варьируется растворяющая способность органических кислот. Для лекарственных веществ Группы В, представленной клоназепамом, добавление органической кислоты оказывает чрезвычайно ограниченное воздействие, т.е. растворимость улучшается, как правило, менее чем трехкратно. Например, растворимость клоназепама составляет около 11,6 мкг/мл и 6,9 мкг/мл в буферах с pH 2,3 и pH 6,8, содержащих, соответственно, более высокую и более низкую концентрации фумаровой кислоты.
| Таблица 1 | |||||
| Зависимости растворимости слабоосновных лекарственных веществ | |||||
| Растворимость ондансетрона · HCl в водном буфере | Растворимость илоперидона в водном буфере | Растворимость клоназепама в водном буфере | |||
| pH | мг/мл | pH | мг/мл | pH | мг/мл |
| 1,0 | > | 1,2 | 3,90 | 2,2 | 0,0114 |
| 2,20 | 23,3 | 3,01 | 1,437 | 2,8 | 0,0102 |
| 3,20 | 25,7 | 3,06 | 0,917 | 3,2 | 0,0096 |
| 4,20 | 10,9 | 4,08 | 0,681 | 3,8 | 0,0092 |
| 5,00 | 3,6 | 4,46 | 0,586 | 4,2 | 0,0091 |
| 5,60 | 1,7 | 5,09 | 0,341 | 4,8 | 0,0086 |
| 6,20 | 0,4 | 6,11 | 0,117 | 5,4 | 0,0084 |
| 6,80 | 0,036 | 7,02 | 0,011 | 6,2 | 0,008 |
| 7,00 | 0,025 | ||||
| Концентрация фумаровой кислоты | Растворимость ондансетрона · HCl в фумаровой кислоте | Растворимость клоназепама в фумаровой кислоте | |||||||
| мг/мл | pH | Мг/мл | pH | мг/мл | |||||
| 5,0 | 2,01 | 26,9 | 2,3 | 0,0116 | |||||
| 2,5 | 2,14 | 27,0 | 2,8 | 0,0103 | |||||
| 1,0 | 2,40 | 26,1 | 3,2 | 0,0096 | |||||
| 0,25 | 2,75 | 26,2 | 3,7 | 0,0098 | |||||
| 0,05 | 3,49 | 26,0 | 5,50 | 0,29 | |||||
| 0,01 | 4,05 | 26,1 | |||||||
| 0,0025 | 4,33 | ||||||||
| Фумаровая кислота | Аспарагиновая кислота | Глутаминовая кислота | |||||||
| pH | мг/мл | pH | мг/мл | pH | мг/мл | ||||
| 2,4 | 1,15 | 2,85 | 9,30 | 3,07 | 5,95 | ||||
| 2,8 | 0,72 | 3,40 | 5,52 | 3,41 | 5,16 | ||||
| 3,2 | 0,46 | 3,89 | 3,79 | 3,80 | 3,26 | ||||
| 4,0 | 0,19 | 4,52 | 1,37 | 4,40 | 1,70 | ||||
| 5,0 | 0,19 | 5,57 | 0,15 | 5,50 | 0,29 | ||||
| 6,1 | 0,03 | ||||||||
В одном из вариантов осуществления изобретения термин «слабоосновное плохорастворимое лекарственное вещество» относится к азот-(N)-содержащему селективному 5-НТ3-антагонисту серотонина, имеющему рКа в интервале от около 5 до 14, растворимость - не более 200 мкг/мл при pH 6,8 и отношение оптимальной максимальной дозы к растворимости при pH 6,8 не менее чем около 100. В других вариантах осуществления изобретения селективный 5-НТ3-антагонист серотонина выбирается из группы, включающей ондансетрон, трописетрон, гранисетрон, доласетрон и палоносетрон, и содержит фармацевтически приемлемые соли, сольваты, сложные эфиры, стереоизомеры и их смеси.
Ондансетрон предписывается для предотвращения тошноты и рвоты, связанных с радиотерапией и/или химиотерапией, а также для предотвращения послеоперационной тошноты и/или рвоты. В продаже имеется препарат Zofran® в таблетках (ондансетрона HCl дигидрат, 4, 8 и 24 мг эквивалента основания). Ондансетрон применяется по 8 мг два раза в день при химиотерапии и по 8 мг три раза в день при радиотерапии. Одноразовая дневная дозировка ондансетрона гидрохлорида является коммерчески целесообразной и способна упростить режим введения и улучшить соблюдение больными режима и схемы лечения. Ондансетрон существует в виде рацемата и содержит α-гидроксилированный вторичный амин с рКа 7,4. Ондансетрон · HCl характеризуется зависящим от pH профилем растворимости (снижение растворимости на 2-3 порядка при увеличении pH). Ондансетрон хорошо абсорбируется из желудочно-кишечного тракта и подвергается некоторому пресистемному метаболизму. Период полувыведения составляет в среднем 3,8±1 ч. Поскольку растворение лекарственного вещества потенциально является ограничивающим скорость фактором для абсорбции в дистальной части ЖК тракта по причине уменьшения растворимости, одноразовая дневная лекарственная форма в соответствии с одним из вариантов осуществления изобретения должна включать в себя, по меньшей мере, две совокупности гранул: одну совокупность МВ- или БВ-частиц и вторую совокупность - СИВ-частиц.
Термин «СИВ-частица» или «СИВ-гранула» относится к частице, содержащей лекарственное вещество, например, к грануле, покрытой лекарственным веществом, грануле, содержащей лекарственное вещество, или частице лекарственного вещества, которая покрыта слоем СИВ-покрытия (покрытия с синхронизированным импульсным высвобождением). СИВ-покрытие обеспечивает импульс мгновенного высвобождения лекарственного вещества или профиль замедленного высвобождения лекарственного вещества после заранее определенного времени запаздывания. Термин «время запаздывания» относится к периоду времени непосредственно после введения частицы, содержащей лекарственное вещество, когда из частицы высвобождается менее чем около 10% и, в частности, практически нулевое количество лекарственного вещества. В некоторых вариантах осуществления изобретения время запаздывания, составляющее, по меньшей мере, около 2-10 ч., достигается путем покрытия частиц слоем, например, комбинации, по меньшей мере, одного нерастворимого в воде полимера и, по меньшей мере, одного кишечнорастворимого полимера (например, комбинации этилцеллюлозы и фталата гипромеллозы). СИВ-слой может, необязательно, содержать пластификатор.
Термин «ЗВ-слой» относится к слою, обеспечивающему свойства замедленного высвобождения, например, к слою, который замедляет высвобождение лекарственного вещества из частицы, содержащей лекарственное вещество, однако не обеспечивает заметного «времени запаздывания». ЗВ-слой, или покрытие включает в себя нерастворимый в воде полимер, такой как этилцеллюлоза.
Используемый здесь термин «мгновенное высвобождение», или MB, относится к высвобождению количества активного вещества, большего или равного около 50% (особенно в случае маскировки вкуса для включения в лекарственную форму таблеток, растворяющихся во рту), в некоторых вариантах осуществления изобретения - более чем около 75%, в других вариантах осуществления изобретения - более чем около 90%, или, в соответствии с некоторыми вариантами осуществления изобретения, - более чем 95%, в течение около 2 ч.у например, в течение около одного часа после введения лекарственной формы. Термин также может относиться к высвобождению активного вещества из лекарственной формы с синхронизированным импульсным высвобождением, отличающейся тем, что импульс мгновенного высвобождения происходит после истечения некоторого времени запаздывания. Используемый здесь, а также в конкретных примерах термин «частицы лекарственного вещества с быстрым высвобождением (БВ)» включает покрытые лекарственным веществом гранулы сахара размером 45-60 меш, в других вариантах осуществления изобретения - 60-80 меш, а также водорастворимые микрогранулы, содержащие лактозу и фумаровую кислоту, которые включают в себя указанное лекарственное вещество и разработаны таким образом, чтобы обеспечивать профили растворения, сходные с профилями растворения эталонной готовой лекарственной формы (например, в случае ондансетрона · HCl, БВ-частицы лекарственного вещества и препарат Zofran® имеют сходные профили растворения).
Клинические термины - «концентрация в плазме», «временная зависимость», «Cmax», «AUC», «Tmax», «период полувыведения» имеют свои общепринятые значения и поэтому не переопределяются. Если не указано другое, все процентные и другие отношения вычисляются по весу в расчете на общий вес композиции.
Тестирование растворения МВ-гранул, как с маскировкой вкуса, так и без нее, проводились согласно Фармакопее США на Приборе 1 (корзинки при 100 об./мин.) или Приборе 2 (лопасти при 50 об./мин.) в 900 мл 0,1 н. HCl при 37°С, тогда как тестирование растворения ЗВ- и СИВ-гранул проводились в приборе согласно Фармакопее США с использованием двухстадийной растворяющей среды (первые 2 ч. - в 700 мл 0,1 н HCl при 37°С, затем - путем тестирования растворения при pH 6,8, полученном путем добавления 200 мл модификатора pH). Высвобождение лекарственного вещества/кислоты с течением времени определялось при помощи ВЭЖХ на образцах, отобранных через выбранные промежутки времени.
В некоторых случаях начало высвобождения лекарственного вещества должно происходить через несколько часов после перорального введения для обеспечения соответствующей концентрации в плазме, пригодной для одноразового дневного режима введения, зависящего от периода полувыведения активного вещества. В соответствии с отдельными особенностями изобретения высвобождение лекарственного вещества может быть отложено на время до около 8-10 ч. после перорального введения.
Конкретные варианты осуществления изобретения будут описаны более подробно со ссылкой на сопроводительные фигуры (фиг.1.А и 1.Б). На фиг.1.А сердцевина 10, покрытая ЗВ-слоем, включает в себя ЗВ-слой 12 нанесенный на частицу, содержащую органическую кислоту, включающую слой фармацевтически приемлемой органической кислоты в связывающем веществе 14, нанесенном на инертную сердцевину 16 частицы. Инертная сердцевина 16 частицы, слой покрытия органической кислоты 14 и регулирующий скорость растворения ЗВ-слой 12 формируют покрытую ЗВ-слоем содержащую органическую кислоту частицу 10. На фиг.1.Б показан образец СИВ-частицы. СИВ-гранула 20 включает в себя покрытие 22, обеспечивающее время запаздывания, нанесенное на первичный 3 В-слой 24, защитный изолирующий слой 26 и слой слабоосновного лекарственного вещества 28, нанесенный на покрытую ЗВ-слоем содержащую кислоту частицу 10. В некоторых вариантах осуществления данного изобретения промежуточный барьерный ЗВ-слой не наносится, т.е. СИВ-слой наносится непосредственно на МВ-частицу, покрытую слоем изолирующего покрытия.
Слабоосновное лекарственное вещество, как правило, наносится из раствора полимерного связывающего вещества. ЗВ-покрытие задерживает высвобождение лекарственного вещества, в то время как покрытие, обеспечивающее время запаздывания, обеспечивает время запаздывания (период времени, в течение которого проявляется менее 10%, в частности, нулевое количество, высвобождаемой дозы). Таким образом, покрытие 22, обеспечивающее время запаздывания, наружное ЗВ-покрытие (если присутствует) на МВ-гранулах 24 и внутреннее ЗВ-покрытие 12 на содержащей кислоту сердцевине совместно регулируют свойства высвобождения как лекарственного вещества, так и кислоты из СИВ-гранул.
Слабоосновное плохорастворимое лекарственное вещество может находиться в форме кристаллов лекарственного вещества, аморфных частиц лекарственного вещества, гранул (например, лекарственного вещества, гранулированного с одним или несколькими вспомогательными веществами) или их комбинации. Альтернативно, слой лекарственного вещества может наноситься на инертную сердцевину или на инертную сердцевину, покрытую слоем других компонентов композиции, например, слоем фармацевтически приемлемой кислоты и/или слоем изолирующего материала или ЗВ-слоем в соответствии с данными здесь определениями. В одном из вариантов осуществления изобретения слой лекарственного вещества наносится на инертную сердцевину (например, как описано здесь), которая вначале была покрыта слоем фармацевтически приемлемой органической кислоты, а затем покрыта ЗВ-слоем (например, как описано здесь). В других вариантах осуществления изобретения первым на инертную сердцевину наносится лекарственное вещество, а затем последовательно наносятся ЗВ-слой и слой фармацевтически приемлемой органической кислоты. В других вариантах осуществления изобретения частицы самого лекарственного вещества (например, кристаллического или аморфного) последовательно покрываются ЗВ-слоем и слоем фармацевтически приемлемой органической кислоты.
В одном из вариантов осуществления изобретения инертной сердцевиной может быть сферическая частица сахара, целлюлозы, диоксида кремния, маннит-микрокристаллической целлюлозы и т.п., имеющая подходящее распределение размеров частицы (например, для БВ-частиц - сферические частицы сахара размером 20-25 меш или 60-80 меш, или сферические частицы целлюлозы размером 100-200 мкм).
Для нанесения слоя лекарственного вещества на инертную сердцевину или покрытую инертную сердцевину, лекарственное вещество может растворяться в подходящем растворителе, а покрытие может наноситься с использованием различных способов, например, процессов нанесения покрытия в псевдоожиженном слое. Альтернативно, лекарственное вещество может быть объединено с фармацевтически приемлемым связывающим веществом и нанесено на сердцевину. Для изготовления частиц сердцевины на основе покрытых инертных частиц может использоваться водная среда или среда фармацевтически приемлемого растворителя. Тип инертного связывающего вещества, которое используется для связывания водорастворимой органической кислоты или слабоосновного лекарственного вещества с инертной частицей или покрытой ЗВ-слоем содержащей кислоту сердцевиной, не является определяющим, однако обычно включает в себя водорастворимые или растворимые в спирте связывающие вещества, такие как поливинилпирролидон (ПВП или повидон), сополимеры поливинилпирролидона и винилового спирта, сополимеры поливинилпирролидона и винилацетата, сополимеры поливинилпирролидона и винилхлорида, сополимеры поливинилпирролидона и винилбутирата, сополимеры поливинилпирролидона и виниллаурата, сополимеры поливинилпирролидона и винилстеарата, гидроксипропилцеллюлозу, или гипромеллозу (НРМС), гидроксипропилметилцеллюлозу (НРМС), гидроксипропилцеллюлозу, карбоксиалкилцеллюлозы, полиэтиленоксид, полисахариды, такие как декстран, крахмалы, такие как кукурузный крахмал, гуммиарабик, карбоксиметилцеллюлозу, желатин и т.д., которые растворяются или диспергируются в воде, спирте, ацетоне или их смесях. Связывающее вещество может использоваться в.любой концентрации, обеспечивающей его способность наноситься на инертную частицу. Как правило, связывающее вещество используется в концентрации от около 0,5 до 10% вес. Органическая кислота или слабоосновное лекарственное вещество предпочтительно могут присутствовать в составе данного покрытия в форме раствора. Концентрация лекарственного вещества может варьироваться в зависимости от нанесения, однако, как правило, используются концентрации от 5 до 30% вес. в зависимости от вязкости состава покрытия.
В других вариантах осуществления изобретения частица может включать в себя кристалл органической кислоты (например, фумаровой кислоты) с требуемым средним размером частиц, покрытый слоем нерастворимого в воде полимера (или комбинации-нерастворимого в воде полимера и водорастворимого, или кишечнорастворимого, полимера), затем покрытый слоем лекарственного вещества так, чтобы высвобождение кислоты происходило медленнее, чем растворение/высвобождение лекарственного вещества из частицы или синхронно с ним, что гарантирует незавершенность высвобождения кислоты до исчерпания лекарственного вещества.
В соответствии с другими вариантами осуществления изобретения сердцевины, содержащие лекарственное вещество, могут изготавливаться путем роторного гранулирования или гранулирования с последующей экструзией-сферониэацией, или таблетирования в микротаблетки. Органическая кислота, связывающее вещество и, необязательно, другие фармацевтически приемлемые вспомогательные вещества (например, разбавители/заполнители) могут смешиваться в грануляторе с большим усилием сдвига или в грануляторе с псевдоожиженным слоему таком как гранулятор Glatt GPCG, и гранулироваться с образованием агломератов. Для изготовления сферических частиц (пеллетов) влажная масса может подвергаться экструзии и сферонизации. Для изготовления пеллетов, содержащих органическую кислоту, смесь, включающая в себя частицы кислоты, связывающего вещества и, необязательно, заполнителя/разбавителя, или гранулы, содержащие лекарственное вещество, также могут прессоваться в микротаблетки (диаметром около 1-1,5 мм). В данных вариантах содержание кислоты может составлять до 95% вес. в расчете на общий вес гранулированной, экструдированной или прессованной сердцевины. Данные содержащие кислоту сердцевины покрываются 3 В-мембраной перед нанесением слоя лекарственного вещества и последующим покрытием функциональными полимерами.
СИВ-частицы согласно настоящему изобретению включают слой, который включает в себя фармацевтически приемлемую кислоту, отделенную от слоя, содержащего лекарственное вещество, ЗВ-слоем. ЗВ-слой включает в себя нерастворимый в воде полимер.
Образцы фармацевтически приемлемых органических кислот, которые улучшают растворимость лекарственного вещества, включают лимонную кислоту, фумаровую кислоту, яблочную кислоту, винную кислоту, янтарную кислоту, щавелевую кислоту, аспарагиновую кислоту, глутаминовую кислоту и т.п. Отношение органической кислоты к лекарственному веществу варьируется от около 5:1 до 1:10 по весу, включая 5:1, 4:1, 3:1, 2:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9 и 1:10.
Используется свойство органических кислых буферов увеличивать растворимость, и, в то же время, 1 л situ образование аддуктов кислоты предотвращается за счет наличия ЗВ-слоя между внутренним слоем органической кислоты и слоем слабоосновного лекарственного вещества. ЗВ-слой точно регулирует высвобождение органической кислоты так, чтобы обеспечивать отсутствие остатка лекарственного вещества в лекарственной форме при недостатке солюбилизирующей кислоты в СИВ-частице.
Типичные примеры нерастворимых в воде полимеров, применимых в ЗВ-слое, включают этилцеллюлозу, поливининилацетат (например, Kollicoat SR#30D, BASF), ацетат целлюлозы, ацетат-бутират целлюлозы, нейтральные сополимеры на основе этилакрилата и метилметакрилата, сополимеры сложных эфиров акриловой и метакриловой кислот с четвертичными аммониевыми группами, такие как Eudragit® NE, RS и RS30D, RL или RL30D и т.п.
Нерастворимый в воде полимер ЗВ-слоя может дополнительно пластифицироваться одним или несколькими фармацевтически приемлемыми пластификаторами. Типичные примеры пластификаторов включают триацетин, трибутилцитрат, триэтилцитрат, ацетил-три-н-бутилцитрат диэтилфталат, касторовое масло, дибутилсебацинат, ацетилированные моноглицериды и т.п., а также их смеси. Пластификатор, если он используется, может составлять от 3 до 30% вес. или, более характерно, от 10 до 25% вес. в расчете на полимер. Тип пластификатора и его содержание зависят от полимера, или полимеров, и природы системы покрытия (например, основанной на воде или органическом растворителе, растворе или дисперсии, а также общем содержании твердых веществ).
Слой, содержащий фармацевтически приемлемую кислоту, затем, необязательно, может покрываться вторым ЗВ-покрытием, изолирующим покрытием (например, гипромеллозой) и/или СИВ-слоем, который включает в себя фармацевтически приемлемый нерастворимый в воде полимер (например у описанный здесь), объединенный с одним или несколькими водорастворимыми или кишечнорастворимыми полимерами.
Типичные примеры водорастворимых полимеров, применимых для данного изобретения, включают поливинилпирролидон (ПВП), гидроксипропилметилцеллюлозу (НРМС), гидроксипропилцеллюлозу (НРС), полиэтиленгликоль и т.п.
Типичные примеры кишечнорастворимых полимеров, применимых для данного изобретения, включают сложные эфиры целлюлозы и их производные (ацетат-фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-сукцинат гидроксипропилметилцеллюлозы), поливинилацетат фталат, чувствительные к рН сополимеры метакриловой кислоты и метилметакрилата, а также шеллак. Данные полимеры могут использоваться в виде сухого порошка или водной дисперсии. Некоторые имеющиеся в продаже материалы, которые можно использовать, представляют собой сополимеры метакриловой кислоты, продаваемые под торговой маркой Eudragit® (L100, S100, L30D) и производимые Rohm Pharma, Cellacefate® (ацетат-фталат целлюлозы), производимые Eastman Chemical Co., Aquateric® (водная дисперсия ацетата-фталата целлюлозы), производимые FMC Corp., a Aqoat® (водная дисперсия ацетата-сукцината гидроксипропилметилцеллюлоэы), производимые Shin Etsu K.K.
Водная среда или среда фармацевтически приемлемого растворителя может использоваться для изготовления частиц сердцевины, содержащих органическую кислоту, с целью нанесения на них слоя лекарственного вещества, т.е. содержащих кислоту гранул, изготавливаемых путем нанесения слоя кислоты на инертную сердцевину (например, сферические частицы сахара), или МВ-гранул - путем нанесения слоя лекарственного вещества на содержащие кислоту сердцевины, или непосредственно на сферические частицы сахара из раствора соответствующего полимерного связывающего вещества посредством оборудования с псевдоожиженным слоем. Кроме того, для растворения функциональных полимеров с целью покрытия содержащих кислоту гранул, МВ-гранул или ЗВ-гранул, могут использоваться водные дисперсии функциональных полимеров, которые доступны в виде дисперсий или системы растворителей.
Вообще, желательно, чтобы поверхность частиц, покрытых слоем лекарственного вещества, была подвергнута грунтовке перед нанесением мембранных барьерных покрытий, или чтобы различные мембранные слои были разделены путем нанесения тонкой пленки гидроксипропилметилцеллюлозы (НРМС) (например, Pharmacoat 603 или Opadry® Clear). Несмотря на то, что, как правило, используется НРМС, также возможно использование других грунтов, таких как гидроксипропилцеллюлоза (НРС) или этилцеллюлоза с более низкой вязкостью. Любое из описанных здесь покрытий может наноситься с использованием любой технологии покрытия из числа традиционно используемых в фармацевтической промышленности, однако особенно удобно покрытие в псевдоожиженном слое.
Отдельные покрытия на содержащих кислоту сердцевинах и МВ-гранулах варьируются в интервале от около 5 до 50% вес. в зависимости от относительной растворимости органической кислоты и лекарственного вещества, природы лекарственного вещества, состава покрытия и требуемого времени запаздывания. В одном из вариантов осуществления изобретения содержащие кислоту и лекарственное вещество СИВ-частицы могут обеспечиваться ЗВ-покрытием из пластифицированного нерастворимого в воде полимера, такого как этилцеллюлоза (ЕС-10) в количестве от около 5 до 50% вес. для задержки высвобождения кислоты на время около 5-20 ч. В некоторых вариантах осуществления изобретения частицы, содержащие кислоту и лекарственное вещество, могут оснащаться СИВ-покрытием из пластифицированной этилцеллюлозы и фталата гидроксипропилметилцеллюлозы (гипромеллозы) (HP-55) в количестве от 10 до 50% вес., в то время как МВ-гранулы с целью достижения высвобождения лекарственного вещества, синхронизированного с высвобождением кислоты, покрываются этилцеллюлозой (ЕС-10) в количестве 5-20% вес. Еще в одном из вариантов осуществления настоящего изобретения МВ-гранулы могут не оснащаться каким-либо барьерным покрытием, а наружное СИВ-покрытие из ЕС-10/НР-55/пластификатора в количествах около 45,5/40/14,5 до привеса около 30-50% вес. регулирует высвобождение лекарственного вещества после истечения времени запаздывания. Состав покрывающего слоя и вес отдельных полимеров являются важными факторами, которые следует учитывать для достижения требуемого профиля высвобождения лекарственного вещества/кислоты и времени запаздывания перед значительным высвобождением лекарственного вещества.
В одном из вариантов осуществления изобретения активная сердцевина лекарственной формы согласно настоящему изобретению может включать в себя инертную частицу, покрытую органической кислотой, ЗВ-покрытием, слоем лекарственного вещества (МВ-гранулы), дополнительным барьером или ЗВ-покрытием и/или покрытием, обеспечивающим время запаздывания. Количество органической кислоты и загрузка лекарственного вещества в сердцевину будет зависеть от лекарственного вещества, дозы, зависящей от pH растворимости, улучшения растворимости и периода полувыведения. Специалисты в данной области могут выбрать соответствующее количество лекарственного вещества/кислоты для нанесения покрытия на сердцевину и нанесения ЗВ-покрытия соответствующей толщины перед нанесением слоя лекарственного вещества и дальнейшего покрытия функциональными полимерами с целью планирования высвобождения кислоты, которое, в соответствии с некоторыми вариантами осуществления изобретения синхронизировано с высвобождением лекарственного вещества для гарантии полного высвобождения лекарственного вещества до исчерпания кислоты, поступающей из СИВ-гранул.
В некоторых особых вариантах осуществления изобретения лекарственное вещество наносится на покрытые ЗВ-покрытием гранулы, содержащие фумаровую кислоту (например, гранула сахара, покрытая слоем, содержащим фумаровую кислоту). Лекарственное вещество (т.е. ондансетрон) и раствор полимерного связывающего вещества (например, повидона) наносятся на покрытую ЗВ-покрытием гранулу, содержащую фумаровую кислоту, которая затем покрывается защитным изолирующим покрытием, включающим в себя гидрофильный полимер, такой как Pharmacoat 603 (Hypromellose 2910, 3 сП) или Opadry® Clear, для образования МВ-гранул. В одном из вариантов осуществления изобретения МВ-гранулы, содержащие лекарственное вещество, могут покрываться дважды: внутренней мембраной барьерного покрытия с нерастворимым в воде полимером (например, этилцеллюлозой) в чистом виде или в сочетании с водорастворимым полимером, покрытием, обеспечивающим время запаздывания, которое состоит из нерастворимого в воде полимера в сочетании с кишечнорастворимым полимером, - с образованием СИВ-гранул, имеющих время запаздывания (высвобождения с задержкой начала высвобождения) приблизительно 1-10 ч. с момента перорального введения. Нерастворимый в воде полимер и кишечнорастворимый полимер могут присутствовать в весовом отношении от около 9:1 до около 1:4, например, в весовом отношении от около 3:1 до 1:1. Покрытие, как правило, включает в себя от около 5% вес. до около 60% вес., например, от около 10% вес. до около 50% вес., в расчете на покрытые гранулы. В соответствии еще с одним вариантом осуществления изобретения МВ-гранулы могут просто покрываться комбинацией нерастворимого в воде полимера и кишечнорастворимого полимера в указанных выше количествах.
Если требуется быстрое высвобождение лекарственного вещества вначале, лекарственные формы согласно настоящему изобретению могут включать в себя комбинацию СИВ- и MB- и/или БВ-частиц, где MB- и/или БВ-частицы обеспечивают начальное быстрое высвобождение лекарственного вещества, а замедленное высвобождение обеспечивается СИВ-частицами. В некоторых вариантах осуществления изобретения лекарственные формы согласно настоящему изобретению включают в себя комбинацию СИВ- и МВ-частиц, а в других вариантах лекарственные формы согласно настоящему изобретению включают комбинации СИВ- и БВ-частиц или комбинации СИВ-, MB- и БВ-частиц.
Как описано здесь, МВ-частицы высвобождают более чем около 50% лекарственного вещества в течение около двух часов после дозирования. БВ-частицы представляют собой частный случай частиц с мгновенным высвобождением и обладают значительно большей скоростью высвобождения лекарственного вещества в сравнении с МВ-частицами, например, высвобождая, по меньшей мере, около 80% лекарственного вещества в течение около пятнадцати минут при тестировании растворения с использованием метода растворения согласно Фармакопее США (USP) (Прибор 2 - лопатки при 50 об./мин.) и двухстадийная растворяющая среда при 37°С (первые два часа - 0,1 н. HCl, затем - тестирование в буфере при pH 6,8). В одном из вариантов осуществления изобретения БВ-частицы включают в себя слабоосновное плохорастворимое лекарственное вещество, нанесенное на инертные сердцевины с небольшим размером частиц, такие как сферические частицы сахара размером 60-80 меш. В других вариантах осуществления изобретения БВ-частицы включают в себя лекарственное вещество, гранулированное с, по меньшей мере, одним водорастворимым вспомогательным веществом, таким как лактоза, и, по меньшей мере, одной органической кислотой, такой как фумаровая кислота. Оба типа описанных выше БВ-частиц, содержащих ондансетрон, демонстрируют быстрое растворение, близкое к таковому для эталонного лекарственного препарата Zofran® IR в таблетках по 8 мг в условиях способа селективного растворения in vitro с использованием Прибора 2 согласно Фармакопее США в 500 мл буфера при pH 6,8.
Таким образом, в одном из вариантов осуществления изобретения многочастичные фармацевтические композиции согласно настоящему изобретению включают в себя частицы лекарственного вещества с быстрым высвобождением (например, покрытые лекарственным веществом гранулы, включающие в себя сферические частицы сахара размером 60-80 меш или гранулы) и одну или несколько совокупностей СИВ-частиц. В некоторых вариантах осуществления изобретения многочастичные фармацевтические композиции согласно настоящему изобретению, содержащие совокупности БВ- и СИВ-частиц, высвобождают лекарственное вещество и кислоту с близкими скоростями. В других вариантах такие композиции высвобождают кислоту медленнее, чем лекарственное вещество во избежание возникновения остатка нерастворенного лекарственного вещества в СИВ-частицах.
В отдельных вариантах осуществления изобретения многочастичные лекарственные композиции согласно изобретению включают в себя частицы лекарственного вещества с быстрым высвобождением и одну или несколько совокупностей гранул с СИВ-покрытием, содержащих блокирующий агент серотонина 5-НТ3 где каждая СИВ-гранула включает в себя:
а) частицу сердцевины, содержащую органическую кислоту (кристаллы органической кислоты, пеллет, гранулу и т.п.);
б) барьерную мембрану или мембрану замедленного высвобождения на частице сердцевины, содержащей органическую кислоту, где мембрана включает в себя нерастворимый в воде полимер или нерастворимый в воде полимер в сочетании с водорастворимым или кишечнорастворимым полимером;
в) слабоосновное лекарственное вещество, нанесенное на покрытую барьером частицу сердцевины, содержащую органическую кислоту, и, необязательно, оснащенный защитным герметизирующим покрытием, с образованием гранулы с мгновенным высвобождением (MB);
г) в случае, если предусматриваются ЗВ-гранулы, - мембрану ЗВ-покрытия на МВ-грануле, где мембрана включает в себя нерастворимый в воде полимер или нерастворимый в воде полимер в сочетании с водорастворимым полимером, формирующую ЗВ-гранулы; и/или
д) в случае, если предусматриваются СИВ-гранулы, - мембрану покрытия, обеспечивающую время запаздывания, на грануле с 3 В-покрытием по стадии (г) или непосредственно на МВ-грануле по стадии (в), где мембрана включает в себя нерастворимый в воде полимер или нерастворимый в воде полимер в сочетании с кишечнорастворимым полимером, с образованием гранулы с синхронизированным импульсным высвобождением (СИВ).
Композиции совокупностей СИВ-гранул в соответствии с отдельными особенностями данного изобретения, как правило, демонстрируют требуемые, или целевые, профили высвобождения лекарственного вещества и кислоты вслед за истечением заранее определенного времени запаздывания, составляющего, по меньшей мере, 2 ч., при тестировании на высвобождение лекарственного вещества и/или кислоты с использованием описанного здесь двухстадийного метода растворения.
Фармацевтическая композиция селективного блокирующего агента серотонина 5-НТ3 с растворимостью не более чем около 200 мкг/мл при pH 6,8 и соотношением максимальной оптимальной дозы и растворимости при pH 6,8 не менее чем около 100, такая как ондансетрона гидрохлорида дигидрат, может быть изготовлена путем заполнения жесткой желатиновой капсулы совокупностями СИВ- и БВ-гранул или путем прессования в традиционную таблетку.
В соответствии с отдельными особенностями настоящего изобретения, фармацевтическая многочастичная лекарственная форма может включать в себя БВ-частицы лекарственного вещества, первую совокупность СИВ-гранул и совокупность ЗВ-гранул или вторую совокупность СИВ-гранул. В некоторых вариантах осуществления изобретения отношение БВ-частиц лекарственного вещества к первой совокупности СИВ-гранул, совокупности ЗВ-гранул, или второй совокупности СИВ-гранул, может варьироваться от около 10:90:0 до около 40:10:50.
Настоящее изобретение также предусматривает способ изготовления многочастичной лекарственной формы, включающей в себя частицы с быстрым высвобождением лекарственного вещества и одну или несколько совокупностей гранул с синхронизированным импульсным высвобождением, или одно или несколько слабоосновных активных веществ, включающих содержащие кислоту сердцевины с ЗВ-покрытием, т.е. серии тщательно регулируемых по времени импульсов так, что активные агенты и кислота, размещаемые в тщательно разделенных/изолированных слоях СИВ-частицы, не вступают в контакт друг с другом с образованием аддуктов кислоты до тех пор, пока лекарственная форма не вступает в контакт с растворяющей средой или биологическими жидкостями после перорального приема внутрь. Лекарственная форма, изготовленная таким способом, демонстрирует сложные профили высвобождения лекарственного вещества и кислоты, которые сопоставимы: в частности, профиль высвобождения кислоты является более медленным, чем профиль высвобождения лекарственного вещества, поэтому в лекарственной форме не остается лекарственного вещества, не растворившегося по причине недостатка солюбилизирующей органической кислоты.
В соответствии с одним из вариантов осуществления настоящего изобретения способ изготовления лекарственных форм для одноразовой дневной дозировки, содержащий СИВ-гранулы, может включать следующие стадии:
а), обеспечение содержащей кислоту частицы сердцевины (т.е. кристаллов органической кислоты с требуемым распределением размеров частиц или частицы, включающей в себя инертную частицу (например, сферическую частицу сахара, целлюлозы, маннит-мелкокристаллической целлюлозы или диоксида кремния) с нанесенным на нее слоем органической кислоты из раствора полимерного связывающего вещества);
б) покрытие содержащей кислоту частицы сердцевины мембраной ЗВ-покрытия, включающей нерастворимый в воде полимер, такой как ЕС-10 (этилцеллюлоза со средней вязкостью 10 сП), отдельно или в комбинации с водорастворимым полимером (например, повидоном или ПЭГ 400), или кишечнорастворимым полимером, таким как фталат гидроксипропилметилцеллюлозы (например, HP-55);
в) нанесение слоя слабоосновного лекарственного вещества, такого как ондансетрона гидрохлорида дигидрат, на содержащую кислоту частицу сердцевины с ЗВ-покрытием с последующим нанесением защитного изолирующего покрытия Pharmacoat 603 или Opadry® Clear с образованием МВ-гранулы;
г) необязательно, нанесение на МВ-гранулу мембраны барьерного покрытия из раствора нерастворимого в воде полимера (например, этилцеллюлоэы) отдельно или в комбинации с водорастворимым полимером (например, полиэтиленгликолем, ПЭГ 400) с образованием ЗВ-гранулы;
д) нанесение на ЗВ-гранулу по стадии (г) или непосредственно на МВ-гранулу по стадии (в) мембраны покрытия, обеспечивающего время запаздывания, из раствора нерастворимого в воде полимера в сочетании с кишечнорастворимым полимером (например, фталатом этилцеллюлозы и гипромеллозы) в соотношении около 10:1-1:4 с образованием гранулы частицы с синхронизированным импульсным высвобождением (СИВ) лекарственного вещества в совместно рассматриваемой заявке на патент США №11/120139, поданной 2 мая 2005 г., заявке на патент США №11/668167 с датой приоритета 27 января 2006 г., заявке на патент США №11/668408 с датой приоритета 27 января 2006 г., заявке на патент США №11/847219 с датой приоритета 31 августа 2006 г., патенте США №6500454, патенте США №6627223, патенте США №6663888 и патенте США №7048945, которые посредством ссылки в полной мере включены в настоящее описание;
е) заполнение БВ-частицами лекарственного вещества (описанными здесь) и одной или несколькими совокупностями СИВ-гранул твердой желатиновой капсулы или прессование в традиционные таблетки, демонстрирующие профили в плазме, пригодные для режима одноразовой дневной дозировки с пониженной частотой нежелательных явлений, включая несоблюдение режима терапии.
Настоящее изобретение также направлено на лекарственные формы для многоразовой дозировки, т.е. готовые лекарственные формы в форме многочастичных лекарственных форм (например, твердых желатиновых капсул или традиционных таблеток, изготавливаемых с использованием ротационного таблеточного пресса), включающих одну или несколько совокупностей гранул для перорального введения с целью обеспечения целевых профилей ФК в организме пациентов, нуждающихся в лечении. Традиционные таблетки при попадании в желудок быстро диспергируются. Одна или несколько совокупностей гранул с покрытием могут прессоваться в таблетки вместе с соответствующими вспомогательными веществами (например, связывающим веществом, разбавителем/заполнителем и разрыхлителем для традиционных таблеток).
В некоторых вариантах осуществления изобретения для объединения в готовые лекарственные формы, MB- и БВ-гранулы (гранулы с мгновенным и быстрым высвобождением) изготавливаются путем нанесения указанного лекарственного вещества из раствора полимерного связывающего вещества на инертные сердцевины среднего размера, используемые для изготовления ЗВ- и/или СИВ-гранул,. а также инертные сердцевины с малым размером частиц, таким как 45-60 меш или, в особенности, на инертные сердцевины размером 60-80 меш соответственно. Альтернативно, БВ-частицы со средним размером частиц не более 400 мкм могут изготавливаться путем гранулирования указанного лекарственного вещества, водорастворимого вспомогательного вещества, такого как лактоза, и органической кислоты.
Приведенные ниже неограничивающие примеры, иллюстрирующие лекарственные формы для доставки лекарственных веществ, такие как капсулы или традиционные таблетки, включают в себя быстрый импульс высвобождения, сходный с таковым для эталонного продукта. Указанные композиции поддерживают концентрацию лекарственного вещества в плазме на уровне, который обеспечивает приемлемый клинический результат, и минимизируют возникновение побочных эффектов, связанных с Cmax и Cmin.
Пример 1
1.А Сердцевины, содержащие фумаровую кислоту: Гидроксипропилцеллюлозу (Klucel LF, 23,9 г) медленно добавляли к денатурированному стандартному спирту SD 3С 190 при тщательном перемешивании для растворения, затем медленно добавляли фумаровую кислоту (215,4 г) до растворения. В аппарат Glatt GPCG 5, оснащенный 9-дюймовым вкладышем Вюрстера для распыления снизу, 10-дюймовой разделительной колонкой и 16 мм трубопроводом, загружали 3750 г сферических частиц сахара размером 25-30 меш. Сферические частицы сахара покрывали слоем раствора фумаровой кислоты, поддерживая температуру продукта около 33-34°С и скорость потока воздуха на отверстии заслонки 38%. Кислотные сердцевины высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались через сита 20-30 меш.
1.Б Сердцевины фумаровой кислоты с ЗВ-покрытием: Сердцевины фумаровой кислоты (3750 г), полученные выше, покрывались раствором ЕС-10 и ПЭГ 400, растворенных в смеси 98/2 ацетон/вода (6% твердых веществ) до привеса 10% вес., в двух соотношениях: (Б.1) 60/40 и (Б.2) 75/25, - для изучения его влияния на высвобождение лекарственного вещества из ЗВ- и СИВ-гранул. Использовались следующие условия обработки: давление распыляемого воздуха: 2 бар; диаметр форсунки: 1 мм; пластина распределения воздуха снизу: «В» с ситом 15 калибра 100 меш, интервал распыления/встряхивания: 30 с/3 с; температура продукта поддерживалась 35±1°С, объем поступающего воздуха: 155-175 куб. футов в минуту (кубических метров в секунду), скорость распыления увеличивалась от 8 до 30 г/мин.;
1.В МВ-гранулы ондансетрона гидрохлорида: Повидон (ПВП К-29/32, 19,5 г) медленно добавляли к смеси 50/50 воды/денатурированного стандартного спирта 3С, 190 (3699,4 г) при перемешивании до растворения. Для растворения лекарственного вещества ондансетрона гидрохлорида дигидрат (175,2 г) медленно добавляли в раствор связывающего вещества. Кислотные сердцевины с ЗВ-покрытием (3700 г), полученные выше на стадиях Б.1 и Б.2, покрывались в аппарате Glatt GPCG 5 раствором лекарственного вещества (5% твердых веществ) при поддержании температуры продукта 36±1°С, объема поступающего воздуха - 60-65 куб. футов в минуту, и увеличении скорости распыления от около 20-25 г/мин. Гранулы, покрытые слоем лекарственного вещества, обеспечивались защитным изолирующим покрытием Pharmacoat® 603 (гипромеллоза 2910; 3 сП) (привес 2%) с образованием МВ-гранул.
1.Г ЗВ-гранулы ондансетрона гидрохлорида: описанные выше МВ-гранулы ондансетрона гидрохлорида (3700 г) покрывались защитным покрытием (ЗВ-покрытием) путем распыления раствора 5% вес. и 10% вес.(7,5% твердых веществ) 90/10 ЕС-10/ТЕС (триэтилцитрата) и высушивались в аппарате Glatt в течение 10 мин. для удаления избытка остаточного растворителя. Высушенные гранулы просеивались для удаления сдвоенных в случае их образования.
1.Д СИВ-гранулы ондансетрона гидрохлорида: ЗВ-гранулы ондансетрона гидрохлорида (3500 г) из Примера 1.Г дополнительно покрывались мембраной покрытия, обеспечивающего время запаздывания, из ЕС-10/НР-55/ТЕС (триэтилцитрата) в соотношении 45,5/40,0/14.5 до привеса 30%, 40% и 50%. СИВ-гранулы высушивались в аппарате Glatt при той же температуре для удаления остаточного растворителя и просеивались.
На фиг.2 показаны профили синхронизированного высвобождения, полученные для фумаровой кислоты и ондансетрона из ЗВ-гранул (партия №1084-060 - МВ-гранулы, покрытые 10% вес. 60/40 ЕС-10/ПЭГ 400 в расчете на сердцевины, содержащие фумаровую кислоту, покрытые 10% 75/25 ЕС-10/ПЭГ 400) и СИВ-гранул (партия №1084-060 - МВ-гранулы, полученные нанесением слоя на сердцевины, содержащие фумаровую кислоту, покрытые 10% 75/25 ЕС-10/ПЭГ 400), покрытые ЕС-10/НР-55/ТЕС в соотношении 63/22/15 до привеса 15% вес.(полученные, как описано ниже в Примере 6). Высвобождение фумаровой кислоты происходит значительно медленнее, чем высвобождение ондансетрона, что, таким образом, гарантирует отсутствие ондансетрона в покрытой грануле по причине исчерпания фумаровой кислоты.
Пример 2
2.А Сердцевины, содержащие фумаровую кислоту: Сердцевины, содержащие фумаровую кислоту, изготавливались согласно процедуре, описанной в Примере 1.А, за исключением того, что вместо спирта использовалась смесь 90/10 денатурированного стандартного спирта (SD 3С, 190) и воды.
2.Б Сердцевины, содержащие фумаровую кислоту, покрытые ЗВ-покрытием:
Сердцевины фумаровой кислоты (3750 г)у полученные выше, покрывались раствором ЕС-10, а также или ПЭГ 400 (Б.1) в отношении 60/40, или ТЕС (Б.2) в соотношении 90/10, в качестве пластификатора, растворенных в смеси 98/2 ацетон/вода (6% твердых веществ) до привеса 10%.
2.В МВ-гранулы ондансетрона гидрохлорида: МВ-гранулы ондансетрона гидрохлорида из примеров Б.1 и Б.2 изготавливались аналогично описанному в примере 1.В. Гранулы, покрытые лекарственным веществом, обеспечивались защитным изолирующим покрытием Pharmacoat® 603 (гипромеллоза 2910; 3 сП) до привеса 2%.
2.Г ЗВ-гранулы ондансетрона гидрохлорида: ЗВ-гранулы ондансетрона гидрохлорида (1080 г) покрывались барьерным покрытием (ЗВ-покрытием) путем распыления раствора ЕС-10, а также либо ПЭГ 400 (Г.1) в соотношении 60/40, либо ТЕС (Г.2) в соотношении 90/10, в качестве пластификатора, растворенных в смеси 98/2 ацетон/вода (7,5% твердых веществ) до привеса 10%, и высушивались в аппарате Glatt при той же температуре в течение 10 мин. для удаления остаточного растворителя. Высушенные гранулы просеивались для удаления сдвоенных в случае их образования.
2.Д СИВ-гранулы ондансетрона гидрохлорида: ЗВ-гранулы ондансетрона гидрохлорида из приведенных выше примеров Д.1 и Д.2 дополнительно покрывались мембраной покрытия, обеспечивающего время запаздывания, из ЕС-10/НР-55/ТЕС в трех соотношениях: 45,5/40/14,5 (Д.1 - партия №1084-066), 50,5/35/14,5 (Д.2 - партия №1117-025) и 60,5/25/14,5 (Д.3 - партия №1117-044), растворенных а смеси 90/10 ацетон/вода (7,5% твердых веществ) до привеса до 50% вес. СИВ-гранулы высушивались аппарате Glatt для удаления остаточного растворителя и просеивались через сито 18 меш.
На фиг.4 показаны профили высвобождения для ондансетрона гидрохлорида из СИВ-гранул, покрытых ЕС-10/НР-55/ТЕС в трех различных соотношениях (Д.1, Д.2 и Д.3). В частности, на фиг.4 показаны профили высвобождения для следующих составов:
(1) СИВ-гранулы, партия №1084-066 - покрытие 50% вес. ЕС-10/НР-55/ТЕС в соотношении 45,5/40/14,5, нанесенное на МВ-гранулы, покрытые 10% 60/40 ЕС-10/ПЭГ 400 (7,5% твердых веществ), в то время как МВ-гранулы (слой 5% лекарственного вещества, нанесенный из смеси 90/10 ондансетрон/ПВП), включают в себя сердцевины фумаровой кислоты (слой 4%, нанесенный на сферические частицы сахара из смеси кислота/Klucel), покрытые 10% 60/40 ЕС-10/ПЭГ 400.
(2) СИВ-гранулы, партия №1117-025 - покрытие 50% вес. ЕС-10/НР-55/ТЕС в соотношении 50,5/35/14,5 (7,5% твердых веществ), нанесенное на МВ-гранулы, покрытые 10% 90/10 ЕС-10/ТЕС (7,5% твердых веществ), в то время как МВ-гранулы (слой 6% лекарственного вещества, нанесенный из смеси 90/10 ондансетрон/ Klucel LF (5% твердых веществ)), включают в себя сердцевины фумаровой кислоты (слой, нанесенный на сферические частицы сахара из смеси кислота/ПВП), покрытые 10% 90/10 ЕС-10/ТЕС (7,5% твердых веществ) для загрузки лекарственного вещества 10% вес.
(3) СИВ-гранулы, партия №1117-044 - покрытие 50% вес. ЕС-10/НР-55/ТЕС в соотношении 60,5/25/14,5, нанесенное на МВ-гранулы, покрытые 10% 90/10 ЕС-10/ТЕС, в то время как МВ-гранулы (слой 6% лекарственного вещества, нанесенный из смеси 90/10 ондансетрон/Klucel LF), включают в себя сердцевины фумаровой кислоты (слой, нанесенный на сферические частицы сахара из смеси кислота/ПВП), покрытые 10% 90/10 ЕС-10/ТЕС.
Пример 3
3.А Сердцевины, содержащие фумаровую кислоту: Гидроксипропилцеллюлозу (Klucel LF, 53,6 г) медленно добавляли к смеси 90/10 стандартный спирт 190/вода с содержанием твердых веществ 4% при тщательном перемешивании до растворения, затем медленно добавляли до растворения фумаровую кислоту (482,1 г). В аппарат Glatt GPCG 5, оснащенный 9-дюймовым вкладышем Вюрстера для распыления снизу и 10-дюймовой разделительной колонкой, загружали 3750 г сферических частиц сахара с размером 25-30 меш. Сферические частицы сахара покрывались слоем раствора фумаровой кислоты при поддержании температуры продукта около 33-35°С и скорости распыления 8-60 мл/мин. Кислотные сердцевины высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались через сита 40-80 меш.
3.Б Сердцевины, содержащие фумаровую кислоту, покрытые ЗВ-покрычием: Кислотные сердцевины (3750 г), полученные выше, покрывались раствором (с содержанием твердых веществ 7,5%) 177,6 г этилцеллюлозы (ЕС-10) и 19,7 г триэтилцитрата (ТЕС) в соотношении 90/10, растворенными в смеси 95/5 ацетон/вода до привеса 5% вес., с последующими процедурами, которые раскрыты ниже.
3.В МВ-гранулы ондансетрона гидрохлорида: Гидроксипропилцеллюлозу (Klucel LF, 44,3 г) медленно добавляли к смеси 50/50 стандартный спирт 190/вода (4247,4 г спирта + 4247,4 г воды, 5% твердых веществ) при тщательном перемешивании для растворения, затем медленно, при перемешивании для растворения лекарственного вещества добавляли ондансетрон · HCl (402,8 г). Кислотные сердцевины, покрытые ЗВ-покрытием (3500 г), покрывались раствором лекарственного вещества в аппарате Glatt GPCG 5, покрытые слоем лекарственного вещества гранулы обеспечивались защитным изолирующим покрытием Pharmacoat 603 (80,5 г до привеса около 2%) и высушивались в аппарате Glatt с образованием МВ-гранул (объем партии: 4028 г).
3.Г ЗВ-гранулы ондансетрона гидрохлорида: МВ-гранулы ондансетрона гидрохлорида (3500 г) покрывались барьерным покрытием (ЗВ-покрытием) путем распыления раствора (7,5% твердых веществ) 5% вес. 90/10 ЕС-10/ТЕС и высушивались в аппарате Glatt при той же температуре в течение 10 мин. для удаления избытка остаточного растворителя. Высушенные гранулы просеивались для удаления сдвоенных в случае их образования.
3.Д СИВ-гранулы ондансещрона гидрохлорида: ЗВ-гранулы ондансетрона гидрохлорида (2600 г), полученные выше, затем покрывались мембраной покрытия, обеспечивающего время запаздывания, из раствора ЕС-10/НР-55/ТЕС в соотношении 60,5/25/14,5, растворенных в смеси 90/10 ацетон/вода (7,5% твердых веществ) до привеса 30%, 45% и 50%. Покрытые гранулы выдерживались при 60°С в течение 30 мин. и, после охлаждения до комнатной температуры, просеивались через сито 18 меш.
3.Е МдВ-капсулы ондансетрона гидрохлорида: МВ-гранулы ондансетрона гидрохлорида (РЕ364ЕА0001) и СИВ-гранулы (партия № РЕ366ЕА0001 с 30% покрытия, обеспечивающего время запаздывания, партия № РЕ367ЕА0001 с 45% покрытия, обеспечивающего время запаздывания, и партия № РЕ368ЕА0001 с 50% покрытия, обеспечивающего время запаздывания) инкапсулировались в соотношении 35%/65% в твердые желатиновые капсулы с образованием МдВ-капсул (капсул с модифицированным высвобождением), 16 мг (партии № PF380EA0001, PF381EA0001 и PF382EA0001) QD (одноразовая дневная дозировка) для поискового исследования биологической доступности в организме человека в сравнении с товарным препаратом Zofran® с дозировкой 8 мг (в расчете на ондансетрон) дважды в день. На фиг.4 показаны профили высвобождения лекарственного вещества из трех МдВ-капсул, включающих в себя MB- и СИВ-гранулы. На фиг.5 представлены временные зависимости концентрации ондансетрона в плазме, вычисленные с использованием профилей высвобождения лекарственного препарата in vitro, представленных на фиг.4.
Пример 4
Для доказательства правильности концепции (РОС) проводилось четырехстороннее перекрестное поисковое исследование, которое включало 12 принадлежащих к европеоидной расе мужчин, клинически здоровых добровольцев в возрасте от 18 до 55 лет, с периодом вымывания 7 дней. Каждый доброволец получал дозу 250 мл минеральной воды и единичную дозу 16 мг Тестового Состава (А (PF380EA0001), Б (PF381EA0001) или В (PF382EA0001)) из Примера 3) в 8.00 или две дозы препарата Zofran® (т.е. одну в 8.00 и вторую в 16.30 после голодания в течение ночи (по меньшей мере у 12 ч.), обед подавался в 11.00). Образцы крови брались в моменты времени 0 (перед получением дозы) у 20 мин., 40 мин., 1 ч., 1,5 ч., 2 ч., 3 ч., 4 ч., 6 ч., 8,5 ч. (перед получением второй дозы), 9 ч. 10 мин., 9,5 ч., 10 ч., 10,5 ч., 11,5 ч., 12,5 ч., 14,5 ч., 17 ч., 20 ч., 22 ч., 24 ч. и 36 ч. Профили ФК (фармакокинетики) представлены на фиг.6. Поисковое исследование ФК показывает, что профили в плазме Тестовых Составов А (РЕ380ЕА0001), Б (РЕ381ЕА0001) и В (РЕ382ЕА0001) характерны для составов с замедленным высвобождением, т.е. наблюдаемый полупериод длится значительно дольше, чем для препарата Zofran. AUC или Cmax Тестовых Составов значительно не отклоняются от таковых для препарата Zofran® (т.е., AUC - в пределах ±25%, а Cmax - приблизительно 70% наблюдаемого для препарата Zofran). Фактическое значение Cmax для препарата Zofran® в дозировке 8 мг составляет 30 нг/мл в сравнении с прогнозируемой величиной 24 нг/мл, в то время как нормированное фактическое значение Cmax для МВ-компонента составляет 24 нг/мл. Приблизительно 70% препарата Zofran® в дозировке 8 мг при приеме дважды в день абсорбируется в течение 24 ч. Тестовые Составы А-В демонстрируют ожидаемую тенденцию последозирования вплоть до точки пересечения через около 15-16 ч.; затем Формула В продолжает проявлять более низкую временную зависимость концентрации в плазме вопреки прогнозируемому поведению.
При рассмотрении фиг.6 видно, что введение органической кислоты в качестве солюбилизатора для слабоосновных лекарственных веществ, характеризующееся зависимым от pH профилем растворимости (т.е. демонстрирующей снижение растворимости при pH кишечника 6,8 примерно на 2 порядка в сравнении с их максимальной растворимостью в ЖК соке), а также функциональное покрытие кислоты перед нанесением активного ингредиента имеет значительное влияние на время запаздывания, требуемый профиль полного высвобождения кислоты перед исчерпанием буфера и, соответственно, на полную абсорбцию в дистальной части ЖК тракта, где лекарственное вещество практически нерастворимо.
На фиг.7 видно, что высвобождение и последующая абсорбция мгновенно высвобожденной части тестовых лекарственных форм происходят значительно медленнее и менее полно в сравнении с единичной дозой эталонного препарата Zofran.
Исследования проводились с целью разработки способа дискриминационного растворения в попытке понять различия в эффективности между тестовыми и эталонным составами и для переформулировки МВ-части тестового состава с профилем растворения, сходным с таковым для тестового препарата. На фиг.8 показаны профили растворения МВ-гранул, введенных в тестовые капсулы составов, в сравнении с препаратом Zofran® при тестировании растворения при различных температурах. Хотя растворение из МВ-гранул в 0,1 н HCl происходит медленнее при более низких температурах, сама по себе температура не представляется ответственной за наблюдаемые различия. Поскольку растворимость лекарственного вещества уменьшается примерно на два порядка при изменении pH от 1,2 до 6,8, было выдвинуто предположение, что причиной задержки Cmax, например, может являться задержка в опорожнении желудка.
Пример 5
5.А БВ-гранулы ондансетрона гидрохлорида с загрузкой лекарственного вещества 5%: Гидроксипропилцеллюлозу (Klucel LF производства Aqualon, 16,5 г) медленно добавляли к смеси 50/50 вода/денатурированный стандартный спирт ЗС, 190 (1500 г каждого растворителя) с перемешиванием до растворения.. Ондансетрона гидрохлорида дигидрат (150 г) медленно добавляли к раствору связывающего вещества до растворения лекарственного вещества. Сферические частицы сахара размером 60-80 меш (2773,5 г) покрывали раствором лекарственного вещества (5% твердых веществ) в аппарате Glatt GPCG 5 до достижения загрузки лекарственного вещества 5% вес. в следующих условиях: пластина распределения воздуха: В с ситом 100 меш, диаметр форсунки: 1 мм, высота разделительной колонки: 10 дюймов, вкладыш Вюрстера для распыления снизу 9 дюймов, температура продукта 36-37°С, объем подаваемого воздуха 60-65 куб. футов в минуту, скорость распыления возрастала от около 20-25 г/мин. Гранулы, покрытые слоем лекарственного вещества, обеспечивались защитным изолирующим покрытием Pharmacoat 603 (гипромеллоза 2910; 3 сП) (привес 2%) с образованием БВ-гранул. БВ-гранулы высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались через сита 40-80 меш. Более 90% МВ-гранул имели интервал размеров частиц от 50 до 100 меш.
5.Б ВВ-гранулы ондансетрона гидрохлорида с загрузкой лекарственного вещества 10%: Гидроксипропилцеллюлозу (33,0 г) медленно добавляли к смеси 50/50 вода/денатурированный стандартный спирт 3С, 190 (2500 г каждого растворителя) с перемешиванием до растворения. Ондансетрона гидрохлорид (300 г) медленно добавляли к раствору связывающего вещества до растворения лекарственного вещества. Сферические частицы сахара размером 60-80 меш (2607 г) покрывали раствором лекарственного вещества (5% твердых веществ) в аппарате Glatt GPCG 5 до достижения загрузки лекарственного вещества 10% вес. в условиях, аналогичных описанным выше. Более 90% БВ-гранул имели интервал размеров частиц от 50 до 100 меш.
5.В БВ-гранулы ондансетрона гидрохлорида с загрузкой лекарственного вещества 10%: Фумаровая кислота (270 г), а затем Klucel LF (120 г) и ондансетрон · HCl (600 г) медленно добавлялись к смеси 50/50 денатурированного стандартного этилового спирта 190 и воды (5000 г каждого) в баке из нержавеющей стали с перемешиванием до растворения. В аппарат Glatt GPCG 5, оснащенный вкладышем Вюрстера для распыления сверху и предварительно прогретый в течение не менее чем 30 мин., загружалась высушенная распылением лактоза (Fast Flo Lactose; 2130 г), микрокристаллическая целлюлоза (MCC, Avicel РН102; 2400 г), кросповидон (XL-10; 480 г), и смесь гранулировалась при распылении 25-100 г/мин, в следующих условиях: грануляционная камера: GPCG 5 с распылением сверху, наконечник форсунки: 1,2 мм, температура подаваемого воздуха: 55°С, целевой воздушный поток: 80 куб. футов в минуту, давление распыляемого воздуха: 2,0 бар, температура продукта: 50°С. Гранулы высушивались до потери веса <2% при температуре 55°С. Гранулы просеивались через сито 20 меш и смешивались со стеаратом магния (10 г на 5000 г гранул) в объеме 0,5 куб. фута со скоростью вращения 21 об./мин. в течение 5 мин.
Профили растворения частиц с быстрым высвобождением лекарственного вещества (слой лекарственного вещества, нанесенный на сферические частицы сахара размером 60-80 меш и на гранулы, содержащие водорастворимую лактозу и фумаровую кислоту) из Примеров 5.А, 5.Б и 5.В, как показано при тестировании при pH 6,8, сходны с таковым для препарата Zofran® с дозировкой 8 мг в МВ-таблетках (см. фиг.9, где показаны профили растворения для МВ-гранул, нанесенных на сферические частицы сахара размером 25-30 меш из Примера 3.В (партия № РЕ364ЕА0004, используемая для заполнения МдВ-капсул, использованных в исследовании для доказательства правильности концепции (РОС) в Примере 4), БВ-гранул из Примера 5.Б (партия №1117-126), БВ гранул из Примера 5.В (партия №1117-185) и для препарата Zofran).
Пример 6
6.А Сердцевины, содержащие фумаровую кислому: сферические частицы сахара размером 25-30 меш (3750 г) покрывались слоем фумаровой кислоты (482,1 г) из раствора (4% твердых веществ) Klucel LF (53,6 г) аналогично раскрытию из Примера 3 для достижения загрузки кислоты 11,25% вес. Кислотные сердцевины высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались через сита 20-30 меш.
6.Б Сердцевины, содержащие фумаровую кислоту, покрытые 3 В-покрытием: Кислотные сердцевины (3750 г), полученные выше, покрывались раствором 177,6 г этилцеллюлозы (ЕС-10) и 19,7 г триэтилцитрата (ТЕС) в соотношении 90/10, растворенными в смеси 95/5 ацетон/вода (7,5% твердых веществ) до привеса 5%.
6.В МВ-гранулы ондансетрона гидрохлорида: МВ-гранулы ондансетрона гидрохлорида дигидрата с загрузкой лекарственного вещества 10% вес. изготавливались путем распыления раствора (5% твердых веществ) ондансетрона гидрохлорида дигидрата (402,8 г) и Klucel LF (44,3 г) в смеси 50/50 этанол/вода (4247,4 г каждого) на ЗВ-гранулы фумаровой кислоты (3500 г) в аппарате Glatt GPCG 5 в следующих условиях: пластина распределения воздуха: «В» с ситом 15 калибра 100 меш; диаметр форсунки: 1 мм; высота разделительной колонки: 10 дюймов; 9-дюймовый вкладыш Вюрстера для распыления снизу; температура продукта: 34±1°С; объем впускаемого воздуха: 150 куб. футов в минуту; давление распыляемого воздуха: 1,5 бар; скорость распыления возрастала от 8 до 30 мл/мин. Гранулы, покрытые слоем лекарственного вещества, обеспечивались защитным изолирующим покрытием Phannacoat 603 (гипромеллоза 2910; 3 сП) (привес 2%) с образованием МВ-гранул. МВ-гранулы высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались через сита для удаления частиц, имеющих большие и меньшие размеры.
6.Г СИВ-гранулы ондансетрона гидрохлорида с 15% покрытия: на МВ-гранулы ондансетрона гидрохлорида (3500 г) наносилось покрытие, обеспечивающее время запаздывания, из этилцеллюлозы (389,1 г), HP-55 (фталата гидромеллозы, 135,9 г) и ТЕС (триэтилцитрата, 92,6 г) (соотношение 63:22:15) в смеси 90/10 ацетон/вода путем распыления 15% вес. раствора (18% твердых веществ) и высушивания в аппарате Glatt при той же температуре в течение 10 мин. для удаления избытка остаточного растворителя. Высушенные гранулы просеивались для удаления сдвоенных гранул в случае их образования.
6.Д СИВ-гранулы ондансетрона гидрохлорида с 10% покрытия: на МВ-гранулы ондансетрона гидрохлорида (3500 г) наносилось покрытие, обеспечивающее время запаздывания, из этилцеллюлозы (245,0 г) у HP-55 (гидромеллозы фталата, 85,6 г) и ТЕС (триэтилцитрата, 58,3 г) (соотношение 63:22:15) в смеси 90/10 ацетон/вода путем распыления 10% вес. раствора (18% твердых веществ) и высушивания в аппарате Glatt при той же температуре в течение 10 мин. для удаления избытка остаточного растворителя. Высушенные гранулы просеивались для удаления сдвоенных в случае их образования.
Пример 7
7.А МдВ-капсулы ондансетрона гидрохлорида PF391EA0001: Для изготовления Тестовых Составов А (МдВ-капсулы, 20 мг (8 мг БВ + 12 мг СИВ (T80~8 ч))) соответствующими количествами гранул с быстрым высвобождением (100,0 мг БВ-гранул, партия № РЕ391ЕА0001), изготовленных в соответствии с раскрытием из Примера 5.В, и СИВ-гранул (166,2 мг СИВ-гранул, партия № РЕ392ЕА0001), изготовленных в соответствии с раскрытием из Примера 6.Д, заполнялись твердые желатиновые капсулы размера «0».
7.Б МдВ-капсулы ондансетрона гидрохлорида PF392EA0001: Для изготовления Тестовых Составов Б (МдВ-капсулы, 24 мг (8 мг БВ + 16 мг СИВ (T80%~8 ч))), соответствующими количествами гранул с быстрым высвобождением (100,0 мг БВ-гранул, партия № РЕ391ЕА0001), изготовленных в соответствии с раскрытием из Примера 5.В, и СИВ-гранул (221,6 мг СИВ-гранул, партия № РЕ292ЕА0001), изготовленных в соответствии с раскрытием из Примера 6.Д, заполнялись твердые желатиновые капсулы размера «0».
7.В МдВ-капсулы ондансетрона гидрохлорида. PF379EA0001: Для изготовления Тестовых Составов В (МдВ-капсулы, 24 мг (8 мг БВ + 16 мг СИВ (Т80%~12 ч)), соответствующими количествами гранул с быстрым высвобождением (100,0 мг БВ-гранул, материал № РЕ391ЕА0001), изготовленных в соответствии с раскрытием из Примера 5.В, и СИВ-гранул (234,6 мг СИВ-гранул, материал № РЕ393ЕА0001), изготовленных в соответствии с раскрытием из Примера 6.Г, заполнялись твердые желатиновые капсулы размера «0».
На фиг.10 приведены профили высвобождения из составов МдВ-капсул, использованных в исследовании для доказательства правильности концепции в Примере 4, которые покрыты барьерным покрытием и покрытием, обеспечивающим время запаздывания, из ЕС-10/НР-55/ТЕС в соотношении 60,5/25/14,5 до привеса 30%, 45% и 50% (PF380EA0001, PF381EA0001 и PF382EA0001, где все они содержат по 8 мг МВ-гранул + 8 мг СИВ-гранул) и препараты МдВ-капсул, PF391EA0001 (8 мг БВ-гранул + 12 мг СИВ-гранул), PF392EA0001 (8 мг БВ-гранул + 16 мг СИВ-гранул) и PF379EA0001 (8 мг БВ-гранул + 16 мг СИВ-гранул). Дозировки всех препаратов МдВ-капсул были отрегулированы (МВ/БВ-компонент - до 8 мг, СИВ-компонент - до 12 мг или 16 мг). Препараты МдВ-капсул из Примера 7 (PF391EA0001, PF392EA0001 и PF379EA0001) обладают более короткими временами запаздывания, а также более быстрыми профилями высвобождения для максимизации высвобождения ондансетрона и сопутствующей абсорбции в дистальной части ЖК тракта.
7.Г Поисковое исследование фармакокинетики на МдВ-капсулах ондансетрона гидрохлорида в сравнении с препаратом Zofran:
Проведено четырехстороннее перекрестное поисковое исследование фармакокинетики, которое включало 12 принадлежащих к европеоидной расе мужчин, клинически здоровых добровольцев в возрасте от 18 до 55 лет, с периодом вымывания 7 дней. Каждый доброволец получал дозу 250 мл минеральной воды и единичный Тест 1 (20 мг; PF391EA0001), Тест 2 (24 мг; PF391EA0001) или Тест 3 (24 мг; PF379EA0001) из Примера 7 в 8.00 или две дозы препарата Zofran® (8 мг) в 8.00 и 16.30 после голодания в течение ночи (по меньшей мере, 12 ч., обед подавался в 11.00). Образцы крови брались в моменты времени 0 (перед получением дозы), 20 мин., 40 мин., 1 ч., 1,5 ч., 2 ч., 3 ч., 4 ч., 6 ч., 8,5 ч. (перед введением второй дозы), 9 ч. 10 мин., 9,5 ч., 10 ч., 10,5 ч., 11,5 ч., 12,5 ч., 14,5 ч., 17 ч., 20 ч., 22 ч., 24 ч. и 36 ч. На фиг.11 приведены полученные временные зависимости средней концентрации в плазме. Параметры ФК (фактические, а также для нормированных доз) приведены в Таблице 2. Относительная биологическая доступность в сравнении с эталоном - 8 мг MB дважды в день - составляет приблизительно 0,85 для всех тестовых препаратов (Тестовые Формулы A, Б и В) по прошествии 24 ч.
| Таблица 2 | |||
| Параметры ФК из поискового исследования ФК | |||
| Параметры ФК Средние (90% C.I.) | Тест А (Ондансетрон 20 мг, PF391EA0001) | Тест Б (Ондансетрон 24 мг, PF392EA0001) | Тест В (Ондансетрон 24 мг, PF379EA0001) |
| Cmax | 89%(84-95%) | 107%(100-114%) | 104%(97-111%) |
| AUCt | 109%(102-117%) | 132%(132-152%) | 137%(128-146%) |
| AUCinf: | 113%(105-122%) | 150%(139-161%) | 145%(135-146%) |
| Параметры ФК, нормированные на дозу | |||
| Относительная биологическая доступность (Доверительный интервал 90%) | 92%(86-98%) | 98%(92-104%) | 95%(89-101%) |
Пример 8
8.А Сердцевины, содержащие фумаровую кислоту: Сферические частицы микрокристаллической целлюлозы (Cellets 100 со средним размером частиц около 100 мкм из аппарата Glatt, 933,3 г) покрывались слоем фумаровой кислоты (240 г) из раствора (4% твердых веществ) Klucel LF (26,7 г) аналогично раскрытию из Примера 3 до достижения загрузки кислоты 10% вес.Кислотные сердцевины высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались через сита 40-150 меш.
8.Б ЗВ-гранулы фумаровой кислоты: Кислотные сердцевины (900 г), полученные выше, покрывались раствором 270 г этилцеллюлозы (ЕС-10) и 30 г триэтилцитрата (ТЕС) в соотношении 90/10, растворенных в смеси 95/5 ацетон/вода (7,5% твердых веществ) до привеса 25%.
8.В МВ-гранулы ондансетрона с загрузкой лекарственного вещества 13%: МВ-гранулы ондансетрона гидрохлорида дигидрата с загрузкой лекарственного вещества 13% вес. изготавливались путем распыления раствора ондансетрона гидрохлорида дигидрата (140,4 г) и Klucel LF (15,6 г) в смеси 50/50 этанол/вода (1560 г каждого) на кислотные сердцевины с ЗВ-покрытием (900 г) в аппарате Glatt GPCG 3. Покрытые лекарственным веществом гранулы обеспечивались защитным изолирующим покрытием Pharmacoat® 603 (гипромеллоза 2910; 3 сП) (привес 2%) с образованием МВ-гранул. МВ-гранулы высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались для удаления частиц большего и меньшего размеров.
8.Г СИВ-гранулы ондансетрона: на МВ-гранулы ондансетрона гидрохлорида наносилось покрытие, обеспечивающее время запаздывания, из ЕС-10/НР-55/ТЕС (соотношение: 68:22:10) в смеси 90/10 ацетон/вода путем распыления раствора (7,5% твердых веществ) до привеса 30%, 35% и 40% и они высушивались в аппарате Glatt при той же температуре в течение 10 мин. для удаления избытка остаточного растворителя. Высушенные гранулы просеивались для удаления сдвоенных в случае их образования.
8.Д МВ-гранулы с маскировкой вкуса: МВ-гранулы ондансетрона, изготовленные в соответствии с раскрытием из Примера 8.В, подвергались маскировке вкуса путем покрытия в псевдоожиженном слое (например, в аппарате Glatt GPCG 3) раствором Ethocel 10 сП и Eudragit® EPO в соотношении 50:50 в соответствии с раскрытиями совместно рассматриваемой заявки на патент №11/248596, поданной 12 октября 2005 г, до привеса 20%. Гранулы с маскировкой вкуса высушивались в аппарате в течение 10 мин. для удаления остаточного растворителя/влаги и просеивались через сита 40-80 меш.
8.Е Быстродиспергирующиеся микрогранулы: Быстродиспергирующиеся микрогранулы, включающие в себя сахарный спирт, такой как маннит, и разрыхлитель, такой как кросповидон, изготавливались в соответствии с процедурой, раскрытой в опубликованной совместно рассматриваемой заявке на патент США №2005/0232988, опубликованной 20 октября 2005 г, содержание которой ссылкой включается в настоящее описание. D-маннит (152 кг) со средним размером частиц приблизительно 20 мкм или менее (Pearlitol 25, Roquette, Франция) смешивался с 8 кг поперечно связанного повидона (Crospovidone XL-10, ISP) в грануляторе с большим усилием сдвига (GMX 600, Vector), гранулировался с очищенной водой (приблизительно 32 кг), подвергался мокрому помолу с использованием ротационной мельницы Quadro и высушивался в печи Греунбурга. Быстродиспергирующиеся микрогранулы, полученные таким способом, имеют средний размер частиц в интервале приблизительно 20-300 мкм.
8.Ж Ондансетрона гидрохлорид ODT МдВ, 24 мг: Быстродиспергирующиеся микрогранулы (5600 г) смешивали с МВ-гранулами с маскировкой вкуса (769 г), СИВ-гранулами с покрытием 40% (2051 г) и предварительно смешанной смесью вспомогательных веществ: корригента, подсластителя и дополнительного разрыхлителя (1580 г) в V-обраэном блендере с двойным корпусом в течение 15 мин. до получения гомогенно распределенной смеси для прессования. Таблетки весом приблизительно 1000 мг прессовались с использованием промышленного таблеточного пресса, оснащенного внешней системой смазки со средней твердостью в интервале около 40-50 H и прочностью таблеток на истирание около <0,5% вес. Полученный таким образом ондансетрона гидрохлорид ODT МдВ, 24 мг быстро размельчается в ротовой полости, образуя однородную, легкопроглатываемую суспензию, включающую в себя покрытые гранулы ондансетрона гидрохлорида, которые обеспечивают целевой профиль, пригодный для режима одноразовой дневной дозировки.
Из приведенных демонстраций ясно, что введение органической кислоты в качестве солюбилиэатора в СИВ-гранулы, включающие в себя слабоосновный селективный блокирующий агент серотонина 5-НТ3, характеризующийся зависимым от pH профилем растворимости (т.е. демонстрирующий снижение растворимости при pH кишечника 6,8 приблизительно на два порядка в сравнении с его максимальной растворимостью в желудочном соке), и функциональное покрытие кислоты перед нанесением слоя активного фармацевтического ингредиента имеет значительное влияние на время запаздывания, требуемый профиль полного высвобождения лекарственного вещества до исчерпания буфера. Кроме того, активный фармацевтический ингредиент остается в неизменной форме в твердой лекарственной форме до его высвобождения для абсорбции в ЖК тракте. Кроме того, с целью обеспечения ускоренного растворения, сходного с таковым для эталонного лекарственного препарата, спроектирована болюсная доза, включающая в себя частицы с быстрым высвобождением лекарственного вещества.
Claims (32)
1. Фармацевтическая композиция, которая включает в себя совокупность частиц с синхронизированным импульсным высвобождением и частиц с быстрым высвобождением, где:
каждая совокупность частиц с синхронизированным импульсным высвобождением включает в себя сердцевину, покрытую слоем с синхронизированным импульсным высвобождением;
сердцевина включает в себя слабоосновное плохорастворимое лекарственное вещество и фармацевтически приемлемую органическую кислоту, которые отделены друг от друга слоем с замедленным высвобождением;
каждая частица с быстрым высвобождением включает в себя гранулу, включающую слабоосновное плохорастворимое лекарственное вещество, фармацевтически приемлемое полимерное связывающее вещество, по меньшей мере, одно вспомогательное вещество и, по меньшей мере, один разрыхлитель.
каждая совокупность частиц с синхронизированным импульсным высвобождением включает в себя сердцевину, покрытую слоем с синхронизированным импульсным высвобождением;
сердцевина включает в себя слабоосновное плохорастворимое лекарственное вещество и фармацевтически приемлемую органическую кислоту, которые отделены друг от друга слоем с замедленным высвобождением;
каждая частица с быстрым высвобождением включает в себя гранулу, включающую слабоосновное плохорастворимое лекарственное вещество, фармацевтически приемлемое полимерное связывающее вещество, по меньшей мере, одно вспомогательное вещество и, по меньшей мере, один разрыхлитель.
2. Фармацевтическая композиция по п.1, отличающаяся тем, что сердцевина включает в себя первую инертную гранулу, слой органической кислоты, слой с замедленным высвобождением и слой лекарственного вещества, где:
слой органической кислоты включает в себя фармацевтически приемлемую органическую кислоту и первое фармацевтически приемлемое полимерное связывающее вещество;
слой с замедленным высвобождением включает в себя первый фармацевтически приемлемый нерастворимый в воде полимер;
слой лекарственного вещества включает в себя слабоосновное плохорастворимое лекарственное вещество и второе фармацевтически приемлемое полимерное связывающее вещество.
слой органической кислоты включает в себя фармацевтически приемлемую органическую кислоту и первое фармацевтически приемлемое полимерное связывающее вещество;
слой с замедленным высвобождением включает в себя первый фармацевтически приемлемый нерастворимый в воде полимер;
слой лекарственного вещества включает в себя слабоосновное плохорастворимое лекарственное вещество и второе фармацевтически приемлемое полимерное связывающее вещество.
3. Фармацевтическая композиция по п.1, отличающаяся тем, что слой с синхронизированным импульсным высвобождением включает в себя фармацевтически приемлемый нерастворимый в воде полимер и кишечнорастворимый полимер.
4. Фармацевтическая композиция по п.2, отличающаяся тем, что фармацевтически приемлемая органическая кислота выбирается из группы, включающей лимонную кислоту, молочную кислоту, фумаровую кислоту, яблочную кислоту, винную кислоту, янтарную кислоту, щавелевую кислоту, аспарагиновую кислоту и глутаминовую кислоту.
5. Фармацевтическая композиция по п.2, отличающаяся тем, что каждое из первого и второго фармацевтически приемлемых полимерных связывающих веществ независимо выбирается из группы, включающей поливинилпирролидон, сополимеры поливинилпирролидона и винилового спирта, сополимеры поливинилпирролидона и винилацетата, сополимеры поливинилпирролидона с винилхлоридом, сополимеры поливинилпирролидона с винилбутиратом, сополимеры поливинилпирролидона с виниллауратом, сополимеры поливинилпирролидона с винилстеаратом, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиалкилцеллюлозы, полиэтиленоксид, натриевую соль карбоксиметилцеллюлозы, декстран, гуммиарабик, крахмал и желатин.
6. Фармацевтическая композиция по п.1, отличающаяся тем, что слабоосновное плохорастворимое лекарственное вещество включает в себя антагонист 5-НТ3-рецепторов серотонина.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что антагонист 5-НТ3-рецепторов серотонина выбирается из группы, включающей ондансетрон, трописетрон, гранисетрон, доласетрон и палоносетрон.
8. Фармацевтическая композиция по п.2, отличающаяся тем, что слабоосновное плохорастворимое лекарственное вещество включает в себя антагонист 5-НТ3-рецепторов серотонина.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что антагонист 5-НТ3-рецепторов серотонина выбирается из группы, включающей ондансетрон, трописетрон, гранисетрон, доласетрон и палоносетрон.
10. Фармацевтическая композиция по п.2, отличающаяся тем, что фармацевтически приемлемый нерастворимый в воде полимер выбирается из группы, включающей этилцеллюлозу, ацетат целлюлозы, поливинилацетат, нейтральные сополимеры этилакрилата и метилметакрилата, сополимеры сложных эфиров акриловой и метакриловой кислот, содержащих четвертичные аммониевые группы, и воски.
11. Фармацевтическая композиция по п.3, отличающаяся тем, что кишечнорастворимый полимер выбирается из группы, включающей фталат ацетата целлюлозы, фталат гидроксипропилметилцеллюлозы, сукцинат ацетата гидроксипропилметилцеллюлозы, фталат поливинилацетата, чувствительные к pH сополимеры метакриловой кислоты и метилметакрилата, и шеллак.
12. Фармацевтическая композиция по п.1, отличающаяся тем, что первая инертная гранула имеет средний размер частиц около 25-30 меш, а вторая инертная гранула имеет средний размер частиц, выбираемый из группы, включающей около 45-60 меш, около 60-80 меш и около 80-200 меш.
13. Фармацевтическая композиция по п.12, отличающаяся тем, что первая и вторая инертные гранулы включают в себя сахар или микрокристаллическую целлюлозу.
14. Фармацевтическая композиция по п.2, отличающаяся тем, что каждая частица с синхронизированным импульсным высвобождением включает в себя гранулу сахара размером 25-30 меш, последовательно покрытую слоем органической кислоты, первым слоем с замедленным высвобождением, слоем лекарственного вещества, необязательно изолирующим слоем и, необязательно вторым слоем с замедленным высвобождением.
15. Фармацевтическая композиция по п.14, отличающаяся тем, что слой органической кислоты включает в себя фумаровую кислоту и гидроксипропилцеллюлозу.
16. Фармацевтическая композиция по п.14, отличающаяся тем, что первый слой с замедленным высвобождением включает в себя этилцеллюлозу и фармацевтически приемлемый пластификатор.
17. Фармацевтическая композиция по п.14, отличающаяся тем, что второй слой с замедленным высвобождением присутствует и включает в себя этилцеллюлозу и фармацевтически приемлемый пластификатор.
18. Фармацевтическая композиция по п.17, отличающаяся тем, что первый и второй слои с замедленным высвобождением включают в себя этилцеллюлозу и фармацевтически приемлемый пластификатор.
19. Фармацевтическая композиция по п.14, отличающаяся тем, что первый слой с замедленным высвобождением включает в себя этилцеллюлозу и фармацевтически приемлемый пластификатор, а второй слой с замедленным высвобождением отсутствует.
20. Фармацевтическая композиция по п.14, отличающаяся тем, что необязательный изолирующий слой присутствует и включает в себя гидроксипропилметилцеллюлозу.
21. Фармацевтическая композиция по п.14, отличающаяся тем, что слабоосновное плохорастворимое лекарственное вещество в гранулах с синхронизированным импульсным высвобождением и частицы с быстрым высвобождением включают в себя ондансетрон или его фармацевтически приемлемую соль, сольват и/или сложный эфир.
22. Фармацевтическая композиция по п.14, отличающаяся тем, что:
каждая частица с синхронизированным импульсным высвобождением включает в себя:
слой органической кислоты, который включает в себя фумаровую кислоту и гидроксипропилцеллюлозу;
первый слой с замедленным высвобождением, который включает в себя этилцеллюлозу и первый фармацевтически приемлемый пластификатор;
слой лекарственного вещества, который включает в себя гидроксипропилцеллюлозу и ондансетрон или его фармацевтически приемлемую соль, сольват и/или сложный эфир;
необязательный изолирующий слой, который присутствует и включает в себя гидроксипропилметилцеллюлозу;
слой с синхронизированным импульсным высвобождением, который включает в себя этилцеллюлозу, фталат гидроксипропилметилцеллюлозы и второй фармацевтически приемлемый пластификатор;
каждая частица с быстрым высвобождением включает в себя гранулу, включающую в себя:
ондансетрон или его фармацевтически приемлемую соль, сольват и/или сложный эфир;
фумаровую кислоту;
лактозу;
микрокристаллическую целлюлозу и
кросповидон.
каждая частица с синхронизированным импульсным высвобождением включает в себя:
слой органической кислоты, который включает в себя фумаровую кислоту и гидроксипропилцеллюлозу;
первый слой с замедленным высвобождением, который включает в себя этилцеллюлозу и первый фармацевтически приемлемый пластификатор;
слой лекарственного вещества, который включает в себя гидроксипропилцеллюлозу и ондансетрон или его фармацевтически приемлемую соль, сольват и/или сложный эфир;
необязательный изолирующий слой, который присутствует и включает в себя гидроксипропилметилцеллюлозу;
слой с синхронизированным импульсным высвобождением, который включает в себя этилцеллюлозу, фталат гидроксипропилметилцеллюлозы и второй фармацевтически приемлемый пластификатор;
каждая частица с быстрым высвобождением включает в себя гранулу, включающую в себя:
ондансетрон или его фармацевтически приемлемую соль, сольват и/или сложный эфир;
фумаровую кислоту;
лактозу;
микрокристаллическую целлюлозу и
кросповидон.
23. Фармацевтическая композиция по п.22, отличающаяся тем, что первый и второй фармацевтически приемлемые пластификаторы независимо выбираются из группы, включающей триацетин, трибутилцитрат, триэтилцитрат, ацетил-три-н-бутилцитрат, диэтилфталат, дибутилсебацинат, полиэтиленгликоль, полипропиленгликоль, касторовое масло, ацетилированные моно- и диглицериды, а также их смесей.
24. Фармацевтическая композиция по п.23, отличающаяся тем, что первый и второй фармацевтически приемлемые пластификаторы оба являются триэтилцитратом, а второй слой с замедленным высвобождением отсутствует.
25. Капсула, которая включает в себя фармацевтическую композицию по п.1.
26. Капсула, которая включает в себя фармацевтическую композицию по п.24.
27. Способ лечения рвоты, при котором вводят фармацевтическую композицию по п.1 пациенту, который нуждается в лечении.
28. Способ по п.27, отличающийся тем, что указанное введение осуществляют один раз в день.
29. Способ лечения рвоты, при котором вводят фармацевтическую композицию по п.24 пациенту, который нуждается в лечении.
30. Способ по п.29, отличающийся тем, что указанное введение осуществляют один раз в день.
31. Фармацевтическая композиция по п.21, в которой слабоосновное плохорастворимое лекарственное вещество в гранулах с синхронизированным импульсным высвобождением и частицы с быстрым высвобождением включает в себя ондансетрона гидрохлорид.
32. Фармацевтическая композиция по п.22 в которой каждая частица с быстрым высвобождением включает в себя гранулу, включающую в себя:
ондансетрона гидрохлорид;
фумаровую кислоту;
лактозу;
микрокристаллическую целлюлозу и кросповидон.
ондансетрона гидрохлорид;
фумаровую кислоту;
лактозу;
микрокристаллическую целлюлозу и кросповидон.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US3584008P | 2008-03-12 | 2008-03-12 | |
| US61/035,840 | 2008-03-12 | ||
| US12/209,285 US8133506B2 (en) | 2008-03-12 | 2008-09-12 | Drug delivery systems comprising weakly basic drugs and organic acids |
| US12/209,285 | 2008-09-12 | ||
| PCT/US2009/036787 WO2009114606A1 (en) | 2008-03-12 | 2009-03-11 | Drug delivery systems comprising weakly basic drugs and organic acids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010141726A RU2010141726A (ru) | 2012-04-20 |
| RU2504362C2 true RU2504362C2 (ru) | 2014-01-20 |
Family
ID=41063296
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010141726/15A RU2504362C2 (ru) | 2008-03-12 | 2009-03-11 | Системы доставки лекарственных веществ, включающие в себя слабоосновные лекарственные вещества и органические кислоты |
Country Status (24)
| Country | Link |
|---|---|
| US (1) | US8133506B2 (ru) |
| EP (1) | EP2265261B1 (ru) |
| JP (1) | JP5634882B2 (ru) |
| KR (1) | KR101660927B1 (ru) |
| CN (1) | CN101977593B (ru) |
| AR (1) | AR071562A1 (ru) |
| AU (1) | AU2009223019C1 (ru) |
| BR (1) | BRPI0908942A2 (ru) |
| CA (1) | CA2718257C (ru) |
| CL (1) | CL2009000598A1 (ru) |
| DK (1) | DK2265261T3 (ru) |
| ES (1) | ES2590479T3 (ru) |
| HU (1) | HUE029680T2 (ru) |
| IL (1) | IL208089A0 (ru) |
| MX (1) | MX2010010052A (ru) |
| NZ (1) | NZ587897A (ru) |
| PL (1) | PL2265261T3 (ru) |
| PT (1) | PT2265261T (ru) |
| RU (1) | RU2504362C2 (ru) |
| SA (1) | SA109300166B1 (ru) |
| SG (1) | SG10201405929UA (ru) |
| TW (1) | TWI440480B (ru) |
| WO (1) | WO2009114606A1 (ru) |
| ZA (1) | ZA201006557B (ru) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2007211101B2 (en) * | 2006-01-27 | 2013-05-02 | Adare Pharmaceuticals, Inc. | Drug delivery systems comprising weakly basic drugs and organic acids |
| ES2550035T3 (es) * | 2006-01-27 | 2015-11-04 | Adare Pharmaceuticals, Inc. | Sistemas de administración de fármacos que comprenden un agente de bloqueo selectivo de la serotonina 5-HT3 débilmente básico y ácidos orgánicos |
| DK2300475T3 (en) | 2008-06-11 | 2014-12-08 | Genentech Inc | Diazacarbazoler and methods of using |
| EP2416764A4 (en) * | 2009-04-09 | 2013-09-04 | Alkermes Pharma Ireland Ltd | COMPOSITION FOR ACTIVE COMPOSITION |
| US20110003005A1 (en) * | 2009-07-06 | 2011-01-06 | Gopi Venkatesh | Methods of Treating PDNV and PONV with Extended Release Ondansetron Compositions |
| CN102048705B (zh) * | 2009-11-10 | 2012-07-18 | 齐鲁制药有限公司 | 盐酸帕洛诺司琼口腔崩解片制剂及其制备方法 |
| SG10201407947WA (en) | 2009-11-30 | 2015-01-29 | Aptalis Pharmatech Inc | Compressible-coated pharmaceutical compositions and tablets and methods of manufacture |
| WO2011082426A1 (en) * | 2010-01-04 | 2011-07-07 | Eurand, Inc. | Controlled release compositions comprising meclizine or related piperazine derivatives |
| US20120164233A1 (en) * | 2010-07-30 | 2012-06-28 | Ranbaxy Laboratories Limited | Pulsatile release pharmaceutical formulation of dexlansoprazole |
| MY165149A (en) * | 2010-08-13 | 2018-02-28 | Euro Celtique Sa | Use of binders for manufacturing storage stable formulations |
| US9011912B2 (en) | 2010-10-07 | 2015-04-21 | Abon Pharmaceuticals, Llc | Extended-release oral dosage forms for poorly soluble amine drugs |
| NZ611467A (en) | 2010-12-02 | 2015-06-26 | Aptalis Pharmatech Inc | Rapidly dispersing granules, orally disintegrating tablets and methods |
| JP5638151B2 (ja) * | 2010-12-23 | 2014-12-10 | パーデュー、ファーマ、リミテッド、パートナーシップ | 不正加工抵抗性の(tamperresistant)固形経口剤形 |
| EP2861236B1 (en) * | 2012-06-15 | 2019-07-17 | Pharmathen S.A. | Pharmaceutical composition containing phosphate binding polymer |
| SG11201506064UA (en) | 2013-02-05 | 2015-08-28 | Purdue Pharma Lp | Tamper resistant pharmaceutical formulations |
| US10751287B2 (en) | 2013-03-15 | 2020-08-25 | Purdue Pharma L.P. | Tamper resistant pharmaceutical formulations |
| JP6392355B2 (ja) * | 2013-09-13 | 2018-09-19 | アール.ピー.シェーラー テクノロジーズ、エルエルシー | ペレット包含錠剤 |
| CN105797162B (zh) * | 2014-12-31 | 2022-10-25 | 昆明积大制药股份有限公司 | 药用辅料表面改性方法 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5705190A (en) * | 1995-12-19 | 1998-01-06 | Abbott Laboratories | Controlled release formulation for poorly soluble basic drugs |
| US5840329A (en) * | 1997-05-15 | 1998-11-24 | Bioadvances Llc | Pulsatile drug delivery system |
| US6702803B2 (en) * | 2000-01-20 | 2004-03-09 | Delsys Pharmaceutical Corporation | Multi-step drug dosage forms |
| US20050118269A1 (en) * | 2002-03-14 | 2005-06-02 | Hidetoshi Hamamoto | External preparation for wounds |
| WO2007090091A2 (en) * | 2006-01-27 | 2007-08-09 | Eurand, Inc. | Drug delivery systems comprising weakly basic drugs and organic acids |
Family Cites Families (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3634584A (en) | 1969-02-13 | 1972-01-11 | American Home Prod | Sustained action dosage form |
| US3954959A (en) | 1973-03-28 | 1976-05-04 | A/S Alfred Benzon | Oral drug preparations |
| GB1468172A (en) | 1973-03-28 | 1977-03-23 | Benzon As Alfred | Oral drug preparations |
| DE2336218C3 (de) | 1973-07-17 | 1985-11-14 | Byk Gulden Lomberg Chemische Fabrik Gmbh, 7750 Konstanz | Orale Arzneiform |
| DD146547A5 (de) | 1978-07-15 | 1981-02-18 | Boehringer Sohn Ingelheim | Arzneimittel-retardform mit unloeslichen poroesen diffusionshuellen |
| IE48715B1 (en) | 1978-12-22 | 1985-05-01 | Elan Corp Plc | New galencial forms for administration of medicaments by oral route,with programmed release and processes for preparing same |
| DE3000979A1 (de) | 1980-01-12 | 1981-07-23 | Dr. Karl Thomae Gmbh, 7950 Biberach | Neue dipyridamol-retardformen und verfahren zu ihrer herstellung |
| DE3124090A1 (de) | 1981-06-19 | 1983-01-05 | Dr. Karl Thomae Gmbh, 7950 Biberach | Neue orale dipyridamolformen |
| DE3126703A1 (de) | 1981-07-07 | 1983-01-27 | Dr. Karl Thomae Gmbh, 7950 Biberach | Bromhexin-retardform und verfahren zu ihrer herstellung |
| DE3237575A1 (de) | 1982-10-09 | 1984-04-12 | Dr. Karl Thomae Gmbh, 7950 Biberach | Neue orale mopidamolformen |
| IE55745B1 (en) | 1983-04-06 | 1991-01-02 | Elan Corp Plc | Sustained absorption pharmaceutical composition |
| IE56459B1 (en) | 1983-12-21 | 1991-08-14 | Elan Corp Ltd | Controlled absorption pharmaceutical formulation |
| IE56999B1 (en) | 1983-12-22 | 1992-03-11 | Elan Corp Plc | Pharmaceutical formulation |
| US4894240A (en) | 1983-12-22 | 1990-01-16 | Elan Corporation Plc | Controlled absorption diltiazem formulation for once-daily administration |
| JPS62114910A (ja) | 1985-11-13 | 1987-05-26 | エラン コ−ポレ−シヨン ピ− エル シ− | 吸収がコントロ−ルされた医薬製剤 |
| IE58401B1 (en) | 1986-06-20 | 1993-09-08 | Elan Corp Plc | Controlled absorption pharmaceutical composition |
| DE3627423A1 (de) | 1986-08-13 | 1988-02-18 | Thomae Gmbh Dr K | Arzneimittel enthaltend dipyridamol oder mopidamol und o-acetylsalicylsaeure bzw. deren physiologisch vertraegliche salze, verfahren zu ihrer herstellung und ihre verwendung zur bekaempfung der thrombusbildung |
| EP0585355B1 (en) | 1991-05-20 | 1995-03-22 | Marion Laboratories, Inc. | Multi-layered controlled release formulation |
| DK1058538T3 (da) | 1998-03-06 | 2002-10-21 | Eurand Int | Hurtigt desintegrerende tabletter |
| US6602521B1 (en) | 1998-09-29 | 2003-08-05 | Impax Pharmaceuticals, Inc. | Multiplex drug delivery system suitable for oral administration |
| EP2020229A1 (en) * | 1998-11-02 | 2009-02-04 | Elan Pharma International Limited | Multiparticulate modified release composition |
| US6936275B2 (en) | 1999-12-20 | 2005-08-30 | Scolr, Inc. | Amino acid modulated extended release dosage form |
| US6627223B2 (en) * | 2000-02-11 | 2003-09-30 | Eurand Pharmaceuticals Ltd. | Timed pulsatile drug delivery systems |
| US6500457B1 (en) * | 2000-08-14 | 2002-12-31 | Peirce Management, Llc | Oral pharmaceutical dosage forms for pulsatile delivery of an antiarrhythmic agent |
| WO2002036558A2 (en) | 2000-10-30 | 2002-05-10 | Teva Pharmaceutical Industries Ltd. | Novel crystal and solvate forms of ondansetron hydrochloride and processes for their preparation |
| DE10149674A1 (de) | 2001-10-09 | 2003-04-24 | Apogepha Arzneimittel Gmbh | Orale Darreichungsformen für Propiverin oder seinen pharmazeutisch annehmbaren Salzen mit verlängerter Wirkstoffreisetzung |
| US20040019096A1 (en) | 2001-10-23 | 2004-01-29 | Vlassios Andronis | Novel formulations of carvedilol |
| US6663888B2 (en) | 2001-12-14 | 2003-12-16 | Eurand Pharmaceuticals Ltd. | Pulsatile release histamine H2 antagonist dosage form |
| US7939102B2 (en) | 2002-06-07 | 2011-05-10 | Torrent Pharmaceuticals Ltd. | Controlled release formulation of lamotrigine |
| WO2004096182A1 (en) | 2003-04-30 | 2004-11-11 | Ranbaxy Laboratories Limited | Extended release matrix tablets of carvedilol |
| GB0317663D0 (en) * | 2003-07-29 | 2003-09-03 | Astrazeneca Ab | Pharmaceutical composition |
| RS20050835A (en) | 2004-01-06 | 2007-08-03 | Panacea Biotec Ltd., | Compositions of buccal dosage forms for extended drug release and the process of preparing such compositions |
| WO2005077341A1 (en) | 2004-01-19 | 2005-08-25 | Ranbaxy Laboratories Limited | Orally disintegrating pharmaceutical compositions of ondansetron |
| US8545881B2 (en) | 2004-04-19 | 2013-10-01 | Eurand Pharmaceuticals, Ltd. | Orally disintegrating tablets and methods of manufacture |
| JP4277904B2 (ja) * | 2004-04-30 | 2009-06-10 | アステラス製薬株式会社 | 経口投与用時限放出型粒子状医薬組成物及び該組成物を含有する口腔内速崩壊錠 |
| CA2590802A1 (en) * | 2004-12-20 | 2006-06-29 | Collegium Pharmaceutical, Inc. | Pharmaceutical compositions for sleep disorders |
| US20060280795A1 (en) | 2005-06-08 | 2006-12-14 | Dexcel Pharma Technologies, Ltd. | Specific time-delayed burst profile delivery system |
| HU227490B1 (en) * | 2005-08-26 | 2011-07-28 | Egis Gyogyszergyar Nyilvanosan Muekoedoe Reszvenytarsasag | Sustained release pharmaceutical preparation containing carvedilol |
| ES2550035T3 (es) | 2006-01-27 | 2015-11-04 | Adare Pharmaceuticals, Inc. | Sistemas de administración de fármacos que comprenden un agente de bloqueo selectivo de la serotonina 5-HT3 débilmente básico y ácidos orgánicos |
| CA2661683C (en) * | 2006-08-31 | 2015-11-24 | Eurand, Inc | Drug delivery systems comprising solid solutions of weakly basic drugs |
-
2008
- 2008-09-12 US US12/209,285 patent/US8133506B2/en active Active
-
2009
- 2009-03-11 JP JP2010550837A patent/JP5634882B2/ja active Active
- 2009-03-11 HU HUE09718989A patent/HUE029680T2/en unknown
- 2009-03-11 KR KR1020107022295A patent/KR101660927B1/ko active IP Right Grant
- 2009-03-11 BR BRPI0908942A patent/BRPI0908942A2/pt not_active IP Right Cessation
- 2009-03-11 EP EP09718989.8A patent/EP2265261B1/en active Active
- 2009-03-11 ES ES09718989.8T patent/ES2590479T3/es active Active
- 2009-03-11 CA CA2718257A patent/CA2718257C/en active Active
- 2009-03-11 CN CN200980108774.3A patent/CN101977593B/zh active Active
- 2009-03-11 DK DK09718989.8T patent/DK2265261T3/en active
- 2009-03-11 WO PCT/US2009/036787 patent/WO2009114606A1/en active Application Filing
- 2009-03-11 PL PL09718989T patent/PL2265261T3/pl unknown
- 2009-03-11 NZ NZ587897A patent/NZ587897A/xx not_active IP Right Cessation
- 2009-03-11 SG SG10201405929UA patent/SG10201405929UA/en unknown
- 2009-03-11 MX MX2010010052A patent/MX2010010052A/es active IP Right Grant
- 2009-03-11 RU RU2010141726/15A patent/RU2504362C2/ru not_active IP Right Cessation
- 2009-03-11 PT PT97189898T patent/PT2265261T/pt unknown
- 2009-03-11 TW TW098107970A patent/TWI440480B/zh not_active IP Right Cessation
- 2009-03-11 AU AU2009223019A patent/AU2009223019C1/en not_active Ceased
- 2009-03-12 AR ARP090100890A patent/AR071562A1/es unknown
- 2009-03-12 CL CL2009000598A patent/CL2009000598A1/es unknown
- 2009-03-14 SA SA109300166A patent/SA109300166B1/ar unknown
-
2010
- 2010-09-12 IL IL208089A patent/IL208089A0/en unknown
- 2010-09-13 ZA ZA2010/06557A patent/ZA201006557B/en unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5705190A (en) * | 1995-12-19 | 1998-01-06 | Abbott Laboratories | Controlled release formulation for poorly soluble basic drugs |
| US5840329A (en) * | 1997-05-15 | 1998-11-24 | Bioadvances Llc | Pulsatile drug delivery system |
| US6702803B2 (en) * | 2000-01-20 | 2004-03-09 | Delsys Pharmaceutical Corporation | Multi-step drug dosage forms |
| US20050118269A1 (en) * | 2002-03-14 | 2005-06-02 | Hidetoshi Hamamoto | External preparation for wounds |
| WO2007090091A2 (en) * | 2006-01-27 | 2007-08-09 | Eurand, Inc. | Drug delivery systems comprising weakly basic drugs and organic acids |
| US20070196491A1 (en) * | 2006-01-27 | 2007-08-23 | Eurand, Inc. | Drug delivery systems comprising weakly basic drugs and organic acids |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2504362C2 (ru) | Системы доставки лекарственных веществ, включающие в себя слабоосновные лекарственные вещества и органические кислоты | |
| RU2428176C2 (ru) | Системы доставки лекарственного средства, содержащие слабоосновные лекарственные средства и органические кислоты | |
| JP5918179B2 (ja) | 弱塩基性選択性セロトニン5−ht3遮断剤および有機酸を含む薬物送達系 | |
| US20100080846A1 (en) | Dipyridamole and acetylsalicylic acid formulations and process for preparing same | |
| AU2013204408B2 (en) | Drug delivery systems comprising weakly basic selective serotonin 5-HT3 blocking agent and organic acids | |
| MX2008009616A (en) | Drug delivery systems comprising weakly basic selective serotonin 5-ht3 blocking agent and organic acids | |
| AU2013204400A1 (en) | Drug delivery systems comprising weakly basic drugs and organic acids |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner | ||
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20160312 |