RU2487873C2 - 5-substituted indazole as kinase inhibitors - Google Patents
5-substituted indazole as kinase inhibitors Download PDFInfo
- Publication number
- RU2487873C2 RU2487873C2 RU2009149696/04A RU2009149696A RU2487873C2 RU 2487873 C2 RU2487873 C2 RU 2487873C2 RU 2009149696/04 A RU2009149696/04 A RU 2009149696/04A RU 2009149696 A RU2009149696 A RU 2009149696A RU 2487873 C2 RU2487873 C2 RU 2487873C2
- Authority
- RU
- Russia
- Prior art keywords
- indazol
- triazol
- carboxamide
- benzyl
- indazole
- Prior art date
Links
- 0 C*C1C=CC(*)C1C Chemical compound C*C1C=CC(*)C1C 0.000 description 10
- HMYHIKAXGAPRJL-UHFFFAOYSA-N C#Cc(cc1)cc(C#N)c1F Chemical compound C#Cc(cc1)cc(C#N)c1F HMYHIKAXGAPRJL-UHFFFAOYSA-N 0.000 description 1
- OWFXIOWLTKNBAP-UHFFFAOYSA-N CC(C)CCON=O Chemical compound CC(C)CCON=O OWFXIOWLTKNBAP-UHFFFAOYSA-N 0.000 description 1
- OOMAOWASFMLDOS-UHFFFAOYSA-N CC([n]1ncc2cc(-[n]3nnc(C)c3)ccc12)=O Chemical compound CC([n]1ncc2cc(-[n]3nnc(C)c3)ccc12)=O OOMAOWASFMLDOS-UHFFFAOYSA-N 0.000 description 1
- JNWIBFFQBLTCMJ-UHFFFAOYSA-N CC([n]1ncc2cc(I)ccc12)=O Chemical compound CC([n]1ncc2cc(I)ccc12)=O JNWIBFFQBLTCMJ-UHFFFAOYSA-N 0.000 description 1
- BGKLFAQCHHCZRZ-UHFFFAOYSA-N Cc(cc(cc1)I)c1N Chemical compound Cc(cc(cc1)I)c1N BGKLFAQCHHCZRZ-UHFFFAOYSA-N 0.000 description 1
- CMAOLVNGLTWICC-UHFFFAOYSA-N Cc(cc1C#N)ccc1F Chemical compound Cc(cc1C#N)ccc1F CMAOLVNGLTWICC-UHFFFAOYSA-N 0.000 description 1
- NGIUTERFVXJARU-UHFFFAOYSA-N N#Cc1cc(-c2c[nH]nn2)ccc1F Chemical compound N#Cc1cc(-c2c[nH]nn2)ccc1F NGIUTERFVXJARU-UHFFFAOYSA-N 0.000 description 1
- BIZHQRAAZMDWNK-UHFFFAOYSA-N N#Cc1cc(I)ccc1F Chemical compound N#Cc1cc(I)ccc1F BIZHQRAAZMDWNK-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/12—Drugs for genital or sexual disorders; Contraceptives for climacteric disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Pain & Pain Management (AREA)
- Oncology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Cardiology (AREA)
- Rheumatology (AREA)
- Pulmonology (AREA)
- Heart & Thoracic Surgery (AREA)
- Reproductive Health (AREA)
- Psychiatry (AREA)
- Immunology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Ophthalmology & Optometry (AREA)
- Hospice & Palliative Care (AREA)
- Obesity (AREA)
- Psychology (AREA)
- Communicable Diseases (AREA)
- Dermatology (AREA)
- Vascular Medicine (AREA)
Abstract
Description
Область изобретенияField of Invention
Настоящее изобретение относится к 5-замещенным индазол- содержащим соединениям, способам получения таких соединений, композициям, содержащим такие соединения, которые являются полезными для ингибирования киназ, таких как гликогенсинтаза-киназа 3 (GSK-3), Rho киназа (ROCK), Janus киназы (JAK), AKT, PAK4, PLK, CK2, KDR, MK2, JNKl, aurora, pim 1 и nek 2.The present invention relates to 5-substituted indazole-containing compounds, methods for producing such compounds, compositions containing such compounds that are useful for inhibiting kinases, such as glycogen synthase kinase 3 (GSK-3), Rho kinase (ROCK), Janus kinase (JAK), AKT, PAK4, PLK, CK2, KDR, MK2, JNKl, aurora, pim 1 and nek 2.
Предпосылки изобретенияBACKGROUND OF THE INVENTION
Протеинкиназы представляют собой класс ферментов, которые катализируют перенос фосфатной группы от АТФ к тирозиновому, сериновому, треониновому или гистидиновому остаткам, расположенным на белковом субстрате. Очевидно, что протеинкиназы играют определенную роль в нормальном клеточном росте. Многие белки рецепторов факторов роста содержат внутриклеточные домены, которые функционируют как протеинкиназы, и именно через эту функцию они осуществляют передачу сигнала. Взаимодействие факторов роста с их рецепторами является необходимым событием в нормальной регуляции клеточного роста, и состояние фосфорилирования белков субстрата часто связано с модуляцией клеточного роста.Protein kinases are a class of enzymes that catalyze the transfer of a phosphate group from ATP to tyrosine, serine, threonine or histidine residues located on a protein substrate. Obviously, protein kinases play a role in normal cell growth. Many growth factor receptor proteins contain intracellular domains that function as protein kinases, and it is through this function that they transmit signals. The interaction of growth factors with their receptors is a necessary event in the normal regulation of cell growth, and the state of phosphorylation of substrate proteins is often associated with modulation of cell growth.
Хорошо известно, что аномальное фосфорилирование белка может быть непосредственно связано с некоторыми болезненными состояниями или может быть фактором, способствующим началу развития таких заболеваний. Как результат, протеинкиназы являются целями, на которые направлены новые фармацевтические исследования (Cohen, P. Nature Reviews Drug Discovery, 1:309-315, 2002). Различные ингибиторы протеинкиназы имеют клиническое применение для лечения широкого ряда различных заболеваний, таких как рак, хронические воспалительные заболевания, диабет и удар.It is well known that abnormal protein phosphorylation can be directly associated with some disease states or it can be a factor contributing to the onset of such diseases. As a result, protein kinases are the targets of new pharmaceutical research (Cohen, P. Nature Reviews Drug Discovery, 1: 309-315, 2002). Various protein kinase inhibitors are clinically used to treat a wide range of different diseases, such as cancer, chronic inflammatory diseases, diabetes and stroke.
Протеинкиназы представляют собой большое и разнообразное семейство ферментов, которые катализируют фосфорилирование белка и играют ключевую роль в клеточной передаче сигнала. Протеинкиназы могут проявлять положительное или отрицательное регуляторное действие, в зависимости от их белков-мишеней. Протеинкиназы участвуют в специфических сигнальных путях, которые регулируют клеточные функции, такие как, но не ограничиваясь этим, метаболизм, развитие клеточного цикла, клеточную адгезию, функцию сосудов, апоптоз и ангиогенез. Как результат, нарушение клеточной сигнальной активности связывают со многими заболеваниями, наиболее характерные из которых включают рак и диабет. Регуляция сигнальной трансдукции цитокинами и связь сигнальных молекул с прото-онкогенами и опухоль-супрессорными генами были в достаточной степени документально подтверждены. Подобным образом, связь между диабетом, вирусными инфекциями и связанными с этим состояниями также относят за счет регуляции протеинкиназ.Protein kinases are a large and diverse family of enzymes that catalyze protein phosphorylation and play a key role in cell signaling. Protein kinases can exhibit a positive or negative regulatory effect, depending on their target proteins. Protein kinases are involved in specific signaling pathways that regulate cellular functions, such as, but not limited to, metabolism, cell cycle development, cell adhesion, vascular function, apoptosis and angiogenesis. As a result, impaired cellular signaling activity is associated with many diseases, the most characteristic of which include cancer and diabetes. The regulation of signal transduction by cytokines and the association of signal molecules with proto-oncogenes and tumor suppressor genes have been sufficiently documented. Similarly, the link between diabetes, viral infections, and related conditions is also attributed to the regulation of protein kinases.
Поскольку протеинкиназы регулируют почти каждый клеточный процесс, включая метаболизм, клеточную пролиферацию, клеточную дифференциацию и клеточное выживание, они являются привлекательными мишенями для терапевтического вмешательства при различных болезненных состояниях. Например, контроль клеточного цикла и ангиогенез, где протеинкиназы играют важную роль, представляют собой клеточные процессы, связанные с различными болезненными состояниями, такими как, но не ограничиваясь этим, рак, воспалительные заболевания, аномальный ангиогенез и связанные с этим заболевания, атеросклероз, дегенерация желтого пятна, диабет, ожирение и боль.Since protein kinases regulate almost every cellular process, including metabolism, cell proliferation, cell differentiation, and cell survival, they are attractive targets for therapeutic intervention in various disease states. For example, cell cycle control and angiogenesis, where protein kinases play an important role, are cellular processes associated with various disease states, such as, but not limited to, cancer, inflammatory diseases, abnormal angiogenesis and related diseases, atherosclerosis, yellow degeneration spots, diabetes, obesity and pain.
Выяснение запутанных путей протеинкиназ и сложности взаимосвязей и взаимодействия между различными протеинкиназами и киназными путями подчеркивает важность разработки фармацевтических средств, способных действовать как модуляторы, регуляторы или ингибиторы протеинкиназ, обладающие благоприятной активностью на различные киназы или различные киназные пути.Finding out the intricate pathways of protein kinases and the complexity of the relationships and interactions between different protein kinases and kinase pathways underscores the importance of developing pharmaceuticals that can act as modulators, regulators, or inhibitors of protein kinases that have beneficial activity on various kinases or different kinase pathways.
Поэтому предполагается, что из-за сложности внутриклеточных сигнальных каскадов протеинкиназных путей, средства, которые влияют на различные пути одновременно, могут быть необходимыми для существенной клинической активности. Хотя считается, что отдельно взятое средство, которое обеспечивает комбинированные эффекты, является привлекательным, существует необходимость в идентификации и применении отдельных средств, которые прицельно действуют на нужные комбинации и различные пути, которые являются клинически эффективными в условиях конкретного заболевания.Therefore, it is assumed that due to the complexity of the intracellular signaling cascades of protein kinase pathways, agents that affect different pathways simultaneously may be necessary for significant clinical activity. Although it is believed that a single agent that provides combined effects is attractive, there is a need for identification and application of individual agents that target the desired combinations and various pathways that are clinically effective in a particular disease.
Гликогенсинтаза-киназа-3 (GSK-3) представляет собой сериновую/треониновую киназу, кодируемую двумя изоформами, GSK-3α и GSK-3β, с молекулярной массой 51 и 47 кДа, соответственно. Они имеют 97% сходства последовательностей в их киназных каталитических доменах. GSK-3α изоформа имеет вытянутый глицин-обогащенный N-концевой хвост. Был идентифицирован минорный вариант сплайсинга GSK-3β (экспрессируемый на уровне ~15% от общего количества) с вставкой из 13 аминокислот в киназном домене. Этот вариант имел пониженную активность в отношении tau. GSK-3 сохранилась во многих видах в процессе эволюции, и до сих пор присутствует у всех млекопитающих с высокой гомологией в киназном домене. Обе изоформы экспрессируются во многих тканях млекопитающих, включая головной мозг. Фармакологические ингибиторы GSK-3 не могут селективно ингибировать одну из изоформ.Glycogen synthase kinase-3 (GSK-3) is a serine / threonine kinase encoded by two isoforms, GSK-3α and GSK-3β, with a molecular weight of 51 and 47 kDa, respectively. They have 97% sequence similarity in their kinase catalytic domains. The GSK-3α isoform has an elongated glycine-enriched N-terminal tail. A minor GSK-3β splicing variant was identified (expressed at ~ 15% of the total) with an insertion of 13 amino acids in the kinase domain. This variant had reduced tau activity. GSK-3 has survived in many species during evolution, and is still present in all mammals with high homology in the kinase domain. Both isoforms are expressed in many mammalian tissues, including the brain. Pharmacological inhibitors of GSK-3 cannot selectively inhibit one of the isoforms.
GSK-3β играет важную роль в контроле метаболизма, дифференциации и выживания. Первоначально она была идентифицирована как фермент, способный фосфорилировать и, следовательно, ингибировать гликогенсинтазу. В последствии, было установлено, что GSK-3β является идентичной tau протеинкиназе 1 (TPK1), ферменту, который фосфорилирует tau белок в эпитопах, которые, как было обнаружено, также гиперфосфорилируются при болезни Альцгеймера и некоторых таупатиях.GSK-3β plays an important role in controlling metabolism, differentiation and survival. It was originally identified as an enzyme capable of phosphorylating and therefore inhibiting glycogen synthase. Subsequently, GSK-3β was found to be identical to tau protein kinase 1 (TPK1), an enzyme that phosphorylates tau protein in epitopes that have also been found to be hyperphosphorylated in Alzheimer's disease and some taupathies.
Интересно, что фосфорилирование GSK-3β протеинкиназой B (AKT) приводит к потере киназной активности, и было сделано предположение, что это ингибирование может опосредовать некоторые эффекты нейротрофических факторов. Более того, фосфорилирование β-катенина (белка, участвующего в клеточном выживании), осуществляемое GSK-3β, приводит к его разрушению зависимым от убихитинилирования протеасомальным путем.Interestingly, phosphorylation of GSK-3β protein kinase B (AKT) leads to a loss of kinase activity, and it has been suggested that this inhibition may mediate some effects of neurotrophic factors. Moreover, the phosphorylation of β-catenin (a protein involved in cell survival) by GSK-3β leads to its destruction by a proteasome-dependent ubiquitinylation.
Поэтому оказалось, что ингибирование GSK-3β активности может привести к нейротрофической активности. Существуют доказательства, что литий, неконкурентный ингибитор GSK-3β, усиливает нейритогенез в некоторых моделях и может также повышать выживание нервных клеток через индукцию факторов выживания, таких как Bcl-2, и ингибирование экспрессии проапоптических факторов, таких как P53 и Bax.Therefore, it turned out that inhibition of GSK-3β activity can lead to neurotrophic activity. There is evidence that lithium, a non-competitive GSK-3β inhibitor, enhances neuritogenesis in some models and can also enhance nerve cell survival through the induction of survival factors such as Bcl-2 and the inhibition of the expression of proapoptotic factors such as P53 and Bax.
Дальнейшие исследования показали, что β-амилоид повышает активность GSK-3β и фосфорилирование белка tau. Более того, это гиперфосфорилирование, а также нейротоксические эффекты β-амилоида блокируются хлоридом лития и антисмысловой мРНК GSK-3β. Взятые вместе, эти наблюдения говорят о том, что GSK-3β может быть звеном между двумя основными патологическим процессами при болезни Альцгеймера: аномальный процессинг APP (амилоидный белок-предшественник) и гиперфосфорилирование белка tau.Further studies have shown that β-amyloid increases GSK-3β activity and tau protein phosphorylation. Moreover, this hyperphosphorylation as well as the neurotoxic effects of β-amyloid are blocked by lithium chloride and GSK-3β antisense mRNA. Taken together, these observations suggest that GSK-3β can be the link between the two main pathological processes in Alzheimer's disease: abnormal APP processing (amyloid precursor protein) and tau protein hyperphosphorylation.
Эти экспериментальные наблюдения показывают, что GSK-3β может найти применение в профилактике и лечении нейропатологических последствий и дефицита познавательной способности и внимания, связанных с болезнью Альцгеймера, а также других острых и хронических нейродегенеративных заболеваний. Они включают, но не ограничиваются этим: болезнь Паркинсона, таупатии (например, лобно-височно-теменная деменция, кортикобазальная дегенерация, болезнь Пика, прогрессирующий супрануклеарный паралич) и другие деменции, включая сосудистую деменцию; острый удар и другие травматические поражения; цереброваскулярные расстройства (например, возрастная дегенерация желтого пятна); травму головного и спинного мозга; периферические невропатии; ретинопатии и глаукому.These experimental observations show that GSK-3β can be used in the prevention and treatment of neuropathological consequences and cognitive and attention deficits associated with Alzheimer's disease, as well as other acute and chronic neurodegenerative diseases. These include, but are not limited to: Parkinson's disease, taupathy (eg, frontotemporal-parietal dementia, corticobasal degeneration, Peak disease, progressive supranuclear palsy) and other dementias, including vascular dementia; sharp blow and other traumatic lesions; cerebrovascular disorders (e.g. age-related macular degeneration); brain and spinal cord injury; peripheral neuropathies; retinopathy and glaucoma.
GSK-3β также может найти применение для лечения других заболеваний, таких как: инсулин-независимый диабет и ожирение; маниакально-депрессивное заболевание; шизофрения; алопеция; воспаления; раковые заболевания, такие как рак молочной железы, немелкоклеточная карцинома легкого, рак щитовидной железы, T или B-клеточный лейкоз и некоторые вирус-индуцированные опухоли.GSK-3β can also be used to treat other diseases, such as: insulin-independent diabetes and obesity; manic-depressive disease; schizophrenia; alopecia; inflammation cancers such as breast cancer, non-small cell lung carcinoma, thyroid cancer, T or B cell leukemia, and some virus-induced tumors.
Rho киназы (ROCK), первые Rho эффекторы, которые были описаны, представляют собой сериновые/треониновые киназы, которые играют важную роль в фундаментальных процессах клеточной миграции, клеточной пролиферации и клеточного выживания. Аномальную активацию Rho/ROCK пути наблюдали при различных расстройствах. Примеры болезненных состояний, где соединения по настоящему изобретению имеют потенциально полезные терапевтические эффекты, благодаря их анти-вазоспазматической активности, включают сердечно-сосудистые заболевания, такие как гипертензия, хроническая и застойная сердечная недостаточность, сердечная гипертрофия, рестеноз, хроническая почечная недостаточность, спазм сосудов головного мозга после субарахноидального кровоизлияния, легочная гипертензия и атеросклероз. Свойство мышечной релаксации также является полезным для лечения астмы, мужских эректильных дисфункций, женских сексуальных дисфункций и синдрома гиперреактивного мочевого пузыря. Повреждение головного и спинного мозга у взрослого позвоночного животного активирует ROCK, ингибируя посредством этого рост и распространение невритов. Ингибирование ROCK приводит к индукции роста новых аксонов, распространению аксонов через поражения в ЦНС, ускоренной регенерации и усиленному функциональному восстановлению после острого нейронного поражения у млекопитающих (повреждение спинного мозга, травматическое повреждение головного мозга). Также было подтверждено, что ингибирование Rho/ROCK пути является эффективным в других животных моделях нейродегенерации, например, удара, воспалительных и демиелинизирующих заболеваний, болезни Альцгеймера, а также для лечения боли. Ингибиторы Rho/ROCK пути поэтому обладают потенциалом для профилактики нейродегенерации и стимуляции нейрорегенерации при различных неврологических расстройствах, включая повреждение спинного мозга, болезнь Альцгеймера, удар, рассеянный склероз, амиотрофический боковой склероз, а также для лечения боли. Было показано, что ингибиторы ROCK обладают противовоспалительными свойствами. Таким образом, соединения по настоящему изобретению можно использовать для лечения нейровоспалительных заболеваний, таких как удар, рассеянный склероз, болезнь Альцгеймера, болезнь Гентингтона, болезнь Паркинсона, амиотрофический боковой склероз и воспалительная боль, а также других воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит, астма, синдром раздраженного кишечника, болезнь Крона, псориаз, язвенный колит, обыкновенная волчанка и воспалительное заболевание кишечника. Поскольку ингибиторы ROCK уменьшают клеточную пролиферацию и клеточную миграцию, они могли бы быть полезными для лечения рака и метастазов опухоли. Более того, если свидетельства, говорящие о том, что ингибиторы ROCK подавляют цитоскелетную реаранжировку при вирусной инвазии, таким образом, они также имеют потенциальную терапевтическую ценность для применения в качестве противовирусных и антибактериальных средств. Ингибиторы ROCK также являются полезными для лечения резистентности к инсулину и диабета. Кроме того, было показано, что ингибиторы ROCK уменьшают прогрессирование кистозного фиброза (Abstract S02.3, 8th World Congress on Inflammation, Copenhagen, Denmark, June 16-20, 2007).Rho kinases (ROCK), the first Rho effectors to be described, are serine / threonine kinases that play an important role in the fundamental processes of cell migration, cell proliferation and cell survival. Abnormal activation of the Rho / ROCK pathway has been observed in various disorders. Examples of disease states where the compounds of the present invention have potentially beneficial therapeutic effects due to their anti-vasospasmodic activity include cardiovascular diseases such as hypertension, chronic and congestive heart failure, cardiac hypertrophy, restenosis, chronic renal failure, spasm of the head vessels brain after subarachnoid hemorrhage, pulmonary hypertension and atherosclerosis. The muscle relaxation property is also useful for treating asthma, male erectile dysfunctions, female sexual dysfunctions, and hyperreactive bladder syndrome. Damage to the brain and spinal cord in an adult vertebrate activates ROCK, thereby inhibiting the growth and spread of neuritis. ROCK inhibition leads to the induction of new axon growth, axon propagation through lesions in the central nervous system, accelerated regeneration, and enhanced functional recovery after acute neural lesions in mammals (spinal cord injury, traumatic brain injury). It has also been confirmed that inhibition of the Rho / ROCK pathway is effective in other animal models of neurodegeneration, for example, stroke, inflammatory and demyelinating diseases, Alzheimer's disease, and also for the treatment of pain. Rho / ROCK pathway inhibitors therefore have the potential to prevent neurodegeneration and stimulate neuroregeneration in various neurological disorders, including spinal cord injury, Alzheimer's disease, stroke, multiple sclerosis, amyotrophic lateral sclerosis, and also for the treatment of pain. ROCK inhibitors have been shown to have anti-inflammatory properties. Thus, the compounds of the present invention can be used to treat neuroinflammatory diseases such as stroke, multiple sclerosis, Alzheimer's disease, Huntington's disease, Parkinson's disease, amyotrophic lateral sclerosis and inflammatory pain, as well as other inflammatory diseases such as rheumatoid arthritis, osteoarthritis, asthma, irritable bowel syndrome, Crohn's disease, psoriasis, ulcerative colitis, lupus erythematosus, and inflammatory bowel disease. Since ROCK inhibitors reduce cell proliferation and cell migration, they could be useful in treating cancer and tumor metastases. Moreover, if there is evidence that ROCK inhibitors suppress cytoskeletal rearrangement during viral invasion, thus they also have potential therapeutic value for use as antiviral and antibacterial agents. ROCK inhibitors are also useful for treating insulin resistance and diabetes. In addition, ROCK inhibitors have been shown to reduce the progression of cystic fibrosis (Abstract S02.3, 8th World Congress on Inflammation, Copenhagen, Denmark, June 16-20, 2007).
Кроме того, было показано, что Rho-ассоциированные закрученные в спираль-образующие спираль протеинкиназы (ROCK)-1 и -2 усиливают фосфорилирование легкой цепи миозина (MLC) путем ингибирования MLC фосфатазы, а также фосфорилирования MLC. Это приводит к регулированию сокращения актина-миозина. Последние сообщения показали, что ингибирование ROCK приводит к прерыванию воспалительного клеточного хемотаксиса, а также ингибированию сокращения гладких мышц в моделях легочного воспаления, связанного с астмой. Поэтому ингибиторы Rho/ROCK пути должны быть полезными для лечения астмы.In addition, it has been shown that Rho-associated helically-helix-forming protein kinases (ROCKs) -1 and -2 enhance myosin light chain phosphorylation (MLC) by inhibiting MLC phosphatase as well as MLC phosphorylation. This leads to regulation of actin-myosin reduction. Recent reports have shown that inhibition of ROCK interrupts inflammatory cellular chemotaxis, as well as inhibition of smooth muscle contraction in models of pulmonary inflammation associated with asthma. Therefore, Rho / ROCK pathway inhibitors should be useful in treating asthma.
Киназы Janus (JAK) представляют собой важное семейство внутриклеточных тирозиновых протеинкиназ (PTK) с 4 членами, присутствующими у млекопитающих, JAK1, JAK2, JAK3 и TYK2, также гомологами у цыпленка, рыб и Drosophila. JAK играют критическую роль в некоторых важных внутриклеточных сигнальных путях, включая основной путь JAK/STAT, центральный для опосредования передачи сигнала цитокинов. Именно эта центральная роль в передаче сигнала цитокинов подкрепляет мнение, что специфические ингибиторы JAK могут найти широкое терапевтическое применение в ситуациях, где активность цитокинов приводит к заболеванию. Важные примеры включают аутоиммунные заболевания, такие как ревматоидный артрит и псориаз, миелопролиферативные синдромы, такие как, лейкозы, лимфомы и сердечно-сосудистые заболевания.Janus kinases (JAK) are an important family of intracellular tyrosine protein kinases (PTKs) with 4 members present in mammals, JAK1, JAK2, JAK3 and TYK2, also homologs in chicken, fish and Drosophila. JAKs play a critical role in several important intracellular signaling pathways, including the main JAK / STAT pathway, central to mediate cytokine signaling. It is this central role in cytokine signaling that reinforces the belief that specific JAK inhibitors can find wide therapeutic application in situations where cytokine activity leads to disease. Important examples include autoimmune diseases such as rheumatoid arthritis and psoriasis, myeloproliferative syndromes such as leukemia, lymphomas, and cardiovascular diseases.
JAK2, член семейства киназ Janus (JAK) тирозиновых протеикиназ (PTK), является важным внутриклеточным медиатором передачи сигнала цитокинов. Мутации JAK2 гена связаны с гематологическими раковыми заболеваниями, и аберрантная JAK активность также связана с различными иммунными заболеваниями, включая ревматоидный артрит.JAK2, a member of the Janus kinase family (JAK) of tyrosine protein kinases (PTK), is an important intracellular mediator of cytokine signal transduction. Mutations of the JAK2 gene are associated with hematologic cancers, and aberrant JAK activity is also associated with various immune diseases, including rheumatoid arthritis.
Киназы Aurora представляют собой семейство мультигенных митотических сериновых-треониновых киназ, которые действуют как класс новых онкогенов. Эти киназы включают в качестве членов aurora-A, aurora-B и aurora-B. Они гиперактивируются и/или сверх-экспрессируются в некоторых солидных опухолях, включая, но, не ограничиваясь этим, рак молочной железы, яичников, предстательной железы, поджелудочной железы и колоректальный рак. В частности, aurora-A представляет собой центросомальную киназу, и ее локализация зависит от клеточного цикла и играет важную роль в развитии клеточного цикла и клеточной пролиферации. Aurora-A расположена в области 20ql3 хромосомы, которая часто амплифицируется в некоторых различных типах злокачественных опухолей, таких как колоректальный рак, рак молочной железы и мочевого пузыря. Ингибирование aurora киназной активности может помочь в уменьшении клеточной пролиферации, роста опухоли и потенциально онкогенеза.Aurora kinases are a family of multigenic mitotic serine-threonine kinases that act as a class of new oncogenes. These kinases include aurora-A, aurora-B, and aurora-B as members. They are hyperactivated and / or overexpressed in some solid tumors, including, but not limited to, breast, ovarian, prostate, pancreas and colorectal cancer. In particular, aurora-A is a centrosomal kinase, and its localization depends on the cell cycle and plays an important role in the development of the cell cycle and cell proliferation. Aurora-A is located in the 20ql3 region of the chromosome, which is often amplified in some different types of malignant tumors, such as colorectal cancer, breast and bladder cancer. Inhibition of aurora kinase activity may help in reducing cell proliferation, tumor growth, and potentially oncogenesis.
Следовательно, остается потребность в разработке способов, включающих применение лекарственного средства на основе одного активного вещества, способного прицельно действовать на несколько специфических типов киназ или киназных путей. В частности, такие способы воздействуют на нужную комбинацию нескольких мишеней с достижением, таким образом, клинической эффективности.Consequently, there remains a need for the development of methods involving the use of a drug based on one active substance capable of targeting several specific types of kinases or kinase pathways. In particular, such methods act on the desired combination of several targets, thereby achieving clinical efficacy.
Краткое описание изобретенияSUMMARY OF THE INVENTION
В основном варианте воплощения, настоящее изобретение обеспечивает соединения формулы (I)In a general embodiment, the present invention provides compounds of formula (I)
или их фармацевтически приемлемые соли, гдеor their pharmaceutically acceptable salts, where
A представляет собойA represents
R1 представляет собой водород, алкил, арил, гетероцикл, гетероарил, RaRbN-, RcRdN-C(O)- или RcRdN-S(O)2-;R 1 represents hydrogen, alkyl, aryl, heterocycle, heteroaryl, R a R b N-, R c R d NC (O) - or R c R d NS (O) 2 -;
R2 представляет собой водород, алкоксикарбонил, алкил, алкилкарбонил, арилкарбонил, гетероциклкарбонил или ReRfN-алкил-C(O)-;R 2 represents hydrogen, alkoxycarbonyl, alkyl, alkylcarbonyl, arylcarbonyl, heterocyclecarbonyl or R e R f N-alkyl-C (O) -;
R3 представляет собой алкил, алкокси, арил, циано, циклоалкил, галоген, галогеналкил, гетероарил, нитро или RgRhN-;R 3 represents alkyl, alkoxy, aryl, cyano, cycloalkyl, halogen, haloalkyl, heteroaryl, nitro or R g R h N-;
R4 представляет собой алкил, алкоксиалкил, арил, циклоалкил, гетероарил, гетероцикл, гетероциклалкил, RjRkN- или RjRkN-алкил-;R 4 represents alkyl, alkoxyalkyl, aryl, cycloalkyl, heteroaryl, heterocycle, heterocyclalkyl, R j R k N - or R j R k N-alkyl;
R5 представляет собой алкил, арил или гетероарил;R 5 represents alkyl, aryl or heteroaryl;
R6 представляет собой алкил, алкоксиалкил, RjRkN-алкил-, арил, циклоалкил или гетероарил;R 6 represents alkyl, alkoxyalkyl, R j R k N-alkyl-, aryl, cycloalkyl or heteroaryl;
R7 представляет собой алкил, арил или гетероарил;R 7 represents alkyl, aryl or heteroaryl;
Ra и Rb, каждый независимо, представляют собой водород, алкил, арилалкил, циклоалкил, циклоалкилалкил, гетероарилалкил, R4-C(O)- или R5-S(O)2-;R a and R b each independently represent hydrogen, alkyl, arylalkyl, cycloalkyl, cycloalkylalkyl, heteroarylalkyl, R 4 -C (O) - or R 5 -S (O) 2 -;
Rc и Rd, каждый независимо, представляют собой водород, алкил или гетероарил;R c and R d each independently represent hydrogen, alkyl or heteroaryl;
Re и Rf, каждый независимо, представляют собой водород, алкил, арилалкил, гетероарилалкил, R6-C(O)- или R7-S(O)2-;R e and R f each independently represent hydrogen, alkyl, arylalkyl, heteroarylalkyl, R 6 —C (O) - or R 7 —S (O) 2 -;
Rg и Rh, каждый независимо, представляют собой водород, алкил или алкилкарбонил;R g and R h each independently represent hydrogen, alkyl or alkylcarbonyl;
Rj и Rk, каждый независимо, представляют собой водород, алкил, арил, арилалкил, циклоалкил, гетероарил или гетероцикл;R j and R k each independently represent hydrogen, alkyl, aryl, arylalkyl, cycloalkyl, heteroaryl or heterocycle;
Ri, Rii, Riii, Riv, Rv, Rvi, Rvii, Rviii, Rix, Rx, Rxi, Rxii, Rxiii, Rxiv, Rxv, Rxvi, Rxvii, Rxviii, Rxix, Rxx, Rxxi, Rxxii и Rxxiii, каждый независимо, представляют собой алкил, алкокси, алкоксиалкил, алкоксикарбонил, алкоксикарбонилалкил, арил, арилалкил, арил(гидрокси)алкил, арилоксиалкил, арилкарбонил, арилтиоалкил, карбокси, карбоксиалкил, цианоалкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, галоген, гетероарил, гетероарилалкил, гетероцикл, гетероциклалкил, гетероциклкарбонил, гидроксиалкил, триалкилсилилалкил, H2NC(O)-алкил, ZaZbN-, ZaZbNалкил, ZcZdNC(O)- или ZcZdNS(O)2-, где RXiV, Rxv, RXVi и RXVii могут присутствовать по любой открытой валентности в соединениях (xiv), (xv), (xvi) или (xvii);R i , R ii , R iii , R iv , R v , R vi , R vii , R viii , R ix , R x , R xi , R xii , R xiii , R xiv , R xv , R xvi , R xvii , R xviii , R xix , R xx , R xxi , R xxii and R xxiii are each independently alkyl, alkoxy, alkoxyalkyl, alkoxycarbonyl, alkoxycarbonylalkyl, aryl, arylalkyl, aryl (hydroxy) alkyl, aryloxyalkyl, arylcarbonyl, carboxy, carboxyalkyl, cyanoalkyl, cycloalkyl, cycloalkylalkyl, cycloalkylcarbonyl, halogen, heteroaryl, heteroarylalkyl, heterocycle geterotsiklalkil, heterocycle-hydroxyalkyl, trialkylsilylalkyl, H 2 NC (O) -alkyl, Z a Z b N-, Z a Z b Nalkil, Z c Z d NC (O) - or Z c Z d NS (O) 2 -, where R XiV , R xv , R XVi and R XVii may be present by any open valency in compounds (xiv), (xv), (xvi) or (xvii);
Za и Zb, каждый независимо, представляют собой водород, алкил, алкоксикарбонилалкил, арил, арилалкил, циклоалкил, H2NC(O)-, H2NалкилC(O)-, H2NC(O)-алкил, диалкилNC(O)- или диалкилNC(O)-алкил-;Z a and Z b each independently represent hydrogen, alkyl, alkoxycarbonylalkyl, aryl, arylalkyl, cycloalkyl, H 2 NC (O) -, H 2 N alkyl C (O) -, H 2 NC (O) -alkyl, dialkyl NC ( O) - or dialkylNC (O) -alkyl-;
Zc и Zd, каждый независимо, представляют собой водород, алкил, алкоксиалкил, арил, арилалкил, арил(гидрокси)алкил, циклоалкил, циклоалкилалкил, гетероарилалкил, гетероцикл, гетероциклалкил, гидроксиалкил, H2NC(O)-алкил-, диалкилNC(O)-алкил-, диалкилN-алкил- или CHZeZf;Z c and Z d each independently represent hydrogen, alkyl, alkoxyalkyl, aryl, arylalkyl, aryl (hydroxy) alkyl, cycloalkyl, cycloalkylalkyl, heteroarylalkyl, heterocycle, heterocyclalkyl, hydroxyalkyl, H 2 NC (O) -alkyl-, dialkylNC (O) -alkyl-, dialkylN-alkyl- or CHZ e Z f ;
Ze представляет собой арил или гетероарил;Z e represents aryl or heteroaryl;
Zf представляет собой гетероарилалкил, гетероциклалкил или Z1Z2N-алкил-;Z f represents heteroarylalkyl, heterocycloalkyl or Z 1 Z 2 N-alkyl-;
m имеет значение 0, 1 или 2;m is 0, 1 or 2;
a имеет значение 0 или 1;a is 0 or 1;
b имеет значение 0, 1 или 2;b is 0, 1 or 2;
c имеет значение 0, 1, 2 или 3; иc is 0, 1, 2 or 3; and
d имеет значение 0, 1, 2, 3 или 4.d is 0, 1, 2, 3 or 4.
Также обеспечиваются фармацевтически приемлемые композиции, включающие терапевтически эффективное количество соединения формулы (I) в сочетании с фармацевтически приемлемым носителем.Also provided are pharmaceutically acceptable compositions comprising a therapeutically effective amount of a compound of formula (I) in combination with a pharmaceutically acceptable carrier.
Целью настоящего изобретения является обеспечение соединений, которые являются полезными для профилактики или лечения заболеваний, вызванных аномальной активностью протеинкиназы. Кроме того, изобретение также обеспечивает фармацевтически эффективные композиции соединений по настоящему изобретению, которые являются полезными для профилактики или лечения указанных заболеваний.The aim of the present invention is the provision of compounds that are useful for the prevention or treatment of diseases caused by abnormal activity of protein kinase. In addition, the invention also provides pharmaceutically effective compositions of the compounds of the present invention, which are useful for the prevention or treatment of these diseases.
Настоящее изобретение также относится к фармацевтической композиции, которая включает, по меньшей мере, одно 5-замещенное индазольное соединение формулы (I), которое может существовать в виде его фармацевтически приемлемой соли или пролекарства, в присутствии или в отсутствие фармацевтически приемлемых носителей, драже, адъювантов или других вспомогательных веществ.The present invention also relates to a pharmaceutical composition, which includes at least one 5-substituted indazole compound of formula (I), which may exist in the form of a pharmaceutically acceptable salt or prodrug thereof, in the presence or absence of pharmaceutically acceptable carriers, pills, adjuvants or other excipients.
Соединения по настоящему изобретению обладают ингибируещей активностью в отношении GSK-3, ROCK-1, ROCK-2, JAK2, а также других киназ и являются полезными для ингибирования таких киназ. Некоторые соединения по настоящему изобретению являются селективными в отношении одной или нескольких киназ и могут быть полезными для селективного ингибирования таких киназ. Следовательно, соединения по настоящему изобретению являются полезными в качестве активного ингредиента для получения композиции, которая обеспечивает возможность профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK-3, и, более конкретно, нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Кроме того, соединения по настоящему изобретению также являются полезными в качестве активного ингредиента для получения композиции для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона, таупатии (например, лобно-височно-теменная деменция, кортикобазальная дегенерация, болезнь Пика, прогрессирующей супрануклеарный паралич) и других деменций, включая сосудистую деменцию; острый удар и другие травматические поражения; цереброваскулярные расстройства (например, возрастная дегенерация желтого пятна); травма головного и спинного мозга; периферические невропатии; ретинопатия и глаукома; и других заболеваний, таких как инсулин-независимый диабет (такой как диабет типа II) и ожирение; маниакально-депрессивное заболевание; шизофрения; алопеция; раковые заболевания, такие как рак молочной железы, немелкоклеточная карцинома легкого, рак щитовидной железы, T или B-клеточный лейкоз и некоторые вирус-индуцированные опухоли.The compounds of the present invention have inhibitory activity against GSK-3, ROCK-1, ROCK-2, JAK2, as well as other kinases, and are useful for inhibiting such kinases. Some compounds of the present invention are selective for one or more kinases and may be useful for selectively inhibiting such kinases. Therefore, the compounds of the present invention are useful as an active ingredient in the preparation of a composition that provides the possibility of prophylactic and / or therapeutic treatment of a disease caused by abnormal activity of GSK-3, and, more specifically, of neurodegenerative diseases such as Alzheimer's disease. In addition, the compounds of the present invention are also useful as an active ingredient for preparing a composition for the prophylactic and / or therapeutic treatment of neurodegenerative diseases such as Parkinson's disease, tauopathy (e.g., frontotemporal-parietal dementia, corticobasal degeneration, Peak's disease, progressive supranuclear palsy) and other dementias, including vascular dementia; sharp blow and other traumatic lesions; cerebrovascular disorders (e.g. age-related macular degeneration); trauma to the brain and spinal cord; peripheral neuropathies; retinopathy and glaucoma; and other diseases, such as insulin-independent diabetes (such as type II diabetes) and obesity; manic-depressive disease; schizophrenia; alopecia; cancers such as breast cancer, non-small cell lung carcinoma, thyroid cancer, T or B cell leukemia, and some virus-induced tumors.
Подробное описание изобретенияDETAILED DESCRIPTION OF THE INVENTION
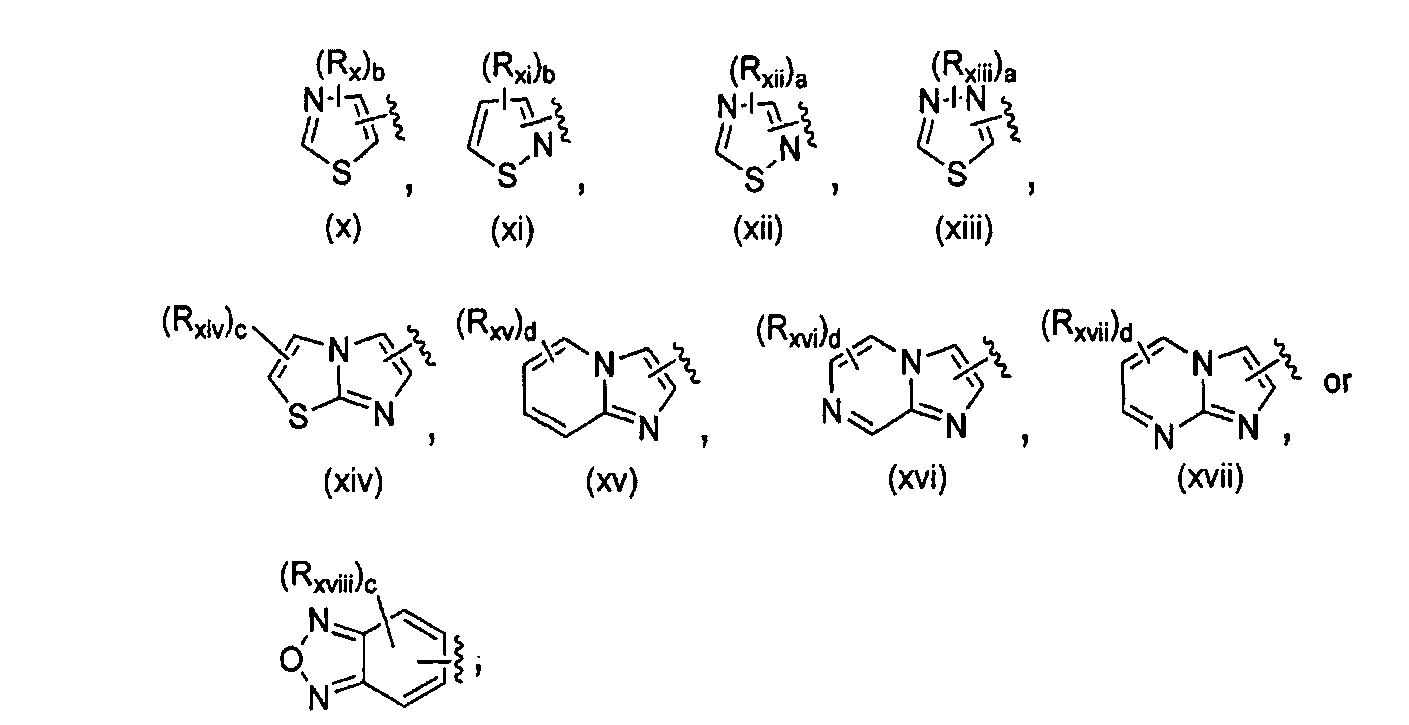
Соединения по настоящему изобретению имеют формулу (I), описанную выше. Более конкретно, соединения формулы (I) могут включать, но не ограничиваются этим, соединения, где A представляет собой (ii), (iii), (iv), (vii), (x), (xiv), (xv), (xvi), (xvii), (xviii), (xix), (xx), (xxi), (xxii) или (xxiii).The compounds of the present invention have the formula (I) described above. More specifically, compounds of formula (I) may include, but are not limited to, compounds where A is (ii), (iii), (iv), (vii), (x), (xiv), (xv), (xvi), (xvii), (xviii), (xix), (xx), (xxi), (xxii) or (xxiii).
В другом варианте воплощения настоящего изобретения раскрывается соединение формулы (I), где A представляет собой (ii),In another embodiment, a compound of formula (I) is disclosed wherein A is (ii),
R1 представляет собой водород, арил, гетероарил, гетероцикл, RaRbN- или RcRdN-C(O)-; R2 представляет собой водород, алкоксикарбонил, гетероциклкарбонил, алкилкарбонил или ReRfN-алкил-C(O)-; R4 представляет собой алкил, алкоксиалкил, арил, циклоалкил, гетероцикл, гетероциклалкил, RjRkN- или RjRkN-алкил-; R5 представляет собой алкил, арил или гетероарил; Ra и Rb, каждый независимо, представляют собой водород, арилалкил, циклоалкилалкил, R4-C(О)- или R5-S(O)2-; Rc и Rd, каждый независимо, представляют собой водород или гетероарил, Re и Rf, каждый независимо, представляют собой водород или алкил, Rj и Rk, каждый независимо, представляют собой водород, алкил, арил, циклоалкил или гетероцикл; Rii представляет собой алкил, алкоксиалкил, алкоксикарбонил, арил, арилалкил, арил(гидрокси)алкил, арилоксиалкил, арилкарбонил, алкоксикарбонилалкил, арилтиоалкил, карбокси, карбоксиалкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, галоген, гетероарил, гетероарилалкил, гетероцикл, гетероциклалкил, гетероциклкарбонил, гидроксиалкил, триалкилсилилалкил, ZaZbN-, ZaZbNалкил- или ZcZdNC(О)-; Za и Zb, каждый независимо, представляют собой водород, алкил или H2NалкилC(O)-; Zc и Zd, каждый независимо, представляют собой водород, алкил, алкоксиалкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарилалкил, гетероциклалкил, гидроксиалкил или диалкилN-алкил-; m имеет значение 0; и b имеет значение 0, 1 или 2.R 1 represents hydrogen, aryl, heteroaryl, heterocycle, R a R b N - or R c R d NC (O) -; R 2 represents hydrogen, alkoxycarbonyl, heterocyclecarbonyl, alkylcarbonyl or R e R f N-alkyl-C (O) -; R 4 represents alkyl, alkoxyalkyl, aryl, cycloalkyl, heterocycle, heterocycloalkyl, R j R k N- or R j R k N-alkyl-; R 5 represents alkyl, aryl or heteroaryl; R a and R b each independently represent hydrogen, arylalkyl, cycloalkylalkyl, R 4 -C (O) - or R 5 -S (O) 2 -; R c and R d each independently represent hydrogen or heteroaryl, R e and R f each independently represent hydrogen or alkyl, R j and R k each independently represent hydrogen, alkyl, aryl, cycloalkyl or heterocycle ; R ii represents alkyl, alkoxyalkyl, alkoxycarbonyl, aryl, arylalkyl, aryl (hydroxy) alkyl, aryloxyalkyl, arylcarbonyl, alkoxycarbonylalkyl, arylthioalkyl, carboxy, carboxyalkyl, cycloalkyl, cycloalkylalkylalkylalkylalkylalkylalkylalkylalkyl hydroxyalkyl, trialkylsilylalkyl, Z a Z b N-, Z a Z b N alkyl, or Z c Z d NC (O) -; Z a and Z b each independently represent hydrogen, alkyl or H 2 N alkyl C (O) -; Z c and Z d each independently represent hydrogen, alkyl, alkoxyalkyl, aryl, arylalkyl, cycloalkyl, cycloalkylalkyl, heteroarylalkyl, heterocycloalkyl, hydroxyalkyl or dialkyl N-alkyl-; m is 0; and b is 0, 1 or 2.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (iii),In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (iii),
R1 представляет собой водород или RaRbN-; R2 представляет собой водород; R4 представляет собой RjRkN-алкил-; Ra и Rb, каждый независимо, представляют собой водород или R4-C(O)-; Rj и Rk, каждый, представляют собой алкил; Riii представляет собой алкоксикарбонилалкил, алкил, арилалкил, цианоалкил, гетероциклалкил или H2NC(O)-алкил-; c имеет значение 0, 1 или 2; и m имеет значение 0.R 1 represents hydrogen or R a R b N-; R 2 represents hydrogen; R 4 represents R j R k N-alkyl-; R a and R b each independently represent hydrogen or R 4 —C (O) -; R j and R k are each alkyl; R iii represents alkoxycarbonylalkyl, alkyl, arylalkyl, cyanoalkyl, heterocycloalkyl or H 2 NC (O) -alkyl-; c is 0, 1 or 2; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (iv),In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (iv),
R1 представляет собой водород или R3RbN-; R2 представляет собой водород; R3 и Rb, каждый, представляют собой водород; RiV представляет собой арил, арилалкил, гетероцикл, гетероциклалкил, ZaZbNалкил или ZcZdNS(O)2-; Za и Zb, каждый независимо, представляют собой водород или алкил; Zc и Zd, каждый, представляют собой алкил; c имеет значение 0, 1 или 2; и m имеет значение 0.R 1 represents hydrogen or R 3 R b N-; R 2 represents hydrogen; R 3 and R b each represent hydrogen; R iV represents aryl, arylalkyl, heterocycle, heterocyclalkyl, Z a Z b N alkyl or Z c Z d NS (O) 2 -; Z a and Z b each independently represent hydrogen or alkyl; Z c and Z d each represent alkyl; c is 0, 1 or 2; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (vii),In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (vii),
R1 представляет собой водород, алкил или RaRbN; R2 представляет собой водород; Ra и Rb, каждый, представляют собой водород; RVii представляет собой алкил, алкоксикарбонил, арил, арилалкил, циклоалкил, гетероциклалкил, гетероциклкарбонил, гидроксиалкил или ZcZdNC(O)-; Zc и Zd, каждый независимо, представляют собой водород, алкил, алкоксиалкил, арил, арилалкил, арил(гидрокси)алкил, циклоалкил, циклоалкилалкил, гетероарилалкил, гетероцикл, гетероциклалкил, гидроксиалкил или CHZeZf, Ze представляет собой арил или гетероарил, Zf представляет собой гетероарилалкил, гетероциклалкил или Z1Z2N-алкил-; b имеет значение 1; и m имеет значение 0.R 1 represents hydrogen, alkyl or R a R b N; R 2 represents hydrogen; R a and R b each represent hydrogen; R Vii represents alkyl, alkoxycarbonyl, aryl, arylalkyl, cycloalkyl, heterocycloalkyl, heterocyclecarbonyl, hydroxyalkyl or Z c Z d NC (O) -; Z c and Z d each independently represent hydrogen, alkyl, alkoxyalkyl, aryl, arylalkyl, aryl (hydroxy) alkyl, cycloalkyl, cycloalkylalkyl, heteroarylalkyl, heterocycle, heterocyclalkyl, hydroxyalkyl or CHZ e Z f , Z e represents aryl or heteroaryl, Z f represents heteroarylalkyl, heterocycloalkyl or Z 1 Z 2 N-alkyl-; b is 1; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (x),In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (x),
R1 представляет собой водород; R2 представляет собой водород; Rx представляет собой алкил, арил или ZaZbN-; Za и Zb, каждый независимо, представляют собой водород, алкил, арил или арилалкил; b имеет значение 1 или 2; и m имеет значение 0.R 1 represents hydrogen; R 2 represents hydrogen; R x represents alkyl, aryl or Z a Z b N-; Z a and Z b each independently represent hydrogen, alkyl, aryl or arylalkyl; b is 1 or 2; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xiv),In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (xiv),
R1 представляет собой водород; R2 представляет собой водород; RXiV представляет собой ZaZbN-; Za и Zb, каждый независимо, представляют собой водород или циклоалкил; c имеет значение 1; и m имеет значение 0.R 1 represents hydrogen; R 2 represents hydrogen; R XiV represents Z a Z b N-; Z a and Z b each independently represent hydrogen or cycloalkyl; c is 1; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xv),In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (xv),
(xv)(xv)
R1 представляет собой водород или R3RbN-; R2 представляет собой водород; R3 и Rb, каждый, представляют собой водород; Rxv представляет собой ZaZbN-; Za и Zb, каждый независимо, представляют собой водород, алкоксикарбонилалкил, арил, арилалкил или циклоалкил; d имеет значение 0 или 1; и m имеет значение 0.R 1 represents hydrogen or R 3 R b N-; R 2 represents hydrogen; R 3 and R b each represent hydrogen; R xv represents Z a Z b N-; Z a and Z b each independently represent hydrogen, alkoxycarbonylalkyl, aryl, arylalkyl or cycloalkyl; d is 0 or 1; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xvi)In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (xvi)
R1 представляет собой водород; R2 представляет собой водород; RXVi представляет собой ZaZbN-; Za и Zb, каждый независимо, представляют собой водород или циклоалкил; d имеет значение 1; и m имеет значение 0.R 1 represents hydrogen; R 2 represents hydrogen; R XVi represents Z a Z b N-; Z a and Z b each independently represent hydrogen or cycloalkyl; d is 1; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xvii)In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (xvii)
R1 представляет собой водород; R2 представляет собой водород; RXVii представляет собой арил или ZaZbN-; Za и Zb, каждый независимо, представляют собой водород, алкил, алкоксикарбонилалкил, арил, арилалкил, циклоалкил или H2NC(O)-алкил-; d имеет значение 0 или 1; и m имеет значение 0.R 1 represents hydrogen; R 2 represents hydrogen; R XVii represents aryl or Z a Z b N-; Z a and Z b each independently represent hydrogen, alkyl, alkoxycarbonylalkyl, aryl, arylalkyl, cycloalkyl or H 2 NC (O) -alkyl-; d is 0 or 1; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xviii)In another embodiment of the present invention, a compound of formula (I) is disclosed wherein A is (xviii)
R1 представляет собой RaRbN-; R2 представляет собой водород; Ra и Rb, каждый, представляют собой водород; c имеет значение 0; и m имеет значение 0.R 1 represents R a R b N-; R 2 represents hydrogen; R a and R b each represent hydrogen; c is 0; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xix)In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (xix)
R1 представляет собой RaRbN-; R2 представляет собой водород; Ra и Rb, каждый независимо, представляют собой водород; c имеет значение 0; и m имеет значение 0.R 1 represents R a R b N-; R 2 represents hydrogen; R a and R b each independently represent hydrogen; c is 0; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xx)In another embodiment of the present invention, a compound of formula (I) is disclosed wherein A is (xx)
R1 представляет собой RaRbN-; R2 представляет собой водород; R4 представляет собой RjRkN-алкил-; Ra и Rb, каждый, представляют собой водород или R4-C(O)-; Rj и Rk независимо представляют собой алкил; Rxx представляет собой ZaZbN- или гетероцикл; Za и Zb независимо представляют собой водород или алкил; c имеет значение 0 или 1; и m имеет значение 0.R 1 represents R a R b N-; R 2 represents hydrogen; R 4 represents R j R k N-alkyl-; R a and R b each represent hydrogen or R 4 —C (O) -; R j and R k independently represent alkyl; R xx represents Z a Z b N - or a heterocycle; Z a and Z b independently represent hydrogen or alkyl; c is 0 or 1; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xxi)In another embodiment of the present invention, a compound of formula (I) is disclosed wherein A is (xxi)
R1 представляет собой RaRbN-; R2 представляет собой водород; Ra и Rb, каждый, представляют собой водород; RXXi представляет собой алкокси; d имеет значение 1; и m имеет значение 0.R 1 represents R a R b N-; R 2 represents hydrogen; R a and R b each represent hydrogen; R XXi represents alkoxy; d is 1; and m has a value of 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xxii)In another embodiment of the present invention, a compound of formula (I) is disclosed, wherein A is (xxii)
R1 представляет собой RaRbN-; R2 представляет собой водород; R4 представляет собой RjRkN-алкил-; Ra и Rb, каждый независимо, представляют собой водород или R4-C(O)-; Rj и Rk, каждый, представляют собой алкил; c имеет значение 0 и m имеет значение 0.R 1 represents R a R b N-; R 2 represents hydrogen; R 4 represents R j R k N-alkyl-; R a and R b each independently represent hydrogen or R 4 —C (O) -; R j and R k are each alkyl; c is 0 and m is 0.
В другом варианте воплощения настоящего изобретения, раскрывается соединение формулы (I), где A представляет собой (xxiii)In another embodiment of the present invention, a compound of formula (I) is disclosed wherein A is (xxiii)
R1 представляет собой RaRbN-; R2 представляет собой водород; Ra и Rb, каждый, представляют собой водород; c имеет значение 0; и m имеет значение 0.R 1 represents R a R b N-; R 2 represents hydrogen; R a and R b each represent hydrogen; c is 0; and m has a value of 0.
Конкретные варианты воплощения, рассматриваемые как часть настоящего изобретения, включают, но не ограничиваются этим, соединения формулы (I), например:Specific embodiments contemplated as part of the present invention include, but are not limited to, compounds of formula (I), for example:
5-(1-бензил-1H-1,2,3-триазол-5-ил)-1H-индазольное соединение с 5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазолом;5- (1-benzyl-1H-1,2,3-triazol-5-yl) -1H-indazole compound with 5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H indazole;
5-(1H-1,2,3-триазол-5-ил)-1H-индазол;5- (1H-1,2,3-triazol-5-yl) -1H-indazole;
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол;5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5-[1-(2-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(3-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (3-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(4-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (4-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(3-метоксибензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (3-methoxybenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(2-фторбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(3-фторбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (3-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(4-фторбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (4-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(2-хлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(3-хлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (3-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(4-хлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (4-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(2-бромбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2-bromobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(2-нитробензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(3-нитробензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (3-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(4-нитробензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (4-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
2-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил}бензонитрил;2 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile;
3-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил}бензонитрил;3 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile;
4-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил}бензонитрил;4 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile;
5-{1-[2-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1- [2- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5-{1-[3-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1- [3- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5-{1-[4-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1- [4- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5-{1-[3-(трифторметокси)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1- [3- (trifluoromethoxy) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5-{1-[4-(трифторметокси)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1- [4- (trifluoromethoxy) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5-[1-(4-трет-бутилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (4-tert-butylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
метил 3-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил} бензоат;methyl 3 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzoate;
метил 4-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил}бензоат;methyl 4 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzoate;
5-[1-(2,4-диметилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2,4-dimethylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(3,5-диметилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (3,5-dimethylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(2,3-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2,3-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(2,4-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2,4-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(2,5-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (2,5-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-(3,5-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (3,5-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-{1-[2,4-бис(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1- [2,4-bis (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
N-циклогексил-6-(1H-индазол-5-ил)имидазо[2,1-b][1,3]тиазол-5-амин;N-cyclohexyl-6- (1H-indazol-5-yl) imidazo [2,1-b] [1,3] thiazol-5-amine;
N-циклогексил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-амин;N-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine;
N-циклогексил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиразин-3-амин;N-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrazin-3-amine;
5-[1-бензил-4-(4-фторфенил)-1H-индазол-5-ил]-1H-индазол;5- [1-benzyl-4- (4-fluorophenyl) -1H-indazol-5-yl] -1H-indazole;
N-{3-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-индазол-1-ил]пропил}-N,N-диметиламин;N- {3- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-indazol-1-yl] propyl} -N, N-dimethylamine;
N-циклогексил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-амин;N-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine;
5-[4-(4-фторфенил)-1-(1-фенилэтил)-1H-индазол-5-ил]-1H-индазол;5- [4- (4-fluorophenyl) -1- (1-phenylethyl) -1H-indazol-5-yl] -1H-indazole;
2-(1H-индазол-5-ил)-N-изопропилимидазо[1,2-a]пиримидин-3-амин;2- (1H-indazol-5-yl) -N-isopropylimidazo [1,2-a] pyrimidin-3-amine;
4-(1H-индазол-5-ил)-N-фенил-1,3-тиазол-2-амин;4- (1H-indazol-5-yl) -N-phenyl-1,3-thiazol-2-amine;
5-(2-метил-1,3-тиазол-4-ил)-1H-индазол;5- (2-methyl-1,3-thiazol-4-yl) -1H-indazole;
N-этил-4-(1H-индазол-5-ил)-1,3-тиазол-2-амин;N-ethyl-4- (1H-indazol-5-yl) -1,3-thiazol-2-amine;
N-бензил-4-(1H-индазол-5-ил)-1,3-тиазол-2-амин;N-benzyl-4- (1H-indazol-5-yl) -1,3-thiazol-2-amine;
4-(1H-индазол-5-ил)-1,3-тиазол-2-амин;4- (1H-indazol-5-yl) -1,3-thiazol-2-amine;
4-(1H-индазол-5-ил)-N-(2-фенилэтил)-1,3-тиазол-2-амин;4- (1H-indazol-5-yl) -N- (2-phenylethyl) -1,3-thiazol-2-amine;
N-бензил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-амин;N-benzyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine;
N-бутил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-амин;N-butyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine;
N-(4-хлорфенил)-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-амин;N- (4-chlorophenyl) -2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine;
2-(1H-индазол-5-ил)-N-(4-метоксифенил)имидазо[1,2-a]пиримидин-3-амин;2- (1H-indazol-5-yl) -N- (4-methoxyphenyl) imidazo [1,2-a] pyrimidin-3-amine;
2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин;2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidine;
метил N-[2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-ил]глицинат;methyl N- [2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-yl] glycinate;
N-бензил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-амин;N-benzyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine;
N-(4-хлорфенил)-2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-амин;N- (4-chlorophenyl) -2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine;
2-(1H-индазол-5-ил)-N-(4-метоксифенил)имидазо[1,2-a]пиридин-3-амин;2- (1H-indazol-5-yl) -N- (4-methoxyphenyl) imidazo [1,2-a] pyridin-3-amine;
трет-бутил 4-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-индазол-1-ил}пиперидин-1-карбоксилат;tert-butyl 4- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-indazol-1-yl} piperidine-1-carboxylate;
3,5-бис(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол;3,5-bis (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5-(1-бензил-1H-1,2,3-триазол-4-ил)-3-фенил-1H-индазол;5- (1-benzyl-1H-1,2,3-triazol-4-yl) -3-phenyl-1H-indazole;
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин;5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1-[(1-метилпиперидин-4-ил)карбонил]-1H-индазол-3-амин;5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1 - [(1-methylpiperidin-4-yl) carbonyl] -1H-indazol-3-amine;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-метоксиацетамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-methoxyacetamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide;
Ν-[5-(1-бензил-lΗ-1,2,3-триазол-4-ил)-lΗ-индазол-3-ил]бутанамид;Ν- [5- (1-benzyl-lΗ-1,2,3-triazol-4-yl) -lΗ-indazol-3-yl] butanamide;
5-[4-(4-фторфенил)-1-пиперидин-4-ил-1H-индазол-5-ил]-1H-индазол;5- [4- (4-fluorophenyl) -1-piperidin-4-yl-1H-indazol-5-yl] -1H-indazole;
5-{4-(4-фторфенил)-1-[2-(1-метилпирролидин-2-ил)этил]-1H-индазол-5-ил}-1H-индазол;5- {4- (4-fluorophenyl) -1- [2- (1-methylpyrrolidin-2-yl) ethyl] -1H-indazol-5-yl} -1H-indazole;
5-{4-(4-фторфенил)-1-[3-(4-метилпиперазин-1-ил)пропил]-1H-индазол-5-ил}-1H-индазол;5- {4- (4-fluorophenyl) -1- [3- (4-methylpiperazin-1-yl) propyl] -1H-indazol-5-yl} -1H-indazole;
этил 5-(1H-индазол-5-ил)изоксазол-3-карбоксилат;ethyl 5- (1H-indazol-5-yl) isoxazole-3-carboxylate;
5-(1H-индазол-5-ил)-N-метилизоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N-methylisoxazole-3-carboxamide;
5-(3-бензилизоксазол-5-ил)-1H-индазол;5- (3-benzylisoxazol-5-yl) -1H-indazole;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide;
5-(3-пропилизоксазол-5-ил)-1H-индазол;5- (3-propylisoxazol-5-yl) -1H-indazole;
N-бензил-4-(1H-индазол-5-ил)-5-фенил-1,3-тиазол-2-амин;N-benzyl-4- (1H-indazol-5-yl) -5-phenyl-1,3-thiazol-2-amine;
4-(1H-индазол-5-ил)-N,5-дифенил-1,3-тиазол-2-амин;4- (1H-indazol-5-yl) -N, 5-diphenyl-1,3-thiazol-2-amine;
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол;5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5-(1-бензил-4-циклопропил-1H-1,2,3-триазол-5-ил)-1H-индазол;5- (1-benzyl-4-cyclopropyl-1H-1,2,3-triazol-5-yl) -1H-indazole;
2-(1H-индазол-5-ил)-3-фенилимидазо[1,2-a]пиримидин;2- (1H-indazol-5-yl) -3-phenylimidazo [1,2-a] pyrimidine;
5-[1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[3-(пиперидин-1-илкарбонил)изоксазол-5-ил]-1H-индазол;5- [3- (piperidin-1-ylcarbonyl) isoxazol-5-yl] -1H-indazole;
5-(1H-индазол-5-ил)-N-фенилизоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N-phenylisoxazole-3-carboxamide;
N-циклогексил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N-cyclohexyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-[3-(пиперидин-1-илметил)изоксазол-5-ил]-1H-индазол;5- [3- (piperidin-1-ylmethyl) isoxazol-5-yl] -1H-indazole;
[5-(1H-индазол-5-ил)изоксазол-3-ил]метанол;[5- (1H-indazol-5-yl) isoxazol-3-yl] methanol;
5-(1H-индазол-5-ил)-N-(2-метоксиэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-methoxyethyl) isoxazole-3-carboxamide;
5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол;5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5-(4-бензил-1H-1,2,3-триазол-1-ил)-1H-индазол;5- (4-benzyl-1H-1,2,3-triazol-1-yl) -1H-indazole;
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин;5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
5-(1-бензил-4-циклопропил-1H-1,2,3-триазол-5-ил)-1H-индазол-3-амин;5- (1-benzyl-4-cyclopropyl-1H-1,2,3-triazol-5-yl) -1H-indazol-3-amine;
5-(3-изобутилизоксазол-5-ил)-1H-индазол-3-амин;5- (3-isobutylisoxazol-5-yl) -1H-indazol-3-amine;
5-(3-бензилизоксазол-5-ил)-1H-индазол-3-амин;5- (3-benzylisoxazol-5-yl) -1H-indazol-3-amine;
N-{2-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-имидазол-1-ил]этил}-N,N-диметиламин;N- {2- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] ethyl} -N, N-dimethylamine;
5-[4-(4-фторфенил)-1-(3-морфолин-4-илпропил)-1H-индазол-5-ил]-1H-индазол;5- [4- (4-fluorophenyl) -1- (3-morpholin-4-ylpropyl) -1H-indazol-5-yl] -1H-indazole;
5-[4-(4-фторфенил)-1-(3-пирролидин-1-илпропил)-1H-индазол-5-ил]-1H-индазол;5- [4- (4-fluorophenyl) -1- (3-pyrrolidin-1-ylpropyl) -1H-indazol-5-yl] -1H-indazole;
5-{4-(4-фторфенил)-1-[2-(4-метилпиперидин-1-ил)этил]-1H-имидазол-5-ил}-1H-индазол;5- {4- (4-fluorophenyl) -1- [2- (4-methylpiperidin-1-yl) ethyl] -1H-imidazol-5-yl} -1H-indazole;
5-[1-(1-бензилпиперидин-4-ил)-4-(4-фторфенил)-1H-имидазол-5-ил]-1H-индазол;5- [1- (1-benzylpiperidin-4-yl) -4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole;
5-[4-(4-фторфенил)-1-(2-морфолин-4-илэтил)-1H-имидазол-5-ил]-1H-индазол;5- [4- (4-fluorophenyl) -1- (2-morpholin-4-yl-ethyl) -1H-imidazol-5-yl] -1H-indazole;
5-[1-(1-бензилпирролидин-3-ил)-4-(4-фторфенил)-1H-имидазол-5-ил]-1H-индазол;5- [1- (1-benzylpyrrolidin-3-yl) -4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole;
2-{4-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-имидазол-1-ил]пиперидин-1-ил}-2-оксоэтанол;2- {4- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] piperidin-1-yl} -2-oxoethanol;
5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин;5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
2-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]пропан-2-ол;2- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-2-ol;
5-[4-(метоксиметил)-1H-1,2,3-триазол-1-ил]-1H-индазол;5- [4- (methoxymethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
1-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]-1-фенилэтанол;1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] -1-phenylethanol;
5-(4-пропил-1H-1,2,3-триазол-1-ил)-1H-индазол;5- (4-propyl-1H-1,2,3-triazol-1-yl) -1H-indazole;
1-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]пропан-2-ол;1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-2-ol;
3-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]пропан-1-ол;3- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-1-ol;
1-{[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]метил}-1H-1,2,3-бензотриазол;1 - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} -1H-1,2,3-benzotriazole;
5-{4-[(фенилтио)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол;5- {4 - [(phenylthio) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5-(4-циклопропил-1H-1,2,3-триазол-1-ил)-1H-индазол;5- (4-cyclopropyl-1H-1,2,3-triazol-1-yl) -1H-indazole;
5-[4-(2-фенилэтил)-1H-1,2,3-триазол-1-ил]-1H-индазол;5- [4- (2-phenylethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
5-[4-(циклогексилметил)-1H-1,2,3-триазол-1-ил]-1H-индазол;5- [4- (cyclohexylmethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
5-(4-циклопентил-1H-1,2,3-триазол-1-ил)-1H-индазол;5- (4-cyclopentyl-1H-1,2,3-triazol-1-yl) -1H-indazole;
1-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]циклогексанол;1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] cyclohexanol;
5-[4-(феноксиметил)-1H-1,2,3-триазол-1-ил]-1H-индазол;5- [4- (phenoxymethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
5-{4-[(1,1-диоксидотиоморфолин-4-ил)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол;5- {4 - [(1,1-dioxidothiomorpholin-4-yl) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5-[4-(3-фенилпропил)-1H-1,2,3-триазол-1-ил]-1H-индазол;5- [4- (3-phenylpropyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил](фенил)метанон;[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (phenyl) methanone;
N,N-диэтил-N-{[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]метил}амин;N, N-diethyl-N - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} amine;
этил N-[2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-ил]-бета-аланинат;ethyl N- [2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-yl] beta-alaninate;
5-(1-бензил-5-метил-1H-1,2,3-триазол-4-ил)-1H-индазол;5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5-(1-бензил-5-метил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин;5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
N3-[2-(1H-индазол-5-ил)имидазо[1,2-α]пиримидин-3-ил]-β-аланинамид;N 3 - [2- (1H-indazol-5-yl) imidazo [1,2-α] pyrimidin-3-yl] -β-alaninamide;
5-(1-бензил-5-иод-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин;5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
N-{3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенил}-N'-(3-метилфенил)мочевина;N- {3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} -N '- (3-methylphenyl )urea;
5-(1H-индазол-5-ил)-N-(2-изопропоксиэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-isopropoxyethyl) isoxazole-3-carboxamide;
5-[3-(морфолин-4-илкарбонил)изоксазол-5-ил]-1H-индазол;5- [3- (morpholin-4-ylcarbonyl) isoxazol-5-yl] -1H-indazole;
5-(1H-индазол-5-ил)-N-(3-морфолин-4-илпропил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (3-morpholin-4-ylpropyl) isoxazole-3-carboxamide;
N-[2-(1H-индазол-4-ил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2- (1H-indazol-4-yl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
(3R)-1-{[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}пиперидин-3-ол;(3R) -1 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperidin-3-ol;
1-{[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}пиперидин-3-карбоксамид;1 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperidin-3-carboxamide;
2-[2-(4-{[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}пиперазин-1-ил)этокси]этанол;2- [2- (4 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperazin-1-yl) ethoxy] ethanol;
5-{3-[(4-метил-1,4-диазепан-1-ил)карбонил]изоксазол-5-ил}-1H-индазол;5- {3 - [(4-methyl-1,4-diazepan-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
N-(3-гидроксипропил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- (3-hydroxypropyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1R)-2-гидрокси-1-фенилэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R) -2-hydroxy-1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[3-(1H-индазол-1-ил)пропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [3- (1H-indazol-1-yl) propyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[3-(2-оксопирролидин-1-ил)пропил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- [3- (2-oxopyrrolidin-1-yl) propyl] isoxazole-3-carboxamide;
N-{2-[4-(аминосульфонил)фенил]этил}-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- {2- [4- (aminosulfonyl) phenyl] ethyl} -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил](3-хлорфенил)метанон;[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (3-chlorophenyl) methanone;
[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил](циклопропил)метанон;[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (cyclopropyl) methanone;
5-[5-циклопропил-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [5-cyclopropyl-1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
N1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]метил}глицинамид;N 1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] methyl} glycinamide;
(4-фторфенил)[4-(lΗ-индазол-5-ил)-1-(тетрагидро-2Η-пиран-4-илметил)-lΗ-1,2,3-триазол-5-ил]метанон;(4-fluorophenyl) [4- (lΗ-indazol-5-yl) -1- (tetrahydro-2Η-pyran-4-ylmethyl) -lΗ-1,2,3-triazol-5-yl] methanone;
(4-хлорфенил)[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил]метанон;(4-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone;
(3-хлорфенил)[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил]метанон;(3-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone;
(2-хлорфенил) [4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил}метанон;(2-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl} methanone;
циклопентил[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил}метанон;cyclopentyl [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl} methanone;
1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоновую кислоту;1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxylic acid;
5-{5-(4-фторфенил)-1-[4-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин;5- {5- (4-fluorophenyl) -1- [4- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
5-[1-бензил-5-(4-фторфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [1-benzyl-5- (4-fluorophenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил](тетрагидро-2H-пиран-4-ил)метанон;[4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] (tetrahydro-2H-pyran-4- sludge) methanone;
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-{1-бензил-5-[(4-метилпиперазин-1-ил)карбонил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1-benzyl-5 - [(4-methylpiperazin-1-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-4-ол;1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-4-ol;
1-ацетил-5-[5-(4-фторфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол;1-acetyl-5- [5- (4-fluorophenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
1-бензил-4-(1H-индазол-5-ил)-N,N-диметил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N, N-dimethyl-1H-1,2,3-triazole-5-carboxamide;
N,1-дибензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;N, 1-dibenzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
N-(2-гидрокси-2-фенилэтил)-5-(1H-индазол-5-ил)-N-метилизоксазол-3-карбоксамид;N- (2-hydroxy-2-phenylethyl) -5- (1H-indazol-5-yl) -N-methylisoxazole-3-carboxamide;
N-[(1S)-2-гидрокси-1-фенилэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1S) -2-hydroxy-1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-бензил-N-(2-гидроксиэтил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N-benzyl-N- (2-hydroxyethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-3-метил-1H-индазол;5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -3-methyl-1H-indazole;
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
2-{2-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]этил}-1H-изоиндол-1,3(2H)-дион;2- {2- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] ethyl} -1H-isoindol-1,3 (2H) -dione;
5-{4-[(2,4-дихлорфенокси)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол;5- {4 - [(2,4-Dichlorophenoxy) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5-{4-[(2,6-дихлорфенокси)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол;5- {4 - [(2,6-dichlorophenoxy) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5-[5-(4-фторфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [5- (4-fluorophenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
1-{[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]метил}-1H-индазол;1 - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} -1H-indazole;
5-[1-бензил-5-(пиперидин-1-илкарбонил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1-benzyl-5- (piperidin-1-ylcarbonyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[5-(2-метилфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [5- (2-methylphenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[5-(2-метилфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [5- (2-methylphenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5-[1-бензил-5-(морфолин-4-илкарбонил)-1H-1,2,3-триазол-4-ил]-1H-индазол;5- [1-benzyl-5- (morpholin-4-ylcarbonyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5-[1-бензил-5-(4-метоксифенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [1-benzyl-5- (4-methoxyphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
N-[(1S)-1-бензил-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1S) -1-benzyl-2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1S,2R)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1S, 2R) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-{3-[(3-фенилморфолин-4-ил)карбонил]изоксазол-5-ил}-1H-индазол;5- {3 - [(3-phenylmorpholin-4-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
N-бензил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N-benzyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
((1S)-2-{[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-ил)метанол;((1S) -2 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} -6,7-dimethoxy-1,2,3,4-tetrahydroisoquinolin-1-yl) methanol ;
N-[(1R)-3-гидрокси-1-фенилпропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R) -3-hydroxy-1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1S)-3-гидрокси-1-фенилпропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1S) -3-hydroxy-1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-2,3-дигидро-1H-инден-1-ил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N-2,3-dihydro-1H-inden-1-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-2,3-дигидро-1H-инден-2-ил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N-2,3-dihydro-1H-inden-2-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(1-фенилпропил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (1-phenylpropyl) isoxazole-3-carboxamide;
5-{1-бензил-5-[3-(диметиламино)фенил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин;5- {1-benzyl-5- [3- (dimethylamino) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
5-{1-бензил-5-[4-(диметиламино)фенил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин;5- {1-benzyl-5- [4- (dimethylamino) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
N-{3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенил}ацетамид;N- {3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} acetamide;
N-{4-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенил}ацетамид;N- {4- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} acetamide;
5-{1-бензил-5-[3-(1H-пиразол-1-ил)фенил]-lH-1,2,3-триазол-4-ил}-1H-индазол-3-амин;5- {1-benzyl-5- [3- (1H-pyrazol-1-yl) phenyl] -lH-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
5-[1-бензил-5-(1-метил-1H-пиразол-4-ил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [1-benzyl-5- (1-methyl-1H-pyrazol-4-yl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]-N-фенилбензамид;3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] -N-phenylbenzamide;
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]-N-бензилбензамид;3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] -N-benzylbenzamide;
5-[1-бензил-5-(1-метил-1H-индол-5-ил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [1-benzyl-5- (1-methyl-1H-indol-5-yl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5-[1-бензил-5-(3-метоксифенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [1-benzyl-5- (3-methoxyphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5-[1-бензил-5-(3-морфолин-4-илфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин;5- [1-benzyl-5- (3-morpholin-4-ylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5-[3-(1,3-дигидро-2H-изоиндол-2-илкарбонил)изоксазол-5-ил]-1H-индазол;5- [3- (1,3-dihydro-2H-isoindol-2-ylcarbonyl) isoxazol-5-yl] -1H-indazole;
5-{3-[(4-метил-2-фенилпиперазин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол;5- {3 - [(4-methyl-2-phenylpiperazin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-4-амин;1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-4-amine;
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамид;N- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide;
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензолсульфонамид;N- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzenesulfonamide;
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(4-метоксифенил)мочевина;N- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (4-methoxyphenyl) urea;
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бутанамид;N- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] butanamide;
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-метилпропанамид;N- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-methylpropanamide;
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]циклопропанкарбоксамид;N- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] cyclopropanecarboxamide;
N-[1-бензоил-5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил}бензамид;N- [1-benzoyl-5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl} benzamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-фторбензамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-fluorobenzamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide;
N-бензил-5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин;N-benzyl-5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
N-[(1R)-1-бензил-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R) -1-benzyl-2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1-бензил-1H-пиразол-4-ил)-1H-индазол;5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazole;
N-[(1R)-3-гидрокси-1-фенилпропил]-5-(3-метил-1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R) -3-hydroxy-1-phenylpropyl] -5- (3-methyl-1H-indazol-5-yl) isoxazole-3-carboxamide;
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенол;3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenol;
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]бензамид;3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] benzamide;
5-{1-бензил-5-[4-(метилсульфонил)фенил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин;5- {1-benzyl-5- [4- (methylsulfonyl) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-хлорбензамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-chlorobenzamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-4-хлорбензамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -4-chlorobenzamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]этансульфонамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] ethanesulfonamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензолсульфонамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzenesulfonamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-хлорбензолсульфонамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-chlorobenzenesulfonamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-хлорбензолсульфонамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-chlorobenzenesulfonamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-4-хлорбензолсульфонамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -4-chlorobenzenesulfonamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2,5-диметилфуран-3-сульфонамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2,5-dimethylfuran-3-sulfonamide;
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(2-хлорбензил)-1H-индазол-3-амин;5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (2-chlorobenzyl) -1H-indazol-3-amine;
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(3-хлорбензил)-1H-индазол-3-амин;5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (3-chlorobenzyl) -1H-indazol-3-amine;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-хлорбензамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-chlorobenzamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-фурамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-furamide;
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-этил-1H-индазол-3-амин;5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N-ethyl-1H-indazol-3-amine;
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(4-хлорбензил)-1H-индазол-3-амин;5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (4-chlorobenzyl) -1H-indazol-3-amine;
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(3-фурилметил)-1H-индазол-3-амин;5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (3-furylmethyl) -1H-indazol-3-amine;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-[5-метил-2-(трифторметил)-3-фурил]мочевину;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- [5-methyl-2- (trifluoromethyl ) -3-furyl] urea;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-фурамид;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-furamide;
5-(1H-индазол-5-ил)-N-[(1S)-1-фенилпропил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1S) -1-phenylpropyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1R)-1-фенилпропил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1R) -1-phenylpropyl] isoxazole-3-carboxamide;
5-(1-бензил-1H-пиразол-4-ил)-1H-индазол-3-амин;5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazol-3-amine;
1-бензил-4-(1H-индазол-5-ил)-N-[(2S)-тетрагидрофуран-2-илметил]-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N - [(2S) -tetrahydrofuran-2-ylmethyl] -1H-1,2,3-triazole-5-carboxamide;
1-бензил-4-(1H-индазол-5-ил)-N-(2-изопропоксиэтил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N- (2-isopropoxyethyl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-4-(1H-индазол-5-ил)-N-[(2R)-тетрагидрофуран-2-илметил]-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N - [(2R) -tetrahydrofuran-2-ylmethyl] -1H-1,2,3-triazole-5-carboxamide;
1-бензил-4-(1H-индазол-5-ил)-N-(тетрагидрофуран-3-илметил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N- (tetrahydrofuran-3-ylmethyl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-циклопентил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N-cyclopentyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-(циклопентилметил)-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N- (cyclopentylmethyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-этил-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N-ethyl-4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-бензил-4-(1H-индазол-5-ил)-N-изопропил-N-метил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N-isopropyl-N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-бензил-4-(1H-индазол-5-ил)-N-(2-метоксиэтил)-N-метил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N- (2-methoxyethyl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-бензил-4-(1H-индазол-5-ил)-N-фенил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N-phenyl-1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-(4-хлорфенил)-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N- (4-chlorophenyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-4-(1H-индазол-5-ил)-N-(2-морфолин-4-илэтил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-4- (1H-indazol-5-yl) -N- (2-morpholin-4-yl-ethyl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-[2-(диметиламино)этил]-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N- [2- (dimethylamino) ethyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-(2-гидроксиэтил)-4-(1H-индазол-5-ил)-N-пропил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N- (2-hydroxyethyl) -4- (1H-indazol-5-yl) -N-propyl-1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-[3-(диметиламино)пропил]-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N- [3- (dimethylamino) propyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-[2-(диэтиламино)этил]-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N- [2- (diethylamino) ethyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
N,1-дибензил-N-этил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;N, 1-dibenzyl-N-ethyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
N,1-дибензил-N-(2-гидроксиэтил)-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;N, 1-dibenzyl-N- (2-hydroxyethyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
(3R)-1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-3-ол;(3R) -1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-3-ol;
1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-4-карбоксамид;1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidine-4-carboxamide;
5-{1-бензил-5-[(2,6-диметилморфолин-4-ил)карбонил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1-benzyl-5 - [(2,6-dimethylmorpholin-4-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5-{5-[(4-ацетилпиперазин-1-ил)карбонил]-1-бензил-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {5 - [(4-acetylpiperazin-1-yl) carbonyl] -1-benzyl-1H-1,2,3-triazol-4-yl} -1H-indazole;
5-{1-бензил-5-[(4-фенилпиперазин-1-ил)карбонил]-1H-1,2,3-триазол-4-ил}-1H-индазол;5- {1-benzyl-5 - [(4-phenylpiperazin-1-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
1-бензил-N-[(1R)-1-(гидроксиметил)-2-метилпропил]-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N - [(1R) -1- (hydroxymethyl) -2-methylpropyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-[(1S)-1-(гидроксиметил)-2-метилпропил]-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N - [(1S) -1- (hydroxymethyl) -2-methylpropyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-бензил-N-[3-(1H-индазол-1-ил)пропил]-4(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид;1-benzyl-N- [3- (1H-indazol-1-yl) propyl] -4 (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-этилмочевину;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-ethylurea;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-фенилмочевину;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-phenylurea;
N-бензил-N'-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]мочевину;N-benzyl-N '- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] urea;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(2-хлорфенил)мочевину;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (2-chlorophenyl) urea;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(3-хлорфенил)мочевину;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (3-chlorophenyl) urea;
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(4-хлорфенил)мочевину;N- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (4-chlorophenyl) urea;
N-[5-(1-бензил-5-иод-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамид;N- [5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide;
3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропаннитрил;3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propannitrile;
2-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]ацетамид;2- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] acetamide;
метил 3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропаноат;methyl 3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propanoate;
3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропанамид;3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propanamide;
[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]ацетонитрил;[4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] acetonitrile;
4-(3-амино-1H-индазол-5-ил)-N,N-диметил-1H-индазол-1-сульфонамид;4- (3-amino-1H-indazol-5-yl) -N, N-dimethyl-1H-indazol-1-sulfonamide;
5-пиразин-2-ил-1H-индазол-3-амин;5-pyrazin-2-yl-1H-indazol-3-amine;
5-тиен-2-ил-1H-индазол-3-амин;5-thien-2-yl-1H-indazol-3-amine;
5-(2-аминопиримидин-4-ил)-1H-индазол-3-амин;5- (2-aminopyrimidin-4-yl) -1H-indazol-3-amine;
5-(2-метоксипиридин-3-ил)-1H-индазол-3-амин;5- (2-methoxypyridin-3-yl) -1H-indazol-3-amine;
5-имидазо[1,2-a]пиридин-3-ил-1H-индазол-3-амин;5-imidazo [1,2-a] pyridin-3-yl-1H-indazol-3-amine;
N2,N2-диметил-N1-[5-(1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]глицинамид;N 2 , N 2 -dimethyl-N 1 - [5- (1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] glycinamide;
5-(1H-пиразол-5-ил)-1H-индазол-3-амин;5- (1H-pyrazol-5-yl) -1H-indazol-3-amine;
5-(4-метил-1H-индазол-5-ил)-1H-индазол-3-амин;5- (4-methyl-1H-indazol-5-yl) -1H-indazol-3-amine;
5-(1H-индазол-4-ил)-1H-индазол-3-амин;5- (1H-indazol-4-yl) -1H-indazol-3-amine;
N2,N2-диметил-N1-{5-[1-(3-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}глицинамид;N 2 , N 2 -dimethyl-N 1 - {5- [1- (3-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} glycinamide;
5-(1-бензил-1H-индазол-4-ил)-1H-индазол-3-амин;5- (1-benzyl-1H-indazol-4-yl) -1H-indazol-3-amine;
N1-{5-[1-(4-трет-бутилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}-N2,N2-диметилглицинамид;N 1 - {5- [1- (4-tert-butylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} -N 2 , N 2 -dimethylglycinamide;
N2,N2-диметил-N1-{5-[1-(2-пиперидин-1-илэтил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}глицинамид;N 2 , N 2 -dimethyl-N 1 - {5- [1- (2-piperidin-1-yl-ethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} glycinamide;
N2,N2-диметил-N1-{5-[1-(2-морфолин-4-илэтил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}глицинамид;N 2 , N 2 -dimethyl-N 1 - {5- [1- (2-morpholin-4-yl-ethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} glycinamide;
N1-(5-{1-[2-(3,5-диметилизоксазол-4-ил)этил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-ил)-N2,N2-диметилглицинамид;N 1 - (5- {1- [2- (3,5-dimethylisoxazol-4-yl) ethyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-yl) - N 2 , N 2 -dimethylglycinamide;
N1-(5-{1-[2-(3,5-диметил-1H-пиразол-4-ил)этил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-ил)-N2,N2-диметилглицинамид;N 1 - (5- {1- [2- (3,5-dimethyl-1H-pyrazol-4-yl) ethyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3 -yl) -N 2 , N 2 -dimethylglycinamide;
2-(4-{3-[(N,N-диметилглицил)амино]-1H-индазол-5-ил}-1H-1,2,3-триазол-1-ил)-2-метилпропановую кислоту;2- (4- {3 - [(N, N-dimethylglycyl) amino] -1H-indazol-5-yl} -1H-1,2,3-triazol-1-yl) -2-methylpropanoic acid;
этил (4-{3-[(N,N-диметилглицил)амино]-1H-индазол-5-ил}-1H-1,2,3-триазол-1-ил)ацетат;ethyl (4- {3 - [(N, N-dimethylglycyl) amino] -1H-indazol-5-yl} -1H-1,2,3-triazol-1-yl) acetate;
N2,N2-диметил-N1-(5-{1-[(триметилсилил)метил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-ил)глицинамид;N 2 , N 2 -dimethyl-N 1 - (5- {1 - [(trimethylsilyl) methyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-yl) glycinamide;
N1-[5-(3-фурил)-1H-индазол-3-ил]-N2,N2-диметилглицинамид;N 1 - [5- (3-furyl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide;
N2,N2-диметил-N1-[5-(1H-пиразол-5-ил)-1H-индазол-3-ил]глицинамид;N 2 , N 2 -dimethyl-N 1 - [5- (1H-pyrazol-5-yl) -1H-indazol-3-yl] glycinamide;
N2,N2-диметил-N1-(5-пиримидин-5-ил-1H-индазол-3-ил)глицинамид;N 2 , N 2 -dimethyl-N 1 - (5-pyrimidin-5-yl-1H-indazol-3-yl) glycinamide;
N1-[5-(2,1,3-бензоксадиазол-5-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамид;N 1 - [5- (2,1,3-benzoxadiazol-5-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide;
N2,N2-диметил-N1-[5-(1H-пиразол-4-ил)-1H-индазол-3-ил]глицинамид;N 2 , N 2 -dimethyl-N 1 - [5- (1H-pyrazol-4-yl) -1H-indazol-3-yl] glycinamide;
N2,N2-диметил-N1-[5-(1-метил-1H-пиразол-4-ил)-1H-индазол-3-ил]глицинамид;N 2 , N 2 -dimethyl-N 1 - [5- (1-methyl-1H-pyrazol-4-yl) -1H-indazol-3-yl] glycinamide;
N1-[5-(3,5-диметил-1H-пиразол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамид;N 1 - [5- (3,5-dimethyl-1H-pyrazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide;
N1-{5-[2-(диметиламино)пиримидин-5-ил]-1H-индазол-3-ил}-N2,N2-диметилглицинамид;N 1 - {5- [2- (dimethylamino) pyrimidin-5-yl] -1H-indazol-3-yl} -N 2 , N 2 -dimethylglycinamide;
N2,N2-диметил-N1-[5-(2-морфолин-4-илпиримидин-5-ил)-1H-индазол-3-ил]глицинамид;N 2 , N 2 -dimethyl-N 1 - [5- (2-morpholin-4-yl-pyrimidin-5-yl) -1H-indazol-3-yl] glycinamide;
N2,N2-диметил-N1-{5-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-1H-индазол-3-ил}глицинамид;N 2 , N 2 -dimethyl-N 1 - {5- [1- (2-morpholin-4-yl-ethyl) -1H-pyrazol-4-yl] -1H-indazol-3-yl} glycinamide;
N1-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамид;N 1 - [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide;
N1-[5-(1-бензил-1H-пиразол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамид;N 1 - [5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-метилглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2- methylglycinamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-пирролидин-1-илацетамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-pyrrolidin-1-yl-acetamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклопентилглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclopentylglycinamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклопропилглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclopropylglycinamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-тетрагидро-2H-пиран-4-илглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2- tetrahydro-2H-pyran-4-yl-glycinamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(3-гидроксипирролидин-1-ил)ацетамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (3-hydroxypyrrolidin-1-yl) acetamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(3-гидроксипиперидин-1-ил)ацетамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (3-hydroxypiperidin-1-yl) acetamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N3,N3-диметил-бета-аланинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 3 , N 3 -dimethyl-beta-alaninamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-морфолин-4-илацетамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-morpholin-4-yl-acetamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(4-метилпиперазин-1-ил)ацетамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (4-methylpiperazin-1-yl) acetamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(3-оксопиперазин-1-ил)ацетамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (3-oxopiperazin-1-yl) acetamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-изопропилглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -isopropylglycinamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклогексилглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclohexylglycinamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]ацетамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] acetamide;
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклобутилглицинамид;N 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclobutylglycinamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-пропилмочевину;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-propylurea;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]этансульфонамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] ethanesulfonamide;
5-(1-бензил-1H-1,2,3-триазол-4-ил)-N-(циклопропилметил)-1H-индазол-3-амин;5- (1-benzyl-1H-1,2,3-triazol-4-yl) -N- (cyclopropylmethyl) -1H-indazol-3-amine;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-этилмочевина;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-ethylurea;
1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]пирролидин-2-он;1- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] pyrrolidin-2-one;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-4-(диметиламино)бутанамид;N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -4- (dimethylamino) butanamide;
N-3,4-дигидро-1H-изохромен-4-ил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N-3,4-dihydro-1H-isochromen-4-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-(циклогексилметил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- (cyclohexylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-(3-хлорбензил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- (3-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(2-метоксибензил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-methoxybenzyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[2-(трифторметил)бензил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- [2- (trifluoromethyl) benzyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[3-(трифторметил)бензил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- [3- (trifluoromethyl) benzyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[4-(трифторметил)бензил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- [4- (trifluoromethyl) benzyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(пиридин-2-илметил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (pyridin-2-ylmethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(пиридин-3-илметил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (pyridin-3-ylmethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(пиридин-4-илметил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (pyridin-4-ylmethyl) isoxazole-3-carboxamide;
N-(2-хлорбензил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- (2-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-(4-хлорбензил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- (4-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(1-фенил-2-пиперидин-1-илэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (1-phenyl-2-piperidin-1-yl-ethyl) isoxazole-3-carboxamide;
N-[2-(1H-индазол-1-ил)-1-фенилэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2- (1H-indazol-1-yl) -1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(2-морфолин-4-ил-1-фенилэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-morpholin-4-yl-1-phenylethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[2-(4-метилпиперазин-1-ил)-1-фенилэтил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- [2- (4-methylpiperazin-1-yl) -1-phenylethyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(1-фенил-2-пирролидин-1-илэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (1-phenyl-2-pyrrolidin-1-yl-ethyl) isoxazole-3-carboxamide;
трет-бутил 2-({[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}амино)-2-фенилэтилкарбамат;tert-butyl 2 - ({[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} amino) -2-phenylethylcarbamate;
5-(1H-индазол-5-ил)-N-(1-нафтилметил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (1-naphthylmethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(2-фенилэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-phenylethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(2-пиридин-2-илэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-pyridin-2-yl-ethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(2-пиридин-3-илэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-pyridin-3-yl-ethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-(2-пиридин-4-илэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N- (2-pyridin-4-yl-ethyl) isoxazole-3-carboxamide;
N-[2-(2-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2- (2-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[2-(3-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2- (3-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[2-(4-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-бензил-N-этил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N-benzyl-N-ethyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-метил-N-(1-нафтилметил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N-methyl-N- (1-naphthylmethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-метил-N-(2-фенилэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N-methyl-N- (2-phenylethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-метил-N-(2-пиридин-2-илэтил)изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N-methyl-N- (2-pyridin-2-yl-ethyl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1R)-1-фенилэтил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1R) -1-phenylethyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-1,2,3,4-тетрагидронафталин-1- илизоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N-1,2,3,4-tetrahydronaphthalen-1-yl-isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1S)-1-(1-нафтил)этил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1S) -1- (1-naphthyl) ethyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1R)-1-(1-нафтил)этил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1R) -1- (1-naphthyl) ethyl] isoxazole-3-carboxamide;
N-[3-(диметиламино)-1-фенилпропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [3- (dimethylamino) -1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-(2,3-дигидро-1,4-бензодиоксин-5-илметил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- (2,3-dihydro-1,4-benzodioxin-5-ylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-(3,4-дигидро-2H-1,5-бензодиоксепин-6-илметил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- (3,4-dihydro-2H-1,5-benzodioxepin-6-ylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1-метил-1H-индол-4-ил)метил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1-methyl-1H-indol-4-yl) methyl] isoxazole-3-carboxamide;
5-{3-[(3-фенилпирролидин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол;5- {3 - [(3-phenylpyrrolidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
5-{3-[(2-фенилпирролидин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол;5- {3 - [(2-phenylpyrrolidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
5-{3-[(2-фенилпиперидин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол;5- {3 - [(2-phenylpiperidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
5-(1H-индазол-5-ил)-N-[(1S)-1-фенилэтил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1S) -1-phenylethyl] isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1R)-1-(4-метилфенил)этил]-изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1R) -1- (4-methylphenyl) ethyl] -isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1S)-1-(4-метилфенил)этил]-изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1S) -1- (4-methylphenyl) ethyl] -isoxazole-3-carboxamide;
N-[(1R,2S)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R, 2S) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1R,2R)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R, 2R) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1R)-1-(4-бромфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R) -1- (4-bromophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1S)-1-(4-бромфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1S) -1- (4-bromophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1R)-1-(4-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1R) -1- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[(1S)-1-(4-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1S) -1- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1S)-1-(2-нафтил)этил]изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1S) -1- (2-naphthyl) ethyl] isoxazole-3-carboxamide;
N-[1-(4-этоксифенил)-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [1- (4-ethoxyphenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[2-гидрокси-1-(4-изопропилфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2-hydroxy-1- (4-isopropylphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[1-(3,4-диметилфенил)-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [1- (3,4-dimethylphenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[2-гидрокси-1-(2-метоксифенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2-hydroxy-1- (2-methoxyphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[2-гидрокси-1-(4-метилфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [2-hydroxy-1- (4-methylphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1R)-1-(2-метоксифенил)этил]-изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1R) -1- (2-methoxyphenyl) ethyl] -isoxazole-3-carboxamide;
N-[(1S)-1-(3,4-дифторфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N - [(1S) -1- (3,4-difluorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-[(1R)-1-(3-метоксифенил)этил]-изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - [(1R) -1- (3-methoxyphenyl) ethyl] -isoxazole-3-carboxamide;
5-(1H-индазол-5-ил)-N-{(1R)-1-[3-(трифторметил)-фенил]этил}изоксазол-3-карбоксамид;5- (1H-indazol-5-yl) -N - {(1R) -1- [3- (trifluoromethyl) phenyl] ethyl} isoxazole-3-carboxamide;
N-[1-(2,3-дигидро-1,4-бензодиоксин-6-ил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [1- (2,3-dihydro-1,4-benzodioxin-6-yl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-[1-(3,5-дихлорфенил)-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамид;N- [1- (3,5-Dichlorophenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
трет-бутил 5-(1-бензил-1H-1,2,3-триазол-4-ил)-3-[({[6-(трифторметил)пиридин-2-ил]амино}карбонил)амино]-1H-индазол-1-карбоксилат;tert-butyl 5- (1-benzyl-1H-1,2,3-triazol-4-yl) -3 - [({[[6- (trifluoromethyl) pyridin-2-yl] amino} carbonyl) amino] -1H indazole-1-carboxylate;
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1-[(1-метилпиперидин-2-ил)карбонил]-1H-индазол-3-амин;5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1 - [(1-methylpiperidin-2-yl) carbonyl] -1H-indazol-3-amine;
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1-[(диметиламино)-ацетил]-1H-индазол-3-амин;5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1 - [(dimethylamino) acetyl] -1H-indazol-3-amine;
трет-бутил 3-амино-5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-карбоксилат;tert-butyl 3-amino-5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole-1-carboxylate;
N-[5-(1-бензил-1Η-1,2,3-триазол-4-ил)-1Η-индазол-3-ил]-2-пиперидин-1-илацетамид;N- [5- (1-benzyl-1Η-1,2,3-triazol-4-yl) -1Η-indazol-3-yl] -2-piperidin-1-yl-acetamide;
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-морфолин-4-илацетамид; иN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-morpholin-4-yl-acetamide; and
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-1-метилпиперидин-2-карбоксамид.N- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -1-methylpiperidin-2-carboxamide.
Все патенты, патентные заявки и ссылочные документы, известные из литературы, на которые имеются ссылки в настоящем описании, включены в настоящую заявку посредством ссылки во всей их полноте. В случае несоответствий, настоящее раскрытие, включая определения, будет иметь преимущество.All patents, patent applications and reference documents known from the literature that are referred to in the present description, are incorporated into this application by reference in their entirety. In case of inconsistencies, this disclosure, including definitions, will take precedence.
Как они использованы в тексте настоящего описания и прилагаемой формулы изобретения, представленные ниже термины имеют следующие значения:As they are used in the text of the present description and the attached claims, the following terms have the following meanings:
Термин "алкенил", как он используется в настоящей заявке, означает углеводород с линейной или разветвленной цепью, содержащий от 2 до 10 атомов углерода и содержащий, по меньшей мере, одну углерод-углеродную двойную связь, образованную путем удаления двух атомов водорода. Репрезентативные примеры алкенила включают, но не ограничиваются этим, этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил, 5-гексенил, 2-гептенил, 2-метил-1-гептенил и 3-деценил.The term “alkenyl,” as used herein, means a straight or branched chain hydrocarbon containing from 2 to 10 carbon atoms and containing at least one carbon-carbon double bond formed by the removal of two hydrogen atoms. Representative examples of alkenyl include, but are not limited to, ethenyl, 2-propenyl, 2-methyl-2-propenyl, 3-butenyl, 4-pentenyl, 5-hexenyl, 2-heptenyl, 2-methyl-1-heptenyl and 3- decentralized.
Термин "алкокси", как он используется в настоящей заявке, означает алкильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через атом кислорода. Репрезентативные примеры алкокси включают, но не ограничиваются этим, метокси, этокси, пропокси, 2-пропокси, бутокси, трет-бутокси, пентилокси и гексилокси.The term “alkoxy,” as used herein, means an alkyl group, as defined herein, appended to the parent molecular moiety through an oxygen atom. Representative examples of alkoxy include, but are not limited to, methoxy, ethoxy, propoxy, 2-propoxy, butoxy, tert-butoxy, pentyloxy and hexyloxy.
Термин "алкоксиалкокси", как он используется в настоящей заявке, означает алкоксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через другую алкоксигруппу, определенную в настоящей заявке. Репрезентативные примеры алкоксиалкокси включают, но не ограничиваются этим, трет-бутоксиметокси, 2-этоксиэтокси, 2-метоксиэтокси и метоксиметокси.The term “alkoxyalkoxy,” as used herein, means an alkoxy group, as defined herein, appended to the parent molecular moiety through another alkoxy group, as defined herein. Representative examples of alkoxyalkoxy include, but are not limited to, tert-butoxymethoxy, 2-ethoxyethoxy, 2-methoxyethoxy and methoxymethoxy.
Термин "алкоксиалкоксиалкил", как он используется в настоящей заявке, означает алкоксиалкоксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры алкоксиалкоксиалкила включают, но не ограничиваются этим, трет-бутоксиметоксиметил, этоксиметоксиметил, (2-метоксиэтокси)метил и 2-(2-метоксиэтокси)этил.The term “alkoxyalkoxyalkyl,” as used herein, means an alkoxyalkoxy group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of alkoxyalkoxyalkyl include, but are not limited to, tert-butoxymethoxymethyl, ethoxymethoxymethyl, (2-methoxyethoxy) methyl and 2- (2-methoxyethoxy) ethyl.
Термин "алкоксиалкил", как он используется в настоящей заявке, означает алкоксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры алкоксиалкила включают, но не ограничиваются этим, трет-бутоксиметил, 2-этоксиэтил, 2-метоксиэтил и метоксиметил.The term “alkoxyalkyl,” as used herein, means an alkoxy group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of alkoxyalkyl include, but are not limited to, tert-butoxymethyl, 2-ethoxyethyl, 2-methoxyethyl, and methoxymethyl.
Термин "алкоксикарбонил", как он используется в настоящей заявке, означает алкоксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через карбонильную группу, определенную в настоящей заявке. Репрезентативные примеры алкоксикарбонила включают, но не ограничиваются этим, метоксикарбонил, этоксикарбонил и трет-бутоксикарбонил.The term “alkoxycarbonyl,” as used herein, means an alkoxy group, as defined herein, appended to the parent molecular moiety through a carbonyl group, as defined herein. Representative examples of alkoxycarbonyl include, but are not limited to, methoxycarbonyl, ethoxycarbonyl, and tert-butoxycarbonyl.
Термин "алкоксикарбонилалкил", как он используется в настоящей заявке, означает алкоксикарбонильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры алкоксикарбонилалкила включают, но не ограничиваются этим, 3-метоксикарбонилпропил, 4-этоксикарбонилбутил и 2-трет-бутоксикарбонилэтил.The term “alkoxycarbonylalkyl,” as used herein, means an alkoxycarbonyl group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of alkoxycarbonylalkyl include, but are not limited to, 3-methoxycarbonylpropyl, 4-ethoxycarbonylbutyl and 2-tert-butoxycarbonylethyl.
Термин "алкил", как он используется в настоящей заявке, означает углеводород с линейной или разветвленной цепью, содержащий от 1 до 10 атомов углерода. Репрезентативные примеры алкила включают, но не ограничиваются этим, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил и н-децил.The term “alkyl,” as used herein, means a straight or branched chain hydrocarbon containing from 1 to 10 carbon atoms. Representative examples of alkyl include, but are not limited to, methyl, ethyl, n-propyl, isopropyl, n-butyl, sec-butyl, isobutyl, tert-butyl, n-pentyl, isopentyl, neopentyl, n-hexyl, 3-methylhexyl, 2,2-dimethylpentyl, 2,3-dimethylpentyl, n-heptyl, n-octyl, n-nonyl and n-decyl.
Термин "алкилкарбонил", как он используется в настоящей заявке, означает алкильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через карбонильную группу, определенную в настоящей заявке. Репрезентативные примеры алкилкарбонила включают, но не ограничиваются этим, ацетил, 1-оксопропил, 2,2-диметил-1-оксопропил, 1-оксобутил и 1-оксопентил.The term “alkylcarbonyl,” as used herein, means an alkyl group, as defined herein, appended to the parent molecular moiety through a carbonyl group, as defined herein. Representative examples of alkylcarbonyl include, but are not limited to, acetyl, 1-oxo-propyl, 2,2-dimethyl-1-oxo-propyl, 1-oxo-butyl and 1-oxo-pentyl.
Термин "алкилкарбонилалкил", как он используется в настоящей заявке, означает алкилкарбонильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры алкилкарбонилалкила включают, но не ограничиваются этим, 2-оксопропил, 3,3-диметил-2-оксопропил, 3-оксобутил и 3-оксопентил.The term “alkylcarbonylalkyl,” as used herein, means an alkylcarbonyl group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of alkylcarbonylalkyl include, but are not limited to, 2-oxo-propyl, 3,3-dimethyl-2-oxo-propyl, 3-oxo-butyl and 3-oxo-pentyl.
Термин "алкилкарбонилокси", как он используется в настоящей заявке, означает алкилкарбонильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через атом кислорода. Репрезентативные примеры алкилкарбонилоксиа включают, но не ограничиваются этим, ацетилокси, этилкарбонилокси и трет-бутилкарбонилокси.The term “alkylcarbonyloxy,” as used herein, means an alkylcarbonyl group, as defined herein, appended to the parent molecular moiety through an oxygen atom. Representative examples of alkylcarbonyloxy include, but are not limited to, acetyloxy, ethylcarbonyloxy and tert-butylcarbonyloxy.
Термин "алкилен" означает двухвалентную группу, образованную из углеводорода с линейной или разветвленной цепью, состоящую из от 1 до 10 атомов углерода. Репрезентативные примеры алкилена включают, но не ограничиваются этим, -CH2-, -CH(CH3)-, -C(CH3)2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH2CH2CH2- и -CH2CH(CH3)CH2-.The term “alkylene” means a divalent group derived from a straight or branched chain hydrocarbon consisting of from 1 to 10 carbon atoms. Representative examples of alkylene include, but are not limited to, —CH 2 -, —CH (CH 3 ) -, —C (CH 3 ) 2 -, —CH 2 CH 2 -, —CH 2 CH 2 CH 2 -, —CH 2 CH 2 CH 2 CH 2 - and -CH 2 CH (CH 3 ) CH 2 -.
Термин "алкилен-NRg-", как он используется в настоящей заявке, означает алкиленовую группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через -NRg-группу, определенную в настоящей заявке.The term “alkylene-NR g -”, as used herein, means an alkylene group, as defined herein, appended to the parent molecular moiety through an —NR g- group, as defined herein.
Термин "алкилсульфинил", как он используется в настоящей заявке, означает алкильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через сульфинильную группу, определенную в настоящей заявке. Репрезентативные примеры алкилсульфинила включают, но не ограничиваются этим, метилсульфинил и этилсульфинил.The term “alkylsulfinyl,” as used herein, means an alkyl group, as defined herein, appended to the parent molecular moiety through a sulfinyl group, as defined herein. Representative examples of alkylsulfinyl include, but are not limited to, methylsulfinyl and ethylsulfinyl.
Термин "алкилсульфинилалкил", как он используется в настоящей заявке, означает алкилсульфинильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры алкилсульфинилалкила включают, но не ограничиваются этим, метилсульфинилметил и этилсульфинилметил.The term “alkylsulfinylalkyl,” as used herein, means an alkylsulfinyl group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of alkylsulfinylalkyl include, but are not limited to, methylsulfinylmethyl and ethylsulfinylmethyl.
Термин "алкилсульфонил", как он используется в настоящей заявке, означает алкильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через сульфонильную группу, определенную в настоящей заявке. Репрезентативные примеры алкилсульфонила включают, но не ограничиваются этим, метилсульфонил и этилсульфонил.The term “alkylsulfonyl,” as used herein, means an alkyl group, as defined herein, appended to the parent molecular moiety through a sulfonyl group, as defined herein. Representative examples of alkylsulfonyl include, but are not limited to, methylsulfonyl and ethylsulfonyl.
Термин "алкилсульфонилалкил", как он используется в настоящей заявке, означает алкилсульфонильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры алкилсульфонилалкила включают, но не ограничиваются этим, метилсульфонилметил и этилсульфонилметил.The term “alkylsulfonylalkyl,” as used herein, means an alkylsulfonyl group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of alkylsulfonylalkyl include, but are not limited to, methylsulfonylmethyl and ethylsulfonylmethyl.
Термин "алкилтио", как он используется в настоящей заявке, означает алкильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через атом серы. Репрезентативные примеры алкилтио включают, но не ограничиваются этим, метилтио, этилтио, трет-бутилтио и гексилтио.The term “alkylthio,” as used herein, means an alkyl group, as defined herein, appended to the parent molecular moiety through a sulfur atom. Representative examples of alkylthio include, but are not limited to, methylthio, ethylthio, tert-butylthio and hexylthio.
Термин "алкилтиоалкил", как он используется в настоящей заявке, означает алкилтиогруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры алкилтиоалкила включают, но не ограничиваются этим, метилтиометил и 2-(этилтио)этил.The term “alkylthioalkyl,” as used herein, means an alkylthio group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of alkylthioalkyl include, but are not limited to, methylthiomethyl and 2- (ethylthio) ethyl.
Термин "алкинил", как он используется в настоящей заявке, означает линейную или разветвленную углеводородную группу, содержащую от 2 до 10 атомов углерода и содержащую, по меньшей мере, одну углерод-углеродную тройную связь. Репрезентативные примеры алкинила включают, но не ограничиваются этим, ацетиленил, 1-пропинил, 2-пропинил, 3-бутинил, 2-пентинил и 1-бутинил.The term “alkynyl,” as used herein, means a linear or branched hydrocarbon group containing from 2 to 10 carbon atoms and containing at least one carbon-carbon triple bond. Representative examples of alkynyl include, but are not limited to, acetylenyl, 1-propynyl, 2-propynyl, 3-butynyl, 2-pentynyl and 1-butynyl.
Термин "арил", как он используется в настоящей заявке, означает фенил, бициклический арил или трициклический арил. Бициклический арил представляет собой нафтил или фенил, конденсированный с циклоалкилом, или фенил, конденсированный с циклоалкенилом, или фенил, конденсированный с моноциклическим гетероарильным кольцом, определенным в настоящей заявке, или фенил, конденсированный с моноциклическим гетероциклом, определенным в настоящей заявке. Бициклический арил по настоящему изобретению должен быть присоединен к исходной молекулярной группе через любой доступный углеродный атом, содержащийся в фенильном кольце. Репрезентативные примеры бициклического арила включают, но не ограничиваются этим, 2,3-дигидро-1,4-бензодиоксин-5-ил, 2,3-дигидро-1,4-бензодиоксин-6-ил, 3,4-дигидро-2H-1,5-бензодиоксепин-6-ил, дигидроинденил, инденил, индол-4-ил, нафтил, дигидронафталинил и тетрагидронафталинил. Трициклический арил представляет собой антрацен или фенантрен, или бициклический арил, конденсированный с циклоалкилом, или бициклический арил, конденсированный с циклоалкенилом, или бициклический арил, конденсированный с фенилом. Трициклический арил присоединен к исходной молекулярной группе через любой атом углерода, содержащийся в трициклическом ариле. Репрезентативные примеры трициклического арильного кольца включают, но не ограничиваются этим, азуленил, дигидроантраценил, флуоренил и тетрагидрофенантренил.The term “aryl,” as used herein, means phenyl, bicyclic aryl, or tricyclic aryl. Bicyclic aryl is naphthyl or phenyl condensed with cycloalkyl, or phenyl condensed with cycloalkenyl, or phenyl condensed with a monocyclic heteroaryl ring as defined herein, or phenyl condensed with a monocyclic heterocycle as defined herein. The bicyclic aryl of the present invention should be attached to the parent molecular moiety through any available carbon atom contained in the phenyl ring. Representative examples of bicyclic aryl include, but are not limited to, 2,3-dihydro-1,4-benzodioxin-5-yl, 2,3-dihydro-1,4-benzodioxin-6-yl, 3,4-dihydro-2H -1,5-benzodioxepin-6-yl, dihydroindenyl, indenyl, indol-4-yl, naphthyl, dihydronaphthalenyl and tetrahydronaphthalenyl. The tricyclic aryl is anthracene or phenanthrene, or a bicyclic aryl condensed with cycloalkyl, or a bicyclic aryl condensed with cycloalkenyl, or a bicyclic aryl condensed with phenyl. A tricyclic aryl is attached to the parent molecular moiety through any carbon atom contained in a tricyclic aryl. Representative examples of a tricyclic aryl ring include, but are not limited to, azulenyl, dihydroanthracenyl, fluorenyl, and tetrahydrophenanthrenyl.
Арильные группы по настоящему изобретению, необязательно, являются замещенными 1, 2, 3, 4 или 5 заместителями, независимо выбранными из алкенила, алкокси, алкоксиалкокси, алкоксиалкоксиалкила, алкоксиалкила, алкоксикарбонила, алкоксикарбонилалкила, алкила, алкилкарбонила, алкилкарбонилалкила, алкилкарбонилокси, алкилсульфинила, алкилсульфинилалкил, алкилсульфонил, алкилсульфонилалкил, алкилтио, алкилтиоалкила, алкинила, арил*NC(O)-, арил*NHC(O)NH-, карбокси, карбоксиалкила, циано, цианоалкила, формила, формилалкила, галогена, галогеналкила, гетероарила, гидрокси, гидроксиалкил, меркапто, морфолино, нитро, Z1Z2N- или (Z3Z4N)карбонила. Арил*, необязательно, является замещенным 1, 2 или 3 заместителями, независимо выбранными из алкила, галогена, циано или нитро. Z1 и Z2, каждый независимо, выбран из водорода, алкила или алкилкарбонила.The aryl groups of the present invention are optionally substituted with 1, 2, 3, 4 or 5 substituents independently selected from alkenyl, alkoxy, alkoxyalkoxy, alkoxyalkoxyalkyl, alkoxyalkyl, alkoxycarbonyl, alkoxycarbonylalkyl, alkyl, alkylcarbonyl, alkylcarbonylalkylalkylalkyl, alkylalkylalkyl, alkyl alkylsulfonyl, alkylsulfonylalkyl, alkylthio, alkylthioalkyl, alkynyl, aryl * NC (O) -, aryl * NHC (O) NH-, carboxy, carboxyalkyl, cyano, cyanoalkyl, formyl, formylalkyl, halogen, haloalkyl, goethe roaryl, hydroxy, hydroxyalkyl, mercapto, morpholino, nitro, Z 1 Z 2 N - or (Z 3 Z 4 N) carbonyl. Aryl * is optionally substituted with 1, 2 or 3 substituents independently selected from alkyl, halogen, cyano or nitro. Z 1 and Z 2 are each independently selected from hydrogen, alkyl or alkylcarbonyl.
Термин "арилокси", как он используется в настоящей заявке, означает арильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через атом кислорода. Репрезентативные примеры арилокси включают, но не ограничиваются этим, фенокси, нафтилокси, 3-бромфенокси, 4-хлорфенокси, 4-метилфенокси и 3,5-диметоксифенокси.The term “aryloxy,” as used herein, means an aryl group, as defined herein, appended to the parent molecular moiety through an oxygen atom. Representative examples of aryloxy include, but are not limited to, phenoxy, naphthyloxy, 3-bromophenoxy, 4-chlorophenoxy, 4-methylphenoxy and 3,5-dimethoxyphenoxy.
Термин "арилоксиалкил", как он используется в настоящей заявке, означает арилоксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкильную группу, определенную в настоящей заявке. Репрезентативные примеры арилоксиалкила включают, но не ограничиваются этим, 2-феноксиэтил, 3-нафт-2-илоксипропил и 3-бромфеноксиметил.The term “aryloxyalkyl,” as used herein, means an aryloxy group, as defined herein, appended to the parent molecular moiety through an alkyl group, as defined herein. Representative examples of aryloxyalkyl include, but are not limited to, 2-phenoxyethyl, 3-naphth-2-yloxypropyl and 3-bromophenoxymethyl.
Термин "арилалкил", как он используется в настоящей заявке, означает арильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры арилалкила включают, но не ограничиваются этим, бензил, 2-фенилэтил, 3-фенилпропил и 2-нафт-2-илэтил.The term “arylalkyl,” as used herein, means an aryl group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of arylalkyl include, but are not limited to, benzyl, 2-phenylethyl, 3-phenylpropyl, and 2-naphth-2-yl-ethyl.
Термин "арил(гидрокси)алкил", как он используется в настоящей заявке, означает арильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, содержащую одну гидроксигруппу, определенную в настоящей заявке. Репрезентативные примеры арил(гидрокси)алкила включают, но не ограничиваются этим, 2-фенилэтанол-2-ил и 2-гидрокси-2-фенилэтанил.The term “aryl (hydroxy) alkyl,” as used herein, means an aryl group, as defined herein, appended to the parent molecular moiety through an alkylene group containing one hydroxy, as defined herein. Representative examples of aryl (hydroxy) alkyl include, but are not limited to, 2-phenylethanol-2-yl and 2-hydroxy-2-phenylethanyl.
Термин "арилкарбонил", как он используется в настоящей заявке, означает арильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через карбонильную группу, определенную в настоящей заявке. Репрезентативные примеры арилкарбонила включают, но не ограничиваются этим, бензоил и нафтоил.The term “arylcarbonyl,” as used herein, means an aryl group, as defined herein, appended to the parent molecular moiety through a carbonyl group, as defined herein. Representative examples of arylcarbonyl include, but are not limited to, benzoyl and naphthoyl.
Термин "арилтио", как он используется в настоящей заявке, означает арильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через атом серы. Репрезентативные примеры арилтио включают, но не ограничиваются этим, фенилтио и 2-нафтилтио.The term “arylthio,” as used herein, means an aryl group, as defined herein, appended to the parent molecular moiety through a sulfur atom. Representative examples of arylthio include, but are not limited to, phenylthio and 2-naphthylthio.
Термин "арилтиоалкил", как он используется в настоящей заявке, означает арилтиогруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры арилтиоалкила включают, но не ограничиваются этим, фенилтиометил, 2-нафт-2-илтиоэтил и 5-фенилтиометил.The term “arylthioalkyl,” as used herein, means an arylthio group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of arylthioalkyl include, but are not limited to, phenylthiomethyl, 2-naphth-2-ylthioethyl, and 5-phenylthiomethyl.
Термин "азидо", как он используется в настоящей заявке, означает -N3 группу.The term “azido,” as used herein, means an —N 3 group.
Термин "азидоалкил", как он используется в настоящей заявке, означает азидогруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке.The term “azidoalkyl,” as used herein, means an azido group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein.
Термин "карбонил", как он используется в настоящей заявке, означает -C(O)-группу.The term “carbonyl,” as used herein, means a —C (O) group.
Термин "карбокси", как он используется в настоящей заявке, означает -CO2H группу.The term “carboxy,” as used herein, means a —CO 2 H group.
Термин "карбоксиалкил", как он используется в настоящей заявке, означает карбоксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры карбоксиалкила включают, но не ограничиваются этим, карбоксиметил, 2-карбоксиэтил и 3-карбоксипропил.The term “carboxyalkyl,” as used herein, means a carboxy group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of carboxyalkyl include, but are not limited to, carboxymethyl, 2-carboxyethyl, and 3-carboxypropyl.
Термин "циано", как он используется в настоящей заявке, означает -CN группу.The term “cyano,” as used herein, means a —CN group.
Термин "цианоалкил", как он используется в настоящей заявке, означает цианогруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры цианоалкила включают, но не ограничиваются этим, цианометил, 2-цианоэтил и 3-цианопропил.The term “cyanoalkyl,” as used herein, means a cyano group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of cyanoalkyl include, but are not limited to, cyanomethyl, 2-cyanoethyl, and 3-cyanopropyl.
Термин "циклоалкенил", как он используется в настоящей заявке, означает моноциклическую или бициклическую кольцевую систему, содержащую от 3 до 10 атомов углерода и содержащую, по меньшей мере, одну углерод-углеродную двойную связь, образованную путем удаления двух атомов водорода. Репрезентативные примеры моноциклических кольцевых систем включают, но не ограничиваются этим, 2-циклогексен-1-ил, 3-циклогексен-1-ил, 2,4-циклогексадиен-1-ил и 3-циклопентен-1-ил. Бициклические кольцевые системы представлены, в качестве примера, моноциклической циклоалкенильной кольцевой системой, которая является конденсированной с другим моноциклическим циклоалкильным кольцом, определенным в настоящей заявке, моноциклическим арильным кольцом, определенным в настоящей заявке, моноциклическим гетероциклом, определенным в настоящей заявке, или моноциклическим гетероарилом, определенным в настоящей заявке. Бициклические кольцевые системы по настоящему изобретению должны быть присоединены к исходной молекулярной группе через доступный атом углерода в циклоалкенильном кольце. Репрезентативные примеры бициклических кольцевых систем включают, но не ограничиваются этим, 4,5-дигидро-бензо[1,2,5]оксадиазол, 3a,4,5,6,7,7a-гексагидро-1H-инденил, 1,2,3,4,5,6-гексагидро-пенталенил, 1,2, 3,4,4a,5,6,8a-октагидро-пенталенил.The term “cycloalkenyl,” as used herein, means a monocyclic or bicyclic ring system containing from 3 to 10 carbon atoms and containing at least one carbon-carbon double bond formed by the removal of two hydrogen atoms. Representative examples of monocyclic ring systems include, but are not limited to, 2-cyclohexen-1-yl, 3-cyclohexen-1-yl, 2,4-cyclohexadien-1-yl and 3-cyclopenten-1-yl. Bicyclic ring systems are, by way of example, a monocyclic cycloalkenyl ring system that is fused to another monocyclic cycloalkyl ring as defined herein, a monocyclic aryl ring as defined herein, a monocyclic heterocycle as defined herein, or a monocyclic heteroaryl in this application. The bicyclic ring systems of the present invention should be attached to the parent molecular moiety through an accessible carbon atom in the cycloalkenyl ring. Representative examples of bicyclic ring systems include, but are not limited to, 4,5-dihydro-benzo [1,2,5] oxadiazole, 3a, 4,5,6,7,7a-hexahydro-1H-indenyl, 1,2, 3,4,5,6-hexahydro-pentalenyl, 1,2, 3,4,4a, 5,6,8a-octahydro-pentalenyl.
Термин "циклоалкил", как он используется в настоящей заявке, означает моноциклическую, бициклическую или спироциклическую кольцевую систему. Моноциклические кольцевые системы представлены, в качестве примера, насыщенной циклической углеводородной группой, содержащей от 3 до 8 атомов углерода. Примеры моноциклических кольцевых систем включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Бициклические циклоалкильные группы по настоящему изобретению представлены, в качестве примера, моноциклическим циклоалкильным кольцом, конденсированным с другим моноциклическим циклоалкильным кольцом, или моноциклическим циклоалкильным кольцом, конденсированным с циклоалкенилом, или моноциклическим циклоалкильным кольцом, конденсированным с фенильным кольцом, или моноциклическим циклоалкильным кольцом, конденсированным с моноциклическим гетероарильным кольцом, определенным в настоящей заявке, или моноциклическим циклоалкильным кольцом, конденсированным с моноциклическим гетероциклом, определенным в настоящей заявке. Бициклические циклоалкильные кольцевые системы по настоящему изобретению должны быть присоединены к исходной молекулярной группе через доступный атом углерода в моноциклоалкильном кольце.The term “cycloalkyl,” as used herein, means a monocyclic, bicyclic or spirocyclic ring system. Monocyclic ring systems are exemplified by a saturated cyclic hydrocarbon group containing from 3 to 8 carbon atoms. Examples of monocyclic ring systems include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl and cyclooctyl. The bicyclic cycloalkyl groups of the present invention are exemplified by a monocyclic cycloalkyl ring fused to another monocyclic cycloalkyl ring, or a monocyclic cycloalkyl ring fused to cycloalkenyl, or a monocyclic cycloalkyl ring fused to a phenyl ring, or a monocyclic fused to cycloalkyl a heteroaryl ring as defined herein or a monocyclic cycloalkyl a ring fused to a monocyclic heterocycle as defined herein. The bicyclic cycloalkyl ring systems of the present invention should be attached to the parent molecular moiety through an accessible carbon atom in the monocycloalkyl ring.
Циклоалкильные группы по настоящему изобретению, необязательно, являются замещенными 1, 2, 3 или 4 заместителями, выбраными из алкенила, алкокси, алкоксиалкокси, алкоксиалкила, алкоксикарбонила, алкоксисульфонила, алкила, алкилкарбонила, алкилкарбонилокси, алкилсульфонила, алкилтио, алкилтиоалкила, алкинила, карбокси, циано, формила, галогеналкокси, галогеналкила, галогена, гидрокси, гидроксиалкила, меркапто, оксо, Z1Z2N- или (Z3Z4N)карбонила.The cycloalkyl groups of the present invention are optionally substituted with 1, 2, 3 or 4 substituents selected from alkenyl, alkoxy, alkoxyalkoxy, alkoxyalkyl, alkoxycarbonyl, alkoxy sulfonyl, alkyl, alkylcarbonyl, alkylcarbonyloxy, alkylsulfonyl, alkylthio, alkylthio, alkylthio, alkylthio , formyl, haloalkoxy, haloalkyl, halogen, hydroxy, hydroxyalkyl, mercapto, oxo, Z 1 Z 2 N- or (Z 3 Z 4 N) carbonyl.
Термин "циклоалкилалкил", как он используется в настоящей заявке, означает циклоалкильную группу, присоединенную к исходной молекулярной группе через алкильную группу, определенную в настоящей заявке.The term “cycloalkylalkyl,” as used herein, means a cycloalkyl group attached to the parent molecular moiety through an alkyl group as defined herein.
Термин "циклоалкилкарбонил", как он используется в настоящей заявке, означает циклоалкильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через карбонильную группу, определенную в настоящей заявке. Репрезентативные примеры циклоалкилкарбонила включают, но не ограничиваются этим, циклопропилкарбонил, 2-циклобутилкарбонил и циклогексилкарбонил.The term “cycloalkylcarbonyl,” as used herein, means a cycloalkyl group, as defined herein, appended to the parent molecular moiety through a carbonyl group, as defined herein. Representative examples of cycloalkylcarbonyl include, but are not limited to, cyclopropylcarbonyl, 2-cyclobutylcarbonyl and cyclohexylcarbonyl.
Термин "формил", как он используется в настоящей заявке, означает -C(O)H группу.The term “formyl,” as used herein, means a —C (O) H group.
Термин "формилалкил", как он используется в настоящей заявке, означает формильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры формилалкила включают, но не ограничиваются этим, формилметил и 2-формилэтил.The term “formylalkyl,” as used herein, means a formyl group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of formylalkyl include, but are not limited to, formylmethyl and 2-formylethyl.
Термин "гало" или "галоген", как он используется в настоящей заявке, означает -Cl, -Br, -I или -F.The term “halo” or “halogen,” as used herein, means —Cl, —Br, —I, or —F.
Термин "галогеналкокси", как он используется в настоящей заявке, означает, по меньшей мере, один атом галогена, определенный в настоящей заявке, присоединенный к исходной молекулярной группе через алкоксигруппу, определенную в настоящей заявке. Репрезентативные примеры галогеналкокси включают, но не ограничиваются этим, хлорметокси, 2-фторэтокси, трифторметокси и пентафторэтокси.The term “haloalkoxy,” as used herein, means at least one halogen atom as defined herein attached to the parent molecular moiety through an alkoxy group as defined herein. Representative examples of haloalkoxy include, but are not limited to, chloromethoxy, 2-fluoroethoxy, trifluoromethoxy, and pentafluoroethoxy.
Термин "галогеналкил", как он используется в настоящей заявке, означает, по меньшей мере, один атом галогена, определенный в настоящей заявке, присоединенный к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры галогеналкила включают, но не ограничиваются этим, хлорметил, 2-фторэтил, трифторметил, пентафторэтил и 2-хлор-3-фторпентил.The term “haloalkyl,” as used herein, means at least one halogen atom, as defined herein, attached to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of haloalkyl include, but are not limited to, chloromethyl, 2-fluoroethyl, trifluoromethyl, pentafluoroethyl, and 2-chloro-3-fluoropentyl.
Термин "гетероарил", как он используется в настоящей заявке, означает моноциклический гетероарил или бициклический гетероарил. Моноциклический гетероарил представляет собой 5 или 6-членное кольцо, содержащее, по меньшей мере, один гетероатом, независимо выбранный из O, N или S. 5-членное кольцо содержит две двойные связи и может содержать один, два, три или четыре гетероатома. 6-членное кольцо содержит три двойные связи и может содержать один, два, три или четыре гетероатома. 5- или 6-членный гетероарил связан с исходной молекулярной группой через любой атом углерода или любой атом азота, содержащийся в гетероариле. Репрезентативные примеры моноциклического гетероарила включают, но не ограничиваются этим, фурил, индазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, тиазолил, тиенил, триазолил и триазинил. Бициклический гетероарил состоит из моноциклического гетероарила, конденсированного с моноциклическим арильным кольцом, определенным в настоящей заявке, моноциклическим циклоалкильным кольцом, определенным в настоящей заявке, моноциклическим циклоалкенильным кольцом, определенным в настоящей заявке, другим моноциклическим гетероарильным или моноциклическим гетероциклильным кольцом, определенным в настоящей заявке. Бициклические гетероарильные кольцевые системы по настоящему изобретению должны быть присоединены к исходной молекулярной группе через доступный атом углерода в гетероарильном кольце. Бициклический гетероарил связан с исходной молекулярной группой через любой атом углерода или любой атом азота, содержащийся в бициклическом гетероариле. Репрезентативные примеры бициклического гетероарила включают, но не ограничиваются этим, бензофуранил, бензоксадиазолил, 1,3-бензотиазолил, бензимидазолил, бензодиоксолил, бензотиофенил, хроменил, циннолинил, фуропиридин, индолил, индазолил, изоиндолил, изохинолинил, нафтиридинил, оксазолопиридин, хинолинил, тиенопиридин и тиенопиридинил.The term “heteroaryl,” as used herein, means monocyclic heteroaryl or bicyclic heteroaryl. A monocyclic heteroaryl is a 5 or 6 membered ring containing at least one heteroatom independently selected from O, N or S. The 5 membered ring contains two double bonds and may contain one, two, three or four heteroatoms. The 6 membered ring contains three double bonds and may contain one, two, three or four heteroatoms. A 5- or 6-membered heteroaryl is bonded to the parent molecular moiety through any carbon atom or any nitrogen atom contained in the heteroaryl. Representative examples of monocyclic heteroaryl include, but are not limited to, furyl, indazolyl, isoxazolyl, isothiazolyl, oxadiazolyl, oxazolyl, pyridinyl, pyridazinyl, pyrimidinyl, pyrazinyl, pyrazolyl, thiazylazole, thiazylazole. A bicyclic heteroaryl consists of a monocyclic heteroaryl fused to a monocyclic aryl ring as defined herein, a monocyclic cycloalkyl ring as defined herein, a monocyclic cycloalkenyl ring as defined herein, another monocyclic heteroaryl or monocyclic heterocyclic ring. The bicyclic heteroaryl ring systems of the present invention should be attached to the parent molecular group through an accessible carbon atom in the heteroaryl ring. A bicyclic heteroaryl is bonded to the parent molecular moiety through any carbon atom or any nitrogen atom contained in the bicyclic heteroaryl. Representative examples of bicyclic heteroaryl include, but are not limited to, benzofuranyl, benzoxadiazolyl, 1,3-benzothiazolyl, benzimidazolyl, benzodioxolyl, benzothiophenyl, chromenyl, cinnolinyl, furopyridine, indolyl, indazinopyridinyl, isoquinopyridinyl, thioquinopyridinyl .
Гетероарильные группы по настоящему изобретению, необязательно, являются замещенными 1, 2, 3 или 4 заместителями, независимо выбранными из алкенила, алкокси, алкоксиалкокси, алкоксиалкила, алкоксикарбонила, алкоксикарбонилалкила, алкоксисульфонила, алкила, алкилкарбонила, алкилкарбонилалкила, алкилкарбонилокси, алкилтио, алкилтиоалкила, алкинила, бензила, карбокси, карбоксиалкила, циано, цианоалкила, формила, галогеналкокси, галогеналкила, галогена, гидрокси, гидроксиалкила, меркапто, нитро, Z1Z2N- или (Z3Z4N)карбонила. Гетероарильные группы по настоящему изобретению, которые являются замещенными, могут присутствовать в виде таутомеров. Настоящее изобретение охватывает все таутомеры, включая неароматические таутомеры.The heteroaryl groups of the present invention are optionally substituted with 1, 2, 3 or 4 substituents independently selected from alkenyl, alkoxy, alkoxyalkoxy, alkoxyalkyl, alkoxycarbonyl, alkoxycarbonylalkyl, alkoxy sulfonyl, alkyl, alkylcarbonyl, alkylcarbonylalkyl, alkylalkyl, alkylalkyl, alkyl benzyl, carboxy, carboxyalkyl, cyano, cyanoalkyl, formyl, haloalkoxy, haloalkyl, halogen, hydroxy, hydroxyalkyl, mercapto, nitro, Z 1 Z 2 N - or (Z 3 Z 4 N) carbonyl. Heteroaryl groups of the present invention that are substituted may be present as tautomers. The present invention covers all tautomers, including non-aromatic tautomers.
Термин "гетероарилалкил", как он используется в настоящей заявке, означает гетероарильную группу, присоединенную к исходной молекулярной группе через алкильную группу, определенную в настоящей заявке.The term “heteroarylalkyl,” as used herein, means a heteroaryl group attached to the parent molecular moiety through an alkyl group as defined herein.
Термин "гетероцикл" или "гетероциклический", как он используется в настоящей заявке, относится к моноциклической, бициклической, трициклической или спироциклической кольцевой системе, которая содержит, по меньшей мере, один гетероатом. Моноциклический гетероцикл представляет собой 3, 4, 5, 6 или 7-членное кольцо, содержащее, по меньшей мере, один гетероатом, независимо выбранный из группы, состоящей из O, N и S. 3 или 4-членное кольцо содержит 1 гетероатом, выбранный из группы, состоящей из O, N и S. 5-членное кольцо не содержит совсем или содержит одну двойную связь и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. 6 или 7-членное кольцо не содержит совсем или содержит одну или две двойные связи и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Моноциклический гетероцикл связан с исходной молекулярной группой через любой атом углерода или любой атом азота, содержащийся в моноциклическом гетероцикле. Репрезентативные примеры моноциклического гетероцикла включают, но не ограничиваются этим, азетидинил, азепанил, азиридинил, диазепанил, 1,3-диоксанил, 1,3-диоксоланил, 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, изоиндолин-1,3-дион, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидотиоморфолинил (тиоморфолинсульфон), тиопиранил и тритианил. Бициклический гетероцикл по настоящему изобретению определяется как моноциклический гетероцикл, конденсированный с фенильной группой, циклоалкильной группой, определенной в настоящей заявке, циклоалкенильной группой, определенной в настоящей заявке, другой моноциклической гетероциклильной группой, определенной в настоящей заявке, или спироциклическим кольцом, где один атом углерода моноциклического гетероцикла связан образующими мостик двумя концами алкиленовой цепи. Бициклический гетероцикл по настоящему изобретению связан с исходной молекулярной группой через любой атом углерода или любой атом азота, содержащийся в гетероциклическом кольце. Репрезентативные примеры бициклического гетероцикла включают, но не ограничиваются этим, 1,3-бензодиоксолил, 1,3-бензодитиолил, 2,3-дигидро-1,4-бензодиоксинил, 2,3-дигидро-1-бензофуранил, 2,3-дигидро-1-бензотиенил, 3,4-дигидро-1H-изохромен-4-ил, 2,3-дигидро-1H-индолил, сукцинмимидил и 1,2,3,4-тетрагидрохинолинил. Трициклический гетероцикл представляет собой бициклический гетероцикл, конденсированный с фенилом, или бициклический гетероцикл, конденсированный с циклоалкилом, или бициклический гетероцикл, конденсированный с циклоалкенилом, или бициклический гетероцикл, конденсированный с моноциклическим гетероциклом. Трициклический гетероцикл связан с исходной молекулярной группой через любой атом углерода или любой атом азота, содержащийся в трициклическом гетероцикле. Репрезентативные примеры трициклического гетероцикла включают, но не ограничиваются этим, 2,3,4,4a,9,9a-гексагидро-1H-карбазолил, 5a,6,7,8,9,9a-гексагидродибензо[b,d]фуранил и 5a,6,7,8,9,9a-гексагидродибензо[b,d]тиенил.The term “heterocycle” or “heterocyclic,” as used herein, refers to a monocyclic, bicyclic, tricyclic or spirocyclic ring system that contains at least one heteroatom. A monocyclic heterocycle is a 3, 4, 5, 6 or 7 membered ring containing at least one heteroatom independently selected from the group consisting of O, N and S. A 3 or 4 membered ring contains 1 heteroatom selected from the group consisting of O, N and S. The 5-membered ring does not contain at all or contains one double bond and one, two or three heteroatoms selected from the group consisting of O, N and S. The 6 or 7-membered ring does not contains completely or contains one or two double bonds and one, two or three heteroatoms selected from the group consisting of O, N and S. A monocyclic heterocycle is bound to the parent molecular moiety through any carbon atom or any nitrogen atom contained in a monocyclic heterocycle. Representative examples of a monocyclic heterocycle include, but are not limited to, azetidinyl, azepanyl, aziridinyl, diazepanyl, 1,3-dioxanyl, 1,3-dioxolanyl, 1,3-dithiolanyl, 1,3-dithianyl, imidazolinyl, imidazolidinyl, isothiazolinyl , isoxazolinyl, isoxazolidinyl, isoindolin-1,3-dione, morpholinyl, oxadiazolinyl, oxadiazolidinyl, oxazolinyl, oxazolidinyl, piperazinyl, piperidinyl, pyranyl, pyrazolinyl-tetra-tyrinyl di-tetra-tyrinyl di-tetra-tyrinyl di-tetra-tyrinyl di-tetra-di-di-tetra-di-di-tetra-di-di-tetra-di-di-tetra-di-di-di-tetra-di-di-tetra-di-di-di-arynyl-tetra-di-di-thinyl-di-tetra-di-di-tetra-di-tyne-di-tetra-di-di-thinyl-di-Tyridinyl-tetra-di-Tyridinyl-Tyridinyl-Tyrnidinyl-Tyridinyl-Tyridinyl-Tyridinyl Tyridinyl Tyridinyl Tyridinyl Tyridinyl Tyridinyl Tyridinyl Tyridinyl Tyrenediyl Tyrnidinyl Tyridinyl Tires iazolinyl, thiazolidinyl, thiomorpholinyl, 1,1-dioxidothiomorpholinyl (thiomorpholinesulfone), thiopyranyl and tritianil. The bicyclic heterocycle of the present invention is defined as a monocyclic heterocycle fused to a phenyl group, a cycloalkyl group defined in this application, a cycloalkenyl group defined in this application, another monocyclic heterocyclic group defined in this application, or a spirocyclic ring, where one carbon atom is monocyclic the heterocycle is connected by forming the bridge with two ends of the alkylene chain. The bicyclic heterocycle of the present invention is linked to the parent molecular moiety through any carbon atom or any nitrogen atom contained in the heterocyclic ring. Representative examples of a bicyclic heterocycle include, but are not limited to, 1,3-benzodioxolyl, 1,3-benzodithiolyl, 2,3-dihydro-1,4-benzodioxinyl, 2,3-dihydro-1-benzofuranyl, 2,3-dihydro -1-benzothienyl, 3,4-dihydro-1H-isochromen-4-yl, 2,3-dihydro-1H-indolyl, succinimimidyl and 1,2,3,4-tetrahydroquinolinyl. A tricyclic heterocycle is a bicyclic heterocycle condensed with phenyl, or a bicyclic heterocycle condensed with cycloalkyl, or a bicyclic heterocycle condensed with cycloalkenyl, or a bicyclic heterocycle condensed with a monocyclic heterocycle. A tricyclic heterocycle is linked to the parent molecular group through any carbon atom or any nitrogen atom contained in a tricyclic heterocycle. Representative examples of a tricyclic heterocycle include, but are not limited to, 2,3,4,4a, 9,9a-hexahydro-1H-carbazolyl, 5a, 6,7,8,9,9a-hexahydrodibenzo [b, d] furanyl and 5a , 6,7,8,9,9a-hexahydrodibenzo [b, d] thienyl.
Гетероциклы по настоящему изобретению, необязательно, являются замещенными 1, 2 или 3 заместителями, независимо выбранными из алкенила, алкокси, алкоксиалкокси, алкоксиалкила, алкоксикарбонила, алкоксикарбонилалкила, алкоксисульфонила, алкила, алкилкарбонила, алкилкарбонилалкила, алкилкарбонилокси, алкилтио, алкилтиоалкила, алкинила, арила, бензила, карбокси, карбоксиалкила, циано, цианоалкила, формила, галогеналкокси, галогеналкила, галогена, гидрокси, гидроксиалкила, гидроксиалкилкарбонила, гидроксиалкоксиалкила, меркапто, оксо, Z1Z2N- или (Z3Z4N)карбонила.The heterocycles of the present invention are optionally substituted with 1, 2 or 3 substituents independently selected from alkenyl, alkoxy, alkoxyalkoxy, alkoxyalkyl, alkoxycarbonyl, alkoxycarbonylalkyl, alkoxyisulfonyl, alkyl, alkylcarbonyl, alkylcarbonyl, alkylthioalkylalkylalkylalkylalkylalkylalkylalkylalkylalkylalkylalkylalkylalkylalkyl , carboxy, carboxyalkyl, cyano, cyanoalkyl, formyl, haloalkoxy, haloalkyl, halogen, hydroxy, hydroxyalkyl, hydroxyalkylcarbonyl, hydroxyalkoxyalkyl, mercapto, oxo, Z 1 Z 2 N- or (Z 3 Z 4 N) carbonyl.
Термин "гетероциклалкил", как он используется в настоящей заявке, означает гетероциклильную группу, присоединенную к исходной молекулярной группе через алкильную группу, определенную в настоящей заявке.The term “heterocycloalkyl,” as used herein, means a heterocyclyl group attached to the parent molecular moiety through an alkyl group as defined herein.
Термин "гетероциклкарбонил", как он используется в настоящей заявке, означает гетероцикл, определенный в настоящей заявке, присоединенный к исходной молекулярной группе через карбонильную группу, определенную в настоящей заявке.The term “heterocyclecarbonyl,” as used herein, means a heterocycle, as defined herein, appended to the parent molecular moiety through a carbonyl group, as defined herein.
Термин "гидрокси", как он используется в настоящей заявке, означает -OH группу.The term “hydroxy,” as used herein, means an —OH group.
Термин "гидроксиалкил", как он используется в настоящей заявке, означает, по меньшей мере, одну гидроксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры гидроксиалкила включают, но не ограничиваются этим, гидроксиметил, 2-гидроксиэтил, 3-гидроксипропил, 2,3-дигидроксипентил и 2-этил-4-гидроксигептил.The term “hydroxyalkyl,” as used herein, means at least one hydroxy group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of hydroxyalkyl include, but are not limited to, hydroxymethyl, 2-hydroxyethyl, 3-hydroxypropyl, 2,3-dihydroxypentyl and 2-ethyl-4-hydroxyheptyl.
Термин "гидроксиалкилкарбонил", как он используется в настоящей заявке, означает гидроксиалкильную группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через карбонильную группу, определенную в настоящей заявке. Репрезентативные примеры включают, но не ограничиваются этим, 2-гидроксиацетил и 4-гидроксибутаноил.The term “hydroxyalkylcarbonyl,” as used herein, means a hydroxyalkyl group, as defined herein, appended to the parent molecular moiety through a carbonyl group, as defined herein. Representative examples include, but are not limited to, 2-hydroxyacetyl and 4-hydroxybutanoyl.
Термин "гидроксиалкоксиалкил", как он используется в настоящей заявке, означает гидроксиалкоксигруппу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры гидроксиалкоксиалкила включают, но не ограничиваются этим, (2-гидрокси-этокси)-этил и (3-гидрокси-пропокси)-этил.The term “hydroxyalkoxyalkyl,” as used herein, means a hydroxyalkoxy group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of hydroxyalkoxyalkyl include, but are not limited to, (2-hydroxy-ethoxy) ethyl and (3-hydroxy-propoxy) ethyl.
Термин "гидрокси-защитная группа" или "O-защитная группа" означает заместитель, который защищает гидроксильные группы от нежелательных реакций в ходе синтетических процедур. Примеры гидрокси-защитных групп включают, но не ограничиваются этим, замещенные простые метиловые эфиры, например, метоксиметил, бензилоксиметил, 2-метоксиэтоксиметил, 2-(триметилсилил)-этоксиметил, бензил и трифенилметил; тетрагидропираниловые эфиры; замещенные простые этиловые эфиры, например, 2,2,2-трихлорэтил и трет-бутил; силиловые эфиры, например, триметилсилил, трет-бутилдиметилсилил и трет-бутилдифенилсилил; циклические ацетали и кетали, например, метиленацеталь, ацетонид и бензилиденацеталь; циклические сложные орто-эфиры, например, метоксиметилен; циклические карбонаты; и циклические боронаты. Традиционно используемые гидрокси-защитные группы раскрыты в T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, New York (1999).The term “hydroxy protecting group” or “O-protecting group” means a substituent that protects the hydroxyl groups from undesired reactions during synthetic procedures. Examples of hydroxy protecting groups include, but are not limited to, substituted methyl ethers, for example, methoxymethyl, benzyloxymethyl, 2-methoxyethoxymethyl, 2- (trimethylsilyl) ethoxymethyl, benzyl and triphenylmethyl; tetrahydropyranyl ethers; substituted ethyl ethers, for example, 2,2,2-trichloroethyl and tert-butyl; silyl ethers, for example trimethylsilyl, tert-butyldimethylsilyl and tert-butyldiphenylsilyl; cyclic acetals and ketals, for example, methylene acetal, acetonide and benzylidene acetal; cyclic ortho esters, for example methoxymethylene; cyclic carbonates; and cyclic boronates. Traditionally used hydroxy protecting groups are disclosed in T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, New York (1999).
Термин "меркапто", как он используется в настоящей заявке, означает -SH группу.The term “mercapto,” as used herein, means an —SH group.
Термин "азот-защитная группа", как он используется в настоящей заявке, означает группы, которые предназначены для защиты аминогруппы от нежелательных реакций в ходе синтетических процедур. Предпочтительными азот-защитными группами являются ацетил, бензоил, бензил, бензилоксикарбонил (Cbz), формил, фенилсульфонил, трет-бутоксикарбонил (Boc), трет-бутилацетил, трифторацетил и трифенилметил (тритил).The term "nitrogen protecting group", as used herein, means groups that are intended to protect an amino group from undesirable reactions during synthetic procedures. Preferred nitrogen protecting groups are acetyl, benzoyl, benzyl, benzyloxycarbonyl (Cbz), formyl, phenylsulfonyl, tert-butoxycarbonyl (Boc), tert-butylacetyl, trifluoroacetyl and triphenylmethyl (trityl).
Термин "нитро", как он используется в настоящей заявке, означает -NO2 группу.The term “nitro,” as used herein, means an —NO 2 group.
Термин "триалкилсилил", как он используется в настоящей заявке, означает три независимо выбранные алкильные группы, определенные в настоящей заявке, присоединенные к исходной молекулярной группе через атом кремния. Репрезентативные примеры триалкилсилила включают, но не ограничиваются этим, триметилсилил, триэтилсилил, трет-бутилдиметилсилил и триизопропилсилил.The term “trialkylsilyl,” as used herein, means three independently selected alkyl groups, as defined herein, appended to the parent molecular moiety through a silicon atom. Representative examples of trialkylsilyl include, but are not limited to, trimethylsilyl, triethylsilyl, tert-butyldimethylsilyl, and triisopropylsilyl.
Термин "триалкилсилилалкил", как он используется в настоящей заявке, означает триалкилсилильную группу, определенную в настоящей заявке, присоединенные к исходной молекулярной группе через алкиленовую группу, определенную в настоящей заявке. Репрезентативные примеры триалкилсилилалкила включают, но не ограничиваются этим, триметилсилилметил, 2-триметилсилилэтил и 2-трет-бутилдиметилсилилэтил.The term “trialkylsilylalkyl,” as used herein, means a trialkylsilyl group, as defined herein, appended to the parent molecular moiety through an alkylene group, as defined herein. Representative examples of trialkylsilylalkyl include, but are not limited to, trimethylsilylmethyl, 2-trimethylsilylethyl and 2-tert-butyldimethylsilylethyl.
Термин "Z1Z2N", как он используется в настоящей заявке, означает две группы, Z1 и Z2, которые присоединены к исходной молекулярной группе через атом азота. Z1 и Z2, каждый независимо, представляют собой водород, алкоксикарбонил, алкил, алкилкарбонил, арил, арилалкил и формил. В некоторых случаях в настоящем изобретении, Z1 и Z2, взятые вместе с атомом азота, с которым они связаны, образуют гетероциклическое кольцо. Репрезентативные примеры Z1Z2N включают, но не ограничиваются этим, амино, метиламино, ацетиламино, ацетилметиламино, фениламино, бензиламино, азетидинил, пирролидинил и пиперидинил.The term “Z 1 Z 2 N”, as used herein, means two groups, Z 1 and Z 2 , which are attached to the parent molecular group through a nitrogen atom. Z 1 and Z 2 each independently represent hydrogen, alkoxycarbonyl, alkyl, alkylcarbonyl, aryl, arylalkyl and formyl. In some cases, in the present invention, Z 1 and Z 2 taken together with the nitrogen atom to which they are bonded form a heterocyclic ring. Representative examples of Z 1 Z 2 N include, but are not limited to, amino, methylamino, acetylamino, acetylmethylamino, phenylamino, benzylamino, azetidinyl, pyrrolidinyl and piperidinyl.
Термин " Z3Z4N", как он используется в настоящей заявке, означает две группы, Z3 и Z4, которые присоединены к исходной молекулярной группе через атом азота. Z3 и Z4, каждый независимо, представляют собой водород, алкил, арил и арилалкил. Репрезентативные примеры Z3Z4N включают, но не ограничиваются этим, амино, метиламино, фениламино и бензиламино.The term “Z 3 Z 4 N”, as used herein, means two groups, Z 3 and Z 4 , which are attached to the parent molecular group through a nitrogen atom. Z 3 and Z 4 each independently represent hydrogen, alkyl, aryl and arylalkyl. Representative examples of Z 3 Z 4 N include, but are not limited to, amino, methylamino, phenylamino, and benzylamino.
Термин "(Z3Z4N)карбонил", как он используется в настоящей заявке, означает NZ3Z4 группу, определенную в настоящей заявке, присоединенную к исходной молекулярной группе через карбонильную группу, определенную в настоящей заявке. Репрезентативные примеры (Z3Z4N)карбонила включают, но не ограничиваются этим, аминокарбонил, (метиламино)карбонил, (диметиламино)карбонил и (этилметиламино)карбонил.The term “(Z 3 Z 4 N) carbonyl,” as used herein, means an NZ 3 Z 4 group, as defined herein, appended to the parent molecular moiety through a carbonyl group, as defined herein. Representative examples of (Z 3 Z 4 N) carbonyl include, but are not limited to, aminocarbonyl, (methylamino) carbonyl, (dimethylamino) carbonyl, and (ethylmethylamino) carbonyl.
Термин "оксо", как он используется в настоящей заявке, означает =О группу.The term "oxo" as used in this application means = O group.
Термин "сульфинил", как он используется в настоящей заявке, означает -S(O)- группу.The term "sulfinyl", as used in this application, means -S (O) - group.
Термин "сульфонил", как он используется в настоящей заявке, означает -SO2- группу.The term “sulfonyl,” as used herein, means —SO 2 —group.
Термин "сульфонамид", как он используется в настоящей заявке, означает -SO2NH2 группу.The term “sulfonamide”, as used herein, means an —SO 2 NH 2 group.
Термин "таутомер", как он используется в настоящей заявке, означает сдвиг протона от одного атома в соединении к другому атому в этом же соединении, где два или более структурно отличных соединения находятся в равновесии друг с другом.The term "tautomer" as used in this application means a proton shift from one atom in a compound to another atom in the same compound, where two or more structurally different compounds are in equilibrium with each other.
Соединения по настоящему изобретению могут существовать в виде стереоизомеров, где присутствуют асимметрические или хиральные центры. Эти стереоизомеры представляют собой "R" или "S" в зависимости от конфигурации заместителей вокруг хирального атома углерода. Термины "R" и "S", используемые в настоящей заявке, означают конфигурации, определенные в IUPAC 1974 Recommendations for Section E, Fundamental Stereochemistry, Pure Appl. Chem., 1976, 45:13-30. Настоящее изобретение предусматривает различные стереоизомеры и их смеси, и они специально включены в объем настоящего изобретения. Стереоизомеры включают энантиомеры и диастереомеры и смеси энантиомеров или диастереомеров. Индивидуальные стереоизомеры соединений по настоящему изобретению можно получить синтетическим способом из коммерчески доступных исходных веществ, которые содержат асимметрические или хиральные центры, или путем получения рацемических смесей с последующим разделением, что хорошо известно специалистам в данной области. Такие способы разделения представляют собой, в качестве примера, (1) присоединение смеси энантиомеров к хиральному вспомогательному веществу, разделение полученной смеси диастереомеров при помощи перекристаллизации или хроматографии и выделение оптически чистого продукта из вспомогательного вещества; или (2) непосредственное разделение смеси оптических энантиомеров на хиральных хроматографических колонках.The compounds of the present invention can exist as stereoisomers where asymmetric or chiral centers are present. These stereoisomers are “R” or “S” depending on the configuration of the substituents around the chiral carbon atom. The terms "R" and "S" as used in this application mean configurations defined in IUPAC 1974 Recommendations for Section E, Fundamental Stereochemistry, Pure Appl. Chem., 1976, 45: 13-30. The present invention provides for various stereoisomers and mixtures thereof, and they are specifically included in the scope of the present invention. Stereoisomers include enantiomers and diastereomers and mixtures of enantiomers or diastereomers. The individual stereoisomers of the compounds of the present invention can be obtained synthetically from commercially available starting materials that contain asymmetric or chiral centers, or by preparing racemic mixtures followed by resolution, as is well known to those skilled in the art. Such separation methods are, by way of example, (1) coupling a mixture of enantiomers to a chiral auxiliary, separating the resulting mixture of diastereomers by recrystallization or chromatography, and isolating an optically pure product from the auxiliary; or (2) direct separation of the mixture of optical enantiomers on chiral chromatographic columns.
Соединения и способы по настоящему изобретению будут более понятны посредством ссылки на представленные ниже Примеры, которые предназначены в качестве иллюстрации, а не для ограничения объема настоящего изобретения. Кроме того, все ссылки, имеющиеся в настоящей заявке, включены посредством ссылки.The compounds and methods of the present invention will be better understood by reference to the Examples below, which are intended to illustrate and not to limit the scope of the present invention. In addition, all references in this application are incorporated by reference.
Названия соединений указаны с использованием программы наименования Name Pro, поставщиком которой является ACD/Labs. Альтернативно, названия соединений указаны с использованием программы наименования AUTONOM, поставщиком которой является компания MDL Information Systems GmbH (ранее известная как Beilstein Informationssysteme), Frankfurt, Germany, и она является частью набора программ CHEMDRA W® ULTRA v. 6.0.2 и ISIS Draw v. 2.5. Также, названия соединений указаны с использованием алгоритма наименования Struct=Name, который является частью набора программ CHEMDRA W® ULTRA v. 9.0.7.Connection names are specified using the Name Pro naming program, which is supplied by ACD / Labs. Alternatively, compound names are listed using the AUTONOM naming program, which is supplied by MDL Information Systems GmbH (formerly known as Beilstein Informationssysteme), Frankfurt, Germany, and is part of the CHEMDRA W® ULTRA v software suite. 6.0.2 and ISIS Draw v. 2.5. Also, compound names are indicated using the naming algorithm Struct = Name, which is part of the CHEMDRA W® ULTRA v software suite. 9.0.7.
АббревиатурыAbbreviations
Аббревиатуры, которые использованы в описаниях Схем и в Примерах, которые представлены ниже, следующие: ДМФА для N,N-диметилформамида, DMSO для диметилсульфоксида, EtOAc для этилацетата, CHCl3 для хлороформа, CH2Cl2 для дихлорметана, CH3CN для ацетонитрила, ТГФ для тетрагидрофурана, HATU для гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония, EDC или EDCI для гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, ЖХ/МС для жидкостной хроматографии/масс-спектроскопии, NH4OAc для ацетата аммония, NaBH(OAc)3 для триацетоксиборогидрида натрия, PBS для бычьего сывороточного альбумина, PBS для фосфатно-буферного солевого раствора, TMS для триметилсилила, MW для микроволнового облучения, DMAP для 4-(диметиламино)пиридина, dppf для 1,1'-бис(дифенилфосфино)ферроцена, ТФУ для трифторуксусной кислоты, BINAP для 2,2'-бис(дифенилфосфино)-1,1'-бинафила, TBAF для тетрабутиламмонийфторида, Tween для полиоксоэтиленсорбитанмонолаурата, ВЭЖХ для высоко-эффективной жидкостной хроматографии, DME для 1,2-диметоксиэтана, Boc для трет-бутоксикарбонила, BSA для бычьего сывороточного альбумина, DTT для дитиотреитола, АТФ для аденозинтрифосфата, EDTA для этилендиаминтетрауксусной кислоты, HPMC для гидроксипропилметилцеллюлозы, TMB для 3,3',5,5'-тетраметилбензидина и HEPES для 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты.The abbreviations used in the descriptions of the Schemes and in the Examples below are as follows: DMF for N, N-dimethylformamide, DMSO for dimethyl sulfoxide, EtOAc for ethyl acetate, CHCl 3 for chloroform, CH 2 Cl 2 for dichloromethane, CH 3 CN for acetonitrile , THF for tetrahydrofuran, HATU for O- (7-azabenzotriazol-1-yl) -N, N, N ', N'-tetramethyluronium hexafluorophosphate, EDC or EDCI for 1- (3-dimethylaminopropyl) -3-ethylcarbodiimide hydrochloride, LC / MS for liquid chromatography / mass spectroscopy, NH 4 OAc for ammonium acetate, NaBH (OAc) 3 for sodium triacetoxyborohydride, PBS for sheep’s serum albumin, PBS for phosphate buffered saline, TMS for trimethylsilyl, MW for microwave irradiation, DMAP for 4- (dimethylamino) pyridine, dppf for 1,1'-bis (diphenylphosphino) ferrocene, TFA for trifluoroacetic acid, BINAP for 2,2'-bis (diphenylphosphino) -1,1'-binafil, TBAF for tetrabutylammonium fluoride, Tween for polyoxyethylene sorbitan monolaurate, HPLC for high performance liquid chromatography, DME for 1,2-dimethoxyethane, Boc for tert-butoxycarbonyl, BSA for bovine serum albumin, DTT for dithiothreitol, ATP for adenosint ifosfata, EDTA for ethylenediaminetetraacetic acid, HPMC for hydroxypropylmethylcellulose, TMB for 3,3 ', 5,5'-tetramethylbenzidine and HEPES for 4- (2-hydroxyethyl) -1-piperazineethanesulfonic acid.
Получение соединений по настоящему изобретениюObtaining compounds of the present invention
Соединения и способы по настоящему изобретению будут более понятны в связи с представленными ниже Схемами синтеза и Примерами, которые иллюстрируют средства, при помощи которых можно получить соединения по настоящему изобретению.The compounds and methods of the present invention will be better understood in connection with the Synthesis Schemes and Examples presented below, which illustrate the means by which the compounds of the present invention can be obtained.
Схема 1Scheme 1
Как показано на Схеме 1, соединения формулы 2, которые являются типичными представителями соединений формулы (I), могут быть получены следующим образом. Соединения формулы 1, где R1 и R2 определены в формуле (I) и X1 представляет собой иод, бром или хлор, и которые могут быть получены из коммерческих источников или могут быть синтезированы в соответствии со способами, известными из литературы, при обработке реагентом А-M1, где A имеет значение, определенное в формуле (I), и M1 представляет собой -Sn(Rz)3 или -B(ORy)2, где Rz представляет собой алкил или арил и Ry представляет собой водород, алкил, арил, или две группы Ry вместе с атомом бора, с которым они связаны, образуют 1,3-диоксоборолан, в присутствии палладиевого катализатора будут обеспечивать соединения формулы 2. В таких реакциях между соединениями формулы 1 и соединениями формулы -Sn(Rz)3, широко известных как сочетания по методу Стилле, используют палладиевый катализатор, такой как, но не ограничиваясь этим, тетракис(трифенилфосфин)палладий(0), дихлорбис(трифенилфосфин)палладий(II), трис(дибензиллиденацетон)дипалладий или диацетат палладия, в присутствии или в отсутствие лиганда, такого как три(2-фурил)фосфин или трифениларсин, в растворителе, таком как толуол или ДМФА, при температуре от около 25°C до около 150°C. Кроме того, могут быть добавлены соли Li(I), Cu(I) или Mn(II) для улучшения реакционной способности или специфичности. В реакциях между соединениями формулы 1 и соединениями формулы -B(ORy)2, широко известных как связывания по методу Сузуки, используют палладиевые катализаторы, такие как, но не ограничиваясь этим, тетракис(трифенилфосфин)палладий(0), дихлорбис(трифенилфосфин)палладий(II), трис(дибензилидинацетон)дипалладий или диацетат палладия. Можно добавить лиганд палладия, такой как 2-(дициклогексилфосфино)бифенил, три-трет-бутилфосфин или трис(2-фурил)фосфин, и основание, такое как, но не ограничиваясь этим, водный K3PO4, карбонат цезия, карбонат калия или Na2CO3, в растворителях, таких как толуол, диметоксиэтан, диоксан, вода или ДМФА, при температуре от около 25°C до около 150°C. Реакцию также можно осуществлять при нагревании в реакторе, представляющем собой микроволновую печь.As shown in Scheme 1, compounds of formula 2, which are typical representatives of compounds of formula (I), can be prepared as follows. The compounds of formula 1, where Rone and R2 defined in formula (I) and Xone represents iodine, bromine or chlorine, and which can be obtained from commercial sources or can be synthesized in accordance with methods known from the literature, when treated with reagent A-Monewhere A has the meaning defined in formula (I), and Monerepresents -Sn (Rz)3 or -B (ORy)2where Rz represents alkyl or aryl and Ry represents hydrogen, alkyl, aryl, or two groups Ry together with the boron atom to which they are attached form 1,3-dioxoborolane, in the presence of a palladium catalyst, compounds of formula 2 will be provided. In such reactions between compounds of formula 1 and compounds of formula -Sn (Rz)3commonly known as Stille combinations, a palladium catalyst is used, such as, but not limited to, tetrakis (triphenylphosphine) palladium (0), dichlorobis (triphenylphosphine) palladium (II), tris (dibenzylideneacetone) dipalladium or palladium diacetate, in the presence of or in the absence of a ligand, such as tri (2-furyl) phosphine or triphenylarsine, in a solvent, such as toluene or DMF, at a temperature of from about 25 ° C to about 150 ° C. In addition, salts of Li (I), Cu (I) or Mn (II) can be added to improve reactivity or specificity. In reactions between compounds of formula 1 and compounds of formula -B (ORy)2commonly known as Suzuki bindings, palladium catalysts are used, such as, but not limited to, tetrakis (triphenylphosphine) palladium (0), dichlorobis (triphenylphosphine) palladium (II), tris (dibenzylidine acetone) dipalladium or palladium diacetate. You can add a palladium ligand, such as 2- (dicyclohexylphosphino) biphenyl, tri-tert-butylphosphine or tris (2-furyl) phosphine, and a base such as, but not limited to, aqueous K3POfour, cesium carbonate, potassium carbonate or Na2CO3, in solvents such as toluene, dimethoxyethane, dioxane, water or DMF, at a temperature of from about 25 ° C to about 150 ° C. The reaction can also be carried out by heating in a microwave reactor.
Хотя многие органостаннаны являются коммерчески доступными или описаны в литературе, можно также получить дополнительные станнаны из А-галогенидов или А-трифлатов путем обработки гекса-алкилдистаннаном формулы ((Rz)3Sn)2 в присутствии Pd(Ph3P)4. Подобным образом, в отсутствие коммерчески доступных борорганических реагентов, -B(ORy)2 можно получить из соответствующих галогенидов или трифлатов (A-галоген или А-трифлат) через металлообмен с литийорганическим соединением с последующим добавлением алкилбората.Although many organostannans are commercially available or described in the literature, additional stannanes can also be obtained from A-halides or A-triflates by treatment with hexa-alkyl distannan of the formula ((R z ) 3 Sn) 2 in the presence of Pd (Ph 3 P) 4 . Similarly, in the absence of commercially available organoboron reagents, -B (OR y ) 2 can be obtained from the corresponding halides or triflates (A-halogen or A-triflate) via metal exchange with an organolithium compound followed by alkyl borate.
Схема 2Scheme 2
Соединения формулы 2, где R1 и R2 определены в формуле (I), и A представляет собой гетероарильное кольцо, связанное с исходной группой через атом азота, можно получить как проиллюстрировано на Схеме 2. Обработка соединений формулы I реагентом формулы А-Н, где H представляет собой водород по атому азота, содержащемуся в гетероарильном кольце A, в присутствии основания, такого как, но не ограничиваясь этим, трет-бутоксид натрия или карбонат цезия, и металлического катализатора, такого как, но не ограничиваясь этим, металлическая медь, CuI или диацетат палладия, и необязательно с лигандом, таким как, но не ограничиваясь этим, BINAP или три-трет-бутилфосфин, будет обеспечивать соединения формулы 2.The compounds of formula 2, where R 1 and R 2 are defined in formula (I), and A is a heteroaryl ring bonded to the parent group through a nitrogen atom, can be prepared as illustrated in Scheme 2. Treatment of compounds of formula I with a reagent of formula AH, where H represents hydrogen on the nitrogen atom contained in the heteroaryl ring A, in the presence of a base such as, but not limited to, sodium tert-butoxide or cesium carbonate, and a metal catalyst such as, but not limited to, metallic copper, CuI or diacetate palladium, and optionally with a ligand, such as, but not limited to, BINAP or tri-tert-butylphosphine, will provide compounds of formula 2.
Схема 3Scheme 3
Как указано выше для Схемы 1, соединения формулы (I) могут быть синтезированы с использованием сочетания по методу Стилле, как описано на Схеме 3. Соединения формулы 3, где Rii имеет значение, определенное в формуле (I), при их обработке соединениями формулы 4, где R1 имеет значение, определенное в формуле (I), и P1 представляет собой азот-защитную группу, такую как, но не ограничиваясь этим, трет-бутилоксикарбонил или ацетил, в присутствии дихлорбис(трифенилфосфин)палладия(II) и (тиофен-2-карбонилокси)меди, в толуоле, в условиях нагревания, будут обеспечивать соединения формулы 5. Соединения формулы 5, при их обработке в условиях, известных как используемых для удаления защитной группы, таких как хлористоводородная кислота или трифторуксусная кислота в растворителе, таком как уксусная кислота или диоксан, когда защитная группа представляет собой трет-бутилоксикарбонил, или гидроксид натрия, гидроксид лития или гидроксид калия в водной смеси ТГФ, изопропанола или диоксана, когда защитная группа представляет собой ацетил, будут обеспечивать соединения формулы 6, которые являются типичными представителями соединений формулы (I) где A представляет собой (ii).As indicated above for Scheme 1, the compounds of formula (I) can be synthesized using the Stille coupling as described in Scheme 3. The compounds of formula 3, where R ii has the meaning defined in formula (I), when treated with compounds of the formula 4, where R 1 has the meaning defined in formula (I), and P 1 represents a nitrogen protecting group, such as, but not limited to, tert-butyloxycarbonyl or acetyl, in the presence of dichlorobis (triphenylphosphine) palladium (II) and (thiophene-2-carbonyloxy) copper, in toluene, under heating, will provide Compound of Formula 5. Compounds of Formula 5, when processed under conditions known to be used to remove the protecting group, such as hydrochloric acid or trifluoroacetic acid in a solvent such as acetic acid or dioxane, when the protecting group is tert-butyloxycarbonyl, or sodium hydroxide, lithium hydroxide or potassium hydroxide in an aqueous mixture of THF, isopropanol or dioxane, when the protective group is acetyl, will provide compounds of formula 6, which are typical my representatives of the compounds of formula (I) where A represents (ii).
Схема 4Scheme 4
Соединения формулы 3, используемые в Схеме 3 для получения соединений формулы (I), можно получить, как показано на Схеме 4. Соединения формулы 7, которые получают из коммерческих источников или которые можно получить в соответствии со способами, известными специалистам в данной области, при обработке их либо 1,1,1-трибутил-N,N-диметилстаннамином или метил этил(трибутилстаннил)карбаматом, будут обеспечивать соединения формулы 8. Алкины формулы 8, при нагревании в присутствии соединений формулы 9, где Rii имеет значение, определенное в формуле (I), и N3 представляет собой азид, будут обеспечивать соединения формулы 3.The compounds of formula 3 used in Scheme 3 to obtain compounds of formula (I) can be obtained as shown in Scheme 4. Compounds of formula 7, which are obtained from commercial sources or which can be obtained in accordance with methods known to specialists in this field, when treating them with either 1,1,1-tributyl-N, N-dimethylstannamine or methyl ethyl (tributylstannyl) carbamate will provide compounds of formula 8. Alkines of formula 8, when heated in the presence of compounds of formula 9, where R ii has the meaning defined in formula (I), and N 3 is an azide, compounds of formula 3 will provide.
Схема 5Scheme 5
Как показано на Схеме 5, соединения формулы 12, которые являются типичными представителями соединений формулы (I), где A представляет собой (ii), могут быть получены следующим образом. Соединения формулы 10, где R1 имеет значение, определенное в формуле (I), и X1 представляет собой иод, бром, хлор или трифлат, при их обработке TMS ацетиленом в присутствии иодида меди, дихлорбис(трифенилфосфин)палладия(II) и триэтиламина, с последующей обработкой тетрабутиламмонийфторидом или гидроксидом калия, будут обеспечивать соединения формулы 11. Реакцию можно осуществлять в растворителе, таком как, но не ограничиваясь этим, ДМФА, при температуре окружающей среды или в условиях нагревания. Соединения формулы 11, при их обработке Rii-Cl, азидом натрия, сульфат меди и металлической медью, в условиях нагревания, в растворителе, таком как диоксан, будут обеспечивать соединения формулы 12, которые являются типичными представителями соединений формулы (I), где A представляет собой (ii).As shown in Scheme 5, compounds of formula 12, which are typical representatives of compounds of formula (I), where A represents (ii), can be obtained as follows. The compounds of formula 10, where R 1 has the meaning defined in formula (I) and X 1 represents iodine, bromine, chlorine or triflate, when they are treated with TMS acetylene in the presence of copper iodide, dichlorobis (triphenylphosphine) palladium (II) and triethylamine , followed by treatment with tetrabutylammonium fluoride or potassium hydroxide, will provide compounds of formula 11. The reaction can be carried out in a solvent, such as, but not limited to, DMF, at ambient temperature or under heating conditions. Compounds of formula 11, when treated with R ii -Cl, sodium azide, copper sulfate and metallic copper, under heating, in a solvent such as dioxane, will provide compounds of formula 12, which are typical representatives of compounds of formula (I), where A represents (ii).
Схема 6Scheme 6
Альтернативно, соединения формулы 13, при их обработке TMS-ацетиленом в присутствии иодида меди, дихлорбис(трифенилфосфин)палладия(II) и триэтиламина, с последующей обработкой тетрабутиламмонийфторидом или гидроксидом калия, будут обеспечивать соединения формулы 14. Реакцию можно осуществлять в растворителе, таком как, но не ограничиваясь этим, ДМФА, при температуре окружающей среды или в условиях нагревания. Соединения формулы 14, при их обработке соединениями формулы 9, где Rii имеет значение, определенное в формуле (I), или азидом натрия, сульфатом меди и металлической медью в условиях нагревания будут обеспечивать соединения формулы 15. Соединения формулы 15, при нагревании в присутствии гидразина в этаноле, будут обеспечивать соединения формулы 16. Соединения формулы 16, при их обработке ди-трет-бутилдикарбонатом и каталитическим количеством DMAP в растворителе, таком как ТГФ или ацетонитрил, будут обеспечивать соединения формулы 17. Соединения формулы 17, при их обработке соединениями формулы 18 в присутствии основания, такого как, но не ограничиваясь этим, пиридин, в растворителе, таком как дихлорметан, с последующей обработкой трифторуксусной кислотой будут обеспечивать соединения формулы 19. Соединения формулы 16, при обработке карбоновой кислотой с использованием условий связывания карбоновой кислоты-амина, известных специалистам в данной области, будут обеспечивать соединения формулы 19A. Стандартные условия связывания карбоновой кислоты-амина включают добавление связывающего реагента, такого как, но не ограничиваясь этим, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI), 1,3-дициклогексилкарбодиимид (DCC), хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты (BOPCl), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или тетрафторборат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (TBTU), с использованием или без вспомогательного вещества, такого как, но не ограничиваясь этим, 1-гидрокси-7-азабензотриазол (HOAT) или гидрат 1-гидроксибензотриазола (HOBT), в растворителе, таком как, но не ограничиваясь этим, дихлорметан.Alternatively, compounds of formula 13, when treated with TMS-acetylene in the presence of copper iodide, dichlorobis (triphenylphosphine) palladium (II) and triethylamine, followed by treatment with tetrabutylammonium fluoride or potassium hydroxide, will provide compounds of formula 14. The reaction can be carried out in a solvent such as , but not limited to, DMF, at ambient temperature or under heating. Compounds of formula 14, when treated with compounds of formula 9, where R ii has the meaning defined in formula (I), or sodium azide, copper sulfate and metallic copper under heating conditions will provide compounds of formula 15. Compounds of formula 15, when heated in the presence of hydrazine in ethanol will provide compounds of formula 16. Compounds of formula 16, when treated with di-tert-butyl dicarbonate and a catalytic amount of DMAP in a solvent such as THF or acetonitrile, will provide compounds of formula 17. Compounds of form 17, when treated with compounds of formula 18 in the presence of a base such as, but not limited to, pyridine, in a solvent such as dichloromethane, followed by treatment with trifluoroacetic acid, will provide compounds of formula 19. Compounds of formula 16, when treated with a carboxylic acid with using the carboxylic acid-amine coupling conditions known to those skilled in the art, compounds of formula 19A will be provided. Standard carboxylic acid-amine coupling conditions include the addition of a coupling reagent such as, but not limited to, 1- (3-dimethylaminopropyl) -3-ethylcarbodiimide hydrochloride (EDCI), 1,3-dicyclohexylcarbodiimide (DCC), bis (2- oxo-3-oxazolidinyl) phosphinic acid (BOPCl), O- (7-azabenzotriazol-1-yl) -N, N, N ', N'-tetramethyluronium hexafluorophosphate (HATU), or O-benzotriazol-1-yl-N tetrafluoroborate , N, N ', N'-tetramethyluronium (TBTU), with or without an adjuvant, such as, but not limited to, 1-hydroxy-7-azabenzotriaz l (HOAT) or 1-hydroxybenzotriazole hydrate (HOBT), in a solvent such as, but not limited to, dichloromethane.
Схема 7Scheme 7
Соединения формулы 24, которые являются типичными представителями соединений формулы (I), могут быть получены следующим образом. Соединения формулы 20, где X1 представляет собой галоген или трифлат, при их обработке соединением формулы 21, уксусным ангидридом и основанием, таким как, но не ограничиваясь этим, ацетат калия, в условиях нагревания будут обеспечивать соединения формулы 22. Соединения формулы 22, при их обработке азидом натрия, сульфатом меди, основанием, таким как карбонат натрия, и соединения формулы 23, где Rii имеет значение, определенное в формуле (I), и которые либо являются доступными из коммерческих источников, либо могут быть получены специалистами в данной области, будут обеспечивать соединения формулы 24.Compounds of formula 24, which are representative of compounds of formula (I), may be prepared as follows. Compounds of formula 20, wherein X 1 is halogen or triflate, when treated with a compound of formula 21, acetic anhydride and a base such as, but not limited to, potassium acetate, compounds of formula 22 will be provided under heating conditions. Compounds of formula 22 their treatment with sodium azide, copper sulfate, a base such as sodium carbonate, and the compounds of formula 23, where R ii has the meaning defined in formula (I), and which are either available from commercial sources or can be obtained by specialists in this area, will provide compounds of formula 24.
Схема 8Scheme 8
Как показано на Схеме 8, соединения формулы 29 и 30, которые являются типичными представителями соединений формулы (I), могут быть получены следующим образом. Соединения формулы 25, где R1 имеет значение, определенное в формуле (I), и X1 представляет собой галоген или трифлат, при их обработке соединениями формулы 23, иодидом меди, дихлорбис(трифенилфосфин)палладием(II) и триэтиламином в ДМФА, при температуре окружающей среды или в условиях нагревания будут обеспечивать соединения формулы 27. Соединения формулы 27, при их обработке соединениями формулы 9 в условиях нагревания и либо без растворителя, либо в растворителе, таком как, но не ограничиваясь этим, диоксан, будут обеспечивать соединения формулы 29 и 30.As shown in Scheme 8, compounds of formula 29 and 30, which are typical representatives of compounds of formula (I), can be obtained as follows. Compounds of formula 25, wherein R 1 is as defined in formula (I) and X 1 is halogen or triflate when treated with compounds of formula 23, copper iodide, dichlorbis (triphenylphosphine) palladium (II) and triethylamine in DMF, at ambient temperature or under heating conditions, compounds of formula 27 will provide. Compounds of formula 27, when treated with compounds of formula 9 under heating conditions and either without a solvent or in a solvent such as, but not limited to, dioxane, will provide compounds of the formula 29 and 30.
Схема 9Scheme 9
Соединения формулы 32, которые являются типичными представителями соединений формулы (I), где A представляет собой (vii) и R1 и RVii определены в формуле (I), могут быть получены следующим образом. Альдегиды формулы 31, где Rvii имеет значение, определенное в формуле (I), которые могут быть получены из коммерческих источников, при их обработке гидрохлоридом гидроксиламина и водным раствором гидроксида натрия, будут обеспечивать промежуточное соединение оксима, которое, при его окислении Хлорамином T тригидратом, с последующей обработкой сульфатом меди и медной проволокой и соединениями формулы 11, будут обеспечивать соединения формулы 32.Compounds of formula 32, which are typical representatives of compounds of formula (I), wherein A is (vii) and R 1 and R Vii are defined in formula (I), can be prepared as follows. Aldehydes of the formula 31, where R vii has the meaning defined in formula (I), which can be obtained from commercial sources, when treated with hydroxylamine hydrochloride and an aqueous solution of sodium hydroxide, will provide an intermediate oxime compound which, when oxidized with Chloramine T trihydrate , followed by treatment with copper sulfate and a copper wire and compounds of formula 11, will provide compounds of formula 32.
Схема 10Pattern 10
Соединения формулы 38, которые являются типичными представителями соединений формулы (I), где A представляет собой (x), получают следующим образом. Соединения формулы 33, где R1 имеет значение, определенное в формуле (I), которые могут быть получены из коммерческих источников или могут быть получены специалистами в данной области, при их обработке N,O-диметилгидроксиламином с использованием кислотных условий связывания, известных специалистам в данной области, будут обеспечивать соединения формулы 34. Стандартные условия связывания карбоновой кислоты-амина включают добавление связывающего реагента, такого как, но не ограничиваясь этим, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI), 1,3-дициклогексилкарбодиимид (DCC), хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты (BOPCl), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или тетрафторборат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (TBTU), с использованием или без вспомогательного вещества, такого как, но не ограничиваясь этим, 1-гидрокси-7-азабензотриазол (HOAT) или гидрат 1-гидроксибензотриазола (HOBT), в растворителе, таком как, но не ограничиваясь этим, дихлорметан. Соединения формулы 34, при их обработке реагентом Гриньяра, таким как бензилмагнийбромид, в растворителе, таком как тетрагидрофуран, при температуре ниже температуры окружающей среды будут обеспечивать соединения формулы 35. Соединения формулы 35, при их обработке реагентом, представляющим собой защитную группу, таким как, но не ограничиваясь этим, ди-трет-бутилдикарбонат, и каталитическим количеством DMAP в растворителе, таком как ТГФ или ацетонитрил, будут обеспечивать соединения формулы 36. Соединения формулы 36, при их обработке трибромидом пиридиния в растворителе, таком как, но не ограничиваясь этим, ТГФ, с нагреванием или без нагревания будут обеспечивать соединения формулы 36 A. Соединения формулы 36 A, при их обработке соединениями формулы 37 с нагреванием или без нагревания, с последующей обработкой продукта, подвергая его условиям, которые удаляют азот-защитную группу, будут обеспечивать соединения формулы 38. Традиционно используемые азот-защитные группы, а также способы их удаления раскрыты в T.W. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, New York (1999).Compounds of formula 38, which are representative of compounds of formula (I), wherein A is (x), are prepared as follows. The compounds of formula 33, where R 1 has the meaning defined in formula (I), which can be obtained from commercial sources or can be obtained by specialists in this field, when they are treated with N, O-dimethylhydroxylamine using acidic coupling conditions known to specialists in compounds of formula 34 will provide in this area. Standard conditions for the coupling of a carboxylic acid-amine include the addition of a binding reagent, such as, but not limited to, 1- (3-dimethylaminopropyl) -3-ethylcarbodi hydrochloride amide (EDCI), 1,3-dicyclohexylcarbodiimide (DCC), bis (2-oxo-3-oxazolidinyl) phosphinic acid chloride (BOPCl), O- (7-azabenzotriazol-1-yl) -N, N, N 'hexafluorophosphate , N'-tetramethyluronium (HATU) or tetrafluoroborate O-benzotriazol-1-yl-N, N, N ', N'-tetramethyluronium (TBTU), with or without an excipient such as, but not limited to, 1- hydroxy-7-azabenzotriazole (HOAT) or 1-hydroxybenzotriazole hydrate (HOBT), in a solvent such as, but not limited to, dichloromethane. Compounds of formula 34, when treated with a Grignard reagent such as benzyl magnesium bromide, in a solvent such as tetrahydrofuran, will provide compounds of formula 35 at ambient temperature. Compounds of formula 35, when treated with a reagent that is a protecting group, such as but not limited to, di-tert-butyl dicarbonate and a catalytic amount of DMAP in a solvent such as THF or acetonitrile will provide compounds of formula 36. Compounds of formula 36, when they are treated with tribromido pyridinium in a solvent such as, but not limited to, THF, with or without heating, will provide compounds of formula 36 A. Compounds of formula 36 A, when treated with compounds of formula 37 with or without heating, followed by treatment of the product, exposing it Compounds of Formula 38 will provide conditions that remove a nitrogen protecting group. Traditionally used nitrogen protecting groups and methods for their removal are disclosed in TW Greene and PGM Wuts, Protective Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, New York (1999).
Схема 11Scheme 11
Соединения формулы 36, где R1 имеет значение, определенное в формуле (I), и P1 представляет собой азот-защитную группу, при их обработке соединениями формулы 39 в условиях нагревания, с последующей обработкой продукта, подвергая его условиям, которые, как это известно специалистам в данной области, удаляют азот-защитную группу, или как показано в литературе, будут обеспечивать соединения формулы 40, которые являются типичными представителями соединений формулы (I), где A представляет собой (xvii).Compounds of formula 36, wherein R 1 is as defined in formula (I) and P 1 is a nitrogen protecting group when they are treated with compounds of formula 39 under heating conditions, followed by treatment of the product, subjecting it to conditions that, like this It is known to those skilled in the art that the nitrogen protecting group is removed, or, as shown in the literature, will provide compounds of formula 40, which are typical representatives of compounds of formula (I), where A is (xvii).
Схема 12Pattern 12
Как показано на Схеме 12, соединения формулы 47, которые являются типичными представителями соединений формулы (I), где A представляет собой (x), могут быть получены следующим образом. Соединения формулы 41, где R1 имеет значение, определенное в формуле (I), при их обработке ди-трет-бутилдикарбонатом и каталитическим количеством DMAP в растворителе, таком как ТГФ или ацетонитрил, будут обеспечивать соединения формулы 42. Обработка соединений формулы 42 трибутил(1-этоксивинил)станнаном и дихлорбис(трифенилфосфин)палладием(II) будет обеспечивать соединения формулы 44. Соединения формулы 44, при их обработке трибромидом пиридиния в ТГФ будут обеспечивать соединения формулы 45. Соединения формулы 45, при их обработке соединениями формулы 46 в растворителе, таком как, но не ограничиваясь этим, этанол, где Rx имеет значение, определенное в формуле (I), будут обеспечивать соединения формулы 47.As shown in Scheme 12, compounds of formula 47, which are typical representatives of compounds of formula (I), where A is (x), can be obtained as follows. Compounds of formula 41, wherein R 1 is as defined in formula (I), when treated with di-tert-butyl dicarbonate and a catalytic amount of DMAP in a solvent such as THF or acetonitrile, compounds of formula 42 will be provided. Treatment of compounds of formula 42 with tributyl ( 1-ethoxyvinyl) stannane and dichlorobis (triphenylphosphine) palladium (II) will provide compounds of formula 44. Compounds of formula 44, when treated with pyridinium tribromide in THF, will provide compounds of formula 45. Compounds of formula 45, when treated with compounds of form uly 46 in a solvent such as, but not limited to, ethanol, wherein R x is as defined in formula (I), will provide compounds of formula 47.
Схема 13Pattern 13
Как показано на Схеме 13, соединения формулы 51, которые являются типичными представителями соединений формулы (I), где A представляет собой (iv), могут быть получены следующим образом. Соединения формулы 48, где R1 имеет значение, определенное в формуле (I), и которые являются либо доступными через коммерческие источники, либо их можно получить в соответствии с процедурами, описанными в литературе, или как показано в настоящей заявке, при нагревании в присутствии соединений формулы 49, а также соединений формулы 50, которые либо являются коммерчески доступными, либо могут быть получены специалистами в данной области с использованием процедур, описанных в литературе, будут обеспечивать соединения формулы 51.As shown in Scheme 13, compounds of formula 51, which are typical representatives of compounds of formula (I), where A is (iv), can be obtained as follows. The compounds of formula 48, where R 1 has the meaning defined in formula (I), and which are either available through commercial sources, or can be obtained in accordance with the procedures described in the literature, or as shown in this application, when heated in the presence of compounds of formula 49, as well as compounds of formula 50, which are either commercially available or can be obtained by specialists in this field using the procedures described in the literature, will provide compounds of formula 51.
Схема 14Scheme 14
Как показано на Схеме 14, соединения формулы 55, которые являются типичными представителями соединений формулы (I), где A представляет собой (xiv), (xv), (xvi) или (xvii), могут быть получены следующим образом. Соединения формулы (52), где R1 имеет значение, определенное в формуле (I), при их обработке бутиллитием с последующей обработкой ДМФА, а затем кислотной обработкой, будут обеспечивать соединения формулы 48. Соединения формулы 48, при их обработке соединениями формулы 51, где X представляет собой -CH-, -N- или -S-, Y представляет собой -CH-, -N- или связь, и три(трифлат)ом скандия, с последующей обработкой соединениями формулы 54, где Za определен в формуле (I), будут обеспечивать соединения формулы 55.As shown in Scheme 14, compounds of formula 55, which are typical representatives of compounds of formula (I), where A is (xiv), (xv), (xvi) or (xvii), can be obtained as follows. The compounds of formula (52), where R 1 has the meaning defined in formula (I), when they are treated with butyllithium followed by treatment with DMF and then acid treatment, will provide compounds of formula 48. Compounds of formula 48, when treated with compounds of formula 51, where X is —CH—, —N— or —S—, Y is —CH—, —N— or a bond, and three (triflate) ohm scandium, followed by treatment with compounds of formula 54, where Z a is defined in the formula (I) will provide compounds of formula 55.
Схема 15Scheme 15
Как показано на Схеме 15, соединения формулы 56, которые являются типичными представителями соединений формулы (I), где A представляет собой (vii), могут быть получены следующим образом. Соединения формулы (11), где R1 имеет значение, определенное в формуле (I), при их обработке реагентом, таким как, но не ограничиваясь этим, этил 2-хлор-2-(гидроксиимино)ацетат, с основанием, таким как, но не ограничиваясь этим, триэтиламин, будут обеспечивать соединения формулы 56. Реакцию можно осуществить в растворителе, таком как, но ограничиваясь этим, толуол, и может потребоваться применение нагревания.As shown in Scheme 15, compounds of formula 56, which are representative of compounds of formula (I), wherein A is (vii), can be prepared as follows. The compounds of formula (11), where R 1 has the meaning defined in formula (I), when they are treated with a reagent, such as, but not limited to, ethyl 2-chloro-2- (hydroxyimino) acetate, with a base such as, but not limited to triethylamine, will provide compounds of formula 56. The reaction can be carried out in a solvent such as, but not limited to, toluene, and the use of heat may be required.
Схема 16Pattern 16
Как показано на Схеме 16, соединения формулы 29, которые являются типичными представителями соединений формулы (I), где A представляет собой (ii), могут быть получены следующим образом. Соединения формулы (27), где R1 имеет значение, определенное в формуле (I), при их обработке соединением формулы 9, RiiC(O)Cl или ICl, CuI и триэтиламином в растворителе, таком как, но не ограничиваясь этим, тетрагидрофуран, будут обеспечивать соединения формулы 29. Реакцию можно осуществить при температуре окружающей среды или с применением нагревания.As shown in Scheme 16, compounds of formula 29, which are typical representatives of compounds of formula (I), where A represents (ii), can be obtained as follows. The compounds of formula (27), where R 1 has the meaning defined in formula (I), when they are treated with a compound of formula 9, R ii C (O) Cl or ICl, CuI and triethylamine in a solvent, such as, but not limited to, tetrahydrofuran will provide compounds of formula 29. The reaction can be carried out at ambient temperature or using heat.
Схема 17Scheme 17
Как показано на Схеме 17, соединения формулы 57, которые являются типичными представителями соединений формулы (I), где A представляет собой (vi), могут быть получены следующим образом. Соединения формулы 45, где R1 имеет значение, определенное в формуле (I), при их обработке формиатом аммония и муравьиной кислотой, будут обеспечивать соединение формулы 57.As shown in Scheme 17, compounds of formula 57, which are typical representatives of compounds of formula (I), wherein A is (vi), can be prepared as follows. The compounds of formula 45, where R 1 has the meaning defined in formula (I), when treated with ammonium formate and formic acid, will provide a compound of formula 57.
Схема 18Scheme 18
Как показано на Схеме 18, соединения формулы 58, которые являются типичными представителями соединений формулы (I), где A представляет собой (vii), могут быть получены следующим образом. Соединения формулы 48, где R1 имеет значение, определенное в формуле (I), при их обработке нитрометаном, будут обеспечивать соединения формулы 58 (Organic Preparations и Procedures International, 2001, 33, 381-386).As shown in Scheme 18, compounds of formula 58, which are typical representatives of compounds of formula (I), where A is (vii), can be obtained as follows. The compounds of formula 48, where R 1 has the meaning defined in formula (I), when treated with nitromethane, will provide compounds of formula 58 (Organic Preparations and Procedures International, 2001, 33, 381-386).
Схема 19Scheme 19
Как показано на Схеме 19, соединения формулы 60, которые являются типичными представителями соединений формулы (I), где A представляет собой (vi), могут быть получены следующим образом. Соединения формулы 48, где R1 имеет значение, определенное в формуле (I), при их обработке 1-(изоцианометилсульфонил)-4-метилбензолом, 59, и подходящим основанием, таким как, но не ограничиваясь этим, карбонат калия, в растворителе, таком как метанол или тетрагидрофуран, и с последующей обработкой подходящей кислотой, такой как хлористоводородная кислота, будут обеспечивать соединения формулы 60.As shown in Scheme 19, compounds of formula 60, which are typical representatives of compounds of formula (I), wherein A is (vi), can be prepared as follows. The compounds of formula 48, where R 1 has the meaning defined in formula (I), when they are treated with 1- (isocyanomethylsulfonyl) -4-methylbenzene, 59, and a suitable base, such as, but not limited to, potassium carbonate, in a solvent, such as methanol or tetrahydrofuran, and followed by treatment with a suitable acid, such as hydrochloric acid, will provide compounds of formula 60.
Схема 20Scheme 20
Как показано на Схеме 20, соединения формулы 63, которые являются типичными представителями соединений формулы (I), где A представляет собой (vi), могут быть получены следующим образом. Соединения формулы 33, где R1 имеет значение, определенное в формуле (I), при их обработке подходящим хлорирующим агентом, таким как тионилхлорид, будут обеспечивать соединения формулы 61. Соединения формулы 61, при их обработке 2-(триметилсилил)-2H-1,2,3-триазолом, 62, в растворителе, таком как сульфолан, будут обеспечивать соединение формулы 63.As shown in Scheme 20, compounds of formula 63, which are typical representatives of compounds of formula (I), where A is (vi), can be prepared as follows. Compounds of formula 33, wherein R 1 is as defined in formula (I), when treated with a suitable chlorinating agent such as thionyl chloride, compounds of formula 61 will be provided. Compounds of formula 61, when treated with 2- (trimethylsilyl) -2H-1 , 2,3-triazole, 62, in a solvent such as sulfolane, will provide a compound of formula 63.
Схема 21Scheme 21
Как показано на Схеме 21, соединения формулы 66, которые являются типичными представителями соединений формулы (I), где A представляет собой (ix), могут быть получены следующим образом. Соединения формулы 61, где R1 имеет значение, определенное в формуле (I), при их обработке гидразином в подходящем растворителе, таком как тетрагидрофуран, будут обеспечивать соединения формулы 64. Соединения формулы 64, при их обработке триметилортоформиатом, 65, в присутствии каталитического количества п-толуолсульфоновой кислоты в растворителе, таком как тетрагидрофуран, будут обеспечивать соединения формулы 66.As shown in Scheme 21, compounds of formula 66, which are typical representatives of compounds of formula (I), where A is (ix), can be obtained as follows. Compounds of formula 61, where R 1 is as defined in formula (I), when they are treated with hydrazine in a suitable solvent such as tetrahydrofuran, will provide compounds of formula 64. Compounds of formula 64, when treated with trimethyl orthoformate, 65, in the presence of a catalytic amount p-toluenesulfonic acid in a solvent such as tetrahydrofuran will provide compounds of formula 66.
Схема 22Scheme 22
Как показано на Схеме 22, соединения формулы 69, которые являются типичными представителями соединений формулы (I), где A определен в формуле (I), могут быть получены следующим образом. Соединения формулы 67, где Ry представляет собой водород, алкил, арил, или две группы Ry вместе с атомом бора, с которым они связаны, образуют 1,3-диоксоборолан, в присутствии палладиевого катализатора с использованием условий реакции Сузуки, описанных на Схеме 1 в присутствии гетероарилиодида (A-I) обеспечивают соединения формулы 68. Соединения формулы 68 преобразуют в соединения формулы 69 путем обработки гидразином, как описано на Схеме 6.As shown in Scheme 22, compounds of formula 69, which are typical representatives of compounds of formula (I), wherein A is defined in formula (I), can be prepared as follows. Compounds of formula 67, wherein R y is hydrogen, alkyl, aryl, or two R y groups, together with the boron atom to which they are bonded, form 1,3-dioxoborolan in the presence of a palladium catalyst using the Suzuki reaction conditions described in Scheme 1 in the presence of heteroaryl iodide (AI), compounds of formula 68 are provided. Compounds of formula 68 are converted to compounds of formula 69 by treatment with hydrazine as described in Scheme 6.
Схема 23Scheme 23
Как показано на Схеме 23, соединения формулы 74, которые являются типичными представителями соединений формулы (I), где Rii и R4 имеют значения, определенные для формулы (I), получают, исходя из соединения формулы 70, где X1 представляет собой иод, бром или хлор. Обработка соединений формулы 70 сначала гидразином, а затем ди-трет-бутилдикарбонатом, как описано на Схеме 6, дает соединения формулы 71. Соединения формулы 71, при их взаимодействии с хлорангидридами кислот формулы 18 в присутствии основания, такого как карбонат калия, в тетрагидрофуране, при температуре окружающей среды, в течение от 2 до 8 часов обеспечивают соединения формулы 72. Альтернативно, соединения формулы 72 могут быть получены из соединений формулы 71 с использованием условий, описанных на Схеме 6. Соединения формулы 72 подвергают взаимодействию с (триметилсилил)ацетиленом в условиях, описанных на Схемах 5 и 6, с получением соединений формулы 73. Соединения формулы 74 получают из соединений формулы 73 путем их обработки Rii-N3 в водном трет-бутаноле, в присутствии сульфата меди(II) и (R)-2-((S)-1,2-дигидроксиэтил)-4-гидрокси-5-оксо-2,5-дигидрофуран-3-олата натрия, при 40-80°C в течение времени от 1 до 6 часов.As shown in Scheme 23, compounds of formula 74, which are typical representatives of compounds of formula (I), wherein R ii and R 4 are as defined for formula (I), are prepared starting from a compound of formula 70, where X 1 is iodine , bromine or chlorine. Treatment of compounds of formula 70 first with hydrazine and then with di-tert-butyl dicarbonate as described in Scheme 6 gives compounds of formula 71. Compounds of formula 71, when reacted with acid chlorides of formula 18 in the presence of a base such as potassium carbonate, in tetrahydrofuran, at ambient temperature, compounds of formula 72 are provided for 2 to 8 hours. Alternatively, compounds of formula 72 can be prepared from compounds of formula 71 using the conditions described in Scheme 6. Compounds of formula 72 are subjected to reacting with (trimethylsilyl) acetylene under the conditions described in Schemes 5 and 6 to give compounds of formula 73. Compounds of formula 74 are prepared from compounds of formula 73 by treating R ii -N 3 in aqueous tert-butanol in the presence of copper sulfate (II ) and (R) -2 - ((S) -1,2-dihydroxyethyl) -4-hydroxy-5-oxo-2,5-dihydrofuran-3-sodium olate, at 40-80 ° C for a period of time from 1 up to 6 hours.
Схема 24Scheme 24
Как показано на Схеме 24, соединения формулы 76, которые являются типичными представителями соединений формулы (I), где A и R4 определены для формулы (I), получают из соединений формулы 75. Соединения формулы 75 можно обработать -B(ORy)2, где A имеет значения, определенные для формулы (I), и Ry представляет собой водород, алкил, арил, или две группы Ry вместе с атомом бора, с которым они связаны, образуют 1,3-диоксоборолан, в присутствии палладиевого катализатора, с использованием условий реакции Сузуки, описанных на Схеме 1, с получением соединения формулы 76.As shown in Scheme 24, compounds of formula 76, which are representative of compounds of formula (I), wherein A and R 4 are defined for formula (I), are prepared from compounds of formula 75. Compounds of formula 75 can be treated with -B (OR y ) 2 where A has the meanings defined for formula (I), and R y represents hydrogen, alkyl, aryl, or two R y groups together with the boron atom to which they are attached form 1,3-dioxoborolan in the presence of a palladium catalyst using the Suzuki reaction conditions described in Scheme 1 to give a compound of the formula 76.
Схема 25Pattern 25
Как показано на Схеме 25, соединения формулы 80, которые являются типичными представителями соединений формулы (I), где Rii и R4 определены для формулы (I), получают следующим образом. Соединения формулы 77 и 78 подвергают взаимодействию в условиях связывания по методу Стилле, описанных на Схеме 3, дают соединения формулы 79. Соединения формулы 79, при взаимодействии, как описано на Схеме 6, обеспечивают соединения формулы 80.As shown in Scheme 25, compounds of formula 80, which are representative of compounds of formula (I), wherein R ii and R 4 are defined for formula (I), are prepared as follows. Compounds of formula 77 and 78 are coupled under the Still conditions of binding described in Scheme 3 to give compounds of formula 79. Compounds of formula 79, when reacted as described in Scheme 6, provide compounds of formula 80.
Схема 26Scheme 26
Как показано на Схеме 26, соединения формул 82, 83., 84 и 85, которые являются типичными представителями соединений формулы (I), где A, R4, R5, Ra и Rj имеют значения, определенные для формулы (I), получают из соединений формулы 81. Соединения формулы 81 можно обработать хлорангидридом кислоты, 18, в растворителе, таком как тетрагидрофуран, в присутствии основания, такого как карбонат калия или триэтиламин, с получением соединений формулы 82. Альтернативным растворителем является дихлорметан, и альтернативным основанием является пиридин. Хлорангидриды кислот можно получить из соответствующих карбоновых кислот путем обработки оксалилхлоридом с каталитическим количеством N,N-диметилформамида. Для получения соединений формулы 83, соединения формулы 81 можно обработать RjNCO в нагретом пиридине. Соединения формулы 84 получают из соединений формулы 81 путем обработки R5SO2Cl в пиридине при комнатной температуре или около этого. Соединения формулы 85 также получают из соединений формулы 81 в реакции восстановительного аминирования с RaCHO в присутствии восстановителя, такого как триацетоксиборогидрид натрия или цианоборогидрид натрия, и уксусной кислоты в растворителе, таком как 1,2-дихлорэтан, при комнатной температуре или около этого, и с последующей обработкой трифторуксусной кислотой в дихлорметане для удаления трет-бутоксикарбонильной защитной группы.As shown in Scheme 26, the compounds of formulas 82, 83 . 84 and 85, which are typical representatives of compounds of formula (I), wherein A, R 4 , R 5 , R a and R j are as defined for formula (I), are prepared from compounds of formula 81. Compounds of formula 81 can be treated acid chloride, 18, in a solvent such as tetrahydrofuran, in the presence of a base such as potassium carbonate or triethylamine, to give compounds of formula 82. An alternative solvent is dichloromethane, and pyridine is an alternative base. Acid chlorides can be obtained from the corresponding carboxylic acids by treatment with oxalyl chloride with a catalytic amount of N, N-dimethylformamide. To obtain compounds of formula 83, compounds of formula 81 can be treated with R j NCO in heated pyridine. Compounds of formula 84 are prepared from compounds of formula 81 by treating R 5 SO 2 Cl in pyridine at or near room temperature. Compounds of formula 85 are also prepared from compounds of formula 81 in a reductive amination reaction with R a CHO in the presence of a reducing agent such as sodium triacetoxyborohydride or sodium cyanoborohydride and acetic acid in a solvent such as 1,2-dichloroethane at or near room temperature, and followed by treatment with trifluoroacetic acid in dichloromethane to remove the tert-butoxycarbonyl protecting group.
Схема 27Scheme 27
Как показано на Схеме 27, соединения формулы 87, где A, Rj и Rk определены для формулы (I), можно получить из соединений формулы 86. Соединения формулы 86 получают, как описано для соединений формулы 82 на Схеме 26. Соединения формулы 86 затем можно подвергнуть нагреванию в присутствии амина, HNRjRk, и основания, такого как триэтиламин, в растворителе, таком как ацетонитрил, с получением соединений формулы 87. Альтернативно, амин можно заменить гетероциклами, такими как пирролидин, пиперидин, пиперазин и морфолин.As shown in Scheme 27, compounds of formula 87, where A, R j and R k are defined for formula (I), can be obtained from compounds of formula 86. Compounds of formula 86 are prepared as described for compounds of formula 82 in Scheme 26. Compounds of formula 86 it can then be heated in the presence of an amine, HNR j R k , and a base such as triethylamine in a solvent such as acetonitrile to give compounds of formula 87. Alternatively, the amine can be replaced by heterocycles such as pyrrolidine, piperidine, piperazine and morpholine.
Схема 28Scheme 28
Как показано на Схеме 28, соединения формулы 89, где A, R1, R2, R3, m, Zc и Zd определены для формулы (I), можно получить из соединений формулы 88. Соединения формулы 88 можно получить, как описано на Схемах 1-4, 7-9, 22, 24 и 26. В процессе получения соединений формулы 88, карбоновокислотная группа в виде боковой цепи в A может быть защищена в виде сложного эфира и затем гидролизована, оставляя карбоновую кислоту открытой без защиты, способами, которые известны специалистам в области органического синтеза. Соединения формулы 88, при их обработке амином (HNZcZd) с использованием условий связывания карбоновой кислоты-амина, известных специалистам в данной области, будут обеспечивать соединения формулы 89. Стандартные условий связывания карбоновой кислоты- амина включают добавление связывающего реагента, такого как, но не ограничиваясь этим, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI), 1,3-дициклогексилкарбодиимид (DCC), хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты (BOPCl), гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) или тетрафторборат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (TBTU), необязательно в присутствии основания, такого как триэтиламин или диизопропилэтиламин, с использованием или без вспомогательного вещества, такого как, но не ограничиваясь этим, 1-гидрокси-7-азабензотриазол (HOAT) или гидрат 1-гидроксибензотриазола (HOBT), в растворителе, таком как, но не ограничиваясь этим, дихлорметан или N,N-диметилформамид.As shown in Scheme 28, compounds of formula 89, where A, R 1 , R 2 , R 3 , m, Z c and Z d are defined for formula (I), can be obtained from compounds of formula 88. Compounds of formula 88 can be prepared as described in Schemes 1-4, 7-9, 22, 24 and 26. In the process of preparing compounds of formula 88, the carboxylic acid group as a side chain in A can be protected as an ester and then hydrolyzed, leaving the carboxylic acid open without protection, by methods known to those skilled in the art of organic synthesis. Compounds of formula 88, when treated with amine (HNZ c Z d ) using the carboxylic acid-amine coupling conditions known to those skilled in the art, will provide compounds of formula 89. Standard carboxylic acid-amine coupling conditions include the addition of a coupling reagent such as but not limited to 1- (3-dimethylaminopropyl) -3-ethylcarbodiimide hydrochloride (EDCI), 1,3-dicyclohexylcarbodiimide (DCC), bis (2-oxo-3-oxazolidinyl) phosphinic acid chloride (BOPCl), O- hexafluorophosphate (7-azabenzotriazol-1-yl) -N, N, N ', N'-tetra amethyluronium (HATU) or tetrafluoroborate O-benzotriazol-1-yl-N, N, N ′, N′-tetramethyluronium (TBTU), optionally in the presence of a base such as triethylamine or diisopropylethylamine, with or without an excipient, such as but not limited to, 1-hydroxy-7-azabenzotriazole (HOAT) or 1-hydroxybenzotriazole hydrate (HOBT), in a solvent such as, but not limited to, dichloromethane or N, N-dimethylformamide.
ПРИМЕРЫEXAMPLES
Соединения и способы по настоящему изобретению будут лучше понятны при обращении к представленным ниже примерам, которые предназначены в качестве иллюстрации, а не ограничения объема настоящего изобретения.The compounds and methods of the present invention will be better understood when referring to the examples below, which are intended to illustrate and not limit the scope of the present invention.
Пример 1Example 1
5-(1-бензил-1H-1,2,3-триазол-5-ил)-1H-индазольное соединение с 5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазолом5- (1-benzyl-1H-1,2,3-triazol-5-yl) -1H-indazole compound with 5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H indazole
Пример 1AExample 1A
трет-Бутил 5-иод-1H-индазол-1-карбоксилатtert-Butyl 5-iodo-1H-indazole-1-carboxylate
К охлажденному на ледяной бане раствору 4-иод-2-метиланилина (20 г, 83,24 ммоль) в хлороформе (250 мл) добавляли по каплям раствор уксусного ангидрида (21,2 г, 208,11 ммоль) в хлороформе (50 мл). По завершении добавления смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли ацетат калия (2,5 г, 24,97 ммоль) и изоамилнитрит (22,3 мл, 166,48 ммоль) и смесь нагревали при 70°C в течение 20 часов. Смесь охлаждали и гасили насыщенным водным раствором NaHCO3 до pH 7. Смесь экстрагировали дихлорметаном и органическую фазу сушили над сульфатом натрия и фильтровали. Растворитель выпаривали при пониженном давлении. Неочищенное твердое вещество промывали метанолом, растворяли в тетрагидрофуране (200 мл) и обрабатывали теплым раствором KOH (60 г) в воде (200 мл). Смесь перемешивали в течение 15 минут и обрабатывали 6н раствором HCl до pH 1. Слои разделяли, органический слой сушили над сульфатом натрия и фильтровали и растворитель выпаривали при пониженном давлении. Неочищенное твердое вещество растворяли в дихлорметане (500 мл) и добавляли триэтиламин (23 мл, 166,48 ммоль) и ди-трет-бутилдикарбонат (23,6 г, 108,2 ммоль) и каталитическое количество диметиламинопиридина (~ 5 мг). Смесь перемешивали при комнатной температуре в течение 2 часов, разбавляли водой, экстрагировали дихлорметаном, сушили при помощи сульфата натрия и фильтровали. Растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения. MS (ESI+) m/z 344,9 (M+H)+.To a solution of 4-iodo-2-methylaniline (20 g, 83.24 mmol) in chloroform (250 ml) cooled in an ice bath was added dropwise a solution of acetic anhydride (21.2 g, 208.11 mmol) in chloroform (50 ml ) Upon completion of the addition, the mixture was stirred at room temperature for 1 hour. Potassium acetate (2.5 g, 24.97 mmol) and isoamyl nitrite (22.3 ml, 166.48 mmol) were added and the mixture was heated at 70 ° C for 20 hours. The mixture was cooled and quenched with saturated aqueous NaHCO 3 to pH 7. The mixture was extracted with dichloromethane and the organic phase was dried over sodium sulfate and filtered. The solvent was evaporated under reduced pressure. The crude solid was washed with methanol, dissolved in tetrahydrofuran (200 ml) and treated with a warm solution of KOH (60 g) in water (200 ml). The mixture was stirred for 15 minutes and treated with 6N HCl to pH 1. The layers were separated, the organic layer was dried over sodium sulfate and filtered and the solvent was evaporated under reduced pressure. The crude solid was dissolved in dichloromethane (500 ml) and triethylamine (23 ml, 166.48 mmol) and di-tert-butyl dicarbonate (23.6 g, 108.2 mmol) and a catalytic amount of dimethylaminopyridine (~ 5 mg) were added. The mixture was stirred at room temperature for 2 hours, diluted with water, extracted with dichloromethane, dried with sodium sulfate and filtered. The solvent was evaporated under reduced pressure to obtain the title compound. MS (ESI +) m / z 344.9 (M + H) + .
Пример 1BExample 1B
трет-Бутил 5-((триметилсилил)этинил)-1H-индазол-1-карбоксилатtert-Butyl 5 - ((trimethylsilyl) ethynyl) -1H-indazole-1-carboxylate
Соединение Примера 1A (10,81 г, 31,4 ммоль), дихлорбис(трифенилфосфин)палладий(II) (1,1 г, 1,57 ммоль) и иодид меди(I) (365 мг, 1,92 ммоль) объединяли в триэтиламине (70 мл) в инертной атмосфере. Добавляли триметилсилилацетилен (5,0 мл, 36,0 ммоль) и смесь перемешивали при 60°C в течение ночи. Растворитель удаляли при пониженном давлении и полученный остаток растворяли в метиленхлориде и промывали 1 н раствором хлористоводородной кислоты. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 215,0 (M-99)+.The compound of Example 1A (10.81 g, 31.4 mmol), dichlorobis (triphenylphosphine) palladium (II) (1.1 g, 1.57 mmol) and copper (I) iodide (365 mg, 1.92 mmol) were combined in triethylamine (70 ml) in an inert atmosphere. Trimethylsilylacetylene (5.0 ml, 36.0 mmol) was added and the mixture was stirred at 60 ° C. overnight. The solvent was removed under reduced pressure, and the resulting residue was dissolved in methylene chloride and washed with a 1N hydrochloric acid solution. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 215.0 (M-99) + .
Пример 1CExample 1C
5-Этинил-1H-индазол5-Ethinyl-1H-indazole
Соединение Примера 1B (7,93 г, 25,2 ммоль) растворяли в метаноле (150 мл). Добавляли 1 н раствор гидроксида калия (50 мл) и смесь перемешивали при температуре окружающей среды в течение 1 часа. Растворитель удаляли при пониженном давлении и полученную суспензию растворяли в этилацетате и промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия и фильтровали и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,24 (с, 1H), 8,10 (с, 1H), 7,95 (с, 1H), 7,55 (д, J=8,82 Гц, 1H), 7,39 (дд, J=8,48, 1,36 Гц, 1H), 4,03 (с, 1H).The compound of Example 1B (7.93 g, 25.2 mmol) was dissolved in methanol (150 ml). A 1N potassium hydroxide solution (50 ml) was added and the mixture was stirred at ambient temperature for 1 hour. The solvent was removed under reduced pressure, and the resulting suspension was dissolved in ethyl acetate and washed with water and brine. The organic layer was dried over sodium sulfate and filtered, and the solvent was removed under reduced pressure to obtain the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.24 (s, 1H), 8.10 (s, 1H), 7.95 (s, 1H), 7.55 (d, J = 8.82 Hz, 1H), 7.39 (dd, J = 8.48, 1.36 Hz, 1H), 4.03 (s, 1H).
Пример 1DExample 1D
5-(1-бензил-1H-1,2,3-триазол-5-ил)-1H-индазольное соединение с 5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазолом5- (1-benzyl-1H-1,2,3-triazol-5-yl) -1H-indazole compound with 5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H indazole
В сосуд для микроволнового нагрева добавляли 100,0 мг (0,70 ммоль) соединения Примера 1C и 94 мг (0,70 ммоль) бензилазида. Смесь нагревали при 160°C в течение 20 минут с использованием микроволнового облучения (CEM-Discover, 100 Ватт, время повышения температуры до заданного уровня 1 минута). Смесь растворяли в этилацетате и очищали при помощи хроматографии на силикагеле, используя для элюирования 75% этилацетата в гексане, с получением указанных в заголовке соединений. H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,28 (с, 1H), 13,12 (с, 1H), 8,61 (с, 1H), 8,23 (с, 1H), 8,13 (с, 1H), 8,11 (с, 1H), 7,94 (с, 1H), 7,82-7,89 (м, 2H), 7,56-7,70 (м, 2H), 7,20-7,44 (м, 9H), 6,97-7,02 (м, 2H), 5,69 (с, 2H), 5,65 (с, 2H). MS (CI) m/z 276 (M+H)+.100.0 mg (0.70 mmol) of the compound of Example 1C and 94 mg (0.70 mmol) of benzylazide were added to the microwave heating vessel. The mixture was heated at 160 ° C for 20 minutes using microwave irradiation (CEM-Discover, 100 watts, time to rise to a predetermined level of 1 minute). The mixture was dissolved in ethyl acetate and purified by silica gel chromatography using 75% ethyl acetate in hexane to elute to give the title compounds. H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.28 (s, 1H), 13.12 (s, 1H), 8.61 (s, 1H), 8.23 (s, 1H), 8.13 (s, 1H), 8.11 (s , 1H), 7.94 (s, 1H), 7.82-7.89 (m, 2H), 7.56-7.70 (m, 2H), 7.20-7.44 (m, 9H ), 6.97-7.02 (m, 2H), 5.69 (s, 2H), 5.65 (s, 2H). MS (CI) m / z 276 (M + H) + .
Пример 2Example 2
5-(1H-1,2,3-триазол-5-ил)-1H-индазол5- (1H-1,2,3-triazol-5-yl) -1H-indazole
В сосуд для микроволнового нагрева добавляли 100,0 мг (0,70 ммоль) соединения Примера 1C, 81 мг (0,7 ммоль) триметилсилилазида, CuI (4 мг) и диметилформамид/метанол (1 мл, 9:1). Смесь нагревали при 160°C в течение 20 минут с использованием микроволнового облучения (CEM-Discover, 100 Ватт, время повышения температуры до заданного уровня 1 минута). Смесь растворяли в этилацетате и органический слой промывали водой. Органический слой сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении и очищали при помощи хроматографии на силикагеле, используя для элюирования 80% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,16 (с, 1H), 8,31 (с, 1H), 8,25 (с, 1H), 8,13 (с, 1H), 7,87 (д, J=8,82 Гц, 1H), 7,62 (д, J=8,82 Гц, 1H). MS (CI) m/z 186 (M+H)+.100.0 mg (0.70 mmol) of the compound of Example 1C, 81 mg (0.7 mmol) of trimethylsilyl azide, CuI (4 mg) and dimethylformamide / methanol (1 ml, 9: 1) were added to the microwave heating vessel. The mixture was heated at 160 ° C for 20 minutes using microwave irradiation (CEM-Discover, 100 watts, time to rise to a predetermined level of 1 minute). The mixture was dissolved in ethyl acetate and the organic layer was washed with water. The organic layer was dried over anhydrous MgSO 4 , filtered and concentrated under reduced pressure and purified by silica gel chromatography using 80% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.16 (s, 1H), 8.31 (s, 1H), 8.25 (s, 1H), 8.13 (s, 1H), 7.87 (d, J = 8.82 Hz, 1H ), 7.62 (d, J = 8.82 Hz, 1H). MS (CI) m / z 186 (M + H) + .
Пример 3Example 3
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Пример 3AExample 3A
трет-Бутил 5-иод-1H-индазол-1-карбоксилатtert-Butyl 5-iodo-1H-indazole-1-carboxylate
К охлажденному на ледяной бане раствору 4-иод-2-метиланилина (20 г, 83,24 ммоль) в хлороформе (250 мл) добавляли по каплям через капельную воронку раствор уксусного ангидрида (21,2 г, 208,11 ммоль) в хлороформе (50 мл). По завершении добавления смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли ацетат калия (2,5 г, 24,97 ммоль) и изоамилнитрит (22,3 мл, 166,48 ммоль) и смесь нагревали при 70°C в течение 20 часов. Смесь затем охлаждали и гасили насыщенным водным раствором NaHCO3 до pH 7. Смесь экстрагировали дихлорметаном, сушили над сульфатом натрия, фильтровали и растворитель выпаривали при пониженном давлении. Неочищенное твердое вещество промывали метанолом, растворяли в тетрагидрофуране (200 мл) и обрабатывали теплым раствором KOH (60 г) в воде (200 мл). Смесь перемешивали в течение 15 минут и обрабатывали 6н раствором HCl до pH 1. Слои разделяли, органический слой сушили над сульфатом натрия и фильтровали и растворитель выпаривали при пониженном давлении. Неочищенное вещество растворяли в дихлорметане (500 мл) и триэтиламин (23 мл, 166,48 ммоль) и добавляли ди-трет-бутилдикарбонат (23,6 г, 108,2 ммоль) и каталитическое количество диметиламинопиридина (~5 мг). Смесь перемешивали при комнатной температуре в течение 2 часов, гасили водой, экстрагировали дихлорметаном и сушили над сульфатом натрия и фильтровали. Растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения. MS (ESI+) m/z 344,9 (M+H)+.To a solution of 4-iodo-2-methylaniline (20 g, 83.24 mmol) in chloroform (250 ml) cooled in an ice bath was added dropwise through a dropping funnel a solution of acetic anhydride (21.2 g, 208.11 mmol) in chloroform (50 ml). Upon completion of the addition, the mixture was stirred at room temperature for 1 hour. Potassium acetate (2.5 g, 24.97 mmol) and isoamyl nitrite (22.3 ml, 166.48 mmol) were added and the mixture was heated at 70 ° C for 20 hours. The mixture was then cooled and quenched with saturated aqueous NaHCO 3 to pH 7. The mixture was extracted with dichloromethane, dried over sodium sulfate, filtered and the solvent was evaporated under reduced pressure. The crude solid was washed with methanol, dissolved in tetrahydrofuran (200 ml) and treated with a warm solution of KOH (60 g) in water (200 ml). The mixture was stirred for 15 minutes and treated with 6N HCl to pH 1. The layers were separated, the organic layer was dried over sodium sulfate and filtered and the solvent was evaporated under reduced pressure. The crude material was dissolved in dichloromethane (500 ml) and triethylamine (23 ml, 166.48 mmol) and di-tert-butyl dicarbonate (23.6 g, 108.2 mmol) and a catalytic amount of dimethylaminopyridine (~ 5 mg) were added. The mixture was stirred at room temperature for 2 hours, quenched with water, extracted with dichloromethane and dried over sodium sulfate and filtered. The solvent was evaporated under reduced pressure to obtain the title compound. MS (ESI +) m / z 344.9 (M + H) + .
Пример 3BExample 3B
трет-Бутил 5-((триметилсилил)этинил)-1H-индазол-1-карбоксилатtert-Butyl 5 - ((trimethylsilyl) ethynyl) -1H-indazole-1-carboxylate
Соединение Примера 3A, (10,81 г, 31,4 ммоль), дихлорбис(трифенилфосфин)палладий(II) (1,1 г, 1,57 ммоль) и иодид меди(I) (365 мг, 1,92 ммоль) объединяли в триэтиламине (70 мл) в инертной атмосфере. Добавляли триметилсилилацетилен (5,0 мл, 36,0 ммоль) и смесь перемешивали при 60°C в течение ночи. Растворитель удаляли при пониженном давлении и полученный остаток растворяли в метиленхлориде и промывали 1 н раствором хлористоводородной кислоты. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 215,0 (M-99)+.The compound of Example 3A, (10.81 g, 31.4 mmol), dichlorobis (triphenylphosphine) palladium (II) (1.1 g, 1.57 mmol) and copper (I) iodide (365 mg, 1.92 mmol) combined in triethylamine (70 ml) in an inert atmosphere. Trimethylsilylacetylene (5.0 ml, 36.0 mmol) was added and the mixture was stirred at 60 ° C. overnight. The solvent was removed under reduced pressure, and the resulting residue was dissolved in methylene chloride and washed with a 1N hydrochloric acid solution. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 215.0 (M-99) + .
Пример 3CExample 3C
5-Этинил-1H-индазол5-Ethinyl-1H-indazole
Соединение Примера 3B (7,93 г, 25,2 ммоль) растворяли в метаноле (150 мл). Добавляли 1н раствор гидроксида калия (50 мл) и смесь перемешивали при температуре окружающей среды в течение 1 часа. Растворитель удаляли при пониженном давлении и полученную суспензию растворяли в этилацетате и промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,24 (с, 1H), 8,10 (с, 1H), 7,95 (с, 1H), 7,55 (д, J=8,82 Гц, 1H), 7,39 (дд, J=8,48, 1,36 Гц, 1H), 4,03 (с, 1H).The compound of Example 3B (7.93 g, 25.2 mmol) was dissolved in methanol (150 ml). A 1N potassium hydroxide solution (50 ml) was added and the mixture was stirred at ambient temperature for 1 hour. The solvent was removed under reduced pressure, and the resulting suspension was dissolved in ethyl acetate and washed with water and brine. The organic layer was dried over sodium sulfate, filtered and the solvent was removed under reduced pressure to obtain the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.24 (s, 1H), 8.10 (s, 1H), 7.95 (s, 1H), 7.55 (d, J = 8.82 Hz, 1H), 7.39 (dd, J = 8.48, 1.36 Hz, 1H), 4.03 (s, 1H).
Пример 3D3D example
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Соединение Примера 3C (40 мг, 0,28 ммоль), бензилазид (37 мг, 0,28 ммоль), CuSO4 (14 мг, 0,056 ммоль) и медную проволоку (14 мг) объединяли в трет-бутаноле (0,5 мл) и воде (0,5 мл) и нагревали в микроволновом реакторе CEM-Discover в течение 10 минут при 125°C и 100 Ватт. К смеси добавляли 1M HCl и воду, продукт экстрагировали дихлорметаном и очищали при помощи хроматографии на силикагеле (50% этилацетата в гексане) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,10 (с, 1H), 8,60 (с, 1H), 8,23 (с, 1H), 8,11 (с, 1H), 7,85 (д, J=8,59, 1,53 Гц, 1H), 7,59 (д, J=8,59 Гц, 1H), 7,26-7,49 (м, 5H), 5,65 (с, 2H). MS (ESI+) m/z 276,0 (M+H)+.The compound of Example 3C (40 mg, 0.28 mmol), benzylazide (37 mg, 0.28 mmol), CuSO 4 (14 mg, 0.056 mmol) and copper wire (14 mg) were combined in tert-butanol (0.5 ml ) and water (0.5 ml) and heated in a CEM-Discover microwave reactor for 10 minutes at 125 ° C and 100 watts. 1M HCl and water were added to the mixture, the product was extracted with dichloromethane and purified by silica gel chromatography (50% ethyl acetate in hexane) to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.10 (s, 1H), 8.60 (s, 1H), 8.23 (s, 1H), 8.11 (s, 1H), 7.85 (d, J = 8.59, 1, 53 Hz, 1H), 7.59 (d, J = 8.59 Hz, 1H), 7.26-7.49 (m, 5H), 5.65 (s, 2H). MS (ESI +) m / z 276.0 (M + H) + .
Пример 4Example 4
5-[1-(2-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
В 5-мл микроволновую реакционную трубку CEM Microwave, которая была снабжена стержневой мешалкой из micro-flea с тефлоновым покрытием добавляли 17,6 мг (0,124 ммоль) соединения Примера 3C, 300 мкл водного раствора, содержащего 7,80 мг (0,118 ммоль) азида натрия; с последующим добавлением 15,79 мкл (0,118 ммоль; 21,80 мг 0,95 эквивалента) 2-метил-бензилбромида (добавляемого без растворителя). К суспензии затем добавляли 300 мкл трет-бутанола; 25 мг медной проволоки; и в завершение 50 мкл 1 н водного раствора пентагидрата сульфата меди. Микроволновой реакционный сосуд затем закрывали крышкой и нагревали при перемешивании в течение 10 минут при 125°C при мощности 100 Ватт в микроволновом устройстве CEM-Discover. После охлаждения до температуры окружающей среды смесь разбавляли 0,25 н водным раствором HCl; и водную суспензию экстрагировали дихлорметаном. Органический слой промывали дистиллированной водой; насыщенным водным раствором NaCl; и затем сушили над безводным сульфатом натрия и фильтровали. Высушеный раствор разбавляли ацетонитрилом; и растворимое органическое вещество затем фильтровали через пробку из стекловаты, на которую сверху был нанесен дополнительный слой безводного сульфата натрия. Аликвоту фильтрата затем отбирали для последующего ЖХ/МС анализа. Те растворы, которые содержали желаемый триазольный продукт, затем упаривали в вакууме и затем снова растворяли в 1,50 мл смеси 1:1 DMSO/метанол. Раствор неочищенного триазольного продукта затем очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода 0,1% ТФУ с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,37 (с, 3H), 5,66 (с, 2H), 7,16-7,34 (м, 4H), 7,63 (д, J=8,54 Гц, 1H), 7,87 (д, J=8,70, 1,37 Гц, 1H), 8,14 (с, 1H), 8,25 (с, 1H), 8,49 (с, 1H). MS (ESI+) m/z 289,9 (M+H)+.17.6 mg (0.124 mmol) of the compound of Example 3C, 300 μl of an aqueous solution containing 7.80 mg (0.118 mmol) of azide was added to a 5 ml CEM Microwave reaction tube equipped with a Teflon-coated micro-flea rod stirrer. sodium; followed by 15.79 μl (0.118 mmol; 21.80 mg 0.95 equivalent) of 2-methyl-benzyl bromide (added without solvent). 300 μl of tert-butanol was then added to the suspension; 25 mg of copper wire; and finally 50 μl of a 1 N aqueous solution of copper sulfate pentahydrate. The microwave reaction vessel was then lidded and heated with stirring for 10 minutes at 125 ° C. at 100 watts in a CEM-Discover microwave device. After cooling to ambient temperature, the mixture was diluted with 0.25 N aqueous HCl; and the aqueous suspension was extracted with dichloromethane. The organic layer was washed with distilled water; saturated aqueous NaCl; and then dried over anhydrous sodium sulfate and filtered. The dried solution was diluted with acetonitrile; and the soluble organic matter was then filtered through a glass wool plug onto which an additional layer of anhydrous sodium sulfate was applied on top. An aliquot of the filtrate was then taken for subsequent LC / MS analysis. Those solutions that contained the desired triazole product were then evaporated in vacuo and then redissolved in 1.50 ml of a 1: 1 DMSO / methanol mixture. The solution of the crude triazole product was then purified by reverse phase HPLC using an acetonitrile / water 0.1% TFA gradient elution method to give the title compound. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.37 (s, 3H), 5.66 (s, 2H), 7.16-7.34 (m, 4H), 7.63 (d, J = 8.54 Hz, 1H), 7.87 (d, J = 8.70, 1.37 Hz, 1H), 8.14 (s, 1H), 8.25 (s, 1H), 8.49 (s, 1H). MS (ESI +) m / z 289.9 (M + H) + .
Пример 5Example 5
5-[1-(3-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (3-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-метилбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,58 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,87 (д, J=8,85, 1,53 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,30 (т, J=7,63 Гц, 1H), 7,14-7,24 (м, 3H), 5,60 (с, 2H), 2,31 (с, 3H). MS (ESI+) m/z 289,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the replacement of 2-methylbenzyl bromide with 3-methylbenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.58 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.87 (d, J = 8.85, 1.53 Hz, 1H), 7.64 (d, J = 8.54 Hz, 1H), 7.30 (t, J = 7.63 Hz, 1H), 7.14-7.24 (m, 3H), 5.60 (s, 2H) 2.31 (s, 3H). MS (ESI +) m / z 289.8 (M + H) + .
Пример 6Example 6
5-[1-(4-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (4-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-метилбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,55 (с, 1H), 8,24 (с, 1H), 8,14 (с, 1H), 7,86 (д, J=8,54, 1,53 Гц, 1H), 7,63 (д, J=8,85 Гц, 1H), 7,25-7,33 (м, 2H), 7,18-7,24 (м, 2H), 5,59 (с, 2H), 2,29 (с, 3H). MS (ESI+) m/z 290,1 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 4-methylbenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.55 (s, 1H), 8.24 (s, 1H), 8.14 (s, 1H), 7.86 (d, J = 8.54, 1.53 Hz, 1H), 7.63 (d, J = 8.85 Hz, 1H), 7.25-7.33 (m, 2H), 7.18-7.24 (m, 2H), 5.59 (s, 2H), 2, 29 (s, 3H). MS (ESI +) m / z 290.1 (M + H) + .
Пример 7Example 7
5-[1-(3-метоксибензил)-1H-1,2,3-триазол-4-ил]-1H-индазол Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-метоксибензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,59 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,87 (д, J=8,54, 1,53 Гц, 1H), 7,64 (д, J=8,85 Гц, 1H), 7,33 (т, J=7,93 Гц, 1H), 6,89-7,00 (м, 3H), 5,62 (с, 2H), 3,76 (с, 3H). MS (ESI+) m/z 306,1 (M+H)+.5- [1- (3-methoxybenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole The title compound was prepared according to the procedure for Example 4 with 2-methylbenzyl bromide 3 substituted -methoxybenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.59 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.87 (d, J = 8.54, 1.53 Hz, 1H), 7.64 (d, J = 8.85 Hz, 1H), 7.33 (t, J = 7.93 Hz, 1H), 6.89-7.00 (m, 3H), 5.62 (s, 2H) 3.76 (s, 3H). MS (ESI +) m / z 306.1 (M + H) + .
Пример 8Example 8
5-[1-(2-фторбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2-фторбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,57 (с, 1H), 8,25 (с, 1H), 8,12-8,17 (м, 1H), 7,87 (д, J=8,54, 1,53 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,41-7,49 (м, J=7,32, 7,32 Гц, 2H), 7,22-7,33 (м, J=7,02 Гц, 2H), 5,71 (с, 2H). MS (ESI+) m/z 293,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 2-fluorobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.57 (s, 1H), 8.25 (s, 1H), 8.12-8.17 (m, 1H), 7.87 (d, J = 8.54, 1.53 Hz, 1H) 7.64 (d, J = 8.54 Hz, 1H), 7.41-7.49 (m, J = 7.32, 7.32 Hz, 2H), 7.22-7.33 (m , J = 7.02 Hz, 2H); 5.71 (s, 2H). MS (ESI +) m / z 293.9 (M + H) + .
Пример 9Example 9
5-[1-(3-фторбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (3-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-фторбензилбромидом. H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,61 (с, 1H), 8,25 (с, 1H), 8,15 (с, 1H), 7,87 (д, J=8,85, 1,53 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,41-7,51 (м, 1H), 7,15-7,28 (м, 3H), 5,68 (с, 2H). MS (ESI+) m/z 293,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the substitution of 2-methylbenzyl bromide by 3-fluorobenzyl bromide. H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.61 (s, 1H), 8.25 (s, 1H), 8.15 (s, 1H), 7.87 (d, J = 8.85, 1.53 Hz, 1H), 7.64 (d, J = 8.54 Hz, 1H), 7.41-7.51 (m, 1H), 7.15-7.28 (m, 3H), 5.68 (s, 2H). MS (ESI +) m / z 293.8 (M + H) + .
Пример 10Example 10
5-[1-(4-фторбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (4-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-фторбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,58 (с, 1H), 8,24 (с, 1H), 8,14 (с, 1H), 7,86 (д, J=8,85, 1,53 Гц, 1H), 7,64 (д, J=8,85 Гц, 1H), 7,46 (д, J=8,85, 5,49 Гц, 2H), 7,24 (т, J=9,00 Гц, 2H), 5,64 (с, 2H). MS (ESI+) m/z 293,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 4-fluorobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.58 (s, 1H), 8.24 (s, 1H), 8.14 (s, 1H), 7.86 (d, J = 8.85, 1.53 Hz, 1H), 7.64 (d, J = 8.85 Hz, 1H), 7.46 (d, J = 8.85, 5.49 Hz, 2H), 7.24 (t, J = 9.00 Hz, 2H), 5 64 (s, 2H). MS (ESI +) m / z 293.9 (M + H) + .
Пример 11Example 11
5-[1-(2-хлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2-хлорбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,56 (с, 1H), 8,26 (с, 1H), 8,14 (с, 1H), 7,88 (д, J=8,54, 1,53 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,55 (д, J=7,63, 1,53 Гц, 1H), 7,32-7,48 (м, 3H), 5,76 (с, 2H). MS (ESI+) m/z 309,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 2-chlorobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.56 (s, 1H), 8.26 (s, 1H), 8.14 (s, 1H), 7.88 (d, J = 8.54, 1.53 Hz, 1H), 7.64 (d, J = 8.54 Hz, 1H), 7.55 (d, J = 7.63, 1.53 Hz, 1H), 7.32-7.48 (m, 3H), 5.76 ( s, 2H). MS (ESI +) m / z 309.8 (M + H) + .
Пример 12Example 12
5-[1-(3-хлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (3-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-хлорбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,62 (с, 1H), 8,26 (с, 1H), 8,15 (с, 1H), 7,87 (д, J=8,54, 1,53 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,40-7,49 (м, J=7,63 Гц, 3H), 7,35 (д, J=6,41 Гц, 1H), 5,67 (с, 2H). MS (ESI+) m/z 309,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 3-chlorobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.62 (s, 1H), 8.26 (s, 1H), 8.15 (s, 1H), 7.87 (d, J = 8.54, 1.53 Hz, 1H), 7.64 (d, J = 8.54 Hz, 1H), 7.40-7.49 (m, J = 7.63 Hz, 3H), 7.35 (d, J = 6.41 Hz, 1H), 5 67 (s, 2H). MS (ESI +) m / z 309.8 (M + H) + .
Пример 13Example 13
5-[1-(4-хлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (4-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-хлорбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,58 (с, 1H), 8,24 (с, 1H), 8,15 (с, 1H), 7,86 (д, J=8,54, 1,53 Гц, 1H), 7,64 (д, J=8,85 Гц, 1H), 7,45-7,52 (м, 2H), 7,38-7,44 (м, 2H), 5,65 (с, 2H). MS (ESI-) m/z 307,7 (M-H)-.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 4-chlorobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.58 (s, 1H), 8.24 (s, 1H), 8.15 (s, 1H), 7.86 (d, J = 8.54, 1.53 Hz, 1H), 7.64 (d, J = 8.85 Hz, 1H), 7.45-7.52 (m, 2H), 7.38-7.44 (m, 2H), 5.65 (s, 2H). MS (ESI-) m / z 307.7 (MH) - .
Пример 14Example 14
5-[1-(2-бромбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2-bromobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2-бромбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,55 (с, 1H), 8,26 (с, 1H), 8,14 (с, 1H), 7,88 (д, J=8,54, 1,53 Гц, 1H), 7,72 (д, J=7,93 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,41-7,50 (м, 1H), 7,27-7,40 (м, 2H), 5,74 (с, 2H). MS (ESI+) m/z 353,5 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 2-bromobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.55 (s, 1H), 8.26 (s, 1H), 8.14 (s, 1H), 7.88 (d, J = 8.54, 1.53 Hz, 1H), 7.72 (d, J = 7.93 Hz, 1H), 7.64 (d, J = 8.54 Hz, 1H), 7.41-7.50 (m, 1H), 7.27-7.40 ( m, 2H); 5.74 (s, 2H). MS (ESI +) m / z 353.5 (M + H) + .
Пример 15Example 15
5-[1-(2-нитробензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2-нитробензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,57 (с, 1H), 8,27 (с, 1H), 8,12-8,22 (м, 2H), 7,88 (д, J=8,54, 1,53 Гц, 1H), 7,75-7,83 (м, 1H), 7,60-7,72 (м, 2H), 7,27 (д, J=7,63 Гц, 1H), 6,02 (с, 2H). MS (ESI+) m/z 320,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 2-nitrobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.57 (s, 1H), 8.27 (s, 1H), 8.12-8.22 (m, 2H), 7.88 (d, J = 8.54, 1.53 Hz, 1H) 7.75-7.83 (m, 1H), 7.60-7.72 (m, 2H), 7.27 (d, J = 7.63 Hz, 1H), 6.02 (s, 2H ) MS (ESI +) m / z 320.8 (M + H) + .
Пример 16Example 16
5-[1-(3-нитробензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (3-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-нитробензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,65 (с, 1H), 8,21-8,28 (м, 3H), 8,15 (с, 1H), 7,80-7,91 (м, 2H), 7,73 (т, J=7,78 Гц, 1H), 7,65 (д, J=8,54 Гц, 1H), 5,83 (с, 2H). MS (ESI+) m/z 320,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 3-nitrobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.65 (s, 1H), 8.21-8.28 (m, 3H), 8.15 (s, 1H), 7.80-7.91 (m, 2H), 7.73 (t, J = 7.78 Hz, 1H), 7.65 (d, J = 8.54 Hz, 1H), 5.83 (s, 2H). MS (ESI +) m / z 320.8 (M + H) + .
Пример 17Example 17
5-[1-(4-нитробензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (4-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-нитробензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,64 (с, 1H), 8,22-8,31 (м, 3H), 8,15 (с, 1H), 7,88 (д, J=8,70, 1,37 Гц, 1H), 7,57-7,68 (м, 3H), 5,83 (с, 2H). MS (ESI+) m/z 320,7 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 4-nitrobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.64 (s, 1H), 8.22-8.31 (m, 3H), 8.15 (s, 1H), 7.88 (d, J = 8.70, 1.37 Hz, 1H) 7.57-7.68 (m, 3H); 5.83 (s, 2H). MS (ESI +) m / z 320.7 (M + H) + .
Пример 18Example 18
2-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил} бензонитрил2 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2-цианобензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,61 (с, 1H), 8,26 (с, 1H), 8,15 (с, 1H), 7,93 (д, J=7,63 Гц, 1H), 7,88 (д, J=8,54, 1,53 Гц, 1H), 7,72-7,80 (м, 1H), 7,57-7,68 (м, 2H), 7,53 (д, J=7,93 Гц, 1H), 5,86 (с, 2H). MS (ESI+) m/z 300,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 2-cyanobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.61 (s, 1H), 8.26 (s, 1H), 8.15 (s, 1H), 7.93 (d, J = 7.63 Hz, 1H), 7.88 (d, J = 8.54, 1.53 Hz, 1H), 7.72-7.80 (m, 1H), 7.57-7.68 (m, 2H), 7.53 (d, J = 7.93 Hz, 1H), 5.86 (s, 2H). MS (ESI +) m / z 300.9 (M + H) + .
Пример 19Example 19
3-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил} бензонитрил3 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-цианобензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,63 (с, 1H), 8,26 (с, 1H), 8,15 (с, 1H), 7,85-7,93 (м, 2H), 7,83 (д, J=7,63 Гц, 1H), 7,72 (д, J=8,24 Гц, 1H), 7,56-7,68 (м, 2H), 5,74 (с, 2H). MS (ESI+) m/z 300,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the replacement of 2-methylbenzyl bromide with 3-cyanobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.63 (s, 1H), 8.26 (s, 1H), 8.15 (s, 1H), 7.85-7.93 (m, 2H), 7.83 (d, J = 7, 63 Hz, 1H), 7.72 (d, J = 8.24 Hz, 1H), 7.56-7.68 (m, 2H), 5.74 (s, 2H). MS (ESI +) m / z 300.9 (M + H) + .
Пример 20Example 20
4-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил} бензонитрил4 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-цианобензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,62 (с, 1H), 8,26 (с, 1H), 8,15 (с, 1H), 7,82-7,93 (м, J=8,24 Гц, 3H), 7,65 (д, J=8,54 Гц, 1H), 7,54 (д, J=8,24 Гц, 2H), 5,78 (с, 2H). MS (ESI+) m/z 300,7 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 4-cyanobenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.62 (s, 1H), 8.26 (s, 1H), 8.15 (s, 1H), 7.82-7.93 (m, J = 8.24 Hz, 3H), 7.65 (d, J = 8.54 Hz, 1H), 7.54 (d, J = 8.24 Hz, 2H), 5.78 (s, 2H). MS (ESI +) m / z 300.7 (M + H) + .
Пример 21Example 21
5-{1-[2-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1- [2- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2-трифторметилбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,56 (с, 1H), 8,27 (с, 1H), 8,15 (с, 1H), 7,89 (д, J=8,85, 1,53 Гц, 1H), 7,85 (д, J=7,93 Гц, 1H), 7,72 (т, J=7,63 Гц, 1H), 7,55-7,68 (м, 2H), 7,33 (д, J=7,93 Гц, 1H), 5,85 (с, 2H). MS (ESI+) m/z 300,7 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 2-trifluoromethylbenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.56 (s, 1H), 8.27 (s, 1H), 8.15 (s, 1H), 7.89 (d, J = 8.85, 1.53 Hz, 1H), 7.85 (d, J = 7.93 Hz, 1H), 7.72 (t, J = 7.63 Hz, 1H), 7.55-7.68 (m, 2H), 7.33 (d, J = 7.93 Hz, 1H); 5.85 (s, 2H). MS (ESI +) m / z 300.7 (M + H) + .
Пример 22Example 22
5-{1-[3-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1- [3- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-трифторметилбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,65 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,87 (д, J=8,70, 1,37 Гц, 1H), 7,77 (с, 1H), 7,71-7,76 (м, 1H), 7,61-7,69 (м, 3H), 5,78 (с, 2H). MS (ESI+) m/z 344,0 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the replacement of 2-methylbenzyl bromide with 3-trifluoromethylbenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.65 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.87 (d, J = 8.70, 1.37 Hz, 1H), 7.77 (s, 1H), 7.71-7.76 (m, 1H), 7.61-7.69 (m, 3H), 5.78 (s, 2H). MS (ESI +) m / z 344.0 (M + H) + .
Пример 23Example 23
5-{1-[4-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1- [4- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-трифторметилбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,63 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,87 (д, J=8,54 Гц, 1H), 7,78 (д, J=7,93 Гц, 2H), 7,63 (д, J=8,54 Гц, 1H), 7,58 (д, J=7,93 Гц, 2H), 5,78 (с, 2H). MS (ESI+) m/z 344,2 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the substitution of 2-methylbenzyl bromide by 4-trifluoromethylbenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.63 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.87 (d, J = 8.54 Hz, 1H), 7.78 (d, J = 7.93 Hz, 2H), 7.63 (d, J = 8.54 Hz, 1H), 7.58 (d, J = 7.93 Hz, 2H), 5.78 (s, 2H). MS (ESI +) m / z 344.2 (M + H) + .
Пример 24Example 24
5-{1-[3-(трифторметокси)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1- [3- (trifluoromethoxy) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-трифторметоксибензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,64 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,87 (д, J=8,54 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,56 (т, J=8,24 Гц, 1H), 7,31-7,45 (м, 3H), 5,73 (с, 2H). MS (ESI+) m/z 359,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted by 3-trifluoromethoxybenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.64 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.87 (d, J = 8.54 Hz, 1H), 7.64 (d, J = 8.54 Hz, 1H), 7.56 (t, J = 8.24 Hz, 1H), 7.31-7.45 (m, 3H), 5.73 (s, 2H). MS (ESI +) m / z 359.9 (M + H) + .
Пример 25Example 25
5-{1-[4-(трифторметокси)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1- [4- (trifluoromethoxy) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-трифторметоксибензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,61 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,87 (д, J=8,70, 1,37 Гц, 1H), 7,63 (д, J=8,54 Гц, 1H), 7,52 (д, J=8,85 Гц, 2H), 7,40 (д, J=8,24 Гц, 2H), 5,70 (с, 2H). MS (ESI+) m/z 359,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the replacement of 2-methylbenzyl bromide with 4-trifluoromethoxybenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.61 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.87 (d, J = 8.70, 1.37 Hz, 1H), 7.63 (d, J = 8.54 Hz, 1H), 7.52 (d, J = 8.85 Hz, 2H), 7.40 (d, J = 8.24 Hz, 2H), 5.70 (s , 2H). MS (ESI +) m / z 359.9 (M + H) + .
Пример 26Example 26
5-[1-(4-трет-бутилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (4-tert-butylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-трет-бутилбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,58 (с, 1H), 8,24 (с, 1H), 8,13 (с, 1H), 7,86 (д, J=8,85, 1,53 Гц, 1H), 7,63 (д, J=8,54 Гц, 1H), 7,42 (д, J=8,24 Гц, 2H), 7,32 (д, J=8,24 Гц, 2H), 5,60 (с, 2H), 1,26 (с, 9H). MS (ESI+) m/z 332,1 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted with 4-tert-butylbenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.58 (s, 1H), 8.24 (s, 1H), 8.13 (s, 1H), 7.86 (d, J = 8.85, 1.53 Hz, 1H), 7.63 (d, J = 8.54 Hz, 1H), 7.42 (d, J = 8.24 Hz, 2H), 7.32 (d, J = 8.24 Hz, 2H), 5.60 (s , 2H); 1.26 (s, 9H). MS (ESI +) m / z 332.1 (M + H) + .
Пример 27Example 27
метил 3-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил} бензоатmethyl 3 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzoate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3-карбометоксибензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,62 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,92-7,99 (м, 2H), 7,87 (д, J=8,54, 1,53 Гц, 1H), 7,68 (д, J=7,63 Гц, 1H), 7,63 (д, J=8,54 Гц, 1H), 7,58 (т, J=7,63 Гц, 1H), 5,75 (с, 2H), 3,86 (с, 3H). MS (ESI+) m/z 333,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the replacement of 2-methylbenzyl bromide by 3-carbomethoxybenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.62 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.92-7.99 (m, 2H), 7.87 (d, J = 8, 54, 1.53 Hz, 1H), 7.68 (d, J = 7.63 Hz, 1H), 7.63 (d, J = 8.54 Hz, 1H), 7.58 (t, J = 7.63 Hz, 1H), 5.75 (s, 2H), 3.86 (s, 3H). MS (ESI +) m / z 333.9 (M + H) + .
Пример 28Example 28
метил 4-{[4-(1H-индазол-5-ил)-1H-1,2,3-триазол-1-ил]метил}бензоатmethyl 4 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzoate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 4-карбометоксибензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,62 (с, 1H), 8,25 (с, 1H), 8,14 (с, 1H), 7,99 (д, J=8,24 Гц, 2H), 7,87 (д, J=8,85 Гц, 1H), 7,63 (д, J=8,54 Гц, 1H), 7,49 (д, J=8,24 Гц, 2H), 5,76 (с, 2H), 3,85 (с, 3H). MS (ESI+) m/z 333,9 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the replacement of 2-methylbenzyl bromide by 4-carbomethoxybenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.62 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 7.99 (d, J = 8.24 Hz, 2H), 7.87 (d, J = 8.85 Hz, 1H), 7.63 (d, J = 8.54 Hz, 1H), 7.49 (d, J = 8.24 Hz, 2H), 5.76 (s, 2H), 3.85 (s, 3H). MS (ESI +) m / z 333.9 (M + H) + .
Пример 29Example 29
5-[1-(2,4-диметилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2,4-dimethylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2,4-диметилбензилхлорид. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,45 (с, 1H), 8,24 (с, 1H), 8,13 (с, 1H), 7,86 (д, J=8,54 Гц, 1H), 7,62 (д, J=8,54 Гц, 1H), 7,12 (д, J=7,93 Гц, 1H), 7,07 (с, 1H), 7,04 (д, J=7,63 Гц, 1H), 5,60 (с, 2H), 2,32 (с, 3H), 2,26 (с, 3H). MS (ESI+) m/z 304,0 (M+H)+.The title compound was prepared according to the procedure described in Example 4 with substitution of 2-methylbenzyl bromide 2,4-dimethylbenzyl chloride. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.45 (s, 1H), 8.24 (s, 1H), 8.13 (s, 1H), 7.86 (d, J = 8.54 Hz, 1H), 7.62 (d, J = 8.54 Hz, 1H), 7.12 (d, J = 7.93 Hz, 1H), 7.07 (s, 1H), 7.04 (d, J = 7.63 Hz, 1H), 5.60 (s, 2H); 2.32 (s, 3H); 2.26 (s, 3H). MS (ESI +) m / z 304.0 (M + H) + .
Пример 30Example 30
5-[1-(3,5-диметилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (3,5-dimethylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3,5-диметилбензилбромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,56 (с, 1H), 8,24 (с, 1H), 8,13 (с, 1H), 7,87 (д, J=8,54 Гц, 1H), 7,63 (д, J=8,54 Гц, 1H), 6,95-7,01 (м, 3H), 5,55 (с, 2H), 2,26 (с, 6H). MS (ESI+) m/z 304,2 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with the replacement of 2-methylbenzyl bromide by 3,5-dimethylbenzyl bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.56 (s, 1H), 8.24 (s, 1H), 8.13 (s, 1H), 7.87 (d, J = 8.54 Hz, 1H), 7.63 (d, J = 8.54 Hz, 1H), 6.95-7.01 (m, 3H), 5.55 (s, 2H), 2.26 (s, 6H). MS (ESI +) m / z 304.2 (M + H) + .
Пример 31Example 31
5-[1-(2,3-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2,3-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2,3-дихлорбензилхлоридом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,59 (с, 1H), 8,26 (с, 1H), 8,14 (с, 1H), 7,88 (д, J=8,70, 1,37 Гц, 1H), 7,69 (д, J=8,09, 1,37 Гц, 1H), 7,63 (д, J=8,54 Гц, 1H), 7,44 (т, J=7,78 Гц, 1H), 7,31 (д, J=7,78, 1,07 Гц, 1H), 5,81 (с, 2H). MS (ESI+) m/z 343,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted by 2,3-dichlorobenzyl chloride. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.59 (s, 1H), 8.26 (s, 1H), 8.14 (s, 1H), 7.88 (d, J = 8.70, 1.37 Hz, 1H), 7.69 (d, J = 8.09, 1.37 Hz, 1H), 7.63 (d, J = 8.54 Hz, 1H), 7.44 (t, J = 7.78 Hz, 1H), 7 31 (d, J = 7.78, 1.07 Hz, 1H); 5.81 (s, 2H). MS (ESI +) m / z 343.8 (M + H) + .
Пример 32Example 32
5-[1-(2,4-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2,4-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2,4-дихлорбензилхлоридом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,56 (с, 1H), 8,25 (с, 1H), 8,13 (с, 1H), 7,87 (д, J=8,54 Гц, 1H), 7,72 (д, J=2,14 Гц, 1H), 7,63 (д, J=8,54 Гц, 1H), 7,50 (д, J=8,39, 1,98 Гц, 1H), 7,40 (д, J=8,24 Гц, 1H), 5,74 (с, 2H). MS (ESI-) m/z 341,8 (M-H)-.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted by 2,4-dichlorobenzyl chloride. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.56 (s, 1H), 8.25 (s, 1H), 8.13 (s, 1H), 7.87 (d, J = 8.54 Hz, 1H), 7.72 (d, J = 2.14 Hz, 1H), 7.63 (d, J = 8.54 Hz, 1H), 7.50 (d, J = 8.39, 1.98 Hz, 1H), 7.40 (d , J = 8.24 Hz, 1H); 5.74 (s, 2H). MS (ESI-) m / z 341.8 (MH) - .
Пример 33Example 33
5-[1-(2,5-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (2,5-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2,5-дихлорбензилхлоридом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,59 (с, 1H), 8,26 (с, 1H), 8,14 (с, 1H), 7,88 (д, J=8,85 Гц, 1H), 7,63 (д, J=8,85 Гц, 1H), 7,56-7,61 (м, 1H), 7,49-7,55 (м, 1H), 7,47 (д, J=2,44 Гц, 1H), 5,75 (с, 2H). MS (ESI+) m/z 343,8 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted by 2,5-dichlorobenzyl chloride. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.59 (s, 1H), 8.26 (s, 1H), 8.14 (s, 1H), 7.88 (d, J = 8.85 Hz, 1H), 7.63 (d, J = 8.85 Hz, 1H), 7.56-7.61 (m, 1H), 7.49-7.55 (m, 1H), 7.47 (d, J = 2.44 Hz, 1H) 5.75 (s, 2H). MS (ESI +) m / z 343.8 (M + H) + .
Пример 34Example 34
5-[1-(3,5-дихлорбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (3,5-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 3,5-дихлорбензилхлоридом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,64 (с, 1H), 8,26 (с, 1H), 8,15 (с, 1H), 7,87 (д, J=8,85 Гц, 1H), 7,57-7,71 (м, 2H), 7,44 (д, J=1,53 Гц, 2H), 5,69 (с, 2H). MS (ESI+) m/z 344,1 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted by 3,5-dichlorobenzyl chloride. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.64 (s, 1H), 8.26 (s, 1H), 8.15 (s, 1H), 7.87 (d, J = 8.85 Hz, 1H), 7.57-7.71 (m, 2H), 7.44 (d, J = 1.53 Hz, 2H), 5.69 (s, 2H). MS (ESI +) m / z 344.1 (M + H) + .
Пример 35Example 35
5-{1-[2,4-бис(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1- [2,4-bis (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 4, с замещением 2-метилбензилбромида 2,4-бис(трифторметил)бромидом. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,62 (с, 1H), 8,27 (с, 1H), 8,07-8,18 (м, 3H), 7,89 (д, J=8,70, 1,37 Гц, 1H), 7,64 (д, J=8,54 Гц, 1H), 7,49 (д, J=7,93 Гц, 1H), 5,96 (с, 2H). MS (ESI+) m/z 411,7 (M+H)+.The title compound was prepared according to the procedure described in Example 4, with 2-methylbenzyl bromide substituted by 2,4-bis (trifluoromethyl) bromide. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.62 (s, 1H), 8.27 (s, 1H), 8.07-8.18 (m, 3H), 7.89 (d, J = 8.70, 1.37 Hz, 1H) 7.64 (d, J = 8.54 Hz, 1H); 7.49 (d, J = 7.93 Hz, 1H); 5.96 (s, 2H). MS (ESI +) m / z 411.7 (M + H) + .
Пример 36Example 36
N-циклогексил-6-(1H-индазол-5-ил)имидазо[2,1-b][1,3]тиазол-5-аминN-cyclohexyl-6- (1H-indazol-5-yl) imidazo [2,1-b] [1,3] thiazol-5-amine
Пример 36AExample 36A
1H-индазол-5-карбальдегид1H-indazole-5-carbaldehyde
К раствору 5-броминдазола (5 г, 25,38 ммоль) в тетрагидрофуране (100 мл), охлажденному при -50°C, в атмосфере аргона добавляли по каплям раствор 1,6 M н-бутиллития в гексане (40 мл, 63,44 ммоль). Добавляли диметилформамид (3,9 мл, 50,75 ммоль) и смеси давали нагреться до комнатной температуры и перемешивали в течение 15 минут. Смесь затем гасили водой, экстрагировали этилацетатом, предварительно абсорбировали на силикагель и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-30% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,03 (с, 1H), 8,45 (с, 1H), 8,35 (с, 1H), 7,85 (дд, J=8,70, 1,37 Гц, 1H), 7,69 (д, J=8,54 Гц, 1H).To a solution of 5-bromoindazole (5 g, 25.38 mmol) in tetrahydrofuran (100 ml) cooled at -50 ° C under argon was added dropwise a solution of 1.6 M n-butyllithium in hexane (40 ml, 63, 44 mmol). Dimethylformamide (3.9 ml, 50.75 mmol) was added and the mixture was allowed to warm to room temperature and was stirred for 15 minutes. The mixture was then quenched with water, extracted with ethyl acetate, pre-absorbed onto silica gel and purified by silica gel chromatography using a gradient of 10-30% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 10.03 (s, 1H), 8.45 (s, 1H), 8.35 (s, 1H), 7.85 (dd, J = 8.70, 1.37 Hz, 1H), 7.69 (d, J = 8.54 Hz, 1H).
Пример 36BExample 36B
N-циклогексил-6-(1H-индазол-5-ил)имидазо[2,1-b][1,3]тиазол-5-аминN-cyclohexyl-6- (1H-indazol-5-yl) imidazo [2,1-b] [1,3] thiazol-5-amine
Соединение Примера 36A (50 мг, 0,34 ммоль) и 2-аминотиазол (28 мг, 0,34 ммоль) объединяли со скандийтрифлатом (8 мг, 0,017 ммоль) в безводном метаноле (1 мл) в 4-мл сосуде. Сосуд герметично закрывали и встряхивали при температуре окружающей среды в течение 30 минут. Добавляли циклогексилизоцианид (42 мл, 0,34 ммоль) и смесь встряхивали в течение 2 дней при комнатной температуре. Смесь очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода 0,1% ТФУ с получением указанного в заголовке соединения в форме соли ТФУ. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,12 (с, 1H), 8,32 (с, 1H), 8,13 (с, 1H), 8,05 (д, J=8,85, 1,22 Гц, 1H), 7,92 (д, J=4,27 Гц, 1H), 7,60 (д, J=8,54 Гц, 1H), 7,37 (д, J=3,66 Гц, 1H), 4,89 (с, 1H), 2,78-2,94 (м, 1H), 1,73-1,83 (м, 2H), 1,58-1,68 (м, 2H), 1,45-1,53 (м, 1H), 1,16-1,29 (м, 2H), 1,04-1,14 (м, 3H). MS (ESI+) m/z 338,1 (M+H)+.The compound of Example 36A (50 mg, 0.34 mmol) and 2-aminothiazole (28 mg, 0.34 mmol) were combined with scandium triflate (8 mg, 0.017 mmol) in anhydrous methanol (1 ml) in a 4 ml vessel. The vessel was sealed and shaken at ambient temperature for 30 minutes. Cyclohexyl isocyanide (42 ml, 0.34 mmol) was added and the mixture was shaken for 2 days at room temperature. The mixture was purified by reverse phase HPLC using an acetonitrile / water 0.1% TFA gradient elution method to give the title compound in the form of a TFA salt. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.12 (s, 1H), 8.32 (s, 1H), 8.13 (s, 1H), 8.05 (d, J = 8.85, 1.22 Hz, 1H), 7.92 (d, J = 4.27 Hz, 1H), 7.60 (d, J = 8.54 Hz, 1H), 7.37 (d, J = 3.66 Hz, 1H), 4.89 (s , 1H), 2.78-2.94 (m, 1H), 1.73-1.83 (m, 2H), 1.58-1.68 (m, 2H), 1.45-1.53 (m, 1H), 1.16-1.29 (m, 2H), 1.04-1.14 (m, 3H). MS (ESI +) m / z 338.1 (M + H) + .
Пример 37Example 37
N-циклогексил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-аминN-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 36B, с замещением 2-аминотиазола 2-аминопиридином. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,04 (с, 1H), 8,57 (с, 1H), 8,23-8,39 (м, 2H), 8,11 (с, 1H), 7,57 (д, J=8,54 Гц, 1H), 7,46 (д, J=8,85 Гц, 1H), 7,12-7,21 (м, 1H), 6,88 (т, J=6,71 Гц, 1H), 4,78 (д, J=5,80 Гц, 1H), 2,78-2,91 (м, 1H), 1,69-1,77 (м, J=10,98 Гц, 2H), 1,57-1,67 (м, 2H), 1,45-1,53 (м, 1H), 1,21-1,34 (м, 2H), 1,01-1,16 (м, 3H). MS (ESI+) m/z 332,1 (M+H)+.The title compound was prepared according to the procedure described in Example 36B with 2-aminothiazole substituted with 2-aminopyridine. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.04 (s, 1H), 8.57 (s, 1H), 8.23-8.39 (m, 2H), 8.11 (s, 1H), 7.57 (d, J = 8, 54 Hz, 1H), 7.46 (d, J = 8.85 Hz, 1H), 7.12-7.21 (m, 1H), 6.88 (t, J = 6.71 Hz, 1H) 4.78 (d, J = 5.80 Hz, 1H), 2.78-2.91 (m, 1H), 1.69-1.77 (m, J = 10.98 Hz, 2H), 1.57-1.67 (m, 2H), 1.45-1.53 (m, 1H), 1.21-1.34 (m, 2H), 1.01-1.16 (m, 3H ) MS (ESI +) m / z 332.1 (M + H) + .
Пример 38Example 38
N-циклогексил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиразин-3-аминN-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrazin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 36B, с замещением 2-аминотиазола 2-аминопиразином. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,12 (с, 1H), 8,90 (д, J=1,22 Гц, 1H), 8,61 (с, 1H), 8,37 (д, J=4,58, 1,53 Гц, 1H), 8,29 (д, J=8,70, 1,37 Гц, 1H), 8,15 (с, 1H), 7,85 (д, J=4,58 Гц, 1H), 7,62 (д, J=8,85 Гц, 1H), 5,05 (д, J=6,71 Гц, 1H), 2,81-2,99 (м, 1H), 1,70-1,77 (м, J=10,68 Гц, 2H), 1,58-1,67 (м, 2Н), 1,47 (с, 1Н), 1,24-1,38 (м, 2Н), 1,00-1,16 (м, 3Н). MS (ESI+) m/z 333,1 (М+Н)+.The title compound was prepared according to the procedure described in Example 36B with 2-aminothiazole substituted with 2-aminopyrazine. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.12 (s, 1H), 8.90 (d, J = 1.22 Hz, 1H), 8.61 (s, 1H), 8.37 (d, J = 4.58, 1.53 Hz , 1H), 8.29 (d, J = 8.70, 1.37 Hz, 1H), 8.15 (s, 1H), 7.85 (d, J = 4.58 Hz, 1H), 7 62 (d, J = 8.85 Hz, 1H), 5.05 (d, J = 6.71 Hz, 1H), 2.81-2.99 (m, 1H), 1.70-1, 77 (m, J = 10.68 Hz, 2H), 1.58-1.67 (m, 2H), 1.47 (s, 1H), 1.24-1.38 (m, 2H), 1 00-1.16 (m, 3H). MS (ESI +) m / z 333.1 (M + H) + .
Пример 39Example 39
5- [1-бензил-4-(4-фторфенил)-1Н-имидазол-5-ил]-1Н-индазол5- [1-benzyl-4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole
В 20-мл сцинтилляционный сосуд добавляли 50,0 мг (0,34 ммоль) соединения Примера 36А. К этому твердому веществу добавляли 2,0 мл раствора диметилформамида, содержащего 0,46 ммоль (49 мг) бензиламина и 50 мг порошкообразных активированных 4Å молекулярных сит. Сосуд затем закрывали крышкой и нагревали при 60°С в течение 4 часов на орбитальном встряхивающем устройстве. Сосуду давали охладиться до температуры окружающей среды; и крышку открывали. К суспензии добавляли 32 мг (0,23 ммоль) безводного карбоната калия с последующим добавлением 66 мг (0,23 ммоль) α-(п-толуолсульфонил)-4-фторбензилизонитрила. Сосуд затем закрывали крышкой и нагревали в течение ночи при 60°С на встряхивающем устройстве. Сосуд удаляли из встряхивающего устройства; давали охладиться до температуры окружающей среды; и полученную суспензию фильтровали. Фильтрат упаривали при пониженном давлении при умеренном нагревании на Savant Speed Vac. Неочищенные остатки снова растворяли в смеси 1:1 DMSO/метанол и очищали при помощи обращенно-фазовой ВЭЖХ с использованием градиентного элюирования ацетонитрил/вода ТФУ метода с получением указанного в заголовке соединения в форме соли ТФУ. 1Н ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,01 (с, 1Н), 8,12 (с, 1Н), 7,76 (с, 1Н), 7,60 (д, J=8,48 Гц, 2Н), 7,32-7,45 (м, 2Н), 7,09-7,30 (м, 6Н), 6,96 (д, J=6,61, 2,88 Гц, 2Н), 5,23 (с, 2Н). MS (ECI) m/z 369 (М+Н)+.50.0 mg (0.34 mmol) of the compound of Example 36A was added to a 20 ml scintillation vessel. To this solid was added 2.0 ml of a solution of dimethylformamide containing 0.46 mmol (49 mg) of benzylamine and 50 mg of powdered activated 4Å molecular sieves. The vessel was then closed with a lid and heated at 60 ° C for 4 hours on an orbital shaker. The vessel was allowed to cool to ambient temperature; and the lid was opened. 32 mg (0.23 mmol) of anhydrous potassium carbonate was added to the suspension, followed by 66 mg (0.23 mmol) of α- (p-toluenesulfonyl) -4-fluorobenzylisonitrile. The vessel was then covered with a lid and heated overnight at 60 ° C on a shaker. The vessel was removed from the shaker; allowed to cool to ambient temperature; and the resulting suspension was filtered. The filtrate was evaporated under reduced pressure with moderate heating on a Savant Speed Vac. The crude residues were redissolved in a 1: 1 DMSO / methanol mixture and purified by reverse phase HPLC using gradient elution with the acetonitrile / water TFA method to give the title compound in the form of a TFA salt. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 9.01 (s, 1H), 8.12 (s, 1H), 7.76 (s, 1H), 7.60 (d, J = 8.48 Hz, 2H), 7.32-7.45 (m, 2H), 7.09-7.30 (m, 6H), 6.96 (d, J = 6.61, 2.88 Hz, 2H), 5.23 (s, 2H). MS (ECI) m / z 369 (M + H) + .
Пример 40Example 40
N-{3-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-индазол-1-ил]пропил}-N,N-диметиламинN- {3- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-indazol-1-yl] propyl} -N, N-dimethylamine
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 39, с замещением бензиламина N1,N1-диметилпропан-1,3-диамином. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,49 (с, 1H), 8,88 (с, 1H), 8,19 (с, 1H), 7,94 (с, 1H), 7,73 (д, J=8,81 Гц, 1H), 7,29-7,44 (м, 3H), 7,17 (т, J=8,98 Гц, 2H), 4,01 (т, J=7,12 Гц, 2H), 2,89-3,04 (м, J=10,51 Гц, 2H), 2,68 (с, 3H), 2,67 (с, 3H), 1,87-2,02 (м, 2H). MS (ECI) m/z 364 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 39, with the substitution of benzylamine N 1 , N 1 -dimethylpropane-1,3-diamine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 9.49 (s, 1H), 8.88 (s, 1H), 8.19 (s, 1H), 7.94 (s, 1H), 7.73 (d, J = 8.81 Hz, 1H ), 7.29-7.44 (m, 3H), 7.17 (t, J = 8.98 Hz, 2H), 4.01 (t, J = 7.12 Hz, 2H), 2.89 -3.04 (m, J = 10.51 Hz, 2H), 2.68 (s, 3H), 2.67 (s, 3H), 1.87-2.02 (m, 2H). MS (ECI) m / z 364 (M + H) + .
Пример 41Example 41
N-циклогексил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-аминN-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии процедурой, описанной в Примере 36B, с использованием пиримидин-2-амина вместо тиазол-2-амина. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,21-13,41 (м, 1H), 9,07 (д, J=5,80 Гц, 1H), 8,85 (д, J=3,05 Гц, 1H), 8,51 (с, 1H), 8,24 (с, 1H), 8,14 (д, J=8,70, 1,37 Гц, 1H), 7,73 (д, J=8,85 Гц, 1H), 7,47-7,56 (м, 1H), 5,25-5,41 (м, J=2,75 Гц, 1H), 2,81-2,91 (м, J=10,53, 10,53 Гц, 1H), 1,74-1,83 (м, 2H), 1,56-1,66 (м, 2H), 1,43-1,50 (м, 1H), 1,24 (кв., J=1 1,09 Гц, 2H), 1,00-1,14 (м, 3H). MS (ESI+) m/z 333,1 (M+H)+.The title compound was prepared in the form of a TFU salt according to the procedure described in Example 36B using pyrimidin-2-amine instead of thiazole-2-amine. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.21-13.41 (m, 1H), 9.07 (d, J = 5.80 Hz, 1H), 8.85 (d, J = 3.05 Hz, 1H), 8.51 (s , 1H), 8.24 (s, 1H), 8.14 (d, J = 8.70, 1.37 Hz, 1H), 7.73 (d, J = 8.85 Hz, 1H), 7 , 47-7.56 (m, 1H), 5.25-5.41 (m, J = 2.75 Hz, 1H), 2.81-2.91 (m, J = 10.53, 10, 53 Hz, 1H), 1.74-1.83 (m, 2H), 1.56-1.66 (m, 2H), 1.43-1.50 (m, 1H), 1.24 (q ., J = 1 1.09 Hz, 2H), 1.00-1.14 (m, 3H). MS (ESI +) m / z 333.1 (M + H) + .
Пример 42Example 42
5-[4-(4-фторфенил)-1-(1-фенилэтил)-1H-индазол-5-ил]-1H-индазол5- [4- (4-fluorophenyl) -1- (1-phenylethyl) -1H-indazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 1-фенилэтанамина вместо бензиламина. 1H ЯМР (300 МГц, CDCl3) δ м.д. 8,04 (с, 1H), 7,75-7,84 (м, 1H), 7,35-7,55 (м, 4H), 7,20-7,31 (м, 5H), 6,76-7,01 (м, 4H), 5,09 (кв., J=7,12 Гц, 1H), 1,82 (д, 3H). MS (ECI) m/z 383 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 1-phenylethanamine instead of benzylamine. 1 H NMR (300 MHz, CDCl 3 ) δ ppm 8.04 (s, 1H), 7.75-7.84 (m, 1H), 7.35-7.55 (m, 4H), 7.20-7.31 (m, 5H), 6, 76-7.01 (m, 4H), 5.09 (q, J = 7.12 Hz, 1H), 1.82 (d, 3H). MS (ECI) m / z 383 (M + H) + .
Пример 43Example 43
2-(1H-индазол-5-ил)-N-изопропилимидазо[1,2-a]пиримидин-3-амин2- (1H-indazol-5-yl) -N-isopropylimidazo [1,2-a] pyrimidin-3-amine
Соединение Примера 36A (42 мг, 0,287 ммоль) и 2-аминопиримидин (27 мг, 0,284 ммоль) объединяли со скандийтрифлатом (7 мг, 0,014 ммоль) в безводном метаноле (2 мл) в 4-мл сосуде. Сосуд герметично закрывали и встряхивали при температуре окружающей среды в течение 30 минут. Добавляли изопропилизоцианид (27 мл, 0,286 ммоль) и смесь встряхивали при температуре окружающей среды в течение ночи, а затем при 40°C в течение 2 часов. Смесь абсорбировали на силикагеле и очищали хроматографией на силикагеле с использованием для элюирования градиента 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,08 (с, 1H), 8,75 (д, J=6,95, 1,86 Гц, 1H), 8,60 (с, 1H), 8,31 (д, J=8,82, 1,36 Гц, 1H), 8,20 (д, J=4,75 Гц, 1H), 8,14 (с, 1H), 7,60 (д, J=8,82 Гц, 1H), 7,03 (д, J=6,78, 4,07 Гц, 1H), 6,54 (д, J=4,75 Гц, 1H), 4,86 (д, J=5,09 Гц, 1H), 1,05 (д, J=6,10 Гц, 6H). MS (ESI+) m/z 293,0 (M+H)+.The compound of Example 36A (42 mg, 0.287 mmol) and 2-aminopyrimidine (27 mg, 0.284 mmol) were combined with scandium triflate (7 mg, 0.014 mmol) in anhydrous methanol (2 ml) in a 4 ml vessel. The vessel was sealed and shaken at ambient temperature for 30 minutes. Isopropylisocyanide (27 ml, 0.286 mmol) was added and the mixture was shaken at ambient temperature overnight and then at 40 ° C for 2 hours. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.08 (s, 1H), 8.75 (d, J = 6.95, 1.86 Hz, 1H), 8.60 (s, 1H), 8.31 (d, J = 8.82, 1.36 Hz, 1H), 8.20 (d, J = 4.75 Hz, 1H), 8.14 (s, 1H), 7.60 (d, J = 8.82 Hz, 1H), 7 03 (d, J = 6.78, 4.07 Hz, 1H), 6.54 (d, J = 4.75 Hz, 1H), 4.86 (d, J = 5.09 Hz, 1H) 1.05 (d, J = 6.10 Hz, 6H). MS (ESI +) m / z 293.0 (M + H) + .
Пример 44Example 44
4-(1H-индазол-5-ил)-N-фенил-1,3-тиазол-2-амин4- (1H-indazol-5-yl) -N-phenyl-1,3-thiazol-2-amine
Пример 44AExample 44A
трет-Бутил 5-бром-1H-индазол-1-карбоксилатtert-Butyl 5-bromo-1H-indazole-1-carboxylate
5-Броминдазол (4,40 г, 22,3 ммоль) и каталитическое количество диметиламинопиридина (~50 мг) растворяли в дихлорметане (100 мл). Добавляли ди-трет-бутилдикарбонат (5,43 г, 24,9 ммоль) и смесь перемешивали при температуре окружающей среды в течение ночи. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 297,2 (M+H)+.5-Bromoindazole (4.40 g, 22.3 mmol) and a catalytic amount of dimethylaminopyridine (~ 50 mg) were dissolved in dichloromethane (100 ml). Di-tert-butyl dicarbonate (5.43 g, 24.9 mmol) was added and the mixture was stirred at ambient temperature overnight. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 297.2 (M + H) + .
Пример 44BExample 44B
трет-Бутил 5-ацетил-1H-индазол-1-карбоксилатtert-Butyl 5-acetyl-1H-indazole-1-carboxylate
Соединение Примера 44A (5,12 г, 17,2 ммоль), трибутил(1-этоксивинил)олово (7,0 мл, 20,7 ммоль) и дихлорбис(трифенилфосфин)палладий(II) (672 мг, 0,957 ммоль) объединяли в толуоле (85 мл). В смесь барботировали азот в течение 5 минут и смесь нагревали до 100°C в герметично закрытой пробирке в течение ночи. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 283,0 (M+Na)+.The compound of Example 44A (5.12 g, 17.2 mmol), tributyl (1-ethoxyvinyl) tin (7.0 ml, 20.7 mmol) and dichlorbis (triphenylphosphine) palladium (II) (672 mg, 0.957 mmol) were combined in toluene (85 ml). Nitrogen was bubbled into the mixture for 5 minutes and the mixture was heated to 100 ° C in a sealed tube overnight. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 283.0 (M + Na) + .
Пример 44CExample 44C
трет-Бутил 5-(2-бромацетил)-1H-индазол-1-карбоксилатtert-Butyl 5- (2-bromoacetyl) -1H-indazole-1-carboxylate
Соединение Примера 44B (1,60 г, 6,15 ммоль) и трибромид пиридиния (1,98 г, 6,19 ммоль) объединяли в тетрагидрофуране и нагревали до 40°C в течение 2 часов. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 360,9 (M+Na)+.The compound of Example 44B (1.60 g, 6.15 mmol) and pyridinium tribromide (1.98 g, 6.19 mmol) were combined in tetrahydrofuran and heated to 40 ° C. for 2 hours. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 360.9 (M + Na) + .
Пример 44DExample 44D
4-(1H-индазол-5-ил)-N-фенил-1,3-тиазол-2-амин4- (1H-indazol-5-yl) -N-phenyl-1,3-thiazol-2-amine
Соединение Примера 44C (71 мг, 0,208 ммоль) и 1-фенил-2-тиомочевину (33 мг, 0,217 ммоль) объединяли в этаноле (300 мл) в 4-мл сосуде. Сосуд встряхивали при 80°C в течение ночи. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент метанол в дихлорметане (0-5%), с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,08 (с, 1H), 10,23 (с, 1H), 8,32 (с, 1H), 8,14 (с, 1H), 7,93 (д, J=8,59, 1,53 Гц, 1H), 7,75 (д, J=8,75, 1,07 Гц, 1H), 7,58 (д, J=8,90 Гц, 1H), 7,36 (д, J=8,59, 7,36 Гц, 1H), 7,25 (с, 1H), 6,92-7,02 (м, 1H). MS (ESI+) m/z 292,9 (M+H)+.The compound of Example 44C (71 mg, 0.208 mmol) and 1-phenyl-2-thiourea (33 mg, 0.217 mmol) were combined in ethanol (300 ml) in a 4 ml vessel. The vessel was shaken at 80 ° C. overnight. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of methanol in dichloromethane (0-5%) to elute to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.08 (s, 1H), 10.23 (s, 1H), 8.32 (s, 1H), 8.14 (s, 1H), 7.93 (d, J = 8.59, 1, 53 Hz, 1H), 7.75 (d, J = 8.75, 1.07 Hz, 1H), 7.58 (d, J = 8.90 Hz, 1H), 7.36 (d, J = 8.59, 7.36 Hz, 1H), 7.25 (s, 1H), 6.92-7.02 (m, 1H). MS (ESI +) m / z 292.9 (M + H) + .
Пример 45Example 45
5-(2-метил-1,3-тиазол-4-ил)-1H-индазол5- (2-methyl-1,3-thiazol-4-yl) -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 44D, с замещением 1-фенил-2-тиомочевины тиоацетамидом. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,10 (с, 1H), 8,34 (с, 1H), 8,12 (с, 1H), 7,94 (д, J=8,82, 1,70 Гц, 1H), 7,85 (с, 1H), 7,57 (д, J=8,82 Гц, 1H), 2,73 (с, 3H). MS (ESI+) m/z 215,9 (M+H)+.The title compound was prepared according to the procedure described in Example 44D, with 1-phenyl-2-thiourea substituted with thioacetamide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.10 (s, 1H), 8.34 (s, 1H), 8.12 (s, 1H), 7.94 (d, J = 8.82, 1.70 Hz, 1H), 7.85 (s, 1H), 7.57 (d, J = 8.82 Hz, 1H), 2.73 (s, 3H). MS (ESI +) m / z 215.9 (M + H) + .
Пример 46Example 46
N-этил-4-(1H-индазол-5-ил)-1,3-тиазол-2-аминN-ethyl-4- (1H-indazol-5-yl) -1,3-thiazol-2-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 44D, с замещением 1-фенил-2-тиомочевины этилтиомочевиной. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,04 (с, 1H), 8,21 (с, 1H), 8,09 (с, 1H), 7,83 (д, J=8,65, 1,53 Гц, 1H), 7,58 (т, J=5,43 Гц, 1H), 7,51 (д, J=8,82 Гц, 1H), 6,96 (с, 1H), 3,22-3,34 (м, 2H), 1,21 (т, J=7,29 Гц, 3H). MS (ESI+) m/z 244,9 (M+H)+.The title compound was prepared according to the procedure described in Example 44D, with 1-phenyl-2-thiourea substituted with ethylthiourea. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.04 (s, 1H), 8.21 (s, 1H), 8.09 (s, 1H), 7.83 (d, J = 8.65, 1.53 Hz, 1H), 7.58 (t, J = 5.43 Hz, 1H), 7.51 (d, J = 8.82 Hz, 1H), 6.96 (s, 1H), 3.22-3.34 (m, 2H) 1.21 (t, J = 7.29 Hz, 3H). MS (ESI +) m / z 244.9 (M + H) + .
Пример 47Example 47
N-бензил-4-(1H-индазол-5-ил)-1,3-тиазол-2-аминN-benzyl-4- (1H-indazol-5-yl) -1,3-thiazol-2-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 44D, с замещением 1-фенил-2-тиомочевины 1-бензил-2-тиомочевиной. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,02 (с, 1H), 8,21 (с, 1H), 8,12 (т, J=5,83 Гц, 1H), 8,08 (с, 1H), 7,83 (д, J=8,90, 1,53 Гц, 1H), 7,50 (д, J=8,90 Гц, 1H), 7,39-7,45 (м, 2H), 7,35 (т, J=7,52 Гц, 2H), 7,26 (т, J=7,21 Гц, 1H), 6,97 (с, 1H), 4,54 (д, J=5,83 Гц, 1H). MS (ESI+) m/z 306,9 (M+H)+.The title compound was prepared according to the procedure described in Example 44D, with 1-phenyl-2-thiourea substituted by 1-benzyl-2-thiourea. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.02 (s, 1H), 8.21 (s, 1H), 8.12 (t, J = 5.83 Hz, 1H), 8.08 (s, 1H), 7.83 (d, J = 8.90, 1.53 Hz, 1H), 7.50 (d, J = 8.90 Hz, 1H), 7.39-7.45 (m, 2H), 7.35 (t, J = 7.52 Hz, 2H), 7.26 (t, J = 7.21 Hz, 1H), 6.97 (s, 1H), 4.54 (d, J = 5.83 Hz, 1H). MS (ESI +) m / z 306.9 (M + H) + .
Пример 48Example 48
4-(1H-индазол-5-ил)-1,3-тиазол-2-амин4- (1H-indazol-5-yl) -1,3-thiazol-2-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 44D, с замещением 1-фенил-2-тиомочевины тиомочевиной. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,03 (с, 1H), 8,17 (с, 1H), 8,07 (с, 1H), 7,81 (д, J=8,82, 1,36 Гц, 1H), 7,50 (д, J=8,82 Гц, 1H), 7,01 (с, 2H), 6,92 (с, 1H). MS (ESI+) m/z 216,9 (M+H)+.The title compound was prepared according to the procedure described in Example 44D, with the replacement of 1-phenyl-2-thiourea with thiourea. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.03 (s, 1H), 8.17 (s, 1H), 8.07 (s, 1H), 7.81 (d, J = 8.82, 1.36 Hz, 1H), 7.50 (d, J = 8.82 Hz, 1H), 7.01 (s, 2H), 6.92 (s, 1H). MS (ESI +) m / z 216.9 (M + H) + .
Пример 49Example 49
4-(1H-индазол-5-ил)-N-(2-фенилэтил)-1,3-тиазол-2-амин4- (1H-indazol-5-yl) -N- (2-phenylethyl) -1,3-thiazol-2-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 44D с замещением 1-фенил-2-тиомочевины 1-фенэтилтиомочевиной. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,03 (с, 1H), 8,23 (с, 1H), 8,09 (с, 1H), 7,85 (д, J=8,65, 1,53 Гц, 1H), 7,71 (т, J=5,43 Гц, 1H), 7,51 (д, J=8,82 Гц, 1H), 7,26-7,36 (м, 4H), 7,18-7,26 (м, 1H), 6,97 (с, 1H), 3,47-3,59 (м, 1H), 2,94 (т, J=7,44 Гц, 1H). MS (ESI+) m/z 321,0 (M+H)+.The title compound was prepared according to the procedure described in Example 44D with 1-phenyl-2-thiourea substituted by 1-phenethylthiourea. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.03 (s, 1H), 8.23 (s, 1H), 8.09 (s, 1H), 7.85 (d, J = 8.65, 1.53 Hz, 1H), 7.71 (t, J = 5.43 Hz, 1H), 7.51 (d, J = 8.82 Hz, 1H), 7.26-7.36 (m, 4H), 7.18-7.26 ( m, 1H), 6.97 (s, 1H), 3.47-3.59 (m, 1H), 2.94 (t, J = 7.44 Hz, 1H). MS (ESI +) m / z 321.0 (M + H) + .
Пример 50Example 50
N-бензил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-аминN-benzyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 43, с использованием бензилизоцианида вместо изопропилизоцианида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,10 (с, 1H), 8,50-8,58 (м, 2H), 8,39 (д, J=4,07, 2,03 Гц, 1H), 8,25 (д, J=8,81, 1,36 Гц, 1H), 8,13 (с, 1H), 7,61 (д, J=8,81 Гц, 1H), 7,24 (с, 5H), 6,92 (д, J=6,78, 4,07 Гц, 1H), 5,44 (т, J=6,27 Гц, 1H), 4,13 (д, J=6,10 Гц, 2H). MS (ESI+) m/z 341,0 (M+H)+.The title compound was prepared according to the procedure described in Example 43 using benzyl isocyanide instead of isopropyl isocyanide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.10 (s, 1H), 8.50-8.58 (m, 2H), 8.39 (d, J = 4.07, 2.03 Hz, 1H), 8.25 (d, J = 8.81, 1.36 Hz, 1H), 8.13 (s, 1H), 7.61 (d, J = 8.81 Hz, 1H), 7.24 (s, 5H), 6.92 ( d, J = 6.78, 4.07 Hz, 1H), 5.44 (t, J = 6.27 Hz, 1H), 4.13 (d, J = 6.10 Hz, 2H). MS (ESI +) m / z 341.0 (M + H) + .
Пример 51Example 51
N-бутил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-аминN-butyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 43, с использованием бутилизоцианида вместо изопропилизоцианида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,09 (с, 1H), 8,70 (д, J=6,78, 2,03 Гц, 1H), 8,55 (с, 1H), 8,44 (д, J=4,07, 2,03 Гц, 1H), 8,25 (д, J=8,82, 1,36 Гц, 1H), 8,14 (с, 1H), 7,61 (д, J=8,82 Гц, 1H), 7,03 (д, J=6,78, 4,07 Гц, 1H), 4,90 (т, J=5,93 Гц, 1H), 2,96 (с, 2H), 1,49 (с, 2H), 1,34 (с, 2H), 0,82 (т, J=7,29 Гц, 3H). MS (ESI+) m/z 307,0 (M+H)+.The title compound was prepared according to the procedure described in Example 43 using butyl isocyanide instead of isopropyl isocyanide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.09 (s, 1H), 8.70 (d, J = 6.78, 2.03 Hz, 1H), 8.55 (s, 1H), 8.44 (d, J = 4.07, 2.03 Hz, 1H), 8.25 (d, J = 8.82, 1.36 Hz, 1H), 8.14 (s, 1H), 7.61 (d, J = 8.82 Hz, 1H), 7.03 (d, J = 6.78, 4.07 Hz, 1H), 4.90 (t, J = 5.93 Hz, 1H), 2.96 (s, 2H), 1, 49 (s, 2H), 1.34 (s, 2H), 0.82 (t, J = 7.29 Hz, 3H). MS (ESI +) m / z 307.0 (M + H) + .
Пример 52Example 52
N-(4-хлорфенил)-2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-аминN- (4-chlorophenyl) -2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 43, с использованием 4-хлорфенилизоцианида вместо изопропилизоцианида. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,12 (с, 1H), 8,58 (дд, J=4,12, 1,98 Гц, 1H), 8,46 (д, J=15,87 Гц, 2H), 8,40 (дд, J=6,71, 1,83 Гц, 1H), 8,06-8,16 (м, 2H), 7,58 (д, J=8,85 Гц, 1H), 7,18 (д, J=8,85 Гц, 2H), 7,05 (дд, J=6,71, 3,97 Гц, 1H), 6,57 (д, J=8,85 Гц, 2H). MS (ESI+) m/z 361,0 (M+H)+.The title compound was prepared according to the procedure described in Example 43 using 4-chlorophenyl isocyanide instead of isopropyl isocyanide. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.12 (s, 1H), 8.58 (dd, J = 4.12, 1.98 Hz, 1H), 8.46 (d, J = 15.87 Hz, 2H), 8.40 (dd , J = 6.71, 1.83 Hz, 1H), 8.06-8.16 (m, 2H), 7.58 (d, J = 8.85 Hz, 1H), 7.18 (d, J = 8.85 Hz, 2H), 7.05 (dd, J = 6.71, 3.97 Hz, 1H), 6.57 (d, J = 8.85 Hz, 2H). MS (ESI +) m / z 361.0 (M + H) + .
Пример 53Example 53
2-(1H-индазол-5-ил)-N-(4-метоксифенил)имидазо[1,2-a]пиримидин-3-амин2- (1H-indazol-5-yl) -N- (4-methoxyphenyl) imidazo [1,2-a] pyrimidin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 43, с использованием 4-метоксифенилизоцианида вместо изопропилизоцианида. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,10 (с, 1H), 8,56 (дд, J=3,97, 2,14 Гц, 1H), 8,47 (с, 1H), 8,36 (дд, J=6,56, 1,98 Гц, 1H), 8,15 (дд, J=8,70, 1,37 Гц, 1H), 8,10 (с, 1H), 7,99 (с, 1H), 7,57 (д, J=8,54 Гц, 1H), 7,03 (дд, J=6,71, 4,27 Гц, 1H), 6,76 (д, J=8,85 Гц, 2H), 6,50 (д, J=8,85 Гц, 2H), 3,63 (с, 3H). MS (ESI+) m/z 357,4 (M+H)+.The title compound was prepared according to the procedure described in Example 43 using 4-methoxyphenyl isocyanide instead of isopropyl isocyanide. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.10 (s, 1H), 8.56 (dd, J = 3.97, 2.14 Hz, 1H), 8.47 (s, 1H), 8.36 (dd, J = 6.56, 1.98 Hz, 1H), 8.15 (dd, J = 8.70, 1.37 Hz, 1H), 8.10 (s, 1H), 7.99 (s, 1H), 7.57 ( d, J = 8.54 Hz, 1H), 7.03 (dd, J = 6.71, 4.27 Hz, 1H), 6.76 (d, J = 8.85 Hz, 2H), 6, 50 (d, J = 8.85 Hz, 2H); 3.63 (s, 3H). MS (ESI +) m / z 357.4 (M + H) + .
Пример 54Example 54
2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 44D, с использованием 2-аминопиримидина вместо 1-фенил-2-тиомочевины. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,13 (с, 1H), 8,96 (дд, J=6,78, 2,03 Гц, 1H), 8,51 (дд, J=4,41, 2,03 Гц, 1H), 8,42 (с, 1H), 8,36 (с, 1H), 8,15 (с, 1H), 8,01 (дд, J=8,82, 1,70 Гц, 1H), 7,62 (д, J=8,48 Гц, 1H), 7,04 (дд, J=6,61, 4,24 Гц, 1H). MS (ESI+) m/z 236,1 (M+H)+.The title compound was prepared according to the procedure described in Example 44D using 2-aminopyrimidine instead of 1-phenyl-2-thiourea. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.13 (s, 1H), 8.96 (dd, J = 6.78, 2.03 Hz, 1H), 8.51 (dd, J = 4.41, 2.03 Hz, 1H), 8 42 (s, 1H), 8.36 (s, 1H), 8.15 (s, 1H), 8.01 (dd, J = 8.82, 1.70 Hz, 1H), 7.62 ( d, J = 8.48 Hz, 1H), 7.04 (dd, J = 6.61, 4.24 Hz, 1H). MS (ESI +) m / z 236.1 (M + H) + .
Пример 55Example 55
метил N-[2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-ил]глицинатmethyl N- [2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-yl] glycinate
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 36B, с использованием 2-аминопиридина вместо 2-аминотиазола и метил 2-изоцианоацетата вместо циклогексилизоцианида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,41 (с, 1H), 8,90 (д, J=6,75 Гц, 1H), 8,38 (с, 1H), 8,27 (с, 1H), 7,84-7,98 (м, 3H), 7,77 (д, J=8,90 Гц, 1H), 7,55 (тд, J=6,75, 1,23 Гц, 1H), 5,95-6,06 (м, 1H), 3,87 (д, J=4,60 Гц, 2H), 3,51 (с, 3H). MS (ESI+) m/z 340,1 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 36B using 2-aminopyridine instead of 2-aminothiazole and methyl 2-isocyanoacetate instead of cyclohexyl isocyanide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.41 (s, 1H), 8.90 (d, J = 6.75 Hz, 1H), 8.38 (s, 1H), 8.27 (s, 1H), 7.84-7.98 (m, 3H), 7.77 (d, J = 8.90 Hz, 1H), 7.55 (td, J = 6.75, 1.23 Hz, 1H), 5.95-6.06 ( m, 1H), 3.87 (d, J = 4.60 Hz, 2H), 3.51 (s, 3H). MS (ESI +) m / z 340.1 (M + H) + .
Пример 56Example 56
N-бензил-2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-аминN-benzyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 36B, с использованием 2-аминопиридина вместо 2-аминотиазола и бензилизоцианида вместо циклогексилизоцианида. Конечный продукт осаждался из раствора с образрованием осадка, и его выделяли после фильтрации. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,04 (с, 1H), 8,49 (с, 1H), 8,16-8,27 (м, 2H), 8,09 (с, 1H), 7,58 (д, J=8,90 Гц, 1H), 7,44 (д, J=8,90 Гц, 1H), 7,19-7,35 (м, 5H), 7,13 (ддд, J=8,98, 6,67, 0,92 Гц, 1H), 6,80 (тд, J=6,75, 0,92 Гц, 1H), 5,32 (т, J=6,14 Гц, 1H), 4,12 (д, J=6,14 Гц, 2H). MS (ESI+) m/z 322,1 (M+H)+.The title compound was prepared according to the procedure described in Example 36B using 2-aminopyridine instead of 2-aminothiazole and benzyl isocyanide instead of cyclohexyl isocyanide. The final product precipitated from the solution with the formation of a precipitate, and it was isolated after filtration. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.04 (s, 1H), 8.49 (s, 1H), 8.16-8.27 (m, 2H), 8.09 (s, 1H), 7.58 (d, J = 8, 90 Hz, 1H), 7.44 (d, J = 8.90 Hz, 1H), 7.19-7.35 (m, 5H), 7.13 (ddd, J = 8.98, 6.67 , 0.92 Hz, 1H), 6.80 (td, J = 6.75, 0.92 Hz, 1H), 5.32 (t, J = 6.14 Hz, 1H), 4.12 (d , J = 6.14 Hz, 2H). MS (ESI +) m / z 322.1 (M + H) + .
Пример 57Example 57
N-(4-хлорфенил)-2-(1H-индазол-5-ил)имидазо[1,2-a]пиридин-3-аминN- (4-chlorophenyl) -2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 36B, с использованием 2-аминопиридина вместо 2-аминотиазола и 1-хлор-4-изоцианобензола вместо циклогексилизоцианида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,06 (с, 1H), 8,39 (с, 2H), 8,05-8,14 (м, 2H), 7,94 (д, J=6,75 Гц, 1H), 7,62 (д, J=8,90 Гц, 1H), 7,55 (д, J=8,59 Гц, 1H), 7,28-7,34 (м, 1H), 7,17 (д, J=8,90 Гц, 2H), 6,88-6,96 (м, J=6,75, 6,75 Гц, 1H), 6,53 (д, J=8,59 Гц, 2H). MS (ESI+) m/z 360,0 (M+H)+.The title compound was prepared according to the procedure described in Example 36B using 2-aminopyridine instead of 2-aminothiazole and 1-chloro-4-isocyanobenzene instead of cyclohexyl isocyanide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.06 (s, 1H), 8.39 (s, 2H), 8.05-8.14 (m, 2H), 7.94 (d, J = 6.75 Hz, 1H), 7.62 (d, J = 8.90 Hz, 1H), 7.55 (d, J = 8.59 Hz, 1H), 7.28-7.34 (m, 1H), 7.17 (d, J = 8.90 Hz, 2H), 6.88-6.96 (m, J = 6.75, 6.75 Hz, 1H), 6.53 (d, J = 8.59 Hz, 2H). MS (ESI +) m / z 360.0 (M + H) + .
Пример 58Example 58
2-(1H-индазол-5-ил)-N-(4-метоксифенил)имидазо[1,2-a]пиридин-3-амин2- (1H-indazol-5-yl) -N- (4-methoxyphenyl) imidazo [1,2-a] pyridin-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 36B, с использованием 2-аминопиридина вместо 2-аминотиазола и 1-изоциано-4-метоксибензола вместо циклогексилизоцианида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,04 (с, 1H), 8,44 (с, 1H), 8,14 (д, J=8,90, 1,23 Гц, 1H), 8,06 (с, 1H), 7,87-7,96 (м, 2H), 7,59 (д, J=8,90 Гц, 1H), 7,54 (д, J=8,59 Гц, 1H), 7,24-7,33 (м, 1H), 6,86-6,93 (м, J=6,75, 6,75 Гц, 1H), 6,75 (д, J=9,21 Гц, 2H), 6,47 (д, J=9,21 Гц, 2H), 3,63 (с, 3H). MS (ESI+) m/z 356,1 (M+H)+.The title compound was prepared according to the procedure described in Example 36B using 2-aminopyridine instead of 2-aminothiazole and 1-isocyano-4-methoxybenzene instead of cyclohexyl isocyanide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.04 (s, 1H), 8.44 (s, 1H), 8.14 (d, J = 8.90, 1.23 Hz, 1H), 8.06 (s, 1H), 7.87 -7.96 (m, 2H), 7.59 (d, J = 8.90 Hz, 1H), 7.54 (d, J = 8.59 Hz, 1H), 7.24-7.33 ( m, 1H), 6.86-6.93 (m, J = 6.75, 6.75 Hz, 1H), 6.75 (d, J = 9.21 Hz, 2H), 6.47 (d , J = 9.21 Hz, 2H); 3.63 (s, 3H). MS (ESI +) m / z 356.1 (M + H) + .
Пример 59Example 59
трет-бутил 4-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-имидазол-1-ил]пиперидин-1-карбоксилатtert-butyl 4- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] piperidine-1-carboxylate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием трет-бутил 4-аминопиперидин-1-карбоксилата вместо бензиламина. 1H ЯМР (400 МГц, ДМСО-d5) δ м.д. 13,32 (с, 1H), 8,14 (с, 1H), 8,01 (с, 1H), 7,79 (с, 1H), 7,68 (д, J=8,59 Гц, 2H), 7,24-7,39 (м, 2H), 6,97 (т, J=8,90 Гц, 2H), 3,91-4,05 (м, 2H), 3,71-3,84 (м, 1H), 2,53-2,69 (м, 2H), 1,76-1,94 (м, 4H), 1,35-1,40 (м, 9H). MS (DCI) m/z 462 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using tert-butyl 4-aminopiperidine-1-carboxylate instead of benzylamine. 1 H NMR (400 MHz, DMSO-d 5 ) δ ppm 13.32 (s, 1H), 8.14 (s, 1H), 8.01 (s, 1H), 7.79 (s, 1H), 7.68 (d, J = 8.59 Hz, 2H ), 7.24-7.39 (m, 2H), 6.97 (t, J = 8.90 Hz, 2H), 3.91-4.05 (m, 2H), 3.71-3, 84 (m, 1H), 2.53-2.69 (m, 2H), 1.76-1.94 (m, 4H), 1.35-1.40 (m, 9H). MS (DCI) m / z 462 (M + H) + .
Пример 60Example 60
3,5-бис(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол3,5-bis (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Пример 60AExample 60A
трет-Бутил 5-бром-3-иод-1H-индазол-1-карбоксилатtert-Butyl 5-bromo-3-iodo-1H-indazole-1-carboxylate
К раствору 5-броминдазола (10 г, 50,75 ммоль) в диметилформамиде (100 мл) добавляли KOH (10 г, 177,63 ммоль). В течение 2 часов добавляли иод (20 г, 78,80 ммоль). Смесь обрабатывали раствором Na2S2O3 (20 г) в воде (200 мл), экстрагировали этилацетатом, промывали насыщенным солевым раствором, сушили над сульфатом натрия и фильтровали и растворитель удаляли при пониженном давлении. Твердое вещество растворяли в дихлорметане (350 мл) и обрабатывали ди-трет-бутилдикарбонатом (14,4 г, 65,98 ммоль) и диметиламинопиридином (10 мг, 0,08 ммоль). Смесь перемешивали в течение 20 минут при комнатной температуре и пропускали непосредственно через слой силикагеля с получением указанного в заголовке соединения. MS (DCI/NH3) m/z 422,9 (M+H)+.To a solution of 5-bromoindazole (10 g, 50.75 mmol) in dimethylformamide (100 ml) was added KOH (10 g, 177.63 mmol). Iodine (20 g, 78.80 mmol) was added over 2 hours. The mixture was treated with a solution of Na 2 S 2 O 3 (20 g) in water (200 ml), extracted with ethyl acetate, washed with brine, dried over sodium sulfate and filtered and the solvent was removed under reduced pressure. The solid was dissolved in dichloromethane (350 ml) and treated with di-tert-butyl dicarbonate (14.4 g, 65.98 mmol) and dimethylaminopyridine (10 mg, 0.08 mmol). The mixture was stirred for 20 minutes at room temperature and passed directly through a layer of silica gel to give the title compound. MS (DCI / NH 3 ) m / z 422.9 (M + H) + .
Пример 60BExample 60B
трет-бутил 5-бром-3-фенил-1H-индазол-1-карбоксилат и трет-бутил 5-бром-3-иод-1H-индазол-1-карбоксилатtert-butyl 5-bromo-3-phenyl-1H-indazole-1-carboxylate and tert-butyl 5-bromo-3-iodo-1H-indazole-1-carboxylate
К раствору соединения Примера 60A (2,1 г, 5 ммоль) в толуоле (10 мл) добавляли Pd(PPh3)4 (173 мг, 0,15 ммоль), раствор Na2CO3 (1,1 г, 10 ммоль) в воде (5 мл) и раствор фенилбороновой кислоты (671 мг, 5,5 ммоль) в метаноле (3 мл). Смесь перемешивали при комнатной температуре в течение 5 дней, гасили водой, экстрагировали этилацетатом и очищали при помощи хроматографии на силикагеле, используя для элюирования смесь 5% этилацетата/гексан, с получением указанных в заголовке соединений в виде смеси. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,28 (д, J=1,53 Гц, 1H), 8,12 (д, J=8,85 Гц, 1H), 7,97-8,04 (м, 3H), 7,80-7,86 (м, 2H), 7,75 (д, J=1,83 Гц, 1H), 7,54-7,63 (м, 3H), 1,68 (с, 9H), 1,64 (с, 9H). MS (ESI+) m/z 373,9 (M+H)+.To a solution of the compound of Example 60A (2.1 g, 5 mmol) in toluene (10 ml) was added Pd (PPh 3 ) 4 (173 mg, 0.15 mmol), a solution of Na 2 CO 3 (1.1 g, 10 mmol ) in water (5 ml) and a solution of phenylboronic acid (671 mg, 5.5 mmol) in methanol (3 ml). The mixture was stirred at room temperature for 5 days, quenched with water, extracted with ethyl acetate and purified by silica gel chromatography using 5% ethyl acetate / hexane for elution to give the title compounds as a mixture. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 8.28 (d, J = 1.53 Hz, 1H), 8.12 (d, J = 8.85 Hz, 1H), 7.97-8.04 (m, 3H), 7.80-7 86 (m, 2H), 7.75 (d, J = 1.83 Hz, 1H), 7.54-7.63 (m, 3H), 1.68 (s, 9H), 1.64 ( s, 9H). MS (ESI +) m / z 373.9 (M + H) + .
Пример 60CExample 60C
трет-Бутил 3,5-бис((триметилсилил)этинил)-1H-индазол-1-карбоксилат и трет-бутил 5-бром-3-((триметилсилил)этинил)-1H-индазол-1-карбоксилатtert-Butyl 3,5-bis ((trimethylsilyl) ethynyl) -1H-indazole-1-carboxylate and tert-butyl 5-bromo-3 - ((trimethylsilyl) ethynyl) -1H-indazole-1-carboxylate
Соединение Примера 60B (1 г, 2,55 ммоль), дихлорбис(трифенилфосфин)палладий(II) (89 мг, 0,13 ммоль), триэтиламин (1,78 мл, 12,75 ммоль), триметилсилилацетилен (0,432 мл, 3,06 ммоль) и CuI (24 мг, 0,13 ммоль) объединяли в диметилформамиде (10 мл) и перемешивали при комнатной температуре в течение 20 часов. Смесь разбавляли этилацетатом, промывали водой и очищали при помощи хроматографии на силикагеле с получением указанных в заголовке соединений. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,10 (д, J=8,85 Гц, 1H), 8,07 (д, J=8,85 Гц, 1H), 7,97 (д, J=1,83 Гц, 1H), 7,84 (с, 1H), 7,82 (дд, J=8,85, 1,83 Гц, 1H), 7,71 (дд, J=8,54, 1,53 Гц, 1H), 1,65 (с, 18H), 0,33 (д, J=0,92 Гц, 18H).The compound of Example 60B (1 g, 2.55 mmol), dichlorobis (triphenylphosphine) palladium (II) (89 mg, 0.13 mmol), triethylamine (1.78 ml, 12.75 mmol), trimethylsilylacetylene (0.432 ml, 3 06 mmol) and CuI (24 mg, 0.13 mmol) were combined in dimethylformamide (10 ml) and stirred at room temperature for 20 hours. The mixture was diluted with ethyl acetate, washed with water and purified by silica gel chromatography to give the title compounds. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 8.10 (d, J = 8.85 Hz, 1H), 8.07 (d, J = 8.85 Hz, 1H), 7.97 (d, J = 1.83 Hz, 1H), 7, 84 (s, 1H), 7.82 (dd, J = 8.85, 1.83 Hz, 1H), 7.71 (dd, J = 8.54, 1.53 Hz, 1H), 1.65 (s, 18H), 0.33 (d, J = 0.92 Hz, 18H).
Пример 60DExample 60D
трет-бутил 3, 5-диэтинил-1H-индазол-1-карбоксилат и трет-бутил 5-бром-3-этинил-1H-индазол-1-карбоксилатtert-butyl 3, 5-diethynyl-1H-indazole-1-carboxylate and tert-butyl 5-bromo-3-ethynyl-1H-indazole-1-carboxylate
К раствору соединения Примера 60C (350 мг, 0,85 ммоль) в тетрагидрофуране (5 мл) добавляли раствор 1M TBAF в тетрагидрофуране (2 мл, 2 ммоль). Через 10 минут растворитель выпаривали при пониженном давлении и неочищенную смесь очищали при помощи хроматографии на силикагеле, элюируя смесью 5% этилацетата в гексане, с получением указанных в заголовке соединений. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,12 (д, J=7,93 Гц, 1H), 8,07 (д, J=8,85 Гц, 1H), 8,01 (д, J=1,53 Гц, 1H), 7,90 (с, 1H), 7,83 (дд, J=8,85, 1,83 Гц, 1H), 7,74 (дд, J=8,85, 1,53 Гц, 1H), 4,91 (с, 1H), 4,90 (с, 1H), 4,29 (с, 1H), 1,66 (с, 9H), 1,65 (с, 9H).To a solution of the compound of Example 60C (350 mg, 0.85 mmol) in tetrahydrofuran (5 ml) was added a solution of 1M TBAF in tetrahydrofuran (2 ml, 2 mmol). After 10 minutes, the solvent was evaporated under reduced pressure, and the crude mixture was purified by silica gel chromatography, eluting with 5% ethyl acetate in hexane, to give the title compounds. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 8.12 (d, J = 7.93 Hz, 1H), 8.07 (d, J = 8.85 Hz, 1H), 8.01 (d, J = 1.53 Hz, 1H), 7, 90 (s, 1H), 7.83 (dd, J = 8.85, 1.83 Hz, 1H), 7.74 (dd, J = 8.85, 1.53 Hz, 1H), 4.91 (s, 1H), 4.90 (s, 1H), 4.29 (s, 1H), 1.66 (s, 9H), 1.65 (s, 9H).
Пример 60EExample 60E
3,5-бис(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол3,5-bis (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 3D, с использованием соединения Примера 60D вместо соединения Примера 3C. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,35 (с, 1H), 8,76 (с, 1H), 8,71 (с, 1H), 8,70 (с, 1H), 7,92 (д, J=8,61, 1,28 Гц, 1H), 7,64 (д, J=8,79 Гц, 1H), 7,38-7,43 (м, 8H), 7,33-7,37 (м, 2H), 5,73 (с, 2H), 5,66 (с, 2H). MS (ESI+) m/z 433,2 (M+H)+.The title compound was prepared according to the procedure described in Example 3D using the compound of Example 60D instead of the compound of Example 3C. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.35 (s, 1H), 8.76 (s, 1H), 8.71 (s, 1H), 8.70 (s, 1H), 7.92 (d, J = 8.61, 1, 28 Hz, 1H), 7.64 (d, J = 8.79 Hz, 1H), 7.38-7.43 (m, 8H), 7.33-7.37 (m, 2H), 5, 73 (s, 2H); 5.66 (s, 2H). MS (ESI +) m / z 433.2 (M + H) + .
Пример 61Example 61
5-(1-бензил-1H-1,2,3-триазол-4-ил)-3-фенил-1H-индазол5- (1-benzyl-1H-1,2,3-triazol-4-yl) -3-phenyl-1H-indazole
Пример 61AExample 61A
трет-Бутил 3-фенил-5-((триметилсилил)этинил)-1H-индазол-1-карбоксилат и трет-бутил 5-бром-3-фенил-1H-индазол-1-карбоксилатtert-Butyl 3-phenyl-5 - ((trimethylsilyl) ethynyl) -1H-indazole-1-carboxylate and tert-butyl 5-bromo-3-phenyl-1H-indazole-1-carboxylate
Соединение Примера 60B (1 г, 2,55 ммоль), дихлорбис(трифенилфосфин)палладий(II) (89 мг, 0,13 ммоль), триэтиламин (1,78 мл, 12,75 ммоль), триметилсилилацетилен (0,432 мл, 3,06 ммоль) и CuI (24 мг, 0,13 ммоль) объединяли в диметилформамиде (10 мл) и перемешивали при комнатной температуре в течение 20 часов. Смесь разбавляли этилацетатом и очищали при помощи хроматографии на силикагеле с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,29 (д, J=1,53 Гц, 1H), 8,09-8,19 (м, 3H), 7,96-8,03 (м, 4H), 7,83 (дд, J=8,85, 1,83 Гц, 1H), 7,72 (дд, J=8,85, 1,53 Гц, 1H), 7,50-7,65 (м, 6H), 1,68 (с, 18H), 0,26-0,27 (м, 9H).The compound of Example 60B (1 g, 2.55 mmol), dichlorobis (triphenylphosphine) palladium (II) (89 mg, 0.13 mmol), triethylamine (1.78 ml, 12.75 mmol), trimethylsilylacetylene (0.432 ml, 3 06 mmol) and CuI (24 mg, 0.13 mmol) were combined in dimethylformamide (10 ml) and stirred at room temperature for 20 hours. The mixture was diluted with ethyl acetate and purified by silica gel chromatography to give the title compound. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 8.29 (d, J = 1.53 Hz, 1H), 8.09-8.19 (m, 3H), 7.96-8.03 (m, 4H), 7.83 (dd, J = 8.85, 1.83 Hz, 1H), 7.72 (dd, J = 8.85, 1.53 Hz, 1H), 7.50-7.65 (m, 6H), 1.68 (s , 18H); 0.26-0.27 (m, 9H).
Пример 61BExample 61B
трет-Бутил 5-этинил-3-фенил-1H-индазол-1-карбоксилат и трет-бутил 5-бром-3-фенил-1H-индазол-1-карбоксилатtert-Butyl 5-ethynyl-3-phenyl-1H-indazole-1-carboxylate and tert-butyl 5-bromo-3-phenyl-1H-indazole-1-carboxylate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 60D, с использованием соединения Примера 61A вместо соединения Примера 60C. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,28 (д, J=1,53 Гц, 1H), 8,21 (с, 1H), 8,16 (д, J=8,54 Гц, 1H), 8,12 (д, J=8,85 Гц, 1H), 7,97-8,05 (м, 4H), 7,83 (дд, J=8,85, 1,83 Гц, 1H), 7,75 (дд, J=8,85, 1,53 Гц, 1H), 7,53-7,64 (м, 6H), 4,27 (с, 1H), 1,68 (с, 9H), 1,68 (с, 9H).The title compound was prepared according to the procedure described in Example 60D using the compound of Example 61A instead of the compound of Example 60C. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 8.28 (d, J = 1.53 Hz, 1H), 8.21 (s, 1H), 8.16 (d, J = 8.54 Hz, 1H), 8.12 (d, J = 8 , 85 Hz, 1H), 7.97-8.05 (m, 4H), 7.83 (dd, J = 8.85, 1.83 Hz, 1H), 7.75 (dd, J = 8, 85, 1.53 Hz, 1H), 7.53-7.64 (m, 6H), 4.27 (s, 1H), 1.68 (s, 9H), 1.68 (s, 9H).
Пример 61CExample 61C
5-(1-бензил-1H-1,2,3-триазол-4-ил)-3-фенил-1H-индазол5- (1-benzyl-1H-1,2,3-triazol-4-yl) -3-phenyl-1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 3D, с использованием соединения Примера 61B вместо соединения Примера 3C. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,38 (с, 1H), 8,77 (с, 1H), 8,52 (с, 1H), 8,06 (д, J=7,33 Гц, 2H), 7,98 (д, J=8,79 Гц, 1H), 7,69 (д, J=8,79 Гц, 1H), 7,53-7,61 (м, J=7,51, 7,51 Гц, 2H), 7,33-7,48 (м, 6H), 5,68 (с, 2H). MS (ESI+) m/z 352,0 (M+H)+.The title compound was prepared according to the procedure described in Example 3D using the compound of Example 61B instead of the compound of Example 3C. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.38 (s, 1H), 8.77 (s, 1H), 8.52 (s, 1H), 8.06 (d, J = 7.33 Hz, 2H), 7.98 (d, J = 8.79 Hz, 1H), 7.69 (d, J = 8.79 Hz, 1H), 7.53-7.61 (m, J = 7.51, 7.51 Hz, 2H), 7 33-7.48 (m, 6H); 5.68 (s, 2H). MS (ESI +) m / z 352.0 (M + H) + .
Пример 62Example 62
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Пример 62AExample 62A
2-Фтор-5-((триметилсилил)этинил)бензонитрил2-Fluoro-5 - ((trimethylsilyl) ethynyl) benzonitrile
5-Бром-2-фторбензонитрил (5,01 г, 25,0 ммоль), дихлорбис(трифенилфосфин)палладий(II) (652 мг, 0,929 ммоль) и иодид меди(I) (413 мг, 2,17 ммоль) объединяли в триэтиламине (15 мл) в атмосфере азота. Добавляли триметилсилилацетилен (4,2 мл, 29,7 ммоль) и смесь нагревали до 100°C. Смесь отверждалась, и реакцию отслеживали методом ЖХ/МС. После завершения реакции смесь разбавляли метиленхлоридом и промывали 1 н раствором HCl. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, элюируя с использованием градиента этилацетата в гексане (5-45%), с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,09 (дд, J=6,10, 2,03 Гц, 1H), 7,77-7,97 (м, 1H), 7,54 (т, J=9,15 Гц, 1H), 0,15-0,32 (м, 9H).5-Bromo-2-fluorobenzonitrile (5.01 g, 25.0 mmol), dichlorobis (triphenylphosphine) palladium (II) (652 mg, 0.929 mmol) and copper (I) iodide (413 mg, 2.17 mmol) were combined in triethylamine (15 ml) under nitrogen. Trimethylsilylacetylene (4.2 ml, 29.7 mmol) was added and the mixture was heated to 100 ° C. The mixture was cured and the reaction was monitored by LC / MS. After completion of the reaction, the mixture was diluted with methylene chloride and washed with 1 N HCl. The organic layer was absorbed on silica gel and purified by silica gel chromatography eluting with a gradient of ethyl acetate in hexane (5-45%) to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.09 (dd, J = 6.10, 2.03 Hz, 1H), 7.77-7.97 (m, 1H), 7.54 (t, J = 9.15 Hz, 1H), 0 15-0.32 (m, 9H).
Пример 62BExample 62B
5-Этинил-2-фторбензонитрил5-Ethinyl-2-fluorobenzonitrile
Тетрабутиламмонийфторид (1,0 M раствор в тетрагидрофуране 70 мл) добавляли к раствору соединения Примера 62A (5,05 г, 23,2 ммоль) в тетрагидрофуране (50 мл) и оставляли для перемешивания в течение 20 минут. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, элюируя с использованием градиента 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,13 (дд, J=6,27, 2,20 Гц, 1H), 7,82-7,95 (м, 1H), 7,56 (т, J=8,99 Гц, 1H), 4,40 (с, 1H).Tetrabutylammonium fluoride (1.0 M solution in tetrahydrofuran 70 ml) was added to a solution of the compound of Example 62A (5.05 g, 23.2 mmol) in tetrahydrofuran (50 ml) and allowed to stir for 20 minutes. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography eluting with a gradient of 5-40% ethyl acetate in hexane to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.13 (dd, J = 6.27, 2.20 Hz, 1H), 7.82-7.95 (m, 1H), 7.56 (t, J = 8.99 Hz, 1H), 4 40 (s, 1H).
Пример 62CExample 62C
5-(1-Бензил-1H-1,2,3-триазол-4-ил)-2-фторбензонитрил5- (1-Benzyl-1H-1,2,3-triazol-4-yl) -2-fluorobenzonitrile
Соединение Примера 62B (1,68 г, 11,6 ммоль) растворяли в трет-бутаноле (14 мл). Добавляли бензилазид (2,14 г, 15,8 ммоль) и смесь переносили в 14 микроволновых сосудов (1,0 мл каждый). В каждый микроволновой сосуд добавляли воду (0,5 мл), небольшой кусок медной проволоки и 1 M раствор сульфата меди(II) (0,5 мл) и сосуды нагревали в микроволновом реакторе CEM-Discover при 125°C с использованием мощности 100 Ватт, в течение 10 минут каждый. Содержимое сосудов объединяли, разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Органическое вещество абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-50% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,73 (с, 1H), 8,33-8,44 (м, 1H), 8,19-8,32 (м, 1H), 7,56-7,70 (м, 1H), 7,28-7,47 (м, 5H), 5,68 (с, 2H).The compound of Example 62B (1.68 g, 11.6 mmol) was dissolved in tert-butanol (14 ml). Benzylazide (2.14 g, 15.8 mmol) was added and the mixture was transferred to 14 microwave vessels (1.0 ml each). Water (0.5 ml), a small piece of copper wire and 1 M copper (II) sulfate solution (0.5 ml) were added to each microwave vessel and the vessels were heated in a CEM-Discover microwave reactor at 125 ° C using a power of 100 watts for 10 minutes each. The contents of the vessels were combined, diluted with ethyl acetate and washed with water and brine. The organic material was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-50% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.73 (s, 1H), 8.33-8.44 (m, 1H), 8.19-8.32 (m, 1H), 7.56-7.70 (m, 1H), 7, 28-7.47 (m, 5H); 5.68 (s, 2H).
Пример 62DExample 62D
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Гидразингидрат (18 мл) добавляли к соединению Примера 62C (1,93 г, 6,94 ммоль) в этаноле (10 мл). Смесь нагревали до 95°C в течение ночи. Смесь разбавляли этилацетатом и промывали водой. Некоторое количество продукта осаждалось в делительной воронке, и его фильтровали с получением указанного в заголовке соединения. Этилацетатный слой концентрировали при пониженном давлении и полученное твердое вещество растирали в порошок с метанолом с получением дополнительного количества указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,43 (с, 1H), 8,42 (с, 1H), 8,21 (с, 1H), 7,67 (д, J=8,82, 1,70 Гц, 1H), 7,38 (с, 5H), 7,26 (д, J=8,48 Гц, 1H), 5,64 (с, 2H), 5,38 (с, 2H). MS (ESI+) m/z 291,0 (M+H)+.Hydrazine hydrate (18 ml) was added to the compound of Example 62C (1.93 g, 6.94 mmol) in ethanol (10 ml). The mixture was heated to 95 ° C. overnight. The mixture was diluted with ethyl acetate and washed with water. A certain amount of product precipitated in a separatory funnel and was filtered to obtain the title compound. The ethyl acetate layer was concentrated under reduced pressure, and the resulting solid was triturated with methanol to give an additional amount of the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.43 (s, 1H), 8.42 (s, 1H), 8.21 (s, 1H), 7.67 (d, J = 8.82, 1.70 Hz, 1H), 7.38 (s, 5H), 7.26 (d, J = 8.48 Hz, 1H), 5.64 (s, 2H), 5.38 (s, 2H). MS (ESI +) m / z 291.0 (M + H) + .
Пример 63Example 63
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1-[(1-метилпиперидин-4-ил)карбонил]-1H-индазол-3-амин5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1 - [(1-methylpiperidin-4-yl) carbonyl] -1H-indazol-3-amine
Соединение Примера 62D (44 мг, 0,152 ммоль), гидрохлорид 1-метилпиперидин-4-карбоновой кислоты (27 мг, 0,150 ммоль) и HATU (61 мг, 0,160 ммоль) объединяли в тетрагидрофуране (2 мл). добавляли диизопропилэтиламин (110 мл, 0,631 ммоль) и смесь нагревали до 90°C в течение 30 минут. Смесь разбавляли метиленхлоридом и промывали 1 н раствором гидроксида натрия. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-15% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,58 (с, 1H), 8,47 (с, 1H), 8,26 (д, J=8,48 Гц, 1H), 7,97 (д, J=8,48, 1,70 Гц, 1H), 7,38 (с, 5H), 6,58 (с, 2H), 5,67 (с, 2H), 3,35-3,47 (м, 1H), 2,95 (д, J=1 1,19 Гц, 2H), 2,28 (с, 3H), 2,03-2,20 (м, 2H), 1,92 (с, 2H), 1,77 (с, 2H). MS (ESI+) m/z 416,2 (M+H)+.The compound of Example 62D (44 mg, 0.152 mmol), 1-methylpiperidin-4-carboxylic acid hydrochloride (27 mg, 0.150 mmol) and HATU (61 mg, 0.160 mmol) were combined in tetrahydrofuran (2 ml). diisopropylethylamine (110 ml, 0.631 mmol) was added and the mixture was heated to 90 ° C for 30 minutes. The mixture was diluted with methylene chloride and washed with 1 N sodium hydroxide solution. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-15% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.58 (s, 1H), 8.47 (s, 1H), 8.26 (d, J = 8.48 Hz, 1H), 7.97 (d, J = 8.48, 1.70 Hz , 1H), 7.38 (s, 5H), 6.58 (s, 2H), 5.67 (s, 2H), 3.35-3.47 (m, 1H), 2.95 (d, J = 1.19 Hz, 2H), 2.28 (s, 3H), 2.03-2.20 (m, 2H), 1.92 (s, 2H), 1.77 (s, 2H) . MS (ESI +) m / z 416.2 (M + H) + .
Пример 64Example 64
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-метоксиацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-methoxyacetamide
Пример 64AExample 64A
трет-Бутил 3-амино-5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-карбоксилатtert-Butyl 3-amino-5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole-1-carboxylate
Соединение Примера 62D (1,80 г, 6,20 ммоль) суспендировали в метиленхлориде (100 мл) с каталитическим количеством диметиламинопиридина. Добавляли раствор ди-трет-бутилдикарбоната (1,36 г, 6,23 ммоль) в метиленхлориде (50 мл) по каплям в течение 1 часа. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. MS (ESI+) m/z 391,1 (M+H)+.The compound of Example 62D (1.80 g, 6.20 mmol) was suspended in methylene chloride (100 ml) with a catalytic amount of dimethylaminopyridine. A solution of di-tert-butyl dicarbonate (1.36 g, 6.23 mmol) in methylene chloride (50 ml) was added dropwise over 1 hour. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. MS (ESI +) m / z 391.1 (M + H) + .
Пример 64BExample 64B
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-метоксиацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-methoxyacetamide
Соединение Примера 64A (45 мг, 0,115 ммоль) растворяли в метиленхлориде (1,5 мл) и пиридине (0,5 мл). Добавляли метоксиацетилхлорид (18 мкл, 0,197 ммоль) и смесь перемешивали при температуре окружающей среды в течение 2 часов. Растворители удаляли с использованием теплого потока азота, смесь вводили в колонку с силикагелем и продукт очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением трет-бутил 5-(1-бензил-1H-1,2,3-триазол-4-ил)-3-(2-метоксиацетамидо)-1H-индазол-1-карбоксилата (58 мг). Промежутотчное соединение растворяли в метиленхлориде (2 мл) и трифторуксусной кислоте (1 мл) и перемешивали при температуре окружающей среды в течение ночи. Растворители удаляли при пониженном давлении и смесь очищали при помощи препаративной ВЭЖХ на колонке C8, с использованием градиента от 10% до 100% ацетонитрила/вода, содержащая 0,1% трифторуксусной кислоты, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,79 (с, 1H), 10,16 (с, 1H), 8,59 (с, 1H), 8,20 (с, 1H), 7,83 (д, J=8,65, 1,53 Гц, 1H), 7,51 (д, J=8,82 Гц, 1H), 7,37 (с, 5H), 5,64 (с, 2H), 4,12 (с, 2H), 3,42 (с, 3H). MS (ESI+) m/z 363,0 (M+H)+.The compound of Example 64A (45 mg, 0.115 mmol) was dissolved in methylene chloride (1.5 ml) and pyridine (0.5 ml). Methoxyacetyl chloride (18 μl, 0.197 mmol) was added and the mixture was stirred at ambient temperature for 2 hours. The solvents were removed using a warm nitrogen stream, the mixture was introduced into a column of silica gel, and the product was purified by chromatography on silica gel using a gradient of 0-5% methanol in dichloromethane to elute to give tert-butyl 5- (1-benzyl-1H-1 , 2,3-triazol-4-yl) -3- (2-methoxyacetamido) -1H-indazole-1-carboxylate (58 mg). The intermediate compound was dissolved in methylene chloride (2 ml) and trifluoroacetic acid (1 ml) and stirred at ambient temperature overnight. The solvents were removed under reduced pressure and the mixture was purified by preparative HPLC on a C8 column using a gradient of 10% to 100% acetonitrile / water containing 0.1% trifluoroacetic acid to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.79 (s, 1H), 10.16 (s, 1H), 8.59 (s, 1H), 8.20 (s, 1H), 7.83 (d, J = 8.65, 1, 53 Hz, 1H), 7.51 (d, J = 8.82 Hz, 1H), 7.37 (s, 5H), 5.64 (s, 2H), 4.12 (s, 2H), 3 42 (s, 3H). MS (ESI +) m / z 363.0 (M + H) + .
Пример 65Example 65
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Соединение Примера 64A (81 мг, 0,207 ммоль) растворяли в метиленхлориде (2 мл) и пиридине (0,5 мл). Добавляли гидрохлорид диметиламиноацетилхлорида, 80% (120 мг, 0,607 ммоль) тремя порциями в течение 2 часов и смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли трифторуксусную кислоту (2 мл) и смесь перемешивали в течение 3 часов. Смесь разбавляли метиленхлоридом и промывали 1 н раствором гидроксида натрия. Органический слой абсорбировали на силикагеле и очищали с использованием хроматографии на силикагеле, используя для элюирования градиент 5-15% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,77 (с, 1H), 10,05 (с, 1H), 8,58 (с, 1H), 8,24 (с, 1H), 7,82 (д, J=8,65, 1,53 Гц, 1H), 7,50 (д, J=8,82 Гц, 1H), 7,30-7,44 (м, 5H), 5,64 (с, 2H), 3,16-3,20 (м, 2H), 2,34 (с, 6H). MS (ESI+) m/z 376,1 (M+H)+.The compound of Example 64A (81 mg, 0.207 mmol) was dissolved in methylene chloride (2 ml) and pyridine (0.5 ml). Dimethylaminoacetyl chloride hydrochloride, 80% (120 mg, 0.607 mmol) was added in three portions over 2 hours and the mixture was stirred at ambient temperature overnight. Trifluoroacetic acid (2 ml) was added and the mixture was stirred for 3 hours. The mixture was diluted with methylene chloride and washed with 1 N sodium hydroxide solution. The organic layer was absorbed on silica gel and purified using silica gel chromatography using a gradient of 5-15% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.77 (s, 1H), 10.05 (s, 1H), 8.58 (s, 1H), 8.24 (s, 1H), 7.82 (d, J = 8.65, 1, 53 Hz, 1H), 7.50 (d, J = 8.82 Hz, 1H), 7.30-7.44 (m, 5H), 5.64 (s, 2H), 3.16-3, 20 (m, 2H); 2.34 (s, 6H). MS (ESI +) m / z 376.1 (M + H) + .
Пример 66Example 66
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бутанамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] butanamide
Соединение Примера 64A (76 мг, 0,195 ммоль) растворяли в метиленхлориде (2 мл) и пиридине (0,2 мл). Добавляли бутирилхлорид (26 мкл, 0,250 ммоль) и смесь перемешивали при температуре окружающей среды в течение 2 часов. Добавляли трифторуксусную кислоту (1 мл) и смесь перемешивали в течение 3 часов. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали с использованием хроматографии на силикагеле, используя для элюирования градиент 1-8% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,70 (с, 1H), 10,30 (с, 1H), 8,57 (с, 1H), 8,23 (с, 1H), 7,81 (д, J=8,82 Гц, 1H), 7,49 (д, J=8,82 Гц, 1H), 7,37 (с, 5H), 5,64 (с, 2H), 2,39 (т, J=7,29 Гц, 2H), 1,67 (с, 2H), 0,97 (т, J=7,46 Гц, 3H). MS (ESI+) m/z 361,1 (M+H)+.The compound of Example 64A (76 mg, 0.195 mmol) was dissolved in methylene chloride (2 ml) and pyridine (0.2 ml). Butyryl chloride (26 μl, 0.250 mmol) was added and the mixture was stirred at ambient temperature for 2 hours. Trifluoroacetic acid (1 ml) was added and the mixture was stirred for 3 hours. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified using silica gel chromatography using a gradient of 1-8% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.70 (s, 1H), 10.30 (s, 1H), 8.57 (s, 1H), 8.23 (s, 1H), 7.81 (d, J = 8.82 Hz, 1H ), 7.49 (d, J = 8.82 Hz, 1H), 7.37 (s, 5H), 5.64 (s, 2H), 2.39 (t, J = 7.29 Hz, 2H ), 1.67 (s, 2H), 0.97 (t, J = 7.46 Hz, 3H). MS (ESI +) m / z 361.1 (M + H) + .
Пример 67Example 67
5-[4-(4-фторфенил)-1-пиперидин-4-ил-1H-индазол-5-ил]-1H-индазол5- [4- (4-fluorophenyl) -1-piperidin-4-yl-1H-indazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием пиперидин-4-амина вместо бензиламина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,28 (с, 1H), 8,14 (с, 1H), 7,94 (с, 1H), 7,78 (с, 1H), 7,63-7,72 (м, 2H), 7,21-7,43 (м, 2H), 6,90-7,04 (м, 2H), 4,14 (д, J=5,59, 1,86 Гц, 1H), 3,53-3,74 (м, J=5,76 Гц, 1H), 2,94 (д, J=12,21 Гц, 2H), 2,21-2,35 (м, 2H), 1,74-1,88 (м, 3H). MS (DCI) m/z 362 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using piperidin-4-amine instead of benzylamine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.28 (s, 1H), 8.14 (s, 1H), 7.94 (s, 1H), 7.78 (s, 1H), 7.63-7.72 (m, 2H), 7 21-7.43 (m, 2H), 6.90-7.04 (m, 2H), 4.14 (d, J = 5.59, 1.86 Hz, 1H), 3.53-3 74 (m, J = 5.76 Hz, 1H), 2.94 (d, J = 12.21 Hz, 2H), 2.21-2.35 (m, 2H), 1.74-1, 88 (m, 3H). MS (DCI) m / z 362 (M + H) + .
Пример 68Example 68
5-{4-(4-фторфенил)-1-[2-(1-метилпирролидин-2-ил)этил]-1H-индазол-5-ил}-1H-индазол5- {4- (4-fluorophenyl) -1- [2- (1-methylpyrrolidin-2-yl) ethyl] -1H-indazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 2-(1-метилпирролидин-2-ил)этанамина вместо бензиламина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,30 (с, 1H), 8,14 (с, 1H), 7,86 (с, 1H), 7,82 (с, 1H), 7,68 (д, J=8,48 Гц, 1H), 7,24-7,47 (м, 3H), 6,92-7,08 (м, 2H), 3,83 (т, J=7,80 Гц, 2H), 2,71-2,93 (м, 1H), 1,88-2,01 (м, 3H), 1,74-1,88 (м, 1H), 1,00-1,83 (м, 7H). MS (DCI) m/z 390 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 2- (1-methylpyrrolidin-2-yl) ethanamine instead of benzylamine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.30 (s, 1H), 8.14 (s, 1H), 7.86 (s, 1H), 7.82 (s, 1H), 7.68 (d, J = 8.48 Hz, 1H ), 7.24-7.47 (m, 3H), 6.92-7.08 (m, 2H), 3.83 (t, J = 7.80 Hz, 2H), 2.71-2, 93 (m, 1H), 1.88-2.01 (m, 3H), 1.74-1.88 (m, 1H), 1.00-1.83 (m, 7H). MS (DCI) m / z 390 (M + H) + .
Пример 69Example 69
5-{4-(4-фторфенил)-1-[3-(4-метилпиперазин-1-ил)пропил]-1H-имидазол-5-ил}-1H-индазол5- {4- (4-fluorophenyl) -1- [3- (4-methylpiperazin-1-yl) propyl] -1H-imidazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 3-(4-метилпиперазин-1-ил)пропан-1-амина вместо бензиламина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,13 (с, 1H), 7,81 (с, 2H), 7,67 (д, J=8,48 Гц, 1H), 7,32-7,45 (м, 2H), 7,27 (д, J=8,48, 1,36 Гц, 1H), 6,87-7,06 (м, 2H), 3,72-3,91 (м, 2H), 1,92-2,21 (м, 10H), 1,91-2,20 (с, 3H), 1,51-1,66 (м, 2H). MS (ESI+) m/z 419 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 3- (4-methylpiperazin-1-yl) propan-1-amine instead of benzylamine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.13 (s, 1H), 7.81 (s, 2H), 7.67 (d, J = 8.48 Hz, 1H), 7.32-7.45 (m, 2H), 7.27 (d, J = 8.48, 1.36 Hz, 1H), 6.87-7.06 (m, 2H), 3.72-3.91 (m, 2H ), 1.92-2.21 (m, 10H), 1.91-2.20 (s, 3H), 1.51-1.66 (m, 2H). MS (ESI +) m / z 419 (M + H) + .
Пример 70Example 70
этил 5-(1H-индазол-5-ил)изоксазол-3-карбоксилатethyl 5- (1H-indazol-5-yl) isoxazole-3-carboxylate
Соединение Примера 3C (1,83 г, 12,9 ммоль) растворяли в толуоле (60 мл) и триэтиламине (2,2 мл) и нагревали до 90°C. Этил 2-хлор-2-(гидроксиимино)ацетат (1,89 г, 12,5 ммоль) растворяли в толуоле (15 мл) и добавляли по каплям в течение 30 минут. После добавления смесь разбавляли этилацетатом и промывали 1 н раствором хлористоводородной кислоты. Органический слой концентрировали при пониженном давлении и полученный остаток растирали в порошок с метанолом с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,38 (с, 1H), 8,43 (с, 1H), 8,23 (с, 1H), 7,92 (д, J=8,82, 1,36 Гц, 1H), 7,70 (д, J=8,82 Гц, 1H), 7,44 (с, 1H), 4,41 (кв., J=7,12 Гц, 2H), 1,35 (т, J=7,12 Гц, 3H). MS (ESI+) m/z 257,9 (M+H)+.The compound of Example 3C (1.83 g, 12.9 mmol) was dissolved in toluene (60 ml) and triethylamine (2.2 ml) and heated to 90 ° C. Ethyl 2-chloro-2- (hydroxyimino) acetate (1.89 g, 12.5 mmol) was dissolved in toluene (15 ml) and added dropwise over 30 minutes. After addition, the mixture was diluted with ethyl acetate and washed with 1 N hydrochloric acid. The organic layer was concentrated under reduced pressure, and the resulting residue was triturated with methanol to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.38 (s, 1H), 8.43 (s, 1H), 8.23 (s, 1H), 7.92 (d, J = 8.82, 1.36 Hz, 1H), 7.70 (d, J = 8.82 Hz, 1H), 7.44 (s, 1H), 4.41 (q, J = 7.12 Hz, 2H), 1.35 (t, J = 7.12 Hz, 3H). MS (ESI +) m / z 257.9 (M + H) + .
Пример 71Example 71
5-(1H-индазол-5-ил)-N-метилизоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N-methylisoxazole-3-carboxamide
Пример 71 AExample 71 A
5-(1H-индазол-5-ил)изоксазол-3-карбоновая кислота5- (1H-indazol-5-yl) isoxazole-3-carboxylic acid
Соединение Примера 70 (1,50 г, 5,83 ммоль) растворяли в тетрагидрофуране (100 мл), метанол (10 мл) и воде (10 мл). Добавляли гидроксид калия (680 мг, 12,1 ммоль) и смесь перемешивали при температуре окружающей среды в течение 2 часов. Растворители удаляли при пониженном давлении и полученный остаток растирали в порошок со смесью 1 н хлористоводородной кислоты и метанола с получением твердого вещества, которое фильтровали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-dd) δ м.д. 13,37 (с, 1H), 8,39 (с, 1H), 8,22 (с, 1H), 7,90 (дд, J=8,81, 1,36 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,30 (с, 1H).The compound of Example 70 (1.50 g, 5.83 mmol) was dissolved in tetrahydrofuran (100 ml), methanol (10 ml) and water (10 ml). Potassium hydroxide (680 mg, 12.1 mmol) was added and the mixture was stirred at ambient temperature for 2 hours. The solvents were removed under reduced pressure, and the resulting residue was triturated with a mixture of 1 n hydrochloric acid and methanol to give a solid, which was filtered to obtain the title compound. 1 H NMR (300 MHz, DMSO-d d ) δ ppm 13.37 (s, 1H), 8.39 (s, 1H), 8.22 (s, 1H), 7.90 (dd, J = 8.81, 1.36 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H); 7.30 (s, 1H).
Пример 71BExample 71B
5-(1H-индазол-5-ил)-N-метилизоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N-methylisoxazole-3-carboxamide
Соединение Примера 71A (46 мг, 0,201 ммоль), HATU (88 мг, 0,231 ммоль) и диизопропилэтиламин (133 мкл, 0,764 ммоль) объединяли в тетрагидрофуране (2 мл). Добавляли монометиламин (40% раствор в воде) (50 мкл) и реакционную смесь перемешивали при 50°C в течение 2 часов. Смесь разбавляли метиленхлоридом и промывали 1 н раствором гидроксида натрия, 1 н раствором хлористоводородной кислоты и насыщенным солевым раствором. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,72 (кв., J=4,30 Гц, 1H), 8,39 (с, 1H), 8,23 (с, 1H), 7,89 (д, J=8,65, 1,53 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,28 (с, 1H), 2,80 (д, J=4,75 Гц, 3H). MS (ESI+) m/z 243,0 (M+H)+.The compound of Example 71A (46 mg, 0.21 mmol), HATU (88 mg, 0.231 mmol) and diisopropylethylamine (133 μl, 0.764 mmol) were combined in tetrahydrofuran (2 ml). Monomethylamine (40% solution in water) (50 μl) was added and the reaction mixture was stirred at 50 ° C for 2 hours. The mixture was diluted with methylene chloride and washed with 1 N sodium hydroxide solution, 1 N hydrochloric acid solution and saturated saline. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.72 (q, J = 4.30 Hz, 1H), 8.39 (s, 1H), 8.23 (s, 1H), 7.89 (d, J = 8.65, 1.53 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H), 7.28 (s, 1H), 2.80 (d, J = 4.75 Hz, 3H). MS (ESI +) m / z 243.0 (M + H) + .
Пример 72Example 72
5-(3-бензилизоксазол-5-ил)-1H-индазол5- (3-benzylisoxazol-5-yl) -1H-indazole
Фенилацетальдегид (90+ %) (266 мг, 2,38 ммоль) растворяли в трет-бутаноле (1 мл) и воде (1 мл). Добавляли гидроксиламингидрохлорид (79 мг, 1,14 ммоль) с последующим добавлением 6 н раствора гидроксида натрия (19 мкл, 31,7 ммоль). Смесь перемешивали в течение 30 минут. Медленно добавляли хлорамин-T тригидрат (308 мг, 1,09 ммоль) в течение 5 минут, с последующим добавлением сульфата меди (II) и небольшого куска медной проволоки. Добавляли соединение Примера 3C (154 мг, 1,08 ммоль) и смесь перемешивали при 50°C в течение 2 часов, затем при температуре окруающей среды в течение ночи. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,31 (с, 1H), 8,28 (с, 1H), 8,18 (с, 1H), 7,79 (дд, J=8,65, 1,53 Гц, 1H), 7,64 (д, J=8,81 Гц, 1H), 7,13-7,46 (м, 5H), 6,83 (с, 1H), 4,04 (с, 2H). MS (ESI+) m/z 275,7 (M+H)+.Phenylacetaldehyde (90+%) (266 mg, 2.38 mmol) was dissolved in tert-butanol (1 ml) and water (1 ml). Hydroxylamine hydrochloride (79 mg, 1.14 mmol) was added, followed by 6 N sodium hydroxide solution (19 μl, 31.7 mmol). The mixture was stirred for 30 minutes. Chloramine-T trihydrate (308 mg, 1.09 mmol) was slowly added over 5 minutes, followed by the addition of copper (II) sulfate and a small piece of copper wire. The compound of Example 3C (154 mg, 1.08 mmol) was added and the mixture was stirred at 50 ° C for 2 hours, then at ambient temperature overnight. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.31 (s, 1H), 8.28 (s, 1H), 8.18 (s, 1H), 7.79 (dd, J = 8.65, 1.53 Hz, 1H), 7.64 (d, J = 8.81 Hz, 1H), 7.13-7.46 (m, 5H), 6.83 (s, 1H), 4.04 (s, 2H). MS (ESI +) m / z 275.7 (M + H) + .
Пример 73Example 73
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide
Соединение Примера 64A (72 мг, 0,184 ммоль) растворяли в метиленхлориде (2 мл) и пиридине (0,2 мл). Добавляли бензоилхлорид (36 мкл, 0,310 ммоль) и смесь перемешивали при температуре окружающей среды в течение 2 часов. Добавляли трифторуксусную кислоту (1 мл) и смесь перемешивали в течение 3 часов. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали хроматографией на силикагеле, используя для элюирования градиент 1-8% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,88 (с, 1H), 10,81 (с, 1H), 8,63 (с, 1H), 8,16 (с, 1H), 8,06-8,13 (м, 2H), 7,88 (д, J=8,82, 1,36 Гц, 1H), 7,59-7,64 (м, J=7,12 Гц, 1H), 7,51-7,59 (м, 3H), 7,31-7,42 (м, 5H), 5,63 (с, 2H). MS (ESI+) m/z 395,1 (M+H)+.The compound of Example 64A (72 mg, 0.184 mmol) was dissolved in methylene chloride (2 ml) and pyridine (0.2 ml). Benzoyl chloride (36 μl, 0.310 mmol) was added and the mixture was stirred at ambient temperature for 2 hours. Trifluoroacetic acid (1 ml) was added and the mixture was stirred for 3 hours. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 1-8% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.88 (s, 1H), 10.81 (s, 1H), 8.63 (s, 1H), 8.16 (s, 1H), 8.06-8.13 (m, 2H), 7 88 (d, J = 8.82, 1.36 Hz, 1H), 7.59-7.64 (m, J = 7.12 Hz, 1H), 7.51-7.59 (m, 3H ), 7.31-7.42 (m, 5H), 5.63 (s, 2H). MS (ESI +) m / z 395.1 (M + H) + .
Пример 74Example 74
5-(3-пропилизоксазол-5-ил)-1H-индазол5- (3-propylisoxazol-5-yl) -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 72, с использованием бутральдегида вместо фенилацетальдегида. 1H ЯМР (300 МГц, ДМСО-d<j) δ м.д. 13,31 (с, 1H), 8,28 (с, 1H), 8,20 (с, 1H), 7,76-7,85 (м, 1H), 7,63-7,70 (м, 1H), 6,88 (с, 1H), 2,63 (т, J=7,46 Гц, 2H), 1,61-1,79 (м, 2H), 0,96 (т, J=7,29 Гц, 3H). MS (ESI+) m/z 228,0 (M+H)+.The title compound was prepared according to the procedure described in Example 72 using butraldehyde instead of phenylacetaldehyde. 1 H NMR (300 MHz, DMSO-d < j) δ ppm 13.31 (s, 1H), 8.28 (s, 1H), 8.20 (s, 1H), 7.76-7.85 (m, 1H), 7.63-7.70 (m, 1H), 6.88 (s, 1H), 2.63 (t, J = 7.46 Hz, 2H), 1.61-1.79 (m, 2H), 0.96 (t, J = 7 , 29 Hz, 3H). MS (ESI +) m / z 228.0 (M + H) + .
Пример 75Example 75
N-бензил-4-(1H-индазол-5-ил)-5-фенил-1,3-тиазол-2-аминN-benzyl-4- (1H-indazol-5-yl) -5-phenyl-1,3-thiazol-2-amine
Пример 75AExample 75A
1H-индазол-5-карбоновая кислота1H-indazole-5-carboxylic acid
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 3A, с использованием метил 4-амино-3-метилбензоата вместо 4-иод-2-метиланилина. В процессе конечной обработки добавление 6 н раствора HCl до достижения pH 6 приводило к образованию твердого вещества, которое фильтровали, промывали два раза водой и сушили в вакууме с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,32 (с, 1H), 12,83 (с, 1H), 8,46 (с, 1H), 8,24 (с, 1H), 7,92 (дд, J=8,82, 1,70 Гц, 1H), 7,60 (д, J=8,82 Гц, 1H).The title compound was prepared according to the procedure described in Example 3A using methyl 4-amino-3-methylbenzoate instead of 4-iodo-2-methylaniline. During the final treatment, the addition of a 6 N HCl solution until a pH of 6 was reached, and a solid formed, which was filtered, washed twice with water and dried in vacuo to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.32 (s, 1H), 12.83 (s, 1H), 8.46 (s, 1H), 8.24 (s, 1H), 7.92 (dd, J = 8.82, 1, 70 Hz, 1H); 7.60 (d, J = 8.82 Hz, 1H).
Пример 75BExample 75B
N-Метокси-N-метил-1H-индазол-5-карбоксамидN-Methoxy-N-methyl-1H-indazole-5-carboxamide
К суспензии соединения Примера 75A (1,6 г, 10 ммоль) и N,O-диметилгидроксиламина (1,1 г, 11 ммоль) в дихлорметане (40 мл) и диметилформамиде (10 мл) добавляли триэтиламин (1,67 мл, 12 ммоль) и EDC (2,1 г, 11 ммоль) и смесь перемешивали при комнатной температуре в течение 24 часов. Растворители выпаривали при пониженном давлении и полученный остаток разбавляли этилацетатом и промывали водой. Органический слой сушили над сульфатом натрия и очищали при помощи колоночной хроматографии на силикагеле в этилацетате с получением указанного в заголовке соединения. MS (ESI+) m/z 206,0 (M+H)+.To a suspension of the compound of Example 75A (1.6 g, 10 mmol) and N, O-dimethylhydroxylamine (1.1 g, 11 mmol) in dichloromethane (40 ml) and dimethylformamide (10 ml) was added triethylamine (1.67 ml, 12 mmol) and EDC (2.1 g, 11 mmol) and the mixture was stirred at room temperature for 24 hours. The solvents were evaporated under reduced pressure, and the resulting residue was diluted with ethyl acetate and washed with water. The organic layer was dried over sodium sulfate and purified by silica gel column chromatography in ethyl acetate to obtain the title compound. MS (ESI +) m / z 206.0 (M + H) + .
Пример 75CExample 75C
1-(1H-индазол-5-ил)-2-фенилэтанон1- (1H-indazol-5-yl) -2-phenylethanone
Раствор соединения Примера 75B (900 мг, 4,39 ммоль) в тетрагидрофуране (10 мл) охлаждали в атмосфере аргона с использованием ледяной бани и обрабатывали при помощи 2M раствора бензилмагнийхлорида в тетрагидрофуране (6,6 мл, 13,16 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре с последующим добавлением еще одного эквивалента бензилмагнийхлорида. Смесь нагревали при 70°C в течение 9 часов. Добавляли еще один эквивалент бензилмагнийхлорида и реакционную смесь нагревали при 70°C еще в течение 90 минут и давали охладиться до комнатной температуры. Добавляли насыщенный водный раствор хлорида аммония и продукт экстрагировали этилацетатом и очищали при помощи колоночной хроматографии на силикагеле, с использованием 30% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 237,1 (M+H)+.A solution of the compound of Example 75B (900 mg, 4.39 mmol) in tetrahydrofuran (10 ml) was cooled under argon using an ice bath and treated with a 2M solution of benzyl magnesium chloride in tetrahydrofuran (6.6 ml, 13.16 mmol). The reaction mixture was stirred overnight at room temperature, followed by the addition of another equivalent of benzyl magnesium chloride. The mixture was heated at 70 ° C for 9 hours. Another equivalent of benzyl magnesium chloride was added and the reaction mixture was heated at 70 ° C for another 90 minutes and allowed to cool to room temperature. A saturated aqueous solution of ammonium chloride was added and the product was extracted with ethyl acetate and purified by silica gel column chromatography using 30% ethyl acetate in hexane to give the title compound. MS (ESI +) m / z 237.1 (M + H) + .
Пример 75DExample 75D
трет-Бутил 5-(2-фенилацетил)-1H-индазол-1-карбоксилатtert-Butyl 5- (2-phenylacetyl) -1H-indazole-1-carboxylate
К суспензии соединения Примера 75C (236 мг, 1 ммоль) в дихлорметане (2 мл) добавляли ди-трет-бутилдикарбонат (327 мг, 1,5 ммоль) и щепотку диметиламинопиридина (~2 мг). Смесь перемешивали в течение 15 минут и пропускали через слой силикагеля и элюировали дихлорметаном. Растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения. MS (ESI+) m/z 337,0 (M+H)+.To a suspension of the compound of Example 75C (236 mg, 1 mmol) in dichloromethane (2 ml) was added di-tert-butyl dicarbonate (327 mg, 1.5 mmol) and a pinch of dimethylaminopyridine (~ 2 mg). The mixture was stirred for 15 minutes and passed through a pad of silica gel and eluted with dichloromethane. The solvent was evaporated under reduced pressure to obtain the title compound. MS (ESI +) m / z 337.0 (M + H) + .
Пример 75EExample 75E
2-Бром-1-(1H-индазол-5-ил)-2-фенилэтанон2-Bromo-1- (1H-indazol-5-yl) -2-phenylethanone
К раствору соединения Примера 75D (336 мг, 1 ммоль) в тетрагидрофуране (20 мл), нагреваемому при 40°C на масляной бане, добавляли по каплям через капельную воронку раствор трибромида пиридиния (352 мг, 1,1 ммоль) в тетрагидрофуране (20 мл) в течение 10 минут. Реакционную смесь нагревали еще в течение 2 часов и затем охлаждали, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения. MS (ESI-) m/z 212,9 (M-H)".To a solution of the compound of Example 75D (336 mg, 1 mmol) in tetrahydrofuran (20 ml), heated at 40 ° C in an oil bath, a solution of pyridinium tribromide (352 mg, 1.1 mmol) in tetrahydrofuran (20) was added dropwise through a funnel. ml) for 10 minutes. The reaction mixture was heated for another 2 hours and then cooled, filtered and the filtrate was evaporated to give the title compound. MS (ESI-) m / z 212.9 (MH). "
Пример 75FExample 75F
N-бензил-4-(1H-индазол-5-ил)-5-фенил-1,3-тиазол-2-аминN-benzyl-4- (1H-indazol-5-yl) -5-phenyl-1,3-thiazol-2-amine
Сосуд, содержащий соединение Примера 75E (50 мг, 0,16 ммоль) и 1-бензилтиомочевину (26 мг, 0,16 ммоль) в этаноле (1 мл), закрывали крышкой и нагревали в нагревательном устройстве с встряхиванием при 80°C в течение 2 часов. Раствор неочищенного продукта очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения в форме соли ТФУ. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,99 (с, 1H), 8,33-8,37 (м, 1H), 8,01 (с, 1H), 7,92-7,99 (м, 1H), 7,82 (с, 1H), 7,60-7,67 (м, J=7,83, 7,83 Гц, 1H), 7,31-7,45 (м, 5H), 7,17-7,30 (м, 5H), 4,53 (д, J=4,60 Гц, 2H). MS (ESI+) m/z 383,0 (M+H)+.The vessel containing the compound of Example 75E (50 mg, 0.16 mmol) and 1-benzylthiourea (26 mg, 0.16 mmol) in ethanol (1 ml) was closed with a lid and heated in a heating device with shaking at 80 ° C for 2 hours. The crude product solution was purified by reverse phase HPLC using an acetonitrile / water gradient 0.1% TFA gradient elution method to give the title compound in the form of a TFA salt. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.99 (s, 1H), 8.33-8.37 (m, 1H), 8.01 (s, 1H), 7.92-7.99 (m, 1H), 7.82 (s, 1H), 7.60-7.67 (m, J = 7.83, 7.83 Hz, 1H), 7.31-7.45 (m, 5H), 7.17-7.30 (m, 5H), 4.53 (d, J = 4.60 Hz, 2H). MS (ESI +) m / z 383.0 (M + H) + .
Пример 76Example 76
4-(1H-индазол-5-ил)-N,5-дифенил-1,3-тиазол-2-амин4- (1H-indazol-5-yl) -N, 5-diphenyl-1,3-thiazol-2-amine
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 75F, с использованием 1-фенилтиомочевины вместо 1-бензилтиомочевины. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,09 (с, 1H), 10,29 (с, 1H), 8,05 (д, J=0,92 Гц, 1H), 7,89 (д, J=1,53, 0,92 Гц, 1H), 7,69 (д, J=8,59, 1,23 Гц, 2H), 7,47 (дт, J=8,59, 0,92 Гц, 1H), 7,40-7,44 (м, 1H), 7,26-7,37 (м, 7H), 6,94-7,02 (м, J=7,36, 7,36 Гц, 1H). MS (ESI+) m/z 369,0 (M+H)+.The title compound was prepared in the form of a TFA salt in accordance with the procedure described in Example 75F using 1-phenylthiourea instead of 1-benzylthiourea. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.09 (s, 1H), 10.29 (s, 1H), 8.05 (d, J = 0.92 Hz, 1H), 7.89 (d, J = 1.53, 0.92 Hz , 1H), 7.69 (d, J = 8.59, 1.23 Hz, 2H), 7.47 (dt, J = 8.59, 0.92 Hz, 1H), 7.40-7, 44 (m, 1H), 7.26-7.37 (m, 7H), 6.94-7.02 (m, J = 7.36, 7.36 Hz, 1H). MS (ESI +) m / z 369.0 (M + H) + .
Пример 77Example 77
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Пример 77AExample 77A
трет-бутил 5-(циклопропилэтинил)-1H-индазол-1-карбоксилатtert-butyl 5- (cyclopropylethynyl) -1H-indazole-1-carboxylate
Соединение Примера 44A (2,31 г, 7,77 ммоль), циклопропилацетилен (620 мг, 9,37 ммоль), дихлорбис(трифенилфосфин)палладий(II) (170 мг, 0,242 ммоль) и иодид меди(I) (92 мг, 0,483 ммоль) объединяли в триэтиламине (10 мл) в инертной атмосфере азота. Смесь нагревали до 100°C в герметично закрытой пробирке в течение 4 часов. Смесь разбавляли метиленхлоридом и промывали 1 н раствором хлористоводородной кислоты. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 283,0 (M+H)+.The compound of Example 44A (2.31 g, 7.77 mmol), cyclopropylacetylene (620 mg, 9.37 mmol), dichlorobis (triphenylphosphine) palladium (II) (170 mg, 0.242 mmol) and copper (I) iodide (92 mg , 0.483 mmol) were combined in triethylamine (10 ml) under an inert nitrogen atmosphere. The mixture was heated to 100 ° C in a sealed tube for 4 hours. The mixture was diluted with methylene chloride and washed with 1 N hydrochloric acid. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 283.0 (M + H) + .
Пример 77BExample 77B
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Соединение Примера 77A (145 мг, 0,51 ммоль) и бензилазид (82 мг, 0,62 ммоль) нагревали без растворителя в микроволновом реакторе CEM-Discover при 150°C и 150 Ватт в течение 10 минут. Неочищенную смесь растворяли в дихлорметане и очищали при помощи колоночной хроматографии на силикагеле, с использованием 50% этилацетата в гексане в качестве элюента. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,12 (с, 1H), 8,11 (д, J=5,52 Гц, 2H), 7,79 (д, J=8,59, 1,53 Гц, 1H), 7,60 (д, J=8,59 Гц, 1H), 7,26-7,45 (м, 5H), 5,69 (с, 2H), 1,78-1,92 (м, 1H), 0,98-1,09 (м, 2H), 0,31-0,45 (м, 2H). MS (ESI+) m/z 316,0 (M+H)+.The compound of Example 77A (145 mg, 0.51 mmol) and benzylazide (82 mg, 0.62 mmol) were heated without solvent in a CEM-Discover microwave reactor at 150 ° C. and 150 watts for 10 minutes. The crude mixture was dissolved in dichloromethane and purified by silica gel column chromatography using 50% ethyl acetate in hexane as the eluent. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.12 (s, 1H), 8.11 (d, J = 5.52 Hz, 2H), 7.79 (d, J = 8.59, 1.53 Hz, 1H), 7.60 (d , J = 8.59 Hz, 1H), 7.26-7.45 (m, 5H), 5.69 (s, 2H), 1.78-1.92 (m, 1H), 0.98- 1.09 (m, 2H); 0.31-0.45 (m, 2H). MS (ESI +) m / z 316.0 (M + H) + .
Пример 78Example 78
5-(1-бензил-4-циклопропил-1H-1,2,3-триазол-5-ил)-1H-индазол5- (1-benzyl-4-cyclopropyl-1H-1,2,3-triazol-5-yl) -1H-indazole
Указанное в заголовке соединение выделяли в виде побочного продукта в соответствии с процедурой, описанной в Примере 77B. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,29 (с, 1H), 8,14 (с, 1H), 7,80 (с, 1H), 7,65 (д, J=8,85 Гц, 1H), 7,29 (д, J=8,54, 1,53 Гц, 1H), 7,21-7,27 (м, 3H), 6,93 (д, J=7,48, 1,98 Гц, 2H), 5,49 (с, 2H), 1,70-1,80 (м, 1H), 0,81-0,92 (м, 4H). MS (ESI+) m/z 316,0 (M+H)+.The title compound was isolated as a by-product in accordance with the procedure described in Example 77B. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.29 (s, 1H), 8.14 (s, 1H), 7.80 (s, 1H), 7.65 (d, J = 8.85 Hz, 1H), 7.29 (d, J = 8.54, 1.53 Hz, 1H), 7.21-7.27 (m, 3H), 6.93 (d, J = 7.48, 1.98 Hz, 2H), 5.49 ( s, 2H), 1.70-1.80 (m, 1H), 0.81-0.92 (m, 4H). MS (ESI +) m / z 316.0 (M + H) + .
Пример 79Example 79
2-(1H-индазол-5-ил)-3-фенилимидазо[1,2-a]пиримидин2- (1H-indazol-5-yl) -3-phenylimidazo [1,2-a] pyrimidine
Сосуд, содержащий соединение Примера 75E (80 мг, 0,25 ммоль) и пиримидин-2-амин (23 мг, 0,25 ммоль) в этаноле (1 мл), закрывали крышкой и нагревали в нагревательном устройстве с встряхиванием при 80°C в течение 21 часа. Раствор неочищенного продукта очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,69 (дд, J=4,30, 1,84 Гц, 1H), 8,59 (дд, J=6,75, 1,84 Гц, 1H), 8,07 (с, 1H), 8,02 (с, 1H), 7,46-7,65 (м, 7H), 7,16 (дд, J=6,75, 3,99 Гц, 1H). MS (ESI+) m/z 312,0 (M+H)+.The vessel containing the compound of Example 75E (80 mg, 0.25 mmol) and pyrimidin-2-amine (23 mg, 0.25 mmol) in ethanol (1 ml) was closed with a lid and heated in a heating device with shaking at 80 ° C within 21 hours. The crude product solution was purified by reverse phase HPLC using an acetonitrile / water 0.1% TFA gradient elution method to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.69 (dd, J = 4.30, 1.84 Hz, 1H), 8.59 (dd, J = 6.75, 1.84 Hz, 1H), 8.07 (s, 1H), 8 02 (s, 1H), 7.46-7.65 (m, 7H), 7.16 (dd, J = 6.75, 3.99 Hz, 1H). MS (ESI +) m / z 312.0 (M + H) + .
Пример 80Example 80
5-[1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Пример 80AExample 80A
4-(азидометил)тетрагидро-2H-пиран4- (azidomethyl) tetrahydro-2H-pyran
4-(Иодметил)тетрагидро-2H-пиран (4,76 г, 21,1 ммоль) растворяли в диметилсульфоксиде (25 мл). Добавляли азид натрия (2,70 г, 41,5 ммоль) и смесь перемешивали при температуре окружающей среды в течение ночи. Полученную суспензию разбавляли простым диэтиловым эфиром и промывали водой. Органический слой концентрировали при пониженном давлении с получением указанного в заголовке соединения. Продукт использовали непосредственно в последующих реакциях без его идентификации.4- (Iodomethyl) tetrahydro-2H-pyran (4.76 g, 21.1 mmol) was dissolved in dimethyl sulfoxide (25 ml). Sodium azide (2.70 g, 41.5 mmol) was added and the mixture was stirred at ambient temperature overnight. The resulting suspension was diluted with diethyl ether and washed with water. The organic layer was concentrated under reduced pressure to obtain the title compound. The product was used directly in subsequent reactions without identification.
Пример 80BExample 80B
5-[1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Соединение Примера 80A (122 мг, 0,864 ммоль) и соединение Примера 3C (150 мг, 0,619 ммоль) объединяли в микроволновом сосуде с трет-бутанолом (1 мл) и водой (1 мл). Добавляли небольшой кусок медной проволоки с последующим добавлением сульфата меди(II) (5 мг, 0,02 ммоль) и содержимое сосуда перемешивали в микроволновом устройстве (CEM-Discover) при 125°C при 100 Вт в течение 10 минут. Смесь разбавляли метиленхлоридом и промывали 1 н раствором хлористоводородной кислоты. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, DMS(MJ) δ м.д. 13,11 (с, 1H), 8,53 (с, 1H), 8,22 (с, 1H), 8,12 (с, 1H), 7,85 (д, J=8,48, 1,36 Гц, 1H), 7,60 (д, J=8,82 Гц, 1H), 4,32 (д, J=7,12 Гц, 2H), 3,85 (д, J=1 1,70, 2,54 Гц, 2H), 3,21-3,36 (м, 2H), 2,14 (с, 1H), 1,47 (с, 2H), 1,30 (с, 2H). MS (ESI+) m/z 284,0 (M+H)+.The compound of Example 80A (122 mg, 0.864 mmol) and the compound of Example 3C (150 mg, 0.619 mmol) were combined in a microwave vessel with tert-butanol (1 ml) and water (1 ml). A small piece of copper wire was added followed by copper (II) sulfate (5 mg, 0.02 mmol) and the contents of the vessel were mixed in a microwave device (CEM-Discover) at 125 ° C at 100 W for 10 minutes. The mixture was diluted with methylene chloride and washed with 1 N hydrochloric acid. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMS (M J ) δ ppm 13.11 (s, 1H), 8.53 (s, 1H), 8.22 (s, 1H), 8.12 (s, 1H), 7.85 (d, J = 8.48, 1.36 Hz, 1H), 7.60 (d, J = 8.82 Hz, 1H), 4.32 (d, J = 7.12 Hz, 2H), 3.85 (d, J = 1 1.70, 2.54 Hz, 2H), 3.21-3.36 (m, 2H), 2.14 (s, 1H), 1, 47 (s, 2H), 1.30 (s, 2H). MS (ESI +) m / z 284.0 (M + H) + .
Пример 81Example 81
5-[3-(пиперидин-1-илкарбонил)изоксазол-5-ил]-1H-индазол5- [3- (piperidin-1-ylcarbonyl) isoxazol-5-yl] -1H-indazole
Пример 81AExample 81A
5-(1H-индазол-5-ил)изоксазол-3-карбоновая кислота5- (1H-indazol-5-yl) isoxazole-3-carboxylic acid
Соединение Примера 70 (1,50 г, 5,83 ммоль) растворяли в тетрагидрофуране (100 мл), метаноле (10 мл) и воде (10 мл). Добавляли гидроксид калия (680 мг, 12,1 ммоль) и смесь перемешивали при температуре окружающей среды в течение 2 часов. Растворители удаляли при пониженном давлении и полученный остаток растирали в порошок со смесью 1 н хлористоводородной кислоты и метанола с получением твердого вещества, которое фильтровали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,41 (с, 1H), 8,23 (с, 1H), 7,91 (дд, J=8,82, 1,70 Гц, 1H), 7,70 (д, J=8,82 Гц, 1H), 7,36 (с, 1H).The compound of Example 70 (1.50 g, 5.83 mmol) was dissolved in tetrahydrofuran (100 ml), methanol (10 ml) and water (10 ml). Potassium hydroxide (680 mg, 12.1 mmol) was added and the mixture was stirred at ambient temperature for 2 hours. The solvents were removed under reduced pressure, and the resulting residue was triturated with a mixture of 1 n hydrochloric acid and methanol to give a solid, which was filtered to obtain the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.41 (s, 1H), 8.23 (s, 1H), 7.91 (dd, J = 8.82, 1.70 Hz, 1H), 7.70 (d, J = 8.82 Hz, 1H); 7.36 (s, 1H).
Пример 81BExample 81B
5-[3-(пиперидин-1-илкарбонил)изоксазол-5-ил]-1H-индазол5- [3- (piperidin-1-ylcarbonyl) isoxazol-5-yl] -1H-indazole
Соединение Примера 81A (110 мг, 0,480 ммоль), пиперидин (55 мкл, 0,556 ммоль) и HATU (101 мг, 0,266 ммоль) объединяли в диметилформамиде (2 мл). Добавляли диизопропилэтиламин (133 мкл, 0,764 ммоль) и реакционную смесь перемешивали при 45°C в течение 2 часов. Смесь разбавляли этилацетатом и промывали 1 н раствором гидроксида натрия, 1 н раствором хлористоводородной кислоты, водой (3 раза) и насыщенным солевым раствором. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 8,34-8,40 (м, 1H), 8,21-8,25 (м, 1H), 7,84-7,91 (м, 1H), 7,66-7,72 (м, 1H), 7,20 (с, 1H), 3,59-3,69 (м, 2H), 3,48-3,58 (м, 2H), 1,47-1,72 (м, 6H). MS (ESI+) m/z 297,0 (M+H)+.The compound of Example 81A (110 mg, 0.480 mmol), piperidine (55 μl, 0.556 mmol) and HATU (101 mg, 0.266 mmol) were combined in dimethylformamide (2 ml). Diisopropylethylamine (133 μl, 0.764 mmol) was added and the reaction mixture was stirred at 45 ° C for 2 hours. The mixture was diluted with ethyl acetate and washed with 1 N sodium hydroxide solution, 1 N hydrochloric acid solution, water (3 times) and brine. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.37 (s, 1H), 8.34-8.40 (m, 1H), 8.21-8.25 (m, 1H), 7.84-7.91 (m, 1H), 7, 66-7.72 (m, 1H), 7.20 (s, 1H), 3.59-3.69 (m, 2H), 3.48-3.58 (m, 2H), 1.47- 1.72 (m, 6H). MS (ESI +) m / z 297.0 (M + H) + .
Пример 82Example 82
5-(1H-индазол-5-ил)-N-фенилизоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N-phenylisoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием анилина вместо пиперидина. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,40 (с, 1H), 10,74 (с, 1H), 8,44 (с, 1H), 8,25 (с, 1H), 7,93 (д, J=8,85, 1,53 Гц, 1H), 7,82 (д, J=7,63 Гц, 2H), 7,72 (д, J=8,85 Гц, 1H), 7,44 (с, 1H), 7,35-7,42 (м, 2H), 7,16 (т, J=7,32 Гц, 1H). MS (ESI+) m/z 304,9 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using aniline instead of piperidine. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.40 (s, 1H), 10.74 (s, 1H), 8.44 (s, 1H), 8.25 (s, 1H), 7.93 (d, J = 8.85, 1, 53 Hz, 1H), 7.82 (d, J = 7.63 Hz, 2H), 7.72 (d, J = 8.85 Hz, 1H), 7.44 (s, 1H), 7.35 -7.42 (m, 2H); 7.16 (t, J = 7.32 Hz, 1H). MS (ESI +) m / z 304.9 (M + H) + .
Пример 83Example 83
N-циклогексил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN-cyclohexyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Соединение Примера 81A (53 мг, 0,231 ммоль), циклогексиламин (29 мкл, 0,253 ммоль) и HATU (101 мг, 0,266 ммоль) объединяли в диметилформамиде (2 мл). Добавляли диизопропилэтиламин (133 мкл, 0,764 ммоль) и реакционную смесь перемешивали при 45°C в течение 2 часов. Смесь разбавляли этилацетатом и промывали 1 н раствором гидроксида натрия, 1 н раствором хлористоводородной кислоты, водой (3 раз) и насыщенным солевым раствором. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,58 (д, J=8,14 Гц, 1H), 8,38 (с, 1H), 8,22 (с, 1H), 7,88 (д, J=8,81, 1,70 Гц, 1H), 7,69 (д, J=8,81 Гц, 1H), 7,28 (с, 1H), 3,69-3,86 (м, 1H), 1,77 (с, 4H), 1,60 (д, J=12,21 Гц, 1H), 1,20-1,46 (м, 4H), 1,06-1,20 (м, 1H). MS (ESI+) m/z 311,0 (M+H)+.The compound of Example 81A (53 mg, 0.231 mmol), cyclohexylamine (29 μl, 0.253 mmol) and HATU (101 mg, 0.266 mmol) were combined in dimethylformamide (2 ml). Diisopropylethylamine (133 μl, 0.764 mmol) was added and the reaction mixture was stirred at 45 ° C for 2 hours. The mixture was diluted with ethyl acetate and washed with 1 N sodium hydroxide solution, 1 N hydrochloric acid solution, water (3 times) and brine. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.58 (d, J = 8.14 Hz, 1H), 8.38 (s, 1H), 8.22 (s, 1H), 7.88 (d, J = 8.81, 1.70 Hz, 1H), 7.69 (d, J = 8.81 Hz, 1H), 7.28 (s, 1H), 3.69-3.86 (m, 1H) 1.77 (s, 4H), 1.60 (d, J = 12.21 Hz, 1H), 1.20-1.46 (m, 4H), 1.06-1.20 (m, 1H ) MS (ESI +) m / z 311.0 (M + H) + .
Пример 84Example 84
5-[3-(пиперидин-1-илметил)изоксазол-5-ил]-1H-индазол5- [3- (piperidin-1-ylmethyl) isoxazol-5-yl] -1H-indazole
Соединение Примера 81B (22 мг, 0,0742 ммоль) растворяли в тетрагидрофуране (2,5 мл) в инертной атмосфере азота. Добавляли литийалюминийгидрид (1,0 M раствор в тетрагидрофуране) (250 мкл) и смесь нагревали до 70°C в течение 20 минут. Добавляли метанол и смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент метанола в дихлорметане (0-7%), с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,30 (с, 1H), 8,31 (с, 1H), 8,20 (с, 1H), 7,84 (д, J=8,59, 1,53 Гц, 1H), 7,66 (д, J=8,59 Гц, 1H), 6,92 (с, 1H), 3,54 (с, 2H), 2,32-2,46 (м, 2H), 1,47-1,59 (м, 4H), 1,33-1,46 (м, 2H). MS (ESI+) m/z 283,0 (M+H)+.The compound of Example 81B (22 mg, 0.0742 mmol) was dissolved in tetrahydrofuran (2.5 ml) in an inert nitrogen atmosphere. Lithium aluminum hydride (1.0 M solution in tetrahydrofuran) (250 μl) was added and the mixture was heated to 70 ° C for 20 minutes. Methanol was added and the mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of methanol in dichloromethane (0-7%) to elute to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.30 (s, 1H), 8.31 (s, 1H), 8.20 (s, 1H), 7.84 (d, J = 8.59, 1.53 Hz, 1H), 7.66 (d, J = 8.59 Hz, 1H), 6.92 (s, 1H), 3.54 (s, 2H), 2.32-2.46 (m, 2H), 1.47-1, 59 (m, 4H), 1.33-1.46 (m, 2H). MS (ESI +) m / z 283.0 (M + H) + .
Пример 85Example 85
[5-(1H-индазол-5-ил)изоксазол-3-ил]метанол[5- (1H-indazol-5-yl) isoxazol-3-yl] methanol
Соединение Примера 70 (84 мг, 0,366 ммоль) растворяли в тетрагидрофуране (8 мл). Добавляли литийалюминийгидрид (1,0 M раствор в тетрагидрофуране) (3,0 мл) 1,0-мл порциями в течение 2 часов. По окончании добавления, смесь перемешивали еще в течение 30 минут. Смесь разбавляли метиленхлоридом и промывали водой и органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-20% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,31 (с, 1H), 8,31 (с, 1H), 8,21 (с, 1H), 7,83 (д, J=8,59, 1,53 Гц, 1H), 7,67 (д, J=8,90 Гц, 1H), 6,93 (с, 1H), 5,51 (с, 1H), 4,56 (д, J=2,45 Гц, 1H). MS (ESI+) m/z 215,9 (M+H)+.The compound of Example 70 (84 mg, 0.366 mmol) was dissolved in tetrahydrofuran (8 ml). Lithium aluminum hydride (1.0 M solution in tetrahydrofuran) (3.0 ml) was added in 1.0 ml portions over 2 hours. Upon completion of the addition, the mixture was stirred for another 30 minutes. The mixture was diluted with methylene chloride and washed with water, and the organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-20% methanol in dichloromethane to elute to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.31 (s, 1H), 8.31 (s, 1H), 8.21 (s, 1H), 7.83 (d, J = 8.59, 1.53 Hz, 1H), 7.67 (d, J = 8.90 Hz, 1H), 6.93 (s, 1H), 5.51 (s, 1H), 4.56 (d, J = 2.45 Hz, 1H). MS (ESI +) m / z 215.9 (M + H) + .
Пример 86Example 86
5-(1H-индазол-5-ил)-N-(2-метоксиэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-methoxyethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-метоксиэтиламина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,74 (т, J=4,92 Гц, 1H), 8,39 (с, 1H), 8,23 (с, 1H), 7,89 (д, J=8,65, 1,53 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,30 (с, 1H), 3,38-3,53 (м, 4H), 3,28 (с, 3H). MS (ESI+) m/z 287,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2-methoxyethylamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.74 (t, J = 4.92 Hz, 1H), 8.39 (s, 1H), 8.23 (s, 1H), 7.89 (d, J = 8.65, 1.53 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H), 7.30 (s, 1H), 3.38-3.53 (m, 4H) 3.28 (s, 3H). MS (ESI +) m / z 287.0 (M + H) + .
Пример 87Example 87
5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Пример 87AExample 87A
1-(5-Иод-1H-индазол-1-ил)этанон1- (5-Iodo-1H-indazol-1-yl) ethanone
4-Иод-2-метиланилин (30,2 г, 130 ммоль) растворяли в хлороформе (300 мл) и охлаждали до 5°C. Добавляли по каплям уксусный ангидрид (35 мл, 343 ммоль) и смеси давали нагреться до температуры окружающей среды. Добавляли ацетат калия (4,21 г, 42,9 ммоль) и изоамилнитрит (37 мл, 277 ммоль) и смесь нагревали до 70°C в течение ночи. Смесь нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали метиленхлоридомом. Растворители удаляли при пониженном давлении и полученный остаток растирали в порошок с метанолом с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,41 (с, 1H), 8,33 (с, 1H), 8,05-8,21 (м, 1H), 7,90 (дд, J=8,48, 1,70 Гц, 1H), 2,71 (с, 3H).4-Iodo-2-methylaniline (30.2 g, 130 mmol) was dissolved in chloroform (300 ml) and cooled to 5 ° C. Acetic anhydride (35 ml, 343 mmol) was added dropwise and the mixture was allowed to warm to ambient temperature. Potassium acetate (4.21 g, 42.9 mmol) and isoamyl nitrite (37 ml, 277 mmol) were added and the mixture was heated to 70 ° C. overnight. The mixture was neutralized with saturated aqueous sodium bicarbonate and extracted with methylene chloride. The solvents were removed under reduced pressure and the resulting residue was triturated with methanol to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.41 (s, 1H), 8.33 (s, 1H), 8.05-8.21 (m, 1H), 7.90 (dd, J = 8.48, 1.70 Hz, 1H) 2.71 (s, 3H).
Пример 87BExample 87B
1-Бензил-5-фенил-4-(трибутилстаннил)-1H-1,2,3-триазол1-Benzyl-5-phenyl-4- (tributylstannyl) -1H-1,2,3-triazole
Фенилэтинил-три-н-бутилолово (8,25 г, 21,1 ммоль) и бензилазид (2,3 мл, 18,4 ммоль) объединяли и нагревали до 150°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 526,3 (M+H)+.Phenylethynyl-tri-n-butyltin (8.25 g, 21.1 mmol) and benzylazide (2.3 ml, 18.4 mmol) were combined and heated to 150 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 526.3 (M + H) + .
Пример 87CExample 87C
1-(5-(1-Бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-ил)этанон1- (5- (1-Benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-1-yl) ethanone
Соединение Примера 87A (139 мг, 0,486 ммоль), соединение Примера 87B (284 мг, 0,542 ммоль), дихлорбис(трифенилфосфин)палладий(II) (40 мг, 0,057 ммоль) и тиофен-2-карбоксилат меди (167 мг, 0,876 ммоль) объединяли в толуоле (1,5 мл) в микроволновом сосуде в инертной атмосфере азота. Сосуд нагревали в микроволновом устройстве (CEM-Discover) до 150°C при 125 Ватт в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 394,1 (M+H)+.The compound of Example 87A (139 mg, 0.486 mmol), the compound of Example 87B (284 mg, 0.542 mmol), dichlorobis (triphenylphosphine) palladium (II) (40 mg, 0.057 mmol) and copper thiophene-2-carboxylate (167 mg, 0.876 mmol) ) were combined in toluene (1.5 ml) in a microwave vessel under an inert atmosphere of nitrogen. The vessel was heated in a microwave device (CEM-Discover) to 150 ° C at 125 watts for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 394.1 (M + H) + .
Пример 87DExample 87D
5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Соединение Примера 87C (95 мг, 0,242 ммоль) растворяли в тетрагидрофуране (2,0 мл), метаноле (1,0 мл) и воде (1,0 мл) и добавляли гидроксид калия (64 мг, 1,14 ммоль). Смесь перемешивали в течение 2 часов и разбавляли этилацетатом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,08 (с, 1H), 8,00 (с, 1H), 7,79 (с, 1H), 7,44-7,56 (м, 5H), 7,24-7,36 (м, 5H), 6,95-7,03 (м, 2H), 5,49 (с, 2H). MS (ESI+) m/z 252,1 (M+H)+.The compound of Example 87C (95 mg, 0.242 mmol) was dissolved in tetrahydrofuran (2.0 ml), methanol (1.0 ml) and water (1.0 ml) and potassium hydroxide (64 mg, 1.14 mmol) was added. The mixture was stirred for 2 hours and diluted with ethyl acetate and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.08 (s, 1H), 8.00 (s, 1H), 7.79 (s, 1H), 7.44-7.56 (m, 5H), 7.24-7.36 (m, 5H), 6.95-7.03 (m, 2H), 5.49 (s, 2H). MS (ESI +) m / z 252.1 (M + H) + .
Пример 88Example 88
5-(4-бензил-1H-1,2,3-триазол-1-ил)-1H-индазол5- (4-benzyl-1H-1,2,3-triazol-1-yl) -1H-indazole
Соединение Примера 87A (969 мг, 3,39 ммоль), 3-фенил-1-пропин (392 мг, 3,37 ммоль), азид натрия (278 мг, 4,28 ммоль), аскорбат натрия (68 мг, 3,43 ммоль), карбонат натрия (75 мг, 0,708 ммоль) и L-пролин (78 мг, 8,98 ммоль) объединяли в 1:1 смеси диметилсульфоксида и воды (10 мл). Добавляли сульфат меди(II) пентагидрат (46 мг, 0,184 ммоль) и смесь перемешивали при 65°C в течение 3 часов. Добавляли 6н раствор гидроксида натрия (1 мл) и смесь перемешивали в течение 30 минут для удаления защиты у индазола. Смесь разбавляли этилацетатом и промывали 1 н раствором хлористоводородной кислоты. Органический слой концентрировали при пониженном давлении и полученный остаток растирали в порошок с метанолом. Оставшиеся твердые частицы абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,35 (с, 1H), 8,58 (с, 1H), 8,17-8,27 (м, 1H), 7,86 (д, J=8,82, 2,03 Гц, 1H), 7,67-7,77 (м, 1H), 7,27-7,36 (м, 2H), 7,18-7,27 (м, 1H), 4,10 (с, 1H). MS (ESI+) m/z 276,0 (M+H)+.The compound of Example 87A (969 mg, 3.39 mmol), 3-phenyl-1-propine (392 mg, 3.37 mmol), sodium azide (278 mg, 4.28 mmol), sodium ascorbate (68 mg, 3, 43 mmol), sodium carbonate (75 mg, 0.708 mmol) and L-proline (78 mg, 8.98 mmol) were combined in a 1: 1 mixture of dimethyl sulfoxide and water (10 ml). Copper (II) sulfate pentahydrate (46 mg, 0.184 mmol) was added and the mixture was stirred at 65 ° C for 3 hours. A 6N sodium hydroxide solution (1 ml) was added and the mixture was stirred for 30 minutes to remove the protection from indazole. The mixture was diluted with ethyl acetate and washed with 1 N hydrochloric acid. The organic layer was concentrated under reduced pressure, and the resulting residue was triturated with methanol. The remaining solids were absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.35 (s, 1H), 8.58 (s, 1H), 8.17-8.27 (m, 1H), 7.86 (d, J = 8.82, 2.03 Hz, 1H) 7.67-7.77 (m, 1H); 7.27-7.36 (m, 2H); 7.18-7.27 (m, 1H); 4.10 (s, 1H). MS (ESI +) m / z 276.0 (M + H) + .
Пример 89Example 89
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Пример 89AExample 89A
5-(Циклопропилэтинил)-2-фторбензонитрил5- (cyclopropylethinyl) -2-fluorobenzonitrile
5-Бром-2-фторбензонитрил (3,06 г, 15,3 ммоль), дихлорбис(трифенилфосфин)палладий(II) (478 мг, 0,681 ммоль) и иодид меди(I) (165 мг, 0,866 ммоль) объединяли в триэтиламине (15 мл) в инертной атмосфере азота. Добавляли циклопропилацетилен (1,8 мл) и смесь нагревали до 60°C, пока она не превращалась в черное твердое вещество. Смесь разбавляли метиленхлоридом и промывали 1 н раствором хлористоводородной кислоты. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 319,0 (M+H)+.5-Bromo-2-fluorobenzonitrile (3.06 g, 15.3 mmol), dichlorobis (triphenylphosphine) palladium (II) (478 mg, 0.681 mmol) and copper (I) iodide (165 mg, 0.866 mmol) were combined in triethylamine (15 ml) in an inert atmosphere of nitrogen. Cyclopropylacetylene (1.8 ml) was added and the mixture was heated to 60 ° C until it turned into a black solid. The mixture was diluted with methylene chloride and washed with 1 N hydrochloric acid. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 319.0 (M + H) + .
Пример 89BExample 89B
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Соединение Примера 89A (211 мг, 1,14 ммоль) и бензилазид (143 мкл, 1,14 ммоль) объединяли в микроволновом (CEM-Discover) сосуде и нагревали до 160°C, с использованием мощности 100 Ватт, в течение 26 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 20-60% этилацетата в гексане, с получением смеси неразделимых триазольных региомеров. Смесь региомеров обрабатывали гидразингидратом (3,0 мл) и этанолом (3,0 мл) и нагревали до 90°C в течение 1 часа. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 1-6% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,43 (с, 1H), 8,07 (с, 1H), 7,63 (д, J=8,65, 1,53 Гц, 1H), 7,32-7,45 (м, 3H), 7,24-7,32 (м, 3H), 5,68 (с, 2H), 5,40 (с, 2H), 1,69-1,83 (м, 1H), 0,98-1,08 (м, 2H), 0,32-0,42 (м, 2H). MS (ESI+) m/z 331,1 (M+H)+.The compound of Example 89A (211 mg, 1.14 mmol) and benzylazide (143 μl, 1.14 mmol) were combined in a microwave (CEM-Discover) vessel and heated to 160 ° C. using a power of 100 watts for 26 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 20-60% ethyl acetate in hexane to elute to give a mixture of inseparable triazole regiomers. The regiomer mixture was treated with hydrazine hydrate (3.0 ml) and ethanol (3.0 ml) and heated to 90 ° C. for 1 hour. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 1-6% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.43 (s, 1H), 8.07 (s, 1H), 7.63 (d, J = 8.65, 1.53 Hz, 1H), 7.32-7.45 (m, 3H) 7.24-7.32 (m, 3H), 5.68 (s, 2H), 5.40 (s, 2H), 1.69-1.83 (m, 1H), 0.98-1 08 (m, 2H); 0.32-0.42 (m, 2H). MS (ESI +) m / z 331.1 (M + H) + .
Пример 90Example 90
5-(1-бензил-4-циклопропил-1H-1,2,3-триазол-5-ил)-1H-индазол-3-амин5- (1-benzyl-4-cyclopropyl-1H-1,2,3-triazol-5-yl) -1H-indazol-3-amine
Указанное в заголовке соединение выделяли в виде побочного продукта в соответствии с процедурой, описанной в Примере 89B. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,62 (с, 1H), 7,79 (с, 1H), 7,32 (д, J=8,48 Гц, 1H), 7,20-7,27 (м, 3H), 7,15 (д, J=8,65, 1,53 Гц, 1H), 6,93 (д, J=7,12, 2,37 Гц, 2H), 5,49 (с, 2H), 5,45 (с, 2H), 1,71-1,82 (м, 1H), 0,80-0,89 (м, 4H). MS (ESI+) m/z 331,1 (M+H)+.The title compound was isolated as a by-product in accordance with the procedure described in Example 89B. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.62 (s, 1H), 7.79 (s, 1H), 7.32 (d, J = 8.48 Hz, 1H), 7.20-7.27 (m, 3H), 7.15 (d, J = 8.65, 1.53 Hz, 1H), 6.93 (d, J = 7.12, 2.37 Hz, 2H), 5.49 (s, 2H), 5.45 ( s, 2H), 1.71-1.82 (m, 1H), 0.80-0.89 (m, 4H). MS (ESI +) m / z 331.1 (M + H) + .
Пример 91Example 91
5-(3-изобутилизоксазол-5-ил)-1H-индазол-3-амин5- (3-isobutylisoxazol-5-yl) -1H-indazol-3-amine
Пример 91AExample 91A
2-фтор-5-(3-изобутилизоксазол-5-ил)бензонитрил2-fluoro-5- (3-isobutylisoxazol-5-yl) benzonitrile
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 72, с использованием изовалеральдегида вместо фенилацетальдегида и с использованием соединения Примера 62B вместо соединения Примера 3C. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,47 (дд, J=6,10, 2,03 Гц, 1H), 8,19-8,29 (м, 1H), 7,71 (т, J=8,99 Гц, 1H), 7,08 (с, 1H), 2,56 (д, J=7,12 Гц, 2H), 1,86-2,10 (м, 1H), 0,94 (д, J=6,78 Гц, 6H).The title compound was prepared according to the procedure described in Example 72 using isovaleraldehyde instead of phenylacetaldehyde and using the compound of Example 62B instead of the compound of Example 3C. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.47 (dd, J = 6.10, 2.03 Hz, 1H), 8.19-8.29 (m, 1H), 7.71 (t, J = 8.99 Hz, 1H), 7 08 (s, 1H), 2.56 (d, J = 7.12 Hz, 2H), 1.86-2.10 (m, 1H), 0.94 (d, J = 6.78 Hz, 6H).
Пример 91BExample 91B
5-(3-изобутилизоксазол-5-ил)-1H-индазол-3-амин5- (3-isobutylisoxazol-5-yl) -1H-indazol-3-amine
К соединению Примера 91A (75 мг, 0,307 ммоль) добавляли гидразингидрат (1,5 мл) в этаноле (1,0 мл). Смесь нагревали до 70°C в течение ночи в герметично закрытом сосуде. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединенияTo the compound of Example 91A (75 mg, 0.307 mmol) was added hydrazine hydrate (1.5 ml) in ethanol (1.0 ml). The mixture was heated to 70 ° C. overnight in a sealed vessel. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound
1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,67 (с, 1H), 8,26 (с, 1H), 7,66 (дд, J=8,82, 1,70 Гц, 1H), 7,32 (д, J=8,48 Гц, 1H), 6,67 (с, 1H), 5,56 (с, 2H), 2,51-2,58 (м, 2H), 1,89-2,11 (м, 1H), 0,95 (д, J=6,44 Гц, 6H). MS (ESI+) m/z 257,0 (M+H)+. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.67 (s, 1H), 8.26 (s, 1H), 7.66 (dd, J = 8.82, 1.70 Hz, 1H), 7.32 (d, J = 8.48 Hz , 1H), 6.67 (s, 1H), 5.56 (s, 2H), 2.51-2.58 (m, 2H), 1.89-2.11 (m, 1H), 0, 95 (d, J = 6.44 Hz, 6H). MS (ESI +) m / z 257.0 (M + H) + .
Пример 92Example 92
5-(3-бензилизоксазол-5-ил)-1H-индазол-3-амин5- (3-benzylisoxazol-5-yl) -1H-indazol-3-amine
Пример 92AExample 92A
5-(3-бензилизоксазол-5-ил)-2-фторбензонитрил5- (3-benzylisoxazol-5-yl) -2-fluorobenzonitrile
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 72, с использованием соединения Примера 62B вместо соединения Примера 3C. Неочищенный продукт использовали на следующей стадии без дополнительной очистки или определения его характеристик.The title compound was prepared according to the procedure described in Example 72 using the compound of Example 62B instead of the compound of Example 3C. The crude product was used in the next step without further purification or determination of its characteristics.
Пример 92BExample 92B
5-(3-бензилизоксазол-5-ил)-1H-индазол-3-амин5- (3-benzylisoxazol-5-yl) -1H-indazol-3-amine
К соединению Примера 92A (65 мг, 0,234 ммоль) добавляли гидразингидрат (1,5 мл) в этаноле (1,0 мл). Смесь нагревали до 70°C в течение ночи в герметично закрытом сосуде. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-20% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,67 (с, 1H), 8,26 (с, 1H), 7,66 (д, J=8,82, 1,70 Гц, 1H), 7,32 (д, J=8,48 Гц, 1H), 6,67 (с, 1H), 5,56 (с, 2H), 2,45-2,57 (м, 2H), 1,91-2,08 (м, 1H), 0,95 (д, J=6,44 Гц, 6H). MS (ESI+) m/z 291,0 (M+H)+.To the compound of Example 92A (65 mg, 0.234 mmol) was added hydrazine hydrate (1.5 ml) in ethanol (1.0 ml). The mixture was heated to 70 ° C. overnight in a sealed vessel. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-20% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.67 (s, 1H), 8.26 (s, 1H), 7.66 (d, J = 8.82, 1.70 Hz, 1H), 7.32 (d, J = 8.48 Hz , 1H), 6.67 (s, 1H), 5.56 (s, 2H), 2.45-2.57 (m, 2H), 1.91-2.08 (m, 1H), 0, 95 (d, J = 6.44 Hz, 6H). MS (ESI +) m / z 291.0 (M + H) + .
Пример 93Example 93
N-{2-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-имидазол-1-ил]этил}-N,N-диметиламинN- {2- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] ethyl} -N, N-dimethylamine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 2-диметиламиноэтиламина вместо бензиламина. 1H ЯМР (500 МГц, c) δ м.д. 13,28 (с, 1H), 8,14 (с, 1H), 7,78-7,87 (м, 2H), 7,68 (д, J=8,54 Гц, 1H), 7,33-7,41 (м, 2H), 7,28 (д, J=8,54, 1,53 Гц, 1H), 6,95-7,05 (м, 2H), 3,86 (т, J=6,56 Гц, 2H), 2,31 (т, J=6,71 Гц, 2H), 2,00 (с, 6H).The title compound was prepared according to the procedure described in Example 39 using 2-dimethylaminoethylamine instead of benzylamine. 1 H NMR (500 MHz, s) δ ppm 13.28 (s, 1H), 8.14 (s, 1H), 7.78-7.87 (m, 2H), 7.68 (d, J = 8.54 Hz, 1H), 7.33 -7.41 (m, 2H), 7.28 (d, J = 8.54, 1.53 Hz, 1H), 6.95-7.05 (m, 2H), 3.86 (t, J = 6.56 Hz, 2H), 2.31 (t, J = 6.71 Hz, 2H), 2.00 (s, 6H).
Пример 94Example 94
5-[4-(4-фторфенил)-1-(3-морфолин-4-илпропил)-1H-имидазол-5-ил]-1H-индазол5- [4- (4-fluorophenyl) -1- (3-morpholin-4-ylpropyl) -1H-imidazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 3-морфолинопропиламина вместо бензиламина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 13,28 (с, 1H), 8,14 (с, 1H), 7,79-7,87 (м, 2H), 7,68 (д, J=8,24 Гц, 1H), 7,34-7,42 (м, 2H), 7,28 (д, J=8,54, 1,53 Гц, 1H), 6,92-7,03 (м, 2H), 3,77-3,89 (м, 2H), 3,24-3,30 (м, 4H), 2,10 (т, J=6,56 Гц, 2H), 1,96-2,05 (м, 4H), 1,54-1,66 (м, 2H). MS (ESI+) m/z 406,1 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 3-morpholinopropylamine instead of benzylamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 13.28 (s, 1H), 8.14 (s, 1H), 7.79-7.87 (m, 2H), 7.68 (d, J = 8.24 Hz, 1H), 7.34 -7.42 (m, 2H), 7.28 (d, J = 8.54, 1.53 Hz, 1H), 6.92-7.03 (m, 2H), 3.77-3.89 (m, 2H), 3.24-3.30 (m, 4H), 2.10 (t, J = 6.56 Hz, 2H), 1.96-2.05 (m, 4H), 1, 54-1.66 (m, 2H). MS (ESI +) m / z 406.1 (M + H) + .
Пример 95Example 95
5-[4-(4-фторфенил)-1-(3-пирролидин-1-илпропил)-1H-имидазол-5-ил]-1H-индазол5- [4- (4-fluorophenyl) -1- (3-pyrrolidin-1-ylpropyl) -1H-imidazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 3-пирролидинопропиламина вместо бензиламина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,13 (д, J=0,92 Гц, 1H), 7,79-7,85 (м, 2H), 7,68 (д, J=8,54 Гц, 1H), 7,38 (д, J=8,85, 5,49 Гц, 2H), 7,27 (д, J=8,54, 1,53 Гц, 1H), 6,99 (т, J=9,00 Гц, 2H), 3,82-3,90 (м, 2H), 2,21 (т, J=6,71 Гц, 2H), 2,08-2,18 (м, 4H), 1,56-1,65 (м, 2H), 1,44-1,53 (м, 4H). MS (ESI+) m/z 390,2 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 3-pyrrolidinopropylamine instead of benzylamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.13 (d, J = 0.92 Hz, 1H), 7.79-7.85 (m, 2H), 7.68 (d, J = 8.54 Hz, 1H), 7.38 (d , J = 8.85, 5.49 Hz, 2H), 7.27 (d, J = 8.54, 1.53 Hz, 1H), 6.99 (t, J = 9.00 Hz, 2H) 3.82-3.90 (m, 2H), 2.21 (t, J = 6.71 Hz, 2H), 2.08-2.18 (m, 4H), 1.56-1.65 (m, 2H), 1.44-1.53 (m, 4H). MS (ESI +) m / z 390.2 (M + H) + .
Пример 96Example 96
5-{4-(4-фторфенил)-1-[2-(4-метилпиперидин-1-ил)этил]-1H-имидазол-5-ил}-1H-индазол5- {4- (4-fluorophenyl) -1- [2- (4-methylpiperidin-1-yl) ethyl] -1H-imidazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 2-(4-метилпиперидин-1-ил)этанамина вместо бензиламина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 13,29 (с, 1H), 8,14 (с, 1H), 7,83 (с, 1H), 7,81 (с, 1H), 7,67 (д, J=8,54 Гц, 1H), 7,32-7,40 (м, 2H), 7,28 (дд, J=8,54, 1,53 Гц, 1H), 6,93-7,04 (м, 2H), 3,85 (т, J=6,56 Гц, 2H), 2,60 (д, J=1 1,60 Гц, 2H), 2,37 (т, J=6,56 Гц, 2H), 1,71-1,85 (м, 2H), 1,45 (д, J=1 1,29 Гц, 2H), 1,15-1,30 (м, 1H), 0,95-1,07 (м, 2H), 0,83 (д, J=6,71 Гц, 3H) MS (ESI+) m/z 404,1 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 2- (4-methylpiperidin-1-yl) ethanamine instead of benzylamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 13.29 (s, 1H), 8.14 (s, 1H), 7.83 (s, 1H), 7.81 (s, 1H), 7.67 (d, J = 8.54 Hz, 1H ), 7.32-7.40 (m, 2H), 7.28 (dd, J = 8.54, 1.53 Hz, 1H), 6.93-7.04 (m, 2H), 3, 85 (t, J = 6.56 Hz, 2H), 2.60 (d, J = 1.60 Hz, 2H), 2.37 (t, J = 6.56 Hz, 2H), 1.71 -1.85 (m, 2H), 1.45 (d, J = 1.29 Hz, 2H), 1.15-1.30 (m, 1H), 0.95-1.07 (m, 2H), 0.83 (d, J = 6.71 Hz, 3H) MS (ESI +) m / z 404.1 (M + H) + .
Пример 97Example 97
5-[1-(1-бензилпиперидин-4-ил)-4-(4-фторфенил)-1H-имидазол-5-ил]-1H-индазол5- [1- (1-benzylpiperidin-4-yl) -4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 4-амино-N-бензилпиперидина вместо бензиламина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 13,32 (с, 1H), 8,14 (с, 1H), 8,02 (с, 1H), 7,78 (с, 1H), 7,69 (д, J=8,54 Гц, 1H), 7,17-7,40 (м, 8H), 6,97 (т, J=8,85 Гц, 2H), 3,50-3,63 (м, 1H), 3,40 (с, 2H), 2,82 (д, J=1 1,90 Гц, 2H), 1,90-2,05 (м, 2H), 1,72-1,89 (м, 4H). MS (ESI+) m/z 452,2 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 4-amino-N-benzylpiperidine instead of benzylamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 13.32 (s, 1H), 8.14 (s, 1H), 8.02 (s, 1H), 7.78 (s, 1H), 7.69 (d, J = 8.54 Hz, 1H ), 7.17-7.40 (m, 8H), 6.97 (t, J = 8.85 Hz, 2H), 3.50-3.63 (m, 1H), 3.40 (s, 2H), 2.82 (d, J = 1 1.90 Hz, 2H), 1.90-2.05 (m, 2H), 1.72-1.89 (m, 4H). MS (ESI +) m / z 452.2 (M + H) + .
Пример 98Example 98
5-[4-(4-фторфенил)-1-(2-морфолин-4-илэтил)-1H-имидазол-5-ил]-1H-индазол5- [4- (4-fluorophenyl) -1- (2-morpholin-4-yl-ethyl) -1H-imidazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 2-морфолиноэтиламина вместо бензиламина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 13,27 (с, 1H), 8,14 (с, 1H), 7,86 (с, 1H), 7,81 (с, 1H), 7,67 (д, J=8,54 Гц, 1H), 7,33-7,42 (м, 2H), 7,29 (д, J=8,54 Гц, 1H), 6,95-7,06 (м, 2H), 3,87 (т, J=6,41 Гц, 2H), 3,42-3,51 (м, 4H), 2,40 (т, J=6,56 Гц, 2H), 2,21 (д, J=3,97 Гц, 4H). MS (ESI+) m/z 392,1 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 2-morpholinoethylamine instead of benzylamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 13.27 (s, 1H), 8.14 (s, 1H), 7.86 (s, 1H), 7.81 (s, 1H), 7.67 (d, J = 8.54 Hz, 1H ), 7.33-7.42 (m, 2H), 7.29 (d, J = 8.54 Hz, 1H), 6.95-7.06 (m, 2H), 3.87 (t, J = 6.41 Hz, 2H), 3.42-3.51 (m, 4H), 2.40 (t, J = 6.56 Hz, 2H), 2.21 (d, J = 3.97 Hz, 4H). MS (ESI +) m / z 392.1 (M + H) + .
Пример 99Example 99
5-[1-(1-бензилпирролидин-3-ил)-4-(4-фторфенил)-1H-имидазол-5-ил]-1H-индазол5- [1- (1-benzylpyrrolidin-3-yl) -4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 3-пирролидинобензиламина вместо бензиламина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 13,29 (с, 1H), 8,13 (с, 1H), 8,03 (с, 1H), 7,76 (с, 1H), 7,67 (д, J=8,54 Гц, 1H), 7,29-7,38 (м, 6H), 7,20-7,28 (м, 2H), 6,98 (т, J=9,00 Гц, 2H), 4,25-4,34 (м, 1H), 3,53-3,69 (м, 2H), 2,89-2,97 (м, 1H), 2,84 (д, J=9,76, 3,05 Гц, 1H), 2,55 (д, J=10,07, 6,71 Гц, 1H), 2,17-2,34 (м, 2H), 1,92-2,03 (м, 1H). MS (ESI+) m/z 438,1 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 3-pyrrolidinobenzylamine instead of benzylamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 13.29 (s, 1H), 8.13 (s, 1H), 8.03 (s, 1H), 7.76 (s, 1H), 7.67 (d, J = 8.54 Hz, 1H ), 7.29-7.38 (m, 6H), 7.20-7.28 (m, 2H), 6.98 (t, J = 9.00 Hz, 2H), 4.25-4, 34 (m, 1H), 3.53-3.69 (m, 2H), 2.89-2.97 (m, 1H), 2.84 (d, J = 9.76, 3.05 Hz, 1H), 2.55 (d, J = 10.07, 6.71 Hz, 1H), 2.17-2.34 (m, 2H), 1.92-2.03 (m, 1H). MS (ESI +) m / z 438.1 (M + H) + .
Пример 100Example 100
Пример 100 удален и не является частью данного документа.Example 100 is deleted and is not part of this document.
Пример 101Example 101
2-{4-[4-(4-фторфенил)-5-(1H-индазол-5-ил)-1H-имидазол-1-ил]пиперидин-1-ил}-2-оксоэтанол2- {4- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] piperidin-1-yl} -2-oxoethanol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 39, с использованием 1-(4-аминопиперидин-1-ил)-2-гидроксиэтанона вместо бензиламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 13,27 (с, 1H), 8,14 (с, 1H), 7,99 (с, 1H), 7,81 (с, 1H), 7,69 (д, J=8,48 Гц, 1H), 7,25-7,39 (м, 4H), 6,91-7,03 (м, 2H), 4,48 (т, J=5,43 Гц, 1H), 4,34-4,44 (м, 1H), 4,07 (т, J=5,59 Гц, 1H), 3,79-3,91 (м, 1H), 3,64-3,77 (м, 1H), 2,85 (м, 1H), 2,77-2,90 (м, 5H). MS (DCI) m/z 420 (M+H)+.The title compound was prepared according to the procedure described in Example 39 using 1- (4-aminopiperidin-1-yl) -2-hydroxyethanone instead of benzylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 13.27 (s, 1H), 8.14 (s, 1H), 7.99 (s, 1H), 7.81 (s, 1H), 7.69 (d, J = 8.48 Hz, 1H ), 7.25-7.39 (m, 4H), 6.91-7.03 (m, 2H), 4.48 (t, J = 5.43 Hz, 1H), 4.34-4, 44 (m, 1H), 4.07 (t, J = 5.59 Hz, 1H), 3.79-3.91 (m, 1H), 3.64-3.77 (m, 1H), 2 85 (m, 1H); 2.77-2.90 (m, 5H). MS (DCI) m / z 420 (M + H) + .
Пример 102Example 102
5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Пример 102AExample 102A
5-(1-Бензил-5-фенил-1H-1,2,3-триазол-4-ил)-2-фторбензонитрил5- (1-Benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -2-fluorobenzonitrile
Соединение Примера 87B (415 мг, 0,792 ммоль), 5-бром-2-фторбензонитрил (158 мг, 0,790 ммоль), дихлорбис(трифенилфосфин)палладий(II) (52 мг, 0,074 ммоль) и тиофен-2-карбоксилат меди (226 мг, 1,19 ммоль) объединяли в толуоле (2 мл) в микроволновом сосуде в инертной атмосфере азота. Сосуд нагревали в микроволновом устройстве (CEM-Discover) до 150°C при 125 Ватт в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент этилацетата в гексане (5-40%), с получением указанного в заголовке соединения. MS (ESI+) m/z 355,1 (M+H)+.The compound of Example 87B (415 mg, 0.792 mmol), 5-bromo-2-fluorobenzonitrile (158 mg, 0.790 mmol), dichlorobis (triphenylphosphine) palladium (II) (52 mg, 0.074 mmol) and copper thiophene-2-carboxylate (226 mg, 1.19 mmol) were combined in toluene (2 ml) in a microwave vessel in an inert atmosphere of nitrogen. The vessel was heated in a microwave device (CEM-Discover) to 150 ° C at 125 watts for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of ethyl acetate in hexane (5-40%) to elute to afford the title compound. MS (ESI +) m / z 355.1 (M + H) + .
Пример 102BExample 102B
5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Соединение Примера 102A (120 мг, 0,339 ммоль) обрабатывали гидразингидратом (1,0 мл) в этаноле (1,0 мл) и нагревали до 60°C в течение ночи. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,40 (с, 1H), 8,06 (с, 1H), 7,42-7,55 (м, 3H), 7,23-7,33 (м, 5H), 7,02-7,10 (м, 2H), 6,94-7,02 (м, 2H), 5,49 (с, 2H), 5,34 (с, 2H). MS (ESI+) m/z 367,1 (M+H)+.The compound of Example 102A (120 mg, 0.339 mmol) was treated with hydrazine hydrate (1.0 ml) in ethanol (1.0 ml) and heated to 60 ° C. overnight. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.40 (s, 1H), 8.06 (s, 1H), 7.42-7.55 (m, 3H), 7.23-7.33 (m, 5H), 7.02-7, 10 (m, 2H), 6.94-7.02 (m, 2H), 5.49 (s, 2H), 5.34 (s, 2H). MS (ESI +) m / z 367.1 (M + H) + .
Пример 103Example 103
2-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]пропан-2-ол2- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-2-ol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 2-метил-3-бутин-2-ола вместо 3-фенил-1-пропина, за исключением того, что неочищенную реакционную смесь гасили при помощи 2 мл 1 н водного раствора NaOH; и перемешивали в течение 1,5 часов при температуре окружающей среды. Суспензию затем сушили путем испарения с использованием потока нагретого газообразного азота перед осуществлением эстракции. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,51 (с, 1H), 8,22-8,29 (м, 2H), 7,88 (д, J=9,00, 1,98 Гц, 1H), 7,77 (д, J=8,85 Гц, 1H), 1,57 (с, 6H). MS (ESI+) m/z 244,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 2-methyl-3-butyn-2-ol instead of 3-phenyl-1-propine, except that the crude reaction mixture was quenched with 2 ml 1 n aqueous NaOH solution; and stirred for 1.5 hours at ambient temperature. The suspension was then dried by evaporation using a stream of heated nitrogen gas before performing the extraction. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.51 (s, 1H), 8.22-8.29 (m, 2H), 7.88 (d, J = 9.00, 1.98 Hz, 1H), 7.77 (d, J = 8.85 Hz, 1H); 1.57 (s, 6H). MS (ESI +) m / z 244.0 (M + H) + .
Пример 104Example 104
5-[4-(метоксиметил)-1H-1,2,3-триазол-1-ил]-1H-индазол5- [4- (methoxymethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием метилпропаргилового эфира вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,73 (с, 1H), 8,23-8,29 (м, J=1,83 Гц, 2H), 7,88 (д, J=8,85, 2,14 Гц, 1H), 7,78 (д, J=9,15 Гц, 1H), 4,57 (с, 2H), 3,35 (с, 3H). MS (ESI+) m/z 230,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using methylpropargyl ether instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.73 (s, 1H), 8.23-8.29 (m, J = 1.83 Hz, 2H), 7.88 (d, J = 8.85, 2.14 Hz, 1H), 7 78 (d, J = 9.15 Hz, 1H); 4.57 (s, 2H); 3.35 (s, 3H). MS (ESI +) m / z 230.0 (M + H) + .
Пример 105Example 105
1-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]-1-фенилэтанол1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] -1-phenylethanol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 2-фенил-3-бутин-2-ола вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,52 (с, 1H), 8,21-8,28 (м, 2H), 7,87 (д, J=8,85, 2,14 Гц, 1H), 7,76 (д, J=9,15 Гц, 1H), 7,51-7,57 (м, 2H), 7,34 (т, J=7,78 Гц, 2H), 7,24 (т, J=7,32 Гц, 1H), 1,92 (с, 3H). MS (ESI+) m/z 306,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 2-phenyl-3-butyn-2-ol instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.52 (s, 1H), 8.21-8.28 (m, 2H), 7.87 (d, J = 8.85, 2.14 Hz, 1H), 7.76 (d, J = 9.15 Hz, 1H), 7.51-7.57 (m, 2H), 7.34 (t, J = 7.78 Hz, 2H), 7.24 (t, J = 7.32 Hz, 1H), 1.92 (s, 3H). MS (ESI +) m / z 306.0 (M + H) + .
Пример 106Example 106
5-(4-пропил-1H-1,2,3-триазол-1-ил)-1H-индазол5- (4-propyl-1H-1,2,3-triazol-1-yl) -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 1-пентина вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,50 (с, 1H), 8,20-8,30 (м, 2H), 7,87 (д, J=9,00, 1,98 Гц, 1H), 7,77 (д, J=8,85 Гц, 1H), 2,71 (т, J=7,48 Гц, 2H), 1,64-1,78 (м, 2H), 0,97 (т, J=7,32 Гц, 3H). MS (ESI+) m/z 228,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 1-pentin instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.50 (s, 1H), 8.20-8.30 (m, 2H), 7.87 (d, J = 9.00, 1.98 Hz, 1H), 7.77 (d, J = 8.85 Hz, 1H), 2.71 (t, J = 7.48 Hz, 2H), 1.64-1.78 (m, 2H), 0.97 (t, J = 7.32 Hz, 3H). MS (ESI +) m / z 228.0 (M + H) + .
Пример 107Example 107
1-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]пропан-2-ол1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-2-ol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием пент-4-ин-2-ола вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,49 (с, 1H), 8,20-8,33 (м, 2H), 7,88 (дд, J=9,00, 1,98 Гц, 1H), 7,74-7,82 (м, 1H), 3,95-4,08 (м, 1H), 2,74-2,89 (м, 2H), 1,16 (д, J=6,10 Гц, 3H). MS (ESI+) m/z 244,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using pent-4-in-2-ol instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.49 (s, 1H), 8.20-8.33 (m, 2H), 7.88 (dd, J = 9.00, 1.98 Hz, 1H), 7.74-7.82 ( m, 1H), 3.95-4.08 (m, 1H), 2.74-2.89 (m, 2H), 1.16 (d, J = 6.10 Hz, 3H). MS (ESI +) m / z 244.0 (M + H) + .
Пример 108Example 108
3-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]пропан-1-ол3- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-1-ol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 4-пентин-1-ола вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,50 (с, 1H), 8,28 (с, 1H), 8,23 (д, J=1,83 Гц, 1H), 7,83-7,91 (м, 1H), 7,74-7,82 (м, 1H), 4,50 (т, J=6,41 Гц, 1H), 3,51 (т, J=6,41 Гц, 2H), 2,77 (т, J=7,63 Гц, 2H), 1,80-1,90 (м, 2H). MS (ESI+) m/z 244,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 4-pentin-1-ol instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.50 (s, 1H), 8.28 (s, 1H), 8.23 (d, J = 1.83 Hz, 1H), 7.83-7.91 (m, 1H), 7.74 -7.82 (m, 1H), 4.50 (t, J = 6.41 Hz, 1H), 3.51 (t, J = 6.41 Hz, 2H), 2.77 (t, J = 7.63 Hz, 2H); 1.80-1.90 (m, 2H). MS (ESI +) m / z 244.0 (M + H) + .
Пример 109Example 109
1-{[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]метил}-1H-1,2,3-бензотриазол1 - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} -1H-1,2,3-benzotriazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 1-пропаргил-1H-бензотриазола вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,91 (с, 1H), 8,21-8,29 (м, 2H), 8,07 (д, J=8,54 Гц, 1H), 7,99 (д, J=8,54 Гц, 1H), 7,84 (д, J=9,00, 1,98 Гц, 1H), 7,72-7,81 (м, 1H), 7,57-7,65 (м, 1H), 7,41-7,52 (м, 1H), 6,16 (с, 2H). MS (ESI-) m/z 315,0 (M-H)-.The title compound was prepared according to the procedure described in Example 88 using 1-propargyl-1H-benzotriazole instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.91 (s, 1H), 8.21-8.29 (m, 2H), 8.07 (d, J = 8.54 Hz, 1H), 7.99 (d, J = 8.54 Hz , 1H), 7.84 (d, J = 9.00, 1.98 Hz, 1H), 7.72-7.81 (m, 1H), 7.57-7.65 (m, 1H), 7.41-7.52 (m, 1H); 6.16 (s, 2H). MS (ESI-) m / z 315.0 (MH) - .
Пример 110Example 110
5-{4-[(фенилтио)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол5- {4 - [(phenylthio) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием фенилпропаргилсульфида вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,59 (с, 1H), 8,26 (с, 1H), 8,21 (д, J=1,22 Гц, 1H), 7,80-7,86 (м, 1H), 7,72-7,79 (м, 1H), 7,43 (д, J=8,39, 1,37 Гц, 2H), 7,35 (т, J=7,78 Гц, 2H), 7,22 (т, J=7,32 Гц, 1H), 4,38 (с, 2H). MS (ESI+) m/z 308,3 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using phenylpropargyl sulfide instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.59 (s, 1H), 8.26 (s, 1H), 8.21 (d, J = 1.22 Hz, 1H), 7.80-7.86 (m, 1H), 7.72 -7.79 (m, 1H), 7.43 (d, J = 8.39, 1.37 Hz, 2H), 7.35 (t, J = 7.78 Hz, 2H), 7.22 ( t, J = 7.32 Hz, 1H), 4.38 (s, 2H). MS (ESI +) m / z 308.3 (M + H) + .
Пример 111Example 111
5-(4-циклопропил-1H-1,2,3-триазол-1-ил)-1H-индазол5- (4-cyclopropyl-1H-1,2,3-triazol-1-yl) -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием циклопропилацетилена вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,46 (с, 1H), 8,25 (с, 1H), 8,20 (д, J=1,53 Гц, 1H), 7,84 (д, J=9,00, 1,98 Гц, 1H), 7,76 (д, J=8,85 Гц, 1H), 1,97-2,14 (м, 1H), 0,93-1,06 (м, 2H), 0,77-0,91 (м, 2H). MS (ESI+) m/z 226,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using cyclopropylacetylene instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.46 (s, 1H), 8.25 (s, 1H), 8.20 (d, J = 1.53 Hz, 1H), 7.84 (d, J = 9.00, 1.98 Hz , 1H), 7.76 (d, J = 8.85 Hz, 1H), 1.97-2.14 (m, 1H), 0.93-1.06 (m, 2H), 0.77- 0.91 (m, 2H). MS (ESI +) m / z 226.0 (M + H) + .
Пример 112Example 112
5-[4-(2-фенилэтил)-1H-1,2,3-триазол-1-ил]-1H-индазол5- [4- (2-phenylethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 1-фенил-1-бутина вместо 3-фенил-1-пропина. Продукт представлял собой 1:1 смесь исходного вещества и указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,48 (с, 1H), 8,25 (с, 1H), 8,21 (д, J=1,53 Гц, 1H), 8,06 (с, 1H), 7,81-7,89 (м, 1H), 7,73-7,80 (м, 1H), 7,61 (дд, J=8,85, 1,53 Гц, 1H), 7,45 (д, J=8,54 Гц, 1H), 7,25-7,36 (м, 4H), 7,17-7,25 (м, 1H), 3,04 (с, 4H). MS (ESI+) m/z 290,1 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 1-phenyl-1-butine instead of 3-phenyl-1-propine. The product was a 1: 1 mixture of the starting material and the title compound. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.48 (s, 1H), 8.25 (s, 1H), 8.21 (d, J = 1.53 Hz, 1H), 8.06 (s, 1H), 7.81-7.89 (m, 1H), 7.73-7.80 (m, 1H), 7.61 (dd, J = 8.85, 1.53 Hz, 1H), 7.45 (d, J = 8.54 Hz, 1H), 7.25-7.36 (m, 4H), 7.17-7.25 (m, 1H), 3.04 (s, 4H). MS (ESI +) m / z 290.1 (M + H) + .
Пример 113Example 113
5-[4-(циклогексилметил)-1H-1,2,3-триазол-1-ил]-1H-индазол5- [4- (cyclohexylmethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 3-циклогексил-1-пропина вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,49 (с, 1H), 8,21-8,29 (м, 2H), 7,88 (д, J=9,00, 1,98 Гц, 1H), 7,77 (д, J=8,85 Гц, 1H), 2,61 (д, J=6,71 Гц, 2H), 1,54-1,77 (м, 6H), 1,08-1,30 (м, 3H), 0,91-1,05 (м, 2H). MS (ESI+) m/z 282,2 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 3-cyclohexyl-1-propine instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.49 (s, 1H), 8.21-8.29 (m, 2H), 7.88 (d, J = 9.00, 1.98 Hz, 1H), 7.77 (d, J = 8.85 Hz, 1H), 2.61 (d, J = 6.71 Hz, 2H), 1.54-1.77 (m, 6H), 1.08-1.30 (m, 3H), 0.91-1.05 (m, 2H). MS (ESI +) m / z 282.2 (M + H) + .
Пример 114Example 114
5-(4-циклопентил-1H-1,2,3-триазол-1-ил)-1H-индазол5- (4-cyclopentyl-1H-1,2,3-triazol-1-yl) -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием циклопентилацетилена вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,52 (с, 1H), 8,19-8,30 (м, 2H), 7,88 (д, J=9,00, 1,98 Гц, 1H), 7,77 (д, J=8,85 Гц, 1H), 3,13-3,27 (м, 1H), 1,98-2,15 (м, 2H), 1,57-1,84 (м, 6H). MS (ESI+) m/z 254,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using cyclopentylacetylene instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.52 (s, 1H), 8.19-8.30 (m, 2H), 7.88 (d, J = 9.00, 1.98 Hz, 1H), 7.77 (d, J = 8.85 Hz, 1H), 3.13-3.27 (m, 1H), 1.98-2.15 (m, 2H), 1.57-1.84 (m, 6H). MS (ESI +) m / z 254.0 (M + H) + .
Пример 115Example 115
1-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]циклогексанол1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] cyclohexanol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 1-этинил-1-циклогексанола вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,52 (с, 1H), 8,21-8,30 (м, J=1,53 Гц, 2H), 7,89 (дд, J=9,00, 1,98 Гц, 1H), 7,77 (д, J=8,85 Гц, 1H), 2,16-2,46 (м, 1H), 1,92-2,05 (м, 2H), 1,77-1,86 (м, 2H), 1,61-1,77 (м, 2H), 1,51-1,59 (м, 1H), 1,42-1,51 (м, 2H), 1,28-1,40 (м, J=9,92, 2,90 Гц, 1H). MS (ESI+) m/z 284,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 1-ethynyl-1-cyclohexanol instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.52 (s, 1H), 8.21-8.30 (m, J = 1.53 Hz, 2H), 7.89 (dd, J = 9.00, 1.98 Hz, 1H), 7 77 (d, J = 8.85 Hz, 1H), 2.16-2.46 (m, 1H), 1.92-2.05 (m, 2H), 1.77-1.86 (m , 2H), 1.61-1.77 (m, 2H), 1.51-1.59 (m, 1H), 1.42-1.51 (m, 2H), 1.28-1.40 (m, J = 9.92, 2.90 Hz, 1H). MS (ESI +) m / z 284.0 (M + H) + .
Пример 116Example 116
5-[4-(феноксиметил)-1H-1,2,3-триазол-1-ил]-1H-индазол5- [4- (phenoxymethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием фенилпропаргилового эфира вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,87 (с, 1H), 8,22-8,34 (м, 2H), 7,89 (д, J=8,85, 1,83 Гц, 1H), 7,79 (д, J=9,15 Гц, 1H), 7,29-7,41 (м, 2H), 7,09 (д, J=7,63 Гц, 2H), 6,99 (т, J=7,32 Гц, 1H), 5,25 (с, 2H). MS (ESI+) m/z 292,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using phenylpropargyl ether instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.87 (s, 1H), 8.22-8.34 (m, 2H), 7.89 (d, J = 8.85, 1.83 Hz, 1H), 7.79 (d, J = 9.15 Hz, 1H), 7.29-7.41 (m, 2H), 7.09 (d, J = 7.63 Hz, 2H), 6.99 (t, J = 7.32 Hz, 1H), 5.25 (s, 2H). MS (ESI +) m / z 292.0 (M + H) + .
Пример 117Example 117
5-{4-[(1,1-диоксидотиоморфолин-4-ил)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол5- {4 - [(1,1-dioxidothiomorpholin-4-yl) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием N-пропаргилтиоморфолин-сульфона вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,81 (с, 1H), 8,24-8,36 (м, 2H), 7,89 (д, J=9,00, 1,98 Гц, 1H), 7,80 (д, J=9,15 Гц, 1H), 4,38 (с, 2H), 3,30-3,56 (м, J=39,36 Гц, 8H). MS (ESI+) m/z 332,9 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using N-propargylthiomorpholine sulfone instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.81 (s, 1H), 8.24-8.36 (m, 2H), 7.89 (d, J = 9.00, 1.98 Hz, 1H), 7.80 (d, J = 9.15 Hz, 1H), 4.38 (s, 2H), 3.30-3.56 (m, J = 39.36 Hz, 8H). MS (ESI +) m / z 332.9 (M + H) + .
Пример 118Example 118
5-[4-(3-фенилпропил)-1H-1,2,3-триазол-1-ил]-1H-индазол5- [4- (3-phenylpropyl) -1H-1,2,3-triazol-1-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 1-фенил-1-пентина вместо 3-фенил-1-пропина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 8,52 (с, 1H), 8,26 (с, 1H), 8,23 (д, J=1,53 Гц, 1H), 7,87 (д, J=9,00, 1,98 Гц, 1H), 7,76 (д, J=9,15 Гц, 1H), 7,31 (т, J=7,32 Гц, 2H), 7,23-7,28 (м, 2H), 7,20 (т, J=7,32 Гц, 1H), 2,74 (т, J=7,63 Гц, 2H), 2,65-2,72 (м, 2H), 1,95-2,05 (м, 2H). MS (ESI+) m/z 304,2 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 1-phenyl-1-pentin instead of 3-phenyl-1-propine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 8.52 (s, 1H), 8.26 (s, 1H), 8.23 (d, J = 1.53 Hz, 1H), 7.87 (d, J = 9.00, 1.98 Hz , 1H), 7.76 (d, J = 9.15 Hz, 1H), 7.31 (t, J = 7.32 Hz, 2H), 7.23-7.28 (m, 2H), 7 , 20 (t, J = 7.32 Hz, 1H), 2.74 (t, J = 7.63 Hz, 2H), 2.65-2.72 (m, 2H), 1.95-2, 05 (m, 2H). MS (ESI +) m / z 304.2 (M + H) + .
Пример 119Example 119
[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил](фенил)метанон[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (phenyl) methanone
Пример 119AExample 119A
трет-Бутил 5-этинил-1H-индазол-1-карбоксилатtert-Butyl 5-ethynyl-1H-indazole-1-carboxylate
К раствору соединения Примера 3C (230 мг, 1,62 ммоль) в дихлорметане (10 мл) добавляли ди-трет-бутилдикарбонат (459 мг, 2,1 ммоль) и щепотку диметиламинопиридина (~3 мг) и смесь перемешивали в течение 30 минут при комнатной температуре. Добавляли воду и продукт экстрагировали дихлорметаном, сушили над сульфатом натрия, фильтровали и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения. MS (ESI+) m/z 265,0 (M+Na)+.To a solution of the compound of Example 3C (230 mg, 1.62 mmol) in dichloromethane (10 ml) was added di-tert-butyl dicarbonate (459 mg, 2.1 mmol) and a pinch of dimethylaminopyridine (~ 3 mg) and the mixture was stirred for 30 minutes at room temperature. Water was added and the product was extracted with dichloromethane, dried over sodium sulfate, filtered and the solvent was evaporated under reduced pressure to obtain the title compound. MS (ESI +) m / z 265.0 (M + Na) + .
Пример 119BExample 119B
[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил](фенил)метанон[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (phenyl) methanone
В атмосфере аргона сосуд, содержащий соединение Примера 119A (90 мг, 0,37 ммоль), бензилазид (0,047 мл, 0,37 ммоль), тетрагидрофуран (3 мл), триэтиламин (0,062 мл, 0,44 ммоль), CuI (71 мг, 0,37 ммоль) и бензоилхлорид (0,059 мл, 0,51 ммоль), закрывали крышкой и встряхивали в течение 16 часов. Растворители выпаривали и продукт очищали при помощи колоночной хроматографии на силикагеле в 5-30% этилацетата в гексане. Неочищенное вещество обрабатывали при помощи ТФУ (0,5 мл) в дихлорметане (1 мл) и очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 13,08 (с, 1H), 7,98 (с, 1H), 7,77 (с, 1H), 7,54 (д, J=8,24, 1,22 Гц, 2H), 7,43-7,48 (м, 1H), 7,33-7,40 (м, 2H), 7,22-7,30 (м, 5H), 7,17-7,21 (м, 2H), 5,74 (с, 2H). MS (ESI+) m/z 380,1 (M+H)+.In an argon atmosphere, a vessel containing the compound of Example 119A (90 mg, 0.37 mmol), benzylazide (0.047 ml, 0.37 mmol), tetrahydrofuran (3 ml), triethylamine (0.062 ml, 0.44 mmol), CuI (71 mg, 0.37 mmol) and benzoyl chloride (0.059 ml, 0.51 mmol) were capped and shaken for 16 hours. The solvents were evaporated and the product was purified by silica gel column chromatography in 5-30% ethyl acetate in hexane. The crude material was treated with TFA (0.5 ml) in dichloromethane (1 ml) and purified by reverse phase HPLC using an acetonitrile / water gradient elution method of 0.1% TFA to give the title compound. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 13.08 (s, 1H), 7.98 (s, 1H), 7.77 (s, 1H), 7.54 (d, J = 8.24, 1.22 Hz, 2H), 7.43 -7.48 (m, 1H), 7.33-7.40 (m, 2H), 7.22-7.30 (m, 5H), 7.17-7.21 (m, 2H), 5 74 (s, 2H). MS (ESI +) m / z 380.1 (M + H) + .
Пример 120Example 120
N,N-диэтил-N-{[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]метил}аминN, N-diethyl-N - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 1,1-диэтилпропаргиламина вместо 3-фенил-1-пропина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,98 (с, 1H), 8,30 (д, J=1,36 Гц, 1H), 8,27 (с, 1H), 7,85-7,93 (м, 1H), 7,75-7,83 (м, 1H), 4,53 (д, J=4,07 Гц, 2H), 3,11-3,23 (м, 4H), 1,31 (т, J=7,12 Гц, 6H). MS (ESI+) m/z 271,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 1,1-diethylpropargylamine instead of 3-phenyl-1-propine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.98 (s, 1H), 8.30 (d, J = 1.36 Hz, 1H), 8.27 (s, 1H), 7.85-7.93 (m, 1H), 7.75 -7.83 (m, 1H), 4.53 (d, J = 4.07 Hz, 2H), 3.11-3.23 (m, 4H), 1.31 (t, J = 7.12 Hz, 6H). MS (ESI +) m / z 271.0 (M + H) + .
Пример 121Example 121
этил N-[2-(1H-индазол-5-ил)имидазо[1,2-a]пиримидин-3-ил]-бета-аланинатethyl N- [2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-yl] beta-alaninate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 43, с использованием этилизоцианопропионат вместо изопропилизоцианида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,09 (с, 1H), 8,71 (д, J=6,78, 2,03 Гц, 1H), 8,54 (с, 1H), 8,46 (д, J=4,24, 1,87 Гц, 1H), 8,23 (д, J=8,82, 1,36 Гц, 1H), 8,14 (с, 1H), 7,61 (д, J=8,82 Гц, 1H), 7,05 (д, J=6,78, 4,07 Гц, 1H), 5,03 (т, J=5,93 Гц, 1H), 3,96 (кв., J=7,12 Гц, 2H), 3,23 (кв., J=6,22 Гц, 2H), 2,47-2,55 (м, 2H), 1,08 (т, J=7,12 Гц, 3H). MS (ESI+) m/z 351,1 (M+H)+.The title compound was prepared according to the procedure described in Example 43 using ethyl isocyanopropionate instead of isopropyl isocyanide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.09 (s, 1H), 8.71 (d, J = 6.78, 2.03 Hz, 1H), 8.54 (s, 1H), 8.46 (d, J = 4.24, 1.87 Hz, 1H), 8.23 (d, J = 8.82, 1.36 Hz, 1H), 8.14 (s, 1H), 7.61 (d, J = 8.82 Hz, 1H), 7.05 (d, J = 6.78, 4.07 Hz, 1H), 5.03 (t, J = 5.93 Hz, 1H), 3.96 (q, J = 7, 12 Hz, 2H), 3.23 (q, J = 6.22 Hz, 2H), 2.47-2.55 (m, 2H), 1.08 (t, J = 7.12 Hz, 3H ) MS (ESI +) m / z 351.1 (M + H) + .
Пример 122Example 122
5-(1-бензил-5-метил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Пример 122AExample 122A
1-Бензил-5-метил-4-(трибутилстаннил)-1H-1,2,3-триазол1-Benzyl-5-methyl-4- (tributylstannyl) -1H-1,2,3-triazole
Трибутил(1-пропинил)олово (3,87 г, 11,8 ммоль) и бензилазид (2,2 мл, 17,6 ммоль) объединяли и нагревали до 150°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 464,2 (M+H)+.Tributyl (1-propynyl) tin (3.87 g, 11.8 mmol) and benzylazide (2.2 ml, 17.6 mmol) were combined and heated to 150 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 464.2 (M + H) + .
Пример 122BExample 122B
1-(5-(1-Бензил-5-метил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-ил)этанон1- (5- (1-Benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazol-1-yl) ethanone
Соединение Примера 87A (235 мг, 0,821 ммоль), соединение Примера 122A (380 мг, 0,822 ммоль), дихлорбис(трифенилфосфин)палладий(II) (60 мг, 0,085 ммоль) и тиофен-2-карбоксилат меди (325 мг, 1,23 ммоль) объединяли в толуоле (2,0 мл) в микроволновом сосуде в инертной атмосфере азота. Сосуд нагревали в микроволновом устройстве (CEM-Discover) до 150°C при 125 Ватт в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 332,2 (M+H)+.The compound of Example 87A (235 mg, 0.821 mmol), the compound of Example 122A (380 mg, 0.822 mmol), dichlorobis (triphenylphosphine) palladium (II) (60 mg, 0.085 mmol) and copper thiophene-2-carboxylate (325 mg, 1, 23 mmol) were combined in toluene (2.0 ml) in a microwave vessel under an inert nitrogen atmosphere. The vessel was heated in a microwave device (CEM-Discover) to 150 ° C at 125 watts for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 332.2 (M + H) + .
Пример 122CExample 122C
5-(1-бензил-5-метил-1H-1,2,3-триазол-4-ил)-1H-индазол5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazole
Соединение Примера 122B (109 мг, 0,329 ммоль) растворяли в тетрагидрофуране (3,0 мл) и воде (0,5 мл) и добавляли гидроксид калия (53 мг, 0,945 ммоль). Смесь перемешивали в течение 2 часов, разбавляли этилацетатом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-5% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,13 (с, 1H), 8,12 (с, 1H), 8,01 (с, 1H), 7,71-7,78 (м, 1H), 7,59-7,66 (м, 1H), 7,31-7,45 (м, 3H), 7,23-7,29 (м, 2H), 5,65 (с, 2H), 2,43 (с, 3H). MS (ESI+) m/z 290,1 (M+H)+.The compound of Example 122B (109 mg, 0.329 mmol) was dissolved in tetrahydrofuran (3.0 ml) and water (0.5 ml) and potassium hydroxide (53 mg, 0.945 mmol) was added. The mixture was stirred for 2 hours, diluted with ethyl acetate and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-5% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.13 (s, 1H), 8.12 (s, 1H), 8.01 (s, 1H), 7.71-7.78 (m, 1H), 7.59-7.66 (m, 1H), 7.31-7.45 (m, 3H), 7.23-7.29 (m, 2H), 5.65 (s, 2H), 2.43 (s, 3H). MS (ESI +) m / z 290.1 (M + H) + .
Пример 123Example 123
5-(1-бензил-5-метил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Пример 123AExample 123A
5-(1-Бензил-5-метил-1H-1,2,3-триазол-4-ил)-2-фторбензонитрил5- (1-Benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -2-fluorobenzonitrile
Соединение Примера 122A (415 мг, 0,792 ммоль), 5-бром-2-фторбензонитрил (158 мг, 0,790 ммоль), дихлорбис(трифенилфосфин)палладий(II) (52 мг, 0,074 ммоль) и тиофен-2-карбоксилат меди (226 мг, 1,19 ммоль) объединяли в толуоле (2 мл) в микроволновом сосуде в инертной атмосфере азота. Сосуд нагревали в микроволновом устройстве (CEM-Discover) при 150°C при 125 Ватт в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 293,0 (M+H)+.The compound of Example 122A (415 mg, 0.792 mmol), 5-bromo-2-fluorobenzonitrile (158 mg, 0.790 mmol), dichlorbis (triphenylphosphine) palladium (II) (52 mg, 0.074 mmol) and copper thiophene-2-carboxylate (226 mg, 1.19 mmol) were combined in toluene (2 ml) in a microwave vessel in an inert atmosphere of nitrogen. The vessel was heated in a microwave device (CEM-Discover) at 150 ° C at 125 watts for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 293.0 (M + H) + .
Пример 123BExample 123B
5-(1-бензил-5-метил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Соединение Примера 123A (120 мг, 0,339 ммоль) обрабатывали гидразингидратом (1,0 мл) в этаноле (1,0 мл) и нагревали до 60°C в течение ночи. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент метанол в дихлорметане (0-5%), с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,43 (с, 1H), 7,98 (с, 1H), 7,60 (д, J=8,65, 1,53 Гц, 1H), 7,27-7,44 (м, 4H), 7,21-7,27 (м, 2H), 5,65 (с, 2H), 5,41 (с, 2H), 2,41 (с, 3H). MS (ESI+) m/z 305,1 (M+H)+.The compound of Example 123A (120 mg, 0.339 mmol) was treated with hydrazine hydrate (1.0 ml) in ethanol (1.0 ml) and heated to 60 ° C. overnight. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of methanol in dichloromethane (0-5%) to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.43 (s, 1H), 7.98 (s, 1H), 7.60 (d, J = 8.65, 1.53 Hz, 1H), 7.27-7.44 (m, 4H) 7.21-7.27 (m, 2H); 5.65 (s, 2H); 5.41 (s, 2H); 2.41 (s, 3H). MS (ESI +) m / z 305.1 (M + H) + .
Пример 124Example 124
N3-[2-(1H-индазол-5-ил)имидазо[1,2-α]пиримидин-3-ил]-β-аланамидN 3 - [2- (1H-indazol-5-yl) imidazo [1,2-α] pyrimidin-3-yl] -β-alanamide
Соединение Примера 121 (42 мг, 0,120 ммоль) и 7 н раствор аммиака в метаноле (1,0 мл) объединяли и нагревали до 60°C в течение ночи. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент метанола в дихлорметане (1-7%), с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,09 (с, 1H), 8,76 (д, J=6,78, 2,03 Гц, 1H), 8,56 (с, 1H), 8,45 (д, J=4,07, 2,03 Гц, 1H), 8,24 (д, J=8,82, 1,36 Гц, 1H), 8,15 (с, 1H), 7,61 (д, J=8,48 Гц, 1H), 7,32 (с, 1H), 7,03 (д, J=6,78, 4,07 Гц, 1H), 6,85 (с, 1H), 4,93 (т, J=6,10 Гц, 1H), 3,11-3,23 (м, 2H), 2,32 (т, J=6,78 Гц, 2H). MS (ESI+) m/z 322,0 (M+H)+.The compound of Example 121 (42 mg, 0.120 mmol) and a 7 N solution of ammonia in methanol (1.0 ml) were combined and heated to 60 ° C. overnight. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of methanol in dichloromethane (1-7%) to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.09 (s, 1H), 8.76 (d, J = 6.78, 2.03 Hz, 1H), 8.56 (s, 1H), 8.45 (d, J = 4.07, 2.03 Hz, 1H), 8.24 (d, J = 8.82, 1.36 Hz, 1H), 8.15 (s, 1H), 7.61 (d, J = 8.48 Hz, 1H), 7.32 (s, 1H), 7.03 (d, J = 6.78, 4.07 Hz, 1H), 6.85 (s, 1H), 4.93 (t, J = 6 , 10 Hz, 1H), 3.11-3.23 (m, 2H), 2.32 (t, J = 6.78 Hz, 2H). MS (ESI +) m / z 322.0 (M + H) + .
Пример 125Example 125
5-(1-бензил-5-иод-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Пример 125AExample 125A
5-(1-Бензил-5-иод-1H-1,2,3-триазол-4-ил)-2-фторбензонитрил5- (1-Benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -2-fluorobenzonitrile
Смесь соединения Примера 62B (200 мг, 1,38 ммоль), бензилазида (0,176 мл, 1,38 ммоль), тетрагидрофурана (12 мл), триэтиламина (0,230, 1,56 ммоль), CuI (263 мг, 1,38 ммоль) и ICl (0,069 мл, 1,38 ммоль) в атмосфере аргона перемешивали при комнатной температуре в течение 24 часов. Растворитель выпаривали и неочищенную смесь растворяли в дихлорметане, загружали непосредственно в колонку с силикагелем и элюировали смесью этилацетат/гексан (10-20%) с получением указанного в заголовке соединения. MS (ESI+) m/z 404,9 (M+H)+.A mixture of the compound of Example 62B (200 mg, 1.38 mmol), benzylazide (0.176 ml, 1.38 mmol), tetrahydrofuran (12 ml), triethylamine (0.230, 1.56 mmol), CuI (263 mg, 1.38 mmol ) and ICl (0.069 ml, 1.38 mmol) under argon were stirred at room temperature for 24 hours. The solvent was evaporated and the crude mixture was dissolved in dichloromethane, loaded directly onto a silica gel column and eluted with ethyl acetate / hexane (10-20%) to give the title compound. MS (ESI +) m / z 404.9 (M + H) + .
Пример 125BExample 125B
5-(1-бензил-5-иод-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Соединение Примера 125A (50 мг, 0,12 ммоль) и гидразинмоногидрат (1 мл) в этаноле (1 мл) нагревали при 95°C в течение 2 часов. Добавляли воду и твердое вещество собирали фильтрованием и затем очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения в форме соли ТФУ. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 12,07 (с, 1H), 8,30 (с, 1H), 7,83 (д, J=8,85, 1,53 Гц, 1H), 7,44 (д, J=8,54 Гц, 1H), 7,38-7,43 (м, J=7,32, 7,32 Гц, 2H), 7,32-7,37 (м, 1H), 7,23-7,27 (м, J=7,02 Гц, 2H), 5,74 (с, 2H), 4,00 (с, 2H). MS (ESI+) m/z 417,0 (M+H)+.The compound of Example 125A (50 mg, 0.12 mmol) and hydrazine monohydrate (1 ml) in ethanol (1 ml) were heated at 95 ° C. for 2 hours. Water was added and the solid was collected by filtration and then purified by reverse phase HPLC using a gradient elution method with acetonitrile / water 0.1% TFA to give the title compound in the form of a TFA salt. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 12.07 (s, 1H), 8.30 (s, 1H), 7.83 (d, J = 8.85, 1.53 Hz, 1H), 7.44 (d, J = 8.54 Hz , 1H), 7.38-7.43 (m, J = 7.32, 7.32 Hz, 2H), 7.32-7.37 (m, 1H), 7.23-7.27 (m , J = 7.02 Hz, 2H), 5.74 (s, 2H), 4.00 (s, 2H). MS (ESI +) m / z 417.0 (M + H) + .
Пример 126Example 126
N-{3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенил}-N'-(3-метилфенил)мочевинаN- {3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} -N '- (3-methylphenyl )urea
Пример 126AExample 126A
1-(3-(1-Бензил-4-(3-циано-4-фторфенил)-1H-1,2,3-триазол-5-ил)фенил)-3-м-толилмочевина1- (3- (1-Benzyl-4- (3-cyano-4-fluorophenyl) -1H-1,2,3-triazol-5-yl) phenyl) -3-m-tolylurea
В атмосфере аргона сосуд, содержащий соединение Примера 125A (94 мг, 0,23 ммоль), 1-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-3-м-толилмочевину (полученную в соответствии с процедурой, описанной в WO2004/113304) (990 мг, 0,26 ммоль), PdCl2dppf.дихлорметан (19 мг, 0,02 ммоль), карбонат калия (64 мг, 0,46 ммоль), DME (2 мл) и воду (0,2 мл), закрывали крышкой и нагревали в нагревательном устройстве с встряхиванием при 80°C в течение 90 минут. Растворители выпаривали и продукт экстрагировали метанолом/дихлорметаном. Очистка при помощи колоночной хроматографии на силикагеле с использованием 10% этилацетата в гексане давала указанное в заголовке соединение. MS (ESI+) m/z 503,2 (M+H)+.In an argon atmosphere, a vessel containing the compound of Example 125A (94 mg, 0.23 mmol), 1- (3- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) phenyl) - 3-m-tolylurea (obtained in accordance with the procedure described in WO2004 / 113304) (990 mg, 0.26 mmol), PdCl 2 dppf. Dichloromethane (19 mg, 0.02 mmol), potassium carbonate (64 mg, 0 , 46 mmol), DME (2 ml) and water (0.2 ml) were covered with a lid and heated in a heating device with shaking at 80 ° C for 90 minutes. The solvents were evaporated and the product was extracted with methanol / dichloromethane. Purification by silica gel column chromatography using 10% ethyl acetate in hexane afforded the title compound. MS (ESI +) m / z 503.2 (M + H) + .
Пример 126BExample 126B
N-{3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенил}-N'-(3-метилфенил)мочевинаN- {3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} -N '- (3-methylphenyl )urea
Соединение Примера 126A (25 мг, 0,05 ммоль) и гидразинмоногидрат (0,5 мл) в этаноле (2 мл) нагревали при 80°C в течение 1 часа. Неочищенную смесь загружали в колонку с силикагелем и элюировали с использованием градиента 0-5% метанола в дихлорметане с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,40 (с, 1H), 8,79 (с, 1H), 8,63 (с, 1H), 8,12 (с, 1H), 7,57 (д, J=8,24, 1,22 Гц, 1H), 7,43 (т, J=1,83 Гц, 1H), 7,38 (т, J=7,93 Гц, 1H), 7,23-7,34 (м, 4H), 7,08-7,22 (м, 4H), 7,03 (д, J=6,71 Гц, 2H), 6,88 (д, J=7,63 Гц, 1H), 6,78 (д, J=7,32 Гц, 1H), 5,50 (с, 2H), 5,36 (с, 2H), 2,26 (с, 3H). MS (ESI+) m/z 515,3 (M+H)+.The compound of Example 126A (25 mg, 0.05 mmol) and hydrazine monohydrate (0.5 ml) in ethanol (2 ml) were heated at 80 ° C. for 1 hour. The crude mixture was loaded onto a silica gel column and eluted using a gradient of 0-5% methanol in dichloromethane to give the title compound. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.40 (s, 1H), 8.79 (s, 1H), 8.63 (s, 1H), 8.12 (s, 1H), 7.57 (d, J = 8.24, 1, 22 Hz, 1H), 7.43 (t, J = 1.83 Hz, 1H), 7.38 (t, J = 7.93 Hz, 1H), 7.23-7.34 (m, 4H) , 7.08-7.22 (m, 4H), 7.03 (d, J = 6.71 Hz, 2H), 6.88 (d, J = 7.63 Hz, 1H), 6.78 ( d, J = 7.32 Hz, 1H), 5.50 (s, 2H), 5.36 (s, 2H), 2.26 (s, 3H). MS (ESI +) m / z 515.3 (M + H) + .
Пример 127Example 127
5-(1H-индазол-5-ил)-N-(2-изопропоксиэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-isopropoxyethyl) isoxazole-3-carboxamide
В 20-мл сосуд добавляли раствор соединения Примера 81A (37 мг, 0,18 ммоль), растворенного в диметилформамиде (0,8 мл), с последующим добавлением HATU (61 мг, 0,18 ммоль), растворенного в диметилформамиде (0,8 мл). Затем добавляли раствор 2-изопропоксиэтанамина (20 мг, 0,20 ммоль), растворенного в диметилформамиде (0,9 мл), с последующим добавлением диизопропилэтиламина (42 мг, 0,36 ммоль), растворенного в диметилформамиде (0,8 мл). Смесь затем встряхивали при 40°C в течение трех часов. Неочищенную реакционную смесь фильтровали через Si-карбонатный картридж (6 мл, 2 г), поставляемый компанией Silicycle Chemical Division, с использованием метанола, контролировали методом ЖХ/МС и концентрировали досуха. Остаток растворяли в смеси 1:1 DMSO/метанол и очищали при помощи обращенно-фазовой ВЭЖХ (Agilent, градиент 5%-100% ТФУ/вода, в течение 8 минут). 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,38-8,43 (м, 1H), 8,22-8,30 (м, 1H), 7,90 (д, 1H), 7,73 (д, 1H), 7,21-7,29 (м, 1H), 3,56-3,65 (м, 1H), 3,52 (т, 2H), 3,43 (т, 2H), 1,10 (д, 6H). MS (ESI+) m/z 315 (M+H)+.A solution of the compound of Example 81A (37 mg, 0.18 mmol) dissolved in dimethylformamide (0.8 ml) was added to a 20-ml vessel, followed by the addition of HATU (61 mg, 0.18 mmol) dissolved in dimethylformamide (0, 8 ml). Then, a solution of 2-isopropoxyethanamine (20 mg, 0.20 mmol) dissolved in dimethylformamide (0.9 ml) was added, followed by diisopropylethylamine (42 mg, 0.36 mmol) dissolved in dimethylformamide (0.8 ml). The mixture was then shaken at 40 ° C for three hours. The crude reaction mixture was filtered through a Si-carbonate cartridge (6 ml, 2 g) supplied by Silicycle Chemical Division using methanol, monitored by LC / MS and concentrated to dryness. The residue was dissolved in a 1: 1 DMSO / methanol mixture and purified by reverse phase HPLC (Agilent, gradient 5% -100% TFA / water, over 8 minutes). 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.38-8.43 (m, 1H), 8.22-8.30 (m, 1H), 7.90 (d, 1H), 7.73 (d, 1H), 7.21-7, 29 (m, 1H), 3.56-3.65 (m, 1H), 3.52 (t, 2H), 3.43 (t, 2H), 1.10 (d, 6H). MS (ESI +) m / z 315 (M + H) + .
Пример 128Example 128
5-[3-(морфолин-4-илкарбонил)изоксазол-5-ил]-1H-индазол5- [3- (morpholin-4-ylcarbonyl) isoxazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием морфолина вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,36-8,43 (м, 1H), 8,22-8,29 (м, 1H), 7,89 (д, 1H), 7,72 (д, 1H), 7,11-7,22 (м, 1H), 3,68-3,72 (м, 4H), 3,61-3,68 (м, 4H). MS (ESI+) m/z 299 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using morpholine instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.36-8.43 (m, 1H), 8.22-8.29 (m, 1H), 7.89 (d, 1H), 7.72 (d, 1H), 7.11-7, 22 (m, 1H), 3.68-3.72 (m, 4H), 3.61-3.68 (m, 4H). MS (ESI +) m / z 299 (M + H) + .
Пример 129Example 129
5-(1H-индазол-5-ил)-N-(3-морфолин-4-илпропил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (3-morpholin-4-ylpropyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 127, с использованием 3-морфолинопропан-1-амина вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,37-8,46 (м, 1H), 8,20-8,31 (м, 1H), 7,91 (д, 1H), 7,73 (д, 1H), 7,17-7,36 (м, 1H), 3,98-4,08 (м, 2H), 3,57-3,73 (м, 2H), 3,42-3,51 (м, 2H), 3,35-3,41 (м, 2H), 3,14-3,22 (м, 2H), 3,01-3,14 (м, 2H), 1,88-2,06 (м, 2H). MS (ESI+) m/z 356 (M+H)+.The title compound was prepared in the form of a TFA salt in accordance with the procedure described in Example 127 using 3-morpholinopropan-1-amine instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.37-8.46 (m, 1H), 8.20-8.31 (m, 1H), 7.91 (d, 1H), 7.73 (d, 1H), 7.17-7, 36 (m, 1H), 3.98-4.08 (m, 2H), 3.57-3.73 (m, 2H), 3.42-3.51 (m, 2H), 3.35- 3.41 (m, 2H), 3.14-3.22 (m, 2H), 3.01-3.14 (m, 2H), 1.88-2.06 (m, 2H). MS (ESI +) m / z 356 (M + H) + .
Пример 130Example 130
N-[2-(1H-имидазол-4-ил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2- (1H-imidazol-4-yl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием 2-(1H-имидазол-4-ил)этанамина вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,90-8,97 (м, 1H), 8,34-8,46 (м, 1H), 8,20-8,32 (м, 1H), 7,90 (д, 1H), 7,72 (д, 1H), 7,38-7,49 (м, 1H), 7,14-7,28 (м, 1H), 3,57 (т, 2H), 2,96 (т, 2H). MS (ESI+) m/z 323 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using 2- (1H-imidazol-4-yl) ethanamine instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.90-8.97 (m, 1H), 8.34-8.46 (m, 1H), 8.20-8.32 (m, 1H), 7.90 (d, 1H), 7, 72 (d, 1H), 7.38-7.49 (m, 1H), 7.14-7.28 (m, 1H), 3.57 (t, 2H), 2.96 (t, 2H) . MS (ESI +) m / z 323 (M + H) + .
Пример 131Example 131
(3R)-1-{[5-(1H-индазол-5-ил)изоксазол-3-ил]-карбонил}пиперидин-3-ол(3R) -1 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperidin-3-ol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием гидрохлорида (R)-пиперидин-3-ола вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,34-8,45 (м, 1H), 8,19-8,30 (м, 1H), 7,89 (д, 1H), 7,72 (д, 1H), 7,13 (д, 1H), 4,03-4,19 (м, 1H), 3,64-3,72 (м, 1H), 3,54-3,62 (м, 1H), 3,34-3,44 (м, 1H), 3,20-3,32 (м, 1H), 2,99-3,10 (м, 1H), 1,67-2,03 (м, 2H), 1,36-1,61 (м, 2H). MS (ESI+) m/z 313 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using (R) -piperidin-3-ol hydrochloride instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.34-8.45 (m, 1H), 8.19-8.30 (m, 1H), 7.89 (d, 1H), 7.72 (d, 1H), 7.13 (d, 1H), 4.03-4.19 (m, 1H), 3.64-3.72 (m, 1H), 3.54-3.62 (m, 1H), 3.34-3.44 ( m, 1H), 3.20-3.32 (m, 1H), 2.99-3.10 (m, 1H), 1.67-2.03 (m, 2H), 1.36-1, 61 (m, 2H). MS (ESI +) m / z 313 (M + H) + .
Пример 132Example 132
1-{[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}пиперидин-3-карбоксамид1 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperidin-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием пиперидин-3-карбоксамида вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,36-8,45 (м, 1H), 8,22-8,32 (м, 1H), 7,90 (д, 1H), 7,72 (д, 1H), 7,07-7,23 (м, 1H), 4,27-4,56 (м, 1H), 3,91-4,05 (м, 1H), 3,09-3,37 (м, 1H), 2,85-3,04 (м, 1H), 2,31-2,45 (м, 1H), 1,89-2,05 (м, 1H), 1,73-1,86 (м, 1H), 1,60-1,72 (м, 1H), 1,36-1,55 (м, 1H). MS (ESI-) m/z 338 (M-H)-.The title compound was prepared according to the procedure described in Example 127 using piperidine-3-carboxamide instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.36-8.45 (m, 1H), 8.22-8.32 (m, 1H), 7.90 (d, 1H), 7.72 (d, 1H), 7.07-7, 23 (m, 1H), 4.27-4.56 (m, 1H), 3.91-4.05 (m, 1H), 3.09-3.37 (m, 1H), 2.85- 3.04 (m, 1H), 2.31-2.45 (m, 1H), 1.89-2.05 (m, 1H), 1.73-1.86 (m, 1H), 1, 60-1.72 (m, 1H); 1.36-1.55 (m, 1H). MS (ESI-) m / z 338 (MH) - .
Пример 133Example 133
2-[2-(4-{[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}пиперазин-1-ил)этокси]этанол2- [2- (4 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperazin-1-yl) ethoxy] ethanol
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 127, с использованием 2-(2-(пиперазин-1-ил)этокси)этанола вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,39-8,48 (м, 1H), 8,19-8,32 (м, 1H), 7,92 (д, 1H), 7,74 (д, 1H), 7,17-7,27 (м, 1H), 4,49-4,60 (м, 1H), 3,94-4,01 (м, 1H), 3,76-3,81 (м, 4H), 3,56-3,63 (м, 2H), 3,51-3,56 (м, 2H), 3,33-3,43 (м, 3H), 3,13-3,23 (м, 1H), 2,65-2,75 (м, 2H). MS (ESI+) m/z 386 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 127 using 2- (2- (piperazin-1-yl) ethoxy) ethanol instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.39-8.48 (m, 1H), 8.19-8.32 (m, 1H), 7.92 (d, 1H), 7.74 (d, 1H), 7.17-7, 27 (m, 1H), 4.49-4.60 (m, 1H), 3.94-4.01 (m, 1H), 3.76-3.81 (m, 4H), 3.56- 3.63 (m, 2H), 3.51-3.56 (m, 2H), 3.33-3.43 (m, 3H), 3.13-3.23 (m, 1H), 2, 65-2.75 (m, 2H). MS (ESI +) m / z 386 (M + H) + .
Пример 134Example 134
5-{3-[(4-метил-1,4-диазепан-1-ил)карбонил]изоксазол-5-ил}-1H-индазол5- {3 - [(4-methyl-1,4-diazepan-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 127, с использованием 1-метил-1,4-диазепана вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,38-8,46 (м, 1H), 8,22-8,32 (м, 1H), 7,85-7,98 (м, 1H), 7,75 (д, 1H), 7,22 (д, 1H), 4,07-4,19 (м, 1H), 3,69-3,77 (м, 2H), 3,59-3,67 (м, 1H), 3,44-3,59 (м, 1H), 3,35-3,44 (м, 1H), 3,24-3,35 (м, 2H), 2,84-2,95 (м, 3H), 2,66-2,74 (м, 1H), 2,10-2,26 (м, 2H). MS (ESI+) m/z 326 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 127 using 1-methyl-1,4-diazepane instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.38-8.46 (m, 1H), 8.22-8.32 (m, 1H), 7.85-7.98 (m, 1H), 7.75 (d, 1H), 7, 22 (d, 1H), 4.07-4.19 (m, 1H), 3.69-3.77 (m, 2H), 3.59-3.67 (m, 1H), 3.44- 3.59 (m, 1H), 3.35-3.44 (m, 1H), 3.24-3.35 (m, 2H), 2.84-2.95 (m, 3H), 2, 66-2.74 (m, 1H); 2.10-2.26 (m, 2H). MS (ESI +) m / z 326 (M + H) + .
Пример 135Example 135
N-(3-гидроксипропил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- (3-hydroxypropyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием 3-аминопропан-1-ола вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,36-8,45 (м, 1H), 8,20-8,30 (м, 1H), 7,84-7,94 (м, 1H), 7,71 (д, 1H), 7,18-7,28 (м, 1H), 3,48 (т, 2H), 3,35 (т, 2H), 1,64-1,78 (м, 2H). MS (ESI+) m/z 387 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using 3-aminopropan-1-ol instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.36-8.45 (m, 1H), 8.20-8.30 (m, 1H), 7.84-7.94 (m, 1H), 7.71 (d, 1H), 7, 18-7.28 (m, 1H), 3.48 (t, 2H), 3.35 (t, 2H), 1.64-1.78 (m, 2H). MS (ESI +) m / z 387 (M + H) + .
Пример 136Example 136
N-[(1R)-2-гидрокси-1-фенилэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R) -2-hydroxy-1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием (R)-2-амино-2-фенилэтанола вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 9,11 (д, 1H), 8,37-8,46 (м, 1H), 8,23-8,28 (м, 1H), 7,91 (д, 1H), 7,73 (д, 1H), 7,40-7,45 (м, 2H), 7,32-7,39 (м, 2H), 7,23-7,32 (м, 2H), 5,05-5,13 (м, 1H), 3,66-3,72 (м, 2H). MS (ESI+) m/z 349 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using (R) -2-amino-2-phenylethanol instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 9.11 (d, 1H), 8.37-8.46 (m, 1H), 8.23-8.28 (m, 1H), 7.91 (d, 1H), 7.73 (d, 1H), 7.40-7.45 (m, 2H), 7.32-7.39 (m, 2H), 7.23-7.32 (m, 2H), 5.05-5.13 ( m, 1H); 3.66-3.72 (m, 2H). MS (ESI +) m / z 349 (M + H) + .
Пример 137Example 137
N-[3-(1H-индазол-1-ил)пропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [3- (1H-indazol-1-yl) propyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием 3-(1H-индазол-1-ил)пропан-1-амина вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 9,02-9,10 (м, 1H), 8,40-8,44 (м, 1H), 8,25-8,29 (м, 1H), 7,87-7,95 (м, 1H), 7,71-7,82 (м, 2H), 7,61-7,69 (м, 1H), 7,20-7,29 (м, 1H), 4,28 (т, 2H), 3,33 (т, 2H), 2,06-2,19 (м, 2H). MS (ESI+) m/z 337 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using 3- (1H-indazol-1-yl) propan-1-amine instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 9.02-9.10 (m, 1H), 8.40-8.44 (m, 1H), 8.25-8.29 (m, 1H), 7.87-7.95 (m, 1H) ), 7.71-7.82 (m, 2H), 7.61-7.69 (m, 1H), 7.20-7.29 (m, 1H), 4.28 (t, 2H), 3.33 (t, 2H); 2.06-2.19 (m, 2H). MS (ESI +) m / z 337 (M + H) + .
Пример 138Example 138
5-(1H-индазол-5-ил)-N-[3-(2-оксопирролидин-1-ил)пропил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- [3- (2-oxopyrrolidin-1-yl) propyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием 1-(3-аминопропил)пирролидин-2-она вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,38-8,43 (м, 1H), 8,24-8,30 (м, 1H), 7,87-7,93 (м, 1H), 7,73 (д, 1H), 7,22-7,26 (м, 1H), 3,39 (т, 2H), 3,21-3,30 (м, 4H), 2,26 (т, 2H), 1,90-2,00 (м, 2H), 1,70-1,79 (м, 2H). MS (ESI+) m/z 354 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using 1- (3-aminopropyl) pyrrolidin-2-one instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.38-8.43 (m, 1H), 8.24-8.30 (m, 1H), 7.87-7.93 (m, 1H), 7.73 (d, 1H), 7, 22-7.26 (m, 1H), 3.39 (t, 2H), 3.21-3.30 (m, 4H), 2.26 (t, 2H), 1.90-2.00 ( m, 2H), 1.70-1.79 (m, 2H). MS (ESI +) m / z 354 (M + H) + .
Пример 139Example 139
N-{2-[4-(аминосульфонил)фенил]этил}-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- {2- [4- (aminosulfonyl) phenyl] ethyl} -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 127, с использованием 4-(2-аминоэтил)бензолсульфонамида вместо 2-изопропоксиэтанамина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,37-8,42 (м, 1H), 8,24-8,29 (м, 1H), 7,86-7,93 (м, 1H), 7,70-7,80 (м, 3H), 7,47 (д, 2H), 7,20-7,24 (м, 1H), 3,57 (т, 2H), 2,96 (т, 2H). MS (ESI+) m/z 412 (M+H)+.The title compound was prepared according to the procedure described in Example 127 using 4- (2-aminoethyl) benzenesulfonamide instead of 2-isopropoxyethanamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.37-8.42 (m, 1H), 8.24-8.29 (m, 1H), 7.86-7.93 (m, 1H), 7.70-7.80 (m, 3H ), 7.47 (d, 2H), 7.20-7.24 (m, 1H), 3.57 (t, 2H), 2.96 (t, 2H). MS (ESI +) m / z 412 (M + H) + .
Пример 140Example 140
[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил](3-хлорфенил)метанон[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (3-chlorophenyl) methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием 3-хлорбензоилхлорида вместо бензоилхлорида. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,09 (с, 1H), 7,99 (с, 1H), 7,77 (с, 1H), 7,38-7,51 (м, 4H), 7,28-7,37 (м, 3H), 7,20-7,27 (м, 4H), 5,78 (с, 2H). MS (ESI+) m/z 414,1 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using 3-chlorobenzoyl chloride instead of benzoyl chloride. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.09 (s, 1H), 7.99 (s, 1H), 7.77 (s, 1H), 7.38-7.51 (m, 4H), 7.28-7.37 (m, 3H), 7.20-7.27 (m, 4H), 5.78 (s, 2H). MS (ESI +) m / z 414.1 (M + H) + .
Пример 141Example 141
[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил] (циклопропил)метанон[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (cyclopropyl) methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием циклопропанкарбонилхлорида вместо бензоилхлорида. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,26 (с, 1H), 8,18 (с, 1H), 8,08 (с, 1H), 7,61-7,70 (м, 2H), 7,29-7,40 (м, 3H), 7,24 (д, J=7,02 Гц, 2H), 5,79 (с, 2H), 1,86-2,00 (м, 1H), 0,98-1,12 (м, 2H), 0,77-0,93 (м, 2H). MS (ESI+) m/z 344,1 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using cyclopropanecarbonyl chloride instead of benzoyl chloride. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.26 (s, 1H), 8.18 (s, 1H), 8.08 (s, 1H), 7.61-7.70 (m, 2H), 7.29-7.40 (m, 3H), 7.24 (d, J = 7.02 Hz, 2H), 5.79 (s, 2H), 1.86-2.00 (m, 1H), 0.98-1.12 (m , 2H); 0.77-0.93 (m, 2H). MS (ESI +) m / z 344.1 (M + H) + .
Пример 142Example 142
5-[5-циклопропил-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [5-cyclopropyl-1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Пример 142AExample 142A
5-Циклопропил-1-((тетрагидро-2H-пиран-4-ил)метил)-4-(трибутилстаннил)-1H-1,2,3-триазол5-Cyclopropyl-1 - ((tetrahydro-2H-pyran-4-yl) methyl) -4- (tributylstannyl) -1H-1,2,3-triazole
Циклопропилацетилен (142 мг, 2,15 ммоль) добавляли к 1,1,1-трибутил-N,N-диметилстаннанамину (716 мг, 2,14 ммоль) в гексане (3,0 мл) и перемешивали в герметично закрытом сосуде при 70°C в течение 2 часов. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли соединение Примера 80A (455 мг, 3,22 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент этилацетата в гексане (5-50%), с получением указанного в заголовке соединения. MS (ESI+) m/z 498,3 (M+H)+.Cyclopropylacetylene (142 mg, 2.15 mmol) was added to 1,1,1-tributyl-N, N-dimethylstannanamine (716 mg, 2.14 mmol) in hexane (3.0 ml) and stirred in a sealed vessel at 70 ° C for 2 hours. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. The compound of Example 80A (455 mg, 3.22 mmol) was added and the vessel was again sealed and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of ethyl acetate in hexane (5-50%) to elute to give the title compound. MS (ESI +) m / z 498.3 (M + H) + .
Пример 142BExample 142B
1-(5-(5-Циклопропил-1-((тетрагидро-2H-пиран-4-ил)метил)-1H-1,2,3-триазол-4-ил)-1H-индазол-1-ил)этанон1- (5- (5-Cyclopropyl-1 - ((tetrahydro-2H-pyran-4-yl) methyl) -1H-1,2,3-triazol-4-yl) -1H-indazol-1-yl) ethanone
Соединение Примера 142A (220 мг, 0,444 ммоль), соединение Примера 87A (128 мг, 0,447 ммоль), дихлорбис(трифенилфосфин)палладий(II) (33 мг, 0,047 ммоль) и тиофен-2-карбоксилат меди (127 мг, 0,666 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали 150°C в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-70% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 366,0 (M+H)+.The compound of Example 142A (220 mg, 0.444 mmol), the compound of Example 87A (128 mg, 0.447 mmol), dichlorobis (triphenylphosphine) palladium (II) (33 mg, 0.047 mmol) and copper thiophene-2-carboxylate (127 mg, 0.666 mmol) ) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated to 150 ° C for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-70% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 366.0 (M + H) + .
Пример 142CExample 142C
5-[5-циклопропил-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [5-cyclopropyl-1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Соединение Примера 142B (46 мг, 0,126 ммоль) растворяли в тетрагидрофуране (2,0 мл) и воде (0,5 мл) и добавляли гидроксид калия (80 мг, 1,43 ммоль). Смесь перемешивали в течение 2 часов, разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-8% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, CDCl3) δ м.д. 8,19 (с, 1H), 7,96 (д, J=8,82 Гц, 1H), 7,61 (д, J=7,80 Гц, 1H), 7,25-7,28 (м, 1H), 4,34 (д, J=6,44 Гц, 2H), 4,02 (д, J=1 1,36, 3,56 Гц, 2H), 3,42 (т, J=1 1,53 Гц, 2H), 2,33-2,46 (м, 1H), 1,81-1,95 (м, 1H), 1,59-1,70 (м, 2H), 1,43-1,58 (м, 2H), 1,23-1,28 (м, 1H), 1,10-1,20 (м, 2H), 0,47-0,62 (м, 2H). MS (ESI+) m/z 324,1 (M+H)+.The compound of Example 142B (46 mg, 0.126 mmol) was dissolved in tetrahydrofuran (2.0 ml) and water (0.5 ml) and potassium hydroxide (80 mg, 1.43 mmol) was added. The mixture was stirred for 2 hours, diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-8% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, CDCl 3 ) δ ppm 8.19 (s, 1H), 7.96 (d, J = 8.82 Hz, 1H), 7.61 (d, J = 7.80 Hz, 1H), 7.25-7.28 (m , 1H), 4.34 (d, J = 6.44 Hz, 2H), 4.02 (d, J = 1 1.36, 3.56 Hz, 2H), 3.42 (t, J = 1 1.53 Hz, 2H), 2.33-2.46 (m, 1H), 1.81-1.95 (m, 1H), 1.59-1.70 (m, 2H), 1.43 -1.58 (m, 2H), 1.23-1.28 (m, 1H), 1.10-1.20 (m, 2H), 0.47-0.62 (m, 2H). MS (ESI +) m / z 324.1 (M + H) + .
Пример 143Example 143
N1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]метил}глицинамидN 1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] methyl} glycinamide
Пример 143AExample 143A
2-((1-Бензил-4-(трибутилстаннил)-lΗ-1,2,3-триазол-5-ил)метил)изоиндолин-1,3-дион2 - ((1-Benzyl-4- (tributylstannyl) -lΗ-1,2,3-triazol-5-yl) methyl) isoindolin-1,3-dione
N-Пропаргилфталимид (2,35 мг, 12,7 ммоль) добавляли к 1,1,1-трибутил-N,N-диметилстаннанамину (4,23 мг, 12,7 ммоль) в гексане (3,0 мл) и перемешивали в герметично закрытом сосуде при 70°C в течение 2 часов. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли бензилазид (2,0 мл, 16,0 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 609,3 (M+H)+.N-Propargylphthalimide (2.35 mg, 12.7 mmol) was added to 1,1,1-tributyl-N, N-dimethylstannanamine (4.23 mg, 12.7 mmol) in hexane (3.0 ml) and stirred in a tightly closed vessel at 70 ° C for 2 hours. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. Benzylazide (2.0 ml, 16.0 mmol) was added and the vessel was again hermetically sealed and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 609.3 (M + H) + .
Пример 143BExample 143B
2-((4-(1-Ацетил-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил)метил)изоиндолин-1,3-дион2 - ((4- (1-Acetyl-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl) methyl) isoindolin-1,3-dione
Соединение Примера 143A (567 мг, 0,934 ммоль), соединение Примера 87A (268 мг, 0,934 ммоль), дихлорбис(трифенилфосфин)палладий(II) (67 мг, 0,095 ммоль) и тиофен-2-карбоксилат меди (268 мг, 1,41 ммоль) объединяли в толуоле (2,5 мл) в микроволновом сосуде в инертной атмосфере азота. Сосуд нагревали в микроволновом устройстве (CEM-Discover) до 150°C при 125 Ватт в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 477,2 (M+H)+.The compound of Example 143A (567 mg, 0.934 mmol), the compound of Example 87A (268 mg, 0.934 mmol), dichlorobis (triphenylphosphine) palladium (II) (67 mg, 0.095 mmol) and copper thiophene-2-carboxylate (268 mg, 1, 41 mmol) were combined in toluene (2.5 ml) in a microwave vessel under an inert nitrogen atmosphere. The vessel was heated in a microwave device (CEM-Discover) to 150 ° C at 125 watts for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 477.2 (M + H) + .
Пример 143CExample 143C
(1-Бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил)метанамин(1-Benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl) methanamine
Соединение Примера 143B (140 мг, 0,294 ммоль) обрабатывали гидразингидратом (0,7 мл) в этаноле (0,7 мл) и перемешивали при температуре окружающей среды в течение ночи. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 1-6% метанола в дихлорметане, с получением указанного в заголовке соединения. MS (ESI+) m/z 305,0 (M+H)+.The compound of Example 143B (140 mg, 0.294 mmol) was treated with hydrazine hydrate (0.7 ml) in ethanol (0.7 ml) and stirred at ambient temperature overnight. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 1-6% methanol in dichloromethane to elute to give the title compound. MS (ESI +) m / z 305.0 (M + H) + .
Пример 143DExample 143D
N1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]метил}глицинамидN 1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] methyl} glycinamide
Соединение Примера 143C (66 мг, 0,217 ммоль), N-(трет-бутоксикарбонил)-глицин (39 мг, 0,223 ммоль) и ΗATU (85 мг, 0,224 ммоль) объединяли в метиленхлориде (2,5 мл). Добавляли диизопропилэтиламин (150 мкл, 0,865 ммоль) и смесь перемешивали при температуре окружающей среды в течение ночи. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-6% метанола в дихлорметане, с получением трет-бутил 2-((1-бензил-4-(lΗ-индазол-5-ил)-lΗ-1,2,3-триазол-5-ил)метиламино)-2-оксоэтилкарбамата. Этот карбамат растворяли в тетрагидрофуране (2 мл) и добавляли 0,5 мл раствора 1 н хлористоводородной кислоты в диэтиловом эфире и смесь перемешивали в течение 20 минут при комнатной температуре. Растворители удаляли при пониженном давлении и к смеси добавляли диэтиловый эфир и перемешивали при комнатной температуре в течение ночи. Растворитель декантировали и полученный остаток сушили под потоком азота с получением указанного в заголовке соединения в форме гидрохлоридной соли. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,21 (с, 1H), 9,02 (т, J=5,09 Гц, 1H), 8,11-8,16 (м, 2H), 8,06 (с, 2H), 7,75-7,82 (м, 1H), 7,64 (д, J=8,82 Гц, 1H), 7,30-7,45 (м, 3H), 7,23-7,31 (м, 2H), 5,72 (с, 2H), 4,57 (д, J=5,09 Гц, 2H), 3,41 (кв., J=5,76 Гц, 2H). MS (ESI+) m/z 362,1 (M+H)+.The compound of Example 143C (66 mg, 0.217 mmol), N- (tert-butoxycarbonyl) glycine (39 mg, 0.223 mmol) and ΗATU (85 mg, 0.224 mmol) were combined in methylene chloride (2.5 ml). Diisopropylethylamine (150 μl, 0.865 mmol) was added and the mixture was stirred at ambient temperature overnight. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-6% methanol in dichloromethane to elute to give tert-butyl 2 - ((1-benzyl-4- (lΗ-indazol-5-yl) -lΗ -1,2,3-triazol-5-yl) methylamino) -2-oxoethyl carbamate. This carbamate was dissolved in tetrahydrofuran (2 ml), and 0.5 ml of a solution of 1 n hydrochloric acid in diethyl ether was added, and the mixture was stirred for 20 minutes at room temperature. The solvents were removed under reduced pressure, and diethyl ether was added to the mixture, and stirred at room temperature overnight. The solvent was decanted and the resulting residue was dried under a stream of nitrogen to obtain the title compound in the form of a hydrochloride salt. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.21 (s, 1H), 9.02 (t, J = 5.09 Hz, 1H), 8.11-8.16 (m, 2H), 8.06 (s, 2H), 7.75 -7.82 (m, 1H), 7.64 (d, J = 8.82 Hz, 1H), 7.30-7.45 (m, 3H), 7.23-7.31 (m, 2H ), 5.72 (s, 2H), 4.57 (d, J = 5.09 Hz, 2H), 3.41 (q, J = 5.76 Hz, 2H). MS (ESI +) m / z 362.1 (M + H) + .
Пример 144Example 144
(4-фторфенил) [4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил}метанон(4-fluorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl} methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием 4-фторбензоилхлорида вместо бензоилхлорида и с использованием соединения Примера 80A вместо бензилазида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,10 (с, 1H), 8,00 (с, 1H), 7,72-7,80 (м, 3H), 7,38-7,44 (м, 1H), 7,30-7,36 (м, 1H), 7,09-7,19 (м, 2H), 4,41 (д, J=7,12 Гц, 2H) 3,80 (д, J=1 1,36, 2,54 Гц, 2H), 3,14-3,26 (м, 2H), 2,04-2,19 (м, 1H), 1,38-1,49 (м, 2H), 1,19-1,35 (м, 2H). MS (ESI+) m/z 406,1 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using 4-fluorobenzoyl chloride instead of benzoyl chloride and using the compound of Example 80A instead of benzyl azide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.10 (s, 1H), 8.00 (s, 1H), 7.72-7.80 (m, 3H), 7.38-7.44 (m, 1H), 7.30-7, 36 (m, 1H), 7.09-7.19 (m, 2H), 4.41 (d, J = 7.12 Hz, 2H) 3.80 (d, J = 1 1.36, 2, 54 Hz, 2H), 3.14-3.26 (m, 2H), 2.04-2.19 (m, 1H), 1.38-1.49 (m, 2H), 1.19-1 35 (m, 2H). MS (ESI +) m / z 406.1 (M + H) + .
Пример 145Example 145
(4-хлорфенил)[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил]метанон(4-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием 4-хлорбензоилхлорида вместо бензоилхлорида и с использованием соединения Примера 80A вместо бензилазида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,10 (с, 1H), 8,00 (с, 1H), 7,77 (с, 1H), 7,68 (д, J=8,48 Гц, 2H), 7,29-7,45 (м, 4H), 4,42 (д, J=7,12 Гц, 2H), 3,81 (д, J=1 1,19, 2,71 Гц, 2H), 3,14-3,27 (м, 2H), 2,03-2,19 (м, 1H), 1,38-1,51 (м, 2H), 1,22-1,36 (м, 2H). MS (ESI+) m/z 422,1 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using 4-chlorobenzoyl chloride instead of benzoyl chloride and using the compound of Example 80A instead of benzylazide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.10 (s, 1H), 8.00 (s, 1H), 7.77 (s, 1H), 7.68 (d, J = 8.48 Hz, 2H), 7.29-7.45 (m, 4H), 4.42 (d, J = 7.12 Hz, 2H), 3.81 (d, J = 1 1.19, 2.71 Hz, 2H), 3.14-3.27 (m, 2H), 2.03-2.19 (m, 1H), 1.38-1.51 (m, 2H), 1.22-1.36 (m, 2H). MS (ESI +) m / z 422.1 (M + H) + .
Пример 146Example 146
(3-хлорфенил)[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил}метанон(3-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl} methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием 3-хлорбензоилхлорида вместо бензоилхлорида и с использованием соединения Примера 80A вместо бензилазида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,04 (с, 1H), 7,95 (с, 1H), 7,64 (с, 1H), 7,48-7,54 (м, 1H), 7,29-7,35 (м, 1H), 7,22-7,28 (м, 1H), 7,13-7,22 (м, 3H), 4,58 (д, J=7,12 Гц, 2H), 3,86 (д, J=1 1,53, 2,37 Гц, 2H), 3,20-3,30 (м, 2H), 2,11-2,24 (м, 1H), 1,45-1,54 (м, 2H), 1,33-1,44 (м, 2H). MS (ESI+) m/z 422,1 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using 3-chlorobenzoyl chloride instead of benzoyl chloride and using the compound of Example 80A instead of benzyl azide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.04 (s, 1H), 7.95 (s, 1H), 7.64 (s, 1H), 7.48-7.54 (m, 1H), 7.29-7.35 (m, 1H), 7.22-7.28 (m, 1H), 7.13-7.22 (m, 3H), 4.58 (d, J = 7.12 Hz, 2H), 3.86 (d , J = 1 1.53, 2.37 Hz, 2H), 3.20-3.30 (m, 2H), 2.11-2.24 (m, 1H), 1.45-1.54 ( m, 2H), 1.33-1.44 (m, 2H). MS (ESI +) m / z 422.1 (M + H) + .
Пример 147Example 147
(2-хлорфенил)[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил}метанон(2-Chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl} methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием 2-хлорбензоилхлорида вместо бензоилхлорида и с использованием соединения Примера 80A вместо бензилазида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,08 (с, 1H), 7,99 (с, 1H), 7,75 (с, 1H), 7,66 (т, J=1,86 Гц, 1H), 7,56 (д, J=7,80 Гц, 1H), 7,47-7,53 (м, 1H), 7,36-7,42 (м, 1H), 7,23-7,34 (м, 2H), 4,45 (д, J=6,78 Гц, 2H), 3,82 (д, J=1 l,19, 2,37 Гц, 2H), 3,18-3,29 (м, 2H), 2,09-2,23 (м, 1H), 1,41-1,53 (м, 2H), 1,28-1,38 (м, 2H). MS (ESI+) m/z 422,1 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using 2-chlorobenzoyl chloride instead of benzoyl chloride and using the compound of Example 80A instead of benzylazide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.08 (s, 1H), 7.99 (s, 1H), 7.75 (s, 1H), 7.66 (t, J = 1.86 Hz, 1H), 7.56 (d, J = 7.80 Hz, 1H), 7.47-7.53 (m, 1H), 7.36-7.42 (m, 1H), 7.23-7.34 (m, 2H), 4, 45 (d, J = 6.78 Hz, 2H), 3.82 (d, J = 1 l, 19, 2.37 Hz, 2H), 3.18-3.29 (m, 2H), 2, 09-2.23 (m, 1H), 1.41-1.53 (m, 2H), 1.28-1.38 (m, 2H). MS (ESI +) m / z 422.1 (M + H) + .
Пример 148Example 148
циклопентил[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил}метанонcyclopentyl [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl} methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием циклопентанкарбонилхлорида вместо бензоилхлорида и с использованием соединения Примера 80A вместо бензилазида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,27 (с, 1H), 8,18 (с, 1H), 7,95 (с, 1H), 7,68 (д, J=8,48 Гц, 1H), 7,52 (д, J=8,48, 1,70 Гц, 1H), 4,47 (д, J=7,12 Гц, 2H), 3,85 (д, J=1 1,53, 2,37 Гц, 2H), 3,18-3,30 (м, 2H), 3,02-3,14 (м, 1H), 2,00-2,17 (м, 1H), 1,19-1,76 (м, 12H). MS (ESI+) m/z 380,1 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using cyclopentanecarbonyl chloride instead of benzoyl chloride and using the compound of Example 80A instead of benzyl azide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.27 (s, 1H), 8.18 (s, 1H), 7.95 (s, 1H), 7.68 (d, J = 8.48 Hz, 1H), 7.52 (d, J = 8.48, 1.70 Hz, 1H), 4.47 (d, J = 7.12 Hz, 2H), 3.85 (d, J = 1 1.53, 2.37 Hz, 2H), 3.18-3.30 (m, 2H), 3.02-3.14 (m, 1H), 2.00-2.17 (m, 1H), 1.19-1.76 (m, 12H) ) MS (ESI +) m / z 380.1 (M + H) + .
Пример 149Example 149
1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоновая кислота1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxylic acid
Пример 149AExample 149A
Метил 1-бензил-4-(трибутилстаннил)-1H-1,2,3-триазол-5-карбоксилатMethyl 1-benzyl-4- (tributylstannyl) -1H-1,2,3-triazole-5-carboxylate
Метилпропиолат (5,75 г, 68,4 ммоль) добавляли к метилэтил(трибутилстаннил)карбамату (26,9 г, 68,6 ммоль) в большой герметично закрытой пробирке. Смесь нагревали до 70°C в течение ночи. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли бензилазид (10,2 мл, 81,6 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 508,3 (M+H)+.Methyl propiolate (5.75 g, 68.4 mmol) was added to methylethyl (tributylstannyl) carbamate (26.9 g, 68.6 mmol) in a large hermetically sealed tube. The mixture was heated to 70 ° C. overnight. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. Benzylazide (10.2 ml, 81.6 mmol) was added and the vessel was sealed again and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 508.3 (M + H) + .
Пример 149BExample 149B
метил 4-(1-ацетил-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-карбоксилатmethyl 4- (1-acetyl-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazole-5-carboxylate
Соединение Примера 149A (7,17 г, 14,1 ммоль), соединение Примера 87A (4,02 г, 14,1 ммоль), дихлорбис(трифенилфосфин)палладий(II) (1,01 мг, 1,44 ммоль) и тиофен-2-карбоксилат меди (4,07 мг, 21,3 ммоль) объединяли в толуоле (55 мл) в большой герметично закрытой пробирке в инертной атмосфере азота. Пробирку герметично закрывали и нагревали при 150°C в течение 30 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 376,1 (M+H)+.The compound of Example 149A (7.17 g, 14.1 mmol), the compound of Example 87A (4.02 g, 14.1 mmol), dichlorobis (triphenylphosphine) palladium (II) (1.01 mg, 1.44 mmol) and copper thiophene-2-carboxylate (4.07 mg, 21.3 mmol) was combined in toluene (55 ml) in a large hermetically sealed tube in an inert nitrogen atmosphere. The tube was sealed and heated at 150 ° C for 30 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 376.1 (M + H) + .
Пример 149CExample 149C
1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоновая кислота1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxylic acid
Соединение Примера 149B (3,40 мг, 9,06 ммоль) растворяли в тетрагидрофуране (100 мл), метаноле (10 мл) и воде (10 мл) и добавляли гидроксид калия (1,63 г, 29,1 ммоль). Смесь перемешивали в течение 3 часов, разбавляли этилацетатом и промывали 1 н раствором хлористоводородной кислоты, промывали насыщенным солевым раствором и объединенные органические слои сушили над сульфатом натрия. После фильтрования растворители удаляли при пониженном давлении с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,16 (с, 1H), 8,11-8,18 (м, 2H), 7,66-7,76 (м, 1H), 7,54-7,62 (м, 1H), 7,31-7,43 (м, 3H), 7,22-7,29 (м, 2H), 5,93 (с, 2H). MS (ESI+) m/z 320,0 (M+H)+.The compound of Example 149B (3.40 mg, 9.06 mmol) was dissolved in tetrahydrofuran (100 ml), methanol (10 ml) and water (10 ml) and potassium hydroxide (1.63 g, 29.1 mmol) was added. The mixture was stirred for 3 hours, diluted with ethyl acetate and washed with a 1N hydrochloric acid solution, washed with brine, and the combined organic layers were dried over sodium sulfate. After filtration, the solvents were removed under reduced pressure to obtain the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.16 (s, 1H), 8.11-8.18 (m, 2H), 7.66-7.76 (m, 1H), 7.54-7.62 (m, 1H), 7, 31-7.43 (m, 3H), 7.22-7.29 (m, 2H), 5.93 (s, 2H). MS (ESI +) m / z 320.0 (M + H) + .
Пример 150Example 150
5-{5-(4-фторфенил)-1-[4-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин5- {5- (4-fluorophenyl) -1- [4- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine
Пример 150AExample 150A
1-(азидометил)-4-(трифторметил)бензол1- (azidomethyl) -4- (trifluoromethyl) benzene
Азид натрия (2,30 г, 35,4 ммоль) добавляли к раствору 4-(трифторметил)бензилбромида (4,26 г, 17,8 ммоль), растворенного в диметилсульфоксиде (15 мл), и перемешивали при температуре окружающей среды в течение ночи. Смесь разбавляли этилацетатом, промывали водой и насыщенным солевым раствором и сушили над сульфатом натрия. После фильтрования растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения. Неочищенный продукт использовали на следующей стадии без его дополнительного анализа.Sodium azide (2.30 g, 35.4 mmol) was added to a solution of 4- (trifluoromethyl) benzyl bromide (4.26 g, 17.8 mmol) dissolved in dimethyl sulfoxide (15 ml), and stirred at ambient temperature for nights. The mixture was diluted with ethyl acetate, washed with water and brine, and dried over sodium sulfate. After filtration, the solvent was removed under reduced pressure to obtain the title compound. The crude product was used in the next step without further analysis.
Пример 150BExample 150B
5-(4-фторфенил)-4-(трибутилстаннил)-1-(4-(трифторметил)бензил)-1H-1,2,3-триазол5- (4-fluorophenyl) -4- (tributylstannyl) -1- (4- (trifluoromethyl) benzyl) -1H-1,2,3-triazole
4-Фторфенилацетилен (524 мг, 4,36 ммоль) добавляли к 1,1,1-трибутил-N,N-диметилстаннанамину (1,46 г, 4,37 ммоль) и смесь перемешивали в герметично закрытом сосуде при 50°C в течение 30 минут. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли соединение Примера 150A (1,28 г, 6,30 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-35% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 612,3 (M+H)+.4-Fluorophenylacetylene (524 mg, 4.36 mmol) was added to 1,1,1-tributyl-N, N-dimethylstannanamine (1.46 g, 4.37 mmol) and the mixture was stirred in a hermetically sealed vessel at 50 ° C. within 30 minutes. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. The compound of Example 150A (1.28 g, 6.30 mmol) was added and the vessel was again hermetically sealed and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-35% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 612.3 (M + H) + .
Пример 150CExample 150C
2-фтор-5-(5-(4-фторфенил)-1-(4-(трифторметил)бензил)-1H-1,2,3-триазол-4-ил)бензонитрил2-fluoro-5- (5- (4-fluorophenyl) -1- (4- (trifluoromethyl) benzyl) -1H-1,2,3-triazol-4-yl) benzonitrile
Соединение Примера 150B (485 мг, 0,795 ммоль), 5-бром-2-фторбензонитрил (143 мг, 0,715 ммоль), дихлорбис(трифенилфосфин)палладий(II) (49 мг, 0,070 ммоль) и тиофен-2-карбоксилат меди (205 мг, 1,08 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали при 150°C в течение 30 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 441,2 (M+H)+.The compound of Example 150B (485 mg, 0.795 mmol), 5-bromo-2-fluorobenzonitrile (143 mg, 0.715 mmol), dichlorobis (triphenylphosphine) palladium (II) (49 mg, 0.070 mmol) and copper thiophene-2-carboxylate (205 mg, 1.08 mmol) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated at 150 ° C for 30 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 441.2 (M + H) + .
Пример 150DExample 150D
5-{5-(4-фторфенил)-1-[4-(трифторметил)бензил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин5- {5- (4-fluorophenyl) -1- [4- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine
Соединение Примера 150C обрабатывали гидразингидратом (1,0 мл) в этаноле (1,0 мл) и реакционную смесь перемешивали и нагревали до 65°C в течение 3 часов. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-6% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,42 (с, 1H), 8,04 (с, 1H), 7,67 (д, J=8,14 Гц, 2H), 7,26-7,41 (м, 4H), 7,22 (д, J=8,48 Гц, 2H), 7,03-7,15 (м, 2H), 5,62 (с, 2H), 5,36 (с, 2H). MS (ESI+) m/z 453,1 (M+H)+.The compound of Example 150C was treated with hydrazine hydrate (1.0 ml) in ethanol (1.0 ml) and the reaction mixture was stirred and heated to 65 ° C for 3 hours. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-6% methanol in dichloromethane for elution to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.42 (s, 1H), 8.04 (s, 1H), 7.67 (d, J = 8.14 Hz, 2H), 7.26-7.41 (m, 4H), 7.22 (d, J = 8.48 Hz, 2H), 7.03-7.15 (m, 2H), 5.62 (s, 2H), 5.36 (s, 2H). MS (ESI +) m / z 453.1 (M + H) + .
Пример 151Example 151
5-[1-бензил-5-(4-фторфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (4-fluorophenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Пример 151AExample 151A
1-бензил-5-(4-фторфенил)-4-(трибутилстаннил)-1H-1,2,3-триазол1-benzyl-5- (4-fluorophenyl) -4- (tributylstannyl) -1H-1,2,3-triazole
4-Фторфенилацетилен (525 мг, 4,37 ммоль) добавляли к 1,1,1-трибутил-N,N-диметилстаннанамину (1,46 г, 4,37 ммоль) и смесь перемешивали в герметично закрытом сосуде при 50°C в течение 2 часов. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли бензилазид (850 мкл, 6,80 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-35% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 544,4 (M+H)+.4-Fluorophenylacetylene (525 mg, 4.37 mmol) was added to 1,1,1-tributyl-N, N-dimethylstannanamine (1.46 g, 4.37 mmol) and the mixture was stirred in a hermetically sealed vessel at 50 ° C. within 2 hours. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. Benzylazide (850 μl, 6.80 mmol) was added and the vessel was again hermetically sealed and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-35% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 544.4 (M + H) + .
Пример 151BExample 151B
5-(1-Бензил-5-(4-фторфенил)-1H-1,2,3-триазол-4-ил)-2-фторбензонитрил5- (1-Benzyl-5- (4-fluorophenyl) -1H-1,2,3-triazol-4-yl) -2-fluorobenzonitrile
Соединение Примера 151A (361 мг, 0,666 ммоль), 5-бром-2-фторбензонитрил (119 мг, 0,595 ммоль), дихлорбис(трифенилфосфин)палладий(II) (45 мг, 0,064 ммоль) и тиофен-2-карбоксилат меди (193 мг, 1,01 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали 150°C в течение 30 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 373,0 (M+H)+.The compound of Example 151A (361 mg, 0.666 mmol), 5-bromo-2-fluorobenzonitrile (119 mg, 0.595 mmol), dichlorobis (triphenylphosphine) palladium (II) (45 mg, 0.064 mmol) and copper thiophene-2-carboxylate (193 mg, 1.01 mmol) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated to 150 ° C. for 30 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 373.0 (M + H) + .
Пример 151CExample 151C
5-[1-бензил-5-(4-фторфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (4-fluorophenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Соединение Примера 151B (135 мг, 0,363 ммоль) обрабатывали гидразингидратом (1,0 мл) в этаноле (1,0 мл) и перемешивали и нагревали до 65°C в течение 3 часов. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-6% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,40 (с, 1H), 8,02 (с, 1H), 7,24-7,38 (м, 7H), 7,03-7,14 (м, 2H), 6,98 (д, J=7,29, 2,20 Гц, 2H), 5,50 (с, 2H), 5,35 (с, 2H). MS (ESI+) m/z 385,1 (M+H)+.The compound of Example 151B (135 mg, 0.363 mmol) was treated with hydrazine hydrate (1.0 ml) in ethanol (1.0 ml) and stirred and heated to 65 ° C. for 3 hours. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-6% methanol in dichloromethane for elution to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.40 (s, 1H), 8.02 (s, 1H), 7.24-7.38 (m, 7H), 7.03-7.14 (m, 2H), 6.98 (d, J = 7.29, 2.20 Hz, 2H), 5.50 (s, 2H), 5.35 (s, 2H). MS (ESI +) m / z 385.1 (M + H) + .
Пример 152Example 152
[4-(1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-5-ил](тетрагидро-2H-пиран-4-ил)метанон[4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] (tetrahydro-2H-pyran-4- silt) methanone
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 119B, с использованием соединения Примера 80A вместо бензилазида и с использованием тетрагидро-2H-пиран-4-карбонилхлорида вместо бензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,30 (с, 1H), 8,18 (с, 1H), 8,00 (с, 1H), 7,69 (д, J=8,48 Гц, 1H), 7,53 (д, J=8,65, 1,53 Гц, 1H), 4,48 (д, J=7,12 Гц, 2H), 3,79-3,90 (м, 2H), 3,62-3,74 (м, 2H), 3,18-3,30 (м, 2H), 2,76-2,88 (м, 1H), 2,64-2,76 (м, 2H), 2,00-2,17 (м, 1H), 1,20-1,58 (м, 8H). MS (ESI+) m/z 396,0 (M+H)+.The title compound was prepared according to the procedure described in Example 119B using the compound of Example 80A instead of benzyl azide and using tetrahydro-2H-pyran-4-carbonyl chloride instead of benzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.30 (s, 1H), 8.18 (s, 1H), 8.00 (s, 1H), 7.69 (d, J = 8.48 Hz, 1H), 7.53 (d, J = 8.65, 1.53 Hz, 1H), 4.48 (d, J = 7.12 Hz, 2H), 3.79-3.90 (m, 2H), 3.62-3.74 ( m, 2H), 3.18-3.30 (m, 2H), 2.76-2.88 (m, 1H), 2.64-2.76 (m, 2H), 2.00-2, 17 (m, 1H), 1.20-1.58 (m, 8H). MS (ESI +) m / z 396.0 (M + H) + .
Пример 153Example 153
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Пример 153AExample 153A
1-бензил-5-o-толил-4-(трибутилстаннил)-1H-1,2,3-триазол1-benzyl-5-o-tolyl-4- (tributylstannyl) -1H-1,2,3-triazole
2-Этинилтолуол (456 мкл, 3,62 ммоль) добавляли к 1,1,1-трибутил-N,N-диметилстаннанамину (1,21 г, 3,62 ммоль) и смесь перемешивали в герметично закрытом сосуде при 70°C в течение 3 часов. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли бензилазид (678 мкл, 5,42 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-45% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 539,8 (M+H)+.2-Ethynyltoluene (456 μl, 3.62 mmol) was added to 1,1,1-tributyl-N, N-dimethylstannanamine (1.21 g, 3.62 mmol) and the mixture was stirred in a hermetically sealed vessel at 70 ° C. within 3 hours. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. Benzylazide (678 μl, 5.42 mmol) was added and the vessel was again sealed and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-45% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 539.8 (M + H) + .
Пример 153BExample 153B
1-(5-(1-Бензил-5-o-толил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-ил)этанон1- (5- (1-Benzyl-5-o-tolyl-1H-1,2,3-triazol-4-yl) -1H-indazol-1-yl) ethanone
Соединение Примера 153A (119 мг, 0,221 ммоль), соединение Примера 87A (63 мг, 0,221 ммоль), дихлорбис(трифенилфосфин)палладий(II) (16 мг, 0,023 ммоль) и тиофен-2-карбоксилат меди (65 мг, 0,341 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали при 150°C в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-45% этилацетат в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 408,7 (M+H)+.The compound of Example 153A (119 mg, 0.221 mmol), the compound of Example 87A (63 mg, 0.221 mmol), dichlorobis (triphenylphosphine) palladium (II) (16 mg, 0.023 mmol) and copper thiophene-2-carboxylate (65 mg, 0.341 mmol) ) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated at 150 ° C for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-45% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 408.7 (M + H) + .
Пример 153CExample 153C
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Соединение Примера 153B (42 мг, 0,103 ммоль) растворяли в тетрагидрофуране (2,0 мл) и воде (0,3 мл) и добавляли гидроксид калия (48 мг, 0,856 ммоль). Смесь перемешивали в течение 1 часа, разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 1-6% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,07 (с, 1H), 7,97 (с, 1H), 7,73 (с, 1H), 7,44-7,53 (м, 3H), 7,39 (т, J=6,95 Гц, 1H), 7,28-7,35 (м, 2H), 7,21-7,29 (м, 3H), 6,86-6,95 (м, 2H), 5,28-5,45 (м, 2H), 1,59 (с, 3H). MS (ESI+) m/z 366,1 (M+H)+.The compound of Example 153B (42 mg, 0.103 mmol) was dissolved in tetrahydrofuran (2.0 ml) and water (0.3 ml) and potassium hydroxide (48 mg, 0.856 mmol) was added. The mixture was stirred for 1 hour, diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 1-6% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.07 (s, 1H), 7.97 (s, 1H), 7.73 (s, 1H), 7.44-7.53 (m, 3H), 7.39 (t, J = 6, 95 Hz, 1H), 7.28-7.35 (m, 2H), 7.21-7.29 (m, 3H), 6.86-6.95 (m, 2H), 5.28-5 45 (m, 2H); 1.59 (s, 3H). MS (ESI +) m / z 366.1 (M + H) + .
Пример 154Example 154
5-{1-бензил-5-[(4-метилпиперазин-1-ил)карбонил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1-benzyl-5 - [(4-methylpiperazin-1-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 149C вместо соединения Примера 81A и с использованием 1-метилпиперазина вместо пиперидина и тетрагидрофурана вместо диметилформамида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,20 (с, 1H), 8,16 (с, 1H), 7,96 (с, 1H), 7,57-7,69 (м, 2H), 7,31-7,44 (м, 3H), 7,23-7,30 (м, 2H), 5,36-5,83 (м, 2H), 3,40-3,65 (м, J=4,75 Гц, 2H), 2,38-2,49 (м, 2H), 2,10-2,22 (м, 2H), 1,89 (с, 3H), 1,40 (т, J=4,92 Гц, 2H). MS (ESI+) m/z 402,2 (M+H)+.The title compound was prepared according to the procedure described in Example 81B, using the compound of Example 149C instead of the compound of Example 81A and using 1-methylpiperazine instead of piperidine and tetrahydrofuran instead of dimethylformamide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.20 (s, 1H), 8.16 (s, 1H), 7.96 (s, 1H), 7.57-7.69 (m, 2H), 7.31-7.44 (m, 3H), 7.23-7.30 (m, 2H), 5.36-5.83 (m, 2H), 3.40-3.65 (m, J = 4.75 Hz, 2H), 2 38-2.49 (m, 2H), 2.10-2.22 (m, 2H), 1.89 (s, 3H), 1.40 (t, J = 4.92 Hz, 2H). MS (ESI +) m / z 402.2 (M + H) + .
Пример 155Example 155
5-{[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил]карбонил}пиперидин-4-ол5 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-4-ol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 149C вместо соединения Примера 81A и с использованием 4-гидроксипиперидина вместо пиперидина и тетрагидрофурана вместо диметилформамида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,15-13,24 (м, 1H), 8,16 (с, 1H), 7,97 (с, 1H), 7,55-7,68 (м, 2H), 7,32-7,43 (м, 3H), 7,23-7,30 (м, 2H), 5,41-5,83 (м, J=65,10 Гц, 2H), 4,58 (д, J=3,39 Гц, 1H), 3,74-3,91 (м, 1H), 3,37-3,48 (м, 2H), 2,66-2,79 (м, 1H), 2,25-2,47 (м, 1H), 1,54-1,68 (м, 1H), 1,20-1,36 (м, 1H), 0,74-0,90 (м, 1H), 0,40-0,60 (м, 1H). MS (ESI+) m/z 403,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using the compound of Example 149C instead of the compound of Example 81A and using 4-hydroxypiperidine instead of piperidine and tetrahydrofuran instead of dimethylformamide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.15-13.24 (m, 1H), 8.16 (s, 1H), 7.97 (s, 1H), 7.55-7.68 (m, 2H), 7.32-7, 43 (m, 3H), 7.23-7.30 (m, 2H), 5.41-5.83 (m, J = 65.10 Hz, 2H), 4.58 (d, J = 3, 39 Hz, 1H), 3.74-3.91 (m, 1H), 3.37-3.48 (m, 2H), 2.66-2.79 (m, 1H), 2.25-2 47 (m, 1H), 1.54-1.68 (m, 1H), 1.20-1.36 (m, 1H), 0.74-0.90 (m, 1H), 0.40 -0.60 (m, 1H). MS (ESI +) m / z 403.1 (M + H) + .
Пример 156Example 156
1-ацетил-5-[5-(4-фторфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол1-acetyl-5- [5- (4-fluorophenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Пример 156AExample 156A
5-(4-фторфенил)-1-((тетрагидро-2H-пиран-4-ил)метил)-4-(трибутилстаннил)-1H-1,2,3-триазол5- (4-fluorophenyl) -1 - ((tetrahydro-2H-pyran-4-yl) methyl) -4- (tributylstannyl) -1H-1,2,3-triazole
4-Фторфенилацетилен (440 мкл, 3,88 ммоль) добавляли к 1,1,1-трибутил-N,N-диметилстаннанамину (1,30 г, 3,89 ммоль) и смесь перемешивали в герметично закрытом сосуде при 50°C в течение 40 минут. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли соединение Примера 80A (710 мкл, 5,68 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 552,4 (M+H)+.4-Fluorophenylacetylene (440 μl, 3.88 mmol) was added to 1,1,1-tributyl-N, N-dimethylstannanamine (1.30 g, 3.89 mmol) and the mixture was stirred in a sealed vessel at 50 ° C in for 40 minutes. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. The compound of Example 80A (710 μl, 5.68 mmol) was added and the vessel was sealed again and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 552.4 (M + H) + .
Пример 156BExample 156B
1-ацетил-5-[5-(4-фторфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол1-acetyl-5- [5- (4-fluorophenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Соединение Примера 156A (433 мг, 0,787 ммоль), соединение Примера 87A (205 мг, 0,717 ммоль), дихлорбис(трифенилфосфин)палладий(II) (55 мг, 0,078 ммоль) и тиофен-2-карбоксилат меди (224 мг, 1,17 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали до 150°C в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-45% этилацетата в гексане, и растирали в порошок с метанолом с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,40-8,48 (м, J=0,68 Гц, 1H), 8,25 (д, J=8,82 Гц, 1H), 7,82-7,91 (м, 1H), 7,73 (д, J=8,48, 1,70 Гц, 1H), 7,50-7,60 (м, 2H), 7,38-7,49 (м, 2H), 4,13 (д, J=7,12 Гц, 2H), 3,76 (д, J=1 1,36, 2,54 Гц, 2H), 3,10-3,25 (м, 2H), 2,70 (с, 3H), 1,86-2,08 (м, 1H), 1,37 (д, J=12,55, 1,70 Гц, 2H), 1,03-1,23 (м, 2H). MS (ESI+) m/z 420,2 (M+H)+.The compound of Example 156A (433 mg, 0.787 mmol), the compound of Example 87A (205 mg, 0.717 mmol), dichlorobis (triphenylphosphine) palladium (II) (55 mg, 0.078 mmol) and copper thiophene-2-carboxylate (224 mg, 1, 17 mmol) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated to 150 ° C for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-45% ethyl acetate in hexane for elution and triturated with methanol to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.40-8.48 (m, J = 0.68 Hz, 1H), 8.25 (d, J = 8.82 Hz, 1H), 7.82-7.91 (m, 1H), 7 73 (d, J = 8.48, 1.70 Hz, 1H), 7.50-7.60 (m, 2H), 7.38-7.49 (m, 2H), 4.13 (d , J = 7.12 Hz, 2H), 3.76 (d, J = 1 1.36, 2.54 Hz, 2H), 3.10-3.25 (m, 2H), 2.70 (s , 3H), 1.86-2.08 (m, 1H), 1.37 (d, J = 12.55, 1.70 Hz, 2H), 1.03-1.23 (m, 2H). MS (ESI +) m / z 420.2 (M + H) + .
Пример 157Example 157
1-бензил-4-(1H-индазол-5-ил)-N,N-диметил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N, N-dimethyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 149C вместо соединения Примера 81A и с использованием диметиламина вместо пиперидина и тетрагидрофурана вместо диметилформамида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,19 (с, 1H), 8,15 (с, 1H), 7,96 (т, J=1,19 Гц, 1H), 7,62 (д, J=1,36 Гц, 2H), 7,33-7,44 (м, 3H), 7,24-7,33 (м, 2H), 5,59 (с, 2H), 2,92 (с, 3H), 2,21 (с, 3H). MS (ESI+) m/z 347,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B, using the compound of Example 149C instead of the compound of Example 81A and using dimethylamine instead of piperidine and tetrahydrofuran instead of dimethylformamide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.19 (s, 1H), 8.15 (s, 1H), 7.96 (t, J = 1.19 Hz, 1H), 7.62 (d, J = 1.36 Hz, 2H), 7.33-7.44 (m, 3H), 7.24-7.33 (m, 2H), 5.59 (s, 2H), 2.92 (s, 3H), 2.21 (s, 3H). MS (ESI +) m / z 347.1 (M + H) + .
Пример 158Example 158
N,1-дибензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамидN, 1-dibenzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 149C вместо соединения Примера 81A и с использованием бензиламина вместо пиперидина и тетрагидрофурана вместо диметилформамида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,15 (с, 1H), 9,35 (т, J=6,10 Гц, 1H), 8,01 (д, J=12,55 Гц, 2H), 7,68 (д, J=8,82, 1,36 Гц, 1H), 7,53 (д, J=8,82 Гц, 1H), 7,17-7,41 (м, 10H), 5,66 (с, 2H), 4,41 (д, J=6,10 Гц, 2H). MS (ESI+) m/z 409,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B, using the compound of Example 149C instead of the compound of Example 81A and using benzylamine instead of piperidine and tetrahydrofuran instead of dimethylformamide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.15 (s, 1H), 9.35 (t, J = 6.10 Hz, 1H), 8.01 (d, J = 12.55 Hz, 2H), 7.68 (d, J = 8 82, 1.36 Hz, 1H), 7.53 (d, J = 8.82 Hz, 1H), 7.17-7.41 (m, 10H), 5.66 (s, 2H), 4 41 (d, J = 6.10 Hz, 2H). MS (ESI +) m / z 409.1 (M + H) + .
Пример 159Example 159
N-(2-гидрокси-2-фенилэтил)-5-(1H-индазол-5-ил)-N-метилизоксазол-3-карбоксамидN- (2-hydroxy-2-phenylethyl) -5- (1H-indazol-5-yl) -N-methylisoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием DL-альфа-(метиламинометил)бензилового спирта вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,01 (с, 1H), 8,29 (с, 1H), 8,17 (с, 1H), 7,73-7,85 (м, 1H), 7,62-7,72 (м, 1H), 7,16-7,43 (м, 5H), 6,86 (с, 1H), 5,17 (д, J=4,39 Гц, 1H), 4,89 (с, 1H), 3,71 (д, J=5,49 Гц, 2H), 3,10 (с, 3H). MS (ESI+) m/z 363,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using DL-alpha- (methylaminomethyl) benzyl alcohol instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.01 (s, 1H), 8.29 (s, 1H), 8.17 (s, 1H), 7.73-7.85 (m, 1H), 7.62-7.72 (m, 1H), 7.16-7.43 (m, 5H), 6.86 (s, 1H), 5.17 (d, J = 4.39 Hz, 1H), 4.89 (s, 1H), 3.71 (d, J = 5.49 Hz, 2H); 3.10 (s, 3H). MS (ESI +) m / z 363.1 (M + H) + .
Пример 160Example 160
N-[(1S)-2-гидрокси-1-фенилэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1S) -2-hydroxy-1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (S)-2-амино-2-фенилэтанола вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 9,05 (д, J=8,14 Гц, 1H), 8,40 (с, 1H), 8,23 (с, 1H), 7,89 (д, J=8,65, 1,53 Гц, 1H), 7,70 (д, J=8,82 Гц, 1H), 7,20-7,46 (м, 6H), 5,02-5,13 (м, 1H), 4,98 (т, J=5,59 Гц, 1H), 3,61-3,82 (м, 2H). MS (ESI+) m/z 349,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (S) -2-amino-2-phenylethanol in place of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.37 (s, 1H), 9.05 (d, J = 8.14 Hz, 1H), 8.40 (s, 1H), 8.23 (s, 1H), 7.89 (d, J = 8.65, 1.53 Hz, 1H), 7.70 (d, J = 8.82 Hz, 1H), 7.20-7.46 (m, 6H), 5.02-5.13 ( m, 1H), 4.98 (t, J = 5.59 Hz, 1H), 3.61-3.82 (m, 2H). MS (ESI +) m / z 349.0 (M + H) + .
Пример 161Example 161
N-бензил-N-(2-гидроксиэтил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN-benzyl-N- (2-hydroxyethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-(бензиламино)этанола вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 9,05 (д, J=8,48 Гц, 1H), 8,40 (с, 1H), 8,23 (с, 1H), 7,89 (д, J=8,65, 1,53 Гц, 1H), 7,70 (д, J=8,82 Гц, 1H), 7,22-7,45 (м, 6H), 5,02-5,14 (м, 1H), 4,98 (т, J=5,76 Гц, 1H), 3,61-3,81 (м, 2H). MS (ESI+) m/z 349,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2- (benzylamino) ethanol instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.37 (s, 1H), 9.05 (d, J = 8.48 Hz, 1H), 8.40 (s, 1H), 8.23 (s, 1H), 7.89 (d, J = 8.65, 1.53 Hz, 1H), 7.70 (d, J = 8.82 Hz, 1H), 7.22-7.45 (m, 6H), 5.02-5.14 ( m, 1H), 4.98 (t, J = 5.76 Hz, 1H), 3.61-3.81 (m, 2H). MS (ESI +) m / z 349.0 (M + H) + .
Пример 162Example 162
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-3-метил-1H-индазол5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -3-methyl-1H-indazole
Пример 162AExample 162A
1-(5-Бром-3-метил-1H-индазол-1-ил)этанон1- (5-Bromo-3-methyl-1H-indazol-1-yl) ethanone
5-Бром-3-метил-1H-индазол (838 мг, 3,97 ммоль) растворяли в метиленхлориде (15 мл) и диизопропилэтиламине (0,7 мл). Добавляли уксусный ангидрид (500 мкл, 5,29 ммоль) и смесь перемешивали при температуре окружающей среды в течение ночи. Смесь разбавляли этилацетатом, промывали 1 н раствором гидроксида натрия, затем 1 н раствором хлористоводородной кислоты, затем насыщенным солевым раствором. Органический слой сушили над сульфатом натрия и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения. MS (ESI+) m/z 252,7 (M+H)+.5-Bromo-3-methyl-1H-indazole (838 mg, 3.97 mmol) was dissolved in methylene chloride (15 ml) and diisopropylethylamine (0.7 ml). Acetic anhydride (500 μl, 5.29 mmol) was added and the mixture was stirred at ambient temperature overnight. The mixture was diluted with ethyl acetate, washed with 1 N sodium hydroxide solution, then with 1 N hydrochloric acid solution, then with brine. The organic layer was dried over sodium sulfate and the solvent was removed under reduced pressure to obtain the title compound. MS (ESI +) m / z 252.7 (M + H) + .
Пример 162BExample 162B
1-(5-(1-Бензил-5-o-толил-1H-1,2,3-триазол-4-ил)-3-метил-1H-индазол-1-ил)этанон1- (5- (1-Benzyl-5-o-tolyl-1H-1,2,3-triazol-4-yl) -3-methyl-1H-indazol-1-yl) ethanone
Соединение Примера 153A (436 мг, 0,808 ммоль), Пример 162A (205 мг, 0,810 ммоль), дихлорбис(трифенилфосфин)палладий(II) (56 мг, 0,080 ммоль) и тиофен-2-карбоксилат меди (239 мг, 1,25 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали 150°C в течение 30 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 422,6 (M+H)+.The compound of Example 153A (436 mg, 0.808 mmol), Example 162A (205 mg, 0.810 mmol), dichlorbis (triphenylphosphine) palladium (II) (56 mg, 0.080 mmol) and copper thiophene-2-carboxylate (239 mg, 1.25 mmol) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated to 150 ° C. for 30 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 422.6 (M + H) + .
Пример 162CExample 162C
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-3-метил-1H-индазол5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -3-methyl-1H-indazole
Соединение Примера 162B (202 мг, 0,548 ммоль) растворяли в тетрагидрофуране (5,0 мл), метаноле (0,5 мл) и воде (0,5 мл) и добавляли гидроксид калия (133 мг, 2,37 ммоль). Смесь перемешивали в течение 1 часа и затем разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 30-80% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,63 (с, 1H), 7,70 (с, 1H), 7,44-7,52 (м, 1H), 7,38-7,43 (м, 1H), 7,29-7,38 (м, 4H), 7,22-7,29 (м, 3H), 6,89-6,96 (м, J=6,44, 3,05 Гц, 2H), 5,30-5,48 (м, 2H), 2,32 (с, 3H), 1,58 (с, 3H). MS (ESI+) m/z 380,1 (M+H)+.The compound of Example 162B (202 mg, 0.548 mmol) was dissolved in tetrahydrofuran (5.0 ml), methanol (0.5 ml) and water (0.5 ml) and potassium hydroxide (133 mg, 2.37 mmol) was added. The mixture was stirred for 1 hour and then diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 30-80% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.63 (s, 1H), 7.70 (s, 1H), 7.44-7.52 (m, 1H), 7.38-7.43 (m, 1H), 7.29-7, 38 (m, 4H), 7.22-7.29 (m, 3H), 6.89-6.96 (m, J = 6.44, 3.05 Hz, 2H), 5.30-5, 48 (m, 2H), 2.32 (s, 3H), 1.58 (s, 3H). MS (ESI +) m / z 380.1 (M + H) + .
Пример 163Example 163
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Пример 163 AExample 163 A
5-(1-Бензил-5-o-толил-1H-1,2,3-триазол-4-ил)-2-фторбензонитрил5- (1-Benzyl-5-o-tolyl-1H-1,2,3-triazol-4-yl) -2-fluorobenzonitrile
Соединение Примера 153A (450 мг, 0,834 ммоль), 5-бром-2-фторбензонитрил (167 мг, 0,835 ммоль), дихлорбис(трифенилфосфин)палладий(II) (56 мг, 0,080 ммоль) и тиофен-2-карбоксилат меди (242 мг, 1,27 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали при 150°C в течение 30 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 369,2 (M+H)+.The compound of Example 153A (450 mg, 0.834 mmol), 5-bromo-2-fluorobenzonitrile (167 mg, 0.835 mmol), dichlorobis (triphenylphosphine) palladium (II) (56 mg, 0.080 mmol) and copper thiophene-2-carboxylate (242 mg, 1.27 mmol) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated at 150 ° C for 30 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 369.2 (M + H) + .
Пример 163BExample 163B
5-[1-бензил-5-(2-метилфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Соединение Примера 163A (202 мг, 0,548 ммоль) обрабатывали гидразингидратом (1,0 мл) в этаноле (1,0 мл) и перемешивали и нагревали до 60°C в течение ночи. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 35-85% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,38 (с, 1H), 8,11 (с, 1H), 7,41-7,49 (м, 1H), 7,33-7,40 (м, J=6,95, 6,95 Гц, 1H), 7,28-7,32 (м, 2H), 7,21-7,28 (м, 3H), 7,00-7,06 (м, 1H), 6,86-6,95 (м, 3H), 5,27-5,44 (м, 4H), 1,58 (с, 3H). MS (ESI+) m/z 381,1 (M+H)+.The compound of Example 163A (202 mg, 0.548 mmol) was treated with hydrazine hydrate (1.0 ml) in ethanol (1.0 ml) and stirred and heated to 60 ° C. overnight. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 35-85% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.38 (s, 1H), 8.11 (s, 1H), 7.41-7.49 (m, 1H), 7.33-7.40 (m, J = 6.95, 6.95 Hz, 1H), 7.28-7.32 (m, 2H), 7.21-7.28 (m, 3H), 7.00-7.06 (m, 1H), 6.86-6, 95 (m, 3H), 5.27-5.44 (m, 4H), 1.58 (s, 3H). MS (ESI +) m / z 381.1 (M + H) + .
Пример 164Example 164
2-{2-[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]этил}-1H-изоиндол-1,3(2H)-дион2- {2- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] ethyl} -1H-isoindol-1,3 (2H) -dione
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 2-(бут-3-инил)изоиндолин-1,3-диона вместо 3-фенил-1-пропина. Неочищенный продукт подвергали обработке 25% ТФУ/дихлорметан и очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,33 (с, 1H), 8,65 (с, 1H), 8,22 (с, 1H), 8,18 (д, J=1,53 Гц, 1H), 7,78-7,90 (м, 5H), 7,71-7,75 (м, 1H), 3,92 (т, J=7,21 Гц, 2H), 3,08 (т, J=7,21 Гц, 2H). MS (ESI+) m/z 359,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 2- (but-3-ynyl) isoindolin-1,3-dione instead of 3-phenyl-1-propine. The crude product was treated with 25% TFA / dichloromethane and purified by reverse phase HPLC using an acetonitrile / water gradient gradient of 0.1% TFA to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.33 (s, 1H), 8.65 (s, 1H), 8.22 (s, 1H), 8.18 (d, J = 1.53 Hz, 1H), 7.78-7.90 (m, 5H), 7.71-7.75 (m, 1H), 3.92 (t, J = 7.21 Hz, 2H), 3.08 (t, J = 7.21 Hz, 2H) . MS (ESI +) m / z 359.0 (M + H) + .
Пример 165Example 165
5-{4-[(2,4-дихлорфенокси)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол5- {4 - [(2,4-Dichlorophenoxy) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 2,4-дихлор-1-(проп-2-инилокси)бензола вместо 3-фенил-1-пропина. Неочищенный продукт подвергали обработке 25% ТФУ/дихлорметан и очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,38 (с, 1H), 8,93 (с, 1H), 8,28 (д, J=1,53 Гц, 1H), 8,23 (с, 1H), 7,88 (д, J=8,90, 1,84 Гц, 1H), 7,76 (д, J=8,90 Гц, 1H), 7,59 (д, J=2,46 Гц, 1H), 7,39-7,49 (м, 2H), 5,37 (с, 2H). MS (ESI+) m/z 359,9 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 2,4-dichloro-1- (prop-2-ynyloxy) benzene instead of 3-phenyl-1-propine. The crude product was treated with 25% TFA / dichloromethane and purified by reverse phase HPLC using an acetonitrile / water gradient gradient of 0.1% TFA to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.38 (s, 1H), 8.93 (s, 1H), 8.28 (d, J = 1.53 Hz, 1H), 8.23 (s, 1H), 7.88 (d, J = 8.90, 1.84 Hz, 1H), 7.76 (d, J = 8.90 Hz, 1H), 7.59 (d, J = 2.46 Hz, 1H), 7.39-7 49 (m, 2H); 5.37 (s, 2H). MS (ESI +) m / z 359.9 (M + H) + .
Пример 166Example 166
5-{4-[(2,6-дихлорфенокси)метил]-1H-1,2,3-триазол-1-ил}-1H-индазол5- {4 - [(2,6-dichlorophenoxy) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием 1,3-дихлор-2-(проп-2-инилокси)бензола вместо 3-фенил-1-пропина. Неочищенный продукт подвергали обработке 25% ТФУ/дихлорметан и очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 13,39 (с, 1H), 8,97 (с, 1H), 8,29 (д, J=1,53 Гц, 1H), 8,24 (с, 1H), 7,89 (д, J=9,00, 1,98 Гц, 1H), 7,76 (д, J=8,85 Гц, 1H), 7,51-7,55 (м, 2H), 7,19-7,26 (м, J=8,24, 8,24 Гц, 1H), 5,23 (с, 2H). MS (ESI+) m/z 359,9 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using 1,3-dichloro-2- (prop-2-ynyloxy) benzene instead of 3-phenyl-1-propine. The crude product was treated with 25% TFA / dichloromethane and purified by reverse phase HPLC using an acetonitrile / water gradient gradient of 0.1% TFA to obtain the title compound. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 13.39 (s, 1H), 8.97 (s, 1H), 8.29 (d, J = 1.53 Hz, 1H), 8.24 (s, 1H), 7.89 (d, J = 9.00, 1.98 Hz, 1H), 7.76 (d, J = 8.85 Hz, 1H), 7.51-7.55 (m, 2H), 7.19-7.26 ( m, J = 8.24, 8.24 Hz, 1H), 5.23 (s, 2H). MS (ESI +) m / z 359.9 (M + H) + .
Пример 167Example 167
5-[5-(4-фторфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [5- (4-fluorophenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Соединение Примера 156B (168 мг, 0,401 ммоль) растворяли в тетрагидрофуране (5,0 мл), метаноле (0,5 мл) и воде (0,5 мл) и добавляли гидроксид калия (138 мг, 2,46 ммоль). Смесь перемешивали в течение 1 часа и разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 0-7% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,08 (с, 1H), 8,02 (с, 1H), 7,77 (с, 1H), 7,50-7,58 (м, 2H), 7,37-7,49 (м, 4H), 4,11 (д, J=7,12 Гц, 2H), 3,76 (д, J=1 1,53, 2,71 Гц, 2H), 3,11-3,24 (м, 2H), 1,88-2,03 (м, 1H), 1,30-1,43 (м, J=12,72, 1,86 Гц, 2H), 1,04-1,22 (м, 2H). MS (ESI+) m/z 378,1 (M+H)+.The compound of Example 156B (168 mg, 0.401 mmol) was dissolved in tetrahydrofuran (5.0 ml), methanol (0.5 ml) and water (0.5 ml) and potassium hydroxide (138 mg, 2.46 mmol) was added. The mixture was stirred for 1 hour and diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 0-7% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.08 (s, 1H), 8.02 (s, 1H), 7.77 (s, 1H), 7.50-7.58 (m, 2H), 7.37-7.49 (m, 4H), 4.11 (d, J = 7.12 Hz, 2H), 3.76 (d, J = 1 1.53, 2.71 Hz, 2H), 3.11-3.24 (m, 2H), 1.88-2.03 (m, 1H), 1.30-1.43 (m, J = 12.72, 1.86 Hz, 2H), 1.04-1.22 (m, 2H). MS (ESI +) m / z 378.1 (M + H) + .
Пример 168Example 168
1-{[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]метил}-1H-индазол1 - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} -1H-indazole
Пример 168AExample 168A
1-(Проп-2-инил)-1H-индазол1- (Prop-2-ynyl) -1H-indazole
Индазол (530 мг, 4,49 ммоль) растворяли в диметилформамиде (4 мл). Медленно добавляли гидрид натрия (60% суспензия в минеральном масле, 231 мг, 5,78 ммоль) и смесь перемешивали в течение 10 минут. Добавляли пропаргилбромид (80% масс. в толуоле, 5,0 мл) и смесь перемешивали при температуре окружающей среды в течение ночи. Смесь разбавляли этилацетатом, промывали избыточным количеством воды, абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-30% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 157,1 (M+H)+.Indazole (530 mg, 4.49 mmol) was dissolved in dimethylformamide (4 ml). Sodium hydride (60% suspension in mineral oil, 231 mg, 5.78 mmol) was slowly added and the mixture was stirred for 10 minutes. Propargyl bromide (80% by weight in toluene, 5.0 ml) was added and the mixture was stirred at ambient temperature overnight. The mixture was diluted with ethyl acetate, washed with excess water, absorbed on silica gel and purified by silica gel chromatography using a gradient of 5-30% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 157.1 (M + H) + .
Пример 168BExample 168B
1-{[1-(1H-индазол-5-ил)-1H-1,2,3-триазол-4-ил]метил}-1H-индазол1 - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 88, с использованием соединения Примера 168A вместо 3-фенил-1-пропина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,78 (с, 1H), 8,22 (д, J=2,03, 0,68 Гц, 1H), 8,20 (с, 1H), 8,10 (д, J=1,02 Гц, 1H), 7,80-7,87 (м, 2H), 7,75-7,80 (м, 1H), 7,68-7,74 (м, 1H), 7,39-7,46 (м, 1H), 7,13-7,19 (м, 1H), 5,81 (с, 2H). MS (ESI+) m/z 316,0 (M+H)+.The title compound was prepared according to the procedure described in Example 88 using the compound of Example 168A instead of 3-phenyl-1-propine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.78 (s, 1H), 8.22 (d, J = 2.03, 0.68 Hz, 1H), 8.20 (s, 1H), 8.10 (d, J = 1.02 Hz, 1H), 7.80-7.87 (m, 2H), 7.75-7.80 (m, 1H), 7.68-7.74 (m, 1H ), 7.39-7.46 (m, 1H), 7.13-7.19 (m, 1H), 5.81 (s, 2H). MS (ESI +) m / z 316.0 (M + H) + .
Пример 169Example 169
5-[1-бензил-5-(пиперидин-1-илкарбонил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1-benzyl-5- (piperidin-1-ylcarbonyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 149C вместо соединения Примера 81A и с использованием тетрагидрофурана вместо диметилформамида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,20 (с, 1H), 8,16 (с, 1H), 7,95-8,00 (м, J=1,02 Гц, 1H), 7,62-7,68 (м, 1H), 7,57-7,63 (м, 1H), 7,31-7,44 (м, 3H), 7,24-7,30 (м, 2H), 5,36-5,84 (м, J=69,17 Гц, 2H), 3,43-3,59 (м, 2H), 2,43-2,59 (м, 2H), 1,17-1,46 (м, J=39,67 Гц, 4H), 0,49-0,65 (м, 2H). MS (ESI+) m/z 387,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using the compound of Example 149C instead of the compound of Example 81A and using tetrahydrofuran instead of dimethylformamide.oneH NMR (300 MHz, DMSO-d6) δ ppm 13.20 (s, 1H), 8.16 (s, 1H), 7.95-8.00 (m, J = 1.02 Hz, 1H), 7.62-7.68 (m, 1H) 7.57-7.63 (m, 1H), 7.31-7.44 (m, 3H), 7.24-7.30 (m, 2H), 5.36-5.84 (m, J = 69.17 Hz, 2H), 3.43-3.59 (m, 2H), 2.43-2.59 (m, 2H), 1.17-1.46 (m, J = 39, 67 Hz, 4H), 0.49-0.65 (m, 2H). MS (ESI +) m / z 387.1 (M + H)+.
Пример 170Example 170
5-[5-(2-метилфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [5- (2-methylphenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Пример 170AExample 170A
1-((Тетрагидро-2H-пиран-4-ил)метил)-5-o-толил-4-(трибутилстаннил)-1H-1,2,3-триазол1 - ((Tetrahydro-2H-pyran-4-yl) methyl) -5-o-tolyl-4- (tributylstannyl) -1H-1,2,3-triazole
2-Этинилтолуол (576 мг, 4,57 ммоль) добавляли к 1,1,1-трибутил-N,N-диметилстаннанамин (1,53 г, 4,58 ммоль) и смесь перемешивали в герметично закрытом сосуде при 70°C в течение 2 часов. Смесь охлаждали до температуры окружающей среды и содержимое сосуда перемешивали без герметизации в течение 10 минут. Добавляли соединение Примера 80A (648 мг, 4,59 ммоль) и сосуд снова герметично закрывали и нагревали до 130°C в течение ночи. Смесь очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 5-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 548,4 (M+H)+.2-Ethynyltoluene (576 mg, 4.57 mmol) was added to 1,1,1-tributyl-N, N-dimethylstannanamine (1.53 g, 4.58 mmol) and the mixture was stirred in a hermetically sealed vessel at 70 ° C. within 2 hours. The mixture was cooled to ambient temperature and the contents of the vessel were mixed without sealing for 10 minutes. The compound of Example 80A (648 mg, 4.59 mmol) was added and the vessel was again sealed and heated to 130 ° C. overnight. The mixture was purified by silica gel chromatography using a gradient of 5-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 548.4 (M + H) + .
Пример 170BExample 170B
1-(5-(1-((Тетрагидро-2H-пиран-4-ил)метил)-5-o-толил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-ил)этанон1- (5- (1 - ((Tetrahydro-2H-pyran-4-yl) methyl) -5-o-tolyl-1H-1,2,3-triazol-4-yl) -1H-indazole-1- silt) ethanone
Соединение Примера 170A (432 мг, 0,791 ммоль), соединение Примера 87A (222 мг, 0,776 ммоль), дихлорбис(трифенилфосфин)палладий(II) (58 мг, 0,083 ммоль) и тиофен-2-карбоксилат меди (231 мг, 1,21 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали при 150°C в течение 20 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 20-70% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 416,2 (M+H)+.The compound of Example 170A (432 mg, 0.791 mmol), the compound of Example 87A (222 mg, 0.776 mmol), dichlorobis (triphenylphosphine) palladium (II) (58 mg, 0.083 mmol) and copper thiophene-2-carboxylate (231 mg, 1, 21 mmol) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated at 150 ° C for 20 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 20-70% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 416.2 (M + H) + .
Пример 170CExample 170C
5-[5-(2-метилфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [5- (2-methylphenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Соединение Примера 170B (184 мг, 0,443 ммоль) растворяли в тетрагидрофуране (3,0 мл), метаноле (0,3 мл) и воде (0,3 мл) и добавляли гидроксид калия (140 мг, 2,50 ммоль). Смесь перемешивали в течение 3 часов и разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 35-100% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,08 (с, 1H), 7,98 (с, 1H), 7,68-7,74 (м, J=1,02, 1,02 Гц, 1H), 7,49-7,56 (м, 1H), 7,45-7,49 (м, 3H), 7,41-7,45 (м, J=7,46 Гц, 2H), 4,10 (д, J=13,73, 6,95 Гц, 1H), 3,89 (д, J=13,90, 7,80 Гц, 1H), 3,77 (д, J=10,51, 2,71 Гц, 2H), 3,10-3,24 (м, 2H), 1,92 (с, 3H), 1,88-1,98 (м, 1H), 1,26-1,43 (м, 2H), 1,04-1,21 (м, 2H). MS (ESI+) m/z 374,1 (M+H)+.The compound of Example 170B (184 mg, 0.443 mmol) was dissolved in tetrahydrofuran (3.0 ml), methanol (0.3 ml) and water (0.3 ml) and potassium hydroxide (140 mg, 2.50 mmol) was added. The mixture was stirred for 3 hours and diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 35-100% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.08 (s, 1H), 7.98 (s, 1H), 7.68-7.74 (m, J = 1.02, 1.02 Hz, 1H), 7.49-7.56 ( m, 1H), 7.45-7.49 (m, 3H), 7.41-7.45 (m, J = 7.46 Hz, 2H), 4.10 (d, J = 13.73, 6.95 Hz, 1H), 3.89 (d, J = 13.90, 7.80 Hz, 1H), 3.77 (d, J = 10.51, 2.71 Hz, 2H), 3, 10-3.24 (m, 2H), 1.92 (s, 3H), 1.88-1.98 (m, 1H), 1.26-1.43 (m, 2H), 1.04- 1.21 (m, 2H). MS (ESI +) m / z 374.1 (M + H) + .
Пример 171Example 171
5-[5-(2-метилфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [5- (2-methylphenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Пример 171AExample 171A
2-фтор-5-(1-((тетрагидро-2H-пиран-4-ил)метил)-5-o-толил-1H-1,2,3-триазол-4-ил)бензонитрил2-fluoro-5- (1 - ((tetrahydro-2H-pyran-4-yl) methyl) -5-o-tolyl-1H-1,2,3-triazol-4-yl) benzonitrile
Соединение Примера 170A (411 мг, 0,752 ммоль), 5-бром-2-фторбензонитрил (151 мг, 0,755 ммоль), дихлорбис(трифенилфосфин)палладий(II) (52 мг, 0,074 ммоль) и тиофен-2-карбоксилат меди (223 мг, 1,17 ммоль) объединяли в толуоле (2,0 мл) в 4-мл сосуде в инертной атмосфере азота. Сосуд герметично закрывали и нагревали 150°C в течение 30 минут. Смесь абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиента 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 377,6 (M+H)+.The compound of Example 170A (411 mg, 0.752 mmol), 5-bromo-2-fluorobenzonitrile (151 mg, 0.755 mmol), dichlorobis (triphenylphosphine) palladium (II) (52 mg, 0.074 mmol) and copper thiophene-2-carboxylate (223 mg, 1.17 mmol) were combined in toluene (2.0 ml) in a 4 ml vessel under an inert nitrogen atmosphere. The vessel was sealed and heated to 150 ° C. for 30 minutes. The mixture was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 377.6 (M + H) + .
Пример 171BExample 171B
5-[5-(2-метилфенил)-1-(тетрагидро-2H-пиран-4-илметил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [5- (2-methylphenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Соединение Примера 171A (175 мг, 0,465 ммоль) обрабатывали гидразингидратом (2,0 мл) в этаноле (2,0 мл) и смесь перемешивали и нагревали до 65°C в течение 2 часов. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 1-8% метанола в дихлорметане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,39 (с, 1H), 8,08 (с, 1H), 7,45-7,55 (м, 1H), 7,37-7,45 (м, 3H), 7,01-7,08 (м, J=8,48 Гц, 1H), 6,89-6,97 (м, 1H), 5,34 (с, 2H), 4,09 (д, J=13,73, 6,95 Гц, 1H), 3,89 (д, J=13,73, 7,63 Гц, 1H), 3,70-3,81 (м, 2H), 3,08-3,24 (м, 2H), 1,91 (с, 3H), 1,84-1,99 (м, 1H), 1,22-1,41 (м, 2H), 1,04-1,20 (м, 2H). MS (ESI+) m/z 389,1 (M+H)+.The compound of Example 171A (175 mg, 0.465 mmol) was treated with hydrazine hydrate (2.0 ml) in ethanol (2.0 ml) and the mixture was stirred and heated to 65 ° C for 2 hours. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 1-8% methanol in dichloromethane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.39 (s, 1H), 8.08 (s, 1H), 7.45-7.55 (m, 1H), 7.37-7.45 (m, 3H), 7.01-7, 08 (m, J = 8.48 Hz, 1H), 6.89-6.97 (m, 1H), 5.34 (s, 2H), 4.09 (d, J = 13.73, 6, 95 Hz, 1H), 3.89 (d, J = 13.73, 7.63 Hz, 1H), 3.70-3.81 (m, 2H), 3.08-3.24 (m, 2H ), 1.91 (s, 3H), 1.84-1.99 (m, 1H), 1.22-1.41 (m, 2H), 1.04-1.20 (m, 2H). MS (ESI +) m / z 389.1 (M + H) + .
Пример 172Example 172
5-[1-бензил-5-(морфолин-4-илкарбонил)-1H-1,2,3-триазол-4-ил]-1H-индазол5- [1-benzyl-5- (morpholin-4-ylcarbonyl) -1H-1,2,3-triazol-4-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 149C вместо соединения Примера 81A, морфолина вместо пиперидина и тетрагидрофурана вместо диметилформамида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,22 (с, 1H), 8,18 (с, 1H), 7,95-8,03 (м, 1H), 7,64-7,70 (м, 1H), 7,57-7,64 (м, 1H), 7,33-7,45 (м, 3H), 7,24-7,31 (м, 2H), 5,76 (с, 1H), 5,52 (с, 1H), 3,33-3,59 (м, 4H), 2,61-2,74 (м, 2H), 2,45-2,59 (м, 2H). MS (ESI+) m/z 389,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using the compound of Example 149C instead of the compound of Example 81A, morpholine instead of piperidine and tetrahydrofuran instead of dimethylformamide. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.22 (s, 1H), 8.18 (s, 1H), 7.95-8.03 (m, 1H), 7.64-7.70 (m, 1H), 7.57-7, 64 (m, 1H), 7.33-7.45 (m, 3H), 7.24-7.31 (m, 2H), 5.76 (s, 1H), 5.52 (s, 1H) 3.33-3.59 (m, 4H); 2.61-2.74 (m, 2H); 2.45-2.59 (m, 2H). MS (ESI +) m / z 389.1 (M + H) + .
Пример 173Example 173
5-[1-бензил-5-(4-метоксифенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (4-methoxyphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
В атмосфере аргона сосуд, содержащий соединение Примера 125B (50 мг, 0,12 ммоль), 4-метоксифенилбороновую кислоту (20 мг, 0,13 ммоль), PdCl2(dppf).дихлорметан (10 мг, 0,01 ммоль) и карбонат калия (33 мг, 0,24 ммоль) в DME (2 мл) и воде (0,2 мл), закрывали крышкой и нагревали при 80°C в нагревательном устройстве с встряхиванием в течение 48 часов. Растворитель выпаривали при пониженном давлении и продукт очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,85 (с, 1H), 8,18 (с, 1H), 7,26-7,34 (м, 3H), 7,19-7,25 (м, 2H), 7,16-7,19 (м, 2H), 7,02 (т, J=8,13 Гц, 4H), 5,47 (с, 2H), 3,80 (с, 3H). MS (ESI+) m/z 397,1 (M+H)+.In an argon atmosphere, a vessel containing the compound of Example 125B (50 mg, 0.12 mmol), 4-methoxyphenylboronic acid (20 mg, 0.13 mmol), PdCl 2 (dppf). Dichloromethane (10 mg, 0.01 mmol) and potassium carbonate (33 mg, 0.24 mmol) in DME (2 ml) and water (0.2 ml) were covered with a lid and heated at 80 ° C. in a heating device with shaking for 48 hours. The solvent was evaporated under reduced pressure and the product was purified by reverse phase HPLC using an acetonitrile / water gradient 0.1% TFA gradient elution method to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.85 (s, 1H), 8.18 (s, 1H), 7.26-7.34 (m, 3H), 7.19-7.25 (m, 2H), 7.16-7, 19 (m, 2H), 7.02 (t, J = 8.13 Hz, 4H), 5.47 (s, 2H), 3.80 (s, 3H). MS (ESI +) m / z 397.1 (M + H) + .
Пример 174Example 174
N-[(1S)-1-бензил-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1S) -1-benzyl-2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (S)-(-)-2-амино-3-фенил-1-пропанола вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,47 (д, J=8,82 Гц, 1H), 8,38 (с, 1H), 8,22 (с, 1H), 7,87 (д, J=8,82, 1,70 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,23-7,31 (м, 3H), 7,22 (с, 1H), 7,12-7,21 (м, 1H), 4,90 (т, J=5,59 Гц, 1H), 4,07-4,28 (м, 1H), 3,40-3,58 (м, 2H), 2,89-3,00 (м, 1H), 2,75-2,86 (м, 1H). MS (ESI+) m/z 363,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (S) - (-) - 2-amino-3-phenyl-1-propanol instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.47 (d, J = 8.82 Hz, 1H), 8.38 (s, 1H), 8.22 (s, 1H), 7.87 (d, J = 8.82, 1.70 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H), 7.23-7.31 (m, 3H), 7.22 (s, 1H) 7.12-7.21 (m, 1H), 4.90 (t, J = 5.59 Hz, 1H), 4.07-4.28 (m, 1H), 3.40-3.58 (m, 2H), 2.89-3.00 (m, 1H), 2.75-2.86 (m, 1H). MS (ESI +) m / z 363.0 (M + H) + .
Пример 175Example 175
N-[(1S,2R)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1S, 2R) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (1S,2R)-(-)-цис-1-амино-2-инданола вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,38 (с, 1H), 8,42 (с, 1H), 8,24 (с, 1H), 8,16 (д, J=8,48 Гц, 1H), 7,91 (д, J=8,82, 1,70 Гц, 1H), 7,71 (д, J=8,48 Гц, 1H), 7,45 (с, 1H), 7,16-7,32 (м, 4H), 5,36-5,47 (м, 2H), 4,50-4,61 (м, 1H), 3,14 (д, J=15,43, 5,26 Гц, 1H), 2,90 (д, J=16,28, 1,70 Гц, 1H). MS (ESI+) m/z 361,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (1S, 2R) - (-) - cis-1-amino-2-indanol instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.38 (s, 1H), 8.42 (s, 1H), 8.24 (s, 1H), 8.16 (d, J = 8.48 Hz, 1H), 7.91 (d, J = 8.82, 1.70 Hz, 1H), 7.71 (d, J = 8.48 Hz, 1H), 7.45 (s, 1H), 7.16-7.32 (m, 4H) , 5.36-5.47 (m, 2H), 4.50-4.61 (m, 1H), 3.14 (d, J = 15.43, 5.26 Hz, 1H), 2.90 (d, J = 16.28, 1.70 Hz, 1H). MS (ESI +) m / z 361.0 (M + H) + .
Пример 176Example 176
5-{3-[(3-фенилморфолин-4-ил)карбонил]изоксазол-5-ил}-1H-индазол5- {3 - [(3-phenylmorpholin-4-yl) carbonyl] isoxazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием гидрохлорида 3-фенилморфолина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,38 (с, 1H), 8,32-8,46 (м, 1H), 8,24 (с, 1H), 7,81-7,96 (м, 1H), 7,70 (д, J=8,82 Гц, 1H), 7,37-7,55 (м, 4H), 7,26-7,37 (м, 2H), 5,34-5,71 (м, 1H), 4,51 (д, J=13,22 Гц, 1H), 3,78-4,39 (м, 3H), 3,59 (т, J=1 1,36 Гц, 1H), 3,33-3,41 (м, 1H). MS (ESI+) m/z 375,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 3-phenylmorpholine hydrochloride instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.38 (s, 1H), 8.32-8.46 (m, 1H), 8.24 (s, 1H), 7.81-7.96 (m, 1H), 7.70 (d, J = 8.82 Hz, 1H), 7.37-7.55 (m, 4H), 7.26-7.37 (m, 2H), 5.34-5.71 (m, 1H), 4 51 (d, J = 13.22 Hz, 1H), 3.78-4.39 (m, 3H), 3.59 (t, J = 1 1.36 Hz, 1H), 3.33-3 41 (m, 1H). MS (ESI +) m / z 375.0 (M + H) + .
Пример 177Example 177
N-бензил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN-benzyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием бензиламина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 9,35 (т, J=6,27 Гц, 1H), 8,40 (с, 1H), 8,23 (с, 1H), 7,89 (д, J=8,82, 1,70 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,33-7,40 (м, 4H), 7,32 (с, 1H), 7,22-7,30 (м, 1H), 4,48 (д, J=6,10 Гц, 2H). MS (ESI+) m/z 319,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using benzylamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 9.35 (t, J = 6.27 Hz, 1H), 8.40 (s, 1H), 8.23 (s, 1H), 7.89 (d, J = 8.82, 1.70 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H), 7.33-7.40 (m, 4H), 7.32 (s, 1H) 7.22-7.30 (m, 1H); 4.48 (d, J = 6.10 Hz, 2H). MS (ESI +) m / z 319.0 (M + H) + .
Пример 178Example 178
((1S)-2-{[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил}-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-ил)метанол((1S) -2 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} -6,7-dimethoxy-1,2,3,4-tetrahydroisoquinolin-1-yl) methanol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (S)-(6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-ил)метанола вместо пиперидина. MS (ESI+) m/z 435,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (S) - (6,7-dimethoxy-1,2,3,4-tetrahydroisoquinolin-1-yl) methanol instead of piperidine. MS (ESI +) m / z 435.1 (M + H) + .
Пример 179Example 179
N-[(1R)-3-гидрокси-1-фенилпропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R) -3-hydroxy-1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (R)-3-амино-3-фенилпропанола вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 9,24 (д, J=8,48 Гц, 1H), 8,39 (с, 1H), 8,23 (с, 1H), 7,88 (д, J=8,82, 1,70 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,38-7,46 (м, 2H), 7,34 (т, J=7,46 Гц, 2H), 7,19-7,30 (м, 2H), 5,09-5,27 (м, 1H), 4,62 (т, J=4,92 Гц, 1H), 3,37-3,52 (м, 2H), 2,00-2,16 (м, 1H), 1,84-2,00 (м, 1H). MS (ESI+) m/z 363,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (R) -3-amino-3-phenylpropanol instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.37 (s, 1H), 9.24 (d, J = 8.48 Hz, 1H), 8.39 (s, 1H), 8.23 (s, 1H), 7.88 (d, J = 8.82, 1.70 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H), 7.38-7.46 (m, 2H), 7.34 (t, J = 7.46 Hz, 2H), 7.19-7.30 (m, 2H), 5.09-5.27 (m, 1H), 4.62 (t, J = 4.92 Hz, 1H), 3.37-3.52 (m, 2H), 2.00-2.16 (m, 1H), 1.84-2.00 (m, 1H). MS (ESI +) m / z 363.1 (M + H) + .
Пример 180Example 180
N-[(1S)-3-гидрокси-1-фенилпропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1S) -3-hydroxy-1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (S)-3-амино-3-фенилпропанола вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 9,24 (д, J=8,14 Гц, 1H), 8,39 (с, 1H), 8,22 (с, 1H), 7,88 (д, J=8,65, 1,53 Гц, 1H), 7,69 (д, J=8,81 Гц, 1H), 7,37-7,45 (м, 2H), 7,29-7,37 (м, 2H), 7,19-7,29 (м, 2H), 5,08-5,30 (м, 1H), 4,55-4,68 (м, 1H), 3,37-3,51 (м, 2H), 2,00-2,14 (м, 1H), 1,83-1,99 (м, 1H). MS (ESI+) m/z 363,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (S) -3-amino-3-phenylpropanol instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 9.24 (d, J = 8.14 Hz, 1H), 8.39 (s, 1H), 8.22 (s, 1H), 7.88 (d, J = 8.65, 1.53 Hz, 1H), 7.69 (d, J = 8.81 Hz, 1H), 7.37-7.45 (m, 2H), 7.29-7.37 ( m, 2H), 7.19-7.29 (m, 2H), 5.08-5.30 (m, 1H), 4.55-4.68 (m, 1H), 3.37-3, 51 (m, 2H), 2.00-2.14 (m, 1H), 1.83-1.99 (m, 1H). MS (ESI +) m / z 363.0 (M + H) + .
Пример 181Example 181
N-2,3-дигидро-1H-инден-1-ил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN-2,3-dihydro-1H-inden-1-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 1-аминоиндана вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 9,13 (д, J=8,14 Гц, 1H), 8,39 (с, 1H), 8,23 (с, 1H), 7,89 (д, J=8,82, 1,36 Гц, 1H), 7,70 (д, J=8,82 Гц, 1H), 7,35 (с, 1H), 7,15-7,32 (м, 4H), 5,55 (кв., J=7,91 Гц, 1H), 2,95-3,08 (м, 1H), 2,76-2,94 (м, 1H), 2,37-2,49 (м, 1H), 2,01-2,15 (м, 1H). MS (ESI+) m/z 345,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 1-aminoindan instead of piperidine. 1 H NMR (300 MHz, DMSO-d6) δ ppm 13.37 (s, 1H), 9.13 (d, J = 8.14 Hz, 1H), 8.39 (s, 1H), 8.23 (s, 1H), 7.89 (d, J = 8.82, 1.36 Hz, 1H), 7.70 (d, J = 8.82 Hz, 1H), 7.35 (s, 1H), 7.15-7.32 (m, 4H) 5.55 (q, J = 7.91 Hz, 1H), 2.95-3.08 (m, 1H), 2.76-2.94 (m, 1H), 2.37-2, 49 (m, 1H); 2.01-2.15 (m, 1H). MS (ESI +) m / z 345.0 (M + H) + .
Пример 182Example 182
N-2,3-дигидро-1H-инден-2-ил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN-2,3-dihydro-1H-inden-2-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-аминоиндана вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 9,08 (д, J=7,46 Гц, 1H), 8,39 (с, 1H), 8,23 (с, 1H), 7,89 (д, J=8,82, 1,70 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,31 (с, 1H), 7,10-7,28 (м, 4H), 4,63-4,79 (м, 1H), 3,24 (д, J=15,77, 7,63 Гц, 2H), 2,96-3,08 (м, 2H). MS (ESI+) m/z 345,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2-aminoindane instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.37 (s, 1H), 9.08 (d, J = 7.46 Hz, 1H), 8.39 (s, 1H), 8.23 (s, 1H), 7.89 (d, J = 8.82, 1.70 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H), 7.31 (s, 1H), 7.10-7.28 (m, 4H) 4.63-4.79 (m, 1H); 3.24 (d, J = 15.77; 7.63 Hz, 2H); 2.96-3.08 (m, 2H). MS (ESI +) m / z 345.0 (M + H) + .
Пример 183Example 183
5-(1H-индазол-5-ил)-N-(1-фенилпропил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (1-phenylpropyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием альфа-этилбензиламина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 9,18 (д, J=8,82 Гц, 1H), 8,38 (с, 1H), 8,22 (с, 1H), 7,88 (д, J=8,82, 1,36 Гц, 1H), 7,69 (д, J=8,48 Гц, 1H), 7,39-7,48 (м, 2H), 7,34 (т, J=7,29 Гц, 2H), 7,19-7,29 (м, 2H), 4,84-5,00 (м, 1H), 1,69-2,04 (м, 2H), 0,91 (т, J=7,29 Гц, 3H). MS (ESI+) m/z 347,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using alpha-ethylbenzylamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 9.18 (d, J = 8.82 Hz, 1H), 8.38 (s, 1H), 8.22 (s, 1H), 7.88 (d, J = 8.82, 1.36 Hz, 1H), 7.69 (d, J = 8.48 Hz, 1H), 7.39-7.48 (m, 2H), 7.34 (t, J = 7.29 Hz, 2H), 7.19-7.29 (m, 2H), 4.84-5.00 (m, 1H), 1.69-2.04 (m, 2H), 0.91 (t, J = 7.29 Hz, 3H). MS (ESI +) m / z 347.1 (M + H) + .
Пример 184Example 184
5-{1-бензил-5-[3-(диметиламино)фенил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин5- {1-benzyl-5- [3- (dimethylamino) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 173, с использованием 3-(диметиламино)фенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,52 (с, 1H), 8,17 (с, 1H), 7,22-7,35 (м, 4H), 7,08-7,15 (м, 2H), 7,03 (д, J=6,71 Гц, 2H), 6,82 (д, J=8,39, 2,29 Гц, 1H), 6,48-6,54 (м, 2H), 5,47 (с, 2H), 2,78 (с, 6H). MS (ESI+) m/z 410,2 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 173 using 3- (dimethylamino) phenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.52 (s, 1H), 8.17 (s, 1H), 7.22-7.35 (m, 4H), 7.08-7.15 (m, 2H), 7.03 (d, J = 6.71 Hz, 2H), 6.82 (d, J = 8.39, 2.29 Hz, 1H), 6.48-6.54 (m, 2H), 5.47 (s, 2H ), 2.78 (s, 6H). MS (ESI +) m / z 410.2 (M + H) + .
Пример 185Example 185
5-{1-бензил-5-[4-(диметиламино)фенил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин5- {1-benzyl-5- [4- (dimethylamino) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 173, с использованием 4-(диметиламино)фенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,65 (с, 1H), 8,17 (с, 1H), 7,23-7,38 (м, 3H), 7,12-7,16 (м, 2H), 7,01-7,09 (м, 4H), 6,74-6,78 (м, 2H), 5,45 (с, 2H), 2,95 (с, 6H). MS (ESI+) m/z 410,2 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 173 using 4- (dimethylamino) phenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.65 (s, 1H), 8.17 (s, 1H), 7.23-7.38 (m, 3H), 7.12-7.16 (m, 2H), 7.01-7, 09 (m, 4H), 6.74-6.78 (m, 2H), 5.45 (s, 2H), 2.95 (s, 6H). MS (ESI +) m / z 410.2 (M + H) + .
Пример 186Example 186
N-{3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенил}ацетамидN- {3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} acetamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 3-ацетамидофенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,05 (с, 1H), 8,14 (с, 1H), 7,69 (д, J=8,54 Гц, 1H), 7,54 (с, 1H), 7,41 (т, J=7,93 Гц, 1H), 7,24-7,32 (м, 3H), 7,08-7,16 (м, 2H), 6,93-7,04 (м, 3H), 5,48 (с, 2H), 2,01 (с, 3H). MS (ESI+) m/z 424,2 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 3-acetamidophenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 10.05 (s, 1H), 8.14 (s, 1H), 7.69 (d, J = 8.54 Hz, 1H), 7.54 (s, 1H), 7.41 (t, J = 7.93 Hz, 1H), 7.24-7.32 (m, 3H), 7.08-7.16 (m, 2H), 6.93-7.04 (m, 3H), 5, 48 (s, 2H); 2.01 (s, 3H). MS (ESI +) m / z 424.2 (M + H) + .
Пример 187Example 187
N-{4-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенил}ацетамидN- {4- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} acetamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 4-ацетамидофенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,14 (с, 1H), 8,07 (с, 1H), 7,66 (д, J=8,85 Гц, 2H), 7,24-7,32 (м, 3H), 7,18-7,22 (м, 2H), 7,04-7,11 (м, 2H), 6,98-7,02 (м, 2H), 5,48 (с, 2H), 5,35 (с, 2H), 2,04-2,10 (м, 3H). MS (ESI+) m/z 424,1 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 4-acetamidophenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 10.14 (s, 1H), 8.07 (s, 1H), 7.66 (d, J = 8.85 Hz, 2H), 7.24-7.32 (m, 3H), 7.18 -7.22 (m, 2H), 7.04-7.11 (m, 2H), 6.98-7.02 (m, 2H), 5.48 (s, 2H), 5.35 (s , 2H); 2.04-2.10 (m, 3H). MS (ESI +) m / z 424.1 (M + H) + .
Пример 188Example 188
5-{1-бензил-5-[3-(1H-пиразол-1-ил)фенил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин5- {1-benzyl-5- [3- (1H-pyrazol-1-yl) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 3-(1H-пиразол-1-ил)фенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,40 (с, 1H), 8,45 (д, J=2,75 Гц, 1H), 8,09 (с, 1H), 7,99 (д, J=8,24, 1,53 Гц, 1H), 7,80-7,85 (м, 1H), 7,74 (д, J=1,83 Гц, 1H), 7,56 (т, J=7,93 Гц, 1H), 7,20-7,30 (м, 3H), 7,06-7,16 (м, 3H), 6,98-7,04 (м, 2H), 6,53-6,54 (м, 1H), 5,55 (с, 2H), 5,35 (с, 2H). MS (ESI+) m/z 433,2 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 3- (1H-pyrazol-1-yl) phenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.40 (s, 1H), 8.45 (d, J = 2.75 Hz, 1H), 8.09 (s, 1H), 7.99 (d, J = 8.24, 1.53 Hz , 1H), 7.80-7.85 (m, 1H), 7.74 (d, J = 1.83 Hz, 1H), 7.56 (t, J = 7.93 Hz, 1H), 7 , 20-7.30 (m, 3H), 7.06-7.16 (m, 3H), 6.98-7.04 (m, 2H), 6.53-6.54 (m, 1H) 5.55 (s, 2H); 5.35 (s, 2H). MS (ESI +) m / z 433.2 (M + H) + .
Пример 189Example 189
5-[1-бензил-5-(1-метил-1H-пиразол-4-ил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (1-methyl-1H-pyrazol-4-yl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 1-метил-1H-пиразол-4-илбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,78 (с, 1H), 8,11 (с, 1H), 7,87 (с, 1H), 7,43 (с, 1H), 7,27-7,41 (м, 4H), 7,24 (д, J=8,54 Гц, 1H), 7,05-7,11 (м, J=7,02 Гц, 2H), 5,54 (с, 2H), 3,86 (с, 3H). MS (ESI+) m/z 370,9 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 1-methyl-1H-pyrazol-4-ylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.78 (s, 1H), 8.11 (s, 1H), 7.87 (s, 1H), 7.43 (s, 1H), 7.27-7.41 (m, 4H), 7 24 (d, J = 8.54 Hz, 1H), 7.05-7.11 (m, J = 7.02 Hz, 2H), 5.54 (s, 2H), 3.86 (s, 3H). MS (ESI +) m / z 370.9 (M + H) + .
Пример 190Example 190
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]-N-фенилбензамид3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] -N-phenylbenzamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 3-(фенилкарбамоил)фенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,41 (с, 1H), 10,22 (с, 1H), 8,07-8,12 (м, 2H), 7,95 (с, 1H), 7,73 (д, J=7,63 Гц, 2H), 7,60 (т, J=7,78 Гц, 1H), 7,43 (д, J=7,63 Гц, 1H), 7,32-7,39 (м, 2H), 7,21-7,30 (м, 3H), 7,05-7,15 (м, 3H), 7,00 (д, J=6,71 Гц, 2H), 5,54 (с, 2H), 5,36 (с, 2H). MS (ESI+) m/z 486,2 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 3- (phenylcarbamoyl) phenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.41 (s, 1H), 10.22 (s, 1H), 8.07-8.12 (m, 2H), 7.95 (s, 1H), 7.73 (d, J = 7, 63 Hz, 2H), 7.60 (t, J = 7.78 Hz, 1H), 7.43 (d, J = 7.63 Hz, 1H), 7.32-7.39 (m, 2H) , 7.21-7.30 (m, 3H), 7.05-7.15 (m, 3H), 7.00 (d, J = 6.71 Hz, 2H), 5.54 (s, 2H ), 5.36 (s, 2H). MS (ESI +) m / z 486.2 (M + H) + .
Пример 191Example 191
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]-N-бензилбензамид3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] -N-benzylbenzamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 3-(бензилкарбамоил)фенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,41 (с, 1H), 9,04 (т, J=5,95 Гц, 1H), 8,07 (с, 1H), 8,01 (д, J=7,93 Гц, 1H), 7,85 (с, 1H), 7,56 (т, J=7,78 Гц, 1H), 7,41 (д, J=7,63 Гц, 1H), 7,21-7,35 (м, 8H), 7,01-7,11 (м, 2H), 6,96 (д, J=7,32, 2,14 Гц, 2H), 5,52 (с, 2H), 5,35 (с, 2H), 4,45 (д, J=5,80 Гц, 2H). MS (ESI+) m/z 500,2 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 3- (benzylcarbamoyl) phenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.41 (s, 1H), 9.04 (t, J = 5.95 Hz, 1H), 8.07 (s, 1H), 8.01 (d, J = 7.93 Hz, 1H), 7.85 (s, 1H), 7.56 (t, J = 7.78 Hz, 1H), 7.41 (d, J = 7.63 Hz, 1H), 7.21-7.35 (m , 8H), 7.01-7.11 (m, 2H), 6.96 (d, J = 7.32, 2.14 Hz, 2H), 5.52 (s, 2H), 5.35 ( s, 2H); 4.45 (d, J = 5.80 Hz, 2H). MS (ESI +) m / z 500.2 (M + H) + .
Пример 192Example 192
5-[1-бензил-5-(1-метил-1H-индол-5-ил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (1-methyl-1H-indol-5-yl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 173, с использованием 1-метил-1H-индол-5-илбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,35 (с, 1H), 8,14 (с, 1H), 7,54 (д, J=8,54 Гц, 1H), 7,50 (д, J=1,53 Гц, 1H), 7,42 (д, J=3,05 Гц, 1H), 7,24-7,33 (м, 3H), 6,97-7,05 (м, 5H), 6,44 (д, J=2,75 Гц, 1H), 5,46 (с, 2H), 5,33 (с, 2H), 3,83 (с, 3H). MS (ESI+) m/z 420,1 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 173 using 1-methyl-1H-indol-5-ylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.35 (s, 1H), 8.14 (s, 1H), 7.54 (d, J = 8.54 Hz, 1H), 7.50 (d, J = 1.53 Hz, 1H), 7.42 (d, J = 3.05 Hz, 1H), 7.24-7.33 (m, 3H), 6.97-7.05 (m, 5H), 6.44 (d, J = 2.75 Hz, 1H), 5.46 (s, 2H), 5.33 (s, 2H), 3.83 (s, 3H). MS (ESI +) m / z 420.1 (M + H) + .
Пример 193Example 193
5-[1-бензил-5-(3-метоксифенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (3-methoxyphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 3-метоксифенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,40 (с, 1H), 8,08 (с, 1H), 7,34-7,40 (м, 1H), 7,24-7,32 (м, 3H), 7,03-7,11 (м, 3H), 6,98-7,02 (м, 2H), 6,80-6,85 (м, 2H), 5,49 (с, 2H), 5,35 (с, 2H), 3,66 (с, 3H). MS (ESI+) m/z 397,1 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 3-methoxyphenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.40 (s, 1H), 8.08 (s, 1H), 7.34-7.40 (m, 1H), 7.24-7.32 (m, 3H), 7.03-7, 11 (m, 3H), 6.98-7.02 (m, 2H), 6.80-6.85 (m, 2H), 5.49 (s, 2H), 5.35 (s, 2H) 3.66 (s, 3H). MS (ESI +) m / z 397.1 (M + H) + .
Пример 194Example 194
5-[1-бензил-5-(3-морфолин-4-илфенил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-амин5- [1-benzyl-5- (3-morpholin-4-ylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine
В атмосфере аргона сосуд, содержащий соединение Примера 125B (35 мг, 0,09 ммоль), 3-морфолинофенилбороновую кислоту (21 мг, 0,09 ммоль), PdCl2(dppf).дихлорметан (7 мг, 0,009 ммоль) и карбонат калия (24 мг, 0,18 ммоль) в DME (1 мл) и воде (0,1 мл), закрывали крышкой и нагревали при 80°C в нагревательном устройстве с встряхиванием в течение 3 дней. Растворитель выпаривали при пониженном давлении и продукт очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения в форме соли ТФУ. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,52 (с, 1H), 8,14 (с, 1H), 7,26-7,34 (м, 4H), 6,98-7,12 (м, 5H), 6,67-6,75 (м, 2H), 5,47 (с, 2H), 3,57-3,73 (м, 4H), 2,91-3,03 (м, 4H). MS (ESI+) m/z 452,2 (M+H)+.In an argon atmosphere, a vessel containing the compound of Example 125B (35 mg, 0.09 mmol), 3-morpholinophenylboronic acid (21 mg, 0.09 mmol), PdCl 2 (dppf). Dichloromethane (7 mg, 0.009 mmol) and potassium carbonate (24 mg, 0.18 mmol) in DME (1 ml) and water (0.1 ml) were covered with a lid and heated at 80 ° C. in a heating device with shaking for 3 days. The solvent was evaporated under reduced pressure, and the product was purified by reverse phase HPLC using an acetonitrile / water gradient gradient of 0.1% TFA to obtain the title compound in the form of a TFA salt. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.52 (s, 1H), 8.14 (s, 1H), 7.26-7.34 (m, 4H), 6.98-7.12 (m, 5H), 6.67-6, 75 (m, 2H), 5.47 (s, 2H), 3.57-3.73 (m, 4H), 2.91-3.03 (m, 4H). MS (ESI +) m / z 452.2 (M + H) + .
Пример 195Example 195
5-[3-(1,3-дигидро-2H-изоиндол-2-илкарбонил)изоксазол-5-ил]-1H-индазол5- [3- (1,3-dihydro-2H-isoindol-2-ylcarbonyl) isoxazol-5-yl] -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием изоиндолина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,38 (с, 1H), 8,43 (с, 1H), 8,25 (с, 1H), 7,93 (д, J=8,82, 1,36 Гц, 1H), 7,71 (д, J=8,48 Гц, 1H), 7,30-7,47 (м, 5H), 5,18 (с, 2H), 4,92 (с, 2H). MS (ESI+) m/z 331,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using isoindoline instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.38 (s, 1H), 8.43 (s, 1H), 8.25 (s, 1H), 7.93 (d, J = 8.82, 1.36 Hz, 1H), 7.71 (d, J = 8.48 Hz, 1H), 7.30-7.47 (m, 5H), 5.18 (s, 2H), 4.92 (s, 2H). MS (ESI +) m / z 331.0 (M + H) + .
Пример 196Example 196
5-{3-[(4-метил-2-фенилпиперазин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол5- {3 - [(4-methyl-2-phenylpiperazin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 1-метил-3-фенилпиперазина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,12 (с, 1H), 8,28-8,36 (м, 1H), 8,18 (с, 1H), 7,83 (д, J=8,79, 1,46 Гц, 1H), 7,67 (д, J=8,79 Гц, 1H), 7,48 (д, J=7,69 Гц, 2H), 7,30-7,40 (м, 2H), 7,21-7,29 (м, 1H), 7,14 (с, 1H), 5,56-5,73 (м, J=5,86 Гц, 1H), 3,99-4,19 (м, J=8,42 Гц, 1H), 3,38-3,47 (м, 1H), 3,05-3,21 (м, J=7,69 Гц, 1H), 2,80 (д, J=1 1,72 Гц, 1H), 2,41 (д, J=12,08, 4,39 Гц, 1H), 2,24 (с, 3H), 2,02-2,16 (м, 1H). MS (ESI+) m/z 388,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 1-methyl-3-phenylpiperazine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.12 (s, 1H), 8.28-8.36 (m, 1H), 8.18 (s, 1H), 7.83 (d, J = 8.79, 1.46 Hz, 1H) 7.67 (d, J = 8.79 Hz, 1H), 7.48 (d, J = 7.69 Hz, 2H), 7.30-7.40 (m, 2H), 7.21- 7.29 (m, 1H), 7.14 (s, 1H), 5.56-5.73 (m, J = 5.86 Hz, 1H), 3.99-4.19 (m, J = 8.42 Hz, 1H), 3.38-3.47 (m, 1H), 3.05-3.21 (m, J = 7.69 Hz, 1H), 2.80 (d, J = 1 1.72 Hz, 1H), 2.41 (d, J = 12.08, 4.39 Hz, 1H), 2.24 (s, 3H), 2.02-2.16 (m, 1H). MS (ESI +) m / z 388.1 (M + H) + .
Пример 197Example 197
1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-4-амин1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-4-amine
Пример 197AExample 197A
трет-Бутил 1-(1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбонил)пиперидин-4-илкарбаматtert-Butyl 1- (1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carbonyl) piperidin-4-ylcarbamate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 149C вместо соединения Примера 81B и с использованием 4-Boc-аминопиперидина вместо пиперидина. MS (ESI+) m/z 502,3 (M+H)+.The title compound was prepared according to the procedure described in Example 81B, using the compound of Example 149C instead of the compound of Example 81B and using 4-Boc-aminopiperidine instead of piperidine. MS (ESI +) m / z 502.3 (M + H) + .
Пример 197BExample 197B
1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-4-амин1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-4-amine
Соединение Примера 197A (101 мг, 0,201 ммоль) растворяли в 4 M хлористоводородной кислоты в диоксане (4 мл) и метаноле (1 мл) и перемешивали при температуре окружающей среды в течение 2 часов. Растворители удаляли при пониженном давлении с получением указанного в заголовке соединения в форме соли HCl. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,18 (с, 1H), 7,92-8,08 (м, J=1,36 Гц, 3H), 7,53-7,70 (м, 2H), 7,24-7,47 (м, 5H), 5,40-5,73 (м, J=3,39 Гц, 2H), 4,34-4,63 (м, 1H), 3,44-3,53 (м, J=3,39 Гц, 1H), 2,95-3,17 (м, 2H), 2,76-2,94 (м, J=1 1,02, 11,02 Гц, 1H), 1,87-2,03 (м, J=1 1,87 Гц, 1H), 1,30-1,52 (м, J=10,85 Гц, 2H), 0,66-0,91 (м, J=10,17 Гц, 1H). MS (ESI+) m/z 402,2 (M+H)+.The compound of Example 197A (101 mg, 0.21 mmol) was dissolved in 4 M hydrochloric acid in dioxane (4 ml) and methanol (1 ml) and stirred at ambient temperature for 2 hours. The solvents were removed under reduced pressure to obtain the title compound in the form of an HCl salt. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.18 (s, 1H), 7.92-8.08 (m, J = 1.36 Hz, 3H), 7.53-7.70 (m, 2H), 7.24-7.47 ( m, 5H), 5.40-5.73 (m, J = 3.39 Hz, 2H), 4.34-4.63 (m, 1H), 3.44-3.53 (m, J = 3.39 Hz, 1H), 2.95-3.17 (m, 2H), 2.76-2.94 (m, J = 1 1.02, 11.02 Hz, 1H), 1.87- 2.03 (m, J = 1 1.87 Hz, 1H), 1.30-1.52 (m, J = 10.85 Hz, 2H), 0.66-0.91 (m, J = 10 , 17 Hz, 1H). MS (ESI +) m / z 402.2 (M + H) + .
Пример 198Example 198
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамидN- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide
Пример 198AExample 198A
трет-бутил 3-амино-5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-карбоксилатtert-butyl 3-amino-5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazole-1-carboxylate
Соединение Примера 102B (200 мг, 0,55 ммоль) и N,N-диметилпиридин-4-амин (5 мг, 0,04 ммоль) растворяли в метиленхлориде. Смесь перемешивали при комнатной температуре, добавляя при этом по каплям раствор ди-трет-бутилдикарбоната (120 мг, 0,55 ммоль) в 5 мл метиленхлорида. Реакционную смесь оставляли для перемешивания при комнатной температуре в течение 8 часов, концентрировали в условиях вакуума, растворяли в метиленхлориде (10 мл) и промывали разбавленным водным раствором HCl (1н, 10 мл) и насыщенным водным раствором NaHCO3 (10 мл). Органический слой концентрировали и очищали при помощи обращенно-фазовой-ВЭЖХ (CH3CN/H2O/NH4OAc) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,29 (с, 2H), 7,43-7,59 (м, 3H), 7,23-7,38 (м, 6H), 6,98 (д, J=7,17, 2,39 Гц, 2H), 6,38 (с, 2H), 5,52 (с, 2H), 1,55 (с, 9H). MS (ESI+) m/z 467 (M+H)+.The compound of Example 102B (200 mg, 0.55 mmol) and N, N-dimethylpyridin-4-amine (5 mg, 0.04 mmol) was dissolved in methylene chloride. The mixture was stirred at room temperature while adding a solution of di-tert-butyl dicarbonate (120 mg, 0.55 mmol) in 5 ml of methylene chloride dropwise. The reaction mixture was allowed to stir at room temperature for 8 hours, concentrated in vacuo, dissolved in methylene chloride (10 ml) and washed with dilute aqueous HCl (1N, 10 ml) and saturated aqueous NaHCO 3 (10 ml). The organic layer was concentrated and purified by reverse phase-HPLC (CH 3 CN / H 2 O / NH 4 OAc) to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.29 (s, 2H), 7.43-7.59 (m, 3H), 7.23-7.38 (m, 6H), 6.98 (d, J = 7.17, 2.39 Hz, 2H), 6.38 (s, 2H), 5.52 (s, 2H), 1.55 (s, 9H). MS (ESI +) m / z 467 (M + H) + .
Пример 198BExample 198B
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамидN- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide
Соединение Примера 198A (37,5 мг, 0,08 ммоль) и пиридин (12,7 мг, 0,16 ммоль) растворяли в метиленхлориде (2 мл). Смесь оставляли для перемешивания при комнатной температуре. К смеси добавляли бензоилхлорид (14 мг, 0,1 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение ночи, концентрировали в условиях вакуума и очищали при помощи обращенно-фазовой-ВЭЖХ (CH3CN/H2O/NH4OAc) с получением Boc-защищенного предшественника. Предшественник обрабатывали смесью 1:1 ТФУ/дихлорметан (2 мл) в течение 1 часа и концентрировали в условиях вакуума с получением указанного в заголовке соединения в форме соли ТФУ. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,84 (с, 1H), 10,70 (с, 1H), 8,01 (д, J=6,99 Гц, 2H), 7,87 (с, 1H), 7,50-7,69 (м, 3H), 7,36-7,48 (м, 5H), 7,18-7,35 (м, 5H), 6,92-7,03 (м, 2H), 5,48 (с, 2H). MS (ESI+) m/z 471 (M+H)+.The compound of Example 198A (37.5 mg, 0.08 mmol) and pyridine (12.7 mg, 0.16 mmol) were dissolved in methylene chloride (2 ml). The mixture was allowed to stir at room temperature. Benzoyl chloride (14 mg, 0.1 mmol) was added to the mixture. The reaction mixture was allowed to stir at room temperature overnight, concentrated in vacuo, and purified by reverse phase HPLC (CH 3 CN / H 2 O / NH 4 OAc) to give a Boc-protected precursor. The precursor was treated with a 1: 1 mixture of TFA / dichloromethane (2 ml) for 1 hour and concentrated in vacuo to give the title compound in the form of a TFA salt. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.84 (s, 1H), 10.70 (s, 1H), 8.01 (d, J = 6.99 Hz, 2H), 7.87 (s, 1H), 7.50-7.69 (m, 3H), 7.36-7.48 (m, 5H), 7.18-7.35 (m, 5H), 6.92-7.03 (m, 2H), 5.48 (s , 2H). MS (ESI +) m / z 471 (M + H) + .
Пример 199Example 199
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензолсульфонамидN- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzenesulfonamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 198B, с использованием бензолсульфонилхлорида вместо бензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,69 (с, 1H), 10,61 (с, 1H), 7,99 (с, 1H), 7,70-7,76 (м, 2H), 7,45-7,62 (м, 6H), 7,24-7,36 (м, 7H), 6,99 (д, J=6,99, 2,21 Гц, 2H), 5,50 (с, 2H). MS (ESI+) m/z 507 (M+H)+.The title compound was prepared according to the procedure described in Example 198B using benzenesulfonyl chloride instead of benzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.69 (s, 1H), 10.61 (s, 1H), 7.99 (s, 1H), 7.70-7.76 (m, 2H), 7.45-7.62 (m, 6H), 7.24-7.36 (m, 7H), 6.99 (d, J = 6.99, 2.21 Hz, 2H), 5.50 (s, 2H). MS (ESI +) m / z 507 (M + H) + .
Пример 200Example 200
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(4-метоксифенил)мочевинаN- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (4-methoxyphenyl) urea
Соединение Примера 198A (25 мг, 0,54 ммоль) растворяли в диоксане (2 мл) и к раствору добавляли 1-изоцианато-4-метоксибензол (24 мг, 0,16 ммоль). Реакционную смесь перемешивали при 80°C в течение 12 часов, концентрировали и очищали при помощи обращенно-фазовой-ВЭЖХ (CH3CN/H2O/NH4OAc) с получением Boc-защищенного предшественника. Предшественник обрабатывали смесью 1:1 ТФУ/дихлорметан (2 мл) в течение 1 часа и концентрировали в условиях вакуума с получением указанного в заголовке соединения в форме соли ТФУ. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,54 (с, 1H), 9,51 (с, 1H), 9,42 (с, 1H), 8,28 (с, 1H), 7,45-7,51 (м, 3H), 7,36-7,42 (м, 2H), 7,24-7,35 (м, 7H), 6,98 (д, J=7,17, 2,39 Гц, 2H), 6,87-6,94 (м, 2H), 5,50 (с, 2H), 3,74 (с, 3H). MS (ESI+) m/z 516 (M+H)+.The compound of Example 198A (25 mg, 0.54 mmol) was dissolved in dioxane (2 ml), and 1-isocyanato-4-methoxybenzene (24 mg, 0.16 mmol) was added to the solution. The reaction mixture was stirred at 80 ° C for 12 hours, concentrated and purified by reverse phase-HPLC (CH 3 CN / H 2 O / NH 4 OAc) to give a Boc-protected precursor. The precursor was treated with a 1: 1 mixture of TFA / dichloromethane (2 ml) for 1 hour and concentrated in vacuo to give the title compound in the form of a TFA salt. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.54 (s, 1H), 9.51 (s, 1H), 9.42 (s, 1H), 8.28 (s, 1H), 7.45-7.51 (m, 3H), 7 , 36-7.42 (m, 2H), 7.24-7.35 (m, 7H), 6.98 (d, J = 7.17, 2.39 Hz, 2H), 6.87-6 94 (m, 2H); 5.50 (s, 2H); 3.74 (s, 3H). MS (ESI +) m / z 516 (M + H) + .
Пример 201Example 201
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бутанамидN- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] butanamide
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 198B, с использованием бутирилхлорида вместо бензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,77-10,84 (м, 1H), 8,07 (с, 1H), 7,97 (д, J=8,82 Гц, 1H), 7,64 (д, J=8,82, 1,47 Гц, 1H), 7,43-7,57 (м, 3H), 7,22-7,38 (м, 5H), 6,91-7,06 (м, 2H), 5,50 (с, 2H), 2,33 (т, J=7,17 Гц, 2H), 1,54-1,60 (м, 2H), 0,91 (т, J=7,35 Гц, 3H). MS (ESI+) m/z 437 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 198B using butyryl chloride instead of benzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.77-10.84 (m, 1H), 8.07 (s, 1H), 7.97 (d, J = 8.82 Hz, 1H), 7.64 (d, J = 8.82, 1.47 Hz, 1H), 7.43-7.57 (m, 3H), 7.22-7.38 (m, 5H), 6.91-7.06 (m, 2H), 5.50 (s, 2H), 2.33 (t, J = 7.17 Hz, 2H), 1.54-1.60 (m, 2H), 0.91 (t, J = 7.35 Hz, 3H) . MS (ESI +) m / z 437 (M + H) + .
Пример 202Example 202
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-метилпропанамидN- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-methylpropanamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 198B, с использованием изобутирилхлорида вместо бензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,66 (с, 1H), 10,12 (с, 1H), 7,80 (с, 1H), 7,42-7,55 (м, 4H), 7,33-7,39 (м, 1H), 7,22-7,32 (м, 5H), 6,97 (д, J=6,99, 2,57 Гц, 2H), 5,48 (с, 1H), 2,59-2,69 (м, 1H), 1,07 (д, J=6,99 Гц, 6H). MS (ESI+) m/z 437 (M+H)+.The title compound was prepared according to the procedure described in Example 198B using isobutyryl chloride instead of benzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.66 (s, 1H), 10.12 (s, 1H), 7.80 (s, 1H), 7.42-7.55 (m, 4H), 7.33-7.39 (m, 1H), 7.22-7.32 (m, 5H), 6.97 (d, J = 6.99, 2.57 Hz, 2H), 5.48 (s, 1H), 2.59-2 69 (m, 1H); 1.07 (d, J = 6.99 Hz, 6H). MS (ESI +) m / z 437 (M + H) + .
Пример 203Example 203
N-[5-(1-бензил-5-фенил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]циклопропанкарбоксамидN- [5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] cyclopropanecarboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 198B, с использованием циклопропанкарбонилхлорида вместо бензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,45-10,64 (с, 1H), 7,91 (с, 1H), 7,43-7,55 (м, 3H), 7,31-7,43 (м, 2H), 7,23-7,30 (м, 5H), 6,97 (д, J=7,17, 2,39 Гц, 2H), 5,48 (с, 2H), 1,77-1,91 (м, 1H), 0,69-0,87 (м, 4H). MS (ESI+) m/z 435 (M+H)+.The title compound was prepared according to the procedure described in Example 198B using cyclopropanecarbonyl chloride instead of benzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.45-10.64 (s, 1H), 7.91 (s, 1H), 7.43-7.55 (m, 3H), 7.31-7.43 (m, 2H), 7, 23-7.30 (m, 5H), 6.97 (d, J = 7.17, 2.39 Hz, 2H), 5.48 (s, 2H), 1.77-1.91 (m, 1H), 0.69-0.87 (m, 4H). MS (ESI +) m / z 435 (M + H) + .
Пример 204Example 204
N-[1-бензоил-5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил}бензамидN- [1-benzoyl-5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl} benzamide
Соединение Примера 89B (33 мг, 0,1 ммоль) растворяли в тетрагидрофуране (0,6 мл) в микроволновой пробирке CEM. Добавляли бензоилхлорид (28 мг, 0,2 ммоль) и смесь нагревали при 120°C в течение 15 минут в микроволновом устройстве CEM-Discover. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток очищали при помощи обращенно-фазовой-ВЭЖХ (CH3CN/H2O/NH4OAc) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,35 (с, 1H), 8,55 (д, J=8,82 Гц, 1H), 8,36 (с, 1H), 8,17 (д, J=8,64, 1,65 Гц, 1H), 8,06 (д, J=7,54, 2,39 Гц, 4H), 7,51-7,72 (м, 6H), 7,26-7,45 (м, 5H), 5,71 (с, 2H), 1,76-1,87 (м, 1H), 1,11 (д, J=6,62 Гц, 2H), 0,44 (д, J=4,41 Гц, 2H). MS (ESI+) m/z 539 (M+H)+.The compound of Example 89B (33 mg, 0.1 mmol) was dissolved in tetrahydrofuran (0.6 ml) in a CEM microwave tube. Benzoyl chloride (28 mg, 0.2 mmol) was added and the mixture was heated at 120 ° C for 15 minutes in a CEM-Discover microwave device. The reaction mixture was cooled to room temperature and concentrated. The residue was purified by reverse phase-HPLC (CH 3 CN / H 2 O / NH 4 OAc) to obtain the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.35 (s, 1H), 8.55 (d, J = 8.82 Hz, 1H), 8.36 (s, 1H), 8.17 (d, J = 8.64, 1.65 Hz , 1H), 8.06 (d, J = 7.54, 2.39 Hz, 4H), 7.51-7.72 (m, 6H), 7.26-7.45 (m, 5H), 5.71 (s, 2H), 1.76-1.87 (m, 1H), 1.11 (d, J = 6.62 Hz, 2H), 0.44 (d, J = 4.41 Hz , 2H). MS (ESI +) m / z 539 (M + H) + .
Пример 205Example 205
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-фторбензамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-fluorobenzamide
Пример 205AExample 205A
трет-Бутил 3-амино-5-(1-бензил-S-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-карбоксилатtert-Butyl 3-amino-5- (1-benzyl-S-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazole-1-carboxylate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 198A, с использованием соединения Примера 89B вместо соединения Примера 102A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,26 (с, 1H), 7,96-8,07 (м, 1H), 7,86-7,95 (м, 1H), 7,35-7,46 (м, 3H), 7,28-7,35 (м, 2H), 6,35-6,47 (м, 2H), 5,70 (с, 2H), 1,72-1,84 (м, 1H), 1,60 (с, 9H), 0,99-1,10 (д, J=1,84 Гц, 2H), 0,38 (д, J=3,68 Гц, 2H). MS (ESI+) m/z 431 (M+H)+.The title compound was prepared according to the procedure described in Example 198A using the compound of Example 89B instead of the compound of Example 102A. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.26 (s, 1H), 7.96-8.07 (m, 1H), 7.86-7.95 (m, 1H), 7.35-7.46 (m, 3H), 7, 28-7.35 (m, 2H), 6.35-6.47 (m, 2H), 5.70 (s, 2H), 1.72-1.84 (m, 1H), 1.60 ( s, 9H), 0.99-1.10 (d, J = 1.84 Hz, 2H), 0.38 (d, J = 3.68 Hz, 2H). MS (ESI +) m / z 431 (M + H) + .
Пример 205BExample 205B
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-фторбензамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-fluorobenzamide
Соединение Примера 205A (25 мг, 0,058 ммоль) и пиридин (9,2 мг, 0,116 ммоль) растворяли в метиленхлориде (1 мл). Смесь оставляли для перемешивания при комнатной температуре и к смеси добавляли 3-фторбензоилхлорид (11,1 мг, 0,58 ммоль). Реакционную смесь оставляли для перемешивания при комнатной температуре в течение ночи, концентрировали и очищали при помощи обращенно-фазовой-ВЭЖХ (CH3CN/H2O/NH4OAc) с получением Boc-защищенного предшественника. Предшественник обрабатывали смесью 1:1 ТФУ/дихлорметан (2 мл) в течение 1 часа и концентрировали в условиях вакуума с получением указанного в заголовке соединения в форме соли ТФУ. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,58 (с, 1H), 7,75 (с, 1H), 7,51-7,60 (м, 1H), 7,46 (д, J=8,82, 1,47 Гц, 1H), 7,15-7,28 (м, 2H), 7,10 (д, J=2,21 Гц, 1H), 6,88-7,05 (м, 6H), 5,31 (с, 2H), 1,35-1,47 (м, J=5,15 Гц, 1H), 0,68 (д, J=8,27, 1,65 Гц, 2H), 0,03 (д, J=5,52 Гц, 2H). MS (ESI+) m/z 453 (M+H)+.The compound of Example 205A (25 mg, 0.058 mmol) and pyridine (9.2 mg, 0.116 mmol) were dissolved in methylene chloride (1 ml). The mixture was allowed to stir at room temperature and 3-fluorobenzoyl chloride (11.1 mg, 0.58 mmol) was added to the mixture. The reaction mixture was allowed to stir at room temperature overnight, concentrated and purified by reverse phase-HPLC (CH 3 CN / H 2 O / NH 4 OAc) to give a Boc-protected precursor. The precursor was treated with a 1: 1 mixture of TFA / dichloromethane (2 ml) for 1 hour and concentrated in vacuo to give the title compound in the form of a TFA salt. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.58 (s, 1H), 7.75 (s, 1H), 7.51-7.60 (m, 1H), 7.46 (d, J = 8.82, 1.47 Hz, 1H) 7.15-7.28 (m, 2H), 7.10 (d, J = 2.21 Hz, 1H), 6.88-7.05 (m, 6H), 5.31 (s, 2H ), 1.35-1.47 (m, J = 5.15 Hz, 1H), 0.68 (d, J = 8.27, 1.65 Hz, 2H), 0.03 (d, J = 5.52 Hz, 2H). MS (ESI +) m / z 453 (M + H) + .
Пример 206Example 206
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием бензоилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,89 (с, 1H), 10,83 (с, 1H), 8,02-8,15 (м, 3H), 7,83 (д, J=8,82, 1,47 Гц, 1H), 7,50-7,66 (м, 4H), 7,24-7,43 (м, 5H), 5,67 (с, 2H), 1,77 (м, 1H), 0,99-1,10 (м, 2H), 0,39 (м, 2H). MS (ESI+) m/z 435 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using benzoyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.89 (s, 1H), 10.83 (s, 1H), 8.02-8.15 (m, 3H), 7.83 (d, J = 8.82, 1.47 Hz, 1H) 7.50-7.66 (m, 4H), 7.24-7.43 (m, 5H), 5.67 (s, 2H), 1.77 (m, 1H), 0.99-1 10 (m, 2H); 0.39 (m, 2H). MS (ESI +) m / z 435 (M + H) + .
Пример 207Example 207
N-бензил-5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-аминN-benzyl-5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
К раствору соединения Примера 89B (18,3 мг, 0,05 ммоль) в диметилформамиде (2 мл) добавляли уксусную кислоту (15 мг, 0,25 ммоль) и бензальдегид (6,4 мг, 0,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. К смеси добавляли триацетоксиборогидрид натрия (NaBH(OAc)3, 32 мг, 0,15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, концентрировали и очищали при помощи обращенно-фазовой-ВЭЖХ (CH3CN/H2O/NH4OAc) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,09 (с, 1H), 9,24 (с, 1H), 8,02-8,10 (м, 3H), 7,84-7,90 (м, 1H), 7,49-7,67 (м, 4H), 7,25-7,45 (м, 5H), 5,70 (с, 2H), 3,30 (с, 2H), 1,88-1,95 (м, 1H), 1,01-1,09 (м, 2H), 0,43 (д, J=4,04 Гц, 2H). MS (ESI+) m/z 421 (M+H)+.To a solution of the compound of Example 89B (18.3 mg, 0.05 mmol) in dimethylformamide (2 ml) was added acetic acid (15 mg, 0.25 mmol) and benzaldehyde (6.4 mg, 0.06 mmol). The reaction mixture was stirred at room temperature overnight. Sodium triacetoxyborohydride (NaBH (OAc) 3 , 32 mg, 0.15 mmol) was added to the mixture. The reaction mixture was stirred at room temperature for 3 hours, concentrated and purified by reverse phase-HPLC (CH 3 CN / H 2 O / NH 4 OAc) to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.09 (s, 1H), 9.24 (s, 1H), 8.02-8.10 (m, 3H), 7.84-7.90 (m, 1H), 7.49-7, 67 (m, 4H), 7.25-7.45 (m, 5H), 5.70 (s, 2H), 3.30 (s, 2H), 1.88-1.95 (m, 1H) 1.01-1.09 (m, 2H); 0.43 (d, J = 4.04 Hz, 2H). MS (ESI +) m / z 421 (M + H) + .
Пример 208Example 208
N-[(1R)-1-бензил-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R) -1-benzyl-2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (R)-(+)-2-амино-3-фенил-1-пропанола (37 мг, 0,245 ммоль) вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,36 (с, 1H), 8,46 (д, J=8,82 Гц, 1H), 8,37 (с, 1H), 8,22 (с, 1H), 7,87 (дд, J=8,82, 1,36 Гц, 1H), 7,69 (д, J=8,82 Гц, 1H), 7,12-7,35 (м, 6H), 4,89 (т, J=5,59 Гц, 1H), 4,13-4,25 (м, 1H), 3,40-3,58 (м, 2H), 2,90-2,99 (м, 1H), 2,74-2,87 (м, 1H). MS (ESI+) m/z 363,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (R) - (+) - 2-amino-3-phenyl-1-propanol (37 mg, 0.245 mmol) instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.36 (s, 1H), 8.46 (d, J = 8.82 Hz, 1H), 8.37 (s, 1H), 8.22 (s, 1H), 7.87 (dd, J = 8.82, 1.36 Hz, 1H), 7.69 (d, J = 8.82 Hz, 1H), 7.12-7.35 (m, 6H), 4.89 (t, J = 5.59 Hz, 1H), 4.13-4.25 (m, 1H), 3.40-3.58 (m, 2H), 2.90-2.99 (m, 1H), 2.74 -2.87 (m, 1H). MS (ESI +) m / z 363.0 (M + H) + .
Пример 209Example 209
5-(1-бензил-1H-пиразол-4-ил)-1H-индазол5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazole
Пример 209AExample 209A
1-(5-Бром-1H-индазол-1-ил)этанон1- (5-Bromo-1H-indazol-1-yl) ethanone
4-Бром-2-метиланилин (25,0 г, 134 ммоль) растворяли в хлороформе (250 мл) и смесь охлаждали до 5°C. Добавляли по каплям уксусный ангидрид (35 мл, 343 ммоль) и смеси давали нагреться до температуры окружающей среды. Добавляли ацетат калия (3,97 г, 40,4 ммоль) и изоамилнитрит (35 мл, 262 ммоль) и смесь нагревали при 70°C в течение ночи. Смесь нейтрализовали насыщенным раствором бикарбоната натрия и экстрагировали метиленхлоридомом. Объединенные органические слои концентрировали при пониженном давлении и полученный остаток растирали в порошок с метанолом с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,45 (с, 1H), 8,26 (д, J=8,82 Гц, 1H), 8,17 (д, J=1,70 Гц, 1H), 7,77 (дд, J=8,82, 2,03 Гц, 1H), 2,72 (с, 3H).4-Bromo-2-methylaniline (25.0 g, 134 mmol) was dissolved in chloroform (250 ml) and the mixture was cooled to 5 ° C. Acetic anhydride (35 ml, 343 mmol) was added dropwise and the mixture was allowed to warm to ambient temperature. Potassium acetate (3.97 g, 40.4 mmol) and isoamyl nitrite (35 ml, 262 mmol) were added and the mixture was heated at 70 ° C. overnight. The mixture was neutralized with saturated sodium bicarbonate and extracted with methylene chloride. The combined organic layers were concentrated under reduced pressure and the resulting residue was triturated with methanol to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.45 (s, 1H), 8.26 (d, J = 8.82 Hz, 1H), 8.17 (d, J = 1.70 Hz, 1H), 7.77 (dd, J = 8 82, 2.03 Hz, 1H); 2.72 (s, 3H).
Пример 209BExample 209B
5-(1-бензил-1H-пиразол-4-ил)-1H-индазол5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazole
Соединение Примера 209A (425 мг, 1,78 ммоль), 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (508 мг, 1,79 ммоль), дихлорбис(трифенилфосфин)палладий(II) (133 мг, 0,189 ммоль) и карбонат калия (742 мг, 5,37 ммоль) объединяли в герметично закрытом сосуде с диоксаном (10 мл) и водой (1 мл) в инертной атмосфере азота и смесь нагревали до 110°C в течение ночи. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 45-90% этилацетата в гексане, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,00 (с, 1H), 8,25 (с, 1H), 8,02 (с, 1H), 7,92 (с, 2H), 7,55-7,61 (м, 1H), 7,48-7,54 (м, 1H), 7,25-7,40 (м, 5H), 5,35 (с, 2H). MS (ESI+) m/z 274,9 (M+H)+.The compound of Example 209A (425 mg, 1.78 mmol), 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole (508 mg, 1.79 mmol), dichlorobis (triphenylphosphine) palladium (II) (133 mg, 0.189 mmol) and potassium carbonate (742 mg, 5.37 mmol) were combined in a sealed vessel with dioxane (10 ml) and water (1 ml) in an inert atmosphere of nitrogen and the mixture was heated to 110 ° C overnight. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 45-90% ethyl acetate in hexane to elute to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.00 (s, 1H), 8.25 (s, 1H), 8.02 (s, 1H), 7.92 (s, 2H), 7.55-7.61 (m, 1H), 7 48-7.54 (m, 1H); 7.25-7.40 (m, 5H); 5.35 (s, 2H). MS (ESI +) m / z 274.9 (M + H) + .
Пример 210Example 210
N-[(1R)-3-гидрокси-1-фенилпропил]-5-(3-метил-1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R) -3-hydroxy-1-phenylpropyl] -5- (3-methyl-1H-indazol-5-yl) isoxazole-3-carboxamide
Пример 210AExample 210A
трет-Бутил 5-бром-3-метил-1H-индазол-1-карбоксилатtert-Butyl 5-bromo-3-methyl-1H-indazole-1-carboxylate
5-Бром-3-метил-1H-индазол (5,11 г, 24,2 ммоль) и каталитическое количество диметиламинопиридина (~30 мг) растворяли в метиленхлориде (100 мл). Добавляли ди-трет-бутилдикарбонат (5,9 г, 27,0 ммоль) и смесь перемешивали при температуре окружающей среды в течение 3 часов. Растворитель удаляли при пониженном давлении и полученный остаток разбавляли этилацетатом и промывали 1 н раствором гидроксида натрия (два раза), 0,1н раствором хлористоводородной кислоты и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения. MS (ESI+) m/z 210,8 (M-Boc)+.5-Bromo-3-methyl-1H-indazole (5.11 g, 24.2 mmol) and a catalytic amount of dimethylaminopyridine (~ 30 mg) were dissolved in methylene chloride (100 ml). Di-tert-butyl dicarbonate (5.9 g, 27.0 mmol) was added and the mixture was stirred at ambient temperature for 3 hours. The solvent was removed under reduced pressure, and the resulting residue was diluted with ethyl acetate and washed with a 1N sodium hydroxide solution (two times), a 0.1N hydrochloric acid solution, and saturated saline. The organic layer was dried over sodium sulfate and filtered. The filtrate was concentrated under reduced pressure to obtain the title compound. MS (ESI +) m / z 210.8 (M-Boc) + .
Пример 210BExample 210B
трет-Бутил 3-метил-5-((триметилсилил)этинил)-1H-индазол-1-карбоксилатtert-Butyl 3-methyl-5 - ((trimethylsilyl) ethynyl) -1H-indazole-1-carboxylate
Соединение Примера 210A (7,55 г, 24,3 ммоль), дихлорбис(трифенилфосфин)палладий(II) (870 мг, 1,24 ммоль) и иодид меди(I) (250 мг, 1,31 ммоль) объединяли в триэтиламине (60 мл) в инертной атмосфере азота. Добавляли триметилсилилацетилен (4,0 мл, 28,9 ммоль) и смесь нагревали при 60°C в течение ночи. Смесь разбавляли метиленхлоридом и промывали при помощи 0,1 M хлористоводородной кислоты. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-40% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 228,9 (M-Boc)+.The compound of Example 210A (7.55 g, 24.3 mmol), dichlorobis (triphenylphosphine) palladium (II) (870 mg, 1.24 mmol) and copper (I) iodide (250 mg, 1.31 mmol) were combined in triethylamine (60 ml) in an inert atmosphere of nitrogen. Trimethylsilylacetylene (4.0 ml, 28.9 mmol) was added and the mixture was heated at 60 ° C. overnight. The mixture was diluted with methylene chloride and washed with 0.1 M hydrochloric acid. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-40% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 228.9 (M-Boc) + .
Пример 210CExample 210C
5-Этинил-3-метил-1H-индазол5-Ethinyl-3-methyl-1H-indazole
Соединение Примера 210B (7,26 г, 22,1 ммоль) растворяли в метаноле (170 мл). Добавляли 1н раствор гидроксида калия (45 мл) и смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель удаляли при пониженном давлении и полученный остаток разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения. MS (ESI+) m/z 157,1 (M+H)+.The compound of Example 210B (7.26 g, 22.1 mmol) was dissolved in methanol (170 ml). A 1N potassium hydroxide solution (45 ml) was added and the mixture was stirred at ambient temperature overnight. The solvent was removed under reduced pressure and the resulting residue was diluted with ethyl acetate and washed with water and brine. The organic layer was dried over sodium sulfate and concentrated under reduced pressure to obtain the title compound. MS (ESI +) m / z 157.1 (M + H) + .
Пример 210DExample 210D
этил 5-(3-метил-1H-индазол-5-ил)изоксазол-3-карбоксилатethyl 5- (3-methyl-1H-indazol-5-yl) isoxazole-3-carboxylate
Соединение Примера 210C (411 мг, 2,63 ммоль) растворяли в толуоле (15 мл) и триэтиламине (478 мкл) и нагревали до 90°C. Добавляли этилхлороксимидоацетат (480 мг, 3,17 ммоль), растворенный в толуоле (15 мл), медленно по каплям в течение 30 минут. После добавления смесь разбавляли этилацетатом и промывали 1 н раствором хлористоводородной кислоты. Органический слой концентрировали при пониженном давлении и полученный остаток растирали в порошок с метанолом с получением указанного в заголовке соединения. MS (ESI+) m/z 271,9 (M+H)+.The compound of Example 210C (411 mg, 2.63 mmol) was dissolved in toluene (15 ml) and triethylamine (478 μl) and heated to 90 ° C. Ethyl chloroximidoacetate (480 mg, 3.17 mmol) dissolved in toluene (15 ml) was added slowly dropwise over 30 minutes. After addition, the mixture was diluted with ethyl acetate and washed with 1 N hydrochloric acid. The organic layer was concentrated under reduced pressure, and the resulting residue was triturated with methanol to give the title compound. MS (ESI +) m / z 271.9 (M + H) + .
Пример 210EExample 210E
5-(3-метил-1H-индазол-5-ил)изоксазол-3-карбоновая кислота5- (3-methyl-1H-indazol-5-yl) isoxazole-3-carboxylic acid
Соединение Примера 210D (325 мг, 1,20 ммоль) растворяли в тетрагидрофуране (10 мл), метаноле (1 мл) и воде (1 мл) и добавляли гидроксид калия (150 мг, 2,67 ммоль). Смесь перемешивали при температуре окружающей среды в течение 3 часов. Смесь разбавляли этилацетатом и промывали 1 н раствором хлористоводородной кислоты. Продукт осаждался в делительной воронке, и его фильтровали с получением указанного в заголовке соединения. MS (ESI+) m/z 243,9 (M+H)+.The compound of Example 210D (325 mg, 1.20 mmol) was dissolved in tetrahydrofuran (10 ml), methanol (1 ml) and water (1 ml) and potassium hydroxide (150 mg, 2.67 mmol) was added. The mixture was stirred at ambient temperature for 3 hours. The mixture was diluted with ethyl acetate and washed with 1 N hydrochloric acid. The product precipitated in a separatory funnel and was filtered to give the title compound. MS (ESI +) m / z 243.9 (M + H) + .
Пример 210FExample 210F
N-[(1R)-3-гидрокси-1-фенилпропил]-5-(3-метил-1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R) -3-hydroxy-1-phenylpropyl] -5- (3-methyl-1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием соединения Примера 210E вместо соединения Примера 81A и с использованием (R)-3-амино-3-фенилпропан-1-ола вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,93 (с, 1H), 8,45 (д, J=8,82 Гц, 1H), 8,33 (с, 1H), 7,84 (д, J=8,82, 1,70 Гц, 1H), 7,59 (д, J=9,16 Гц, 1H), 7,21-7,29 (м, 5H), 7,13-7,21 (м, 1H), 4,89 (т, J=5,59 Гц, 1H), 4,10-4,26 (м, 1H), 3,42-3,56 (м, 2H), 2,88-3,00 (м, 1H), 2,75-2,87 (м, 1H), 2,55 (с, 3H). MS (ESI+) m/z 377,1 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using the compound of Example 210E instead of the compound of Example 81A and using (R) -3-amino-3-phenylpropan-1-ol instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.93 (s, 1H), 8.45 (d, J = 8.82 Hz, 1H), 8.33 (s, 1H), 7.84 (d, J = 8.82, 1.70 Hz , 1H), 7.59 (d, J = 9.16 Hz, 1H), 7.21-7.29 (m, 5H), 7.13-7.21 (m, 1H), 4.89 ( t, J = 5.59 Hz, 1H), 4.10-4.26 (m, 1H), 3.42-3.56 (m, 2H), 2.88-3.00 (m, 1H) 2.75-2.87 (m, 1H); 2.55 (s, 3H). MS (ESI +) m / z 377.1 (M + H) + .
Пример 211Example 211
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]фенол3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenol
В атмосфере аргона сосуд, содержащий соединение Примера 125B (35 мг, 0,09 ммоль), 3-гидроксифенилбороновую кислоту (12 мг, 0,09 ммоль), PdCl2(dppf).дихлорметан (7 мг, 0,009 ммоль) и карбонат калия (24 мг, 0,18 ммоль) в DME (1 мл) и воде (0,1 мл), закрывали крышкой и нагревали при 80°C в нагревательном устройстве с встряхиванием в течение 3 дней. Растворитель выпаривали и продукт очищали при помощи обращенно-фазовой ВЭЖХ, используя метод градиентного элюирования ацетонитрил/вода 0,1% ТФУ, с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,40 (с, 1H), 9,68 (с, 1H), 8,09 (с, 1H), 7,24-7,35 (м, 5H), 6,98-7,13 (м, 3H), 6,88 (д, J=8,09, 1,98 Гц, 1H), 6,73 (с, 1H), 6,60-6,66 (м, 1H), 5,47 (с, 2H), 5,35 (с, 2H). MS (ESI+) m/z 383,1 (M+H)+.In an argon atmosphere, a vessel containing the compound of Example 125B (35 mg, 0.09 mmol), 3-hydroxyphenylboronic acid (12 mg, 0.09 mmol), PdCl 2 (dppf). Dichloromethane (7 mg, 0.009 mmol) and potassium carbonate (24 mg, 0.18 mmol) in DME (1 ml) and water (0.1 ml) were covered with a lid and heated at 80 ° C. in a heating device with shaking for 3 days. The solvent was evaporated and the product was purified by reverse phase HPLC using an acetonitrile / water 0.1% TFA gradient elution method to give the title compound. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.40 (s, 1H), 9.68 (s, 1H), 8.09 (s, 1H), 7.24-7.35 (m, 5H), 6.98-7.13 (m, 3H), 6.88 (d, J = 8.09, 1.98 Hz, 1H), 6.73 (s, 1H), 6.60-6.66 (m, 1H), 5.47 (s , 2H); 5.35 (s, 2H). MS (ESI +) m / z 383.1 (M + H) + .
Пример 212Example 212
3-[4-(3-амино-1H-индазол-5-ил)-1-бензил-1H-1,2,3-триазол-5-ил]бензамид3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] benzamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 3-карбамоилфенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,41 (с, 1H), 8,07 (с, 1H), 7,97-8,03 (м, 2H), 7,83-7,87 (м, 1H), 7,53 (т, J=7,78 Гц, 1H), 7,45 (с, 1H), 7,38 (д, J=7,63 Гц, 1H), 7,23-7,30 (м, 3H), 7,00-7,10 (м, 2H), 6,96 (д, J=7,48, 1,98 Гц, 2H), 5,51 (с, 2H), 5,35 (с, 2H). MS (ESI+) m/z 410,1 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 3-carbamoylphenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.41 (s, 1H), 8.07 (s, 1H), 7.97-8.03 (m, 2H), 7.83-7.87 (m, 1H), 7.53 (t, J = 7.78 Hz, 1H), 7.45 (s, 1H), 7.38 (d, J = 7.63 Hz, 1H), 7.23-7.30 (m, 3H), 7, 00-7.10 (m, 2H), 6.96 (d, J = 7.48, 1.98 Hz, 2H), 5.51 (s, 2H), 5.35 (s, 2H). MS (ESI +) m / z 410.1 (M + H) + .
Пример 213Example 213
5-{1-бензил-5-[4-(метилсульфонил)фенил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-амин5- {1-benzyl-5- [4- (methylsulfonyl) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 173, с использованием 4-(метилсульфонил)фенилбороновой кислоты вместо 4-метоксифенилбороновой кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,44 (с, 1H), 7,94-8,01 (м, 3H), 7,58 (д, J=8,54 Гц, 2H), 7,22-7,30 (м, 3H), 7,04-7,13 (м, 2H), 6,98 (д, J=7,48, 1,98 Гц, 2H), 5,56 (с, 2H), 5,37 (с, 2H), 3,28 (с, 3H). MS (ESI+) m/z 445,2 (M+H)+.The title compound was prepared according to the procedure described in Example 173 using 4- (methylsulfonyl) phenylboronic acid instead of 4-methoxyphenylboronic acid. 1 H NMR (500 MHz, DMSO-d 6 ) δ ppm 11.44 (s, 1H), 7.94-8.01 (m, 3H), 7.58 (d, J = 8.54 Hz, 2H), 7.22-7.30 (m, 3H) 7.04-7.13 (m, 2H), 6.98 (d, J = 7.48, 1.98 Hz, 2H), 5.56 (s, 2H), 5.37 (s, 2H ), 3.28 (s, 3H). MS (ESI +) m / z 445.2 (M + H) + .
Пример 214Example 214
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-хлорбензамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-chlorobenzamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием 2-хлорбензоилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,94 (с, 1H), 8,24 (с, 1H), 7,85 (д, J=8,82, 1,47 Гц, 1H), 7,65 (д, J=6,99, 1,84 Гц, 1H), 7,43-7,61 (м, 4H), 7,26-7,42 (м, 5H), 5,68 (с, 2H), 1,71-1,83 (м, 1H), 1,04-1,12 (м, 2H), 0,37-0,45 (м, 2H). MS (ESI+) m/z 469 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using 2-chlorobenzoyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.94 (s, 1H), 8.24 (s, 1H), 7.85 (d, J = 8.82, 1.47 Hz, 1H), 7.65 (d, J = 6.99, 1.84 Hz, 1H), 7.43-7.61 (m, 4H), 7.26-7.42 (m, 5H), 5.68 (s, 2H), 1.71-1.83 (m, 1H), 1.04-1.12 (m, 2H), 0.37-0.45 (m, 2H). MS (ESI +) m / z 469 (M + H) + .
Пример 215Example 215
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-4-хлорбензамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -4-chlorobenzamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием 4-хлорбензоилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,53 (с, 1H), 7,65-7,71 (м, 3H), 7,42 (д, J=8,82, 1,47 Гц, 1H), 7,18-7,24 (м, 2H), 7,12-7,18 (м, 1H), 6,93-7,02 (м, 3H), 6,83-6,92 (м, 3H), 5,27 (с, 2H), 1,30-1,44 (м, 1H), 0,59-0,67 (м, 2H), -0,07-0,04 (м, 2H). MS (ESI+) m/z 469 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using 4-chlorobenzoyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.53 (s, 1H), 7.65-7.71 (m, 3H), 7.42 (d, J = 8.82, 1.47 Hz, 1H), 7.18-7.24 ( m, 2H), 7.12-7.18 (m, 1H), 6.93-7.02 (m, 3H), 6.83-6.92 (m, 3H), 5.27 (s, 2H), 1.30-1.44 (m, 1H), 0.59-0.67 (m, 2H), -0.07-0.04 (m, 2H). MS (ESI +) m / z 469 (M + H) + .
Пример 216Example 216
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]этансульфонамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] ethanesulfonamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием этансульфонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,19 (с, 1H), 8,15 (с, 1H), 7,82 (д, J=8,64, 1,65 Гц, 1H), 7,53 (д, J=8,82 Гц, 1H), 7,35-7,45 (м, 3H), 7,27-7,35 (м, 2H), 5,69 (с, 2H), 3,30 (кв., J=7,35 Гц, 2H), 1,74, 1,87 (м, 1H), 1,27-1,36 (м, 3H), 1,02-1,12 (м, 2H), 0,34-0,44 (м, 2H). MS (ESI+) m/z 423 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using ethanesulfonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.19 (s, 1H), 8.15 (s, 1H), 7.82 (d, J = 8.64, 1.65 Hz, 1H), 7.53 (d, J = 8.82 Hz , 1H), 7.35-7.45 (m, 3H), 7.27-7.35 (m, 2H), 5.69 (s, 2H), 3.30 (q, J = 7, 35 Hz, 2H), 1.74, 1.87 (m, 1H), 1.27-1.36 (m, 3H), 1.02-1.12 (m, 2H), 0.34-0 44 (m, 2H). MS (ESI +) m / z 423 (M + H) + .
Пример 217Example 217
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензолсульфонамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzenesulfonamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием бензолсульфонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,75 (с, 1H), 10,69 (с, 1H), 8,02 (с, 1H), 7,71-7,83 (м, 3H), 7,43-7,60 (м, 4H), 7,34-7,43 (м, 3H), 7,27-7,34 (м, 2H), 5,69 (с, 2H), 1,69-1,83 (м, 1H), 0,99-1,11 (м, 2H), 0,31-0,45 (м, 2H). MS (ESI+) m/z 471 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using benzenesulfonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.75 (s, 1H), 10.69 (s, 1H), 8.02 (s, 1H), 7.71-7.83 (m, 3H), 7.43-7.60 (m, 4H), 7.34-7.43 (m, 3H), 7.27-7.34 (m, 2H), 5.69 (s, 2H), 1.69-1.83 (m, 1H) 0.99-1.11 (m, 2H); 0.31-0.45 (m, 2H). MS (ESI +) m / z 471 (M + H) + .
Пример 218Example 218
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-хлорбензолсульфонамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-chlorobenzenesulfonamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием 2-хлорбензол-1-сульфонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,36 (с, 1H), 10,60 (с, 1H), 7,67 (с, 1H), 7,62 (д, J=7,91, 1,65 Гц, 1H), 7,40 (д, J=8,82, 1,47 Гц, 1H), 7,14-7,27 (м, 2H), 7,00-7,12 (м, 4H), 6,96-7,00 (м, 1H), 6,90-6,95 (м, 2H), 5,31 (с, 2H), 1,29-1,44 (м, 1H), 0,61-0,74 (м, 2H), -0,05-0,05 (м, 2H). MS (ESI+) m/z 505 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using 2-chlorobenzene-1-sulfonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.36 (s, 1H), 10.60 (s, 1H), 7.67 (s, 1H), 7.62 (d, J = 7.91, 1.65 Hz, 1H), 7.40 (d, J = 8.82, 1.47 Hz, 1H), 7.14-7.27 (m, 2H), 7.00-7.12 (m, 4H), 6.96-7.00 (m, 1H), 6.90-6.95 (m, 2H), 5.31 (s, 2H), 1.29-1.44 (m, 1H), 0.61-0.74 (m , 2H), -0.05-0.05 (m, 2H). MS (ESI +) m / z 505 (M + H) + .
Пример 219Example 219
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-хлорбензолсульфонамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-chlorobenzenesulfonamide
Указанное в заголовке соединение получали в форме соли HCl в соответствии с процедурой, описанной в Примере 205B, с использованием 3-хлорбензол-1-сульфонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,84 (с, 1H), 10,86 (с, 1H), 8,00 (с, 1H), 7,82 (с, 1H), 7,72 (д, J=7,72 Гц, 1H), 7,64 (д, J=1,84 Гц, 1H), 7,57 (д, J=7,72 Гц, 1H), 7,50 (д, J=8,82 Гц, 1H), 7,34-7,45 (м, 3H), 7,28-7,34 (м, 2H), 5,69 (с, 2H), 1,71-1,83 (м, 1H), 1,06 (м, 2H), 0,37 (м, 2H). MS (ESI+) m/z 505 (M+H)+.The title compound was prepared in the form of an HCl salt according to the procedure described in Example 205B using 3-chlorobenzene-1-sulfonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.84 (s, 1H), 10.86 (s, 1H), 8.00 (s, 1H), 7.82 (s, 1H), 7.72 (d, J = 7.72 Hz, 1H ), 7.64 (d, J = 1.84 Hz, 1H), 7.57 (d, J = 7.72 Hz, 1H), 7.50 (d, J = 8.82 Hz, 1H), 7.34-7.45 (m, 3H), 7.28-7.34 (m, 2H), 5.69 (s, 2H), 1.71-1.83 (m, 1H), 1, 06 (m, 2H); 0.37 (m, 2H). MS (ESI +) m / z 505 (M + H) + .
Пример 220Example 220
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-4-хлорбензолсульфонамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -4-chlorobenzenesulfonamide
Указанное в заголовке соединение получали в форме соли HCl в соответствии с процедурой, описанной в Примере 205B, с использованием 4-хлорбензол-1-сульфонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,80 (с, 1H), 10,79 (с, 1H), 8,00 (с, 1H), 7,73-7,83 (м, 3H), 7,56-7,64 (м, 2H), 7,49 (д, J=8,82 Гц, 1H), 7,34-7,45 (м, 3H), 7,28-7,34 (м, 2H), 5,69 (с, 2H), 1,71-1,86 (м, 1H), 0,99-1,12 (м, 2H), 0,31-0,43 (м, 2H). MS (ESI+) m/z 505 (M+H)+.The title compound was obtained in the form of an HCl salt according to the procedure described in Example 205B using 4-chlorobenzene-1-sulfonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.80 (s, 1H), 10.79 (s, 1H), 8.00 (s, 1H), 7.73-7.83 (m, 3H), 7.56-7.64 (m, 2H), 7.49 (d, J = 8.82 Hz, 1H), 7.34-7.45 (m, 3H), 7.28-7.34 (m, 2H), 5.69 (s , 2H), 1.71-1.86 (m, 1H), 0.99-1.12 (m, 2H), 0.31-0.43 (m, 2H). MS (ESI +) m / z 505 (M + H) + .
Пример 221Example 221
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2,5-диметилфуран-3-сульфонамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2,5-dimethylfuran-3-sulfonamide
Указанное в заголовке соединение получали в форме соли HCl в соответствии с процедурой, описанной в Примере 205B, с использованием 2,5-диметилфуран-3-сульфонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,82 (с, 1H), 10,48 (с, 1H), 8,00 (с, 1H), 7,78 (д, J=8,64, 1,65 Гц, 1H), 7,50 (д, J=9,19 Гц, 1H), 7,34-7,45 (м, 3H), 7,28-7,33 (м, 2H), 6,20 (с, 1H), 5,69 (с, 2H), 2,11 (с, 6H), 1,71-1,84 (м, 1H), 1,01-1,11 (м, 2H), 0,32-0,41 (м, 2H). MS (ESI+) m/z 489 (M+H)+.The title compound was obtained in the form of an HCl salt according to the procedure described in Example 205B using 2,5-dimethylfuran-3-sulfonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.82 (s, 1H), 10.48 (s, 1H), 8.00 (s, 1H), 7.78 (d, J = 8.64, 1.65 Hz, 1H), 7.50 (d, J = 9.19 Hz, 1H), 7.34-7.45 (m, 3H), 7.28-7.33 (m, 2H), 6.20 (s, 1H), 5, 69 (s, 2H), 2.11 (s, 6H), 1.71-1.84 (m, 1H), 1.01-1.11 (m, 2H), 0.32-0.41 ( m, 2H). MS (ESI +) m / z 489 (M + H) + .
Пример 222Example 222
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(2-хлорбензил)-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (2-chlorobenzyl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 207 с использованием 2-хлорбензальдегида вместо бензальдегида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,55 (с, 1H), 8,20 (с, 1H), 7,69 (д, J=8,46, 1,47 Гц, 1H), 7,49 (д, J=8,82 Гц, 1H), 7,34-7,46 (м, 4H), 7,23-7,33 (м, 5H), 5,69 (с, 2H), 4,56 (с, 2H), 1,72-1,83 (м, 1H), 0,99-1,09 (м, 2H), 0,35-0,42 (м, 2H). MS (ESI+) m/z 455 (M+H)+.The title compound was prepared according to the procedure described in Example 207 using 2-chlorobenzaldehyde instead of benzaldehyde. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.55 (s, 1H), 8.20 (s, 1H), 7.69 (d, J = 8.46, 1.47 Hz, 1H), 7.49 (d, J = 8.82 Hz , 1H), 7.34-7.46 (m, 4H), 7.23-7.33 (m, 5H), 5.69 (s, 2H), 4.56 (s, 2H), 1, 72-1.83 (m, 1H), 0.99-1.09 (m, 2H), 0.35-0.42 (m, 2H). MS (ESI +) m / z 455 (M + H) + .
Пример 223Example 223
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(3-хлорбензил)-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (3-chlorobenzyl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 207, с использованием 3-хлорбензальдегида вместо бензальдегида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,53 (с, 1H), 8,15 (с, 1H), 7,59-7,77 (м, 1H), 7,25-7,48 (м, 10H), 5,68 (с, 2H), 4,49 (с, 2H), 1,71-1,80 (м, 1H), 1,04 (с, 2H), 0,38 (с, 2H).The title compound was prepared according to the procedure described in Example 207 using 3-chlorobenzaldehyde instead of benzaldehyde. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.53 (s, 1H), 8.15 (s, 1H), 7.59-7.77 (m, 1H), 7.25-7.48 (m, 10H), 5.68 (s, 2H), 4.49 (s, 2H), 1.71-1.80 (m, 1H), 1.04 (s, 2H), 0.38 (s, 2H).
Пример 224Example 224
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-хлорбензамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-chlorobenzamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием 3-хлорбензоилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,99 (с, 1H), 8,12 (с, 2H), 8,03 (д, J=7,72 Гц, 1H), 7,83 (д, J=8,46 Гц, 1H), 7,68 (с, 1H), 7,58 (т, J=8,09 Гц, 2H), 7,33-7,44 (м, 3H), 7,25-7,33 (м, 2H), 5,68 (с, 2H), 1,72-1,86 (м, 1H), 0,99-1,12 (м, 2H), 0,34-0,45 (м, 2H). MS (ESI+) m/z 470 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using 3-chlorobenzoyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.99 (s, 1H), 8.12 (s, 2H), 8.03 (d, J = 7.72 Hz, 1H), 7.83 (d, J = 8.46 Hz, 1H), 7.68 (s, 1H), 7.58 (t, J = 8.09 Hz, 2H), 7.33-7.44 (m, 3H), 7.25-7.33 (m, 2H) 5.68 (s, 2H); 1.72-1.86 (m, 1H); 0.99-1.12 (m, 2H); 0.34-0.45 (m, 2H). MS (ESI +) m / z 470 (M + H) + .
Пример 225Example 225
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-фурамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-furamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 205B, с использованием фуран-2-карбонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,36 (с, 1H), 7,71 (с, 1H), 7,42 (д, J=8,82, 1,47 Гц, 1H), 7,15 (д, J=8,82 Гц, 1H), 7,06 (д, J=3,31 Гц, 1H), 6,93-7,03 (м, 3H), 6,86-6,93 (м, 2H), 6,31 (д, J=3,49, 1,65 Гц, 1H), 5,28 (с, 1H), 1,31-1,45 (м, 1H), 0,59-0,71 (м, 2H), -0,05-0,05 (м, 2H). MS (ESI+) m/z 425 (M+H)+.The title compound was prepared according to the procedure described in Example 205B using furan-2-carbonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.36 (s, 1H), 7.71 (s, 1H), 7.42 (d, J = 8.82, 1.47 Hz, 1H), 7.15 (d, J = 8.82 Hz , 1H), 7.06 (d, J = 3.31 Hz, 1H), 6.93-7.03 (m, 3H), 6.86-6.93 (m, 2H), 6.31 ( d, J = 3.49, 1.65 Hz, 1H), 5.28 (s, 1H), 1.31-1.45 (m, 1H), 0.59-0.71 (m, 2H) , -0.05-0.05 (m, 2H). MS (ESI +) m / z 425 (M + H) + .
Пример 226Example 226
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-этил-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N-ethyl-1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 207 с использованием ацетальдегида вместо бензальдегида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,56 (с, 1H), 8,30-8,42 (м, 1H), 7,90-8,17 (м, 2H), 7,20-7,45 (м, 5H), 5,70 (с, 2H), 1,78-1,93 (м, 2H), 1,67 (с, 1H), 1,06 (м, 3H), 0,95 (м, 2H), 0,29-0,48 (м, 2H). MS (ESI+) m/z 359 (M+H)+.The title compound was prepared according to the procedure described in Example 207 using acetaldehyde instead of benzaldehyde. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.56 (s, 1H), 8.30-8.42 (m, 1H), 7.90-8.17 (m, 2H), 7.20-7.45 (m, 5H), 5, 70 (s, 2H), 1.78-1.93 (m, 2H), 1.67 (s, 1H), 1.06 (m, 3H), 0.95 (m, 2H), 0.29 -0.48 (m, 2H). MS (ESI +) m / z 359 (M + H) + .
Пример 227Example 227
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(4-хлорбензил)-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (4-chlorobenzyl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 207, с использованием 4-хлорбензальдегида вместо бензальдегида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,01 (с, 1H), 9,25 (с, 1H), 8,25-8,33 (м, 1H), 8,09 (д, J=8,46 Гц, 1H), 7,84-7,97 (м, 2H), 7,57-7,73 (м, 2H), 7,26-7,51 (м, 6H), 5,70 (с, 2H), 1,71-1,84 (м, 1H), 0,97-1,15 (м, 2H), 0,36-0,47 (м, 2H). MS (ESI+) m/z 455 (M+H)+.The title compound was prepared according to the procedure described in Example 207 using 4-chlorobenzaldehyde instead of benzaldehyde. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.01 (s, 1H), 9.25 (s, 1H), 8.25-8.33 (m, 1H), 8.09 (d, J = 8.46 Hz, 1H), 7.84 -7.97 (m, 2H), 7.57-7.73 (m, 2H), 7.26-7.51 (m, 6H), 5.70 (s, 2H), 1.71-1 84 (m, 1H); 0.97-1.15 (m, 2H); 0.36-0.47 (m, 2H). MS (ESI +) m / z 455 (M + H) + .
Пример 228Example 228
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-N-(3-фурилметил)-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -N- (3-furylmethyl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 207, с использованием фуран-3-карбальдегида вместо бензальдегида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,21 (с, 1H), 7,90 (с, 1H), 7,71-7,82 (м, 1H), 7,55-7,68 (м, 2H), 7,24-7,51 (м, 6H), 5,68 (с, 2H), 4,33 (с, 2H), 1,67-1,85 (м, 1H), 0,95-1,13 (м, 2H), 0,30-0,42 (м, 2H). MS (ESI+) m/z 411 (M+H)+.The title compound was prepared according to the procedure described in Example 207 using furan-3-carbaldehyde instead of benzaldehyde. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 8.21 (s, 1H), 7.90 (s, 1H), 7.71-7.82 (m, 1H), 7.55-7.68 (m, 2H), 7.24-7, 51 (m, 6H), 5.68 (s, 2H), 4.33 (s, 2H), 1.67-1.85 (m, 1H), 0.95-1.13 (m, 2H) 0.30-0.42 (m, 2H). MS (ESI +) m / z 411 (M + H) + .
Пример 229Example 229
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-[5-метил-2-(трифторметил)-3-фурил]мочевинаN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- [5-methyl-2- (trifluoromethyl ) -3-furyl] urea
Соединение Примера 205A (30 мг, 0,07 ммоль) растворяли в диоксане (2 мл) и к раствору добавляли 3-изоцианато-5-метил-2-(трифторметил)фуран (40 мг, 0,21 ммоль). Реакционную смесь перемешивали при 80°C в течение 12 часов, концентрировали и очищали при помощи обращенно-фазовой-ВЭЖХ (CH3CN/H2O/NH4OAc) с получением Boc-защищенного предшественника. Предшественник растворяли в метаноле и обрабатывали избыточным количеством HCl в диоксане (4 M, 0,5 ммоль). Реакционную смесь оставляли для перемешивания в течение 5 часов и концентрировали в условиях вакуума с получением указанного в заголовке соединения в форме соли HCl. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,73 (с, 1H), 10,19 (с, 1H), 8,40 (с, 1H), 7,83 (д, J=8,82, 1,47 Гц, 1H), 7,64-7,75 (м, 1H), 7,49 (д, J=8,82 Гц, 1H), 7,35-7,45 (м, 3H), 7,27-7,35 (м, 2H), 5,69 (с, 2H), 2,33 (с, 3H), 1,73-1,84 (м, 1H), 1,02-1,11 (м, 2H), 0,35-0,43 (м, 2H). MS (ESI+) m/z 522 (M+H)+.The compound of Example 205A (30 mg, 0.07 mmol) was dissolved in dioxane (2 ml) and 3-isocyanato-5-methyl-2- (trifluoromethyl) furan (40 mg, 0.21 mmol) was added to the solution. The reaction mixture was stirred at 80 ° C for 12 hours, concentrated and purified by reverse phase-HPLC (CH 3 CN / H 2 O / NH 4 OAc) to give a Boc-protected precursor. The precursor was dissolved in methanol and treated with excess HCl in dioxane (4 M, 0.5 mmol). The reaction mixture was allowed to stir for 5 hours and concentrated in vacuo to give the title compound in the form of an HCl salt. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.73 (s, 1H), 10.19 (s, 1H), 8.40 (s, 1H), 7.83 (d, J = 8.82, 1.47 Hz, 1H), 7.64 -7.75 (m, 1H), 7.49 (d, J = 8.82 Hz, 1H), 7.35-7.45 (m, 3H), 7.27-7.35 (m, 2H ), 5.69 (s, 2H), 2.33 (s, 3H), 1.73-1.84 (m, 1H), 1.02-1.11 (m, 2H), 0.35- 0.43 (m, 2H). MS (ESI +) m / z 522 (M + H) + .
Пример 230Example 230
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-3-фурамидN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -3-furamide
Указанное в заголовке соединение получали в форме соли HCl в соответствии с процедурой, описанной в Примере 205B, с использованием фуран-3-карбонилхлорида вместо 3-фторбензоилхлорида. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,64 (с, 1H), 8,46 (с, 1H), 8,13 (с, 1H), 7,74-7,84 (м, 2H), 7,52-7,58 (м, 1H), 7,33-7,46 (м, 3H), 7,24-7,33 (м, 3H), 7,06 (с, 1H), 5,68 (с, 2H), 1,70-1,86 (м, 1H), 0,99-1,09 (м, 2H), 0,33-0,44 (м, 2H). MS (ESI+) m/z 425 (M+H)+.The title compound was obtained in the form of an HCl salt according to the procedure described in Example 205B using furan-3-carbonyl chloride instead of 3-fluorobenzoyl chloride. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 10.64 (s, 1H), 8.46 (s, 1H), 8.13 (s, 1H), 7.74-7.84 (m, 2H), 7.52-7.58 (m, 1H), 7.33-7.46 (m, 3H), 7.24-7.33 (m, 3H), 7.06 (s, 1H), 5.68 (s, 2H), 1.70 -1.86 (m, 1H), 0.99-1.09 (m, 2H), 0.33-0.44 (m, 2H). MS (ESI +) m / z 425 (M + H) + .
Пример 231Example 231
5-(1H-индазол-5-ил)-N-[(1S)-1-фенилпропил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1S) -1-phenylpropyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (S)-(-)-1-фенилпропиламина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 9,20 (д, J=8,48 Гц, 1H), 8,39 (с, 1H), 8,23 (с, 1H), 7,88 (д, J=8,81, 1,70 Гц, 1H), 7,69 (д, J=8,81 Гц, 1H), 7,38-7,49 (м, 2H), 7,18-7,38 (м, 4H), 4,83-5,02 (м, 1H), 1,73-1,97 (м, 2H), 0,86-0,97 (м, 3H). MS (ESI+) m/z 347,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (S) - (-) - 1-phenylpropylamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.37 (s, 1H), 9.20 (d, J = 8.48 Hz, 1H), 8.39 (s, 1H), 8.23 (s, 1H), 7.88 (d, J = 8.81, 1.70 Hz, 1H), 7.69 (d, J = 8.81 Hz, 1H), 7.38-7.49 (m, 2H), 7.18-7.38 ( m, 4H), 4.83-5.02 (m, 1H), 1.73-1.97 (m, 2H), 0.86-0.97 (m, 3H). MS (ESI +) m / z 347.0 (M + H) + .
Пример 232Example 232
5-(1H-индазол-5-ил)-N-[(1R)-1-фенилпропил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1R) -1-phenylpropyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (R)-(-)-1-фенилпропиламина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,37 (с, 1H), 9,20 (д, J=8,48 Гц, 1H), 8,39 (с, 1H), 8,23 (с, 1H), 7,88 (д, J=8,65, 1,53 Гц, 1H), 7,69 (д, J=8,81 Гц, 1H), 7,39-7,48 (м, 2H), 7,18-7,38 (м, 4H), 4,85-4,99 (м, 1H), 1,74-1,97 (м, 2H), 0,91 (т, J=7,29 Гц, 3H). MS (ESI+) m/z 347,0 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (R) - (-) - 1-phenylpropylamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.37 (s, 1H), 9.20 (d, J = 8.48 Hz, 1H), 8.39 (s, 1H), 8.23 (s, 1H), 7.88 (d, J = 8.65, 1.53 Hz, 1H), 7.69 (d, J = 8.81 Hz, 1H), 7.39-7.48 (m, 2H), 7.18-7.38 ( m, 4H), 4.85-4.99 (m, 1H), 1.74-1.97 (m, 2H), 0.91 (t, J = 7.29 Hz, 3H). MS (ESI +) m / z 347.0 (M + H) + .
Пример 233Example 233
5-(1-бензил-1H-пиразол-4-ил)-1H-индазол-3-амин5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazol-3-amine
Пример 233AExample 233A
5-(1-Бензил-1H-пиразол-4-ил)-2-фторбензонитрил5- (1-Benzyl-1H-pyrazol-4-yl) -2-fluorobenzonitrile
5-Бром-2-фторбензонитрил (484 мг, 2,42 ммоль), 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол (736 мг, 2,59 ммоль), дихлорбис(трифенилфосфин)палладий(II) (174 мг, 0,248 ммоль) и карбонат калия (1,36 г, 9,84 ммоль) объединяли в герметично закрытом сосуде с диоксаном (10 мл) и водой (1 мл) в инертной атмосфере азота и смесь нагревали до 110°C в течение ночи. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой абсорбировали на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гексане, с получением указанного в заголовке соединения. MS (ESI+) m/z 290,0 (M+H)+.5-Bromo-2-fluorobenzonitrile (484 mg, 2.42 mmol), 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole (736 mg, 2.59 mmol), dichlorobis (triphenylphosphine) palladium (II) (174 mg, 0.248 mmol) and potassium carbonate (1.36 g, 9.84 mmol) were combined in a sealed vessel with dioxane (10 ml) and water (1 ml) under an inert nitrogen atmosphere and the mixture was heated to 110 ° C. overnight. The mixture was diluted with methylene chloride and washed with water. The organic layer was absorbed on silica gel and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in hexane to elute to give the title compound. MS (ESI +) m / z 290.0 (M + H) + .
Пример 233BExample 233B
5-(1-бензил-1H-пиразол-4-ил)-1H-индазол-3-амин5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazol-3-amine
Соединение Примера 233A (591 мг, 2,13 ммоль) обрабатывали гидразингидратом (4,0 мл) в этаноле (3,0 мл) и перемешивали и нагревали до 70°C в течение ночи. Смесь разбавляли метиленхлоридом и промывали водой. Органический слой концентрировали при пониженном давлении и полученный остаток растирали в порошок с метанолом с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 11,32 (с, 1H), 8,10 (с, 1H), 7,85 (с, 1H), 7,80 (с, 1H), 7,44 (д, J=8,48, 1,70 Гц, 1H), 7,25-7,41 (м, 5H), 7,21 (д, J=8,82 Гц, 1H), 5,35 (с, 2H), 5,24-5,30 (м, 2H). MS (ESI+) m/z 290,0 (M+H)+.The compound of Example 233A (591 mg, 2.13 mmol) was treated with hydrazine hydrate (4.0 ml) in ethanol (3.0 ml) and stirred and heated to 70 ° C. overnight. The mixture was diluted with methylene chloride and washed with water. The organic layer was concentrated under reduced pressure, and the resulting residue was triturated with methanol to give the title compound. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 11.32 (s, 1H), 8.10 (s, 1H), 7.85 (s, 1H), 7.80 (s, 1H), 7.44 (d, J = 8.48, 1, 70 Hz, 1H), 7.25-7.41 (m, 5H), 7.21 (d, J = 8.82 Hz, 1H), 5.35 (s, 2H), 5.24-5, 30 (m, 2H). MS (ESI +) m / z 290.0 (M + H) + .
Пример 234Example 234
1-бензил-4-(1H-индазол-5-ил)-N-[(2S)-тетрагидрофуран-2-илметил]-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N - [(2S) -tetrahydrofuran-2-ylmethyl] -1H-1,2,3-triazole-5-carboxamide
В 20-мл сосуд добавляли раствор соединения Примера 149C (51 мг, 0,16 ммоль), растворенного в диметилформамиде (0,5 мл), с последующим добавлением (S)-(+)-тетрагидрофурфуриламина (18,2 мг, 0,18 ммоль), растворенного в диметилформамиде (0,9 мл). Добавляли HATU (68 мг, 0,18 ммоль), растворенный в диметилформамиде (0,5 мл), с последующим добавлением раствора диизопропилэтиламина (0,087 мл, 0,5 ммоль), растворенного в диметилформамиде (0,5 мл). Смесь встряхивали при 50°C в течение ночи. Реакционную смесь фильтровали через Si-карбонатный картридж (6 мл - 1 г), поставляемый компанией Silicycle Chemical Division, и фильтрат переносили в 20-мл сосуды. Реакционную смесь контролировали методом ЖХ/МС и концентрировали досуха. Остаток растворяли в смеси 1:1 DMSO/метанол и очищали при помощи обращенно-фазовой ВЭЖХ (Agilent, градиент 5%-100% ТФУ/вода, в течение 8 минут). 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 1,35-1,54 (м, 1H), 1,64-1,96 (м, 3H), 3,17-3,26 (м, 1H), 3,32-3,38 (м, 1H), 3,50-3,77 (м, 2H), 3,81-4,00 (м, 1H), 5,58-5,74 (м, 2H), 7,21-7,41 (м, 5H), 7,54-7,66 (м, 1H), 7,68-7,84 (м, 1H), 8,01-8,19 (м, 2H). MS (ESI-) m/z 401 (M-H)-.A solution of the compound of Example 149C (51 mg, 0.16 mmol) dissolved in dimethylformamide (0.5 ml) was added to a 20 ml vessel, followed by the addition of (S) - (+) - tetrahydrofurfurylamine (18.2 mg, 0, 18 mmol) dissolved in dimethylformamide (0.9 ml). HATU (68 mg, 0.18 mmol) dissolved in dimethylformamide (0.5 ml) was added, followed by a solution of diisopropylethylamine (0.087 ml, 0.5 mmol) dissolved in dimethylformamide (0.5 ml). The mixture was shaken at 50 ° C. overnight. The reaction mixture was filtered through a Si-carbonate cartridge (6 ml - 1 g), supplied by Silicycle Chemical Division, and the filtrate was transferred into 20 ml vessels. The reaction mixture was monitored by LC / MS and concentrated to dryness. The residue was dissolved in a 1: 1 DMSO / methanol mixture and purified by reverse phase HPLC (Agilent, gradient 5% -100% TFA / water, over 8 minutes). 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 1.35-1.54 (m, 1H), 1.64-1.96 (m, 3H), 3.17-3.26 (m, 1H), 3.32-3.38 (m, 1H ), 3.50-3.77 (m, 2H), 3.81-4.00 (m, 1H), 5.58-5.74 (m, 2H), 7.21-7.41 (m 5H), 7.54-7.66 (m, 1H), 7.68-7.84 (m, 1H), 8.01-8.19 (m, 2H). MS (ESI-) m / z 401 (MH) - .
Пример 235Example 235
1-бензил-4-(1H-индазол-5-ил)-N-(2-изопропоксиэтил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N- (2-isopropoxyethyl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 2-аминоэтилизопропилового эфира вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 0,98 (д, 6H), 3,31-3,45 (м, 4H), 3,45-3,57 (м, 1H), 5,61-5,74 (м, 2H), 7,25-7,46 (м, 5H), 7,57-7,65 (м, 1H), 7,68-7,80 (м, 1H), 8,04-8,13 (м, 2H). MS (ESI+) m/z 405 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using 2-aminoethylisopropyl ether instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 0.98 (d, 6H), 3.31-3.45 (m, 4H), 3.45-3.57 (m, 1H), 5.61-5.74 (m, 2H), 7, 25-7.46 (m, 5H), 7.57-7.65 (m, 1H), 7.68-7.80 (m, 1H), 8.04-8.13 (m, 2H). MS (ESI +) m / z 405 (M + H) + .
Пример 236Example 236
1-бензил-4-(1H-индазол-5-ил)-N-[(2R)-тетрагидрофуран-2-илметил]-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N - [(2R) -tetrahydrofuran-2-ylmethyl] -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием (R)-(-)-тетрагидрофурфуриламина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 1,34-1,60 (м, 1H), 1,65-1,94 (м, 3H), 3,16-3,26 (м, 1H), 3,33-3,39 (м, 1H), 3,51-3,77 (м, 2H), 3,78-4,00 (м, 1H), 5,60-5,73 (м, 2H), 7,26-7,45 (м, 5H), 7,56-7,68 (м, 1H), 7,71-7,79 (м, 1H), 8,01-8,15 (м, 2H). MS (ESI-) m/z 401 (M-H)-.The title compound was prepared according to the procedure described in Example 234 using (R) - (-) - tetrahydrofurfurylamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 1.34-1.60 (m, 1H), 1.65-1.94 (m, 3H), 3.16-3.26 (m, 1H), 3.33-3.39 (m, 1H ), 3.51-3.77 (m, 2H), 3.78-4.00 (m, 1H), 5.60-5.73 (m, 2H), 7.26-7.45 (m 5H), 7.56-7.68 (m, 1H), 7.71-7.79 (m, 1H), 8.01-8.15 (m, 2H). MS (ESI-) m / z 401 (MH) - .
Пример 237Example 237
1-бензил-4-(1H-индазол-5-ил)-N-(тетрагидрофуран-3-илметил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N- (tetrahydrofuran-3-ylmethyl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 3-аминометилтетрагидрофурана вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 1,36-1,59 (м, 1H), 1,67-2,00 (м, 1H), 2,19-2,45 (м, 1H), 3,11-3,23 (м, 2H), 3,45-3,77 (м, 2H), 5,45-6,14 (м, 2H), 7,16-7,44 (м, 5H), 7,50-7,84 (м, 2H), 7,96-8,25 (м, 2H). MS (ESI+) m/z 403 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using 3-aminomethyltetrahydrofuran instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 1.36-1.59 (m, 1H), 1.67-2.00 (m, 1H), 2.19-2.45 (m, 1H), 3.11-3.23 (m, 2H ), 3.45-3.77 (m, 2H), 5.45-6.14 (m, 2H), 7.16-7.44 (m, 5H), 7.50-7.84 (m , 2H); 7.96-8.25 (m, 2H). MS (ESI +) m / z 403 (M + H) + .
Пример 238Example 238
1-бензил-N-циклопентил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N-cyclopentyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием циклопентиламина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 1,19-1,63 (м, 6H), 1,71-1,99 (м, 2H), 3,99-4,37 (м, 1H), 5,52-5,77 (м, 2H), 7,22-7,45 (м, 5H), 7,55-7,83 (м, 2H), 7,95-8,20 (м, 2H). MS (ESI-) m/z 385 (M-H)-.The title compound was prepared according to the procedure described in Example 234 using cyclopentylamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 1.19-1.63 (m, 6H), 1.71-1.99 (m, 2H), 3.99-4.37 (m, 1H), 5.52-5.77 (m, 2H) ), 7.22-7.45 (m, 5H), 7.55-7.83 (m, 2H), 7.95-8.20 (m, 2H). MS (ESI-) m / z 385 (MH) - .
Пример 239Example 239
1-бензил-N-(циклопентилметил)-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N- (cyclopentylmethyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием аминометилциклопентана вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 1,02-1,28 (м, 2H), 1,34-1,73 (м, 6H), 1,83-2,17 (м, 1H), 3,03-3,17 (м, 2H), 5,51-5,80 (м, 2H), 7,20-7,42 (м, 5H), 7,52-7,81 (м, 2H), 7,93-8,19 (м, 2H). MS (ESI+) m/z 401 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using aminomethylcyclopentane instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 1.02-1.28 (m, 2H), 1.34-1.73 (m, 6H), 1.83-2.17 (m, 1H), 3.03-3.17 (m, 2H) ), 5.51-5.80 (m, 2H), 7.20-7.42 (m, 5H), 7.52-7.81 (m, 2H), 7.93-8.19 (m , 2H). MS (ESI +) m / z 401 (M + H) + .
Пример 240Example 240
1-бензил-N-этил-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N-ethyl-4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием гидрохлорида N-метилэтиламина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 0,33-0,56 (м, 1H), 0,90-1,14 (м, 2H), 2,15-2,25 (м, 2H), 2,58-2,69 (м, 1H), 2,82-3,01 (м, 1H), 3,35-3,52 (м, 1H), 5,40-5,67 (м, 2H), 7,14-7,48 (м, 5H), 7,56-7,79 (м, 2H), 7,90-8,24 (м, 2H). MS (ESI+) m/z 361 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using N-methylethylamine hydrochloride instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 0.33-0.56 (m, 1H), 0.90-1.14 (m, 2H), 2.15-2.25 (m, 2H), 2.58-2.69 (m, 1H ), 2.82-3.01 (m, 1H), 3.35-3.52 (m, 1H), 5.40-5.67 (m, 2H), 7.14-7.48 (m 5H), 7.56-7.79 (m, 2H), 7.90-8.24 (m, 2H). MS (ESI +) m / z 361 (M + H) + .
Пример 241Example 241
1-бензил-4-(1H-индазол-5-ил)-N-изопропил-N-метил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N-isopropyl-N-methyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием метилизопропиламина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 0,22-0,51 (м, 2H), 0,84-1,09 (м, 4H), 1,96-2,13 (м, 2H), 2,74-2,87 (м, 1H), 4,44-4,92 (м, 1H), 5,43-5,67 (м, 2H), 7,20-7,44 (м, 5H), 7,51-7,73 (м, 2H), 7,84-8,14 (м, 2H). MS (ESI+) m/z 375 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using methylisopropylamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 0.22-0.51 (m, 2H), 0.84-1.09 (m, 4H), 1.96-2.13 (m, 2H), 2.74-2.87 (m, 1H ), 4.44-4.92 (m, 1H), 5.43-5.67 (m, 2H), 7.20-7.44 (m, 5H), 7.51-7.73 (m , 2H); 7.84-8.14 (m, 2H). MS (ESI +) m / z 375 (M + H) + .
Пример 242Example 242
1-бензил-4-(1H-индазол-5-ил)-N-(2-метоксиэтил)-N-метил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N- (2-methoxyethyl) -N-methyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием N-(2-метоксиэтил)метиламина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 2,25-2,42 (м, 2H), 2,74-3,06 (м, 4H), 3,40-3,75 (м, 3H), 5,38-5,73 (м, 2H), 7,18-7,45 (м, 5H), 7,53-7,74 (м, 2H), 7,85-8,19 (м, 2H). MS (ESI+) m/z 391 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using N- (2-methoxyethyl) methylamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 2.25-2.42 (m, 2H), 2.74-3.06 (m, 4H), 3.40-3.75 (m, 3H), 5.38-5.73 (m, 2H) ), 7.18-7.45 (m, 5H), 7.53-7.74 (m, 2H), 7.85-8.19 (m, 2H). MS (ESI +) m / z 391 (M + H) + .
Пример 243Example 243
1-бензил-4-(1H-индазол-5-ил)-N-фенил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N-phenyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием анилина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 5,65-5,79 (м, 2H), 7,04-7,55 (м, 10H), 7,54-7,84 (м, 2H), 7,95-8,21 (м, 2H). MS (ESI+) m/z 395 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using aniline instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 5.65-5.79 (m, 2H), 7.04-7.55 (m, 10H), 7.54-7.84 (m, 2H), 7.95-8.21 (m, 2H ) MS (ESI +) m / z 395 (M + H) + .
Пример 244Example 244
1-бензил-N-(4-хлорфенил)-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N- (4-chlorophenyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 4-хлоранилина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 5,70-5,74 (м, 2H), 7,25-7,42 (м, 7H), 7,43-7,52 (м, 2H), 7,54-7,66 (м, 1H), 7,68-7,77 (м, 1H), 8,03-8,15 (м, 2H). MS (ESI-) m/z 427 (M-H)-.The title compound was prepared according to the procedure described in Example 234 using 4-chloroaniline instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 5.70-5.74 (m, 2H), 7.25-7.42 (m, 7H), 7.43-7.52 (m, 2H), 7.54-7.66 (m, 1H ), 7.68-7.77 (m, 1H), 8.03-8.15 (m, 2H). MS (ESI-) m / z 427 (MH) - .
Пример 245Example 245
1-бензил-4-(1H-индазол-5-ил)-N-(2-морфолин-4-илэтил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-4- (1H-indazol-5-yl) -N- (2-morpholin-4-yl-ethyl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием N-(3-аминопропил)морфолина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 2,94-3,13 (м, 6H), 3,46-3,61 (м, 2H), 3,63-3,79 (м, 4H), 5,61-5,88 (м, 2H), 7,19-7,46 (м, 5H), 7,56-7,88 (м, 2H), 7,88-8,30 (м, 2H). MS (ESI-) m/z 430 (M-H)-.The title compound was prepared according to the procedure described in Example 234 using N- (3-aminopropyl) morpholine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 2.94-3.13 (m, 6H), 3.46-3.61 (m, 2H), 3.63-3.79 (m, 4H), 5.61-5.88 (m, 2H) ), 7.19-7.46 (m, 5H), 7.56-7.88 (m, 2H), 7.88-8.30 (m, 2H). MS (ESI-) m / z 430 (MH) - .
Пример 246Example 246
1-бензил-N-[2-(диметиламино)этил]-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N- [2- (dimethylamino) ethyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 234, с использованием N,N,N-триметилэтилендиамина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 2,28-2,42 (м, 3H), 2,73-3,00 (м, 6H), 3,07-3,19 (м, 2H), 3,56-3,80 (м, 2H), 5,55-5,68 (м, 2H), 7,24-7,47 (м, 5H), 7,56-7,78 (м, 2H), 7,91-8,02 (м, 1H), 8,10-8,17 (м, 1H). MS (ESI+) m/z 404 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 234 using N, N, N-trimethylethylenediamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 2.28-2.42 (m, 3H), 2.73-3.00 (m, 6H), 3.07-3.19 (m, 2H), 3.56-3.80 (m, 2H) ), 5.55-5.68 (m, 2H), 7.24-7.47 (m, 5H), 7.56-7.78 (m, 2H), 7.91-8.02 (m , 1H), 8.10-8.17 (m, 1H). MS (ESI +) m / z 404 (M + H) + .
Пример 247Example 247
1-бензил-N-(2-гидроксиэтил)-4-(1H-индазол-5-ил)-N-пропил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N- (2-hydroxyethyl) -4- (1H-indazol-5-yl) -N-propyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 2-(пропиламино)этанола вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 0,22-0,39 (м, 1H), 0,80-1,06 (м, 3H), 1,50-1,75 (м, 1H), 2,65-2,78 (м, 1H), 2,80-2,94 (м, 1H), 2,97-3,09 (м, 1H), 3,37-3,50 (м, 1H), 3,51-3,63 (м, 1H), 3,61-3,73 (м, 1H), 5,39-5,74 (м, 2H), 7,20-7,44 (м, 5H), 7,50-7,85 (м, 2H), 7,86-8,25 (м, 2H). MS (ESI+) m/z 405 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using 2- (propylamino) ethanol instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 0.22-0.39 (m, 1H), 0.80-1.06 (m, 3H), 1.50-1.75 (m, 1H), 2.65-2.78 (m, 1H) ), 2.80-2.94 (m, 1H), 2.97-3.09 (m, 1H), 3.37-3.50 (m, 1H), 3.51-3.63 (m , 1H), 3.61-3.73 (m, 1H), 5.39-5.74 (m, 2H), 7.20-7.44 (m, 5H), 7.50-7.85 (m, 2H); 7.86-8.25 (m, 2H). MS (ESI +) m / z 405 (M + H) + .
Пример 248Example 248
1-бензил-N-[3-(диметиламино)пропил]-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N- [3- (dimethylamino) propyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 234, с использованием N,N,N-триметил-1,3-пропандиамина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,06-8,23 (м, 1H), 7,85-8,05 (м, 1H), 7,57-7,73 (м, 2H), 7,19-7,48 (м, 5H), 5,41-5,74 (м, 2H), 3,36-3,45 (м, 2H), 2,88-3,10 (м, 3H), 2,60-2,86 (м, 5H), 2,24-2,42 (м, 4H), 1,73-1,91 (м, 1H). MS (ESI+) m/z 418 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 234 using N, N, N-trimethyl-1,3-propanediamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.06-8.23 (m, 1H), 7.85-8.05 (m, 1H), 7.57-7.73 (m, 2H), 7.19-7.48 (m, 5H ), 5.41-5.74 (m, 2H), 3.36-3.45 (m, 2H), 2.88-3.10 (m, 3H), 2.60-2.86 (m 5H); 2.24-2.42 (m, 4H); 1.73-1.91 (m, 1H). MS (ESI +) m / z 418 (M + H) + .
Пример 249Example 249
1-бензил-N-[2-(диэтиламино)этил]-4-(1H-индазол-5-ил)-N-метил-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N- [2- (diethylamino) ethyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 234, с использованием N,N-диэтил-N-метилэтилендиамина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,82-8,24 (м, 2H), 7,56-7,76 (м, 2H), 7,15-7,49 (м, 5H), 5,54-5,71 (м, 2H), 3,60-3,77 (м, 2H), 3,20-3,24 (м, 2H), 3,13-3,18 (м, 2H), 3,03-3,11 (м, 2H), 2,32-2,44 (м, 3H), 0,63-1,41 (м, 6H). MS (ESI+) m/z 432 (M+H)+.The title compound was prepared in the form of a TFA salt in accordance with the procedure described in Example 234 using N, N-diethyl-N-methylethylenediamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.82-8.24 (m, 2H), 7.56-7.76 (m, 2H), 7.15-7.49 (m, 5H), 5.54-5.71 (m, 2H) ), 3.60-3.77 (m, 2H), 3.20-3.24 (m, 2H), 3.13-3.18 (m, 2H), 3.03-3.11 (m , 2H); 2.32-2.44 (m, 3H); 0.63-1.41 (m, 6H). MS (ESI +) m / z 432 (M + H) + .
Пример 250Example 250
N,1-дибензил-N-этил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамидN, 1-dibenzyl-N-ethyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием N-этилбензиламина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,81-8,20 (м, 2H), 7,49-7,71 (м, 2H), 7,24-7,51 (м, 9H), 6,39-7,18 (м, 2H), 5,41-5,74 (м, 2H), 4,53-4,84 (м, 1H), 3,82-4,00 (м, 1H), 3,37-3,54 (м, 1H), 2,61-2,78 (м, 1H), 0,91-1,08 (м, 1H), 0,27-0,45 (м, 2H). MS (ESI+) m/z 437 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using N-ethylbenzylamine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.81-8.20 (m, 2H), 7.49-7.71 (m, 2H), 7.24-7.51 (m, 9H), 6.39-7.18 (m, 2H) ), 5.41-5.74 (m, 2H), 4.53-4.84 (m, 1H), 3.82-4.00 (m, 1H), 3.37-3.54 (m , 1H), 2.61-2.78 (m, 1H), 0.91-1.08 (m, 1H), 0.27-0.45 (m, 2H). MS (ESI +) m / z 437 (M + H) + .
Пример 251Example 251
N,1-дибензил-N-(2-гидроксиэтил)-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамидN, 1-dibenzyl-N- (2-hydroxyethyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием N-бензилэтаноламина вместо (S)-(+)-тетрагидрофурфуриламина. MS (ESI+) m/z 453 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using N-benzylethanolamine instead of (S) - (+) - tetrahydrofurfurylamine. MS (ESI +) m / z 453 (M + H) + .
Пример 252Example 252
(3R)-1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-3-ол(3R) -1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-3-ol
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием гидрохлорида (R)-(+)-3-гидроксипиперидина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,83-8,22 (м, 2H), 7,51-7,78 (м, 2H), 7,23-7,45 (м, 5H), 5,46-5,75 (м, 2H), 3,80-4,31 (м, 1H), 3,40-3,68 (м, 1H), 2,58-3,15 (м, 2H), 2,19-2,49 (м, 1H), 0,31-2,14 (м, 4H). MS (ESI+) m/z 403 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using (R) - (+) - 3-hydroxypiperidine hydrochloride instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.83-8.22 (m, 2H), 7.51-7.78 (m, 2H), 7.23-7.45 (m, 5H), 5.46-5.75 (m, 2H) ), 3.80-4.31 (m, 1H), 3.40-3.68 (m, 1H), 2.58-3.15 (m, 2H), 2.19-2.49 (m , 1H); 0.31-2.14 (m, 4H). MS (ESI +) m / z 403 (M + H) + .
Пример 253Example 253
1-{[1-бензил-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-ил]карбонил}пиперидин-4-карбоксамид1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidine-4-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием изонипекотамида вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,86-8,24 (м, 2H), 7,53-7,70 (м, 2H), 7,22-7,46 (м, 5H), 5,42-5,77 (м, 2H), 4,19-4,48 (м, 1H), 2,65-3,10 (м, 2H), 2,27-2,47 (м, 1H), 2,05-2,24 (м, 1H), 1,65-1,89 (м, 1H), 1,29-1,55 (м, 1H), 0,98-1,27 (м, 1H), 0,52-0,87 (м, 1H). MS (ESI+) m/z 430 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using isonipecotamide instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.86-8.24 (m, 2H), 7.53-7.70 (m, 2H), 7.22-7.46 (m, 5H), 5.42-5.77 (m, 2H) ), 4.19-4.48 (m, 1H), 2.65-3.10 (m, 2H), 2.27-2.47 (m, 1H), 2.05-2.24 (m , 1H), 1.65-1.89 (m, 1H), 1.29-1.55 (m, 1H), 0.98-1.27 (m, 1H), 0.52-0.87 (m, 1H). MS (ESI +) m / z 430 (M + H) + .
Пример 254Example 254
5-{1-бензил-5-[(2,6-диметилморфолин-4-ил)карбонил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1-benzyl-5 - [(2,6-dimethylmorpholin-4-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 2,6-диметилморфолина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,87-8,27 (м, 2H), 7,50-7,76 (м, 2H), 7,12-7,45 (м, 5H), 5,46-5,68 (м, 2H), 4,16-4,43 (м, 1H), 2,61-2,98 (м, 1H), 2,16-2,41 (м, 2H), 1,77-2,13 (м, 1H), 0,86-1,39 (м, 3H), 0,38-0,83 (м, 3H). MS (ESI+) m/z 417 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using 2,6-dimethylmorpholine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.87-8.27 (m, 2H), 7.50-7.76 (m, 2H), 7.12-7.45 (m, 5H), 5.46-5.68 (m, 2H) ), 4.16-4.43 (m, 1H), 2.61-2.98 (m, 1H), 2.16-2.41 (m, 2H), 1.77-2.13 (m , 1H), 0.86-1.39 (m, 3H), 0.38-0.83 (m, 3H). MS (ESI +) m / z 417 (M + H) + .
Пример 255Example 255
5-{5-[(4-ацетилпиперазин-1-ил)карбонил]-1-бензил-1H-1,2,3-триазол-4-ил}-1H-индазол5- {5 - [(4-acetylpiperazin-1-yl) carbonyl] -1-benzyl-1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 1-ацетилпиперазина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,89-8,41 (м, 2H), 7,55-7,86 (м, 2H), 7,07-7,51 (м, 5H), 5,44-5,82 (м, 2H), 3,46-3,70 (м, 3H), 3,35-3,49 (м, 2H), 2,57-2,93 (м, 3H), 1,61-2,03 (м, 3H). MS (ESI+) m/z 430 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using 1-acetylpiperazine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.89-8.41 (m, 2H), 7.55-7.86 (m, 2H), 7.07-7.51 (m, 5H), 5.44-5.82 (m, 2H ), 3.46-3.70 (m, 3H), 3.35-3.49 (m, 2H), 2.57-2.93 (m, 3H), 1.61-2.03 (m , 3H). MS (ESI +) m / z 430 (M + H) + .
Пример 256Example 256
5-{1-бензил-5-[(4-фенилпиперазин-1-ил)карбонил]-1H-1,2,3-триазол-4-ил}-1H-индазол5- {1-benzyl-5 - [(4-phenylpiperazin-1-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 1-фенилпиперазина вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (SOO МГЦ, ДМСО-d6/D2O) δ м.д. 7,79-8,38 (м, 2H), 7,53-7,73 (м, 2H), 7,22-7,46 (м, 5H), 7,05-7,19 (м, 2H), 6,64-6,79 (м, 3H), 5,54-5,68 (м, 2H), 3,50-3,90 (м, 2H), 2,93-3,15 (м, 2H), 2,62-2,89 (м, 2H), 2,19-2,43 (м, 2H). MS (ESI-) m/z 462 (M-H)-.The title compound was prepared according to the procedure described in Example 234 using 1-phenylpiperazine instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (SOO MHz, DMSO-d 6 / D 2 O) δ ppm 7.79-8.38 (m, 2H), 7.53-7.73 (m, 2H), 7.22-7.46 (m, 5H), 7.05-7.19 (m, 2H) ), 6.64-6.79 (m, 3H), 5.54-5.68 (m, 2H), 3.50-3.90 (m, 2H), 2.93-3.15 (m , 2H); 2.62-2.89 (m, 2H); 2.19-2.43 (m, 2H). MS (ESI-) m / z 462 (MH) - .
Пример 257Example 257
1-бензил-N-[(1R)-1-(гидроксиметил)-2-метилпропил]-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N - [(1R) -1- (hydroxymethyl) -2-methylpropyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием (R)-(+)-2-амино-3-метил-1-бутанола вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,95-8,31 (м, 2H), 7,52-7,96 (м, 2H), 7,18-7,46 (м, 5H), 5,42-5,86 (м, 2H), 3,68-3,94 (м, 1H), 3,38-3,59 (м, 2H), 1,49-2,08 (м, 1H), 0,50-1,20 (м, 6H). MS (ESI+) m/z 405 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using (R) - (+) - 2-amino-3-methyl-1-butanol instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.95-8.31 (m, 2H), 7.52-7.96 (m, 2H), 7.18-7.46 (m, 5H), 5.42-5.86 (m, 2H) ), 3.68-3.94 (m, 1H), 3.38-3.59 (m, 2H), 1.49-2.08 (m, 1H), 0.50-1.20 (m , 6H). MS (ESI +) m / z 405 (M + H) + .
Пример 258Example 258
1-бензил-N-[(1S)-1-(гидроксиметил)-2-метилпропил]-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N - [(1S) -1- (hydroxymethyl) -2-methylpropyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием (S)-(-)-2-амино-3-метил-1-бутанола вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 7,94-8,36 (м, 2H), 7,52-7,84 (м, 2H), 7,18-7,51 (м, 5H), 5,57-5,76 (м, 2H), 3,75-3,94 (м, 1H), 3,35-3,54 (м, 2H), 1,70-1,94 (м, 1H), 0,54-1,09 (м, 6H). MS (ESI+) m/z 405 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using (S) - (-) - 2-amino-3-methyl-1-butanol instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 7.94-8.36 (m, 2H), 7.52-7.84 (m, 2H), 7.18-7.51 (m, 5H), 5.57-5.76 (m, 2H) ), 3.75-3.94 (m, 1H), 3.35-3.54 (m, 2H), 1.70-1.94 (m, 1H), 0.54-1.09 (m , 6H). MS (ESI +) m / z 405 (M + H) + .
Пример 259Example 259
1-бензил-N-[3-(1H-индазол-1-ил)пропил]-4-(1H-индазол-5-ил)-1H-1,2,3-триазол-5-карбоксамид1-benzyl-N- [3- (1H-indazol-1-yl) propyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 234, с использованием 1-(3-аминопропил)индазола вместо (S)-(+)-тетрагидрофурфуриламина. 1H ЯМР (300 МГц, ДМСО-d6/D2O) δ м.д. 8,57-8,85 (м, 1H), 7,92-8,16 (м, 2H), 7,60-7,80 (м, 2H), 7,47-7,55 (м, 2H), 7,19-7,40 (м, 5H), 5,54-5,75 (м, 2H), 3,83-4,21 (м, 2H), 3,19-3,26 (м, 2H), 1,79-2,06 (м, 2H). MS (ESI+) m/z 427 (M+H)+.The title compound was prepared according to the procedure described in Example 234 using 1- (3-aminopropyl) indazole instead of (S) - (+) - tetrahydrofurfurylamine. 1 H NMR (300 MHz, DMSO-d 6 / D 2 O) δ ppm 8.57-8.85 (m, 1H), 7.92-8.16 (m, 2H), 7.60-7.80 (m, 2H), 7.47-7.55 (m, 2H ), 7.19-7.40 (m, 5H), 5.54-5.75 (m, 2H), 3.83-4.21 (m, 2H), 3.19-3.26 (m , 2H); 1.79-2.06 (m, 2H). MS (ESI +) m / z 427 (M + H) + .
Пример 260Example 260
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-этилмочевинаN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-ethylurea
Указанное в заголовке соединение получали в форме соли хлористоводородной кислоты в соответствии с процедурой, описанной в Примере 229, с использованием изоцианатоэтана вместо 3-изоцианато-5-метил-2-(трифторметил)фурана. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,38 (с, 1H), 9,47 (с, 1H), 8,38 (с, 1H), 7,85-7,97 (м, 1H), 7,78 (д, J=8,82, 1,47 Гц, 1H), 7,34-7,50 (м, 4H), 7,24-7,33 (м, 2H), 5,69 (с, 2H), 3,17-3,29 (м, 2H), 1,70-1,83 (м, 1H), 1,12 (т, J=7,17 Гц, 3H), 1,00-1,08 (м, 2H), 0,37 (д, J=3,68 Гц, 2H). MS (ESI+) m/z 402 (M+H)+.The title compound was obtained in the form of a hydrochloric acid salt according to the procedure described in Example 229 using isocyanatoethane instead of 3-isocyanato-5-methyl-2- (trifluoromethyl) furan. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.38 (s, 1H), 9.47 (s, 1H), 8.38 (s, 1H), 7.85-7.97 (m, 1H), 7.78 (d, J = 8, 82, 1.47 Hz, 1H), 7.34-7.50 (m, 4H), 7.24-7.33 (m, 2H), 5.69 (s, 2H), 3.17-3 29 (m, 2H), 1.70-1.83 (m, 1H), 1.12 (t, J = 7.17 Hz, 3H), 1.00-1.08 (m, 2H), 0.37 (d, J = 3.68 Hz, 2H). MS (ESI +) m / z 402 (M + H) + .
Пример 261Example 261
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-фенилмочевинаN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-phenylurea
Указанное в заголовке соединение получали в форме соли хлористоводородной кислоты в соответствии с процедурой, описанной в Примере 229, с использованием изоцианатобензола вместо 3-изоцианато-5-метил-2-(трифторметил)фурана. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,47-12,78 (м, 1H), 9,64 (с, 1H), 8,39 (с, 1H), 7,70-7,95 (м, 1H), 7,45-7,60 (м, 3H), 7,27-7,45 (м, 7H), 7,02 (м, 1H), 5,69 (с, 2H), 1,79 (м, 1H), 1,07 (м, 2H), 0,40 (м, 2H). MS (ESI+) m/z 450 (M+H)+.The title compound was obtained in the form of a hydrochloric acid salt according to the procedure described in Example 229 using isocyanatobenzene instead of 3-isocyanato-5-methyl-2- (trifluoromethyl) furan. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.47-12.78 (m, 1H), 9.64 (s, 1H), 8.39 (s, 1H), 7.70-7.95 (m, 1H), 7.45-7, 60 (m, 3H), 7.27-7.45 (m, 7H), 7.02 (m, 1H), 5.69 (s, 2H), 1.79 (m, 1H), 1.07 (m, 2H); 0.40 (m, 2H). MS (ESI +) m / z 450 (M + H) + .
Пример 262Example 262
N-бензил-N'-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]мочевинаN-benzyl-N '- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] urea
Указанное в заголовке соединение получали в форме соли хлористоводородной кислоты в соответствии с процедурой, описанной в Примере 229, с использованием (изоцианатометил)бензола вместо 3-изоцианато-5-метил-2-(трифторметил)фурана. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,42 (с, 1H), 9,61 (с, 1H), 8,37 (с, 1H), 8,23-8,33 (м, 1H), 7,79 (д, J=8,82, 1,47 Гц, 1H), 7,36-7,50 (м, 4H), 7,28-7,36 (м, 6H), 7,21-7,27 (м, 1H), 5,69 (с, 2H), 4,45 (д, J=5,88 Гц, 2H), 1,65-1,79 (т, J=8,27, 8,27 Гц, 1H), 0,99-1,08 (м, 2H), 0,30-0,43 (м, 2H). MS (ESI+) m/z 464 (M+H)+.The title compound was obtained in the form of a hydrochloric acid salt in accordance with the procedure described in Example 229, using (isocyanatomethyl) benzene instead of 3-isocyanato-5-methyl-2- (trifluoromethyl) furan. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.42 (s, 1H), 9.61 (s, 1H), 8.37 (s, 1H), 8.23-8.33 (m, 1H), 7.79 (d, J = 8, 82, 1.47 Hz, 1H), 7.36-7.50 (m, 4H), 7.28-7.36 (m, 6H), 7.21-7.27 (m, 1H), 5 69 (s, 2H), 4.45 (d, J = 5.88 Hz, 2H), 1.65-1.79 (t, J = 8.27, 8.27 Hz, 1H), 0, 99-1.08 (m, 2H); 0.30-0.43 (m, 2H). MS (ESI +) m / z 464 (M + H) + .
Пример 263Example 263
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(2-хлорфенил)мочевинаN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (2-chlorophenyl) urea
Указанное в заголовке соединение получали в форме соли хлористоводородной кислоты в соответствии с процедурой, описанной в Примере 229, с использованием 1-хлор-2-изоцианатобензола вместо 3-изоцианато-5-метил-2-(трифторметил)фурана. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,74 (с, 1H), 10,23 (с, 1H), 8,44 (с, 1H), 8,34 (д, J=8,09 Гц, 1H), 7,83 (д, J=8,82, 1,47 Гц, 1H), 7,46-7,55 (м, 2H), 7,35-7,45 (м, 3H), 7,28-7,35 (м, 3H), 7,03-7,12 (м, 1H), 5,70 (с, 2H), 1,70-1,86 (м, 1H), 1,00-1,12 (м, 2H), 0,33-0,45 (м, 2H). MS (ESI+) m/z 484 (M+H)+.The title compound was obtained in the form of a hydrochloric acid salt according to the procedure described in Example 229 using 1-chloro-2-isocyanatobenzene instead of 3-isocyanato-5-methyl-2- (trifluoromethyl) furan. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.74 (s, 1H), 10.23 (s, 1H), 8.44 (s, 1H), 8.34 (d, J = 8.09 Hz, 1H), 7.83 (d, J = 8.82, 1.47 Hz, 1H), 7.46-7.55 (m, 2H), 7.35-7.45 (m, 3H), 7.28-7.35 (m, 3H ), 7.03-7.12 (m, 1H), 5.70 (s, 2H), 1.70-1.86 (m, 1H), 1.00-1.12 (m, 2H), 0.33-0.45 (m, 2H). MS (ESI +) m / z 484 (M + H) + .
Пример 264Example 264
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(3-хлорфенил)мочевинаN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (3-chlorophenyl) urea
Указанное в заголовке соединение получали в форме соли хлористоводородной кислоты в соответствии с процедурой, описанной в Примере 229, с использованием 1-хлор-3-изоцианатобензола вместо 3-изоцианато-5-метил-2-(трифторметил)фурана. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,66 (с, 1H), 10,02 (с, 1H), 9,71 (с, 1H), 8,22-8,48 (м, 1H), 7,71-7,91 (м, 2H), 7,51 (д, J=8,46 Гц, 1H), 7,37-7,46 (м, 2H), 7,26-7,37 (м, 5H), 7,02-7,11 (м, 1H), 5,69 (с, 2H), 1,73-1,89 (м, 1H), 0,99-1,11 (м, 2H), 0,33-0,48 (м, 2H). MS (ESI+) m/z 484 (M+H)+.The title compound was obtained in the form of a hydrochloric acid salt according to the procedure described in Example 229 using 1-chloro-3-isocyanatobenzene instead of 3-isocyanato-5-methyl-2- (trifluoromethyl) furan. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.66 (s, 1H), 10.02 (s, 1H), 9.71 (s, 1H), 8.22-8.48 (m, 1H), 7.71-7.91 (m, 2H), 7.51 (d, J = 8.46 Hz, 1H), 7.37-7.46 (m, 2H), 7.26-7.37 (m, 5H), 7.02-7 11 (m, 1H), 5.69 (s, 2H), 1.73-1.89 (m, 1H), 0.99-1.11 (m, 2H), 0.33-0.48 (m, 2H). MS (ESI +) m / z 484 (M + H) + .
Пример 265Example 265
N-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-(4-хлорфенил)мочевинаN- [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N '- (4-chlorophenyl) urea
Указанное в заголовке соединение получали в форме соли хлористоводородной кислоты в соответствии с процедурой, описанной в Примере 229, с использованием 1-хлор-4-изоцианатобензола вместо 3-изоцианато-5-метил-2-(трифторметил)фурана. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,65 (с, 1H), 9,96 (с, 1H), 9,68 (с, 1H), 8,37 (с, 1H), 7,81 (д, J=8,82, 1,47 Гц, 1H), 7,53-7,60 (м, 2H), 7,50 (д, J=8,82 Гц, 1H), 7,39-7,44 (м, 1H), 7,33-7,40 (м, 4H), 7,27-7,32 (м, 2H), 5,69 (с, 2H), 1,71-1,87 (м, 1H), 1,00-1,12 (м, 2H), 0,34-0,44 (м, 2H). MS (ESI+) m/z 484 (M+H)+.The title compound was obtained in the form of a hydrochloric acid salt according to the procedure described in Example 229 using 1-chloro-4-isocyanatobenzene instead of 3-isocyanato-5-methyl-2- (trifluoromethyl) furan. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.65 (s, 1H), 9.96 (s, 1H), 9.68 (s, 1H), 8.37 (s, 1H), 7.81 (d, J = 8.82, 1, 47 Hz, 1H), 7.53-7.60 (m, 2H), 7.50 (d, J = 8.82 Hz, 1H), 7.39-7.44 (m, 1H), 7, 33-7.40 (m, 4H), 7.27-7.32 (m, 2H), 5.69 (s, 2H), 1.71-1.87 (m, 1H), 1.00- 1.12 (m, 2H); 0.34-0.44 (m, 2H). MS (ESI +) m / z 484 (M + H) + .
Пример 266Example 266
N-[5-(1-бензил-5-иод-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамидN- [5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide
Пример 266AExample 266A
трет-бутил 3-амино-5-(1-бензил-5-иод-1H-1,2,3-триазол-4-ил)-1H-индазол-1-карбоксилатtert-butyl 3-amino-5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazole-1-carboxylate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 198A, с использованием соединения Примера 125B вместо соединения Примера 102B. Продукт использовали непосредственно в последующих реакциях без определения его характеристик.The title compound was prepared according to the procedure described in Example 198A using the compound of Example 125B instead of the compound of Example 102B. The product was used directly in subsequent reactions without determining its characteristics.
Пример 266BExample 266B
N-[5-(1-бензил-5-иод-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]бензамидN- [5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] benzamide
Указанное в заголовке соединение получали в форме соли ТФУ в соответствии с процедурой, описанной в Примере 205B, с использованием соединения Примера 266A вместо соединения Примера 205A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 12,97 (с, 1H), 10,89 (с, 1H), 8,28 (с, 1H), 8,05-8,14 (м, 2H), 7,88 (д, J=8,82, 1,47 Гц, 1H), 7,58-7,67 (м, 2H), 7,54 (т, J=7,35 Гц, 2H), 7,29-7,45 (м, 3H), 7,23 (д, J=6,99 Гц, 2H), 5,73 (с, 2H). MS (ESI+) m/z 521 (M+H)+.The title compound was obtained in the form of a TFA salt in accordance with the procedure described in Example 205B using the compound of Example 266A instead of the compound of Example 205A. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 12.97 (s, 1H), 10.89 (s, 1H), 8.28 (s, 1H), 8.05-8.14 (m, 2H), 7.88 (d, J = 8, 82, 1.47 Hz, 1H), 7.58-7.67 (m, 2H), 7.54 (t, J = 7.35 Hz, 2H), 7.29-7.45 (m, 3H ), 7.23 (d, J = 6.99 Hz, 2H), 5.73 (s, 2H). MS (ESI +) m / z 521 (M + H) + .
Пример 267Example 267
3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропаннитрил3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propannitrile
Пример 267AExample 267A
3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пропаннитрил3- (4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazol-1-yl) propannitrile
К раствору 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (5,00 г, 25,8 ммоль) в ацетонитриле (50 мл) добавляли акрилонитрил (3,4 мл, 52 ммоль) с последующим добавлением 1,8-диазабицикло[5.4.0]ундец-7-ена (1,94 мл, 12,9 ммоль). Примерно через 2 часа реакционную смесь концентрировали при пониженном давлении. Неочищенное вещество затем растворяли в минимальном количестве дихлорметана и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 10-50% этилацетата в гептане, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,03 (с, 1H), 7,64 (с, 1H), 4,40 (т, J=6,4 Гц, 2H), 3,06 (т, J=6,4 Гц, 2H), 1,26 (с, 12H). MS (ESI+) m/z 247,3 (M+H)+.To a solution of 4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole (5.00 g, 25.8 mmol) in acetonitrile (50 ml) was added acrylonitrile (3.4 ml, 52 mmol) followed by 1.8-diazabicyclo [5.4.0] undec-7-ene (1.94 ml, 12.9 mmol). After about 2 hours, the reaction mixture was concentrated under reduced pressure. The crude material was then dissolved in a minimal amount of dichloromethane and purified by silica gel chromatography using a gradient of 10-50% ethyl acetate in heptane to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.03 (s, 1H), 7.64 (s, 1H), 4.40 (t, J = 6.4 Hz, 2H), 3.06 (t, J = 6.4 Hz, 2H), 1.26 (s, 12H). MS (ESI +) m / z 247.3 (M + H) + .
Пример 267BExample 267B
3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропаннитрил3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propannitrile
В микроволновой сосуд добавляли 5-бром-1H-индазол-3-амин (0,14 г, 0,66 ммоль), тетракис(трифенилфосфин)палладий(0) (0,076 г, 0,066 ммоль) и карбонат натрия (0,147 г, 1,39 ммоль) с последующим добавлением раствора соединения Примера 267A (0,212 г, 0,858 ммоль) в 1,2-диметоксиэтане (2,50 мл) и затем воды (1,25 мл). Смесь нагревали в микроволновом устройстве CEM при около 150°C в течение около 20 минут (максимальное давление 275 ф/кв.дюйм (19 кг/см2), время повышения температуры до заданного уровня около 2 минут, максимальная мощность 200 ватт) и затем смесь концентрировали при пониженном давлении. Добавляли метанол (20 мл) и полученную смесь перемешивали около 1 часа. Нерастворимое вещество удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении на силикагеле и очищали при помощи хроматографии на силикагеле, используя для элюирования ступенчатый градиент дихлорметан/метанол/гидроксид аммония (990:9:1→985:13,5:1,5→980:18:2), с получением твердого вещества. Это твердое вещество растворяли в минимальном количестве горячего ацетонитрила (~2 мл), фильтровали для удаления минорных количеств нерастворимых веществ, промывая при этом метанолом (<0,5 мл), и оставляли для осаждения при температуре окружающей среды. Полученное твердое вещество, которое образовалось в течение ночи, собирали фильтрованием, промывая при этом дополнительным количеством ацетонитрила, и сушили в вакуумной печи при около 60°C в течение около 2 часов с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,35 (с, 1H), 8,10 (с, 1H), 7,86 (с, 1H), 7,84 (с, 1H), 7,44 (дд, J=8,54, 1,26 Гц, 1H), 7,23 (д, J=8,62 Гц, 1H), 5,32 (с, 2H), 4,42 (т, J=6,36 Гц, 2H), 3,10 (т, J=6,43 Гц, 2H). MS (ESI+) m/z 253,2 (M+H)+.5-Bromo-1H-indazole-3-amine (0.14 g, 0.66 mmol), tetrakis (triphenylphosphine) palladium (0) (0.076 g, 0.066 mmol) and sodium carbonate (0.147 g, 1) were added to the microwave vessel , 39 mmol) followed by the addition of a solution of the compound of Example 267A (0.212 g, 0.858 mmol) in 1,2-dimethoxyethane (2.50 ml) and then water (1.25 ml). The mixture was heated in a CEM microwave device at about 150 ° C for about 20 minutes (maximum pressure 275 psi (19 kg / cm 2 ), time to rise to a predetermined level of about 2 minutes, maximum power 200 watts) and then the mixture was concentrated under reduced pressure. Methanol (20 ml) was added and the resulting mixture was stirred for about 1 hour. Insoluble matter was removed by filtration. The filtrate was concentrated under reduced pressure on silica gel and purified by chromatography on silica gel using a step gradient of dichloromethane / methanol / ammonium hydroxide (990: 9: 1 → 985: 13.5: 1.5 → 980: 18: 2), to obtain a solid. This solid was dissolved in a minimum amount of hot acetonitrile (~ 2 ml), filtered to remove minor amounts of insoluble matter, washing with methanol (<0.5 ml), and allowed to precipitate at ambient temperature. The resulting solid that formed overnight was collected by filtration, washing with additional acetonitrile, and dried in a vacuum oven at about 60 ° C for about 2 hours to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.35 (s, 1H), 8.10 (s, 1H), 7.86 (s, 1H), 7.84 (s, 1H), 7.44 (dd, J = 8.54, 1, 26 Hz, 1H), 7.23 (d, J = 8.62 Hz, 1H), 5.32 (s, 2H), 4.42 (t, J = 6.36 Hz, 2H), 3.10 (t, J = 6.43 Hz, 2H). MS (ESI +) m / z 253.2 (M + H) + .
Пример 268Example 268
2-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]ацетамид2- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] acetamide
Пример 268AExample 268A
2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)ацетамид2- (4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazol-1-yl) acetamide
Суспензию 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (2,00 г, 10,3 ммоль), 2-бромацетамида (2,14 г, 15,5 ммоль) и карбоната калия (2,14 г, 15,5 ммоль) в ацетоне (60 мл) нагревали при около 50°C в течение около 3,5 дней. Реакционную смесь затем охлаждали до температуры окружающей среды, фильтровали через диатомовую землю, промывая при этом дополнительным количеством ацетона, и затем концентрировали при пониженном давлении. Неочищенное вещество затем растворяли в минимальном количестве дихлорметана и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 80-100% этилацетата в гептане, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,88 (с, 1H), 7,57 (с, 1H), 7,46 (с, 1H), 7,24 (с, 1H), 4,77 (с, 2H), 1,26 (с, 12H). MS (ESI+) m/z 252,2 (M+H)+.Suspension of 4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole (2.00 g, 10.3 mmol), 2-bromoacetamide (2.14 g , 15.5 mmol) and potassium carbonate (2.14 g, 15.5 mmol) in acetone (60 ml) were heated at about 50 ° C for about 3.5 days. The reaction mixture was then cooled to ambient temperature, filtered through diatomaceous earth, washing with additional acetone, and then concentrated under reduced pressure. The crude material was then dissolved in a minimal amount of dichloromethane and purified by chromatography on silica gel using a gradient of 80-100% ethyl acetate in heptane to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 7.88 (s, 1H), 7.57 (s, 1H), 7.46 (s, 1H), 7.24 (s, 1H), 4.77 (s, 2H), 1.26 (s , 12H). MS (ESI +) m / z 252.2 (M + H) + .
Пример 268BExample 268B
2-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]ацетамид2- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] acetamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 267B, с использованием соединения Примера 268A вместо соединения Примера 267A и с использованием нагревания при около 120°C в течение около 10 минут. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,32 (с, 1H), 7,98 (с, 1H), 7,87 (с, 1H), 7,77 (с, 1H), 7,48 (с, 1H), 7,45 (д, J=8,6 Гц, 1H), 7,26 (с, 1H), 7,22 (д, J=8,7 Гц, 1H), 5,28 (с, 2H), 4,78 (с, 2H). MS (ESI+) m/z 257,2 (M+H)+.The title compound was prepared according to the procedure described in Example 267B using the compound of Example 268A instead of the compound of Example 267A and using heating at about 120 ° C. for about 10 minutes. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.32 (s, 1H), 7.98 (s, 1H), 7.87 (s, 1H), 7.77 (s, 1H), 7.48 (s, 1H), 7.45 (d , J = 8.6 Hz, 1H), 7.26 (s, 1H), 7.22 (d, J = 8.7 Hz, 1H), 5.28 (s, 2H), 4.78 (s , 2H). MS (ESI +) m / z 257.2 (M + H) + .
Пример 269Example 269
метил 3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил}пропаноатmethyl 3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl} propanoate
Пример 269AExample 269A
метил 3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пропаноатmethyl 3- (4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazol-1-yl) propanoate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 267A, с использованием метилакрилата вместо акрилонитрила. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,91 (с, 1H), 7,57 (с, 1H), 4,35 (т, J=6,73 Гц, 2H), 2,87 (т, J=6,75 Гц, 2H), 3,59 (с, 3H), 1,24 (с, 12H). MS (ESI+) m/z 281,2 (M+H)+.The title compound was prepared according to the procedure described in Example 267A using methyl acrylate instead of acrylonitrile. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 7.91 (s, 1H), 7.57 (s, 1H), 4.35 (t, J = 6.73 Hz, 2H), 2.87 (t, J = 6.75 Hz, 2H), 3.59 (s, 3H); 1.24 (s, 12H). MS (ESI +) m / z 281.2 (M + H) + .
Пример 269BExample 269B
метил 3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропаноатmethyl 3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propanoate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 267B, с использованием соединения Примера 269A вместо соединения Примера 267A и с использованием нагревания при около 120°C в течение около 20 минут. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,32 (с, 1H), 8,00 (с, 1H), 7,85 (с, 1H), 7,76 (с, 1H), 7,42 (д, J=8,50 Гц, 1H), 7,21 (д, J=8,61 Гц, 1H), 5,28 (с, 2H), 4,37 (т, J=6,71 Гц, 2H), 3,61 (с, 3H), 2,92 (т, J=6,69 Гц, 2H). MS (ESI+) m/z 286,2 (M+H)+.The title compound was prepared according to the procedure described in Example 267B using the compound of Example 269A instead of the compound of Example 267A and using heating at about 120 ° C. for about 20 minutes. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.32 (s, 1H), 8.00 (s, 1H), 7.85 (s, 1H), 7.76 (s, 1H), 7.42 (d, J = 8.50 Hz, 1H ), 7.21 (d, J = 8.61 Hz, 1H), 5.28 (s, 2H), 4.37 (t, J = 6.71 Hz, 2H), 3.61 (s, 3H ), 2.92 (t, J = 6.69 Hz, 2H). MS (ESI +) m / z 286.2 (M + H) + .
Пример 270Example 270
3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропанамид3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propanamide
Пример 270AExample 270A
3-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пропанамид3- (4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazol-1-yl) propanamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 267A, с использованием акриламида вместо акрилонитрила (0,72 г, 53%). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,84 (с, 1H), 7,56 (с, 1H), 7,37 (с, 1H), 6,88 (с, 1H), 4,30 (т, J=6,80 Гц, 2H), 2,60 (т, J=6,79 Гц, 2H), 1,24 (с, 12H). MS (ESI+) m/z 266,2 (M+H)+.The title compound was prepared according to the procedure described in Example 267A using acrylamide instead of acrylonitrile (0.72 g, 53%). 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 7.84 (s, 1H), 7.56 (s, 1H), 7.37 (s, 1H), 6.88 (s, 1H), 4.30 (t, J = 6.80 Hz, 2H ), 2.60 (t, J = 6.79 Hz, 2H), 1.24 (s, 12H). MS (ESI +) m / z 266.2 (M + H) + .
Пример 270BExample 270B
3-[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил]пропанамид3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propanamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 267B, с использованием соединения Примера 270A вместо соединения Примера 267A и с использованием нагревания при около 120°C в течение около 15 минут (0,056 г, 22%). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,32 (с, 1H), 7,94 (д, J=0,53 Гц, 1H), 7,84 (с, 1H), 7,75 (д, J=0,54 Гц, 1H), 7,42 (м, 2H), 7,20 (д, J=8,26 Гц, 1H), 6,89 (с, 1H), 5,27 (с, 2H), 4,32 (т, J=6,89 Гц, 2H), 2,65 (т, J=6,89 Гц, 2H). MS (ESI+) m/z 271,0 (M+H)+.The title compound was prepared according to the procedure described in Example 267B using the compound of Example 270A instead of the compound of Example 267A and using heating at about 120 ° C. for about 15 minutes (0.056 g, 22%). 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.32 (s, 1H), 7.94 (d, J = 0.53 Hz, 1H), 7.84 (s, 1H), 7.75 (d, J = 0.54 Hz, 1H), 7.42 (m, 2H), 7.20 (d, J = 8.26 Hz, 1H), 6.89 (s, 1H), 5.27 (s, 2H), 4.32 (t, J = 6.89 Hz, 2H); 2.65 (t, J = 6.89 Hz, 2H). MS (ESI +) m / z 271.0 (M + H) + .
Пример 271Example 271
[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил}ацетонитрил[4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl} acetonitrile
Пример 271AExample 271A
2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)ацетонитрил2- (4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazol-1-yl) acetonitrile
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 268A, с использованием 2-бромацетонитрила вместо 2-бромацетамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,99 (с, 1H), 7,66 (с, 1H), 5,45 (с, 2H), 1,25 (с, 12H).The title compound was prepared according to the procedure described in Example 268A using 2-bromoacetonitrile instead of 2-bromoacetamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 7.99 (s, 1H); 7.66 (s, 1H); 5.45 (s, 2H); 1.25 (s, 12H).
Пример 271BExample 271B
трет-бутил 3-(бис(трет-бутоксикарбонил)амино)-5-бром-1H-индазол-1-карбоксилатtert-butyl 3- (bis (tert-butoxycarbonyl) amino) -5-bromo-1H-indazole-1-carboxylate
К 5-бром-1H-индазол-3-амину (2,00 г, 9,43 ммоль) в тетрагидрофуране (20 мл) добавляли 4-(диметиламино)пиридин (0,230 г, 1,886 ммоль) и ди-трет-бутилдикарбонат (6,18 г, 28,3 ммоль). Реакционную смесь нагревали при 50°C в течение около 2 часов, охлаждали до температуры окружающей среды и концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире (100 мл) и затем промывали последовательно 1 н раствором хлористоводородной кислоты (2×25 мл), 1 н раствором гидроксида натрия (2×25 мл) и насыщенным солевым раствором (25 мл). Органический слой затем сушили над сульфатом натрия, фильтровали, концентрировали при пониженном давлении и сушили в вакуумной печи при около 60°C с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) 8,05 (д, J=8,95 Гц, 1H), 7,99 (д, J=1,90 Гц, 1H), 7,81 (дд, J=8,94, 1,89 Гц, 1H), 1,65 (с, 9H), 1,40 (с, 18H). MS (ESI+) m/z 512,2 (M+H)+.To 5-bromo-1H-indazole-3-amine (2.00 g, 9.43 mmol) in tetrahydrofuran (20 ml) was added 4- (dimethylamino) pyridine (0.230 g, 1.886 mmol) and di-tert-butyl dicarbonate ( 6.18 g, 28.3 mmol). The reaction mixture was heated at 50 ° C for about 2 hours, cooled to ambient temperature and concentrated under reduced pressure. The residue was dissolved in diethyl ether (100 ml) and then washed sequentially with 1 N hydrochloric acid solution (2 × 25 ml), 1 N sodium hydroxide solution (2 × 25 ml) and brine (25 ml). The organic layer was then dried over sodium sulfate, filtered, concentrated under reduced pressure, and dried in a vacuum oven at about 60 ° C. to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) 8.05 (d, J = 8.95 Hz, 1H), 7.99 (d, J = 1.90 Hz, 1H), 7.81 (dd, J = 8.94, 1.89 Hz, 1H), 1.65 (s, 9H), 1.40 (s, 18H). MS (ESI +) m / z 512.2 (M + H) + .
Пример 271CExample 271C
трет-бутил 3-(бис(трет-бутоксикарбонил)амино)-5-(1-(цианометил)-1H-пиразол-4-ил)-1H-индазол-1-карбоксилатtert-butyl 3- (bis (tert-butoxycarbonyl) amino) -5- (1- (cyanomethyl) -1H-pyrazol-4-yl) -1H-indazole-1-carboxylate
В сосуд загружали соединение Примера 271A (0,682 г, 2,93 ммоль), соединение Примера 271B (1,25 г, 2,44 ммоль), карбонат цезия (1,99 г, 6,10 ммоль), 1,4-диоксан (12,5 мл) и воду (2,50 мл). После цикла вакуум/продувка азотом через мембранную перегородку, добавляли трис(дибензилиденацетон)дипалладий(0) (0,112 г, 0,122 ммоль) и тетрафторборат три-трет-бутилфосфония (0,085 г, 0,29 ммоль) и сосуд закрывали крышкой после продувки азотом. Примерно через 6 часов при температуре окружающей среды реакционную смесь распределяли между насыщенным водным раствором бикарбоната натрия и дихлорметаном (каждый по 50 мл). Слои разделяли и водный слой экстрагировали дополнительным количеством дихлорметана (2×50 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенное масло растворяли в минимальном количестве дихлорметана и очищали при помощи хроматографии на силикагеле, используя для элюирования градиент 20-60% этилацетата в гептане, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,43 (с, 1H), 8,19 (с, 1H), 8,08 (д, J=9,22 Гц, 1H), 7,93 (м, 2H), 5,53 (с, 2H), 1,67 (с, 9H), 1,39 (с, 18H). MS (ESI+) m/z 539,3 (M+H)+.The compound of Example 271A (0.682 g, 2.93 mmol), the compound of Example 271B (1.25 g, 2.44 mmol), cesium carbonate (1.99 g, 6.10 mmol), 1,4-dioxane were loaded into the vessel (12.5 ml) and water (2.50 ml). After a vacuum / nitrogen purge cycle through the membrane, Tris (dibenzylideneacetone) dipalladium (0) (0.112 g, 0.122 mmol) and tri-tert-butylphosphonium tetrafluoroborate (0.085 g, 0.29 mmol) were added and the lid was closed after purging with nitrogen. After about 6 hours at ambient temperature, the reaction mixture was partitioned between saturated aqueous sodium bicarbonate and dichloromethane (each 50 ml). The layers were separated and the aqueous layer was extracted with additional dichloromethane (2 × 50 ml). The combined organic layers were washed with brine, dried over magnesium sulfate, filtered and concentrated under reduced pressure. The crude oil was dissolved in a minimal amount of dichloromethane and purified by silica gel chromatography using a gradient of 20-60% ethyl acetate in heptane to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.43 (s, 1H), 8.19 (s, 1H), 8.08 (d, J = 9.22 Hz, 1H), 7.93 (m, 2H), 5.53 (s, 2H ), 1.67 (s, 9H), 1.39 (s, 18H). MS (ESI +) m / z 539.3 (M + H) + .
Пример 271DExample 271D
[4-(3-амино-1H-индазол-5-ил)-1H-пиразол-1-ил}ацетонитрил[4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl} acetonitrile
К раствору трет-бутил 3-(бис(трет-бутоксикарбонил)амино)-5-(1-(цианометил)-1H-пиразол-4-ил)-1H-индазол-1-карбоксилата (0,30 г, 0,557 ммоль) в дихлорметане (4,0 мл) добавляли трифторуксусную кислоту (2,0 мл). Примерно через 45 минут реакционную смесь медленно гасили насыщенным водным раствором бикарбоната натрия. Полученную смесь экстрагировали дихлорметаном (3×25 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением неочищенного твердого вещества. Белый осадок, который был суспендирован как в исходном водном слое, так и в слое насыщенного солевого раствора, фильтровали и добавляли к неочищенному твердому веществу. Полученное твердое вещество растирали в порошок с дихлорметаном/метанолом (19:1). Оставшееся твердое вещество собирали фильтрованием под вакуумом и сушили в вакуумной печи при около 70°C с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,37 (с, 1H), 8,12 (с, 1H), 7,92 (с, 1H), 7,89 (с, 1H), 7,49-7,41 (м, 1H), 7,24 (д, J=8,71 Гц, 1H), 5,52 (с, 2H), 5,31 (с, 2H). MS (ESI+) m/z 239,1 (M+H)+.To a solution of tert-butyl 3- (bis (tert-butoxycarbonyl) amino) -5- (1- (cyanomethyl) -1H-pyrazol-4-yl) -1H-indazole-1-carboxylate (0.30 g, 0.557 mmol ) trichloroacetic acid (2.0 ml) was added in dichloromethane (4.0 ml). After about 45 minutes, the reaction mixture was slowly quenched with saturated aqueous sodium bicarbonate. The resulting mixture was extracted with dichloromethane (3 × 25 ml). The combined organic layers were washed with brine, dried over magnesium sulfate, filtered and concentrated under reduced pressure to give a crude solid. A white precipitate, which was suspended both in the starting aqueous layer and in the saturated brine layer, was filtered and added to the crude solid. The resulting solid was triturated with dichloromethane / methanol (19: 1). The remaining solid was collected by suction filtration and dried in a vacuum oven at about 70 ° C. to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.37 (s, 1H), 8.12 (s, 1H), 7.92 (s, 1H), 7.89 (s, 1H), 7.49-7.41 (m, 1H), 7 24 (d, J = 8.71 Hz, 1H), 5.52 (s, 2H), 5.31 (s, 2H). MS (ESI +) m / z 239.1 (M + H) + .
Пример 272Example 272
4-(3-амино-1H-индазол-5-ил)-N,N-диметил-1H-имидазол-1-сульфонамид4- (3-amino-1H-indazol-5-yl) -N, N-dimethyl-1H-imidazole-1-sulfonamide
3-Циано-4-фторфенилбороновую кислоту (0,083 г, 0,503 ммоль), 4-иод-N,N-диметил-1H-имидазол-1-сульфонамид (0,167 г, 0,554 ммоль), карбонат натрия (0,128 г, 1,208 ммоль) и тетракис(трифенилфосфин)палладий(0) (0,035 г, 0,030 ммоль) объединяли в диметоксиэтане (4 мл) и воде (1,5 мл). Реакционную смесь нагревали в микроволновом устройстве (CEM-Discover) при около 150°C в течение около 25 минут. Органический слой отделяли и растворитель удаляли при пониженном давлении. К остатку добавляли этанол (0,7 мл) и гидразинмоногидрат (1 мл). Реакционную смесь нагревали при около 80°C в течение около 20 часов. Реакционную смесь распределяли между водой (5 мл) и дихлорметаном (100 мл). Органический слой отделяли и концентрировали при пониженном давлении. Остаток очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,42 (с, 1H), 8,25 (с, 1H), 8,21 (д, J=1,36 Гц, 1H), 7,92 (д, J=1,37 Гц, 1H), 7,74 (дд, J=8,66, 1,58 Гц, 1H), 7,23 (д, J=8,68 Гц, 1H), 5,35 (с, 2H), 2,87 (с, 6H). MS (ESI+) m/z 307,2 (M+H)+.3-Cyano-4-fluorophenylboronic acid (0.083 g, 0.503 mmol), 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide (0.167 g, 0.554 mmol), sodium carbonate (0.128 g, 1.208 mmol) and tetrakis (triphenylphosphine) palladium (0) (0.035 g, 0.030 mmol) were combined in dimethoxyethane (4 ml) and water (1.5 ml). The reaction mixture was heated in a microwave device (CEM-Discover) at about 150 ° C for about 25 minutes. The organic layer was separated and the solvent was removed under reduced pressure. Ethanol (0.7 ml) and hydrazine monohydrate (1 ml) were added to the residue. The reaction mixture was heated at about 80 ° C for about 20 hours. The reaction mixture was partitioned between water (5 ml) and dichloromethane (100 ml). The organic layer was separated and concentrated under reduced pressure. The residue was purified by reverse phase HPLC using an acetonitrile / water gradient gradient elution method (0.05 M ammonium acetate) to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.42 (s, 1H), 8.25 (s, 1H), 8.21 (d, J = 1.36 Hz, 1H), 7.92 (d, J = 1.37 Hz, 1H), 7.74 (dd, J = 8.66, 1.58 Hz, 1H), 7.23 (d, J = 8.68 Hz, 1H), 5.35 (s, 2H), 2.87 (s , 6H). MS (ESI +) m / z 307.2 (M + H) + .
Пример 273Example 273
5-пиразин-2-ил-1H-индазол-3-амин5-pyrazin-2-yl-1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 2-иодпиразина вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,61 (с, 1H), 9,18 (д, 1H, J=1,6), 8,66 (дд, 1H, J=1,7, 2,4), 8,59 (д, 1H, J=1,0), 8,51 (д, 1H, J=2,5), 8,04 (дд, 1H, J=1,8, 8,8), 7,35 (д, 1H, J=9,2), 5,54 (с, 2H). MS (ESI+) m/z 212,2 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 2-iodopyrazine instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.61 (s, 1H), 9.18 (d, 1H, J = 1.6), 8.66 (dd, 1H, J = 1.7, 2.4), 8.59 (d, 1H , J = 1.0), 8.51 (d, 1H, J = 2.5), 8.04 (dd, 1H, J = 1.8, 8.8), 7.35 (d, 1H, J = 9.2), 5.54 (s, 2H). MS (ESI +) m / z 212.2 (M + H) + .
Пример 274Example 274
5-тиен-2-ил-1H-индазол-3-амин5-thien-2-yl-1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 2-иодтиофена вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,47 (с, 1H), 7,99 (д, 1H, J=1,4), 7,55 (дд, 1H, J=1,8, 8,8), 7,43 (дд, 1H, J=1,0, 5,1), 7,35 (дд, 1H, J=1,1, 3,6), 7,26 (д, 1H, J=8,6), 7,10 (дд, 1H, J=3,5, 5,1), 5,42 (д, 2H, J=8,8). MS (ESI+) m/z 216,1 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 2-iodothiophene instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.47 (s, 1H), 7.99 (d, 1H, J = 1.4), 7.55 (dd, 1H, J = 1.8, 8.8), 7.43 (dd, 1H , J = 1.0, 5.1), 7.35 (dd, 1H, J = 1.1, 3.6), 7.26 (d, 1H, J = 8.6), 7.10 ( dd, 1H, J = 3.5, 5.1), 5.42 (d, 2H, J = 8.8). MS (ESI +) m / z 216.1 (M + H) + .
Пример 275Example 275
5-(2-аминопиримидин-4-ил)-1H-индазол-3-амин5- (2-aminopyrimidin-4-yl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 5-иодпиримидин-2-амина вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,40 (с, 1H), 8,53 (с, 2H), 7,91 (дд, 1H, J=0,7, 1,5), 7,47 (дд, 1H, J=1,8, 8,6), 7,28 (дд, 1H, J=0,7, 8,7), 6,64 (с, 2H), 5,36 (с, 2H), 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,41 (с, 1H), 8,53 (с, 2H), 7,92 (м, 1H), 7,47 (дд, J=8,66, 1,74 Гц, 1H), 7,28 (дд, J=8,63, 0,65 Гц, 1H), 6,64 (с, 2H), 5,36 (с, 2H). MS (ESI+) m/z 227,2 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 5-iodopyrimidin-2-amine instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.40 (s, 1H), 8.53 (s, 2H), 7.91 (dd, 1H, J = 0.7, 1.5), 7.47 (dd, 1H, J = 1.8 , 8.6), 7.28 (dd, 1H, J = 0.7, 8.7), 6.64 (s, 2H), 5.36 (s, 2H), 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.41 (s, 1H), 8.53 (s, 2H), 7.92 (m, 1H), 7.47 (dd, J = 8.66, 1.74 Hz, 1H), 7.28 (dd, J = 8.63, 0.65 Hz, 1H), 6.64 (s, 2H), 5.36 (s, 2H). MS (ESI +) m / z 227.2 (M + H) + .
Пример 276Example 276
5-(2-метоксипиридин-3-ил)-1H-индазол-3-амин5- (2-methoxypyridin-3-yl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 3-иод-2-метоксипиридина вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,43 (с, 1H), 8,14 (дд, 1H, J=1,9, 5,0), 7,86 (с, 1H), 7,71 (дд, 1H, J=2,0, 7,2), 7,42 (дд, 1H, J=1,7, 8,7), 7,26 (д, 1H, J=8,6), 7,09 (дд, 1H, J=5,0, 7,3), 5,38 (с, 2H), 3,89 (с, 3H). MS (ESI+) m/z 241,2 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 3-iodo-2-methoxypyridine instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.43 (s, 1H), 8.14 (dd, 1H, J = 1.9, 5.0), 7.86 (s, 1H), 7.71 (dd, 1H, J = 2.0 , 7.2), 7.42 (dd, 1H, J = 1.7, 8.7), 7.26 (d, 1H, J = 8.6), 7.09 (dd, 1H, J = 5.0, 7.3), 5.38 (s, 2H), 3.89 (s, 3H). MS (ESI +) m / z 241.2 (M + H) + .
Пример 277Example 277
5-имидазо[1,2-a]пиридин-3-ил-1H-индазол-3-амин5-imidazo [1,2-a] pyridin-3-yl-1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 3-бромимидазо[1,2-a]пиридина вместо 4-иод-N,N-диметил-1H-имидазол 1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,52 (дт, 1H, J=1,2, 7,0), 7,99 (дд, 1H, J=0,7, 1,7), 7,68 (с, 1H), 7,65 (дт, 2H, J=1,2, 9,0), 7,46 (дд, 1H, J=1,8, 8,6), 7,39 (дд, 1H, J=0,8, 8,6), 7,28 (ддд, 1H, J=1,2, 6,6, 9,2), 6,96 (тд, 1H, J=1,3, 6,7), 5,47 (с, 2H). MS (ESI+) m/z 250,2 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 3-bromimidazo [1,2-a] pyridine instead of 4-iodo-N, N-dimethyl-1H-imidazole 1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.52 (dt, 1H, J = 1.2, 7.0), 7.99 (dd, 1H, J = 0.7, 1.7), 7.68 (s, 1H), 7.65 (dt, 2H, J = 1.2, 9.0), 7.46 (dd, 1H, J = 1.8, 8.6), 7.39 (dd, 1H, J = 0.8, 8 6), 7.28 (ddd, 1H, J = 1.2, 6.6, 9.2), 6.96 (td, 1H, J = 1.3, 6.7), 5.47 ( s, 2H). MS (ESI +) m / z 250.2 (M + H) + .
Пример 278Example 278
N2,N2-диметил-N1-[5-(1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]глицинамидN 2 , N 2 -dimethyl-N 1 - [5- (1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] glycinamide
Соединение Примера 65 (257 мг, 0,685 ммоль) растворяли в этаноле (15 мл). Реакционную смесь гидрировали в аппарате H-Cube с использованием гидроксида палладия (20%) на углероде при температуре около 80°C и давлении около 60 ф/кв.дюйм (4,29 кг/см2) в течение около 8 часов. Растворитель удаляли при пониженном давлении и остаток очищали при помощи обращенно-фазовой ВЭЖХ, с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,16-8,37 (м, 1H), 7,10-7,46 (ушир.с, 2H), 7,00-7,34 (ушир.с, 2H), 6,87-7,24 (ушир.с, 2H), 3,33-3,34 (м, 2H). MS (ESI+) m/z 286,2 (M+H)+.The compound of Example 65 (257 mg, 0.685 mmol) was dissolved in ethanol (15 ml). The reaction mixture was hydrogenated in an H-Cube apparatus using palladium hydroxide (20%) on carbon at a temperature of about 80 ° C and a pressure of about 60 psi (4.29 kg / cm 2 ) for about 8 hours. The solvent was removed under reduced pressure, and the residue was purified by reverse phase HPLC using a gradient elution method with acetonitrile / water (0.05 M ammonium acetate) to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.16-8.37 (m, 1H), 7.10-7.46 (br s, 2H), 7.00-7.34 (br s, 2H), 6.87-7.24 (broad s, 2H), 3.33-3.34 (m, 2H). MS (ESI +) m / z 286.2 (M + H) + .
Пример 279Example 279
5-(1H-пиразол-5-ил)-1H-индазол-3-амин5- (1H-pyrazol-5-yl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 5-иод-1H-пиразола вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,87-7,94 (м, 3H), 7,60-7,63 (м, 1H), 7,48 (дд, J=8,55, 1,62 Гц, 1H), 7,19-7,32 (м, 2H), 5,25-5,28 (м, 2H). MS (ESI+) m/z 200,1 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 5-iodo-1H-pyrazole instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 7.87-7.94 (m, 3H), 7.60-7.63 (m, 1H), 7.48 (dd, J = 8.55, 1.62 Hz, 1H), 7.19- 7.32 (m, 2H); 5.25-5.28 (m, 2H). MS (ESI +) m / z 200.1 (M + H) + .
Пример 280Example 280
5-(4-метил-1H-имидазол-5-ил)-1H-индазол-3-амин5- (4-methyl-1H-imidazol-5-yl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 5-иод-4-метил-1H-имидазола вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,85 (с, 1H), 7,52 (д, 2H, J=6,6), 7,22 (м, 1H), 5,3 2 (ушир.с, 2H), 2,37 (с, 3H). MS (ESI+) m/z 214,1 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 5-iodo-4-methyl-1H-imidazole instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 7.85 (s, 1H), 7.52 (d, 2H, J = 6.6), 7.22 (m, 1H), 5.3 2 (br s, 2H), 2.37 (s , 3H). MS (ESI +) m / z 214.1 (M + H) + .
Пример 281Example 281
5-(1H-имидазол-4-ил)-1H-индазол-3-амин5- (1H-imidazol-4-yl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 4-иод-1H-имидазола вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,07 (с, 1H), 7,66 (с, 1H), 7,63 (д, 1H, J=8,6), 7,37 (с, 1H), 7,20 (д, 1H, J=8,8), 5,28 (с, 2H). MS (ESI+) m/z 200,1 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 4-iodo-1H-imidazole instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.07 (s, 1H), 7.66 (s, 1H), 7.63 (d, 1H, J = 8.6), 7.37 (s, 1H), 7.20 (d, 1H, J = 8.8), 5.28 (s, 2H). MS (ESI +) m / z 200.1 (M + H) + .
Пример 282Example 282
N2,N2-диметил-N1-{5-[1-(3-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}глицинамидN 2 , N 2 -dimethyl-N 1 - {5- [1- (3-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} glycinamide
Пример 282AExample 282A
5-бром-1H-индазол-3-амин5-bromo-1H-indazole-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 62D, с использованием 5-бром-2-фторбензонитрила вместо соединения Примера 62C. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,55 (с, 1H), 7,92 (д, J=1,87 Гц, 1H), 7,30 (дд, J=8,79, 1,89 Гц, 1H), 7,19 (д, J=8,78 Гц, 1H), 5,41 (с, 2H).The title compound was prepared according to the procedure described in Example 62D using 5-bromo-2-fluorobenzonitrile instead of the compound of Example 62C. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.55 (s, 1H), 7.92 (d, J = 1.87 Hz, 1H), 7.30 (dd, J = 8.79, 1.89 Hz, 1H), 7.19 (d , J = 8.78 Hz, 1H), 5.41 (s, 2H).
Пример 282BExample 282B
трет-бутил 3-амино-5-бром-1H-индазол-1-карбоксилатtert-butyl 3-amino-5-bromo-1H-indazole-1-carboxylate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 64A, с использованием соединения Примера 282A вместо соединения Примера 62D. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,12 (д, J=1,93 Гц, 1H), 7,95-7,81 (м, 1H), 7,65 (дд, J=8,85, 1,96 Гц, 1H), 6,39 (д, J=4,44 Гц, 1H), 1,58 (м, 9H).The title compound was prepared according to the procedure described in Example 64A using the compound of Example 282A instead of the compound of Example 62D. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.12 (d, J = 1.93 Hz, 1H), 7.95-7.81 (m, 1H), 7.65 (dd, J = 8.85, 1.96 Hz, 1H), 6 39 (d, J = 4.44 Hz, 1H); 1.58 (m, 9H).
Пример 282CExample 282C
трет-бутил 5-бром-3-(2-(диметиламино)ацетамидо)-1H-индазол-1-карбоксилатtert-butyl 5-bromo-3- (2- (dimethylamino) acetamido) -1H-indazole-1-carboxylate
К смеси соединения Примера 282B (24,43 г, 78 ммоль), карбоната калия (81 г, 587 ммоль) и гидрохлорида 2-(диметиламино)ацетилхлорида (43,3 г, 274 ммоль) добавляли тетрагидрофуран (200 мл). Реакционную смесь перемешивали при комнатной температуре в течение около 2 часов. Реакционную смесь фильтровали и фильтрат промывали водой (50 мл). Органический слой отделяли и водный слой экстрагировали дихлорметаном (3×100 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали при помощи хроматографии на силикагеле, элюируя метанолом в дихлорметане (5%), с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,72 (с, 1H), 8,19 (д, 1H, J=1,6), 8,03 (д, 1H, J=9,0), 7,76 (дд, 1H, J=2,0, 9,0), 3,22 (с, 2H), 2,32 (с, 6H), 1,63 (с, 9H).Tetrahydrofuran (200 ml) was added to a mixture of the compound of Example 282B (24.43 g, 78 mmol), potassium carbonate (81 g, 587 mmol) and 2- (dimethylamino) acetyl chloride hydrochloride (43.3 g, 274 mmol). The reaction mixture was stirred at room temperature for about 2 hours. The reaction mixture was filtered and the filtrate was washed with water (50 ml). The organic layer was separated and the aqueous layer was extracted with dichloromethane (3 × 100 ml). The combined organic extracts were dried over magnesium sulfate, filtered and concentrated under reduced pressure. The residue was purified by silica gel chromatography, eluting with methanol in dichloromethane (5%), to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.72 (s, 1H), 8.19 (d, 1H, J = 1.6), 8.03 (d, 1H, J = 9.0), 7.76 (dd, 1H, J = 2 , 0, 9.0), 3.22 (s, 2H), 2.32 (s, 6H), 1.63 (s, 9H).
Пример 282DExample 282D
трет-бутил 3-(2-(диметиламино)ацетамидо)-5-((триметилсилил)этинил)-1H-индазол-1-карбоксилатtert-butyl 3- (2- (dimethylamino) acetamido) -5 - ((trimethylsilyl) ethynyl) -1H-indazole-1-carboxylate
К смеси соединения Примера 282C (2,56 г, 6,44 ммоль), хлорида бис(трифенилфосфин)палладия(II) (0,225 г, 0,321 ммоль) и иодида меди(I) (0,073 г, 0,383 ммоль) добавляли триэтиламин (20 мл, 144 ммоль) с последующим добавлением этинилтриметилсилана (0,760 г, 7,73 ммоль). Реакционную смесь нагревали при около 60°C в течение около 3 часов. Реакционную смесь разбавляли дихлорметаном (100 мл), промывали водой (20 мл) и насыщенным солевым раствором (20 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали при помощи хроматографии на силикагеле, используя для элюирования этилацетат в дихлорметане (10%), с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,69 (с, 1H), 8,08 (с, 1H), 8,04 (д, 1H, J=9,0), 7,62 (д, 1H, J=8,8), 3,21 (с, 2H), 2,30 (с, 6H), 1,61 (с, 9H), 0,23 (с, 9H).To a mixture of the compound of Example 282C (2.56 g, 6.44 mmol), bis (triphenylphosphine) palladium (II) chloride (0.225 g, 0.321 mmol) and copper (I) iodide (0.073 g, 0.383 mmol) was added triethylamine (20 ml, 144 mmol) followed by ethinyltrimethylsilane (0.760 g, 7.73 mmol). The reaction mixture was heated at about 60 ° C for about 3 hours. The reaction mixture was diluted with dichloromethane (100 ml), washed with water (20 ml) and brine (20 ml), dried over magnesium sulfate, filtered and concentrated under reduced pressure. The residue was purified by silica gel chromatography using ethyl acetate in dichloromethane (10%) to elute to give the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.69 (s, 1H), 8.08 (s, 1H), 8.04 (d, 1H, J = 9.0), 7.62 (d, 1H, J = 8.8), 3, 21 (s, 2H), 2.30 (s, 6H), 1.61 (s, 9H), 0.23 (s, 9H).
Пример 282EExample 282E
2-(диметиламино)-N-(5-этинил-1H-индазол-3-ил)ацетамид2- (dimethylamino) -N- (5-ethynyl-1H-indazol-3-yl) acetamide
К соединению Примера 282D (0,303 г, 0,731 ммоль) в метаноле (5 мл) добавляли водный раствор гидроксида калия (1,46 мл, 1,46 ммоль, 1,0 н раствор). Реакционную смесь перемешивали при комнатной температуре в течение около 1 часа. Растворитель удаляли при пониженном давлении и остаток растворяли в этилацетате (80 мл). Органический слой отделяли и промывали водой (10 мл) и насыщенным солевым раствором (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,89 (с, 1H), 10,14 (с, 1H), 8,00 (д, 1H, J=12,1), 7,44 (с, 2H), 7,38 (д, 1H, J=8,6), 4,02 (с, 1H), 3,17 (с, 2H), 2,33 (с, 6H).To the compound of Example 282D (0.303 g, 0.731 mmol) in methanol (5 ml) was added an aqueous solution of potassium hydroxide (1.46 ml, 1.46 mmol, 1.0 N solution). The reaction mixture was stirred at room temperature for about 1 hour. The solvent was removed under reduced pressure and the residue was dissolved in ethyl acetate (80 ml). The organic layer was separated and washed with water (10 ml) and brine (10 ml), dried over magnesium sulfate, filtered and concentrated under reduced pressure to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.89 (s, 1H), 10.14 (s, 1H), 8.00 (d, 1H, J = 12.1), 7.44 (s, 2H), 7.38 (d, 1H, J = 8.6), 4.02 (s, 1H), 3.17 (s, 2H), 2.33 (s, 6H).
Пример 282FExample 282F
N2,N2-диметил-N1-{5-[1-(3-метилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}глицинамидN 2 , N 2 -dimethyl-N 1 - {5- [1- (3-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} glycinamide
К суспензии соединения Примера 282E (0,16 г, 0,660 ммоль) в трет-бутаноле (1,2 мл) добавляли 1-(азидометил)-3-метилбензол (0,098 г, 0,667 ммоль), затем воду (1,2 мл). Добавляли раствор (R)-2-((S)-1,2-дигидроксиэтил)-4-гидрокси-5-оксо-2,5-дигидрофуран-3-олата натрия (0,057 мл, 0,066 ммоль, 1,6 M в воде) и водный раствор сульфата меди (II) пентагидрата (0,019 мл, 6,6 мкмоль, 0,34M). Реакционную смесь нагревали при около 60°C в течение около 2 часов. Растворитель удаляли при пониженном давлении и остаток очищали при помощи обращенно-фазовой ВЭЖХ, с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,77 (с, 1H), 10,05 (с, 1H), 8,56 (с, 1H), 8,24 (с, 1H), 7,82 (д, 1H, J=8,6), 7,50 (д, 1H, J=8,8), 7,28 (т, 1H, J=7,6), 7,16 (м, 4H), 5,59 (с, 2H), 3,18 (с, 2H), 2,34 (с, 6H), 2,30 (с, 3H). MS (ESI+) m/z 390,3 (M+H)+.To a suspension of the compound of Example 282E (0.16 g, 0.660 mmol) in tert-butanol (1.2 ml) was added 1- (azidomethyl) -3-methylbenzene (0.098 g, 0.667 mmol), then water (1.2 ml) . A solution of (R) -2 - ((S) -1,2-dihydroxyethyl) -4-hydroxy-5-oxo-2,5-dihydrofuran-3-sodium olate (0.057 ml, 0.066 mmol, 1.6 M in water) and an aqueous solution of copper (II) sulfate pentahydrate (0.019 ml, 6.6 μmol, 0.34 M). The reaction mixture was heated at about 60 ° C for about 2 hours. The solvent was removed under reduced pressure, and the residue was purified by reverse phase HPLC using a gradient elution method with acetonitrile / water (0.05 M ammonium acetate) to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.77 (s, 1H), 10.05 (s, 1H), 8.56 (s, 1H), 8.24 (s, 1H), 7.82 (d, 1H, J = 8.6) 7.50 (d, 1H, J = 8.8), 7.28 (t, 1H, J = 7.6), 7.16 (m, 4H), 5.59 (s, 2H), 3 18 (s, 2H); 2.34 (s, 6H); 2.30 (s, 3H). MS (ESI +) m / z 390.3 (M + H) + .
Пример 283Example 283
5-(1-бензил-1H-имидазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-1H-imidazol-4-yl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 272, с использованием 1-бензил-4-иод-1H-имидазола вместо 4-иод-N,N-диметил-1H-имидазол-1-сульфонамида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,29 (с, 1H), 8,07 (с, 1H), 7,79 (с, 1H), 7,61 (д, 1H, J=8,6), 7,46 (с, 1H), 7,36 (м, 5H), 7,17 (д, 1H, J=8,8), 5,28 (с, 2H), 5,22 (с, 2H). MS (ESI+) m/z 290,2 (M+H)+.The title compound was prepared according to the procedure described in Example 272 using 1-benzyl-4-iodo-1H-imidazole instead of 4-iodo-N, N-dimethyl-1H-imidazole-1-sulfonamide. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.29 (s, 1H), 8.07 (s, 1H), 7.79 (s, 1H), 7.61 (d, 1H, J = 8.6), 7.46 (s, 1H) 7.36 (m, 5H), 7.17 (d, 1H, J = 8.8), 5.28 (s, 2H), 5.22 (s, 2H). MS (ESI +) m / z 290.2 (M + H) + .
Пример 284Example 284
N1-{5-[1-(4-трет-бутилбензил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}-N2,N2-диметилглицинамидN 1 - {5- [1- (4-tert-butylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} -N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием 1-(азидометил)-4-трет-бутилбензола вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,88 (с, 1H), 10,05 (с, 1H), 8,57 (с, 1H), 8,23 (с, 1H), 7,81 (д, 1H, J=8,8), 7,50 (д, 1H, J=8,8), 7,41 (д, 2H, J=8,2), 7,30 (д, 2H, J=8,2), 3,18 (с, 2H), 2,34 (с, 6H), 1,26 (с, 9H). MS (ESI+) m/z 432,2 (M+H)+.The title compound was prepared according to the procedure described in Example 282F using 1- (azidomethyl) -4-tert-butylbenzene instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.88 (s, 1H), 10.05 (s, 1H), 8.57 (s, 1H), 8.23 (s, 1H), 7.81 (d, 1H, J = 8.8) 7.50 (d, 1H, J = 8.8), 7.41 (d, 2H, J = 8.2), 7.30 (d, 2H, J = 8.2), 3.18 ( s, 2H), 2.34 (s, 6H), 1.26 (s, 9H). MS (ESI +) m / z 432.2 (M + H) + .
Пример 285Example 285
N2,N2-диметил-N1-{5-[1-(2-пиперидин-1-илэтил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}глицинамидN 2 , N 2 -dimethyl-N 1 - {5- [1- (2-piperidin-1-yl-ethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием 1-(2-азидоэтил)пиперидина вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,91 (с, 1H), 10,07 (с, 1H), 8,47 (с, 1H), 8,22 (с, 1H), 7,80 (дд, 1H, J=1,2, 8,7), 7,52 (д, 1H, J=8,8), 4,49 (т, 2H, J=6,4), 3,19 (с, 2H), 2,76 (т, 2H, J=6,4), 2,41 (с, 4H), 2,35 (с, 6H), 1,69 (с, 3H), 1,47 (м, 4H), 1,37 (дд, 2H, J=5,2, 10,2). MS (ESI-) m/z 395,3 (M-H)-.The title compound was prepared according to the procedure described in Example 282F using 1- (2-azidoethyl) piperidine instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.91 (s, 1H), 10.07 (s, 1H), 8.47 (s, 1H), 8.22 (s, 1H), 7.80 (dd, 1H, J = 1.2, 8.7), 7.52 (d, 1H, J = 8.8), 4.49 (t, 2H, J = 6.4), 3.19 (s, 2H), 2.76 (t, 2H, J = 6.4), 2.41 (s, 4H), 2.35 (s, 6H), 1.69 (s, 3H), 1.47 (m, 4H), 1.37 (dd , 2H, J = 5.2, 10.2). MS (ESI-) m / z 395.3 (MH) - .
Пример 286Example 286
N2,N2-диметил-N1-{5-[1-(2-морфолин-4-илэтил)-1H-1,2,3-триазол-4-ил]-1H-индазол-3-ил}глицинамидN 2 , N 2 -dimethyl-N 1 - {5- [1- (2-morpholin-4-yl-ethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-yl} glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием 4-(2-азидоэтил)морфолина вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,83 (с, 1H), 10,07 (с, 1H), 8,49 (с, 1H), 8,23 (с, 1H), 7,81 (дд, 1H, J=1,3, 8,7), 7,52 (д, 1H, J=8,8), 4,53 (т, 2H, J=6,3), 3,55 (м, 4H), 3,19 (с, 2H), 2,80 (т, 2H, J=6,3), 2,45 (м, 4H), 2,35 (с, 6H). MS (ESI-) m/z 397,3 (M-H)-.The title compound was prepared according to the procedure described in Example 282F using 4- (2-azidoethyl) morpholine instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.83 (s, 1H), 10.07 (s, 1H), 8.49 (s, 1H), 8.23 (s, 1H), 7.81 (dd, 1H, J = 1.3, 8.7), 7.52 (d, 1H, J = 8.8), 4.53 (t, 2H, J = 6.3), 3.55 (m, 4H), 3.19 (s, 2H), 2.80 (t, 2H, J = 6.3), 2.45 (m, 4H), 2.35 (s, 6H). MS (ESI-) m / z 397.3 (MH) - .
Пример 287Example 287
N1-(5-{1-[2-(3,5-диметилизоксазол-4-ил)этил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-ил)-N2,N2-диметилглицинамидN 1 - (5- {1- [2- (3,5-dimethylisoxazol-4-yl) ethyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-yl) - N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием 4-(2-азидоэтил)-3,5-диметилизоксазола вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,90 (с, 1H), 10,07 (с, 1H), 8,44 (с, 1H), 8,21 (с, 1H), 7,78 (дд, 1H, J=1,3, 8,7), 7,52 (д, 1H, J=8,8), 4,51 (т, 2H, J=6,7), 3,19 (с, 2H), 2,93 (т, 2H, J=6,7), 2,35 (с, 6H), 2,08 (д, 6H, J=4,3). MS (ESI-) m/z 407,2 (M-H)-.The title compound was prepared according to the procedure described in Example 282F using 4- (2-azidoethyl) -3,5-dimethylisoxazole instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.90 (s, 1H), 10.07 (s, 1H), 8.44 (s, 1H), 8.21 (s, 1H), 7.78 (dd, 1H, J = 1.3, 8.7), 7.52 (d, 1H, J = 8.8), 4.51 (t, 2H, J = 6.7), 3.19 (s, 2H), 2.93 (t, 2H, J = 6.7), 2.35 (s, 6H), 2.08 (d, 6H, J = 4.3). MS (ESI-) m / z 407.2 (MH) - .
Пример 288Example 288
N1-(5-{1-[2-(3,5-диметил-1H-пиразол-4-ил)этил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-ил)-N2,N2-диметилглицинамидN 1 - (5- {1- [2- (3,5-dimethyl-1H-pyrazol-4-yl) ethyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3 -yl) -N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием 4-(2-азидоэтил)-3,5-диметил-1H-пиразола вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,85 (с, 1H), 10,06 (с, 1H), 8,37 (с, 1H), 8,21 (с, 1H), 7,78 (д, 1H, J=8,8), 7,51 (д, 1H, J=8,8), 4,42 (т, 2H, J=6,9), 3,19 (с, 2H), 2,89 (т, 2H, J=7,0), 2,35 (с, 6H), 1,97 (с, 6H). MS (ESI-) m/z 406,2 (M-H)-.The title compound was prepared according to the procedure described in Example 282F using 4- (2-azidoethyl) -3,5-dimethyl-1H-pyrazole instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.85 (s, 1H), 10.06 (s, 1H), 8.37 (s, 1H), 8.21 (s, 1H), 7.78 (d, 1H, J = 8.8) 7.51 (d, 1H, J = 8.8), 4.42 (t, 2H, J = 6.9), 3.19 (s, 2H), 2.89 (t, 2H, J = 7.0), 2.35 (s, 6H), 1.97 (s, 6H). MS (ESI-) m / z 406.2 (MH) - .
Пример 289Example 289
2-(4-{3-[(N,N-диметилглицил)амино]-1H-индазол-5-ил}-1H-1,2,3-триазол-1-ил)-2-метилпропановая кислота2- (4- {3 - [(N, N-dimethylglycyl) amino] -1H-indazol-5-yl} -1H-1,2,3-triazol-1-yl) -2-methylpropanoic acid
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием 2-азидо-2-метилпропановой кислоты вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,77 (с, 1H), 10,03 (с, 1H), 8,47 (с, 1H), 8,22 (с, 1H), 7,85 (дд, 1H, J=0,9, 8,7), 7,49 (д, 1H, J=8,6), 3,21 (с, 2H), 2,36 (с, 6H), 1,77 (с, 6H). MS (ESI-) m/z 370,2 (M-H)-.The title compound was prepared according to the procedure described in Example 282F using 2-azido-2-methylpropanoic acid instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.77 (s, 1H), 10.03 (s, 1H), 8.47 (s, 1H), 8.22 (s, 1H), 7.85 (dd, 1H, J = 0.9, 8.7), 7.49 (d, 1H, J = 8.6), 3.21 (s, 2H), 2.36 (s, 6H), 1.77 (s, 6H). MS (ESI-) m / z 370.2 (MH) - .
Пример 290Example 290
этил (4-{3-[(N,N-диметилглицил)амино]-1H-индазол-5-ил}-1H-1,2,3-триазол-1-ил)ацетатethyl (4- {3 - [(N, N-dimethylglycyl) amino] -1H-indazol-5-yl} -1H-1,2,3-triazol-1-yl) acetate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием этил 2-азидоацетата вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,87 (с, 1H), 10,08 (с, 1H), 8,51 (с, 1H), 8,26 (с, 1H), 7,82 (дд, 1H, J=1,4, 8,7), 7,53 (д, 1H, J=8,8), 5,44 (с, 2H), 4,21 (кв., 2H, J=7,0), 3,19 (с, 2H), 2,35 (с, 6H), 1,24 (т, 3H, J=7,1). MS (ESI+) m/z 372,2 (M+H)+.The title compound was prepared according to the procedure described in Example 282F using ethyl 2-azidoacetate instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.87 (s, 1H), 10.08 (s, 1H), 8.51 (s, 1H), 8.26 (s, 1H), 7.82 (dd, 1H, J = 1.4, 8.7), 7.53 (d, 1H, J = 8.8), 5.44 (s, 2H), 4.21 (q, 2H, J = 7.0), 3.19 (s , 2H); 2.35 (s, 6H); 1.24 (t, 3H, J = 7.1). MS (ESI +) m / z 372.2 (M + H) + .
Пример 291Example 291
N2,N2-диметил-N1-(5-{1-[(триметилсилил)метил]-1H-1,2,3-триазол-4-ил}-1H-индазол-3-ил)глицинамидN 2 , N 2 -dimethyl-N 1 - (5- {1 - [(trimethylsilyl) methyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-yl) glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 282F, с использованием (азидометил)триметилсилана вместо 1-(азидометил)-3-метилбензола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 13,04 (с, 1H), 10,20 (с, 1H), 8,46 (с, 1H), 8,36 (с, 1H), 7,94 (дд, 1H, J=1,3, 8,7), 7,65 (д, 1H, J=8,8), 4,18 (с, 2H), 3,33 (с, 2H), 2,49 (с, 6H), 0,25 (м, 9H). MS (ESI+) m/z 372,2 (M+H)+.The title compound was prepared according to the procedure described in Example 282F using (azidomethyl) trimethylsilane instead of 1- (azidomethyl) -3-methylbenzene. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 13.04 (s, 1H), 10.20 (s, 1H), 8.46 (s, 1H), 8.36 (s, 1H), 7.94 (dd, 1H, J = 1.3, 8.7), 7.65 (d, 1H, J = 8.8), 4.18 (s, 2H), 3.33 (s, 2H), 2.49 (s, 6H), 0.25 (m, 9H). MS (ESI +) m / z 372.2 (M + H) + .
Пример 292Example 292
N1-[5-(3-фурил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 - [5- (3-furyl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием фуран-3-илбороновой кислоты вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,70 (с, 1H), 9,98 (с, 1H), 8,08 (с, 1H), 7,90 (с, 1H), 7,72 (т, 1H, J=1,6), 7,59 (дд, 1H, J=1,4, 8,7), 7,45 (д, 1H, J=8,8), 6,87 (с, 1H), 3,17 (с, 2H), 2,33 (с, 6H). MS (ESI+) m/z 285,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A, using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using furan-3-ylboronic acid instead of 1-benzyl-4- (4,4,5 , 5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole. 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.70 (s, 1H), 9.98 (s, 1H), 8.08 (s, 1H), 7.90 (s, 1H), 7.72 (t, 1H, J = 1.6) 7.59 (dd, 1H, J = 1.4, 8.7), 7.45 (d, 1H, J = 8.8), 6.87 (s, 1H), 3.17 (s, 2H), 2.33 (s, 6H). MS (ESI +) m / z 285.2 (M + H) + .
Пример 293Example 293
N2,N2-диметил-N1-[5-1H-пиразол-5-ил)-1H-индазол-3-ил]глицинамидN 2 , N 2 -dimethyl-N 1 - [5-1H-pyrazol-5-yl) -1H-indazol-3-yl] glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием 1H-пиразол-5-илбороновой кислоты вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,68 (с, 1H), 10,01 (с, 1H), 8,12 (с, 1H), 7,80 (д, 1H, J=9,0), 7,69 (с, 1H), 7,46 (д, 1H, J=8,6), 6,60 (д, 1H, J=2,0), 3,17 (д, 2H, J=6,4), 2,34 (с, 6H). MS (ESI+) m/z 285,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A, using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using 1H-pyrazol-5-ylboronic acid instead of 1-benzyl-4- (4.4 , 5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.68 (s, 1H), 10.01 (s, 1H), 8.12 (s, 1H), 7.80 (d, 1H, J = 9.0), 7.69 (s, 1H) 7.46 (d, 1H, J = 8.6), 6.60 (d, 1H, J = 2.0), 3.17 (d, 2H, J = 6.4), 2.34 ( s, 6H). MS (ESI +) m / z 285.2 (M + H) + .
Пример 294Example 294
N2,N2-диметил-N1-(5-пиримидин-5-ил-1H-индазол-3-ил)глицинамидN 2 , N 2 -dimethyl-N 1 - (5-pyrimidin-5-yl-1H-indazol-3-yl) glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием пиримидин-5-илбороновой кислоты вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,87 (с, 1H), 10,11 (с, 1H), 9,16 (с, 1H), 9,09 (с, 2H), 8,16 (с, 1H), 7,75 (дд, 1H, J=1,5, 8,8), 7,60 (д, 1H, J=8,8), 3,18 (с, 2H), 2,33 (с, 6H). MS (ESI+) m/z 297,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A, using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using pyrimidin-5-ylboronic acid instead of 1-benzyl-4- (4,4,5 , 5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole. 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.87 (s, 1H), 10.11 (s, 1H), 9.16 (s, 1H), 9.09 (s, 2H), 8.16 (s, 1H), 7.75 (dd , 1H, J = 1.5, 8.8), 7.60 (d, 1H, J = 8.8), 3.18 (s, 2H), 2.33 (s, 6H). MS (ESI +) m / z 297.2 (M + H) + .
Пример 295Example 295
N1-[5-(2,1,3-бензоксадиазол-5-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 - [5- (2,1,3-benzoxadiazol-5-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием бензо[c][1,2,5]оксадиазол-5-илбороновой кислоты вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,87 (с, 1H), 10,15 (с, 1H), 8,29 (с, 1H), 8,21 (с, 1H), 8,16 (д, 1H, J=9,4), 7,99 (дд, 1H, J=1,1, 9,4), 7,85 (м, 1H), 7,59 (д, 1H, J=8,8), 3,19 (с, 2H), 2,34 (с, 6H). MS (ESI+) m/z 337,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A, using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using benzo [c] [1,2,5] oxadiazol-5-ylboronic acid instead of 1 -benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole. 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.87 (s, 1H), 10.15 (s, 1H), 8.29 (s, 1H), 8.21 (s, 1H), 8.16 (d, 1H, J = 9.4) 7.99 (dd, 1H, J = 1.1, 9.4), 7.85 (m, 1H), 7.59 (d, 1H, J = 8.8), 3.19 (s, 2H), 2.34 (s, 6H). MS (ESI +) m / z 337.2 (M + H) + .
Пример 296Example 296
N2,N2-диметил-N1-[5-(1H-пиразол-4-ил)-1H-индазол-3-ил]глицинамидN 2 , N 2 -dimethyl-N 1 - [5- (1H-pyrazol-4-yl) -1H-indazol-3-yl] glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,62 (с, 1H), 9,94 (с, 1H), 7,95 (с, 2H), 7,87 (с, 1H), 7,58 (д, 1H, J=8,8), 7,42 (д, 1H, J=8,8), 3,16 (с, 2H), 2,34 (с, 6H). MS (ESI+) m/z 285,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A, using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using 4- (4,4,5,5-tetramethyl-1,3,2- dioxaborolan-2-yl) -1H-pyrazole instead of 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole. 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.62 (s, 1H), 9.94 (s, 1H), 7.95 (s, 2H), 7.87 (s, 1H), 7.58 (d, 1H, J = 8.8) 7.42 (d, 1H, J = 8.8); 3.16 (s, 2H); 2.34 (s, 6H). MS (ESI +) m / z 285.2 (M + H) + .
Пример 297Example 297
N2,N2-диметил-N1-[5-(1-метил-1H-пиразол-4-ил)-1H-индазол-3-ил]глицинамидN 2 , N 2 -dimethyl-N 1 - [5- (1-methyl-1H-pyrazol-4-yl) -1H-indazol-3-yl] glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,64 (с, 1H), 9,98 (с, 1H), 8,04 (с, 1H), 7,86 (с, 1H), 7,76 (с, 1H), 7,55 (дд, 1H, J=1,6, 8,6), 7,43 (д, 1H, J=8,8), 3,87 (с, 3H), 3,17 (с, 2H), 2,35 (с, 6H). MS (ESI+) m/z 299,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A, using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using 1-methyl-4- (4,4,5,5-tetramethyl-1, 3,2-dioxaborolan-2-yl) -1H-pyrazole instead of 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole. 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.64 (s, 1H), 9.98 (s, 1H), 8.04 (s, 1H), 7.86 (s, 1H), 7.76 (s, 1H), 7.55 (dd , 1H, J = 1.6, 8.6), 7.43 (d, 1H, J = 8.8), 3.87 (s, 3H), 3.17 (s, 2H), 2.35 (s, 6H). MS (ESI +) m / z 299.2 (M + H) + .
Пример 298Example 298
N1-[5-(3,5-диметил-1H-пиразол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 - [5- (3,5-dimethyl-1H-pyrazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием 3,5-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,63 (с, 1H), 10,02 (с, 1H), 7,63 (с, 1H), 7,46 (м, 1H), 7,27 (дд, 1H, J=1,6, 8,6), 3,16 (с, 2H), 2,32 (с, 6H), 2,18 (с, 6H). MS (ESI+) m/z 323,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A, using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using 3,5-dimethyl-4- (4,4,5,5-tetramethyl- 1,3,2-dioxaborolan-2-yl) -1H-pyrazole instead of 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole . 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.63 (s, 1H), 10.02 (s, 1H), 7.63 (s, 1H), 7.46 (m, 1H), 7.27 (dd, 1H, J = 1.6, 8.6), 3.16 (s, 2H), 2.32 (s, 6H), 2.18 (s, 6H). MS (ESI +) m / z 323.2 (M + H) + .
Пример 299Example 299
N1-{5-[2-(диметиламино)пиримидин-5-ил]-1H-индазол-3-ил}-N2,N2-диметилглицинамидN 1 - {5- [2- (dimethylamino) pyrimidin-5-yl] -1H-indazol-3-yl} -N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием N,N-диметил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин-2-амина вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,72 (с, 1H), 10,03 (с, 1H), 8,62 (с, 2H), 7,91 (с, 1H), 7,58 (дд, 1H, J=1,6, 8,6), 7,51 (д, 1H, J=8,5), 3,16 (с, 8H), 2,33 (с, 6H). MS (ESI+) m/z 340,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using N, N-dimethyl-5- (4,4,5,5-tetramethyl- 1,3,2-dioxaborolan-2-yl) pyrimidin-2-amine instead of 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H- pyrazole. 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.72 (s, 1H), 10.03 (s, 1H), 8.62 (s, 2H), 7.91 (s, 1H), 7.58 (dd, 1H, J = 1.6, 8.6), 7.51 (d, 1H, J = 8.5), 3.16 (s, 8H), 2.33 (s, 6H). MS (ESI +) m / z 340.2 (M + H) + .
Пример 300Example 300
N2,N2-диметил-N1-[5-(2-морфолин-4-илпиримидин-5-ил)-1H-индазол-3-ил]глицинамидN 2 , N 2 -dimethyl-N 1 - [5- (2-morpholin-4-ylpyrimidin-5-yl) -1H-indazol-3-yl] glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием 4-(5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин-2-ил)морфолина вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,74 (с, 1H), 10,03 (с, 1H), 8,67 (с, 2H), 7,94 (с, 1H), 7,60 (дд, 1H, J=1,8, 8,8), 7,52 (д, 1H, J=8,5), 3,74 (м, 4H), 3,67 (м, 4H), 3,17 (с, 2H), 2,33 (с, 6H). MS (ESI+) m/z 382,2 (M+H)+.The title compound was prepared according to the procedure described in Example 233A using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using 4- (5- (4,4,5,5-tetramethyl-1,3) , 2-dioxaborolan-2-yl) pyrimidin-2-yl) morpholine instead of 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl) -1H-pyrazole . 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.74 (s, 1H), 10.03 (s, 1H), 8.67 (s, 2H), 7.94 (s, 1H), 7.60 (dd, 1H, J = 1.8, 8.8), 7.52 (d, 1H, J = 8.5), 3.74 (m, 4H), 3.67 (m, 4H), 3.17 (s, 2H), 2.33 (s, 6H). MS (ESI +) m / z 382.2 (M + H) + .
Пример 301Example 301
N2,N2-диметил-N1-{5-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-1H-индазол-3-ил}глицинамидN 2 , N 2 -dimethyl-N 1 - {5- [1- (2-morpholin-4-yl-ethyl) -1H-pyrazol-4-yl] -1H-indazol-3-yl} glycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 233A, с использованием соединения Примера 282C вместо 5-бром-2-фторбензонитрила и с использованием 4-(2-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)этил)морфолина вместо 1-бензил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола. 1H ЯМР (600 МГц, ДМСО-d6) δ м.д. 12,63 (с, 1H), 9,96 (с, 1H), 8,09 (с, 1H), 7,85 (с, 1H), 7,77 (с, 1H), 7,54 (дд, 1H, J=1,5, 8,8), 7,43 (д, 1H, J=8,5), 4,24 (т, 2H, J=6,6), 3,54 (м, 4H), 3,16 (с, 2H), 2,73 (т, 2H, J=6,6), 2,41 (с, 4H), 2,34 (с, 6H). MS (ESI+) m/z 398,3 (M+H)+.The title compound was prepared according to the procedure described in Example 233A using the compound of Example 282C instead of 5-bromo-2-fluorobenzonitrile and using 4- (2- (4- (4,4,5,5-tetramethyl- 1,3,2-dioxaborolan-2-yl) -1H-pyrazol-1-yl) ethyl) morpholine instead of 1-benzyl-4- (4,4,5,5-tetramethyl-1,3,2-dioxaborolan- 2-yl) -1H-pyrazole. 1 H NMR (600 MHz, DMSO-d 6 ) δ ppm 12.63 (s, 1H), 9.96 (s, 1H), 8.09 (s, 1H), 7.85 (s, 1H), 7.77 (s, 1H), 7.54 (dd , 1H, J = 1.5, 8.8), 7.43 (d, 1H, J = 8.5), 4.24 (t, 2H, J = 6.6), 3.54 (m, 4H), 3.16 (s, 2H), 2.73 (t, 2H, J = 6.6), 2.41 (s, 4H), 2.34 (s, 6H). MS (ESI +) m / z 398.3 (M + H) + .
Пример 302Example 302
N1-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 - [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Пример 302AExample 302A
1-бензил-5-циклопропил-4-(трибутилстаннил)-1H-1,2,3-триазол1-benzyl-5-cyclopropyl-4- (tributylstannyl) -1H-1,2,3-triazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 142A, с использованием толуола вместо гексана и с использованием (азидометил)бензола вместо соединения Примера 80A. Неочищенный продукт использовали на следующей стадии без очистки.The title compound was prepared according to the procedure described in Example 142A using toluene instead of hexane and using (azidomethyl) benzene instead of the compound of Example 80A. The crude product was used in the next step without purification.
Пример 302BExample 302B
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-2-фторбензонитрил5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -2-fluorobenzonitrile
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 142B, с использованием соединения Примера 302A вместо соединения Примера 142A и с использованием 2-фтор-5-иодбензонитрила вместо соединения Примера 87A. MS (ESI+) m/z 319,2 (M+H)+.The title compound was prepared according to the procedure described in Example 142B using the compound of Example 302A instead of the compound of Example 142A and using 2-fluoro-5-iodobenzonitrile instead of the compound of Example 87A. MS (ESI +) m / z 319.2 (M + H) + .
Пример 302CExample 302C
5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-амин5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 62D, с использованием соединения Примера 302B вместо соединения Примера 62C. MS (ESI-) m/z 299,2 (M-H)-.The title compound was prepared according to the procedure described in Example 62D using the compound of Example 302B instead of the compound of Example 62C. MS (ESI-) m / z 299.2 (MH) - .
Пример 302DExample 302D
трет-бутил 3-амино-5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-карбоксилатtert-butyl 3-amino-5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazole-1-carboxylate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 64A, с использованием соединения Примера 302C вместо соединения Примера 62D.The title compound was prepared according to the procedure described in Example 64A using the compound of Example 302C instead of the compound of Example 62D.
Пример 302EExample 302E
N1-[5-(1-бензил-5-циклопропил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 - [5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 64B, с использованием соединения Примера 302D вместо соединения Примера 64A и с использованием гидрохлорида диметиламиноацетилхлорида вместо метоксиацетилхлорида. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,76 (с, 1H), 10,06 (с, 1H), 8,18 (с, 1H), 7,79 (д, 1H, J=8,8), 7,50 (д, 1H, J=8,8), 7,34 (м, 5H), 5,68 (с, 2H), 3,16 (с, 2H), 2,32 (с, 6H), 1,76 (м, 1H), 1,05 (кв., 2H, J=6,1), 0,39 (кв., 2H, J=5,4). MS (ESI+) m/z 416,3 (M+H)+. MS (ESI+) m/z 416,3 (M+H)+.The title compound was prepared according to the procedure described in Example 64B using the compound of Example 302D instead of the compound of Example 64A and using dimethylaminoacetyl chloride hydrochloride instead of methoxyacetyl chloride. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.76 (s, 1H), 10.06 (s, 1H), 8.18 (s, 1H), 7.79 (d, 1H, J = 8.8), 7.50 (d, 1H, J = 8.8), 7.34 (m, 5H), 5.68 (s, 2H), 3.16 (s, 2H), 2.32 (s, 6H), 1.76 (m, 1H ), 1.05 (q, 2H, J = 6.1), 0.39 (q, 2H, J = 5.4). MS (ESI +) m / z 416.3 (M + H) + . MS (ESI +) m / z 416.3 (M + H) + .
Пример 303Example 303
N1[5-(1-бензил-1H-пиразол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 [5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Пример 303AExample 303A
трет-бутиловый эфир 3-амино-5-(1-бензил-1H-пиразол-4-ил)-индазол-1-карбоновой кислоты3-amino-5- (1-benzyl-1H-pyrazol-4-yl) indazole-1-carboxylic acid tert-butyl ester
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 64A, с использованием соединения Примера 233B вместо соединения Примера 62D (0,925 г, 100%). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,19 (с, 1H), 8,04 (с, 1H), 7,90-7,95 (м, 1H), 7,87 (с, 1H), 7,74 (д, J=1,6 Гц, 1H), 7,28-7,36 (м, 5H), 6,27 (с, 2H), 5,37 (с, 2H), 1,58 (с, 9H). MS (ESI+) m/z 390 (M+H)+.The title compound was prepared according to the procedure described in Example 64A using the compound of Example 233B instead of the compound of Example 62D (0.925 g, 100%). 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.19 (s, 1H), 8.04 (s, 1H), 7.90-7.95 (m, 1H), 7.87 (s, 1H), 7.74 (d, J = 1, 6 Hz, 1H), 7.28-7.36 (m, 5H), 6.27 (s, 2H), 5.37 (s, 2H), 1.58 (s, 9H). MS (ESI +) m / z 390 (M + H) + .
Пример 303BExample 303B
N1-[5-(1-бензил-1H-пиразол-4-ил)-1H-индазол-3-ил]-N2,N2-диметилглицинамидN 1 - [5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazol-3-yl] -N 2 , N 2 -dimethylglycinamide
Суспензию 2-(диметиламино)уксусной кислоты (32 мг, 0,308 ммоль) и оксалилхлорида (0,31 мл, 0,61 ммоль) в дихлорметане (5 мл) и диметилформамиде (2 капли) перемешивали при температуре окружающей среды в течение около 1 часа, затем концентрировали при пониженном давлении. Остаток суспендировали в тетрагидрофуране (3 мл) и добавляли к суспензии соединения Примера 303A (40 мг, 0,103 ммоль) и карбоната калия (43 мг, 0,308 ммоль) в тетрагидрофуране (5 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение около 30 минут, затем добавляли трифторуксусную кислоту (4 мл) и реакционную смесь нагревали при около 60°C в течение около 20 часов. Реакционную смесь охлаждали до температуры окружающей среды и концентрировали при пониженном давлении, разбавляли дихлорметаном (20 мл) и промывали 15% водным раствором гидроксид натрия (20 мл). Органический экстракт отделяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения ацетата соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,97 (с, 1H), 8,21 (с, 1H), 7,83 (с, 1H), 7,82 (с, 1H), 7,56 (д, J=8,7 Гц, 1H), 7,43 (д, J=8,6 Гц, 1H), 7,32-7,40 (м, 2H), 7,25-7,32 (м, 3H), 5,35 (с, 2H), 3,16 (с, 2H), 2,33 (с, 6H), 1,91 (с, 3H). MS (ESI+) m/z 375 (M+H)+.A suspension of 2- (dimethylamino) acetic acid (32 mg, 0.308 mmol) and oxalyl chloride (0.31 ml, 0.61 mmol) in dichloromethane (5 ml) and dimethylformamide (2 drops) was stirred at ambient temperature for about 1 hour , then concentrated under reduced pressure. The residue was suspended in tetrahydrofuran (3 ml) and added to a suspension of the compound of Example 303A (40 mg, 0.103 mmol) and potassium carbonate (43 mg, 0.308 mmol) in tetrahydrofuran (5 ml). The reaction mixture was stirred at ambient temperature for about 30 minutes, then trifluoroacetic acid (4 ml) was added and the reaction mixture was heated at about 60 ° C for about 20 hours. The reaction mixture was cooled to ambient temperature and concentrated under reduced pressure, diluted with dichloromethane (20 ml) and washed with 15% aqueous sodium hydroxide solution (20 ml). The organic extract was separated, dried over magnesium sulfate, filtered and concentrated under reduced pressure. The crude material was purified by reverse phase HPLC using a gradient elution method with acetonitrile / water (0.05 M ammonium acetate) to obtain the title salt acetate compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 9.97 (s, 1H), 8.21 (s, 1H), 7.83 (s, 1H), 7.82 (s, 1H), 7.56 (d, J = 8.7 Hz, 1H ), 7.43 (d, J = 8.6 Hz, 1H), 7.32-7.40 (m, 2H), 7.25-7.32 (m, 3H), 5.35 (s, 2H), 3.16 (s, 2H), 2.33 (s, 6H), 1.91 (s, 3H). MS (ESI +) m / z 375 (M + H) + .
Пример 304Example 304
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-метилглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2- methylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 303B, с использованием 2-(трет-бутоксикарбонил(метил)амино)уксусной кислоты вместо 2-(диметиламино)уксусной кислоты и с использованием соединения Примера 64A вместо соединения Примера 303A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,56 (с, 1H), 8,28 (с, 1H), 7,78-7,88 (м, 1H), 7,45-7,56 (м, 1H), 7,28-7,45 (5H, m), 5,64 (2H, s), 2,37 (с, 2H), 1,89 (с, 3H). MS (ESI+) m/z 362 (M+H)+.The title compound was prepared according to the procedure described in Example 303B using 2- (tert-butoxycarbonyl (methyl) amino) acetic acid instead of 2- (dimethylamino) acetic acid and using the compound of Example 64A instead of the compound of Example 303A. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.56 (s, 1H), 8.28 (s, 1H), 7.78-7.88 (m, 1H), 7.45-7.56 (m, 1H), 7.28-7, 45 (5H, m), 5.64 (2H, s), 2.37 (s, 2H), 1.89 (s, 3H). MS (ESI +) m / z 362 (M + H) + .
Пример 305Example 305
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-пирролидин-1-илацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-pyrrolidin-1-yl-acetamide
Пример 305AExample 305A
трет-бутил 5-(1-бензил-1H-1,2,3-триазол-4-ил)-3-(2-бромацетамидо)-1H-индазол-1-карбоксилатtert-butyl 5- (1-benzyl-1H-1,2,3-triazol-4-yl) -3- (2-bromoacetamido) -1H-indazole-1-carboxylate
К суспензии соединения Примера 64A (500 мг, 1,28 ммоль) в тетрагидрофуране (12 мл) добавляли диизопропилэтиламин (0,22 мл, 1,28 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение около 15 минут, затем добавляли 2-бромацетилхлорид (0,11 мл, 1,2 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение около 16 часов, затем добавляли дополнительное количество 2-бромацетилхлорида (0,11 мл, 1,2 ммоль). Реакционную смесь перемешивали еще в течение 15 минут, затем концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде коричневого твердого вещества. Это вещество использовали без дополнительной очистки.To a suspension of the compound of Example 64A (500 mg, 1.28 mmol) in tetrahydrofuran (12 ml) was added diisopropylethylamine (0.22 ml, 1.28 mmol). The reaction mixture was stirred at ambient temperature for about 15 minutes, then 2-bromoacetyl chloride (0.11 ml, 1.2 mmol) was added. The reaction mixture was stirred at ambient temperature for about 16 hours, then an additional amount of 2-bromoacetyl chloride (0.11 ml, 1.2 mmol) was added. The reaction mixture was stirred for another 15 minutes, then concentrated under reduced pressure to obtain the title compound as a brown solid. This substance was used without further purification.
Пример 305BExample 305B
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-пирролидин-1-илацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-pyrrolidin-1-yl-acetamide
К раствору соединения Примера 305A (44 мг, 0,086 ммоль) и диизопропилэтиламина (0,015 мл, 0,086 ммоль) в ацетонитриле (1 мл) добавляли пирролидин (0,021 мл, 0,25 ммоль) и реакционную смесь нагревали при около 60°C в течение около 15 минут. Реакционную смесь охлаждали до температуры окружающей среды и добавляли трифторуксусную кислоту (1 мл). Реакционную смесь нагревали при около 60°C в течение около 48 часов. Реакционную смесь концентрировали при пониженном давлении, разбавляли дихлорметаном (20 мл) и промывали 15% водным раствором гидроксида натрия (20 мл). Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,58 (с, 1H), 8,24 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,27- 7,45 (м, 5H), 5,64 (с, 2H), 3,35 (с, 2H), 2,65 (с, 4H), 1,76 (с, 4H). MS (ESI+) m/z 402 (M+H)+.To a solution of the compound of Example 305A (44 mg, 0.086 mmol) and diisopropylethylamine (0.015 ml, 0.086 mmol) in acetonitrile (1 ml) was added pyrrolidine (0.021 ml, 0.25 mmol) and the reaction mixture was heated at about 60 ° C for about 15 minutes. The reaction mixture was cooled to ambient temperature and trifluoroacetic acid (1 ml) was added. The reaction mixture was heated at about 60 ° C for about 48 hours. The reaction mixture was concentrated under reduced pressure, diluted with dichloromethane (20 ml) and washed with 15% aqueous sodium hydroxide solution (20 ml). The organic layer was separated, dried over magnesium sulfate, filtered and concentrated under reduced pressure. The crude material was purified by reverse phase HPLC using a gradient elution method with acetonitrile / water (0.05 M ammonium acetate) to obtain the title compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.58 (s, 1H), 8.24 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.50 (d, J = 8.7 Hz, 1H), 7.27-7.45 (m, 5H), 5.64 (s, 2H), 3.35 (s, 2H), 2.65 (s, 4H), 1.76 (s, 4H). MS (ESI +) m / z 402 (M + H) + .
Пример 306Example 306
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклопентилглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclopentylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 305B, с использованием циклопентанамина вместо пирролидина (0,004 г, 12%). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,56 (с, 1H), 8,31 (с, 1H), 7,73-7,86 (д, J=8,8 Гц, 1H), 7,49 (д, J=8,7 Гц, 1H), 7,29-7,45 (м, 5H), 5,64 (с, 2H), 3,37 (с, 2H), 2,99-3,14 (м, 1H), 1,60-1,80 (м, 4H), 1,30-1,50 (м, 4H). MS (ESI+) m/z 416 (M+H)+.The title compound was prepared according to the procedure described in Example 305B using cyclopentanamine instead of pyrrolidine (0.004 g, 12%). 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.56 (s, 1H), 8.31 (s, 1H), 7.73-7.86 (d, J = 8.8 Hz, 1H), 7.49 (d, J = 8.7 Hz , 1H), 7.29-7.45 (m, 5H), 5.64 (s, 2H), 3.37 (s, 2H), 2.99-3.14 (m, 1H), 1, 60-1.80 (m, 4H); 1.30-1.50 (m, 4H). MS (ESI +) m / z 416 (M + H) + .
Пример 307Example 307
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклопропилглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclopropylglycinamide
К раствору соединения Примера 305 A (100 мг, 0,196 ммоль) и диизопропилэтиламин (0,034 мл, 0,19 ммоль) в ацетонитриле (1 мл) добавляли циклопропанамин (11 мг, 0,19 ммоль) и реакционную смесь нагревали при около 60°C в течение около 1 часа. Реакционную смесь охлаждали до температуры окружающей среды и добавляли хлористоводородную кислоту (раствор 4 н в диоксане, 1 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение около 16 часов. Реакционную смесь концентрировали при пониженном давлении и неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения ацетата соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,18 (с, 1H), 8,28 (с, 1H), 8,56 (с, 1H), 7,81 (д, J=8,6 Гц, 1H), 7,49 (д, J=8,7 Гц, 1H), 7,30-7,45 (м, 5H), 5,64 (с, 2H), 3,45 (с, 2H), 2,18-2,26 (м, 1H), 1,89 (с, 3H), 0,37-0,45 (м, 2H), 0,29-0,37 (м, 2H). MS (ESI+) m/z 388 (M+H)+.To a solution of the compound of Example 305 A (100 mg, 0.196 mmol) and diisopropylethylamine (0.034 ml, 0.19 mmol) in acetonitrile (1 ml) was added cyclopropanamine (11 mg, 0.19 mmol) and the reaction mixture was heated at about 60 ° C for about 1 hour. The reaction mixture was cooled to ambient temperature and hydrochloric acid was added (4 N solution in dioxane, 1 ml). The reaction mixture was stirred at ambient temperature for about 16 hours. The reaction mixture was concentrated under reduced pressure, and the crude material was purified by reverse phase HPLC using an acetonitrile / water gradient method (0.05 M ammonium acetate) to obtain the title salt acetate compound. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.18 (s, 1H), 8.28 (s, 1H), 8.56 (s, 1H), 7.81 (d, J = 8.6 Hz, 1H), 7.49 (d, J = 8.7 Hz, 1H), 7.30-7.45 (m, 5H), 5.64 (s, 2H), 3.45 (s, 2H), 2.18-2.26 (m, 1H), 1.89 (s, 3H), 0.37-0.45 (m, 2H), 0.29-0.37 (m, 2H). MS (ESI +) m / z 388 (M + H) + .
Пример 308Example 308
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-тетрагидро-2H-пиран-4-илглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2- tetrahydro-2H-pyran-4-yl-glycinamide
Указанное в заголовке соединение получали в форме соли ацетата в соответствии с процедурой, описанной в Примере 307, с использованием тетрагидро-2H-пиран-4-амина вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,56 (с, 1H), 8,31 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,31-7,45 (м, 5H), 5,64 (с, 2H), 3,84 (д, J=11,2 Гц, 2H), 3,43 (с, 2H), 3,30 (т, J=10,8 Гц, 2H), 2,62-2,74 (м, 1H), 1,88 (с, 3H), 1,75-1,85 (м, 2H), 1,24-1,39 (м, 2H). MS (ESI+) m/z 432 (M+H)+.The title compound was obtained in the form of an acetate salt in accordance with the procedure described in Example 307 using tetrahydro-2H-pyran-4-amine instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.56 (s, 1H), 8.31 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.50 (d, J = 8.7 Hz, 1H), 7.31-7.45 (m, 5H), 5.64 (s, 2H), 3.84 (d, J = 11.2 Hz, 2H), 3.43 (s, 2H), 3.30 (t, J = 10.8 Hz, 2H), 2.62-2.74 (m, 1H), 1.88 (s, 3H), 1.75-1.85 (m, 2H), 1, 24-1.39 (m, 2H). MS (ESI +) m / z 432 (M + H) + .
Пример 309Example 309
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(3-гидрокси пирролидин-1-ил)ацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (3-hydroxy pyrrolidin-1-yl) acetamide
Указанное в заголовке соединение получали в форме соли диацетата в соответствии с процедурой, описанной в Примере 307, с использованием пирролидин-3-ола вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,09 (с, 1H), 8,22 (с, 1H), 8,58 (с, 1H), 7,82 (д, J=8,7 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,28-7,45 (м, 5H), 5,64 (с, 2H), 4,16-4,26 (м, 1H), 3,34 (с, 2H), 2,77-2,93 (м, 2H), 2,52-2,65 (м, 2H), 1,98-2,13 (м, 1H), 1,87 (с, 6H), 1,56-1,69 (м, 1H). MS (ESI+) m/z 418 (M+H)+.The title compound was obtained in the form of a diacetate salt in accordance with the procedure described in Example 307 using pyrrolidin-3-ol instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.09 (s, 1H), 8.22 (s, 1H), 8.58 (s, 1H), 7.82 (d, J = 8.7 Hz, 1H), 7.50 (d, J = 8.7 Hz, 1H), 7.28-7.45 (m, 5H), 5.64 (s, 2H), 4.16-4.26 (m, 1H), 3.34 (s, 2H), 2.77-2.93 (m, 2H), 2.52-2.65 (m, 2H), 1.98-2.13 (m, 1H), 1.87 (s, 6H) 1.56-1.69 (m, 1H). MS (ESI +) m / z 418 (M + H) + .
Пример 310Example 310
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(3-гидрокси пиперидин-1-ил)ацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (3-hydroxy piperidin-1-yl) acetamide
Указанное в заголовке соединение получали в форме соли ацетата в соответствии с процедурой, описанной в Примере 307, с использованием пиперидин-3-ола вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,05 (с, 1H), 8,56 (с, 1H), 8,23 (с, 1H), 7,82 (д, J=8,7 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,29-7,44 (м, 5H), 5,64 (с, 2H), 3,55-3,67 (м, 1H), 3,20 (с, 2H), 2,77-2,88 (м, 1H), 2,60-2,70 (м, 1H), 2,22-2,35 (м, 1H), 2,12-2,23 (м, 1H), 1,88 (с, 3H), 1,66-1,78 (м, 2H), 1,43-1,59 (м, 1H), 1,13-1,27 (м, 1H). MS (ESI+) m/z 432 (M+H)+.The title compound was obtained in the form of an acetate salt in accordance with the procedure described in Example 307 using piperidin-3-ol instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.05 (s, 1H), 8.56 (s, 1H), 8.23 (s, 1H), 7.82 (d, J = 8.7 Hz, 1H), 7.50 (d, J = 8.7 Hz, 1H), 7.29-7.44 (m, 5H), 5.64 (s, 2H), 3.55-3.67 (m, 1H), 3.20 (s, 2H), 2.77-2.88 (m, 1H), 2.60-2.70 (m, 1H), 2.22-2.35 (m, 1H), 2.12-2.23 ( m, 1H), 1.88 (s, 3H), 1.66-1.78 (m, 2H), 1.43-1.59 (m, 1H), 1.13-1.27 (m, 1H). MS (ESI +) m / z 432 (M + H) + .
Пример 311Example 311
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N3,N3-диметил-бета-аланинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 3 , N 3 -dimethyl-beta-alaninamide
Указанное в заголовке соединение получали в форме соли ацетата в соответствии с процедурой, описанной в Примере 307, с использованием диметиламина вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,48 (с, 1H), 8,54 (с, 1H), 8,26 (с, 1H), 7,80 (д, J=8,7 Гц, 1H), 7,48 (д, J=8,7 Гц, 1H), 7,30-7,44 (м, 5H), 5,64 (с, 2H), 2,60 (д, J=6,1 Гц, 2H), 2,54 (д, J=6,3 Гц, 2H), 2,21 (с, 6H), 1,90 (с, 3H). MS (ESI+) m/z 390 (M+H)+.The title compound was obtained in the form of an acetate salt in accordance with the procedure described in Example 307, using dimethylamine instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.48 (s, 1H), 8.54 (s, 1H), 8.26 (s, 1H), 7.80 (d, J = 8.7 Hz, 1H), 7.48 (d, J = 8.7 Hz, 1H), 7.30-7.44 (m, 5H), 5.64 (s, 2H), 2.60 (d, J = 6.1 Hz, 2H), 2.54 (d, J = 6.3 Hz, 2H), 2.21 (s, 6H), 1.90 (s, 3H). MS (ESI +) m / z 390 (M + H) + .
Пример 312Example 312
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-морфолин-4-илацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-morpholin-4-yl-acetamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 307, с использованием морфолина вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,10 (с, 1H), 8,57 (с, 1H), 8,23 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,29-7,46 (м, 5H), 5,64 (с, 2H), 3,59-3,71 (м, 4H), 3,22-3,28 (м, 2H), 2,54-2,64 (м, 4H). MS (ESI+) m/z 418 (M+H)+.The title compound was prepared according to the procedure described in Example 307 using morpholine instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.10 (s, 1H), 8.57 (s, 1H), 8.23 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.50 (d, J = 8.7 Hz, 1H), 7.29-7.46 (m, 5H), 5.64 (s, 2H), 3.59-3.71 (m, 4H), 3.22-3, 28 (m, 2H); 2.54-2.64 (m, 4H). MS (ESI +) m / z 418 (M + H) + .
Пример 313Example 313
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(4-метилпиперазин-1-ил)ацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (4-methylpiperazin-1-yl) acetamide
Указанное в заголовке соединение получали в форме диацетатной соли в соответствии с процедурой, описанной в Примере 307, с использованием 1-метилпиперазина вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,57 (с, 1H), 8,25 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,32-7,43 (м, 5H), 5,64 (с, 2H), 3,22 (с, 2H), 2,53-2,65 (м, 4H), 2,31-2,45 (м, 4H), 2,17 (с, 3H), 1,85 (с, 6H). MS (ESI+) m/z 431 (M+H)+.The title compound was obtained in the form of a diacetate salt according to the procedure described in Example 307, using 1-methylpiperazine instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.57 (s, 1H), 8.25 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.50 (d, J = 8.7 Hz, 1H), 7.32-7.43 (m, 5H), 5.64 (s, 2H), 3.22 (s, 2H), 2.53-2.65 (m, 4H), 2.31-2, 45 (m, 4H), 2.17 (s, 3H), 1.85 (s, 6H). MS (ESI +) m / z 431 (M + H) + .
Пример 314Example 314
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-(3-оксопиперазин-1-ил)ацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2- (3-oxopiperazin-1-yl) acetamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 307, с использованием пиперазин-2-она вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,21 (с, 1H), 8,57 (с, 1H), 8,22 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 7,31-7,46 (м, 5H), 5,64 (с, 2H), 3,36 (с, 2H), 3,24 (с, 2H), 3,17 (с, 2H), 2,78 (с, 2H). MS (ESI+) m/z 431 (M+H)+.The title compound was prepared according to the procedure described in Example 307 using piperazin-2-one instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.21 (s, 1H), 8.57 (s, 1H), 8.22 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.50 (d, J = 8.7 Hz, 1H), 7.31-7.46 (m, 5H), 5.64 (s, 2H), 3.36 (s, 2H), 3.24 (s, 2H), 3 17 (s, 2H); 2.78 (s, 2H). MS (ESI +) m / z 431 (M + H) + .
Пример 315Example 315
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-изопропилглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -isopropylglycinamide
Указанное в заголовке соединение получали в форме ацетатной соли в соответствии с процедурой, описанной в Примере 307, с использованием пропан-2-амина вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,56 (с, 1H), 8,31 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,49 (д, J=8,7 Гц, 1H), 7,31-7,44 (м, 5H), 5,64 (с, 2H), 3,39 (с, 2H), 2,73-2,86 (м, 1H), 1,90 (с, 3H), 1,04 (д, J=6,1 Гц, 6H). MS (ESI+) m/z 390 (M+H)+.The title compound was obtained in the form of an acetate salt in accordance with the procedure described in Example 307, using propan-2-amine instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.56 (s, 1H), 8.31 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.49 (d, J = 8.7 Hz, 1H), 7.31-7.44 (m, 5H), 5.64 (s, 2H), 3.39 (s, 2H), 2.73-2.86 (m, 1H), 1.90 (s, 3H), 1.04 (d, J = 6.1 Hz, 6H). MS (ESI +) m / z 390 (M + H) + .
Пример 316Example 316
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклогексилглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclohexylglycinamide
Указанное в заголовке соединение получали в форме ацетатной соли в соответствии с процедурой, описанной в Примере 307, с использованием циклогексанамина вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,55 (с, 1H), 8,31 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,49 (д, J=8,7 Гц, 1H), 7,30-7,44 (м, 5H), 5,64 (с, 2H), 3,40 (с, 2H), 1,90 (с, 3H), 1,80-1,88 (м, 2H), 1,63- 1,73 (м, 2H), 1,50-1,60 (м, 1H), 1,02-1,29 (м, 5H). MS (ESI+) m/z 430 (M+H)+.The title compound was obtained in the form of an acetate salt in accordance with the procedure described in Example 307, using cyclohexanamine instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.55 (s, 1H), 8.31 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.49 (d, J = 8.7 Hz, 1H), 7.30-7.44 (m, 5H), 5.64 (s, 2H), 3.40 (s, 2H), 1.90 (s, 3H), 1.80-1.88 (m, 2H), 1.63-1.73 (m, 2H), 1.50-1.60 (m, 1H), 1.02-1.29 (m, 5H). MS (ESI +) m / z 430 (M + H) + .
Пример 317Example 317
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]ацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] acetamide
К смеси соединения Примера 64A (20 мг, 0,051 ммоль) и диизопропилэтиламина (0,063 мл, 0,35 ммоль) в тетрагидрофуране (1,5 мл) добавляли ацетилхлорид (0,013 мл, 0,17 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение около 1,5 часов. Добавляли хлористоводородную кислоту (раствор 4 н в диоксане, 1,5 мл) и смесь перемешивали при температуре окружающей среды в течение около 16 часов. Растворитель удаляли при пониженном давлении и неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения в виде ацетатной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,35 (с, 1H), 8,57 (с, 1H), 8,22 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,48 (д, J=8,7 Гц, 1H), 7,33-7,42 (м, 5H), 5,64 (с, 2H), 2,13 (с, 3H). MS (ESI-) m/z 331 (M-H)-.To a mixture of the compound of Example 64A (20 mg, 0.051 mmol) and diisopropylethylamine (0.063 ml, 0.35 mmol) in tetrahydrofuran (1.5 ml) was added acetyl chloride (0.013 ml, 0.17 mmol) and the reaction mixture was stirred at ambient temperature for about 1.5 hours. Hydrochloric acid (4 N solution in dioxane, 1.5 ml) was added and the mixture was stirred at ambient temperature for about 16 hours. The solvent was removed under reduced pressure and the crude material was purified by reverse phase HPLC using an acetonitrile / water gradient gradient elution method (0.05 M ammonium acetate) to obtain the title compound as an acetate salt. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.35 (s, 1H), 8.57 (s, 1H), 8.22 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.48 (d, J = 8.7 Hz, 1H), 7.33-7.42 (m, 5H), 5.64 (s, 2H), 2.13 (s, 3H). MS (ESI-) m / z 331 (MH) - .
Пример 318Example 318
N1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N2-циклобутилглицинамидN 1 - [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N 2 -cyclobutylglycinamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 307, с использованием циклобутанамина вместо циклопропанамина. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,56 (с, 1H), 8,29 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,49 (д, J=8,7 Гц, 1H), 7,31-7,45 (м, 5H), 5,64 (с, 2H), 3,31 (с, 2H), 2,01-2,20 (м, 2H), 1,48-1,83 (м, 5H). MS (ESI+) m/z 402 (M+H)+.The title compound was prepared according to the procedure described in Example 307 using cyclobutanamine instead of cyclopropanamine. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 8.56 (s, 1H), 8.29 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.49 (d, J = 8.7 Hz, 1H), 7.31-7.45 (m, 5H), 5.64 (s, 2H), 3.31 (s, 2H), 2.01-2.20 (m, 2H), 1.48-1, 83 (m, 5H). MS (ESI +) m / z 402 (M + H) + .
Пример 319Example 319
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-пропилмочевинаN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-propylurea
К раствору соединения Примера 64A (75 мг, 0,19 ммоль) в пиридине (2 мл) добавляли 1-изоцианатопропан (16 мг, 0,19 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение около 3 часов. Добавляли дополнительное количество изоцианата (0,1 мл) добавляли и смесь нагревали при около 80°C в течение около 16 часов. Реакционную смесь охлаждали до температуры окружающей среды и добавляли воду (5 мл). Полученный осадок собирали фильтрованием, затем обрабатывали хлористоводородной кислотой (4 н раствор в диоксане, 3 мл) и перемешивали при комнатной температуре в течение около 4,5 часов. Добавляли диэтиловый эфир (5 мл) и осадок собирали фильтрованием. Неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения в виде ацетатной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,34 (с, 1H), 8,50 (с, 1H), 8,42 (с, 1H), 7,80 (д, J=8,7 Гц, 1H), 7,38 (д, J=8,7 Гц, 1H), 7,31-7,48 (м, 5H), 5,65 (с, 2H), 3,18 (дд, J=6,6, 12,7 Гц, 2H), 1,51 (дд, J=7,1, 14,3 Гц, 2H), 0,91 (т, J=7,3 Гц, 3H). MS (ESI+) m/z 376 (M+H)+.To a solution of the compound of Example 64A (75 mg, 0.19 mmol) in pyridine (2 ml) was added 1-isocyanatopropane (16 mg, 0.19 mmol) and the reaction mixture was stirred at ambient temperature for about 3 hours. Additional isocyanate (0.1 ml) was added, and the mixture was heated at about 80 ° C for about 16 hours. The reaction mixture was cooled to ambient temperature and water (5 ml) was added. The resulting precipitate was collected by filtration, then treated with hydrochloric acid (4 N solution in dioxane, 3 ml) and stirred at room temperature for about 4.5 hours. Diethyl ether (5 ml) was added and the precipitate was collected by filtration. The crude material was purified by reverse phase HPLC using a gradient elution method with acetonitrile / water (0.05 M ammonium acetate) to obtain the title compound as an acetate salt. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 9.34 (s, 1H), 8.50 (s, 1H), 8.42 (s, 1H), 7.80 (d, J = 8.7 Hz, 1H), 7.38 (d, J = 8.7 Hz, 1H), 7.31-7.48 (m, 5H), 5.65 (s, 2H), 3.18 (dd, J = 6.6, 12.7 Hz, 2H) 1.51 (dd, J = 7.1, 14.3 Hz, 2H); 0.91 (t, J = 7.3 Hz, 3H). MS (ESI +) m / z 376 (M + H) + .
Пример 320Example 320
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]этансульфонамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] ethanesulfonamide
К раствору соединения Примера 64A (75 мг, 0,19 ммоль) в пиридине (2 мл) добавляли этансульфонилхлорид (25 мг, 0,19 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение около 3 часов. Добавляли дополнительное количество сульфонилхлорида (25 мг, 0,19 ммоль) и реакционную смесь перемешивали в течение около 48 часов. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в дихлорметане (10 мл) и промывали 1 н водным раствором хлористоводородной кислоты (10 мл). Органическую часть отделяли, сушили при пониженном давлении и обрабатывали хлористоводородной кислотой (4 н раствор в диоксане, 5 мл) и перемешивали при комнатной температуре в течение около 12 часов. Реакционную смесь концентрировали при пониженном давлении и неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения в виде ацетатной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,12 (с, 1H), 8,61 (с, 1H), 8,24 (с, 1H), 7,83 (д, J=8,7 Гц, 1H), 7,52 (д, J=8,7 Гц, 1H), 7,29-7,48 (м, 5H), 5,64 (с, 2H), 3,29 (д, J=9,2 Гц, 2H), 1,31 (т, J=7,3 Гц, 3H). MS (ESI+) m/z 383 (M+H)+.To a solution of the compound of Example 64A (75 mg, 0.19 mmol) in pyridine (2 ml) was added ethanesulfonyl chloride (25 mg, 0.19 mmol) and the reaction mixture was stirred at room temperature for about 3 hours. Additional sulfonyl chloride (25 mg, 0.19 mmol) was added and the reaction mixture was stirred for about 48 hours. The reaction mixture was concentrated under reduced pressure, and the residue was dissolved in dichloromethane (10 ml) and washed with a 1N aqueous solution of hydrochloric acid (10 ml). The organic part was separated, dried under reduced pressure and treated with hydrochloric acid (4 N solution in dioxane, 5 ml) and stirred at room temperature for about 12 hours. The reaction mixture was concentrated under reduced pressure, and the crude material was purified by reverse phase HPLC using an acetonitrile / water gradient method (0.05 M ammonium acetate) to obtain the title compound as an acetate salt. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.12 (s, 1H), 8.61 (s, 1H), 8.24 (s, 1H), 7.83 (d, J = 8.7 Hz, 1H), 7.52 (d, J = 8.7 Hz, 1H), 7.29-7.48 (m, 5H), 5.64 (s, 2H), 3.29 (d, J = 9.2 Hz, 2H), 1.31 (t, J = 7.3 Hz, 3H). MS (ESI +) m / z 383 (M + H) + .
Пример 321Example 321
5-(1-бензил-1H-1,2,3-триазол-4-ил)-N-(циклопропилметил)-1H-индазол-3-амин5- (1-benzyl-1H-1,2,3-triazol-4-yl) -N- (cyclopropylmethyl) -1H-indazol-3-amine
Смесь соединения Примера 64A (100 мг, 0,256 ммоль), циклопропанкарбальдегида (0,057 мл, 0,76 ммоль), триацетоксиборогидрида натрия (163 мг, 0,76 ммоль) и уксусной кислоты (0,044 мл, 0,76 ммоль) в 1,2-дихлорэтане (5 мл) перемешивали при температуре окружающей среды в течение около 2,5 часов. Добавляли хлористоводородную кислоту (4 н раствор в диоксане, 4 мл) и реакционную смесь перемешивали в течение около 16 часов. Осадок собирали фильтрованием, промывая простым эфиром (10 мл). Твердое вещество растворяли в дихлорметане (10 мл) и обрабатывали трифторуксусной кислотой (0,1 мл) и реакционную смесь перемешивали при комнатной температуре в течение около 2 часов. Реакционную смесь нейтрализовали добавлением 15% водного раствора гидроксида натрия (около 15 мл) и органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения в виде ацетатной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,43 (с, 1H), 8,41 (с, 1H), 8,28 (с, 1H), 7,68 (д, J=8,7 Гц, 1H), 7,32-7,45 (м, 5H), 7,26 (д, J=8,6 Гц, 1H), 6,08 (т, J=5,7 Гц, 1H), 5,64 (с, 2H), 3,12 (т, J=6,2 Гц, 2H), 1,04-1,22 (м, 1H), 0,35-0,53 (м, 2H), 0,17-0,32 (м, 2H). MS (ESI+) m/z 345 (M+H)+.A mixture of the compound of Example 64A (100 mg, 0.256 mmol), cyclopropanecarbaldehyde (0.057 ml, 0.76 mmol), sodium triacetoxyborohydride (163 mg, 0.76 mmol) and acetic acid (0.044 ml, 0.76 mmol) in 1.2 -dichloroethane (5 ml) was stirred at ambient temperature for about 2.5 hours. Hydrochloric acid (4 N solution in dioxane, 4 ml) was added and the reaction mixture was stirred for about 16 hours. The precipitate was collected by filtration, washing with ether (10 ml). The solid was dissolved in dichloromethane (10 ml) and treated with trifluoroacetic acid (0.1 ml) and the reaction mixture was stirred at room temperature for about 2 hours. The reaction mixture was neutralized by the addition of a 15% aqueous sodium hydroxide solution (about 15 ml) and the organic layer was separated, dried over magnesium sulfate, filtered and concentrated under reduced pressure. The crude material was purified by reverse phase HPLC using a gradient elution method with acetonitrile / water (0.05 M ammonium acetate) to obtain the title compound as an acetate salt. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 11.43 (s, 1H), 8.41 (s, 1H), 8.28 (s, 1H), 7.68 (d, J = 8.7 Hz, 1H), 7.32-7.45 (m, 5H), 7.26 (d, J = 8.6 Hz, 1H), 6.08 (t, J = 5.7 Hz, 1H), 5.64 (s, 2H), 3.12 (t, J = 6.2 Hz, 2H), 1.04-1.22 (m, 1H), 0.35-0.53 (m, 2H), 0.17-0.32 (m, 2H ) MS (ESI +) m / z 345 (M + H) + .
Пример 322Example 322
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-N'-этилмочевинуN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -N'-ethylurea
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 319, с использованием изоцианатоэтана вместо 1-изоцианатопропана. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,32 (с, 1H), 8,49 (с, 1H), 8,42 (с, 1H), 7,81 (д, J=8,7 Гц, 1H), 7,70 (д, J=8,7 Гц, 1H), 7,31-7,49 (м, 5H), 5,65 (с, 2H), 3,23 (д, J=6,9 Гц, 2H), 1,12 (т, J=7,1 Гц, 3H). MS (ESI+) m/z 362 (M+H)+.The title compound was prepared according to the procedure described in Example 319 using isocyanatoethane instead of 1-isocyanatopropane. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 9.32 (s, 1H), 8.49 (s, 1H), 8.42 (s, 1H), 7.81 (d, J = 8.7 Hz, 1H), 7.70 (d, J = 8.7 Hz, 1H), 7.31-7.49 (m, 5H), 5.65 (s, 2H), 3.23 (d, J = 6.9 Hz, 2H), 1.12 (t, J = 7.1 Hz, 3H). MS (ESI +) m / z 362 (M + H) + .
Пример 323Example 323
1-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]пирролидин-2-он1- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] pyrrolidin-2-one
Суспензию соединения Примера 64A (200 мг, 0,51 ммоль) и диизопропилэтиламина (0,089 мл, 0,51 ммоль) в тетрагидрофуране (5 мл) перемешивали в течение около 15 минут при температуре окружающей среды, затем добавляли 4-бромбутаноилхлорид (0,059 мл, 0,51 ммоль). Реакционную смесь перемешивали в течение около 16 часов. Осадок удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток поглощали в ацетонитрил (5 мл) и обрабатывали диизопропилэтиламином (0,089 мл, 0,51 ммоль) и нагревали при около 60°C в течение около 16 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток обрабатывали хлористоводородной кислотой (4 н раствор в диоксане, 5 мл) и реакционную смесь перемешивали при комнатной температуре в течение около 2 часов. Реакционную смесь концентрировали при пониженном давлении и неочищенное вещество очищали при помощи обращенно-фазовой ВЭЖХ с использованием метода градиентного элюирования ацетонитрил/вода (0,05 M ацетата аммония) с получением указанного в заголовке соединения в виде ацетатной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 12,84 (с, 1H), 8,56 (с, 1H), 8,49 (с, 1H), 7,84 (д, J=8,6 Гц, 1H), 7,51 (д, J=8,7 Гц, 1H), 7,29-7,46 (м, 5H), 5,64 (с, 2H), 3,96 (т, J=6,9 Гц, 2H), 2,56 (т, J=7,9 Гц, 2H), 2,25-2,12 (м, 2H). MS (ESI+) m/z 359 (M+H)+.A suspension of the compound of Example 64A (200 mg, 0.51 mmol) and diisopropylethylamine (0.089 ml, 0.51 mmol) in tetrahydrofuran (5 ml) was stirred for about 15 minutes at ambient temperature, then 4-bromobutanoyl chloride (0.059 ml, 0.51 mmol). The reaction mixture was stirred for about 16 hours. The precipitate was removed by filtration and the filtrate was concentrated under reduced pressure. The residue was taken up in acetonitrile (5 ml) and treated with diisopropylethylamine (0.089 ml, 0.51 mmol) and heated at about 60 ° C for about 16 hours. The reaction mixture was cooled to room temperature and concentrated under reduced pressure. The residue was treated with hydrochloric acid (4 N solution in dioxane, 5 ml) and the reaction mixture was stirred at room temperature for about 2 hours. The reaction mixture was concentrated under reduced pressure, and the crude material was purified by reverse phase HPLC using an acetonitrile / water gradient method (0.05 M ammonium acetate) to obtain the title compound as an acetate salt. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 12.84 (s, 1H), 8.56 (s, 1H), 8.49 (s, 1H), 7.84 (d, J = 8.6 Hz, 1H), 7.51 (d, J = 8.7 Hz, 1H), 7.29-7.46 (m, 5H), 5.64 (s, 2H), 3.96 (t, J = 6.9 Hz, 2H), 2.56 (t, J = 7.9 Hz, 2H); 2.25-2.12 (m, 2H). MS (ESI +) m / z 359 (M + H) + .
Пример 324Example 324
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-4-(диметиламино)бутанамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -4- (dimethylamino) butanamide
Указанное в заголовке соединение получали в форме диацетатной соли в соответствии с процедурой, описанной в Примере 303B, с использованием 4-(диметиламино)бутановой кислоты вместо 2-(диметиламино)уксусной кислоты и с использованием соединения Примера 64A вместо соединения Примера 303A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,34 (с, 1H), 8,53 (с, 1H), 8,22 (с, 1H), 7,78 (д, J=8,7 Гц, 1H), 7,47 (д, J=8,7 Гц, 1H), 7,30-7,41 (м, 5H), 5,62 (с, 2H), 2,41 (т, J=7,2 Гц, 2H), 2,28 (т, J=6,8 Гц, 2H), 2,14 (с, 6H), 1,84 (с, 6H), 1,74-1,77 (м, 2H). MS (ESI-) m/z 462 (M-H)-.The title compound was obtained in the form of a diacetate salt according to the procedure described in Example 303B using 4- (dimethylamino) butanoic acid instead of 2- (dimethylamino) acetic acid and using the compound of Example 64A instead of the compound of Example 303A. 1 H NMR (400 MHz, DMSO-d 6 ) δ ppm 10.34 (s, 1H), 8.53 (s, 1H), 8.22 (s, 1H), 7.78 (d, J = 8.7 Hz, 1H), 7.47 (d, J = 8.7 Hz, 1H), 7.30-7.41 (m, 5H), 5.62 (s, 2H), 2.41 (t, J = 7.2 Hz, 2H), 2.28 (t, J = 6.8 Hz, 2H), 2.14 (s, 6H), 1.84 (s, 6H), 1.74-1.77 (m, 2H). MS (ESI-) m / z 462 (MH) - .
Пример 325Example 325
N-3,4-дигидро-1H-изохромен-4-ил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN-3,4-dihydro-1H-isochromen-4-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 3,4-дигидро-1H-изохромен-4-амина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,02 (д, 1H), 8,4 (м, 1H), 8,22 (м, 1H), 7,75 (м, 2H), 7,2-7,4 (м, 5H), 5,24 (м, 1H), 4,75 (м, 2H), 4,02 (м, 1H), 3,8 (м, 1H). MS m/z (ESI+) 361 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 3,4-dihydro-1H-isochromen-4-amine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.02 (d, 1H), 8.4 (m, 1H), 8.22 (m, 1H), 7.75 (m, 2H), 7.2 -7.4 (m, 5H), 5.24 (m, 1H), 4.75 (m, 2H), 4.02 (m, 1H), 3.8 (m, 1H). MS m / z (ESI +) 361 (M + H) + .
Пример 326Example 326
N-(циклогексилметил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- (cyclohexylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
5-(1H-Индазол-5-ил)изоксазол-3-карбоновую кислоту (35 мг, 0,15 ммоль, Пример 71A) растворяли в N,N-диметилформамиде (0,8 мл) с последующим добавлением HATU (60 мг, 0,15 ммоль), растворенного в N,N-диметилформамиде (0,8 мл). Затем добавляли раствор 1-циклогексилметанамина (17 мг, 0,17 ммоль), растворенного в N,N-диметилформамиде (0,8 мл), с последующим добавлением диизопропилэтиламина (56 мкл, 0,31 ммоль), растворенного в N,N-диметилформамиде (0,8 мл). Полученную смесь встряхивали в течение 3 часов при 40°C. Реакционную смесь фильтровали, контролировали методом ЖХ/МС и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали при помощи обращенно-фазовой ВЭЖХ (колонка Phenomenex® Luna® C8 (2) 5 мкм 100Å AXIA™ (30 мм × 75 мм), 50 мл/мин, 10-100% ацетонитрила/0,1% трифторуксусной кислоты в воде) с получением указанного в заголовке продукта. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 0,91-0,97 (м, 2H), 1,12-1,27 (м, 4H), 1,61-1,75 (м, 5H), 3,08-3,16 (м, 2H), 7,22-7,24 (м, 1H), 7,71-7,75 (м, 1H), 7,87-7,92 (м, 1H), 8,23-8,27 (м, 1H), 8,38-8,41 (м, 1H). MS (ESI+) m/z 325 (M+H)+; (ESI-) m/z 323 (M-H)-.5- (1H-Indazol-5-yl) isoxazole-3-carboxylic acid (35 mg, 0.15 mmol, Example 71A) was dissolved in N, N-dimethylformamide (0.8 ml) followed by the addition of HATU (60 mg, 0.15 mmol) dissolved in N, N-dimethylformamide (0.8 ml). Then a solution of 1-cyclohexylmethanamine (17 mg, 0.17 mmol) dissolved in N, N-dimethylformamide (0.8 ml) was added, followed by diisopropylethylamine (56 μl, 0.31 mmol) dissolved in N, N- dimethylformamide (0.8 ml). The resulting mixture was shaken for 3 hours at 40 ° C. The reaction mixture was filtered, monitored by LC / MS and concentrated to dryness. Residues were dissolved in 1: 1 dimethyl sulfoxide / methanol and purified by reverse phase HPLC (Phenomenex® Luna® C8 (2) column 5 μm 100Å AXIA ™ (30 mm × 75 mm), 50 ml / min, 10-100% acetonitrile / 0.1% trifluoroacetic acid in water) to give the title product. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 0.91-0.97 (m, 2H), 1.12-1.27 (m, 4H), 1.61-1.75 (m, 5H), 3.08-3.16 (m, 2H) ), 7.22-7.24 (m, 1H), 7.71-7.75 (m, 1H), 7.87-7.92 (m, 1H), 8.23-8.27 (m , 1H), 8.38-8.41 (m, 1H). MS (ESI +) m / z 325 (M + H) + ; (ESI-) m / z 323 (MH) - .
Пример 327Example 327
N-(3-хлорбензил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- (3-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-(3-хлорфенил)метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,47-4,52 (м, 2H), 7,27-7,29 (м, 1H), 7,30-7,42 (м, 4H), 7,72-7,75 (м, 1H), 7,89-7,93 (м, 1H), 8,25-8,28 (м, 1H), 8,41-8,42 (м, 1H). MS (ESI+) m/z 353 (M+H)+; (ESI-) m/z 351 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- (3-chlorophenyl) methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.47-4.52 (m, 2H), 7.27-7.29 (m, 1H), 7.30-7.42 (m, 4H), 7.72-7.75 (m, 1H ), 7.89-7.93 (m, 1H), 8.25-8.28 (m, 1H), 8.41-8.42 (m, 1H). MS (ESI +) m / z 353 (M + H) + ; (ESI-) m / z 351 (MH) - .
Пример 328Example 328
5-(1H-индазол-5-ил)-N-(2-метоксибензил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-methoxybenzyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-(2-метоксифенил)метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,82-3,86 (м, 3H), 4,45-4,50 (м, 2H), 6,92-6,97 (м, 1H), 7,01-7,04 (м, 1H), 7,19-7,24 (м, 1H), 7,26-7,31 (м, 2H), 7,69-7,77 (м, 1H), 7,88-7,93 (м, 1H), 8,24-8,28 (м, 1H), 8,38-8,44 (м, 1H). MS (ESI+) m/z 349 (M+H)+; (ESI-) m/z 347 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- (2-methoxyphenyl) methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.82-3.86 (m, 3H), 4.45-4.50 (m, 2H), 6.92-6.97 (m, 1H), 7.01-7.04 (m, 1H) ), 7.19-7.24 (m, 1H), 7.26-7.31 (m, 2H), 7.69-7.77 (m, 1H), 7.88-7.93 (m , 1H), 8.24-8.28 (m, 1H), 8.38-8.44 (m, 1H). MS (ESI +) m / z 349 (M + H) + ; (ESI-) m / z 347 (MH) - .
Пример 329Example 329
5-(1H-индазол-5-ил)-N-[2-(трифторметил)бензил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- [2- (trifluoromethyl) benzyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-[2-(трифторметил)фенил]метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,66-4,73 (м, 2H), 7,29-7,33 (м, 1H), 7,49-7,60 (м, 2H), 7,67-7,79 (м, 3H), 7,91-7,94 (м, 1H), 8,26-8,28 (м, 1H), 8,41-8,45 (м, 1H). MS (ESI+) m/z 387 (M+H)+; (ESI-) m/z 385 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- [2- (trifluoromethyl) phenyl] methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.66-4.73 (m, 2H), 7.29-7.33 (m, 1H), 7.49-7.60 (m, 2H), 7.67-7.79 (m, 3H) ), 7.91-7.94 (m, 1H), 8.26-8.28 (m, 1H), 8.41-8.45 (m, 1H). MS (ESI +) m / z 387 (M + H) + ; (ESI-) m / z 385 (MH) - .
Пример 330Example 330
5-(1H-индазол-5-ил)-N-[3-(трифторметил)бензил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- [3- (trifluoromethyl) benzyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-[3-(трифторметил)фенил]метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,57-4,61 (м, 2H), 7,28-7,31 (м, 1H), 7,59-7,77 (м, 5H), 7,90-7,94 (м, 1H), 8,27-8,28 (м, 1H), 8,40-8,43 (м, 1H). MS (ESI-) m/z 385 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- [3- (trifluoromethyl) phenyl] methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.57-4.61 (m, 2H), 7.28-7.31 (m, 1H), 7.59-7.77 (m, 5H), 7.90-7.94 (m, 1H ), 8.27-8.28 (m, 1H), 8.40-8.43 (m, 1H). MS (ESI-) m / z 385 (MH) - .
Пример 331Example 331
5-(1H-индазол-5-ил)-N-[4-(трифторметил)бензил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- [4- (trifluoromethyl) benzyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-[4-(трифторметил)фенил]метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,55-4,60 (с, 2H), 7,27-7,30 (м, 1H), 7,54-7,59 (м, 2H), 7,70-7,76 (м, 3H), 7,88-7,94 (м, 1H), 8,24-8,28 (м, 1H), 8,40-8,44 (м, 1H). MS (ESI+) m/z 387 (M+H)+; (ESI-) m/z 385 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- [4- (trifluoromethyl) phenyl] methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.55-4.60 (s, 2H), 7.27-7.30 (m, 1H), 7.54-7.59 (m, 2H), 7.70-7.76 (m, 3H ), 7.88-7.94 (m, 1H), 8.24-8.28 (m, 1H), 8.40-8.44 (m, 1H). MS (ESI +) m / z 387 (M + H) + ; (ESI-) m / z 385 (MH) - .
Пример 332Example 332
5-(1H-индазол-5-ил)-N-(пиридин-2-илметил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (pyridin-2-ylmethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-пиридин-2-илметанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,74-4,84 (с, 2H), 7,30-7,34 (м, 1H), 7,68-7,81 (м, 3H), 7,89-7,97 (м, 1H), 8,22-8,33 (м, 2H), 8,40-8,45 (м, 1H), 8,67-8,76 (м, 1H). MS (ESI+) m/z 320 (M+H)+; (ESI-) m/z 318 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1-pyridin-2-ylmethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.74-4.84 (s, 2H), 7.30-7.34 (m, 1H), 7.68-7.81 (m, 3H), 7.89-7.97 (m, 1H ), 8.22-8.33 (m, 2H), 8.40-8.45 (m, 1H), 8.67-8.76 (m, 1H). MS (ESI +) m / z 320 (M + H) + ; (ESI-) m / z 318 (MH) - .
Пример 333Example 333
5-(1H-индазол-5-ил)-N-(пиридин-3-илметил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (pyridin-3-ylmethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-пиридин-3-илметанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,61-4,68 (с, 2H), 7,27-7,31 (м, 1H), 7,70-7,75 (м, 1H), 7,83-7,94 (м, 2H), 8,24-8,28 (м, 1H), 8,31-8,37 (м, 1H), 8,40-8,44 (м, 1H), 8,69-8,74 (м, 1H), 8,77-8,82 (м, 1H). MS (ESI+) m/z 320 (M+H)+; (ESI-) m/z 318 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1-pyridin-3-ylmethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.61-4.68 (s, 2H), 7.27-7.31 (m, 1H), 7.70-7.75 (m, 1H), 7.83-7.94 (m, 2H) ), 8.24-8.28 (m, 1H), 8.31-8.37 (m, 1H), 8.40-8.44 (m, 1H), 8.69-8.74 (m , 1H); 8.77-8.82 (m, 1H). MS (ESI +) m / z 320 (M + H) + ; (ESI-) m / z 318 (MH) - .
Пример 334Example 334
5-(1H-индазол-5-ил)-N-(пиридин-4-илметил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (pyridin-4-ylmethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-пиридин-4-илметанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,73-4,80 (с, 2H), 7,30-7,33 (м, 1H), 7,73-7,78 (м, 1H), 7,89-7,97 (м, 3H), 8,25-8,30 (м, 1H), 8,40-8,46 (м, 1H), 8,76-8,83 (м, 2H). MS (ESI-) m/z 318 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1-pyridin-4-ylmethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.73-4.80 (s, 2H), 7.30-7.33 (m, 1H), 7.73-7.78 (m, 1H), 7.89-7.97 (m, 3H ), 8.25-8.30 (m, 1H), 8.40-8.46 (m, 1H), 8.76-8.83 (m, 2H). MS (ESI-) m / z 318 (MH) - .
Пример 335Example 335
N-(2-хлорбензил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- (2-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-(2-хлорфенил)метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,54-4,58 (с, 2H), 7,27-7,32 (м, 1H), 7,33-7,42 (м, 3H), 7,47-7,49 (м, 1H), 7,71-7,77 (м, 1H), 7,88-7,98 (м, 1H), 8,24-8,27 (м, 1H), 8,41-8,44 (м, 1H). MS (ESI+) m/z 353 (M+H)+; (ESI-) m/z 351 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- (2-chlorophenyl) methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.54-4.58 (s, 2H), 7.27-7.32 (m, 1H), 7.33-7.42 (m, 3H), 7.47-7.49 (m, 1H ), 7.71-7.77 (m, 1H), 7.88-7.98 (m, 1H), 8.24-8.27 (m, 1H), 8.41-8.44 (m , 1H). MS (ESI +) m / z 353 (M + H) + ; (ESI-) m / z 351 (MH) - .
Пример 336Example 336
N-(4-хлорбензил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- (4-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-(4-хлорфенил)метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,42-4,49 (м, 2H), 7,22-7,31 (м, 1H), 7,34-7,49 (м, 4H), 7,70-7,76 (м, 1H), 7,84-7,92 (м, 1H), 8,17-8,30 (м, 1H), 8,35-8,47 (м, 1H). MS (ESI-) m/z 351 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- (4-chlorophenyl) methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.42-4.49 (m, 2H), 7.22-7.31 (m, 1H), 7.34-7.49 (m, 4H), 7.70-7.76 (m, 1H ), 7.84-7.92 (m, 1H), 8.17-8.30 (m, 1H), 8.35-8.47 (m, 1H). MS (ESI-) m / z 351 (MH) - .
Пример 337Example 337
5-(1H-индазол-5-ил)-N-(1-фенил-2-пиперидин-1-илэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (1-phenyl-2-piperidin-1-yl-ethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 1-фенил-2-пиперидин-1-илэтанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,12 (д, 1H), 8,4 (с, 1H), 8,22 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 7,2-7,4 (м, 6H), 5,2 (м, 1H), 3,2 (м, 2H), 2,3 (м, 4H), 1,2-1,4 (м, 6H). MS (ESI+) m/z 416 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 1-phenyl-2-piperidin-1-ylethanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.12 (d, 1H), 8.4 (s, 1H), 8.22 (s, 1H), 7.9 (d, 1H), 7.7 (d, 1H), 7.2-7.4 (m, 6H), 5.2 (m, 1H), 3.2 (m, 2H), 2.3 (m, 4H), 1.2- 1.4 (m, 6H). MS (ESI +) m / z 416 (M + H) + .
Пример 338Example 338
N-[2-(1H-индазол-1-ил)-1-фенилэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2- (1H-indazol-1-yl) -1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-(1H-индазол-1-ил)-1-фенилэтанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,5 (д, 1H), 8,4 (с, 1H), 8,22 (с, 1H), 7,78 (м, 1H), 7,52 (д, 2H), 7,72 (д, 2H), 7,2-7,4 (м, 5H), 6,85 (с, 1H), 5,44 (м, 1H), 4,44 (м, 2H). MS (ESI+) m/z 399 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2- (1H-indazol-1-yl) -1-phenylethanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.5 (d, 1H), 8.4 (s, 1H), 8.22 (s, 1H), 7.78 (m, 1H), 7.52 (d, 2H), 7.72 (d, 2H), 7.2-7.4 (m, 5H), 6.85 (s, 1H), 5.44 (m, 1H), 4.44 ( m, 2H). MS (ESI +) m / z 399 (M + H) + .
Пример 339Example 339
5-(1H-индазол-5-ил)-N-(2-морфолин-4-ил-1-фенилэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-morpholin-4-yl-1-phenylethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-морфолин-4-ил-1-фенилэтанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,2 (д, 1H), 8,4 (с, 1H), 8,22 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 7,2-7,4 (м, 6H), 5,2 (м, 1H), 3,6 (м, 4H), 3,4 (м, 2H), 2,4 (м, 4H). MS (ESI+) m/z 418 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2-morpholin-4-yl-1-phenylethanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.2 (d, 1H), 8.4 (s, 1H), 8.22 (s, 1H), 7.9 (d, 1H), 7.7 (d, 1H), 7.2-7.4 (m, 6H), 5.2 (m, 1H), 3.6 (m, 4H), 3.4 (m, 2H), 2.4 ( m, 4H). MS (ESI +) m / z 418 (M + H) + .
Пример 340Example 340
5-(1H-индазол-5-ил)-N-[2-(4-метилпиперазин-1-ил)-1-фенилэтил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- [2- (4-methylpiperazin-1-yl) -1-phenylethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-(4-метилпиперазин-1-ил)-1-фенилэтанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,6 (ушир.с, 1H), 9,14 (д, 1H), 8,4 (с, 1H), 8,22 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 7,2-7,4 (м, 6H), 5,2 (м, 1H), 3,2 (м, 2H), 2,4 (м, 4H), 2,2 (м, 4H), 2,1 (м, 3H). MS (ESI+) m/z 432 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2- (4-methylpiperazin-1-yl) -1-phenylethanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.6 (br s, 1H), 9.14 (d, 1H), 8.4 (s, 1H), 8.22 (s, 1H), 7.9 (d, 1H), 7.7 (d, 1H), 7.2-7.4 (m, 6H), 5.2 (m, 1H), 3.2 (m, 2H), 2.4 (m, 4H), 2.2 ( m, 4H); 2.1 (m, 3H). MS (ESI +) m / z 432 (M + H) + .
Пример 341Example 341
5-(1H-индазол-5-ил)-N-(1-фенил-2-пирролидин-1-илэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (1-phenyl-2-pyrrolidin-1-yl-ethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 1-фенил-2-пирролидин-1-илэтанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,14 (д, 1H), 8,4 (с, 1H), 8,22 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 7,2-7,4 (м, 6H), 5,18 (м, 1H), 3,2 (м, 2H), 2,4 (м, 4H), 1,8 (м, 3H). MS (ESI+) m/z 402,5 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 1-phenyl-2-pyrrolidin-1-ylethanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.14 (d, 1H), 8.4 (s, 1H), 8.22 (s, 1H), 7.9 (d, 1H), 7.7 (d, 1H), 7.2-7.4 (m, 6H), 5.18 (m, 1H), 3.2 (m, 2H), 2.4 (m, 4H), 1.8 ( m, 3H). MS (ESI +) m / z 402.5 (M + H) + .
Пример 342Example 342
трет-бутил 2-({[5-(1H-индазол-5-ил)изоксазол-3-ил]карбонил} амино)-2-фенилэтилкарбаматtert-butyl 2 - ({[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} amino) -2-phenylethylcarbamate
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием трет-бутил 2-амино-2-фенилэтилкарбамата вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,14 (д, 1H), 8,4 (с, 1H), 8,22 (с, 1H), 7,9 (д, 1H), 7,7 (д, 1H), 7,2-7,4 (м, 6H), 7,00 (т, 1H), 5,18 (м, 1H), 3,2 (м, 2H), 1,4 (с, 9H). MS (ESI+) m/z 449 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using tert-butyl 2-amino-2-phenylethylcarbamate instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.14 (d, 1H), 8.4 (s, 1H), 8.22 (s, 1H), 7.9 (d, 1H), 7.7 (d, 1H), 7.2-7.4 (m, 6H), 7.00 (t, 1H), 5.18 (m, 1H), 3.2 (m, 2H), 1.4 ( s, 9H). MS (ESI +) m / z 449 (M + H) + .
Пример 343Example 343
5-(1H-индазол-5-ил)-N-(1-нафтилметил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (1-naphthylmethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1-(1-нафтил)метанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 4,93-4,99 (м, 2H), 7,28-7,32 (м, 1H), 7,48-7,66 (м, 4H), 7,70-7,76 (м, 1H), 7,86-7,92 (м, 2H), 7,96-8,00 (м, 1H), 8,18-8,23 (м, 1H), 8,24-8,27 (м, 1H), 8,38-8,44 (м, 1H). MS (ESI-) m/z 367 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1- (1-naphthyl) methanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 4.93-4.99 (m, 2H), 7.28-7.32 (m, 1H), 7.48-7.66 (m, 4H), 7.70-7.76 (m, 1H) ), 7.86-7.92 (m, 2H), 7.96-8.00 (m, 1H), 8.18-8.23 (m, 1H), 8.24-8.27 (m , 1H), 8.38-8.44 (m, 1H). MS (ESI-) m / z 367 (MH) - .
Пример 344Example 344
5-(1H-индазол-5-ил)-N-(2-фенилэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-phenylethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 2-фенилэтанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,84-2,92 (т, 2H), 3,47-3,57 (т, 2H), 7,18-7,35 (м, 6H), 7,69-7,77 (м, 1H), 7,86-7,91 (м, 1H), 8,22-8,29 (м, 1H), 8,37-8,44 (м, 1H). MS (ESI+) m/z 333 (M+H)+; (ESI-) m/z 331 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 2-phenylethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.84-2.92 (t, 2H), 3.47-3.57 (t, 2H), 7.18-7.35 (m, 6H), 7.69-7.77 (m, 1H ), 7.86-7.91 (m, 1H), 8.22-8.29 (m, 1H), 8.37-8.44 (m, 1H). MS (ESI +) m / z 333 (M + H) + ; (ESI-) m / z 331 (MH) - .
Пример 345Example 345
5-(1H-индазол-5-ил)-N-(2-пиридин-2-илэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-pyridin-2-yl-ethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 2-пиридин-2-илэтанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,22-3,29 (т, 2H), 3,71-3,75 (т, 2H), 7,14-7,26 (м, 1H), 7,70-7,75 (м, 1H), 7,81-7,94 (м, 3H), 8,23-8,29 (м, 1H), 8,35-8,44 (м, 2H), 8,71-8,83 (м, 1H). MS (ESI+) m/z 334 (M+H)+; (ESI-) m/z 332 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 2-pyridin-2-yl-ethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.22-3.29 (t, 2H), 3.71-3.75 (t, 2H), 7.14-7.26 (m, 1H), 7.70-7.75 (m, 1H ), 7.81-7.94 (m, 3H), 8.23-8.29 (m, 1H), 8.35-8.44 (m, 2H), 8.71-8.83 (m , 1H). MS (ESI +) m / z 334 (M + H) + ; (ESI-) m / z 332 (MH) - .
Пример 346Example 346
5-(1H-индазол-5-ил)-N-(2-пиридин-3-илэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-pyridin-3-yl-ethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 2-пиридин-3-илэтанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,01-3,13 (т, 2H), 3,55-3,70 (т, 2H), 7,14-7,26 (м, 1H), 7,70-7,77 (м, 1H), 7,84-7,95 (м, 2H), 8,25-8,29 (м, 1H), 8,36-8,45 (м, 2H), 8,69-8,75 (м, 1H), 8,77-8,84 (м, 1H). MS (ESI+) m/z 334 (M+H)+; (ESI-) m/z 332 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 2-pyridin-3-yl-ethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.01-3.13 (t, 2H), 3.55-3.70 (t, 2H), 7.14-7.26 (m, 1H), 7.70-7.77 (m, 1H ), 7.84-7.95 (m, 2H), 8.25-8.29 (m, 1H), 8.36-8.45 (m, 2H), 8.69-8.75 (m , 1H); 8.77-8.84 (m, 1H). MS (ESI +) m / z 334 (M + H) + ; (ESI-) m / z 332 (MH) - .
Пример 347Example 347
5-(1H-индазол-5-ил)-N-(2-пиридин-4-илэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N- (2-pyridin-4-yl-ethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 2-пиридин-4-илэтанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,12-3,23 (т, 2H), 3,67-3,71 (т, 2H), 7,20-7,21 (м, 1H), 7,69-7,76 (м, 1H), 7,86-7,91 (м, 3H), 8,25-8,27 (м, 1H), 8,38-8,41 (м, 1H), 8,70-8,77 (м, 2H). MS (ESI+) m/z 334 (M+H)+; (ESI-) m/z 332 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 2-pyridin-4-ylethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.12-3.23 (t, 2H), 3.67-3.71 (t, 2H), 7.20-7.21 (m, 1H), 7.69-7.76 (m, 1H ), 7.86-7.91 (m, 3H), 8.25-8.27 (m, 1H), 8.38-8.41 (m, 1H), 8.70-8.77 (m , 2H). MS (ESI +) m / z 334 (M + H) + ; (ESI-) m / z 332 (MH) - .
Пример 348Example 348
N-[2-(2-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2- (2-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 2-(2-хлорфенил)этанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,99-3,05 (т, 2H), 3,54-3,61 (т, 2H), 7,21-7,23 (м, 1H), 7,26-7,33 (м, 2H), 7,35-7,40 (м, 1H), 7,41-7,47 (м, 1H), 7,70-7,75 (м, 1H), 7,87-7,93 (м, 1H), 8,23-8,31 (м, 1H), 8,37-8,44 (м, 1H). MS (ESI+) m/z 367 (M+H)+; (ESI-) m/z 365 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 2- (2-chlorophenyl) ethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.99-3.05 (t, 2H), 3.54-3.61 (t, 2H), 7.21-7.23 (m, 1H), 7.26-7.33 (m, 2H) ), 7.35-7.40 (m, 1H), 7.41-7.47 (m, 1H), 7.70-7.75 (m, 1H), 7.87-7.93 (m , 1H), 8.23-8.31 (m, 1H), 8.37-8.44 (m, 1H). MS (ESI +) m / z 367 (M + H) + ; (ESI-) m / z 365 (MH) - .
Пример 349Example 349
N-[2-(3-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2- (3-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 2-(3-хлорфенил)этанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,89 (т, 2H), 3,54 (т, 2H), 7,19-7,42 (м, 5H), 7,69-7,77 (м, 1H), 7,86-7,94 (м, 1H), 8,22-8,29 (м, 1H), 8,38-8,42 (м, 1H). MS (ESI-) m/z 365 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 2- (3-chlorophenyl) ethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.89 (t, 2H), 3.54 (t, 2H), 7.19-7.42 (m, 5H), 7.69-7.77 (m, 1H), 7.86-7, 94 (m, 1H), 8.22-8.29 (m, 1H), 8.38-8.42 (m, 1H). MS (ESI-) m / z 365 (MH) - .
Пример 350Example 350
N-[2-(4-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 2-(4-хлорфенил)этанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,86 (т, 2H), 3,50 (т, 2H), 7,17-7,24 (м, 1H), 7,27-7,41 (м, 4H), 7,71-7,76 (м, 1H), 7,85-7,91 (м, 1H), 8,21-8,29 (м, 1H), 8,34-8,44 (м, 1H). MS (ESI-) m/z 365 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 2- (4-chlorophenyl) ethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.86 (t, 2H), 3.50 (t, 2H), 7.17-7.24 (m, 1H), 7.27-7.41 (m, 4H), 7.71-7, 76 (m, 1H), 7.85-7.91 (m, 1H), 8.21-8.29 (m, 1H), 8.34-8.44 (m, 1H). MS (ESI-) m / z 365 (MH) - .
Пример 351Example 351
N-бензил-N-этил-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN-benzyl-N-ethyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали N-бензил-N-этиламин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,06-1,19 (м, 3H), 3,37-3,49 (м, 2H), 4,69-4,76 (м, 2H), 7,21-7,28 (м, 1H), 7,28-7,49 (м, 5H), 7,69-7,78 (м, 1H), 7,83-7,97 (м, 1H), 8,24-8,32 (м, 1H), 8,36-8,46 (м, 1H). MS (ESI+) m/z 347 (M+H)+; (ESI-) m/z 345 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that N-benzyl-N-ethylamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.06-1.19 (m, 3H), 3.37-3.49 (m, 2H), 4.69-4.76 (m, 2H), 7.21-7.28 (m, 1H ), 7.28-7.49 (m, 5H), 7.69-7.78 (m, 1H), 7.83-7.97 (m, 1H), 8.24-8.32 (m , 1H); 8.36-8.46 (m, 1H). MS (ESI +) m / z 347 (M + H) + ; (ESI-) m / z 345 (MH) - .
Пример 352Example 352
5-(1H-индазол-5-ил)-N-метил-N-(1-нафтилметил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N-methyl-N- (1-naphthylmethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали N-метил-N-(1-нафтилметил)амин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,04-3,11 (м, 3H), 5,20-5,35 (м, 2H), 7,20-7,31 (м, 1H), 7,33-7,66 (м, 4H), 7,66-7,77 (м, 1H), 7,81-8,18 (м, 4H), 8,20-8,28 (м, 1H), 8,31-8,45 (м, 1H). MS (ESI+) m/z 383 (M+H)+; (ESI-) m/z 381 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that N-methyl-N- (1-naphthylmethyl) amine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.04-3.11 (m, 3H), 5.20-5.35 (m, 2H), 7.20-7.31 (m, 1H), 7.33-7.66 (m, 4H ), 7.66-7.77 (m, 1H), 7.81-8.18 (m, 4H), 8.20-8.28 (m, 1H), 8.31-8.45 (m , 1H). MS (ESI +) m / z 383 (M + H) + ; (ESI-) m / z 381 (MH) - .
Пример 353Example 353
5-(1H-индазол-5-ил)-N-метил-N-(2-фенилэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N-methyl-N- (2-phenylethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали N-метил-N-(2-фенилэтил)амин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,86-2,97 (м, 2H), 3,06-3,13 (м, 3H), 3,70-3,74 (м, 2H), 6,64-7,39 (м, 6H), 7,69-7,92 (м, 2H), 8,24-8,44 (м, 2H). MS (ESI+) m/z 347 (M+H)+; (ESI-) m/z 345 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that N-methyl-N- (2-phenylethyl) amine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.86-2.97 (m, 2H), 3.06-3.13 (m, 3H), 3.70-3.74 (m, 2H), 6.64-7.39 (m, 6H ), 7.69-7.92 (m, 2H), 8.24-8.44 (m, 2H). MS (ESI +) m / z 347 (M + H) + ; (ESI-) m / z 345 (MH) - .
Пример 354Example 354
5-(1H-индазол-5-ил)-N-метил-N-(2-пиридин-2-илэтил)изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N-methyl-N- (2-pyridin-2-yl-ethyl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали N-метил-N-(2-пиридин-2-илэтил)амин вместо 1-циклогексилметанамин. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,07-3,22 (м, 3H), 3,26-3,39 (м, 2H), 3,92-4,04 (м, 2H), 6,85-7,14 (м, 1H), 7,65-8,05 (м, 4H), 8,23-8,56 (м, 3H), 8,65-8,86 (м, 1H). MS (ESI+) m/z 348 (M+H)+; (ESI-) m/z 346 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that N-methyl-N- (2-pyridin-2-yl-ethyl) amine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.07-3.22 (m, 3H), 3.26-3.39 (m, 2H), 3.92-4.04 (m, 2H), 6.85-7.14 (m, 1H ), 7.65-8.05 (m, 4H), 8.23-8.56 (m, 3H), 8.65-8.86 (m, 1H). MS (ESI +) m / z 348 (M + H) + ; (ESI-) m / z 346 (MH) - .
Пример 355Example 355
5-(1H-индазол-5-ил)-N-[(1R)-1-фенилэтил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1R) -1-phenylethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали (1R)-1-фенилэтанамин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,49-1,54 (м, 3H), 5,12-5,20 (м, 1H), 7,23-7,29 (м, 2H), 7,33-7,46 (м, 4H), 7,71-7,75 (м, 1H), 7,87-7,91 (м, 1H), 8,22-8,28 (м, 1H), 8,37-8,42 (м, 1H). MS (ESI+) m/z 333 (M+H)+; (ESI-) m/z 331 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that (1R) -1-phenylethanamine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.49-1.54 (m, 3H), 5.12-5.20 (m, 1H), 7.23-7.29 (m, 2H), 7.33-7.46 (m, 4H ), 7.71-7.75 (m, 1H), 7.87-7.91 (m, 1H), 8.22-8.28 (m, 1H), 8.37-8.42 (m , 1H). MS (ESI +) m / z 333 (M + H) + ; (ESI-) m / z 331 (MH) - .
Пример 356Example 356
5-(1H-индазол-5-ил)-N-1,2,3,4-тетрагидронафталин-1- илизоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N-1,2,3,4-tetrahydronaphthalen-1-yl-isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 326, за исключением того, что использовали 1,2,3,4-тетрагидронафталин-1-амин вместо 1-циклогексилметанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,72-2,09 (м, 4H), 2,68-2,85 (м, 2H), 5,19-5,26 (м, 1H), 7,12-7,24 (м, 4H), 7,29-7,35 (м, 1H), 7,69-7,77 (м, 1H), 7,86-7,93 (м, 1H), 8,25-8,30 (м, 1H), 8,38-8,43 (м, 1H). MS (ESI-) m/z 357 (M-H)-.The title compound was prepared using the procedure described in Example 326, except that 1,2,3,4-tetrahydronaphthalen-1-amine was used instead of 1-cyclohexylmethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.72-2.09 (m, 4H), 2.68-2.85 (m, 2H), 5.19-5.26 (m, 1H), 7.12-7.24 (m, 4H) ), 7.29-7.35 (m, 1H), 7.69-7.77 (m, 1H), 7.86-7.93 (m, 1H), 8.25-8.30 (m , 1H), 8.38-8.43 (m, 1H). MS (ESI-) m / z 357 (MH) - .
Пример 357Example 357
5-(1H-индазол-5-ил)-N-[(1S)-1-(1-нафтил)этил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1S) -1- (1-naphthyl) ethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (1S)-1-(1-нафтил)этанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,4 (д, 1H), 8,4 (с, 1H), 8,25 (с, 1H), 8,22 (ушир.с, 1H), 7,95 (д, 1H), 7,85 (м, 2H), 7,65 (м, 2H), 7,5 (м, 3H), 7,3 (с, 1H), 5,9 (м, 1H), 1,65 (д, 3H). MS (ESI+) m/z 382,9 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (1S) -1- (1-naphthyl) ethanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.4 (d, 1H), 8.4 (s, 1H), 8.25 (s, 1H), 8.22 (br s, 1H), 7 95 (d, 1H), 7.85 (m, 2H), 7.65 (m, 2H), 7.5 (m, 3H), 7.3 (s, 1H), 5.9 (m, 1H), 1.65 (d, 3H). MS (ESI +) m / z 382.9 (M + H) + .
Пример 358Example 358
5-(1H-индазол-5-ил)-N-[(1R)-1-(1-нафтил)этил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1R) -1- (1-naphthyl) ethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (1R)-1-(1-нафтил)этанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,4 (д, 1H), 8,4 (с, 1H), 8,25 (с, 1H), 8,22 (ушир.с, 1H), 7,95 (д, 1H), 7,85 (м, 2H), 7,65 (м, 2H), 7,5 (м, 3H), 7,3 (с, 1H), 5,9 (м, 1H), 1,65 (д, 3H). MS (ESI+) m/z 382,9 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (1R) -1- (1-naphthyl) ethanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.4 (d, 1H), 8.4 (s, 1H), 8.25 (s, 1H), 8.22 (br s, 1H), 7 95 (d, 1H), 7.85 (m, 2H), 7.65 (m, 2H), 7.5 (m, 3H), 7.3 (s, 1H), 5.9 (m, 1H), 1.65 (d, 3H). MS (ESI +) m / z 382.9 (M + H) + .
Пример 359Example 359
N-[3-(диметиламино)-1-фенилпропил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [3- (dimethylamino) -1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием N3,N3-диметил-1-фенилпропан-1,3-диамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,4 (д, 1H), 8,4 (с, 1H), 8,25 (с, 1H), 7,92 (м, 1H), 7,7 (м, 1H), 7,3-7,5 (м, 6H), 5,15 (м, 1H), 3,2 (м, 2H), 7,75 (с, 6H), 2,35 (м, 1H), 2,15 (м, 1H). MS (ESI+) m/z 390 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using N 3 , N 3 -dimethyl-1-phenylpropane-1,3-diamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.4 (d, 1H), 8.4 (s, 1H), 8.25 (s, 1H), 7.92 (m, 1H), 7.7 (m, 1H), 7.3-7.5 (m, 6H), 5.15 (m, 1H), 3.2 (m, 2H), 7.75 (s, 6H), 2.35 ( m, 1H); 2.15 (m, 1H). MS (ESI +) m / z 390 (M + H) + .
Пример 360Example 360
Ν-(2,3-дигидро-1,4-бензодиоксин-5-илметил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидΝ- (2,3-dihydro-1,4-benzodioxin-5-ylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 1-(2,3-дигидро-1,4-бензодиоксин-5-ил)метанамина вместо пиперидина. 1H ЯМР (SOO МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,24 (т, 1H), 8,4 (с, 1H), 8,25 (с, 1H), 7,92 (д, 1H), 7,7 (д, 1H), 7,24 (с, 1H), 6,9 (м, 3H), 4,4 (д, 2H), 4,3 (д, 2H), 4,25 (д, 2H). MS (ESI+) m/z 377 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 1- (2,3-dihydro-1,4-benzodioxin-5-yl) methanamine instead of piperidine. 1 H NMR (SOO MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.24 (t, 1H), 8.4 (s, 1H), 8.25 (s, 1H), 7.92 (d, 1H), 7.7 (d, 1H), 7.24 (s, 1H), 6.9 (m, 3H), 4.4 (d, 2H), 4.3 (d, 2H), 4.25 (d, 2H) . MS (ESI +) m / z 377 (M + H) + .
Пример 361Example 361
N-(3,4-дигидро-2H-1,5-бензодиоксепин-6-илметил)-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- (3,4-dihydro-2H-1,5-benzodioxepin-6-ylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 1-(3,4-дигидро-2H-1,5-бензодиоксепин-6-ил)метанамина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,2 (т, 1H), 8,4 (с, 1H), 8,25 (с, 1H), 7,92 (д, 1H), 7,7 (д, 1H), 7,24 (с, 1H), 6,9 (м, 3H), 4,42 (д, 2H), 4,15 (м, 4H), 2,2 (м, 2H). MS (ESI+) m/z 391 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 1- (3,4-dihydro-2H-1,5-benzodioxepin-6-yl) methanamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.2 (t, 1H), 8.4 (s, 1H), 8.25 (s, 1H), 7.92 (d, 1H), 7.7 (d, 1H), 7.24 (s, 1H), 6.9 (m, 3H), 4.42 (d, 2H), 4.15 (m, 4H), 2.2 (m, 2H) . MS (ESI +) m / z 391 (M + H) + .
Пример 362Example 362
5-(1H-индазол-5-ил)-N-[(1-метил-1H-индол-4-ил)метил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1-methyl-1H-indol-4-yl) methyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием (1-метил-1H-индол-4-ил)метиламина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 9,24 (т, 1H), 8,4 (с, 1H), 8,25 (с, 1H), 7,92 (д, 1H), 7,7 (д, 1H), 7,38 (м, 3H), 7,18 (м, 1H), 7,0 (д, 1H), 6,6 (с, 1H), 4,7 (д, 2H), 3,8 (с, 3H). MS (ESI+) m/z 372 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using (1-methyl-1H-indol-4-yl) methylamine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 9.24 (t, 1H), 8.4 (s, 1H), 8.25 (s, 1H), 7.92 (d, 1H), 7.7 (d, 1H), 7.38 (m, 3H), 7.18 (m, 1H), 7.0 (d, 1H), 6.6 (s, 1H), 4.7 (d, 2H) 3.8 (s, 3H). MS (ESI +) m / z 372 (M + H) + .
Пример 363Example 363
5-{3-[(3-фенилпирролидин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол5- {3 - [(3-phenylpyrrolidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 3-фенилпирролидина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 8,4 (м, 1H), 8,25 (с, 1H), 7,92 (д, 1H), 7,8 (д, 1H), 7,24 (м, 6H), 4,4 (м, 1H), 3,4 (м, 2H), 2,4 (м, 2H), 2,0 (м, 2H). MS (ESI+) m/z 359 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 3-phenylpyrrolidine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 8.4 (m, 1H), 8.25 (s, 1H), 7.92 (d, 1H), 7.8 (d, 1H), 7.24 (m, 6H), 4.4 (m, 1H), 3.4 (m, 2H), 2.4 (m, 2H), 2.0 (m, 2H). MS (ESI +) m / z 359 (M + H) + .
Пример 364Example 364
5-{3-[(2-фенилпирролидин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол5- {3 - [(2-phenylpyrrolidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-фенилпирролидина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 8,4 (м, 1H), 8,25 (с, 1H), 7,92 (д, 1H), 7,8 (д, 1H), 7,24 (м, 6H), 5,6 (м, 0,3H), 5,2 (м, 0,7H), 4,0 (м, 2H), 1,8-2,0 (м, 4H). MS (ESI+) m/z 390 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2-phenylpyrrolidine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 8.4 (m, 1H), 8.25 (s, 1H), 7.92 (d, 1H), 7.8 (d, 1H), 7.24 (m, 6H), 5.6 (m, 0.3H), 5.2 (m, 0.7H), 4.0 (m, 2H), 1.8-2.0 (m, 4H). MS (ESI +) m / z 390 (M + H) + .
Пример 365Example 365
5-{3-[(2-фенилпиперидин-1-ил)карбонил]изоксазол-5-ил}-1H-индазол5- {3 - [(2-phenylpiperidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole
Указанное в заголовке соединение получали в соответствии с процедурой, описанной в Примере 81B, с использованием 2-фенилпиперидина вместо пиперидина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 13,4 (ушир.с, 1H), 8,4 (м, 1H), 8,25 (с, 1H), 7,92 (д, 1H), 7,8 (д, 1H), 7,24 (м, 6H), 5,6 (м, 0,3H), 5,2 (м, 0,7H), 4,0 (м, 2H), 1,8-2,0 (м, 6H). MS (ESI+) m/z 373 (M+H)+.The title compound was prepared according to the procedure described in Example 81B using 2-phenylpiperidine instead of piperidine. 1 H NMR (300 MHz, DMSO-d 6 ) δ ppm 13.4 (br s, 1H), 8.4 (m, 1H), 8.25 (s, 1H), 7.92 (d, 1H), 7.8 (d, 1H), 7.24 (m, 6H), 5.6 (m, 0.3H), 5.2 (m, 0.7H), 4.0 (m, 2H), 1.8-2.0 (m, 6H). MS (ESI +) m / z 373 (M + H) + .
Пример 366Example 366
5-(1H-индазол-5-ил)-N-[(1S)-1-фенилэтил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1S) -1-phenylethyl] isoxazole-3-carboxamide
5-(1H-Индазол-5-ил)изоксазол-3-карбоновую кислоту (36 мг, 0,16 ммоль, Пример 71A) растворяли в N,N-диметилформамиде (1,0 мл) с последующим добавлением HATU (60 мг, 0,16 ммоль), растворенного в N,N-диметилформамиде (0,5 мл). Затем добавляли раствор (S)-1-фенилэтанамина (22 мг, 0,18 ммоль), растворенного в N,N-диметилформамиде (0,6 мл) с последующим добавлением диизопропилэтиламина (56 мкл, 0,32 ммоль), растворенного в N,N-диметилформамиде (0,2 мл). Полученную смесь встряхивали в течение 3 часов при 40°C. Реакционную смесь фильтровали, контролировали методом ЖХ/МС и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали при помощи обращенно-фазовой ВЭЖХ (колонка Phenomenex® Luna® C8(2) 5 мкм 100Å AXIA™ (30 мм × 75 мм), 50 мл/мин, 10-100% ацетонитрила/0,1% трифторуксусной кислоты в воде) с получением указанного в заголовке продукта. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,50 (д, 3H), 5,06-5,22 (м, 1H), 7,23-7,29 (м, 2H), 7,34-7,38 (м, 2H), 7,40-7,45 (м, 2H), 7,70-7,75 (м, 1H), 7,87-7,92 (м, 1H), 8,25-8,27 (м, 1H), 8,39-8,41 (м, 1H), 9,28 (д, 1H). MS (ESI+) m/z 333 (M+H)+; (ESI-) m/z 331 (M-H)-.5- (1H-Indazol-5-yl) isoxazole-3-carboxylic acid (36 mg, 0.16 mmol, Example 71A) was dissolved in N, N-dimethylformamide (1.0 ml) followed by the addition of HATU (60 mg, 0.16 mmol) dissolved in N, N-dimethylformamide (0.5 ml). Then, a solution of (S) -1-phenylethanamine (22 mg, 0.18 mmol) dissolved in N, N-dimethylformamide (0.6 ml) was added, followed by diisopropylethylamine (56 μl, 0.32 mmol) dissolved in N N-dimethylformamide (0.2 ml). The resulting mixture was shaken for 3 hours at 40 ° C. The reaction mixture was filtered, monitored by LC / MS and concentrated to dryness. Residues were dissolved in 1: 1 dimethyl sulfoxide / methanol and purified by reverse phase HPLC (Phenomenex® Luna® C8 (2) column 5 μm 100Å AXIA ™ (30 mm × 75 mm), 50 ml / min, 10-100% acetonitrile / 0.1% trifluoroacetic acid in water) to give the title product. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.50 (d, 3H), 5.06-5.22 (m, 1H), 7.23-7.29 (m, 2H), 7.34-7.38 (m, 2H), 7, 40-7.45 (m, 2H), 7.70-7.75 (m, 1H), 7.87-7.92 (m, 1H), 8.25-8.27 (m, 1H), 8.39-8.41 (m, 1H); 9.28 (d, 1H). MS (ESI +) m / z 333 (M + H) + ; (ESI-) m / z 331 (MH) - .
Пример 367Example 367
5-(1H-индазол-5-ил)-Ν-[(1R)-1-(4-метилфенил)этил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -Ν - [(1R) -1- (4-methylphenyl) ethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R)-1-(4-метилфенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,49 (д, 3H), 2,25-2,31 (м, 3H), 5,09-5,18 (м, 1H), 7,14-7,18 (м, 2H), 7,23-7,24 (м, 1H), 7,28-7,32 (м, 2H), 7,70-7,75 (м, 1H), 7,86-7,92 (м, 1H), 8,22-8,29 (м, 1H), 8,37-8,42 (м, 1H), 9,19 (д, 1H). MS (ESI+) m/z 347 (M+H)+; (ESI-) 345 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1R) -1- (4-methylphenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.49 (d, 3H), 2.25-2.31 (m, 3H), 5.09-5.18 (m, 1H), 7.14-7.18 (m, 2H), 7, 23-7.24 (m, 1H), 7.28-7.32 (m, 2H), 7.70-7.75 (m, 1H), 7.86-7.92 (m, 1H), 8.22-8.29 (m, 1H); 8.37-8.42 (m, 1H); 9.19 (d, 1H). MS (ESI +) m / z 347 (M + H) + ; (ESI-) 345 (MH) - .
Пример 368Example 368
5-(1H-индазол-5-ил)-N-[(1S)-1-(4-метилфенил)этил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1S) -1- (4-methylphenyl) ethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1S)-1-(4-метилфенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,48 (д, 3H), 2,26-2,30 (м, 3H), 5,05-5,23 (м, 1H), 7,15-7,17 (м, 2H), 7,22-7,25 (м, 1H), 7,28-7,32 (м, 2H), 7,67-7,79 (м, 1H), 7,86-7,93 (м, 1H), 8,22-8,30 (м, 1H), 8,38-8,41 (м, 1H), 9,21 (д, 1H). MS (ESI-) m/z 345(M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1S) -1- (4-methylphenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.48 (d, 3H), 2.26-2.30 (m, 3H), 5.05-5.23 (m, 1H), 7.15-7.17 (m, 2H), 7, 22-7.25 (m, 1H), 7.28-7.32 (m, 2H), 7.67-7.79 (m, 1H), 7.86-7.93 (m, 1H), 8.22-8.30 (m, 1H), 8.38-8.41 (m, 1H), 9.21 (d, 1H). MS (ESI-) m / z 345 (MH) - .
Пример 369Example 369
N-[(1R,2S)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R, 2S) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R,2S)-1-аминоиндан-2-ол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,89-2,96 (м, 1H), 3,13-3,21 (м, 1H), 4,55-4,61 (м, 1H), 5,40-5,47 (м, 1H), 7,21-7,34 (м, 4H), 7,39-7,42 (м, 1H), 7,72-7,77 (м, 1H), 7,91-7,95 (м, 1H), 8,25-8,29 (м, 1H), 8,42-8,45 (м, 1H). MS (ESI-) m/z 359 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1R, 2S) -1-aminoindan-2-ol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.89-2.96 (m, 1H), 3.13-3.21 (m, 1H), 4.55-4.61 (m, 1H), 5.40-5.47 (m, 1H) ), 7.21-7.34 (m, 4H), 7.39-7.42 (m, 1H), 7.72-7.77 (m, 1H), 7.91-7.95 (m , 1H), 8.25-8.29 (m, 1H), 8.42-8.45 (m, 1H). MS (ESI-) m / z 359 (MH) - .
Пример 370Example 370
N-[(1R,2R)-2-гидрокси-2,3-дигидро-1H-инден-1-ил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R, 2R) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R,2R)-1-аминоиндан-2-ол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,72-2,83 (м, 1H), 3,13-3,30 (м, 1H), 4,44-4,53 (м, 1H), 5,24-5,32 (м, 1H), 7,10-7,18 (м, 1H), 7,20-7,27 (м, 3H), 7,30-7,33 (м, 1H), 7,72-7,78 (м, 1H), 7,91-7,93 (м, 1H), 8,24-8,29 (м, 1H), 8,41-8,45 (м, 1H), 9,17 (д, 1H). MS (ESI-) m/z 359 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1R, 2R) -1-aminoindan-2-ol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.72-2.83 (m, 1H), 3.13-3.30 (m, 1H), 4.44-4.53 (m, 1H), 5.24-5.32 (m, 1H) ), 7.10-7.18 (m, 1H), 7.20-7.27 (m, 3H), 7.30-7.33 (m, 1H), 7.72-7.78 (m , 1H), 7.91-7.93 (m, 1H), 8.24-8.29 (m, 1H), 8.41-8.45 (m, 1H), 9.17 (d, 1H ) MS (ESI-) m / z 359 (MH) - .
Пример 371Example 371
N-[(1R)-1-(4-бромфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R) -1- (4-bromophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R)-1-(4-бромфенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,50 (д, 3H), 5,08-5,18 (м, 1H), 7,21-7,27 (м, 1H), 7,36-7,41 (м, 2H), 7,50-7,59 (м, 2H), 7,70-7,76 (м, 1H), 7,86-7,93 (м, 1H), 8,23-8,29 (м, 1H), 8,38-8,41 (м, 1H), 9,32 (д, 1H). MS (ESI+) m/z 411 (M+H)+.The title compound was prepared using the procedure described in Example 366, except that (1R) -1- (4-bromophenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.50 (d, 3H), 5.08-5.18 (m, 1H), 7.21-7.27 (m, 1H), 7.36-7.41 (m, 2H), 7, 50-7.59 (m, 2H), 7.70-7.76 (m, 1H), 7.86-7.93 (m, 1H), 8.23-8.29 (m, 1H), 8.38-8.41 (m, 1H); 9.32 (d, 1H). MS (ESI +) m / z 411 (M + H) + .
Пример 372Example 372
N-[(1S)-1-(4-бромфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1S) -1- (4-bromophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (lS)-1-(4-бромфенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,49 (д, 3H), 5,09-5,19 (м, 1H), 7,23-7,25 (м, 1H), 7,37-7,40 (м, 2H), 7,53-7,57 (м, 2H), 7,71-7,75 (м, 1H), 7,87-7,92 (м, 1H), 8,25-8,27 (м, 1H), 8,38-8,41 (м, 1H), 9,32 (д, 1H). MS (ESI) отрицательный ион 409 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (lS) -1- (4-bromophenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.49 (d, 3H), 5.09-5.19 (m, 1H), 7.23-7.25 (m, 1H), 7.37-7.40 (m, 2H), 7, 53-7.57 (m, 2H), 7.71-7.75 (m, 1H), 7.87-7.92 (m, 1H), 8.25-8.27 (m, 1H), 8.38-8.41 (m, 1H); 9.32 (d, 1H). MS (ESI) negative ion 409 (MH) - .
Пример 373Example 373
N-[(1R)-1-(4-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1R) -1- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R)-1-(4-хлорфенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,50 (д, 3H), 5,10-5,21 (м, 1H), 7,22-7,26 (м, 1H), 7,38-7,47 (м, 4H), 7,70-7,75 (м, 1H), 7,87-7,92 (м, 1H), 8,20-8,28 (м, 1H), 8,38-8,41 (м, 1H), 9,33 (д, 1H). MS (ESI-) m/z 365 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1R) -1- (4-chlorophenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.50 (d, 3H), 5.10-5.21 (m, 1H), 7.22-7.26 (m, 1H), 7.38-7.47 (m, 4H), 7, 70-7.75 (m, 1H), 7.87-7.92 (m, 1H), 8.20-8.28 (m, 1H), 8.38-8.41 (m, 1H), 9.33 (d, 1H). MS (ESI-) m / z 365 (MH) - .
Пример 374Example 374
N-[(1S)-1-(4-хлорфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1S) -1- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1S)-1-(4-хлорфенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,49 (д, 3H), 5,12-5,19 (м, 1H), 7,23-7,25 (м, 1H), 7,39-7,47 (м, 4H), 7,71-7,74 (м, 1H), 7,87-7,91 (м, 1H), 8,25-8,27 (м, 1H), 8,37-8,43 (м, 1H), 9,32 (д, 1H). MS (ESI-) m/z 365 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1S) -1- (4-chlorophenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.49 (d, 3H), 5.12-5.19 (m, 1H), 7.23-7.25 (m, 1H), 7.39-7.47 (m, 4H), 7, 71-7.74 (m, 1H), 7.87-7.91 (m, 1H), 8.25-8.27 (m, 1H), 8.37-8.43 (m, 1H), 9.32 (d, 1H). MS (ESI-) m / z 365 (MH) - .
Пример 375Example 375
5-(1H-индазол-5-ил)-N-[(1S)-1-(2-нафтил)этил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1S) -1- (2-naphthyl) ethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1S)-1-(2-нафтил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,61 (д, 3H), 5,30-5,38 (м, 1H), 7,25-7,26 (м, 1H), 7,48-7,55 (м, 2H), 7,60-7,63 (м, 1H), 7,72-7,75 (м, 1H), 7,88-7,95 (м, 5H), 8,25-8,28 (м, 1H), 8,39-8,43 (м, 1H), 9,39 (д, 1H). MS (ESI-) m/z 381 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1S) -1- (2-naphthyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.61 (d, 3H), 5.30-5.38 (m, 1H), 7.25-7.26 (m, 1H), 7.48-7.55 (m, 2H), 7, 60-7.63 (m, 1H), 7.72-7.75 (m, 1H), 7.88-7.95 (m, 5H), 8.25-8.28 (m, 1H), 8.39-8.43 (m, 1H); 9.39 (d, 1H). MS (ESI-) m / z 381 (MH) - .
Пример 376Example 376
N-[1-(4-этоксифенил)-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [1- (4-ethoxyphenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали 2-амино-2-(4-этоксифенил)этанол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,32 (т, 3H), 3,62-3,67 (м, 1H), 3,70-3,73 (м, 1H), 3,96-4,06 (м, 2H), 4,98-5,06 (м, 1H), 6,87-6,91 (м, 2H), 7,23-7,36 (м, 3H), 7,70-7,75 (м, 1H), 7,88-7,91 (м, 1H), 8,25-8,27 (м, 1H), 8,39-8,42 (м, 1H). MS (ESI-) m/z 391 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that 2-amino-2- (4-ethoxyphenyl) ethanol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.32 (t, 3H), 3.62-3.67 (m, 1H), 3.70-3.73 (m, 1H), 3.96-4.06 (m, 2H), 4, 98-5.06 (m, 1H), 6.87-6.91 (m, 2H), 7.23-7.36 (m, 3H), 7.70-7.75 (m, 1H), 7.88-7.91 (m, 1H), 8.25-8.27 (m, 1H), 8.39-8.42 (m, 1H). MS (ESI-) m / z 391 (MH) - .
Пример 377Example 377
N-[2-гидрокси-1-(4-изопропилфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2-hydroxy-1- (4-isopropylphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали 2-амино-2-(4-изопропилфенил)этанол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,18 (д, 6H), 2,81-2,91 (м, 1H), 3,65-3,70 (м, 1H), 3,72-3,74 (м, 1H), 5,01-5,09 (м, 1H), 7,20-7,28 (м, 3H), 7,29-7,35 (м, 2H), 7,72-7,80 (м, 1H), 7,87-7,95 (м, 1H), 8,24-8,29 (м, 1H), 8,38-8,44 (м, 1H). MS (ESI-) m/z 389 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that 2-amino-2- (4-isopropylphenyl) ethanol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.18 (d, 6H), 2.81-2.91 (m, 1H), 3.65-3.70 (m, 1H), 3.72-3.74 (m, 1H), 5, 01-5.09 (m, 1H), 7.20-7.28 (m, 3H), 7.29-7.35 (m, 2H), 7.72-7.80 (m, 1H), 7.87-7.95 (m, 1H), 8.24-8.29 (m, 1H), 8.38-8.44 (m, 1H). MS (ESI-) m / z 389 (MH) - .
Пример 378Example 378
N-[1-(3,4-диметилфенил)-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [1- (3,4-dimethylphenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали 2-амино-2-(3,4-диметилфенил)этанол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,30 (д, 6H), 3,56-3,63 (м, 1H), 3,65-3,73 (м, 1H), 5,32-5,42 (м, 1H), 7,06-7,08 (м, 2H), 7,23-7,28 (м, 2H), 7,69-7,76 (м, 1H), 7,87-7,95 (м, 1H), 8,25-8,28 (м, 1H), 8,39-8,43 (м, 1H). MS (ESI-) m/z 375 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that 2-amino-2- (3,4-dimethylphenyl) ethanol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.30 (d, 6H), 3.56-3.63 (m, 1H), 3.65-3.73 (m, 1H), 5.32-5.42 (m, 1H), 7, 06-7.08 (m, 2H), 7.23-7.28 (m, 2H), 7.69-7.76 (m, 1H), 7.87-7.95 (m, 1H), 8.25-8.28 (m, 1H); 8.39-8.43 (m, 1H). MS (ESI-) m / z 375 (MH) - .
Пример 379Example 379
N-[2-гидрокси-1-(2-метоксифенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2-hydroxy-1- (2-methoxyphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали 2-амино-2-(2-метоксифенил)этанол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,60-3,66 (м, 2H), 3,84-3,88 (м, 3H), 5,37-5,48 (м, 1H), 6,95 (т, 1H), 7,00-7,06 (м, 1H), 7,24-7,31 (м, 2H), 7,32-7,36 (м, 1H), 7,71-7,77 (м, 1H), 7,85-7,97 (м, 1H), 8,24-8,28 (м, 1H), 8,40-8,45 (м, 1H). MS (ESI+) m/z 379 (M+H)+; отрицательный ион 377 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that 2-amino-2- (2-methoxyphenyl) ethanol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.60-3.66 (m, 2H), 3.84-3.88 (m, 3H), 5.37-5.48 (m, 1H), 6.95 (t, 1H), 7, 00-7.06 (m, 1H), 7.24-7.31 (m, 2H), 7.32-7.36 (m, 1H), 7.71-7.77 (m, 1H), 7.85-7.97 (m, 1H), 8.24-8.28 (m, 1H), 8.40-8.45 (m, 1H). MS (ESI +) m / z 379 (M + H) + ; negative ion 377 (MH) - .
Пример 380Example 380
N-[2-гидрокси-1-(4-метилфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [2-hydroxy-1- (4-methylphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали 2-амино-2-(4-метилфенил)этанол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,26-2,32 (м, 3H), 3,65-3,70 (м, 1H), 3,72-3,75 (м, 1H), 5,01-5,08 (м, 1H), 7,10-7,21 (м, 2H), 7,25-7,35 (м, 3H), 7,70-7,77 (м, 1H), 7,86-7,95 (м, 1H), 8,26-8,28 (м, 1H), 8,39-8,46 (м, 1H). MS (ESI+) m/z 363 (M+H)+; (ESI-) m/z 361 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that 2-amino-2- (4-methylphenyl) ethanol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 2.26-2.32 (m, 3H), 3.65-3.70 (m, 1H), 3.72-3.75 (m, 1H), 5.01-5.08 (m, 1H) ), 7.10-7.21 (m, 2H), 7.25-7.35 (m, 3H), 7.70-7.77 (m, 1H), 7.86-7.95 (m , 1H), 8.26-8.28 (m, 1H), 8.39-8.46 (m, 1H). MS (ESI +) m / z 363 (M + H) + ; (ESI-) m / z 361 (MH) - .
Пример 381Example 381
5-(1H-индазол-5-ил)-N-[(1R)-1-(2-метоксифенил)этил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1R) -1- (2-methoxyphenyl) ethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R)-1-(2-метоксифенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,43 (д, 3H), 3,82-3,86 (м, 3H), 5,41-5,50 (м, 1H), 6,95 (т, 1H), 7,00-7,05 (м, 1H), 7,23-7,29 (м, 2H), 7,35-7,39 (м, 1H), 7,71-7,76 (м, 1H), 7,88-7,92 (м, 1H), 8,25-8,27 (м, 1H), 8,37-8,43 (м, 1H). MS (ESI+) m/z 363 (M+H)+; (ESI-) m/z 361 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1R) -1- (2-methoxyphenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.43 (d, 3H), 3.82-3.86 (m, 3H), 5.41-5.50 (m, 1H), 6.95 (t, 1H), 7.00-7, 05 (m, 1H), 7.23-7.29 (m, 2H), 7.35-7.39 (m, 1H), 7.71-7.76 (m, 1H), 7.88- 7.92 (m, 1H), 8.25-8.27 (m, 1H), 8.37-8.43 (m, 1H). MS (ESI +) m / z 363 (M + H) + ; (ESI-) m / z 361 (MH) - .
Пример 382Example 382
N-[(1S)-1-(3,4-дифторфенил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN - [(1S) -1- (3,4-difluorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1S)-1-(3,4-дифторфенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,50 (д, 3H), 5,09-5,24 (м, 1H), 7,21-7,30 (м, 2H), 7,35-7,44 (м, 1H), 7,44-7,53 (м, 1H), 7,68-7,82 (м, 1H), 7,86-7,94 (м, 1H), 8,26-8,27 (м, 1H), 8,39-8,42 (м, 1H). MS (ESI-) m/z 367 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1S) -1- (3,4-difluorophenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.50 (d, 3H), 5.09-5.24 (m, 1H), 7.21-7.30 (m, 2H), 7.35-7.44 (m, 1H), 7, 44-7.53 (m, 1H), 7.68-7.82 (m, 1H), 7.86-7.94 (m, 1H), 8.26-8.27 (m, 1H), 8.39-8.42 (m, 1H). MS (ESI-) m / z 367 (MH) - .
Пример 383Example 383
5-(1H-индазол-5-ил)-N-[(1R)-1-(3-метоксифенил)этил]изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - [(1R) -1- (3-methoxyphenyl) ethyl] isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R)-1-(3-метоксифенил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,50 (д, 3H), 3,75-3,77 (м, 3H), 5,01-5,19 (м, 1H), 6,80-6,87 (м, 1H), 6,97-7,02 (м, 2H), 7,21-7,32 (м, 2H), 7,70-7,75 (м, 1H), 7,87-7,95 (м, 1H), 8,22-8,31 (м, 1H), 8,37-8,43 (м, 1H). MS (ESI-) m/z 361 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1R) -1- (3-methoxyphenyl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.50 (d, 3H), 3.75-3.77 (m, 3H), 5.01-5.19 (m, 1H), 6.80-6.87 (m, 1H), 6, 97-7.02 (m, 2H), 7.21-7.32 (m, 2H), 7.70-7.75 (m, 1H), 7.87-7.95 (m, 1H), 8.22-8.31 (m, 1H); 8.37-8.43 (m, 1H). MS (ESI-) m / z 361 (MH) - .
Пример 384Example 384
5-(1H-индазол-5-ил)-N-{(1R)-1-[3-(трифторметил)фенил]этил} изоксазол-3-карбоксамид5- (1H-indazol-5-yl) -N - {(1R) -1- [3- (trifluoromethyl) phenyl] ethyl} isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали (1R)-1-[3-(трифторметил)фенил]этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,54 (д, 3H), 5,22-5,29 (м, 1H), 7,23-7,27 (м, 1H), 7,58-7,69 (м, 2H), 7,71-7,75 (м, 2H), 7,77-7,83 (м, 1H), 7,87-7,92 (м, 1H), 8,24-8,29 (м, 1H), 8,38-8,42 (м, 1H). MS (ESI-) m/z 399 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that (1R) -1- [3- (trifluoromethyl) phenyl] ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.54 (d, 3H), 5.22-5.29 (m, 1H), 7.23-7.27 (m, 1H), 7.58-7.69 (m, 2H), 7, 71-7.75 (m, 2H), 7.77-7.83 (m, 1H), 7.87-7.92 (m, 1H), 8.24-8.29 (m, 1H), 8.38-8.42 (m, 1H). MS (ESI-) m / z 399 (MH) - .
Пример 385Example 385
N-[1-(2,3-дигидро-1,4-бензодиоксин-6-ил)этил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [1- (2,3-dihydro-1,4-benzodioxin-6-yl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали 1-(2,3-дигидро-1,4-бензодиоксин-6-ил)этанамин вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,46 (д, 3H), 4,18-4,25 (м, 4H), 5,01-5,10 (м, 1H), 6,80-6,95 (м, 3H), 7,22-7,24 (м, 1H), 7,70-7,74 (м, 1H), 7,87-7,91 (м, 1H), 8,26-8,27 (м, 1H), 8,39-8,41 (м, 1H). MS (ESI-) m/z 389 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that 1- (2,3-dihydro-1,4-benzodioxin-6-yl) ethanamine was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 1.46 (d, 3H), 4.18-4.25 (m, 4H), 5.01-5.10 (m, 1H), 6.80-6.95 (m, 3H), 7, 22-7.24 (m, 1H), 7.70-7.74 (m, 1H), 7.87-7.91 (m, 1H), 8.26-8.27 (m, 1H), 8.39-8.41 (m, 1H). MS (ESI-) m / z 389 (MH) - .
Пример 386Example 386
N-[1-(3,5-дихлорфенил)-2-гидроксиэтил]-5-(1H-индазол-5-ил)изоксазол-3-карбоксамидN- [1- (3,5-Dichlorophenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide
Указанное в заголовке соединение получали, с использованием процедуры, описанной в Примере 366, за исключением того, что использовали 2-амино-2-(3,5-дихлорфенил)этанол вместо (S)-1-фенилэтанамина. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,68-3,72 (м, 1H), 3,76-3,78 (м, 1H), 5,02-5,10 (м, 1H), 7,26-7,29 (м, 1H), 7,47-7,52 (м, 3H), 7,72-7,75 (м, 1H), 7,89-7,93 (м, 1H), 8,25-8,28 (м, 1H), 8,39-8,44 (м, 1H). MS (ESI-) m/z 415 (M-H)-.The title compound was prepared using the procedure described in Example 366, except that 2-amino-2- (3,5-dichlorophenyl) ethanol was used instead of (S) -1-phenylethanamine. 1 H NMR (500 MHz, DMSO-d 6 / D 2 O) δ ppm 3.68-3.72 (m, 1H), 3.76-3.78 (m, 1H), 5.02-5.10 (m, 1H), 7.26-7.29 (m, 1H) ), 7.47-7.52 (m, 3H), 7.72-7.75 (m, 1H), 7.89-7.93 (m, 1H), 8.25-8.28 (m , 1H), 8.39-8.44 (m, 1H). MS (ESI-) m / z 415 (MH) - .
Пример 387Example 387
трет-бутил 5-(1-бензил-1H-1,2,3-триазол-4-ил)-3-[({[6-(трифторметил)пиридин-2-ил]амино}карбонил)амино]-1H-индазол-1-карбоксилатtert-butyl 5- (1-benzyl-1H-1,2,3-triazol-4-yl) -3 - [({[[6- (trifluoromethyl) pyridin-2-yl] amino} carbonyl) amino] -1H indazole-1-carboxylate
Раствор трифосгена в дихлорметане охлаждали до 0°C в атмосфере азота. Затем медленно по каплям добавляли смесь триэтиламина (0,426 мл, 3,07 ммоль) и соединения Примера 64A (150 мг, 0,384 ммоль) в дихлорметане (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли 6-(трифторметил)пиридин-2-амин (62,3 мг, 0,384 ммоль) с последующим перемешиванием в течение ночи при комнатной температуре. Осадок отфильтровывали и промывали дихлорметаном и водой. Продукт сушили в условиях вакуума с получением указанного в заголовке соединения. MS m/z 579,3 (M+Η)+.A solution of triphosgene in dichloromethane was cooled to 0 ° C in a nitrogen atmosphere. A mixture of triethylamine (0.426 ml, 3.07 mmol) and the compound of Example 64A (150 mg, 0.384 mmol) in dichloromethane (2 ml) was then slowly added dropwise. The resulting mixture was stirred at room temperature for 1 hour. Then 6- (trifluoromethyl) pyridin-2-amine (62.3 mg, 0.384 mmol) was added, followed by stirring overnight at room temperature. The precipitate was filtered off and washed with dichloromethane and water. The product was dried in vacuo to give the title compound. MS m / z 579.3 (M + Η) + .
Пример 388Example 388
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1-[(1-метилпиперидин-2-ил)карбонил]-1H-индазол-3-амин5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1 - [(1-methylpiperidin-2-yl) carbonyl] -1H-indazol-3-amine
Гидрохлорид 1-метилпиперидин-3-карбоновой кислоты объединяли со смесью диметилформамида и дихлорметана в атмосфере азота и перемешивали в течение 15 минут. Затем добавляли по порциям карбонилдиимидазол. Полученный раствор перемешивали при комнатной температуре в течение 1 часа. Затем добавляли соединение Примера 62 с последующим добавлением перемешиванием при 60°C в течение 2 часов и затем при комнатной температуре в течение ночи. Реакционную смесь выливали в ледяную водау и добавляли насыщенный солевой раствор. Охлажденный раствор декантировали и остаток поглощали в дихлорметан и промывали водой (2×). Органический слой сушили при помощи сульфата магния и летучие вещества удаляли при пониженном давлении. Декантированный раствор экстрагировали этилацетатом (3×). Объединенные органические слои промывали насыщенным солевым раствором (2×), сушили при помощи сульфата магния и концентрировали. Остаток поглощали в небольшое количество ацетона и затем добавляли по каплям в дистиллированную воду. Осадок собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения. MS m/z 579,3 (M+Η)+.1-Methylpiperidine-3-carboxylic acid hydrochloride was combined with a mixture of dimethylformamide and dichloromethane in a nitrogen atmosphere and stirred for 15 minutes. Then carbonyldiimidazole was added portionwise. The resulting solution was stirred at room temperature for 1 hour. Then, the compound of Example 62 was added, followed by stirring at 60 ° C for 2 hours and then at room temperature overnight. The reaction mixture was poured into ice water and brine was added. The cooled solution was decanted and the residue was taken up in dichloromethane and washed with water (2 ×). The organic layer was dried with magnesium sulfate and the volatiles were removed under reduced pressure. The decanted solution was extracted with ethyl acetate (3 ×). The combined organic layers were washed with brine (2 ×), dried with magnesium sulfate and concentrated. The residue was taken up in a small amount of acetone and then added dropwise to distilled water. The precipitate was collected by filtration, washed with water and dried to obtain the title compound. MS m / z 579.3 (M + Η) + .
Пример 389Example 389
5-(1-бензил-1H-1,2,3-триазол-4-ил)-1-[(диметиламино)-ацетил]-1H-индазол-3-амин5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1 - [(dimethylamino) -acetyl] -1H-indazol-3-amine
2-(Диметиламино)уксусную кислоту растворяли в диметилформамиде и пиридине в атмосфере азота при комнатной температуре в течение 15 минут. Добавляли по порциям карбонилдиимидазол. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли соединение Примера 62 и смесь перемешивали в течение ночи при комнатной температуре. Летучее вещество удаляли при пониженном давлении и остаток добавляли в ледяную воду. Добавляли хлорид натрия, и происходило осаждение густого масла из охлажденного раствора. Раствор декантировали. Остаток промывали водой (3×) и затем сушили. Из декантированного раствора в течение ночи происходило выделение осадка из смеси вода/диметилформамид. Оказалось, что это исходное вещество, которое отфильтровывали и сливали. Остаток, содержащий продукт, кристаллизовали в дихлорметане, собирали фильтрованием, промывали небольшим количеством дихлорметана и простого эфира. Продукт сушили с получением указанного в заголовке соединения. MS m/z 376,3 (M+Η)+.2- (Dimethylamino) acetic acid was dissolved in dimethylformamide and pyridine in a nitrogen atmosphere at room temperature for 15 minutes. Carbonyldiimidazole was added portionwise. The resulting mixture was stirred at room temperature for 1 hour. Then, the compound of Example 62 was added and the mixture was stirred overnight at room temperature. Volatile material was removed under reduced pressure and the residue was added to ice water. Sodium chloride was added and thick oil precipitated from the cooled solution. The solution was decanted. The residue was washed with water (3 ×) and then dried. From the decanted solution, a precipitate was separated from the water / dimethylformamide mixture overnight. It turned out that this is the starting material, which was filtered and drained. The residue containing the product was crystallized in dichloromethane, collected by filtration, washed with a small amount of dichloromethane and ether. The product was dried to give the title compound. MS m / z 376.3 (M + Η) + .
Пример 390Example 390
трет-бутил 3-амино-5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-1-карбоксилатtert-butyl 3-amino-5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole-1-carboxylate
Пример 62 суспендировали в дихлорметане вместе с каталитическим количеством диметиламинопиридина. Добавляли раствор ди-трет-бутилдикарбоната в дихлорметане (160 мл) в течение 1 часа. Реакционную смесь перемешивали приблизительно в течение 40 часов. Добавляли силикагель и смесь концентрировали. Эту содержащую диоксид кремния смесь вносили в колонку с силикагелем и вещество элюировали сначала дихлорметаном, а затем смесью 1% метанола/дихлорметан и в завершение смесью 2% метанола/дихлорметан. Фракции, содержащие желаемый продукт, объединяли и концентрировали с получением указанного в заголовке соединения. MS m/z 391,3 (M+Η)+.Example 62 was suspended in dichloromethane together with a catalytic amount of dimethylaminopyridine. A solution of di-tert-butyl dicarbonate in dichloromethane (160 ml) was added over 1 hour. The reaction mixture was stirred for approximately 40 hours. Silica gel was added and the mixture was concentrated. This silica-containing mixture was added to a silica gel column and the material was eluted first with dichloromethane and then with 1% methanol / dichloromethane and finally with 2% methanol / dichloromethane. Fractions containing the desired product were combined and concentrated to give the title compound. MS m / z 391.3 (M + Η) + .
Пример 391Example 391
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-пиперидин-1-илацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-piperidin-1-yl-acetamide
2-(Пиперидин-1-ил)уксусную кислоту объединяли с диметилформамидом и пиридином. Смесь перемешивали в течение 15 минут при комнатной температуре и затем добавляли по порциям карбонилдиимидазол. Продолжали перемешивание при комнатной температуре в течение 1 часа и затем добавляли соединение Примера 64A, продолжая перемешивание в течение 24 часов. Реакционную смесь нагревали до 60°C в течение 14 часов. Получали небольшое количество указанного в заголовке соединения. MS m/z 416,3 (M+Η)+.2- (piperidin-1-yl) acetic acid was combined with dimethylformamide and pyridine. The mixture was stirred for 15 minutes at room temperature and then carbonyldiimidazole was added portionwise. Stirring was continued at room temperature for 1 hour, and then the compound of Example 64A was added, while stirring was continued for 24 hours. The reaction mixture was heated to 60 ° C for 14 hours. A small amount of the title compound was obtained. MS m / z 416.3 (M + Η) + .
Пример 392Example 392
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-2-морфолин-4-илацетамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -2-morpholin-4-yl-acetamide
2-Морфолиноуксусную кислоту объединяли с диметилформамидом и пиридином. Смесь перемешивали в течение 15 минут при комнатной температуре затем добавляли по порциям карбонилдиимидазол. Продолжали перемешивание при комнатной температуре в течение 1 часа и затем добавляли соединение Примера 64A, продолжая перемешивание в течение 28 часов. Реакционную смесь нагревали до 60°C в течение 4 часов и затем продолжали перемешивание в течение ночи при комнатной температуре. Реакционную смесь снова нагревали до 60°C в течение 7 часов. Получали небольшое количество указанного в заголовке соединения. MS m/z 418,3 (M+Η)+.2-Morpholinoacetic acid was combined with dimethylformamide and pyridine. The mixture was stirred for 15 minutes at room temperature, then carbonyldiimidazole was added portionwise. Stirring was continued at room temperature for 1 hour, and then the compound of Example 64A was added, while stirring was continued for 28 hours. The reaction mixture was heated to 60 ° C for 4 hours and then stirring was continued overnight at room temperature. The reaction mixture was again heated to 60 ° C for 7 hours. A small amount of the title compound was obtained. MS m / z 418.3 (M + Η) + .
Пример 393Example 393
N-[5-(1-бензил-1H-1,2,3-триазол-4-ил)-1H-индазол-3-ил]-1-метилпиперидин-2-карбоксамидN- [5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-yl] -1-methylpiperidin-2-carboxamide
Гидрохлорид 1-метилпиперидин-3-карбоновой кислоты объединяли с диметилформамидом и пиридином. Смесь перемешивали в течение 15 минут при комнатной температуре и затем добавляли по порциям карбонилдиимидазол. Продолжали перемешивание при комнатной температуре в течение 1 часа и затем добавляли соединение Примера 64A, продолжая перемешивание в течение 28 часов. Реакционную смесь нагревали до 60°C в течение 4,25 часов и затем продолжали перемешивание в течение ночи при комнатной температуре. Реакционную смесь снова нагревали до 60°C в течение 7 часов. Получали небольшое количество указанного в заголовке соединения. MS m/z 416,3 (M+H)+.1-Methylpiperidin-3-carboxylic acid hydrochloride was combined with dimethylformamide and pyridine. The mixture was stirred for 15 minutes at room temperature and then carbonyldiimidazole was added portionwise. Stirring was continued at room temperature for 1 hour, and then the compound of Example 64A was added, while stirring was continued for 28 hours. The reaction mixture was heated to 60 ° C for 4.25 hours and then stirring was continued overnight at room temperature. The reaction mixture was again heated to 60 ° C for 7 hours. A small amount of the title compound was obtained. MS m / z 416.3 (M + H) + .
Биологические данныеBiological data
Анализ ингибирования ROCK-2ROCK-2 Inhibition Assay
Соединения формулы (I) испытывали на их способность ингибировать His6-меченный по N-концу рекомбинантный человеческий ROCK-2, остатки 11-552, экспрессируемый бакуловирусом в Sf21 клетках (Upstate). В 384-луночных, имеющих v-образное дно полипропиленовых планшетах (Axygen) 1 нМ (конечная концентрация) в 10 мкл рекомбинантного His6-меченного по N-концу рекомбинантного человеческого ROCK-2, остатки 11-552, экспрессируемого бакуловирусом в Sf21 клетках (Upstate), смешивали с 2 мкМ (конечная концентрация) в 10 мкл биотинилированного пептидного субстрата (биотин-Aha-KEAKEKRQEQIAKRRRLSSLRASTSKSGGSQK (SEQ ID NO:I)) (Genemed) и различными концентрациями ингибитора (2% DMSO конечная концентрация) в реакционном буфере (25 мМ HEPES, pH 7,5, 0,5 мМ DTT, 10 мМ MgCl2, 100 мкМ Na3VO4, 0,075 мг/мл Triton X-100) и реакцию инициировали путем добавления 5 мкМ немеченного АТФ, содержащего 0,01 мкКи [33P]-АТФ (Perkin Elmer). Реакцию гасили через 1 час путем добавления 50 мкл стоп-буфера (50 мМ EDTA, 2M NaCl конечная концентрация). 80 мкл реакционных смесей после остановки реакции переносили в 384-луночные покрытые стрептавидином планшеты FlashPlates (Perkin Elmer), инкубировали в течение 10 минут при комнатной температуре, промывали 3 раза при помощи 0,05% Tween-20/PBS, с использованием автоматического устройства для промывки планшетов ELX-405 (BioTek) и подсчитывали с использованием сцинтилляционного устройства для считывания планшетов TopCount (Packard).The compounds of formula (I) were tested for their ability to inhibit His6-N-terminally recombinant human ROCK-2, residues 11-552, expressed by baculovirus in Sf21 cells (Upstate). In 384-well V-bottomed polypropylene plates (Axygen) 1 nM (final concentration) in 10 μl of recombinant His6-N-terminal recombinant human ROCK-2, residues 11-552 expressed by baculovirus in Sf21 cells (Upstate ), mixed with 2 μM (final concentration) in 10 μl of biotinylated peptide substrate (Biotin-Aha-KEAKEKRQEQIAKRRRLSSLRASTSKSGGSQK (SEQ ID NO: I)) (Genemed) and various inhibitor concentrations (2% DMSO final concentration) in reaction buffer (25 HEPES, pH 7.5, 0.5 mM DTT, 10 mM MgCl 2, 100 mM Na 3 VO 4, 0.075 mg / ml Triton X-100), and the reaction initsiirova and by the addition of 5 uM unlabelled ATP containing 0.01 uCi [33 P] -ATP (Perkin Elmer). The reaction was quenched after 1 hour by adding 50 μl of a stop buffer (50 mm EDTA, 2M NaCl final concentration). After stopping the reaction, 80 μl of the reaction mixtures were transferred to 384-well streptavidin-coated FlashPlates (Perkin Elmer) plates, incubated for 10 minutes at room temperature, washed 3 times with 0.05% Tween-20 / PBS using an automatic device washing the ELX-405 plates (BioTek) and counting using a TopCount plate scintillation reader (Packard).
Анализ ингибирования ROCK-1ROCK-1 Inhibition Assay
Соединения формулы (I) испытывали на их способность ингибировать His6-меченный по N-концу рекомбинантный человеческий ROCK-1, аминокислоты 17-535, экспрессируемый бакуловирусом в Sf21 клетках (Upstate). В 384-луночных, имеющих v-образное дно полипропиленовых планшетах (Axygen) 2 нМ (конечная концентрация) в 10 мкл рекомбинантного His6-меченного по N-концу рекомбинантного человеческого ROCK-1, аминокислоты 17-535, экспрессируемого бакуловирусом в Sf21 клетках (Upstate), смешивали с 2 мкМ (конечная концентрация) биотинилированного пептидного субстрата (биотин-Aha-VRRLRRLTAREAA (SEQ ID NO:2)) (Genemed) и различными концентрациями ингибитора (2% DMSO конечная концентрация) в 10 мкл реакционного буфера (25 мМ HEPES, pH 7,5, 0,5 мМ DTT, 10 мМ MgCl2, 100 мкМ Na3VO4, 0,075 мг/мл Triton X-100) и реакцию инициировали путем добавления 5 мкМ немеченного АТФ, содержащего 0,01 мкКи [33P]-АТФ (Perkin Elmer). Реакцию гасили через 1 час путем добавления 50 мкл стоп-буфера (50 мМ EDTA, 2M NaCl конечная концентрация). 80 мкл реакционных смесей после остановки реакции переносили в 384-луночные покрытые стрептавидином планшеты FlashPlates (Perkin Elmer), инкубировали в течение 10 минут при комнатной температуре, промывали 3 раза при помощи 0,05% Tween-20/PBS, с использованием автоматического устройства для промывки планшетов ELX-405 (BioTek) и подсчитывали с использованием сцинтилляционного устройства для считывания планшетов TopCount (Packard).The compounds of formula (I) were tested for their ability to inhibit His6-N-terminally recombinant human ROCK-1, amino acids 17-535, expressed by baculovirus in Sf21 cells (Upstate). In 384-well V-bottomed polypropylene plates (Axygen) 2 nM (final concentration) in 10 μl of recombinant His6-N-terminal recombinant human ROCK-1, amino acids 17-535 expressed by baculovirus in Sf21 cells (Upstate ) were mixed with 2 μM (final concentration) of biotinylated peptide substrate (Biotin-Aha-VRRLRRLTAREAA (SEQ ID NO: 2)) (Genemed) and various inhibitor concentrations (2% DMSO final concentration) in 10 μl of reaction buffer (25 mM HEPES , pH 7.5, 0.5 mm DTT, 10 mm MgCl 2 , 100 μm Na 3 VO 4 , 0.075 mg / ml Triton X-100) and the reaction was initiated by put add 5 µM unlabeled ATP containing 0.01 µCi [ 33 P] -ATP (Perkin Elmer). The reaction was quenched after 1 hour by adding 50 μl of a stop buffer (50 mm EDTA, 2M NaCl final concentration). After stopping the reaction, 80 μl of the reaction mixtures were transferred to 384-well streptavidin-coated FlashPlates (Perkin Elmer) plates, incubated for 10 minutes at room temperature, washed 3 times with 0.05% Tween-20 / PBS using an automatic device washing the ELX-405 plates (BioTek) and counting using a TopCount plate scintillation reader (Packard).
Анализ ингибирования GSKGSK Inhibition Assay
Соединения формулы (I) испытывали на их способность ингибировать His6-меченный по N-концу GSK-3, экспрессируемый бакуловирусом в Sf21 клетках (Upstate). В 384-луночных, имеющих v-образное дно полипропиленовых планшетах (Axygen) 10 мкл рекомбинантного His-меченного по N-концу GSK3, экспрессируемого бакуловирусом в Sf21 клетках (Upstate), смешивали с 10 мкл биотинилированного пептидного субстрата (биотин-ahx-YRRAAVPPSPSLSRHSSPHQS(p)EDEEE (SEQ ID NO:3)), 2 мкМ конечная концентрация (Genemed), и различными концентрациями ингибитора (2% DMSO конечная концентрация) в реакционном буфере (20 мМ HEPES, pH 7,5, 1 мМ DTT, 10 мМ MgCl2 100 мкМ Na3VO4, 0,075 мг/мл Triton X-100) и реакцию инициировали путем добавления 20 мкМ [33P]-АТФ, 5 мкМ конечная концентрация, 2 мКи/ мкмоль (Perkin Elmer). Реакцию гасили через 1 час путем добавления 50 мкл стоп-буфера (50 мМ EDTA, 2M NaCl конечная концентрация). 80 мкл реакционных смесей после остановки реакции переносили в 384-луночные покрытые стрептавидином планшеты FlashPlates (Perkin Elmer), инкубировали в течение 10 минут при комнатной температуре, промывали 3 раза при помощи 0,05% Tween-20/PBS, с использованием автоматического устройства для промывки планшетов ELX-405 (BioTek) и подсчитывали с использованием сцинтилляционного устройства для считывания планшетов TopCount (Packard).The compounds of formula (I) were tested for their ability to inhibit His6 N-terminal GSK-3 expressed by baculovirus in Sf21 cells (Upstate). In 384-well v-shaped polypropylene plates (Axygen), 10 μl of N-terminal recombinant His-labeled GSK3 expressed by baculovirus in Sf21 cells (Upstate) was mixed with 10 μl of biotinylated peptide substrate (biotin-ahx-YRRAAVPHPSPSSR p) EDEEE (SEQ ID NO: 3)), 2 μM final concentration (Genemed), and various inhibitor concentrations (2% DMSO final concentration) in the reaction buffer (20 mM HEPES, pH 7.5, 1 mM DTT, 10 mM MgCl 2 100 μM Na 3 VO 4 , 0.075 mg / ml Triton X-100) and the reaction was initiated by adding 20 μM [ 33 P] -ATP, 5 μM final concentration, 2 mCi / μmol (Perkin Elm er). The reaction was quenched after 1 hour by adding 50 μl of a stop buffer (50 mm EDTA, 2M NaCl final concentration). After stopping the reaction, 80 μl of the reaction mixtures were transferred to 384-well streptavidin-coated FlashPlates (Perkin Elmer) plates, incubated for 10 minutes at room temperature, washed 3 times with 0.05% Tween-20 / PBS using an automatic device washing the ELX-405 plates (BioTek) and counting using a TopCount plate scintillation reader (Packard).
Анализ ингибирования GSK-3β человекаHuman GSK-3β Inhibition Assay
Соединения испытывали на их способность ингибировать человеческую гликогенсинтаза-киназу-3 бета (hGSK-3β), что касается ее способности фосфорилировать биотин-YRRAAVPPSPSLSRHSSPHQ(pS)EDEEE. Соединения инкубировали с 0,5 мкКи 33P-АТФ, 10 мкМ АТФ, 0,0125U hGSK-3β (растворы для определения клеточной сигнальной активности от Upstate) и 1 мкМ субстрата (биотин-YRRAAVPPSPSLSRHSSPHQ(pS)EDEEE (SEQ ID NO:3)) в 50 мМ HEPES, 10 мМ MgCl2, 100 мкМ Na3VO4, 1 мМ DTT, 0,0075% Triton, 2% ДМСО (общий объем 50 мкл) в течение 30 минут при комнатной температуре. Инкубацию останавливали путем добавления равного объема 100 мМ EDTA, 4 M NaCl2. 80 мкл этой смеси добавляли в покрытые стрептавидином планшеты FlashPlates (PerkinElmer). После стадии промывки, 33P включение определяли с использованием жидкостного сцинтилляционного счетчика для микропланшетов MicroBeta (PerkinElmer). Значения ИК50 определяли путем подгонки сигмоидальной кривой доза-ответ к счету при различных концентрациях в GraphPad Prism.The compounds were tested for their ability to inhibit human glycogen synthase kinase-3 beta (hGSK-3β) as regards its ability to phosphorylate biotin-YRRAAVPPSPSLSRHSSPHQ (pS) EDEEE. Compounds were incubated with 0.5 μCi 33 P-ATP, 10 μM ATP, 0.0125U hGSK-3β (solutions for determining cell signal activity from Upstate) and 1 μM substrate (Biotin-YRRAAVPPSPSLSRHSSPHQ (pS) EDEEE (SEQ ID NO: 3 )) in 50 mM HEPES, 10 mM MgCl 2 , 100 μM Na 3 VO 4 , 1 mM DTT, 0.0075% Triton, 2% DMSO (total volume 50 μl) for 30 minutes at room temperature. The incubation was stopped by adding an equal volume of 100 mm EDTA, 4 M NaCl 2 . 80 μl of this mixture was added to streptavidin-coated FlashPlates plates (PerkinElmer). After the washing step, the 33 P inclusion was determined using a MicroBeta liquid microplate scintillation counter (PerkinElmer). IR 50 values were determined by fitting the sigmoidal dose-response curve to the count at various concentrations in GraphPad Prism.
Анализ ингибирования GSK-3α человекаHuman GSK-3α Inhibition Assay
Соединения испытывали на их способность ингибировать человеческую гликогенсинтаза-киназу-3 альфа (hGSK-3α), 0,5 нМ конечная концентрация, в отношении фосфорилирования биотин-YRRAAVPPSPSLSRHSSPHQ(pS)EDEEE (SEQ ID NO:3). Соединения инкубировали с 0,5 Ки 33P-АТФ, 10 M АТФ, 0,0125U hGSK-3 (растворы для определения клеточной сигнальной активности от Upstate) и 2 мкМ субстрата (биотин-YRRAAVPPSPSLSRHSSPHQ(pS)EDEEE) в 50 мМ HEPES, 10 мМ MgCl2, 100 мкМ Na3VO4, 1 мМ DTT, 0,0075% Triton, 2% DMSO (общий объем 50 мкл) в течение 30 минут при комнатной температуре. Инкубацию останавливали путем добавления равного объема 100 мМ EDTA, 4M NaCl2. 80 мкл этой смеси добавляли в покрытые стрептавидином планшеты FlashPlates (PerkinElmer). После стадии промывки определяли 33P включение с использованием жидкостного сцинтилляционного счетчика для микропланшетов (PerkinElmer). Значения ИК50 определяли путем подгонки сигмоидальной кривой доза-ответ к числу импульсов при различных концентрациях в GraphPad Prism.The compounds were tested for their ability to inhibit human glycogen synthase kinase-3 alpha (hGSK-3α), 0.5 nM final concentration, with respect to phosphorylation of biotin-YRRAAVPPSPSLSRHSSPHQ (pS) EDEEE (SEQ ID NO: 3). Compounds were incubated with 0.5 Ci 33 P-ATP, 10 M ATP, 0.0125U hGSK-3 (solutions for determining cellular signal activity from Upstate) and 2 μM substrate (biotin-YRRAAVPPSPSLSRHSSPHQ (pS) EDEEE) in 50 mM HEPES, 10 mM MgCl 2 , 100 μM Na 3 VO 4 , 1 mM DTT, 0.0075% Triton, 2% DMSO (total volume 50 μl) for 30 minutes at room temperature. Incubation was stopped by adding an equal volume of 100 mM EDTA, 4M NaCl 2 . 80 μl of this mixture was added to streptavidin-coated FlashPlates plates (PerkinElmer). After the washing step, 33 P incorporation was determined using a liquid microplate scintillation counter (PerkinElmer). IR 50 values were determined by fitting the sigmoidal dose-response curve to the number of pulses at various concentrations in GraphPad Prism.
Анализ ингибирования JAK2JAK2 Inhibition Assay
Активность в отношении Jak2 киназы определяли при помощи гомогенного, с разрешением по времени, флуоресцентного (HTRF) киназного анализа in vitro (Mathis, G., HTRF(R) Technology. J Biomol Screen, 1999. 4(6):p. 309-314). Конкретно, 10 мкл His6-меченного по C-концу, рекомбинантного человеческого JAK2, аминокислоты 808-конец, экспрессируемого бакуловирусом в Sf21 клетках (Upstate), смешивали с 10 мкл ингибитора (различные концентрации, конечная концентрация DMSO 2%) и 10 мкл АТФ (5 мкМ конечная концентрация) в реакционном буфере (50 мМ HEPES, pH 7,5, 10 мМ MgCl2, 2 мМ MnCl2, 0,1% BSA и 1 мМ DTT, конечный объем 40 мкл). Реакционную смесь инициировали путем добавления 10 мкл Bio-PDK пептиад (Биотин-Ahx-KTFCGTPEYLAPEVRREPRILSEEEQEMFRDFDYIADWC (SEQ ID NO:4), конечная концентрация 0,5 мкМ) в черном 384-луночном планшете (Packard). После 60 минут инкубации при комнатной температуре реакцию гасили путем добавления 60 мкл стоп/проявляющего буфера с получением 30 мМ EDTA, 1 мкг/мл стрептавидин-APC (Prozyme), 50 нг/мл анти-фосфотирозинового mAb PT66-K криптат европия, 30 мМ HEPES, pH 7,5, 120 мМ BCF, 0,005% Tween-20, 0,05% BSA). Гашеную реакционную смесь оставляли выстаиваться при комнатной температуре в течение 1 часа и затем считывали в детекторе флуоресценции с разрешением по времени (Envision, Perkin Elmer) при 615 нм и 665 нм одновременно. Отношение между сигналами 615 нм и 665 нм использовали для расчета значения ИК50.Jak2 kinase activity was determined using a homogeneous, time-resolved, in vitro fluorescence (HTRF) kinase assay (Mathis, G., HTRF (R) Technology. J Biomol Screen, 1999.4 (6): p. 309- 314). Specifically, 10 μl of His6-labeled C-terminus recombinant human JAK2, the 808-amino acid expressed by baculovirus in Sf21 cells (Upstate), was mixed with 10 μl of inhibitor (various concentrations, final concentration of DMSO 2%) and 10 μl of ATP ( 5 μM final concentration) in the reaction buffer (50 mM HEPES, pH 7.5, 10 mM MgCl 2 , 2 mM MnCl 2 , 0.1% BSA and 1 mM DTT, final volume 40 μl). The reaction mixture was initiated by adding 10 μl of Bio-PDK peptides (Biotin-Ahx-KTFCGTPEYLAPEVRREPRILSEEEQEMFRDFDYIADWC (SEQ ID NO: 4), final concentration 0.5 μM) in a 384 black well plate (Packard). After 60 minutes of incubation at room temperature, the reaction was quenched by adding 60 μl of stop / developing buffer to obtain 30 mM EDTA, 1 μg / ml streptavidin-APC (Prozyme), 50 ng / ml anti-phosphotyrosine mAb PT66-K europium cryptate, 30 mM HEPES, pH 7.5, 120 mM BCF, 0.005% Tween-20, 0.05% BSA). The quenched reaction mixture was allowed to stand at room temperature for 1 hour and then read in a time resolution fluorescence detector (Envision, Perkin Elmer) at 615 nm and 665 nm simultaneously. The ratio between the 615 nm and 665 nm signals was used to calculate the IR 50 value.
Методы - анализ репортерного гена β-катенинаMethods - Analysis of β-catenin reporter gene
Соединения испытывали на их способность модулировать β-катенин-модулируемую генную транскрипцию в LEF/TCF(T-клеточный фактор) анализе репортерного гена. Клетки нейробластомы человека SY-SY5Y нестабильно трансфицировали при помощи 80 нг/лунка плазмиды TOPFLASH (растворы для определения клеточной сигнальной активности от Upstate), содержащей два набора из трех копий TCF связывающего сайта, расположенного выше от тимидинкиназного минимального промотора, и открытую рамку считывания люциферазы мотылька, или при помощи 80 нг/лунка плазмиды FOPFLASH (растворы для определения клеточной сигнальной активности от Upstate), содержащей три копии мутированного TCF связывающего сайта, расположенного выше от тимидинкиназного минимального промотора, и открытую рамку считывания люциферазы мотылька. Кроме того, все клетки были нестабильно трансфицированы при помощи 20 нг/лунка pRL-TK плазмиды (Promega), содержащей тимидинкиназный промотор вируса простого герпеса, для обеспечения уровней экспрессии люциферазы Renilla от низкого до среднего. Среду для трансфекции заменяли бессывороточной средой, содержащей испытываемое вещество, и инкубировали в течение 24 часов при 370C. Инкубацию останавливали и количественные определения осуществляли с использованием анализа Dual Glo Luciferase Assay (Promega), как указано, и для подсчета использовали считывающее устройство Pherastar (BMG).Compounds were tested for their ability to modulate β-catenin-modulated gene transcription in a LEF / TCF (T cell factor) reporter gene assay. Human neuroblastoma cells SY-SY5Y were unstably transfected with 80 ng / well of TOPFLASH plasmid (Upstate cell signaling solutions) containing two sets of three copies of the TCF binding site upstream of the thymidine kinase minimal promoter and an open moth luciferase reading frame or using 80 ng / well of the FOPFLASH plasmid (Upstate cell signaling solutions) containing three copies of the mutated TCF binding site upstream of thymidine kinases of the minimal promoter and an open reading frame moth luciferase. In addition, all cells were unstably transfected with a 20 ng / well pRL-TK plasmid (Promega) containing the herpes simplex virus thymidine kinase promoter to ensure low to medium Renilla luciferase expression levels. The transfection medium was replaced with a serum-free medium containing the test substance and incubated for 24 hours at 37 ° C. The incubation was stopped and quantification was performed using a Dual Glo Luciferase Assay (Promega) assay as indicated, and a Pherastar reader was used for counting ( BMG).
Активность люциферазы мотылька нормализовали к активности люциферазы Renilla на лунку. Затем нормализованный TOPFLASH ответ сравнивали с нормализованным FOPFLASH ответом, таким образом, получая специфический сигнал LEF/TCF. Максимальный ответ представляет собой максимальное отношение между нормализованными сигналами TOPFLASH и FOPFLASH. Сигмоидальные кривые доза-ответ строили с использованием программы Graphpad Prism.Moth luciferase activity was normalized to Renilla luciferase activity per well. Then, the normalized TOPFLASH response was compared with the normalized FOPFLASH response, thereby obtaining a specific LEF / TCF signal. The maximum response is the maximum ratio between the normalized TOPFLASH and FOPFLASH signals. Sigmoidal dose-response curves were constructed using Graphpad Prism.
Мышиная модель острой астмыA mouse model of acute asthma
Самок мышей Balb/c закупали у компании Taconic и помещали в Abbott Bioresearch Center. Животных использовали в возрасте 8-12 недель. Все протоколы были одобрены Institutional Animal Care and Use Committee (IACUC). Дексаметазон (Dex) и овальбумин (OVA) закупали у компании Sigma. Эндотоксин удаляли из овальбумина с использованием DetoxiGel (Pierce), в соответствии протоколом изготовителя, и конечное вещество содержало менее чем 0,1 EU/мг белка. Alum Imject закупали у компании Pierce.Female Balb / c mice were purchased from Taconic and placed in the Abbott Bioresearch Center. Animals were used at the age of 8-12 weeks. All protocols have been approved by the Institutional Animal Care and Use Committee (IACUC). Dexamethasone (Dex) and ovalbumin (OVA) were purchased from Sigma. Endotoxin was removed from ovalbumin using DetoxiGel (Pierce), according to the manufacturer's protocol, and the final substance contained less than 0.1 EU / mg protein. Alum Imject was purchased from Pierce.
Животных сенсибилизировали к OVA в день 0 и 7 путем интраперитонеальной инъекции 8 мкг OVA в 2 мг alum. В дни 14 и 16 животные получали интраназальную стимуляцию 0,3 мкг OVA в 50 мкл стерильного PBS. Животным интраперитонеально вводили репрезентативное соединение формулы (I) (растворенное с 0,5% HMPC, 0,02% Tween 80 в воде) два раза в день при дозах 3, 10 и 30 мг/кг/доза, начиная в день 13 в дневное время. Конечную дозу соединения вводили за 30 минут до измерение гиперреактивности дыхательных путей (AHR). Дексаметазон вводили перорально раз в день в дни 13-17 при дозе 3 мг/кг. Все конечные результаты анализировали в день 17 через 24 часа после второй OVA стимуляции. AHR анализировали с использованием плетизмографии всего тела находящихся в бессознательном состоянии обездвиженных животных. Вкратце, хирургический уровень наркоза обеспечивали путем интраперитонеальной инъекции кетамина и ксилазина. Хирургическим путем вставляли трахеальную канюлю между третьим и четвертым трахеальными кольцами. Самопроизвольное дыхание предотвращали путем внутривенной (в/в) инъекции в яремную вену панкуронийбромида. Животных помещали в плетизмограф для исследования всего организма (Buxco) и осуществляли искусственную вентиляцию легких с 0,2 мл комнатного воздуха при 150 вдохов в минуту с использованием автоматического аппарата искусственного дыхания с контролируемым объемом (Harvard Apparatus). Давление в легком и поток в плетизмографе измеряли с использованием датчиков и сопротивление легких рассчитывали в виде отношения давление/поток с использованием программы Biosystem Xa. Измеряли сопротивление на базовой линии, а также сопротивление после стимуляции метахолином (3, 10 или 30 мг/мл), доставку которого осуществляли при помощи встроенного в линию ультразвукового ингалятора. После завершения испытания функции легких, легкие промывали 4 раза при помощи 0,5 мл стерильного PBS. Промывочную жидкость анализировали на IL-13, AMCазу, Muc5ac и клеточные инфильтраты. Эффективность испытываемого соединения испытывали при дозах 3, 10 и 30 мг/кг b.i.d (6, 20, 60 мг/кг/день). Стимуляция при помощи OVA вызывала повышение сопротивления легких до 6,90 см H2O/мл/сек против 4,65 см H2O/мл/сек у животных, которых стимулировали при помощи PBS. Обработка мышей испытываемым соединением существенно ингибировала (p<0,001) метахолин-индуцированное сопротивление дыхательных путей до 4,55 см H2O/мл/сек и 4,77 см H2O/мл/сек при дозах в пределах от 1 до 100 мг/кг. Для предпочтительных соединений необходима доза менее чем 50 мг/кг для проявления указанного ответа. Для наиболее предпочтительных соединений необходима доза менее чем 30 мг/кг для проявления указанного ответа. Это ингибирование было эквивалентным измерениям, полученным в группе с PBS-стимуляцией (4,65 см H2O/мл/сек) и в группе обработки 3 мг/кг дексаметазоном (4,76 см H2O/мл/сек).Animals were sensitized to OVA on days 0 and 7 by intraperitoneal injection of 8 μg OVA in 2 mg alum. On days 14 and 16, animals received intranasal stimulation of 0.3 μg OVA in 50 μl of sterile PBS. The animals were administered intraperitoneally a representative compound of formula (I) (dissolved with 0.5% HMPC, 0.02% Tween 80 in water) twice a day at doses of 3, 10 and 30 mg / kg / dose, starting on day 13 daily time. The final dose of the compound was administered 30 minutes before the measurement of airway hyperresponsiveness (AHR). Dexamethasone was administered orally once a day on days 13-17 at a dose of 3 mg / kg. All end results were analyzed on day 17 24 hours after the second OVA stimulation. AHR was analyzed using whole body plethysmography of unconscious immobilized animals. Briefly, a surgical level of anesthesia was provided by intraperitoneal injection of ketamine and xylazine. A tracheal cannula was inserted surgically between the third and fourth tracheal rings. Spontaneous breathing was prevented by intravenous (iv) injection of pancuronium bromide into the jugular vein. The animals were placed in a plethysmograph to study the whole organism (Buxco) and artificial lung ventilation was performed with 0.2 ml of room air at 150 breaths per minute using a controlled volume automatic breathing apparatus (Harvard Apparatus). The pressure in the lung and the flow in the plethysmograph were measured using sensors and the resistance of the lungs was calculated as the pressure / flow ratio using the Biosystem Xa program. The resistance was measured on the baseline, as well as the resistance after stimulation with methacholine (3, 10 or 30 mg / ml), the delivery of which was carried out using the in-line ultrasonic inhaler. After completing a lung function test, the lungs were washed 4 times with 0.5 ml sterile PBS. Wash fluid was analyzed for IL-13, AMCase, Muc5ac, and cell infiltrates. The effectiveness of the test compound was tested at doses of 3, 10 and 30 mg / kg bid (6, 20, 60 mg / kg / day). OVA stimulation caused an increase in lung resistance to 6.90 cm H 2 O / ml / s versus 4.65 cm H 2 O / ml / s in animals stimulated with PBS. Treatment of mice with the test compound significantly inhibited (p <0.001) methacholine-induced airway resistance up to 4.55 cm H 2 O / ml / s and 4.77 cm H 2 O / ml / s at doses ranging from 1 to 100 mg / kg Preferred compounds require a dose of less than 50 mg / kg for the manifestation of this response. For the most preferred compounds, a dose of less than 30 mg / kg is required for the manifestation of this response. This inhibition was equivalent to the measurements obtained in the group with PBS stimulation (4.65 cm H 2 O / ml / s) and in the treatment group 3 mg / kg dexamethasone (4.76 cm H 2 O / ml / s).
Измерение IL-13: концентрации IL-13 в бронхоальвеолярной промывочной жидкости (BAL) измеряли при помощи анализа ELISA (R & D Systems), в соответствии с инструкциями изготовителя. Концентрации IL-13 в BAL жидкости были существенным образом индуцированы до 102,5 пг/мл у OVA-стимулированных мышей по сравнению с уровнем ниже определяемого у PBS-стимулированной группы. Существенное ингибирование этой индукции (p<0,05) на 60% наблюдали после введения испытываемых соединений при дозе 30 мг/кг. Не было никакого заметного ингибирования в группах введения дозы 3 мг/кг или 10 мг/кг.Measurement of IL-13: IL-13 concentrations in the bronchoalveolar wash fluid (BAL) were measured using an ELISA assay (R & D Systems), in accordance with the manufacturer's instructions. Concentrations of IL-13 in BAL fluid were significantly induced up to 102.5 pg / ml in OVA-stimulated mice compared to a level lower than that determined in the PBS-stimulated group. Significant inhibition of this induction (p <0.05) by 60% was observed after administration of the test compounds at a dose of 30 mg / kg. There was no noticeable inhibition in the dose groups of 3 mg / kg or 10 mg / kg.
Измерение AMCазы: активность кислотной хитиназы млекопитающих (AMCазы) определяли в 1:10 разведении BAL жидкости с 0,01% BSA, 30 мМ цитрата натрия, 60 мМ фосфата натрия, pH 5,2, в присутствии 80 мкМ 4-метилумбеллиферил β-D-N,N'-диацетилхитобиозида. Реакционные смеси инкубировали в течение 15 минут при комнатной температуре и реакции гасили путем добавления 100 мкл 1 M глицин/NaOH pH 10,6. Образование продукта определяли методом эмиссии флуоресценции при 460 нм с возбуждением при 385 нм, с использованием флуорометра Fluorskan Ascent. Индукцию активности AMCазы до 28,5U наблюдали у OVA-стимулированных животных, по сравнению с 2,17U у PBS-стимулированных животных. Существенное ингибирование этой индукции (p<0,01) на 35% наблюдали после введения испытываемых соединений в группе введения дозы 30 мг/кг.AMCase measurement: mammalian acid chitinase activity (AMCase) was determined at 1:10 dilution of BAL fluid with 0.01% BSA, 30 mM sodium citrate, 60 mM sodium phosphate, pH 5.2, in the presence of 80 μM 4-methylumbelliferyl β-DN , N'-diacetylchitobioside. The reaction mixtures were incubated for 15 minutes at room temperature and the reactions were quenched by adding 100 μl of 1 M glycine / NaOH pH 10.6. Product formation was determined by fluorescence emission at 460 nm with excitation at 385 nm using a Fluorskan Ascent fluorometer. Induction of AMCase activity up to 28.5U was observed in OVA-stimulated animals, compared to 2.17U in PBS-stimulated animals. Significant inhibition of this induction (p <0.01) by 35% was observed after administration of the test compounds in the dose administration group of 30 mg / kg.
Измерение MUC5AC: Концентрации гена муцина MUC5AC определяли в формате анализа ELISA. Вкратце, образцы BAL разбавляли 1:2 в буфере (2% BSA в PBS) и высевали в 96-луночные планшеты для высокого связывания белка (Costar) и сушили. После серии промывок в течение 1 часа добавляли 1:100 разведение биотинилированного MUC5AC антитела (Clone 45M, Lab Vision). Планшеты промывали и добавляли в планшет 1:3000 разведение стрептавидин-HRP (Southern Biotech) в течение 15 минут. Планшеты затем проявляли с использованием TMB субстрата (Sigma) в течение 30 минут. Реакцию останавливали при помощи 1M H2SO4 и затем планшеты считывали в спектрофотометре при OD 450 нм. Уровни MUC5AC снижались более чем на 50% после введения испытываемых соединений.MUC5AC Measurement: MUC5AC mucin gene concentrations were determined in an ELISA assay format. Briefly, BAL samples were diluted 1: 2 in buffer (2% BSA in PBS) and plated in 96-well high protein binding plates (Costar) and dried. After a series of washes for 1 hour, a 1: 100 dilution of biotinylated MUC5AC antibody (Clone 45M, Lab Vision) was added. The plates were washed and 1: 3000 dilution of streptavidin-HRP (Southern Biotech) was added to the plate for 15 minutes. The tablets were then developed using TMB substrate (Sigma) for 30 minutes. The reaction was stopped using 1M H 2 SO 4 and then the tablets were read in a spectrophotometer at OD 450 nm. MUC5AC levels decreased by more than 50% after administration of test compounds.
Определение антиноцицептивного эффекта: Модели невропатической болиDetermination of the Antinociceptive Effect: Neuropathic Pain Models
Модель невропатической боли, вызванной лигированием спинального нерва (L5/L6). Как было подробно описано ранее Kim и Chung (Kim S. H.; Chung J.M. An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat. Pain 1992, 50, 355-363), делали 1,5 см разрез дорсально к люмбосакральному сплетению. У анестезированных крыс параспинальные мышцы (с левой стороны) отделяли от остистых отростков, L5 и L6 спинальные нервы выделяли и плотно лигировали 3-0 шелковыми нитями. После гемостаза рану сшивали и смазывали мазью на основе антибиотика. Крысам давали выздороветь и затем помещали в клетку с мягкой подстилкой на 14 дней перед поведенческим испытанием на механическую аллодинию.Model of neuropathic pain caused by ligation of the spinal nerve (L5 / L6). As previously described in detail by Kim and Chung (Kim SH; Chung JM An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat. Pain 1992, 50, 355-363), a 1.5 cm incision was made dorsally to the lumbosacral plexus . In anesthetized rats, the paraspinal muscles (on the left side) were separated from the spinous processes, L5 and L6 spinal nerves were isolated and tightly ligated with 3-0 silk threads. After hemostasis, the wound was sutured and smeared with an antibiotic-based ointment. Rats were allowed to recover and were then placed in a cage with soft litter for 14 days before the mechanical allodynia behavior test.
Модель невропатической боли, вызванной лигированием седалищного нерва. Как было подробно описано ранее Bennett и Xie (Bennett G. J.; Xie Y-K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain 1988, 33, 87-107), анестезированным крысам делали 1,5 см разрез 0,5 см ниже области таза и высвобождали бедренные двуглавые мышцы и ягодичные наружные мышцы (правая сторона). Седалищный нерв обнажали, выделяли и накладывали вокруг него четыре неплотные лигатуры (5-0 хромовый кетгут) с разделением в 1 мм. Крысам давали выздороветь и затем помещали в клетку с мягкой подстилкой на 14 дней перед поведенческим испытанием на механическую аллодинию, как описано выше. Кроме того, животных также испытывали на холодную аллодинию, окуная их заднюю лапу в ванну с холодной водой (4,5°C) и определяя латентность отдергивания лапы.A model of neuropathic pain caused by ligation of the sciatic nerve. As described previously in detail by Bennett and Xie (Bennett GJ; Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain 1988, 33, 87-107), the anesthetized rats were cut 1.5 cm 0.5 cm below the pelvic area and released the femoral biceps and gluteus external muscles (right side). The sciatic nerve was exposed, isolated and four loose ligatures (5-0 chromium catgut) were placed around it with a separation of 1 mm. The rats were allowed to recover and were then placed in a soft-litter cage for 14 days before the mechanical allodynia behavior test, as described above. In addition, animals were also tested for cold allodynia by dipping their hind paw in a bath of cold water (4.5 ° C) and determining the latency of the paw withdrawal.
Выбранные аналоги соединений формулы (I), которые вводили либо интраперитонеально либо перорально, показали более чем 30% ингибирование тактильной аллодинии в моделях невропатической боли Chung и Bennett, описанных в настоящей заявке, при дозах в пределах 1-150 мг/кг.Selected analogs of the compounds of formula (I), which were administered either intraperitoneally or orally, showed more than 30% inhibition of tactile allodynia in the Chung and Bennett neuropathic pain models described herein at doses ranging from 1-150 mg / kg.
Обобщая вышесказанное, репрезентативное соединение формулы (I) в мышиной модели острой астмы было эффективным в ингибировании сопротивления дыхательных путей при дозе в пределах от 1 до 100 мг/кг. Обработка с использованием высокой дозы (30 мг/кг) также ингибировала IL-13 индукцию, а также активность AMCазы и уровни MUC5AC в BAL жидкости.Summarizing the above, a representative compound of formula (I) in a mouse model of acute asthma was effective in inhibiting airway resistance at a dose in the range of 1 to 100 mg / kg. High dose treatment (30 mg / kg) also inhibited IL-13 induction, as well as AMCase activity and MUC5AC levels in BAL fluid.
Репрезентативные соединения формулы (I) в крысиных моделях невропатической боли были эффективными, как было продемонстрировано более чем 30% ингибированием тактильной аллодинии при дозах в пределах 1-150 мг/кг.Representative compounds of formula (I) in rat models of neuropathic pain were effective, as demonstrated by more than 30% inhibition of tactile allodynia at doses ranging from 1-150 mg / kg.
Соединения формулы (I), как было обнаружено, ингибируют человеческий ROCK-2, His-меченный по N-концу GSK-3β, человеческий GSK-3β, His6-меченный рекомбинантный человеческмй JAK2 и люциферазу мотылька, демонстрируя значение ИК50 от около 1,0 мкМ до около 10 мкМ, предпочтительно, от около 100 нМ до около 1,0 мкМ. Более предпочтительно, соединения формулы (I), как было обнаружено, ингибируют человеческий ROCK-2, His-меченный по N-концу GSK-3β, человеческий GSK-3β, His6-меченный, рекомбинантный человеческмй JAK2 и люциферазу мотылька, демонстрируя значение ИК50 от около 10 нМ до около 100 нМ и, наиболее предпочтительно, менее чем 10 нМ. Кроме того, некоторые соединения формулы (I) продемонстрировали ингибирование человеческого ROCK-2 с селективностью более чем в 10 раз большей по сравнению с панелью из 50 киназных мишеней. Некоторые соединения формулы (I) продемонстрировали ингибирование человеческого GSK-3β с селективностью более чем в 10 раз большей по сравнению с панелью из 50 киназных мишеней. Некоторые соединения формулы (I) продемонстрировали ингибирование His6-меченного рекомбинантного человеческого JAK2 с селективностью более чем в 10 раз большей по сравнению с панелью из 50 киназных мишеней.The compounds of formula (I) were found to inhibit human ROCK-2, His-labeled at the N-terminus of GSK-3β, human GSK-3β, His6-labeled recombinant human JAK2 and moth luciferase, showing an IC 50 value of from about 1, 0 μM to about 10 μM, preferably from about 100 nM to about 1.0 μM. More preferably, the compounds of formula (I) were found to inhibit human ROCK-2, His-N-labeled GSK-3β, human GSK-3β, His6-labeled, recombinant human JAK2 and moth luciferase, showing an IC 50 value from about 10 nM to about 100 nM and, most preferably, less than 10 nM. In addition, some compounds of formula (I) demonstrated inhibition of human ROCK-2 with a selectivity of more than 10 times greater than a panel of 50 kinase targets. Some compounds of formula (I) demonstrated inhibition of human GSK-3β with a selectivity of more than 10 times greater than a panel of 50 kinase targets. Some compounds of formula (I) demonstrated inhibition of His6-labeled recombinant human JAK2 with a selectivity of more than 10 times that of a panel of 50 kinase targets.
Способы введенияAdministration Methods
Настоящее изобретение также обеспечивает фармацевтические композиции, которые включают соединения по настоящему изобретению. Фармацевтические композиции включают соединения по настоящему изобретению, сформулированные вместе с одним или несколькими нетоксичными фармацевтически приемлемыми носителями.The present invention also provides pharmaceutical compositions that include the compounds of the present invention. Pharmaceutical compositions include the compounds of the present invention formulated with one or more non-toxic pharmaceutically acceptable carriers.
Фармацевтические композиции по настоящему изобретению можно вводить человеку и другим млекопитающим перорально, ректально, парентерально, интрацистернально, интравагинально, местным путем (например, в виде порошков, мазей или капель), буккально или в виде перорального или назального спрея. Термин "парентерально", как он используется в настоящей заявке, относится к способам введения, которые включают внутривенную, внутримышечную, интраперитонеальную, интрастернальную, подкожную и внутрисуставную инъекцию и инфузию.The pharmaceutical compositions of the present invention can be administered to humans and other mammals orally, rectally, parenterally, intracisternally, intravaginally, topically (for example, in the form of powders, ointments or drops), buccally or as an oral or nasal spray. The term “parenteral” as used herein refers to methods of administration that include intravenous, intramuscular, intraperitoneal, intrasternal, subcutaneous and intraarticular injection and infusion.
Термин "фармацевтически приемлемый носитель", как он используется в настоящей заявке, означает нетоксичный инертный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующее вещество или вспомогательное вещество для формулирования любого типа. Некоторые примеры веществ, которые могут служить в качестве фармацевтически подходящих носителей, включают сахара, такие как, но не ограничиваясь этим, лактоза, глюкоза и сахароза; крахмалы, такие как, но не ограничиваясь этим, кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как, но не ограничиваясь этим, натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; эксципиенты, такие как, но не ограничиваясь этим, масло какао и воски для суппозиториев; масла, такие как, но не ограничиваясь этим, арахисовое масло, масло семян хлопчатника, саффлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль; сложные эфиры, такие как, но не ограничиваясь этим, этилолеат и этиллаурат; агар; буферные вещества, такие как, но не ограничиваясь этим, гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые лубриканты, такие как, но не ограничиваясь этим, лаурилсульфат натрия и стеарат магния, а также красители, агенты высвобождения, агенты покрытия, подсластители, отдушки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композиции, по усмотрению специалиста, составляющего композицию.The term "pharmaceutically acceptable carrier", as used herein, means a non-toxic inert solid, semi-solid or liquid excipient, diluent, encapsulating substance or excipient for any type of formulation. Some examples of substances that can serve as pharmaceutically acceptable carriers include sugars, such as, but not limited to, lactose, glucose, and sucrose; starches, such as, but not limited to, corn starch and potato starch; cellulose and its derivatives, such as, but not limited to, sodium carboxymethyl cellulose, ethyl cellulose and cellulose acetate; powdered tragacanth; malt; gelatin; talc; excipients, such as, but not limited to, cocoa butter and suppository waxes; oils such as, but not limited to, peanut oil, cottonseed oil, safflower oil, sesame oil, olive oil, corn oil and soybean oil; glycols; such as propylene glycol; esters such as, but not limited to, ethyl oleate and ethyl laurate; agar; buffering agents such as, but not limited to, magnesium hydroxide and aluminum hydroxide; alginic acid; pyrogen-free water; isotonic saline; ringer's solution; ethyl alcohol and phosphate buffered saline, as well as other non-toxic compatible lubricants, such as, but not limited to, sodium lauryl sulfate and magnesium stearate, as well as colorants, release agents, coating agents, sweeteners, perfumes and fragrances, preservatives and antioxidants may also be present at the discretion of the person making the composition.
Фармацевтические композиции по настоящему изобретению для парентеральной инъекции включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные растворы или дисперсии для инъекций непосредственно перед использованием. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоли и подобные), растительные масла (такие как оливковое масло), органические сложные эфиры для инъекций (такие как этилолеат) и подходящие смеси из таких веществ. Подходящую текучесть можно поддерживать, например, путем использования материалов покрытия, таких как лецитин, путем поддержания нужного размера частиц, в случае дисперсий, и путем использования поверхностно-активных веществ.The pharmaceutical compositions of the present invention for parenteral injection include pharmaceutically acceptable sterile aqueous or non-aqueous solutions, dispersions, suspensions or emulsions, as well as sterile powders for reconstitution into sterile injectable solutions or dispersions immediately before use. Examples of suitable aqueous and non-aqueous vehicles, diluents, solvents or excipients include water, ethanol, polyols (such as glycerin, propylene glycol, polyethylene glycols and the like), vegetable oils (such as olive oil), organic esters for injection (such as ethyl oleate) and suitable mixtures of such substances. Suitable fluidity can be maintained, for example, by using coating materials such as lecithin, by maintaining the desired particle size, in the case of dispersions, and by using surfactants.
Эти композиции также могут содержать адъюванты, такие как консерванты, смечивающие вещества, эмульгаторы и диспергирующие вещества. Предотвращение действия микроорганизмов можно обеспечить путем включения различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенолсорбиновой кислоты и подобных. Также может быть желательным включение изотонических веществ, таких как сахара, хлорид натрия и подобные. Пролонгированную абсорбцию фармацевтического препарата для инъекций можно обеспечить путем включения веществ, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.These compositions may also contain adjuvants, such as preservatives, wetting agents, emulsifiers and dispersing agents. Prevention of the action of microorganisms can be achieved by the inclusion of various antibacterial and antifungal agents, for example, paraben, chlorobutanol, phenolsorbic acid and the like. It may also be desirable to include isotonic substances such as sugars, sodium chloride and the like. Prolonged absorption of the pharmaceutical preparation for injection can be achieved by the inclusion of substances that slow down absorption, such as aluminum monostearate and gelatin.
В некоторых случаях, для пролонгирования действия лекарственного средства желательно замедлить абсорбцию лекарственного средства из подкожной или внутримышечной инъекции. Это можно осуществить путем использования жидкой суспензии кристаллического или аморфного вещества с плохой водорастворимостью. Скорость абсорбции лекарственного средства тогда будет зависеть от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, замедленную абсорбцию парентерально вводимой лекарственной формы обеспечивают путем растворения или суспендирования лекарственного средства в масляном носителе.In some cases, to prolong the action of the drug, it is desirable to slow the absorption of the drug from subcutaneous or intramuscular injection. This can be done by using a liquid suspension of a crystalline or amorphous substance with poor water solubility. The absorption rate of the drug will then depend on its dissolution rate, which, in turn, may depend on the size of the crystals and crystalline form. Alternatively, delayed absorption of a parenterally administered dosage form is provided by dissolving or suspending the drug in an oil vehicle.
Депо препараты для инъекций получают путем образования микроинкапсулирующих матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения лекарственного средства к полимеру и природы конкретного используемого полимера, можно контрлировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депо препараты для инъекций также получают путем захвата лекарственного средства в липосомы или микроэмульсии, которые являются совместимыми с тканями организма.Depot preparations for injection are prepared by forming microencapsulating drug matrices in biodegradable polymers such as polylactide-polyglycolide. Depending on the ratio of drug to polymer and the nature of the particular polymer used, the rate of release of the drug can be controlled. Examples of other biodegradable polymers include poly (orthoesters) and poly (anhydrides). Depot drugs for injection are also obtained by capturing the drug in liposomes or microemulsions that are compatible with body tissues.
Композиции для инъекций можно стерилизовать, например, фильтрованием через удерживающий бактерии фильтр или путем включения стерилизующих веществ в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной среде для инъекций непосредственно перед использованием.Compositions for injection can be sterilized, for example, by filtration through a bacteria-retaining filter or by incorporating sterilizing agents in the form of sterile solid compositions that can be dissolved or dispersed in sterile water or another sterile medium for injection immediately before use.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение может быть смешано с, по меньшей мере, одним инертным, фармацевтически подходящим носителем или эксципиентом, таким как цитрат натрия или дикальцийфосфат и/или a) наполнителями или создающими объем веществами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота; b) связующими, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь; c) увлажнителями, такими как глицерин; d) дезинтегрантами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; e) замедляющими растворение веществами, такими как парафин; f) ускорителями абсорбции, такими как четвертичные аммониевые соединения; g) смечивающими веществами, такими как цетиловый спирт и глицеринмоностеарат; h) абсорбентами, такими как каолиновая и бентонитовая глина, и i) лубрикантами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и смесями таких веществ. В случае капсул, таблеток и пилюль, дозированная форма также может включать буферные вещества.Solid dosage forms for oral administration include capsules, tablets, pills, powders and granules. In such solid dosage forms, the active compound may be mixed with at least one inert, pharmaceutically acceptable carrier or excipient, such as sodium citrate or dicalcium phosphate and / or a) excipients or bulking agents such as starches, lactose, sucrose, glucose, mannitol and silicic acid; b) binders such as carboxymethyl cellulose, alginates, gelatin, polyvinylpyrrolidone, sucrose and gum arabic; c) humectants, such as glycerin; d) disintegrants such as agar-agar, calcium carbonate, potato or tapioca starch, alginic acid, certain silicates and sodium carbonate; e) retardants such as paraffin; f) absorption accelerators such as quaternary ammonium compounds; g) humectants, such as cetyl alcohol and glycerol monostearate; h) absorbents, such as kaolin and bentonite clay, and i) lubricants, such as talc, calcium stearate, magnesium stearate, solid polyethylene glycols, sodium lauryl sulfate, and mixtures thereof. In the case of capsules, tablets and pills, the dosage form may also include buffering agents.
Твердые композиции подобного типа также можно использовать в качестве наполнителей в желатиновых капсулах с мягким и твердым наполнением, с использованием таких носителей как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и подобных веществ.Solid compositions of a similar type can also be used as fillers in soft and hard filled gelatin capsules using carriers such as lactose or milk sugar, as well as high molecular weight polyethylene glycols and the like.
Твердые дозированные формы, такие как таблетки, драже, капсулы, пилюли и гранулы, можно получить с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области формулирования фармацевтических композиций. Они, необязательно, могут содержать вещества, делающие препарат непрозрачным, и могут также иметь такую композицию, которая позволяет им высвобождать активный ингредиент(ингредиенты) только, или преимущественно, в определенной части кишечного тракта, необязательно, отсроченным образом. Примеры композиций для заливки препарата, которые можно использовать, включают полимерные вещества и воски.Solid dosage forms, such as tablets, dragees, capsules, pills and granules, can be prepared with coatings and coatings, such as enteric coatings and other coatings well known in the art of formulating pharmaceutical compositions. They may optionally contain substances that make the drug opaque, and may also have a composition that allows them to release the active ingredient (s) only, or predominantly, in a certain part of the intestinal tract, optionally, in a delayed manner. Examples of fillable compositions that can be used include polymeric substances and waxes.
Активные соединения также могут быть в микроинкапсулированной форме, если это является подходящим, с одним или несколькими из указанных выше носителей.The active compounds may also be in microencapsulated form, if appropriate, with one or more of the above carriers.
Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие дозированные формы могут содержать инертные разбавители, традиционно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие вещества и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, масло семян хлопчатника, арахисовое масло, кукурузное масло, масло из зародышей масличных семян, оливковое масло, касторовое масло и кунжутное масло), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана, и смеси таких веществ.Liquid dosage forms for oral administration include pharmaceutically acceptable emulsions, solutions, suspensions, syrups and elixirs. In addition to the active compounds, liquid dosage forms may contain inert diluents traditionally used in the art, such as, for example, water or other solvents, solubilizing agents and emulsifiers, such as ethyl alcohol, isopropyl alcohol, ethyl carbonate, ethyl acetate, benzyl alcohol, benzyl benzoate, propylene glycol, 1,3-butylene glycol, dimethylformamide, oils (in particular cottonseed oil, peanut oil, corn oil, oilseed oil, olive oil, castor oil and kun utnoe oil), glycerol, tetrahydrofurfuryl alcohol, polyethylene glycols and fatty acid esters of sorbitan, and mixtures of such materials.
Помимо инертных разбавителей, пероральные композиции также могут включать адъюванты, такие как смечивающие вещества, эмульгаторы и суспендирующие вещества, подсластители, отдушки и ароматизаторы.In addition to inert diluents, oral compositions may also include adjuvants, such as wetting agents, emulsifiers and suspending agents, sweeteners, perfumes and flavorings.
Суспензии, помимо активных соединений, могут содержать суспендирующие вещества, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар, трагакант и смеси таких веществ.Suspensions, in addition to the active compounds, may contain suspending agents, for example, ethoxylated isostearyl alcohols, polyoxyethylene sorbitol and esters of sorbitan, microcrystalline cellulose, aluminum metahydroxide, bentonite, agar-agar, tragacanth, and mixtures of such substances.
Композиции для ректального или вагинального введения, предпочтительно, представляют собой суппозитории, которые можно получить путем смешивания соединений по настоящему изобретению с подходящими нераздражающими носителями или наполнителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при комнатной температуре, но жидкими при температуре тела, и поэтому расплавляются в прямой кишке или влагалище и высвобождают активное соединение.Compositions for rectal or vaginal administration are preferably suppositories, which can be prepared by mixing the compounds of the present invention with suitable non-irritating carriers or excipients, such as cocoa butter, polyethylene glycol or suppository wax, which are solid at room temperature but liquid at body temperature, and therefore melt in the rectum or vagina and release the active compound.
Соединения по настоящему изобретению также можно вводить в форме липосом. Как это известно из уровня техники, липосомы, как правило, получают из фосфолипидов или других липидных веществ. Липосомы образуют из одно- или многослойных гидратированных жидких кристаллов, которые диспергируют в водной среде. Можно использовать любой нетоксичный, физиологически приемлемый и метаболизируемый липид, способный образовывать липосомы. Композиции по настоящему изобретению в форме липосом могут содержать, помимо соединения по настоящему изобретению, стабилизаторы, консерванты, эксципиенты и подобные вещества. Предпочтительными липидами являются природные и синтетические фосфолипиды и фосфатидилхолины (лецитины), которые используют по отдельности или вместе.The compounds of the present invention can also be administered in the form of liposomes. As is known in the art, liposomes are typically derived from phospholipids or other lipid substances. Liposomes are formed from single or multilayer hydrated liquid crystals that are dispersed in an aqueous medium. Any non-toxic, physiologically acceptable and metabolizable lipid capable of forming liposomes can be used. The compositions of the present invention in the form of liposomes may contain, in addition to the compounds of the present invention, stabilizers, preservatives, excipients and the like. Preferred lipids are natural and synthetic phospholipids and phosphatidylcholines (lecithins), which are used individually or together.
Способы образования липосом известны из уровня техники. Смотри, например, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.Y. (1976), p. 33 et seq.Methods for forming liposomes are known in the art. See, for example, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.Y. (1976), p. 33 et seq.
Дозированные формы для местного введения соединений по настоящему изобретению включают порошки, спреи, мази и препараты для ингаляций. Активное соединение можно смешивать в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами, буферными веществами или пропеллентами, которые могут потребоваться. Препараты для введения в глаз, глазные мази, порошки и растворы также предусматриваются как входящие в объем настоящего изобретения.Dosage forms for topical administration of the compounds of the present invention include powders, sprays, ointments, and inhalation preparations. The active compound can be mixed under sterile conditions with a pharmaceutically acceptable carrier and any necessary preservatives, buffers or propellants that may be required. Formulations for administration to the eye, ophthalmic ointments, powders and solutions are also contemplated as being within the scope of the present invention.
Фактические уровни доз активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьировать так, чтобы получить количество активного соединения(соединений), которое является эффективным для достижения желаемого терапевтического ответа для конкретного пациента, композиций и способа введения. Выбор уровня дозы будет зависеть от активности конкретного соединения, пути введения, тяжести состояния, подлежащего лечению, и состояния и предшествующей истории болезни пациента, подлежащего лечению.Actual dose levels of the active ingredients in the pharmaceutical compositions of the present invention may vary so as to obtain an amount of the active compound (s) that is effective to achieve the desired therapeutic response for a particular patient, compositions and route of administration. The choice of dose level will depend on the activity of the particular compound, the route of administration, the severity of the condition to be treated, and the condition and previous medical history of the patient to be treated.
При использовании в указанных выше или других лечениях, терапевтически эффективное количество одного из соединений по настоящему изобретению можно использовать в чистой форме, когда такие формы существуют, в форме фармацевтически приемлемой соли, сложного эфира или пролекарства. Фраза "терапевтически эффективное количество" соединения по настоящему изобретению означает количество соединения, достаточное для лечения расстройств, при разумном отношении польза/риск, применимом к любому медицинскому лечению. Однако должно быть понятно, что общая суточная доза соединений и композиций по настоящему изобретению зависит от мнения лечащего врача, в рамках разумной медицинской практики. Конкретный уровень терапевтически эффективной дозы для любого конкретного пациента будет зависеть от многих факторов, включая расстройство, подлежащее лечению, и тяжесть расстройства; активность конкретного используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, путь введения и скорость выведения из организма конкретного используемого соединения; продолжительность лечения; лекарственные средства, используемые в сочетании или одновременно с конкретным соединением, которое используют; и подобные факторы, хорошо известные в медицине.When used in the above or other treatments, a therapeutically effective amount of one of the compounds of the present invention can be used in pure form when such forms exist, in the form of a pharmaceutically acceptable salt, ester or prodrug. The phrase “therapeutically effective amount” of a compound of the present invention means an amount of the compound sufficient to treat the disorder, with a reasonable benefit / risk ratio applicable to any medical treatment. However, it should be understood that the total daily dose of the compounds and compositions of the present invention depends on the opinion of the attending physician, within the framework of sound medical practice. The specific level of therapeutically effective dose for any given patient will depend on many factors, including the disorder to be treated and the severity of the disorder; the activity of the particular compound used; specific composition used; age, body weight, general health, gender and diet of the patient; time of administration, route of administration and rate of excretion of the particular compound used from the body; duration of treatment; drugs used in combination with or at the same time as the specific compound to be used; and similar factors well known in medicine.
Термин "фармацевтически приемлемая соль", как он используется в настоящей заявке, означает соли, полученные из неорганических или органических кислот. Соли могут быть получены in situ в процессе конечного выделения и очистки соединений формулы (I), или их можно получить отдельно путем взаимодействия формы свободного основания соединения формулы (I) с неорганической или органической кислотой. Репрезентативные кислотно-аддитивные соли включают, но не ограничиваются этим, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат (изетионат), лактат, малеат, фумарат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфат, (L) тартрат, (D) тартрат, (DL) тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат.The term "pharmaceutically acceptable salt", as used in this application, means salts derived from inorganic or organic acids. Salts can be obtained in situ during the final isolation and purification of compounds of formula (I), or they can be prepared separately by reacting the free base form of the compound of formula (I) with an inorganic or organic acid. Representative acid addition salts include, but are not limited to, acetate, adipate, alginate, citrate, aspartate, benzoate, benzenesulfonate, bisulfate, butyrate, camphorate, camphorsulfonate, digluconate, glycerophosphate, hemisulfate, heptanoate, hexanohydrochloride, hexanohydrochloride, hydroiodide, 2-hydroxyethanesulfonate (isethionate), lactate, maleate, fumarate, methanesulfonate, nicotinate, 2-naphthalene sulfonate, oxalate, pamoate, pectinate, persulfate, 3-phenylpropionate, picrate, pivalate, propionate, succinate, tartrate, sulfate (D) tartrate, (DL) tartre t, thiocyanate, phosphate, glutamate, bicarbonate, p-toluenesulfonate and undecanoate.
Термин "фармацевтически приемлемое пролекарство" или "пролекарство", как он используется в настоящей заявке, представляет такие пролекарства соединений по настоящему изобретению, которые, в соответствии со здравой медицинской оценкой, являются подходящими для использования в контакте с тканями человека и низших животных, без чрезмерной токсичности, раздражения, аллергических реакций и т.п. Пролекарства по настоящему изобретению могут быстро преобразовываться in vivo в соединения формулы (I), например, в результате гидролиза в крови.The term “pharmaceutically acceptable prodrug” or “prodrug” as used herein represents prodrugs of the compounds of the present invention which, according to a sound medical assessment, are suitable for use in contact with human and lower animal tissues, without excessive toxicity, irritation, allergic reactions, etc. The prodrugs of the present invention can be rapidly converted in vivo to compounds of formula (I), for example, by hydrolysis in the blood.
Настоящее изобретение предусматривает соединения формулы (I), образованные синтетическим путем или образованные путем биопреобразования in vivo.The present invention provides compounds of formula (I) formed synthetically or formed by in vivo bioconversion.
Соединения по настоящему изобретению могут существовать в несольватированных, а также в сольватированных формых, включая гидратированные формы, такие как полугидраты. Как правило, сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода и этанол, среди прочих, являются эквивалентными несольватированным формам для целей настоящего изобретения.The compounds of the present invention can exist in unsolvated as well as solvated forms, including hydrated forms, such as hemihydrates. Typically, solvated forms with pharmaceutically acceptable solvents such as water and ethanol, among others, are equivalent to unsolvated forms for the purposes of the present invention.
Общая суточная доза соединений по настоящему изобретению для введения человеку или низшим животным может находиться в пределах от около 0,003 до около 30 мг/кг/день. Для перорального введения более предпочтительные дозы могут находиться в пределах от около 0,01 до около 10 мг/кг/день. Если желательно, эффективную суточную дозу можно разделить на несколько доз в целях введения; следовательно, композиции, содержащие разовую дозу, могут содержать такие количества или дробные части этой дозы, которые составляют суточную дозу.The total daily dose of the compounds of the present invention for administration to humans or lower animals may range from about 0.003 to about 30 mg / kg / day. For oral administration, more preferred doses may range from about 0.01 to about 10 mg / kg / day. If desired, the effective daily dose may be divided into several doses for administration purposes; therefore, compositions containing a single dose may contain such amounts or fractional parts of this dose that make up the daily dose.
Протеинкиназы можно подразделить на широкие группы на основании идентичности аминокислоты(аминокислот), на которую они нацелены (серин/треонин, тирозин, лизин и гистидин). Например, тирозиновые киназы включают рецепторные тирозиновые киназы (RTK), такие как факторы роста, и нерецепторные тирозиновые киназы, такие как семейство src киназ. Также существуют протеинкиназы с двойной специфичностью, которые нацелены как на тирозин, так и серин/треонин, такие как циклин-зависимые киназы (CDK) и митогенактивируемые протеинкиназы (MAPK).Protein kinases can be divided into broad groups based on the identity of the amino acid (s) they are targeting (serine / threonine, tyrosine, lysine and histidine). For example, tyrosine kinases include receptor tyrosine kinases (RTK), such as growth factors, and non-receptor tyrosine kinases, such as the src kinase family. There are also dual specificity protein kinases that target both tyrosine and serine / threonine, such as cyclin-dependent kinases (CDKs) and mitogen-activated protein kinases (MAPKs).
Тирозиновые протеинкиназы (PTK) образуют крупное семейство киназ, которые регулируют передачу сигналов от клетки к клетке, которые участвуют в росте, дифференциации, адгезии, подвижности и гибели (Pearson, M. et al., In Protein Tyrosine Kinases; Fabbro, D., McCormick, F., Eds.; Humana Press Inc., 2006; pp 1-29.). Члены семейства тирозиновых киназ включают, но не ограничиваются этим, Yes, BMX, Syk, EphA1, FGFR3, RYK, MUSK, JAK1 и EGFR. Тирозиновые киназы подразделяются на два класса, а именно, тирозиновые киназы рецепторного типа и нерецепторного типа. Интересно, что все семейство тирозиновых киназ состоит из, по меньшей мере, 90 охарактеризованных киназ, из которых, по меньшей мере, 58 киназ рецепторного типа и, по меньшей мере, 32 киназы нерецепторного типа, и включает, по меньшей мере, в общей сложности 30 субсемейств. Тирозиновые киназы связаны с различными заболеваниями человека, включая диабет и рак (Pearson, M. et al., In Protein Tyrosine Kinases; Fabbro, D., McCormick, F., Eds.; Humana Press Inc., 2006; pp 1-29.). Тирозиновые киназы часто принимают участие в большинстве форм злокачественных заболеваний человека и связаны с широким рядом различных врожденных синдромов (Robertson et al., Trends Genet. 16:265-271, 2000). Нерецепторные тирозиновые киназы представляют группу внутриклеточных ферментов, которые не имеют внеклеточных и трансмембранных последовательностей. В настоящее время идентифицировано более 32 семейств нерецепторных тирозиновых киназ (Robinson et al., Oncogene 19, 5548-5557, 2000). Репрезентативные примеры включают Src, Btk, Csk, ZAP70 и Kak семейства. В частности, Src семейство является самым большим семейством нерецепторных тирозиновых киназ, состоящим из Src, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr и Yrk тирозиновых протеинкиназ. Src семейство киназ связано с онкогенезом, клеточной пролиферацией и прогрессированием опухоли. Было обнаружено, что многие из тирозиновых протеинкиназ участвуют в клеточных сигнальных путях, которые связаны с различными патологическими состояниями, включая, но не ограничиваясь этим, рак и гиперпролиферативные расстройства и иммунные расстройства.Tyrosine protein kinases (PTKs) form a large family of kinases that regulate cell-to-cell signaling that are involved in growth, differentiation, adhesion, motility, and death (Pearson, M. et al., In Protein Tyrosine Kinases; Fabbro, D., McCormick, F., Eds .; Humana Press Inc., 2006; pp 1-29.). Members of the tyrosine kinase family include, but are not limited to, Yes, BMX, Syk, EphA1, FGFR3, RYK, MUSK, JAK1, and EGFR. Tyrosine kinases are divided into two classes, namely, receptor-type and non-receptor-type tyrosine kinases. Interestingly, the entire family of tyrosine kinases consists of at least 90 characterized kinases, of which at least 58 receptor type kinases and at least 32 non-receptor kinases, and includes at least a total of 30 subfamilies. Tyrosine kinases are associated with various human diseases, including diabetes and cancer (Pearson, M. et al., In Protein Tyrosine Kinases; Fabbro, D., McCormick, F., Eds .; Humana Press Inc., 2006; pp 1-29 .). Tyrosine kinases are often involved in most forms of human malignant diseases and are associated with a wide range of different congenital syndromes (Robertson et al., Trends Genet. 16: 265-271, 2000). Non-receptor tyrosine kinases represent a group of intracellular enzymes that do not have extracellular and transmembrane sequences. Currently, more than 32 families of non-receptor tyrosine kinases have been identified (Robinson et al., Oncogene 19, 5548-5557, 2000). Representative examples include Src, Btk, Csk, ZAP70 and Kak families. In particular, the Src family is the largest non-receptor tyrosine kinase family consisting of Src, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr, and Yrk tyrosine protein kinases. The Src kinase family is associated with oncogenesis, cell proliferation, and tumor progression. It has been found that many of the tyrosine protein kinases are involved in cellular signaling pathways that are associated with various pathological conditions, including, but not limited to, cancer and hyperproliferative disorders and immune disorders.
Циклинзависимые киназы CDK представляют группу внутриклеточных ферментов, которые контролируют прохождение через клеточный цикл и играют существенную роль в клеточной пролиферации (Cohen, P. Nature Reviews Drug Discovery 1, 309-315, 2002). Репрезентативные примеры CDK включают, но не ограничиваются этим, циклин-зависимую киназу 2 (CDK2), циклин-зависимую киназу 7 (CDK7), циклин-зависимую киназу 6 (CDK6) и белок 2, контролирующий клеточное деление (CDC2). CDK участвуют в регуляции переходов между различными фазами клеточного цикла, например, переход от стадии покоя в G1 (промежуток между митозом и началом репликации ДНК для нового цикла клеточного деления) к фазе S (период активного синтеза ДНК) или переход от G2 к фазе M, в которой происходит активный митоз и деление клетки (Rowell et al. Critical Reviews in Immunology 26(3), 189-212, 2006). CDK комплексы образуются через ассоциацию регуляторной циклиновой субъединицы (например, циклин A, B1, B2, D1, D2, D3 и E) и каталитической киназной субъединицы (например, cdc2 (CDK1), CDK2, CDK4, CDK5 и CDK6). CDK демонстрируют абсолютную зависимость от циклиновой субъединицы, чтобы фосфорилировать их субстраты, на которые они нацелены, и различные пары киназа/циклин обладают функцией регулирования продвижения через специфические части клеточного цикла. Кроме того, CDK участвуют в различных болезненных состояниях, включая но не ограничиваясь этим, состояния, демонстрирующие фенотип рака, различные опухолевые расстройства, и в неврологических расстройствах (Pallas et al. Current Medicinal Chemistry: Central Nervous System Agents 5(2), 101-109, 2005).CDK cyclin-dependent kinases represent a group of intracellular enzymes that control passage through the cell cycle and play a significant role in cell proliferation (Cohen, P. Nature Reviews Drug Discovery 1, 309-315, 2002). Representative examples of CDK include, but are not limited to, cyclin-dependent kinase 2 (CDK2), cyclin-dependent kinase 7 (CDK7), cyclin-dependent kinase 6 (CDK6), and cell division control protein 2 (CDC2). CDKs are involved in the regulation of transitions between different phases of the cell cycle, for example, the transition from the resting stage in G1 (the interval between mitosis and the beginning of DNA replication for a new cell division cycle) to phase S (the period of active DNA synthesis) or the transition from G2 to phase M, in which active mitosis and cell division occurs (Rowell et al. Critical Reviews in Immunology 26 (3), 189-212, 2006). CDK complexes are formed through the association of a regulatory cyclin subunit (e.g., cyclin A, B1, B2, D1, D2, D3, and E) and a catalytic kinase subunit (e.g., cdc2 (CDK1), CDK2, CDK4, CDK5, and CDK6). CDKs demonstrate absolute dependence on the cyclin subunit to phosphorylate their substrates that they are targeting, and various kinase / cyclin pairs have the function of regulating movement through specific parts of the cell cycle. In addition, CDKs are involved in various disease states, including, but not limited to, those showing a cancer phenotype, various tumor disorders, and neurological disorders (Pallas et al. Current Medicinal Chemistry: Central Nervous System Agents 5 (2), 101- 109, 2005).
Митогенактивируемые протеинкиназы (MAP) участвуют в трансдукции сигналов к ядру клетки в ответ на внеклеточные стимулы. Репрезентативные примеры MAP киназ включают, но не ограничиваются этим, митогенактивируемую протеинкиназу 3 (MAPK3), митогенактивируемую протеинкиназу 1 (ERK2), митогенактивируемую протеинкиназу 7 (MAPK7), митогенактивируемую протеинкиназу 8 (JNK1), митогенактивируемую протеинкиназу 14 (p38 альфа), митогенактивируемую протеинкиназу 10 (MAPK 10), JNK3 альфа протеинкиназу, стрессактивируемую протеинкиназу JNK2 и митогенактивируемую протеинкиназу 14 (MAPK14). MAP киназы представляют собой семейство пролин-направленных сериновых/треониновых киназ, которые опосредуют сигнальную трансдукцию от внеклеточных рецепторов или теплового шока или УФ-излучения (Barr et al., Trends in Pharmacological Sciences 27(10), 525-530, 2006). MAP киназы активируются через фосфорилирование треонина и тирозина обладающими двойной специфичностью протеинкиназами, включая тирозиновые киназы, такие как факторы роста. Клеточная пролиферация и дифференциация, как было показано, находятся под регуляторным контролем различных MAP киназных каскадов (Sridhar et al., Pharmaceutical Research, 17:11 1345-1353, 2000). Таким образом, MAP киназный путь играет критическую роль в различных болезненных состояниях, например, дефекты активностей MAP киназ, как было показано, приводят к аберрантной клеточной пролиферации и карциногенезу (Qi et al., Journal of Cell Science 118(16), 3569-3572, 2005). Более того, активность MAP киназ также связана с резистентностью к инсулину, связанной с диабетом типа 2 (Fujishiro et al. Recent Research Developments in Physiology 1(Pt. 2), 801-812, 2003).Mitogen-activated protein kinases (MAPs) are involved in signal transduction to the cell nucleus in response to extracellular stimuli. Representative examples of MAP kinases include, but are not limited to, mitogen-activated protein kinase 3 (MAPK3), mitogen-activated protein kinase 1 (MAPK7), mitogen-activated protein kinase 8 (JNK1), mitogen-activated protein kinase kinase 10 (p kinase kinase 14) (p. (MAPK 10), JNK3 alpha protein kinase, stress-activated protein kinase JNK2 and mitogen-activated protein kinase 14 (MAPK14). MAP kinases are a family of proline directed serine / threonine kinases that mediate signal transduction from extracellular receptors or heat shock or UV radiation (Barr et al., Trends in Pharmacological Sciences 27 (10), 525-530, 2006). MAP kinases are activated through phosphorylation of threonine and tyrosine with dual-specific protein kinases, including tyrosine kinases, such as growth factors. Cell proliferation and differentiation have been shown to be under the regulatory control of various MAP kinase cascades (Sridhar et al., Pharmaceutical Research, 17:11 1345-1353, 2000). Thus, the MAP kinase pathway plays a critical role in various disease states, for example, defects in the activity of MAP kinases have been shown to lead to aberrant cell proliferation and carcinogenesis (Qi et al., Journal of Cell Science 118 (16), 3569-3572 , 2005). Moreover, the activity of MAP kinases is also associated with insulin resistance associated with type 2 diabetes (Fujishiro et al. Recent Research Developments in Physiology 1 (Pt. 2), 801-812, 2003).
p90 Рибосомальные S6 киназы (Rsk) представляют собой сериновые/треониновые киназы, которые играют определенную роль в митогенактивируемом клеточном росте и пролиферации, дифференциации и клеточном выживании. Примеры членов Rsk семейства киназ включают, но не ограничиваются этим, рибосомальную протеинкиназу S6, 90 кДа, полипептид 2 (Rsk3), рибосомальную протеинкиназу S6, 90 кДа, полипептид 6 (Rsk4), рибосомальную протеинкиназу S6, 90 кДа, полипептид 3 (Rsk2) и рибосомальную протеинкиназу S6, 90 кДа, полипептид 1 (Rsk1/p90Rsk). Члены Rsk семейства активируются связанными с внеклеточным сигналом киназами и фосфоинозитидзависимой протеинкиназой 1 (Frodin and Gammeltoft, Mol. Cell. Endocrinol. 151, 65-77, 1999). В обычных условиях RSK киназы локализуются в цитоплазме клетки, а при стимуляции митогенами активированные (фосфорилириованные связанной с внеклеточным сигналом киназой) RSK преходящим образом перемещаются к плазменной мембране, где они становятся полностью активированными. Полностью активированная RSK фосфорилирует субстраты, которые участвуют в клеточном росте, пролиферации, дифференциации и клеточном выживании (Clark et al. Cancer Research 65, 3108-3116, 2005). RSK сигнальные пути также связывают с модуляцией клеточного цикла (Gross et al., J. Biol. Chem. 276, 46099-46103, 2001). Имеющиеся на настоящий момент данные дают основание предположить, что малые молекулы, которые ингибируют Rsk, могут быть полезными терапевтическими средствами для профилактики и лечения рака и воспалительных заболеваний.p90 Ribosomal S6 kinases (Rsk) are serine / threonine kinases that play a role in mitogen-activated cell growth and proliferation, differentiation, and cell survival. Examples of members of the Rsk kinase family include, but are not limited to, ribosomal protein kinase S6, 90 kDa, polypeptide 2 (Rsk3), ribosomal protein kinase S6, 90 kDa, polypeptide 6 (Rsk4), ribosomal protein kinase S6, 90 kDa, polypeptide 3 (Rsk2) and ribosomal protein kinase S6, 90 kDa, polypeptide 1 (Rsk1 / p90Rsk). Members of the Rsk family are activated by kinases associated with extracellular signal and phosphoinositide-dependent protein kinase 1 (Frodin and Gammeltoft, Mol. Cell. Endocrinol. 151, 65-77, 1999). Under normal conditions, RSK kinases are localized in the cytoplasm of the cell, and when stimulated by mitogens, activated (phosphorylated kinases bound to the extracellular signal) RSK transiently move to the plasma membrane, where they become fully activated. Fully activated RSK phosphorylates substrates that are involved in cell growth, proliferation, differentiation, and cell survival (Clark et al. Cancer Research 65, 3108-3116, 2005). RSK signaling pathways are also associated with cell cycle modulation (Gross et al., J. Biol. Chem. 276, 46099-46103, 2001). Currently available evidence suggests that small molecules that inhibit Rsk may be useful therapeutic agents for the prevention and treatment of cancer and inflammatory diseases.
Члены семейства протеинкиназ контрольных точек (CHK) представляют собой сериновые/треониновые киназы, которые играют важную роль в развитии клеточного цикла. Примеры членов семейства протеинкиназ контрольных точек включают, но не ограничиваются этим, CHK1 и CHK2. Киназы контрольных точек представляют собой системы контроля, которые координируют развитие клеточного цикла, оказывая влияние на образование, активацию и последующую инактивацию циклин-зависимых киназ. Киназы контрольных точек предотвращают развитие клеточного цикла в неподходящее для этого время, поддерживают метаболический баланс клеток при “остановке” клетки в определенной точке клеточного цикла и, в некоторых случаях, могут индуцировать апоптоз (программированная клеточная гибель), когда требования контрольной точки не были удовлетворены (Nurse, Cell, 91, 865-867, 1997; Hartwell et al., Science, 266, 1821-1828, 1994). Члены семейства киназ контрольных точек связаны с пролиферативными расстройствами, фенотипами рака и другими заболеваниями, связанными с повреждением и репарацией ДНК (Kumagai and Dunphy Cell Cycle, 5, 1265-1268 (2006); Xiao et al., Molecular Cancer Therapeutics 5, 1935-1943, 2006).Members of the control point protein kinase (CHK) family are serine / threonine kinases, which play an important role in the development of the cell cycle. Examples of members of the family of protein kinase control points include, but are not limited to, CHK1 and CHK2. Control point kinases are control systems that coordinate the development of the cell cycle, affecting the formation, activation and subsequent inactivation of cyclin-dependent kinases. Control point kinases prevent the development of the cell cycle at the wrong time, maintain the metabolic balance of cells when the cell “stops” at a certain point in the cell cycle, and, in some cases, can induce apoptosis (programmed cell death) when the requirements of the control point were not satisfied ( Nurse, Cell, 91, 865-867, 1997; Hartwell et al., Science, 266, 1821-1828, 1994). Control point kinase family members are associated with proliferative disorders, cancer phenotypes, and other diseases associated with DNA damage and repair (Kumagai and Dunphy Cell Cycle, 5, 1265-1268 (2006); Xiao et al., Molecular Cancer Therapeutics 5, 1935- 1943, 2006).
Киназы Aurora представляют собой семейство мультигенных митотических сериновых-треониновых киназ, которое функционирует как класс новых онкогенов. Эти киназы включают aurora-A и aurora-B. Киназы Aurora гиперактивируются и/или чрезмерно экспрессируются в некоторых сόлидных опухолях, включая, но не ограничиваясь этим, рак молочной железы, яичников, предстательной железы, поджелудочной железы и колоректальный рак. В частности, aurora-A представляет собой центросомальную киназу, которая играет важную роль в развитии клеточного цикла и клеточной пролиферации. Aurora-A расположена в области 20q13 хромосомы, которая часто амплифицируется в некоторых различных типах злокачественных опухолей, таких как колоректальный рак, рак молочной железы и мочевого пузыря. Также существует тесная взаимосвязь между aurora-A и высоким гисто-прогностическим уровнем анеуплойдии, что делает эту киназу потенциальным прогностическим вектором. Ингибирование активности киназы aurora может снизить клеточную пролиферацию, рост опухоли и потенциально канцерогенез. Подробное описании функции киназы aurora представлено в Journal of Cell Science, 119, 3664-3675, 2006.Aurora kinases are a family of multigenic mitotic serine-threonine kinases that functions as a class of new oncogenes. These kinases include aurora-A and aurora-B. Aurora kinases are overactive and / or overexpressed in some solid tumors, including, but not limited to, breast, ovarian, prostate, pancreatic, and colorectal cancer. In particular, aurora-A is a centrosomal kinase that plays an important role in cell cycle development and cell proliferation. Aurora-A is located on the 20q13 region of the chromosome, which is often amplified in some different types of malignant tumors, such as colorectal cancer, breast and bladder cancer. There is also a close relationship between aurora-A and a high histo-prognostic level of aneuploidy, which makes this kinase a potential prognostic vector. Inhibition of aurora kinase activity can reduce cell proliferation, tumor growth, and potentially carcinogenesis. A detailed description of the function of aurora kinase is presented in Journal of Cell Science, 119, 3664-3675, 2006.
Rho-ассоциированные, содержащие скрученную спираль сериновые/треониновые протеинкиназы ROCK-1 и ROCK-2, как считается, играют основную роль в цитоскелетной динамике, выполняя роль расположенных ниже эффекторов Rho/Rac семейства активируемых цитокинами и факторами роста небольших GTPаз. ROCK фосфорилируют различные субстраты, включая, но не ограничиваясь этим, фосфатазу легкой цепи миозина, легкую цепь миозина, эзрин-радиксин-моэзиновые белки и LIM (для Lin11, Is1l и Mec3) киназы. ROCK также опосредуют образование актиновых стрессовых волокон и фокальные адгезии в различных типах клеток. ROCK играют важную роль в клеточной миграции путем усиления клеточной сократительной способности, и они необходимы для ретракции хвостов моноцитов и раковых клеток. Ингибиторы ROCK, как также было показано, снижают рассеивание опухолевых клеток in vivo. Проведенные в последнее время эксперименты определили новые функции ROCK в клетках, включая центросомальное расположение и регуляцию размера клеток, что может способствовать различным физиологическим и патологическим состояниям (Mueller et al, Nature Reviews Drug Discovery 4, 387-398, 2005). Члены ROCK семейства являются привлекательными мишенями для вмешательства при различных патологиях, включая рак и сердечно-сосудистые заболевания. Ингибиторы ROCK могут быть полезными терапевтическими средствами для лечения гипертензии, стенокардии и астмы. Кроме того, Rho, как предполагают, играет определенную роль в нарушениях периферического кровообращения, артериосклерозе, воспалении и аутоиммунных заболеваниях и, таким образом, представляет собой полезную мишень для терапии (Shimokawa et al, Arteriosclerosis, Thrombosis and Vascular Biology, 25, 1767-1775, 2005).Rho-associated twisted helix serine / threonine protein kinases ROCK-1 and ROCK-2 are thought to play a major role in cytoskeletal dynamics, acting as downstream effectors of the Rho / Rac family of cytokine-activated and small GTPase growth factors. ROCK phosphorylates various substrates, including, but not limited to, myosin light chain phosphatase, myosin light chain, ezrin-radixin-moesin proteins, and LIM (for Lin11, Is1l, and Mec3) kinases. ROCK also mediates the formation of actin stress fibers and focal adhesion in various types of cells. ROCKs play an important role in cell migration by enhancing cell contractility, and they are necessary for the retraction of the tails of monocytes and cancer cells. ROCK inhibitors have also been shown to reduce tumor cell dispersion in vivo. Recent experiments have identified new ROCK functions in cells, including centrosomal location and regulation of cell size, which may contribute to various physiological and pathological conditions (Mueller et al, Nature Reviews Drug Discovery 4, 387-398, 2005). Members of the ROCK family are attractive targets for intervention in various pathologies, including cancer and cardiovascular diseases. ROCK inhibitors can be useful therapeutic agents for the treatment of hypertension, angina pectoris and asthma. In addition, Rho is thought to play a role in peripheral circulatory disorders, arteriosclerosis, inflammation, and autoimmune diseases and, thus, is a useful target for therapy (Shimokawa et al, Arteriosclerosis, Thrombosis and Vascular Biology, 25, 1767-1775 , 2005).
Ограниченный успех фармакотерапевтических подходов при повреждении спинного мозга в большой степени связан с неспособностью поврежденных нервных волокон в белом веществе человеческого спинного мозга возобновлять рост и снова устанавливать синаптические контакты с их разъединенными партнерами-нейронами. Агрессивное микроокружение, характеризующееся присутствием большого разнообразия молекулярных ингибиторов роста невритов на участке поражения, в рубцовой ткани и на ЦНС миелине, является причиной этой необратимой остановки роста невритов. В культуре ткани эти ингибиторы роста невритов часто индуцируют весьма драматичные ответы, включая коллапс образования и утрату неврита. Рубцовая ткань в головном и спинном мозге человека является сильным и персистентным барьером для любой регенерации роста невритов, и ингибиторы ROCK могли бы помочь поврежденным волокнам расти или распространяться за пределы этой ингибирующей регенерацию ткани. Различные факты указывают на то, что в результате повреждения головного и спинного мозга происходит сильная активация RhoA-ROCK пути. Из-за постоянного присутствия ингибиторов роста невритов на участке поражения или вокруг него и в ЦНС миелине, такая активация потенциально могла бы сохраняться в течение длительного времени, делая ингибирование ROCK привлекательной целью не только для неотложного лечение острых и под-острых случаев, но также для хронического лечения повреждения спинного мозга. Ингибирование ROCK двумя различными малыми молекулами-ингибиторами ROCK (Y-27632 и фасудил) стимулировало или ускоряло функциональное восстановление в различных моделях травмы спинного мозга мышей и крыс при их местном или системном введении сразу после повреждения в виде разовой дозы или в течение нескольких недель (Dergham, P. et al. Rho signaling pathway targeted to promote spinal cord repair. J. Neurosci. 22, 6570-6577, 2002; Hara, M. et al. Protein kinase inhibition by fasudil hydrochloride promotes neurological recovery after spinal cord injury in rats. J. Neurosurg. Spine 93, 94-101, 2000.; Fournier, A. E. et al. ROCK inhibition enhances axonal regeneration in the injured CNS. J. Neurosci. 23, 1416-1423, 2003; Sung, J. K. et al. A possible role of RhoA/Rho-kinase in experimental spinal cord injury in rat. Brain Res. 959, 29-38, 2003; Tanaka, H. et al. Cytoplasmic p21(Cipl/WAFl) enhances axonal regeneration and functional recovery after spinal cord injury in rats. Neuroscience 127, 155-164, 2004). В этих исследованиях, ингибирование ROCK не только усиливало рост нервных волокон за пределами участка поражения, но также имело нейрозащитное действие и уменьшало повреждение ткани и образование пустот. На основании этих исследований на грызунах, ингибиторы ROCK, которые обладают нейрозащитным и стимулирующим нейрорегенерацию действием, могли бы принести существенную пользу пациентам с повреждением спинного мозга. Кроме того, они могли бы нормализовать кровоток в спинном мозге, благодаря их сосудорасширяющему эффекту, таким образом, еще сильнее способствуя сохранению ткани.The limited success of pharmacotherapeutic approaches in spinal cord injury is largely associated with the inability of damaged nerve fibers in the white matter of the human spinal cord to resume growth and again establish synaptic contacts with their disconnected neuron partners. Aggressive microenvironment, characterized by the presence of a wide variety of molecular inhibitors of neuritis growth in the lesion site, in scar tissue and on the central nervous system myelin, is the cause of this irreversible arrest of neuritis growth. In tissue culture, these neuritis growth inhibitors often induce highly dramatic responses, including the collapse of the formation and loss of neuritis. Scar tissue in the human brain and spinal cord is a strong and persistent barrier to any regeneration of neuritis growth, and ROCK inhibitors could help damaged fibers grow or spread beyond this regeneration-inhibiting tissue. Various facts indicate that as a result of damage to the brain and spinal cord, a strong activation of the RhoA-ROCK pathway occurs. Due to the continued presence of neuritis growth inhibitors in the area of the lesion or around it and in the central nervous system of myelin, such activation could potentially persist for a long time, making ROCK inhibition an attractive target not only for emergency treatment of acute and subacute cases, but also for chronic treatment of spinal cord injury. ROCK inhibition by two different small ROCK inhibitor molecules (Y-27632 and fasudil) stimulated or accelerated functional recovery in various models of spinal cord injury in mice and rats when they are topically or systemically administered immediately after injury in a single dose or for several weeks (Dergham , P. et al. Rho signaling pathway targeted to promote spinal cord repair. J. Neurosci. 22, 6570-6577, 2002; Hara, M. et al. Protein kinase inhibition by fasudil hydrochloride promotes neurological recovery after spinal cord injury in rats J. Neurosurg. Spine 93, 94-101, 2000 .; Fournier, AE et al. ROCK inhibition enhances axonal regeneration in the injured CNS. J. Neurosci. 23, 1416-1423, 2003; Sung, JK et al. A possible role of RhoA / Rho-kinase in experimental spinal cord injury in rat. Brain Res. 959, 29-38, 2003; Tanaka, H. et al. Cytoplasmic p21 (Cipl / WAFl) enhances axonal regeneration and functional recovery after spinal cord injury in rats. Neuroscience 127, 155-164, 2004). In these studies, ROCK inhibition not only enhanced nerve fiber growth outside the lesion site, but also had a neuroprotective effect and reduced tissue damage and void formation. Based on these rodent studies, ROCK inhibitors, which have a neuroprotective and stimulating neuroregeneration effect, could be of significant benefit to patients with spinal cord injury. In addition, they could normalize blood flow in the spinal cord, due to their vasodilating effect, thus further contributing to tissue conservation.
Патологически, болезнь Альцгеймера характеризуется на микроскопическом уровне внутриклеточными нейрофибриллярными сплетениями и внеклеточными амилоидными агрегатами. Нейрофибриллярные сплетения содержат аберрантно фосфорилированный tau белок, ассоциированный с микротрубочками белок и субстрат для ROCK, тогда как амилоидные агрегаты образуются преимущественно посредством токсических амилоидных-β (Aβ) пептидов, имеющих в длину 42-аминокислот. Недавно было показано (Zhou, Y. et al. Nonsteroidal anti-inflammatory drugs can lower amiloidogenic Aβ42 by inhibiting Rho. Science 302, 1215-1217, 2003), что в клетках, секретирующих Aβ42, и у трансгенных PDAPP МЫШЕЙ, продуцирующих большие количества Aβ42, некоторые нестероидные противовоспалительные лекарственные средства (NSAID) снижали уровень Aβ42 путем ингибирования RhoA-ROCK пути. Ингибитор ROCK, Y-27632, был эффективным в снижении уровней Aβ42 как в клеточной культуре, так и у PDAPP трансгенных мышей при введении путем интрацеребровентрикулярной инъекции. Активация Rho геранилгеранилпирофосфатом, липидом, необходимым для мембранного прикрепления Rho, повышала уровни Aβ42; это повышение полностью предотвращалось при помощи Y-27632. Ингибитор ROCK, Y-27632, который использовали в животных моделях болезни Альцгеймера, был эффективным, вызывая снижение количества уровней токсичного Aβ42, но не оказывал никакого эффекта на общие уровни Aβ, и этот эффект ингибиторов Rho или ROCK является, по меньшей мере, одним механизмом, посредством которого NSAIDs снижают уровни Aβ42. В дополнение ко многим другим терапевтическим вмешательствам, эти ингибиторы обладают таким хорошо подтвержденным документально преимуществом, которое состоит в стимуляции возобновляемого роста невритов, и поэтому является возможным, что ингибирование этого пути может привести к восстановлению амилоид-поврежденной невральной цепи.Pathologically, Alzheimer's disease is characterized at the microscopic level by intracellular neurofibrillary plexuses and extracellular amyloid aggregates. The neurofibrillary plexuses contain an aberrantly phosphorylated tau protein, microtubule-associated protein and substrate for ROCK, while amyloid aggregates are formed primarily by toxic amyloid-β (Aβ) peptides having 42 amino acids in length. It has recently been shown (Zhou, Y. et al. Nonsteroidal anti-inflammatory drugs can lower amiloidogenic Aβ42 by inhibiting Rho. Science 302, 1215-1217, 2003) that in Aβ42 secreting cells and in transgenic PDAPP MOUSES producing large quantities Aβ42, some non-steroidal anti-inflammatory drugs (NSAIDs) lowered Aβ42 levels by inhibiting the RhoA-ROCK pathway. The ROCK inhibitor, Y-27632, was effective in reducing Aβ42 levels in both cell culture and PDAPP transgenic mice when administered by intracerebroventricular injection. Activation of Rho by geranyl geranyl pyrophosphate, a lipid necessary for membrane attachment of Rho, increased Aβ42 levels; this increase was completely prevented by Y-27632. The ROCK inhibitor, Y-27632, which was used in animal models of Alzheimer's disease, was effective, causing a decrease in the level of toxic Aβ42, but had no effect on total Aβ levels, and this effect of Rho or ROCK inhibitors is at least one mechanism by which NSAIDs lower Aβ42 levels. In addition to many other therapeutic interventions, these inhibitors have such a well-documented advantage that they stimulate the renewable growth of neuritis, and therefore it is possible that inhibition of this pathway can lead to the restoration of the amyloid-damaged neural chain.
Наиболее важным в патогенезе заболевания является миграция лейкоцитов за пределы эндотелия головного мозга в ЦНС и воспалительный каскад, стимулируемый этими клетками, который в конечном результате приводит к демиелинизации участков волокон ЦНС и повреждению и потере невритов. Лейкоциты нуждаются в активном RhoA и ROCK для их продвижения за пределы эндотелия головного мозга, поскольку их транс-эндотелиальная миграция была предотвращена ингибитором ROCK Y-2763294.The most important in the pathogenesis of the disease is the migration of leukocytes beyond the endothelium of the brain to the central nervous system and the inflammatory cascade stimulated by these cells, which ultimately leads to demyelination of the CNS fibers and damage and loss of neuritis. White blood cells need active RhoA and ROCK to move beyond the endothelium of the brain, since their trans-endothelial migration was prevented by the ROCK inhibitor Y-2763294.
Нейрозащитное действие ингибиторов ROCK фасудила и гидроксифасудила не ограничивается моделями повреждения спинного мозга, но также были сообщения о таком эффекте в церебральных мультиинфарктных моделях песчанок и крыс (Toshima Y, Satoh S, Ikegaki I, Asano T. A new model of cerebral microthrombosis in rats and the neuroprotective effect of a Rho-kinase inhibitor. Stroke 31, 2245-2250, 2000; Satoh, S. et al. Pharmacological profile of hydroxy fasudil as a selective ROCK inhibitor on ischemic brain damage. Life Si. 69, 1441-1453, 2001; Kitaoka, Y. et al. Involvement of RhoA and possible neuroprotective effect of fasudil, a ROCK inhibitor, in NMDA-induced neurotoxicity in the rat retina. Brain Res.l018, 111-118, 2004). В моделях удара у грызунов некоторые ингибиторы регенерации, такие как ROCK-активирующий NgR1 комплекс и один из его лигандов, NOGO-A, были нейтрализованы спустя 24 часа или даже 1 неделю после индукции церебрального удара, и наблюдали улучшенное функциональное восстановление (Lee, J. K., Kim, J. E., Sivula, M. & Strittmatter, S. M. Nogo receptor antagonism promotes stroke recovery by enhancing axonal plasticity. J. Neurosci. 24, 6209-6217, 2004; Wiessner, C. et al. Anti-Nogo-A antibody infusion 24 hours after experimental stroke improved behavioral outcome and corticospinal plasticity in normotensive and spontaneously hypertensive rats. J. Cereb. Blood FlowMetab. 23, 154-165, 2003). Блокирование ROCK поэтому является достижимой нейрорегенеративной стратегией; кроме того, такая стратегия имеет преимущество, состоящее в том, что терапевтическое окно для использования этих ингибиторов может быть больше, чем для тромболитического или нейрозащитного вариантов лечения удара.The neuroprotective effects of the FOCK inhibitors of fasudil and hydroxyfasudil are not limited to models of spinal cord injury, but there have also been reports of this effect in cerebral multi-infarct models of gerbils and rats (Toshima Y, Satoh S, Ikegaki I, Asano T. A new model of cerebral microthrombosis in rats and the neuroprotective effect of a Rho-kinase inhibitor. Stroke 31, 2245-2250, 2000; Satoh, S. et al. Pharmacological profile of hydroxy fasudil as a selective ROCK inhibitor on ischemic brain damage. Life Si. 69, 1441-1453, 2001; Kitaoka, Y. et al. Involvement of RhoA and possible neuroprotective effect of fasudil, a ROCK inhibitor, in NMDA-induced neurotoxicity in the rat retina. Brain Res.l018, 111-118, 2004). In rodent shock models, some regeneration inhibitors, such as the ROCK-activating NgR1 complex and one of its ligands, NOGO-A, were neutralized 24 hours or even 1 week after cerebral stroke induction, and improved functional recovery was observed (Lee, JK, Kim, JE, Sivula, M. & Strittmatter, SM Nogo receptor antagonism promotes stroke recovery by enhancing axonal plasticity. J. Neurosci. 24, 6209-6217, 2004; Wiessner, C. et al. Anti-Nogo-A antibody infusion 24 hours after experimental stroke improved behavioral outcome and corticospinal plasticity in normotensive and spontaneously hypertensive rats. J. Cereb. Blood Flow Metab. 23, 154-165, 2003). Blocking ROCK is therefore an achievable neuroregenerative strategy; in addition, such a strategy has the advantage that the therapeutic window for using these inhibitors may be larger than for thrombolytic or neuroprotective treatment options for stroke.
Повреждения нервных клеток в периферической нервной системе или в ЦНС человека может привести к состоянию хронической боли, известному как невропатическая боль. Недавно было показано, что воспалительные медиаторы, такие как лизофосфатидиновая кислота (LPA), которая продуцируется в ответ на повреждение, участвуют в инициации невропатической боли в мышиной модели повреждения периферического нерва (Inoue, M. et al. Initiation of neuropathic pain requires lysophosphatidic acid receptor signaling. Nature Med. 10, 712-718, 2004). LPA присутствует на участках поражения в периферической нервной системе и ЦНС и проявляет свою функцию путем связывания с G-белок-связанными LPA рецепторами, что приводит к активации RhoA-ROCK пути. Ингибитор ROCK, Y-27632, предотвращает инициацию невропатической боли после повреждения нерва или LPA инъекции, тогда другой ингибитор ROCK, H-1152, облегчает невропатическую боль в модели рассечения спинального нерва L5 (Tatsumi, S. et al. Involvement of Rho-kinase in iflammatory and neuropathic pain through phosphorylation of myristoylated alanine-rich C-kinase substrate (MARCKS). Neuroscience 131, 491-498, 2005). Результаты этих испытаний показывают, что ROCK является потенциальной мишенью для лекарственных средств, которая отвечает за индукцию, а также поддержание хронических состояний боли.Damage to nerve cells in the peripheral nervous system or in the human central nervous system can lead to a state of chronic pain known as neuropathic pain. It has recently been shown that inflammatory mediators, such as lysophosphatidic acid (LPA), which is produced in response to damage, are involved in the initiation of neuropathic pain in a murine model of peripheral nerve damage (Inoue, M. et al. Initiation of neuropathic pain requires lysophosphatidic acid receptor signaling. Nature Med. 10, 712-718, 2004). LPA is present at lesions in the peripheral nervous system and central nervous system and exerts its function by binding to G-protein-coupled LPA receptors, which leads to activation of the RhoA-ROCK pathway. The ROCK inhibitor, Y-27632, prevents the initiation of neuropathic pain after nerve damage or LPA injection, then another ROCK inhibitor, H-1152, alleviates neuropathic pain in the L5 spinal nerve dissection model (Tatsumi, S. et al. Involvement of Rho-kinase in iflammatory and neuropathic pain through phosphorylation of myristoylated alanine-rich C-kinase substrate (MARCKS). Neuroscience 131, 491-498, 2005). The results of these tests show that ROCK is a potential drug target that is responsible for the induction as well as the maintenance of chronic pain conditions.
Более того, Schueller et al. (Abstract 1216, 8th World Congress on Inflammation, Copenhagen, DenMark, June 16-20, 2007) продемонстрировали, что SLx-2119, перорально биодоступный, сильнодействующий и высокоселективный ингибитор ROCK 2, снижает атерогенез в присутствии сильно повышенных уровней липидов в группах, состоящих из 8 имеющих ApoE-“нокаут” мышей, и это говорит о том, что селективное ингибирование ROCK 2 имеет потенциал ограничения атеросклероза.Moreover, Schueller et al. (Abstract 1216, 8th World Congress on Inflammation, Copenhagen, DenMark, June 16-20, 2007) demonstrated that SLx-2119, an orally bioavailable, potent, and highly selective ROCK 2 inhibitor, reduces atherogenesis in the presence of very elevated lipid levels in groups consisting of out of 8 ApoE-knockout mice, which suggests that selective inhibition of ROCK 2 has the potential to limit atherosclerosis.
70 кДа рибосомальная S6 киназа (p70S6K) активируется различными митогенами, факторами роста и гормонами. Активация p70S6K происходит через фосфорилирование на различных участках, и основной мишенью активированной киназы является 40S рибосомальный белок S6, основной компонент механизма, участвующего в синтезе белков в клетках млекопитающих. Кроме того, активация p70S6K связана с контролем клеточного цикла, дифференциацией нервных клеток, регуляцией клеточной подвижности и с клеточным ответом, что является важным для метастазов опухоли, иммунитета и восстановления ткани. Модуляция активности p70S6 киназы также может иметь терапевтическое применение при расстройствах, таких как рак, воспаление и различные невропатиии. Подробное обсуждение p70S6K киназ можно найти в Prog. Cell Cycle Res., 1, 21-32, 1995, а также в Immunol. Cell Biol. 78, 447-51, 2000.70 kDa ribosomal S6 kinase (p70S6K) is activated by various mitogens, growth factors and hormones. P70S6K activation occurs through phosphorylation at various sites, and the main target of activated kinase is the 40S ribosomal protein S6, the main component of the mechanism involved in the synthesis of proteins in mammalian cells. In addition, p70S6K activation is associated with cell cycle control, differentiation of nerve cells, regulation of cell motility and cellular response, which is important for tumor metastases, immunity and tissue repair. Modulation of the activity of p70S6 kinase can also be of therapeutic use in disorders such as cancer, inflammation, and various neuropathies. A detailed discussion of p70S6K kinases can be found in Prog. Cell Cycle Res., 1, 21-32, 1995, and also in Immunol. Cell Biol. 78, 447-51, 2000.
Гликогенсинтаза-киназа 3 (GSK-3) представляет собой широко экспрессируемую, конститутивно активную сериновую/треониновую киназу, которая фосфорилирует клеточные субстраты и посредством этого регулирует широкий ряд различных клеточных функций, включая развитие, метаболизм, генную транскрипцию, трансляцию белка, цитоскелетную организацию, регуляцию клеточного цикла и апоптоз. GSK-3 первоначально была описана как ключевой фермент, участвующий в метаболизме гликогена, но в настоящее время известно, что она регулируют широкий ряд клеточных функций. Ранее были идентифицированы две формы этого фермента, GSK-3+ƒ и GSK-3+ƒ. Активность GSK-3+ƒ отрицательно регулируется протеинкиназой B/Akt и сигнальным путем Wnt. Поэтому малые молекулы, являющиеся ингибиторами GSK-3, могут иметь некоторые терапевтические применения, включая лечение и профилактику нейродегенеративных заболеваний и стимуляцию нейрогенерации при различных неврологических расстройствах (Gartner et al. J. Cell Science, 2006, 119, 3927-3934. Zhou et al. Neuron, 2004, 42, 897-912), диабете типа II, биполярных расстройствах, ударе, раке, остеоартрите, остеопорозе, ревматоидном артрите (Cuzzocrea et al. Clinical Immunology, 2006, 120, 57-67) и хроническом воспалительном заболевании. Общий обзор: Kockeritz et al., Current Drug Targets, 7, 1377-1388, 2006. Обзор неврологических применений: Current Drug Targets, 7(11), 1389-1397 и 1399-1409, 2006.Glycogen synthase kinase 3 (GSK-3) is a widely expressed, constitutively active serine / threonine kinase that phosphorylates cell substrates and thereby regulates a wide range of different cellular functions, including development, metabolism, gene transcription, protein translation, cytoskeletal organization, regulation cell cycle and apoptosis. GSK-3 was originally described as a key enzyme involved in glycogen metabolism, but it is now known to regulate a wide range of cellular functions. Two forms of this enzyme have been identified previously, GSK-3 + ƒ and GSK-3 + ƒ. GSK-3 + ƒ activity is negatively regulated by protein kinase B / Akt and the Wnt signaling pathway. Therefore, small molecules that are GSK-3 inhibitors may have some therapeutic applications, including the treatment and prevention of neurodegenerative diseases and the stimulation of neurogenesis in various neurological disorders (Gartner et al. J. Cell Science, 2006, 119, 3927-3934. Zhou et al Neuron, 2004, 42, 897-912), type II diabetes, bipolar disorder, stroke, cancer, osteoarthritis, osteoporosis, rheumatoid arthritis (Cuzzocrea et al. Clinical Immunology, 2006, 120, 57-67) and chronic inflammatory disease. General overview: Kockeritz et al., Current Drug Targets, 7, 1377-1388, 2006. Overview of neurological uses: Current Drug Targets, 7 (11), 1389-1397 and 1399-1409, 2006.
Протеинкиназы стали привлекательными мишенями для лечения раковых заболеваний (Fabbro et al., Pharmacology & Therapeutics 93:79-98, 2002). Предполагают, что участие протеинкиназ в развитии злокачественных опухолей человека может происходить посредством следующего: (1) геномные перестройки (например, BCR-ABL в хроническом миелогенном лейкозе), (2) мутации, приводящие к конститутивно активной киназной активности, например, острый миелогенный лейкоз и желудочно-кишечные опухоли, (3) нарушенная регуляция киназной активности путем активации онкогенов или потери функций супрессора опухоли, как, например, при раковых заболеваниях с онкогенным RAS, (4) нарушенная регуляция киназной активности в результате сверх-экспрессии, как в случае EGFR, и (5) эктопическая экспрессия факторов роста, которая может способствовать развитию и сохранению опухолевого фенотипа (Fabbro et al., Pharmacology & Therapeutics 93:79-98, 2002).Protein kinases have become attractive targets for the treatment of cancer (Fabbro et al., Pharmacology & Therapeutics 93: 79-98, 2002). It is suggested that the participation of protein kinases in the development of human malignant tumors can occur through the following: (1) genomic rearrangements (for example, BCR-ABL in chronic myelogenous leukemia), (2) mutations leading to constitutively active kinase activity, for example, acute myelogenous leukemia and gastrointestinal tumors, (3) impaired regulation of kinase activity by activation of oncogenes or loss of tumor suppressor functions, as, for example, in cancer with oncogenic RAS, (4) impaired regulation of kinase asset spine resulting in over-expression, as in the case of EGFR, and (5) ectopic expression of growth factors that can contribute to the development and preservation of the tumor phenotype (Fabbro et al, Pharmacology & Therapeutics 93:. 79-98, 2002).
Некоторые раковые заболевания связаны с ангиогенезом. Ангиогенез представляет собой рост новых капиллярных кровеносных сосудов из ранее существующей сосудистой сети (Risau, W., Nature 386:671-674, 1997). Было показано, что протеинкиназы могут способствовать развитию и сохранению опухолевого фенотипа (Fabbro et al., Pharmacology & Therapeutics 93:79-98, 2002). Например, VEGF A-D и четыре их рецептора связаны с фенотипами, которые включают неоваскуляризацию и повышенную сосудистую проницаемость, такими как опухолевый ангиогенез и лимфангиогенез (Matter, A., Drug Discov. Today 6:1005-1023, 2001).Some cancers are associated with angiogenesis. Angiogenesis is the growth of new capillary blood vessels from a pre-existing vasculature (Risau, W., Nature 386: 671-674, 1997). It has been shown that protein kinases can contribute to the development and maintenance of a tumor phenotype (Fabbro et al., Pharmacology & Therapeutics 93: 79-98, 2002). For example, VEGF A-D and their four receptors are associated with phenotypes that include neovascularization and increased vascular permeability, such as tumor angiogenesis and lymphangiogenesis (Matter, A., Drug Discov. Today 6: 1005-1023, 2001).
Было признано, что подход на основе одного средства, которое специфическим образом нацелено на одну киназу или один киназный путь, может быть недостаточным для лечения заболеваний и расстройств, в частности рака, по некоторым причинам. Модели дают основание предположить, что необходимо от 5 до 7 мутаций для преобразования нормальной клетки в злокачественную. Кроме того, общепризнано, что рак является результатом изменений в нескольких путях, в частности, протеинкиназных путях, которые связаны с такими процессами, как клеточный рост, пролиферация, апоптоз, подвижность или инвазия. В большинстве раковых заболеваний, общим характерным признаком является одновременная сверхэкспрессия и/или гиперактивация различных протеинкиназ, таких как рецепторные и нерецепторные киназы, сериновые/треониновые киназы, P13 киназы и связанные с клеточным циклом киназы. На самом деле, некоторые из этих киназ, либо отдельно, либо в сочетании с другими киназами, участвуют в различных процессах, важных для клеточного выживания, пролиферации, роста и злокачественного преобразования, подвижности и инвазии, ведущих к метастазам и ангиогенезу или воспалению и заболеваниям, расстройствам и состояниям, связанным с ними.It was recognized that a single agent approach that specifically targets one kinase or single kinase pathway may not be sufficient to treat diseases and disorders, in particular cancer, for some reason. Models suggest that 5 to 7 mutations are needed to convert a normal cell to a malignant one. In addition, it is generally accepted that cancer results from changes in several pathways, in particular, protein kinase pathways that are associated with processes such as cell growth, proliferation, apoptosis, motility, or invasion. In most cancers, a common characteristic is the simultaneous overexpression and / or hyperactivation of various protein kinases, such as receptor and non-receptor kinases, serine / threonine kinases, P13 kinases and cell cycle-related kinases. In fact, some of these kinases, either alone or in combination with other kinases, are involved in various processes important for cell survival, proliferation, growth and malignant transformation, motility and invasion, leading to metastases and angiogenesis or inflammation and diseases, disorders and conditions associated with them.
Следовательно, блокирование одной киназной мишени может быть клинически недостаточным, поскольку существует несколько мишеней, представляющих собой киназы, которые влияют на прогрессирование состояния, заболевания или расстройства. Кроме того, блокирование одной киназной мишени может быть клинически недостаточным, поскольку избыточные киназа-опосредованные пути и альтернативные онкогенные или воспалительные механизмы могут компенсировать блокированную киназную мишень. Более того, применение одного средства также может повысить вероятность развития резистентности к этому средству.Therefore, blocking a single kinase target may be clinically insufficient, since there are several kinase targets that affect the progression of a condition, disease, or disorder. In addition, blocking a single kinase target may be clinically insufficient, since excessive kinase-mediated pathways and alternative oncogenic or inflammatory mechanisms can compensate for a blocked kinase target. Moreover, the use of a single agent can also increase the likelihood of developing resistance to this agent.
Сердечно-сосудистое заболевание является причиной почти четверти общей годовой смертности во всем мире. Сосудистые расстройства, такие как атеросклероз и рестеноз, являются результатом нарушений роста стенок сосудов и ограничения притока крови к жизненно важным органам. Различные киназные пути, например JNK, активируются атерогенными стимулами и регулируются через локальную продукцию цитокинов и факторов роста в клетках сосудов (Yang et al, Immunity 9:575, 1998). Ишемия и ишемия вместе с реперфузией в сердце, почке или головном мозге приводят к клеточной гибели и образованию рубцов, что может в результате привести к застойной сердечной недостаточности, почечной недостаточности или церебральной дисфункции. При трансплантации органов реперфузия ранее ишемических донорских органов приводит к острому лейкоцит-опосредованному повреждению ткани и замедлению функции трансплантата. Пути ишемии и реперфузии опосредованы различными киназами. Например, JNK путь связан с лейкоцит-опосредованным повреждением ткани (Li et al., Mol. Cell. Biol. 16:5947-5954, 1996). И наконец, усиленный апоптоз в сердечных тканях также связывают с киназной активностью (Pombo et al., J. Biol. Chem. 269:26546-26551, 1994).Cardiovascular disease accounts for nearly a quarter of total annual deaths worldwide. Vascular disorders, such as atherosclerosis and restenosis, are the result of impaired growth of the walls of blood vessels and limitation of blood flow to vital organs. Various kinase pathways, such as JNK, are activated by atherogenic stimuli and are regulated through local production of cytokines and growth factors in vascular cells (Yang et al, Immunity 9: 575, 1998). Ischemia and ischemia, together with reperfusion in the heart, kidney, or brain, lead to cell death and scarring, which can result in congestive heart failure, renal failure, or cerebral dysfunction. During organ transplantation, reperfusion of previously ischemic donor organs leads to acute leukocyte-mediated tissue damage and a decrease in transplant function. Ways of ischemia and reperfusion are mediated by various kinases. For example, the JNK pathway is associated with leukocyte-mediated tissue damage (Li et al., Mol. Cell. Biol. 16: 5947-5954, 1996). Finally, enhanced apoptosis in cardiac tissues is also associated with kinase activity (Pombo et al., J. Biol. Chem. 269: 26546-26551, 1994).
Claims (18)
или его фармацевтически приемлемая соль, где
А представляет собой
R1 представляет собой водород или RaRbN;
R2 представляет собой водород;
R3 представляет собой алкил, алкокси, арил, циано, циклоалкил, галоген, галогеналкил, гетероарил, нитро или RgRhN-;
Ra и Rb каждый представляет собой водород-;
Rg и Rh каждый независимо представляют собой водород, С1-10алкил или С1-10алкилкарбонил;
Ri, Rii, Riii, Riv, Rv, Rvi, Rvii, Rviii, Rix, Rx, Rxi, Rxii, Rxiii, Rx1v, Rxv, Rxvi, Rxvii и Rxviii каждый независимо представляют собой С1-10алкокси, С1-10алкокси-С1-10алкил, С1-10алкоксикарбонил, С1-10алкоксикарбонил-С1-10алкил, арил, арил-С1-10алкил, арил-С1-10-(гидрокси)алкил, арилоксиалкил, арилкарбонил, арилтиоалкил, карбокси, карбокси-С1-10алкил, С1-10цианоалкил, С3-8циклоалкил, С3-8циклоалкил-С1-10алкил, С3-8циклоалкилкарбонил, галоген, гетероарил, гетероарил-С1-10алкил, гетероцикл, гетероцикл-С1-10, С1-10алкил, гетероциклкарбонил, С1-10гидроксиалкил, С1-10триалкилсилил-С1-10алкил, H2NC(O)-С1-10алкил, ZaZbN-, ZaZbN-С1-10алкил, ZcZdNC(O)- или ZcZdNS(O)2; Za и Zb каждый независимо представляют собой водород, С1-10алкил, алкоксикарбонил-С1-10алкил, арил, арил-С1-10алкил, С3-8циклоалкил, H2NC(O)-, H2TN-С1-10алкилС(O)-, H2NC(О)-С1-10алкил, С1-10диалкилNС(О)- или С1-10диалкилNС(О)-алкил-;
Zc и Zd каждый независимо представляют собой водород, С1-10алкил, С1-10алкокси-С1-10алкил, арил, арил-С1-10алкил, арил- С1-10(гидрокси)алкил, С3-8циклоалкил, С3-8циклоалкил-С1-10алкил, гетероарил-С1-10алкил, гетероцикл, гетероциклС1-10алкил, С1-10гидроксиалкил, H2NC(O)-С1-10алкил-, С1-10диалкилNС(О)-С1-10алкил-, С1-10диалкилN-С1-10алкил- или CHZeZf;
Ze представляет собой арил или гетероарил;
Zf представляет собой гетероарил-С1-10алкил или гетероцикл-С1-10алкил;
m имеет значение 0;
а имеет значение 0 или 1;
b имеет значение 0, 1 или 2;
с имеет значение 0, 1, 2 или 3; d имеет значение 0, 1, 2, 3 или 4,
где арил означает фенил, дигидроинденил, инденил, нафтил,
дигидронафталинил или тетрагидронафталинил;
где гетероарил означает фурил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, тиазолил, тиенил, триазолил, триазинил, бензофуранил, бензоксадиазолил, 1,3-бензотиазолил, бензимидазолил, бензодиоксолил, бензотиофенил, хроменил, циннолинил, фуропиридин, индолил, индазолил, изоиндолил, изохинолинил, нафтиридинил, оксазолопиридин, хинолинил, тиенопиридин или тиенопиридинил; и
где гетероцикл означает азетидинил, азепанил, азиридинил, диазепанил, 1,3-диоксанил, 1,3-диоксоланил, 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, изоиндолин-1,3-дион, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидотиоморфолинил, тиопиранил, тритианил, 1,3-бензодиоксолил, 1,3-бензодитиолил, 2,3-дигидро-1,4-бензодиоксинил, 2,3-дигидро-1-бензофуранил, 2,3-дигидро-1-бензотиенил, 3,4-дигидро-1Н-изохромен-4-ил, 2,3-дигидро-1Н-индолил, сукцинимидил, 1,2,3,4-тетрагидрохинолинил, 2,3,4,4а,9,9а-гексагидро-1Н-карбазолил, 5а,6,7,8,9,9а-гексагидродибензо[b,d]фуранил или 5а,6,7,8,9,9а-гексагидробензо[b,d]тиенил.1. The compound of formula (I)
or its pharmaceutically acceptable salt, where
A represents
R 1 represents hydrogen or R a R b N;
R 2 represents hydrogen;
R 3 represents alkyl, alkoxy, aryl, cyano, cycloalkyl, halogen, haloalkyl, heteroaryl, nitro or R g R h N-;
R a and R b each represents hydrogen;
R g and R h each independently represent hydrogen, C 1-10 alkyl or C 1-10 alkylcarbonyl;
R i , R ii , R iii , R iv , R v , R vi , R vii , R viii , R ix , R x , R xi , R xii , R xiii , R x1v , R xv , R xvi , R xvii and R xviii each independently represents C 1-10 alkoxy, C 1-10 alkoxy-C 1-10 alkyl, C 1-10 alkoxycarbonyl, C 1-10 alkoxycarbonyl-C 1-10 alkyl, aryl, aryl-C 1- 10 alkyl, aryl-C 1-10 - (hydroxy) alkyl, aryloxyalkyl, arylcarbonyl, arylthioalkyl, carboxy, carboxy-C 1-10 alkyl, C 1-10 cyanoalkyl, C 3-8 cycloalkyl, C 3-8 cycloalkyl-C 1-10 alkyl, C 3-8 cycloalkylcarbonyl, halogen, heteroaryl, heteroaryl-C 1-10 alkyl, heterocycle, heterocycle-C 1-10 , C 1-10 alkyl, heterocyclecarbonyl, C 1-10 hydroxyalkyl, C 1-10 trialkylsi lil-C 1-10 alkyl, H 2 NC (O) -C 1-10 alkyl, Z a Z b N-, Z a Z b N-C 1-10 alkyl, Z c Z d NC (O) - or Z c Z d NS (O) 2 ; Z a and Z b each independently represent hydrogen, C 1-10 alkyl, alkoxycarbonyl-C 1-10 alkyl, aryl, aryl-C 1-10 alkyl, C 3-8 cycloalkyl, H 2 NC (O) -, H 2 TN-C 1-10 alkylC (O) -, H 2 NC (O) -C 1-10 alkyl, C 1-10 dialkylNC (O) - or C 1-10 dialkylNC (O) -alkyl-;
Z c and Z d each independently represent hydrogen, C 1-10 alkyl, C 1-10 alkoxy-C 1-10 alkyl, aryl, aryl-C 1-10 alkyl, aryl-C 1-10 (hydroxy) alkyl, C3-8 cycloalkyl, C3-8 cycloalkyl-C1-10 alkyl, heteroaryl-C 1-10 alkyl, heterocycle geterotsiklS 1-10 alkyl, C 1-10 hydroxyalkyl, H 2 NC (O) -C 1- 10 alkyl-, C 1-10 dialkylNC (O) -C 1-10 alkyl-, C 1-10 dialkylN-C 1-10 alkyl- or CHZ e Z f ;
Z e represents aryl or heteroaryl;
Z f represents heteroaryl-C 1-10 alkyl or heterocycle-C 1-10 alkyl;
m is 0;
It has a value of 0 or 1;
b is 0, 1 or 2;
c is 0, 1, 2 or 3; d is 0, 1, 2, 3 or 4,
where aryl means phenyl, dihydroindenyl, indenyl, naphthyl,
dihydronaphthalenyl or tetrahydronaphthalenyl;
where heteroaryl means furyl, imidazolyl, isoxazolyl, isothiazolyl, oxadiazolyl, oxazolyl, pyridinyl, pyridazinyl, pyrimidinyl, pyrazinyl, pyrazolyl, pyrrolyl, tetrazolyl, thiadiazolyl, benzyl azolazole, benzyl azolazole, triazolaziazolazole, triazolaziazolazole, triazolaziazolazole, triazolaziazolazole, triazolazoles , benzodioxolyl, benzothiophenyl, chromenyl, cinnolinyl, furopyridine, indolyl, indazolyl, isoindolyl, isoquinolinyl, naphthyridinyl, oxazolopyridine, quinolinyl, thienopyridine or thienopyridinyl; and
where the heterocycle means azetidinyl, azepanyl, aziridinyl, diazepanyl, 1,3-dioxanyl, 1,3-dioxolanyl, 1,3-dithiolanyl, 1,3-dithianyl, imidazolinyl, imidazolidinyl, isothiazolinyl, isothiazolidinyl, isoxazolidinyl, isoxazolidinyl , 3-dione, morpholinyl, oxadiazoline, oxadiazolidine, oxazolinyl, oxazolidinyl, piperazinyl, piperidinyl, pyranyl, pyrazolinyl, pyrazolidinyl, pyrrolinyl, pyrrolidinyl, tetrahydrofuranyl, tetrahydrothienyl, thiadiazoline, thiadiazolidine, thiazolinyl, thiazolidinyl, thiomorpholinyl, 1,1-dioksidotiomorfolinil, ti supported, tritianil, 1,3-benzodioxolyl, 1,3-benzodithiolyl, 2,3-dihydro-1,4-benzodioxinyl, 2,3-dihydro-1-benzofuranyl, 2,3-dihydro-1-benzothienyl, 3, 4-dihydro-1H-isochromen-4-yl, 2,3-dihydro-1H-indolyl, succinimidyl, 1,2,3,4-tetrahydroquinolinyl, 2,3,4,4a, 9,9a-hexahydro-1H- carbazolyl, 5a, 6,7,8,9,9a-hexahydro-dibenzo [b, d] furanyl or 5a, 6,7,8,9,9a-hexahydrobenzo [b, d] thienyl.
R11 представляет собой С1-10алкокси-С1-10алкил, С1-10алкоксикарбонил, арил, арил-С1-10алкил, арил-С1-10 (гидрокси)алкил, арилокси-С1-10алкил, арилкарбонил, алкоксикарбонил-С1-10алкил, арил-С1-10тиоалкил, карбокси, карбокси-С1-10алкил, С3-8циклоалкил, С3-8циклоалкил-С1-10алкил, С3-8циклоалкилкарбонил, галоген, гетероарил, гетероарил-С1-10алкил, гетероцикл, гетероцикл-С1-10алкил, гетероциклкарбонил, С1-10гидроксиалкил, С1-10триалкилсилил-С1-10алкил, ZaZbN-, ZaZbN-С1-10алкил- или ZcZdNC(O)-;
Za и Zb каждый независимо представляют собой водород, С1-10алкил или H2N-С1-10алкилС(O)-;
Zc и Zd каждый независимо представляют собой водород, С1-10алкил, С1-10алкокси-С1-10алкил, арил, арил-С1-10алкил, С3-8циклоалкил, С3-8циклоалкил-С1-10алкил, гетероарил-С1-10алкил, гетероцикл-С1-10алкил, С1-10гидроксиалкил или С1-10диалкилN-С1-10алкил-; и
b имеет значение 0, 1 или 2.3. The compound according to claim 2, where a represents (ii),
R 11 represents C 1-10 alkoxy-C 1-10 alkyl, C 1-10 alkoxycarbonyl, aryl, aryl-C 1-10 alkyl, aryl-C 1-10 (hydroxy) alkyl, aryloxy-C 1-10 alkyl , arylcarbonyl, alkoxycarbonyl-C 1-10 alkyl, aryl-C 1-10 thioalkyl, carboxy, carboxy-C 1-10 alkyl, C 3-8 cycloalkyl, C 3-8 cycloalkyl-C 1-10 alkyl, C 3- 8 cycloalkylcarbonyl, halogen, heteroaryl, heteroaryl-C 1-10 alkyl, heterocycle, heterocycle-C 1-10 alkyl, heterocycle carbonyl, C 1-10 hydroxyalkyl, C 1-10 trialkylsilyl-C 1-10 alkyl, Z a Z b N -, Z a Z b N — C 1-10 alkyl or Z c Z d NC (O) -;
Z a and Z b each independently represent hydrogen, C 1-10 alkyl or H 2 N — C 1-10 alkylC (O) -;
Z c and Z d each independently represent hydrogen, C 1-10 alkyl, C 1-10 alkoxy-C 1-10 alkyl, aryl, aryl-C 1-10 alkyl, C 3-8 cycloalkyl, C 3-8 cycloalkyl -C 1-10 alkyl, heteroaryl-C 1-10 alkyl, heterocycle-C 1-10 alkyl, C 1-10 hydroxyalkyl or C 1-10 dialkyl N-C 1-10 alkyl-; and
b is 0, 1, or 2.
R11 представляет собой арил, арил-С1-10алкил, С3-8циклоалкил, С3-8циклоалкил-С1-10алкил или галоген;
b имеет значение 1 или 2.4. The compound according to claim 3, where
R 11 represents aryl, aryl-C 1-10 alkyl, C 3-8 cycloalkyl, C 3-8 cycloalkyl-C 1-10 alkyl or halogen;
b is 1 or 2.
Riii представляет собой арил-С1-10алкил; и
с имеет значение 1.5. The compound according to claim 1, where a represents (iii),
R iii represents aryl-C 1-10 alkyl; and
c is 1.
Riii представляет собой С1-10алкоксикарбонил-С1-10алкил, арил-С1-10алкил, С1-10цианоалкил, гетероцикл-С1-10алкил или H2NC(O)-С1-10алкил-;
с имеет значение 0, 1 или 2.6. The compound according to claim 2, where a represents (iii)
R iii represents C 1-10 alkoxycarbonyl-C 1-10 alkyl, aryl-C 1-10 alkyl, C 1-10 cyanoalkyl, heterocycle-C 1-10 alkyl or H 2 NC (O) -C 1-10 alkyl -;
c is 0, 1 or 2.
Riv представляет собой арил, арил-С1-10алкил, гетероцикл, гетероцикл-С1-10алкил или ZaZbN-С1-10алкил или ZcZdNS(O)2-;
Za и Zb каждый независимо представляют собой водород или С1-10алкил;
Zc и Zd каждый представляют собой С1-10алкил; и
с имеет значение 0 или 1.7. The compound according to claim 2, where a represents (iv)
R iv represents aryl, aryl-C 1-10 alkyl, heterocycle, heterocycle-C 1-10 alkyl or Z a Z b N-C 1-10 alkyl or Z c Z d NS (O) 2 -;
Z a and Z b each independently represent hydrogen or C 1-10 alkyl;
Z c and Z d each represent C 1-10 alkyl; and
c is 0 or 1.
Rvii представляет собой С1-10алкоксикарбонил, арил, арил-С1-10алкил, С3-8циклоалкил, гетероцикл-С1-10алкил, гетероциклкарбонил, С1-10гидроксиалкил или ZcZdNC(O)-;
Zc и Zd каждый независимо представляют собой водород, С1-10алкил, С1-10алкокси-С1-10алкил, арил, арил-С1-10алкил, арил-С1-10(гидрокси)алкил, С3-8циклоалкил, С3-8циклоалкил-С1-10алкил, гетероарил-С1-10алкил, гетероцикл, гетероцикл-С1-10алкил, С1-10гидроксиалкил или CHZeZf;
Ze представляет собой арил или гетероарил;
Zf представляет собой гетероарил-С1-10алкил или гетероцикл-С1-10алкил; и b имеет значение 1.8. The compound according to claim 2, where a represents (vii)
R vii represents C 1-10 alkoxycarbonyl, aryl, aryl-C 1-10 alkyl, C 3-8 cycloalkyl, heterocycle-C 1-10 alkyl, heterocyclecarbonyl, C 1-10 hydroxyalkyl or Z c Z d NC (O) -;
Z c and Z d each independently represent hydrogen, C 1-10 alkyl, C 1-10 alkoxy-C 1-10 alkyl, aryl, aryl-C 1-10 alkyl, aryl-C 1-10 (hydroxy) alkyl, C 3-8 cycloalkyl, C 3-8 cycloalkyl-C 1-10 alkyl, heteroaryl-C 1-10 alkyl, heterocycle, heterocycle-C 1-10 alkyl, C 1-10 hydroxyalkyl or CHZ e Z f ;
Z e represents aryl or heteroaryl;
Z f represents heteroaryl-C 1-10 alkyl or heterocycle-C 1-10 alkyl; and b is 1.
Rvii представляет собой С1-10алкоксикарбонил, арил-С1-10алкил, С3-8циклоалкил, гетероцикл-С1-10алкил, гетероциклкарбонил, С1-10гидроксиалкил или ZcZdNC(O)-;
Zc и Zd каждый независимо представляют собой водород, С1-10алкил, С1-10алкокси-С1-10алкил, арил, арил-С1-10алкил, арил-С1-10(гидрокси)алкил, С3-8циклоалкил, гетероарил-С1-10алкил, гетероцикл- С1-10алкил или С1-10гидроксиалкил; и
b имеет значение 1.9. The compound according to claim 2, where a represents (vii)
R vii represents C 1-10 alkoxycarbonyl, aryl-C 1-10 alkyl, C 3-8 cycloalkyl, heterocycle-C 1-10 alkyl, heterocyclecarbonyl, C 1-10 hydroxyalkyl or Z c Z d NC (O) -;
Z c and Z d each independently represent hydrogen, C 1-10 alkyl, C 1-10 alkoxy-C 1-10 alkyl, aryl, aryl-C 1-10 alkyl, aryl-C 1-10 (hydroxy) alkyl, C 3-8 cycloalkyl, heteroaryl-C 1-10 alkyl, heterocycle-C 1-10 alkyl or C 1-10 hydroxyalkyl; and
b is 1.
Rvii представляет собой арил-С1-10алкил; и
b имеет значение 1.10. The method according to claim 2, where a represents (vii)
R vii represents aryl-C 1-10 alkyl; and
b is 1.
R1 представляет собой водород;
Rx представляет собой арил или ZaZbN-;
Za и Zb каждый независимо представляют собой водород, С1-10алкил, арил или арил-С1-10алкил; и
b имеет значение 1 или 2.11. The compound according to claim 2, where a represents (x)
R 1 represents hydrogen;
R x represents aryl or Z a Z b N-;
Z a and Z b each independently represent hydrogen, C 1-10 alkyl, aryl or aryl-C 1-10 alkyl; and
b is 1 or 2.
R1 представляет собой водород;
Rxiv представляет собой ZaZbN-;
Za и Zb каждый независимо представляют собой водород или С3-8циклоалкил; и
с имеет значение 1.12. The compound according to claim 2, where a represents (xiv)
R 1 represents hydrogen;
R xiv represents Z a Z b N-;
Z a and Z b each independently represent hydrogen or C 3-8 cycloalkyl; and
c is 1.
Rxv представляет собой ZaZbN-;
Za и Zb каждый независимо представляют собой водород, С1-10алкоксикарбонил-С1-10алкил, арил, арил-С1-10алкил или С3-8циклоалкил; и
d имеет значение 0 или 1.13. The compound according to claim 2, where a represents (xv)
R xv represents Z a Z b N-;
Z a and Z b each independently represent hydrogen, C 1-10 alkoxycarbonyl-C 1-10 alkyl, aryl, aryl-C 1-10 alkyl or C 3-8 cycloalkyl; and
d is 0 or 1.
R1 представляет собой водород;
Rxvii представляет собой ZaZbN-;
Za и Zb каждый независимо представляют собой водород или С3-8циклоалкил; и
d имеет значение 1.14. The compound according to claim 2, where a represents (xvi)
R 1 represents hydrogen;
Rx vii is Z a Z b N-;
Z a and Z b each independently represent hydrogen or C 3-8 cycloalkyl; and
d is 1.
R1 представляет собой водород;
Rxvii представляет собой ZaZbN- или арил;
Za и Zb каждый независимо представляют собой водород, С1-10алкил, С1-10алкоксикарбонил-С1-10алкил, арил, арил-С1-10алкил, С1-10циклоалкил или H2NC(O)-С1-10алкил; и
d имеет значение 0 или 1.15. The compound according to claim 2, where a represents (xvii)
R 1 represents hydrogen;
R xvii represents Z a Z b N - or aryl;
Z a and Z b each independently represent hydrogen, C 1-10 alkyl, C 1-10 alkoxycarbonyl-C 1-10 alkyl, aryl, aryl-C 1-10 alkyl, C 1-10 cycloalkyl or H 2 NC (O ) -C 1-10 alkyl; and
d is 0 or 1.
R1 представляет собой RaRbN-;
с имеет значение 0.16. The compound according to claim 2, where a represents (xviii)
R 1 represents R a R b N-;
c is 0.
5-(1-бензил-1Н-1,2,3-триазол-5-ил)-1Н-индазольное соединение с 5-(1-бензил-1Н-1,2,3-триазол-4-ил)-1Н-индазолом;
5-(1-бензил-1Н-1,2,3-триазол-4-ил)-1Н-индазол;
5-[1-(2-метилбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(3-метилбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(4-метилбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(3-метоксибензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(2-фторбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(3-фторбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(4-фторбензил)-1H-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(2-хлорбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(3-хлорбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(4-хлорбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(2-бромбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(2-нитробензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(3-нитробензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(4-нитробензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
2-{[4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-1-ил]метил}бензонитрил;
3-{[4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-1-ил]метил}бензонитрил;
4-{[4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-1-ил]метил}бензонитрил;
5-{1-[2-(трифторметил)бензил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
5-{1-[3-(трифторметил)бензил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
5-{1-[4-(трифторметил)бензил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
5-{1-[3-(трифторметокси)бензил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
5-{1-[4-(трифторметокси)бензил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
5-[1-(4-трет-бутилбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
метил 3-{[4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-1-ил]метил}бензоат;
метил 4-{[4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-1-ил]метил}бензоат;
5-[1-(2,4-диметилбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(3,5-диметилбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(2,3-дихлорбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(2,4-дихлорбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(2,5-дихлорбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-(3,5-дихлорбензил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-{1-[2,4-бис(трифторметил)бензил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
N-циклогексил-6-(1Н-индазол-5-ил)имидазо[2,1-b][1,3]тиазол-5-амин;
N-циклогексил-2-(1Н-индазол-5-ил)имидазо[1,2-а]пиридин-3-амин;
N-циклогексил-2-(1Н-индазол-5-ил)имидазо[1,2-а]пиразин-3-амин;
5-[1-бензил-4-(4-фторфенил)-1Н-имидазол-5-ил]-1Н-индазол;
N-{3-[4-(4-фторфенил)-5-(1Н-индазол-5-ил)-1Н-имидазол-1-ил]пропил}-N,N-диметиламин;
5-[4-(4-фторфенил)-1-(1-фенилэтил)-1Н-имидазол-5-ил]-1Н-индазол;
4-(1Н-индазол-5-ил)-N-фенил-1,3-тиазол-2-амин;
N-этил-4-(1Н-индазол-5-ил)-1,3-тиазол-2-амин;
N-бензил-4-(1Н-индазол-5-ил)-1,3-тиазол-2-амин;
4-(1Н-индазол-5-ил)-1,3-тиазол-2-амин;
4-(1Н-индазол-5-ил)-N-(2-фенилэтил)-1,3-тиазол-2-амин;
N-бензил-2-(1Н-индазол-5-ил)имидазо[1,2-а]пиримидин-3-амин;
N-бутил-2-(1Н-индазол-5-ил)имидазо[1,2-а]пиримидин-3-амин;
N-(4-хлорфенил)-2-(1Н-индазол-5-ил)имидазо[1,2-а]пиримидин-3-амин;
2-(1Н-индазол-5-ил)-N-(4-метоксифенил)имидазо[1,2-а]пиримидин-3-амин;
2-(1Н-индазол-5-ил)имидазо[1,2-а]пиримидин;
метил N-[2-(1Н-индазол-5-ил)имидазо[1,2-а]пиридин-3-ил]глицинат;
N[-бензил-2-(1Н-индазол-5-ил)имидазо[1,2-а]пиридин-3-амин;
N(4-хлорфенил)-2-(1Н-индазол-5-ил)имидазо[1,2-а]пиридин-3-амин;
2-(1Н-индазол-5-ил)-N-(4-метоксифенил)имидазо[1,2-а]пиридин-3-амин;
трет-бутил 4-[4-(4-фторфенил)-5-(1Н-индазол-5-ил)-1Н-имидазол-1-ил]пиперидин-1-карбоксилат;
5-(1-бензил-1Н-1,2,3-триазол-4-ил)-1Н-индазол-3-амин;
5-[4-(4-фторфенил)-1-пиперидин-4-ил-1Н-имидазол-5-ил]-1Н-индазол;
5-{4-(4-фторфенил)-1-[2-(1-метилпирролидин-2-ил)этил]-1Н-имидазол-5-ил}-1Н-индазол;
5-{4-(4-фторфенил)-1-[3-(4-метилпиперазин-1-ил)пропил]-1Н-имидазол-5-ил}-1Н-индазол;
этил 5-(1Н-индазол-5-ил)изоксазол-3-карбоксилат;
5-(1Н-индазол-5-ил)-N-метилизоксазол-3-карбоксамид;
5-(3-бензилизоксазол-5-ил)-1Н-индазол;
N-бензил-4-(1Н-индазол-5-ил)-5-фенил-1,3-тиазол-2-амин;
4-(1Н-индазол-5-ил)-N,5-дифенил-1,3-тиазол-2-амин;
5-(1-бензил-5-циклопропил-1Н-1,2,3-триазол-4-ил)-1Н-индазол;
5-(1-бензил-4-циклопропил-1Н-1,2,3-триазол-5-ил)-1Н-индазол;
2-(1Н-индазол-5-ил)-3-фенилимидазо[1,2-а]пиримидин;
5-[1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-4-ил]-1Н-имидазол;
5-[3-(пиперидин-1-илкарбонил)изоксазол-5-ил]-1Н-индазол;
5-(1Н-индазол-5-ил)-N-фенилизоксазол-3-карбоксамид;
N-циклогексил-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-[3-(пиперидин-1-илметил)изоксазол-5-ил]-1Н-индазол;
[5-(1Н-индазол-5-ил)изоксазол-3-ил]метанол;
5-(1Н-индазол-5-ил)-N-(2-метоксиэтил)изоксазол-3-карбоксамид;
5-(1-бензил-5-фенил-1Н-1,2,3-триазол-4-ил)-1Н-индазол;
5-(4-бензил-1Н-1,2,3-триазол-1-ил)-1Н-индазол;
5-(1-бензил-5-циклопропил-1Н-1,2,3-триазол-4-ил)-1Н-индазол-3-амин;
5-(1-бензил-4-циклопропил-1Н-1,2,3-триазол-5-ил)-1Н-индазол-3-амин;
5-(3-бензилизоксазол-5-ил)-1Н-индазол-3-амин;
N-{2-[4-(4-фторфенил)-5-(1Н-индазол-5-ил)-1Н-имидазол-1-ил]этил}-N,N-диметиламин;
5-[4-(4-фторфенил)-1-(3-морфолин-4-илпропил)-1Н-имидазол-5-ил]-1Н-индазол;
5-[4-(4-фторфенил)-1-(3-пирролидин-1-илпропил)-1Н-имидазол-5-ил]-1Н-индазол;
5-{4-(4-фторфенил)-1-[2-(4-метилпиперидин-1-ил)этил]-1Н-имидазол-5-ил}-1Н-индазол;
5-[1-(1-бензилпиперидин-4-ил)-4-(4-фторфенил)-1Н-имидазол-5-ил]-1Н-индазол;
5-[4-(4-фторфенил)-1-(2-морфолин-4-илэтил)-1Н-имидазол-5-ил]-1Н-индазол;
5-[1-(1-бензилпирролидин-3-ил)-4-(4-фторфенил)-1Н-имидазол-5-ил]-1Н-индазол;
2-{4-[4-(4-фторфенил)-5-(1Н-индазол-5-ил)-1Н-имидазол-1-ил]пиперидин-1-ил}-2-оксоэтанол;
5-(1-бензил-5-фенил-1Н-1,2,3-триазол-4-ил)-1Н-индазол-3-амин;
2-[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]пропан-2-ол;
5-[4-(метоксиметил)-1Н-1,2,3-триазол-1-ил]-1Н-индазол;
1-[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]-1-фенилэтанол;
1-[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]пропан-2-ол;
3-[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]пропан-1-ол;
1-{[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]метил}-1Н-1,2,3-бензотриазол;
5-{4-[(фенилтио)метил]-1Н-1,2,3-триазол-1-ил}-1Н-индазол;
5-(4-циклопропил-1Н-1,2,3-триазол-1-ил)-1Н-индазол;
5-[4-(2-фенилэтил)-1Н-1,2,3-триазол-1-ил]-1Н-индазол;
5-[4-(циклогексилметил)-1Н-1,2,3-триазол-1-ил]-1Н-индазол;
5-(4-циклопентил-1Н-1,2,3-триазол-1-ил)-1Н-индазол;
1-[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]циклогексанол;
5-[4-(феноксиметил)-1Н-1,2,3-триазол-1-ил]-1Н-индазол;
5-(4-[(1,1-диоксидотиоморфолин-4-ил)метил]-1H-1,2,3-триазол-1-ил}-1Н-индазол;
5-[4-(3-фенилпропил)-1Н-1,2,3-триазол-1-ил]-1Н-индазол;
[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил](фенил)метанон;
N,N-диэтил-N-{[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]метил}амин;
этил N-[2-(1Н-индазол-5-ил)имидазо[1,2-а]пиримидин-3-ил]-бета-аланинат;
5-(1-бензил-5-метил-1Н-1,2,3-триазол-4-ил)-1Н-индазол;
5-(1-бензил-5-метил-1Н-1,2,3-триазол-4-ил)-1Н-индазол-3-амин;
N-[2-(1Н-индазол-5-ил)имидазо[1,2-а]пиримидин-3-ил]-β-аланинамид;
5-(1-бензил-5-иод-1Н-1,2,3-триазол-4-ил)-1Н-индазол-3-амин;
N-{3-[4-(3-амино-1Н-индазол-5-ил)-1-бензил-1Н-1,2,3-триазол-5-ил]фенил}-N'-(3-метилфенил)мочевину;
5-(1H-индазол-5-ил)-N-(2-изопропоксиэтил)изоксазол-3-карбоксамид;
5-[3-(морфолин-4-илкарбонил)изоксазол-5-ил]-1Н-индазол;
5-(1Н-индазол-5-ил)-N-(3-морфолин-4-илпропил)изоксазол-3-карбоксамид;
N-[2-(1Н-имидазол-4-ил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
(3R)-1-{[5-(1Н-индазол-5-ил)изоксазол-3-ил]карбонил}пиперидин-3-ол;
1-{[5-(1Н-индазол-5-ил)изоксазол-3-ил]карбонил}пиперидин-3-карбоксамид;
2-[2-(4-{[5-(1Н-индазол-5-ил)изоксазол-3-ил]карбонил}пиперазин-1-ил)этокси]этанол;
5-{3-[(4-метил-1,4-диазепан-1-ил)карбонил]изоксазол-5-ил}-1Н-индазол;
N-(3-гидроксипропил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[(1R)-2-гидрокси-1-фенилэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[3-(1Н-имидазол-1-ил)пропил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[3-(2-оксопирролидин-1-ил)пропил]изоксазол-3-карбоксамид;
N-{2-[4-(аминосульфонил)фенил]этил}-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил](3-хлорфенил)метанон;
[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил](циклопропил)метанон;
5-[5-циклопропил-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
N1-{[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил]метил}глицинамид;
(4-фторфенил)[4-(1Н-индазол-5-ил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-5-ил]метанон;
(4-хлорфенил)[4-(1Н-индазол-5-ил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-5-ил]метанон;
(3-хлорфенил)[4-(1Н-индазол-5-ил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-5-ил]метанон;
(2-хлорфенил)[4-(1Н-индазол-5-ил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-5-ил]метанон;
циклопентил[4-(1Н-индазол-5-ил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-5-ил]метанон;
1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоновую кислоту;
5-{5-(4-фторфенил)-1-[4-(трифторметил)бензил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол-3-амин;
5-[1-бензил-5-(4-фторфенил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
[4-(1Н-индазол-5-ил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-5-ил](тетрагидро-2Н-пиран-4-ил)метанон;
5-[1-бензил-5-(2-метилфенил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-{1-бензил-5-[(4-метилпиперазин-1-ил)карбонил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
1-{[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил]карбонил}пиперидин-4-ол;
1-бензил-4-(1Н-индазол-5-ил)-N,N-диметил-1Н-1,2,3-триазол-5-карбоксамид;
N,1-дибензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
N-(2-гидрокси-2-фенилэтил)-5-(1Н-индазол-5-ил)-N-метилизоксазол-3-карбоксамид;
N-[(18)-2-гидрокси-1-фенилэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-бензил-N-(2-гидроксиэтил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-[1-бензил-5-(2-метилфенил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
2-{2-[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]этил}-1Н-изоиндол-1,3(2Н)-дион;
5-{4-[(2,4-дихлорфенокси)метил]-1Н-1,2,3-триазол-1-ил}-1Н-индазол;
5-{4-[(2,6-дихлорфенокси)метил]-1Н-1,2,3-триазол-1-ил}-1Н-индазол;
5-[5-(4-фторфенил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
1-{[1-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-4-ил]метил}-1Н-индазол;
5-[1-бензил-5-(пиперидин-1-илкарбонил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[5-(2-метилфенил)-1 (тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[5-(2-метилфенил)-1-(тетрагидро-2Н-пиран-4-илметил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
5-[1-бензил-5-(морфолин-4-илкарбонил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол;
5-[1-бензил-5-(4-метоксифенил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
N-[(1S)-1-бензил-2-гидроксиэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[(1S,2R)-2-гидрокси-2,3-дигидро-1Н-инден-1-ил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-{3-[(3-фенилморфолин-4-ил)карбонил]изоксазол-5-ил}-1Н-индазол;
N-бензил-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
((1S)-2-{[5-(1Н-индазол-5-ил)изоксазол-3-ил]карбонил}-6,7-диметокси-1,2,3,4-тетрагидроизохинолин-1-ил)метанол;
N[(1R)-3-гидрокси-1-фенилпропил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N[(1S)-3-гидрокси-1-фенилпропил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-2,3-дигидро-1Н-инден-1-ил-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-2,3-дигидро-1Н-инден-2-ил-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(1-фенилпропил)изоксазол-3-карбоксамид;
5-{1-бензил-5-[3-(диметиламино)фенил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол-3-амин;
5-{1-бензил-5-[4-(диметиламино)фенил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол-3-амин;
N-{3-[4-(3-амино-1Н-индазол-5-ил)-1-бензил-1Н-1,2,3-триазол-5-ил]фенил}ацетамид;
N-{4-[4-(3-амино-1Н-индазол-5-ил)-1-бензил-1Н-1,2,3-триазол-5-ил]фенил}ацетамид;
5-{1-бензил-5-[3-(1Н-пиразол-1-ил)фенил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол-3-амин;
5-[1-бензил-5-(1-метил-1Н-пиразол-4-ил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
3-[4-(3-амино-1Н-индазол-5-ил)-1-бензил-1Н-1,2,3-триазол-5-ил]-N-фенилбензамид;
3-[4-(3-амино-1Н-индазол-5-ил)-1-бензил-1Н-1,2,3-триазол-5-ил]-N-бензилбензамид;
5-[1-бензил-5-(1-метил-1Н-индол-5-ил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
5-[1-бензил-5-(3-метоксифенил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
5-[1-бензил-5-(3-морфолин-4-илфенил)-1Н-1,2,3-триазол-4-ил]-1Н-индазол-3-амин;
5-[3-(1,3-дигидро-2Н-изоиндол-2-илкарбонил)изоксазол-5-ил]-1Н-индазол;
5-{3-[(4-метил-2-фенилпиперазин-1-ил)карбонил]изоксазол-5-ил}-1Н-индазол;
1-{[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил]карбонил}пиперидин-4-амин;
N-[(1R)-1-бензил-2-гидроксиэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1-бензил-1Н-пиразол-4-ил)-1Н-индазол;
3-[4-(3-амино-1Н-индазол-5-ил)-1-бензил-1Н-1,2,3-триазол-5-ил]фенол;
3-[4-(3-амино-1Н-индазол-5-ил)-1-бензил-1Н-1,2,3-триазол-5-ил]бензамид;
5-{1-бензил-5-[4-(метилсульфонил)фенил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол-3-амин;
5-(1Н-индазол-5-ил)-N-[(1S)-1-фенилпропил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1R)-1-фенилпропил]изоксазол-3-карбоксамид;
5-(1-бензил-1Н-пиразол-4-ил)-1Н-индазол-3-амин;
1-бензил-4-(1Н-индазол-5-ил)-N-[(2S)-тетрагидрофуран-2-илметил]-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-4-(1Н-индазол-5-ил)-N-(2-изопропоксиэтил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-4-(1Н-индазол-5-ил)-N-[(2R)-тетрагидрофуран-2-илметил]-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-4-(1Н-индазол-5-ил)-N-(тетрагидрофуран-3-илметил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-циклопентил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-(циклопентилметил)-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-этил-4-(1Н-индазол-5-ил)-N-метил-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-4-(1Н-индазол-5-ил)-1,-изопропил-N-метил-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-4-(1Н-индазол-5-ил)-N-(2-метоксиэтил)-N-метил-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-4-(1 Н-индазол-5-ил)-N-фенил-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-(4-хлорфенил)-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-4-(1Н-индазол-5-ил)-N-(2-морфолин-4-илэтил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-[2-(диметиламино)этил]-4-(1Н-индазол-5-ил)-N-метил-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-(2-гидроксиэтил)-4-(1Н-индазол-5-ил)-N-пропил-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-[3-(диметиламино)пропил]-4-(1Н-индазол-5-ил)-N-метил-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-[2-(диэтиламино)этил]-4-(1Н-индазол-5-ил)-N-метил-1Н-1,2,3-триазол-5-карбоксамид;
N,1-дибензил-N-этил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
N,1-дибензил-N-(2-гидроксиэтил)-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
(3R)-1-{[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил]карбонил}пиперидин-3-ол;
1-{[1-бензил-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-ил]карбонил}пиперидин-4-карбоксамид;
5-{1-бензил-5-[(2,6-диметилморфолин-4-ил)карбонил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
5-{5-[(4-ацетилпиперазин-1-ил)карбонил]-1-бензил-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
5-{1-бензил-5-[(4-фенилпиперазин-1-ил)карбонил]-1Н-1,2,3-триазол-4-ил}-1Н-индазол;
1-бензил-N-[(1R)-1-(гидроксиметил)-2-метилпропил]-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-[(1S)-1-(гидроксиметил)-2-метилпропил]-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
1-бензил-N-[3-(1Н-имидазол-1-ил)пропил]-4-(1Н-индазол-5-ил)-1Н-1,2,3-триазол-5-карбоксамид;
3-[4-(3-амино-1Н-индазол-5-ил)-1Н-пиразол-1-ил]пропаннитрил;
2-[4-(3-амино-1Н-индазол-5-ил)-1Н-пиразол-1-ил]ацетамид;
метил 3-[4-(3-амино-1Н-индазол-5-ил)-1Н-пиразол-1-ил]пропаноат;
3-[4-(3-амино-1Н-индазол-5-ил)-1Н-пиразол-1-ил]пропанамид;
[4-(3-амино-1Н-индазол-5-ил)-1Н-пиразол-1-ил]ацетонитрил;
4-(3-амино-1Н-индазол-5-ил)-N,N-диметил-1Н-имидазол-1-сульфонамид;
5-имидазо[1,2-а]пиридин-3-ил-1Н-индазол-3-амин;
5-(1Н-пиразол-5-ил)-1Н-индазол-3-амин;
5-(1Н-имидазол-4-ил)-1Н-индазол-3-амин;
5-(1-бензил-1Н-имидазол-4-ил)-1Н-индазол-3-амин;
N-3,4-дигидро-1Н-изохромен-4-ил-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-(циклогексилметил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-(3-хлорбензил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(2-метоксибензил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[2-(трифторметил)бензил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[3-(трифторметил)бензил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[4-(трифторметил)бензил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(пиридин-2-илметил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(пиридин-3-илметил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(пиридин-4-илметил)изоксазол-3-карбоксамид;
N-(2-хлорбензил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-(4-хлорбензил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-]-N-[-(1-фенил-2-пиперидин-1-илэтил)изоксазол-3-карбоксамид;
N-[2-(1Н-имидазол-1-ил)-1-фенилэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-]-N-(2-морфолин-4-ил-1-фенилэтил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[2-(4-метилпиперазин-1-ил)-1-фенилэтил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(1-фенил-2-пирролидин-1-илэтил)изоксазол-3-карбоксамид;
трет-бутил 2-({[5-(1Н-индазол-5-ил)изоксазол-3-ил]карбонил}амино)-2-фенилэтилкарбамат;
5-(1Н-индазол-5-ил)-N-(1-нафтилметил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(2-фенилэтил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(2-пиридин-2-илэтил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(2-пиридин-3-илэтил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-(2-пиридин-4-илэтил)изоксазол-3-карбоксамид;
N-[2-(2-хлорфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[2-(3-хлорфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[2-(4-хлорфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-бензил-N-этил-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-метил-N-(1-нафтилметил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-метил-N-(2-фенилэтил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-метил-N-(2-пиридин-2-илэтил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1R)-1-фенилэтил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-1,2,3,4-тетрагидронафталин-1-илизоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1S)-1-(1-нафтил)этил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1R)-1-(1-нафтил)этил]изоксазол-3-карбоксамид;
N-[3-(диметиламино)-1-фенилпропил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-(2,3-дигидро-1,4-бензодиоксин-5-илметил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-(3,4-дигидро-2Н-1,5-бензодиоксепин-6-илметил)-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1-метил-1Н-индол-4-ил)метил]изоксазол-3-карбоксамид;
5-{3-[(3-фенилпирролидин-1-ил)карбонил]изоксазол-5-ил}-1Н-индазол;
5-{3-[(2-фенилпирролидин-1-ил)карбонил]изоксазол-5-ил}-1Н-индазол;
5-{3-[(2-фенилпиперидин-1-ил)карбонил]изоксазол-5-ил}-1Н-индазол;
5-(1Н-индазол-5-ил)-N-[(1S)-1-фенилэтил]изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1R)-1-(4-метилфенил)этил]-изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1S)-1-(4-метилфенил)этил]изоксазол-3-карбоксамид;
N-[(1R,2S)-2-гидрокси-2,3-дигидро-1Н-инден-1-ил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-(1R,2R)-2-гидрокси-2,3-дигидро-1Н-инден-1-ил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[(1R)-1-(4-бромфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[(1S)-1-(4-бромфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[(1R)-1-(4-хлорфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[(1S)-1-(4-хлорфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1S)-1-(2-нафтил)этил]изоксазол-3-карбоксамид;
N-[1-(4-этоксифенил)-2-гидроксиэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[2-гидрокси-1-(4-изопропилфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-(3,4-диметилфенил)-2-гидроксиэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[2-гидрокси-1-(2-метоксифенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
N-[2-гидрокси-1-(4-метилфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1R)-1-(2-метоксифенил)этил]-изоксазол-3-карбоксамид;
N-[(1S)-1-(3,4-дифторфенил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-[(1R)-1-(3-метоксифенил)этил]-изоксазол-3-карбоксамид;
5-(1Н-индазол-5-ил)-N-{(1R)-1-[3-(трифторметил)фенил]-этил}изоксазол-3-карбоксамид;
N-[1-(2,3-дигидро-1,4-бензодиоксин-6-ил)этил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид; или
N-[1-(3,5-дихлорфенил)-2-гидроксиэтил]-5-(1Н-индазол-5-ил)изоксазол-3-карбоксамид.17. A compound selected from the group including:
5- (1-benzyl-1H-1,2,3-triazol-5-yl) -1H-indazole compound with 5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H indazole;
5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5- [1- (2-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (3-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (4-methylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (3-methoxybenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (2-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (3-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (4-fluorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (2-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (3-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (4-chlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (2-bromobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (2-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (3-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (4-nitrobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
2 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile;
3 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile;
4 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzonitrile;
5- {1- [2- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5- {1- [3- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5- {1- [4- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5- {1- [3- (trifluoromethoxy) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5- {1- [4- (trifluoromethoxy) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5- [1- (4-tert-butylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
methyl 3 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzoate;
methyl 4 - {[4- (1H-indazol-5-yl) -1H-1,2,3-triazol-1-yl] methyl} benzoate;
5- [1- (2,4-dimethylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (3,5-dimethylbenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (2,3-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (2,4-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (2,5-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1- (3,5-dichlorobenzyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- {1- [2,4-bis (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
N-cyclohexyl-6- (1H-indazol-5-yl) imidazo [2,1-b] [1,3] thiazol-5-amine;
N-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine;
N-cyclohexyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrazin-3-amine;
5- [1-benzyl-4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole;
N- {3- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] propyl} -N, N-dimethylamine;
5- [4- (4-fluorophenyl) -1- (1-phenylethyl) -1H-imidazol-5-yl] -1H-indazole;
4- (1H-indazol-5-yl) -N-phenyl-1,3-thiazol-2-amine;
N-ethyl-4- (1H-indazol-5-yl) -1,3-thiazol-2-amine;
N-benzyl-4- (1H-indazol-5-yl) -1,3-thiazol-2-amine;
4- (1H-indazol-5-yl) -1,3-thiazol-2-amine;
4- (1H-indazol-5-yl) -N- (2-phenylethyl) -1,3-thiazol-2-amine;
N-benzyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine;
N-butyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine;
N- (4-chlorophenyl) -2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-amine;
2- (1H-indazol-5-yl) -N- (4-methoxyphenyl) imidazo [1,2-a] pyrimidin-3-amine;
2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidine;
methyl N- [2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-yl] glycinate;
N [-benzyl-2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine;
N (4-chlorophenyl) -2- (1H-indazol-5-yl) imidazo [1,2-a] pyridin-3-amine;
2- (1H-indazol-5-yl) -N- (4-methoxyphenyl) imidazo [1,2-a] pyridin-3-amine;
tert-butyl 4- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] piperidine-1-carboxylate;
5- (1-benzyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
5- [4- (4-fluorophenyl) -1-piperidin-4-yl-1H-imidazol-5-yl] -1H-indazole;
5- {4- (4-fluorophenyl) -1- [2- (1-methylpyrrolidin-2-yl) ethyl] -1H-imidazol-5-yl} -1H-indazole;
5- {4- (4-fluorophenyl) -1- [3- (4-methylpiperazin-1-yl) propyl] -1H-imidazol-5-yl} -1H-indazole;
ethyl 5- (1H-indazol-5-yl) isoxazole-3-carboxylate;
5- (1H-indazol-5-yl) -N-methylisoxazole-3-carboxamide;
5- (3-benzylisoxazol-5-yl) -1H-indazole;
N-benzyl-4- (1H-indazol-5-yl) -5-phenyl-1,3-thiazol-2-amine;
4- (1H-indazol-5-yl) -N, 5-diphenyl-1,3-thiazol-2-amine;
5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5- (1-benzyl-4-cyclopropyl-1H-1,2,3-triazol-5-yl) -1H-indazole;
2- (1H-indazol-5-yl) -3-phenylimidazo [1,2-a] pyrimidine;
5- [1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-imidazole;
5- [3- (piperidin-1-ylcarbonyl) isoxazol-5-yl] -1H-indazole;
5- (1H-indazol-5-yl) -N-phenylisoxazole-3-carboxamide;
N-cyclohexyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- [3- (piperidin-1-ylmethyl) isoxazol-5-yl] -1H-indazole;
[5- (1H-indazol-5-yl) isoxazol-3-yl] methanol;
5- (1H-indazol-5-yl) -N- (2-methoxyethyl) isoxazole-3-carboxamide;
5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5- (4-benzyl-1H-1,2,3-triazol-1-yl) -1H-indazole;
5- (1-benzyl-5-cyclopropyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
5- (1-benzyl-4-cyclopropyl-1H-1,2,3-triazol-5-yl) -1H-indazol-3-amine;
5- (3-benzylisoxazol-5-yl) -1H-indazol-3-amine;
N- {2- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] ethyl} -N, N-dimethylamine;
5- [4- (4-fluorophenyl) -1- (3-morpholin-4-ylpropyl) -1H-imidazol-5-yl] -1H-indazole;
5- [4- (4-fluorophenyl) -1- (3-pyrrolidin-1-ylpropyl) -1H-imidazol-5-yl] -1H-indazole;
5- {4- (4-fluorophenyl) -1- [2- (4-methylpiperidin-1-yl) ethyl] -1H-imidazol-5-yl} -1H-indazole;
5- [1- (1-benzylpiperidin-4-yl) -4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole;
5- [4- (4-fluorophenyl) -1- (2-morpholin-4-yl-ethyl) -1H-imidazol-5-yl] -1H-indazole;
5- [1- (1-benzylpyrrolidin-3-yl) -4- (4-fluorophenyl) -1H-imidazol-5-yl] -1H-indazole;
2- {4- [4- (4-fluorophenyl) -5- (1H-indazol-5-yl) -1H-imidazol-1-yl] piperidin-1-yl} -2-oxoethanol;
5- (1-benzyl-5-phenyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
2- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-2-ol;
5- [4- (methoxymethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] -1-phenylethanol;
1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-2-ol;
3- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] propan-1-ol;
1 - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} -1H-1,2,3-benzotriazole;
5- {4 - [(phenylthio) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5- (4-cyclopropyl-1H-1,2,3-triazol-1-yl) -1H-indazole;
5- [4- (2-phenylethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
5- [4- (cyclohexylmethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
5- (4-cyclopentyl-1H-1,2,3-triazol-1-yl) -1H-indazole;
1- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] cyclohexanol;
5- [4- (phenoxymethyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
5- (4 - [(1,1-dioxidothiomorpholin-4-yl) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5- [4- (3-phenylpropyl) -1H-1,2,3-triazol-1-yl] -1H-indazole;
[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (phenyl) methanone;
N, N-diethyl-N - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} amine;
ethyl N- [2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-yl] beta-alaninate;
5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazole;
5- (1-benzyl-5-methyl-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
N- [2- (1H-indazol-5-yl) imidazo [1,2-a] pyrimidin-3-yl] -β-alaninamide;
5- (1-benzyl-5-iodo-1H-1,2,3-triazol-4-yl) -1H-indazol-3-amine;
N- {3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} -N '- (3-methylphenyl urea
5- (1H-indazol-5-yl) -N- (2-isopropoxyethyl) isoxazole-3-carboxamide;
5- [3- (morpholin-4-ylcarbonyl) isoxazol-5-yl] -1H-indazole;
5- (1H-indazol-5-yl) -N- (3-morpholin-4-ylpropyl) isoxazole-3-carboxamide;
N- [2- (1H-imidazol-4-yl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
(3R) -1 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperidin-3-ol;
1 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperidin-3-carboxamide;
2- [2- (4 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} piperazin-1-yl) ethoxy] ethanol;
5- {3 - [(4-methyl-1,4-diazepan-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
N- (3-hydroxypropyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N - [(1R) -2-hydroxy-1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- [3- (1H-imidazol-1-yl) propyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- [3- (2-oxopyrrolidin-1-yl) propyl] isoxazole-3-carboxamide;
N- {2- [4- (aminosulfonyl) phenyl] ethyl} -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (3-chlorophenyl) methanone;
[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] (cyclopropyl) methanone;
5- [5-cyclopropyl-1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
N one- {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] methyl} glycine;
(4-fluorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone;
(4-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone;
(3-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone;
(2-chlorophenyl) [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone;
cyclopentyl [4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] methanone;
1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxylic acid;
5- {5- (4-fluorophenyl) -1- [4- (trifluoromethyl) benzyl] -1H-1,2,3-triazol-4-yl} -1H-indazole-3-amine;
5- [1-benzyl-5- (4-fluorophenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
[4- (1H-indazol-5-yl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-5-yl] (tetrahydro-2H-pyran-4- sludge) methanone;
5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- {1-benzyl-5 - [(4-methylpiperazin-1-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-4-ol;
1-benzyl-4- (1H-indazol-5-yl) -N, N-dimethyl-1H-1,2,3-triazole-5-carboxamide;
N, 1-dibenzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
N- (2-hydroxy-2-phenylethyl) -5- (1H-indazol-5-yl) -N-methylisoxazole-3-carboxamide;
N - [(18) -2-hydroxy-1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-benzyl-N- (2-hydroxyethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- [1-benzyl-5- (2-methylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
2- {2- [1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] ethyl} -1H-isoindol-1,3 (2H) -dione;
5- {4 - [(2,4-Dichlorophenoxy) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5- {4 - [(2,6-dichlorophenoxy) methyl] -1H-1,2,3-triazol-1-yl} -1H-indazole;
5- [5- (4-fluorophenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
1 - {[1- (1H-indazol-5-yl) -1H-1,2,3-triazol-4-yl] methyl} -1H-indazole;
5- [1-benzyl-5- (piperidin-1-ylcarbonyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [5- (2-methylphenyl) -1 (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [5- (2-methylphenyl) -1- (tetrahydro-2H-pyran-4-ylmethyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5- [1-benzyl-5- (morpholin-4-ylcarbonyl) -1H-1,2,3-triazol-4-yl] -1H-indazole;
5- [1-benzyl-5- (4-methoxyphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
N - [(1S) -1-benzyl-2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N - [(1S, 2R) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- {3 - [(3-phenylmorpholin-4-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
N-benzyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
((1S) -2 - {[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} -6,7-dimethoxy-1,2,3,4-tetrahydroisoquinolin-1-yl) methanol ;
N [(1R) -3-hydroxy-1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N [(1S) -3-hydroxy-1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-2,3-dihydro-1H-inden-1-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-2,3-dihydro-1H-inden-2-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (1-phenylpropyl) isoxazole-3-carboxamide;
5- {1-benzyl-5- [3- (dimethylamino) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
5- {1-benzyl-5- [4- (dimethylamino) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
N- {3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} acetamide;
N- {4- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenyl} acetamide;
5- {1-benzyl-5- [3- (1H-pyrazol-1-yl) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
5- [1-benzyl-5- (1-methyl-1H-pyrazol-4-yl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] -N-phenylbenzamide;
3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] -N-benzylbenzamide;
5- [1-benzyl-5- (1-methyl-1H-indol-5-yl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5- [1-benzyl-5- (3-methoxyphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5- [1-benzyl-5- (3-morpholin-4-ylphenyl) -1H-1,2,3-triazol-4-yl] -1H-indazol-3-amine;
5- [3- (1,3-dihydro-2H-isoindol-2-ylcarbonyl) isoxazol-5-yl] -1H-indazole;
5- {3 - [(4-methyl-2-phenylpiperazin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-4-amine;
N - [(1R) -1-benzyl-2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazole;
3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] phenol;
3- [4- (3-amino-1H-indazol-5-yl) -1-benzyl-1H-1,2,3-triazol-5-yl] benzamide;
5- {1-benzyl-5- [4- (methylsulfonyl) phenyl] -1H-1,2,3-triazol-4-yl} -1H-indazol-3-amine;
5- (1H-indazol-5-yl) -N - [(1S) -1-phenylpropyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1R) -1-phenylpropyl] isoxazole-3-carboxamide;
5- (1-benzyl-1H-pyrazol-4-yl) -1H-indazol-3-amine;
1-benzyl-4- (1H-indazol-5-yl) -N - [(2S) -tetrahydrofuran-2-ylmethyl] -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-4- (1H-indazol-5-yl) -N- (2-isopropoxyethyl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-4- (1H-indazol-5-yl) -N - [(2R) -tetrahydrofuran-2-ylmethyl] -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-4- (1H-indazol-5-yl) -N- (tetrahydrofuran-3-ylmethyl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N-cyclopentyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N- (cyclopentylmethyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N-ethyl-4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-benzyl-4- (1H-indazol-5-yl) -1, -isopropyl-N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-benzyl-4- (1H-indazol-5-yl) -N- (2-methoxyethyl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-benzyl-4- (1 H-indazol-5-yl) -N-phenyl-1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N- (4-chlorophenyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-4- (1H-indazol-5-yl) -N- (2-morpholin-4-yl-ethyl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N- [2- (dimethylamino) ethyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N- (2-hydroxyethyl) -4- (1H-indazol-5-yl) -N-propyl-1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N- [3- (dimethylamino) propyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N- [2- (diethylamino) ethyl] -4- (1H-indazol-5-yl) -N-methyl-1H-1,2,3-triazole-5-carboxamide;
N, 1-dibenzyl-N-ethyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
N, 1-dibenzyl-N- (2-hydroxyethyl) -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
(3R) -1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidin-3-ol;
1 - {[1-benzyl-4- (1H-indazol-5-yl) -1H-1,2,3-triazol-5-yl] carbonyl} piperidine-4-carboxamide;
5- {1-benzyl-5 - [(2,6-dimethylmorpholin-4-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
5- {5 - [(4-acetylpiperazin-1-yl) carbonyl] -1-benzyl-1H-1,2,3-triazol-4-yl} -1H-indazole;
5- {1-benzyl-5 - [(4-phenylpiperazin-1-yl) carbonyl] -1H-1,2,3-triazol-4-yl} -1H-indazole;
1-benzyl-N - [(1R) -1- (hydroxymethyl) -2-methylpropyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N - [(1S) -1- (hydroxymethyl) -2-methylpropyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
1-benzyl-N- [3- (1H-imidazol-1-yl) propyl] -4- (1H-indazol-5-yl) -1H-1,2,3-triazole-5-carboxamide;
3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propannitrile;
2- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] acetamide;
methyl 3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propanoate;
3- [4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] propanamide;
[4- (3-amino-1H-indazol-5-yl) -1H-pyrazol-1-yl] acetonitrile;
4- (3-amino-1H-indazol-5-yl) -N, N-dimethyl-1H-imidazole-1-sulfonamide;
5-imidazo [1,2-a] pyridin-3-yl-1H-indazol-3-amine;
5- (1H-pyrazol-5-yl) -1H-indazol-3-amine;
5- (1H-imidazol-4-yl) -1H-indazol-3-amine;
5- (1-benzyl-1H-imidazol-4-yl) -1H-indazol-3-amine;
N-3,4-dihydro-1H-isochromen-4-yl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- (cyclohexylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- (3-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (2-methoxybenzyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- [2- (trifluoromethyl) benzyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- [3- (trifluoromethyl) benzyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- [4- (trifluoromethyl) benzyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (pyridin-2-ylmethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (pyridin-3-ylmethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (pyridin-4-ylmethyl) isoxazole-3-carboxamide;
N- (2-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- (4-chlorobenzyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -] - N - [- (1-phenyl-2-piperidin-1-yl-ethyl) isoxazole-3-carboxamide;
N- [2- (1H-imidazol-1-yl) -1-phenylethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -] - N- (2-morpholin-4-yl-1-phenylethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- [2- (4-methylpiperazin-1-yl) -1-phenylethyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (1-phenyl-2-pyrrolidin-1-yl-ethyl) isoxazole-3-carboxamide;
tert-butyl 2 - ({[5- (1H-indazol-5-yl) isoxazol-3-yl] carbonyl} amino) -2-phenylethylcarbamate;
5- (1H-indazol-5-yl) -N- (1-naphthylmethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (2-phenylethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (2-pyridin-2-yl-ethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (2-pyridin-3-yl-ethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N- (2-pyridin-4-yl-ethyl) isoxazole-3-carboxamide;
N- [2- (2-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- [2- (3-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- [2- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N-benzyl-N-ethyl-5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N-methyl-N- (1-naphthylmethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N-methyl-N- (2-phenylethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N-methyl-N- (2-pyridin-2-yl-ethyl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1R) -1-phenylethyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N-1,2,3,4-tetrahydronaphthalen-1-yl-isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1S) -1- (1-naphthyl) ethyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1R) -1- (1-naphthyl) ethyl] isoxazole-3-carboxamide;
N- [3- (dimethylamino) -1-phenylpropyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- (2,3-dihydro-1,4-benzodioxin-5-ylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- (3,4-dihydro-2H-1,5-benzodioxepin-6-ylmethyl) -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1-methyl-1H-indol-4-yl) methyl] isoxazole-3-carboxamide;
5- {3 - [(3-phenylpyrrolidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
5- {3 - [(2-phenylpyrrolidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
5- {3 - [(2-phenylpiperidin-1-yl) carbonyl] isoxazol-5-yl} -1H-indazole;
5- (1H-indazol-5-yl) -N - [(1S) -1-phenylethyl] isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1R) -1- (4-methylphenyl) ethyl] -isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1S) -1- (4-methylphenyl) ethyl] isoxazole-3-carboxamide;
N - [(1R, 2S) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- (1R, 2R) -2-hydroxy-2,3-dihydro-1H-inden-1-yl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N - [(1R) -1- (4-bromophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N - [(1S) -1- (4-bromophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N - [(1R) -1- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N - [(1S) -1- (4-chlorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1S) -1- (2-naphthyl) ethyl] isoxazole-3-carboxamide;
N- [1- (4-ethoxyphenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- [2-hydroxy-1- (4-isopropylphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- (3,4-dimethylphenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- [2-hydroxy-1- (2-methoxyphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
N- [2-hydroxy-1- (4-methylphenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1R) -1- (2-methoxyphenyl) ethyl] -isoxazole-3-carboxamide;
N - [(1S) -1- (3,4-difluorophenyl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - [(1R) -1- (3-methoxyphenyl) ethyl] -isoxazole-3-carboxamide;
5- (1H-indazol-5-yl) -N - {(1R) -1- [3- (trifluoromethyl) phenyl] ethyl} isoxazole-3-carboxamide;
N- [1- (2,3-dihydro-1,4-benzodioxin-6-yl) ethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide; or
N- [1- (3,5-Dichlorophenyl) -2-hydroxyethyl] -5- (1H-indazol-5-yl) isoxazole-3-carboxamide.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US93396007P | 2007-06-08 | 2007-06-08 | |
| US60/933,960 | 2007-06-08 | ||
| PCT/US2008/065727 WO2008154241A1 (en) | 2007-06-08 | 2008-06-04 | 5-heteroaryl substituted indazoles as kinase inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2009149696A RU2009149696A (en) | 2011-07-20 |
| RU2487873C2 true RU2487873C2 (en) | 2013-07-20 |
Family
ID=39951673
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2009149696/04A RU2487873C2 (en) | 2007-06-08 | 2008-06-04 | 5-substituted indazole as kinase inhibitors |
Country Status (13)
| Country | Link |
|---|---|
| EP (1) | EP2167491A1 (en) |
| JP (2) | JP5451602B2 (en) |
| KR (1) | KR20100032886A (en) |
| CN (1) | CN101790526A (en) |
| AU (1) | AU2008262038A1 (en) |
| BR (1) | BRPI0811065A2 (en) |
| CA (1) | CA2689117A1 (en) |
| IL (1) | IL202318A0 (en) |
| MX (1) | MX2009013213A (en) |
| RU (1) | RU2487873C2 (en) |
| SG (1) | SG182187A1 (en) |
| WO (1) | WO2008154241A1 (en) |
| ZA (1) | ZA200908624B (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2725979C2 (en) * | 2014-06-25 | 2020-07-08 | Ф. Хоффманн-Ля Рош Аг | Imidazo[1,2-a]pyrazin-1-yl-benzamides for treating spinal muscular atrophy |
| US10899742B1 (en) | 2016-12-01 | 2021-01-26 | Arvinas Operations, Inc. | Tetrahydronaphthalene and tetrahydroisoquinoline derivatives as estrogen receptor degraders |
Families Citing this family (111)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8546404B2 (en) | 2005-12-13 | 2013-10-01 | Merck Sharp & Dohme | Compounds that are ERK inhibitors |
| DE602007009932D1 (en) | 2006-02-16 | 2010-12-02 | Schering Corp | PYRROLIDIN DERIVATIVES AS ERK HEMMER |
| US8648069B2 (en) * | 2007-06-08 | 2014-02-11 | Abbvie Inc. | 5-substituted indazoles as kinase inhibitors |
| EP2157859A4 (en) * | 2007-06-19 | 2011-01-12 | Takeda Pharmaceutical | Indazole compounds for activating glucokinase |
| WO2009011880A2 (en) | 2007-07-17 | 2009-01-22 | Amgen Inc. | Heterocyclic modulators of pkb |
| WO2009011871A2 (en) | 2007-07-17 | 2009-01-22 | Amgen Inc. | Thiadiazole modulators of pkb |
| WO2009028543A1 (en) * | 2007-08-30 | 2009-03-05 | Takeda Pharmaceutical Company Limited | Substituted pyrazole derivative |
| MX2010009268A (en) | 2008-02-21 | 2010-09-14 | Schering Corp | Compounds that are erk inhibitors. |
| AR071780A1 (en) * | 2008-05-15 | 2010-07-14 | Nerviano Medical Sciences Srl | BICYCLE CARBONILAMINO-PIRAZOLES CARBAMILILE DERIVATIVES AS PROFARMACOS |
| WO2010059658A1 (en) * | 2008-11-20 | 2010-05-27 | Glaxosmithkline Llc | Chemical compounds |
| SI2464232T1 (en) | 2009-08-10 | 2016-03-31 | Samumed, Llc. | Indazole inhibitors of the wnt signal pathway and therapeutic uses thereof |
| EP3001903B1 (en) | 2009-12-21 | 2017-10-25 | Samumed, LLC | 1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| UY33213A (en) * | 2010-02-18 | 2011-09-30 | Almirall Sa | PIRAZOL DERIVATIVES AS JAK INHIBITORS |
| KR101233082B1 (en) | 2010-02-25 | 2013-02-14 | 주식회사 이큐스앤자루 | A composition containing of novel imidazole pyrazine compound having Influenza virus activity for treating antivirus |
| WO2011107530A2 (en) | 2010-03-03 | 2011-09-09 | Probiodrug Ag | Novel inhibitors |
| WO2011136264A1 (en) * | 2010-04-28 | 2011-11-03 | 第一三共株式会社 | [5,6] heterocyclic compound |
| WO2011140333A1 (en) | 2010-05-07 | 2011-11-10 | The Board Of Trustees Of The Leland Stanford Junior University | Identification of stabilizers of multimeric proteins |
| EA023544B1 (en) * | 2010-12-20 | 2016-06-30 | Мерк Сероно С.А. | Indazolyl triazol derivatives |
| CN106986862A (en) | 2010-12-22 | 2017-07-28 | Abbvie 公司 | Hepatitis c inhibitor and application thereof |
| US9090592B2 (en) * | 2010-12-30 | 2015-07-28 | AbbVie Deutschland GmbH & Co. KG | Heterocyclic compounds and their use as glycogen synthase kinase-3 inhibitors |
| CN102675286B (en) * | 2011-03-07 | 2015-08-19 | 中国科学院上海药物研究所 | One class indazole compounds and preparation method thereof, purposes and pharmaceutical composition |
| CU24263B1 (en) * | 2011-04-07 | 2017-07-04 | Bayer Ip Gmbh | DERIVATIVES OF IMIDAZOPIRIDAZINAS INHIBITORS OF QUINASA AKT, USEFUL FOR THE TREATMENT OF CANCER |
| CA2838784A1 (en) * | 2011-08-12 | 2013-02-21 | F. Hoffmann-La Roche Ag | Pyrazolo[3,4-c]pyridine compounds and methods of use |
| PE20141678A1 (en) | 2011-09-14 | 2014-11-21 | Samumed Llc | INDAZOL-3-CARBOXAMIDES AND THEIR USE AS INHIBITORS OF THE WNT / B-CATENIN SIGNALING PATHWAY |
| DK2921485T3 (en) | 2011-12-27 | 2018-11-12 | Bayer Cropscience Ag | isoxazole |
| GEP20166489B (en) * | 2012-02-21 | 2016-06-10 | Acraf | 1h-indazole-3-carboxamide compounds as glycogen synthase kinase 3 beta inhibitors |
| PH12017500997A1 (en) | 2012-04-04 | 2018-02-19 | Samumed Llc | Indazole inhibitors of the wnt signal pathway and therapeutic uses thereof |
| EP3593800A1 (en) | 2012-05-04 | 2020-01-15 | Samumed, LLC | 1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| TW201406758A (en) * | 2012-06-28 | 2014-02-16 | Daiichi Sankyo Co Ltd | Tricyclic compounds |
| CN105120862A (en) | 2013-01-08 | 2015-12-02 | 萨穆梅德有限公司 | 3-(benzoimidazol-2-yl)-indazole inhibitors of the wnt signaling pathway and therapeutic uses thereof |
| WO2014134772A1 (en) * | 2013-03-04 | 2014-09-12 | Merck Sharp & Dohme Corp. | Compounds inhibiting leucine-rich repeat kinase enzyme activity |
| WO2014134774A1 (en) | 2013-03-04 | 2014-09-12 | Merck Sharp & Dohme Corp. | Compounds inhibiting leucine-rich repeat kinase enzyme activity |
| EP2964221B1 (en) | 2013-03-04 | 2017-12-06 | Merck Sharp & Dohme Corp. | Compounds inhibiting leucine-rich repeat kinase enzyme activity |
| WO2014134776A1 (en) | 2013-03-04 | 2014-09-12 | Merck Sharp & Dohme Corp. | Compounds inhibiting leucine-rich repeat kinase enzyme activity |
| JO3383B1 (en) * | 2013-03-14 | 2019-03-13 | Lilly Co Eli | CDC7 Inhibitors |
| ES2661437T3 (en) * | 2013-06-21 | 2018-04-02 | Zenith Epigenetics Corp. | New substituted bicyclic compounds as bromodomain inhibitors |
| ME03654B (en) | 2014-02-13 | 2020-07-20 | Incyte Corp | Cyclopropylamines as lsd1 inhibitors |
| EP3392244A1 (en) | 2014-02-13 | 2018-10-24 | Incyte Corporation | Cyclopropylamines as lsd1 inhibitors |
| WO2015123437A1 (en) | 2014-02-13 | 2015-08-20 | Incyte Corporation | Cyclopropylamines as lsd1 inhibitors |
| UA122389C2 (en) | 2014-02-13 | 2020-11-10 | Інсайт Корпорейшн | Cyclopropylamines as lsd1 inhibitors |
| KR20160135283A (en) | 2014-03-20 | 2016-11-25 | 사뮤메드, 엘엘씨 | 5-substituted indazole-3-carboxamides and preparation and use thereof |
| WO2015143652A1 (en) * | 2014-03-26 | 2015-10-01 | Merck Sharp & Dohme Corp. | TrkA KINASE INHIBITORS,COMPOSITIONS AND METHODS THEREOF |
| US9695168B2 (en) | 2014-07-10 | 2017-07-04 | Incyte Corporation | Substituted imidazo[1,5-α]pyridines and imidazo[1,5-α]pyrazines as LSD1 inhibitors |
| US9695167B2 (en) | 2014-07-10 | 2017-07-04 | Incyte Corporation | Substituted triazolo[1,5-a]pyridines and triazolo[1,5-a]pyrazines as LSD1 inhibitors |
| US9695180B2 (en) | 2014-07-10 | 2017-07-04 | Incyte Corporation | Substituted imidazo[1,2-a]pyrazines as LSD1 inhibitors |
| US9758523B2 (en) | 2014-07-10 | 2017-09-12 | Incyte Corporation | Triazolopyridines and triazolopyrazines as LSD1 inhibitors |
| WO2016025129A1 (en) | 2014-08-14 | 2016-02-18 | Alhamadsheh Mamoun M | Conjugation of pharmaceutically active agents with transthyretin ligands through adjustable linkers to increase serum half-life |
| WO2016040182A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 2-(1h-indazol-3-yl)-1h-imidazo[4,5-c]pyridine and therapeutic uses thereof |
| WO2016040193A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| WO2016040181A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040180A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-benzo[d]imidazol-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040188A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040190A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| WO2016040185A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 2-(1h-indazol-3-yl)-3h-imidazo[4,5-b]pyridine and therapeutic uses thereof |
| WO2016040184A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| EA037112B1 (en) | 2015-03-02 | 2021-02-08 | Ригель Фармасьютикалс, Инк. | Tgf- inhibitors |
| ES2757948T3 (en) | 2015-04-03 | 2020-04-30 | Incyte Corp | Heterocyclic compounds as LSD1 inhibitors |
| US10463651B2 (en) | 2015-08-03 | 2019-11-05 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-indazoles and therapeutic uses thereof |
| US10604512B2 (en) | 2015-08-03 | 2020-03-31 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-indazoles and therapeutic uses thereof |
| US10285983B2 (en) | 2015-08-03 | 2019-05-14 | Samumed, Llc | 3-(1H-pyrrolo[2,3-B]pyridin-2-yl)-1H-pyrazolo[3,4-B] pyridines and therapeutic uses thereof |
| US10226453B2 (en) | 2015-08-03 | 2019-03-12 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017024004A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10329309B2 (en) | 2015-08-03 | 2019-06-25 | Samumed, Llc | 3-(3H-imidazo[4,5-B]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017023989A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-benzo[d]imidazol-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| WO2017023980A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017023987A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[3,2-c]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| WO2017023972A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10350199B2 (en) | 2015-08-03 | 2019-07-16 | Samumed, Llc | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-indazoles and therapeutic uses thereof |
| WO2017023988A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(3h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| WO2017023975A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017024003A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-pyrrolo[3,2-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10206908B2 (en) | 2015-08-03 | 2019-02-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-pyrazolo[3,4-C]pyridines and therapeutic uses thereof |
| WO2017024026A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-indol-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017024025A1 (en) | 2015-08-03 | 2017-02-09 | Sunil Kumar Kc | 3-(1h-pyrrolo[2,3-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| JP7427363B2 (en) | 2015-08-12 | 2024-02-05 | インサイト・ホールディングス・コーポレイション | LSD1 inhibitor salt |
| JP6982748B2 (en) | 2015-11-06 | 2021-12-17 | バイオスプライス セラピューティクス インコーポレイテッド | 2- (1H-Indazole-3-yl) -3H-imidazole [4,5-c] pyridine and their anti-inflammatory use |
| US20170273307A1 (en) * | 2016-03-28 | 2017-09-28 | Trent University | Silane-based antimicrobial coatings and methods of making and using the same |
| CA3021678A1 (en) | 2016-04-22 | 2017-10-26 | Incyte Corporation | Formulations of an lsd1 inhibitor |
| EP3464285B1 (en) | 2016-06-01 | 2022-09-21 | BioSplice Therapeutics, Inc. | Process for preparing n-(5-(3-(7-(3-fluorophenyl)-3h-imidazo[4,5-c]pyridin-2-yl)-1h-indazol-5-yl)pyridin-3-yl)-3-methylbutanamide |
| CN110234631B (en) | 2016-09-21 | 2023-02-28 | 维克特斯生物系统有限公司 | Composition for treating hypertension and/or fibrosis |
| JOP20190053A1 (en) | 2016-09-23 | 2019-03-21 | Novartis Ag | Aza-indazole compounds for use in tendon and/or ligament injuries |
| PT3515894T (en) | 2016-09-23 | 2021-07-13 | Novartis Ag | Indazole compounds for use in tendon and/or ligament injuries |
| MX2019004616A (en) | 2016-10-21 | 2019-11-21 | Samumed Llc | Methods of using indazole-3-carboxamides and their use as wnt/b-catenin signaling pathway inhibitors. |
| MA46696A (en) | 2016-11-07 | 2019-09-11 | Samumed Llc | READY-TO-USE SINGLE-DOSE INJECTABLE FORMULATIONS |
| JP7157752B2 (en) | 2017-02-17 | 2022-10-20 | エイドス セラピューティクス,インコーポレイティド | Methods for the preparation of AG-10, intermediates thereof and salts thereof |
| JP7311228B2 (en) | 2017-06-30 | 2023-07-19 | ベイジン タイド ファーマシューティカル カンパニー リミテッド | RHO-related protein kinase inhibitors, pharmaceutical compositions containing same and methods for preparation and use thereof |
| JP2020525525A (en) * | 2017-06-30 | 2020-08-27 | ベイジン タイド ファーマシューティカル カンパニー リミテッドBeijing Tide Pharmaceutical Co., Ltd. | RHO-related protein kinase inhibitor, pharmaceutical composition containing RHO-related protein kinase inhibitor, preparation method and use of the pharmaceutical composition |
| BR112020015509A2 (en) | 2018-02-15 | 2021-01-26 | Vertex Pharmaceuticals Incorporated | macrocycles as modulators of cystic fibrosis transmembrane conductance regulators, pharmaceutical compositions thereof, their use in the treatment of cystic fibrosis, and the process for their production |
| WO2019183463A1 (en) | 2018-03-23 | 2019-09-26 | Eidos Therapeutics, Inc. | Methods of treating ttr amyloidosis using ag10 |
| CN112020496B (en) * | 2018-04-18 | 2023-04-28 | 南京明德新药研发有限公司 | Benzopyrazoles as RHO kinase inhibitors |
| TWI834708B (en) | 2018-08-17 | 2024-03-11 | 美商文涵治療有限公司 | Formulations of ag10 |
| US10968200B2 (en) | 2018-08-31 | 2021-04-06 | Incyte Corporation | Salts of an LSD1 inhibitor and processes for preparing the same |
| CN111138426B (en) * | 2018-11-02 | 2023-03-10 | 安徽中科拓苒药物科学研究有限公司 | Indazole kinase inhibitor and application thereof |
| JP2022520671A (en) | 2019-02-08 | 2022-03-31 | フリークエンシー・セラピューティクス・インコーポレイテッド | Valproic acid compounds and WNT agonists for the treatment of ear disorders |
| CN110218694A (en) * | 2019-05-30 | 2019-09-10 | 华中农业大学 | A kind of kiwifruit fruit amyloplaste extracting method |
| TW202115092A (en) | 2019-08-14 | 2021-04-16 | 美商維泰克斯製藥公司 | Modulators of cystic fibrosis transmembrane conductance regulator |
| US11873300B2 (en) | 2019-08-14 | 2024-01-16 | Vertex Pharmaceuticals Incorporated | Crystalline forms of CFTR modulators |
| TW202120517A (en) | 2019-08-14 | 2021-06-01 | 美商維泰克斯製藥公司 | Process of making cftr modulators |
| CN111171023B (en) * | 2020-01-10 | 2021-12-21 | 中国药科大学 | Compound with Pim1 inhibitory activity and preparation method and medical application thereof |
| CN113350347B (en) * | 2020-03-05 | 2023-07-04 | 安徽中科拓苒药物科学研究有限公司 | Use of indazoles |
| US20230365553A1 (en) * | 2020-07-15 | 2023-11-16 | Ifm Due, Inc. | Compounds and compositions for treating conditions associated with sting activity |
| WO2022076629A1 (en) * | 2020-10-07 | 2022-04-14 | Vertex Pharmaceuticals Incorporated | Modulators of cystic fibrosis transmembrane conductance regulator |
| CN112266378B (en) * | 2020-11-09 | 2021-10-12 | 延边大学 | Imidazole derivative containing indazole structure and preparation method and application thereof |
| CN113336759B (en) * | 2020-12-25 | 2022-12-06 | 中国药科大学 | Bromodomain protein 4 small molecule inhibitor, preparation method and application thereof |
| CN117529475A (en) * | 2021-01-08 | 2024-02-06 | 艾福姆德尤股份有限公司 | Heterobicyclic compounds containing urea or analogs for the treatment of diseases associated with STING activity and compounds thereof |
| KR20230056824A (en) * | 2021-10-20 | 2023-04-28 | 전북대학교산학협력단 | PAK4 inhibitors and use thereof |
| WO2023186773A1 (en) | 2022-03-30 | 2023-10-05 | Nerviano Medical Sciences S.R.L. | Substituted 3-amino indazole derivatives as kinase inhibitors |
| CN114651898B (en) * | 2022-03-31 | 2024-04-05 | 天津溢佳同惠科技集团有限公司 | Triazole feed additive for improving immunity as well as preparation method and application thereof |
| WO2023218201A1 (en) * | 2022-05-11 | 2023-11-16 | Cancer Research Technology Limited | Ikk inhibitors |
| KR102607237B1 (en) * | 2023-06-07 | 2023-11-30 | 주식회사 젠센 | New triazole substituted indazole derivatives and use thereof |
| CN116891460A (en) * | 2023-07-12 | 2023-10-17 | 浙江大学 | Indazole derivative or pharmaceutically acceptable salt thereof and application thereof |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001053268A2 (en) * | 2000-01-18 | 2001-07-26 | Agouron Pharmaceuticals, Inc. | Indazole compounds, pharmaceutical compositions, and their use for mediating or inhibiting cell proliferation |
| WO2004013410A1 (en) * | 2002-08-06 | 2004-02-12 | Richard Stone | Warp triplet composite forming fabric |
| WO2004031158A1 (en) * | 2002-10-02 | 2004-04-15 | Sanofi-Aventis | Indazolecarboxamide derivatives, preparation and use thereof as cdk1, cdk2 and cdk4 inhibitors |
| WO2004039325A2 (en) * | 2002-10-24 | 2004-05-13 | Celgene Corporation | Treatment of pain with jnk inhibitors |
| WO2005009997A1 (en) * | 2003-07-30 | 2005-02-03 | Pfizer Inc. | 3,5 disubstituted indazole compounds, pharmaceutical compositions, and methods for mediating or inhibiting cell proliferation |
| US20050090529A1 (en) * | 2003-07-31 | 2005-04-28 | Pfizer Inc | 3,5 Disubstituted indazole compounds with nitrogen-bearing 5-membered heterocycles, pharmaceutical compositions, and methods for mediating or inhibiting cell proliferation |
| WO2005099703A1 (en) * | 2004-03-16 | 2005-10-27 | Sanofi-Aventis | Use of indazolecarboxamide derivatives for the preparation of a medicament that is intended for the treatment and prevention of paludism |
| RU2005121897A (en) * | 2002-12-12 | 2006-01-20 | Авентис Фарма С.А. (Fr) | AMINOINDAZOLE DERIVATIVES AND THEIR APPLICATION AS KINAZ INHIBITORS |
| WO2006130297A2 (en) * | 2005-04-29 | 2006-12-07 | Celgene Corporation | Solid forms of 1-( 5-(ih-i , 2 , 4 -triazol- 5 -yl)(1h-indazol-3-yl))-3-(2-piperidylethoxy)benzene |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7211594B2 (en) * | 2000-07-31 | 2007-05-01 | Signal Pharmaceuticals, Llc | Indazole compounds and compositions thereof as JNK inhibitors and for the treatment of diseases associated therewith |
| EP1363702A4 (en) * | 2001-01-30 | 2007-08-22 | Cytopia Pty Ltd | Methods of inhibiting kinases |
| PT1532145E (en) * | 2002-08-02 | 2007-01-31 | Vertex Pharma | Pyrazole compositions useful as inhibitors of gsk-3 |
| WO2005074642A2 (en) * | 2004-01-30 | 2005-08-18 | Smithkline Beecham Corporation | Chemical compounds |
| CA2567977A1 (en) * | 2004-04-22 | 2006-01-05 | Memory Pharmaceutical Corporation | Indoles, 1h-indazoles, 1,2-benzisoxazoles, 1,2-benzoisothiazoles, and preparation and uses thereof |
| US7429604B2 (en) * | 2004-06-15 | 2008-09-30 | Bristol Myers Squibb Company | Six-membered heterocycles useful as serine protease inhibitors |
| DE102004028862A1 (en) * | 2004-06-15 | 2005-12-29 | Merck Patent Gmbh | 3-aminoindazoles |
| EP1758873A1 (en) * | 2004-06-22 | 2007-03-07 | Rigel Pharmaceuticals, Inc. | Ubiquitin ligase inhibitors |
| AU2005322338B2 (en) * | 2004-12-27 | 2011-06-09 | Alcon, Inc. | Aminopyrazine analogs for treating glaucoma and other rho kinase-mediated diseases |
| TW200803863A (en) * | 2005-11-10 | 2008-01-16 | Schering Corp | Method for inhibiting protein kinases |
| WO2007117465A2 (en) * | 2006-03-31 | 2007-10-18 | Abbott Laboratories | Indazole compounds |
-
2008
- 2008-06-04 CN CN200880102038A patent/CN101790526A/en active Pending
- 2008-06-04 CA CA002689117A patent/CA2689117A1/en not_active Abandoned
- 2008-06-04 RU RU2009149696/04A patent/RU2487873C2/en not_active IP Right Cessation
- 2008-06-04 JP JP2010511293A patent/JP5451602B2/en not_active Expired - Fee Related
- 2008-06-04 AU AU2008262038A patent/AU2008262038A1/en not_active Abandoned
- 2008-06-04 EP EP08770094A patent/EP2167491A1/en not_active Withdrawn
- 2008-06-04 BR BRPI0811065-4A2A patent/BRPI0811065A2/en not_active IP Right Cessation
- 2008-06-04 MX MX2009013213A patent/MX2009013213A/en not_active Application Discontinuation
- 2008-06-04 KR KR1020107000409A patent/KR20100032886A/en not_active Application Discontinuation
- 2008-06-04 WO PCT/US2008/065727 patent/WO2008154241A1/en active Application Filing
- 2008-06-04 SG SG2012043113A patent/SG182187A1/en unknown
-
2009
- 2009-11-24 IL IL202318A patent/IL202318A0/en unknown
- 2009-12-04 ZA ZA2009/08624A patent/ZA200908624B/en unknown
-
2013
- 2013-12-25 JP JP2013266989A patent/JP2014074057A/en active Pending
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001053268A2 (en) * | 2000-01-18 | 2001-07-26 | Agouron Pharmaceuticals, Inc. | Indazole compounds, pharmaceutical compositions, and their use for mediating or inhibiting cell proliferation |
| WO2004013410A1 (en) * | 2002-08-06 | 2004-02-12 | Richard Stone | Warp triplet composite forming fabric |
| WO2004031158A1 (en) * | 2002-10-02 | 2004-04-15 | Sanofi-Aventis | Indazolecarboxamide derivatives, preparation and use thereof as cdk1, cdk2 and cdk4 inhibitors |
| WO2004039325A2 (en) * | 2002-10-24 | 2004-05-13 | Celgene Corporation | Treatment of pain with jnk inhibitors |
| RU2005121897A (en) * | 2002-12-12 | 2006-01-20 | Авентис Фарма С.А. (Fr) | AMINOINDAZOLE DERIVATIVES AND THEIR APPLICATION AS KINAZ INHIBITORS |
| WO2005009997A1 (en) * | 2003-07-30 | 2005-02-03 | Pfizer Inc. | 3,5 disubstituted indazole compounds, pharmaceutical compositions, and methods for mediating or inhibiting cell proliferation |
| US20050090529A1 (en) * | 2003-07-31 | 2005-04-28 | Pfizer Inc | 3,5 Disubstituted indazole compounds with nitrogen-bearing 5-membered heterocycles, pharmaceutical compositions, and methods for mediating or inhibiting cell proliferation |
| WO2005099703A1 (en) * | 2004-03-16 | 2005-10-27 | Sanofi-Aventis | Use of indazolecarboxamide derivatives for the preparation of a medicament that is intended for the treatment and prevention of paludism |
| WO2006130297A2 (en) * | 2005-04-29 | 2006-12-07 | Celgene Corporation | Solid forms of 1-( 5-(ih-i , 2 , 4 -triazol- 5 -yl)(1h-indazol-3-yl))-3-(2-piperidylethoxy)benzene |
Non-Patent Citations (1)
| Title |
|---|
| SHEELA A. THOMAS et al. Identification of a novel 3,5-disubstituted pyridine as potent, selective, and orally active inhibitor of Aktl kinase. Bioorganic & Medicinal Chemistry Letters. 2006, 16, p.3740-3744. * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2725979C2 (en) * | 2014-06-25 | 2020-07-08 | Ф. Хоффманн-Ля Рош Аг | Imidazo[1,2-a]pyrazin-1-yl-benzamides for treating spinal muscular atrophy |
| US10899742B1 (en) | 2016-12-01 | 2021-01-26 | Arvinas Operations, Inc. | Tetrahydronaphthalene and tetrahydroisoquinoline derivatives as estrogen receptor degraders |
| RU2750484C2 (en) * | 2016-12-01 | 2021-06-28 | Эрвинэс Оперейшнс, Инк. | Derivatives of tetrahydronaphtalene and tetrahydroisoquinoline as deconstructors of estrogen receptor |
| US11597720B2 (en) | 2016-12-01 | 2023-03-07 | Arvinas Operations, Inc. | Tetrahydronaphthalene and tetrahydroisoquinoline derivatives as estrogen receptor degraders |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2009149696A (en) | 2011-07-20 |
| CN101790526A (en) | 2010-07-28 |
| JP2010529137A (en) | 2010-08-26 |
| BRPI0811065A2 (en) | 2014-12-02 |
| MX2009013213A (en) | 2010-03-30 |
| ZA200908624B (en) | 2015-08-26 |
| CA2689117A1 (en) | 2008-12-18 |
| AU2008262038A1 (en) | 2008-12-18 |
| EP2167491A1 (en) | 2010-03-31 |
| JP5451602B2 (en) | 2014-03-26 |
| SG182187A1 (en) | 2012-07-30 |
| WO2008154241A1 (en) | 2008-12-18 |
| IL202318A0 (en) | 2010-06-30 |
| KR20100032886A (en) | 2010-03-26 |
| JP2014074057A (en) | 2014-04-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2487873C2 (en) | 5-substituted indazole as kinase inhibitors | |
| US9163007B2 (en) | 5-substituted indazoles as kinase inhibitors | |
| US11987560B2 (en) | Inhibitors of lysine specific demethylase-1 | |
| JP6663866B2 (en) | Lysine-specific inhibitors of demethylase-1 | |
| US11891389B2 (en) | PGDH inhibitors and methods of making and using | |
| DK2504333T3 (en) | Morpholinothiazoler which alpha-7 positive allosteric modulators | |
| EP3813819A1 (en) | Inhibitors of cyclin-dependent kinases | |
| EA025086B1 (en) | Indole amide derivatives and related compounds for use in the treatment of neurodegenerative diseases | |
| JP2019172676A (en) | Inhibitors of lysine specific demethylase-1 | |
| AU2013361255A1 (en) | Histone demethylase inhibitors | |
| AU2014298017B2 (en) | Heterobicycloaryl RORC2 inhibitors and methods of use thereof | |
| JP2005530760A (en) | Protein kinase modulator and method of use thereof | |
| BRPI0713576A2 (en) | compound, pharmaceutical formulation, use of a compound, and methods for preventing and / or treating condition, disorder and disease, for enhancing bone formation, for enhancing spongy bone formation and / or new bone formation, for increasing density bone mineral, to reduce the incidence of fracture and to improve fracture healing, and process for preparing a compound | |
| DK2817302T3 (en) | 1H-indazole-3-carboxamide compounds as glycogen synthase kinase-3 beta inhibitors | |
| JP2013533318A (en) | Heteroaryl and uses thereof | |
| DK2817301T3 (en) | Use of 1H-indazole-3-carboxamide compounds as glycogen synthase kinase-3 beta inhibitors | |
| KR20240102934A (en) | Pyrrolo[2,3-b]pyridine PGDH inhibitor and methods of preparation and use | |
| AU2013231090A1 (en) | 5-heteroaryl substituted indazoles as kinase inhibitors | |
| CA2959290A1 (en) | 2-aminothiazole derivative or salt thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20141128 |
|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20150605 |