KR20190112299A - 결합제 - Google Patents
결합제 Download PDFInfo
- Publication number
- KR20190112299A KR20190112299A KR1020197025095A KR20197025095A KR20190112299A KR 20190112299 A KR20190112299 A KR 20190112299A KR 1020197025095 A KR1020197025095 A KR 1020197025095A KR 20197025095 A KR20197025095 A KR 20197025095A KR 20190112299 A KR20190112299 A KR 20190112299A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- gitr
- antigen
- antibody
- ser
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/005—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies constructed by phage libraries
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/23—Immunoglobulins specific features characterized by taxonomic origin from birds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Physical Education & Sports Medicine (AREA)
- Urology & Nephrology (AREA)
- Neurology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Biomedical Technology (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Neurosurgery (AREA)
- Pulmonology (AREA)
- Dermatology (AREA)
- Rheumatology (AREA)
- Reproductive Health (AREA)
- Hematology (AREA)
- Gastroenterology & Hepatology (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
본 발명은 글루코코르티코이드-유도 TNF 수용체 (GITR)에 특이적으로 결합하는 항체 분자 및 그의 항원-결합 부분에 관한 것이다. 본 발명의 특정 양상에서, 상기 항체 분자는 인간 GITR 및 시노몰구스 원숭이 GITR에 특이적으로 결합한다. 본 발명의 항-GITR 항체 분자는 뮤린 항-GITR 항체 6C8 유래의 CDR 서열을 사용하여 개발 및 최적화되었다. 상기 항체 분자의 의학적 용도가 개시되어 있다.
Description
본 발명은 글루코코르티코이드-유도 TNF 수용체 (glucocorticoid-induced TNF receptor: GITR)에 특이적으로 결합하는 항체 분자 및 그의 의학적 용도에 관한 것이다.
GITR (또한 TNFRSF18로 알려져 있음)은 TNF 수용체 상과 (superfamily)의 공동-자극 구성원이다. GITR의 발현은 주로 T 세포, NK 세포, B 세포에서 관찰되었고, 더 적은 정도로 일부 다른 조혈 세포 타입에서 관찰되었다. GITR은 휴지기의 T 및 NK 세포에서 낮은 발현을 나타내었지만, CD4+Foxp3+ 조절 T 세포 (Treg)에서 구성적으로 높은 발현 수준을 나타내었다. GITR 리간드 또는 효능제 항-GITR 항체에 의한 GITR의 인 비트로 (In vitro) 또는 인 비보 (in vivo) 진입 (engagement)으로 CD4+ 및 CD8+ T 세포의 확장을 유발하고, Treg 억제에 대한 T 세포의 저항성을 향상시켰다.
전임상에서 GITR 신호전달을 유도하여 실험 종양에서 이펙터 T 세포 (Teff)의 활성화를 향상시키고 또한 Treg의 활성을 감소시킬 수 있다는 증거를 제시하였다. 효능제 항-GITR mAb의 투여로 향상된 내인성 Teff 반응, 종양 미세환경에서 Treg의 빈도 감소, 이후 다수의 뮤린 (murine) 종양 모델에서 종양 거부를 초래하였다. 그러므로, 항-GITR mAb는 암 및 다른 환경에서 면역치료제로서 작용하여, 현재 확립된 암 면역요법의 효과를 증폭시킬 잠재력을 갖는다.
현재 승인된 대부분의 항체 치료제는 면역화된 설치류로부터 유래되었다. 이들 항체의 대부분은 뮤린 CDR의 인간 v-유전자 프레임워크 서열로의 "이식 (grafting)"을 통해, "인간화 (humanization)"로 알려져 있는 과정을 겪었다 (Nelson et al., 2010, Nat Rev Drug Discov 9: 767-774 참조). 이러한 과정은 종종 정확하지 않아서, 결과의 항체의 표적 결합 친화도 감소를 초래하였다. 원래 항체의 결합 친화도로 회복되기 위해, 통상적으로 이식된 v-도메인의 가변 도메인 프레임워크에서 주요 위치에 뮤린 잔기를 도입하였다 (또한 "역-돌연변이 (back-mutations)"로 알려져 있음).
CDR 이식 및 역 돌연변이를 통해 인간화된 항체는 임상에서 전체 뮤린 v-도메인을 갖는 것에 비해 더 낮은 면역 반응율을 유도하는 것으로 나타났지만, 이러한 기본적인 이식 방법을 사용하여 인간화된 항체는 이식된 CDR 루프에 여전히 수용된 면역원성 모티프 및 잠재적인 물리적 불안정성으로 인해 여전히 상당한 임상 개발 위험을 갖는다. 단백질 면역원성의 동물 테스트로 종종 사람에서 면역 반응을 예측하지 못하기 때문에, 치료 용도의 항체 엔지니어링 (antibody engineering)은 예측된 인간 T-세포 에피토프 함량, 비-인간 생식세포 아미노산 함량 및 정제된 단백질의 응집 가능성을 최소화하는데 중점을 두었다.
그러므로, 이상적인 인간화 효능성 항-GITR 항체는 특성이 잘 규명된 인간 생식세포 서열의 프레임워크 및 CDR 모두에 발견되는 잔기와 동일한 잔기를 가능한 많이 v-도메인에서 가질 것이다. Townsend 등 (2015; PNAS 112: 15354-15359)은 래트 (rat), 토끼 및 마우스 (mouse) 항체 유래의 CDR이 바람직한 인간 프레임워크로 이식되고, 그 다음에 "증강된 이진 치환법 (Augmented Binary Substitution)"으로 불리는 인간 생식세포-계열 접근법으로 처리하여 항체를 생성하는 방법을 개시하였다. 이러한 접근법은 원래 항체 파라토프 (paratopes)에서 근본적인 가소성을 입증하였지만, 매우 정확한 항체-항원 공-결정 구조 데이터가 부재하는 경우, 임의의 주어진 항체의 CDR 루프에서 개별 잔기가 인간 생식세포로 전환될 수 있는지, 및 어떤 조합인지를 신뢰할 수 있게 예측하는 것은 여전히 불가능하다.
그러므로 CDR 생식세포는, 본 예에서 표적 결합 특이성, 인간 및 동물 시험 종 (예: 게잡이 원숭이 (crab-eating macaque)로도 알려져 있는 시노몰구스 원숭이 (cynomolgus monkey), 즉 마카카 파시쿨라리스 (Macaca fascicularis)) 모두로부터 유래된 GITR에 대한 친화도, v-도메인 생물물리학적 안정성 및/또는 IgG 발현 수율을 포함하는 분자의 다수의 기능적 특성이 바람직하게 유지되어야 하기 때문에, 복잡한 다인성 문제가 있다. 항체 엔지니어링 연구에 따르면 주요 CDR에서 단일 잔기 위치도 이러한 모든 원하는 분자 특성에 극적인 영향을 줄 수 있다고 개시하였다.
WO2006/105021에서는 "6C8"로 명명된 효능성 뮤린 항-GITR IgG 분자, 및 6C8의 인간화 형태의 제조를 개시하였다. 이러한 6C8의 인간화 형태는 고전적인 인간화 기술, 즉 Kabat-정의된 뮤린 CDR을 인간 중쇄 및 경쇄 프레임워크 서열로 이식하고, 인간 프레임워크 잔기의 일부를 상응하게 위치된 6C8 뮤린 잔기로 역-돌연변이시킴으로써 생산되었다. WO2006/105021에서는 잠재적인 글리코실화 부위를 변형시키기 위해 6C8의 Kabat-정의된 뮤린 CDR 중 하나에 대한 하나의 아미노산 변형만을 개시하였다. 전술한 이유로, WO2006/105021에 개시된 이러한 6C8의 인간화 형태는 이상적이지 않았다.
본 발명은 다수의 최적화된 항-GITR 항체 및 그의 의학적 용도를 제공한다.
본 발명의 일 양상에 따르면, 인간 GITR 및 선택적으로 또한 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 제공하고, 상기 항체 분자 또는 항원-결합 부분은 하기를 갖는 중쇄 가변 영역을 포함하며:
하기 순서로 아미노산 서열을 갖는 HCDR1: G-F-S 또는 S-L의 보존적 치환 (conservative substitution) 또는 L-S-T의 보존적 치환 또는 T-S 또는 임의의 아미노산 (예를 들어, F)-G의 보존적 치환 또는 G-M 또는 임의의 아미노산 (예를 들어, Y, F, L 또는 W)-G의 보존적 치환 또는 G-V의 보존적 치환 또는 V-G의 보존적 치환 또는 G의 보존적 치환 (서열번호: 1);
하기 순서로 아미노산 서열을 갖는 HCDR2: L 또는 L-A의 보존적 치환 또는 A-H의 보존적 치환 또는 H-I의 보존적 치환 또는 I-W-W-D의 보존적 치환 또는 D-D의 보존적 치환 또는 D-D의 보존적 치환 또는 D-K-Y-Y-N 또는 임의의 아미노산 (예를 들어, V)-P 또는 임의의 아미노산 (예를 들어, D)-S-L의 보존적 치환 또는 L-K-S 또는 임의의 아미노산 (예를 들어, G)의 보존적 치환 (서열번호: 2); 및
하기 순서로 아미노산 서열을 갖는 HCDR3: T 또는 임의의 아미노산 (예를 들어, G, A, N, S 또는 I)-R 또는 임의의 아미노산 (예를 들어, D, T 또는 V)-R 또는 임의의 아미노산 (예를 들어, Q, L, M, I 또는 V)-Y-F 또는 F-P-F-A-Y의 보존적 치환 (서열번호: 3);
상기 HCDR1, HCDR2 또는 HCDR3 중 적어도 하나는 허용되는 경우 아미노산 서열 GFSLSTSGMGVG (서열번호: 4; 6C8 뮤린 HCDR1), LAHIWWDDDKYYNPSLKS (서열번호: 5; 6C8 뮤린 HCDR2), LAHIWWDDDKYYQPSLKS (서열번호: 65; 6C8 돌연변이체 HCDR2) 및 TRRYFPFAY (서열번호: 6; 6C8 뮤린 HCDR3) 각각과 비교하여 적어도 하나의 아미노산 차이를 갖는다.
본 발명의 다른 양상에서, 상기 항체 분자 또는 항원-결합 부분은 하기를 갖는 중쇄 가변 영역을 포함한다:
하기 순서로 아미노산 서열을 갖는 HCDR1: F-S-L-S-T-S/F-G-Y-G (서열번호: 7);
하기 순서로 아미노산 서열을 갖는 HCDR2: I-W-W-D-D-D-K-Y-Y-V-D-S-V-K-G (서열번호: 8); 및
하기 순서로 아미노산 서열을 갖는 HCDR3: T-R-Q/L/V-Y-F-P-F-A (서열번호: 9).
본 발명의 바람직한 양상에서, 상기 항체 분자는 인간 GITR, 또한 시노몰구스 원숭이 GITR에 특이적으로 결합한다.
상기 항체 분자 또는 항원-결합 부분은 하기를 갖는 경쇄 가변 영역을 더 포함할 수 있고:
하기 순서로 아미노산 서열을 갖는 LCDR1: K 또는 K-A의 보존적 치환 또는 A-S-Q-N의 보존적 치환 또는 N-V-G의 보존적 치환 또는 G-T의 보존적 치환 또는 T-N 또는 임의의 아미노산 (예를 들어, Y)-V의 보존적 치환 또는 V-A의 보존적 치환 (서열번호: 10);
하기 순서로 아미노산 서열을 갖는 LCDR2: S 또는 임의의 아미노산 (예를 들어 Y, E, D, F, L 또는 N)-A-S 또는 임의의 아미노산 (예를 들어, Y)-Y 또는 임의의 아미노산 (예를 들어, N)-R-Y 또는 임의의 아미노산 (예를 들어 A 또는 D)-S 또는 S의 보존적 치환 (서열번호: 11); 및
하기 순서로 아미노산 서열을 갖는 LCDR3: Q-Q 또는 Q-Y 또는 임의의 아미노산 (예를 들어, R 또는 H)-N의 보존적 치환 또는 N-T 또는 임의의 아미노산 (예를 들어 K 또는 N)-D 또는 임의의 아미노산 (예를 들어, W, L, S, E, V 또는 N)-P-L-T의 보존적 치환 (서열번호: 12);
상기 LCDR1, LCDR2 또는 LCDR3 중 적어도 하나는 허용되는 경우 아미노산 서열 KASQNVGTNVA (서열번호: 13) (6C8 뮤린 LCDR1), SASYRYS (서열번호: 14) (6C8 뮤린 LCDR2) 및 QQYNTDPLT (서열번호: 15) (6C8 뮤린 LCDR3) 각각과 비교하여 적어도 하나의 아미노산 차이를 갖는다.
다른 양상에서, 본 발명의 항체 분자 또는 항원-결합 부분은 하기를 갖는 경쇄 가변 영역을 포함한다:
하기 순서로 아미노산 서열을 갖는 LCDR1: A-S-Q-N/S-V-G-T/S-N (서열번호: 16);
하기 순서로 아미노산 서열을 갖는 LCDR2: S/Y-A-S-Y/N-R-Y-S/T (서열번호: 17); 및
하기 순서로 아미노산 서열을 갖는 LCDR3: Y-S-T/N-D-P-L (서열번호: 18).
본 발명에 따르면 본원에 정의된 항체 분자 또는 그의 항원-결합 부분이 치료제에 연결되어 있는 면역접합체 (immunoconjugate)를 제공한다.
다른 양상에서 본 발명은 본원에 정의된 항체 분자 또는 그의 항원-결합 부분을 코딩하는 핵산 분자를 제공한다.
본 발명의 핵산 분자를 포함하는 벡터 (vector)를 추가로 제공한다.
또한 본원에 정의된 본 발명의 핵산 분자 또는 벡터를 포함하는 숙주 세포를 제공한다.
추가적 양상에서 항-GITR 항체 및/또는 그의 항원-결합 부분을 제조하는 방법을 제공하며, 상기 방법은 본 발명의 숙주 세포를 상기 항체 및/또는 그의 항원-결합 부분의 발현 및/또는 생산을 유도하는 조건하에 배양하는 단계, 및 상기 항체 및/또는 그의 항원-결합 부분을 상기 숙주 세포 또는 배양물로부터 단리하는 단계를 포함한다.
본 발명의 다른 양상에서, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터를 포함하는 약학적 조성물을 제공한다.
피험체에서 면역 반응을 증강시키는 방법을 추가로 제공하며, 상기 방법은 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물의 유효한 양을 투여하는 단계를 포함한다.
추가적 양상에서, 피험체에서 암을 치료 또는 예방하는 방법을 제공하며, 상기 방법은 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물의 유효한 양을 투여하는 단계를 포함한다.
본 발명은 또한 암 치료에 사용하기 위한, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물을 제공한다.
다른 양상에서, 본 발명은 제2 치료제, 예를 들어 항암제와 조합된 조합 형태로 개별적으로, 순차적으로 또는 동시에 사용하기 위한, 본원에 정의된 본 발명의 항체 분자, 또는 그의 항원-결합 부분, 또는 면역접합체, 또는 핵산 분자, 또는 벡터, 또는 치료 방법을 제공한다.
추가적 양상에서, 암 치료용 약제의 제조에 있어서, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물의 용도를 제공한다.
또한, 본 발명은 인간 GITR 및 선택적으로 또한 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 생산하는 방법을 제공하며, 상기 방법은 하기 단계를 포함한다:
(1) 비-인간 출처 유래의 항-GITR CDR을 인간 v-도메인 프레임워크에 이식하여 인간화 항-GITR 항체 분자 또는 그의 항원-결합 부분을 생산하는 단계;
(2) 상기 CDR에서 하나 이상의 돌연변이를 포함하는 인간화 항-GITR 항체 분자 또는 그의 항원-결합 부분의 클론의 파지 라이브러리 (phage library)를 생성하는 단계;
(3) 인간 GITR 및 시노몰구스 원숭이 GITR로의 결합에 대해 상기 파지 라이브러리를 스크리닝 (screening)하는 단계;
(4) 상기 스크리닝 단계 (3)로부터 인간 GITR 및 시노몰구스 원숭이 GITR에 대해 결합 특이성을 갖는 클론을 선택하는 단계; 및
(5) 상기 단계 (4)로부터 선택된 클론으로부터 인간 GITR 및 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 생산하는 단계.
도 1. 인간 GITR - Fc로의 IgG 결합에 대한 직접 적정 ELISA. 인간 IgG1 형식의 카메라 항-GITR 및 인간 생식세포 이식편을 인간 GITR-Fc 단백질에 대해 적정하였다 (μg/ml). 키메라 IgG와 동등한 결합 활성을 나타내는 클론 (VH1 및 VL3 패밀리)은 A에 도시되어 있고, 결합이 손상된 클론 (VH2 및 VH4 패밀리)은 B에 도시되어 있다. 각 그래프에서, X-축은 IgG 농도 (μg/ml)로 나타내고, Y-축은 결합 신호 (OD 450 nm)를 나타내었다.
도 2. GITR Jurkat 세포 리포터 분석 ( GITR 효능성). 인간 IgG1 형식의 인간 생식세포 이식된 항체를 Promega GITR+ Jurkat 세포 리포터 분석에 적용하였다. 이러한 분석은 이식편 패밀리 VH1, VH3 및 VH4의 IgG 중에, 클론 VH3/VL2는 가장 강력한, 농도-의존적 효능 활성을 나타내는 것을 보여주었다. 상기 이식편 중 VH2 패밀리는 ELISA에 의한 효과적인 표적 결합의 결여로 인해 생략되었다. X-축은 mAb의 농도 (ng/ml)를 나타내고, Y-축은 배수 유도 (fold induction)를 나타낸다. 도면 범례에서, "LM"은 리간드 다량체를 나타내고, "C"는 대조군을 나타낸다.
도 3. 인간 및 cyno GITR - Fc 단백질에 대한 라이브러리- 유래된 항- GITR scFv 의 직접 결합 ELISA. A는 브랜치 (Branch) A periprep ELISA (hum-cyno-hum-cyno)를 나타내고, B는 브랜치 B periprep ELISA (cyno-hum-cyno-hum)를 나타내며, C는 브랜치 C periprep ELISA (hum-hum-hum-hum)를 나타낸다. 클론은 3개의 개별 파지 선택 브랜치 (A, B, C)로부터 유래되고, 여기서 파지 개체군은 각 라운드의 비오티닐화 (biotinylated) 인간 (hum) 또는 시노몰구스 (cyno) GITR-Fc 단백질에서 선택되었다. 각 선택 라운드 후에, 라운드 당 92개의 라이브러리-유래된 클론 (검정색 원) 플러스 2개의 포지티브 대조군 (회색 별) 및 2개의 네가티브 대조군 scFv (회색 사각형)를 hum 및 cyno GITR-Fc 모두에 대해 스크리닝하였다. 각 라운드에서 평균 ± SD 값을 회색 막대로 나타내었다. 각 그래프에서, X-축은 선택 라운드 ("R")를 나타내고, 여기서 "H"는 인간을 나타내며, "C"는 cyno를 나타내고, Y-축은 결합 신호 (OD 450 nm)를 나타낸다.
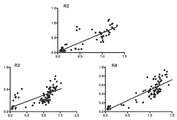
도 4. 인간 및 cyno GITR - Fc 단백질에 대한 선택된 항 - GITR scFv에 대해 직접 결합 ELISA의 선형 회귀 상관 분석. 3개의 개별 파지 선택 브랜치 (A, B, C)로부터의 결합 값을 플로팅하여, 라운드 ("R") 2, 3 및 4 후에 hum (X-축) 및 cyno (Y-축) GITR-Fc 모두에 대한 단일 클론의 결합 신호 (OD 450 nm)를 보여주었다. 라이브러리-유래된 항-GITR 클론은 각 분석에 있어서 상관 추세선과 함께 검정색 원으로 표시하였다. 브랜치 C 값은 인간 GITR 단백질 만에서의 선택으로 더 편향된 개체군을 초래하고, 더 많은 클론은 cyno가 아닌 인간에 대해 반응성을 나타내는 것을 보여주었다.
도 5. 생식세포 돌연변이에 대한 CDR 잔기 내성의 분석. 132개의 독특한 GITR-결합 scFv 클론의 ELISA-포지티브 개체군의 CDR에서 뮤린 아미노산 보유 빈도의 플롯이 각각 (A) VL 및 (B) VH 도메인에 대해 도시되었다. HCDR3 이외에, 인간/뮤린 잔기 돌연변이 유발을 표적으로 하는 잔기만을 플로팅하였다. 각 플롯에서, Y-축은 뮤린 잔기의 보유 퍼센트를 나타내고, CDR 잔기는 X-축에 도시되어 있다. X-축에서 괄호로 언급된 CDR 잔기는 이식을 위해 사용된 인간 생식세포에서 발견되는 것과 동일하였다 (IGKV3-11 및 IGHV3-7). 괄호로 표시하지 않고, 그 값이 0으로 설정된 잔기는 이식 과정 중에 인간 생식세포로 돌연변이되었다. A 및 B 모두에서, 75%에서 회색 점선은 인간 생식세포로 대체된 뮤린 잔기의 내성에 대한 컷오프 (cutoff)를 나타낸다.
도 6. 인간 및 cyno GITR - Fc 단백질로의 IgG 결합에 대한 직접 적정 ELISA. 인간 IgG1 형식의 키메라 항-GITR (mVH/mVL), 인간 생식세포 이식편 (VH1/VL1, VH3/VL2) 및 라이브러리-유래된 클론을 인간 (A, C) 및 cyno (B, D) GITR-Fc 단백질에 대한 직접 결합 ELISA에서 적정하였다 (μg/ml). 인간 및 cyno 모두에 대한 VH1/VL1 및 VH3/VL2 IgG와 동등하거나 또는 이보다 향상된 결합 활성을 나타내는 클론은 (A) 및 (B)에 도시하였다. 인간 GITR-Fc, cyno GITR-Fc 또는 모두에 대한 VH1/VL1 및 VH3/VL2 IgG보다 떨어지는 결합 활성을 나타내는 클론은 (C) 및 (D)에 도시하였다. 각 그래프에서, X-축은 IgG 농도 (μg/ml)를 나타내고, Y-축은 결합 신호 (OD 450 nm)를 나타낸다.
도 7. 우선순위가 높은 리드 (leads)에 대한 GITR Jurkat 세포 리포터 분석. 인간 IgG1 형식의 리드 클론 D-A6 (A), I-C2 (B) 및 G-G10 (C)에 대해 세포 표면에서 인간 GITR의 가교의 중복 분석으로 모두 3개의 클론이 항-HA 항체 가교된 인간 GITRL 단백질 (x-연결된 ["x-L"] GITRL)과 유사한 농도 범위에서 농도-의존적 효능 활성을 유도하는 것을 보여주었고, 여기서 D-A6은 리간드 활성의 가장 유사한 모방체이다. 각 그래프에서, X-축은 mAb 농도 (ng/ml)를 나타내고, Y-축은 상대 광 유닛 (relative light units: RLU)을 나타내며, 대조군 κ IgG1은 "C κ IgG1"로 표시된다.
도 8. 우선순위가 높은 리드 클론에 대한 결합 특이성 분석. mVH/mVL (A), VH3/VL2 (B) 및 리드 조작된 IgG 클론 G-G10 (C), I-C2 (D) 및 D-A6 (E)에 대한 표적외 상동 결합 위험 (off-target homologue binding risk)을 GITR-Fc 오르토로그 (orthologs) 및 13개의 인간 TNFRSF 및 면역글로불린 상과 단백질 (각 X-축에 표지된 바와 같음)의 패널에서 직접 ELISA로 조사하였다. 인간, cyno 및 뮤린 GITR-Fc (h/c/mGITR-Fc)로의 결합은 1 μg/ml의 IgG 농도에서 수행되었다. 모든 다른 단백질로의 결합은 10 μg/ml의 IgG 농도에서 수행되었다. 각 플롯에서, Y-축은 결합 신호 (OD 450 nm)를 나타낸다. 모든 IgG에 있어서, hGITR-Fc 및 cGITR-Fc 단독에 대한 결합이 관찰되었다. mGITR-Fc 또는 임의의 상동 인간 단백질에 대한 배경 이상의 결합은 관찰되지 않았다.
도 9. 리드 및 대조군 IgG에 있어서 인간 GITR - Fc로의 VH1/VL1 IgG 결합에 대한 HTRF 경쟁 분석. VH1/VL1 IgG에 대한 HTRF 결합 신호를 라이브러리-유래된 리드 D-A6, I-C2 및 G-G10, 네가티브 대조군으로서 이소타입 ("I") IgG1, 플러스 포지티브 대조군으로서 표지되지 않은 VH1/VL1을 포함하는 적정된 경쟁인자 IgG의 존재하에 조사하였다. X-축은 IgG1 농도 (μg/ml)를 나타내고, Y-축은 HTRF 665/615 비율을 나타내었다. 모든 라이브러리-유래된 IgG는 VH1-VL1 결합에서 농도-의존적 감소를 나타내었고, 이는 공유된 에피토프의 유지를 시사한다.
도 10. 인간 및 cyno GITR + 안정적으로-형질감염된 뮤린 세포로의 결합에서 리드 및 대조군 IgG의 유세포분석 테스트. 리드 라이브러리-유래된 및 대조군 IgG ("I IgG1"은 이소타입 IgG1을 나타냄)를 (A) 인간 및 (B) cyno-형질감염된 뮤린 세포에서 특이적 결합에 대해 조사하였다. 세포주 모두에 대한 농도-의존적 결합이 관찰되었다. 인간 GITR-형질감염된 인간 Jurkat 세포에서 GITR 효능성 분석에서와 같이, 본 실험에서 최대 결합 신호는 모든 인간화 클론 및 이식된 클론에 대해 대략 1000 ng/ml에서 관찰되었다. 관련이 없는 인간 수용체 (C)로 형질감염된 뮤린 세포에 대해 배경 이상의 결합 신호가 관찰되지 않았다. 각 그래프에서, X-축은 IgG1의 농도 (ng/ml)를 나타내고, Y-축은 평균 형광 세기 (mean fluoresence intensity: MFI)를 나타낸다.
도 11. GITR Jurkat 세포 리포터 분석에서 D-A6 및 VH1/VL1 IgG1 항체의 이중-정제된 단량체 버전의 상대 효능. 인간 IgG1 형식의 ProA-SEC 정제된 D-A6 및 VH1/VL1 항체를 Promega GITR+ Jurkat 세포 리포터 분석에 적용하였다. 상기 분석은 클론 D-A6이 GITR 신호전달 유도에서 VH1/VL1보다 유의하게 보다 강력하다는 것을 보여주었다. X-축은 mAb의 농도 (nM)를 나타내고, Y-축은 RLU를 나타낸다.
도 12. GITR 발현 세포의 유세포분석에서 막 결합의 특이성. A) 본 분석에서, CHO-K1 인간 GITR+ 세포로의 항체 결합의 특이성을 과량의 가용성의, 정제된 재조합 인간 GITR 리간드 (GITRL) 단백질의 존재 또는 부재하에 유세포분석 염색에 의해 나타내었다. VH1/VL1 및 D-A6 항체 모두에 있어서, 1.1 μg/ml의 항체에 대한 GITR+ 세포로의 결합 신호는 10 μg/ml의 가용성 GITRL 단백질의 존재하에 > 10-배 감소하였다. 네가티브 대조군 항-GFP 항체는 CHO-K1 GITR 세포로의 측정가능한 결합을 나타내지 않았다. "N"은 나이브 (naive) 세포를 나타내고; "A"는 활성화된 세포를 나타낸다. B) D-A6 IgG1 및 VH1/VL1 IgG1 모두는 또한 세포가 CD3/CD28 자극을 통해 활성화되지만, 나이브하지 않을 때 인간 HuT78 T 세포주에 대한 명확한 반응성을 보였다. 활성화된 세포에서 GITR 상향조절은 항-인간 GITR 모노클로날 시약 항체 108-17에 의한 강한 포지티브 염색에 의해 확인되었다. "Ab"는 1.11 μg/ml 항체를 나타내고; "Ab + GITRL"은 1.11 μg/ml 항체 + 10 μg/ml GITRL을 나타낸다. X-축은 항체를 나타내고, y-축은 살아 있는 세포의 MFI를 나타낸다. 각 플롯에서, Y-축은 살아있는 세포의 MFI를 나타낸다.
도 13. CHO -K1 인간 세포 (그래프 A) 및 cyno GITR + 세포 (그래프 B)를 사용한 Jurkat 세포 리포터 분석에서 FcγRIIIa 신호전달의 유도에서 D-A6 VH1/VL1 IgG1, D-A6 IgG1 - N297A 및 VH1/VL1 IgG1 - N297A ( 아글리코실화 ) 항체의 상대 효능. 각 그래프에서, x-축은 항체 농도 (ng/ml)를 나타내고, y-축은 RLU를 나타낸다. 본 분석은 IgG1 형태의 D-A6 및 VH1/VL1 항체가 (NK 세포에서 ADCC 활성의 유도를 나타내는) FcγRIIIa 신호전달을 유도할 수 있는 반면에, D-A6 IgG1-N297A 또는 VH1/VL1 IgG1-N297A 항체는 신호전달을 유도하지 않는다는 것을 보여주었다. 중요하게도, D-A6 IgG1은 신호전달 유도에 있어서 VH1/VL1 IgG1보다 유의하게 보다 강력했다.
도 14. 개발 위험 ELISA. 본 분석은 IgG1 및 IgG1-N297A 형태의 D-A6 항체가 음전하를 띤 생체분자인 인슐린 (그래프 A), 이중가닥 DNA (dsDNA) (그래프 B) 및 단일가닥 DNA (ssDNA) (그래프 C)로의 결합에 대해 음성임을 나타내었다. 각 그래프에서, X-축은 IgG 농도 (μg/ml)를 나타내고, Y-축은 결합 신호 (OD 450 nm)를 나타낸다. 상기 분자에 대한 강한 표적외 결합은 치료용 항체의 임상 성능이 불량하다는 고위험 지표인 것으로 나타났다.
도 15. 우선순위가 높은 리드에 대한 GITR Jurkat 세포 리포터 분석. 리드 클론 IgG1null 및 IgG1-N297A 형식의 D-A6 (A), D-A6.1 (B) 및 IgG1 형식의, 라이브러리-유래된 리드 G-G10 (C) 및 I-C2 (D)에 대해 세포 표면에서 인간 GITR의 가교 중복 분석은 모든 클론이 VH1/VL1 IgG1과 비교하여 보다 강력한 농도-의존적 효능 활성을 유발하는 것을 보여주었다. C 및 D에서, "I IgG1"은 이소타입 IgG1을 나타낸다. 각 그래프에서, x-축은 IgG 농도 (ng/ml)를 나타내고, y-축은 RLU를 나타낸다.
도 2. GITR Jurkat 세포 리포터 분석 ( GITR 효능성). 인간 IgG1 형식의 인간 생식세포 이식된 항체를 Promega GITR+ Jurkat 세포 리포터 분석에 적용하였다. 이러한 분석은 이식편 패밀리 VH1, VH3 및 VH4의 IgG 중에, 클론 VH3/VL2는 가장 강력한, 농도-의존적 효능 활성을 나타내는 것을 보여주었다. 상기 이식편 중 VH2 패밀리는 ELISA에 의한 효과적인 표적 결합의 결여로 인해 생략되었다. X-축은 mAb의 농도 (ng/ml)를 나타내고, Y-축은 배수 유도 (fold induction)를 나타낸다. 도면 범례에서, "LM"은 리간드 다량체를 나타내고, "C"는 대조군을 나타낸다.
도 3. 인간 및 cyno GITR - Fc 단백질에 대한 라이브러리- 유래된 항- GITR scFv 의 직접 결합 ELISA. A는 브랜치 (Branch) A periprep ELISA (hum-cyno-hum-cyno)를 나타내고, B는 브랜치 B periprep ELISA (cyno-hum-cyno-hum)를 나타내며, C는 브랜치 C periprep ELISA (hum-hum-hum-hum)를 나타낸다. 클론은 3개의 개별 파지 선택 브랜치 (A, B, C)로부터 유래되고, 여기서 파지 개체군은 각 라운드의 비오티닐화 (biotinylated) 인간 (hum) 또는 시노몰구스 (cyno) GITR-Fc 단백질에서 선택되었다. 각 선택 라운드 후에, 라운드 당 92개의 라이브러리-유래된 클론 (검정색 원) 플러스 2개의 포지티브 대조군 (회색 별) 및 2개의 네가티브 대조군 scFv (회색 사각형)를 hum 및 cyno GITR-Fc 모두에 대해 스크리닝하였다. 각 라운드에서 평균 ± SD 값을 회색 막대로 나타내었다. 각 그래프에서, X-축은 선택 라운드 ("R")를 나타내고, 여기서 "H"는 인간을 나타내며, "C"는 cyno를 나타내고, Y-축은 결합 신호 (OD 450 nm)를 나타낸다.
도 4. 인간 및 cyno GITR - Fc 단백질에 대한 선택된 항 - GITR scFv에 대해 직접 결합 ELISA의 선형 회귀 상관 분석. 3개의 개별 파지 선택 브랜치 (A, B, C)로부터의 결합 값을 플로팅하여, 라운드 ("R") 2, 3 및 4 후에 hum (X-축) 및 cyno (Y-축) GITR-Fc 모두에 대한 단일 클론의 결합 신호 (OD 450 nm)를 보여주었다. 라이브러리-유래된 항-GITR 클론은 각 분석에 있어서 상관 추세선과 함께 검정색 원으로 표시하였다. 브랜치 C 값은 인간 GITR 단백질 만에서의 선택으로 더 편향된 개체군을 초래하고, 더 많은 클론은 cyno가 아닌 인간에 대해 반응성을 나타내는 것을 보여주었다.
도 5. 생식세포 돌연변이에 대한 CDR 잔기 내성의 분석. 132개의 독특한 GITR-결합 scFv 클론의 ELISA-포지티브 개체군의 CDR에서 뮤린 아미노산 보유 빈도의 플롯이 각각 (A) VL 및 (B) VH 도메인에 대해 도시되었다. HCDR3 이외에, 인간/뮤린 잔기 돌연변이 유발을 표적으로 하는 잔기만을 플로팅하였다. 각 플롯에서, Y-축은 뮤린 잔기의 보유 퍼센트를 나타내고, CDR 잔기는 X-축에 도시되어 있다. X-축에서 괄호로 언급된 CDR 잔기는 이식을 위해 사용된 인간 생식세포에서 발견되는 것과 동일하였다 (IGKV3-11 및 IGHV3-7). 괄호로 표시하지 않고, 그 값이 0으로 설정된 잔기는 이식 과정 중에 인간 생식세포로 돌연변이되었다. A 및 B 모두에서, 75%에서 회색 점선은 인간 생식세포로 대체된 뮤린 잔기의 내성에 대한 컷오프 (cutoff)를 나타낸다.
도 6. 인간 및 cyno GITR - Fc 단백질로의 IgG 결합에 대한 직접 적정 ELISA. 인간 IgG1 형식의 키메라 항-GITR (mVH/mVL), 인간 생식세포 이식편 (VH1/VL1, VH3/VL2) 및 라이브러리-유래된 클론을 인간 (A, C) 및 cyno (B, D) GITR-Fc 단백질에 대한 직접 결합 ELISA에서 적정하였다 (μg/ml). 인간 및 cyno 모두에 대한 VH1/VL1 및 VH3/VL2 IgG와 동등하거나 또는 이보다 향상된 결합 활성을 나타내는 클론은 (A) 및 (B)에 도시하였다. 인간 GITR-Fc, cyno GITR-Fc 또는 모두에 대한 VH1/VL1 및 VH3/VL2 IgG보다 떨어지는 결합 활성을 나타내는 클론은 (C) 및 (D)에 도시하였다. 각 그래프에서, X-축은 IgG 농도 (μg/ml)를 나타내고, Y-축은 결합 신호 (OD 450 nm)를 나타낸다.
도 7. 우선순위가 높은 리드 (leads)에 대한 GITR Jurkat 세포 리포터 분석. 인간 IgG1 형식의 리드 클론 D-A6 (A), I-C2 (B) 및 G-G10 (C)에 대해 세포 표면에서 인간 GITR의 가교의 중복 분석으로 모두 3개의 클론이 항-HA 항체 가교된 인간 GITRL 단백질 (x-연결된 ["x-L"] GITRL)과 유사한 농도 범위에서 농도-의존적 효능 활성을 유도하는 것을 보여주었고, 여기서 D-A6은 리간드 활성의 가장 유사한 모방체이다. 각 그래프에서, X-축은 mAb 농도 (ng/ml)를 나타내고, Y-축은 상대 광 유닛 (relative light units: RLU)을 나타내며, 대조군 κ IgG1은 "C κ IgG1"로 표시된다.
도 8. 우선순위가 높은 리드 클론에 대한 결합 특이성 분석. mVH/mVL (A), VH3/VL2 (B) 및 리드 조작된 IgG 클론 G-G10 (C), I-C2 (D) 및 D-A6 (E)에 대한 표적외 상동 결합 위험 (off-target homologue binding risk)을 GITR-Fc 오르토로그 (orthologs) 및 13개의 인간 TNFRSF 및 면역글로불린 상과 단백질 (각 X-축에 표지된 바와 같음)의 패널에서 직접 ELISA로 조사하였다. 인간, cyno 및 뮤린 GITR-Fc (h/c/mGITR-Fc)로의 결합은 1 μg/ml의 IgG 농도에서 수행되었다. 모든 다른 단백질로의 결합은 10 μg/ml의 IgG 농도에서 수행되었다. 각 플롯에서, Y-축은 결합 신호 (OD 450 nm)를 나타낸다. 모든 IgG에 있어서, hGITR-Fc 및 cGITR-Fc 단독에 대한 결합이 관찰되었다. mGITR-Fc 또는 임의의 상동 인간 단백질에 대한 배경 이상의 결합은 관찰되지 않았다.
도 9. 리드 및 대조군 IgG에 있어서 인간 GITR - Fc로의 VH1/VL1 IgG 결합에 대한 HTRF 경쟁 분석. VH1/VL1 IgG에 대한 HTRF 결합 신호를 라이브러리-유래된 리드 D-A6, I-C2 및 G-G10, 네가티브 대조군으로서 이소타입 ("I") IgG1, 플러스 포지티브 대조군으로서 표지되지 않은 VH1/VL1을 포함하는 적정된 경쟁인자 IgG의 존재하에 조사하였다. X-축은 IgG1 농도 (μg/ml)를 나타내고, Y-축은 HTRF 665/615 비율을 나타내었다. 모든 라이브러리-유래된 IgG는 VH1-VL1 결합에서 농도-의존적 감소를 나타내었고, 이는 공유된 에피토프의 유지를 시사한다.
도 10. 인간 및 cyno GITR + 안정적으로-형질감염된 뮤린 세포로의 결합에서 리드 및 대조군 IgG의 유세포분석 테스트. 리드 라이브러리-유래된 및 대조군 IgG ("I IgG1"은 이소타입 IgG1을 나타냄)를 (A) 인간 및 (B) cyno-형질감염된 뮤린 세포에서 특이적 결합에 대해 조사하였다. 세포주 모두에 대한 농도-의존적 결합이 관찰되었다. 인간 GITR-형질감염된 인간 Jurkat 세포에서 GITR 효능성 분석에서와 같이, 본 실험에서 최대 결합 신호는 모든 인간화 클론 및 이식된 클론에 대해 대략 1000 ng/ml에서 관찰되었다. 관련이 없는 인간 수용체 (C)로 형질감염된 뮤린 세포에 대해 배경 이상의 결합 신호가 관찰되지 않았다. 각 그래프에서, X-축은 IgG1의 농도 (ng/ml)를 나타내고, Y-축은 평균 형광 세기 (mean fluoresence intensity: MFI)를 나타낸다.
도 11. GITR Jurkat 세포 리포터 분석에서 D-A6 및 VH1/VL1 IgG1 항체의 이중-정제된 단량체 버전의 상대 효능. 인간 IgG1 형식의 ProA-SEC 정제된 D-A6 및 VH1/VL1 항체를 Promega GITR+ Jurkat 세포 리포터 분석에 적용하였다. 상기 분석은 클론 D-A6이 GITR 신호전달 유도에서 VH1/VL1보다 유의하게 보다 강력하다는 것을 보여주었다. X-축은 mAb의 농도 (nM)를 나타내고, Y-축은 RLU를 나타낸다.
도 12. GITR 발현 세포의 유세포분석에서 막 결합의 특이성. A) 본 분석에서, CHO-K1 인간 GITR+ 세포로의 항체 결합의 특이성을 과량의 가용성의, 정제된 재조합 인간 GITR 리간드 (GITRL) 단백질의 존재 또는 부재하에 유세포분석 염색에 의해 나타내었다. VH1/VL1 및 D-A6 항체 모두에 있어서, 1.1 μg/ml의 항체에 대한 GITR+ 세포로의 결합 신호는 10 μg/ml의 가용성 GITRL 단백질의 존재하에 > 10-배 감소하였다. 네가티브 대조군 항-GFP 항체는 CHO-K1 GITR 세포로의 측정가능한 결합을 나타내지 않았다. "N"은 나이브 (naive) 세포를 나타내고; "A"는 활성화된 세포를 나타낸다. B) D-A6 IgG1 및 VH1/VL1 IgG1 모두는 또한 세포가 CD3/CD28 자극을 통해 활성화되지만, 나이브하지 않을 때 인간 HuT78 T 세포주에 대한 명확한 반응성을 보였다. 활성화된 세포에서 GITR 상향조절은 항-인간 GITR 모노클로날 시약 항체 108-17에 의한 강한 포지티브 염색에 의해 확인되었다. "Ab"는 1.11 μg/ml 항체를 나타내고; "Ab + GITRL"은 1.11 μg/ml 항체 + 10 μg/ml GITRL을 나타낸다. X-축은 항체를 나타내고, y-축은 살아 있는 세포의 MFI를 나타낸다. 각 플롯에서, Y-축은 살아있는 세포의 MFI를 나타낸다.
도 13. CHO -K1 인간 세포 (그래프 A) 및 cyno GITR + 세포 (그래프 B)를 사용한 Jurkat 세포 리포터 분석에서 FcγRIIIa 신호전달의 유도에서 D-A6 VH1/VL1 IgG1, D-A6 IgG1 - N297A 및 VH1/VL1 IgG1 - N297A ( 아글리코실화 ) 항체의 상대 효능. 각 그래프에서, x-축은 항체 농도 (ng/ml)를 나타내고, y-축은 RLU를 나타낸다. 본 분석은 IgG1 형태의 D-A6 및 VH1/VL1 항체가 (NK 세포에서 ADCC 활성의 유도를 나타내는) FcγRIIIa 신호전달을 유도할 수 있는 반면에, D-A6 IgG1-N297A 또는 VH1/VL1 IgG1-N297A 항체는 신호전달을 유도하지 않는다는 것을 보여주었다. 중요하게도, D-A6 IgG1은 신호전달 유도에 있어서 VH1/VL1 IgG1보다 유의하게 보다 강력했다.
도 14. 개발 위험 ELISA. 본 분석은 IgG1 및 IgG1-N297A 형태의 D-A6 항체가 음전하를 띤 생체분자인 인슐린 (그래프 A), 이중가닥 DNA (dsDNA) (그래프 B) 및 단일가닥 DNA (ssDNA) (그래프 C)로의 결합에 대해 음성임을 나타내었다. 각 그래프에서, X-축은 IgG 농도 (μg/ml)를 나타내고, Y-축은 결합 신호 (OD 450 nm)를 나타낸다. 상기 분자에 대한 강한 표적외 결합은 치료용 항체의 임상 성능이 불량하다는 고위험 지표인 것으로 나타났다.
도 15. 우선순위가 높은 리드에 대한 GITR Jurkat 세포 리포터 분석. 리드 클론 IgG1null 및 IgG1-N297A 형식의 D-A6 (A), D-A6.1 (B) 및 IgG1 형식의, 라이브러리-유래된 리드 G-G10 (C) 및 I-C2 (D)에 대해 세포 표면에서 인간 GITR의 가교 중복 분석은 모든 클론이 VH1/VL1 IgG1과 비교하여 보다 강력한 농도-의존적 효능 활성을 유발하는 것을 보여주었다. C 및 D에서, "I IgG1"은 이소타입 IgG1을 나타낸다. 각 그래프에서, x-축은 IgG 농도 (ng/ml)를 나타내고, y-축은 RLU를 나타낸다.
본 발명의 제1 양상에 따르면, 인간 GITR 및 선택적으로 또한 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 제공하며, 상기 항체 분자 또는 항원-결합 부분은 하기를 갖는 중쇄 가변 영역을 포함하고:
하기 순서로 아미노산 서열을 갖는 HCDR1: G-F-S 또는 S-L의 보존적 치환 또는 L-S-T의 보존적 치환 또는 T-S 또는 임의의 아미노산 (예를 들어, F)-G의 보존적 치환 또는 G-M 또는 임의의 아미노산 (예를 들어, Y, F, L 또는 W)-G의 보존적 치환 또는 G-V의 보존적 치환 또는 V-G의 보존적 치환 또는 G의 보존적 치환 (서열번호: 1);
하기 순서로 아미노산 서열을 갖는 HCDR2: L 또는 L-A의 보존적 치환 또는 A-H의 보존적 치환 또는 H-I의 보존적 치환 또는 I-W-W-D의 보존적 치환 또는 D-D의 보존적 치환 또는 D-D의 보존적 치환 또는 D-K-Y-Y-N 또는 임의의 아미노산 (예를 들어, V) -P 또는 임의의 아미노산 (예를 들어, D)-S-L의 보존적 치환 또는 L-K-S 또는 임의의 아미노산 (예를 들어, G)의 보존적 치환 (서열번호: 2); 및
하기 순서로 아미노산 서열을 갖는 HCDR3: T 또는 임의의 아미노산 (예를 들어, G, A, N, S 또는 I)-R 또는 임의의 아미노산 (예를 들어, D, T 또는 V)-R 또는 임의의 아미노산 (예를 들어, Q, L, M, I 또는 V)-Y-F 또는 F-P-F-A-Y의 보존적 치환 (서열번호: 3);
상기 HCDR1, HCDR2 또는 HCDR3 중 적어도 하나는 상기 정의에 따라 허용되는 경우, 아미노산 서열 GFSLSTSGMGVG (서열번호: 4; 6C8 뮤린 HCDR1), LAHIWWDDDKYYNPSLKS (서열번호: 5; 6C8 뮤린 HCDR2), LAHIWWDDDKYYQPSLKS (서열번호: 65; 6C8 돌연변이체 HCDR2) 및 TRRYFPFAY (서열번호: 6; 6C8 뮤린 HCDR3) 각각과 비교하여, 적어도 하나의 아미노산 차이, 예를 들어 1, 2, 3, 4, 5 또는 초과의 아미노산 차이를 갖는다.
WO2006/105021에 개시된 6C8 뮤린 항체 유래의 HCDR2를 정의하는 서열 LAHIWWDDDKYYNPSLKS (서열번호: 5)는 위치 N에서 N을 갖는 야생형 뮤린 서열을 포함한다. WO2006/105021에 개시된 위치 N에서 Q를 갖는 그의 돌연변이체 형태 (LAHIWWDDDKYYQPSLKS; 서열번호: 65)는 추정 글리코실화 부위를 제거한 것으로 언급되었다.
상기 항체 분자 또는 그의 항원-결합 부분의 HCDR1, HCDR2 및 HCDR3은 각각 상기 정의에 따라 허용되는 경우, 아미노산 서열 GFSLSTSGMGVG (서열번호: 4; 6C8 뮤린 HCDR1), LAHIWWDDDKYYNPSLKS (서열번호: 5; 6C8 뮤린 HCDR2), LAHIWWDDDKYYQPSLKS (서열번호: 65; 6C8 돌연변이체 HCDR2) 및 TRRYFPFAY (서열번호: 6; 6C8 뮤린 HCDR3) 각각과 비교하여, 적어도 하나의 아미노산 차이, 예를 들어 1, 2, 3, 4, 5 또는 초과의 아미노산 차이를 가질 수 있다.
본 발명에 따른 항체 분자 또는 그의 항원-결합 부분은 하기를 갖는 경쇄 가변 영역을 추가로 포함할 수 있고:
하기 순서로 아미노산 서열을 갖는 LCDR1: K 또는 K-A의 보존적 치환 또는 A-S-Q-N의 보존적 치환 또는 N-V-G의 보존적 치환 또는 G-T의 보존적 치환 또는 T-N 또는 임의의 아미노산 (예를 들어, Y)-V의 보존적 치환 또는 V-A의 보존적 치환 (서열번호: 10);
하기 순서로 아미노산 서열을 갖는 LCDR2: S 또는 임의의 아미노산 (예를 들어 Y, E, D, F, L 또는 N)-A-S 또는 임의의 아미노산 (예를 들어, Y)-Y 또는 임의의 아미노산 (예를 들어, N)-R-Y 또는 임의의 아미노산 (예를 들어 A 또는 D)-S 또는 S의 보존적 치환 (서열번호: 11); 및
하기 순서로 아미노산 서열을 갖는 LCDR3: Q-Q 또는 Q-Y 또는 임의의 아미노산 (예를 들어, R 또는 H)-N의 보존적 치환 또는 N-T 또는 임의의 아미노산 (예를 들어 K 또는 N)-D 또는 임의의 아미노산 (예를 들어, W, L, S, E, V 또는 N)-P-L-T의 보존적 치환 (서열번호: 12);
상기 LCDR1, LCDR2 또는 LCDR3 중 적어도 하나는 상기 정의에 따라 허용되는 경우, 아미노산 서열 KASQNVGTNVA (서열번호: 13; 6C8 뮤린 LCDR1), SASYRYS (서열번호: 14; 6C8 뮤린 LCDR2) 및 QQYNTDPLT (서열번호: 15; 6C8 뮤린 LCDR3) 각각과 비교하여, 적어도 하나의 아미노산 차이, 예를 들어 1, 2, 3, 4, 5 또는 초과의 아미노산 차이를 갖는다.
상기 항체 분자 또는 그의 항원-결합 부분의 LCDR1, LCDR2 및 LCDR3은 각각 상기 정의에 따라 허용되는 경우, 아미노산 서열 KASQNVGTNVA (서열번호: 13; 6C8 뮤린 LCDR1), SASYRYS (서열번호: 14; 6C8 뮤린 LCDR2) 및 QQYNTDPLT (서열번호: 15; 6C8 뮤린 LCDR3) 각각과 비교하여, 적어도 하나의 아미노산 차이, 예를 들어 1, 2, 3, 4, 5 또는 초과의 아미노산 차이를 가질 수 있다.
본원에서 상술한 바와 같이, 본 발명자는 WO2006/105021에 개시된 뮤린 항-GITR 항체 6C8 유래의 CDR 서열을 사용하여 다수의 최적화된 항-GITR 항체 분자를 생성하는데 처음으로 성공하였다. 시노몰구스 원숭이 GITR뿐만 아니라 인간 GITR 모두에 대해 결합 특이성을 갖는 본 발명의 바람직한 항체 분자가 선택되었다 (동물 시험 종에서 연구를 용이하게 하기 위함). 본원에 개시된 최적화된 항체 분자를 추가로 정제하여 GITR의 시노몰구스 원숭이 오르토로그에 대해 결합을 향상시키고, 인간 GITR 신호전달의 효능성에서 효능을 향상시키며, FcγRIIIa 수용체의 진입을 향상시켜서, 인 비보 ADCC 반응, 우수한 가변 도메인 안정성, 높은 발현 수율, 및/또는 감소된 면역원성을 유도하였다.
본 발명의 바람직한 최적화된 항-GITR 항체 분자는 상응하는 뮤린 CDR 또는 다른 (예컨대 프레임워크) 아미노산 위치에서 반드시 인간 생식세포 치환의 최대 수를 가질 필요는 없다. 하기 실험 부분에서 상술되는 바와 같이, 본 발명자는 "최대로 인간화된" 항체 분자가 항-GITR 결합 특징 및/또는 다른 원하는 특성에서 반드시 "최대로 최적화될" 필요는 없다는 것을 발견하였다.
본 발명은 본원에 정의된 항체 분자 또는 그의 항원-결합 부분의 아미노산 서열에 대한 변형을 포함한다. 예를 들어, 본 발명은 특성에 유의한 영향을 주지 않는 기능적으로 동등한 가변 영역 및 CDR을 포함하는 항체 분자 및 상응하는 그의 항원-결합 부분뿐만 아니라 활성 및/또는 친화도가 증강되거나 또는 감소된 변이체를 포함한다. 예를 들어, 상기 아미노산 서열은 돌연변이되어 GITR에 대해 원하는 결합 친화도를 갖는 항체를 수득할 수 있다. 단일 또는 다수의 아미노산 잔기의 서열내 삽입뿐만 아니라 길이가 1개의 잔기 내지 100개 이상의 잔기를 포함하는 폴리펩티드 범위의 아미노- 및/또는 카르복실-말단 융합을 포함하는 삽입이 예상된다. 말단 삽입의 예로는 N-말단 메티오닐 잔기를 갖는 항체 분자 또는 에피토프 태그에 융합된 항체 분자를 포함한다. 상기 항체 분자의 다른 삽입 변이체는 혈액 순환에서 항체의 반감기를 증가시키는 효소 또는 폴리펩티드의 항체의 N- 또는 C-말단으로의 융합을 포함한다.
본 발명의 항체 분자 또는 항원-결합 부분은 글리코실화 및 비글리코실화 폴리펩티드뿐만 아니라 예를 들어 상이한 당에 의한 글리코실화, 아세틸화 및 인산화와 같은 다른 번역후 변형을 갖는 폴리펩티드를 포함할 수 있다. 본 발명의 항체 분자 또는 항원-결합 부분은 예를 들어 하나 이상의 아미노산 잔기를 부가, 제거 또는 치환에 의해 이러한 번역후 변형을 변경하도록 돌연변이되어 글리코실화 부위가 형성 또는 제거될 수 있다.
본 발명의 항체 분자 또는 항원-결합 부분은 예를 들어 아미노산 치환에 의해 변형되어 항체에서 잠재적인 단백질분해 부위가 제거될 수 있다.
상기 항체 분자 또는 그의 항원-결합 부분에서, 상기 HCDR1은 아미노산 서열 G-F-S/T-L/F-S-T/A-S/F-G/S-M/Y/F/L/W-G/A-V/M-G/S (서열번호: 19)를 가질 수 있고;
상기 HCDR2는 아미노산 서열 L/V-A/S-H/N-I/V-W-W-D/E-D/S-D/E-K-Y-Y-N/V-P/D-S-L/V-K-S/G (서열번호: 20)를 가질 수 있으며;
상기 HCDR3은 아미노산 서열 T/G/A/N/S/I-R/D/T/V-R/Q/L/M/I/V-Y-F/Y-P-F-A-Y (서열번호: 21)를 가질 수 있다.
예를 들어, 상기 HCDR1은 아미노산 서열 G-F-S/T-L/F-S-T/A-S/F-G/S-M/Y/F/L/W-G/A-V/M-G/S (서열번호: 19)를 가질 수 있고;
상기 HCDR2는 아미노산 서열 L/V-A/S-H/N-I/V-W-W-D/E-D/S-D/E-K-Y-Y-V-D-S-V-K-G (서열번호: 30)를 가질 수 있으며;
상기 HCDR3은 아미노산 서열 T/G/A/N/S/I-R/D/T/V-R/Q/L/M/I/V-Y-F/Y-P-F-A-Y (서열번호: 21)를 가질 수 있다.
상기 항체 분자 또는 그의 항원-결합 부분에서, 상기 LCDR1은 아미노산 서열 K/R-A/T-S-Q-N/D/S-V-G/S-T/S/N-N/Y-V/L-A (서열번호: 22)를 가질 수 있고;
상기 LCDR2는 아미노산 서열 S/Y/E/D/F/L/N-A-S/Y-Y/N-R-Y/A/D-S/T (서열번호: 23)를 가질 수 있으며;
상기 LCDR3은 아미노산 서열 Q-Q/H-Y/R/H-N/S/R-T/K/N-D/W/L/S/E/V/N-P-L-T (서열번호: 24)를 가질 수 있다.
예를 들어, 상기 LCDR1은 아미노산 서열 R-A/T-S-Q-N/D/S-V-G/S-T/S/N-N/Y-V/L-A (서열번호: 174)를 가질 수 있고;
상기 LCDR2는 아미노산 서열 S/Y/E/D/F/L/N-A-S/Y-Y/N-R-Y/A/D-S/T (서열번호: 23)를 가질 수 있으며;
상기 LCDR3은 아미노산 서열 Q-Q/H-Y/R/H-N/S/R-T/K/N-D/W/L/S/E/V/N-P-L-T (서열번호: 24)를 가질 수 있다.
본 발명의 다른 양상에서, 인간 글루코코르티코이드-유도 TNF 수용체 (GITR) 및 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 제공하며, 상기 항체 분자 또는 항원-결합 부분은 하기를 갖는 중쇄 가변 영역을 포함한다:
하기 순서로 아미노산 서열을 갖는 HCDR1: F-S-L-S-T-S/F-G-Y-G (서열번호: 7);
하기 순서로 아미노산 서열을 갖는 HCDR2: I-W-W-D-D-D-K-Y-Y-V-D-S-V-K-G (서열번호: 8); 및
하기 순서로 아미노산 서열을 갖는 HCDR3: T-R-Q/L/V-Y-F-P-F-A (서열번호: 9).
상기 CDR 서열은 하기 표 1에 개시된 바와 같이 "통일된" 정의보다는 더 짧은 "AHo" 정의를 사용하여 정의된다. AHo 정의는 구조 생물학에 기반하고, 모든 면역글로불린 v-도메인에 대한 명명법을 통일하는 것을 목표로 한다.
Aho CDR 정의를 사용하여 상기에 정의된 항체 분자 또는 항원-결합 부분은 대안으로서 다음과 같이 통일된 정의를 사용하여 정의될 수 있다:
상기 HCDR1은 하기 순서로 아미노산 서열을 포함하고: G-F-S-L-S-T-S/F-G-Y-G-V-G (서열번호: 25);
상기 HCDR2는 하기 순서로 아미노산 서열을 포함하며: L-A-H-I-W-W-D-D-D-K-Y-Y-V-D-S-V-K-G (서열번호: 26);
상기 HCDR3은 하기 순서로 아미노산 서열을 포함한다: T-R-Q/L/V-Y-F-P-F-A-Y (서열번호: 27).
본 발명의 이러한 양상에서, 상기 항체 분자 또는 그의 항원-결합 부분은 하기를 갖는 경쇄 가변 영역을 포함할 수 있다:
하기 순서로 아미노산 서열을 갖는 LCDR1: A-S-Q-N/S-V-G-T/S-N (서열번호: 16);
하기 순서로 아미노산 서열을 갖는 LCDR2: S/Y-A-S-Y/N-R-Y-S/T (서열번호: 17); 및
하기 순서로 아미노산 서열을 갖는 LCDR3: Y-S-T/N-D-P-L (서열번호: 18).
다시, 상기 CDR 서열은 AHo 정의를 사용하여 정의된다. 대안으로서, 통일된 정의를 사용하여, 상기 항체 분자 또는 그의 항원-결합 부분은 경쇄 가변 영역을 포함할 수 있고, 여기서:
상기 LCDR1은 하기 순서로 아미노산 서열을 포함하고: R-A-S-Q-N/S-V-G-T/S-N-L-A (서열번호: 28);
상기 LCDR2는 하기 순서로 아미노산 서열을 포함하며: S/Y-A-S-Y/N-R-Y-S/T (서열번호: 17);
상기 LCDR3은 하기 순서로 아미노산 서열을 포함한다: Q-Q-Y-S-T/N-D-P-L-T (서열번호: 173).
본 발명의 이러한 양상의 특정 구현예는 하기를 포함하는 항체 분자 또는 그의 항원-결합 부분을 포함한다:
(a) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 D_A6]; 또는
(b) 아미노산 서열 GFSLSTFGYGVG (서열번호: 35) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGTNLA (서열번호: 36) (LCDR1), YASYRYT (서열번호: 37) (LCDR2) 및 QQYSNDPLT (서열번호: 38) (LCDR3) [클론 G_G10]; 또는
(c) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRLYFPFAY (서열번호: 39) (HCDR3), RASQNVGSNLA (서열번호: 40) (LCDR1), SASNRYS (서열번호: 41) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 I_C2]; 또는
(d) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRVYFPFAY (서열번호: 42) (HCDR3), RASQNVGTNLA (서열번호: 43) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 H_B3]; 또는
(e) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASNRYT (서열번호: 44) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 A6.1].
상기에 정의된 클론 D_A6의 CDR 서열을 포함하는 항체 분자 또는 그의 항원-결합 부분은 본 발명의 구체적인 특정 구현예이다.
본 발명에 따른 항체 분자 또는 항원-결합 부분은 WO2006/105021에서 "HuN6C8-Agly"로 표지된 인간화 뮤린 항-GITR IgG 항체와 비교하여 향상된 GITR 활성화를 가질 수 있다.
알려져 있는 항체 HuN6C8-Agly는 Leap Therapeutics, Inc.에 의해 현재 개발된 항체 "TRX-518" (또는 "TRX518")과 동일한 것으로 이해된다. 상기 HuN6C8-Agly/TRX-518 항체는 WO2006/105021에 정의된 "서열번호: 53" (및 하기 표 2에서 "GITR-VH1" 서열에 해당함) 및 WO2006/105021에 정의된 "서열번호: 44" (및 하기 표 2에서 GITR-VL1 서열에 해당함)를 포함한다. 상기 HuN6C8-Agly/TRX-518 경쇄의 전체 서열은 WO2006/105021의 "서열번호: 58"로 정의되고, 상기 HuN6C8-Agly/TRX-518 중쇄의 전체 서열은 WO2006/105021의 "서열번호: 61"로 정의된다.
본원에서 사용되는 향상된 GITR 활성화는 예를 들어 하기 실시예 1에 개시되는 바와 같이, Promega GITR 생물학적분석 키트 (CS184006)에서 최대 신호 (RLU 값 또는 배수 활성화)를 나타내는 것으로 정의될 수 있고, 이는 항체 TRX-518에 대해 관찰된 것보다 적어도 1.5-배 더 높다.
본 발명에 따른 항체 분자 또는 항원-결합 부분은 항체 TRX-518과 비교하여 향상된 인 실리코 (in silico) 면역원성을 가질 수 있다.
인 실리코 면역원성은 예를 들어 하기 실시예 1에 개시되는 바와 같이, Lonza Epibase IS 시스템 (버전 3)을 사용하여 결정될 수 있다.
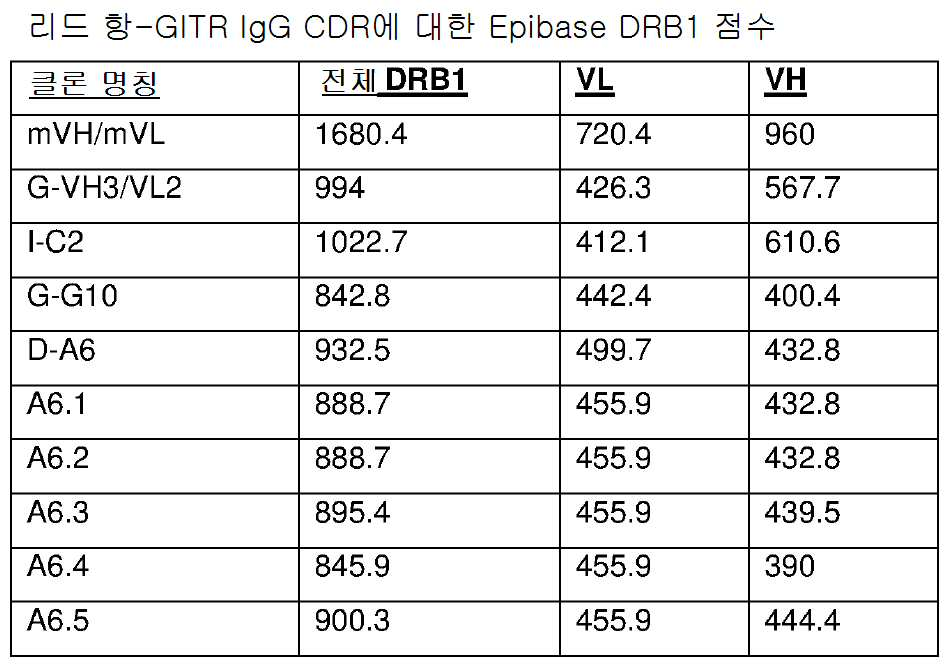
본 발명에 따른 항체 분자 또는 항원-결합 부분은 Lonza Epibase IS 시스템 (버전 3)에 의해 결정되는 바와 같이, 1600 미만, 예를 들어 1500 미만, 1100 미만, 또는 구체적으로 900 미만의 인 실리코 면역원성 전체 DRB1 점수를 가질 수 있다.
본 발명에 따른 항체 분자 또는 항원-결합 부분은 항체 TRX-518과 비교하여 시노몰구스 원숭이 GITR에 대해 향상된 친화도를 가질 수 있다. 친화도는 하기 실시예 1에 개시되는 바와 같이 SPR 분석을 사용하여 결정될 수 있다.
본 발명의 다른 특정 구현예에서, 상기 항체 분자 또는 그의 항원-결합 부분은 하기를 포함할 수 있다:
(a) 아미노산 서열 GFSLSTSGMGMS (서열번호: 61) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), NRRYFPFAY (서열번호: 45) (HCDR3), RASQNVGSNLA (서열번호: 40) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYSNDPLT (서열번호: 38) (LCDR3) [클론 C_B10]; 또는
(b) 아미노산 서열 GFSLSTSGYGVS (서열번호: 47) (HCDR1), LAHVWWDDEKYYVDSVKG (서열번호: 48) (HCDR2), NRRYFPFAY (서열번호: 45) (HCDR3), RASQSVGTNVA (서열번호: 49) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYNNWPLT (서열번호: 50) (LCDR3) [클론 C_D5]; 또는
(c) 아미노산 서열 GFSFSTSGYGVS (서열번호: 51) (HCDR1), LAHIWWDDEKYYVDSVKG (서열번호: 52) (HCDR2), NRRYFPFAY (서열번호: 45) (HCDR3), RASQNVGTNLA (서열번호: 43) (LCDR1), SASYRAS (서열번호: 53) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 C_F2]; 또는
(d) 아미노산 서열 GFSLSTSGMGVS (서열번호: 54) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), NRRYFPFAY (서열번호: 45) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 F_B11]; 또는
(e) 아미노산 서열 GFSFSTSGMGVS (서열번호: 56) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), NRRYFPFAY (서열번호: 45) (HCDR3), RASQSVGSNVA (서열번호: 57) (LCDR1), SASNRYT (서열번호: 44) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 F_B9]; 또는
(f) 아미노산 서열 GFSLSTSGMGMG (서열번호: 58) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), SRRYFPFAY (서열번호: 59) (HCDR3), RASQNVGSNLA (서열번호: 40) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 H_A3]; 또는
(g) 아미노산 서열 GFSLSTSSYGVS (서열번호: 60) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), TRLYFPFAY (서열번호: 39) (HCDR3), RASQSVGTNLA (서열번호: 36) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSNDPLT (서열번호: 38) (LCDR3) [클론 J_C5]; 또는
(h) 아미노산 서열 GFSLSTSGMGMS (서열번호: 61) (HCDR1), LAHIWWDDEKYYVDSVKG (서열번호: 52) (HCDR2), NRRYFPFAY (서열번호: 45) (HCDR3), RASQSVGTNVA (서열번호: 49) (LCDR1), SASYRAS (서열번호: 53) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 K_A12]; 또는
(i) 아미노산 서열 GFSLSTSGYGMS (서열번호: 62) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 MH]; 또는
(j) 아미노산 서열 GFSLSTSGMGMS (서열번호: 61) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 MH-1]; 또는
(k) 아미노산 서열 GFSLSTSGYGVS (서열번호: 47) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 MH-2]; 또는
(l) 아미노산 서열 GFSLSTSGYGMS (서열번호: 62) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQNVGSNLA (서열번호: 40) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 MH-3]; 또는
(m) 아미노산 서열 GFSLSTSGYGMS (서열번호: 62) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNVA (서열번호: 57) (LCDR1), SASYRAT (서열번호: 46) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 MH-4]; 또는
(n) 아미노산 서열 GFSLSTSGYGMS (서열번호: 62) (HCDR1), VAHIWWDDEKYYVDSVKG (서열번호: 55) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 MH-5]; 또는
(o) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASNRYT (서열번호: 44) (LCDR2) 및 QQYSTNPLT (서열번호: 63) (LCDR3) [클론 A6.2]; 또는
(p) 아미노산 서열 GFSLSTSGYGVS (서열번호: 47) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASNRYT (서열번호: 44) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 A6.3]; 또는
(q) 아미노산 서열 GFSLSTSGYGMS (서열번호: 62) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASNRYT (서열번호: 44) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 A6.4]; 또는
(r) 아미노산 서열 GFSLSTSGYGMG (서열번호: 64) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASNRYT (서열번호: 44) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 A6.5].
본 발명의 다른 특정 구현예에서, 상기 항체 분자 또는 그의 항원-결합 부분은 하기 표 3 및 4에서 확인된 추가의 개별 클론에 대해 언급된 HCDR1-3 및 LCDR1-3 서열을 포함할 수 있다.
특정 클론이 그의 이름에 밑줄을 포함하는 경우, 밑줄은 동일한 클론에 있어서 하이픈 (hyphen)으로 대체될 수 있다. 예를 들어, 명칭 "D_A6" 및 "D-A6"은 동일한 클론을 나타내며, 이러한 명칭은 본원에서 상호교환 가능하게 사용된다.
본원에 정의된 항체 분자 또는 항원-결합 부분은 번역후 변형 (post-translational modification: PTM) 부위, 예를 들어 글리코실화 부위 (N-연결되거나 또는 O-연결된), 탈아미드화 부위, 인산화 부위 또는 이성질체화/단편화 부위를 제거하는 하나 이상의 치환, 결실 및/또는 삽입을 포함할 수 있다.
350개 이상의 PTM 타입이 알려져 있다. PTM의 주요 형태는 인산화, 글리코실화 (N- 및 O-연결된), 수모일화 (sumoylation), 팔미토일화 (palmitoylation), 아세틸화, 술페이트화 (sulfation), 미리스토일화 (myristoylation), 프레닐화 (prenylation) 및 (K 및 R 잔기의) 메틸화를 포함한다. 특정 PTM을 담당하는 추정 아미노산 부위를 확인하는 통계적 방법은 당 분야에 잘 알려져 있다 (Zhou et al., 2016, Nature Protocols 1: 1318-1321 참조). 이러한 부위를 예를 들어 치환, 결실 및/또는 삽입에 의해 제거하고, 그 다음에 선택적으로 (a) 결합 활성 및/또는 (b) PTM의 손실에 대한 (실험적 및/또는 이론적) 테스트가 고려되었다.
예를 들어, 상기 6C8 뮤린 LCDR1 (본원에 정의된 바와 같음, 즉 아미노산 서열 KASQNVGTNVA (서열번호: 13))은 잔기 8 (T)에서 추정 O-연결 글리코실화 부위를 갖는 것으로 확인되었다. 이러한 부위는 예를 들어 (예컨대 S, A 또는 N으로의) 보존적 치환에 의해 제거되는 것이 예상된다 (예를 들어 클론 D_A6 및 표 3 및 4에서 다른 클론).
유사하게, 상기 6C8 뮤린 LCDR3 (본원에 정의된 바와 같음, 즉 아미노산 서열 QQYNTDPLT (서열번호: 15))은 잔기 4 (N)에서 추정 탈아미드화 부위를 갖는 것으로 확인되었다. 이러한 부위는 예를 들어 (예컨대 S, H, D, T, K, G, E, Q 또는 R로의) 보존적 치환에 의해 제거되는 것이 예상된다 (예를 들어 클론 D_A6 및 표 3 및 4에서 다른 클론).
또한 예로서, 상기 6C8 뮤린 HCDR1 (본원에 정의된 바와 같음, 즉 아미노산 서열 GFSLSTSGMGVG (서열번호: 4))은 잔기 9 (M)에서 추정 산화 부위를 갖는 것으로 확인되었다. 이러한 부위는 예를 들어 임의의 아미노산 (예컨대 Y, F, L 또는 W)으로의 치환에 의해 제거되는 것이 예상된다 (예를 들어 클론 D_A6 및 표 3 및 4에서 다른 클론).
상기 항체 분자 또는 그의 항원-결합 부분은 인간, 인간화 또는 키메라일 수 있다.
상기 항체 분자 또는 그의 항원-결합 부분은 CDR이 삽입된 하나 이상의 인간 가변 도메인 프레임워크 스캐폴드 (scaffolds)를 포함할 수 있다.
상기 항체 분자 또는 그의 항원-결합 부분은 상응하는 HCDR 서열이 삽입된 IGHV3-7 인간 생식세포 스캐폴드를 포함할 수 있다.
상기 항체 분자 또는 그의 항원-결합 부분은 상응하는 LCDR 서열이 삽입된 IGKV3-11 인간 생식세포 스캐폴드를 포함할 수 있다.
상기 항체 분자 또는 그의 항원-결합 부분은 면역학적으로 불활성인 불변 영역을 포함할 수 있다.
상기 항체 분자 또는 그의 항원-결합 부분은 Fab 단편, F(ab)2 단편, Fv 단편, 4량체 항체, 4가 항체, 다가특이적 항체 (예를 들어, 2가 항체), 도메인-특이적 항체, 단일 도메인 항체, 모노클로날 항체 또는 융합 단백질일 수 있다. 항체 분자 및 그의 제조 및 사용 방법은 예를 들어 Holliger & Hudson (2005, Nature Biotechnol. 23(9): 1126-1136)에 개시되어 있다.
본 발명의 다른 양상에서, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분이 치료제에 연결되어 있는 면역접합체를 제공한다.
적합한 치료제의 예로는 세포독소, 방사성동위원소, 화학요법제, 면역조절제, 항-혈관형성제, 항증식제 (antiproliferative agents), 전-세포사멸제 (pro-apoptotic agents), 및 세포증식억제 (cytostatic) 및 세포용해 (cytolytic) 효소 (예를 들어 RNAses)를 포함한다. 추가의 치료제로는 치료용 핵산, 예컨대 면역조절제, 항-혈관형성제, 항-증식제 또는 전-세포사멸제를 코딩하는 유전자를 포함한다. 이러한 약물 서술어는 상호 배타적이지 않으며, 그러므로 치료제는 하나 이상의 상기 용어를 사용하여 기재될 수 있다.
면역접합체에 사용하기에 적합한 치료제의 예로는 탁산 (taxanes), 마이탄신 (maytansines), CC-1065 및 듀오카르마이신 (duocarmycins), 칼리케아미신 (calicheamicins) 및 다른 엔디인 (enediynes), 및 아우리스타틴 (auristatins)을 포함한다. 다른 예로는 항-폴레이트 (anti-folates), 빈카 알칼로이드 (vinca alkaloids), 및 안트라사이클린 (anthracyclines)을 포함한다. 식물 독소, 다른 생체활성 단백질, 효소 (즉, ADEPT), 방사성동위원소, 감광제가 또한 면역접합체에 사용될 수 있다. 또한, 접합체는 리포좀 또는 폴리머와 같은 세포독성제로서 2차 담체를 사용하여 제조될 수 있다. 적합한 세포독소는 세포의 기능을 저해 또는 방해 및/또는 세포의 파괴를 초래하는 작용제를 포함한다. 대표적인 세포독소는 항생제, 튜불린 (tubulin) 중합화 저해제, DNA에 결합하여 파괴되는 알킬화제, 및 단백질 합성 또는 필수 세포 단백질의 기능을 방해하는 작용제 예컨대 단백질 키나제, 포스파타제, 토포이소머라제, 효소 및 사이클린을 포함한다.
대표적인 세포독소는 이에 한정되는 것은 아니지만, 독소루비신 (doxorubicin), 다우노루비신 (daunorubicin), 이다루비신 (idarubicin), 아클라루비신 (aclarubicin), 조루비신 (zorubicin), 미톡산트론 (mitoxantrone), 에피루비신 (epirubicin), 카루비신 (carubicin), 노갈라마이신 (nogalamycin), 메노가릴 (menogaril), 피타루비신 (pitarubicin), 발루비신 (valrubicin), 시타라빈 (cytarabine), 겜시타빈 (gemcitabine), 트리플루리딘 (trifluridine), 안시타빈 (ancitabine), 에노시타빈 (enocitabine), 아자시티딘 (azacitidine), 독시플루딘 (doxifluhdine), 펜토스타틴 (pentostatin), 브록수딘 (broxuhdine), 카페시타빈 (capecitabine), 클라드빈 (cladhbine), 데시타빈 (decitabine), 플록수딘 (floxuhdine), 플루다라빈 (fludarabine), 고제로틴 (gougerotin), 푸로마이신 (puromycin), 테가푸르 (tegafur), 티아조푼 (tiazofuhn), 아다마이신 (adhamycin), 시스플라틴 (cisplatin), 카르보플라틴 (carboplatin), 시클로포스파미드 (cyclophosphamide), 다카르바진 (dacarbazine), 빈블라스틴 (vinblastine), 빈크리스틴 (vincristine), 미톡산트론 (mitoxantrone), 블레오마이신 (bleomycin), 메클로레타민 (mechlorethamine), 프레드니손 (prednisone), 프로카르바진 (procarbazine), 메토트렉세이트 (methotrexate), 플루로우라실 (flurouracils), 에토포시드 (etoposide), 탁솔 (taxol), 탁솔 유사체, 플라틴 (platins) 예컨대 시스-플라틴 및 카르보-플라틴, 미토마이신 (mitomycin), 티오테파 (thiotepa), 탁산, 빈크리스틴 (vincristine), 다우노루비신, 에피루비신, 악티노마이신 (actinomycin), 안트라마이신 (authramycin), 아자세린 (azaserines), 블레오마이신, 타목시펜 (tamoxifen), 이다루비신, 돌라스타틴 (dolastatins)/아우리스타틴, 헤미아스테를린 (hemiasterlins), 에스페라미신 (esperamicins) 및 마이탄시노이드 (maytansinoids)를 포함한다.
적합한 면역조절제는 종양에서 호르몬 작용을 차단하는 항-호르몬 및 시토킨 생산을 억제하고, 자기-항원 발현을 하향-조절하거나, 또는 MHC 항원을 차단하는 면역억제제를 포함한다.
또한, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분을 코딩하는 핵산 분자를 제공한다.
본원에 정의된 본 발명의 핵산 분자를 포함하는 벡터를 추가로 제공한다.
또한, 본원에 정의된 본 발명의 핵산 분자 또는 벡터를 포함하는 숙주 세포를 제공한다.
추가적 양상에서, 항-GITR 항체 및/또는 그의 항원-결합 부분을 제조하는 방법을 제공하며, 상기 방법은 본 발명의 숙주 세포를 상기 항체 및/또는 그의 항원-결합 부분의 발현 및/또는 생산을 유도하는 조건하에 배양하는 단계, 및 상기 항체 및/또는 그의 항원-결합 부분을 상기 숙주 세포 또는 배양물로부터 단리하는 단계를 포함한다.
본 발명의 다른 양상에서, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터를 포함하는 약학적 조성물을 제공한다.
피험체에서 면역 반응을 증강시키는 방법을 추가로 제공하며, 상기 방법은 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물의 유효한 양을 투여하는 단계를 포함한다.
추가적 양상에서, 피험체에서 암을 치료 또는 예방하는 방법을 제공하며, 상기 방법은 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물의 유효한 양을 투여하는 단계를 포함한다.
상기 암은 예를 들어 하기로 구성된 그룹으로부터 선택될 수 있다: 췌장암, 흑색종, 유방암, 폐암, 기관지암, 결장직장암, 전립선암, 위암, 난소암, 방광암 (urinary bladder cancer), 뇌 또는 중추 신경계 암, 말초 신경계 암, 식도암, 자궁경부암, 자궁 또는 자궁내막 암, 구강 또는 인두 암, 간암, 신장암, 고환암, 담도암, 소장 또는 충수 암, 침샘암, 갑상선암, 부신암 (adrenal gland cancer), 골육종, 연골육종, 및 혈액 조직 (hematological tissue) 암.
본 발명은 또한 암 치료에 사용하기 위한, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물을 제공한다.
다른 양상에서, 본 발명은 제2 치료제, 예를 들어 항암제와 조합된 조합 형태로 개별적으로, 순차적으로 또는 동시에 사용하기 위한, 본원에 정의된 본 발명의 항체 분자, 또는 그의 항원-결합 부분, 또는 면역접합체, 또는 핵산 분자, 또는 벡터, 또는 치료 방법을 제공한다.
추가적 양상에서, 암 치료용 약제의 제조에서, 본원에 정의된 본 발명의 항체 분자 또는 그의 항원-결합 부분, 또는 본원에 정의된 본 발명의 면역접합체, 또는 본원에 정의된 본 발명의 핵산 분자, 또는 본원에 정의된 본 발명의 벡터, 또는 본원에 정의된 본 발명의 약학적 조성물의 용도를 제공한다.
본 발명의 약학적 조성물은 약학적으로 허용가능한 부형제를 포함할 수 있다. 약학적으로 허용가능한 부형제는 부차적 반응을 유발하지 않고, 또한 예를 들어 항-GITR 항체 분자 투여를 촉진하거나, 체내 그의 수명 및/또는 그의 효능을 증가시키거나 또는 용액 중 그의 용해도를 증가시키는, 약학적 조성물로 진입하는 화합물 또는 화합물들의 조합일 수 있다. 이러한 약학적으로 허용가능한 비히클은 잘 알려져 있고, 또한 항-GITR 항체 분자의 투여 형태의 기능으로서 당업자에 의해 조정될 것이다.
일부 구현예에서, 상기 항-GITR 항체 분자는 투여 전에 재구성을 위한 동결건조된 형태로 제공될 수 있다. 예를 들어, 동결건조된 항체 분자는 개체에게 투여하기 전에 멸균수에서 재구성되고, 식염수와 혼합될 수 있다.
상기 항-GITR 항체 분자는 통상적으로 약학적 조성물의 형태로 투여될 것이며, 이는 항체 분자 이외에 적어도 하나의 성분을 포함할 수 있다. 그러므로 약학적 조성물은 항-GITR 항체 분자 이외에, 약학적으로 허용가능한 부형제, 담체, 버퍼, 안정화제 또는 당업자에게 잘 알려져 있는 다른 물질을 포함할 수 있다. 이러한 물질은 비독성이어야 하고, 상기 항-GITR 항체 분자의 효능을 방해하지 않아야 한다. 상기 담체 또는 다른 물질의 정확한 특성은 투여 경로에 의존할 것이며, 이는 하기에서 논의되는 바와 같이 볼루스 (bolus), 인퓨젼 (infusion), 주사 또는 임의의 다른 적합한 경로일 수 있다.
비경구 투여, 예를 들어 주사에 의한 피하 또는 정맥내 투여에 있어서, 상기 항-GITR 항체 분자를 포함하는 약학적 조성물은 발열원 (pyrogen)이 없고, 적합한 pH, 등장성 및 안정성을 갖는 비경구적으로 허용가능한 수용액의 형태일 수 있다. 당 분야의 관련된 기술로 예를 들어, 염화나트륨 주사제, 링커 주사제 (Ringe's Injection), 락테이트된 링거 주사제 (Lactated Ringer's Injection)와 같은 등장성 비히클을 사용하여 적합한 용액을 잘 제조할 수 있다. 보존제, 안정화제, 버퍼, 산화방지제 및/또는 다른 첨가제는 필요에 따라 사용될 수 있고, 버퍼 예컨대 포스페이트, 시트레이트 및 다른 유기 산; 산화방지제, 예컨대 아스코르브산 및 메티오닌; 보존제 (예컨대 옥타데실디메틸벤질 암모늄 클로리드; 헥사메토늄 클로리드; 벤잘코늄 클로리드; 벤제토늄 클로리드; 페놀, 부틸 또는 벤질 알콜; 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 시클로헥산올; 3'-펜탄올; 및 m-크레졸); 저분자량 폴리펩티드; 단백질, 예컨대 혈청 알부민, 젤라틴 또는 면역글로불린; 친수성 폴리머, 예컨대 폴리비닐피롤리돈; 아미노산, 예컨대 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌, 또는 리신; 모노사카리드, 디사카리드 및 글루코스, 만노스 또는 덱스트린을 포함하는 다른 탄수화물; 킬레이트제, 예컨대 EDTA; 당, 예컨대 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염-형성 반대 이온, 예컨대 나트륨; 금속 복합체 (예: Zn-단백질 복합체); 및/또는 비-이온성 계면활성제, 예컨대 TWEENTM, PLURONICSTM 또는 폴리에틸렌 글리콜 (PEG)을 포함한다.
항-GITR 항체 분자를 포함하는 약학적 조성물은 치료될 병태에 따라 단독으로 또는 다른 치료와 조합하여 동시에 또는 순차적으로 투여될 수 있다.
본원에 개시된 항-GITR 항체 분자는 인간 또는 동물에서, 예방적 또는 방지적 치료 (예: 개체에서 병태 발생 위험을 감소시키거나; 그의 발병을 지연시키거나; 또는 발병 후에 그의 중증도를 감소시키기 위해 개체에서 병태가 발병하기 전의 치료)를 포함하는 치료 방법에 사용될 수 있다. 상기 치료 방법은 상기 항-GITR 항체 분자를 이를 필요로 하는 개체에게 투여하는 단계를 포함할 수 있다.
투여는 통상 "치료적으로 유효한 양"으로 수행되고, 이는 환자에게 유익을 보여주기에 충분한 것이다. 이러한 유익으로는 적어도 하나의 증상의 최소한의 개선일 수 있다. 투여되는 실제 양, 투여 속도 및 시간 경로는 치료되는 질병의 특성 및 중증도, 치료되는 특정 포유동물, 개별 환자의 임상적 상태, 질병의 원인, 조성물 전달 부위, 투여 방법, 투여 일정 및 전문의에게 알려져 있는 다른 요인에 의존할 것이다. 투여량 결정 등과 같은 치료 처방은 일반 의사 및 다른 의학 박사의 책임 범위내에 있고, 증상의 중증도 및/또는 치료되는 질환의 진행에 따라 달라질 수 있다. 항체 분자의 적합한 투여량은 당 분야에 잘 알려져 있다 (Ledermann J.A. et al., 1991, Int. J. Cancer 47: 659-664; Bagshawe K.D. et al., 1991, Antibody, Immunoconjugates and Radiopharmaceuticals 4: 915-922). 구체적인 투여량은 본원에서 또는 Physician's Desk Reference (2003)에서 투여되는 약제의 형태에 적절하게 표시될 수 있다. 항체 분자의 치료적으로 유효한 양 또는 적절한 용량은 동물 모델에서 그의 인 비트로 활성과 인 비보 활성을 비교하여 결정될 수 있다. 마우스 및 다른 시험 동물에서 유효한 투여량을 인간에게 외삽하는 방법이 알려져 있다. 상기 항체가 예방용 또는 치료용인지 여부, 치료되는 부위의 크기 및 위치, 항체의 정확한 특성 (예: 전체 항체, 단편) 및 항체에 부착된 임의의 검출가능한 표지 또는 다른 분자의 특성을 포함하는 다수의 요인에 따라 정확한 투여량이 달라질 것이다.
통상적인 항체 투여량은 전신 적용을 위해 100 μg 내지 1 g의 범위 및 국소 적용을 위해 1 μg 내지 1 mg의 범위일 것이다. 처음에 보다 높은 로딩 용량, 그 다음에 하나 이상의 보다 낮은 용량들이 투여될 수 있다. 전형적으로, 상기 항체는 전체 항체, 예컨대 IgG1 또는 IgG4 이소타입일 것이다. 이는 성인 환자의 단회 치료를 위한 투여량이며, 이는 어린이 및 유아에 대해 비례적으로 조정될 수 있고, 또한 분자량에 비례하여 다른 항체 형식에 맞게 조정될 수 있다. 치료는 의사의 판단에 따라, 매일, 주 2회, 매주 또는 매달 간격으로 반복될 수 있다. 개체에 대한 치료 일정은 항체 조성물의 약동학적 및 약역학적 특성, 투여 경로 및 치료되는 병태의 특성에 따라 달라질 수 있다.
치료는 주기적일 수 있고, 투여 사이의 기간은 약 2주 이상, 예컨대 약 3주 이상, 약 4주 이상, 한달에 약 1회 이상, 약 5주 이상, 또는 약 6주 이상일 수 있다. 예를 들어, 치료는 2주 내지 4주 마다 또는 4주 내지 8주마다 수행될 수 있다. 치료는 수술 전 및/또는 후에 제공될 수 있고, 및/또는 외과적 치료 또는 침습 절차의 해부학적 부위에 직접 투여 또는 적용될 수 있다. 적합한 제형 및 투여 경로는 상기에 개시되어 있다.
일부 구현예에서, 본원에 개시된 항-GITR 항체 분자는 피하 주사로 투여될 수 있다. 피하 주사는 예를 들어 장기간 예방/치료를 위해 오토-인젝터 (auto-injector)를 사용하여 투여될 수 있다.
일부 바람직한 구현예에서, 상기 항-GITR 항체 분자의 치료적 효과는 용량에 따라 수 반감기 동안 지속될 수 있다. 예를 들어, 상기 항-GITR 항체 분자의 단회 용량의 치료적 효과는 개체에서 1 개월 이상, 2 개월 이상, 3 개월 이상, 4 개월 이상, 5 개월 이상, 또는 6 개월 이상 동안 지속될 수 있다.
본 발명은 또한 인간 GITR 및 선택적으로 또한 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 생산하는 방법을 제공하며, 상기 방법은 하기 단계를 포함한다:
(1) 비-인간 출처 유래의 항-GITR CDR을 인간 v-도메인 프레임워크에 이식하여 인간화 항-GITR 항체 분자 또는 그의 항원-결합 부분을 생산하는 단계;
(2) 상기 CDR에서 하나 이상의 돌연변이를 포함하는 인간화 항-GITR 항체 분자 또는 그의 항원-결합 부분의 클론의 파지 라이브러리를 생성하는 단계;
(3) 인간 GITR 및 선택적으로 또한 시노몰구스 원숭이 GITR로의 결합에 대해 상기 파지 라이브러리를 스크리닝하는 단계;
(4) 상기 스크리닝 단계 (3)로부터 인간 GITR 및 선택적으로 또한 시노몰구스 원숭이 GITR에 대해 결합 특이성을 갖는 클론을 선택하는 단계; 및
(5) 상기 단계 (4)로부터 선택된 클론으로부터 인간 GITR 및 선택적으로 또한 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 생산하는 단계.
상기 방법에 적용가능한 정제 (refinement)는 하기 실시예 1에 개시된 바와 같다.
본원에서 사용되는, 용어 "글루코코르티코이드-유도 TNF 수용체" 및 "GITR"은 글루코코르티코이드-유도 TNF 수용체 및 GITR의 생물학적 활성의 적어도 일부를 보유하는 그의 변이체를 나타낸다. 본원에서 사용되는, GITR은 인간, 래트, 마우스 및 닭을 포함하는 네이티브 서열 GITR의 모든 포유동물 종을 포함한다. 용어 "GITR"은 인간 GITR의 변이체, 이소형태 및 종 상동체를 포함하는데 사용된다. 본 발명의 항체는 인간 이외의 종 유래의 GITR, 구체적으로 시노몰구스 원숭이 (마카카 파시쿨라리스) 유래의 GITR과 교차 반응할 수 있다. 소정의 구현예에서, 상기 항체는 인간 GITR에 대해 완전히 특이적일 수 있고, 비-인간 교차-반응성을 나타내지 않을 수 있다.
본원에서 사용되는, 본 발명의 항체의 문맥에서 사용되는 "길항제" 또는 "항-GITR 길항제 항체" (용어 "항-GITR 항체"와 상호교환 가능하게 사용됨)는 GITR에 결합할 수 있고, 또한 GITR 생물학적 활성 및/또는 GITR 신호전달에 의해 매개된 하류 경로(들)를 저해할 수 있는 항체를 나타낸다. 항-GITR 길항제 항체는, GITR 신호전달에 의해 매개된 하류 경로를 포함하는 GITR 생물학적 활성, 예컨대 GITR에 대한 수용체 결합 및/또는 세포 반응의 유발을 (유의한 정도로) 차단, 길항, 억제 또는 감소시킬 수 있는 항체를 포함한다. 본 발명의 목적을 위해, 용어 "항- GITR 길항제 항체"는 GITR 자체, 및 GITR 생물학적 활성 (이에 한정되는 것은 아니지만 Teff의 활성화를 증강시키고, Treg의 활성을 감소시키는 그의 역량을 포함), 또는 활성 또는 생물학적 활성의 결과가 실질적으로 무의미해지거나, 임의의 의미있는 정도로 감소 또는 중화되는 모든 용어, 표제, 및 기능적 상태 및 특성을 포함하는 것으로 명백하게 이해될 것이다.
GITR이 다른 수용체에 결합하는 것보다 더 큰 친화도, 결합력 (avidity), 보다 용이하고 및/또는 보다 긴 지속시간으로 결합하는 경우, GITR과 "특이적으로 결합", "특이적으로 상호작용", "우선적으로 결합, "결합" 또는 "상호작용"한다.
"항체 분자"는 면역글로불린 분자의 가변 영역에 위치한, 적어도 하나의 항원 인식 부위를 통해, 탄수화물, 폴리뉴클레오티드, 지질, 폴리펩티드 등과 같은 표적에 특이적으로 결합할 수 있는 면역글로불린 분자이다. 본원에서 사용되는, 용어 "항체 분자"는 온전한 폴리클로날 또는 모노클로날 항체뿐만 아니라 임의의 항원 결합 단편 (예를 들어, "항원-결합 부분") 또는 그의 단일 사슬, 항체를 포함하는 융합 단백질, 및 예를 들어 한정되지 않고, scFv, 단일 도메인 항체 (예를 들어, 샤크 (shark) 및 카멜리드 (camelid) 항체), 막시바디 (maxibodies), 미니바디 (minibodies), 인트라바디 (intrabodies), 디아바디 (diabodies), 트리아바디 (triabodies), 테트라바디 (tetrabodies), v-NAR 및 비스-scFv를 포함하는 항원 인식 부위를 포함하는 면역글로불린 분자의 임의의 다른 변형된 입체형태를 포함한다.
"항체 분자"는 임의의 부류의 항체, 예컨대 IgG, IgA, 또는 IgM (또는 그의 하위 부류)를 포함하고, 상기 항체는 임의의 특정 부류를 가질 필요는 없다. 그의 중쇄의 불변 영역의 항체 아미노산 서열에 따라, 면역글로불린은 상이한 부류로 지정될 수 있다. 면역글로불린은 5개의 주요 부류가 있으며: IgA, IgD, IgE, IgG 및 IgM, 또한 이중 몇 개는 하위부류 (이소타입), 예를 들어 lgG1, lgG2, lgG3, lgG4, lgA1 및 lgA2로 더 세분화될 수 있다. 면역글로불린의 상이한 부류에 상응하는 중쇄 불변 영역은 각각 알파, 델타, 엡실론, 감마 및 뮤로 불린다. 면역글로불린의 상이한 부류의 서브유닛 구조 및 3차원 입체형태는 잘 알려져 있다.
본원에서 사용되는 용어 항체 분자의 "항원 결합 부분"은 GITR에 특이적으로 결합하는 역량을 보유하는 온전한 항체의 하나 이상의 단편을 나타낸다. 항체 분자의 항원 결합 기능은 온전한 항체의 단편에 의해 수행될 수 있다. 항체 분자의 용어 "항원 결합 부분" 내에 포함되는 결합 단편의 예로는 Fab; Fab'; F(ab')2; VH 및 CH1 도메인으로 구성되는 Fd 단편; 항체의 단일 암 (arm)의 VL 및 VH 도메인으로 구성되는 Fv 단편; 단일 도메인 항체 (dAb) 단편, 및 단리된 상보적 결정 영역 (CDR)을 포함한다.
용어 "Fc 영역"은 면역글로불린 중쇄의 C-말단 영역을 정의하는데 사용된다. 상기 "Fc 영역"은 네이티브 서열 Fc 영역 또는 변이체 Fc 영역일 수 있다. 면역글로불린 중쇄의 Fc 영역의 경계는 가변할 수 있지만, 인간 IgG 중쇄 Fc 영역은 통상적으로 위치 Cys226 또는 Pro230에서 아미노산 잔기로부터 그의 카르복실-말단까지의 신장 (stretch)으로 정의된다. 상기 Fc 영역에서 잔기의 넘버링은 Kabat에서와 같이 EU index의 넘버링이다. 면역글로불린의 Fc 영역은 일반적으로 2개의 불변 도메인인, CH2 및 CH3을 포함한다. 당 분야에 알려져 있는 바와 같이, Fc 영역은 이량체 또는 단량체 형태로 존재할 수 있다.
항체의 "가변 영역"은 단독으로 또는 조합하여, 항체 경쇄의 가변 영역 또는 항체 중쇄의 가변 영역을 나타낸다. 당 분야에 알려져 있는 바와 같이, 중쇄 및 경쇄의 가변 영역 각각은 초가변 영역으로 알려져 있는 3개의 상보적 결정 영역 (CDR)에 의해 연결된 4개의 프레임워크 영역 (FRs)으로 구성되고, 항체의 항원 결합 부위의 형성에 기여한다. CDR을 플랭크 (flank)하기 위해 FR을 선택하는 경우, 예를 들어 항체를 인간화 또는 최적화하는 경우, 동일한 표준 부류의 CDR 서열을 포함하는 항체 유래의 FR이 바람직하다. 그럼에도 불구하고, 이러한 FR은 필요하다면 그의 길이를 증가시키거나 또는 단축시키는 것을 포함하는, 예를 들어 돌연변이화 또는 결실에 의해 변형될 수 있다.
본 출원에서 사용된 "통일된" CDR 정의는 현장에서 형성되는 많은 상이하고 종종 상충되는 방식으로 사용되는 도메인들을 조합하고, 이는 단리 및 항원과의 그의 공-결정에서 면역글로불린 레퍼토리 분석 및 항체의 구조 분석의 조합에 기반한다 (review by Swindells et al., 2016, abYsis: Integrated Antibody Sequence and Structure-Management, Analysis, and Prediction. J Mol Biol. [PMID: 27561707; Epub 22 August 2016] 참조). 본원에서 사용되는 CDR 정의 ("통일된" 정의 또는 "본 출원의 정의"로 지칭될 때)는 이러한 이전의 모든 통찰을 포함하고, 표적-결합 상보성을 잠재적으로 매개하는 전체 잔기 랜드스케이프를 샘플링하는데 필요한 모든 적절한 루프 위치를 포함한다.
하기 표 1은 동일한 CDR을 정의하기 위해 잘-알려져 있는 대체 시스템과 비교하여, "통일된" 정의에 따라 본원에서 정의되는 바와 같이 6C8 뮤린 항-GITR 항체 CDR의 아미노산 서열을 나타낸다. 본 발명의 항체 분자 또는 그의 항원-결합 부분은 하기 표 1에 개시된 임의의 CDR 정의를 사용하여 정의될 수 있다.
참고 목적으로, 6C8 뮤린 항-GITR 항체 중쇄 및 경쇄 가변 영역 (WO2016/105021에 개시된 바와 같음)에 대한 전체 고전적인 Kabat 넘버링은 하기와 같다.
가변 중쇄:
가변 경쇄:
본원에서 사용되는 용어 "보존적 치환"은 아미노산을 기능적 활성을 유의하게 유해하게 변경하지 않는 다른 아미노산으로 대체하는 것을 나타낸다. "보존적 치환"의 바람직한 예로는 하나의 아미노산을 하기 BLOSUM 62 치환 매트릭스에서 값이 ≥0인 다른 아미노산으로 대체하는 것이다 (Henikoff & Henikoff, 1992, PNAS 89: 10915-10919 참조):
용어 "모노클로날 항체" (Mab)는 예를 들어 임의의 진핵생물, 원핵생물, 또는 파지 클론을 포함하는 단일 카피 또는 클론으로부터 유래되지만, 생산되는 방법에 의해 유래되는 것은 아닌 항체 또는 그의 항원-결합 부분을 나타낸다. 바람직하게, 본 발명의 모노클로날 항체는 동종 또는 실질적으로 동종 개체군에 존재한다.
"인간화" 항체 분자는 비-인간 (예를 들어, 뮤린) 항체 분자, 또는 그의 항원-결합 부분의 형태를 나타내고, 이는 비-인간 면역글로불린으로부터 유래된 최소 서열을 포함하는 키메라 면역글로불린, 면역글로불린 사슬, 또는 그의 단편 (예컨대 Fv, Fab, Fab', F(ab')2 또는 항체의 다른 항원-결합 부분서열)이다. 인간화 항체는 수용체의 CDR 유래의 잔기가 원하는 특이성, 친화도 및 역량 (capacity)을 갖는 비-인간 종 (공여체 항체) 예컨대 마우스, 래트, 또는 토끼의 CDR 유래의 잔기로 대체된 인간 면역글로불린 (수용체 항체)일 수 있다.
"인간 항체 또는 전체 인간 항체"는 인간 항체 유전자를 갖는 유전자이식 마우스 또는 인간 세포 유래의 항체 분자 또는 그의 항원-결합 부분을 나타낸다.
용어 "키메라 항체"는 가변 영역 서열이 하나의 종으로부터 유래되고, 불변 영역 서열은 다른 종으로부터 유래되는 항체 분자 또는 그의 항원-결합 부분, 예컨대 가변 영역 서열이 마우스 항체로부터 유래되고, 불변 영역 서열은 인간 항체로부터 유래되는 항체 분자를 나타낸다.
"항체-약물 접합체" 및 "면역접합체"는 GITR에 결합하고, 세포독성제, 세포증식억제제 및/또는 치료제에 접합된, 항체 유도체를 포함한, 항체 분자 또는 그의 항원-결합 부분을 나타낸다.
본 발명의 항체 분자 또는 그의 항원-결합 부분은 당 분야에 잘 알려져 있는 기술, 예를 들어 재조합 기술, 파지 디스플레이 기술 (phage display technologies), 합성 기술 또는 이러한 기술들의 조합 또는 당 분야에 용이하게 알려져 있는 다른 기술을 사용하여 생산될 수 있다.
용어 "에피토프"는 항체 분자의 항원-결합 영역 중 하나 이상에서, 항체 분자 또는 그의 항원-결합 부분에 의해 인식 및 결합될 수 있는 분자의 부분을 나타낸다. 에피토프는 1차, 2차 또는 3차 단백질 구조의 정의된 영역으로 구성될 수 있고, 항체 또는 그의 항원-결합 부분의 항원 결합 영역에 의해 인식된 표적의 2차 구조적 유닛 또는 구조적 도메인의 조합을 포함한다. 에피토프는 마찬가지로 아미노산 또는 당 곁사슬과 같은 분자의 정의된 화학적으로 활성인 표면 그룹화로 구성될 수 있으며, 특정 3차원 구조적 특성뿐만 아니라 특정 전하 특성을 갖는다. 본원에서 사용되는 용어 "항원성 에피토프"는 당 분야에 잘 알려져 있는 임의의 방법, 예를 들어 통상적인 면역분석, 항체 경쟁적 결합 분석 또는 x-선 결정학 또는 관련된 구조 결정 방법 (예를 들어 NMR)에 의해 결정되는 바와 같이 항체 분자가 특이적으로 결합할 수 있는 폴리펩티드의 부분으로서 정의된다.
용어 "결합 친화도" 또는 "KD"는 특정 항원-항체 상호작용의 해리 속도를 나타낸다. 상기 KD는 결합 속도 또는 "on-율 (on-rate) (kon)"에 대한 "off-율 (off-rate) (koff)"로 불리는 해리 속도의 비율이다. 그러므로 KD는 koff / kon과 같고, 몰 농도 (M)로 표시된다. KD가 작을수록, 결합 친화도는 강해진다. 그러므로, 1 μM의 KD는 1 nM의 KD와 비교하여 약한 결합 친화도를 나타낸다. 항체에 대한 KD 값은 당 분야에 잘 확립되어 있는 방법을 사용하여 결정될 수 있다. 항체의 KD를 결정하는 한가지 방법은 표면 플라스몬 공명 (surface plasmon resonance: SPR), 전형적으로 바이오센서 시스템 예컨대 Biacore® 시스템을 사용하는 것이다.
용어 "역가"는 생물학적 활성의 측정치이며, IC50, 또는 본원에 기재된 바와 같이 GITR 활성 분석에서 측정된 활성의 50%를 저해하기 위한 항원 GITR에 대한 항체 또는 항체 약물 접합체의 유효 농도로 나타낼 수 있다.
본원에서 사용되는 문구 "유효한 양" 또는 "치료적으로 유효한 양"은 원하는 치료 결과를 달성하기 위해 (투여량 및 기간 및 투여 수단에 대해) 필요한 양을 나타낸다. 유효한 양은 피험체에게 치료적 유익을 부여하는데 필요한 활성제의 적어도 최소 양으로, 독성 양보다는 적다.
본 발명의 항체 분자의 생체활성과 관련하여 본원에서 사용되는 용어 "저해" 또는 "중화"는 이에 한정되는 것은 아니지만, 항체 분자의 생물학적 활성 또는 GITR로의 결합 상호작용을 포함하는 저해되는 대상의 진행 또는 중증도를 예를 들어 항체가 실질적으로 길항, 금지, 방지, 억제, 지연, 방해, 제거, 정지, 감소 또는 역전시키는 능력을 의미한다.
"숙주 세포"는 폴리뉴클레오티드 삽입물의 혼입을 위한 벡터(들)의 수용자이거나 또는 수용자가 될 수 있는 개별 세포 또는 세포 배양물을 포함한다. 숙주 세포는 단일 숙주 세포의 자손을 포함하고, 상기 자손은 자연적, 우발적, 또는 의도적 돌연변이에 의해 원래 모체 세포와 반드시 (형태 또는 게놈 DNA 보체에서) 완전히 동일할 필요는 없다. 숙주 세포는 본 발명의 폴리뉴클레오티드(들)로 인 비보에서 형질감염된 세포를 포함한다.
본원에서 사용되는, "벡터"는 관심있는 하나 이상의 유전자(들) 또는 서열(들)을 숙주 세포에 전달, 바람직하게는 발현시킬 수 있는 구조체를 의미한다. 벡터의 예로는 이에 한정되는 것은 아니지만, 바이러스 벡터, 네이키드 (naked) DNA 또는 RNA 발현 벡터, 플라스미드, 코스미드 또는 파지 벡터, 양이온성 축합제와 결합된 DNA 또는 RNA 발현 벡터, 리포좀으로 캡슐화된 DNA 또는 RNA 발현 벡터, 및 소정의 진핵 세포, 예컨대 생산 세포를 포함한다.
본원에서 사용되는 용어 "치료하다"는 달리 지시하지 않는 한, 이러한 용어가 적용되는 질병 또는 병태, 또는 이러한 질병 또는 병태의 하나 이상의 증상을 역전, 완화, 이의 진행을 저해, 이의 진행을 지연, 이의 발병을 지연, 또는 예방하는 것을 의미한다. 본원에서 사용되는 용어 "치료"는 달리 지시하지 않는 한, 상기 정의된 바와 같은 치료 행위를 나타낸다. 용어 "치료하는"은 또한 피험체의 보강 및 신보강 (neoadjuvant) 치료를 포함한다. 의심을 피하기 위해, 본원에서 "치료"에 대한 언급은 치료적, 완화적 및 예방적 치료에 대한 언급을 포함한다. 의심을 피하기 위해, 본원에서 "치료"에 대한 언급은 치료적, 완화적 및 예방적 치료에 대한 언급을 포함한다.
본원에서 "포함하는"이라는 언어를 갖는 구현예가 기재되고, "구성되는" 및/또는 "필수적으로 구성되는"이라는 용어로 기재된 유사한 구현예가 또한 제공되는 것으로 이해된다.
본 발명의 양상 또는 구현예는 Markush 그룹 또는 다른 대체 그룹의 관점에서 기재되는 경우, 본 발명은 전체적으로 열거된 전체 그룹, 개별적으로 상기 그룹의 각 구성원 및 상기 주요 그룹의 모든 가능한 하위그룹뿐만 아니라 상기 그룹 구성원의 하나 이상이 부재한 주요 그룹을 포함한다. 본 발명은 또한 청구된 발명에서 그룹 구성원 중 하나 이상을 명시적으로 배제하는 것을 고려한다.
달리 정의하지 않는 한, 본원에서 사용되는 모든 기술 및 과학 용어는 본 발명이 속하는 기술 분야의 당업자에 의해 통상적으로 이해되는 것과 동일한 의미를 갖는다. 상충이 있는 경우, 정의를 포함하는 본 명세서가 우선할 것이다. 본 명세서 및 청구범위를 통해, 단어 "포함하다" 또는 파생어 예컨대 "포함한다" 또는 "포함하는"은 명시된 정수 또는 정수의 그룹을 포함할 뿐만 아니라 임의의 다른 정수 또는 정수의 그룹을 배제하지 않는 것으로 이해될 것이다. 문맥에서 달리 요구하지 않는 한, 단수 형태의 용어는 복수 형태를 포함할 것이며, 복수 형태의 용어는 단수 형태를 포함할 것이다. 용어 "예" 또는 "예를 들어" 다음에 나오는 임의의 예(들)는 완전하거나 또는 제한하는 것을 의미하지 않는다.
본 발명의 실시는 달리 지시하지 않는 한, 당 기술 분야에 속하는 분자 생물학 (재조합 기술 포함), 미생물학, 세포 생물학, 생화학 및 면역학의 통상의 기술을 이용할 것이다.
본 발명의 구체적인 비-제한적인 구현예는 첨부된 도면을 참조하여 기재될 것이다.
실시예
1. 최적화된 항-
GITR
치료용 항체의 생성
도입
본 실시예에서, 본 발명자는 효능이 있는 최적화된 항-GITR 항체의 패널을 성공적으로 생성하였다. 이러한 항-GITR 항체는 잘 발현되었고, 생물물리학적으로 안정하며, 가용성이 높았고, 바람직한 인간 생식세포에 대한 최대 동일성을 가졌다.
물질 및 방법
IgG
클로닝
, 일시적 발현, 정제
항체 v-도메인 코딩 DNA 서열을 개별 플라스미드 벡터 내에 개별 IgG 중쇄 및 경쇄 발현 카세트로 제한-결찰 클로닝을 통해 클로닝하였다. IgG는 제조자의 프로토콜에 따라 무-내독소 (endotoxin-free) IgG 발현 플라스미드 제제로 형질감염 후에 HEK-293expi 세포에서 일시적으로 발현되었다. IgG는 단일-단계 프로토콜을 사용하여 정제되었다: 조건화 배지를 PBS pH 7.4로 사전-평형화된 1 ml ProA 세파로스 (sepharose) 컬럼에 로딩되었다 (neat). 상기 컬럼을 5배 컬럼 부피의 PBS pH 7.4로 세척하였고, 그 후에 단백질을 100mM 글리신, pH 2.7로 용출시켰고, 30 kDa 커트오프 투석막을 사용하여 PBS pH 7.4에서 투석시켰다.
IgG
적정 결합 ELISA
Greiner Bio-One High bind ELISA 플레이트를 코팅하기 위해서, 표적 단백질을 카르보네이트 버퍼에서 1 μg/ml로 희석시켰고, 4℃, o/n에서 웰 당 100 μl로 첨가하였다. 코팅된 플레이트를 PBS pH7.4로 3회 세척하였고, 1시간 동안 RT에서 PBS 중 1% BSA (380 μl/웰)로 차단하였고, 그 다음에 PBS-Tween 20 (PBST)으로 3회 세척하였다. 그 다음에 GITR 항체 (100 μl/웰; PBST로 희석)를 첨가하였고, 그 후에 RT에서 1시간 동안 인큐베이트하였다. 그 다음에 플레이트를 PBST로 3회 세척하였고, 염소 항-인간 카파 사슬-HRP (100 μl/웰)를 RT에서 1시간 동안 첨가하였다. 그 다음에 플레이트를 PBST로 3회, PBS로 2회 세척한 후에, 웰 당 100 μl TMB를 첨가하였다. 반응은 100 μl 2M H2SO4/웰을 첨가하여 중지시켰고, OD를 450nm로 플레이트 판독기에서 판독하였다. 음전하를 띤 생체분자 표면에서 ELISA를 통한 IgG 결합 분석을 이전에 개시된 바와 같이 수행하였다 (Mouquet et al., 2010, Nature 467: 591-595 참조).
GITR
세포-기반 분석
Promega제 GITR 생물학적분석 키트 (CS184006)를 사용하여 항-GITR IgG가 GITR과 가교하고 수용체를 작용시키는 역량에 대해 항-GITR IgG를 분석하였다. 이러한 분석은 "GloResponse" NFkB-luc2/GITR Jurkat 세포에 기반한다. 상기 분석을 제조자의 지시에 따라, HA-태그된 인간 GITRL 단백질 플러스 항-HA 태그 항체를 포지티브 대조군으로 사용하여 수행하였다. 관련되지 않은 수용체에 대해 특이성을 갖는 인간 IgG1은 이소타입 네가티브 대조군으로 사용하였다.
Promega제 ADCC 생물학적분석 키트 (G7015)를 사용하여 항-GITR IgG가 인간 또는 cyno GITR-발현하는 CHO-K1 세포와 결합한 후에 ADCC를 유도하는 능력에 대해 상기 항-GITR IgG를 분석하였다. 이러한 분석은 FcγRIIIa 수용체를 안정하게 발현하는 조작된 Jurkat 이펙터 세포, V158 (높은 친화성) 변이체, 및 반딧불이 루시퍼라제의 발현을 유도하는 NFAT 반응 요소를 기반으로 한다. 상기 분석은 제조자의 지시에 따라, IgG1 및 아글리코실화 IgG1 형태 모두의 항-GITR 항체를 사용하여 수행하였다.
G-VL1-VH3 라이브러리 생성 및 선택
G-VL2-VH3 scFv 레퍼토리를 질량 올리고 합성 (mass oligo synthesis) 및 PCR에 의해 조립하였다. 그 다음에 증폭된 scFv 레퍼토리를 파지미드 (phagemid) 벡터로 제한-결찰을 통해 클로닝하고, 이. 콜리 (E. coli) TG-1 세포로 형질전환하고, 특성 규명하고, 파지 레퍼토리는 이전에 상세히 개시된 바와 같이 본질적으로 구조되었다 (Finlay et al., 2011, Methods Mol Biol 681: 383-401).
파지 선택은 스트렙타비딘 (streptavidin) 자기 미세비드 (magnetic microbeads)를 GITR-Fc 단백질 (인간 또는 cyno)로 코팅하고, 상기 비드를 PBS로 3회 세척하고, PBS pH 7.4 플러스 5% 탈지유 단백질 (MPBS)에 재현탁시킴으로써 수행되었다. 상기 비드를 선택 라운드 1에서 200 nM 표적 단백질로 코팅하였고, 그 다음에 후속하는 라운드들에서 100, 50 및 10 nM로 코팅하였다.
HTRF
결합 경쟁 분석
경쟁 HTRF 분석은 이식 및 라이브러리-유래된 클론에 의해 VH1/VL1 IgG에 대한 에피토프 경쟁을 조사하기 위해 수립되었다. 상기 정제된 VH1/VL1 IgG를 제조자의 지침에 따라 라벨링 키트 (labelling kit) (CisBio)를 사용하여 터븀 (terbium)으로 표지하였다. 최종 반응 믹스는 1Х 분석 버퍼 [50 mM 소듐 포스페이트, pH 7.5, 400 mM 포타슘 플루오리드, 및 0.1% BSA (w/v)] 중에 전체 반응 부피 20 μl로, 비오티닐화 인간 GITR-Fc, SA-XL665 (CisBio), 터븀-표지된 모체 XT-M4, 및 전술한 바와 같이 제조된 관심있는 경쟁인자 IgG를 함유하였다. 시약을 MiniTrak 액체 핸들링 플랫폼 (Perkin-Elmer)에서 384-웰 저-용량 블랙 플레이트 (Nunc)로 순차적으로 첨가하였다. 반응을 1시간 동안 실온에서 진행하였고, 플레이트를, 340 nm에서 여기 및 615 nm (VH1-VL1-크립테이트로부터의 입력 공여체 형광 측정) 및 665 nm (SAXL665로부터의 출력 수용체 형광 측정)에서 2개의 방출 판독값으로 플레이트 판독기에서 순차적으로 판독하였다. 판독값은 665 nm/615 nm 비율로 나타내었다.
결합 특이성 분석
항-GITR 항체를 ELISA로 다중반응성 (polyreactivity)에 대해 테스트하였다. 정제된, 재조합, 표적 및 비-표적 항원을 4℃에서 밤새 카르보네이트 버퍼 중에 웰 당 100 ng로 96-웰 Nunc maxisorp 플레이트에서 코팅하였다. 그 다음에 플레이트를 PBS로 3회 세척하였고, PBS 중 1% BSA로 차단하였고, 그 다음에 PBS-Tween20으로 3회 세척하였다. 그 다음에 1차 항체의 희석 시리즈를 적용하였고, 플레이트를 PBS-Tween20으로 3회 세척하였고, 그 후에 염소 항-인간 카파 사슬-HRP 1:4,000 2차 항체를 적용하였다. 그 다음에 웰을 PBS-Tween20으로 3회, PBS로 2회 세척하였고, 100 μl TMB 퍼옥시다제 기질을 웰에 첨가하였고, 반응은 100 μl 2M H2SO4를 첨가하여 중지시켰고, 흡광도는 450 nm에서 판독하였다.
항-GITR 항체는 또한 유세포분석기로 결합 특이성에 대해 테스트하였다. HuT78 세포를 항-CD3/항-CD28 비드와 3일 동안 인큐베이트하여 활성화시켰다. 나이브 세포를 배지에서 단독으로 인큐베이트하였다. 인큐베이트 종료시에, 상기 세포를 수확하였고, 활성화된 세포로부터 자석을 사용하여 비드를 제거하였다. 세포를 생존 염료 (viability dye)와 인큐베이트하였고, 그 다음에 4℃에서 항-GITR 항체로 염색하였다. 상업적으로 입수가능한 항-인간 GITR 모노클로날 항체 108-17 (PE로 직접 표지됨; BioLegend Inc.로부터 입수함, Cat. # 371202)은 포지티브 대조군으로 또한 포함되었다. VH1/Vl1 및 D-A6 IgG1 단백질의 결합은 PE 표지된 염소 항-인간 IgG와의 후속하는 인큐베이트에 의해 검출되었다. 세포를 4% PFA로 고정시켰고, 그 후에 4℃에서 밤새 PBS 중에 저장하였다. 세포는 다음 날 BD Fortessa flow cytometer running Diva 소프트웨어를 사용하여 분석되었다. 분석은 FlowJo 소프트웨어를 사용하여 수행되었다. 단일 세포는 스캐터 (scatter)에 의해 게이팅 (gating)되었고, 살아있는 세포는 생존 염료를 사용하여 게이팅되었다. 단일의 살아있는 세포의 PE 채널에서 중간 형광 세기 (median fluorescence intensity: MFI)를 결정하고 플로팅하였다. 각 염색 조건은 이중으로 수행되었다.
항-
GITR
Fab
단편의
Biacore
친화도 분석
IgG1 및 GITR-Fc 단백질 모두 다량체이므로, 표면 플라스몬 공명 (SPR)을 통한 정확한 1:1 결합 친화도 측정을 달성하는 것은 어렵다. 이러한 문제를 최소화하기 위해, 단량체 Fab 단편 ("Fabs")을 VH1/VL1 및 D-A6 IgG1 단백질 모두로부터 GingisKHAN 키트 (Genovis)를 사용하여 제조하였다. 그 다음에 Fab는 Biacore 분석에서 사용하기 위해 HBE-EP 버퍼로 버퍼 교환하였다.
친화도 추정을 위해, 항-인간 IgG Fc 항체를 Biacore CM5 칩의 3개의 유세포 (Fc 1 내지 Fc 3) 상에 pH 5에서 아민 커플링하였다. 상기 칩에 고정된 항-Fc 항체의 수준은 대략 550 RU이었다. 그 다음에 인간 및 cyno GITR-Fc 및 관련이 없는 수용체-Fc 단백질을 항-Fc 항체 상에서 (거의/완전히 포화될 때까지 상기 항체 표면에 주입하여) 포획하여 80-100 RU가 포획되었다. 그 다음에 Fab 단량체를 120초 동안 50 μl/분의 유속으로 37℃에서 칩에 포획된 Fc 단백질 상에 주입하였고, 그 후에 Biacore 러닝 버퍼 (HBS-EP)를 240초 동안 50 μl/분으로 칩상에 흘렸다. 상기 칩은 10 mM 글리신 pH 2의 2 x 15초 주입을 사용하여 사이클 사이에서 재생시켰다. 테스트된 Fab 시료의 농도는 400, 200, 100, 50, 25, 12.5, 및 6.25 nM이었다. Biacore 러닝 버퍼 대조군 (0 nM)은 또한 대조군으로 포함되었다.
결과 및 토의
바람직한 인간 생식세포 v-
유전자 상에
CDR
이식
효능성 뮤린 항-GITR IgG 6C8의 CDR (mVH/mVL; WO2006/105021 및 표 2 참조)은 CDR 이식을 사용하여 인간 생식세포 면역글로불린 v-도메인 프레임워크 서열 스캐폴드에 초기에 도입되었다. 최적의 약물-유사 특성을 갖는 최종 리드 치료용 IgG 화합물에 대한 발명자의 공학적 노력을 편향시키기 위해, 본 발명자는 높은 안정성을 갖는 것으로 알려져 있고, 발현된 인간 항체 레퍼토리에서 높은 빈도로 사용되는 "바람직한" 생식세포 스캐폴드 상에 모체 항체의 CDR을 이식하는 것을 선택하였다.
참조 분자로서 본 발명자는 또한 가장 가까운 생식세포 프레임워크 (hVH1/VL1)에 CDR을 이식하였다. 이러한 스캐폴드 및 이식된 CDR 정의는 하기 표 2에 요약되어 있다. 뮤린 항-GITR 항체에 대한 중쇄 및 경쇄 서열도 또한 하기 표 2에 개시되어 있다. 이러한 CDR 이식 과정은 잘 알려져 있지만, 주어진 인간 v-도메인 서열 세트가 비-인간 CDR 이식에 적합한 수용체 프레임워크로서 작용하는지를 예측하는데는 여전히 문제가 있다. 적합하지 않은 프레임워크의 사용으로 표적 결합 기능의 손실, 단백질 안정성 문제 또는 심지어 최종 IgG의 손상된 발현을 초래할 수 있다. 본 연구에서, 이러한 과정은 모체 항체가 인간 항체 레퍼토리에서 낮은 빈도로 사용되는 표준 HCDR1 구조 (H1-15-1)를 사용한다는 사실에 의해 더욱 복잡해졌다. 이러한 관찰은 항체가 "가장 가까운 생식세포" 서열 (가장 가까운 아미노산 상동성을 갖는 인간 생식세포) 상에 인간화되어야 하지만, 가장 가까운 중쇄 생식세포 (IGHV2-70)은 기능적으로-발현된 인간 항체 레퍼토리에서 거의 사용되지 않아서, 결과의 항체는 바람직하지 않은 약리학적 및 제조 품질의 위험으로 제조된다는 가정으로 당업자를 유도할 수 있다.
7개의 v-도메인 이식편 (4 VH, 3 VL)은 표 1에 요약되는 바와 같이 CDR 정의를 사용하여 인 실리코로 설계되었다. 상기 이식 및 mVH/mVL v-도메인의 v-도메인 유전자 서열은 이중가닥 DNA 카세트로 합성되었고, 전장 인간 IgG1 항체의 발현을 위해 설계된 플라스미드로 클로닝되었다. 이러한 플라스미드를 사용하여 HEK-293 세포의 일시적 형질감염을 수행하였고, 상기 발현된 IgG를 단백질 A 컬럼을 통해 정제하였다. CDR-이식된 v-도메인의 모든 가능한 조합을 기능에 대해 테스트하기 위해, 모두 4개의 인간화 중쇄를 3개의 인간화 경쇄 각각과 공동-발현시켜서, 12개의 IgG를 4개의 패밀리 (VH1-4)로 그룹화하였다.
정제된 IgG1 단백질에서 GITR-결합 기능의 보유를 인간 GITR-Fc에 대한 직접 결합 ELISA에서 적정에 의해 먼저 조사하였다. 이러한 실험은 VH2 및 VH4 패밀리에 있어서 mVH/mVL IgG (EC50 ≥ 0.004 μg/ml)와 비교하여 표적 결합이 손상되었고, 모든 결합 기능이 VH2 패밀리에서 본질적으로 제거되었음을 보여주었다 (도 1B). 이러한 발견은 기능이 유지되어야 한다면, 모체 항체의 CDR이 무작위로 선택된 인간 v-도메인 프레임워크로 간단히 이식될 수 없다는 것을 나타내었다. 중요하게도, VH2 IgG 패밀리에서 결합 기능의 > 100-배 손실은, HCDR1이 이식을 위해 사용된 프레임워크에서 발견된 인간 생식세포 HCDR1의 네이티브 서열과 일치하도록 선험적으로 (a priori) 완전히 생식세포 계열이 될 수 없음을 추가적으로 보여주었다. mVH/mVL IgG1과 동등하거나 또는 향상된 결합 기능이 VH1 및 VH3 패밀리의 항체에서 관찰되었다 (도 1A).
ELISA 결합 데이터에 기반하여, mVH/mVL, VH1, VH3 및 VH4 패밀리 IgG는 세포-기반 재조합 수용체 리포터 분석에서 GITR의 농도-의존적 효능제 활성에 대해 테스트되었다. 이러한 분석으로 VH3/VL2 조합은 가장 강력한 농도-의존적 수용체 활성화를 제공하는 것을 입증하였다 (도 2). 그러므로 이러한 이식편은 CDR 돌연변이 유발 및 개선된 클론의 선택을 위한 주형으로서 채택되었다.
라이브러리 생성 및 스크리닝
v-도메인 서열 VL2 및 VH3을 VL-VH scFv 형식으로 조합하였고, 돌연변이 유발 라이브러리 카세트를 질량 올리고 합성 및 조립에 의해 생성하였다. 최종 scFv 라이브러리 (G-VL2-VH3이라고 함)를 파지 디스플레이 벡터에 결찰시켰고, 전기영동을 통해 이. 콜리로 형질전환시켜서 3.0 x 108 비의존적 클론을 생성하였다. 라이브러리 구축 품질은 딥 시퀀싱 (deep sequencing)에 의해 > 100,000 클론으로 확인되었다. 이러한 시퀀싱 데이터는 각 분산 위치에서 뮤린 또는 인간 생식세포 잔기를 코딩하는 위치가 50%의 빈도로 효과적으로 샘플링되었음을 보여주었다. 헬퍼 파지 (helper phage) M13을 사용하여 라이브러리를 구조하였고, 비오티닐화 인간 및 시노몰구스 원숭이 GITR-Fc 단백질에서 선택이 수행되었다.
선택후 스크리닝 (도 3A, B, C) 및 DNA 시퀀싱으로 CDR 내에서 유의하게 증가된 인간 함량을 갖는 132개의 독특한, 인간 및 cyno GITR-결합, scFv 클론의 존재를 나타내었고, 프레임워크 서열은 전체 생식세포를 유지하였다. 상기 132개의 클론 중, 74개의 클론은 모든 CDR에서 생식세포 돌연변이를 갖는 것으로 발견되었다 (표 3). 리드 클론을 인간 및 cyno GITR-Fc 모두로의 결합에 대해 ELISA 신호에 대한 CDR 생식세포의 수준에 기반하여 순위를 매겼다 (도 4). 그 다음에 이러한 순위로부터 상위 11개의 클론의 v-도메인을 하기와 같이 추가적 테스트를 위해 IgG 발현 벡터로 서브-클로닝하였다 (표 4 참조).
라이브러리 선택으로부터 직접 유래된 리드 클론에 대해 모든 CDR에서 생식세포 돌연변이가 관찰되었지만, 서열 분석을 통해 추가의 클론이 최대 인간화를 갖도록 설계되는 것이 가능하였다. 그러므로, 인간 및 cyno 단백질에 대한 결합 신호를 갖는 132개의 서열-유일 적중 (hits)을 사용하여 상기 기능적으로 특성화된 개체군의 CDR에서 뮤린 아미노산에 대한 보유 빈도 (retention frequency: RF)를 분석하였다. 위치 아미노산 RF는 VL 및 VH 도메인에서 발견되는 퍼센트로 나타내었다 (도 5A & B). RF < 75%를 갖는 뮤린 잔기는 일련의 조합 설계에서 표적-결합 파라토프에 필수적이지 않고, 생식세포에 개방될 수 있는 위치로 간주되었다.
RF > 75%를 갖는 뮤린 잔기 만을 포함하는 설계를 "MH" (MH = 최대 인간화)로 나타내었다. 이러한 클론 및 CDR에 뮤린 잔기를 다시 첨가한 5개의 추가 디자이너 클론 (MH-1 내지 MH-5; 표 4 참조)을 유전자 합성에 의해 생성하였고, 상기에 요약된 11개의 라이브러리-유래된 클론과 같이, 생산을 위해 인간 IgG1 발현 벡터로 클로닝되었다. 모두 17개의 IgG가 용이하게 발현되었고, HEK-293 세포의 일시적 형질감염으로부터 정제되었다. 단일 단백질 A 컬럼 정제 단계 후에, 분석용 HPLC 크기 배제 크로마토그래피로 모든 리드는 97.65 내지 99.75% 범위의 단량체 IgG 함량을 갖는 것으로 나타났다.
리드
IgG
친화도, 안정성 및 특이성 특성 규명
그 다음에, 전술한 17개의 정제된 IgG를 직접 적정 ELISA 형식의 인간 및 cyno GITR-Fc로의 결합에 대해 테스트하였다. 놀랍게도, 상기 분석으로 많은 (14/17) 클론이 VH1/VL1 및 VH3/VL2 IgG (디자이너 클론 MH, MH1-4를 포함)에 필적하는 인간 GITR에 대한 결합 친화도를 보유하면서, 단 3개의 클론 (D-A6, I-C2 및 G-G10)만이 cyno GITR-Fc에 필적하거나 또는 더 우수한 결합을 유지하는 것을 나타내었다 (도 6). GITR 효능성 리포터 분석에서, D-A6, I-C2 및 G-G10 모두는 또한 항체 가교된 인간 GITRL과 동일한 농도 범위에서 인간 GITR의 농도-의존적 수용체 활성화를 나타내었다 (도 7A-C). 모든 IgG 및 GITRL에 대한 최대 신호는 1000-2000 ng/ml에서 관찰되었다.
돌연변이 및 재선택 과정 중에 리드 클론이 표적 특이성의 손실을 겪지 않는다는 것을 보장하기 위해; D-A6, I-C2, G-G10, mVH/mVL 및 VH3/VL2 클론을, 뮤린 GITR-Fc 및 인간 TNFRSF 구성원 및 일반적인 면역글로불린 상과 구성원을 포함하는 14개의 정제된 단백질 패널로의 결합에 대해 테스트하였다 (도 8 A-E). 모두 5개의 IgG는 GITR-Fc에 대해 1 μg/ml에서 결합 신호를 나타내었고 (인간 OD450 nm > 3.0, cyno > 1.0), 임의의 다른 단백질에 대해 검출가능한 결합을 나타내지 않았다 (OD450 nm <0.1).
VH1/VL1 인간
IgG
이식편과
에피토프
경쟁의
HTRF
분석
VH1/VL1 IgG의 변경되지 않은 가장 가까운-생식세포 이식된 CDR과 라이브러리-유래된 클론의 경쟁을 조사하기 위해서, 동질성 시간 분해 형광도 (Homogeneous Time Resolved Fluorescence: HTRF) 분석을 확립하였다. 이러한 분석은 용액상 결합에서 터븀-표지된 VH1/VL1 IgG, 비오티닐화 hGITR-Fc 및 스트렙타비딘-XL665를 포함하였다. 그 다음에, 표지되지 않은 IgG VH1/VL1 (포지티브 대조군), 이소타입 대조군 및 리드 IgG D-A6, G-G10 및 I-C2를 광범위한 농도 범위 (0.003-100 μg/ml)에 걸쳐 첨가하였다. IgG VH1/VL1, D-A6, G-G10 및 I-C2 모두는 결합 신호의 농도-의존적 감소를 보였고, 이는 이들이 GITR로의 VH1/VL1 IgG의 결합을 차단하는 것을 나타낸다 (도 9). 중요하게도, 클론 D-A6은 선형 단계에서 비표지된 VH1/VL1 IgG의 곡선과 완전히 중첩되는 저해 곡선을 나타내었고, 이는 mVH/mVL과 비교하여 (인간 생식세포에 대한) 12개의 CDR 돌연변이를 가짐에도 불구하고, 클론 D-A6에서 친화도 및 에피토프 특이성 모두를 완전히 유지하는 것을 시사하였다.
D-A6
IgG1
대 VH1/VL1
IgG1에
대한
GITR
효능성
역가의
인 비트로 분석
유세포 분석, 에피토프 경쟁 및 수용체 효능성 데이터에 기반하여, 추가의 인 비트로 분석을 위해 IgG D-A6을 우선순위화하였다. 이량체와 같은 IgG의 활성 응집체를 통상적으로 IgG1 발현 및 정제 절차 중에 생산하였다. 이러한 응집체는 수용체 효능성 분석에서 거짓-양성 또는 과장된 신호를 형성할 수 있다. D-A6과 VH1/VL1 IgG 사이에 정확한 비교를 위해서, 이들은 각각 2회 정제되었다: 첫 번째는 단백질 A 컬럼 결합에 의해, 두 번째는 크기 배제 크로마토그래피에 의해 인간 IgG1을 갖는 예상되는 분자 (대략 150 kDa)보다 큰 임의의 단백질 종을 제거하였다. 그 다음에 완전히 정제된 IgG1 단백질은 세포-기반 리포터 분석에서 GITR의 농도-의존적 효능제 활성화에 대해 테스트하였다. 이러한 분석으로 예기치 않게, D-A6 IgG1은 VH1/VL1 IgG보다 유의하게 더 강한 농도-의존적 수용체 활성화를 나타내는 것으로 입증되었다 (도 11). 상기 분석에서, 항체 모두의 중복 분석을 사용하여, D-A6 클론은 다음을 나타내었다: 1. VH1/VL1에 대한 최대 RLU 값이 11664인 것에 대해, D-A6에 대한 최대 RLU 값은 21876인 것으로 보다 높은 전체 역가; 2. VH1/VL1과 비교하여, 0.1 내지 133 nM에서 테스트된 D-A6 IgG1의 모든 농도에서 더 높은 신호.
세포막에서 리드
IgG
결합 특이성의
유세포
분석
세포 표면에서 GITR로의 농도-의존적 결합을 유세포 분석법을 사용하여 분석하였다. 마우스 GITR-Fc에 결합하는 IgG가 관찰되지 않았기 때문에, 전매 뮤린 모세포종 (blastoma) 및 CHO-K1 세포는 인간 또는 cyno GITR 전장 cDNA로 안정하게 형질감염되었다. 그 다음에 IgG mVH/mVL, VH1/VL1, VH3/VL2, D-A6, G-G10, I-C2 및 이소타입 대조군 IgG1은 인간, cyno 또는 네가티브 대조군 (관련되지 않은 인간 수용체로 안정하게 형질감염된) 뮤린 모세포종 세포로의 결합에 대해 농도 범위 10,000-13.7 ng/ml에 대해 테스트되었다 (도 10). 이소타입 대조군 이외의 모든 IgG는 각 사례에서 대략 1111 ng/ml의 최대 MFI로, 인간 및 cyno GITR+ 세포로의 농도-의존적 결합을 보였다. 임의의 IgG에 있어서 임의의 농도에서 네가티브 대조군 세포주에 대해 측정가능한 결합이 관찰되지 않았다.
GITR+ 인간 세포에 리드 IgG의 결합을 조사하기 위해서, HuT78 세포를 3일 동안 항-CD3/항-CD28 비드와 인큐베이트하여 활성화시켰다. t-세포의 활성화는 GITR 발현의 상향조절과 관련이 있다. 나이브 세포를 배지에서 단독으로 인큐베이트하였다. 그 다음에 IgG VH1/VL1, D-A6 및 항-GITR 상업용 대조군 항체 '108-17'을 활성화된 세포 및 나이브 세포로의 결합에 대해 10 μg/ml에서 테스트하였다. 모두 3개의 항체는 활성화된 세포에 대해 강한 결합을 보였지만, 나이브 세포에 대해서는 식별가능한 결합을 보이지 않았다 (도 12A). 유사하게 활성화된 HuT78 세포는 그 다음에 IgG1 VH1/VL1, D-A6 및 네가티브 대조군, 인간 IgG1 카파 항-GFP 상업용 항체 'AbD18705_hIgG1'로 1.1 μg/ml로 염색되었다. 각 사례에서, 10 μg/ml 인간 GITR 리간드 단백질의 존재 또는 부재하에 염색이 수행되었다. 항-GFP 대조군은 어느 분석에서도 활성화된 세포로의 결합을 보이지 않았고, IgG VH1/VL1 및 D-A6 모두는 과량의 GITRL 단백질의 부재하에 결합을 보였다 (도 12B). 상기 분석으로 클론 D-A6은 활성화된 인간 T-세포에서 GITR에 특이적으로 결합하고, 그의 결합 부위는 GITR에 대한 본래 결합 파트너인 GITRL의 결합 부위와 중첩되는 것으로 나타났다.
IgG1
및
IgG1
-
N297A
항체에 의한 농도-의존적
FcγRIIIa
진입의 인 비트로 분석
TRX-518로도 알려져 있는 모노클로날 6C8의 인간화 형태는 비-글리코실화 인간 IgG1이다. 표준 n-연결된 글리코실화의 제거는 인간 IgG1 Fc CH2 영역에 돌연변이 N297A를 첨가하여 달성되었다. 이러한 아글리코실화 Fc 영역은 항체-결합된 세포에 대해 NK 세포에 의해 ADCC를 유도하는 것과 관련이 있는, 매우 중요한 FcγRIIIa 수용체를 포함하는 모든 인간 Fcγ 수용체로의 결합을 위해 널 (null)이 된다. 항-GITR 효능제 항체에서 ADCC 활성의 존재는 GITR을 높은 수준으로 발현하는 것으로 알려져 있는 면역억제 종양-침윤 Treg 세포를 고갈시킬 수 있어서 매우 유익할 수 있다.
VH1/VL1 (v-도메인은 TRX-518과 아미노산 서열이 동일함) 및 D-A6 v-도메인이 ADCC를 유도하는 능력을 조사하기 위해서, 항체 모두는 인간 IgG1 및 IgG1-N297A 형식으로 발현되었다. 상기 항체들은 전술한 바와 같이 proA-SEC로 정제되었고, 그 다음에 CHO-K1 표적 세포가 인간 또는 cyno GITR을 표적 세포 개체군으로서 안정하게 발현시키면서 Promega ADCC 분석에 사용되었다. 인간 (도 13A) 및 cyno (도 13B) CHO-K1 세포 모두에서, VH1/VL1 및 D-A6 IgG1 항체 모두는 용량-의존적 FcγRIIIa 활성화를 보였지만, IgG1-N297A 항체는 사용된 임의의 농도에서 신호전달을 유도하지 않았다. 중요하게도, 상기 D-A6 IgG1은 VH1/VL1 IgG1보다 유의하게 보다 효능이 있었다 (> 2-배) (도 13A, 13B). 인간 GITR 세포에서, 관찰된 EC50 값은 D-A6 IgG1에 대해 15.4 nM이고, VH1/VL1 IgG1에 대해 35.6 nM이었다. cyno GITR 세포에서, 관찰된 EC50 값은 D-A6 IgG1에 대해 57.9 nM이고, VH1/VL1 IgG1에 대해 160.0 nM이었다.
'개발가능성' ELISA 분석에서 리드
IgG
D-A6 분석
치료적 사용을 목적으로 하는 몇 가지 지표 생물학적 기질에 IgG의 결합은 생체이용률이 떨어지고 인 비보 반감기가 짧기 때문에 환자에서 성능이 떨어지는 것에 대한 고위험 지표라는 것이 당 분야에 알려져 있다. 3가지 이러한 생물학적 기질은 인슐린, dsDNA 및 ssDNA이다. 그러므로 이러한 3가지 기질을 사용하여 ELISA 플레이트를 코팅하고 최적화된 리드 D-A6의 IgG1 및 IgG1-N297A 버전의 결합을 조사하였다. 이러한 인간 IgG-기반 항체에 대한 결합 신호를 임상 시험에서 다중반응성이 있고 성능이 떨어져서 그의 진행이 중지된 것으로 밝혀진 "포지티브 대조군" 인간 IgG 항체와 비교하였다 (보코시주맙 (Bococizumab) 및 브리아키누맙 (Briakinumab) 인간 IgG1 유사체). 네가티브 대조군 인간 IgG1 항체에 있어서, IgG1 우스테키누맙 (Ustekinumab) 유사체는 브리아키누맙과 동일한 치료 표적과 반응하지만, pK가 더 길고, 치료제로서 성공적으로 승인되었기 때문에 사용되었다. 도 14에 도시된 ELISA 분석에서, 포지티브 대조군 항체는 모두 3개의 기질에 대해 예상된 강한 반응성을 나타내었고, 반면 네가티브 대조군은 낮은 반응성을 보였다. 중요하게도, D-A6 IgG1 및 IgG1-N297A 단백질 모두는 3개 모두의 기질에 대해 네가티브 대조군보다 작거나 같은 결합을 보였다. 이러한 발견은 최적화된 클론 D-A6에서 매우 특이적인 표적-유도 결합의 유지를 강조하였다.
리드 v-도메인의 인
실리코
면역원성 분석
최근 미국 FDA 지침은 치료제 개발을 위한 모든 항체에 대해 t-세포 에피토프 위험의 인 실리코 면역원성 평가를 권장하였다 (USFDA [2014] Guidance for Industry - Immunogenicity Assessment for Therapeutic Protein Products 참조). 인간 t-세포 에피토프 함량에 대한 항-GITR 항체를 조사하기 위해, IgG mVH/mVL, VH3/VL2, D-A6, G-G10 및 I-C2에 대한 v-도메인 서열을 글로벌 인구 통계에 기반한 DRB1 점수를 위해 Lonza Epibase ISTM 시스템 (버전 3)에 제출하였다 (표 5). 이러한 분석에서, 인간 t-세포 면역원성 위험은 v-도메인 모두에 걸친 전체 점수가 주어졌다. 개시하는 뮤린 클론 mVH/mVL은 1680.4의 점수를 받았고, 이는 치료제로서의 사용이 현재 승인된 키메라 항체에 대한 예측된 면역원성 범위의 하한에 있다 (1500 내지 >2400). 이식된 클론 VH3/VL2 (프레임워크에서 역 돌연변이를 갖지 않는 직접 생식세포 이식편)는 994.0의 감소된 점수를 나타내었고, 이는 치료제로서의 사용이 현재 승인된 인간화 항체에 대한 예측된 면역원성 범위보다 낮다 (1000 내지 1600). 리드 클론 D-A6 및 G-G10은 각각 932.5 및 842.8의 점수를 받았다. 이러한 점수는 치료제로서의 사용이 현재 승인된 전체 인간 항체에 대한 예측된 면역원성 범위에 있다 (250 내지 1200).
클론 D-A6 (전 기능 유지) 및 MH (cyno GITR 결합 및 인간 GITR 효능성 제거)의 서열 비교는 5개의 아미노산만이 차이를 보였다. 면역원성 및 기능에 있어서 이러한 돌연변이의 영향을 조사하기 위해, 5개의 추가의 디자이너 돌연변이체 (A6.1 내지 A6.5, CDR 서열에 대해 표 4 참조)가 또한 Epibase 분석을 위해 제출되었다 (표 5). 상기 평가는 이들 돌연변이체에 대한 전체 DRB1 점수가 클론 A6.4에서 D-A6의 예측된 면역원성을 845.9의 낮은 수준으로 추가로 감소시킬 수 있음을 보여주었다. 그러나, A6.1 내지 A6.5에 대한 ELISA 결합 분석이 IgG1 단백질에서 수행될 때, 모든 클론은 인간 GITR에 대한 결합을 유지하였지만, VH1/VL1 및 D-A6과 비교하여 cyno GITR로의 결합은 A6.1 만이 유지하였다. Cyno GITR 결합은 클론 A6.2 내지 A6.5 모두에 대해 크게 감소하였다.
항-
GITR
Fab
단편 대
hGITR
-
Fc
및
cGITR
-
Fc에
대한
SPR
친화도 분석
GITR 효능성 및 ADCC 분석은 모든 개시된 리드 클론 D-A6이 VH1/VL1에 대해 유의하게 향상되었음을 나타내었기 때문에, 본 발명자는 Biacore에서 이들 2개의 항체에 대한 친화도 값을 분석하였다. 단량체 Fab 단편을 생성하였고, 인간 및 cyno GITR-Fc 코팅된 바이오센서 칩에서 이동상으로 유동시켜서, 1:1 결합 값을 유도하였다. 이러한 데이터는 VH1/VL1 및 D-A6 FAb에 대한 KD 값이 ELISA 데이터와 일치하게, 인간 GITR에서 거의 동일하지만, D-A6 Fab는 cyno GITR에 대해 대략 4-배의 향상된 친화도를 나타내었다 (표 6). 모든 분석에 대한 Chi2 값은 < 0.15였고, 이는 데이터가 1:1 Langmuir 키네틱 모델에 정확하게 피팅되는 것을 나타낸다.
추가의 리드
IgG1
대 VH1/VL1
IgG1에
대한
GITR
효능성
역가의
인 비트로 분석
IgG D-A6은 IgG1 형식의 수용체 효능성에서 향상된 역가를 나타내기 때문에, 추가적인 GITR 효능성 분석을 위해 일련의 추가의 리드를 우선순위로 하였다. 이러한 분석으로 IgG1null 및 IgG1-N297A 형식의 D-A6 클론 (도 15A), D-A6.1 클론 (도 15B) 및 IgG1 형식의, 라이브러리-유래된 리드 G-G10 (도 15C) 및 I-C2 (도 15D), 모두는 또한 VH1/VL1 IgG보다 유의하게 보다 강한 농도-의존적 수용체 활성화를 나타내는 것으로 입증되었다. 상기 분석에서, 모든 항체의 중복 분석을 사용하여, 상기 IgG 클론은 하기를 나타내었다: 1. 그의 최대 RLU 값에서 보다 높은 전체 역가; 2. I-C2를 제외하고, VH1/VL1과 비교하여 테스트된 IgG의 모든 농도에서 보다 높은 신호. 이소타입 인간 IgG1이 또한 포함되었고 (도 15C, 15D), 이는 수용체를 작동시키는데 능력은 보이지 않았다.
본 발명은 바람직하거나 또는 예시되는 구현예를 참고로 기재되었지만, 당업자는 본 발명의 사상 및 범위를 벗어나지 않으면서 다양한 변형 및 변경이 수행될 수 있고, 이러한 변형은 본원에서 명확하게 고려되었다는 것을 인식할 것이다. 본원 및 첨부된 청구범위에 개시된 특정 구현예에 대한 한정은 의도되지 않았고, 또한 추론되어서는 안된다.
본원에서 인용된 모든 문헌은 그의 전문이 본원에 참고로 포함된다.
하기 각 표 1-4에서, 서열번호는 각 서열 아래에 괄호로 나타내었다.
(1) IMGT 시스템에 기반한 이식에 사용되는 인간 생식세포 정의. (2) 상기 CDR에서 서열 대시선은 서열 배열에 기반하여 샘플링된 잔기의 간격을 보여주기 위해 부가됨. (3) CDR 잔기는 진하게 밑줄되어 있다. 전술한 바와 같이, 본원에서 사용된 일부 CDR 정의는 고전적인 Kabat 정의와 비교하여 확장된 정의이다.
SEQUENCE LISTING
<110> ULTRAHUMAN ONE LIMITED
<120> BINDING AGENTS
<130> P/75554.WO01/MR
<150> GB 1713296.0
<151> 2017-08-18
<150> GB 1701351.7
<151> 2017-01-27
<160> 174
<170> BiSSAP 1.3.6
<210> 1
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 3
<223> S or a conservative substitution of S
<220>
<221> VARIANT
<222> 4
<223> L or a conservative substitution of L
<220>
<221> VARIANT
<222> 6
<223> T or a conservative substitution of T
<220>
<221> VARIANT
<222> 7
<223> S or any amino acid (for example, F)
<220>
<221> VARIANT
<222> 8
<223> G or a conservative substitution of G
<220>
<221> VARIANT
<222> 9
<223> M or any amino acid (for example, Y, F, L or W)
<220>
<221> VARIANT
<222> 10
<223> G or a conservative substitution of G
<220>
<221> VARIANT
<222> 11
<223> V or a conservative substitution of V
<220>
<221> VARIANT
<222> 12
<223> G or a conservative substitution of G
<400> 1
Gly Phe Xaa Xaa Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 2
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> L or a conservative substitution of L
<220>
<221> VARIANT
<222> 2
<223> A or a conservative substitution of A
<220>
<221> VARIANT
<222> 3
<223> H or a conservative substitution of H
<220>
<221> VARIANT
<222> 4
<223> D or a conservative substitution of D
<220>
<221> VARIANT
<222> 7
<223> D or a conservative substitution of D
<220>
<221> VARIANT
<222> 8
<223> D or a conservative substitution of D
<220>
<221> VARIANT
<222> 9
<223> D or a conservative substitution of D
<220>
<221> VARIANT
<222> 13
<223> N or any amino acid (for example, V)
<220>
<221> VARIANT
<222> 14
<223> P or any amino acid (for example, D)
<220>
<221> VARIANT
<222> 16
<223> L or a conservative substitution of L
<220>
<221> VARIANT
<222> 18
<223> S or any amino acid (for example, G)
<400> 2
Xaa Xaa Xaa Xaa Trp Trp Xaa Xaa Xaa Lys Tyr Tyr Xaa Xaa Lys Xaa
1 5 10 15
Lys Xaa
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> T or any amino acid (for example, G, A, N, S or I)
<220>
<221> VARIANT
<222> 2
<223> R or any amino acid (for example, D, T or V)
<220>
<221> VARIANT
<222> 3
<223> R or any amino acid (for example, Q, L, M, I or V)
<220>
<221> VARIANT
<222> 5
<223> F or a conservative substitution of F
<400> 3
Xaa Xaa Xaa Tyr Xaa Pro Phe Ala Tyr
1 5
<210> 4
<211> 12
<212> PRT
<213> Muridae
<400> 4
Gly Phe Ser Leu Ser Thr Ser Gly Met Gly Val Gly
1 5 10
<210> 5
<211> 18
<212> PRT
<213> Muridae
<400> 5
Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu
1 5 10 15
Lys Ser
<210> 6
<211> 9
<212> PRT
<213> Muridae
<400> 6
Thr Arg Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 6
<223> S/F
<400> 7
Phe Ser Leu Ser Thr Xaa Gly Tyr Gly
1 5
<210> 8
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 8
Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Val Asp Ser Val Lys Gly
1 5 10 15
<210> 9
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 3
<223> Q/L/V
<400> 9
Thr Arg Xaa Tyr Phe Pro Phe Ala
1 5
<210> 10
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> K or a conservative substitution of K
<220>
<221> VARIANT
<222> 2
<223> A or a conservative substitution of A
<220>
<221> VARIANT
<222> 5
<223> N or a conservative substitution of N
<220>
<221> VARIANT
<222> 7
<223> G or a conservative substitution of G
<220>
<221> VARIANT
<222> 8
<223> T or a conservative substitution of T
<220>
<221> VARIANT
<222> 9
<223> N or any amino acid (for example, Y)
<220>
<221> VARIANT
<222> 10
<223> V or a conservative substitution of V
<400> 10
Xaa Xaa Ser Gln Xaa Val Xaa Xaa Xaa Xaa Ala
1 5 10
<210> 11
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> S or any amino acid (for example Y, E, D, F, L or N)
<220>
<221> VARIANT
<222> 3
<223> S or any amino acid (for example, Y)-
<220>
<221> VARIANT
<222> 4
<223> Y or any amino acid (for example, N)
<220>
<221> VARIANT
<222> 6
<223> Y or any amino acid (for example A or D)
<220>
<221> VARIANT
<222> 7
<223> S or a conservative substitution of S
<400> 11
Xaa Ala Xaa Xaa Arg Xaa Xaa
1 5
<210> 12
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 2
<223> Q or a conservative substitution of Q
<220>
<221> VARIANT
<222> 3
<223> Y or any amino acid (for example, R or H)
<220>
<221> VARIANT
<222> 4
<223> N or a conservative substitution of N
<220>
<221> VARIANT
<222> 5
<223> T or any amino acid (for example K or N)
<220>
<221> VARIANT
<222> 6
<223> D or any amino acid (for example, W, L, S, E, V or N)
<400> 12
Gln Xaa Xaa Xaa Xaa Xaa Pro Leu Thr
1 5
<210> 13
<211> 11
<212> PRT
<213> Muridae
<400> 13
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 14
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 15
<211> 9
<212> PRT
<213> Muridae
<400> 15
Gln Gln Tyr Asn Thr Asp Pro Leu Thr
1 5
<210> 16
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 4
<223> N/S
<220>
<221> VARIANT
<222> 7
<223> T/S
<400> 16
Ala Ser Gln Xaa Val Gly Xaa Asn
1 5
<210> 17
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> S/Y
<220>
<221> VARIANT
<222> 4
<223> Y/N
<220>
<221> VARIANT
<222> 7
<223> S/T
<400> 17
Xaa Ala Ser Xaa Arg Tyr Xaa
1 5
<210> 18
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 3
<223> T/N
<400> 18
Tyr Ser Xaa Asp Pro Leu
1 5
<210> 19
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 3
<223> S/T
<220>
<221> VARIANT
<222> 4
<223> L/F
<220>
<221> VARIANT
<222> 6
<223> T/A
<220>
<221> VARIANT
<222> 7
<223> S/F
<220>
<221> VARIANT
<222> 8
<223> G/S
<220>
<221> VARIANT
<222> 9
<223> M/Y/F/L/W
<220>
<221> VARIANT
<222> 10
<223> G/A
<220>
<221> VARIANT
<222> 11
<223> V/M
<220>
<221> VARIANT
<222> 12
<223> G/S
<400> 19
Gly Phe Xaa Xaa Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 20
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> L/V
<220>
<221> VARIANT
<222> 2
<223> A/S
<220>
<221> VARIANT
<222> 3
<223> H/N
<220>
<221> VARIANT
<222> 4
<223> I/V
<220>
<221> VARIANT
<222> 7
<223> D/E
<220>
<221> VARIANT
<222> 8
<223> D/S
<220>
<221> VARIANT
<222> 9
<223> D/E
<220>
<221> VARIANT
<222> 13
<223> N/V
<220>
<221> VARIANT
<222> 14
<223> P/D
<220>
<221> VARIANT
<222> 16
<223> L/V
<220>
<221> VARIANT
<222> 18
<223> S/G
<400> 20
Xaa Xaa Xaa Xaa Trp Trp Xaa Xaa Xaa Lys Tyr Tyr Xaa Xaa Ser Xaa
1 5 10 15
Lys Xaa
<210> 21
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> T/G/A/N/S/I
<220>
<221> VARIANT
<222> 2
<223> R/D/T/V
<220>
<221> VARIANT
<222> 3
<223> R/Q/L/M/I/V
<220>
<221> VARIANT
<222> 5
<223> F/Y
<400> 21
Xaa Xaa Xaa Tyr Xaa Pro Phe Ala Tyr
1 5
<210> 22
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> K/R
<220>
<221> VARIANT
<222> 2
<223> A/T
<220>
<221> VARIANT
<222> 5
<223> N/D/S
<220>
<221> VARIANT
<222> 7
<223> G/S
<220>
<221> VARIANT
<222> 8
<223> T/S/N
<220>
<221> VARIANT
<222> 9
<223> N/Y
<220>
<221> VARIANT
<222> 10
<223> V/L
<400> 22
Xaa Xaa Ser Gln Xaa Val Xaa Xaa Xaa Xaa Ala
1 5 10
<210> 23
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> S/Y/E/D/F/L/N
<220>
<221> VARIANT
<222> 2
<223> S/Y
<220>
<221> VARIANT
<222> 4
<223> Y/N
<220>
<221> VARIANT
<222> 6
<223> Y/A/D
<220>
<221> VARIANT
<222> 7
<223> S/T
<400> 23
Xaa Ala Xaa Xaa Arg Xaa Xaa
1 5
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 2
<223> Q/H
<220>
<221> VARIANT
<222> 3
<223> Y/R/H
<220>
<221> VARIANT
<222> 4
<223> N/S/R
<220>
<221> VARIANT
<222> 5
<223> T/K/N
<220>
<221> VARIANT
<222> 6
<223> D/W/L/S/E/V/N
<400> 24
Gln Xaa Xaa Xaa Xaa Xaa Pro Leu Thr
1 5
<210> 25
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 7
<223> S/F
<400> 25
Gly Phe Ser Leu Ser Thr Xaa Gly Tyr Gly Val Gly
1 5 10
<210> 26
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 26
Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 27
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 3
<223> Q/L/V
<400> 27
Thr Arg Xaa Tyr Phe Pro Phe Ala Tyr
1 5
<210> 28
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 5
<223> N/S
<220>
<221> VARIANT
<222> 8
<223> T/S
<400> 28
Arg Ala Ser Gln Xaa Val Gly Xaa Asn Leu Ala
1 5 10
<210> 29
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 29
Gly Phe Ser Leu Ser Thr Ser Gly Tyr Gly Val Gly
1 5 10
<210> 30
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 1
<223> L/V
<220>
<221> VARIANT
<222> 2
<223> A/S
<220>
<221> VARIANT
<222> 3
<223> H/N
<220>
<221> VARIANT
<222> 4
<223> I/V
<220>
<221> VARIANT
<222> 7
<223> D/E
<220>
<221> VARIANT
<222> 8
<223> D/S
<220>
<221> VARIANT
<222> 9
<223> D/E
<400> 30
Xaa Xaa Xaa Xaa Trp Trp Xaa Xaa Xaa Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 31
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 31
Thr Arg Gln Tyr Phe Pro Phe Ala Tyr
1 5
<210> 32
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 32
Arg Ala Ser Gln Ser Val Gly Ser Asn Leu Ala
1 5 10
<210> 33
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 33
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 34
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 34
Gln Gln Tyr Ser Thr Asp Pro Leu Thr
1 5
<210> 35
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 35
Gly Phe Ser Leu Ser Thr Phe Gly Tyr Gly Val Gly
1 5 10
<210> 36
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 36
Arg Ala Ser Gln Ser Val Gly Thr Asn Leu Ala
1 5 10
<210> 37
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 37
Tyr Ala Ser Tyr Arg Tyr Thr
1 5
<210> 38
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 38
Gln Gln Tyr Ser Asn Asp Pro Leu Thr
1 5
<210> 39
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 39
Thr Arg Leu Tyr Phe Pro Phe Ala Tyr
1 5
<210> 40
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 40
Arg Ala Ser Gln Asn Val Gly Ser Asn Leu Ala
1 5 10
<210> 41
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 41
Ser Ala Ser Asn Arg Tyr Ser
1 5
<210> 42
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 42
Thr Arg Val Tyr Phe Pro Phe Ala Tyr
1 5
<210> 43
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 43
Arg Ala Ser Gln Asn Val Gly Thr Asn Leu Ala
1 5 10
<210> 44
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 44
Ser Ala Ser Asn Arg Tyr Thr
1 5
<210> 45
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 45
Asn Arg Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 46
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 46
Ser Ala Ser Tyr Arg Ala Thr
1 5
<210> 47
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 47
Gly Phe Ser Leu Ser Thr Ser Gly Tyr Gly Val Ser
1 5 10
<210> 48
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 48
Leu Ala His Val Trp Trp Asp Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 49
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 49
Arg Ala Ser Gln Ser Val Gly Thr Asn Val Ala
1 5 10
<210> 50
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 50
Gln Gln Tyr Asn Asn Trp Pro Leu Thr
1 5
<210> 51
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 51
Gly Phe Ser Phe Ser Thr Ser Gly Tyr Gly Val Ser
1 5 10
<210> 52
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 52
Leu Ala His Ile Trp Trp Asp Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 53
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 53
Ser Ala Ser Tyr Arg Ala Ser
1 5
<210> 54
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 54
Gly Phe Ser Leu Ser Thr Ser Gly Met Gly Val Ser
1 5 10
<210> 55
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 55
Val Ala His Ile Trp Trp Asp Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 56
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 56
Gly Phe Ser Phe Ser Thr Ser Gly Met Gly Val Ser
1 5 10
<210> 57
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 57
Arg Ala Ser Gln Ser Val Gly Ser Asn Val Ala
1 5 10
<210> 58
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 58
Gly Phe Ser Leu Ser Thr Ser Gly Met Gly Met Gly
1 5 10
<210> 59
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 59
Ser Arg Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 60
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 60
Gly Phe Ser Leu Ser Thr Ser Ser Tyr Gly Val Ser
1 5 10
<210> 61
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 61
Gly Phe Ser Leu Ser Thr Ser Gly Met Gly Met Ser
1 5 10
<210> 62
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 62
Gly Phe Ser Leu Ser Thr Ser Gly Tyr Gly Met Ser
1 5 10
<210> 63
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 63
Gln Gln Tyr Ser Thr Asn Pro Leu Thr
1 5
<210> 64
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 64
Gly Phe Ser Leu Ser Thr Ser Gly Tyr Gly Met Gly
1 5 10
<210> 65
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 65
Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Gln Pro Ser Leu
1 5 10 15
Lys Ser
<210> 66
<211> 7
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 66
Thr Ser Gly Met Gly Val Gly
1 5
<210> 67
<211> 16
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 67
His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 68
<211> 9
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 68
Gly Phe Ser Leu Ser Thr Ser Gly Met
1 5
<210> 69
<211> 6
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 69
Trp Trp Asp Asp Asp Lys
1 5
<210> 70
<211> 11
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 70
Ala Arg Thr Arg Arg Tyr Phe Pro Phe Ala Tyr
1 5 10
<210> 71
<211> 10
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 71
Gly Phe Ser Leu Ser Thr Ser Gly Met Gly
1 5 10
<210> 72
<211> 7
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 72
Ile Trp Trp Asp Asp Asp Lys
1 5
<210> 73
<211> 6
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 73
Gln Asn Val Gly Thr Asn
1 5
<210> 74
<211> 9
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 74
Phe Ser Leu Ser Thr Ser Gly Met Gly
1 5
<210> 75
<211> 15
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 75
Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 76
<211> 8
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 76
Thr Arg Arg Tyr Phe Pro Phe Ala
1 5
<210> 77
<211> 8
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 77
Ala Ser Gln Asn Val Gly Thr Asn
1 5
<210> 78
<211> 6
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 78
Tyr Asn Thr Asp Pro Leu
1 5
<210> 79
<211> 10
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 79
His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr
1 5 10
<210> 80
<211> 8
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 80
Ser Thr Ser Gly Met Gly Val Gly
1 5
<210> 81
<211> 12
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 81
Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr
1 5 10
<210> 82
<211> 10
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 82
Ala Arg Thr Arg Arg Tyr Phe Pro Phe Ala
1 5 10
<210> 83
<211> 7
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 83
Gly Thr Asn Val Ala Trp Tyr
1 5
<210> 84
<211> 10
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 84
Leu Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr
1 5 10
<210> 85
<211> 8
<212> PRT
<213> Muridae
<220>
<223> CDR
<400> 85
Gln Gln Tyr Asn Thr Asp Pro Leu
1 5
<210> 86
<211> 119
<212> PRT
<213> Muridae
<220>
<223> VH DOMAIN
<400> 86
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Gln Leu Thr Ile Ser Lys Asp Thr Ser Arg Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Thr Ser Val Asp Thr Ala Asp Ala Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Thr Arg Arg Tyr Phe Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 87
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH DOMAIN
<400> 87
Gln Val Thr Leu Arg Glu Ser Gly Pro Ala Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Thr Arg Arg Tyr Phe Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 88
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> VH DOMAIN
<400> 88
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Val Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Thr Arg Arg Tyr Phe Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 89
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH DOMAIN
<400> 89
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Val Asp Ser
50 55 60
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu
65 70 75 80
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Thr Arg Arg Tyr Phe Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 90
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> VH DOMAIN
<400> 90
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Ser Pro Ser
50 55 60
Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala
65 70 75 80
Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr
85 90 95
Cys Ala Arg Thr Arg Arg Tyr Phe Pro Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 91
<211> 107
<212> PRT
<213> Muridae
<220>
<223> VL DOMAIN
<400> 91
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val His Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Thr Asp Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 92
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL DOMAIN
<400> 92
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Thr Asp Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 93
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL DOMAIN
<400> 93
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Thr Asp Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 94
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL DOMAIN
<400> 94
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Thr Asp Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 95
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 95
Thr Arg Met Tyr Phe Pro Phe Ala Tyr
1 5
<210> 96
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 96
Gly Phe Thr Phe Ser Thr Ser Ser Tyr Gly Met Ser
1 5 10
<210> 97
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 97
Leu Ala Asn Ile Trp Trp Asp Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 98
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 98
Gln Gln Tyr Asn Asn Asp Pro Leu Thr
1 5
<210> 99
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 99
Arg Ala Ser Gln Ser Val Gly Ser Tyr Leu Ala
1 5 10
<210> 100
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 100
Glu Ala Ser Tyr Arg Ala Ser
1 5
<210> 101
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 101
Thr Arg Ile Tyr Phe Pro Phe Ala Tyr
1 5
<210> 102
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 102
Val Ala Asn Ile Trp Trp Asp Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 103
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 103
Arg Ala Ser Gln Ser Val Gly Thr Tyr Val Ala
1 5 10
<210> 104
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 104
Asp Ala Ser Asn Arg Tyr Thr
1 5
<210> 105
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 105
Gly Phe Ser Phe Ser Thr Ser Gly Tyr Gly Met Gly
1 5 10
<210> 106
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 106
Leu Ala Asn Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 107
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 107
Gln Gln Tyr Ser Asn Trp Pro Leu Thr
1 5
<210> 108
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 108
Ala Arg Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 109
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 109
Gln Gln Tyr Asn Thr Trp Pro Leu Thr
1 5
<210> 110
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 110
Gly Phe Ser Leu Ser Thr Ser Ser Met Gly Met Ser
1 5 10
<210> 111
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 111
Arg Ala Ser Gln Asn Val Gly Ser Tyr Val Ala
1 5 10
<210> 112
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 112
Gly Arg Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 113
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 113
Gly Phe Thr Phe Ser Thr Ser Gly Tyr Gly Met Gly
1 5 10
<210> 114
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 114
Gln Gln Tyr Ser Thr Trp Pro Leu Thr
1 5
<210> 115
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 115
Gly Phe Thr Leu Ser Thr Ser Gly Tyr Gly Val Gly
1 5 10
<210> 116
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 116
Leu Ala Asn Ile Trp Trp Asp Ser Asp Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 117
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 117
Arg Ala Ser Gln Asn Val Gly Thr Tyr Leu Ala
1 5 10
<210> 118
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 118
Ser Ala Ser Asn Arg Ala Thr
1 5
<210> 119
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 119
Arg Ala Ser Gln Asp Val Gly Thr Tyr Leu Ala
1 5 10
<210> 120
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 120
Gly Phe Thr Leu Ser Ala Ser Gly Tyr Gly Met Gly
1 5 10
<210> 121
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 121
Val Ala Asn Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 122
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 122
Arg Ala Ser Gln Asn Val Gly Ser Tyr Leu Ala
1 5 10
<210> 123
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 123
Arg Ala Ser Gln Asn Val Gly Thr Tyr Val Ala
1 5 10
<210> 124
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 124
Asp Ala Ser Asn Arg Tyr Ser
1 5
<210> 125
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 125
Thr Asp Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 126
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 126
Gly Phe Thr Phe Ser Thr Ser Gly Trp Ala Trp Gly
1 5 10
<210> 127
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 127
Gln Gln Arg Asn Asn Asp Pro Leu Thr
1 5
<210> 128
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 128
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 129
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 129
Gly Phe Thr Leu Ser Thr Ser Gly Tyr Gly Met Ser
1 5 10
<210> 130
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 130
Ser Ala Ser Asn Arg Ala Ser
1 5
<210> 131
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 131
Ile Arg Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 132
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 132
Leu Ala His Ile Trp Trp Asp Ser Asp Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 133
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 133
Gly Phe Ser Leu Ser Thr Phe Ser Tyr Gly Val Ser
1 5 10
<210> 134
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 134
Asp Ala Ser Tyr Arg Tyr Thr
1 5
<210> 135
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 135
Gly Phe Thr Phe Ser Thr Ser Gly Met Gly Val Ser
1 5 10
<210> 136
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 136
Gly Phe Thr Leu Ser Thr Ser Gly Met Gly Met Ser
1 5 10
<210> 137
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 137
Gln His Tyr Ser Thr Asp Pro Leu Thr
1 5
<210> 138
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 138
Gly Phe Thr Phe Ser Thr Ser Gly Met Gly Met Ser
1 5 10
<210> 139
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 139
Arg Ala Ser Gln Asn Val Gly Ser Asn Val Ala
1 5 10
<210> 140
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 140
Leu Ser His Ile Trp Trp Asp Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 141
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 141
Val Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 142
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 142
Thr Thr Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 143
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 143
His Arg Ile Tyr Phe Pro Phe Ala Tyr
1 5
<210> 144
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 144
Gly Phe Ser Leu Ser Thr Ser Ser Met Gly Met Gly
1 5 10
<210> 145
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 145
Arg Ala Ser Gln Asn Val Gly Thr Asn Val Ala
1 5 10
<210> 146
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 146
Asn Ala Ser Asn Arg Ala Ser
1 5
<210> 147
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 147
Ser Ala Tyr Tyr Arg Ala Thr
1 5
<210> 148
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 148
Gln Gln Tyr Ser Thr Leu Pro Leu Thr
1 5
<210> 149
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 149
Ser Arg Leu Tyr Phe Pro Phe Ala Tyr
1 5
<210> 150
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 150
Gly Phe Thr Leu Ser Thr Ser Gly Met Gly Val Ser
1 5 10
<210> 151
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 151
Gln Gln His Asn Asn Asp Pro Leu Thr
1 5
<210> 152
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 152
Phe Ala Ser Asn Arg Ala Thr
1 5
<210> 153
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 153
Gly Phe Thr Leu Ser Thr Ser Gly Tyr Gly Val Ser
1 5 10
<210> 154
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified
<400> 154
Val Ala His Val Trp Trp Asp Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 155
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 155
Ser Ala Ser Tyr Arg Asp Thr
1 5
<210> 156
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 156
Gly Phe Ser Leu Ser Thr Ser Gly Phe Gly Met Ser
1 5 10
<210> 157
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 157
Thr Val Arg Tyr Phe Pro Phe Ala Tyr
1 5
<210> 158
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 158
Thr Arg Arg Tyr Tyr Pro Phe Ala Tyr
1 5
<210> 159
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 159
Gln Gln Tyr Ser Thr Ser Pro Leu Thr
1 5
<210> 160
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 160
Gly Phe Ser Leu Ser Thr Ser Gly Phe Gly Val Ser
1 5 10
<210> 161
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 161
Asn Arg Leu Tyr Phe Pro Phe Ala Tyr
1 5
<210> 162
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 162
Gly Phe Ser Leu Ser Thr Ser Ser Leu Gly Met Ser
1 5 10
<210> 163
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 163
Gly Phe Thr Leu Ser Thr Ser Gly Met Gly Val Gly
1 5 10
<210> 164
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 164
Arg Ala Ser Gln Asn Val Ser Thr Asn Val Ala
1 5 10
<210> 165
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 165
Gln Gln Tyr Asn Asn Val Pro Leu Thr
1 5
<210> 166
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 166
Val Ala His Ile Trp Trp Glu Asp Glu Lys Tyr Tyr Val Asp Ser Val
1 5 10 15
Lys Gly
<210> 167
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 167
Arg Ala Ser Gln Asn Val Gly Asn Asn Val Ala
1 5 10
<210> 168
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 168
Gln Gln Tyr Ser Thr Glu Pro Leu Thr
1 5
<210> 169
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 169
Gln Gln Tyr Arg Thr Asp Pro Leu Thr
1 5
<210> 170
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 170
Gln Gln His Asn Lys Asp Pro Leu Thr
1 5
<210> 171
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 171
Arg Thr Ser Gln Asn Val Gly Thr Tyr Val Ala
1 5 10
<210> 172
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<400> 172
Leu Ala Ser Asn Arg Val Thr
1 5
<210> 173
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Modified CDR
<220>
<221> VARIANT
<222> 5
<223> T/N
<400> 173
Gln Gln Tyr Ser Xaa Asp Pro Leu Thr
1 5
<210> 174
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR
<220>
<221> VARIANT
<222> 2
<223> A/T
<220>
<221> VARIANT
<222> 5
<223> N/D/S
<220>
<221> VARIANT
<222> 7
<223> G/S
<220>
<221> VARIANT
<222> 8
<223> T/S/N
<220>
<221> VARIANT
<222> 9
<223> N/Y
<220>
<221> VARIANT
<222> 10
<223> V/L
<400> 174
Arg Xaa Ser Gln Xaa Val Xaa Xaa Xaa Xaa Ala
1 5 10
Claims (28)
- 인간 글루코코르티코이드-유도 TNF 수용체 (glucocorticoid-induced TNF receptor: GITR) 및 시노몰구스 원숭이 (cynomolgus monkey) GITR에 특이적으로 결합하는 인간, 인간화 또는 키메라 항체 분자, 또는 그의 항원-결합 부분으로서, 상기 항체 분자 또는 항원-결합 부분은 하기를 갖는 중쇄 가변 영역을 포함하는 항체 분자 또는 항원-결합 부분:
하기 순서로 아미노산 서열을 갖는 HCDR1: F-S-L-S-T-S/F-G-Y-G (서열번호: 7);
하기 순서로 아미노산 서열을 갖는 HCDR2: I-W-W-D-D-D-K-Y-Y-V-D-S-V-K-G (서열번호: 8); 및
하기 순서로 아미노산 서열을 갖는 HCDR3: T-R-Q/L/V-Y-F-P-F-A (서열번호: 9). - 청구항 1에 있어서,
상기 HCDR1은 하기 순서의 아미노산 서열: G-F-S-L-S-T-S/F-G-Y-G-V-G (서열번호: 25)을 포함하고;
상기 HCDR2는 하기 순서의 아미노산 서열: L-A-H-I-W-W-D-D-D-K-Y-Y-V-D-S-V-K-G (서열번호: 26)을 포함하며;
상기 HCDR3은 하기 순서의 아미노산 서열: T-R-Q/L/V-Y-F-P-F-A-Y (서열번호: 27)을 포함하는 것인 항체 분자 또는 항원-결합 부분. - 청구항 1 또는 2에 있어서, 하기를 갖는 경쇄 가변 영역을 포함하는 것인 항체 분자 또는 항원-결합 부분:
하기 순서로 아미노산 서열을 갖는 LCDR1: A-S-Q-N/S-V-G-T/S-N (서열번호: 16);
하기 순서로 아미노산 서열을 갖는 LCDR2: S/Y-A-S-Y/N-R-Y-S/T (서열번호: 17); 및
하기 순서로 아미노산 서열을 갖는 LCDR3: Y-S-T/N-D-P-L (서열번호: 18). - 청구항 3에 있어서,
상기 LCDR1은 하기 순서의 아미노산 서열: R-A-S-Q-N/S-V-G-T/S-N-L-A (서열번호: 28)을 포함하고;
상기 LCDR2는 하기 순서의 아미노산 서열: S/Y-A-S-Y/N-R-Y-S/T (서열번호: 17)을 포함하며;
상기 LCDR3은 하기 순서의 아미노산 서열: Q-Q-Y-S-T/N-D-P-L-T (서열번호: 173)을 포함하는 것인 항체 분자 또는 항원-결합 부분. - 청구항 1 내지 4 중 어느 항에 있어서, 하기를 포함하는 것인 항체 분자 또는 항원-결합 부분:
(a) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 D_A6]; 또는
(b) 아미노산 서열 GFSLSTFGYGVG (서열번호: 35) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGTNLA (서열번호: 36) (LCDR1), YASYRYT (서열번호: 37) (LCDR2) 및 QQYSNDPLT (서열번호: 38) (LCDR3) [클론 G_G10]; 또는
(c) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRLYFPFAY (서열번호: 39) (HCDR3), RASQNVGSNLA (서열번호: 40) (LCDR1), SASNRYS (서열번호: 41) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 I_C2]; 또는
(d) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRVYFPFAY (서열번호: 42) (HCDR3), RASQNVGTNLA (서열번호: 43) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 H_B3]; 또는
(e) 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASNRYT (서열번호: 44) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 A6.1]. - 청구항 1 내지 5 중 어느 항에 있어서, 아미노산 서열 GFSLSTSGYGVG (서열번호: 29) (HCDR1), LAHIWWDDDKYYVDSVKG (서열번호: 26) (HCDR2), TRQYFPFAY (서열번호: 31) (HCDR3), RASQSVGSNLA (서열번호: 32) (LCDR1), SASYRYT (서열번호: 33) (LCDR2) 및 QQYSTDPLT (서열번호: 34) (LCDR3) [클론 D_A6]을 포함하는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 6 중 어느 항에 있어서, WO2006/105021에서 "HuN6C8-Agly"로 표지된 인간화 뮤린 항-GITR IgG 항체와 비교하여 향상된 GITR 활성화를 갖는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 7 중 어느 항에 있어서, WO2006/105021에서 "HuN6C8-Agly"로 표지된 인간화 뮤린 항-GITR IgG 항체와 비교하여 향상된 인 실리코 (in silico) 면역원성을 갖는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 8 중 어느 항에 있어서, WO2006/105021에서 "HuN6C8-Agly"로 표지된 인간화 뮤린 항-GITR IgG 항체와 비교하여 시노몰구스 원숭이 GITR에 대해 향상된 친화도를 갖는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 9 중 어느 항에 있어서, 번역후 변형 부위, 예를 들어 글리코실화 부위, 탈아미드화 부위, 인산화 부위 또는 이성질체화/단편화 부위를 제거하는 하나 이상의 치환, 결실 또는 삽입을 포함하는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 10 중 어느 항에 있어서, 상기 CDR이 삽입된 하나 이상의 인간 가변 도메인 프레임워크 스캐폴드 (scaffolds)를 포함하는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 11 중 어느 항에 있어서, 상응하는 HCDR 서열이 삽입된 IGHV3-7 인간 생식세포 스캐폴드를 포함하는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 8 중 어느 항에 있어서, 상응하는 LCDR 서열이 삽입된 IGKV3-11 인간 생식세포 스캐폴드를 포함하는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 13 중 어느 항에 있어서, 면역학적으로 불활성인 불변 영역을 포함하는 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 14 중 어느 항에 있어서, Fab 단편, F(ab)2 단편, Fv 단편, 4량체 항체, 4가 항체, 다가특이적 항체 (예를 들어, 2가 항체), 도메인-특이적 항체, 단일 도메인 항체, 모노클로날 항체 또는 융합 단백질인 것인 항체 분자 또는 항원-결합 부분.
- 청구항 1 내지 15 중 어느 항에 정의된 항체 분자 또는 그의 항원-결합 부분이 치료제에 연결되어 있는 면역접합체.
- 청구항 1 내지 15 중 어느 항에 정의된 항체 분자 또는 그의 항원-결합 부분을 코딩하는 핵산 분자.
- 청구항 17의 핵산 분자를 포함하는 벡터.
- 청구항 17에 정의된 핵산 분자 또는 청구항 18에 정의된 벡터를 포함하는 숙주 세포.
- 항-GITR 항체 및/또는 그의 항원-결합 부분을 제조하는 방법으로서, 청구항 19에 정의된 숙주 세포를, 상기 항체 및/또는 그의 항원-결합 부분의 발현 및/또는 생산을 유도하는 조건하에 배양하는 단계, 및 상기 항체 및/또는 그의 항원-결합 부분을 상기 숙주 세포 또는 배양물로부터 단리시키는 단계를 포함하는 방법.
- 청구항 1 내지 15 중 어느 항에 정의된 항체 분자 또는 그의 항원-결합 부분, 또는 청구항 17에 정의된 핵산 분자, 또는 청구항 18에 정의된 벡터를 포함하는 약학적 조성물.
- 피험체에서 면역 반응을 증강시키는 방법으로서, 청구항 1 내지 15 중 어느 항에 정의된 항체 분자 또는 그의 항원-결합 부분, 또는 청구항 16에 정의된 면역접합체, 또는 청구항 17에 정의된 핵산 분자, 또는 청구항 18에 정의된 벡터, 또는 청구항 21에 정의된 약학적 조성물의 유효한 양을 투여하는 단계를 포함하는 방법.
- 피험체에서 암을 치료 또는 예방하는 방법으로서, 청구항 1 내지 15 중 어느 항에 정의된 항체 분자 또는 그의 항원-결합 부분, 또는 청구항 16에 정의된 면역접합체, 또는 청구항 17에 정의된 핵산 분자, 또는 청구항 18에 정의된 벡터, 또는 청구항 21에 정의된 약학적 조성물의 유효한 양을 투여하는 단계를 포함하는 방법.
- 청구항 23에 있어서, 상기 암은 췌장암, 흑색종, 유방암, 폐암, 기관지암, 결장직장암, 전립선암, 위암, 난소암, 방광암 (urinary bladder cancer), 뇌 또는 중추신경계 암, 말초 신경계 암, 식도암, 자궁경부암, 자궁 또는 자궁내막 암, 구강 또는 인두 암, 간암, 신장암, 고환암, 담도암, 소장 또는 충수 암, 침샘암, 갑상선암, 부신암 (adrenal gland cancer), 골육종, 연골육종, 및 혈액 조직 (hematological tissues) 암으로 구성된 그룹으로부터 선택되는 것인 방법.
- 암 치료에 사용하기 위한, 청구항 1 내지 15 중 어느 항에 정의된 항체 분자 또는 그의 항원-결합 부분, 또는 청구항 16에 정의된 면역접합체, 또는 청구항 17에 정의된 핵산 분자, 또는 청구항 18에 정의된 벡터, 또는 청구항 21에 정의된 약학적 조성물.
- 청구항 23 내지 25 중 어느 항에 있어서, 상기 항체, 그의 항원-결합 부분, 면역접합체, 핵산, 벡터 또는 약학적 조성물은 제2 치료제, 예를 들어 항암제와 조합된 조합 형태로 개별적으로, 순차적으로 또는 동시에 사용하기 위한 것인 항체 분자, 또는 그의 항원-결합 부분, 또는 면역접합체, 또는 핵산 분자, 또는 벡터, 또는 치료 방법.
- 암 치료용 약제의 제조에 있어서, 청구항 1 내지 15 중 어느 항에 정의된 항체 분자 또는 그의 항원-결합 부분, 또는 청구항 16에 정의된 면역접합체, 또는 청구항 17에 정의된 핵산 분자, 또는 청구항 18에 정의된 벡터, 또는 청구항 21에 정의된 약학적 조성물의 용도.
- 인간 GITR 및 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 생산하는 방법으로서, 하기 단계를 포함하는 것인 방법:
(1) 비-인간 출처 유래의 항-GITR CDR을 인간 v-도메인 프레임워크에 이식하여 인간화 항-GITR 항체 분자 또는 그의 항원-결합 부분을 생산하는 단계;
(2) 상기 CDR에서 하나 이상의 돌연변이를 포함하는 인간화 항-GITR 항체 분자 또는 그의 항원-결합 부분의 클론의 파지 라이브러리 (phage library)를 생성하는 단계;
(3) 인간 GITR 및 시노몰구스 원숭이 GITR로의 결합에 대해 상기 파지 라이브러리를 스크리닝 (screening)하는 단계;
(4) 상기 스크리닝 단계 (3)로부터 인간 GITR 및 시노몰구스 원숭이 GITR에 대해 결합 특이성을 갖는 클론을 선택하는 단계; 및
(5) 상기 단계 (4)로부터 선택된 클론으로부터 인간 GITR 및 시노몰구스 원숭이 GITR에 특이적으로 결합하는 항체 분자 또는 그의 항원-결합 부분을 생산하는 단계.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1701351.7 | 2017-01-27 | ||
| GBGB1701351.7A GB201701351D0 (en) | 2017-01-27 | 2017-01-27 | Binding agents |
| GB1713296.0 | 2017-08-18 | ||
| GBGB1713296.0A GB201713296D0 (en) | 2017-08-18 | 2017-08-18 | Binding agents |
| PCT/GB2018/050239 WO2018138521A1 (en) | 2017-01-27 | 2018-01-26 | Binding agents |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190112299A true KR20190112299A (ko) | 2019-10-04 |
Family
ID=61132825
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197025095A KR20190112299A (ko) | 2017-01-27 | 2018-01-26 | 결합제 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US10457736B2 (ko) |
| EP (1) | EP3574013A1 (ko) |
| JP (1) | JP7169296B2 (ko) |
| KR (1) | KR20190112299A (ko) |
| CN (1) | CN110475787A (ko) |
| AU (1) | AU2018213124A1 (ko) |
| BR (1) | BR112019015453A2 (ko) |
| CA (1) | CA3051797A1 (ko) |
| IL (1) | IL268288A (ko) |
| MX (1) | MX2019008905A (ko) |
| RU (1) | RU2019125975A (ko) |
| SG (1) | SG11201906963QA (ko) |
| WO (1) | WO2018138521A1 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220153516A (ko) * | 2021-05-10 | 2022-11-18 | 메디맵바이오 주식회사 | 항-gitr 항체 및 이의 용도 |
| CN118050505A (zh) * | 2024-04-15 | 2024-05-17 | 南京佰抗生物科技有限公司 | 一种多联检荧光免疫层析检测卡 |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102123322B1 (ko) | 2019-11-01 | 2020-06-16 | 주식회사 미래에스엠 | 상판 오픈형 다용도 선반 |
| KR20210132400A (ko) | 2020-04-27 | 2021-11-04 | 유미경 | 다용도 선반 |
| TW202246334A (zh) * | 2021-02-02 | 2022-12-01 | 美商美國禮來大藥廠 | Gitr拮抗劑及其使用方法 |
| WO2023060144A1 (en) * | 2021-10-05 | 2023-04-13 | Lanier Biotherapeutics | Monoclonal antibodies to il-25 and uses thereof |
| IL314907A (en) | 2022-03-15 | 2024-10-01 | Yeda Res & Dev | Antibodies against GITR and their uses |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2343320B1 (en) * | 2005-03-25 | 2017-10-25 | GITR, Inc. | Anti-gitr antibodies and uses thereof |
| EP2473531A4 (en) | 2009-09-03 | 2013-05-01 | Merck Sharp & Dohme | ANTI-GITRANT ANTIBODIES |
| TW201605896A (zh) | 2013-08-30 | 2016-02-16 | 安美基股份有限公司 | Gitr抗原結合蛋白 |
| JP6847666B2 (ja) * | 2014-05-28 | 2021-03-24 | アジェナス インコーポレイテッド | 抗gitr抗体及びその使用法 |
| JP6449338B2 (ja) | 2014-06-06 | 2019-01-09 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | グルココルチコイド誘導腫瘍壊死因子受容体(gitr)に対する抗体およびその使用 |
| MA41044A (fr) | 2014-10-08 | 2017-08-15 | Novartis Ag | Compositions et procédés d'utilisation pour une réponse immunitaire accrue et traitement contre le cancer |
-
2018
- 2018-01-26 BR BR112019015453-1A patent/BR112019015453A2/pt unknown
- 2018-01-26 AU AU2018213124A patent/AU2018213124A1/en not_active Abandoned
- 2018-01-26 SG SG11201906963QA patent/SG11201906963QA/en unknown
- 2018-01-26 WO PCT/GB2018/050239 patent/WO2018138521A1/en unknown
- 2018-01-26 KR KR1020197025095A patent/KR20190112299A/ko not_active Application Discontinuation
- 2018-01-26 EP EP18702550.7A patent/EP3574013A1/en not_active Withdrawn
- 2018-01-26 JP JP2019561375A patent/JP7169296B2/ja active Active
- 2018-01-26 CA CA3051797A patent/CA3051797A1/en active Pending
- 2018-01-26 CN CN201880020490.8A patent/CN110475787A/zh active Pending
- 2018-01-26 RU RU2019125975A patent/RU2019125975A/ru unknown
- 2018-01-26 MX MX2019008905A patent/MX2019008905A/es unknown
- 2018-08-17 US US16/104,434 patent/US10457736B2/en active Active
-
2019
- 2019-05-29 US US16/424,676 patent/US20190375846A1/en not_active Abandoned
- 2019-07-28 IL IL268288A patent/IL268288A/en unknown
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220153516A (ko) * | 2021-05-10 | 2022-11-18 | 메디맵바이오 주식회사 | 항-gitr 항체 및 이의 용도 |
| CN118050505A (zh) * | 2024-04-15 | 2024-05-17 | 南京佰抗生物科技有限公司 | 一种多联检荧光免疫层析检测卡 |
Also Published As
| Publication number | Publication date |
|---|---|
| US10457736B2 (en) | 2019-10-29 |
| RU2019125975A (ru) | 2021-03-01 |
| MX2019008905A (es) | 2019-11-18 |
| US20190375846A1 (en) | 2019-12-12 |
| RU2019125975A3 (ko) | 2021-10-01 |
| CN110475787A (zh) | 2019-11-19 |
| JP7169296B2 (ja) | 2022-11-10 |
| IL268288A (en) | 2019-09-26 |
| US20190010241A1 (en) | 2019-01-10 |
| WO2018138521A1 (en) | 2018-08-02 |
| JP2020505075A (ja) | 2020-02-20 |
| EP3574013A1 (en) | 2019-12-04 |
| CA3051797A1 (en) | 2018-08-02 |
| AU2018213124A1 (en) | 2019-09-12 |
| BR112019015453A2 (pt) | 2020-03-24 |
| SG11201906963QA (en) | 2019-08-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11370840B2 (en) | Method of using anti-CD47 antibody molecules | |
| JP7458569B2 (ja) | Cd47結合剤 | |
| US20160194402A1 (en) | Cd70-binding peptides and method, process and use relating thereto | |
| CN111683970A (zh) | C-kit结合剂 | |
| KR20190112299A (ko) | 결합제 | |
| JP2020504171A (ja) | 抗PD−1抗体との組み合わせのための抗Tim−3抗体 | |
| JP7419238B2 (ja) | Pd1結合剤 | |
| US20230295311A1 (en) | Anti c-met antibodies | |
| KR20220091490A (ko) | Pd1 및 vegfr2 이중 결합제 | |
| TW201702263A (zh) | 抗-cd20-/抗-baff雙特異性抗體 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |