KR20170096220A - 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 - Google Patents
중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 Download PDFInfo
- Publication number
- KR20170096220A KR20170096220A KR1020177022493A KR20177022493A KR20170096220A KR 20170096220 A KR20170096220 A KR 20170096220A KR 1020177022493 A KR1020177022493 A KR 1020177022493A KR 20177022493 A KR20177022493 A KR 20177022493A KR 20170096220 A KR20170096220 A KR 20170096220A
- Authority
- KR
- South Korea
- Prior art keywords
- alkyl
- substituted
- disease
- quot
- diol
- Prior art date
Links
- 0 *OC(N1C=C(C(F)(F)F)C=CC1)=O Chemical compound *OC(N1C=C(C(F)(F)F)C=CC1)=O 0.000 description 4
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/40—Oxygen atoms
- C07D211/44—Oxygen atoms attached in position 4
- C07D211/46—Oxygen atoms attached in position 4 having a hydrogen atom as the second substituent in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/40—Oxygen atoms
- C07D211/44—Oxygen atoms attached in position 4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/191—Carboxylic acids, e.g. valproic acid having two or more hydroxy groups, e.g. gluconic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/451—Non condensed piperidines, e.g. piperocaine having a carbocyclic group directly attached to the heterocyclic ring, e.g. glutethimide, meperidine, loperamide, phencyclidine, piminodine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/92—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with a hetero atom directly attached to the ring nitrogen atom
- C07D211/96—Sulfur atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Psychology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Hydrogenated Pyridines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
본 발명은 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 화합물, 및 이를 사용하는 조성물과 방법을 제공한다. 특히, 본 발명은 파킨슨병을 예방 및/또는 치료하는 방법을 제공한다.
Description
관련 출원과의 상호 참조
본 출원은 2009년 10월 19일자로 출원된 미국 가출원 제61/252,803호의 이익을 주장하며, 이의 내용은 본원에 참조로 포함된다.
기술분야
본 발명은 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 약리학적 샤페론으로 알려진 신규 화합물, 및 이를 사용하는 조성물과 방법을 제공한다. 특히, 본 발명은 파킨슨병을 예방 및/또는 치료하는 방법을 제공한다.
중추신경계의 많은 퇴행성 질환은 단백질 또는 지질의 병리학적 응집과 연관된다. 예를 들어, 시뉴클레인병증(synucleinopathy)은 시뉴클레인 단백질 항상성의 붕괴에서 발생하는 질환의 그룹이다. 특히, 알파-시뉴클레인 응집은 루이소체(Lewy bodies)를 특징으로 하는 병리학적 상태, 예를 들어 파킨슨병, 루이소체 치매 및 다계통위축과 연관된다. 또한, 알파-시뉴클레인 절편, 즉 비 아베타 구성 요소(non-Abeta component)가 알츠하이머병의 아밀로이드 플라크에서 발견된다. 최근에는, 뇌에서 시뉴클레인의 축적을 방지하기 위하여 뇌에서 글루코세레브로시다아제(베타-글루코시다아제; GCase) 활성의 향상이 보여졌다(문헌[Sean Clark, Ying Sun, You-Hai Xu, Gregory Grabowski, 및 Brandon Wustman, “A biochemical link between Gaucher and Parkinson's disease and a potential new approach to treating synucleinopathies: a pharmacological chaperone for beta-glucocerebrosidase prevents accumulation of alpha-synuclein in a Parkinson's mouse model,” 신경과학 학회 연례 회의(Society for Neuroscience Annual Meeting)에서 제출됨, San Diego, CA, 2007]). 따라서, GCase 활성을 향상시키는 제제는 중추신경계의 퇴행성 질환을 발병시키거나 진단될 위험이 있는 환자에 대한 경감을 제공할 수 있다.
환자에게 더 높은 질의 삶을 제공하고 더 나은 임상 결과를 달성하는 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는데 사용될 수 있는 새로운 치료 화합물에 대한 필요성이 있다. 특히, 환자에게 더 높은 질의 삶을 제공하고 더 나은 임상 결과를 달성하는 시뉴클레인병증, 예를 들어 파킨슨병 및 알츠하이머병을 예방 및/또는 치료하는 새로운 치료 화합물에 대한 필요성이 있다.
본 발명은, 중추신경계의 퇴행성 질환을 발병시키거나 진단될 위험이 있는 환자에서 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 화합물 및 이를 사용하는 조성물과 방법을 제공하고, 본원에 기재된 화합물의 유효량을 중추신경계의 퇴행성 질환의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 것을 포함한다.
하나의 양태에서, 중추신경계의 퇴행성 질환을 발병시키거나 진단될 위험이 있는 환자에서 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 화합물 및 이를 사용하는 조성물과 방법이 제공되고, 화학식 I에 정의된 화합물의 유효량을 중추신경계의 퇴행성 질환의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 것을 포함하며,
[화학식 I]
여기에서,
R1은 C(R2)(R3)(R4)이고;
R2는 수소, -OH 또는 할로겐이며;
R3은 수소, -OH, 할로겐 또는 C1-8 알킬이고;
R4는 할로겐, C1-8 알킬, 치환된 C1-8 알킬, 아릴, 치환된 아릴, 알킬사이클로알킬 또는 치환된 알킬사이클로알킬이며;
R3 및 R4는 이들이 부착된 탄소와 결합하여 사이클로알킬 고리를 형성할 수 있고, 이는 선택적으로 바람직하게 할로겐, 보다 바람직하게는 하나 이상의 플루오린 원자로 치환될 수 있으며;
R6은 수소, C1-8 알킬, 치환된 C1-8 알킬, 아릴알킬, 치환된 아릴알킬, 알킬아릴 또는 치환된 알킬아릴이고;
Z는 선택적이며, 존재한다면 Z는 -(CH2)1-8-, -C(=O)-, -S(=O)2NH-, -S(=O)2-, -C(=S)NH-, -S(=O)2-CH3, C(=O)-NH-, -S(=O)2-NR9R10, -C(=O)C1-8 알킬 또는 -C(=O)CH(NH2)CH3이고;
R9는 수소, C1-8 알킬 또는 치환된 C1-8 알킬이며;
R10은 수소, C1-8 알킬 또는 치환된 C1-8 알킬이고;
R5는 수소, C1-8 알킬, 치환된 C1-8 알킬, 아릴, 치환된 아릴, C1-8 알케닐, 치환된 C1-8 알케닐, 아릴알킬, 치환된 아릴알킬, 알킬아릴, 치환된 알킬아릴, 아미노아릴알킬 또는 치환된 아미노아릴알킬이며;
R7은 -OH 또는 할로겐이고;
R8은 수소, 할로겐 또는 C1-8 알킬이며,
만약 R4가 할로겐일 때 R2 및 R3이 둘 다 수소일 수 없다면, Z는 존재하지 않고, R7은 -OH이며, R5, R6 및 R8은 수소이다.
다른 양태에서, 중추신경계의 퇴행성 질환을 발병시키거나 진단될 위험이 있는 환자에서 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 화합물 및 이를 사용하는 조성물과 방법이 제공되고, 화학식 II에 정의된 화합물의 유효량을 중추신경계의 퇴행성 질환의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 것을 포함하며,
[화학식 II]
여기에서,
R1은 C(R2)(R3)(R4)이고;
R2는 수소, -OH 또는 할로겐이며;
R3은 수소, -OH, 할로겐 또는 -CH3이고;
R4는 할로겐, -CH3, 페닐, 플루오로페닐, 메틸페닐, 사이클로헥실메틸이며, 여기에서 R4가 할로겐일 때, R2 및 R3은 둘 다 수소일 수 없고;
R3 및 R4는 이들이 부착된 탄소와 결합하여 사이클로알킬 고리를 형성할 수 있으며, 이는 선택적으로 하나 이상의 할로겐 원자로 치환될 수 있고;
R6 은 수소, 페닐알킬 또는 치환된 페닐알킬이며;
Z는 선택적이고, 존재한다면 Z는 -(CH2)-, -C(=O)-, -S(=O)2NH-, -S(=O)2-, -S(=O)2-CH3, C(=O)-NH-, -S(=O)2NR9R10, -C(=S)-NH- 또는 -C(=O)2-CH3이며;
R9는 수소 또는 CH3이고;
R10은 수소 또는 CH3이며;
R5는 수소 또는 아미노페닐알킬이고;
R7은 -OH 또는 할로겐이며;
R8은 수소, 할로겐 또는 -CH3이고,
만약 R4가 할로겐일 때 R2 및 R3이 둘 다 수소일 수 없다면, Z는 존재하지 않으며, R7은 -OH이고, R5, R6 및 R8은 수소이다.
또 다른 양태에서, 중추신경계의 퇴행성 질환을 발병시키거나 진단될 위험이 있는 환자에서 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 화합물 및 이를 사용하는 조성물과 방법이 제공되고, 화학식 III에 정의된 화합물의 유효량을 중추신경계의 퇴행성 질환의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 것을 포함하며,
[화학식 III]
여기에서,
R1은 C(R2)(R3)(R4)이고;
R2는 수소, -OH 또는 할로겐이며;
R3은 수소, -OH, 할로겐 또는 -CH3이고;
R4는 할로겐, -CH3, 페닐, 플루오로페닐, 메틸페닐, 사이클로헥실메틸이며, 여기에서 R4가 할로겐일 때, R2 및 R3은 둘 다 수소일 수 없고;
R3 및 R4는 이들이 부착된 탄소와 결합하여 사이클로알킬 고리를 형성할 수 있으며, 이는 선택적으로 하나 이상의 할로겐 원자로 치환될 수 있고;
R7은 -OH 또는 할로겐이며;
R8은 수소, 할로겐 또는 -CH3이고,
만약 R4가 할로겐일 때 R2 및 R3이 둘 다 수소일 수 없다면, R7은 -OH이며, R6 및 R8은 수소이다.
상기 언급된 화학식 I, II 및 III에서 R2, R3 및 R4는 불안정한 분자를 만들도록 선택되지 않을 것임을 당업자는 이해한다.
또 다른 양태에서, 중추신경계의 퇴행성 질환을 발병시키거나 진단될 위험이 있는 환자에서 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 화합물 및 이를 사용하는 조성물과 방법이 제공되고, 하기로부터 선택되는 화합물, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물의 유효량을 중추신경계의 퇴행성 질환의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 것을 포함한다.
하나의 실시형태에서, 화합물은 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5S)-5-벤질피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물이다. 하나의 실시형태에서, 화합물은 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물이다. 하나의 실시형태에서, 화합물은 (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물이다. 하나의 구체예에서, 화합물은 (3R,4R,5S)-5-벤질피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물이다.
하나의 실시형태에서, 퇴행성 질환은 시뉴클레인병증이다. 하나의 실시형태에서, 퇴행성 질환은 루이소체를 특징으로 한다. 하나의 실시형태에서, 퇴행성 질환은 파킨슨병, 루이소체 치매, 다계통위축 또는 알츠하이머병이다. 하나의 실시형태에서, 퇴행성 질환은 적어도 하나의 단백질의 응집과 연관된다. 하나의 실시형태에서, 퇴행성 질환은 알파-시뉴클레인의 응집과 연관된다. 하나의 실시형태에서, 퇴행성 질환은 비 아베타 구성 요소의 응집과 연관된다. 하나의 실시형태에서, 퇴행성 질환은 적어도 하나의 당지질의 축적과 연관된다. 하나의 실시형태에서, 퇴행성 질환은 적어도 하나의 글리코스핑고지질의 축적과 연관된다. 하나의 실시형태에서, 퇴행성 질환은 글루코세레브로시드의 축적과 연관된다. 하나의 실시형태에서, 퇴행성 질환은 글루코세레브로시다아제 내 돌연변이와 연관된다. 하나의 실시형태에서, 본 방법은 적어도 하나의 다른 치료제의 유효량을 투여하는 것을 추가로 포함한다. 하나의 실시형태에서, 적어도 하나의 다른 치료제는 레보도파, 항콜린제, 카테콜-O-메틸트랜스퍼라아제 억제제, 도파민 수용체 작용제, 모노아민 옥시다아제 억제제, 말초 탈카르복실라아제 억제제(peripheral decarboxylase inhibitor) 또는 항염제이다.
본 발명은 또한 파킨슨병을 발병시키거나 진단될 위험이 있는 환자에서 파킨슨병을 예방 및/또는 치료하는 방법을 제공하며, 이는 상기 언급된 화합물 중 임의의 것, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물, 또는 이의 둘 이상의 임의의 조합의 유효량을 파킨슨병의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 것을 포함한다.
하나의 실시형태에서, 본 발명은 화합물 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5S)-5-벤질피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물을 투여하는 것을 포함한다. 하나의 실시형태에서, 상기 방법은 화합물 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물을 투여하는 것을 포함한다. 하나의 실시형태에서, 상기 방법은 화합물 (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물을 투여하는 것을 포함한다. 하나의 실시형태에서, 상기 방법은 화합물 (3R,4R,5S)-5-벤질피페리딘-3,4-디올, 또는 이의 약학적으로 허용되는 염, 용매화물 또는 전구약물을 투여하는 것을 포함한다.
하나의 실시형태에서, 상기 방법은 적어도 하나의 다른 치료제의 유효량을 투여하는 것을 포함한다. 하나의 실시형태에서, 적어도 하나의 다른 치료제는 레보도파, 항콜린제, 카테콜-O-메틸트랜스퍼라아제 억제제, 도파민 수용체 작용제, 모노아민 옥시다아제 억제제, 말초 탈카르복실라아제 억제제 또는 항염제이다.
본 발명은 또한 하기를 포함하는 키트를 제공한다:
● 단독으로 또는 조합하여 본 발명의 화합물 중 임의의 것의 유효량을 포함하는 용기; 및
● 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 상기 키트의 사용 지침.
하나의 실시형태에서, 중추신경계의 퇴행성 질환은 파킨슨병이다. 하나의 실시형태에서, 중추신경계의 퇴행성 질환은 알츠하이머병이다.
본원에서 사용된 하기 용어는 이하에 설명된 정의를 가질 것이다.
본원에서 사용된 어구 “중추신경계의 퇴행성 질환”는 중추신경계의 임의의 구성 요소, 예를 들어 뉴런, 미엘린초 또는 축색 돌기(axon)의 조기 퇴화와 연관된 임의의 질환을 의미한다. 이러한 질환은 이에 한정되는 것은 아니지만, 다발경색성치매, 헌팅턴병, 피크병, 근위축성측색경화증, 크로츠펠트-야콥병, 전두엽치매, 기저피질퇴화, 진행성핵상마비, 파킨슨병, 루이소체 치매, 다계통위축 또는 알츠하이머병를 포함한다.
본원에서 사용된 용어 “치료”는 언급된 질환과 연관된 하나 이상의 증상을 개선시키는 것을 의미한다.
본원에서 사용된 용어 “예방”은 언급된 질환의 증상을 완화시키는 것을 의미한다.
본원에서 사용된 어구 “유효량”은 언급된 질환을 발병시키거나 진단될 위험이 있는 환자를 예방 및/또는 치료하며, 따라서 원하는 치료 효과를 가져오는데 효과적인 양을 의미한다.
본원에서 사용된 용어 “환자”는 포유동물(예컨대, 인간)을 의미한다.
하기 열거된 것은 본 발명을 기술하는데 사용된 다양한 용어의 화학적 정의이다. 개별적으로 또는 더 큰 기(group)의 일부로서 구체적인 예에서 달리 한정되지 않는다면, 이들 정의는 본 명세서 전체에 걸쳐 사용된 용어에 적용된다.
용어 “알킬”은, 탄소 원자가 1개 내지 20개, 바람직하게는 탄소 원자가 1개 내지 8개, 보다 바람직하게는 탄소 원자가 1개 내지 6개인 직쇄 또는 분지쇄의 비치환된 탄화수소기를 지칭한다. 표현 “저급 알킬”은 탄소 원자가 1개 내지 4개인 비치환된 알킬기를 지칭한다.
용어 “치환된 알킬”은, 예를 들어 1개 내지 4개의 치환기, 예를 들어 할로, 하이드록시, 알콕시, 옥소, 알카노일, 아릴옥시, 알카노일옥시, 아미노, 알킬아미노, 아릴아미노, 아랄킬아미노, 2개의 아미노 치환기가 알킬, 아릴 또는 아랄킬로부터 선택된 이치환된 아민; 알카노일아미노, 아로일아미노, 아랄카노일아미노, 치환된 알카노일아미노, 치환된 아릴아미노, 치환된 아랄카노일아미노, 티올, 알킬티오, 아릴티오, 아랄킬티오, 알킬티오노, 아릴티오노, 아랄킬티오노, 알킬술포닐, 아릴술포닐, 아랄킬술포닐, 술폰아미도, 예컨대 SO2NH2, 치환된 술폰아미도, 니트로, 시아노, 카르복시, 카르바밀, 예컨대 CONH2, 치환된 카르바밀, 예컨대 CONH알킬, CONH아릴, CONH아랄킬 또는 질소 상에 알킬, 아릴 또는 아랄킬로부터 선택된 2개의 치환기가 있는 경우; 알콕시카르보닐, 아릴, 치환된 아릴, 구아니디노 및 복소환, 예를 들어 인돌릴, 이미다졸릴, 푸릴, 티에닐, 티아졸릴, 피롤리딜, 피리딜, 피리미딜 등으로 치환된 알킬기를 지칭한다. 상기 언급된 것에서 치환기가 추가로 치환되는 경우, 알킬, 알콕시, 아릴 또는 아랄킬로 치환될 것이다.
용어 “할로겐” 또는 “할로”는 플루오린, 염소, 브롬 및 요오드를 지칭한다.
용어 “아릴”은 페닐기, 나프틸기, 바이페닐기 및 디페닐기와 같은 고리 부분 내 탄소 원자가 6개 내지 12개인 모노사이클릭 또는 바이사이클릭 방향족 탄화수소기를 지칭하며, 이들 각각은 치환될 수 있다.
용어 “아랄킬”은 벤질과 같은 알킬 기를 통해 직접 결합된 아릴기를 지칭한다. 유사하게, 용어 “알킬아릴”은 메틸벤질과 같은 아릴기를 통해 직접 결합된 알킬기를 지칭한다.
용어 “치환된 아릴”은, 예를 들어 1개 내지 4개의 치환기, 예를 들어 알킬, 치환된 알킬, 할로, 트리플루오로메톡시, 트리플루오로메틸, 하이드록시, 알콕시, 알카노일, 알카노일옥시, 아미노, 알킬아미노, 아랄킬아미노, 디알킬아미노, 알카노일아미노, 티올, 알킬티오, 우레이도, 니트로, 시아노, 카르복시, 카르복시알킬, 카르바밀, 알콕시카르보닐, 알킬티오노, 아릴티오노, 아릴술포닐아민, 술폰산, 알킬술포닐, 술폰아미도, 아릴옥시 등으로 치환된 아릴기를 지칭한다. 치환기는 하이드록시, 알킬, 알콕시, 아릴, 치환된 아릴, 치환된 알킬 또는 아랄킬로 추가로 치환될 수 있다.
용어 “헤테로아릴”은, 예를 들어 4원 내지 7원의 모노사이클릭, 7원 내지 11원의 바이사이클릭, 또는 10원 내지 15원의 트리사이클릭 고리계이고, 적어도 하나의 헤테로원자 및 적어도 하나의 탄소 원자 함유 고리, 예를 들어 피리딘, 테트라졸, 인다졸을를 가지는, 선택적으로 치환된 방향족기를 지칭한다.
용어 “알케닐”은, 탄소 원자가 2개 내지 20개, 바람직하게는 탄소 원자가 2개 내지 15개, 가장 바람직하게는 탄소 원자가 2개 내지 8개이며, 1개 내지 4개의 이중결합을 가지는, 직쇄 또는 분지쇄의 탄화수소기를 지칭한다.
용어 “치환된 알케닐”은 예를 들어 1개 내지 2개의 치환기, 예를 들어 할로, 하이드록시, 알콕시, 알카노일, 알카노일옥시, 아미노, 알킬아미노, 디알킬아미노, 알카노일아미노, 티올, 알킬티오, 알킬티오노, 알킬술포닐, 술폰아미도, 니트로, 시아노, 카르복시, 카르바밀, 치환된 카르바밀, 구아니디노, 인돌릴, 이미다졸릴, 푸릴, 티에닐, 티아졸릴, 피롤리딜, 피리딜, 피리미딜 등으로 치환되는 알케닐기를 지칭한다.
용어 “알키닐”은 탄소 원자가 2개 내지 20개, 바람직하게는 탄소 원자가 2개 내지 15개, 가장 바람직하게는 탄소 원자가 2개 내지 8개이며, 1개 내지 4개의 삼중결합을 가지는, 직쇄 또는 분지쇄의 탄화수소기를 지칭한다.
용어 “치환된 알키닐”은 예를 들어 치환기, 예를 들어 할로, 하이드록시, 알콕시, 알카노일, 알카노일옥시, 아미노, 알킬아미노, 디알킬아미노, 알카노일아미노, 티올, 알킬티오, 알킬티오노, 알킬술포닐, 술폰아미도, 니트로, 시아노, 카르복시, 카르바밀, 치환된 카르바밀, 구아니디노 및 헤테로사이클로, 예컨대 이미다졸릴, 푸릴, 티에닐, 티아졸릴, 피롤리딜, 피리딜, 피리미딜 등으로 치환되는 알키닐기를 지칭한다.
용어 “사이클로알킬”은, 바람직하게 고리를 1개 내지 3개 및 불포화 C3~C7의 카르보사이클릭 고리와 추가로 융합될 수 있는 탄소를 고리 당 3개 내지 7개 함유하는 선택적으로 치환, 포화된 사이클릭 탄화수소 고리계를 지칭한다. 예시적인 기는 사이클로프로필, 사이클로부틸, 사이클로펜틸, 사이클로헥실, 사이클로헵틸, 사이클로옥틸, 사이클로데실, 사이클로도데실 및 아다만틸을 포함한다. 예시적인 치환기는 상기 기재된 하나 이상의 알킬기, 또는 알킬 치환기로서 상기 기재된 하나 이상의 기를 포함한다.
용어 “헤테로사이클”, “헤테로사이클릭” 및 “헤테로사이클로”는, 예를 들어 4원 내지 7원의 모노사이클릭, 7원 내지 11원의 바이사이클릭, 또는 10원 내지 15원의 트리사이클릭 고리계이며, 적어도 하나의 탄소 원자 함유 고리 내에 적어도 하나의 헤테로원자를 가지는, 선택적으로 치환된, 완전 포화 또는 불포화 방향족 또는 비방향족 사이클릭기를 지칭한다. 헤테로원자를 함유하는 헤테로사이클릭기의 각각의 고리는 질소 원자, 산소 원자 및 황 원자로부터 선택된 1개, 2개 또는 3개의 헤테로원자를 가질 수 있으며, 여기에서 질소 및 황 헤테로원자는 또한 선택적으로 산화될 수 있고 질소 헤테로원자는 또한 선택적으로 4차화(quaternized)될 수 있다. 헤테로사이클릭기는 임의의 헤테로원자 또는 탄소 원자에서 부착될 수 있다.
예시적인 모노사이클릭 헤테로사이클릭기는 피롤리디닐, 피롤릴, 인돌릴, 피라졸릴, 옥세타닐, 피라졸리닐, 이미다졸릴, 이미다졸리닐, 이미다졸리디닐, 옥사졸릴, 옥사졸리디닐, 이소옥사졸리닐, 이소옥사졸릴, 티아졸릴, 티아디아졸릴, 티아졸리디닐, 이소티아졸릴, 이소티아졸리디닐, 푸릴, 테트라하이드로푸릴, 티에닐, 옥사디아졸릴, 피페리디닐, 피페라지닐, 2-옥소피페라지닐, 2-옥소피페리디닐, 2-옥소피롤리디닐, 2-옥사제피닐, 아제피닐, 4-피페리도닐, 피리딜, N-옥소-피리딜, 피라지닐, 피리미디닐, 피리다지닐, 테트라하이드로피라닐, 모르폴리닐, 티아모르폴리닐, 티아모르폴리닐 술폭사이드, 티아모르폴리닐 술폰, 1,3-디옥솔란 및 테트라하이드로-1, 1-디옥소티에닐, 디옥사닐, 이소티아졸리디닐, 티에타닐, 티라닐(thiiranyl), 트리아지닐 및 트리아졸릴 등을 포함한다.
예시적인 바이사이클릭 헤테로사이클릭 기는 2,3-디하이드로-2-옥소-1H-인돌릴, 벤조티아졸릴, 벤족사졸릴, 벤조티에닐, 퀴뉴클리디닐, 퀴놀리닐, 퀴놀리닐-N-옥사이드, 테트라하이드로이소퀴놀리닐, 이소퀴놀리닐, 벤즈이미다졸릴, 벤조피라닐, 인돌리지닐, 벤조푸릴, 크로모닐, 쿠마리닐, 시놀리닐, 퀴녹사리닐, 인다졸릴, 피롤로피리딜, 푸로피리디닐(예를 들어, 푸로[2,3-c]피리디닐, 푸로[3,1-b]피리디닐] 또는 푸로[2,3-b]피리디닐), 디하이드로이소인돌릴, 디하이드로퀴나졸리닐(예를 들어, 3,4-디하이드로-4-옥소-퀴나졸리닐), 벤즈이소티아졸릴, 벤즈이속사졸릴, 벤조디아지닐, 벤조푸라자닐, 벤조티오피라닐, 벤조트리아졸릴, 벤즈피라졸릴, 디하이드로벤조푸릴, 디하이드로벤조티에닐, 디하이드로벤조티오피라닐, 디하이드로벤조티오피라닐 술폰, 디하이드로벤조피라닐, 인돌리닐, 이소크로마닐, 이소인돌리닐, 나프티리디닐, 프탈라지닐, 피페로닐, 푸리닐, 피리도피리딜, 퀴나졸리닐, 테트라하이드로퀴놀리닐, 티에노푸릴, 티에노피리딜, 티에노티에닐 등을 포함한다.
예시적인 치환기는 상기 기재된 바와 같은 하나 이상의 알킬 또는 아랄킬 기 또는 알킬 치환기로서 상기 기재된 하나 이상의 기를 포함한다.
또한 에폭사이드 및 아지리딘과 같은 더 작은 헤테로사이클도 포함된다.
용어 “헤테로원자”는 산소, 황 및 질소를 포함할 것이다.
파킨슨병은 환자에서 영국 파킨슨병 협회 두뇌 은행 임상 진단 기준(United Kingdom Parkinson's Disease Society brain-bank clinical diagnostic criteria)(문헌[Hughes et al., Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 1992; 55:181-184] 참조) 및/또는 문헌[Gelb et al., Diagnostic Criteria for Parkinson's Disease. Arch Neurol . 1999; 56(1):33-39]에 기술된 기준에 따라서 진단될 수 있다. 유사하게, 파킨슨병의 중증도는 파킨슨병 평가 척도(Unified Parkinson's Disease Rating Scale)를 사용하여 확인할 수 있다. 예를 들어, 문헌[Fahn 및 Elton, Members of the Unified Parkinson's Disease Rating Scale Development Committee. Unified Parkinson's Disease Rating Scale. In: Fahn et al., Recent developments in Parkinson's disease. New York: Macmillan, 1987: 153-163]을 참조한다.
알츠하이머병은 환자에서 문헌[Diagnostic and Statistical Manual of Mental Disorders, 4th ed.: DSM-IV. Washington, D.C.: American Psychiatric Association, 1994]의 알츠하이머형 치매에 대한 기준에 따라서 진단될 수 있다. 유사하게, 예상되는 알츠하이머병에 대한 기준은 [National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer's Disease and Related Disorders Association]의 기준을 기초로 하여 확인할 수 있다. 또한, 문헌[McKhann et al., Clinical diagnosis of Alzheimer's disease: report of the NINCDS-ADRDA work group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology 1984; 34:939-944]을 참조한다.
다계통위축(MSA)은 움직임, 균형 및 뇌의 자동 제어 센터에서의 아교세포질포함체(glial cytoplasmic inclusion bodies)(또는 파프-란토스체(Papp-Lantos bodies)라고도 함)를 특징으로 한다. MSA의 가장 일반적인 첫번째 징후는 첫번째 제시에서 62%에서 발견된 “운동불능-근경직 증후군(akinetic-rigid syndrome)”(즉, 파킨슨병과 유사하게 움직임 개시의 느림)이 나타나는 것이다. 시작될 때 다른 일반적인 징후는 균형에서의 문제(22%에서 발견됨), 그 다음 비뇨 생식기의 문제(9%)를 포함한다. 남성에게 있어서, 첫번째 징후는 발기부전(발기하거나 발기를 유지할 수 없음)일 수 있다. 남성 및 여성 모두 종종 급뇨, 빈뇨, 불완전 배뇨 또는 소변을 볼 수 없음(요폐)을 포함한 방광에서의 문제를 겪는다. 5명의 MSA 환자에서 약 1명은 질환의 첫해에 낙상을 겪을 것이다. 질환이 진행하면서 3가지 그룹의 증상이 두드러진다. 이러한 증상에는 (i) 파킨슨 증상(parkinsonism)(느리고, 경직된 움직임, 손글씨가 작아지고 가늘고 길게 됨); (ii) 소뇌 실조증(움직임과 균형 조정의 어려움); 및 (iii) 자율신경 실조증(자율 신체 기능에 장애가 있음), 예를 들어 기립시 어지름증 또는 실신을 야기하는 기립성 저혈압증, 요실금, 발기 불능; 변비; 구강 건조증 및 피부 건조증; 이한증에 의한 체온 조절의 어려움; 수면 동안의 이상 호흡이 있다. 특히, 이러한 모든 증상을 모든 환자가 경험하지는 않는다.
루이소체 치매(DLB)는 진행성 치매의 가장 일반적인 유형 중 하나이다. DLB의 주요 특징은, (1) 기민도(alertness) 및 집중에 있어서 확연한 “변동”, 예를 들어 빈번한 졸음, 기면(lethargy), 허공을 응시하는데 소비되는 시간의 길어짐 또는 와해된 언어; (2) 재발성 환시, 및; (3) 파킨슨병 운동 증상, 예를 들어 경직 및 자발적인 움직임의 상실의 3가지 추가적인 한정된 특징과 조합된 진행성 인지 감퇴증이다. 사람은 또한 우울증을 겪을 수 있다. DLB의 증상은, 기억 및 운동 제어의 특정한 양태를 제어하는 뇌의 부분에서 뉴런의 핵 내부의 알파-시뉴클레인 단백질의 축적된 부분인 루이소체의 증가에 기인한다. 연구원들은 알파-시뉴클레인이 루이소체로 축적되는 이유 또는 루이소체가 DLB의 증상을 야기하는 방법을 정확하게 알지 못하지만, 연구원들은 알파-시뉴클레인 축적이 또한 “시뉴클레인병증”으로 지칭되는 파킨슨병, 다계통위축 및 여러 가지 다른 질환과 연관되어 있음을 안다. DLB와 파킨슨병 사이, DLB와 알츠하이머병 사이의 증상의 유사성은 종종 의사가 최종 진단을 하는 것을 어렵게 할 수 있다. 게다가, 루이소체는 또한 종종 파킨슨병 및 알츠하이머병이 있는 사람의 뇌에서 발견된다. 이러한 결과는 DLB가 치매의 이러한 다른 원인과 관련되어 있거나 또는 개인이 동시에 2가지 질환을 가질 수 있음을 시사한다. DLB는 보통 질환의 알려진 가족력이 없는 사람에게서 산발적으로 일어난다. 그러나, 드문 가족성의 사례가 때때로 보고되었다.
화합물
본 발명의 신규 화합물이 하기에 제공된다.
화학 공정
본 발명의 조성물은 하기 반응식 중 하나 이상에 따라서 만들어 질 수 있다.
공정 반응식 1:
(( 2S,3S,4aR,8R,8aR )-2,3- 디메톡시 -2,3- 디메틸옥타하이드로 - [1,4]디옥시노[2,3-c]피리딘 -8-일)메탄올 하이드로클로라이드 (2). MeOH(500mL) 중 1(20.0g, 55.0mmol)의 용액을 Pd(OH)2(4g 내지 6g) 및 암모늄포메이트(14g, 220mmol)과 합하고, 혼합물을 50℃ 내지 55℃에서 가열하였다. 암모늄포메이트의 추가 양(3 x 100.0mmol)을 다음 8시간에 걸쳐서 첨가하였다. 최종 첨가 후, 반응 혼합물을 추가로 교반하고 50℃ 내지 55℃에서 추가 16시간 동안 가열하였다. 촉매를 여과로 제거하고 여과액을 진공에서 증발시켰다. 조 생성물을 아세톤(150mL) 중에 용해하고, 여과하였으며, 2-PrOH 중 HCl을 첨가하였다. 살포(seeding)하고 그 다음 빙욕 중에서 냉각시킨 후, 생성물을 백색 결정질 고체(11.0g, 71%)로서 수집하였다. 1H NMR (DMSO-d6) 9.45 (s, 2H), 4.80 (t, 1H, ex), 3.85 (m, 1H), 3.0-3.75 (m, 11H), 2.8 (q, 2H), 1.95 (m, 1H), 1.2 (2, 6H).
(( 2S,3S,4aR,8R,8aR )-6- 벤질 -2,3- 디메톡시 -2,3- 디메틸옥타하이드로 - [1,4]디옥시노[2,3-c]피리딘 -8-일)메탄올 (3). DMF(200mL) 중 2(14.85g, 50.0mmol)의 용액에 K2CO3(17.25g, 125mmol)를 첨가하였고, 혼합물을 40℃에서 약 4시간 동안 교반하였다. 이 때, BnCl(5.7mL, 50.0mmol)을 한 번에 첨가하고, 반응물을 40℃에서 밤새 교반하였다. 용매를 진공에서 증발시키고, 잔류물을 물(600mL) 중에 현탁시켰으며, HCl을 첨가하여 잔류물을 용해시켰다. 용액을 Et2O로 세척한 다음, Na2CO3로 염기성화하였다. 용액을 EtOAc로 추출하고(2회), 합한 추출물을 물, 그 다음 브라인(brine)으로 세척하였으며, 그 다음 MgSO4 상에서 건조시켰다. 용액을 여과하였고, 여과액을 진공에서 증발시켜 무색 내지 매우 옅은 황색의 점성 오일로서 표제 화합물(17.2g, 95% 초과)을 제공하였으며, 이는 추가 정제없이 사용하였다. 1H NMR (CDCl3) 7.3 (m, 5H), 3.6-3.8 (m, 2H), 3.5 (s, 3H), 3.4 (t, 1H), 3.26 (s, 3H), 3.268 (s, 3H), 2.9 (m, 2H), 2.2 (br s, 1H), 2.05 (m, 1H), 1.85 (t, 1H), 1.28 (s, 3H), 1.26 (s, 3H).
((2S,3S,4aR,8R,8aR) -6- 벤질 -2,3- 디메톡시 -2,3- 디메틸옥타하이드로 - [1,4]디옥시노[2,3-c]피리딘 -8-일)카르복스알데히드(일반 절차 A)(4). -78℃까지 냉각된 CH2Cl2(150 mL) 중 DMSO(7.3g, 96.9mmol)의 용액에 CH2Cl2 중 옥살릴 클로라이드(6.1mL, 72.8mmol)의 용액을 적가하였다. 첨가가 완료된 후, 반응 혼합물을 CH2Cl2 중 3(17.0g, 48.4mmol)의 용액이 적가될 때 추가 30분 동안 교반하였다. 첨가가 완료된 후, 반응물을 1시간 동안 -78℃에서 교반한 다음, 디이소프로필에틸아민(34.4mL, 193mmol)을 적가하였다. 이 첨가가 완료된 후, 냉각욕(cooling bath)을 제거하였고, 포화 NaHCO3을 첨가할 때 반응 혼합물을 0℃까지 가온되게 하였다. 혼합물을 약간의 추가 CH2Cl2로 희석한 다음 유기층을 분리하고 MgSO4 상에서 건조시켰다. 여과 후, 용매를 진공에서 증발시키고, 조 생성물을 실리카겔 크로마토그래피(Hex/EtOAc)로 정제하여 점성 오일로서 표제 화합물(12.7g, 75%)을 제공하였다. 1H NMR (CDCl3) 9.73 (s, 1H), 7.2 (m, 5H), 3.75 (m, 2H), 3.5 (q, 2H), 3.2 (2s, 6H), 2.7-3.0 (m, 3H), 2.05 (m, 2H), 1.25 (2s, 6H).
(( 2S,3S,4aR,8S,8aR )-6- 벤질 -8,8- 디플루오로메틸 -2,3- 디메톡시 -2,3- 디메틸옥타하이드로 -[1,4]디옥시노[2,3-c]피리딘 하이드로클로라이드 (일반 절차 B)(5). -15℃까지 냉각된 CH2Cl2(50mL) 중 DAST(1.4mL, 10.3mmol)의 용액에 4(2.4g, 6.9mmol)의 용액을 적가하였다. 10분 후, 빙욕을 제거하고 반응물을 실온에서 밤새 교반하였다. 이 때, 반응 혼합물을 다시 빙욕에서 냉각시키고, 포화 NaHCO3의 첨가(이 양이 약간 발열을 생성하므로 처음에는 적가함)로 반응물을 퀀칭하였다. 유기층을 분리하고 Na2SO4 상에서 건조시켰으며, 여과하고 용매를 진공에서 증발시켜 황색 오일을 제공하였다. 잔류물을 실리카겔 상에서 크로마토그래피(Hex/EtOAc)로 정제하여 무색 오일로서 표제 화합물(1.6g, 62%)을 제공하였다. 1H NMR (CDCl3) 7.2 (m, 5H), 6.0 (dt, 1H), 3.75 (m, 1H), 3.55 (m, 3H), 3.2 (2s, 6H), 2.95 (m, 1H), 2.85 (m, 1H), 2.3 (m, 2H), 1.5 (br s, 1H), 1.2 (2s, 6H).
( 3R,4R,5S )-5-( 디플루오로메틸 )피페리딘 3,4- 디올 하이드로클로라이드 (일반 절차 C)(6). 화합물 5(1.6g, 4.3mmol)를 EtOH/H2O/HCl(40mL/40mL/5mL)의 혼합물 중에서 환류 가열하고, 출발 물질을 더 이상 검출할 수 없을 때까지 반응을 HPLC로 모니터링하였다. 용매를 진공에서 증발시킨 다음 EtOH와 함께 2회 동시증발시켰다. 잔류물을 MeOH 중에 용해시키고 Pd(OH)2 상에서 수소화하였다. 완료되면, 촉매를 여과로 제거하고 여과액을 진공에서 증발시켰다. 잔류물을 EtOH(50mL)로부터 백색 고체(mp 168℃ 내지 170℃)인 표제 화합물(0.55g, 66%)로 재결정화하였다. 1H NMR (D2O) 6.15 (dt, 1H), 4.3-4.8 (m, 2H), 3.0 (t, 1H), 2.85 (t, 1H), 2.3 (m, 1H).
(R)및(S)-1-(( 2S,3S,4aR,8R,8aR )-6- 벤질 -2,3- 디메톡시 -2,3- 디메틸옥타하이드로 -[1,4]디옥시노[2,3-c]피리딘-8-일)에탄올 일반 절차 D(15/16). 무수 THF(100mL) 중 4(7.0g, 20.0mmol)의 용액에 MeMgBr(3:1 THF/톨루엔 중 20.0mL, 1.4M)을 첨가하고 반응물을 밤새 실온에서 교반하였다. 반응물을 포화 NH4Cl로 퀀칭하고 혼합물을 EtOAc로 추출하였다(2회). 합한 추출물을 브라인으로 세척하고, Na2SO4 상에서 건조시켰으며, 여과액을 진공에서 증발시켰다. 잔류물을 실리카겔 크로마토그래피(헥산/2-PrOH)로 정제하여 주요 이성질체(15)(1.6g, 24.6%)를 제공하였다. 1H NMR (CDCl3).7.3 (m, 5H), 4.15 (m, 1H), 3.5-3.9 (m, 3H), 3.3 (2s, 6H), 2.85 (m, 2H), 2.0 (2m, 4H), 1.3 (2s, 6H), 1.2 (d, 3H). 또한 소수 이성질체(16)(0.55g, 7.5%)를 분리하였다. 7.3 (m, 5H), 3.75 (m, 2H), 3.5 (m, 2H), 3.2 (2s, 6H), 2.8 (m, 2H), 2.0 (t, 1H), 1.75 (m, 2H), 1.2 (2s, 6H), 1.0 (d, 3H).
( 3R,4R,5R )- 5((R)-1-하이드록시에틸)피페리딘 3,4- 디올 (17). 출발 물질을 더 이상 HPLC로 검출할 수 없을 때까지 화합물 15(0.55g, 1.5mmol)를 9/1 TFA:H2O(20mL)의 혼합물 중에서 교반하였다. 휘발성 물질을 제거하고 잔류물을 EtOH와 함께 2회 내지 3회 동시증발시킨 다음 EtOH 중에 용해시키고 고체 K2CO3로 처리하였다. 고체를 여과한 후, 여과액을 진공에서 증발시켰으며, 잔류물을 HCl 염으로 전환시키고 Pd(OH)2 상에서 수소화하였다. 촉매를 여과하고, 여과액을 진공에서 증발시켰다. 조 생성물을 0.1N NH4OH로 용리하는 이온 교환 수지(Dowex 50WX8-200)를 사용하여 정제하였다. 적절한 분액을 합하고 동결건조하여 표제 화합물(0.12g, 50%)을 제공하였다. 1H NMR (D2O) 4.2 (q, 1H), 3.65 (m, 1H), 3.45 (m, 3H), 2.8 (m, 2H), 1.65 (m, 1H), 1.15 (d, 3H).
( 3R,4R,5R )- 5((S)-1-하이드록시에틸)피페리딘 3,4- 디올 (10). 화합물 16(0.34g, 0.93mmol)을 상기 기술된 바와 같이 탈보호하여 표제 화합물(0.11g, 75%)을 제공하였다. 1H NMR (D2O) 4.15 (m, 2H), 3.5 (m, 1H), 3.35 (t, 1H), 3.15 (m, 2H), 1.8 (m, 1H), 1.1 (d, 3H).
(( 2S,3S,4aR,8R,8aR )-6- 벤질 -8(S)-( 1플루오로에틸 )-2,3- 디메톡시 -2,3- 디메틸옥타하이드로 -[1,4]디옥시노[2,3-c]피리딘 (11). 일반 절차 B를 사용하여 화합물 15(1.8g, 5.0mmol)를 플루오르화하였다. 실리카겔 크로마토그래피(Hex/EtOAc)는 표제 화합물(0.42g , 23%)을 제공하였다. 1H NMR (CDCl3) 7.25 (m, 5H), 4.7-4.9 (dq, 1H), 3.75 (m, 2H), 3.4 (m, 2H), 3.2 (2s, 6H), 2.8 (m, 2H), 2.0 (m, 3H), 1.35 (dd, 3H), 1.2 (2s, 6H).
( 3R,4R,5R )- 5((S)-1-플루오로에틸)피페리딘 3,4- 디올 하이드로클로라이드 (13). 화합물 11(0.42g, 1.14mmol)을 일반 절차 C에 기술된 바와 같이 탈보호하였다. 촉매를 제거한 후, 여과액을 진공에서 증발시킨 다음 EtOH와 함께 동시증발시켰다(2회). 생성된 잔류물을 아세톤과 함께 분쇄하여 백색 고체로서 표제 화합물(0.20g, 88%)을 제공하였다. 1H NMR (DMSO-d6) 9.0 (br s, 2H), 5.6 (d, 1H, ex), 5.4 (d, 1H, ex), 5.0-5.2 (dq, 1H), 3.55 (m, 1H), 3.2 (m, 2H), 2.9 (t, 1H), 2.7 (t, 1H), 2.2 (m, 1H), 1.3 (dd, 3H).
(( 2S,3S,4aR,8R,8aR )-6- 벤질 -8(R)-( 1플루오로에틸 )-2,3- 디메톡시 -2,3- 디메틸옥타하이드로 -[1,4]디옥시노[2,3-c]피리딘(12). 일반 절차 B를 사용하여 화합물 16(0.55g, 1.5mmol)을 플루오르화하여 표제 화합물(0.22g, 40%)을 제공하였다. 1H NMR (CDCl3) 7.3 (m, 5H), 5.0 (dq, 1H), 3.8 (m, 1H), 3.5-3.75 (m, 3H), 3.3 (2s, 6H), 3.0 (d, 1H), 2.9 (m, 1H), 2.1 (m, 2H), 1.85 (m, 1H), 1.3 (2s, 6H).
( 3R,4R,5R )-5((R)-(1- 플루오로에틸 )피페리딘 3,4- 디올 하이드로클로라이드 (14). 화합물 12(0.22g, 0.6mmol)를 일반 절차 C에 기술된 바와 같이 탈보호하였다. 촉매를 제거한 후, 여과액을 진공에서 증발시킨 다음 EtOH와 함께 동시증발시켰다(2회). 생성된 잔류물을 아세톤과 함께 분쇄하여 백색 고체로서 표제 화합물(0.08g, 67%)을 제공하였다. 1H NMR (D2O) 5.1 (dq, 1H), 3.5 (m, 4H), 2.8 (m, 2H), 1.8 (m, 1H), 1.3 (dd, 3H).
공정 반응식 2:
(( 2 S ,3 S ,4a R ,8 R ,8a R )-2,3- 디메톡시 -2,3- 디메틸옥타하이드로 - [1,4]디옥시노[2,3-c]피리딘 -8-일)메탄올 하이드로클로라이드 (2). MeOH(500mL) 중 1(20.0g, 55.0mmol)의 용액을 Pd(OH)2(4g 내지 6g) 및 암모늄포메이트(14g, 220mmol)과 합하고, 혼합물을 50℃ 내지 55℃에서 가열하였다. 암모늄포메이트의 추가 양(3 x 100.0mmol)을 다음 8시간에 걸쳐서 첨가하였다. 최종 첨가 후, 반응 혼합물을 추가로 교반하고 50℃ 내지 55℃에서 추가 16시간 동안 가열하였다. 촉매를 여과로 제거하고 여과액을 진공에서 증발시켰다. 조 생성물을 아세톤(150mL) 중에 용해하고, 여과하였으며, 2-PrOH 중 HCl을 첨가하였다. 살포(seeding)하고 그 다음 빙욕 중에서 냉각시킨 후, 생성물을 백색 결정질 고체(11.0g, 71%)로서 수집하였다. 1H NMR (DMSO-d 6) 9.45 (s, 2H), 4.80 (t, 1H, ex), 3.85 (m, 1H), 3.0-3.75 (m, 11H), 2.8 (q, 2H), 1.95 (m, 1H), 1.2 (2, 6H).
(( 2 S ,3 S ,4aR,8 R ,8a R )-6- 벤질 -2,3- 디메톡시 -2,3- 디메틸옥타하이드로 - [1,4]디옥시노[2,3-c]피리딘 -8-일)메탄올(3). DMF(200mL) 중 2(14.85g, 50.0mmol)의 용액에 K2CO3(17.25g, 125mmol)를 첨가하였고, 혼합물을 40℃에서 약 4시간 동안 교반하였다. 이 때, BnCl(5.7mL, 50.0mmol)을 한 번에 첨가하고, 반응물을 40℃에서 밤새 교반하였다. 용매를 진공에서 증발시키고, 잔류물을 물(600mL) 중에 현탁시켰으며, HCl을 첨가하여 잔류물을 용해시켰다. 용액을 Et2O로 세척한 다음, Na2CO3로 염기성화하였다. 용액을 EtOAc로 추출하고(2회), 합한 추출물을 물, 그 다음 브라인으로 세척하였으며, 그 다음 MgSO4 상에서 건조시켰다. 용액을 여과하였고, 여과액을 진공에서 증발시켜 무색 내지 매우 옅은 황색의 점성 오일로서 표제 화합물(17.2g, 95% 초과)을 제공하였으며, 이는 추가 정제없이 사용하였다. 1H NMR (CDCl3) 7.3 (m, 5H), 3.6-3.8 (m, 2H), 3.5 (s, 3H), 3.4 (t, 1H), 3.26 (s, 3H), 3.268 (s, 3H), 2.9 (m, 2H), 2.2 (br s, 1H), 2.05 (m, 1H), 1.85 (t, 1H), 1.28 (s, 3H), 1.26 (s, 3H).
((2 S ,3 S ,4aR,8 R ,8a R ) -6- 벤질 -2,3- 디메톡시 -2,3- 디메틸옥타하이드로 - [1,4]디옥시노[2,3-c]피리딘 -8-일)카르복스알데히드(일반 절차 A)(4). -78℃까지 냉각된 CH2Cl2(150 mL) 중 DMSO(7.3g, 96.9mmol)의 용액에 CH2Cl2 중 옥살릴 클로라이드(6.1mL, 72.8mmol)의 용액을 적가하였다. 첨가가 완료된 후, 반응 혼합물을 CH2Cl2 중 3(17.0g, 48.4mmol)의 용액이 적가될 때 추가 30분 동안 교반하였다. 첨가가 완료된 후, 반응물을 1시간 동안 -78℃에서 교반한 다음, 디이소프로필에틸아민(34.4mL, 193mmol)을 적가하였다. 이 첨가가 완료된 후, 냉각욕을 제거하였고, 포화 NaHCO3을 첨가할 때 반응 혼합물을 0℃까지 가온되게 하였다. 혼합물을 약간의 추가 CH2Cl2로 희석한 다음 유기층을 분리하고 MgSO4 상에서 건조시켰다. 여과 후, 용매를 진공에서 증발시키고, 조 생성물을 실리카겔 크로마토그래피(Hex/EtOAc)로 정제하여 점성 오일로서 표제 화합물(12.7g, 75%)을 제공하였다. 1H NMR (CDCl3) 9.73 (s, 1H), 7.2 (m, 5H), 3.75 (m, 2H), 3.5 (q, 2H), 3.2 (2s, 6H), 2.7-3.0 (m, 3H), 2.05 (m, 2H), 1.25 (2s, 6H).
(( 2 S ,3 S ,4a R ,8 S ,8a R )-6- 벤질 -8,8- 디플루오로메틸 -2,3- 디메톡시 -2,3- 디메틸옥타하이드로 -[1,4]디옥시노[2,3-c]피리딘 하이드로클로라이드 (일반 절차 B)(5). -15℃까지 냉각된 CH2Cl2(50mL) 중 DAST(1.4mL, 10.3mmol)의 용액에 4(2.4g, 6.9mmol)의 용액을 적가하였다. 10분 후, 빙욕을 제거하고 반응물을 실온에서 밤새 교반하였다. 이 때, 반응 혼합물을 다시 빙욕에서 냉각시키고, 포화 NaHCO3의 첨가(이 양이 약간 발열을 생성하므로 처음에는 적가함)로 반응물을 퀀칭하였다. 유기층을 분리하고 Na2SO4 상에서 건조시켰으며, 여과하고 용매를 진공에서 증발시켜 황색 오일을 제공하였다. 잔류물을 실리카겔 상에서 크로마토그래피(Hex/EtOAc)로 정제하여 무색 오일로서 표제 화합물(1.6g, 62%)을 제공하였다. 1H NMR (CDCl3) 7.2 (m, 5H), 6.0 (dt, 1H), 3.75 (m, 1H), 3.55 (m, 3H), 3.2 (2s, 6H), 2.95 (m, 1H), 2.85 (m, 1H), 2.3 (m, 2H), 1.5 (br s, 1H), 1.2 (2s, 6H).
( 3 R ,4 R ,5 S )-5-( 디플루오로메틸 )피페리딘 3,4- 디올 하이드로클로라이드 (일반 절차 C)(6). 화합물 5(1.6g, 4.3mmol)를 EtOH/H2O/HCl(40mL/40mL/5mL)의 혼합물 중에서 환류 가열하고, 출발 물질을 더 이상 검출할 수 없을 때까지 반응을 HPLC로 모니터링하였다. 용매를 진공에서 증발시킨 다음 EtOH와 함께 2회 동시증발시켰다. 잔류물을 MeOH 중에 용해시키고 Pd(OH)2 상에서 수소화하였다. 완료되면, 촉매를 여과로 제거하고 여과액을 진공에서 증발시켰다. 잔류물을 EtOH(50mL)로부터 백색 고체(mp 168℃ 내지 170℃)인 표제 화합물(0.55g, 66%)로 재결정화하였다. 1H NMR (D2O) 6.15 (dt, 1H), 4.3-4.8 (m, 2H), 3.0 (t, 1H), 2.85 (t, 1H), 2.3 (m, 1H).
( 3 R ,4 R ,5 S )- 1.부틸 -5-( 디플루오로메틸 )피페리딘 3,4- 디올 (일반 절차 D)(7a; R 5 = Bu ). 6(0.30g, 1.4mmol), K2CO3(0.48g, 3.5mmol) 및 BuBr(0.20g, 1.4mmol)의 혼합물을 DMF(10mL) 중에서 합하고 밤새 60℃에서 가열하였다. 용매를 진공에서 증발시켰으며 잔류물을 EtOAc 중에 용해하고, 물, 그 다음 브라인으로 세척하였으며, Na2SO4 상에서 건조시켰다. 여과 후, 여과액을 진공에서 증발시켜 크로마토그래피(CH2Cl2/(9:1) MeOH/NH4OH)로 정제한 조 생성물을 제공하며 무색 시럽으로서 표제 화합물(0.25g, 80%)을 제공하였다. MH+ = 224. 1H NMR (DMSO-d 6 ) 6.2 (t, 1H, J = 57 Hz), 5.13 (d, 1H, ex), 4.91 (d, 1H, ex), 3.3 (m, 1H), 3.1 (m,1H), 2.9 (m, 2H), 2.3 (m, 2H), 1.95 (m, 2H), 1.75 (t, 1H), 1.2-1.5 (2m, 4H), 0.9 (t, 3H).
( 3 R ,4 R ,5 S )- 1.알릴 -5-( 디플루오로메틸 )피페리딘 3,4- 디올 (7b; R 5 = 알릴). 일반 절차 D를 따라서, 알릴 브로마이드(0.17g, 1.4mmol)를 사용하여 백색 고체로서 표제 화합물(0.22g, 76%)을 획득하였다. MH+ = 208. 1H NMR (DMSO-d 6 ) 6.2 (t, 1H, J = 57 Hz), 5.8 (m, 1H), 5.2 (m, 3H), 4.92 (d, 1H), 3.3 (m, 1H), 3.1 (1H), 2.95 (d, 2H), 2.85 (d, 2H), 1.9 (br m, 2H), 1.75 (t, 1H).
( 3 R ,4 R ,5 S )-5-( 디플루오로메틸 )-1-(4- 플루오로벤질 )피페리딘 3,4- 디올 (7c; R 5 = 4- 플루오로벤질 ). 반응을 실온에서 실행하고 4-플루오로벤질 브로마이드(0.26g, 1.4mmol)를 사용하는 것을 제외하고는 일반 절차 D를 따라서, 백색 고체로서 표제 화합물(0.22g, 56%)을 획득하였다. MH+ = 276. 1H NMR (DMSO-d 6 ) 7.4 (m, 2H), 7.15 (m, 2H), 6.2 (t, 1H, J = 57 Hz), 5.2 (d, 1H, ex), 4.9 (d, 1H, ex), 3.5 (q, 2H), 3.3 (m, 1H), 3.1 (m, 1H), 2.8 (m, 2H), 2.0 (m, 2H), 1.8 (t, 1H).
( 3 R ,4 R ,5 S )-5-( 디플루오로메틸 )-1-(4- 메틸벤질 )피페리딘 3,4- 디올 (7d; R 5 = 4-메틸벤질). 반응을 실온에서 실행하고 4-메틸벤질 브로마이드(0.26g, 1.4mmol)를 사용하는 것을 제외하고는 일반 절차 D를 따라서, 백색 고체로서 표제 화합물(0.30g, 81%)을 획득하였다. MH+ = 272. 1H NMR (DMSO-d 6 ) 7.2 (m, 4H), 6.2 (t, 1H, J = 57 Hz), 5.2 (d, 1H, ex), 4.9 (d, 1H, ex), 3.5 (q, 2H), 3.3 (1H), 3.05 (m, 1H), 2.8 (m, 2H), 2.5 (s, 3H), 1.95 (m, 2H), 1.8 (t, 1H).
( 3 R ,4 R ,5 S )-5-( 디플루오로메틸 )-1-(4- 메톡실벤질 )피페리딘 3,4- 디올 (7e; R 5 = 4- 메톡실벤질 ). 반응을 실온에서 실행하고 4-메톡실벤질 클로라이드(0.26g, 1.4mmol)를 사용하는 것을 제외하고는 일반 절차 D를 따라서, 무색 시럽으로서 표제 화합물(0.19g, 49%)을 획득하였다. MH+ = 288. 1H NMR (DMSO-d 6 ) 7.3 (m, 1H), 6.85 (m, 3H) 6.2 (t, 1H, J = 57 Hz), 5.2 (d, 1H, ex), 4.9 (d, 1H, ex), 3.75 (s, 3H), 3.5 (q, 2H), 3.4 (m, 1H), 3.1 (m, 1H), 2.85(m, 2H), 1.95 (m, 2H), 1.8 (t, 1H).
1-(( 3 S ,4 R ,5 R )-3-( 디플루오로메틸 )-4,5- 디하이드록시피페리딘 -1-일)펜탄-1-온(8a; Z = CO; R 5 = 부틸). 반응을 실온에서 실행하고 펜타노일 클로라이드(0.17g, 1.4mmol)를 사용하는 것을 제외하고는 일반 절차 D를 따라서, 백색 고체로서 표제 화합물(0.26g, 71%)을 획득하였다. MH+ = 252. 1H NMR (DMSO-d 6 ) 5.9-6.5 (dt, 1H), 5.35 (m, 1H, ex), 5.25 (m, 1H), ex), 4.2 (dd, 1H), 3.75 (dd, 1H), 3.35 (m, 2H), 3.1 (m, 1H), 2.85 (m, 1H), 2.3 (t, 2H), 1.9 br m, 1H), 1.4 (m, 2H), 1.25 (m, 2H), 0.85 (t, 3H).
( 3 R ,4 R ,5 S )-5-( 디플루오로메틸 )-1-( 메탄술포닐 )피페리딘 3,4- 디올 (8b; Z = SO 2 ; R 5 = Me) 반응을 실온에서 실행하고 메탄술포닐 클로라이드(0.16g, 1.4mmol)를 사용하는 것을 제외하고는 일반 절차 D를 따라서, 백색 고체로서 표제 화합물(0.17g, 51%)을 획득하였다. 1H NMR (DMSO-d 6 ) 6.2 (t, 1H, J = 53 Hz), 5.43 (d, 1H, ex), 5.38 (d, 1H, ex), 3.2-3.7 (m, 4H), 2.95 (s, 3H), 2.85 (m, 1H), 2.7 (t, 1H), 2.1 (br s, 1H).
( 3 R ,4 R ,5 S )-5-( 디플루오로메틸 )-1- 토실피페리딘 3,4- 디올 (8b; Z = SO 2 ; R 5 = Ph) 반응을 실온에서 실행하고 톨루엔술포닐 클로라이드(0.26g, 1.4mmol)를 사용하는 것을 제외하고는 일반 절차 D를 따라서, 백색 고체로서 표제 화합물(0.35g, 67%)을 획득하였다. 1H NMR (DMSO-d 6 ) 7.6 (d, 2H), 7.45 (d, 2H), 6.25 (t, 1H, J = 53 Hz), 5.4 (2d, 2H, ex), 3.3-3.55 (m, 4H), 3.2 (m, 1H), 2.5 (m, 3H), 2.4 (t, 1H), 2.1 (m, 1H).
( 3 S ,4 R ,5 R )-3-( 디플루오로메틸 )-4,5- 디하이드록시 - N - 프로필피페리딘 -1- 카르복사미드 (일반 절차 E)(9a; X = O; R 5 = 프로필). 무수 THF(5mL) 중 6(유리 염기)(0.29g, 1.2mmol)의 용액에 프로필 이소시아네이트(0.10g, 1.2mmol)를 첨가하고 반응물을 실온에서 밤새 교반하였다. 용매를 진공에서 증발시키고 잔류물을 크로마토그래피(CH2Cl2/MeOH)로 정제하여 백색 고체로서 표제 화합물(0.14g, 48%)을 제공하였다. MH+ = 253. 1H NMR (DMSO-d 6 ) 6.7 (t, 1H), 6.22 (t, 1H, J = 53 Hz), 5.25 (d, 1H, ex), 5.15 (d, 1H, ex), 4.05 (d, 1H), 3.9 (d, 1H), 3.3 (m, 2H), 3.0 (q, 2H), 2.5 (m, 1H), 1.8 (br d, 1H), 1.4 (m, 2H), 0.85 (t, 3H).
( 3 S ,4 R , 5 R )-3-( 디플루오로메틸 )-4,5- 디하이드록시 - N - 페닐피페리딘 -1- 카르복사미드 (9b; X = O; R 5 = 페닐). 일반 절차 E를 따라서, 페닐 이소시아네이트(0.14g, 1.2mmol)를 사용하여 백색 고체로서 표제 화합물(0.21g, 62%)을 획득하였다. MH+ = 287. 1H NMR (DMSO-d 6 ) 8.7 (s, 1H), 7.45 (d, 2H), 7.3 (t, 2H), 6.95 (t, 1H), 6.3 (t, 1H, J = 53 Hz), 5.35 (d, 1H), 5.25 (d, 1H), 4.1 (t, 2H), 3.3 (m, 2H), 2.85 (t, 1H), 2.75 (t, 1H), 1.95 (br d, 1H).
( 3 S ,4 R ,5 R )-3-( 디플루오로메틸 )-4,5- 디하이드록시 - N - 부틸피페리딘 -1- 카르복사미드 (9c; X = O; R 5 = 부틸). 일반 절차 E를 따라서, 부틸 이소시아네이트(0.12g, 1.2mmol)를 사용하여 백색 고체로서 표제 화합물(0.24g, 76%)을 획득하였다. MH+ = 267. 1H NMR (DMSO-d 6 ) 6.6 (t, 1H), 6.2 (t, 1H, J = 53 Hz), 5.25 (d, 1H), 5.1 (d, 1H), 4.05 (d, 1H), 3.9 (d, 1H), 3.35 (m, 2H), 3.05 (q, 2H), 2.65 (t, 1H), 2.45 (m, 1H), 1.8 (br d, 1H), 1.2-1.4 (2m, 4H), 0.85 (t, 3H).
( 3 S ,4 R ,5 R )-3-( 디플루오로메틸 )-4,5- 디하이드록시 - N - 부틸피페리딘 -1- 카르보티오아미드 (9d; X = S; R 5 = 부틸). 일반 절차 E를 따라서, 부틸 이소티오시아네이트(0.14g, 1.2mmol)를 사용하여 무색 시럽으로서 표제 화합물(0.21g, 63%)을 획득하였다. MH+ = 283. 1H NMR (DMSO-d 6 ) 7.85 (t, 1H), 6.25 (t, 1H), 5.35 (2d, 2H), 4.8 (d, 1H), 4.45 (d, 1H), 3.45 (m, 2H), 3.25 (m, 1H), 3.05 (t, 1H), 2.8 (t, 1H), 1.85 (br d, 1H), 1.4 (m, 2H), 1.35 (m, 2H), 1.1 (m, 1H), 0.95 (t, 3H).
( 3 S ,4 R ,5 R )-3-( 디플루오로메틸 )-4,5- 디하이드록시 - N - 페닐피페리딘 -1- 카르보티오아미드 (9e; X = S; R 5 = 페닐). 일반 절차 E를 따라서, 페닐 이소티오시아네이트(0.16g, 1.2mmol)를 사용하여 백색 고체로서 표제 화합물(0.31g, 86%)을 획득하였다. MH+ = 303. 1H NMR (DMSO-d 6 ) 9.5 (s, 1H), 7.3 (m, 4H), 7.1 (t, 1H), 6.35 (t, 1H), 5.35 (2d, 2H), 4.85 (d, 1H), 4.55 (d, 1H), 3.45 (m, 2H), 3.2 (t, 1H), 3.0 (t, 1H), 2.05 (br d, 1H).
본 발명의 화합물은 또한 하기 일반 반응식을 사용하여 당업자에 의해 만들어 질 수 있다.
[반응식 3]
[반응식 4]
[반응식 5]
[반응식 6]
[반응식 7]
염, 용매화물 및 전구약물
본 발명의 화합물은 본원에 개시된 화합물의 약학적으로 허용되는 염, 용매화물 및 전구약물을 포함한다. 약학적으로 허용되는 염은 Li, Na, K, Ca, Mg, Fe, Cu, Zn, Mn과 같은 무기 염기로부터 유래되는 염; N,N'-디아세틸에틸렌디아민, 글루카민, 트리에틸아민, 콜린, 수산화물, 디사이클로헥실아민, 메트포르민, 벤질아민, 트리알킬아민, 티아민과 같은 유기 염기의 염; 알킬페닐아민, 글리시놀, 페닐 글리시놀과 같은 키랄 염기, 글리신, 알라닌, 발린, 루신, 이소루신, 노르루신, 티로신, 시스틴, 시스테인, 메티오닌, 프롤린, 하이드록시 프롤린, 히스티딘, 오미딘, 리신, 아르기닌, 세린과 같은 천연 아미노산의 염; D-이성질체 또는 치환된 아미노산과 같은 비천연 아미노산; 구아니딘, 치환기가 니트로, 아미노, 알킬, 알케닐, 알키닐, 암모늄 또는 치환된 암모늄 염 및 알루미늄 염으로부터 선택된 치환된 구아니딘을 포함한다. 염은 적절하다면 하이드로클로라이드, 술페이트, 니트레이트, 포스페이트, 퍼클로레이트, 보레이트, 하이드로할라이드, 아세테이트, 타르트레이트, 말리에이트, 시트레이트, 숙시네이트, 팔모에이트, 메탄술포네이트, 벤조에이트, 살리실레이트, 벤젠술포네이트, 아스코르베이트, 글리세로포스페이트, 케토글루타레이트인 산 부가 염을 포함할 수 있다. 하나의 실시형태에서, 본원에 개시된 화합물의 약학적으로 허용되는 염은 하이드로클로라이드 염이다.
“용매화물”은 하나 이상의 용매 분자와 화합물의 물리적 회합을 나타낸다. 이러한 물리적 회합은 수소 결합을 포함한 이온 결합 및 공유 결합의 정도를 다양화하는 것을 포함한다. 특정 경우에서, 용매화물은, 예를 들어 하나 이상의 용매 분자가 결정질 고체의 결정 격자에 포함될 때 분리될 수 있을 것이다. “용매화물”은 용액 상 및 분리가능한 용매화물을 모두 포함한다. “수화물”은 용매 분자가 H2O인 용매화물이다. 적합한 용매화물의 다른 비제한적인 예는 알코올(예컨대, 에탄올레이트, 메탄올레이트 등)을 포함한다.
전구약물은 생체 내에서 활성 형태로 전환되는 화합물이다(예컨대, 문헌[R. B. Silverman, 1992, "The Organic Chemistry of Drug Design and Drug Action", Academic Press, Chapter 8]을 참조하며, 이는 본원에 참조로 포함되어 있음). 추가적으로, 전구약물의 논의는 문헌[T. Higuchi 및 V. Stella, Pro-drugs as Novel Delivery Systems, Volume 14 of the A.C.S. Symposium Series; 및 Bioreversible Carriers in Drug Design, Edward B. Roche, ed., American Pharmaceutical Association and Pergamon Press, 1987]에서 제공되며, 이들 모두 본원에 참조로 포함된다. 전구약물은 (예컨대, 통상적으로 프로테아제의 반응 자리로 들어가지 않을 화합물을 허용하는) 생체내분포(biodistribution) 또는 특정 화합물에 대한 약동학을 바꾸는데 사용될 수 있다. 예를 들어, 카르복시산기는 예컨대 메틸기 또는 에틸기와 에스테르화되어 에스테르를 생성할 수 있다. 상기 에스테르가 개체에 투여될 때, 에스테르는 효소로 또는 비효소로, 환원으로, 산화로 또는 가수분해로 절단되어 음이온기가 나타난다. 음이온기는 절단되는 부분(예컨대, 아실옥시메틸 에스테르)과 에스테르화되어 이후 분해될 중간체 화합물을 나타내어 활성 화합물을 생성할 수 있다.
전구약물의 예 및 이의 용도는 당업계에 잘 알려져 있다(예컨대, 문헌[Berge et al. (1977) "Pharmaceutical Salts", J. Pharm . Sci. 66:1-19] 참조). 전구약물은 화합물의 최종 분리 및 정제 동안에 동일계 내에서, 또는 정제된 화합물을 적합한 유도체화제와 개별적으로 반응시킴으로써 제조될 수 있다. 예를 들어 하이드록시 기는 촉매의 존재 하에서 카르복시산을 이용한 처리를 통하여 에스테르로 전환될 수 있다. 절단가능한 알코올 전구약물 부분의 예는 치환 및 비치환, 분지 또는 미분지 저급 알킬 에스테르 부분(예컨대, 에틸 에스테르), 저급 알케닐 에스테르, 디-저급 알킬-아미노 저급-알킬 에스테르(예컨대, 디메틸아미노에틸 에스테르), 아실아미노 저급 알킬 에스테르, 아실옥시 저급 알킬 에스테르(예컨대, 피바로일옥시메틸 에스테르), 아릴 에스테르(페닐 에스테르), 아릴-저급 알킬 에스테르(예컨대, 벤질 에스테르), (예컨대 메틸, 할로 또는 메톡시 치환기로) 치환된 아릴 및 아릴-저급 알킬 에스테르, 아미드, 저급-알킬 아미드, 디-저급 알킬 아미드 및 하이드록시 아미드를 포함한다.
(본원에 개시된 화합물의 염, 용매화물 및 전구약물뿐만 아니라 전구약물의 염 및 용매화물의 입체이성질체를 포함하여) 다양한 치환기 상의 비대칭 탄소로 인하여 존재할 수 있는 입체이성질체와 같은, 본원에 개시된 화합물의 모든 입체이성질체(예를 들어, 기하이성질체, 광학이성질체 등), 예를 들어 거울상이성질체(비대칭 탄소의 부재시에서 조차도 존재할 수 있음), 회전이성질체(rotameric), 회전억제이성질체(atropisomer) 및 부분입체이성질체는 본 발명의 범주 내인 것으로 고려된다. 이들 화합물의 각각의 입체이성질체는, 예를 들어 실질적으로 다른 이성질체가 없을 수 있거나, 또는 예를 들어 라세미체로서 또는 모든 다른 입체이성질체와, 또는 다른 선택된 입체이성질체와 혼합될 수 있다. 상기 언급된 화합물의 키랄 중심은 IUPAC 1974 Recommendations에 한정된 바와 같이 S 또는 R 배치를 가질 수 있다. 용어 “염”, “용매화물”, “전구약물” 등의 사용은 본원에 개시된 본 발명의 화합물의 거울상이성질체, 입체이성질체, 회전이성질체, 호변이성질체, 라세미체 또는 전구약물의 염, 용매화물 및 전구약물에 동일하게 적용되는 것으로 의도된다.
제형
치료제(들)는 정제 또는 캡슐 또는 액상의 형태로, 또는 주사용 멸균 수용액으로 임의의 투여 경로, 예를 들어 경구 투여에 적합하게 제형화될 수 있다. 치료제(들)가 경구 투여용으로 제형화될 때, 정제 또는 캡슐은 약학적으로 허용되는 부형제, 예를 들어 결합제(예컨대, 전호화분(pregelatinized) 옥수수 녹말, 폴리비닐피롤리돈 또는 하이드록시프로필 메틸셀룰로오스); 충전제(예컨대, 락토오스, 미세결정 셀룰로오스 또는 칼슘 하이드로겐 포스페이트); 윤활제(예컨대, 마그네슘 스테아레이트, 탈크 또는 실리카); 붕해제(예컨대, 감자 녹말 또는 소듐 스타치 글리콜레이트); 또는 습윤제(예컨대, 소듐 라우릴 설페이트)와 함께 통상적인 방법으로 제조될 수 있다. 정제는 당업계에 잘 알려진 방법으로 코팅될 수 있다. 경구 투여용 액상 제조물은 예를 들어 용액, 시럽 또는 현탁액의 형태를 취할 수 있거나, 사용 전에 물 또는 다른 적합한 비히클과 구성되는 건조 제품으로서 제공될 수 있다. 이러한 액상 제조물은 약학적으로 허용되는 첨가제, 예를 들어 현탁제(예컨대, 소르비톨 시럽, 셀룰로오스 유도체 또는 하이드로제네이티드 식용 지방); 에멀션화제(예컨대, 레시틴 또는 아카시아); 비수성 비히클(예컨대, 아몬드 오일, 유상 에스테르, 에틸 알코올 또는 분별 식물성 오일); 또는 보존제(예컨대, 메틸 또는 프로필-p-하이드록시벤조에이트 또는 소르빈산)와 함께 통상적인 방법으로 제조될 수 있다. 액상 제조물은 또한 적절하게 완충염, 향미제, 착색제 또는 감미제를 함유할 수 있다. 경구 투여용 제조물은 방출 제어형 또는 서방형의 치료제(들)를 제공하도록 적합하게 제형화될 수 있다.
본 발명의 특정 실시형태에서, 치료제(들)는 전신 흡수를 허용하는 투여형으로 투여되어 치료제(들)가 혈액-뇌장벽을 가로질러 뉴런 세포에 효과를 발휘할 수 있도록 한다. 예를 들어, 비경구용/주사용 사용에 적합한 치료제(들)의 약학적 제형은 일반적으로 멸균 수용액(수용성인 경우), 또는 멸균 주사용액 또는 분산액의 즉석 제조용 분산제 및 멸균 분말을 포함한다. 모든 경우에서, 제형은 멸균형이어야 하며 주사가 용이한 정도로 유동적이어야 한다. 이는 제조 및 저장 조건 하에서 안정적이어야 하며, 세균 및 진균과 같은 미생물의 오염 작용에 대하여 방제되어야 한다. 담체는 예를 들어 물, 에탄올, 폴리올(예를 들어, 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등)을 포함하는 용매 또는 분산 매질, 이의 적합한 혼합물 또는 식물성 오일일 수 있다. 예를 들어 레시틴과 같은 코팅제의 사용에 의해, 분산제의 경우에 필요한 입자 크기의 유지에 의해 그리고 계면활성제의 사용에 의해 적절한 유동성이 유지될 수 있다. 미생물의 작용 방제는 다양한 항세균제 및 항진균제, 예를 들어 파라벤, 클로로부탄올, 페놀, 벤질 알코올, 소르빈산 등에 의해 이루어질 수 있다. 많은 경우에, 등장화제, 예를 들어 당 또는 소듐 클로라이드를 포함하는 것이 합리적일 것이다. 주사용 조성물의 장기 흡수는 조성물 중 흡수를 지연시키는 제제, 예를 들어 알루미늄 모노스테아레이트 또는 젤라틴의 사용에 의해 이루어질 수 있다.
멸균 주사용액은 필요에 따라 상기 열거된 여러 가지의 다른 성분과 함께 적절한 용매 중에 필요한 양으로 치료제(들)를 포함시킨 후, 여과살균 또는 종말살균법에 의해 제조된다. 일반적으로, 분산액은 다양한 멸균 활성 성분을 염기성 분산 매질 및 상기 열거된 것으로부터 필요한 다른 성분을 함유하는 멸균 비히클로 포함시킴으로써 제조된다. 멸균 주사용액의 제조를 위한 멸균 분말의 경우에, 바람직한 제조 방법은 미리 멸균 여과한 용액으로부터 활성 성분 및 임의의 추가적인 원하는 성분의 분말을 생성하는 진공 건조 및 냉동 건조 기법이다.
제형은 부형제를 함유할 수 있다. 제형에 포함될 수 있는 약학적으로 허용되는 부형제로는 시트레이트 완충제,포스페이트 완충제, 아세테이트 완충제 및 바이카르보네이트 완충제와 같은 완충제, 아미노산, 요소, 알코올, 아스코르브산, 인지질; 혈청 알부민, 콜라겐 및 젤라틴과 같은 단백질; EDTA 또는 EGTA와 같은 염, 및 소듐 클로라이드; 리포좀; 폴리비닐피롤리돈; 덱스트란, 만니톨, 소르비톨 및 글리세롤과 같은 당; 프로필렌 글리콜 및 폴리에틸렌 글리콜(예컨대, PEG-4000, PEG-6000); 글리세롤; 글리신 또는 다른 아미노산; 및 지질이 있다. 제형과의 사용을 위한 완충제 시스템은 시트레이트; 아세테이트; 바이카르보네이트; 및 포스페이트 완충제를 포함한다. 포스페이트 완충제가 바람직한 실시형태이다.
또한 제형은 비이온성 세정제를 함유할 수 있다. 바람직한 비이온성 세정제는 폴리소르베이트(Polysorbate) 20, 폴리소르베이트 80, 트리톤(Triton) X-100, 트리톤 X-114, Nonidet P-40, 옥틸 α-글루코시드, 옥틸 β-글루코시드, Brij 35, 플루로닉(Pluronic) 및 트윈(Tween) 20을 포함한다.
투여 경로
치료제(들)는 경구, 또는 정맥내, 피하, 동맥내, 복강내, 눈, 근육내, 볼, 직장, 질, 안와내, 뇌내, 진피내, 두개내, 척수내, 뇌심실내(intraventricularly), 척추 강내, 낭내(intracisternally), 관절내, 폐내, 비강내, 경점막, 경피 또는 흡입을 포함한 비경구로 투여될 수 있다. 하나의 바람직한 실시형태에서, 치료제(들)는 경구로 투여된다.
치료제(들)의 투여는 제형의 주기적인 볼루스 주사에 의할 수 있거나, 또는 외부(예컨대, 정맥주사 백) 또는 내부(예컨대, 생분해성 임플란트)의 저장체로부터 정맥내 또는 복강내 투여에 의해 투여될 수 있다. 예컨대, 미국 특허 제4,407,957호 및 제5,798,113호를 참조하며, 각각은 본원에 참조로 포함된다. 폐내 전달 방법 및 장치는 예를 들어 미국 특허 제5,654,007호, 제5,780,014호 및 제5,814,607호에 기술되어 있으며, 각각은 본원에 참조로 포함된다. 다른 유용한 비경구 전달 시스템은 에틸렌-비닐 아세테이트 공중합체 입자, 삼투성 펌프, 이식형 주입 시스템, 펌프 전달, 캡슐화된 세포 전달, 리포솜 전달, 바늘을 이용한 주사(needle-delivered injection), 무침 주사(needle-less injection), 네뷸라이저, 분무기(aerosolizer), 전기천공 및 경피 패치를 포함한다. 무침 주사기 장치는 미국 특허 제5,879,327호; 제5,520,639호; 제5,846,233호 및 제5,704,911호에 기술되어 있으며, 이들의 명세서는 본원에 참조로 포함된다. 상기 기술된 임의의 제형은 이러한 방법을 사용하여 투여될 수 있다.
피하 주사는 자가 투여가 가능한 이점이 있으며, 또한 정맥 투여에 비하여 혈장 반감기가 길어진다. 게다가, 리필이 가능한 펜 및 무침 주사 장치와 같이 환자 편의를 위해 고안된 다양한 장치가 본원에 논의된 본 발명의 제형과 함께 사용될 수 있다.
투여량
적합한 약학적 제조물은 단위 투여형이다. 이러한 형태에서, 제조물은 활성 성분의 적절한 양, 예컨대 원하는 목적을 달성하기 위한 유효량을 함유하는 적절한 크기의 단위 용량으로 세분된다. 특정 실시형태에서, 치료제(들)는 매일 하나 이상의 용량(예컨대, 하루 한번, 하루 2번, 하루 3번)으로 투여된다. 특정 실시형태에서, 치료제(들)는 간헐적으로 투여된다.
예시적인 투약 요법은 2008년 6월 11일에 WO 제2008/134628호로 공개된 국제 특허출원 PCT/US08/61764호 및 2008년 10월 24일에 출원된 미국 가출원 제61/108,192호에 기술되어 있으며, 이들 모두 전체적으로 본원에 참조로 포함된다. 하나의 실시형태에서, 치료제(들)는, 초기에 매일 “부하 용량(loading dose)”이 주어진 후 매일이 아닌 간격으로 투여되는 것을 포함하는 간헐적인 투약 요법으로 투여된다.
언급된 질환을 예방 또는 치료하기 위한 치료제(들)의 유효량은 당업자가 사례별로 결정할 수 있다. 치료제(들)의 투여 양 및 빈도는 환자의 연령, 상태 및 체격과 같은 인자뿐만 아니라 질환의 발병 위험 또는 치료할 언급된 질환의 증상의 중증도를 고려하여 주치의(내과의)의 판단에 따라서 조절될 것이다.
조합 약물 치료
본 발명의 치료제(들)는 적어도 하나의 다른 치료제와 조합하여 투여될 수 있다. 적어도 하나의 다른 치료제와 함께 본 발명의 치료제(들)의 투여는 순차적 또는 동시 투여를 포함하는 것으로 이해된다. 하나의 실시형태에서, 치료제는 개별 투여형으로 투여된다. 다른 실시형태에서, 2 이상의 치료제가 동일한 투여형으로 동시에 투여된다.
특정 실시형태에서, 본 발명의 치료제(들)는, 항운동장애제(anti-dyskinesia agent)(예컨대, 카비도파, 레보도파), 항감염제(예컨대, 미글루스타트), 항종양제(예컨대, 부설팬, 사이클로포스파미드), 위장관제(예컨대, 메틸프레드니솔론), 미량영양소(예컨대, 칼시트리올, 콜레칼시페롤, 에르고칼시페롤, 비타민 D), 혈관수축제(예컨대, 칼시트리올)인 적어도 하나의 다른 치료제와 조합하여 투여된다.
특정 실시형태에서, 본 발명의 치료제(들)은 알로프레그나놀론, 저콜레스테롤식, 또는 스타틴(예컨대, Lipitor®)과 같은 콜레스테롤 저하제; 페노피브레이트(Lipidil®)와 같은 피브레이트; 니아신; 및/또는 콜레스티라민(Questran®)과 같은 결합 수지와 조합하여 투여된다.
하나의 실시형태에서, 본 발명의 치료제(들)는 유전자 치료와 조합하여 투여된다. 유전자 치료는 글루코세레브로시다아제와 같은 대체 유전자와 함께 또는 SNCA 유전자에 대한 억제 RNA(siRNA)와 함께 고려될 수 있다. 유전자 치료는 2004년 2월 17일에 출원된 미국 특허 제7,446,098호에 보다 상세히 기술되어 있다.
하나의 실시형태에서, 본 발명의 치료제(들)는 항염제(예컨대, 이부프로펜 또는 다른 NSAID)인 적어도 하나의 다른 치료제와 조합하여 투여된다.
하나의 실시형태에서, 본 발명의 치료제(들)는 N-부틸-데옥시노지리마이신(Zavesca®; Actelion Pharmaceuticals, US 사(社)로부터 입수가능한 미글루스타트, South San Francisco, CA, US)과 같은 글루코세레브로시다아제에 대한 기질 억제제와 조합하여 투여된다.
본 발명의 치료제(들)와 하나 이상의 다른 리소좀 효소에 대한 치료제인 적어도 하나의 다른 치료제의 조합이 또한 고려된다. 하기는 리소좀 효소에 대한 치료제의 비제한적인 목록이다.
| 리소좀 효소 | 치료제 |
| α-글루코시다아제 GenBank 기탁번호 제Y00839호 |
1-데옥시노지리마이신(DNJ) α-호모노지리마이신 카스타노스페르민 |
| 산성 β-글루코시다아제 (β-글루코세레브로시다아제) GenBank 기탁번호 제J03059호 |
이소파고민 C-벤질 이소파고민 및 유도체 N-알킬(C9-12)-DNJ 글루코이미다졸(및 유도체) C-알킬-IFG(및 유도체) N-알킬-β-발레인아민 플루페노진 칼리스테진 A3, B1, B2 및 C1 |
| α-갈락토시다아제 A GenBank 기탁번호 제NM000169호 |
1-데옥시갈락토노지리마이신(DGJ) α-알로-호모노지리마이신 α-갈락토-호모노지리마이신 β-1-C-부틸-데옥시노지리마이신 칼리스테진 A2 및 B2 N-메틸 칼리스테진 A2 및 B2 |
| 산성 β-갈락토시다아제 GenBank 기탁번호 제M34423호 |
4-에피-이소파고민 1-데옥시갈락토노지리마이신 |
| 갈락토세레브로시다아제(산성 β-갈락토시다아제) GenBank 기탁번호 제D25283호 |
4-에피-이소파고민 1-데옥시갈락토노지리마이신 |
| 산성 α-만노시다아제 GenBank 기탁번호 제U68567호 |
1-데옥시만노지리마이신 스와인소닌 만노스타틴 A |
| 산성 β-만노시다아제 GenBank 기탁번호 제U60337호 |
2-하이드록시-이소파고민 |
| 산성 α-L-푸코시다아제 GenBank 기탁번호 제NM_000147호 |
1-데옥시푸코노지리마이신 β-호모푸코노지리마이신 2,5-이미노-1,2,5-트리데옥시-L-글루시톨 2,5-데옥시-2,5-이미노-D-푸시톨 2,5-이미노-1,2,5-트리데옥시-D-알트리톨 |
| α-N-아세틸글루코사미니다아제 GenBank 기탁번호 제U40846호 |
1,2-디데옥시-2-N-아세트아미도-노지리마이신 |
| α-N-아세틸갈락토사미니다아제 GenBank 기탁번호 제M62783호 |
1,2-디데옥시-2-N-아세트아미도-갈락토노지리마이신 |
| β-헥소사미니다아제 A GenBank 기탁번호 제NM_000520호 |
2-N-아세틸아미노-이소파고민 1,2-디데옥시-2-아세트아미도-노지리마이신 나그스타틴 |
| β-헥소사미니다아제 B GenBank 기탁번호 제NM_000521호 |
2-N-아세트아미도-이소파고민 1,2-디데옥시-2-아세트아미도-노지리마이신 나그스타틴 |
| α-L-이두로니다아제 GenBank 기탁번호 제NM_000203호 |
1-데옥시이두로노지리마이신 2-카르복시-3,4,5-트리데옥시피페리딘 |
| β-글루쿠로니다아제 GenBank 기탁번호 제NM_000181호 |
6-카르복시-이소파고민 2-카르복시-3,4,5-트리데옥시피페리딘 |
| 시알리다아제 GenBank 기탁번호 제U84246호 |
2,6-디데옥시-2,6, 이미노-시알산 시아스타틴 B |
| 이두로네이트 술파타아제 GenBank 기탁번호 제AF_011889호 |
2,5-안하이드로만니톨-6-술페이트 |
| 산성 스핑고마이엘리나아제 GenBank 기탁번호 제M59916호 |
데시프라민, 포스파티딜이노시톨-4,5-디포스페이트 |
특정 실시형태에서, 본 발명의 치료제(들)는 항운동장애제(예컨대, 카비도파, 레보도파), 항감염제(예컨대, 사이클로스포린, 미글루스타트, 피리메타민), 항종양제(예컨대, 알렘투주맙(Alemtuzumab), 아자티오프린, 부설팬, 클로파라빈, 사이클로포스파미드, 멜파란, 메토트렉세이트, 리툭시맙), 항류마티즘제(예컨대, 리툭시맙), 위장관제(예컨대, 메틸프레드니솔론), 미량영양소(예컨대, 칼시트리올, 콜레칼시페롤, 에르고칼시페롤, 폴산, 비타민 D), 생식제어제(reproductive control agent)(예컨대, 메토트렉세이트), 호흡기관제(예컨대, 테트라하이드로졸린), 혈관수축제(예컨대, 칼시트리올, 테트라하이드로졸린)인 적어도 하나의 다른 치료제와 조합하여 투여된다.
특정 실시형태에서, 본 발명의 치료제(들)는 β-헥소사미니다아제 A에 대한 치료제 및/또는 산성 β-갈락토시다아제에 대한 치료제인 적어도 하나의 치료제와 조합하여 투여된다. 특정 실시형태에서, 본 발명의 치료제(들)는 항감염제(예컨대, 미그루스타트), 항종양제(예컨대, 알렘투주맙, 부설팬, 사이클로포스파미드), 위장관제(예컨대, 메틸프레드니솔론)인 적어도 하나의 치료제와 조합하여 투여된다.
본 발명의 치료제(들)는 이에 한정되는 것은 아니지만, RNAi, 도파민 대체(예컨대, 레바도파(L-DOPA)), 도파민 대체 안정화제(예컨대, 카르비도파 및 엔타카폰), 항콜린제(예컨대, 트리헥시페니딜, 벤조트로핀 메실레이트(Cogentin®), 트리헥시페니딜 HCL(Artane®) 및 프로시클리딘), 카테콜-O-메틸트랜스퍼라아제(COMT) 억제제(예컨대, 엔타카폰(Comtan®) 및 톨카폴(Tasmar®)), 도파민 수용제 작용제(예컨대, 브로모크립틴(Parlodel®), 프라미펙솔(Mirapex®), 로피니롤(Requip®)), 페르골라이드(Permax) 및 APOKYN™ 주사(아포모르핀 하이드로클로라이드), 모노아민 옥시다아제(MAO) 억제제(즉, MAO-A 및/또는 MAO-B 억제제, 예컨대, 셀레길린(데프레닐, Eldepryl®, Carbex®), 셀레길린 HCI 구강 붕해 정제(Zelapar®), 및 라사길린(Azilect®)), 말초 탈카르복실라아제 억제제, 아만타딘(Symmetrel®), 및 리바스티그민 타르트레이트(Exelon®)를 포함하는 적어도 하나의 다른 치료제와 조합하여 투여될 수 있다.
또한 본 발명의 치료제(들)와 둘 이상의 다른 치료제의 조합이 고려된다. 다른 치료제의 예시적인 조합은 이에 한정되는 것은 아니지만, 카르비도파/레보도파(Sinemet® 또는 Parcopa®), 카르비도파, 레보도파 및 엔타카폰(Stalevo®), 브로모크립톤(Parlodel®)과 같은 도파민 수용체 작용제를 갖는 레보도파, 프라미펙솔(Mirapex®), 로피니롤(Requip®)), 페르골리드(Permax), 또는 APOKYN™ 주사(아포모르핀 하이드로클로라이드)를 포함한다.
하나의 실시형태에서, 본 발명의 치료제(들)는 알파-시뉴클레인 및 아쥬반트를 포함하는 백신과 같은 백신 요법과 조합하여 투여된다(Pilcher et al., Lancet Neurol. 2005; 4(8):458-9).
하나의 실시형태에서, 본 발명의 치료제(들)는 덱스트로메토르판(Li et al., FASEB J. 2005; Apr;19(6):489-96); 제니스테인(Wang et al., Neuroreport. 2005; Feb 28;16(3):267-70), 또는 미노시클린(Blum et al., Neurobiol Dis. 2004; Dec;17(3):359-66)과 같은 보호될 수 있는 적어도 하나의 다른 치료제와 조합하여 투여된다.
하나의 실시형태에서, 본 발명의 치료제(들)는 알파-시뉴클레인에 대한 치료제(예컨대, Hsp70)인 적어도 하나의 다른 치료제와 조합하여 투여된다.
파킨슨병이 있는 환자는 진전(tremor), 경직, 운동완서 및 자세 불균형을 겪는다. 루이소체 치매가 있는 환자는 기억 상실과 같은 정신적 몰락 및 단순한 작업의 수행 불능에 더하여 강력한 정신병 증상(환시)을 겪는다. 증상에서의 식별가능한 개선, 또는 질환을 발병시킬 위험이 있는 환자에서 특정 증상의 개시를 지연, 또는 질환 진행의 지연은 본원에서 제공되는 치료법에 대한 유리한 반응의 증거일 것이다.
추가적으로, 측정가능한 대리 마커(surrogate marker)가 또한 치료에 대한 반응을 평가하는데 유용할 수 있다. 예를 들어, 일부 연구자들은 파킨슨병이 있는 환자의 혈장에서 더 높은 수준의 알파-시뉴클레인을 검출 또는 올리고머 형태의 알파-시뉴클레인이 검출되었음을 보고한 반면(Lee et al., J Neural Transm. 2006;113(10):1435-9; El-Agnaf et al., FASEB J. 2006;20(3):419-25), 일부 연구자들은 정상 대조군에 비하여 파킨슨병 환자에서 감소된 혈장 알파-시뉴클레인을 보고하였다(Li et al., Exp Neurol. 2007;204(2):583-8).
특정 실시형태에서, 본 발명의 치료제(들)는 알코올 억제제(예컨대, 아캄프로세이트), 마약성 진통제(예컨대, 레미펜타닐), 항운동장애제(예컨대, 아만타딘, 아포모르핀, 벤세라지드, 브로모크립틴, 카베르골린, 카르비도파, 덱세티마이드, 드록시도파, 엔타카폰, 레보도파, 리수라이드, 메만틴, 피리베딜, 프라미펙솔, 로피니롤, 셀레길린, 시네메트), 항감염제(예컨대, 아만타딘, 아목시실린, 클라리스로마이신, 에탄올, 인터페론, 미노시클린, PS-K), 항비만제(예컨대, 페닐프로판올아민, 토피라메이트), 항경련제(예컨대, 에티라세탐, 토피라메이트), 항구토제(예컨대, 트리메토벤즈아미드), 혈압강하제(예컨대, 트란돌라프릴), 항종양제(예컨대, 카베르골린, PS-K), 중추신경계 억제제(예컨대, 아리피프라졸, 벤조카인, 클로자핀, 코카인, 덱스메데토미딘, 디펜히드라민, 이소플루레인, 리튬, 리튬 카르보네이트, 메틸페론(Metylperon), 모르핀, 프로포폴, 쿠에타핀, 라클로프라이드, 레미펜타닐, 소듐 옥시베이트), 중추신경계 자극제(예컨대, 카페인 시트레이트, 모다피닐, 니코틴 폴라크릴렉스), 응혈제(예컨대, 아르기닌 바소프레신, 데아미노 아르기닌 바소프레신, 바소프레신), 피부용 제제(예컨대, 로라타딘, 프로메타진), 위장관제(예컨대, 디펜히드라민, 돔페리돈, 오메프라졸, 트리메토벤즈아미드), 수면제 및/또는 진정제(예컨대, 레미펜타닐), 미량영양소(예컨대, 알파-토코페롤, 코엔자임 Q10, 에르고칼시페롤, 하이드록소코발라민, 철, 토코페롤 아세테이트, 토코페롤, 비타민 B12, 비타민 D, 비타민 E), 신경보호제(예컨대, 엘리프로딜, 모다피닐, 라사길린, 리바스티그민, 토피라메이트), 뇌기능개선제(nootropic agent)(예컨대, 도네페질, 에티라세탐), 향정신제(예컨대, 아리피프라졸, 시탈로프람, 클로자핀, 둘록세틴, 리튬, 리튬 카르보네이트, 메틸페론, 노르트립틸린, 파록세틴, 쿠에타핀, 라클로프라이드, 벤라팍신), 호흡기관제(예컨대, 덱스트로메토르판, 구아이페네신, 이프라트로피움, 나파졸린, 옥시메타졸린, 페닐에프린, 페닐프로판올아민), 혈관수축제(예컨대, 나파졸린, 옥시메타졸린, 페닐에프린, 페닐프로판올아민)인 적어도 하나의 다른 치료제와 조합하여 투여된다.
하나의 바람직한 실시형태에서, 질환이 파킨슨병일 때 상기 언급한 다른 치료제가 투여된다.
특정 실시형태에서, 본 발명의 치료제(들)는 니코틴 알파-7 작용제(예컨대, MEM 3454 또는 MEM 63908, 두 가지 모두 Memory Pharmaceuticals로부터 입수가능함)인 적어도 하나의 다른 치료제와 조합하여 투여된다. 특정 실시형태에서, 본 발명의 치료제(들)는 R3487및/또는 R4996(두 가지 모두 Roche로부터 입수가능함)인 적어도 하나의 다른 치료제와 조합하여 투여된다. 또한 본 발명의 치료제(들)와 둘 이상의 다른 치료제의 조합이 고려된다. 다른 치료제의 예시적인 조합은 이에 한정되는 것은 아니지만, R3487/MEM 3454 및 R4996/MEM 63908을 포함한다.
특정 실시형태에서, 본 발명의 치료제(들)는 적어도 하나의 콜린에스테라아제 억제제(예컨대, 도네페질(상표명 Aricept), 갈랄타민(상표명 Razadyne), 및 리바스티그민(상표명 Exelon 및 Exelon Patch)과 조합하여 투여된다.
특정 실시형태에서, 본 발명의 치료제(들)는 적어도 하나의 비상경적 NMDA 수용제 길항제(예컨대, 메만틴(상표명 Akatinol, Axura, Ebixa/Abixa, Memox 및 Namenda))와 조합하여 투여된다.
특정 실시형태에서, 본 발명의 치료제(들)는 비마약성 진통제(예컨대, 셀레콕시브, 레스베라트롤, 로페콕시브, TNFR-Fc 융합 단백질), 항운동장애제(예컨대, 덱세티마이드, 가바펜틴, 레보도파, 메만틴), 항감염제(예컨대, 아세틸시스테인, 아사이클로버, 벤조에이트, 데옥시글루코오스, 독시사이클린, 인터페론 알파(Alfa)-2a, 인터페론-알파, 인터페론, 목시플록사신, PS-K, 퀴나크린, 리팜핀, 살리실산, 발라시클로버), 항염제(예컨대, 아스피린, 셀레콕시브, 커큐민, 이부프로펜, 인도메타신, 나프록센, 레스베라트롤, 로페콕시브, TNFR-Fc 융합 단백질), 항비만제(예컨대, 페닐프로판올아민), 항경련제(예컨대, 가바펜틴, 호모타우린, 라모트리진), 항구토제(예컨대, 올란자핀), 혈압강하제(예컨대, 트란돌라프릴), 탈콜레스테롤제(예컨대, 아토르바스타틴, 콜린, 클로피브릭산, 프라바스타틴, 심바스타틴), 항종양제(예컨대, 브리오스타틴 1, 카르무스틴, 사이클로포스파미드, 인터페론 알파(Alfa)-2a, 루프롤라이드, 메톡시프로제스테론 17-아세테이트, 메틸테스토스테론, PK 11195, 프레드니손, PS-K, 레스베라트롤, 2,3-디하이드로-1H-이미다조(1,2-b)피라졸), 항류마티즘제(예컨대, 아스피린, 셀레콕시브, 커큐민, 이부프로펜, 인도메타신, 나프록센, 레스베라트롤, 로페콕시브, TNFR-Fc 융합 단백질), 중추신경계 억제제(예컨대, 아리피프라졸, 벤조카인, 코카인, 가바펜틴, 할로페리돌, 할로페리돌 데카노에이트, 리튬, 리튬 카르보네이트, 로라제팜, 미다졸람, 올란자핀, 페르페나진, 프로포폴, 쿠에타핀, 리스페리돈, 소듐 옥시베이트, 트라조돈, 발프로산, 졸피뎀), 중추신경계 자극제(예컨대, 카페인 시트레이트, 모다피닐, 니코틴 폴라크릴렉스), 채널차단제(예컨대, 가바펜틴,라모트리진), 응혈제(예컨대, 안티플라스만, 비타민 K), 피부용 제제(예컨대, 미네랄 오일, 살리실산), 위장관제(예컨대, 콜린, 할로페리돌, 로라제팜, 올란자핀, 오메프라졸, TNFR-Fc 융합 단백질), 수면제 및/또는 진정제(예컨대, 졸피뎀), 혈당강하제(예컨대, 인슐린, Asp(B28)-, 로지글리타존), 미량영양소(예컨대, 알파-토코페롤, 아스코르브산, 코엔자임 Q10, 구리, 폴산, 하이드록소코발라민, 이노시톨, 철, 니아신, 니아신아미드, 니코틴산, 피리독신, 셀레늄, 티옥산, 토코페롤 아세테이트, 토코페롤, 비타민 B12, 비타민 B6, 비타민 E, 비타민 K), 신경보호제(예컨대, 후페르진 A, 모다피닐, 네피라세탐, 라사길린, 리바스티그민, (3-아미노프로필)(n-부틸)포스핀산), 뇌기능개선제(예컨대, 도네페질, 네피라세탐), 혈소판응집 억제제(예컨대, 레스베라트롤), 향정신제(예컨대, 아리피프라졸, 부프로피온, 시탈로프람, 둘록세틴, 가바펜틴, 할로페리돌, 할로페리돌 데카노에이트, 리튬, 리튬 카르보네이트, 로라제팜, 미다졸람, 네피라세탐, 올란자핀, 파록세틴, 페르페나진, 쿠에타핀, 리스페리돈, 세르트랄린, 트라조돈, 트립토판, 발프로산, 벤라팍신), 생식제어제(예컨대, 에스트라디올 17 베타-시피오네이트, 에스트라디올 3-벤조에이트, 에스트라디올 발레레이트, 인도메타신, 류프롤리드, 메드록시프로제스테론, 메드록시프로제스테론 17-아세테이트, 미페프리스톤), 호흡기관제(예컨대, 아세틸시스테인, 덱스트로메토르판, 구아이페네신, 나파졸린, 옥시메타졸린, 페닐에프린, 페닐프로판올아민), 또는 혈관수축제(예컨대, 나파졸린, 옥시메타졸린, 페닐에프린, 페닐프로판올아민)인 적어도 하나의 다른 치료제와 조합하여 투여된다.
하나의 바람직한 실시형태에서, 질환이 알츠하이머병일 때 상기 언급한 다른 치료제가 투여된다.
실시예
본 발명은 하기 제시된 실시예에 의하여 추가적으로 기술된다. 이러한 실시예의 사용은 단지 예시적인 것이며 결코 본 발명 또는 임의의 예시된 것의 범주 및 의미를 제한하는 것이 아니다. 또한, 본 발명은 본원에 기술된 임의의 특정한 바람직한 실시형태로 제한되지 않는다. 실제로, 본 명세서에 따라 본 발명의 다수의 변형 및 수정이 당업자에게 명백할 것이다. 그러므로, 본 발명은 청구범위에 부여된 등가의 전체 범주와 함께 첨부된 청구범위에 의해서만 제한되어야 한다.
실시예 1: 저해 상수의 결정
본 발명의 신규 화합물에 대한 Gcase의 결합 친화력(Ki 결합 상수로 정의함)은 효소 억제 분석을 사용하여 경험적으로 결정하였다. 간단히, 효소 억제 분석을 사용하여 결합하는 시험 화합물의 능력 및 농도 의존적 방식으로 형광생성 기질의 가수분해를 방지하는 시험 화합물의 능력을 모니터링하였다. 구체적으로, 재조합 인간 GCase(rhGCase; Cerezyme®, Genzyme Corp.)의 효소 활성은 각각의 시험 화합물의 부재시 또는 각각의 시험 화합물의 다양한 양의 존재시 4-메틸움베리페릴-β-D-글루코피라노시드(4-MU-β-D-Glc) 형광생성 기질을 사용하여 측정하였다. 결과 데이터는 저해 대조 물질이 없는 샘플(화합물이 없음; 100% 효소 활성에 해당함)에 대하여 모든 시험 샘플을 비교함으로써 분석하여 시험 화합물의 존재시 잔여 효소 활성을 결정하였다. 그 다음 정규화된 잔여 활성 데이터(y축)를 시험 화합물의 농도(x축)에 대하여 그래프로 나타내어 효소 활성을 50% 저해하게 되는 시험 화합물 농도(IC50로 정의함)를 추론하였다. 그 다음 각각의 시험 화합물에 대한 IC50 값을 Cheng-Prusoff 방정식(하기 상술함)에 대입하여 시험 화합물에 대한 Gcase의 결합 친화력을 정확하게 반영하는 절대 저해 상수 Ki를 도출하였다. 효소 저해 분석은 pH 7.0(소포체 pH) 및 pH 5.2(리소좀 pH)에서 수행하여 소포체 및 리소좀에서 Gcase에 대한 화합물의 결합 친화력(즉, 효능)을 통찰하였다.
시험관내 분석
다양한 농도의 시험 화합물을 pH 7.0 및 pH 5.2에서 0.25% 소듐 타우로콜레이트가 있는 50mM 소듐 포스페이트 완충제로 이루어진 완충제 “M” 중에 제조하였다. 또한 효소(Cerezyme®, 인간 효소 β-글루코세레브로시다아제의 재조합 형태)를 pH 7.0 및 pH 5.2에서 동일한 완충제 “M” 중에 희석하였다. 기질 용액은 2가지 pH에서 0.15% 트리톤 X-100이 있는 완충제 “M” 중 3mM 4-메틸움베리페론 β-D-글루코피라노시드로 이루어졌다. 희석된 효소 5㎕를 다양한 농도의 억제제 또는 완충제 “M” 단독 15㎕에 첨가하고, 기질 제조물 50㎕와 함께 37℃에서 1시간 동안 항온처리하여 pH 7.0 및 pH 5.2에서 β-글루코시다아제 활성을 평가하였다. 동일한 부피의 pH 10.6, 0.4M 글리신 첨가에 의해 반응을 중지시켰다. 355nm 여기 및 460nm 방출을 사용하여 웰당 1초 동안 플레이트 판독기 상에서 형광을 측정하였다. 효소의 첨가없이 또는 억제제의 첨가없이 한 항온처리를 사용하여 각각 효소 활성이 없는 것 및 최대 활성을 정의하고 주어진 분석에 대하여 저해율(%)을 정규화하였다. 참조 화합물 IFG-타르트레이트 및 몇 가지 시험 화합물에 대한 이러한 시험관내 저해 분석 결과가 하기 표 2A에 요약되어 있다.
[표 2A]
동일계 내 분석
리소좀 Gcase 활성에 대한 본 발명의 신규 화합물의 영향을 정상 개체로부터 생성된 섬유아세포를 사용하여 동일계 내에서 분석하였다. 48웰 플레이트에 파종된 세포를 표시된 농도의 화합물과 함께 16시간 내지 24시간 동안 배양하였다. 용량 반응 분석을 위하여, 세포를 동일계 내에서 기질인 5-(펜타플루오로벤조일아미노)플루오레세인 디-β-D-글루코피라노시드(PFBFDβGlu)와 함께 1시간 동안 배양하였고, 이어서 세포를 용해하여 화합물의 존재시 기질 가수분해의 정도를 측정하였다. 분석은 IC50을 중심으로 하여, 5자리수를 포함하는 12개의 농도 범위를 이용하였다. 구체적으로, 다음의 농도 범위를 이용하였다: (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5R)-5-(1-하이드록시에틸)-피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올: 1.0 x 10-3 내지 3.0 x 10-9M; (3R,4R,5R)-5-(1-하이드록시에틸)-피페리딘-3,4-디올: 1.0 x 10-4 내지 3.0 x 10-10M; 및 (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올: 1.0 x 10-3 내지 3.0 x 10-11M; 여기에서 화합물은 명시된 범위에서 가장 높은 농도로부터 1:3으로 연속적으로 희석하였다. 화합물의 부재시 활성에 대한 화합물의 존재시 활성의 비율로서 저해를 결정하였다. 워시아웃 분석을 위하여, 세포를 16시간 내지 24시간 동안 IC90과 동일한 농도에서 화합물로 처리하였다. 세포를 광범위하게 세척하고 약물이 없는 배지에서 배양하여 세포로부터의 순 화합물 유출량을 차감하였다. 그 다음 세포를 리소좀 Gcase 활성에 대하여 화합물 제거 후 총 8시간에 걸쳐서 2시간 간격으로 시험하였다. 시간 경과에 따른 활성의 증가를 단일 지수 함수로 맞추어 화합물의 제거 시간을 결정하였다. 참조 화합물 IFG-타르트레이트 및 몇 가지 시험 화합물에 대한 이러한 동일계 내 저해 분석 결과가 하기 표 2B에 요약되어 있다.
[표 2B]
참조 화합물 IFG-타르트레이트와 비교하여, 다음과 같은 주목할 만한 점이 있다: (i) 시험 화합물 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5R)-5-(1-하이드록시에틸)-피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올은 Gcase 활성이 농도 의존적으로 증가하고, 훨씬 더 낮은 농도에서 참조 화합물 IFG-타르트레이트와 동일한 최대 수준으로 효소 활성이 향상되었음이 발견되었다; (ii) 시험 화합물 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올은 참조 화합물 IFG-타르트레이트보다 상당히 더 빠르게 리소좀 격막이 세척으로 제거되었다(동일계 내 제거); 및 (iii) 시험 화합물 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5R)-5-(1-하이드록시에틸)-피페리딘-3,4-디올, (3R,4R,5R)-5-(1-하이드록시에틸)-피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올은 Gcase 활성을 저해하였다.
실시예 2: 혈액-뇌장벽 투과
참조 화합물 IFG-타르트레이트와 본 발명의 몇 가지 화합물(즉, (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5R)-5-(1-하이드록시에틸)-피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올)의 혈액-뇌장벽(BBB) 투과를 마우스에 경구 투여한 후 분석하였다. 이를 위하여, 8주령의 야생형 수컷 마우스(C57BL/6)에 참조 화합물 또는 시험 화합물의 단일 30mg/kg(유리 염기 당량)의 경구(p.o.) 복용량을 위관으로 투여하였다(n = 시점 당 마우스 3마리). 복용 용액은 수중으로 제조하였다. 복용 후, 마우스를 복용 후 0시간, 0.5시간, 1시간 및 4시간 후의 시점에 CO2로 안락사시켰다. 안락사 후, 전혈을 하대정맥에서 리튬 헤파린 튜브로 수집하였다. 유사하게, 뇌를 각각의 마우스에서 수집하였다. 혈장은 전혈을 2,700 x g에서 10분 동안 4℃에서 회전시킴으로써 얻은 후, 드라이아이스 상에 저장하였다. 전뇌(whole brain)는 차가운 PBS로 세척하여 오염 혈액을 제거하고, 닦아서 건조시키며, 드라이아이스 상에서 급속냉동하고, 최종적으로 분석 때까지 -80℃에서 저장하였다. 분석용 뇌 샘플을 준비하기 위하여, 조직 50mg 내지 100mg을 조직 mg 당 400㎕의 물로 균질화하였다. 그 다음에 샘플을 원심분리에 의하여 정화하였다. 그 다음에, 뇌 호모게네이트 상청액 25㎕ 또는 혈장 25㎕를 아세토니트릴:물(95/5) 25㎕와 합하였다. 여기에 아세토니트릴 25㎕ 및 내부 표준 50㎕(아세토니트릴:메탄올(70:30) 중 0.5% 포름산 중 100ng/mL IFG-타르트레이트 13C2-15N)으로 보충하였다. 샘플을 다시 원심분리로 정화하고 상층액 75㎕를 아세토니트릴 75㎕와 합하였다. 그 다음에 PPD 사(社)에서 LC-MS/MS(3230 Deming Way, Middleton, WI 53562)로 화합물 수준에 대하여 샘플을 분석하였다. 간단히, (A) 95:5 아세토니트릴:물 또는 (B) 70:20:10 메탄올:물:아세토니트릴 중 5mM 암모늄포메이트 및 0.05% 포름산으로 이루어진 이동상의 혼합물로 평형시킨 Thermo Betasil, Silica-100, 50 x 3mm, 5μ 컬럼을 이용하였다. 분석을 위해 20㎕ 내지 30㎕의 샘플을 주입하였다. 약물 농도를 계산하기 위하여 혈장(ng/mL) 및 뇌(ng/g)에 대한 원데이터(raw data)를 각각의 화합물의 분자량을 사용하고 조직 1g은 1mL 부피와 대등한 것으로 가정하여 nM으로 전환하였다. 시간의 함수로서 농도를 GraphPad Prism version 4.02에서 플롯팅하였다.
참조 화합물(즉, IFG-타르트레이트) 또는 시험 화합물(즉, (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5R)-5-(1-하이드록시에틸)-피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 또는 (3R,4R,5S)-5-벤질피페리딘-3,4-디올)의 단일 30mg/kg(유리 염기 당량)의 경구 복용량을 투여한 마우스에서 검출된 혈장 수준 및 뇌 수준은 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올이 IFG-타르트레이트와 비교하여 혈액-뇌장벽을 더 용이하게 가로지르는 것을 반영한다. 추가적으로, IFG-타르트레이트의 투여 후에 관찰된 것보다 더 높은 수준의 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올이 뇌에서 검출되었다.
실시예 3: GCase 향상
경구 투여된 시험 화합물 ((3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 또는 (3R,4R,5S)-5-벤질피페리딘-3,4-디올)의 Gcase 수준을 상승시키는 능력을 마우스에서 평가하였다. 이를 위하여, 8주령의 야생형 수컷 마우스(C57BL/6)에 본 발명의 화합물(즉, (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올, (3R,4R,5S)-5-((R)-1-플루오로프로필)피페리딘-3,4-디올 하이드로클로라이드 또는 (3R,4R,5S)-5-벤질피페리딘-3,4-디올)의 단일 경구 복용량을 (위관으로) 투여하였다. 각각의 화합물에 대하여 투여된 상세한 용량은 표 3A 및 표 3B에 제공되어 있다. 복용 용액은 수중으로 제조하였다. 화합물은 2주일에 거쳐서 하기와 같이 투여하였다: 제1주, 월요일부터 금요일(투여함), 토요일부터 일요일(투여하지 않음); 제2주, 월요일부터 목요일(투여함); 금요일에 부검함. 따라서, 전체 9개 복용량(매일 새로 제조한 복용 용액)이 각각의 마우스에게 주여졌으며, 마지막 복용과 부검 사이에 24시간 동안 워시아웃하였다.
복용을 완료한 후, 마우스는 CO2로 안락사시켰으며, 전혈을 하대정맥에서 리튬 헤파린 튜브로 수집하였다. 혈장은 혈액을 2700g에서 10분 동안 4℃에서 회전시킴으로써 수집하였다. 간, 비장, 폐 및 뇌 조직을 제거하고, 차가운 PBS로 세척하며, 닦아서 건조시키고, 드라이아이스 상에서 급속냉동하며, 분석 때까지 -80℃에서 저장하였다. pH 5.2에서 3초 내지 5초 동안 얼음 상에서 마이크로 호모게나이저를 이용하여 500μL McIlvane(MI) 완충제(100mM 소듐 시트레이트, 200mM 소듐 포스페이트 디베이직, 0.25% 소듐 타우로콜레이트, 및 0.1% 트리톤 X-100, pH 5.2) 중에서 대략 50mg의 조직을 균질화함으로써 Gcase 수준을 측정하였다. 그 다음 호모게네이트를 실온에서 2.5mM 콘두리톨-B-에폭시드(CBE) 없이 및 2.5mM 콘두리톨-B-에폭시드(CBE)와 함께 30분 동안 항온처리하였다. 마지막으로, 3.7mM 4-메틸움베리페릴-β-글루코시드(4-MUG) 기질을 첨가하고 37℃에서 60분 동안 항온처리하였다. pH 10.6, 0.4M 글리신 첨가에 의해 반응을 중지시켰다. 355nm 여기 및 460nm 방출을 사용하여 웰당 1초 동안 플레이트 판독기 상에서 형광을 측정하였다. 제조자 지시에 따라 MicroBCA 키트를 사용하여 용해물 중 전체 단백질을 측정하였다. 1.0nM 내지 50μM 범위인 4-메틸움베리페론(4-MU) 표준 곡선은 원 형광 데이터(raw fluorescence data)의 (CBE의 존재시 및 부재시) 절대 Gcase 활성으로의 전환을 위하여 동시에 실행하고, 시간당 단백질의 mg 당 방출된 4-MU의 nmol(nmol/mg 단백질/hr)로서 표현하였다. Microsoft Excel(Redmond, WA) 및 GraphPad Prism 버젼 4.02를 사용하여 Gcase 수준 및 단백질 수준을 계산하였다.
표 3A 및 표 3B는 상기 기술된 바와 같이 마우스에서 시험한 각각의 화합물에 대하여 투여한 용량뿐만 아니라 뇌 및 비장 각각에서 Gcase 향상의 결과 수준, 조직에서 화합물 농도, GCase 분석에서 화합물 농도 및 저해 상수(Ki)를 요약한다.
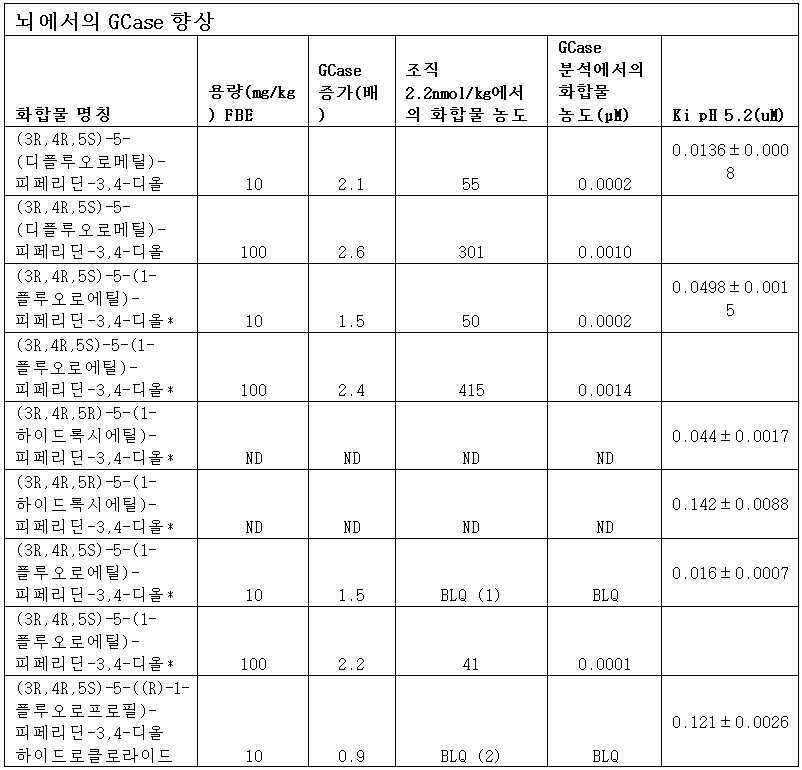
[표 3A]
[표 3B]
표 3A 및 표 3B에 반영된 바와 같이, (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올 또는 (3R,4R,5S)-5-벤질피페리딘-3,4-디올이 투여된 마우스는 뇌 및 비장에서 유의한 Gcase 향상을 입증하였다.
실시예 4: 래트 약동학
약동학(PK) 데이터를 래트에서 획득하여 시험 화합물의 생체이용가능성을 평가하였다. 특히, 농도/시간 곡선(AUC) 하의 면적에 의하여 측정된 생체이용가능성, 이용가능한 용량의 분획(%F; 하기에서 더 정의함), 클리어런스(CL), 분포 용적(Vd) 및 반감기(t½)의 PK 파라미터를 계산하였다. 이를 위하여, 8주령의 스프래그-다우리(Sprague-Dawley) 수컷 래트에게 유리 염기의 3mg/kg과 동등한 단일 정맥내(IV) 용량 또는 유리 염기의 10mg/kg, 30mg/kg 및 100mg/kg과 동등한 시험 화합물의 단일 점증(escalating) 경구 복용량을 (위관으로) 제공하였다. 복용 그룹당 3마리의 래트를 사용하였다. 혈액을 24시간에 걸쳐서 수집하였다. 정맥내 투여 후 혈액 수집 시점은 0분, 2.5분, 5분, 10분, 15분, 30분, 45분, 1시간, 2시간, 4시간, 8시간, 12시간 및 24시간이었고, 경구 투여 후 혈액 수집 시점은 0분, 5분, 15분, 30분, 45분, 1시간, 2시간, 3시간, 4시간, 8시간, 12시간 및 24시간이었다. PPD에서 LC-MS/MS로 화합물 수준에 대하여 혈장 샘플을 분석하였다. VD, %F, CL 및 t½를 계산하기 위하여 Win-nonLin에서 비구획 분석에 의하여 원데이터를 분석하였다.
상기 언급된 연구에 기초한 (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올에 대한 다양한 약동학 파라미터는 하기 표 4A 내지 표 4D에 상술되어 있다.
[표 4A]
[표 4B]
[표 4C]
[표 4D]
표 4A 내지 표 4D에 반영된 바와 같이, (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올은 약물 개발에 대하여 유리한 약동학 프로파일을 가진다. 특히, (3R,4R,5S)-5-(디플루오로메틸)피페리딘-3,4-디올, (3R,4R,5S)-5-(1-플루오로에틸)피페리딘-3,4-디올 및 (3R,4R,5S)-5-벤질피페리딘-3,4-디올은 우수한 경구용 생체이용가능성(대략 50% 내지 100%) 및 용량 비례, 1.0시간 내지 4.0시간의 반감기, 및 말초 조직으로의 적절한 투과를 시사하는 분포 용적을 나타낸다.
Claims (1)
- 하기 화학식 i의 화합물의 유효량을 파킨슨병의 예방 및/또는 치료를 필요로 하는 환자에게 투여하는 것을 포함하는, 파킨슨병을 발병시키거나 진단될 위험이 있는 있는 환자에서 파킨슨병을 예방 및/또는 치료하는 방법:
[화학식 i]
여기에서,
R1은 C(R2)(R3)(R4)이고;
R2는 수소, -OH 또는 할로겐이며;
R3은 수소, -OH, 할로겐 또는 C1-8 알킬이고;
R4는 할로겐, C1-8 알킬, 치환된 C1-8 알킬, 아릴, 치환된 아릴, 알킬사이클로알킬 또는 치환된 알킬사이클로알킬이며;
R3 및 R4는 이들이 부착된 탄소와 결합하여 사이클로알킬 고리를 형성할 수 있고, 이는 선택적으로 바람직하게 할로겐, 보다 바람직하게는 하나 이상의 플루오린 원자로 치환될 수 있으며;
R6은 수소, C1-8 알킬, 치환된 C1-8 알킬, 아릴알킬, 치환된 아릴알킬, 알킬아릴 또는 치환된 알킬아릴이고;
Z는 선택적이며, 존재한다면 Z는 -(CH2)1-8-, -C(=O)-, -S(=O)2NH-, -S(=O)2-, -C(=S)NH-, -S(=O)2-CH3, C(=O)-NH-, -S(=O)2-NR9R10, -C(=O)C1-8 알킬 또는 -C(=O)CH(NH2)CH3이고;
R9는 수소, C1-8 알킬 또는 치환된 C1-8 알킬이며;
R10은 수소, C1-8 알킬 또는 치환된 C1-8 알킬이고;
R5는 수소, C1-8 알킬, 치환된 C1-8 알킬, 아릴, 치환된 아릴, C1-8 알케닐, 치환된 C1-8 알케닐, 아릴알킬, 치환된 아릴알킬, 알킬아릴, 치환된 알킬아릴, 아미노아릴알킬 또는 치환된 아미노아릴알킬이며;
R7은 -OH 또는 할로겐이고;
R8은 수소, 할로겐 또는 C1-8 알킬이며,
만약 R4가 할로겐일 때 R2 및 R3이 둘 다 수소일 수 없다면, Z는 존재하지 않고, R7은 -OH이며, R5, R6 및 R8은 수소이다.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US25280309P | 2009-10-19 | 2009-10-19 | |
| US61/252,803 | 2009-10-19 | ||
| PCT/US2010/051447 WO2011049736A1 (en) | 2009-10-19 | 2010-10-05 | Novel compositions for preventing and/or treating degenerative disorders of the central nervous system |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127012936A Division KR101769396B1 (ko) | 2009-10-19 | 2010-10-05 | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177037220A Division KR101880411B1 (ko) | 2009-10-19 | 2010-10-05 | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20170096220A true KR20170096220A (ko) | 2017-08-23 |
| KR101813988B1 KR101813988B1 (ko) | 2018-01-02 |
Family
ID=43879775
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127012936A KR101769396B1 (ko) | 2009-10-19 | 2010-10-05 | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 |
| KR1020177037220A KR101880411B1 (ko) | 2009-10-19 | 2010-10-05 | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 |
| KR1020177022493A KR101813988B1 (ko) | 2009-10-19 | 2010-10-05 | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127012936A KR101769396B1 (ko) | 2009-10-19 | 2010-10-05 | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 |
| KR1020177037220A KR101880411B1 (ko) | 2009-10-19 | 2010-10-05 | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 |
Country Status (27)
| Country | Link |
|---|---|
| US (4) | US8604206B2 (ko) |
| EP (2) | EP3143875B1 (ko) |
| JP (2) | JP5805649B2 (ko) |
| KR (3) | KR101769396B1 (ko) |
| CN (2) | CN105367485B (ko) |
| AR (1) | AR078606A1 (ko) |
| AU (3) | AU2010308396B2 (ko) |
| BR (1) | BR112012009121A2 (ko) |
| CA (1) | CA2778348C (ko) |
| CY (1) | CY1118966T1 (ko) |
| DK (1) | DK2490532T3 (ko) |
| ES (2) | ES2814178T3 (ko) |
| HK (1) | HK1219724A1 (ko) |
| HR (1) | HRP20170236T1 (ko) |
| HU (1) | HUE033116T2 (ko) |
| IL (1) | IL219160B (ko) |
| LT (1) | LT2490532T (ko) |
| MX (2) | MX340807B (ko) |
| PL (1) | PL2490532T3 (ko) |
| PT (1) | PT2490532T (ko) |
| RS (1) | RS55679B1 (ko) |
| RU (2) | RU2581058C2 (ko) |
| SG (1) | SG10201507159XA (ko) |
| SI (1) | SI2490532T1 (ko) |
| SM (1) | SMT201700105B (ko) |
| TW (1) | TWI642434B (ko) |
| WO (1) | WO2011049736A1 (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL2490532T3 (pl) | 2009-10-19 | 2017-05-31 | Amicus Therapeutics, Inc. | Nowe kompozycje do zapobiegania i/lub leczenia zaburzeń zwyrodnieniowych ośrodkowego układu nerwowego |
| ES2716871T3 (es) | 2009-10-19 | 2019-06-17 | Amicus Therapeutics Inc | Nuevas composiciones para prevenir y/o tratar trastornos de almacenamiento lisosomal |
| EP2591823A1 (en) * | 2011-11-11 | 2013-05-15 | Biologische Heilmittel Heel GmbH | Composition for treating or preventing neurodegenerative disorders |
| CA2868459A1 (en) | 2012-03-27 | 2013-10-03 | Amicus Therapeutics, Inc. | Polymorphs of (3r,4r,5s)-5-(difluoromethyl)piperidine-3,4-diol fumarate and uses thereof |
| WO2015095963A1 (en) * | 2013-12-23 | 2015-07-02 | Alectos Therapeutics Inc. | Glucocerebrosidase modulators and uses thereof |
| US10179128B2 (en) | 2015-08-31 | 2019-01-15 | Amicus Therapeutics, Inc. | Regimens for treating and preventing lysosomal disorders and degenerative disorders of the central nervous system |
| US11358926B2 (en) | 2017-04-25 | 2022-06-14 | Amicus Therapeutics, Inc. | Compositions for preventing and/or treating degenerative disorders of the central nervous system and/or lysosomal storage disorders |
| RU2676956C1 (ru) * | 2017-08-25 | 2019-01-11 | Общество с ограниченной ответственностью "Международный Биотехнологический Центр "Генериум" | Антитела для связывания имиглюцеразы и их применение в аффинной хроматографии |
| KR101991276B1 (ko) | 2018-01-19 | 2019-06-21 | 전남대학교산학협력단 | 신규 균주 페니실리움 아쿠아티쿰 및 이를 이용한 퇴행성 뇌질환 치료제 |
| WO2020023390A1 (en) | 2018-07-25 | 2020-01-30 | Modernatx, Inc. | Mrna based enzyme replacement therapy combined with a pharmacological chaperone for the treatment of lysosomal storage disorders |
| US20240252418A1 (en) * | 2023-01-31 | 2024-08-01 | Bioeutectics Corporation | Additives (Adjuvants, Anti Freezing Agents, Antimicrobial and Antioxidants) in Natural Deep Eutectic Solvents and Mixtures |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4407957A (en) | 1981-03-13 | 1983-10-04 | Damon Corporation | Reversible microencapsulation of a core material |
| AU666118B2 (en) | 1991-04-25 | 1996-02-01 | Brown University Research Foundation | Implantable biocompatible immunoisolatory vehicle for delivery of selected therapeutic products |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| US5569189A (en) | 1992-09-28 | 1996-10-29 | Equidyne Systems, Inc. | hypodermic jet injector |
| DE69332105T2 (de) | 1992-09-29 | 2003-03-06 | Inhale Therapeutic Systems, San Carlos | Pulmonale abgabe von aktiven fragmenten des parathormons |
| DE69531098T2 (de) | 1994-03-09 | 2004-04-29 | Novo Nordisk A/S | Piperidine und pyrrolidine |
| US5863903A (en) * | 1994-03-09 | 1999-01-26 | Novo Nordisk A/S | Use of hydroxy alkyl piperidine and pyrrolidine compounds to treat diabetes |
| FR2718357B1 (fr) | 1994-04-06 | 1997-10-03 | Defarges Alain Moreau | Perfectionnements apportés à un dispositif d'injection par jet sans aiguille. |
| US5599302A (en) | 1995-01-09 | 1997-02-04 | Medi-Ject Corporation | Medical injection system and method, gas spring thereof and launching device using gas spring |
| US5780014A (en) | 1995-04-14 | 1998-07-14 | Inhale Therapeutic Systems | Method and apparatus for pulmonary administration of dry powder alpha 1-antitrypsin |
| US5654007A (en) | 1995-06-07 | 1997-08-05 | Inhale Therapeutic Systems | Methods and system for processing dispersible fine powders |
| TW498067B (en) * | 1996-07-19 | 2002-08-11 | Hoffmann La Roche | 4-hydroxy-piperidine derivatives |
| US6274597B1 (en) * | 1998-06-01 | 2001-08-14 | Mount Sinai School Of Medicine Of New York University | Method of enhancing lysosomal α-Galactosidase A |
| US20040082641A1 (en) * | 2002-10-28 | 2004-04-29 | Rytved Klaus Asger | Use of glycogen phosphorylase inhibitors for treatment of cardiovascular diseases |
| AU2003273762A1 (en) * | 2002-10-28 | 2004-05-13 | Novo Nordisk A/S | Use of glycogen phosphorylase inhibitors for treatment of cardiovascular diseases |
| US7446098B2 (en) | 2003-02-18 | 2008-11-04 | Mount Sinai School Of Medicine Of New York University | Combination therapy for treating protein deficiencies |
| JP2007516294A (ja) * | 2003-12-23 | 2007-06-21 | エムユーエスシー ファウンデーション フォー リサーチ ディベロップメント | 炎症性の疾患または症状の予防および治療のための方法および組成物 |
| ES2364586T3 (es) * | 2006-05-24 | 2011-09-07 | Amicus Therapeutics, Inc. | Sal tartrato de isofagomina y métodos de uso. |
| US7501439B2 (en) * | 2006-05-24 | 2009-03-10 | Amicus Therapeutics, Inc. | Tartrate salt of isofagomine and methods of use |
| BRPI0713442A2 (pt) * | 2006-06-23 | 2012-03-06 | Amicus Therapeutics, Inc. | Método para o tratamento de desrodens neurológicas, pelo aumento da atividade de b-glicocerebrosidase |
| MX2009011473A (es) | 2007-04-26 | 2010-01-18 | Amicus Therapeutics Inc | Regimenes de dosificacion para el tratamiento de enfermedades por almacenamiento lisosomal que utilizan chaperonas farmacologicas. |
| US20110237538A1 (en) | 2008-08-06 | 2011-09-29 | Summit Corporation Plc | Treatment of lysosomal storage disorders and other proteostatic diseases |
| AU2010233188B2 (en) | 2009-04-09 | 2015-07-16 | Amicus Therapeutics, Inc. | Methods for preventing and/or treating lysosomal storage disorders |
| ES2505243T3 (es) | 2009-04-09 | 2014-10-09 | Amicus Therapeutics, Inc. | Agentes terapéuticos para prevenir y/o tratar trastornos degenerativos del sistema nervioso central |
| ES2716871T3 (es) * | 2009-10-19 | 2019-06-17 | Amicus Therapeutics Inc | Nuevas composiciones para prevenir y/o tratar trastornos de almacenamiento lisosomal |
| PL2490532T3 (pl) * | 2009-10-19 | 2017-05-31 | Amicus Therapeutics, Inc. | Nowe kompozycje do zapobiegania i/lub leczenia zaburzeń zwyrodnieniowych ośrodkowego układu nerwowego |
| ES2646099T3 (es) * | 2009-10-19 | 2017-12-12 | Amicus Therapeutics, Inc. | Método para el tratamiento de la enfermedad de Alzheimer utilizando chaperonas farmacológicas para aumentar la actividad de gangliosidasas |
| KR102023720B1 (ko) | 2012-09-03 | 2019-09-20 | 엘지이노텍 주식회사 | 보이스 코일 모터 |
-
2010
- 2010-10-05 PL PL10825396T patent/PL2490532T3/pl unknown
- 2010-10-05 CN CN201510783936.0A patent/CN105367485B/zh not_active Expired - Fee Related
- 2010-10-05 KR KR1020127012936A patent/KR101769396B1/ko active IP Right Grant
- 2010-10-05 KR KR1020177037220A patent/KR101880411B1/ko active IP Right Grant
- 2010-10-05 MX MX2012004548A patent/MX340807B/es active IP Right Grant
- 2010-10-05 SI SI201031401A patent/SI2490532T1/sl unknown
- 2010-10-05 ES ES16191218T patent/ES2814178T3/es active Active
- 2010-10-05 EP EP16191218.3A patent/EP3143875B1/en active Active
- 2010-10-05 DK DK10825396.4T patent/DK2490532T3/en active
- 2010-10-05 KR KR1020177022493A patent/KR101813988B1/ko active IP Right Grant
- 2010-10-05 ES ES10825396.4T patent/ES2617192T3/es active Active
- 2010-10-05 SG SG10201507159XA patent/SG10201507159XA/en unknown
- 2010-10-05 US US12/898,112 patent/US8604206B2/en active Active
- 2010-10-05 JP JP2012535221A patent/JP5805649B2/ja active Active
- 2010-10-05 BR BR112012009121A patent/BR112012009121A2/pt not_active Application Discontinuation
- 2010-10-05 MX MX2016000153A patent/MX368459B/es unknown
- 2010-10-05 HU HUE10825396A patent/HUE033116T2/en unknown
- 2010-10-05 RU RU2012120759/04A patent/RU2581058C2/ru active
- 2010-10-05 AU AU2010308396A patent/AU2010308396B2/en not_active Ceased
- 2010-10-05 CA CA2778348A patent/CA2778348C/en active Active
- 2010-10-05 EP EP10825396.4A patent/EP2490532B1/en active Active
- 2010-10-05 PT PT108253964T patent/PT2490532T/pt unknown
- 2010-10-05 CN CN2010800566279A patent/CN102655747A/zh active Pending
- 2010-10-05 RS RS20170153A patent/RS55679B1/sr unknown
- 2010-10-05 LT LTEP10825396.4T patent/LT2490532T/lt unknown
- 2010-10-05 WO PCT/US2010/051447 patent/WO2011049736A1/en active Application Filing
- 2010-10-05 RU RU2015147509A patent/RU2015147509A/ru unknown
- 2010-10-12 AR ARP100103715A patent/AR078606A1/es unknown
- 2010-10-12 TW TW099134782A patent/TWI642434B/zh not_active IP Right Cessation
-
2012
- 2012-04-15 IL IL219160A patent/IL219160B/en not_active IP Right Cessation
-
2013
- 2013-03-01 HK HK16107625.0A patent/HK1219724A1/zh unknown
- 2013-11-19 US US14/084,131 patent/US9409862B2/en active Active
-
2015
- 2015-03-30 JP JP2015069784A patent/JP6258245B2/ja active Active
-
2016
- 2016-06-08 AU AU2016203817A patent/AU2016203817B2/en not_active Ceased
- 2016-07-22 US US15/217,217 patent/US20160326114A1/en not_active Abandoned
-
2017
- 2017-02-13 HR HRP20170236TT patent/HRP20170236T1/hr unknown
- 2017-02-16 SM SM201700105T patent/SMT201700105B/it unknown
- 2017-02-22 CY CY20171100240T patent/CY1118966T1/el unknown
- 2017-12-07 AU AU2017272296A patent/AU2017272296B2/en not_active Ceased
-
2018
- 2018-06-01 US US15/995,813 patent/US10421724B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101813988B1 (ko) | 중추신경계의 퇴행성 질환을 예방 및/또는 치료하는 신규 조성물 | |
| KR101848938B1 (ko) | 리소좀 축적 질환을 예방 및/또는 치료하는 신규 조성물 | |
| JP5634498B2 (ja) | 中枢神経系の変性障害の予防および/または治療方法 | |
| KR20190134807A (ko) | 중추 신경계의 퇴행성 질환 및/또는 리소솜 저장병을 예방 및/또는 치료하기 위한 신규한 조성물 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| E701 | Decision to grant or registration of patent right | ||
| A107 | Divisional application of patent | ||
| GRNT | Written decision to grant |