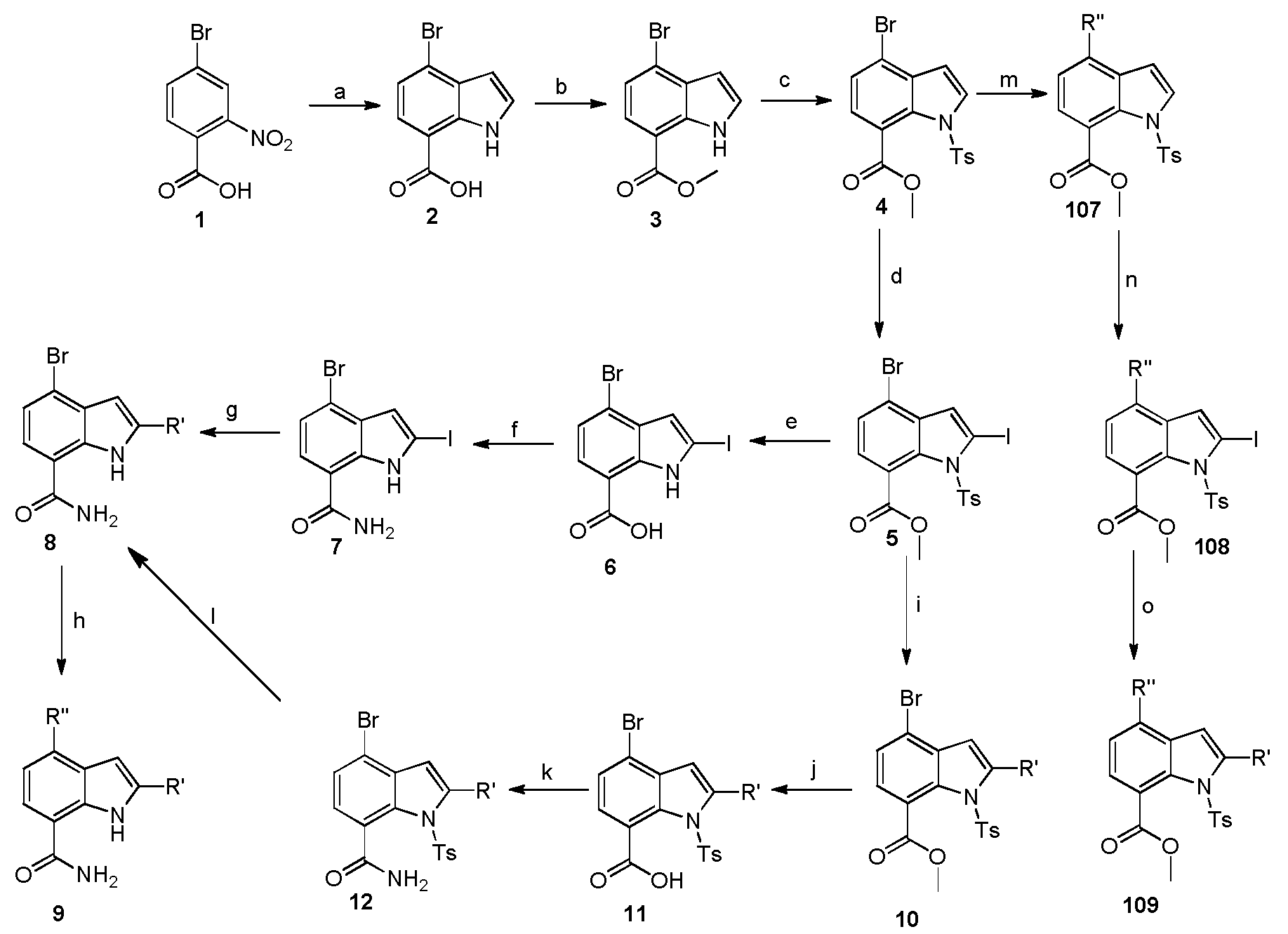
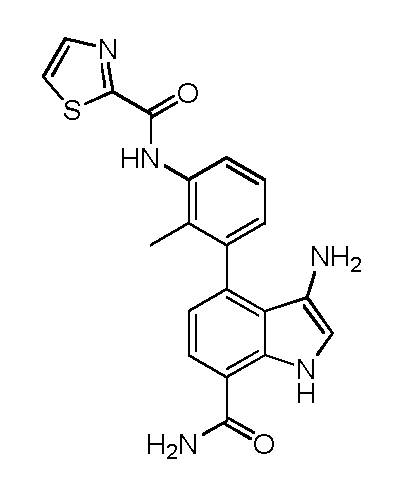
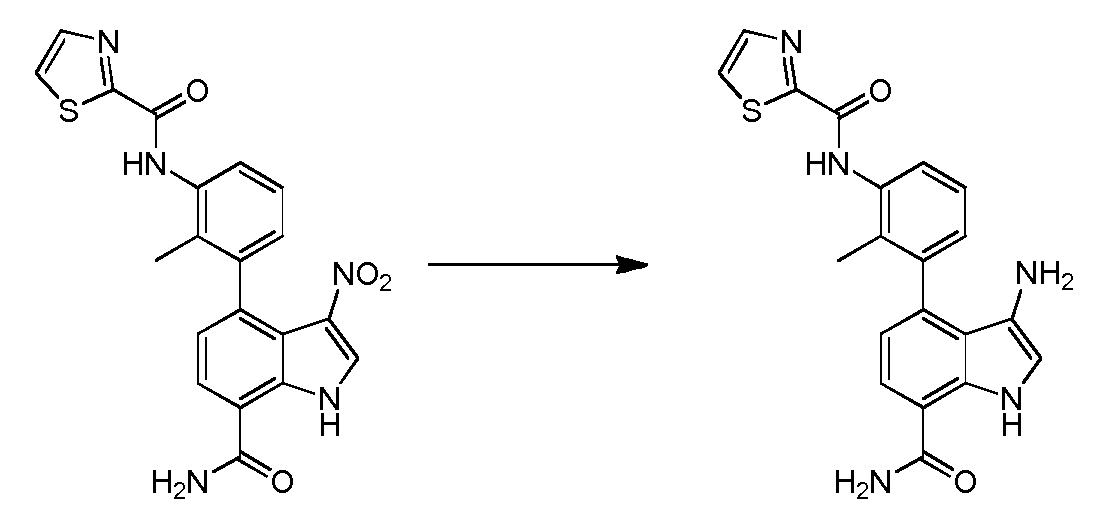
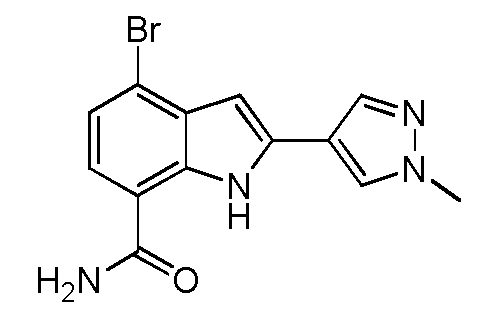
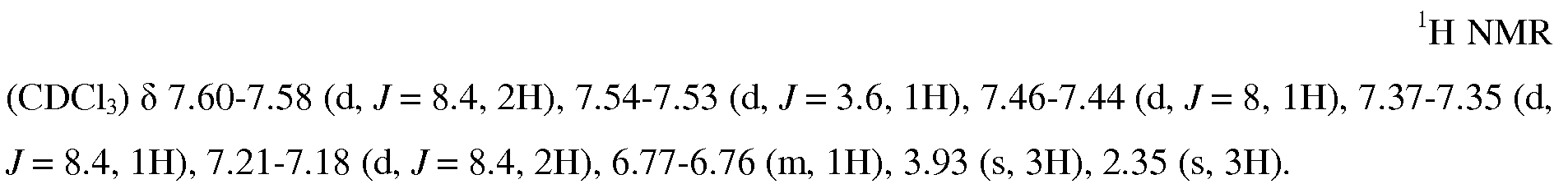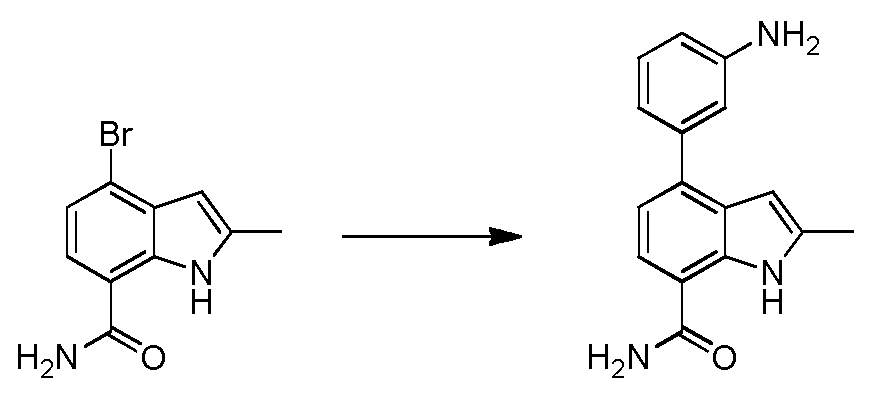KR20160025580A - Btk 억제제로서 1급 카복스아미드 - Google Patents
Btk 억제제로서 1급 카복스아미드 Download PDFInfo
- Publication number
- KR20160025580A KR20160025580A KR1020167002152A KR20167002152A KR20160025580A KR 20160025580 A KR20160025580 A KR 20160025580A KR 1020167002152 A KR1020167002152 A KR 1020167002152A KR 20167002152 A KR20167002152 A KR 20167002152A KR 20160025580 A KR20160025580 A KR 20160025580A
- Authority
- KR
- South Korea
- Prior art keywords
- carboxamide
- indole
- optionally substituted
- methylphenyl
- phenyl
- Prior art date
Links
- 0 *c(c(N)c1)ccc1[N+]([O-])=O Chemical compound *c(c(N)c1)ccc1[N+]([O-])=O 0.000 description 11
- NURWPSYWENWHQK-UHFFFAOYSA-N CC(C)(C)OC(N(C1)CC1Oc(c1c2[nH]cc1)ccc2Br)=O Chemical compound CC(C)(C)OC(N(C1)CC1Oc(c1c2[nH]cc1)ccc2Br)=O NURWPSYWENWHQK-UHFFFAOYSA-N 0.000 description 2
- NNBCWOPFTICYEF-UHFFFAOYSA-N CCOC(C(CC1)CCC1(C(F)(F)F)O)=O Chemical compound CCOC(C(CC1)CCC1(C(F)(F)F)O)=O NNBCWOPFTICYEF-UHFFFAOYSA-N 0.000 description 2
- UQAZBFCGSUKHOS-UHFFFAOYSA-N CCOCCc1cc(c(-c2cccc(N)c2)ccc2C(N)=O)c2[nH]1 Chemical compound CCOCCc1cc(c(-c2cccc(N)c2)ccc2C(N)=O)c2[nH]1 UQAZBFCGSUKHOS-UHFFFAOYSA-N 0.000 description 2
- JGTGFLGRNLRDOL-UHFFFAOYSA-N CC(C)(C)OC(N(C1)CC1N(C)c1ccc(C(N)=O)c([nH]2)c1cc2I)=O Chemical compound CC(C)(C)OC(N(C1)CC1N(C)c1ccc(C(N)=O)c([nH]2)c1cc2I)=O JGTGFLGRNLRDOL-UHFFFAOYSA-N 0.000 description 1
- XEJRUMDEXFRSMA-UHFFFAOYSA-N CC(C)(C)OC(N(C1)CC1N(C)c1ccc(C(OC)=O)c2c1cc[n]2S(c1ccc(C)cc1)(=O)=O)=O Chemical compound CC(C)(C)OC(N(C1)CC1N(C)c1ccc(C(OC)=O)c2c1cc[n]2S(c1ccc(C)cc1)(=O)=O)=O XEJRUMDEXFRSMA-UHFFFAOYSA-N 0.000 description 1
- SQQZHJDUYZIXEZ-UHFFFAOYSA-N CC(C)(C)OC(N(C1)CC1Oc(c1c2[nH]cc1)ccc2C#N)=O Chemical compound CC(C)(C)OC(N(C1)CC1Oc(c1c2[nH]cc1)ccc2C#N)=O SQQZHJDUYZIXEZ-UHFFFAOYSA-N 0.000 description 1
- JWSKJADXSVASEX-UHFFFAOYSA-N CC(C)(C)OC(N(C1)CC1Oc(cc1[N+]([O-])=O)ccc1Br)=O Chemical compound CC(C)(C)OC(N(C1)CC1Oc(cc1[N+]([O-])=O)ccc1Br)=O JWSKJADXSVASEX-UHFFFAOYSA-N 0.000 description 1
- MHUCOLOONIWBBF-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)c(c2c3[nH]cc2)c1cc3Br)=O Chemical compound CC(C)(C)OC(N(CC1)c(c2c3[nH]cc2)c1cc3Br)=O MHUCOLOONIWBBF-UHFFFAOYSA-N 0.000 description 1
- WYVIDPFECIJRMM-UHFFFAOYSA-N CC(C)(C)OC(N(CC1)c(cc2[N+]([O-])=O)c1cc2Br)=O Chemical compound CC(C)(C)OC(N(CC1)c(cc2[N+]([O-])=O)c1cc2Br)=O WYVIDPFECIJRMM-UHFFFAOYSA-N 0.000 description 1
- HHGHDLRJYKGBGC-UHFFFAOYSA-N CC(C)(C)OC(N(CCC1)CC1c1ccc(C(N)=O)c2c1cc(-c1c[n](C)nc1)[nH]2)=O Chemical compound CC(C)(C)OC(N(CCC1)CC1c1ccc(C(N)=O)c2c1cc(-c1c[n](C)nc1)[nH]2)=O HHGHDLRJYKGBGC-UHFFFAOYSA-N 0.000 description 1
- YSJVEDWUTUMUBS-CYBMUJFWSA-N CC(C)(C)OC(N(CCC1)C[C@@H]1N(C=Nc(cc1)c2cc1F)C2=O)=O Chemical compound CC(C)(C)OC(N(CCC1)C[C@@H]1N(C=Nc(cc1)c2cc1F)C2=O)=O YSJVEDWUTUMUBS-CYBMUJFWSA-N 0.000 description 1
- OKCXVHFTTAWVHR-UHFFFAOYSA-N CC(C)(C)OC(N1CC(c2ccc(C(N)=O)c3c2cc(-c2c[n](C)nc2)[nH]3)=CCC1)=O Chemical compound CC(C)(C)OC(N1CC(c2ccc(C(N)=O)c3c2cc(-c2c[n](C)nc2)[nH]3)=CCC1)=O OKCXVHFTTAWVHR-UHFFFAOYSA-N 0.000 description 1
- AFXVHCFNGAXSLG-UHFFFAOYSA-N CC(C)(C)OC(NC(CC1)C=C1c1ccc(C(N)=O)c2c1cc[nH]2)=O Chemical compound CC(C)(C)OC(NC(CC1)C=C1c1ccc(C(N)=O)c2c1cc[nH]2)=O AFXVHCFNGAXSLG-UHFFFAOYSA-N 0.000 description 1
- KCUPLYBTPSFWDZ-UHFFFAOYSA-N CC(C)(C)OC(NC1CC(c2ccc(C(N)=O)c3c2cc[nH]3)=CC1)=O Chemical compound CC(C)(C)OC(NC1CC(c2ccc(C(N)=O)c3c2cc[nH]3)=CC1)=O KCUPLYBTPSFWDZ-UHFFFAOYSA-N 0.000 description 1
- HYJGOMGZUTXKRQ-UHFFFAOYSA-N CC(N(CC1)CC=C1c1cc(c(-c2c(C)c(N)ccc2)ccc2C(N)=O)c2[nH]1)=O Chemical compound CC(N(CC1)CC=C1c1cc(c(-c2c(C)c(N)ccc2)ccc2C(N)=O)c2[nH]1)=O HYJGOMGZUTXKRQ-UHFFFAOYSA-N 0.000 description 1
- YWZCROIWSUOWHD-UHFFFAOYSA-N CC(N(CC1)CCC1c1cc(c(-c2c(C)c(N)ccc2)ccc2C(N)=O)c2[nH]1)=O Chemical compound CC(N(CC1)CCC1c1cc(c(-c2c(C)c(N)ccc2)ccc2C(N)=O)c2[nH]1)=O YWZCROIWSUOWHD-UHFFFAOYSA-N 0.000 description 1
- BVUHSDUJEFATFW-UHFFFAOYSA-N CC1(C)OB(c2cccc(N(CCc3c4cccc3)C4=O)c2C)OC1(C)C Chemical compound CC1(C)OB(c2cccc(N(CCc3c4cccc3)C4=O)c2C)OC1(C)C BVUHSDUJEFATFW-UHFFFAOYSA-N 0.000 description 1
- HVNVJUSWCCSNDJ-SNAWJCMRSA-N CCOC(/C=C/c1c[s]c(-c2c[n](C)nc2)n1)=O Chemical compound CCOC(/C=C/c1c[s]c(-c2c[n](C)nc2)n1)=O HVNVJUSWCCSNDJ-SNAWJCMRSA-N 0.000 description 1
- ZXYAWONOWHSQRU-UHFFFAOYSA-N CCOC(C(CC1)CCC1=O)=O Chemical compound CCOC(C(CC1)CCC1=O)=O ZXYAWONOWHSQRU-UHFFFAOYSA-N 0.000 description 1
- MYZWJCMXOOKDBX-UHFFFAOYSA-N CCOCCc1cc(c(-c2cccc(N)c2)ccc2C(N)O)c2[nH]1 Chemical compound CCOCCc1cc(c(-c2cccc(N)c2)ccc2C(N)O)c2[nH]1 MYZWJCMXOOKDBX-UHFFFAOYSA-N 0.000 description 1
- HOPANDDRHUVWJO-UHFFFAOYSA-N CCOCCc1cc(c(-c2cccc(NC(C=C)=O)c2)ccc2C(N)=O)c2[nH]1 Chemical compound CCOCCc1cc(c(-c2cccc(NC(C=C)=O)c2)ccc2C(N)=O)c2[nH]1 HOPANDDRHUVWJO-UHFFFAOYSA-N 0.000 description 1
- VZVTVEDQMUHJSQ-UHFFFAOYSA-N COC(C(c1c2cc[n]1Cc(cc1)ccc1OC)=CNC2=O)=O Chemical compound COC(C(c1c2cc[n]1Cc(cc1)ccc1OC)=CNC2=O)=O VZVTVEDQMUHJSQ-UHFFFAOYSA-N 0.000 description 1
- VPPLPGHGVMUNHU-UHFFFAOYSA-N COC(c(c1c2cc[nH]1)cnc2Cl)=O Chemical compound COC(c(c1c2cc[nH]1)cnc2Cl)=O VPPLPGHGVMUNHU-UHFFFAOYSA-N 0.000 description 1
- JTVCWDSRZUGXMN-NSCUHMNNSA-N C[n]1ncc(-c2nc(/C=C/C(O)=O)c[s]2)c1 Chemical compound C[n]1ncc(-c2nc(/C=C/C(O)=O)c[s]2)c1 JTVCWDSRZUGXMN-NSCUHMNNSA-N 0.000 description 1
- IPJYARINWXFMEN-UHFFFAOYSA-N Cc(cc1)ccc1-c1cc(c(Nc2ccn[n]2C)ccc2C(N)=O)c2[nH]1 Chemical compound Cc(cc1)ccc1-c1cc(c(Nc2ccn[n]2C)ccc2C(N)=O)c2[nH]1 IPJYARINWXFMEN-UHFFFAOYSA-N 0.000 description 1
- RYKYCVSSQMUGRN-UHFFFAOYSA-N NC(CC1)CC1c1ccc(C(N)=O)c2c1cc[nH]2 Chemical compound NC(CC1)CC1c1ccc(C(N)=O)c2c1cc[nH]2 RYKYCVSSQMUGRN-UHFFFAOYSA-N 0.000 description 1
- LWLNFGXRWCBLBK-UHFFFAOYSA-N NC(c(c([nH]1)c2cc1I)ccc2Br)=O Chemical compound NC(c(c([nH]1)c2cc1I)ccc2Br)=O LWLNFGXRWCBLBK-UHFFFAOYSA-N 0.000 description 1
- YWILRCCCIHSUIF-UHFFFAOYSA-N NC(c(cc1)c2[nH]ccc2c1-c1cccc(C(NCC#N)=O)c1)=O Chemical compound NC(c(cc1)c2[nH]ccc2c1-c1cccc(C(NCC#N)=O)c1)=O YWILRCCCIHSUIF-UHFFFAOYSA-N 0.000 description 1
- MWLQHECJEZYTJT-UHFFFAOYSA-N Nc(c1c2[nH]cc1)ccc2C#N Chemical compound Nc(c1c2[nH]cc1)ccc2C#N MWLQHECJEZYTJT-UHFFFAOYSA-N 0.000 description 1
- AHWPXOQJDGUMLO-SNVBAGLBSA-N O=C1N([C@H]2CNCCC2)C=Nc(cc2)c1cc2F Chemical compound O=C1N([C@H]2CNCCC2)C=Nc(cc2)c1cc2F AHWPXOQJDGUMLO-SNVBAGLBSA-N 0.000 description 1
- DEJJKFMIPXFAME-BQBZGAKWSA-N O[C@@H](CCNC1)[C@H]1NC(c1ncc[s]1)=O Chemical compound O[C@@H](CCNC1)[C@H]1NC(c1ncc[s]1)=O DEJJKFMIPXFAME-BQBZGAKWSA-N 0.000 description 1
- MTNZLOXGKDQNKA-UHFFFAOYSA-N [O-][N+](c1cc(O)ccc1Br)=O Chemical compound [O-][N+](c1cc(O)ccc1Br)=O MTNZLOXGKDQNKA-UHFFFAOYSA-N 0.000 description 1
- NCXPKXIBSGHIBG-UHFFFAOYSA-N [O-][N+](c1cc(OCc2ncc[s]2)ccc1Br)=O Chemical compound [O-][N+](c1cc(OCc2ncc[s]2)ccc1Br)=O NCXPKXIBSGHIBG-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/405—Indole-alkanecarboxylic acids; Derivatives thereof, e.g. tryptophan, indomethacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/08—Indoles; Hydrogenated indoles with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, directly attached to carbon atoms of the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/10—Indoles; Hydrogenated indoles with substituted hydrocarbon radicals attached to carbon atoms of the hetero ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/10—Indoles; Hydrogenated indoles with substituted hydrocarbon radicals attached to carbon atoms of the hetero ring
- C07D209/12—Radicals substituted by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/10—Indoles; Hydrogenated indoles with substituted hydrocarbon radicals attached to carbon atoms of the hetero ring
- C07D209/14—Radicals substituted by nitrogen atoms, not forming part of a nitro radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/10—Indoles; Hydrogenated indoles with substituted hydrocarbon radicals attached to carbon atoms of the hetero ring
- C07D209/18—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
- C07D217/22—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the nitrogen-containing ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/54—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings condensed with carbocyclic rings or ring systems
- C07D231/56—Benzopyrazoles; Hydrogenated benzopyrazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/04—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Indole Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Peptides Or Proteins (AREA)
Abstract
본 발명은 화학식 I의 카복스아미드 화합물, 이의 약제학적으로 허용되는 염, 프로드럭, 생물학적 활성 대사물질, 입체이성체 및 이성체를 제공한다.
화학식 I
상기 화학식 I에서, 상기 변수는 본원에 정의되어 있다.
본 발명의 화합물은, 류머티스 관절염, 소아 류머티스 관절염, 골관절염, 크론병, 염증성 장 질환, 궤양성 대장염, 건선관절염, 건선, 강직척추염, 간질성방광염, 천식, 전신 홍반 루푸스, 루푸스신장염, B 세포 만성 림프성 림프종, 다발성 경화증, 만성 림프성백혈병, 소세포성림프종, 외투 세포 림프종, B-세포 비-호지킨 림프종, 활성화된 B-세포형 확산 거대 B-세포 림프종, 다발골수종, 확산 거대 B-세포 림프종, 소포 림프종, 털세포백혈병 또는 림프모구 림프종을 포함하는 면역학적 및 종양학적 상태를 치료하기 위해 유용하다.
화학식 I
상기 화학식 I에서, 상기 변수는 본원에 정의되어 있다.
본 발명의 화합물은, 류머티스 관절염, 소아 류머티스 관절염, 골관절염, 크론병, 염증성 장 질환, 궤양성 대장염, 건선관절염, 건선, 강직척추염, 간질성방광염, 천식, 전신 홍반 루푸스, 루푸스신장염, B 세포 만성 림프성 림프종, 다발성 경화증, 만성 림프성백혈병, 소세포성림프종, 외투 세포 림프종, B-세포 비-호지킨 림프종, 활성화된 B-세포형 확산 거대 B-세포 림프종, 다발골수종, 확산 거대 B-세포 림프종, 소포 림프종, 털세포백혈병 또는 림프모구 림프종을 포함하는 면역학적 및 종양학적 상태를 치료하기 위해 유용하다.
Description
관련 출원
본 출원은 2013년 6월 26에 출원된 미국 가출원 제61/839,729호 및 2013년 10월 30일에 출원된 미국 가출원 제61/897,577호의 출원일에 대한 우선권 및 이의 이익을 주장하고, 이들 각각의 전체 내용은 참조로서 본원에 포함된다.
본 발명의 배경
단백질 키나제는 매우 다양한 세포 프로세스의 조절 및 세포 기능의 유지에서 중심 역할을 하는 거대 부류의 단백질을 나타낸다. 부분적, 비제한적인, 이들 키나제의 목록은 다음을 포함한다: 비-수용체 티로신 키나제, 예를 들면, Tec 부류(BTK, ITK, Tec, ETK/BMX 및 RLK/TXK), Janus 키나제 부류(Jak1, Jak2, Jak3 및 Tyk2); 융합 키나제, 예를 들면, BCR-Abl, 국소 부착 키나제(FAK), Fes, Lck 및 Syk; 수용체 티로신 키나제, 예를 들면, 표피 성장 인자 수용체(EGFR), 혈소판-유도된 성장 인자 수용체 키나제(PDGF-R), 줄기 세포 인자에 대한 수용체 키나제, c-kit, 간세포 성장 인자 수용체, c-Met, 및 섬유모세포 성장 인자 수용체, FGFR3; 및 세린/트레오닌 키나제, 예를 들면, b-RAF, 미토겐-활성화된 단백질 키나제(예를 들면, MKK6) 및 SAPK2β. 비정상 키나제 활성은 양성 및 악성 증식성 장애 뿐만 아니라 면역계 및 신경계의 부적합한 활성으로부터 야기되는 질환을 포함하는 다수의 질환 상태에서 관찰되었다. 신규한 본 발명의 화합물은 하나 이상의 단백질 키나제의 활성을 억제하고, 따라서, 키나제-매개된 질환의 치료에서 유용할 것으로 예상된다.
브루튼 티로신 키나제(BTK)는 B 세포, 혈소판, 비만 세포, 호염기구, 호산구, 대식세포 및 호중구 뿐만 아니라 뼈 파괴에 연관된 파골세포를 포함하는 다수의 조혈 세포에서 면역수용체 시그널링(BCR, FcεR, FcγR, DAP12, Dectin-1, GPVI 등)에서 주요한 역할을 하는 비-수용체 티로신 키나제이다[평가를 위해 참조 Brunner et al., 2005 Histol. Histopathol., 20:945, Mohamed et al., 2009 Immunol. Rev., 228:58]. BTK의 돌연변이는 사람에서 X-연관된 무감마글로불린혈증(XLA) 및 마우스에서 X-연관된 면역 결핍(Xid)을 야기하는 것으로 공지되어 있고, 이는 제한된 B-세포 생성 및 감소된 항체가를 특징으로 한다[참조: Lindvall et al., 2005 Immunol. Rev., 203:200]. 다중 세포 타입에서 BTK의 조합된 작용은 이를 자가면역 질환에 대한 매력적인 표적이 되게 한다. BTK는 다른 Tec 부류 키나제(ITK, Tec, ETK/BMX 및 RLK/TXK)에 대한 서열 상동성과 관련된다.
B-림프구에서, BTK는 B-세포 수용체(BCR) 진입에 따른 B-세포 발현 및 Ca2+ 이동을 위해 요구되고[참조: Khan et al., 1995 Immunity 3:283; Genevier et al., 1997 Clin. Exp. Immun., 110:286], 여기서, Src 부류 키나제(예를 들면, Lyn), Syk 및 PI3K의 하향스트림인 것이 고려된다. BTK는 항원에 대한 가슴샘-의존성 및 가슴샘-비의존성 타입2 반응 둘다에서 중요한 것으로 나타났다[참조: Khan et al., Immunity 1995; 3; 283]. 비만 세포에서, BTK 마우스 녹-아웃을 사용한 연구[참조: Hata et al., 1998 J. Exp. Med., 187:1235; Schmidt et al., 2009 Eur. J. Immun., 39:3228]는 사이토킨, 예를 들면, TNF, IL-2, 및 IL-4의 FcεRI 유도된 시그널링, 히스타민 방출 및 생성에서 BTK의 역할을 나타낸다. 혈소판에서, BTK는, 콜레겐에 반응하고 혈소판 응집을 촉진하고 섬유모세포-유사 윤활막세포로부터 사이토킨 생성에 기여하는 것으로 나타나는 당단백질 VI(GPVI) 수용체를 통한 시그널링에서 중요하다[참조: Hsu et al., 2013 Immun. Letters, 150:97]. 단핵구 및 대식세포에서, BTK의 작용은 FcγRI 유도된 신호에 연관되고, 또한 TLR2, TLR4, TLR8 및 TLR9를 포함하는 톨-유사 수용체-유도된 사이토킨 반응에서 역할을 할 수 있다[참조: Horwood et al., 2003 J. Exp. Med., 197:1603; Horwood et al., 2006 J. Immunol., 176:3635; Perez de Diego et al., 2006 Allerg. Clin. Imm., 117:1462; Doyle et al., 2007 J. Biol. Chem., 282:36959, Hasan et al., 2007 Immunology, 123:239; Sochorava et al., 2007 Blood, 109:2553; Lee et al., 2008, J. Biol. Chem., 283:11189].
따라서, BTK의 억제는 자가면역 반응의 효과적인 억제를 야기하는 염증 반응의 수개의 중요한 연결에서 개입하는 것으로 예상된다. B-세포 수용체 활성, 항체-Fc 수용체 상호작용 및 GPVI 수용체 시그널링에 관한 이러한 질환은 BTK 억제제로 치료하여 조절될 수 있다. BTK 억제는 BCR 시그널링를 차단하여 자가면역 질환의 개시 및 대식세포, 호중구, 호염기구, 및 비만 세포에 대한 FcR 시그널링의 폐기에 의해 효과기 기(phase) 둘 다에서 작용하는 것 같다. 또한, BTK의 차단은 파골세포 성숙의 억제를 통해 추가의 이익을 제공할 수 있고, 따라서, 류머티스 관절염에 관련된 뼈 침식(bone erosion) 및 전체 관절 파괴를 약화시킨다. BTK의 억제는 다수의 염증 및 알레르기 질환 - 예를 들면, (이에 제한되는 것은 아니지만), 류머티스 관절염(RA), 전신 홍반 루푸스(SLE), 다발성 경화증(MS) 및 I형 과민 반응, 예를 들면, 알레르기 비염, 알레르기 결막염, 아토피 피부염, 알레르기 천식 및 전신 아나필락시스를 치료하는데 사용될 수 있다. 염증 장애 및 자가면역 뿐만 아니라 백혈병 및 림프종을 위한 치료제로서 BTK의 표적화에 대한 평가는 문헌을 참조한다[참조: Uckun & Qazi, 2010 Expert Opin. Ther. Pat., 20:1457]. BTK가 조혈계의 암에서 고도로 발현되고, BTK-의존성 시그널링은 여기서 탈조절되는 것으로 고려되기 때문에, BTK 억제제는 B-세포 림프종/백혈병 및 다른 종양학적 질환 - 예를 들면, (이에 제한되는 것은 아니지만) 급성 림프모구 백혈병(ALL), 만성 림프성백혈병(CLL), 비-호지킨 림프종(NHL), 소세포성림프종(SLL), 및 급성 골수성 백혈병을 위한 유용한 치료제인 것으로 예상된다[평가를 위해 참조: Buggy & Elias 2012 Int Rev Immunol. 31:119]. 종합하면, BTK 억제제는 다수의 염증 질환 및 면역학적 장애 뿐만 아니라 혈액학적 암을 치료하는데 강력한 방법을 제공한다.
발명의 요지
제1 양태에서, 본 발명은 화학식 I의 화합물 또는 이의 약제학적으로 허용되는 염, 프로드럭, 생물학적 활성 대사물질, 이성체, 또는 입체이성체를 제공한다:
화학식 I
상기 화학식 I에
X는 NR2 또는 S이고;
Y는 N 또는 CR1이고, Z는 N 또는 CR1이거나; Y는 CR1R2이고, Z는 CR1R2이고;
A는 N 또는 CR4이고;
E는 N 또는 CR5이고;
R1은 독립적으로 H, 중수소, CN, 할로겐, CF3, -NRcRc, -N(Ra)C(O)Rb, 임의로 치환된 (C1-C6)알킬, 임의로 치환된 (C2-C6)알케닐, 임의로 치환된 아릴, 임의로 치환된 (C3-C6)사이클로알킬, 임의로 치환된 (C3-C6)사이클로알케닐, 임의로 치환된 헤테로아릴, 또는 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴이고;
R2는 독립적으로 H, 중수소, 또는 임의로 치환된 (C1-C3)알킬이고;
R3은 할로겐, -N(Ra)2, 임의로 치환된 아릴, 임의로 치환된 (C3-C7)사이클로알킬, 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴, 또는 임의로 치환된 헤테로아릴이거나;
R3은 -R301-L-R302이고, 여기서,
R301은 결합, -O-, -OCH2-, -NRd-, 또는 임의로 치환된 (C1-C3)알킬렌이고,
L은 임의로 치환된 페닐, 임의로 치환된 (C3-C6)사이클로알킬; 하나 이상의 헤테로원자를 포함하고, 상기 헤테로원자 중 적어도 하나가 질소인 임의로 치환된 헤테로아릴 또는 포화 또는 부분 포화 헤테로사이클릴이거나;
L은 -L1-L2이고, 여기서, L1은 R301에 부착되고,
L1은 임의로 치환된 페닐, 임의로 치환된 헤테로아릴 또는 임의로 치환된 포화 또는 부분 포화 카보사이클 또는 포화 또는 부분 포화 헤테로사이클릴이고;
L2는 결합, CH2, NRd, CH2N(H), S(O)2N(H), 또는 -O-이고;
R302는 CN, -CH2CN, 임의로 치환된 -C(=O)R302a, -(CH2)n-임의로 치환된 포화 또는 부분 포화 헤테로사이클릴 또는 임의로 치환된 -S(O)2(C2)알케닐이고;
여기서, R302a는 임의로 치환된 (C1-C4)알킬, 임의로 치환된 (C2-C4)알케닐, (C2-C4)알키닐, -C(O)-(C1-C4)알킬, 임의로 치환된 포화 또는 부분 불포화 (C3-C6)사이클로알킬, 임의로 치환된 아릴, 임의로 치환된 헤테로아릴, -N(H)- 임의로 치환된 헤테로아릴 또는 -(CH2)n-임의로 치환된 불포화 또는 부분 포화 헤테로사이클릴이고;
R4는 H, 중수소, CN, 임의로 치환된 (C1-C3)알킬, 임의로 치환된 (C3-C6) 사이클로알킬 또는 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴 , 또는 임의로 치환된 헤테로아릴이고;
여기서, 상기 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴; 및 임의로 치환된 헤테로아릴은 적어도 하나의 질소 원자를 포함하거나;
R3 및 R4는, 이들이 부착된 탄소 원자와 함께, 임의로 치환된, 포화, 불포화 또는 부분 불포화 5 또는 6원 카보사이클릭 환 또는 N, S 및 O로부터 선택된 하나의 이상의 헤테로원자를 포함하는 임의로 치환된, 포화, 또는 부분 불포화 5 또는 6원 헤테로사이클릭 환을 형성하고;
R5는 H, 중수소, 할로겐, 또는 임의로 치환된 (C1-C3)알킬이고;
Ra는 독립적으로 H, -C(O)-임의로 치환된 (C2-C6)알케닐, 임의로 치환된 (C1-C6)알킬, -(CH2)n-임의로 치환된 (C3-C6)사이클로알킬, -(CH2)n-임의로 치환된 헤테로사이클릴, 또는 -(CH2)n-임의로 치환된 헤테로아릴로부터 선택되고;
Rb는 H, 임의로 치환된 (C1-C6)알킬, 임의로 치환된 (C2-C6)알케닐, 임의로 치환된 (C2-C6)알키닐, -CH2-O-임의로 치환된 아릴, 또는 -CH2-O-임의로 치환된 헤테로아릴이고;
Rc는 독립적으로 H, 임의로 치환된 (C1-C6)알킬, 임의로 치환된 (C3-C6)사이클로알킬, 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴, 임의로 치환된 아릴 또는 임의로 치환된 헤테로아릴이고;
Rd는 H, 임의로 치환된 헤테로사이클릴, -(CH2)-임의로 치환된 (C3-C6)사이클로알킬, -(CH2)-임의로 치환된 헤테로아릴 또는 임의로 치환된 (C1-C3)알킬이고;
Rf는 임의로 치환된 (C1-C3)알킬, 임의로 치환된 (C2-C4)알케닐 또는 임의로 치환된 (C2-C4)알키닐이고;
n은 독립적으로 0 또는 1이다.
제2 양태에서, 본 발명은 제1 양태에 따른 화합물을 제공하고, 여기서, Y는 CR1이고, Y의 R1은 H, 임의로 치환된 에테닐, 임의로 치환된 에틸, 임의로 치환된 메틸, 임의로 치환된 2,3-디하이드로벤조푸라닐, 임의로 치환된 1,4-디옥사닐, 임의로 치환된 3,4-디하이드로-2H-벤조[b][1,4]옥사지닐, 임의로 치환된 6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사지닐, 임의로 치환된 크로마닐, 임의로 치환된 사이클로헥세닐, 임의로 치환된 사이클로프로필, 임의로 치환된 테트라하이드로푸라닐, 임의로 치환된 이소크로마닐, 임의로 치환된 1,2,3,4-테트라하이드로-이소퀴놀리닐, 임의로 치환된 이속사졸릴, 임의로 치환된 모르폴리닐, 임의로 치환된 옥세타닐, 임의로 치환된 페닐, 임의로 치환된 피페리디닐, 임의로 치환된 피페라지닐, 임의로 치환된 3,6-디하이드로-2H-피라닐, 임의로 치환된 피라노[4,3-b]피리디닐, 임의로 치환된 피라졸릴, 임의로 치환된 피리디닐, 임의로 치환된 3H-피리딘-1-온, 임의로 치환된 1,2,3,6-테트라하이드로피리디닐, 임의로 치환된 피리미디닐, 임의로 치환된 피롤리디닐, 임의로 치환된 2,5-디하이드로피롤릴, 임의로 치환된 테트라하이드로피라닐 또는 임의로 치환된 테트라하이드로-2H-티오피라닐이다.
제3 양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, R1은 H이거나, R1은 CN, OH, =O, 할로겐, (C1-C4)알킬, (C1-C4)알콕시, -CH2CH2OH, -CH2C(CH3)2OH, -CH2CH(OH)CH2OH, -CH=CH2, -CH2NH2, -CH2N(H)C(O)Re, -C(O)(C1-C4)알킬, -C(O)(C1-C4)알콕시, -C(O)NH2, -C(O)N(CH3)2, -C(O)-임의로 치환된 헤테로사이클릴, -N(H)C(O)CH3, N(CH3)2, -S(O)2(C1-C4)알킬, -S(O)2-피롤리디닐, (C1-C4)알콕시, -CH2-모르폴리닐, -CH2CH2-모르폴리닐, 모르폴리닐, 테트라하이드로피라닐로 이루어진 그룹으로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되고;
여기서, Re는 (C1-C3)알킬, -CH2Cl, -C≡CH, -C≡CCH3, -CH=CH2, -CH=CHCH3, -C(=CH2)CH3, -CH2CN, -CH2CH2N(CH3)2, -CH2CH2-피페리디닐, -CH2O-임의로 치환된 페닐이다.
제4양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, R3은 -N(H)C(O)CH=CH2, 임의로 치환된 이속사졸릴, 임의로 치환된 페닐, 임의로 치환된 피라졸릴, 임의로 치환된 피리디닐, 임의로 치환된 피리미디닐, 임의로 치환된 티아졸릴, 또는 임의로 치환된 티에닐이다.
제5 양태에서, 본 발명은 제4항에 따른 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, R3은 -NH2, -NHCH3, (C1-C4)알킬 및 -C(O)(C2-C4)알케닐로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환된다.
제 6양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, X는 NR2이고, R2는 H이다.
제7 양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, Y는 CR1이고, Y의 R1은 H, 임의로 치환된 페닐, 임의로 치환된 피페라지닐, 임의로 치환된 피라졸릴, 또는 임의로 치환된 1,2,3,6-테트라하이드로피리디닐이다.
제8 양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, Y는 CR1이고, Y의 R1은 할로겐, (C1-C4)알킬, -C(O)(C1-C4)알킬, 및 -S(O)2(C1-C4)알킬로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환된다.
제9 양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서,
Z는 N이거나, Z는 CR1이고, Z의 R1은 H이고;
A는 CR4이고, R4는 H이거나 -C(O)CH=CH2로 치환된 아제티디닐이다.
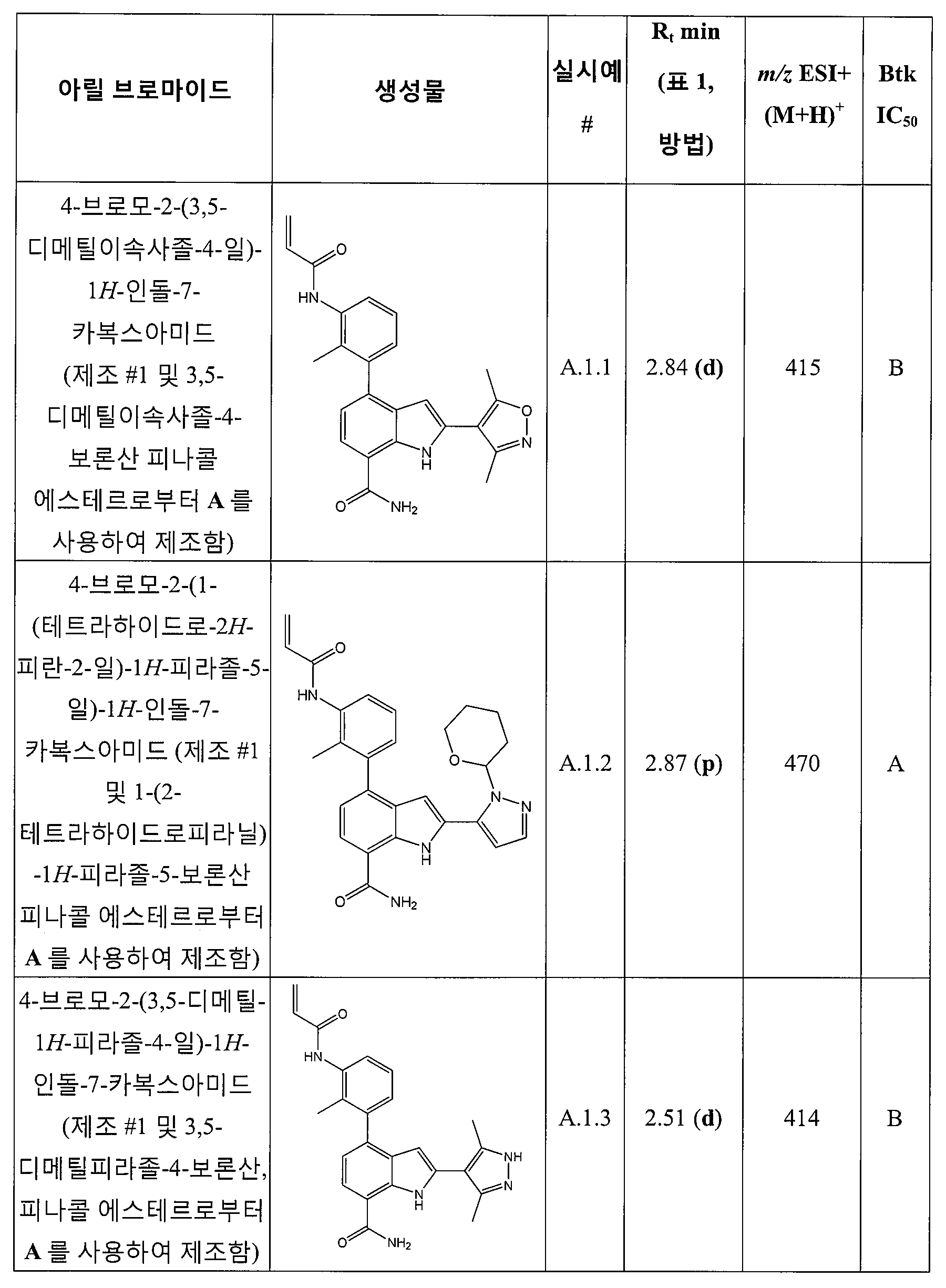
제10 양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, 상기 화합물은,
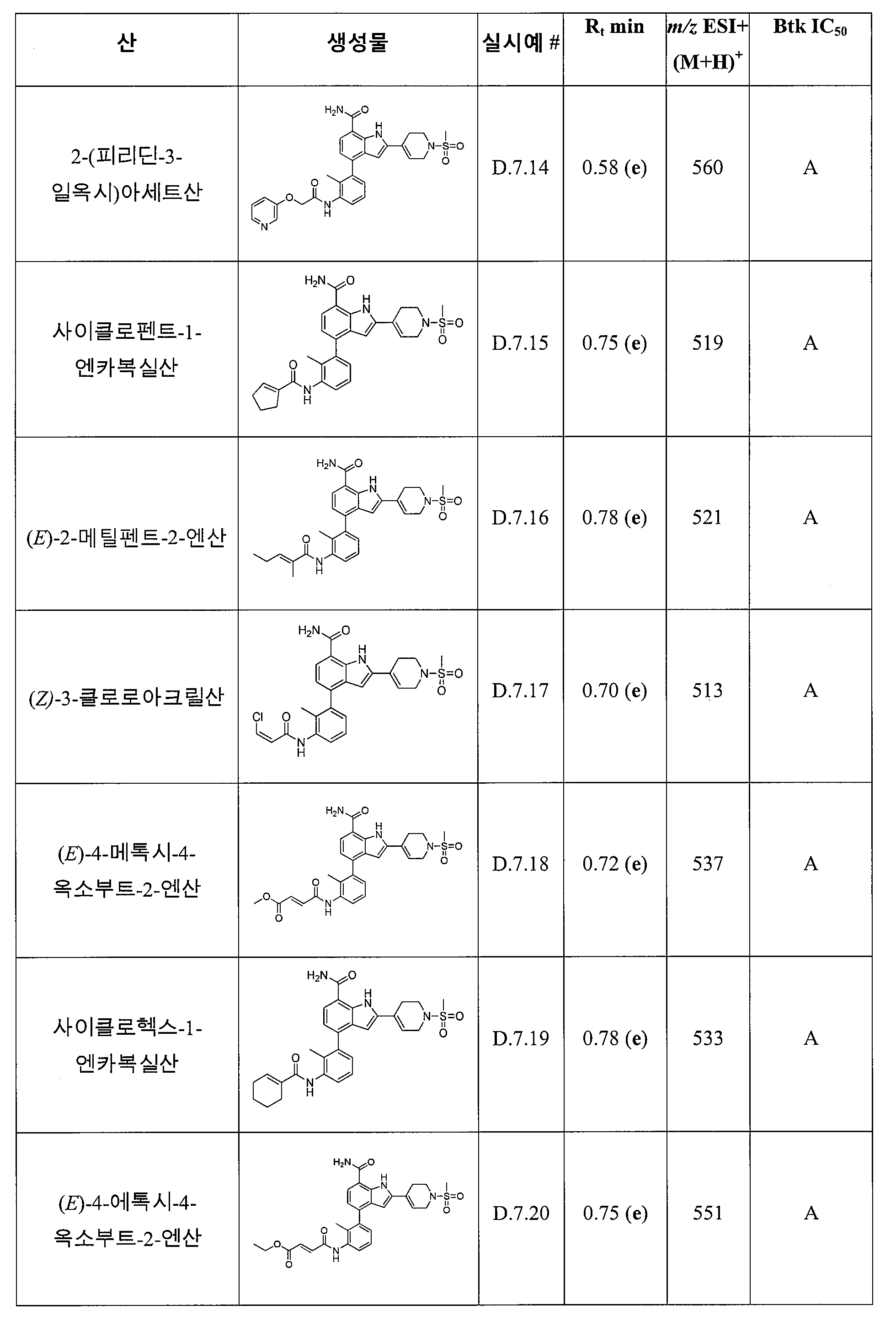
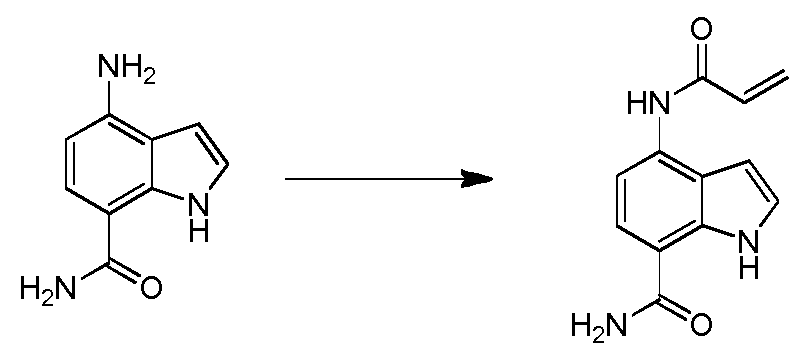
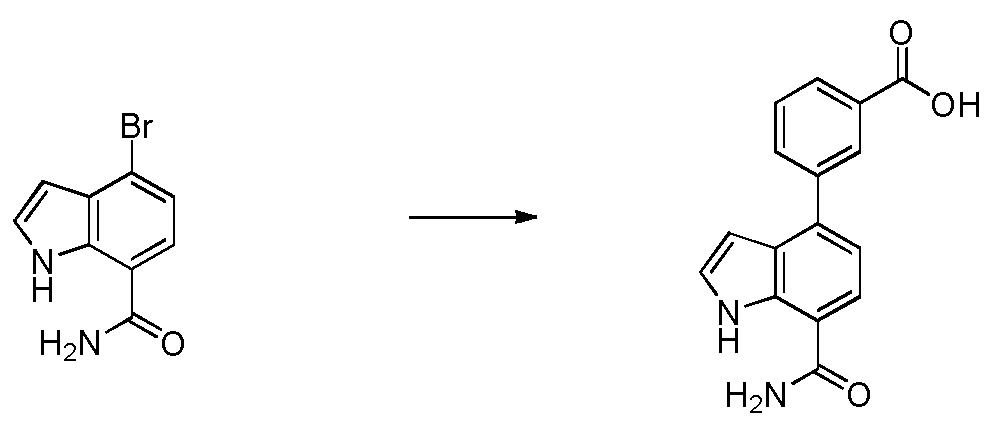
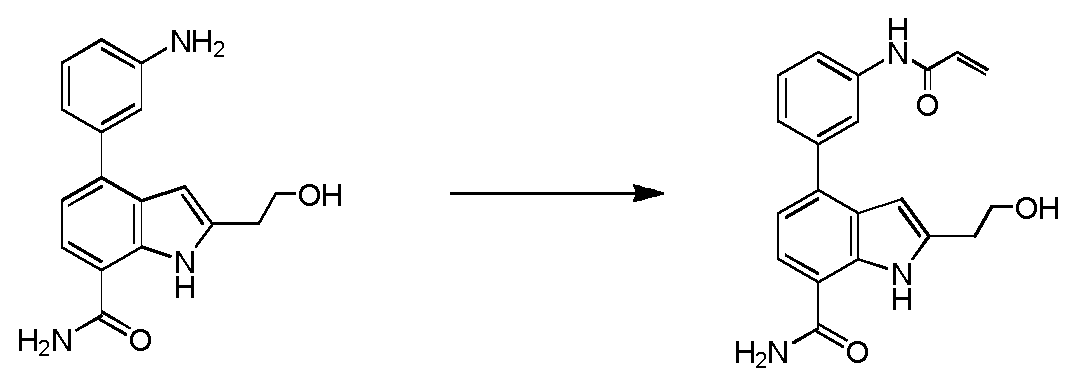
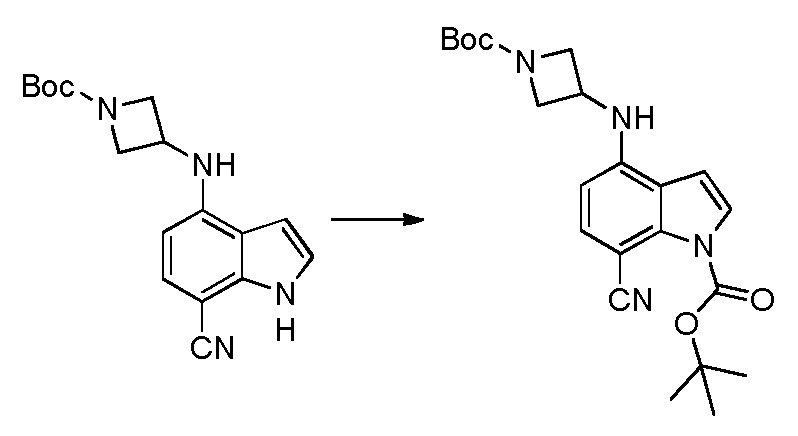
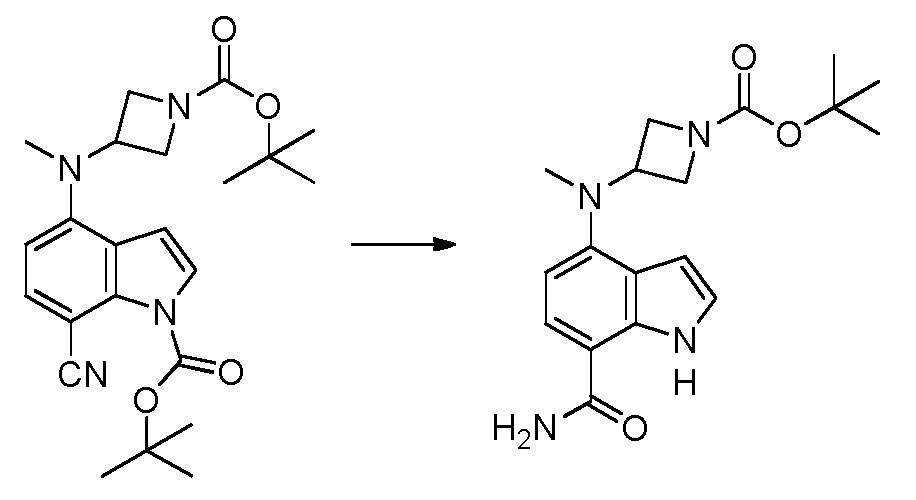
4-(3-아미노-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(피리딘-3-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-(3,5-디메틸이속사졸-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
2-(1-아세틸피페리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(피리딘-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(티오펜-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(2-아미노페닐)-1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(5-아미노피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-아미노피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-아미노에틸아미노)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(2-아미노에틸아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(피리미딘-5-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1H-피라졸-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1H-피라졸-5-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(티아졸-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(피리딘-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(티오펜-3-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1-메틸-1H-피라졸-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1H-피라졸-3-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(2-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-페닐-1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-에닐)1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-(1-아크릴로일피페리딘 3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(2-아미노에틸아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-((1R,2R)-2-아미노사이클로헥실아미노)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드*;
4-(1-메틸-1H-피라졸-5-일아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-요오도-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3,5-디메틸이속사졸-4-일)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(2-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드; 또는
2-(1-아세틸피페리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드이다.
제11 양태에서, 본 발명은 제1 내지 제3 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, R3은 -R301-L-R302이고, R301은 결합, N(H), N(CH3), CH2, C(H)(임의로 치환된 (C1-C3)알킬), O, 또는 OCH2이다.
제12 양태에서, 본 발명은 제1 내지 제3 또는 제11 양태 중 어느 것에 따른 화합물을 제공하고, 여기서,
L은 임의로 치환된 아제티디닐, 임의로 치환된 사이클로펜틸, 임의로 치환된 3,6-디아자바이사이클로[3.2.0]헵타닐, 임의로 치환된 1,4-디옥사닐, 임의로 치환된 모르폴리닐, 임의로 치환된 [1,4]옥세파닐, 임의로 치환된 페닐, 임의로 치환된 피페리디닐, 또는 임의로 치환된 피롤리디닐이거나;
L은 L1-L2이고, 여기서,
L1은 임의로 치환된 사이클로헥실, 임의로 치환된 사이클로펜틸, 임의로 치환된 페닐, 임의로 치환된 피페리디닐, 임의로 치환된 피리디닐이고;
L2는 N(H), N(CH3), N(CH2CH2OH), N(CH2CH(CH3)2), N(옥세타닐), N(CH2-사이클로펜틸), N(CH2-티아졸릴), O, S(O)2N(H), 또는 CH2N(H)이다.
제13 양태에서, 본 발명은 제1 내지 제3 및 제11 및 제12 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, L 또는 L1은 할로겐, CN, OH, (C1-C4)알콕시, (C1-C4)알킬, -CH2OH, -N(H)CH2-헤테로아릴, 벤질옥시, 및 -OCH2-헤테로아릴로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환된다.
제14 양태에서, 본 발명은 제1 내지 제3 및 제11 내지 제13 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, R302는 -C(O)CH3, -C(O)C(O)CH3, -C(O)CF2(Cl), -CH(CH3)2, -CH2Cl, -CH2CN, -C(O)CH2CN, -C(O)CH2CH3, -C(O)CH2F, -C(O)CH(CH3)2, -C(O)-CH2CH(CH3)2, -C(O)CH(CH3)(Cl), -C(O)CH2CH(CH3)CH3, -C(O)CH(Cl)CH2CH3, -CH2CH2OH, -C(O)CH2CH2N(CH3)2, -C(O)CH=CH2, -C(O)C≡CH, -C(O)CH=CHCl, -C(O)CH=CHCH3, -C(O)C(=CH2)CH3, -C(O)C(CH2CH3)=CH2, -C(O)CH=CHCH(CH3)2, -C(O)CH=CHC(O)OH, -C(O)CH=CHC(O)N(H)CH2CH3, -C(O)CH=CHCH2N(CH3)2, -C(O)CH=CHC(O)OCH3, -C(O)CH=CHC(O)OCH2CH3, -C(O)CH=CHC(O)N(H)CH3, -C(O)CH=CHC(O)CH2CH2OCH3, -C(O)CH=CHC(O)N(CH3)2, -C(O)CH=CHC(O)N(H)CH2CH3, -C(O)CH=CHC(O)N(H)CH2CH2OCH3, -C(O)CH=CHCH2N(H)CH2CH2OCH3, -C(O)C(CN)=C(OH)(CH3), -C(O)CH=CH-임의로 치환된 피라졸릴-C(O)CH=CHCH2N(H)-임의로 치환된 사이클로프로필, -C(O)CH=CHCH2N(H)CH2-임의로 치환된 테트라하이드로푸라닐, -C(O)CH=CHC(O)NH2, -C(O)CH=CHC(O)N(H)- 임의로 치환된 사이클로프로필, -C(O)C(CH3)=CHCH3, -C(O)C(CH3)=CHCH2CH3, -C(O)C(=CH2)CH2N(CH3)2, -C(O)C(=CH2)CH2NH2, -C(O)C(=CH2)CH2N(H)(CH3), -C(O)C(=CH2)CH3, -C(O)C(=CH2)CH2- 임의로 치환된 모르폴리닐, -C(O)C(=CH2)-임의로 치환된 페닐, -CH2- 임의로 치환된 벤조[d]이소티아졸릴, -C(O)-CH2-O-임의로 치환된 페닐, -CH2-임의로 치환된 티아졸릴, -CH2CH2-임의로 치환된 모르폴리닐, -C(O)CH2O-임의로 치환된 페닐, -C(O)CH2CH2-임의로 치환된 피페라지닐, -C(O)CH2CH2- 임의로 치환된 피페리디닐, -C(O)CH2O-임의로 치환된 피리디닐, -C(O)CH2CH2 임의로 치환된 피롤리디닐, -C(O)CH=CH 임의로 치환된 사이클로프로필, -C(O)CH=CHCH2- 임의로 치환된 모르폴리닐, -C(O)CH=CHCH2- 임의로 치환된 피페리디닐, -C(O)CH=CH- 임의로 치환된 피라졸릴, -C(O)CH=CH-임의로 치환된 피리디닐, -C(O)CH=CH-임의로 치환된 티아졸릴, -C(O)-임의로 치환된 사이클로헥세닐, -C(=O)-임의로 치환된 사이클로헥실, -C(O)-임의로 치환된 사이클로펜테닐, -C(O)-사이클로펜틸, 임의로 치환된 이미다조[1,2-a]피라지닐, 임의로 치환된 테트라하이드로이미다조[1,2-a]피라지닐, 임의로 치환된 디하이드로-이소인돌릴, 임의로 치환된 1,2,3,4-테트라하이드로-이소퀴놀리닐, 임의로 치환된 이소퀴놀리닐, -C(O)-임의로 치환된 이속사졸릴, -C(O)-임의로 치환된 옥사졸릴, 임의로 치환된 옥세타닐,-C(=O)- 임의로 치환된 페닐, 임의로 치환된 피페리디닐, -C(O)-임의로 치환된 피페리디닐, 임의로 치환된 피라졸릴, -C(O)CH2O-임의로 치환된 피리다지닐, -C(O)-임의로 치환된 피리디닐, 임의로 치환된 피리미디닐, 임의로 치환된 퀴나졸리닐, 임의로 치환된 디하이드로퀴놀리닐, 임의로 치환된 -C(O)-테트라하이드로벤조[b]티오페닐, -C(O)-임의로 치환된 테트라하이드로피라닐, -C(O)-임의로 치환된 테트라하이드로피리디닐, -C(O)-티아졸릴, -C(O)N(H)-티아졸릴, -C(O)NHCH2CN, 또는 -S(O)2CH=CH2이다.
제15 양태에서, 본 발명은 제1 내지 제3 또는 제13 내지 제14 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, X는 NR2이고, R2는 H이다.
제16 양태에서, 본 발명은 제1 내지 제3 또는 제13 내지 제15 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, Y는 CR1이고, Y의 R1은 할로겐, CN, =O, (C1-C4)알킬, (C2-C4)알케닐, -CH2NH2, -CH2CH2OH, -CH2CH(OH)CH2CH3, -CH2CH(OH)CH2OH, -CH2CH2OCH2CH3, -CH2C(OH)(CH3)2, -CH2NHC(O)(C1-C4)알킬, -CH2NHC(O)CH2Cl, -CH2NHC(O)CH2CN, -CH2NHC(O)CH2CH2N(CH3)2, -CH2NHC(O)C(=CH2)CH3, -CH2NHC(O)(C2-C4)알키닐, -CH2NHC(O)CH2CH2-피페리디닐, -(C1-C4)알킬-모르폴리닐, -CH2NHC(O)CH2O-페닐로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되고, 여기서, 상기 페닐은 할로겐, (C1-C4)알콕시, -C(O)(C1-C4)알킬, -C(O)(C1-C4)알콕시, -C(O)N(H)2, -C(O)N(CH3)2, -C(O)-모르폴리닐, -C(O)-피롤리디닐, N(CH3)2, -NHC(O)(C1-C4)알킬, -NHC(O)(C2-C4)알케닐, -NHC(O)CH2CN, -S(O)2(C1-C4)알킬, -S(O)2-피롤리디닐, 모르폴리닐, 테트라하이드로피라닐, 또는 4-메틸피페라진카보닐로 임의로 치환된다.
제17 양태에서, 본 발명은 제1 내지 제3 또는 제13 내지 제16 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, Z는 CR1이고, Z의 R1은 H, (C1-C4)알킬, -NHC(O)CH2Cl, -NHC(O)CH2CN, -NHC(O)(C2-C4)알케닐, -NHC(O)(C2-C4)알키닐, -NHC(O)C(=CH2)CH3, -NHC(O)CH2-페닐이고, 여기서, 상기 페닐은 할로겐, 또는 CH3로 치환된 피라졸릴로 임의로 치환된다.
제18 양태에서, 본 발명은 제1 내지 제3 또는 제13 내지 제17 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, R302는 할로겐, CF3, OCF3, =O, CHF2, CN, C(O)OH, OH, (C1-C4)알킬, (C1-C4)알콕시, (C3-C6)사이클로알킬, -(C1-C4)알킬CN, -(C1-C4)알킬C(O)NH2, -C(O)NH2, -C(O)N(H)(C1-C4)알킬, -C(O)N(C1-C4)알킬)2, -C(O)N(H)사이클로프로필, -C(O)(C1-C4)알콕시, NH2, N(H)CH3, N(CH3)2, 또는 임의로 치환된 벤질로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환된다.
제19 양태에서, 본 발명은 제1 내지 제3 또는 제13 내지 제18 양태 중 어느 것에 따른 화합물을 제공하고, 여기서,
X는 NR2이고, 여기서, R2는 H이고;
Y는 CR1이고, 여기서, R1은 H, CH3, 치환된 피라졸릴, 6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사지닐 또는 테트라하이드로푸라닐이고;
Z는 CR1이고, 여기서, R1은 H이고;
E는 CR5이고, 여기서, R5는 H이고;
R3은 -R301-L-R302이고, 여기서,
R301은 결합, -O-, -N(H)-, -N(CH3)- 또는 -C(H)(CH3)-이고;
L은 아제티디닐, 3,6-디아자바이사이클로[3.2.0]헵타닐, 모르폴리닐, [1,4]옥세파닐, 피페리디닐, 또는 피롤리디닐이고;
여기서, 상기 아제티디닐은 CH3로 임의로 치환되고;
여기서, 상기 피페리디닐은 -CH2OH로 임의로 치환되고;
R302는 -C(O)CH=CH2 또는 -C(O)C≡CH이다.
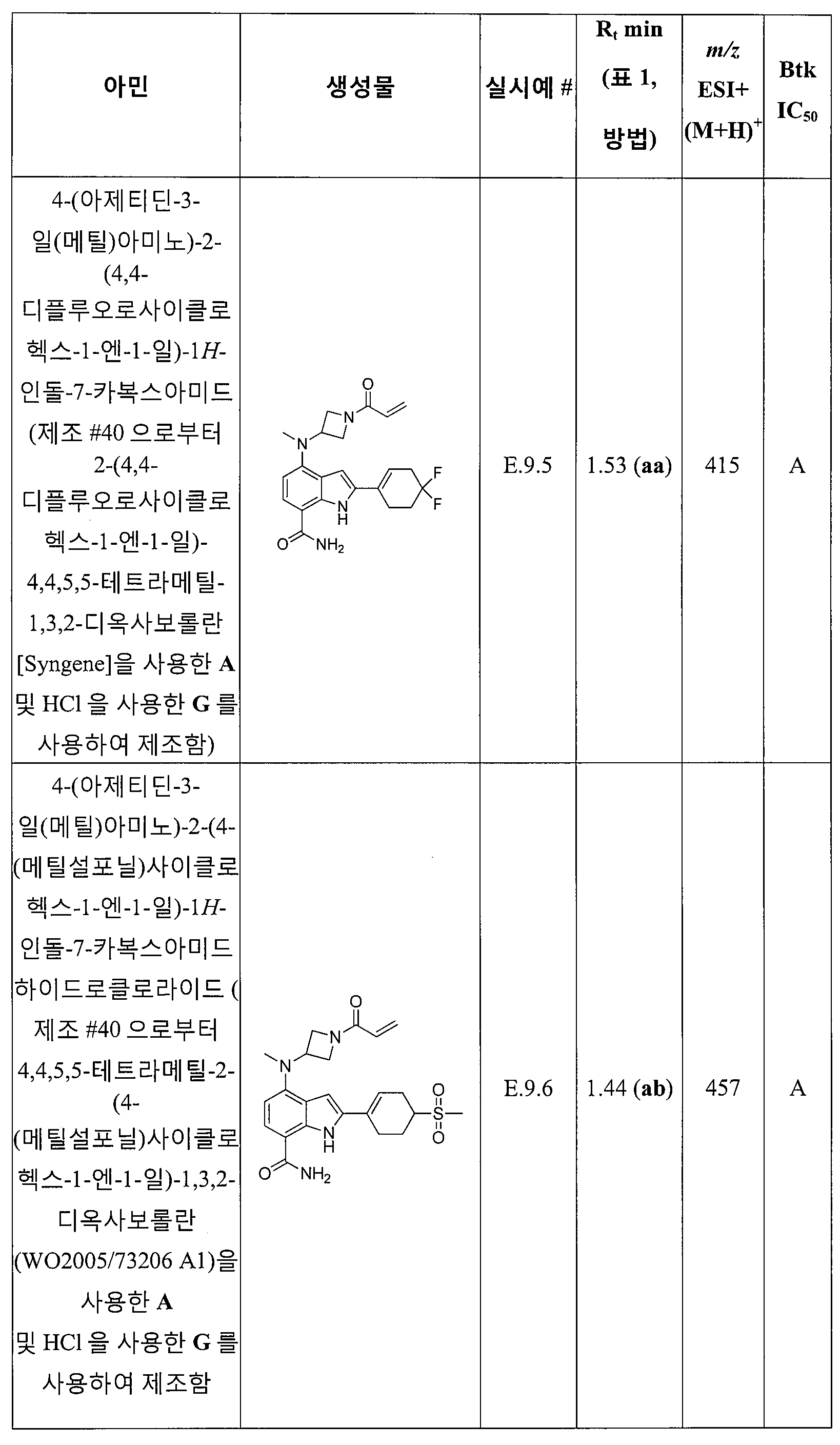
제12 양태에서, 본 발명은 제1 내지 제3 또는 제13 내지 제19 양태 중 어느 것에 따른 화합물을 제공하고, 여기서, 상기 화합물은 다음과 같다:
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-인돌-7-카복스아미드;
4-(5-아세틸티오펜-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1-(4-메톡시벤질)-1H-피라졸-5-일아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-옥소이소인돌린-2-일)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(6-메틸-1-옥소이소인돌린-2-일)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-1-옥소이소인돌린-2-일)-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-1-옥소이소인돌린-2-일)-2-메틸페닐)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(피리딘-3-일)-1H-인돌-4-일)-4-메틸페닐)티아졸-2-카복스아미드 2,2,2-트리플루오로아세테이트;
N-(3-(7-카바모일-2-(피리딘-3-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
(R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-2-(4-플루오로페닐)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드*;
(R)-2-(1-메틸-1H-피라졸-4-일)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드*;
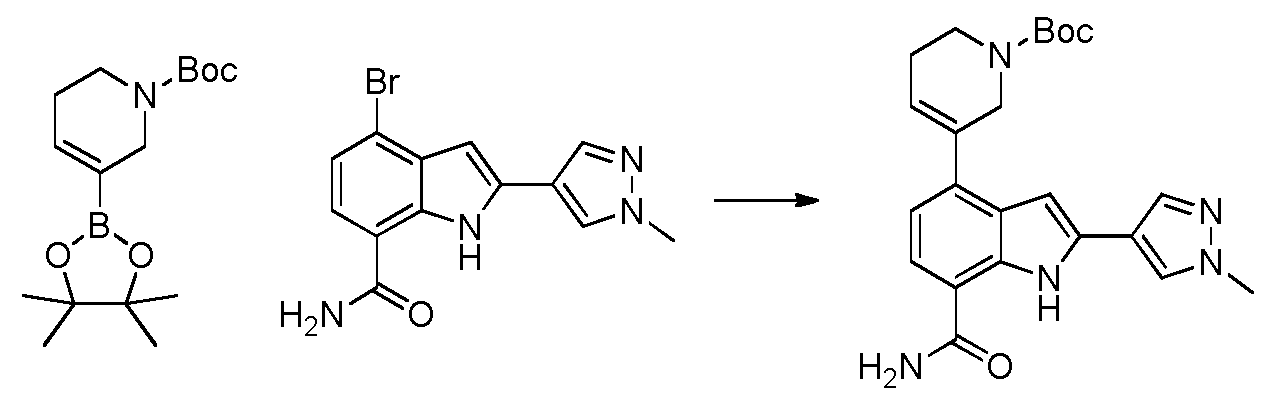
2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-3급-부틸벤즈아미도)피페리딘-1-일)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-3급-부틸벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-N-(1-(7-카바모일-1H-인돌-4-일)피페리딘-3-일)-2-메틸옥사졸-4-카복스아미드*;
(R)-4-(3-(3-티아졸-2-일우레이도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
4-(3-(4-3급-부틸벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-(7-사이클로프로필-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-3급-부틸벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-메톡시벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
(R)-5-3급-부틸-N-(1-(7-카바모일-1H-인돌-4-일)피페리딘-3-일)이속사졸-3-카복스아미드*;
(R)-2-(1-메틸-1H-피라졸-4-일)-4-(3-(4-(트리플루오로메틸)벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-메톡시벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-(트리플루오로메틸)벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-(디플루오로메틸)벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
2-(3,6-디하이드로-2H-피란-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-(1-아미노-2-메틸-1-옥소프로판-2-일)벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
(R)-2-(1-메틸-1H-피라졸-4-일)-4-(3-(4-(트리플루오로메톡시)벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
2-(1-(2-하이드록시에틸)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(6-플루오로-1-옥소이소인돌린-2-일)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
2-(3,6-디하이드로-2H-피란-4-일)-4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-(하이드록시메틸)페닐)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-사이클로프로필벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
2-(2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-((R)-2,3-디하이드록시프로필)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드*;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-(하이드록시메틸)페닐)티아졸-2-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(4-3급-부틸벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
N-(3-(2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-메틸-2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
에틸 3-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트;
2-(1-메틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
2-(1-((S)-2,3-디하이드록시프로필)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-메틸페닐)-N-메틸티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-메틸페닐)-N-(옥세탄-3-일)티아졸-2-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(4-(2-시아노프로판-2-일)벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)벤즈아미도)-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(1-(2-하이드록시-2-메틸프로필)-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(8-옥소-5,6-디하이드로이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(8-옥소이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
4-(2-메틸-3-(옥세탄-3-일아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
2-(1-아세틸피페리딘-4-일)-4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(R)-N-(1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)피페리딘-3-일)-2-메틸옥사졸-4-카복스아미드*;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1H-인돌-7-카복스아미드*;
2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카복스아미드;
4-(3-(4-(디플루오로메틸)-N-(옥세탄-3-일)벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(옥세탄-3-일아미노)페닐)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-(2-하이드록시에틸아미노)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(R)-N-(1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드*;
4-(3-(사이클로헥산카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)-N-(2-하이드록시에틸)벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)이소티아졸-4-카복스아미드;
4-(2-메틸-3-(테트라하이드로-2H-피란-4-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-메틸피페리딘-3-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-메틸피페리딘-4-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(사이클로펜탄카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)-2-메틸티아졸-4-카복스아미드;
4-(3-(3-메톡시사이클로헥산카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-메틸부탄아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-이소부티르아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(니코틴아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)-5-메틸티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-6-옥소-1,6-디하이드로피리딘-3-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-((3R,4R)-1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드;
(R)-4-(3-아크릴아미도피페리딘-1-일)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드*;
4-(2-메틸-3-(티아졸-2-일메틸아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(N-(티아졸-2-일메틸)아크릴아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(Z)-4-(2-메틸-3-(2-메틸부트-2-엔아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(피페리딘-1-일)프로판아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-시아노아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-프로피온아미도페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-메타크릴아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드l;
4-(3-(2-클로로-2,2-디플루오로아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-클로로프로판아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-4-(3-부트-2-엔아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐);
4-(3-(2-(4-플루오로페녹시)아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(피롤리딘-1-일)프로판아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-(4-시아노페녹시)아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-(피리딘-3-일옥시)아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(사이클로펜트-1-엔카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(2-메틸펜트-2-엔아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(Z)-4-(3-(3-클로로아크릴아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-메틸 4-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐아미노)-4-옥소부트-2-에노에이트;
4-(3-(사이클로헥스-1-엔카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-에틸 4-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐아미노)-4-옥소부트-2-에노에이트;
4-(2-메틸-3-(2-페녹시아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-플루오로아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-에닐)-1H-인돌-7-카복스아미드;
4-(2-(아크릴아미도메틸)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(3-(디메틸아미노)프로판아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-아크릴아미도페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(아크릴아미도메틸)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(아크릴아미도메틸)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-시아노피리미딘-4-일아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
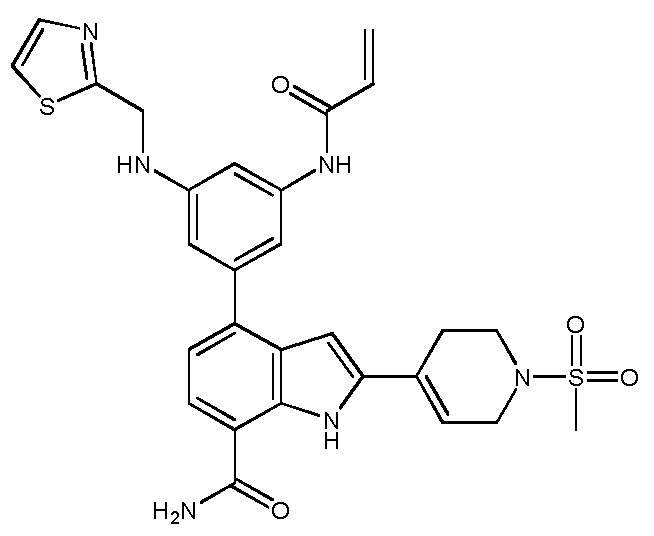
4-(3-(6-사이클로프로필-8-플루오로-1-옥소이소퀴놀린-2(1H)-일)-2-(하이드록시메틸)페닐)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메톡시피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-(피리딘-2-일옥시)아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)푸마르아미드;
4-(3-(2-클로로부탄아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(4-메틸피페라진-1-일)프로판아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-(피리다진-3-일옥시)아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
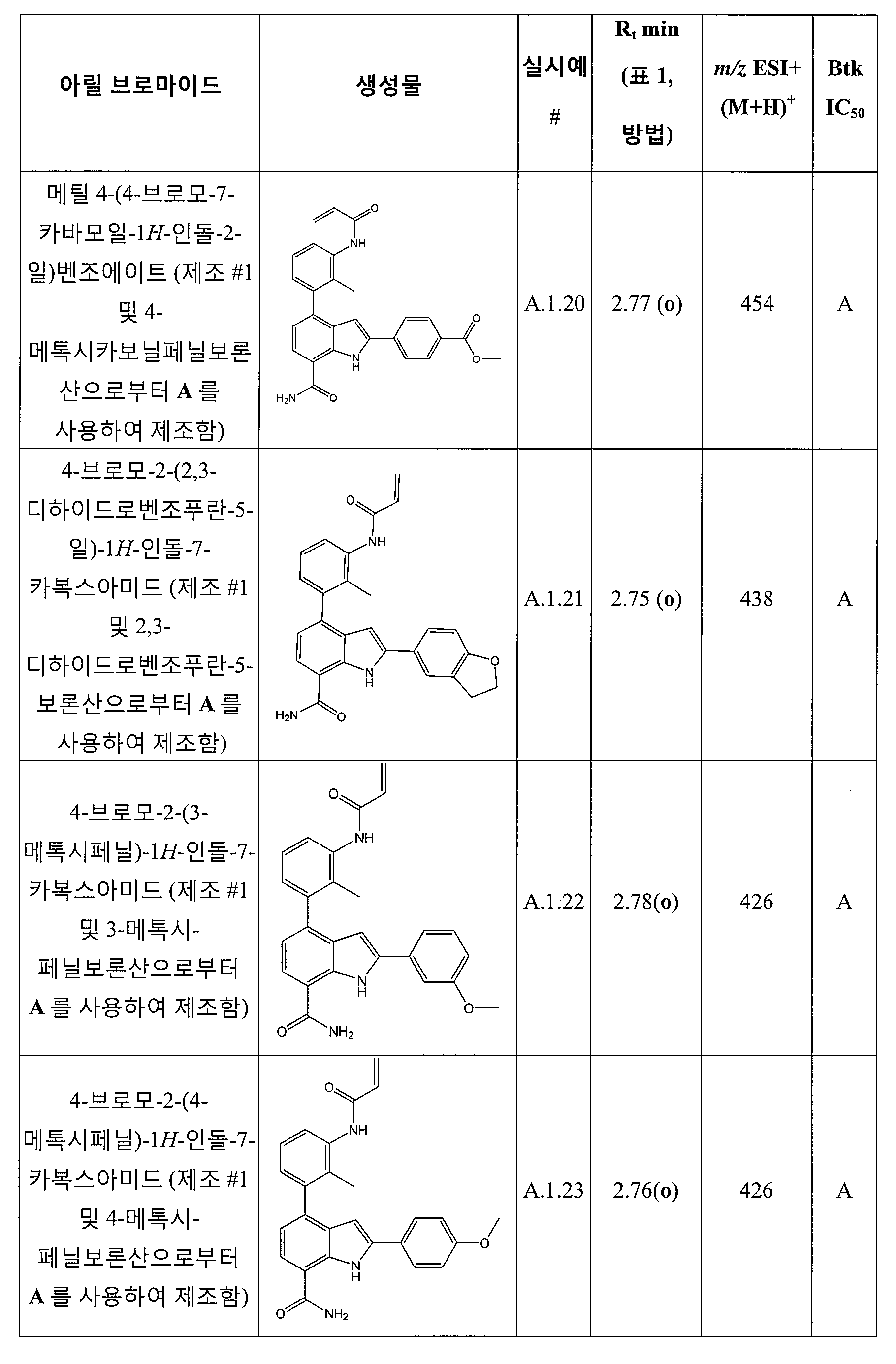
메틸 3-(4-(3-아크릴아미도-2-메틸페닐)-7-카바모일-1H-인돌-2-일)벤조에이트;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(6-메틸피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-카바모일페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-3-메틸-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3,5-디메틸이속사졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-(테트라하이드로-2H-피란-2-일)-1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3,5-디메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-이소프로필-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1,3-디메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-에틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-이소부틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(E)-N-(3-(3-부트-2-엔아미도-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-3-메타크릴아미도-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(3-부트-2-인아미도-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-3-(2-(4-플루오로페녹시)아세트아미도)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-플루오로피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-에틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
2-(3-아세트아미도페닐)-4-(3-아크릴아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메톡시피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-시아노페닐)-1H-인돌-7-카복스아미드;
메틸 4-(4-(3-아크릴아미도-2-메틸페닐)-7-카바모일-1H-인돌-2-일)벤조에이트;
4-(3-아크릴아미도-2-메틸페닐)-2-(2,3-디하이드로벤조푸란-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-(디메틸아미노)페닐)-1H-인돌-7-카복스아미드;
4-(2-(2-클로로아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-아세트아미도페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
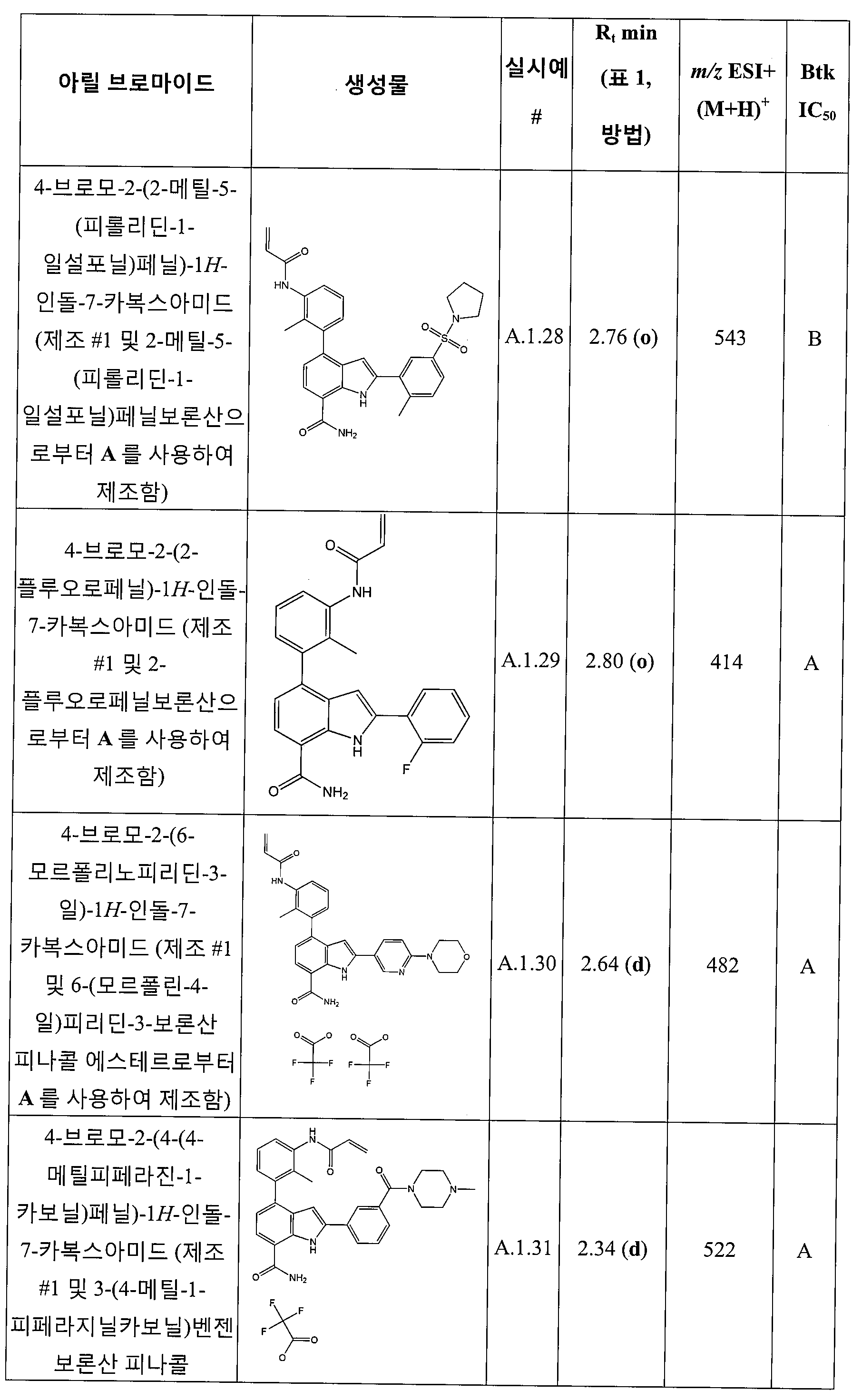
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메틸-5-(피롤리딘-1-일설포닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-플루오로페닐)-1H-인돌-7-카복스아미드;
N-(3-(3-아크릴아미도-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-3-(2-클로로아세트아미도)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-메틸-1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-(2-모르폴리노에틸)-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(6-모르폴리노피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-(4-메틸피페라진-1-카보닐)페닐)-1H-인돌-7-카복스아미드;
N-(3-(2-(2-(아크릴아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(아세트아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-(프로피온아미도메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(부티르아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
(E)-N-(3-(2-(2-(부트-2-엔아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-(메타크릴아미도메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-(프로피올아미도메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(부트-2-인아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-시아노아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((3-(디메틸아미노)프로판아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((3-(피페리딘-1-일)프로판아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-페녹시아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-(4-플루오로페녹시)아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-클로로아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(아미노메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-페닐-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-(메틸설포닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(디메틸카바모일)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(모르폴린-4-카보닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(피롤리딘-1-카보닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(4-메틸피페라진-1-카보닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(메틸설포닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(6-메톡시피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메톡시페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-3-(2-시아노아세트아미도)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(2-아크릴아미도페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(모르폴리노메틸)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-카바모일페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-(티아졸-2-일메틸아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(N-메틸아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(메틸아미노)페닐)-1H-인돌-7-카복스아미드;
4-(3-(N-메틸아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-메틸렌부탄아미도)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(피롤리딘-1-일)프로판아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-메타크릴아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(3-사이클로프로필아크릴아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(피리딘-2-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(1-메틸-1H-피라졸-4-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-에틸 4-(3-(7-카바모일-1H-인돌-4-일)-2-메틸페닐아미노)-4-옥소부트-2-에노에이트;
(E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(피리딘-3-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-메틸펜트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)-2-메틸페닐)-N4-에틸말레아미드;
4-(3-아세트아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-부트-2-엔아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-모르폴리노프로판아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(티아졸-2-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-페닐아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-(피페리딘-1-일)부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-((테트라하이드로푸란-2-일)메틸아미노)부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(2-메톡시에틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(사이클로프로필아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-모르폴리노부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-(4-메틸피페라진-1-일)부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-(벤질옥시)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-(벤질옥시)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
4-(2-아크릴아미도-4-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
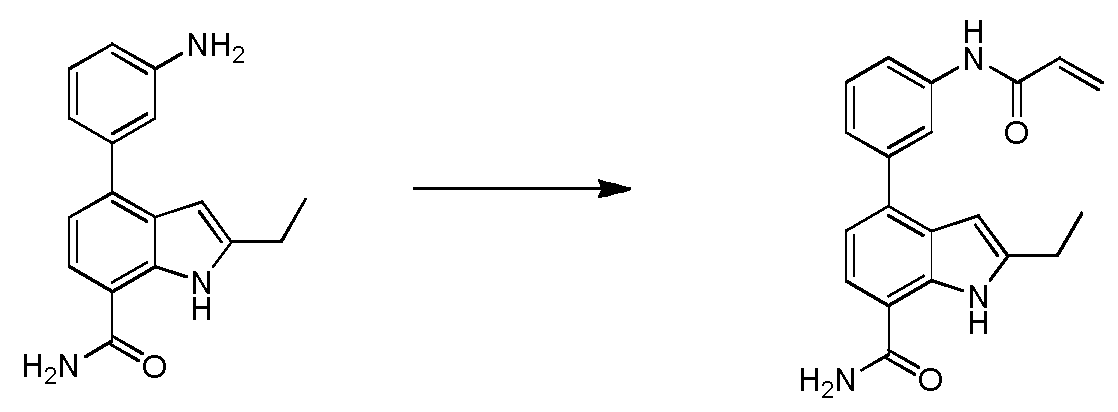
4-(3-아크릴아미도-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-(2-아크릴아미도-4-(벤질옥시)페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-아크릴아미도피리딘-4-일)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-(2-메톡시에틸)말레아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-에틸말레아미드;
4-(3-(1-메틸-1,2,5,6-테트라하이드로피리딘-3-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(비닐설폰아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(2-옥소프로판아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-메틸 4-(3-(7-카바모일-1H-인돌-4-일)페닐아미노)-4-옥소부트-2-에노에이트;
4-(3-(시아노메틸카바모일)페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-1H-인돌-4-일)페닐)-5-메틸이속사졸-4-카복스아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-메틸푸마르아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4,N4-디메틸푸마르아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-에틸푸마르아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-사이클로프로필푸마르아미드;
(E)-4-(3-(7-카바모일-1H-인돌-4-일)페닐아미노)-4-옥소부트-2-엔산;
4-(3-(N-이소부틸아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
1-아크릴로일-1,2,3,6-테트라하이드로-피롤로[2,3-e]인돌-5-카복실산 아미드;
4-아크릴아미도-1H-인돌-7-카복스아미드;
4-(3-(N-(시아노메틸)설파모일)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
4-(3-((2-옥소프로판아미도)메틸)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-1H-인다졸-7-카복스아미드;
4-(3-아크릴아미도-2-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2-클로로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2,4-디플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2,6-디플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-클로로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2,3-디플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-비닐-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-에틸-1H-인돌-7-카복스아미드;
4-(3-(2-(모르폴리노메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(2-((디메틸아미노)메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-((1R,3S)-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(시스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-((1S,3S)-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(트랜스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(시스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(3-(2-(아미노메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-((1R,3S)-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(3-(2-((메틸아미노)메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-메틸-1H-인돌-7-카복스아미드;
4-((1S,3S)-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드;
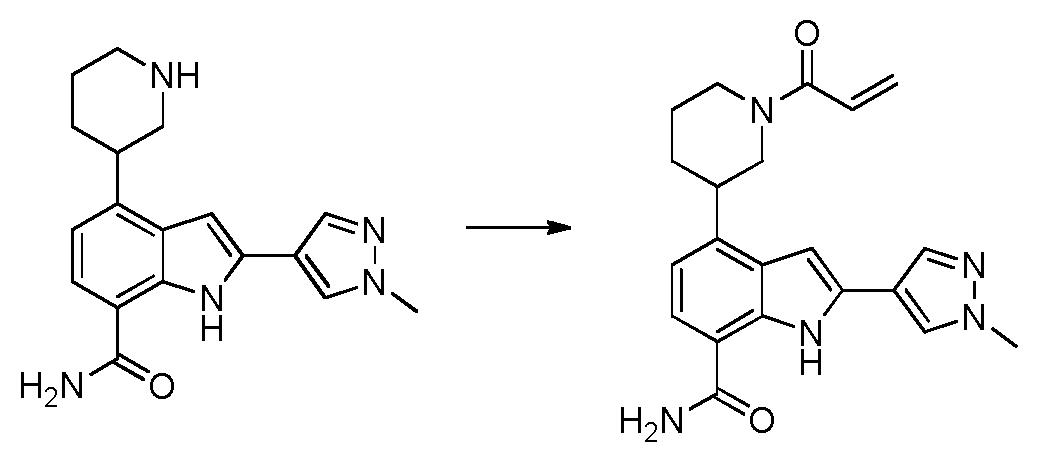
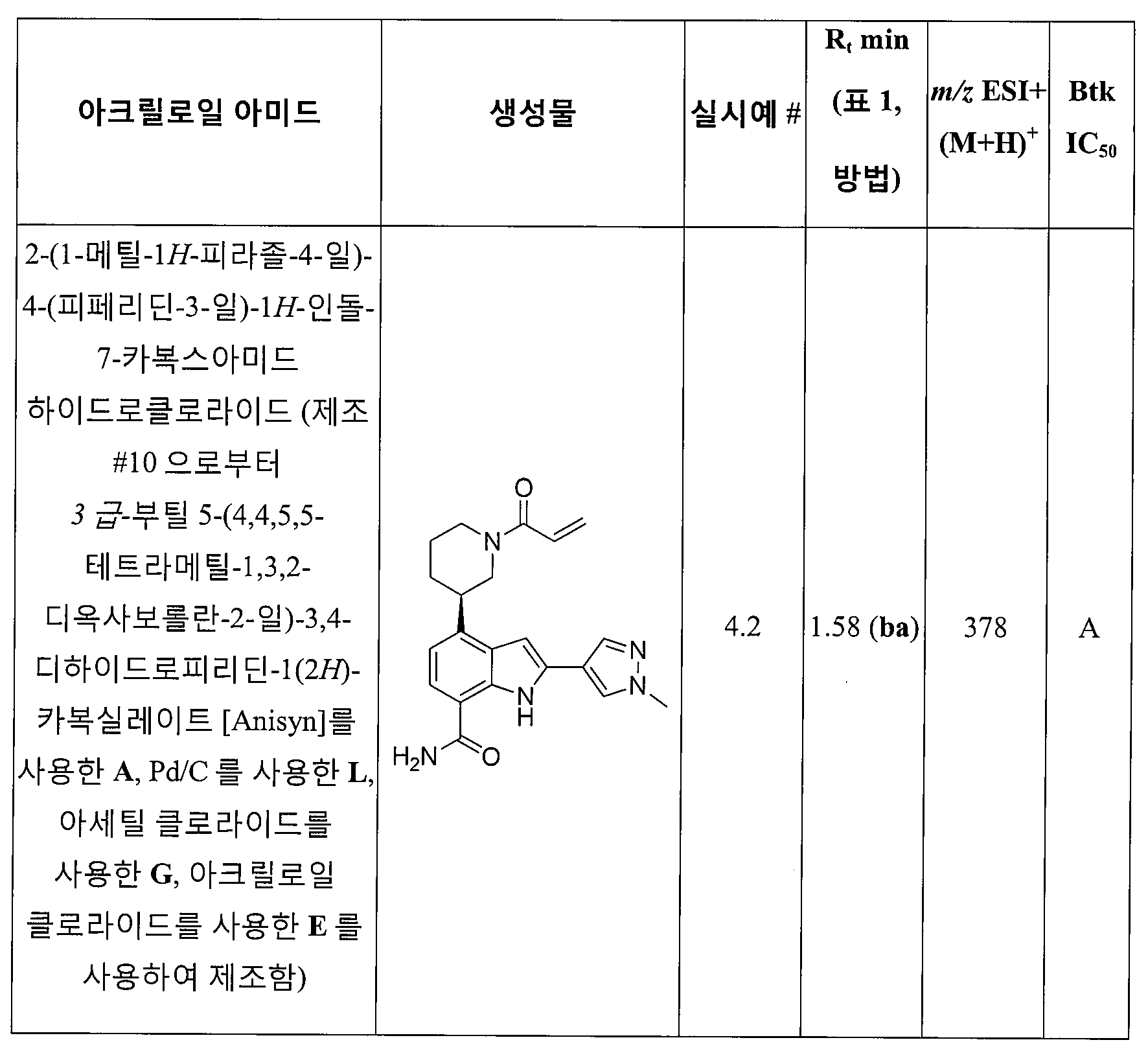
4-(1-아크릴로일피페리딘 3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-이소프로필-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-메틸피페리딘-4-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(N-(사이클로펜틸메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
에틸 4-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)5,6-디하이드로피리딘-1(2H)-카복실레이트;
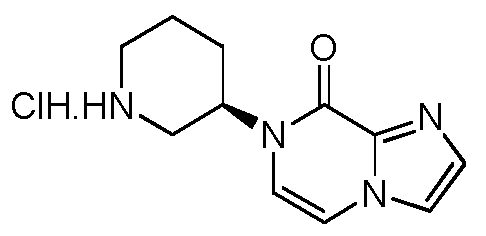
(R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카보니트릴;
4-(2,6-디클로로벤질)-2-(p-톨릴)-1H-인돌-7-카복스아미드;
(E)-4-(3-(2-시아노-3-하이드록시부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
4-(시스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(트랜스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(트랜스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
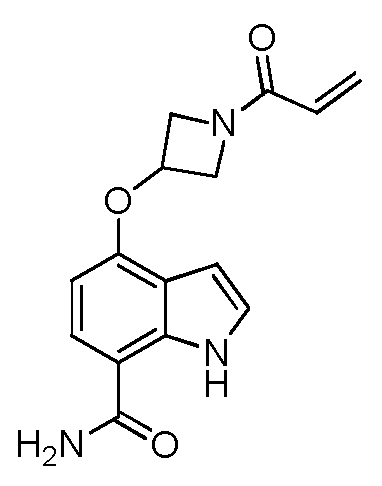
4-((1-아크릴로일아제티딘-3-일)옥시)-1H-인돌-7-카복스아미드;
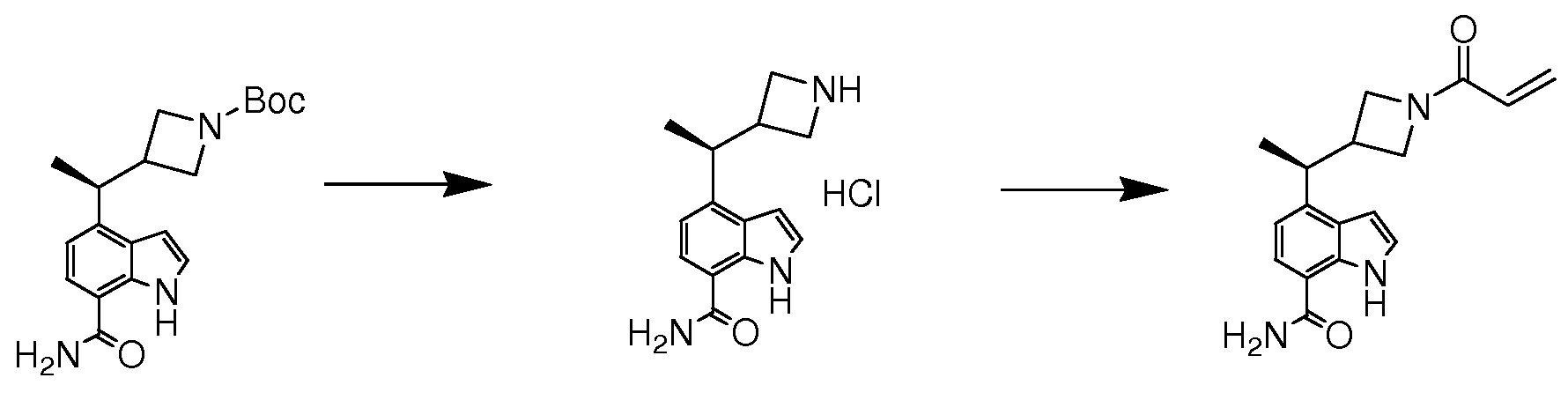
(S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드;
(R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드*;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드*;
(S)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드*;
(S)-4-(1-아크릴로일피페리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드;
(R)-4-(4-아크릴로일모르폴린-2-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(S)-4-(4-아크릴로일모르폴린-2-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(R)-4-(1-아크릴로일피롤리딘-3-일)-2-(6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-일)-1H-인돌-7-카복스아미드;
2-메틸-4-(메틸(1-프로피올로일아제티딘-3-일)아미노)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피롤리딘-3-일)-2-(6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-일)-1H-인돌-7-카복스아미드;
(R)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(S)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(S)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(R)-7-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카복스아미드;
(S)-7-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카복스아미드;
(S)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-인돌-7-카복스아미드;
4-((3S,5R)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-((3S,5S)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-((3R,5S)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-((3R,5R)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
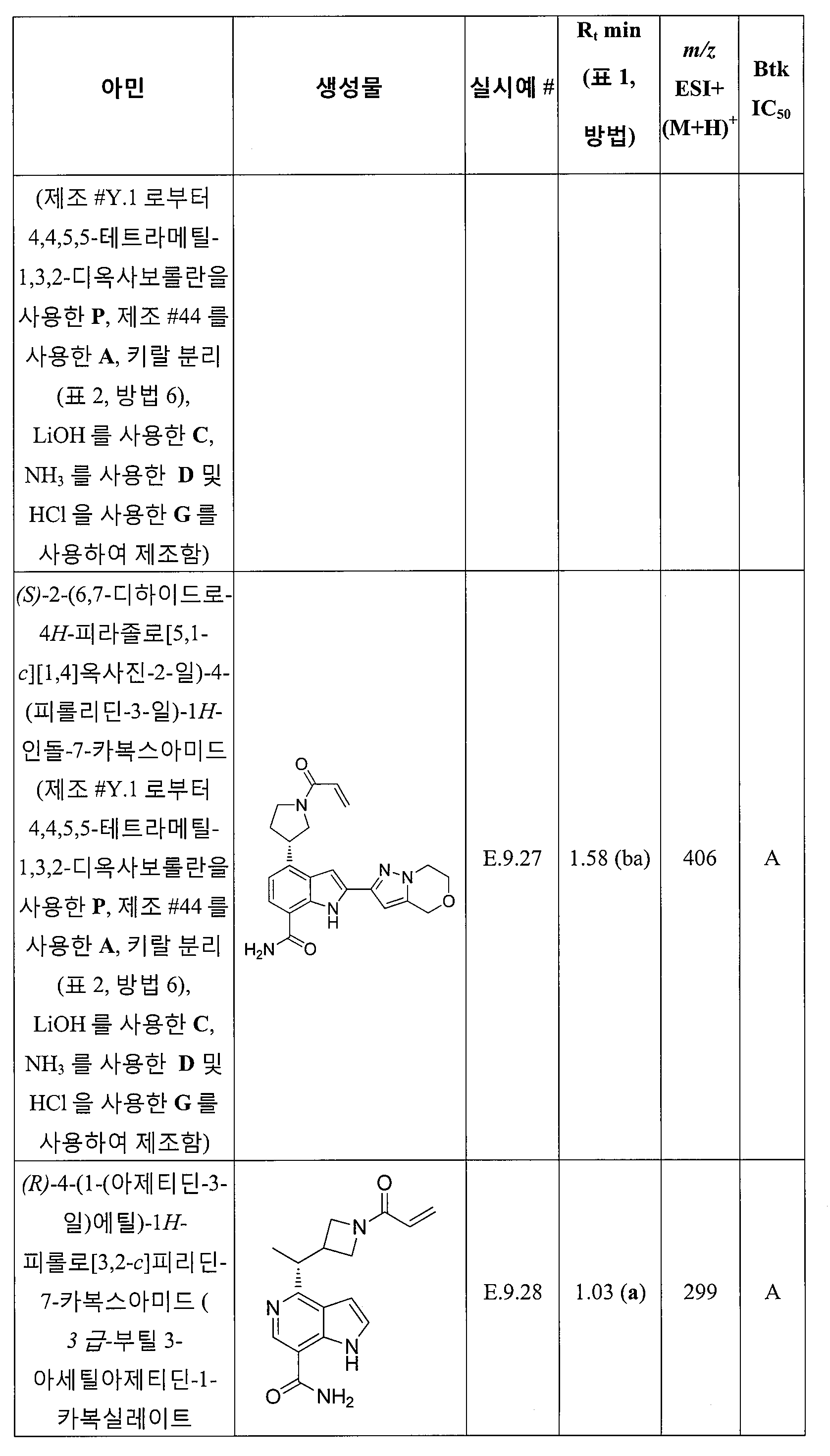
(R)-4-(1-아크릴로일피롤리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피롤리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-((1R,3R)-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-2-메틸-4-(1-프로피오닐피롤리딘-3-일)-1H-인돌-7-카복스아미드;
(S)-2-메틸-4-(1-프로피오닐피롤리딘-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(이소크로만-7-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(4-(메틸설포닐)사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(6-모르폴리노피리딘-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(7,8-디하이드로-5H-피라노[4,3-b]피리딘-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(크로만-7-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(5-(모르폴리노메틸)피리딘-2-일)-1H-인돌-7-카복스아미드;
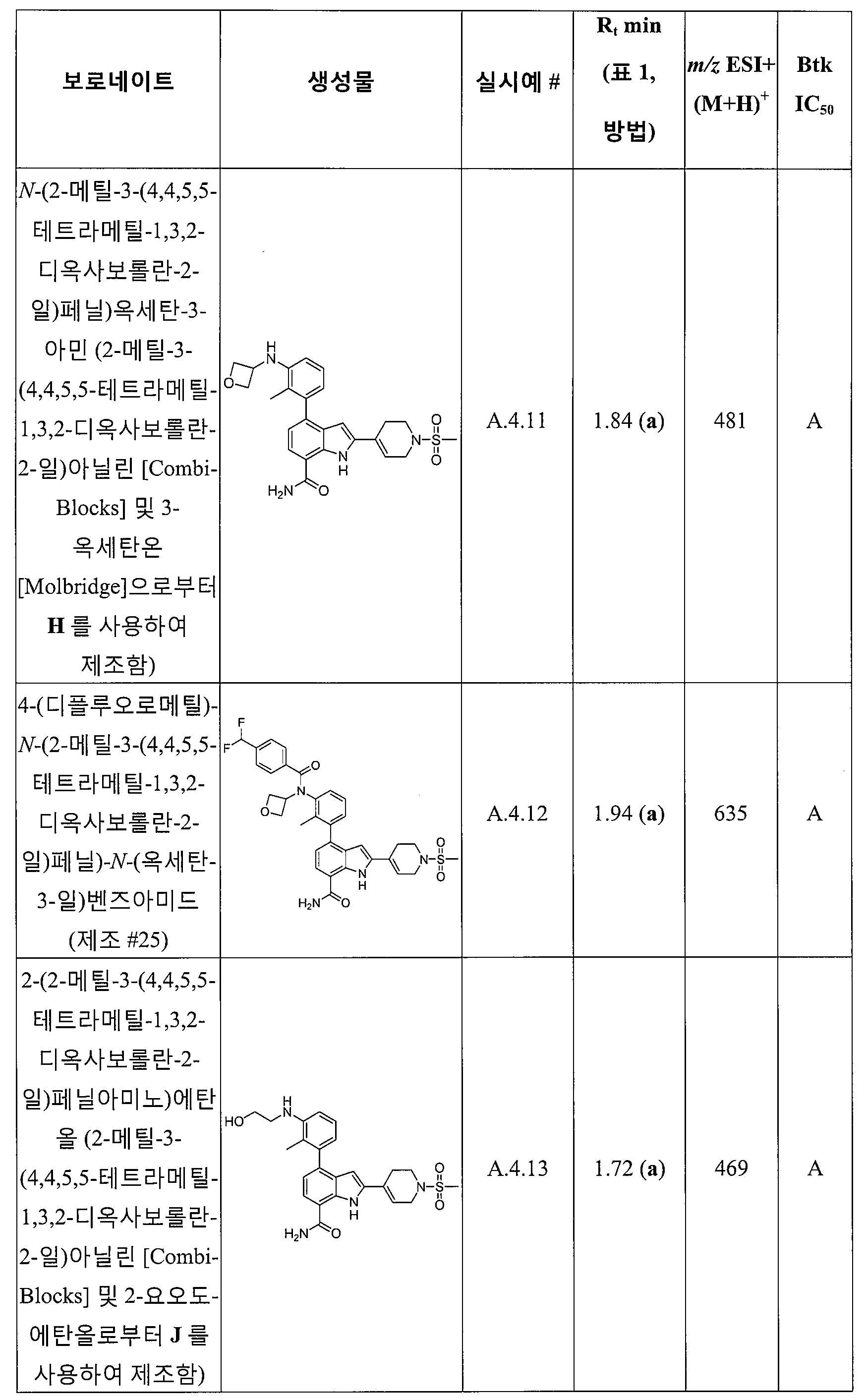
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(3,4-디하이드로-2H-벤조[b][1,4]옥사진-6-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1-메틸-1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(2-에틸-1,2,3,4-테트라하이드로이소퀴놀린-6-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1,3-디메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1,1-디옥시도테트라하이드로-2H-티오피란-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1-프로필피페리딘-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(3-하이드록시옥세탄-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-메틸-1H-인돌-7-카복스아미드;
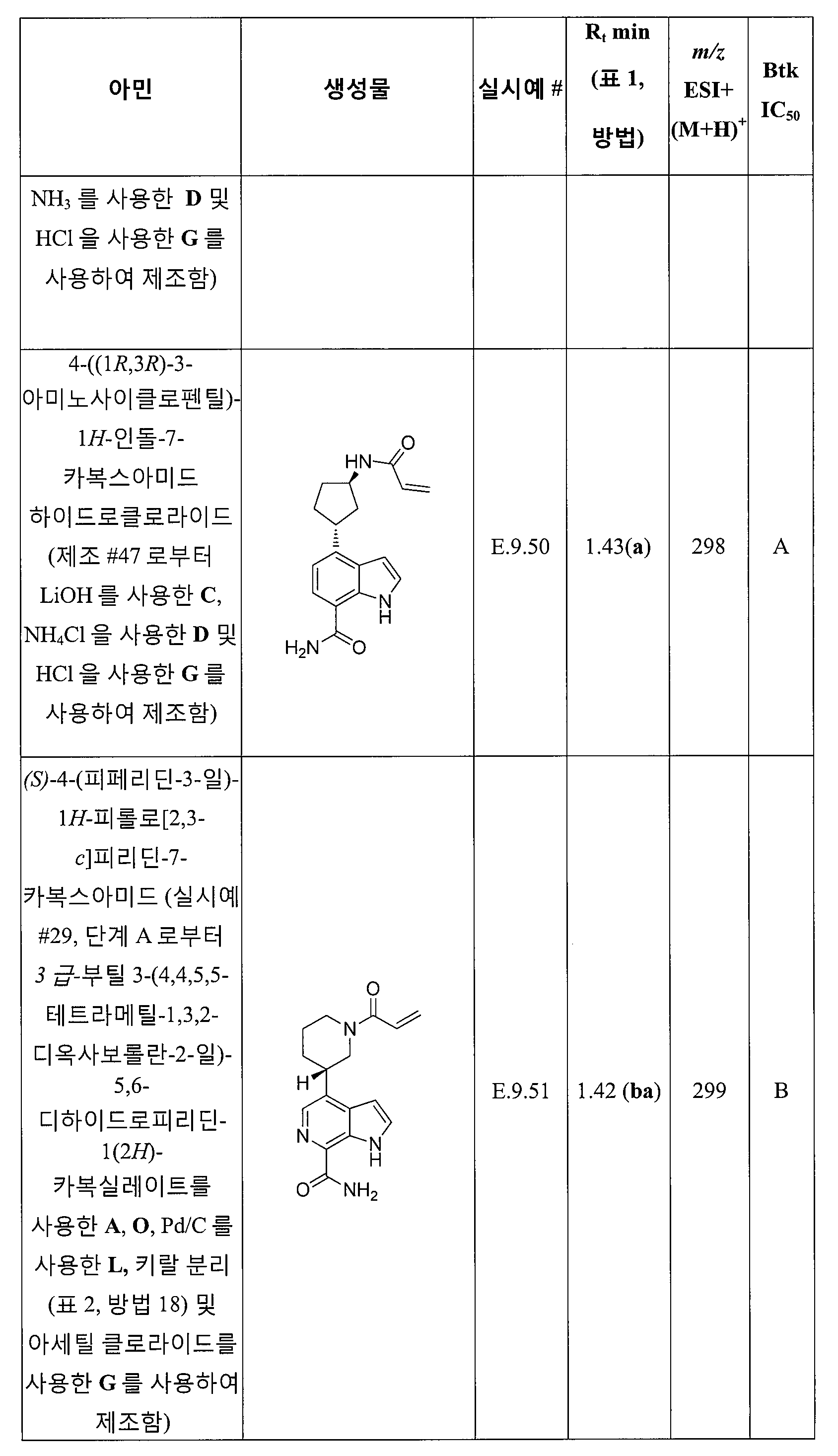
(R)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피롤리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드*;
(R)-4-(1-아크릴로일피롤리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드*;
4-((1R,5S)-6-아크릴로일-3,6-디아자바이사이클로[3.2.0]헵탄-3-일)-1H-인돌-7-카복스아미드;
4-((1S,5R)-6-아크릴로일-3,6-디아자바이사이클로[3.2.0]헵탄-3-일)-1H-인돌-7-카복스아미드;
(R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-((1-아크릴로일-3-메틸아제티딘-3-일)(메틸)아미노)-1H-인돌-7-카복스아미드;
4-((1-시아노아제티딘-3-일)(메틸)아미노)-2-메틸-1H-인돌-7-카복스아미드;
4-(2-클로로-6-플루오로벤질)-2-p-톨릴-1H-인돌-7-카복스아미드;
(S)-4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드;
(R)-4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드;
(S)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(S)-4-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드; 또는
(R)-4-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드.
제21 양태에서, 본 발명은 제1항의 화합물의 치료학적 유효량을 이를 필요로 하는 환자에게 투여함을 포함하는 질환의 치료 방법을 제공한다.
제22 양태에서, 본 발명은 상기 양태 중 어느 하나에 따른 화합물을 제공하고, 여기서, 상기 질환은 류머티스 관절염, 소아 류머티스 관절염, 골관절염, 크론병, 염증성 장 질환, 궤양성 대장염, 건선관절염, 건선, 강직척추염, 간질성방광염, 천식, 전신 홍반 루푸스, 루푸스신장염, B 세포 만성 림프성 림프종, 다발성 경화증, 만성 림프성백혈병, 소세포성림프종, 외투 세포 림프종, B-세포 비-호지킨 림프종, 활성화된 B-세포형 확산 거대 B-세포 림프종, 다발골수종, 확산 거대 B-세포 림프종, 소포 림프종, 털세포백혈병 또는 림프모구 림프종이다.
제23 양태에서, 본 발명은 상기 양태 중 어느 것에 따른 화합물을 투여하는 것과 함께 자가면역 장애를 치료하기 위한 성분을 포함하는 패키지된 제품을 포함하는 키트를 제공한다.
제24 양태에서, 본 발명은 제23 양태에 따른 키트를 제공하고, 여기서, 상기 패키지된 제품은 제1항의 화합물 및 사용 지시서를 포함한다.
제25 양태에서, 본 발명은 제1 내지 제20 양태 중 어느 것에 따른 화합물 및 하나 이상의 약제학적으로 허용되는 부형제를 포함하는 약제학적 조성물을 제공한다.
발명의 상세한 설명
단백질 키나제는 500개 효소가 넘는 광범위하고 다양한 부류이고, 종양유전자, 성장 인자 수용체, 신호 전달 중간체, 아폽토시스 관련된 키나제 및 사이클린 의존성 키나제를 포함한다. 이들은 포스페이트 그룹을 특정 티로신, 세린 또는 트레오닌 아미노 산 잔기로 이동시키는데 책임이 있고, 이들의 기질 특이성의 결과로서 티로신 및 세린/트레오닌 키나제로서 광범위하게 분류된다.
단백질 키나제는 매우 다양한 세포 프로세스의 조절 및 세포 기능의 유지에서 중심 역할을 하는 거대 부류의 단백질을 나타낸다. 부분적, 비제한적인, 이들 키나제의 목록은 다음을 포함한다: 비-수용체 티로신 키나제, 예를 들면, Tec 부류(BTK, ITK, Tec, ETK/BMX 및 RLK/TXK), Janus 키나제 부류(Jak1, Jak2, Jak3 및 Tyk2); 융합 키나제, 예를 들면, BCR-Abl, 국소 부착 키나제(FAK), Fes, Lck 및 Syk; 수용체 티로신 키나제, 예를 들면, 표피 성장 인자 수용체(EGFR), 혈소판-유도된 성장 인자 수용체 키나제(PDGF-R), 줄기 세포 인자에 대한 수용체 키나제, c-kit, 간세포 성장 인자 수용체, c-Met, 및 섬유모세포 성장 인자 수용체, FGFR3; 및 세린/트레오닌 키나제, 예를 들면, b-RAF, 미토겐-활성화된 단백질 키나제(예를 들면, MKK6) 및 SAPK2β. 비정상 키나제 활성은 양성 및 악성 증식성 장애 뿐만 아니라 면역계 및 신경계의 부적합한 활성으로부터 야기되는 질환을 포함하는 다수의 질환 상태에서 관찰되었다. 신규한 본 발명의 화합물은 하나 이상의 단백질 키나제의 활성을 억제하고, 따라서, 키나제-매개된 질환의 치료에서 유용할 것으로 예상된다.
브루튼 티로신 키나제(BTK)는 B 세포, 혈소판, 비만 세포, 호염기구, 호산구, 대식세포 및 호중구 뿐만 아니라 뼈 파괴에 연관된 파골세포를 포함하는 다수의 조혈 세포에서 면역수용체 시그널링(BCR, FcεR, FcγR, DAP12, Dectin-1, GPVI 등)에서 주요한 역할을 하는 비-수용체 티로신 키나제이다[평가를 위해 참조: Brunner et al., 2005 Histol. Histopathol., 20:945, Mohamed et al., 2009 Immunol. Rev., 228:58]. BTK의 돌연변이는 사람에서 X-연관된 무감마글로불린혈증(XLA) 및 마우스에서 X-연관된 면역 결핍(Xid)을 야기하는 것으로 공지되어 있고, 이는 제한된 B-세포 생성 및 감소된 항체가를 특징으로 한다[참조: Lindvall et al., 2005 Immunol. Rev., 203:200]. 다중 세포 타입에서 BTK의 조합된 작용은 이를 자가면역 질환에 대한 매력적인 표적이 되게 한다. BTK는 다른 Tec 부류 키나제(ITK, Tec, ETK/BMX 및 RLK/TXK)에 대한 서열 상동성과 관련된다.
B-림프구에서, BTK는 B-세포 수용체(BCR) 진입에 따른 B-세포 발현 및 Ca2+ 이동을 위해 요구되고[참조: Khan et al., 1995 Immunity 3:283; Genevier et al., 1997 Clin. Exp. Immun., 110:286], 여기서, Src 부류 키나제(예를 들면, Lyn), Syk 및 PI3K의 하향스트림인 것이 고려된다. BTK는 항원에 대한 가슴샘-의존성 및 가슴샘-비의존성 타입2 반응 둘다에서 중요한 것으로 나타났다[참조: Khan et al., Immunity 1995; 3; 283]. 비만 세포에서, BTK 마우스 녹-아웃을 사용한 연구[참조: Hata et al., 1998 J. Exp. Med., 187:1235; Schmidt et al., 2009 Eur. J. Immun., 39:3228]는 사이토킨, 예를 들면, TNF, IL-2, 및 IL-4의 FcεRI 유도된 시그널링, 히스타민 방출 및 생성에서 BTK의 역할을 나타낸다. 혈소판에서, BTK는, 콜레겐에 반응하고 혈소판 응집을 촉진하고 섬유모세포-유사 윤활막세포로부터 사이토킨 생성에 기여하는 것으로 나타나는 당단백질 VI(GPVI) 수용체를 통한 시그널링에서 중요하다[참조: Hsu et al., 2013 Immun. Letters 150:97]. 단핵구 및 대식세포에서, BTK의 작용은 FcγRI 유도된 신호에 연관되고, 또한 TLR2, TLR4, TLR8 및 TLR9를 포함하는 톨-유사 수용체-유도된 사이토킨 반응에서 역할을 할 수 있다[참조: Horwood et al., 2003 J. Exp. Med., 197:1603; Horwood et al., 2006 J. Immunol., 176:3635; Perez de Diego et al., 2006 Allerg. Clin. Imm., 117:1462; Doyle et al., 2007 J. Biol. Chem., 282:36959, Hasan et al., 2007 Immunology, 123:239; Sochorava et al., 2007 Blood, 109:2553; Lee et al., 2008, J. Biol. Chem., 283:11189].
따라서, BTK의 억제는 자가면역 반응의 효과적인 억제를 야기하는 염증 반응의 수개의 중요한 연결에서 개입하는 것으로 예상된다. B-세포 수용체 활성, 항체-Fc 수용체 상호작용 및 GPVI 수용체 시그널링에 관한 이러한 질환은 BTK 억제제로 치료하여 조절될 수 있다. BTK 억제는 BCR 시그널링를 차단하여 자가면역 질환의 개시 및 대식세포, 호중구, 호염기구, 및 비만 세포에 대한 FcR 시그널링의 폐기에 의해 효과기 기 둘 다에서 작용하는 것 같다. 또한, BTK의 차단은 파골세포 성숙의 억제를 통해 추가의 이익을 제공할 수 있고, 따라서, 류머티스 관절염에 관련된 뼈 침식 및 전체 관절 파괴를 약화시킨다. BTK의 억제는 다수의 염증 및 알레르기 질환 - 예를 들면, (이에 제한되는 것은 아니지만), 류머티스 관절염(RA), 전신 홍반 루푸스(SLE), 다발성 경화증(MS) 및 I형 과민 반응, 예를 들면, 알레르기 비염, 알레르기 결막염, 아토피 피부염, 알레르기 천식 및 전신 아나필락시스를 치료하는데 사용될 수 있다. 염증 장애 및 자가면역 뿐만 아니라 백혈병 및 림프종을 위한 치료제로서 BTK의 표적화에 대한 평가는 문헌을 참조한다[참조: Uckun & Qazi 2010 Expert Opin Ther Pat 20:1457]. BTK가 조혈계의 암에서 고도로 발현되고, BTK-의존성 시그널링은 여기서 탈조절되는 것으로 고려되기 때문에, BTK 억제제는 B-세포 림프종/백혈병 및 다른 종양학적 질환 - 예를 들면, (이에 제한되는 것은 아니지만) 급성 림프모구 백혈병(ALL), 만성 림프성백혈병(CLL), 비-호지킨 림프종(NHL), 소세포성림프종(SLL), 및 급성 골수성 백혈병을 위한 유용한 치료제인 것으로 예상된다[평가를 위해 참조: Buggy & Elias 2012 Int Rev Immunol. 31:119]. 종합하면, BTK 억제제는 다수의 염증 질환 및 면역학적 장애 뿐만 아니라 혈액학적 암을 치료하는데 강력한 방법을 제공한다
모든 키나제는 통상의 분자, ATP를 결합하고, 따라서, 구조적으로 유사한 결합 포켓(binding pockets)을 갖는다. 따라서, 임의의 키나제 억제제에 대한 도전 중 하나는 키나제 억제제가 결합 포켓의 상동으로 인해 하나 초과의 키나제를 억제하는 경향이 있다는 것이다. 예를 들면, 스타우로스포린, 잘 특성화된 뒤섞인 키나제 억제제는, 사람 키놈(kinome)으로부터 kd <3 μM 키나제로 적어도 253을 억제하는 것으로 나타났다[참조: Nature Biotechnology, 208, 26, p. 127]. 추가로, 수개의 시판되는 키나제 억제제는 하나 초과의 의도된 키나제를 억제하는 것으로 공지되어 있고, 예를 들면, 이마티닙(Gleevec®)는 ABL, ARG, PDGFR-α/β 및 c-KIT 키나제를 표적화하고, 소라페닙(Nexavar®)은 B-RAF, VEGFRs, PDGFR-α/β, FLT3 및 c-KIT를 표적화하고, 수니티닙(Sutent®)은 VEGFR, PDGFR, CSF1R, FLT3 및 c-KIT를 표적화한다[참조: Nature Reviews Drug Discovery 2011, 10, 111].
사람 키놈에서 특정 키나제의 억제는 약제학적 치료제로서 사용되는 경우 목적하지 않은 효과를 갖는 것으로 공지되어 있다. 예를 들면, 다수의 키나제 표적은 현재 시판되는 키나제 억제제에 대한 심장독성 프로파일에서 역할을 한다는 것에 연루된다. 이들 키나제는, 이에 제한되는 것은 아니지만, VEGFR2, PI3K, AKT, PDGFR-α/β, AMPK, GSK3, ERKs, CDK2, Aurora, PLK, JNK, CAMKII< PDK1, mTOR, LKB1, CAMKKβ, MEK1/2, PKA, PKCα, RAF1, B-RAF, EGFR, ERBB2, c-Kit, ABL, ARG, JAK2, FAK, DMPK, LTK, ROCK, LKB1, LDB3, PIM, GRK2, GRK5, ASK1, 및 PTEN을 포함할 수 있다[참조: Nature Reviews Drug Discovery 2011, 10:111]. 시판되는 키나제 억제제로부터의 하나의 예는 수니티닙을 사용한 임상 시도에서, 환자는 고혈압 위험이 증가되는 것으로 밝혀졌다[참조: The Lancet 2006, 368:1329; and J. Clin. Oncol. 2009, 27:3584]. 증가된 고혈압에 대한 기전에 관한 후속 연구는 PDGFR 및 VEGFR이 역할을 할 수 있는 반면에, 표적화-이탈(off-target) 키나제 억제, 예를 들면, AMPK가, 또한 수니티닙의 고혈압 위험 증가에 기여할 수 있다는 것을 제시한다[참조: Curr. Hypertens. Rep. 2011, 13:436]. 추가로, CSF1R, KIT, FYN, PDGFR 베타, FGR, LCK, 에프린 수용체 B2, FRK, ABL1, PDGFR1 알파, HCK, ABL2, LYN, ZAK, YES1, MAP4K4, PKN1, BRAF, DDR2, MAP4K5 및 STK24를 포함하는 키나제의 목록에 대한 활성을 기초로 하여 심장독성의 예측 방법인 출원된 특허 출원 US 2011/0212461이 있다. 따라서, 선택적 프로파일 Btk 키나제를 사용한 키나제 억제제의 확인이 바람직하다. 본 발명의 화합물은 다른 키나제 보다 Btk의 억제에 대해 선택적이다.
대부분의 키나제는, 수용체 또는 비-수용체 티로신 키나제 또는 S/T 키나제가 세포 시그널링 경로에 연관된 것으로 밝혀졌는지에 상관없이, 면역조절, 염증, 또는 증식성 장애, 예를 들면, 암을 포함하는 다수의 병원성 상태에 연관된다.
다수의 자가면역 질환 및 만성 염증, 뿐만 아니라 급성 반응 관련 질환은, 하나 이상의 사이토킨의 과도한 또는 조절되지 않은 생성 또는 활성에 연관되었다.
본 발명의 화합물은 또한 사람에서 류머티스 관절염, 천식, 알레르기 천식, 골관절염, 소아 관절염, 루푸스, 루푸스신장염, 전신 홍반 루푸스(SLE), 강직척추염, 눈 상태, 간질성방광염, 암, 고형 종양, 육종, 섬유육종, 골종, 흑색종, 망막모세포종, 횡문근육종, 교모세포종, 신경모세포종, 기형암종, 과민 반응, 운동과다 운동 장애, 과민 폐렴, 고혈압, 운동감소 운동 장애, 대동맥 및 말초 동맥류(aneuryisms), 시상하부-뇌하수체-부신축 평가, 대동맥박리, 동맥 고혈압, 동맥경화증, 동정맥루, 실조, 척수소뇌 변성, 연쇄구균 근염, 소뇌의 구조적 병소, 아급성 경화 범뇌염, 실신, 심혈관계의 매독, 전신 아나필락시스, 전신 염증 반응 증후군, 전신 발병 소아 류머티스 관절염, T-세포 또는 FAB ALL, 모세혈관확장증, 폐쇄혈전혈관염, 이식, 외상/출혈, III형 과민 반응, IV형 과민, 불안정 협심증, 요독증, 요로성패혈증, 두드러기, 판막 심장 질환, 정맥류, 혈관염, 정맥 질환, 정맥 혈전증, 심실 세동, 바이러스 및 진균 감염, 바이탈(vital) 뇌염/무균수막염, 바이탈-관련 림프조직구(hemaphagocytic) 증후군, 베르니케-코르사코프 증후군, 윌슨 질환, 임의의 장기 또는 조직의 이종이식편 거부반응, 심장 이식 거부, 혈색소침착증, 혈액투석, 용혈요독 증후군/혈전용해 혈소판감소자색반, 출혈, 특발성 폐 섬유증, 항체 매개 세포독성, 무력, 소아 척수근위축증, 대동맥의 염증, 인플루엔자 A, 이온화 방사선 노출, 홍채섬모체염/포도막염/시신경염, 소아 척수근위축증, 림프종, 골수종, 백혈병, 악성 복수, 조혈 암, 당뇨병 상태, 예를 들면, 인슐린-의존성 진성 당뇨병 녹내장, 당뇨병 망막병증 또는 미세혈관병증, 낫적혈구 빈혈, 만성 염증, 사구체신염, 이식편 거부반응, 라임 질환, 폰 힙펠 린도우 질환, 유사천포창, 파제트 질환, 섬유증, 사르코이드증, 간경화증, 갑상샘염, 과다점도 증후군, 오슬러-웨버-렌두 질환, 만성 폐쇄 폐 질환, 천식 또는 화상에 이은 부종, 외상, 방사선, 뇌졸중, 저산소증, 허혈, 난소 과다자극 증후군, 관류후 증후군, 펌프후 증후군, MI 심장절개후 증후군, 자간전증, 불규칙과다월경, 자궁내막증, 폐 고혈압, 소아 혈관종, 또는 단순 포진, 대상 포진, 사람 결핍 바이러스, 파라폭스바이러스, 원생동물 또는 톡소포자충증에 의한 감염, 진행핵상마비(progressive supranucleo palsy), 원발성 폐 고혈압, 방사선 요법, 레이노 증후군, 레이노 질환, 레프섬 질환, 규칙적이고 협소한 QRS 빈맥, 신장혈관 고혈압, 제한심근병증, 육종, 노인성 무도병, 루이소체 타입 노인치매, 쇼크, 피부 동종이식, 피부 변화 증후군, 눈 또는 황반 부종, 눈 신생혈관 질환, 공막염, 방사상각막절개, 포도막염, 유리체염, 근시, 시신경 유두소와(optic pits), 만성 망막 박리, 레이저 치료-후 합병증, 결막염, 스타르가르트 질환, 이일즈 질환, 망막병증, 황반변성, 재협착, 허혈/재관류 손상, 허혈 뇌졸중, 혈관 폐쇄, 경동맥 폐쇄 질환, 궤양성 대장염, 염증성 장 질환, 당뇨병, 진성 당뇨병, 인슐린 의존성 진성 당뇨병, 알레르기 질환, 피부염 공피증, 이식편 대 숙주 질환, 기관 이식 거부(이에 제한되는 것은 아니지만, 골수 및 실질 장기 거부를 포함함), 장기 이식 관련 급성 또는 만성 면역 질환, 사르코이드증, 파종 혈관내 응고, 가와사키 질환, 콩팥 증후군, 만성 피로 증후군, 베게너 육아종증, 헤노흐-쉔라인 자반증, 신장의 미세 혈관염, 만성 활동성 간염, 패혈쇼크, 독성 쇼크 증후군, 패혈증 증후군, 악액질, 감염성 질환, 기생충 질환, 후천 결핍 증후군, 급성 횡단척수염, 헌팅톤 무도병, 뇌졸중, 원발성 담관간경화증, 용혈빈혈, 악성종양, 애디슨 질환, 특발성 애디슨 질환, 산발성, 다선성 결핍 I형 및 다선성 결핍 II형, 슈미트 증후군, 성인 (급성) 호흡곤란 증후군, 탈모, 원형탈모, 혈청반응음성 관절병증, 관절병증, 라이터 질환, 건선성 관절병증, 궤양성 결장 관절병증, 장병성 윤활막염, 클라미디아, 예르시니아 및 살모넬라 관련 관절병증, 죽상 질환/동맥경화증, 아토피 알레르기, 자가면역 수포 질환, 보통천포창, 낙엽천포창, 유사천포창, 선상 IgA 질환, 자가면역 용혈 빈혈, 쿰스 포지티브 용혈 빈혈, 후천 악성 빈혈, 소아 악성 빈혈, 말초 혈관 장애, 복막염, 악성 빈혈, 근육통성뇌염(myalgic encephalitis)/로얄 프리 질환, 만성 점막피부칸디다증, 거대세포 동맥염. 원발성 경화 간염, 잠복 자가면역 간염, 후천 결핍 질환 증후군, 후천 결핍 관련 질환, A형 간염, B형 간염, C형 간염, His 다발 부정맥, HIV 감염/HIV 신경병증, 공통 가변된 결핍(공통 가변성 저감마글로불린혈증), 확장심장근육병증, 여성불임, 난소 기능상실, 조기 난소 기능상실, 섬유화 폐 질환, 만성 부상 치유, 잠복 섬유화 폐포염, 염증-후 간질성 폐 질환, 간질성 폐렴, 폐포자충 폐렴, 폐렴, 결합 조직 질환 관련된 간질성 폐 질환, 혼합된 결합 조직 질환, 관련된 폐 질환, 전신 경화증 관련된 간질성 폐 질환, 류머티스 관절염 관련된 간질성 폐 질환, 전신 홍반 루푸스 관련된 폐 질환, 피부근염/다발근염 관련된 폐 질환, 쇼그렌 질환 관련된 폐 질환, 강직척추염 관련된 폐 질환, 혈관염 미만 폐 질환, 혈철소증 관련된 폐 질환, 약물-유도된 간질성 폐 질환, 방사선 섬유증, 폐쇄세기관지염, 만성 호산구 폐렴, 림프성 침윤성 폐 질환, 감염후 간질성 폐 질환, 통풍 관절염, 자가면역 간염, 1형 자가면역 간염(전형 자가면역 또는 루푸스양 간염), 2형 자가면역 간염(항-LKM 항체 간염), 자가면역 매개 저혈당증, 흑색가시세포증을 동반한 타입 B 인슐린 저항, 부갑상샘기능저하증, 장기 이식 관련 급성 면역 질환, 장기 이식 관련 만성 면역 질환, 골관절염, 원발성 경화 담관염, 건선 타입 1, 건선 타입 2, 특발성 백혈구 감소, 자가면역 호중성백혈구감소증, 신장 질환 NOS, 사구체신염, 신장의 미세 혈관염, 라임 질환, 원반모양홍반루푸스, 남성불임 특발성 또는 NOS, 정자 자가면역, 다발성 경화증(모든 서브타입), 교감눈염증, 결합 조직 질환에 이어지는 폐 고혈압, 급성 및 만성 통증(상이한 형태의 통증), 굿파스처 증후군, 결절다발동맥염의 폐 징후, 급성 류마티스 열, 류마티스 척추염, 스틸 질환, 전신 경화증, 쇼그렌 증후군, 다카야스 질환/동맥염, 자가면역 혈소판감소증, 독성, 이식, 및 부적합한 혈관화 관련 질환, 예를 들면, 당뇨병 망막병증, 미숙아 망막병증, 노화 관련 황반변성에 의한 맥락막 혈관신생, 및 소아 혈관종의 치료에 유용하다. 추가로, 이러한 화합물은, 예를 들면, 황반 부종, 뇌 부종, 급성 폐 손상, 성인 호흡곤란 증후군(ARDS), 증식성 장애, 예를 들면, 재협착, 섬유화 장애, 예를 들면, 간경화증 및 죽상동맥경화증, 혈관사이 세포 증식성 장애, 예를 들면, 당뇨병 신장병증, 악성 신경화증, 혈전 미세혈관병증 증후군, 및 사구체병증, 신근 혈관형성, 심장 및 뇌 부정맥(collaterals), 허혈 팔다리 혈관형성, 허혈/재관류 손상, 소화궤양 헬리코박터 관련 질환, 바이러스-유도된 혈관형성 장애, 자간전증, 불규칙과다월경, 고양이할큄열, 피부홍조, 신생혈관 녹내장 및 망막병증, 예를 들면, 당뇨병 망막병증에 관련된 것들, 조숙 망막병증, 또는 노화-관련 황반변성을 포함하는 복수, 유출물, 및 삼출물과 같은 장애의 치료에 유용할 수 있다. 추가로, 이들 화합물은 과증식성 장애, 예를 들면, 갑상샘 과다형성(특히 그레이브 질환), 및 낭종(예를 들면, 다낭성 난소 증후군(스테인-레벤탈 증후군)의 난소 간질 특성의 혈관과다 및 다낭성 신장 질환에 대항하는 활성제로서 사용할 수 있는데, 이는 이러한 질환이 성장 및/또는 전이에 대한 혈관 세포의 증식을 요구하기 때문이다.
또한 다른 양태에서, 본원에 기재된 화합물은 암, 예를 들면, B-세포 증식성 장애를 치료하는데 사용될 수 있고, 여기에는, 이에 제한되는 것은 아니지만 확산 거대 B 세포 림프종, 소포 림프종, 만성 림프성 림프종, 만성 림프성백혈병, B-세포 전림프성백혈병, 림프형질세포성 림프종/발덴스트롬 마크로글로불린혈증, 비장 변연부 림프종, 혈장 세포 골수종, 형질세포종, 림프절외 변연부 B 세포 림프종, 결절 변연부 B 세포 림프종, 외투 세포 림프종, 종격(흉선) 거대 B 세포 림프종, 혈관내 거대 B 세포 림프종, 원발성 삼출 림프종, 버킷 림프종/백혈병, 림프종양 육아종증, 췌장 암, 고형 또는 혈액학적 종양, 양성 또는 악성 종양, 뇌, 신장의 암종(예를 들면, 신장 세포 암종(RCC)), 편평 세포 암종, 침샘 암종, 간, 부신, 방광, 유방, 위(stomach), 위(gastric) 종양, 난소, 결장, 직장, 전립샘, 췌장, 폐, 질, 자궁내막, 자궁경부, 고환, 비뇨생식관, 식도, 후두, 피부, 뼈 또는 갑상샘, 육종, 교모세포종, 신경모세포종, 다발골수종 또는 위장 암, 특히 결장 암종 또는 직장결장 선종 또는 두경부 종양, 표피 과다증식, 건선, 전립선 비대, 신생물, 상피 특성(character)의 신생물, 선종, 샘암종, 각질가시세포종, 표피모양 암종, 거대 세포 암종, 비-소-세포 폐 암종, 림프종, (예를 들면, 비-호지킨 림프종(NHL) 및 호지킨 림프종(또한 호지킨 또는 호지킨 질환으로 언급됨)을 포함함), 유방 암종, 소포 암종, 미분화 암종, 유두상 암종, 고환종, 흑색종, 또는 백혈병이 포함된다.
또한 다른 양태에서, 본원에 기재된 화합물은 베체트 질환, 골다공증, 뼈 암, 및 뼈 전이, 전신 경화증, 접촉성 피부염 및 다른 습진성 피부염, 지루 피부염, 편평태선, 물집표피박리증, 혈관피부염, 혈관염(vasculitides), 피부 호산구증가증, 또는 봄철 결막염을 치료하는데 사용될 수 있다.
또한 다른 양태에서, 본원에 기재된 화합물은, 급성 비염, 알레르기, 위축성 비염, 및 건락성 비염, 비후 비염, 화농성 비염, 건성 비염 및 약물성 비염을 포함하는 만성 비염; 크루프, 섬유소 및 거짓막 비염 및 샘병(scrofoulous) 비염을 포함하는 막 비염, 신경성 비염(건초열) 및 혈관운동성 비염을 포함하는 계절성 비염, 사르코이드증, 농부 폐 및 관련 질환, 섬유화 폐, 및 특발성 간질성 폐렴을 포함하는 코점막의 염증을 특징으로 하는 상태를 치료하는데 사용될 수 있다.
본 발명의 화학식 I의 화합물은 단독으로 추가의 제제, 예를 들면, 치료학적 제제와 병용하여 사용할 수 있고, 상기 추가의 제제는 이의 의도된 목적을 위해 당해 기술 분야의 숙련가에 의해 선택된다. 예를 들면, 추가의 제제는 본 발명의 화합물에 의해 치료될 질환 또는 상태를 치료하는데 유용한 것으로 당해 기술 분야에 인지된 치료학적 제제일 수 있다. 추가의 제제는 또한 치료학적 조성물에 유리한 특성을 부여하는 제제, 예를 들면, 조성물의 점도에 영향을 미치는 제제일 수 있다.
본 발명 내에 포함된 병용물은 이의 의도된 목적을 위해 유용한 병용물인 것으로 추가로 이해되어야 한다. 하기에 기재된 제제는 목적을 위해 예시되고 제한되는 것을 의도하지 않는다. 본 발명의 일부인 병용물은 본 발명의 화합물 및 하기 열거된 것으로부터 선택되는 적어도 하나의 추가의 제제일 수 있다. 병용물은 또한, 병용물이 존재하여 형성된 조성물이 이의 의도된 기능을 수행할 수 있도록, 하나 초과의 추가의 제제, 예를 들면, 2 또는 3개의 추가의 제제를 포함할 수 있다.
바람직한 병용물은 이부프로펜과 같은 약물을 포함하는 NSAIDS로서 또한 언급되는 비-스테로이드성 소염 약물(들)이다. 다른 바람직한 병용물은 프레드니솔론을 포함하는 코르티코스테로이드이고; 스테로이드 사용의 널리 공지된 부작용은 본 발명의 화합물과 병용하여 환자를 치료하는 경우 요구되는 스테로이드 용량을 점점 적게하여 감소시키거나 심지어 없앨 수 도 있다. 본 발명의 화학식 I의 화합물과 병용될 수 있는 류머티스 관절염을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 사이토킨 억제 소염 약물(들)(CSAIDs); 다른 사람 사이토킨 또는 성장 인자에 대한 항체 또는 이의 길항제, 예를 들면, TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-21, IL-23, 인터페론, EMAP-II, GM-CSF, FGF, MMP-13 및 PDGF. 본 발명의 화합물은 세포 표면 분자에 대한 항체, 예를 들면, CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80(B7.1), CD86(B7.2), CD90, CTLA 또는 CD154(gp39 또는 CD40L)를 포함하는 이들의 리간드와 병용할 수 있다.
치료학적 제제의 바람직한 병용물은 자가면역 및 후속적인 염증 캐스케이드에서 상이한 포인트에서 간섭할 수 있다; 바람직한 예는 키메라, 사람화 또는 사람 TNF 항체와 같은 TNF 길항제, D2E7(미국 특허 6,090,382, HUMIRA™), CA2(REMICADE™), SIMPONI™(골리무맙), CIMZIA™, ACTEMRA™, CDP 571, 및 용해성 p55 또는 p75 TNF 수용체, 이의 유도체,(p75TNFR1gG(ENBREL™) 또는 p55TNFR1gG(Lenercept), 및 또한 TNFα 전환 효소(TACE) 억제제를 포함하고; 유사하게는 IL-1 억제제(인터류킨-1-전환 효소 억제제, IL-1RA 등)는 동일한 이유로 효과적일 수 있다. 다른 바람직한 병용물은 인터류킨 11을 포함한다. 또한 다른 바람직한 병용물은, IL-18 기능과 평행하게, 이에 의존적으로 또는 이와 협력하여 작용할 수 있는 자가면역 반응의 다른 주요 플레이어(key players)이고; IL-12 항체 또는 용해성 IL-12 수용체, 또는 IL-12 결합 단백질을 포함하는 IL-12 길항제가 특히 바람직하다. IL-12 및 IL-18이 중복되지만 분명한 기능을 갖고, 둘다에 대한 길항제의 병용물이 가장 효과적일 수 있다는 것이 나타났다. 또한 또다른 바람직한 병용물은 비-고갈 항-CD4 억제제이다. 또한 다른 바람직한 병용물은 항체, 용해성 수용체 또는 길항성 리간드를 포함하는 공-자극 경로 CD80(B7.1) 또는 CD86(B7.2)의 길항제를 포함한다.
본 발명의 화학식 I의 화합물은 또한 제제, 예를 들면, 메토트렉세이트, 6-머캅토푸린, 아자티오프린 설파살라진, 메살라진, 올살라진 클로로퀴닌/하이드록시클로로퀸, 펜실라민, 아우로티오말레이트(근육내 및 경구), 아자티오프린, 코키신, 코르티코스테로이드(경구, 흡입 및 국소 주사), 베타-2 아드레날린수용체 작용제(살부타몰, 터부탈린, 살메테랄), 크산틴(테오필린, 아미노필린), 크로모글리케이트, 네도크로밀, 케토티펜, 이프라트로퓸 및 옥시트로퓸, 사이클로스포린, FK506, 라파마이신, 미코페놀레이트 모페틸, 레플루노마이드, NSAIDs, 예를 들면, 이부프로펜, 코르티코스테로이드, 예를 들면, 프레드니솔론, 포스포디에스테라제 억제제, 아데노신 작용제, 항혈전제, 보체 억제제, 아드레날린성 제제, 염증촉진성 사이토킨에 의해 시그널링을 간섭하는 제제, 예를 들면, TNFα 또는 IL-1(예를 들면, NIK, IKK, JAK1, JAK2, JAK3, p38 또는 MAP 키나제 억제제), IL-1β 전환 효소 억제제, T-세포 시그널링 억제제, 예를 들면, 키나제 억제제, 메탈로프로테이나제 억제제, 설파살라진, 6-머캅토푸린, 안지오텐신 전환 효소 억제제, 용해성 사이토킨 수용체 및 이의 유도체(예를 들면, 용해성 p55 또는 p75 TNF 수용체 및 유도체 p75TNFRIgG(Enbrel™) 및 p55TNFRIgG(Lenercept), sIL-1RI, sIL-1RII, sIL-6R), 소염성 사이토킨(예를 들면, IL-4, IL-10, IL-11, IL-13 및 TGFβ), 셀레콕시브, 엽산, 하이드록시클로로퀸 설페이트, 로페콕시브, 에타네르셉트, 인플릭시맙, 나프록센, 발레콕시브, 설파살라진, 메틸프레드니솔론, 멜록시캄, 메틸프레드니솔론 아세테이트, 금 나트륨 티오말레이트, 아스피린, 트리암시놀론 아세토나이드, 프로폭시펜 나프실레이트/apap, 폴레이트, 나부메톤, 디클로페낙, 피록시캄, 에토돌락, 디클로페낙 나트륨, 옥사프로진, 옥시코돈 HCl, 하이드로코돈 비타르트레이트/apap, 디클로페낙 나트륨/미소프로스톨, 펜타닐, 아나킨라, 트라마돌 HCl, 살살레이트, 술린닥, 시아노코발라민/fa/피리독신, 아세트아미노펜, 알렌드로네이트 나트륨, 프레드니솔론, 모르핀 설페이트, 리도카인 하이드로클로라이드, 인도메타신, 글루코사민 sulf/콘드로이틴, 아미트리프틸린 HCl, 설파디아진, 옥시코돈 HCl/아세트아미노펜, 올로파타딘 HCl 미소프로스톨, 나프록센 나트륨, 오메프라졸, 사이클로포스파미드, 리툭시맙, IL-1 TRAP, MRA, CTLA4-IG, IL-18 BP, 항-IL-12, 항-IL15, BIRB-796, SCIO-469, VX-702, AMG-548, VX-740, 로플루밀라스트, IC-485, CDC-801, S1P1 작용제(예를 들면, FTY720), PKC 부류 억제제(예를 들면, 루복시스타우린 또는 AEB-071) 및 메소프람과 병용될 수 있다. 바람직한 병용물은 메토트렉세이트 또는 레플루노마이드 및 중간정도 또는 중증 류머티스 관절염 케이스에서, 사이클로스포린 및 상기 언급된 항-TNF 항체를 포함한다.
본 발명의 화학식 I의 화합물과 병용될 수 있는 염증성 장 질환을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 부데노사이드; 표피 성장 인자; 코르티코스테로이드; 사이클로스포린, 설파살라진; 아미노살리실레이트; 6-머캅토푸린; 아자티오프린; 메트로니다졸; 리폭시게나제 억제제; 메살라민; 올살라진; 바살아지드; 항산화제; 트롬복산 억제제; IL-1 수용체 길항제; 항-IL-1β 모노클로날 항체; 항-IL-6 모노클로날 항체; 성장 인자; 엘라스타제 억제제; 피리디닐-이미다졸 화합물; 다른 사람 사이토킨 또는 성장 인자에 대한 항체 또는 이의 길항제, 예를 들면, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-15, IL-16, IL-23, EMAP-II, GM-CSF, FGF, 및 PDGF; 세포 표면 분자, 예를 들면, CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 또는 이들의 리간드; 메토트렉세이트; 사이클로스포린; FK506; 라파마이신; 미코페놀레이트 모페틸; 레플루노마이드; NSAIDs, 예를 들면, 이부프로펜; 코르티코스테로이드, 예를 들면, 프레드니솔론; 포스포디에스테라제 억제제; 아데노신 작용제; 항혈전제; 보체 억제제; 아드레날린성 제제; 염증촉진성 사이토킨에 의한 신호를 간섭하는 제제, 예를 들면, TNFα 또는 IL-1(예를 들면, NIK, IKK, p38 또는 MAP 키나제 억제제); IL-1β 전환 효소 억제제; TNFα 전환 효소 억제제; T-세포 시그널링 억제제, 예를 들면, 키나제 억제제; 메탈로프로테이나제 억제제; 설파살라진; 아자티오프린; 6-머캅토푸린; 안지오텐신 전환 효소 억제제; 용해성 사이토킨 수용체 및 이의 유도체(예를 들면, 용해성 p55 또는 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R) 및 소염성 사이토킨(예를 들면, IL-4, IL-10, IL-11, IL-13 및 TGFβ). 화학식 I의 화합물과 병용될 수 있는 크론병을 위한 치료학적 제제의 바람직한 예는 다음을 포함한다: TNF 길항제, 예를 들면, 항-TNF 항체, D2E7(미국 특허 6,090,382, HUMIRA™), CA2(REMICADE™), CDP 571, TNFR-Ig 구조물(constructs),(p75TNFRIgG(ENBREL™) 및 p55TNFRIgG(LENERCEPT™) 억제제 및 PDE4 억제제. 화학식 I의 화합물은 코르티코스테로이드, 예를 들면, 부데노사이드 및 덱사메타손; 설파살라진, 5-아미노살리실산; 올살라진; 및 염증촉진성 사이토킨의 합성 또는 작용을 간섭하는 제제, 예를 들면, IL-1, 예를 들면, IL-1β 전환 효소 억제제 및 IL-1ra; T 세포 신호 억제제, 예를 들면, 티로신 키나제 억제제; 6-머캅토푸린; IL-11; 메살라민; 프레드니손; 아자티오프린; 머캅토푸린; 인플릭시맙; 메틸프레드니솔론 나트륨 석시네이트; 디페녹실레이트/atrop 설페이트; 로페라미드 하이드로클로라이드; 메토트렉세이트; 오메프라졸; 폴레이트; 시프로플록사신/덱스트로스-물; 하이드로코돈 비타르트레이트/apap; 테트라사이클린 하이드로클로라이드; 플루오시노나이드; 메트로니다졸; 티메로살/붕산; 콜레스티라민/수크로스; 시프로플록사신 하이드로클로라이드; 효스키아민 설페이트; 메페리딘 하이드로클로라이드; 미다졸람 하이드로클로라이드; 옥시코돈 HCl/아세트아미노펜; 프로메타진 하이드로클로라이드; 나트륨 포스페이트; 설파메톡사졸/트리메토프림; 셀레콕시브; 폴리카보필; 프로폭시펜 나프실레이트; 하이드로코르티손; 멀티비타민; 바살아지드 디나트륨; 코데인 포스페이트/apap; 콜레세벨람 HCl; 시아노코발라민; 엽산; 레보플록사신; 메틸프레드니솔론; 나탈리주맙 및 인터페론-감마와 병용될 수 있다.
화학식 I의 화합물과 병용될 수 있는 다발성 경화증을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 코르티코스테로이드; 프레드니솔론; 메틸프레드니솔론; 아자티오프린; 사이클로포스파미드; 사이클로스포린; 메토트렉세이트; 4-아미노피리딘; 티자니딘; 인터페론-β1a(AVONEX®; Biogen); 인터페론-β1b(베타SERON®; Chiron/Berlex); 인터페론 α-n3)(Interferon Sciences/Fujimoto), 인터페론-β(Alfa Wassermann/J&J), 인터페론 β1A-IF(Serono/Inhale Therapeutics), 페그인터페론 α 2b(Enzon/Schering-Plough), 고폴리머 1(Cop-1; COPAXONE®; Teva Pharmaceutical Industries, Inc.); 고압성 산소; 정맥내 면역글로불린; 클라드리빈; 다른 사람 사이토킨 또는 성장 인자 및 이들의 수용체에 대한 항체 또는 이의 길항제, 예를 들면, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, IL-23, IL-15, IL-16, EMAP-II, GM-CSF, FGF, 및 PDGF. 화학식 I의 화합물은 세포 표면 분자에 대한 항체, 예를 들면, CD2, CD3, CD4, CD8, CD19, CD20, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90 또는 이들의 리간드와 병용될 수 있다. 화학식 I의 화합물은 또한 제제, 예를 들면, 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 미코페놀레이트 모페틸, 레플루노마이드, S1P1 작용제, NSAIDs, 예를 들면, 이부프로펜, 코르티코스테로이드, 예를 들면, 프레드니솔론, 포스포디에스테라제 억제제, 아데노신 작용제, 항혈전제, 보체 억제제, 아드레날린성 제제, 염증촉진성 사이토킨에 의한 신호를 간섭하는 제제, 예를 들면, TNFα□ 또는 IL-1(예를 들면, NIK, IKK, p38 또는 MAP 키나제 억제제), IL-1β 전환 효소 억제제, TACE 억제제, T-세포 신호 억제제, 예를 들면, 키나제 억제제, 메탈로프로테이나제 억제제, 설파살라진, 아자티오프린, 6-머캅토푸린, 안지오텐신 전환 효소 억제제, 용해성 사이토킨 수용체 및 이의 유도체(예를 들면, 용해성 p55 또는 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R) 및 소염성 사이토킨(예를 들면, IL-4, IL-10, IL-13 및 TGFβ)과 병용될 수 있다.
화학식 I의 화합물과 병용될 수 있는 다발성 경화증을 위한 치료학적 제제의 바람직한 예는 인터페론-β, 예를 들면, IFNβ1a 및 IFNβ1b; 코팍손, 코르티코스테로이드, 카스파제 억제제, 예를 들면, 카스파제-1의 억제제, IL-1 억제제, TNF 억제제, 및 항체 내지 CD40 리간드 및 CD80을 포함한다.
화학식 I의 화합물은 또한 제제, 예를 들면, 알렘투주맙, 드로나비놀, 다클리주맙, 미토크산트론, 크살리프로덴 하이드로클로라이드, 팜프리딘, 글라티라머 아세테이트, 나탈리주맙, 신나비돌, α-이뮤노킨 NNSO3, ABR-215062, AnergiX.MS, 케모킨 수용체 길항제, BBR-2778, 칼라구알린, CPI-1189, LEM(리포솜 캡슐화 미토크산트론), THC.CBD(칸나비노이드 작용제), MBP-8298, 메소프람(PDE4 억제제), MNA-715, 항-IL-6 수용체 항체, 뉴로박스, 피르페니돈 알로트라프 1258(RDP-1258), sTNF-R1, 탈람파넬, 테리플루노마이드, TGF-베타2, 티플리모타이드, VLA-4 길항제(예를 들면, TR-14035, VLA4 Ultrahaler, Antegran-ELAN/Biogen), 인터페론 감마 길항제 및 IL-4 작용제와 병용될 수 있다.
화학식 I의 화합물과 병용될 수 있는 강직척추염을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 이부프로펜, 디클로페낙, 미소프로스톨, 나프록센, 멜록시캄, 인도메타신, 디클로페낙, 셀레콕시브, 로페콕시브, 설파살라진, 메토트렉세이트, 아자티오프린, 미노사이클린, 프레드니손, 및 항-TNF 항체, D2E7(미국 특허 6,090,382; HUMIRA™), CA2(REMICADE™), CDP 571, TNFR-Ig 구조물,(p75TNFRIgG(ENBREL™) 및 p55TNFRIgG(LENERCEPT™).
화학식 I의 화합물과 병용될 수 있는 천식을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 알부테롤, 살메테롤/플루티카손, 몬테루카스트 나트륨, 플루티카손 프로피오네이트, 부데소나이드, 프레드니손, 살메테롤 시나포에이트, 레발부테롤 HCl, 알부테롤 설페이트/이프라트로퓸, 프레드니솔론 나트륨 포스페이트, 트리암시놀론 아세토나이드, 베클로메타손 디프로피오네이트, 이프라트로퓸 브로마이드, 아지트로마이신, 피르부테롤 아세테이트, 프레드니솔론, 테오필린 무수, 메틸프레드니솔론 나트륨 석시네이트, 클라리트로마이신, 자피르루카스트, 포르모테롤 푸마레이트, 인플루엔자 바이러스 백신, 아목시실린 트리하이드레이트, 플루니솔라이드, 알레르기 주사, 클로몰린 나트륨, 펙소페나딘 하이드로클로라이드, 플루니솔라이드/멘톨, 아목시실린/클라불라네이트, 레보플록사신, 흡입기 보조 장치, 구아이페네신, 덱사메타손 나트륨 포스페이트, 목시플록사신 HCl, 독시사이클린 하이클레이트, 구아이페네신/d-메토르판, p-에페드린/cod/클로르페니르, 가티플록사신, 세티리진 하이드로클로라이드, 모메타손 푸로에이트, 살메테롤 시나포에이트, 벤조나테이트, 세팔렉신, pe/하이드로코돈/클로르페니르, 세티리진 HCl/슈도에페드, 페닐에프린/cod/프로메타진, 코데인/프로메타진, 세프프로질, 덱사메타손, 구아이페네신/슈도에페드린, 클로르페니르아민/하이드로코돈, 네도크로밀 나트륨, 터부탈린 설페이트, 에피네프린, 메틸프레드니솔론, 항-IL-13 항체, 및 메타프로테레놀 설페이트.
화학식 I의 화합물과 병용될 수 있는 COPD를 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 알부테롤 설페이트/이프라트로퓸, 이프라트로퓸 브로마이드, 살메테롤/플루티카손, 알부테롤, 살메테롤 시나포에이트, 플루티카손 프로피오네이트, 프레드니손, 테오필린 무수, 메틸프레드니솔론 나트륨 석시네이트, 몬테루카스트 나트륨, 부데소나이드, 포르모테롤 푸마레이트, 트리암시놀론 아세토나이드, 레보플록사신, 구아이페네신, 아지트로마이신, 베클로메타손 디프로피오네이트, 레발부테롤 HCl, 플루니솔라이드, 세프트리악손 나트륨, 아목시실린 트리하이드레이트, 가티플록사신, 자피르루카스트, 아목시실린/클라불라네이트, 플루니솔라이드/멘톨, 클로르페니르아민/하이드로코돈, 메타프로테레놀 설페이트, 메틸프레드니솔론, 모메타손 푸로에이트, p-에페드린/cod/클로르페니르, 피르부테롤 아세테이트, p-에페드린/로라타딘, 터부탈린 설페이트, 티오트로퓸 브로마이드, (R,R)-포르모테롤, TgAAT, 실로밀라스트 및 로플루밀라스트.
화학식 I의 화합물과 병용될 수 있는 HCV를 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 인터페론-알파-2α, 인터페론-알파-2β, 인터페론-알파 con1, 인터페론-알파-n1, 페길화 인터페론-알파-2α, 페길화 인터페론-알파-2β, 리바비린, peg인터페론 알파-2b + 리바비린, 우르소데옥시콜산, 글리시리즈산, 티말파신, 막사민, VX-497 및 다음 표적을 사용한 개입을 통해 HCV를 치료하는데 사용되는 임의의 화합물: HCV 폴리머라제, HCV 프로테아제, HCV 헬리카제, 및 HCV IRES(내부 리보솜 진입 위치).
화학식 I의 화합물과 병용될 수 있는 특발성 폐섬유증을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 프레드니손, 아자티오프린, 알부테롤, 콜키신, 알부테롤 설페이트, 디곡신, 감마 인터페론, 메틸프레드니솔론 나트륨 석시네이트, 로라제팜, 푸로세마이드, 리시노프릴, 니트로글리세린, 스피로노락톤, 사이클로포스파미드, 이프라트로퓸 브로마이드, 악티노마이신 d, 알테플레이스, 플루티카손 프로피오네이트, 레보플록사신, 메타프로테레놀 설페이트, 모르핀 설페이트, 옥시코돈 HCl, 칼륨 클로라이드, 트리암시놀론 아세토나이드, 탁롤리무스 무수, 칼슘, 인터페론-알파, 메토트렉세이트, 미코페놀레이트 모페틸 및 인터페론-감마-1β.
화학식 I의 화합물과 병용될 수 있는 심근경색을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 아스피린, 니트로글리세린, 메토프롤롤 타르트레이트, 에톡사파린 나트륨, 헤파린 나트륨, 클로피도그렐 비설페이트, 카베딜롤, 아테놀롤, 모르핀 설페이트, 메토프롤롤 석시네이트, 와파린 나트륨, 리시노프릴, 이소소르바이드 모노니트레이트, 디곡신, 푸로세마이드, 심바스타틴, 라미프릴, 테넥테플레이스, 에날라프릴 말레에이트, 토르세마이드, 레타베이스, 로사르탄 칼륨, 퀴나프릴 하이드로클로라이드/마그네슘 카보네이트, 부메타나이드, 알테플레이스, 에날라프릴라트, 아미오다론 하이드로클로라이드, 티로피반 HCl m-하이드레이트, 딜티아젬 하이드로클로라이드, 카프토프릴, 이르베사르탄, 발사르탄, 프로프라놀롤 하이드로클로라이드, 포시노프릴 나트륨, 리도카인 하이드로클로라이드, 에프티피바타이드, 세파졸린 나트륨, 아트로핀 설페이트, 아미노카프로산, 스피로노락톤, 인터페론, 소탈롤 하이드로클로라이드, 칼륨 클로라이드, 도쿠세이트 나트륨, 도부타민 HCl, 알프라졸람, 프라바스타틴 나트륨, 아토르바스타틴 칼슘, 미다졸람 하이드로클로라이드, 메페리딘 하이드로클로라이드, 이소소르바이드 디니트레이트, 에피네프린, 도파민 하이드로클로라이드, 비발리루빈, 로수바스타틴, 에제티미브/심바스타틴, 아바시미브, 및 카리포리드.
화학식 I의 화합물과 병용될 수 있는 건선을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 칼시포트리엔, 클로베타솔 프로피오네이트, 트리암시놀론 아세토나이드, 할로베타솔 프로피오네이트, 타자로텐, 메토트렉세이트, 플루오시노나이드, 베타메타손 디프로프 증강, 플루오시놀론 아세토나이드, 아시트레틴, 타르 샴푸, 베타메타손 발레레이트, 모메타손 푸로에이트, 케토코나졸, 프라목신/플루오시놀론, 하이드로코르티손 발레레이트, 플루란드레놀라이드, 우레아, 베타메타손, 클로베타솔 프로피오네이트/emoll, 플루티카손 프로피오네이트, 아지트로마이신, 하이드로코르티손, 습윤 포뮬라(moisturizing formula), 엽산, 데소나이드, 피멕롤리무스, 콜타르, 디플로라손 디아세테이트, 에타네르셉트 폴레이트, 락트산, 메톡살렌, hc/비스무트 subgal/znox/resor, 메틸프레드니솔론 아세테이트, 프레드니손, 선스크린, 할시노나이드, 살리실산, 안트랄린, 클로코르톨론 피발레이트, 석탄 추출물, 콜타르/살리실산, 콜타르/살리실산/황, 데속시메타손, 디아제팜, 에몰리언트, 플루오시노나이드/에몰리언트, 광유/피마자유/na lact, 광유/땅콩유, 페트롤리움/이소프로필 미리스테이트, 프소랄렌, 살리실산, soap/트리브롬살란, 티메로살/붕산, 셀레콕시브, 인플릭시맙, 사이클로스포린, 알레파셉트, 에팔리주맙, 탁롤리무스, 피멕롤리무스, PUVA, UVB, 설파살라진, ABT-874 및 우스테키나맙.
화학식 I의 화합물과 병용될 수 있는 건선관절염을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 메토트렉세이트, 에타네르셉트, 로페콕시브, 셀레콕시브, 엽산, 설파살라진, 나프록센, 레플루노마이드, 메틸프레드니솔론 아세테이트, 인도메타신, 하이드록시클로로퀸 설페이트, 프레드니손, 술린닥, 베타메타손 디프로프 증강, 인플릭시맙, 메토트렉세이트, 폴레이트, 트리암시놀론 아세토나이드, 디클로페낙, 디메틸설폭사이드, 피록시캄, 디클로페낙 나트륨, 케토프로펜, 멜록시캄, 메틸프레드니솔론, 나부메톤, 톨메틴 나트륨, 칼시포트리엔, 사이클로스포린, 디클로페낙 나트륨/미소프로스톨, 플루오시노나이드, 글루코사민 설페이트, 금 나트륨 티오말레이트, 하이드로코돈 비타르트레이트/apap, 이부프로펜, 리세드로네이트 나트륨, 설파디아진, 티오구아닌, 발레콕시브, 알레파셉트, D2E7(미국 특허 6,090,382, HUMIRA™), 및 에팔리주맙.
화학식 I의 화합물과 병용될 수 있는 재협착을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 시롤리무스, 파클리탁셀, 에베롤리무스, 탁롤리무스, ABT-578, 및 아세트아미노펜.
화학식 I의 화합물과 병용될 수 있는 좌골신경통을 위한 치료학적 제제의 비제한적인 예는 다음을 포함한다: 하이드로코돈 비타르트레이트/apap, 로페콕시브, 사이클로벤즈아프린 HCl, 메틸프레드니솔론, 나프록센, 이부프로펜, 옥시코돈 HCl/아세트아미노펜, 셀레콕시브, 발레콕시브, 메틸프레드니솔론 아세테이트, 프레드니손, 코데인 포스페이트/apap, 트라마돌 HCl/아세트아미노펜, 메탁살론, 멜록시캄, 메토카르바몰, 리도카인 하이드로클로라이드, 디클로페낙 나트륨, 가바펜틴, 덱사메타손, 카리소프로돌, 케토롤락 트로메타민, 인도메타신, 아세트아미노펜, 디아제팜, 나부메톤, 옥시코돈 HCl, 티자니딘 HCl, 디클로페낙 나트륨/미소프로스톨, 프로폭시펜 n-pap, asa/옥시코드/옥시코돈 ter, 이부프로펜/하이드로코돈 비트, 트라마돌 HCl, 에토돌락, 프로폭시펜 HCl, 아미트리프틸린 HCl, 카리소프로돌/코데인 phos/asa, 모르핀 설페이트, 멀티비타민, 나프록센 나트륨, 오르페나드린 시트레이트, 및 테마제팜.
화학식 I의 화합물과 병용될 수 있는 SLE(루푸스)를 위한 치료학적 제제의 바람직한 예는 다음을 포함한다: NSAIDS, 예를 들면, 디클로페낙, 나프록센, 이부프로펜, 피록시캄, 인도메타신; COX2 억제제, 예를 들면, 셀레콕시브, 로페콕시브, 발레콕시브; 말라리아 예방약, 예를 들면, 하이드록시클로로퀸; 스테로이드, 예를 들면, 프레드니손, 프레드니솔론, 부데노사이드, 덱사메타손; 세포독성, 예를 들면, 아자티오프린, 사이클로포스파미드, 미코페놀레이트 모페틸, 메토트렉세이트; PDE4의 억제제 또는 푸린 합성 억제제, 예를 들면, Cellcept®. 화학식 I의 화합물은 또한 제제, 예를 들면, 설파살라진, 5-아미노살리실산, 올살라진, Imuran® 및, 염증촉진성 사이토킨, 예를 들면, IL-1, 예를 들면, IL-1β 전환 효소 억제제와 같은 카스파제 억제제 및 IL-1ra의 합성, 생성 또는 작용을 간섭하는 제제와 병용될 수 있다. 화학식 I의 화합물은 또한 T 세포 시그널링 억제제, 예를 들면, 티로신 키나제 억제제; 또는 T 세포 활성화 분자를 표적으로 하는 분자, 예를 들면, CTLA-4-IgG 또는 항-B7 부류 항체, 항-PD-1 부류 항체와 함께 사용될 수 있다. 화학식 I의 화합물은 IL-11 또는 항-사이토킨 항체, 예를 들면, 포노톨리주맙(항-IFNg 항체), 또는 항-수용체 수용체 항체, 예를 들면, 항-IL-6 수용체 항체 및 B-세포 표면 분자에 대한 항체와 함께 병용될 수 있다. 화학식 I의 화합물은 또한 LJP 394(아베티무스), B-세포를 고갈 또는 불활성화시키는 제제, 예를 들면, 리툭시맙(항-CD20 항체), 림포스태트-B(항-BlyS 항체), TNF 길항제, 예를 들면, 항-TNF 항체, D2E7(미국 특허 6,090,382; HUMIRA™), CA2(REMICADE™), CDP 571, TNFR-Ig 구조물, (p75TNFRIgG(ENBREL™) 및 p55TNFRIgG(LENERCEPT™)과 함께 사용될 수 있다.
본 발명에서, 다음 정의가 적용가능하다:
"치료학적 유효량"은 상태의 진행을 완전히 또는 부분적으로 억제하거나,`적어도 부분적으로 하나 이상의 상태의 증상을 완화시키는 화학식 I의 화합물 또는 2개 초과의 이러한 화합물의 배합물의 양이다. 치료학적 유효량은 또한 예방적으로 효과적인 양일 수 있다. 치료학적으로 효과적인 양은 환자의 사이즈 및 성별, 치료될 상태, 상태의 중증도 및 추구하는 결과에 좌우될 수 있다. 주어진 환자에 대해, 치료학적 유효량은 당해 기술 분야의 숙련가들에게 공지된 방법에 의해 결정될 수 있다.
"약제학적으로 허용되는 염"은 유리 염기의 생물학적 효과 및 특성을 유지하고, 무기 산, 예를 들면, 염산, 수소화브롬산, 황산, 질산, 및 인산 또는 유기 산, 예를 들면, 설폰산, 카복실산, 유기 인산, 메탄설폰산, 에탄설폰산, p-톨루엔설폰산, 시트르산, 푸마르산, 말레산, 석신산, 벤조산, 살리실산, 락트산, 타르타르산(예를 들면, (+) 또는 (-)-타르타르산 또는 이의 혼합물), 아미노 산(예를 들면, (+) 또는 (-)-아미노 산 또는 이의 혼합물) 등과의 반응으로 수득된 염을 언급한다. 이들 염은 당해 기술분야의 숙련가들에게 공지된 방법으로 제조될 수 있다.
산성 치환체를 갖는 특정한 화학식 I의 화합물은 약제학적으로 허용되는 염기를 갖는 염으로서 존재할 수 있다. 본 발명은 이러한 염을 포함한다. 이러한 염의 예는 나트륨 염, 칼륨 염, 리신 염 및 아르기닌 염을 포함한다. 이들 염은 당해 기술분야의 숙련가들에게 공지된 방법에 의해 제조될 수 있다.
특정한 화학식 I의 화합물 및 이들의 염은 하나 초과의 결정형으로 존재할 수 있고, 본 발명은 각각의 결정형 및 이의 혼합물을 포함한다.
특정한 화학식 I의 화합물 및 이들의 염은 또한 용해화물, 예를 들면, 수화물의 형태로 존재할 수 있고, 본 발명 각각이 용해화물 및 이의 혼합물을 포함할 수 있다.
특정한 화학식 I의 화합물은 하나 이상의 키랄 중심을 포함할 수 있고, 상이한 임의의 활성 형태로 존재한다. 화학식 I의 화합물이 하나의 키랄 중심을 포함하는 경우, 화합물은 2개의 에난티오머성 형태로 존재하고, 본 발명은 둘다의 에난티오머 및 에난티오머의 혼합물, 예를 들면, 라세미 혼합물을 포함한다. 에난티오머는, 당해 기술분야의 숙련가들에게 공지된 방법에 의해, 예를 들면, 결정화로 분리될 수 있는 부분입체이성체성 염의 형성; 예를 들면, 결정화, 기체-액체 또는 액체 크로마토그래피로 분리될 수 있는 부분입체이성체성 유도체 또는 복합물의 형성; 하나의 에난티오머의 에난티오머-특이적 시약과의 선택적 반응, 예를 들면, 효소적 에스테르화; 또는 키랄 환경에서, 예를 들면, 키랄 지지체, 예를 들면, 결합된 키랄 리간드를 갖는 실리카 상에서 또는 키랄 용매의 존재하에 기체-액체 또는 액체 크로마토그래피에 의해 분할될 수 있다. 목적하는 에난티오머를 상기한 분리 절차 중 하나를 사용하여 또다른 화학적 실체로 전화시키는 것이 적절할 수 있고, 추가의 단계가 목적하는 에난티오머성 형태를 유리시키는데 요구된다. 대안적으로, 특정 에난티오머는, 임의의 활성 시약, 기질, 촉매 또는 용매를 사용하여 비대칭 합성하여 또는 하나의 에난티오머를 비대칭 변형에 의해 다른 것으로 전환시켜 합성될 수 있다.
화학식 I의 화합물이 하나 초과의 키랄 중심을 포함하는 경우, 부분입체이성체성 형태로 존재할 수 있다. 부분입체이성체성 화합물은 당해 기술분야의 숙련가들에게 공지된 방법에 의해, 예를 들면, 크로마토그래피 또는 결정화에 의해 분리될 수 있고, 개별적인 에난티오머는 상기한 바와 같이 분리될 수 있다. 본 발명은 화학식 I의 화합물의 각각의 부분입체이성체(및 이의 혼합물)을 포함한다.
특정한 화학식 I의 화합물은 상이한 호변이성체성 형태로 또는 상이한 기하이성체로서 존재할 수 있고, 본 발명은 화학식 I의 화합물의 각각의 호변이성체 및/또는 기하이성체 및 이의 혼합물를 포함한다.
특정한 화학식 I의 화합물은 분리될 수 있는 다양한 안정한 입체형태(conformational forms)로 존재할 수 있다. 하나의 비대칭 단일 결합 둘레의 제한된 회전으로 인한, 예를 들면, 입체장애 또는 환 스트레인(ring strain) 때문에, 비틀린 비대칭은 상이한 형태이성질체의 분리를 허용할 수 있다. 본 발명은 화학식 I의 화합물 및 이의 혼합물의 입체형태 이성체 각각을 포함한다.
특정한 화학식 I의 화합물은 쯔비터이온성 형태로 존재할 수 있고, 본 발명은 각각의 쯔비터이온성 형태의 화학식 I의 화합물 및 이의 혼합물을 포함한다.
본원에 사용된 용어 "프로드럭"은 생체내에서 몇몇 생리학적 화학적 프로세스에 의해 모 약물로 전환되는 제제를 언급한다(예를 들면, 생리학적 pH가 목적하는 약물 형태로 전환시키도록 하는 프로드럭). 프로드럭은 종종 유용한데, 이는 몇몇 상황에서 프로드럭이 모 약물 보다 투여하기에 용이할 수 있기 때문이다. 이들은, 예를 들면, 경구 투여로 생체이용가능할 수 있지만, 모 약물은 그렇지 않다. 프로드럭은 또한 모 약물 보다 약리학적 조성물에서 개선된 용해성을 가질 수 있다. 제한 없이, 프로드럭의 예는 본 발명의 화합물이어야 하고, 여기서, 세포 막을 가로질러 전달을 수행하기 위해 에스테르("프로드럭")으로서 투여되고, 여기서는 수용성이 유리하지 않지만, 일단 세포 내에서 카복실산으로 대사적으로 가수분해되고, 여기서는 수용성이 유리하다.
프로드럭은 다수의 유용한 특성을 갖는다. 예를 들면, 프로드럭은 궁극적 약물 보다 더 양호한 수용성일 수 있고, 이에 의해 약물의 정맥내 투여를 수행할 수 있다. 프로드럭은 또한 궁극적 약물 보다 더 높은 수준의 경구 생체이용률을 가질 수 있다. 투여 후, 프로드럭은 효소적으로 또는 화학적으로 개열되어 궁극적 약물을 혈액 또는 조직에 전달한다.
개열시 예시적인 프로드럭은 상응하는 유리 산을 방출하고, 본 발명의 화합물의 이러한 가수분해가능한 에스테르-형성 잔기는, 이에 제한되는 것은 아나지만, 카복실산 치환체를 포함하고, 여기서, 상기 유리 수소는 (C1-C4)알킬, (C1-C12)알카노일옥시메틸, (C4-C9)1-(알카노일옥시)에틸, 5 내지 10개의 탄소 원자를 갖는 1-메틸-1-(알카노일옥시)-에틸, 3 내지 6개의 탄소 원자를 갖는 알콕시카보닐옥시메틸, 4 내지 7개의 탄소 원자를 갖는 1-(알콕시카보닐옥시)에틸, 5 내지 8개의 탄소 원자를 갖는 1-메틸-1-(알콕시카보닐옥시)에틸, 3 내지 9개의 탄소 원자를 갖는 N-(알콕시카보닐)아미노메틸, 4 내지 10개의 탄소 원자를 갖는 1-(N-(알콕시카보닐)아미노)에틸, 3-프탈리딜, 4-크로토노락토닐, 감마-부티로락톤-4-일, 디-N,N-(C1-C2)알킬아미노(C2-C3)알킬(예를 들면, β-디메틸아미노에틸), 카바모일-(C1-C2)알킬, N,N-디(C1-C2)-알킬카바모일-(C1-C2)알킬 및 피페리디노-, 피롤리디노- 또는 모르폴리노(C2-C3)알킬로 대체된다.
다른 예시적인 프로드럭은 화학식 I의 알콜을 방출하고, 여기서, 하이드록실 치환체(예를 들면, R1은 하이드록실을 포함함)의 상기 유리 수소는 (C1-C6)알카노일옥시메틸, 1-((C1-C6)알카노일옥시)에틸, 1-메틸-1-((C1-C6)알카노일옥시)에틸, (C1-C12)알콕시카보닐옥시메틸, N-(C1-C6)알콕시카보닐아미노-메틸, 석시노일, (C1-C6)알카노일, α-아미노(C1-C4)알카노일, 아릴아세틸(arylactyl) 및 α-아미노아실, 또는 α-아미노아실-α-아미노아실로 대체되고, 여기서, 상기 α-아미노아실 모이어티는 독립적으로 단백질에서 발견되는 자연 발생되는 L-아미노 산 중 어느 것, P(O)(OH)2, -P(O)(O(C1-C6)알킬)2 또는 글리코실(탄수화물의 헤미아세탈의 하이드록실의 탈착로부터 생성된 라디칼)이다.
본원에 사용된 용어 "브릿징된(bridged) (C5-C12) 사이클로알킬 그룹"은, 2 또는 3개의 C3-C10 사이클로알킬 환을 갖는 포화 또는 불포화, 바이사이클릭 또는 폴리사이클릭 브릿징된 탄화수소 그룹을 의미한다. 브릿징되지 않은 사이클로알킬은 배제된다. 브릿징된 사이클릭 탄화수소는, 예를 들면, 바이사이클로[2.1.1]헥실, 바이사이클로[2.2.1]헵틸, 바이사이클로[2.2.2]옥틸, 바이사이클로[3.2.1]옥틸, 바이사이클로[4.3.1]데실, 바이사이클로[3.3.1]노닐, 보르닐, 보르네닐, 노르보르닐, 노르보르네닐, 6,6-디메틸바이사이클로 [3.1.1]헵틸, 트리사이클로부틸, 및 아다만틸을 포함할 수 있다.
본원에 사용된 용어 "브릿징된 (C2-C10) 헤테로사이클릴"은 바이사이클릭 또는 폴리사이클릭 아자-브릿징된 탄화수소 그룹을 의미하고, 아자노르보르닐, 퀴누클리디닐, 이소퀴누클리디닐, 트로파닐, 아자바이사이클로[3.2.1]옥타닐, 아자바이사이클로[2.2.1]헵타닐, 2-아자바이사이클로[3.2.1]옥타닐, 아자바이사이클로[3.2.1]옥타닐, 아자바이사이클로[3.2.2]노나닐, 아자바이사이클로[3.3.0]노나닐, 및 아자바이사이클로 [3.3.1]노나닐을 포함할 수 있다.
본원에 사용된 용어 "헤테로사이클릭," "헤테로사이클릴" 또는 "헤테로사이클릴렌"은, 이에 제한되는 것은 아니지만, 모노사이클릭, 바이사이클릭, 트리사이클릭 및 스피로사이클릭 환을 포함하는 비-방향족, 환 시스템을 포함하고, 이는 완전히 포화되거나 하나 이상의 불포화 단위를 포함할 수 있고(명확하게 하기 위해, 불포화의 정도는 방향족 환 시스템을 생성하지 않는다), 적어도 하나의 헤테로원자, 예를 들면, 질소, 산소, 또는 황을 포함하는 5 내지 12개의 원자를 갖는다. 예시의 목적을 위해, 본 발명의 범위를 제한하는 것으로 해석해서는 안되고, 다음은 헤테로사이클릭 환의 예이다: 아제피닐, 아제티디닐, 인돌리닐, 이소인돌리닐, 모르폴리닐, 피페라지닐, 피페리디닐, 피롤리디닐, 퀴누클루디닐, 티오모르폴리닐, 테트라하이드로피라닐, 테트라하이드로푸라닐, 테트라하이드로인돌릴, 티오모르폴리닐 및 트로파닐.
본원에 사용된 용어 "헤테로아릴" 또는 "헤테로아릴렌"은, 이에 제한되는 것은 아니지만, 모노사이클릭, 바이사이클릭 및 트리사이클릭 환을 포함하는 방향족 환 시스템을 포함하고, 적어도 하나의 헤테로원자, 예를 들면, 질소, 산소, 또는 환을 포함하는 5 내지 12개의 원자를 갖는다. 예시의 목적을 위해, 본 발명의 범위를 제한하는 것으로 해석해서는 안된다: 아자인돌릴, 벤조(b)티에닐, 벤즈이미다졸릴, 벤조푸라닐, 벤족사졸릴, 벤조티아졸릴, 벤조티아디아졸릴, 벤족사디아졸릴, 푸라닐, 이미다졸릴, 이미다조피리디닐, 인돌릴, 인다졸릴, 이속사졸릴, 이소티아졸릴, 옥사디아졸릴, 옥사졸릴, 푸리닐, 피라닐, 피라지닐, 피라졸릴, 피리디닐, 피리미디닐, 피롤릴, 피롤로[2,3-d]피리미디닐, 피라졸로[3,4-d]피리미디닐, 퀴놀리닐, 퀴나졸리닐, 트리아졸릴, 티아졸릴, 티오페닐, 테트라졸릴, 티아디아졸릴, 티에닐, 6H-피롤로[2,3-e][1,2,4]트리아졸로[4,3-a]피라지닐, 6H-이미다조[1,5-a]피롤로[2,3-e]피라지닐, 1,6-디하이드로피라졸로[3,4-d]피롤로[2,3-b]피리딘, 3H-3,4,6,8a-테트라아자-as인다세닐, 3H-이미다조[1,2-a]피롤로[2,3-e]피라지닐, 피라졸로[3,4-d]피롤로[2,3-b]피리디닐, 1,6-디하이드로-1,2,5,6-테트라자-as-인다세닐, 3H-3,4,8a-트리아자-as-인다세닐, 6H-3-옥사-2,5,6-트리아자-as-인다세닐, 3,6-디하이드로-2,3,6-테트라아자-as-인다세닐, 1,6-디하이드로-디피롤로[2,3-b;2'3'-d]피리디닐, 6H-3-티아-2,5,6-트리아자-as-인다세닐 또는 1,6-디하이드로이미다조[4,5-d]피롤로[2,3-b]피리딘.
본원에 사용된 "알킬," "알킬렌" 또는 표기, 예를 들면, "(C1-C8)"은 완전히 포화된 직쇄형 또는 분지형 탄화수소를 포함한다. 알킬의 예는 메틸, 에틸, 프로필, 이소프로필, 부틸, 펜틸, 헥실 및 이의 이성체이다. 본원에 사용된 "알케닐," "알케닐렌," "알키닐렌" 및 "알키닐"은 C2-C8을 의미하고, 하나 이상의 불포화 단위를 포함하는 직쇄형 또는 분지형 탄화수소를 포함하는데, 알케닐의 경우 하나 이상의 이중 결합을 포함하고, 알키닐의 경우 하나 이상의 삼중 결합을 포함한다. .
본원에 사용된 "방향족" 그룹(또는 "아릴" 또는 "아릴렌" 그룹)은 방향족 카보사이클릭 환 시스템(예를 들면, 페닐) 및 융합된 폴리사이클릭 방향족 환 시스템(예를 들면, 나프틸, 비페닐 및 1,2,3,4-테트라하이드로나프틸)을 포함한다.
본원에 사용된 "사이클로알킬" 또는 "사이클로알킬렌"은 완전히 포화된 C3-C12 모노사이클릭 또는 멀티사이클릭 (예를 들면, 바이사이클릭, 트리사이클릭, 스피로사이클릭 등) 탄화수소를 의미한다. 사이클로알킬 그룹의 예는 사이클로프로필, 사이클로부틸, 사이클로펜틸, 및 사이클로헥실이다.
본원에 사용된 "사이클로알케닐"은, 하나 이상의 불포화 결합을 갖지만 방향족 그룹에 해당되지 않는, C3-C12 모노사이클릭 또는 멀티사이클릭(예를 들면, 바이사이클릭, 트리사이클릭, 스피로사이클릭 등) 탄화수소를 의미한다. 사이클로알케닐 그룹의 예는 사이클로펜테닐 및 사이클로헥세닐이다.
본원에 사용된 다수의 모이어티 또는 치환체는 "치환된" 또는 "임의로 치환된" 것으로 언급된다. 모이어티가 이들 용어 중 하나로 개질되는 경우, 달리 기재되지 않는 한, 치환을 위해 이용가능한 것으로 당해 기술 분야의 숙련가들에게 공지된 모이어티의 임의의 부분이 치환될 수 있는 것을 나타내고, 이는 하나 이상의 치환체를 포함하고, 여기서, 하나 초과의 치환체의 경우에는 각각의 치환체는 독립적으로 선택된다. 치환에 대한 이러한 의미는 당해 기술 분야에 잘 공지되고/되거나 본 개시에 의해 교시된다. 예시의 목적을 위해, 본 발명의 범위를 제한하는 것으로 해석되어서는 안되고, 치환체인 그룹의 몇몇의 예는 다음과 같다: (C1-C8)알킬 그룹, (C2-C8)알케닐 그룹, (C2-C8)알키닐 그룹, (C3-C10)사이클로알킬 그룹, 할로겐(F, Cl, Br 또는 I), 할로겐화된 (C1-C8)알킬 그룹(예를 들면, 이에 제한되는 것은 아니지만, -CF3), -O-(C1-C8)알킬 그룹, =O, =CH2, -OH, -CH2OH, -CH2NH2, (C1-C4)알킬-OH, -CH2CH2OCH2CH3, -S-(C1-C8)알킬 그룹, -SH, -NH(C1-C8)알킬 그룹, -N((C1-C8)알킬)2 그룹, -NH2, -C(O)NH2, -CH2NHC(O)(C1-C4)알킬, -CH2NHC(O)CH2Cl, -CH2NHC(O)CH2CN, -CH2NHC(O)CH2CH2N(CH3)2, -CH2NHC(O)C(=CH2)CH3, -CH2NHC(O)(C2-C4)알키닐, -CH2NHC(O)CH2CH2-피페리디닐, -(C1-C4)알킬-모르폴리닐, -CH2NHC(O)CH2O-페닐(여기서, 상기 페닐은 할로겐으로 임의로 치환된다), (C1-C4)알콕시, -C(O)(C1-C4)알킬, -C(O)(C1-C4)알콕시, -C(O)N(H)2, -C(O)N(CH3)2, -C(O)(C1-C6)헤테로아릴, N(CH3)2, -NHC(O)(C1-C4)알킬, -NHC(O)(C2-C4)알케닐, -NHC(O)CH2CN, -S(O)2(C1-C4)알킬, -S(O)2(C1-C6)헤테로아릴, -S(O)2(C1-C6) (C1-C6)헤테로사이클릴, 4-메틸피페라진카보닐, -(C1-C4)알킬C(O)NH2, -C(O)NH(C1-C8)알킬 그룹, -C(O)N((C1-C8)알킬)2, -C(O)N(H)(C3-C8)사이클로알킬 그룹, -C(O)(C1-C4)알콕시, -NHC(O)H, -NHC(O)(C1-C8)알킬 그룹, -NHC(O)(C3-C8)사이클로알킬 그룹, -N((C1-C8)알킬)C(O)H, -N((C1-C8)알킬)C(O)(C1-C8)알킬 그룹, -NHC(O)NH2, -NHC(O)NH(C1-C8)알킬 그룹, -N((C1-C8)알킬)C(O)NH2 그룹, -NHC(O)N((C1-C8)알킬)2 그룹, -N((C1-C8)알킬)C(O)N((C1-C8)알킬)2 그룹, -N((C1-C8)알킬)C(O)NH((C1-C8)알킬), -NHCH2-헤테로아릴, 벤질, -OCH2-헤테로아릴, -C(O)H, -C(O)(C1-C8)알킬 그룹, -CN, -NO2, -S(O)(C1-C8)알킬 그룹, -S(O)2(C1-C8)알킬 그룹, -S(O)2N((C1-C8)알킬)2 그룹, -S(O)2NH(C1-C8)알킬 그룹, -S(O)2NH(C3-C8)사이클로알킬 그룹, -S(O)2NH2 그룹, -NHS(O)2(C1-C8)알킬 그룹, -N((C1-C8)알킬)S(O)2(C1-C8)알킬 그룹, -(C1-C8)알킬-O-(C1-C8)알킬 그룹, -O-(C1-C8)알킬-O-(C1-C8)알킬 그룹, -C(O)OH, -C(O)O(C1-C8)알킬 그룹, NHOH, NHO(C1-C8)알킬 그룹, -O-할로겐화된 (C1-C8)알킬 그룹(예를 들면, 이에 제한되는 것은 아니지만, -OCF3), -S(O)2-할로겐화된 (C1-C8)알킬 그룹(예를 들면, 이에 제한되는 것은 아니지만, -S(O)2CF3), -S-할로겐화된 (C1-C8)알킬 그룹(예를 들면, 이에 제한되는 것은 아니지만, -SCF3), -(C1-C6)헤테로사이클릴 (예를 들면, 이에 제한되는 것은 아니지만, 피롤리딘, 테트라하이드로푸란, 피란 또는 모르폴린), -(C1-C6)헤테로아릴 (예를 들면, 이에 제한되는 것은 아니지만, 테트라졸, 이미다졸, 푸란, 피라진 또는 피라졸), -페닐, 임의로 치환된 벤질, -NHC(O)O-(C1-C6)알킬 그룹, -N((C1-C6)알킬)C(O)O-(C1-C6)알킬 그룹, -C(=NH)-(C1-C6)알킬 그룹, -C(=NOH)-(C1-C6)알킬 그룹, 또는 -C(=N-O-(C1-C6)알킬)-(C1-C6)알킬 그룹.
본원에 사용된 용어 "키트"는 자가면역 장애의 치료를 위해 본 발명의 화학식 I의 화합물과 함께 투여하는 성분을 포함하는 패키지된 제품을 언급한다. 키트는 바람직하게는 키트의 성분을 고정하는 상자 또는 컨테이너를 포함한다. 상자 또는 컨테이너는 라벨 또는 식약청 승인된 프로토콜과 함께 부착된다. 상자 또는 컨테이너는 바람직하게는 플라스틱, 폴리에틸렌, 폴리프로필렌, 에틸렌, 또는 프로필렌 용기 내에 포함되는 본 발명의 성분을 고정한다. 용기는 마개가 있는-튜브 또는 병일 수 있다. 키트는 또한 화학식 I의 화합물을 투여하기 위한 지시서를 포함할 수 있다.
하나 이상의 본 발명의 화합물은 사람 환자에게 자체로 또는 약제학적 조성물로 투여될 수 있고, 상기 조성물에서, 상기 화합물은 생물학적 적합한 담체 또는 부형제(들)와 함께 본원에 기재된 질환 또는 상태를 치료 또는 개선시키기 위한 용량에서 혼합된다. 이들 화합물의 혼합물은 또한 간단한 혼합물로서 또는 적합한 제형화 약제학적 조성물로 환자에게 투여될 수 있다. 치료학적 유효 용량은 본원에 기재된 질환 또는 상태의 예방 또는 약화를 야기하는데 충분한 화합물 또는 화합물들의 양을 언급한다. 본 출원의 화합물의 제형화 기술 및 투여는 당해 기술 분야의 숙련가에게 잘 공지된 문헌에서 발견될 수 있다[예를 들면, 참조: "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA, latest edition].
적합한 투여 경로는, 예를 들면, 경구, 점안제, 직장, 경점막, 국소, 또는 장 투여; 근육내, 피하, 수질내 주사, 뿐만 아니라 건초내, 직접 심실내, 정맥내, 복막내, 비내, 또는 안내 주사를 포함하는 비경구 전달을 포함할 수 있다.
대안적으로, 화합물을 전신 방식 보다는 국소로, 예를 들면, 화합물을 직접적으로 부종 부위로 주사하여, 종종 데포 또는 지연 방출 제형으로 투여할 수 있다.
또한, 표적 약물 전달 시스템으로, 예를 들면, 내피 세포-특이적 항체로 코팅된 리포솜으로 약물을 투여할 수 있다.
본 발명의 약제학적 조성물은 자체 공지된 방식으로, 예를 들면, 통상적인 혼합, 용해, 과립화, 드라제-제조, 빻기(levigating), 유화, 캡슐화, 포획(entrapping) 또는 동결건조 방법으로 제조될 수 있다.
따라서, 본 발명에 따른 사용을 위한 약제학적 조성물은 약제학적으로 사용할 수 있도록 제제화하는 활성 화합물의 가공을 촉진하는 부형제 및 보조제를 포함하는 하나 이상의 생리학적으로 허용되는 담체를 사용하여 통상적인 방식으로 제형화할 수 있다. 적합한 제형화는 선택된 투여 경로에 좌우된다.
주사를 위해, 본 발명의 제제는 수용액 내에서, 바람직하게는 생리학적으로 적합한 완충액, 예를 들면, 행크스 용액, 링거 용액, 또는 생리학적 식염 완충액 내에서 제형화될 수 있다. 경점막 투여를 위해, 침투되는 장벽에 적합한 침투제가 제형에서 사용된다. 이러한 침투제는 일반적으로 당해 기술 분야에 공지되어 있다.
경구 투여를 위해, 화합물은 활성 화합물과 당해 기술 분야에 잘 공지된 약제학적으로 허용되는 담체를 배합하여 용이하게 제형화할 수 있다. 이러한 담체는 본 발명의 화합물이 정제, 알약, 드라제, 캡슐제, 액제, 겔제, 시럽제, 슬러리제, 현탁액제 등으로 치료될 환자에 의한 경구 섭취를 위해 제형화될 수 있게 한다. 경구 용도를 위한 약제학적 제제는 활성 화합물을 고체 부형제와 배합하고, 임의로 수득한 혼합물을 분쇄하고, 목적하는 경우, 적합한 보조제를 첨가한 후 과립물의 혼합물을 가공하여 정제 또는 드라제 코어를 수득하여 얻어질 수 있다. 적합한 부형제는 특히, 필러, 예를 들면, 락토스, 수크로스, 만니톨, 또는 소르비톨을 포함하는 당; 예를 들면, 옥수수 전분, 밀 전분, 쌀 전분, 감자 전분, 젤라틴, 트라가칸트 검, 메틸 셀룰로스, 하이드록시프로필메틸-셀룰로스, 나트륨 카복시메틸셀룰로스, 및/또는 폴리비닐피롤리돈(PVP)과 같은 셀룰로스 제제이다. 목적하는 경우, 붕해제를 첨가할 수 있고, 예를 들면, 가교-결합된 폴리비닐 피롤리돈, 아가, 또는 알긴산 또는 이의 염 예를 들면, 나트륨 알기네이트이다.
드라제 코어는 적합한 코팅으로 제공된다. 이러한 목적을 위해, 농축된 당 용액을 사용할 수 있고, 이는 임의로 아라비아 검, 탈크, 폴리비닐 피롤리돈, 카보폴 겔, 폴리에틸렌 글리콜, 및/또는 티타늄 디옥사이드, 래커 용액, 및 적합한 유기 용매 또는 용매 혼합물을 포함할 수 있다. 안료 또는 염료는 확인을 위해 또는 활성 화합물 용량의 상이한 조합을 확인하기 위해 정제 또는 드라제 코팅에 첨가될 수 있다.
경구로 사용될 수 있는 약제학적 제제는 젤라틴으로 만든 푸쉬-피트(push-fit) 캡슐, 뿐만 아니라 젤라틴 및 가소제, 예를 들면, 글리세롤 또는 소르비톨로 만든 연질 밀봉된 캡슐을 포함한다. 푸쉬-피트 캡슐은 활성 성분을 필러, 예를 들면, 락토스, 결합제, 예를 들면, 전분, 및/또는 윤활제, 예를 들면, 탈크 또는 마그네슘 스테아레이트 및, 임의로, 안정화제와 혼합하여 포함할 수 있다. 연질 캡슐에서, 활성 화합물은 적합한 액체, 예를 들면, 지방 오일, 액체 파라핀, 또는 액체 폴리에틸렌 글리콜에 용해 또는 현탁될 수 있다. 추가로, 안정화제를 첨가할 수 있다. 경구 투여용 모든 제형은 이러한 투여에 적합한 용량 내에 있어야 한다.
협측 투여를 위해, 조성물은 통상적 방식으로 제형화된 정제 또는 로젠지제 형태를 가질 수 있다.
흡입에 의해 투여를 위해, 본 발명에 따른 용도를 위한 화합물은 편리하게는 가압된 팩(pressurized packs) 또는 네뷸라이저로부터 에어로졸 스프레이 프레젠테이션 형태로 적합한 추진체, 예를 들면, 디클로로디플루오로메탄, 트리클로로플루오로메탄, 디클로로테트라플루오로에탄, 이산화탄소 또는 다른 적합한 기체를 사용하여 전달된다. 가압된 에어로졸의 경우, 용량 단위는 계량된 양을 전달하기 위한 밸브를 제공하여 결정될 수 있다. 흡입기(inhaler 또는 insufflator)에서 사용하기 위한 예를 들면, 젤라틴의 캡슐 및 카트리지를 화합물의 분말 믹스 및 적합한 분말 베이스, 예를 들면, 락토스 또는 전분을 포함하여 제형화할 수 있다.
화합물은 주사, 예를 들면, 볼루스(bolus) 주사 또는 연속 주입에 의해 비경구 투여용으로 제형화될 수 있다. 주사용 제형은 첨가된 보존제를 갖는 단위 용량형으로, 예를 들면, 앰풀로 또는 다중-용량 컨테이너로 존재할 수 있다. 조성물은 유성 또는 수성 비히클 중 현탁액, 용액 또는 에멀젼으로서 형태를 가질 수 있고, 제형화 제제, 예를 들면, 현탁, 안정화 및/또는 분산 제제를 포함할 수 있다.
비경구 투여용 약제학적 제형은 수용성 형태의 활성 화합물의 수용액을 포함한다. 추가로, 활성 화합물의 현탁액은 적합한 유성 주사 현탁액으로서 제조될 수 있다. 적합한 친유성 용매 또는 비히클은 지방 오일, 예를 들면, 참기름, 또는 합성 지방산 에스테르, 예를 들면, 에틸 올레에이트 또는 트리글리세라이드, 또는 리포솜을 포함한다. 수성 주사 현탁액은 현탁액의 점도를 증가시키는 물질을 포함할 수 있고, 예를 들면, 나트륨 카복시메틸 셀룰로스, 소르비톨, 또는 덱스트란이다. 임의로, 현탁액은 또한 적합한 안정화제 또는 화합물의 용해도를 증가시켜 고농축된 용액의 제조를 가능하게 하는 제제를 포함할 수 있다.
대안적으로, 활성 성분은 사용전에 적합한 비히클, 예를 들면, 멸균 발열원-비함유 물과 함께 구조화를 위한 분말 형태로 존재할 수 있다.
화합물은 또한, 예를 들면, 통상적인 좌제 베이스, 예를 들면, 코코아 버터 또는 다른 글리세라이드를 포함하는 직장용 조성물, 예를 들면, 좌제 또는 정체 관장으로 제형화될 수 있다.
추가로, 상기 기재된 제형에, 화합물은 또한 데포 제제로서 제형화될 수 있다. 이러한 장시간 작용 제형은 주입(예를 들면, 피하 또는 근육내 또는 근육내 주사에 의해)으로 투여될 수 있다. 따라서, 예를 들면, 화합물은 적합한 중합체성 또는 소수성 물질(예를 들면, 허용되는 오일 중 에멀젼으로서) 또는 이온 교환 수지를 사용하여, 또는 난용성 유도체로서, 예를 들면, 난용성 염으로서 제형화될 수 있다.
소수성인 본 발명의 화합물을 위한 약제학적 담체의 예는 벤질 알콜, 비극성 계면활성제, 물-혼화성 유기 중합체, 및 수성 상을 포함하는 공용매 시스템이다. 공용매 시스템은 VPD 공용매 시스템일 수 있다. VPD는 3% w/v 벤질 알콜, 8% w/v의 비극성 계면활성제 폴리소르베이트 80, 및 65% w/v 폴리에틸렌 글리콜 300의 절대 에탄올로 용적을 채운 용액이다. VPD 공용매 시스템(VPD:5W)은 5% 덱스트로스의 수용액으로 1:1 희석된 VPD로 이루어진다. 이 공용매 시스템은 소수성 화합물을 잘 용해시키고, 자체로 전신 투여시 낮은 독성을 생성한다. 자연스럽게, 공용매 시스템의 비율은 이의 용해도 및 독성 특성을 파괴시키지 않으면서 상당히 가변적일 수 있다. 또한, 공용매 성분의 정체는 가변적일 수 있고: 예를 들면, 다른 낮은-독성 비극성 계면활성제는 폴리소르베이트 80 대신에 사용될 수 있고; 폴리에틸렌 글리콜의 분획 크기는 가변적일 수 있고; 다른 생체적합 중합체는 폴리에틸렌 글리콜, 예를 들면, 폴리비닐 피롤리돈을 대체할 수 있고; 다른 당 또는 폴리삭카라이드는 덱스트로스를 대체할 수 있다.
대안적으로, 소수성 약제학적 화합물을 위한 다른 전달 시스템을 사용할 수 있다. 리포솜 및 에멀젼은 소수성 약물을 위한 전달 비히클 또는 담체의 잘 공지된 예이다. 특정한 유기 용매, 예를 들면, 디메틸설폭사이드를 또한, 보통 더 큰 독성의 대가를 치루지만, 사용할 수 있다. 추가로, 화합물은 지속-방출 시스템, 예를 들면, 치료학적 제제를 포함하는 고체 소수성 중합체의 반투과성 매트리스를 사용하여 전달할 수 있다. 다양한 지속-방출 물질이 확립되어 있고, 당해 기술분야의 숙련가들에 의해 잘 공지되어 있다. 지속-방출 캡슐제는, 이들의 화학적 특성에 좌우되어, 화합물을 수주 동안 내지 100일에 걸쳐서 방출할 수 있다. 치료학적 시약의 화학적 특성 및 생물학적 안정성에 좌우되어, 단백질 안정화의 추가의 전략이 사용될 수 있다.
약제학적 조성물은 또한 적합한 고체 또는 겔 상 담체 또는 부형제를 포함할 수 있다. 이러한 담체 또는 부형제의 예는, 이에 제한되는 것은 아나지만 칼슘 카보네이트, 칼슘 포스페이트, 다양한 당, 전분, 셀룰로스 유도체, 젤라틴, 및 중합체, 예를 들면, 폴리에틸렌 글리콜을 포함한다.
본 발명의 화합물 대부분은 약제학적으로 적합한 짝이온을 갖는 염으로서 제공될 수 있다. 약제학적으로 적합한 염은, 이에 제한되는 것은 아니지만, 염산, 황산, 아세트산, 락트산, 타르타르산, 말산, 석신산 등을 포함하는 다수의 산으로 형성될 수 있다. 염은 상응하는 유리 염기 형태로 존재하는 것 보다 수성 또는 다른 양성자성 용매 중에 더 용해성이 되는 경향이 있다.
본 발명에서 사용하기에 적합한 약제학적 조성물은 상기 활성 성분이 이의 의도된 목적을 성취하기 위해 유효량으로 포함되는 조성물을 포함한다. 보다 특히, 치료학적 유효량은 치료될 대상자의 존재하는 증상의 발달을 예방하거나 이러한 증상을 완화시키는데 효과적인 양을 의미한다. 유효량의 결정은 당해 기술분야의 숙련가들의 능력 내에서 용이하게 할 수 있다.
본 발명의 방법에서 사용된 화합물에 대해, 치료학적 유효 용량은 세포 검정으로부터 초기에 평가될 수 있다. 예를 들면, 용량은 순환 세포 검정에서 측정된 IC50(예를 들면, 제공된 단백질 키나제 활성의 최대 억제의 반을 성취하는 시험 화합물의 농도)을 포함하는 순환 농도 범위를 성취하기 위해 세포 및 동물 모델에서 제형화될 수 있다. 일부 경우, 이러한 측정이 화합물에 대한 혈장 단백질의 결합 효과와 비슷하기 때문에 3 내지 5%의 혈청 알부민의 존재하에 IC50을 측정하는 것이 적합하다. 이러한 정보는 사람에서 유용한 용량을 보다 정확하게 측정하는데 사용될 수 있다. 추가로, 전신 투여에 가장 바람직한 화합물은 혈장에서 안전하게 성취가능한 수준에서 온전한 세포에서 단백질 키나제 시그널링을 효과적으로 억제한다.
치료학적 유효 용량은 환자에서 증상의 개선을 야기하는 화합물의 양을 언급한다. 이러한 화합물의 독성 및 치료학적 효능은 세포 배양 또는 실험 동물에서 표준 약제학적 절차에 의해 측정될 수 있고, 예를 들면, 최대 허용 용량(MTD) 및 ED50(50% 최대 반응에 대한 유효 용량)를 측정한다. 독성 치료학적 효과 간의 용량 비는 치료학적 지수이고, MTD 내지 ED50 간의 비로서 표현될 수 있다. 높은 치료학적 지수를 나타내는 화합물이 바람직하다. 이들 세포 배양 검정 및 동물 연구로부터 수득된 데이터는 사람에서 사용하기 위한 용량의 범위를 제형화되는데 사용될 수 있다. 이러한 화합물의 용량은 바람직하게는 독성이 미미하거나 없는 ED50을 포함하는 순환 농도의 범위 내에 있다. 용량은 사용되는 용량형 및 사용되는 투여 경로에 좌우되어 이러한 범위 내에서 가변적일 수 있다. 정확한 제형, 투여 경로 및 용량은 환자의 상태를 고려하여 개별 의사에 의해 선택될 수 있다[예를 들면, 참조: Fingl et al., 1975, in The Pharmacological Basis of Therapeutics, Ch. 1, p. 1]. 위기의 치료에서, MTD에 근접하는 급성 볼루스 또는 주입의 투여는 신속한 반응을 수득하기 위해 요구될 수 있다.
용량의 양 및 간격은 개별적으로 조절되어, 키나제 조절 효과, 또는 최소 유효 농도(MEC)를 유지하는데 충분한 활성 모이어티의 혈장 수준을 제공할 수 있다. MEC는 각각의 화합물에 대해 다양할 수 있지만, 다음 생체내 데이터; 예를 들면, 본원에 기재된 검정을 사용하여 단백질 키나제의 50 내지 90% 억제를 달성하는데 필수적인 농도로부터 평가될 수 있다. MEC를 성취하는데 필수적인 용량은 개별적 특성 및 투여 경로에 따라 좌우될 수 있다. 그러나, HPLC 검정 또는 생물검정은 혈장 농도를 측정하는데 사용될 수 있다.
투약 간격은 또한 MEC 값을 사용하여 측정할 수 있다. 화합물은 증상의 목적하는 개선이 성취될 때까지 시간의 10 내지 90%, 바람직하게는 30 내지 90%, 바람직하게는 50 내지 90% 동안 MEC 위로 혈장 수준을 유지시키는 용법을 사용하여 투여되어야 한다. 국소 투여 또는 선택적 흡수의 경우, 약물의 유효 국소 농도는 혈장 농도와 관련될지 않을 수 있다.
투여되는 조성물의 양은, 물론, 치료될 대상자, 대상자의 체중, 병의 중증도, 투여 방식 및 처방 의사의 판단에 좌우될 수 있다.
조성물은, 목적하는 경우, 팩 또는 디스펜서 장치 내에 존재할 수 있고, 상기 장치는 활성 성분을 포함하는 하나 이상의 단위 용량형을 포함할 수 있다. 팩은 예를 들면, 금속 또는 플라스틱 호일, 예를 들면, 블리스터 팩을 포함할 수 있다. 팩 또는 디스펜서 장치는 투여를 위한 지시서를 동반할 수 있다. 적합한 약제학적 담체 중에 제형화된 본 발명의 화합물을 포함하는 조성물은 또한 제조되고, 적합한 컨테이너에 위치되고, 지시된 상태의 치료를 위해 라벨화될 수 있다.
일부 제형화에서, 예를 들면, 유체 에너지 밀링에 의해 수득된 매우 작은 크기의 입자 형태의 본 발명의 화합물을 사용하는 것이 유리할 수 있다.
약제학적 조성물의 제조에서 본 발명의 화합물의 용도는 다음 기술에 의해 예시된다. 이러한 기술에서, 용어 "활성 화합물"은 임의의 본 발명의 화합물을 나타내지만, 특히 다른 실시예 중 하나의 최종 생성물인 임의의 화합물을 나타낸다.
a) 캡슐제
캡슐제의 제조에서, 10중량부의 활성 화합물 및 240중량부의 락토스를 탈응집시키고 블렌딩시킬 수 있다. 혼합물을 경성 젤라틴 캡슐 내로 충전시킬 수 있고, 각각의 캡슐은 활성 화합물의 단위 용량 또는 단위 용량의 일부를 포함한다.
b) 정제
정제는, 예를 들면, 다음 성분으로부터 제조할 수 있다.
중량부
활성 화합물 10
락토스 190
옥수수 전분 22
폴리비닐피롤리돈 10
마그네슘 스테아레이트 3
활성 화합물, 락토스 및 전분 일부를 탈응집시키고, 블렌딩하고, 수득한 혼합물을 폴리비닐피롤리돈의 에탄올 중 용액으로 과립화할 수 있다. 무수 과립물을 마그네슘 스테아레이트 및 나머지 전분과 블렌딩할 수 있다. 이어서, 혼합물을 정제화 장치에서 압축하여 정제를 제공하고, 이들 각각은 활성 화합물의 단위 용량 또는 단위 용량의 일부를 포함한다.
c) 장용 코팅 정제
정제는 상기 (b)에 기재된 방법으로 제조될 수 있다. 정제는 통상적인 방법으로 20% 셀룰로스 아세테이트 프탈레이트 및 3% 디에틸 프탈레이트의 에탄올:디클로로메탄(1:1) 중 용액을 사용하여 장용 코팅될 수 있다.
d) 좌제
좌제의 제조에서, 예를 들면, 100중량부의 활성 화합물을 1300중량부의 트리글리세라이드 좌제 베이스로 도입할 수 있고, 혼합물을 각각 치료학적 유효량의 활성 성분을 포함하는 좌제로 형성한다.
본 발명의 조성물에서, 활성 화합물은, 목적하는 경우, 다른 적합한 약리학적 활성 성분과 회합될 수 있다. 예를 들면, 본 발명의 화합물은 본원에 기재된 질환 또는 상태를 치료하는 것으로 공지된 또다른 치료학적 제제와 병용하여 투여될 수 있다. 예를 들면, VEGF 또는 안지오포이에틴의 생성을 억제 또는 감소시키고, VEGF 또는 안지오포이에틴에 대한 세포내 반응을 약화시키고, 세포내 신호 전달을 차단하고, 혈관 과투과성을 억제하고, 염증을 감소시키고, 또는 부종 또는 혈관신생의 형성을 억제하거나 예방하는 하나 이상의 추가의 약제학적 제제를 갖는다. 본 발명의 화합물은 투여 과정이 적합하기만 하면 추가의 약제학적 제제 이전에, 후속하여 또는 동시에 투여할 수 있다. 추가의 약제학적 제제는, 이에 제한되는 것은 아나지만, 항부종 스테로이드, NSAIDS, ras 억제제, 항-TNF 제제, 항-IL1 제제, 항히스타민, PAF-길항제, COX-1 억제제, COX-2 억제제, NO 신타제 억제제, Akt/PTB 억제제, IGF-1R 억제제, PKC 억제제, PI3 키나제 억제제, 칼시뉴린 억제제 및 면역억제제를 포함한다. 본 발명의 화합물 및 추가의 약제학적 제제는 상가적으로(additively) 또는 상승적으로(synergistically) 작용한다. 따라서, 혈관형성, 혈관 과투과성를 억제하고/하거나 부종의 형성을 억제하는 이러한 물질의 병용물의 투여는 어느 하나의 물질 단독 투여 보다 과증식성 장애, 혈관형성, 혈관 과투과성 또는 부종의 유해한 효과의 더 큰 경감을 제공할 수 있다. 악성 장애의 치료에서, 항증식성 또는 세포독성 화학요법 또는 방사선요법과의 병용은 본 발명의 범위 내에 포함된다.
본 발명은 또한 약제로서 화학식 I의 화합물의 용도를 포함한다.
본 발명의 추가의 측면은 포유동물, 특히 사람에서 혈관 과투과성, 혈관형성-의존성 장애, 증식성 질환 및/또는 면역계의 장애를 치료하기 위한 약제의 제조에서 화학식 I의 화합물 또는 이의 염의 용도를 제공한다.
본 발명은 또한, 치료학적 유효량의 화학식 I의 화합물을 이를 필요로 하는 포유동물, 특히 사람에게 투여함을 포함하는 혈관 과투과성, 부적합한 혈관신생, 증식성 질환 및/또는 면역계의 장애의 치료 방법을 제공한다.
약어
Ac 아세틸
AcOH 빙초산
Bn 벤질
BnBr 벤질 브로마이드
Boc t-부톡시카보닐
Boc2O 디-3급-부틸 디카보네이트
BPO 벤조일 퍼옥사이드
br 광역
t-BuOH 3급-부탄올
(CH2O)n 파라포름알데히드
d 이중선
dba 디벤질리덴아세톤
DCAD (E)-비스(4-클로로벤질) 디아젠-1,2-디카복실레이트
DCE 1,2-디클로로에탄
DCM 디클로로메탄(메틸렌 클로라이드)
dd 이중선의 이중
DIEA N,N-디이소프로필에틸아민
DMA 디메틸아세트아미드
DMAP 4-디메틸아미노피리딘
DME 1,2-디메톡시에탄
DMF N,N-디메틸포름아미드
DMSO 디메틸 설폭사이드
dppf 1,1'-비스(디페닐포스피노)페로센
EDC 1-(3-디메틸아미노프로필)-3-에틸카보디이미드
EDCㆍHCl N1-((에틸이미노)메틸렌)-N3,N3-디메틸프로판-1,3-디아민 하이드로클로라이드
equiv 당량(들)
EtOAc 에틸 아세테이트
Et2O 디에틸 에테르
EtOH 에탄올
Fmoc 플루오레닐메틸옥시카보닐
g 그램(들)
h 시간(들)
HATU 4-(3-아크릴아미도페닐)-2-에틸-1H-인돌-7-카복스아미드
HOBt 1H-벤조[d][1,2,3]트리아졸-1-올 하이드레이트
HPLC 고압 액체 크로마토그래피
IPA 이소프로필 알콜
KHMDS 칼륨 비스(트리메틸실릴)아미드
KOAc 칼륨 아세테이트
KOt-Bu 칼륨 3급-부톡사이드
LC/MS 액체 크로마토그래피/질량 분광
LDA 리튬 디이소프로필아미드
LiHMDS 리튬 비스(트리메틸실릴)아미드
m 다중선
M 몰(Molar)
MeCN 아세토니트릴
MeOH 메틸 알콜
min 분(들)
mmol 밀리몰
MS 질량 분광
MsCl 메탄설포닐 클로라이드
MTBE 3급-부틸 메틸 에테르
n- 노르말(Normal) (비분지형)
N 노르말(Normal)
NaBH(OAc)3 나트륨 트리아세톡시하이드로보레이트
NaHMDS 나트륨 비스(트리메틸실릴)아미드
n-BuLi n-부틸 리튬
NaOt-Bu 나트륨 3급-부톡사이드
NBS N-브로모석신이미드
NCS N-클로로석신이미드
NH4OAc 암모늄 아세테이트
NMP N-메틸피롤리디논
NMR 핵 자기 공명
Pd2dba3 트리스(디벤질리덴아세톤)디팔라듐(0)
Pd(OAc)2 팔라듐(II) 아세테이트
Pet ether 페트롤리움 에테르
pH -log[H+]
Pd(PPh3)4 테트라키스(트리페닐포스핀)팔라듐(0)
Pd(PPh3)2Cl2 비스(트리페닐포스핀)팔라듐(II) 클로라이드
PMB 파라-메톡시벤질
PPh3 트리페닐포스핀
ppm 백만부
PrOH 프로판올
psi 제곱인치당 파운드
PyBOP ((1H-벤조[d][1,2,3]트리아졸-1-일)옥시)트리(피롤리딘-1-일)포스포늄 헥사플루오로포스페이트(V)
Rt 체류 시간
rt 실온
s 단일선
SEM 2-(트리메틸실릴)에톡시메틸
SEMCl 2-(트리메틸실릴)에톡시메틸 클로라이드
SFC 초임계유체 크로마토그래피
SPE 고상 추출
t 삼중선
t- 3급
TBAF 테트라부틸암모늄 플루오라이드
TBME 3급-부틸 메틸 에테르
TBDMS 3급-부틸디메틸실란
TBSCl 3급-부틸디메틸실릴 클로라이드
TBTU 2-(1H-벤조[d][1,2,3]트리아졸-1-일)-1,1,3,3-테트라메틸이소우로늄 테트라플루오로보레이트
TEA 트리에틸아민
tert- 3급
3급-부틸 X-Phos 2-디-3급-부틸포스피노-2',4',6'-트리이소프로필비페닐
TFA 트리플루오로아세트산
THF 테트라하이드로푸란
TLC 박층 크로마토그래피
TMS 트리메틸실릴
TMSCl 트리메틸실릴 클로라이드
TMSI 트리메틸실릴 요오다이드
TsCl p-톨루엔설포닐 클로라이드
UV 자외선
wt% 중량 퍼센트
X-Phos 2-디사이클로헥실포스피노-2',4',6'-트리이소프로필비페닐
일반 합성 반응식
본 발명의 화합물을 반응식 I 내지 XVIII에 예시된 합성 변형을 사용하여 제조할 수 있다. 출발 물질은 시판되고, 본원에 기재된 절차에 의해, 문헌 절차에 의해, 또는 당해 유기 화학 기술 분야의 숙련가들에게 잘 공지된 절차에 의해 제조될 수 있다.
본 발명의 1H-인돌-7-카복스아미드 화합물(9)을 제조하기 위한 방법을 반응식 I에 예시한다. 반응식 I, 단계 a에서, 시판되는 4-브로모-2-니트로벤조산(1)과 비닐마그네슘 브로마이드를, 바르톨리(Bartoli) 인돌 합성을 통해 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 제조 #1, 단계 A)를 사용하여 반응시켜 인돌(2)을 수득한다. 인돌(2)을 요오드화메틸로 알킬화하여(반응식 I, 단계 b) 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 제조 #1, 단계 B)을 사용하여 메틸 1H-인돌-7-카복실레이트(3)를 수득할 수 있다. 수득한 인돌(3)은 제조 #1, 단계 C에 기재된 것 또는 문헌[참조: Greene, T.W. 및 Wuts, P.G.M. "Protective Groups in Organic Synthesis, 3rd Edition", 1999, Wiley-Interscience; Larock, R.C. "Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition", 1999, Wiley-VCH]에 기재된 것과 같은 조건을 사용하여 보호된 토실(Ts)일 수 있다(반응식 I, 단계 c). 단계 d에서, 메틸 4-브로모-1-토실-1H-인돌-7-카복실레이트(4)의 지시된 리튬화, 이어서, 요오드로 음이온의 포획은 메틸 4-브로모-2-요오도-1H-인돌-7-카복실레이트(5)를 제조 #1 단계 D에 기재된 것과 같은 조건을 사용하여 수득한다. 토실 보호된 메틸 4-브로모-2-요오도-1H-인돌-7-카복실레이트(5)를 가수분해하고, 수성 염기 조건하에서 하나의 단계 e에서 탈보호하여 4-브로모-2-요오도-1H-인돌-7-카복실산(6)을 제조 #1, 단계 E에 기재되거나 당해 기술 분야의 숙련가들에게 공지된 것(예를 들면, 상기 참조된 Larock, R.C. 또는 Greene, T.W. 및 Wuts, P.G.M.으로부터의 책)과 같은 조건을 사용하여 수득할 수 있다. 단계 f에서, 4-브로모-2-요오도-1H-인돌-7-카복실산(6)을 일반적 절차 D에 기재된 것과 같은 조건을 사용하여 1급 아미드(7)로 전환시킬 수 있다. 4-브로모-2-요오도-1H-인돌-7-카복스아미드(7)에, 이에 제한되는 것은 아니지만, 일반적 절차 A 및 실시예 #22, 단계 A에 기재된 것과 같은 스즈키(Suzuki) 또는 또는 스틸(Stille) 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 대안적으로, 단계 i에서, 토실 보호된 인돌(5)에 일반적 절차 A(예를 들면, 제조 #15 단계 A)에 기재된 이에 제한되는 것은 아니지만, 스즈키 또는 스틸 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 에스테르(10)를 가수분해하여 제조 #15, 단계 B 또는 일반적 절차 C에 기재된 것과 같은 잘 공지된 조건을 사용하여 산(11)을 수득한다(반응식 I, 단계 j). 단계 k에서, 카복실산(11)을 일반적 절차 D에 기재된 것과 같은 조건을 사용하여 나타낸 바와 같이 1급 아미드(12)로 전환시킬 수 있다. 인돌(12)의 설폰아미드 보호 그룹의 제거는 일반적 절차 N에 기재된 것과 같은 조건을 사용하여, 당해 기술 분야의 숙련가들에게 공지된 방법[예를 들면, 상기 참조된 Larock, R.C. 또는 Greene, T.W. 및 Wuts, P.G.M.]에 의해 수행되어 인돌(8)을 수득할 수 있다(반응식 I, 단계 l). 인돌(8)과 시판되거나 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, Larock, R.C. "Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition", 1999, Wiley-VCH 또는 일반적 절차 P 참조)에 의해 제조된 보로네이트 에스테르 또는 보론산을, 일반적 절차 A에 기재된 것과 같은 스즈키 커플링 반응을 사용하여 반응시켜, 1H-인돌-7-카복스아미드 화합물(9)을 수득한다. 대안적으로, 단계 h에서, 인돌(8)에, 이에 제한되는 것은 아니지만, 일반적 절차 T 및 U에 기재된 바와 같은 부흐발트(Buchwald) 또는 네기시(Negishi) 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 인돌(9)에서 R" 그룹의 추가 관능화는 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 인돌(9)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 알콜을 포함하는 인돌(9)로부터 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 제조할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 1급 또는 2급 아민을 포함하는 인돌(9)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, R' 또는 R"에서 보호 그룹을 포함하는 인돌(9)의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.에 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, TBDMS-보호된 알콜을 포함하는 R"에 대해, 상기 보호 그룹은 제거되어 보호되지 않은 알콜(예를 들면, 일반적 절차 M)을 수득할 수 있고, 이어서, 상기 탈보호된 화합물(9)을 상기한 바와 같이 추가로 반응시킬 수 있다. 대안적으로, 화합물(4)은 먼저 단계 m에서, 이에 제한되는 것은 아니지만, 스즈키, 부흐발트, 또는 네기시를 포함하는 커플링 반응을 일반적 절차 A,T 및 U에 기재된 조건을 사용하여 수행하여 화합물(107)을 수득하고, 이어서, 일반적 절차 Y에 예시된 요오드화 반응으로 화합물(108)을 수득할 수 있다(단계 n). 인돌(108)에, 이에 제한되는 것은 아니지만, 일반적 절차 A에 기재된 바와 같은 스즈키 또는 스틸 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행하여 화합물(109)을 수득할 수 있다. 이어서, 화합물(109)에 단계 j, k 및 I와 유사한 가수분해, 아미드화 및 탈-토실화 반응을 수행하여 화합물(9)에 도달할 것을 예상할 수 있다.
반응식 I
본 발명의 1H-인돌-7-카복스아미드 화합물(9)을 제조하는 대안적인 방법을 반응식 II에 예시한다. 단계 a에서, 반응식 I로부터 인돌(3)을 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.에 발견되는 것 또는 제조 #10, 단계 A에 기재된 것과 같은 문헌에 공지된 조건을 사용하여 SEM 그룹으로 보호할 수 있다. 수득한 SEM 보호된 인돌(13)에 지시된 리튬화, 이어서, 친전자체로 음이온(예를 들면, 요오도메탄)의 포획을 수행하여 실시예 #19, 단계 A에 기재된 조건을 사용하여 단계 b에 나타낸 바와 같이 인돌(14)을 수득할 수 있거나, 단계 g에서 나타낸 바와 같이 요오드로 음이온을 포획하여 메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(17)를 제조 #10, 단계 B)에 기재된 것과 같은 조건을 사용하여 수득할 수 있다. 단계 h에서, 인돌(14)에, 이에 제한되는 것은 아니지만, 상기 참조된 Larock, R.C., 일반적 절차 A, 및 제조 #10, 단계 C에 기재된 바와 같은 스즈키 또는 스틸 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응을 수행할 수 있다. 에스테르(14)를 가수분해하여 제조 #10, 단계 D, 또는 일반적 절차 C에 기재된 것과 같은 잘 공지된 조건을 사용하여 산(15)를 수득한다(단계 c). 인돌 카복실산(15)을 일반적 절차 D에 기재된 것과 같은 조건을 사용하여 나타낸 바와 같이 1급 아미드(16)으로 전환시킬 수 있다. 1H-인돌-7-카복스아미드 화합물(16)의 SEM 보호 그룹을 제조 #10, 단계 E에 기재된 것과 같은 방법으로 또는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.에 기재된 것과 같은 조건을 사용하여 제거하여 1H-인돌-7-카복스아미드(8)를 수득할 수 있다. 이어서, 인돌(8)을 상기(반응식 I)한 바와 같이 추가로 반응시켜 표적 1H-인돌-7-카복스아미드 화합물(9)을 수득할 수 있다.
반응식 II
본 발명의 인돌-7-카복스아미드 화합물(9)을 제조하는 추가의 방법은 반응식 III에 예시된다. 에스테르(17)를 가수분해하여 제조 #10, 단계 D 또는 일반적 절차 C에 기재된 것과 같은 잘 공지된 조건을 사용하여 산(18)을 수득한다(단계 a). 산(18)은 일반적 절차 D에 기재된 것과 같은 조건을 사용하여 나타낸 바와 같이 1급 아미드(19)로 전환될 수 있다. 인돌(19)의 SEM 보호 그룹을 실시예 #19, 단계 D에 기재된 것과 같은 방법에 의해 또는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.에 기재된 것과 같은 조건을 사용하여 제거하여 1H-인돌-7-카복스아미드(7)를 수득할 수 있다. 이어서, 인돌(7)을 상기한 바와 같이 추가로 반응시켜 표적 1H-인돌-7-카복스아미드 화합물(9)을 수득할 수 있다.
반응식 III
본 발명의 1H-인돌-7-카복스아미드 화합물(9)을 제조하는 대안적인 방법은 반응식 IV에 예시된다. 인돌(19)에, 이에 제한되는 것은 아니지만, 실시예 #22, 단계 A에 기재된 것과 같은 스틸 커플링 반응 또는 일반적 절차 A에 기재된 것과 같은 스즈키 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 단계 b에서, 인돌-7-카복스아미드(16)를 시판되는 보로네이트 에스테르 또는 보론산과 반응시키거나, 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 실시예 #22, 단계 B; Larock, R.C. "Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd edition", 1999, Wiley-VCH; 또는 일반적 절차 A 참조)으로 스즈키 커플링 반응(예를 들면, 실시예 #19 또는 일반적 절차 A)을 사용하여 제조할 수 있다. 인돌(20)의 SEM 보호 그룹을 실시예 #22, 단계 D에 기재된 것과 같은 방법에 의해 또는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.에 기재된 것과 같은 조건을 사용하여 제거하여 1H-인돌-7-카복스아미드(9)를 수득할 수 있다. 이어서, 인돌(9)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 IV
본 발명의 인돌-7-카복스아미드 화합물(9)은 또한 반응식 V에 예시된 경로를 사용하여 제조할 수 있다. 단계 a에서, 메틸 에스테르(21)를 일반적 절차 F, 또는 상기 참조된 Larock, R.C.에 기재된 바와 같은 표준 조건을 사용하여 제조한다. 에놀화가능한 케톤(23)을 m-니트로아닐린(22)과 반응시켜 일반적 절차 F, 또는 Tetrahedron, 2004, 60(2), 347에 기재된 바와 같은 표준 조건을 사용하여 4-니트로인돌(24)(단계 b)을 수득한다. 단계 c에서, 산(24)을 일반적 절차 D 또는 F에 기재된 것과 같은 조건을 사용하여 나타낸 바와 같이 1급 아미드(25)로 전환될 수 있다. 아미노 인돌(26)을 1급 아미드(25)의 니트로 그룹을 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 일반적 절차 F, 또는 상기 참조된 Larock, R.C.)을 사용하여 환원시켜 제조한다. (26)을 디아조화, 이어서, 요오드화하여 일반적 절차 F, 또는 상기 참조된 Larock, R.C.에 기재된 바와 같은 표준 조건을 사용하여 (27)을 제공한다. 단계 f에서, 인돌(27)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 바와 같은 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 이어서, 인돌(9)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 V
본 발명의 1H-인돌-7-카복스아미드 화합물(30)의 제조 방법을 반응식 VI에 예시한다. 반응식 VI, 단계 a에서, 시판되는 4-브로모-1H-인돌-7-카보니트릴[Sinova](28)을 가수분해하여 제조 #2에 기재된 것 또는 당해 기술 분야의 숙련가들에게 공지된 것(예를 들면, 상기 참조된 Larock, R.C. 또는 Greene, T.W. 및 Wuts, P.G.M.으로부터의 책)과 같은 조건을 사용하여 1급 아미드(29)를 수득한다. 단계 b에서, 인돌(29)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 대안적으로, 인돌(29)을 일반적 절차 P에 기재된 것과 같은 반응을 사용하여 보로네이트 에스테르(31)로 전환할 수 있다. 인돌(31)에 일반적 절차 A에 기재된 것 또는 당해 기술 분야의 숙련가들에게 공지된 것과 같은 조건(예를 들면, 상기 참조된 Larock, R.C.)를 사용하여 스즈키 커플링을 수행할 수 있다. 인돌(30)에서 R' 그룹의 추가의 관능화를, 목적하는 경우, 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 인돌(30)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 알콜을 포함하는 인돌(30)로부터 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 제조할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 R'을 갖는 1급 또는 2급 아민을 포함하는 인돌(30)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, 보호되지 않은 화합물을 수득하기 위한 1H-인돌-7-카복스아미드 화합물(30)에서 R' 그룹의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.에 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, Boc 그룹과 같은 보호 그룹은 보호된 아민으로부터 제거되어 보호되지 않은 아민을 수득할 수 있고(예를 들면, 일반적 절차 G), 이어서, 상기 탈보호된 화합물(30)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 VI
본 발명의 1H-인돌-7-카복스아미드 화합물(35)의 제조 방법을 반응식 VII에 예시한다. 인돌(29)의 니트로화(반응식 VII 단계 a)를 제조 #7, 단계 C에 기재되거나 당해 기술 분야의 숙련가들에게 공지된 것(예를 들면, 상기 참조된 Larock, R.C.)과 같은 조건을 사용하여 수행할 수 있다. 단계 b에서, 인돌(32)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 아미노 인돌(34)을 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 제조 #7, 단계 E, 또는 상기 참조된 Larock, R.C.)을 사용하여 니트로인돌(33)을 환원시켜 제조한다. 아미노 인돌(34)을 일반적 절차 D 또는 E에 기재된 것과 같은 조건을 사용하여 단계 d에 나타낸 바와 같이 전환시켜 아미드(35)를 수득할 수 있다.
반응식 VII
본 발명의 1H-피롤로[3,2-c]피리딘-7-카복스아미드(39)의 제조 방법을 반응식 VIII에 예시한다. 반응식 VIII, 단계 a에서, 6-브로모-4-니트로니코틴산(36)[참조: European Journal of Medicinal Chemistry 1977, 12(6), 541]과 비닐마그네슘 브로마이드를 바르톨리 인돌 합성을 통해 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 제조 #9, 단계 A)을 사용하여 반응시켜 피롤로[3,2-c]피리딘(37)을 수득한다. 단계 b에서, 화합물(37)의 산을 일반적 절차 D에 기재된 것과 같은 조건을 사용하여 나타낸 바와 같이 1급 아미드(38)로 전환할 수 있다. 피롤로[3,2-c]피리딘(38)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 피롤로[3,2-c]피리딘(39)에서 R' 그룹의 추가의 관능화는 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 인돌(39)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 알콜을 포함하는 인돌(39)로부터 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 제조할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 1급 또는 2급 아민을 포함하는 인돌(39)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, R'에서 보호 그룹을 포함하는 인돌(39)의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, TBDMS-보호된 알콜을 포함하는 R"에 대해, 상기 보호 그룹을 제거하여 보호되지 않은 알콜을 수득할 수 있고(예를 들면, 일반적 절차 M), 이어서, 상기 탈보호된 화합물(39)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 VIII
본 발명의 1H-피롤로[2,3-c]피리딘-7-카복스아미드(44)의 제조 방법을 반응식 IX에 예시한다. 반응식 IX, 단계 a에서, 5-브로모-2-클로로-3-니트로피리딘(40)과 비닐마그네슘 브로마이드를 바르톨리 인돌 합성을 통해 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 실시예 #2, 단계 A)을 사용하여 반응시켜 피롤로[2,3-c]피리딘(41)을 수득한다. 단계 b에서, 피롤로[2,3-c]피리딘(41)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행하여 피롤로[2,3-c]피리딘(42)을 수득할 수 있다. 단계 c에서, 피롤로[2,3-c]피리딘(42)의 Pd-매개된 카보닐화로 실시예 #2, 단계 C에 기재된 것과 같은 당해 기술 분야의 숙련가들에게 공지된 방법을 사용하여 에스테르(43)를 수득한다. 에스테르(43)에 실시예 #2, 단계 D에 기재된 것 또는 당해 기술 분야의 숙련가들에게 공지된 것(예를 들면, 상기 참조된 Larock, R.C.)과 같은 가암모니아분해를 수행하여 화합물(44)을 수득할 수 있다. 피롤로[2,3-c]피리딘(44)에서 R' 그룹의 추가의 관능화를 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 인돌(44)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 알콜을 포함하는 인돌(44)로부터 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 제조할 수 있다. 또한, 보호된 알콜을 포함하는 인돌(44)의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 M에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 R'을 갖는 1급 또는 2급 아민을 포함하는 인돌(44)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, 보호되지 않은 화합물을 수득하기 위한 1H-인돌-7-카복스아미드 화합물(44)에서 R' 그룹의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, Boc 그룹과 같은 보호 그룹은 보호된 아민으로부터 제거되어 보호되지 않은 아민(예를 들면, 일반적 절차 G)을 수득할 수 있고, 이어서, 상기 탈보호된 화합물(44)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 IX
본 발명의 1H-인돌-7-카복스아미드(51)의 제조 방법을 반응식 X에 예시한다. 반응식 X, 단계 a에서, 인돌(45)에 빌스메이어-하크(Vilsmeier-Haack) 반응을 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 실시예 #3, 단계 A)을 사용하여 수행하여 알데히드(46)를 수득한다. 알데히드(46)를 4-메톡시벤질아민(PMB)으로 환원적 아민화하여 일반적 절차 H에 기재된 것과 같은 조건을 사용하여 아민(47)을 수득한다(반응식 X, 단계 b). 에스테르(47)를 가수분해하여 실시예 #3, 단계 C 또는 일반적 절차 C에 기재된 것과 같은 잘 공지된 조건을 사용하여 산(48)을 수득한다(단계 c). 산(48)을 일반적 절차 D에 기재된 것과 같은 조건을 사용하여 나타낸 바와 같이 1급 아미드(49)로 전환시킬 수 있다. 인돌(49)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 인돌(50)을 실시예 #3, 단계 F에 기재된 것과 같은 조건을 사용하여 전환시켜 메틸 인돌(51)을 수득할 수 있다.
반응식 X
본 발명의 1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카복스아미드(58)의 제조 방법을 반응식 XI에 예시한다. 5-브로모인돌린(52)의 니트로화(반응식 XI, 단계 a)를 실시예 #4, 단계 A에 기재된 것 또는 당해 기술 분야의 숙련가들에게 공지된 것(예를 들면, 상기 참조된 Larock, R.C.)과 같은 조건을 사용하여 수행할 수 있다. 수득한 인돌린(53)을 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.(예를 들면, 실시예 #4, 단계 B에 기재된 것 또는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M.에 기재된 것과 같은 조건을 사용하여 Boc 보호 그룹)에 기재된 조건을 사용하여 보호할 수 있다(반응식 XI, 단계 b). 반응식 XI, 단계 c에서, 인돌린(54)과 비닐마그네슘 브로마이드를 바르톨리 인돌 합성을 통해 당해 기술 분야의 숙련가들에게 공지된 방법을 사용하여 실시예 #4, 단계 C에 기재된 조건을 사용하여 반응시켜 인돌(55)을 수득한다. 단계 d에서, 브로마이드(55)를 Pd-매개된 시안화하여 상응하는 니트릴(56)을 수득한다(예를 들면, 실시예 #4, 단계 D 또는 Tetrahedron Letters 1999, 40(47), 8193-8195). 니트릴(56)을 후속적으로 가수분해하여 1급 아미드(57)(반응식 XI, 단계 e)를 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 일반적 절차 O)을 사용하여 수득한다. 1급 아미드(57)를 전환시켜 아미드(58)를 일반적 절차 D 또는 E에 기재된 것과 같은 조건을 사용하여 단계 f에 나타낸 바와 같이 수득할 수 있다.
반응식 XI
본 발명의 벤즈이미다졸(64)의 제조 방법을 반응식 XII에 예시한다. 단계 a에서, 4,7-디브로모벤조[c][1,2,5]티아디아졸(59)에, 이에 제한되는 것은 아니지만, 스즈키, 부흐발트, 또는 네기시 커플링 반응 일반적 절차 A, T 및 U에 기재된 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 단계 b에서, 브로마이드(60)의 Pd-매개된 시안화는 상응하는 니트릴(61)을 수득한다(예를 들면, Tetrahedron Letters 1999, 40(47), 8193-8195). 니트릴(61)에 개환을 수행하여 실시예 #14, 단계 C에 기재된 것과 같은 조건을 사용하여 디아민(62)을 수득할 수 있다. 반응식 XII, 단계 d에 나타낸 바와 같이, 디아민(62)의 환화는 알데히드와 반응시켜 수행할 수 있다(예를 들면, 실시예 #14, 단계 D). 니트릴(63)의 가수분해는 일반적 절차 O에 기재된 것과 같은 당해 기술 분야의 숙련가들에게 공지된 방법을 사용하여 벤즈이미다졸(64)(반응식 XII, 단계 e)을 제공한다.
반응식 XII
본 발명의 인다졸(70)의 제조 방법을 반응식 XIII에 예시한다. 반응식 XIII, 단계 a에서, 2-아미노-4-클로로-3-메틸벤조산[Enamine](65)을 일반적 절차 F 또는 상기 참조된 Larock, R.C.에 기재된 바와 같은 표준 조건을 사용하여 에스테르화한다. 단계 b에서, 에스테르(66)를 환화시켜 인다졸(67)을 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 실시예 #18, 단계 B 또는 WO2007/113596)을 사용하여 수득한다. 에스테르(67)를 가수분해하여 산(68)(반응식 XIII, 단계 c)을 일반적 절차 C에 기재된 것과 같은 잘 공지된 조건을 사용하여 수득한다. 산(68)을 일반적 절차 D에 기재된 것과 같은 조건을 사용하여 단계 d에 나타낸 바와 같이 아미드(69)로 전환시킬 수 있다. 인돌(69)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 인돌(70)에서 R' 그룹의 추가의 관능화를 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 인돌(70)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 알콜을 포함하는 인돌(70)로부터 제조할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 R'를 갖는 1급 또는 2급 아민을 포함하는 인돌(70)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, 보호되지 않은 화합물을 수득하기 위한 1H-인돌-7-카복스아미드 화합물(70)에서 R' 그룹의 탈보호를 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, Boc 그룹과 같은 보호 그룹은 보호된 아민으로부터 제거되어 보호되지 않은 아민을 수득할 수 있고(예를 들면, 일반적 절차 G), 이어서, 상기 탈보호된 화합물(70)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 XIII
본 발명의 1H-인돌-7-카복스아미드 화합물(77)의 제조 방법을 반응식 XIV에 예시한다. 반응식 XIV, 단계 a에서, 인돌(71)을 제조 #1 단계 C에 기재된 것 또는 Greene, T.W. 및 Wuts, P.G.M. 또는 상기 참조된 Larock, R.C.에 기재된 것과 같은 조건을 사용하여 토실(Ts) 보호될 수 있다(반응식 I, 단계 c). 단계 b에서, 4-플루오로-1-토실-1H-인돌-7-카보니트릴(72)의 지시된 리튬화에 이어서, 요오드로 음이온을 포획하여 제조 #1, 단계 D에 기재된 것과 같은 조건을 사용하여 인돌(73)을 수득한다. 4-플루오로-2-요오도-1-토실-1H-인돌-7-카보니트릴(73)에, 이에 제한되는 것은 아니지만, 일반적 절차 A에 기재된 것과 같은 스즈키 커플링 반응을 포함하여 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행할 수 있다. 토실 보호된 카보니트릴(74)에서 R' 그룹의 추가의 관능화는 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 아미드, 에테르, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아의 형성은 R'를 갖는 1급 또는 2급 아민을 포함하는 화합물(74)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, 보호되지 않은 화합물을 수득하기 위한 화합물(74)에서 R' 그룹의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, Boc 그룹과 같은 보호 그룹은 보호된 아민으로부터 제거되어 보호되지 않은 아민을 수득할 수 있고(예를 들면, 제조 #27, 단계 D 또는 일반적 절차 G), 이어서, 상기 탈보호된 화합물(74)은 상기한 바와 같이 아민으로서 추가로 반응시킬 수 있다. 단계 d에 나타낸 인돌 카보니트릴(74)과 아민을 변위 화학을 통해 일반적 절차 B에 기재된 것과 같은 당해 기술 분야의 숙련가들에게 공지된 조건을 사용하여 화합물(75)을 수득할 수 있다. 토실 보호된 1H-인돌-7-카보니트릴(75)을 수성 염기 조건하에 하나의 단계에서 탈보호시켜 실시예 #12, 단계 B에 기재된 것 또는 당해 기술 분야의 숙련가들에게 공지된 것(예를 들면, 상기 참조된 Larock, R.C. 또는 Greene, T.W. 및 Wuts, P.G.M.으로부터의 책)과 같은 조건을 사용하여 화합물(76)을 수득할 수 있다. 단계 f에서, 1H-인돌-7-카보니트릴(76)을 가수분해하여 제조 #2에 기재된 것 또는 당해 기술 분야의 숙련가들에게 공지된 것(예를 들면, 상기 참조된 Larock, R.C. 또는 Greene, T.W. 및 Wuts, P.G.M.으로부터의 책)과 같은 조건을 사용하여 1급 아미드(77)를 수득한다. 추가로, 아미드, 카바메이트, 우레아, 또는 치환된 아민을 1급 또는 2급 아민을 포함하는 1H-인돌-7-카복스아미드 화합물(77)로부터 제조할 수 있다(예를 들면, 일반적 절차). 또한, 1급 또는 2급 아민을 포함하는 1H-인돌-7-카복스아미드 화합물(77)의 탈보호를 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, 보호 그룹(예를 들면, Boc 그룹)을 포함하는 R" 또는 R"'에 대해, 상기 보호 그룹을 제거하여 보호되지 않은 아민(예를 들면, 일반적 절차 G)을 수득할 수 있고, 이어서, 상기 탈보호된 화합물(3)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 XIV
본 발명의 7-클로로티아졸로[5,4-c]피리딘-4-카복스아미드(87)의 제조 방법을 반응식 XV에 예시한다. 알데히드(78)의 위티그(Wittig) 반응(단계 a)을 트리페닐 포스포늄으로 수행하여 제조 #46, 단계 A 또는 상기 참조된 Larock, R.C.에 기재된 것과 같은 당해 기술 분야의 숙련가들들에게 공지된 표준 조건을 사용하여 α, β 불포화 메틸 에스테르(79)를 수득한다. 이러한 중간체와 보로네이트 또는 보론산을 스즈키 반응을 통해 단계 b에서, 제조 #46, 단계 B에 예시된 조건을 사용하여 반응시킨다. 중간체(80)를 가수분해하여 산을 제조 #46, 단계 B에 나타낸 바와 같이 수득한다(단계 c). 단계 d에서, 산을 아실 아지드로 아실 클로라이드의 동일계내 형성을 통해 제조 #46, 단계 D 또는 WO 2012/035039에 기재된 것과 같은 표준 조건을 사용하여 전환시킨다. 이어서, 아실 아지드 중간체에 커티어스(Curtius) 재배열를 수행하고, 환화시켜 피리돈(83)을 단계 e에서, 고온(예를 들면, 제조 #46, 단계 E 또는 WO 2012/035039)하에 수득할 수 있다. POCl3로 처리시, 단계 f에서, 피리딘-2-클로라이드를 형성하고(예를 들면, 제조 #46, 단계 F 또는 WO 2012/035039), 이를 후속적으로 NCS로 단계 g에서 처리하여, 4-브로모-7-클로로티아졸로[5,4-c]피리딘 중간체(85)를 제조 #46, 단계 G에 예시된 바와 같이 수득할 수 있다. (85)에서 브로모 그룹의 시아노 관능기로의 전환을 Pd-촉매된 시안화 반응을 통해 수행하고, 시아노 그룹의 후속적인 가수분해로 7-클로로티아졸로[5,4-c]피리딘-4-카복스아미드를 제조 #46, 단계 H에 예시된 바와 같이 수득한다. 단계 j에서, 티아졸로[5,4-c]피리딘-4-카복스아미드(87)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행하여 티아졸로[5,4-c]피리딘-4-카복스아미드(88)를 수득할 수 있다.
반응식 XV
반응식 VIII에 나타낸 경로에 대한 1H-피롤로[3,2-c]피리딘-7-카복스아미드(39)의 제조의 제2의 대안은 반응식 XVI에 나타내고, 여기서, 1H-피롤로[3,2-c]피리딘-7-카복스아미드(39)를 또한 시판되는 메틸 1H-피롤로[3,2-c]피리딘-7-카복실레이트(89)로부터 제조할 수 있고, 이를 먼저 단계 a에서 일반적 절차 AH에 나타낸 당해 기술 분야의 숙련가들에게 공지된 표준 조건을 사용하여 토실화한다. 이어서, 토실화된 중간체(90)를 일반적 절차 AC에 기재된 것과 같은 조건을 사용하여 산화시켜(단계 b) N-옥사이드 중간체(91)를 수득한다. 단계 c에서, 상기 물질을 제조 #45, 단계 C에 예시된 바와 같이 할로겐화시키고, 이어서, 염기를 사용하여 가수분해시켜, 토실 그룹을 제거하고, 에스테르를 산으로 일반적 절차 X에 기재된 것과 같은 조건을 사용하여 가수분해한다. 이어서, 상기 산에 일반적 절차 D에 예시된 바와 같이 표준 아민 커플링 반응을 수행하여 단계 e에서 아미드를 수득할 수 있다. 피롤로[3,2-c]피리딘(94)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행하여 화합물(39)을 수득할 수 있다. 피롤로[3,2-c]피리딘(39)의 R' 그룹의 추가의 관능화는 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 피롤로[3,2-c]피리딘(39)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 알콜을 포함하는 인돌(39)로부터 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 제조할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 1급 또는 2급 아민을 포함하는 인돌(39)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, R'에서 보호 그룹을 포함하는 인돌(39)의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, TBDMS-보호된 알콜을 포함하는 R"에 대해, 상기 보호 그룹을 제거하여 보호되지 않은 알콜을 수득할 수 있고(예를 들면, 일반적 절차 M), 이어서, 상기 탈보호된 화합물(39)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 XVI
1H-피롤로[3,2-c]피리딘-7-카복스아미드(39)의 제조를 위한 반응식 VIII 및 XVI에 나타낸 경로에 대한 제3의 대안을 반응식 XVII에 나타낸다. 단계 a에서, (4-메톡시페닐)메탄아민을 디메틸 3-옥소펜탄디오에이트로 처리하여 중간체(96)를 수득하고, 이를 단리하지 않는다. 단계 b에서, 클로로아세트알데히드로 처리하여 동일계내에서 제조 #37, 단계 A 또는 WO 2005121140에 예시된 조건을 사용하여 환화시킨다. 단계 c에서 (97)의 산성 수소의 탈양성자화 및 메틸포르메이트의 반응을, 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 제조 #37, 단계 B, 또는 WO 2005121140)을 사용하여 수행하여 중간체(98)를 수득한다. 단계 d에서, 중간체(98)의 환화를 제조 #37, 단계 C 또는 WO 2005121140에 예시된 바와 같은 조건을 사용하여 수행하여 피리디논 중간체(99)를 수득한다. 단계 e에서 피리디논 중간체(99)의 후속적인 방향족화 및 할로겐화를 잘 공지된 조건(예를 들면, 제조 #37, 단계 D 또는 WO 2005121140)을 사용하여 수행하여 피롤로[3,2-c]피리딘(100)을 수득한다. (100)에서 에스테르 관능기의 가수분해로 일반적 절차 C에 기재된 바와 같은 표준 조건을 사용하여 산(93)을 수득한다(단계 f). 이어서, 산에 일반적 절차 D에 예시된 아민 커플링 반응을 수행하여 단계 e에서 아미드를 수득할 수 있다. 피롤로[3,2-c]피리딘 94에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하여 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행하여 화합물(39)을 수득할 수 있다. 피롤로[3,2-c]피리딘(39)에서 R' 그룹의 추가의 관능화를 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 피롤로[3,2-c]피리딘(39)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 알콜을 포함하는 인돌(39)로부터 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 제조할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 1급 또는 2급 아민을 포함하는 인돌(39)로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, R'에서 보호 그룹을 포함하는 인돌(39)의 탈보호는 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, TBDMS-보호된 알콜을 포함하는 R"에 대해, 상기 보호 그룹은 제거하여 보호되지 않은 알콜을 수득할 수 있고(예를 들면, 일반적 절차 M), 이어서, 상기 탈보호된 화합물(39)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 XVII
본 발명의 1H-피롤로[2,3-c]피리딘-7-카복스아미드(44)를 제조하기 위한 방법을 반응식 XVIII에 예시한다. 4-브로모-1H-피롤로[2,3-c]피리딘(101)을 당해 기술 분야의 숙련가들에게 공지된 방법(예를 들면, 일반적 절차 AC)을 사용하여 N-옥사이드 중간체로 산화시킨다. 단계 b에서 N-옥사이드(102)의 시안화를 일반적 절차 AD에 예시된 것과 같은 조건을 사용하여 수행하여 카보니트릴(103)을 수득한다. 카보니트릴(103)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행하여 피롤로[2,3-c]피리딘(106)을 수득할 수 있다. 단계 f에서 표준 조건(예를 들면, 일반적 절차 O)를 사용하는 피롤로[2,3-c]피리딘(106)의 후속적인 가수분해로 화합물(44)을 수득할 수 있다. 대안적으로, 카보니트릴(103)을 먼저 단계 c에 나타낸 바와 같이 가수분해하여 공지된 조건(예를 들면, 일반적 절차 O)을 수행하는 경우 아미드(104)를 수득할 수 있다. 이어서, 아미드(104)에, 이에 제한되는 것은 아니지만, 일반적 절차 A, T 및 U에 기재된 스즈키, 부흐발트, 또는 네기시 커플링 반응을 포함하는 당해 기술 분야의 숙련가들에게 공지된 다양한 반응(예를 들면, 상기 참조된 Larock, R.C.)을 수행하여 화합물(44)을 수득할 수 있다. 피롤로[2,3-c]피리딘(44)에서 R' 그룹의 추가의 관능화를 당해 기술 분야의 숙련가들에게 공지된 반응(예를 들면, 상기 참조된 Larock, R.C.)을 사용하여 수행할 수 있다. 예를 들면, 이중 결합을 포함하는 피롤로[2,3-c]피리딘(44)을 일반적 절차 L에 기재된 것과 같은 수소화 조건을 사용하여 포화 시스템으로 환원시킬 수 있다. 에테르를 알콜을 포함하는 피롤로[2,3-c]피리딘(44)으로부터 일반적 절차 Q에 기재된 것과 같은 조건을 사용하여 제조할 수 있다. 추가로, 아미드, 우레아, 설폰아미드, 아릴 아민, 헤테로아릴 아민, 또는 설포닐 우레아를 1급 또는 2급 아민을 포함하는 피롤로[2,3-c]피리딘(44)으로부터 제조할 수 있다(예를 들면, 일반적 절차 D, E, I, H, 및 J). 또한, R'에서 보호 그룹을 포함하는 피롤로[2,3-c]피리딘(44)의 탈보호를 상기 참조된 Greene, T.W. 및 Wuts, P.G.M. 또는 일반적 절차 G, M, 또는 N에 기재된 것과 같은 조건을 사용하여 수행할 수 있다. 예를 들면, TBDMS-보호된 알콜을 포함하는 R"에 대해, 상기 보호 그룹을 제거하여 보호되지 않은 알콜을 수득할 수 있고(예를 들면, 일반적 절차 M), 이어서, 상기 탈보호된 화합물(44)을 상기한 바와 같이 추가로 반응시킬 수 있다.
반응식 XVIII
목적하는 경우, 반응식 I 내지 XVIII에서 키랄 화합물 중 어느 것의 키랄 분리를 부분입체이성체성 염의 키랄 분취용 HPLC, 키랄 SFC 또는 결정화와 같은 당해 기술 분야의 숙련가들에게 공지된 방법을 사용하여 수행할 수 있다.
일반적 절차 및 실시예
본 출원에 개시된 화합물 대부분을 구조화하는데 사용되는 일반적 합성 반응식은 하기 반응식 1 내지 34에 기재되어 있다. 이들 반응식을 단지 예시 목적으로 제공하고, 본 발명의 범위를 제한하는 것으로 이해해서는 안된다.
반응식 1. 아릴 또는 헤테로아릴 할라이드의 아릴 또는 헤테로아릴 보론산 또는 보로네이트와의 스즈키 반응(일반적 절차 A)
반응식 2. 아릴 할라이드의 아민과의 친핵성 치환(일반적 절차 B)
반응식 3. 에스테르의 카복실산으로의 가수분해(일반적 절차 C)
반응식 4. 아민 및 카복실산으로부터 아미드의 형성(일반적 절차 D)
반응식 5. 아민 및 산 할라이드 또는 무수물로부터 아미드의 형성(일반적 절차 E)
반응식 6. 4-요오도인돌-7-카복스아미드의 형성(일반적 절차 F)
반응식 7. Boc-보호된 아민의 산성 개열(일반적 절차 G)
반응식 8. 알데히드 또는 케톤과 1급 또는 2급 아민과의 환원적 아민화(일반적 절차 H)
반응식 9. 아민 및 설포닐 클로라이드로부터 설폰아미드의 형성(일반적 절차 I)
반응식 10. 알킬 할라이드의 아민 친핵체로의 치환(일반적 절차 J)
반응식 11. 아세토나이드의 가수분해(일반적 절차 K)
반응식 12. 알켄의 수소화(일반적 절차 L)
반응식 13. O-실릴 에테르로부터 실릴 그룹의 제거(일반적 절차 M)
반응식 14. 설폰아미드의 가수분해(일반적 절차 N)
반응식 15. 니트릴의 1급 아미드로의 가수분해(일반적 절차 O)
반응식 16. 아릴 할라이드 또는 헤테로아릴 할라이드로부터 보로네이트의 형성 (일반적 절차 P)
반응식 17: 알콜의 미쓰노부 반응(일반적 절차 Q)
반응식 18. Fe를 사용하는 니트로 그룹의 아민으로의 환원(일반적 절차 R)
반응식 19. 아릴 메틸 에테르의 탈메틸화(일반적 절차 S)
반응식 20. 아릴 할라이드 또는 헤테로아릴 할라이드의 아민과의 부흐발트 반응(일반적 절차 T)
반응식 21. 아릴 할라이드 또는 헤테로아릴 할라이드와 유기아연과의 네기시 가교-커플링 반응(일반적 절차 U)
반응식 22. Boc-보호된 아민 및 카복실산으로부터 아미드의 형성(일반적 절차 V)
반응식 23. 비닐 트리플레이트의 비닐 보로네이트 또는 보론산으로의 전환(일반적 절차 W)
반응식 24. 염기성 조건하에서 에스테르의 카복실산으로의 가수분해 및 N-토실 보호된 헤테로아릴 환으로부터 토실 그룹의 제거(일반적 절차 X)
반응식 25. 2-요오도-1H-인돌 또는 2-요오도-1H-아자인돌 환을 수득하기 위한 1H-인돌 또는 1H-아자 인돌 환의 요오드화(일반적 절차 Y)
반응식 26. N-Boc 보호된 아민의 형성(일반적 절차 Z)
반응식 27. 케톤의 비닐 트리플레이트로의 전환(일반적 절차 AA)
반응식 28. 이중 결합의 환원 및 CBZ 보호된 아민으로부터 CBZ 그룹의 제거(일반적 절차 AB)
반응식 29. N 함유 헤테로 방향족 환의 N-산화(일반적 절차 AC)
반응식 30. 헤테로아릴 환을 포함하는 N-옥사이드의 시안화(일반적 절차 AD)
반응식 31. 알콜을 형성하기 위한 에스테르의 환원(일반적 절차 AE)
반응식 32. 피리딘 환의 피페리딘 환으로의 환원(일반적 절차 AF)
반응식 33. 비닐 트리플레이트의 보릴화 및 동일계내 형성된 보로네이트의 아릴 할라이드와의 스즈키 반응(일반적 절차 AG)
반응식 34. N-토실 보호된 헤테로방향족 환의 형성(일반적 절차 AH)
일반적 절차의 열거
일반적 절차 A 아릴 또는 헤테로아릴 할라이드의 아릴 또는 헤테로아릴 보론산 또는 보로네이트와의 스즈키 반응
일반적 절차 B 아릴 할라이드와 아민과의 친핵성 치환
일반적 절차 C 에스테르의 카복실산으로의 가수분해
일반적 절차 D 아민 및 카복실산으로부터 아미드의 형성
일반적 절차 E 아민 및 산 할라이드 또는 무수물로부터 아미드의 형성
일반적 절차 F 4-요오도인돌-7-카복스아미드의 형성
일반적 절차 G Boc-보호된 아민의 산성 개열
일반적 절차 H 알데히드 또는 케톤의 1급 또는 2급 아민과의 환원적 아민화
일반적 절차 I 아민 및 설포닐 클로라이드로부터의 설폰아미드의 형성
일반적 절차 J 알킬 할라이드의 아민 친핵체로의 치환
일반적 절차 K 아세토나이드의 가수분해
일반적 절차 L 알켄의 수소화
일반적 절차 M O-실릴 에테르로부터 실릴 그룹의 제거
일반적 절차 N 설폰아미드의 가수분해
일반적 절차 O 니트릴의 1급 아미드로의 가수분해
일반적 절차 P 아릴 할라이드 또는 헤테로아릴 할라이드로부터 보로네이트의 형성
일반적 절차 Q 알콜의 미쓰노부 반응
일반적 절차 R Fe를 사용하는 니트로 그룹에서 아민으로의 환원
일반적 절차 S 아릴 메틸 에테르의 탈메틸화
일반적 절차 T 아릴 할라이드 또는 헤테로아릴 할라이드와 아민과의 부흐발트 반응
일반적 절차 U 아릴 할라이드 또는 헤테로아릴 할라이드의 유기아연과의 네기시 가교-커플링 반응
일반적 절차 V Boc-보호된 아민 및 카복실산으로부터 아미드의 형성
일반적 절차 W 비닐 트리플레이트의 비닐 보로네이트 또는 보론산으로의 전환
일반적 절차 X 염기성 조건하의 에스테르에서 카복실산으로의 가수분해 및 N-토실 보호된 헤테로아릴 환으로부터 토실 그룹의 제거
일반적 절차 Y 2- 요오도-1H-인돌 또는 2-요오도-1H-아자인돌 환을 제공하기 위한 1H-인돌 또는 1H-아자 인돌 환의 요오드화
일반적 절차 Z N-Boc 보호된 아민의 형성
일반적 절차 AA 케톤에서 비닐 트리플레이트로의 전환
일반적 절차 AB 이중 결합의 환원 및 CBZ 보호된 아민으로부터 CBZ 그룹의 제거
일반적 절차 AC N 함유 헤테로 방향족 환의 N-산화
일반적 절차 AD 헤테로아릴 환을 포함하는 N-옥사이드의 시안화
일반적 절차 AE 알콜을 형성하기 위한 에스테르의 환원
일반적 절차 AF 피리딘 환의 피페리딘 환으로의 환원
일반적 절차 AG 비닐 트리플레이트의 보릴화 및 새로 형성된 보로네이트와 아릴 할라이드와의 스즈키 반응
일반적 절차 AH N-토실 보호된 헤테로방향족 환의 형성
다음 실시예를 이의 제조에 사용된 최종 일반적 절차에 따라 정리한다. 임의의 신규한 중간체로의 합성 경로를 적합한 추가 반응물 또는 시약과 함께 이의 명칭 뒤에 괄호 내의 일반적 절차(문자 코드)를 연속하여 열거하여 상세하게 설명한다. 이러한 프로토콜의 작업 실시예는 비-제한적 예시로서 실시예 #A.3.7을 사용하여 하기에 제공된다. 실시예 #A.3.7은 2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(4-(디플루오로메틸)벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드이고, 이는 반응식 A에 나타낸 바와 같이 2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-브로모-1H-인돌-7-카복스아미드로부터 4-(디플루오로메틸)-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)벤즈아미드를 사용한 일반적 절차 A를 사용하여 제조되었다.
반응식 A
실시예 #A.3.7에 대한 전구체, 2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-브로모-1H-인돌-7-카복스아미드를, (반응식 B에 나타낸 바와 같이) 4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1)를 1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-일)에타논, 시판되는 Combi-Blocks과 일반적 절차 A에 제공된 조건에 따라서 반응시켜 제조하였다. 이에 따라, 실시예 #A.3.7은 다음과 같이 기재할 수 있다: 실시예 #A.3.7을 4-(디플루오로메틸)-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)벤즈아미드(제조 #29) 및 2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-브로모-1H-인돌-7-카복스아미드(4-브로모-2-요오도-1H-인돌-7-카복스아미드[제조 #1] 및 1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-일)에타논[Combi-Blocks]을 사용한 A를 사용하여 제조함)로부터 일반적 절차 A를 사용하여 제조하였다. 일반적 절차 후 표에서, 이는 표의 타이틀에서 하나의 반응물 및 생성물과 동일한 열에 있는 개별적인 컬럼에서 하나를 사용하여 나타낸다.
반응식 B
시분해형광공명에너지전이(trFRET)로 측정된 생체내 BTK 키나제 활성
인-하우스(in-house) BTK는 재결합 사람 촉매적 도메인에 상응하고(aa 393 - 659), 이는 N-말단 his 태그를 사용하여 SF9 세포에서 발현되고, 고정된 금속 친화 크로마토그래피에 의해 정제되었다. BTK를 펩타이드 기질(바이오틴-TYR1, 서열: Biotin-(Ahx)-GAEEEIYAAFFA-COOH, 0.2 μM 최종)과 함께 다양한 억제제 농도에서 다음 반응 완충액 중에서 혼합하였다: 50 mM MOPSO pH 6.5, 10 mM MgCl2, 2 mM MnCl2, 2.5 mM DTT, 0.01% BSA, 0.1 mM Na3VO4 및 0.001 mM ATP. 실온에서 항온배양한지 약 60분 후, 반응을 EDTA(최종 농도: 100 mM)를 첨가하여 켄칭하고, 검출 시약(최종 대략적 농도: 30 mM HEPES pH 7.0, 0.06% BSA, 0.006% Tween-20, 0.24 M KF, 80 ng/mL PT66K (유로퓸 표지된 항-포스포티로신 항체 cat #61T66KLB Cisbio, Bedford, MA) 및 0.6μg/mL SAXL(Phycolink 스트렙타비딘-알로피코시아닌 수용체, cat #PJ25S, Prozyme, San Leandro, CA)를 첨가하여 발달시켰다. 발달된 반응물을 암실에서 약 60분 동안 실온에서 항온배양하고, 이어서, 여기를 위한 337nm 레이저를 사용하고 665nm에서 방출 파장을 모니터링하는 시분해형광 검출기(Rubystar, BMG)를 통해 판독하였다. 검정의 선형 범위 내에서, 665nm에서 관찰된 신호는 직접적으로 포스포릴화된 생성물에 관련되고, IC50 값을 계산하는데 사용될 수 있다.
하기의 표 및 실시예의 목적을 위해, 각 화합물의 Btk IC50을 다음과 같이 표현한다: A = 0.1μM 미만의 IC50을 갖는 화합물, B = 0.1 μM 내지 1 μM 범위 내의 IC50을 갖는 화합물, 및 C = 1 μM 내지 10 μM 범위 내의 Btk IC50을 갖는 화합물.
분석 방법
분석 데이터는 하기 절차 내에, 일반적 절차의 예시에, 또는 실시예의 표에 포함되었다. 달리 나타내지 않는 한, 모든 1H NMR 데이터는 Varian 400 MHz Mercury Plus, Inova, 또는 400-MR 장치 상에서 수집하고, 화학적 이동은 백만부(ppm)로 인용된다. LC/MS 및 HPLC 데이터는 표 1에 제공된 하위 케이스 방법 문자를 사용하여 LC/MS 및 HPLC 조건의 표를 참조한다.
표 1. LC/MS 및 HPLC 방법
표 2. 키랄 HPLC 방법
일반적 정제 방법
일반적 절차를 위해, 최종 화합물은 당해 기술 분야의 숙련가들에게 공지된 임의의 기술 또는 기술의 조합에 의해 정제될 수 있다. 제한되지 않는 일부 실시예는 고체상(즉, 실리카 겔, 알루미나, 등) 및 목적하는 화합물을 용리하는 용매(또는 용매의 배합물)(즉, 헥산, 헵탄, EtOAc, DCM, MeOH, EtOH, MeCN, 물 등)을 사용한 컬럼 크로마토그래피; 고체상(즉, 실리카 겔, 알루미나 등) 및 목적하는 화합물을 용리하는 용매(또는 용매의 배합물)(즉, 헥산, 헵탄, EtOAc, DCM, MeOH, EtOH, MeCN, 물 등)를 사용하는 분취용 TLC; 역상 HPLC(비제한적 조건에 대해 표 1 참조); 적합한 용매(즉, MeOH, EtOH, IPA, EtOAc, 톨루엔 등) 또는 용매의 배합물(즉, EtOAc/헵탄, EtOAc/MeOH 등)로부터 재결정화; 고체상 및 목적하는 화합물을 용리하는 적합한 용매(즉, EtOH/헵탄, MeOH/헵탄, IPA/헵탄 등, 개질제, 예를 들면, 디에틸아민, TFA 등을 사용하거나 사용하지 않음)를 사용한 키랄 LC; 고체상 및, 적합한 개질제(즉, MeOH, EtOH, IPA, 추가의 개질제, 예를 들면, 디에틸아민, TFA 등을 사용하거나 사용하지 않음)를 사용한 CO2를 사용하는 키랄 SFC; 용매의 배합물(즉, DMF/물, DMSO/DCM, EtOAc/헵탄 등)로부터 침전; 적합한 용매(즉, EtOAc, DCM, MeCN, MeOH, EtOH, IPA, n-PrOH 등)를 사용한 분쇄; 화합물을 액체 중에 용해시키고, 적합하게 혼합되지 않는 액체(즉, DCM/물, EtOAc/물, DCM/포화 NaHCO3, EtOAc/포화 NaHCO3, DCM/10% 수성 HCl, EtOAc/10% 수성 HCl 등)로 세척한 추출; 증류(즉, 간단, 분별, 구젤로르(Kugelrohr) 등); 적합한 온도, 캐리어 기체 및 유속을 사용한 기체 크로마토그래피; 적합한 온도 및 압력에서 승화; 용매(즉, 헵탄, 헥산, EtOAc, DCM, MeOH 등) 또는 용매의 배합물을 사용하여 매질(즉, Florosil®, 알루미나, Celite®, 실리카 겔 등)을 통한 여과; 고체 지지체(수지계, 즉, 이온 교환)를 사용한 또는 사용하지 않는 염 형성을 포함한다. 이들 기술의 모든 설명은 다음 문헌에서 발견할 수 있다[참조: Gordon, A. J. and Ford, R. A. "The Chemist's Companion", 1972; Palleros, D. R. "Experimental Organic Chemistry", 2000; Still, W. C., Kahn, M. and Mitra, A. J. Org. Chem. 1978, 43, 2923; Yan, B. "Analysis and Purification Methods in Combinatorial Chemistry" 2003; Harwood, L. M., Moody, C. J. and Percy, J. M. "Experimental Organic Chemistry: Standard and Microscale, 2nd Edition", 1999; Stichlmair, J. G. and Fair, J. R. "Distillation; Principles and Practices" 1998; Beesley T. E. and Scott, R. P. W. "Chiral Chromatography", 1999; Landgrebe, J. A. "Theory and Practice in Organic Laboratory, 4th Edition", 1993; Skoog, D. A. and Leary, J. J. "Principles of Instrumental Analysis, 4th Edition" 1992; Subramanian, G. "Chiral Separation Techniques 3rd Edition" 2007; Kazakevich, Y. and Lobrutto, R. "HPLC for Pharmaceutical Scientists" 2007]. 다음 일반적 절차 중 어느 것을 통해 제조된 최종 또는 중간체 화합물을 임의로 상기한 정제 방법 중 하나 이상을 사용하여 정제할 수 있다.
제조 및 실시예
각각의 일반적 절차에 사용된 일반적 합성 방법은 지정된 일반적 절차를 사용하여 합성된 화합물의 예시에 따르고 포함한다. 본원에 언급된 특정 조건 및 시약 중 어느 것도 본 발명의 범위를 제한하는 것으로 해석되어서는 안되고, 단지 예시적 목적을 위해 제공된다. 모든 출발 물질은 화학명 뒤에 언급되지 않는 한 Sigma-Aldrich(Fluka 및 Discovery CPR을 포함함)로부터 시판된다. 시약/반응물 명칭은 시판 병에 명명된 바와 같거나, IUPAC 규약, CambridgeSoft® ChemDraw Ultra 9.0.7, CambridgeSoft® Chemistry E-Notebook v9.0.127 또는 v11.0.3.68, 또는 AutoNom 2000에 제공된 바와 같이 제공된다. 염(예: 하이드로클로라이드, 아세테이트)로 지정된 화합물은 염의 1몰(molar) 당량 초과를 포함할 수 있다. 본 발명의 화합물은 절대 입체화학이 시판되는 에난티오머적으로 순수한 출발 물질 또는 입체이성체적으로 정의된 중간체의 사용에 의해, 또는 X-선 회절에 의해 측정되고, 실시예 번호 뒤에 별표로 표시된다.
제조 #1. 4-브로모-2-요오도-1H-인돌-7-카복스아미드
단계 A: 4-브로모-1H-인돌-7-카복실산
4-브로모-2-니트로벤조산(30g,122mmol)의 무수 THF(500mL) 중 용액에, 비닐마그네슘 브로마이드(51.2mL, 512mmol, 1 N)의 THF 중 용액을 약 -30 내지 -50℃에서 적가하였다. 반응 혼합물을 약 -30 내지 -40℃에서 약 2시간 동안 교반하였다. 이어서, 반응 혼합물을 포화 NH4Cl 수용액에 붓고, 혼합물을 EtOAc로 추출하였다(200mL × 2). 합한 유기 층을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 4-브로모-1H-인돌-7-카복실산(33g 조 물질)을 수득하고, 이를 다음 단계를 위해 추가 정제 없이 직접 사용하였다.
단계 B: 메틸 4-브로모-1H-인돌-7-카복실레이트
4-브로모-1H-인돌-7-카복실산(33g, 137mmol)의 DMF(300mL) 중 용액에, Cs2CO3(90g, 276mmol)를 첨가하고, 실온에서 1시간 동안 교반하였다. 이어서, 요오도메탄(29.3g, 206mmol)을 약 0℃에서 적가하였다. 반응 혼합물을 실온으로 약 3시간 동안 가온하였다. 혼합물을 물로 붓고, EtOAc로 추출하였다(200mL × 2). 합한 유기 층을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하고, 잔류물을 실리카 겔 컬럼 크로마토그래피로 정제하여 메틸 4-브로모-1H-인돌-7-카복실레이트(13.8g, 20%)를 수득하였다:
단계 C: 메틸 4-브로모-1-토실-1H-인돌-7-카복실레이트
메틸 4-브로모-1H-인돌-7-카복실레이트(130g, 512mmol)의 무수 THF(1500mL) 중 용액에 NaH(18.4g, 767mmol)를 분획으로 약 0℃에서 첨가하고, 약 1시간 동안 0℃에서 교반하였다. 이어서, TsCl(117g, 614mmol)을 분획으로 약 0℃에서 첨가하였다. 반응 혼합물을 실온으로 약 2시간 동안 가온하였다. 반응 혼합물을 빙수로 붓고, EtOAc(1000mL × 2)로 추출하였다. 합한 유기 층을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하고, 잔류물을 실리카 겔 컬럼 크로마토그래피로 정제하여 메틸 4-브로모-1-토실-1H-인돌-7-카복실레이트(150g, 72%)를 수득하였다:
단계 D: 메틸 4-브로모-2-요오도-1-토실-1H-인돌-7-카복실레이트
펜탄 중 t-BuLi(3.92g, 61.2mmol)에서 교반된 디이소프로필아민(6.2g, 61.2mmol)의 무수 THF(100mL) 중 용액에 약 0℃에서 N2 분위기하에 첨가하고, 혼합물을 약 10분 동안 교반하였다. 메틸 4-브로모-1-토실-1H-인돌-7-카복실레이트(10g, 24.49mmol)의 무수 THF(100mL) 중 용액을 약 -70℃에서 N2 분위기하에 첨가하였다. 약 30분 후, I2(9.33g, 36.7mmol)의 무수 THF(50mL) 중 용액을 첨가하였다. 약 30분 후, 냉각 욕을 제거하고, 혼합물을 다시 약 1시간 동안 교반하였다. 혼합물을 포화 수성 Na2S2O3로 켄칭하였다. 물 및 EtOAc를 혼합물에 첨가하였다. 층을 분리하고, 수성 층을 EtOAc(300mL × 2)로 추출하였다. 합한 유기 층을 염수로 세척하고, 무수 Na2SO4로 건조시키고, 여과하고, 감압하에 농축하고, 잔류물을 실리카 겔 컬럼 크로마토그래피로 정제하여 메틸 4-브로모-2-요오도-1-토실-1H-인돌-7-카복실레이트(7.5g, 38%)를 수득하였다:
단계 E: 4-브로모-2-요오도-1H-인돌-7-카복실산
메틸 4-브로모-2-요오도-1-토실-1H-인돌-7-카복실레이트(75g, 23.4mmol)의 MeOH(750mL), THF(1500mL) 및 물(750mL) 중 용액에, LiOH(67g, 280mmol)를 첨가하고, 반응 혼합물을 약 45℃에서 약 3시간 동안 가열하였다. 수득한 용액을 감압하에 농축하여 MeOH 및 THF를 제거하고, 이어서, 용액을 pH = 6 내지 7로 HCl(1 N)를 사용하여 조정하고, 침전물을 여과하고, 고진공으로 건조시켜 4-브로모-2-요오도-1H-인돌-7-카복실산(45g, 88%)을 수득하였다:
단계 F: 4-브로모-2-요오도-1H-인돌-7-카복스아미드
4-브로모-2-요오도-1H-인돌-7-카복실산(45g, 123mmol)의 DMF(450mL) 중 용액에 HOBt(28.2g, 184mmol), PyBOP(96g, 184mmol), NH4Cl(10g, 184.5mmol) 및 DIEA(63.6g, 492mmol)를 첨가하였다. 반응 혼합물을 실온에서 약 2시간 동안 교반하였다. 물을 첨가하고, 반응 혼합물을 EtOAc(1000mL × 2)로 추출하고, 유기 상을 무수 Na2SO4로 건조시키고, 감압하에 농축하고, 잔류물을 Pet 에테르 : EtOAc(20:1 내지 1:1)를 사용하는 컬럼 크로마토그래피로 정제하여 4-브로모-2-요오도-1H-인돌-7-카복스아미드(25g, 56%)를 수득하였다:
제조 #2. 4-브로모-1H-인돌-7-카복스아미드
4-브로모-1H-인돌-7-카보니트릴(3g, 13.57mmol, Sinova)의 EtOH(36.2mL)/DMSO(9.05mL) 중 용액에 과산화수소(28.0mL, 274mmol) 및 NaOH(28.0mL, 28.0mmol)를 서서히 첨가하였다. 반응 혼합물을 실온에서 약 1시간 동안 교반하였다. 물을 첨가하고, 침전물을 여과하여 수집하고, 물로 세척하고, 진공하에 건조시켜 4-브로모-1H-인돌-7-카복스아미드(2.85g, 88%)를 수득하였다. LC/MS (표 1, 방법 f) Rt = 1.42 min; MS m/z: 280 (M+MeCN)+.
제조 #3. 2-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-3,4-디하이드로이소퀴놀린-1(2H)-온
단계 A: 3,4-디하이드로이소퀴놀린-1(2H)-온
2,3-디하이드로-1H-인덴-1-온(30g, 227mmol)의 DCM(300mL) 중 용액에 메탄설폰산(300mL)을 첨가하고, 용액을 약 0℃로 냉각시켰다. 나트륨 아지드(30g, 461mmol)를 용액으로 분획으로 약 0℃에서 첨가하고, 반응 혼합물을 밤새 실온에서 교반하였다. 반응 혼합물을 20% 수성 NaOH로 중화시키고, DCM(2 × 1 L)으로 추출하였다. 유기 상을 무수 Na2SO4로 건조시키고, 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 3,4-디하이드로이소퀴놀린-1(2H)-온(5g, 15%)을 수득하였다:
단계 B: 2-(3-브로모-2-메틸페닐)-3,4-디하이드로이소퀴놀린-1(2H)-온
3,4-디하이드로이소퀴놀린-1(2H)-온(3.5g, 13.6mmol), 1,3-디브로모-2-메틸벤젠(17.5g, 70.5mmol) 및 K2CO3(9.85g, 71.3mmol)의 DMSO(40mL) 중 혼합물을 N2로 퍼징하고, CuI(1.75g, 9mmol)로 처리하고, 약 160℃로 약 4시간 동안 가열하였다. 반응 혼합물을 DCM으로 희석시키고, Celite®를 통해 여과하였다. 여과물을 5% 수산화암모니아로 세척하고, 건조시키고, 농축하였다. 잔류물을 실리카 겔 상 컬럼 크로마토그래피로 정제하여 2-(3-브로모-2-메틸페닐)-3,4-디하이드로이소퀴놀린-1(2H)-온(6g, 80%)을 수득하였다:
단계 C: 2-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-3,4-디하이드로이소퀴놀린-1(2H)-온
2-(3-브로모-2-메틸페닐)-3,4-디하이드로이소퀴놀린-1(2H)-온(4.6g, 14.6mmol), 비스(피나콜라토)디보론(8.8g, 34.6mmol) 및 CH3COOK(9g, 91.8mmol)의 1,4-디옥산(100mL) 및 DMSO(20mL) 중 혼합물에, PdCl2(dppf)(1g, 1.4mmol)를 첨가하였다. 반응 혼합물을 약 120℃에서 밤새 N2 보호하에 가열하였다. 주위 온도로 냉각한 후, 반응 혼합물을 Celite®를 통해 여과하고, 고체를 EtOAc로 세척하고, 여과물을 물 및 염수로 세척하고, Na2SO4에서 건조시키고, 농축하고, 잔류물을 실리카 겔 상 컬럼 크로마토그래피로 정제하여 2-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-3,4-디하이드로이소퀴놀린-1(2H)-온(1.5g, 28%)을 수득하였다:
제조 #4. N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드
2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(1.9g, 8.15mmol, CombiBlocks)의 DCM(50mL) 중 용액에, DIEA(2.1g, 16.3mmol) 및 HATU(4.03g, 10.6mmol)를 실온에서 첨가하였다. 약 5분 후, 티아졸-2-카복실산(1.9g, 8.15mmol)을 첨가하고, 용액을 약 3시간 동안 실온에서 교반하였다. 반응 혼합물을 물에 붓고, DCM(100mL × 2)으로 추출하고, 유기 상을 염수로 세척하고, 무수 Na2SO4로 건조시키고, 감압하에 농축하고, 잔류물을 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 10:1 내지 3:1로 용리됨)로 정제하여 N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드(1g, 36%)를 수득하였다:
제조 #5. 1-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2(1H)-온
단계 A: 5-브로모-1-메틸피리딘-2(1H)-온
약 0℃에서 5-브로모피리딘-2-올(4g, 23mmol)의 THF(200mL) 중 용액에 NaH(0.83g, 34.7mmol)를 분획으로 첨가하였다. 반응 혼합물을 실온에서 약 15분 동안 교반하고, 이어서, 요오도메탄(9.8g, 69mmol)을 첨가하였다. 혼합물을 밤새 실온에서 교반하였다. 반응 완료 후(TLC 모니터링), 반응 혼합물을 약 0℃로 냉각시키고, 물을 첨가하고, EtOAc(100mL × 2)로 추출하였다. 유기 층을 염수로 세척하고, 무수 Na2SO4로 건조시키고, 여과하고, 감압하에 농축하여 5-브로모-1-메틸피리딘-2-(1H)-온(3g, 69%)을 수득하였다:
단계 B: 1-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2(1H)-온
5-브로모-1-메틸피리딘-2(1H)-온(1.0g, 5.32mmol), KOH(0.78g, 7.98mmol) 및 비스(피나콜라토)디보론(0.162g, 6.38mmol)의 1,4-디옥산(20mL) 중 혼합물에, 트리사이클로헥실포스핀(149mg, 0.532mmol), Pd2dba3(487mg, 0.532mmol)를 N2 분위기하에 첨가하였다. 혼합물을 약 80℃에서 약 5시간 동안 교반하였다. 이어서, 물을 첨가하고, 수성 층을 EtOAc(50mL × 2)로 추출하고, 유기 층을 무수 Na2SO4에서 건조시키고, 감압하에 농축하고, 잔류물을 실리카 겔 상 컬럼 크로마토그래피로 정제하여 1-메틸-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리딘-2(1H)-온(0.80g, 64%)을 수득하였다:
제조 #6. 4-(3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐아미노)피리미딘-2-카보니트릴
마이크로파 바이알에 4-클로로피리미딘-2-카보니트릴(100mg, 0.717mmol, CombiPhos), 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(314mg, 1.433mmol), 및 N-에틸-N-이소프로필프로판-2-아민(0.250mL, 1.433mmol)을 MeCN(7mL) 중에 첨가하였다. 바이알을 밀봉하고, 마이크로웨이브에서 약 150℃에서 약 20분 동안 교반하면서 가열하였다. 반응 혼합물을 실온으로 냉각시키고, 용매를 가온된 질소 스트림하에 제거하였다. 잔류물을 DCM(10mL)에 용해시키고, 물(10mL)로 세척하였다. 혼합물을 Biotage 상 분리기를 사용하여 분리시키고, 유기 상을 진공에서 농축하여 조 생성물을 수득하였다. 조 생성물을 실리카 겔 컬럼에 첨가하고, 10 내지 60% EtAcO/헵탄으로 용리하여 4-(3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐아미노)피리미딘-2-카보니트릴(0.11g, 48%)을 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.89 min; MS m/z: 323 (M+H)+.
제조 #7. N-(3-(3-아미노-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
단계 A: 4-브로모-1H-인돌-7-카복실산
메틸 4-브로모-1H-인돌-7-카복실레이트(6g, 23mmol, 제조 #1 단계 B)의 THF(300mL), 물(60mL) 및 MeOH(60mL) 중 용액에 수산화리튬(2.83g, 118mmol)을 첨가하였다. 이어서, 혼합물을 밤새 환류되도록 가열하였다. 실온으로 냉각한 후, 용매를 감압하에 제거하고, 수성 층을 4 N HCl을 첨가하여 약 pH 6으로 산성화하였다. 침전물을 여과하고, 고체를 건조시켜 4-브로모-1H-인돌-7-카복실산(5.5g, 97%)을 수득하였다:
단계 B: 4-브로모-1H-인돌-7-카복스아미드
4-브로모-1H-인돌-7-카복실산(5.5g, 22.91mmol), EDC(6.59g, 34.4mmol) 및 HOBt(5.26g, 34.4mmol) 중 THF(150mL) 및 DCM(180mL)의 용액을 실온에서 1시간 동안 교반하였다. 이어서, 혼합물을 NH3 기체로 약 15분 동안 버블링하고, 수득한 혼합물을 실온에서 밤새 교반하였다. 혼합물을 물을 첨가하여 희석시키고, DCM으로 추출하였다. 유기 상을 염수로 세척하고, 건조시키고, 농축하여 잔류물을 수득하고, 이를 에테르에서 현탁시키고, 여과하여 4-브로모-1H-인돌-7-카복스아미드(5.3g, 97%)를 수득하였다:
단계 C: 4-브로모-3-니트로-1H-인돌-7-카복스아미드
4-브로모-1H-인돌-7-카복스아미드(5.3g, 22.17mmol) 및 AgNO3(11.30g, 66.5mmol)의 CH3CN(100mL) 중 용액에 벤조일 클로라이드(9.35g, 66.5mmol)를 CH3CN(20mL) 중에서 약 0℃에서 첨가하고, 혼합물을 약 0℃에서 1시간 동안 암실에서 교반하였다. 물 및 EtOAc를 첨가하였다. 유기 상을 농축하여 잔류물을 수득하고, 이를 DCM으로 세척하여 4-브로모-3-니트로-1H-인돌-7-카복스아미드(2.6g, 41%)를 수득하였다:
단계 D: N-(3-(7-카바모일-3-니트로-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
4-브로모-3-니트로-1H-인돌-7-카복스아미드(4g, 14mmol), N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드(5.8g, 16.9mmol, 제조 #4)의 1,4-디옥산(100mL) 및 물(25mL) 중 용액에 Pd(PPh3)4(0.81g, 0.7mmol) 및 CsF(6.4g, 42mmol)를 첨가하고, 혼합물을 약 120℃에서 밤새 N2하에 교반하였다. 실온으로 냉각한 후, 혼합물을 물을 첨가하여 희석시키고, EtOAc로 추출하였다. 유기 상을 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 prep-HPLC(표 1, 방법 ah)로 정제하여 조 물질 N-(3-(7-카바모일-3-니트로-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(2g, 33%)를 수득하였다: LC/MS (표 1, 방법 l) Rt = 1.44 min; MS m/z: 422 (M+H)+.
단계 E: N-(3-(3-아미노-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
N-(3-(7-카바모일-3-니트로-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(0.20g, 0.48mmol)의 EtOH(20mL) 중 용액에 라네이 Ni(0.10g)을 첨가하고, 혼합물을 실온에서 H2 50 psi하에 약 6시간 동안 교반하였다. 혼합물을 여과하고, 여과물을 감압하에 농축하여 조 물질 N-(3-(3-아미노-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(0.11g, 59%)를 수득하고, 이를 추가 정제 없이 사용하였다: LC/MS (표 1, 방법 l) Rt = 1.54 min; MS m/z: 392 (M+H)+.
제조 #8. 4-하이드록시-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-4-(트리플루오로메틸)사이클로헥산카복스아미드
단계 A: 에틸 4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복실레이트
환저 플라스크를 에틸 4-옥소사이클로헥산카복실레이트(10.0g, 58.8mmol) 및 CsF(8.92g, 58.8mmol)로 DME(100mL) 중에서 약 23℃에서 채웠다. 반응물을 빙욕(ice bath)에서 약 5℃로 냉각시키고, 이어서, 트리메틸(트리플루오로메틸)실란(8.35g, 58.8mmol)을 이러한 속도로 적가하여 반응 온도를 8℃ 아래로 유지하였다. 반응물을 약 18시간 동안 약 23℃에서 교반하였다. TBAF(19.4mL, THF 중 1M 용액, 19.39mmol)를 적가하고, 혼합물을 약 20분 동안 교반하였다. 혼합물을 EtOAc(200mL)로 희석시키고, 물(3 x 200mL)로 세척하였다. 유기 층을 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하였다. 잔류물을 헵탄 중 10 내지 50% EtOAc 구배를 사용하는 실리카 겔 상에서 정제하여 에틸 4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복실레이트(9.27g, 67%)를 수득하였다. 생성물은 다음 단계에 추가 정제 없이 이성체의 혼합물로서 사용되었다:
단계 B: (1s,4s)-4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복실산
무수 EtOH(90mL)를 나트륨(1.03g, 45.0mmol)으로 실온에서 처리하고, 혼합물을 나트륨이 용해될 때까지 교반하였다. 에틸 4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복실레이트(9.00g, 37.5mmol)의 EtOH(90mL) 중 용액을 첨가하고, 혼합물을 약 70℃에서 질소하에 약 18시간 동안 가열하였다. 혼합물에 2N 수성 NaOH(18.7mL, 37.5mmol)를 첨가하고, 혼합물을 가열하면서 약 70℃에서 약 4시간 동안 교반하였다. 반응물을 실온으로 냉각시키고, 농축하여 대부분의 EtOH를 제거하였다. 수득한 현탁액을 물(50mL)로 희석시켜 맑은 용액을 수득하였다. 용액을 진한 HCl로 pH = 2로 산성화시켰다. 용액을 약 50mL의 용적으로 농축하고, 침전된 생성물을 여과하여 수집하였다. 침전물을 물(2 x 8mL)로 세정하고, 약 18시간 동안 감압하에 건조시켜 (1s,4s)-4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복실산을 백색 고체(5.99g, 75%)로서 수득하였다: LC/MS (표 1, 방법 a) Rt = 1.35 min; MS m/z 211 (M-H)-
단계 C: (1s,4s)-4-하이드록시-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-4-(트리플루오로메틸)사이클로헥산카복스아미드
(1s,4s)-4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복실산(100mg, 0.471mmol) 및 2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(110mg, 0.471mmol, CombiBlocks)을 DMF(2.0mL) 중에 포함하는 용액을 DIEA(0.082mL, 0.471mmol) 및 2-(3H-[1,2,3]트리아졸로[4,5-b]피리딘-3-일)-1,1,3,3-테트라메틸이소우로늄 헥사플루오로포스페이트(V)(179mg, 0.471mmol)로 처리하고, 혼합물을 실온에서 약 1시간 동안 교반하였다. 혼합물을 물(5mL)로 희석시키고, 분쇄하고, 상청액을 경사분리하였다. 잔류물을 EtOAc(10mL)에 용해시키고, Na2SO4에서 건조시키고, 여과하고, 농축하였다. 잔류물을 헵탄 중 25 내지 75% EtOAc의 구배를 사용하는 실리카 겔 상에서 정제하였다. 생성물 분획을 합하고, 농축하고, 감압하에 고체로 건조시켜 (1s,4s)-4-하이드록시-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-4-(트리플루오로메틸)사이클로헥산카복스아미드를 고체(135mg, 67%)로서 수득하였다: LC/MS (표 1, 방법 b) Rt = 1.56 min; MS m/z 428 (M+H)+,
제조 #9: 4-브로모-1H-피롤로[3,2-c]피리딘-7-카복스아미드
단계 A: 4-브로모-1H-피롤로[3,2-c]피리딘-7-카복실산
6-브로모-4-니트로니코틴산(3.8g, 15.4mmol)[참조: Eur. J. Med. Chem. 1977, 12(6), 541]의 무수 THF(100mL) 중 용액을 약 -40 내지 -50℃에서 약 5분 동안 교반하였다. 이어서, 비닐마그네슘 브로마이드(THF 중 1N, 69.2mL, 69.2mmol)를 적가하였다. 혼합물을 약 -40 내지 -50℃에서 약 4시간 동안 교반하였다. 혼합물을 포화 수성 NH4Cl(2mL)로 켄칭하였다. 용매를 감압하에 제거하여 잔류물을 수득하고, 이를 prep-HPLC(표 1, 방법 w)로 정제하여 4-브로모-1H-피롤로[3,2-c]피리딘-7-카복실산(1g, 27%)를 수득하였다:
단계 B: 4-브로모-1H-피롤로[3,2-c]피리딘-7-카복스아미드
4-브로모-1H-피롤로[3,2-c]피리딘-7-카복실산(100mg, 0.42mmol)의 DMF(2mL) 중 용액에 HOBt(95mg, 0.62mmol) 및 EDCI(119mg, 0.62mmol)를 첨가하였다. 반응 혼합물을 실온에서 약 1시간 동안 교반한 후, NH3/THF(10mL)를 첨가하고, 수득한 혼합물을 실온에서 밤새 교반하였다. 이어서, 현탁액을 여과하고, 여과물을 감압하에 농축하였다. 물을 첨가하고, EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 4-브로모-1H-피롤로[3,2-c]피리딘-7-카복스아미드(60mg, 42%)를 수득하였다. 생성물은 추가 정제 없이 사용하였다:
제조 #10. 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드
단계 A: 메틸 4-브로모-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트
메틸 4-브로모-1H-인돌-7-카복실레이트(35g, 138mmol, 제조 #1 단계 B)의 무수 THF(1500mL) 중 용액에 NaH(10g, 250mmol)를 분획으로 약 0℃에서 첨가하고, 1시간 동안 약 0℃에서 교반하였다. 이어서, SEMCl(31.9mL, 180mmol)을 분획으로 약 0℃에서 첨가하였다. 반응 혼합물을 실온으로 가온되게 하고, 약 12시간 동안 교반하였다. 이어서, 반응 혼합물에 포화 수성 NH4Cl을 첨가하고, EtOAc로 추출하였다. 합한 유기 층을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 메틸 4-브로모-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(32g, 60%)를 수득하였다:
단계 B: 메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트
메틸 4-브로모-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(10g, 26mmol, 제조 #1 단계 B)의 무수 THF(200mL) 중 용액에 리튬 디이소프로필아미드(18mL, 36mmol)를 약 -70℃에서 첨가하고, 약 2시간 동안 교반하였다. 이어서, I2(10g, 39mmol)의 무수 THF(50mL) 중 용액을 상기 용액에 약 -70℃에서 적가하고, 이어서, 약 2시간 동안 교반하였다. 혼합물을 수성 Na2S2O3 용액에 붓고, EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 압력하에 농축하여 잔류물을 수득하고, 이를 컬럼 크로마토그래피(Pet 에테르:EtOAc = 200:1으로 용리됨)로 정제하여 메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(6.2g, 47%)를 수득하였다:
단계 C: 메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트
메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(1.1g, 2.2mmol)의 DME(20mL) 및 물(5mL) 중 용액에 1-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(0.49g, 2.37mmol), PdCl2(dppf)(0.176g, 0.216mmol) 및 Na2CO3(0.894g, 6.47mmol)를 첨가하였다. 혼합물을 환류까지 약 3시간 동안 가열하였다. 실온으로 냉각한 후, 물(20mL)을 용액에 첨가하고, EtOAc(50mL)로 추출하였다. 유기 상을 Na2SO4에서 건조시키고, 진공에서 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 10:1로 용리됨)로 정제하여 메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(0.65g, 65%)를 수득하였다:
단계 D: 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산
메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(0.65mg, 1.41mmol)의 THF(10mL), MeOH(2mL) 및 물(2mL) 중 용액에 LiOH(0.17mg, 7.04mmol)를 첨가하였다. 혼합물을 환류까지 약 4시간 동안 가열하였다. 실온으로 냉각한 후, 용매를 감압하에 제거하고, 수성 층을 수성 HCl(1N)로 pH=4까지 산성화시키고, EtOAc(10mL)로 추출하고, Na2SO4에서 건조시키고, 감압하에 농축하여 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산(0.63g, 99%)을 수득하였다:
단계 E: 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드
4-브로모-2-(1-메틸-1H-피라졸-4-일)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산(0.63g, 1.4mmol)의 DMF(10mL) 중 용액에 PyBOP(1.46g, 2.80mmol), HOBt(0.43g, 2.80mmol), NH4Cl(0.11g, 2.10mmol) 및 DIEA(0.72g, 5.60mmol)를 첨가하였다. 혼합물을 실온에서 약 2시간 동안 교반하였다. 물(20mL)을 혼합물에 첨가하고, EtOAc(30mL)로 추출하였다. 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 3:1로 용리됨)로 정제하여 조 물질 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드를 수득하였다. 이를 무수 THF(10mL)에 용해시키고 (2.02g, 12.2mmol) 및 에탄-1,2-디아민(2.20g, 36.7mmol)을 첨가하고, 약 100℃로 약 2시간 동안 가열하였다. 실온으로 냉각한 후, 물을 첨가하여 혼합물을 희석시키고, EtOAc로 추출하고, 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 3:1로 용리됨)로 정제하여 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드(0.20g, 51%)를 수득하였다:
제조 #11. 3-(2-(((3급-부틸디메틸실릴)옥시)메틸)-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-6-플루오로퀴나졸린-4(3H)-온
단계 A: (2-아미노-6-브로모페닐)메탄올
2-아미노-6-브로모벤조산(19.8g, 91.7mmol)의 THF(190mL) 중 용액을 LiAlH4(7.00g, 183mmol)의 THF(190mL) 중 현탁액에 약 0℃에서 적가하였다. 첨가를 완료한 후, 혼합물을 실온에서 약 4시간 동안 교반하였다. 이어서, 혼합물을 EtOAc(180mL)로 켄칭하였다. 혼합물을 H2O(1.1 L)에 붓고, 여과하였다. 여과물을 EtOAc(3 × 900mL)로 추출하였다. 합한 유기 층을 Na2SO4에서 건조시키고, 여과하고, 농축하였다. 잔류물을 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc=50:1-5:1로 용리됨)로 정제하여 (2-아미노-6-브로모페닐)메탄올(10g, 54%)을 수득하였다:
단계 B: 3-브로모-2-(((3급-부틸디메틸실릴)옥시)메틸)아닐린
(2-아미노-6-브로모페닐)메탄올(3.02g, 15mmol) 및 이미다졸(1.83g, 27mmol)의 DMF(40mL) 중 용액에 TBsCl(3.39g, 22.5mmol)을 분획으로 약 0℃에서 첨가하였다. 이어서, 수득한 혼합물을 실온에서 밤새 교반하였다. 혼합물을 H2O(80mL)에 붓고, MTBE(3 × 80mL)로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하였다. 잔류물을 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc=15:1로 용리됨)로 정제하여 3-브로모-2-(((3급-부틸디메틸실릴)옥시)메틸)아닐린(4.2g, 89%)을 수득하였다:
단계 C: 3-(3-브로모-2-(((3급-부틸디메틸실릴)옥시)메틸)페닐)-6-플루오로퀴나졸린-4(3H)-온
3-브로모-2-(((3급-부틸디메틸실릴)옥시)메틸)아닐린(3.5g, 11mmol), 2-아미노-5-플루오로-벤조산(1.7g, 11mmol) 및 CH(OMe)3(1.8g, 16.5mmol)의 THF(30mL) 중 혼합물을 약 120℃에서 밀봉된 튜브에서 밤새 가열하였다. 혼합물을 실온으로 냉각시키고, 감압하에 농축하였다. 잔류물을 EtOAc로 세척하여 3-(3-브로모-2-(((3급-부틸디메틸실릴)옥시)메틸)페닐)-6-플루오로퀴나졸린-4(3H)-온(1.3g, 25%)을 수득하였다:
단계 D: 3-(2-(((3급-부틸디메틸실릴)옥시)메틸)-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-6-플루오로퀴나졸린-4(3H)-온
3-(3-브로모-2-(((3급-부틸디메틸실릴)옥시)메틸)페닐)-6-플루오로퀴나졸린-4(3H)-온(4g, 8.6mmol), 4,4,5,5,4',4',5',5'-옥타메틸-[2,2']bi[[1,3,2] 디옥사보롤라닐(2.6g, 10.4mmol), KOAc(1.7g, 17.2mmol) 및 Pd(dppf)Cl2(0.8g)의 DMSO/1,4-디옥산(8mL: 40mL) 중 혼합물을 약 110℃로 N2 분위기하에 약 2시간 동안 가열하였다. 혼합물을 실온으로 냉각시키고, EtOAc(100mL)로 희석시키고, 여과하고, 여과물을 H2O(30mL) 및 염수(30mL)로 연속적으로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르/EtOAc, 30:1 내지 5:1)로 정제하여 3-(2-(((3급-부틸디메틸실릴)옥시)메틸)-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-6-플루오로퀴나졸린-4(3H)-온(1.7g, 38%)을 수득하였다:
제조 #12: (R)-7-(피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온 하이드로클로라이드
단계 A: (R)-3급-부틸 (1-벤질피페리딘-3-일)카바메이트
(R)-3급-부틸 피페리딘-3-일카바메이트(40.0g, 0.2 mol, 1.0당량) 및 TEA(22.22g, 0.22 mol, 1.1당량)의 DCM(500mL) 중 용액에 브로모메틸-벤젠(37.62g, 0.22 mol, 1.1당량)을 0℃에서 적가하였다. 밤새 약 25℃에서 교반한 후, 용액을 DCM으로 희석시키고, 물로 세척하였다. 유기 층을 건조시키고, 증발시켜 (R)-3급-부틸 (1-벤질피페리딘-3-일)카바메이트(58.0g, 100%)를 수득하고, 이를 추가 정제 없이 다음 단계에서 사용하였다:
단계 B: (R)-1-벤질피페리딘-3-아민 하이드로클로라이드
(R)-3급-부틸 (1-벤질피페리딘-3-일)카바메이트(58.0g, 0.2 mol, 1.0당량)의 MeOH(200mL) 중 용액에 HCl/MeOH(4.0 M, 200mL)를 첨가하고, 혼합물을 약 2시간 동안 교반하였다. 용매를 진공으로 제거하여 (R)-1-벤질피페리딘-3-아민 하이드로클로라이드(50g)를 수득하였다:
단계 C: (R)-N-(1-벤질피페리딘-3-일)-1H-이미다졸-2-카복스아미드
1H-이미다졸-2-카복실산(16.8g, 0.15mol)의 DMF(500mL) 중 용액에 HATU(57g, 0.15mol)를 첨가하고, 혼합물을 약 2시간 동안 실온에서 교반하였다. 이어서, (R)-3급-부틸 (1-벤질피페리딘-3-일)카바메이트(39.45g, 0.15mol)를 용액에 첨가하고, 혼합물을 밤새 교반하였다. 추가의 1H-이미다졸-2-카복실산(5.2g, 46mmol) 및 HATU(17.6g, 46mmol, 0.3당량)를 첨가하고, 혼합물을 실온에서 3일 동안 교반하였다. 용매를 제거하고, 잔류물을 EtOAc에 용해시키고, 물로 세척하고, 건조시키고, 농축하였다. 잔류물을 실리카 겔 상 컬럼 크로마토그래피로 정제하여 조 물질 (R)-N-(1-벤질피페리딘-3-일)-1H-이미다졸-2-카복스아미드(50g)를 수득하였다: LC/MS (표 1, 방법 k) Rt = 1.15 min; MS m/z: 285 (M+H)+.
단계 D: (R)-N-(1-벤질피페리딘-3-일)-1-(2,2-디에톡시에틸)-1H-이미다졸-2-카복스아미드
(R)-7-(1-벤질피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온(73.0g, 150mmol, 조 물질), 2-브로모-1,1-디에톡시-에탄(30g, 150mmol), K2CO3(41.4g, 300mmol) 및 KI(1g)의 DMF(500mL) 중 혼합물을 약 120℃로 3일 동안 가열하였다. 용매를 제거하였다. 잔류물을 DCM에 용해시키고, 물로 세척하고, 건조시키고, 증발시켜 (R)-N-(1-벤질피페리딘-3-일)-1-(2,2-디에톡시에틸)-1H-이미다졸-2-카복스아미드(30g, 75mmol)를 오일로서 수득하였다: LC/MS (표 1, 방법 k) Rt = 1.81 min; MS m/z: 401 (M+H)+.
단계 E: (R)-7-(1-벤질피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온
(R)-N-(1-벤질피페리딘-3-일)-1-(2,2-디에톡시에틸)-1H-이미다졸-2-카복스아미드(30.0g, 75mmol, 조 물질)의 2N HCl(200mL) 중 혼합물을 밤새 환류되도록 가열하였다. 용매를 제거하고, 잔류물을 물(50mL)로 희석시키고, 이를 포화 Na2CO3에 의해 pH 10로 염기성화시켰다. 수성 상을 DCM으로 추출하고, 건조시키고, 증발시켰다. 잔류물을 실리카 겔 상 컬럼 크로마토그래피로 정제하여 (R)-7-(1-벤질피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온(3.0g, 9.7mmol)을 수득하였다:
단계 F: (R)-3급-부틸 3-(8-옥소이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-카복실레이트
(R)-7-(1-벤질피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온(2.13g, 6.9mmol)의 MeOH(40mL) 중 용액에 (Boc)2O(3.09g, 13.8mmol) 및 Pd/C(1.5g)를 첨가하였다. 혼합물을 H2 벌룬하에 밤새 수소화하고, 이어서, 여과하였다. 여과물을 농축시키고, 실리카 겔 상 컬럼 크로마토그래피로 정제하여 (R)-3급-부틸 3-(8-옥소이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-카복실레이트(1.4g, 64%)를 수득하였다:
단계 G: (R)-7-(피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온 하이드로클로라이드
(R)-3급-부틸 3-(8-옥소이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-카복실레이트(1.4g, 4.4mmol)의 MeOH(10mL) 중 용액에 HCl/MeOH(4 M, 10mL)를 첨가하고, 혼합물을 약 1시간 동안 실온에서 교반하였다. 용매를 제거하여 (R)-7-(피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온 하이드로클로라이드(1.35g, 100%)를 수득하였다:
제조 #13: (R)-7-(피페리딘-3-일)-6,7-디하이드로이미다조[1,2-a]피라진-8(5H)-온 하이드로클로라이드
단계 A: (R)-3급-부틸 3-(8-옥소-5,6-디하이드로이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-카복실레이트
(R)-7-(1-벤질피페리딘-3-일)이미다조[1,2-a]피라진-8(7H)-온(0.77g, 2.5mmol)의 MeOH(20mL) 중 용액에 (Boc)2O(1.09g, 5.0mmol) 및 Pd(OH)2(0.5g)를 첨가하였다. 혼합물을 H2 벌룬하에 밤새 수소화하고, 이어서, 여과하였다. 여과물을 증발시키고, 실리카 겔 상 컬럼 크로마토그래피로 정제하여 (R)-3급-부틸 3-(8-옥소-5,6-디하이드로이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-카복실레이트(0.5g, 60%)를 수득하였다:
단계 B: (R)-7-(피페리딘-3-일)-6,7-디하이드로이미다조[1,2-a]피라진-8(5H)-온 하이드로클로라이드
(R)-3급-부틸 3-(8-옥소-5,6-디하이드로이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-카복실레이트(0.5g, 1.5mmol, 1당량)의 MeOH(5mL) 중 용액에 HCl/MeOH(4.0 M, 5mL)를 첨가하고, 혼합물을 1시간 동안 실온에서 교반하였다. 용매를 제거하여 (R)-7-(피페리딘-3-일)-6,7-디하이드로이미다조[1,2-a]피라진-8(5H)-온 하이드로클로라이드(0.45g, 100%)를 수득하였다:
제조 #14: (Z)-4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-엔산
4-(3-아미노페닐)-1H-인돌-7-카복스아미드(0.25g, 0.995mmol, 제조 #A.1), 푸란-2,5-디온(0.117g, 1.19mmol), 및 N-에틸-N-이소프로필프로판-2-아민(0.521mL, 2.98mmol)의 DMF(10.0mL) 중 용액에 첨가하였다. 혼합물을 실온에서 밤새 교반하였다. 용매를 고 진공하에 제거하고, 잔류물을 prep HPLC(표 2, 방법 y)로 정제하여 (Z)-4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-엔산(0.32g, 92%)을 고체로서 수득하였다. LC/MS (표 1, 방법 g) Rt = 1.37 min; MS m/z 350 (M+H)+.
제조 #15. 3급-부틸 3-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트
단계 A. 메틸 4-브로모-2-(1-(3급-부톡시카보닐)-2,5-디하이드로-1H-피롤-3-일)-1-토실-1H-인돌-7-카복실레이트
메틸 4-브로모-2-요오도-1-토실-1H-인돌-7-카복실레이트(1g, 1.9mmol, 제조 #1, 단계 D)의 DME(20mL)/물(5mL) 중 혼합물에 3급-부틸 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트(0.72g, 2.4mmol), Na2CO3(0.6g, 5.6mmol) 및 Pd(dppf)Cl2(0.2g, 0.28mmol)를 첨가하였다. 반응 혼합물을 실온에서 10시간 동안 N2 분위기하에 교반하였다. 여과후, 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(헥산:EtOAc = 5:1로 용리됨)로 정제하여 메틸 4-브로모-2-(1-(3급-부톡시카보닐)-2,5-디하이드로-1H-피롤-3-일)-1-토실-1H-인돌-7-카복실레이트(0.6g, 56%)를 황색 고체로서 수득하였다:
단계 B: 4-브로모-2-(1-(3급-부톡시카보닐)-2,5-디하이드로-1H-피롤-3-일)-1H-인돌-7-카복실산
메틸 4-브로모-2-(1-(3급-부톡시카보닐)-2,5-디하이드로-1H-피롤-3-일)-1-토실-1H-인돌-7-카복실레이트(2.5g, 4.34mmol)의 THF(20mL)/MeOH(5mL)/물(5mL) 중 용액에 LiOHㆍH2O(2.5g, 59.5mmol)를 실온에서 첨가하였다. 반응 혼합물을 실온에서 약 3시간 동안 교반하였다. 반응물을 농축시키고, 잔류물을 2N HCl를 첨가하여 약 pH 5로 산성화시키고, EtOAc(3 x 50mL)로 추출하였다. 합한 유기 층을 건조시키고, 농축하여 고체를 수득하고, 이를 EtOAc 및 MTBE로 세척하여 4-브로모-2-(1-(3급-부톡시카보닐)-2,5-디하이드로-1H-피롤-3-일)-1H-인돌-7-카복실산(1g, 56.5%)을 백색 고체로서 수득하였다:
단계 C: 3급-부틸 3-(4-브로모-7-카바모일-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트
4-브로모-2-(1-(3급-부톡시카보닐)-2,5-디하이드로-1H-피롤-3-일)-1H-인돌-7-카복실산(1g, 2. 5mmol)의 DMF(6mL) 중 용액에 PyBOP(2.6g, 4.9mmol), HOBt(0.75g, 4.91mmol), DIEA(1.7mL, 9.82mmol) 및 NH4Cl(0.2g, 3.7mmol)를 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 물로 켄칭한 후, 수성 층을 EtOAc(3 x 25mL)로 추출하였다. 합한 유기 층을 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 prep-HPLC(표 1, 방법 ad)로 정제하여 3급-부틸 3-(4-브로모-7-카바모일-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트(0.6g, 54%)를 백색 고체로서 수득하였다:
단계 D: 3급-부틸 3-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트
3급-부틸 3-(4-브로모-7-카바모일-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트(0.6g, 1.48mmol), 3-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)퀴나졸린-4(3H)-온(1g, 2.95mmol, WO 2011159857), K2CO3(0.816g, 5.91mmol) 및 Pd(dppf)Cl2(0.22g, 0.3mmol)의 THF(20mL)/MeOH(5mL)/물(5mL) 중 용액을 약 60℃에서 약 2시간 동안 N2 분위기하에 교반하였다. 용매를 제거하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(헥산:EtOAc = 2:1로 용리됨)로 정제하여 3급-부틸 3-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트(0.6g, 72%)를 고체로서 수득하였다:
제조 #16. 3급-부틸 4-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트
단계 A: 3급-부틸 2-(4-브로모-7-카바모일-1H-인돌-2-일)벤질카바메이트
화합물 메틸 4-브로모-2-요오도-1-토실-1H-인돌-7-카복실레이트(2.4g, 6.58mmol, 제조 #1) 및 3급-부틸 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(2.0g, 6.58mmol)의 THF(50mL), MeOH(10mL) 및 물(10mL) 중 용액에 Na2CO3(2.1g, 19.73mmol) 및 Pd(dppf)Cl2(0.481g, 0.658mmol)를 첨가하고, 혼합물을 약 80℃로 약 3시간 동안 가열하였다. 수득한 용액을 EtOAc(100mL)로 희석시키고, 물(30mL)로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 1:1로 용리됨)로 정제하여 3급-부틸 4-(4-브로모-7-카바모일-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(2g, 72%)를 고체로서 수득하였다:
단계 B: 3급-부틸 4-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트
3급-부틸 4-(4-브로모-7-카바모일-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(2g, 4.76mmol) 및 3-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)퀴나졸린-4(3H)-온(2.59g, 7.14mmol, WO 2011159857)의 THF(40mL), MeOH(10mL) 및 물(10mL) 중 용액에 Na2CO3(1.513g, 14.28mmol) 및 Pd(dppf)Cl2(0.348g, 0.476mmol)를 첨가하였다. 혼합물을 약 80℃로 약 4시간 동안 가열하였다. 수득한 용액을 EtOAc(100mL)로 희석시키고, 물 및 염수(각각 30mL)로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 1:1로 용리됨)로 정제하여 3급-부틸 4-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(1.4g, 51%)를 고체로서 수득하였다:
제조 #17: 1-(메틸설포닐)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1,2,3,6-테트라하이드로피리딘
3급-부틸 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(4.03g, 13.03mmol, Carbocore)의 HCl(디옥산 중 4 M, 19.55mL, 78mmol) 중 용액을 주위온도에서 약 2시간 동안 교반하였다. 용액을 감압하에 농축하고, 이어서, DCM(20.05mL)에 용해시키고, TEA(12.72mL, 91mmol)를 첨가하였다. 혼합물을 약 0℃로 냉각시키고, 메탄설포닐 클로라이드(1.83mL, 23.5mmol)를 적가하였다. 혼합물을 주위온도에서 약 2시간 동안 교반하였다. 혼합물에 1N HCl(60mL)을 첨가하고, 유기 층을 포화 수성 중탄산나트륨(60mL)으로 추출하고, MgSO4에서 건조시키고, 여과하고, 감압하에 농축하였다. 잔류물을 EtOAc 및 헵탄의 혼합물로 분쇄하고, 여과하고, 건조하였다(1.477g). 여과물을 농축시키고, 잔류물을 EtOAc 및 헵탄의 혼합물로 분쇄하고, 여과하고, 건조시켜 제2 로트(second lot)(0.940g)를 수득하였다. 로트를 합하여 1-(메틸설포닐)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1,2,3,6-테트라하이드로피리딘(2.41g, 64%)을 수득하였다. LC/MS (표 1, 방법 a) Rt = 2.18 min: MS m/z: 288 (M+H)+.
제조 #18: 4-브로모-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드
1-(메틸설포닐)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1,2,3,6-테트라하이드로피리딘(0.446g, 1.55mmol, 제조 #17), 4-브로모-2-요오도-1H-인돌-7-카복스아미드(0.54g, 1.48mmol, 제조 #1), 탄산나트륨(0.470g, 4.44mmol) 및 1,1'-비스(디페닐포스피노)페로센]디클로로팔라듐(II)(0.108g, 0.148mmol)을 포함하는 플라스크를 질소로 퍼징하였다. THF(15.0mL), MeOH(2.10mL), 및 물(2.10mL)의 혼합물을 첨가하였다. 혼합물을 약 2시간 동안 약 70℃에서 교반하였다. 혼합물을 Celite®를 통해 여과하고, EtOAc로 세정하고, 감압하에 농축하였다. 잔류물을 DCM로 분쇄하고, 여과하고, DCM, EtOAc으로 세척하여 고체(0.315g)를 수득하였다. 여과물을 농축시키고, 실리카 겔 상 컬럼 크로마토그래피(40 내지 100% EtOAc/헵탄)로 정제하였다. 수득한 잔류물을 DCM로 분쇄하고, 여과하고, 건조시켜 고체(0.125g)를 수득하였다. 고체를 합하여 4-브로모-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(0.44g, 75%)를 수득하였다. LC/MS (표 1, 방법 a) Rt = 1.92 min: MS m/z: 400 (M+H)+.
제조 #19: N-메틸-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드
THF(10mL) 중 N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드(502mg, 1.46mmol, 제조 #4)에 수소화나트륨(70.0mg, 1.75mmol)를 약 0℃에서 첨가하고, 약 25분 동안 교반하였다. 혼합물에 요오도메탄(0.363mL, 5.83mmol)을 약 0℃에서 첨가하였다. 반응 혼합물을 실온으로 되게 하고, 이어서, 실온에서 약 18시간 동안 교반하였다. 혼합물에 물을 첨가하고, DCM으로 2회 추출하고, 층을 분리하였다. 합한 유기 층을 증발시키고, 잔류물을 정상 크로마토그래피를 사용하여 정제하여 N-메틸-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드(0.406g, 59%)를 수득하였다. LC/MS (표 1, 방법 f) Rt = 1.97 min: MS m/z: 359 (M+H)+.
제조 #20. (R)-1-((2,2-디메틸-1,3-디옥솔란-4-일)메틸)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸
4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(1g, 5.15mmol)의 DMF(25.8mL) 중 혼합물에 수소화나트륨(0.206g, 5.15mmol)을 첨가하였다. 혼합물을 실온에서 약 10분 동안 질소하에 교반하였다. (S)-(+)-2,2-디메틸-1,3-디옥솔란-4-일메틸 p-톨루엔설포네이트(1.62g, 5.67mmol)를 첨가하고, 혼합물을 약 90℃에서 밤새 질소 분위기하에 교반하였다. 반응물을 실온으로 냉각시키고, EtOAc 및 물 사이에 분배하였다. 수성 층을 EtOAc(2x)로 재-추출하고, 유기 상을 합하고, 물, 염수로 세척하고, 무수 MgSO4에서 건조시키고, 여과하고, 감압하에 농축하였다. 잔류물을 EtOAc/헥산(30 내지 75%)로 실리카 겔 상 컬럼 크로마토그래피로 정제하여 (R)-1-((2,2-디메틸-1,3-디옥솔란-4-일)메틸)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(0.66g, 42%)을 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.41 min; MS m/z: 309 (M+H)+.
제조 #21. (S)-1-((2,2-디메틸-1,3-디옥솔란-4-일)메틸)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸
4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(1.0g, 5.2mmol)의 DMF(25.8mL) 중 혼합물에 수소화나트륨(0.206g, 5.15mmol)을 첨가하였다. 혼합물을 실온에서 약 10분 동안 질소하에 교반하였다. (R)-(2,2-디메틸-1,3-디옥솔란-4-일)메틸 4-메틸벤젠설포네이트(1.62g, 5.67mmol)를 첨가하고, 혼합물을 약 90℃에서 밤새 질소 분위기하에 교반하였다. 반응물을 실온으로 냉각시키고, EtOAc 및 물 사이에 분배하였다. 수성 층을 EtOAc(2x)로 재-추출하고, 유기 상을 합하고, 물, 염수로 세척하고, 무수 MgSO4에서 건조시키고, 여과하고, 감압하에 농축하였다. 잔류물을 EtOAc/헥산(30 내지 75%)을 사용하여 실리카 겔 상 컬럼 크로마토그래피로 정제하여 (S)-1-((2,2-디메틸-1,3-디옥솔란-4-일)메틸)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(0.83g, 52%)을 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.35 min; MS m/z: 251 (M-(CH3)2CHO +H)+.
제조 #22: N-(3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)아크릴아미드
바이알에 DCM(10mL) 중 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(0.30g, 1.37mmol), 및 DIEA(0.72mL, 4.11mmol)를 첨가하였다. 혼합물을 약 0℃로 냉각시키고, 아크릴로일 클로라이드(0.122mL, 1.51mmol)를 교반하면서 첨가하였다. 혼합물을 약 20분 동안 실온으로 가온하면서 교반하였다. 혼합물을 추가의 DCM(10mL)으로 희석시키고, 물(2 x 10mL)로 세척하고, Biotage 상 분리기를 통해 여과하고, 질소의 가온 스트림하에 농축시켜 N-(3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)아크릴아미드(0.375g, 100%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.70 min; MS m/z: 274 (M+H)+.
제조 #23: N-(트랜스-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드
트랜스 이성체의 혼합물
단계 A. 벤질 4-(하이드록시이미노)피페리딘-1-카복실레이트
벤질 4-옥소피페리딘-1-카복실레이트(10g, 42.9mmol), NH2OH HCl(5.9g, 86mmol) 및 K2CO3(11.8g, 86mmol)의 EtOH(45mL) 중 혼합물을 약 50℃에서 약 0.5시간 동안 가열하였다. 이어서, 용매를 감압하에 제거하였다. 물 및 EtOAc를 잔류물에 첨가하였다. 수성 상을 EtOAc(3 × 75mL)로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 벤질 4-(하이드록시이미노)피페리딘-1-카복실레이트(10g, 94%)를 수득하였다.
단계 B. 벤질 4-((토실옥시)이미노)피페리딘-1-카복실레이트
벤질 4-(하이드록시이미노)피페리딘-1-카복실레이트(12.2g, 49.1mmol)의 피리딘(75mL) 중 용액에 TsCl(12.2g, 64mmol)을 약 0℃에서 서서히 첨가하였다. 반응 혼합물을 이 온도에서 약 0.5시간 동안 교반하고, 실온에서 추가로 2시간 동안 교반하였다. 이어서, 용매를 감압하에 제거하였다. 물 및 EtOAc를 잔류물에 첨가하였다. 수성 상을 EtOAc(3 × 125mL)로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4에서 건조하였다. 용매를 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 15:1)로 정제하여 벤질 4-((토실옥시)이미노)피페리딘-1-카복실레이트(5g, 25.3%)를 수득하였다:
단계 C. 벤질 3-아미노-4-옥소피페리딘-1-카복실레이트 하이드로클로라이드
Na(28.6mg, 1.243mmol)를 EtOH(6.5mL)에 첨가하고, 혼합물을 Na가 완전히 용해될 때까지 교반하였다. MgSO4(0.98g)를 용액에 첨가하고, 이어서, 벤질 4-((토실옥시)이미노)피페리딘-1-카복실레이트(0.5g, 1.242mmol)를 용액에 약 0℃에서 첨가하였다. 반응 후 혼합물을 약 30℃에서 약 2시간 동안 가열하고, 혼합물을 여과하고, 1 N HCl(6.5mL)을 여과물에 첨가하였다. 여과물을 실온에서 약 0.5시간 동안 교반하고, 농축하였다. 잔류물을 EtOH(3mL)와 혼합하고, 여과하였다. 여과물을 농축하여 조 벤질 3-아미노-4-옥소피페리딘-1-카복실레이트 하이드로클로라이드(200mg, 0.702mmol)를 수득하였다:
단계 D. 벤질 4-옥소-3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트
티아졸-2-카복실산(189mg, 14.6mmol) 및 HATU(723mg, 1.9mmol)의 DMF(20mL) 중 용액을 실온에서 0.5시간 동안 교반하고, 이어서, DIEA(945mg, 7.31mmol) 및 벤질 3-아미노-4-옥소피페리딘-1-카복실레이트 하이드로클로라이드(500mg, 1.76mmol)를 혼합물에 첨가하였다. 반응 용액을 실온에서 약 4시간 동안 교반하였다. 물을 혼합물에 첨가하고, EtOAc(3 × 45mL)로 추출하였다. 합한 유기 층을 염수로 수회 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 Prep-HPLC(표 1, 방법 ai)로 정제하여 벤질 4-옥소-3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트(82mg, 12%)를 수득하였다.
단계 E. 트랜스-벤질 4-하이드록시-3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트
벤질 4-옥소-3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트(6.9g, 19.2mmol)의 MeOH(50mL) 중 용액에 NaBH4(0.726g, 0.019mmol)를 배치에서 첨가하고, 혼합물을 실온에서 약 0.5시간 동안 교반하였다. 이어서, 물(50mL)을 반응 혼합물에 첨가하고, DCM(3 × 60mL)으로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 트랜스-벤질 4-하이드록시-3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트(3g, 43%)를 수득하였다.
단계 F. N-(트랜스-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드
트랜스-벤질 4-하이드록시-3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트(0.7g, 1.937mmol)의 MeCN(15mL) 중 교반된 용액에 TMSI(1.55g, 775mmol)를 서서히 약 0℃에서 첨가하고, 이어서, 혼합물을 실온에서 약 1시간 동안 교반하였다. 물을 혼합물에 붓고, MeCN을 감압하에 제거하였다. 1 N HCl을 잔류물에 첨가하고, 혼합물을 MTBE(3 × 30mL)로 추출하였다. 이어서, 수성 상을 NaOH(3 N)로 약 pH = 12로 염기성화하고, DCM(6 × 45mL)으로 추출하였다. 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 Prep-TLC(1:1 MeOH/DCM)로 정제하여 N-(트랜스-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드(50mg, 11%)를 수득하였다:
제조 #24: 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드
단계 A. 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산
메틸 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(10g, 19.6mmol, 제조 #10, 단계 B)의 MeOH(150mL), THF(300mL) 및 물(150mL) 중 용액에 수산화리튬 수화물(12g, 286mmol)를 첨가하였다. 수득한 혼합물을 약 45℃에서 약 3시간 동안 가열하였다. 이어서, 혼합물을 감압하에 농축하여 대부분 용매를 제거하고, 잔류물을 물에 용해시켰다. 수성 혼합물을 수성 HCl(1N)를 첨가하여 약 pH 6으로 산성화시켰다. 침전물을 여과하고, 고체를 건조시켜 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산(9.1g, 94%)을 고체로서 수득하였다:
단계 B. 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드
4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산(8g, 16mmol), EDCI(4.6g, 24mmol) 및 HOBt(3.7g, 24mmol)의 THF(240mL) 및 DCM(280mL) 중 용액을 실온에서 약 1시간 동안 교반하였다. 이어서, 혼합물을 NH3 기체로 15분 동안 발포시키고, 실온에서 밤새 교반하였다. 이어서, 혼합물을 농축시키고, 수성 NaHCO3 및 EtOAc 사이에 분배하였다. 유기 상을 염수로 세척하고, 건조시키고, 농축하여 잔류물을 수득하고, 이를 Pet 에테르에 현탁시키고, 고체를 여과하여 수집하여 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(7.2g, 90%)를 백색 고체로서 수득하였다:
제조 #25: 4-(디플루오로메틸)-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-N-(옥세탄-3-일)벤즈아미드
4-(디플루오로메틸)벤조산(0.089g, 0.519mmol, Oakwood)의 DCM(3.46mL) 중 용액을 질소하에 아황산 디클로라이드(0.075mL, 1.037mmol) 및 1액적의 DMF로 처리하였다. 혼합물을 약 35℃에서 약 16시간 동안 교반하였다. 반응물을 감압하에 농축시키고, 잔류물을 헵탄으로 분쇄하고, 농축하였다. 잔류물을 DCM(3.46mL)에 용해시키고, N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)옥세탄-3-아민(0.100g, 0.346mmol, 2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린[Combi-Blocks] 및 3-옥세탄온[(Molbridge]으로부터 H를 사용하여 제조됨) 및 TEA(0.193mL, 1.383mmol)를 첨가하였다. 혼합물을 주위온도에서 약 4시간 동안 교반하고, 이어서, DCM(10mL)으로 희석시키고, 포화 수성 중탄산나트륨(10mL)으로 켄칭하였다. 유기 상을 합하고, 30mL 포화 수성 중탄산나트륨으로 세척하였다. 유기 층을 MgSO4에서 건조시키고, 여과하고, 감압하에 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(0 내지 40% EtOAc/헵탄)로 정제하여 황색 오일을 수득하고, 이는 정치시 고화되어 4-(디플루오로메틸)-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)-N-(옥세탄-3-일)벤즈아미드(0.092g, 60%)를 수득하였다. LCMS (표 1, 방법 a) Rt = 2.51 min: MS m/z: 444 (M+H)+.
제조 #26: 2-메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸-1-일)프로판-2-올
4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(2.0g, 10.31mmol)의 2,2-디메틸옥시란(11.96mL, 134mmol) 중 용액에 30mL 마이크로파 바이알에서 탄산세슘(0.521g, 1.60mmol)을 첨가하였다. 혼합물을 마이크로파 오븐에서 약 120℃에서 약 30분 동안 가열하였다. 반응물을 냉각시키고, 여과하였다. 수득한 용액을 증발 건조시켜 2-메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸-1-일)프로판-2-올을 백색 고체로서 수득하였다(2.7g, 99%); (표 1, 방법 g) Rt = 1.34 min.; MS m/z: 267 (M+H)+
제조 #27: 4-플루오로-2-요오도-1-토실-1H-인돌-7-카보니트릴
단계 A. 4-플루오로-1-토실-1H-인돌-7-카보니트릴
4-플루오로-1H-인돌-7-카보니트릴(5.3g, 33.1mmol, Sinova)의 DMF(92mL) 중 용액에 NaH(2.0g, 49.6mmol)를 0℃에서 N2 분위기하에 첨가하고, 약 30분 동안 교반하였다. 이어서, TsCl(9.46g, 49.6mmol)을 상기 혼합물에 첨가하고, 실온에서 약 5시간 동안 교반하였다. 혼합물을 포화 NH4Cl 수용액(200mL)에 붓고, EtOAc(100mL × 3)로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 MTBE로 세척하여 4-플루오로-1-토실-1H-인돌-7-카보니트릴(7g, 67.3%)을 고체로서 수득하였다:
단계 B. 4-플루오로-2-요오도-1-토실-1H-인돌-7-카보니트릴
새롭게 제조된 LDA(67mL, 38.2mmol)를 4-플루오로-1-토실-1H-인돌-7-카보니트릴(10g, 31.8mmol)의 THF(50mL) 중 용액에 약 -78℃에서 적가하였다. 첨가를 완료한 후, 혼합물을 추가로 45분 동안 교반하였다. 이어서, I2(9.69g, 38.2mmol)의 THF(50mL) 중 용액을 혼합물에 약 -78℃에서 적가하였다. 첨가 후, 혼합물을 다시 약 1시간 동안 교반하였다. 용액을 포화 수성 Na2S2O3(400mL)에 붓고, EtOAc(100mL × 3)로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 EtOAc로 세척하여 4-플루오로-2-요오도-1-토실-1H-인돌-7-카보니트릴(8.5g, 61%)을 고체로서 수득하였다:
단계 C. 3급-부틸 4-(7-시아노-4-플루오로-1-토실-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트
4-플루오로-2-요오도-1-토실-1H-인돌-7-카보니트릴(2.92g, 6.63mmol) 및 3급-부틸 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(2.05g, 6.63mmol)의 THF(20mL), MeOH(4mL) 및 물(4mL)의 혼합물 중 용액에 Na2CO3(2.108g, 19.89mmol) 및 PdCl2(dppf) DCM(0.541g, 0.663mmol)을 첨가하였다. 혼합물을 약 80℃에서 약 3시간 동안 가열하였다. 이어서, 반응물을 냉각시키고, EtOAc(30mL)로 희석시키고, 물(3 × 10mL)로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc = 10:1로 용리됨)로 정제하여 3급-부틸 4-(7-시아노-4-플루오로-1-토실-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(2.5g, 76%)를 수득하였다:
단계 D. 4-플루오로-2-(1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-7-카보니트릴 하이드로클로라이드
3급-부틸 4-(7-시아노-4-플루오로-1-토실-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(2.7g, 5.45mmol)의 EtOAc(30mL) 중 용액에 HCl/EtOAc(30mL)를 약 0℃에서 적가하고, 이어서, 반응물을 실온에서 약 3시간 동안 교반하였다. 혼합물을 여과하고, 필터 케이크를 EtOAc로 세척하여 4-플루오로-2-(1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-7-카보니트릴 하이드로클로라이드(1.96g, 83%)를 수득하였다:
단계 E. 4-플루오로-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-7-카보니트릴
3급-부틸 4-(7-시아노-4-플루오로-1-토실-1H-인돌-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(1.96g, 4.54mmol) 및 TEA(1.84g, 18.2mmol)의 DCM(30mL) 중 용액에 MsCl(0.623g, 5.44mmol)을 첨가하고, 이어서, 혼합물을 실온에서 약 24시간 동안 교반하였다. 이어서, 물을 혼합물에 첨가하고, 반응 혼합물을 DCM(3 × 30mL)으로 추출하였다. 합한 유기 층을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 4-플루오로-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-7-카보니트릴(1.35g, 63%)을 수득하고, 이를 다음 단계에서 임의의 추가 정제 없이 사용하였다. LC/MS (표 1, 방법 f) Rt = 2.15 min; MS m/z: 474 (M+H)+.
제조 #28: 3-브로모-N-(시아노메틸)벤젠설폰아미드
2-아미노아세토니트릴 하이드로클로라이드(0.50g, 5.40mmol)의 피리딘(27.0mL) 중 냉각된(0℃) 용액에 3-브로모벤젠-1-설포닐 클로라이드(0.779mL, 5.40mmol)를 서서히 첨가하였다. 혼합물을 실온으로 서서히 가온하고, 약 16시간 동안 교반하였다. 혼합물을 감압하에 농축하고, 잔류물을 DCM에 용해시키고, 1N HCl, 포화 중탄산나트륨, 염수로 세척하고, Biotage 상 분리기를 통해 각 세척 단계 후 여과하였다. 유기 상을 감압하에 농축하여 조 생성물을 수득하였다. 조 생성물을 EtOAc/헵탄(0 내지 40%)로 용리된 실리카 겔 상 컬럼 크로마토그래피로 정제하여 3-브로모-N-(시아노메틸)벤젠설폰아미드(0.61g, 41%)를 수득하였다:
제조 #29: 4-사이클로프로필-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)벤즈아미드
2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(0.350g, 1.501mmol) 및 HATU(0.856g, 2.252mmol)의 DCM(2mL) 중 용액에 TEA(0.628mL, 4.50mmol) 및 4-(디플루오로메틸)벤조산(0.336g, 1.952mmol)를 첨가하였다. 혼합물을 약 실온에서 약 18시간 동안 교반하였다. 혼합물을 증발시키고, 수득한 잔류물을 30 내지 50% 헥산 중 EtOAc의 구배로 용리된 실리카 겔 크로마토그래피로 정제하여 4-사이클로프로필-N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)벤즈아미드(0.52, 89%)를 수득하였다; LC/MS (표 1, 방법 c) Rt = 2.10 min.; MS m/z: 388 (M+H)+
제조 #30: (R)-6-플루오로-2-(피페리딘-3-일)이소인돌린-1-온 하이드로클로라이드
단계 A: 메틸 5-플루오로-2-메틸벤조에이트
5-플루오로-2-메틸벤조산(20g, 0.13mol)의 무수 MeOH(200mL) 중 용액에 SOCl2(38.9g, 0.33mol)를 적가하였다. 수득한 혼합물을 실온에서 밤새 교반하였다. 용매를 증발 건조시켜 메틸 5-플루오로-2-메틸벤조에이트(24g, 99%)를 오일로서 수득하였다.
단계 B: 메틸 2-(브로모메틸)-5-플루오로벤조에이트
메틸 5-플루오로-2-메틸벤조에이트(24g, 0.14mol)의 CCl4(250mL) 중 용액에 NBS(28g, 0.16mol) 및 BPO(1.7g, 7.2mmol)를 첨가하였다. 반응 혼합물을 환류까지 약 18시간 동안 가열하였다. 뜨거운 반응 혼합물을 여과하고, 여과물을 진공에서 농축하여 메틸 2-(브로모메틸)-5-플루오로벤조에이트(35g, 조 물질)를 수득하고, 이를 다음 단계 반응에서 직접적으로 추가 정제 없이 사용하였다.
단계 C: (R)-3급-부틸 3-(6-플루오로-1-옥소이소인돌린-2-일)피페리딘-1-카복실레이트
메틸 2-(브로모메틸)-5-플루오로벤조에이트(35g)의 MeCN(400mL) 중 용액에 K2CO3(39g, 0.29mol) 및 3-(R)-아미노-피페리딘-1-카복실산 3급-부틸 에스테르(20g, 0.10mol)를 첨가하였다. 반응 혼합물을 환류까지 약 3시간 동안 가열하고, 이어서, 실온에서 밤새 교반하였다. 수득한 현탁액을 여과하고, 여과물을 진공하에 농축하여 잔류물을 수득하고, 이를 EtOAc(300mL)에 용해시키고, 염수(2×100mL)로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 농축하였다. 수득한 잔류물을 실리카 겔 상 컬럼 크로마토그래피(15:1 페트롤리움 에테르: EtOAc로 용리시킴)로 정제하여 (R)-3급-부틸 3-(6-플루오로-1-옥소이소인돌린-2-일)피페리딘-1-카복실레이트(12g, 25%)를 고체로서 수득하였다:
단계 D: (R)-6-플루오로-2-(피페리딘-3-일)이소인돌린-1-온 하이드로클로라이드
(R)-3급-부틸 3-(6-플루오로-1-옥소이소인돌린-2-일)피페리딘-1-카복실레이트(12g, 0.036mol)의 DCM(100mL) 중 용액에 MeOH 중 1M HCl(150mL)을 첨가하였다. 수득한 혼합물을 실온에서 밤새 교반하였다. 반응 혼합물을 진공하에 농축하여 (R)-6-플루오로-2-(피페리딘-3-일)이소인돌린-1-온 하이드로클로라이드 B(9.0g, 100%)를 고체로서 수득하였다. LCMS (ESI+): m/z 235 (M+H)+, Rt: 1.90 min.;
제조 #31 : (R)-3-(피페리딘-3-일)퀴나졸린-4(3H)-온
단계 A: (R)-3급-부틸 3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트
2-아미노벤조산(7.5g, 54.7mmol) 및 3-(R)-아미노-피페리딘-1-카복실산 3급-부틸 에스테르(10.9g, 54.7mmol)의 THF(20mL) 중 용액에 트리에틸 오르토포르메이트(8.1g, 54.7mmol)를 첨가하였다. 반응 혼합물을 약 110℃로 밀봉된 튜브에서 밤새 가열하였다. 실온으로 냉각한 후, 혼합물을 물로 희석시키고, EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(10:1 페트롤리움 에테르: EtOAc로 용리시킴)로 정제하여 (R)-3급-부틸 3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(7.5g, 42%)를 황색 고체로서 수득하였다.
단계 B: (R)-3-(피페리딘-3-일)퀴나졸린-4(3H)-온
(R)-3급-부틸 3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(12.5g, 36mmol)의 1M HCl/MeOH(150mL) 중 반응 용액을 약 실온에서 약 2.5시간 동안 교반하였다. 혼합물을 여과하였다. 고체를 EtOAc로 세척하고, 건조시켜 (R)-3-(피페리딘-3-일)퀴나졸린-4(3H)-온(10g, 98%)을 백색 고체로서 수득하였다. LCMS (ESI+): m/z 248 (M+H)+, RT: 1.90 min.
제조 #32 : (R)-6-플루오로-3-(피페리딘-3-일)퀴나졸린-4(3H)-온 하이드로클로라이드
단계 A: (R)-3급-부틸 3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트
2-아미노-5-플루오로벤조산(7.5g, 48.4mmol), 3-(R)--아미노-피페리딘-1-카복실산 3급-부틸 에스테르(9.68g, 48.4mmol) 및 트리에틸 오르토포르메이트(7.2g, 48.4mmol)의 THF(20mL) 중 반응 용액을 약 110℃로 밀봉된 튜브에서 밤새 가열하였다. 실온으로 냉각한 후, 혼합물을 물로 희석시켰다. 수성 층을 EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(10:1 페트롤리움 에테르: EtOAc로 용리시킴)로 정제하여 (R)-3급-부틸 3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(6.25g, 37%)를 고체로서 수득하였다.
단계 B: (R)-6-플루오로-3-(피페리딘-3-일)퀴나졸린-4(3H)-온 하이드로클로라이드
(R)-3급-부틸 3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(12.5g, 36mmol)의 1M HCl/MeOH(150mL) 중 용액을 약 실온에서 약 2.5시간 동안 교반하였다. 혼합물을 여과하고, 고체를 EtOAc로 세척하고, 건조시켜 (R)-6-플루오로-3-(피페리딘-3-일)퀴나졸린-4(3H)-온 하이드로클로라이드(10g, 98%)를 고체로서 수득하였다. LC/MS (ESI+): m/z 248 (M+H)+, RT: 1.90 min.
제조 #33: 7-사이클로프로필-5-플루오로-3-(피페리딘-3-일)퀴나졸린-4(3H)-온 하이드로클로라이드
단계 A: 3급-부틸 3-(7-브로모-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트
2-아미노-4-브로모-6-플루오로벤조산(7g, 0.03mol, WO 2011075699에 따라 제조됨) 및 3-아미노-피페리딘-1-카복실산 3급-부틸 에스테르(6.6g, 0.033mol)의 THF(50mL) 중 용액에 트리에틸 오르토포르메이트(6.6g, 0.044mol)를 첨가하였다. 반응 혼합물을 약 110℃에서 밀봉된 튜브에서 밤새 가열하였다. 대략 실온으로 냉각시킨 후, 혼합물을 물로 희석시켰다. 수성 EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(50:1 페트롤리움 에테르: EtOAc로 용리시킴)로 정제하여 3급-부틸 3-(7-브로모-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(6.4g, 50%)를 고체로서 수득하였다.
단계 B: 3급-부틸 3-(7-사이클로프로필-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트
3급-부틸 3-(7-브로모-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(20g, 0.047mol), Pd(OAc)2(0.526g, 0.002mol), 트리사이클로헥실포스핀(1.31g, 0.005mol), 무수 K3PO4(50g, 0.236mol) 및 물(40mL)의 톨루엔(200mL) 중 혼합물에 사이클로프로필보론산(6.06g, 0.07mol)을 첨가하였다. 반응 혼합물을 환류까지 밤새 N2하에 가열하였다. 실온으로 냉각한 후, 혼합물을 물로 희석시켰다. 수성 층을 EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(50:1 페트롤리움 에테르: EtOAc로 용리시킴)로 정제하여 3급-부틸 3-(7-사이클로프로필-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(15g, 83%)를 고체로서 수득하였다.
단계 C: 7-사이클로프로필-5-플루오로-3-(피페리딘-3-일)퀴나졸린-4-(3H)-온 하이드로클로라이드
3급-부틸 3-(7-사이클로프로필-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-카복실레이트(15g, 0.039mmol)의 1M HCl/MeOH(150mL) 중 용액을 약 실온에서 약 2.5시간 동안 교반하였다. 혼합물을 여과하고, 고체를 EtOAc로 세척하고, 건조시켜 7-사이클로프로필-5-플루오로-3-(피페리딘-3-일)퀴나졸린-4(3H)-온 하이드로클로라이드(10g, 91%)를 고체로서 수득하였다.
제조 #34: 2-(벤질옥시)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린
단계 A: 1-(벤질옥시)-4-브로모-2-니트로벤젠
4-브로모-2-니트로페놀(5g, 22.9mmol)의 아세톤(100mL) 중 용액에 (브로모메틸)벤젠(4.7g, 27.5mmol) 및 K2CO3(6.3g, 45.9mmol)를 첨가하였다. 혼합물을 밤새 환류시켰다. 실온으로 냉각한 후, 혼합물을 여과하였다. 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 TBME로 세척하여 1-(벤질옥시)-4-브로모-2-니트로벤젠(6.3g, 89%)을 수득하였다:
단계 B: 2-(벤질옥시)-5-브로모아닐린
1-(벤질옥시)-4-브로모-2-니트로벤젠(2g, 6.5mmol)의 EtOH(80mL) 및 물(20mL) 중 용액에 철(1.8g, 32.5mmol) 및 NH4Cl(1.7g, 32.5mmol)을 첨가하였다. 수득한 혼합물을 3시간 동안 환류시켰다. 혼합물을 여과하였다. 여과물을 물로 희석시키고, EtOAc로 추출하였다. 유기 층을 농축하여 2-(벤질옥시)-5-브로모아닐린(1.6g, 89%)을 수득하였다:
단계 C: 2-(벤질옥시)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린
2-(벤질옥시)-5-브로모아닐린(2.0g, 7.19mmol)의 DMSO(30mL) 중 용액에 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란)(2.2g, 8.6mmol), Pd(dppf)Cl2(0.53g, 0.72mmol) 및 칼륨 아세테이트(2.1g, 21.6mmol)를 첨가하였다. 혼합물을 80℃에서 밤새 N2하에 교반하였다. 실온으로 냉각한 후, 혼합물을 물로 희석시키고, EtOAc로 추출하였다. 유기 층을 농축시키고, 컬럼에 의해 정제하여 2-(벤질옥시)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(1.5g, 64%)을 수득하였다:
제조 #35: 3-(벤질옥시)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린
단계 A: 3-브로모-5-니트로페놀
1-브로모-3-메톡시-5-니트로벤젠(19g, 82mmol)의 DCM(800mL) 중 용액에 DCM(120mL) 중 BBr3(27.9mL, 295mmol)를 적가하였다. 수득한 혼합물을 밤새 환류되도록 가열하였다. 빙수에서 냉각시킨 후, 혼합물을 물을 첨가하여 희석하였다. 이어서, 혼합물을 염수로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 3-브로모-5-니트로페놀(8g, 44%)을 고체로서 수득하였다:
단계 B: 1-(벤질옥시)-3-브로모-5-니트로벤젠
3-브로모-5-니트로페놀의 아세톤(50mL) 중 용액에 (브로모메틸)벤젠(2.4g, 13.8mmol) 및 K2CO3(3.2g, 22.9mmol)를 첨가하였다. 수득한 혼합물을 밤새 환류되도록 가열하였다. 혼합물을 여과하였다. 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 TBME로 세척하여 1-(벤질옥시)-3-브로모-5-니트로벤젠(1.3g, 37%)을 고체로서 수득하였다:
단계 C: 3-(벤질옥시)-5-브로모아닐린
1-(벤질옥시)-3-브로모-5-니트로벤젠(1.3g, 4.2mmol)의 EtOH(30mL) 및 물(7.5mL) 중 용액에 철(1.2g, 21.1mmol) 및 NH4Cl(1.1g, 21.1mmol)을 첨가하였다. 혼합물을 밤새 환류되도록 가열하였다. 혼합물을 여과하였다. 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 물을 첨가하여 희석시키고, EtOAc로 추출하였다. 유기 층을 감압하에 농축하여 3-(벤질옥시)-5-브로모아닐린(1g, 85%)을 수득하였다:
단계 D: 3-(벤질옥시)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린
3-(벤질옥시)-5-브로모아닐린(1g, 3.6mmol) 및 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란)(1.1g, 4.3mmol)의 DMSO(1mL) 중 용액에 Pd(dppf)Cl2(0.26g, 0.36mmol) 및 칼륨 아세테이트(1.1g, 10.8mmol)를 첨가하였다. 혼합물을 약 80℃로 밤새 N2하에 가열하였다. 실온으로 냉각한 후, 혼합물을 물을 첨가하여 희석시키고, EtOAc로 추출하였다. 유기 층을 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 3-(벤질옥시)-5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(1g, 86%)을 고체로서 수득하였다:
제조 #36: 4-(벤질옥시)-1-브로모-2-니트로벤젠
4-브로모-3-니트로페놀(2g, 9.17mmol, 제조 #S.1)의 아세톤(50mL) 중 용액에 BnBr(1.9g, 11.0mmol) 및 K2CO3(2.5g, 18.4mmol)를 첨가하였다. 혼합물을 여과하였다. 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 TBME로 세척하여 4-(벤질옥시)-1-브로모-2-니트로벤젠(2.6g, 92%)을 수득하였다:
제조 #37: 4-(벤질옥시)-1-브로모-2-니트로벤젠
단계 A: 메틸 2-(2-메톡시-2-옥소에틸)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트
플라스크를 디메틸 3-옥소펜탄디오에이트(77.0g, 442mmol), (4-메톡시페닐)메탄아민(60.1mL, 460mmol) 및 무수 NaOAc(72.5g, 884mmol)로 디옥산(100mL) 중에서 채웠다. 반응 혼합물을 약 실온에서 약 30분 동안 교반하고, 이어서, 약 50℃로 가열하고, 약 16시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 디옥산(250mL)을 첨가하였다. 2-클로로아세트알데히드(51.9mL, 442mmol)를 적가 펀넬을 통해 첨가하였다. 약 7시간 후, 추가의 2-클로로아세트알데히드(17.4g, 221mmol)를 첨가하고, 약 16시간 동안 교반하였다. 추가의 2-클로로아세트알데히드(17.4g, 221mmol)를 첨가하고, 약 5시간 동안 교반하고, 추가의 2-클로로아세트알데히드를 첨가하고(25.9mL, 221mmol), 2-클로로아세트알데히드의 최종 분획(25.9mL, 221mmol)을 약 2시간 후에 첨가하고, 약 72시간 동안 교반되게 한다. NaOAc(36.3g, 442mmol)를 첨가하고, 용액을 약 16시간 동안 교반하였다. 반응 혼합물을 빙욕하에 냉각시키고, 빙수를 이에 첨가하였다(약 500mL). 혼합물을 DCM(850mL)으로 추출하였다. 유기 층을 물(4 x 700mL)로 세척하였다. 유기 층을 MgSO4에서 건조시키고, 여과하고, 농축하여 점성 오일을 수득하였다. 조 물질을 섬광 크로마토그래피(3 컬럼 용적을 위해 헵탄을 사용하여, 4 컬럼 용적에 걸쳐 0 내지 25% EtOAc/헵탄, 4 컬럼 용적에 걸쳐 20 내지 35%)로 정제하였다. 순수한 분획을 합하고, 농축하고, 최소량의 Et2O를 첨가하여 생성물의 제1 배치를 침전시키고, 이를 여과하여 수집하였다. 여과물을 불순한 분획과 함게 합하고, 진공하에 농축하고, 이소프로판올로부터 재결정화하여 고체를 수득하고, 이를 여과를 통해 수집하고, 생성물의 제1 배치와 합하였다. 물질을 진공 오븐에서 약 70℃에서 약 16시간 동안 건조시켜 메틸 2-(2-메톡시-2-옥소에틸)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트(28.5g, 20%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.20 min; MS m/z: 318 (M+H)+.
단계 B: 메틸 2-(1-아미노-3-메톡시-3-옥소프로프-1-엔-2-일)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트
플라스크를 NaH(23.3g, 582mmol) 및 THF(500mL)로 채웠다. 혼합물을 약 0℃로 냉각시키고, 메틸 2-(2-메톡시-2-옥소에틸)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트(28g, 88mmol)를 분획으로 첨가하였다. 내부 온도를 첨가 동안 10℃ 아래로 측정하였다. 현탁액을 약 0℃에서 약 1시간 동안 교반하였다. 메틸 포르메이트(7.62mL, 124mmol)를 첨가하였다. 반응 혼합물을 실온으로 가온되도록 하고, 약 16시간 동안 교반하였다. 추가의 메틸 포르메이트(1.09mL, 17.6mmol)를 첨가하고, 혼합물을 실온에서 약 4 내지 5시간 동안 교반하고, 이 시점에서 모든 출발 물질이 소비되었다. 반응물을 얼음에서 냉각시키고, MeOH(5mL)를 첨가하여 켄칭하고, 물을 발포가 멈출때까지 조심스럽게 첨가하였다. 이어서, 혼합물을 pH 약 1로 수성 6N HCl을 사용하여 산성화시키고, 그 동안 플라스크를 빙욕에 유지하였다. 반응 혼합물을 EtOAc(100mL) 및 물(100mL)로 희석시켰다. 수성 층을 분리하고, EtOAc(3x50mL)로 추출하였다. 이어서, 합한 유기 층을 MgSO4에서 건조시키고, 여과하였다. 용매를 증발시켜 2개 층으로 이루어진 오일을 수득하였다. 더 얇은 상부 층은 맑고, 피펫을 사용하여 분리하고, 폐기하였다. 잔류하는 하부 층은 조 중간체, 메틸 2-(1-하이드록시-3-메톡시-3-옥소프로프-1-엔-2-일)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트였다. 플라스크를 이러한 조 메틸 2-(1-하이드록시-3-메톡시-3-옥소프로프-1-엔-2-일)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트(30g, 87mmol) 및 MeOH(300mL)로 채웠다. 암모늄 아세테이트(33.5g, 434mmol)를 첨가하고, 반응 혼합물을 약 4시간 동안 환류시키고, 약 60℃에서 약 72시간 동안 교반하였다. 반응 혼합물을 진공하에 농축하고, 물(200mL) 및 EtOAc(200mL)로 희석시켰다. 생성물의 일부는 침전되고, 여과하여 수집하였다. 유기 층을 분리시키고, 수성 층을 EtOAc(2x80mL)로 다시 추출하였다. 합한 유기 층을 MgSO4에서 건조시키고, 여과하고, 농축하였다. 잔류물을 Et2O(200mL)에 현탁시키고, 약 10분 동안 교반하고, 여과하여 생성물을 수집하였다. 이러한 배치를 이전 침전물과 합하고, 진공 오븐에서 약 70℃에서 약 4시간 동안 건조시켜 메틸 2-(1-아미노-3-메톡시-3-옥소프로프-1-엔-2-일)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트(25.7g, 82%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.88 min; MS m/z: 345 (M+H)+.
단계 C: 메틸 1-(4-메톡시벤질)-4-옥소-4,5-디하이드로-1H-피롤로[3,2-c]피리딘-7-카복실레이트
플라스크를 메틸 2-(1-아미노-3-메톡시-3-옥소프로프-1-엔-2-일)-1-(4-메톡시벤질)-1H-피롤-3-카복실레이트(24.6g, 71.4mmol) 및 t-BuONa(6.87g, 71.4mmol)로 DMA(100mL) 중에서 채웠다. 용액을 약 150℃에서 약 10분 동안 가열하고, 실온으로 냉각시켰다. 이어서, 용액을 빙수(250mL)로 붓고, EtOAc(200mL)로 희석시켰다. 혼합물을 실온에서 약 45분 동안 교반하였다. 형성된 침전물을 여과하고, 물로 세척하고, 이어서, 진공 오븐에서 약 70℃에서 약 16시간 동안 건조시켜 메틸 1-(4-메톡시벤질)-4-옥소-4,5-디하이드로-1H-피롤로[3,2-c]피리딘-7-카복실레이트(18.9g, 85%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.76 min; MS m/z: 313 (M+H)+.
단계 D: 메틸 4-클로로-1H-피롤로[3,2-c]피리딘-7-카복실레이트
메틸 1-(4-메톡시벤질)-4-옥소-4,5-디하이드로-1H-피롤로[3,2-c]피리딘-7-카복실레이트(24g, 76mmol)의 페닐 포스포로디클로리데이트(30.8mL, 206mmol) 중 혼합물을 약 150℃에서 약 30분 동안 가열하였다. LCMS는 에스테르 및 산의 혼합물로의 완전한 전환을 나타내었다. 반응 혼합물을 약 0℃로 냉각시키고, 50% 수성 NaOH를 pH 약 7까지 서서히 첨가하였다. 반응 혼합물을 DCM(3x100mL)으로 추출하였다. 유기 층을 합하고, 감압하에 농축하였다. 잔류물을 Et2O(100mL)에 현탁시키고, 약 30℃에서 약 1시간 동안 교반하고, 실온으로 냉각시키고, 여과하였다. 여과물을 농축하여 조 메틸 4-클로로-1-(4-메톡시벤질)-1H-피롤로 [3,2-c]피리딘-7-카복실레이트(22.5g, 75%)를 흑색 오일로서 수득하였다. 이러한 조 메틸 4-클로로-1-(4-메톡시벤질)-1H-피롤로[3,2-c]피리딘-7-카복실레이트(21.76g, 65.8mmol) 및 트리플산 무수물(7.50mL, 44.4mmol)의 TFA(50mL) 중 혼합물을 약 50℃에서 약 16시간 동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 빙냉 NaHCO3 용액에 첨가하였다. 수성 NaOH를 서서히 가하여 pH를 약 9로 조정하였다. 고체를 여과하고, Et2O에서 초음파처리하였다. 침전물을 여과하고, 여과물을 농축하여 메틸 4-클로로-1H-피롤로[3,2-c]피리딘-7-카복실레이트(9.4g, 68%)를 수득하였다: LCMS (표 1, 방법 a) Rt = 1.83 min; MS m/z: 211 (M+H)+.
제조 #38: 메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-메틸-1H-인돌-7-카복실레이트
단계 A: 1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-메틸-1H-인돌-1,7-디카복실레이트
1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-요오도-1H-인돌-1,7-디카복실레이트(2.0g, 3.5mmol, 제조 #Y.1)의 THF(35mL) 중 용액에 Zn(Me)2(헥산 중 1 M, 21.04mL, 21.04mmol)를 첨가하였다. 혼합물을 질소를 사용하여 탈기하고, Pd(dppf)Cl2(0.257g, 0.351mmol)를 하나의 분획으로 첨가하고, 실온에서 약 19시간 동안 교반하였다. 반응물을 약 45℃로 가온하고, 약 22시간 동안 교반하였다. 반응 혼합물을 포화 수성 NaHCO3(50mL)를 첨가하여 조심스럽게 켄칭하고, EtOAc(50mL) 및 염수(20mL)로 희석시켰다. 층을 분리하고, 수성 상을 EtOAc(2x50mL)로 추출하였다. 합한 유기 추출물을 염수로 세척하고, MgSO4에서 건조시키고, 여과하고, 감압하에 농축하고, 실리카 겔 상 컬럼 크로마토그래피(0 내지 50% EtOAc/헵탄)으로 정제하여 1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-메틸-1H-인돌-1,7-디카복실레이트(1.45g, 79%)를 수득하였다: LCMS (표 1, 방법 ba) Rt = 3.02 min; MS m/z: 476 (M+H)+.
단계 B: 메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-메틸-1H-인돌-7-카복실레이트
1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-메틸-1H-인돌-1,7-디카복실레이트(1.40g, 3.05mmol)의 MeOH(7mL) 중 용액을 마이크로파 반응 바이알에 첨가하고, 용액을 약 120℃로 약 30분 동안 가열하였다. 반응 혼합물을 실리카 겔 상으로 흡수시키고, 실리카 겔 크로마토그래피(0 내지 50% EtOAc/헵탄)를 사용하여 정제하여 메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-메틸-1H-인돌-7-카복실레이트(1g, 86%)를 수득하였다: LCMS (표 1, 방법 as) Rt = 2.58 min; MS m/z: 359 (M+NH4)+.
제조 #39: 메틸 4-(1-(3급-부톡시카보닐)-1,2,5,6-테트라하이드로피리딘-3-일)-1-토실-1H-인돌-7-카복실레이트
플라스크를 메틸 4-(1-(3급-부톡시카보닐)-1,2,5,6-테트라하이드로피리딘-3-일)-1-토실-1H-인돌-7-카복실레이트(2.00g, 3.92mmol, 3급-부틸 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트와 함께 A를 사용하여 제조 #1, 단계 B로부터 제조됨)로 THF(39.2mL) 중에서 채웠다. 용액을 약 -71℃로 냉각시켰다. LDA(헥산/THF 중 1M 용액, 5.88mL, 5.88mmol)를 약 5분에 걸쳐서 적가하면서, 온도를 -65℃ 아래로 유지하였다. 용액을 약 -72℃에서 약 45분 동안 교반하였다. CH3I(0.367mL, 5.88mmol)를 첨가하였다. 혼합물을 약 -70℃에서 추가로 2.5시간 동안 교반하고, 이어서, 포화 수성 Na2CO3 용액(150mL)으로 켄칭하였다. 혼합물을 EtOAc(2 x 200mL) 및 DCM(1 x 100mL)으로 추출하였다. 합한 유기 층을 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하고, 실리카 겔 상 컬럼 크로마토그래피(25 내지 75% EtOAc/헵탄)으로 정제하여 메틸 4-(1-(3급-부톡시카보닐)-1,2,5,6-테트라하이드로피리딘-3-일)-1-토실-1H-인돌-7-카복실레이트(1.67g, 57%, 70% 순도)를 수득하였다: LCMS (표 1, 방법 as) Rt = 2.88 min; MS m/z: 542 (M+NH4)+.
제조 #40: 3급-부틸 3-((7-카바모일-2-요오도-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트
단계 A: 메틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-요오도-1-토실-1H-인돌-7-카복실레이트
메틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-1-토실-1H-인돌-7-카복실레이트(4.00g, 7.79mmol, 3급-부틸-3-아미노아제티딘-1-카복실레이트를 사용한 T 및 CH3I를 사용한 J를 사용하여 제조 #1, 단계 C로부터 제조함)의 THF(60mL) 중 용액에 약 -78℃에서 LDA(THF 중 2M 용액, 5.84mL, 11.7mmol)를 서서히 첨가하였다. 반응물을 약 -78℃에서 약 1시간 동안 교반하고, I2(2.97g, 11.7mmol)의 THF(10mL) 중 용액을 서서히 첨가하고, 반응물을 약 -78℃에서 약 4시간 동안 교반하였다. 냉각 욕을 제거하여 반응물을 실온으로 가온하고, 반응을 포화 수성 Na2S2O3(120mL)를 첨가하여 켄칭하고, 추가의 EtOAc(2 x 150mL)로 추출하고, 염수(2x150mL)로 세척하였다. 합한 유기 상을 무수 Na2SO4로 건조시키고, 여과하고, 감압하에 농축하여 조 생성물, 메틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-요오도-1-토실-1H-인돌-7-카복실레이트(4.1g, 80%)를 수득하였다: LC/MS (표 1, 방법 aa) Rt = 1.87 min; MS m/z: 640 (M+H)+.
단계 B: 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-요오도-1H-인돌-7-카복실산
메틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-요오도-1-토실-1H-인돌-7-카복실레이트(15.5g, 24.2mmol)의 MeOH(75mL):THF(75mL):물(30mL) 중 용액에 KOH(9.52g, 170mmol)를 첨가하였다. 혼합물을 약 60℃에서 약 16시간 동안 교반하고, 냉각시키고, 수성 2N HCl로 산성화시켰다. EtOAc(2 x 350mL)로 추출하고, 염수(2 x 300mL)로 세척하였다. 합한 유기 상을 무수 Na2SO4로 건조시키고, 여과하고, 감압하에 농축하여 조 생성물 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-요오도-1H-인돌-7-카복실산(11.4g, 99%)을 수득하였다: LC/MS (표 1, 방법 aa) Rt = 1.86 min; MS m/z: 416 (M +H-tBu)+.
단계 C: 3급-부틸 3-((7-카바모일-2-요오도-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트
4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-요오도-1H-인돌-7-카복실산(13.7g, 29.1mmol), HOBt(8.90g, 58.1mmol) 및 EDC(11.2g, 58.1mmol)를 DMF(260mL)에 용해시키고, DIEA(25.4mL, 145mmol)를 첨가하였다. 혼합물을 실온에서 약 10분 동안 교반하고, NH4Cl(12.4g, 233mmol)을 첨가하였다. 혼합물을 실온에서 약 16시간 동안 교반하고, 포화 수성 NH4Cl(1 L)을 첨가하였다. 고체를 여과하여 수집하고, 물로 세척하고, 건조시켜 조 생성물 3급-부틸 3-((7-카바모일-2-요오도-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(13.4g, 97%)를 수득하였다: LC/MS (표 1, 방법 aa) Rt = 1.81 min; MS m/z: 471 (M+H)+.
제조 #41: 4-(아제티딘-3-일(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드
반응 바이알을 3급-부틸 3-((7-카바모일-2-요오도-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(0.050g, 0.11mmol, 제조 #40), (Z)-부트-2-엔-1,4-디올(0.014g, 0.16mmol), NaHCO3(10.7mg, 0.128mmol) 및 PdCl2(1.885mg, 10.63 μmol)로 NMP(1.2mL) 중에서 채웠다. 혼합물을 질소로 퍼징하고, 약 130℃에서 약 1시간 동안 가열하였다. EtOAc(2 x 20mL)로 추출하고, 염수(2 x 20mL)로 세척하였다. 합한 유기 상을 무수 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하고, Prep TLC(EtOAc)로 정제하여 조 3급-부틸 3-((7-카바모일-2-(2,3-디하이드로푸란-3-일)-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(0.028g, 39%)를 수득하였다. 3급-부틸 3-((7-카바모일-2-(2,3-디하이드로푸란-3-일)-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(0.055g, 0.081mmol)의 DCM(1.5mL) 중 혼합물을 약 0℃에서 빙욕에서 교반하였다. 트리에틸실란(0.014g, 0.12mmol)을 첨가하고, 이어서, BF3.OEt2(0.015mL, 0.122mmol)를 적가하였다. 혼합물을 약 0℃에서 약 1시간 동안 교반하고, pH 약 8로 되도록 Na2CO3의 포화 수용액로 켄칭하고, 이어서, 여과하였다. 여과물을 Prep HPLC(표 1, 방법 bc)로 정제하여 4-(아제티딘-3-일(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드(0.008mg, 28%)를 수득하였다: LC/MS (표 1, 방법 av) Rt = 1.03 min; MS m/z: 315 (M+H)+.
제조 #42: 메틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-(3-하이드록시옥세탄-3-일)-1-토실-1H-인돌-7-카복실레이트
메틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-1-토실-1H-인돌-7-카복실레이트(0.80g, 1.56mmol, 3급-부틸-3-아미노아제티딘-1-카복실레이트를 사용한 T 및 CH3I를 사용한 J를 사용하여 제조 #1, 단계 C로부터 제조함)의 THF(12mL) 중 냉각된 용액에 약 -78℃에서 LDA(THF 중 2M 용액, 1.168mL, 2.336mmol)를 서서히 첨가하였다. 반응물을 약 -78℃에서 약 1시간 동안 교반하고, 이어서, 옥세탄-3-온(0.168g, 2.34mmol)의 THF(1mL) 중 용액을 서서히 첨가하고, 반응 혼합물을 약 -78℃에서 약 4시간 동안 교반하였다. 냉각 욕을 제거하고, 반응을 포화 수성 NH4CI 용액으로 켄칭하였다. 혼합물을 EtOAc(2x50mL)로 추출하고, 염수(2 x5 0mL)로 세척하였다. 합한 유기 상을 무수 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하고, Prep-TLC(1:1 EtOAc/pet. Et2O)로 정제하여 메틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-2-(3-하이드록시옥세탄-3-일)-1-토실-1H-인돌-7-카복실레이트(0.55g, 59%)를 수득하였다: LC/MS (표 1, 방법 av) Rt = 1.67 min; MS m/z: 586 (M+H)+.
제조 #43: 3급-부틸 2-(7-시아노-1-토실-1H-인돌-4-일)모르폴린-4-카복실레이트
단계 A: 4-브로모-1-토실-1H-인돌-7-카보니트릴
환저 플라스크를 4-브로모-1H-인돌-7-카보니트릴(4.50g, 20.4mmol) 및 THF(75mL)로 채웠다. 용액을 약 0℃로 냉각시키고, 이어서, NaH(광유 중 60% 분산액, 1.22g, 30.5mmol)를 첨가하였다. 용액을 약 0℃에서 약 40분 동안 교반하고, 이어서, 4-메틸벤젠-1-설포닐 클로라이드(4.66g, 24.4mmol)를 첨가하였다. 빙욕을 제거하고, 혼합물을 실온에서 약 15시간 동안 교반하였다. 혼합물을 냉수(약 150mL)로 붓고, 생성물을 EtOAc(4x75mL)로 추출하였다. 합한 추출물을 물(75mL)로 세척하고, MgSO4에서 건조시키고, 여과하고, 감압하에 농축하여 4-브로모-1-토실-1H-인돌-7-카보니트릴(5.74g, 75%)을 수득하였다:
단계 B: 1-토실-4-비닐-1H-인돌-7-카보니트릴
환저 플라스크를 4-브로모-1-토실-1H-인돌-7-카보니트릴(8.54g, 22.8mmol), Na2CO3(7.24g, 68.3mmol) 및 PdCl2(dppf)(1.665g, 2.276mmol)로 채우고, 이어서, THF(70.2mL): MeOH(10.03mL): 물(10.03mL)을 첨가하였다. 반응 혼합물을 N2로 약 15분 동안 퍼징하고, 4,4,5,5-테트라메틸-2-비닐-1,3,2-디옥사보롤란(4.63mL, 27.3mmol)을 첨가하고, 혼합물을 약 70℃로 약 5시간 동안 가열하였다. 혼합물을 실온으로 냉각시키고, DCM(75mL) 및 물(50mL)을 첨가하였다. 층을 분리하고, 수성 층을 DCM(50mL)으로 추출하였다. 합한 추출물을 MgSO4에서 건조시키고, 여과하고, 감압하에 농축하고, DCM으로 용리하는 실리카 겔의 플러그를 통해 통과시키고, 진공하에 농축하였다. 잔류물을 Et2O/EtOAc의 혼합물에 현탁시키고, 여과하고, 이어서, 침전물을 소량의 EtOAc/Et2O로 세척하였다. 이에 따라, 수득한 물질을 진공 오븐에서 건조시켜 1-토실-4-비닐-1H-인돌-7-카보니트릴(5.62g, 77%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.57 min; MS m/z: 323 (M+H)+.
단계 C: 4-(옥시란-2-일)-1-토실-1H-인돌-7-카보니트릴
1-토실-4-비닐-1H-인돌-7-카보니트릴(0.40g, 1.241mmol)의 디옥산(16mL) 및 물(8mL) 중 현탁액 AcOH(0.0710mL, 1.24mmol)를 첨가하였다. 혼합물을 약 0℃로 냉각시켰다. NBS(0.243g, 1.36mmol)를 하나의 분획으로 첨가하였다. 반응물을 실온으로 가온되게 하고, 약 2시간 동안 교반하였다. NaOH(2M 수용액, 8.0mL, 16mmol)를 하나의 분획으로 첨가하였다. 형성된 고체를 여과하여 수집하고, 물로 세척하고, 진공 오븐에서 약 60℃에서 약 16시간 동안 건조시켜 4-(옥시란-2-일)-1-토실-1H-인돌-7-카보니트릴(0.29g, 68%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.36 min; MS m/z: 339 (M+H)+.
단계 C: 4-(1-하이드록시-2-((2-하이드록시에틸)아미노)에틸)-1-토실-1H-인돌-7-카보니트릴
4-(옥시란-2-일)-1-토실-1H-인돌-7-카보니트릴(0.285g, 0.841mmol)의 IPA (8mL) 중 현탁액에 TEA(0.586mL, 4.21mmol), 이어서, 2-아미노에탄올(0.253mL, 4.21mmol)을 첨가하였다. 혼합물을 약 75℃에서 약 3시간 동안 가열하고, 감압하에 농축하였다. 잔류물을 EtOAc 및 물 사이에 분배하였다. 혼합물을 EtOAc(2x10mL)로 추출하였다. 합한 유기 층을 Na2SO4에서 건조시키고, 여과하고, 농축하고, 진공 펌프하에 건조시켜 4-(1-하이드록시-2-((2-하이드록시에틸)아미노)에틸)-1-토실-1H-인돌-7-카보니트릴(0.39g, 94%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.53 min; MS m/z: 400 (M+H)+.
단계 D: 3급-부틸 (2-(7-시아노-1-토실-1H-인돌-4-일)-2-하이드록시에틸)(2-하이드록시에틸)카바메이트
4-(1-하이드록시-2-((2-하이드록시에틸)아미노)에틸)-1-토실-1H-인돌-7-카보니트릴(0.336g, 0.673mmol)의 EtOAc(3mL) 중 용액에 DIEA(0.176mL, 1.01mmol)를 첨가하고, 이어서, 디-3급-부틸 디카보네이트(0.220g, 1.01mmol)의 EtOAc(1mL) 중 용액을 실온에서 적가하였다. THF(1mL)를 혼합물을 용해하는 것을 돕기 위해 첨가하고, 실온에서 약 2시간 동안 교반하였다. 추가의 DIEA(0.060mL, 0.34mmol) 및 디-3급-부틸 디카보네이트(0.073g, 0.34mmol)를 첨가하였다. 혼합물을 실온에서 다시 약 2시간 동안 교반하였다. 용매를 감압하에 제거하고, 섬광 크로마토그래피(25 내지 50% EtOAc/헵탄)로 정제하고, 이어서, HPLC(표 1, 방법 bd)로 정제하여 3급-부틸 (2-(7-시아노-1-토실-1H-인돌-4-일)-2-하이드록시에틸)(2-하이드록시에틸)카바메이트(0.25g, 74%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.22 min; MS m/z: 500 (M+H)+.
단계 E: 3급-부틸 2-(7-시아노-1-토실-1H-인돌-4-일)모르폴린-4-카복실레이트
3급-부틸-(2-(7-시아노-1-토실-1H-인돌-4-일)-2-하이드록시에틸)(2-하이드록시에틸)카바메이트(0.50g, 1.0mmol) 및 PPh3(0.315g, 1.20mmol)를 톨루엔(10mL) 중에서 약 0℃에서 채운 바이알에 TEA(0.367mL, 2.63mmol)를 첨가하고, 이어서, DCAD(0.441g, 1.20 mmol)를 첨가하였다. 용액을 약 0℃ 약 5분 동안 교반하고, 이어서, 약 실온에서 약 16시간 동안 교반하였다. 추가의 PPh3(0.131g, 0.500mmol) 및 DCAD(0.184g, 0.500mmol)를 실온에서 첨가하고, 혼합물을 약 실온에서 약 6시간 동안 교반하였다. 반응 혼합물을 여과하고, 여과물을 농축시키고, 섬광 크로마토그래피(0 내지 30% EtOAc/헵탄)로 정제하여 3급-부틸 2-(7-시아노-1-토실-1H-인돌-4-일)모르폴린-4-카복실레이트(0.41g, 84%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.72 min; MS m/z: 499 (M+H2O)+.
제조 #44: 2-요오도-6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진
단계 A: 2-니트로-6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진
(1-(2-브로모에틸)-3-니트로-1H-피라졸-5-일)메탄올(4.0g, 12mmol)[Princeton]의 NMP(7.7mL) 중 혼합물을 약 130℃에서 약 16시간 동안 가열하였다. 혼합물을 DCM으로 희석시키고, 물 및 염수로 세척하였다. 유기 층을 건조시키고, 농축하고, 실리카 겔 상 크로마토그래피(0 내지 5% MeOH/ DCM)로 정제하여 2-니트로-6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진(1g, 49%)을 수득하였다:
단계 B: 6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-아민
2-니트로-6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진(4.0g, 24mmol)의 EtOAc(59.1mL) 및 MeOH(59.1mL) 중 용액을 첨가 전에, 플라스크를 Pd/C(10 wt%, 0.755g, 0.709mmol)로 질소하에 채웠다. 반응물을 실온에서 약 16시간 동안 교반하였다. 반응 혼합물을 Celite®의 플러그를 통해 여과하고, 여과물을 감압하에 농축하여 6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-아민(3.2g, 97%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 0.61 min; MS m/z: 140 (M+H)+.
단계 C: 2-요오도-6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진
50mL 환저 플라스크를 6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-아민(1.5g, 11mmol) 및 진한 HCl(2.43mL, 29.6mmol)로 채웠다. 혼합물을 약 0℃로 냉각시켰다. NaNO2(0.707g, 10.2mmol)의 물(10mL) 중 용액을 첨가하고, 반응물을 약 15분 동안 교반하였다. KI(2.86g, 17.3mmol)의 물(10mL) 중 용액을 조심스럽게 첨가하고, 반응물을 약 0℃에서 약 1시간 동안 교반하고, 실온에서 약 30분 동안 교반하였다. 반응 혼합물을 EtOAc(20mL) 및 물(20mL)로 희석시키고, 이어서, 수성 층을 분리시켰다. 용액을 실리카 겔 상 크로마토그래피(0 내지 50% EtOAc/헵탄)를 통해 정제하여 2-요오도-6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진(0.996g, 37%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.58 min; MS m/z: 251 (M+H)+.
제조 #45: 메틸 4-클로로-1-토실-1H-피롤로[3,2-c]피리딘-7-카복실레이트
단계 A: 메틸 1-토실-1H-피롤로[3,2-c]피리딘-7-카복실레이트
환저 플라스크를 메틸 1H-피롤로[3,2-c]피리딘-7-카복실레이트(14g, 79mmol) 및 THF(225mL)[Pharmablock]로 채우고, 용액을 약 5℃로 냉각시키고, 이어서, KHMDS(THF 중 1M, 79mL, 79mmol)를 첨가하였다. 이어서, 용액을 약 1시간 동안 교반하고, 이어서, 4-메틸벤젠-1-설포닐 클로라이드(15.2g, 79.0mmol)의 THF(25mL) 중 용액을 첨가하였다. 혼합물을 약 2시간 동안 약 0 내지 5℃에서 교반하고, 이어서, 포화 수성 NH4Cl 및 DCM을 첨가하였다. 층을 분리하고, 유기 용액을 MgSO4에서 건조시키고, 여과하고, 감압하에 농축하고, 실리카 겔 크로마토그래피( 0 내지 50% EtOAc/DCM)로 정제하여 메틸 1-토실-1H-피롤로[3,2-c]피리딘-7-카복실레이트(18.8g, 72%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.10 min; MS m/z: 331 (M+H)+.
단계 B: 7-(메톡시카보닐)-1-토실-1H-피롤로[3,2-c]피리딘 5-옥사이드
환저 플라스크를 메틸 1-토실-1H-피롤로[3,2-c]피리딘-7-카복실레이트(16.0g, 48.4mmol) 및 EtOAc(150mL)로 채웠다. 반응 용액에 3-클로로벤조퍼옥소산(14.2g, 82mmol)의 EtOAc(80mL) 중 용액을 첨가하고, 실온에서 약 16시간 동안 교반하였다. 반응 혼합물에 포화 수성 Na2CO3(50mL)를 첨가하고, 층을 분리하였다. 수성 층을 EtOAc(2x30mL) 및 DCM(2x30mL)으로 추출하였다. 합한 추출물을 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 농후한 오일을 수득하고, 이를 진공 펌프에서 건조시켜 7-(메톡시카보닐)-1-토실-1H-피롤로[3,2-c]피리딘 5-옥사이드(11.6g, 69%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.73 min; MS m/z: 347 (M+H)+.
단계 C: 메틸 4-클로로-1-토실-1H-피롤로[3,2-c]피리딘-7-카복실레이트
환저 플라스크를 7-(메톡시카보닐)-1-토실-1H-피롤로[3,2-c]피리딘 5-옥사이드(11.6g, 33.5mmol) 및 PCl3(26.5mL, 285mmol)로 채우고, 약 60℃로 약 2시간 동안 가열하였다. 용액을 실온으로 냉각시키고, 교반하면서 빙수로 서서히 붓고, 수득한 혼합물을 포화 수성 Na2CO3를 첨가하여 중성화시켰다. 수성 혼합물을 EtOAc(3x40mL)로 추출하고, 합한 추출물을 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 메틸 4-클로로-1-토실-1H-피롤로[3,2-c]피리딘-7-카복실레이트(8.47g, 69%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.46 min; MS m/z: 365 (M+H)+.
제조 #46: 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카복스아미드
단계 A: (E)-에틸 3-(2-브로모티아졸-4-일)아크릴레이트
1 L 환저 플라스크를 에틸 2-(트리페닐포스포라닐리덴)아세테이트(37.2g, 107mmol)로 DCM(130mL) 중에서 채우고 무색 용액을 수득하였다. 용액을 약 0℃로 냉각시키고, 2-브로모티아졸-4-카브알데히드(20.5g, 107mmol)[ArkPharm]의 DCM(500mL) 중 용액을 적가 깔때기를 통해 적가하였다. 반응 혼합물을 실온으로 서서히 가온하고, 약 2시간 동안 교반하고, 이어서, 감압하에 농축하였다. 혼합물을 Et2O(300mL)에 흡수시키고, 약 40℃에서 약 30분 동안 교반하였다. 이어서, 이를 냉각시키고, 여과하고, Et2O(50mL)로 세척하였다. 침전물을 폐기하고, 여과물을 농축하여 용적을 반으로 하였다. 형성된 침전물을 여과하여 수집하여 생성물의 제1 배치를 수득하였다. 여과물을 농축시키고, Et2O를 첨가하고(60mL), 혼합물을 실온에서 약 20분 동안 교반하고, 새로 형성된 침전물을 다시 여과하여 생성물의 제2 배치를 수집하였다. 이 배치로부터의 여과물을 감압하에 농축하고, 실리카 겔 크로마토그래피(0 내지 10% EtOAc/헵탄)로 정제하였다. 이에 따라 수득한 물질을 Et2O로부터 재결정화하여 생성물의 제3 및 최종 배치를 수득하였다. 모든 배치를 합하여 백색 결정성 물질을 수득하고, (E)-에틸 3-(2-브로모티아졸-4-일)아크릴레이트(20.1g, 72%): LC/MS (표 1, 방법 as) Rt = 2.26 min; MS m/z: 262, 264 (M+H)+.
단계 B: (E)-에틸 3-(2-(1-메틸-1H-피라졸-3-일)티아졸-4-일)아크릴레이트
500mL 환저 플라스크를 1-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(20.7g, 100mmol), (E)-에틸 3-(2-브로모티아졸-4-일)아크릴레이트(20.1g, 77.0mmol), Na2CO3(24.4g, 230mmol), PdCl2(dppf)(5.61g, 7.67mmol) 및 (E)-에틸 3-(2-브로모티아졸-4-일)아크릴레이트(20.1g, 77.0mmol)로 채웠다. 고체 혼합물에 THF(150mL): MeOH(21.00mL): 물(21mL)을 첨가하고, 현탁액을 탈기하고, N2로 약 20분 동안 퍼징하였다. 반응 혼합물을 약 75℃에서 약 15시간 동안 가열하였다. 반응물을 여과하고, EtOAc(100mL)로 세척하고, 여과물을 물(70mL)로 세척하였다. 수성 층을 EtOAc(2x70mL)로 추출하고, 합한 유기 상을 MgSO4에서 건조시키고, 여과하고, 농축하였다. 잔류물에 DCM(50mL) 및 헵탄(150mL)을 첨가하였다. 전체 현탁액을 여과하고, 아세톤 및 이소프로판올로 세척하고, 진공 오븐에서 건조시켜 생성물의 제1 배치를 수득하였다. 여과물을 농축시키고, DCM(40mL)에 용해시키고, 실리카 겔 플러그(용리액: 50% EtOAc/헵탄)를 통해 통과시켰다. 여과물을 농축시키고, 아세톤(35mL)에서 환류시키고, 냉각시켰다. 침전물을 여과하고, 이소프로판올로 세척하고, 제1 배치와 합하고, 진공 오븐에서 약 70℃에서 약 16시간 동안 건조시켜 (E)-에틸 3-(2-(1-메틸-1H-피라졸-3-일)티아졸-4-일)아크릴레이트(15.2g, 75%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.94 min; MS m/z: 264(M+H)+.
단계 C: (E)-3-(2-(1-메틸-1H-피라졸-4-일)티아졸-4-일)아크릴산
20mL 반응 바이알에서, (E)-에틸 3-(2-(1-메틸-1H-피라졸-4-일)티아졸-4-일)아크릴레이트(15.2g, 57.7mmol) 및 LiOH(4.15g, 173mmol)을 MeOH(60mL): 물(12mL) 중에서 첨가하였다. 반응 혼합물을 약 40℃에서 약 2시간 동안 교반하였다. 반응 혼합물을 농축시키고, 물(50mL)로 희석시키고, DCM(50x3mL)으로 세척하였다. 수성 층을 더 이상의 침전물이 형성되지 않을 때까지 1N HCl로 산성화시켰다. 침전물을 여과를 통해 수집하고, 진공 오븐에서 약 60℃에서 약 16시간 동안 건조시켜 (E)-3-(2-(1-메틸-1H-피라졸-4-일)티아졸-4-일)아크릴산(12.3g, 91%)을 수득하였다:
단계 D: (E)-3-(2-(1-메틸-1H-피라졸-4-일)티아졸-4-일)아크릴로일 아지드
(E)-3-(2-(1-메틸-1H-피라졸-4-일)티아졸-4-일)아크릴산(11.2g, 47.4mmol)의 아세톤(170mL) 중 현탁액에 TEA(6.61mL, 47.4mmol)를 첨가하고, 혼합물을 빙욕에서 냉각시켰다. 이소부틸 클로로포르메이트(6.22mL, 47.4mmol)를 적가하였다. 약 3.5시간 후, NaN3(3.85g, 59.2mmol)의 물(15mL) 중 용액을 조심스럽게 첨가하고, 반응물을 약 3시간 동안 약 0℃에서 교반하였다. 반응 혼합물을 얼음 위에 붓고, 약 5분 동안 교반하고, 여과하고, 물(50mL)로 세척하였다. 침전물을 진공 오븐에서 약 60℃에서 약 16시간 동안 건조시켜 (E)-3-(2-(1-메틸-1H-피라졸-4-일)티아졸-4-일)아크릴로일 아지드(9.6g, 78%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.91 min; MS m/z: 261(M+H)+.
단계 E: 2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4(5H)-온
250mL 3-구 환저 플라스크를 트리부틸아민(6.10mL, 25.6mmol)으로 디페닐에테르(30mL) 중에서 채웠다. 반응 혼합물을 약 190℃로 가열하고, (E)-3-(2-(1-메틸-1H-피라졸-4-일)티아졸-4-일)아크릴로일 아지드(5.60g, 21.5mmol)의 디페닐에테르(80mL) 중 용액을 조심스럽게 첨가하고, 반응물을 약 5시간 동안 약 190℃에서 교반하였다. 반응 혼합물을 냉각시키고, 페트롤리움 에테르(300mL)로 붓고, 약 5분 동안 교반하고, 여과하였다. 침전물을 진공 오븐에서 약 70℃에서 약 30분 동안 건조하였다. 물질을 Et2O(100mL)에 현탁시키고, 약 50℃에서 약 20분 동안 가열하였다. 이어서, 이를 여과하고, 차가운 Et2O로 세척하였다. 침전물을 진공 오븐에서 약 70℃에서 약 10시간 동안 건조시켜 2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4(5H)-온(3.8g, 76%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.13 min; MS m/z: 233 (M+H)+.
단계 F: 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4(5H)-온
250mL 환저 플라스크에서 MeCN(80mL) 중 2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4(5H)-온(3.7g, 16mmol)을 첨가하여 현탁액을 수득하였다. 반응 혼합물을 교반하면서 약 80℃로 가열하였다. NCS(3.19g, 23.9mmol))의 MeCN(25mL) 중 용액을 적가 깔때기를 통해 적가하고, 반응물을 약 5시간 동안 약 80℃에서 교반하였다. 혼합물을 물(100mL)로 희석시키고, 여과하고, 물(40mL)로 세척하였다. 침전물을 진공 오븐에서 약 70℃에서 약 16시간 동안 건조시켜 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4(5H)-온(3.55g, 84%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.27 min; MS m/z: 267 (M+H)+.
단계 G: 4-브로모-7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘
100mL 3-구 환저 플라스크에서 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4(5H)-온(1.30g, 4.87mmol) 및 POBr3(3.91g, 13.6mmol)의 혼합물을 약 70℃로 약 10분 동안 가열하고, 이어서, 약 120℃로 약 45분 동안 가열하였다. 추가의 POBr3(1.40g, 4.87mmol)를 첨가하고, 약 50분 동안 가열하였다. 혼합물을 빙욕에서 냉각시키고, 여기에 분쇄된 얼음 및 물(40mL)의 혼합물을 조심스럽게 첨가하였다. 혼합물을 실온에서 약 16시간 동안 교반하였다. 현탁액에 DCM(60mL)을 첨가하고, 약 30분 동안 교반하고, 이어서, 여과하여 모든 흑색 고체를 제거하였다. DCM 층을 분리하고, 수성 층을 DCM(2x20mL)으로 추출하였다. 합한 유기 층을 MgSO4에서 건조시키고, 여과하고, 실리카 겔(4 내지 6g) 상에 흡수시켰다. 상기 물질을 실리카 겔 크로마토그래피(1 내지 3% EtOAc/헵탄)로 정제하여 4-브로모-7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘(0.85g, 53%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.20 min; MS m/z: 331 (M+H)+.
단계 H: 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카보니트릴
50mL 환저 플라스크에서, 4-브로모-7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘(0.770g, 2.13mmol), Zn(CN)2(0.168g, 1.44mmol) 및 Pd(PPh3)4(0.174g, 0.151mmol)를 DMF(10mL) 중에서 첨가하였다. 플라스크를 탈기하고, 질소로 퍼징하고, 이어서, 질소하에 약 110℃ 내지 120℃에서 약 50분 동안 열적으로 가열하였다. 반응 혼합물을 물(25mL)로 희석시키고, 약 5분 동안 교반하고, 여과하고, 물(6mL)로 세척하였다. 침전물을 진공 오븐에서 약 70℃에서 약 16시간 동안 건조시켜 조 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카보니트릴(0.67g, 98%)을 수득하였다. MeOH(12mL) 중 NaOH(1M 수용액, 7.29mL, 7.29mmol)를 채운 플라스크에 H2O2(30% 수용액, 1.24mL, 12.2mmol)를 첨가하였다. 이 용액을 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카보니트릴(0.670g, 2.43mmol)을 포함하는 플라스크에 첨가하고, 약 30℃에서 약 5분 동안 교반하였다. 반응 혼합물을 물(51mL)로 희석시키고, 실온에서 약 5분 동안 교반하고, 여과하였다. 침전물을 Et2O로 분쇄하고, 여과하고, 진공 오븐에서 약 16시간 동안 건조시켜 7-클로로-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카복스아미드(0.597g, 84%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.58 min; MS m/z: 294(M+H)+.
제조 #47: 메틸 4-((1R,3R)-3-((3급-부톡시카보닐)아미노)사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트
단계 A: 메틸 4-(3-옥소사이클로펜트-1-엔-1-일)-1-토실-1H-인돌-7-카복실레이트
플라스크를 메틸 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1-토실-1H-인돌-7-카복실레이트(1.74g, 3.82mmol, 제조 #1, 단계 C로부터 비스(피나콜라토)디보론을 사용한 A를 사용하여 제조함)로 2-메틸-THF(18.64mL) 및 물(12.43mL) 중에 채웠다. 혼합물을 약 10℃ 차가운 수욕(water bath)에 냉각시켰다. NaIO4(1.23g, 5.73mmol)를 첨가하고, 반응물을 약 30분 동안 교반하고, 수성 1M HCl(8.41mL, 8.41mmol)을 적가하였다. 혼합물을 실온에서 약 16시간 동안 교반하였다. 추가의 2-메틸-THF(50mL)를 첨가하고, 수성 층을 분리시키고, 유기 층을 10% 수성 Na2S2O3(2x30mL), 포화 수성 NaHCO3(30mL) 및 염수(20mL)로 세척하였다. 이어서, 유기 층을 Na2SO4에서 건조시키고, 여과하고, 농축하여 조 (7-(메톡시카보닐)-1-토실-1H-인돌-4-일)보론산을 수득하였다. 100mL 환저 플라스크에 디옥산(17mL) 중 조 (7-(메톡시카보닐)-1-토실-1H-인돌-4-일)보론산(1.59g, 4.26mmol)을 첨가하였다. Cs2CO3(3.47g, 10.7mmol)의 물(4.26mL) 중 용액을 첨가하고, 혼합물을 질소로 탈기하고, 이어서, PdCl2(PPh3)2(0.209g, 0.298mmol) 및 3-브로모사이클로펜트-2-엔온(1.4mL, 12.8mmol)을 불활성 분위기하에 첨가하였다. 혼합물을 약 80℃에서 약 3시간 동안 가열하고, 이어서, 실온으로 냉각시키고, DCM(100mL) 및 물(50mL)을 첨가하였다. 층을 분리하고, 수성 층을 DCM(2x50mL)으로 추출하였다. 합한 유기 상을 MgSO4에서 건조하였다. 용매를 진공에서 제거하고, 잔류물을 실리카 겔 크로마토그래피(0 내지 60% EtOAc/헵탄)를 사용하여 정제하여 메틸 4-(3-옥소사이클로펜트-1-엔-1-일)-1-토실-1H-인돌-7-카복실레이트(1.2g, 69%)를 수득하였다:
단계 B: (R)-메틸 4-(3-옥소사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트
40mL 반응 바이알에서, (2S,5S)-5-벤질-3-메틸-2-(5-메틸푸란-2-일)이미다졸리딘-4-온(0.190g, 0.703mmol) 및 메틸 4-(3-옥소사이클로펜트-1-엔-1-일)-1-토실-1H-인돌-7-카복실레이트(3.05g, 7.45mmol)를 THF(5.67mL) 중에 첨가하였다. 혼합물을 약 0℃로 냉각시키고, 질소로 탈기하였다. 디-3급-부틸 2,6-디메틸-1,4-디하이드로피리딘-3,5-디카복실레이트(1.05g, 3.40mmol) 및 트리클로로아세트산(0.071mL, 0.70mmol)을 불활성 분위기하에 첨가하였다. 반응 혼합물을 약 4℃에서 약 16시간 동안 교반하였다. 추가의 디-3급-부틸 2,6-디메틸-1,4-디하이드로피리딘-3,5-디카복실레이트(0.420g, 1.36mmol)를 첨가하고, 반응을 냉각하면서 약 72시간 동안 교반하였다. 조 물질을 실리카 겔 상에 흡수시키고, 실리카 겔 크로마토그래피(0 내지 45% EtAOc/헵탄)를 통해 정제하여 (R)-메틸 4-(3-옥소사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트(1g, 79%)를 수득하였다.
단계 C: 메틸 4-((1R,3S)-3-하이드록시사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트
200mL 환저 플라스크에서, THF(32.4mL) 중 (R)-메틸 4-(3-옥소사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트(1.60g, 3.89mmol)를 첨가하였다. 용액을 약 -78℃로 냉각시켰다. L-셀렉트라이드(7.78mL, 7.78mmol)를 약 20분 동안 적가하고, 혼합물을 약 16시간 동안 교반하였다. 반응 혼합물을 빙욕에서 냉각시키고, 포화 수성 NH4Cl(60mL)을 적가하고, 이어서, EtOAc(100mL) 및 물(20mL)을 첨가하였다. 유기 층을 분리시키고, 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하고, 실리카 겔 크로마토그래피(0 내지 65% EtOAc/헵탄)를 통해 정제하였다. 수득한 잔류물을 키랄 크로마토그래피(표 2, 방법 19)를 사용하여 정제하여 메틸 4-((1R,3S)-3-하이드록시사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트(0.36g, 22%)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 2.21 min; MS m/z: 431(M+H2O)+.
단계 D: 메틸 4-((1R,3R)-3-((3급-부톡시카보닐)아미노)사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트
40mL 반응 바이알에서, THF(3.4mL) 중 메틸 4-((1R,3S)-3-하이드록시사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트(0.35g, 0.85mmol) 및 PPh3(0.266g, 1.02mmol)를 첨가하였다. 용액을 약 10℃로 냉각시키고, DIEA(0.148mL, 0.846mmol)를 첨가하고, 이어서, DIAD(0.197mL, 1.02mmol)를 적가하고, 반응 혼합물을 약 30분 동안 교반하였다. 디페닐 포스포르아지데이트(0.219mL, 1.02mmol)를 적가하고, 실온에서 약 3시간 동안 교반하였다. PPh3(0.289g, 1.10mmol)의 THF(0.6mL) 중 용액을 적가하고, 혼합물을 약 18시간 동안 교반하였다. 물(0.183mL, 10.2mmol)을 첨가하고, 혼합물을 약 45℃에서 약 72시간 동안 가열하였다. 반응 혼합물에 DCM(10.7mL, 166mmol) 및 칼륨 수소포스페이트(0.737g, 4.23mmol)의 물 중 용액(2.14mL, 119mmol)을 첨가하였다. 디-3급-부틸 디카보네이트(0.393mL, 1.69mmol)의 DCM 중 용액(2.14mL, 33.2mmol)을 적가하고, 실온에서 약 1시간 동안 교반하였다. 염수(2mL)를 첨가하고, 유기 층을 분리시키고, 염수(3mL)로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하고, 실리카 겔 크로마토그래피(0 내지 40% EtOAc/헵탄)를 통해 정제하여 메틸 4-((1R,3R)-3-((3급-부톡시카보닐)아미노)사이클로펜틸)-1-토실-1H-인돌-7-카복실레이트(0.396g, 59%)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 2.72 min; MS m/z: 530 (M+H2O)+.
제조 #48: 3급-부틸 3-((7-카바모일-2-(5-(모르폴리노메틸)피리딘-2-일)-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트
4-((6-브로모피리딘-3-일)메틸)모르폴린(0.300g, 1.17mmol)의 THF(5mL) 중 혼합물에 n-BuLi(1.17mL, 2.92mmol)를 첨가하였다. 혼합물을 약 -78℃에서 약 1시간 동안 교반하고, 이어서, 트리부틸클로로스타난(0.949g, 2.92mmol)을 서서히 첨가하였다. 혼합물을 실온으로 약 1시간 동안 가온되게 하고, NH4Cl의 포화 용액을 첨가하였다. 혼합물을 EtOAc로 추출하고, 합한 유기 층을 Na2SO4에서 건조시키고, 여과하고, 진공에서 농축하여 조 4-((6-(트리부틸스타닐)피리딘-3-일)메틸)모르폴린을 수득하였다. DMF(2mL) 중 3급-부틸 3-((7-카바모일-2-요오도-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(0.300g, 0.638mmol, 제조 #40)를 포함하는 용액을 LiCl(0.270g, 6.38mmol), PdCl2(dppf)-CH2Cl2 첨가물(adduct)(0.156g, 0.191mmol) 및 4-((6-(트리부틸스타닐)피리딘-3-일)메틸)모르폴린(0.894g, 1.91mmol)으로 처리하였다. 혼합물을 약 100℃에서 약 16시간 동안 가열하고, 냉각시키고, Celite®를 통해 여과하고, EtOAc 및 물 사이에 분배하였다. 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하였다. 잔류물을 실리카 겔 크로마토그래피(0 내지 5% MeOH/DCM)로 정제하여 3급-부틸 3-((7-카바모일-2-(5-(모르폴리노메틸)피리딘-2-일)-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(0.172g, 11%)를 수득하였다: LCMS (표 1, 방법 av) Rt = 1.24 min; MS m/z: 521 (M+H)+.
제조 #49: 3급-부틸 6-(7-카바모일-1H-피롤로[2,3-c]피리딘-4-일)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트
3급-부틸 6-(7-시아노-1-토실-1H-피롤로[2,3-c]피리딘-4-일)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(0.973g, 1.97mmol, 3급-부틸 6-(((트리플루오로메틸)설포닐)옥시)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(제조 # W.1)로부터 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란 및 제조 #AH.1을 사용한 AG를 사용하여 제조함)의 EtOH(3.93mL) 중 용액에 약 0℃에서 NaOH(1N 수용액, 7.87mL, 7.87mmol), 이어서, H2O2(30% 수용액, 1.12mL, 9.84mmol)를 첨가하였다. 약 10분 후 빙욕을 제거하였다. 약 1시간 후 추가의 NaOH(1N 수용액, 7mL, 7mmol) 및 H2O2(30% 수용액, 1.00mL, 8.82mmol) 및 DCM(3mL)을 첨가하였다. 반응 혼합물을 약 1시간 동안 교반하고, 약 15mL로 농축되게 하고, 물(10mL) 및 DCM(20mL)로 희석시켰다. 현탁액을 여과하여 모든 고체를 제거하였다. DCM 층을 분리시키고, MgSO4에서 건조시키고, 여과하고, 농축하고, 실리카 겔 크로마토그래피를 통해 정제하여 3급-부틸 6-(7-카바모일-1H-피롤로[2,3-c]피리딘-4-일)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(0.138g, 20%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.90 min; MS m/z: 359 (M+H)+.
일반적 절차 A: 아릴 또는 헤테로아릴 할라이드의 아릴 또는 헤테로아릴 보론산 또는 보로네이트와의 스즈키 반응
아릴 할라이드(바람직하게는 1당량), 보론산 또는 보로네이트 에스테르(1 내지 2당량, 바람직하게는 1.1당량), 및 무기 염기(예를 들면, KF, Na2CO3, K2CO3 또는 Cs2CO3, 바람직하게는 Na2CO3 또는 Cs2CO3)(1.1 내지 16당량, 바람직하게는 2당량)의 용매(예를 들면, THF, DME, DMF, 1,4-디옥산, 1,4-디옥산/물, DME/물, 1,4-디옥산/물, 톨루엔/EtOH/물, 1,4-디옥산/EtOH/물 또는 THF/MeOH/물 바람직하게는 THF/MeOH/물, 1,4-디옥산/물, DME/물 또는 1,4-디옥산/EtOH/물) 중 혼합물에 팔라듐 촉매(예를 들면, Pd(OAc)2, Pd2dba3, Pd(PPh3)4, 비스(아세테이토)트리페닐포스핀팔라듐(II), 중합체-결합된 FibreCatTM 1032, SiliaCat DPP-Pd, PdCl2(dppf), (1,1'-비스(디페닐포스피노)페로센)디클로로팔라듐(II), 또는 Pd(PPh3)2Cl2; 바람직하게는 PdCl2(dppf), (1,1'-비스(디페닐포스피노)페로센)디클로로팔라듐(II), 또는 SiliaCat DPP-Pd 0.01 내지 0.20당량, 바람직하게는 0.1당량)를 첨가하고, 리간드(예를 들면, 트리사이클로헥실포스핀, 트리-3급-부틸-포스핀; 바람직하게는 없음 또는 트리사이클로헥실포스핀; 0.01 내지 1.0당량, 바람직하게는 0.16당량)를 임의로 첨가한다. 혼합물을 약 40 내지 120℃(바람직하게는 약 70 내지 85℃)에서 약 1 내지 48시간(바람직하게는 약 24시간)동안 열적으로, 또는 약 100 내지 200℃(바람직하게는 약 120 내지 150℃)에서 약 5 내지 60분 동안(바람직하게는 약 20 내지 45분) 마이크로웨이브(바람직하게는 5분 램프(ramp) 시간, 300 Watts 최대 전력, 250 psi 최대 압력)에서 가열한다. 혼합물을 실온으로 냉각되게 하고, 다음 방법 중 하나를 사용하여 후처리한다. 방법 1. 물을 함유하는 반응에 대해, 혼합물을 유기 용매(예를 들면, DCM 또는 EtOAc)로 희석시킬 수 있다. 층을 분리시키고, 유기 용액을 임의로 물 및/또는 염수로 세척하고, 무수 MgSO4 또는 Na2SO4로 건조시키고, 여과하고, 용매를 감압하에 제거하여 목적하는 화합물을 수득하였다. 방법 2. 혼합물을 감압하에 농축한다. 방법 3. 촉매를 여과하여 제거하고, 여과물을 감압하에 농축한다.
일반적 절차 A의 예시
제조 #A.1: 4-(3-아미노페닐)-1H-인돌-7-카복스아미드
용기를 4-브로모-1H-인돌-7-카복스아미드(2.08g, 8.70mmol, 제조 #2), 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(2.10g, 9.57mmol), 탄산나트륨(2.77g, 26.1mmol), [1,1'-비스(디페닐포스피노)페로센]디클로로팔라듐(II)(0.637g, 0.870mmol)으로 채우고, 질소로 퍼징하였다. THF(71.4mL), MeOH(10mL), 및 물(10mL)의 혼합물을 첨가하고, 반응물을 약 70℃에서 약 24시간 동안 교반하였다. 혼합물을 Celite®를 통해 여과하고, 용매를 감압하에 제거하고, 잔류물을 MeOH/DCM(0 내지 10%)로 용리된 실리카 겔 상 컬럼 크로마토그래피로 정제하여 고체를 수득하였다. 고체를 에테르로 분쇄하여 4-(3-아미노페닐)-1H-인돌-7-카복스아미드(1.37g, 63%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 0.76 min; MS m/z: 293(M+MeCN+H)+.
표 A.1 N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)아크릴아미드(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린 및 아크릴로일 클로라이드로부터 E를 사용하여 제조함)로부터 일반적 절차 A를 사용하여 제조한 실시예
표 A.2 N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드(제조 #4)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.3 2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-브로모-1H-인돌-7-카복스아미드(4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1) 및 1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-일)에타논[Combi-Blocks]를 사용한 A를 사용하여 제조됨)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.4 4-브로모-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(제조 #18)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.5 4-브로모-1H-인돌-7-카복스아미드(제조 #2)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.6: 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인돌-7-카복스아미드(제조 #P.1)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.7 4-요오도-2-(피리딘-3-일)-1H-인돌-7-카복스아미드(실시예 #F.1)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.8 4-요오도-2-(p-톨릴)-1H-인돌-7-카복스아미드(1-(p-톨릴)에타논으로부터 F를 사용하여 제조됨)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.9 4-요오도-2-(p-톨릴)-1H-인돌-7-카복스아미드(1-(4-플루오로페닐)에타논을 사용하여 F로 제조됨)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.10 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드(4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1)로부터 1-메틸-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸을 사용한 A를 사용하여 제조함)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.11: 4-브로모-2-(3,6-디하이드로-2H-피란-4-일)-1H-인돌-7-카복스아미드(4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1) 및 2-(3,6-디하이드로-2H-피란-4-일)-4,4,5,5-테트라메틸-1,3,2-디옥사보롤란으로부터 A를 사용하여 제조됨)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.12: 4-브로모-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드(4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1) 및 2-(4-플루오로페닐)-4,4,5,5-테트라메틸-1,3,2-디옥사보롤란으로부터 A를 사용하여 제조됨)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.13: 4-브로모-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드(4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1) 및 5-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)피리미딘으로부터 A를 사용하여 제조됨)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.14: 4-브로모-2-(1-(2-하이드록시-2-메틸프로필)-1H-피라졸-4-일)-1H-인돌-7-카복스아미드(4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1) 및 2-메틸-1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸-1-일)프로판-2-올(제조 #26)로부터 A를 사용하여 제조됨)로부터 일반적 절차 A를 사용하여 제조된 실시예
표 A.15: 2-(3-클로로-2-(하이드록시메틸)페닐)-6-사이클로프로필-8-플루오로이소퀴놀린-1(2H)-온[U.S. 20100222325]으로부터 일반적 절차 A를 사용하여 제조된 실시예
일반적 절차 B: 아민을 사용한 아릴 할라이드의 친핵성 치환
아릴 할라이드 또는 헤테로아릴 할라이드의 용액 및 적합한 유기 용매(예를 들면, DMSO, 1,4-디옥산, n-부탄올, THF, 피리딘, 바람직하게는 DMSO 또는 피리딘)에 아민(1 내지 10당량, 바람직하게는 1당량) 및 염기(예를 들면, TEA, 피리딘, DIEA, K2CO3, 바람직하게는 TEA; 1 내지 5당량, 바람직하게는 1당량)를 첨가하였다. 수득한 용액을 약 20 내지 150℃(바람직하게는 약 130 내지 150℃)에서 열적으로 약 1시간 내지 72시간(바람직하게는 약 24시간) 동안 또는 마이크로웨이브에서 약 5분 내지 2시간(바람직하게는 약 30분) 동안 가열한다. 혼합물을 진공하에 또는 가온 질소 스트림하에서 임의로 농축하여 중간체 또는 표적 화합물을 수득하거나, 매질(예를 들면, SiCO3 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH, DMSO, 1:1 MeOH/DMSO, 2:1 MeOH/DMSO)로 세정하고, 이어서, 진공하에 또는 가온 질소 스트림하에서 임의로 농축시켜 목적 화합물을 수득한다. .
일반적 절차 B의 예시
제조 #B.1: (R)-3급-부틸 1-(7-시아노-1H-인돌-4-일)피페리딘-3-일카바메이트
(R)-3급-부틸 피페리딘-3-일카바메이트(1.501g, 7.49mmol) 및 4-플루오로-1H-인돌-7-카보니트릴(0.6g, 3.75mmol)의 피리딘(3.02mL, 37.5mmol) 중 혼합물을 약 150℃ 약 30분 동안 마이크로파 오븐에서 가열하였다. 혼합물을 증발시켜 건조시키고, 수득한 잔류물을 헥산 중 EtOAc의 30 내지 100%의 구배로 용리되는 실리카 겔 크로마토그래피로 정제하여 (R)-3급-부틸 1-(7-시아노-1H-인돌-4-일)피페리딘-3-일카바메이트(0.4g, 31%)를 수득하였다; LC/MS (표 1, 방법 g) Rt = 1.69 min.; MS m/z: 341 (M+H)+
일반적 절차 C: 에스테르의 카복실산으로의 가수분해
에스테르(바람직하게는 1당량)를 순수하게 또는 유기 용매(예를 들면, 1,4-디옥산, MeOH, 또는 THF/MeOH, 바람직하게는 1,4-디옥산) 중에 포함하는 플라스크에 수성 염기(예를 들면, 수성 NaOH 또는 LiOH; 1 내지 10당량, 바람직하게는 2 내지 6당량)를 첨가한다. 혼합물을 약 0 내지 100℃(바람직하게는 약 25 내지 60℃)에서 약 1 내지 48시간(바람직하게는 약 4 내지 24시간) 동안 교반한다. 유기 용매를 임의로 진공에서 농축한다. 이어서, 혼합물을 적합한 수성 산(예를 들면, 수성 HCl)을 첨가하여 산성화한다. 침전물이 형성되면, 이를 여과하여 수집하여 생성물을 수득할 수 있다. 혼합물 또는 여과물을, 고체가 생성물이 아닌 경우, 임의로 진공에서 농축하여 목적 화합물을 카복실레이트 염으로서 수득할 수 있다. 대안적으로, 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 목적 화합물로서 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 C의 예시
실시예 #C.1: (E)-4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-엔산
(E)-메틸 4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-에노에이트(0.610g, 1.68mmol, 실시예 #D.1)를 1,4-디옥산(8.39mL)에 현탁시켰다. 수산화리튬(물 중 1M, 8.39mL, 8.39mmol)을 첨가하고, 혼합물을 약 60℃에서 약 1시간 동안 교반하였다. 반응물을 약 8mL로 농축하여 물(10mL)로 희석시켰다. pH를 1N HCl을 사용하여 약 4로 조정하였다. 고체를 수집하고, 물로 세척하고, 진공하에 건조시켜 (E)-4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-엔산(0.45g, 77%)을 고체로서 수득하였다. 50mg의 조 생성물을 분취용-HPLC(표 1, 방법 af)로 추가로 정제하여 30.9mg을 수득하여 분석적으로 순수한 (E)-4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-엔산을 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.64 min; MS m/z: 350 (M+H)+ (Btk IC50 = C)
일반적 절차 D: 아민 및 카복실산으로부터 아미드의 형성
플라스크에 특정한 순서 없이, 카복실산 또는 카복실레이트 염(1 내지 5당량, 바람직하게는 1.1 내지 1.5당량), 아민(1 내지 5당량, 바람직하게는 1 내지 1.5당량), 유기 용매(예를 들면, DCM, DCE, THF, 또는 1,4-디옥산, DMF, DMF/피리딘 바람직하게는 DCM 또는 DMF/피리딘), 펩타이드 커플링 시약(예를 들면, BOP-Cl, HATU, EDC, DCI, PyBOP, 또는 EDCㆍHCl, 바람직하게는 HATU 또는 EDC; 1 내지 10당량, 바람직하게는 1 내지 2.5당량), 염기(예를 들면, TEA, DIEA, 피리딘 또는 DIEA, 바람직하게는 DIEA; 1 내지 20당량, 바람직하게는 1 내지 5당량) 및 임의로 HOBt(0 내지 5당량, 바람직하게는 0 내지 1당량)를 첨가한다. 이어서, 혼합물을 약 10 내지 60℃(바람직하게는 약 25 내지 50℃)에서 약 5분 내지 48시간(바람직하게는 약 5분 내지 24시간) 동안 교반한다. 임의로, 추가 양의 상기 시약을 첨가하여 반응을 완료시킬 수 있다. 혼합물을 임의로 진공에서 농축하여 목적 화합물을 수득한다. 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득하였다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 생성물을 분할(partition)하지 않는 경우, 혼합물을 5분 내지 1시간(바람직하게는 30분) 동안 교반할 수 있고, 고체를 진공 여과를 통해 수집할 수 있다. 대안적으로, 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 D의 예시:
실시예 #D.1: (E)-메틸 4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-에노에이트
(E)-4-메톡시-4-옥소부트-2-엔산(0.43g, 3.28mmol)의 DCM(40mL) 중 용액 및 DIEA(0.59mL, 3.58mmol)에 HATU(1.362g, 3.58mmol)를 첨가하였다. 혼합물을 실온에서 5분 동안 교반하고, 이어서, 4-(3-아미노페닐)-1H-인돌-7-카복스아미드(0.75g, 2.98mmol, 제조 #A.1)를 첨가하였다. 혼합물을 실온에서 약 3시간 동안 교반하였다. 혼합물을 농축시키고, 잔류물을 물 및 EtOAc 사이에 현탁시켰다. 혼합물을 실온에서 약 30분 동안 교반하고, 여과하여 고체를 수집하고, 이를 물 및 EtOAc로 세척하고, 진공하에 건조시켜 (E)-메틸 4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-에노에이트(0.64g, 59%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.45 min; MS m/z: 364 (M+H)+ (Btk IC50 = A)
표 D.1 N-(3-(2-(2-(아미노메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(실시예 #1)로부터 일반적 절차 D를 사용하여 제조된 실시예
표 D.2 아민 및 2-(3-옥소벤조[d]이소티아졸-2(3H)-일)아세트산[Matrix]으로부터 일반적 절차 D를 사용하여 제조된 실시예
표 D.3 N-(3-(3-아미노-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(제조 #7)로부터 일반적 절차 D를 사용하여 제조된 실시예
표 D.4 (E)-4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-엔산(실시예 #C.1)으로부터 일반적 절차 D를 사용하여 제조된 실시예
표 D.5 산 및 2-(1-아세틸피페리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드(실시예 #L.1)로부터 일반적 절차 D를 사용하여 제조된 실시예
표 D.6 4-(3-아미노페닐)-1H-인돌-7-카복스아미드(제조 #A.1)로부터 일반적 절차 B를 사용하여 제조된 실시예
표 D.7: 4-(3-아미노-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(실시예 #A.4.5)로부터 일반적 절차 D를 사용하여 제조된 실시예.
표 D.8: 4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드(실시예 #16)로부터 일반적 절차 D를 사용하여 제조된 화합물.
표 D.9 (Z)-4-((3-(7-카바모일-1H-인돌-4-일)페닐)아미노)-4-옥소부트-2-엔산(제조 #14)으로부터 일반적 절차 D를 사용하여 제조된 실시예
표 D.10. 프로피올산으로부터 아민을 사용한 일반적 절차 D를 사용하여 제조된 실시예
일반적 절차 E: 아민 및 산 할라이드 또는 무수물로부터 아미드의 형성
임의로 하이드로클로라이드 염으로서 아민(1 내지 3당량, 바람직하게는 1 내지 3당량)의 유기 용매(예를 들면, DCM, DCE, DMF, DMA, NMP, THF, Et2O 또는 1,4-디옥산, 바람직하게는 DMF, DMA, 또는 DCM) 중 용액에 염기(예를 들면, TEA, DIEA 또는 피리딘; 1 내지 4당량, 바람직하게는 TEA 또는 DIEA 1 내지 3당량) 및 산 할라이드 또는 무수물(1 내지 4당량, 바람직하게는 1 내지 4당량)을 첨가한다. 산 할라이드 또는 무수물의 첨가 전에 혼합물을 임의로 약 0℃로 냉각한다. 혼합물을 약 0 내지 60℃(바람직하게는 약 0 내지 50℃)에서 약 5분 내지 20시간(바람직하게는 약 20분 내지 2시간) 동안 교반되게 한다. 혼합물을 임의로 AcOH로 중성화한다. 혼합물을 임의로 진공에서 농축하여 최종 화합물을 수득한다. 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득하였다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다. 대안적으로, 반응물의 농축으로부터 잔류물을 물에 현탁시키고, 초음파처리하고, 진공 여과를 통해 수집한다.
일반적 절차 E의 예시:
실시예 #E.1. 4-(3-아크릴아미도-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드
바이알에 DCM(5mL) 중 4-(3-아미노-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드(0.189g, 0.496mmol, 실시예 #21), 및 DIEA(0.129mL, 0.743mmol)를 첨가하였다. 혼합물을 약 0℃로 냉각시키고, 아크릴로일 클로라이드(0.044mL, 0.545mmol)를 교반하면서 첨가하였다. 혼합물을 실온으로 약 20분 동안 가온하고, 이어서, 농축하고, 잔류물을 물(30mL)에 현탁시켰다. 현탁액을 약 5분 동안 음파처리하고, 여과하고, 물, 에테르로 세척하고, 진공하에 건조하였다. 조 생성물을 실리카 겔 컬럼에 첨가하고, 헵탄/EtOAc(0 내지 100%)로 용리하여 4-(3-아크릴아미도-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드(0.16g, 74%)를 수득하였다: LC/MS (표 1, 방법 g) Rt = 3.02 min; MS m/z: 436 (M+H)+. (BTK IC50 = A)
표 E.1. 아크릴로일 클로라이드로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.2 4-(3-아미노페닐)-1H-인돌-7-카복스아미드로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.3. 4-(2-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(실시예 #A.4.2)로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.4 N-(3-(2-(2-(아미노메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(실시예 #1)로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.5 N-(3-(3-아미노-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(제조 #7)로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.6. 에틸 카보노-클로리데이트로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.7 2-옥소프로파노일 클로라이드(피루브산 및 1,1-디클로로디메틸 에테르[합성, 1975, 3 163-164]로부터 제조됨)로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.8 아세틸 클로라이드로부터 일반적 절차 E를 사용하여 제조된 실시예
표 E.9. 아크릴로일 클로라이드로부터 아민을 사용한 일반적 절차 E를 사용하여 제조된 실시예
표 E.9.1. 아크릴로일 클로라이드로부터 아민을 사용한 일반적 절차 E를 사용하여 제조된 실시예
표 E.10. 프로피오닐 클로라이드로부터 아민을 사용한 일반적 절차 E를 사용하여 제조된 실시예
일반적 절차 F: 4-요오도인돌-7-카복스아미드의 형성
2-아미노-4-니트로벤조산(바람직하게는 1당량)의 MeOH 중 용액에 진한 황산(바람직하게는 1당량)을 서서히 첨가하였다. 수득한 용액을 약 75℃에서 약 3일 동안 가열한다. 냉각 후, 반응물을 수성 NaOH 용액을 첨가하여 pH 약 10까지 중화시킨다. 반응물을 EtOAc로 추출하고, 무수 황산나트륨에서 건조시키고, 여과하고, 농축한다. 이 중간체(바람직하게는 1당량)에 메틸 케톤(1 내지 2당량, 바람직하게는 2당량) 및 유기 용매(바람직하게는 디메틸 설폭사이드)를 첨가한다. 반응물을 약 -15℃로 냉각시킨다. 염기(바람직하게는 칼륨 3급-부톡사이드 2당량)를 첨가한다. 약 2.5시간 동안 실온에서 교반한 후, 반응물을 포화 수성 염화암모늄 용액으로 켄칭시키고, 이어서, 약 1시간 동안 실온에서 교반한다. 수득한 현탁액을 여과하고, 물로 세척하고, 고체를 고진공하에 건조시킨다. 이 중간체(바람직하게는 1당량)에 ((1H-벤조[d][1,2,3]트리아졸-1-일)옥시)트리(피롤리딘-1-일)포스포늄 헥사플루오로포스페이트(V)(바람직하게는 2당량), 하이드록시벤조트리아졸 하이드레이트(바람직하게는 2당량) 및 염화암모늄(바람직하게는 1.5당량) 및 유기 용매(바람직하게는 DMF)를 첨가한다. 유기 염기(바람직하게는 디이소프로필에틸아민, 4당량)를 첨가한다. 반응 혼합물을 실온에서 밤새 교반한다. 혼합물을 물로 붓고, 수득한 침전물을 여과하고, 물 및 EtOAc로 세척하고, 수집한다. 이 중간체(바람직하게는 1당량)에 유기 용매(바람직하게는 MeOH)를 첨가하고, 용액을 질소로 퍼징한다. 이 용액에 탄소 상 10% 팔라듐(바람직하게는 0.1당량)을 첨가한다. 수득한 현탁액을 수소(30 psi)로 처리한다. 밤새 실온에서 교반 후, 반응물을 여과하고, 고체를 MeOH로 세정한다. 여과물을 농축한다. 질산나트륨(바람직하게는 2.2당량)의 물 중 용액을 이 중간체의 유기 용매(바람직하게는 MeCN) 중 빙냉 현탁액(바람직하게는 1당량) 및 2N HCl(바람직하게는 5.4당량)에 교반하면서 첨가하고, 온도를 약 -5℃ 아래로 유지한다. 약 30분 동안 교반한 후, 수성 요오드화칼륨(바람직하게는 2.5당량)의 냉각된 용액을 반응물에 첨가하고, 수득한 혼합물을 실온에서 약 30분 동안 교반한다. 반응물 약 85℃에 약 5분 동안 가열한다. 반응물을 실온으로 냉각시키고, 포화 수성 중탄산나트륨으로 pH 8로 중화시킨다. 혼합물을 DCM으로 추출한다. 유기 층을 염수로 세척하고, 황산나트륨에서 건조시키고, 여과하고, 농축한다. 잔류물을 섬광 크로마토그래피(바람직하게는 실리카 겔, 페트롤리움 에테르)로 정제하여 목적 화합물을 수득한다.
일반적 절차 F의 예시
실시예 #F.1: 4-요오도-2-(피리딘-3-일)-1H-인돌-7-카복스아미드
2-아미노-4-니트로벤조산(102g, 560mmol)의 MeOH(1.5 L) 중 용액에 진한 황산(0.030 L, 560mmol)을 서서히 첨가하였다. 수득한 용액을 약 75℃에서 약 3일 동안 가열하였다. 냉각 후, 생성물은 수성 NaOH 용액을 첨가하여 pH 약 10까지 중화시킨다. 조 생성물을 EtOAc로 추출하고, 무수 황산나트륨에서 건조하고, 여과하고, 농축하여 메틸 2-아미노-4-니트로벤조에이트(100g, 91%)를 수득한다. LC/MS(표 1, 방법 ar) Rt = 1.85 min; MS m/z 197.1 (M+H)+. 이 물질(25g, 127mmol) 및 1-(피리딘-3-일)에타논(30.9g, 255mmol)의 디메틸 설폭사이드(150mL) 중 분획에 약 -15℃에서 칼륨 3급-부톡사이드(28.6g, 255mmol)를 첨가하였다. 약 2.5시간 동안 실온에서 교반한 후, 반응을 포화 수성 염화암모늄 용액(100mL)으로 켄칭하고, 이어서, 약 1시간 동안 실온에서 교반하였다. 수득한 현탁액을 여과하고, 물로 세척하고, 고진공하에 건조시켜 4-니트로-2-(피리딘-3-일)-1H-인돌-7-카복실산(22.4g, 34%)을 수득하였다. LC/MS (표 1, 방법 ab) Rt = 1.50 min; MS m/z 284.1 (M+H)+. 이 물질(26.9g, 95mmol), ((1H-벤조[d][1,2,3]트리아졸-1-일)옥시)트리(피롤리딘-1-일)포스포늄 헥사플루오로포스페이트(V)(99g, 190mmol), 하이드록시벤조트리아졸 하이드레이트(29.1g, 190mmol) 및 염화암모늄(7.62g, 142mmol)의 DMF(150mL) 중 혼합물에 디이소프로필에틸아민(66.3mL, 380mmol)을 첨가하였다. 반응 혼합물을 실온에서 밤새 교반하였다. 혼합물을 1000mL 물에 붓고, 침전물을 여과하고, 물 및 EtOAc로 세척하고, 수집하여 4-니트로-2-(피리딘-3-일)-1H-인돌-7-카복스아미드(17.48g, 56%)를 수득하였다. LC/MS (표 1, 방법 ar) Rt = 1.44 min; MS m/z 283.1 (M+H)+. 이 물질(17.5g, 52.6mmol)의 MeOH(1.5 L) 중 질소-퍼징된 교반된 용액에 탄소 상 10% 팔라듐(5.60g, 5.26mmol)을 첨가하였다. 수득한 현탁액을 수소(30 psi)로 처리하였다. 밤새 실온에서 교반한 후, 반응물을 여과하고, 고체를 MeOH로 세정하였다. 여과물을 농축하여 4-아미노-2-(피리딘-3-일)-1H-인돌-7-카복스아미드(10g, 75%)를 수득하였다. LC/MS (표 1, 방법 ar) Rt = 1.10 min; MS m/z 253.1 (M+H)+. 질산나트륨(7.82g, 113mmol)의 물(20mL) 중 용액을 MeCN(150mL) 중 이 물질(13g, 51.5mmol) 및 2N 염화수소(188mL, 376mmol)의 빙냉 현탁액에 교반하면서 첨가하고, 온도를 약 -5℃ 아래로 유지하였다. 약 30분 동안 교반한 후, 수성 요오드화칼륨(21.4g, 129mmol)의 냉각된 용액을 반응물에 첨가하고, 수득한 혼합물을 실온에서 약 30분 동안 교반하였다. 반응물을 수욕(85℃)에서 5분 동안 가열하였다. 반응물을 실온으로 냉각시키고, 포화 수성 중탄산나트륨으로 pH 8로 중화시켰다. 혼합물을 DCM으로 추출하였다. 유기 층을 염수로 세척하고, 황산나트륨에서 건조시키고, 여과하고, 농축하였다. 잔류물을 섬광 크로마토그래피(실리카 겔, 페트롤리움 에테르)로 정제하여 4-요오도-2-(피리딘-3-일)-1H-인돌-7-카복스아미드(2.0g, 9%)를 수득하였다. LC/MS (표 1, 방법 ab) Rt = 1.88 min; MS m/z 364.0 (M+H)+. (Btk IC50 = B)
일반적 절차 G: Boc-보호된 아민의 산성 개열
N-Boc 아민(1당량)의 유기 용매(예를 들면, DCM, DCE, 1,4-디옥산, EtOAc, 또는 MeOH, 바람직하게는 DCM, EtOAc, 또는 1,4-디옥산) 중 용액에 산(예를 들면, TFA 또는 HCl, 바람직하게는 TFA; 2 내지 35당량, 바람직하게는 15 내지 25당량)을 첨가한다. 혼합물을 약 0 내지 100℃(바람직하게는 약 20 내지 60℃)에서 약 1 내지 24시간(바람직하게는 약 1 내지 6시간) 동안 교반한다. 임의로, 추가의 산(2 내지 35당량, 바람직하게는 20 내지 25당량)을 첨가할 수 있고, 혼합물을 약 0 내지 100℃(바람직하게는 약 15 내지 60℃)에서 약 1 내지 24시간(바람직하게는 약 1 내지 6시간) 동안 교반한다. 혼합물에 고체가 존재하는 경우, 혼합물을 임의로 여과하고, 고체를 유기 용매, 예를 들면, 1,4-디옥산 또는 Et2O로 세척할 수 있다. 이어서, 수득한 고체를 임의로 감압하에 건조시켜 목적 화합물을 수득한다. 대안적으로, 혼합물을 임의로 진공에서 농축하여 최종 화합물을 수득할 수 있다. 대안적으로, 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득하였다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 G의 예시
실시예 #G.1. 2-(2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드
3급-부틸 3-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트(0.6g, 1mmol, 제조 #15)의 EtOAc(20mL) 중 용액에 HCl/EtOAc를 실온에서 첨가하였다. 반응 혼합물을 실온에서 1시간 동안 교반하였다. 고체를 여과를 통해 염으로서 수집하고, 건조시켜 2-(2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드 하이드로클로라이드(0.5g, 94%)를 수득하였다: LC/MS (표 1, 방법 d) Rt = 2.39 min; MS m/z: 462 (M+H)+ (Btk IC50 = A).
표 G.1 일반적 절차 G를 사용하여 제조된 실시예
일반적 절차 H: 알데히드 또는 케톤의 1급 또는 2급 아민과의 환원적 아민화
알데히드 또는 케톤(바람직하게는 1.0당량 내지 1.3당량) 및 아민 또는 아민 염(바람직하게는 1.0 내지 2.2당량)을 유기 용매 또는 유기 용매의 혼합물(예를 들면, DCM, DCE 또는 MeOH, 또는 DCE 및 MeOH의 혼합물, 바람직하게는 DCE, MeOH, 또는 1:1 MeOH/DCM)에서 약 실온 내지 약 80℃(바람직하게는 약 실온)에서 첨가한다. 아민 염이 사용되는 경우, 아민 염기(예를 들면, TEA 또는 DIEA, 1.0 내지 2.2당량)를 임의로 첨가한다. AcOH(0.1당량 내지 5.0당량)를 임의로 첨가한다. 혼합물을 실온에서 약 1 내지 90분(바람직하게는 5 내지 30분) 동안 교반한다. 환원제(예를 들면, NaBH(OAc)3, Na(CN)BH3, NaBH4, BiotageTM으로부터의 MP-시아노보로하이드라이드, 0.5 내지 5.0당량, 바람직하게는 2.5 내지 3.0당량의 NaBH(OAc)3)를, 고체로서 또는 유기 용매(DCM, DCE 또는 MeOH, 또는 DCE 및 MeOH의 혼합물로서) 중 용액으로서 첨가한다. 혼합물을 실온에서 약 30분 내지 72시간(바람직하게는 1 내지 24시간) 동안 교반한다. 조 혼합물을 감압하에 농축할 수 있거나, 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 임의로 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl 또는 Na2SO3)을 포함하는 수용액으로 세척할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, MgSO4 또는 Na2SO4)로 건조하고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 H의 예시
실시예 #H.1. 2-(1-메틸-2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드
2-(2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드(50mg, 0.1mmol, 실시예 #G.1)의 MeOH(1mL) 중 용액에 (CH2O)n(1.6mg, 0.054mmol)을 실온에서 첨가하였다. 실온에서 1시간 동안 N2 분위기하에 교반한 후, NaBH(OAc)3(60mg, 0.27mmol)를 첨가하였다. 수득한 혼합물을 실온에서 2시간 동안 교반하였다. 용매를 감압하에 제거하여 잔류물을 수득하고, 이를 prep-HPLC로 정제하여 2-(1-메틸-2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드(15mg, 32%)를 수득하였다: LC/MS (표 1, 방법 o) Rt = 2.05 min; MS m/z: 476 (M+H)+ (Btk IC50 A).
표 H.1 4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(실시예 #G.1.1)로부터 일반적 절차 H를 사용하여 제조된 실시예
표 H.2 4-(3-아미노-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(실시예 #A.4.5)로부터 일반적 절차 H를 사용하여 제조된 실시예
일반적 절차 I: 아민 및 설포닐 클로라이드로부터 설폰아미드의 형성
플라스크에 임의로 하이드로클로라이드 염으로서 아민(1.0당량), 용매 또는 용매의 혼합물(예를 들면, DCM, DCE, EtOAc, THF, 1,4-디옥산, 피리딘, DME, 또는 피리딘/DCM, 바람직하게는 THF, 임의로 염기(예를 들면, TEA, DIEA, 바람직하게는 DIEA; 1 내지 5당량, 바람직하게는 1 내지 2당량)을 포함함) 및 설포닐 클로라이드(0.9 내지 2.0당량, 바람직하게는 1.0 내지 1.25당량)를 첨가한다. 혼합물을 약 0 내지 80℃(바람직하게는 약 0 내지 35℃)에서 약 1시간 내지 24시간(바람직하게는 5 내지 16시간) 동안 교반한다. 혼합물을 임의로 진공에서 농축하여 잔류물을 목적 화합물로서 수득할 수 있다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 I의 예시
실시예 #I.1: 4-(3-(비닐설폰아미도)페닐)-1H-인돌-7-카복스아미드
4-(3-아미노페닐)-1H-인돌-7-카복스아미드(0.11g, 0.438mmol, 제조 #A.1), THF(4mL) 및 DIEA(0.152mL, 0.876mmol)의 혼합물에 약 0℃(빙욕)에서 에텐설포닐 클로라이드(0.058g, 0.460mmol, FCH Group)를 첨가하였다. 빙욕을 제거하고, 혼합물을 약 6시간 동안 실온에서 교반하였다. 반응 혼합물을 감압하에 농축하고, 잔류물을 DCM에 용해시키고, 물(2x), 염수로 세척하고, Biotage 상 분리기를 통해 통과시켰다. 화합물을 감압하에 농축하고, 잔류물을 DCM 중 0 내지 10% MeOH의 구배를 사용하여 실리카 겔 상에서 정제하여 고체를 수득할 수 있다. 고체를 에테르(3x, 에테르를 각각 첨가한 후 초음파처리)로 분쇄하였다. 고체를 밤새 감압하에 75℃에서 건조시켜 4-(3-(비닐설폰아미도)페닐)-1H-인돌-7-카복스아미드(29mg, 19%)를 수득하였다: LC/MS (표 1, 방법 c) Rt = 2.34 min; MS m/z 342 (M+H)+. (Btk IC50 = A)
일반적 절차 J: 알킬 할라이드의 아민 친핵체로의 치환
플라스크를 알킬 할라이드(바람직하게는 1당량) 및 유기 용매(예를 들면, THF, MeCN, DMF, DMA, NMP 또는 DMSO; 바람직하게는 THF 또는 MeCN)로 채운다. 플라스크에 특정한 순서 없이 아민 친핵체(1 내지 25당량, 바람직하게는 1.2 내지 20당량) 및 임의로 염기(예를 들면, LiHMDS, NaH, K2CO3, NaHMDS, NaOt-Bu, KHMDS 또는 KOt-Bu, 바람직하게는 없음, NaH 또는 K2CO3; 1 내지 5당량, 바람직하게는 1 내지 3당량)를 첨가한다. 혼합물을 약 0 내지 100℃(바람직하게는 약 0 내지 40℃)에서 약 1 내지 24시간(바람직하게는 약 3 내지 20시간) 동안 교반한다. 혼합물을 임의로 진공에서 농축하여 잔류물을 목적 화합물로서 수득할 수 있다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다. 대안적으로, 반응 혼합물의 농축으로부터의 잔류물을 물에 현탁시키고, 초음파처리하고, 진공 여과를 통해 수집할 수 있다.
일반적 절차 J의 예시
실시예 #J.1: (E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드
(E)-4-(3-(4-브로모부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드(1.4g, 3.40mmol, 4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드(실시예 #16) 및 (E)-4-브로모부트-2-에노일 클로라이드[J.Org.Chem. 2011, 76, 4467]로부터 E를 사용하여 제조함)의 THF(24mL) 중 용액에 0℃에서 THF 중 2 M 디메틸아민(34.0mL, 67.9mmol)을 첨가하였다. 혼합물을 3시간 동안 실온으로 가온하면서 교반하였다. 혼합물을 감압하에 농축하고, 물(15mL)을 잔류물에 첨가하였다. 혼합물을 약 20분 동안 실온에서 음파처리하고, 여과하고, 물로 세척하고, 감압하에 건조시켰다. 잔류물을 실리카 겔 컬럼에 첨가하고, MeOH/DCM(0 내지 15%,)으로 용리하여 조 생성물(0.650g)을 수득하였다. 조 생성물을 DMA(5mL)에 용해시키고, 물(100mL)을 첨가하고, 그 동안 20분 동안 실온에서 교반하였다. 혼합물을 여과하고, 물(50mL x 3)로 세척하고, 감압하에 건조시켜 (E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드(0.40g, 31%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.05 min; MS m/z 377 (M+H)+. (Btk IC50 B)
표 J.1 (E)-4-(3-(4-브로모부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드(4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드(실시예 #16) 및 (E)-4-브로모부트-2-에노일 클로라이드[J.Org.Chem. 2011, 76, 4467]로부터 E를 사용하여 제조함)로부터 일반적 절차 J를 사용하여 제조된 실시예
표 J.2: (E)-4-(3-(4-브로모부트-2-엔아미도)-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드(4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드(실시예 #2) 및 (E)-4-브로모부트-2-에노일 클로라이드[J.Org.Chem. 2011, 76, 4467]로부터 E를 사용하여 제조함)로부터 일반적 절차 J를 사용하여 제조된 실시예
표 J.3: 시안 브로마이드로부터 아민을 사용한 일반적 절차 J를 사용하여 제조된 실시예
일반적 절차 K: 아세토나이드의 가수분해
아세토나이드(바람직하게는 1당량)의 유기 용매(예를 들면, 1,4-디옥산 및 THF, 바람직하게는 THF) 중 용액에 1,4-디옥산 중 산, 예를 들면, 4 M HCl(3 내지 100당량, 바람직하게는 30 내지 40당량)을 첨가한다. 반응 혼합물을 약 20 내지 120℃(바람직하게는 일반적 가열을 사용하여 약 실온; 마이크로파 조사를 사용하여 약 120℃)에서 약 0.25 내지 24시간(바람직하게는 일반적 가열을 사용하여 약 4시간; 마이크로파 조사를 사용하여 약 20분) 동안 가열한다. 반응 혼합물을 주위 온도로 냉각되게 하고, 이후에 임의로 유기 용매(예를 들면, EtOAc 또는 DCM) 및 수성 염기(예를 들면, NaHCO3, Na2CO3 또는 NaOH, 바람직하게는 NaHCO3) 사이에 분배하고, 수성 층을 임의로 추가의 유기 용매(예를 들면, EtOAc 또는 DCM)로 추출한다. 유기 층을 무수 MgSO4 또는 Na2SO4로 건조시키고, 여과하고, 감압하에 농축한다. 대안적으로 용매를 감압하에 제거하여 목적하는 화합물을 수득한다.
일반적 절차 K의 예시:
실시예 #K.1*: 2-(1-((R)-2,3-디하이드록시프로필)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드
2-(1-(((R)-2,2-디메틸-1,3-디옥솔란-4-일)메틸)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드(0.047g, 0.082mmol, 4-브로모-2-요오도-1H-인돌-7-카복스아미드 및 (R)-1-((2,2-디메틸-1,3-디옥솔란-4-일)메틸)-4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-피라졸(제조 #20)로부터 A, 3-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)퀴나졸린-4(3H)-온[PCT Int. Appl., WO 2011159857]으로부터 A를 사용하여 제조함)의 THF(5mL) 중 용액에 1,4-디옥산 중 4 M HCl(0.5mL)을 첨가하였다. 혼합물을 실온에서 약 4시간 동안 교반하였다. 반응 혼합물을 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 af)로 정제하여 2-(1-((R)-2,3-디하이드록시프로필)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드(0.035g, 80%)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 1.65 min; MS m/z 535. (Btk IC50 = A)
표 K.1 아세토나이드로부터 일반적 절차 K를 사용하여 제조된 실시예
일반적 절차 L: 알켄의 수소화
환저 플라스크를 팔라듐 촉매, 예를 들면, Pd/C 또는 Pd(OH)2(10 또는 20 wt%, 약 0.005 내지 1.0당량, 바람직하게는 0.5 내지 1.0당량)로 채운다. 플라스크를 배출시키고, 이어서, 질소로 2 내지 5회(바람직하게는 3회) 플러슁하고, 이후에 유기 용매 또는 용매의 혼합물(예를 들면, EtOAc, MeOH, EtOH 또는 MeOH/AcOH, 바람직하게는 MeOH/AcOH)을 질소 분위기하에 첨가한다. 혼합물에 알켄(바람직하게는 1당량)을, 순수하게 또는 임의로 유기 용매 또는 용매의 혼합물(예를 들면, EtOAc, MeOH, EtOH 또는 MeOH/AcOH, 바람직하게는 MeOH) 중 용액으로서 첨가한다. 혼합물을 수소 분위기(약 30 내지 50 psi)하에 약 1 내지 60시간(바람직하게는 약 4 내지 5시간) 동안 교반한다. 임의로 반응물을 Pd/C 또는 Pd(OH)2 카트리지(10 또는 20 wt%)를 갖는 H-큐브 장치를 사용하여 수행할 수 있고, 출발 물질을 바람직한 용매 중 용액으로서 시스템을 통해 통과시킨다. 반응이 TLC, LC/MS, 또는 HPLC로 모니터링하여 완료된 것으로 진행되지 않는 경우, 혼합물을 임의로 약 30 내지 80℃(바람직하게는 약 50℃)로 약 1 내지 24시간(바람직하게는 약 16시간) 동안 가열할 수 있고, H-큐브가 반응을 수행하는데 사용되는 경우, 압력을 증가시킬 수 있다(25 내지 50 bar, 바람직하게는 40 내지 50 bar). 이어서, 혼합물을 여과하고, 필터 케이크를 유기 용매(예를 들면, EtOAc, MeOH 또는 EtOH, 바람직하게는 반응물 용매)로 세정하고, 여과물을 감압하에 농축하여 조 생성물을 수득한다.
일반적 절차 L의 예시
실시예 #L.1: 2-(1-아세틸피페리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드(300mg, 0.772mmol, 4-브로모-2-요오도-1H-인돌-7-카복스아미드(제조 #1) 및 1-(4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-일)에타논[Combi-Blocks]를 사용한 A, 3-아미노-2-메틸페닐보론산, 피나콜 에스테르[Combi-Blocks]를 사용한 A를 사용하여 제조함) 및 용매 MeOH(72mL)를 20 wt% Pd/C(60.0mg, 0.564mmol)에 250mL 스텐레스 스틸 압력 병에서 첨가하고, 약 4.5시간 동안 30 psi에서 이어서, 약 50℃에서 약 16시간 동안 교반하였다. 반응물을 여과하고, 진공에서 농축하고, 잔류물을 DCM 중 0 내지 10% MeOH의 구배를 사용하는 실리카 겔 상에서 정제하여 2-(1-아세틸피페리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드(77.1mg, 0.197mmol)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.06 min; MS m/z 391. (Btk IC50 = B)
일반적 절차 M: O-실릴 에테르로부터 실릴 그룹의 제거
방법 1:
O-실릴-에테르(1당량)의 유기 용매(예를 들면, DMF, 1,4-디옥산, 또는 DCM, 바람직하게는 DCM) 중 용액에 산(예를 들면, TFA 또는 HCl, 5 내지 50당량, 바람직하게는 30당량)을 첨가하고, 혼합물을 약 0 내지 50℃(바람직하게는 약 15 내지 25℃)에서 약 1 내지 48시간(바람직하게는 약 4 내지 16시간) 동안 교반한다. 대안적으로, 추가의 산(5 내지 20당량, 바람직하게는 10당량)을 첨가할 수 있고, 혼합물을 약 30 내지 100℃(바람직하게는 약 50 내지 80℃)로 약 0.5 내지 10시간(바람직하게는 약 1 내지 5시간) 동안 가열한다.
방법 2:
O-실릴 에테르(1당량)의 유기 용매(예를 들면, DMF, 1,4-디옥산, 또는 DCM, 바람직하게는 DMF) 중 용액에 플루오라이드 공급원, 예를 들면, HF, TBAF(1 내지 10당량, 바람직하게는 4당량)를 첨가하고, 혼합물을 약 20 내지 110℃(바람직하게는 약 25 내지 60℃)에서 약 1 내지 20시간(바람직하게는 약 2 내지 8시간) 동안 교반한다.
이들 중 하나의 방법을 위해, 목적 화합물을 임의로 혼합물을 냉각시키고, 침전물을 여과하여 단리할 수 있다. 대안적으로, 혼합물을 임의로 진공에서 농축하여 목적 화합물을 수득한다. 대안적으로, 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, 또는 EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 M의 예시:
실시예 #M.1: N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-(하이드록시메틸)페닐)티아졸-2-카복스아미드
N-(2-(((3급-부틸디메틸실릴)옥시)메틸)-3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)페닐)티아졸-2-카복스아미드(100mg, 0.170mmol, 티아졸-2-카복실산 및 2-((3급-부틸디메틸실릴옥시)메틸)-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린[Matrix]으로부터 D, A 및 제조 # 10을 사용하여 제조함)의 1,4-디옥산(2mL) 중 용액에 3 N 수성 HCl(2mL, 6.00mmol)을 첨가하고, 혼합물을 약 25℃에서 약 3시간 동안 교반하였다. 수득한 용액을 EtOAc(5mL)로 희석시키고, 물(3mL)로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 농축하여 조 생성물을 수득하고, 이를 Prep-TLC(DCM:MeOH=20:1)로 정제하여 N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-(하이드록시메틸)페닐)티아졸-2-카복스아미드(36mg, 45%)를 수득하였다:
표 M.1 O-실릴 에테르로부터 일반적 절차 M을 사용하여 제조된 실시예
일반적 절차 N: 설폰아미드의 가수분해
설폰아미드, 예를 들면, 설포닐-보호된 인돌(바람직하게는 1당량)을 유기 용매(예를 들면, 1,4-디옥산, MeOH, 또는 THF/MeOH, 바람직하게는 1,4-디옥산) 중에 포함하는 플라스크에 염기(예를 들면, K2CO3, Cs2CO3, 수성 Na2CO3 또는 수성 NaOH, 1 내지 30당량; 바람직하게는 Cs2CO3 1 내지 5당량)를 첨가한다. 혼합물을 약 25 내지 100℃(바람직하게는 약 60℃)에서 약 1 내지 72시간(바람직하게는 약 1 내지 18시간) 동안 교반한다. 반응물이 TLC, LC/MS, 또는 HPLC로 모니팅하여 완료로 진행되지 않는 경우, 추가의 염기(예를 들면, K2CO3, Cs2CO3, 수성 Na2CO3 또는 수성 NaOH, 바람직하게는 Cs2CO3 1 내지 5당량) 및/또는 공용매(예를 들면, EtOH)를 첨가한다. 반응을 약 25 내지 100℃(바람직하게는 약 60℃)에서 약 0.25 내지 3시간(바람직하게는 약 1 내지 2시간) 동안 계속한다. 추가의 염기 불안정성 그룹이 존재하는 경우(예를 들면, 에스테르 또는 시아노 그룹), 이 그룹을 또한 가수분해할 수 있다. 반응물을 다음 방법 중 하나를 사용하여 후처리한다. 방법 1. 유기 용매를 임의로 감압하에 제거하고, 수용액을 적합한 수성 산(예를 들면, 수성 HCl)을 첨가하여 중성화한다. 적합한 유기 용매(예를 들면, EtOAc 또는 DCM) 및 물을 첨가한다. 층을 분리시키고, 유기 용액을 무수 Na2SO4 또는 MgSO4에서 건조하고, 여과하고, 농축하여 감압하에 건조시켜 목적 화합물을 수득하였다. 방법 2. 유기 용매를 임의로 감압하에 제거하고, 적합한 유기 용매(예를 들면, EtOAc 또는 DCM) 및 물을 첨가한다. 층을 분리시키고, 유기 용액을 무수 Na2SO4 또는 MgSO4에서 건조시키고, 여과하고, 농축하여 감압하에 건조시켜 목적 화합물을 수득한다. 방법 3. 반응 혼합물을 감압하에 농축하고, 직접적으로 후속 방법 중 하나에 의해 정제한다.
일반적 절차 N의 예시:
제조 #N.1: : (R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카보니트릴.
(R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1-토실-1H-인돌-7-카보니트릴(0.12g, 0.229mmol, 4-플루오로-1-토실-1H-인돌-7-카보니트릴(제조 #27, 단계 A) 및 (R)-3-(피페리딘-3-일)퀴나졸린-4(3H)-온(제조 #31)로부터 B를 사용하여 제조함)의 THF(2mL) 및 MeOH(1mL) 중 혼합물에 탄산세슘(0.128mL, 1.60mmol)을 첨가하고, 실온에서 약 18시간 동안 교반하였다. 반응물을 물(60mL)로 희석시키고, 또다른 20분 동안 교반하였다. 혼합물을 DCM으로 추출하고, Biotage 상 분리기를 통해 통과시켜 건조하여 잔여 물을 제거하고, 증발 건조시켜 (R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카보니트릴(0.044g, 52%)을 수득하였다; LC/MS (표 1, 방법 g) Rt = 1.50 min.; MS m/z: 370 (M+H)+
일반적 절차 O: 니트릴의 1급 아미드로의 가수분해
니트릴(바람직하게는 1당량)을 유기 용매(예를 들면, MeOH, EtOH, DMSO, DMSO/MeOH, 또는 DMSO/EtOH, 바람직하게는 DMSO/EtOH) 중에 포함하는 플라스크에 염기(예를 들면, KOH, 수성 KOH 또는 수성 NaOH, 1 내지 30당량, 바람직하게는 KOH 3 내지 5당량, 바람직하게는 수성 NaOH 10 내지 15당량)를 첨가한다. 혼합물을 약 실온에서 약 1 내지 30분(바람직하게는 약 1 내지 10분) 동안 교반하고, 이어서, 30% H2O2(5 내지 30당량 바람직하게는 9 내지 27당량)를 혼합물에 서서히 첨가하고, 반응 혼합물을 실온에서 약 10 내지 30분 동안 교반하였다. 반응물을 TLC, LC/MS, 또는 HPLC로 모니터링하여 완료된 것으로 진행되지 않는 경우, 반응을 실온에서 약 0.25 내지 1시간(바람직하게는 약 0.25 내지 0.5시간) 동안 계속한다. 반응물을 다음 방법 중 하나를 사용하여 후처리한다. 방법 1. 혼합물을 포화 NH4Cl 및 물로 희석시키고, 약 실온에서 약 1 내지 30분 동안 교반한다. 수득한 현탁액을 여과하여 수집하고, 적합한 용매(예를 들면, MeOH, EtOH, 또는 물)로 세척하고, 필터케이크를 진공하에 건조시켜 목적 화합물을 수득하였다. 방법 2. 유기 용매를 임의로 감압하에 제거하고, 적합한 유기 용매(예를 들면, EtOAc 또는 DCM) 및 물을 첨가한다. 층을 분리시키고, 유기 용액을 무수 Na2SO4 또는 MgSO4에서 건조시키고, 여과하고, 농축하여 감압하에 건조시켜 목적 화합물을 수득한다. 방법 3. 반응 혼합물을 감압하에 농축하고, 직접적으로 후속 방법 중 하나에 의해 정제한다.
일반적 절차 O의 예시:
실시예 #O.1: N-(트랜스-1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드
N-(트랜스-1-(7-시아노-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드(36mg, 0.068mmol, 제조 #27 및 제조 #23으로부터 B, Cs2CO3를 사용한 N를 사용하여 제조함)의 DMSO(0.8mL) 중 교반된 용액에 EtOH(4.8mL) 및 KOH(12.81mg, 0.228mmol)를 첨가하였다. 혼합물을 실온에서 약 10분 동안 교반하고, 이어서, 30% H2O2(0.070mg, 0.615 umol)를 혼합물에 서서히 첨가하고, 반응 혼합물을 실온에서 약 15분 동안 교반하였다. 이어서, 물(6mL)을 혼합물에 첨가하고, 용액을 EtOAc(3 × 20mL)로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 섬광 크로마토그래피로 정제하여 N-(트랜스-1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드(15mg, 40%)를 수득하였다: LC/MS (표 1, 방법 d) Rt = 2.52 min.; MS m/z: 545 (M+H)+. (Btk IC50 = A)
표 O.1 일반적 절차 O를 사용하여 제조한 실시예
일반적 절차 P: 아릴 할라이드 또는 헤테로아릴 할라이드로부터 보로네이트의 형성
할라이드, 예를 들면, 브로모 인돌(바람직하게는 1당량), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란)(1 내지 3당량, 바람직하게는 1.2당량), 칼륨 아세테이트(2 내지 5당량, 바람직하게는 3당량)의 용매(예를 들면, THF 또는 1,4-디옥산; 바람직하게는 1,4-디옥산) 중 혼합물에, 팔라듐 촉매(예를 들면, Pd2dba3 또는 (1,1'-비스(디페닐포스피노)페로센)디클로로팔라듐(II)의 DCM과의 착물; 바람직하게는 DCM과의 1,1'-비스(디페닐포스피노)페로센)디클로로팔라듐(II) 착물, 0.01 내지 0.20당량, 바람직하게는 0.1당량)를 첨가한다. 혼합물을 약 40 내지 120℃(바람직하게는 약 80℃)에서 약 1 내지 24시간(바람직하게는 약 16시간) 동안 가열한다. 혼합물을 실온으로 냉각되게 하고, 다음 방법 중 하나를 사용하여 후처리한다. 방법 1. 혼합물을 유기 용매(예를 들면, DCM 또는 EtOAc)로 희석할 수 있고, 유기 용액을 임의로 물 및/또는 염수로 세척하고, 무수 MgSO4 또는 Na2SO4로 건조시키고, 여과하고, 용매를 감압하에 제거하여 목적하는 화합물을 수득한다. 방법 2. 혼합물을 감압하에 농축하고, 상기한 정제 방법 중 하나 이상을 사용하여 임의로 정제하여 목적하는 화합물을 수득한다. 방법 3. 촉매를 여과하여 제거하고, 여과물을 감압하에 농축한다.
일반적 절차 P의 예시
제조 #P.1: 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인돌-7-카복스아미드
4-브로모-1H-인돌-7-카복스아미드(5g, 20.9mmol, 제조 #2), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란)(6.37g, 25.1mmol), 칼륨 아세테이트(6.16g, 62.7mmol) 및 Pd(dppf)Cl2-DCM(0.85g, 1.05mmol)의 1,4-디옥산(2mL) 중 혼합물을 약 80℃에서 N2하에 밤새 가열하였다. 용매를 감압하에 제거하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인돌-7-카복스아미드(3g, 50%)를 수득하였다:
일반적 절차 Q: 알콜의 미쓰노부 반응
유기 용매(예를 들면, THF, 벤젠, 톨루엔, 또는 1,4-디옥산, 바람직하게는 톨루엔 또는 1,4-디옥산) 중 알콜(바람직하게는 1당량)에 적합한 산성 반응물(예를 들면, 카복실산, 페놀 또는 헤테로아릴 알콜, 1 내지 3당량, 바람직하게는 1당량), 이어서, 트리-n-부틸포스핀, 트리페닐포스핀 또는 중합체 결합된 트리페닐포스핀(바람직하게는 트리페닐포스핀, 1 내지 3당량, 바람직하게는 1.2당량), 및 TMAD를 첨가하고, 1,1'-(아조디카보닐)디피페리딘, DIAD 또는 DEAD(바람직하게는 DEAD, 1 내지 3당량, 바람직하게는 1.2당량)를 약 0 내지 120℃(바람직하게는 0 내지 25℃)에서 적가한다. 반응 혼합물을 약 25 내지 120℃에서 약 5 내지 48시간(바람직하게는 약 16시간) 동안 교반한다. 대안적으로, 약 0.1 내지 24시간 후, 추가의 포스핀 시약(0.2 내지 2당량) 및 TMAD, 1,1'-(아조디카보닐)디피페리딘, DIAD 또는 DEAD(0.2 내지 1당량)를 첨가하여 반응을 완료되게 한다. 방법 1. 중합체 결합된 시약이 사용되는 경우, 반응 혼합물을 여과하고, 용매의 혼합물, 예를 들면, DCM, EtOAc 및 MeOH(바람직하게는 DCM 이어서 MeOH)로 세척한다. 여과물을 감압하에 농축한다. 방법 2. 중합체 결합된 시약이 사용되지 않는 경우, 반응 혼합물을 임의로 유기 용매, 예를 들면, DCM 또는 EtOAc로 희석시키고, 이어서, 물, 포화 수성 NaHCO3, 염수로 세척하고, 무수 Na2SO4 또는 MgSO4에서 건조시키고, 여과하고, 감압하에 농축시킨다. 대안적으로, 반응 혼합물을 직접적으로 감압하에 농축한다.
일반적 절차 Q의 예시
제조 #Q.1: 2-((4-브로모-3-니트로페녹시)메틸)티아졸
4-브로모-3-니트로페놀(2g, 9.17mmol, 제조 #S.1), 티아졸-2-일메탄올(1.01g, 9.17mmol) 및 트리페닐포스핀(2.9g, 11.01mmol)의 무수 톨루엔(50mL) 중 용액에 DEAD(1.7mL, 11.01mmol)를 약 0℃에서 N2하에 첨가하였다. 이어서, 혼합물을 밤새 환류되도록 가열하였다. 실온으로 냉각한 후, 혼합물을 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 2-((4-브로모-3-니트로페녹시)메틸)티아졸(2g, 69%)을 수득하였다:
일반적 절차 R: Fe를 사용하는 니트로 그룹의 아민으로의 환원
니트로-함유 화합물의 용매(예를 들면, MeOH, EtOH, MeOH/물 또는 EtOH/물, 바람직하게는 EtOH/물) 중 혼합물에 Fe(3 내지 5당량, 바람직하게는 5당량) 및 NH4Cl(3 내지 5당량, 바람직하게는 5당량)을 첨가한다. 혼합물을 약 40 내지 100℃(바람직하게는 약 80℃)에서 약 2 내지 24시간(바람직하게는 약 16시간) 동안 가열한다. 혼합물을 실온으로 냉각되게 하고, 다음 방법 중 하나를 사용하여 후처리한다. 방법 1. 혼합물을 유기 용매(예를 들면, DCM 또는 EtOAc)로 희석할 수 있고, 유기 용액을 임의로 물 및/또는 염수로 세척하고, 무수 MgSO4 또는 Na2SO4로 건조시키고, 여과하고, 용매를 감압하에 제거하여 목적하는 화합물을 수득한다. 방법 2. 혼합물을 감압하에 농축하고, 상기한 정제 방법 중 하나 이상을 사용하여 임의로 정제하여 목적하는 화합물을 수득한다. 방법 3. 촉매를 여과하여 제거하고, 여과물을 감압하에 농축한다. 이러한 일반적 절차를 통해 제조된 중간체 및 최종 화합물을 임의로 상기한 정제 방법 중 하나 이상을 사용하여 정제할 수 있다.
일반적 절차 R의 예시
제조 #R.1: 2-브로모-5-(티아졸-2-일메톡시)아닐린
2-((4-브로모-3-니트로페녹시)메틸)티아졸(1g, 3.2mmol)의 EtOH(40mL) 및 물(20mL) 중 용액에 철(0.88g, 15.8mmol) 및 NH4Cl(0.85g, 15.8mmol)을 첨가하였다. 혼합물을 밤새 환류되도록 가열하였다. 혼합물을 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 물을 첨가하여 희석시키고, EtOAc로 추출하였다. 유기 층을 감압하에 농축하여 2-브로모-5-(티아졸-2-일메톡시)아닐린(0.7g, 77%)을 수득하였다: LC/MS (표 1, 방법 l) Rt = 1.46 min; MS m/z 285 (M+H)+.
일반적 절차 S: 아릴 메틸 에테르의 탈메틸화
메톡시 화합물의 용매(예를 들면, DCM, DCE, THF, 벤젠, 톨루엔, 또는 1,4-디옥산, 바람직하게는 DCM) 중 혼합물에 BBr3(2 내지 24당량, 바람직하게는 2.5당량)을 서서히 첨가한다. 혼합물을 약 30 내지 110℃(바람직하게는 약 45℃)에서 약 2 내지 24시간(바람직하게는 약 4 내지 24시간) 동안 가열한다. 혼합물을 0 내지 10℃(바람직하게는 약 0℃)로 냉각되게 하고, 물로 희석시킨다. 혼합물을 유기 용매(예를 들면, DCM 또는 EtOAc)로 희석할 수 있고, 유기 용액을 임의로 물 및/또는 포화 NaHCO3 및/또는 염수로 세척하고, 무수 MgSO4 또는 Na2SO4로 건조시키고, 여과하고, 용매를 감압하에 제거하여 목적하는 화합물을 수득한다.
일반적 절차 S의 예시
제조 #S.1: 4-브로모-3-니트로페놀
1-브로모-4-메톡시-2-니트로벤젠(20g, 82mmol)의 DCM(800mL) 중 용액에 DCM(120mL) 중 BBr3(19mL, 207mmol)를 적가하였다. 수득한 혼합물을 밤새 환류되도록 가열하였다. 혼합물을 얼음물에서 냉각시키고, 물을 첨가하여 희석시켰다. 이어서, 혼합물을 포화 NaHCO3 및 염수로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 4-브로모-3-니트로페놀(6g, 31%)을 고체로서 수득하였다:
일반적 절차 T: 아릴 할라이드 또는 헤테로아릴 할라이드의 아민과의 부흐발트 반응
아릴 할라이드 또는 헤테로아릴 할라이드(1.0당량), 아민(1 내지 2.2당량, 바람직하게는 1 내지 1.2당량), 팔라듐 촉매(예를 들면, Pd2dba3 또는 Pd(OAc)2, 바람직하게는 Pd2dba3; 0.01 내지 1.0당량, 바람직하게는 0.04 내지 0.1당량), 리간드(예를 들면, X-phos, Xanthphos 또는 3급-부틸-X-phos, 바람직하게는 3급-부틸-X-phos 또는 X-Phos, 0.01 내지 2.0당량, 바람직하게는 0.04 내지 0.1당량) 및 염기(예를 들면, K2CO3, Na2CO3, Cs2CO3, K3PO4, NaOt-Bu, KOt-Bu, KOAc, KOH, 바람직하게는 K2CO3; 1 내지 5당량, 바람직하게는 1 내지 3당량)의 혼합물을 용매(예를 들면, 1,4-디옥산, t-BuOH, 바람직하게는 t-BuOH)에 첨가한다. 혼합물을 불활성 분위기(예를 들면, 질소 또는 아르곤, 바람직하게는 질소)하게 탈기시키고, 통상적인 가열로 약 80 내지 100℃(바람직하게는 약 85 내지 95℃)에서 약 2 내지 24시간(바람직하게는 약 18시간) 동안 가열하거나 또는 마이크로파 가열로 약 100 내지 150℃에서 약 30분 동안 내지 2시간까지 가열한다. 혼합물을 실온으로 냉각시킨다. 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH, DMSO, 1:1 MeOH/DMSO 또는 2:1 MeOH/DMSO, 바람직하게는 MeOH/DMSO)로 세정하고, 이어서, 여과물을 임의로 진공에서 농축하거나 가온 질소 스트림하에 잔류물을 수득한다.
일반적 절차 T의 예시
제조 #T.1: 4-(1-메틸-1H-피라졸-5-일아미노)-2-p-톨릴-1H-인돌-7-카복스아미드
4-요오도-2-(p-톨릴)-1H-인돌-7-카복스아미드(99mg, 0.26mmol, 1-(p-톨릴)에타논을 사용한 F를 사용하여 제조함), 1-메틸-1H-피라졸-5-일아민(27mg, 0.26mmol, Maybridge-Int), X-Phos(7.53mg, 0.016mmol), K2CO3(44mg, 0.316mmol), 및 Pd2dba3(14mg, 0.016mmol)를 t-BuOH(1.32mL) 중에서 밀봉된 마이크로파처리 튜브에서 합하였다. 튜브를 탈기하고, N2로 퍼징하고, 약 85℃에서 18시간 동안 가열하였다. 반응물을 실온으로 냉각시키고, Celite®를 통해 여과하였다. 여과물을 DCM으로 2회 추출하였다. 합한 유기 층을 농축하였다. 잔류물 생성물을 정상 컬럼에서 정제하였다(18mg, 20%): LC/MS (표 1, 방법 f) Rt = 1.48 min; MS m/z 346 (M+H)+. (Btk IC50 = B)
표 T.1 4-요오도-2-(p-톨릴)-1H-인돌-7-카복스아미드(1-(p-톨릴)에타논을 사용한 F를 사용하여 제조됨)로부터 일반적 절차 T를 사용하여 제조된 실시예
일반적 절차 U: 아릴 할라이드 또는 헤테로아릴 할라이드의 유기아연과의 네기시 가교-커플링 반응
아릴 할라이드 또는 헤테로아릴 할라이드(바람직하게는 1.0당량), 유기 용매 또는 용매의 혼합물(예를 들면, THF, Et2O 또는 1,4-디옥산, 바람직하게는 THF), 유기아연 화합물(0.67 내지 1.5당량, 바람직하게는 0.9 내지 1.2당량), 팔라듐 촉매(예를 들면, Pd(PPh3)4, 0.01 내지 1.0당량, 바람직하게는 0.025 내지 0.10당량)의 혼합물을 약 실온 내지 90℃(바람직하게는 약 85℃)에서 약 1 내지 24시간(바람직하게는 약 18시간) 동안 교반한다. 혼합물을 실온으로 냉각시킨다. 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 임의로 특정한 순서 없이 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 U의 예시
제조 #U.1: 4-(2-클로로-6-플루오로벤질)-2-p-톨릴-1H-인돌-7-카복스아미드
4-요오도-2-(p-톨릴)-1H-인돌-7-카복스아미드(97mg, 0.258mmol, 1-(p-톨릴)에타논으로부터 F를 사용하여 제조됨), (2-클로로-6-플루오로벤질)아연(II) 브로마이드(0.77mL, 0.387mmol) 및 테트라키스(트리페닐포스핀)팔라듐(0)(15mg, 0.013mmol)을 THF(0.82mL) 중에 밀봉된 마이크로파 관에서 용해시키고, 85℃에서 약 18시간 동안 열적으로 가열하였다. 반응물을 실온으로 냉각시키고, Celite®를 통해 여과하였다. 여과물을 농축하여 잔류물을 수득하였다. 잔류물을 헥산 중 EtOAc로 용리하는 정상 컬럼 상에서 정제하여 4-(2-클로로-6-플루오로벤질)-2-p-톨릴-1H-인돌-7-카복스아미드(30mg, 30%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 2.09 min; MS m/z 393 (M+H)+.
표 U.1 4-요오도-2-(p-톨릴)-1H-인돌-7-카복스아미드(1-(p-톨릴)에타논을 사용한 F를 사용하여 제조됨)로부터 일반적 절차 U를 사용하여 제조된 실시예
일반적 절차 V: Boc-보호된 아민 및 카복실산으로부터 아미드의 형성
N-Boc 아민(1당량)의 유기 용매(예를 들면, DCM, DCE, 1,4-디옥산 또는 MeOH, 바람직하게는 DCM 또는 1,4-디옥산) 중 용액에 산(예를 들면, TFA 또는 HCl, 바람직하게는 TFA; 2 내지 100당량, 바람직하게는 25 내지 50당량)을 첨가한다. 혼합물을 약 0 내지 100℃(바람직하게는 약 20 내지 60℃)에서 약 0.5 내지 24시간(바람직하게는 약 0.5 내지 6시간) 동안 교반한다. 임의로, 추가의 산(2 내지 35당량, 바람직하게는 20 내지 25당량)을 첨가할 수 있고, 혼합물을 약 0 내지 100℃(바람직하게는 약 20 내지 60℃)에서 약 1 내지 24시간(바람직하게는 약 1 내지 6시간) 동안 교반하였다. 혼합물에 고체가 존재하는 경우, 혼합물을 임의로 여과할 수 있고, 고체를 유기 용매, 예를 들면, 1,4-디옥산 또는 Et2O로 세척하였다. 이어서, 수득한 고체를 임의로 감압하에 건조시킨다. 대안적으로, 반응 혼합물을 감압하에 농축한다. 잔류물에 플라스크 중에서 특정한 순서 없이, 카복실산 또는 카복실레이트 염(1 내지 5당량, 바람직하게는 1.1 내지 1.5당량), 유기 용매(예를 들면, DCM, DCE, DMF, THF, 또는 1,4-디옥산, 바람직하게는 DCM 또는 DMF), 펩타이드 커플링 시약(예를 들면, BOP-Cl, IBCF, HATU, DCI, PyBOP, 또는 EDCㆍHCl, 바람직하게는 HATU; 1 내지 10당량, 바람직하게는 1 내지 2당량), 염기(예를 들면, TEA, DIEA, 피리딘 또는 DIEA, 바람직하게는 DIEA; 1 내지 20당량, 바람직하게는 1 내지 5당량) 및 임의로 HOBt(0 내지 5당량, 바람직하게는 0 내지 1당량)를 첨가한다. 이어서, 혼합물을 약 10 내지 60℃(바람직하게는 약 25 내지 50℃)에서 약 15분 내지 48시간(바람직하게는 약 15분 내지 24시간) 동안 교반한다. 임의로, 추가양의 상기 시약을 첨가하여 반응을 완료시킬 수 있다. 혼합물을 임의로 진공에서 농축하여 목적 화합물을 수득한다. 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, MeCN, DCM, Et2O, MeOH, EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 V의 예시
제조 #V.1: (R)-N-(1-(7-시아노-1H-인돌-4-일)피페리딘-3-일)-2-메틸옥사졸-4-카복스아미드
(R)-3급-부틸 1-(7-시아노-1H-인돌-4-일)피페리딘-3-일카바메이트(0.11g, 0.333mmol, 제조 #B.1)의 DCM(1mL) 중 용액에 TFA(1mL)를 첨가하고, 용액을 약 25℃에서 약 30분 동안 교반하였다. 혼합물을 증발시켜 건조시키고, 이어서, DMF(2mL), TEA(0.139mL, 0.999mmol), HATU(190mg, 0.499mmol) 및 2-메틸옥사졸-4-카복실산(0.055g, 0.433mmol)을 첨가하였다. 혼합물을 약 실온에서 약 18시간 동안 교반하였다. 반응물을 증발시키고, 헥산 중 30 내지 100% EtOAc의 구배로 용리하는 수득한 잔류물을 실리카 겔 크로마토그래피로 정제하여 (R)-N-(1-(7-시아노-1H-인돌-4-일)피페리딘-3-일)-2-메틸옥사졸-4-카복스아미드(0.092g, 79%)를 수득하였다; LC/MS (표 1, 방법 g) Rt = 1.35 min.; MS m/z: 350 (M+H)+
일반적 절차 W: 비닐 트리플레이트의 비닐 보로네이트 또는 보론산으로의 전환
보론산 또는 보로네이트(1 내지 2당량, 바람직하게는 1.1당량), 팔라듐 촉매(예를 들면, Pd(OAc)2, Pd2dba3, Pd(PPh3)4, 비스(아세테이토)트리페닐포스핀팔라듐(II), PdCl2(dppf), (1,1'-비스(디페닐포스피노)페로센)디클로로팔라듐(II), 또는 Pd(PPh3)2Cl2; 바람직하게는 PdCl2(dppf) 또는 Pd(PPh3)2Cl2; 0.01 내지 0.20당량, 바람직하게는 0.05 내지 0.1당량), 염기(예를 들면, KF, KOAc, Na2CO3, K2CO3 또는 Cs2CO3, 바람직하게는 K2CO3 또는 KOAc)(1.1 내지 16당량, 바람직하게는 1.5 내지 2당량) 및 임의로 포스핀 첨가제(바람직하게는 PPh3; 0.01 내지 0.1당량, 바람직하게는 0.06당량)의 유기 용매(예를 들면, 디옥산, DME 또는 DCE, 바람직하게는 디옥산) 중 혼합물에 비닐 트리플레이트(1당량)를 첨가한다. 혼합물을 불활성 분위기하에 약 60 내지 90℃(바람직하게는 70 내지 80℃)에서 약 1 내지 20시간(바람직하게는 8 내지 16시간) 동안 가열한다. 혼합물을 임의로 진공에서 농축하여 목적 화합물을 수득한다. 대안적으로, 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, ACN, DCM, Et2O, MeOH, 또는 EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 W의 예시
제조 #W.1: 3급-부틸 6-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트
100mL 3구 환저 플라스크를 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란)(1.10g, 4.34mmol, 제조 #AA.1), PPh3(0.062g, 0.24mmol), Pd(PPh3)2Cl2(0.138g, 0.197mmol) 및 K2CO3(0.818g, 5.92mmol)로 채웠다. 이 혼합물에 3급-부틸 6-(((트리플루오로메틸)설포닐)옥시)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(1.37g, 3.94mmol)의 디옥산(30mL) 중 용액을 첨가하였다. 전체 혼합물을 약 5분 동안 탈기하고, 질소로 퍼징하였다. 혼합물을 약 75℃에서 약 15시간 동안 가열하였다. 혼합물을 EtOAc(30mL) 및 물(30mL)로 희석시켰다. 유기 층을 분리시키고, MgSO4에서 건조시키고, 여과하고, 농축하였다. 수득한 혼합물을 실리카 겔 크로마토그래피(10 내지 40% EtOAc/헵탄)로 정제하여 3급-부틸 6-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(0.57g, 44%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.65 min; MS m/z: 226 (M+H-Boc)+
일반적 절차 X: 염기성 조건하에 에스테르의 카복실산으로의 가수분해 및 N-토실 보호된 헤테로아릴 환으로부터 토실 그룹의 제거
에스테르 관능기를 갖는 화합물 및 토실-보호된 헤테로방향족 환(1당량)을 순수하게 또는 유기 용매(예를 들면, 1,4-디옥산, MeOH, 또는 THF/MeOH, THF/물/MeOH 바람직하게는 THF/물/MeOH) 중에 포함하는 플라스크에 염기 또는 염기의 배합물(예를 들면, 수성 또는 고체 Na2CO3, KOH, Cs2CO3, K2CO3, NaOH 또는 LiOH, 바람직하게는 LiOH, 또는 KOH; 1 내지 10당량, 바람직하게는 5 내지 10당량)을 ?가한다. 혼합물을 약 0 내지 100℃(바람직하게는 약 40 내지 85℃)에서 약 1 내지 48시간(바람직하게는 약 1 내지 24시간) 동안 교반한다. 임의로, 더 많은 염기(예를 들면, 수성 또는 고체 Na2CO3, KOH, Cs2CO3, K2CO3, NaOH 또는 LiOH, 바람직하게는 LiOH 또는 NaOH, 1 내지 10당량, 바람직하게는 2 내지 6당량)를 첨가하고, 혼합물을 약 0 내지 100℃(바람직하게는 약 10 내지 100℃)에서 약 1 내지 48시간(바람직하게는 약 4 내지 24시간) 동안 교반한다. 이어서, 혼합물을 적합한 수성 산(예를 들면, 수성 HCl, AcOH 또는 시트르산, 바람직하게는 시트르산)을 첨가하여 산성화시킨다. 혼합물을 임의로 진공에서 농축하여 목적 화합물을 수득한다. 대안적으로, 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, ACN, DCM, Et2O, MeOH, 또는 EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 X의 예시
제조 #X.1: 4-(1-(3급-부톡시카보닐)-1,2,5,6-테트라하이드로피리딘-3-일)-2-메틸-1H-인돌-7-카복실산
환저 플라스크를 메틸 4-(1-(3급-부톡시카보닐)-1,2,5,6-테트라하이드로피리딘-3-일)-2-메틸-1-토실-1H-인돌-7-카복실레이트(1.67g, 2.30mmol, 제조 #39)로 THF(12mL), 물(4mL) 및 MeOH(4mL) 중에 채웠다. LiOH(모노하이드레이트, 0.468g, 11.1mmol)를 첨가하였다. 혼합물을 약 60℃에서 교반하였다. 약 7시간 후, 추가의 LiOH(모노하이드레이트, 0. 234g, 5.57mmol)를 첨가하고, 혼합물을 약 24시간 동안 약 60℃에서 교반되게 하였다. 혼합물을 5% 시트르산(200mL)으로 희석시키고, DCM(2 x 100mL) 및 3:1, CHCl3: 이소프로판올(100mL)로 추출하였다. 합한 유기 층을 물(50mL)로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 4-(1-(3급-부톡시카보닐)-1,2,5,6-테트라하이드로피리딘-3-일)-2-메틸-1H-인돌-7-카복실산(1.16g, 93%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.33 min; MS m/z: 355 (M-H)-.
일반적 절차 Y: 2-요오도-1H-인돌 또는 2-요오도-1H-아자인돌 환을 수득하기 위한 1H-인돌 또는 1H-아자 인돌 환의 요오드화
인돌 또는 아자인돌(1당량)의 유기 용매(예를 들면, THF 또는 Et2O, 바람직하게는 THF) 중 용액에 약 -60 내지 -78℃(바람직하게는 약 -70 내지 -78℃)에서 염기(예를 들면, BuLi 또는 LDA, 바람직하게는 LDA; 1 내지 2당량, 바람직하게는 1.1 내지 1.5당량)를 첨가한다. 이어서, 반응 혼합물을 약 30 내지 45분 동안 교반하고, 이어서, 요오드(1 내지 2당량, 바람직하게는 1.4 내지 1.6당량)를 첨가한다. 반응 혼합물을 약 10 내지 60분(바람직하게는 약 10 내지 30분) 동안 교반한다. 혼합물을 임의로 Na2S2O3로 켄칭한다. 혼합물을 임의로 진공에서 농축하여 목적 화합물을 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 임의로 특정한 순서 없이 세척할 수 있다. 이어서, 유기 용액을 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 임의로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 Y의 예시
제조 #Y.1: 1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-2-요오도-1H-인돌-1,7-디카복실레이트
무수 1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-1H-인돌-1,7-디카복실레이트(10.0g, 22.5mmol, (제조 #Z.1)의 THF(136mL) 중 용액을 약 -78℃로 냉각시키고, LDA(THF 중 1M, 33.7mL, 33.7mmol)를 적가하였다. 약 45분 후, 요오드(7.99g, 31.5mmol)의 THF(15mL) 중 용액을 적가하고, 그 동안 온도를 약 -71℃에서 유지하였다. 이어서, 반응 혼합물을 Na2S2O3 및 NaHCO3의 수용액(10:1, 150mL)을 부어 켄칭하였다. 혼합물을 EtOAc로 희석시키고, 층을 분리하였다. 수성 상을 EtOAc(3x50mL)로 추출하였다. 합한 유기 층을 염수로 세척하고, MgSO4에서 건조시키고, 여과하였다. 용매를 감압하에 제거하여 메틸 4-(1-(3급-부톡시카보닐)-2,5-디하이드로-1H-피롤-3-일)-1H-인돌-7-카복실레이트(10.4g, 97%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.90 min; MS m/z: 588 (M+NH4)+.
일반적 절차 Z: N-Boc 보호된 아민의 형성
아민 또는 아민 염(바람직하게는 1당량)의 유기 용매(예를 들면, ACN, 1,4-디옥산, DCM, DMF 또는 THF, 바람직하게는 DCM) 중 용액에 수성 염기, 예를 들면, Na2CO3, NaOH, K2CO3 또는 NaHCO3, 바람직하게는 Na2CO3(2 내지 20당량, 바람직하게는 2 내지 10당량) 또는 유기 염기, 예를 들면, TEA 또는 DIEA, 바람직하게는 TEA(1 내지 5당량, 바람직하게는 1 내지 2당량)을 첨가하고, 이어서, Boc 이동 시약, 예를 들면, BoC2O, Boc ON, Boc-아지드 또는 Boc-OSu 바람직하게는 Boc2O(1 내지 4당량, 바람직하게는 1 내지 2당량)를 첨가한다. 임의로, 첨가제, 예를 들면, DMAP(0.01 내지 0.1당량, 바람직하게는 0.05당량)를 첨가할 수 있다. 아민 염이 사용되지 않는 경우, 염기의 첨가는 선택적이다. 혼합물을 약 0 내지 40℃(바람직하게는 약 0 내지 25℃)에서 약 2 내지 24시간(바람직하게는 약 2 내지 16시간) 동안 교반한다. 혼합물을 임의로 진공에서 농축하여 목적 화합물을 수득할 수 있다. 대안적으로, 혼합물을 매질(예를 들면, 실리카 겔 또는 Celite®)을 통해 임의로 여과하고, 이를 적합한 용매(예를 들면, EtOAc, 1,4-디옥산, THF, ACN, DCM, Et2O, MeOH, EtOH)로 세정하고, 이어서, 임의로 진공에서 농축하여 잔류물을 목적 화합물로서 수득한다. 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 Z의 예시
제조 #Z.1: 1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-1H-인돌-1,7-디카복실레이트
200mL 환저 플라스크에서, 메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-1H-인돌-7-카복실레이트(12.4g, 36.0mmol, 메틸 4-브로모-1H-인돌-7-카복실레이트[Anthem]로부터 3급-부틸 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트[AKSCI]를 사용한 A 및 Pd/C를 사용한 L을 사용하여 제조함) 및 디-3급-부틸 디카보네이트(9.43g, 43.2mmol))를 ACN(100mL) 중에서 첨가하였다. DMAP(0.22g, 1.8mmol)를 첨가하고, 반응 혼합물을 실온에서 약 18시간 동안 교반하고, TEA(10mL, 72mmol) 및 디-3급-부틸 디카보네이트(1.60mL, 6.87mmol)를 첨가하였다. 반응 혼합물을 실온에서 약 16시간 동안 교반하였다. 혼합물을 희석된 아세트산 및 EtOAc로 추출하였다. 합한 유기 층을 MgSO4에서 건조시키고, 감압하에 농축하고, 실리카 겔 크로마토그래피(0 내지 25% EtOAC/헵탄)를 사용하여 정제하여 1-3급-부틸 7-메틸 4-(1-(3급-부톡시카보닐)피롤리딘-3-일)-1H-인돌-1,7-디카복실레이트(12.5g, 70%, 89% 순도)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.79 min; MS m/z: 462 (M+NH4)+.
일반적 절차 AA: 사이클릭 케톤의 사이클릭 비닐 트리플레이트로의 전환
케톤(1당량)의 유기 용매(예를 들면, THF, 디옥산 또는 에테르 바람직하게는 THF) 중 용액을 약 -60 내지 -78℃(바람직하게는 약 -65 내지 -75℃)로 냉각시킨다. 이어서, 염기를 서서히 첨가한다(예를 들면, LiHMDS, KHMDS 또는 NaHMDS 바람직하게는 KHMDS). 약 20 내지 60분(바람직하게는 60분) 후, 트리플레이트화 시약의 용액을 첨가하는데, 예를 들면, THF 중 N-(5-클로로-2-피리딜)비스(트리플루오로메탄설폰이미드)) 또는 1,1,1-트리플루오로-N-페닐-N-((트리플루오로메틸)설포닐)메탄설폰아미드이다. 이어서, 반응 혼합물을 실온으로 약 1 내지 1.5시간 동안 가온되게 한다. 이어서, 반응 혼합물을 NH4Cl 또는 물의 포화 용액으로 켄칭하고, 유기 용매(예를 들면, DCM 또는 EtOAc)로 희석할 수 있다. 층을 분리시키고, 유기 용액을 임의로 물 및/또는 염수로 세척하고, 무수 MgSO4 또는 Na2SO4로 건조시키고, 여과하고, 용매를 감압하에 제거하여 목적하는 화합물을 수득한다.
일반적 절차 AA의 예시
제조 #AA.1: 3급-부틸 6-(((트리플루오로메틸)설포닐)옥시)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트
3급-부틸 6-옥소-1,4-옥사제판-4-카복실레이트(5.00g, 23.2mmol)[Arkpharm]의 THF(51.6mL) 중 용액에 약 -78℃에서 KHMDS(THF 중 1M, 30.2mL, 30.2mmol)를 적가하고, 내부 온도를 약 -72 내지 -74℃에서 유지하였다. 이어서, 혼합물을 약 -77℃에서 약 1시간 동안 교반하였다. 1,1,1-트리플루오로-N-페닐-N-((트리플루오로메틸)설포닐)메탄설폰아미드(7.88g, 22.1mmol)의 THF(25.8mL) 중 용액을 적가하였다. 혼합물을 약 0℃로 약 1 내지 2시간 동안 점차적으로 가온하였다. 반응 혼합물을 NH4Cl의 포화 수용액으로 켄칭하고, EtOAc(2x75mL)로 추출하였다. 합한 유기 층을 염수로 세척하고, MgSO4에서 건조시키고, 여과하고, 감압하에 농축하고, 천연 알루미나(용리제로서 EtOAc/헵탄)의 플러그를 통해 통과시켜 (((트리플루오로메틸)설포닐)옥시)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(5.1g, 63.2%)를 수득하였다;
일반적 절차 AB: 이중 결합의 환원 및 CBZ 보호된 아민으로부터 CBZ 그룹의 제거
환저 플라스크를 팔라듐 촉매, 예를 들면, Pd/C 또는 Pd(OH)2(10 또는 20 wt%, 약 0.005 내지 1.0당량, 바람직하게는 0.5 내지 1.0당량)로 채운다. 이어서, 플라스크를 배출시키고, 이어서, 유기 용매 또는 용매의 혼합물(예를 들면, EtOAc, MeOH, EtOH 또는 MeOH/AcOH, 바람직하게는 MeOH/AcOH)을 질소 분위기하에 첨가하기 전에 2 내지 5회(바람직하게는 3회) 질소로 플러슁한다. 혼합물에 알켄 관능기를 갖는 화합물 및 N-CBZ 보호된 아민(바람직하게는 1당량)을, 순수하게 또는 임의로 유기 용매 또는 용매의 혼합물(예를 들면, EtOAc, MeOH, EtOH 또는 MeOH/AcOH, 바람직하게는 MeOH) 중 용액으로, 첨가한다. 혼합물을 수소 분위기(약 30 내지 50 psi)하에 약 1 내지 60시간(바람직하게는 약 4 내지 5시간) 동안 교반한다. 임의로 반응물을 Pd/C 또는 Pd(OH)2 카트리지(10 또는 20wt%)를 사용한 H-큐브 장치를 사용하여 수행할 수 있고, 출발 물질을 바람직한 용매 중 용액으로서 시스템을 통해 통과시킨다. 반응물이 TLC, LC/MS, 또는 HPLC로 모니팅하여 완료로 진행되지 않는 경우, 혼합물은 임의로 약 30 내지 80℃(바람직하게는 약 50℃)로 약 1 내지 24시간(바람직하게는 약 16시간) 동안 가열될 수 있고, H-큐브를 사용하여 반응을 수행하는 경우, 압력을 증가시킬 수 있다(25 내지 50 bar, 바람직하게는 40 내지 50 bar). 이어서, 혼합물을 여과하고, 필터 케이크를 유기 용매(예를 들면, EtOAc, MeOH 또는 EtOH, 바람직하게는 반응물 용매)로 세정하고 ,여과물을 감압하에 농축하여 조 생성물을 수득한다.
일반적 절차 AB의 예시
제조 #AB.1: 4-(피페리딘-3-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드
환저 플라스크를 Pd(OH)2(20 wt %, 0.336g, 0.478mmol)로 채우고, 이어서, 벤질 3-(7-카바모일-1H-피롤로[3,2-c]피리딘-4-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(1.8g, 4.8mmol, 제조 #45 및 벤질 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트[Arkpharm]로부터 A, LiOH를 사용한 Y 및 NH4Cl를 사용한 D를 사용하여 제조됨)의 MeOH(30mL) 및 AcOH(10mL) 중 용액을 서서히 첨가하였다. 플라스크를 N2로 퍼징하고, 이어서, H2로 벌룬을 사용하여 여과하였다. 이어서, 반응 혼합물을 약 45℃에서 약 3시간 동안 가열하였다. 반응 혼합물을 실온으로 냉각시키고, Celite®의 패드를 통해 여과하고, MeOH로 세척하였다. 여과물을 감압하에 농축시키고, MeOH 중에 용해시키고, 이어서, MP-카보네이트 비즈를 실온에서 약 2시간 동안 교반하여 처리하였다. 비즈를 여과제거하고, 여과물을 감압하에 농축하여 4-(피페리딘-3-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드(0.84g, 72%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 0.58 min.; MS m/z: 245 (M+H)+.
일반적 절차 AC: N 함유 헤테로 방향족 환의 N-산화
N-함유 헤테로 방향족 화합물(1당량)의 유기 용매(예를 들면, DCE, DME, DCM 또는 EtOAc, 바람직하게는 DCM) 중 용액을 약 0℃로 냉각시키고, 산화 시약, 예를 들면, 3-클로로벤조퍼옥소산 또는 마그네슘 모노퍼옥시프탈레이트 헥사하이드레이트(1 내지 3당량, 바람직하게는 2당량). 용액을 실온에서 약 2 내지 24시간(바람직하게는 약 10 내지 16시간) 동안 교반한다. 혼합물을 임의로 여과하여 목적하는 생성물을 수득하거나, 임의로 진공에서 농축하여 잔류물을 수득하고, 잔류물 또는 용액을 임의로 물 및 유기 용매(예를 들면, EtOAc, Et2O 또는 DCM) 사이에 분배할 수 있다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 AC의 예시
제조 #AC.1: 4-브로모-1H-피롤로[2,3-c]피리딘 6-옥사이드
플라스크를 4-브로모-1H-피롤로[2,3-c]피리딘(10.0g, 50.8mmol) [Combiblocks]으로 채우고, EtOAc(254mL)에 용해시켰다. 플라스크를 약 0℃로 냉각시키고, 3-클로로벤조퍼옥소산(10.5g, 60.9mmol)의 EtOAc(254mL) 중 용액을 서서히 첨가하였다. 반응물을 실온으로 약 16시간 동안 가온하면서 교반하였다. 형성된 침전물을 여과를 통해 수집하고, 진공 오븐에서 건조시켜 4-브로모-1H-피롤로[2,3-c]피리딘 6-옥사이드(0.85g, 79%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.18 min; MS m/z: 213, 215(M+H)+.
일반적 절차 AD: N-옥사이드 함유 헤테로아릴 환의 시안화
플라스크를 적합한 유기 용매, 예를 들면, ACN 중 N-옥사이드 헤테로방향족 화합물(1당량)로 채운다. TEA를 첨가한다(1 내지 2당량, 바람직하게는 1.5당량). 이어서, TMSCN(2 내지 5당량, 바람직하게는 3 내지 4당량)을 시린지를 사용하여 첨가한다. 반응 혼합물을 TLC 또는 LC/MS를 통해 출발 물질의 완전한 소모가 관찰될 때까지 환류시킨다. 반응 혼합물을 실온으로 냉각시키고, 적합하게는 바람직하게는 NaOH의 수용액으로 켄칭하고, 유기 용매, 예를 들면, DCM 또는 EtOAC로 추출한다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 AD의 예시
제조 #AD.1: 4-브로모-1H-피롤로[2,3-c]피리딘-7-카보니트릴
플라스크를 4-브로모-1H-피롤로[2,3-c]피리딘-6-옥사이드 3-클로로벤조에이트(6.25g, 16.91mmol, 제조 #AC.1)로 ACN(97mL) 및 TEA(3.56mL, 25.4mmol) 중에 채웠다. TMSCN(9.02mL, 67.6mmol)을 하나의 분획으로 시린지를 통해 첨가하고, 혼합물을 약 45분 동안 환류시켰다. 반응을 50mL의 수성 1 M NaOH 용액을 조심스럽게 첨가하여 켄칭하고, 분별깔때기로 옮기고, 수성 1M NaOH 용액(200mL) 및 EtOAc(200mL)로 희석시켰다. 층을 분리하고, 유기 상을 50mL의 수성 1 M NaOH 용액로 다시 세척하였다. 합한 수성 추출물을 EtOAc(4 x 75mL)로 세척하고, 이어서, 1 M NaOH(2 x 20mL) 및 염수(1 x 50mL)로 세척하고, Na2SO4에서 건조시키고, 여과하고, 용매를 제거하여 4-브로모-1H-피롤로[2,3-c]피리딘-7-카보니트릴(3.84g, 93%)을 수득하였다:
일반적 절차 AE: 알콜을 형성하기 위한 에스테르의 환원
에스테르의 적합한 유기 용매(예를 들면, THF, 디옥산, DCM 또는 EtOAc, 바람직하게는 THF) 중 용액에 임의로 물(1 내지 4당량, 바람직하게는 2당량)을 첨가한다. 이어서, 혼합물을 약 0℃로 냉각시키고, 환원제를 첨가한다(예를 들면, LiBH4 또는 LAH, 바람직하게는 LiBH4; 2 내지 12당량, 바람직하게는 6당량). 반응 혼합물을 약 5 내지 24시간 동안 에스테르가 완전한 소모될 때까지 교반한다. 추가의 환원제를 요구되는 경우 임의로 첨가할 수 있다. 이어서, 반응 혼합물을 NH4Cl의 수용액으로 켄칭한다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 AE의 예시
제조 #AE.1: 3급-부틸 3-(7-카바모일-1H-인돌-4-일)-5-(하이드록시메틸)피페리딘-1-카복실레이트
500mL 환저 플라스크에서, THF(150mL) 중 1-3급-부틸 3-메틸 5-(7-카바모일-1H-인돌-4-일)피페리딘-1,3-디카복실레이트(6.75g, 16.8mmol, 제조 #AF.1로부터 Z를 사용하여 제조함)를 첨가하였다. 반응 혼합물을 약 0℃로 냉각시키고, 물(0.606mL, 33.6mmol)을 첨가하였다. LiBH4(2.93g, 135mmol)를 첨가하고, 반응 혼합물을 실온에서 약 12시간 동안 교반하였다. 추가의 LiBH4(2.93g, 135mmol)를 첨가하고, 반응 혼합물을 약 3시간 동안 교반하였다. 반응 혼합물을 NH4Cl(800mL)의 포화 수용액에 약 -10℃에서 조심스럽게 첨가하였다. 혼합물을 DCM(500mL)으로 추출하였다. DCM 층을 MgSO4에서 건조시키고, 여과하고, 농축하여 조 3급-부틸 3-(7-카바모일-1H-인돌-4-일)-5-(하이드록시메틸)피페리딘-1-카복실레이트(6.35g, 101%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 1.74 min; MS m/z: 374 (M+H)+.
일반적 절차 AF: 피리딘 환의 피페리딘 환으로의 환원
피리딘(1당량)의 아세트산 중 용액에 환원 시약(예를 들면, PtO2, Pd(OH)2 또는 Pd/C, 바람직하게는 PtO2; 0.05 내지 0.5당량, 바람직하게는 0.1 내지 0.2당량)을 첨가한다. 반응 혼합물을 약 50℃에서 약 20 내지 50 psi(바람직하게는 약 30 psi)에서 약 6 내지 12시간(바람직하게는 약 10시간) 동안 가열한다. 반응 혼합물을 감압하에 농축하여 목적하는 화합물을 수득한다.
일반적 절차 AF의 예시
제조 #AF.1: 메틸 5-(7-카바모일-1H-인돌-4-일)피페리딘-3-카복실레이트
메틸 5-(7-카바모일-1H-인돌-4-일)니코티네이트(6.25g, 23.7mmol, 제조 # P.1로부터 메틸 5-브로모니코티네이트를 사용한 A를 사용하여 제조함) 및 AcOH(70mL)를 50mL 압력병에서 PtO2(1.26g, 5.55mmol)로 첨가하고, 약 10시간 동안 약 50℃에서 약 30 psi에서 진탕하였다. 수득한 흑색 용액을 감압하에 농축하고, Celite®의 플러그를 통해 여과하고, DCM으로 세척하였다. 이어서, 여과물을 농후한 점성 흑색 오일 잔류물로 농축시킨다. 이 물질을 15% MeOH/EtOAc에 용해시키고, 거대 실리카 겔 플러그를 통해 통과시켰다. 플러그를 10% MeOH/EtOAc(250mL), 이어서, 35 내지 40% MeOH/EtOAc(1.5L)로 플러슁하여 메틸 5-(7-카바모일-1H-인돌-4-일)피페리딘-3-카복실레이트(6.3g, 79%)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 0.96 min; MS m/z: 302 (M+H)+.
일반적 절차 AG: 트리플레이트의 원 포트(One pot) 보릴화 및 동일계내 형성된 보로네이트의 아릴 할라이드와의 스즈키 반응
비닐 트리플레이트(바람직하게는 1당량), 보론산 또는 보로네이트 에스테르(1 내지 2당량, 바람직하게는 1.1당량), 및 무기 염기(예를 들면, KF, Na2CO3, K2CO3 또는 Cs2CO3, 바람직하게는 Na2CO3 또는 Cs2CO3; 1.1 내지 16당량, 바람직하게는 2당량)의 용매(예를 들면, THF, DME, DMF, 1,4-디옥산, 1,4-디옥산, 바람직하게는 디옥산) 중 혼합물에 팔라듐 촉매(예를 들면, Pd(OAc)2, Pd2dba3, Pd(PPh3)4, 비스(아세테이토)트리페닐포스핀팔라듐(II), 중합체-결합된 FibreCatTM 1032, SiliaCat DPP-Pd, PdCl2(dppf) 또는 Pd(PPh3)2Cl2; 바람직하게는 PdCl2(dppf) 또는 Pd(PPh3)2Cl2; 0.01 내지 0.20당량, 바람직하게는 0.05 내지 0.1당량)를 첨가하고, 리간드(예를 들면, 트리사이클로헥실포스핀, 트리-3급-부틸-포스핀; 바람직하게는 없음 또는 PPh3; 0.01 내지 1.0당량, 바람직하게는 0.01 내지 0.03당량)를 임의로 첨가한다. 혼합물을 약 40 내지 120℃(바람직하게는 약 70 내지 85℃)에서 약 1 내지 48시간(바람직하게는 약 2 내지 4시간) 동알 열적으로 가열하거나, 약 100 내지 200℃(바람직하게는 약 120 내지 150℃)에서 약 5 내지 60분(바람직하게는 약 20 내지 45분) 동안 마이크로웨이브(바람직하게는 5 min 램프 시간, 300 Watts 최대 전력, 250 psi 최대 압력)에서 가열한다. 혼합물을 임의로 실온으로 냉각되게 하고, 여과한다. 반응 혼합물에 아릴 할라이드(1 내지 2당량), 물(사용된 원래의 유기 용매의 약 1/3 내지 1/4 용적) 및 임의로 추가의 촉매를 첨가하고, 염기 및 리가든를 첨가하고(바람직하게는 제1 반응에 사용된 것과 동일한 것), 동일 온도에서 약 3 내지 24시간(바람직하게는 약 8 내지 10시간) 동안 가열하고, 다음 방법 중 하나를 사용하여 후처리한다. 방법 1. 물을 포함하는 반응에 대해, 혼합물을 유기 용매(예를 들면, DCM 또는 EtOAc)로 희석할 수 있다. 층을 분리시키고, 유기 용액을 임의로 물 및/또는 염수로 세척하고, 무수 MgSO4 또는 Na2SO4로 건조시키고, 여과하고, 용매를 감압하에 제거하여 목적하는 화합물을 수득한다. 방법 2. 혼합물을 감압하에 농축한다. 방법 3. 촉매를 여과하여 제거하고, 여과물을 감압하에 농축시킨다.
일반적 절차 AG의 예시
제조 #AG.1: 3급-부틸 6-(7-(메톡시카보닐)-1H-피롤로[3,2-c]피리딘-4-일)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트
40mL 마이크로파 반응 바이알을 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란)(0.995g, 3.92mmol), PPh3(0.056g, 0.214mmol), Pd(PPh3)2Cl2(0.125g, 0.178mmol) 및 K2CO3(0.738g, 5.34mmol)로 채웠다. 이 혼합물을에 3급-부틸 6-(((트리플루오로메틸)설포닐)옥시)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(1.24g, 3.56mmol, 제조 #AA.1)의 디옥산(13mL) 중 용액을 첨가하였다. 전체 혼합물을 약 5분 동안 탈기하고, 질소로 퍼징하였다. 혼합물을 약 75℃에서 약 2시간 동안 가열하였다. 반응 혼합물에 메틸 4-클로로-1H-피롤로[3,2-c]피리딘-7-카복실레이트(0.600g, 2.85mmol), Pd(PPh3)2Cl2(125mg, 0.178mmol) , K2CO3(0.492g, 3.56mmol) 및 물(3.25mL)을 첨가하였다. 전체 현탁액을 질소로 약 10분 동안 탈기하고, 약 75℃에서 약 8시간 동안 가열하였다. 반응 혼합물을 냉각시키고, Celite®의 플러그 및 MgSO4에서 여과하고, 농축하고, 실리카 겔 크로마토그래피(0 내지 40% EtOAc/헵탄)로 정제하여 3급-부틸 6-(7-(메톡시카보닐)-1H-피롤로[3,2-c]피리딘-4-일)-2,3-디하이드로-1,4-옥사제핀-4(7H)-카복실레이트(0.3g, 23%)를 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.04 min; MS m/z: 374(M+H)+.
일반적 절차 AH: N-토실 보호된 헤테로방향족 환의 형성
N-헤테로방향족 환, 예를 들면, 인돌 또는 아자인돌(1당량)을 갖는 화합물의 적합한 유기 용매(예를 들면, THF, DMF, DCE, 톨루엔 또는 디옥산, 바람직하게는 THF) 중 용액을 임의로 약 0℃로 냉각시키고, 염기(예를 들면, NaH, KOH 또는 NaOH, 바람직하게는 NaH; 1 내지 2당량, 바람직하게는 1.1 내지 1.3당량)를 첨가한다. 반응 혼합물을 약 10 내지 30분 동안 교반하고, 4-메틸-벤젠설포닐 클로라이드(1 내지 3당량, 바람직하게는 1 내지 1.5당량)를 첨가한다. 반응 혼합물을 임의로 출발 N-헤테로방향족 화합물이 완전히 소모될 때까지 냉각된 경우 실온으로 가온되게 하거나 임의로 약 30 내지 90℃로 가열한다. 추가의 염기 및 토실화 시약을 요구되는 경우 임의로 첨가할 수 있다. 반응 혼합물을 물을 첨가하여 켄칭하고, 유기 용매(예를 들면, EtOAc 또는 DCM)로 추출한다. 유기 층을 단리시키고, 물 및/또는 산(예를 들면, HCl, AcOH 또는 NH4Cl)을 포함하는 수용액 및/또는 염기(예를 들면, NaHCO3, Na2CO3, NaOH, KOH 또는 NH4OH)를 포함하는 수용액 및/또는 무기 염(예를 들면, NaCl, Na2SO3 또는 Na2S2O3)을 포함하는 수용액으로 특정한 순서 없이 임의로 세정할 수 있다. 이어서, 유기 용액을 임의로 건조제(예를 들면, 무수 MgSO4 또는 Na2SO4)로 건조시키고, 여과하고, 진공에서 농축하여 목적 화합물을 수득할 수 있다.
일반적 절차 AH의 예시
제조 #AH.1: 4-브로모-1-토실-1H-피롤로[2,3-c]피리딘-7-카보니트릴
플라스크를 4-브로모-1H-피롤로[2,3-c]피리딘-7-카보니트릴(0.985g, 4.44mmol, 제조 # AD.1)로 THF(30mL) 중에 채운다. NaH(광유 중 60% 분산액, 0.213g, 5.32mmol)를 약 0℃에서 분획으로 첨가하였다. 혼합물을 약 15분 동안 교반되게 하고, 이어서, 4-메틸-벤젠설포닐 클로라이드(0.930g, 4.88mmol)를 하나의 분획으로 첨가하고, 반응물을 실온으로 가온되게 하고, 약 16시간 동안 교반하였다. 추가의 NaH(광유 중 60% 분산액, 0.355g, 0.89mmol) 및 4-메틸벤젠-1-설포닐 클로라이드(0.254g, 1.33mmol)를 차례로 첨가하고, 실온에서 약 1시간 동안 교반하였다. 반응 혼합물을 물(30mL)로 희석시키고, EtOAc(60mL)로 추출하였다. 유기 층을 MgSO4에서 건조시키고, 여과하고, 농축하고, 실리카 겔 크로마토그래피(0 내지 35% EtOAc/헵탄)를 사용하여 정제하여 4-브로모-1-토실-1H-피롤로[2,3-c]피리딘-7-카보니트릴(1.35g, 81%)을 수득하였다: LC/MS (표 1, 방법 as) Rt = 2.51 min; MS m/z: 376, 378(M+H)+.
실시예 #1: 3급-부틸 2-(4-브로모-7-카바모일-1H-인돌-2-일)벤질카바메이트
메틸페닐)티아졸-2-카복스아미드
단계 A: 3급-부틸 2-(4-브로모-7-카바모일-1H-인돌-2-일)벤질카바메이트
4-브로모-2-요오도-1H-인돌-7-카복스아미드(2.5g, 6.8mmol, 제조 #1)의 THF(185mL), MeOH(25mL) 및 물(25mL) 중 용액에 3급-부틸 2-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)벤질카바메이트(2.7g, 8.2mmol, JW), Pd(dppf)Cl2(0.5g, 0.7mmol) 및 Na2CO3(2.2g, 20.6mmol)를 첨가하였다. 혼합물을 약 80℃에서 밤새 질소하에 교반하였다. 용매를 감압하에 제거하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 조 물질 3급-부틸 2-(4-브로모-7-카바모일-1H-인돌-2-일)벤질카바메이트(2.5g, 5.6mmol)를 수득하였다.
단계 B: 3급-부틸 2-(7-카바모일-4-(2-메틸-3-(티아졸-2-카복스아미도)페닐)-1H-인돌-2-일)벤질카바메이트
2-(4-브로모-7-카바모일-1H-인돌-2-일)벤질카바메이트(2.5g, 5.6mmol)의 THF(185mL), MeOH(25mL) 및 물(25mL) 중 용액에 N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드(2.3g, 6.8mmol, 제조 #4), Pd(dppf)Cl2(0.4g, 0.6mmol) 및 Na2CO3(1.8g, 16.9mmol)를 첨가하였다. 혼합물을 약 80℃에서 밤새 질소하에 교반하였다. 용매를 감압하에 제거하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 3급-부틸 2-(7-카바모일-4-(2-메틸-3-(2-옥소-2-(티아졸-2-일)에틸)페닐)-1H-인돌-2-일)벤질카바메이트(3g, 92%)를 수득하였다:
단계 C: N-(3-(2-(2-(아미노메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
3급-부틸 2-(7-카바모일-4-(2-메틸-3-(2-옥소-2-(티아졸-2-일)에틸)페닐)-1H-인돌-2-일)벤질카바메이트(3g, 5.2mmol)의 DCM(50mL) 및 TFA(10mL) 중 용액을 약 25℃에서 약 6시간 동안 교반하였다. 용매를 감압에 의해 제거하였다. 물을 첨가하고, 용액을 포화 수성 NaHCO3를 첨가하여 pH 9로 염기성화하였다. 혼합물을 EtOAc로 추출하였다. 유기 상을 농축하여 N-(3-(2-(2-(아미노메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(2.2g, 89%)를 수득하였다: LC/MS (표 1, 방법 b) Rt = 2.53 min; MS m/z: 482(M+H)+. (Btk IC50 = B)
실시예 #2: 4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드
단계 A: 4-브로모-7-클로로-1H-피롤로[2,3-c]피리딘
5-브로모-2-클로로-3-니트로피리딘(10g, 0.042mol)의 무수 THF(150mL) 중 용액에, 비닐마그네슘 브로마이드(17g, 0.127mol)의 THF 중 용액을 -30 내지 -50℃에서 적가하였다. 반응 혼합물을 -30 내지 -40℃에서 2시간 동안 교반하였다. 이어서, 반응 혼합물을 포화 NH4Cl 수용액에 붓고, 혼합물을 EtOAc(50mL × 3)로 추출하였다. 합한 유기 층을 염수로 세척하고, 무수 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하고, 잔류물을 컬럼 크로마토그래피로 정제하여 4-브로모-7-클로로-1H-피롤로[2,3-c]피리딘( 3g, 31%)을 수득하였다:
단계 B: 3-(7-클로로-1H-피롤로[2,3-c]피리딘-4-일)-2-메틸아닐린
4-브로모-7-클로로-1H-피롤로[2,3-c]피리딘[Matrix](5g, 21.6mmol), 2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(7.55g, 32.4mmol, CombiBlocks) 및 탄산나트륨(1.6g, 64.8mmol)의 THF(80mL), MeOH(80mL) 및 물(20mL) 중 혼합물에, Pd(dppf)Cl2(1.6g, 2.16mmol)를 첨가하고, 혼합물을 수회 탈기하고, 약 70℃로 밤새 N2하에 가열하였다. 반응 혼합물을 Celite®를 통해 여과하고, 감압하에 농축하고, 잔류물을 컬럼 크로마토그래피로 정제하여 3-(7-클로로-1H-피롤로[2,3-c]피리딘-4-일)-2-메틸아닐린(2.2g, 40%)을 수득하였다:
단계 C: 메틸 4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복실레이트
3-(7-클로로-1H-피롤로[2,3-c]피리딘-4-일)-2-메틸아닐린(800mg, 3.1mmol)의 무수 MeOH(80mL) 중 용액에, Et3N(3.1g, 31mmol) 및 Pd(dppf)Cl2(0.45g, 0.62mmol)를 첨가하고, 반응 혼합물을 약 130℃로 약 24시간 동안 CO하에 가열하였다. 반응 혼합물을 감압하에 농축하고, 잔류물을 실리카 겔 컬럼으로 정제하여 메틸 4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복실레이트(0.60g, 69%)를 수득하였다:
단계 D: 4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드
메틸 4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복실레이트(600mg, 2.13mmol)의 MeOH(10mL), 암모니아(2mL) 중 용액에 첨가하고, 반응 혼합물을 밤새 실온에서 교반하였다. 혼합물을 농축시키고, 잔류물을 prep-TLC(30:1 DCM/MeOH)로 정제하여 4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드(320mg, 56%)를 수득하였다:
실시예 #3: N-(3-(7-카바모일-3-메틸-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
단계 A: 메틸 4-브로모-3-포밀-1H-인돌-7-카복실레이트
POCl3(2.4mL, 26mmol)를 DMF(60mL) 용액으로 0℃에서 적가하고, 약 30분 동안 교반하였다. 이어서, 메틸 4-브로모-1H-인돌-7-카복실레이트(5g, 13mmol, 제조 #1, 단계 B)의 DMF(60mL) 중 용액을 상기 반응 혼합물로 약 0℃에서 적가하고, 약 20분 동안 교반하였다. 수득한 반응 혼합물을 약 90℃로 약 3시간 동안 가열하였다. 실온으로 냉각한 후, 혼합물을 빙수로 붓고, 수성 NaOH 용액을 첨가하여 pH = 8 내지 9로 염기성화하였다. 수성 혼합물을 EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 메틸 4-브로모-3-포밀-1H-인돌-7-카복실레이트(3.5g, 95%)를 수득하였다:
단계 B: 메틸 4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복실레이트
메틸 4-브로모-3-포밀-1H-인돌-7-카복실레이트(3.5g, 12.4mmol)의 무수 DCE(50mL) 중 용액에 (4-메톡시페닐)메탄아민(2.6g, 18.6mmol) 및 촉매량의 AcOH를 첨가하였다. 반응 혼합물을 실온에서 약 1시간 동안 교반하였다. 이어서, NaBH(OAc)3(13.2g, 62mmol)를 분획으로 첨가하고, 실온에서 밤새 교반하였다. 반응이 완료된 경우, 물을 첨가하여 반응을 켄칭하였다. 수성 상을 DCM으로 추출하였다. 합한 유기 상을 감압하에 농축하여 잔류물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 메틸 4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복실레이트(4g, 80%)를 수득하였다:
단계 C: 4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복실산
메틸 4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복실레이트(5.4g, 13.4mmol)의 THF(250mL), MeOH(50mL) 및 물(50mL) 중 용액에 LiOH(1.6g, 67.0mmol)를 첨가하고, 환류까지 약 6시간 동안 가열하였다. 실온으로 냉각한 후, 유기 용매를 감압하에 제거하였다. 수성 상을 1 N HCl로 pH=5 내지 6로 산성화시켰다. 이어서, 현탁액을 여과하고, 필터 케이크를 물로 세척하고, 건조시켜 4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복실산(4g, 77%)을 수득하였다:
단계 D: 4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복스아미드
4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복실산(9.3g, 23.9mmol), EDCI(5.5g, 28.7mmol) 및 HOBt(4.4g, 28.7mmol)의 THF(350mL) 및 DCM(420mL) 중 혼합물을 실온에서 약 1시간 동안 교반하였다. 이어서, 반응 혼합물을 암모니아 기체로 약 15분 동안 약 -60℃에서 발포하고, 실온으로 가온시키고, 밤새 교반하였다. 용매를 감압하에 제거하고, MeOH를 첨가하였다. 현탁액을 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 Prep-HPLC(표 1, 방법 s)로 정제하여 4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복스아미드(2.1g, 23%)를 수득하였다: LC/MS (표 1, 방법 d) Rt = 2.31 min; MS m/z: 388 (M+H)+
단계 E: N-(3-(7-카바모일-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
4-브로모-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-7-카복스아미드(100mg, 0.26mmol), N-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)티아졸-2-카복스아미드(116mg, 0.39mmol, 제조 #4) 및 CsF(39mg, 0.26mmol)의 1,4-디옥산(2mL) 및 물(0.4mL) 중 용액에 Pd(PPh3)4(29.8mg, 0.03mmol)를 첨가하였다. 이어서, 반응 혼합물을 약 100℃로 질소하에 약 12시간 동안 가열하였다. 실온으로 냉각한 후, 물을 첨가하고, EtOAc로 추출하였다. 합한 유기 상을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 조 생성물을 수득하고, 이를 Prep-HPLC(표 1, 방법 r)로 정제하여 N-(3-(7-카바모일-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(10mg, 8%)를 수득하였다:
단계 F: N-(3-(7-카바모일-3-메틸-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
N-(3-(7-카바모일-3-(((4-메톡시벤질)아미노)메틸)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(10mg, 0.02mmol)의 무수 MeOH(5mL) 중 용액에 무수 Pd/C(5 mg)를 첨가하고, 실온에서 수소(50 Psi)하에 밤새 교반하였다. 이어서, 반응 혼합물을 여과하고, 여과물을 감압하에 농축하여 잔류물을 수득하고, 이를 Prep-HPLC(표 1, 방법 q)로 정제하여 N-(3-(7-카바모일-3-메틸-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드(1.1mg, 15%)를 수득하였다: LC/MS (표 1, 방법 j) Rt = 3.05 min; MS m/z: 391 (M+H)+. (Btk IC50 = B)
실시예 #4: N-(3-(7-카바모일-3-메틸-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드
단계 A: 5-브로모-6-니트로인돌린
5-브로모인돌린(12.33g, 83mmol)의 H2SO4(60mL) 중 용액에 KNO3(7.55mL, 74.7mmol)를 약 0℃에서 첨가하였다. 용액을 0 내지 10℃에서 약 1시간 동안 교반하고, 이어서, 혼합물을 밤새 실온에서 교반하였다. 혼합물을 빙수로 붓고, NaCO3로 약 pH 8로 염기성화하였다. 혼합물을 EtOAc(300mL × 3)로 추출하고, 유기 상을 NaSO4로 건조하고, 감압하에 농축하고, 잔류물을 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르: EtOAc=20:1)로 정제하여 5-브로모-6-니트로인돌린(12.3g, 81%)을 수득하였다:
단계 B: 3급-부틸 5-브로모-6-니트로인돌린-1-카복실레이트
5-브로모-6-니트로인돌린(7.5g, 30.9mmol)의 DCM(750mL) 중 용액에 (Boc)2O(13.47g, 61.7mmol)를 0℃에서 첨가하였다. 이어서, Et3N(9.37g, 93mmol) 및 DMAP(0.337g, 3.09mmol)를 혼합물에 첨가하였다. 혼합물을 밤새 실온에서 교반하였다. 반응 혼합물을 물에 붓고, DCM(300mL × 3)로 추출하고, 유기 상을 NaSO4로 건조하고, 감압하에 농축하고, 잔류물을 실리카 겔 컬럼(Pet 에테르 : EtOAc = 30:1)로 정제하여 3급-부틸 5-브로모-6-니트로인돌린-1-카복실레이트(6.7g, 63%)를 수득하였다:
단계 C: 3급-부틸 5-브로모-2,3-디하이드로피롤로[2,3-e]인돌-1(6H)-카복실레이트
3급-부틸 5-브로모-6-니트로인돌린-1-카복실레이트(4g, 11.66mmol)의 THF(60mL) 중 혼합물에 비닐마그네슘 브로마이드(6.43g, 49.0mmol)를 -40 내지 50℃에서 첨가하고, 이어서, 수득한 혼합물을 -20 내지 -30℃에서 약 2시간 동안 교반하고, 이어서, 밤새 실온에서 교반하였다. 혼합물을 포화 NH4Cl 용액에 붓고, EtOAc(100mL × 3)로 추출하였다. 유기 상을 NaSO4로 건조시키고, 감압하에 농축하고, 잔류물을 실리카 겔 크로마토그래피(Pet 에테르:EtOAc=50:1)로 정제하여 3급-부틸 5-브로모-2,3-디하이드로피롤로[2,3-e]인돌-1(6H)-카복실레이트(0.7g, 18%)를 수득하였다:
단계 D: 1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카보니트릴
3급-부틸 5-브로모-2,3-디하이드로피롤로[2,3-e]인돌-1(6H)-카복실레이트(60mg, 0.178mmol)의 DMF(2mL) 중 용액에 Zn(CN)2(12.53mg, 0.107mmol) 및 Pd(PPh3)4(20.56mg, 0.018mmol)를 첨가하였다. 용액을 약 145℃에서 약 50분 동안 마이크로파 N2하에 가열하였다. 혼합물을 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 aj)로 정제하여 1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카보니트릴(20mg, 61%)을 수득하였다:
단계 E: 1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카복스아미드
1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카보니트릴(160mg, 0.873mmol)의 DMSO(4mL) 중 용액에, K2CO3(300mg, 2.171mmol)를 첨가하고, 이어서, H2O2(4mL, 39.2mmol)를 실온에서 적가하였다. 그리고 반응 혼합물을 밤새 실온에서 교반하였다. 혼합물을 물에 붓고, EtOAc(20mL × 3)로 추출하고, 유기 상을 포화 수성 Na2S2O3로 세척하고, 건조시키고, 농축하고, 잔류물을 prep-HPLC(표 1, 방법 ak)로 정제하여 1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카복스아미드(70mg, 40%)를 수득하였다: LC/MS (표 1, 방법 d) Rt = 1.43 min; MS m/z: 202 (M+H)+.
단계 F: 1-아크릴로일-1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카복스아미드
1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카복스아미드(15mg, 0.075mmol)의 DCM(10mL) 중 용액에, Et3N(1mL, 7.17mmol)을 첨가하고, 이어서, 아크릴로일 클로라이드(10mg, 0.11mmol)의 DCM(0.5mL) 중 용액을 0℃에서 적가하였다. 반응 혼합물을 밤새 실온에서 교반하였다. 반응 용액을 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 t)로 정제하여 1-아크릴로일-1,2,3,6-테트라하이드로피롤로[2,3-e]인돌-5-카복스아미드(12mg, 63%)를 수득하였다:
실시예 #5: 4-아크릴아미도-1H-인돌-7-카복스아미드
단계 A: 4-아미노-1-토실-1H-인돌-7-카보니트릴
4-플루오로-1-토실-1H-인돌-7-카보니트릴(500mg, 1.59mmol, 제조 #27, 단계 A)의 1,4-디옥산(5mL) 중 용액에, 암모니아(2.5mL, 116mmol)를 첨가하였다. 혼합물을 약 120℃에서 밤새 교반하였다. 반응 혼합물을 감압하에 농축하고, 잔류물을 실리카 겔 컬럼으로 정제하여 4-아미노-1-토실-1H-인돌-7-카보니트릴(100mg, 20%)을 수득하였다:
단계 B: 4-아미노-1H-인돌-7-카보니트릴
4-아미노-1-토실-1H-인돌-7-카보니트릴(90mg, 0.289mmol)의 THF(2mL), MeOH(1mL) 및 물(1mL) 중 용액에 LiOH(69mg, 2.89mmol)를 첨가하였다. 혼합물을 약 40℃에서 밤새 교반하였다. 반응 혼합물을 감압하에 농축시키고, 물을 첨가하고, EtOAc(20mL × 3)로 추출하였다. 합한 유기 상을 Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 4-아미노-1H-인돌-7-카보니트릴(40mg, 88%)을 수득하였다:
단계 C: 4-아미노-1H-인돌-7-카복스아미드
4-아미노-1H-인돌-7-카보니트릴(40mg, 0.254mmol)의 DMSO(2mL) 중 용액에, K2CO3(52.8mg, 0.382mmol) 및 30% H2O2(2mL)를 실온에서 첨가하였다. 반응 혼합물을 실온에서 5시간 동안 교반하였다. 물을 반응 혼합물에 첨가하고, 혼합물을 EtOAc(20mL × 3)로 추출하고, 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하고, 잔류물을 prep-TLC(DCM:MeOH=15:1)로 정제하여 4-아미노-1H-인돌-7-카복스아미드(30mg, 67%)를 수득하였다:
단계 D: 4-아크릴아미도-1H-인돌-7-카복스아미드
4-아미노-1H-인돌-7-카복스아미드(30mg, 0.171mmol)의 DCM(3mL) 중 용액에, DIEA(0.060mL, 0.342mmol) 및 아크릴로일 클로라이드(18.60mg, 0.205mmol)를 첨가하고, 반응 혼합물을 밤새 실온에서 교반하였다. 이어서, 반응 혼합물을 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 u)로 정제하여 4-아크릴아미도-1H-인돌-7-카복스아미드(17mg, 43%)를 수득하였다: LC/MS (표 1, 방법 d) Rt = 2.10 min; MS m/z: 230 (M+H)+. (Btk IC50 = C)
실시예 #6: 4-아크릴아미도-1H-인돌-7-카복스아미드
단계 A: 4-(3-아크릴아미도-5-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드
환저 플라스크에 NMP(2mL) 및 HCl, 37% (0.222mL) 중 4-(3-아크릴아미도-5-니트로페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(0.175g, 0.343mmol, 4-브로모-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(제조 #18) 및 3-아미노-5-니트로페닐보론산 하이드로클로라이드[CombiBlocks]로부터 A, E 및 아크릴로일 클로라이드를 사용하여 제조함)을 첨가하여 적색 현탁액을 수득하였다. 반응물을 약 85℃로 가열하고, 주석(II) 클로라이드(0.600g, 0.316mmol)를 첨가하였다. 반응물을 약 85℃에서 약 1.5시간 동안 교반하였다. 추가의 주석(II) 클로라이드(2.39g, 1.26mmol)를 첨가하고, 반응물을 추가로 약 85℃에서 약 2시간 동안 교반하였다. 반응물을 실온으로 냉각시키고, DCM(30mL), MeOH(10mL), 및 1N NaOH(15mL)를 첨가하였다. 혼합물을 약 2시간 동안 격렬하게 교반하고, 여과하고, 여과물을 DCM(3x)으로 추출하였다. 유기 층을 합하고, 용매를 진공하에 제거하였다. 물 및 EtOAc을 잔류물에 첨가하고 EtOAc(4x)로 추출하였다. 유기 층을 합하고, 물 및 염수로 세척하였다. 유기 층을 합하고, 용매를 진공하에 제거하였다. 조 생성물을 실리카 겔 컬럼에 첨가하고, DCM 중 0 내지 10% MeOH로 용리하였다. 물질을 prep-HPLC로 추가로 정제하여(표 1, 방법 ag) 4-(3-아크릴아미도-5-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(20mg, 12%)를 수득하였다: LC/MS (표 1, 방법 g) Rt = 1.12 min.; MS m/z: 480 (M+H)+.
단계 B: 4-(3-아크릴아미도-5-(티아졸-2-일메틸아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드
4-(3-아크릴아미도-5-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(20mg, 0.042mmol) 및 티아졸-2-카브알데히드(4.03μl, 0.046mmol)의 MeOH(1mL) 중 교반된 용액에 MP-시아노보로하이드라이드(88mg, 0.167mmol) 및 아세트산(9.55μl, 0.167mmol)을 첨가하였다. 슬러리를 약 40℃에서 약 40시간 동안 교반하였다. 현탁액을 여과하고, 수지를 DCM 및 MeOH로 세척하였다. 여과물을 Si-카보네이트의 플러그를 통해 통과시켰다. 여과물을 감압하에 농축하고, 잔류물을 Prep-TLC(10% MeOH/DCM)로 정제하고, 이어서 Prep-TLC(5% MeOH/DCM)로 제2 정제하여 4-(3-아크릴아미도-5-(티아졸-2-일메틸아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드(7.2mg, 25%)를 수득하였다: LC/MS (표 1, 방법 g) Rt = 1.56 min.; MS m/z: 577 (M+H)+. (Btk IC50 = A)
실시예 #7. (E)-4-(3-(2-시아노-3-하이드록시부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드
N-(3-(7-카바모일-1H-인돌-4-일)페닐)-5-메틸이속사졸-4-카복스아미드(0.060g, 0.166mmol, 실시예 #E.2.1) 및 NaOH(0.008g, 0.200mmol)의 MeOH(1.9mL) 중 혼합물을 바이알에서 약 60℃에서 가열하였다. 약 2시간 후, 반응물을 실온으로 냉각시키고, 1N 수성 HCl을 첨가하여 산성화시켰다. 수득한 침전물을 진공 여과를 통해 수집하여 진공하에 약 55℃에서 건조시킨 후 (E)-4-(3-(2-시아노-3-하이드록시부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드(0.047g, 78%)를 고체로서 수득하였다: LC/MS (표 1, 방법 c) Rt = 2.79 min.; MS m/z: 361 (M+H)+. (Btk IC50 = C)
실시예 #8. 4-(시스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드 및 실시예 #9. 4-(트랜스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드
단계 A: 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥스-2-엔-1-일)카바메이트 및 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥스-3-엔-1-일)카바메이트
4-브로모-1H-인돌-7-카복스아미드(296mg, 1.237mmol, 제조 #2)의 용액에, [3-(4,4,5,5-테트라메틸[l,3,2]디옥사보롤란-2-일)-사이클로헥스-3-에닐]-카밤산 3급-부틸 에스테르 및 [3-(4,4,5,5-테트라메틸-[l,3,2]디옥사보롤란-2-일)-사이클로헥스-2-에닐]-카밤산 3급-부틸 에스테르(400mg, 1.237mmol, U.S. 2009/0197864), Na2CO3(328mg, 3.09mmol), PdCl2(dppf)-DCM 부가물(101mg, 0.124mmol)의 THF:MeOH:H2O(비: 4:2:2, 20mL) 중 용액을 N2 분위기하에 첨가하고, 혼합물을 약 100℃에서 밤새 가열하였다. 반응 혼합물을 Celite®의 패드를 통해 여과하였다. 수득한 혼합물을 EtOAc(30mL)로 희석시키고, H2O(20mL × 2)로 세척하고, Na2SO4로 건조하고, 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 x)로 정제하여 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥스-2-엔-1-일)카바메이트 및 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥스-3-엔-1-일)카바메이트(300mg, 68%)의 혼합물을 수득하였다: LC/MS (표 1, 방법 l) Rt = 1.67 min; MS m/z: 356 (M+H)+.
단계 B: 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥실)카바메이트
3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥스-2-엔-1-일)카바메이트 및 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥스-3-엔-1-일)카바메이트(300mg, 0.844mmol)의 THF(20mL) 중 용액에, Pd/C(44.9mg, 0.422mmol)를 첨가하고, 반응 혼합물을 실온에서 약 3시간 동안 H2 분위기하에 교반하였다. 혼합물을 여과하고, 감압하에 농축하여 조 생성물 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥실)카바메이트(290mg, 96%)를 수득하고, 이를 다음 단계에 직접 사용하였다. LC/MS (표 1, 방법 l) Rt = 1.53 min; MS m/z: 358 (M+H)+.
단계 C: 4-(3-아미노사이클로헥실)-1H-인돌-7-카복스아미드
3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로헥실)카바메이트(220mg, 0.615mmol)의 MeOH(10mL) 중 용액에, MeOH/HCl(10mL)을 약 0℃에서 첨가하고, 이어서, 반응 혼합물을 실온에서 약 3시간 동안 교반하였다. 반응 혼합물을 감압하에 농축하여 조 생성물 4-(3-아미노사이클로헥실)-1H-인돌-7-카복스아미드(100mg, 63%)을 수득하고, 이를 다음 단계에 직접 사용하였다. LC/MS (표 1, 방법 l) Rt = 0.54 min; MS m/z: 258 (M+H)+.
단계 D: 4-(시스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드 및 4-(트랜스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드
4-(3-아미노사이클로헥실)-1H-인돌-7-카복스아미드(120mg, 0.466mmol)의 DCM(3mL) 중 용액에, DIEA(120mg, 0.933mmol)를 첨가하고, 아크릴로일 클로라이드(42.2mg, 0.466mmol)를 약 0℃에서 적가하고, 혼합물을 약 0℃에서 약 10분 동안 교반하고, 이어서, 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 y)로 정제하여 4-(시스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드(27mg, 19%)를 수득하였다.
(Btk IC50 = A) 및 4-(트랜스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드(33mg, 23%)를 수득하였다:
실시예 #10 및 #11: 4-(시스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드 및 4-(트랜스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드
단계 A: 3-((3급-부톡시카보닐)아미노)사이클로펜트-1-엔-1-일 트리플루오로메탄설포네이트 및 4-((3급-부톡시카보닐)아미노)사이클로펜트-1-엔-1-일 트리플루오로메탄설포네이트
새롭게 제조된 LDA 용액(THF 중 2M, 9.38mL)에 3급-부틸 (3-옥소사이클로펜틸)카바메이트(2.00g, 10.0mmol)를 THF(4mL) 중에서 약 -78℃에서 적가하였다. 혼합물을 실온으로 약 30분 동안 가온하고, 이어서, 약 -78℃로 다시 냉각시켰다. 1,1,1-트리플루오로-N-페닐-N-((트리플루오로메틸)설포닐)메탄설폰아미드(5.38g, 15.1mmol)의 THF(10mL) 중 용액을 반응 혼합물에 약 -78℃에서 적가하였다. 수득한 혼합물을 실온으로 가온하고, 또다른 3시간 동안 교반하였다. EtOAc(30mL)로 처리하고, 혼합물을 H2O(20mL × 3) 및 염수(10mL)로 세척하고, Na2SO4로 건조하고, 감압하에 농축하고, 잔류물을 실리카 겔 상 크로마토그래피로 정제하여 3-((3급-부톡시카보닐)아미노)사이클로펜트-1-엔-1-일 트리플루오로메탄설포네이트 및 4-((3급-부톡시카보닐)아미노)사이클로펜트-1-엔-1-일 트리플루오로메탄설포네이트(0.82g, 25%)의 혼합물을 수득하고, 이를 다음 단계에서 추가 정제 없이 사용하였다.
단계 B: 3급-부틸 (3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)사이클로펜트-2-엔-1-일)카바메이트 및 3급-부틸 (3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)사이클로펜트-3-엔-1-일)카바메이트
3-((3급-부톡시카보닐)아미노)사이클로펜트-1-엔-1-일 트리플루오로메탄설포네이트 및 4-((3급-부톡시카보닐)아미노)사이클로펜트-1-엔-1-일 트리플루오로메탄설포네이트(720mg, 2.173mmol), 4,4,4',4',5,5,5',5'-옥타메틸-2,2'-비(1,3,2-디옥사보롤란)(662mg, 2.61mmol), PdCl2(dppf)-DCM 부가물(177mg, 0.217mmol) 및 KOAc(427mg, 4.35mmol)의 1,4-디옥산(20mL) 중 혼합물을 N2 분위기하에 약 100℃에서 밤새 가열하였다. 수득한 혼합물을 DCM(30mL)으로 희석시키고, H2O(20mL × 2)로 세척하고, 감압하에 농축하고, 잔류물을 실리카 겔로 정제하여 3급-부틸 (3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)사이클로펜트-2-엔-1-일)카바메이트 및 3급-부틸 (3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)사이클로펜트-3-엔-1-일)카바메이트(0.42g, 63%)의 조 혼합물을 수득하고, 이를 직접적으로 다음 단계에서 추가 정제 없이 사용하였다.
단계 C: 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜트-2-엔-1-일)카바메이트 및 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜트-3-엔-1-일)카바메이트
4-브로모-1H-인돌-7-카복스아미드(325mg, 1.36mmol, 제조 #2), 3급-부틸 (3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)사이클로펜트-2-엔-1-일)카바메이트 및 3급-부틸 (3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)사이클로펜트-3-엔-1-일)카바메이트(420mg, 1.36mmol), Na2CO3(360mg, 3.4mmol), PdCl2(dppf)-DCM 부가물(111mg, 0.136mmol)의 THF:MeOH:H2O(비: 4:2:2, 15mL) 중 용액에 N2 분위기하에, 혼합물을 약 100℃에서 밤새 교반하였다. 반응 혼합물을 여과하여 Pd 착물을 제거하였다. 수득한 혼합물을 EtOAc(30mL)로 희석시키고, H2O(20mL × 2)로 세척하고, Na2SO4로 건조시키고, 농축하고, prep-HPLC로 정제하여(표 1, 방법 y) 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜트-2-엔-1-일)카바메이트 및 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜트-3-엔-1-일)카바메이트(0.32g, 69%)의 혼합물을 수득하였다: LC/MS (표 1, 방법 l) Rt = 1.65 min; MS m/z: 342 (M+H)+.
단계 D: 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜틸)카바메이트
3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜트-2-엔-1-일)카바메이트 및 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜트-3-엔-1-일)카바메이트(300mg, 0.844mmol)의 THF(20mL) 중 용액에, Pd/C(44.9mg, 0.422mmol)를 첨가하고, 혼합물을 약 3시간 동안 실온에서 H2하에 교반하였다. 혼합물을 여과하고, 감압하에 농축하여 조 물질 3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜틸)카바메이트(0.29g, 96%)를 수득하고, 이를 다음 단계에 직접적으로 추가 정제 없이 사용하였다. LC/MS (표 1, 방법 l) Rt = 1.50 min; MS m/z: 344 (M+H)+.
단계 E: 4-(시스-3-아미노사이클로펜틸)-1H-인돌-7-카복스아미드 및 4-(트랜스-3-아미노사이클로펜틸)-1H-인돌-7-카복스아미드
3급-부틸 (3-(7-카바모일-1H-인돌-4-일)사이클로펜틸)카바메이트(250mg, 0.728mmol)의 MeOH(10mL) 중 용액에 약 0℃에서 MeOH/HCl(10mL)를 첨가하고, 혼합물을 약 3시간 동안 실온에서 교반하였다. 혼합물을 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 t)로 정제하여 4-(트랜스-3-아미노사이클로펜틸)-1H-인돌-7-카복스아미드(10mg, 6%) 및 4-(시스-3-아미노사이클로펜틸)-1H-인돌-7-카복스아미드(50mg, 28%)를 수득하였다. 4-(시스-3-아미노사이클로펜틸)-1H-인돌-7-카복스아미드(50mg, 0.206mmol)의 DCM(3mL) 중 용액에, DIEA(53mg, 0.411mmol)를 첨가하고, 이어서, 아크릴로일 클로라이드(18.60mg, 0.206mmol)를 약 0℃에서 적가하고, 혼합물을 약 0℃에서 약 10분 동안 교반하고, 이어서, 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 z)로 정제하여 4-(시스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드(20mg, 33%)를 수득하였다:
4-(트랜스-3-아미노사이클로펜틸)-1H-인돌-7-카복스아미드(10mg, 0.041mmol)의 DCM(1mL) 중 용액에, DIEA(11mg, 0.082mmol)를 첨가하고, 이어서, 아크릴로일 클로라이드(3.72mg, 0.041mmol)를 적가하고, 혼합물을 약 0℃에서 약 10분 동안 교반하고, 농축하고, prep-HPLC로 정제하여(표 1, 방법 z) 4-(트랜스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드(1.1mg, 9%)를 수득하였다:
실시예 #12*: (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1H-인돌-7-카복스아미드
단계 A: (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1-토실-1H-인돌-7-카보니트릴
(R)-3급-부틸 2-옥소-1,3'-비피페리딘-1'-카복실레이트(100mg, 0.354mmol, WO 2011/029046)의 DCM(4mL) 중 용액에 TFA(1.000mL)를 첨가하였다. 반응물을 약 4시간 동안 실온에서 교반하였다. 용매를 스트리핑하고, 4-플루오로-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-7-카보니트릴(168mg, 0.354mmol, 제조 #27) 및 TEA(0.197mL, 1.417mmol)의 DMSO(2mL) 중 혼합물을 첨가하였다. 바이알을 밀봉하고, 반응물을 마이크로웨이브에서 약 120℃에서 약 30분 동안 가열하였다. 물(20mL)을 첨가하고, DCM으로 추출하고, 이어서, 염수로 세척하고, 상 분리기를 통해 퉁과시켜 잔여 물을 제거하였다. 증발시키고, 0 내지 100% EtOAc/헥산의 구배로 용리하는 실리카 상 크로마토그래피하여 조 물질 (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1-토실-1H-인돌-7-카보니트릴(0.041g, 18.21%)을 수득하였다.
단계 B: (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1H-인돌-7-카복스아미드
Cs2CO3(20.50mg, 0.063mmol) 및 (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1-토실-1H-인돌-7-카보니트릴(40mg, 0.063mmol)의 THF(2mL) 및 MeOH(1.000mL) 중 혼합물을 실온에서 밤새 교반하였다. 용액을 물(15mL)로 희석시키고, 약 20분 동안 교반하였다. DCM을 첨가하여 현탁액을 용해시키고, 혼합물을 Biotage 상 분리기를 통해 여과하였다. 유기 상을 수집하고, 농축하였다. 중간체를 t-부탄올(1mL) 및 DMSO(0.500mL)에 용해시키고, NaOH(0.377mL, 0.755mmol) 및 과산화수소(0.175mL, 1.699mmol)를 첨가하였다. 혼합물을 약 20분 동안 실온에서 교반하고, 포화 NH4Cl(1mL)을 첨가하였다. 혼합물을 물(15mL)로 희석시키고, 약 15분 동안 교반하였다. 고체를 여과하여 수집하고, 수회 물로 세척하고, 진공하에 건조시키고, prep-HPLC로 정제하였다(표 1, 방법 aq). 샘플을 회수하고, DCM에 용해시켰다. 유기 상을 합하고, 포화 중탄산나트륨으로 세척하고, Biotage 상 분리기를 통해 여과하고, 농축하여 (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1H-인돌-7-카복스아미드(3mg, 9.54%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.37 min; MS m/z: 500 (M+H)+. (Btk IC50 = B)
실시예 #13*: (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드
단계 A: (R)-2-메틸-N-(피페리딘-3-일)벤즈아미드
(R)-3급-부틸 3-(2-메틸벤즈아미도)피페리딘-1-카복실레이트(19.0g, 59.7mmol, (R)-3급-부틸 3-아미노피페리딘-1-카복실레이트로 및 2-메틸벤조산으로부터 D를 사용하여 제조함)의 HCl(MeOH 중 2 N, 300mL, 600mmol) 중 혼합물을 실온에서 약 4시간 동안 교반하고, 이어서, 감압하에 농축하여 조 물질 (R)-2-메틸-N-(피페리딘-3-일)벤즈아미드(20.0g)을 수득하고, 이를 추가 정제 없이 추가 단계에서 직접적으로 사용하였다.
단계 B: (R)-N-(1-벤질피페리딘-3-일)-2-메틸벤즈아미드
(R)-2-메틸-N-(피페리딘-3-일)벤즈아미드(20.0g, 조 물질) 및 TEA(30.1g, 298.5mmol)의 DCM(260mL) 중 용액에 BnBr(11.2g, 65.7mmol)을 실온에서 약 30분 동안 적가하였다. 이어서, 혼합물을 실온에서 밤새 교반하였다. 완료된 후, DCM(1 L)을 첨가하고, 혼합물을 H2O(3 × 100mL)로 세척하였다. 유기 상을 무수 Na2SO4에서 건조시키고, 감압하에 농축하여 (R)-N-(1-벤질피페리딘-3-일)-2-메틸벤즈아미드(12.0g, 두 단계에서 걸쳐 65%)을 수득하였다: LC/MS (표 1, 방법 l) Rt = 0.91 min; MS m/z: 309 (M+H)+.
단계 C: (R)-2-(1-벤질피페리딘-3-일)이소퀴놀린-1(2H)-온
(R)-N-(1-벤질피페리딘-3-일)-2-메틸벤즈아미드(12.0g, 38.9mmol)의 THF 중 용액에 n-BuLi(2.5 M, 32.7mL)을 -22 내지 -14℃에서, 약 30분 동안 적가하였다. 수득한 짙은 적색 용액을 약 -22℃에서 약 30분 동안 교반하고, DMF를 약 -14℃ 아래에서 첨가하였다(내부). 첨가가 완료된 후, 용액을 약 -22℃에서 약 30분 동안 교반하였다. 이어서, HCl(6 N 수성, 25mL, 150mmol)을 서서히 첨가하고, 온도를 5℃ 아래로 유지하였다. 혼합물을 포화 NaOH을 약 0℃에서 첨가하여 pH 14로 염기성화하고, DCM(3 × 500mL)으로 추출하였다. 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 (R)-2-(1-벤질피페리딘-3-일)이소퀴놀린-1(2H)-온(12.0g, 97%)을 고체로서 수득하였다: LC/MS (표 1, 방법 l) Rt = 1.35 min; MS m/z: 319 (M+H)+.
단계 D: (R)-2-(피페리딘-3-일)-3,4-디하이드로이소퀴놀린-1(2H)-온
(R)-2-(1-벤질피페리딘-3-일)이소퀴놀린-1(2H)-온(12g, 37.7mmol) 및 Pd(OH)2(0.5g)의 MeOH 중 혼합물을 약 50℃에서 H2 분위기(50 psi)하에 밤새 교반하였다. 이어서, 혼합물을 Celite®를 통해 여과하고, 여과물을 농축하였다. 조 생성물을 섬광 크로마토그래피로 정제하여 6.3g의 조 생성물을 수득하고, 이를 MTBE(15mL) 및 HCl/MeOH(5mL)의 혼합물에서 재결정화하여 (R)-2-(피페리딘-3-일)-3,4-디하이드로이소퀴놀린-1(2H)-온(HCl 염)을 고체(2.1g, 21%)로서 수득하였다:
단계 E: (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1-토실-1H-인돌-7-카보니트릴
4-플루오로-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-7-카보니트릴(318mg, 0.672mmol, 제조 #27), (R)-2-(피페리딘-3-일)-3,4-디하이드로이소퀴놀린-1(2H)-온 하이드로클로라이드(179mg, 0.672mmol) 및 TEA(0.374mL, 2.69mmol)의 DMSO(4mL) 중 혼합물을 마이크로웨이브에서 약 120℃에서 약 20분 동안 가열하였다. 반응물을 마이크로웨이브에서 약 120℃에서 추가의 30분 동안 가열하였다. 물(50mL)을 첨가하고, DCM로 추출하였다. 용액을 염수로 세척하고, 상 분리기를 통해 통과시켜 잔여 물을 제거하였다. 유기 상을 농축하고, 0 내지 100% EtOAc/헥산의 구배로 용리하는 실리카 상 크로마토그래피하여 조 물질 (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1-토실-1-인돌-7-카보니트릴(110mg, 24%)을 수득하였다. 물질을 추가 정제 없이 사용하였다.
단계 F: (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드
Cs2CO3(51.9mg, 0.159mmol) 및 (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1-토실-1H-인돌-7-카보니트릴(109mg, 0.159mmol)의 THF(2mL) 및 MeOH(1.000mL) 중 혼합물을 실온에서 밤새 교반하였다. 혼합물을 물(15mL)로 희석시키고, 약 20분 동안 교반하였다. 침전물을 여과하여 수집하고, 필터 케이크를 물로 세척하였다. 필터 케이크를 t-부탄올 (1mL) 및 DMSO(0.500mL)에 용해시키고, NaOH(0.956mL, 1.91mmol) 및 과산화수소(0.444mL, 4.30mmol)를 첨가하였다. 혼합물을 약 20분 동안 실온에서 교반하고, 포화 NH4Cl(1mL)을 첨가하였다. 혼합물을 물(15mL)로 희석시키고, 약 15분 동안 교반하였다. 고체를 여과하여 수집하고, 물로 수회 세척하고, 진공하에 건조시켰다. 수득한 고체를 prep-HPLC로 정제하였다(표 1, 방법 ap). 샘플을 회수하고, DCM에 용해시켰다. 유기 상을 합하고, 포화 중탄산나트륨으로 세척하고, Biotage 상 분리기를 통해 여과하고, 농축하였다. 잔류물을 진공 오븐에서 약 50℃에서 약 48시간 동안 추가로 건조시켜 (R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드(30mg, 34%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.63 min; MS m/z: 548 (M+H)+. (Btk IC50 = A)
실시예 #13A*: (R)-N-(1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드
단계 A: (R)-3급-부틸 3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트
(R)-3급-부틸 3-아미노피페리딘-1-카복실레이트(2g, 9.99mmol) 및 티아졸-2-카복실산(1.29g, 9.99mmol)의 DCM(40mL) 중 용액에 HATU(4.85, 12.5mmol) 및 DIEA(3.87g, 29.9mmol)를 첨가하고, 혼합물을 실온에서 밤새 교반하였다. 이어서, 혼합물을 물로 붓고, DCM(3 × 80mL)으로 추출하였다. 합한 유기 층을 포화 수성 NaHCO3(80mL) 및 염수(80mL)로 세척하고, Na2SO4에서 건조시켰다. 용매를 감압하에 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피로 정제하여 (R)-3급-부틸 3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트(2.2g, 71%)를 수득하였다:
단계 B: (R)-N-(피페리딘-3-일)티아졸-2-카복스아미드
(R)-3급-부틸 3-(티아졸-2-카복스아미도)피페리딘-1-카복실레이트(1.9g, 6.1mmol)의 EtOAc(20mL) 중 용액에 HCl/EtOAc(20mL)를 약 0℃에서 적가하고, 이어서, 반응물을 실온에서 약 3시간 동안 교반하였다. 혼합물을 여과하고, 필터 케이크는 흡습성이었다. 필터 케이크를 물 및 포화 수성 NaHCO3 용액에 용해시켰다. 혼합물을 DCM(3 × 50mL)으로 추출하고, 합한 유기 층을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 (R)-N-(피페리딘-3-일)티아졸-2-카복스아미드(1.2g, 5.68mmol, 93%)를 수득하였다:
단계 C: (R)-N-(1-(7-시아노-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드
4-플루오로-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-7-카보니트릴(200mg, 0.422mmol, 제조 #27), (R)-N-(피페리딘-3-일) 티아졸-2-카복스아미드(178mg, 0.842mmol) 및 TEA(170mg, 1.680mmol)의 DMSO(2mL) 중 혼합물을 마이크로파 상태하에 약 120℃에서 약 1시간 동안 가열하였다. 물(10mL) 혼합물에 첨가하고, DCM(3 × 20mL)으로 추출하였다. 유기 층을 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 감압하에 농축하여 조 생성물을 수득하고, 이를 Prep-TLC(DCM:MeOH = 75:1)로 정제하여 (R)-N-(1-(7-시아노-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드(20mg, 7%)를 수득하였다: LC/MS (표 1, 방법 m) Rt = 2.24 min; MS m/z: 665 (M+H)+.
단계 D: (R)-N-(1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드
DMSO(1mL) 및 n-부탄올(2mL)의 혼합물 중 (R)-N-(1-(7-시아노-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1-토실-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드(76mg, 0.114mmol), NaOH(54.9mg, 1.37mmol) 및 30% H2O2(350mg, 3.09mmol)의 혼합물을 실온에서 약 24시간 동안 교반하였다. 이어서, 포화 수성 NH4Cl(2mL)을 첨가하고, 물(30mL)로 희석시키고, 30분 동안 교반하였다. 고체를 여과하여 수집하고, 물로 수회 세척하고, 조 생성물을 Prep-TLC(50:1 DCM/MeOH)로 정제하여 (R)-N-(1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드(32mg, 53%)를 수득하였다: LC/MS (표 1, 방법 d) Rt = 2.90 min; MS m/z: 529 (M+H)+. (Btk IC50 = A)
실시예 #14: 2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카복스아미드
단계 A: 3-(3-(7-브로모벤조[c][1,2,5]티아디아졸-4-일)-2-메틸페닐)퀴나졸린-4(3H)-온
톨루엔(40mL), MeOH(10mL) 및 물(10mL)의 혼합물 중 4,7-디브로모벤조[c][1,2,5]티아디아졸(1.029g, 3.5mmol) 및 3-(2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)퀴나졸린-4(3H)-온(1.141g, 3.15mmol, WO 2011159857)의 용액에 Na2CO3(0.742g, 7.00mmol) 및 Pd(PPh3)4(0.081g, 0.070mmol)를 첨가하였다. 혼합물을 약 100℃로 24시간 동안 가열하였다. 수득한 용액을 실온으로 냉각시키고, EtOAc로 희석시키고, 물 및 염수로 세척하고, Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc=5:1 내지 1:1로 용리됨)로 정제하여 3-(3-(7-브로모벤조[c][1,2,5]티아디아졸-4-일)-2-메틸페닐)퀴나졸린-4(3H)-온(1.0g, 64%)을 수득하였다:
단계 B: 7-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)벤조[c][1,2,5]티아디아졸-4-카보니트릴
3-(3-(7-브로모벤조[c][1,2,5]티아디아졸-4-일)-2-메틸페닐)퀴나졸린-4(3H)-온(0.449g, 1mmol)의 DMF(12mL) 중 용액에 Zn(CN)2(0.076g, 0.650mmol) 및 Pd(PPh3)4(0.046g, 0.040mmol)를 첨가하였다. 혼합물을 약 160℃로 약 15분 동안 N2 분위기하에 마이크로웨이브 반응기에서 가열하였다. 수득한 용액을 EtOAc로 희석시키고, 염수(4 x)로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc=5:1 내지 1:1로 용리됨)로 정제하여 7-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)벤조[c][1,2,5]티아디아졸-4-카보니트릴(0.3g, 76%)을 수득하였다:
단계 C: 2,3-디아미노-2'-메틸-3'-(4-옥소퀴나졸린-3(4H)-일)-[1,1'-비페닐]-4-카보니트릴
2,3-디아미노-2'-메틸-3'-(4-옥소퀴나졸린-3(4H)-일)-[1,1'-비페닐]-4-카보니트릴(0.53mg, 1.34mmol)의 AcOH(50mL) 중 용액에 아연(1.75g, 26.8mmol)을 첨가하고, 혼합물을 약 120℃로 약 2시간 동안 가열하였다. 용매를 농축시키고, 잔류물을 EtOAc로 흡수시키고, 포화 수성 NaHCO3 용액 및 염수로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc=1:1 내지 0:1로 용리됨)로 정제하여 2,3-디아미노-2'-메틸-3'-(4-옥소퀴나졸린-3(4H)-일)-[1,1'-비페닐]-4-카보니트릴(0.4g, 81%)을 수득하였다: LC/MS (표 1, 방법 l) Rt = 1.33 min; MS m/z: 368 (M+H)+.
단계 D: 2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카보니트릴
2,3-디아미노-2'-메틸-3'-(4-옥소퀴나졸린-3(4H)-일)-[1,1'-비페닐]-4-카보니트릴(400mg, 1.09mmol)의 DMF(15mL) 중 용액에 1-메틸-1H-피라졸-4-카브알데히드(240mg, 2.18mmol) 및 TMsCl(0.417mL, 3.27mmol)을 첨가하였다. 혼합물을 약 100℃로 약 30분 동안 마이크로웨이브 반응기에서 가열하였다. 수득한 용액을 EtOAc로 희석시키고, 염수(4 x)로 세척하였다. 유기 상을 Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 실리카 겔 상 컬럼 크로마토그래피(Pet 에테르:EtOAc=1:1, 이어서, EtOAc:MeOH=50:1로 용리됨)로 정제하여 2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카보니트릴(200mg, 40%)을 수득하였다: LC/MS (표 1, 방법 m) Rt = 1.78 min; MS m/z: 458 (M+H)+.
단계 E: 2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카복스아미드
부탄올(6mL) 및 DMSO(3mL)의 혼합물 중 2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카보니트릴(278mg, 0.608mmol)의 용액에 NaOH(292mg, 7.29mmol) 및 H2O2(1.68mL, 16.4mmol)를 첨가하였다. 혼합물을 약 24시간 동안 약 25℃에서 교반하였다. 수득한 용액을 포화 NH4Cl 수용액으로 켄칭하고, EtOAc로 추출하였다. 유기 상을 Na2SO4에서 건조시키고, 여과하고, 농축하여 조 생성물을 수득하고, 이를 prep-HPLC (표 1, 방법 n)로 정제하여 2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카복스아미드(140mg, 48%)를 수득하였다: LCMS (표 1, 방법 d) Rt = 2.53 min; MS m/z: 476 (M+H)+. (Btk IC50 = B)
실시예 #15: 4-(3-아크릴아미도페닐)-1H-인다졸-7-카복스아미드
단계 A: 3-(7-카바모일-1H-인돌-4-일)벤조산
4-브로모-1H-인돌-7-카복스아미드(0.5g, 2.091mmol, 제조 #2), (3-(메톡시카보닐)페닐)보론산(0.565g, 3.14mmol), 탄산나트륨(2.61mL, 5.23mmol)의 DME(10.00mL) 중 혼합물을 탈기하고, 질소로 약 5분 동안 퍼징하고, 이어서, 테트라키스(트리페닐포스핀)팔라듐(0)(0.121g, 0.105mmol)을 첨가하였다. 반응 용기를 밀봉하고, 마이크로파(Biotage Initiator)로 약 110℃에서 약 45분 동안 가열하였다. 혼합물을 실온으로 냉각시키고, 이어서, 약 50mL의 물을 첨가하였다. 침전물을 여과하고, 공기-건조시키고, 추가 정제 없이 사용하였다. 이어서, 이러한 조 물질을 THF(25mL)에 용해시키고, 수산화리튬(0.250g, 10.46mmol)의 물(25mL) 중 용액으로 처리하였다. 반응 혼합물을 실온에서 밤새 교반하였다. THF를 제거하고, 수성 층을 DCM으로 추출하여 트리페닐포스핀 옥사이드를 제거하였다. 이어서, 수성 상을 1N HCl 용액로 약 pH 2로 산성화시켰다. 침전물을 여과하고, 건조시켜 0.58g의 조 3-(7-카바모일-1H-인돌-4-일)벤조산을 고체로서 수득하였다. LC/MS (표 1, 방법 g) Rt = 1.37 min; MS m/z 281 (M+H)+.
단계 B: 4-(3-((시아노메틸)카바모일)페닐)-1H-인돌-7-카복스아미드
3-(7-카바모일-1H-인돌-4-일)벤조산(0.1g, 0.357mmol), TBTU(0.172g, 0.535mmol) 및 DIEA(0.249mL, 1.43mmol)의 DMF(5.0mL) 중 혼합물을 실온에서 약 5분 동안 교반하고, 이어서, 2-아미노아세토니트릴,염산(0.040g, 0.43mmol)을 첨가하였다. 반응 혼합물을 동일한 온도에서 밤새 교반하였다. 물을 첨가하고, 수성 상을 EtOAc로 추출하였다. 유기 층을 염수로 세척하고, 황산마그네슘에서 건조시키고, 여과하였다. 여과물을 건조시키고, 조 물질을 prep HPLC(표 1, 방법 i)로 정제하여 시아노메틸)카바모일)페닐)-1H-인돌-7-카복스아미드(0.065g, 57%)를 고체로서 수득하였다. LC/MS (표 1, 방법 g) Rt = 1.30 min; MS m/z 319 (M+H)+ (Btk IC50 = C)
실시예 #16: 4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드
4-브로모-1H-인돌-7-카복스아미드(1.28g, 5.35mmol, 제조 #2), 2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(1.37g, 5.89mmol, Combi-Blocks), Na2CO3(1.70g, 16.06mmol) 및 [1,1'-비스(디페닐포스피노)페로센]디클로로팔라듐(II)(0.392g, 0.535mmol)의 THF(41.8mL), MeOH(5.86 Ll), 및 물(5.86mL) 중 혼합물을 약 70℃에서 약 16시간 동안 질소 분위기하에 교반하였다. 혼합물을 Celite®를 통해 여과하고, 감압하에 농축하였다. 조 생성물을 DCM 중 0 내지 10% MeOH를 사용하는 실리카 겔 컬럼으로 정제하여 조 생성물을 수득하였다. 잔류물을 DCM(약 5분 동안 음파처리 2 x)으로 분쇄하고, 여과하고, DCM으로 세척하고, 감압하에 건조시켜 4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드(0.86g, 61%)를 수득하였다: LC/MS (표 1, 방법 g) Rt = 1.03 min; MS m/z: 266 (M+H)+. (Btk IC50 = C)
실시예 #17: 4-(3-아크릴아미도-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드
4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드(3.0g, 11.3mmol, 실시예 #2) 및 TEA(3.14mL, 22.5mmol)의 THF(113mL) 중 용액에 아크릴로일 클로라이드(1.01mL, 12.4mmol)를 0℃에서 서서히 첨가하였다. 반응물을 약 0℃에서 약 20분 동안 교반하였다. 혼합물을 감압하에 농축하고, 물(100mL)을 첨가하고, 현탁액을 30분 동안 음파처리하고, 여과하고, 물(100mL), 에테르(100mL)로 세척하고, 건조시켜 4-(3-아크릴아미도-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드(3.05g, 85%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.27 min; MS m/z: 321 (M+H)+. (Btk IC50 = A)
실시예 #18: 4-(3-아크릴아미도페닐)-1H-인다졸-7-카복스아미드
단계 A: 메틸 2-아미노-4-클로로-3-메틸벤조에이트
2-아미노-4-클로로-3-메틸벤조산(5.0g, 26.9mmol, En아민) 및 탄산세슘(13.2g, 40.4mmol)의 DMF(100mL) 중 혼합물에 요오도메탄(1.77mL, 28.3mmol)을 첨가하였다. 이어서, 혼합물을 실온에서 약 16시간 동안 교반하였다. 물을 첨가하고, EtOAc로 추출하였다. 유기 층을 염수로 세척하고, 황산마그네슘에서 건조시키고, 여과하였다. 여과물을 농축시키고, 실리카 겔 상 크로마토그래피(헵탄 중 5 내지 60% EtOAc)로 정제하여 메틸 2-아미노-4-클로로-3-메틸벤조에이트(4.48g)를 고체로서 수득하였다. LC/MS (표 1, 방법 g) Rt = 1.74 min; MS m/z 200 (M+H)+.
단계 B: 메틸 4-클로로-1H-인다졸-7-카복실레이트
메틸 2-아미노-4-클로로-3-메틸벤조에이트(4.5g, 22.5mmol)의 CHCl3(100mL) 중 용액에 아세트산 무수물(4.89mL, 51.8mmol)을 첨가하였다. 이어서, 혼합물을 실온에서 약 2시간 동안 교반하고, 이어서, 이소펜틸 니트라이트(6.68mL, 49.6mmol) 및 칼륨 아세테이트(0.664g, 6.76mmol)를 첨가하였다. 반응 혼합물을 환류에서 약 18시간 동안 가열하였다. 반응물을 DCM으로 희석시키고, 포화 중탄산나트륨으로 세척하고, 황산마그네슘에서 건조하였다. 여과물을 농축시켜 조 물질 메틸 4-클로로-1H-인다졸-7-카복실레이트(4.46g)를 수득한다: LC/MS (표 1, 방법 g) Rt = 1.47 min; MS m/z 211 (M+H)+.
단계 C: 4-클로로-1H-인다졸-7-카복스아미드
메틸 4-클로로-1H-인다졸-7-카복실레이트(4.3g, 20.4mmol)의 1,4-디옥산(75mL) 중 현탁액에 KOH(1.69g, 26.5mmol)의 물(75mL) 중 용액을 첨가하였다. 이어서, 반응 혼합물을 실온에서 약 16시간 동안 교반하여 맑은 용액을 수득하였다. 용매를 제거하고, 잔류물을 1N HCl로 처리하여 조(crude) 산을 침전시키고, 이를 추가 정제 없이 사용하였다. 이러한 조 산(0.5g, 2.54mmol), N1-((에틸이미노)메틸렌)-N3,N3-디메틸프로판-1,3-디아민 하이드로클로라이드(0.731g, 3.82mmol) 및 HOBt(0.584g, 3.82mmol)의 DMF(15mL) 중 혼합물을 실온에서 약 60분 동안 교반하고, 이어서, 암모니아(1,4-디옥산 중 0.5 N 용액, 50.9mL, 25.4mmol)를 첨가하였다. 반응 혼합물을 실온에서 약 6시간 동안 교반하였다. 현탁액을 여과하고, EtOAc로 세척하였다. 여과물을 농축시키고, 물로 처리하였다. 침전물을 여과하고, 물로 세척하고, 공기-건조시켜 4-클로로-1H-인다졸-7-카복스아미드(0.43g)를 고체로서 수득하였다; LC/MS (표 1, 방법 g) Rt = 1.00 min; MS m/z 196 (M+H)+.
단계 D: 4-(3-아미노페닐)-1H-인다졸-7-카복스아미드
4-클로로-1H-인다졸-7-카복스아미드(0.15g, 0.767mmol), 3급-부틸 (3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)페닐)카바메이트(0.367g, 1.15mmol), 탄산세슘(0.75g, 2.3mmol)의 DME(4.0mL) 및 물(2.0mL) 중 현탁액을 탈기하고, 질소로 5분 동안 퍼징하였다. 이어서, 트리스(디벤질리덴아세톤)디팔라듐(0)(0.07g, 0.077mmol) 및 2-(디사이클로헥실포스피노)-2',4',6'-트리이소프로필비페닐(0.037g, 0.077mmol)을 첨가하였다. 반응 용기를 밀봉하고, Biotage Initiator를 사용하여 약 140℃에서 약 30분 동안 가열하였다. 혼합물을 실온으로 냉각시키고, Celite®의 패드를 통해 여과하였다. 여과물을 물 및 EtOAc 사이에 분배하였다. 유기 층을 염수로 세척하고, 황산마그네슘에서 건조시키고, 여과하였다. 여과물을 농축시키고, 실리카 겔 상 크로마토그래피(30 내지 100% EtOAc/헵탄)로 정제하였다. 이어서, 이 생성물을 DCM(2mL)에 용해시키고, TFA(5mL, 64.9mmol)로 처리하였다. 반응 혼합물 실온에서 밤새 교반하였다. 과량의 TFA 및 용매를 제거하여 조 물질 4-(3-아미노페닐)-1H-인다졸-7-카복스아미드, 트리플루오로아세트산(0.195g)을 고체로서 수득하였다. LC/MS (표 1, 방법 g) Rt = 0.25 min; MS m/z 253(M+H)+.
단계 E: 4-(3-아크릴아미도페닐)-1H-인다졸-7-카복스아미드
4-(3-아미노페닐)-1H-인다졸-7-카복스아미드, TFA(0.1g, 0.27mmol), DIEA(0.143mL, 0.819mmol)의 THF(2.5mL) 중 현탁액을 빙욕에서 냉각시키고, 아크릴로일 클로라이드(0.026mL, 0.31mmol)를 서서히 첨가한다. 30분 후, 반응물을 MeOH로 처리하고, 약 5분 동안 교반하였다. 이어서, 용매를 진공하에 제거하고, 잔류물을 DCM으로 분쇄하여 4-(3-아크릴아미도페닐)-1H-인다졸-7-카복스아미드(56 mg)를 고체로서 수득하였다:
실시예 #19: 4-(3-아크릴아미도페닐)-1H-인다졸-7-카복스아미드
단계 A: 메틸 4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트
디이소프로필아민(1.45mL 10.1mmol) 및 무수 THF(30mL)의 용액에, t-BuLi(11mL, 11.7mmol)의 펜탄 중 용액을 약 -78℃에서 질소 분위기하에 첨가하고, 반응 혼합물을 약 30분 동안 교반하였다. 이어서, 메틸 4-브로모-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(3g, 7.81mmol, 제조 #10, 단계 A)의 무수 THF(10mL) 중 용액을 약 -78℃에서 첨가하였다. 약 2시간 후, 요오도메탄(2.216g, 15.61mmol)의 무수 THF(10mL) 중 용액을 약 -78℃에서 첨가하였다. 혼합을 계속하여 약 2시간 동안 약 -78℃에서 교반하였다. 반응 혼합물을 수성 NH4Cl로 켄칭하고, EtOAc(500mL × 3)로 추출하였다. 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 ao)로 정제하여 메틸 4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(1g, 32%)를 고체로서 수득하였다:
단계 B: 4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산
메틸 4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실레이트(0.6g, 1.5mmol)의 MeOH(3mL), THF(6mL) 및 물(3mL) 중 용액에, LiOH(0.361g, 15.1mmol)를 첨가하고, 반응 혼합물을 약 45℃로 약 3시간 동안 가열하였다. 반응 혼합물을 1N HCl을 첨가하여 pH < 3로 조정하고, 이어서, EtOAc(300mL × 3)로 추출하고, 유기 상을 감압하에 농축하여 4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산(0.5g, 86%)을 고체로서 수득하였다:
단계 C: 4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드
4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복실산(0.5g, 1.30mmol)의 THF(10mL) 및 DCM(12mL) 중 용액에, HOBt(0.299g, 1.95mmol) 및 EDCI(0.374g, 1.95mmol)를 약 0℃에서 첨가하였다. 이어서, 반응 혼합물을 약 1시간 동안 실온에서 교반하고, 이어서, NH3 기체로 약 20분 동안 발포시키고, 밤새 실온에서 교반을 계속하였다. 수성 NaHCO3를 첨가하고, 혼합물을 EtOAc(200mL × 3)로 추출하고, 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(0.45g, 90%)를 고체로서 수득하였다:
단계 D: 4-브로모-2-메틸-1H-인돌-7-카복스아미드
4-브로모-2-메틸-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(350mg, 0.913mmol)의 THF(15mL) 중 용액에 TBAF(2.4g, 9.13mmol) 및 에탄-1,2-디아민(1.1g, 18.3mmol)을 첨가하였다. 혼합물을 밤새 환류시켰다. 반응 혼합물을 감압하에 농축하고, 잔류물을 실리카 겔 컬럼으로 정제하여 4-브로모-2-메틸-1H-인돌-7-카복스아미드(180mg, 78%)를 고체로서 수득하였다:
단계 E: 4-(3-아미노페닐)-2-메틸-1H-인돌-7-카복스아미드
4-브로모-2-메틸-1H-인돌-7-카복스아미드(180mg, 0.711mmol)의 THF(8mL) 및 물(4mL) 및 MeOH(4mL) 중 용액에 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(187mg, 0.853mmol), Pd(dppf)Cl2(104mg, 0.142mmol) 및 Na2CO3(226mg, 2.13mmol)를 첨가하고, 용액을 약 90℃에서 약 2시간 동안 가열하였다. 반응 혼합물을 감압하에 농축하고, 실리카 겔 컬럼으로 정제하여 4-(3-아미노페닐)-2-메틸-1H-인돌-7-카복스아미드(80mg, 42%)를 고체로서 수득하였다:
단계 F: 4-(3-아크릴아미도페닐)-2-메틸-1H-인돌-7-카복스아미드
4-(3-아미노페닐)-2-메틸-1H-인돌-7-카복스아미드(80mg, 0.302mmol)의 DCM(6mL)중 용액에, 아크릴로일 클로라이드(40.9mg, 0.452mmol) 및 DIEA(0.105mL, 0.603mmol)를 약 0℃에서 첨가하였다. 혼합물을 약 1시간 동안 실온에서 교반하였다. 반응 혼합물을 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 an)로 정제하여 4-(3-아크릴아미도페닐)-2-메틸-1H-인돌-7-카복스아미드(10mg, 11%)를 고체로서 수득하였다: LC/MS (표 1, 방법 j) Rt = 2.07 min; MS m/z: 320 (M+H)+. (Btk IC50 = A)
실시예 #20: 4-(3-아크릴아미도페닐)-2-에틸-1H-인돌-7-카복스아미드
단계 A: 4-브로모-2-요오도-1H-인돌-7-카복스아미드
4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드((1.5g, 3.03mmol, 제조 #24)의 THF(20mL) 중 용액에, TBAF(15.84g, 60.6mmol) 및 에탄-1,2-디아민(1.82g, 30.3mmol)을 첨가하고, 용액을 환류에서 밤새 가열하였다. 용액을 감압하에 농축하고, 물(30mL) 및 EtOAc(30mL)를 첨가하고, 유기 상을 건조시키고, 감압하에 농축하였다. 잔류물을 컬럼 크로마토그래피(Pet 에테르:EtOAc = 10: 1 내지 1:1)로 정제하여 4-브로모-2-요오도-1H-인돌-7-카복스아미드(700mg, 63%)를 수득하였다: LC/MS (표 1, 방법 k) Rt = 1.91 min; MS m/z: 367 (M+H)+.
단계 B: 4-브로모-2-비닐-1H-인돌-7-카복스아미드
4-브로모-2-요오도-1H-인돌-7-카복스아미드(0.630g, 1.726mmol)의 1.4-디옥산(4.5mL) 및 물(0.5mL) 중 용액에, CsF(0.787g, 5.18mmol), Pd(PPh3)2Cl2(0.242g, 0.345mmol) 및 칼륨 트리플루오로(비닐)보레이트(254mg, 1.899mmol)를 첨가하였다. 반응 혼합물을 약 90℃로 약 2시간 동안 N2 분위기하에 가열하였다. 혼합물을 감압하에 농축하고, 잔류물을 컬럼 크로마토그래피로 정제하여 4-브로모-2-비닐-1H-인돌-7-카복스아미드(0.140g, 31%)를 수득하였다:
단계 C: 4-(3-아미노페닐)-2-비닐-1H-인돌-7-카복스아미드
4-브로모-2-비닐-1H-인돌-7-카복스아미드(0.12g, 0.45mmol)의 THF(10mL), 물(5mL) 및 MeOH(5mL) 중 용액에, 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(119mg, 0.543mmol), PdCl2(dppf)(66.2mg, 0.091mmol) 및 Na2CO3(144mg, 1.358mmol)를 첨가하였다. 반응 혼합물을 약 90℃에서 약 2시간 동안 가열하였다. 혼합물을 감압하에 농축하고, 잔류물을 실리카 겔 상 컬럼 크로마토그래피로 정제하여 4-(3-아미노페닐)-2-비닐-1H-인돌-7-카복스아미드(80mg, 75%)를 수득하였다: LC/MS (표 1, 방법 l) Rt = 1.06 min; MS m/z: 278 (M+H)+.
단계 C: 4-(3-아미노페닐)-2-에틸-1H-인돌-7-카복스아미드
4-(3-아미노페닐)-2-비닐-1H-인돌-7-카복스아미드(46mg, 0.116mmol)의 THF(10mL) 중 용액에, Pd/C(10mg, 0.094mmol)를 첨가하였다. 혼합물을 약 1.5시간 동안 실온에서 교반하였다. 혼합물을 Celite®의 패드를 통해 여과하고, 여과물을 감압하에 농축하여 4-(3-아미노페닐)-2-에틸-1H-인돌-7-카복스아미드(40mg, 70%)를 수득하고, 이를 다음 단계에서 직접적으로 사용하였다: LC/MS (표 1, 방법 l) Rt = 1.21 min; MS m/z: 280 (M+H)+.
단계 D: 4-(3-아크릴아미도페닐)-2-에틸-1H-인돌-7-카복스아미드
4-(3-아미노페닐)-2-에틸-1H-인돌-7-카복스아미드(20mg, 0.072mmol)의 DCM(15mL) 중 용액에, TEA(29mg, 0.288mmol) 및 아크릴로일 클로라이드(13.05mg, 0.144mmol)를 약 0℃에서 첨가하였다. 용액을 밤새 실온에서 교반하였다. 용액을 감압하에 농축하고, 잔류물을 pre-HPLC(표 1, 방법 am)로 정제하여 4-(3-아크릴아미도페닐)-2-에틸-1H-인돌-7-카복스아미드(9mg, 38%)를 수득하였다: LC/MS (표 1, 방법 d) Rt = 2.91 min; MS m/z: 334 (M+H)+. (Btk IC50 = A)
실시예 #21: 4-(3-아미노-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-에닐)-1H-인돌-7-카복스아미드
단계 A: 4-브로모-2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드
2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-4,4,5,5-테트라메틸-1,3,2-디옥사보롤란(0.267g, 1.09mmol, Syngene), 4-브로모-2-요오도-1H-인돌-7-카복스아미드(0.363g, 0.995mmol, 제조 #1), Na2CO3(0.316g, 2.98mmol)의 THF(7mL), MeOH(0.98mL), 및 물(0.98mL) 중 혼합물에 [1,1'-비스(디페닐포스피노)페로센]디클로로팔라듐(II)(0.073g, 0.099mmol)을 첨가하였다. 혼합물을 질소로 발포하고, 용기를 밀봉하고, 약 80℃에서 약 4시간 동안 가열하였다. 반응물을 실온으로 냉각시키고, Celite®를 통해 여과하고, 감압하에 농축하였다. 잔류물을 EtOAc/헥산(30 내지 100%)을 사용하는 실리카 겔 컬럼으로 정제하여 조 생성물을 수득하고, 이를 30 내지 70% EtOAc/헥산의 구배로 용리하는 실리카 겔 컬럼으로 추가하여 정제하여 4-브로모-2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드(0.25g, 71%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.82 min; MS m/z: 357 (M+H)+.
단계 B: 4-(3-아미노-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-에닐)-1H-인돌-7-카복스아미드
4-브로모-2-(4,4-디플루오로사이클로헥스-1-에닐)-1H-인돌-7-카복스아미드(0.48g, 0.622mmol), 2-메틸-3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(0.203g, 0.870mmol, Combi-Blocks), Na2CO3(0.198g, 1.865mmol) 및 [1,1'-비스(디페닐포스피노)페로센]디클로로팔라듐(II)(0.045g, 0.062mmol)의 THF(5mL), MeOH(0.700mL), 및 물(0.700mL) 중 혼합물을 약 70℃에서 약 16시간 동안 질소 분위기하에 교반하였다. 혼합물을 Celite®를 통해 여과하고, 감압하에 농축하였다. 잔류물을 EtOAc/헵탄(50 내지 75%)을 사용하는 실리카 겔 컬럼을 통하여 통과시켜 조 생성물을 수득하였다. 조 생성물을 DCM(약 5분 동안 음파처리 2 x)으로 분쇄하고, 여과하고, DCM으로 세척하고, 감압하에 건조시켜 4-(3-아미노-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-에닐)-1H-인돌-7-카복스아미드(134mg, 57%)를 수득하였다: LC/MS (표 1, 방법 f) Rt = 1.36 min; MS m/z: 382 (M+H)+. (Btk IC50 = A)
실시예 #22: 4-(3-아크릴아미도페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드
단계 A: (E)-4-브로모-2-(2-에톡시비닐)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드
5개의 반응 용기를 4-브로모-2-요오도-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(1g, 2.02mmol, 제조 #24)의 톨루엔(100mL) 중 용액으로 채우고, (E)-트리부틸(2-에톡시비닐)스타난(1.09g, 3.03mmol), Pd(PPh3)2Cl2(0.142g, 0.202mmol) 및 LiCl(0.428g, 10.1mmol)을 첨가하였다. 혼합물을 약 90℃에서 밤새 N2 분위기하에 가열하였다. 모든 5개의 반응 혼합물을 합하고, 감압하에 농축하고, 잔류물을 실리카 겔 컬럼으로 정제하여 (E)-4-브로모-2-(2-에톡시비닐)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(2g, 45%)를 황색 고체로서 수득하였다:
단계 B: (E)-4-(3-아미노페닐)-2-(2-에톡시비닐)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드
(E)-4-브로모-2-(2-에톡시비닐)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(1.5g, 3.41mmol)의 THF(20mL), 물(10mL) 및 MeOH(10mL) 중 용액에 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)아닐린(0.897g, 4.10mmol), Pd(dppf)Cl2(0.5g, 0.683mmol) 및 Na2CO3(1.085g, 10.24mmol)를 첨가하였다. 용액을 약 90℃에서 약 2시간 동안 가열하였다. 반응 혼합물을 감압하에 농축하고, 실리카 겔 컬럼으로 정제하여 (E)-4-(3-아미노페닐)-2-(2-에톡시비닐)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(0.80g, 52%)를 수득하였다:
단계 C: 4-(3-아미노페닐)-2-(2-에톡시에틸)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드
2개의 반응 용기를 (E)-4-(3-아미노페닐)-2-(2-에톡시비닐)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(400mg, 0.886mmol)의 MeOH(60mL) 중 용액, Pd/C(400mg, 10%)로 채웠다. 혼합물을 약 1시간 동안 실온에서 H2(14 psi) 분위기하에 교반하였다. 2개의 반응 혼합물을 합하고, 여과하고, 감압하에 농축하여 4-(3-아미노페닐)-2-(2-에톡시에틸)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(600mg, 75%)를 고체로서 수득하고, 이를 직접적으로 다음 단계를 위해 사용하였다:
단계 D: 4-(3-아미노페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드
4-(3-아미노페닐)-2-(2-에톡시에틸)-1-((2-(트리메틸실릴)에톡시)메틸)-1H-인돌-7-카복스아미드(500mg, 1.10mmol)의 THF(20mL) 중 용액에 TBAF(2.88g, 11.0mmol) 및 에탄-1,2-디아민(1.33g, 22.0mmol)을 첨가하였다. 혼합물을 약 5시간 동안 약 80℃에서 교반하였다. 반응 혼합물을 감압하에 농축하고, 잔류물을 실리카 겔 컬럼으로 정제하여 4-(3-아미노페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드(267mg, 75%)를 고체로서 수득하였다:
단계 E: 4-(3-아크릴아미도페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드
2개의 반응 용기를 4-(3-아미노페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드(60mg, 0.186mmol)의 DCM(2mL) 중 용액으로 채웠다. DIEA(0.065mL, 0.371mmol) 및 아크릴로일 클로라이드(25.2mg, 0.278mmol)를 첨가하고, 혼합물을 약 1시간 동안 실온에서 교반하였다. 2개의 반응 혼합물을 합하고, 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 w)로 정제하여 4-(3-아크릴아미도페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드(21.6mg, 26.4%)를 고체로서 수득하였다: LC/MS (표 1, 방법 d) Rt = 2.95 min; MS m/z: 378 (M-H)-. (Btk IC50 = A)
실시예 #23: 4-(3-아크릴아미도페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드
단계 A: 4-(3-아미노페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드
2개의 반응 용기를 4-(3-아미노페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드(100mg, 0.309mmol, 실시예 #22, 단계 D)의 DCM(10mL) 중 용액으로 채우고, 트리브로모보란(387mg, 1.55mmol)을 약 -78℃에서 적가하였다. 혼합물을 약 2시간 동안 약 0℃에서 교반하였다. 2개의 반응 혼합물을 합하고, 수성 NaHCO3를 첨가하고, 혼합물을 DCM(100mL × 3)으로 추출하였다. 유기 상을 Na2SO4에서 건조시키고, 감압하에 농축하여 4-(3-아미노페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드(160mg, 88%)를 황색 고체로서 수득하였다:
단계 B: 4-(3-아미노페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드
4-(3-아미노페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드(40mg, 0.135mmol)의 피리딘(4mL) 중 용액에 EDCI(31mg, 0.163mmol) 및 아크릴산(9.8mg, 0.135mmol)을 첨가하였다. 혼합물을 약 3시간 동안 약 110℃에서 교반하였다. 반응 혼합물을 감압하에 농축하고, 잔류물을 prep-HPLC(표 1, 방법 al)로 정제하여 4-(3-아크릴아미도페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드(4.5mg, 10%)를 고체로서 수득하였다: LC/MS (표 1, 방법 j) Rt = 2.46 min; MS m/z: 350 (M+H)+. (Btk IC50 = A)
실시예 #24: 4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-인돌-7-카복스아미드
단계 A: 3급-부틸- 3-((7-시아노-1H-인돌-4-일)아미노)아제티딘-1-카복실레이트
4mL 반응 바이알에서, 4-브로모-1H-인돌-7-카보니트릴(200mg, 0.905mmol, Sinova), 클로로[2-(디사이클로헥실포스피노)-3,6-디메톡시-2',4',6'-트리이소프로필-1,1'-비페닐][2-(2-아미노-에틸)페닐]팔라듐(II)(9.03mg, 0.011mmol), 및 디사이클로헥실(2',4',6'-트리이소프로필-3,6-디메톡시-[1,1'-비페닐]-2-일)포스핀(6.07mg, 0.011mmol)을 첨가하였다. 고체 혼합물을 배출시키고, 질소로 역충전하였다. 리튬 비스(트리메틸실릴)아미드(2.17mL, 2.17mmol)를 첨가하고, 이어서, 3급-부틸-3-아미노아제티딘-1-카복실레이트(170μl, 1.09mmol)를 첨가하였다. 반응 혼합물을 약 65℃에서 약 2.5시간 동안 가열하였다. 반응 혼합물을 수개 액적의 1N HCl로 켄칭하고, EtOAc(10mL)로 희석시켰다. EtOAc 층을 NaHCO3의 포화 수용액으로 세척하고, MgSO4에서 건조시키고, 여과하고, 진공하에 농축하였다. 조 물질을 헵탄 중 5 내지 40% EtOAc의 구배를 사용하는 섬광 크로마토그래피를 통해 정제하여 3급-부틸-3-((7-시아노-1H-인돌-4-일)아미노)아제티딘-1-카복실레이트(160mg, 57%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 2.13 min.; MS m/z: 311 (M-H)-.
단계 B: 3급-부틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)아미노)-7-시아노-1H-인돌-1-카복실레이트
100mL 환저 플라스크에서, MeCN(5mL) 중 3급-부틸 3-((7-시아노-1H-인돌-4-일)아미노)아제티딘-1-카복실레이트(200mg, 0.640mmol)를 첨가하여 갈색 용액을 수득하였다. DMAP(15.6mg, 0.128mmol) 및 BOC2O(419mg, 1.92mmol)를 첨가하였다. 반응 혼합물을 약 18시간 동안 실온에서 교반하였다. 반응 혼합물을 물(2mL) 및 EtOAc(3mL)로 희석시켰다. 전체 현탁액을 여과하고, EtOAc(5mL)로 세척하였다. 수집된 백색 침전물을 진공 오븐에서 약 70℃에서 약 2시간 동안 건조시켜 3급-부틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)아미노)-7-시아노-1H-인돌-1-카복실레이트(154mg, 58.3%)를 수득하였다. LC/MS (표 1, 방법 as) Rt = 2.54 min.; MS m/z: 411 (M-H)-.
단계 C: 3급-부틸-4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-7-시아노-1H-인돌-1-카복실레이트
4mL 반응 바이알에서, DMF(1mL) 중 수소화나트륨(23.9mg, 0.598mmol, 광유 중 60%)을 첨가하여 백색 현탁액을 수득하였다. 반응 혼합물을 약 0℃로 냉각시키고, 3급-부틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)아미노)-7-시아노-1H-인돌-1-카복실레이트(145mg, 0.352mmol)를 DMF(4mL) 중 용액으로서 첨가하였다. 약 30분 후, 요오도메탄(33μl, 0.528mmol)을 첨가하였다. 교반을 0℃에서 약 1시간 동안 계속하였다. 반응을 물(15mL)로 켄칭하고, EtOAc(20mL)로 추출하였다. 유기 층을 MgSO4에서 건조시키고, 여과하고, 농축하였다. 물질을 5분에 걸쳐서 0 내지 25% EtOAc/헵탄의 구배를 사용하는 섬광 크로마토그래피를 통해 정제하고, 이어서, 25% EtOAc/헵탄에서 5분 동안 유지하여 조 3급-부틸-4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-7-시아노-1H-인돌-1-카복실레이트(148mg, 71.1%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 2.71 min.; MS m/z: 427 (M+H)+.
단계 D: 3급-부틸 3-((7-카바모일-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트
3급-부틸 4-((1-(3급-부톡시카보닐)아제티딘-3-일)(메틸)아미노)-7-시아노-1H-인돌-1-카복실레이트(148mg, 0.250mmol)의 에탄올 (2mL)/DMSO(0.500mL) 중 용액에 과산화수소(0.515mL, 5.04mmol) 및 NaOH(1M, 0.515mL, 0.515mmol)를 첨가하였다. 반응 혼합물을 실온에서 약 2시간 동안 교반하였다. 반응 혼합물에 물(5mL)을 첨가하고, 침전물을 여과하여 수집하고, 물(5mL)로 세척하고, 진공 오븐에서 약 70℃에서 약 2시간 동안 건조시켜 3급-부틸 3-((7-카바모일-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(60mg, 52%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 1.97 min.; MS m/z: 345 (M+H)+.
단계 E: 4-(아제티딘-3-일(메틸)아미노)-1H-인돌-7-카복스아미드
4mL 반응 바이알에서, 1,4-디옥산(2mL) 중 3급-부틸 3-((7-카바모일-1H-인돌-4-일)(메틸)아미노)아제티딘-1-카복실레이트(60mg, 0.129mmol)를 첨가하여 미-백색 용액을 수득하였다. 디옥산 중 4M HCl(0.129mL, 0.516mmol)를 첨가하였다. 반응물을 실온에서 약 2시간 동안 교반하였다. 이를 약 50℃ 약 2시간 동안 가온시켰다. 추가의 디옥산 중 4M HCl(0.129mL, 0.516mmol)을 첨가하고, 교반을 약 50℃에서 약 45분 동안 계속하였다. 반응 혼합물을 여과하고, DCM으로 세척하여 침전물을 수득하였다. 침전물을 물(2mL)에 용해시키고, 소수의 액적의 5N 수성 NaOH 용액으로 염기성화시켰다. 이어서, 수성 층을 DCM(2 x 7mL) 및 EtOAc(2 x 8mL)로 추출하였다. 유기 층을 합하고, MgSO4에서 건조시키고, 여과하고, 농축하여 4-(아제티딘-3-일(메틸)아미노)-1H-인돌-7-카복스아미드(29mg, 66%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 0.73min.; MS m/z: 245 (M+H)+.
단계 F: 4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-인돌-7-카복스아미드
플라스크를 4-(아제티딘-3-일(메틸)아미노)-1H-인돌-7-카복스아미드(28mg, 0.083mmol) 및 N-에틸-N-이소프로필프로판-2-아민(65μl, 0.373mmol)으로 DCM(5mL) 중에 채웠다. 혼합물을 빙욕에서 0℃로 냉각시켰다. 아크릴로일 클로라이드(7.38μl, 0.091mmol)를 첨가하고, 혼합물 약 20분 동안 교반하였다. 반응 혼합물을 농축하였다. 물질을 7분에 걸쳐 1.0 내지 3.3% MeOH/DCM의 구배를 사용하고 5분 동안 3.3%에서 유지하는 섬광 크로마토그래피를 통해 정제하여 4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-인돌-7-카복스아미드(10.5mg, 43%)를 수득하였다; LC/MS (표 1, 방법 a) Rt = 1.31 min.; MS m/z: 299 (M+H)+. (Btk IC50 = A)
실시예 #25 : 4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드
단계 A: 3급-부틸 3-(7-카바모일-1H-인돌-4-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트
20mL 바이알을 4-브로모-1H-인돌-7-카복스아미드(300mg, 1.255mmol), 3급-부틸 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(466mg, 1.506mmol), (1,1-비스(디페닐포스피노)페로센)디클로로팔라듐(92mg, 0.125mmol) 및 탄산나트륨(399mg, 3.76mmol)로 채웠다. 고체 혼합물에 THF(6mL):MeOH(0.840mL):물(0.840mL)을 첨가하였다. 현탁액을 약 5분 동안 질소로 살포하였다. 반응 혼합물을 약 70℃에서 밤새 가열하였다. 반응 혼합물을 Celite®의 패드 상에서 여과하고, 농축하고, 실리카 겔 컬럼(30 내지 60% EtOAc/헵탄)으로 정제하여 3급-부틸 3-(7-카바모일-1H-인돌-4-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(355mg, 83%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 2.14min.; MS m/z: 340 (M-H)-.
단계 B: 3급-부틸 3-(7-카바모일-1H-인돌-4-일)피페리딘-1-카복실레이트
플라스크를 3급-부틸 3-(7-카바모일-1H-인돌-4-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(355mg, 1.04mmol) 및 팔라듐(55.3mg, 0.520mmol)으로 채웠다. 에틸 아세테이트(10mL)를 진공하에 첨가하고, 혼합물을 H2 벌룬하에 실온에서 약 5시간 동안 교반하였다. 반응 혼합물을 Celite®의 패드의 패드 상에서 여과하고, MeOH(20mL) 및 EtOAc(30mL)로 세척하였다. 여과물을 감압하에 농축하여 3급-부틸 3-(7-카바모일-1H-인돌-4-일)피페리딘-1-카복실레이트(357mg, 100%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 2.14 min.; MS m/z: 342 (M-H)-.
단계 C: 4-(피페리딘-3-일)-1H-인돌-7-카복스아미드
플라스크를 메탄올(5mL)로 채우고, 0℃로 냉각하였다. 아세틸 클로라이드(0.828mL, 11.6mmol)를 적가하고, 빙욕을 제거하였다. 혼합물을 실온에서 약 25분 동안 교반하였다. 이어서, 용액을 3급-부틸 3-(7-카바모일-1H-인돌-4-일)피페리딘-1-카복실레이트(100mg, 0.291mmol)에 첨가하고, 반응 혼합물을 실온에서 약 4시간 동안 교반하였다. 혼합물을 진공하에 농축하였다. 잔류물을 물(10mL)에 용해시키고, EtOAc(7mL)로 세척하였다. 수성 층을 소수개의 액적의 50% w/w NaOH 용액으로 염기성화시키고, EtOAc(12mL)로 추출하였다. EtOAc 층을 MgSO4에서 건조시키고, 여과하고, 농축하여 4-(피페리딘-3-일)-1H-인돌-7-카복스아미드(40mg, 56%)를 수득하였다; 물질을 다음 단계에서 추가 확인 없이 사용하였다.
단계 D: 4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드
플라스크를 4-(피페리딘-3-일)-1H-인돌-7-카복스아미드(40mg, 0.164mmol) 및 N-에틸-N-이소프로필프로판-2-아민(43μl, 0.247mmol)로 DCM(5mL) 중에 채웠다. 혼합물을 0℃로 냉각하였다. 아크릴로일 클로라이드(14.69μl, 0.181mmol)를 첨가하고, 혼합물 약 20분 동안 교반하였다. 반응 혼합물을 농축하였다. 물질을 10분에 걸쳐 1.0 내지 5.5% MeOH/CH2Cl2의 구배를 사용하는 실리카 겔 컬럼으로 정제하여 4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드(41mg, 84%)를 수득하였다; LC/MS (표 1, 방법 a) Rt = 1.53min.; MS m/z: 298 (M+H)+. (Btk IC50 = B)
실시예 #26: 4-(1-아크릴로일피페리딘 3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드
단계 A: 3급-부틸 3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트
20mL 바이알을 4-브로모-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드(216mg, 0.677mmol, 제조 #10), 3급-부틸 3-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(251mg, 0.812mmol), (1,1-비스(디페닐포스피노)페로센)디클로로팔라듐(1:1)의 DCM과의 착물(55.3mg, 0.068mmol) 및 탄산나트륨(215mg, 2.03mmol)으로 채웠다. 고체 혼합물에 THF(3mL):MeOH(0.420mL):물(0.420mL)을 첨가하였다. 현탁액을 약 5분 동안 N2로 살포하였다. 반응 혼합물을 약 70℃에서 밤새 가열하였다. 반응 혼합물을 셀라이트 패드에서 여과하고, 농축하고, 실리카 겔 컬럼(0 내지 2% MeOH/DCM)로 정제하여 3급-부틸 3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(227mg, 80%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 2.09 min.; MS m/z: 422 (M+H)+.
단계 B: 3급-부틸 3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)피페리딘-1-카복실레이트
플라스크를 3급-부틸 3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-5,6-디하이드로피리딘-1(2H)-카복실레이트(227mg, 0.539mmol) 및 탄소 상 10% 팔라듐(28.7mg, 0.027mmol)으로 채웠다. 에틸 아세테이트(5mL)를 진공하에 첨가하고, 혼합물을 H2 벌룬하에 실온에서 약 5시간 동안 교반하였다. 반응 혼합물을 Celite®의 패드의 패드 상에서 여과하고, MeOH(20mL) 및 EtOAc(30mL)로 세척하였다. 여과물을 감압하에 농축하여 표제 화합물(177mg, 78%)을 수득하였다; LC/MS (방법 as) Rt = 2.08 min.; MS m/z: 424 (M+H)+.
단계 C: 2-(1-메틸-1H-피라졸-4-일)-4-(피페리딘-3-일)-1H-인돌-7-카복스아미드
플라스크를 MeOH(2mL)로 채우고, 0℃로 냉각하였다. 아세틸 클로라이드(0.151mL, 2.12mmol)를 적가하고, 빙욕을 제거하였다. 혼합물을 실온에서 약 25분 동안 교반하였다. 이어서, 용액을 3급-부틸 3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)피페리딘-1-카복실레이트(30mg, 0.071mmol)에 첨가하고, 반응 혼합물을 실온에서 밤새 교반하였다. 혼합물을 진공하에 농축하였다. 잔류물을 물(3mL)에 용해시키고, DCM(3mL)으로 세척하였다. 수성 층을 소수개의 액적의 5N NaOH로 염기성화시켜 현탁액을 수득하고, 이에 DCM을 첨가하였다. DCM 층을 분리시키고, 수성 층은 침전물을 형성하고, 이를 여과를 통해 수집하고, DCM/EtOAC/MeOH(1:1:1)의 혼합물(6mL)로 세척하였다. 이 여과물을 DCM 층과 합하고, 진공하에 농축하여 2-(1-메틸-1H-피라졸-4-일)-4-(피페리딘-3-일)-1H-인돌-7-카복스아미드(18mg, 79%)를 수득하였다; LC/MS (표 1, 방법 as) Rt = 1.03 min.; MS m/z: 324 (M+H)+.
단계 D: 4-(1-아크릴로일피페리딘 3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드
플라스크를 2-(1-메틸-1H-피라졸-4-일)-4-(피페리딘-3-일)-1H-인돌-7-카복스아미드(18mg, 0.056mmol) 및 N-에틸-N-이소프로필프로판-2-아민(0.044mL, 0.250mmol)로 DCM(5mL) 중에 채웠다. 혼합물을 빙욕에서 0℃로 냉각시켰다. 아크릴로일 클로라이드(4.97μl, 0.061mmol)를 첨가하고, 혼합물을 약 20분 동안 교반하였다. 반응 혼합물을 농축하였다. 물질을 실리카 겔 컬럼(2.0 내지 6.5% MeOH/DCM)으로 정제하여 4-(1-아크릴로일피페리딘 3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드(9mg, 43%)를 수득하였다; LC/MS (표 1, 방법 a) Rt = 1.56 min.; MS m/z: 378 (M+H)+. (Btk IC50 = A)
실시예 #27: 4-((1-아크릴로일아제티딘-3-일)옥시)-1H-인돌-7-카복스아미드
단계 A: 3급-부틸 3-(4-브로모-3-니트로페녹시)아제티딘-1-카복실레이트
탄산세슘(2.038g, 6.26mmol)을 DMF(12mL) 중에 첨가하여 백색 현탁액을 수득하였다. 분자체(4Å, 8 내지 12 메시, 비드, 100mg) 4-브로모-3-니트로페놀(1g, 4.59mmol) 및 3급-부틸 3-((메틸설포닐)옥시)아제티딘-1-카복실레이트(1.048g, 4.17mmol)를 첨가하고, 혼합물을 약 85℃에서 약 18시간 동안 가열하였다. 조 혼합물을 EtOAc(50mL) 및 포화 수성 염화암모늄 용액(30mL) 사이에 분배하였다. 유기 층을 염수(30mL)로 세척하고, 황산나트륨에서 건조시키고, 여과하고, 농축하여 3급-부틸 3-(4-브로모-3-니트로페녹시)아제티딘-1-카복실레이트(0.799g, 2.14mmol, 46.7% 수율)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 2.62 min; MS m/z 373, 375 (M+H)+.
단계 B: 3급-부틸 3-((7-브로모-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트
100mL 환저 플라스크를 질소로 탈기하고, 약 -70℃로 무수-얼음/아세톤 욕에서 냉각시켰다. 비닐마그네슘 브로마이드의 THF 중 용액(1.0 M, 21.59mL, 21.59mmol)을 플라스크로 첨가하였다. 이어서, 3급-부틸 3-(4-브로모-3-니트로페녹시)아제티딘-1-카복실레이트(2.65g, 5.40mmol)의 2-메틸-THF(18mL) 중 용액을 8분 동안 적가하고, 혼합물을 약 -70℃에서 약 1시간 동안 교반하고, 반응 혼합물을 포화 수성 염화암모늄 용액(22mL)에 의해 약 -60℃에서 켄칭하였다. 수득한 혼합물을 실온으로 가온하고, EtOAc(50mL) 및 물(40mL)을 첨가하였다. 층을 분리시키고, 수성 층을 EtOAc(50mL)로 추출하고, 합한 유기 층을 염수(50mL)로 세척하고, 황산나트륨에서 건조시키고, 여과하고, 농축하여 오렌지색 오일을 수득하고, 이를 0 내지 40% EtOAc/헵탄의 구배로 용리하는 실리카 겔 크로마토그래피로 정제하여 3급-부틸 3-((7-브로모-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트(0.87g, 2.37mmol, 43.9% 수율)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 2.52 min; MS m/z 367, 369 (M+H)+.
단계 C: 3급-부틸 3-((7-시아노-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트
20mL 마이크로파 반응 바이알에서, 3급-부틸 3-((7-브로모-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트(0.8g, 2.178mmol), 아연 시아나이드(0.512g, 4.36mmol) 및 DMF(12mL)을 첨가하여 황색 현탁액을 수득하였다. 바이알을 질소로 탈기하고, 테트라키스(트리페닐포스핀)팔라듐(0)(0.755g, 0.654mmol)을 첨가하였다. 혼합물을 질소로 탈기하고, 이어서, 반응 혼합물을 Biotage® 마이크로파 반응기에서 약 160℃에서 약 30분 동안 가열하였다(2psi 최대 압력, 235 max watts). 수득한 오렌지색 현탁액을 Celite®를 통해 여과하고, DMF(10mL) 및 2-메틸-THF(3x10mL)로 세척하고, 여과물을 진공에서 농축하여 대부분의 DMF를 제거하고, 이어서, 이를 2-메틸-THF(50mL) 및 포화 수성 염화암모늄 용액(50mL) 사이에 분배하였다. 유기 층을 물(30mL) 및 염수(30mL)로 세척하고, 황산나트륨에서 건조시키고, 여과하고, 농축하여 오렌지색 오일을 수득하고, 이를 0 내지 50% EtOAc/헵탄의 구배로 용리하는 실리카 겔 크로마토그래피로 정제하여 3급-부틸 3-((7-시아노-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트(0.28g, 0.894mmol, 41.0% 수율)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 2.29 min; MS m/z 314 (M+H)+.
단계 D: 4-((1-아크릴로일아제티딘-3-일)옥시)-1H-인돌-7-카복스아미드
3급-부틸 3-((7-시아노-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트(0.28g, 0.894mmol) 및 칼륨 카보네이트(0.309g, 2.234mmol)의 DMSO(2.98mL) 중 혼합물을 빙냉 수욕으로 약 10℃로 냉각시키고, 이어서, 과산화수소(0.091ml, 0.894mmol)를 적가하였다. 반응 혼합물을 실온에서 약 18시간 동안 교반하고, 과산화수소(0.023mL, 0.225mmol)를 첨가하였다. 반응 혼합물을 실온에서 약 추가의 9시간 동안 교반하였다. 물(30mL)을 반응 혼합물에 첨가하고, 혼합물을 EtOAc(2 x 30mL)로 추출하고, 합한 유기 층을 황산나트륨에서 건조시키고, 여과하고, 농축하여 조 3급-부틸 3-((7-카바모일-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트를 수득하고, 이를 직접적으로 다음 단계에서 사용하였다.
3급-부틸 3-((7-카바모일-1H-인돌-4-일)옥시)아제티딘-1-카복실레이트(0.27g, 0.815mmol)의 MeOH(4.45mL) 중 현탁액에 염화수소(디옥산 중 4.0 M, 4.07mL, 16.30mmol)를 적가하였다. 혼합물을 실온에서 약 30분 동안 교반하고, 이어서, 혼합물을 진공에서 농축하여 조 4-(아제티딘-3-일옥시)-1H-인돌-7-카복스아미드 하이드로클로라이드를 수득하고, 이를 직접적으로 다음 단계에서 사용하였다.
4-(아제티딘-3-일옥시)-1H-인돌-7-카복스아미드 하이드로클로라이드(0.218g, 0.815mmol)의 DCM(13.0mL) 중 현탁액을 약 -10℃로 얼음/나트륨 클로라이드 욕에서 냉각시키고, TEA(0.568mL, 4.08mmol)를 적가하고; 이어서, 아크릴로일 클로라이드(0.075mL, 0.897mmol)의 DCM(3.26mL) 중 용액을 시린지를 통해 적가하고, 반응 혼합물을 약 30분 동안 교반하였다. 반응 혼합물을 진공에서 농축하고, 조 물질을 0 내지 10% MeOH/DCM의 구배로 용리하는 실리카 겔 크로마토그래피로 정제하여 4-((1-아크릴로일아제티딘-3-일)옥시)-1H-인돌-7-카복스아미드(0.16g, 0.555mmol, 68.1% 수율)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 1.37 min; MS m/z 286 (M+H)+. (Btk IC50 = A)
실시예 #28*: (S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드 및 (R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드
단계 A: 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)비닐)아제티딘-1-카복실레이트 및 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)에틸리덴)아제티딘-1-카복실레이트
디이소프로필아민(0.646mL, 4.57mmol)의 THF(3.8mL) 중 용액에 약 0℃에서 n-부틸리튬(헥산 중 2 M)(2.28mL, 4.57mmol)의 용액에 적가하였다(내부 온도를 약 3℃ 아래로 유지하였다). 반응 혼합물을 약 0℃에서 약 30분 동안 교반하고, 약 -78℃로 냉각시켰다. 3급-부틸 3-아세틸아제티딘-1-카복실레이트(0.758g, 3.81mmol)의 THF(7.6mL) 중 용액을 적가하고(약 -70℃ 아래로 내부 온도를 유지함), 이어서, 반응 혼합물을 약 -78℃에서 약 30분 동안 교반하였다. 1,1,1-트리플루오로-N-페닐-N-((트리플루오로메틸)설포닐)메탄설폰아미드(1.42g, 4.00mmol)의 THF(7.6mL) 중 용액을 적가하였다(내부 온도를 약 -70℃ 아래로 유지함). 첨가 후, 혼합물을 약 4시간 동안 약 0℃로 가온되게 하고, 반응 혼합물을 포화 NH4Cl로 켄칭하고, EtOAc( 3 x 50mL)로 추출하고, 농축하고, 0 내지 15% EtOAc/헵탄의 구배로 용리하는 실리카 겔 크로마토그래피로 정제하여 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)비닐)아제티딘-1-카복실레이트 및 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)에틸리덴)아제티딘-1-카복실레이트의 혼합물을 황색 오일(0.398g, 31%)로서 수득하였다: 1H NMR (400 MHz, CDCl3) 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)비닐)아제티딘-1-카복실레이트: δ 5.32 (d, J = 4.2 Hz, 1H), 5.16 (dd, J = 4.2, 1.0 Hz, 1H), 4.15 (t, J = 8.8 Hz, 2H), 3.93 (dd, J = 8.8, 6.1 Hz, 2H), 3.49 - 3.37 (m, 1H), 1.44 (s, 9H); 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)에틸리덴)아제티딘-1-카복실레이트: δ 4.58 - 4.53 (m, 2H), 4.52 - 4.49 (m, 2H), 1.98 - 1.94 (m, 3H), 1.45 (s, 9H)
단계 B: 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)비닐)아제티딘-1-카복실레이트 및 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸리덴)아제티딘-1-카복실레이트
바이알에 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)비닐)아제티딘-1-카복실레이트 및 3급-부틸 3-(1-(((트리플루오로메틸)설포닐)옥시)에틸리덴)아제티딘-1-카복실레이트(0.388g, 1.17mmol), 4-(4,4,5,5-테트라메틸-1,3,2-디옥사보롤란-2-일)-1H-인돌-7-카복스아미드(0.279g, 0.975mmol), Pd(dppf)Cl2(0.043g, 0.059mmol) 및 탄산나트륨(0.31g, 2.93mmol)의 혼합물을 채우고, 1,4-디옥산(3mL) 및 물(1mL)을 첨가하였다. 반응 혼합물을 배출시키고, 질소로 충전시키고(3회 반복). 이어서, 혼합물을 약 80℃에서 약 1시간 동안 가열하였다. 반응 혼합물을 농축시키고, MeOH/DCM로 희석시켰다. 혼합물을 여과하고, MeOH/DCM로 세척하고, 여과물을 농축하여 건조시켰다. 조 생성물을 0 내지 3% MeOH/DCM의 구배로 용리하는 실리카 겔 크로마토그래피로 정제하여 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)비닐)아제티딘-1-카복실레이트 및 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸리덴)아제티딘-1-카복실레이트의 혼합물(0.277g, 83%)을 황색 오일로서 수득하였다: LC/MS (표 1, 방법 a) Rt = 2.08, 2.13 min.; MS m/z: 340 (M-H)-.
단계 C: 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸)아제티딘-1-카복실레이트
10 wt% Pd/C(0.026g, 0.024mmol)로 채운 플라스크에 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)비닐)아제티딘-1-카복실레이트 및 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸리덴)아제티딘-1-카복실레이트(0.26g, 0.76mmol)의 EtOAc(10mL) 중 용액 약 2개 액적의 MeOH을 첨가하였다. 혼합물을 수소 벌룬으로 약 실온에서 약 2시간 동안 수소화하였다. 반응 혼합물을 Celite®의 패드를 통해 여과하고, EtOAc로 세척하였다. 여과물을 농축하여 건조시켜 3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸)아제티딘-1-카복실레이트(0.212g, 81%)를 밝은 황색 포움으로서 수득하였다: LC/MS (표 1, 방법 a) Rt = 2.08 min.; MS m/z: 342 (M-H)-.
단계 D: (S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드 및 (R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드
3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸)아제티딘-1-카복실레이트(0.17g, 0.495mmol)를 분취용 키랄 HPLC(표 2, 방법 1)로 정제하여 (S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드(0.063g, 37%)(Rt = 12.339 min, 또는 = 포지티브) 및 (R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드(0.066g, 39%)(Rt = 18.959 min, 또는 = 네가티브)를 수득하였다.
단계 E.1: (S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드
(S)-3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸)아제티딘-1-카복실레이트(0.063g, 0.183mmol) 및 MeOH(1mL)를 채운 바이알에 염화수소(디옥산 중 4 M, 0.92mL, 3.67mmol)를 약 실온에서 첨가하였다. 혼합물을 약 30분 동안 교반하고, 이어서, 혼합물을 진공에서 농축하여 조 (S)-3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸)아제티딘-1-카복실레이트 하이드로클로라이드를 수득하고, 이를 추가의 정제 없이 사용하였다.
(S)-4-(1-(아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드 하이드로클로라이드(0.051, 0.183mmol)의 THF(2mL) 및 DCM(1mL) 중 현탁액에 약 0℃에서 N-에틸-N-이소프로필프로판-2-아민(0.096mL, 0.550mmol), 이어서, 아크릴로일 클로라이드(0.017mL, 0.202mmol)를 첨가하였다. 혼합물을 약 0℃에서 약 30분 동안 교반하였다. 혼합물을 MeOH로 켄칭하고, 휘발성 물질을 감압하에 제거하였다. 잔류물을 DCM 및 포화 수성 NaHCO3 사이에 분배하였다. 유기 층을 농축시키고, 조 생성물을 0 내지 5% MeOH/DCM의 구배로 용리하는 실리카 겔 크로마토그래피로 정제하여 (S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드(0.039g, 69.9%)를 백색 고체로서 수득하였다: LC/MS (표 1, 방법 a) Rt = 1.50 min.; MS m/z: 298 (M+H)+. (Btk IC50 = B)
단계 E.2: (R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드
(R)-3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸)아제티딘-1-카복실레이트(0.066g, 0.192mmol) 및 MeOH(1mL)를 채운 바이알에 염화수소(디옥산 중 4 M, 0.96mL, 3.84mmol)를 약 실온에서 첨가하였다. 혼합물을 실온에서 약 1시간 동안 교반하고, 이어서, 혼합물을 진공에서 농축하여 조 (R)-3급-부틸 3-(1-(7-카바모일-1H-인돌-4-일)에틸)아제티딘-1-카복실레이트 하이드로클로라이드를 수득하고, 이를 추가의 정제 없이 사용하였다.
(R)-4-(1-(아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드 하이드로클로라이드(0.054g, 0.192mmol)의 THF(2mL) 및 DCM(1mL) 중 현탁액에 약 0℃에서 N-에틸-N-이소프로필프로판-2-아민(0.1mL, 0.577mmol)을 첨가하고, 이어서, 아크릴로일 클로라이드(0.018mL, 0.212mmol)를 적가하였다. 혼합물을 약 0℃에서 약 30분 동안 교반하였다. 혼합물을 MeOH로 켄칭하고, 휘발성 물질을 감압하에 제거하였다. 잔류물을 DCM 및 포화 수성 NaHCO3 사이에 분배하였다. 유기 층을 농축시키고, 조 생성물을 0 내지 5% MeOH/DCM의 구배로 용리하는 실리카 겔 크로마토그래피로 정제하여 (R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드(0.042g, 73.2%)를 백색 고체로서 수득하였다. LC/MS (표 1, 방법 a) Rt = 1.50 min.; MS m/z: 298 (M+H)+. (Btk IC50 = A)
실시예 #29: 4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드
단계 A: 4-브로모-1H-피롤로[2,3-c]피리딘-7-카보니트릴
4-브로모-1H-피롤로[2,3-c]피리딘[ChemTec](10.4g, 52.8mmol)의 DCM(66.0mL) 및 DME(66.0mL) 중 용액에 3-클로로벤조퍼옥소산(21.29g, 95mmol, 77중량%)을 하나의 분획으로 첨가하고, 혼합물을 약 16시간 동안 교반되게 하였다. 유기 용매를 감압하에 제거하고, 고체를 DCM으로 분쇄하고, 고체를 여과하여 둘다의 생성물의 혼합물 및 벤조산을 수득하였다. 여과물은 여전히 추가의 생성물을 포함하고, 이를 추가로 감압하에 농축하여 제2 여과를 수행하였다. 합한 필터 케이크를 건조시키고, 자석 교반 바를 포함하는 1L 환저 플라스크로 옮겼다. MeCN(264mL) 및 TEA(14.8mL, 106mmol)를 첨가하여 미-백색 슬러리를 수득하였다. 트리메틸실릴 시아나이드(24.64mL, 185mmol)를 하나의 분획으로 시린지를 통해 첨가하고, 혼합물을 환류까지 가열하였다. 가열한지 약 2시간 후, 혼합물을 실온으로 냉각되게 하였다. 반응을 100mL의 1 M NaOH를 첨가하여 켄칭하고, 100mL의 EtOAc로 희석시키고, 분별깔때기로 옮기고, 100mL의 1 M NaOH 및 100mL의 EtOAc로 추가로 희석시켰다. 층을 분리하고, 수성 상을 EtOAc(3 x 150mL)로 추출하였다. 합한 유기 추출물을 염수 및 1 M NaOH의 1:1 혼합물(2 x 50mL)로 세척하고, Na2SO4에서 건조시키고, 여과하고, 용매를 제거하여 4-브로모-1H-피롤로[2,3-c]피리딘-7-카보니트릴을 황갈색 고체(10.28g, 80%)로서 수득하였다.
단계 B: 4-브로모-1H-피롤로[2,3-c]피리딘-7-카복스아미드
4-브로모-1H-피롤로[2,3-c]피리딘-7-카보니트릴(10.2g, 45.9mmol)의 EtOH(104mL) 중 용액에 NaOH(115mL, 115mmol) 및 30% 과산화수소(80mL, 781mmol)의 1 M 수용액을 첨가하고, 반응 혼합물을 약 45℃로 가열하고, 약 30분 동안 교반하였다. 유기 용매를 감압하에 제거하였다. 혼합물을 30mL의 물로 희석시키고, 여과하여 4-브로모-1H-피롤로[2,3-c]피리딘-7-카복스아미드를 밝은 황색 고체(9.87g, 83%)로서 수득하였다. LC/MS (표 1, 방법 as) : Rt = 1.81 min; MS m/z: 240, 242 (M+H)+.
단계 C: 3급-부틸 3-((7-카바모일-1H-피롤로[2,3-c]피리딘-4-일)(메틸)아미노)아제티딘-1-카복실레이트
4-브로모-1H-피롤로[2,3-c]피리딘-7-카복스아미드(580mg, 2.416mmol)를 12mL의 무수 디옥산에 용해시키고, 약 1시간 동안 Na2SO4에서 건조하였다. 이어서, 용액을 오븐-건조된 75mL 압력 용기로 여과하고, 상기 건조제를 3mL의 디옥산을 사용하여 세척하였다. 용액을 아르곤의 스트림을 사용하여 탈기시키고, 3급-부틸 3-(메틸아미노)아제티딘-1-카복실레이트 하이드로클로라이드(0.969g, 4.35mmol, Synthonix)를 첨가하고, 이어서, 클로로(2-디사이클로헥실포스피노-2',4',6'-트리이소프로필-1,1'-비페닐)[2-(2-아미노에틸)페닐)]팔라듐(II)(0.089g, 0.12mmol) 및 X-Phos(0.057g, 0.12mmol)를 첨가하였다. 혼합물을 약 10분 동안 탈기하고, LiHMDS(THF 중 1 M, 10.87mL, 10.87mmol)를 시린지를 통해 적가하고, 바이알을 밀봉시키고, 약 90℃로 약 19시간 동안 가열하였다. 반응물을 실온으로 냉각시키고, 수성 NaHCO3(20mL)을 첨가하여 켄칭하고, EtOAc(50mL)로 희석시켰다. 물(10mL) 및 염수(10mL)를 사용하여 추가로 희석하여 용해를 완료시키고, 층을 분리하였다. 수성 상을 EtOAc(3 x 20mL)로 추출하였다. 합한 유기 추출물을 1:1 염수 및 수성 NaHCO3(20mL)로 세척하고, Na2SO4에서 건조시키고, 여과하고, 용매를 감압하에 제거하였다. 조 물질을 실리카 상에 부착시키고, 0 내지 5%의 MeOH/DCM으로 용리하는 실리카 컬럼(40g)을 사용하여 정제하였다. 생성물 함유 분획을 감압하에 농축하여 3급-부틸 3-((7-카바모일-1H-피롤로[2,3-c]피리딘-4-일)(메틸)아미노)아제티딘-1-카복실레이트를 밝은-황색 고체(0.61g, 69%)로서 수득하였다.
단계 D: 4-(아제티딘-3-일(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드 하이드로클로라이드
자석 교반 바 및 MeOH(1.97mL)를 포함하는 50mL 환저 플라스크에 아세틸 클로라이드(1307μl, 18.38mmol)를 약 0℃에서 시린지를 통해 첨가하였다. 약 10분 후, 혼합물을 실온으로 가온하고, 약 1시간 동안 교반하였다. 이이서, 3급-부틸 3-((7-카바모일-1H-피롤로[2,3-c]피리딘-4-일)(메틸)아미노)아제티딘-1-카복실레이트(127mg, 0.368mmol)의 MeOH(1970μl) 및 DCM(657μl) 중 용액을 시린지를 통해 적가하고, 반응물을 약 5시간 동안 실온에서 교반하였다. 용매를 감압하에 제거하여 4-(아제티딘-3-일(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드 하이드로클로라이드(128mg, 99%)를 수득하였다. LC/MS (표 1, 방법 at) : Rt = 0.93 min.; MS m/z: 246 (M+H)+.
단계 E: 4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드
4-(아제티딘-3-일(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드 하이드로클로라이드(101mg, 0.36mL)의 DCM(5760μl) 및 에틸디이소프로필아민(258μl, 1.440mmol) 중 냉각된 용액에 아크릴로일 클로라이드(50mg, 0.552mmol)의 DCM(1440μl) 중 용액을 시린지를 통해 내부 온도 또는 -4℃ 아래를 유지하면서 적가하였다. 혼합물을 15분 동안 교반되게 하였다. 반응을 0.3mL의 물을 첨가하여 켄칭하고, 용매 용적을 1.5mL로 감소시키고, 혼합물을 4g의 실리카로 적재하였다. 물질을 24g 실리카 컬럼, 0 내지 10% MeOH/DCM를 사용하여 정제하였다. 생성물 함유 분획을 감압하에 농축하여 4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드를 백색 고체(89mg, 78%)로서 수득하였다.
실시예 #30*: (R)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드 및 (S)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드
4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드(0.03g, 0.10mmol)의 샘플을 분취용 키랄 HPLC(표 2, 방법 2)를 통해 정제하여 (R)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드(0.012g, 40%)(Rt = 17.14 min, 또는 = 포지티브)(Btk IC50 = B) 및 (S)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드(0.013g, 43%)(Rt = 20.46 min, 또는 = 네가티브)(Btk IC50 = A)를 수득하였다: LC/MS (표 1, 방법 a) Rt = 1.47 min.; MS m/z: 298 (M+H)+.
표 3. 키랄 방법: 표 2, 방법 4를 사용하여 아크릴로일 아미드로부터 제조된 실시예
표 4. 키랄 방법: 표 2, 방법 15를 사용하여 아크릴로일 아미드로부터 제조된 실시예
표 5. 아크릴로일 아미드로부터 키랄 방법: 표 2, 방법 16을 사용하여 제조된 실시예
SEQUENCE LISTING
<110> ABBVIE INC.
<120> PRIMARY CARBOXAMIDES AS BTK INHIBITORS
<130> 117813-72720
<140> PCT/US2014/044247
<141> 2014-06-26
<150> 61/897,577
<151> 2013-10-30
<150> 61/839,729
<151> 2013-06-26
<160> 1
<170> KopatentIn 1.71
<210> 1
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<220>
<223> N-term biotin
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Ahx
<400> 1
Xaa Gly Ala Glu Glu Glu Ile Tyr Ala Ala Phe Phe Ala
1 5 10
Claims (25)
- 화학식 I의 화합물 또는 이의 약제학적으로 허용되는 염, 프로드럭, 생물학적 활성 대사물질, 이성체, 또는 입체이성체:
화학식 I
상기 화학식 I에서,
X는 NR2 또는 S이고;
Y는 N 또는 CR1이고, Z는 N 또는 CR1이거나; Y는 CR1R2이고, Z는 CR1R2이고;
A는 N 또는 CR4이고;
E는 N 또는 CR5이고;
R1은 독립적으로 H, 중수소, CN, 할로겐, CF3, -NRcRc, -N(Ra)C(O)Rb, 임의로 치환된 (C1-C6)알킬, 임의로 치환된 (C2-C6)알케닐, 임의로 치환된 아릴, 임의로 치환된 (C3-C6)사이클로알킬, 임의로 치환된 (C3-C6)사이클로알케닐, 임의로 치환된 헤테로아릴, 또는 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴이고;
R2는 독립적으로 H, 중수소, 또는 임의로 치환된 (C1-C3)알킬이고;
R3은 할로겐, -N(Ra)2, 임의로 치환된 아릴, 임의로 치환된 (C3-C7)사이클로알킬, 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴, 또는 임의로 치환된 헤테로아릴이거나;
R3은 -R301-L-R302이고, 여기서,
R301은 결합, -O-, -OCH2-, -NRd-, 또는 임의로 치환된 (C1-C3)알킬렌이고,
L은 임의로 치환된 페닐, 임의로 치환된 (C3-C6)사이클로알킬; 하나 이상의 헤테로원자를 포함하고, 상기 헤테로원자 중 적어도 하나가 질소인 임의로 치환된 헤테로아릴 또는 포화 또는 부분 포화 헤테로사이클릴이거나;
L은 -L1-L2이고, 여기서, L1은 R301에 부착되고,
L1은 임의로 치환된 페닐, 임의로 치환된 헤테로아릴 또는 임의로 치환된 포화 또는 부분 포화 카보사이클 또는 포화 또는 부분 포화 헤테로사이클릴이고;
L2는 결합, CH2, NRd, CH2N(H), S(O)2N(H), 또는 -O-이고;
R302는 CN, -CH2CN, 임의로 치환된 -C(=O)R302a, -(CH2)n-임의로 치환된 포화 또는 부분 포화 헤테로사이클릴 또는 임의로 치환된 -S(O)2(C2)알케닐이고;
여기서, R302a는 임의로 치환된 (C1-C4)알킬, 임의로 치환된 (C2-C4)알케닐, (C2-C4)알키닐, -C(O)-(C1-C4)알킬, 임의로 치환된 포화 또는 부분 불포화 (C3-C6)사이클로알킬, 임의로 치환된 아릴, 임의로 치환된 헤테로아릴, -N(H)- 임의로 치환된 헤테로아릴 또는 -(CH2)n-임의로 치환된 불포화 또는 부분 포화 헤테로사이클릴이고;
R4는 H, 중수소, CN, 임의로 치환된 (C1-C3)알킬, 임의로 치환된 (C3-C6) 사이클로알킬 또는 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴, 또는 임의로 치환된 헤테로아릴이고;
여기서, 상기 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴; 및 임의로 치환된 헤테로아릴은 적어도 하나의 질소 원자를 포함하거나;
R3 및 R4는, 이들이 부착된 탄소 원자와 함께, 임의로 치환된, 포화, 불포화 또는 부분 불포화 5 또는 6원 카보사이클릭 환, 또는 N, S 및 O로부터 선택된 하나의 이상의 헤테로원자를 포함하는 임의로 치환된, 포화, 또는 부분 불포화 5 또는 6원 헤테로사이클릭 환을 형성하고;
R5는 H, 중수소, 할로겐, 또는 임의로 치환된 (C1-C3)알킬이고;
Ra는 독립적으로 H, -C(O)-임의로 치환된 (C2-C6)알케닐, 임의로 치환된 (C1-C6)알킬, -(CH2)n-임의로 치환된 (C3-C6)사이클로알킬, -(CH2)n-임의로 치환된 헤테로사이클릴, 또는 -(CH2)n-임의로 치환된 헤테로아릴로부터 선택되고;
Rb는 H, 임의로 치환된 (C1-C6)알킬, 임의로 치환된 (C2-C6)알케닐, 임의로 치환된 (C2-C6)알키닐, -CH2-O-임의로 치환된 아릴, 또는 -CH2-O-임의로 치환된 헤테로아릴이고;
Rc는 독립적으로 H, 임의로 치환된 (C1-C6)알킬, 임의로 치환된 (C3-C6)사이클로알킬, 임의로 치환된 포화 또는 부분 포화 헤테로사이클릴, 임의로 치환된 아릴 또는 임의로 치환된 헤테로아릴이고;
Rd는 H, 임의로 치환된 헤테로사이클릴, -(CH2)-임의로 치환된 (C3-C6)사이클로알킬, -(CH2)-임의로 치환된 헤테로아릴 또는 임의로 치환된 (C1-C3)알킬이고;
Rf는 임의로 치환된 (C1-C3)알킬, 임의로 치환된 (C2-C4)알케닐 또는 임의로 치환된 (C2-C4)알키닐이고;
n은 독립적으로 0 또는 1이다. - 제1항에 있어서, Y가 CR1이고, Y의 R1이 H, 임의로 치환된 에테닐, 임의로 치환된 에틸, 임의로 치환된 메틸, 임의로 치환된 2,3-디하이드로벤조푸라닐, 임의로 치환된 1,4-디옥사닐, 임의로 치환된 3,4-디하이드로-2H-벤조[b][1,4]옥사지닐, 임의로 치환된 6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사지닐, 임의로 치환된 크로마닐, 임의로 치환된 사이클로헥세닐, 임의로 치환된 사이클로프로필, 임의로 치환된 테트라하이드로푸라닐, 임의로 치환된 이소크로마닐, 임의로 치환된 1,2,3,4-테트라하이드로-이소퀴놀리닐, 임의로 치환된 이속사졸릴, 임의로 치환된 모르폴리닐, 임의로 치환된 옥세타닐, 임의로 치환된 페닐, 임의로 치환된 피페리디닐, 임의로 치환된 피페라지닐, 임의로 치환된 3,6-디하이드로-2H-피라닐, 임의로 치환된 피라노[4,3-b]피리디닐, 임의로 치환된 피라졸릴, 임의로 치환된 피리디닐, 임의로 치환된 3H-피리딘-1-온, 임의로 치환된 1,2,3,6-테트라하이드로피리디닐, 임의로 치환된 피리미디닐, 임의로 치환된 피롤리디닐, 임의로 치환된 2,5-디하이드로피롤릴, 임의로 치환된 테트라하이드로피라닐 또는 임의로 치환된 테트라하이드로-2H-티오피라닐인, 화합물.
- 제2항에 있어서, R1이 H이거나, R1이 CN, OH, =O, 할로겐, (C1-C4)알킬, (C1-C4)알콕시, -CH2CH2OH, -CH2C(CH3)2OH, -CH2CH(OH)CH2OH, -CH=CH2, -CH2NH2, -CH2N(H)C(O)Re, -C(O)(C1-C4)알킬, -C(O)(C1-C4)알콕시, -C(O)NH2, -C(O)N(CH3)2, -C(O)-임의로 치환된 헤테로사이클릴, -N(H)C(O)CH3, N(CH3)2, -S(O)2(C1-C4)알킬, -S(O)2-피롤리디닐, (C1-C4)알콕시, -CH2-모르폴리닐, -CH2CH2-모르폴리닐, 모르폴리닐, 테트라하이드로피라닐로 이루어진 그룹으로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되고;
여기서, Re는 (C1-C3)알킬, -CH2Cl, -C≡CH, -C≡CCH3, -CH=CH2, -CH=CHCH3, -C(=CH2)CH3, -CH2CN, -CH2CH2N(CH3)2, -CH2CH2-피페리디닐, -CH2O-임의로 치환된 페닐인, 화합물. - 제3항에 있어서, R3이 -N(H)C(O)CH=CH2, 임의로 치환된 이속사졸릴, 임의로 치환된 페닐, 임의로 치환된 피라졸릴, 임의로 치환된 피리디닐, 임의로 치환된 피리미디닐, 임의로 치환된 티아졸릴, 또는 임의로 치환된 티에닐인, 화합물.
- 제4항에 있어서, R3이 -NH2, -NHCH3, (C1-C4)알킬 및 -C(O)(C2-C4)알케닐로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되는, 화합물.
- 제5항에 있어서, X가 NR2이고, R2가 H인, 화합물.
- 제6항에 있어서, Y가 CR1이고, Y의 R1이 H, 임의로 치환된 페닐, 임의로 치환된 피페라지닐, 임의로 치환된 피라졸릴, 또는 임의로 치환된 1,2,3,6-테트라하이드로피리디닐인, 화합물.
- 제7항에 있어서, Y가 CR1이고, Y의 R1이 할로겐, (C1-C4)알킬, -C(O)(C1-C4)알킬, 및 -S(O)2(C1-C4)알킬로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되는, 화합물.
- 제8항에 있어서,
Z가 N이거나, Z가 CR1이고, Z의 R1이 H이고;
A가 CR4이고, R4가 H이거나 -C(O)CH=CH2로 치환된 아제티디닐인, 화합물. - 제9항에 있어서, 상기 화합물이
4-(3-아미노-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(피리딘-3-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-(3,5-디메틸이속사졸-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
2-(1-아세틸피페리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(피리딘-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(티오펜-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(2-아미노페닐)-1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(5-아미노피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-아미노피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-아미노에틸아미노)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(2-아미노에틸아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(피리미딘-5-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1H-피라졸-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1H-피라졸-5-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(티아졸-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(피리딘-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(티오펜-3-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1-메틸-1H-피라졸-4-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1H-피라졸-3-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(2-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-페닐-1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-에닐)1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-(1-아크릴로일피페리딘 3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(2-아미노에틸아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-((1R,2R)-2-아미노사이클로헥실아미노)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드*;
4-(1-메틸-1H-피라졸-5-일아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-요오도-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아미노-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3,5-디메틸이속사졸-4-일)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(2-아미노페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드; 또는
2-(1-아세틸피페리딘-4-일)-4-(3-아미노-2-메틸페닐)-1H-인돌-7-카복스아미드인, 화합물. - 제3항에 있어서, R3이 -R301-L-R302이고, R301이 결합, N(H), N(CH3), CH2, C(H)(임의로 치환된 (C1-C3)알킬), O, 또는 OCH2인, 화합물.
- 제11항에 있어서,
L이 임의로 치환된 아제티디닐, 임의로 치환된 사이클로펜틸, 임의로 치환된 3,6-디아자바이사이클로[3.2.0]헵타닐, 임의로 치환된 1,4-디옥사닐, 임의로 치환된 모르폴리닐, 임의로 치환된 [1,4]옥세파닐, 임의로 치환된 페닐, 임의로 치환된 피페리디닐, 또는 임의로 치환된 피롤리디닐이거나;
L이 L1-L2이고, 여기서,
L1이 임의로 치환된 사이클로헥실, 임의로 치환된 사이클로펜틸, 임의로 치환된 페닐, 임의로 치환된 피페리디닐, 임의로 치환된 피리디닐이고;
L2가 N(H), N(CH3), N(CH2CH2OH), N(CH2CH(CH3)2), N(옥세타닐), N(CH2-사이클로펜틸), N(CH2-티아졸릴), O, S(O)2N(H), 또는 CH2N(H)인, 화합물. - 제12항에 있어서, L 또는 L1이 할로겐, CN, OH, (C1-C4)알콕시, (C1-C4)알킬, -CH2OH, -N(H)CH2-헤테로아릴, 벤질옥시, 및 -OCH2-헤테로아릴로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되는, 화합물.
- 제13항에 있어서, R302가 -C(O)CH3, -C(O)C(O)CH3, -C(O)CF2(Cl), -CH(CH3)2, -CH2Cl, -CH2CN, -C(O)CH2CN, -C(O)CH2CH3, -C(O)CH2F, -C(O)CH(CH3)2, -C(O)-CH2CH(CH3)2, -C(O)CH(CH3)(Cl), -C(O)CH2CH(CH3)CH3, -C(O)CH(Cl)CH2CH3, -CH2CH2OH, -C(O)CH2CH2N(CH3)2, -C(O)CH=CH2, -C(O)C≡CH, -C(O)CH=CHCl, -C(O)CH=CHCH3, -C(O)C(=CH2)CH3, -C(O)C(CH2CH3)=CH2, -C(O)CH=CHCH(CH3)2, -C(O)CH=CHC(O)OH, -C(O)CH=CHC(O)N(H)CH2CH3, -C(O)CH=CHCH2N(CH3)2, -C(O)CH=CHC(O)OCH3, -C(O)CH=CHC(O)OCH2CH3, -C(O)CH=CHC(O)N(H)CH3, -C(O)CH=CHC(O)CH2CH2OCH3, -C(O)CH=CHC(O)N(CH3)2, -C(O)CH=CHC(O)N(H)CH2CH3, -C(O)CH=CHC(O)N(H)CH2CH2OCH3, -C(O)CH=CHCH2N(H)CH2CH2OCH3, -C(O)C(CN)=C(OH)(CH3), -C(O)CH=CH-임의로 치환된 피라졸릴-C(O)CH=CHCH2N(H)-임의로 치환된 사이클로프로필, -C(O)CH=CHCH2N(H)CH2-임의로 치환된 테트라하이드로푸라닐, -C(O)CH=CHC(O)NH2, -C(O)CH=CHC(O)N(H)- 임의로 치환된 사이클로프로필, -C(O)C(CH3)=CHCH3, -C(O)C(CH3)=CHCH2CH3, -C(O)C(=CH2)CH2N(CH3)2, -C(O)C(=CH2)CH2NH2, -C(O)C(=CH2)CH2N(H)(CH3), -C(O)C(=CH2)CH3, -C(O)C(=CH2)CH2- 임의로 치환된 모르폴리닐, -C(O)C(=CH2)-임의로 치환된 페닐, -CH2- 임의로 치환된 벤조[d]이소티아졸릴, -C(O)-CH2-O-임의로 치환된 페닐, -CH2-임의로 치환된 티아졸릴, -CH2CH2-임의로 치환된 모르폴리닐, -C(O)CH2O-임의로 치환된 페닐, -C(O)CH2CH2-임의로 치환된 피페라지닐, -C(O)CH2CH2- 임의로 치환된 피페리디닐, -C(O)CH2O-임의로 치환된 피리디닐, -C(O)CH2CH2 임의로 치환된 피롤리디닐, -C(O)CH=CH 임의로 치환된 사이클로프로필, -C(O)CH=CHCH2- 임의로 치환된 모르폴리닐, -C(O)CH=CHCH2- 임의로 치환된 피페리디닐, -C(O)CH=CH- 임의로 치환된 피라졸릴, -C(O)CH=CH-임의로 치환된 피리디닐, -C(O)CH=CH-임의로 치환된 티아졸릴, -C(O)-임의로 치환된 사이클로헥세닐, -C(=O)-임의로 치환된 사이클로헥실, -C(O)-임의로 치환된 사이클로펜테닐, -C(O)-사이클로펜틸, 임의로 치환된 이미다조[1,2-a]피라지닐, 임의로 치환된 테트라하이드로이미다조[1,2-a]피라지닐, 임의로 치환된 디하이드로이소인돌릴, 임의로 치환된 1,2,3,4-테트라하이드로-이소퀴놀리닐, 임의로 치환된 이소퀴놀리닐, -C(O)-임의로 치환된 이속사졸릴, -C(O)-임의로 치환된 옥사졸릴, 임의로 치환된 옥세타닐, -C(=O)- 임의로 치환된 페닐, 임의로 치환된 피페리디닐, -C(O)-임의로 치환된 피페리디닐, 임의로 치환된 피라졸릴, -C(O)CH2O-임의로 치환된 피리다지닐, -C(O)-임의로 치환된 피리디닐, 임의로 치환된 피리미디닐, 임의로 치환된 퀴나졸리닐, 임의로 치환된 디하이드로퀴놀리닐, 임의로 치환된 -C(O)-테트라하이드로벤조[b]티오페닐, -C(O)-임의로 치환된 테트라하이드로피라닐, -C(O)-임의로 치환된 테트라하이드로피리디닐, -C(O)-티아졸릴, -C(O)N(H)-티아졸릴, -C(O)NHCH2CN, 또는 -S(O)2CH=CH2인, 화합물.
- 제14항에 있어서, X가 NR2이고, R2가 H인, 화합물.
- 제15항에 있어서, Y가 CR1이고, Y의 R1이 할로겐, CN, =O, (C1-C4)알킬, (C2-C4)알케닐, -CH2NH2, -CH2CH2OH, -CH2CH(OH)CH2CH3, -CH2CH(OH)CH2OH, -CH2CH2OCH2CH3, -CH2C(OH)(CH3)2, -CH2NHC(O)(C1-C4)알킬, -CH2NHC(O)CH2Cl, -CH2NHC(O)CH2CN, -CH2NHC(O)CH2CH2N(CH3)2, -CH2NHC(O)C(=CH2)CH3, -CH2NHC(O)(C2-C4)알키닐, -CH2NHC(O)CH2CH2-피페리디닐, -(C1-C4)알킬-모르폴리닐, -CH2NHC(O)CH2O-페닐로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되고, 여기서, 상기 페닐은 할로겐, (C1-C4)알콕시, -C(O)(C1-C4)알킬, -C(O)(C1-C4)알콕시, -C(O)N(H)2, -C(O)N(CH3)2, -C(O)-모르폴리닐, -C(O)-피롤리디닐, N(CH3)2, -NHC(O)(C1-C4)알킬, -NHC(O)(C2-C4)알케닐, -NHC(O)CH2CN, -S(O)2(C1-C4)알킬, -S(O)2-피롤리디닐, 모르폴리닐, 테트라하이드로피라닐, 또는 4-메틸피페라진카보닐로 임의로 치환되는, 화합물.
- 제16항에 있어서, Z가 CR1이고, Z의 R1이 H, (C1-C4)알킬, -NHC(O)CH2Cl, -NHC(O)CH2CN, -NHC(O)(C2-C4)알케닐, -NHC(O)(C2-C4)알키닐, -NHC(O)C(=CH2)CH3, -NHC(O)CH2-페닐이고, 여기서, 상기 페닐은 할로겐 또는 CH3로 치환된 피라졸릴로 임의로 치환되는, 화합물.
- 제17항에 있어서, R302가 할로겐, CF3, OCF3, =O, CHF2, CN, C(O)OH, OH, (C1-C4)알킬, (C1-C4)알콕시, (C3-C6)사이클로알킬, -(C1-C4)알킬CN, -(C1-C4)알킬C(O)NH2, -C(O)NH2, -C(O)N(H)(C1-C4)알킬, -C(O)N(C1-C4)알킬)2, -C(O)N(H)사이클로프로필, -C(O)(C1-C4)알콕시, NH2, N(H)CH3, N(CH3)2, 또는 임의로 치환된 벤질로부터 독립적으로 선택된 하나 이상의 치환체로 임의로 치환되는, 화합물.
- 제1항에 있어서,
X가 NR2이고, 여기서, R2는 H이고;
Y가 CR1이고, 여기서, R1은 H, CH3, 치환된 피라졸릴, 6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사지닐 또는 테트라하이드로푸라닐이고;
Z가 CR1이고, 여기서, R1은 H이고;
E가 CR5이고, 여기서, R5는 H이고;
R3이 -R301-L-R302이고, 여기서,
R301은 결합, -O-, -N(H)-, -N(CH3)- 또는 -C(H)(CH3)-이고;
L이 아제티디닐, 3,6-디아자바이사이클로[3.2.0]헵타닐, 모르폴리닐, [1,4]옥세파닐, 피페리디닐, 또는 피롤리디닐이고;
여기서, 상기 아제티디닐은 CH3로 임의로 치환되고;
여기서, 상기 피페리디닐은 -CH2OH로 임의로 치환되고;
R302는 -C(O)CH=CH2 또는 -C(O)C≡CH인, 화합물. - 제1항에 있어서, 상기 화합물이 다음과 같은, 화합물:
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-인돌-7-카복스아미드;
4-(5-아세틸티오펜-2-일)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(1-(4-메톡시벤질)-1H-피라졸-5-일아미노)-2-p-톨릴-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-옥소이소인돌린-2-일)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(6-메틸-1-옥소이소인돌린-2-일)페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-1-옥소이소인돌린-2-일)-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-1-옥소이소인돌린-2-일)-2-메틸페닐)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(피리딘-3-일)-1H-인돌-4-일)-4-메틸페닐)티아졸-2-카복스아미드 2,2,2-트리플루오로아세테이트;
N-(3-(7-카바모일-2-(피리딘-3-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
(R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-2-(4-플루오로페닐)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드*;
(R)-2-(1-메틸-1H-피라졸-4-일)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드*;
2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-3급-부틸벤즈아미도)피페리딘-1-일)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-3급-부틸벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-N-(1-(7-카바모일-1H-인돌-4-일)피페리딘-3-일)-2-메틸옥사졸-4-카복스아미드*;
(R)-4-(3-(3-티아졸-2-일우레이도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
4-(3-(4-3급-부틸벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-(7-사이클로프로필-5-플루오로-4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-3급-부틸벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-메톡시벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
(R)-5-3급-부틸-N-(1-(7-카바모일-1H-인돌-4-일)피페리딘-3-일)이속사졸-3-카복스아미드*;
(R)-2-(1-메틸-1H-피라졸-4-일)-4-(3-(4-(트리플루오로메틸)벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-메톡시벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-(트리플루오로메틸)벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-4-(3-(4-(디플루오로메틸)벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
2-(3,6-디하이드로-2H-피란-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
2-(4-플루오로페닐)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-(1-아미노-2-메틸-1-옥소프로판-2-일)벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
(R)-2-(1-메틸-1H-피라졸-4-일)-4-(3-(4-(트리플루오로메톡시)벤즈아미도)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
2-(1-(2-하이드록시에틸)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(6-플루오로-1-옥소이소인돌린-2-일)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
2-(3,6-디하이드로-2H-피란-4-일)-4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-(하이드록시메틸)페닐)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
(R)-4-(3-(4-사이클로프로필벤즈아미도)피페리딘-1-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드*;
2-(2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-((R)-2,3-디하이드록시프로필)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드*;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-(하이드록시메틸)페닐)티아졸-2-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(4-3급-부틸벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
N-(3-(2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-메틸-3-(4,5,6,7-테트라하이드로벤조[b]티오펜-2-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-메틸-2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
2-(1-아세틸-2,5-디하이드로-1H-피롤-3-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
에틸 3-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)-2,5-디하이드로-1H-피롤-1-카복실레이트;
2-(1-메틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
2-(1-((S)-2,3-디하이드록시프로필)-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-메틸페닐)-N-메틸티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-4-일)-2-메틸페닐)-N-(옥세탄-3-일)티아졸-2-카복스아미드;
2-(1-아세틸-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(4-(2-시아노프로판-2-일)벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)벤즈아미도)-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-(6-플루오로-4-옥소퀴나졸린-3(4H)-일)-2-메틸페닐)-2-(1-(2-하이드록시-2-메틸프로필)-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(8-옥소-5,6-디하이드로이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(8-옥소이미다조[1,2-a]피라진-7(8H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
4-(2-메틸-3-(옥세탄-3-일아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-하이드록시-4-(트리플루오로메틸)사이클로헥산카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(1-옥소-3,4-디하이드로이소퀴놀린-2(1H)-일)피페리딘-1-일)-1H-인돌-7-카복스아미드*;
2-(1-아세틸피페리딘-4-일)-4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(R)-N-(1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)피페리딘-3-일)-2-메틸옥사졸-4-카복스아미드*;
(R)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(2-옥소-1,3'-비피페리딘-1'-일)-1H-인돌-7-카복스아미드*;
2-(1-메틸-1H-피라졸-4-일)-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-벤조[d]이미다졸-7-카복스아미드;
4-(3-(4-(디플루오로메틸)-N-(옥세탄-3-일)벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(옥세탄-3-일아미노)페닐)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)벤즈아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-(2-하이드록시에틸아미노)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(R)-N-(1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)피페리딘-3-일)티아졸-2-카복스아미드*;
4-(3-(사이클로헥산카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-(디플루오로메틸)-N-(2-하이드록시에틸)벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)이소티아졸-4-카복스아미드;
4-(2-메틸-3-(테트라하이드로-2H-피란-4-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-메틸피페리딘-3-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-메틸피페리딘-4-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(사이클로펜탄카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)-2-메틸티아졸-4-카복스아미드;
4-(3-(3-메톡시사이클로헥산카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-메틸부탄아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-이소부티르아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(니코틴아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)-5-메틸티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(1-메틸-6-옥소-1,6-디하이드로피리딘-3-일)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-((3R,4R)-1-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-4-하이드록시피페리딘-3-일)티아졸-2-카복스아미드;
(R)-4-(3-아크릴아미도피페리딘-1-일)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드*;
4-(2-메틸-3-(티아졸-2-일메틸아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(N-(티아졸-2-일메틸)아크릴아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(Z)-4-(2-메틸-3-(2-메틸부트-2-엔아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(피페리딘-1-일)프로판아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-시아노아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-프로피온아미도페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-메타크릴아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드l;
4-(3-(2-클로로-2,2-디플루오로아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-클로로프로판아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-4-(3-부트-2-엔아미도-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐);
4-(3-(2-(4-플루오로페녹시)아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(피롤리딘-1-일)프로판아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-(4-시아노페녹시)아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-(피리딘-3-일옥시)아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(사이클로펜트-1-엔카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(2-메틸펜트-2-엔아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(Z)-4-(3-(3-클로로아크릴아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-메틸 4-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐아미노)-4-옥소부트-2-에노에이트;
4-(3-(사이클로헥스-1-엔카복스아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
(E)-에틸 4-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐아미노)-4-옥소부트-2-에노에이트;
4-(2-메틸-3-(2-페녹시아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-플루오로아세트아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4,4-디플루오로사이클로헥스-1-에닐)-1H-인돌-7-카복스아미드;
4-(2-(아크릴아미도메틸)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(3-(디메틸아미노)프로판아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-아크릴아미도페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(아크릴아미도메틸)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(아크릴아미도메틸)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(2-시아노피리미딘-4-일아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(6-사이클로프로필-8-플루오로-1-옥소이소퀴놀린-2(1H)-일)-2-(하이드록시메틸)페닐)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메톡시피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-(피리딘-2-일옥시)아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-4-일)-2-메틸페닐)푸마르아미드;
4-(3-(2-클로로부탄아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(4-메틸피페라진-1-일)프로판아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-(피리다진-3-일옥시)아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-4-(3-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
메틸 3-(4-(3-아크릴아미도-2-메틸페닐)-7-카바모일-1H-인돌-2-일)벤조에이트;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(6-메틸피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-카바모일페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-3-메틸-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3,5-디메틸이속사졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-(테트라하이드로-2H-피란-2-일)-1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3,5-디메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-이소프로필-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1,3-디메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-에틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-이소부틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(E)-N-(3-(3-부트-2-엔아미도-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-3-메타크릴아미도-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(3-부트-2-인아미도-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-3-(2-(4-플루오로페녹시)아세트아미도)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-플루오로피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-에틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
2-(3-아세트아미도페닐)-4-(3-아크릴아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메톡시피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-시아노페닐)-1H-인돌-7-카복스아미드;
메틸 4-(4-(3-아크릴아미도-2-메틸페닐)-7-카바모일-1H-인돌-2-일)벤조에이트;
4-(3-아크릴아미도-2-메틸페닐)-2-(2,3-디하이드로벤조푸란-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-(디메틸아미노)페닐)-1H-인돌-7-카복스아미드;
4-(2-(2-클로로아세트아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-아세트아미도페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메틸-5-(피롤리딘-1-일설포닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-플루오로페닐)-1H-인돌-7-카복스아미드;
N-(3-(3-아크릴아미도-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-3-(2-클로로아세트아미도)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-메틸-1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-(2-모르폴리노에틸)-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(6-모르폴리노피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(3-(4-메틸피페라진-1-카보닐)페닐)-1H-인돌-7-카복스아미드;
N-(3-(2-(2-(아크릴아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(아세트아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-(프로피온아미도메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(부티르아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
(E)-N-(3-(2-(2-(부트-2-엔아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-(메타크릴아미도메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-(프로피올아미도메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(부트-2-인아미도메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-시아노아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((3-(디메틸아미노)프로판아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((3-(피페리딘-1-일)프로판아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-페녹시아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-(4-플루오로페녹시)아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(7-카바모일-2-(2-((2-클로로아세트아미도)메틸)페닐)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
N-(3-(2-(2-(아미노메틸)페닐)-7-카바모일-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-페닐-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-(메틸설포닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(디메틸카바모일)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(피리미딘-5-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(모르폴린-4-카보닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(피롤리딘-1-카보닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(4-메틸피페라진-1-카보닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(메틸설포닐)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(6-메톡시피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(2-메톡시페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-3-(2-시아노아세트아미도)-1H-인돌-4-일)-2-메틸페닐)티아졸-2-카복스아미드;
4-(2-아크릴아미도페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-(모르폴리노메틸)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(4-카바모일페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-(티아졸-2-일메틸아미노)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(N-메틸아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(메틸아미노)페닐)-1H-인돌-7-카복스아미드;
4-(3-(N-메틸아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-메틸렌부탄아미도)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-(피롤리딘-1-일)프로판아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-메타크릴아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(3-사이클로프로필아크릴아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(피리딘-2-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(1-메틸-1H-피라졸-4-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-에틸 4-(3-(7-카바모일-1H-인돌-4-일)-2-메틸페닐아미노)-4-옥소부트-2-에노에이트;
(E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(피리딘-3-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-메틸펜트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)-2-메틸페닐)-N4-에틸말레아미드;
4-(3-아세트아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-부트-2-엔아미도-2-메틸페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(3-모르폴리노프로판아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(3-(티아졸-2-일)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(2-페닐아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-(피페리딘-1-일)부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-((테트라하이드로푸란-2-일)메틸아미노)부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(2-메톡시에틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(사이클로프로필아미노)부트-2-엔아미도)-2-메틸페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-모르폴리노부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(2-메틸-3-(4-(4-메틸피페라진-1-일)부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-(벤질옥시)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-(벤질옥시)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
4-(2-아크릴아미도-4-(티아졸-2-일메톡시)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-(2-아크릴아미도-4-(벤질옥시)페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도피리딘-3-일)-1H-인돌-7-카복스아미드;
4-(2-아크릴아미도피리딘-4-일)-1H-인돌-7-카복스아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-(2-메톡시에틸)말레아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-에틸말레아미드;
4-(3-(1-메틸-1,2,5,6-테트라하이드로피리딘-3-카복스아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(비닐설폰아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(2-옥소프로판아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-메틸 4-(3-(7-카바모일-1H-인돌-4-일)페닐아미노)-4-옥소부트-2-에노에이트;
4-(3-(시아노메틸카바모일)페닐)-1H-인돌-7-카복스아미드;
N-(3-(7-카바모일-1H-인돌-4-일)페닐)-5-메틸이속사졸-4-카복스아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-메틸푸마르아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4,N4-디메틸푸마르아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-에틸푸마르아미드;
N1-(3-(7-카바모일-1H-인돌-4-일)페닐)-N4-사이클로프로필푸마르아미드;
(E)-4-(3-(7-카바모일-1H-인돌-4-일)페닐아미노)-4-옥소부트-2-엔산;
4-(3-(N-이소부틸아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
1-아크릴로일-1,2,3,6-테트라하이드로-피롤로[2,3-e]인돌-5-카복실산 아미드;
4-아크릴아미도-1H-인돌-7-카복스아미드;
4-(3-(N-(시아노메틸)설파모일)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
4-(3-((2-옥소프로판아미도)메틸)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-1H-인다졸-7-카복스아미드;
4-(3-아크릴아미도-2-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-플루오로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2-클로로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2,4-디플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2,6-디플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-메틸페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-메톡시페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-4-클로로페닐)-1H-인돌-7-카복스아미드;
4-(5-아크릴아미도-2,3-디플루오로페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-5-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-시아노페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-비닐-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-에틸-1H-인돌-7-카복스아미드;
4-(3-(2-(모르폴리노메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-(2-((디메틸아미노)메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
(E)-4-(3-(4-(디메틸아미노)부트-2-엔아미도)-2-메틸페닐)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-((1R,3S)-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(시스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-((1S,3S)-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(트랜스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(시스-3-아크릴아미도사이클로헥실)-1H-인돌-7-카복스아미드;
4-(3-(2-(아미노메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-((1R,3S)-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(3-(2-((메틸아미노)메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-메틸-1H-인돌-7-카복스아미드;
4-((1S,3S)-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-(2-에톡시에틸)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도페닐)-2-(2-하이드록시에틸)-1H-인돌-7-카복스아미드;
4-(1-아크릴로일피페리딘 3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-아크릴아미도-2-메틸페닐)-2-(1-이소프로필-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-(3-(4-사이클로프로필벤즈아미도)-2-메틸페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(2-메틸-3-(1-메틸피페리딘-4-카복스아미도)페닐)-2-(1-(메틸설포닐)-1,2,3,6-테트라하이드로피리딘-4-일)-1H-인돌-7-카복스아미드;
4-(3-(N-(사이클로펜틸메틸)아크릴아미도)페닐)-1H-인돌-7-카복스아미드;
에틸 4-(7-카바모일-4-(2-메틸-3-(4-옥소퀴나졸린-3(4H)-일)페닐)-1H-인돌-2-일)5,6-디하이드로피리딘-1(2H)-카복실레이트;
(R)-4-(3-(4-옥소퀴나졸린-3(4H)-일)피페리딘-1-일)-1H-인돌-7-카보니트릴;
4-(2,6-디클로로벤질)-2-(p-톨릴)-1H-인돌-7-카복스아미드;
(E)-4-(3-(2-시아노-3-하이드록시부트-2-엔아미도)페닐)-1H-인돌-7-카복스아미드;
4-(시스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(트랜스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-(트랜스-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)옥시)-1H-인돌-7-카복스아미드;
(S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드*;
(R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-인돌-7-카복스아미드*;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드*;
(S)-4-(1-아크릴로일피페리딘-3-일)-1H-인돌-7-카복스아미드*;
(S)-4-(1-아크릴로일피페리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드;
(R)-4-(4-아크릴로일모르폴린-2-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(S)-4-(4-아크릴로일모르폴린-2-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(R)-4-(1-아크릴로일피롤리딘-3-일)-2-(6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-일)-1H-인돌-7-카복스아미드;
2-메틸-4-(메틸(1-프로피올로일아제티딘-3-일)아미노)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피롤리딘-3-일)-2-(6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-일)-1H-인돌-7-카복스아미드;
(R)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(S)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(S)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(R)-7-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카복스아미드;
(S)-7-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)티아졸로[5,4-c]피리딘-4-카복스아미드;
(S)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-인돌-7-카복스아미드;
4-((3S,5R)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-((3S,5S)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-((3R,5S)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
4-((3R,5R)-1-아크릴로일-5-(하이드록시메틸)피페리딘-3-일)-1H-인돌-7-카복스아미드;
(R)-4-(1-아크릴로일피롤리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피롤리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-((1R,3R)-3-아크릴아미도사이클로펜틸)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-4-(1-아크릴로일피페리딘-3-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-2-메틸-4-(1-프로피오닐피롤리딘-3-일)-1H-인돌-7-카복스아미드;
(S)-2-메틸-4-(1-프로피오닐피롤리딘-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(이소크로만-7-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(6,7-디하이드로-4H-피라졸로[5,1-c][1,4]옥사진-2-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(4,4-디플루오로사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(4-(메틸설포닐)사이클로헥스-1-엔-1-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(6-모르폴리노피리딘-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(7,8-디하이드로-5H-피라노[4,3-b]피리딘-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(크로만-7-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(5-(모르폴리노메틸)피리딘-2-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(3,4-디하이드로-2H-벤조[b][1,4]옥사진-6-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1-메틸-1H-피라졸-5-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(2-에틸-1,2,3,4-테트라하이드로이소퀴놀린-6-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1,3-디메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1,1-디옥시도테트라하이드로-2H-티오피란-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(1-프로필피페리딘-4-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(3-하이드록시옥세탄-3-일)-1H-인돌-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-메틸-1H-인돌-7-카복스아미드;
(R)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-인돌-7-카복스아미드;
(S)-4-(1-아크릴로일피롤리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드*;
(R)-4-(1-아크릴로일피롤리딘-3-일)-2-메틸-1H-인돌-7-카복스아미드*;
4-((1R,5S)-6-아크릴로일-3,6-디아자바이사이클로[3.2.0]헵탄-3-일)-1H-인돌-7-카복스아미드;
4-((1S,5R)-6-아크릴로일-3,6-디아자바이사이클로[3.2.0]헵탄-3-일)-1H-인돌-7-카복스아미드;
(R)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
(S)-4-(1-(1-아크릴로일아제티딘-3-일)에틸)-1H-피롤로[3,2-c]피리딘-7-카복스아미드;
4-((1-아크릴로일아제티딘-3-일)아미노)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
4-((1-아크릴로일-3-메틸아제티딘-3-일)(메틸)아미노)-1H-인돌-7-카복스아미드;
4-((1-시아노아제티딘-3-일)(메틸)아미노)-2-메틸-1H-인돌-7-카복스아미드;
4-(2-클로로-6-플루오로벤질)-2-p-톨릴-1H-인돌-7-카복스아미드;
(S)-4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드;
(R)-4-((1-아크릴로일아제티딘-3-일)(메틸)아미노)-2-(테트라하이드로푸란-3-일)-1H-인돌-7-카복스아미드;
(S)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(R)-4-(4-아크릴로일-1,4-옥사제판-6-일)-1H-피롤로[2,3-c]피리딘-7-카복스아미드;
(S)-4-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드; 또는
(R)-4-(1-아크릴로일피페리딘-3-일)-2-(1-메틸-1H-피라졸-4-일)-1H-인돌-7-카복스아미드. - 제1항의 화합물의 치료학적 유효량을 이를 필요로 하는 환자에게 투여함을 포함하는, 질환을 치료하는 방법.
- 제21항에 있어서, 상기 질환이 류머티스 관절염, 소아 류머티스 관절염, 골관절염, 크론병, 염증성 장 질환, 궤양성 대장염, 건선관절염, 건선, 강직척추염, 간질성방광염, 천식, 전신 홍반 루푸스, 루푸스신장염, B 세포 만성 림프성 림프종, 다발성 경화증, 만성 림프성백혈병, 소세포성림프종, 외투 세포 림프종, B-세포 비-호지킨 림프종, 활성화된 B-세포형 확산(diffuse) 거대 B-세포 림프종, 다발골수종, 확산 거대 B-세포 림프종, 소포 림프종, 털세포백혈병 또는 림프모구 림프종인, 방법.
- 제1항의 화합물을 투여하는 것과 함께 자가면역 장애를 치료하기 위한 성분을 포함하는 패키지된 제품을 포함하는 키트.
- 제23항에 있어서, 상기 패키지된 제품이 제1항의 화합물 및 사용 지시서를 포함하는, 키트.
- 제1항에 따른 화합물 및 하나 이상의 약제학적으로 허용되는 부형제를 포함하는 약제학적 조성물.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361839729P | 2013-06-26 | 2013-06-26 | |
| US61/839,729 | 2013-06-26 | ||
| US201361897577P | 2013-10-30 | 2013-10-30 | |
| US61/897,577 | 2013-10-30 | ||
| PCT/US2014/044247 WO2014210255A1 (en) | 2013-06-26 | 2014-06-26 | Primary carboxamides as btk inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20160025580A true KR20160025580A (ko) | 2016-03-08 |
| KR102273997B1 KR102273997B1 (ko) | 2021-07-08 |
Family
ID=52116191
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020167002152A KR102273997B1 (ko) | 2013-06-26 | 2014-06-26 | Btk 억제제로서 1급 카복스아미드 |
Country Status (29)
| Country | Link |
|---|---|
| US (4) | US9567339B2 (ko) |
| EP (3) | EP3483167A1 (ko) |
| JP (3) | JP6509838B2 (ko) |
| KR (1) | KR102273997B1 (ko) |
| CN (1) | CN105530932B (ko) |
| AU (3) | AU2014302365B2 (ko) |
| BR (1) | BR112015032330B1 (ko) |
| CA (1) | CA2916298C (ko) |
| CY (1) | CY1121146T1 (ko) |
| DK (1) | DK3013337T3 (ko) |
| ES (1) | ES2708998T3 (ko) |
| HK (1) | HK1224202A1 (ko) |
| HR (1) | HRP20190093T1 (ko) |
| HU (1) | HUE040645T2 (ko) |
| IL (2) | IL243332B (ko) |
| LT (1) | LT3013337T (ko) |
| ME (1) | ME03307B (ko) |
| MX (1) | MX355943B (ko) |
| NZ (1) | NZ754039A (ko) |
| PL (1) | PL3013337T3 (ko) |
| PT (1) | PT3013337T (ko) |
| RS (1) | RS58273B1 (ko) |
| RU (1) | RU2708395C2 (ko) |
| SG (2) | SG10201802444XA (ko) |
| SI (1) | SI3013337T1 (ko) |
| TW (1) | TWI642657B (ko) |
| UY (1) | UY35630A (ko) |
| WO (1) | WO2014210255A1 (ko) |
| ZA (1) | ZA201509012B (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170061175A (ko) * | 2014-10-24 | 2017-06-02 | 브리스톨-마이어스 스큅 컴퍼니 | 키나제 억제제로서 유용한 인돌 카르복스아미드 화합물 |
| KR20190044652A (ko) * | 2016-09-02 | 2019-04-30 | 브리스톨-마이어스 스큅 컴퍼니 | 인돌 카르복스아미드 화합물을 제조하는 방법 |
Families Citing this family (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2708395C2 (ru) * | 2013-06-26 | 2019-12-06 | Эббви Инк. | Первичные карбоксамиды в качестве ингибиторов bтk |
| US9951056B2 (en) | 2013-09-30 | 2018-04-24 | Beijing Innocare Pharma Tech Co., Ltd. | Substituted nicotinamide inhibitors of BTK and their preparation and use in the treatment of cancer, inflammation and autoimmune disease |
| AR104259A1 (es) * | 2015-04-15 | 2017-07-05 | Celgene Quanticel Res Inc | Inhibidores de bromodominio |
| EP3328866B1 (en) * | 2015-07-27 | 2019-10-30 | Eli Lilly and Company | 7-phenylethylamino-4h-pyrimido[4,5-d][1,3]oxazin-2-one compounds and theit use as mutant idh1 inhibitors |
| EP3365340B1 (en) | 2015-10-19 | 2022-08-10 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| LT3377484T (lt) * | 2015-11-17 | 2023-12-27 | Merck Patent Gmbh | Dauginės sklerozės gydymo būdai, panaudojant pirimidino ir piridino junginius su btk inhibitoriniu aktyvumu |
| HRP20221035T1 (hr) | 2015-11-19 | 2022-11-11 | Incyte Corporation | Heterociklički spojevi kao imunomodulatori |
| CA3005766A1 (en) | 2015-12-17 | 2017-06-22 | Merck Patent Gmbh | Polycyclic tlr7/8 antagonists and use thereof in the treatment of immune disorders |
| AU2016379372A1 (en) | 2015-12-22 | 2018-08-02 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| WO2017192961A1 (en) | 2016-05-06 | 2017-11-09 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| US20170335530A1 (en) * | 2016-05-23 | 2017-11-23 | Fatu K. Kofa | Pet waste vacuum and disposal device and method |
| EP3464279B1 (en) | 2016-05-26 | 2021-11-24 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CN105924840A (zh) * | 2016-06-01 | 2016-09-07 | 扬州兰都塑料科技有限公司 | 一种阻燃电力电缆 |
| CN106083707B (zh) * | 2016-06-01 | 2018-10-26 | 温州大学 | 一种非对称杂芳基硫醚的合成方法 |
| CN105837993A (zh) * | 2016-06-01 | 2016-08-10 | 扬州兰都塑料科技有限公司 | 一种阻燃电力电缆用阻燃剂 |
| CN105884673B (zh) * | 2016-06-03 | 2018-05-11 | 温州大学 | 一种吲哚衍生物的合成方法 |
| JP7000357B2 (ja) | 2016-06-20 | 2022-01-19 | インサイト・コーポレイション | 免疫調節剤としての複素環化合物 |
| MA45669A (fr) | 2016-07-14 | 2019-05-22 | Incyte Corp | Composés hétérocycliques utilisés comme immunomodulateurs |
| CN109563075B (zh) | 2016-08-08 | 2022-09-30 | 默克专利股份公司 | Tlr7/8拮抗剂及其用途 |
| MA46045A (fr) | 2016-08-29 | 2021-04-28 | Incyte Corp | Composés hétérocycliques utilisés comme immunomodulateurs |
| CN108779115B (zh) | 2016-10-14 | 2021-02-26 | 江苏恒瑞医药股份有限公司 | 五元杂芳环并桥环类衍生物、其制备方法及其在医药上的应用 |
| CN110381997A (zh) | 2016-12-12 | 2019-10-25 | 茂体外尔公司 | 用于治疗和预防癌症和感染性疾病的包含病毒基因治疗和免疫检查点抑制剂的方法和组合物 |
| WO2018119266A1 (en) | 2016-12-22 | 2018-06-28 | Incyte Corporation | Benzooxazole derivatives as immunomodulators |
| DK3558990T3 (da) | 2016-12-22 | 2022-09-12 | Incyte Corp | Tetrahydroimidazo[4,5-c]pyridinderivater som pd-l1 internaliseringsinducere |
| MA47120A (fr) | 2016-12-22 | 2021-04-28 | Incyte Corp | Dérivés pyridine utilisés en tant qu'immunomodulateurs |
| WO2018119236A1 (en) | 2016-12-22 | 2018-06-28 | Incyte Corporation | Triazolo[1,5-a]pyridine derivatives as immunomodulators |
| US20200385364A1 (en) * | 2017-01-26 | 2020-12-10 | Araxes Pharma Llc | Fused n-heterocyclic compounds and methods of use thereof |
| WO2018140599A1 (en) | 2017-01-26 | 2018-08-02 | Araxes Pharma Llc | Benzothiophene and benzothiazole compounds and methods of use thereof |
| CN106928201B (zh) * | 2017-02-22 | 2019-08-23 | 江汉大学 | 合成2-乙烯基吲哚衍生物的方法 |
| US11639346B2 (en) | 2017-05-25 | 2023-05-02 | Araxes Pharma Llc | Quinazoline derivatives as modulators of mutant KRAS, HRAS or NRAS |
| CN107098845A (zh) * | 2017-07-06 | 2017-08-29 | 贵州大学 | 一种5‑氰基‑6‑硝基吲哚的制备工艺 |
| CN107721988A (zh) * | 2017-10-31 | 2018-02-23 | 无锡福祈制药有限公司 | 具有抗炎活性的异吲哚‑1‑酮类化合物 |
| US11100492B2 (en) | 2018-02-19 | 2021-08-24 | Peter Garrett | General purpose re-loadable card aggregation implementation |
| EP3774791B1 (en) | 2018-03-30 | 2022-12-21 | Incyte Corporation | Heterocyclic compounds as immunomodulators |
| CA3099994A1 (en) | 2018-05-11 | 2019-11-04 | Incyte Corporation | Tetrahydro-imidazo[4,5-c]pyridine derivatives as pd-l1 immunomodulators |
| BR112021001709A2 (pt) | 2018-08-01 | 2021-05-04 | Araxes Pharma Llc | compostos espiro heterocíclicos e métodos de uso dos mesmos para o tratamento de câncer |
| AU2020242287A1 (en) | 2019-03-21 | 2021-09-02 | INSERM (Institut National de la Santé et de la Recherche Médicale) | A Dbait molecule in combination with kinase inhibitor for the treatment of cancer |
| JP2022544189A (ja) | 2019-08-09 | 2022-10-17 | インサイト・コーポレイション | Pd-1/pd-l1阻害剤の塩 |
| CA3155852A1 (en) | 2019-09-30 | 2021-04-08 | Incyte Corporation | PYRIDO[3,2-D]PYRIMIDINE COMPOUNDS AS IMMUNOMODULATORS |
| CN114761006A (zh) | 2019-11-08 | 2022-07-15 | Inserm(法国国家健康医学研究院) | 对激酶抑制剂产生耐药性的癌症的治疗方法 |
| CA3160131A1 (en) | 2019-11-11 | 2021-05-20 | Incyte Corporation | Salts and crystalline forms of a pd-1/pd-l1 inhibitor |
| WO2021148581A1 (en) | 2020-01-22 | 2021-07-29 | Onxeo | Novel dbait molecule and its use |
| JP2023526052A (ja) * | 2020-05-12 | 2023-06-20 | ピーエムブイ ファーマシューティカルズ, インコーポレイテッド | 変異体p53機能を復元させるための方法および化合物 |
| JP2023528421A (ja) * | 2020-06-02 | 2023-07-04 | ジービー005, インコーポレイテッド | キナーゼ阻害剤 |
| WO2021255091A1 (en) | 2020-06-19 | 2021-12-23 | Bayer Aktiengesellschaft | 1,3,4-oxadiazoles and their derivatives as fungicides |
| JP2023536620A (ja) | 2020-08-04 | 2023-08-28 | ノバルティス アーゲー | Cllの治療 |
| CR20230185A (es) | 2020-09-30 | 2023-06-27 | Astrazeneca Ab | Compuestos y su uso en el tratamiento del cáncer |
| WO2022094172A2 (en) * | 2020-10-30 | 2022-05-05 | Newave Pharmaceutical Inc. | Inhibitors of btk |
| KR20230117573A (ko) | 2020-11-06 | 2023-08-08 | 인사이트 코포레이션 | Pd-1 및 pd-l1 억제제, 및 이의 염 및 결정형의 제조 방법 |
| US11760756B2 (en) | 2020-11-06 | 2023-09-19 | Incyte Corporation | Crystalline form of a PD-1/PD-L1 inhibitor |
| US11780836B2 (en) | 2020-11-06 | 2023-10-10 | Incyte Corporation | Process of preparing a PD-1/PD-L1 inhibitor |
| JP2024504602A (ja) * | 2021-01-12 | 2024-02-01 | ジービー005, インコーポレイテッド | キナーゼ阻害剤としてのインドール誘導体 |
| CN114853723B (zh) * | 2021-02-03 | 2023-11-24 | 药雅科技(上海)有限公司 | 吲哚类化合物btk抑制剂的制备及其应用 |
| CN114957241B (zh) * | 2021-02-23 | 2023-08-22 | 药雅科技(上海)有限公司 | 杂环类化合物作为激酶抑制剂的制备及其应用 |
| CN114853752B (zh) * | 2021-02-03 | 2023-08-22 | 药雅科技(上海)有限公司 | Btk抑制剂吡啶并杂环类化合物的制备及其应用 |
| CN114957242B (zh) * | 2021-02-23 | 2023-08-22 | 药雅科技(上海)有限公司 | 吡啶并杂环类化合物作为激酶抑制剂的制备及其应用 |
| WO2022166468A1 (zh) * | 2021-02-03 | 2022-08-11 | 药雅科技(上海)有限公司 | Bruton's酪氨酸激酶抑制剂及其应用 |
| CN116348453A (zh) * | 2021-04-25 | 2023-06-27 | 烨辉医药科技(上海)有限公司 | 杂芳族甲酰胺化合物及其用途 |
| CN115521313B (zh) * | 2021-06-24 | 2023-11-03 | 山东大学 | 一种降解btk蛋白的化合物及其制备方法和应用 |
| IL314122A (en) | 2022-01-27 | 2024-09-01 | Pmv Pharmaceuticals Inc | Deuterium-converted compounds to restore mutant P53 activity |
| WO2023227080A1 (zh) * | 2022-05-25 | 2023-11-30 | 百极弘烨(南通)医药科技有限公司 | 一种protac化合物、含其的药物组合物及其制备方法和应用 |
| WO2023250431A2 (en) * | 2022-06-22 | 2023-12-28 | Children's Hospital Medical Center | Multi-cyclic irak and flt3 inhibiting compounds and uses thereof |
| WO2024081748A2 (en) * | 2022-10-12 | 2024-04-18 | Maze Therapeutics, Inc. | Inhibitors of solute carrier family 6a member 19 (slc6a19) and methods of use thereof |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20070057969A (ko) * | 2004-09-21 | 2007-06-07 | 글락소 그룹 리미티드 | 화학적 화합물 |
| US20090143372A1 (en) * | 2007-10-31 | 2009-06-04 | Jianghe Deng | Chemical compounds |
| KR20100015797A (ko) * | 2007-03-23 | 2010-02-12 | 스미스클라인 비참 코포레이션 | Ikk2 억제제로서의 인돌 카르복스아미드 |
| US8362065B2 (en) * | 2008-12-19 | 2013-01-29 | Bristol-Myers Squibb Company | Carbazole carboxamide compounds useful as kinase inhibitors |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4025510A (en) * | 1975-12-01 | 1977-05-24 | E. I. Du Pont De Nemours And Company | 2,4-Diaryl[1,3,4H]thiadiazines fused to quinoxalines |
| US6090382A (en) | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| DE10022925A1 (de) * | 2000-05-11 | 2001-11-15 | Basf Ag | Substituierte Indole als PARP-Inhibitoren |
| WO2003009852A1 (en) * | 2001-07-24 | 2003-02-06 | Merck & Co., Inc. | Tyrosine kinase inhibitors |
| WO2004041285A1 (en) * | 2002-10-31 | 2004-05-21 | Amgen Inc. | Antiinflammation agents |
| WO2005012283A1 (en) | 2003-07-31 | 2005-02-10 | Boehringer Ingelheim Pharmaceuticals, Inc. | Substituted benzothiophene compounds and uses thereof |
| GB0400895D0 (en) * | 2004-01-15 | 2004-02-18 | Smithkline Beecham Corp | Chemical compounds |
| RU2006142741A (ru) * | 2004-05-04 | 2008-06-10 | Ф.Хоффманн-Ля Рош Аг (Ch) | Тиенопиридины как ингибиторы ikk |
| CA2569887A1 (en) | 2004-06-09 | 2005-12-22 | Glaxo Group Limited | Pyrrolopyridine derivatives |
| CN101189243A (zh) * | 2005-04-06 | 2008-05-28 | 阿斯利康(瑞典)有限公司 | 取代的杂环及其作为chk1、pdk1和pak抑制剂的应用 |
| US20090275570A1 (en) | 2005-04-06 | 2009-11-05 | Astrazeneca Ab | Substituted heterocycles and their use as chk1, pdk1 and pak inhibitors |
| WO2007005534A2 (en) * | 2005-06-30 | 2007-01-11 | Smithkline Beecham Corporation | Chemical compounds |
| WO2007113596A1 (en) | 2006-04-03 | 2007-10-11 | Istituto Di Ricerche Di Biologia Molecolare P. Angeletti Spa | Amide substituted indazole and benzotriazole derivatives as poly(adp-ribose)polymerase (parp) inhibitors |
| CA2684240A1 (en) * | 2007-04-16 | 2008-10-30 | Serenex, Inc. | Tetrahydroindole and tetrahydroindazole derivatives |
| CN101687036A (zh) * | 2007-04-27 | 2010-03-31 | 阿斯利康(瑞典)有限公司 | 治疗恶性血液病的chk1抑制剂与b细胞耗尽抗体 |
| WO2008150490A2 (en) * | 2007-06-01 | 2008-12-11 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of psoriasis and crohn's disease |
| CN101481380B (zh) * | 2008-01-08 | 2012-10-17 | 浙江医药股份有限公司新昌制药厂 | 噻吩并哒嗪类化合物及其制备方法、药物组合物及其用途 |
| AR070317A1 (es) | 2008-02-06 | 2010-03-31 | Osi Pharm Inc | Furo (3,2-c) piridina y tieno (3,2-c) piridinas |
| US8338439B2 (en) | 2008-06-27 | 2012-12-25 | Celgene Avilomics Research, Inc. | 2,4-disubstituted pyrimidines useful as kinase inhibitors |
| CN102711473B (zh) | 2009-09-04 | 2016-11-09 | 比奥根Ma公司 | 布鲁顿酪氨酸激酶抑制剂 |
| WO2011075699A2 (en) | 2009-12-18 | 2011-06-23 | Sunovion Pharmaceuticals Inc. | Compounds for treating disorders mediated by metabotropic glutamate receptor 5, and methods of use thereof |
| US20110212461A1 (en) | 2010-02-26 | 2011-09-01 | Hans Marcus Ludwig Bitter | Prediction of cardiotoxicity |
| MX2012013378A (es) | 2010-05-20 | 2013-01-24 | Hoffmann La Roche | Derivados de pirrolo [2, 3-b] pirazina-7-carboxamida y sus uso como inhibidores de cinasa janus (jak) y cinasa tirosina del brazo (syk). |
| WO2011159857A1 (en) | 2010-06-16 | 2011-12-22 | Bristol-Myers Squibb Company | Carboline carboxamide compounds useful as kinase inhibitors |
| EP2592933B1 (en) | 2010-07-16 | 2017-04-05 | Anderson Gaweco | Mif inhibitors and their uses |
| JP5822934B2 (ja) | 2010-09-15 | 2015-11-25 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | アザベンゾチアゾール化合物、組成物及び使用方法 |
| FR2969151B1 (fr) * | 2010-12-17 | 2016-11-04 | Oreal | Derives du 4-amino et leur utilisation pour la coloration d'oxydation des fibres keratiniques. |
| WO2012142498A2 (en) | 2011-04-13 | 2012-10-18 | Innovimmune Biotherapeutics, Inc. | Mif inhibitors and their uses |
| EP2561759A1 (en) * | 2011-08-26 | 2013-02-27 | Bayer Cropscience AG | Fluoroalkyl-substituted 2-amidobenzimidazoles and their effect on plant growth |
| WO2013148603A1 (en) | 2012-03-27 | 2013-10-03 | Takeda Pharmaceutical Company Limited | Cinnoline derivatives as as btk inhibitors |
| RU2708395C2 (ru) * | 2013-06-26 | 2019-12-06 | Эббви Инк. | Первичные карбоксамиды в качестве ингибиторов bтk |
-
2014
- 2014-06-26 RU RU2016102137A patent/RU2708395C2/ru active
- 2014-06-26 US US14/315,504 patent/US9567339B2/en active Active
- 2014-06-26 ES ES14817453T patent/ES2708998T3/es active Active
- 2014-06-26 RS RS20190083A patent/RS58273B1/sr unknown
- 2014-06-26 PT PT14817453T patent/PT3013337T/pt unknown
- 2014-06-26 AU AU2014302365A patent/AU2014302365B2/en active Active
- 2014-06-26 PL PL14817453T patent/PL3013337T3/pl unknown
- 2014-06-26 NZ NZ754039A patent/NZ754039A/en unknown
- 2014-06-26 JP JP2016524175A patent/JP6509838B2/ja active Active
- 2014-06-26 LT LTEP14817453.5T patent/LT3013337T/lt unknown
- 2014-06-26 ME MEP-2019-21A patent/ME03307B/me unknown
- 2014-06-26 CN CN201480047196.8A patent/CN105530932B/zh active Active
- 2014-06-26 SG SG10201802444XA patent/SG10201802444XA/en unknown
- 2014-06-26 EP EP18202730.0A patent/EP3483167A1/en not_active Withdrawn
- 2014-06-26 MX MX2015017973A patent/MX355943B/es active IP Right Grant
- 2014-06-26 WO PCT/US2014/044247 patent/WO2014210255A1/en active Application Filing
- 2014-06-26 EP EP14817453.5A patent/EP3013337B1/en active Active
- 2014-06-26 TW TW103122168A patent/TWI642657B/zh active
- 2014-06-26 CA CA2916298A patent/CA2916298C/en active Active
- 2014-06-26 SI SI201431050T patent/SI3013337T1/sl unknown
- 2014-06-26 HU HUE14817453A patent/HUE040645T2/hu unknown
- 2014-06-26 SG SG11201510503UA patent/SG11201510503UA/en unknown
- 2014-06-26 KR KR1020167002152A patent/KR102273997B1/ko active IP Right Grant
- 2014-06-26 EP EP21194489.7A patent/EP4008328A1/en active Pending
- 2014-06-26 BR BR112015032330-8A patent/BR112015032330B1/pt active IP Right Grant
- 2014-06-26 DK DK14817453.5T patent/DK3013337T3/en active
- 2014-06-26 UY UY0001035630A patent/UY35630A/es active IP Right Grant
-
2015
- 2015-12-10 ZA ZA2015/09012A patent/ZA201509012B/en unknown
- 2015-12-24 IL IL243332A patent/IL243332B/en active IP Right Grant
-
2016
- 2016-11-01 HK HK16112545.7A patent/HK1224202A1/zh unknown
-
2017
- 2017-01-05 US US15/398,978 patent/US20170174624A1/en not_active Abandoned
-
2019
- 2019-01-16 HR HRP20190093TT patent/HRP20190093T1/hr unknown
- 2019-01-18 CY CY20191100073T patent/CY1121146T1/el unknown
- 2019-02-08 AU AU2019200901A patent/AU2019200901A1/en not_active Abandoned
- 2019-04-02 JP JP2019070362A patent/JP6770127B2/ja active Active
- 2019-05-23 US US16/421,006 patent/US20190284135A1/en not_active Abandoned
- 2019-06-05 IL IL267101A patent/IL267101A/en unknown
-
2020
- 2020-09-24 JP JP2020159339A patent/JP2021001212A/ja active Pending
-
2021
- 2021-02-11 US US17/173,613 patent/US20210179556A1/en not_active Abandoned
- 2021-03-08 AU AU2021201463A patent/AU2021201463A1/en not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20070057969A (ko) * | 2004-09-21 | 2007-06-07 | 글락소 그룹 리미티드 | 화학적 화합물 |
| KR20100015797A (ko) * | 2007-03-23 | 2010-02-12 | 스미스클라인 비참 코포레이션 | Ikk2 억제제로서의 인돌 카르복스아미드 |
| US20120040958A1 (en) * | 2007-03-23 | 2012-02-16 | Glaxosmithkline Llc | Indole carboxamides as ikk2 inhibitors |
| US20090143372A1 (en) * | 2007-10-31 | 2009-06-04 | Jianghe Deng | Chemical compounds |
| US8362065B2 (en) * | 2008-12-19 | 2013-01-29 | Bristol-Myers Squibb Company | Carbazole carboxamide compounds useful as kinase inhibitors |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20170061175A (ko) * | 2014-10-24 | 2017-06-02 | 브리스톨-마이어스 스큅 컴퍼니 | 키나제 억제제로서 유용한 인돌 카르복스아미드 화합물 |
| KR20180132167A (ko) * | 2014-10-24 | 2018-12-11 | 브리스톨-마이어스 스큅 컴퍼니 | 키나제 억제제로서 유용한 인돌 카르복스아미드 화합물 |
| KR20190044652A (ko) * | 2016-09-02 | 2019-04-30 | 브리스톨-마이어스 스큅 컴퍼니 | 인돌 카르복스아미드 화합물을 제조하는 방법 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102273997B1 (ko) | Btk 억제제로서 1급 카복스아미드 | |
| KR101718384B1 (ko) | 신규한 트리사이클릭 화합물 | |
| US10280184B2 (en) | Heterocyclic kinase inhibitors | |
| KR20140005882A (ko) | 푸로[3,2-d]피리미딘 화합물 | |
| KR20120102724A (ko) | 신규한 트리사이클릭 화합물 | |
| KR20140015151A (ko) | 신규한 트리사이클릭 화합물 | |
| TW201706258A (zh) | 作為tnf信號傳遞調節劑之吲唑酮 | |
| TW201702247A (zh) | 作為tnf信號傳遞調節劑之吲唑酮 | |
| TW201429959A (zh) | 雜環核荷爾蒙受體調節劑 | |
| NZ714797B2 (en) | Primary carboxamides as btk inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |