KR20150104911A - 암 진단용 마커 및 이를 이용한 암 진단 방법 - Google Patents
암 진단용 마커 및 이를 이용한 암 진단 방법 Download PDFInfo
- Publication number
- KR20150104911A KR20150104911A KR1020140026861A KR20140026861A KR20150104911A KR 20150104911 A KR20150104911 A KR 20150104911A KR 1020140026861 A KR1020140026861 A KR 1020140026861A KR 20140026861 A KR20140026861 A KR 20140026861A KR 20150104911 A KR20150104911 A KR 20150104911A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- formula
- gsh
- fluorescence
- thiol
- Prior art date
Links
- GZSQXVQODBNCMK-VOTSOKGWSA-N CC[n+]1ccc(/C=C/c2ccc3OC(CCCC4=O)C4=Cc3c2)cc1 Chemical compound CC[n+]1ccc(/C=C/c2ccc3OC(CCCC4=O)C4=Cc3c2)cc1 GZSQXVQODBNCMK-VOTSOKGWSA-N 0.000 description 2
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/78—Ring systems having three or more relevant rings
- C07D311/80—Dibenzopyrans; Hydrogenated dibenzopyrans
- C07D311/82—Xanthenes
- C07D311/84—Xanthenes with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 9
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Urology & Nephrology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Medicinal Chemistry (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- Food Science & Technology (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Oncology (AREA)
- General Physics & Mathematics (AREA)
- Microbiology (AREA)
- Hospice & Palliative Care (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
Abstract
Description
본 발명은 살아있는 세포 내에서 티올-함유 아미노산(글루타티온(GSH))의 농도를 검출하여 정상 세포 및 암 세포를 구별할 수 있으며, 혈액 및 조직 내에서도 티올-함유 아미노산을 측정하여 암의 성장을 인지할 수 있는 암 세포 진단을 위한 마커 및 이이를 이용한 암 진단 방법에 관한 것이다.
글루타티온(GSH)은 세포 내에서 함량이 가장 큰 티올로서, 세포 내 농도는 1~10 mM 범위이며 생물학적 산화환원 시스템의 항상성에 있어 매우 중요한 역할을 한다. 세포 내의 글루타티온/산화 글루타티온(GSH/GSSG) 비율은 세포 내 산화환원 상태를 알려주는 중요한 지표로서 정상적인 생리적 조건 하에서 100 : 1을 초과하며, 이수치가 비정상적인 경우 다수의 질병 및 암과 연관된 경우가 많다 ((a) S. C. Lu, Curr. Top. Cell. Regul. 2000, 36, 95-116; (b) T. P. Akerboom, M. Bilzer, H. Sies, J. Biol. Chem. 1982, 257, 4248-4252; (c) D. M. Townsend, K. D. Tew, H. Tapiero, Biomed. Pharmacother. 2003, 57, 145-155).
간은 혈액과, 신장, 폐, 대장 및 소장과 같은 타기관에 GSH를 공급하므로, 체내의 산화환원 상태 유지에 기여하는 매우 중요한 기관으로서, 산화 스트레스가 심할 경우, 간세포의 GSH/GSSG 비율은 4 : 1 미만으로 감소할 수 있다(O. W. Griffith, Free Radic. Biol. Med. 1999, 27, 922-935). 또한, GSH의 조직간 이동은 다른 조직으로의 암 전이에도 지대한 영향을 미친다. 따라서, 간 내의 GSH/GSSG 비율의 변화와 간 티올 함량을 정량적으로 파악하는 것은 중요한 의미가 있다.
생체 내의 특정한 분자를 검출하기 위한 목적으로, 특히 생체 내 및 생체 외에서 티올을 영상화하기 위한 용도로 민감도, 특이성, 사용의 용이성 면에서 다른 방법들에 비해 뚜렷한 장점을 가지는 다양한 화학정량 형광 마커가 개발되었다. 그러나, 티올 검출을 위한 형광 표지자에 관해서는 많이 연구된 바 있지만((a) P. K. Pullela, T. Chiku, M. J. Carvan, D. S. Sem, Anal. Biochem. 2006, 352, 265-273; (b) N. Shao, J. Jin, H. Wang, J. Zheng, R. Yang, W. Chan, Z. Abliz, J. Am. Chem. Soc. 2010, 132, 725-736; (c) X. Chen, Y. Zhou, X. Peng, J. Yoon, Chem. Soc. Rev. 2010, 39, 2120-2135; (d) L.-L. Yin, Z.-Z. Chen, L.-L. Tong, K.-H. Xu, B. Tang, Chin. J. Anal. Chem. 2009, 37, 1073-1081; (e) H. S. Jung, K. C. Ko, G. H. Kim, A. R. Lee, Y. C. Na, C. Kang, J. Y. Lee, J. S. Kim, Org. Lett. 2011, 13, 1498-1501; (e) H. S. Jung, J. H. Han, Y. Habata, C. Kang, J. S. Kim, Chem. Commun. 2011, 47, 5142-5144), 이를 실제로 이용하여 간과 같은 특정 기관에서 티올을 검출한 예는 아직까지 보고된 바가 없다.
또한, 기존 티올 검출을 위한 형광 마커는 다른 단백질 또는 GSH와 유사한 구조인 Cys(시스테인) 및 Hcy(호모시스테인) 간의 교차 반응성에 의한 간섭으로 인해 선명한 측정이 어려운 문제가 있다.
따라서, 살아있는 세포, 조직 및 혈전에서 GSH의 검출을 위한 높은 민감도 및 선택도뿐만 아니라 독성이 없는 마커가 요구되고 있다.
본 발명의 목적은 살아있는 세포 내에서 티올-함유 아미노산(글루타티온(GSH))의 농도를 검출하여 정상 세포 및 암 세포를 구별할 수 있으며, 혈액 및 조직 내에서도 티올-함유 아미노산을 측정하여 암의 성장을 인지할 수 있는 암 진단용 마커 제공하는데 있다.
또한, 본 발명의 다른 목적은 상기 암 진단용 마커를 이용하여 암을 예측 또는 진단하기 위한 정보를 제공하는 방법을 제공하는데 있다.
상기한 목적을 달성하기 위한 본 발명의 화합물은 하기 [화학식 1]로 표시된다;
[화학식 1]
또한, 상기한 다른 목적을 달성하기 위한 본 발명의 암 진단용 마커는 하기 [화학식 1]을 포함한다;
[화학식 1]
상기 화합물은 티올-함유 아미노산을 검출할 수 있으며, 티올-함유 아미노산은 글루타티온(GSH), Cys(시스테인) 및 Hcy(호모시스테인)로 이루어진 군에서 선택된 1종 이상을 들 수 있으나, 바람직하게는 글루타티온(GSH)이다.
또한, 상기한 또 다른 목적을 달성하기 위한 본 발명의 생체내 티올-함유 아미노산을 검출하여 암을 예측 또는 진단하기 위하여 정보를 제공하는 방법은 (a) 피검체로부터 분리된 조직 샘플을 제공하는 단계; (b) 상기 제공된 샘플에 상기 [화학식 1]로 표시되는 화합물을 첨가하는 단계; 및 (c) 상기 화합물이 첨가된 샘플의 형광을 측정하는 단계를 포함할 수 있다.
또한, 상기한 또 다른 목적을 달성하기 위한 본 발명의 하기 [화학식 1]로 표시되는 화합물의 제조방법은 하기 [반응식 1]에 따라 하기 [화학식 2]의 화합물과 1-에틸-4-메틸피리디늄 요오드를 에탄올로 교반한 후 피페리딘을 첨가하여 반응함으로써 제조된다;
[반응식 1]
[화학식 2] [화학식 1].
상기 [화학식 2]의 화합물은 하기 [반응식 2]에 따라 디클로로메탄(DCM)에 용해된 피리디늄클로로크롬메이트(PCC) 현탁액에 하기 [화학식 3]의 화합물을 첨가하여 반응함으로써 제조된다;
[반응식 2]
[화학식 3] [화학식 2].
상기 [화학식 3]의 화합물은 하기 [반응식 3]에 따라 테트라언하이드로퓨란(THF)에 용해된 2-하이드록시-5-(하이드록시메틸)벤즈알데하이드 용액에 2-사이클로헥센-1-원, 이미다졸 및 탈이온수를 첨가하여 반응함으로써 제조된다;
[반응식 3]
[화학식 3].
본 발명의 암 진단용 마커는 티올에 대하여 우수한 선택도 및 민감도를 보이며 살아있는 세포 내에서 GSH의 농도를 검출하여 정상 세포 및 암 세포를 구별할 수 있으며, 혈액, 종양 및 조직(간)내에서도 GSH를 측정하여 암의 성장을 인지할 수 있다.
또한, 본 발명의 마커는 전혈, 종양 및 조직에서 민감하고 정확하게 GSH 수준을 검출하며 무독성이므로 암 진단에 사용할 수 있을 뿐만 아니라 암의 병리학에서 광범위한 생물학적 및 임상에 응용될 수 있다.
도 1a는 100 당량의 GSH 존재하에서 [화학식 1] 화합물의 시간에 따른 흡광 변화를 나타낸 그래프이다.
도 1b는 GSH의 부재 및 존재하에서 [화학식 1] 화합물의 여기(점선) 및 발광 스펙트럼이다.
도 2a는 100 당량의 GSH 존재하에서 [화학식 1] 화합물의 시간에 따른 형광 변화를 나타낸 그래프이다.
도 2b는 상이한 농도로 GSH를 첨가 후 [화학식 1] 화합물의 형광 변화를 나타낸 그래프이다.
도 3은 상이한 pH값 하에서 GSH의 존재(붉은 점) 및 부재(검은 점)에 따른 [화학식 1] 화합물의 형광 강도 비율(I496/I550)의 변화를 나타낸 그래프이다.
도 4a, 4b 및 4c는 PBS 용액 내 각각 100 당량, 1 당량 및 10 당량 Cys의 존재하에서 [화학식 1] 화합물의 시간에 따른 형광 변화를 나타낸 그래프이다.
도 5a, 5b 및 5c는 PBS 용액 내 각각 100 당량, 1 당량 및 10 당량 Hcy의 존재하에서 [화학식 1] 화합물의 시간에 따른 형광 변화를 나타낸 그래프이다.
도 6은 DMSO-d6/D2O(3/1)에서 Cys(1 당량) 및 GSH(1 당량)의 부재 및 존재하에서 [화학식 1] 화합물(5 mM)의 1H-NMR 스펙트럼이다(시료 첨가 2시간 후 데이터 측정).
도 7a 및 7b는 상온에서 PBS 용액 내 다양한 시료의 존재하에서 [화학식 1] 화합물의 형광 스펙트럼이다(시료 첨가 1분(7a) 및 2시간(7b) 후 측정).
도 7c는 상온에서 PBS 용액 내 다양한 시료의 존재하에서 [화학식 1] 화합물의 형광 변화를 나타낸 그래프이다(시료 첨가 1분(파란 막대) 및 2시간(빨간 막대) 동안 [화학식 1] 화합물과 배양 후 측정).
도 8은 GSH만 존재할 때와 Cys 또는 Hcy이 GSH와 같이 존재하는 조건하에서 [화학식 1] 화합물의 496 nm와 550 nm에서 형광세기비율을 비교한 그래프이다.
도 9a는 HeLa, HepG2, Hep3B, Huh7, HPH, 및 BJ에서 상이한 농도(0, 5, 20, 50, 및 100 μM)의 [화학식 1] 화합물에 대하여 540 nm에서 측정된 흡광도 그래프이다.
도 9b는 [화학식 1] 화합물의 상이한 농도에 대한 세포독성 효과를 나타낸 그래프이다
도 10a-d는 살아있는 HeLa 세포와 [화학식 1] 화합물을 2시간 동안 배양한 후의 공초점 형광 및 명시야(bright-field) 이미지이다.
도 10e-h는 살아있는 HeLa 세포를 0.2 mM NEM로 미리 배양하고 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 및 위상 콘트라스트 이미지이다.
도 10i-l은 살아있는 HeLa 세포를 0.5 mM NEM로 미리 배양하고 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 및 위상 콘트라스트 이미지이다.
도 10m-p는 살아있는 HeLa 세포를 1 mM NEM로 미리 배양하고 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 및 위상 콘트라스트 이미지이다.
도 11은 2시간 동안 [화학식 1] 화합물로 처리되기 전에 상이한 NEM 농도로 배양된 HeLa 세포의 B/Y의 정량 분석을 나타낸 그래프이다.
도 12a-f는 살아있는 암 세포주(HeLa, HepG2, Huh7, 및 Hep3B), 인간 일차 간세포(HPH) 및 정상 삼유 아세포 세포주(BJ)를 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 이미지이다(배율: X200).
도 12g는 [화학식 1] 화합물의 B/Y비율을 정량 분석한 그래프이다(G: 노란색 채널 및 파란색 채널의 평균 형광 강도).
도 12h는 웨스턴 블롯에 의해 총 세포 내 GSH 농도의 정량분석을 나타낸 그래프이다.
도 12i는 지수, 2차 다항식 및 선분(linear fit)의 회귀 모델을 도 12g 및 도 12h에 적용한 세포 내 GSH(μM)의 상이한 세포주 및 식(expression)에서 B/Y 비율에 대한 산포도 데이터를 나타낸 그래프이다.
도 13a-c는 정상 및 이종이식 마우스에서 얻은 스냅 냉동 간 및 종양 조직에 대한 [화학식 1] 화합물의 B/Y 비율 이미지이다.
도 13d는 이종이식 마우스 모델 및 해부된 종양, 조직에 대한 이미지이다.
도 13e는 정상 마우스 및 종양 이종이식 마우스의 전혈에 대한 [화학식 1] 화합물의 B/Y 비율(n = 3 및n = 5)을 나타낸 그래프이다.
도 14는 상이한 농도에서 GSH 비율인 산포도 데이터에 대한 선형 회귀 모델에 의해 맞춰진 표준곡선이다.
도 1b는 GSH의 부재 및 존재하에서 [화학식 1] 화합물의 여기(점선) 및 발광 스펙트럼이다.
도 2a는 100 당량의 GSH 존재하에서 [화학식 1] 화합물의 시간에 따른 형광 변화를 나타낸 그래프이다.
도 2b는 상이한 농도로 GSH를 첨가 후 [화학식 1] 화합물의 형광 변화를 나타낸 그래프이다.
도 3은 상이한 pH값 하에서 GSH의 존재(붉은 점) 및 부재(검은 점)에 따른 [화학식 1] 화합물의 형광 강도 비율(I496/I550)의 변화를 나타낸 그래프이다.
도 4a, 4b 및 4c는 PBS 용액 내 각각 100 당량, 1 당량 및 10 당량 Cys의 존재하에서 [화학식 1] 화합물의 시간에 따른 형광 변화를 나타낸 그래프이다.
도 5a, 5b 및 5c는 PBS 용액 내 각각 100 당량, 1 당량 및 10 당량 Hcy의 존재하에서 [화학식 1] 화합물의 시간에 따른 형광 변화를 나타낸 그래프이다.
도 6은 DMSO-d6/D2O(3/1)에서 Cys(1 당량) 및 GSH(1 당량)의 부재 및 존재하에서 [화학식 1] 화합물(5 mM)의 1H-NMR 스펙트럼이다(시료 첨가 2시간 후 데이터 측정).
도 7a 및 7b는 상온에서 PBS 용액 내 다양한 시료의 존재하에서 [화학식 1] 화합물의 형광 스펙트럼이다(시료 첨가 1분(7a) 및 2시간(7b) 후 측정).
도 7c는 상온에서 PBS 용액 내 다양한 시료의 존재하에서 [화학식 1] 화합물의 형광 변화를 나타낸 그래프이다(시료 첨가 1분(파란 막대) 및 2시간(빨간 막대) 동안 [화학식 1] 화합물과 배양 후 측정).
도 8은 GSH만 존재할 때와 Cys 또는 Hcy이 GSH와 같이 존재하는 조건하에서 [화학식 1] 화합물의 496 nm와 550 nm에서 형광세기비율을 비교한 그래프이다.
도 9a는 HeLa, HepG2, Hep3B, Huh7, HPH, 및 BJ에서 상이한 농도(0, 5, 20, 50, 및 100 μM)의 [화학식 1] 화합물에 대하여 540 nm에서 측정된 흡광도 그래프이다.
도 9b는 [화학식 1] 화합물의 상이한 농도에 대한 세포독성 효과를 나타낸 그래프이다
도 10a-d는 살아있는 HeLa 세포와 [화학식 1] 화합물을 2시간 동안 배양한 후의 공초점 형광 및 명시야(bright-field) 이미지이다.
도 10e-h는 살아있는 HeLa 세포를 0.2 mM NEM로 미리 배양하고 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 및 위상 콘트라스트 이미지이다.
도 10i-l은 살아있는 HeLa 세포를 0.5 mM NEM로 미리 배양하고 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 및 위상 콘트라스트 이미지이다.
도 10m-p는 살아있는 HeLa 세포를 1 mM NEM로 미리 배양하고 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 및 위상 콘트라스트 이미지이다.
도 11은 2시간 동안 [화학식 1] 화합물로 처리되기 전에 상이한 NEM 농도로 배양된 HeLa 세포의 B/Y의 정량 분석을 나타낸 그래프이다.
도 12a-f는 살아있는 암 세포주(HeLa, HepG2, Huh7, 및 Hep3B), 인간 일차 간세포(HPH) 및 정상 삼유 아세포 세포주(BJ)를 [화학식 1] 화합물로 2시간 동안 배양한 후의 공초점 형광 이미지이다(배율: X200).
도 12g는 [화학식 1] 화합물의 B/Y비율을 정량 분석한 그래프이다(G: 노란색 채널 및 파란색 채널의 평균 형광 강도).
도 12h는 웨스턴 블롯에 의해 총 세포 내 GSH 농도의 정량분석을 나타낸 그래프이다.
도 12i는 지수, 2차 다항식 및 선분(linear fit)의 회귀 모델을 도 12g 및 도 12h에 적용한 세포 내 GSH(μM)의 상이한 세포주 및 식(expression)에서 B/Y 비율에 대한 산포도 데이터를 나타낸 그래프이다.
도 13a-c는 정상 및 이종이식 마우스에서 얻은 스냅 냉동 간 및 종양 조직에 대한 [화학식 1] 화합물의 B/Y 비율 이미지이다.
도 13d는 이종이식 마우스 모델 및 해부된 종양, 조직에 대한 이미지이다.
도 13e는 정상 마우스 및 종양 이종이식 마우스의 전혈에 대한 [화학식 1] 화합물의 B/Y 비율(n = 3 및n = 5)을 나타낸 그래프이다.
도 14는 상이한 농도에서 GSH 비율인 산포도 데이터에 대한 선형 회귀 모델에 의해 맞춰진 표준곡선이다.
본 발명은 살아있는 세포 내에서 티올-함유 아미노산(글루타티온(GSH))의 농도를 검출하여 정상 세포 및 암 세포를 구별할 수 있으며, 혈액 및 조직 내에서도 티올-함유 아미노산을 측정하여 암의 성장을 인지할 수 있는 암 진단용 마커 및 이를 이용한 암 진단 방법에 관한 것이다.
이하, 본 발명을 상세하게 설명한다.
본 발명의 화합물은 하기 [화학식 1]로 표시되며, 이를 포함하여 암 진단용 마커로 이용할 수 있다. 상기 암 세포 진단을 위한 마커는 살아있는 암 세포, 생체내 종양 및 혈액 등에서 티올-함유 아미노산, 예컨대 글루타티온(GSH)의 농도변화를 감지하기 위한 형광 마커이다.
[화학식 1]
본 발명에 따른 [화학식 1]은 크로메논(Chromenone) 유도체로서, 마이클 친핵성 첨가에 대한 수용체로서 작용한다.
또한, 센서내로 특정 작용기의 도입은 바이오 티올과 센서 사이의 정전기적 인력을 증가시켜 티올 검출의 선택도를 향상시키기 위한 좋은 전략이 될 수 있다. 이에 따라, 본 발명에서는 비닐 링커에 의한 크로메논(Chromenone) 골격에 피리디늄(pyridinium) 잔기를 부착하여 생물학적 티올의 식별을 위한 새로운 형광 마커([화학식 1])를 제안하고 있다.
본 발명에 따른 [화학식 1]은 하기 [반응식 4]에 따라 티올의 존재(RSH)하에서, 마이클 추가에 의해 유도된 크로메논(Chromenone) 잔기의 링 오프닝으로 인하여 크로메논(Chromenone) 형광 채널이 차단되고 페닐피리딜비닐렌 채널을 활성화시켜, 형광의 정량적 변화를 이끌 수 있다. 이는 다양한 바이오매트릭스(biomatrices)에서 자가 형광의 간섭을 감소시킴으로써 높은 신호/배경 비율을 나타낸다.
[반응식 4]
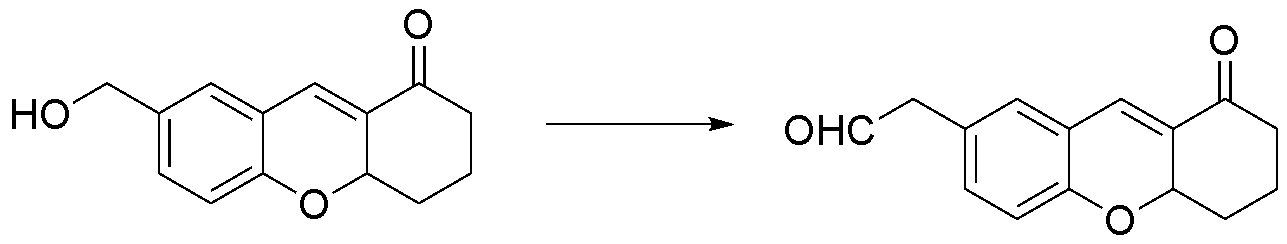
상기 [화학식 1]의 화합물은 하기 [반응식 A]의 합성과정으로 합성된다.
[반응식 A]
[화학식 3] [화학식 2] [화학식 1]
상기 암 세포 진단을 위한 마커에 포함되는 [화학식 1]의 화합물은 테트라언하이드로퓨란(THF)에 용해된 2-하이드록시-5-(하이드록시메틸)벤즈알데하이드 용액에 2-사이클로헥센-1-원 및 이미다졸을 첨가한 후 탈이온수를 첨가하여 20 내지 30 ℃에서 40 내지 55시간 동안 교반하여 [화학식 3]의 화합물을 제조한 후, 디클로로메탄(DCM)에 용해된 피리디늄클로로크롬메이트(PCC) 현탁액에 상기 [화학식 3]의 화합물을 첨가하여 20 내지 30 ℃에서 0.5 내지 3시간 동안 교반하여 [화학식 2]의 화합물을 제조한 다음, 상기 [화학식 2]의 화합물과 1-에틸-4-메틸피리디늄 요오드를 에탄올로 교반한 후 피페리딘을 첨가하여 20분 내지 2시간 동안 80 내지 110 ℃로 환류 교반하여 제조하였다.
이러한 화합물의 구조는 1H-NMR, 13C-NMR, ESI-MS 분석 등을 통하여 확인할 수 있다.
이하, 본 발명의 이해를 돕기 위하여 바람직한 실시예를 제시하나, 하기 실시예는 본 발명을 예시하는 것일 뿐 본 발명의 범주 및 기술사상 범위 내에서 다양한 변경 및 수정이 가능함은 당업자에게 있어서 명백한 것이며, 이러한 변형 및 수정이 첨부된 특허청구범위에 속하는 것도 당연한 것이다.
<
실시예
>
합성예
1. [화학식 1]로 표시되는 화합물의 합성
1-1. [화학식 3]으로 표시되는 화합물의 합성
[반응식 3]
[화학식 3]
THF(3 ㎖)에 용해된 2-하이드록시-5-(하이드록시메틸)벤즈알데하이드(600 mg, 4 mmol) 용액에 1.5 당량의 2-사이클로헥센-1-원(576 mg, 6 mmol) 및 1.5 당량의 이미다졸(408 mg, 6 mmol)을 첨가한 후 탈이온수(3 ㎖)와 혼합한 다음 상기 혼합물을 상온(25 ℃)에서 교반하였다. 반응이 종료되면(TLC로 확인), 최종 혼합물을 1M HCl(20 ㎖)로 처리하고, 에틸아세테이트로 추출한 후 유기층을 Na2SO4로 건조한 다음 진공하에서 농축하였다. 상기 농축액을 실리카겔 플래쉬 크로마토그래피(Hexane/EtOAc = 100% to 30%)로 정제하여 노란색 고체인 [화학식 3]의 화합물 460 mg(수율: 50%)을 얻었다.
1H-NMR(CDCl3)δ(ppm):δ 1.64-1.75(m, 1H), 1.95-2.11(m, 2H), 2.33-2.61(m, 3H), 4.60(s, 1H), 4.95-4.99(m, 1H), 6.86(d, J=8.3Hz, 1H), 7.21(s, 1H), 7.24-7.27(m, 1H), 7.39(s, 1H); 13C-NMR(CDCl3)δ(ppm): 18.14, 29.81, 39.02, 64.78, 74.91, 116.32, 122.28, 128.76, 130.76, 131.27, 131.65, 134.96, 155.56, 197.86; ESI-MS: m/z=229.05[M-H]-.
1-2. [화학식 2]로 표시되는 화합물의 합성
[반응식 2]
[화학식 3] [화학식 2]
디클로로메탄(DCM)(50 ㎖)에 용해된 피리디늄클로로크롬메이트(Pyridiniumchlorochromate, 646 mg, 3 mmol) 현탁액에 [화학식 3]의 화합물(460 mg, 2 mmol)을 첨가한 후 상온(25 ℃)에서 교반하고 TLC로 확인하였다. 반응이 종료되면, 실리카겔이 끈적한 부산물을 흡착시키고 혼합물을 여과한 후 물로 세척하였다. 유기층을 Na2SO4로 건조한 다음 진공하에서 농축하였다. 상기 농축액을 실리카겔 플래쉬 크로마토그래피(Hexane/EtOAc = 100% to 70%)로 정제하여 노란색 고체인 [화학식 2]의 화합물 460 mg(수율: 80%)을 얻었다.
1H-NMR(CDCl3)δ(ppm):δ 1.68-1.80(m, 1H), 2.00-2.18(m, 2H), 2.37-2.67(m, 3H), 5.11-5.16(m, 1H), 6.99(d, J=8.4Hz, 1H), 7.42(d, J=2.2Hz, 1H), 7.73(d, J=1.9Hz, 1H), 7.79(dd, J=8.4Hz, 1H), 9.88(s, 1H); 13C-NMR(CDCl3)δ(ppm): 18.11, 29.81, 39.01, 75.69, 117.03, 122.29, 130.14, 131.23, 131.46, 131.87, 133.69, 160.86, 190.48, 197.24; ESI-MS: m/z=227.05[M-H]-.
1-3. [화학식 1]로 표시되는 화합물의 합성
[반응식 1]
[화학식 2] [화학식 1]
[화학식 2]의 화합물(82 mg, 0.36mmol)과 1-에틸-4-메틸피리디늄 요오드(76 mg, 0.3 mmol)를 에탄올(20 ㎖)로 교반한 후 피페리딘(0.02 ㎖)을 첨가하여 1시간 동안 환류 교반한 다음 진공으로 증발시켰다. 생성된 고체를 CH2Cl2로 용해시킨 후 유기층을 물로 3번 세척한 다음 무수 MgSO4로 건조시키고 진공하에서 농축하였다. 상기 농축액을 실리카겔 컬럼 크로마토그래피(MeOH/ CH2Cl2 =5% to 8%)로 정제하여 밝은 갈색 고체인 [화학식 1]의 화합물 56 mg(수율: 40%)을 얻었다.
1H-NMR(CDCl3)δ(ppm): 1.70(t, J=7.3Hz, 3H), 2.08-2.16(m, 1H), 2.35-2.45(m, 2H), 2.49-2.64(m, 3H), 4.81(q, J=7.2Hz, 2H), 5.05-5.09(m, 1H), 6.93(d, J=8.5Hz, 1H), 7.07(d, J=16.2Hz, 1H), 7.37-7.38(m, 1H), 7.49(d, J=1.6Hz, 1H), 7.58-7.61(m, 1H), 7.68(d, J=8.2Hz, 1H), 8.06(d, J=6.6Hz, 2H), 9.00(d, J=6.6Hz, 2H).13C-NMR(CDCl3)δ(ppm): 17.14, 18.11, 29.82, 39.05, 56.94, 75.30, 117.41, 122.92, 123.90, 127.46, 128.13, 130.08, 130.36, 131.47, 132.68, 141.06, 144.09, 154.54, 157.19, 197.58. HRMS(FAB) m/z calcd for C22H22NO2 +[M]: 332.1651. Found 332.1651.
시험예
1. [화학식 1] 화합물의
분광특성
도 1a는 PBS 용액 내 100 당량의 GSH 존재하에서 [화학식 1] 화합물(20 μM)의 시간에 따른 흡광 변화를 나타낸 그래프이며, 도 1b는 PBS 용액(pH=7.4, 10 mM)내 GSH(1 mM, 100 당량)의 부재 및 존재하에서 [화학식 1] 화합물(10 μM)의 여기(점선) 및 발광(실선) 스펙트럼이다(GSH 첨가 2시간 후 측정)(Ex = 372 nm, Em = 550 nm 및 496 nm. Slit: 5 nm/ 5 nm).
도 2a는 100 당량의 GSH 존재하에서 [화학식 1] 화합물(10 μM)의 시간에 따른 형광 변화를 나타낸 그래프이며(삽입도: 시간 함수로서 형광 강도 비율(I496/I550)변화를 나타낸 그래프), 도 2b는 상이한 농도로 GSH(0-200 당량) 첨가 2시간 후 [화학식 1] 화합물(10 μM)의 형광 변화를 나타낸 그래프이다(삽입도: GSH 농도의 함수로서 형광 강도 비율(I496/I550)변화를 나타낸 그래프; PBS 용액(pH=7.4, 10 mM), λex = 372 nm, Slit: 5 nm/ 5 nm).
본 발명의 실시예에 따라 제조된 [화학식 1] 화합물의 분광특성은 가상의 생리학적 조건(10 mM 인산 완충 식염수(PBS), pH 7.4)하에서 관찰한다.
티올의 부재에서, [화학식 1]의 화합물은 372 nm에서 하나의 주요 흡수피크와 321 nm에서 숄더피크(shoulder peak)를 나타내었으며(도 1a), 372 nm에서 여기(점선)될 때 550 nm에서 강하게 발광(실선)된다(도 1b). 도 1a에 도시된 바와 같이, [화학식 1]의 화합물에 GSH 100 당량을 첨가하고 2시간 후 321 nm에서 흡수 피크의 강도는 서서히 감소하였다. 동시에, 최대 발광 피크는 496 nm로 블루 시프트되고, 형광 강도의 비율(I496/I550)은 0.52에서 1.50으로 서서히 변하였다(2.88배)(도 2a).
도 2b에 도시된 바와 같이, 형광 적정 분석법으로 [화학식 1]의 화합물(10 μM)을 다양한 농도의 GSH로 처리한 결과 3.75×10-6 M의 계산된 검출 한계로 형광 강도 비율(I496/I550) 및 GSH의 농도(0 내지 1.5 mM 범위) 사이의 좋은 선형성이 관찰되었다.
시험예
2.
pH
에 따른 [화학식 1] 화합물의 형광 반응성
도 3은 상이한 pH값 하에서 GSH(100 당량)의 존재(붉은 점) 및 부재(검은 점)에 따른 [화학식 1] 화합물의 형광 강도 비율(I496/I550)의 변화를 나타낸 그래프이다(GSH 첨가 2시간 후 측정).
도 3에 도시된 바와 같이, GSH가 존재하지 않는 경우에 [화학식 1] 화합물의 형광 스펙트럼은 pH 4 내지 11에서 크게 변하지 않았지만, GSH가 존재하는 경우에 [화학식 1] 화합물의 형광 스펙트럼은 pH 4 내지 11, 특히 pH 7 내지 10에서 큰 변화를 보였다.
이러한 결과는 [화학식 1]의 화합물이 생리적 pH 범위에서 GSH를 검출하는데 이용될 수 있다는 것을 나타낸다.
시험예
3.
Cys
및
Hcy
에 대한 [화학식 1] 화합물의 형광 변화
도 4a, 4b 및 4c는 PBS 용액(pH=7.4, 10 mM)내 각각 100 당량, 1 당량 및 10 당량 Cys의 존재하에서 [화학식 1] 화합물(10 μM)의 시간에 따른 형광 변화를 나타낸 그래프이다(삽입도: 시간 함수에 따른 형광 강도 비율(I496/I550) 변화를 나타낸 그래프; λex = 372 nm, Slit: 5 nm/ 5 nm).
도 5a, 5b 및 5c는 PBS 용액(pH=7.4, 10 mM)내 각각 100 당량, 1 당량 및 10 당량 Hcy의 존재하에서 [화학식 1] 화합물(10 μM)의 시간에 따른 형광 변화를 나타낸 그래프이다(삽입도: 시간 함수에 따른 형광 강도 비율(I496/I550) 변화를 나타낸 그래프; λex = 372 nm, Slit: 5 nm/ 5 nm).
도 4a에 도시된 바와 같이, [화학식 1] 화합물의 수용액에 Cys 100 당량을 첨가함에 따라 550 nm에서 최대 발광 피크가 1분 이내에 496 nm로 블루-시프트되었고, 형광 강도 비율(I496/I550)은 동일한 시간(1분 이내)에 3.08배(0.52에서 1.61로)증가하였다. 그 후, 550 nm에서 발광 피크의 강도가 점차 증가하는 동안 496 nm의 발광 피크 강도는 점차 감소되어, 상기 두 발광 비율(I496/I550)은 40분에 1.61에서 0.57로 감소되었다. 이와 같은 형광의 특이한 변화는 Cys 1 당량 및 10당량에서도 관찰되었다(도 4b 및 도 4c). 즉, Cys 1 내지 100 당량의 넓은 범위에 걸쳐 관찰되었다.
또한, [화학식 1] 화합물의 수용액에 Hcy 100 당량을 첨가함에 따라 550 nm에서 최대 발광 피크가 5분 이내에 496 nm로 블루-시프트되었고, 형광 강도 비율(I496/I550)은 5분 이내에 0.52에서 1.73로 증가하였다(도 5a). 그 후, 형광 강도 비율(I496/I550)은 2시간에 걸쳐 근소하게 감소하였다.
형광 변화에서 Hcy의 영향은 Cys와 마찬가지로 농도와 독립적이다. 구체적으로, Hcy의 낮은 농도(1 당량 및 10 당량)의 첨가는 시간이 지나더라도 유사한 형광 변화를 보인다(도 5b 및 도 5c).
시험예
4. 반응
메카니즘
제안
상이한 티올-함유 아미노산(바이오 티올)의 존재에서 [화학식 1] 화합물의 고유한 형광 변화에 기초하여 하기 [반응식 5]의 메카니즘을 제안한다.
[반응식 5]
티올이 [화학식 1] 화합물 용액(‘1’로 표시됨)에 첨가되면, 크로메논(Chromenone) 백본의 α 위치를 먼저 공격하고, 페놀레이트 A를 유도하여, 컨쥬게이트된 피리디늄 모이어티를 가진 새로운 도너-억셉터 시스템을 생성함으로써 496 nm에서 방출하게 만든다. 이 상태에서, 각각의 친핵성에 기초하여 반응속도는 Cys>Hcy>>GSH 순서이다.
페놀레이트 도너(phenolate donor)에서 피리디늄 억셉터(pyridinium acceptor)로 π-전자의 쌍의 순차적 이동에 따라 p-퀴논-메티드(p-quinone-methide) 유형 공명구조 B가 형성되어 β위치에서 티올에 의하여 공격을 받을 수 있다. 이는 구조적 변화에 의하여 구조 C를 생성하고, 496 nm에서 550 nm로 발광 피크를 이동시킨다.
Cys, Hcy, GSH의 친핵성 및 첫 번째 부가적으로 유도된 입체 효과 향상을 고려해 보면, 반응성 순서는 Cys>Hcy>> GSH 0일 것이다.
도 6에 도시된 바와 같이, 이러한 가정된 메카니즘은 1H NMR에 의해 증명되었으며, 이 밖에도 ESI-MS를 통해서도 증명하였다.
시험예
5.
티올
-함유 아미노산에 대한 [화학식 1] 화합물의 선택도 평가
도 7a 및 7b는 상온에서 PBS 용액(pH=7.4, 10 mM)내 다양한 시료(Ala, Arg, Asn, Asp, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Tau, Thr, Trp, Tyr, Val, K+, Mg2 +, Na+, Zn2+, Ca2+, H2O2, Cys, Hcy 및 GSH)의 존재하에서 [화학식 1] 화합물(10 μM)의 형광 스펙트럼이며(λex = 372 nm, Slit: 5 nm/ 5 nm)(Cys 100 당량, Hcy 100 당량 및 GSH 100 당량을 제외한 모든 시료는 200 당량이며, 시료 첨가 1분(7a) 및 2시간(7b) 후 측정). 도 7c는 상온에서 PBS 용액(pH=7.4, 10 mM)내 다양한 시료(1. only, 2. Ala, 3. Arg, 4. Asn, 5. Asp, 6. Gln, 7. Glu, 8. Gly, 9. His, 10. Ile, 11. Leu, 12. Lys, 13. Met, 14. Phe, 15. Pro, 16. Ser, 17. Tau, 18. Thr, 19. Trp, 20. Tyr, 21. Val, 22. K+, 23. Mg2+, 24. Na+, 25. Zn2+, 26. Ca2+, 27. H2O2, 28. Cys, 29. Hcy 및 30. GSH)의 존재하에서 [화학식 1] 화합물(10 μM)의 형광 변화를 나타낸 그래프이다(Cys 100 당량, Hcy 100 당량 및 GSH 100 당량을 제외한 모든 시료는 200 당량이며, 시료 첨가 1분(파란 막대) 및 2시간(빨간 막대) 동안 [화학식 1] 화합물과 배양 후 측정, λex = 372 nm, Slit: 5 nm/ 5 nm).
티올-함유 아미노산에 대한 [화학식 1] 화합물의 선택도를 평가하기 위해 수용액(10 mM PBS 완충액, pH 7.4) 상에서 생물학적으로 관련된 시료에 노출시 [화학식 1] 화합물의 형광 강도 및 형광 강도 비율(I496/I550) 변화를 모니터하였다(도 7).
구체적으로 도 7a 및 도 7b에 도시된 바와 같이, Cys, Hcy 및 GSH를 제외한 나머지 시료(Ala, Arg, Asn, Asp, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Tau, Thr, Trp, Tyr, Val, K+, Mg2 +, Na+, Zn2 +, Ca2 +, H2O2)는 형광 스펙트럼에서 변화가 없었으며, Cys, Hcy 및 GSH에서만 즉각적으로 변화하는 형광 스펙트럼을 관찰하였다.
또한 도 7c에 도시된 바와 같이, Cys, Hcy 및 GSH를 제외한 나머지 시료는 I496/I550 변화가 거의 없었으나, Cys, Hcy 및 GSH는 1분 후 각각 1.61, 1.50, 및 0.85의 I496/I550 값을 나타내었으며, 이 값은 2시간 후 각각 0.57, 1.56, 및 1.50로 변경되었다.
이러한 결과는 [화학식 1] 화합물이 Cys, Hcy, 및 GSH를 식별하는데 사용될 수 있음을 나타낸다.
시험예
6. [화학식 1] 화합물과의 결합을 위해
GSH
와 경쟁하는
Cys
및
Hcy
의 능력 측정
도 8은 GSH만 존재할 때와 Cys 또는 Hcy이 GSH와 같이 존재하는 조건하에서 [화학식 1] 화합물의 496 nm와 550 nm에서 형광세기비율을 비교한 그래프이다.
GSH의 세포 내 농도는 Cys의 30배 이상 및 Hcy의 80배 이상인 것으로 보고되어 있다. 따라서 Cys(30 μM) 또는 Hcy(15 μM)의 존재하에서 [화학식 1] 화합물(10 mM)의 형광 변화를 GSH(1 mM)로 테스트하였으며, 그 결과는 [화학식 1] 화합물이 Cys 및 Hcy에서 최소한의 간섭과 생물학적 관련 농도에서 GSH를 감지할 수 있음을 보여준다(도 8).
시험예
7.
생존능
및 살아있는 세포에서
GSH
의 정량적 측정
도 9a는 HeLa, HepG2, Hep3B, Huh7, HPH, 및 BJ에서 상이한 농도(0, 5, 20, 50, 및 100 μM)의 [화학식 1] 화합물에 대하여 540 nm에서 측정된 흡광도 그래프이며, 도 9b는 [화학식 1] 화합물의 상이한 농도에 대한 세포독성 효과를 나타낸 그래프이다(24시간 동안 처리되고, MTT 분석이 수행됨).
도 10에서 (a-d) 살아있는 HeLa 세포의 공초점 형광 및 명시야(bright-field) 이미지는 2시간 동안 [화학식 1] 화합물(5μM)과 배양한 것을 나타내었다: (a) 위상 콘트라스트 영상, (b) 노란색 채널 형광, (c) 파란색 채널 형광, (d) (b) 및 (c)에서 생성된 비율 이미지; (e-h) 살아있는 HeLa 세포의 공초점 형광 및 위상 콘트라스트 이미지는 30분 동안 0.2 mM NEM과 미리 배양된 후 2시간 동안 [화학식 1] 화합물(5 μM)과 배양한 것을 나타내었다: (e) 위상 콘트라스트 영상, (f) 노란색 채널 형광, (g) 파란색 채널 형광, (h) (f) 및 (g)에서 생성된 비율 이미지; (i-l) 살아있는 HeLa 세포의 공초점 형광 및 위상 콘트라스트 이미지는 30분 동안 0.5 mM NEM과 미리 배양된 후 2시간 동안 [화학식 1] 화합물(5 μM)과 배양한 것을 나타내었다: (i) 위상 콘트라스트 영상, (j) 노란색 채널 형광, (k) 파란색 채널 형광, (l) (j) 및 (k)에서 생성된 비율 이미지; (m-p) 살아있는 HeLa 세포의 공초점 형광 및 위상 콘트라스트 이미지는 30분 동안 1 mM NEM과 미리 배양된 후 2시간 동안 [화학식 1] 화합물(5 μM)과 배양한 것을 나타내었다: (m) 위상 콘트라스트 영상, (n) 노란색 채널 형광, (o) 파란색 채널 형광, (p) (n) 및 (o)에서 생성된 비율 이미지이다(배율: X200).
도 11은 2시간 동안 [화학식 1] 화합물(5 μM)로 처리되기 전에 상이한 NEM 농도로 배양된 HeLa 세포의 B/Y의 정량 분석을 나타낸 그래프이다.
4종의 상피성 암 세포주[HeLa 세포(자궁 경부암), HepG2, Huh7 및 Hep3B 세포(간암)], 정상 인간 일차 간세포(HPH) 및 정상 인간 섬유아세포(BJ)에서 MTT 분석은 [화학식 1] 화합물이 매우 낮은 독성이며(도 9b), 세포 생존에 영향을 주지 않고 바이오 마커로 사용 가능성이 있다고 나타내었다. 구체적으로 도 9b에 도시된 바와 같이, 제어 세포는 복합조건(compound condition)없이 100% 살아있으며, [화학식 1] 화합물로 처리된 세포의 86% 이상은 100 μM 농도에서 24시간 배양 후 살아있다. 이는 [화학식 1] 화합물이 모든 세포주에 대한 세포독성에 영향을 주지 않음을 나타낸다.
세포 내 GSH 및 실험 과정중에 자동산화를 겪어야 하는 극단적인 불안정성은 살아있는 세포에서 GSH 수준을 측정하는데 매우 힘들게 한다. 따라서 세포 내 GSH 농도의 비교 분석 전에, HeLa 세포를 사용하여 [화학식 1] 화합물의 포화농도의 지속시간을 최적화하였다.
도 10d에 도시된 바와 같이, [화학식 1] 화합물 5 mM은 2시간 동안 HeLa 세포와 배양될 때 우수한 세포 투과성이 있고, 1.04의 B/Y(파란색/노란색) 발광 비율로 노란색 및 파란색 발광 채널에서 모두 강하게 형광되었다.
[화학식 1]의 화합물과 GSH의 반응을 방해하는 다른 단백질 여부를 확인하기 위하여, HeLa 세포는 티올 특이 결합 시약인 N-ethylmaleimide(NEM)로 미리 배양되었다.
B/Y 비율은 살아있는 세포에서 정량적 형광의 변화가 [화학식 1]의 화합물과 세포 내 GSH의 반응에 의해 발생한다는 것을 제안한 농도 의존적 방법에 따라 NEM 처리에 의해 현저하게 감소한다(도 10 및 도 11). 도 11의 그래프는 [화학식 1]의 화합물 비율의 최소 검출 한계가 0.5일 것이라고 보여준다.
이러한 [화학식 1] 화합물의 B/Y 비율은 세포독성 없이 비교적 짧은 잠복기 후 살아있는 세포에서 세포 내 GSH 농도를 보고할 수 있음을 나타낸다.
시험예
8. [화학식 1] 화합물을 이용한 암 세포 진단
도 12a-f는 살아있는 암 세포주(HeLa, HepG2, Huh7, 및 Hep3B), 인간 일차 간세포(HPH) 및 정상 삼유 아세포 세포주(BJ)를 [화학식 1] 화합물(5 μM)로 2시간 동안 배양한 후의 공초점 형광 이미지이며(배율: X200), 도 12g는 [화학식 1] 화합물의 B/Y비율을 정량 분석한 그래프이다(G: 노란색 채널 및 파란색 채널의 평균 형광 강도).
4개의 상이한 암종 세포주(HeLa 세포, HepG2 세포, Huh7 세포 및 Hep3B 세포)를 사용하여 [화학식 1]의 화합물이 다양한 바이오매트릭스(biomatrices)에서 암 조직의 검출에 실제 사용될 수 있는지 여부를 확인한다.
먼저, [화학식 1]의 화합물은 공초점 현미경 이미지에 의해 결정된 것으로서 테스트된 모든 세포주에서 양호한 적응력을 보인다(도 12).
세포주의 B/Y비율은 HepG2(1.50) > HeLa(1.04) > Huh7(0.86) > Hep3B(0.82) > HPH(0.53) > BJ(0.53)이다(도 12g). 예컨대, 정상 세포에 비하여 암 세포의 B/Y비율이 더 높은 것을 확인할 수 있다.
구체적으로, 미성숙 간세포 또는 태아 간의 전구세포인 헤파토블라스트마(hepatoblastma) HepG2 세포주의 B/Y비율은 간세포 암종 Huh7 및 Hep3B 세포보다 상당히 높으며, 정상 세포인 HPH 및 BJ 세포주의 B/Y 값은 모든 암 세포주보다 상당히 낮다(P<0.05).
이러한 데이터는 [화학식 1] 화합물의 B/Y 비율 값이 세포분화상태 및/또는 조직 타입 사이를 구별(정상 세포와 암 세포의 구별)할 수 있을 것이라고 제안한다.
시험예
9. B/Y 비율을 이용한
GSH
농도 확인
도 12h는 웨스턴 블롯에 의해 총 세포 내 GSH 농도의 정량분석을 나타낸 그래프이다. 상기 값은 GAPDH로 정규화되었으며, 수치는 3번 반복 실시한 3번의 독립된 실험의 평균의 표준편차(SD)로 나타내었다(P < 0.05).
[화학식 1] 화합물로부터 얻은 B/Y 비율 값으로 살아있는 세포에서의 GSH 농도를 추정할 수 있다.
사실상 세포 내 GSH 농도를 측정하기 위해서, 웨스턴 블롯 분석(western blot analysis)은 각각의 세포주에서 추출된 단백질 샘플로 수행된다. 웨스턴 블롯 데이터는 모든 6개의 상이한 세포주(암 세포 및 정상 세포)에서 세포 내 GSH(μM/g protein)의 단백질 수준이 [화학식 1] 화합물의 B/Y 비율과 우수한 상관관계에 있다는 것을 확인시켜 주었다(도 12g 및 도 12h). 그러나 정상 세포(BJ 및 HPH) 및 암 세포 사이의 GSH 농도의 통계적 의의는 웨스턴 블롯의 정량 분석이 약하다.
따라서 B/Y 비율이 웨스턴 블롯에 비해 세포 내 GSH 농도를 검출하는 것에 더 민감하다는 것을 확인하였다.
시험예
10. B/Y 비율 및 회귀 모델을 이용한
GSH
농도 확인
도 12i는 지수, 2차 다항식 및 선분(linear fit)의 회귀 모델을 도 12g 및 도 12h에 적용한 세포 내 GSH(μM)의 상이한 세포주 및 식(expression)에서 B/Y 비율에 대한 산포도 데이터를 나타낸 그래프이다. 도 12i의 데이터는 3번의 독립된 실험의 평균의 표준편차(SD)로 나타내었다. 이는 B/Y 비율 및 웨스턴 블롯의 쌍 비교를 실시하고, 정상 및 암 세포 사이의 중요성을 보고하였다. *(P < 0.05)
회귀 모델 분석을 지수 및 선형 회귀 적합(linear regression fit)과 비교하여 나타낸, 2차 다항 회귀가 모든 6개의 상이한 세포주의 웨스턴 블롯 분석 값 및 [화학식 1] 화합물 B/Y 비율의 산포도 데이터에 가장 적합하다(도 12i)
최소 제곱법 분석(Least squares analysis)은 하기 수학식 1로 표시된 바와 같이 데이터에 대한 최적선을 위해 사용된다. 이 수학식 1에 따르면, 정상 세포인 HPH 및 BJ에서 GSH의 세포 내 농도는 암 세포에 비해 1.4배 낮다(각각 1.65 대 2.38 μM/g 단백질).
[수학식 1]
상기와 같은 결과는 HepG2 세포가 일반적인 사람 간보다 약 2.0배 높은 GSH 농도를 보이는 이전 연구와 잘 일치한다. 상기 HepG2의 GSH 농도는 3.40 μM이다.
이와 함께, [화학식 1] 화합물의 B/Y 비율이 2차 다항식 상관관계로 다른 살아있는 세포에서 세포 내 GSH 농도를 성공적으로 나타낼 수 있다.
시험예
11. 생체 조직 및
전혈에서의
GSH
농도 측정
도 13은 정상 및 이종이식 마우스에서 얻은 스냅 냉동 간 및 종양 조직에 대한 [화학식 1] 화합물의 B/Y 비율 이미지이다(조직은 2시간 동안 2 mM [화학식 1] 화합물과 배양된 것이다, 배율: ×200). 도 13a는 정상 마우스의 간; 13b는 종양 이종이식 마우스의 간; 13c는 이종이식 마우스의 종양 조직이다.
도 13d는 이종이식 마우스 모델 및 해부된 종양, 조직에 대한 이미지이며, 도 13e는 정상 마우스 및 종양 이종이식 마우스의 전혈에 대한 [화학식 1] 화합물의 B/Y 비율(n = 3 및 n = 5)을 나타낸 그래프이다. 상기 데이터는 3번의 독립된 실험의 평균 표준편차(SD)로 나타내었다. *(P < 0.05).
도 14는 상이한 농도(5 μM [화학식 1] 화합물을 함유한 증류수 10, 50, 75, 100, 200, 300, 400, 및 500 μM/L)에서 GSH 비율인 산포도 데이터에 대한 선형 회귀 모델에 의해 맞춰진 표준곡선이다. 상기 표준곡선은 3번의 독립된 실험의 평균(SEM)의 평균 표준편차에 의해 제조되며, 하기 수학식 2에 의해 설명된 바와 같이 베스트 라인이다.
[수학식 2]
암환자의 임상시료에서 높은 농도의 GSH가 검출되지만, 전혈 또는 특정 대상 조직에서의 GSH 측정은 상대적으로 적게 보고되어 있다. 이전 연구는 간암 및 재생 간 조직의 GSH 수준이 정상 조직에 비해 더 높은 것으로 나타났다.
따라서 정상 조직, 이종이식 마우스 및 이종이식 종양 조직으로부터 얻은 스냅 냉동 간을 사용하여 [화학식 1] 화합물의 B/Y 비율을 비교하였다.
모든 검사 조직의 공초점 형광 이미지는 예상대로 [화학식 1] 화합물의 B/Y 비율이 이종이식 간보다 정상 간에서 낮은 것으로 나타났다(도 13a-c).
또한, 전혈을 이용하여 [화학식 1] 화합물의 B/Y 비율을 확인하였다.
전혈 1 중량부를 증류수 30 중량부로 희석한 희석된 전혈의 농도가 5μM일 때, [화학식 1] 화합물의 B/Y 비율은 정상 마우스에 비해 종양 이종이식 마우스에서 상대적으로 높았다(P < 0.05)(도 13e). 정상적인 혈액(도 13e)에서 초록색 코드 번호)과 비교하여 종양에서 GSH의 B/Y 비율에 근거하면, 종양 혈액에서 GSH의 비율은 정상적인 혈액 보다 약 1.5배 높다.
또한, 표준 곡선으로부터 추정된 종양 이종이식 마우스 전혈의 평균 GSH 농도는 [화학식 1] 화합물의 농도에 상관없이 정상 마우스(3.2 mM/L)보다 상대적으로 높았다(18.7 mM/L)(도 14).
이러한 결과는 전혈의 GSH 농도가 종양 조직의 글루타티온 S-전이효소(GST) 활성과 강하게 연관된 것으로 이전 임상 연구 결과와 일치한다.
인간 전혈에서 GSH의 평균 농도는 1.02 mM이고, 이는 [화학식 1]의 화합물이 소량의 희석된 인간 전혈에서 GSH를 측정하기에 충분히 민감하다는 것을 추측할 수 있다.
본 발명에 따른 형광 마커인 [화학식 1]의 화합물은 암 조직 성장의 결과로서 간에서 증가된 GSH 식(expression)의 이미지를 제시하는 최초의 연구이다.
또한, 높은 B/Y 비율은 암 또는 종양을 진단하는 [화학식 1] 화합물의 잠재적 사용을 제안한다.
Claims (8)
- 제2항에 있어서, 상기 화합물은 티올-함유 아미노산을 검출하는 것을 특징으로 하는 암 진단용 마커.
- 제3항에 있어서, 상기 티올-함유 아미노산은 글루타티온(GSH)인 것을 특징으로 하는 암 진단용 마커.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020140026861A KR101563899B1 (ko) | 2014-03-07 | 2014-03-07 | 암 진단용 마커 및 이를 이용한 암 진단 방법 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020140026861A KR101563899B1 (ko) | 2014-03-07 | 2014-03-07 | 암 진단용 마커 및 이를 이용한 암 진단 방법 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20150104911A true KR20150104911A (ko) | 2015-09-16 |
| KR101563899B1 KR101563899B1 (ko) | 2015-10-28 |
Family
ID=54244445
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020140026861A KR101563899B1 (ko) | 2014-03-07 | 2014-03-07 | 암 진단용 마커 및 이를 이용한 암 진단 방법 |
Country Status (1)
| Country | Link |
|---|---|
| KR (1) | KR101563899B1 (ko) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210044731A (ko) * | 2019-10-15 | 2021-04-23 | 고려대학교 산학협력단 | 단백질 응집체 검출용 형광 프로브 화합물 및 이를 포함하는 단백질 응집체 검출용 형광 센서 |
| WO2021125831A3 (ko) * | 2019-12-18 | 2021-09-02 | 고려대학교 산학협력단 | 암 세포 검출용 발광 프로브 화합물 및 이를 포함하는 암 세포 검출용 발광 센서 |
| CN113929652A (zh) * | 2020-07-14 | 2022-01-14 | 兰州大学 | 一种硫化物响应的自释放型连接子分子 |
| CN114163423A (zh) * | 2021-11-09 | 2022-03-11 | 济南大学 | 可实现癌细胞筛选的谷胱甘肽比率可逆荧光探针、制备方法与应用 |
| CN116178355A (zh) * | 2023-01-19 | 2023-05-30 | 昆明理工大学 | 一种检测硫醇的化学发光试剂、合成方法及应用 |
| CN116814262A (zh) * | 2023-06-30 | 2023-09-29 | 陕西科技大学 | 一种基于铋基钙钛矿量子点荧光传感器的制备方法及其应用 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102105937B1 (ko) * | 2018-10-24 | 2020-04-29 | 고려대학교 산학협력단 | 암 세포 검출용 형광 프로브 화합물 및 이를 포함하는 암 세포 검출용 형광 센서 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101255261B1 (ko) | 2011-10-25 | 2013-04-16 | 고려대학교 산학협력단 | 시스테인 선택성을 갖는 화학정량 형광 표지자, 그 제조방법 및 이를 이용한 생체내 시스테인 영상화 방법 |
-
2014
- 2014-03-07 KR KR1020140026861A patent/KR101563899B1/ko active IP Right Grant
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210044731A (ko) * | 2019-10-15 | 2021-04-23 | 고려대학교 산학협력단 | 단백질 응집체 검출용 형광 프로브 화합물 및 이를 포함하는 단백질 응집체 검출용 형광 센서 |
| WO2021125831A3 (ko) * | 2019-12-18 | 2021-09-02 | 고려대학교 산학협력단 | 암 세포 검출용 발광 프로브 화합물 및 이를 포함하는 암 세포 검출용 발광 센서 |
| CN113929652A (zh) * | 2020-07-14 | 2022-01-14 | 兰州大学 | 一种硫化物响应的自释放型连接子分子 |
| CN114163423A (zh) * | 2021-11-09 | 2022-03-11 | 济南大学 | 可实现癌细胞筛选的谷胱甘肽比率可逆荧光探针、制备方法与应用 |
| CN114163423B (zh) * | 2021-11-09 | 2023-12-12 | 济南大学 | 可实现癌细胞筛选的谷胱甘肽比率可逆荧光探针、制备方法与应用 |
| CN116178355A (zh) * | 2023-01-19 | 2023-05-30 | 昆明理工大学 | 一种检测硫醇的化学发光试剂、合成方法及应用 |
| CN116178355B (zh) * | 2023-01-19 | 2024-06-11 | 昆明理工大学 | 一种检测硫醇的化学发光试剂、合成方法及应用 |
| CN116814262A (zh) * | 2023-06-30 | 2023-09-29 | 陕西科技大学 | 一种基于铋基钙钛矿量子点荧光传感器的制备方法及其应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR101563899B1 (ko) | 2015-10-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101563899B1 (ko) | 암 진단용 마커 및 이를 이용한 암 진단 방법 | |
| Zhang et al. | A minimalist fluorescent probe for differentiating Cys, Hcy and GSH in live cells | |
| Hu et al. | A fluorescent probe for simultaneous discrimination of GSH and Cys/Hcy in human serum samples via distinctly-separated emissions with independent excitations | |
| Zhang et al. | A low dose, highly selective and sensitive colorimetric and fluorescent probe for biothiols and its application in bioimaging | |
| Lv et al. | A highly selective ESIPT-based fluorescent probe for cysteine sensing and its bioimaging application in living cells | |
| Tang et al. | A ratiometric time-gated luminescence probe for hydrogen sulfide based on copper (II)-coupled lanthanide complexes | |
| CN106866689B (zh) | 一种检测血液中谷胱甘肽的荧光探针及其合成方法与应用 | |
| Wang et al. | A colorimetric and ratiometric dual-site fluorescent probe with 2, 4-dinitrobenzenesulfonyl and aldehyde groups for imaging of aminothiols in living cells and zebrafish | |
| Hu et al. | A FRET approach for luminescence sensing Cr3+ in aqueous solution and living cells through functionalizing glutathione and glucose moieties | |
| Zhu et al. | A novel colorimetric and ratiometric fluorescent probe for cysteine based on conjugate addition-cyclization-elimination strategy with a large Stokes shift and bioimaging in living cells | |
| CN110698454B (zh) | 一种异佛尔酮类硫化氢荧光探针及其制备方法与应用 | |
| CN109232626A (zh) | 一种基于二氟硼氧基香豆素的so2比率型荧光探针 | |
| US20160116455A1 (en) | Fluorescent probe sensing tyrosine kinase and use thereof | |
| Yang et al. | Imaging of formaldehyde in live cells and daphnia magna via Aza-Cope reaction utilizing fluorescence probe with large stokes shifts | |
| Ma et al. | Dual-functional probes for sequential thiol and redox homeostasis sensing in live cells | |
| Zhou et al. | Intracellular endogenous glutathione detection and imaging by a simple and sensitive spectroscopic off–on probe | |
| CN105601658B (zh) | 一种能够区分生物硫醇的荧光探针的制备与应用 | |
| CN114539183B (zh) | 一种癌细胞组织诊断的脂滴靶向和生物硫醇敏感的荧光探针及制备和应用 | |
| Zhao et al. | A β-allyl carbamate fluorescent probe for vicinal dithiol proteins | |
| KR102078439B1 (ko) | 하이드라지드 결합된 나프탈이미드 유도체 및 이의 구리 풀 이미징 용도 | |
| JP5585960B2 (ja) | チオールの検出方法 | |
| US12055546B2 (en) | Fluorescent probe for detecting carboxypeptidase activity | |
| CN108218817B (zh) | 一种区分GSH、Cys、SO2荧光探针及其制备方法和应用 | |
| EP3551637B1 (en) | A compound for the detection of hno in biological systems | |
| CN109734710A (zh) | 一种检测半胱氨酸的荧光探针及其合成方法与应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20181008 Year of fee payment: 4 |